生化学検査方法及びそのための装置
【課題】必要検体量が微量でかつ低コストである生化学検査の方法及びそのための装置を提供することにある。
【解決手段】検査試薬および検体を膜に噴射することによって付与し、該膜で該検査試薬と該検体とを反応させる生化学検査方法。
【解決手段】検査試薬および検体を膜に噴射することによって付与し、該膜で該検査試薬と該検体とを反応させる生化学検査方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、検体及び検査試薬をインクジェット法で膜に噴射することによって付与し、生化学検査を行う方法及び装置に関する。
【背景技術】
【0002】
血液、尿等を検体として人の病気を診断する方法は長く行われている。この方法の一つとして、ウェットケミストリー分析法がある。これは、いわゆる溶液試薬を用いる方法であって歴史も古く、多数の項目について検出試薬も開発されており、測定機も簡易小型機から大型全自動機まで各種ある。ウェットケミストリーに使用される検体は、血漿、血清、尿等であって、通常全血をそのまま検体として使用することはない。
【0003】
ウェットケミストリー法の欠点は、検体の調製・供給にある。この方法では、透明溶液の透過測定を前提としているので、全血検体をそのまま測定試料とすることはできない。即ち、全血検体を採血後、遠心分離した上清の血漿または血清をサンプルカップに移すか、または遠心分離管そのものをサンプルカップの代わりに測定機にセットする等の方法が取られている。これらの操作を行う煩雑さに加えて、赤血球の混入無しに確実にサンプリングするのに十分な血漿または血清の確保という課題がある(たとえば特許文献1)。
【0004】
遠心分離後の血漿200μlを確保するためには、通常1.5〜2mlの全血を必要とする。遠心分離やその後の操作を注意深く行ったとしても、最少必要採血量は500μl前後と推定される。
【0005】
一方、分析測定に必要な試料の量は1項目あたり10μl程度であるので、10項目テストしたとしても100μl、20項目テストしたとしても200μlに過ぎない。病院等で実際に採血される量は2〜20mlである。即ち、最終的に必要な血漿量の50〜100倍が採血されている。
【0006】
注射器を用いて血管に針を刺し、採血されることは、健常者であっても精神的および肉体的に苦痛を伴うものである。体質的に血管が細く採血が困難な人や病弱な患者には、採血に伴う苦痛は想像以上のものであり、更に繰り返し採血される患者にとっては、採血量を最小限に抑えたいという願いは大きい。分析測定用試料の量を減らし得る方法としては、特許文献2および3に記載されているようなインクジェット法を用いた分析測定方法が挙げられる。
【0007】
検体の調製・供給に伴う欠点を克服した分析方法として、定性・定量分析に必要な全ての試薬を試薬紙や多層分析フィルムのような分析要素の中に組み込んだ、いわゆるドライケミストリー分析要素が多数開発・商品化され、市販されている(たとえば特許文献4)。
【0008】
ドライケミストリー分析要素は、便利ではあるが反応に必要な全ての試薬を素子の中に組み込まねばならない。さらに用いられる試薬の特性が分析対象項目によってそれぞれ異なるので、処方開発及び製造条件の最適化に多大の労力と時間、設備がかかるという大きな課題がある。
【0009】
また、全ての試薬を含んでいるので、分析要素を長期に渡って保存するには十分な乾燥状態を確保する必要がある。このため、通常分析要素1枚毎に防湿包装をし、必要に応じて更に乾燥剤を包装内に共存させる等の対策がとられている。保存温度も、冷蔵保存が前提となっている。
【0010】
こうした乾燥包装および冷蔵保存を前提としても、保存期間は1〜2年が限度であり、したがってドライケミストリー分析要素の価格を押し上げている。
【特許文献1】特開平6−34632号公報
【特許文献2】特開2000−33712号公報
【特許文献3】特開2003−322630号公報
【特許文献4】特開2000−146959号公報
【発明の開示】
【発明が解決しようとする課題】
【0011】
本発明は、上記の背景技術における課題を鑑みてなされたものであり、その目的は、必要検体量が微量かつ低コストで生化学検査を行う方法及びそのための装置を提供することに関する。
【課題を解決するための手段】
【0012】
本発明の生化学検査方法は、検体および検査試薬を膜に噴射することによって付与し、膜で検査試薬と検体とを反応させて検査を行うことを特徴とする検査方法である。
【0013】
本発明の生化学検査装置は、検体及び検査試薬を膜にスポットする手段、検査試薬と検体とを膜において反応させる手段、検体中の検査対象成分を検出する手段を有することを特徴とする装置である。
【発明の効果】
【0014】
本発明によれば、膜に検体および検査試薬をスポットして生化学検査を行うことにより、微量の検体でかつ低コストで生化学検査を行うことが可能となる。
【0015】
さらに、インクジェット法を用いてスポットすることにより、検体および検査試薬を微量にスポットすることが可能となるために、微量の検体でかつ低コストで生化学検査を行うことが可能となる。
【0016】
また、検査試薬を全て液体状態で保存することができるため、ドライケミストリーのように乾燥包装をする必要が無く、低コストで生化学検査を行うことが可能となる。
【発明を実施するための最良の形態】
【0017】
以下、本発明に含まれる各態様について詳細に説明する。
【0018】
(膜構成)
本発明で検査試薬および検体を噴射する膜の一例を図1に示す。図1に示したように、本発明に用いられる膜は単層膜でも多層膜でも可能であるが、多層膜が好ましく用いられる。
【0019】
図1(A)のように血球濾過層を有する膜を用いると、検体と検査試薬反応後に血球濾過層を除去することにより、反射・透過のいずれかの光学的測定が可能である。
【0020】
図1(B)のように血球濾過層及び反射層を有する膜を用いると、血球濾過層を除去することなく反射による光学的測定が可能である。
【0021】
血球濾過層としては表面が親水化された微多孔性層を用いることができる。表面が親水化されており血球分離能を有する微多孔性層としては、表面が親水化された弗素含有ポリマー、ポリスルホン等を用いることができる。
【0022】
弗素含有ポリマーとしては、ポリビニリデンフルオリドやポリテトラフルオロエチレンなどがあり、ポリテトラフルオロエチレンが好ましい。弗素含有ポリマーからなる微多孔性層の微孔のサイズは、約0.2μmから約60μm、好ましくは約1μmから約20μm、更に好ましくは1から10μmの範囲である。上記微多孔性層の空隙率は約40%から約95%、好ましくは約50%から約80%の範囲である。上記微多孔性層の厚さは約10μmから約200μm、好ましくは約30μmから約150μm、製造工程中でのしわ発生等の取り扱い性を考慮すると、最も好ましくは約50μmから約120μmの範囲である。
【0023】
弗素含有ポリマーの微多孔性層は特開昭57−66359号(米国特許第4783315号)公報に記載の物理的活性化処理(好ましくはグロー放電処理又はコロナ放電処理)を微多孔性層の少なくとも片面に施すことによる。これにより、微多孔性層の表面を親水化して、隣接する微多孔性展開層との部分接着に用いられる接着剤の接着力を強化することができる。
【0024】
これらの弗素含有ポリマーの微多孔性膜の作製には、1種または2種以上の弗素含有ポリマーを混合しても良いし、弗素を含まない1種または2種以上のポリマーや繊維と弗素含有ポリマーとを混合し、製膜したものでも良い。
【0025】
弗素含有ポリマーの微多孔性膜は、そのままでは表面張力が低く血球濾過層として用いようとしても、水性液体試料ははじかれてしまって膜の表面や内部に拡散、浸透しない。弗素含有ポリマーの微多孔性膜に親水性を付与し親水性を高めるために、弗素含有ポリマーの微多孔性膜の外部表面及び内部の空隙の表面を実質的に親水化するために充分な量の界面活性剤を弗素含有ポリマーの微多孔性膜に含浸させる。これにより、前記の水性液体試料がはじかれる問題点を解決することができる。
【0026】
水性液体試料がはじかれることなく膜の表面や内部に拡散、浸透、移送されるのに充分な親水性を弗素含有ポリマーの微多孔性膜に付与するには、次の条件が挙げられる。すなわち、一般に弗素含有ポリマーの微多孔性膜の空隙体積の約0.01%から約10%、好ましくは約0.1%から約5.0%、更に好ましくは0.1%から1%の界面活性剤で微多孔性膜の空隙の表面が被覆されることが必要である。例えば、厚さが50μmの弗素含有ポリマーの微多孔性膜の場合、含浸される界面活性剤の量は、一般に0.05g/m2から2.5g/m2の範囲であることが好ましい。弗素含有ポリマーの微多孔性膜に界面活性剤を含浸させる方法としては、まず、界面活性剤の低沸点(沸点約50℃から約120℃の範囲が好ましい)の有機溶媒(例えば、アルコール、エステル、ケトン)溶液に弗素含有ポリマーの微多孔性膜を浸漬する。溶液を微多孔性膜の内部空隙に実質的に充分に行きわたらせた後、微多孔性膜を溶液から静かに引き上げ、風(温風が好ましい)を送り乾燥させる方法が一般的である。血球濾過層を構成する微多孔性層に含有させる前処理試薬等の成分とともに界面活性剤を弗素含有ポリマーの微多孔性膜に含有させることもできる。
【0027】
弗素含有ポリマーの微多孔性膜を親水性化処理に用いられる界面活性剤としては、非イオン性(ノニオン性)、陰イオン性(アニオン性)、陽イオン性(カチオン性)、両性いずれの界面活性剤も用いることができる。
【0028】
これらの界面活性剤のうちでは、ノニオン性界面活性剤が、赤血球を溶血させる作用が比較的低いので、全血を検体とするための多層膜においては有利である。ノニオン性界面活性剤としては、アルキルフェノキシポリエトキシエタノール、アルキルポリエーテルアルコール、ポリエチレングリコールモノエステル、ポリエチレングリコールジエステル、高級アルコールエチレンオキシド付加物(縮合物)、多価アルコールエステルエチレンオキシド付加物(縮合物)、高級脂肪酸アルカノールアミドなどがある。
【0029】
ノニオン性界面活性剤の具体例として、次のものがある;
アルキルフェノキシポリエトキシエタノールとしては、イソオクチルフェノキシポリエトキシエタノール:(Triton X−100:オキシエチレン単位平均9〜10含有)(Triton X−45:オキシエチレン単位平均5含有)、ノニルフェノキシポリエトキシエタノール:(IGEPAL CO−630:オキシエチレン単位平均9含有)(IGEPAL CO−710:オキシエチレン単位平均10〜11含有)(LENEX 698:オキシエチレン単位平均9含有)、
アルキルポリエーテルアルコールとしては、高級アルコール ポリオキシエチレン エーテル:(Triton X−67:CA Registry No.59030−15−8)。
【0030】
弗素含有ポリマーの微多孔性膜は、その多孔性空間に水不溶化した1種または2種以上の水溶性高分子を設けることによって親水化したものでもよい。水溶性高分子の例として、酸素を含む炭化水素にはポリビニルアルコール、ポリエチレンオキサイド、ポリエチレングリコール、メチルセルロース、エチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、窒素を含むものにはポリアクリルアミド、ポリビニルピロリドン、ポリビニルアミン、ポリエチレンイミン、負電荷を有するものとしてポリアクリル酸、ポリメタアクリル酸、ポリスチレンスルホン酸などを挙げることが出来る。不溶化は熱処理、アセタール化処理、エステル化処理、重クロム酸カリによる化学反応、電離性放射線による架橋反応等によって行えばよい。
【0031】
ポリスルホンの微多孔性膜は以下に示すように製造することが出来る。すなわち、ポリスルホンをジオキサン、テトラヒドロフラン、ジメチルホルムアミド、ジメチルアセトアミド、N−メチル−2−ピロリドンあるいはこれらの混合溶媒等に溶解して製膜原液を作製する。続いて、これを支持体上に又は直接凝固液中に流延し洗浄、乾燥して作製する。ポリスルホンの微多孔性膜も弗素含有ポリマーと同様界面活性剤を含有させ、あるいは水不溶化した水溶性高分子を設けることによって親水化することができる。
【0032】
多孔性展開層は、水性の検体に含有されている成分を実質的に偏在させることなしに平面的に拡げ、単位面積当りほぼ一定量の割合で親水性ポリマー層に供給する機能を有する層である。これまでドライケミストリーに使われている展開層として公知の非繊維質及び繊維質の全ての多孔性材料を用いることができる。具体的には特開昭49−53888号公報に開示されているメンブランフィルター(ブラッシュドポリマー)に代表される非繊維性等方的微多孔質媒体層、特開昭55−90859号公報等に開示されたポリマーミクロビーズが水不膨潤性の接着剤で点接触状に接着されて成る連続空隙含有三次元格子粒状構造物層に代表される非繊維性多孔性層、特開昭55−164356号公報等に開示された織物布地からなる多孔性層、特開昭60−222769号公報等に開示された編物布地からなる層、各種の濾紙等を挙げることができるが、これらに限定されるものではない。
【0033】
展開層は、1層だけに限定する必要はなく、特開昭61−4959号公報、特開昭62−138756号公報等に開示されている様に、2層以上の層を重ねて用いることができる。展開層を2層以上重ねた多層膜については、検体のスポット時には全層が積層一体化されている構成をとることが必須であるが、その後のプロセスでは必ずしも一体化されている必要はない。必要に応じて、第一の展開層と第二の展開層の間を剥離した状態で使用することができる。
【0034】
展開層中には、検体の展開を促進するために、ノニオン、アニオン、カチオンまたは両性の界面活性剤を含ませることができる。また、展開性をコントロールする目的で、親水性のポリマー等の展開制御剤を含ませることができる。更に、目的とする検出反応を促進する為の、または干渉や妨害反応を低減もしくは阻止する為の各種試薬、あるいは試薬の一部を含ませることができる。
【0035】
展開層の厚さは、20〜200μm、好ましくは50〜170μm、更に好ましくは80〜150μmである。
【0036】
親水性ポリマー層には、これまでドライケミストリーに使われている公知の水に対して可溶性、膨潤性、親水性である各種ポリマーを用いることができる。水吸収時の膨潤率が30℃で約150%から約2000%、好ましくは約250%から約1500%の範囲の天然又は合成親水性ポリマーを使用することができる。具体的には、特開昭59−171864号公報、特開昭60−108753号公報等に開示されたゼラチン(例えば、酸処理ゼラチン、脱イオンゼラチン等)、ゼラチン誘導体(例えば、フタル化ゼラチン、ヒドロキシアクリレートグラフトゼラチン等)、アガロース、プルラン、プルラン誘導体、ポリアクリルアミド、ポリビニルアルコール、ポリビニルピロリドン等を挙げることができるが、これらに限定されるものではない。親水性ポリマー層に代えて、親水性表面を有する紙やポリマー多孔質膜を用いることもできる。
【0037】
親水性ポリマー層の厚さは、乾燥時に約1μmから約100μm、好ましくは約3μmから約50μm、特に好ましくは約5μmから約30μmであり、実質的に透明であることが好ましい。層中には、目的とする反応を促進する、または干渉や妨害反応を防止もしくは低減するための各種試薬あるいは試薬の一部を含ませることができる。
【0038】
支持体としては、これまでドライケミストリーに使われている公知の水不透過性の支持体を用いることができる。具体的には、ポリエチレンテレフタレート、ビスフェノールAのポリカーボネート、ポリスチレン、セルロースエステル(例えば、スルロースジアセテート、セルローストリアセテート、セルロースアセテートプロピオネート等)等から成る透明フィルムを用いることができる。支持体の厚さは、約50μmから1mm、好ましくは約80μmから約300μmである。
【0039】
支持体は、通常光透過性のものを用いるが、展開層側から測定をする場合には、着色されていても光不透過性であっても良い。
【0040】
支持体の表面には、必要により公知の下塗層または接着層を設けて親水性ポリマー層との接着を強固にすることができる。
【0041】
検体をスポット後に弗素含有ポリマーからなる微多孔性層を剥離除去する態様においては、展開層と微多孔性層とは接着されている必要は無く、検体の拡散・浸透が定量的に進行するように積層されていれば良い。
【0042】
(測定方法)
被検物質について説明する。本願発明では対象とする被検物質は特に限定されない。通常臨床検査の分野で測定される酵素、脂質、無機イオン、代謝産物、蛋白質等の他、各種グロブリン、免疫抗原、免疫抗体等の生体由来成分、薬物、ホルモン、腫瘍マーカー等、分析方法が確立していれば分析対象とすることができる。
【0043】
上記膜に検査試薬をスポットし、さらに検体を付与することにより、試薬と検体を反応させて生化学検査を行う。また、検査試薬と検体とを膜に同時に付与してもよい。
【0044】
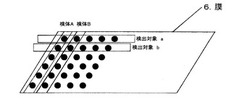
スポットは自由に位置を変更することができ、図2のように必要に応じて複数種類の検査項目をマトリクス状にスポットすることができる。また、検体をスポットするノズルをディスポーザブルにすることにより、図2のように必要に応じて同一膜上に複数種類の検体をマトリクス状にスポットすることができる。
【0045】
検査試薬と検体とを膜に付与する方法として、微量の検体でかつ低コストで検査を行うためには、インクジェット法を用いることが好ましい。さらにバブルジェット法(登録商標)を用いるとよい。
【0046】
検査試薬および検体を膜にスポットした後、インキュベーションをして検査試薬と被検物質とを反応させる。好ましくは、膜周囲が覆われた囲いの中に置いた状態で加熱する方法で行う。これにより、周囲の温度、湿度に影響されることなく一定の乾燥状態となる。温度範囲は10〜60℃、好ましくは20〜50℃、更に好ましくは30〜45℃である。インキュベーション中の温度変動は±5℃、好ましくは±3℃、更に好ましくは±1℃である。
【0047】
必要に応じて、弗素含有ポリマーから成る界面活性剤を含有する微多孔性層を除去しても良い。
【0048】
分析すべき項目に対応した測定試薬溶液としては、ウェットケミストリーで公知の試薬溶液を用いることができる。これらは、検査対象成分と反応して、主として光学的手段で検出することができる。光学的な手段の例を挙げると、色変化、発色(呈色)、蛍光、発光、紫外線領域における吸収波長の変化、混濁発生等の変化を生じさせる。
【0049】
本発明の方法では、膜の水不透過性支持体を通して測光する方法が最も適用範囲が広いが、検体が全血ではない場合や検体供給後に微多孔性層を除去して測定する場合等には、透過測光方式により測定することができる。また、水不透過性支持体が不透明な場合には、支持体の反対側から測定することもできる。
【実施例】
【0050】
以下、本発明を実施例により更に具体的に説明する。なお、本発明は以下の実施例のみに限定されるものではない。
【0051】
(実施例1)
(1)膜の作製
ゼラチン様の下塗のある厚さ180μmのポリエチレンテレフタレートの透明フィルムベースの上に、0.2%のノニオン界面活性剤p−ノニルフェノキシポリグリシドール(グリシドール単位平均10含有)を含むゼラチンを、乾燥膜厚がおよそ15μmになるように塗布・乾燥する。その上に、界面活性剤を用いて親水化処理したポリエステル編物布地を特開昭62−224299号公報に記載の方法に従ってラミネートする。更に、7%のポリビニルピロリドン(平均分子量120万)をポリエステル編物展開層の上に2g/m2の塗布量となる様に塗布する。
【0052】
(2)弗素含有ポリマーの親水化処理
ポリテトラフルオロエチレンの微多孔性膜(Zitex A135(米国ノートン社製))を、20%のTriton X−100を含むエタノール溶液に含浸する。微多孔中に含まれる空気を除去して、微多孔の中に該活性剤溶液を十分に浸透させた後、該溶液から引き上げて、50℃の乾燥風を吹き付けて乾燥させる。
【0053】
(3)(1)で作製した膜を15mm×15mmの大きさに切りだす。一方、(2)で作成した親水化処理した弗素含有ポリマーの微多孔性膜を15mm×15mmに切りだし、前記膜の上に重ねる。これを、特開昭57−63452号公報に記載されている方法でプラスチック枠の中に組み込み、膜を完成させる。
【0054】
(4)GGT測定試薬溶液の調製
pH8.1のトリスバッファー(10mM)溶液10mlに、TritonX−100を10μl、グリシルグリシンを156mg及びL−γ−グルタミル−3−カルボキシ−4−ニトロアニリドを5.9mg溶解し、GGT測定試薬溶液を調製する。
【0055】
(5)検体のスポット
健常者からヘパリン採血した全血検体を2mlずつ3本の試験管に分け、試験管2及び3にはそれぞれ10μl、20μlの10000U/Lの上記調製したGGT測定試薬溶液を含む生理食塩水を添加する。なお、試験管1は生理食塩水を添加せず、上記全血検体のみを含む。上記(3)で作製した膜の上から、上記試験管1から3の全血検体のサンプル各20μlを、インクジェット法を用いて各サンプルにつき3枚ずつスポットする。全血は、該微多孔性膜上で横に広がりつつ、内部に浸透した。約10秒後に、拡散が完全に進行したことを確認した後、ピンセットを用いて該微多孔性膜を剥離除去する。
【0056】
(6)インキュベーション
上記試料を点着した分析要素を、特願平2−90562号公報に記載の方法に従って、37℃で10分間開放系中で加温し、乾燥させる。
【0057】
(7)測定
測定試薬溶液を膜にスポットしてから1分後と5分後の反射光学濃度の差(ΔODR)を求める。
【図面の簡単な説明】
【0058】
【図1】本発明の実施の形態における膜を例示する模式図である。
【図2】本発明の実施の形態における膜に検査試薬及び検体をスポットする模式図である。
【符号の説明】
【0059】
1 血球濾過層
2 展開層
3 反射層
4 親水性ポリマー層
5 支持体
6 膜
【技術分野】
【0001】
本発明は、検体及び検査試薬をインクジェット法で膜に噴射することによって付与し、生化学検査を行う方法及び装置に関する。
【背景技術】
【0002】
血液、尿等を検体として人の病気を診断する方法は長く行われている。この方法の一つとして、ウェットケミストリー分析法がある。これは、いわゆる溶液試薬を用いる方法であって歴史も古く、多数の項目について検出試薬も開発されており、測定機も簡易小型機から大型全自動機まで各種ある。ウェットケミストリーに使用される検体は、血漿、血清、尿等であって、通常全血をそのまま検体として使用することはない。
【0003】
ウェットケミストリー法の欠点は、検体の調製・供給にある。この方法では、透明溶液の透過測定を前提としているので、全血検体をそのまま測定試料とすることはできない。即ち、全血検体を採血後、遠心分離した上清の血漿または血清をサンプルカップに移すか、または遠心分離管そのものをサンプルカップの代わりに測定機にセットする等の方法が取られている。これらの操作を行う煩雑さに加えて、赤血球の混入無しに確実にサンプリングするのに十分な血漿または血清の確保という課題がある(たとえば特許文献1)。
【0004】
遠心分離後の血漿200μlを確保するためには、通常1.5〜2mlの全血を必要とする。遠心分離やその後の操作を注意深く行ったとしても、最少必要採血量は500μl前後と推定される。
【0005】
一方、分析測定に必要な試料の量は1項目あたり10μl程度であるので、10項目テストしたとしても100μl、20項目テストしたとしても200μlに過ぎない。病院等で実際に採血される量は2〜20mlである。即ち、最終的に必要な血漿量の50〜100倍が採血されている。
【0006】
注射器を用いて血管に針を刺し、採血されることは、健常者であっても精神的および肉体的に苦痛を伴うものである。体質的に血管が細く採血が困難な人や病弱な患者には、採血に伴う苦痛は想像以上のものであり、更に繰り返し採血される患者にとっては、採血量を最小限に抑えたいという願いは大きい。分析測定用試料の量を減らし得る方法としては、特許文献2および3に記載されているようなインクジェット法を用いた分析測定方法が挙げられる。
【0007】
検体の調製・供給に伴う欠点を克服した分析方法として、定性・定量分析に必要な全ての試薬を試薬紙や多層分析フィルムのような分析要素の中に組み込んだ、いわゆるドライケミストリー分析要素が多数開発・商品化され、市販されている(たとえば特許文献4)。
【0008】
ドライケミストリー分析要素は、便利ではあるが反応に必要な全ての試薬を素子の中に組み込まねばならない。さらに用いられる試薬の特性が分析対象項目によってそれぞれ異なるので、処方開発及び製造条件の最適化に多大の労力と時間、設備がかかるという大きな課題がある。
【0009】
また、全ての試薬を含んでいるので、分析要素を長期に渡って保存するには十分な乾燥状態を確保する必要がある。このため、通常分析要素1枚毎に防湿包装をし、必要に応じて更に乾燥剤を包装内に共存させる等の対策がとられている。保存温度も、冷蔵保存が前提となっている。
【0010】
こうした乾燥包装および冷蔵保存を前提としても、保存期間は1〜2年が限度であり、したがってドライケミストリー分析要素の価格を押し上げている。
【特許文献1】特開平6−34632号公報
【特許文献2】特開2000−33712号公報
【特許文献3】特開2003−322630号公報
【特許文献4】特開2000−146959号公報
【発明の開示】
【発明が解決しようとする課題】
【0011】
本発明は、上記の背景技術における課題を鑑みてなされたものであり、その目的は、必要検体量が微量かつ低コストで生化学検査を行う方法及びそのための装置を提供することに関する。
【課題を解決するための手段】
【0012】
本発明の生化学検査方法は、検体および検査試薬を膜に噴射することによって付与し、膜で検査試薬と検体とを反応させて検査を行うことを特徴とする検査方法である。
【0013】
本発明の生化学検査装置は、検体及び検査試薬を膜にスポットする手段、検査試薬と検体とを膜において反応させる手段、検体中の検査対象成分を検出する手段を有することを特徴とする装置である。
【発明の効果】
【0014】
本発明によれば、膜に検体および検査試薬をスポットして生化学検査を行うことにより、微量の検体でかつ低コストで生化学検査を行うことが可能となる。
【0015】
さらに、インクジェット法を用いてスポットすることにより、検体および検査試薬を微量にスポットすることが可能となるために、微量の検体でかつ低コストで生化学検査を行うことが可能となる。
【0016】
また、検査試薬を全て液体状態で保存することができるため、ドライケミストリーのように乾燥包装をする必要が無く、低コストで生化学検査を行うことが可能となる。
【発明を実施するための最良の形態】
【0017】
以下、本発明に含まれる各態様について詳細に説明する。
【0018】
(膜構成)
本発明で検査試薬および検体を噴射する膜の一例を図1に示す。図1に示したように、本発明に用いられる膜は単層膜でも多層膜でも可能であるが、多層膜が好ましく用いられる。
【0019】
図1(A)のように血球濾過層を有する膜を用いると、検体と検査試薬反応後に血球濾過層を除去することにより、反射・透過のいずれかの光学的測定が可能である。
【0020】
図1(B)のように血球濾過層及び反射層を有する膜を用いると、血球濾過層を除去することなく反射による光学的測定が可能である。
【0021】
血球濾過層としては表面が親水化された微多孔性層を用いることができる。表面が親水化されており血球分離能を有する微多孔性層としては、表面が親水化された弗素含有ポリマー、ポリスルホン等を用いることができる。
【0022】
弗素含有ポリマーとしては、ポリビニリデンフルオリドやポリテトラフルオロエチレンなどがあり、ポリテトラフルオロエチレンが好ましい。弗素含有ポリマーからなる微多孔性層の微孔のサイズは、約0.2μmから約60μm、好ましくは約1μmから約20μm、更に好ましくは1から10μmの範囲である。上記微多孔性層の空隙率は約40%から約95%、好ましくは約50%から約80%の範囲である。上記微多孔性層の厚さは約10μmから約200μm、好ましくは約30μmから約150μm、製造工程中でのしわ発生等の取り扱い性を考慮すると、最も好ましくは約50μmから約120μmの範囲である。
【0023】
弗素含有ポリマーの微多孔性層は特開昭57−66359号(米国特許第4783315号)公報に記載の物理的活性化処理(好ましくはグロー放電処理又はコロナ放電処理)を微多孔性層の少なくとも片面に施すことによる。これにより、微多孔性層の表面を親水化して、隣接する微多孔性展開層との部分接着に用いられる接着剤の接着力を強化することができる。
【0024】
これらの弗素含有ポリマーの微多孔性膜の作製には、1種または2種以上の弗素含有ポリマーを混合しても良いし、弗素を含まない1種または2種以上のポリマーや繊維と弗素含有ポリマーとを混合し、製膜したものでも良い。
【0025】
弗素含有ポリマーの微多孔性膜は、そのままでは表面張力が低く血球濾過層として用いようとしても、水性液体試料ははじかれてしまって膜の表面や内部に拡散、浸透しない。弗素含有ポリマーの微多孔性膜に親水性を付与し親水性を高めるために、弗素含有ポリマーの微多孔性膜の外部表面及び内部の空隙の表面を実質的に親水化するために充分な量の界面活性剤を弗素含有ポリマーの微多孔性膜に含浸させる。これにより、前記の水性液体試料がはじかれる問題点を解決することができる。
【0026】
水性液体試料がはじかれることなく膜の表面や内部に拡散、浸透、移送されるのに充分な親水性を弗素含有ポリマーの微多孔性膜に付与するには、次の条件が挙げられる。すなわち、一般に弗素含有ポリマーの微多孔性膜の空隙体積の約0.01%から約10%、好ましくは約0.1%から約5.0%、更に好ましくは0.1%から1%の界面活性剤で微多孔性膜の空隙の表面が被覆されることが必要である。例えば、厚さが50μmの弗素含有ポリマーの微多孔性膜の場合、含浸される界面活性剤の量は、一般に0.05g/m2から2.5g/m2の範囲であることが好ましい。弗素含有ポリマーの微多孔性膜に界面活性剤を含浸させる方法としては、まず、界面活性剤の低沸点(沸点約50℃から約120℃の範囲が好ましい)の有機溶媒(例えば、アルコール、エステル、ケトン)溶液に弗素含有ポリマーの微多孔性膜を浸漬する。溶液を微多孔性膜の内部空隙に実質的に充分に行きわたらせた後、微多孔性膜を溶液から静かに引き上げ、風(温風が好ましい)を送り乾燥させる方法が一般的である。血球濾過層を構成する微多孔性層に含有させる前処理試薬等の成分とともに界面活性剤を弗素含有ポリマーの微多孔性膜に含有させることもできる。
【0027】
弗素含有ポリマーの微多孔性膜を親水性化処理に用いられる界面活性剤としては、非イオン性(ノニオン性)、陰イオン性(アニオン性)、陽イオン性(カチオン性)、両性いずれの界面活性剤も用いることができる。
【0028】
これらの界面活性剤のうちでは、ノニオン性界面活性剤が、赤血球を溶血させる作用が比較的低いので、全血を検体とするための多層膜においては有利である。ノニオン性界面活性剤としては、アルキルフェノキシポリエトキシエタノール、アルキルポリエーテルアルコール、ポリエチレングリコールモノエステル、ポリエチレングリコールジエステル、高級アルコールエチレンオキシド付加物(縮合物)、多価アルコールエステルエチレンオキシド付加物(縮合物)、高級脂肪酸アルカノールアミドなどがある。
【0029】
ノニオン性界面活性剤の具体例として、次のものがある;
アルキルフェノキシポリエトキシエタノールとしては、イソオクチルフェノキシポリエトキシエタノール:(Triton X−100:オキシエチレン単位平均9〜10含有)(Triton X−45:オキシエチレン単位平均5含有)、ノニルフェノキシポリエトキシエタノール:(IGEPAL CO−630:オキシエチレン単位平均9含有)(IGEPAL CO−710:オキシエチレン単位平均10〜11含有)(LENEX 698:オキシエチレン単位平均9含有)、
アルキルポリエーテルアルコールとしては、高級アルコール ポリオキシエチレン エーテル:(Triton X−67:CA Registry No.59030−15−8)。
【0030】
弗素含有ポリマーの微多孔性膜は、その多孔性空間に水不溶化した1種または2種以上の水溶性高分子を設けることによって親水化したものでもよい。水溶性高分子の例として、酸素を含む炭化水素にはポリビニルアルコール、ポリエチレンオキサイド、ポリエチレングリコール、メチルセルロース、エチルセルロース、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、窒素を含むものにはポリアクリルアミド、ポリビニルピロリドン、ポリビニルアミン、ポリエチレンイミン、負電荷を有するものとしてポリアクリル酸、ポリメタアクリル酸、ポリスチレンスルホン酸などを挙げることが出来る。不溶化は熱処理、アセタール化処理、エステル化処理、重クロム酸カリによる化学反応、電離性放射線による架橋反応等によって行えばよい。
【0031】
ポリスルホンの微多孔性膜は以下に示すように製造することが出来る。すなわち、ポリスルホンをジオキサン、テトラヒドロフラン、ジメチルホルムアミド、ジメチルアセトアミド、N−メチル−2−ピロリドンあるいはこれらの混合溶媒等に溶解して製膜原液を作製する。続いて、これを支持体上に又は直接凝固液中に流延し洗浄、乾燥して作製する。ポリスルホンの微多孔性膜も弗素含有ポリマーと同様界面活性剤を含有させ、あるいは水不溶化した水溶性高分子を設けることによって親水化することができる。
【0032】
多孔性展開層は、水性の検体に含有されている成分を実質的に偏在させることなしに平面的に拡げ、単位面積当りほぼ一定量の割合で親水性ポリマー層に供給する機能を有する層である。これまでドライケミストリーに使われている展開層として公知の非繊維質及び繊維質の全ての多孔性材料を用いることができる。具体的には特開昭49−53888号公報に開示されているメンブランフィルター(ブラッシュドポリマー)に代表される非繊維性等方的微多孔質媒体層、特開昭55−90859号公報等に開示されたポリマーミクロビーズが水不膨潤性の接着剤で点接触状に接着されて成る連続空隙含有三次元格子粒状構造物層に代表される非繊維性多孔性層、特開昭55−164356号公報等に開示された織物布地からなる多孔性層、特開昭60−222769号公報等に開示された編物布地からなる層、各種の濾紙等を挙げることができるが、これらに限定されるものではない。
【0033】
展開層は、1層だけに限定する必要はなく、特開昭61−4959号公報、特開昭62−138756号公報等に開示されている様に、2層以上の層を重ねて用いることができる。展開層を2層以上重ねた多層膜については、検体のスポット時には全層が積層一体化されている構成をとることが必須であるが、その後のプロセスでは必ずしも一体化されている必要はない。必要に応じて、第一の展開層と第二の展開層の間を剥離した状態で使用することができる。
【0034】
展開層中には、検体の展開を促進するために、ノニオン、アニオン、カチオンまたは両性の界面活性剤を含ませることができる。また、展開性をコントロールする目的で、親水性のポリマー等の展開制御剤を含ませることができる。更に、目的とする検出反応を促進する為の、または干渉や妨害反応を低減もしくは阻止する為の各種試薬、あるいは試薬の一部を含ませることができる。
【0035】
展開層の厚さは、20〜200μm、好ましくは50〜170μm、更に好ましくは80〜150μmである。
【0036】
親水性ポリマー層には、これまでドライケミストリーに使われている公知の水に対して可溶性、膨潤性、親水性である各種ポリマーを用いることができる。水吸収時の膨潤率が30℃で約150%から約2000%、好ましくは約250%から約1500%の範囲の天然又は合成親水性ポリマーを使用することができる。具体的には、特開昭59−171864号公報、特開昭60−108753号公報等に開示されたゼラチン(例えば、酸処理ゼラチン、脱イオンゼラチン等)、ゼラチン誘導体(例えば、フタル化ゼラチン、ヒドロキシアクリレートグラフトゼラチン等)、アガロース、プルラン、プルラン誘導体、ポリアクリルアミド、ポリビニルアルコール、ポリビニルピロリドン等を挙げることができるが、これらに限定されるものではない。親水性ポリマー層に代えて、親水性表面を有する紙やポリマー多孔質膜を用いることもできる。
【0037】
親水性ポリマー層の厚さは、乾燥時に約1μmから約100μm、好ましくは約3μmから約50μm、特に好ましくは約5μmから約30μmであり、実質的に透明であることが好ましい。層中には、目的とする反応を促進する、または干渉や妨害反応を防止もしくは低減するための各種試薬あるいは試薬の一部を含ませることができる。
【0038】
支持体としては、これまでドライケミストリーに使われている公知の水不透過性の支持体を用いることができる。具体的には、ポリエチレンテレフタレート、ビスフェノールAのポリカーボネート、ポリスチレン、セルロースエステル(例えば、スルロースジアセテート、セルローストリアセテート、セルロースアセテートプロピオネート等)等から成る透明フィルムを用いることができる。支持体の厚さは、約50μmから1mm、好ましくは約80μmから約300μmである。
【0039】
支持体は、通常光透過性のものを用いるが、展開層側から測定をする場合には、着色されていても光不透過性であっても良い。
【0040】
支持体の表面には、必要により公知の下塗層または接着層を設けて親水性ポリマー層との接着を強固にすることができる。
【0041】
検体をスポット後に弗素含有ポリマーからなる微多孔性層を剥離除去する態様においては、展開層と微多孔性層とは接着されている必要は無く、検体の拡散・浸透が定量的に進行するように積層されていれば良い。
【0042】
(測定方法)
被検物質について説明する。本願発明では対象とする被検物質は特に限定されない。通常臨床検査の分野で測定される酵素、脂質、無機イオン、代謝産物、蛋白質等の他、各種グロブリン、免疫抗原、免疫抗体等の生体由来成分、薬物、ホルモン、腫瘍マーカー等、分析方法が確立していれば分析対象とすることができる。
【0043】
上記膜に検査試薬をスポットし、さらに検体を付与することにより、試薬と検体を反応させて生化学検査を行う。また、検査試薬と検体とを膜に同時に付与してもよい。
【0044】
スポットは自由に位置を変更することができ、図2のように必要に応じて複数種類の検査項目をマトリクス状にスポットすることができる。また、検体をスポットするノズルをディスポーザブルにすることにより、図2のように必要に応じて同一膜上に複数種類の検体をマトリクス状にスポットすることができる。
【0045】
検査試薬と検体とを膜に付与する方法として、微量の検体でかつ低コストで検査を行うためには、インクジェット法を用いることが好ましい。さらにバブルジェット法(登録商標)を用いるとよい。
【0046】
検査試薬および検体を膜にスポットした後、インキュベーションをして検査試薬と被検物質とを反応させる。好ましくは、膜周囲が覆われた囲いの中に置いた状態で加熱する方法で行う。これにより、周囲の温度、湿度に影響されることなく一定の乾燥状態となる。温度範囲は10〜60℃、好ましくは20〜50℃、更に好ましくは30〜45℃である。インキュベーション中の温度変動は±5℃、好ましくは±3℃、更に好ましくは±1℃である。
【0047】
必要に応じて、弗素含有ポリマーから成る界面活性剤を含有する微多孔性層を除去しても良い。
【0048】
分析すべき項目に対応した測定試薬溶液としては、ウェットケミストリーで公知の試薬溶液を用いることができる。これらは、検査対象成分と反応して、主として光学的手段で検出することができる。光学的な手段の例を挙げると、色変化、発色(呈色)、蛍光、発光、紫外線領域における吸収波長の変化、混濁発生等の変化を生じさせる。
【0049】
本発明の方法では、膜の水不透過性支持体を通して測光する方法が最も適用範囲が広いが、検体が全血ではない場合や検体供給後に微多孔性層を除去して測定する場合等には、透過測光方式により測定することができる。また、水不透過性支持体が不透明な場合には、支持体の反対側から測定することもできる。
【実施例】
【0050】
以下、本発明を実施例により更に具体的に説明する。なお、本発明は以下の実施例のみに限定されるものではない。
【0051】
(実施例1)
(1)膜の作製
ゼラチン様の下塗のある厚さ180μmのポリエチレンテレフタレートの透明フィルムベースの上に、0.2%のノニオン界面活性剤p−ノニルフェノキシポリグリシドール(グリシドール単位平均10含有)を含むゼラチンを、乾燥膜厚がおよそ15μmになるように塗布・乾燥する。その上に、界面活性剤を用いて親水化処理したポリエステル編物布地を特開昭62−224299号公報に記載の方法に従ってラミネートする。更に、7%のポリビニルピロリドン(平均分子量120万)をポリエステル編物展開層の上に2g/m2の塗布量となる様に塗布する。
【0052】
(2)弗素含有ポリマーの親水化処理
ポリテトラフルオロエチレンの微多孔性膜(Zitex A135(米国ノートン社製))を、20%のTriton X−100を含むエタノール溶液に含浸する。微多孔中に含まれる空気を除去して、微多孔の中に該活性剤溶液を十分に浸透させた後、該溶液から引き上げて、50℃の乾燥風を吹き付けて乾燥させる。
【0053】
(3)(1)で作製した膜を15mm×15mmの大きさに切りだす。一方、(2)で作成した親水化処理した弗素含有ポリマーの微多孔性膜を15mm×15mmに切りだし、前記膜の上に重ねる。これを、特開昭57−63452号公報に記載されている方法でプラスチック枠の中に組み込み、膜を完成させる。
【0054】
(4)GGT測定試薬溶液の調製
pH8.1のトリスバッファー(10mM)溶液10mlに、TritonX−100を10μl、グリシルグリシンを156mg及びL−γ−グルタミル−3−カルボキシ−4−ニトロアニリドを5.9mg溶解し、GGT測定試薬溶液を調製する。
【0055】
(5)検体のスポット
健常者からヘパリン採血した全血検体を2mlずつ3本の試験管に分け、試験管2及び3にはそれぞれ10μl、20μlの10000U/Lの上記調製したGGT測定試薬溶液を含む生理食塩水を添加する。なお、試験管1は生理食塩水を添加せず、上記全血検体のみを含む。上記(3)で作製した膜の上から、上記試験管1から3の全血検体のサンプル各20μlを、インクジェット法を用いて各サンプルにつき3枚ずつスポットする。全血は、該微多孔性膜上で横に広がりつつ、内部に浸透した。約10秒後に、拡散が完全に進行したことを確認した後、ピンセットを用いて該微多孔性膜を剥離除去する。
【0056】
(6)インキュベーション
上記試料を点着した分析要素を、特願平2−90562号公報に記載の方法に従って、37℃で10分間開放系中で加温し、乾燥させる。
【0057】
(7)測定
測定試薬溶液を膜にスポットしてから1分後と5分後の反射光学濃度の差(ΔODR)を求める。
【図面の簡単な説明】
【0058】
【図1】本発明の実施の形態における膜を例示する模式図である。
【図2】本発明の実施の形態における膜に検査試薬及び検体をスポットする模式図である。
【符号の説明】
【0059】
1 血球濾過層
2 展開層
3 反射層
4 親水性ポリマー層
5 支持体
6 膜
【特許請求の範囲】
【請求項1】
検査試薬および検体を膜に噴射することによって付与し、該膜で該検査試薬と該検体とを反応させる生化学検査方法。
【請求項2】
インクジェット法を用いて前記膜に前記検査試薬および前記検体を付与する、請求項1に記載の生化学検査方法。
【請求項3】
前記インクジェット法がバブルジェット(登録商標)法である請求項2に記載の生化学検査方法。
【請求項4】
前記膜が多層膜で構成される請求項1乃至3のいずれかに記載の生化学検査方法。
【請求項5】
前記検体中の検査対象成分を光学的手段で検出することを含む請求項1乃至4のいずれかに記載の生化学検査方法。
【請求項6】
前記検査試薬および前記検体を前記膜にマトリクス状にスポットする請求項1乃至5のいずれかに記載の生化学検査方法。
【請求項7】
検査試薬および検体を膜に噴射する手段と、
該検査試薬と該検体とを該膜において反応させる手段と、
前記検体中の検査対象成分を検出する手段と、
を有する生化学検査装置。
【請求項8】
前記検出手段が光学的手段である請求項7に記載の生化学検査装置。
【請求項9】
前記検査試薬及び検体をマトリクス状にスポットする請求項7または8に記載の生化学検査装置。
【請求項10】
前記検体をスポットするためのノズルが使い捨てである請求項7乃至9のいずれかに記載の生化学検査装置。
【請求項1】
検査試薬および検体を膜に噴射することによって付与し、該膜で該検査試薬と該検体とを反応させる生化学検査方法。
【請求項2】
インクジェット法を用いて前記膜に前記検査試薬および前記検体を付与する、請求項1に記載の生化学検査方法。
【請求項3】
前記インクジェット法がバブルジェット(登録商標)法である請求項2に記載の生化学検査方法。
【請求項4】
前記膜が多層膜で構成される請求項1乃至3のいずれかに記載の生化学検査方法。
【請求項5】
前記検体中の検査対象成分を光学的手段で検出することを含む請求項1乃至4のいずれかに記載の生化学検査方法。
【請求項6】
前記検査試薬および前記検体を前記膜にマトリクス状にスポットする請求項1乃至5のいずれかに記載の生化学検査方法。
【請求項7】
検査試薬および検体を膜に噴射する手段と、
該検査試薬と該検体とを該膜において反応させる手段と、
前記検体中の検査対象成分を検出する手段と、
を有する生化学検査装置。
【請求項8】
前記検出手段が光学的手段である請求項7に記載の生化学検査装置。
【請求項9】
前記検査試薬及び検体をマトリクス状にスポットする請求項7または8に記載の生化学検査装置。
【請求項10】
前記検体をスポットするためのノズルが使い捨てである請求項7乃至9のいずれかに記載の生化学検査装置。
【図2】


【図1】




【図1】


【公開番号】特開2008−275371(P2008−275371A)
【公開日】平成20年11月13日(2008.11.13)
【国際特許分類】
【出願番号】特願2007−116909(P2007−116909)
【出願日】平成19年4月26日(2007.4.26)
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
【公開日】平成20年11月13日(2008.11.13)
【国際特許分類】
【出願日】平成19年4月26日(2007.4.26)
【出願人】(000001007)キヤノン株式会社 (59,756)
【Fターム(参考)】
[ Back to top ]

