生物学的検定において磁性粒子を処理するための構造体および方法
【課題】 生物学的検定において磁性粒子を処理するための構造体および方法。
【解決手段】 引き込み式のマグネット4およびプローブ3を備えた、生物学的サンプル内の磁性粒子を操作するための磁気ハンドリング構造体1a、ならびに生物学的サンプルの磁性粒子の処理方法。
【解決手段】 引き込み式のマグネット4およびプローブ3を備えた、生物学的サンプル内の磁性粒子を操作するための磁気ハンドリング構造体1a、ならびに生物学的サンプルの磁性粒子の処理方法。
【発明の詳細な説明】
【技術分野】
【0001】
以下は、全般的にはサンプル内において関心対象種目(アイテム)を判定するための構造体および方法に関する。より具体的には、以下、DNA、RNA、断片、補体、ペプチド、ポリペプチド、酵素、プリオン、たんぱく質、メッセンジャーRNA、転移RNA、ミトコンドリアRNAまたはDNA、抗体、抗原、アレルゲン、細胞またはバイロンなどの生物学的実体の一部、表面たんぱく質、上記のものの機能等価物などの指定領域のすべてまたは一部分であるか、これを含むことができる関心対象種目の判定に関する。
【背景技術】
【0002】
患者の健康に関する情報を提供するためには、患者の体液などの患者サンプルに対して、数多くの試験を実行することができる。これらの体液には、血清、全血(whole blood)、尿、スワッブ(swab)、血漿(plasma)、脳脊髄液、リンパ液、中実組織などを含むことができる。
【発明の概要】
【発明が解決しようとする課題】
【0003】
患者の体液に対して実施した試験によって、体液内における上述したものなどの関心対象種目を判定することができる。患者の体液内の関心対象種目のこの判定に基づいて、患者の健康状態に関する情報を得ることができる。
【課題を解決するための手段】
【0004】
本発明の態様の1つでは、サンプル内での関心対象種目の判定を、単一構造体を用いて実施する方法が提供される。サンプルは、この単一構造体に対してアクセス可能となるように提供されている。サンプルを処理するための第1の収容器は、この単一構造体の第1の処理経路に配置される。サンプルは、第1の処理経路において第1の収容器まで移送される。第1の処理経路において、第1の収容器にある試薬が加えられる。第1の収容器の内容物は、第1の処理経路において混合される。サンプル内の関心対象種目は、第1の処理経路において第1の収容器の内容物から分離される。サンプル内の分離された関心対象種目は、単一構造体で、第1の処理経路にある第1の収容器から第2の処理経路にある第2の収容器まで移送される。第2の収容器の内容物は、第2の処理経路において、第1の処理経路の温度と異なる第1の温度に至らされる。第2の収容器内の関心対象種目は、第2の処理経路において検出される。
【0005】
別の方法では、サンプルが単一構造体の第1の処理経路にある第1の収容器まで移送される。サンプル内の関心対象種目は、第1の処理経路において第1の収容器の内容物から分離される。サンプル内の分離された関心対象種目は、単一構造体の第1の処理経路にある第1の収容器から、第2の処理経路にある第2の収容器まで移送される。第2の収容器の内容物は、第2の処理経路において第1の処理経路の温度と異なる第1の温度に至らされる。関心対象種目は、第2の処理経路にある第2の収容器において検出される。
【0006】
追加的な方法では、サンプルが、単一構造体の処理経路にある収容器まで移送される。サンプル内の関心対象種目は、この処理経路において収容器の内容物から分離される。収容器の内容物は、処理経路において第1の温度に至らされる。収容器の内容物は、処理経路において第1の温度と異なる第2の温度まで至らされる。関心対象種目は、処理経路にある収容器において検出される。
【0007】
また別の方法では、サンプルが、単一構造体の第1の処理経路にある第1の収容器まで移送される。このサンプルは、単一構造体の第1の処理経路にある第1の収容器から、第2の処理経路にある第2の収容器まで移送される。第2の収容器の内容物は、第2の処理経路において第1の処理経路の温度と異なる第1の温度に至らされる。関心対象種目は、第2の処理経路にある第2の収容器において検出される。
【0008】
さらに別の方法では、サンプルが、単一構造体の処理経路にある収容器まで移送される。収容器の内容物は、単一構造体の処理経路において第1の温度まで至らされる。収容器の内容物は、単一構造体の処理経路において第1の温度と異なる第2の温度まで至らされる。関心対象種目は、単一構造体の処理経路にある収容器において検出される。
【図面の簡単な説明】
【0009】
【図1】本明細書に記載した収容器構造体の斜視図である。
【図2】図1の収容器構造体の斜視図である。
【図3A】本発明と共に使用することがある装置の一実施形態の全体上面図である。
【図3B】図3Aに示した装置の斜視図である。
【図4】図3Aおよび3Bの装置と共に使用するためのサンプルキューの斜視図である。
【図5A】図3Aおよび3Bに示した装置と共に使用することができるコンポーネントの斜視図である。
【図5B】図3Aおよび3Bに示した装置と共に使用することができるコンポーネントの斜視図である。
【図5C】図3Aおよび3Bに示した装置と共に使用することができるコンポーネントの斜視図である。
【図5D】図3Aおよび3Bに示した装置と共に使用することができるコンポーネントの斜視図である。
【図5E】図3Aおよび3Bに示した装置と共に使用することができるコンポーネントの斜視図である。
【図5F】図3Aおよび3Bに示した装置と共に使用することができるコンポーネントの斜視図である。
【図6】図3Aおよび3Bの装置と共に使用するための収容器および搬送機の斜視図である。
【図7】図3Aおよび3Bに示した装置と共に使用するためのピペット先端ローダの斜視図である。
【図8】図3Aおよび3Bに示した装置と共に使用するためのピペット先端ローダの別の実施形態の斜視図である。
【図9】図3Aおよび3Bの装置と共に使用するための収容器ローダの斜視図である。
【図10】図3Aおよび3Bに示した装置と共に使用するための収容器運搬装置の斜視図である。
【図11】図10の一部分の拡大図である。
【図12A】図1に示した収容器の代替的な実施形態の斜視図である。
【図12B】図1に示した収容器の代替的な実施形態の斜視図である。
【図12C】図1に示した収容器の代替的な実施形態の斜視図である。
【図12D】図1に示した収容器の代替的な実施形態の斜視図である。
【図12E】図1に示した収容器の代替的な実施形態の斜視図である。
【図12F】図1に示した収容器の代替的な実施形態の斜視図である。
【図12G】図1に示した収容器の代替的な実施形態の斜視図である。
【図12H】図1に示した収容器の代替的な実施形態の斜視図である。
【図12I】図1に示した収容器の代替的な実施形態の斜視図である。
【図12J】図1に示した収容器の代替的な実施形態の斜視図である。
【図12K】図1に示した収容器の代替的な実施形態の斜視図である。
【図12L】図1に示した収容器の代替的な実施形態の斜視図である。
【図12M】図1に示した収容器の代替的な実施形態の斜視図である。
【図12N】図1に示した収容器の代替的な実施形態の斜視図である。
【図12O】図1に示した収容器の代替的な実施形態の斜視図である。
【図12P】図1に示した収容器の代替的な実施形態の斜視図である。
【図12Q】図1に示した収容器の代替的な実施形態の斜視図である。
【図12R】図1に示した収容器の代替的な実施形態の斜視図である。
【図13】図12Eの収容器の混合機との係合を表した図である。
【図14】図3Aおよび3Bの処理経路と動作可能な関係で設けられたポートの図である。
【図15】図3Aおよび3Bの装置と共に使用するためのピペッタの分解斜視図である。
【図16】図15のピペッタの1つの動作を表した図である。
【図17】図15のピペッタの別の動作を表した図である。
【図18】図3Aおよび3Bの装置と同様の装置の代替的な実施形態の等角図である。
【図19】図18の装置と実質的に同様の装置の等角図である。
【図20】図3Aおよび3Bの装置と実質的に同様の別の装置の上面図である。
【図21】図20の装置と実質的に同様の別の装置の上面図である。
【図22】図21の装置と実質的に同様の別の装置の上面図である。
【図23】図22の装置と実質的に同様の別の装置の上面図である。
【図24】図23の装置と実質的に同様のまた別の装置の上面図である。
【図25】図3Aおよび3Bの装置と同様のまた別の装置の上面図である。
【図26】図3Aおよび3Bの装置と同様のまた別の装置の上面図である。
【図27A】図3Aおよび3Bの装置と共に使用するための収容器およびシールの斜視図である。
【図27B】図3Aおよび3Bの装置と共に使用するための収容器およびシールの斜視図である。
【図27C】図3Aおよび3Bの装置と共に使用するための収容器およびシールの斜視図である。
【図27D】図3Aおよび3Bの装置と共に使用するための収容器およびシールの斜視図である。
【図27E】図3Aおよび3Bの装置と共に使用するための収容器およびシールの斜視図である。
【図27F】図3Aおよび3Bの装置と共に使用するための収容器およびシールの斜視図である。
【図28】本発明と共に使用することができる光学構成の斜視図である。
【図29】本明細書に記載した構造体の一部分の動作の全体図である。
【図30A】本発明と共に使用することができる熱サイクリングモジュールの断面図である。
【図30B】図30Aのモジュールの上面図である。
【図31】図30Aのモジュールの断面図である。
【図32A】別の熱サイクリングモジュールの断面図である。
【図32B】図32Aのモジュールの上面図である。
【図33】さらに別の熱サイクリングモジュールの全体平面図である。
【図34A】本明細書に記載した図3Aおよび3Bの装置と実質的に同様のさらに別の装置の斜視図である。
【図34B】図34Aの装置の全体上面図である。
【図35A】図34Aの装置と共に使用するための代替サンプル調製処理エリアの斜視図である。
【図35B】図35Aの代替サンプル調製処理エリアの追加的な斜視図である。
【図35C】図35Aの代替サンプル調製処理エリアの追加的な斜視図である。
【図35D】図35Aの代替サンプル調製処理エリアの追加的な斜視図である。
【図35E】図35Aの代替サンプル調製処理エリアの追加的な斜視図である。
【図35F】図35Aの代替サンプル調製処理エリアの追加的な斜視図である。
【図35G】図35Aの代替サンプル調製処理エリアの追加的な斜視図である。
【図36A】図35Aの代替サンプル調製処理エリアの別の図である。
【図36B】図36Aに含まれるマグネットの斜視図である。
【図37】図35Aの代替サンプル調製処理エリアと共に使用するためのコンポーネントの側面断面図である。
【図38】意図的に空白としている。
【図39】図34Aの装置と共に使用するための先端単離格納容器アセンブリの斜視図である。
【図40A】図35Aの代替サンプル調製処理エリアと共に使用するための代替マグネット構成の斜視図である。
【図40B】図35Aの代替サンプル調製処理エリアと共に使用するための別の代替マグネット構成の側面図である。
【図40C】図35Aの代替サンプル調製処理エリアと共に使用するための別の代替マグネット構成の側面図である。
【図40D】図40Bおよび40Cに示した代替マグネット構成と連携させたピペッタの側面図である。
【図40E】図35Aの代替サンプル調製処理エリアと共に使用するための代替的なマグネットアセンブリの斜視図である。
【図41】図35Aの代替サンプル調製処理エリアと共に使用するための代替マグネット構成の側面図である。
【図42A】磁気パターンの1つの図である。
【図42B】別の磁気パターンの1つの図である。
【図42C】さらに別の磁気パターンの1つの図である。
【図43】複数の磁気構成を用いた動作性能データの図である。
【図44】マグネットアレイおよびチューブ保持器アセンブリの図である。
【図45】マグネットおよびチューブ保持器のパターンの1つの図である。
【図46】マグネットおよびチューブ保持器のパターンの別の1つの図である。
【図47】図46に示したパターンの2つのコピーを備えており、かつマグネットが発生させる磁束をより十分に活用できるように、追加的なチューブ保持器をアセンブリの周囲に配置させている、マグネットおよびチューブ保持器パターンの図である。
【図48】核酸結合磁性粒子の洗浄のための収容器1とマグネット(複数のこともある)の好ましい相対的移動を表した図である。
【図49】核酸を磁性粒子から溶離するための収容器1とマグネット(複数のこともある)の好ましい相対的移動を表した図である。
【発明を実施するための形態】
【0010】
本明細書に記載した実施形態は、サンプル内の関心対象種目を判定するための方法および構造体に関する。この関心対象種目は、DNAまたはRNAの1つまたは複数の指定領域であることができ、あるいは断片、補体、ペプチド、ポリペプチド、酵素、プリオン、たんぱく質、メッセンジャーRNA、転移RNA、ミトコンドリアRNAまたはDNA、抗体、抗原、アレルゲン、細胞またはバイロンなど生物学的実体の一部、表面たんぱく質、これらのいずれかの機能等価物、これらのいずれかの濃度または別の所望のサンプル要素であることができる。例示的な一実施形態では、関心対象種目は、CT、CT/GC、MT、HCV、HBV、HPV、HIV、CMV、HLA、HTLV、および感染疾患、遺伝的マーカ、がん、心臓血管性種目、薬理遺伝学的種目など(ただしこれらの限らない)に関連するその他の種目(ただしこれらの限らない)を含む、特異的なDNAまたはRNA領域、抗体、または抗原(ただしこれらの限らない)から選択することができる。いくつかの実施形態では、その関心対象種目は、HCVに対する抗体、HIV 1/HIV 2に対する抗体、B型肝炎コア抗原に対する抗体(HBcAb)、がん胎児性抗原(CEA)、がん抗原19−9(CA19−9)、B型肝炎表面抗原(HBsAg)、B型肝炎表面抗原に対する抗体(HBsAb)、アルファ胎児たんぱく質(AFP)、総前立腺特異抗原(Total PSA)、遊離PSA、甲状腺刺激ホルモン(TSH)、黄体形成ホルモン(LH)、卵胞刺激ホルモン(FSH)、ベータヒト絨毛性ゴナドトロピン(B−hCG)、遊離チロキシン(Free T4)、遊離トリヨードサイロニン(Free T3)、総T4、総T3、プロゲステロン、テストステロン、エストラジオール、プロラクチン、ビタミンB12(B12)、葉酸塩、グリコヘモグロビン(Glycated Hemoglobin)、およびフェリチン(ただしこれらの限らない)から選択することができる。本質的に、ほとんどどのようなものもこの関心対象種目となり得る。
【0011】
本明細書に記載した構造体および方法は、多くの異なる構成で利用することができる。理解しやすくするため、そのDNA/RNAサンプルの調製、増幅、ならびにサンプル内において関心対象種目に対して1時間あたり概ね100回以上の判定を実施する、あるいはサンプル調製が分割されている場合は、サンプル内において関心対象種目に対して1時間あたり概ね300回以上の判定を実施する検出分析器に関して、この構造体および方法を用いることを検討することにする。別法としてこの同じ構造体は、免疫学的検定の分析器として使用することや、免疫学的検定の分析器とDNA/RNA分析器の両者として使用することができる。この構造体および方法は、1時間あたり600回、400回、200回、50回などの判定を実施する分析器などの別の利用形態で用いることができることに留意すべきである。
【0012】
所与の時間期間で実施される試験の回数(スループット)の変更、判定しようとする関心対象種目の調整など個々のニーズに適合するように、多くの構造体を互いに結合させたり、統合させたりすることができる。たとえば、所与の1時間でY回の判定を実施するX個の構造体を、接続させ、接続したこの構造体によって、1時間あたりXY回の判定を実施させることができる。所望であれば、これらの構造体のリソースは、米国特許第6,022,746号で開示されている方式と実質的に同様の方式で割り当てることができる。当該の出願は、本件の譲受人に譲渡されており、その開示の全体を本明細書に組み込むものとする。
【0013】
別の実施形態では、1つまたは複数の構造体を、免疫学的検定の分析器(たとえば、以下で参照する米国特許第5,795,784号で開示されたもの)、血液分析器(たとえば、以下で参照する米国特許第5,891,734号で開示されたもの)など別の分析器と、動作可能に接続させることがある。
【0014】
こうした構造体のすべてが、関心対象の種目を実質的に同じ方法で、すべて同じ判定を実施することに留意すべきである。たとえば、すべての同様の関心対象種目に対するすべての判定処理工程は、与えられた構造体によって実施しようとする判定回数と無関係に、36秒間など同じ時間枠内で実施することができる。これらの構造体は、試薬などの共通要素、使い捨て品、流体やその他の別の要素、搬送技術、判定工程実施メカニズム、ソフトウェアなどを含むことがある。
【0015】
別の用途では、その構造体が、臨床化学または血液学分析器などの異なる構造体または分析器と共に、同じ設定で使用できるように、その構造体は、たとえばコンベアシステムその他と、ならびに支援するハードウェアやソフトウェアと結合させることができる。このコンベアシステムは、1つのサンプルに関して様々な判定を実施できるようにするため、構造体間においてサンプルを移動させることができる。さらに、本明細書では理解しやすくするため1つのみの構造体に関して、構造体の動作を記載しているが、複数の構造体が、同時にまたは異なる時点のいずれかで、同じ方式または異なる方式で動作することが可能であることに留意すべきである。さらに、ある動作方法に関する工程を、別の動作方法の工程と組み合わせて、さらに多くの動作方法を得ることができる。
【0016】
本明細書に記載した構造体または方法はいずれも、米国特許第5,856,194号および同第6,413,780号など、目下のところで利用可能な文献に記載されている構造体および方法を含み、別の構造体や方法あるいはこれらの一部分と、適切な任意の方式で結合させることができる。
【0017】
本明細書に記載した構造体の構築は、様々な関心対象種目に関する試料を費用対効果が高い方法で分析することを目的としている。この構造体によって、ユーザは、この構造体にサンプルを供給すること、構造の処理(たとえば、当該サンプルに対するインキュベーション、調製、溶解(lyse)、溶離、分析、読み取り、等々)を有すること、ならびに処理の結果として構造体レポートを有することが可能となる。構造体サブコンポーネントとしては、そのうちのいくつかのみを示すと、サンプルや試薬などの材料に対する、混合、吸引および分与、インキュベーション、化学分離、および検出についての装置および方法を含む。一般的には、化学オートメーションに関する構造体構築の実現形態は、所望の患者サンプル添加方法、試薬添加方法、スループット(所与の時間期間あたりの判定回数)、汚染低減方法、検出方法、混合の程度、インキュベーション温度、および持続時間の必要性などの多くの要因によって、駆動させることができる。
【0018】
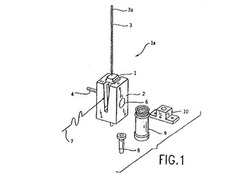
図1は、スループットを相対的に低下させた(各1.5時ごとに約1回の判定などの)環境に適した構造体1aを開示している。この構造体1aは、ベース2内に着脱可能に配置された第1の収容器1を備えている。
【0019】
図示した実施形態では、第1の収容器1は、ある選択量の流体(たとえば、約7mLのサンプルおよび試薬)を包含するだけのサイズとしている。しかし、本発明では、収容器に関して様々な形状およびサイズを使用することが可能であることを理解すべきである。図12Aから図12Pは、第1の収容器1に関する多種多様な代替的な構築を表している。
【0020】
ベース2は、たとえば、上で言及した米国特許第5,795,784号に開示されている処理経路の構築と同様の構築を含み、収容器を受け容れるための適切な任意の構築を有することができる(この場合、図1および図2に示した構造体は、処理経路に沿った適切な箇所に配置されることができる)。もちろん、ベース2は、第1の収容器1の様々な構築を収容するすなわち補完するように修正することができる。
【0021】
ベース2は、機械加工したまたはコーティングしたアルミニウムなどの適切な任意の材料から製作することができる。例示的な一実施形態では、ベース2は、MIL−A−63576 Type I仕上げを伴った6061−T6アルミニウムによって製作されている。第1の収容器1は、さらに、ポリエチレン(たとえば、DOW 30460M HDPEまたはChevron 9512)、ポリプロピレン(たとえば、Montel PD701NやPD702などその代替品)、あるいはポリスチレン(たとえば、DOW 666)による成型物を含み、適切な任意の材料から製作されることができる。
【0022】
プローブ3は、所望の方向(たとえば、X軸、Y軸、および/またはZ軸)へのプローブ3の動きを制御する適切な駆動装置に取り付けられていることが好ましい。所望の動きを提供する任意の駆動装置が、適切であるが、知られている適切な駆動装置としては、Tecanガントリ(Tecan RSPモデルシリーズ(Tecan、スイス))およびAbbott theta−Z ロボット(部品番号78479、Abbott Laboratories、Abbott Park、Illinois)が含まれる。
【0023】
プローブ3は、箇所3aにおいて、プローブ3に吸引および分与機能の実行を可能にさせる適切な構造体(図示せず)と流体接続されている。たとえば、これらの流体機能は、目的とした機能に適した任意のポンプ(たとえば、シリンジ式、ぜん動式(peristaltic)、等々)やバルブ技術を使用して実現することができる。
【0024】
引き込み式マグネット4は、以下で記載するように、第1の収容器1内のサンプル内での関心対象種目の所与の判定の実施中の選択した時点で、第1の収容器1およびベース2に対して移動できるように適切に支持されている。マグネット4の移動によって、その判定処理の工程の実施を有効にすることができ、これによって、当該の工程を、希望に応じて選択的に自動的に実施または回避することが可能となる。一実施形態では、そのマグネット4は、収容器1に相対的に近づくように移動され、第1の収容器1内の磁気応答粒子を第1の収容器1の側壁に引き寄せ、これにより、患者サンプル内の所望の関心対象種目に結合されていることがあるこれらの磁気応答粒子を、残りの患者サンプルまたは第1の収容器1の他の内容物から分離させることができる。
【0025】
こうしたマグネット4によりもたらされる分離の前、分離中、または分離後に、プローブ3によって、第1の収容器1の内容物の一部分を、廃棄物/洗浄リザーバ10に吸引することがある。関心対象種目の判定を強化するためには、引き続いて分与、分離、および吸引の工程が利用されることができる。磁気式分離を希望しない場合(すなわち、磁気式分離工程を回避する場合)の判定期間中に、第1の収容器1およびその内容物に対するマグネット4の磁場の影響を低下させるために、マグネット4を、第1の収容器1から離れるように適切に移動させることができる。
【0026】
別法として、いずれの関心対象種目にも付着されない磁気応答粒子は、第1の収容器1の側壁に引きつけられ、また一方、第1の収容器1の残りの内容物(関心対象種目を含む可能性がある)は、プローブ3などによって第1の収容器1から取り除かれる。
【0027】
このベース2にはさらに、加熱および/または冷却を提供するために、温度調節デバイス7が設けられることもできる(こうした調節を希望する場合)。このデバイス7は、ベース2と手動式または自動式で着脱可能に接続されることができ、適切な制御装置(適切なルーチンを実行させるメモリを備えたコンピュータなど)によって動作させることができ、また伝導、対流、および/または輻射、等々を含む適切な任意の熱伝達手段を利用することができる。たとえば、温度調節された(加熱されたかつ/または冷却された)空気を、第1の収容器1に対して移動させ、第1の収容器1の内容物を所望の方式で温度調節することができる。
【0028】
関心対象種目に対する所与の判定の実施中の様々な時点で、サンプルまたは試料の収容器8(試験管やその他など)内に配置させたサンプルと、試薬収容器9内に包含させた試薬とを、プローブ3の使用などによって第1の収容器1に添加することができる。複数のサンプルおよび/または試薬が望ましい場合は、複数の収容器8および/または9のコンベア、回転ラック(carousel)、再循環することもあり得る移動可能または静止式の別の構成などのアレイを、提供することも可能である。サンプルおよび試薬の収容器8および9は、たとえば、ポリマー様ポリスチレン(DOW 666)、高密度ポリエチレン(DOW 30460M HDPEまたはChevron 9512)、その他を含み適切な任意の材料から製作されることができる。
【0029】
収容器8または9のいずれかの内容物の保存性を向上させるために、サンプルと試薬収容器8、9のいずれか一方または両方に対して、上で言及した米国特許第5,795,784号に開示されているカバーと実質的に同様のカバー30(図5C参照)を設けることができる。このカバー30は、Lexington Medical 3481005 EPDM、Abbott EPDM(Ashland、Ohio)などの適切な任意の材料から製作することができる。適切な収容器8および9、ならびに対応するカバーは、上で言及した米国特許第Des.401,697号、同第Des.401,699号、および同第Des.397,938号に示されている。収容器(収容器8など)を別の収容器または搬送機にはめ込むための方法は、同じ所有者による米国特許第5,915,583号に記載されており、これも本発明の趣旨の域内で使用することができる。
【0030】
第1の収容器1にサンプルおよび/または試薬を添加した後、プローブ3を、適切に洗浄して汚染物を除去し、これにより第1の収容器1が、それ以降汚染物に曝露される可能性を低下させることができる。たとえば、プローブ3に対する流体洗浄のために、プローブ3を、廃棄物/洗浄リザーバ10に移動させることができる。プローブ3は、別法として、その開示全体を参照によって本明細書に組み込むものとする米国特許第5,232,669号に開示されているピペッタ先端などの使い捨て式先端を組み込むように修正されることができ、この使い捨て式先端は、目的とした用途を完了したのち、プローブ3との流体/運搬インタフェースから廃棄するように排出される。図5Fは、使い捨て式先端28の別の例を示している。
【0031】
ベース2内には、ボア6など所望の検出器を収容するための適切な開口を設けることができ、検出器は、光電子増倍管、フォトダイオードなどの構造体によって使用するのに有利である。図示した図1の実施形態では、米国特許第5,795,784号に開示されたのと同じ構造体と同様の方式で、そのボア6を、マグネット4と反対位置に配置させている。したがって、蛍光物質その他などのラベルが発生させた化学ルミネセンスその他の信号の検出など、同様の動作が可能である。
【0032】
ベース2上には、さらに図2に示した適切な混合機5が設けられている。混合機5は、たとえば、所望の時点で第1の収容器1に軌道運動を誘導し、第1の収容器1の内容物を混合させることができる力を、混合機5に加える適切な駆動装置5aと結合させている。適切な混合機の代替的な構築は、図13および米国特許第5,795,784号に示されている。
【0033】
ベース2は、混合機5に対して所望の混合の達成を可能にするために、第1の収容器1の移動の自由を制限するように構築されている。この点に関する支援のために、ベース2は、さらに蓋(図示せず)を含むことができる。
【0034】
所望であれば、図1に示した構造体1aは、相対的に高いスループットの環境を提供するために、所与の時間期間内に約100回などより多くの判定回数を実行するように修正することができる。このように修正する場合、その各々が、プローブ3、マグネット4、混合機5、検出器用のボア6、および温度調節デバイス7のうちの1つまたは複数を実際的に含むように、構造体1aのアレイを、互いに動作可能に接続させることができ、こうした要素は、接続される各構造体1aに個々に設けられているか、あるいは構造体1a同士で適切に共有されている。プローブ3、マグネット4、検出器6、加熱/冷却素子7、および/または混合機5は、選択的に作動され、サンプルおよび試薬の吸引および分与などの所望の作用を、判定処理中の所望の時点で実行させることができ、こうした構成は、所望の工程を達成するためにこれらのコンポーネントの選択的な自動操作に特によく適したものである。こうした構成では、サンプル内での関心対象種目の判定は、複数の位置にわたって、または複数の構造体1aにより実施することができ、これにより、少なくとも2つのサンプルを、実質的に同時に処理することが可能となる。
【0035】
複数の構造体1aの操作上の接続を円滑にするには、コンベア(有界式(bounded)やエンドレス式)、回転ラック、その他などの運搬システムを用いて、第1の収容器1をある構造体1aから別の構造体まで移動させることができる。運搬システムは、上で言及した米国特許第5,795,784号に開示されている処理経路と実質的に同様とすることができる。構造体(複数のこともある)1aの箇所に応じて、その運搬システムおよび/または個々の構造体は、所与の時点で実施することを希望する機能のみを、判定に提供するように構築することができる。たとえば、相対的に多くの回数の(たとえば、100回の)構造体1aを、互いに動作可能に接続させることがあり、かつ構造体1aのあるサブセット(たとえば、5個)だけが、混合機5を含むことができる。
【0036】
図3A、図3B、および図18は、実質的に互いに隣接して配置された複数の構造体1aを本質的に含む装置100を表している。この実施形態では、第1の収容器1は、収容器ローダおよび図9に示した運搬装置35から第1の処理経路11まで、実質的に自動的にロードされる。別法として、第1の収容器1は、米国特許第5,795,784号に記載された方式で手動式や自動式でロードすることができる。収容器1は、たとえば選択した各時間間隔ごとに(各36秒ごとなどに)1つの位置として、実施中の判定に関する目的とするフォーマットまたはプロトコルの要件に従って、様々な動作(試薬添加、サンプル添加、インキュベーション、混合、洗浄、その他など)を選択的に自動的に実行する場所である第1の処理経路11に沿った様々な箇所まで、第1の処理経路11を通って移動されている。装置100の例示的な一実施形態では、第1の収容器1は、第1の処理経路11に沿って概ね各36秒ごとに、概ね1.2インチ(約3cm)移動される。
【0037】
第1の処理経路11は、第1の処理経路11をある所望の温度に維持するために、少なくとも1つの適切な温度制御装置またはヒータを含んでいる。第1の処理経路11は、複数のヒータを用いるなどによって、ある1つの温度に、あるいは所望の任意の数の温度に保持されることができる。たとえば一実施形態では、ヒータは、第1の処理経路11を摂氏約37度に維持することができ、また一方、別の実施形態では、第1の処理経路11のある一部分は摂氏約37度に維持されながら、第1の処理経路の別の一部分は摂氏約70度に維持されることができる。 第1の処理経路11を少なくとも1つの温度まで加熱する一方、この少なくとも1つの温度に維持された収容器1を、別の温度から隔絶させるためには、適切な任意の方法を使用することができる。したがって一例として、第1の処理経路11は、摂氏約37度で約20分間の溶解などの第1のインキュベーションと、摂氏約50度にで約20分間の溶離などの第2のインキュベーションとを、単一の第1の収容器1によって実施するために使用されることができる。溶解と溶離の両方のために第1の処理経路11で使用される収容器1は、収容器1を、第1の温度に曝露させながら、第2の温度から熱的に隔絶させること、ならびにこの逆とさせることができる。
【0038】
一例として、第1の処理経路11は、アルミニウムその他など適切な材料から製作することができ、こうした場合で、第1の処理経路11を、ある適切な時点で第1の温度または第2の温度まで加熱(たとえば、伝導的に加熱)する場合には、第1の処理経路11のうち第1の温度に曝露させた部分を、第1の処理経路11の第2の温度に曝露させた部分から断熱するために1つの部材が導入されることができる。この部材は、断熱材料、物理的なバリア、その他とすることができ、またこの部材は、第1の処理経路11の第1の温度(たとえば、摂氏37度)に特異的な部分および第2の温度(たとえば、摂氏50度)に特異的な部分において計測した温度状態に基づいて、能動的に冷却または加熱され、これによって、第1の収容器1の第1または第2の温度に対する曝露を適宜制限することができる。
【0039】
別の実施形態では、第1の処理経路11を、第1の温度(たとえば、摂氏37度)に維持することができる。第2の温度(たとえば、摂氏50度)に維持することが望ましい第1の処理経路11の一部分においては、IR源その他などの少なくとも1つの別の熱エネルギー源を、第1の処理経路11と熱的に結合させ、必要な時点で第1の処理経路11の対応する部分に所望量の熱を提供することができる。収容器1内に存在する内容物は、当該の追加的熱源(たとえば、IR源)に対する曝露の間に、第2の温度までの温度上昇を受け、続いて、収容器1がこの追加的な熱源への曝露から外されるにつれて、第1の温度まで熱低下を起こすことができる。
【0040】
図10および図11は、図3A、図3B、および図11に示した装置100の第1の処理経路11で使用することができる、収容器運搬を表している。この構造体では、第1の収容器1を、第1の処理経路11上に配置させた後、ベルト36は、ベルト36上のピン36aとの係合を介して第1の収容器1を移動させる。駆動装置38は、マウント39によって装置100上に適切に支持されると共に、駆動ギア40および被駆動ギア41を介してベルト36を駆動可能に係合している。
【0041】
図3Aおよび図3Bに戻ると、サンプル収容器8内に配置させたサンプルは、収容器搬送機27(たとえば、トレイ)内に適切にロードされ、この収容器搬送機27(たとえば、トレイ)は、装置100のデッキ上にある入力キュー17にロードされる。様々な処理工程は、本明細書に開示した本発明の様々な態様の広義の趣旨域内にあり、ある方式で実施するように記載されているか別の方式で実施するように記載されているかによらず、手動式および/または自動式で実施することができることを理解すべきである。
【0042】
サンプル収容器8、ならびに関連する収容器搬送機27の例を、図6に表している。収容器8および収容器搬送機27は、上で言及した米国特許第5,915,583号および同第Des.401,697号に開示されている収容器と実質的に同様とすることができる。ただし当業者には本発明の趣旨の域内において、広範な構成が適切となることが理解されよう。
【0043】
入力キュー17は、Abbott Laboratories(たとえば、Abbott FPC Flexible Pipetting Center)から目下のところ入手可能なものなどの構成、あるいは米国特許第5,795,784号に記載された構造体を含み、所望の数のサンプル収容器8を保持するために適切な任意の構成とすることができる。入力キュー17に関するこうした適切な構成の1つを、図4に表しており、この構成は、米国特許第5,795,784号に開示されているコンベアシステムと同様のコンベアシステムを備えている。図4に示した実施形態は、入力キュー17および装置100が協働できるように、図3Aおよび図3Bの装置100などの構造体を、スペース17aに配置させることができるように構築されている。この実施形態では、サンプルの入力キュー17と出力キュー17bのそれぞれは、ローカルキュー17cの分だけずらした状態で互いに隣接して配置させることができる。
【0044】
第1の処理経路11に隣接してバーコード読み取り装置25を配置させることができ、これによりバーコード読み取り装置25は、収容器8および/または収容器搬送機27に関連付けされたコードを読み取ることができる。バーコード読み取り装置25は、入力キュー17上に配置された所与のサンプルを、ピペッタ19によってアクセス可能な位置において特定するために使用されることができる。
【0045】
バーコード読み取り装置25があるサンプルを特定すると、ピペッタ19は、当該サンプルを、入力キュー17上のサンプル収容器8から第1の処理経路11に配置された第1の収容器1まで適切に搬送することができる。試薬など別の種目は、所与の判定フォーマットに従って、ピペッタ19およびピペッタ12によって、1つの第1の収容器1に添加される(あるいは、複数のサンプルに対して作業している場合には、複数の第1の収容器1に添加される)ことができる。試薬は、米国特許第5,795,784号に開示されている試薬回転ラックなどの適切な試薬ハンドラー13内に格納されることができる。例示的な一実施形態では、ピペッタ19および12は、以下で指定する「1 Tube DNA/RNA 20−20Min Sample Prep Protocol,1 Tube 1.5hr PCR End Point Protocol」で指定された時点において、1つまたは複数の第1の収容器1に試薬を添加することができる。
【0046】
ボトル29、31、および32(図5A、図5B、図5E、および図19参照)から第1の収容器1に試薬を添加するためには、ピペッタ19および12以外に、適切なポンプ動作メカニズムと流体接続させた分与ノズル(明瞭にするために図示せず)を使用することもできる。一実施形態では、ある1つの収容器(たとえば、収容器31)は、固相微小粒子を含むことができ、この固相微小粒子は、磁気応答式であることが好ましく、また収容器31の内容物を均質化させる(すなわち、流体媒質内に粒子を再懸濁させる)ために、撹拌機を必要とすることがある。撹拌機は、図3Aおよび図3Bに示された微小粒子試薬ハンドラー18内に組み込まれることができ、また適切な作用(その方法のうちのいくつかを挙げるとたとえば、混合用フィン、補完的収容器フィン、および/またはフィン運動)によって均質化を行うことができる。収容器31内の粒子に対する再懸濁は、たとえば、かき混ぜ棒や当技術分野において一般に理解されている関連する装置によって達成させることができる。
【0047】
本明細書に記載した収容器のいくつかまたはすべてを、図3Aおよび図3Bに示した装置100に配置させることがある。収容器の内容物は、試薬シール30(図5Cに示す)を用いて、かつ/または冷蔵を用いて保存されることができる。試薬の分与に関して追加的な柔軟性を提供するために、第1の処理経路11と動作可能に結合された試薬分与ノズルを、運搬メカニズムに組み込み、第1の処理経路11上の所望の任意の位置における試薬の分与を可能にすることができる。
【0048】
第1の収容器1の内容物は、混合するまたは攪拌することが望ましいことがある。第1の処理経路11に沿った第1の収容器1の内容物の混合は、選択した時点で、適切な混合機5によって選択的に自動的に実施することができ、この一例を、図13に示している。この実施形態では、第1の収容器1は、ブラケット44を介して動作可能に係合され、一方ブラケット44は、駆動装置42によって駆動されたときに、ブラケット44および係合した第1の収容器1に対して、運動(たとえば、軌道運動、円運動など)が誘導されるように構成したギアトレイン43と動作可能に結合される。こうした混合は、以下で指定する「1 Tube DNA/RNA 20−20Min Sample Prep Protocol,1 Tube 1.5hr PCR End Point Protocol」で指定された時点など、実施される処理の要件に応じた適切な任意の所望の時点において実施されることができる。
【0049】
ピペッタ19および12が、使い捨て式ピペッタ先端28(図5Fおよび図19参照)と共に使用するように構成されている一実施形態では、1つの先端28または一群の先端28の運搬およびロードは、適切なローダおよび運搬メカニズム33を用いて達成されることができる。こうしたメカニズム33の1つを、図7に示しており、また別のローダおよび運搬メカニズム34を、図8に示している。
【0050】
ピペッタ19または12のいずれかによって先端28を係合させた後、液体レベルの検知(その多くが当技術分野でよく知られている、適切な任意の方法によって実行される)、選択された収容器(複数のこともある)からの吸引、および第1の収容器1への分与が実施される。ピペッタ12または19は、液体レベルおよび/または温度を検出することが可能な装置を含むことができ、この装置としては、光学機器、容量性部材、IR、ソナー、あるいは別の波形発生器(ただし、これらに限らない)を含むことができる。分与した後、洗浄ステーション23において、先端28を液体によって洗浄し、これによって汚染物質に対する曝露を低減させている。第1の収容器1に対する後続の添加は、希望に応じて同様の方式で実施することができる。第1の収容器1に対する所望の添加がすべて完了した後、第1の収容器1の内容物は、第1の収容器1から吸引されるかさもなければ取り出されると共に、遺伝子配列決定、薬理遺伝学的試験などの別の機能を実行することがあり得る所望の箇所に、分与または搬送される。次いで、先端28は、ピペッタ12または19から取り外されて、先端廃棄部24に廃棄されることができ、これによって汚染物質に対する曝露を低減することができる。複数の試薬と単一のサンプルあるいは調製したサンプル操作に対して、単一の先端28を使用することによって、固体廃棄物を減少させることが可能となり、かつ汚染低減の所望のレベルを維持しながら、コストの軽減を提供することが可能である。先端28を含まない場合であっても、ピペッタ12または19を用いて同様の工程を実施することができる。
【0051】
混合機5による混合あるいは第1の収容器1に与えられる別の運動は、第1の収容器1内に包含された流体に対して意図しない分布(たとえば、エアロゾル現象)を引き起こすことがある。図14は、適切な箇所において第1の処理経路11内に組み込まれたポート45を示している。ポート45は、第1の処理経路11上の隣接する第1の収容器1から出てより望ましい箇所まで、第1の収容器1上の空気の流れを引き出す流体圧力源(たとえば、真空などの負の流体圧力源)と流体接続させることができる。この方式により、望ましくない空中浮遊の汚染物質を、制御された箇所に導くことができる。
【0052】
構造体1aおよび装置100によって実行されるいくつかの方法(すなわち、免疫学的診断および/またはPCRサンプル調製方法)で使用される微小粒子の洗浄は、第1の収容器1のいくつかが、マグネット4によって引き寄せられて保持される場合などで、第1の収容器1からの未結合または結合性の微小粒子および/または第1の収容器1の内容物の別の構成成分に対する除去、排出、またはピペット操作を利用することができる。
【0053】
この洗浄を実施するためには、第1の処理経路11に沿った適切な位置に、少なくとも1つの洗浄ゾーン50(図3A参照)を配置させることができる。洗浄ゾーン50は、内容物(たとえば、未結合または結合性の微小粒子)を、第1の収容器1から自動的に排出するまたはピペット操作するように構築されたプローブ49(図16に示す)を含むことができる。複数のプローブ49(たとえば、4つのプローブ)が、単一の洗浄ゾーン50をなすことができる。適切な例示的な洗浄工程(たとえば、磁気式分離、吸引、分与)は、さらに米国特許第5,795,784号に記載されている。
【0054】
DNA/RNA判定の場合など汚染が関心事である場合、プローブ49は、外側チューブ46および内側チューブ47(図15参照)によって形成されることができる。この外側チューブ46は、支持部材46aを介して内側チューブ47に対して実質的に同心状に保持されることができる。いくつかの実施形態では、部材46aは、流体搬送用導管の役割をすることができる。一実施形態では、その外側チューブ46は、洗浄流体源と流体接続され、またその内側チューブ47は、廃棄部に導かれた真空源と流体接続される。この洗浄流体は、第1の収容器1内に保持された関心対象種目に結合させた粒子から、未結合粒子を化学的に洗浄するため、およびさらには内側チューブ47が、排出中に流体(たとえば、第1の収容器1内の流体)と接触状態になった後に、内側チューブ47から望ましくない種目(すなわち、汚染)を除去するためなど、多くの目的のために使用されることができる。
【0055】
第1の収容器1の壁に微小粒子を引き寄せる方法を改善させるためには、第1の収容器1内部にある微小粒子を、第1の収容器1の相対する側に沿って第1の収容器1に隣接して配置させた2つのマグネットを備えたマグネットステーションに曝露されることができる。
【0056】
第1の収容器1の側壁(複数のこともある)に引き寄せられた微小粒子は、図13に示した混合機5などの適切なデバイスを介して、任意の時点で(たとえば、洗浄中に)再懸濁されることが可能である。別法として、第1の収容器1の内部にある流体を適切に移動させることによって、第1の収容器1内部での流体および/または固体の再懸濁を達成するために、プローブ3または49が使用されることができる。こうした一実施形態では、流体(たとえば、洗浄溶液)は、単一または複数の流体ストリームが、その垂直壁など第1の収容器1内部の再懸濁させようとする関連する流体および/または固体材料が存在すると予測される位置に向けられるように、プローブ3または49から分与されることができる。この方式により、第1の収容器1の中で再懸濁させようとする材料を、図17に示すように第1の収容器1内に分散させることができる。
【0057】
選択したフォーマットまたはプロトコルに従って、第1の収容器1の内容物に関する処理を完了した後、第1の収容器1の内容物を、第1の収容器1から移動させ図3に示す第2の収容器15内に配置させる。第2の収容器15に対する材料添加(たとえば、試薬)は、ピペッタ12を介して行われる。次いでこの第2の収容器15は、シーラー21によって封止される。
【0058】
第2の収容器15に関して相対的に迅速な加熱および冷却速度が望ましい場合には、第2の収容器15は、第2の収容器15内容物体積比に対する相対的に大きな加熱表面、および/または第2の収容器15の相対的に薄い壁(複数のこともある)を使用することによって、相対的に迅速な熱エネルギー伝達速度を持続するように構築されることができる。
【0059】
第1の収容器1の内容物の第2の収容器15への自動式方式による移送を容易にするために、第2の収容器15は、第1のチェンバおよび第2のチェンバを用いて構築されることができ、第1のチェンバ開口が、第2のチェンバ開口と比べて相対的により大きい。ピペッタ12は、第1のチェンバに入り、かつ第1のチェンバを、第1の収容器内容物および別の試薬で満たすことが可能であり、次いで第1のチェンバ開口が、シーラー21によって封止される。相対的に小さい第2のチェンバ開口によって、第1のチェンバの内容物が第2のチェンバに移動するのを制限することができる。別法として、第1のチェンバ開口は、収容器をスピナー22に移送する前に、シーラー21によって第1のレベル(「ソフトシール(soft−seal)」と呼ばれる)まで封止されることができる。この場合には、第2の収容器15をスピナー22から除去した後に、第1のチェンバ開口は、第1のレベルと異なる第2のレベルまでシーラー21によって封止されることができる。
【0060】
第2の収容器15は、第1のチェンバの内容物が、遠心力によって第2のチェンバまで変位されるように、第2の収容器15を動かしているスピナーデバイス22まで搬送される。第1のチェンバの内容物が第2のチェンバまで移動した後、さらに処理を行うために、第2の収容器15が、スピナーデバイス22から除去されて熱伝達デバイスに渡される。別法として、第2の収容器15のその第2のチェンバへの充填は、ピペッタ12と結合された流体工学素子からの圧力によって引き起こされる力によって達成されることが可能であり、あるいはピペッタ12を、第2の収容器15の第2のチェンバに入れ、これによって第2のチェンバを満たすことが可能である。
【0061】
望ましい熱伝達速度には、毛管または毛細管様の構造体を有するチューブが適しているが、こうしたチューブを満たすには、典型的には、液体をチューブまで移動させるための力または遠心分離が不可欠である。図27Aから図27Fに示した別の実施形態では、第2の収容器15は、遠心分離などの2次的な動作をまったく行わずに、内容物の第2の収容器15への自動式ピペット作業が可能となるように、毛管と比べてより大きな開口57を通して、内容物を受け取っているアセンブリ15cを備えることができる。追加のDNA増幅の前に、シール15bを、第2の収容器15と係合させ、汚染低減および蒸散制御を提供することができる。シール15bの外側壁58は、第2の収容器15の内側壁59と比べてより小さいため、第2の収容器15と係合させたときに、第2の収容器15内の内容物は、外側壁58の周りに変位することが可能となる。この内容物の変位によって、液体面積に対する熱伝達の比が増大し、これによって相対的に迅速な熱伝達が提供される。いくつかの実施形態では、外側壁58は、第2の収容器15の内側壁59を係合して、シール15bを第2の収容器15に対して実質的に同心状に位置決めするためのフィン(図示せず)を含むことができ、これによって、シール15bの外側壁58の周りにおける内容物の実質的に均一な変位、ならびに内容物に対する実質的に均一な熱伝達が提供される。
【0062】
第2の収容器15およびシール15bは、特に図27Cおよび図27Fに示したアセンブリ15cを形成するように係合可能である。このアセンブリ15cは、さらに処理を行うために、第2の処理経路または熱サイクリング/検出モジュール16に移送されることが可能である。
【0063】
一実施形態では、第2の収容器15をスピナーデバイス22まで運搬する工程は、ピペッタ12が、最大3つまでの試薬およびサンプルを第2の収容器15に添加した後で実施される。次いでロボットにより、第2の収容器15を、第2の処理経路または熱伝達/検出装置16まで移動させる。装置16は、第1の処理経路によって第1の収容器1を至らせる温度(複数のこともある)と同じまたは異なる温度まで、第2の収容器15を至らせることができる。
【0064】
図3Aおよび図3Bは、1時間あたり概ね100回の試験という構造体スループットを得るために、第1の処理経路11上で調製されたサンプルのスループットが、概ね1時間のPCR処理期間と適合するように、112個の熱伝達/検出モジュール16aを備えている熱伝達/検出装置16の一構築を表している。熱伝達/検出装置16は、処理のうちとりわけ、恒温反応、熱サイクリング、統合された熱伝達および検出のために使用されることが可能である。いくつかの実施形態では、熱伝達機能および検出機能は、別々の構造体によって実施することが可能である(たとえば、装置16は、熱転送構造体と検出構造体とを備えることが可能であり、これらは隣接して配置させたり、別々に配置させたり、あるいは適切な任意の方式で配置させたりすることができる)。装置16における検出の後、第2の収容器15は、ロボットによって自動的に除去されて廃棄部に廃棄されるか、さらに判定を行うために別の検出器に移送される。
【0065】
図3Aおよび図3Bに示した実施形態では、第1の処理経路11上では単離サンプル調製を実施することが可能であり、また隣接する装置16上では増幅および検出を実施することが可能であり、これらの2つの処理は、DNA/RNAの化学的性質に特異的な汚染の懸念を低下させるように実質的に別々となっている。
【0066】
サンプルの自動式調製に関する第1の処理経路11は、ロボットなどの別の装置によって、増幅および検出を行うための装置16に動作可能に接続させることができる。
【0067】
さらに第2の処理経路16は、第1の処理経路11の続きとされることができ、これによって、単一処理経路を形成することができる。こうした実施形態では、本明細書に記載した収容器のいずれかを、処理経路全体に沿って使用し、これによって、第1の収容器1から第2の収容器15への移送の必要を無くすことができる。換言すると、サンプルは、サンプル収容器8から本明細書に記載した工程のすべてを実施するために使用される単一処理収容器に移送させることができる。
【0068】
構造体1aおよび装置100に関して、本明細書に記載した広義の発明の趣旨の域内で使用される可能性がある多数の別の可能な修正形態が存在する。一修正形態では、図3Aおよび図3Bの第1の処理経路11は、処理工程が選択的に自動的に実行される処理工程実行レーンと、処理工程が選択的に自動的に回避される処理工程回避レーン(たとえば、洗浄ゾーン50を回避するために配置される)とを含むことができる。反応混合物を含んだ第1の収容器1は、米国特許第5,795,784号に記載された方式と同様にして、選択したフォーマットまたはプロトコルに基づいて、処理工程実行レーンまたは処理工程回避レーンのうちの選択した一方に選択的に自動的に位置決めされることができる。
【0069】
別の修正形態では、第2の収容器15は、毛管、毛細管特性を有するチューブ、米国特許第Des.401,700号に記載されている反応容器、反応チューブ(Sunnyvale、CaliforniaのCepheidによって供給されるものなど)、第1の収容器1と同様のチューブなどとすることができる。さらに、熱伝達/検出装置16は、Peltier、マイクロ波、抵抗性、強制式気体および/または液体加熱/冷却技術を利用することができる。したがって、モジュール16aは、さらに、そのすべてが適切であるような、Cepheid(Sunnyvale、California)によって供給されるSmart Cycler(登録商標)システム、MJ Research、INC(Waltham、Massachusetts)によって供給されるTetrad(登録商標)またはPTC−100(登録商標)システム、Hybaid(Franklin、Massachusetts)によって供給されるSprint(登録商標)システム、Labnet International(Woodbridge、New Jersey)によって供給されるMultigene(登録商標)システム、Stratagene USA(La Jolla、California)によって供給されるRoboCyler(登録商標)40または96システム、Perkin−Elmer(Foster City、California)によって供給される480、9600または9700システムの熱サイクラーおよび/または検出器コンポーネントなどのPeltier、IR、マイクロ波、抵抗性、強制式気体および/または液体加熱/冷却技術を利用することができる。
【0070】
構造体1aおよび装置100のまた別の修正形態も可能である。こうした修正形態に関する以下の例では、同様の構造体に関して共通の参照符号を利用している。
【0071】
図20に示した別の装置110では、熱伝達/検出装置16を、図20に示すように第1の処理経路11内に組み込むことができる。ここで、第1の収容器1は、所望のフォーマットに適した熱ゾーンを通過する間に第1の処理経路11上に維持されている。
【0072】
図21に示した別の装置120では、第1の収容器1は、第2の収容器15に移送され、引き続いてこの第2の収容器15は、所望のフォーマットに適した熱ゾーンを通過する。したがって、熱反応の一部分は、第2の収容器15を熱伝達/検出装置16に移送する前に、第2の収容器15に対する処理ライン15aにおいて実現されることができる。
【0073】
図22に示したまた別の装置130では、第2の処理経路または熱伝達/検出装置16は、個々に制御された複数の第2の処理サブ経路または熱伝達/検出経路16bを含んでいる。熱伝達/検出経路16bの各々は、Abbott Prismの機器の構築と実質的に同様の方式において、ある具体的な関心対象種目に専用とすることができる。
【0074】
図23に表した追加的な装置140では、第1の収容器1の内容物に対して処理を実行し、かつ処理済みの第1の収容器内容物を、所望の試薬を満たした複数ウェルの(たとえば、96ウェルの)トレイなどの反応容器またはトレイ52内に移送することが可能である。この装置140は、さらに、米国特許第5,795,784号に記載されているような第1の処理経路11上のバイパス領域56を含んでいる。このトレイは、封止されて、移送のために手動式または自動式のいずれかで出力キュー54に、熱伝達/検出装置16などの追加の装置に移動させることができる。この修正形態では、さらに処理する前に、サンプルハンドリングキュー17内で所望の検定に従ってサンプルをソートすることによって、顧客ラボのワークフローを改善させるための別の方法を利用することができる。これによれば、各検定ごとに異なる加熱および冷却プロトコルを要求する化学処理で必要となる、加熱および冷却デバイスの統合(たとえば、熱伝達/検出装置16内の多数のモジュール16aの統合)が可能となる。
【0075】
本明細書に記載した構造体ならびにその利用は、最適化されることができる。たとえば、構造体は、実施しようとする判定、サンプル、試薬、収容器などの種目を、その構造体(複数のこともある)の要素にわたって割り当てることによって、所与の時間期間における判定回数が増大するように、調整されることができる。具体的には、オペレータは、この構造体のサンプルハンドラー17上にサンプルを任意の順序でロードすることができる。とりわけ、1回の判定あたりのコストを低減させるため、あるいは構造体の信頼度を改善させるために、1つの構造体に存在させる種目の数を減少させることができる。いくつかの判定(たとえば、DNA/RNA増幅および検出)は、判定ごとに様々に異なることがある加熱および冷却プロトコルが必要となる。このために、コストおよび/または種目の低減が複雑になることがある。これらの低減を達成するには、その構造体(複数のこともある)の要素にわたって種目を割り当てることができる。
【0076】
本明細書で検討している実施形態では、判定方法は、第1の処理、第2の処理、および第3の処理など多数の処理からなることができる。第1の処理は、DNA/RNAサンプル調製、サンプルインキュベーション、免疫学的診断サンプルの調製、および判定などのすべての判定に共通とすることができる。第2の処理(たとえば、増幅など)は、所与の判定に特異的とさせることができる。第3の処理(たとえば、検出)は、すべての判定に共通とするか、所与の判定に特異的とするかのいずれかとすることができる。
【0077】
その構造体(複数のこともある)の要素にわたって種目を割り当てるには、サンプルを特定した後、これを第2および第3の処理の共通性に従ってグループ分けする。たとえば、1回のDNA/RNA検定が、1つのモジュール16a、16b、16c、または16dにおいて以下に記載するプロトコルAなどの1つのプロトコルに従って処理を受けることができ、一方別のDNA/RNA検定が、別のモジュール16a、16b、16c、または16dにおいて以下に記載するプロトコルBなどの別のプロトコルに従って処理を受けることができる。共通の第2および第3の処理によって選択して、サンプルをサンプルハンドラー17から処理経路11まで供給することによって、モジュール16a、16b、16c、または16dの特定の判定(複数のこともある)への割り当てを達成しながら、必要となるモジュール16a、16b、16c、または16dおよび収容器52の数を減少させ、スループットを上昇させることができる。
【0078】
サンプルソート作業は、バーコード読み取り装置を用いて、サンプルハンドラー17によって保持された収容器8上のバーコードを読み取ることによって、サンプル情報を特定することを含むことができる。次いでこの収容器8は、所与の搬送機27内で別の収容器8と共に(機械的に)ソートを受けることができ、次いで搬送機27は、共通の第2および第3の処理を有する判定によって、サンプルハンドラー17内で別の搬送機27と共にソートを受けることができる。ソート後、収容器8からのサンプルは、ピペッタ19によって第1の収容器1に移送される。別法として、サンプルソート作業は、サンプルを、所定のソート順序に基づいて、収容器8から処理経路11上の第1の収容器1まで選択的に移送するピペッタ19によって実現されることができる。
【0079】
サンプルが、処理経路11上の収容器1に入った後、判定方法を含む第1の処理が実施される。第1の処理が完了した後、第2の処理および/または第3の処理が、使用する具体的な構造体に応じて、処理経路11内、すなわち1つまたは複数のモジュール16a、16b、16c、または16d内、あるいは別の装置内のいずれかで行われることができる。
【0080】
共通の第2の処理および/または第3の処理に従ってサンプルをソートまたはグループ分けすることによって、モジュール16a、16b、16c、または16dの最適な数を、所与の関心対象種目の判定に割り当てることが可能となる、すなわち、所与の関心対象種目に対する最大判定回数を、識別することが可能となり、関連するサンプルを、適正にソートすることが可能となり、その構造体(複数のこともある)内にある収容器、試薬などの要素または種目を、所与の構造体(複数のこともある)上にある2つ以上のモジュール16a、16b、16c、または16dにわたって適切に反復させることが可能となる。同様に、2つ以上のモジュール16a、16b、16c、または16dを、特定の判定プロトコルに基づいて反復させることが可能である。
【0081】
図22は、モジュール16bが、サンプルソート作業の結果に従って反復されることができる装置130を示している。図23および図24は、モジュール16を、その装置(複数のこともある)の外部に配置することが可能な別の装置140および150を示している。ここで、ソート済みのサンプルは、装置(複数のこともある)140および150の外部にある複数のモジュール16にわたって反復させることができる。
【0082】
図20は、モジュール16が、処理経路11内に組み込まれている装置110を示している。ここでサンプルソート作業によって、処理経路11に対して、第1の時間期間中にある判定を行うようにプログラムし、次いで第2の時間期間中に別の判定を行うようにプログラムすることが可能となる。
【0083】
さらに処理する前に、サンプルハンドリングキュー17における判定に従ってサンプルをソートすることが必要である用途では、相対的に小さいグループ分けを形成することが望ましいことがある。このグループ分けのサイズによって、トレイ52のサイズ、ならびにその対応する熱伝達/検出装置16を決定することができる。図26に表した装置170では、サンプルは、判定に基づいて相対的に小さいグループ(たとえば、約12個のサンプル)にソートされることができる。トレイ52と、熱サイクリング/検出モジュール16内の熱サイクリング/検出モジュール16cとは共に、モジュール16cが12個からなる各グループ分けに対する個々の制御を提供するように、12個からなるグループ分けを収容できるように構成されている。装置170によって、所望のスループットを維持するために必要となる熱サイクリング/検出モジュール16cの数を少なくすることができる。
【0084】
試験分布リストを管理するため、試薬ロードマップを作成するため、試薬ロードの示唆を行うため、およびデータを管理するために、装置を制御するソフトウェアによるなどの追加的な強化を提供することが可能である。
【0085】
図24に示した装置150では、第1の収容器1の内容物に対して調製が実施されることができ、また調製された第1の収容器の内容物は、別の収容器またはトレイに移送されることができる。収容器1は、試薬添加、熱伝達、および検出を実行する別の装置に、手動式または自動式で移送するために出力キューに移動される。
【0086】
図25に表した装置160では、サンプル入力キュー17内でサンプルをソートする必要はなく、また必要となる熱サイクリング/検出モジュール16dの数が減少する。この装置160では、第2の収容器15は、その各々が個々に制御を受けると共に、各々が1つの検出器を有する、熱サイクリングモジュール16dに移送される。モジュール16dは、回転ラック内部にある複数の(たとえば、約2つのまたは3つの)熱ゾーンを通って、多数の位置にわたって第2の収容器15を熱的移送させることができる。回転ラック上の1つの位置は、1つの検出器を含んでいる。モジュール16dは、別の収容器15がモジュール16d内で処理を受けている間に、追加的な収容器15を順次受け容れるように構成されている。別法では、モジュール16dには、収容器15を完全にロードし、すべての収容器を実質的に同時に処理することができる。
【0087】
モジュール16dの別の実施形態を、図30A、図30B、図31、図32A、および図32Bに表している。図30A、図30B、図31、図32A、および図32Bでは、同じ構造体を示すために同じ参照番号を用いている。モジュール16dに関するこれら別の実施形態は、たとえばPCR生成物の熱増幅および検出に使用されることができる。
【0088】
トレイ70は、熱増幅を生じさせることができる場所である少なくとも1つの区画またはウェル71を有している。図30Bおよび図32Bの実施形態は、8個のウェル71を含んでいるが、ウェル71の数は、希望に応じて変更することができる。識別を容易にするために、ウェル71には番号を付けることが可能であり、またバーコードを付けることができる。この方式により、ウェル71の位置、内容物などを、光学機器を用いるなど機械によってチェックすることが可能である。いくつかの実施形態では、そのトレイ70は、結合される構造体から容易に取り外される使い捨て品とすることができる。
【0089】
ウェル71は、汚染物質に対するウェル71の内容物の曝露を低下させるために、分割器72によって少なくとも1つの側面上に結合されることができる。汚染物質に対する曝露をさらに低減させるためには、ウェル71は、着脱可能にカバーされるか、封止されることができる。
【0090】
トレイ70は、駆動装置シャフト73によって、モータ76(図31)(たとえば、マイクロプロセッサなどにより制御される、ステッピングモータ、サーボモータなど)と動作可能に接続されており、これにより、トレイ70に対して所望の制御式回転を提供することができる。
【0091】
収容器8の内容物は、増幅および検出のために、第1の処理経路11からウェル71に移送されることができる。トレイ70およびウェル71の所望の熱曝露を提供するために、少なくとも1つのヒータ74を、トレイ70と熱的に結合される。複数のまたは異なる熱曝露が所望である場合は、適切な数のヒータ74を含めることが可能である。図30Bおよび図32Bに示すように、4個のヒータ74を、トレイ70と熱的に結合して配置し、これによって、4つの異なる温度または異なる熱曝露を提供することができる。このヒータ74は、電気式、マイクロ波、Peltier効果、強制気体、あるいは同様の技術を利用することができる。
【0092】
ヒータ74は、ウェル71が、ウェル71の内容物の添加の前または後で、所望の温度になっているように動作することができる。いくつかの実施形態では、ヒータ74は、トレイ70上のウェル71の内容物の添加の前または後のいずれかにおいて、トレイ70が、ヒータ74と動作可能に接続されるように、トレイ70から分離されることができる。
【0093】
トレイ70が回転するに従って、ウェル71およびその内容物は、隣接するヒータ74によって提供される温度に曝露される、または該温度に至る。熱の変動は周期的とする(すなわち、所与のパターンを反復する)ことができるため、トレイ70の回転によって、ウェル71およびその内容物を、所望のシーケンス内で所望の時間期間にわたって、所望の温度(複数のこともある)に至らせることができる。したがって、ウェル71およびその内容物は、トレイ70が回転するのに従って、連続的に明確に規定された温度ゾーンに出合うことができる。各ヒータ74は、実施している当該の判定によって規定される、融解、アニーリング、伸張などの所与の反応に特異的な温度に対応させることができる。
【0094】
所与のウェル71を所与のヒータ74に隣接させて配置させる時間期間は、トレイ70の回転速度によって決定される。いくつかの利用形態では、トレイ70の回転数またはステップ移動の回数は、目下のところ入手可能な熱サイクラーによって実行されるサイクル数に比例することがある。トレイ70の回転速度は、ウェル71が、ある指定した時間長にわたってヒータ74に隣接して位置決めされるように制御されることができる。たとえば、第1のヒータ74は、ウェル71を、2重線状DNAストランドを解離(dissociating)または融解(melting)することが可能な温度に至らせることができる。第1のヒータ74に隣接する第2のヒータ74は、ウェル71を、ターゲットとプライマー、またはターゲットとプローブなど、補完的なストランドの関連付けを誘導するような温度に至らせることができる。プライマーの酵素ポリメラーゼ伸張を可能にさせるために、第2のヒータ74または別のヒータ74を使用することができ、またウェル71は、反応を完了させるだけの十分な時間にわたって当該ヒータ74に隣接して位置決めされる。トレイ70の回転速度を調整することによって、ヒータ74の熱「面積(area)」(すなわち、ヒータ74によって、ウェル71およびその内容物をヒータ74に関連付けされた温度に至らせることを可能にするような面積)、ヒータ74に関連付けされた温度値、ならびにある検定に関する最適な熱サイクリングパラメータを、実現することができる。
【0095】
ウェル71に関する所望の熱曝露が完了した後、ウェル71内に存在する関心対象種目を、検出器75によって検出することが可能となる。ウェル71が封止されている場合、シールを除去することがあり、また別法として、検出器75が、ウェル71をモニターして、かつ存在するなら関心対象種目を検出できるように、シールを光透過が可能な材料(存在する場合)から製作することができる。検出器75は、さらに、トレイ70またはウェル71に結合されたバーコードを読み取ることができる。
【0096】
ウェル71を検出器75に対して移動させながらウェル71を読み取ることによって、PCR生成物をリアルタイムで検出するためなど、この検出器75は、ダイナミックモード(リアルタイムモード)で使用されることができる。いくつかの実施形態では、検出器75は、ウェル71が検出器75と出合うたびに、各n回ウェル71を読み取ることができる。この数nは、所定の時点(複数のこともある)で、ウェル71の状態を所定のしきい値と比較することが可能となるように決定されることができる。検出器75は、さらに、静的エンドポイント(static end point)の読み取りのために使用されることも可能である。
【0097】
検出器75は、トレイ70に対して静止状態とさせることができ、またトレイ70に対して移動させることもできる。複数のトレイ70が存在する場合には、複数の検出器75(たとえば、各トレイ70に1つの検出器75)が使用されることができる。ウェル71からの光を検出器75に伝えるために、光ファイバが使用されることがある。
【0098】
検出器75は、ウェル71の内容物を、単一または複数の波長で照射する光源を使用し、これによって、たとえば離散的波長における複数波長放出強度の複数検出器75データ低減に対応することができる。いくつかの実施形態では、検出器75は、ウェル71からの蛍光放出など、単一または複数の波長の単一または並列の検出を備えることができる。
【0099】
図33には、別のモジュール16hを示している。このモジュール16hは、ブロック78の内部に配置された流体搬送用導管77を含んでいる。この導管77は、ブロック78内のコイル79として形成されることができる。ブロック78は、第1の温度を有する少なくとも第1の熱ゾーン80Aと、第1の温度と異なる第2の温度を有する第2の熱ゾーン80Bとが形成されるような、適切な熱エネルギー伝達素子を備えるように構築されている。この構築では、コイル79のいくつかの部分は、コイル79の別の一部分と異なる熱ゾーン80Aまたは80B内にあり、一方コイル79のいくつかの部分は、同じ熱ゾーン80Aまたは80B内にある。
【0100】
収容器1、8または15の内容物または流体は、第1の処理経路11から導管77の入口81まで移送されることができ、また内容物または流体は、ポンプ、毛細管作用などの適切な手段によって、コイル79を通って入口81から流れるように力を受けることができる。コイル79を通って流体が流れると、流体は、熱ゾーン80Aと80Bとの間を移動する際に、異なる温度に出合うまたは該温度に至らせる。
【0101】
熱ゾーン80Aおよび80Bに関連付けられる温度は、特定のPCR増幅の温度と整合するように選択されることができる。この実施形態では、コイル79を含む巻きつけの数またはループの数は、目下のところ入手可能な熱サイクラーによって実施されるサイクルの数と同等である。コイル79内の流体の流れは、指定された時間長にわたって、流体が、各熱ゾーン80Aまたは80B内に留まるように制御される。たとえば、ある熱ゾーン80Bは、2重線状DNAストランドを解離または融解することが可能な温度まで、流体を至らせることができる。もう一方の熱ゾーン80Aは、ターゲットとプライマー、またはターゲットとプローブなど補完的なストランドの関連付けを誘導するような温度に、その流体を至らせることができる。この同じ熱ゾーン80Aは、プライマーの酵素ポリメラーゼ伸張を可能にするために使用されることができる。勿論、流体の流れは、反応を完了させるだけの十分な時間期間にわたって、流体を熱ゾーン80Aまたは80Bに曝露させるように調整される。コイル79内の流体の状態を、上述したのと実質的に同様の方式でモニターするために、コイル79に隣接して検出器75が配置される。
【0102】
様々なサンプルに対応する流体が、空気、緩衝剤などの適切な別の流体によって分離されて、導管77に導入されることができる。
【0103】
装置16には、任意の熱伝達/検出モジュールを使用することができる。たとえば装置16は、その開示の全体を本明細書に組み込む(本件の譲受人に譲渡された)米国特許第5,576,218号に記載された方法を使用することができる。
【0104】
図3Aおよび図3Bに示したモジュール16aは、図29に示すように加熱または冷却を受けた流体を使用して、第2の収容器15において反応内容物の熱サイクリングを提供することができる。流体は、リザーバ65内に格納されて、熱制御装置66によって加熱または冷却を受ける。流体は、計量式ファンまたはポンプ67によって、所望の時点でポート16eを通ってモジュール16aに導かれる。第2の収容器15内の内容物と加熱または冷却を受けた流体との間に熱伝達が生じる。モジュール16aに移送された流体の計測量によって、第2の収容器15内の内容物が、所与の温度に維持される時間が決定される。モジュール16aからの流体の排出は、バルブ68および/または追加的なポンプまたは重力を使用して、ポート16fを通って収容器65または廃棄部に至る。第2の収容器15の熱質量、第2の収容器15の内容物、および収容器65内の計測された流体が知られていれば、第2の収容器15と相互作用する計測された流体の温度を、計算しかつ予測することができ、これによって、流体の第2の収容器15との界面位置における温度制御の必要性が少なくなる。
【0105】
第2の収容器15内において、(たとえば、図29に示したポート16gなど追加的なリザーバポンプおよびポートを追加することによって)内容物の様々な温度を実現することができる。迅速な熱伝達の性能を強化するためには、第2の収容器15を、薄い高分子フィルムからなるパウチとして構築することができる。さらに、熱素子69は、モジュール16aに隣接しかつ該モジュール16aに接触させて位置決めされると共に、所望の温度で制御を受けることができる。
【0106】
例えば第2の収容器15または15dに対する検出器光学機器の向きは、図28に示している適切な一方法を伴う適切な任意の方式で実現することができる。ここに図示したように、第2の収容器15dは、「YZ」で表される第1の軸面上にある少なくとも1つの第1の面60と、「XY」で表される第2の軸面上にある少なくとも1つの第2の面61とを含むことができる。この第1の面60に隣接させて光源62を配置させ、また第1の面60と反対側の第2の面61に隣接させて光検出器63を配置させ、これによって、光源62によって、関心対象種目と関連付けされたラベルに励起が誘導され、ラベルからの信号(たとえば、光)の放出が、検出器または検出器対63によって検出される。第1の軸面の相対的な位置は、信号収集面積を増大させるために、第2の軸面と異ならせている。適切な検出器または検出器対63は、単一フォトダイオード、クワドラント(quadrant)フォトダイオード、ダイオードアレイ、光電子増倍管、あるいはこれら検出デバイスの任意の組合せを含む。光学機器の加熱素子との組合せは、ガラスなどの透明材内に装着された透明な加熱素子64を使用して実現することができ、ヒータは、第2の収容器15dの第2の面のうちの少なくとも1つと隣接し、また恐らくこの第2の面上に置かれるように配置される。いくつかの実施形態では、光源62は、検出器または検出器対63と実質的に直交する面上に置かれることができる。この光学構成では、第2の収容器15dは、たとえば、Cepheid(Sunnyvale、CA)によって供給される反応チューブ、あるいは実質的に半球状、球状、立方体、または四面体の形状(ただし、これらに限らない)を含み、任意の反応収容器構成とすることができる。
【0107】
追加的な第1の収容器の内容物の調製、免疫学的診断、および/または判定処理のモジュールは、共通のロボット工学機器および/またはコンピュータなどシステム処理装置によって、互いに接続させることができることに留意すべきである。さらに、熱伝達/検出装置16は、第1の収容器の内容物または別のサンプルを、処理済みであるか否かによらず、装置100〜170と動作可能に結合されない別の処理経路から受け容れることができることにも留意すべきである。
【0108】
装置100〜170を備える記載した要素は、関心対象種目に対する所望の判定を実現するために、所望の時点で選択的に自動的におよび/または手動式の動作を受けることができる。これらの要素の機能は、所望の結果を得るために、所望の任意の順序で所望の任意の回数だけ実施されることができる。試薬など使用される動作方法および種目は、その開示の全体を本明細書に組み込むものとする、米国特許第5,234,809号に記載されたものと実質的に同様とすることができる。
【0109】
DNA/RNAサンプル抽出プロトコル、およびポリメラーゼ連鎖反応(PCR)プロトコルに関する以下の例は、こうした応用の1つを表している。時間期間、温度、体積、および使用される要素(収容器、溶液、試薬など)は、適宜調整されることが可能である。位置の番号は、図3Aおよび図3Bの装置100に対応している。しかし、これらの位置番号は、また、米国特許第5,795,784号で様々な検定フォーマットを記載するために使用されているのと同様の方式により、処理経路に沿ったステップ移動の回数も示している。
【0110】
1チューブDNA/RNA20−20分サンプル調製プロトコル、および1チューブ1.5時間PCRエンドポイントプロトコル
サンプル調製
0秒−位置0:
機器が、第1の収容器1を第1の処理経路11上にロードする。
【0111】
1〜36秒−位置1:
ピペッタ19が、使い捨て式ピペット先端28を係合させ、磁気応答微小粒子(約0.1ml)を、試薬保存エリア18内の収容器31から吸引し、さらにこれらの微小粒子を、位置1にある第1の収容器1内に分与する。使い捨て式ピペット先端28は、洗浄カップ23内の流体によって洗浄される。ピペッタ19は、試薬ハンドリングエリア13内に配置させた収容器から、内部対照などの別の試薬(約0.05ml)を吸引し、この試薬を第1の収容器1内に分与し、さらに使い捨て式ピペット先端28は、洗浄カップ23内の流体によって第2回目の洗浄を受ける。収容器8内に配置させたサンプル(約1ml)は、ピペッタ19によって吸引され、第1の収容器1内に分与される。使い捨て式ピペット先端28は、ピペッタ19から取り外され、先端廃棄部24内に廃棄される。別法として、微小粒子分与の後で実施するピペッタ洗浄は、省かれることが可能である。このケースでは、微小粒子および内部対照は、実質的に同時にまたは順次に、第1の収容器1内に吸引されて分与される。別法として、液体洗浄のサブセットまたはすべてを、省くことが可能であり、この場合には、微小粒子、内部対照、およびサンプルが、吸引されて、同時におよび/または順次に第1の収容器1内に分与される。
【0112】
37〜72秒−位置2:
第1の処理経路11と結合させた分与ノズルは、図5Bおよび図19に示すような試薬ボトル32など、溶解溶液を包含した試薬収容器と流体接続される。約6mLの溶解溶液を、室温または摂氏約37度のうちのいずれかで、第1の収容器1に分与する。
【0113】
73〜108秒−位置3:
第1の収容器1の内容物が、混合機5によって混合される。第1の収容器1の内容物は、摂氏約37度でインキュベーションされる。
【0114】
109〜1260秒−位置4〜35:
摂氏約37度で、約19.8分間にわたってインキュベーションを継続する。約648秒の時点および約1224秒の時点で、第1の収容器1の内容物を混合する。第1の収容器1の内容物に対する周期的な混合によって、反応が促進される。
【0115】
1261〜1296秒−位置36:
微小粒子に結合された関心対象種目が、マグネット4によって第1の収容器1の側壁上に捕捉される。
【0116】
1297〜1332秒−位置37:
洗浄ゾーン50を含む要素は、磁気式分離、ならびにプローブ49による流体の吸引および分与を含む、本明細書に記載した洗浄機能を実行する。具体的には、微小粒子は、マグネット4によって第1の収容器1の内容物の残りの部分から分離され、またプローブ49によって、未分離の第1の収容器1の内容物が除去される。洗浄溶液(緩衝剤)が、プローブ49から第1の収容器1内に分与される。プローブ49が洗浄される。別法では、たとえば位置36および37において別々に実施される洗浄機能は、第1の処理経路11上の1つの位置で組み合わせられることができる。
【0117】
1333〜1368秒−位置38:
プローブ49は、洗浄および分与機能を実施する。混合機5は、微小粒子を第1の収容器1内の流体(この例では、具体的に洗浄溶液#1)に再懸濁させる。別法として、微小粒子の再懸濁は、図17に関連して上述したように、第1の収容器1への適切な流体分与によって実現することができる。別法として、位置36、37、および/または38で実施される機能は、第1の処理経路11上の1つの位置で組み合わせられることができる。
【0118】
1369〜1404秒−位置39:
微小粒子に結合された関心対象種目が、マグネット4によって第1の収容器1の側壁上に捕捉される。洗浄ゾーン50を含む要素は、磁気式分離、ならびにプローブ49による流体の吸引および分与を含む、本明細書に記載した洗浄機能を実行する。具体的には、微小粒子は、マグネット4によって第1の収容器1の内容物の残りの部分から分離され、またプローブ49によって、未分離の第1の収容器1の内容物が除去される。プローブ49が洗浄される。別法では、たとえば位置36および37において別々に実施される洗浄機能は、第1の処理経路11上の1つの位置で組み合わせられることができる。
【0119】
1405〜1440秒−位置40:
プローブ49は、洗浄および分与機能を実施する。混合機5は、微小粒子を第1の収容器1内の流体に再懸濁させる。別法として、微小粒子の再懸濁は、図17に関連して上述したように、第1の収容器1への適切な流体分与によって実現されることができる。位置36、37、および/または38で実施される機能は、第1の処理経路11上の1つの位置で組み合わせられることができる。
【0120】
1441〜1476秒−位置41:
微小粒子に結合された関心対象種目が、マグネット4によって第1の収容器1の側壁上に捕捉される。洗浄ゾーン50を含む要素は、磁気式分離、ならびにプローブ49による流体の吸引および分与を含む、本明細書に記載した洗浄機能を実行する。具体的には、微小粒子は、マグネット4によって第1の収容器1の内容物の残りの部分から分離され、またプローブ49によって、未分離の第1の収容器1の内容物が除去される。洗浄溶液(緩衝剤)が、プローブ49から第1の収容器1内に分与される。プローブ49が洗浄される。別法では、たとえば位置36および37において別々に実施される洗浄機能は、第1の処理経路11上の1つの位置で組み合わせられることができる。
【0121】
1477〜1512秒−位置42:
プローブ49は、洗浄および分与機能を実施する。混合機は、微小粒子を第1の収容器1内の流体(この例では、具体的に洗浄溶液#2)に再懸濁させる。別法として、微小粒子の再懸濁は、図17に関連して上述したように、第1の収容器1への適切な流体分与によって実現されることができる。位置36、37、および/または38で実施される機能は、第1の処理経路11上の1つの位置で組み合わせられることができる。
【0122】
1513〜1548秒−位置43:
微小粒子に結合された関心対象種目が、マグネット4によって、第1の収容器1の側壁上に捕捉される。洗浄ゾーン50を含む要素は、磁気式分離、ならびにプローブ49による流体の吸引および分与を含む、本明細書に記載した洗浄機能を実行する。具体的には、微小粒子は、マグネット4によって第1の収容器1の内容物の残りの部分から分離され、またプローブ49によって、未分離の第1の収容器1の内容物が除去される。洗浄溶液(緩衝剤)が、プローブ49から第1の収容器1内に分与される。プローブ49が洗浄される。別法では、たとえば位置36および37において別々に実施される洗浄機能は、第1の処理経路11上の1つの位置で組み合わせられることができる。
【0123】
1549〜1584秒−位置44:
プローブ49は、洗浄および分与機能を実施する。混合機5は、微小粒子を第1の収容器1内の流体(この例では、具体的に洗浄溶液#2)に再懸濁させる。別法として、微小粒子の再懸濁は、図17に関連して上述したように、第1の収容器1への適切な流体分与によって実現されることができる。
【0124】
1584〜1620秒−位置45:
微小粒子に結合された関心対象種目が、マグネット4によって、第1の収容器1の側壁上に捕捉される。洗浄ゾーン50を含む要素は、磁気式分離、ならびにプローブ49による流体の吸引および分与を含む、本明細書に記載した洗浄機能を実行する。具体的には、微小粒子は、マグネット4によって第1の収容器1の内容物の残りの部分から分離され、またプローブ49によって、未分離の第1の収容器1の内容物が除去される。プローブ49が洗浄される。別法では、たとえば位置36および37において別々に実施される洗浄機能は、第1の処理経路11上の1つの位置で組み合わせられることができる。
【0125】
1621〜1656秒−位置46:
第1の処理経路11と動作可能に結合され、分与ノズルと流体接続され、かつ第1の処理経路11および図5Eおよび図19に示した収容器29などの試薬収容器と流体結合されたポンプが、溶離試薬などの流体の分与を、第1の収容器1に生じさせる。一実施形態では、周囲温度において、また別法では摂氏約70度において、約80μLの溶離試薬が分与される。
【0126】
1657〜2844秒−位置47〜76:
第1の収容器1内容物が、この例では摂氏約37度で、あるいは実質的に摂氏約50から摂氏約70度までの範囲内にある温度で、約19.8分の期間にわたってインキュベーションされる。周期的に混合することによって、第1の収容器1の内容物の各要素間の反応が促進される。溶離試薬によって、関心対象種目が微小粒子から解放される。
【0127】
検定
2845〜2880秒−位置77:
位置76において、ピペッタ12は、使い捨て式ピペッタ先端28を係合させ、試薬保存エリア13内の収容器から第1の試薬を吸引し、かつこの試薬を、収容器処理装置ライン15a上の第2の収容器15内に分与する。使い捨て式ピペット先端28は、洗浄カップ24内の流体によって洗浄される。ピペッタ12は、試薬ハンドリングエリア13内の収容器から第2の試薬を吸引し、この第2の試薬を第2の収容器15内に分与し、さらに使い捨て式ピペット先端28は、洗浄カップ24内で洗浄を受ける。第3の試薬が、試薬ハンドリングエリア13内の収容器からピペット先端28内に吸引され、関心対象種目を含む第1の収容器1の内容物(約50μL)が、第1の処理経路11の位置77にある第1の収容器1からピペット先端28に吸引される。第3の試薬および吸引された第1の収容器1の内容物は、ピペット先端28から第2の収容器15内に分与され、またピペッタ12は、使い捨て式ピペット先端28を先端廃棄部24に排出する。別法として、第3の試薬は、ピペッタ12によるか、あるいは第1の処理経路11上の別の分与ノズルによって、位置76において第1の処理経路11上の第1の収容器1内に分与されることができる。別の実施形態では、第1の試薬および第2の試薬の吸引は、吸引の間にピペッタ12を洗浄することなく完了することが可能であり、また各試薬は、第2の収容器15内に実質的に同時に分与されることが可能である。3つの試薬の各々の体積は、実質的に約10μLから約50μLまでの範囲内とすることができる。所与のサンプル内において複数の関心対象種目の検出を希望するなら、第1の収容器1の内容物の一部分を、対応する数の収容器15に移送することも可能である。第1の収容器1の内容物のこれらの複数の移送は、位置77から実施することや、また別法として位置77およびこれに続く位置(複数のこともある)から実施することもできる。1つのサンプルから、約15種など比較的多数の関心対象種目を判定しようとする場合は、ピペッタ19および/または12によって、収容器8および/または第1の収容器1から、複数の吸引および分与を実施することが可能である。
【0128】
2881〜2916秒:
第2の収容器15は、収容器処理装置ライン15a上でシーラー21まで搬送され、ここで第2の収容器15が封止される。封止された第2の収容器15は、スピナー22まで搬送され、ここで第2の収容器15の上側部分内の内容物が、第2の収容器15の下側部分に移される。
【0129】
2917〜2952秒:
ロボットが、第2の収容器15を係合し、第2の収容器15を熱伝達/検出モジュール16a内に配置し、ここで第2の収容器15は、熱サイクルに対して曝露されると共に、第2の収容器15内の関心対象種目が検出される。
【0130】
2953〜8352秒−検定特異的熱サイクリングプロトコル:
第2の収容器15は、指定に従って熱サイクリングプロトコルを受ける。以下に、こうしたプロトコルのいくつかの例を示す。
【0131】
プロトコルA
1.摂氏約59度で約30分間。1サイクル
2.摂氏約95度で約30秒間、摂氏約54度で約30秒間、摂氏約72度で30秒間。4サイクル
3.摂氏約90度で30秒間、摂氏約59度で30秒間、摂氏約72度で30秒間。46サイクル
4.摂氏約94度で5分間、摂氏約45度で15分間、摂氏約25度で10分間。1サイクル
【0132】
プロトコルB
1.摂氏約94度で10分間。1サイクル
2.摂氏約94度で1分間、摂氏約58度で1分間。45サイクル
3.摂氏約58度で10分間、摂氏約94度で5分間、摂氏約55度で15分間、摂氏約25度でこれを維持。
【0133】
プロトコルC
1.摂氏約95度で約9.5分間。1サイクル
2.摂氏約95度で30秒間、摂氏約59度で1分間。41サイクル
3.摂氏約95度で3分間、摂氏約25度で10分間。1サイクル。
【0134】
8353〜8388秒:
選択した特定の熱サイクリングプロトコルが完了した後、第2の収容器15内の関心対象種目を検出し、第2の収容器15は処分される。上述の工程の結果を報告する。
【0135】
本明細書に記載した実施形態のいずれにおいても、溶解(lysis)には、誘導された電気パルス(複数のこともある)や音波処理(sonication)を使用し、これらのパルスによって、DNA/RNAを結合の前に未損傷の形態で曝露されるようにすることを含むことができる。
【0136】
上で開示したDNA/RNA方法またはプロトコルに加えて、装置100〜170によって実行される方法は、免疫学的診断方法とすることがある。たとえば、米国特許第5,795,784号は、上で開示した装置100〜170によって、適切な修正を伴って実行されることができる、様々な方法またはフォーマットを列挙している。さらに、DNA/RNA抽出は、装置100〜170によって増幅しかつ検出されることができ、また別法では、さらに処理を行うために、別の装置100あるいは米国特許第5,795,784号などに開示されている装置などの別の装置に搬送されることができる。第1の収容器1は、所望であれば適切な手段によって封止されることができることを理解されたい。
【0137】
別の実施形態では、第1の収容器1の内容物は、上で検討した処理の後、第1の処理経路11上の位置76から、本装置の適切な光学フローセルに移送されることができる。光学フローセルは、次の米国特許、すなわち米国特許第5,589,394号、同第5,601,234号、同第5,631,165号、同第5,631,730号、同第5,656,499号、同第5,812,419号、および同第5,891,734号(これらのすべての開示は、全体を参照により本明細書に組み込むものとする)に記載されたものと実質的に同様とすることができる。サンプル内の関心対象種目は、光学フローセルを用いて検出されることができる。
【0138】
この実施形態の一修正形態では、サンプルは、第1の収容器1、8、15または別のサンプル搬送容器から、本装置のサンプル受け取りカップに直接移送されることができる。サンプルは、あるラベルを含んだ試薬と混合され、かつ適切にインキュベーションされることができる。この試薬は、ラベルが、サンプル内の細胞および/または核膜に出合うかまたはこれを通過し、これによって、当該サンプル内における関心対象種目の所在箇所と無関係に、ラベルが、サンプル内の関心対象種目と結合され、さもなければこれと関連付けされるように配合されることができる。ラベルが、サンプル内での関心対象種目にまったく出合わない場合(たとえば、サンプル内に関心対象種目がまったく存在しない場合や、サンプル内のすべての関心対象種目が、すでにラベルを関連付けされている場合)には、そのラベルや過剰なラベルを、分離、洗浄などの適切な方法によって除去することができる。ラベルと関連付けされた関心対象種目を含む可能性があるサンプルは、この構造体の光学フローセルに渡され、ラベルが、フローセルと関連付けされた光学機器によって検出され、これによって、関心対象種目の存在が示される。
【0139】
高度な磁気ハンドリング
本明細書に記載した実施形態のいずれにおいても、溶解には、誘導された電気パルス(複数のこともある)や音波処理を含むことができ、これらのパルスによって、核酸(たとえば、DNAおよびRNA)を、結合の前に実質的に未損傷の形態で曝露されるようにする。
【0140】
上で開示した核酸方法またはプロトコルに加えて、装置100〜170によって実行される方法は、免疫学的診断方法とすることができる。たとえば、米国特許第5,795,784号は、上で開示した装置100〜170によって、恐らく適切な修正を伴って実行されることができる、様々な方法またはフォーマットを列挙している。さらに、抽出されたDNAおよび/またはRNAは、装置100〜170によって増幅されかつ検出されることができ、また別法では、さらに処理を行うために、別の装置100あるいは米国特許第5,795,784号などに開示されている装置などの別の装置に搬送されることがある。任意選択では、第1の収容器1は、適切な手段によって封止されることができる。
【0141】
別の実施形態では、第1の収容器1の内容物は、上で検討した処理の後、第1の処理経路11上の位置76から、本構造体の光学フローセルに移送されることができる。光学フローセルは、次の米国特許、すなわち米国特許第5,589,394号、同第5,601,234号、同第5,631,165号、同第5,631,730号、同第5,656,499号、同第5,812,419号、および同第5,891,734号(これらのすべての開示は、全体を参照により本明細書に組み込むものとする)に記載されたものと実質的に同様である。サンプル内の関心対象種目は、光学フローセルによって検出されることができる。
【0142】
この実施形態の一修正形態では、サンプルは、第1の収容器1、8、15または別のサンプル搬送容器から、装置のサンプル受け取りカップに直接移送されることができる。サンプルは、あるラベルを含んだ試薬と混合され、適切にインキュベーションされることができる。この試薬は、ラベルが、サンプル内の細胞および/または核膜に出合うかまたはこれを通過し、これによって、当該サンプル内における関心対象種目の所在箇所と無関係に、ラベルが、サンプル内の関心対象種目と結合され、さもなければ関心対象種目と関連付けされるように配合されることができる。ラベルが、サンプル内での関心対象種目にまったく出合わない場合(たとえば、サンプル内に関心対象種目が、まったく存在しない場合や、サンプル内のすべての関心対象種目が、すでにラベルに関連付けられている場合)には、そのラベルや過剰なラベルを、分離、洗浄などの適切な方法によって除去することができる。ラベルと関連付けされた関心対象種目を含む可能性があるサンプルは、構造体の光学フローセルに渡され、ラベルが、フローセルと関連付けされた光学機器によって検出され、これによって、関心対象種目の存在が示される。
【0143】
サンプル内での関心対象種目の判定を実施するために追加的な方法および構造体が、使用されることがある。図34Aは、収容器8からのサンプルを処理するように構成された別の要素を備えた流体ハンドラー86を示している。流体ハンドラー86は、ルーチンの実験室の用途で一般に用いられる自動ピペット作業工程に対する、知られている流体移送技術を利用している。当業者には、適切な流体ハンドラーが、知られていると共に十分に理解されており、一般に市場で入手可能な流体ハンドラーとしては、Gilson、Hamilton、PSS、Tecan、Tri continent、Packardによって製造されたハンドラーなどが含まれる。装置180は、流体ハンドラー86、ピペット先端28、試薬ハンドラー13a、DNA/RNA処理経路抽出装置11a、収容器8内に包含されたサンプル用の格納容器、原動機(駆動装置)85、シーラー90、増幅および検出デバイス84、ならびに単一構造体また別法では複数の構造体で関心対象種目を処理するために必要となる別の要素を備えるように構成されている。
【0144】
本明細書に記載した上述の化学的例を装置180で処理するためには、流体ハンドラー86は、適切な工程において、ピペッタ12および19によって上述したような組み合わせられた機能を実行する。収容器(複数のこともある)8からのサンプルに対する自動ピペット作業、ならびに関心対象種目の試薬エリア13aからの分離のために有用な試薬に対する自動ピペット作業は、第1の収容器(複数のこともある)1のアレイに実施される。第1の収容器(複数のこともある)1の好都合なアレイを、アセンブリを、交互サンプル調製処理エリア11aで様々な高さに位置決めするために有用な機械要素93を含んでいる、反応容器収容器アセンブリ98として図35Aに示している。アセンブリ98は、さらに、反応処理の間に、第1の収容器(複数のこともある)1のアレイを保持するために保持器91およびカバー92を含んでいる。処理エリア11aを、図35Aに示しており、処理エリア11aは、温度アセンブリ96、温度アセンブリ95、温度アセンブリ97、およびマグネットアセンブリ87からなる。代替的な第1の収容器(複数のこともある)1a〜1rを、図12A〜図12Rに示している。
【0145】
したがって、本発明は、流体から磁性粒子を単離するための装置を提供し、該装置は、少なくともn個の縦列と少なくともm個の横列を有するマグネットアレイを備え、任意に、マグネットの極は平行に向けられ、装置はさらに、少なくともn+1個の収容器または収容器保持器からなるアレイを備え、該収容器または収容器保持器からなるアレイは、各収容器または収容器保持器が、マグネットの一方の極のみに隣接するように、マグネットアレイに隣接して位置決めされ、ここで、nが1から1000までの整数であり、かつmが、1から1000までである。マグネットアレイが、少なくとも1×3となり、かつ収容器アレイが、少なくとも6×8となるように、nが少なくとも1でありかつmが少なくとも3であることが好ましい。複数のマグネットは、各収容器が、複数のマグネットの一方の極のみに隣接することになるように、より大きな1つのマグネットと本質的に同じ磁束密度パターンを発生させることができることが理解されよう。したがって、本発明によってさらに、各収容器が、マグネットの1つの横列または縦列のみに隣接して位置決めされ、マグネット横列内の各マグネットの中心を通って引いた線が、収容器の開放端を画定している外周と交差しておらず、かつ収容器に隣接する各マグネットが、収容器と対面して同じ極を有するように向けられる、マグネットおよび収容器(収容器保持器)からなるアレイが提供される。
【0146】
同様に、マグネットアレイは、少なくとも1つの縦列と少なくとも3つの横列のマグネットを備えることが好ましい。この構成を有する適切なデバイスの1つを、図44に表している。図44では、3×6のマグネットアレイが、6×8の収容器保持器アレイ内に挟み込まれている。任意の縦列の6個のマグネットは、端と端とを隣接されるか、あるいは互いに接近して配置され、これによって6個のマグネットからなる各バンクによって、該バンクの6個のマグネットに等しい長さを有する単一マグネットによる磁束と実質的に同一の磁束パターンを発生させている。したがって当業者であれば、図44の6個のマグネットは、6個より多くのマグネットや6個より少ないマグネットで置き換えることが可能であることを理解されよう。
【0147】
図44に示した実施形態では、図44のマグネットアレイ内の各マグネットは、一対の狭い側面と一対の広い側面とを有しており、これら各一対の側面は、相対向して配置されていると共に、これらのマグネットの広い側面は、マグネットの極を形成させている。
【0148】
したがって、マグネット収容器保持器によって、全体を図45に表している収容器およびマグネットのパターンを有する、マグネットおよび収容器からなるアセンブリが生成される。ただし収容器は、保持器によって保持されると、図46に示すようにある小さい距離だけずれており、またこれより大規模の場合は図47に示したパターンを形成し、マグネットに関する要件を最小にした状態で、収容器保持器内に配置された収容器が保持している磁性粒子の実質的にすべてを捕捉するために、十分な磁束密度パターンを有利に発生する。
【0149】
サンプルおよび試薬のピペット作業の後、アセンブリ98は、適切なロボット工学的原動機85によって、化学処理に適した箇所に位置決めされる。ロボット工学的原動機は、当技術分野では十分に理解されており、所望の要素に関して自動的把持、ならびにX、Y、およびZ軸方向での再配置を提供する。こうしたロボット工学技術に関するよく知られた製造者としては、NSK、Yamaha、Fanuc、Tecanなどが含まれる。本明細書に記載した処理では、アセンブリ98を、分離処理に適した温度に保持させたヒータアセンブリ96に移動させている。適切な任意の時間および温度を使用することが可能である。図示した実施形態では、望ましい温度およびインキュベーション時間の1つは、摂氏37度で20分間であることが分かっている。アセンブリ96の詳細を、構造体104および電子制御式のヒータ素子105を備えるようにして図37に示している。細胞の溶解、たんぱく質の変性、および関心対象種目の固相材料に対する結合(ただし、これらに限らない)を含むことが可能である、初期インキュベーションが完了した時点で、原動機85は、関心対象種目を、ある具体的な実施形態では関心対象となっていない別の種目から分離するために、アセンブリ98をマグネットアセンブリ87に再配置させる。
【0150】
関心対象種目の定量化における信頼性および感度を向上させるために、比較的大きなサンプル入力体積(たとえば、1mL〜4mL)を処理することが、望ましいことがあり得る。サンプルをさらに増幅および検出するために、試薬および反応体積を減少させることが同様に望ましい。同様に、単一収容器の体積にこのような減少を実施することも望ましい。定量化に必要な流体の量は、相対的に大きな反応体積(たとえば、好ましくは1mLを超える、さらに好ましくは2.5mLを超える、任意選択では5mL、または10mLを超える、ただし25mLや100mLを超えないこともまた好ましい)から、相対的に小さい体積まで(たとえば、好ましくは500μL未満まで、さらに好ましくは100μL未満まで、任意選択では50μL未満まで、またいくつかの実施形態では25μL未満まで、ただし少なくとも2μLであることが好ましい)低下させることが好ましい。しかし、関心対象種目たとえば微小粒子を結合させるための反応の間で、溶液内の固相を利用する場合、従来技術方法では、まず大きな体積(たとえば、3.5mL)内に粒子を分散させ、この粒子を分離し、さらに相対的に小さい体積(たとえば、80μL)で、少なくとも自動式機器で特に遠心分離を行わずに適宜完了できるような後続の工程で、粒子の高い捕捉を保証することは可能ではない。
【0151】
図示した実施形態では、本発明は、まずアセンブリ98を、図35Fおよび図35Gに示したような原動機85を備えたマグネットアセンブリ87の第1の位置に位置決めする。マグネット99は、第1の収容器(複数のこともある)の側壁上の相対的に高い領域において結合された関心対象種目が捕捉できるように、第1の収容器反応体積に対して相対的に高い位置に位置決めされる。この実施形態では、最適な捕捉動作性能が得られるように、アレイの1つおきの横列で水平の極を有するマグネットが示されているが、別の適切なマグネット構成を利用することも可能である。ある時間期間(たとえば、15〜210秒、好ましくは45〜135秒)の経過後、原動機85(あるいは、代替的な移動手段)によって、アセンブリ98を、図35Dおよび図35Eに示したマグネットアセンブリ87上の第2の位置まで移動させる。この処理中に、すでに捕捉済みの粒子は、第1の収容器1の壁上を垂直に下に移動させられ(この移動の結果として)、また収容器(複数のこともある)1の中間領域にある未捕捉の粒子(存在する場合)が、さらに捕捉される。磁性粒子がマグネット99によって捕捉できるように適切な時間期間(たとえば、15〜210秒、または45〜135秒)を経過した後、アセンブリ98を、図35Bおよび図35Cに示した原動機85によって、マグネットアセンブリ87上の第3の位置まで移動させることが好ましい。この処理中に、すでに捕捉済みの粒子は、収容器(複数のこともある)の壁上を垂直に下に移動させられ(この移動の結果として)、また収容器(複数のこともある)1のより下側の領域にある未捕捉の粒子が、さらに捕捉され、収容器(複数のこともある)壁上の望ましくかつ相対的に低い位置に至る。連続した各捕捉の後で、未結合の反応混合物を順次吸引および処分するため、また別法では、最終の捕捉段階の後で未結合反応混合物の排出を実施するために、流体ハンドラー86を使用することが望ましいことがある。
【0152】
別の実施形態では、サンプルは、収容器内で磁性粒子および溶解溶液と結合され、かつ、サンプル内の核酸源を溶解させて溶解されたサンプルを生成し、磁性粒子上の核酸を捕捉できるだけの十分な期間にわたって、溶解条件下で保持される。磁性粒子を捕捉することが可能であり、また次いで、溶解されたサンプルの未捕捉部分を、収容器から吸引することが可能である。これ前述の説明に従って、マグネットは、収容器の壁上で相対的に高く配置され、適切な時間期間の後に、収容器に対して移動され、マグネットが、収容器の底部の近くで収容器の脇に配置されるようにする。このことは、収容器の底部の近傍の収容器の側面上に磁性粒子のペレットを単離させ、収容器からの溶解溶液の排出をより効果的にさせ、かつ/または溶解溶液の吸引または排出中における磁性粒子の損失規模を低下させる効果を有する。これについては、図48に示している。
【0153】
所望であれば、洗浄溶液を添加することが可能であり、またマグネットは、図48に示した位置において磁気ペレットを捕捉するように操作されることが可能である。
【0154】
上述した1回または複数回の洗浄工程が完了した後、収容器は、マグネットに対して上昇され、収容器の底部が、マグネットの最上部より高く持ち上げられるようにする。このことによって、ペレットは、核酸を、磁性粒子から溶離させようとする際に、ペレットを留め置く好ましい位置である収容器の底部まで移動させられる。溶離を達成するためには、ある小さい体積の溶離溶液を収容器に添加する。適切な任意の体積の溶離溶液を、使用することが可能であり、また典型的には少なくとも10μl、好ましくは少なくとも30μlが収容器に添加される。しかし、溶離溶液は、多くなり過ぎないようにすることが望ましい。したがって、溶離溶液の最大体積は、好ましくは510μl未満、さらに好ましくは210μl未満、なおさらに好ましくは100μl未満である。こうした少ない溶離溶液体積(たとえば、40μl)を使用するため、磁性粒子を、確実に収容器の底部まで移動させることができることが、より適切であることになる。このことは、本実施形態では、収容器の底部を、図49に示したようにマグネットの最上部の上まで持ち上げることによって実現される。
【0155】
マグネット位置の収容器までの相対的移動は、適切な任意の手段によって達成されることができる。たとえば、ロボット工学的原動機85によって、アレイ状の収容器を、ある箇所から別の箇所まで移動させることができ、図示したように構造支持体によって、アレイ状の収容器を、マグネットアレイ(部分的)に対して異なる高さに配置させる。別の実施形態では、たとえば上昇用アーム(または、複数のアーム)による、あるいは収容器アレイまたはマグネットアレイが、傾斜面を横切るように移動する、収容器とマグネットアレイの結合体を回転させることによるなど、ある種のメカニズムによって、マグネットに対するアレイ状の収容器の箇所を適切にシフトさせることができる。これによれば、マグネットに対する収容器の位置を、連続方式で変化させられるので有利である。当業者であれば、マグネットに対する収容器の位置を変化させるために別の適切な手段を、利用することも可能であることを理解されよう。
【0156】
したがって、本発明はさらに、流体内に懸濁された磁性粒子を分離するための方法を提供し、該方法は、中に磁性粒子が懸濁されている流体を包含するための収容器、自動式ピペット、およびマグネットを有する装置を第1の位置に提供する工程を含み、必要に応じて、マグネットが、収容器の事前に選択したゾーンに磁性粒子を単離する磁場を磁性粒子に対して作用させるように、マグネットもしくは収容器、あるいはマグネットと収容器の両方を移動させ、該方法はさらに、事前に選択したゾーンがピペットから遠位にあるような、収容器の第1の吸引ゾーンから磁性粒子が排出されるように、収容器を横切る磁場を(適切な時間期間にわたって)印加する工程を含む。本方法は、ピペットを流体内に浸漬させ、収容器内の第1の吸引ゾーンから事前に選択した量の流体を吸引することによって、必要に応じて継続される。事前選択の流体量は、流体の体積の1/2(2分の1)未満(たとえば、5%〜50%)とすることが好ましく、また別法では、事前選択の流体量は、流体の体積の約85%(たとえば、約50%を超え約90%まで)である。任意選択では、本方法は、さらに、装置を第2の位置まで移動させ、これによって、磁場をピペットから分離させる工程を含む。この第2の位置において、マグネットによって、磁性粒子に磁場を印加し、磁性粒子を第2の吸引ゾーンから排出することができる。次いで自動式ピペットを進ませて、第2の吸引ゾーンから流体を吸引し、これによって、磁性粒子を流体から分離させる。
【0157】
次いでアセンブリ98を、温度位置97(マグネットが存在しない場所であることが好ましい)まで移動させる。流体ハンドラー86が、洗浄流体を添加しており、次いでアセンブリ98は、未結合反応混合体を廃棄するための追加的な捕捉および吸引のためにマグネットアセンブリ87まで戻される。洗浄および捕捉の処理は、多くの回数にわたって反復される。いくつかの実施形態では、3回から4回の洗浄サイクルが好ましい。
【0158】
洗浄の後、流体ハンドラー86は、溶離緩衝剤を分与することができ、また原動機85は、インキュベーションの間(たとえば、摂氏70度で20分間)に、関心対象種目を固相媒体から分離させる場所である温度アセンブリ95まで、アセンブリ98を移動させることができる。未結合固相の最終の捕捉は、後続の処理をする前に、マグネットアセンブリ87において実施される。後続の処理は、関心対象種目を、第1の収容器(複数のこともある)1から別の収容器(複数のこともある)15まで移送する工程を含むことがある。収容器(複数のこともある)15は、さらに、流体ハンドラー86によって分与された追加的な試薬を含むことがある。収容器(複数のこともある)15は、シーラー21によって封止され、さらに原動機85によって、開口90を通して図34Aに示すように代替サンプル調製処理エリア11aの垂直方向で下側に位置する1つまたは複数の処理経路16iを含む追加的な処理経路16に移送されることができる。この実施形態では、代替サンプル調製処理エリア11aより垂直方向でより下側に処理経路16を位置決めすることによって、サンプル調製処理の増幅処理からの分離が改善され、これによって、単一構造体での汚染の機会が減少する。増幅検出処理(図34Aで示す箇所84)を含む構造体の壁内で、さらに通気孔45を利用することによって、望ましくない任意の空中浮遊汚染物が、増幅および検出処理の近傍からさらに除去され、これによって、処理エリア同士の間での汚染の機会が減少する。
【0159】
固体廃棄物の減少を促進するために、使い捨て式ピペット先端28を利用する流体ハンドラー86は、複数の時点で使用される化学処理の間にある特異的なまたは特定のサンプルで使用するために、先端(複数のこともある)28を保有することができる。処理中の後で再使用するために、処理中の適切な期間にわたってこうした先端(複数のこともある)28を適正に収容しておくために、図39に示すように先端単離収容器107を、先端単離収容器保持器106と連携させている。これによって、先端アレイ内に各先端が保存され、これらが必要となるまで、別の先端から分離される。当業者であれば、固体廃棄物の発生の大幅な低減は、このピペット配備メカニズムおよびアセンブリの使用によりもたらすことができることが理解されよう。
【0160】
別の処理を、記述した処理と組み合わせて、追加的な処理を生成させることができることを理解されたい。たとえば、関心対象種目は、代替サンプル調製処理エリア11aでさらに試薬添加および増幅検出するために、収容器(複数のこともある)1内に保持したままとすることも可能である。さらに、2つ以上のアセンブリ98が、順番に、並列に、あるいは交互に処理を受け、サンプル処理の歩留りを向上させることもできる。さらに、マグネット(複数のこともある)99は、あるメカニズムに装着され、収容器(複数のこともある)1に対するマグネット(複数のこともある)99の相対的配置を提供されることもできる。
【0161】
マグネットアセンブリ87の詳細を、図36Aおよび図36Bに示している。マグネット(複数のこともある)99は、スロット(複数のこともある)103内に位置しており、プレート100および留め具102によって、機械的に保持される。図36Bに示したマグネットの極性は、水平方向であるが、代替的な構成(斜め方向や垂直方向の構成(だたし、これらに限らない)を含む)も適用可能である。マグネットの交互の横列とする方が、収容器(複数のこともある)1に隣接した可能なあらゆる横列を利用することよりも優れている。本発明は、この点に関して具体的な任意の理論によって束縛されるものではないが、この優越性は、図42Aおよび図42Bに示すような、可能なすべての横列を利用する場合には、望ましくない磁束密度パターンが驚くほど増大する(固相ブリッジ109になる)ためであることがある。望ましいフラックス密度パターンを、図42Cに示しており、またこれらの構成間の%捕捉動作性能の比較を、図43に示している。
【0162】
追加的な代替構成を、マグネットアセンブリ87に組み込むことも可能である。上述の処理中に、マグネット(複数のこともある)99および収容器(複数のこともある)1の位置を固定することによって、磁性粒子が、図40Cに示すような静止フラックスパターンで存在するチューブの下側部分に沈殿できるように、捕捉時間を長くして受容可能な結果を得ることも可能である。垂直面でのフラックスパターンの到達を促進させるために、マグネット(複数のこともある)99は、図40Bに示すように垂直の極の向きで位置決めされることができ、これによって、必要となる捕捉時間を短縮することができる。固定のマグネット構成において捕捉時間をさらに短縮させるためには、図40Dに示すように、未結合反応混合物の排出中に、ピペット先端28を、磁束パターン内のある領域まで移動させることができる。こうした技術によって、意図せずに廃棄に向けられることがある未結合磁気の量が減少する。
【0163】
別の実施形態では、マグネットアセンブリ87において円筒状のマグネットを使用することができる。円筒状のマグネットは、円筒の一方の辺縁に沿って磁石のN極を有し、かつこれと反対の辺縁に沿って磁石のS極を有していると有利である。図40Aに示すように、円筒状のマグネット(複数のこともある)99は、収容器(複数のこともある)1を取り囲むような向きにされ、磁性微小粒子の効果的な捕捉を達成することができる。収容器アレイ1の周りにおけるマグネットアレイの構成に関しては、複数の選択肢が利用可能である。たとえば、収容器アレイ内の各収容器1は、図40Aに示したような4つの円筒状のマグネットと隣り合わせて配置されることができる。別法として、2つまたは1つの円筒状マグネットを、各収容器に隣り合わせて配置することができる。別の実施形態では、1つの円筒状マグネットを、収容器アレイ内の収容器1の各2×2サブアレイ(または要素)の間に配置させることができる。図40Eは、円筒状マグネット99の構造体104への据え付けを示している。
【0164】
好ましい一実施形態では、マグネットアセンブリ87の上述した実施形態のいずれについても、図41に示すような大きなバイアスマグネット108と結合させることができる。収容器1アレイの相対する端部を起点とする有効磁場が提供されるように、この大きなバイアスマグネットは、収容器アレイに及んでいる。この大きなバイアスマグネットは、収容器(複数のこともある)1の最上部分において磁束密度を増大させている。この大きなバイアスアレイは、収容器1の高さの2分の1の位置において、磁束密度を3倍に、さらに好ましくは10倍に有利に増大させることができる。図示した実施形態では、試験サンプルにおいて、約10倍のバイアスマグネットから2cmを超える磁束密度の上昇が観察された。明瞭にするため、図41に示す実施形態の収容器は、高さが約12cmとなっている。ライン110は、大きなバイアスマグネットによって提供される磁束の有効到達点への到達を表している。
【技術分野】
【0001】
以下は、全般的にはサンプル内において関心対象種目(アイテム)を判定するための構造体および方法に関する。より具体的には、以下、DNA、RNA、断片、補体、ペプチド、ポリペプチド、酵素、プリオン、たんぱく質、メッセンジャーRNA、転移RNA、ミトコンドリアRNAまたはDNA、抗体、抗原、アレルゲン、細胞またはバイロンなどの生物学的実体の一部、表面たんぱく質、上記のものの機能等価物などの指定領域のすべてまたは一部分であるか、これを含むことができる関心対象種目の判定に関する。
【背景技術】
【0002】
患者の健康に関する情報を提供するためには、患者の体液などの患者サンプルに対して、数多くの試験を実行することができる。これらの体液には、血清、全血(whole blood)、尿、スワッブ(swab)、血漿(plasma)、脳脊髄液、リンパ液、中実組織などを含むことができる。
【発明の概要】
【発明が解決しようとする課題】
【0003】
患者の体液に対して実施した試験によって、体液内における上述したものなどの関心対象種目を判定することができる。患者の体液内の関心対象種目のこの判定に基づいて、患者の健康状態に関する情報を得ることができる。
【課題を解決するための手段】
【0004】
本発明の態様の1つでは、サンプル内での関心対象種目の判定を、単一構造体を用いて実施する方法が提供される。サンプルは、この単一構造体に対してアクセス可能となるように提供されている。サンプルを処理するための第1の収容器は、この単一構造体の第1の処理経路に配置される。サンプルは、第1の処理経路において第1の収容器まで移送される。第1の処理経路において、第1の収容器にある試薬が加えられる。第1の収容器の内容物は、第1の処理経路において混合される。サンプル内の関心対象種目は、第1の処理経路において第1の収容器の内容物から分離される。サンプル内の分離された関心対象種目は、単一構造体で、第1の処理経路にある第1の収容器から第2の処理経路にある第2の収容器まで移送される。第2の収容器の内容物は、第2の処理経路において、第1の処理経路の温度と異なる第1の温度に至らされる。第2の収容器内の関心対象種目は、第2の処理経路において検出される。
【0005】
別の方法では、サンプルが単一構造体の第1の処理経路にある第1の収容器まで移送される。サンプル内の関心対象種目は、第1の処理経路において第1の収容器の内容物から分離される。サンプル内の分離された関心対象種目は、単一構造体の第1の処理経路にある第1の収容器から、第2の処理経路にある第2の収容器まで移送される。第2の収容器の内容物は、第2の処理経路において第1の処理経路の温度と異なる第1の温度に至らされる。関心対象種目は、第2の処理経路にある第2の収容器において検出される。
【0006】
追加的な方法では、サンプルが、単一構造体の処理経路にある収容器まで移送される。サンプル内の関心対象種目は、この処理経路において収容器の内容物から分離される。収容器の内容物は、処理経路において第1の温度に至らされる。収容器の内容物は、処理経路において第1の温度と異なる第2の温度まで至らされる。関心対象種目は、処理経路にある収容器において検出される。
【0007】
また別の方法では、サンプルが、単一構造体の第1の処理経路にある第1の収容器まで移送される。このサンプルは、単一構造体の第1の処理経路にある第1の収容器から、第2の処理経路にある第2の収容器まで移送される。第2の収容器の内容物は、第2の処理経路において第1の処理経路の温度と異なる第1の温度に至らされる。関心対象種目は、第2の処理経路にある第2の収容器において検出される。
【0008】
さらに別の方法では、サンプルが、単一構造体の処理経路にある収容器まで移送される。収容器の内容物は、単一構造体の処理経路において第1の温度まで至らされる。収容器の内容物は、単一構造体の処理経路において第1の温度と異なる第2の温度まで至らされる。関心対象種目は、単一構造体の処理経路にある収容器において検出される。
【図面の簡単な説明】
【0009】
【図1】本明細書に記載した収容器構造体の斜視図である。
【図2】図1の収容器構造体の斜視図である。
【図3A】本発明と共に使用することがある装置の一実施形態の全体上面図である。
【図3B】図3Aに示した装置の斜視図である。
【図4】図3Aおよび3Bの装置と共に使用するためのサンプルキューの斜視図である。
【図5A】図3Aおよび3Bに示した装置と共に使用することができるコンポーネントの斜視図である。
【図5B】図3Aおよび3Bに示した装置と共に使用することができるコンポーネントの斜視図である。
【図5C】図3Aおよび3Bに示した装置と共に使用することができるコンポーネントの斜視図である。
【図5D】図3Aおよび3Bに示した装置と共に使用することができるコンポーネントの斜視図である。
【図5E】図3Aおよび3Bに示した装置と共に使用することができるコンポーネントの斜視図である。
【図5F】図3Aおよび3Bに示した装置と共に使用することができるコンポーネントの斜視図である。
【図6】図3Aおよび3Bの装置と共に使用するための収容器および搬送機の斜視図である。
【図7】図3Aおよび3Bに示した装置と共に使用するためのピペット先端ローダの斜視図である。
【図8】図3Aおよび3Bに示した装置と共に使用するためのピペット先端ローダの別の実施形態の斜視図である。
【図9】図3Aおよび3Bの装置と共に使用するための収容器ローダの斜視図である。
【図10】図3Aおよび3Bに示した装置と共に使用するための収容器運搬装置の斜視図である。
【図11】図10の一部分の拡大図である。
【図12A】図1に示した収容器の代替的な実施形態の斜視図である。
【図12B】図1に示した収容器の代替的な実施形態の斜視図である。
【図12C】図1に示した収容器の代替的な実施形態の斜視図である。
【図12D】図1に示した収容器の代替的な実施形態の斜視図である。
【図12E】図1に示した収容器の代替的な実施形態の斜視図である。
【図12F】図1に示した収容器の代替的な実施形態の斜視図である。
【図12G】図1に示した収容器の代替的な実施形態の斜視図である。
【図12H】図1に示した収容器の代替的な実施形態の斜視図である。
【図12I】図1に示した収容器の代替的な実施形態の斜視図である。
【図12J】図1に示した収容器の代替的な実施形態の斜視図である。
【図12K】図1に示した収容器の代替的な実施形態の斜視図である。
【図12L】図1に示した収容器の代替的な実施形態の斜視図である。
【図12M】図1に示した収容器の代替的な実施形態の斜視図である。
【図12N】図1に示した収容器の代替的な実施形態の斜視図である。
【図12O】図1に示した収容器の代替的な実施形態の斜視図である。
【図12P】図1に示した収容器の代替的な実施形態の斜視図である。
【図12Q】図1に示した収容器の代替的な実施形態の斜視図である。
【図12R】図1に示した収容器の代替的な実施形態の斜視図である。
【図13】図12Eの収容器の混合機との係合を表した図である。
【図14】図3Aおよび3Bの処理経路と動作可能な関係で設けられたポートの図である。
【図15】図3Aおよび3Bの装置と共に使用するためのピペッタの分解斜視図である。
【図16】図15のピペッタの1つの動作を表した図である。
【図17】図15のピペッタの別の動作を表した図である。
【図18】図3Aおよび3Bの装置と同様の装置の代替的な実施形態の等角図である。
【図19】図18の装置と実質的に同様の装置の等角図である。
【図20】図3Aおよび3Bの装置と実質的に同様の別の装置の上面図である。
【図21】図20の装置と実質的に同様の別の装置の上面図である。
【図22】図21の装置と実質的に同様の別の装置の上面図である。
【図23】図22の装置と実質的に同様の別の装置の上面図である。
【図24】図23の装置と実質的に同様のまた別の装置の上面図である。
【図25】図3Aおよび3Bの装置と同様のまた別の装置の上面図である。
【図26】図3Aおよび3Bの装置と同様のまた別の装置の上面図である。
【図27A】図3Aおよび3Bの装置と共に使用するための収容器およびシールの斜視図である。
【図27B】図3Aおよび3Bの装置と共に使用するための収容器およびシールの斜視図である。
【図27C】図3Aおよび3Bの装置と共に使用するための収容器およびシールの斜視図である。
【図27D】図3Aおよび3Bの装置と共に使用するための収容器およびシールの斜視図である。
【図27E】図3Aおよび3Bの装置と共に使用するための収容器およびシールの斜視図である。
【図27F】図3Aおよび3Bの装置と共に使用するための収容器およびシールの斜視図である。
【図28】本発明と共に使用することができる光学構成の斜視図である。
【図29】本明細書に記載した構造体の一部分の動作の全体図である。
【図30A】本発明と共に使用することができる熱サイクリングモジュールの断面図である。
【図30B】図30Aのモジュールの上面図である。
【図31】図30Aのモジュールの断面図である。
【図32A】別の熱サイクリングモジュールの断面図である。
【図32B】図32Aのモジュールの上面図である。
【図33】さらに別の熱サイクリングモジュールの全体平面図である。
【図34A】本明細書に記載した図3Aおよび3Bの装置と実質的に同様のさらに別の装置の斜視図である。
【図34B】図34Aの装置の全体上面図である。
【図35A】図34Aの装置と共に使用するための代替サンプル調製処理エリアの斜視図である。
【図35B】図35Aの代替サンプル調製処理エリアの追加的な斜視図である。
【図35C】図35Aの代替サンプル調製処理エリアの追加的な斜視図である。
【図35D】図35Aの代替サンプル調製処理エリアの追加的な斜視図である。
【図35E】図35Aの代替サンプル調製処理エリアの追加的な斜視図である。
【図35F】図35Aの代替サンプル調製処理エリアの追加的な斜視図である。
【図35G】図35Aの代替サンプル調製処理エリアの追加的な斜視図である。
【図36A】図35Aの代替サンプル調製処理エリアの別の図である。
【図36B】図36Aに含まれるマグネットの斜視図である。
【図37】図35Aの代替サンプル調製処理エリアと共に使用するためのコンポーネントの側面断面図である。
【図38】意図的に空白としている。
【図39】図34Aの装置と共に使用するための先端単離格納容器アセンブリの斜視図である。
【図40A】図35Aの代替サンプル調製処理エリアと共に使用するための代替マグネット構成の斜視図である。
【図40B】図35Aの代替サンプル調製処理エリアと共に使用するための別の代替マグネット構成の側面図である。
【図40C】図35Aの代替サンプル調製処理エリアと共に使用するための別の代替マグネット構成の側面図である。
【図40D】図40Bおよび40Cに示した代替マグネット構成と連携させたピペッタの側面図である。
【図40E】図35Aの代替サンプル調製処理エリアと共に使用するための代替的なマグネットアセンブリの斜視図である。
【図41】図35Aの代替サンプル調製処理エリアと共に使用するための代替マグネット構成の側面図である。
【図42A】磁気パターンの1つの図である。
【図42B】別の磁気パターンの1つの図である。
【図42C】さらに別の磁気パターンの1つの図である。
【図43】複数の磁気構成を用いた動作性能データの図である。
【図44】マグネットアレイおよびチューブ保持器アセンブリの図である。
【図45】マグネットおよびチューブ保持器のパターンの1つの図である。
【図46】マグネットおよびチューブ保持器のパターンの別の1つの図である。
【図47】図46に示したパターンの2つのコピーを備えており、かつマグネットが発生させる磁束をより十分に活用できるように、追加的なチューブ保持器をアセンブリの周囲に配置させている、マグネットおよびチューブ保持器パターンの図である。
【図48】核酸結合磁性粒子の洗浄のための収容器1とマグネット(複数のこともある)の好ましい相対的移動を表した図である。
【図49】核酸を磁性粒子から溶離するための収容器1とマグネット(複数のこともある)の好ましい相対的移動を表した図である。
【発明を実施するための形態】
【0010】
本明細書に記載した実施形態は、サンプル内の関心対象種目を判定するための方法および構造体に関する。この関心対象種目は、DNAまたはRNAの1つまたは複数の指定領域であることができ、あるいは断片、補体、ペプチド、ポリペプチド、酵素、プリオン、たんぱく質、メッセンジャーRNA、転移RNA、ミトコンドリアRNAまたはDNA、抗体、抗原、アレルゲン、細胞またはバイロンなど生物学的実体の一部、表面たんぱく質、これらのいずれかの機能等価物、これらのいずれかの濃度または別の所望のサンプル要素であることができる。例示的な一実施形態では、関心対象種目は、CT、CT/GC、MT、HCV、HBV、HPV、HIV、CMV、HLA、HTLV、および感染疾患、遺伝的マーカ、がん、心臓血管性種目、薬理遺伝学的種目など(ただしこれらの限らない)に関連するその他の種目(ただしこれらの限らない)を含む、特異的なDNAまたはRNA領域、抗体、または抗原(ただしこれらの限らない)から選択することができる。いくつかの実施形態では、その関心対象種目は、HCVに対する抗体、HIV 1/HIV 2に対する抗体、B型肝炎コア抗原に対する抗体(HBcAb)、がん胎児性抗原(CEA)、がん抗原19−9(CA19−9)、B型肝炎表面抗原(HBsAg)、B型肝炎表面抗原に対する抗体(HBsAb)、アルファ胎児たんぱく質(AFP)、総前立腺特異抗原(Total PSA)、遊離PSA、甲状腺刺激ホルモン(TSH)、黄体形成ホルモン(LH)、卵胞刺激ホルモン(FSH)、ベータヒト絨毛性ゴナドトロピン(B−hCG)、遊離チロキシン(Free T4)、遊離トリヨードサイロニン(Free T3)、総T4、総T3、プロゲステロン、テストステロン、エストラジオール、プロラクチン、ビタミンB12(B12)、葉酸塩、グリコヘモグロビン(Glycated Hemoglobin)、およびフェリチン(ただしこれらの限らない)から選択することができる。本質的に、ほとんどどのようなものもこの関心対象種目となり得る。
【0011】
本明細書に記載した構造体および方法は、多くの異なる構成で利用することができる。理解しやすくするため、そのDNA/RNAサンプルの調製、増幅、ならびにサンプル内において関心対象種目に対して1時間あたり概ね100回以上の判定を実施する、あるいはサンプル調製が分割されている場合は、サンプル内において関心対象種目に対して1時間あたり概ね300回以上の判定を実施する検出分析器に関して、この構造体および方法を用いることを検討することにする。別法としてこの同じ構造体は、免疫学的検定の分析器として使用することや、免疫学的検定の分析器とDNA/RNA分析器の両者として使用することができる。この構造体および方法は、1時間あたり600回、400回、200回、50回などの判定を実施する分析器などの別の利用形態で用いることができることに留意すべきである。
【0012】
所与の時間期間で実施される試験の回数(スループット)の変更、判定しようとする関心対象種目の調整など個々のニーズに適合するように、多くの構造体を互いに結合させたり、統合させたりすることができる。たとえば、所与の1時間でY回の判定を実施するX個の構造体を、接続させ、接続したこの構造体によって、1時間あたりXY回の判定を実施させることができる。所望であれば、これらの構造体のリソースは、米国特許第6,022,746号で開示されている方式と実質的に同様の方式で割り当てることができる。当該の出願は、本件の譲受人に譲渡されており、その開示の全体を本明細書に組み込むものとする。
【0013】
別の実施形態では、1つまたは複数の構造体を、免疫学的検定の分析器(たとえば、以下で参照する米国特許第5,795,784号で開示されたもの)、血液分析器(たとえば、以下で参照する米国特許第5,891,734号で開示されたもの)など別の分析器と、動作可能に接続させることがある。
【0014】
こうした構造体のすべてが、関心対象の種目を実質的に同じ方法で、すべて同じ判定を実施することに留意すべきである。たとえば、すべての同様の関心対象種目に対するすべての判定処理工程は、与えられた構造体によって実施しようとする判定回数と無関係に、36秒間など同じ時間枠内で実施することができる。これらの構造体は、試薬などの共通要素、使い捨て品、流体やその他の別の要素、搬送技術、判定工程実施メカニズム、ソフトウェアなどを含むことがある。
【0015】
別の用途では、その構造体が、臨床化学または血液学分析器などの異なる構造体または分析器と共に、同じ設定で使用できるように、その構造体は、たとえばコンベアシステムその他と、ならびに支援するハードウェアやソフトウェアと結合させることができる。このコンベアシステムは、1つのサンプルに関して様々な判定を実施できるようにするため、構造体間においてサンプルを移動させることができる。さらに、本明細書では理解しやすくするため1つのみの構造体に関して、構造体の動作を記載しているが、複数の構造体が、同時にまたは異なる時点のいずれかで、同じ方式または異なる方式で動作することが可能であることに留意すべきである。さらに、ある動作方法に関する工程を、別の動作方法の工程と組み合わせて、さらに多くの動作方法を得ることができる。
【0016】
本明細書に記載した構造体または方法はいずれも、米国特許第5,856,194号および同第6,413,780号など、目下のところで利用可能な文献に記載されている構造体および方法を含み、別の構造体や方法あるいはこれらの一部分と、適切な任意の方式で結合させることができる。
【0017】
本明細書に記載した構造体の構築は、様々な関心対象種目に関する試料を費用対効果が高い方法で分析することを目的としている。この構造体によって、ユーザは、この構造体にサンプルを供給すること、構造の処理(たとえば、当該サンプルに対するインキュベーション、調製、溶解(lyse)、溶離、分析、読み取り、等々)を有すること、ならびに処理の結果として構造体レポートを有することが可能となる。構造体サブコンポーネントとしては、そのうちのいくつかのみを示すと、サンプルや試薬などの材料に対する、混合、吸引および分与、インキュベーション、化学分離、および検出についての装置および方法を含む。一般的には、化学オートメーションに関する構造体構築の実現形態は、所望の患者サンプル添加方法、試薬添加方法、スループット(所与の時間期間あたりの判定回数)、汚染低減方法、検出方法、混合の程度、インキュベーション温度、および持続時間の必要性などの多くの要因によって、駆動させることができる。
【0018】
図1は、スループットを相対的に低下させた(各1.5時ごとに約1回の判定などの)環境に適した構造体1aを開示している。この構造体1aは、ベース2内に着脱可能に配置された第1の収容器1を備えている。
【0019】
図示した実施形態では、第1の収容器1は、ある選択量の流体(たとえば、約7mLのサンプルおよび試薬)を包含するだけのサイズとしている。しかし、本発明では、収容器に関して様々な形状およびサイズを使用することが可能であることを理解すべきである。図12Aから図12Pは、第1の収容器1に関する多種多様な代替的な構築を表している。
【0020】
ベース2は、たとえば、上で言及した米国特許第5,795,784号に開示されている処理経路の構築と同様の構築を含み、収容器を受け容れるための適切な任意の構築を有することができる(この場合、図1および図2に示した構造体は、処理経路に沿った適切な箇所に配置されることができる)。もちろん、ベース2は、第1の収容器1の様々な構築を収容するすなわち補完するように修正することができる。
【0021】
ベース2は、機械加工したまたはコーティングしたアルミニウムなどの適切な任意の材料から製作することができる。例示的な一実施形態では、ベース2は、MIL−A−63576 Type I仕上げを伴った6061−T6アルミニウムによって製作されている。第1の収容器1は、さらに、ポリエチレン(たとえば、DOW 30460M HDPEまたはChevron 9512)、ポリプロピレン(たとえば、Montel PD701NやPD702などその代替品)、あるいはポリスチレン(たとえば、DOW 666)による成型物を含み、適切な任意の材料から製作されることができる。
【0022】
プローブ3は、所望の方向(たとえば、X軸、Y軸、および/またはZ軸)へのプローブ3の動きを制御する適切な駆動装置に取り付けられていることが好ましい。所望の動きを提供する任意の駆動装置が、適切であるが、知られている適切な駆動装置としては、Tecanガントリ(Tecan RSPモデルシリーズ(Tecan、スイス))およびAbbott theta−Z ロボット(部品番号78479、Abbott Laboratories、Abbott Park、Illinois)が含まれる。
【0023】
プローブ3は、箇所3aにおいて、プローブ3に吸引および分与機能の実行を可能にさせる適切な構造体(図示せず)と流体接続されている。たとえば、これらの流体機能は、目的とした機能に適した任意のポンプ(たとえば、シリンジ式、ぜん動式(peristaltic)、等々)やバルブ技術を使用して実現することができる。
【0024】
引き込み式マグネット4は、以下で記載するように、第1の収容器1内のサンプル内での関心対象種目の所与の判定の実施中の選択した時点で、第1の収容器1およびベース2に対して移動できるように適切に支持されている。マグネット4の移動によって、その判定処理の工程の実施を有効にすることができ、これによって、当該の工程を、希望に応じて選択的に自動的に実施または回避することが可能となる。一実施形態では、そのマグネット4は、収容器1に相対的に近づくように移動され、第1の収容器1内の磁気応答粒子を第1の収容器1の側壁に引き寄せ、これにより、患者サンプル内の所望の関心対象種目に結合されていることがあるこれらの磁気応答粒子を、残りの患者サンプルまたは第1の収容器1の他の内容物から分離させることができる。
【0025】
こうしたマグネット4によりもたらされる分離の前、分離中、または分離後に、プローブ3によって、第1の収容器1の内容物の一部分を、廃棄物/洗浄リザーバ10に吸引することがある。関心対象種目の判定を強化するためには、引き続いて分与、分離、および吸引の工程が利用されることができる。磁気式分離を希望しない場合(すなわち、磁気式分離工程を回避する場合)の判定期間中に、第1の収容器1およびその内容物に対するマグネット4の磁場の影響を低下させるために、マグネット4を、第1の収容器1から離れるように適切に移動させることができる。
【0026】
別法として、いずれの関心対象種目にも付着されない磁気応答粒子は、第1の収容器1の側壁に引きつけられ、また一方、第1の収容器1の残りの内容物(関心対象種目を含む可能性がある)は、プローブ3などによって第1の収容器1から取り除かれる。
【0027】
このベース2にはさらに、加熱および/または冷却を提供するために、温度調節デバイス7が設けられることもできる(こうした調節を希望する場合)。このデバイス7は、ベース2と手動式または自動式で着脱可能に接続されることができ、適切な制御装置(適切なルーチンを実行させるメモリを備えたコンピュータなど)によって動作させることができ、また伝導、対流、および/または輻射、等々を含む適切な任意の熱伝達手段を利用することができる。たとえば、温度調節された(加熱されたかつ/または冷却された)空気を、第1の収容器1に対して移動させ、第1の収容器1の内容物を所望の方式で温度調節することができる。
【0028】
関心対象種目に対する所与の判定の実施中の様々な時点で、サンプルまたは試料の収容器8(試験管やその他など)内に配置させたサンプルと、試薬収容器9内に包含させた試薬とを、プローブ3の使用などによって第1の収容器1に添加することができる。複数のサンプルおよび/または試薬が望ましい場合は、複数の収容器8および/または9のコンベア、回転ラック(carousel)、再循環することもあり得る移動可能または静止式の別の構成などのアレイを、提供することも可能である。サンプルおよび試薬の収容器8および9は、たとえば、ポリマー様ポリスチレン(DOW 666)、高密度ポリエチレン(DOW 30460M HDPEまたはChevron 9512)、その他を含み適切な任意の材料から製作されることができる。
【0029】
収容器8または9のいずれかの内容物の保存性を向上させるために、サンプルと試薬収容器8、9のいずれか一方または両方に対して、上で言及した米国特許第5,795,784号に開示されているカバーと実質的に同様のカバー30(図5C参照)を設けることができる。このカバー30は、Lexington Medical 3481005 EPDM、Abbott EPDM(Ashland、Ohio)などの適切な任意の材料から製作することができる。適切な収容器8および9、ならびに対応するカバーは、上で言及した米国特許第Des.401,697号、同第Des.401,699号、および同第Des.397,938号に示されている。収容器(収容器8など)を別の収容器または搬送機にはめ込むための方法は、同じ所有者による米国特許第5,915,583号に記載されており、これも本発明の趣旨の域内で使用することができる。
【0030】
第1の収容器1にサンプルおよび/または試薬を添加した後、プローブ3を、適切に洗浄して汚染物を除去し、これにより第1の収容器1が、それ以降汚染物に曝露される可能性を低下させることができる。たとえば、プローブ3に対する流体洗浄のために、プローブ3を、廃棄物/洗浄リザーバ10に移動させることができる。プローブ3は、別法として、その開示全体を参照によって本明細書に組み込むものとする米国特許第5,232,669号に開示されているピペッタ先端などの使い捨て式先端を組み込むように修正されることができ、この使い捨て式先端は、目的とした用途を完了したのち、プローブ3との流体/運搬インタフェースから廃棄するように排出される。図5Fは、使い捨て式先端28の別の例を示している。
【0031】
ベース2内には、ボア6など所望の検出器を収容するための適切な開口を設けることができ、検出器は、光電子増倍管、フォトダイオードなどの構造体によって使用するのに有利である。図示した図1の実施形態では、米国特許第5,795,784号に開示されたのと同じ構造体と同様の方式で、そのボア6を、マグネット4と反対位置に配置させている。したがって、蛍光物質その他などのラベルが発生させた化学ルミネセンスその他の信号の検出など、同様の動作が可能である。
【0032】
ベース2上には、さらに図2に示した適切な混合機5が設けられている。混合機5は、たとえば、所望の時点で第1の収容器1に軌道運動を誘導し、第1の収容器1の内容物を混合させることができる力を、混合機5に加える適切な駆動装置5aと結合させている。適切な混合機の代替的な構築は、図13および米国特許第5,795,784号に示されている。
【0033】
ベース2は、混合機5に対して所望の混合の達成を可能にするために、第1の収容器1の移動の自由を制限するように構築されている。この点に関する支援のために、ベース2は、さらに蓋(図示せず)を含むことができる。
【0034】
所望であれば、図1に示した構造体1aは、相対的に高いスループットの環境を提供するために、所与の時間期間内に約100回などより多くの判定回数を実行するように修正することができる。このように修正する場合、その各々が、プローブ3、マグネット4、混合機5、検出器用のボア6、および温度調節デバイス7のうちの1つまたは複数を実際的に含むように、構造体1aのアレイを、互いに動作可能に接続させることができ、こうした要素は、接続される各構造体1aに個々に設けられているか、あるいは構造体1a同士で適切に共有されている。プローブ3、マグネット4、検出器6、加熱/冷却素子7、および/または混合機5は、選択的に作動され、サンプルおよび試薬の吸引および分与などの所望の作用を、判定処理中の所望の時点で実行させることができ、こうした構成は、所望の工程を達成するためにこれらのコンポーネントの選択的な自動操作に特によく適したものである。こうした構成では、サンプル内での関心対象種目の判定は、複数の位置にわたって、または複数の構造体1aにより実施することができ、これにより、少なくとも2つのサンプルを、実質的に同時に処理することが可能となる。
【0035】
複数の構造体1aの操作上の接続を円滑にするには、コンベア(有界式(bounded)やエンドレス式)、回転ラック、その他などの運搬システムを用いて、第1の収容器1をある構造体1aから別の構造体まで移動させることができる。運搬システムは、上で言及した米国特許第5,795,784号に開示されている処理経路と実質的に同様とすることができる。構造体(複数のこともある)1aの箇所に応じて、その運搬システムおよび/または個々の構造体は、所与の時点で実施することを希望する機能のみを、判定に提供するように構築することができる。たとえば、相対的に多くの回数の(たとえば、100回の)構造体1aを、互いに動作可能に接続させることがあり、かつ構造体1aのあるサブセット(たとえば、5個)だけが、混合機5を含むことができる。
【0036】
図3A、図3B、および図18は、実質的に互いに隣接して配置された複数の構造体1aを本質的に含む装置100を表している。この実施形態では、第1の収容器1は、収容器ローダおよび図9に示した運搬装置35から第1の処理経路11まで、実質的に自動的にロードされる。別法として、第1の収容器1は、米国特許第5,795,784号に記載された方式で手動式や自動式でロードすることができる。収容器1は、たとえば選択した各時間間隔ごとに(各36秒ごとなどに)1つの位置として、実施中の判定に関する目的とするフォーマットまたはプロトコルの要件に従って、様々な動作(試薬添加、サンプル添加、インキュベーション、混合、洗浄、その他など)を選択的に自動的に実行する場所である第1の処理経路11に沿った様々な箇所まで、第1の処理経路11を通って移動されている。装置100の例示的な一実施形態では、第1の収容器1は、第1の処理経路11に沿って概ね各36秒ごとに、概ね1.2インチ(約3cm)移動される。
【0037】
第1の処理経路11は、第1の処理経路11をある所望の温度に維持するために、少なくとも1つの適切な温度制御装置またはヒータを含んでいる。第1の処理経路11は、複数のヒータを用いるなどによって、ある1つの温度に、あるいは所望の任意の数の温度に保持されることができる。たとえば一実施形態では、ヒータは、第1の処理経路11を摂氏約37度に維持することができ、また一方、別の実施形態では、第1の処理経路11のある一部分は摂氏約37度に維持されながら、第1の処理経路の別の一部分は摂氏約70度に維持されることができる。 第1の処理経路11を少なくとも1つの温度まで加熱する一方、この少なくとも1つの温度に維持された収容器1を、別の温度から隔絶させるためには、適切な任意の方法を使用することができる。したがって一例として、第1の処理経路11は、摂氏約37度で約20分間の溶解などの第1のインキュベーションと、摂氏約50度にで約20分間の溶離などの第2のインキュベーションとを、単一の第1の収容器1によって実施するために使用されることができる。溶解と溶離の両方のために第1の処理経路11で使用される収容器1は、収容器1を、第1の温度に曝露させながら、第2の温度から熱的に隔絶させること、ならびにこの逆とさせることができる。
【0038】
一例として、第1の処理経路11は、アルミニウムその他など適切な材料から製作することができ、こうした場合で、第1の処理経路11を、ある適切な時点で第1の温度または第2の温度まで加熱(たとえば、伝導的に加熱)する場合には、第1の処理経路11のうち第1の温度に曝露させた部分を、第1の処理経路11の第2の温度に曝露させた部分から断熱するために1つの部材が導入されることができる。この部材は、断熱材料、物理的なバリア、その他とすることができ、またこの部材は、第1の処理経路11の第1の温度(たとえば、摂氏37度)に特異的な部分および第2の温度(たとえば、摂氏50度)に特異的な部分において計測した温度状態に基づいて、能動的に冷却または加熱され、これによって、第1の収容器1の第1または第2の温度に対する曝露を適宜制限することができる。
【0039】
別の実施形態では、第1の処理経路11を、第1の温度(たとえば、摂氏37度)に維持することができる。第2の温度(たとえば、摂氏50度)に維持することが望ましい第1の処理経路11の一部分においては、IR源その他などの少なくとも1つの別の熱エネルギー源を、第1の処理経路11と熱的に結合させ、必要な時点で第1の処理経路11の対応する部分に所望量の熱を提供することができる。収容器1内に存在する内容物は、当該の追加的熱源(たとえば、IR源)に対する曝露の間に、第2の温度までの温度上昇を受け、続いて、収容器1がこの追加的な熱源への曝露から外されるにつれて、第1の温度まで熱低下を起こすことができる。
【0040】
図10および図11は、図3A、図3B、および図11に示した装置100の第1の処理経路11で使用することができる、収容器運搬を表している。この構造体では、第1の収容器1を、第1の処理経路11上に配置させた後、ベルト36は、ベルト36上のピン36aとの係合を介して第1の収容器1を移動させる。駆動装置38は、マウント39によって装置100上に適切に支持されると共に、駆動ギア40および被駆動ギア41を介してベルト36を駆動可能に係合している。
【0041】
図3Aおよび図3Bに戻ると、サンプル収容器8内に配置させたサンプルは、収容器搬送機27(たとえば、トレイ)内に適切にロードされ、この収容器搬送機27(たとえば、トレイ)は、装置100のデッキ上にある入力キュー17にロードされる。様々な処理工程は、本明細書に開示した本発明の様々な態様の広義の趣旨域内にあり、ある方式で実施するように記載されているか別の方式で実施するように記載されているかによらず、手動式および/または自動式で実施することができることを理解すべきである。
【0042】
サンプル収容器8、ならびに関連する収容器搬送機27の例を、図6に表している。収容器8および収容器搬送機27は、上で言及した米国特許第5,915,583号および同第Des.401,697号に開示されている収容器と実質的に同様とすることができる。ただし当業者には本発明の趣旨の域内において、広範な構成が適切となることが理解されよう。
【0043】
入力キュー17は、Abbott Laboratories(たとえば、Abbott FPC Flexible Pipetting Center)から目下のところ入手可能なものなどの構成、あるいは米国特許第5,795,784号に記載された構造体を含み、所望の数のサンプル収容器8を保持するために適切な任意の構成とすることができる。入力キュー17に関するこうした適切な構成の1つを、図4に表しており、この構成は、米国特許第5,795,784号に開示されているコンベアシステムと同様のコンベアシステムを備えている。図4に示した実施形態は、入力キュー17および装置100が協働できるように、図3Aおよび図3Bの装置100などの構造体を、スペース17aに配置させることができるように構築されている。この実施形態では、サンプルの入力キュー17と出力キュー17bのそれぞれは、ローカルキュー17cの分だけずらした状態で互いに隣接して配置させることができる。
【0044】
第1の処理経路11に隣接してバーコード読み取り装置25を配置させることができ、これによりバーコード読み取り装置25は、収容器8および/または収容器搬送機27に関連付けされたコードを読み取ることができる。バーコード読み取り装置25は、入力キュー17上に配置された所与のサンプルを、ピペッタ19によってアクセス可能な位置において特定するために使用されることができる。
【0045】
バーコード読み取り装置25があるサンプルを特定すると、ピペッタ19は、当該サンプルを、入力キュー17上のサンプル収容器8から第1の処理経路11に配置された第1の収容器1まで適切に搬送することができる。試薬など別の種目は、所与の判定フォーマットに従って、ピペッタ19およびピペッタ12によって、1つの第1の収容器1に添加される(あるいは、複数のサンプルに対して作業している場合には、複数の第1の収容器1に添加される)ことができる。試薬は、米国特許第5,795,784号に開示されている試薬回転ラックなどの適切な試薬ハンドラー13内に格納されることができる。例示的な一実施形態では、ピペッタ19および12は、以下で指定する「1 Tube DNA/RNA 20−20Min Sample Prep Protocol,1 Tube 1.5hr PCR End Point Protocol」で指定された時点において、1つまたは複数の第1の収容器1に試薬を添加することができる。
【0046】
ボトル29、31、および32(図5A、図5B、図5E、および図19参照)から第1の収容器1に試薬を添加するためには、ピペッタ19および12以外に、適切なポンプ動作メカニズムと流体接続させた分与ノズル(明瞭にするために図示せず)を使用することもできる。一実施形態では、ある1つの収容器(たとえば、収容器31)は、固相微小粒子を含むことができ、この固相微小粒子は、磁気応答式であることが好ましく、また収容器31の内容物を均質化させる(すなわち、流体媒質内に粒子を再懸濁させる)ために、撹拌機を必要とすることがある。撹拌機は、図3Aおよび図3Bに示された微小粒子試薬ハンドラー18内に組み込まれることができ、また適切な作用(その方法のうちのいくつかを挙げるとたとえば、混合用フィン、補完的収容器フィン、および/またはフィン運動)によって均質化を行うことができる。収容器31内の粒子に対する再懸濁は、たとえば、かき混ぜ棒や当技術分野において一般に理解されている関連する装置によって達成させることができる。
【0047】
本明細書に記載した収容器のいくつかまたはすべてを、図3Aおよび図3Bに示した装置100に配置させることがある。収容器の内容物は、試薬シール30(図5Cに示す)を用いて、かつ/または冷蔵を用いて保存されることができる。試薬の分与に関して追加的な柔軟性を提供するために、第1の処理経路11と動作可能に結合された試薬分与ノズルを、運搬メカニズムに組み込み、第1の処理経路11上の所望の任意の位置における試薬の分与を可能にすることができる。
【0048】
第1の収容器1の内容物は、混合するまたは攪拌することが望ましいことがある。第1の処理経路11に沿った第1の収容器1の内容物の混合は、選択した時点で、適切な混合機5によって選択的に自動的に実施することができ、この一例を、図13に示している。この実施形態では、第1の収容器1は、ブラケット44を介して動作可能に係合され、一方ブラケット44は、駆動装置42によって駆動されたときに、ブラケット44および係合した第1の収容器1に対して、運動(たとえば、軌道運動、円運動など)が誘導されるように構成したギアトレイン43と動作可能に結合される。こうした混合は、以下で指定する「1 Tube DNA/RNA 20−20Min Sample Prep Protocol,1 Tube 1.5hr PCR End Point Protocol」で指定された時点など、実施される処理の要件に応じた適切な任意の所望の時点において実施されることができる。
【0049】
ピペッタ19および12が、使い捨て式ピペッタ先端28(図5Fおよび図19参照)と共に使用するように構成されている一実施形態では、1つの先端28または一群の先端28の運搬およびロードは、適切なローダおよび運搬メカニズム33を用いて達成されることができる。こうしたメカニズム33の1つを、図7に示しており、また別のローダおよび運搬メカニズム34を、図8に示している。
【0050】
ピペッタ19または12のいずれかによって先端28を係合させた後、液体レベルの検知(その多くが当技術分野でよく知られている、適切な任意の方法によって実行される)、選択された収容器(複数のこともある)からの吸引、および第1の収容器1への分与が実施される。ピペッタ12または19は、液体レベルおよび/または温度を検出することが可能な装置を含むことができ、この装置としては、光学機器、容量性部材、IR、ソナー、あるいは別の波形発生器(ただし、これらに限らない)を含むことができる。分与した後、洗浄ステーション23において、先端28を液体によって洗浄し、これによって汚染物質に対する曝露を低減させている。第1の収容器1に対する後続の添加は、希望に応じて同様の方式で実施することができる。第1の収容器1に対する所望の添加がすべて完了した後、第1の収容器1の内容物は、第1の収容器1から吸引されるかさもなければ取り出されると共に、遺伝子配列決定、薬理遺伝学的試験などの別の機能を実行することがあり得る所望の箇所に、分与または搬送される。次いで、先端28は、ピペッタ12または19から取り外されて、先端廃棄部24に廃棄されることができ、これによって汚染物質に対する曝露を低減することができる。複数の試薬と単一のサンプルあるいは調製したサンプル操作に対して、単一の先端28を使用することによって、固体廃棄物を減少させることが可能となり、かつ汚染低減の所望のレベルを維持しながら、コストの軽減を提供することが可能である。先端28を含まない場合であっても、ピペッタ12または19を用いて同様の工程を実施することができる。
【0051】
混合機5による混合あるいは第1の収容器1に与えられる別の運動は、第1の収容器1内に包含された流体に対して意図しない分布(たとえば、エアロゾル現象)を引き起こすことがある。図14は、適切な箇所において第1の処理経路11内に組み込まれたポート45を示している。ポート45は、第1の処理経路11上の隣接する第1の収容器1から出てより望ましい箇所まで、第1の収容器1上の空気の流れを引き出す流体圧力源(たとえば、真空などの負の流体圧力源)と流体接続させることができる。この方式により、望ましくない空中浮遊の汚染物質を、制御された箇所に導くことができる。
【0052】
構造体1aおよび装置100によって実行されるいくつかの方法(すなわち、免疫学的診断および/またはPCRサンプル調製方法)で使用される微小粒子の洗浄は、第1の収容器1のいくつかが、マグネット4によって引き寄せられて保持される場合などで、第1の収容器1からの未結合または結合性の微小粒子および/または第1の収容器1の内容物の別の構成成分に対する除去、排出、またはピペット操作を利用することができる。
【0053】
この洗浄を実施するためには、第1の処理経路11に沿った適切な位置に、少なくとも1つの洗浄ゾーン50(図3A参照)を配置させることができる。洗浄ゾーン50は、内容物(たとえば、未結合または結合性の微小粒子)を、第1の収容器1から自動的に排出するまたはピペット操作するように構築されたプローブ49(図16に示す)を含むことができる。複数のプローブ49(たとえば、4つのプローブ)が、単一の洗浄ゾーン50をなすことができる。適切な例示的な洗浄工程(たとえば、磁気式分離、吸引、分与)は、さらに米国特許第5,795,784号に記載されている。
【0054】
DNA/RNA判定の場合など汚染が関心事である場合、プローブ49は、外側チューブ46および内側チューブ47(図15参照)によって形成されることができる。この外側チューブ46は、支持部材46aを介して内側チューブ47に対して実質的に同心状に保持されることができる。いくつかの実施形態では、部材46aは、流体搬送用導管の役割をすることができる。一実施形態では、その外側チューブ46は、洗浄流体源と流体接続され、またその内側チューブ47は、廃棄部に導かれた真空源と流体接続される。この洗浄流体は、第1の収容器1内に保持された関心対象種目に結合させた粒子から、未結合粒子を化学的に洗浄するため、およびさらには内側チューブ47が、排出中に流体(たとえば、第1の収容器1内の流体)と接触状態になった後に、内側チューブ47から望ましくない種目(すなわち、汚染)を除去するためなど、多くの目的のために使用されることができる。
【0055】
第1の収容器1の壁に微小粒子を引き寄せる方法を改善させるためには、第1の収容器1内部にある微小粒子を、第1の収容器1の相対する側に沿って第1の収容器1に隣接して配置させた2つのマグネットを備えたマグネットステーションに曝露されることができる。
【0056】
第1の収容器1の側壁(複数のこともある)に引き寄せられた微小粒子は、図13に示した混合機5などの適切なデバイスを介して、任意の時点で(たとえば、洗浄中に)再懸濁されることが可能である。別法として、第1の収容器1の内部にある流体を適切に移動させることによって、第1の収容器1内部での流体および/または固体の再懸濁を達成するために、プローブ3または49が使用されることができる。こうした一実施形態では、流体(たとえば、洗浄溶液)は、単一または複数の流体ストリームが、その垂直壁など第1の収容器1内部の再懸濁させようとする関連する流体および/または固体材料が存在すると予測される位置に向けられるように、プローブ3または49から分与されることができる。この方式により、第1の収容器1の中で再懸濁させようとする材料を、図17に示すように第1の収容器1内に分散させることができる。
【0057】
選択したフォーマットまたはプロトコルに従って、第1の収容器1の内容物に関する処理を完了した後、第1の収容器1の内容物を、第1の収容器1から移動させ図3に示す第2の収容器15内に配置させる。第2の収容器15に対する材料添加(たとえば、試薬)は、ピペッタ12を介して行われる。次いでこの第2の収容器15は、シーラー21によって封止される。
【0058】
第2の収容器15に関して相対的に迅速な加熱および冷却速度が望ましい場合には、第2の収容器15は、第2の収容器15内容物体積比に対する相対的に大きな加熱表面、および/または第2の収容器15の相対的に薄い壁(複数のこともある)を使用することによって、相対的に迅速な熱エネルギー伝達速度を持続するように構築されることができる。
【0059】
第1の収容器1の内容物の第2の収容器15への自動式方式による移送を容易にするために、第2の収容器15は、第1のチェンバおよび第2のチェンバを用いて構築されることができ、第1のチェンバ開口が、第2のチェンバ開口と比べて相対的により大きい。ピペッタ12は、第1のチェンバに入り、かつ第1のチェンバを、第1の収容器内容物および別の試薬で満たすことが可能であり、次いで第1のチェンバ開口が、シーラー21によって封止される。相対的に小さい第2のチェンバ開口によって、第1のチェンバの内容物が第2のチェンバに移動するのを制限することができる。別法として、第1のチェンバ開口は、収容器をスピナー22に移送する前に、シーラー21によって第1のレベル(「ソフトシール(soft−seal)」と呼ばれる)まで封止されることができる。この場合には、第2の収容器15をスピナー22から除去した後に、第1のチェンバ開口は、第1のレベルと異なる第2のレベルまでシーラー21によって封止されることができる。
【0060】
第2の収容器15は、第1のチェンバの内容物が、遠心力によって第2のチェンバまで変位されるように、第2の収容器15を動かしているスピナーデバイス22まで搬送される。第1のチェンバの内容物が第2のチェンバまで移動した後、さらに処理を行うために、第2の収容器15が、スピナーデバイス22から除去されて熱伝達デバイスに渡される。別法として、第2の収容器15のその第2のチェンバへの充填は、ピペッタ12と結合された流体工学素子からの圧力によって引き起こされる力によって達成されることが可能であり、あるいはピペッタ12を、第2の収容器15の第2のチェンバに入れ、これによって第2のチェンバを満たすことが可能である。
【0061】
望ましい熱伝達速度には、毛管または毛細管様の構造体を有するチューブが適しているが、こうしたチューブを満たすには、典型的には、液体をチューブまで移動させるための力または遠心分離が不可欠である。図27Aから図27Fに示した別の実施形態では、第2の収容器15は、遠心分離などの2次的な動作をまったく行わずに、内容物の第2の収容器15への自動式ピペット作業が可能となるように、毛管と比べてより大きな開口57を通して、内容物を受け取っているアセンブリ15cを備えることができる。追加のDNA増幅の前に、シール15bを、第2の収容器15と係合させ、汚染低減および蒸散制御を提供することができる。シール15bの外側壁58は、第2の収容器15の内側壁59と比べてより小さいため、第2の収容器15と係合させたときに、第2の収容器15内の内容物は、外側壁58の周りに変位することが可能となる。この内容物の変位によって、液体面積に対する熱伝達の比が増大し、これによって相対的に迅速な熱伝達が提供される。いくつかの実施形態では、外側壁58は、第2の収容器15の内側壁59を係合して、シール15bを第2の収容器15に対して実質的に同心状に位置決めするためのフィン(図示せず)を含むことができ、これによって、シール15bの外側壁58の周りにおける内容物の実質的に均一な変位、ならびに内容物に対する実質的に均一な熱伝達が提供される。
【0062】
第2の収容器15およびシール15bは、特に図27Cおよび図27Fに示したアセンブリ15cを形成するように係合可能である。このアセンブリ15cは、さらに処理を行うために、第2の処理経路または熱サイクリング/検出モジュール16に移送されることが可能である。
【0063】
一実施形態では、第2の収容器15をスピナーデバイス22まで運搬する工程は、ピペッタ12が、最大3つまでの試薬およびサンプルを第2の収容器15に添加した後で実施される。次いでロボットにより、第2の収容器15を、第2の処理経路または熱伝達/検出装置16まで移動させる。装置16は、第1の処理経路によって第1の収容器1を至らせる温度(複数のこともある)と同じまたは異なる温度まで、第2の収容器15を至らせることができる。
【0064】
図3Aおよび図3Bは、1時間あたり概ね100回の試験という構造体スループットを得るために、第1の処理経路11上で調製されたサンプルのスループットが、概ね1時間のPCR処理期間と適合するように、112個の熱伝達/検出モジュール16aを備えている熱伝達/検出装置16の一構築を表している。熱伝達/検出装置16は、処理のうちとりわけ、恒温反応、熱サイクリング、統合された熱伝達および検出のために使用されることが可能である。いくつかの実施形態では、熱伝達機能および検出機能は、別々の構造体によって実施することが可能である(たとえば、装置16は、熱転送構造体と検出構造体とを備えることが可能であり、これらは隣接して配置させたり、別々に配置させたり、あるいは適切な任意の方式で配置させたりすることができる)。装置16における検出の後、第2の収容器15は、ロボットによって自動的に除去されて廃棄部に廃棄されるか、さらに判定を行うために別の検出器に移送される。
【0065】
図3Aおよび図3Bに示した実施形態では、第1の処理経路11上では単離サンプル調製を実施することが可能であり、また隣接する装置16上では増幅および検出を実施することが可能であり、これらの2つの処理は、DNA/RNAの化学的性質に特異的な汚染の懸念を低下させるように実質的に別々となっている。
【0066】
サンプルの自動式調製に関する第1の処理経路11は、ロボットなどの別の装置によって、増幅および検出を行うための装置16に動作可能に接続させることができる。
【0067】
さらに第2の処理経路16は、第1の処理経路11の続きとされることができ、これによって、単一処理経路を形成することができる。こうした実施形態では、本明細書に記載した収容器のいずれかを、処理経路全体に沿って使用し、これによって、第1の収容器1から第2の収容器15への移送の必要を無くすことができる。換言すると、サンプルは、サンプル収容器8から本明細書に記載した工程のすべてを実施するために使用される単一処理収容器に移送させることができる。
【0068】
構造体1aおよび装置100に関して、本明細書に記載した広義の発明の趣旨の域内で使用される可能性がある多数の別の可能な修正形態が存在する。一修正形態では、図3Aおよび図3Bの第1の処理経路11は、処理工程が選択的に自動的に実行される処理工程実行レーンと、処理工程が選択的に自動的に回避される処理工程回避レーン(たとえば、洗浄ゾーン50を回避するために配置される)とを含むことができる。反応混合物を含んだ第1の収容器1は、米国特許第5,795,784号に記載された方式と同様にして、選択したフォーマットまたはプロトコルに基づいて、処理工程実行レーンまたは処理工程回避レーンのうちの選択した一方に選択的に自動的に位置決めされることができる。
【0069】
別の修正形態では、第2の収容器15は、毛管、毛細管特性を有するチューブ、米国特許第Des.401,700号に記載されている反応容器、反応チューブ(Sunnyvale、CaliforniaのCepheidによって供給されるものなど)、第1の収容器1と同様のチューブなどとすることができる。さらに、熱伝達/検出装置16は、Peltier、マイクロ波、抵抗性、強制式気体および/または液体加熱/冷却技術を利用することができる。したがって、モジュール16aは、さらに、そのすべてが適切であるような、Cepheid(Sunnyvale、California)によって供給されるSmart Cycler(登録商標)システム、MJ Research、INC(Waltham、Massachusetts)によって供給されるTetrad(登録商標)またはPTC−100(登録商標)システム、Hybaid(Franklin、Massachusetts)によって供給されるSprint(登録商標)システム、Labnet International(Woodbridge、New Jersey)によって供給されるMultigene(登録商標)システム、Stratagene USA(La Jolla、California)によって供給されるRoboCyler(登録商標)40または96システム、Perkin−Elmer(Foster City、California)によって供給される480、9600または9700システムの熱サイクラーおよび/または検出器コンポーネントなどのPeltier、IR、マイクロ波、抵抗性、強制式気体および/または液体加熱/冷却技術を利用することができる。
【0070】
構造体1aおよび装置100のまた別の修正形態も可能である。こうした修正形態に関する以下の例では、同様の構造体に関して共通の参照符号を利用している。
【0071】
図20に示した別の装置110では、熱伝達/検出装置16を、図20に示すように第1の処理経路11内に組み込むことができる。ここで、第1の収容器1は、所望のフォーマットに適した熱ゾーンを通過する間に第1の処理経路11上に維持されている。
【0072】
図21に示した別の装置120では、第1の収容器1は、第2の収容器15に移送され、引き続いてこの第2の収容器15は、所望のフォーマットに適した熱ゾーンを通過する。したがって、熱反応の一部分は、第2の収容器15を熱伝達/検出装置16に移送する前に、第2の収容器15に対する処理ライン15aにおいて実現されることができる。
【0073】
図22に示したまた別の装置130では、第2の処理経路または熱伝達/検出装置16は、個々に制御された複数の第2の処理サブ経路または熱伝達/検出経路16bを含んでいる。熱伝達/検出経路16bの各々は、Abbott Prismの機器の構築と実質的に同様の方式において、ある具体的な関心対象種目に専用とすることができる。
【0074】
図23に表した追加的な装置140では、第1の収容器1の内容物に対して処理を実行し、かつ処理済みの第1の収容器内容物を、所望の試薬を満たした複数ウェルの(たとえば、96ウェルの)トレイなどの反応容器またはトレイ52内に移送することが可能である。この装置140は、さらに、米国特許第5,795,784号に記載されているような第1の処理経路11上のバイパス領域56を含んでいる。このトレイは、封止されて、移送のために手動式または自動式のいずれかで出力キュー54に、熱伝達/検出装置16などの追加の装置に移動させることができる。この修正形態では、さらに処理する前に、サンプルハンドリングキュー17内で所望の検定に従ってサンプルをソートすることによって、顧客ラボのワークフローを改善させるための別の方法を利用することができる。これによれば、各検定ごとに異なる加熱および冷却プロトコルを要求する化学処理で必要となる、加熱および冷却デバイスの統合(たとえば、熱伝達/検出装置16内の多数のモジュール16aの統合)が可能となる。
【0075】
本明細書に記載した構造体ならびにその利用は、最適化されることができる。たとえば、構造体は、実施しようとする判定、サンプル、試薬、収容器などの種目を、その構造体(複数のこともある)の要素にわたって割り当てることによって、所与の時間期間における判定回数が増大するように、調整されることができる。具体的には、オペレータは、この構造体のサンプルハンドラー17上にサンプルを任意の順序でロードすることができる。とりわけ、1回の判定あたりのコストを低減させるため、あるいは構造体の信頼度を改善させるために、1つの構造体に存在させる種目の数を減少させることができる。いくつかの判定(たとえば、DNA/RNA増幅および検出)は、判定ごとに様々に異なることがある加熱および冷却プロトコルが必要となる。このために、コストおよび/または種目の低減が複雑になることがある。これらの低減を達成するには、その構造体(複数のこともある)の要素にわたって種目を割り当てることができる。
【0076】
本明細書で検討している実施形態では、判定方法は、第1の処理、第2の処理、および第3の処理など多数の処理からなることができる。第1の処理は、DNA/RNAサンプル調製、サンプルインキュベーション、免疫学的診断サンプルの調製、および判定などのすべての判定に共通とすることができる。第2の処理(たとえば、増幅など)は、所与の判定に特異的とさせることができる。第3の処理(たとえば、検出)は、すべての判定に共通とするか、所与の判定に特異的とするかのいずれかとすることができる。
【0077】
その構造体(複数のこともある)の要素にわたって種目を割り当てるには、サンプルを特定した後、これを第2および第3の処理の共通性に従ってグループ分けする。たとえば、1回のDNA/RNA検定が、1つのモジュール16a、16b、16c、または16dにおいて以下に記載するプロトコルAなどの1つのプロトコルに従って処理を受けることができ、一方別のDNA/RNA検定が、別のモジュール16a、16b、16c、または16dにおいて以下に記載するプロトコルBなどの別のプロトコルに従って処理を受けることができる。共通の第2および第3の処理によって選択して、サンプルをサンプルハンドラー17から処理経路11まで供給することによって、モジュール16a、16b、16c、または16dの特定の判定(複数のこともある)への割り当てを達成しながら、必要となるモジュール16a、16b、16c、または16dおよび収容器52の数を減少させ、スループットを上昇させることができる。
【0078】
サンプルソート作業は、バーコード読み取り装置を用いて、サンプルハンドラー17によって保持された収容器8上のバーコードを読み取ることによって、サンプル情報を特定することを含むことができる。次いでこの収容器8は、所与の搬送機27内で別の収容器8と共に(機械的に)ソートを受けることができ、次いで搬送機27は、共通の第2および第3の処理を有する判定によって、サンプルハンドラー17内で別の搬送機27と共にソートを受けることができる。ソート後、収容器8からのサンプルは、ピペッタ19によって第1の収容器1に移送される。別法として、サンプルソート作業は、サンプルを、所定のソート順序に基づいて、収容器8から処理経路11上の第1の収容器1まで選択的に移送するピペッタ19によって実現されることができる。
【0079】
サンプルが、処理経路11上の収容器1に入った後、判定方法を含む第1の処理が実施される。第1の処理が完了した後、第2の処理および/または第3の処理が、使用する具体的な構造体に応じて、処理経路11内、すなわち1つまたは複数のモジュール16a、16b、16c、または16d内、あるいは別の装置内のいずれかで行われることができる。
【0080】
共通の第2の処理および/または第3の処理に従ってサンプルをソートまたはグループ分けすることによって、モジュール16a、16b、16c、または16dの最適な数を、所与の関心対象種目の判定に割り当てることが可能となる、すなわち、所与の関心対象種目に対する最大判定回数を、識別することが可能となり、関連するサンプルを、適正にソートすることが可能となり、その構造体(複数のこともある)内にある収容器、試薬などの要素または種目を、所与の構造体(複数のこともある)上にある2つ以上のモジュール16a、16b、16c、または16dにわたって適切に反復させることが可能となる。同様に、2つ以上のモジュール16a、16b、16c、または16dを、特定の判定プロトコルに基づいて反復させることが可能である。
【0081】
図22は、モジュール16bが、サンプルソート作業の結果に従って反復されることができる装置130を示している。図23および図24は、モジュール16を、その装置(複数のこともある)の外部に配置することが可能な別の装置140および150を示している。ここで、ソート済みのサンプルは、装置(複数のこともある)140および150の外部にある複数のモジュール16にわたって反復させることができる。
【0082】
図20は、モジュール16が、処理経路11内に組み込まれている装置110を示している。ここでサンプルソート作業によって、処理経路11に対して、第1の時間期間中にある判定を行うようにプログラムし、次いで第2の時間期間中に別の判定を行うようにプログラムすることが可能となる。
【0083】
さらに処理する前に、サンプルハンドリングキュー17における判定に従ってサンプルをソートすることが必要である用途では、相対的に小さいグループ分けを形成することが望ましいことがある。このグループ分けのサイズによって、トレイ52のサイズ、ならびにその対応する熱伝達/検出装置16を決定することができる。図26に表した装置170では、サンプルは、判定に基づいて相対的に小さいグループ(たとえば、約12個のサンプル)にソートされることができる。トレイ52と、熱サイクリング/検出モジュール16内の熱サイクリング/検出モジュール16cとは共に、モジュール16cが12個からなる各グループ分けに対する個々の制御を提供するように、12個からなるグループ分けを収容できるように構成されている。装置170によって、所望のスループットを維持するために必要となる熱サイクリング/検出モジュール16cの数を少なくすることができる。
【0084】
試験分布リストを管理するため、試薬ロードマップを作成するため、試薬ロードの示唆を行うため、およびデータを管理するために、装置を制御するソフトウェアによるなどの追加的な強化を提供することが可能である。
【0085】
図24に示した装置150では、第1の収容器1の内容物に対して調製が実施されることができ、また調製された第1の収容器の内容物は、別の収容器またはトレイに移送されることができる。収容器1は、試薬添加、熱伝達、および検出を実行する別の装置に、手動式または自動式で移送するために出力キューに移動される。
【0086】
図25に表した装置160では、サンプル入力キュー17内でサンプルをソートする必要はなく、また必要となる熱サイクリング/検出モジュール16dの数が減少する。この装置160では、第2の収容器15は、その各々が個々に制御を受けると共に、各々が1つの検出器を有する、熱サイクリングモジュール16dに移送される。モジュール16dは、回転ラック内部にある複数の(たとえば、約2つのまたは3つの)熱ゾーンを通って、多数の位置にわたって第2の収容器15を熱的移送させることができる。回転ラック上の1つの位置は、1つの検出器を含んでいる。モジュール16dは、別の収容器15がモジュール16d内で処理を受けている間に、追加的な収容器15を順次受け容れるように構成されている。別法では、モジュール16dには、収容器15を完全にロードし、すべての収容器を実質的に同時に処理することができる。
【0087】
モジュール16dの別の実施形態を、図30A、図30B、図31、図32A、および図32Bに表している。図30A、図30B、図31、図32A、および図32Bでは、同じ構造体を示すために同じ参照番号を用いている。モジュール16dに関するこれら別の実施形態は、たとえばPCR生成物の熱増幅および検出に使用されることができる。
【0088】
トレイ70は、熱増幅を生じさせることができる場所である少なくとも1つの区画またはウェル71を有している。図30Bおよび図32Bの実施形態は、8個のウェル71を含んでいるが、ウェル71の数は、希望に応じて変更することができる。識別を容易にするために、ウェル71には番号を付けることが可能であり、またバーコードを付けることができる。この方式により、ウェル71の位置、内容物などを、光学機器を用いるなど機械によってチェックすることが可能である。いくつかの実施形態では、そのトレイ70は、結合される構造体から容易に取り外される使い捨て品とすることができる。
【0089】
ウェル71は、汚染物質に対するウェル71の内容物の曝露を低下させるために、分割器72によって少なくとも1つの側面上に結合されることができる。汚染物質に対する曝露をさらに低減させるためには、ウェル71は、着脱可能にカバーされるか、封止されることができる。
【0090】
トレイ70は、駆動装置シャフト73によって、モータ76(図31)(たとえば、マイクロプロセッサなどにより制御される、ステッピングモータ、サーボモータなど)と動作可能に接続されており、これにより、トレイ70に対して所望の制御式回転を提供することができる。
【0091】
収容器8の内容物は、増幅および検出のために、第1の処理経路11からウェル71に移送されることができる。トレイ70およびウェル71の所望の熱曝露を提供するために、少なくとも1つのヒータ74を、トレイ70と熱的に結合される。複数のまたは異なる熱曝露が所望である場合は、適切な数のヒータ74を含めることが可能である。図30Bおよび図32Bに示すように、4個のヒータ74を、トレイ70と熱的に結合して配置し、これによって、4つの異なる温度または異なる熱曝露を提供することができる。このヒータ74は、電気式、マイクロ波、Peltier効果、強制気体、あるいは同様の技術を利用することができる。
【0092】
ヒータ74は、ウェル71が、ウェル71の内容物の添加の前または後で、所望の温度になっているように動作することができる。いくつかの実施形態では、ヒータ74は、トレイ70上のウェル71の内容物の添加の前または後のいずれかにおいて、トレイ70が、ヒータ74と動作可能に接続されるように、トレイ70から分離されることができる。
【0093】
トレイ70が回転するに従って、ウェル71およびその内容物は、隣接するヒータ74によって提供される温度に曝露される、または該温度に至る。熱の変動は周期的とする(すなわち、所与のパターンを反復する)ことができるため、トレイ70の回転によって、ウェル71およびその内容物を、所望のシーケンス内で所望の時間期間にわたって、所望の温度(複数のこともある)に至らせることができる。したがって、ウェル71およびその内容物は、トレイ70が回転するのに従って、連続的に明確に規定された温度ゾーンに出合うことができる。各ヒータ74は、実施している当該の判定によって規定される、融解、アニーリング、伸張などの所与の反応に特異的な温度に対応させることができる。
【0094】
所与のウェル71を所与のヒータ74に隣接させて配置させる時間期間は、トレイ70の回転速度によって決定される。いくつかの利用形態では、トレイ70の回転数またはステップ移動の回数は、目下のところ入手可能な熱サイクラーによって実行されるサイクル数に比例することがある。トレイ70の回転速度は、ウェル71が、ある指定した時間長にわたってヒータ74に隣接して位置決めされるように制御されることができる。たとえば、第1のヒータ74は、ウェル71を、2重線状DNAストランドを解離(dissociating)または融解(melting)することが可能な温度に至らせることができる。第1のヒータ74に隣接する第2のヒータ74は、ウェル71を、ターゲットとプライマー、またはターゲットとプローブなど、補完的なストランドの関連付けを誘導するような温度に至らせることができる。プライマーの酵素ポリメラーゼ伸張を可能にさせるために、第2のヒータ74または別のヒータ74を使用することができ、またウェル71は、反応を完了させるだけの十分な時間にわたって当該ヒータ74に隣接して位置決めされる。トレイ70の回転速度を調整することによって、ヒータ74の熱「面積(area)」(すなわち、ヒータ74によって、ウェル71およびその内容物をヒータ74に関連付けされた温度に至らせることを可能にするような面積)、ヒータ74に関連付けされた温度値、ならびにある検定に関する最適な熱サイクリングパラメータを、実現することができる。
【0095】
ウェル71に関する所望の熱曝露が完了した後、ウェル71内に存在する関心対象種目を、検出器75によって検出することが可能となる。ウェル71が封止されている場合、シールを除去することがあり、また別法として、検出器75が、ウェル71をモニターして、かつ存在するなら関心対象種目を検出できるように、シールを光透過が可能な材料(存在する場合)から製作することができる。検出器75は、さらに、トレイ70またはウェル71に結合されたバーコードを読み取ることができる。
【0096】
ウェル71を検出器75に対して移動させながらウェル71を読み取ることによって、PCR生成物をリアルタイムで検出するためなど、この検出器75は、ダイナミックモード(リアルタイムモード)で使用されることができる。いくつかの実施形態では、検出器75は、ウェル71が検出器75と出合うたびに、各n回ウェル71を読み取ることができる。この数nは、所定の時点(複数のこともある)で、ウェル71の状態を所定のしきい値と比較することが可能となるように決定されることができる。検出器75は、さらに、静的エンドポイント(static end point)の読み取りのために使用されることも可能である。
【0097】
検出器75は、トレイ70に対して静止状態とさせることができ、またトレイ70に対して移動させることもできる。複数のトレイ70が存在する場合には、複数の検出器75(たとえば、各トレイ70に1つの検出器75)が使用されることができる。ウェル71からの光を検出器75に伝えるために、光ファイバが使用されることがある。
【0098】
検出器75は、ウェル71の内容物を、単一または複数の波長で照射する光源を使用し、これによって、たとえば離散的波長における複数波長放出強度の複数検出器75データ低減に対応することができる。いくつかの実施形態では、検出器75は、ウェル71からの蛍光放出など、単一または複数の波長の単一または並列の検出を備えることができる。
【0099】
図33には、別のモジュール16hを示している。このモジュール16hは、ブロック78の内部に配置された流体搬送用導管77を含んでいる。この導管77は、ブロック78内のコイル79として形成されることができる。ブロック78は、第1の温度を有する少なくとも第1の熱ゾーン80Aと、第1の温度と異なる第2の温度を有する第2の熱ゾーン80Bとが形成されるような、適切な熱エネルギー伝達素子を備えるように構築されている。この構築では、コイル79のいくつかの部分は、コイル79の別の一部分と異なる熱ゾーン80Aまたは80B内にあり、一方コイル79のいくつかの部分は、同じ熱ゾーン80Aまたは80B内にある。
【0100】
収容器1、8または15の内容物または流体は、第1の処理経路11から導管77の入口81まで移送されることができ、また内容物または流体は、ポンプ、毛細管作用などの適切な手段によって、コイル79を通って入口81から流れるように力を受けることができる。コイル79を通って流体が流れると、流体は、熱ゾーン80Aと80Bとの間を移動する際に、異なる温度に出合うまたは該温度に至らせる。
【0101】
熱ゾーン80Aおよび80Bに関連付けられる温度は、特定のPCR増幅の温度と整合するように選択されることができる。この実施形態では、コイル79を含む巻きつけの数またはループの数は、目下のところ入手可能な熱サイクラーによって実施されるサイクルの数と同等である。コイル79内の流体の流れは、指定された時間長にわたって、流体が、各熱ゾーン80Aまたは80B内に留まるように制御される。たとえば、ある熱ゾーン80Bは、2重線状DNAストランドを解離または融解することが可能な温度まで、流体を至らせることができる。もう一方の熱ゾーン80Aは、ターゲットとプライマー、またはターゲットとプローブなど補完的なストランドの関連付けを誘導するような温度に、その流体を至らせることができる。この同じ熱ゾーン80Aは、プライマーの酵素ポリメラーゼ伸張を可能にするために使用されることができる。勿論、流体の流れは、反応を完了させるだけの十分な時間期間にわたって、流体を熱ゾーン80Aまたは80Bに曝露させるように調整される。コイル79内の流体の状態を、上述したのと実質的に同様の方式でモニターするために、コイル79に隣接して検出器75が配置される。
【0102】
様々なサンプルに対応する流体が、空気、緩衝剤などの適切な別の流体によって分離されて、導管77に導入されることができる。
【0103】
装置16には、任意の熱伝達/検出モジュールを使用することができる。たとえば装置16は、その開示の全体を本明細書に組み込む(本件の譲受人に譲渡された)米国特許第5,576,218号に記載された方法を使用することができる。
【0104】
図3Aおよび図3Bに示したモジュール16aは、図29に示すように加熱または冷却を受けた流体を使用して、第2の収容器15において反応内容物の熱サイクリングを提供することができる。流体は、リザーバ65内に格納されて、熱制御装置66によって加熱または冷却を受ける。流体は、計量式ファンまたはポンプ67によって、所望の時点でポート16eを通ってモジュール16aに導かれる。第2の収容器15内の内容物と加熱または冷却を受けた流体との間に熱伝達が生じる。モジュール16aに移送された流体の計測量によって、第2の収容器15内の内容物が、所与の温度に維持される時間が決定される。モジュール16aからの流体の排出は、バルブ68および/または追加的なポンプまたは重力を使用して、ポート16fを通って収容器65または廃棄部に至る。第2の収容器15の熱質量、第2の収容器15の内容物、および収容器65内の計測された流体が知られていれば、第2の収容器15と相互作用する計測された流体の温度を、計算しかつ予測することができ、これによって、流体の第2の収容器15との界面位置における温度制御の必要性が少なくなる。
【0105】
第2の収容器15内において、(たとえば、図29に示したポート16gなど追加的なリザーバポンプおよびポートを追加することによって)内容物の様々な温度を実現することができる。迅速な熱伝達の性能を強化するためには、第2の収容器15を、薄い高分子フィルムからなるパウチとして構築することができる。さらに、熱素子69は、モジュール16aに隣接しかつ該モジュール16aに接触させて位置決めされると共に、所望の温度で制御を受けることができる。
【0106】
例えば第2の収容器15または15dに対する検出器光学機器の向きは、図28に示している適切な一方法を伴う適切な任意の方式で実現することができる。ここに図示したように、第2の収容器15dは、「YZ」で表される第1の軸面上にある少なくとも1つの第1の面60と、「XY」で表される第2の軸面上にある少なくとも1つの第2の面61とを含むことができる。この第1の面60に隣接させて光源62を配置させ、また第1の面60と反対側の第2の面61に隣接させて光検出器63を配置させ、これによって、光源62によって、関心対象種目と関連付けされたラベルに励起が誘導され、ラベルからの信号(たとえば、光)の放出が、検出器または検出器対63によって検出される。第1の軸面の相対的な位置は、信号収集面積を増大させるために、第2の軸面と異ならせている。適切な検出器または検出器対63は、単一フォトダイオード、クワドラント(quadrant)フォトダイオード、ダイオードアレイ、光電子増倍管、あるいはこれら検出デバイスの任意の組合せを含む。光学機器の加熱素子との組合せは、ガラスなどの透明材内に装着された透明な加熱素子64を使用して実現することができ、ヒータは、第2の収容器15dの第2の面のうちの少なくとも1つと隣接し、また恐らくこの第2の面上に置かれるように配置される。いくつかの実施形態では、光源62は、検出器または検出器対63と実質的に直交する面上に置かれることができる。この光学構成では、第2の収容器15dは、たとえば、Cepheid(Sunnyvale、CA)によって供給される反応チューブ、あるいは実質的に半球状、球状、立方体、または四面体の形状(ただし、これらに限らない)を含み、任意の反応収容器構成とすることができる。
【0107】
追加的な第1の収容器の内容物の調製、免疫学的診断、および/または判定処理のモジュールは、共通のロボット工学機器および/またはコンピュータなどシステム処理装置によって、互いに接続させることができることに留意すべきである。さらに、熱伝達/検出装置16は、第1の収容器の内容物または別のサンプルを、処理済みであるか否かによらず、装置100〜170と動作可能に結合されない別の処理経路から受け容れることができることにも留意すべきである。
【0108】
装置100〜170を備える記載した要素は、関心対象種目に対する所望の判定を実現するために、所望の時点で選択的に自動的におよび/または手動式の動作を受けることができる。これらの要素の機能は、所望の結果を得るために、所望の任意の順序で所望の任意の回数だけ実施されることができる。試薬など使用される動作方法および種目は、その開示の全体を本明細書に組み込むものとする、米国特許第5,234,809号に記載されたものと実質的に同様とすることができる。
【0109】
DNA/RNAサンプル抽出プロトコル、およびポリメラーゼ連鎖反応(PCR)プロトコルに関する以下の例は、こうした応用の1つを表している。時間期間、温度、体積、および使用される要素(収容器、溶液、試薬など)は、適宜調整されることが可能である。位置の番号は、図3Aおよび図3Bの装置100に対応している。しかし、これらの位置番号は、また、米国特許第5,795,784号で様々な検定フォーマットを記載するために使用されているのと同様の方式により、処理経路に沿ったステップ移動の回数も示している。
【0110】
1チューブDNA/RNA20−20分サンプル調製プロトコル、および1チューブ1.5時間PCRエンドポイントプロトコル
サンプル調製
0秒−位置0:
機器が、第1の収容器1を第1の処理経路11上にロードする。
【0111】
1〜36秒−位置1:
ピペッタ19が、使い捨て式ピペット先端28を係合させ、磁気応答微小粒子(約0.1ml)を、試薬保存エリア18内の収容器31から吸引し、さらにこれらの微小粒子を、位置1にある第1の収容器1内に分与する。使い捨て式ピペット先端28は、洗浄カップ23内の流体によって洗浄される。ピペッタ19は、試薬ハンドリングエリア13内に配置させた収容器から、内部対照などの別の試薬(約0.05ml)を吸引し、この試薬を第1の収容器1内に分与し、さらに使い捨て式ピペット先端28は、洗浄カップ23内の流体によって第2回目の洗浄を受ける。収容器8内に配置させたサンプル(約1ml)は、ピペッタ19によって吸引され、第1の収容器1内に分与される。使い捨て式ピペット先端28は、ピペッタ19から取り外され、先端廃棄部24内に廃棄される。別法として、微小粒子分与の後で実施するピペッタ洗浄は、省かれることが可能である。このケースでは、微小粒子および内部対照は、実質的に同時にまたは順次に、第1の収容器1内に吸引されて分与される。別法として、液体洗浄のサブセットまたはすべてを、省くことが可能であり、この場合には、微小粒子、内部対照、およびサンプルが、吸引されて、同時におよび/または順次に第1の収容器1内に分与される。
【0112】
37〜72秒−位置2:
第1の処理経路11と結合させた分与ノズルは、図5Bおよび図19に示すような試薬ボトル32など、溶解溶液を包含した試薬収容器と流体接続される。約6mLの溶解溶液を、室温または摂氏約37度のうちのいずれかで、第1の収容器1に分与する。
【0113】
73〜108秒−位置3:
第1の収容器1の内容物が、混合機5によって混合される。第1の収容器1の内容物は、摂氏約37度でインキュベーションされる。
【0114】
109〜1260秒−位置4〜35:
摂氏約37度で、約19.8分間にわたってインキュベーションを継続する。約648秒の時点および約1224秒の時点で、第1の収容器1の内容物を混合する。第1の収容器1の内容物に対する周期的な混合によって、反応が促進される。
【0115】
1261〜1296秒−位置36:
微小粒子に結合された関心対象種目が、マグネット4によって第1の収容器1の側壁上に捕捉される。
【0116】
1297〜1332秒−位置37:
洗浄ゾーン50を含む要素は、磁気式分離、ならびにプローブ49による流体の吸引および分与を含む、本明細書に記載した洗浄機能を実行する。具体的には、微小粒子は、マグネット4によって第1の収容器1の内容物の残りの部分から分離され、またプローブ49によって、未分離の第1の収容器1の内容物が除去される。洗浄溶液(緩衝剤)が、プローブ49から第1の収容器1内に分与される。プローブ49が洗浄される。別法では、たとえば位置36および37において別々に実施される洗浄機能は、第1の処理経路11上の1つの位置で組み合わせられることができる。
【0117】
1333〜1368秒−位置38:
プローブ49は、洗浄および分与機能を実施する。混合機5は、微小粒子を第1の収容器1内の流体(この例では、具体的に洗浄溶液#1)に再懸濁させる。別法として、微小粒子の再懸濁は、図17に関連して上述したように、第1の収容器1への適切な流体分与によって実現することができる。別法として、位置36、37、および/または38で実施される機能は、第1の処理経路11上の1つの位置で組み合わせられることができる。
【0118】
1369〜1404秒−位置39:
微小粒子に結合された関心対象種目が、マグネット4によって第1の収容器1の側壁上に捕捉される。洗浄ゾーン50を含む要素は、磁気式分離、ならびにプローブ49による流体の吸引および分与を含む、本明細書に記載した洗浄機能を実行する。具体的には、微小粒子は、マグネット4によって第1の収容器1の内容物の残りの部分から分離され、またプローブ49によって、未分離の第1の収容器1の内容物が除去される。プローブ49が洗浄される。別法では、たとえば位置36および37において別々に実施される洗浄機能は、第1の処理経路11上の1つの位置で組み合わせられることができる。
【0119】
1405〜1440秒−位置40:
プローブ49は、洗浄および分与機能を実施する。混合機5は、微小粒子を第1の収容器1内の流体に再懸濁させる。別法として、微小粒子の再懸濁は、図17に関連して上述したように、第1の収容器1への適切な流体分与によって実現されることができる。位置36、37、および/または38で実施される機能は、第1の処理経路11上の1つの位置で組み合わせられることができる。
【0120】
1441〜1476秒−位置41:
微小粒子に結合された関心対象種目が、マグネット4によって第1の収容器1の側壁上に捕捉される。洗浄ゾーン50を含む要素は、磁気式分離、ならびにプローブ49による流体の吸引および分与を含む、本明細書に記載した洗浄機能を実行する。具体的には、微小粒子は、マグネット4によって第1の収容器1の内容物の残りの部分から分離され、またプローブ49によって、未分離の第1の収容器1の内容物が除去される。洗浄溶液(緩衝剤)が、プローブ49から第1の収容器1内に分与される。プローブ49が洗浄される。別法では、たとえば位置36および37において別々に実施される洗浄機能は、第1の処理経路11上の1つの位置で組み合わせられることができる。
【0121】
1477〜1512秒−位置42:
プローブ49は、洗浄および分与機能を実施する。混合機は、微小粒子を第1の収容器1内の流体(この例では、具体的に洗浄溶液#2)に再懸濁させる。別法として、微小粒子の再懸濁は、図17に関連して上述したように、第1の収容器1への適切な流体分与によって実現されることができる。位置36、37、および/または38で実施される機能は、第1の処理経路11上の1つの位置で組み合わせられることができる。
【0122】
1513〜1548秒−位置43:
微小粒子に結合された関心対象種目が、マグネット4によって、第1の収容器1の側壁上に捕捉される。洗浄ゾーン50を含む要素は、磁気式分離、ならびにプローブ49による流体の吸引および分与を含む、本明細書に記載した洗浄機能を実行する。具体的には、微小粒子は、マグネット4によって第1の収容器1の内容物の残りの部分から分離され、またプローブ49によって、未分離の第1の収容器1の内容物が除去される。洗浄溶液(緩衝剤)が、プローブ49から第1の収容器1内に分与される。プローブ49が洗浄される。別法では、たとえば位置36および37において別々に実施される洗浄機能は、第1の処理経路11上の1つの位置で組み合わせられることができる。
【0123】
1549〜1584秒−位置44:
プローブ49は、洗浄および分与機能を実施する。混合機5は、微小粒子を第1の収容器1内の流体(この例では、具体的に洗浄溶液#2)に再懸濁させる。別法として、微小粒子の再懸濁は、図17に関連して上述したように、第1の収容器1への適切な流体分与によって実現されることができる。
【0124】
1584〜1620秒−位置45:
微小粒子に結合された関心対象種目が、マグネット4によって、第1の収容器1の側壁上に捕捉される。洗浄ゾーン50を含む要素は、磁気式分離、ならびにプローブ49による流体の吸引および分与を含む、本明細書に記載した洗浄機能を実行する。具体的には、微小粒子は、マグネット4によって第1の収容器1の内容物の残りの部分から分離され、またプローブ49によって、未分離の第1の収容器1の内容物が除去される。プローブ49が洗浄される。別法では、たとえば位置36および37において別々に実施される洗浄機能は、第1の処理経路11上の1つの位置で組み合わせられることができる。
【0125】
1621〜1656秒−位置46:
第1の処理経路11と動作可能に結合され、分与ノズルと流体接続され、かつ第1の処理経路11および図5Eおよび図19に示した収容器29などの試薬収容器と流体結合されたポンプが、溶離試薬などの流体の分与を、第1の収容器1に生じさせる。一実施形態では、周囲温度において、また別法では摂氏約70度において、約80μLの溶離試薬が分与される。
【0126】
1657〜2844秒−位置47〜76:
第1の収容器1内容物が、この例では摂氏約37度で、あるいは実質的に摂氏約50から摂氏約70度までの範囲内にある温度で、約19.8分の期間にわたってインキュベーションされる。周期的に混合することによって、第1の収容器1の内容物の各要素間の反応が促進される。溶離試薬によって、関心対象種目が微小粒子から解放される。
【0127】
検定
2845〜2880秒−位置77:
位置76において、ピペッタ12は、使い捨て式ピペッタ先端28を係合させ、試薬保存エリア13内の収容器から第1の試薬を吸引し、かつこの試薬を、収容器処理装置ライン15a上の第2の収容器15内に分与する。使い捨て式ピペット先端28は、洗浄カップ24内の流体によって洗浄される。ピペッタ12は、試薬ハンドリングエリア13内の収容器から第2の試薬を吸引し、この第2の試薬を第2の収容器15内に分与し、さらに使い捨て式ピペット先端28は、洗浄カップ24内で洗浄を受ける。第3の試薬が、試薬ハンドリングエリア13内の収容器からピペット先端28内に吸引され、関心対象種目を含む第1の収容器1の内容物(約50μL)が、第1の処理経路11の位置77にある第1の収容器1からピペット先端28に吸引される。第3の試薬および吸引された第1の収容器1の内容物は、ピペット先端28から第2の収容器15内に分与され、またピペッタ12は、使い捨て式ピペット先端28を先端廃棄部24に排出する。別法として、第3の試薬は、ピペッタ12によるか、あるいは第1の処理経路11上の別の分与ノズルによって、位置76において第1の処理経路11上の第1の収容器1内に分与されることができる。別の実施形態では、第1の試薬および第2の試薬の吸引は、吸引の間にピペッタ12を洗浄することなく完了することが可能であり、また各試薬は、第2の収容器15内に実質的に同時に分与されることが可能である。3つの試薬の各々の体積は、実質的に約10μLから約50μLまでの範囲内とすることができる。所与のサンプル内において複数の関心対象種目の検出を希望するなら、第1の収容器1の内容物の一部分を、対応する数の収容器15に移送することも可能である。第1の収容器1の内容物のこれらの複数の移送は、位置77から実施することや、また別法として位置77およびこれに続く位置(複数のこともある)から実施することもできる。1つのサンプルから、約15種など比較的多数の関心対象種目を判定しようとする場合は、ピペッタ19および/または12によって、収容器8および/または第1の収容器1から、複数の吸引および分与を実施することが可能である。
【0128】
2881〜2916秒:
第2の収容器15は、収容器処理装置ライン15a上でシーラー21まで搬送され、ここで第2の収容器15が封止される。封止された第2の収容器15は、スピナー22まで搬送され、ここで第2の収容器15の上側部分内の内容物が、第2の収容器15の下側部分に移される。
【0129】
2917〜2952秒:
ロボットが、第2の収容器15を係合し、第2の収容器15を熱伝達/検出モジュール16a内に配置し、ここで第2の収容器15は、熱サイクルに対して曝露されると共に、第2の収容器15内の関心対象種目が検出される。
【0130】
2953〜8352秒−検定特異的熱サイクリングプロトコル:
第2の収容器15は、指定に従って熱サイクリングプロトコルを受ける。以下に、こうしたプロトコルのいくつかの例を示す。
【0131】
プロトコルA
1.摂氏約59度で約30分間。1サイクル
2.摂氏約95度で約30秒間、摂氏約54度で約30秒間、摂氏約72度で30秒間。4サイクル
3.摂氏約90度で30秒間、摂氏約59度で30秒間、摂氏約72度で30秒間。46サイクル
4.摂氏約94度で5分間、摂氏約45度で15分間、摂氏約25度で10分間。1サイクル
【0132】
プロトコルB
1.摂氏約94度で10分間。1サイクル
2.摂氏約94度で1分間、摂氏約58度で1分間。45サイクル
3.摂氏約58度で10分間、摂氏約94度で5分間、摂氏約55度で15分間、摂氏約25度でこれを維持。
【0133】
プロトコルC
1.摂氏約95度で約9.5分間。1サイクル
2.摂氏約95度で30秒間、摂氏約59度で1分間。41サイクル
3.摂氏約95度で3分間、摂氏約25度で10分間。1サイクル。
【0134】
8353〜8388秒:
選択した特定の熱サイクリングプロトコルが完了した後、第2の収容器15内の関心対象種目を検出し、第2の収容器15は処分される。上述の工程の結果を報告する。
【0135】
本明細書に記載した実施形態のいずれにおいても、溶解(lysis)には、誘導された電気パルス(複数のこともある)や音波処理(sonication)を使用し、これらのパルスによって、DNA/RNAを結合の前に未損傷の形態で曝露されるようにすることを含むことができる。
【0136】
上で開示したDNA/RNA方法またはプロトコルに加えて、装置100〜170によって実行される方法は、免疫学的診断方法とすることがある。たとえば、米国特許第5,795,784号は、上で開示した装置100〜170によって、適切な修正を伴って実行されることができる、様々な方法またはフォーマットを列挙している。さらに、DNA/RNA抽出は、装置100〜170によって増幅しかつ検出されることができ、また別法では、さらに処理を行うために、別の装置100あるいは米国特許第5,795,784号などに開示されている装置などの別の装置に搬送されることができる。第1の収容器1は、所望であれば適切な手段によって封止されることができることを理解されたい。
【0137】
別の実施形態では、第1の収容器1の内容物は、上で検討した処理の後、第1の処理経路11上の位置76から、本装置の適切な光学フローセルに移送されることができる。光学フローセルは、次の米国特許、すなわち米国特許第5,589,394号、同第5,601,234号、同第5,631,165号、同第5,631,730号、同第5,656,499号、同第5,812,419号、および同第5,891,734号(これらのすべての開示は、全体を参照により本明細書に組み込むものとする)に記載されたものと実質的に同様とすることができる。サンプル内の関心対象種目は、光学フローセルを用いて検出されることができる。
【0138】
この実施形態の一修正形態では、サンプルは、第1の収容器1、8、15または別のサンプル搬送容器から、本装置のサンプル受け取りカップに直接移送されることができる。サンプルは、あるラベルを含んだ試薬と混合され、かつ適切にインキュベーションされることができる。この試薬は、ラベルが、サンプル内の細胞および/または核膜に出合うかまたはこれを通過し、これによって、当該サンプル内における関心対象種目の所在箇所と無関係に、ラベルが、サンプル内の関心対象種目と結合され、さもなければこれと関連付けされるように配合されることができる。ラベルが、サンプル内での関心対象種目にまったく出合わない場合(たとえば、サンプル内に関心対象種目がまったく存在しない場合や、サンプル内のすべての関心対象種目が、すでにラベルを関連付けされている場合)には、そのラベルや過剰なラベルを、分離、洗浄などの適切な方法によって除去することができる。ラベルと関連付けされた関心対象種目を含む可能性があるサンプルは、この構造体の光学フローセルに渡され、ラベルが、フローセルと関連付けされた光学機器によって検出され、これによって、関心対象種目の存在が示される。
【0139】
高度な磁気ハンドリング
本明細書に記載した実施形態のいずれにおいても、溶解には、誘導された電気パルス(複数のこともある)や音波処理を含むことができ、これらのパルスによって、核酸(たとえば、DNAおよびRNA)を、結合の前に実質的に未損傷の形態で曝露されるようにする。
【0140】
上で開示した核酸方法またはプロトコルに加えて、装置100〜170によって実行される方法は、免疫学的診断方法とすることができる。たとえば、米国特許第5,795,784号は、上で開示した装置100〜170によって、恐らく適切な修正を伴って実行されることができる、様々な方法またはフォーマットを列挙している。さらに、抽出されたDNAおよび/またはRNAは、装置100〜170によって増幅されかつ検出されることができ、また別法では、さらに処理を行うために、別の装置100あるいは米国特許第5,795,784号などに開示されている装置などの別の装置に搬送されることがある。任意選択では、第1の収容器1は、適切な手段によって封止されることができる。
【0141】
別の実施形態では、第1の収容器1の内容物は、上で検討した処理の後、第1の処理経路11上の位置76から、本構造体の光学フローセルに移送されることができる。光学フローセルは、次の米国特許、すなわち米国特許第5,589,394号、同第5,601,234号、同第5,631,165号、同第5,631,730号、同第5,656,499号、同第5,812,419号、および同第5,891,734号(これらのすべての開示は、全体を参照により本明細書に組み込むものとする)に記載されたものと実質的に同様である。サンプル内の関心対象種目は、光学フローセルによって検出されることができる。
【0142】
この実施形態の一修正形態では、サンプルは、第1の収容器1、8、15または別のサンプル搬送容器から、装置のサンプル受け取りカップに直接移送されることができる。サンプルは、あるラベルを含んだ試薬と混合され、適切にインキュベーションされることができる。この試薬は、ラベルが、サンプル内の細胞および/または核膜に出合うかまたはこれを通過し、これによって、当該サンプル内における関心対象種目の所在箇所と無関係に、ラベルが、サンプル内の関心対象種目と結合され、さもなければ関心対象種目と関連付けされるように配合されることができる。ラベルが、サンプル内での関心対象種目にまったく出合わない場合(たとえば、サンプル内に関心対象種目が、まったく存在しない場合や、サンプル内のすべての関心対象種目が、すでにラベルに関連付けられている場合)には、そのラベルや過剰なラベルを、分離、洗浄などの適切な方法によって除去することができる。ラベルと関連付けされた関心対象種目を含む可能性があるサンプルは、構造体の光学フローセルに渡され、ラベルが、フローセルと関連付けされた光学機器によって検出され、これによって、関心対象種目の存在が示される。
【0143】
サンプル内での関心対象種目の判定を実施するために追加的な方法および構造体が、使用されることがある。図34Aは、収容器8からのサンプルを処理するように構成された別の要素を備えた流体ハンドラー86を示している。流体ハンドラー86は、ルーチンの実験室の用途で一般に用いられる自動ピペット作業工程に対する、知られている流体移送技術を利用している。当業者には、適切な流体ハンドラーが、知られていると共に十分に理解されており、一般に市場で入手可能な流体ハンドラーとしては、Gilson、Hamilton、PSS、Tecan、Tri continent、Packardによって製造されたハンドラーなどが含まれる。装置180は、流体ハンドラー86、ピペット先端28、試薬ハンドラー13a、DNA/RNA処理経路抽出装置11a、収容器8内に包含されたサンプル用の格納容器、原動機(駆動装置)85、シーラー90、増幅および検出デバイス84、ならびに単一構造体また別法では複数の構造体で関心対象種目を処理するために必要となる別の要素を備えるように構成されている。
【0144】
本明細書に記載した上述の化学的例を装置180で処理するためには、流体ハンドラー86は、適切な工程において、ピペッタ12および19によって上述したような組み合わせられた機能を実行する。収容器(複数のこともある)8からのサンプルに対する自動ピペット作業、ならびに関心対象種目の試薬エリア13aからの分離のために有用な試薬に対する自動ピペット作業は、第1の収容器(複数のこともある)1のアレイに実施される。第1の収容器(複数のこともある)1の好都合なアレイを、アセンブリを、交互サンプル調製処理エリア11aで様々な高さに位置決めするために有用な機械要素93を含んでいる、反応容器収容器アセンブリ98として図35Aに示している。アセンブリ98は、さらに、反応処理の間に、第1の収容器(複数のこともある)1のアレイを保持するために保持器91およびカバー92を含んでいる。処理エリア11aを、図35Aに示しており、処理エリア11aは、温度アセンブリ96、温度アセンブリ95、温度アセンブリ97、およびマグネットアセンブリ87からなる。代替的な第1の収容器(複数のこともある)1a〜1rを、図12A〜図12Rに示している。
【0145】
したがって、本発明は、流体から磁性粒子を単離するための装置を提供し、該装置は、少なくともn個の縦列と少なくともm個の横列を有するマグネットアレイを備え、任意に、マグネットの極は平行に向けられ、装置はさらに、少なくともn+1個の収容器または収容器保持器からなるアレイを備え、該収容器または収容器保持器からなるアレイは、各収容器または収容器保持器が、マグネットの一方の極のみに隣接するように、マグネットアレイに隣接して位置決めされ、ここで、nが1から1000までの整数であり、かつmが、1から1000までである。マグネットアレイが、少なくとも1×3となり、かつ収容器アレイが、少なくとも6×8となるように、nが少なくとも1でありかつmが少なくとも3であることが好ましい。複数のマグネットは、各収容器が、複数のマグネットの一方の極のみに隣接することになるように、より大きな1つのマグネットと本質的に同じ磁束密度パターンを発生させることができることが理解されよう。したがって、本発明によってさらに、各収容器が、マグネットの1つの横列または縦列のみに隣接して位置決めされ、マグネット横列内の各マグネットの中心を通って引いた線が、収容器の開放端を画定している外周と交差しておらず、かつ収容器に隣接する各マグネットが、収容器と対面して同じ極を有するように向けられる、マグネットおよび収容器(収容器保持器)からなるアレイが提供される。
【0146】
同様に、マグネットアレイは、少なくとも1つの縦列と少なくとも3つの横列のマグネットを備えることが好ましい。この構成を有する適切なデバイスの1つを、図44に表している。図44では、3×6のマグネットアレイが、6×8の収容器保持器アレイ内に挟み込まれている。任意の縦列の6個のマグネットは、端と端とを隣接されるか、あるいは互いに接近して配置され、これによって6個のマグネットからなる各バンクによって、該バンクの6個のマグネットに等しい長さを有する単一マグネットによる磁束と実質的に同一の磁束パターンを発生させている。したがって当業者であれば、図44の6個のマグネットは、6個より多くのマグネットや6個より少ないマグネットで置き換えることが可能であることを理解されよう。
【0147】
図44に示した実施形態では、図44のマグネットアレイ内の各マグネットは、一対の狭い側面と一対の広い側面とを有しており、これら各一対の側面は、相対向して配置されていると共に、これらのマグネットの広い側面は、マグネットの極を形成させている。
【0148】
したがって、マグネット収容器保持器によって、全体を図45に表している収容器およびマグネットのパターンを有する、マグネットおよび収容器からなるアセンブリが生成される。ただし収容器は、保持器によって保持されると、図46に示すようにある小さい距離だけずれており、またこれより大規模の場合は図47に示したパターンを形成し、マグネットに関する要件を最小にした状態で、収容器保持器内に配置された収容器が保持している磁性粒子の実質的にすべてを捕捉するために、十分な磁束密度パターンを有利に発生する。
【0149】
サンプルおよび試薬のピペット作業の後、アセンブリ98は、適切なロボット工学的原動機85によって、化学処理に適した箇所に位置決めされる。ロボット工学的原動機は、当技術分野では十分に理解されており、所望の要素に関して自動的把持、ならびにX、Y、およびZ軸方向での再配置を提供する。こうしたロボット工学技術に関するよく知られた製造者としては、NSK、Yamaha、Fanuc、Tecanなどが含まれる。本明細書に記載した処理では、アセンブリ98を、分離処理に適した温度に保持させたヒータアセンブリ96に移動させている。適切な任意の時間および温度を使用することが可能である。図示した実施形態では、望ましい温度およびインキュベーション時間の1つは、摂氏37度で20分間であることが分かっている。アセンブリ96の詳細を、構造体104および電子制御式のヒータ素子105を備えるようにして図37に示している。細胞の溶解、たんぱく質の変性、および関心対象種目の固相材料に対する結合(ただし、これらに限らない)を含むことが可能である、初期インキュベーションが完了した時点で、原動機85は、関心対象種目を、ある具体的な実施形態では関心対象となっていない別の種目から分離するために、アセンブリ98をマグネットアセンブリ87に再配置させる。
【0150】
関心対象種目の定量化における信頼性および感度を向上させるために、比較的大きなサンプル入力体積(たとえば、1mL〜4mL)を処理することが、望ましいことがあり得る。サンプルをさらに増幅および検出するために、試薬および反応体積を減少させることが同様に望ましい。同様に、単一収容器の体積にこのような減少を実施することも望ましい。定量化に必要な流体の量は、相対的に大きな反応体積(たとえば、好ましくは1mLを超える、さらに好ましくは2.5mLを超える、任意選択では5mL、または10mLを超える、ただし25mLや100mLを超えないこともまた好ましい)から、相対的に小さい体積まで(たとえば、好ましくは500μL未満まで、さらに好ましくは100μL未満まで、任意選択では50μL未満まで、またいくつかの実施形態では25μL未満まで、ただし少なくとも2μLであることが好ましい)低下させることが好ましい。しかし、関心対象種目たとえば微小粒子を結合させるための反応の間で、溶液内の固相を利用する場合、従来技術方法では、まず大きな体積(たとえば、3.5mL)内に粒子を分散させ、この粒子を分離し、さらに相対的に小さい体積(たとえば、80μL)で、少なくとも自動式機器で特に遠心分離を行わずに適宜完了できるような後続の工程で、粒子の高い捕捉を保証することは可能ではない。
【0151】
図示した実施形態では、本発明は、まずアセンブリ98を、図35Fおよび図35Gに示したような原動機85を備えたマグネットアセンブリ87の第1の位置に位置決めする。マグネット99は、第1の収容器(複数のこともある)の側壁上の相対的に高い領域において結合された関心対象種目が捕捉できるように、第1の収容器反応体積に対して相対的に高い位置に位置決めされる。この実施形態では、最適な捕捉動作性能が得られるように、アレイの1つおきの横列で水平の極を有するマグネットが示されているが、別の適切なマグネット構成を利用することも可能である。ある時間期間(たとえば、15〜210秒、好ましくは45〜135秒)の経過後、原動機85(あるいは、代替的な移動手段)によって、アセンブリ98を、図35Dおよび図35Eに示したマグネットアセンブリ87上の第2の位置まで移動させる。この処理中に、すでに捕捉済みの粒子は、第1の収容器1の壁上を垂直に下に移動させられ(この移動の結果として)、また収容器(複数のこともある)1の中間領域にある未捕捉の粒子(存在する場合)が、さらに捕捉される。磁性粒子がマグネット99によって捕捉できるように適切な時間期間(たとえば、15〜210秒、または45〜135秒)を経過した後、アセンブリ98を、図35Bおよび図35Cに示した原動機85によって、マグネットアセンブリ87上の第3の位置まで移動させることが好ましい。この処理中に、すでに捕捉済みの粒子は、収容器(複数のこともある)の壁上を垂直に下に移動させられ(この移動の結果として)、また収容器(複数のこともある)1のより下側の領域にある未捕捉の粒子が、さらに捕捉され、収容器(複数のこともある)壁上の望ましくかつ相対的に低い位置に至る。連続した各捕捉の後で、未結合の反応混合物を順次吸引および処分するため、また別法では、最終の捕捉段階の後で未結合反応混合物の排出を実施するために、流体ハンドラー86を使用することが望ましいことがある。
【0152】
別の実施形態では、サンプルは、収容器内で磁性粒子および溶解溶液と結合され、かつ、サンプル内の核酸源を溶解させて溶解されたサンプルを生成し、磁性粒子上の核酸を捕捉できるだけの十分な期間にわたって、溶解条件下で保持される。磁性粒子を捕捉することが可能であり、また次いで、溶解されたサンプルの未捕捉部分を、収容器から吸引することが可能である。これ前述の説明に従って、マグネットは、収容器の壁上で相対的に高く配置され、適切な時間期間の後に、収容器に対して移動され、マグネットが、収容器の底部の近くで収容器の脇に配置されるようにする。このことは、収容器の底部の近傍の収容器の側面上に磁性粒子のペレットを単離させ、収容器からの溶解溶液の排出をより効果的にさせ、かつ/または溶解溶液の吸引または排出中における磁性粒子の損失規模を低下させる効果を有する。これについては、図48に示している。
【0153】
所望であれば、洗浄溶液を添加することが可能であり、またマグネットは、図48に示した位置において磁気ペレットを捕捉するように操作されることが可能である。
【0154】
上述した1回または複数回の洗浄工程が完了した後、収容器は、マグネットに対して上昇され、収容器の底部が、マグネットの最上部より高く持ち上げられるようにする。このことによって、ペレットは、核酸を、磁性粒子から溶離させようとする際に、ペレットを留め置く好ましい位置である収容器の底部まで移動させられる。溶離を達成するためには、ある小さい体積の溶離溶液を収容器に添加する。適切な任意の体積の溶離溶液を、使用することが可能であり、また典型的には少なくとも10μl、好ましくは少なくとも30μlが収容器に添加される。しかし、溶離溶液は、多くなり過ぎないようにすることが望ましい。したがって、溶離溶液の最大体積は、好ましくは510μl未満、さらに好ましくは210μl未満、なおさらに好ましくは100μl未満である。こうした少ない溶離溶液体積(たとえば、40μl)を使用するため、磁性粒子を、確実に収容器の底部まで移動させることができることが、より適切であることになる。このことは、本実施形態では、収容器の底部を、図49に示したようにマグネットの最上部の上まで持ち上げることによって実現される。
【0155】
マグネット位置の収容器までの相対的移動は、適切な任意の手段によって達成されることができる。たとえば、ロボット工学的原動機85によって、アレイ状の収容器を、ある箇所から別の箇所まで移動させることができ、図示したように構造支持体によって、アレイ状の収容器を、マグネットアレイ(部分的)に対して異なる高さに配置させる。別の実施形態では、たとえば上昇用アーム(または、複数のアーム)による、あるいは収容器アレイまたはマグネットアレイが、傾斜面を横切るように移動する、収容器とマグネットアレイの結合体を回転させることによるなど、ある種のメカニズムによって、マグネットに対するアレイ状の収容器の箇所を適切にシフトさせることができる。これによれば、マグネットに対する収容器の位置を、連続方式で変化させられるので有利である。当業者であれば、マグネットに対する収容器の位置を変化させるために別の適切な手段を、利用することも可能であることを理解されよう。
【0156】
したがって、本発明はさらに、流体内に懸濁された磁性粒子を分離するための方法を提供し、該方法は、中に磁性粒子が懸濁されている流体を包含するための収容器、自動式ピペット、およびマグネットを有する装置を第1の位置に提供する工程を含み、必要に応じて、マグネットが、収容器の事前に選択したゾーンに磁性粒子を単離する磁場を磁性粒子に対して作用させるように、マグネットもしくは収容器、あるいはマグネットと収容器の両方を移動させ、該方法はさらに、事前に選択したゾーンがピペットから遠位にあるような、収容器の第1の吸引ゾーンから磁性粒子が排出されるように、収容器を横切る磁場を(適切な時間期間にわたって)印加する工程を含む。本方法は、ピペットを流体内に浸漬させ、収容器内の第1の吸引ゾーンから事前に選択した量の流体を吸引することによって、必要に応じて継続される。事前選択の流体量は、流体の体積の1/2(2分の1)未満(たとえば、5%〜50%)とすることが好ましく、また別法では、事前選択の流体量は、流体の体積の約85%(たとえば、約50%を超え約90%まで)である。任意選択では、本方法は、さらに、装置を第2の位置まで移動させ、これによって、磁場をピペットから分離させる工程を含む。この第2の位置において、マグネットによって、磁性粒子に磁場を印加し、磁性粒子を第2の吸引ゾーンから排出することができる。次いで自動式ピペットを進ませて、第2の吸引ゾーンから流体を吸引し、これによって、磁性粒子を流体から分離させる。
【0157】
次いでアセンブリ98を、温度位置97(マグネットが存在しない場所であることが好ましい)まで移動させる。流体ハンドラー86が、洗浄流体を添加しており、次いでアセンブリ98は、未結合反応混合体を廃棄するための追加的な捕捉および吸引のためにマグネットアセンブリ87まで戻される。洗浄および捕捉の処理は、多くの回数にわたって反復される。いくつかの実施形態では、3回から4回の洗浄サイクルが好ましい。
【0158】
洗浄の後、流体ハンドラー86は、溶離緩衝剤を分与することができ、また原動機85は、インキュベーションの間(たとえば、摂氏70度で20分間)に、関心対象種目を固相媒体から分離させる場所である温度アセンブリ95まで、アセンブリ98を移動させることができる。未結合固相の最終の捕捉は、後続の処理をする前に、マグネットアセンブリ87において実施される。後続の処理は、関心対象種目を、第1の収容器(複数のこともある)1から別の収容器(複数のこともある)15まで移送する工程を含むことがある。収容器(複数のこともある)15は、さらに、流体ハンドラー86によって分与された追加的な試薬を含むことがある。収容器(複数のこともある)15は、シーラー21によって封止され、さらに原動機85によって、開口90を通して図34Aに示すように代替サンプル調製処理エリア11aの垂直方向で下側に位置する1つまたは複数の処理経路16iを含む追加的な処理経路16に移送されることができる。この実施形態では、代替サンプル調製処理エリア11aより垂直方向でより下側に処理経路16を位置決めすることによって、サンプル調製処理の増幅処理からの分離が改善され、これによって、単一構造体での汚染の機会が減少する。増幅検出処理(図34Aで示す箇所84)を含む構造体の壁内で、さらに通気孔45を利用することによって、望ましくない任意の空中浮遊汚染物が、増幅および検出処理の近傍からさらに除去され、これによって、処理エリア同士の間での汚染の機会が減少する。
【0159】
固体廃棄物の減少を促進するために、使い捨て式ピペット先端28を利用する流体ハンドラー86は、複数の時点で使用される化学処理の間にある特異的なまたは特定のサンプルで使用するために、先端(複数のこともある)28を保有することができる。処理中の後で再使用するために、処理中の適切な期間にわたってこうした先端(複数のこともある)28を適正に収容しておくために、図39に示すように先端単離収容器107を、先端単離収容器保持器106と連携させている。これによって、先端アレイ内に各先端が保存され、これらが必要となるまで、別の先端から分離される。当業者であれば、固体廃棄物の発生の大幅な低減は、このピペット配備メカニズムおよびアセンブリの使用によりもたらすことができることが理解されよう。
【0160】
別の処理を、記述した処理と組み合わせて、追加的な処理を生成させることができることを理解されたい。たとえば、関心対象種目は、代替サンプル調製処理エリア11aでさらに試薬添加および増幅検出するために、収容器(複数のこともある)1内に保持したままとすることも可能である。さらに、2つ以上のアセンブリ98が、順番に、並列に、あるいは交互に処理を受け、サンプル処理の歩留りを向上させることもできる。さらに、マグネット(複数のこともある)99は、あるメカニズムに装着され、収容器(複数のこともある)1に対するマグネット(複数のこともある)99の相対的配置を提供されることもできる。
【0161】
マグネットアセンブリ87の詳細を、図36Aおよび図36Bに示している。マグネット(複数のこともある)99は、スロット(複数のこともある)103内に位置しており、プレート100および留め具102によって、機械的に保持される。図36Bに示したマグネットの極性は、水平方向であるが、代替的な構成(斜め方向や垂直方向の構成(だたし、これらに限らない)を含む)も適用可能である。マグネットの交互の横列とする方が、収容器(複数のこともある)1に隣接した可能なあらゆる横列を利用することよりも優れている。本発明は、この点に関して具体的な任意の理論によって束縛されるものではないが、この優越性は、図42Aおよび図42Bに示すような、可能なすべての横列を利用する場合には、望ましくない磁束密度パターンが驚くほど増大する(固相ブリッジ109になる)ためであることがある。望ましいフラックス密度パターンを、図42Cに示しており、またこれらの構成間の%捕捉動作性能の比較を、図43に示している。
【0162】
追加的な代替構成を、マグネットアセンブリ87に組み込むことも可能である。上述の処理中に、マグネット(複数のこともある)99および収容器(複数のこともある)1の位置を固定することによって、磁性粒子が、図40Cに示すような静止フラックスパターンで存在するチューブの下側部分に沈殿できるように、捕捉時間を長くして受容可能な結果を得ることも可能である。垂直面でのフラックスパターンの到達を促進させるために、マグネット(複数のこともある)99は、図40Bに示すように垂直の極の向きで位置決めされることができ、これによって、必要となる捕捉時間を短縮することができる。固定のマグネット構成において捕捉時間をさらに短縮させるためには、図40Dに示すように、未結合反応混合物の排出中に、ピペット先端28を、磁束パターン内のある領域まで移動させることができる。こうした技術によって、意図せずに廃棄に向けられることがある未結合磁気の量が減少する。
【0163】
別の実施形態では、マグネットアセンブリ87において円筒状のマグネットを使用することができる。円筒状のマグネットは、円筒の一方の辺縁に沿って磁石のN極を有し、かつこれと反対の辺縁に沿って磁石のS極を有していると有利である。図40Aに示すように、円筒状のマグネット(複数のこともある)99は、収容器(複数のこともある)1を取り囲むような向きにされ、磁性微小粒子の効果的な捕捉を達成することができる。収容器アレイ1の周りにおけるマグネットアレイの構成に関しては、複数の選択肢が利用可能である。たとえば、収容器アレイ内の各収容器1は、図40Aに示したような4つの円筒状のマグネットと隣り合わせて配置されることができる。別法として、2つまたは1つの円筒状マグネットを、各収容器に隣り合わせて配置することができる。別の実施形態では、1つの円筒状マグネットを、収容器アレイ内の収容器1の各2×2サブアレイ(または要素)の間に配置させることができる。図40Eは、円筒状マグネット99の構造体104への据え付けを示している。
【0164】
好ましい一実施形態では、マグネットアセンブリ87の上述した実施形態のいずれについても、図41に示すような大きなバイアスマグネット108と結合させることができる。収容器1アレイの相対する端部を起点とする有効磁場が提供されるように、この大きなバイアスマグネットは、収容器アレイに及んでいる。この大きなバイアスマグネットは、収容器(複数のこともある)1の最上部分において磁束密度を増大させている。この大きなバイアスアレイは、収容器1の高さの2分の1の位置において、磁束密度を3倍に、さらに好ましくは10倍に有利に増大させることができる。図示した実施形態では、試験サンプルにおいて、約10倍のバイアスマグネットから2cmを超える磁束密度の上昇が観察された。明瞭にするため、図41に示す実施形態の収容器は、高さが約12cmとなっている。ライン110は、大きなバイアスマグネットによって提供される磁束の有効到達点への到達を表している。
【特許請求の範囲】
【請求項1】
流体内に懸濁された磁性粒子を分離するための方法であって、
磁性粒子が懸濁されている流体を包含するための収容器、自動式ピペット、およびマグネットを有する装置を、第1の位置に設ける工程と、
マグネットが、ピペットから遠位にある収容器の選択ゾーンに磁性粒子を単離する磁場を、磁性粒子に作用させるように、第1の位置においてマグネットおよび収容器を互いに対して配置する工程と、
収容器の第1の吸引ゾーンから磁性粒子を排出するために、選択された時間期間にわたって収容器を横切る磁場を印加する工程と、
収容器内の第1の吸引ゾーンから、流体の体積の1/2(2分の1)を超えない事前に選択した量の流体を吸引する工程と、
ピペットから磁場を分離する第2の位置に装置を配置する工程とを含み、これによって第2の位置において、マグネットが、磁性粒子を第2の吸引ゾーンから排出するように磁性粒子に磁場を印加し、前記方法がさらに、
第2の吸引ゾーンから流体を吸引する工程を含み、これによって磁性粒子が、流体から分離される、方法。
【請求項2】
流体から磁性粒子を単離するための装置であって、
nが少なくとも1でありかつmが少なくとも3であるとして、少なくともn個の縦列と少なくともm個の横列を有するマグネットのアレイと、
マグネットアレイに隣接して位置決めされている少なくともn+1個の収容器のアレイとを備え、各収容器または収容器保持器が、1つのマグネットだけと隣接している、装置。
【請求項3】
nが少なくとも3であり、かつmが少なくとも6である、請求項2に記載の装置。
【請求項4】
マグネットアレイの縦列の数が、収容器アレイの縦列の数の2分の1である、請求項2に記載の装置。
【請求項5】
核酸を単離するための第1の処理経路と、
第1の処理経路の垂直方向下側に位置決めされている、核酸を増幅するための第2の処理経路とを備える装置。
【請求項6】
装置が、さらに水平表面を備え、該水平表面上に、第1の処理経路が搭載され、水平表面が、単離された関心対象種目を包含している反応容器を、第2の処理経路に移送するように構成された開口を含んでいる、請求項5に記載の装置。
【請求項7】
第2の処理経路は、通気孔を含むチェンバ内に封入され、装置は、チェンバから通気孔を通過して空気を流れさせるチェンバ用の圧力源を含む、請求項5に記載の装置。
【請求項8】
サンプル内の関心対象種目を単離するための装置であって、
垂直方向に向けられたマグネットと、
サンプルを有する収容器をマグネットの近傍に保持するように構成された保持器とを備える、装置。
【請求項9】
nが少なくとも1でありかつmが少なくとも3であるとして、少なくともn個の縦列と少なくともm個の横列を有するマグネットのアレイと、
少なくともn+1個の収容器のアレイとを備え、各収容器が、1つのマグネットあるいは1つのマグネット横列だけと隣接するように、マグネットアレイに隣接して位置決めされ、マグネット横列の各マグネットの中心を通って引いた線が、収容器の開放端を画定している外周と交差しない、請求項8に記載の装置。
【請求項10】
nが少なくとも3でありかつmが少なくとも6である、請求項9に記載の装置。
【請求項11】
第1の使い捨て式ピペット先端および第2の使い捨て式ピペット先端を利用する自動式ピペッタであって、第2の使い捨て式ピペット先端からの単離の際に、第1の使い捨て式ピペット先端を保管するように構成された取外し可能な先端単離収容器を備える、自動式ピペッタ。
【請求項12】
収容器アレイのための保持器と、
磁性粒子を捕捉するためのマグネットアレイと、
バイアスマグネットとを備える装置であって、
バイアスマグネットは、収容器アレイの相対する端部を起点とする有効磁場が提供されるように、収容器アレイに及ぶ、装置。
【請求項13】
バイアスマグネットは、収容器アレイ内の収容器の最上部分において磁束密度を増大させる、請求項12に記載の装置。
【請求項14】
バイアスマグネットは、収容器の高さの2分の1の位置において磁束密度を3倍増大させる、請求項13に記載の装置。
【請求項15】
自動式機器において流体内に懸濁された磁性粒子を分離するための方法であって、
機器は、少なくとも1つのマグネットと、自動ピペッタと、磁性微小粒子の流体懸濁を内部に含む収容器とを有しており、かつ
機器は、機器の1つまたは複数のマグネットと収容器を機械的に近接配置することが可能であり、
前記機器は、
収容器を第1のマグネットに対して第1の位置に位置決めし、
収容器の第1の吸引ゾーンから事前に選択した量の流体を吸引するために自動ピペッタを作動させ、
収容器を第1のマグネットまたは第2のマグネットに対して第2の位置に再位置決めし、
第2の吸引ゾーンから流体を吸引し、
これによって、磁性粒子を流体から分離させる、方法。
【請求項16】
自動式機器において流体内に懸濁された磁性粒子を分離するための方法であって、
機器は、少なくとも第1のマグネットと、1つのピペッタと、磁性微小粒子の流体懸濁を内部に含む1つの収容器とを有し、かつ
機器は、機器の1つまたは複数のマグネットと収容器を機械的に近接配置することが可能であり、
前記機器は、
収容器の壁上で磁性微小粒子の一部を捕捉するように、磁場の中心を、収容器の閉鎖端よりも収容器の開放端の方により近くなるように配置させるために、収容器と第1のマグネットとを互いに接近させた位置にする工程を含み、
収容器が、第2のマグネットに接近させた位置になるように、収容器またはマグネットが移動され、第2のマグネットは、第1のマグネットと同じまたは異なることができ、第2のマグネットの磁場の中心が、収容器の開放端よりも収容器の閉鎖端の方により近く、捕捉された磁性微小粒子の回収体が、収容器の壁でより下側に移動し、前記方法がさらに、
収容器から流体の一部分を吸引する工程を実行する、方法。
【請求項17】
サンプルから核酸を単離する方法であって、
核酸が、微小粒子に結合されるように、収容器に対して、核酸を含むサンプル、溶解溶液、および磁性微小粒子を加える工程と、
請求項16に記載の方法により流体から微小粒子を分離する工程とを含み、第2のマグネットの磁場の中心が、収容器の開放端よりも収容器の閉鎖端の方により近くなるように移動されたときに、第2のマグネットの磁場の中心が、収容器の底部の近傍であるが収容器より下側でない位置で収容器に対して横方向に位置決めされ、前記方法がさらに、
収容器に洗浄溶液を加える工程と、
収容器から流体の一部分を吸引する工程と、
収容器の底部が、マグネットの最上部の上まで持ち上げられるように、マグネットに対して収容器を持ち上げる工程と、
溶離緩衝剤を加える工程と、
溶離緩衝剤の一部分を除去し、これによりサンプルから核酸を単離する工程とを含む、方法。
【請求項1】
流体内に懸濁された磁性粒子を分離するための方法であって、
磁性粒子が懸濁されている流体を包含するための収容器、自動式ピペット、およびマグネットを有する装置を、第1の位置に設ける工程と、
マグネットが、ピペットから遠位にある収容器の選択ゾーンに磁性粒子を単離する磁場を、磁性粒子に作用させるように、第1の位置においてマグネットおよび収容器を互いに対して配置する工程と、
収容器の第1の吸引ゾーンから磁性粒子を排出するために、選択された時間期間にわたって収容器を横切る磁場を印加する工程と、
収容器内の第1の吸引ゾーンから、流体の体積の1/2(2分の1)を超えない事前に選択した量の流体を吸引する工程と、
ピペットから磁場を分離する第2の位置に装置を配置する工程とを含み、これによって第2の位置において、マグネットが、磁性粒子を第2の吸引ゾーンから排出するように磁性粒子に磁場を印加し、前記方法がさらに、
第2の吸引ゾーンから流体を吸引する工程を含み、これによって磁性粒子が、流体から分離される、方法。
【請求項2】
流体から磁性粒子を単離するための装置であって、
nが少なくとも1でありかつmが少なくとも3であるとして、少なくともn個の縦列と少なくともm個の横列を有するマグネットのアレイと、
マグネットアレイに隣接して位置決めされている少なくともn+1個の収容器のアレイとを備え、各収容器または収容器保持器が、1つのマグネットだけと隣接している、装置。
【請求項3】
nが少なくとも3であり、かつmが少なくとも6である、請求項2に記載の装置。
【請求項4】
マグネットアレイの縦列の数が、収容器アレイの縦列の数の2分の1である、請求項2に記載の装置。
【請求項5】
核酸を単離するための第1の処理経路と、
第1の処理経路の垂直方向下側に位置決めされている、核酸を増幅するための第2の処理経路とを備える装置。
【請求項6】
装置が、さらに水平表面を備え、該水平表面上に、第1の処理経路が搭載され、水平表面が、単離された関心対象種目を包含している反応容器を、第2の処理経路に移送するように構成された開口を含んでいる、請求項5に記載の装置。
【請求項7】
第2の処理経路は、通気孔を含むチェンバ内に封入され、装置は、チェンバから通気孔を通過して空気を流れさせるチェンバ用の圧力源を含む、請求項5に記載の装置。
【請求項8】
サンプル内の関心対象種目を単離するための装置であって、
垂直方向に向けられたマグネットと、
サンプルを有する収容器をマグネットの近傍に保持するように構成された保持器とを備える、装置。
【請求項9】
nが少なくとも1でありかつmが少なくとも3であるとして、少なくともn個の縦列と少なくともm個の横列を有するマグネットのアレイと、
少なくともn+1個の収容器のアレイとを備え、各収容器が、1つのマグネットあるいは1つのマグネット横列だけと隣接するように、マグネットアレイに隣接して位置決めされ、マグネット横列の各マグネットの中心を通って引いた線が、収容器の開放端を画定している外周と交差しない、請求項8に記載の装置。
【請求項10】
nが少なくとも3でありかつmが少なくとも6である、請求項9に記載の装置。
【請求項11】
第1の使い捨て式ピペット先端および第2の使い捨て式ピペット先端を利用する自動式ピペッタであって、第2の使い捨て式ピペット先端からの単離の際に、第1の使い捨て式ピペット先端を保管するように構成された取外し可能な先端単離収容器を備える、自動式ピペッタ。
【請求項12】
収容器アレイのための保持器と、
磁性粒子を捕捉するためのマグネットアレイと、
バイアスマグネットとを備える装置であって、
バイアスマグネットは、収容器アレイの相対する端部を起点とする有効磁場が提供されるように、収容器アレイに及ぶ、装置。
【請求項13】
バイアスマグネットは、収容器アレイ内の収容器の最上部分において磁束密度を増大させる、請求項12に記載の装置。
【請求項14】
バイアスマグネットは、収容器の高さの2分の1の位置において磁束密度を3倍増大させる、請求項13に記載の装置。
【請求項15】
自動式機器において流体内に懸濁された磁性粒子を分離するための方法であって、
機器は、少なくとも1つのマグネットと、自動ピペッタと、磁性微小粒子の流体懸濁を内部に含む収容器とを有しており、かつ
機器は、機器の1つまたは複数のマグネットと収容器を機械的に近接配置することが可能であり、
前記機器は、
収容器を第1のマグネットに対して第1の位置に位置決めし、
収容器の第1の吸引ゾーンから事前に選択した量の流体を吸引するために自動ピペッタを作動させ、
収容器を第1のマグネットまたは第2のマグネットに対して第2の位置に再位置決めし、
第2の吸引ゾーンから流体を吸引し、
これによって、磁性粒子を流体から分離させる、方法。
【請求項16】
自動式機器において流体内に懸濁された磁性粒子を分離するための方法であって、
機器は、少なくとも第1のマグネットと、1つのピペッタと、磁性微小粒子の流体懸濁を内部に含む1つの収容器とを有し、かつ
機器は、機器の1つまたは複数のマグネットと収容器を機械的に近接配置することが可能であり、
前記機器は、
収容器の壁上で磁性微小粒子の一部を捕捉するように、磁場の中心を、収容器の閉鎖端よりも収容器の開放端の方により近くなるように配置させるために、収容器と第1のマグネットとを互いに接近させた位置にする工程を含み、
収容器が、第2のマグネットに接近させた位置になるように、収容器またはマグネットが移動され、第2のマグネットは、第1のマグネットと同じまたは異なることができ、第2のマグネットの磁場の中心が、収容器の開放端よりも収容器の閉鎖端の方により近く、捕捉された磁性微小粒子の回収体が、収容器の壁でより下側に移動し、前記方法がさらに、
収容器から流体の一部分を吸引する工程を実行する、方法。
【請求項17】
サンプルから核酸を単離する方法であって、
核酸が、微小粒子に結合されるように、収容器に対して、核酸を含むサンプル、溶解溶液、および磁性微小粒子を加える工程と、
請求項16に記載の方法により流体から微小粒子を分離する工程とを含み、第2のマグネットの磁場の中心が、収容器の開放端よりも収容器の閉鎖端の方により近くなるように移動されたときに、第2のマグネットの磁場の中心が、収容器の底部の近傍であるが収容器より下側でない位置で収容器に対して横方向に位置決めされ、前記方法がさらに、
収容器に洗浄溶液を加える工程と、
収容器から流体の一部分を吸引する工程と、
収容器の底部が、マグネットの最上部の上まで持ち上げられるように、マグネットに対して収容器を持ち上げる工程と、
溶離緩衝剤を加える工程と、
溶離緩衝剤の一部分を除去し、これによりサンプルから核酸を単離する工程とを含む、方法。
【図1】


【図2】


【図3A】


【図3B】


【図4】


【図5A】


【図5B】


【図5C】


【図5D】


【図5E】


【図5F】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12A】


【図12B】


【図12C】


【図12D】


【図12E】


【図12F】


【図12G】


【図12H】


【図12I】


【図12J】


【図12K】


【図12L】


【図12M】


【図12N】


【図12O】


【図12P】


【図12Q】


【図12R】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27A】


【図27B】


【図27C】


【図27D】


【図27E】


【図27F】


【図28】


【図29】


【図30A】


【図30B】


【図31】


【図32A】


【図32B】


【図33】


【図34A】


【図34B】


【図35A】


【図35B】


【図35C】


【図35D】


【図35E】


【図35F】


【図35G】


【図36A】


【図36B】


【図37】


【図38】


【図39】


【図40A】


【図40B】


【図40C】


【図40D】


【図40E】


【図41】


【図42A】


【図42B】


【図42C】


【図43】


【図44】


【図45】


【図46】


【図47】


【図48】


【図49】




【図2】


【図3A】


【図3B】


【図4】


【図5A】


【図5B】


【図5C】


【図5D】


【図5E】


【図5F】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12A】


【図12B】


【図12C】


【図12D】


【図12E】


【図12F】


【図12G】


【図12H】


【図12I】


【図12J】


【図12K】


【図12L】


【図12M】


【図12N】


【図12O】


【図12P】


【図12Q】


【図12R】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27A】


【図27B】


【図27C】


【図27D】


【図27E】


【図27F】


【図28】


【図29】


【図30A】


【図30B】


【図31】


【図32A】


【図32B】


【図33】


【図34A】


【図34B】


【図35A】


【図35B】


【図35C】


【図35D】


【図35E】


【図35F】


【図35G】


【図36A】


【図36B】


【図37】


【図38】


【図39】


【図40A】


【図40B】


【図40C】


【図40D】


【図40E】


【図41】


【図42A】


【図42B】


【図42C】


【図43】


【図44】


【図45】


【図46】


【図47】


【図48】


【図49】


【公開番号】特開2012−137501(P2012−137501A)
【公開日】平成24年7月19日(2012.7.19)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−83533(P2012−83533)
【出願日】平成24年4月2日(2012.4.2)
【分割の表示】特願2009−160190(P2009−160190)の分割
【原出願日】平成15年4月25日(2003.4.25)
【出願人】(391008788)アボット・ラボラトリーズ (650)
【氏名又は名称原語表記】ABBOTT LABORATORIES
【Fターム(参考)】
【公開日】平成24年7月19日(2012.7.19)
【国際特許分類】
【出願番号】特願2012−83533(P2012−83533)
【出願日】平成24年4月2日(2012.4.2)
【分割の表示】特願2009−160190(P2009−160190)の分割
【原出願日】平成15年4月25日(2003.4.25)
【出願人】(391008788)アボット・ラボラトリーズ (650)
【氏名又は名称原語表記】ABBOTT LABORATORIES
【Fターム(参考)】
[ Back to top ]

