生物活性ナトリウム利尿ペプチドを測定するための、およびその治療可能性を向上させるための方法および組成物
【課題】サンプル中の生物活性ナトリウム利尿ペプチド、またはその断片の存在または量を調べるよう設計された組成物および方法を提供する。
【解決手段】生物活性ナトリウム利尿ペプチドを検出するが、ナトリウム利尿ペプチドの1種以上の生物学的不活性断片からのシグナルは少なくとも5分の1に低下し、好ましくは、これを感知できるほど検出しないアッセイを実施することを含んでなる、サンプル中のナトリウム利尿ペプチドの存在または量を検出する方法、ならびにナトリウム利尿ペプチドの分解のこれまでには未知であった経路を阻害する組成物を提供する。
【解決手段】生物活性ナトリウム利尿ペプチドを検出するが、ナトリウム利尿ペプチドの1種以上の生物学的不活性断片からのシグナルは少なくとも5分の1に低下し、好ましくは、これを感知できるほど検出しないアッセイを実施することを含んでなる、サンプル中のナトリウム利尿ペプチドの存在または量を検出する方法、ならびにナトリウム利尿ペプチドの分解のこれまでには未知であった経路を阻害する組成物を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本願は、生物活性ナトリウム利尿ペプチドを測定するための、およびその治療可能性を向上させるための方法および組成物と題された、2003年8月20日に出願された米国特許出願第10/645,874号の一部継続出願であり、生物活性ナトリウム利尿ペプチドを測定するための、およびその治療可能性を向上させるための方法および組成物と題された、2004年2月4日に出願された米国仮特許出願第60/642,086号の優先権を主張し、それらの各々から優先権が主張されており、それらの各々は参照により、すべての表、図および特許請求の範囲を含むその全文が本明細書に組み込まれる。
【0002】
本発明は、医療診断および治療法に関する。
【背景技術】
【0003】
本発明の背景についての以下の議論は、単に読者が本発明を理解するのを補助するために提供するものであって、本発明の先行技術を説明または構成するよう承認されるものではない。
【0004】
ナトリウム利尿ペプチドは、身体においてレニン−アンギオテンシン系の活性に対抗するよう作用する天然に生じる物質群である。3つの主要なナトリウム利尿ペプチド:心房で合成される、心房性ナトリウム利尿ペプチド(ANP)、心室で合成される、脳型ナトリウム利尿ペプチド(BNP)、脳で合成される、C型ナトリウム利尿ペプチド(CNP)がある。
【0005】
成熟ヒトA型ナトリウム利尿ペプチド(ANP)(心房性ナトリウム利尿ペプチドとも呼ばれる)は、心房拡張、アンギオテンシンII刺激、エンドセリン、および交感神経刺激(β−アドレナリン受容体媒介性)に応じて心房筋細胞によって合成され、保存され、放出される、生物学的に活性な28アミノ酸ペプチドである。成熟ANPは、128アミノ酸前駆体分子(プロ−ANP)のタンパク質分解切断によって生じ、プロ−ANP分子のアミノ酸99〜126(ANP99〜126)に相当する生物学的に活性な28アミノ酸ペプチドが生じる。N末端プロホルモンセグメントに由来する線状ペプチド断片も生物活性を有すると報告されている。
【0006】
成熟ヒトB型ナトリウム利尿ペプチド(BNP)(脳型ナトリウム利尿ペプチドとも呼ばれる)は、血圧および体液平衡を調節するナトリウム利尿系に関与する、32アミノ酸、4kDaの生物学的に活性なペプチドである(ボノー(Bonow)、R.O.、サーキュレーション(Circulation)、93、1946〜1950頁、1996)。成熟BNPホルモンは、本明細書では「プロ−BNP」と呼ぶ108アミノ酸前駆体分子のタンパク質分解切断によって生じる。切断によって、「NTプロBNP」と呼ばれる76アミノ酸N末端ペプチド(アミノ酸1〜76)と、BNPまたはBNP32と呼ばれる32アミノ酸成熟ホルモン(アミノ酸77〜108)が生じる。これらの種の各々−NTプロ−BNP、BNP−32およびプレ−プロ−BNPは、ヒト血漿中を循環し得ることが示唆されている(タテヤマら、バイオケミカル・バイオフィジオロジー・リサーチ・コミュニケーション(Biochemical Biophysiology Reseach Communication)185、760〜7頁、1992)、ハント(Hunt)ら、バイオケミカル・バイオフィジオロジー・リサーチ・コミュニケーション、214、1175〜83頁、1995)。
【0007】
ヒト脳における主要な活性ナトリウム利尿ペプチドである、成熟ヒトC型ナトリウム利尿ペプチド(CNP)22アミノ酸ペプチド;CNPはまた、一酸化窒素(NO)と同様に作用する、内皮由来弛緩因子であると考えられている(ダビッドソン(Davidson)ら、サーキュレーション93、1155〜9頁、1996)。CNPは、A型ナトリウム利尿ペプチド(ANP)およびB型ナトリウム利尿ペプチド(BNP)と構造的に関連しているが、ANPとBNPは主に心筋で合成されるのに対し、CNPは血管内皮で前駆体(プロ−CNP)として合成される(プリケット(Prickett)ら、バイオケミカル・バイオフィジオロジー・リサーチ・コミュニケーション、286、513〜7頁、2001)。CNPは動脈と静脈の双方に対して血管拡張作用を有すると考えられており、血管平滑筋細胞において細胞内cGMP濃度を高めることによって主に静脈に対して作用すると報告されている。
【0008】
ANPおよびBNPはそれぞれ、心房および心室伸展に応じて放出され、血管緊張低下、副腎皮質におけるアルドステロン分泌の阻害、腎臓におけるレニン分泌の阻害を引き起こす。ANPとBNPの双方ともナトリウム利尿および血管内容量の減少、抗利尿ホルモン(ADH)の拮抗作用によって増幅される作用をもたらす。CNPの生理学的作用はANPおよびBNPのものとは異なり、CNPは降圧効果を有するが、有意な利尿またはナトリウム利尿作用はない。特定の疾病状態では、ナトリウム利尿ペプチドの血管レベルの増加が見出されており、このことは、脳卒中、うっ血性心不全(CHP)、心虚血、全身性高血圧、および急性心筋梗塞をはじめとする疾病の病態生理学における役割を示唆する。例えば、各々、すべての表、図および特許請求の範囲を含むその全文が本明細書に組み入れられる、WO02/089657、WO02/083913およびWO03/016910を参照。当業者には、ナトリウム利尿ペプチドの多数の非ヒト相同体が知られている。
【0009】
ナトリウム利尿ペプチドは、単独で、集団的に、および/またはさらなるタンパク質とともに、種々の循環器症状において疾病マーカーおよび予後の指標として利用できる。例えば、心室で合成されるBNPは、左心室圧、呼吸困難の量、および神経ホルモン調節の状態と相関があるため、このペプチドが心疾患の第1の潜在マーカーとなっている。血漿BNPの濃度の測定は、病因論およびLV収縮機能障害の程度にかかわらず、明らかな心不全を発症する可能性があり得る、および心血管系イベントの危険の高い、種々の心臓異常を有する患者を同定するための、極めて効果的かつ費用効率の高い集団検診技術として発達している。CHF患者の診断および管理を補助する簡単な血液試験を見出すことが、この疾病にかかる驚異的な費用に対して好影響をもたらすことは明確である。
【0010】
循環からのナトリウム利尿ペプチドの除去は、主に、循環におけるクリアランス受容体との結合および酵素分解によって影響を受ける。例えば、チョー(Cho)ら、ハート・ディジーズ(Heart Disease)1、305〜28頁、1999、スミス(Smith)ら、ジャーナル・オブ・エンドクリノロジー(Journal of Endocrinology)167、239〜46頁、2000参照。さらに、ヒトプロ−BNPは、血清中でプロセシングされ、その結果、循環プレ−プロ−BNPが無傷の108アミノ酸型である可能性は低いと報告されている。ハント(Hunt)ら、ペプチデス(Peptides)18、1475〜81頁、1997。ナトリウム利尿ペプチドの分解は中性エンドペプチダーゼによって媒介されると考えられている。例えば、ノーマン(Norman)ら(バイオケミカル・バイオフィジオロジー・リサーチ・コミュニケーション28、175、22〜30頁、1991)は、中性エンドペプチダーゼはヒトBNPを残基2と3の間、残基4と5の間、および残基17と18の間で切断できると報告している。同様に、リンドバーグ(Lindberg)およびアンダーソン(Andersson)(レギュラトリー・ペプチデス(Regulatory peptides)47、53〜63頁、1993)は、ヒトANPは残基3と4の間および残基14と15の間で切断されると報告している。この加水分解産物の生物活性は、無傷のANPよりも約500倍低かった。さらに、クネヒト(Knecht)ら、(ライフ・サイエンシズ(Life Sciences)71、2701〜12頁、2002)は、心不全では腎臓の中性エンドペプチダーゼがアップレギュレートされ、ナトリウム利尿ペプチドレベルが増加している状態と報告している。このため、中性エンドペプチダーゼは循環器疾患の治療における阻害の標的となってきた。例えば、コルチ(Corti)ら、サーキュレーション104、1856〜62頁、2001参照。
【0011】
ナトリウム利尿ペプチドの、特に、血液由来サンプル(例えば、血清、血漿、全血)中での安定性に関する混乱が報告されている。ANPは、BNPよりも中性エンドペプチダーゼのよりよい基質であると報告されている。同様に、シミズら、(クリニカ・ケミカ・アクタ(Clinica Chemica Acta)305、181〜6頁、2001)、ゴビネ−ジョージ(Gobinet−Georges)ら(クリニカル・ケミストリー・アンド・ラボラトリー・メディシン(Clinical Chemistry and Laboratory Medicine)38、519〜23頁、2000)およびマードック(Murdoch)ら(ハート(Heart)78、594〜7頁、1997)は、BNPは特定の血液由来サンプル中では、または血液が特定の条件下で採取される場合には安定であると報告している。シミズらによるより最近の報告(クリニカ・ケミカ・アクタ316、129〜35頁、2002)では、全血中のBNPの94%が、2アミノ末端残基が除去されている消化型であったこと、および血漿中のBNPはいくつかの未同定の型に分解されていたことが示されている。
【発明の概要】
【課題を解決するための手段】
【0012】
本発明は幾分かは、サンプル中の生物活性ナトリウム利尿ペプチド、またはその断片の存在または量を調べるよう設計された組成物および方法に関する。ナトリウム利尿ペプチドの分解は、特に、ナトリウム利尿ペプチドの組織への放出の誘引となるイベントの発生とサンプルを得るか分析する時間との間の経過時間、存在するタンパク質分解酵素の量などの関数であり得る進行中のプロセスである。この分解によって、生物学的機能が低下したか、これを失ったナトリウム利尿ペプチドの循環量が生じ得る(本明細書では、便宜上、ナトリウム利尿ペプチドの「不活性断片」と呼ぶ)。
【0013】
1種以上のナトリウム利尿ペプチドのアッセイを設計する際に、この分解を考慮しないと、注目するナトリウム利尿ペプチドの生物活性型とナトリウム利尿ペプチドの不活性断片の双方を検出するアッセイとなる場合もある。これによって、実際、注目するナトリウム利尿ペプチドが実際には不活性断片に分解されており、アッセイ結果が目的とする分析物をサンプル中に最初に存在する不活性断片のプールと区別できないことによって混乱している場合に、アッセイが特に良好な安定性を示す(すなわち、注目する分析物がサンプル貯蔵の間アッセイに対して失われない)という結論を導くことがある。生物活性型は被験体の生理学的状態とより相関がある場合があるため、また疾病を患っている被験体においてアップレギュレートされたタンパク質分解酵素が、非常に注目される可能性のある被験体において不活性断片の特に大きなプールをもたらす場合があるために、本明細書に記載された組成物および方法は、当業者に対し、生物活性型に特異的でないアッセイと比較して改善された診断および予後情報を提供できる。
【0014】
本明細書に記載した方法および組成物は、当技術分野における、脳卒中、うっ血性心不全(CHF)、心虚血、全身性高血圧、および/または急性心筋梗塞をはじめとする種々の循環器疾患の診断および識別に用いるための、迅速で、感受性のある、特異的な診断アッセイの必要性を満たし得る。さらにまた、本発明の方法および組成物を用いて患者の治療を容易にし、さらなる診断および/または予後指標および指標パネルを開発できる。
【0015】
その結果、第一の態様では、本発明は、生物活性ナトリウム利尿ペプチドを検出するが、ナトリウム利尿ペプチドの1種以上の生物学的不活性断片からのシグナルは少なくとも5分の1に低下し、好ましくは、これを感知できるほど検出しないアッセイを実施することを含んでなる、サンプル中のナトリウム利尿ペプチドの存在または量を検出する方法に関する。生物学的不活性断片としては、生物活性ナトリウム利尿ペプチドのN末端またはC末端のいずれかまたは双方から残基が除去されているもの、および/またはナトリウム利尿ペプチドの分子内ジスルフィド結合によって形成されたループが切断されているものが挙げられる。このような生物学的不活性断片は、例えば、生物活性ナトリウム利尿ペプチド中の1以上のペプチド結合を切断することによって形成され得る。
【0016】
関連態様では、本発明は、無傷のナトリウム利尿ペプチドを検出するが、無傷のナトリウム利尿ペプチドのある部分、好ましくは、少なくともN末端部分が除去されると生じる等モル量のペプチドからのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほど検出しないアッセイを実施することを含んでなる、サンプル中のナトリウム利尿ペプチドの存在または量を検出する方法に関する。
【0017】
種々の実施形態では、本発明は、BNP77〜108を検出するが、等モル量のBNP94〜108からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、BNP77〜108を検出するが、BNP90〜108からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、BNP77〜108を検出するが、BNP81〜108からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、BNP77〜108を検出する
が、BNP79〜108からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、BNP77〜108を検出するが、BNP77〜106からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、および/またはBNP77〜108を検出するが、BNP79〜106からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイを実施することを含んでなる、サンプル中のBNPの存在または量を検出する方法に関する。
【0018】
種々のさらなる実施形態では、本発明は、BNP1〜76を検出するが、等モル量のBNP38〜76からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、BNP1〜76を検出するが、BNP24〜76からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、BNP1〜76を検出するが、BNP12〜76からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、BNP1〜76を検出するが、BNP3〜76からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、BNP1〜76を検出するが、BNP1〜73からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、および/またはBNP1〜76検出するが、BNP3〜73からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイを実施することを含んでなる、サンプル中のBNPの存在または量を検出する方法に関する。
【0019】
さらにその他のさらなる実施形態では、本発明は、ANP99〜126を検出するが、等モル量のANP113〜126からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、ANP99〜126を検出するが、ANP105〜126からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、ANP99〜126を検出するが、ANP102〜126からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、ANP99〜126を検出するが、ANP99〜124からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、および/またはANP99〜126を検出するが、ANP102〜124からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイを実施することを含んでなる、サンプル中のANPの存在または量を検出する方法に関する。
【0020】
以下に説明するように、このようなアッセイは、当業者に公知の種々の方法で設計できる。好ましいアッセイはイムノアッセイであるが、他の方法も当業者に周知である(例えば、バイオセンサーの使用、または当技術分野で公知のナトリウム利尿ペプチドの天然受容体の使用)。適していれば、どんなイムノアッセイを利用してもよい。例えば、分析物結合を直接検出する(例えば、エリプソメーターによる検出によって)アッセイ、酵素結合免疫測定法(ELISA)、ラジオイムノアッセイ(RIA)、競合結合アッセイ、サンドイッチイムノアッセイなど。抗体と1種以上のナトリウム利尿ペプチド断片との特異的免疫学的結合は、直接的に検出しても間接的に検出してもよい。直接標識としては、抗体に付けた、蛍光または発光タグ、金属、色素、放射性核種などが挙げられる。間接標識としては、当技術分野で周知の種々の酵素、例えば、アルカリホスファターゼ、西洋わさびペルオキシダーゼなどが挙げられる。第2の分子、例えば、検出可能な標識に付着させた抗体を、本明細書では、「抗体コンジュゲート」と呼ぶ。また、当業者ならば、ナトリウム利尿ペプチドの天然受容体が存在すること、およびこれらの受容体もまた、結合アッセイの提供において、抗体と類似の方法で使用できることは理解されよう。
【0021】
無傷のナトリウム利尿ペプチドと比較して、ナトリウム利尿ペプチドの生物学的不活性断片からは部分的にまたは完全に失われているエピトープと結合するよう選択された1種以上の抗体を用いるイムノアッセイを構築することができる。例えば、サンドイッチアッセイでは、固相に結合される抗体を、分子のN末端部分と優先的に結合するよう選択し、標識される抗体を、分子のC末端部分と結合するよう選択すれば、アッセイで分子のNおよびC末端部分の双方を含む分子のみが検出される。あるいは、固相と標識した抗体の双方を、分子のN末端部分と結合するよう選択してもよい。
【0022】
当業者ならば、ナトリウム利尿ペプチドの切断によって、抗体が結合するエピトープのすべてを除去することもできるということは理解されよう(例えば、抗体はN末端領域だけに結合する)。あるいは、エピトープは、分子の線状配列中では連続していないが、溶液中の3次元空間においては関連しているナトリウム利尿ペプチドの部分から形成される場合もあり、その結果、エピトープは、記載したアミノ酸残基よりも多くを含んでなるが、記載したアミノ酸残基の領域の除去の結果、抗体の結合が減少し、ひいてはアッセイにおいてシグナルが喪失する。
【0023】
特定の実施形態では、抗体を、1種以上のナトリウム利尿ペプチドに対する個々の親和性に基づいてではなく、イムノアッセイなどの結合アッセイにおいて得られるシグナルに基づいて選択する。当業者ならば、種々の結合アッセイ形式が当技術分野で公知であること、および1種以上の標的分子に対する抗体の個々の親和性よりも重要である適当なアッセイを構築するための抗体の使用はよくあることであることは認識されよう。例えば、競合結合アッセイは、固体表面に結合している受容体(例えば、抗体)を含んでなる場合がある。試験サンプル中の注目する分析物は、同様に受容体と結合する標識された分子との結合と競合する。受容体と結合している標識された分子の量(したがって、アッセイシグナル)は、試験サンプル中の注目する分析物の量と反比例する。この場合には、固相に付着している単一抗体を用いる。あるいは、サンドイッチイムノアッセイでは、通常、固体表面と結合している一次抗体、および通常、検出可能な標識とコンジュゲートしている二次抗体の各々が、試験サンプル中の注目する分析物と結合する。受容体と結合している標識された分子の量(したがって、アッセイシグナル)は、試験サンプル中の注目する分析物の量と正比例する。
【0024】
本発明のイムノアッセイは、生物活性ナトリウム利尿ペプチドと生物学的不活性ナトリウム利尿ペプチドを、および/または無傷のナトリウム利尿ペプチドとナトリウム利尿ペプチド断片とを識別するよう設計することが好ましい。例えば、好ましいイムノアッセイは、無傷のN末端領域を含んでなるナトリウム利尿ペプチドとN末端領域が失われているナトリウム利尿ペプチドの断片を識別する。イムノアッセイは、同一アッセイ条件下で第2群のポリペプチドの同数の分子から得られるシグナルより少なくとも5倍大きい、第1群のポリペプチドの結合に関連するシグナルをイムノアッセイが提供する場合に、第1群のポリペプチドと第2群のポリペプチド間を「識別する」と考えられており、アッセイを2度までしか実施しない場合には、第1群のポリペプチドの量は最大シグナルを得ることが必要である。このようなアッセイ条件下では、シグナルが少なくとも10倍大きいことがより好ましく、少なくとも20倍大きいことがさらにより好ましく、少なくとも50倍大きいこと、少なくとも100倍大きいこと、またはそれ以上が最も好ましい。そのようなアッセイ条件下で、第1群のポリペプチドの結合に関するシグナルが得られるが、第2群のポリペプチドの同数の分子からバックグラウンドを上回るシグナルが得られない場合、アッセイは第2群のポリペプチドを「感知できるほどに検出しない」。
【0025】
もう1つの態様では、本発明は、生物活性ナトリウム利尿ペプチドと特異的に結合するが、ナトリウム利尿ペプチドの生物学的不活性断片とは特異的に結合しない抗体に応じてシグナルが変わるアッセイを実施することを含んでなる、サンプル中のナトリウム利尿ペプチドの存在または量を検出する方法に関する。前記で論じたように、生物学的不活性断片としては、無傷のナトリウム利尿ペプチドのN末端またはC末端のいずれかまたは双方から残基が除去されているもの、および/またはナトリウム利尿ペプチドの分子内ジスルフィド結合によって形成されるループが切断されているものが挙げられる。好ましい実施形態では、無傷のナトリウム利尿ペプチドと特異的に結合するが、ナトリウム利尿ペプチドのN末端部分が除去されるとナトリウム利尿ペプチドから生じるペプチドとは特異的に結合しない抗体に応じてシグナルが変わる条件下でアッセイを実施する。
【0026】
関連態様では、本発明は、無傷のナトリウム利尿ペプチドと特異的に結合するが、ナトリウム利尿ペプチドのある部分、好ましくは、少なくともN末端部分が除去されると生じるナトリウム利尿ペプチドの断片とは特異的に結合しない抗体に応じてシグナルが変わるアッセイを実施することを含んでなる、サンプル中のナトリウム利尿ペプチドの存在または量を検出する方法に関する。
【0027】
種々の実施形態では、本発明は、BNP77〜108と特異的に結合するが、BNP94〜106とは特異的に結合しない抗体に応じてシグナルが変わるアッセイ、BNP77〜108と特異的に結合するが、BNP90〜108とは特異的に結合しない抗体に応じて変わるアッセイ、BNP77〜108と特異的に結合するが、BNP81〜108とは特異的に結合しない抗体に応じて変わるアッセイ、BNP77〜108と特異的に結合するが、BNP79〜108とは特異的に結合しない抗体に応じて変わるアッセイ、BNP77〜108と特異的に結合するが、BNP77〜106とは特異的に結合しない抗体に応じて変わるアッセイ、および/またはBNP77〜108と特異的に結合するが、BNP79〜106とは特異的に結合しない抗体に応じて変わるアッセイを実施することを含んでなる、サンプル中のBNPの存在または量を検出する方法に関する。
【0028】
種々のさらなる実施形態では、本発明は、BNP1〜76と特異的に結合するが、BNP38〜76とは特異的に結合しない抗体に応じてシグナルが変わるアッセイ、BNP1〜76と特異的に結合するが、BNP24〜76とは特異的に結合しない抗体に応じて変わるアッセイ、BNP1〜76と特異的に結合するが、BNP12〜76とは特異的に結合しない抗体に応じて変わるアッセイ、BNP1〜76と特異的に結合するが、BNP3〜76とは特異的に結合しない抗体に応じて変わるアッセイ、BNP1〜76と特異的に結合するが、BNP1〜73とは特異的に結合しない抗体に応じて変わるアッセイ、および/またはBNP1〜76と特異的に結合するが、BNP3〜73とは特異的に結合しない抗体に応じて変わるアッセイを実施することを含んでなる、サンプル中のBNPの存在または量を検出する方法に関する。
【0029】
その他のさらなる実施形態では、本発明は、ANP99〜126と特異的に結合するが、ANP113〜126とは特異的に結合しない抗体に応じてシグナルが変わるアッセイ、ANP99〜126と特異的に結合するが、ANP105〜126とは特異的に結合しない抗体に応じて変わるアッセイ、ANP99〜126と特異的に結合するが、ANP102〜126とは特異的に結合しない抗体に応じて変わるアッセイ、ANP99〜126と特異的に結合するが、ANP99〜124とは特異的に結合しない抗体に応じて変わるアッセイ、および/またはANP99〜126と特異的に結合するが、ANP102〜124とは特異的に結合しない抗体に応じて変わるアッセイを実施することを含んでなる、サンプル中のANPの存在または量を検出する方法に関する。
【0030】
イムノアッセイからのシグナルは、抗体がシグナルが生じるのに必要な複合体の形成に関与する場合には、「抗体との結合に応じて変わる」と考えられている。例えば、固相抗体および二次抗体コンジュゲートを用いて構築されるサンドイッチイムノアッセイでは、その各々が分析物と結合してサンドイッチを形成しなくてはならず、固相抗体と二次抗体の各々がシグナルが生じるのに必要な複合体の形成に関与している。単一抗体を用い、分析物が分析物コンジュゲートと結合について競合する競合イムノアッセイでは、単一抗体がシグナルが生じるのに必要な複合体の形成に関与している。当業者ならば、多数のさらなるイムノアッセイの構築を提供できることを理解されよう。
【0031】
本明細書に記載したアッセイ法はまた、1種以上のナトリウム利尿ペプチドに対するアッセイに先立ってサンプルを一定期間保存するステップを含んでなる。ナトリウム利尿ペプチドの分解は、保存中も進行するプロセスであり得るため、保存考慮は、分子のN末端部分の喪失を減少させるよう選択しなくてはならない。したがって、保存条件は、ナトリウム利尿ペプチド分解の1種以上の阻害剤の添加を含み得る。以下に論じるように、保存条件は中性エンドペプチダーゼの1種以上の阻害剤および/またはプロリル特異的ジペプチジルペプチダーゼの1種以上の阻害剤を含み得る。このような阻害剤は当技術分野では周知である。例えば、コルチら、サーキュレーション104、1856〜62頁、2001、センテン(Senten)ら、ジャーナル・オブ・コンビナトリー・ケミストリー(Journal of Combinatory Chemistry)、5、336〜44頁、2003、センテンら、バイオオーガニック・アンド・メディシナル・ケミストリー・レターズ(Bioorganic and Medicinal Chemistry Letters)12、2825〜8頁、2002参照。代替法では、またはこのような阻害剤と併用して、保存条件は、低温での、好ましくは、サンプルの氷点よりも低い温度での保存を含み得る。
【0032】
もう1つの態様では、本発明は、記載したアッセイを実施するために設定および準備されたアッセイ装置に関する。本明細書に記載したアッセイを実施するための装置は、複数の、個別の、独立した、アドレス可能な場所、すなわち、その各々が注目する個々の分析物または分析物のセットと関連し、そのうちの1種以上がナトリウム利尿ペプチドである「診断ゾーン」を含むことが好ましい。例えば、複数の個別のゾーンの各々が、異なる分析物を結合するための受容体(例えば、抗体)を含み得る。サンプルを装置で反応させた後、診断ゾーンからシグナルが生じ、結果、これは注目するペプチドの存在または量と相関し得る。
【0033】
さらにもう1つの態様では、本明細書に記載した方法によって測定した、注目する1種以上のナトリウム利尿ペプチドの存在または量を、疾病の有無、または疾病予後(例えば、疾病に関連する将来の有害転帰の可能性)と関連付けることができる。好ましい疾病としては、脳卒中、うっ血性心不全(CHF)、心虚血、全身性高血圧、および/または急性心筋梗塞をはじめとする種々の循環器疾患および脳血管疾患が挙げられる。これらの方法は、本明細書に記載した方法によって1種以上のナトリウム利尿ペプチドの存在または量を調べることと、存在または量を注目する疾病または予後と関連付けることとを含んでなることが好ましい。
【0034】
特定の実施形態では、アッセイから得られるシグナルを、1種以上のナトリウム利尿ペプチドの存在または量と関連付ける必要はなく、むしろ、シグナルを疾病の有無または疾病と関連する将来の有害転帰の可能性と直接関連付けることができる。例えば、シグナルxのレベルは、y pg/mLのナトリウム利尿ペプチドがサンプル中に存在することを示し得る。次いで、そのナトリウム利尿ペプチドのy pg/mLがうっ血性心不全を示すことが表から示され得る。どの程度のナトリウム利尿ペプチドが存在するかを決定せずに、シグナルxのレベルをうっ血性心不全と直接的に単に関連付けることは、同等に有効であり得る。このようなシグナルは本発明の抗体を用いるイムノアッセイから得ることが好ましいが、当業者にはその他の方法も周知である。
【0035】
さらにもう1つの態様では、本発明は、ナトリウム利尿ペプチドのアッセイに用いる1種以上の抗体を選択する方法に関する。これらの方法は、アッセイに用いると、注目する生物活性ナトリウム利尿ペプチドを検出するが、ナトリウム利尿ペプチドの生物学的不活性断片からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほど検出しない抗体を選択することを含んでなる。前述のように、生物学的不活性断片としては、無傷のナトリウム利尿ペプチドのN末端もしくはC末端のいずれかまたは双方から残基が除去されているもの、および/またはナトリウム利尿ペプチドの分子内ジスルフィド結合によって形成されるループが切断されているものが挙げられる。
【0036】
関連態様では、本発明は、アッセイに用いると、注目する無傷のナトリウム利尿ペプチドを検出するが、ナトリウム利尿ペプチドのある部分、好ましくは、N末端部分が除去されるとナトリウム利尿ペプチドから生じる同モル量のペプチドからのシグナルが少なくとも5分の1に低下し、、好ましくは、これを感知できるほど検出しない抗体を選択することを含んでなる、アッセイに用いる1種以上の抗体を選択する方法に関する。
【0037】
種々の実施形態では、本方法は、アッセイに用いるとBNP77〜108を検出するが、同モル量のBNP94〜108からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほど検出しない1種以上の抗体を選択すること、BNP77〜108を検出するが、BNP90〜108からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほど検出しない1種以上の抗体を選択すること、BNP77〜108を検出するが、BNP81〜108からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほど検出しない1種以上の抗体を選択すること、BNP77〜108を検出するが、BNP79〜108からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほど検出しない1種以上の抗体を選択すること、BNP77〜108を検出するが、BNP77〜106からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほど検出しない1種以上の抗体を選択すること、および/またはBNP77〜108を検出するが、BNP79〜106からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほど検出しない1種以上の抗体を選択することを含んでなる。
【0038】
種々のさらなる実施形態では、本方法は、アッセイに用いるとBNP1〜76を検出するが、同モル量のBNP38〜76からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しない1種以上の抗体を選択すること、BNP1〜76を検出するが、BNP24〜76からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しない1種以上の抗体を選択すること、BNP1〜76を検出するが、BNP12〜76からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しない1種以上の抗体を選択すること、BNP1〜76を検出するが、BNP3〜76からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しない1種以上の抗体を選択すること、BNP1〜76を検出するが、BNP1〜73からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しない1種以上の抗体を選択すること、および/またはBNP1〜76を検出するが、BNP3〜73からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しない1種以上の抗体を選択することを含んでなる。
【0039】
その他のさらなる実施形態では、本方法は、アッセイに用いるとANP99〜126を検出するが、同モル量のANP113〜126からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しない1種以上の抗体を選択すること、アッセイに用いるとANP99〜126を検出するが、同モル量のANP105〜126からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しない1種以上の抗体を選択すること、アッセイに用いるとANP99〜126を検出するが、同モル量のANP101〜126からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しない1種以上の抗体を選択すること、アッセイに用いるとANP99〜126を検出するが、同モル量のANP99〜124からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しない1種以上の抗体を選択すること、および/またはアッセイに用いるとANP99〜126を検出するが、同モル量のANP101〜124からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しない1種以上の抗体を選択することを含んでなる。
【0040】
その他の関連態様では、本発明は、ナトリウム利尿ペプチドのアッセイに用いる1種以上の抗体を選択する方法に関する。本方法は、生物活性ナトリウム利尿ペプチドと特異的に結合するが、ナトリウム利尿ペプチドの生物学的不活性断片とは特異的に結合しない1種以上の抗体を選択することを含んでなる。前記で論じたように、生物学的不活性断片としては、無傷のナトリウム利尿ペプチドのN末端もしくはC末端のいずれか、もしくは双方から残基が除去されているもの、および/またはナトリウム利尿ペプチドの分子内ジスルフィド結合によって形成されたループが切断されているものが挙げられる。好ましい実施形態では、無傷のナトリウム利尿ペプチドと特異的に結合するが、ナトリウム利尿ペプチドのN末端部分が除去されるとナトリウム利尿ペプチドから生じるペプチドとは特異的に結合しない抗体に応じてシグナルが変わる条件下でアッセイを実施する。
【0041】
さらにその他の関連態様では、本発明は、無傷のナトリウム利尿ペプチドと特異的に結合するが、ナトリウム利尿ペプチドのN末端部分が除去されると生じるナトリウム利尿ペプチドの生物学的不活性断片とは特異的に結合しない抗体を選択することを含んでなる、アッセイに用いる1種以上の抗体を選択する方法に関する。
【0042】
種々の実施形態では、本方法は、BNP77〜108と特異的に結合するが、BNP94〜108とは特異的に結合しない1種以上の抗体を選択すること、BNP77〜108と特異的に結合するが、BNP90〜108とは特異的に結合しない1種以上の抗体を選択すること、BNP77〜108と特異的に結合するが、BNP81〜108とは特異的に結合しない1種以上の抗体を選択すること、BNP77〜108と特異的に結合するが、BNP79〜108とは特異的に結合しない1種以上の抗体を選択すること、BNP77〜108と特異的に結合するが、BNP77〜106とは特異的に結合しない1種以上の抗体を選択すること、および/またはBNP77〜108と特異的に結合するが、BNP79〜106とは特異的に結合しない1種以上の抗体を選択することを含んでなる。
【0043】
種々のさらなる実施形態では、本方法は、BNP1〜76と特異的に結合するが、BNP38〜76とは特異的に結合しない1種以上の抗体を選択すること、BNP1〜76と特異的に結合するが、BNP24〜76とは特異的に結合しない1種以上の抗体を選択すること、BNP1〜76と特異的に結合するが、BNP12〜76とは特異的に結合しない1種以上の抗体を選択すること、BNP1〜76と特異的に結合するが、BNP3〜76とは特異的に結合しない1種以上の抗体を選択すること、BNP1〜76と特異的に結合するが、BNP1〜73とは特異的に結合しない1種以上の抗体を選択すること、および/またはBNP1〜76と特異的に結合するが、BNP3〜73とは特異的に結合しない1種以上の抗体を選択することを含んでなる。
【0044】
その他のさらなる実施形態では、本方法は、ANP99〜126と特異的に結合するが、ANP113〜126とは特異的に結合しない1種以上の抗体を選択すること、ANP99〜126と特異的に結合するが、ANP105〜126とは特異的に結合しない1種以上の抗体を選択すること、ANP99〜126と特異的に結合するが、ANP101〜126とは特異的に結合しない1種以上の抗体を選択すること、ANP99〜126と特異的に結合するが、ANP99〜124とは特異的に結合しない1種以上の抗体を選択すること、および/またはANP99〜126と特異的に結合するが、ANP101〜124とは特異的に結合しない1種以上の抗体を選択することを含んでなる。
【0045】
もう1つの態様では、本発明の1種以上の抗体および/または抗体コンジュゲートを、ナトリウム利尿ペプチドの存在または量を調べるキットとして提供することもできる。これらのキットは、本明細書に記載したような少なくとも1種のアッセイを試験サンプルで実施するための装置および試薬を含んでなることが好ましい。このようなキットは、1種以上のこのような測定を実施するのに十分な試薬、および/または食品医薬品局(FDA)承認表示を含むことが好ましい。
【0046】
さらにもう1つの態様では、本発明は、患者に用いる治療計画を決定する方法に関する。この方法は、本明細書に記載した方法によって1種以上のナトリウム利尿ペプチドの存在または量を調べることと、存在または量を疾病または予後状態と関連付けることとを含んでなることが好ましい。本明細書に論じたように、脳卒中、うっ血性心不全(CHF)、心虚血、全身性高血圧、急性冠症候群、および/または急性心筋梗塞をはじめとする種々の循環器疾患および脳血管疾患の診断および識別は、ANP、BNP、および/またはCNPレベルと関連付けることができる。診断または予後が得られると、治療計画がその診断と一致するよう選択される。
【0047】
本発明のもう1つの目的は、ナトリウム利尿ペプチドを安定化する組成物および方法を提供することである。このような方法によって、特に循環器疾患の治療のための、ナトリウム利尿ペプチドの治療可能性が向上し得る。数種のナトリウム利尿ペプチド、例えば、プロ−BNP、成熟BNP、およびプロ−ANPは、最後から2番目のプロリン残基を含んでなり、プロリル特異的ジペプチジルジペプチダーゼ(「DPP」)に適した基質である。したがって、成熟BNPは、ANPと比べ、中性エンドペプチダーゼによる分解に対して耐性を示すと報告されているが、DPPは、成熟BNP分子の、ならびにプロ−BNPおよびプロ−ANPの、これまで認識されていない分解経路に相当し得る。さらに、プロリン含有ジペプチドの除去により、種々のナトリウム利尿ペプチドが、その他のペプチダーゼによるさらなる分解に対して開放される可能性がある。ナトリウム利尿ペプチド濃度の上昇によって利益を得ることができる被験体は、単独または中性エンドペプチダーゼ阻害剤と組み合わせた1種以上のDPPの阻害剤で治療でき、かつ/またはナトリウム利尿ペプチドおよび/またはDPP安定性の上昇を示すナトリウム利尿ペプチド類似体で治療できる。さらに、被験体から採取したサンプル中のBNPを、保存の間、これらの同様の阻害剤を用いて安定化することもできる。
【0048】
したがって、一態様では、本発明は、1種以上のナトリウム利尿ペプチドの分解を阻害する方法に関する。この方法は、1種以上のプロリル特異的DPPの阻害剤を、ナトリウム利尿ペプチドの分解を阻害するのに十分な量で投与することを含んでなる。
【0049】
もう1つの態様では、本発明は、ナトリウム利尿ペプチド機能の上昇を必要とする被験体、好ましくは、心不全を患っている被験体を治療する方法に関する。この方法は、1種以上のプロリル特異的DPPの阻害剤を被験体に、好ましくはナトリウム利尿ペプチドの分解を阻害するのに十分な量で投与することを含んでなる。
【0050】
特定の実施形態では、プロリル特異的DPPの阻害剤(類)は、プロ−BNP、成熟BNP、および/またはプロ−ANPが基質である1種以上のDPPに対して選択性である。特異的DPP阻害剤を設計および選択する方法は当技術分野では周知である。例えば、レイティング(leiting)ら、バイオケミカル・ジャーナル(Biochemical Journal)371、525〜32頁、2003、セド(Sedo)ら、フィジオロジカル・リサーチ(Physiological Research)52、367〜72頁、2003、ビルハウアー(villhauer)ら、ジャーナル・オブ・メディカル・ケミストリー(Journal of Medical Chemistry)46、2774〜89頁、2003、センテン(Senten)ら、ジャーナル・オブ・コンビナトリー・ケミストリー5、336〜44頁、2003、センテンら、バイオオーガニック・アンド・メディシナル・ケミストリー・レターズ12、2825〜8頁、2002、ボルロー(Borloo)およびメーステル(Meester)、フェアハンドリンゲン−コニンクリーエ・アカデミー・フォア・ゲネースクンデ・ファン・ベルギーエ(Verhandelingen−Koninklijke Academie voor Geneeskunde van Belgie)56、57〜88頁、1994参照。さらに、DPPは、アンチセンスまたはRNAi構築物によってなど、当業者に公知の方法によって発現レベルで阻害できる。DPPはまた、結合タンパク質、例えば、1種以上のDPPと特異的に結合し、ナトリウム利尿ペプチド基質に対するその活性を妨げる抗体またはその断片の使用によっても阻害できる。
【0051】
本明細書に記載した方法は、1種以上のプロリル特異的DPP阻害剤単独での使用を含んでなる場合もあるし、このような阻害剤を、1種以上の中性エンドペプチダーゼの阻害剤および/またはその他のプロテアーゼ阻害剤と、ならびに/あるいはプロリル特異的DPP阻害剤の不在下での中性エンドペプチダーゼの阻害剤の使用および/または外因的に加えたナトリウム利尿ペプチドと比較してナトリウムペプチド機能の上昇を増強するよう、被験体に外因的に加えた1種以上のナトリウム利尿ペプチドと組みあせてもよい。これらの化合物は薬剤組成物の一部として提供できることが好都合である。
【0052】
好ましい実施形態では、本明細書に記載した治療法を受ける被験体は、脳卒中、うっ血性心不全(CHF)、心虚血、全身性高血圧、および/または急性心筋梗塞からなる群から選択される疾病を患っている。特に好ましい実施形態では、本明細書に記載した治療法を受ける被験体は、BNPレベルに基づいて選択される。例えば、被験体は、少なくとも約80pg/mLという治療を受ける前の血漿BNPレベルに基づいて選択でき、少なくとも約100pg/mLが好ましく、少なくとも約200pg/mLがさらにより好ましく、少なくとも約500pg/mLがいっそうより好ましく、少なくとも約1000pg/mLが最も好ましい。
【0053】
さらにもう1つの態様では、本発明は、プロリル特異的DPPの存在下で安定性の上昇をもたらす(例えば、被験体の血中の注目するナトリウム利尿ペプチドのt1/2の増加によって測定されるような)ナトリウム利尿ペプチドの1種以上の類似体を投与することを含んでなる、ナトリウム利尿ペプチド機能の上昇を必要とする被験体を治療する方法に関する。
【0054】
本発明のさらにもう1つの目的は、グリコシル化されている、注目する1種以上のナトリウム利尿ペプチドの存在または量を調べる方法および組成物を提供することである。グリコシル化されたナトリウム利尿ペプチド中の共有結合している糖鎖残基は、種々のアッセイ法のこのようなペプチドを検出する能力に対して実質的な影響を及ぼし得る。アッセイ条件を注意深く選択することによって、このような影響を軽減することができ、その結果、サンプル中の注目するナトリウム利尿ペプチドの存在または量を表すアッセイ結果が得られる。
【0055】
したがって、もう1つの態様では、本発明は、共有結合している糖鎖残基を含んでなる、サンプル中の注目する1種以上のナトリウム利尿ペプチドの存在または量を検出する方法に関する。これらの方法は、1種以上の注目する前記ナトリウム利尿ペプチドから1種以上の共有結合している糖鎖残基を除去することと、サンプルを注目するナトリウム利尿ペプチドについてアッセイすることとを含んでなる。したがって、アッセイ結果は、前記サンプル中の注目する前記ナトリウム利尿ペプチドの存在または量に関する。種々の実施形態では、1種以上のナトリウム利尿ペプチドから、ペプチドの酵素処理によって、ペプチドの非酵素的化学処理によって、またはこれらの方法の組合せによって共有結合している糖鎖残基を除去できる。
【0056】
NおよびO−結合型糖鎖残基を除去する有効な酵素的方法は、当技術分野では周知であり、N−グリカナーゼ(N−グリコシダーゼとしても知られる)、エンドグリコシダーゼH、エンドグリコシダーゼA、O−グリカナーゼ(エンド−α−N−アセチルガラクトサミニダーゼとしても知られる)、α2−(3,6,8,9)−ノイリミニダーゼ(neuriminidase)、β(1,4)−ガラクトシダーゼ、N−アセチルグルコサミニダーゼ、エンドグリコシダーゼF1、エンドグリコシダーゼF2、および/またはエンドグリコシダーゼF3などの酵素を用いる。この羅列は限定しようとするものではない。
【0057】
共有結合している糖鎖残基をペプチドから除去するための非酵素的化学処理の場合には、非還元O−およびN−結合型オリゴ糖の放出にヒドラジン加水分解が有効であるとわかっている。約60℃でのO−結合型オリゴ糖の最初の穏やかなヒドラジン分解と、それに続く約95℃でのN−結合型オリゴ糖のヒドラジン分解によって、オリゴ糖の選択的および順次的放出を達成できる。例えば、パテール(Patel)およびラレク(Rarekh)、メソッヅ・イン・エンジモロジー(Methods in Engymology)230、58〜66頁、1994参照。しかしながら、このような処理の結果、ポリペプチドが破壊されることもある。穏やかな塩基環境においてアルカリ性水素化ホウ素ナトリウムを利用する、O−結合型オリゴ糖のアルカリ−β−脱離が好ましい場合がある。例えば、グリコバイオロジー(Glycobiology):ア・プラクティカル・アプローチ(A Practical Approach)、フクダ,Mおよびコバタ,A編、291〜328頁、IRL/オックスフォード大学出版、オックスフォード、1993参照。さらに、トリフルオロメタンスルホン酸加水分解を用いてもよい。この方法は通常、無傷のポリペプチドを残すが、グリカンの破壊をもたらす。例えば、エッジ(Edge)、バイオケミカル・ジャーナル376、339〜50頁、2003参照。
【0058】
ペプチドからの糖除去についての前述の方法は、天然(非変性)ポリペプチドで、および/またはポリペプチドの変性後に使用できる。酵素的処理であろうと、非酵素的処理であろうと、または双方の処理であろうと、処理を用いてナトリウム利尿ペプチドから共有結合している糖鎖残基を除去し、この処理によって注目する1種以上の、好ましくはすべてのグリコシル化ナトリウム利尿ペプチドから、少なくとも約50%の糖鎖残基が除去されることが好ましく、少なくとも約60%がより好ましく、少なくとも約70%がいっそうより好ましくは、少なくとも約80%がさらにより好ましく、少なくとも約90%〜約100%が最も好ましい。ポリペプチドのグリコシル化度は、ポリペプチドの見かけの質量をポリペプチドのアミノ酸成分の質量と比較し、見かけの質量の差し引き分がグリコシル化によるものであると仮定することによって求めることができる。その他の修飾(例えば、酸化、ニトロ化、リン酸化)が起こっていることがわかっている事象では、これら他の修飾による質量も見かけの質量から差し引くことができる。その結果、脱グリコシル化処理後のポリペプチドの見かけの質量を測定することによって、糖鎖残基の除去度をモニターすることができる。ポリペプチドの見かけの質量を測定する方法(例えば、SDSゲル電気泳動、分析用遠心、ゲル浸透クロマトグラフィー、質量分析など)は、当業者には周知である。
【0059】
このようなグリコシル化ナトリウム利尿ペプチドを含むサンプルが、その用語が本明細書で定義される試験サンプルであり得る。このようなサンプル中に存在するグリコシル化ナトリウム利尿ペプチドは、患者から得たサンプル中など、天然に存在するものである場合もあるし、標準サンプルである場合もある。このような標準を構築するのに用いるナトリウム利尿ペプチドは、活性なグリコシル化機能を含む哺乳類組織培養系における組換えによって発現されることが多い。
【0060】
脱グリコシル化ステップ後、本明細書に記載した方法では、当技術分野で公知のどんなアッセイ法も用いることができる。このようなアッセイ法では、アフィニティー分離、ゲル電気泳動、キャピラリー電気泳動、液体クロマトグラフィー、および/またはHPLCなどの分離法を用いて注目する分析物を検出に向けて分離することができる。好ましい実施形態では、種々のサンドイッチ、競合、または非競合アッセイ形式のアフィニティー分離にイムノアッセイ装置および方法を用い、注目する1種以上のナトリウム利尿ペプチドの存在または量と関連のあるシグナルを生じさせることが多い。さらに、特定の方法および装置、例えば、バイオセンサーおよび光学的免疫測定法を用いて、標識された分子を必要とすることなく、分析物の存在または量を調べることもできる。
【0061】
さらに、アッセイ法の一部として質量分析法を用いることも有利であり得る。本明細書において、用語「質量分析」または「MS」とは、イオンをその質量対電荷比、すなわち「m/z」に基づいて、選別、検出および測定する方法を指す。一般に、注目する1種以上の分子をイオン化し、続いてそのイオンを質量分析機器に導入し、そこで磁場と電場の組合せによって、イオンが質量(「m」)および電荷(「z」)に応じて変わる空間中の経路をたどる。例えば、「マス・スペクトロメトリー・フロム・サーフェシズ(Mass Spectrometry From Surfaces)」と題された米国特許第6,204,500号、「メソッヅ・アンド・アパラタス・フォー・タンデム・マス・スペクトロメトリー(Methods and Apparatus for Tande Mass Spectrometry)」と題された同6,107,623号、「DNA・ダイグノスティクス・ベースド・オン・マス・スペクトロメトリー(DNA Diagnostics Based On Mass Spectrmetry)」と題された同6,268,144号、「サーフェス−エンハンスド・フォトラバイル・アタッチメント・アンド・リリース・フォー・デソープション・アンド・デテクション・オブ・アナリテス(Surface−Enhanced Photolabile Attachment And Release For Desorption And Detection Of Analytes)」と題された同6,124,137号、ライト(Wright)ら、「プロテインチップ・サーフェス・エンハンサー・レーザー・デソープション/イオニゼーション(SELDI)マス・スペクトロメトリー:ア・ノベル・プロテイン・バイオチップ・テクノロジー・フォー・デテクション・オブ・プロステート・キャンサー・バイオマーカーズ・イン・コンプレックス・プロテイン・ミクスチャー(Proteinchip surface enhanced laser desorption/ionization (SELDI) spectrometry:a novel protein biochip technology for detection of prostate cancer biomarkers in complex protein mixtures)」、プロステート・キャンサー・アンド・プロスタティック・ディジーズ(Prostate Cancer and Prostatic Diseases)2、264〜76頁(1999)およびマーチャント(Marchant)およびワインバーガー(Weinberger)、「リーセント・アドバンスメント・イン・サーフェス−エンハンスド・レーザー・デソープション/イオニゼーション−タイム・オブ・フライト−マス・スペクトロメトリー(Recent advancements in surface−enhanced laser desorption/ionization−time of flight−mass spectrometry)」、エレクトロフォレシス(Electrophoresis)21、1164〜67頁(2000)参照、なおその各々は参照により、すべての表、図および特許請求の範囲をはじめとするその全文を本明細書に組み入れる。試験サンプル中の分子(例えば、ペプチド)は、当業者に公知のいずれの方法でイオン化してもよい。これらの方法としては、それだけには限らないが、電子イオン化、化学イオン化、高速原子衝撃、電界脱離、およびマトリックス支援レーザー脱離イオン化(「MALDI」)、表面増強レーザー脱離イオン化(「SELDI」)、光子電離、エレクトロスプレー、および誘導結合プラズマが挙げられる。
【0062】
特定の実施形態では、前記で論じたMS法を、アフィニティー精製ステップ、例えば、注目する1種以上のポリペプチドと特異的に結合する抗体との結合と組み合わせることが好ましい。例えば、ネルソン(Nelson)ら、アナリティカル・ケミストリー(Analytical Chemistry)67、1153頁、1995、タブス(Tubbs)ら、アナリティカル・バイオケミストリー(Analytical Biochemistry)289、26頁、2001、ニーダーコフラー(Niederkofler)ら、アナリティカル・ケミストリー73、3294頁、2001参照。
【0063】
糖タンパク質の一特徴として、特有のグリカンの不均一性がある。所与の糖タンパク質の個々の分子が、ポリペプチド鎖中の同じ付着部位に異なる糖鎖を有することは極めて一般的なことである。糖鎖残基中の構造変化はいずれも、グリコフォームと呼ばれる個別の分子サブセットの形成をもたらす。種々の分離法の場合には、このような不均一性が、注目する種々のポリペプチドの電荷および質量の差、および/または注目する種々のポリペプチドの結合マトリックス(例えば、抗体)との結合の差により分析を実施的に困難にする場合がある。さらに、糖鎖は、容易にプロトン化され得るタンパク質などの化合物と同程度には効率よくイオン化されず、また効率よく気相に運ばれないと思われる。
【0064】
したがって、好ましい実施形態では、本明細書に記載した方法は、同一のアッセイステップを、注目する1種以上のナトリウム利尿ペプチドから1種以上の共有結合している糖鎖残基を除去せずに実施することと比較して、注目する1種以上のナトリウム利尿ペプチドの検出の増加を提供する。本明細書において、用語「検出の増加」とは、注目する1種以上の特定のナトリウム利尿ペプチドのアッセイ法から得られるシグナルの増加を指す。このようなシグナルの増加は、注目するすべてのナトリウム利尿ペプチドを検出する能力の上昇を表すものであり得る。例えば、注目する1種以上のナトリウム利尿ペプチドの特定のグリコシル化型とは結合できない抗体は、そういったナトリウム利尿ペプチドの濃度を過小評価するアッセイシグナルをもたらし、あるいは、注目する1種以上のナトリウム利尿ペプチドの特定のグリコシル化型の効率の悪いイオン化が、そういったナトリウム利尿ペプチドの濃度を過小評価するMSによるアッセイシグナルをもたらす。脱グリコシル化は、アッセイシグナルの増加をもたらし得る。このようなシグナルの増加はまた、注目するナトリウム利尿ペプチドの1種以上の具体的な型を検出する能力の上昇を表すものであり得る。例えば、グリカンの不均一性は、分離法(例えば、質量および/または電荷に基づくもの)において単一ポリペプチドの複数の異なる画分への分離をもたらし得る。脱グリコシル化は、そのような異なる画分の単一画分への併合をもたらし、その結果、その画分のアッセイシグナルの向上を提供し得る。
【0065】
種々の実施形態では、同一アッセイステップを、注目する1種以上のナトリウム利尿ペプチドから1種以上の共有結合している糖鎖残基を除去しないで実施することと比べて、注目する1種以上のナトリウム利尿ペプチド検出の増加を、少なくとも約5%、より好ましくは、少なくとも約10%、いっそうより好ましくは、少なくとも約20%、さらにより好ましくは、少なくとも約50%、いっそうより好ましくは、少なくとも100%、最も好ましくは、少なくとも約200%以上増加するアッセイシグナルによって測定する。
【0066】
特に好ましい実施形態では、注目するナトリウム利尿ペプチドはBNPおよび/または1種以上のその関連断片である。用語「関連断片」は、以下に定義する。好ましいBNP関連断片は、プロ−BNP(BNP1〜108)、NT−プロBNP(BNP1〜76)、BNP3〜108、BNP3〜76、およびBNP79〜108からなる群から選択されるものを含んでなる。この羅列は限定しようとするものではない。
【0067】
関連態様では、本発明は、注目する1種以上のナトリウム利尿ペプチドに共有結合している糖鎖残基の存在(または不在)に感受性があるか、感受性がないのいずれかである抗体を選択および使用する方法に関する。抗体は、注目する1種以上のグリコシル化ナトリウム利尿ペプチドと結合する能力についてスクリーニングでき、その結合を、1種以上の共有結合している糖鎖残基を除去した後の注目する1種以上のナトリウム利尿ペプチドと結合する能力と比較することができる。この基準によって実質的に同一の結合を提供する抗体は、「感受性がない」抗体に相当する。この基準によって、グリコシル化型または脱グリコシル化型について実質的に同一でない結合を提供する抗体は、「感受性のある」抗体に相当する。このような抗体を、注目する1種以上のナトリウム利尿ペプチドを検出するためのアッセイ法に用いるために選択すればよい。
【0068】
これに関連して、用語「1種以上の共有結合している糖鎖残基の除去」は、必ずしも、ポリペプチドから既存の糖鎖残基を除去するための酵素的または非酵素的化学処理の使用を指すものではない。そうではなく、1種以上の共有結合している糖鎖残基を欠くポリペプチドを作製する方法であれば、どんな方法も包含することを意味する。例えば、固相合成法を用いて、このような抗体スクリーニング法に用いるために、すべての糖鎖残基を含まないポリペプチドを作製することもできる。本明細書に記載したスクリーニング法において用いるためには、少なくとも約50%の糖鎖残基が、注目する1種以上の、好ましくはすべてのグリコシル化ナトリウム利尿ペプチドから除去されることが好ましく、少なくとも約60%がより好ましく、少なくとも約70%がいっそうより好ましく、少なくとも約80%がさらにより好ましくは、少なくとも約90%〜約100%が最も好ましい。
【0069】
用語「実質的に同一の結合」とは、アッセイに用いると、前記のスクリーニング比較において、互いに約2倍以内であるシグナルを提供する抗体を指す。1倍はシグナルが同等であることを示し、シグナルが2倍以内であることは一方のシグナルが他方のシグナル×2以下であることを示す。実質的に同一の結合を示す抗体は、約1.75倍以内であるシグナルを提供することが好ましく、約1.5倍以内がより好ましく、約1.25倍以内がいっそうより好ましく、約1.1〜1倍以内であることが最も好ましい。
【0070】
このような抗体はまた、注目する1種以上のグリコシル化ナトリウム利尿ペプチドに対して、1種以上の共有結合している糖鎖残基を除去した後の注目する1種以上のナトリウム利尿ペプチドと比較して「実質的に同一の親和性」を有し得る。1倍とは親和性が等しいことを示し、親和性が2倍以内であるということは、一方の親和性が他方のシグナル×2以下であることを示す。実質的に同一の結合を示す抗体は、約1.75倍以内である親和性を提供することが好ましく、約1.5倍以内がより好ましく、約1.25倍以内がいっそうより好ましく、約1.1〜1倍以内が最も好ましい。
【0071】
前述した本発明の要旨は限定するものではなく、本発明の他の特徴および利点は、以下の本発明の詳細な説明から、および特許請求の範囲から明らかとなるであろう。
【図面の簡単な説明】
【0072】
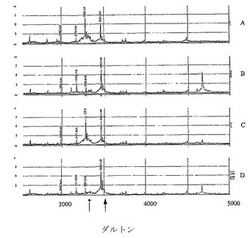
【図1】ジペプチジルぺプチダーゼの阻害剤の不在下(パネルAおよびC)、および存在下(パネルBおおよびD)での、ヒト血清中のBNPおよびその分解産物のマススペクトルを示す図である。
【発明を実施するための形態】
【0073】
本発明は、幾分か、生物活性(例えば、全長)ナトリウム利尿ペプチドを、そのナトリウム利尿ペプチドの生物学的不活性型と識別する方法に関する。本明細書に記載したように、生物活性ナトリウム利尿ペプチドを選択的に認識する抗体を作製し、サンプル中の不活性なナトリウム利尿ペプチド断片の存在によって引き起こされる不正確さを低下させたアッセイに用いることができる。
【0074】
本明細書において、用語「ナトリウム利尿ペプチド」とは、身体においてレニン−アンギオテンシン系の活性に対抗するよう作用する天然に生じるポリペプチドホルモン群のメンバー、およびその生合成前駆体および生物活性断片を指す。3つの主要なヒトナトリウム利尿ペプチドがある:心房で合成される、心房性ナトリウム利尿ペプチド(ANP)、心室で合成される、脳型ナトリウム利尿ペプチド(BNP)、および脳で合成される、C型ナトリウム利尿ペプチド(CNP)。
【0075】
本明細書において、用語「無傷のナトリウム利尿ペプチド」とは、全長プレ−プロ−ナトリウム利尿ペプチド、全長プロ−ナトリウム利尿ペプチド、全長成熟ナトリウム利尿ペプチド、および/または生合成の間のプレ−プロ−またはプロ−ナトリウム利尿ペプチドのプロセシングの際に除去される全長部分を指す。例えば、BNPの場合には、用語「無傷のナトリウム利尿ペプチド」は、全長32アミノ酸成熟BNPホルモン、全長134アミノ酸プレ−プロ−BNP分子、全長108アミノ酸プロ−BNP分子、全長76アミノ酸NT−プロBNP分子、および/または全長26アミノ酸「プレ」ペプチドを包含する。
【0076】
ヒト108アミノ酸BNP前駆体プロ−BNP(BNP1〜108)の配列を配列番号1として示す。成熟、全長BNP(BNP77〜108)には下線が引かれている。
【化1】

(配列番号1)
【0077】
ヒトBNP1〜108は、配列番号2として示される配列を有する大きな前駆体プレ−プロ−BNPとして合成される(「プレ」配列は太字で示されている):
【化2】

(配列番号2)
【0078】
126アミノ酸ヒトANP前駆体プロ−ANP(ANP1〜126)の配列を配列番号3として示す。成熟、全長ANP(ANP99〜126)には下線が引いてある:
【化3】

(配列番号3)
【0079】
ヒトANP1〜126は、配列番号4で示される配列を有する大きな前駆体プレ−プロ−ANPとして合成される(「プレ」配列は太字で示されている):
【化4】

(配列番号4)
【0080】
126アミノ酸ヒトCNP前駆体プロ−CNP(CNP1〜126)の配列を配列番号5として示す。全長成熟CNP型CNP−53(CNP74〜126)は斜体字で示し、全長成熟
CNP型CNP−22(CNP105〜126)には下線が引いてある:
【化5】

(配列番号5)
【0081】
本明細書において、用語「断片」とは、断片が由来するポリペプチドの少なくとも6個の連続するアミノ酸を含んでなるが、完全な親ポリペプチドよりも小さいポリペプチドを指す。したがって、プロ−BNP(BNP1〜108)の断片とは、BNP1〜108の少なくとも6個の連続するアミノ酸を含んでなるポリペプチドを指し、成熟BNPの断片とは、BNP77〜108の少なくとも6個の連続するアミノ酸を含んでなるポリペプチドを指し、プロ−BNPの成熟BNPへの切断によって生じるポリペプチドの断片とは、BNP1〜76の少なくとも6個の連続するアミノ酸を含んでなるポリペプチドを指す。同様に、プロ−ANP(ANP1〜126)の断片とは、ANP1〜126の少なくとも6個の連続するアミノ酸を含んでなるポリペプチドを指し、成熟ANPの断片とは、ANP99〜126の少なくとも6個の連続するアミノ酸を含んでなるポリペプチドを指し、プロ−ANPの成熟ANPへの切断によって生じるポリペプチドの断片とは、ANP1〜98の少なくとも6個の連続するアミノ酸を含んでなるポリペプチドを指し、プロ−CNP(CNP1〜126)の断片とは、CNP1〜126の少なくとも6個の連続するアミノ酸を含んでなるポリペプチドを指し、成熟CNPの断片とは、CNP74〜126またはCNP105〜126の少なくとも6個の連続するアミノ酸を含んでなるポリペプチドを指し、プロ−CNPの成熟CNPへの切断によって生じるポリペプチドの断片とは、CNP1〜73またはCNP1〜104の少なくとも6個の連続するアミノ酸を含んでなるポリペプチドを指す。好ましい実施形態では、断片とは、断片が由来するポリペプチドの少なくとも10個の連続するアミノ酸、断片が由来するポリペプチドの少なくとも15個の連続するアミノ酸、または断片が由来するポリペプチドの少なくとも20個の連続するアミノ酸を含んでなるポリペプチドを指す。
【0082】
本明細書において、用語「関連断片」とは、個々のポリペプチドのまたはその生合成親の1種以上の断片であって、ポリペプチド自体の代理として、または独立マーカーとして検出できるものを指す。例えば、ヒトBNPは、以下、BNP1〜108と呼ぶ、108アミノ酸前駆体分子のタンパク質分解によって得られる。成熟BNPまたは「BNPナトリウム利尿ペプチド」または「BNP−32」は、この前駆体のアミノ酸77〜108に相当する32アミノ酸分子であり、これはBNP77〜108と呼ぶことができる。残りの残基1〜76は、以下、BNP1〜76と呼ぶ。BNP1〜108およびBNP1〜76は「BNP関連断片」の例である。
【0083】
本明細書において、用語「N末端部分の除去によって形成される断片」とは、ナトリウム利尿ペプチド断片に関しては、無傷のペプチドのアミノ末端からの1個以上のアミノ酸の除去によって形成される無傷のナトリウム利尿ペプチドの断片を指す。好ましい実施形態では、このような断片は、無傷のペプチドのアミノ末端からの、少なくとも2、3、4、5、7、10、15、20個、またはそれより多いアミノ酸の除去によって形成される。
【0084】
本明細書において、用語「生物活性」とは、ナトリウム利尿ペプチドおよびその断片に関しては、全長成熟ナトリウム利尿ペプチド、またはロペスら、ジャーナル・オブ・バイオロジカル・ケミストリー(Journal of Biological Chemistry)272、23064〜23068頁、1997に記載されたように測定される、単離し前収縮させたマウス大動脈輪において全長成熟ナトリウム利尿ペプチドによって示される血管緊張低下作用の少なくとも50%を示す、全長成熟ナトリウム利尿ペプチドまたはその前駆体分子に由来するポリペプチドを指す。生物活性ナトリウム利尿ペプチドとしては、全長成熟ナトリウム利尿ペプチドの断片、またはその前駆体型もしくは断片が挙げられる。
【0085】
本明細書において、用語「生物学的不活性」とは、ナトリウム利尿ペプチド断片に関しては、前述の「生物活性」でない、全長成熟ナトリウム利尿ペプチドまたはその前駆体に由来するポリペプチドを指す。本明細書において、用語「生物学的不活性」は、必ずしも、すべての生物活性の完全な喪失を指すものではない。むしろ「生物学的不活性」ナトリウム利尿ペプチド断片は、無傷のナトリウム利尿ペプチドの1以上の生物学的機能の50%未満を示すことが好ましく、25%未満が好ましく、10%未満がより好ましく、1%未満が最も好ましい。この生物学的機能とは、全長成熟ナトリウム利尿ペプチドによって示されるものと比較される、スミス(Smith)ら、ジャーナル・オブ・エンドクリノロジー(Journal of Endorinology)167、239〜46頁、2000に記載されたように測定できる受容体結合、シメカケら、FEBSレターズ(FEBS Letters)309、185〜9頁、1992に記載されたように測定できる培養ラット大動脈平滑筋細胞におけるcGMP産生、および/またはロペスら、ジャーナル・オブ・バイオロジカル・ケミストリー272、23064〜23068頁、1997に記載されたように測定される、全長成熟ナトリウム利尿ペプチドによって示される単離し前収縮させたマウス大動脈輪における血管緊張低下作用であり得る。
【0086】
本明細書において、用語「グリコシル化」とは、ポリペプチドに関しては、共有結合している糖ユニットを、多くの場合グリカン鎖の形で含んでなるポリペプチドを指す。個々の糖ユニットは本明細書では、「共有結合している糖鎖残基」と呼ぶ。真核生物では、ポリペプチドのグリコシル化は、主としてアスパラギン側鎖とのグリコシド結合を介して(「N−結合型」)、セリンまたはスレオニン側鎖グリコシド結合を介して(「O−結合型」)起こり、または、糖鎖橋を介してポリペプチドがホスファチジルイノシトール脂質のアンカーと結合する場合もある(GPI−結合型)。
【0087】
本明細書において、用語「脱グリコシル化」とは、ポリペプチドから1種以上の共有結合している糖鎖残基を除去する方法を指す。すべての共有結合している糖鎖残基の除去が好ましいが、ポリペプチドは、いずれかの共有結合している糖鎖残基が除去されれば脱グリコシル化されたと考えられる。酵素処理、非酵素的処理、または2種の組合せを用いて、ポリペプチドから共有結合している糖鎖残基を除去することができる。ポリペプチドから少なくとも約50%の糖鎖残基が除去されるのが好ましく、少なくとも約60%がより好ましく、少なくとも約70%がいっそうより好ましく、少なくとも80%がさらにより好ましく、少なくとも約90%〜約100%が最も好ましい。
【0088】
本明細書において、用語「精製された」とは、ポリペプチドに関しては、完全な純度を必要とするものではない。そうではなく、注目するポリペプチドが、その他のタンパク質と比較して多量のもの(質量ベースで)が生体サンプル中よりも多い、個別の環境中にあることを示すものに相当する。「個別の環境」とは、単一媒体、例えば、単一溶液、単一ゲル、単一沈殿物などを意味する。精製されたポリペプチドは、例えば、実験室合成、クロマトグラフィー、分取電気泳動、遠心分離、沈殿、アフィニティー精製などをはじめとするいくつかの方法によって獲得できる。注目する1種以上の「精製された」ポリペプチドは、個別の環境のタンパク質含量の少なくとも10%であることが好ましい。1種以上の「実質的に精製された」ポリペプチドは、個別の環境のタンパク質含量の少なくとも50%であり、個別の環境のタンパク質含量の少なくとも75%がより好ましく、個別の環境のタンパク質含量の少なくとも95%が最も好ましい。タンパク質含量は、ハートリー(Hartree)、アナリティカル・バイオケミストリー(Analytical Biochemistry)48、422〜427頁(1972)に記載された、ウシ血清アルブミンをタンパク質標準として用いるローリー(Lowry)ら、ジャーナル・オブ・バイオロジカル・ケミストリー193、265頁、1951の方法の改変を用いて求める。
【0089】
本明細書において、用語「抗体」とは、抗原またはエピトープと特異的に結合できる免疫グロブリン遺伝子または免疫グロブリン遺伝子類またはその断片に由来する、それらをモデルとする、またはそれらによって実質的にコードされるペプチドまたはポリペプチドを指す。例えば、ファンダメンタル・イムノロジー(Fundamental Immunology)、第3版、W.E.ポール(Paul)ら、ラベン・プレス(Raven Press)、N.Y.(1993)、ウィルソン(Wilson)、(1994)ジャーナル・オブ・イムノロジカル・メソッヅ(Journal of Immunological Methods)175、267〜273頁、ヤームッシュ(Yarmush)(1992)ジャーナル・オブ・バイオロジカル・アンド・バイオフィジカル・メソッヅ(Journal of Biochemical and Biophysical Methods)25、85〜97頁参照。用語抗体は、抗原と結合する能力を保持する抗原結合性部分、すなわち、「抗原結合性部位」(例えば、断片、配列、相補性決定領域(CDR)、例えば、(i)Fab断片、VL、VH,CLおよびCH1ドメインからなる一価の断片、(ii)F(ab’)2断片、ヒンジ領域でジスルフィド架橋によって結合している2つのFab断片を含んでなる二価の断片、(iii)VHおよびCH1ドメインからなるFd断片、(iv)抗体の単腕のVLおよびVHドメインからなるFv断片、(v)VHドメインからなるdAb断片(ワード(Ward)ら、(1989)ネイチャー(Nature)341、544〜546頁)、および(vi)単離された相補性決定領域(CDR))を含む。単鎖抗体、モノクローナル抗体、ポリクローナル抗体、および分子生物学的技術によって(例えば、ファージディスプレイ法によって)得られる抗体も、参照により用語「抗体」に含まれる。好ましい抗体は「オムニクローナル」抗体である。これは、各抗体が標的抗原と109M-1〜1010M-1という最小親和性で特異的に結合する、ファージディスプレイライブラリーから選択された種々の抗体分子の混合物を意味する。
【0090】
用語「特異的に結合する」は、抗体が目的とする標的のみと結合することを示すことを意図するものではない。むしろ、抗体は、その目的とする標的に対するその親和性が、非標的分子に対するその親和性と比較して約5倍大きい場合に「特異的に結合する」。標的分子に対する抗体の親和性が、非標的分子に対するその親和性よりも少なくとも約5倍大きいことが好ましく、10倍が好ましく、25倍がより好ましく、50倍がいっそうより好ましく、100倍以上が最も好ましい。好ましい実施形態では、抗体またはその他の結合因子と抗原との間の特異的結合とは、少なくとも106M-1の結合親和性を意味する。少なくとも約107M-1の親和性で結合する抗体が好ましく、約108M-1〜約109M-1、約109M-1〜1010M-1または約1010M-1〜約1011M-1の間が好ましい。
【0091】
親和性は、Kd=koff/konとして算出する(Koffは解離速度定数、konは会合速度定数であり、Kdは平衡定数である)。親和性は、平衡時に種々の濃度(c)で標識したリガンドの結合している画分(r)を測定することによって求めることができる。データはスカッチャード(Scatchard)方程式:r/c=K(n−r)を用いてグラフ化する:
式中、
r=平衡時の結合しているリガンドのモル/受容体のモル、
c=平衡時の遊離リガンド濃度、
K=平衡会合定数、および
n=受容体分子当たりのリガンド結合部位の数。
図解法によってr/cをY軸にrをX軸にプロットし、このようにしてスカッチャードプロットを得る。線の負の傾斜が親和性となる。koffは、結合している標識されたリガンドを標識されていない過剰のリガンドと競合させることによって求めることができる(例えば、米国特許第6,316,409号参照)。ターゲッティング因子の、その標的分子に対する親和性は、少なくとも約1×10-6モル/リットルであることが好ましく、少なくとも約1×10-7モル/リットルであることがより好ましく、少なくとも約1×10-8モル/リットルであることがいっそうより好ましく、少なくとも約1×10-9モル/リットルであることがさらにいっそうより好ましく、少なくとも1×10-10モル/リットルであることが最も好ましい。スカッチャード分析による抗体親和性測定は当技術分野では周知である。例えば、ヴァン・エルプ(van Erp)ら、ジャーナル・オブ・イムノアッセイ(Journal of Immunoassay)12、425〜43頁、1991、ネルソン(Neloson)およびグリズウォルド(Griswold)、コンピュータ・メソッヅ・アンド・プログラムス・イン・バイオメディシン(Computer Methods and Programs in Biomedicine)27、65〜8頁、1988参照。
【0092】
本明細書において、用語「個別の」とは、連続していない表面の領域を指す。すなわち、いずれかの領域の一部ではない境界線が2つの領域の各々を完全に取り囲む場合に、2つの領域は互いに個別である。本明細書において、用語「独立してアドレス可能である」とは、特異的シグナルが得られる表面の個別の領域を指す。当業者ならば、抗体ゾーンも互いに独立であり得るが、表面で互いに接触している場合もあることは理解するであろう。
【0093】
本明細書において、用語「試験サンプル」とは、注目する1種以上の分析物の存在または量が未知であり、アッセイ、好ましくは、イムノアッセイにおいて調べられようとするサンプルを指す。試験サンプルは、被験体、例えば、患者の、診断、予後診断、または評価目的で得られた体液であることが好ましい。特定の実施形態では、このようなサンプルは、進行中の症状の結果または症状に対する治療計画の作用を調べる目的で得る場合がある。好ましい試験サンプルとしては、血液、血清、血漿、脳脊髄液、尿および唾液が挙げられる。さらに、当業者であれば、試験サンプルの中には分画または精製手順、例えば、全血の血清または血漿成分への分離の後により容易に解析できるものもあるということは理解されよう。好ましいサンプルは細菌、ウイルスおよび動物、例えば、イヌおよびネコから得ることができる。特に好ましいサンプルはヒトから得られる。対照目的で、「標準サンプル」とは、注目する1種以上の分析物の存在または量が、1種以上の分析物をアッセイする前に既知であるサンプルを指す。
【0094】
本明細書において、用語「疾病サンプル」とは、所与の疾病を患っていると調べられている被験体から得た組織サンプルを指す。臨床診断の方法は当業者には周知である。例えば、ケリーズ・テキストブック・オブ・インターナル・メディシン(Kelly’s Textbook of Internal Medicine)、第4版、リッピンコット・ウィリアムス&ウィルキンス(Lippincott Williams & Wilkins)、ペンシルバニア州、フィラデルフィア、2000、ザ・メルク・マニュアル・オブ・ダイアグノシス・アンド・セラピー(The Merck Manual of Diagnosis and Therapy)、第17版、メルク・リサーチ・ラボラトリーズ(Merck Research Laboratories)編、ニュージャージー州、ホワイトハウス・ステーション(Whitehouse Station)、1999参照。
【0095】
用語「プロリル特異的ジペプチジルペプチダーゼ」または「プロリル特異的DPP」とは、基質ポリペプチドのN末端からジペプチドを切断し、2番目の位置のプロリン(すなわち、NH2−X−pro−ペプチド−COOH、ここで、Xはアミノ酸であり、proと残りのペプチドの間の結合が切断される)に優先傾向を示すセリンプロテアーゼを指す。このようなプロテアーゼは通常、E.C.3.4.14.X下、例えば、E.C.3.4.14.5および3.4.14.11に分類される。DPPは、DPP−IIおよびDPP−IVなどの種類に分類されることが多い。
【0096】
本明細書において、用語「阻害剤」とは、酵素的(タンパク質分解性)活性に影響を及ぼす分子に関しては、必ずしも全酵素活性の完全な喪失を指さない。むしろ、「阻害剤」は酵素活性を、阻害剤の不在下で示される酵素活性の少なくとも10%減少させ、少なくとも25%がより好ましく、少なくとも50%がいっそうより好ましく、少なくとも75%がさらにより好ましく、少なくとも90%が最も好ましい。in vitroでは、当業者に周知の方法によって酵素活性を直接測定することによって阻害剤の活性を測定することができる。in vivoでも、阻害剤の活性を、酵素基質に対する酵素活性を直接測定することによって測定することができ、または分解酵素の場合には、基質の1/2が被験体(例えば、実験動物)の身体から排除される時間(T1/2)を求めることによって測定することができる。後者の場合には、「阻害剤」は、阻害剤の不在下で示されるT1/2と比較して、T1/2を少なくとも10%延長し、少なくとも25%がより好ましく、少なくとも50%がいっそうより好ましく、少なくとも75%がさらにより好ましく、少なくとも90%が最も好ましい。
【0097】
好ましい阻害剤は、プロテアーゼの特定のクラスに選択的である(例えば、ジペプチジルペプチダーゼに、またはジペプチジルペプチダーゼの特定のサブセットに選択的)。阻害剤は、プロテアーゼの特定のクラスを非標的プロテアーゼより少なくとも10倍より多く阻害する場合に、そのクラスに「選択的」であると考えられており、少なくとも100倍より多くがより好ましく、少なくとも1000倍より多くが最も好ましい。種々のDPP種の選択的阻害剤が知られている。例えば、H−Dab−Pipは、DPP IV(IC50>1mM)(DPP IV;EC3.4.14.5.)を上回ってジペプチジルペプチダーゼII(DPP II;EC3.4.14.2.)に選択的(>7,600倍)であると報告されている。センテンら、バイオオーガニック・アンド・メディシナル・ケミストリー・レターズ12、2825頁、2002。同様に1−[[[2−[(5−シアノピリジン−2−イル)アミノ]エチル]アミノ]アセチル]−2−シアノ−(S)−ピロリジンは、DPP IVの選択的、経口活性阻害剤であると報告されている。アーレン(Ahren)ら、ダイアベーツ・ケア(Diabetes Care)25、869〜75頁、2002。
【0098】
本明細書において、用語「約」は、所与の数の+/−10%を指す。
【0099】
ナトリウム利尿ペプチド断片の、予後および診断マーカーとしての使用
【0100】
前述のように、特定の疾病状態においてナトリウム利尿ペプチドの血中レベルの上昇が見られており、このことは、例えば、脳卒中、うっ血性心不全(CHF)、心虚血、全身性高血圧、および急性心筋梗塞などといった疾病の病態生理における役割を示唆するものである。例えば、WO02/089657、WO02/083913、WO03/016910、ハントら、バイオケミカル・バイオフィジオロジー・リサーチ・コミュニケーション214、1775〜83頁、1995、ベヌゴパール(venugopal)、ジャーナル・オブ・クリニカル・ファーマシー・アンド・セラピューティクス(Journal of Clinical Pharmacy and Therapeutics)26、15〜31頁、2001、およびカーラ(Kalra)ら、サーキュレーション107、571〜3頁、2003参照、なお、それらの各々は、すべての表、図および特許請求の範囲をはじめとするその全文を本明細書に組み入れる。ナトリウム利尿ペプチドは、単独で、集合的に、および/またはさらなるタンパク質とともに、種々の心血管の状態の疾病マーカーおよび予後の指標としても利用できる。
【0101】
循環からのナトリウム利尿ペプチドの除去は分解経路と関連していると報告されている。実際、特定の状況下でナトリウム利尿ペプチドを切断する中性エンドペプチダーゼの阻害剤が特定の循環器疾患の治療において期待できると示唆されている。例えば、トリンダージ(Trindade)およびルーロー(Rouleau)、ハート・フェイリヤー・モニター(Heart Failure Monitor)2、2〜7頁、2001参照。しかし、臨床サンプル中のナトリウム利尿ペプチドの測定は、通常、分子の分解状態を考慮しないで、BNP、ANPおよび/またはCNP、それらの前駆体分子(すわなち、プロ−BNP、プロ−ANP、およびプロ−CNP)、および成熟ナトリウム利尿ペプチドを提供するためのプロ型の切断に起因する断片の測定に焦点を当ててきた。また、ナトリウム利尿ペプチド中のメチオニン残基の酸化によって、還元型と比較して生物活性が低下すると報告されている。コヤマら、ヨーロピアン・ジャーナル・オブ・バイオケミストリー(European Jounal of Biochemistry)203、425〜32頁。本明細書に記載した目的には、メチオニン酸化型を分解産物と考えることができる。
【0102】
本発明は、ナトリウム利尿ペプチドの分解経路およびこの分解の際に形成される産物の理解をもって設計されていないアッセイは、サンプル中の個々のナトリウムペプチドの生物活性型を正確に測定しない場合があることを初めて記載する。注目する生物活性ナトリウム利尿ペプチドとナトリウム利尿ペプチドに由来する不活性断片双方の意図しない測定の結果、サンプル中の生物活性ナトリウム利尿ペプチド濃度を多く見積もる可能性がある。以下、主にBNP関連断片に関して記載するが、当業者ならば、本明細書に記載した一般概念をANPおよびCNP関連断片に等しく当てはまることは理解するであろう。
【0103】
1種以上のナトリウム利尿ペプチドの測定時に、臨床サンプル中に存在し得る種々のナトリウム利尿ペプチドおよびその断片の活性を考慮できないと、いずれかの診断または予後法の精度に重大な結果をもたらす可能性がある。例えば、サンドイッチイムノアッセイをBNPに対して提供し、存在していた生物活性BNPの相当量(例えば、50%)が今や不活性型に分解されている単純な場合を考えてみる。生物活性BNPと不活性断片に共通する領域と結合する抗体を用いて構築されたイムノアッセイでは、サンプル中に存在する生物活性BNPの量が2倍まで多く見積もられ、「偽陽性」結果をもたらす可能性がある。この不正確さは重篤な心不全の場合には特に関連があるが、これは中性エンドペプチダーゼ発現がこれらの患者において高まっていると報告されているためである。クネヒト(Knecht)ら、ライフ・サイエンス(Life Science)71、2701〜12頁、2002。ナトリウム利尿ペプチド分解の原因と考えられている酵素の発現増加は、これらの患者において不活性断片プールを増加させると予測できる。
【0104】
サンプルのナトリウム利尿ペプチド濃度を多く見積もることはまた、患者管理にも重大な結果をもたらし得る。例えば、BNP濃度を用いて、うっ血性心不全の治療が有効であるかどうかを調べることができる(例えば、BNPをモニターして治療で上昇したレベルが正常に戻っているかどうかを確かめることによって)。前記で論じた、同様の「偽陽性」BNP結果は、現治療が有効でないという誤った印象のために医師が治療を継続、増加または改変するよう(例えば、利尿効果のある、ACB阻害剤、ジゴキシン、β−ブロッカー、カルシウムチャンネルブロッカー、および/または血管拡張薬の投与量を増加するよう、または外科的介入を考慮するようにさえ)導く可能性がある。
【0105】
同様に、本発明は、ナトリウム利尿ペプチドのグリコシル化状態を理解して設計されていなかったアッセイは、サンプル中の個々のナトリウム利尿ペプチドの型を同様に正確に測定しない可能性がることを記載する。in vivoで見られる天然グリコシル化プロフィールを欠く、合成ペプチドまたは発現されたペプチドの使用を介してアッセイに用いる抗体を作製することが多い。例えば、BNPについてサンドイッチイムノアッセイを提供し、存在するBNPの相当量(例えば、50%)が、抗体結合を干渉するグリコシル化がなされている単純な場合を考えてみる。このような抗体を用いて構築されたイムノアッセイではサンプル中に存在するBNPの量が2倍低く見積もられ、「偽陰性」結果をもたらす可能性がある。
【0106】
ナトリウム利尿ペプチド間のグリコシル化の相違はまた、個々のナトリウム利尿ペプチドのグリコシル化状態によるナトリウム利尿ペプチド受容体での活性の相違を介してか、生物半減期の相違のいずれかを介して、生物活性の相違をもたらす可能性がある。したがって、本明細書の方法を用いて、特定のグリコシル化状態に特異的なアッセイを作製して、再度このようなアッセイの診断および治療実用性の精度を向上させることができる。
【0107】
当業者ならば、本明細書に記載した方法をポリペプチドに広く適用できること、および本明細書に詳細に記載したナトリウム利尿ペプチドの分析は単に例示的なものであるということを理解されよう。同様の分析の対象となり得るその他の適したポリペプチドとしては、アンギオテンシンI、アンギオテンシンII、バソプレッシン、カルシトニン、カルシトニン遺伝子関連ペプチド、ウロジラチン(urodilatin)、ウロテンシンII、遊離心臓トロポニンI、遊離心臓トロポニンT、トロポニンTおよびトロポニンCの一方または双方を含んでなる複合体中の心臓トロポニンI、トロポニンIおよびトロポニンCの一方または双方を含んでなる複合体中の心臓トロポニンT、総心臓トロポニンI、総心臓トロポニンT、肺サーファクタントタンパク質D、D−二量体、アネキシンV、エノラーゼ、クレアチンキナーゼ、グリコーゲンホスホリラーゼ、心臓型脂肪酸結合タンパク質、ホスホグリセリン酸ムターゼ、S−100、S−100ao、プラスミン−α2−アンチプラスミン複合体、β−トロンボグロブリン、血小板因子4、フィブリノペプチドA、血小板由来成長因子、プロトロンビン断片1+2、P−セレクチン、トロンビン−アンチトロンビンIII複合体、フォン・ウィルブランド因子、組織因子、血栓前駆体タンパク質、ヒト中性エラスターゼ、誘導可能一酸化窒素シンターゼ、リゾホスファチジン酸、マロンジアルデヒド修飾低密度リポタンパク質、マトリックスメタロプロテイナーゼ−1、マトリックスメタロプロテイナーゼ−2、マトリックスメタロプロテイナーゼ−3、マトリックスメタロプロテイナーゼ−9、TIMP1、TIMP2、TIMP3、C−反応性タンパク質、インターロイキン−1β、インターロイキン1受容体アンタゴニスト、インターロイキン−6、腫瘍壊死因子α、可溶性細胞間接着分子−1、血管細胞接着分子、単球走化性タンパク質−1、カスパーゼ−3、ヒトリポカリン型プロスタグランジンDシンターゼ、肥満細胞トリプターゼ、好酸球カチオン性タンパク質、KL−6、プロカルシトニン、ハプトグロビン、s−CD40リガンド、S−FASリガンド、α2アクチン、塩基性カルポニン1、CSRP2エラスチン、LTBP4、平滑筋ミオシン、平滑筋ミオシン重鎖、トランスゲリン(transgelin)、アルドステロン、アンギオテンシンIII、ブラジキニン、エンドセリン1、エンドセリン2、エンドセリン3、レニン、APO B48、膵臓エラスターゼ1、膵臓リパーゼ、sPLA2、トリプシノーゲン活性化ペプチド、αエノラーゼ、LAMP3、ホスホリパーゼD、PLA2G5、タンパク質D、SFTPC、デフェンシンHBD1、デフェンシンHBD2、CXCL−1、CXCL−2、CXCL−3、CCL2、CCL3、CCL4、CCL8、プロカルシトニン、タンパク質C、血清アミロイドA、s−グルタチオン、s−TNF P55、s−TNF P75、TAF1、TGFβ、MMP−11、脳脂肪酸結合タンパク質、CA11、CABP1、CACNA1A、CBLN1、CHN2、切断されたタウ、CRHR1、DRPLA、EGF、GPM6B、GPR7、GPR8、GRIN2C、GRM7、HAPIP、HIF1α、HIP2KCNK4、KCNK9、KCNQ5、MAPK10、n−アセチルアスパルテート、NEUROD2、NRG2、PACE4、ホスホグリセレートムターゼ、PKCγ、プロスタグランジンE2、PTEN、PTPRZ1、RGS9、SCA7、セクレタゴギン(secretagogin)、SLC1A3、SORL1、SREB3、STAC、STX1A、STXBP1、BDNF、シスタチンC、ニューロキニンA、サブスタンスP、インターロイキン−1、インターロイキン−11、インターロイキン−13、インターロイキン−18、インターロイキン−4、およびインターロイキン−10が挙げられる。
【0108】
ナトリウム利尿ペプチドのグリコシル化
【0109】
グリコシル化ポリペプチドは通常、1個以上のアスパラギン残基のアミノ基と結合しているN−結合型糖、1個以上のセリンおよび/またはスレオニン残基のヒドロキシル基と結合しているO−結合型糖またはN−およびO−結合型糖の組合せを含んでなる。本発明はナトリウム利尿ペプチドがグリコシル化されることを初めて証明する。さらに、本発明は、グリコシル化が、特定の方法のサンプル中のナトリウム利尿ペプチドを検出する能力に重大な影響を及ぼし得ることを実証する。
【0110】
いくつかのアプローチを用れば、グリコシル化によって検出スキームにもたらされる可能性のある困難を取り除くことができる。まず、グリコシル化の存在が正確な検出を混乱させている場合には、化学的処理または酵素処理を用いてポリペプチドから糖鎖残基を除去し、それによって注目する1種以上のナトリウム利尿ペプチドを「検出可能な」状態に切り替えることができる。第2に、グリコシル化による干渉を受けない、注目するナトリウム利尿ペプチドの1以上の領域と結合する抗体を注意深く選択して、個々のグリコシル化状態に「非感受性」である抗体を提供することができる。第3に、グリコシル化されているが、脱グリコシル化状態で結合の低下を示す、注目するナトリウム利尿ペプチドの1以上の領域と結合する抗体を注意深く選択して、個々のグリコシル化状態に「感受性」である抗体を提供することができる。第4に、グリコシル化されているが、脱グリコシル化状態で結合の増加を示す、注目するナトリウム利尿ペプチドの1以上の領域と結合する抗体を注意深く選択して、個々のグリコシル化状態に「感受性」である抗体を提供することができる。また、これらのアプローチを必要に応じてまたは所望により組み合わせることもできる。
【0111】
N−およびO−結合型糖鎖残基を除去するための有効な酵素法は、当技術分野では周知であり、N−グリカナーゼ(N−グリコシダーゼとしても知られる)、エンドグリコシダーゼH、エンドグリコシダーゼA、O−グリカナーゼ(エンド−α−N−アセチルガラクトサミニダーゼとしても知られる)、α2−(3,6,8,9)−ノイリミニダーゼ(neuriminidase)、β(1,4)−ガラクトシダーゼ、N−アセチルグルコサミニダーゼ、エンドグリコシダーゼF1、エンドグリコシダーゼF2、および/またはエンドグリコシダーゼF3などの酵素を用いる。この羅列は限定しようとするものではない。このような、ペプチドからの糖除去の酵素法は、天然(非変性)ペプチドに用いることができる。しかし、このような酵素法では、糖ペプチドの変性を用いることができ、これでは脱グリコシル化度を高めることが多い。一般的な変性条件は、ほぼ中性pH(すなわち、約pH6.5と約pH8の間)のバッファー溶液中、約0.01%〜約1%のドデシル硫酸ナトリウム(「SDS」)、および場合によっては、約5mM〜約500mMのβ−メルカプトエタノールの添加を含んでなる。このような方法は、いくつかの脱グリコシル化酵素の安定化に役立ち得る、約0.2%〜約2%のNP−40をさらに含んでなる場合もある。このような変性条件とともに、高温(例えば、約0.5時間〜約48時間の間、約37℃)を用いることもできる。
【0112】
ペプチドから共有結合している糖鎖残基を除去するための非酵素的化学処理の場合には、非還元O−およびN−結合型オリゴ糖の放出においてヒドラジン加水分解が有効であるとわかっている。約60℃でのO−結合型オリゴ糖の最初の穏やかなヒドラジン分解と、それに続く約95℃でのN−結合型オリゴ糖のヒドラジン分解によって、オリゴ糖の選択的および順次的放出を達成できる。例えば、パテールおよびラレク、メソッヅ・イン・エンジモロジー230、58〜66頁、1994参照。しかしながら、このような処理の結果、ポリペプチドが破壊されることもある。穏やかな塩基環境においてアルカリ性水素化ホウ素ナトリウムを利用する、O−結合型オリゴ糖のアルカリ−β−脱離が好ましい場合がある。例えば、グリコバイオロジー:ア・プラクティカル・アプローチ、フクダ,Mおよびコバタ,A編、291〜328頁、IRL/オックスフォード大学出版、オックスフォード、1993参照。さらに、トリフルオロメタンスルホン酸加水分解を用いてもよい。糖間のグリシル結合はトリフルオロメタンスルホン酸による切断に感受性であるが、ペプチド結合は長期の処理に対してでさえ安定であるため、この方法は通常、無傷のポリペプチドを残すが、グリカンの破壊をもたらす。例えば、エッジ、バイオケミカル・ジャーナル376、339〜50頁、2003参照。
【0113】
重要なことに、グリコシル化以外の翻訳後修飾はこのような酵素的またはトリフルオロメタンスルホン酸処理に対して安定であると考えられるので、このような処理後にペプチドにおいて観察される質量の変化は糖残基の除去によるものと見なすことができる。これにより注目するポリペプチド上の抗原性エピトープに対する糖鎖およびグリコシル化部位の相対的寄与率をより理解することが可能となる。また、糖残基の除去によって、観察される質量の相違がアミノ酸含量ではなく糖含量の相違によるものであるかどうかについて疑問がいずれも取り除かれるので、脱グリコシル化によって、ポリペプチド質量(例えば、当業者に周知の方法によって配列と関連付けることができる、サンプル中に存在する注目するナトリウム利尿ペプチドおよびその断片の質量)の相違をより理解することが可能となる。
【0114】
抗体の選択
【0115】
無傷のナトリウム利尿ペプチド断片を選択的に認識し、かつ/またはグリコシル化状態に感受性もしくは非感受性である抗体の作製および選択はいくつかの方法で達成することができる。例えば、一方法としては、断片を精製すること、または例えば、当技術分野で周知の固相ペプチド合成法を用いて注目する断片を合成することがある。例えば、ガイド・トゥー・プロテイン・プリフィケーション(Guide to Prification)、マリーP.ドッチャー(Murray P. Deutcher)編、メソッヅ・イン・エンジモロジー(Methods in Enzymology)第182巻(1990)、ソリッド・フェーズ・ペプチド・シンセシス(Solid Phase Peptide Synthesis)、グレッグB.フィールズ(Greg B.Fields)編、メソッヅ・イン・エンジモロジー第289巻(1997)、キソら、ケミカル・ファーマシー・ブレチン(Chemical Pharmacy Bulletin)(東京)38、1192〜99頁、1990、モスタファビ(Mostafavi)ら、バイオメディカル・ペプチデス、プロテインズ、アンド・ヌクレイック・アシッヅ(Biomedical peptides, Proteins and Nucleic Acids)1、255〜60頁、1995、フジワラら、ケミカル・ファーマシー・ブレチン(東京)44、1326〜31頁、1996参照。次いで、選択したポリペプチドを、例えば、マウスまたはウサギに注射してポリクローナルまたはモノクローナル抗体を作製することができる。当業者ならば、抗体の作製には、例えば、アンチボディーズ、ア・ラボラトリー・マニュアル(Antibodies, A Laboratory Manual)、ハーロー(Harlow)およびデヴィッド・レーン(David Lane)編、コールド・スプリング・ハーバー・ラボラトリー(Cold Spring Harbor Laboratory)(1988)、コールド・スプリング・ハーバー、N.Yに記載されるような多数の手順を利用できることは認識されよう。また、当業者ならば、種々の手順による遺伝情報から、抗体を模倣する結合断片またはFab断片も調製できるということは理解されよう(アンチボディー・エンジニアリング(Antibody Engineering):ア・プラクティカル・アプローチ(A Practical Approach)(ボレベック(Borrebaeck)C.編)1995、オックスフォード大学出版、オックスフォード、ジャーナルオブ・イムノロジー149、3914〜3920頁、(1992))。
【0116】
さらに、多数の出版物によって、選択した標的との結合について、ポリペプチドのライブラリーを作製し、スクリーニングするためのファージディスプレイ技術の使用が報告されている。例えば、クウィルラ(Cwirla)ら、プロシーディングス・オブ・ザ・ナショナル・アカデミー・オブ・サイエンシズ・オブ・ジ・ユナイテッド・ステイツ・オブ・アメリカ(Prociidings of the National Academy of Sciences of the United States of America)87、6378〜82頁、1990、デブリン(Devlin)ら、サイエンス(Science)249、404〜6頁、1990、スコット(Scott)およびスミス(Smith)、サイエンス、249、386〜88頁、1990、およびラドナー(Ladner)ら、米国特許第5,571,698号参照。ファージディスプレイ法の基本概念は、スクリーニングされるポリペプチドをコードするDNAとポリペプチドの間の物理的関係の確立である。この物理的結合はポリペプチドを、ポリペプチドをコードするファージゲノムを封入しているキャプシドの一部として提示するファージ粒子によって提供される。ポリペプチドとその遺伝物質間の物理的関係の確立により、種々のポリペプチドを保持する極めて多数のファージの同時マススクリーニングが可能となる。標的に対して親和性のあるポリペプチドを提示するファージは標的と結合し、これらのファージは標的に対するアフィニティースクリーニングによって濃縮される。これらのファージから提示されるポリペプチドの正体は、それらのそれぞれのゲノムから決定することができる。次いで、これらの方法を用いて、所望の標的に対して結合親和性を有すると同定されたポリペプチドを、従来法を用いて大量に合成することができる。例えば、すべての表、図および特許請求の範囲をはじめとするその全文を本明細書に組み入れる、米国特許第6,057,098号参照。
【0117】
次いで、これらの方法によって作製される抗体を、精製された無傷の注目するナトリウム利尿ペプチドとの親和性および特異性についての一次スクリーニング、および必要に応じて、抗体の、結合から除外されることが望まれるナトリウム利尿ペプチド断片との親和性および特異性についての結果を比較することによって選択することができる。スクリーニング手順は、精製されたナトリウム利尿ペプチド断片のマイクロタイタープレートの別個のウェルへの固定化を含み得る。次いで、可能性ある抗体または抗体群を含有する溶液をそれぞれのマイクロタイターウェルに入れ、約30分間〜2時間インキュベートする。次いで、マイクロタイターウェルを洗浄し、ウェルに標識した二次抗体(例えば、産生された抗体がマウス抗体である場合には、アルカリホスファターゼとコンジュゲートさせた抗マウス抗体)を加え、約30分間インキュベートし、次いで洗浄する。ウェルに基質を加えると、固定化されたナトリウム利尿ペプチドおよび断片に対する抗体が存在する場合には呈色反応が現れる。同様のアプローチを用いてグリコシル化−非感受性抗体をスクリーニングすることができる。この場合には、1種以上の糖鎖残基を含むか、これを欠いている精製ナトリウム利尿ペプチド断片を用いてスクリーニングを行うことができる。
【0118】
次いで、このように同定した抗体を、選択したアッセイ設計で注目するナトリウム利尿ペプチドに対する親和性および特異性についてさらに分析することができる。標的タンパク質についてのイムノアッセイの開発では、精製した標的タンパク質が、選択されている抗体を用いるイムノアッセイの感度および特異性を判断する標準の役割を果たす。種々の抗体の結合親和性は異なり得るので、特定の抗体ペア(例えば、サンドイッチアッセイにおける)は互いに立体障害などによって干渉する可能性があり、抗体の分析性能は、抗体の絶対的な親和性および特異性より重要な尺度であり得る。
【0119】
当業者ならば、抗体または結合断片を作製し、種々のナトリウム利尿ペプチドに対する親和性および特異性についてスクリーニングおよび選択するのに多数のアプローチを取ることができるが、これらのアプローチは本発明の範囲を変更するものではないということは認識されよう。
【0120】
マーカーパネルにおけるナトリウム利尿ペプチドの使用
【0121】
疾病の診断のための、特に識別診断のための1種以上のマーカーを同定するための方法およびシステムはこれまでに記載されている。疾病状態の診断に有用なマーカーを同定するのに適した方法は、2002年12月27日に出願された、メソッヅ・アンド・システム・フォー・ディジーズ・ディテクション・ユージング・マーカー・コンビネーションズ(METHOD AND SYSTEM FOR DISEASE DETECTION USING MARKER COMBINATIONS)と題された米国特許出願第10/331,127号(代理人整理番号071949−6802)に詳細に記載されている。なおこれは参照により、すべての表、図、および特許請求の範囲をはじめとするその全文を本明細書に組み入れる。当業者ならばまた、マーカーの単変量解析を実施でき、複数のマーカーの単変量解析から得たデータを合わせて、異なる疾病状態を識別するマーカーのパネルを形成することができるということも認識されるであろう。
【0122】
診断に有用なマーカーのパネルの開発では、特定のマーカーの存在またはレベルについて調べることによって、いくつかの可能性あるマーカーのデータを被験体群から得ることができる。被験体の群を2セットに分けるが、第1のセットと第2のセットは各々ほぼ同数の被験体を含むことが好ましい。第1のセットは、疾病を患っているか、またはより広くは、第1の状況状態にあると確認されている被験体を含む。例えば、この第1のセットの患者は最近疾病を発生したものであってもよいし、具体的な種類の疾病を患っているものであってもよい。状況状態の確認は、より正確かつ/または費用のかかる試験、例えば、MRIまたはCTによって行うことができる。以下、第1のセットの被験体は「罹患」と呼ぶ。
【0123】
被験体の第2のセットは、単に第1のセットに入らないものである。この第2のセットの被験体は「非罹患」、すなわち、正常な被験体であり得る。あるいは、この第2のセット被験体は、「罹患」被験体によって示される症状を模倣する、1つの症状または一連の症状を示すよう選択することもできる。さらにもう1つの代替法では、この第2のセットが、疾病の発生からの異なる時点のものに相当する場合もある。
【0124】
これらのセットの被験体から得られるデータとしては、本発明の目的上は、個々にまたは群として測定される、ナトリウム利尿ペプチドの1種以上の断片をはじめとする、複数のマーカーのレベルが挙げられる。同一セットのマーカーのデータを各患者に利用できることが好ましい。このマーカーのセットには、個々の疾病または状態の検出に関連があると思われるすべての候補マーカーを含めることができる。実際の既知の関連性は必要ではない。本明細書に記載された方法およびシステムの実施形態を用いて、どの候補マーカーが疾病または状態の診断と最も関連があるかを調べることができる。2セットの被験体における各マーカーのレベルは、ガウス分布のように広範囲にわたって分布する場合がある。しかし、分布の一致は必要ではない。
【0125】
単一マーカーでは、患者を罹患であるか非罹患のいずれであるか決定的に同定することができないことが多い。例えば、患者が重複領域内に入るマーカーレベルを有すると測定される場合、試験結果は患者の診断に役に立たないものとなる。人為的なカットオフを用いて、疾病または状態の検出の陽性と陰性の試験結果間を区別することもできる。カットオフをどこに選択しようと、単一マーカーの診断ツールとしての有効性は影響を受けない。カットオフを変更することは、単に単一マーカーの使用に起因する偽陽性の数と偽陰性の数の間を交換するだけのことである。このような重複を含む試験の有効性は、ROC(受信者動作特性)曲線を用いて表されることが多い。ROC曲線は当業者には周知である。
【0126】
ROC曲線の水平軸は、偽陽性率とともに高まる(1−特異度)を表す。曲線の垂直軸は、真の陽性率とともに高まる感度を表す。したがって、選択した個々のカットオフについて、(1−特異度)の値を求めることができ、また対応する感度も得ることができる。ROC曲線下面積は測定したマーカーレベルが疾病または状態の正確な同定を可能にする可能性の尺度である。したがって、ROC曲線下面積を用いて試験の有効性を調べることもできる。
【0127】
前記で論じたように、単一マーカーのレベルの測定は限定された有用性しかない場合がある。さらなるマーカーの測定によってさらなる情報が得られるが、2つの無関係である可能性のある測定値のレベルを適切に組み合わせることには、困難がある。本発明の実施形態にしたがう方法およびシステムでは、罹患および非罹患患者のセットの種々のマーカーのレベルに関するデータを用いて、有用なパネル応答を得るためのマーカーのパネルを開発することができる。データはデータベース、例えば、マイクロソフトアクセス、オラクル、その他のSQLデータベースで、または単純にデータファイルで提供することができる。データベースまたはデータファイルには、例えば、患者識別子、例えば、名前または番号など、存在する種々のマーカーのレベル、および患者が罹患であるか非罹患であるかを含めることができる。
【0128】
次いで、各マーカーの人為的カットオフ領域をまず選択することができる。カットオフ領域の位置は最初にどの点にでも選択することができるが、この選択は以下に記載する最適化プロセスに影響を及ぼす場合がある。この点に関しては、最適位置の候補近くの選択は、オプティマイザの高速収束を促進し得る。好ましい方法では、カットオフ領域を、2セットの患者の重複領域のほぼ中心を最初に中心とする。一実施形態では、カットオフ領域は単にカットオフ点であり得る。その他の実施形態では、カットオフ領域はゼロより大きい長さを有し得る。これに関しては、カットオフ領域を中心値と長さの大きさによって定義することができる。実際、カットオフ領域の限界の初期選択は、被験体の各セットの予め選択したパーセンタイルにしたがって決定することができる。例えば、それより上で罹患患者の予め選択したパーセンタイルが測定される点を、カットオフ範囲の右(上)端として用いることができる。
【0129】
次いで、各患者の各マーカー値を、指標に対してマッピングすることができる。指標には、カットオフ領域より下の1つの値と、カットオフ領域より上の別の値を割り当てる。例えば、マーカーが通常、非罹患患者に対してより低い値を、罹患患者に対してより高い値を有する場合には、ゼロ指標を個々のマーカーに対して低い値に割り当てるが、このことは陽性診断の可能性が低くなる可能性を示す。その他の実施形態では、指標は多項式に基づいて算出することができる。多項式の係数は、罹患と非罹患被験体間のマーカー値の分布に基づいて求めることができる。
【0130】
種々のマーカーの相対的な重要性は重み係数によって示され得る。重み係数は、まず、各マーカーの係数として割り当てることができる。カットオフ領域と同様、重み係数の初期選択は、許容範囲にあるどんな値にでも選択することができるが、この選択は最適化プロセスに影響を及ぼす可能性がある。この点に関しては、最適位置の候補近くの選択は、オプティマイザの高速収束を促進し得る。好ましい方法では、許容範囲の重み係数はゼロと1の間に及び、各マーカーの初期重み係数は0.5として割り当てることができる。好ましい実施形態では、各マーカーの初期重み係数はそのマーカー自身の有効性と関連があり得る。例えば、ROC曲線は単一マーカーについて作製することができ、ROC曲線下面積をそのマーカーの初期重み係数として用いることができる。
【0131】
次いで、2セットの各々において各被験体のパネル応答を算出することができる。パネル応答は、それに対して各マーカーレベルがマッピングされる指標と各マーカーの重み係数の関数である。好ましい実施形態では、各被験体(j)のパネル応答(R)は以下のように表される:
Rj=ΣwiIi,j,
式中、iはマーカー指数であり、jは被験体指数であり、wiはマーカーiの重み係数であり、Iは被験体jの、それに対してマーカーのマーカーレベルがマッピングされる指標値であり、Σはすべての候補マーカーiにわたる合計である。
【0132】
マーカー値ではなく指標値を用いることの利点の1つは、特別に高いまたは低いマーカーレベルが、その個々のマーカーについて罹患または非罹患の診断の可能性を変更しないということである。通常、特定のレベルを上回るマーカー値は、概ね特定の状況状態を示す。そのレベルを上回るマーカー値は、同じ確かさで状況状態を示す。したがって、特別に高いマーカー値がその状況状態の特別に高い可能性を示すわけではない場合がある。カットオフ領域の片側で一定である指標の使用により、この懸念が排除される。
【0133】
パネル応答はまた、マーカーレベルおよびその他の因子、例えば、患者の家系および性別をはじめとするいくつかのパラメータの全般的な関数であり得る。パネル応答に寄与するその他の因子としては、個々のマーカーの値の経時的な傾斜が挙げられる。例えば、まず病院に到着した時点で、個々のマーカーについて患者を測定することができる。同じマーカーを、1時間後再度測定することができ、変化レベルをパネル応答に反映させることができる。さらに、さらなるマーカーをその他のマーカーから導くことができ、これはパネル応答の値に寄与し得る。例えば、2種のマーカーの値の比率がパネル応答を算出する際の因子となり得る。
【0134】
被験体の各セットにおける各被験体についてパネル応答を得、そこで各セットのパネル応答の分布を解析することができる。目的関数は有効なパネルの選択を容易にするよう定義できる。通常、目的関数は、例えば、罹患セットの被験体のパネル応答と非罹患セットの被験体のパネル応答の重複によって表され得るような、パネルの有効性の指標となるものではければならない。このように、例えば、重複を最小化することによって、目的関数を最適化してパネルの有効性を最大化することができる。
【0135】
好ましい実施形態では、2セットの被験体のパネル応答を表すROC曲線を用いて目的関数を定義することができる。例えば、目的関数はROC曲線下面積を反映し得る。曲線下面積を最大にすることによって、マーカーのパネルの有効性を最大にすることができる。その他の実施形態では、ROC曲線のその他の特徴を用いて目的関数を定義できる。例えば、ROC曲線の傾斜が1に等しい点は有用な特徴であり得る。その他の実施形態では、「ひざ」と呼ばれることもある、感度と特異度の積が最大である点を使用してもよい。一実施形態では、ひざでの感度を最大にすることができる。さらなる実施形態では、所定の特異度レベルの感度を用いて目的関数を定義することができる。その他の実施形態では、所定の感度レベルの特異度を用いることができる。さらにその他の実施形態では、これらROC曲線の特徴の2以上の組合せを用いることができる。
【0136】
パネルのマーカーの1つが、診断されている疾病または状態に特異的であることがあり得る。このようなマーカーが特定の基準値より上または下に存在する場合には、パネル応答を「陽性」試験結果に戻すよう設定することができる。しかし、基準値を満たさない場合であっても、マーカーのレベルを目的関数に寄与する可能性のあるものとして用いることができる。
【0137】
最適化アルゴリズムを用いて目的関数を最大または最小にすることができる。最適化アルゴリズムは当業者に周知であり、これとしてはシンプレックス法およびその他の条件付き最適化技術をはじめとするいくつかの一般に入手可能な最小化または最大化関数が挙げられる。当業者ならば、最小化関数の中には、局所的極小ではなく大域的極小の検索において、その他のものよりも良好であるものがあることは理解されよう。最適化プロセスでは、各マーカーのカットオフ領域の位置および大きさを、マーカー当たり少なくとも2の自由度を提供するよう変更することが可能である。このような可変パラメータは本明細書では独立変数と呼ぶ。好ましい実施形態では、各マーカーの重み係数も、最適化アルゴリズムの反復にわたって変更することができる。種々の実施形態では、これらのパラメータの順列はいずれも、独立変数として使用することができる。
【0138】
前記のパラメータに加えて、各マーカーの意味も独立変数として用いることができる。例えば、多くの場合、特定のマーカーの高レベルが一般的に罹患状態を示すものであるのか非罹患状態を示すものであるのかどうかが知られていない場合がある。このような場合には、最適化プロセスを両側で検索できることが有用であり得る。実際、これはいくつかの方法で実施できる。例えば、一実施形態では、意味が、最適化プロセスによって陽性と陰性の間で反転され得る、真に別個の独立変数であり得る。あるいは、重み係数が負であることを可能にすることによって意味が提供され得る。
【0139】
同様に、最適化アルゴリズムは特定の制限付で提供され得る。例えば、得られたROC曲線は、特定の値よりも大きい曲線下面積を提供するよう制限できる。曲線下面積が0.5であるROC曲線は、完全な乱数度を示し、曲線下面積が1.0は2セットの完全分離を反映する。したがって、特に目的関数が曲線下面積を組み込んでいない場合には、最小許容範囲値、例えば、0.75を制限として用いることができる。その他の制限としては、個々のマーカーの重み係数に対する制限を挙げることができる。さらなる制限によって、すべての重み係数の合計を、特定の値、例えば1.0に制限することができる。
【0140】
最適化アルゴリズムの反復は、通常、目的関数を最小化または最大化しながら、独立パラメータを制限を満たすよう変更する。最適化プロセスにおける反復数は制限することができる。さらに、2つの連続反復間の目的関数の相違が所定の基準値より小さい場合には最適化プロセスを終了することができ、それによって、最適化アルゴリズムが局所性最小または最大の領域に達したことが示される。
【0141】
したがって、最適化プロセスにより、各マーカーの重み係数およびマーカー値を指標に対してマッピングするためのカットオフ領域を含むマーカーのパネルが提供され得る。より少ないマーカーレベルの測定しか必要としない低コストのパネルを開発するために、特定のマーカーをパネルから排除することができる。これに関しては、パネルにおける各マーカーの有効な寄与を求めて、マーカーの相対的重要度を同定することができる。一実施形態では、最適化プロセスに起因する重み係数を用いて、各マーカーの相対的重要度を決定することができる。寄与の最も低いマーカーを排除してもよい。
【0142】
特定の場合では、より小さい重み係数が低い重要度を示すものでない場合がある。同様に、より大きい重み係数が高い重要度を示すものではない場合がある。例えば、最適化プロセスは、関連マーカーが診断と無関係である場合に高い係数をもたらし得る。この場合には、係数を低下させる利点は全くない。この係数を変更することは、目的関数の値に影響を及ぼし得ない。
【0143】
治療計画を決定するためのナトリウム利尿ペプチドの使用
【0144】
ナトリウム利尿ペプチドなどの有用な診断または予後指標は、臨床医が択一的な治療計画の間で選択を行う手助けとなり得る。例えば、急性冠症候群後に心臓トロポニンTまたはIが上昇している患者は、強力な抗血小板物質・抗血栓治療および早期の血管再開通術を含む早期の積極的な戦略から具体的な利益を得るようである。ハム(Hamm)ら、ニュー・イングランド・ジャーナル・オブ・メディシン(New England Journal of medicine)340、1623〜9頁(1999)、モロー(Morrow)ら、ジャーナル・オブ・ジ・アメリカン・カレッジ・オブ・カルディオロジー(Journal of the American college of cardiology)36、1812〜7頁(2000)、キャノン(Cannon)ら、アメリカン・ジャーナル・オブ・カルディオロジー(American Journal of Cardiology)82、731〜6頁(1998)。さらに、心筋梗塞後C−反応性タンパク質が上昇している患者は、HMG−CoAレダクターゼ阻害剤治療から特定の利益を得るようである。リドカー(Ridker)ら、サーキュレーション98、839〜44頁(1998)。うっ血性心不全の患者の中では、試験的研究によって、ACE阻害剤がBNPレベルを用量依存的に低下させ得るということが示唆されている。バン・ベルドヒュイゼン(Van Veldhuisen)ら、ジャーナル・オブ・アメリカン・カレッジ・オブ・カルディオロジー32、1811〜8頁(1998)。
【0145】
同様に、利尿薬および血管拡張薬治療を、生物活性ナトリウム利尿ペプチドレベルに基づいて「調整すること」によって転帰が改善され得る。例えば、トラウトン(Troughton)ら、ランセット(Lancet)355、1126〜30頁(2000)参照。最後に、16人の患者からなる単一の試験的研究において、Q波梗塞後のプラセボではなくACE阻害剤に対するランダム化が、その後の6ヶ月間にわたるBNPレベルの低下と関連があるということがわかった。モトワニ(Motwani)ら、ランセット341、1109〜13頁(1993)。BNPは、有益な心臓および腎臓への作用を有する対抗−調節ホルモンであるので、BNP濃度の変化は心室機能の向上および心室壁張力の低下を反映すると思われる。最近の論文により、NTプロ−BNPとBNPアッセイの相互関係が実証されている(フィッシャー(Fischer)ら、クリニカル・ケミストリー(Clinical Chemistry)47、591〜594頁(2001))。本発明のさらなる目的は、個別にか、マーカーの群のいずれかで考えられる、ナトリウム利尿ペプチドの濃度を用いて、患者の予後を向上するよう利尿薬および血管拡張薬治療を導くことができることである。さらに、患者の予後指標として用いるための、個別にか、マーカーの群で考えられる、ナトリウム利尿ペプチドの測定は本発明の範囲内にある。
【0146】
うっ血性心不全で入院している患者における最近の研究により、連続するBNP測定は、単一の測定と比較して増加した予後情報を提供できるということが示唆されている。すなわち、アッセイにより、BNPが治療後に低下した場合には、引き続き上昇しているままである場合よりも、予後が向上することを実証することができる。チェン(Cheng)ら、ジャーナル・オブ・アメリカン・カレッジ・オブ・カルディオロジー37、386〜91頁、(2001)。したがって、本発明のナトリウム利尿ペプチドの連続測定は、患者におけるマーカーの予後価値および/または診断価値を高めることができ、したがって、本発明の範囲内にある。
【0147】
アッセイ測定戦略
【0148】
試験サンプル中のポリペプチドまたはタンパク質を検出および解析するための多数の方法および装置が当業者には周知である。好ましい実施形態では、多くはイムノアッセイ装置および方法を用いる。例えば、米国特許第6,143,576号、同6,113,855号、同6,019,944号、同5,985,579号、同5,947,124号、同5,939,272号、同5,922,615号、同5,885,527号、同5,851,776号、同5,824,799号、同5,679,526号、同5,525,524号および同5,480,792号参照。なお、それらの各々は参照により、すべての表、図、および特許請求の範囲をはじめとするその全文を本明細書に組み入れる。これらの装置および方法は、種々のサンドイッチ、競合または非競合アッセイ形式において標識した分子を利用して、注目する分析物の存在または量と関連のあるシグナルを生じさせることができる。さらに、特定の方法および装置、例えば、バイオセンサーおよび光学的免疫測定法を用いて、標識した分子を必要とすることなく分析物の存在または量を調べることもできる。例えば、米国特許第5,631,171号および同5,955,377号参照。なお、それらの各々は参照により、すべての表、図、および特許請求の範囲をはじめとするその全文を本明細書に組み入れる。また、当業者ならば、それだけには限らないが、ベックマン・アクセス(Beckman Access)、アボット・アキシム(Abbott AxSym)、ロシェ・エレクシス(Roche ElecSys)、デイド・ベーリング・ストレイタス・システムス(Dade Behring Status systems)をはじめとするロボット機器が、本明細書に教示したイムノアッセイを実施できるイムノアッセイ分析器に入っていることは承知している。抗体の、マーカーとの特異的な免疫学的結合は直接的に検出することも間接的に検出することもできる。直接標識としては、抗体に付けた、蛍光または発光タグ、金属、色素、放射性核種などが挙げられる。間接標識としては、当技術分野で周知の種々の酵素、例えば、アルカリホスファターゼ、西洋わさびペルオキシダーゼなどが挙げられる。
【0149】
1種以上のポリペプチドに特異的な固定化抗体の使用も本発明によって考慮される。抗体は種々の固体支持体、例えば、磁性またはクロマトグラフィーのマトリックス粒子、アッセイ場所(例えば、マイクロタイタープレート)の表面、一片の固体基板物質またはメンブラン(例えば、プラスチック、ナイロン、紙)などに固定化することができる。抗体または複数の抗体類を固体支持体上のアレイにコーティングすることによってアッセイストリップを調製することができる。次いで、このストリップを試験サンプル中に浸漬し、次いで、洗浄および検出ステップによって迅速に処理して測定可能なシグナル、例えば、呈色スポットを生じさせる。
【0150】
複数のポリペプチドの解析を、一試験サンプルを用いて別々にまたは同時に実施できる。別個のまたは連続アッセイに適した装置としては、エレクシス(ElecSys)(ロシュ)、アクスシム(AxSym)(アボット)、アクセス(ベックマン)、アドビア(ADVIA)(登録商標)センタウル(CENTAUR)(登録商標)(バイエル)イムノアッセイシステム、ニコスル・アドバンテージ(NICHOL ADVANTAGE)(登録商標)(ニコルス社(Nichols Institute))イムノアッセイシステムなどの臨床検査室分析器が挙げられる。好ましい装置またはタンパク質チップとしては、単一の表面で複数のポリペプチドの同時アッセイを実施するものがある。特に有用な物理的形式としては、複数の異なる分析物の検出のための複数の個別のアドレス可能な位置を含む表面を含んでなるものがある。このような形式としては、タンパク質マイクロアレイまたは「プロテインチップ」(例えば、ング(Ng)およびイラグ(Ilag)、ジャーナル・オブ・セルラー・アンド・モレキュラー・メディシン(Journal of Cellular and Molecular Medicine)6、329〜340頁、(20020)参照)および特定のキャピラリー装置(例えば、米国特許第6,019,944号参照)が挙げられる。これらの実施形態では、各々個別の表面位置が、各々の位置で検出するために1種以上の分析物を固定化するための抗体を含み得る(例えば、本発明の1種以上のポリペプチド)。あるいは、表面が、表面の個別の位置に固定化された1種以上の個別の粒子(例えば、微小粒子またはナノ粒子)を含んでなる場合もあり、ここで検出のために微小粒子が抗体を含んでなり、1種の分析物(例えば、本発明の1種以上のポリペプチド)を固定化する。
【0151】
さらに、当業者ならば、同一個体から(例えば、連続する時点で)得た複数のサンプルを試験することの価値を承知しているであろう。このように連続するサンプルを試験することによって、ポリペプチドレベルの経時変化を同定することが可能となる。ポリペプチドレベルの増加または減少、ならびにこのようなレベルの変化がないことは、それだけには限らないが、イベントの発生からのおよその時間、救済可能な組織の存在および量、薬物治療の妥当性、再灌流または症状の回復によって示されるような種々の治療の有効性を同定すること、同様の症状を有する種々の種類の疾病の識別、イベントの重篤度の同定、疾病重症度の同定、および患者の予後、例えば、将来のイベントの危険性の同定をはじめとする疾病状態についての有用な情報を提供する。
【0152】
前述のポリペプチドからなり、場合によっては、疾病の診断、予後診断または識別に有用なその他のタンパク質マーカーを含むパネルを、種々の診断に関連する関連情報を提供するよう構築することができる。このようなパネルは、1、2、3、4、5、6、7、8、9、10、15、20またはそれより多い個々の分析物、例えば、本発明の1種以上のポリペプチドを検出するよう構築することができる。当業者ならば、種々の臨床設定において臨床的感度または特異度を最適にするよう、単一分析物または分析物のサブセットの分析を実施できる。これらとしては、それだけには限らないが、外来、応急手当、救命救急診療、集中治療、モニタユニット、入院患者、通院患者、診療室、診療所、および健康診断設定が挙げられる。さらに、当業者ならば、前記の設定の各々において単一の分析物または分析物のサブセットを、臨床的感度および特異度を最適化するよう診断基準点の調節と組み合わせて使用できる。アッセイの臨床的感度は、アッセイが正しく予測する疾病を有するもののパーセンテージとして定義され、アッセイの特異度は、アッセイが正しく予測する疾病を有さないもののパーセンテージとして定義される(ティーツェ・テキストブック・オブ・クリニカル・ケミストリー(Tietz Textbook of Clinical Chemistry)、第2版、カール・バーティス(Carl Burtis)およびエドワード・アシュッド(Edward Ashwood)編、W.B.サウンダース(Saunders)他、496頁)。
【0153】
分析物の分析は、同様に種々の物理的形式で実施できる。例えば、マイクロタイタープレートまたは自動化の使用を用いることで多数の試験サンプルの処理が容易になる。あるいは、単一サンプル形式を開発することで、例えば、外来搬送または救急外来設定において時期を逸することのない迅速な治療および診断が容易になる。
【0154】
前記で論じたように、サンプルが、ひと度サンプルを獲得しても、ナトリウム利尿ペプチドまたはその断片を分解し続ける場合がある。したがって、アッセイに先立って1種以上のプロテアーゼ阻害剤をサンプルに加えることが有利であり得る。当業者には多数のプロテアーゼ阻害剤が知られており、例示的阻害剤は、例えば、http://www.roche−applied−science.com/fst/products.htm?/prod_inf/manuals/protease/prot_toc.htmのザ・コンプリート・ガイド・フォー・プロテアーゼ・インヒビション(The Complete Guide for Protease Inhibition)、ロシェ・モレキュラー・バイオケミカルス(Roche Molecular Biochemicals)、1999年6月3日更新およびヨーロッパ特許出願03013792.1(EP1378242A1として公開)に見ることができる。なお、この各々はその全文を本明細書に組み入れる。種々のメタロプロテアーゼおよびカルシウム依存性プロテアーゼが血液由来サンプル中に存在することが知られているので、EGTAおよび/またはEDTAなどのキレート剤もプロテアーゼ阻害剤として作用する。さらに、またはあるいは、中性エンドペプチダーゼおよび/またはDPPの阻害剤も使用できる。
【0155】
プロリル特異的DPPによるナトリウム利尿ペプチド分解の阻害
【0156】
ナトリウム利尿ペプチドが一部をなす神経液性調節系は、心血管調節の複雑な系に相当する。うっ血性心不全などの疾病は、本質的に、寿命を延長することはできるが基礎疾患は決して治癒しない命にかかわる疾病である。したがって、依然として、基礎疾患を管理するための新規治療的アプローチが必要とされており、この複雑な系における複数の点が臨床医学者によって重要な標的と考えられている。疾病管理におけるアンギオテンシン変換酵素(「ACE」)阻害剤の臨床上の成功により、血管作用性ホルモンに作用する酵素に影響を及ぼすことによって循環器疾患の経過に間接的に影響を及ぼすさらなるアプローチが探求されることとなった。
【0157】
ナトリウム利尿ホルモンの場合には、ホルモンレベルの上昇が患者において治療可能性を有することがわかっている。例えば、チェコウラ(Tsekoura)ら、ヘレニック・ジャーナル・オブ・カルディオロジー(Hellenic Journal of Cardiology)44、266〜70頁、2003参照。中性エンドペプチダーゼ(「NEP」)は重要な分解媒介物であると考えられている。予想通り、NEPの阻害剤は、高血圧、アテローム性動脈硬化および心不全などの疾病を患う患者の治療において用途が見出されている。例えば、コーチ(Corti)ら、サーキュレーション104、1856〜62頁、2001参照。BNPおよびNEP阻害剤双方を用いる併用療法は、心拍出量、血管抵抗性の低下および心臓の負荷軽減に対して相乗効果を生み出すと報告されている。チェン(Chen)ら、サーキュレーション、105、999〜1003頁、2002。NEPを標的とすることは制限を受け得るが、NEPは広範な生物活性ペプチドを代謝する。例えば、ウォルター(Walter)ら、カレント・オピニオン・イン・ネフロロジー・アンド・ハイパーテンション(Current Opinion in Nephrology and Hypertension)6、468〜73頁、1997参照。
【0158】
本発明は循環器疾患、詳しくは、心不全を治療するための新規アプローチを記載する。いくつかのナトリウム利尿ペプチド、例えば、プロ−BNP、成熟BNP、およびプロ−ANPのヒト型は、最後から2番目のプロリン残基を含んでなり、これによってペプチドがプロリル特異的ジペプチジルジペプチダーゼ(「DPP」)の適した基質となっている。DPPの阻害剤は、DPP IVによるグルコース依存性インスリン分泌促進ポリペプチド分解の阻害によって媒介される糖尿病の管理において有用性があると記載されている。例えば、ゴー(Gault)ら、バイオケミカル・バイオフィジオロジー・リサーチ・コミュニケーション、22、207〜13頁、2003参照。しかしながら、循環器疾患の治療におけるその使用はこれまでに報告されていない。
【0159】
選択的DPP阻害剤を調製および同定する方法は当技術分野では周知である。DPP阻害剤としては、ジペプチド類似体Xaa−ボロPro(boroPro)、例えば、Pro−ボロPro、Ala−ボロPro、Val−ボロProおよびLys−ボロPro、およびdab−pipが挙げられる。例えば、センテンら、バイオオーガニック・アンド・メディシナル・ケミストリー・レターズ、12、2825〜28頁、2002、ジョーンズ(Jones)ら、ブラッド、プレパブリッシュド・オンライン(Blood, prepublished online)2003年5月8日、DOI10.1182参照。DPPの多数のさらなるジペプチド類似体阻害剤を、迅速に合成し、スクリーニングするためにコンビナトリアル・ケミストリー法が用いられている。例えば、レイティングら、バイオケミカル・ジャーナル371、525〜32頁、2003、セドら、フィジオロジカル・リサーチ52、367〜72頁、2003、ビルハウアーら、ジャーナル・オブ・メディカル・ケミストリー46、2774〜89頁、2003、センテンら、ジャーナル・オブ・コンビナトリー・ケミストリー5、336〜44頁、2003、および米国特許第5,602,102号、同6,573,287号、同6,548,481号、同6,432,969号、および同6,355,614号参照。これらの出版物に記載された化合物は、本明細書に記載した方法において使用するためのさらなるDPP阻害剤の同定においてリード化合物として用いることができる。小さな有機分子のコンビナトリアルライブラリーを作製するために当技術分野では種々の技術が利用できる。一般的には、ブロンデル(Blondelle)ら、トレンヅ・イン・アナリティカル・ケミストリー(Trends in Analytical chemistry)14、83頁、1995、米国特許第5,359,115号、同5,362,899号、同5,288,514号、および同5,721,099号、チェン(Chen)ら、JACS116、2661頁、1994、カー(Kerr)ら、JACS115、252頁、1993、W092/10092、W093/09668、WO94/08051、W093/20242およびW091/07087参照。約16〜1,000,000またはそれよりも多いオーダーのディヴァーソマー(diversomer)で種々のライブラリーを合成し、本発明に記載した方法を用いて個々の活性または性質についてスクリーニングすることができる。
【0160】
本発明に用いられる阻害剤は小分子であることが好ましく、これは約1000ダルトンより小さい分子量であることを意味する。このような阻害剤は当技術分野ではよく知られている。例えば、W004/07468およびW004/50022、ならびに米国特許第6,710,040号、同6,699,871号、同6,432,969号、同6,303,661号、同6,166,063号、同6,124,305号、同6,110,949号、および同6,107,317号参照。なお、それらの各々は参照によりその全文を本明細書に組み入れる。好ましい小分子阻害剤は経口で有効である。DPP阻害性抗体または抗体断片も本明細書に記載した方法に使用できる。この場合には、DPPに対する抗体を作製し、(例えば、本明細書に記載したファージディスプレイ法を用いて)スクリーニングし、注目する1種以上のナトリウム利尿ペプチドに対するDPP活性を阻害する抗体を同定することができる。
【0161】
化合物は、酵素の供給源として単離したDPP酵素、細胞抽出物、または血液由来サンプル、および基質として単離したナトリウム利尿ペプチドを用いて阻害活性についてスクリーニングすることができる。標的ナトリウム利尿ペプチドからの最後から2番目のプロリン残基の喪失を阻害する条件の選択は、検討中の水性媒質の種類に応じて変わり得る(例えば、血液サンプルにおける阻害は、生物の循環における阻害とは異なる条件を必要とし得る)。このような条件を選択することは当業者の技術の範囲内である。また試験化合物およびその対応する製薬上許容される酸付加塩のDPPを阻害する能力も、クボタら、クリニカル・アンド・エクスペリメンタル・イムノロジー(Clinical and Experimental Immunology)89、192〜7頁、1992に記載されたアッセイの改訂版を用いることによって証明することができる。最後から2番目のプロリン残基の有無の確認は、分子のこのN部分の喪失に感受性であるよう選択したイムノアッセイを用いて、または質量分析の使用によって実施できる。
【0162】
次のステップに進む前に、培養細胞においてDPP活性を調節する候補化合物を、注目する疾病状態と関連している動物モデルで試験することができる。これらの方法では、標識したナトリウム利尿ペプチドを、試験動物に注射し、ナトリウム利尿ペプチドの循環からのクリアランスのT1/2を、阻害剤の存在下および不在下で測定すればよい。DPP依存性ナトリウム利尿ペプチド分解の好ましい動物モデルとしては、ラット、マウス、ヒツジ、イヌ、ネコおよびブタが挙げられる。
【0163】
前記で論じたように、DPP阻害剤とNEP阻害剤および/またはナトリウム利尿ペプチドを用いる併用療法が本発明によって考慮される。さらに、または代替法として、ゴー(Goult)ら、メタボリズム(Metabolism)52、679〜87頁、2003に、グルコース依存性インスリン分泌促進ポリペプチドについて記載されたように、ナトリウム利尿ペプチドを、DPP活性に対して安定化されている類似体として提供することができる。好ましい実施形態では、1個以上の置換、欠失、付加または修飾されたアミノ酸を含むナトリウム利尿ペプチド類似体のライブラリーを、DPP分解に対する安定性の向上についてスクリーニングすることができる。このような類似体は、親ナトリウム利尿ペプチドのナトリウム利尿活性の50%以上を保持することが好ましい。
【0164】
投与する場合には、本発明の製薬製剤を製薬上許容される量で製薬上許容される組成物で適用する。このような製剤は通常、塩、緩衝剤、保存料、適合担体、および場合によってはその他の治療薬を含み得る。医薬に用いる場合には、塩は製薬上許容されるものでなくてはならないが、好都合なことに、製薬上許容されない塩を用いてその製薬上許容される塩を調製することができ、これは本発明の範囲から排除されない。このような薬理学的および製薬上許容される塩としては、それだけには限らないが、以下の酸から調製されるものが挙げられる:塩酸、臭化水素酸、硫酸、硝酸、リン酸、マレイン酸、酢酸、サリチル酸、クエン酸、ギ酸、マロン酸、コハク酸など。また、製薬上許容される塩は、アルカリ金属またはアルカリ土類塩、例えばナトリウム、カリウムまたはカルシウム塩としても調製できる。製薬組成物はまた、適した保存料、例えば、塩化ベンザルコニウム、クロロブタノール、パラベンおよびチメロサルを場合によって含んでもよい。経口、皮下、静脈、筋肉内投与などに適した担体製剤は、レミングトンズ・ファーマシューティカル・サイエンシズ(Remington’s Pharmaceutical Sciences)、マック・パブリッシング社(Mack Publishing Co.)、ペンシルバニア州、イーストンに見出すことができる。
【0165】
被験体を治療するためには種々の投与経路が利用できる。選択される個々の送達様式は、選択された個々の化合物、治療される状態の重篤度および治療効力のために必要とされる投与量に応じて変わる。本発明の方法は、一般的に言えば、医学上許容される投与様式であればいずれを用いて実施してもよく、これは、臨床上許容できない副作用を引き起こさずに有効レベルの活性化合物が得られるいずれかの様式を意味する。このような投与様式としては、経口、直腸、局所、経鼻、皮内、静脈内、または非経口経路が挙げられる。このような投与様式はまた、患者からT細胞または骨髄細胞、幹細胞または初期系統前駆細胞を獲得し、単離した細胞を本発明の化合物とex vivoで接触させ、次いで処理細胞を患者に再導入することも含む。処理した細胞は、生存細胞を投与するための当技術分野で公知のいずれかの方法で患者に再導入すればよい。
【0166】
経口投与は特に好ましい。経口投与に適した組成物は、各々所定量の本発明の化合物を含有する個別単位、例えば、カプセル剤、錠剤、トローチ剤として提供することができる。その他の組成物としては、水性液体または非水性液体中の懸濁液、例えば、シロップ、エリキシルまたはエマルションが挙げられる。経口製剤は腸溶性皮膜を含まないことが好ましいが、これは本発明の環状化合物を消化管の酸性pH条件に曝露して環状分子をその線状対応物に変換することが望ましいからである。
【0167】
その他の送達システムとしては、徐放性、遅延放出性または持続放出送達システムが挙げられる。このようなシステムによって、前述の化合物の反復投与が避けられ、被験体および医師に対する利便性が高まる。多数の種類の放出送達システムが、当業者に利用でき、知られている。それらとしては、ポリマーベースのシステム、例えば、ポリ(ラクチド−グリコリド)、コポリオキサレート、ポリカプロラクトン、ポリエステルアミド、ポリオルトエステル、ポリヒドロキシ酪酸、およびポリアンヒドリドが挙げられる。薬剤を含有する前述のポリマーのマイクロカプセルが、例えば、米国特許第5,075,109号に記載されている。送達システムとしてはまた、ステロール、例えば、コレステロール、コレステロールエステルおよび脂肪酸またはモノ−、ジ−およびトリ−グリセリドなどの中性脂肪を含む脂質である非ポリマーシステム、ヒドロゲル放出システム、サイラスティック(sylastic)システム、ペプチドベースのシステム、ワックス皮膜、従来の結合剤および賦形剤を用いる圧縮錠、部分融合インプラントなどが挙げられる。具体例としては、それだけには限らないが、(a)化合物がマトリックス内の形態に含まれる浸食システム、例えば、米国特許第4,452,775号、同4,667,014,号、同4,748,034号および同5,239,660号に記載されたもの、ならびに(b)有効成分が制御された速度でポリマーから浸透する拡散システム、例えば、米国特許第3,832,253号および同3,854,480号に記載されたものが挙げられる。さらに、ポンプベースのハードウェア送達システムを用いることもでき、これらの中には移植に適応するものもある。
【0168】
長期の持続放出性インプラントの使用は、慢性症状の治療に特に適し得る。本明細書において、長期の放出とは、インプラントが治療レベルの有効成分を少なくとも10日、好ましくは60日間送達するよう構成され配置されていることを意味する。長期の持続放出性インプラントは当業者には周知であり、これには前述の放出システムのいくつかが含まれる。
【0169】
選択した化合物は有効量で投与する。有効量とは、医薬上望ましい結果を提供するのに十分な化合物の投与量である。有効量は、治療されている個々の症状、治療されている被験体の年齢および健康状態、症状の重篤度、治療期間、(あるとすれば)併用療法の性質、具体的な投与経路および保険医の知識と力量の範囲内の同様の因子に応じて変わる。一般に、有効化合物の用量は1日あたり約0.001mg/kg〜1日あたり1000mg/kgとなる。0.001〜100mg/kgの用量範囲が適していると思われ、経口で1日あたり1回または数回の投与が好ましい。他の投与形態、例えば、静脈内投与によってはより少ない用量となる。初回量を適用して、被験体における応答が十分でない場合は、患者の耐容性が許す範囲内までで、より高用量(または異なる、より限局性の送達経路による事実上、より高用量)を用いることができる。化合物の適当な全身レベルを達成するためには1日あたり複数回の投与を考慮する。
【0170】
その他の実施形態は以下の特許請求の範囲内に示される。
【実施例】
【0171】
実施例
以下の実施例は本発明を例示するものである。これらの実施例は、決して本発明の範囲を限定しようとするものではない。
【実施例1】
【0172】
血液サンプリング
血液は、指先穿刺、足底面穿刺、耳たぶ穿刺なども小容量には十分であり得るが、20ゲージのマルチ−サンプルニードルおよび真空管を用いて静脈穿刺によって採取することが好ましい。全血採取用には、血液検体を訓練された研究員によってEDTA含有血液採取チューブに採取する。血清採取用には、血液検体を訓練された研究員によってトロンビン含有血液採取チューブに採取する。血液を5〜10分間凝固させ、遠心分離によって血清を不溶性物質から分離する。血漿採取用には、血液検体を訓練された研究員によってクエン酸塩含有血液採取チューブに採取し、≧12分間遠心分離する。サンプルは使用まで4℃で維持するか、長期間の保存には−20℃以下で凍結させればよい。全血は凍結しないことが好ましい。
【実施例2】
【0173】
組換え抗体調製
抗原でのマウスの免疫化とマウス脾臓由来RNAの精製
マウスを、抗体をコードするmRNAの最適な回収のための脾臓採取のタイミングの経験に基づいて、以下の方法によって免疫化する。2種のマウスを用いる:Balb/c(チャールズ・リバー・ラボラトリーズ(Charles River Laboratories)、マサチューセッツ州、ウィルミントン)およびA/J(ジャクソン・ラボラトリーズ(Jackson Laboratories)、メイン州、バー・ハーバー)。10個体のマウス各々を、フロイントの完全アジュバント中の50μgタンパク質を用いる抗原で、0日目および28日目に腹腔内免疫化する。後眼窩洞の穿刺によってマウスの試験出血を採取する。ストレプトアビジンによって固定化されるビオチン化抗原を用いるELISAによって力価を試験することによって、高いと思われる場合は、マウスを50μgのタンパク質で、70、71および72日目にブーストし、続いて、77日目に屠殺し、脾臓を摘出する。抗体の力価が十分でないと考えられる場合は、マウスを50μgの抗原で56日目にブーストし、63日目に試験出血を採取する。十分な力価が得られる場合には、動物を50μgの抗原で98、99および100日目にブーストし、105日目に脾臓を採取する。通常、1:3200以上の試験出血希釈で、十分であると考えられる、最大半量のELISA応答が得られる。
【0174】
脾臓は層流フード内で採取し、ペトリ皿に移し、脂肪および結合組織を切り取り、廃棄する。迅速に作業し、脾臓を溶液D(25.0gチオシアン酸グアニジン(ベーリンガー・マンハイム(Boehringer Mannheim)、インディアナ州、インディアナポリス)、29.3ml滅菌水、1.76ml 0.75Mクエン酸ナトリウム(pH7.0)、2.64ml 10%サルコシル(フィッシャー・サイエンティフィック(Fisher Scientific)、ペンシルバニア州、ピッツバーグ)、0.36ml 2−メルカプトエタノール(フィッシャー・サイエンティフィック、ペンシルバニア州、ピッツバーグ))1.0mlの存在下、滅菌5ccシリンジのプランジャで柔らかくする。脾臓懸濁液を18ゲージのニードルによって、粘性になり、すべての細胞が溶解するまで吸い上げ、次いで、微量遠心管に移す。ペトリ皿を100μlの溶液Dで洗浄して残存する脾臓をいずれも回収し、これを管に移す。次いで、懸濁液をさらに5〜10回22ゲージのニードルによって吸い上げる。サンプルを2つの微量遠心管に等分に分け、以下のものを、各々添加後に反転して混合しながら、順に加える:100μl 2M酢酸ナトリウム(pH4.0)、1.0ml 水で飽和したフェノール(フィッシャー・サイエンティフィック、ペンシルバニア州、ピッツバーグ)、200μlクロロホルム/イソアミルアルコール49:1(フィッシャー・サイエンティフィック、ペンシルバニア州、ピッツバーグ)。この溶液を10秒間ボルテックス処理し、氷上で15分間インキュベートする。2〜8℃、14,000rpmで20分間遠心分離した後、水相を新しい管に移す、等容積の水で飽和したフェノール/クロロホルム/イソアミルアルコール(50:49:1)を加え、管を10秒間ボルテックス処理する。氷上で15分インキュベートした後、サンプルを2〜8℃で20分間遠心分離し、水相を新しい管に移し、等容量のイソプロパノールを用い、−20℃で最低30分間沈殿させる。4℃、14,000rpmで20分間遠心分離した後、上清を吸引除去し、管を短時間回転させ、液体を残らず除去する。RNAペレットを300μlの溶液Dに各々溶解し、合わせ、等容量のイソプロパノールを用いて−20℃で最低30分間沈殿させる。サンプルを4℃、14,000rpmで20分間遠心分離し、上清を前述のように吸引し、サンプルを100μlの氷冷70%エタノールでリンスする。サンプルを4℃、14,000rpmで20分間再度遠心分離し、70%エタノール溶液を吸引し、RNAペレットを真空乾燥させる。ペレットを100μlの滅菌蒸留水に再懸濁する。40μg/mlの濃度に対して吸光度1.0を用いてA260によって濃度を測定する。RNAは−80℃で保存する。
【0175】
相補DNA(cDNA)の調製
前記のように精製した全RNAを、cDNAの調製のための鋳型として直接用いる。RNA(50μg)を滅菌水で100μLに希釈し、10μL−130ng/mLオリゴdT12を加える。サンプルを70℃で10分間加熱し、次いで、氷上で冷却する。40μL 5×第一鎖バッファー(ギブコ(Gibco)/BRL、メリーランド州、ゲイサーズバーグ)、20μL 0.1Mジチオスレイトール(ギブコ/BRL、メリーランド州、ゲイサーズバーグ)、10μL 20mMデオキシヌクレオシドトリホスフェート(dNTP、ベーリンガー・マンハイム、インディアナ州、インディアナポリス)、および10μLの水を氷上で加える。次いで、サンプルを37℃で2分間インキュベートする。10μLの逆転写酵素(スーパースクリプト(Superscript)TM II、ギブコ/BRL、メリーランド州、ゲイサーズバーグ)を加え、37℃で1時間インキュベーションを続ける。cDNA産物をポリメラーゼ連鎖反応(PCR)に直接用いる。
【0176】
PCRによるcDNAの増幅
PCRを用いて実質的にすべてのHおよびL鎖遺伝子を増幅するために、実質的にすべての公開配列に対応するプライマーを選択する。HおよびLのアミノ末端のヌクレオチド配列は相当な多様性を含むため、米国20030104477に記載されたように、33種のオリゴヌクレオチドを合成し、H鎖の5’プライマーとして用い、29種のオリゴヌクレオチドを合成し、κL鎖の5’プライマーとして用いる。5’プライマーは、以下の基準にしたがって作製する。第1に、L鎖の2番目および4番目のアミノ酸ならびに重鎖の2番目のアミノ酸を保存する。抗体のアミノ酸配列を変更するミスマッチは他のどの位置でも可能とする。第2に、各プライマーの5’側にM13ウラシル鋳型に相補的な20ヌクレオチドの配列を合成する。この配列はHおよびL鎖プライマー間で異なり、L鎖プライマーについてはpelBシグナル配列、H鎖プライマーについてはアルカリホスファターゼシグナル配列の3’側の20ヌクレオチドに対応している。定常領域ヌクレオチド配列には、H鎖およびκL鎖各々に対し、1種の3’プライマーしか必要でない(図2)。各5’および3’プライマーの各対に対し、別個にPCRによる増幅を実施した。各プライマー対に対し、50pmolの5’プライマー、50pmolの3’プライマー、0.25μL TaqDNAポリメラーゼ(5ユニット/μL、ベーリンガー・マンハイム、インディアナ州、インディアナポリス)、3μLのcDNA(実施例2に記載)、5μL 2mM dNTP、5μL MgCl2を含む10×TaqDNAポリメラーゼバッファー(ベーリンガー・マンハイム、インディアナ州、インディアナポリス)、および50μLまでのH2Oを含む50μLの反応を実施する。増幅はGeneAmp(登録商標)9600サーマルサイクラー(パーキン・エルマー(Perkin Elmer)、カリフォルニア州、フォスター・シティー)を用い、以下のプログラムを用いて行う:94℃で1時間、94℃で20秒、55℃で30秒、および72℃で30秒の30サイクル、72℃で6分間、4℃。
【0177】
次いで、PCRプロセスのdsDNA産物を、3’プライマーのみを用いる非対称PCRに付し、実質的に標的遺伝子のアンチセンス鎖のみを作製する。各dsDNA産物に対して、200pmolの3’プライマー、2μLのdsDNA産物、0.5μL TaqDNAポリメラーゼ、10μL 2mM dNTP、10μL MgCl2を含む10×TaqDNAポリメラーゼバッファー(ベーリンガー・マンハイム、インディアナ州、インディアナポリス)、および100μLまでのH2Oを含む100μLの反応を行う。前述したものと同一のPCRプログラムを用いて一本鎖(ss)−DNAを増幅する。
【0178】
高速液体クロマトグラフィーによるss−DNAの精製およびss−DNAのキナーゼ処理
【0179】
H鎖ss−PCR産物およびL鎖ss−PCR産物を、2.5容量のエタノールおよび0.2容量の7.5M酢酸アンモニウムを添加し、−20℃で少なくとも30分間インキュベートすることによってエタノール沈殿させる。2〜8℃、14,000rpm、10分間のエッペンドルフ遠心機での遠心分離によってDNAをペレットにする。上清を注意深く吸引し、管を短時間2回目の回転をさせる。上清の最後の一滴までピペットで除去する。DNAを中程度加熱して10分間真空乾燥させる。H鎖産物を210μLの水中にプールし、L鎖産物を別の210μLの水中にプールする。ss−DNAを、オーブン温度60℃で、ヒューレット・パッカード1090HPLCおよびGen−Pak(商標)FAX陰イオン交換カラム(ミリポア社(Millipore Corp.)、マサチューセッツ州、ミルフォード)を用いる高速液体クロマトグラフィー(HPLC)によって精製する。吸光度を260nmでモニターする。HPLCから溶出されるss−DNAを0.5分画分で回収する。ss−DNAを含有する画分を、前述のようにエタノール沈殿させ、ペレットにし、乾燥させる。乾燥DNAペレットを200μLの滅菌水中にプールする。
【0180】
必要に応じて、ss−DNAを突然変異誘発のための調製において5’でキナーゼ処理する。各サンプルに、24μL 10×キナーゼバッファー(ユナイテッド・ステイツ・バイオケミカル(United States Biochemical)、オハイオ州、クリーブランド)、10.4μL 10mMアデノシン−5’−三リン酸(ベーリンガー・マンハイム、インディアナ州・インディアナポリス)、および2μLポリヌクレオチドキナーゼ(30ユニット/μL、ユナイテッド・ステイツ・バイオケミカル、オハイオ州、クリーブランド)を加え、管を37℃で1時間インキュベートする。管を70℃で10分間インキュベートすることによって反応を停止させる。DNAを平衡化フェノール(pH>8.0、ユナイテッド・ステイツ・バイオケミカル、オハイオ州、クリーブランド)−クロロホルム−イソアミルアルコール(50:49:1)で1回抽出し、クロロホルム:イソアミルアルコール(49:1)で1回抽出することで精製する。抽出後、前述のように、DNAをエタノール沈殿させ、ペレットにする。このDNAペレットを乾燥させ、次いで、50μLの滅菌水に溶解する。DNAのアリコートの260nmでの吸光度を測定し、吸光度1.0に対して33μg/mLを用いることによって濃度を決定する。サンプルは−20℃で保存する。
【0181】
抗体ファージディスプレイベクター
【0182】
抗体をクローニングする抗体ファージディスプレイベクターを、668−4と呼ばれる、イクシス(Ixsys)から供給されるM13ベクターから導く。ベクター668−4は、ヒューズ(Huse)、WO92/06024によって記載された、ベクターに挿入されたマウスモノクローナルFab断片の重鎖および軽鎖をコードするDNA配列を含んでいた。ベクターは、マウス抗体のL鎖可変領域の5’側に融合しているLacプロモーター、pelBシグナル配列、マウス抗体の全κ鎖、マウス抗体のH鎖可変領域の5’末端にアルカリホスファターゼシグナル配列、全可変領域およびH鎖の第1定常領域、ならびにIgG1 H鎖のヒンジ領域の5つのコドンを含んでいる。デカペプチド配列はH鎖ヒンジ領域の3’末端にあり、アンバー停止コドンがデカペプチド配列を偽遺伝子VIII配列から隔てている。アンバー停止によって、大腸菌(E.coli)サプレッサー株、例えば、XL1ブルー(ストラタジーン(Stratagene)、カリフォルニア州、サン・ディエゴ)における遺伝子VIIIタンパク質を含むH鎖融合タンパク質の発現が可能となるが、非サプレッサー細胞株、例えば、MK30(ベーリンガー・マンハイム、インディアナ州、インディアナポリス)では発現されない(図3A参照)。
【0183】
第1の誘導クローニングベクターを作製するために、ウラシル鋳型のオリゴヌクレオチド特異的突然変異誘発によってH鎖およびL鎖の可変領域内に欠失を作製する(クンケル(Kunkel)、プロシーディングス・オブ・ザ・ナショナル・アカデミー・オブ・サイエンシズ・オブ・ジ・ユナイテッド・ステイツ・オブ・アメリカ82、488頁(1985)、クンケルら、メソッヅ・エンジモロジー、154、367頁(1987))。これらの突然変異によって、CDR1の5’末端からCDR3の3’末端の各鎖の領域が欠失し、突然変異によって、そこでタンパク質翻訳が停止するDNA配列が加わる(突然変異オリゴヌクレオチドについては図4参照)。これによって、挿入断片を含まないクローンにおけるHまたはL鎖定常領域の発現が妨げられ、それによってプラークを挿入断片の存在についてスクリーニングすることが可能となる。得られたクローニングベクターをBS11と呼ぶ。
【0184】
BS11に対して多数の変更を行って、本スクリーニング法に用いるクローニングベクターを作製する。重鎖と偽遺伝子VIII配列の間のアンバー停止コドンを除去し、どの重鎖も遺伝子VIIIタンパク質を含む融合タンパク質として発現されるようにする。これによって、BS11に対して、ファージでの抗体のコピー数が増加する。L鎖の3’末端とアルカリホスファターゼシグナル配列の5’末端の間の配列中のHindIII制限酵素部位を欠失させ、抗体をpBR322誘導体にサブクローニングできるようにする。LおよびH鎖のカルボキシル末端の鎖間システイン残基をセリン残基に変更する。これによって、抗体安定性に影響を及ぼすことなく、抗体の発現レベルおよびファージでの抗体のコピー数が増加する。lacプロモーターの5’側および偽遺伝子VIII配列の3’側の非必須DNA配列を欠失させ、M13ベクターの大きさおよび再編成の可能性を小さくする。翻訳停止に加え、転写停止DNA配列をベクターに、L鎖クローニング部位で加え、パニングの際に非特異的に結合する可能性がある、その表面に重鎖タンパク質しか有さないファージが作製されないようにする。最後に、種々のベクターにタンパク質タグのDNA配列を加え、金属キレートクロマトグラフィー(ポリヒスチジン配列)による、またはデカペプチドタグおよびデカペプチドタグと結合する固定化抗体を含む磁性ラテックスを用いるアフィニティー精製による多価ファージの濃縮を可能にする。ベクターBS39はポリヒスチジン配列を、κ鎖の3’末端に含み、重鎖の末端にはタグを含まない。他方、BS45はポリヒスチジン配列を、重鎖定常領域の末端と偽遺伝子VIII配列の間に、デカペプチド配列を、κ鎖定常領域の3’末端に含む。
【0185】
脾臓抗体ファージライブラリーの作製に用いるウラシル鋳型の調製
【0186】
250mLのバッフル付振盪フラスコに入れた50ml 2×YTに、1mLの大腸菌CJ236(バイオラッド(BioRAD)、カリフォルニア州、ハーキュリーズ)一晩培養物を加える。この培養物を37℃でOD600=0.6に増殖させ、10μlのベクターファージ保存液の1/100希釈液を用いて播種し、増殖を6時間継続する。約40mLの培養物を4℃、12,000rpmで15分間遠心分離する。上清(30mL)を新しい遠心管に移し、10mg/ml RnアーゼA(ベーリンガー・マンハイム、インディアナ州、インディアナポリス)15μlを添加した後、室温で15分間インキュベートする。7.5mlの20%ポリエチレングリコール8000(フィッシャー・サイエンティフィック、ペンシルバニア州、ピッツバーグ)/3.5M酢酸アンモニウム(シグマ・ケミカル社、ミズーリ州、セント・ルイス)を加えることによってファージを沈殿させ、氷上で30分間インキュベートする。サンプルを2〜8℃、12,000rpmで15分間遠心分離する。上清を注意深く廃棄し、管を短時間回転させ、上清を残らず除去する。ペレットを400μlの高塩バッファー(300mM NaCl、100mM Tris pH8.0、1mM EDTA)に再懸濁し、1.5mLの試験管に移す。等容量の平衡化フェノール:クロロホルム:イソアミルアルコール(50:49:1)を用い、白色の界面の痕跡が見えなくなるまで、ファージ保存液を反復して抽出し、次いで、等容量のクロロホルム:イソアミルアルコール(49:1)を用いて抽出する。2.5容量のエタノールおよび1/5容量の7.5M酢酸アンモニウムを用いてDNAを沈殿させ、−20℃で30分間インキュベートする。DNAを4℃、14,000rpmで10分間遠心分離し、ペレットを冷70%エタノールで1回洗浄し、真空乾燥させる。ウラシル鋳型DNAを30μlの滅菌水に溶解し、濃度40μg/mlに対して吸光度1.0を用いてA260によって濃度を求める。鋳型を滅菌水で250ng/μlに希釈し、分注し、−20℃で保存する。
【0187】
抗体ファージライブラリーを作製するための、ss−DNAおよび大腸菌へのエレクトロポレーションを用いるウラシル鋳型の突然変異誘発
【0188】
単鎖重鎖および軽鎖遺伝子をファージディスプレイベクターウラシル鋳型に同時に導入することによって、抗体ファージディスプレイライブラリーを作製する。通常の突然変異誘発は2μgスケールで、0.2mL PCR反応管中で以下のものを混合することによって実施する:8μlの(250ng/ml)ウラシル鋳型(実施例5および6)、8μlの10×アニーリングバッファー(200mM Tris pH7.0、20mM MgCl2、500mM NaCl)、3.33μlのキナーゼ処理した単鎖重鎖挿入断片(100ng/μl)、3.1μlのキナーゼ処理した単鎖軽鎖挿入断片(100ng/μl)、および80μlまでの滅菌水。DNAをGeneAmp(登録商標)9600サーマルサイクラーで以下の温度プロフィールを用いてアニーリングする:94℃で20秒、85℃で60秒、30分かけて85℃〜55℃の傾斜、55℃で15分間維持。プログラムが終了した後DNAを氷に移す。伸長/ライゲーションは、8μlの10×合成バッファー(5mM 各dNTP、10mM ATP、100mM Tris pH7.4、50mM MgCl2、20mM DTT)、8μl T4DNAリガーゼ(1U/μl、ベーリンガー・マンハイム、インディアナ州、インディアナポリス)、8μl希釈したT7DNAポリメラーゼ(1U/μl、ニューイングランド・バイオラブス(NewEngland BioLabs)、マサチューセッツ州)を加え、37℃で30分間インキュベートすることによって実施する。反応を300μlの突然変異誘発停止バッファー(10mM Tris pH8.0、10mM EDTA)で停止させる。突然変異誘発DNAを平衡化フェノール(pH>8):クロロホルム:イソアミルアルコール(50:49:1)で1回抽出し、クロロホルム:イソアミルアルコール(49:1)で1回抽出し、DNAを−20℃で少なくとも30分間エタノール沈殿させる。前述のように、DNAをペレットにし、上清を注意深く除去する。サンプルを再度短時間回転させ、ピペットマンを用いてエタノールを残らず除去する。ペレットを真空乾燥させる。DNAを4μlの滅菌水に再懸濁する。
【0189】
1μlの突然変異誘発DNA(500ng)を、40μlの電気的コンピテント大腸菌DH12S(ギブコ/BRL、メリーランド州、ゲイサーズバーグ)にトランスファーする。形質転換された細胞を1.0mL 2×YTブロスと混合し、15mLの滅菌培養管に移す。培養物を23℃、300rpmで一晩振盪することによって第1ラウンドの抗体ファージを作製する。エレクトロポレーションの効率は、培養物の10-3および10-4希釈液10μlをLBアガープレート上にプレーティングすることによって測定する。これらのプレートを37℃で一晩インキュベートする。効率は、10-3希釈液プレート上のプラークの数に105を掛けることによって、または10-4希釈液プレート上のプラーク数に106を掛けることによって求める。エレクトロポレーションから一晩培養したものを、1.5mlの管に移し、14,000rpmで5分間遠心分離することによって細胞をペレットにする。次いで、第1ラウンドの抗体ファージである上清を、15mLのプラグシールキャップ付滅菌遠心管移す。
【0190】
エレクトロポレーションによる大腸菌の形質転換
【0191】
電気的コンピテントな大腸菌細胞を氷上で解凍する。気泡が入らないよう注意しながら、細胞を上下に2〜3回穏やかにピペッティングすることによってDNAを20〜40μLの電気的コンピテントな細胞と混合する。細胞を、再度、移す際に気泡が入らないように注意しながら、氷上で冷却しておいたジーン・パルサー(Gene Pulser)キュベット(0.2cmギャップ、バイオラッド、カリフォルニア州、ハーキュリーズ)に移す。このキュベットを大腸菌パルサー(バイオラッド、カリフォルニア州、ハーキュリーズ)に入れ、製造業者の推奨に従い1.88kVに設定した電圧でエレクトロポレーションを行う。形質転換されたサンプルを、2×YTブロスで1mlに直ちに希釈し、手順の指示通り処理する。
【0192】
ビオチン化抗原および抗体の調製
【0193】
タンパク質抗原または抗体を、最低100容積の20mMホウ酸塩、150mM NaCl、pH8(BBS)に対して、2〜8℃で少なくとも4時間透析する。ビオチン化の前にバッファーを少なくとも1回を交換する。タンパク質抗原または抗体を、ビオチン−XX−NHSエステル(モレキュラー・プローブス(Molecular Probes)、オレゴン州、ユージーン、ジメチルホルムアミド中40mMの保存溶液)と、最終濃度1mMで、室温で1時間反応させる。1時間後、タンパク質抗原または抗体をBBSに十分に透析して未反応の小分子を除去する。
【0194】
アルカリホスファターゼ抗原コンジュゲートの調製
【0195】
アルカリホスファターゼ(AP、カルザイム・ラボラトリーズ(Calzyme Laboratories)、カリフォルニア州、サン・ルイス・オビスポ)を、2〜8℃で少なくとも4時間、最低100容積のカラムバッファー(50mMリン酸カリウム、10mMホウ酸塩、150mM NaCl、1mM MgSO4、pH7.0)に対する透析に付す。APを使用する前に少なくとも2回バッファーを交換する。APを透析から回収し、室温にし、1mg/mL溶液に対して吸光度0.77を用いて280nmの吸光度によって濃度を求める。APをカラムバッファーで5mg/mLに希釈する。APとスクシンイミジル4−(N−マレイミドメチル)シクロヘキサン−1−カルボキシレート(SMCC、ピエルス・ケミカル社(Pierce Chemical CO.)、イリノイ州、ロックフォード)の反応を、20:1の割合のSMCC:APを用いて実施する。SMCCをアセトニトリルに20mg/mLで溶解し、ボルテックス処理または迅速に攪拌しながらAPに加える際に84倍に希釈する。溶液を室温で90分間静置させ、次いで、カラムバッファーで平衡化したカラムにおけるゲル濾過クロマトグラフィー(G50Fine、ファルマシア・バイオテック(Pharmacia Biotech)、ニュージャージー州、ピスカタウェイ)を用いて未反応のSMCCおよび低分子量反応産物をAPから分離する。
【0196】
タンパク質抗原を最低100容積の20mMリン酸カリウム、4mMホウ酸塩、150mM NaCl、pH7.0に対して、2〜8℃で少なくとも4時間透析する。抗原を使用する前に少なくとも2回バッファーを交換する。280nmの吸光度によって、またはローリー法によって抗原の量を定量する。抗原とN−スクシンイミジル3−[2−ピリジルジチオ]プロピオネート(SPDP、ピエルス・ケミカル社、イリノイ州、ロックフォード)の反応を、20:1モル比のSPDP:抗原を用いて実施する。SPDPをジメチルホルムアミドに40mMで溶解し、ボルテックス処理しながら抗原溶液に入れて希釈する。この溶液を室温で90分間静置させ、その時点で、タウリン(アルドリッチ・ケミカル社(Aldrich Chemical Co.)、ウィスコンシン州、ミルウォーキー)を最終濃度20mMに5分間加えることによって反応をクエンチする。タンパク質にジチオスレイトール(フィッシャー・サイエンティフィック、ペンシルバニア州、ピッツバーグ)を最終濃度1mMで30分間加える。50mMリン酸カリウム、10mMホウ酸塩、150mM NaCl、0.1mMエチレンジアミン四酢酸(EDTA、フィッシャー・サイエンティフィック、ペンシルバニア州、ピッツバーグ)、pH7.0で平衡化したカラムにおけるゲル濾過クロマトグラフィーを用いて、低分子量反応産物を抗原から分離する。
【0197】
APおよび抗原を、等モル比でともに混合する。反応物を2時間室温に置く。このコンジュゲートを、1%ウシ血清アルブミン(30%BSA、バイエル、イリノイ州、カンカキーから作製)、10mM Tris、150mM NaCl、1mM MgCl2、0.1mM ZnCl2、0.1%ポリビニルアルコール(80%加水分解、アルドリッチ・ケミカル社、ウィスコンシン州、ミルウォーキー)、pH8.0を含有するブロックで0.1mg/mLに希釈する。
【0198】
アビジン磁性ラテックスの調製
【0199】
磁性ラテックス(エスタポール(Estapor)、10%固体、バングス・ラボラトリーズ(Bangs Laboratories)、インディアナ州、フィッシャー)を十分に再懸濁し、15mlの円錐管に2ml分注する。磁性ラテックスを12mlの蒸留水に懸濁し、磁石を用いて溶液から10分間分離する。依然磁石中にありながら、10mLの滅菌ピペットを用いて液体を注意深く除去する。この洗浄プロセスをさらに3回反復する。最後に洗浄した後、ラテックスを2mlの蒸留水に再懸濁する。別個の50ml円錐管中で、10mgのアビジン−HS(ニュートラアビジン(NeutrAvidin)、ピエルス、イリノイ州、ロックフォード)を18mlの40mM Tris、0.15M塩化ナトリウム、pH7.5(TBS)に溶解する。ボルテックス処理しながら、希釈したアビジン−HSに洗浄した磁性ラテックス2mlを加え、混合物をさらに30秒間ボルテックス処理する。この混合物を、30分毎に振盪しながら、45℃で2時間インキュベートする。磁石を用いてアビジン磁性ラテックスを溶液から分離し、前述したように、20ml BBSで3回洗浄する。最後に洗浄した後、ラテックスを10ml BBSに再懸濁し、4℃で保存する。
【0200】
使用する直前に、アビジン磁性ラテックスをパニングバッファー(40mM TRIS、150mM NaCl、20mg/mL BSA、0.1% Tween20(フィッシャー・サイエンティフィック、ペンシルバニア州、ピッツバーグ)、pH7.5)中で平衡化する。滅菌15ml遠心管にパニング実験に必要なアビジン磁性ラテックス(200μl/サンプル)を加え、パニングバッファーで10mlにする。この管を磁石上に10分間置き、ラテックスを分離する。前述したように、10mL滅菌ピペットで溶液を注意深く除去する。磁性ラテックスを10mLのパニングバッファーに再懸濁し、2回目の洗浄を開始する。磁性ラテックスをパニングバッファーで全3回洗浄する。最後に洗浄した後、ラテックスをパニングバッファーに再懸濁し、初期アリコート容量とする。
【0201】
M13ファージまたは抗体ファージディスプレイベクター突然変異誘発反応で形質転換された細胞のプレーティング
【0202】
100mm LBアガープレートにプレーティングする場合は200μLの大腸菌XL1−ブルーの一晩培養物に、または、滅菌15ml培養管中の150mmプレートにプレーティングする場合は600μLの一晩細胞に、ファージサンプルを加える。LBトップアガー(100mmプレートに対して3mL、または150mmプレートに対して9mL、55℃で保存されたトップアガー、付録A1、モレキュラー・クローニング・ア・ラボラトリーズ・マニュアル(Molecelar Cloning, A Laboratory Manual)、(1989)サムブロック(Sambrook),J)を加えた後、混合物を、アガー表面の過剰な水分を除去するよう予熱しておいた(37℃〜55℃)LBアガープレート上に等分に分配する。プレートを、トップアガーが固化するまで室温で冷却する。指示通り、プレートを反転させ、37℃でインキュベートする。
【0203】
アルカリホスファターゼコンジュゲートを含むニトロセルロースフィルターの現像
【0204】
ニトロセルロースフィルターをLBアガープレート上で一晩インキュベートした後、メンブランピンセットを用いてプレートからフィルターを注意深く回収し、抗原−APコンジュゲートを用いる場合は、カゼインブロック(1%カゼイン(ハマーステン(Hammersten)等級、リサーチ・オーガニックス(Research Organics)、オハイオ州、クリーブランド)を含むブロック)、またはヤギ抗マウスκ−AP(サザン・バイオテクノロジー・アソシエーツ社(Southern Biotechnology Associates Inc)、アラバマ州、バーミンガム)を用いる場合はブロック中のいずれかで、2時間インキュベートする。2時間後、フィルターをAPコンジュゲートとともに2〜4時間インキュベートする。抗原−APコンジュゲートをカゼインブロックに最終濃度1μg/mLで希釈し、ヤギ抗−マウスκ−APコンジュゲートをブロックに最終濃度1μg/mLで希釈する。フィルターを40mM TRIS、150mM NaCl、0.05% Tween20、pH7.5(TBST)(フィッシャー・ケミカル、ペンシルバニア州、ピッツバーグ)で各5分間3回洗浄する。最後の洗浄の後、フィルターを、0.2M 2−アミノ−2−メチル−1−プロパノール(JBLサイエンティフィック(Scientific)、カリフォルニア州、サン・ルイス・オビスポ)、0.5M TRIS、0.33mg/mLニトロブルーテトラゾリウム(フィッシャー・サイエンティフィック、ペンシルバニア州、ピッツバーグ)および0.166mg/mL 5−ブロモ−4−クロロ−3−インドリル−ホスフェート、p−トルイジン塩を含有する溶液中で現像する。
【0205】
重鎖上のタグ、およびκ鎖上のポリヒスチジン配列を用いないBNPペプチドに対するポリクローナルファージの濃縮
【0206】
この実施例では、BNPペプチドに対するファージライブラリーの複数ラウンドのスクリーニングを記載する。何ラウンドかのスクリーニングを、抗体の多重コピーをファージが提示するための濃縮のラウンドと入れ替える。ファージがいずれかの軽鎖を提示するパーセンテージと注目するBNPペプチドに対して特異的な親和性を有するFab断片(以下、「抗原」と呼ぶ)をファージが提示するパーセンテージを、スクリーニングの各ラウンドの後に測定する。
【0207】
第1ラウンド抗体ファージは、前述したようにBS39ウラシル鋳型を用いて調製する。突然変異誘発DNAの2回のエレクトロポレーションの効率は9.7×107PFUおよび8.3×107PFUであった。両エレクトロポレーションから得たファージを合わせ、パニングバッファーで3.2mlに希釈する。ファージを、15mLのプラグシールキャップ付ディスポーザブル滅菌遠心管に2〜1mLのアリコートに分注する。各ファージアリコートに抗原−ビオチン(10μL、10-6M保存濃度)を加える。ファージサンプルを2〜8℃で一晩インキュベートする。
【0208】
インキュベートした後、ファージサンプルをアビジン磁性ラテックスを用いて取り出す。サンプルあたり、平衡化したアビジン磁性ラテックス(実施例11参照)、200μLラテックスをファージとともに室温で10分間インキュベートする。10分後、各ファージサンプルに約9mLのパニングバッファーを加え、磁石を用いて磁性ラテックスを溶液から分離する。磁石中で10分後、結合していないファージを、10mL滅菌ピペットで注意深く除去する。次いで、磁性ラテックスを10mLのパニングバッファーに再懸濁し、2回目の洗浄を開始する。ラテックスを前述したように全5回洗浄する。各洗浄について、管を磁石中に10分間置き、結合していないファージを磁性ラテックスから分離する。5回目の洗浄の後、磁性ラテックスを1mL TBSに再懸濁し、1.5mLの管に移す。この時点でラテックスのアリコートを取り、前述したように、100mm LBアガープレート上にプレーティングする。磁性ラテックスの大部分(99%)を200μL 2×YTに再懸濁し、実施例12に記載したように150mm LBアガープレート上にプレーティングする。100mm LBアガープレートを37℃で6〜7時間インキュベートし、次いで、プレートを室温に移し、ニトロセルロースフィルター(孔サイズ0.45μm、BA85プロトラン(Protran)、シュライシャー・アンド・シュール(Schliecher and Schuell)、ニューハンプシャー州、キーン)をプラーク上にかぶせる。ニトロセルロースフィルターを付けたプレートを室温で一晩インキュベートする。150mmプレートを用いて、磁性ラテックスと結合しているファージを増幅し抗体ファージの次のラウンドを作製する。これらのプレートを37℃で4時間、次いで20℃で一晩インキュベートする。
【0209】
一晩インキュベートした後、抗体ファージを150mmプレートから溶出し、前述したように、アルカリホスファターゼ−抗原を用いてフィルターを発現させる。8mL 2YT培地を菌叢上にピペットで加え、室温で20分間穏やかに振盪することによって150mmプレートから抗体ファージを溶出する。ファージを15mLのプラグシールキャップ付ディスポーザブル滅菌遠心管に移し、LBプレートに由来する細片を、3500rpmで15分間遠心分離することによってペレットにする。次いで、第2ラウンド抗体ファージを新しい管に移す。
【0210】
パニングの第2ラウンドを開始するために、ファージの10-7および10-8希釈液10μLを100mmLBアガープレートにプレーティングすることによって抗体ファージを滴定する。このプレートを37℃で6〜7時間インキュベートし、次いで、プレート上のプラーク数を計数する。また、抗体ファージにおけるκ陽性のパーセンテージをモニターするために、ニトロセルロースフィルターをプレート上にかぶせ、室温で一晩インキュベートする。κ陽性のパーセンテージは無傷のFab断片を提示するファージの割合の尺度である。
【0211】
両第2ラウンド抗体ファージサンプルを、各サンプルをパニングバッファーに最終濃度5×109PFU/mLで希釈し、最終容量を1mLにすることによってプールする(抗
体ファージの力価は約2×1012PFU/mLおよび1.7×1012である)。ファージに抗原−ビオチン(10μL、10-6M保存濃度)を加え、2〜8℃で一晩ファージをインキュベートする。抗体ファージ力価プレート上のニトロセルロースフィルターを、前述したように、ヤギ抗−マウスκAPを用いて発現させる。第2ラウンド抗体ファージを、前述したようにアビジン磁性ラテックスを用いて取り出す。ラテックスをパニングバッファーで洗浄した後、ラテックスを1mL TBSに再懸濁し、1.5mLの管に移す。ラテックスのアリコートを、前述したように、100mm LBアガープレートにプレーティングし、機能的陽性を調べ、ラテックスの残りを150mm LBアガープレートにプレーティングして第3ラウンド抗体ファージを作製する。抗体ファージを滴定し、ファージをパニングバッファーに希釈し、抗原−ビオチンを加え、ファージを2〜8℃で少なくとも16時間インキュベートし、ファージをアビジン磁性ラテックスで取り出し、磁性ラテックスをプレーティングするというこの基本手順を、10ラウンドのパニング継続する。前述したものからの変更は、結合している抗体のアフィニティーを高めるために抗原−ビオチン濃度がより低いということ、および取り出されるファージの数が1010と108の間であるということだけである。
【0212】
抗原−ビオチンに対するパニングの10回目のラウンドの後、抗体ファージを多価ディスプレイのための濃縮のラウンドに付す。濃縮は、提示された軽鎖に融合されているヘキサヒスチジンタグのNi NTAアガロース(キアゲン社(Qiagen Inc.)、カリフォルニア州、チャッツワース)への結合によって達成される。11回目のラウンドの抗体ファージ(2.5mL)を、プラグシールキャップ付15mLのディスポーザブル滅菌遠心管中で2.5mLパニングバッファーに希釈する。以下の手順を用いてNi NTAをパニングバッファーに平衡化する。樹脂(ファージサンプルあたり1mL)を、50mLのプラグシールキャップ付ディスポーザブル滅菌遠心管中で、パニングバッファーで50mLに希釈し、次いで、IEC遠心分離機で、500rpmで1分間ペレットにする。上清を50mLのディスポーザブルピピットを用いて注意深く除去し、2回目の洗浄のために樹脂をパニングバッファーで50mLに再度希釈する。樹脂をパニングバッファー中で平衡化するために、このように樹脂を全4回洗浄する。次いで、平衡化した樹脂をパニングバッファーでその最初の容積に再懸濁する。次いで、平衡化した樹脂(1mL)をファージに加え、管を15分間穏やかに揺り動かす。15分後、IEC遠心分離機で、500rpmで1分間樹脂をペレットにする。上清を10mLディスポーザブルピペットで穏やかに除去し、樹脂を最初の洗浄のために10mLパニングバッファーに再懸濁する。前述したように、樹脂をペレットにし、上清を除去し、樹脂を10mLのパニングバッファーに2回目の再懸濁をする。この手順を全5回のパニングバッファー洗浄のために反復する。5回目の洗浄液を除去した後、樹脂を1mLの溶出バッファー(50mMクエン酸塩、150mM NaCl、pH4.0)に再懸濁し、1.5mLの管に移す。樹脂を1時間穏やかに揺り動かし、抗体ファージを溶出する。1時間後、樹脂をペレットにし(エッペンドルフ遠心分離機で14,000rpm、5分)、樹脂を少しも移さないよう注意しながら、ファージを回収する。ファージ溶液のpHを8に調整するために、1mLのファージサンプルに50μLの1M Tris、pH8.3および46μLの1M NaOHを加える。また、101Lの300mg/mLウシ血清アルブミン(バイエル、イリノイ州、カンカキー)をファージサンプルに加える。前述のように、抗原−ビオチンを用いるパニングの11回目のラウンドのために、得られたファージ溶液(1mL)を15mLのプラグシールキャップ付ディスポーザブル滅菌遠心管に移す。
【0213】
パニングの12回目〜14回目のラウンドを前述のように行い、ここで抗体ファージをNi NTAに結合させ、溶出し、溶出したファージを抗原−ビオチンを用いて取り出す。しかし、ラウンド13において、Ni NTAから溶出したファージに標識していないC末端BNPペプチドを抗原−ビオチンに対して100倍モル過剰で加え、C末端BNPペプチド結合せず、抗原と特異的に結合する抗体を選択する。
【実施例3】
【0214】
生化学的解析
標準的なイムノアッセイ技術を用いてBNPを測定する。これらの技術は、タンパク質標的と特異的に結合する抗体の使用を含む。N−ヒドロキシスクシンイミドビオチン(NHS−ビオチン)を抗体あたり約5のNHS−ビオチン成分の割合で用いて、BNPに対する抗体をビオチン化する。次いで、標準アビジン384ウェルマイクロタイタープレートのウェルにビオチン化した抗体を加え、プレートに結合していないビオチン化抗体を除去する。これによって、マイクロタイタープレートに抗−BNP固相が形成される。別の抗BNP抗体を、標準技術を用い、SMCCおよびSPDP(ピエルス、イリノイ州、ロックフォード)を用いてアルカリホスファターゼにコンジュゲートする。イムノアッセイをTECANジェネシス(Genesis)RSP200/8ワークステーションで実施する。試験サンプル(10μl)をピペットでマイクロタイタープレートのウェルに入れ、60分間インキュベートする。次いで、このサンプルを除去し、ウェルを、150mM NaCl、0.1%アジ化ナトリウム、および0.02%Tween−20を含有する20mMホウ酸塩(pH7.42)からなる洗浄バッファーで洗浄する。次いで、ウェルにアルカリホスファターゼ−抗体コンジュゲートを加え、さらに60分間インキュベートし、その後、抗体コンジュゲートを除去し、洗浄バッファーでウェルを洗浄する。ウェルに基質(アットフォス(AttoPhos)(登録商標)、プロメガ(Promega)、ウィスコンシン州、マディソン)を加え、蛍光産物の形成度を試験サンプル中のBNPの濃度と関連付ける。
【実施例4】
【0215】
DPP阻害剤の合成
【0216】
ペプチドカップリング化学を用いて線状ボロPro化合物を調製することが好ましい。本発明に用いるペプチドカップリング化学法および手順は容易に入手できる。これらの方法を用いる教本の例としては、それだけには限らないが、以下の、参照により本明細書に組み込まれる引用文が挙げられる:P.D.ベイリー(Bailey)、「アン・イントロダクション・トゥー・ペプチド・ケミストリー(An Introduction to Peptide Chemistry)」、ジョン・ウィリー&サンズ(John Wiley & Sons)、1990;ミクロス・ボダンスキー(Miklos Bodansky)、「ペプチド・ケミストリー・ア・プラクティカル・テキストブック(Peptide Chemistry A Practical Textbook)」、スプリンガー−ベルラグ(Springer−Verlag)、1988;ミクロス・ボダンスキー、「プリンシプルズ・オブ・ペプチド・シンセシス、リアクティビティー・アンド・ストラクチャー・コンセプツ・イン・オーガニック・ケミストリー(Principles of Peptide Synthesis, Reactivity and Structure Concepts in Organic Chemistry)」、第16巻、スプリンガー−ベルラグ、1984;およびミクロス・ボダンスキー、「プリンシプルズ・オブ・ペプチド・シンセシス、リアクティビティー・アンド・ストラクチャー・コンセプツ・イン・オーガニック・ケミストリー」第21巻、スプリンガー−ベルラグ、1984。
【0217】
本発明の化合物は、WO98/00439に開示されたようにH−ボロProの合成で開始することができる。H−ボロProの使用は単に例示目的のためであって、本発明の範囲を制限しようとするものではない。WO98/00439に従い、H−ボロProを、従前に開発され、記載された(G.R.フレンケ(flentke)ら、「インヒビション・オブ・ジペプチジル・アミノペプチダーゼIV(DP−IV)バイ・Xaa−ボロProジペプチド・アンド・ユース・オブ・ジーズ・インヒビターズ・トゥー・エクザミン・ザ・ロール・オブ・DP−IV・イン・T−セル・ファンクション(Inhibition of dipeptidyl aminopeptidase IV (DP−IV) by Xaa−boroPro dipeptides and use of these inhibitors to examine the role of DP−IV in T−cell function)」)PNAS(米国)88、1556〜1559頁(1991)、また、米国特許第5,462,928号にも記載されている)合成経路によって調製することができる。あるいは、H−ボロProは新規手順によって製造することもできる(ケリー(Kelly,T.A.ら、「ザ・エフィシャント・シンセシス・アンド・シンプル・レゾルーション・オブ・ア・プロリン・ボロネート・エステル・スータブル・フォー・エンザイム・インヒビション・スタディーズ(The efficient synthesis and simple resolutionof a proline boronate ester suitable for enzyme inhibition studies)」、テトラヘドロン(Tetrahedron)49、1009〜1016頁、(1993))。報告によれば、これら両合成経路ともラセミ化合物のH−ボロProピナンジオールが生成する。
【0218】
WO98/00439によれば、まず、ラセミ化合物のH−ボロProを、光学活性ブロッキング保護基((1S、2S、3R、5S)−+−ピナンジオール異性体)を用いて結晶化によって分割し、次いで、同位体的に純粋なL−ボロProおよびD−ボロProをリジンの立体化学的に純粋なL異性体とカップリングすることによって、Z−Lys−ボロProの立体化学的に純粋なL、LおよびL,Dジアステレオマーを調製する(米国特許第5,462,928号参照)。あるいは、ラセミ化合物のH−ボロProをL−Lysによってカップリングし、ジアステレオマーのPro−ボロProについて従前に記載されているように(W.G.グートハイル(Gutheil)およびW.W.バコブチン(bachovchin)、「セパレーション・オブ・L−Pro−DL−ボロPro・イントゥー・イッツ・コンポーネント・ジアステレオマーズ・アンド・カイネティック・アナリシス・オブ・ゼア・インヒビション・オブ・ジペプチジル・ペプチダーゼ・IV.ア・ニュー・メソッド・フォー・ザ・アナリシス・オブ・スロー、タイト−バインディング・インヒビション(Separation of L−Pro− DL−boroPro into Its Component Diastereomers and Kinetic Analysis of Their Inhibition of Dipeptidyl Peptidase IV. A New Method for the Analysis of Slow, Tight−Binding Inhibition)」)、バイオケミストリー(Biochemistry)32、8723〜8731頁、(1993))、逆相HPLCを用いて得られたジアステレオマーのZ−Lys−ボロPro−ジエステルをその成分L,DとL、Lジアステレオマーに分離することによって、Lys−ボロProのL,LおよびL,Dジアステレオマーを高い光学純度で調製する。
【実施例5】
【0219】
ジペプチジルペプチダーゼの精製
【0220】
以下の実施例はジペプチジルペプチダーゼIVについての例示的なものである:ジペプチジルペプチダーゼIIは、米国特許第6,485,955号の方法と同様に単離し、用いることができる。
【0221】
ブタ酵素を、いくつかの改変を加えながらも、従前に記載されたように(1)精製する。15〜20個体の動物から腎臓を獲得し、皮質を切り取り、−80℃で凍結する。凍結組織(2000〜2500g)を、ワーリングブレンダー中、12Lの0.25Mスクロース中でホモジェナイズする。ホモジェネートを37℃に18時間静置し、DPP4の細胞膜からの切断を促す。切断ステップの後、ホモジェネートを4℃、7000×gで20分間遠心分離することによって清澄化し、上清を回収する。固体硫酸アンモニウムを60%飽和まで加え、10,000×gで遠心分離することによって沈殿物を回収し、廃棄する。上清にさらなる硫酸アンモニウムを80%飽和まで加え、80%ペレットを回収し、20mM Na2HPO4、pH7.4に溶解する。
【0222】
20mM Na2HPO4、pH7.4に対して透析した後、10,000×gで遠心分離することによって調製物を清澄化する。次いで、清澄化した調製物を、同バッファー中で平衡化したConAセファロース300mlにアプライする。一定のA280までバッファーで洗浄した後、カラムを5%(wt/vol)メチルα−D−マンノピラノシドで溶出する。活性画分をプールし濃縮し、5mM酢酸ナトリウム、pH5.0に対して透析する。透析した物質を同バッファー中で平衡化したファルマシア(Pharmacia)・リソース(Resource)Sカラム100mlに流す。フロースルー物質を回収すると、酵素活性のほとんどが含まれている。再度、活性物質を濃縮し、20mM Na2HPO4、pH7.4中で透析する。最後に、濃縮した酵素をファルマシアS−200ゲル濾過カラムでのクロマトグラフィーに付し、低分子量夾雑物を除去する。還元性SDS−PAGEによってカラム画分の純度を分析し、最も純度の高い画分をプールし、濃縮する。精製した酵素を−80℃で20%グリセロール中に保存する。
【実施例6】
【0223】
ジペプチジルペプチダーゼのアッセイ
【0224】
酵素は、ナガツら、アナリティカル・バイオケミストリー、74、466〜76頁、1976に従前に記載されたように、定常状態条件下で、基質としてBNPを用い、以下の改変を加えてアッセイする。反応液は、100μLの最終容量中、100mM ACES、52mM TRIS、52mMエタノールアミン、500μM 基質、0.2% DMSO、および4.5nM酵素、25℃、pH7.4を含む。陽性化合物の解析には、基質と阻害剤濃度双方の関数として定常状態動力学的阻害定数を求める。完全阻害実験は、11の基質濃度および7の阻害剤濃度を含め、3連の測定を行う。Kiが20nM未満である強力結合阻害剤については、酵素濃度を0.5nMに下げ、反応時間を120分に増加する。3枚のプレートからプールしたデータセットを競合的、非競合的、不競合的阻害のいずれかに適当な方程式に当てはめる。
【実施例7】
【0225】
ナトリウム利尿ペプチドの化学的脱グリコシル化
【0226】
N2で飽和したガラス管において、50μgのタンパク質を、100μlのトリフルオロメタンスルホン酸/アニソール(2:1、v/v)試薬とともに暗黒下、4℃で2時間インキュベートする。−20℃の60%(v/v)ピリジンを添加することによって反応を停止する。タンパク質を、25mMリン酸ナトリウムバッファーpH7.0に対して十分に透析する。
【実施例8】
【0227】
ナトリウム利尿ペプチドの酵素的脱グリコシル化
【0228】
40μLのサンプルに2μLの25×プロテアーゼ阻害剤カクテル(シグマ(Sigma)、カタログ番号P2714)、1μLのO−グリカナーゼ(プロザイム(prozyme)、カタログ番号GK80090)、3μLのシアリダーゼA(プロザイム、カタログ番号GK80040)および8μLの200mMリン酸ナトリウムバッファーpH7.0を加える。この混合物を穏やかにボルテックス処理し、20℃で4時間インキュベートする。
【実施例9】
【0229】
質量分析によるナトリウム利尿ペプチドの解析
【0230】
抗体捕獲表面の調製
3μLの抗体溶液(ホウ酸緩衝生理食塩水pH8.0(「BBS」)中、0.25mg/mLの抗BNPモノクローナル抗体)を、PS10プロテインチップアレイ(サイファージェン(Ciphergen)、カタログ番号C553−0044)の適当なスポットにアプライし、このチップを加湿チャンバー中に入れ、20℃で3時間穏やかに攪拌する。抗体溶液を除去し、アレイスポットを3μLの1.5mg/mL BSA/0.1%TritonX−100/0.5M Tris−HCl pH8.0で2回洗浄する。2回目の洗浄で、チップを加湿チャンバー中に、攪拌せずに20℃で3時間入れる。この洗浄の後、アレイを5mM HEPES pH7.5中に浸漬し、過剰のバッファーを除去する。
【0231】
BNPの捕獲
BIOMECロボットピペッティングステーション(ベックマン・インストルメンツ(Beckman Instruments))を用いて、アレイを150μLのBBS中、1%TritonX−100で10分間、150μLのBBS中、10%PEG300/0.1%TritonX−100で10分間、および150μLのBBS中、0.2%Triton X−100で各5分間を3回にて、洗浄する。40μLのBBS中、0.2%TritonX−100および40μLの脱グリコシル化サンプル(または対照サンプル)をアプライし、穏やかに攪拌しながら4℃で一晩インキュベートする。
【0232】
エネルギー吸収マトリックスおよびMS解析の適用
このインキュベーションの後、アレイを150μLの1M尿素/0.1%CHAPS/0.3M KCl/50mM Tris−HCl pH7.5で各1分間、3回洗浄し、300μLの5mM HEPES pH7.5で各3秒間、3回洗浄する。過剰のバッファーを除去し、光沢が全く見えなくなるまでアレイを風乾させる。低分子量の解析には(M/Z<6000)、エネルギー吸収マトリックス(「EAM」)のように適当なスポットに1μLの、0.5%トリフルオロ酢酸(ピエルス、カタログ番号28904)/50%アセトニトリル(ピエルス、カタログ番号20062)中、20%α−シアノ−4−ヒドロキシ桂皮酸(CHCA、サイファージェン、カタログ番号C300−0001)をアプライする。高分子量解析には(M/Z≧6000)、EAMのように適当なスポットに、1μLの、0.5%トリフルオロ酢酸/50%アセトニトリル中、50%シナピン酸(SPA、サイファージェン、カタログ番号C300−0002)をアプライする。スポットを風乾させ、適当なEAMの2回目の1μLの液滴をアプライする。
【0233】
サイファージェン・プロテインチップ・リーダー・モデルPBS IICを用いてMSスペクトルを獲得する。低分子量解析には、以下の機器パラメータを用いる:ハイマスは70kDa、2kDa〜15kDaで最適に設定する;出発レーザー強度を165に設定する;出発検出感度は9に設定する;質量偏向器は1kDaに設定する;獲得方法はSELDI定量に設定する;SELDI獲得パラメータ=26、デルタ=10、トランシエント・パー(transients per)=18、エンディング・ポジション(ending position)=76、および強度で5ショットを含むウォーミング・ポジション(warming positions)=175。高分子量解析には、以下の機器パラメータを用いる:ハイマスは70kDa、3kDa〜30kDaで最適に設定する;出発レーザー強度を200に設定する;出発検出感度は9に設定する;質量偏向器は2kDaに設定する;獲得方法はSELDI定量に設定する;SELDI獲得パラメータ=24、デルタ=10、トランシエント・パー=13、エンディング・ポジション=74、および強度で3ショットを含むウォーミング・ポジション=210。
【実施例10】
【0234】
BNP分解の阻害
【0235】
2種のヒト血漿サンプルを個々に2つの管に分け、その一方に可逆的DPP阻害剤ジプロチンA(Ile−Pro−Ile)を、1mMの濃度まで加えた。各サンプルをヒトBNP77〜108でスパイクし、この混合物を4℃で一晩維持した。各サンプルを、前述したように、抗体捕獲SELDI質量分析に付した。結果を図1に示す。パネルA(添加なし)およびB(ジプロチンA)が一方の血漿サンプルに相当し、パネルC(添加なし)およびD(ジプロチンA)が2番目の血漿サンプルに相当する。捕獲はヒトBNPを認識する抗体を用いて実施した。
【0236】
全長BNP77〜108は約3466Daの分子量(長い矢じり)に、BNP79〜108(最後から2番目のプロリンで切断が生じている)は約3282Da(短い矢じり)に現れると予想される。パネルAとBおよびCとDを比較すると、DPP阻害剤によってBNP77〜108のBNP79〜108への切断が阻害されている。約2988Daの分子量でBNP79〜106であると推定される第2の切断産物も、ジプロチンA処理によって阻害され、約3173Daの分子量でBNP77〜106であると推定される切断産物が相応して増加している。したがって、アミノ末端ser−proジペプチドの除去は、DPP阻害剤の存在に対して感受性であり、第2のカルボキシル末端ジペプチド切断はそうではない。
【0237】
本発明を、当業者がこれを作製し使用するのに十分なほど詳細に説明および例示してきたが、本発明の趣旨および範囲から逸脱することなく種々の代替、改変および改良は明らかであるはずである。
【0238】
当業者ならば、本発明は記載した目的を実施し、記載した結果および利点、ならびにそれらに内在するものを得るのに十分に適応していることを容易に理解するであろう。本明細書に提供した実施例は、好ましい実施形態の代表であり、例示的なものであり、本発明の範囲を制限しようとするものではない。当業者にとっては、その改変およびその他の用途も生じるであろう。これらの改変は本発明の趣旨内に包含され、特許請求の範囲によって画定されている。
【0239】
当業者ならば、本明細書に開示された本発明に、本発明の範囲および趣旨から逸脱することなく、さまざまな置換、改変をなすことがで可能であることは容易に理解できるであろう。
【0240】
本明細書に記載したすべての特許および出版物は、本発明の属する技術分野の技術者のレベルを示すものである。すべての特許および出版物は、各個々の出版物を具体的、かつ、個別に参照により組み入れるよう示すのと同程度に、参照により本明細書に組み入れる。
【0241】
本明細書に例示的に記載した本発明は、本明細書に具体的に開示されていない、いずれかの要素または要素類、制限または制限類がなくとも、適切に実施できる。したがって、例えば、本明細書の各場合において、用語「含んでなっている」、「本質的にからなる」、および「からなる」のいずれかを、他の2つの用語のいずれかと置き換えることができる。用いてきた用語および表現は、説明用語として用いるものであって制限するものではなく、このような用語および表現の使用には、示され、説明される特徴またはその一部の何らかの等価物を排除する意図は全くなく、特許請求される本発明の範囲内で種々の改変が可能であるということは理解されよう。したがって、本発明が、好ましい実施形態および任意の特徴によって具体的に開示されていたとしても、当業者によって、本明細書に開示された考え方の改変および変法をとることができるということ、ならびにこのような改変および変法は、添付の特許請求の範囲によって画定される本発明の範囲内にあると考えられるということは理解されなくてはならない。
【技術分野】
【0001】
本願は、生物活性ナトリウム利尿ペプチドを測定するための、およびその治療可能性を向上させるための方法および組成物と題された、2003年8月20日に出願された米国特許出願第10/645,874号の一部継続出願であり、生物活性ナトリウム利尿ペプチドを測定するための、およびその治療可能性を向上させるための方法および組成物と題された、2004年2月4日に出願された米国仮特許出願第60/642,086号の優先権を主張し、それらの各々から優先権が主張されており、それらの各々は参照により、すべての表、図および特許請求の範囲を含むその全文が本明細書に組み込まれる。
【0002】
本発明は、医療診断および治療法に関する。
【背景技術】
【0003】
本発明の背景についての以下の議論は、単に読者が本発明を理解するのを補助するために提供するものであって、本発明の先行技術を説明または構成するよう承認されるものではない。
【0004】
ナトリウム利尿ペプチドは、身体においてレニン−アンギオテンシン系の活性に対抗するよう作用する天然に生じる物質群である。3つの主要なナトリウム利尿ペプチド:心房で合成される、心房性ナトリウム利尿ペプチド(ANP)、心室で合成される、脳型ナトリウム利尿ペプチド(BNP)、脳で合成される、C型ナトリウム利尿ペプチド(CNP)がある。
【0005】
成熟ヒトA型ナトリウム利尿ペプチド(ANP)(心房性ナトリウム利尿ペプチドとも呼ばれる)は、心房拡張、アンギオテンシンII刺激、エンドセリン、および交感神経刺激(β−アドレナリン受容体媒介性)に応じて心房筋細胞によって合成され、保存され、放出される、生物学的に活性な28アミノ酸ペプチドである。成熟ANPは、128アミノ酸前駆体分子(プロ−ANP)のタンパク質分解切断によって生じ、プロ−ANP分子のアミノ酸99〜126(ANP99〜126)に相当する生物学的に活性な28アミノ酸ペプチドが生じる。N末端プロホルモンセグメントに由来する線状ペプチド断片も生物活性を有すると報告されている。
【0006】
成熟ヒトB型ナトリウム利尿ペプチド(BNP)(脳型ナトリウム利尿ペプチドとも呼ばれる)は、血圧および体液平衡を調節するナトリウム利尿系に関与する、32アミノ酸、4kDaの生物学的に活性なペプチドである(ボノー(Bonow)、R.O.、サーキュレーション(Circulation)、93、1946〜1950頁、1996)。成熟BNPホルモンは、本明細書では「プロ−BNP」と呼ぶ108アミノ酸前駆体分子のタンパク質分解切断によって生じる。切断によって、「NTプロBNP」と呼ばれる76アミノ酸N末端ペプチド(アミノ酸1〜76)と、BNPまたはBNP32と呼ばれる32アミノ酸成熟ホルモン(アミノ酸77〜108)が生じる。これらの種の各々−NTプロ−BNP、BNP−32およびプレ−プロ−BNPは、ヒト血漿中を循環し得ることが示唆されている(タテヤマら、バイオケミカル・バイオフィジオロジー・リサーチ・コミュニケーション(Biochemical Biophysiology Reseach Communication)185、760〜7頁、1992)、ハント(Hunt)ら、バイオケミカル・バイオフィジオロジー・リサーチ・コミュニケーション、214、1175〜83頁、1995)。
【0007】
ヒト脳における主要な活性ナトリウム利尿ペプチドである、成熟ヒトC型ナトリウム利尿ペプチド(CNP)22アミノ酸ペプチド;CNPはまた、一酸化窒素(NO)と同様に作用する、内皮由来弛緩因子であると考えられている(ダビッドソン(Davidson)ら、サーキュレーション93、1155〜9頁、1996)。CNPは、A型ナトリウム利尿ペプチド(ANP)およびB型ナトリウム利尿ペプチド(BNP)と構造的に関連しているが、ANPとBNPは主に心筋で合成されるのに対し、CNPは血管内皮で前駆体(プロ−CNP)として合成される(プリケット(Prickett)ら、バイオケミカル・バイオフィジオロジー・リサーチ・コミュニケーション、286、513〜7頁、2001)。CNPは動脈と静脈の双方に対して血管拡張作用を有すると考えられており、血管平滑筋細胞において細胞内cGMP濃度を高めることによって主に静脈に対して作用すると報告されている。
【0008】
ANPおよびBNPはそれぞれ、心房および心室伸展に応じて放出され、血管緊張低下、副腎皮質におけるアルドステロン分泌の阻害、腎臓におけるレニン分泌の阻害を引き起こす。ANPとBNPの双方ともナトリウム利尿および血管内容量の減少、抗利尿ホルモン(ADH)の拮抗作用によって増幅される作用をもたらす。CNPの生理学的作用はANPおよびBNPのものとは異なり、CNPは降圧効果を有するが、有意な利尿またはナトリウム利尿作用はない。特定の疾病状態では、ナトリウム利尿ペプチドの血管レベルの増加が見出されており、このことは、脳卒中、うっ血性心不全(CHP)、心虚血、全身性高血圧、および急性心筋梗塞をはじめとする疾病の病態生理学における役割を示唆する。例えば、各々、すべての表、図および特許請求の範囲を含むその全文が本明細書に組み入れられる、WO02/089657、WO02/083913およびWO03/016910を参照。当業者には、ナトリウム利尿ペプチドの多数の非ヒト相同体が知られている。
【0009】
ナトリウム利尿ペプチドは、単独で、集団的に、および/またはさらなるタンパク質とともに、種々の循環器症状において疾病マーカーおよび予後の指標として利用できる。例えば、心室で合成されるBNPは、左心室圧、呼吸困難の量、および神経ホルモン調節の状態と相関があるため、このペプチドが心疾患の第1の潜在マーカーとなっている。血漿BNPの濃度の測定は、病因論およびLV収縮機能障害の程度にかかわらず、明らかな心不全を発症する可能性があり得る、および心血管系イベントの危険の高い、種々の心臓異常を有する患者を同定するための、極めて効果的かつ費用効率の高い集団検診技術として発達している。CHF患者の診断および管理を補助する簡単な血液試験を見出すことが、この疾病にかかる驚異的な費用に対して好影響をもたらすことは明確である。
【0010】
循環からのナトリウム利尿ペプチドの除去は、主に、循環におけるクリアランス受容体との結合および酵素分解によって影響を受ける。例えば、チョー(Cho)ら、ハート・ディジーズ(Heart Disease)1、305〜28頁、1999、スミス(Smith)ら、ジャーナル・オブ・エンドクリノロジー(Journal of Endocrinology)167、239〜46頁、2000参照。さらに、ヒトプロ−BNPは、血清中でプロセシングされ、その結果、循環プレ−プロ−BNPが無傷の108アミノ酸型である可能性は低いと報告されている。ハント(Hunt)ら、ペプチデス(Peptides)18、1475〜81頁、1997。ナトリウム利尿ペプチドの分解は中性エンドペプチダーゼによって媒介されると考えられている。例えば、ノーマン(Norman)ら(バイオケミカル・バイオフィジオロジー・リサーチ・コミュニケーション28、175、22〜30頁、1991)は、中性エンドペプチダーゼはヒトBNPを残基2と3の間、残基4と5の間、および残基17と18の間で切断できると報告している。同様に、リンドバーグ(Lindberg)およびアンダーソン(Andersson)(レギュラトリー・ペプチデス(Regulatory peptides)47、53〜63頁、1993)は、ヒトANPは残基3と4の間および残基14と15の間で切断されると報告している。この加水分解産物の生物活性は、無傷のANPよりも約500倍低かった。さらに、クネヒト(Knecht)ら、(ライフ・サイエンシズ(Life Sciences)71、2701〜12頁、2002)は、心不全では腎臓の中性エンドペプチダーゼがアップレギュレートされ、ナトリウム利尿ペプチドレベルが増加している状態と報告している。このため、中性エンドペプチダーゼは循環器疾患の治療における阻害の標的となってきた。例えば、コルチ(Corti)ら、サーキュレーション104、1856〜62頁、2001参照。
【0011】
ナトリウム利尿ペプチドの、特に、血液由来サンプル(例えば、血清、血漿、全血)中での安定性に関する混乱が報告されている。ANPは、BNPよりも中性エンドペプチダーゼのよりよい基質であると報告されている。同様に、シミズら、(クリニカ・ケミカ・アクタ(Clinica Chemica Acta)305、181〜6頁、2001)、ゴビネ−ジョージ(Gobinet−Georges)ら(クリニカル・ケミストリー・アンド・ラボラトリー・メディシン(Clinical Chemistry and Laboratory Medicine)38、519〜23頁、2000)およびマードック(Murdoch)ら(ハート(Heart)78、594〜7頁、1997)は、BNPは特定の血液由来サンプル中では、または血液が特定の条件下で採取される場合には安定であると報告している。シミズらによるより最近の報告(クリニカ・ケミカ・アクタ316、129〜35頁、2002)では、全血中のBNPの94%が、2アミノ末端残基が除去されている消化型であったこと、および血漿中のBNPはいくつかの未同定の型に分解されていたことが示されている。
【発明の概要】
【課題を解決するための手段】
【0012】
本発明は幾分かは、サンプル中の生物活性ナトリウム利尿ペプチド、またはその断片の存在または量を調べるよう設計された組成物および方法に関する。ナトリウム利尿ペプチドの分解は、特に、ナトリウム利尿ペプチドの組織への放出の誘引となるイベントの発生とサンプルを得るか分析する時間との間の経過時間、存在するタンパク質分解酵素の量などの関数であり得る進行中のプロセスである。この分解によって、生物学的機能が低下したか、これを失ったナトリウム利尿ペプチドの循環量が生じ得る(本明細書では、便宜上、ナトリウム利尿ペプチドの「不活性断片」と呼ぶ)。
【0013】
1種以上のナトリウム利尿ペプチドのアッセイを設計する際に、この分解を考慮しないと、注目するナトリウム利尿ペプチドの生物活性型とナトリウム利尿ペプチドの不活性断片の双方を検出するアッセイとなる場合もある。これによって、実際、注目するナトリウム利尿ペプチドが実際には不活性断片に分解されており、アッセイ結果が目的とする分析物をサンプル中に最初に存在する不活性断片のプールと区別できないことによって混乱している場合に、アッセイが特に良好な安定性を示す(すなわち、注目する分析物がサンプル貯蔵の間アッセイに対して失われない)という結論を導くことがある。生物活性型は被験体の生理学的状態とより相関がある場合があるため、また疾病を患っている被験体においてアップレギュレートされたタンパク質分解酵素が、非常に注目される可能性のある被験体において不活性断片の特に大きなプールをもたらす場合があるために、本明細書に記載された組成物および方法は、当業者に対し、生物活性型に特異的でないアッセイと比較して改善された診断および予後情報を提供できる。
【0014】
本明細書に記載した方法および組成物は、当技術分野における、脳卒中、うっ血性心不全(CHF)、心虚血、全身性高血圧、および/または急性心筋梗塞をはじめとする種々の循環器疾患の診断および識別に用いるための、迅速で、感受性のある、特異的な診断アッセイの必要性を満たし得る。さらにまた、本発明の方法および組成物を用いて患者の治療を容易にし、さらなる診断および/または予後指標および指標パネルを開発できる。
【0015】
その結果、第一の態様では、本発明は、生物活性ナトリウム利尿ペプチドを検出するが、ナトリウム利尿ペプチドの1種以上の生物学的不活性断片からのシグナルは少なくとも5分の1に低下し、好ましくは、これを感知できるほど検出しないアッセイを実施することを含んでなる、サンプル中のナトリウム利尿ペプチドの存在または量を検出する方法に関する。生物学的不活性断片としては、生物活性ナトリウム利尿ペプチドのN末端またはC末端のいずれかまたは双方から残基が除去されているもの、および/またはナトリウム利尿ペプチドの分子内ジスルフィド結合によって形成されたループが切断されているものが挙げられる。このような生物学的不活性断片は、例えば、生物活性ナトリウム利尿ペプチド中の1以上のペプチド結合を切断することによって形成され得る。
【0016】
関連態様では、本発明は、無傷のナトリウム利尿ペプチドを検出するが、無傷のナトリウム利尿ペプチドのある部分、好ましくは、少なくともN末端部分が除去されると生じる等モル量のペプチドからのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほど検出しないアッセイを実施することを含んでなる、サンプル中のナトリウム利尿ペプチドの存在または量を検出する方法に関する。
【0017】
種々の実施形態では、本発明は、BNP77〜108を検出するが、等モル量のBNP94〜108からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、BNP77〜108を検出するが、BNP90〜108からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、BNP77〜108を検出するが、BNP81〜108からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、BNP77〜108を検出する
が、BNP79〜108からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、BNP77〜108を検出するが、BNP77〜106からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、および/またはBNP77〜108を検出するが、BNP79〜106からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイを実施することを含んでなる、サンプル中のBNPの存在または量を検出する方法に関する。
【0018】
種々のさらなる実施形態では、本発明は、BNP1〜76を検出するが、等モル量のBNP38〜76からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、BNP1〜76を検出するが、BNP24〜76からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、BNP1〜76を検出するが、BNP12〜76からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、BNP1〜76を検出するが、BNP3〜76からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、BNP1〜76を検出するが、BNP1〜73からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、および/またはBNP1〜76検出するが、BNP3〜73からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイを実施することを含んでなる、サンプル中のBNPの存在または量を検出する方法に関する。
【0019】
さらにその他のさらなる実施形態では、本発明は、ANP99〜126を検出するが、等モル量のANP113〜126からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、ANP99〜126を検出するが、ANP105〜126からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、ANP99〜126を検出するが、ANP102〜126からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、ANP99〜126を検出するが、ANP99〜124からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイ、および/またはANP99〜126を検出するが、ANP102〜124からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しないアッセイを実施することを含んでなる、サンプル中のANPの存在または量を検出する方法に関する。
【0020】
以下に説明するように、このようなアッセイは、当業者に公知の種々の方法で設計できる。好ましいアッセイはイムノアッセイであるが、他の方法も当業者に周知である(例えば、バイオセンサーの使用、または当技術分野で公知のナトリウム利尿ペプチドの天然受容体の使用)。適していれば、どんなイムノアッセイを利用してもよい。例えば、分析物結合を直接検出する(例えば、エリプソメーターによる検出によって)アッセイ、酵素結合免疫測定法(ELISA)、ラジオイムノアッセイ(RIA)、競合結合アッセイ、サンドイッチイムノアッセイなど。抗体と1種以上のナトリウム利尿ペプチド断片との特異的免疫学的結合は、直接的に検出しても間接的に検出してもよい。直接標識としては、抗体に付けた、蛍光または発光タグ、金属、色素、放射性核種などが挙げられる。間接標識としては、当技術分野で周知の種々の酵素、例えば、アルカリホスファターゼ、西洋わさびペルオキシダーゼなどが挙げられる。第2の分子、例えば、検出可能な標識に付着させた抗体を、本明細書では、「抗体コンジュゲート」と呼ぶ。また、当業者ならば、ナトリウム利尿ペプチドの天然受容体が存在すること、およびこれらの受容体もまた、結合アッセイの提供において、抗体と類似の方法で使用できることは理解されよう。
【0021】
無傷のナトリウム利尿ペプチドと比較して、ナトリウム利尿ペプチドの生物学的不活性断片からは部分的にまたは完全に失われているエピトープと結合するよう選択された1種以上の抗体を用いるイムノアッセイを構築することができる。例えば、サンドイッチアッセイでは、固相に結合される抗体を、分子のN末端部分と優先的に結合するよう選択し、標識される抗体を、分子のC末端部分と結合するよう選択すれば、アッセイで分子のNおよびC末端部分の双方を含む分子のみが検出される。あるいは、固相と標識した抗体の双方を、分子のN末端部分と結合するよう選択してもよい。
【0022】
当業者ならば、ナトリウム利尿ペプチドの切断によって、抗体が結合するエピトープのすべてを除去することもできるということは理解されよう(例えば、抗体はN末端領域だけに結合する)。あるいは、エピトープは、分子の線状配列中では連続していないが、溶液中の3次元空間においては関連しているナトリウム利尿ペプチドの部分から形成される場合もあり、その結果、エピトープは、記載したアミノ酸残基よりも多くを含んでなるが、記載したアミノ酸残基の領域の除去の結果、抗体の結合が減少し、ひいてはアッセイにおいてシグナルが喪失する。
【0023】
特定の実施形態では、抗体を、1種以上のナトリウム利尿ペプチドに対する個々の親和性に基づいてではなく、イムノアッセイなどの結合アッセイにおいて得られるシグナルに基づいて選択する。当業者ならば、種々の結合アッセイ形式が当技術分野で公知であること、および1種以上の標的分子に対する抗体の個々の親和性よりも重要である適当なアッセイを構築するための抗体の使用はよくあることであることは認識されよう。例えば、競合結合アッセイは、固体表面に結合している受容体(例えば、抗体)を含んでなる場合がある。試験サンプル中の注目する分析物は、同様に受容体と結合する標識された分子との結合と競合する。受容体と結合している標識された分子の量(したがって、アッセイシグナル)は、試験サンプル中の注目する分析物の量と反比例する。この場合には、固相に付着している単一抗体を用いる。あるいは、サンドイッチイムノアッセイでは、通常、固体表面と結合している一次抗体、および通常、検出可能な標識とコンジュゲートしている二次抗体の各々が、試験サンプル中の注目する分析物と結合する。受容体と結合している標識された分子の量(したがって、アッセイシグナル)は、試験サンプル中の注目する分析物の量と正比例する。
【0024】
本発明のイムノアッセイは、生物活性ナトリウム利尿ペプチドと生物学的不活性ナトリウム利尿ペプチドを、および/または無傷のナトリウム利尿ペプチドとナトリウム利尿ペプチド断片とを識別するよう設計することが好ましい。例えば、好ましいイムノアッセイは、無傷のN末端領域を含んでなるナトリウム利尿ペプチドとN末端領域が失われているナトリウム利尿ペプチドの断片を識別する。イムノアッセイは、同一アッセイ条件下で第2群のポリペプチドの同数の分子から得られるシグナルより少なくとも5倍大きい、第1群のポリペプチドの結合に関連するシグナルをイムノアッセイが提供する場合に、第1群のポリペプチドと第2群のポリペプチド間を「識別する」と考えられており、アッセイを2度までしか実施しない場合には、第1群のポリペプチドの量は最大シグナルを得ることが必要である。このようなアッセイ条件下では、シグナルが少なくとも10倍大きいことがより好ましく、少なくとも20倍大きいことがさらにより好ましく、少なくとも50倍大きいこと、少なくとも100倍大きいこと、またはそれ以上が最も好ましい。そのようなアッセイ条件下で、第1群のポリペプチドの結合に関するシグナルが得られるが、第2群のポリペプチドの同数の分子からバックグラウンドを上回るシグナルが得られない場合、アッセイは第2群のポリペプチドを「感知できるほどに検出しない」。
【0025】
もう1つの態様では、本発明は、生物活性ナトリウム利尿ペプチドと特異的に結合するが、ナトリウム利尿ペプチドの生物学的不活性断片とは特異的に結合しない抗体に応じてシグナルが変わるアッセイを実施することを含んでなる、サンプル中のナトリウム利尿ペプチドの存在または量を検出する方法に関する。前記で論じたように、生物学的不活性断片としては、無傷のナトリウム利尿ペプチドのN末端またはC末端のいずれかまたは双方から残基が除去されているもの、および/またはナトリウム利尿ペプチドの分子内ジスルフィド結合によって形成されるループが切断されているものが挙げられる。好ましい実施形態では、無傷のナトリウム利尿ペプチドと特異的に結合するが、ナトリウム利尿ペプチドのN末端部分が除去されるとナトリウム利尿ペプチドから生じるペプチドとは特異的に結合しない抗体に応じてシグナルが変わる条件下でアッセイを実施する。
【0026】
関連態様では、本発明は、無傷のナトリウム利尿ペプチドと特異的に結合するが、ナトリウム利尿ペプチドのある部分、好ましくは、少なくともN末端部分が除去されると生じるナトリウム利尿ペプチドの断片とは特異的に結合しない抗体に応じてシグナルが変わるアッセイを実施することを含んでなる、サンプル中のナトリウム利尿ペプチドの存在または量を検出する方法に関する。
【0027】
種々の実施形態では、本発明は、BNP77〜108と特異的に結合するが、BNP94〜106とは特異的に結合しない抗体に応じてシグナルが変わるアッセイ、BNP77〜108と特異的に結合するが、BNP90〜108とは特異的に結合しない抗体に応じて変わるアッセイ、BNP77〜108と特異的に結合するが、BNP81〜108とは特異的に結合しない抗体に応じて変わるアッセイ、BNP77〜108と特異的に結合するが、BNP79〜108とは特異的に結合しない抗体に応じて変わるアッセイ、BNP77〜108と特異的に結合するが、BNP77〜106とは特異的に結合しない抗体に応じて変わるアッセイ、および/またはBNP77〜108と特異的に結合するが、BNP79〜106とは特異的に結合しない抗体に応じて変わるアッセイを実施することを含んでなる、サンプル中のBNPの存在または量を検出する方法に関する。
【0028】
種々のさらなる実施形態では、本発明は、BNP1〜76と特異的に結合するが、BNP38〜76とは特異的に結合しない抗体に応じてシグナルが変わるアッセイ、BNP1〜76と特異的に結合するが、BNP24〜76とは特異的に結合しない抗体に応じて変わるアッセイ、BNP1〜76と特異的に結合するが、BNP12〜76とは特異的に結合しない抗体に応じて変わるアッセイ、BNP1〜76と特異的に結合するが、BNP3〜76とは特異的に結合しない抗体に応じて変わるアッセイ、BNP1〜76と特異的に結合するが、BNP1〜73とは特異的に結合しない抗体に応じて変わるアッセイ、および/またはBNP1〜76と特異的に結合するが、BNP3〜73とは特異的に結合しない抗体に応じて変わるアッセイを実施することを含んでなる、サンプル中のBNPの存在または量を検出する方法に関する。
【0029】
その他のさらなる実施形態では、本発明は、ANP99〜126と特異的に結合するが、ANP113〜126とは特異的に結合しない抗体に応じてシグナルが変わるアッセイ、ANP99〜126と特異的に結合するが、ANP105〜126とは特異的に結合しない抗体に応じて変わるアッセイ、ANP99〜126と特異的に結合するが、ANP102〜126とは特異的に結合しない抗体に応じて変わるアッセイ、ANP99〜126と特異的に結合するが、ANP99〜124とは特異的に結合しない抗体に応じて変わるアッセイ、および/またはANP99〜126と特異的に結合するが、ANP102〜124とは特異的に結合しない抗体に応じて変わるアッセイを実施することを含んでなる、サンプル中のANPの存在または量を検出する方法に関する。
【0030】
イムノアッセイからのシグナルは、抗体がシグナルが生じるのに必要な複合体の形成に関与する場合には、「抗体との結合に応じて変わる」と考えられている。例えば、固相抗体および二次抗体コンジュゲートを用いて構築されるサンドイッチイムノアッセイでは、その各々が分析物と結合してサンドイッチを形成しなくてはならず、固相抗体と二次抗体の各々がシグナルが生じるのに必要な複合体の形成に関与している。単一抗体を用い、分析物が分析物コンジュゲートと結合について競合する競合イムノアッセイでは、単一抗体がシグナルが生じるのに必要な複合体の形成に関与している。当業者ならば、多数のさらなるイムノアッセイの構築を提供できることを理解されよう。
【0031】
本明細書に記載したアッセイ法はまた、1種以上のナトリウム利尿ペプチドに対するアッセイに先立ってサンプルを一定期間保存するステップを含んでなる。ナトリウム利尿ペプチドの分解は、保存中も進行するプロセスであり得るため、保存考慮は、分子のN末端部分の喪失を減少させるよう選択しなくてはならない。したがって、保存条件は、ナトリウム利尿ペプチド分解の1種以上の阻害剤の添加を含み得る。以下に論じるように、保存条件は中性エンドペプチダーゼの1種以上の阻害剤および/またはプロリル特異的ジペプチジルペプチダーゼの1種以上の阻害剤を含み得る。このような阻害剤は当技術分野では周知である。例えば、コルチら、サーキュレーション104、1856〜62頁、2001、センテン(Senten)ら、ジャーナル・オブ・コンビナトリー・ケミストリー(Journal of Combinatory Chemistry)、5、336〜44頁、2003、センテンら、バイオオーガニック・アンド・メディシナル・ケミストリー・レターズ(Bioorganic and Medicinal Chemistry Letters)12、2825〜8頁、2002参照。代替法では、またはこのような阻害剤と併用して、保存条件は、低温での、好ましくは、サンプルの氷点よりも低い温度での保存を含み得る。
【0032】
もう1つの態様では、本発明は、記載したアッセイを実施するために設定および準備されたアッセイ装置に関する。本明細書に記載したアッセイを実施するための装置は、複数の、個別の、独立した、アドレス可能な場所、すなわち、その各々が注目する個々の分析物または分析物のセットと関連し、そのうちの1種以上がナトリウム利尿ペプチドである「診断ゾーン」を含むことが好ましい。例えば、複数の個別のゾーンの各々が、異なる分析物を結合するための受容体(例えば、抗体)を含み得る。サンプルを装置で反応させた後、診断ゾーンからシグナルが生じ、結果、これは注目するペプチドの存在または量と相関し得る。
【0033】
さらにもう1つの態様では、本明細書に記載した方法によって測定した、注目する1種以上のナトリウム利尿ペプチドの存在または量を、疾病の有無、または疾病予後(例えば、疾病に関連する将来の有害転帰の可能性)と関連付けることができる。好ましい疾病としては、脳卒中、うっ血性心不全(CHF)、心虚血、全身性高血圧、および/または急性心筋梗塞をはじめとする種々の循環器疾患および脳血管疾患が挙げられる。これらの方法は、本明細書に記載した方法によって1種以上のナトリウム利尿ペプチドの存在または量を調べることと、存在または量を注目する疾病または予後と関連付けることとを含んでなることが好ましい。
【0034】
特定の実施形態では、アッセイから得られるシグナルを、1種以上のナトリウム利尿ペプチドの存在または量と関連付ける必要はなく、むしろ、シグナルを疾病の有無または疾病と関連する将来の有害転帰の可能性と直接関連付けることができる。例えば、シグナルxのレベルは、y pg/mLのナトリウム利尿ペプチドがサンプル中に存在することを示し得る。次いで、そのナトリウム利尿ペプチドのy pg/mLがうっ血性心不全を示すことが表から示され得る。どの程度のナトリウム利尿ペプチドが存在するかを決定せずに、シグナルxのレベルをうっ血性心不全と直接的に単に関連付けることは、同等に有効であり得る。このようなシグナルは本発明の抗体を用いるイムノアッセイから得ることが好ましいが、当業者にはその他の方法も周知である。
【0035】
さらにもう1つの態様では、本発明は、ナトリウム利尿ペプチドのアッセイに用いる1種以上の抗体を選択する方法に関する。これらの方法は、アッセイに用いると、注目する生物活性ナトリウム利尿ペプチドを検出するが、ナトリウム利尿ペプチドの生物学的不活性断片からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほど検出しない抗体を選択することを含んでなる。前述のように、生物学的不活性断片としては、無傷のナトリウム利尿ペプチドのN末端もしくはC末端のいずれかまたは双方から残基が除去されているもの、および/またはナトリウム利尿ペプチドの分子内ジスルフィド結合によって形成されるループが切断されているものが挙げられる。
【0036】
関連態様では、本発明は、アッセイに用いると、注目する無傷のナトリウム利尿ペプチドを検出するが、ナトリウム利尿ペプチドのある部分、好ましくは、N末端部分が除去されるとナトリウム利尿ペプチドから生じる同モル量のペプチドからのシグナルが少なくとも5分の1に低下し、、好ましくは、これを感知できるほど検出しない抗体を選択することを含んでなる、アッセイに用いる1種以上の抗体を選択する方法に関する。
【0037】
種々の実施形態では、本方法は、アッセイに用いるとBNP77〜108を検出するが、同モル量のBNP94〜108からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほど検出しない1種以上の抗体を選択すること、BNP77〜108を検出するが、BNP90〜108からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほど検出しない1種以上の抗体を選択すること、BNP77〜108を検出するが、BNP81〜108からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほど検出しない1種以上の抗体を選択すること、BNP77〜108を検出するが、BNP79〜108からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほど検出しない1種以上の抗体を選択すること、BNP77〜108を検出するが、BNP77〜106からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほど検出しない1種以上の抗体を選択すること、および/またはBNP77〜108を検出するが、BNP79〜106からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほど検出しない1種以上の抗体を選択することを含んでなる。
【0038】
種々のさらなる実施形態では、本方法は、アッセイに用いるとBNP1〜76を検出するが、同モル量のBNP38〜76からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しない1種以上の抗体を選択すること、BNP1〜76を検出するが、BNP24〜76からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しない1種以上の抗体を選択すること、BNP1〜76を検出するが、BNP12〜76からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しない1種以上の抗体を選択すること、BNP1〜76を検出するが、BNP3〜76からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しない1種以上の抗体を選択すること、BNP1〜76を検出するが、BNP1〜73からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しない1種以上の抗体を選択すること、および/またはBNP1〜76を検出するが、BNP3〜73からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しない1種以上の抗体を選択することを含んでなる。
【0039】
その他のさらなる実施形態では、本方法は、アッセイに用いるとANP99〜126を検出するが、同モル量のANP113〜126からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しない1種以上の抗体を選択すること、アッセイに用いるとANP99〜126を検出するが、同モル量のANP105〜126からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しない1種以上の抗体を選択すること、アッセイに用いるとANP99〜126を検出するが、同モル量のANP101〜126からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しない1種以上の抗体を選択すること、アッセイに用いるとANP99〜126を検出するが、同モル量のANP99〜124からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しない1種以上の抗体を選択すること、および/またはアッセイに用いるとANP99〜126を検出するが、同モル量のANP101〜124からのシグナルが少なくとも5分の1に低下し、好ましくは、これを感知できるほどに検出しない1種以上の抗体を選択することを含んでなる。
【0040】
その他の関連態様では、本発明は、ナトリウム利尿ペプチドのアッセイに用いる1種以上の抗体を選択する方法に関する。本方法は、生物活性ナトリウム利尿ペプチドと特異的に結合するが、ナトリウム利尿ペプチドの生物学的不活性断片とは特異的に結合しない1種以上の抗体を選択することを含んでなる。前記で論じたように、生物学的不活性断片としては、無傷のナトリウム利尿ペプチドのN末端もしくはC末端のいずれか、もしくは双方から残基が除去されているもの、および/またはナトリウム利尿ペプチドの分子内ジスルフィド結合によって形成されたループが切断されているものが挙げられる。好ましい実施形態では、無傷のナトリウム利尿ペプチドと特異的に結合するが、ナトリウム利尿ペプチドのN末端部分が除去されるとナトリウム利尿ペプチドから生じるペプチドとは特異的に結合しない抗体に応じてシグナルが変わる条件下でアッセイを実施する。
【0041】
さらにその他の関連態様では、本発明は、無傷のナトリウム利尿ペプチドと特異的に結合するが、ナトリウム利尿ペプチドのN末端部分が除去されると生じるナトリウム利尿ペプチドの生物学的不活性断片とは特異的に結合しない抗体を選択することを含んでなる、アッセイに用いる1種以上の抗体を選択する方法に関する。
【0042】
種々の実施形態では、本方法は、BNP77〜108と特異的に結合するが、BNP94〜108とは特異的に結合しない1種以上の抗体を選択すること、BNP77〜108と特異的に結合するが、BNP90〜108とは特異的に結合しない1種以上の抗体を選択すること、BNP77〜108と特異的に結合するが、BNP81〜108とは特異的に結合しない1種以上の抗体を選択すること、BNP77〜108と特異的に結合するが、BNP79〜108とは特異的に結合しない1種以上の抗体を選択すること、BNP77〜108と特異的に結合するが、BNP77〜106とは特異的に結合しない1種以上の抗体を選択すること、および/またはBNP77〜108と特異的に結合するが、BNP79〜106とは特異的に結合しない1種以上の抗体を選択することを含んでなる。
【0043】
種々のさらなる実施形態では、本方法は、BNP1〜76と特異的に結合するが、BNP38〜76とは特異的に結合しない1種以上の抗体を選択すること、BNP1〜76と特異的に結合するが、BNP24〜76とは特異的に結合しない1種以上の抗体を選択すること、BNP1〜76と特異的に結合するが、BNP12〜76とは特異的に結合しない1種以上の抗体を選択すること、BNP1〜76と特異的に結合するが、BNP3〜76とは特異的に結合しない1種以上の抗体を選択すること、BNP1〜76と特異的に結合するが、BNP1〜73とは特異的に結合しない1種以上の抗体を選択すること、および/またはBNP1〜76と特異的に結合するが、BNP3〜73とは特異的に結合しない1種以上の抗体を選択することを含んでなる。
【0044】
その他のさらなる実施形態では、本方法は、ANP99〜126と特異的に結合するが、ANP113〜126とは特異的に結合しない1種以上の抗体を選択すること、ANP99〜126と特異的に結合するが、ANP105〜126とは特異的に結合しない1種以上の抗体を選択すること、ANP99〜126と特異的に結合するが、ANP101〜126とは特異的に結合しない1種以上の抗体を選択すること、ANP99〜126と特異的に結合するが、ANP99〜124とは特異的に結合しない1種以上の抗体を選択すること、および/またはANP99〜126と特異的に結合するが、ANP101〜124とは特異的に結合しない1種以上の抗体を選択することを含んでなる。
【0045】
もう1つの態様では、本発明の1種以上の抗体および/または抗体コンジュゲートを、ナトリウム利尿ペプチドの存在または量を調べるキットとして提供することもできる。これらのキットは、本明細書に記載したような少なくとも1種のアッセイを試験サンプルで実施するための装置および試薬を含んでなることが好ましい。このようなキットは、1種以上のこのような測定を実施するのに十分な試薬、および/または食品医薬品局(FDA)承認表示を含むことが好ましい。
【0046】
さらにもう1つの態様では、本発明は、患者に用いる治療計画を決定する方法に関する。この方法は、本明細書に記載した方法によって1種以上のナトリウム利尿ペプチドの存在または量を調べることと、存在または量を疾病または予後状態と関連付けることとを含んでなることが好ましい。本明細書に論じたように、脳卒中、うっ血性心不全(CHF)、心虚血、全身性高血圧、急性冠症候群、および/または急性心筋梗塞をはじめとする種々の循環器疾患および脳血管疾患の診断および識別は、ANP、BNP、および/またはCNPレベルと関連付けることができる。診断または予後が得られると、治療計画がその診断と一致するよう選択される。
【0047】
本発明のもう1つの目的は、ナトリウム利尿ペプチドを安定化する組成物および方法を提供することである。このような方法によって、特に循環器疾患の治療のための、ナトリウム利尿ペプチドの治療可能性が向上し得る。数種のナトリウム利尿ペプチド、例えば、プロ−BNP、成熟BNP、およびプロ−ANPは、最後から2番目のプロリン残基を含んでなり、プロリル特異的ジペプチジルジペプチダーゼ(「DPP」)に適した基質である。したがって、成熟BNPは、ANPと比べ、中性エンドペプチダーゼによる分解に対して耐性を示すと報告されているが、DPPは、成熟BNP分子の、ならびにプロ−BNPおよびプロ−ANPの、これまで認識されていない分解経路に相当し得る。さらに、プロリン含有ジペプチドの除去により、種々のナトリウム利尿ペプチドが、その他のペプチダーゼによるさらなる分解に対して開放される可能性がある。ナトリウム利尿ペプチド濃度の上昇によって利益を得ることができる被験体は、単独または中性エンドペプチダーゼ阻害剤と組み合わせた1種以上のDPPの阻害剤で治療でき、かつ/またはナトリウム利尿ペプチドおよび/またはDPP安定性の上昇を示すナトリウム利尿ペプチド類似体で治療できる。さらに、被験体から採取したサンプル中のBNPを、保存の間、これらの同様の阻害剤を用いて安定化することもできる。
【0048】
したがって、一態様では、本発明は、1種以上のナトリウム利尿ペプチドの分解を阻害する方法に関する。この方法は、1種以上のプロリル特異的DPPの阻害剤を、ナトリウム利尿ペプチドの分解を阻害するのに十分な量で投与することを含んでなる。
【0049】
もう1つの態様では、本発明は、ナトリウム利尿ペプチド機能の上昇を必要とする被験体、好ましくは、心不全を患っている被験体を治療する方法に関する。この方法は、1種以上のプロリル特異的DPPの阻害剤を被験体に、好ましくはナトリウム利尿ペプチドの分解を阻害するのに十分な量で投与することを含んでなる。
【0050】
特定の実施形態では、プロリル特異的DPPの阻害剤(類)は、プロ−BNP、成熟BNP、および/またはプロ−ANPが基質である1種以上のDPPに対して選択性である。特異的DPP阻害剤を設計および選択する方法は当技術分野では周知である。例えば、レイティング(leiting)ら、バイオケミカル・ジャーナル(Biochemical Journal)371、525〜32頁、2003、セド(Sedo)ら、フィジオロジカル・リサーチ(Physiological Research)52、367〜72頁、2003、ビルハウアー(villhauer)ら、ジャーナル・オブ・メディカル・ケミストリー(Journal of Medical Chemistry)46、2774〜89頁、2003、センテン(Senten)ら、ジャーナル・オブ・コンビナトリー・ケミストリー5、336〜44頁、2003、センテンら、バイオオーガニック・アンド・メディシナル・ケミストリー・レターズ12、2825〜8頁、2002、ボルロー(Borloo)およびメーステル(Meester)、フェアハンドリンゲン−コニンクリーエ・アカデミー・フォア・ゲネースクンデ・ファン・ベルギーエ(Verhandelingen−Koninklijke Academie voor Geneeskunde van Belgie)56、57〜88頁、1994参照。さらに、DPPは、アンチセンスまたはRNAi構築物によってなど、当業者に公知の方法によって発現レベルで阻害できる。DPPはまた、結合タンパク質、例えば、1種以上のDPPと特異的に結合し、ナトリウム利尿ペプチド基質に対するその活性を妨げる抗体またはその断片の使用によっても阻害できる。
【0051】
本明細書に記載した方法は、1種以上のプロリル特異的DPP阻害剤単独での使用を含んでなる場合もあるし、このような阻害剤を、1種以上の中性エンドペプチダーゼの阻害剤および/またはその他のプロテアーゼ阻害剤と、ならびに/あるいはプロリル特異的DPP阻害剤の不在下での中性エンドペプチダーゼの阻害剤の使用および/または外因的に加えたナトリウム利尿ペプチドと比較してナトリウムペプチド機能の上昇を増強するよう、被験体に外因的に加えた1種以上のナトリウム利尿ペプチドと組みあせてもよい。これらの化合物は薬剤組成物の一部として提供できることが好都合である。
【0052】
好ましい実施形態では、本明細書に記載した治療法を受ける被験体は、脳卒中、うっ血性心不全(CHF)、心虚血、全身性高血圧、および/または急性心筋梗塞からなる群から選択される疾病を患っている。特に好ましい実施形態では、本明細書に記載した治療法を受ける被験体は、BNPレベルに基づいて選択される。例えば、被験体は、少なくとも約80pg/mLという治療を受ける前の血漿BNPレベルに基づいて選択でき、少なくとも約100pg/mLが好ましく、少なくとも約200pg/mLがさらにより好ましく、少なくとも約500pg/mLがいっそうより好ましく、少なくとも約1000pg/mLが最も好ましい。
【0053】
さらにもう1つの態様では、本発明は、プロリル特異的DPPの存在下で安定性の上昇をもたらす(例えば、被験体の血中の注目するナトリウム利尿ペプチドのt1/2の増加によって測定されるような)ナトリウム利尿ペプチドの1種以上の類似体を投与することを含んでなる、ナトリウム利尿ペプチド機能の上昇を必要とする被験体を治療する方法に関する。
【0054】
本発明のさらにもう1つの目的は、グリコシル化されている、注目する1種以上のナトリウム利尿ペプチドの存在または量を調べる方法および組成物を提供することである。グリコシル化されたナトリウム利尿ペプチド中の共有結合している糖鎖残基は、種々のアッセイ法のこのようなペプチドを検出する能力に対して実質的な影響を及ぼし得る。アッセイ条件を注意深く選択することによって、このような影響を軽減することができ、その結果、サンプル中の注目するナトリウム利尿ペプチドの存在または量を表すアッセイ結果が得られる。
【0055】
したがって、もう1つの態様では、本発明は、共有結合している糖鎖残基を含んでなる、サンプル中の注目する1種以上のナトリウム利尿ペプチドの存在または量を検出する方法に関する。これらの方法は、1種以上の注目する前記ナトリウム利尿ペプチドから1種以上の共有結合している糖鎖残基を除去することと、サンプルを注目するナトリウム利尿ペプチドについてアッセイすることとを含んでなる。したがって、アッセイ結果は、前記サンプル中の注目する前記ナトリウム利尿ペプチドの存在または量に関する。種々の実施形態では、1種以上のナトリウム利尿ペプチドから、ペプチドの酵素処理によって、ペプチドの非酵素的化学処理によって、またはこれらの方法の組合せによって共有結合している糖鎖残基を除去できる。
【0056】
NおよびO−結合型糖鎖残基を除去する有効な酵素的方法は、当技術分野では周知であり、N−グリカナーゼ(N−グリコシダーゼとしても知られる)、エンドグリコシダーゼH、エンドグリコシダーゼA、O−グリカナーゼ(エンド−α−N−アセチルガラクトサミニダーゼとしても知られる)、α2−(3,6,8,9)−ノイリミニダーゼ(neuriminidase)、β(1,4)−ガラクトシダーゼ、N−アセチルグルコサミニダーゼ、エンドグリコシダーゼF1、エンドグリコシダーゼF2、および/またはエンドグリコシダーゼF3などの酵素を用いる。この羅列は限定しようとするものではない。
【0057】
共有結合している糖鎖残基をペプチドから除去するための非酵素的化学処理の場合には、非還元O−およびN−結合型オリゴ糖の放出にヒドラジン加水分解が有効であるとわかっている。約60℃でのO−結合型オリゴ糖の最初の穏やかなヒドラジン分解と、それに続く約95℃でのN−結合型オリゴ糖のヒドラジン分解によって、オリゴ糖の選択的および順次的放出を達成できる。例えば、パテール(Patel)およびラレク(Rarekh)、メソッヅ・イン・エンジモロジー(Methods in Engymology)230、58〜66頁、1994参照。しかしながら、このような処理の結果、ポリペプチドが破壊されることもある。穏やかな塩基環境においてアルカリ性水素化ホウ素ナトリウムを利用する、O−結合型オリゴ糖のアルカリ−β−脱離が好ましい場合がある。例えば、グリコバイオロジー(Glycobiology):ア・プラクティカル・アプローチ(A Practical Approach)、フクダ,Mおよびコバタ,A編、291〜328頁、IRL/オックスフォード大学出版、オックスフォード、1993参照。さらに、トリフルオロメタンスルホン酸加水分解を用いてもよい。この方法は通常、無傷のポリペプチドを残すが、グリカンの破壊をもたらす。例えば、エッジ(Edge)、バイオケミカル・ジャーナル376、339〜50頁、2003参照。
【0058】
ペプチドからの糖除去についての前述の方法は、天然(非変性)ポリペプチドで、および/またはポリペプチドの変性後に使用できる。酵素的処理であろうと、非酵素的処理であろうと、または双方の処理であろうと、処理を用いてナトリウム利尿ペプチドから共有結合している糖鎖残基を除去し、この処理によって注目する1種以上の、好ましくはすべてのグリコシル化ナトリウム利尿ペプチドから、少なくとも約50%の糖鎖残基が除去されることが好ましく、少なくとも約60%がより好ましく、少なくとも約70%がいっそうより好ましくは、少なくとも約80%がさらにより好ましく、少なくとも約90%〜約100%が最も好ましい。ポリペプチドのグリコシル化度は、ポリペプチドの見かけの質量をポリペプチドのアミノ酸成分の質量と比較し、見かけの質量の差し引き分がグリコシル化によるものであると仮定することによって求めることができる。その他の修飾(例えば、酸化、ニトロ化、リン酸化)が起こっていることがわかっている事象では、これら他の修飾による質量も見かけの質量から差し引くことができる。その結果、脱グリコシル化処理後のポリペプチドの見かけの質量を測定することによって、糖鎖残基の除去度をモニターすることができる。ポリペプチドの見かけの質量を測定する方法(例えば、SDSゲル電気泳動、分析用遠心、ゲル浸透クロマトグラフィー、質量分析など)は、当業者には周知である。
【0059】
このようなグリコシル化ナトリウム利尿ペプチドを含むサンプルが、その用語が本明細書で定義される試験サンプルであり得る。このようなサンプル中に存在するグリコシル化ナトリウム利尿ペプチドは、患者から得たサンプル中など、天然に存在するものである場合もあるし、標準サンプルである場合もある。このような標準を構築するのに用いるナトリウム利尿ペプチドは、活性なグリコシル化機能を含む哺乳類組織培養系における組換えによって発現されることが多い。
【0060】
脱グリコシル化ステップ後、本明細書に記載した方法では、当技術分野で公知のどんなアッセイ法も用いることができる。このようなアッセイ法では、アフィニティー分離、ゲル電気泳動、キャピラリー電気泳動、液体クロマトグラフィー、および/またはHPLCなどの分離法を用いて注目する分析物を検出に向けて分離することができる。好ましい実施形態では、種々のサンドイッチ、競合、または非競合アッセイ形式のアフィニティー分離にイムノアッセイ装置および方法を用い、注目する1種以上のナトリウム利尿ペプチドの存在または量と関連のあるシグナルを生じさせることが多い。さらに、特定の方法および装置、例えば、バイオセンサーおよび光学的免疫測定法を用いて、標識された分子を必要とすることなく、分析物の存在または量を調べることもできる。
【0061】
さらに、アッセイ法の一部として質量分析法を用いることも有利であり得る。本明細書において、用語「質量分析」または「MS」とは、イオンをその質量対電荷比、すなわち「m/z」に基づいて、選別、検出および測定する方法を指す。一般に、注目する1種以上の分子をイオン化し、続いてそのイオンを質量分析機器に導入し、そこで磁場と電場の組合せによって、イオンが質量(「m」)および電荷(「z」)に応じて変わる空間中の経路をたどる。例えば、「マス・スペクトロメトリー・フロム・サーフェシズ(Mass Spectrometry From Surfaces)」と題された米国特許第6,204,500号、「メソッヅ・アンド・アパラタス・フォー・タンデム・マス・スペクトロメトリー(Methods and Apparatus for Tande Mass Spectrometry)」と題された同6,107,623号、「DNA・ダイグノスティクス・ベースド・オン・マス・スペクトロメトリー(DNA Diagnostics Based On Mass Spectrmetry)」と題された同6,268,144号、「サーフェス−エンハンスド・フォトラバイル・アタッチメント・アンド・リリース・フォー・デソープション・アンド・デテクション・オブ・アナリテス(Surface−Enhanced Photolabile Attachment And Release For Desorption And Detection Of Analytes)」と題された同6,124,137号、ライト(Wright)ら、「プロテインチップ・サーフェス・エンハンサー・レーザー・デソープション/イオニゼーション(SELDI)マス・スペクトロメトリー:ア・ノベル・プロテイン・バイオチップ・テクノロジー・フォー・デテクション・オブ・プロステート・キャンサー・バイオマーカーズ・イン・コンプレックス・プロテイン・ミクスチャー(Proteinchip surface enhanced laser desorption/ionization (SELDI) spectrometry:a novel protein biochip technology for detection of prostate cancer biomarkers in complex protein mixtures)」、プロステート・キャンサー・アンド・プロスタティック・ディジーズ(Prostate Cancer and Prostatic Diseases)2、264〜76頁(1999)およびマーチャント(Marchant)およびワインバーガー(Weinberger)、「リーセント・アドバンスメント・イン・サーフェス−エンハンスド・レーザー・デソープション/イオニゼーション−タイム・オブ・フライト−マス・スペクトロメトリー(Recent advancements in surface−enhanced laser desorption/ionization−time of flight−mass spectrometry)」、エレクトロフォレシス(Electrophoresis)21、1164〜67頁(2000)参照、なおその各々は参照により、すべての表、図および特許請求の範囲をはじめとするその全文を本明細書に組み入れる。試験サンプル中の分子(例えば、ペプチド)は、当業者に公知のいずれの方法でイオン化してもよい。これらの方法としては、それだけには限らないが、電子イオン化、化学イオン化、高速原子衝撃、電界脱離、およびマトリックス支援レーザー脱離イオン化(「MALDI」)、表面増強レーザー脱離イオン化(「SELDI」)、光子電離、エレクトロスプレー、および誘導結合プラズマが挙げられる。
【0062】
特定の実施形態では、前記で論じたMS法を、アフィニティー精製ステップ、例えば、注目する1種以上のポリペプチドと特異的に結合する抗体との結合と組み合わせることが好ましい。例えば、ネルソン(Nelson)ら、アナリティカル・ケミストリー(Analytical Chemistry)67、1153頁、1995、タブス(Tubbs)ら、アナリティカル・バイオケミストリー(Analytical Biochemistry)289、26頁、2001、ニーダーコフラー(Niederkofler)ら、アナリティカル・ケミストリー73、3294頁、2001参照。
【0063】
糖タンパク質の一特徴として、特有のグリカンの不均一性がある。所与の糖タンパク質の個々の分子が、ポリペプチド鎖中の同じ付着部位に異なる糖鎖を有することは極めて一般的なことである。糖鎖残基中の構造変化はいずれも、グリコフォームと呼ばれる個別の分子サブセットの形成をもたらす。種々の分離法の場合には、このような不均一性が、注目する種々のポリペプチドの電荷および質量の差、および/または注目する種々のポリペプチドの結合マトリックス(例えば、抗体)との結合の差により分析を実施的に困難にする場合がある。さらに、糖鎖は、容易にプロトン化され得るタンパク質などの化合物と同程度には効率よくイオン化されず、また効率よく気相に運ばれないと思われる。
【0064】
したがって、好ましい実施形態では、本明細書に記載した方法は、同一のアッセイステップを、注目する1種以上のナトリウム利尿ペプチドから1種以上の共有結合している糖鎖残基を除去せずに実施することと比較して、注目する1種以上のナトリウム利尿ペプチドの検出の増加を提供する。本明細書において、用語「検出の増加」とは、注目する1種以上の特定のナトリウム利尿ペプチドのアッセイ法から得られるシグナルの増加を指す。このようなシグナルの増加は、注目するすべてのナトリウム利尿ペプチドを検出する能力の上昇を表すものであり得る。例えば、注目する1種以上のナトリウム利尿ペプチドの特定のグリコシル化型とは結合できない抗体は、そういったナトリウム利尿ペプチドの濃度を過小評価するアッセイシグナルをもたらし、あるいは、注目する1種以上のナトリウム利尿ペプチドの特定のグリコシル化型の効率の悪いイオン化が、そういったナトリウム利尿ペプチドの濃度を過小評価するMSによるアッセイシグナルをもたらす。脱グリコシル化は、アッセイシグナルの増加をもたらし得る。このようなシグナルの増加はまた、注目するナトリウム利尿ペプチドの1種以上の具体的な型を検出する能力の上昇を表すものであり得る。例えば、グリカンの不均一性は、分離法(例えば、質量および/または電荷に基づくもの)において単一ポリペプチドの複数の異なる画分への分離をもたらし得る。脱グリコシル化は、そのような異なる画分の単一画分への併合をもたらし、その結果、その画分のアッセイシグナルの向上を提供し得る。
【0065】
種々の実施形態では、同一アッセイステップを、注目する1種以上のナトリウム利尿ペプチドから1種以上の共有結合している糖鎖残基を除去しないで実施することと比べて、注目する1種以上のナトリウム利尿ペプチド検出の増加を、少なくとも約5%、より好ましくは、少なくとも約10%、いっそうより好ましくは、少なくとも約20%、さらにより好ましくは、少なくとも約50%、いっそうより好ましくは、少なくとも100%、最も好ましくは、少なくとも約200%以上増加するアッセイシグナルによって測定する。
【0066】
特に好ましい実施形態では、注目するナトリウム利尿ペプチドはBNPおよび/または1種以上のその関連断片である。用語「関連断片」は、以下に定義する。好ましいBNP関連断片は、プロ−BNP(BNP1〜108)、NT−プロBNP(BNP1〜76)、BNP3〜108、BNP3〜76、およびBNP79〜108からなる群から選択されるものを含んでなる。この羅列は限定しようとするものではない。
【0067】
関連態様では、本発明は、注目する1種以上のナトリウム利尿ペプチドに共有結合している糖鎖残基の存在(または不在)に感受性があるか、感受性がないのいずれかである抗体を選択および使用する方法に関する。抗体は、注目する1種以上のグリコシル化ナトリウム利尿ペプチドと結合する能力についてスクリーニングでき、その結合を、1種以上の共有結合している糖鎖残基を除去した後の注目する1種以上のナトリウム利尿ペプチドと結合する能力と比較することができる。この基準によって実質的に同一の結合を提供する抗体は、「感受性がない」抗体に相当する。この基準によって、グリコシル化型または脱グリコシル化型について実質的に同一でない結合を提供する抗体は、「感受性のある」抗体に相当する。このような抗体を、注目する1種以上のナトリウム利尿ペプチドを検出するためのアッセイ法に用いるために選択すればよい。
【0068】
これに関連して、用語「1種以上の共有結合している糖鎖残基の除去」は、必ずしも、ポリペプチドから既存の糖鎖残基を除去するための酵素的または非酵素的化学処理の使用を指すものではない。そうではなく、1種以上の共有結合している糖鎖残基を欠くポリペプチドを作製する方法であれば、どんな方法も包含することを意味する。例えば、固相合成法を用いて、このような抗体スクリーニング法に用いるために、すべての糖鎖残基を含まないポリペプチドを作製することもできる。本明細書に記載したスクリーニング法において用いるためには、少なくとも約50%の糖鎖残基が、注目する1種以上の、好ましくはすべてのグリコシル化ナトリウム利尿ペプチドから除去されることが好ましく、少なくとも約60%がより好ましく、少なくとも約70%がいっそうより好ましく、少なくとも約80%がさらにより好ましくは、少なくとも約90%〜約100%が最も好ましい。
【0069】
用語「実質的に同一の結合」とは、アッセイに用いると、前記のスクリーニング比較において、互いに約2倍以内であるシグナルを提供する抗体を指す。1倍はシグナルが同等であることを示し、シグナルが2倍以内であることは一方のシグナルが他方のシグナル×2以下であることを示す。実質的に同一の結合を示す抗体は、約1.75倍以内であるシグナルを提供することが好ましく、約1.5倍以内がより好ましく、約1.25倍以内がいっそうより好ましく、約1.1〜1倍以内であることが最も好ましい。
【0070】
このような抗体はまた、注目する1種以上のグリコシル化ナトリウム利尿ペプチドに対して、1種以上の共有結合している糖鎖残基を除去した後の注目する1種以上のナトリウム利尿ペプチドと比較して「実質的に同一の親和性」を有し得る。1倍とは親和性が等しいことを示し、親和性が2倍以内であるということは、一方の親和性が他方のシグナル×2以下であることを示す。実質的に同一の結合を示す抗体は、約1.75倍以内である親和性を提供することが好ましく、約1.5倍以内がより好ましく、約1.25倍以内がいっそうより好ましく、約1.1〜1倍以内が最も好ましい。
【0071】
前述した本発明の要旨は限定するものではなく、本発明の他の特徴および利点は、以下の本発明の詳細な説明から、および特許請求の範囲から明らかとなるであろう。
【図面の簡単な説明】
【0072】
【図1】ジペプチジルぺプチダーゼの阻害剤の不在下(パネルAおよびC)、および存在下(パネルBおおよびD)での、ヒト血清中のBNPおよびその分解産物のマススペクトルを示す図である。
【発明を実施するための形態】
【0073】
本発明は、幾分か、生物活性(例えば、全長)ナトリウム利尿ペプチドを、そのナトリウム利尿ペプチドの生物学的不活性型と識別する方法に関する。本明細書に記載したように、生物活性ナトリウム利尿ペプチドを選択的に認識する抗体を作製し、サンプル中の不活性なナトリウム利尿ペプチド断片の存在によって引き起こされる不正確さを低下させたアッセイに用いることができる。
【0074】
本明細書において、用語「ナトリウム利尿ペプチド」とは、身体においてレニン−アンギオテンシン系の活性に対抗するよう作用する天然に生じるポリペプチドホルモン群のメンバー、およびその生合成前駆体および生物活性断片を指す。3つの主要なヒトナトリウム利尿ペプチドがある:心房で合成される、心房性ナトリウム利尿ペプチド(ANP)、心室で合成される、脳型ナトリウム利尿ペプチド(BNP)、および脳で合成される、C型ナトリウム利尿ペプチド(CNP)。
【0075】
本明細書において、用語「無傷のナトリウム利尿ペプチド」とは、全長プレ−プロ−ナトリウム利尿ペプチド、全長プロ−ナトリウム利尿ペプチド、全長成熟ナトリウム利尿ペプチド、および/または生合成の間のプレ−プロ−またはプロ−ナトリウム利尿ペプチドのプロセシングの際に除去される全長部分を指す。例えば、BNPの場合には、用語「無傷のナトリウム利尿ペプチド」は、全長32アミノ酸成熟BNPホルモン、全長134アミノ酸プレ−プロ−BNP分子、全長108アミノ酸プロ−BNP分子、全長76アミノ酸NT−プロBNP分子、および/または全長26アミノ酸「プレ」ペプチドを包含する。
【0076】
ヒト108アミノ酸BNP前駆体プロ−BNP(BNP1〜108)の配列を配列番号1として示す。成熟、全長BNP(BNP77〜108)には下線が引かれている。
【化1】

(配列番号1)
【0077】
ヒトBNP1〜108は、配列番号2として示される配列を有する大きな前駆体プレ−プロ−BNPとして合成される(「プレ」配列は太字で示されている):
【化2】

(配列番号2)
【0078】
126アミノ酸ヒトANP前駆体プロ−ANP(ANP1〜126)の配列を配列番号3として示す。成熟、全長ANP(ANP99〜126)には下線が引いてある:
【化3】

(配列番号3)
【0079】
ヒトANP1〜126は、配列番号4で示される配列を有する大きな前駆体プレ−プロ−ANPとして合成される(「プレ」配列は太字で示されている):
【化4】

(配列番号4)
【0080】
126アミノ酸ヒトCNP前駆体プロ−CNP(CNP1〜126)の配列を配列番号5として示す。全長成熟CNP型CNP−53(CNP74〜126)は斜体字で示し、全長成熟
CNP型CNP−22(CNP105〜126)には下線が引いてある:
【化5】

(配列番号5)
【0081】
本明細書において、用語「断片」とは、断片が由来するポリペプチドの少なくとも6個の連続するアミノ酸を含んでなるが、完全な親ポリペプチドよりも小さいポリペプチドを指す。したがって、プロ−BNP(BNP1〜108)の断片とは、BNP1〜108の少なくとも6個の連続するアミノ酸を含んでなるポリペプチドを指し、成熟BNPの断片とは、BNP77〜108の少なくとも6個の連続するアミノ酸を含んでなるポリペプチドを指し、プロ−BNPの成熟BNPへの切断によって生じるポリペプチドの断片とは、BNP1〜76の少なくとも6個の連続するアミノ酸を含んでなるポリペプチドを指す。同様に、プロ−ANP(ANP1〜126)の断片とは、ANP1〜126の少なくとも6個の連続するアミノ酸を含んでなるポリペプチドを指し、成熟ANPの断片とは、ANP99〜126の少なくとも6個の連続するアミノ酸を含んでなるポリペプチドを指し、プロ−ANPの成熟ANPへの切断によって生じるポリペプチドの断片とは、ANP1〜98の少なくとも6個の連続するアミノ酸を含んでなるポリペプチドを指し、プロ−CNP(CNP1〜126)の断片とは、CNP1〜126の少なくとも6個の連続するアミノ酸を含んでなるポリペプチドを指し、成熟CNPの断片とは、CNP74〜126またはCNP105〜126の少なくとも6個の連続するアミノ酸を含んでなるポリペプチドを指し、プロ−CNPの成熟CNPへの切断によって生じるポリペプチドの断片とは、CNP1〜73またはCNP1〜104の少なくとも6個の連続するアミノ酸を含んでなるポリペプチドを指す。好ましい実施形態では、断片とは、断片が由来するポリペプチドの少なくとも10個の連続するアミノ酸、断片が由来するポリペプチドの少なくとも15個の連続するアミノ酸、または断片が由来するポリペプチドの少なくとも20個の連続するアミノ酸を含んでなるポリペプチドを指す。
【0082】
本明細書において、用語「関連断片」とは、個々のポリペプチドのまたはその生合成親の1種以上の断片であって、ポリペプチド自体の代理として、または独立マーカーとして検出できるものを指す。例えば、ヒトBNPは、以下、BNP1〜108と呼ぶ、108アミノ酸前駆体分子のタンパク質分解によって得られる。成熟BNPまたは「BNPナトリウム利尿ペプチド」または「BNP−32」は、この前駆体のアミノ酸77〜108に相当する32アミノ酸分子であり、これはBNP77〜108と呼ぶことができる。残りの残基1〜76は、以下、BNP1〜76と呼ぶ。BNP1〜108およびBNP1〜76は「BNP関連断片」の例である。
【0083】
本明細書において、用語「N末端部分の除去によって形成される断片」とは、ナトリウム利尿ペプチド断片に関しては、無傷のペプチドのアミノ末端からの1個以上のアミノ酸の除去によって形成される無傷のナトリウム利尿ペプチドの断片を指す。好ましい実施形態では、このような断片は、無傷のペプチドのアミノ末端からの、少なくとも2、3、4、5、7、10、15、20個、またはそれより多いアミノ酸の除去によって形成される。
【0084】
本明細書において、用語「生物活性」とは、ナトリウム利尿ペプチドおよびその断片に関しては、全長成熟ナトリウム利尿ペプチド、またはロペスら、ジャーナル・オブ・バイオロジカル・ケミストリー(Journal of Biological Chemistry)272、23064〜23068頁、1997に記載されたように測定される、単離し前収縮させたマウス大動脈輪において全長成熟ナトリウム利尿ペプチドによって示される血管緊張低下作用の少なくとも50%を示す、全長成熟ナトリウム利尿ペプチドまたはその前駆体分子に由来するポリペプチドを指す。生物活性ナトリウム利尿ペプチドとしては、全長成熟ナトリウム利尿ペプチドの断片、またはその前駆体型もしくは断片が挙げられる。
【0085】
本明細書において、用語「生物学的不活性」とは、ナトリウム利尿ペプチド断片に関しては、前述の「生物活性」でない、全長成熟ナトリウム利尿ペプチドまたはその前駆体に由来するポリペプチドを指す。本明細書において、用語「生物学的不活性」は、必ずしも、すべての生物活性の完全な喪失を指すものではない。むしろ「生物学的不活性」ナトリウム利尿ペプチド断片は、無傷のナトリウム利尿ペプチドの1以上の生物学的機能の50%未満を示すことが好ましく、25%未満が好ましく、10%未満がより好ましく、1%未満が最も好ましい。この生物学的機能とは、全長成熟ナトリウム利尿ペプチドによって示されるものと比較される、スミス(Smith)ら、ジャーナル・オブ・エンドクリノロジー(Journal of Endorinology)167、239〜46頁、2000に記載されたように測定できる受容体結合、シメカケら、FEBSレターズ(FEBS Letters)309、185〜9頁、1992に記載されたように測定できる培養ラット大動脈平滑筋細胞におけるcGMP産生、および/またはロペスら、ジャーナル・オブ・バイオロジカル・ケミストリー272、23064〜23068頁、1997に記載されたように測定される、全長成熟ナトリウム利尿ペプチドによって示される単離し前収縮させたマウス大動脈輪における血管緊張低下作用であり得る。
【0086】
本明細書において、用語「グリコシル化」とは、ポリペプチドに関しては、共有結合している糖ユニットを、多くの場合グリカン鎖の形で含んでなるポリペプチドを指す。個々の糖ユニットは本明細書では、「共有結合している糖鎖残基」と呼ぶ。真核生物では、ポリペプチドのグリコシル化は、主としてアスパラギン側鎖とのグリコシド結合を介して(「N−結合型」)、セリンまたはスレオニン側鎖グリコシド結合を介して(「O−結合型」)起こり、または、糖鎖橋を介してポリペプチドがホスファチジルイノシトール脂質のアンカーと結合する場合もある(GPI−結合型)。
【0087】
本明細書において、用語「脱グリコシル化」とは、ポリペプチドから1種以上の共有結合している糖鎖残基を除去する方法を指す。すべての共有結合している糖鎖残基の除去が好ましいが、ポリペプチドは、いずれかの共有結合している糖鎖残基が除去されれば脱グリコシル化されたと考えられる。酵素処理、非酵素的処理、または2種の組合せを用いて、ポリペプチドから共有結合している糖鎖残基を除去することができる。ポリペプチドから少なくとも約50%の糖鎖残基が除去されるのが好ましく、少なくとも約60%がより好ましく、少なくとも約70%がいっそうより好ましく、少なくとも80%がさらにより好ましく、少なくとも約90%〜約100%が最も好ましい。
【0088】
本明細書において、用語「精製された」とは、ポリペプチドに関しては、完全な純度を必要とするものではない。そうではなく、注目するポリペプチドが、その他のタンパク質と比較して多量のもの(質量ベースで)が生体サンプル中よりも多い、個別の環境中にあることを示すものに相当する。「個別の環境」とは、単一媒体、例えば、単一溶液、単一ゲル、単一沈殿物などを意味する。精製されたポリペプチドは、例えば、実験室合成、クロマトグラフィー、分取電気泳動、遠心分離、沈殿、アフィニティー精製などをはじめとするいくつかの方法によって獲得できる。注目する1種以上の「精製された」ポリペプチドは、個別の環境のタンパク質含量の少なくとも10%であることが好ましい。1種以上の「実質的に精製された」ポリペプチドは、個別の環境のタンパク質含量の少なくとも50%であり、個別の環境のタンパク質含量の少なくとも75%がより好ましく、個別の環境のタンパク質含量の少なくとも95%が最も好ましい。タンパク質含量は、ハートリー(Hartree)、アナリティカル・バイオケミストリー(Analytical Biochemistry)48、422〜427頁(1972)に記載された、ウシ血清アルブミンをタンパク質標準として用いるローリー(Lowry)ら、ジャーナル・オブ・バイオロジカル・ケミストリー193、265頁、1951の方法の改変を用いて求める。
【0089】
本明細書において、用語「抗体」とは、抗原またはエピトープと特異的に結合できる免疫グロブリン遺伝子または免疫グロブリン遺伝子類またはその断片に由来する、それらをモデルとする、またはそれらによって実質的にコードされるペプチドまたはポリペプチドを指す。例えば、ファンダメンタル・イムノロジー(Fundamental Immunology)、第3版、W.E.ポール(Paul)ら、ラベン・プレス(Raven Press)、N.Y.(1993)、ウィルソン(Wilson)、(1994)ジャーナル・オブ・イムノロジカル・メソッヅ(Journal of Immunological Methods)175、267〜273頁、ヤームッシュ(Yarmush)(1992)ジャーナル・オブ・バイオロジカル・アンド・バイオフィジカル・メソッヅ(Journal of Biochemical and Biophysical Methods)25、85〜97頁参照。用語抗体は、抗原と結合する能力を保持する抗原結合性部分、すなわち、「抗原結合性部位」(例えば、断片、配列、相補性決定領域(CDR)、例えば、(i)Fab断片、VL、VH,CLおよびCH1ドメインからなる一価の断片、(ii)F(ab’)2断片、ヒンジ領域でジスルフィド架橋によって結合している2つのFab断片を含んでなる二価の断片、(iii)VHおよびCH1ドメインからなるFd断片、(iv)抗体の単腕のVLおよびVHドメインからなるFv断片、(v)VHドメインからなるdAb断片(ワード(Ward)ら、(1989)ネイチャー(Nature)341、544〜546頁)、および(vi)単離された相補性決定領域(CDR))を含む。単鎖抗体、モノクローナル抗体、ポリクローナル抗体、および分子生物学的技術によって(例えば、ファージディスプレイ法によって)得られる抗体も、参照により用語「抗体」に含まれる。好ましい抗体は「オムニクローナル」抗体である。これは、各抗体が標的抗原と109M-1〜1010M-1という最小親和性で特異的に結合する、ファージディスプレイライブラリーから選択された種々の抗体分子の混合物を意味する。
【0090】
用語「特異的に結合する」は、抗体が目的とする標的のみと結合することを示すことを意図するものではない。むしろ、抗体は、その目的とする標的に対するその親和性が、非標的分子に対するその親和性と比較して約5倍大きい場合に「特異的に結合する」。標的分子に対する抗体の親和性が、非標的分子に対するその親和性よりも少なくとも約5倍大きいことが好ましく、10倍が好ましく、25倍がより好ましく、50倍がいっそうより好ましく、100倍以上が最も好ましい。好ましい実施形態では、抗体またはその他の結合因子と抗原との間の特異的結合とは、少なくとも106M-1の結合親和性を意味する。少なくとも約107M-1の親和性で結合する抗体が好ましく、約108M-1〜約109M-1、約109M-1〜1010M-1または約1010M-1〜約1011M-1の間が好ましい。
【0091】
親和性は、Kd=koff/konとして算出する(Koffは解離速度定数、konは会合速度定数であり、Kdは平衡定数である)。親和性は、平衡時に種々の濃度(c)で標識したリガンドの結合している画分(r)を測定することによって求めることができる。データはスカッチャード(Scatchard)方程式:r/c=K(n−r)を用いてグラフ化する:
式中、
r=平衡時の結合しているリガンドのモル/受容体のモル、
c=平衡時の遊離リガンド濃度、
K=平衡会合定数、および
n=受容体分子当たりのリガンド結合部位の数。
図解法によってr/cをY軸にrをX軸にプロットし、このようにしてスカッチャードプロットを得る。線の負の傾斜が親和性となる。koffは、結合している標識されたリガンドを標識されていない過剰のリガンドと競合させることによって求めることができる(例えば、米国特許第6,316,409号参照)。ターゲッティング因子の、その標的分子に対する親和性は、少なくとも約1×10-6モル/リットルであることが好ましく、少なくとも約1×10-7モル/リットルであることがより好ましく、少なくとも約1×10-8モル/リットルであることがいっそうより好ましく、少なくとも約1×10-9モル/リットルであることがさらにいっそうより好ましく、少なくとも1×10-10モル/リットルであることが最も好ましい。スカッチャード分析による抗体親和性測定は当技術分野では周知である。例えば、ヴァン・エルプ(van Erp)ら、ジャーナル・オブ・イムノアッセイ(Journal of Immunoassay)12、425〜43頁、1991、ネルソン(Neloson)およびグリズウォルド(Griswold)、コンピュータ・メソッヅ・アンド・プログラムス・イン・バイオメディシン(Computer Methods and Programs in Biomedicine)27、65〜8頁、1988参照。
【0092】
本明細書において、用語「個別の」とは、連続していない表面の領域を指す。すなわち、いずれかの領域の一部ではない境界線が2つの領域の各々を完全に取り囲む場合に、2つの領域は互いに個別である。本明細書において、用語「独立してアドレス可能である」とは、特異的シグナルが得られる表面の個別の領域を指す。当業者ならば、抗体ゾーンも互いに独立であり得るが、表面で互いに接触している場合もあることは理解するであろう。
【0093】
本明細書において、用語「試験サンプル」とは、注目する1種以上の分析物の存在または量が未知であり、アッセイ、好ましくは、イムノアッセイにおいて調べられようとするサンプルを指す。試験サンプルは、被験体、例えば、患者の、診断、予後診断、または評価目的で得られた体液であることが好ましい。特定の実施形態では、このようなサンプルは、進行中の症状の結果または症状に対する治療計画の作用を調べる目的で得る場合がある。好ましい試験サンプルとしては、血液、血清、血漿、脳脊髄液、尿および唾液が挙げられる。さらに、当業者であれば、試験サンプルの中には分画または精製手順、例えば、全血の血清または血漿成分への分離の後により容易に解析できるものもあるということは理解されよう。好ましいサンプルは細菌、ウイルスおよび動物、例えば、イヌおよびネコから得ることができる。特に好ましいサンプルはヒトから得られる。対照目的で、「標準サンプル」とは、注目する1種以上の分析物の存在または量が、1種以上の分析物をアッセイする前に既知であるサンプルを指す。
【0094】
本明細書において、用語「疾病サンプル」とは、所与の疾病を患っていると調べられている被験体から得た組織サンプルを指す。臨床診断の方法は当業者には周知である。例えば、ケリーズ・テキストブック・オブ・インターナル・メディシン(Kelly’s Textbook of Internal Medicine)、第4版、リッピンコット・ウィリアムス&ウィルキンス(Lippincott Williams & Wilkins)、ペンシルバニア州、フィラデルフィア、2000、ザ・メルク・マニュアル・オブ・ダイアグノシス・アンド・セラピー(The Merck Manual of Diagnosis and Therapy)、第17版、メルク・リサーチ・ラボラトリーズ(Merck Research Laboratories)編、ニュージャージー州、ホワイトハウス・ステーション(Whitehouse Station)、1999参照。
【0095】
用語「プロリル特異的ジペプチジルペプチダーゼ」または「プロリル特異的DPP」とは、基質ポリペプチドのN末端からジペプチドを切断し、2番目の位置のプロリン(すなわち、NH2−X−pro−ペプチド−COOH、ここで、Xはアミノ酸であり、proと残りのペプチドの間の結合が切断される)に優先傾向を示すセリンプロテアーゼを指す。このようなプロテアーゼは通常、E.C.3.4.14.X下、例えば、E.C.3.4.14.5および3.4.14.11に分類される。DPPは、DPP−IIおよびDPP−IVなどの種類に分類されることが多い。
【0096】
本明細書において、用語「阻害剤」とは、酵素的(タンパク質分解性)活性に影響を及ぼす分子に関しては、必ずしも全酵素活性の完全な喪失を指さない。むしろ、「阻害剤」は酵素活性を、阻害剤の不在下で示される酵素活性の少なくとも10%減少させ、少なくとも25%がより好ましく、少なくとも50%がいっそうより好ましく、少なくとも75%がさらにより好ましく、少なくとも90%が最も好ましい。in vitroでは、当業者に周知の方法によって酵素活性を直接測定することによって阻害剤の活性を測定することができる。in vivoでも、阻害剤の活性を、酵素基質に対する酵素活性を直接測定することによって測定することができ、または分解酵素の場合には、基質の1/2が被験体(例えば、実験動物)の身体から排除される時間(T1/2)を求めることによって測定することができる。後者の場合には、「阻害剤」は、阻害剤の不在下で示されるT1/2と比較して、T1/2を少なくとも10%延長し、少なくとも25%がより好ましく、少なくとも50%がいっそうより好ましく、少なくとも75%がさらにより好ましく、少なくとも90%が最も好ましい。
【0097】
好ましい阻害剤は、プロテアーゼの特定のクラスに選択的である(例えば、ジペプチジルペプチダーゼに、またはジペプチジルペプチダーゼの特定のサブセットに選択的)。阻害剤は、プロテアーゼの特定のクラスを非標的プロテアーゼより少なくとも10倍より多く阻害する場合に、そのクラスに「選択的」であると考えられており、少なくとも100倍より多くがより好ましく、少なくとも1000倍より多くが最も好ましい。種々のDPP種の選択的阻害剤が知られている。例えば、H−Dab−Pipは、DPP IV(IC50>1mM)(DPP IV;EC3.4.14.5.)を上回ってジペプチジルペプチダーゼII(DPP II;EC3.4.14.2.)に選択的(>7,600倍)であると報告されている。センテンら、バイオオーガニック・アンド・メディシナル・ケミストリー・レターズ12、2825頁、2002。同様に1−[[[2−[(5−シアノピリジン−2−イル)アミノ]エチル]アミノ]アセチル]−2−シアノ−(S)−ピロリジンは、DPP IVの選択的、経口活性阻害剤であると報告されている。アーレン(Ahren)ら、ダイアベーツ・ケア(Diabetes Care)25、869〜75頁、2002。
【0098】
本明細書において、用語「約」は、所与の数の+/−10%を指す。
【0099】
ナトリウム利尿ペプチド断片の、予後および診断マーカーとしての使用
【0100】
前述のように、特定の疾病状態においてナトリウム利尿ペプチドの血中レベルの上昇が見られており、このことは、例えば、脳卒中、うっ血性心不全(CHF)、心虚血、全身性高血圧、および急性心筋梗塞などといった疾病の病態生理における役割を示唆するものである。例えば、WO02/089657、WO02/083913、WO03/016910、ハントら、バイオケミカル・バイオフィジオロジー・リサーチ・コミュニケーション214、1775〜83頁、1995、ベヌゴパール(venugopal)、ジャーナル・オブ・クリニカル・ファーマシー・アンド・セラピューティクス(Journal of Clinical Pharmacy and Therapeutics)26、15〜31頁、2001、およびカーラ(Kalra)ら、サーキュレーション107、571〜3頁、2003参照、なお、それらの各々は、すべての表、図および特許請求の範囲をはじめとするその全文を本明細書に組み入れる。ナトリウム利尿ペプチドは、単独で、集合的に、および/またはさらなるタンパク質とともに、種々の心血管の状態の疾病マーカーおよび予後の指標としても利用できる。
【0101】
循環からのナトリウム利尿ペプチドの除去は分解経路と関連していると報告されている。実際、特定の状況下でナトリウム利尿ペプチドを切断する中性エンドペプチダーゼの阻害剤が特定の循環器疾患の治療において期待できると示唆されている。例えば、トリンダージ(Trindade)およびルーロー(Rouleau)、ハート・フェイリヤー・モニター(Heart Failure Monitor)2、2〜7頁、2001参照。しかし、臨床サンプル中のナトリウム利尿ペプチドの測定は、通常、分子の分解状態を考慮しないで、BNP、ANPおよび/またはCNP、それらの前駆体分子(すわなち、プロ−BNP、プロ−ANP、およびプロ−CNP)、および成熟ナトリウム利尿ペプチドを提供するためのプロ型の切断に起因する断片の測定に焦点を当ててきた。また、ナトリウム利尿ペプチド中のメチオニン残基の酸化によって、還元型と比較して生物活性が低下すると報告されている。コヤマら、ヨーロピアン・ジャーナル・オブ・バイオケミストリー(European Jounal of Biochemistry)203、425〜32頁。本明細書に記載した目的には、メチオニン酸化型を分解産物と考えることができる。
【0102】
本発明は、ナトリウム利尿ペプチドの分解経路およびこの分解の際に形成される産物の理解をもって設計されていないアッセイは、サンプル中の個々のナトリウムペプチドの生物活性型を正確に測定しない場合があることを初めて記載する。注目する生物活性ナトリウム利尿ペプチドとナトリウム利尿ペプチドに由来する不活性断片双方の意図しない測定の結果、サンプル中の生物活性ナトリウム利尿ペプチド濃度を多く見積もる可能性がある。以下、主にBNP関連断片に関して記載するが、当業者ならば、本明細書に記載した一般概念をANPおよびCNP関連断片に等しく当てはまることは理解するであろう。
【0103】
1種以上のナトリウム利尿ペプチドの測定時に、臨床サンプル中に存在し得る種々のナトリウム利尿ペプチドおよびその断片の活性を考慮できないと、いずれかの診断または予後法の精度に重大な結果をもたらす可能性がある。例えば、サンドイッチイムノアッセイをBNPに対して提供し、存在していた生物活性BNPの相当量(例えば、50%)が今や不活性型に分解されている単純な場合を考えてみる。生物活性BNPと不活性断片に共通する領域と結合する抗体を用いて構築されたイムノアッセイでは、サンプル中に存在する生物活性BNPの量が2倍まで多く見積もられ、「偽陽性」結果をもたらす可能性がある。この不正確さは重篤な心不全の場合には特に関連があるが、これは中性エンドペプチダーゼ発現がこれらの患者において高まっていると報告されているためである。クネヒト(Knecht)ら、ライフ・サイエンス(Life Science)71、2701〜12頁、2002。ナトリウム利尿ペプチド分解の原因と考えられている酵素の発現増加は、これらの患者において不活性断片プールを増加させると予測できる。
【0104】
サンプルのナトリウム利尿ペプチド濃度を多く見積もることはまた、患者管理にも重大な結果をもたらし得る。例えば、BNP濃度を用いて、うっ血性心不全の治療が有効であるかどうかを調べることができる(例えば、BNPをモニターして治療で上昇したレベルが正常に戻っているかどうかを確かめることによって)。前記で論じた、同様の「偽陽性」BNP結果は、現治療が有効でないという誤った印象のために医師が治療を継続、増加または改変するよう(例えば、利尿効果のある、ACB阻害剤、ジゴキシン、β−ブロッカー、カルシウムチャンネルブロッカー、および/または血管拡張薬の投与量を増加するよう、または外科的介入を考慮するようにさえ)導く可能性がある。
【0105】
同様に、本発明は、ナトリウム利尿ペプチドのグリコシル化状態を理解して設計されていなかったアッセイは、サンプル中の個々のナトリウム利尿ペプチドの型を同様に正確に測定しない可能性がることを記載する。in vivoで見られる天然グリコシル化プロフィールを欠く、合成ペプチドまたは発現されたペプチドの使用を介してアッセイに用いる抗体を作製することが多い。例えば、BNPについてサンドイッチイムノアッセイを提供し、存在するBNPの相当量(例えば、50%)が、抗体結合を干渉するグリコシル化がなされている単純な場合を考えてみる。このような抗体を用いて構築されたイムノアッセイではサンプル中に存在するBNPの量が2倍低く見積もられ、「偽陰性」結果をもたらす可能性がある。
【0106】
ナトリウム利尿ペプチド間のグリコシル化の相違はまた、個々のナトリウム利尿ペプチドのグリコシル化状態によるナトリウム利尿ペプチド受容体での活性の相違を介してか、生物半減期の相違のいずれかを介して、生物活性の相違をもたらす可能性がある。したがって、本明細書の方法を用いて、特定のグリコシル化状態に特異的なアッセイを作製して、再度このようなアッセイの診断および治療実用性の精度を向上させることができる。
【0107】
当業者ならば、本明細書に記載した方法をポリペプチドに広く適用できること、および本明細書に詳細に記載したナトリウム利尿ペプチドの分析は単に例示的なものであるということを理解されよう。同様の分析の対象となり得るその他の適したポリペプチドとしては、アンギオテンシンI、アンギオテンシンII、バソプレッシン、カルシトニン、カルシトニン遺伝子関連ペプチド、ウロジラチン(urodilatin)、ウロテンシンII、遊離心臓トロポニンI、遊離心臓トロポニンT、トロポニンTおよびトロポニンCの一方または双方を含んでなる複合体中の心臓トロポニンI、トロポニンIおよびトロポニンCの一方または双方を含んでなる複合体中の心臓トロポニンT、総心臓トロポニンI、総心臓トロポニンT、肺サーファクタントタンパク質D、D−二量体、アネキシンV、エノラーゼ、クレアチンキナーゼ、グリコーゲンホスホリラーゼ、心臓型脂肪酸結合タンパク質、ホスホグリセリン酸ムターゼ、S−100、S−100ao、プラスミン−α2−アンチプラスミン複合体、β−トロンボグロブリン、血小板因子4、フィブリノペプチドA、血小板由来成長因子、プロトロンビン断片1+2、P−セレクチン、トロンビン−アンチトロンビンIII複合体、フォン・ウィルブランド因子、組織因子、血栓前駆体タンパク質、ヒト中性エラスターゼ、誘導可能一酸化窒素シンターゼ、リゾホスファチジン酸、マロンジアルデヒド修飾低密度リポタンパク質、マトリックスメタロプロテイナーゼ−1、マトリックスメタロプロテイナーゼ−2、マトリックスメタロプロテイナーゼ−3、マトリックスメタロプロテイナーゼ−9、TIMP1、TIMP2、TIMP3、C−反応性タンパク質、インターロイキン−1β、インターロイキン1受容体アンタゴニスト、インターロイキン−6、腫瘍壊死因子α、可溶性細胞間接着分子−1、血管細胞接着分子、単球走化性タンパク質−1、カスパーゼ−3、ヒトリポカリン型プロスタグランジンDシンターゼ、肥満細胞トリプターゼ、好酸球カチオン性タンパク質、KL−6、プロカルシトニン、ハプトグロビン、s−CD40リガンド、S−FASリガンド、α2アクチン、塩基性カルポニン1、CSRP2エラスチン、LTBP4、平滑筋ミオシン、平滑筋ミオシン重鎖、トランスゲリン(transgelin)、アルドステロン、アンギオテンシンIII、ブラジキニン、エンドセリン1、エンドセリン2、エンドセリン3、レニン、APO B48、膵臓エラスターゼ1、膵臓リパーゼ、sPLA2、トリプシノーゲン活性化ペプチド、αエノラーゼ、LAMP3、ホスホリパーゼD、PLA2G5、タンパク質D、SFTPC、デフェンシンHBD1、デフェンシンHBD2、CXCL−1、CXCL−2、CXCL−3、CCL2、CCL3、CCL4、CCL8、プロカルシトニン、タンパク質C、血清アミロイドA、s−グルタチオン、s−TNF P55、s−TNF P75、TAF1、TGFβ、MMP−11、脳脂肪酸結合タンパク質、CA11、CABP1、CACNA1A、CBLN1、CHN2、切断されたタウ、CRHR1、DRPLA、EGF、GPM6B、GPR7、GPR8、GRIN2C、GRM7、HAPIP、HIF1α、HIP2KCNK4、KCNK9、KCNQ5、MAPK10、n−アセチルアスパルテート、NEUROD2、NRG2、PACE4、ホスホグリセレートムターゼ、PKCγ、プロスタグランジンE2、PTEN、PTPRZ1、RGS9、SCA7、セクレタゴギン(secretagogin)、SLC1A3、SORL1、SREB3、STAC、STX1A、STXBP1、BDNF、シスタチンC、ニューロキニンA、サブスタンスP、インターロイキン−1、インターロイキン−11、インターロイキン−13、インターロイキン−18、インターロイキン−4、およびインターロイキン−10が挙げられる。
【0108】
ナトリウム利尿ペプチドのグリコシル化
【0109】
グリコシル化ポリペプチドは通常、1個以上のアスパラギン残基のアミノ基と結合しているN−結合型糖、1個以上のセリンおよび/またはスレオニン残基のヒドロキシル基と結合しているO−結合型糖またはN−およびO−結合型糖の組合せを含んでなる。本発明はナトリウム利尿ペプチドがグリコシル化されることを初めて証明する。さらに、本発明は、グリコシル化が、特定の方法のサンプル中のナトリウム利尿ペプチドを検出する能力に重大な影響を及ぼし得ることを実証する。
【0110】
いくつかのアプローチを用れば、グリコシル化によって検出スキームにもたらされる可能性のある困難を取り除くことができる。まず、グリコシル化の存在が正確な検出を混乱させている場合には、化学的処理または酵素処理を用いてポリペプチドから糖鎖残基を除去し、それによって注目する1種以上のナトリウム利尿ペプチドを「検出可能な」状態に切り替えることができる。第2に、グリコシル化による干渉を受けない、注目するナトリウム利尿ペプチドの1以上の領域と結合する抗体を注意深く選択して、個々のグリコシル化状態に「非感受性」である抗体を提供することができる。第3に、グリコシル化されているが、脱グリコシル化状態で結合の低下を示す、注目するナトリウム利尿ペプチドの1以上の領域と結合する抗体を注意深く選択して、個々のグリコシル化状態に「感受性」である抗体を提供することができる。第4に、グリコシル化されているが、脱グリコシル化状態で結合の増加を示す、注目するナトリウム利尿ペプチドの1以上の領域と結合する抗体を注意深く選択して、個々のグリコシル化状態に「感受性」である抗体を提供することができる。また、これらのアプローチを必要に応じてまたは所望により組み合わせることもできる。
【0111】
N−およびO−結合型糖鎖残基を除去するための有効な酵素法は、当技術分野では周知であり、N−グリカナーゼ(N−グリコシダーゼとしても知られる)、エンドグリコシダーゼH、エンドグリコシダーゼA、O−グリカナーゼ(エンド−α−N−アセチルガラクトサミニダーゼとしても知られる)、α2−(3,6,8,9)−ノイリミニダーゼ(neuriminidase)、β(1,4)−ガラクトシダーゼ、N−アセチルグルコサミニダーゼ、エンドグリコシダーゼF1、エンドグリコシダーゼF2、および/またはエンドグリコシダーゼF3などの酵素を用いる。この羅列は限定しようとするものではない。このような、ペプチドからの糖除去の酵素法は、天然(非変性)ペプチドに用いることができる。しかし、このような酵素法では、糖ペプチドの変性を用いることができ、これでは脱グリコシル化度を高めることが多い。一般的な変性条件は、ほぼ中性pH(すなわち、約pH6.5と約pH8の間)のバッファー溶液中、約0.01%〜約1%のドデシル硫酸ナトリウム(「SDS」)、および場合によっては、約5mM〜約500mMのβ−メルカプトエタノールの添加を含んでなる。このような方法は、いくつかの脱グリコシル化酵素の安定化に役立ち得る、約0.2%〜約2%のNP−40をさらに含んでなる場合もある。このような変性条件とともに、高温(例えば、約0.5時間〜約48時間の間、約37℃)を用いることもできる。
【0112】
ペプチドから共有結合している糖鎖残基を除去するための非酵素的化学処理の場合には、非還元O−およびN−結合型オリゴ糖の放出においてヒドラジン加水分解が有効であるとわかっている。約60℃でのO−結合型オリゴ糖の最初の穏やかなヒドラジン分解と、それに続く約95℃でのN−結合型オリゴ糖のヒドラジン分解によって、オリゴ糖の選択的および順次的放出を達成できる。例えば、パテールおよびラレク、メソッヅ・イン・エンジモロジー230、58〜66頁、1994参照。しかしながら、このような処理の結果、ポリペプチドが破壊されることもある。穏やかな塩基環境においてアルカリ性水素化ホウ素ナトリウムを利用する、O−結合型オリゴ糖のアルカリ−β−脱離が好ましい場合がある。例えば、グリコバイオロジー:ア・プラクティカル・アプローチ、フクダ,Mおよびコバタ,A編、291〜328頁、IRL/オックスフォード大学出版、オックスフォード、1993参照。さらに、トリフルオロメタンスルホン酸加水分解を用いてもよい。糖間のグリシル結合はトリフルオロメタンスルホン酸による切断に感受性であるが、ペプチド結合は長期の処理に対してでさえ安定であるため、この方法は通常、無傷のポリペプチドを残すが、グリカンの破壊をもたらす。例えば、エッジ、バイオケミカル・ジャーナル376、339〜50頁、2003参照。
【0113】
重要なことに、グリコシル化以外の翻訳後修飾はこのような酵素的またはトリフルオロメタンスルホン酸処理に対して安定であると考えられるので、このような処理後にペプチドにおいて観察される質量の変化は糖残基の除去によるものと見なすことができる。これにより注目するポリペプチド上の抗原性エピトープに対する糖鎖およびグリコシル化部位の相対的寄与率をより理解することが可能となる。また、糖残基の除去によって、観察される質量の相違がアミノ酸含量ではなく糖含量の相違によるものであるかどうかについて疑問がいずれも取り除かれるので、脱グリコシル化によって、ポリペプチド質量(例えば、当業者に周知の方法によって配列と関連付けることができる、サンプル中に存在する注目するナトリウム利尿ペプチドおよびその断片の質量)の相違をより理解することが可能となる。
【0114】
抗体の選択
【0115】
無傷のナトリウム利尿ペプチド断片を選択的に認識し、かつ/またはグリコシル化状態に感受性もしくは非感受性である抗体の作製および選択はいくつかの方法で達成することができる。例えば、一方法としては、断片を精製すること、または例えば、当技術分野で周知の固相ペプチド合成法を用いて注目する断片を合成することがある。例えば、ガイド・トゥー・プロテイン・プリフィケーション(Guide to Prification)、マリーP.ドッチャー(Murray P. Deutcher)編、メソッヅ・イン・エンジモロジー(Methods in Enzymology)第182巻(1990)、ソリッド・フェーズ・ペプチド・シンセシス(Solid Phase Peptide Synthesis)、グレッグB.フィールズ(Greg B.Fields)編、メソッヅ・イン・エンジモロジー第289巻(1997)、キソら、ケミカル・ファーマシー・ブレチン(Chemical Pharmacy Bulletin)(東京)38、1192〜99頁、1990、モスタファビ(Mostafavi)ら、バイオメディカル・ペプチデス、プロテインズ、アンド・ヌクレイック・アシッヅ(Biomedical peptides, Proteins and Nucleic Acids)1、255〜60頁、1995、フジワラら、ケミカル・ファーマシー・ブレチン(東京)44、1326〜31頁、1996参照。次いで、選択したポリペプチドを、例えば、マウスまたはウサギに注射してポリクローナルまたはモノクローナル抗体を作製することができる。当業者ならば、抗体の作製には、例えば、アンチボディーズ、ア・ラボラトリー・マニュアル(Antibodies, A Laboratory Manual)、ハーロー(Harlow)およびデヴィッド・レーン(David Lane)編、コールド・スプリング・ハーバー・ラボラトリー(Cold Spring Harbor Laboratory)(1988)、コールド・スプリング・ハーバー、N.Yに記載されるような多数の手順を利用できることは認識されよう。また、当業者ならば、種々の手順による遺伝情報から、抗体を模倣する結合断片またはFab断片も調製できるということは理解されよう(アンチボディー・エンジニアリング(Antibody Engineering):ア・プラクティカル・アプローチ(A Practical Approach)(ボレベック(Borrebaeck)C.編)1995、オックスフォード大学出版、オックスフォード、ジャーナルオブ・イムノロジー149、3914〜3920頁、(1992))。
【0116】
さらに、多数の出版物によって、選択した標的との結合について、ポリペプチドのライブラリーを作製し、スクリーニングするためのファージディスプレイ技術の使用が報告されている。例えば、クウィルラ(Cwirla)ら、プロシーディングス・オブ・ザ・ナショナル・アカデミー・オブ・サイエンシズ・オブ・ジ・ユナイテッド・ステイツ・オブ・アメリカ(Prociidings of the National Academy of Sciences of the United States of America)87、6378〜82頁、1990、デブリン(Devlin)ら、サイエンス(Science)249、404〜6頁、1990、スコット(Scott)およびスミス(Smith)、サイエンス、249、386〜88頁、1990、およびラドナー(Ladner)ら、米国特許第5,571,698号参照。ファージディスプレイ法の基本概念は、スクリーニングされるポリペプチドをコードするDNAとポリペプチドの間の物理的関係の確立である。この物理的結合はポリペプチドを、ポリペプチドをコードするファージゲノムを封入しているキャプシドの一部として提示するファージ粒子によって提供される。ポリペプチドとその遺伝物質間の物理的関係の確立により、種々のポリペプチドを保持する極めて多数のファージの同時マススクリーニングが可能となる。標的に対して親和性のあるポリペプチドを提示するファージは標的と結合し、これらのファージは標的に対するアフィニティースクリーニングによって濃縮される。これらのファージから提示されるポリペプチドの正体は、それらのそれぞれのゲノムから決定することができる。次いで、これらの方法を用いて、所望の標的に対して結合親和性を有すると同定されたポリペプチドを、従来法を用いて大量に合成することができる。例えば、すべての表、図および特許請求の範囲をはじめとするその全文を本明細書に組み入れる、米国特許第6,057,098号参照。
【0117】
次いで、これらの方法によって作製される抗体を、精製された無傷の注目するナトリウム利尿ペプチドとの親和性および特異性についての一次スクリーニング、および必要に応じて、抗体の、結合から除外されることが望まれるナトリウム利尿ペプチド断片との親和性および特異性についての結果を比較することによって選択することができる。スクリーニング手順は、精製されたナトリウム利尿ペプチド断片のマイクロタイタープレートの別個のウェルへの固定化を含み得る。次いで、可能性ある抗体または抗体群を含有する溶液をそれぞれのマイクロタイターウェルに入れ、約30分間〜2時間インキュベートする。次いで、マイクロタイターウェルを洗浄し、ウェルに標識した二次抗体(例えば、産生された抗体がマウス抗体である場合には、アルカリホスファターゼとコンジュゲートさせた抗マウス抗体)を加え、約30分間インキュベートし、次いで洗浄する。ウェルに基質を加えると、固定化されたナトリウム利尿ペプチドおよび断片に対する抗体が存在する場合には呈色反応が現れる。同様のアプローチを用いてグリコシル化−非感受性抗体をスクリーニングすることができる。この場合には、1種以上の糖鎖残基を含むか、これを欠いている精製ナトリウム利尿ペプチド断片を用いてスクリーニングを行うことができる。
【0118】
次いで、このように同定した抗体を、選択したアッセイ設計で注目するナトリウム利尿ペプチドに対する親和性および特異性についてさらに分析することができる。標的タンパク質についてのイムノアッセイの開発では、精製した標的タンパク質が、選択されている抗体を用いるイムノアッセイの感度および特異性を判断する標準の役割を果たす。種々の抗体の結合親和性は異なり得るので、特定の抗体ペア(例えば、サンドイッチアッセイにおける)は互いに立体障害などによって干渉する可能性があり、抗体の分析性能は、抗体の絶対的な親和性および特異性より重要な尺度であり得る。
【0119】
当業者ならば、抗体または結合断片を作製し、種々のナトリウム利尿ペプチドに対する親和性および特異性についてスクリーニングおよび選択するのに多数のアプローチを取ることができるが、これらのアプローチは本発明の範囲を変更するものではないということは認識されよう。
【0120】
マーカーパネルにおけるナトリウム利尿ペプチドの使用
【0121】
疾病の診断のための、特に識別診断のための1種以上のマーカーを同定するための方法およびシステムはこれまでに記載されている。疾病状態の診断に有用なマーカーを同定するのに適した方法は、2002年12月27日に出願された、メソッヅ・アンド・システム・フォー・ディジーズ・ディテクション・ユージング・マーカー・コンビネーションズ(METHOD AND SYSTEM FOR DISEASE DETECTION USING MARKER COMBINATIONS)と題された米国特許出願第10/331,127号(代理人整理番号071949−6802)に詳細に記載されている。なおこれは参照により、すべての表、図、および特許請求の範囲をはじめとするその全文を本明細書に組み入れる。当業者ならばまた、マーカーの単変量解析を実施でき、複数のマーカーの単変量解析から得たデータを合わせて、異なる疾病状態を識別するマーカーのパネルを形成することができるということも認識されるであろう。
【0122】
診断に有用なマーカーのパネルの開発では、特定のマーカーの存在またはレベルについて調べることによって、いくつかの可能性あるマーカーのデータを被験体群から得ることができる。被験体の群を2セットに分けるが、第1のセットと第2のセットは各々ほぼ同数の被験体を含むことが好ましい。第1のセットは、疾病を患っているか、またはより広くは、第1の状況状態にあると確認されている被験体を含む。例えば、この第1のセットの患者は最近疾病を発生したものであってもよいし、具体的な種類の疾病を患っているものであってもよい。状況状態の確認は、より正確かつ/または費用のかかる試験、例えば、MRIまたはCTによって行うことができる。以下、第1のセットの被験体は「罹患」と呼ぶ。
【0123】
被験体の第2のセットは、単に第1のセットに入らないものである。この第2のセットの被験体は「非罹患」、すなわち、正常な被験体であり得る。あるいは、この第2のセット被験体は、「罹患」被験体によって示される症状を模倣する、1つの症状または一連の症状を示すよう選択することもできる。さらにもう1つの代替法では、この第2のセットが、疾病の発生からの異なる時点のものに相当する場合もある。
【0124】
これらのセットの被験体から得られるデータとしては、本発明の目的上は、個々にまたは群として測定される、ナトリウム利尿ペプチドの1種以上の断片をはじめとする、複数のマーカーのレベルが挙げられる。同一セットのマーカーのデータを各患者に利用できることが好ましい。このマーカーのセットには、個々の疾病または状態の検出に関連があると思われるすべての候補マーカーを含めることができる。実際の既知の関連性は必要ではない。本明細書に記載された方法およびシステムの実施形態を用いて、どの候補マーカーが疾病または状態の診断と最も関連があるかを調べることができる。2セットの被験体における各マーカーのレベルは、ガウス分布のように広範囲にわたって分布する場合がある。しかし、分布の一致は必要ではない。
【0125】
単一マーカーでは、患者を罹患であるか非罹患のいずれであるか決定的に同定することができないことが多い。例えば、患者が重複領域内に入るマーカーレベルを有すると測定される場合、試験結果は患者の診断に役に立たないものとなる。人為的なカットオフを用いて、疾病または状態の検出の陽性と陰性の試験結果間を区別することもできる。カットオフをどこに選択しようと、単一マーカーの診断ツールとしての有効性は影響を受けない。カットオフを変更することは、単に単一マーカーの使用に起因する偽陽性の数と偽陰性の数の間を交換するだけのことである。このような重複を含む試験の有効性は、ROC(受信者動作特性)曲線を用いて表されることが多い。ROC曲線は当業者には周知である。
【0126】
ROC曲線の水平軸は、偽陽性率とともに高まる(1−特異度)を表す。曲線の垂直軸は、真の陽性率とともに高まる感度を表す。したがって、選択した個々のカットオフについて、(1−特異度)の値を求めることができ、また対応する感度も得ることができる。ROC曲線下面積は測定したマーカーレベルが疾病または状態の正確な同定を可能にする可能性の尺度である。したがって、ROC曲線下面積を用いて試験の有効性を調べることもできる。
【0127】
前記で論じたように、単一マーカーのレベルの測定は限定された有用性しかない場合がある。さらなるマーカーの測定によってさらなる情報が得られるが、2つの無関係である可能性のある測定値のレベルを適切に組み合わせることには、困難がある。本発明の実施形態にしたがう方法およびシステムでは、罹患および非罹患患者のセットの種々のマーカーのレベルに関するデータを用いて、有用なパネル応答を得るためのマーカーのパネルを開発することができる。データはデータベース、例えば、マイクロソフトアクセス、オラクル、その他のSQLデータベースで、または単純にデータファイルで提供することができる。データベースまたはデータファイルには、例えば、患者識別子、例えば、名前または番号など、存在する種々のマーカーのレベル、および患者が罹患であるか非罹患であるかを含めることができる。
【0128】
次いで、各マーカーの人為的カットオフ領域をまず選択することができる。カットオフ領域の位置は最初にどの点にでも選択することができるが、この選択は以下に記載する最適化プロセスに影響を及ぼす場合がある。この点に関しては、最適位置の候補近くの選択は、オプティマイザの高速収束を促進し得る。好ましい方法では、カットオフ領域を、2セットの患者の重複領域のほぼ中心を最初に中心とする。一実施形態では、カットオフ領域は単にカットオフ点であり得る。その他の実施形態では、カットオフ領域はゼロより大きい長さを有し得る。これに関しては、カットオフ領域を中心値と長さの大きさによって定義することができる。実際、カットオフ領域の限界の初期選択は、被験体の各セットの予め選択したパーセンタイルにしたがって決定することができる。例えば、それより上で罹患患者の予め選択したパーセンタイルが測定される点を、カットオフ範囲の右(上)端として用いることができる。
【0129】
次いで、各患者の各マーカー値を、指標に対してマッピングすることができる。指標には、カットオフ領域より下の1つの値と、カットオフ領域より上の別の値を割り当てる。例えば、マーカーが通常、非罹患患者に対してより低い値を、罹患患者に対してより高い値を有する場合には、ゼロ指標を個々のマーカーに対して低い値に割り当てるが、このことは陽性診断の可能性が低くなる可能性を示す。その他の実施形態では、指標は多項式に基づいて算出することができる。多項式の係数は、罹患と非罹患被験体間のマーカー値の分布に基づいて求めることができる。
【0130】
種々のマーカーの相対的な重要性は重み係数によって示され得る。重み係数は、まず、各マーカーの係数として割り当てることができる。カットオフ領域と同様、重み係数の初期選択は、許容範囲にあるどんな値にでも選択することができるが、この選択は最適化プロセスに影響を及ぼす可能性がある。この点に関しては、最適位置の候補近くの選択は、オプティマイザの高速収束を促進し得る。好ましい方法では、許容範囲の重み係数はゼロと1の間に及び、各マーカーの初期重み係数は0.5として割り当てることができる。好ましい実施形態では、各マーカーの初期重み係数はそのマーカー自身の有効性と関連があり得る。例えば、ROC曲線は単一マーカーについて作製することができ、ROC曲線下面積をそのマーカーの初期重み係数として用いることができる。
【0131】
次いで、2セットの各々において各被験体のパネル応答を算出することができる。パネル応答は、それに対して各マーカーレベルがマッピングされる指標と各マーカーの重み係数の関数である。好ましい実施形態では、各被験体(j)のパネル応答(R)は以下のように表される:
Rj=ΣwiIi,j,
式中、iはマーカー指数であり、jは被験体指数であり、wiはマーカーiの重み係数であり、Iは被験体jの、それに対してマーカーのマーカーレベルがマッピングされる指標値であり、Σはすべての候補マーカーiにわたる合計である。
【0132】
マーカー値ではなく指標値を用いることの利点の1つは、特別に高いまたは低いマーカーレベルが、その個々のマーカーについて罹患または非罹患の診断の可能性を変更しないということである。通常、特定のレベルを上回るマーカー値は、概ね特定の状況状態を示す。そのレベルを上回るマーカー値は、同じ確かさで状況状態を示す。したがって、特別に高いマーカー値がその状況状態の特別に高い可能性を示すわけではない場合がある。カットオフ領域の片側で一定である指標の使用により、この懸念が排除される。
【0133】
パネル応答はまた、マーカーレベルおよびその他の因子、例えば、患者の家系および性別をはじめとするいくつかのパラメータの全般的な関数であり得る。パネル応答に寄与するその他の因子としては、個々のマーカーの値の経時的な傾斜が挙げられる。例えば、まず病院に到着した時点で、個々のマーカーについて患者を測定することができる。同じマーカーを、1時間後再度測定することができ、変化レベルをパネル応答に反映させることができる。さらに、さらなるマーカーをその他のマーカーから導くことができ、これはパネル応答の値に寄与し得る。例えば、2種のマーカーの値の比率がパネル応答を算出する際の因子となり得る。
【0134】
被験体の各セットにおける各被験体についてパネル応答を得、そこで各セットのパネル応答の分布を解析することができる。目的関数は有効なパネルの選択を容易にするよう定義できる。通常、目的関数は、例えば、罹患セットの被験体のパネル応答と非罹患セットの被験体のパネル応答の重複によって表され得るような、パネルの有効性の指標となるものではければならない。このように、例えば、重複を最小化することによって、目的関数を最適化してパネルの有効性を最大化することができる。
【0135】
好ましい実施形態では、2セットの被験体のパネル応答を表すROC曲線を用いて目的関数を定義することができる。例えば、目的関数はROC曲線下面積を反映し得る。曲線下面積を最大にすることによって、マーカーのパネルの有効性を最大にすることができる。その他の実施形態では、ROC曲線のその他の特徴を用いて目的関数を定義できる。例えば、ROC曲線の傾斜が1に等しい点は有用な特徴であり得る。その他の実施形態では、「ひざ」と呼ばれることもある、感度と特異度の積が最大である点を使用してもよい。一実施形態では、ひざでの感度を最大にすることができる。さらなる実施形態では、所定の特異度レベルの感度を用いて目的関数を定義することができる。その他の実施形態では、所定の感度レベルの特異度を用いることができる。さらにその他の実施形態では、これらROC曲線の特徴の2以上の組合せを用いることができる。
【0136】
パネルのマーカーの1つが、診断されている疾病または状態に特異的であることがあり得る。このようなマーカーが特定の基準値より上または下に存在する場合には、パネル応答を「陽性」試験結果に戻すよう設定することができる。しかし、基準値を満たさない場合であっても、マーカーのレベルを目的関数に寄与する可能性のあるものとして用いることができる。
【0137】
最適化アルゴリズムを用いて目的関数を最大または最小にすることができる。最適化アルゴリズムは当業者に周知であり、これとしてはシンプレックス法およびその他の条件付き最適化技術をはじめとするいくつかの一般に入手可能な最小化または最大化関数が挙げられる。当業者ならば、最小化関数の中には、局所的極小ではなく大域的極小の検索において、その他のものよりも良好であるものがあることは理解されよう。最適化プロセスでは、各マーカーのカットオフ領域の位置および大きさを、マーカー当たり少なくとも2の自由度を提供するよう変更することが可能である。このような可変パラメータは本明細書では独立変数と呼ぶ。好ましい実施形態では、各マーカーの重み係数も、最適化アルゴリズムの反復にわたって変更することができる。種々の実施形態では、これらのパラメータの順列はいずれも、独立変数として使用することができる。
【0138】
前記のパラメータに加えて、各マーカーの意味も独立変数として用いることができる。例えば、多くの場合、特定のマーカーの高レベルが一般的に罹患状態を示すものであるのか非罹患状態を示すものであるのかどうかが知られていない場合がある。このような場合には、最適化プロセスを両側で検索できることが有用であり得る。実際、これはいくつかの方法で実施できる。例えば、一実施形態では、意味が、最適化プロセスによって陽性と陰性の間で反転され得る、真に別個の独立変数であり得る。あるいは、重み係数が負であることを可能にすることによって意味が提供され得る。
【0139】
同様に、最適化アルゴリズムは特定の制限付で提供され得る。例えば、得られたROC曲線は、特定の値よりも大きい曲線下面積を提供するよう制限できる。曲線下面積が0.5であるROC曲線は、完全な乱数度を示し、曲線下面積が1.0は2セットの完全分離を反映する。したがって、特に目的関数が曲線下面積を組み込んでいない場合には、最小許容範囲値、例えば、0.75を制限として用いることができる。その他の制限としては、個々のマーカーの重み係数に対する制限を挙げることができる。さらなる制限によって、すべての重み係数の合計を、特定の値、例えば1.0に制限することができる。
【0140】
最適化アルゴリズムの反復は、通常、目的関数を最小化または最大化しながら、独立パラメータを制限を満たすよう変更する。最適化プロセスにおける反復数は制限することができる。さらに、2つの連続反復間の目的関数の相違が所定の基準値より小さい場合には最適化プロセスを終了することができ、それによって、最適化アルゴリズムが局所性最小または最大の領域に達したことが示される。
【0141】
したがって、最適化プロセスにより、各マーカーの重み係数およびマーカー値を指標に対してマッピングするためのカットオフ領域を含むマーカーのパネルが提供され得る。より少ないマーカーレベルの測定しか必要としない低コストのパネルを開発するために、特定のマーカーをパネルから排除することができる。これに関しては、パネルにおける各マーカーの有効な寄与を求めて、マーカーの相対的重要度を同定することができる。一実施形態では、最適化プロセスに起因する重み係数を用いて、各マーカーの相対的重要度を決定することができる。寄与の最も低いマーカーを排除してもよい。
【0142】
特定の場合では、より小さい重み係数が低い重要度を示すものでない場合がある。同様に、より大きい重み係数が高い重要度を示すものではない場合がある。例えば、最適化プロセスは、関連マーカーが診断と無関係である場合に高い係数をもたらし得る。この場合には、係数を低下させる利点は全くない。この係数を変更することは、目的関数の値に影響を及ぼし得ない。
【0143】
治療計画を決定するためのナトリウム利尿ペプチドの使用
【0144】
ナトリウム利尿ペプチドなどの有用な診断または予後指標は、臨床医が択一的な治療計画の間で選択を行う手助けとなり得る。例えば、急性冠症候群後に心臓トロポニンTまたはIが上昇している患者は、強力な抗血小板物質・抗血栓治療および早期の血管再開通術を含む早期の積極的な戦略から具体的な利益を得るようである。ハム(Hamm)ら、ニュー・イングランド・ジャーナル・オブ・メディシン(New England Journal of medicine)340、1623〜9頁(1999)、モロー(Morrow)ら、ジャーナル・オブ・ジ・アメリカン・カレッジ・オブ・カルディオロジー(Journal of the American college of cardiology)36、1812〜7頁(2000)、キャノン(Cannon)ら、アメリカン・ジャーナル・オブ・カルディオロジー(American Journal of Cardiology)82、731〜6頁(1998)。さらに、心筋梗塞後C−反応性タンパク質が上昇している患者は、HMG−CoAレダクターゼ阻害剤治療から特定の利益を得るようである。リドカー(Ridker)ら、サーキュレーション98、839〜44頁(1998)。うっ血性心不全の患者の中では、試験的研究によって、ACE阻害剤がBNPレベルを用量依存的に低下させ得るということが示唆されている。バン・ベルドヒュイゼン(Van Veldhuisen)ら、ジャーナル・オブ・アメリカン・カレッジ・オブ・カルディオロジー32、1811〜8頁(1998)。
【0145】
同様に、利尿薬および血管拡張薬治療を、生物活性ナトリウム利尿ペプチドレベルに基づいて「調整すること」によって転帰が改善され得る。例えば、トラウトン(Troughton)ら、ランセット(Lancet)355、1126〜30頁(2000)参照。最後に、16人の患者からなる単一の試験的研究において、Q波梗塞後のプラセボではなくACE阻害剤に対するランダム化が、その後の6ヶ月間にわたるBNPレベルの低下と関連があるということがわかった。モトワニ(Motwani)ら、ランセット341、1109〜13頁(1993)。BNPは、有益な心臓および腎臓への作用を有する対抗−調節ホルモンであるので、BNP濃度の変化は心室機能の向上および心室壁張力の低下を反映すると思われる。最近の論文により、NTプロ−BNPとBNPアッセイの相互関係が実証されている(フィッシャー(Fischer)ら、クリニカル・ケミストリー(Clinical Chemistry)47、591〜594頁(2001))。本発明のさらなる目的は、個別にか、マーカーの群のいずれかで考えられる、ナトリウム利尿ペプチドの濃度を用いて、患者の予後を向上するよう利尿薬および血管拡張薬治療を導くことができることである。さらに、患者の予後指標として用いるための、個別にか、マーカーの群で考えられる、ナトリウム利尿ペプチドの測定は本発明の範囲内にある。
【0146】
うっ血性心不全で入院している患者における最近の研究により、連続するBNP測定は、単一の測定と比較して増加した予後情報を提供できるということが示唆されている。すなわち、アッセイにより、BNPが治療後に低下した場合には、引き続き上昇しているままである場合よりも、予後が向上することを実証することができる。チェン(Cheng)ら、ジャーナル・オブ・アメリカン・カレッジ・オブ・カルディオロジー37、386〜91頁、(2001)。したがって、本発明のナトリウム利尿ペプチドの連続測定は、患者におけるマーカーの予後価値および/または診断価値を高めることができ、したがって、本発明の範囲内にある。
【0147】
アッセイ測定戦略
【0148】
試験サンプル中のポリペプチドまたはタンパク質を検出および解析するための多数の方法および装置が当業者には周知である。好ましい実施形態では、多くはイムノアッセイ装置および方法を用いる。例えば、米国特許第6,143,576号、同6,113,855号、同6,019,944号、同5,985,579号、同5,947,124号、同5,939,272号、同5,922,615号、同5,885,527号、同5,851,776号、同5,824,799号、同5,679,526号、同5,525,524号および同5,480,792号参照。なお、それらの各々は参照により、すべての表、図、および特許請求の範囲をはじめとするその全文を本明細書に組み入れる。これらの装置および方法は、種々のサンドイッチ、競合または非競合アッセイ形式において標識した分子を利用して、注目する分析物の存在または量と関連のあるシグナルを生じさせることができる。さらに、特定の方法および装置、例えば、バイオセンサーおよび光学的免疫測定法を用いて、標識した分子を必要とすることなく分析物の存在または量を調べることもできる。例えば、米国特許第5,631,171号および同5,955,377号参照。なお、それらの各々は参照により、すべての表、図、および特許請求の範囲をはじめとするその全文を本明細書に組み入れる。また、当業者ならば、それだけには限らないが、ベックマン・アクセス(Beckman Access)、アボット・アキシム(Abbott AxSym)、ロシェ・エレクシス(Roche ElecSys)、デイド・ベーリング・ストレイタス・システムス(Dade Behring Status systems)をはじめとするロボット機器が、本明細書に教示したイムノアッセイを実施できるイムノアッセイ分析器に入っていることは承知している。抗体の、マーカーとの特異的な免疫学的結合は直接的に検出することも間接的に検出することもできる。直接標識としては、抗体に付けた、蛍光または発光タグ、金属、色素、放射性核種などが挙げられる。間接標識としては、当技術分野で周知の種々の酵素、例えば、アルカリホスファターゼ、西洋わさびペルオキシダーゼなどが挙げられる。
【0149】
1種以上のポリペプチドに特異的な固定化抗体の使用も本発明によって考慮される。抗体は種々の固体支持体、例えば、磁性またはクロマトグラフィーのマトリックス粒子、アッセイ場所(例えば、マイクロタイタープレート)の表面、一片の固体基板物質またはメンブラン(例えば、プラスチック、ナイロン、紙)などに固定化することができる。抗体または複数の抗体類を固体支持体上のアレイにコーティングすることによってアッセイストリップを調製することができる。次いで、このストリップを試験サンプル中に浸漬し、次いで、洗浄および検出ステップによって迅速に処理して測定可能なシグナル、例えば、呈色スポットを生じさせる。
【0150】
複数のポリペプチドの解析を、一試験サンプルを用いて別々にまたは同時に実施できる。別個のまたは連続アッセイに適した装置としては、エレクシス(ElecSys)(ロシュ)、アクスシム(AxSym)(アボット)、アクセス(ベックマン)、アドビア(ADVIA)(登録商標)センタウル(CENTAUR)(登録商標)(バイエル)イムノアッセイシステム、ニコスル・アドバンテージ(NICHOL ADVANTAGE)(登録商標)(ニコルス社(Nichols Institute))イムノアッセイシステムなどの臨床検査室分析器が挙げられる。好ましい装置またはタンパク質チップとしては、単一の表面で複数のポリペプチドの同時アッセイを実施するものがある。特に有用な物理的形式としては、複数の異なる分析物の検出のための複数の個別のアドレス可能な位置を含む表面を含んでなるものがある。このような形式としては、タンパク質マイクロアレイまたは「プロテインチップ」(例えば、ング(Ng)およびイラグ(Ilag)、ジャーナル・オブ・セルラー・アンド・モレキュラー・メディシン(Journal of Cellular and Molecular Medicine)6、329〜340頁、(20020)参照)および特定のキャピラリー装置(例えば、米国特許第6,019,944号参照)が挙げられる。これらの実施形態では、各々個別の表面位置が、各々の位置で検出するために1種以上の分析物を固定化するための抗体を含み得る(例えば、本発明の1種以上のポリペプチド)。あるいは、表面が、表面の個別の位置に固定化された1種以上の個別の粒子(例えば、微小粒子またはナノ粒子)を含んでなる場合もあり、ここで検出のために微小粒子が抗体を含んでなり、1種の分析物(例えば、本発明の1種以上のポリペプチド)を固定化する。
【0151】
さらに、当業者ならば、同一個体から(例えば、連続する時点で)得た複数のサンプルを試験することの価値を承知しているであろう。このように連続するサンプルを試験することによって、ポリペプチドレベルの経時変化を同定することが可能となる。ポリペプチドレベルの増加または減少、ならびにこのようなレベルの変化がないことは、それだけには限らないが、イベントの発生からのおよその時間、救済可能な組織の存在および量、薬物治療の妥当性、再灌流または症状の回復によって示されるような種々の治療の有効性を同定すること、同様の症状を有する種々の種類の疾病の識別、イベントの重篤度の同定、疾病重症度の同定、および患者の予後、例えば、将来のイベントの危険性の同定をはじめとする疾病状態についての有用な情報を提供する。
【0152】
前述のポリペプチドからなり、場合によっては、疾病の診断、予後診断または識別に有用なその他のタンパク質マーカーを含むパネルを、種々の診断に関連する関連情報を提供するよう構築することができる。このようなパネルは、1、2、3、4、5、6、7、8、9、10、15、20またはそれより多い個々の分析物、例えば、本発明の1種以上のポリペプチドを検出するよう構築することができる。当業者ならば、種々の臨床設定において臨床的感度または特異度を最適にするよう、単一分析物または分析物のサブセットの分析を実施できる。これらとしては、それだけには限らないが、外来、応急手当、救命救急診療、集中治療、モニタユニット、入院患者、通院患者、診療室、診療所、および健康診断設定が挙げられる。さらに、当業者ならば、前記の設定の各々において単一の分析物または分析物のサブセットを、臨床的感度および特異度を最適化するよう診断基準点の調節と組み合わせて使用できる。アッセイの臨床的感度は、アッセイが正しく予測する疾病を有するもののパーセンテージとして定義され、アッセイの特異度は、アッセイが正しく予測する疾病を有さないもののパーセンテージとして定義される(ティーツェ・テキストブック・オブ・クリニカル・ケミストリー(Tietz Textbook of Clinical Chemistry)、第2版、カール・バーティス(Carl Burtis)およびエドワード・アシュッド(Edward Ashwood)編、W.B.サウンダース(Saunders)他、496頁)。
【0153】
分析物の分析は、同様に種々の物理的形式で実施できる。例えば、マイクロタイタープレートまたは自動化の使用を用いることで多数の試験サンプルの処理が容易になる。あるいは、単一サンプル形式を開発することで、例えば、外来搬送または救急外来設定において時期を逸することのない迅速な治療および診断が容易になる。
【0154】
前記で論じたように、サンプルが、ひと度サンプルを獲得しても、ナトリウム利尿ペプチドまたはその断片を分解し続ける場合がある。したがって、アッセイに先立って1種以上のプロテアーゼ阻害剤をサンプルに加えることが有利であり得る。当業者には多数のプロテアーゼ阻害剤が知られており、例示的阻害剤は、例えば、http://www.roche−applied−science.com/fst/products.htm?/prod_inf/manuals/protease/prot_toc.htmのザ・コンプリート・ガイド・フォー・プロテアーゼ・インヒビション(The Complete Guide for Protease Inhibition)、ロシェ・モレキュラー・バイオケミカルス(Roche Molecular Biochemicals)、1999年6月3日更新およびヨーロッパ特許出願03013792.1(EP1378242A1として公開)に見ることができる。なお、この各々はその全文を本明細書に組み入れる。種々のメタロプロテアーゼおよびカルシウム依存性プロテアーゼが血液由来サンプル中に存在することが知られているので、EGTAおよび/またはEDTAなどのキレート剤もプロテアーゼ阻害剤として作用する。さらに、またはあるいは、中性エンドペプチダーゼおよび/またはDPPの阻害剤も使用できる。
【0155】
プロリル特異的DPPによるナトリウム利尿ペプチド分解の阻害
【0156】
ナトリウム利尿ペプチドが一部をなす神経液性調節系は、心血管調節の複雑な系に相当する。うっ血性心不全などの疾病は、本質的に、寿命を延長することはできるが基礎疾患は決して治癒しない命にかかわる疾病である。したがって、依然として、基礎疾患を管理するための新規治療的アプローチが必要とされており、この複雑な系における複数の点が臨床医学者によって重要な標的と考えられている。疾病管理におけるアンギオテンシン変換酵素(「ACE」)阻害剤の臨床上の成功により、血管作用性ホルモンに作用する酵素に影響を及ぼすことによって循環器疾患の経過に間接的に影響を及ぼすさらなるアプローチが探求されることとなった。
【0157】
ナトリウム利尿ホルモンの場合には、ホルモンレベルの上昇が患者において治療可能性を有することがわかっている。例えば、チェコウラ(Tsekoura)ら、ヘレニック・ジャーナル・オブ・カルディオロジー(Hellenic Journal of Cardiology)44、266〜70頁、2003参照。中性エンドペプチダーゼ(「NEP」)は重要な分解媒介物であると考えられている。予想通り、NEPの阻害剤は、高血圧、アテローム性動脈硬化および心不全などの疾病を患う患者の治療において用途が見出されている。例えば、コーチ(Corti)ら、サーキュレーション104、1856〜62頁、2001参照。BNPおよびNEP阻害剤双方を用いる併用療法は、心拍出量、血管抵抗性の低下および心臓の負荷軽減に対して相乗効果を生み出すと報告されている。チェン(Chen)ら、サーキュレーション、105、999〜1003頁、2002。NEPを標的とすることは制限を受け得るが、NEPは広範な生物活性ペプチドを代謝する。例えば、ウォルター(Walter)ら、カレント・オピニオン・イン・ネフロロジー・アンド・ハイパーテンション(Current Opinion in Nephrology and Hypertension)6、468〜73頁、1997参照。
【0158】
本発明は循環器疾患、詳しくは、心不全を治療するための新規アプローチを記載する。いくつかのナトリウム利尿ペプチド、例えば、プロ−BNP、成熟BNP、およびプロ−ANPのヒト型は、最後から2番目のプロリン残基を含んでなり、これによってペプチドがプロリル特異的ジペプチジルジペプチダーゼ(「DPP」)の適した基質となっている。DPPの阻害剤は、DPP IVによるグルコース依存性インスリン分泌促進ポリペプチド分解の阻害によって媒介される糖尿病の管理において有用性があると記載されている。例えば、ゴー(Gault)ら、バイオケミカル・バイオフィジオロジー・リサーチ・コミュニケーション、22、207〜13頁、2003参照。しかしながら、循環器疾患の治療におけるその使用はこれまでに報告されていない。
【0159】
選択的DPP阻害剤を調製および同定する方法は当技術分野では周知である。DPP阻害剤としては、ジペプチド類似体Xaa−ボロPro(boroPro)、例えば、Pro−ボロPro、Ala−ボロPro、Val−ボロProおよびLys−ボロPro、およびdab−pipが挙げられる。例えば、センテンら、バイオオーガニック・アンド・メディシナル・ケミストリー・レターズ、12、2825〜28頁、2002、ジョーンズ(Jones)ら、ブラッド、プレパブリッシュド・オンライン(Blood, prepublished online)2003年5月8日、DOI10.1182参照。DPPの多数のさらなるジペプチド類似体阻害剤を、迅速に合成し、スクリーニングするためにコンビナトリアル・ケミストリー法が用いられている。例えば、レイティングら、バイオケミカル・ジャーナル371、525〜32頁、2003、セドら、フィジオロジカル・リサーチ52、367〜72頁、2003、ビルハウアーら、ジャーナル・オブ・メディカル・ケミストリー46、2774〜89頁、2003、センテンら、ジャーナル・オブ・コンビナトリー・ケミストリー5、336〜44頁、2003、および米国特許第5,602,102号、同6,573,287号、同6,548,481号、同6,432,969号、および同6,355,614号参照。これらの出版物に記載された化合物は、本明細書に記載した方法において使用するためのさらなるDPP阻害剤の同定においてリード化合物として用いることができる。小さな有機分子のコンビナトリアルライブラリーを作製するために当技術分野では種々の技術が利用できる。一般的には、ブロンデル(Blondelle)ら、トレンヅ・イン・アナリティカル・ケミストリー(Trends in Analytical chemistry)14、83頁、1995、米国特許第5,359,115号、同5,362,899号、同5,288,514号、および同5,721,099号、チェン(Chen)ら、JACS116、2661頁、1994、カー(Kerr)ら、JACS115、252頁、1993、W092/10092、W093/09668、WO94/08051、W093/20242およびW091/07087参照。約16〜1,000,000またはそれよりも多いオーダーのディヴァーソマー(diversomer)で種々のライブラリーを合成し、本発明に記載した方法を用いて個々の活性または性質についてスクリーニングすることができる。
【0160】
本発明に用いられる阻害剤は小分子であることが好ましく、これは約1000ダルトンより小さい分子量であることを意味する。このような阻害剤は当技術分野ではよく知られている。例えば、W004/07468およびW004/50022、ならびに米国特許第6,710,040号、同6,699,871号、同6,432,969号、同6,303,661号、同6,166,063号、同6,124,305号、同6,110,949号、および同6,107,317号参照。なお、それらの各々は参照によりその全文を本明細書に組み入れる。好ましい小分子阻害剤は経口で有効である。DPP阻害性抗体または抗体断片も本明細書に記載した方法に使用できる。この場合には、DPPに対する抗体を作製し、(例えば、本明細書に記載したファージディスプレイ法を用いて)スクリーニングし、注目する1種以上のナトリウム利尿ペプチドに対するDPP活性を阻害する抗体を同定することができる。
【0161】
化合物は、酵素の供給源として単離したDPP酵素、細胞抽出物、または血液由来サンプル、および基質として単離したナトリウム利尿ペプチドを用いて阻害活性についてスクリーニングすることができる。標的ナトリウム利尿ペプチドからの最後から2番目のプロリン残基の喪失を阻害する条件の選択は、検討中の水性媒質の種類に応じて変わり得る(例えば、血液サンプルにおける阻害は、生物の循環における阻害とは異なる条件を必要とし得る)。このような条件を選択することは当業者の技術の範囲内である。また試験化合物およびその対応する製薬上許容される酸付加塩のDPPを阻害する能力も、クボタら、クリニカル・アンド・エクスペリメンタル・イムノロジー(Clinical and Experimental Immunology)89、192〜7頁、1992に記載されたアッセイの改訂版を用いることによって証明することができる。最後から2番目のプロリン残基の有無の確認は、分子のこのN部分の喪失に感受性であるよう選択したイムノアッセイを用いて、または質量分析の使用によって実施できる。
【0162】
次のステップに進む前に、培養細胞においてDPP活性を調節する候補化合物を、注目する疾病状態と関連している動物モデルで試験することができる。これらの方法では、標識したナトリウム利尿ペプチドを、試験動物に注射し、ナトリウム利尿ペプチドの循環からのクリアランスのT1/2を、阻害剤の存在下および不在下で測定すればよい。DPP依存性ナトリウム利尿ペプチド分解の好ましい動物モデルとしては、ラット、マウス、ヒツジ、イヌ、ネコおよびブタが挙げられる。
【0163】
前記で論じたように、DPP阻害剤とNEP阻害剤および/またはナトリウム利尿ペプチドを用いる併用療法が本発明によって考慮される。さらに、または代替法として、ゴー(Goult)ら、メタボリズム(Metabolism)52、679〜87頁、2003に、グルコース依存性インスリン分泌促進ポリペプチドについて記載されたように、ナトリウム利尿ペプチドを、DPP活性に対して安定化されている類似体として提供することができる。好ましい実施形態では、1個以上の置換、欠失、付加または修飾されたアミノ酸を含むナトリウム利尿ペプチド類似体のライブラリーを、DPP分解に対する安定性の向上についてスクリーニングすることができる。このような類似体は、親ナトリウム利尿ペプチドのナトリウム利尿活性の50%以上を保持することが好ましい。
【0164】
投与する場合には、本発明の製薬製剤を製薬上許容される量で製薬上許容される組成物で適用する。このような製剤は通常、塩、緩衝剤、保存料、適合担体、および場合によってはその他の治療薬を含み得る。医薬に用いる場合には、塩は製薬上許容されるものでなくてはならないが、好都合なことに、製薬上許容されない塩を用いてその製薬上許容される塩を調製することができ、これは本発明の範囲から排除されない。このような薬理学的および製薬上許容される塩としては、それだけには限らないが、以下の酸から調製されるものが挙げられる:塩酸、臭化水素酸、硫酸、硝酸、リン酸、マレイン酸、酢酸、サリチル酸、クエン酸、ギ酸、マロン酸、コハク酸など。また、製薬上許容される塩は、アルカリ金属またはアルカリ土類塩、例えばナトリウム、カリウムまたはカルシウム塩としても調製できる。製薬組成物はまた、適した保存料、例えば、塩化ベンザルコニウム、クロロブタノール、パラベンおよびチメロサルを場合によって含んでもよい。経口、皮下、静脈、筋肉内投与などに適した担体製剤は、レミングトンズ・ファーマシューティカル・サイエンシズ(Remington’s Pharmaceutical Sciences)、マック・パブリッシング社(Mack Publishing Co.)、ペンシルバニア州、イーストンに見出すことができる。
【0165】
被験体を治療するためには種々の投与経路が利用できる。選択される個々の送達様式は、選択された個々の化合物、治療される状態の重篤度および治療効力のために必要とされる投与量に応じて変わる。本発明の方法は、一般的に言えば、医学上許容される投与様式であればいずれを用いて実施してもよく、これは、臨床上許容できない副作用を引き起こさずに有効レベルの活性化合物が得られるいずれかの様式を意味する。このような投与様式としては、経口、直腸、局所、経鼻、皮内、静脈内、または非経口経路が挙げられる。このような投与様式はまた、患者からT細胞または骨髄細胞、幹細胞または初期系統前駆細胞を獲得し、単離した細胞を本発明の化合物とex vivoで接触させ、次いで処理細胞を患者に再導入することも含む。処理した細胞は、生存細胞を投与するための当技術分野で公知のいずれかの方法で患者に再導入すればよい。
【0166】
経口投与は特に好ましい。経口投与に適した組成物は、各々所定量の本発明の化合物を含有する個別単位、例えば、カプセル剤、錠剤、トローチ剤として提供することができる。その他の組成物としては、水性液体または非水性液体中の懸濁液、例えば、シロップ、エリキシルまたはエマルションが挙げられる。経口製剤は腸溶性皮膜を含まないことが好ましいが、これは本発明の環状化合物を消化管の酸性pH条件に曝露して環状分子をその線状対応物に変換することが望ましいからである。
【0167】
その他の送達システムとしては、徐放性、遅延放出性または持続放出送達システムが挙げられる。このようなシステムによって、前述の化合物の反復投与が避けられ、被験体および医師に対する利便性が高まる。多数の種類の放出送達システムが、当業者に利用でき、知られている。それらとしては、ポリマーベースのシステム、例えば、ポリ(ラクチド−グリコリド)、コポリオキサレート、ポリカプロラクトン、ポリエステルアミド、ポリオルトエステル、ポリヒドロキシ酪酸、およびポリアンヒドリドが挙げられる。薬剤を含有する前述のポリマーのマイクロカプセルが、例えば、米国特許第5,075,109号に記載されている。送達システムとしてはまた、ステロール、例えば、コレステロール、コレステロールエステルおよび脂肪酸またはモノ−、ジ−およびトリ−グリセリドなどの中性脂肪を含む脂質である非ポリマーシステム、ヒドロゲル放出システム、サイラスティック(sylastic)システム、ペプチドベースのシステム、ワックス皮膜、従来の結合剤および賦形剤を用いる圧縮錠、部分融合インプラントなどが挙げられる。具体例としては、それだけには限らないが、(a)化合物がマトリックス内の形態に含まれる浸食システム、例えば、米国特許第4,452,775号、同4,667,014,号、同4,748,034号および同5,239,660号に記載されたもの、ならびに(b)有効成分が制御された速度でポリマーから浸透する拡散システム、例えば、米国特許第3,832,253号および同3,854,480号に記載されたものが挙げられる。さらに、ポンプベースのハードウェア送達システムを用いることもでき、これらの中には移植に適応するものもある。
【0168】
長期の持続放出性インプラントの使用は、慢性症状の治療に特に適し得る。本明細書において、長期の放出とは、インプラントが治療レベルの有効成分を少なくとも10日、好ましくは60日間送達するよう構成され配置されていることを意味する。長期の持続放出性インプラントは当業者には周知であり、これには前述の放出システムのいくつかが含まれる。
【0169】
選択した化合物は有効量で投与する。有効量とは、医薬上望ましい結果を提供するのに十分な化合物の投与量である。有効量は、治療されている個々の症状、治療されている被験体の年齢および健康状態、症状の重篤度、治療期間、(あるとすれば)併用療法の性質、具体的な投与経路および保険医の知識と力量の範囲内の同様の因子に応じて変わる。一般に、有効化合物の用量は1日あたり約0.001mg/kg〜1日あたり1000mg/kgとなる。0.001〜100mg/kgの用量範囲が適していると思われ、経口で1日あたり1回または数回の投与が好ましい。他の投与形態、例えば、静脈内投与によってはより少ない用量となる。初回量を適用して、被験体における応答が十分でない場合は、患者の耐容性が許す範囲内までで、より高用量(または異なる、より限局性の送達経路による事実上、より高用量)を用いることができる。化合物の適当な全身レベルを達成するためには1日あたり複数回の投与を考慮する。
【0170】
その他の実施形態は以下の特許請求の範囲内に示される。
【実施例】
【0171】
実施例
以下の実施例は本発明を例示するものである。これらの実施例は、決して本発明の範囲を限定しようとするものではない。
【実施例1】
【0172】
血液サンプリング
血液は、指先穿刺、足底面穿刺、耳たぶ穿刺なども小容量には十分であり得るが、20ゲージのマルチ−サンプルニードルおよび真空管を用いて静脈穿刺によって採取することが好ましい。全血採取用には、血液検体を訓練された研究員によってEDTA含有血液採取チューブに採取する。血清採取用には、血液検体を訓練された研究員によってトロンビン含有血液採取チューブに採取する。血液を5〜10分間凝固させ、遠心分離によって血清を不溶性物質から分離する。血漿採取用には、血液検体を訓練された研究員によってクエン酸塩含有血液採取チューブに採取し、≧12分間遠心分離する。サンプルは使用まで4℃で維持するか、長期間の保存には−20℃以下で凍結させればよい。全血は凍結しないことが好ましい。
【実施例2】
【0173】
組換え抗体調製
抗原でのマウスの免疫化とマウス脾臓由来RNAの精製
マウスを、抗体をコードするmRNAの最適な回収のための脾臓採取のタイミングの経験に基づいて、以下の方法によって免疫化する。2種のマウスを用いる:Balb/c(チャールズ・リバー・ラボラトリーズ(Charles River Laboratories)、マサチューセッツ州、ウィルミントン)およびA/J(ジャクソン・ラボラトリーズ(Jackson Laboratories)、メイン州、バー・ハーバー)。10個体のマウス各々を、フロイントの完全アジュバント中の50μgタンパク質を用いる抗原で、0日目および28日目に腹腔内免疫化する。後眼窩洞の穿刺によってマウスの試験出血を採取する。ストレプトアビジンによって固定化されるビオチン化抗原を用いるELISAによって力価を試験することによって、高いと思われる場合は、マウスを50μgのタンパク質で、70、71および72日目にブーストし、続いて、77日目に屠殺し、脾臓を摘出する。抗体の力価が十分でないと考えられる場合は、マウスを50μgの抗原で56日目にブーストし、63日目に試験出血を採取する。十分な力価が得られる場合には、動物を50μgの抗原で98、99および100日目にブーストし、105日目に脾臓を採取する。通常、1:3200以上の試験出血希釈で、十分であると考えられる、最大半量のELISA応答が得られる。
【0174】
脾臓は層流フード内で採取し、ペトリ皿に移し、脂肪および結合組織を切り取り、廃棄する。迅速に作業し、脾臓を溶液D(25.0gチオシアン酸グアニジン(ベーリンガー・マンハイム(Boehringer Mannheim)、インディアナ州、インディアナポリス)、29.3ml滅菌水、1.76ml 0.75Mクエン酸ナトリウム(pH7.0)、2.64ml 10%サルコシル(フィッシャー・サイエンティフィック(Fisher Scientific)、ペンシルバニア州、ピッツバーグ)、0.36ml 2−メルカプトエタノール(フィッシャー・サイエンティフィック、ペンシルバニア州、ピッツバーグ))1.0mlの存在下、滅菌5ccシリンジのプランジャで柔らかくする。脾臓懸濁液を18ゲージのニードルによって、粘性になり、すべての細胞が溶解するまで吸い上げ、次いで、微量遠心管に移す。ペトリ皿を100μlの溶液Dで洗浄して残存する脾臓をいずれも回収し、これを管に移す。次いで、懸濁液をさらに5〜10回22ゲージのニードルによって吸い上げる。サンプルを2つの微量遠心管に等分に分け、以下のものを、各々添加後に反転して混合しながら、順に加える:100μl 2M酢酸ナトリウム(pH4.0)、1.0ml 水で飽和したフェノール(フィッシャー・サイエンティフィック、ペンシルバニア州、ピッツバーグ)、200μlクロロホルム/イソアミルアルコール49:1(フィッシャー・サイエンティフィック、ペンシルバニア州、ピッツバーグ)。この溶液を10秒間ボルテックス処理し、氷上で15分間インキュベートする。2〜8℃、14,000rpmで20分間遠心分離した後、水相を新しい管に移す、等容積の水で飽和したフェノール/クロロホルム/イソアミルアルコール(50:49:1)を加え、管を10秒間ボルテックス処理する。氷上で15分インキュベートした後、サンプルを2〜8℃で20分間遠心分離し、水相を新しい管に移し、等容量のイソプロパノールを用い、−20℃で最低30分間沈殿させる。4℃、14,000rpmで20分間遠心分離した後、上清を吸引除去し、管を短時間回転させ、液体を残らず除去する。RNAペレットを300μlの溶液Dに各々溶解し、合わせ、等容量のイソプロパノールを用いて−20℃で最低30分間沈殿させる。サンプルを4℃、14,000rpmで20分間遠心分離し、上清を前述のように吸引し、サンプルを100μlの氷冷70%エタノールでリンスする。サンプルを4℃、14,000rpmで20分間再度遠心分離し、70%エタノール溶液を吸引し、RNAペレットを真空乾燥させる。ペレットを100μlの滅菌蒸留水に再懸濁する。40μg/mlの濃度に対して吸光度1.0を用いてA260によって濃度を測定する。RNAは−80℃で保存する。
【0175】
相補DNA(cDNA)の調製
前記のように精製した全RNAを、cDNAの調製のための鋳型として直接用いる。RNA(50μg)を滅菌水で100μLに希釈し、10μL−130ng/mLオリゴdT12を加える。サンプルを70℃で10分間加熱し、次いで、氷上で冷却する。40μL 5×第一鎖バッファー(ギブコ(Gibco)/BRL、メリーランド州、ゲイサーズバーグ)、20μL 0.1Mジチオスレイトール(ギブコ/BRL、メリーランド州、ゲイサーズバーグ)、10μL 20mMデオキシヌクレオシドトリホスフェート(dNTP、ベーリンガー・マンハイム、インディアナ州、インディアナポリス)、および10μLの水を氷上で加える。次いで、サンプルを37℃で2分間インキュベートする。10μLの逆転写酵素(スーパースクリプト(Superscript)TM II、ギブコ/BRL、メリーランド州、ゲイサーズバーグ)を加え、37℃で1時間インキュベーションを続ける。cDNA産物をポリメラーゼ連鎖反応(PCR)に直接用いる。
【0176】
PCRによるcDNAの増幅
PCRを用いて実質的にすべてのHおよびL鎖遺伝子を増幅するために、実質的にすべての公開配列に対応するプライマーを選択する。HおよびLのアミノ末端のヌクレオチド配列は相当な多様性を含むため、米国20030104477に記載されたように、33種のオリゴヌクレオチドを合成し、H鎖の5’プライマーとして用い、29種のオリゴヌクレオチドを合成し、κL鎖の5’プライマーとして用いる。5’プライマーは、以下の基準にしたがって作製する。第1に、L鎖の2番目および4番目のアミノ酸ならびに重鎖の2番目のアミノ酸を保存する。抗体のアミノ酸配列を変更するミスマッチは他のどの位置でも可能とする。第2に、各プライマーの5’側にM13ウラシル鋳型に相補的な20ヌクレオチドの配列を合成する。この配列はHおよびL鎖プライマー間で異なり、L鎖プライマーについてはpelBシグナル配列、H鎖プライマーについてはアルカリホスファターゼシグナル配列の3’側の20ヌクレオチドに対応している。定常領域ヌクレオチド配列には、H鎖およびκL鎖各々に対し、1種の3’プライマーしか必要でない(図2)。各5’および3’プライマーの各対に対し、別個にPCRによる増幅を実施した。各プライマー対に対し、50pmolの5’プライマー、50pmolの3’プライマー、0.25μL TaqDNAポリメラーゼ(5ユニット/μL、ベーリンガー・マンハイム、インディアナ州、インディアナポリス)、3μLのcDNA(実施例2に記載)、5μL 2mM dNTP、5μL MgCl2を含む10×TaqDNAポリメラーゼバッファー(ベーリンガー・マンハイム、インディアナ州、インディアナポリス)、および50μLまでのH2Oを含む50μLの反応を実施する。増幅はGeneAmp(登録商標)9600サーマルサイクラー(パーキン・エルマー(Perkin Elmer)、カリフォルニア州、フォスター・シティー)を用い、以下のプログラムを用いて行う:94℃で1時間、94℃で20秒、55℃で30秒、および72℃で30秒の30サイクル、72℃で6分間、4℃。
【0177】
次いで、PCRプロセスのdsDNA産物を、3’プライマーのみを用いる非対称PCRに付し、実質的に標的遺伝子のアンチセンス鎖のみを作製する。各dsDNA産物に対して、200pmolの3’プライマー、2μLのdsDNA産物、0.5μL TaqDNAポリメラーゼ、10μL 2mM dNTP、10μL MgCl2を含む10×TaqDNAポリメラーゼバッファー(ベーリンガー・マンハイム、インディアナ州、インディアナポリス)、および100μLまでのH2Oを含む100μLの反応を行う。前述したものと同一のPCRプログラムを用いて一本鎖(ss)−DNAを増幅する。
【0178】
高速液体クロマトグラフィーによるss−DNAの精製およびss−DNAのキナーゼ処理
【0179】
H鎖ss−PCR産物およびL鎖ss−PCR産物を、2.5容量のエタノールおよび0.2容量の7.5M酢酸アンモニウムを添加し、−20℃で少なくとも30分間インキュベートすることによってエタノール沈殿させる。2〜8℃、14,000rpm、10分間のエッペンドルフ遠心機での遠心分離によってDNAをペレットにする。上清を注意深く吸引し、管を短時間2回目の回転をさせる。上清の最後の一滴までピペットで除去する。DNAを中程度加熱して10分間真空乾燥させる。H鎖産物を210μLの水中にプールし、L鎖産物を別の210μLの水中にプールする。ss−DNAを、オーブン温度60℃で、ヒューレット・パッカード1090HPLCおよびGen−Pak(商標)FAX陰イオン交換カラム(ミリポア社(Millipore Corp.)、マサチューセッツ州、ミルフォード)を用いる高速液体クロマトグラフィー(HPLC)によって精製する。吸光度を260nmでモニターする。HPLCから溶出されるss−DNAを0.5分画分で回収する。ss−DNAを含有する画分を、前述のようにエタノール沈殿させ、ペレットにし、乾燥させる。乾燥DNAペレットを200μLの滅菌水中にプールする。
【0180】
必要に応じて、ss−DNAを突然変異誘発のための調製において5’でキナーゼ処理する。各サンプルに、24μL 10×キナーゼバッファー(ユナイテッド・ステイツ・バイオケミカル(United States Biochemical)、オハイオ州、クリーブランド)、10.4μL 10mMアデノシン−5’−三リン酸(ベーリンガー・マンハイム、インディアナ州・インディアナポリス)、および2μLポリヌクレオチドキナーゼ(30ユニット/μL、ユナイテッド・ステイツ・バイオケミカル、オハイオ州、クリーブランド)を加え、管を37℃で1時間インキュベートする。管を70℃で10分間インキュベートすることによって反応を停止させる。DNAを平衡化フェノール(pH>8.0、ユナイテッド・ステイツ・バイオケミカル、オハイオ州、クリーブランド)−クロロホルム−イソアミルアルコール(50:49:1)で1回抽出し、クロロホルム:イソアミルアルコール(49:1)で1回抽出することで精製する。抽出後、前述のように、DNAをエタノール沈殿させ、ペレットにする。このDNAペレットを乾燥させ、次いで、50μLの滅菌水に溶解する。DNAのアリコートの260nmでの吸光度を測定し、吸光度1.0に対して33μg/mLを用いることによって濃度を決定する。サンプルは−20℃で保存する。
【0181】
抗体ファージディスプレイベクター
【0182】
抗体をクローニングする抗体ファージディスプレイベクターを、668−4と呼ばれる、イクシス(Ixsys)から供給されるM13ベクターから導く。ベクター668−4は、ヒューズ(Huse)、WO92/06024によって記載された、ベクターに挿入されたマウスモノクローナルFab断片の重鎖および軽鎖をコードするDNA配列を含んでいた。ベクターは、マウス抗体のL鎖可変領域の5’側に融合しているLacプロモーター、pelBシグナル配列、マウス抗体の全κ鎖、マウス抗体のH鎖可変領域の5’末端にアルカリホスファターゼシグナル配列、全可変領域およびH鎖の第1定常領域、ならびにIgG1 H鎖のヒンジ領域の5つのコドンを含んでいる。デカペプチド配列はH鎖ヒンジ領域の3’末端にあり、アンバー停止コドンがデカペプチド配列を偽遺伝子VIII配列から隔てている。アンバー停止によって、大腸菌(E.coli)サプレッサー株、例えば、XL1ブルー(ストラタジーン(Stratagene)、カリフォルニア州、サン・ディエゴ)における遺伝子VIIIタンパク質を含むH鎖融合タンパク質の発現が可能となるが、非サプレッサー細胞株、例えば、MK30(ベーリンガー・マンハイム、インディアナ州、インディアナポリス)では発現されない(図3A参照)。
【0183】
第1の誘導クローニングベクターを作製するために、ウラシル鋳型のオリゴヌクレオチド特異的突然変異誘発によってH鎖およびL鎖の可変領域内に欠失を作製する(クンケル(Kunkel)、プロシーディングス・オブ・ザ・ナショナル・アカデミー・オブ・サイエンシズ・オブ・ジ・ユナイテッド・ステイツ・オブ・アメリカ82、488頁(1985)、クンケルら、メソッヅ・エンジモロジー、154、367頁(1987))。これらの突然変異によって、CDR1の5’末端からCDR3の3’末端の各鎖の領域が欠失し、突然変異によって、そこでタンパク質翻訳が停止するDNA配列が加わる(突然変異オリゴヌクレオチドについては図4参照)。これによって、挿入断片を含まないクローンにおけるHまたはL鎖定常領域の発現が妨げられ、それによってプラークを挿入断片の存在についてスクリーニングすることが可能となる。得られたクローニングベクターをBS11と呼ぶ。
【0184】
BS11に対して多数の変更を行って、本スクリーニング法に用いるクローニングベクターを作製する。重鎖と偽遺伝子VIII配列の間のアンバー停止コドンを除去し、どの重鎖も遺伝子VIIIタンパク質を含む融合タンパク質として発現されるようにする。これによって、BS11に対して、ファージでの抗体のコピー数が増加する。L鎖の3’末端とアルカリホスファターゼシグナル配列の5’末端の間の配列中のHindIII制限酵素部位を欠失させ、抗体をpBR322誘導体にサブクローニングできるようにする。LおよびH鎖のカルボキシル末端の鎖間システイン残基をセリン残基に変更する。これによって、抗体安定性に影響を及ぼすことなく、抗体の発現レベルおよびファージでの抗体のコピー数が増加する。lacプロモーターの5’側および偽遺伝子VIII配列の3’側の非必須DNA配列を欠失させ、M13ベクターの大きさおよび再編成の可能性を小さくする。翻訳停止に加え、転写停止DNA配列をベクターに、L鎖クローニング部位で加え、パニングの際に非特異的に結合する可能性がある、その表面に重鎖タンパク質しか有さないファージが作製されないようにする。最後に、種々のベクターにタンパク質タグのDNA配列を加え、金属キレートクロマトグラフィー(ポリヒスチジン配列)による、またはデカペプチドタグおよびデカペプチドタグと結合する固定化抗体を含む磁性ラテックスを用いるアフィニティー精製による多価ファージの濃縮を可能にする。ベクターBS39はポリヒスチジン配列を、κ鎖の3’末端に含み、重鎖の末端にはタグを含まない。他方、BS45はポリヒスチジン配列を、重鎖定常領域の末端と偽遺伝子VIII配列の間に、デカペプチド配列を、κ鎖定常領域の3’末端に含む。
【0185】
脾臓抗体ファージライブラリーの作製に用いるウラシル鋳型の調製
【0186】
250mLのバッフル付振盪フラスコに入れた50ml 2×YTに、1mLの大腸菌CJ236(バイオラッド(BioRAD)、カリフォルニア州、ハーキュリーズ)一晩培養物を加える。この培養物を37℃でOD600=0.6に増殖させ、10μlのベクターファージ保存液の1/100希釈液を用いて播種し、増殖を6時間継続する。約40mLの培養物を4℃、12,000rpmで15分間遠心分離する。上清(30mL)を新しい遠心管に移し、10mg/ml RnアーゼA(ベーリンガー・マンハイム、インディアナ州、インディアナポリス)15μlを添加した後、室温で15分間インキュベートする。7.5mlの20%ポリエチレングリコール8000(フィッシャー・サイエンティフィック、ペンシルバニア州、ピッツバーグ)/3.5M酢酸アンモニウム(シグマ・ケミカル社、ミズーリ州、セント・ルイス)を加えることによってファージを沈殿させ、氷上で30分間インキュベートする。サンプルを2〜8℃、12,000rpmで15分間遠心分離する。上清を注意深く廃棄し、管を短時間回転させ、上清を残らず除去する。ペレットを400μlの高塩バッファー(300mM NaCl、100mM Tris pH8.0、1mM EDTA)に再懸濁し、1.5mLの試験管に移す。等容量の平衡化フェノール:クロロホルム:イソアミルアルコール(50:49:1)を用い、白色の界面の痕跡が見えなくなるまで、ファージ保存液を反復して抽出し、次いで、等容量のクロロホルム:イソアミルアルコール(49:1)を用いて抽出する。2.5容量のエタノールおよび1/5容量の7.5M酢酸アンモニウムを用いてDNAを沈殿させ、−20℃で30分間インキュベートする。DNAを4℃、14,000rpmで10分間遠心分離し、ペレットを冷70%エタノールで1回洗浄し、真空乾燥させる。ウラシル鋳型DNAを30μlの滅菌水に溶解し、濃度40μg/mlに対して吸光度1.0を用いてA260によって濃度を求める。鋳型を滅菌水で250ng/μlに希釈し、分注し、−20℃で保存する。
【0187】
抗体ファージライブラリーを作製するための、ss−DNAおよび大腸菌へのエレクトロポレーションを用いるウラシル鋳型の突然変異誘発
【0188】
単鎖重鎖および軽鎖遺伝子をファージディスプレイベクターウラシル鋳型に同時に導入することによって、抗体ファージディスプレイライブラリーを作製する。通常の突然変異誘発は2μgスケールで、0.2mL PCR反応管中で以下のものを混合することによって実施する:8μlの(250ng/ml)ウラシル鋳型(実施例5および6)、8μlの10×アニーリングバッファー(200mM Tris pH7.0、20mM MgCl2、500mM NaCl)、3.33μlのキナーゼ処理した単鎖重鎖挿入断片(100ng/μl)、3.1μlのキナーゼ処理した単鎖軽鎖挿入断片(100ng/μl)、および80μlまでの滅菌水。DNAをGeneAmp(登録商標)9600サーマルサイクラーで以下の温度プロフィールを用いてアニーリングする:94℃で20秒、85℃で60秒、30分かけて85℃〜55℃の傾斜、55℃で15分間維持。プログラムが終了した後DNAを氷に移す。伸長/ライゲーションは、8μlの10×合成バッファー(5mM 各dNTP、10mM ATP、100mM Tris pH7.4、50mM MgCl2、20mM DTT)、8μl T4DNAリガーゼ(1U/μl、ベーリンガー・マンハイム、インディアナ州、インディアナポリス)、8μl希釈したT7DNAポリメラーゼ(1U/μl、ニューイングランド・バイオラブス(NewEngland BioLabs)、マサチューセッツ州)を加え、37℃で30分間インキュベートすることによって実施する。反応を300μlの突然変異誘発停止バッファー(10mM Tris pH8.0、10mM EDTA)で停止させる。突然変異誘発DNAを平衡化フェノール(pH>8):クロロホルム:イソアミルアルコール(50:49:1)で1回抽出し、クロロホルム:イソアミルアルコール(49:1)で1回抽出し、DNAを−20℃で少なくとも30分間エタノール沈殿させる。前述のように、DNAをペレットにし、上清を注意深く除去する。サンプルを再度短時間回転させ、ピペットマンを用いてエタノールを残らず除去する。ペレットを真空乾燥させる。DNAを4μlの滅菌水に再懸濁する。
【0189】
1μlの突然変異誘発DNA(500ng)を、40μlの電気的コンピテント大腸菌DH12S(ギブコ/BRL、メリーランド州、ゲイサーズバーグ)にトランスファーする。形質転換された細胞を1.0mL 2×YTブロスと混合し、15mLの滅菌培養管に移す。培養物を23℃、300rpmで一晩振盪することによって第1ラウンドの抗体ファージを作製する。エレクトロポレーションの効率は、培養物の10-3および10-4希釈液10μlをLBアガープレート上にプレーティングすることによって測定する。これらのプレートを37℃で一晩インキュベートする。効率は、10-3希釈液プレート上のプラークの数に105を掛けることによって、または10-4希釈液プレート上のプラーク数に106を掛けることによって求める。エレクトロポレーションから一晩培養したものを、1.5mlの管に移し、14,000rpmで5分間遠心分離することによって細胞をペレットにする。次いで、第1ラウンドの抗体ファージである上清を、15mLのプラグシールキャップ付滅菌遠心管移す。
【0190】
エレクトロポレーションによる大腸菌の形質転換
【0191】
電気的コンピテントな大腸菌細胞を氷上で解凍する。気泡が入らないよう注意しながら、細胞を上下に2〜3回穏やかにピペッティングすることによってDNAを20〜40μLの電気的コンピテントな細胞と混合する。細胞を、再度、移す際に気泡が入らないように注意しながら、氷上で冷却しておいたジーン・パルサー(Gene Pulser)キュベット(0.2cmギャップ、バイオラッド、カリフォルニア州、ハーキュリーズ)に移す。このキュベットを大腸菌パルサー(バイオラッド、カリフォルニア州、ハーキュリーズ)に入れ、製造業者の推奨に従い1.88kVに設定した電圧でエレクトロポレーションを行う。形質転換されたサンプルを、2×YTブロスで1mlに直ちに希釈し、手順の指示通り処理する。
【0192】
ビオチン化抗原および抗体の調製
【0193】
タンパク質抗原または抗体を、最低100容積の20mMホウ酸塩、150mM NaCl、pH8(BBS)に対して、2〜8℃で少なくとも4時間透析する。ビオチン化の前にバッファーを少なくとも1回を交換する。タンパク質抗原または抗体を、ビオチン−XX−NHSエステル(モレキュラー・プローブス(Molecular Probes)、オレゴン州、ユージーン、ジメチルホルムアミド中40mMの保存溶液)と、最終濃度1mMで、室温で1時間反応させる。1時間後、タンパク質抗原または抗体をBBSに十分に透析して未反応の小分子を除去する。
【0194】
アルカリホスファターゼ抗原コンジュゲートの調製
【0195】
アルカリホスファターゼ(AP、カルザイム・ラボラトリーズ(Calzyme Laboratories)、カリフォルニア州、サン・ルイス・オビスポ)を、2〜8℃で少なくとも4時間、最低100容積のカラムバッファー(50mMリン酸カリウム、10mMホウ酸塩、150mM NaCl、1mM MgSO4、pH7.0)に対する透析に付す。APを使用する前に少なくとも2回バッファーを交換する。APを透析から回収し、室温にし、1mg/mL溶液に対して吸光度0.77を用いて280nmの吸光度によって濃度を求める。APをカラムバッファーで5mg/mLに希釈する。APとスクシンイミジル4−(N−マレイミドメチル)シクロヘキサン−1−カルボキシレート(SMCC、ピエルス・ケミカル社(Pierce Chemical CO.)、イリノイ州、ロックフォード)の反応を、20:1の割合のSMCC:APを用いて実施する。SMCCをアセトニトリルに20mg/mLで溶解し、ボルテックス処理または迅速に攪拌しながらAPに加える際に84倍に希釈する。溶液を室温で90分間静置させ、次いで、カラムバッファーで平衡化したカラムにおけるゲル濾過クロマトグラフィー(G50Fine、ファルマシア・バイオテック(Pharmacia Biotech)、ニュージャージー州、ピスカタウェイ)を用いて未反応のSMCCおよび低分子量反応産物をAPから分離する。
【0196】
タンパク質抗原を最低100容積の20mMリン酸カリウム、4mMホウ酸塩、150mM NaCl、pH7.0に対して、2〜8℃で少なくとも4時間透析する。抗原を使用する前に少なくとも2回バッファーを交換する。280nmの吸光度によって、またはローリー法によって抗原の量を定量する。抗原とN−スクシンイミジル3−[2−ピリジルジチオ]プロピオネート(SPDP、ピエルス・ケミカル社、イリノイ州、ロックフォード)の反応を、20:1モル比のSPDP:抗原を用いて実施する。SPDPをジメチルホルムアミドに40mMで溶解し、ボルテックス処理しながら抗原溶液に入れて希釈する。この溶液を室温で90分間静置させ、その時点で、タウリン(アルドリッチ・ケミカル社(Aldrich Chemical Co.)、ウィスコンシン州、ミルウォーキー)を最終濃度20mMに5分間加えることによって反応をクエンチする。タンパク質にジチオスレイトール(フィッシャー・サイエンティフィック、ペンシルバニア州、ピッツバーグ)を最終濃度1mMで30分間加える。50mMリン酸カリウム、10mMホウ酸塩、150mM NaCl、0.1mMエチレンジアミン四酢酸(EDTA、フィッシャー・サイエンティフィック、ペンシルバニア州、ピッツバーグ)、pH7.0で平衡化したカラムにおけるゲル濾過クロマトグラフィーを用いて、低分子量反応産物を抗原から分離する。
【0197】
APおよび抗原を、等モル比でともに混合する。反応物を2時間室温に置く。このコンジュゲートを、1%ウシ血清アルブミン(30%BSA、バイエル、イリノイ州、カンカキーから作製)、10mM Tris、150mM NaCl、1mM MgCl2、0.1mM ZnCl2、0.1%ポリビニルアルコール(80%加水分解、アルドリッチ・ケミカル社、ウィスコンシン州、ミルウォーキー)、pH8.0を含有するブロックで0.1mg/mLに希釈する。
【0198】
アビジン磁性ラテックスの調製
【0199】
磁性ラテックス(エスタポール(Estapor)、10%固体、バングス・ラボラトリーズ(Bangs Laboratories)、インディアナ州、フィッシャー)を十分に再懸濁し、15mlの円錐管に2ml分注する。磁性ラテックスを12mlの蒸留水に懸濁し、磁石を用いて溶液から10分間分離する。依然磁石中にありながら、10mLの滅菌ピペットを用いて液体を注意深く除去する。この洗浄プロセスをさらに3回反復する。最後に洗浄した後、ラテックスを2mlの蒸留水に再懸濁する。別個の50ml円錐管中で、10mgのアビジン−HS(ニュートラアビジン(NeutrAvidin)、ピエルス、イリノイ州、ロックフォード)を18mlの40mM Tris、0.15M塩化ナトリウム、pH7.5(TBS)に溶解する。ボルテックス処理しながら、希釈したアビジン−HSに洗浄した磁性ラテックス2mlを加え、混合物をさらに30秒間ボルテックス処理する。この混合物を、30分毎に振盪しながら、45℃で2時間インキュベートする。磁石を用いてアビジン磁性ラテックスを溶液から分離し、前述したように、20ml BBSで3回洗浄する。最後に洗浄した後、ラテックスを10ml BBSに再懸濁し、4℃で保存する。
【0200】
使用する直前に、アビジン磁性ラテックスをパニングバッファー(40mM TRIS、150mM NaCl、20mg/mL BSA、0.1% Tween20(フィッシャー・サイエンティフィック、ペンシルバニア州、ピッツバーグ)、pH7.5)中で平衡化する。滅菌15ml遠心管にパニング実験に必要なアビジン磁性ラテックス(200μl/サンプル)を加え、パニングバッファーで10mlにする。この管を磁石上に10分間置き、ラテックスを分離する。前述したように、10mL滅菌ピペットで溶液を注意深く除去する。磁性ラテックスを10mLのパニングバッファーに再懸濁し、2回目の洗浄を開始する。磁性ラテックスをパニングバッファーで全3回洗浄する。最後に洗浄した後、ラテックスをパニングバッファーに再懸濁し、初期アリコート容量とする。
【0201】
M13ファージまたは抗体ファージディスプレイベクター突然変異誘発反応で形質転換された細胞のプレーティング
【0202】
100mm LBアガープレートにプレーティングする場合は200μLの大腸菌XL1−ブルーの一晩培養物に、または、滅菌15ml培養管中の150mmプレートにプレーティングする場合は600μLの一晩細胞に、ファージサンプルを加える。LBトップアガー(100mmプレートに対して3mL、または150mmプレートに対して9mL、55℃で保存されたトップアガー、付録A1、モレキュラー・クローニング・ア・ラボラトリーズ・マニュアル(Molecelar Cloning, A Laboratory Manual)、(1989)サムブロック(Sambrook),J)を加えた後、混合物を、アガー表面の過剰な水分を除去するよう予熱しておいた(37℃〜55℃)LBアガープレート上に等分に分配する。プレートを、トップアガーが固化するまで室温で冷却する。指示通り、プレートを反転させ、37℃でインキュベートする。
【0203】
アルカリホスファターゼコンジュゲートを含むニトロセルロースフィルターの現像
【0204】
ニトロセルロースフィルターをLBアガープレート上で一晩インキュベートした後、メンブランピンセットを用いてプレートからフィルターを注意深く回収し、抗原−APコンジュゲートを用いる場合は、カゼインブロック(1%カゼイン(ハマーステン(Hammersten)等級、リサーチ・オーガニックス(Research Organics)、オハイオ州、クリーブランド)を含むブロック)、またはヤギ抗マウスκ−AP(サザン・バイオテクノロジー・アソシエーツ社(Southern Biotechnology Associates Inc)、アラバマ州、バーミンガム)を用いる場合はブロック中のいずれかで、2時間インキュベートする。2時間後、フィルターをAPコンジュゲートとともに2〜4時間インキュベートする。抗原−APコンジュゲートをカゼインブロックに最終濃度1μg/mLで希釈し、ヤギ抗−マウスκ−APコンジュゲートをブロックに最終濃度1μg/mLで希釈する。フィルターを40mM TRIS、150mM NaCl、0.05% Tween20、pH7.5(TBST)(フィッシャー・ケミカル、ペンシルバニア州、ピッツバーグ)で各5分間3回洗浄する。最後の洗浄の後、フィルターを、0.2M 2−アミノ−2−メチル−1−プロパノール(JBLサイエンティフィック(Scientific)、カリフォルニア州、サン・ルイス・オビスポ)、0.5M TRIS、0.33mg/mLニトロブルーテトラゾリウム(フィッシャー・サイエンティフィック、ペンシルバニア州、ピッツバーグ)および0.166mg/mL 5−ブロモ−4−クロロ−3−インドリル−ホスフェート、p−トルイジン塩を含有する溶液中で現像する。
【0205】
重鎖上のタグ、およびκ鎖上のポリヒスチジン配列を用いないBNPペプチドに対するポリクローナルファージの濃縮
【0206】
この実施例では、BNPペプチドに対するファージライブラリーの複数ラウンドのスクリーニングを記載する。何ラウンドかのスクリーニングを、抗体の多重コピーをファージが提示するための濃縮のラウンドと入れ替える。ファージがいずれかの軽鎖を提示するパーセンテージと注目するBNPペプチドに対して特異的な親和性を有するFab断片(以下、「抗原」と呼ぶ)をファージが提示するパーセンテージを、スクリーニングの各ラウンドの後に測定する。
【0207】
第1ラウンド抗体ファージは、前述したようにBS39ウラシル鋳型を用いて調製する。突然変異誘発DNAの2回のエレクトロポレーションの効率は9.7×107PFUおよび8.3×107PFUであった。両エレクトロポレーションから得たファージを合わせ、パニングバッファーで3.2mlに希釈する。ファージを、15mLのプラグシールキャップ付ディスポーザブル滅菌遠心管に2〜1mLのアリコートに分注する。各ファージアリコートに抗原−ビオチン(10μL、10-6M保存濃度)を加える。ファージサンプルを2〜8℃で一晩インキュベートする。
【0208】
インキュベートした後、ファージサンプルをアビジン磁性ラテックスを用いて取り出す。サンプルあたり、平衡化したアビジン磁性ラテックス(実施例11参照)、200μLラテックスをファージとともに室温で10分間インキュベートする。10分後、各ファージサンプルに約9mLのパニングバッファーを加え、磁石を用いて磁性ラテックスを溶液から分離する。磁石中で10分後、結合していないファージを、10mL滅菌ピペットで注意深く除去する。次いで、磁性ラテックスを10mLのパニングバッファーに再懸濁し、2回目の洗浄を開始する。ラテックスを前述したように全5回洗浄する。各洗浄について、管を磁石中に10分間置き、結合していないファージを磁性ラテックスから分離する。5回目の洗浄の後、磁性ラテックスを1mL TBSに再懸濁し、1.5mLの管に移す。この時点でラテックスのアリコートを取り、前述したように、100mm LBアガープレート上にプレーティングする。磁性ラテックスの大部分(99%)を200μL 2×YTに再懸濁し、実施例12に記載したように150mm LBアガープレート上にプレーティングする。100mm LBアガープレートを37℃で6〜7時間インキュベートし、次いで、プレートを室温に移し、ニトロセルロースフィルター(孔サイズ0.45μm、BA85プロトラン(Protran)、シュライシャー・アンド・シュール(Schliecher and Schuell)、ニューハンプシャー州、キーン)をプラーク上にかぶせる。ニトロセルロースフィルターを付けたプレートを室温で一晩インキュベートする。150mmプレートを用いて、磁性ラテックスと結合しているファージを増幅し抗体ファージの次のラウンドを作製する。これらのプレートを37℃で4時間、次いで20℃で一晩インキュベートする。
【0209】
一晩インキュベートした後、抗体ファージを150mmプレートから溶出し、前述したように、アルカリホスファターゼ−抗原を用いてフィルターを発現させる。8mL 2YT培地を菌叢上にピペットで加え、室温で20分間穏やかに振盪することによって150mmプレートから抗体ファージを溶出する。ファージを15mLのプラグシールキャップ付ディスポーザブル滅菌遠心管に移し、LBプレートに由来する細片を、3500rpmで15分間遠心分離することによってペレットにする。次いで、第2ラウンド抗体ファージを新しい管に移す。
【0210】
パニングの第2ラウンドを開始するために、ファージの10-7および10-8希釈液10μLを100mmLBアガープレートにプレーティングすることによって抗体ファージを滴定する。このプレートを37℃で6〜7時間インキュベートし、次いで、プレート上のプラーク数を計数する。また、抗体ファージにおけるκ陽性のパーセンテージをモニターするために、ニトロセルロースフィルターをプレート上にかぶせ、室温で一晩インキュベートする。κ陽性のパーセンテージは無傷のFab断片を提示するファージの割合の尺度である。
【0211】
両第2ラウンド抗体ファージサンプルを、各サンプルをパニングバッファーに最終濃度5×109PFU/mLで希釈し、最終容量を1mLにすることによってプールする(抗
体ファージの力価は約2×1012PFU/mLおよび1.7×1012である)。ファージに抗原−ビオチン(10μL、10-6M保存濃度)を加え、2〜8℃で一晩ファージをインキュベートする。抗体ファージ力価プレート上のニトロセルロースフィルターを、前述したように、ヤギ抗−マウスκAPを用いて発現させる。第2ラウンド抗体ファージを、前述したようにアビジン磁性ラテックスを用いて取り出す。ラテックスをパニングバッファーで洗浄した後、ラテックスを1mL TBSに再懸濁し、1.5mLの管に移す。ラテックスのアリコートを、前述したように、100mm LBアガープレートにプレーティングし、機能的陽性を調べ、ラテックスの残りを150mm LBアガープレートにプレーティングして第3ラウンド抗体ファージを作製する。抗体ファージを滴定し、ファージをパニングバッファーに希釈し、抗原−ビオチンを加え、ファージを2〜8℃で少なくとも16時間インキュベートし、ファージをアビジン磁性ラテックスで取り出し、磁性ラテックスをプレーティングするというこの基本手順を、10ラウンドのパニング継続する。前述したものからの変更は、結合している抗体のアフィニティーを高めるために抗原−ビオチン濃度がより低いということ、および取り出されるファージの数が1010と108の間であるということだけである。
【0212】
抗原−ビオチンに対するパニングの10回目のラウンドの後、抗体ファージを多価ディスプレイのための濃縮のラウンドに付す。濃縮は、提示された軽鎖に融合されているヘキサヒスチジンタグのNi NTAアガロース(キアゲン社(Qiagen Inc.)、カリフォルニア州、チャッツワース)への結合によって達成される。11回目のラウンドの抗体ファージ(2.5mL)を、プラグシールキャップ付15mLのディスポーザブル滅菌遠心管中で2.5mLパニングバッファーに希釈する。以下の手順を用いてNi NTAをパニングバッファーに平衡化する。樹脂(ファージサンプルあたり1mL)を、50mLのプラグシールキャップ付ディスポーザブル滅菌遠心管中で、パニングバッファーで50mLに希釈し、次いで、IEC遠心分離機で、500rpmで1分間ペレットにする。上清を50mLのディスポーザブルピピットを用いて注意深く除去し、2回目の洗浄のために樹脂をパニングバッファーで50mLに再度希釈する。樹脂をパニングバッファー中で平衡化するために、このように樹脂を全4回洗浄する。次いで、平衡化した樹脂をパニングバッファーでその最初の容積に再懸濁する。次いで、平衡化した樹脂(1mL)をファージに加え、管を15分間穏やかに揺り動かす。15分後、IEC遠心分離機で、500rpmで1分間樹脂をペレットにする。上清を10mLディスポーザブルピペットで穏やかに除去し、樹脂を最初の洗浄のために10mLパニングバッファーに再懸濁する。前述したように、樹脂をペレットにし、上清を除去し、樹脂を10mLのパニングバッファーに2回目の再懸濁をする。この手順を全5回のパニングバッファー洗浄のために反復する。5回目の洗浄液を除去した後、樹脂を1mLの溶出バッファー(50mMクエン酸塩、150mM NaCl、pH4.0)に再懸濁し、1.5mLの管に移す。樹脂を1時間穏やかに揺り動かし、抗体ファージを溶出する。1時間後、樹脂をペレットにし(エッペンドルフ遠心分離機で14,000rpm、5分)、樹脂を少しも移さないよう注意しながら、ファージを回収する。ファージ溶液のpHを8に調整するために、1mLのファージサンプルに50μLの1M Tris、pH8.3および46μLの1M NaOHを加える。また、101Lの300mg/mLウシ血清アルブミン(バイエル、イリノイ州、カンカキー)をファージサンプルに加える。前述のように、抗原−ビオチンを用いるパニングの11回目のラウンドのために、得られたファージ溶液(1mL)を15mLのプラグシールキャップ付ディスポーザブル滅菌遠心管に移す。
【0213】
パニングの12回目〜14回目のラウンドを前述のように行い、ここで抗体ファージをNi NTAに結合させ、溶出し、溶出したファージを抗原−ビオチンを用いて取り出す。しかし、ラウンド13において、Ni NTAから溶出したファージに標識していないC末端BNPペプチドを抗原−ビオチンに対して100倍モル過剰で加え、C末端BNPペプチド結合せず、抗原と特異的に結合する抗体を選択する。
【実施例3】
【0214】
生化学的解析
標準的なイムノアッセイ技術を用いてBNPを測定する。これらの技術は、タンパク質標的と特異的に結合する抗体の使用を含む。N−ヒドロキシスクシンイミドビオチン(NHS−ビオチン)を抗体あたり約5のNHS−ビオチン成分の割合で用いて、BNPに対する抗体をビオチン化する。次いで、標準アビジン384ウェルマイクロタイタープレートのウェルにビオチン化した抗体を加え、プレートに結合していないビオチン化抗体を除去する。これによって、マイクロタイタープレートに抗−BNP固相が形成される。別の抗BNP抗体を、標準技術を用い、SMCCおよびSPDP(ピエルス、イリノイ州、ロックフォード)を用いてアルカリホスファターゼにコンジュゲートする。イムノアッセイをTECANジェネシス(Genesis)RSP200/8ワークステーションで実施する。試験サンプル(10μl)をピペットでマイクロタイタープレートのウェルに入れ、60分間インキュベートする。次いで、このサンプルを除去し、ウェルを、150mM NaCl、0.1%アジ化ナトリウム、および0.02%Tween−20を含有する20mMホウ酸塩(pH7.42)からなる洗浄バッファーで洗浄する。次いで、ウェルにアルカリホスファターゼ−抗体コンジュゲートを加え、さらに60分間インキュベートし、その後、抗体コンジュゲートを除去し、洗浄バッファーでウェルを洗浄する。ウェルに基質(アットフォス(AttoPhos)(登録商標)、プロメガ(Promega)、ウィスコンシン州、マディソン)を加え、蛍光産物の形成度を試験サンプル中のBNPの濃度と関連付ける。
【実施例4】
【0215】
DPP阻害剤の合成
【0216】
ペプチドカップリング化学を用いて線状ボロPro化合物を調製することが好ましい。本発明に用いるペプチドカップリング化学法および手順は容易に入手できる。これらの方法を用いる教本の例としては、それだけには限らないが、以下の、参照により本明細書に組み込まれる引用文が挙げられる:P.D.ベイリー(Bailey)、「アン・イントロダクション・トゥー・ペプチド・ケミストリー(An Introduction to Peptide Chemistry)」、ジョン・ウィリー&サンズ(John Wiley & Sons)、1990;ミクロス・ボダンスキー(Miklos Bodansky)、「ペプチド・ケミストリー・ア・プラクティカル・テキストブック(Peptide Chemistry A Practical Textbook)」、スプリンガー−ベルラグ(Springer−Verlag)、1988;ミクロス・ボダンスキー、「プリンシプルズ・オブ・ペプチド・シンセシス、リアクティビティー・アンド・ストラクチャー・コンセプツ・イン・オーガニック・ケミストリー(Principles of Peptide Synthesis, Reactivity and Structure Concepts in Organic Chemistry)」、第16巻、スプリンガー−ベルラグ、1984;およびミクロス・ボダンスキー、「プリンシプルズ・オブ・ペプチド・シンセシス、リアクティビティー・アンド・ストラクチャー・コンセプツ・イン・オーガニック・ケミストリー」第21巻、スプリンガー−ベルラグ、1984。
【0217】
本発明の化合物は、WO98/00439に開示されたようにH−ボロProの合成で開始することができる。H−ボロProの使用は単に例示目的のためであって、本発明の範囲を制限しようとするものではない。WO98/00439に従い、H−ボロProを、従前に開発され、記載された(G.R.フレンケ(flentke)ら、「インヒビション・オブ・ジペプチジル・アミノペプチダーゼIV(DP−IV)バイ・Xaa−ボロProジペプチド・アンド・ユース・オブ・ジーズ・インヒビターズ・トゥー・エクザミン・ザ・ロール・オブ・DP−IV・イン・T−セル・ファンクション(Inhibition of dipeptidyl aminopeptidase IV (DP−IV) by Xaa−boroPro dipeptides and use of these inhibitors to examine the role of DP−IV in T−cell function)」)PNAS(米国)88、1556〜1559頁(1991)、また、米国特許第5,462,928号にも記載されている)合成経路によって調製することができる。あるいは、H−ボロProは新規手順によって製造することもできる(ケリー(Kelly,T.A.ら、「ザ・エフィシャント・シンセシス・アンド・シンプル・レゾルーション・オブ・ア・プロリン・ボロネート・エステル・スータブル・フォー・エンザイム・インヒビション・スタディーズ(The efficient synthesis and simple resolutionof a proline boronate ester suitable for enzyme inhibition studies)」、テトラヘドロン(Tetrahedron)49、1009〜1016頁、(1993))。報告によれば、これら両合成経路ともラセミ化合物のH−ボロProピナンジオールが生成する。
【0218】
WO98/00439によれば、まず、ラセミ化合物のH−ボロProを、光学活性ブロッキング保護基((1S、2S、3R、5S)−+−ピナンジオール異性体)を用いて結晶化によって分割し、次いで、同位体的に純粋なL−ボロProおよびD−ボロProをリジンの立体化学的に純粋なL異性体とカップリングすることによって、Z−Lys−ボロProの立体化学的に純粋なL、LおよびL,Dジアステレオマーを調製する(米国特許第5,462,928号参照)。あるいは、ラセミ化合物のH−ボロProをL−Lysによってカップリングし、ジアステレオマーのPro−ボロProについて従前に記載されているように(W.G.グートハイル(Gutheil)およびW.W.バコブチン(bachovchin)、「セパレーション・オブ・L−Pro−DL−ボロPro・イントゥー・イッツ・コンポーネント・ジアステレオマーズ・アンド・カイネティック・アナリシス・オブ・ゼア・インヒビション・オブ・ジペプチジル・ペプチダーゼ・IV.ア・ニュー・メソッド・フォー・ザ・アナリシス・オブ・スロー、タイト−バインディング・インヒビション(Separation of L−Pro− DL−boroPro into Its Component Diastereomers and Kinetic Analysis of Their Inhibition of Dipeptidyl Peptidase IV. A New Method for the Analysis of Slow, Tight−Binding Inhibition)」)、バイオケミストリー(Biochemistry)32、8723〜8731頁、(1993))、逆相HPLCを用いて得られたジアステレオマーのZ−Lys−ボロPro−ジエステルをその成分L,DとL、Lジアステレオマーに分離することによって、Lys−ボロProのL,LおよびL,Dジアステレオマーを高い光学純度で調製する。
【実施例5】
【0219】
ジペプチジルペプチダーゼの精製
【0220】
以下の実施例はジペプチジルペプチダーゼIVについての例示的なものである:ジペプチジルペプチダーゼIIは、米国特許第6,485,955号の方法と同様に単離し、用いることができる。
【0221】
ブタ酵素を、いくつかの改変を加えながらも、従前に記載されたように(1)精製する。15〜20個体の動物から腎臓を獲得し、皮質を切り取り、−80℃で凍結する。凍結組織(2000〜2500g)を、ワーリングブレンダー中、12Lの0.25Mスクロース中でホモジェナイズする。ホモジェネートを37℃に18時間静置し、DPP4の細胞膜からの切断を促す。切断ステップの後、ホモジェネートを4℃、7000×gで20分間遠心分離することによって清澄化し、上清を回収する。固体硫酸アンモニウムを60%飽和まで加え、10,000×gで遠心分離することによって沈殿物を回収し、廃棄する。上清にさらなる硫酸アンモニウムを80%飽和まで加え、80%ペレットを回収し、20mM Na2HPO4、pH7.4に溶解する。
【0222】
20mM Na2HPO4、pH7.4に対して透析した後、10,000×gで遠心分離することによって調製物を清澄化する。次いで、清澄化した調製物を、同バッファー中で平衡化したConAセファロース300mlにアプライする。一定のA280までバッファーで洗浄した後、カラムを5%(wt/vol)メチルα−D−マンノピラノシドで溶出する。活性画分をプールし濃縮し、5mM酢酸ナトリウム、pH5.0に対して透析する。透析した物質を同バッファー中で平衡化したファルマシア(Pharmacia)・リソース(Resource)Sカラム100mlに流す。フロースルー物質を回収すると、酵素活性のほとんどが含まれている。再度、活性物質を濃縮し、20mM Na2HPO4、pH7.4中で透析する。最後に、濃縮した酵素をファルマシアS−200ゲル濾過カラムでのクロマトグラフィーに付し、低分子量夾雑物を除去する。還元性SDS−PAGEによってカラム画分の純度を分析し、最も純度の高い画分をプールし、濃縮する。精製した酵素を−80℃で20%グリセロール中に保存する。
【実施例6】
【0223】
ジペプチジルペプチダーゼのアッセイ
【0224】
酵素は、ナガツら、アナリティカル・バイオケミストリー、74、466〜76頁、1976に従前に記載されたように、定常状態条件下で、基質としてBNPを用い、以下の改変を加えてアッセイする。反応液は、100μLの最終容量中、100mM ACES、52mM TRIS、52mMエタノールアミン、500μM 基質、0.2% DMSO、および4.5nM酵素、25℃、pH7.4を含む。陽性化合物の解析には、基質と阻害剤濃度双方の関数として定常状態動力学的阻害定数を求める。完全阻害実験は、11の基質濃度および7の阻害剤濃度を含め、3連の測定を行う。Kiが20nM未満である強力結合阻害剤については、酵素濃度を0.5nMに下げ、反応時間を120分に増加する。3枚のプレートからプールしたデータセットを競合的、非競合的、不競合的阻害のいずれかに適当な方程式に当てはめる。
【実施例7】
【0225】
ナトリウム利尿ペプチドの化学的脱グリコシル化
【0226】
N2で飽和したガラス管において、50μgのタンパク質を、100μlのトリフルオロメタンスルホン酸/アニソール(2:1、v/v)試薬とともに暗黒下、4℃で2時間インキュベートする。−20℃の60%(v/v)ピリジンを添加することによって反応を停止する。タンパク質を、25mMリン酸ナトリウムバッファーpH7.0に対して十分に透析する。
【実施例8】
【0227】
ナトリウム利尿ペプチドの酵素的脱グリコシル化
【0228】
40μLのサンプルに2μLの25×プロテアーゼ阻害剤カクテル(シグマ(Sigma)、カタログ番号P2714)、1μLのO−グリカナーゼ(プロザイム(prozyme)、カタログ番号GK80090)、3μLのシアリダーゼA(プロザイム、カタログ番号GK80040)および8μLの200mMリン酸ナトリウムバッファーpH7.0を加える。この混合物を穏やかにボルテックス処理し、20℃で4時間インキュベートする。
【実施例9】
【0229】
質量分析によるナトリウム利尿ペプチドの解析
【0230】
抗体捕獲表面の調製
3μLの抗体溶液(ホウ酸緩衝生理食塩水pH8.0(「BBS」)中、0.25mg/mLの抗BNPモノクローナル抗体)を、PS10プロテインチップアレイ(サイファージェン(Ciphergen)、カタログ番号C553−0044)の適当なスポットにアプライし、このチップを加湿チャンバー中に入れ、20℃で3時間穏やかに攪拌する。抗体溶液を除去し、アレイスポットを3μLの1.5mg/mL BSA/0.1%TritonX−100/0.5M Tris−HCl pH8.0で2回洗浄する。2回目の洗浄で、チップを加湿チャンバー中に、攪拌せずに20℃で3時間入れる。この洗浄の後、アレイを5mM HEPES pH7.5中に浸漬し、過剰のバッファーを除去する。
【0231】
BNPの捕獲
BIOMECロボットピペッティングステーション(ベックマン・インストルメンツ(Beckman Instruments))を用いて、アレイを150μLのBBS中、1%TritonX−100で10分間、150μLのBBS中、10%PEG300/0.1%TritonX−100で10分間、および150μLのBBS中、0.2%Triton X−100で各5分間を3回にて、洗浄する。40μLのBBS中、0.2%TritonX−100および40μLの脱グリコシル化サンプル(または対照サンプル)をアプライし、穏やかに攪拌しながら4℃で一晩インキュベートする。
【0232】
エネルギー吸収マトリックスおよびMS解析の適用
このインキュベーションの後、アレイを150μLの1M尿素/0.1%CHAPS/0.3M KCl/50mM Tris−HCl pH7.5で各1分間、3回洗浄し、300μLの5mM HEPES pH7.5で各3秒間、3回洗浄する。過剰のバッファーを除去し、光沢が全く見えなくなるまでアレイを風乾させる。低分子量の解析には(M/Z<6000)、エネルギー吸収マトリックス(「EAM」)のように適当なスポットに1μLの、0.5%トリフルオロ酢酸(ピエルス、カタログ番号28904)/50%アセトニトリル(ピエルス、カタログ番号20062)中、20%α−シアノ−4−ヒドロキシ桂皮酸(CHCA、サイファージェン、カタログ番号C300−0001)をアプライする。高分子量解析には(M/Z≧6000)、EAMのように適当なスポットに、1μLの、0.5%トリフルオロ酢酸/50%アセトニトリル中、50%シナピン酸(SPA、サイファージェン、カタログ番号C300−0002)をアプライする。スポットを風乾させ、適当なEAMの2回目の1μLの液滴をアプライする。
【0233】
サイファージェン・プロテインチップ・リーダー・モデルPBS IICを用いてMSスペクトルを獲得する。低分子量解析には、以下の機器パラメータを用いる:ハイマスは70kDa、2kDa〜15kDaで最適に設定する;出発レーザー強度を165に設定する;出発検出感度は9に設定する;質量偏向器は1kDaに設定する;獲得方法はSELDI定量に設定する;SELDI獲得パラメータ=26、デルタ=10、トランシエント・パー(transients per)=18、エンディング・ポジション(ending position)=76、および強度で5ショットを含むウォーミング・ポジション(warming positions)=175。高分子量解析には、以下の機器パラメータを用いる:ハイマスは70kDa、3kDa〜30kDaで最適に設定する;出発レーザー強度を200に設定する;出発検出感度は9に設定する;質量偏向器は2kDaに設定する;獲得方法はSELDI定量に設定する;SELDI獲得パラメータ=24、デルタ=10、トランシエント・パー=13、エンディング・ポジション=74、および強度で3ショットを含むウォーミング・ポジション=210。
【実施例10】
【0234】
BNP分解の阻害
【0235】
2種のヒト血漿サンプルを個々に2つの管に分け、その一方に可逆的DPP阻害剤ジプロチンA(Ile−Pro−Ile)を、1mMの濃度まで加えた。各サンプルをヒトBNP77〜108でスパイクし、この混合物を4℃で一晩維持した。各サンプルを、前述したように、抗体捕獲SELDI質量分析に付した。結果を図1に示す。パネルA(添加なし)およびB(ジプロチンA)が一方の血漿サンプルに相当し、パネルC(添加なし)およびD(ジプロチンA)が2番目の血漿サンプルに相当する。捕獲はヒトBNPを認識する抗体を用いて実施した。
【0236】
全長BNP77〜108は約3466Daの分子量(長い矢じり)に、BNP79〜108(最後から2番目のプロリンで切断が生じている)は約3282Da(短い矢じり)に現れると予想される。パネルAとBおよびCとDを比較すると、DPP阻害剤によってBNP77〜108のBNP79〜108への切断が阻害されている。約2988Daの分子量でBNP79〜106であると推定される第2の切断産物も、ジプロチンA処理によって阻害され、約3173Daの分子量でBNP77〜106であると推定される切断産物が相応して増加している。したがって、アミノ末端ser−proジペプチドの除去は、DPP阻害剤の存在に対して感受性であり、第2のカルボキシル末端ジペプチド切断はそうではない。
【0237】
本発明を、当業者がこれを作製し使用するのに十分なほど詳細に説明および例示してきたが、本発明の趣旨および範囲から逸脱することなく種々の代替、改変および改良は明らかであるはずである。
【0238】
当業者ならば、本発明は記載した目的を実施し、記載した結果および利点、ならびにそれらに内在するものを得るのに十分に適応していることを容易に理解するであろう。本明細書に提供した実施例は、好ましい実施形態の代表であり、例示的なものであり、本発明の範囲を制限しようとするものではない。当業者にとっては、その改変およびその他の用途も生じるであろう。これらの改変は本発明の趣旨内に包含され、特許請求の範囲によって画定されている。
【0239】
当業者ならば、本明細書に開示された本発明に、本発明の範囲および趣旨から逸脱することなく、さまざまな置換、改変をなすことがで可能であることは容易に理解できるであろう。
【0240】
本明細書に記載したすべての特許および出版物は、本発明の属する技術分野の技術者のレベルを示すものである。すべての特許および出版物は、各個々の出版物を具体的、かつ、個別に参照により組み入れるよう示すのと同程度に、参照により本明細書に組み入れる。
【0241】
本明細書に例示的に記載した本発明は、本明細書に具体的に開示されていない、いずれかの要素または要素類、制限または制限類がなくとも、適切に実施できる。したがって、例えば、本明細書の各場合において、用語「含んでなっている」、「本質的にからなる」、および「からなる」のいずれかを、他の2つの用語のいずれかと置き換えることができる。用いてきた用語および表現は、説明用語として用いるものであって制限するものではなく、このような用語および表現の使用には、示され、説明される特徴またはその一部の何らかの等価物を排除する意図は全くなく、特許請求される本発明の範囲内で種々の改変が可能であるということは理解されよう。したがって、本発明が、好ましい実施形態および任意の特徴によって具体的に開示されていたとしても、当業者によって、本明細書に開示された考え方の改変および変法をとることができるということ、ならびにこのような改変および変法は、添付の特許請求の範囲によって画定される本発明の範囲内にあると考えられるということは理解されなくてはならない。
【特許請求の範囲】
【請求項1】
被験体から得たサンプル中の、注目する1種以上のナトリウム利尿ペプチドの存在または量を検出する方法であって、1種以上の前記ナトリウム利尿ペプチドが共有結合している糖鎖残基を含んでなり、
注目する1種以上の前記ナトリウム利尿ペプチドから1種以上の共有結合している糖鎖残基を除去することと、
前記サンプルをアッセイして前記サンプル中の注目する前記ナトリウム利尿ペプチドの存在または量と関連するアッセイ結果を得ること
とを含んでなる、方法。
【請求項2】
前記の1種以上の共有結合している糖鎖残基を酵素処理によって除去する、請求項1に記載の方法。
【請求項3】
前記酵素処理が、N−結合型糖鎖残基を除去する1種以上の酵素での処理を含んでなる、請求項2に記載の方法。
【請求項4】
前記酵素処理が、O−結合型糖鎖残基を除去する1種以上の酵素での処理を含んでなる、請求項2に記載の方法。
【請求項5】
前記酵素処理が、N−結合型とO−結合型糖鎖残基の双方を除去する1種以上の酵素での処理を含んでなる、請求項2に記載の方法。
【請求項6】
前記の1種以上の共有結合している糖鎖残基を非酵素的化学処理によって除去する、請求項1に記載の方法。
【請求項7】
注目する1種以上の前記ナトリウム利尿ペプチドから糖鎖残基の少なくとも80%が除去される、請求項1に記載の方法。
【請求項8】
被験体がヒトである、請求項1に記載の方法。
【請求項9】
サンプルが血液、血清および血漿からなる群から選択される、請求項1に記載の方法。
【請求項10】
前記アッセイステップが、前記の注目する1種以上のナトリウム利尿ペプチドを、注目する1種以上のナトリウム利尿ペプチドと特異的に結合するよう選択された抗体と接触させることを含んでなる、請求項1に記載の方法。
【請求項11】
前記アッセイステップがイムノアッセイを実施することを含んでなる、請求項10に記載の方法。
【請求項12】
前記アッセイステップが質量分析を実施することを含んでなる、請求項10に記載の方法。
【請求項13】
前記アッセイステップが質量分析を実施することを含んでなる、請求項1に記載の方法。
【請求項14】
前記の注目する1種以上のナトリウム利尿ペプチドが、BNP、1種以上のBNP関連断片、またはBNPと1種以上のBNP関連断片の双方を含んでなる、請求項1に記載の方法。
【請求項15】
前記の1種以上のBNP関連断片がBNPl〜76、BNP1〜108、BNP3〜76、およびBNP3〜108からなる群から選択される、請求項14に記載の方法。
【請求項16】
前記除去ステップの不在下で前記アッセイステップを実施することと比較して、前記方法が注目する1種以上の前記ナトリウム利尿ペプチドの検出を増加させる、請求項1に記載の方法。
【請求項17】
サンプル中の注目する1種以上のナトリウム利尿ペプチドの存在または量を検出する方法であって、1種以上の前記ナトリウム利尿ペプチドが共有結合している糖鎖残基を含んでなり、
注目する1種以上の前記ナトリウム利尿ペプチドから1種以上の共有結合している糖鎖残基を除去した後に得られるアッセイ結果の約2倍以内である、前記の、注目する1種以上のナトリウム利尿ペプチドからのアッセイ結果が得られるよう選択された1種以上の抗体を用いて前記サンプルでイムノアッセイを実施すること
を含んでなる、方法。
【請求項18】
前記の、注目する1種以上の前記ナトリウム利尿ペプチドからの1種以上の共有結合している糖鎖残基の除去によって、質量分析による注目する1種以上の前記ナトリウム利尿ペプチドの検出が増加する、請求項17に記載の方法。
【請求項19】
前記の、注目する1種以上の前記ナトリウム利尿ペプチドからの1種以上の共有結合している糖鎖残基の除去によって、注目する1種以上の前記ナトリウム利尿ペプチドから糖鎖残基の少なくとも80%が除去される、請求項17に記載の方法。
【請求項20】
サンプルがヒト由来である、請求項17に記載の方法。
【請求項21】
サンプルが血液、血清および血漿からなる群から選択される、請求項17に記載の方法。
【請求項22】
前記の注目する1種以上のナトリウム利尿ペプチドがBNP、1種以上のBNP関連断片、またはBNPと1種以上のBNP関連断片の双方を含んでなる、請求項17に記載の方法。
【請求項23】
前記の1種以上のBNP関連断片が、BNPl〜76、BNP1〜l08、BNP3〜76、およびBNP3〜108からなる群から選択される、請求項22に記載の方法。
【請求項24】
アッセイに用いる1種以上の抗体を選択する方法であって、
共有結合している糖鎖残基を含んでなる注目する1種以上のナトリウム利尿ペプチドから得られた第1のアッセイ結果を、注目する1種以上の前記ナトリウム利尿ペプチドから1種以上の共有結合している糖鎖残基を除去した後に前記の注目する1種以上のナトリウム利尿ペプチドから得られる第2のアッセイ結果と比較することによって、前記の1種以上の抗体をスクリーニングすることと、
ここで、前記第1および第2のアッセイ結果は、前記の注目する1種以上のナトリウム利尿ペプチドと、スクリーニングされる前記の1種以上の抗体との結合に応じて変わり、
前記の第2のアッセイ結果の約2倍以内である前記の第1のアッセイ結果が得られる1種以上の抗体を選択すること
とを含んでなる、方法。
【請求項25】
前記の選択された抗体を用いる前記のアッセイを構築することをさらに含んでなる、請求項24に記載の方法。
【請求項26】
前記抗体が抗体発現ライブラリーから選択される、請求項24に記載の方法。
【請求項27】
前記の、注目する1種以上の前記ナトリウム利尿ペプチドからの1種以上の共有結合している糖鎖残基の除去によって、質量分析による注目する1種以上の前記ナトリウム利尿ペプチドの検出が増加する、請求項24に記載の方法。
【請求項28】
前記の、注目する1種以上の前記ナトリウム利尿ペプチドからの1種以上の共有結合している糖鎖残基の除去によって、注目する1種以上の前記ナトリウム利尿ペプチドから、糖鎖残基の少なくとも80%が除去される、請求項24に記載の方法。
【請求項29】
前記の注目する1種以上のナトリウム利尿ペプチドが、BNP、1種以上のBNP関連断片、またはBNPと1種以上のBNP関連断片の双方を含んでなる、請求項24に記載の方法。
【請求項30】
前記の1種以上のBNP関連断片が、BNPl〜76、BNPl〜l08、BNP3〜76、およびBNP3〜l08からなる群から選択される、請求項29に記載の方法。
【請求項31】
水性媒質中の、最後から2番目のアミノ末端プロリン残基を含んでなる1種以上のナトリウム利尿ペプチドの分解を阻害する方法であって、
前記サンプル中に存在する1種以上の前記ナトリウム利尿ペプチドからの前記プロリン残基の喪失を阻害するよう選択された条件下で、前記水性媒質を、1種以上のジペプチジルペプチダーゼの阻害剤と接触させることを含んでなる、方法。
【請求項32】
前記接触ステップが、BNPからの最後から2番目のアミノ末端プロリン残基の喪失を阻害する、請求項31に記載の方法。
【請求項33】
1種以上の前記のジペプチジルペプチダーゼの阻害剤が小分子阻害剤である、請求項31に記載の方法。
【請求項34】
1種以上の前記のジペプチジルペプチダーゼの阻害剤が抗体である、請求項31に記載の方法。
【請求項35】
前記水性媒質が血液、血清または血漿である、請求項31に記載の方法。
【請求項36】
前記水性媒質のすべてまたは一部に存在する1種以上のナトリウム利尿ペプチドについてアッセイを実施することをさらに含んでなる、請求項31に記載の方法。
【請求項37】
被験体において循環BNPの半減期を延長する方法であって、
循環BNPの半減期を延長するよう選択された条件下で、前記被験体に1種以上のジペプチジルペプチダーゼの阻害剤を投与することを含んでなる、方法。
【請求項38】
1種以上の前記ジペプチジルペプチダーゼの阻害剤が小分子阻害剤である、請求項37に記載の方法。
【請求項39】
1種以上の前記ジペプチジルペプチダーゼの阻害剤が抗体である、請求項37に記載の方法。
【請求項40】
前記被験体が、脳卒中、うっ血性心不全、心虚血、全身性高血圧、および急性心筋梗塞からなる群から選択される診断に基づいて、前記の1種以上のジペプチジルペプチダーゼの阻害剤を投与されるよう選択される、請求項37に記載の方法。
【請求項41】
前記被験体が、前記投与ステップの前に少なくとも80pg/mLの血漿BNPレベルを有することに基づいて、前記の1種以上のジペプチジルペプチダーゼの阻害剤を投与されるよう選択される、請求項37に記載の方法。
【請求項42】
前記被験体にBNPまたはその類似体を投与することをさらに含んでなる、請求項37に記載の方法。
【請求項43】
前記被験体に中性エンドペプチダーゼの阻害剤を投与することをさらに含んでなる、請求項37に記載の方法。
【請求項44】
前記被験体にBNPまたはその類似体と中性エンドペプチダーゼの阻害剤とを投与することをさらに含んでなる、請求項37に記載の方法。
【請求項45】
1種以上のジペプチジルペプチダーゼの阻害剤とナトリウム利尿ペプチドとを含んでなる薬剤組成物。
【請求項1】
被験体から得たサンプル中の、注目する1種以上のナトリウム利尿ペプチドの存在または量を検出する方法であって、1種以上の前記ナトリウム利尿ペプチドが共有結合している糖鎖残基を含んでなり、
注目する1種以上の前記ナトリウム利尿ペプチドから1種以上の共有結合している糖鎖残基を除去することと、
前記サンプルをアッセイして前記サンプル中の注目する前記ナトリウム利尿ペプチドの存在または量と関連するアッセイ結果を得ること
とを含んでなる、方法。
【請求項2】
前記の1種以上の共有結合している糖鎖残基を酵素処理によって除去する、請求項1に記載の方法。
【請求項3】
前記酵素処理が、N−結合型糖鎖残基を除去する1種以上の酵素での処理を含んでなる、請求項2に記載の方法。
【請求項4】
前記酵素処理が、O−結合型糖鎖残基を除去する1種以上の酵素での処理を含んでなる、請求項2に記載の方法。
【請求項5】
前記酵素処理が、N−結合型とO−結合型糖鎖残基の双方を除去する1種以上の酵素での処理を含んでなる、請求項2に記載の方法。
【請求項6】
前記の1種以上の共有結合している糖鎖残基を非酵素的化学処理によって除去する、請求項1に記載の方法。
【請求項7】
注目する1種以上の前記ナトリウム利尿ペプチドから糖鎖残基の少なくとも80%が除去される、請求項1に記載の方法。
【請求項8】
被験体がヒトである、請求項1に記載の方法。
【請求項9】
サンプルが血液、血清および血漿からなる群から選択される、請求項1に記載の方法。
【請求項10】
前記アッセイステップが、前記の注目する1種以上のナトリウム利尿ペプチドを、注目する1種以上のナトリウム利尿ペプチドと特異的に結合するよう選択された抗体と接触させることを含んでなる、請求項1に記載の方法。
【請求項11】
前記アッセイステップがイムノアッセイを実施することを含んでなる、請求項10に記載の方法。
【請求項12】
前記アッセイステップが質量分析を実施することを含んでなる、請求項10に記載の方法。
【請求項13】
前記アッセイステップが質量分析を実施することを含んでなる、請求項1に記載の方法。
【請求項14】
前記の注目する1種以上のナトリウム利尿ペプチドが、BNP、1種以上のBNP関連断片、またはBNPと1種以上のBNP関連断片の双方を含んでなる、請求項1に記載の方法。
【請求項15】
前記の1種以上のBNP関連断片がBNPl〜76、BNP1〜108、BNP3〜76、およびBNP3〜108からなる群から選択される、請求項14に記載の方法。
【請求項16】
前記除去ステップの不在下で前記アッセイステップを実施することと比較して、前記方法が注目する1種以上の前記ナトリウム利尿ペプチドの検出を増加させる、請求項1に記載の方法。
【請求項17】
サンプル中の注目する1種以上のナトリウム利尿ペプチドの存在または量を検出する方法であって、1種以上の前記ナトリウム利尿ペプチドが共有結合している糖鎖残基を含んでなり、
注目する1種以上の前記ナトリウム利尿ペプチドから1種以上の共有結合している糖鎖残基を除去した後に得られるアッセイ結果の約2倍以内である、前記の、注目する1種以上のナトリウム利尿ペプチドからのアッセイ結果が得られるよう選択された1種以上の抗体を用いて前記サンプルでイムノアッセイを実施すること
を含んでなる、方法。
【請求項18】
前記の、注目する1種以上の前記ナトリウム利尿ペプチドからの1種以上の共有結合している糖鎖残基の除去によって、質量分析による注目する1種以上の前記ナトリウム利尿ペプチドの検出が増加する、請求項17に記載の方法。
【請求項19】
前記の、注目する1種以上の前記ナトリウム利尿ペプチドからの1種以上の共有結合している糖鎖残基の除去によって、注目する1種以上の前記ナトリウム利尿ペプチドから糖鎖残基の少なくとも80%が除去される、請求項17に記載の方法。
【請求項20】
サンプルがヒト由来である、請求項17に記載の方法。
【請求項21】
サンプルが血液、血清および血漿からなる群から選択される、請求項17に記載の方法。
【請求項22】
前記の注目する1種以上のナトリウム利尿ペプチドがBNP、1種以上のBNP関連断片、またはBNPと1種以上のBNP関連断片の双方を含んでなる、請求項17に記載の方法。
【請求項23】
前記の1種以上のBNP関連断片が、BNPl〜76、BNP1〜l08、BNP3〜76、およびBNP3〜108からなる群から選択される、請求項22に記載の方法。
【請求項24】
アッセイに用いる1種以上の抗体を選択する方法であって、
共有結合している糖鎖残基を含んでなる注目する1種以上のナトリウム利尿ペプチドから得られた第1のアッセイ結果を、注目する1種以上の前記ナトリウム利尿ペプチドから1種以上の共有結合している糖鎖残基を除去した後に前記の注目する1種以上のナトリウム利尿ペプチドから得られる第2のアッセイ結果と比較することによって、前記の1種以上の抗体をスクリーニングすることと、
ここで、前記第1および第2のアッセイ結果は、前記の注目する1種以上のナトリウム利尿ペプチドと、スクリーニングされる前記の1種以上の抗体との結合に応じて変わり、
前記の第2のアッセイ結果の約2倍以内である前記の第1のアッセイ結果が得られる1種以上の抗体を選択すること
とを含んでなる、方法。
【請求項25】
前記の選択された抗体を用いる前記のアッセイを構築することをさらに含んでなる、請求項24に記載の方法。
【請求項26】
前記抗体が抗体発現ライブラリーから選択される、請求項24に記載の方法。
【請求項27】
前記の、注目する1種以上の前記ナトリウム利尿ペプチドからの1種以上の共有結合している糖鎖残基の除去によって、質量分析による注目する1種以上の前記ナトリウム利尿ペプチドの検出が増加する、請求項24に記載の方法。
【請求項28】
前記の、注目する1種以上の前記ナトリウム利尿ペプチドからの1種以上の共有結合している糖鎖残基の除去によって、注目する1種以上の前記ナトリウム利尿ペプチドから、糖鎖残基の少なくとも80%が除去される、請求項24に記載の方法。
【請求項29】
前記の注目する1種以上のナトリウム利尿ペプチドが、BNP、1種以上のBNP関連断片、またはBNPと1種以上のBNP関連断片の双方を含んでなる、請求項24に記載の方法。
【請求項30】
前記の1種以上のBNP関連断片が、BNPl〜76、BNPl〜l08、BNP3〜76、およびBNP3〜l08からなる群から選択される、請求項29に記載の方法。
【請求項31】
水性媒質中の、最後から2番目のアミノ末端プロリン残基を含んでなる1種以上のナトリウム利尿ペプチドの分解を阻害する方法であって、
前記サンプル中に存在する1種以上の前記ナトリウム利尿ペプチドからの前記プロリン残基の喪失を阻害するよう選択された条件下で、前記水性媒質を、1種以上のジペプチジルペプチダーゼの阻害剤と接触させることを含んでなる、方法。
【請求項32】
前記接触ステップが、BNPからの最後から2番目のアミノ末端プロリン残基の喪失を阻害する、請求項31に記載の方法。
【請求項33】
1種以上の前記のジペプチジルペプチダーゼの阻害剤が小分子阻害剤である、請求項31に記載の方法。
【請求項34】
1種以上の前記のジペプチジルペプチダーゼの阻害剤が抗体である、請求項31に記載の方法。
【請求項35】
前記水性媒質が血液、血清または血漿である、請求項31に記載の方法。
【請求項36】
前記水性媒質のすべてまたは一部に存在する1種以上のナトリウム利尿ペプチドについてアッセイを実施することをさらに含んでなる、請求項31に記載の方法。
【請求項37】
被験体において循環BNPの半減期を延長する方法であって、
循環BNPの半減期を延長するよう選択された条件下で、前記被験体に1種以上のジペプチジルペプチダーゼの阻害剤を投与することを含んでなる、方法。
【請求項38】
1種以上の前記ジペプチジルペプチダーゼの阻害剤が小分子阻害剤である、請求項37に記載の方法。
【請求項39】
1種以上の前記ジペプチジルペプチダーゼの阻害剤が抗体である、請求項37に記載の方法。
【請求項40】
前記被験体が、脳卒中、うっ血性心不全、心虚血、全身性高血圧、および急性心筋梗塞からなる群から選択される診断に基づいて、前記の1種以上のジペプチジルペプチダーゼの阻害剤を投与されるよう選択される、請求項37に記載の方法。
【請求項41】
前記被験体が、前記投与ステップの前に少なくとも80pg/mLの血漿BNPレベルを有することに基づいて、前記の1種以上のジペプチジルペプチダーゼの阻害剤を投与されるよう選択される、請求項37に記載の方法。
【請求項42】
前記被験体にBNPまたはその類似体を投与することをさらに含んでなる、請求項37に記載の方法。
【請求項43】
前記被験体に中性エンドペプチダーゼの阻害剤を投与することをさらに含んでなる、請求項37に記載の方法。
【請求項44】
前記被験体にBNPまたはその類似体と中性エンドペプチダーゼの阻害剤とを投与することをさらに含んでなる、請求項37に記載の方法。
【請求項45】
1種以上のジペプチジルペプチダーゼの阻害剤とナトリウム利尿ペプチドとを含んでなる薬剤組成物。
【図1】




【公開番号】特開2011−257407(P2011−257407A)
【公開日】平成23年12月22日(2011.12.22)
【国際特許分類】
【出願番号】特願2011−140418(P2011−140418)
【出願日】平成23年6月24日(2011.6.24)
【分割の表示】特願2006−524054(P2006−524054)の分割
【原出願日】平成16年8月19日(2004.8.19)
【出願人】(500204577)バイオサイト インコーポレイテッド (14)
【Fターム(参考)】
【公開日】平成23年12月22日(2011.12.22)
【国際特許分類】
【出願日】平成23年6月24日(2011.6.24)
【分割の表示】特願2006−524054(P2006−524054)の分割
【原出願日】平成16年8月19日(2004.8.19)
【出願人】(500204577)バイオサイト インコーポレイテッド (14)
【Fターム(参考)】
[ Back to top ]

