生物由来の生理活性物質の測定方法及び測定装置
【課題】攪拌比濁法、光散乱法、あるいはAL結合ビーズ法によって試料中の生物由来の生理活性物質の濃度を測定する場合に、混和液の攪拌に起因して生じる、前記生理活性物質に由来しない凝集またはゲル化を抑制することによって、上記測定の測定精度を向上させる。
【解決手段】ALと生物由来の生理活性物質を含む試料とを混和させ、混和液を攪拌しつつ、混和液におけるALと前記生理活性物質との反応に起因する蛋白質の凝集を検出する際に、所定の界面活性剤を混和液に添加することで、該混和液におけるALと前記生理活性物質との反応に起因しない蛋白質の凝集またはゲル化を抑制する。
【解決手段】ALと生物由来の生理活性物質を含む試料とを混和させ、混和液を攪拌しつつ、混和液におけるALと前記生理活性物質との反応に起因する蛋白質の凝集を検出する際に、所定の界面活性剤を混和液に添加することで、該混和液におけるALと前記生理活性物質との反応に起因しない蛋白質の凝集またはゲル化を抑制する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、エンドトキシンやβ−D−グルカンなど、ALとの反応によってゲル化する特性を有する生物由来の生理活性物質を含有する試料中の該生理活性物質を検出しまたはその濃度を測定するための測定方法及び測定装置に関する。
【背景技術】
【0002】
エンドトキシンはグラム陰性菌の細胞壁に存在するリポ多糖であり、最も代表的な発熱性物質である。このエンドトキシンに汚染された輸液、注射薬剤、血液などが人体に入ると、発熱やショックなどの重篤な副作用を惹起するおそれがある。このため、上記の薬剤などは、エンドトキシンにより汚染されることが無いように管理することが義務付けられている。一方で、敗血症患者血液中のエンドトキシンを測定することにより、重篤なエンドトキシンショックの予防や治療に寄与することもある。
【0003】
注射薬などのエンドトキシン汚染を検出するための半定量的試験法として、従前は以下のような方法がとられることがあった。すなわち、体重1.5kg以上の健康なウサギの耳静脈に、37℃に加温した試料を注射し、注射後3時間まで30分以下の間隔で体温を測定する。注射の40分前から注射までの間に30分間隔で2回測定したウサギの体温の平均値を対象体温とし、対象体温と最高体温との差を体温上昇とする。
【0004】
3匹のウサギを用いて上記の体温上昇を測定し、3匹の体温上昇の合計によって次のような判定が行われる。まず、3匹の体温上昇の合計が1.3℃以下の場合は発熱性物質陰性とし、2.5℃以上の場合は発熱性物質陽性とする。そして、3匹の体温上昇の合計が1.3℃より大きく2.5℃未満である場合にはさらに3匹による試験を追加し、計6匹の体温上昇の合計が3.0℃以下の場合は発熱性物質陰性とし、4.2℃以上の場合は発熱性物質陽性とする。その際の温度上昇の合計が3.0℃より大きく4.2℃未満である場合には、さらに3匹による試験を追加し、計9匹の体温上昇が5.0℃未満であれば発熱性物質陰性とし、5.0℃以上であれば発熱性物質陽性とする。
【0005】
また、β−D−グルカンは真菌に特徴的な細胞膜を構成しているポリサッカライド(多糖体)である。β−D−グルカンを測定することによりカンジダやアスペルギルス、クリプトコッカスのような一般の臨床でよく見られる真菌のみならず、稀な真菌も含む広範囲で真菌感染症のスクリーニングなどに有効である。
【0006】
ところで、カブトガニの血球抽出物(以下、「AL :Amoebocyte lysate」ともいう。
)の中には、エンドトキシンやβ−D−グルカンなどによって活性化されるセリンプロテアーゼが存在する。そして、ALとエンドトキシンやβ−D−グルカンとが反応する際には、それらの量に応じて活性化されたセリンプロテアーゼによる酵素カスケードによって、AL中に存在するコアギュロゲンがコアギュリンへと加水分解されて会合し、不溶性のゲルが生成される。このALの特性を用いて、エンドトキシンやβ−D−グルカンを高感度に検出することが可能である。近年、このことを利用して、エンドトキシンなどの検出または濃度測定にALを用いる方法が考案されている。
【0007】
このエンドトキシンやβ−D−グルカンなどの、ALによって検出可能な生物由来の生理活性物質(以下、所定生理活性物質ともいう)の検出または濃度測定を行う方法としては、所定生理活性物質の検出または濃度測定(以下、単純に「所定生理活性物質の測定」ともいう。)をすべき試料とALを元に製造された試薬(AL試薬)とを混和した混和液を静置し、一定時間後に容器を転倒させて、試料の垂れ落ちの有無によりゲル化したかど
うかを判定し、試料に一定濃度以上のエンドトキシンが含まれるか否かを調べる半定量的なゲル化法がある。
【0008】
あるいは、所定生理活性物質の測定をすべき試料とALとを混和した混和液を37℃が維持された状態で静置し、ALと所定生理活性物質との反応によるゲルの生成に伴う試料の濁りを経時的に計測して解析する比濁法がある。この比濁法においては、測定開始後、透過率がある一定値以下に低下した時点をゲル化時間とする。定量は,ゲル化時間が検体中のエンドトキシン量と相関があることを利用する。すなわち、予め既知量のエンドトキシンが混入している複数の標準試料を測定して作成した検量線と、測定によって得られたゲル化時間とから、検体中のエンドトキシン量を算出する。
【0009】
上記の比濁法によって所定生理活性物質の測定を行う場合には、乾熱滅菌処理されたガラス製測定セルに測定試料とALとの混和液を生成させる。そして、混和液を静置してそのゲル化を外部から光学的に測定する。これに対し、AL試薬と混和した検体を攪拌しながら上記比濁法で測定する攪拌比濁法もある。この攪拌比濁法では、ガラス製測定セル内に入っている攪拌子を回転させることによって測定中も試料が攪拌される。そして、上記比濁法と同様、検量線法によって検体中のエンドトキシン量が算出される。攪拌比濁法では、測定中に試料を攪拌することによって上記の比濁法よりも迅速かつ安定に測定が可能である。
【0010】
また、測定試料とALと共に、表面にALが結合した微粒子(以下、AL結合ビーズともいう。)を含んだ混和液を生成させ、上記攪拌比濁法で測定するAL結合ビーズ法もある。このAL結合ビーズ法では、試料とAL及びAL結合ビーズの反応によって生じるAL結合ビーズの凝集に伴う試料の濁りを経時的に計測して解析する。このAL結合ビーズ法においては、測定開始後、透過率がある一定値以上に上昇した時点をゲル化時間とする。そして、上記攪拌比濁法と同様、検量線法によって検体中のエンドトキシン量が算出される。AL結合ビーズ法は、上記の比濁法や攪拌比濁法よりも迅速に測定をすることができる。これは主にAL結合ビーズ法では、コアギュリンより10から100倍以上大きいAL結合ビーズが凝集するため、透過率の変化が鋭敏となるためである。
【0011】
さらに、測定試料とALとの混和液を例えば磁性攪拌子を用いて攪拌することにより、ゲル微粒子を生成せしめ、ゲル粒子により散乱されるレーザー光の強度から、試料中の所定生理活性物質の存在を短時間で測定できるレーザー光散乱粒子計測法(以下、単に光散乱法ともいう。)も提案されている。試料とALとの反応によってゲル粒子が生成され、反応が進行してそれらが互いに凝集すると、散乱光においてスパイク状のピーク信号が検出される。光散乱法においては、これらのピーク信号がある一定の頻度以上で検出した時点を凝集開始時間とする。上記ゲル化時間と同様、凝集開始時間は検体中のエンドトキシン量と相関があるので、これを利用して検量線法によって検体中のエンドトキシン量を算出する。
【0012】
光散乱法でも、ガラス製試料セル内に入っている攪拌子を回転させることによって、測定中も試料が攪拌されるが、攪拌の目的が攪拌比濁法とは異なる。上記ピーク信号は、ゲル粒子が検体に入射したレーザー光を横切ったときに検出される。ゲル粒子がレーザー光を横切ることができるように攪拌によってゲル粒子を移動させるのである。光散乱法は,上記の比濁法や攪拌比濁法よりも迅速、高感度に測定をすることができる。これは主に光散乱法が、ゲル化の初期段階、すなわち、小さなゲル粒子が生成された時点でこれを検出することができることが要因である。
【0013】
一方、試薬中に添加した凝固酵素に対する合成基質を予め入れておき、凝固酵素によって分解された合成基質が発色、あるいは、蛍光、さらには発光する現象を測定する方法が
あり、発色を利用した方法は比色法と呼ばれ、所定生理活性物質の重要な測定法の一つとして広く利用されている。比色法には、所定生理活性物質の濃度と、一定反応時間後における発色基の遊離量との間に相関関係があることを利用するエンドポイント−比色法や、所定生理活性物質の濃度と、混和液の収光度あるいは透過率がある一定の値に達するのに要する時間,または発色の経時変化率との間に相関関係があることを利用するカイネティック−比色法がある。
【0014】
ここで、上記した攪拌比濁法や光散乱法のように、ガラス製試料セル内でAL試薬と試料の混和液を攪拌子によって攪拌する場合、反応曲線(時間に対する透過率/吸光度(攪拌比濁法)、あるいはゲル粒子数(光散乱法))の形状が変化してしまい、測定によって得られるゲル化時間、あるいは凝集開始時間の精度が低下してしまうことが問題となっている(例えば、非特許文献1を参照。)。これらの問題を回避するため、各測定法では、ゲル化時間、あるいは凝集開始時間を決定するアルゴリズムに工夫をこらし,多少の反応曲線の変化が生じても,測定結果に影響が及ばないようにしている(例えば、特許文献1を参照。)。また、AL試薬と試料の混和液に熱処理済みアルブミンを添加することでエンドトキシンに由来しない凝集を抑制する方法もある。これは主に、攪拌の刺激による凝固酵素の活性化を、熱処理済みアルブミンが抑制することを利用している。
【0015】
しかしながら、特に希薄な血漿製剤中のエンドトキシンや注射用水そのものを、AL試薬の種類やメーカーおよびロットが異なる様々な条件で測定する場合などでは、上記の回避策が充分に機能しない場合があった。これは、攪拌によって反応曲線の形状が変化する原因が、攪拌刺激による凝固酵素の活性化だけではなく多岐に渡ることに起因すると考えられており、さらなる対策が望まれている。
【先行技術文献】
【特許文献】
【0016】
【特許文献1】特開2010−216878号公報
【特許文献2】特開2004−061314号公報
【特許文献3】特開平10−293129号公報
【特許文献4】国際公開第WO2008/038329号パンフレット
【特許文献5】特開2009−150723号公報
【非特許文献】
【0017】
【非特許文献1】高橋学、柴田繁啓、鈴木泰、小鹿雅博、松本尚也、小豆嶋立頼、稲田捷也、遠藤重厚、「エンドトキシン散乱測光法を用いたエンドトキシン測定法の臨床応用における課題」、エンドトキシン血症救命治療研究会誌、第14巻、第1号p.111−119、2010
【発明の概要】
【発明が解決しようとする課題】
【0018】
本発明の目的とするところは、カブトガニの血球抽出物であるALと生物由来の生理活性物質との反応に起因する凝集あるいはゲル化を光学的に測定する、生物由来の生理活性物質の測定法において、より高い測定精度を得るための技術を提供することである。
【0019】
より詳しくは、攪拌比濁法、光散乱法、あるいはAL結合ビーズ法によって試料中の生物由来の生理活性物質の濃度を測定する場合に、AL試薬と試料の混和液の攪拌に起因して生じる、前記生理活性物質に由来しない凝集またはゲル化を抑制することによって、上記測定の測定精度を向上させることを目的とする。
【課題を解決するための手段】
【0020】
本発明は、AL試薬と生物由来の生理活性物質を含む試料とを混和させ、混和液を攪拌しつつ、混和液におけるALと生物由来の生理活性物質との反応に起因する蛋白質の凝集またはゲル化を検出する際に、界面活性剤を混和液に添加することで、該混和液におけるALと生物由来の生理活性物質との反応に起因しない、蛋白質の凝集またはゲル化を抑制することを最大の特徴とする。
【0021】
より詳しくは、カブトガニの血球抽出物であるALと所定の生物由来の生理活性物質を含む試料の混和液を生成し、該混和液を攪拌しつつ、該混和液におけるALと前記生理活性物質との反応に起因する蛋白質の凝集またはゲル化を検出することで、前記試料中の前記生理活性物質を検出しまたは前記生理活性物質の濃度を測定する、生物由来の生理活性物質の測定方法であって、
前記攪拌をする際には、前記混和液に、所定の界面活性剤を添加することで、前記混和液における前記生理活性物質に由来しない凝集またはゲル化を抑制することを特徴とする。
【0022】
ここで、混和液の攪拌によって試料とAL試薬との反応曲線が変化する現象の原因が以下のものであることが明確になってきた。すなわち、生物由来の生理活性物質の含有量が非常に少ない試料を測定する場合は、攪拌によって、(1)AL試薬および/または試料
中に含まれる蛋白質同士が凝集し、あるいは、(2)攪拌に伴うずり応力(物理的刺激)によってプロクロッティング・エンザイムが切断・活性化され、クロッティング・エンザイムに変化し、生物由来の生理活性物質に由来しない凝集物が生成されることが見出された。
【0023】
この生物由来の生理活性物質に由来しない凝集は、攪拌比濁法及び光散乱法の両方の方法においてゲル粒子の発生と同様の信号として検出されてしまうため、反応曲線(タイムコース)の形状に影響を及ぼし、測定精度が低下し、誤計測をもたらす危険性があった。これに対し、発明者らの鋭意研究により、試料とAL試薬の混和時に、界面活性剤を添加することで上記の生物由来の生理活性物質に由来しない凝集またはゲル化の誘発を抑制できることが見出された。特に、この界面活性剤の添加により、AL試薬および/または試
料中に含まれる蛋白質同士の凝集を抑制できることが見出された。さらに、この界面活性剤を試料に添加しても、生物由来の生理活性物質に由来する凝集またはゲル化の測定に影響がないことが実験によって確認された。
【0024】
本発明によれば、特に生物由来の生理活性物質の含有量の少ない試料とAL試薬との混和液における凝集またはゲル化を攪拌しつつ測定する場合に、攪拌による、生物由来の生理活性物質に起因しない凝集またはゲル化を抑制することができる。特に、界面活性剤によってAL試薬および/または試料中に含まれる蛋白質同士の凝集を抑制できることから
、熱処理済みアルブミンでは効果が期待できない場合でも、攪拌による、生物由来の生理活性物質に起因しない凝集またはゲル化を抑制することができる。その結果、生物由来の生理活性物質の測定における精度を向上させることができる。
【0025】
また、本発明においては、前記界面活性剤は、陰イオン系界面活性剤、例えば、純石けん分(脂肪酸ナトリウム)、純石けん分(脂肪酸カリウム)、アルファスルホ脂肪酸エステルナトリウム、直鎖アルキルベンゼンスルホン酸ナトリウム、アルキル硫酸エステルナトリウム、アルキルエーテル硫酸エステルナトリウム、アルファオレフィンスルホン酸ナトリウム、アルキルスルホン酸ナトリウムでもよい。また、非イオン系界面活性剤、例えば、Tween(商品名)、TritonX(商品名)、Pluronic(商品名)、ポリオキシエチレンソルビタンモノラウレート、ポリオキシエチレンソルビタンモノパルミテート、ポリオキシエチレンソルビタンモノステアレート、ポリオキシエチレンソルビタンモノオレエート、ポリオキシエチレンソルビタントリオレエート、ポリオキシエチレ
ン−p−イソオクチルフェノール、ポリエチレンオキシド/ポリプロピレンオキシドブロックポリマー、しょ糖脂肪酸エステルソルビタン脂肪酸エステル、ポリオキシエチレンソルビタン脂肪酸エステル、脂肪酸アルカノールアミド、ポリオキシエチレンアルキルエーテル、ポリオキシエチレンアルキルフェニルエーテルでもよい。また、非イオン系界面活性剤に、シリコーンオイルや植物油を乳化したエマルジョン型消泡剤でもよい。また、両性イオン系界面活性剤、例えば、アルキルアミノ脂肪酸ナトリウム、アルキルベタイン、アルキルアミンオキシドでもよい。また、陽イオン系界面活性剤、例えば、アルキルトリメチルアンモニウム塩、ジアルキルトリメチルアンモニウム塩でもよい。これらの界面活性剤は、試料とAL試薬の混和時に添加されることにより、生物由来の生理活性物質に由来しない凝集またはゲル化の誘発を抑制できることが確認されているため、より確実に、攪拌による、生物由来の生理活性物質に起因しない凝集またはゲル化を抑制することができる。
【0026】
また、本発明においては、前記混和液に、所定の界面活性剤を添加する際の最終濃度は、0.0001%以上10%以下としてもよい。これによって、より効果的に、攪拌による生物由来の生理活性物質に起因しない凝集またはゲル化を抑制することができる。なお、上記最終濃度は、望ましくは、0.0005%以上5%以下がよい。さらに望ましくは、0.005%以上0.5%以下がよい。
【0027】
なお、本発明においては、攪拌による、生物由来の生理活性物質に起因しない凝集またはゲル化を抑制するために、本発明である界面活性剤の添加と合わせて、熱処理済みアルブミンの添加を併用してもよい。
【0028】
また、本発明においては、前記生物由来の生理活性物質は、エンドトキシンまたはβ−D−グルカンであってもよい。
【0029】
そうすれば、最も代表的な発熱性物質であるエンドトキシンの検出または濃度測定がより正確に行なえ、エンドトキシンに汚染された輸液、注射薬剤、血液などが人体に入り、副作用が惹起されることを抑制できる。同様に、β−D−グルカンの検出または濃度測定がより正確に行なえ、カンジダやアスペルギルス、クリプトコッカスのような一般の臨床でよく見られる真菌のみならず、稀な真菌も含む広範囲で真菌感染症のスクリーニングをより正確に行なうことが可能となる。
【0030】
また、本発明は、カブトガニの血球抽出物であるALを含み、所定の生物由来の生理活性物質を含む試料との混和液を生成し、該混和液を攪拌しつつ、前記生理活性物質に起因する蛋白質の凝集またはゲル化を検出することで、前記試料中の前記生理活性物質を検出しまたは前記生理活性物質の濃度を測定するための、生物由来の生理活性物質の測定用試薬であって、所定の界面活性剤が添加され、前記混和液における前記生理活性物質に由来しない凝集またはゲル化を抑制可能としたこと特徴とする生物由来の生理活性物質の測定用試薬であってもよい。また、その場合は、前記所定の界面活性剤は、陰イオン系界面活性剤、例えば、純石けん分(脂肪酸ナトリウム)、純石けん分(脂肪酸カリウム)、アルファスルホ脂肪酸エステルナトリウム、直鎖アルキルベンゼンスルホン酸ナトリウム、アルキル硫酸エステルナトリウム、アルキルエーテル硫酸エステルナトリウム、アルファオレフィンスルホン酸ナトリウム、アルキルスルホン酸ナトリウムでもよい。また、非イオン系界面活性剤、例えば、Tween(商品名)、TritonX(商品名)、Pluronic(商品名)、ポリオキシエチレンソルビタンモノラウレート、ポリオキシエチレンソルビタンモノパルミテート、ポリオキシエチレンソルビタンモノステアレート、ポリオキシエチレンソルビタンモノオレエート、ポリオキシエチレンソルビタントリオレエート、ポリオキシエチレン−p−イソオクチルフェノール、ポリエチレンオキシド/ポリプロピレンオキシドブロックポリマー、しょ糖脂肪酸エステルソルビタン脂肪酸エステル、
ポリオキシエチレンソルビタン脂肪酸エステル、脂肪酸アルカノールアミド、ポリオキシエチレンアルキルエーテル、ポリオキシエチレンアルキルフェニルエーテルでもよい。また、非イオン系界面活性剤に、シリコーンオイルや植物油を乳化したエマルジョン型消泡剤でもよい。また、両性イオン系界面活性剤、例えば、アルキルアミノ脂肪酸ナトリウム、アルキルベタイン、アルキルアミンオキシドでもよい。また、陽イオン系界面活性剤、例えば、アルキルトリメチルアンモニウム塩、ジアルキルトリメチルアンモニウム塩でもよい。
【0031】
また、本発明は、所定の生物由来の生理活性物質を含む試料とカブトガニの血球抽出物であるALとの混和液を光の入射が可能な状態に保持するとともに該混和液における反応を進行させる混和液保持手段と、
前記混和液保持手段中の前記混和液を攪拌する攪拌手段と、
前記混和液保持手段中の混和液に光を入射する光入射手段と、
前記入射光の前記混和液における透過光または散乱光を受光し電気信号に変換する受光手段と、
前記受光手段において変換された電気信号から前記試料中における前記生理活性物質とALとの反応開始時刻を判定する判定手段と、
予め定められた、前記反応開始時刻と前記生理活性物質の濃度との関係より、前記試料中の前記生理活性物質の存在または濃度を導出する導出手段と、を備える生物由来の生理活性物質の測定装置であって、
前記攪拌手段によって、前記混和液を攪拌する際に、所定の界面活性剤を前記混和液に添加する界面活性剤添加手段をさらに備えることを特徴とする生物由来の生理活性物質の測定装置であってもよい。
【0032】
この装置によれば、試料とAL試薬との混和液を攪拌する際に、自動的に、所定の界面活性剤を前記混和液に添加することができ、より簡単に、該混和液における前記生理活性物質に由来しない、蛋白質の凝集またはゲル化を抑制することができる。
【0033】
この装置においても、界面活性剤添加手段によって添加される界面活性剤は、陰イオン系界面活性剤、例えば、純石けん分(脂肪酸ナトリウム)、純石けん分(脂肪酸カリウム)、アルファスルホ脂肪酸エステルナトリウム、直鎖アルキルベンゼンスルホン酸ナトリウム、アルキル硫酸エステルナトリウム、アルキルエーテル硫酸エステルナトリウム、アルファオレフィンスルホン酸ナトリウム、アルキルスルホン酸ナトリウムでもよい。また、非イオン系界面活性剤、例えば、Tween(商品名)、TritonX(商品名)、Pluronic(商品名)、ポリオキシエチレンソルビタンモノラウレート、ポリオキシエチレンソルビタンモノパルミテート、ポリオキシエチレンソルビタンモノステアレート、ポリオキシエチレンソルビタンモノオレエート、ポリオキシエチレンソルビタントリオレエート、ポリオキシエチレン−p−イソオクチルフェノール、ポリエチレンオキシド/ポリプロピレンオキシドブロックポリマー、しょ糖脂肪酸エステルソルビタン脂肪酸エステル、ポリオキシエチレンソルビタン脂肪酸エステル、脂肪酸アルカノールアミド、ポリオキシエチレンアルキルエーテル、ポリオキシエチレンアルキルフェニルエーテルでもよい。また、非イオン系界面活性剤に、シリコーンオイルや植物油を乳化したエマルジョン型消泡剤でもよい。また、両性イオン系界面活性剤、例えば、アルキルアミノ脂肪酸ナトリウム、アルキルベタイン、アルキルアミンオキシドでもよい。また、陽イオン系界面活性剤、例えば、アルキルトリメチルアンモニウム塩、ジアルキルトリメチルアンモニウム塩でもよい。また、混和液に、所定の界面活性剤を添加する際の最終濃度は、0.0001%以上10%以下とするとよい。望ましくは、0.0005%以上5%以下がよい。さらに望ましくは、0.005%以上0.5%以下がよい。さらに、生物由来の生理活性物質は、エンドトキシンまたはβ−D−グルカンとしてもよい。
【0034】
なお、上記した本発明の課題を解決する手段については、可能なかぎり組み合わせて用いることができる。
【発明の効果】
【0035】
本発明にあっては、攪拌比濁法、光散乱法、あるいはAL結合ビーズ法によって試料中の生物由来の生理活性物質の濃度を測定する場合に、混和液の攪拌に起因して生じる、前記生理活性物質に由来しない凝集またはゲル化を抑制することによって、上記測定の測定精度を向上させることができる。
【図面の簡単な説明】
【0036】
【図1】エンドトキシンまたはβ―D−グルカンにより、ALがゲル化する過程及び、その検出方法について説明するための概略図である。
【図2】本発明の実施例1における光散乱粒子計測装置の概略構成を示す図である。
【図3】従来(界面活性剤未添加)のAL試薬を用いた場合の、試料中のエンドトキシン濃度とゲル化検出時間との関係と、検量線とを示すグラフである。
【図4】本発明の実施例1においてTween20を混和液に添加した場合の、反応曲線を示すグラフである。
【図5】本発明の実施例1における試料とAL試薬との混和液に添加するTween20の濃度と、ゲル化検出時間との関係を示すグラフである。
【図6】本発明の実施例1においてTriton X-100を混和液に添加した場合の、反応曲線を示すグラフである。
【図7】本発明の実施例1における試料とAL試薬の混和液に添加するTriton X-100の濃度と、ゲル化検出時間との関係を示すグラフである。
【図8】本発明の実施例1においてTween20を混和液に添加した場合の、試料中のエンドトキシン濃度とゲルが検出時間との関係と、検量線とを示すグラフである。
【図9】APB、Tween20及び、APBとTween20を混和液に添加した場合の、反応曲線を示すグラフである。
【図10】APB及び、Tween20を混和液に添加した場合の、反応曲線を示すグラフである。
【図11】本発明の実施例1における比濁計測装置の概略構成を示す図である。
【図12】本発明の実施例2における光散乱粒子計測装置の概略構成を示す図である。
【図13】本発明の実施例2における比濁計測装置の概略構成を示す図である。
【発明を実施するための形態】
【0037】
<実施例1>
ALとエンドトキシンとが反応してゲルが生成される過程(以下、リムルス反応ともいう。)はよく調べられている。すなわち、図1に示すように、エンドトキシンがAL中のセリンプロテアーゼであるC因子に結合すると、C因子は活性化して活性型C因子となり、活性型C因子はAL中の別のセリンプロテアーゼであるB因子を加水分解して活性化させ活性化B因子とする。この活性化B因子は直ちにAL中の凝固酵素の前駆体を加水分解して凝固酵素とし、さらに、この凝固酵素がAL中のコアギュロゲンを加水分解してコアギュリンを生成する。そして、生成したコアギュリンが互いに会合して不溶性のゲルをさらに生成し、AL全体がこれに巻き込まれてゲル化すると考えられている。
【0038】
また、同様にβ−D−グルカンがAL中のG因子に結合すると、G因子は活性化して活性型G因子となる、活性型G因子はAL中の凝固酵素の前駆体を加水分解して凝固酵素とする。その結果、エンドトキシンとALとの反応と同様、コアギュリンが生成され、生成したコアギュリンが互いに会合して不溶性のゲルをさらに生成する。
【0039】
この一連の反応は哺乳動物に見られるクリスマス因子やトロンビンなどのセリンプロテアーゼを介したフィブリンゲルの生成過程に類似している。このような酵素カスケード反応はごく少量の活性化因子であっても、その後のカスケードを連鎖して活性化していくために非常に強い増幅作用を有する。従って、ALを用いた所定生理活性物質の測定法によれば、サブピコグラム/mLオーダーのきわめて微量の所定生理活性物質を検出することが可能になっている。
【0040】
エンドトキシンならびにβ―D−グルカンを定量するための試薬としては、カブトガニの血球抽出物(AL:Amoebocyte lysate)を原料としたリムルス試薬、ならびに、リムルス試薬に凝固酵素により加水分解され着色強度、蛍光強度、または化学発光強度のいずれかが増加する合成基質を添加した試薬が使用される。また、リムルス試薬中のC因子の組換え体(リコンビナントC因子)とその合成基質(着色、蛍光、化学発光かの手段は問わない)の混合試薬などが使用される場合もある。さらに、リムルス試薬中のG因子の組換え体(リコンビナントG因子)とその合成基質(着色、蛍光、化学発光かの手段は問わない)の混合試薬などを使用することも可能である。
【0041】
エンドトキシンやβ−D−グルカンなどの所定生理活性物質とALとの反応に起因して変化する物理量は、試薬の種類に応じて選択すればよい。試料の光透過率または、濁度、散乱光強度、光散乱粒子数、吸光度、蛍光強度、化学発光強度などの光学的な物理量の変化を検出するか、試料のゲル化に伴う試料の粘性、電気伝導度などの物理量の変化を検出すればよい。これらの物理量の検出には、濁度計、吸光光度計、光散乱光度計、レーザー光散乱粒子計測計、蛍光光度計、フォトンカウンターなどの光学機器、ならびに、これらを応用した専用の測定装置を使用することができる。また、粘度計、電気伝導率計やこれらを応用した専用の測定装置を使用しても構わない。
【0042】
所定生理活性物質を定量する測定法としては前述のように攪拌比濁法ならびに光散乱法が挙げられる。図1に示すように、これらの測定法はALの酵素カスケード反応によって生成されるコアギュリンの会合物を前者は試料の濁りとして、後者は系内に生成されるゲルの微粒子の数として検出することで、高感度な測定を可能にしている。
【0043】
次に、本実施例において散乱光を取得するために使用した光散乱粒子計測装置について説明する。なお、以下の説明においては、所定生理活性物質としてエンドトキシンを例にとって説明するが、以下の説明はβ−D−グルカンなど他の生理活性物質にも適用可能である。図2には、本実施例におけるエンドトキシンの測定装置としての光散乱粒子計測装置1の概略構成を示す。光散乱粒子計測装置1に使用される光源2にはレーザー光源が用いられているが、他に、超高輝度LEDなどを用いてもよい。光源2から照射された光は、入射光学系3で絞られ、試料セル4に入射する。この試料セル4にはエンドトキシンの測定をすべき試料とAL試薬の混和液が保持されている。試料セル4に入射した光は、混和液中の粒子(コアギュロゲンモノマー、ならびに、コアギュロゲンオリゴマーなどの測定対象)で散乱される。
【0044】
試料セル4の、入射光軸の側方には出射光学系5が配置されている。また、出射光学系5の光軸の延長上には、試料セル4内の混和液中の粒子で散乱され出射光学系5で絞られた散乱光を受光し電気信号に変換する受光素子6が配置されている。受光素子6には、受光素子6で光電変換された電気信号を増幅する増幅回路7、増幅回路7によって増幅された電気信号からノイズを除去するためのフィルタ8、ノイズが除去された後の電気信号のピーク数からゲル粒子数を演算し、さらにゲル化検出時間を判定してエンドトキシンの濃度を導出する演算装置9及び、結果を表示する表示器10が電気的に接続されている。
【0045】
また、試料セル4には、外部から電磁力を及ぼすことで回転し、試料としての混和液を
攪拌する攪拌子11が備えられており、試料セル4の外部には、攪拌器12が備えられている。これらにより、攪拌の有無及び攪拌速度の調整が可能となっている。
【0046】
ここで、試料セル4は本実施例の混和液保持手段に相当する。光源2及び入射光学系3は光入射手段に相当する。攪拌子11及び攪拌器12は攪拌手段に相当する。出射光学系5及び受光素子6は受光手段に相当する。演算装置9は判定手段及び導出手段に相当する。
【0047】
上記の光散乱粒子計測装置1においては、リムルス反応の最終段階であるコアギュリンゲル粒子の出現時間(ゲル化検出時間=ゲル化時間)を測定し、エンドトキシン濃度とゲル化検出時間の間に成立する検量関係を用いて検体中のエンドトキシン濃度を算出する。
【0048】
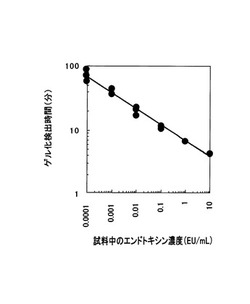
図3に、エンドトキシン濃度とゲル化検出時間との関係及び検量線を示す。なお、図3においては、AL試薬100μLと10〜0.0001EU/mLのエンドトキシンを含む試料100μLを混和した混和液を測定に用いた。試料中のエンドトキシン濃度が10〜0.01EU/mLのとき、試料中のエンドトキシン濃度が低い程、ゲル化検出時間が明確に長くなる検量関係を示したが、0.01EU/mL以下では、エンドトキシン濃度によらず、ゲル化検出時間が14〜30分以内に観測された。結果として、0.01EU/mL以下のエンドトキシンを正確に測定することが困難であった。また検量線の直線性は、相関係数が0.974となり充分とは言えなかった。
【0049】
これは、攪拌子11及び攪拌器12による攪拌の刺激によって蛋白質が変性し不溶性の凝集体が生成し、このエンドトキシンに由来しない凝集物(ゲル粒子)が生成したためである。従って、0.01EU/mL以下の低濃度のエンドトキシンを正確に測定するには、上記のエンドトキシンに由来しない凝集を抑制する必要がある。これに対し、発明者らの鋭意研究により、Tweenなどの界面活性剤の添加によってエンドトキシンに由来しない凝集を抑制できることが分かった。本実施例においては、界面活性剤としてTween20およびTriton X-100を使用し、これによるエンドトキシンに由来しない凝集の抑制効果を調べた。なお、Tween20およびTriton X-100は、いずれもエンドトキシン含有量が少なく、そのまま用いることができたが、エンドトキシンを多く含む場合は予めオートクレーブ滅菌処理により、エンドトキシンを不活化させておけばよい。
【0050】
上記の測定の結果を以下に説明する。AL試薬100μLとTween20(0%、0.001%、0.01%、0.1%、1%)100μLを混和した混和液(すなわちTw
een20の最終濃度は0%、0.0005%、0.005%、0.05%、0.5%となる)を測定に供したときの反応曲線を図4に示す。図4の横軸は反応時間、縦軸はゲル粒子数である。Tween20が0%(すなわち未添加)および0.0005%のとき、ゲル粒子数は反応開始直後から時間の経過とともに急峻に増加し、80分〜100分程度をピークとして再び減少している。これは、反応直後から、攪拌子11及び攪拌器12による攪拌の刺激によって蛋白質が変性し不溶性の凝集体が生成し、このエンドトキシンに由来しない凝集物(ゲル粒子)を計測しているためと考えられる。
【0051】
これに対し、Tween20が0.005%以上含まれるとき、反応開始直後のゲル粒子数の急峻な増加が抑制され、測定されるゲル粒子数は安定的に増加していることが分かる。上記より、界面活性剤がTweenまたは同等品であるときは、最終濃度が0.005%以上0.5%以下であれば、確実に、反応開始直後のゲル粒子数の急峻な増加が抑制される効果が期待できる。エンドトキシンに由来しない凝集物の生成が、AL試薬の種類やメーカーおよびロットによって異なることを考慮すると、一般的には、界面活性剤が0.0001%以上10%以下であれば、程度の差はあるとしても、反応開始直後のゲル粒
子数の急峻な増加が抑制される効果が期待できる。
【0052】
次に、上記の測定の結果として得られたゲル化検出時間を図5に示す。Tween20が0.005%以上含まれるとき、ゲル化検出時間が遅くなる傾向があった。これにより、Tween20を適量添加すれば、エンドトキシンに由来しない凝集を抑制できることが示された。
【0053】
同様に、Tween20に代わって界面活性剤としてTriton X-100を用いたときの反応曲線を図6に示す。図6の横軸は反応時間、縦軸はゲル粒子数である。Triton X-100が0%(すなわち未添加)および0.0005%のとき、上記のエンドトキシンに由来しない凝集物(ゲル粒子)の生成により、ゲル粒子数は反応開始直後から時間の経過とともに急峻に増加した。これに対し、Triton X-100が0.005%以上含まれるとき、ゲル粒子数の反応開始直後の急峻な増加は抑制された。結果として得られたゲル化検出時間を図7に示す。Triton X-100が0.005%以上含まれるとき、ゲル化検出時間が遅くなる傾向があった。
【0054】
これにより、Triton X-100を適量添加することによっても、エンドトキシンに由来しない凝集を抑制できることが示された。上記より、界面活性剤がTriton
Xまたは同等品であるときは、最終濃度が0.005%以上0.5%以下であれば、確実に、反応開始直後のゲル粒子数の急峻な増加が抑制される効果が期待できる。エンドトキシンに由来しない凝集物の生成が、AL試薬の種類やメーカーおよびロットによって異なることを考慮すると、一般的には、界面活性剤が0.0001%以上10%以下であれば、程度の差はあるとしても、反応開始直後のゲル粒子数の急峻な増加が抑制される効果が期待できる。
【0055】
上記のように、Tween20やTriton X-100といった界面活性剤を混和液に添加することにより、エンドトキシンに由来しない凝集が抑制されることが認められたことを受け、Tween20を0.01%含むAL試薬を調製した。このAL試薬100μLと10〜0.0001EU/mLのエンドトキシンを含む試料100μLを混和した混和液(すなわちTween20の終濃度は0.005%)を測定に供した。得られたエンドトキシン濃度とゲル化検出時間との関係及び、検量線を図8に示す。
【0056】
図3に示したTween20が未添加の場合の検量線と図8とを比較して判るように、まず、Tween20を添加した場合には試料中のエンドトキシン濃度が10〜0.01EU/mLの範囲で、Tween20添加時のゲル化検出時間が未添加時より遅くなることはなかった。これは、Tween20がリムルス反応を阻害することはないことを示している。また、Tween20を添加した場合は、10〜0.0001EU/mLの範囲で相関係数0.993という、良好な直線性を有する検量線を得ることができた。これは、Tween20添加によりエンドトキシンに由来しない凝集が抑制された効果と考えられる。
【0057】
さらに、Tweenがエンドトキシンに由来しない凝集を抑制する作用機序を調べるため、安息香酸アミジノフェニル(以下、APBと記すことがある)の添加実験を行った。APBは、プロテアーゼ阻害剤の一つであり、リムルス反応の凝固酵素の活性を阻害する。別のAL試薬を用い、AL試薬100μLと0.1mMのAPB100μLを混和した混和液、および、AL試薬100μLと0.1%のTween20を100μL混和した混和液を測定に用いた場合の反応曲線を図9に示す。また、予め0.1mMのAPBを含むAL試薬100μLと0.1%のTween20を100μL混和した混和液を測定に供したときの反応曲線も図9に示した。
【0058】
図9から判るように、まず、APBを未添加の場合は、測定開始初期から、エンドトキシンに由来しない粒子数の急峻な増加が観察された。図4および図6と比べて粒子数の増加の程度が大きいのは、AL試薬が異なるためである。また、APBを添加した場合でも、上記のゲル粒子数の増加は抑制されることはなかった。これは、上記のエンドトキシンに由来しないゲル粒子数の急峻な増加は、攪拌の刺激による凝固酵素の活性化によるものではなく、蛋白質同士が凝集して生成した凝集体を計測していることを示している。そして、Tween20のみ、および、APBとTween20の両方を添加した場合では、上記のエンドトキシンに由来しないゲル粒子数の単調な増加は著しく抑制された。すなわちTween20が、蛋白質同士の凝集に対して大きな抑制効果を発揮していることが示された。
【0059】
また別のAL試薬を用い、AL試薬100μLと0.1mMのAPB100μLを混和した混和液、および、AL試薬100μLと0.1%のTween20を100μL混和した混和液を測定に用いた場合の反応曲線を図10に示す。図10から判るように、このAL試薬を用いて、APBを未添加の場合は、測定開始初期から粒子数の急峻な増加は観察されず、約100分以降で、エンドトキシンに由来しない粒子数の増加が観察された。図4、図6および図9と比べて粒子数の増加の仕方が異なるのは、AL試薬が異なるためである。そして、APBを添加した場合、上記のゲル粒子数の増加は明確に抑制された。これは、上記のエンドトキシンに由来しないゲル粒子数の増加は、攪拌の刺激による凝固酵素の活性化によるものであることを示している。しかしながら、Tween20を添加しても、上記のエンドトキシンに由来しないゲル粒子数の増加は抑制されなかった。すなわちTween20は、熱処理済みアルブミンとは異なり、攪拌刺激による凝固酵素の活性化に対しては抑制効果を有していないことが示された。
【0060】
このようにTweenは、主に攪拌の刺激による凝固酵素の活性化を抑制すると考えられている熱処理済みアルブミンとは作用機序が異なり、攪拌の刺激による蛋白質同士の凝集を抑制する。従って、熱処理済みアルブミンでは効果が期待できないようなAL試薬に対してもエンドトキシンに由来しない凝集を抑制する効果が期待できる。また、Tweenは、天然物のアルブミンとは異なり、化学的な合成が可能であるため、初期過程におけるエンドトキシンの混入を排除することが容易である。実際、Tweenはリムルス反応を阻害せず(図8)、Tweenの添加によりゲル化検出時間が遅くなったこと(図4および図5)は、本実施例で使用したTweenのエンドトキシン含有量が十分に低いことを示している。
【0061】
上記の実施例においては、本発明を、光散乱粒子計測装置1を用いた光散乱法によってエンドトキシン濃度を測定する場合に適用した例について説明したが、本発明が適用されるのは、光散乱法による場合だけでないことはもちろんである。例えば、攪拌比濁法によってエンドトキシン濃度を測定する場合に適用してもよい。以下に、攪拌比濁法に用いられる比濁計測装置について説明する。
【0062】
図11には、本実施例のエンドトキシンの測定装置の別の例としての比濁計測装置21の概略構成を示す。この比濁計測装置21では、攪拌比濁法によってエンドトキシンの測定を行う。比濁計測装置21においても、調製した希釈系列のエンドトキシンを含んだ試料を混和液保持手段としての測定用ガラス容器(以下、キュベット)22に移注する。キュベット22の周囲を囲うように保温器25が設けられている。この保温器25の内部には図示しない電熱線が備えられており、この電熱線に通電されることにより、キュベット22を約37℃に保温するようになっている。このキュベット22の中にはステンレス製の攪拌子23が備えられている。この攪拌子23は、キュベット22の下部に設置された攪拌器24の作用によってキュベット22の中で回転する。すなわち、攪拌器24はモータ24aとモータ24aの出力軸に設けられた永久磁石24bとからなっている。そして
、モータ24aに通電されることで永久磁石24bが回転する。この永久磁石24bからの磁界が回転するために、ステンレス製の攪拌子23が回転磁界の作用で回転する。この攪拌子23と攪拌器24とは攪拌手段に相当する。
【0063】
なお、比濁計測装置21には光入射手段としての光源26と受光手段としての受光素子29が設置されている。光源26から出射した光はアパーチャ27を通過した後、保温器25に設けられた入射孔25aを通過してキュベット22中の試料に入射される。キュベット22中の試料を透過した光は保温器25に設けられた出射孔25bから出射され、アパーチャ28を通過して受光素子29に照射される。受光素子29では、受光した光の強度に応じた光電信号を出力する。この光電信号の出力は、判定手段及び導出手段としての演算装置30に入力される。演算装置30においては、予め格納されたプログラム(アルゴリズム)に従い、反応開始時刻の判定及び、エンドトキシン濃度の導出が行われる。なお、この他に導出されたエンドトキシン濃度を表示する表示装置を含めて比濁計測装置21としてもよい。
【0064】
なお、上記の実施例では、混和液に添加する界面活性剤として、Tween20やTriton X-100を用いる例について説明したが、界面活性剤としては、商品名が異なっていたとしてもポリオキシエチレンソルビタンモノラウレート、ポリオキシエチレンソルビタンモノパルミテート、ポリオキシエチレンソルビタンモノステアレート、ポリオキシエチレンソルビタンモノオレエート、ポリオキシエチレンソルビタントリオレエート、ポリオキシエチレン−p−イソオクチルフェノール、などを使用してもよい。また、他の非イオン系界面活性剤、例えば、Pluronic、ポリエチレンオキシド/ポリプロピレンオキシドブロックポリマー、しょ糖脂肪酸エステルソルビタン脂肪酸エステル、ポリオキシエチレンソルビタン脂肪酸エステル、脂肪酸アルカノールアミド、ポリオキシエチレンアルキルエーテル、ポリオキシエチレンアルキルフェニルエーテルを用いても、同等の効果を期待することができる。また、界面活性剤であれば、非イオン系のものでなくとも蛋白質同士の凝集を抑制する効果が得られると考えられるので、非イオン系界面活性剤に、シリコーンオイルや植物油を乳化したエマルジョン型消泡剤を使用してもよい。また、陰イオン系界面活性剤、例えば、純石けん分(脂肪酸ナトリウム)、純石けん分(脂肪酸カリウム)、アルファスルホ脂肪酸エステルナトリウム、直鎖アルキルベンゼンスルホン酸ナトリウム、アルキル硫酸エステルナトリウム、アルキルエーテル硫酸エステルナトリウム、アルファオレフィンスルホン酸ナトリウム、アルキルスルホン酸ナトリウムを使用してもよい。また、両性イオン系界面活性剤、例えば、アルキルアミノ脂肪酸ナトリウム、アルキルベタイン、アルキルアミンオキシドを使用してもよい。また、陽イオン系界面活性剤、例えば、アルキルトリメチルアンモニウム塩、ジアルキルトリメチルアンモニウム塩を使用してもよい。また、上記した各種の界面活性剤を混合して使用してもよい。
【0065】
<実施例2>
上記の実施例1においては、一般的な光散乱粒子計測装置1及び、比濁計測装置21を用いて、試料とAL試薬の混和液に対してTween20やTriton X-100などの界面活性剤を添加する例について説明したが、本発明を実施するために、試料とAL試薬の混和液に対して自動的にTweenやTriton Xなどの界面活性剤を添加する
特別な光散乱粒子計測装置及び、比濁計測装置を用いることとしてもよい。
【0066】
図12には、試料とAL試薬の混和液に対してTweenやTriton Xなどの界
面活性剤を自動的に添加する界面活性剤添加装置13を備えた光散乱粒子計測装置31について示す。図2で説明した光散乱粒子計測装置1との相違点は、界面活性剤貯留部13aと、界面活性剤添加管13bを有している点である。この界面活性剤貯留部13aには、測定に先立ち、TweenやTriton Xなどの界面活性剤を精密に測定された量
だけ貯留しておく。そして、測定時に試料とAL試薬の混和液が測定位置にセットされた
際に、図示しないスイッチがONされ、例えば小型ポンプ13cによって、界面活性剤貯留部13aに空気圧が作用する。そして、界面活性剤貯留部13aに貯留されたTweenやTriton Xなどの界面活性剤が、界面活性剤添加管13bを介してキュベット
内に添加される。
【0067】
本実施例によれば、より簡単に、混和液を攪拌する場合に生じる、エンドトキシンに由来しない凝集を低減することができ、エンドトキシン測定の測定精度を向上することができる。上記の界面活性剤添加装置13は界面活性剤添加手段に相当する。
【0068】
なお、本実施例における界面活性剤添加装置13は、上記の構成によるものに限定されないことは当然である。例えば、精密に吐出量を制御可能な液体吐出装置によって、TweenやTriton Xなどの界面活性剤を、測定時に試料とAL試薬の混和液が測定
位置にセットされた際に、吐出するようにしてもよい。あるいは、TweenやTriton Xなどの界面活性剤を必要量吸い上げたスポイト、あるいはピペットをセットして
おき、それらの可撓性のポンプ部を圧縮することで、TweenやTriton Xなど
の界面活性剤を、ガラス製試料セル4内の混和液に添加するようにしてもよい。
【0069】
なお、TweenやTriton Xなどの界面活性剤を試料とAL試薬の混和液に添
加するタイミングは、攪拌子11による攪拌が開始する前であることが望ましい。これによって、より確実に、混和液を攪拌する場合に生じる、エンドトキシンに由来しない凝集を抑制することができる。しかしながら、攪拌子11による攪拌の開始と同時あるいは、攪拌が開始した後であっても、TweenやTriton Xなどの界面活性剤を試料と
AL試薬の混和液に添加することで、エンドトキシンに由来しない凝集を抑制する効果は得ることができる。
【0070】
図13には、同様に、試料とAL試薬の混和液に対してTweenやTriton X
などの界面活性剤を自動的に添加する界面活性剤添加装置33を備えた比濁計測装置41について示す。図11で説明した比濁計測装置21との相違点は、シリンジ33a、ピストン33b及びピストン押圧部33cからなる界面活性剤添加装置33を有している点である。ここでは、シリンジ33aには、TweenやTriton Xなどの界面活性剤
が必要量吸い上げられている。そして、測定時に試料とAL試薬の混和液を保持するキュベット22が測定位置にセットされた際に、図示しないスイッチがONされ、ピストン押圧部33cがピストン33bを押圧し、シリンジ33a内のTweenやTriton
Xなどの界面活性剤が、キュベット22内に添加される。このような比濁計測装置41によっても、より簡単に、混和液を攪拌する場合に生じる、エンドトキシンに由来しない凝集を低減することができ、エンドトキシン測定の測定精度を向上することができる。
【0071】
なお、本実施例における界面活性剤添加装置33も、上記の構成によるものに限定されないことは当然であり、同等の機能を有するものであれば、いかなる装置を使用してもよい。
【符号の説明】
【0072】
1・・・光散乱粒子計測装置
2・・・光源
3・・・入射光学系
4・・・試料セル
5・・・出射光学系
6・・・受光素子
7・・・増幅回路
8・・・ノイズ除去フィルタ
9・・・演算装置
10・・・表示器
11・・・攪拌子
12・・・攪拌器
13・・・界面活性剤添加装置
21・・・比濁計測装置
22・・・ガラス容器(キュベット)
23・・・攪拌子
24・・・攪拌器
24a・・・モータ
24b・・・磁石
25・・・保温器
25a・・・入射孔
25b・・・出射孔
26・・・光源
27・・・アパーチャ
28・・・アパーチャ
29・・・受光素子
30・・・演算装置
31・・・界面活性剤添加装置を備えた光散乱粒子計測装置
33・・・界面活性剤添加装置
41・・・界面活性剤添加装置を備えた比濁計測装置
【技術分野】
【0001】
本発明は、エンドトキシンやβ−D−グルカンなど、ALとの反応によってゲル化する特性を有する生物由来の生理活性物質を含有する試料中の該生理活性物質を検出しまたはその濃度を測定するための測定方法及び測定装置に関する。
【背景技術】
【0002】
エンドトキシンはグラム陰性菌の細胞壁に存在するリポ多糖であり、最も代表的な発熱性物質である。このエンドトキシンに汚染された輸液、注射薬剤、血液などが人体に入ると、発熱やショックなどの重篤な副作用を惹起するおそれがある。このため、上記の薬剤などは、エンドトキシンにより汚染されることが無いように管理することが義務付けられている。一方で、敗血症患者血液中のエンドトキシンを測定することにより、重篤なエンドトキシンショックの予防や治療に寄与することもある。
【0003】
注射薬などのエンドトキシン汚染を検出するための半定量的試験法として、従前は以下のような方法がとられることがあった。すなわち、体重1.5kg以上の健康なウサギの耳静脈に、37℃に加温した試料を注射し、注射後3時間まで30分以下の間隔で体温を測定する。注射の40分前から注射までの間に30分間隔で2回測定したウサギの体温の平均値を対象体温とし、対象体温と最高体温との差を体温上昇とする。
【0004】
3匹のウサギを用いて上記の体温上昇を測定し、3匹の体温上昇の合計によって次のような判定が行われる。まず、3匹の体温上昇の合計が1.3℃以下の場合は発熱性物質陰性とし、2.5℃以上の場合は発熱性物質陽性とする。そして、3匹の体温上昇の合計が1.3℃より大きく2.5℃未満である場合にはさらに3匹による試験を追加し、計6匹の体温上昇の合計が3.0℃以下の場合は発熱性物質陰性とし、4.2℃以上の場合は発熱性物質陽性とする。その際の温度上昇の合計が3.0℃より大きく4.2℃未満である場合には、さらに3匹による試験を追加し、計9匹の体温上昇が5.0℃未満であれば発熱性物質陰性とし、5.0℃以上であれば発熱性物質陽性とする。
【0005】
また、β−D−グルカンは真菌に特徴的な細胞膜を構成しているポリサッカライド(多糖体)である。β−D−グルカンを測定することによりカンジダやアスペルギルス、クリプトコッカスのような一般の臨床でよく見られる真菌のみならず、稀な真菌も含む広範囲で真菌感染症のスクリーニングなどに有効である。
【0006】
ところで、カブトガニの血球抽出物(以下、「AL :Amoebocyte lysate」ともいう。
)の中には、エンドトキシンやβ−D−グルカンなどによって活性化されるセリンプロテアーゼが存在する。そして、ALとエンドトキシンやβ−D−グルカンとが反応する際には、それらの量に応じて活性化されたセリンプロテアーゼによる酵素カスケードによって、AL中に存在するコアギュロゲンがコアギュリンへと加水分解されて会合し、不溶性のゲルが生成される。このALの特性を用いて、エンドトキシンやβ−D−グルカンを高感度に検出することが可能である。近年、このことを利用して、エンドトキシンなどの検出または濃度測定にALを用いる方法が考案されている。
【0007】
このエンドトキシンやβ−D−グルカンなどの、ALによって検出可能な生物由来の生理活性物質(以下、所定生理活性物質ともいう)の検出または濃度測定を行う方法としては、所定生理活性物質の検出または濃度測定(以下、単純に「所定生理活性物質の測定」ともいう。)をすべき試料とALを元に製造された試薬(AL試薬)とを混和した混和液を静置し、一定時間後に容器を転倒させて、試料の垂れ落ちの有無によりゲル化したかど
うかを判定し、試料に一定濃度以上のエンドトキシンが含まれるか否かを調べる半定量的なゲル化法がある。
【0008】
あるいは、所定生理活性物質の測定をすべき試料とALとを混和した混和液を37℃が維持された状態で静置し、ALと所定生理活性物質との反応によるゲルの生成に伴う試料の濁りを経時的に計測して解析する比濁法がある。この比濁法においては、測定開始後、透過率がある一定値以下に低下した時点をゲル化時間とする。定量は,ゲル化時間が検体中のエンドトキシン量と相関があることを利用する。すなわち、予め既知量のエンドトキシンが混入している複数の標準試料を測定して作成した検量線と、測定によって得られたゲル化時間とから、検体中のエンドトキシン量を算出する。
【0009】
上記の比濁法によって所定生理活性物質の測定を行う場合には、乾熱滅菌処理されたガラス製測定セルに測定試料とALとの混和液を生成させる。そして、混和液を静置してそのゲル化を外部から光学的に測定する。これに対し、AL試薬と混和した検体を攪拌しながら上記比濁法で測定する攪拌比濁法もある。この攪拌比濁法では、ガラス製測定セル内に入っている攪拌子を回転させることによって測定中も試料が攪拌される。そして、上記比濁法と同様、検量線法によって検体中のエンドトキシン量が算出される。攪拌比濁法では、測定中に試料を攪拌することによって上記の比濁法よりも迅速かつ安定に測定が可能である。
【0010】
また、測定試料とALと共に、表面にALが結合した微粒子(以下、AL結合ビーズともいう。)を含んだ混和液を生成させ、上記攪拌比濁法で測定するAL結合ビーズ法もある。このAL結合ビーズ法では、試料とAL及びAL結合ビーズの反応によって生じるAL結合ビーズの凝集に伴う試料の濁りを経時的に計測して解析する。このAL結合ビーズ法においては、測定開始後、透過率がある一定値以上に上昇した時点をゲル化時間とする。そして、上記攪拌比濁法と同様、検量線法によって検体中のエンドトキシン量が算出される。AL結合ビーズ法は、上記の比濁法や攪拌比濁法よりも迅速に測定をすることができる。これは主にAL結合ビーズ法では、コアギュリンより10から100倍以上大きいAL結合ビーズが凝集するため、透過率の変化が鋭敏となるためである。
【0011】
さらに、測定試料とALとの混和液を例えば磁性攪拌子を用いて攪拌することにより、ゲル微粒子を生成せしめ、ゲル粒子により散乱されるレーザー光の強度から、試料中の所定生理活性物質の存在を短時間で測定できるレーザー光散乱粒子計測法(以下、単に光散乱法ともいう。)も提案されている。試料とALとの反応によってゲル粒子が生成され、反応が進行してそれらが互いに凝集すると、散乱光においてスパイク状のピーク信号が検出される。光散乱法においては、これらのピーク信号がある一定の頻度以上で検出した時点を凝集開始時間とする。上記ゲル化時間と同様、凝集開始時間は検体中のエンドトキシン量と相関があるので、これを利用して検量線法によって検体中のエンドトキシン量を算出する。
【0012】
光散乱法でも、ガラス製試料セル内に入っている攪拌子を回転させることによって、測定中も試料が攪拌されるが、攪拌の目的が攪拌比濁法とは異なる。上記ピーク信号は、ゲル粒子が検体に入射したレーザー光を横切ったときに検出される。ゲル粒子がレーザー光を横切ることができるように攪拌によってゲル粒子を移動させるのである。光散乱法は,上記の比濁法や攪拌比濁法よりも迅速、高感度に測定をすることができる。これは主に光散乱法が、ゲル化の初期段階、すなわち、小さなゲル粒子が生成された時点でこれを検出することができることが要因である。
【0013】
一方、試薬中に添加した凝固酵素に対する合成基質を予め入れておき、凝固酵素によって分解された合成基質が発色、あるいは、蛍光、さらには発光する現象を測定する方法が
あり、発色を利用した方法は比色法と呼ばれ、所定生理活性物質の重要な測定法の一つとして広く利用されている。比色法には、所定生理活性物質の濃度と、一定反応時間後における発色基の遊離量との間に相関関係があることを利用するエンドポイント−比色法や、所定生理活性物質の濃度と、混和液の収光度あるいは透過率がある一定の値に達するのに要する時間,または発色の経時変化率との間に相関関係があることを利用するカイネティック−比色法がある。
【0014】
ここで、上記した攪拌比濁法や光散乱法のように、ガラス製試料セル内でAL試薬と試料の混和液を攪拌子によって攪拌する場合、反応曲線(時間に対する透過率/吸光度(攪拌比濁法)、あるいはゲル粒子数(光散乱法))の形状が変化してしまい、測定によって得られるゲル化時間、あるいは凝集開始時間の精度が低下してしまうことが問題となっている(例えば、非特許文献1を参照。)。これらの問題を回避するため、各測定法では、ゲル化時間、あるいは凝集開始時間を決定するアルゴリズムに工夫をこらし,多少の反応曲線の変化が生じても,測定結果に影響が及ばないようにしている(例えば、特許文献1を参照。)。また、AL試薬と試料の混和液に熱処理済みアルブミンを添加することでエンドトキシンに由来しない凝集を抑制する方法もある。これは主に、攪拌の刺激による凝固酵素の活性化を、熱処理済みアルブミンが抑制することを利用している。
【0015】
しかしながら、特に希薄な血漿製剤中のエンドトキシンや注射用水そのものを、AL試薬の種類やメーカーおよびロットが異なる様々な条件で測定する場合などでは、上記の回避策が充分に機能しない場合があった。これは、攪拌によって反応曲線の形状が変化する原因が、攪拌刺激による凝固酵素の活性化だけではなく多岐に渡ることに起因すると考えられており、さらなる対策が望まれている。
【先行技術文献】
【特許文献】
【0016】
【特許文献1】特開2010−216878号公報
【特許文献2】特開2004−061314号公報
【特許文献3】特開平10−293129号公報
【特許文献4】国際公開第WO2008/038329号パンフレット
【特許文献5】特開2009−150723号公報
【非特許文献】
【0017】
【非特許文献1】高橋学、柴田繁啓、鈴木泰、小鹿雅博、松本尚也、小豆嶋立頼、稲田捷也、遠藤重厚、「エンドトキシン散乱測光法を用いたエンドトキシン測定法の臨床応用における課題」、エンドトキシン血症救命治療研究会誌、第14巻、第1号p.111−119、2010
【発明の概要】
【発明が解決しようとする課題】
【0018】
本発明の目的とするところは、カブトガニの血球抽出物であるALと生物由来の生理活性物質との反応に起因する凝集あるいはゲル化を光学的に測定する、生物由来の生理活性物質の測定法において、より高い測定精度を得るための技術を提供することである。
【0019】
より詳しくは、攪拌比濁法、光散乱法、あるいはAL結合ビーズ法によって試料中の生物由来の生理活性物質の濃度を測定する場合に、AL試薬と試料の混和液の攪拌に起因して生じる、前記生理活性物質に由来しない凝集またはゲル化を抑制することによって、上記測定の測定精度を向上させることを目的とする。
【課題を解決するための手段】
【0020】
本発明は、AL試薬と生物由来の生理活性物質を含む試料とを混和させ、混和液を攪拌しつつ、混和液におけるALと生物由来の生理活性物質との反応に起因する蛋白質の凝集またはゲル化を検出する際に、界面活性剤を混和液に添加することで、該混和液におけるALと生物由来の生理活性物質との反応に起因しない、蛋白質の凝集またはゲル化を抑制することを最大の特徴とする。
【0021】
より詳しくは、カブトガニの血球抽出物であるALと所定の生物由来の生理活性物質を含む試料の混和液を生成し、該混和液を攪拌しつつ、該混和液におけるALと前記生理活性物質との反応に起因する蛋白質の凝集またはゲル化を検出することで、前記試料中の前記生理活性物質を検出しまたは前記生理活性物質の濃度を測定する、生物由来の生理活性物質の測定方法であって、
前記攪拌をする際には、前記混和液に、所定の界面活性剤を添加することで、前記混和液における前記生理活性物質に由来しない凝集またはゲル化を抑制することを特徴とする。
【0022】
ここで、混和液の攪拌によって試料とAL試薬との反応曲線が変化する現象の原因が以下のものであることが明確になってきた。すなわち、生物由来の生理活性物質の含有量が非常に少ない試料を測定する場合は、攪拌によって、(1)AL試薬および/または試料
中に含まれる蛋白質同士が凝集し、あるいは、(2)攪拌に伴うずり応力(物理的刺激)によってプロクロッティング・エンザイムが切断・活性化され、クロッティング・エンザイムに変化し、生物由来の生理活性物質に由来しない凝集物が生成されることが見出された。
【0023】
この生物由来の生理活性物質に由来しない凝集は、攪拌比濁法及び光散乱法の両方の方法においてゲル粒子の発生と同様の信号として検出されてしまうため、反応曲線(タイムコース)の形状に影響を及ぼし、測定精度が低下し、誤計測をもたらす危険性があった。これに対し、発明者らの鋭意研究により、試料とAL試薬の混和時に、界面活性剤を添加することで上記の生物由来の生理活性物質に由来しない凝集またはゲル化の誘発を抑制できることが見出された。特に、この界面活性剤の添加により、AL試薬および/または試
料中に含まれる蛋白質同士の凝集を抑制できることが見出された。さらに、この界面活性剤を試料に添加しても、生物由来の生理活性物質に由来する凝集またはゲル化の測定に影響がないことが実験によって確認された。
【0024】
本発明によれば、特に生物由来の生理活性物質の含有量の少ない試料とAL試薬との混和液における凝集またはゲル化を攪拌しつつ測定する場合に、攪拌による、生物由来の生理活性物質に起因しない凝集またはゲル化を抑制することができる。特に、界面活性剤によってAL試薬および/または試料中に含まれる蛋白質同士の凝集を抑制できることから
、熱処理済みアルブミンでは効果が期待できない場合でも、攪拌による、生物由来の生理活性物質に起因しない凝集またはゲル化を抑制することができる。その結果、生物由来の生理活性物質の測定における精度を向上させることができる。
【0025】
また、本発明においては、前記界面活性剤は、陰イオン系界面活性剤、例えば、純石けん分(脂肪酸ナトリウム)、純石けん分(脂肪酸カリウム)、アルファスルホ脂肪酸エステルナトリウム、直鎖アルキルベンゼンスルホン酸ナトリウム、アルキル硫酸エステルナトリウム、アルキルエーテル硫酸エステルナトリウム、アルファオレフィンスルホン酸ナトリウム、アルキルスルホン酸ナトリウムでもよい。また、非イオン系界面活性剤、例えば、Tween(商品名)、TritonX(商品名)、Pluronic(商品名)、ポリオキシエチレンソルビタンモノラウレート、ポリオキシエチレンソルビタンモノパルミテート、ポリオキシエチレンソルビタンモノステアレート、ポリオキシエチレンソルビタンモノオレエート、ポリオキシエチレンソルビタントリオレエート、ポリオキシエチレ
ン−p−イソオクチルフェノール、ポリエチレンオキシド/ポリプロピレンオキシドブロックポリマー、しょ糖脂肪酸エステルソルビタン脂肪酸エステル、ポリオキシエチレンソルビタン脂肪酸エステル、脂肪酸アルカノールアミド、ポリオキシエチレンアルキルエーテル、ポリオキシエチレンアルキルフェニルエーテルでもよい。また、非イオン系界面活性剤に、シリコーンオイルや植物油を乳化したエマルジョン型消泡剤でもよい。また、両性イオン系界面活性剤、例えば、アルキルアミノ脂肪酸ナトリウム、アルキルベタイン、アルキルアミンオキシドでもよい。また、陽イオン系界面活性剤、例えば、アルキルトリメチルアンモニウム塩、ジアルキルトリメチルアンモニウム塩でもよい。これらの界面活性剤は、試料とAL試薬の混和時に添加されることにより、生物由来の生理活性物質に由来しない凝集またはゲル化の誘発を抑制できることが確認されているため、より確実に、攪拌による、生物由来の生理活性物質に起因しない凝集またはゲル化を抑制することができる。
【0026】
また、本発明においては、前記混和液に、所定の界面活性剤を添加する際の最終濃度は、0.0001%以上10%以下としてもよい。これによって、より効果的に、攪拌による生物由来の生理活性物質に起因しない凝集またはゲル化を抑制することができる。なお、上記最終濃度は、望ましくは、0.0005%以上5%以下がよい。さらに望ましくは、0.005%以上0.5%以下がよい。
【0027】
なお、本発明においては、攪拌による、生物由来の生理活性物質に起因しない凝集またはゲル化を抑制するために、本発明である界面活性剤の添加と合わせて、熱処理済みアルブミンの添加を併用してもよい。
【0028】
また、本発明においては、前記生物由来の生理活性物質は、エンドトキシンまたはβ−D−グルカンであってもよい。
【0029】
そうすれば、最も代表的な発熱性物質であるエンドトキシンの検出または濃度測定がより正確に行なえ、エンドトキシンに汚染された輸液、注射薬剤、血液などが人体に入り、副作用が惹起されることを抑制できる。同様に、β−D−グルカンの検出または濃度測定がより正確に行なえ、カンジダやアスペルギルス、クリプトコッカスのような一般の臨床でよく見られる真菌のみならず、稀な真菌も含む広範囲で真菌感染症のスクリーニングをより正確に行なうことが可能となる。
【0030】
また、本発明は、カブトガニの血球抽出物であるALを含み、所定の生物由来の生理活性物質を含む試料との混和液を生成し、該混和液を攪拌しつつ、前記生理活性物質に起因する蛋白質の凝集またはゲル化を検出することで、前記試料中の前記生理活性物質を検出しまたは前記生理活性物質の濃度を測定するための、生物由来の生理活性物質の測定用試薬であって、所定の界面活性剤が添加され、前記混和液における前記生理活性物質に由来しない凝集またはゲル化を抑制可能としたこと特徴とする生物由来の生理活性物質の測定用試薬であってもよい。また、その場合は、前記所定の界面活性剤は、陰イオン系界面活性剤、例えば、純石けん分(脂肪酸ナトリウム)、純石けん分(脂肪酸カリウム)、アルファスルホ脂肪酸エステルナトリウム、直鎖アルキルベンゼンスルホン酸ナトリウム、アルキル硫酸エステルナトリウム、アルキルエーテル硫酸エステルナトリウム、アルファオレフィンスルホン酸ナトリウム、アルキルスルホン酸ナトリウムでもよい。また、非イオン系界面活性剤、例えば、Tween(商品名)、TritonX(商品名)、Pluronic(商品名)、ポリオキシエチレンソルビタンモノラウレート、ポリオキシエチレンソルビタンモノパルミテート、ポリオキシエチレンソルビタンモノステアレート、ポリオキシエチレンソルビタンモノオレエート、ポリオキシエチレンソルビタントリオレエート、ポリオキシエチレン−p−イソオクチルフェノール、ポリエチレンオキシド/ポリプロピレンオキシドブロックポリマー、しょ糖脂肪酸エステルソルビタン脂肪酸エステル、
ポリオキシエチレンソルビタン脂肪酸エステル、脂肪酸アルカノールアミド、ポリオキシエチレンアルキルエーテル、ポリオキシエチレンアルキルフェニルエーテルでもよい。また、非イオン系界面活性剤に、シリコーンオイルや植物油を乳化したエマルジョン型消泡剤でもよい。また、両性イオン系界面活性剤、例えば、アルキルアミノ脂肪酸ナトリウム、アルキルベタイン、アルキルアミンオキシドでもよい。また、陽イオン系界面活性剤、例えば、アルキルトリメチルアンモニウム塩、ジアルキルトリメチルアンモニウム塩でもよい。
【0031】
また、本発明は、所定の生物由来の生理活性物質を含む試料とカブトガニの血球抽出物であるALとの混和液を光の入射が可能な状態に保持するとともに該混和液における反応を進行させる混和液保持手段と、
前記混和液保持手段中の前記混和液を攪拌する攪拌手段と、
前記混和液保持手段中の混和液に光を入射する光入射手段と、
前記入射光の前記混和液における透過光または散乱光を受光し電気信号に変換する受光手段と、
前記受光手段において変換された電気信号から前記試料中における前記生理活性物質とALとの反応開始時刻を判定する判定手段と、
予め定められた、前記反応開始時刻と前記生理活性物質の濃度との関係より、前記試料中の前記生理活性物質の存在または濃度を導出する導出手段と、を備える生物由来の生理活性物質の測定装置であって、
前記攪拌手段によって、前記混和液を攪拌する際に、所定の界面活性剤を前記混和液に添加する界面活性剤添加手段をさらに備えることを特徴とする生物由来の生理活性物質の測定装置であってもよい。
【0032】
この装置によれば、試料とAL試薬との混和液を攪拌する際に、自動的に、所定の界面活性剤を前記混和液に添加することができ、より簡単に、該混和液における前記生理活性物質に由来しない、蛋白質の凝集またはゲル化を抑制することができる。
【0033】
この装置においても、界面活性剤添加手段によって添加される界面活性剤は、陰イオン系界面活性剤、例えば、純石けん分(脂肪酸ナトリウム)、純石けん分(脂肪酸カリウム)、アルファスルホ脂肪酸エステルナトリウム、直鎖アルキルベンゼンスルホン酸ナトリウム、アルキル硫酸エステルナトリウム、アルキルエーテル硫酸エステルナトリウム、アルファオレフィンスルホン酸ナトリウム、アルキルスルホン酸ナトリウムでもよい。また、非イオン系界面活性剤、例えば、Tween(商品名)、TritonX(商品名)、Pluronic(商品名)、ポリオキシエチレンソルビタンモノラウレート、ポリオキシエチレンソルビタンモノパルミテート、ポリオキシエチレンソルビタンモノステアレート、ポリオキシエチレンソルビタンモノオレエート、ポリオキシエチレンソルビタントリオレエート、ポリオキシエチレン−p−イソオクチルフェノール、ポリエチレンオキシド/ポリプロピレンオキシドブロックポリマー、しょ糖脂肪酸エステルソルビタン脂肪酸エステル、ポリオキシエチレンソルビタン脂肪酸エステル、脂肪酸アルカノールアミド、ポリオキシエチレンアルキルエーテル、ポリオキシエチレンアルキルフェニルエーテルでもよい。また、非イオン系界面活性剤に、シリコーンオイルや植物油を乳化したエマルジョン型消泡剤でもよい。また、両性イオン系界面活性剤、例えば、アルキルアミノ脂肪酸ナトリウム、アルキルベタイン、アルキルアミンオキシドでもよい。また、陽イオン系界面活性剤、例えば、アルキルトリメチルアンモニウム塩、ジアルキルトリメチルアンモニウム塩でもよい。また、混和液に、所定の界面活性剤を添加する際の最終濃度は、0.0001%以上10%以下とするとよい。望ましくは、0.0005%以上5%以下がよい。さらに望ましくは、0.005%以上0.5%以下がよい。さらに、生物由来の生理活性物質は、エンドトキシンまたはβ−D−グルカンとしてもよい。
【0034】
なお、上記した本発明の課題を解決する手段については、可能なかぎり組み合わせて用いることができる。
【発明の効果】
【0035】
本発明にあっては、攪拌比濁法、光散乱法、あるいはAL結合ビーズ法によって試料中の生物由来の生理活性物質の濃度を測定する場合に、混和液の攪拌に起因して生じる、前記生理活性物質に由来しない凝集またはゲル化を抑制することによって、上記測定の測定精度を向上させることができる。
【図面の簡単な説明】
【0036】
【図1】エンドトキシンまたはβ―D−グルカンにより、ALがゲル化する過程及び、その検出方法について説明するための概略図である。
【図2】本発明の実施例1における光散乱粒子計測装置の概略構成を示す図である。
【図3】従来(界面活性剤未添加)のAL試薬を用いた場合の、試料中のエンドトキシン濃度とゲル化検出時間との関係と、検量線とを示すグラフである。
【図4】本発明の実施例1においてTween20を混和液に添加した場合の、反応曲線を示すグラフである。
【図5】本発明の実施例1における試料とAL試薬との混和液に添加するTween20の濃度と、ゲル化検出時間との関係を示すグラフである。
【図6】本発明の実施例1においてTriton X-100を混和液に添加した場合の、反応曲線を示すグラフである。
【図7】本発明の実施例1における試料とAL試薬の混和液に添加するTriton X-100の濃度と、ゲル化検出時間との関係を示すグラフである。
【図8】本発明の実施例1においてTween20を混和液に添加した場合の、試料中のエンドトキシン濃度とゲルが検出時間との関係と、検量線とを示すグラフである。
【図9】APB、Tween20及び、APBとTween20を混和液に添加した場合の、反応曲線を示すグラフである。
【図10】APB及び、Tween20を混和液に添加した場合の、反応曲線を示すグラフである。
【図11】本発明の実施例1における比濁計測装置の概略構成を示す図である。
【図12】本発明の実施例2における光散乱粒子計測装置の概略構成を示す図である。
【図13】本発明の実施例2における比濁計測装置の概略構成を示す図である。
【発明を実施するための形態】
【0037】
<実施例1>
ALとエンドトキシンとが反応してゲルが生成される過程(以下、リムルス反応ともいう。)はよく調べられている。すなわち、図1に示すように、エンドトキシンがAL中のセリンプロテアーゼであるC因子に結合すると、C因子は活性化して活性型C因子となり、活性型C因子はAL中の別のセリンプロテアーゼであるB因子を加水分解して活性化させ活性化B因子とする。この活性化B因子は直ちにAL中の凝固酵素の前駆体を加水分解して凝固酵素とし、さらに、この凝固酵素がAL中のコアギュロゲンを加水分解してコアギュリンを生成する。そして、生成したコアギュリンが互いに会合して不溶性のゲルをさらに生成し、AL全体がこれに巻き込まれてゲル化すると考えられている。
【0038】
また、同様にβ−D−グルカンがAL中のG因子に結合すると、G因子は活性化して活性型G因子となる、活性型G因子はAL中の凝固酵素の前駆体を加水分解して凝固酵素とする。その結果、エンドトキシンとALとの反応と同様、コアギュリンが生成され、生成したコアギュリンが互いに会合して不溶性のゲルをさらに生成する。
【0039】
この一連の反応は哺乳動物に見られるクリスマス因子やトロンビンなどのセリンプロテアーゼを介したフィブリンゲルの生成過程に類似している。このような酵素カスケード反応はごく少量の活性化因子であっても、その後のカスケードを連鎖して活性化していくために非常に強い増幅作用を有する。従って、ALを用いた所定生理活性物質の測定法によれば、サブピコグラム/mLオーダーのきわめて微量の所定生理活性物質を検出することが可能になっている。
【0040】
エンドトキシンならびにβ―D−グルカンを定量するための試薬としては、カブトガニの血球抽出物(AL:Amoebocyte lysate)を原料としたリムルス試薬、ならびに、リムルス試薬に凝固酵素により加水分解され着色強度、蛍光強度、または化学発光強度のいずれかが増加する合成基質を添加した試薬が使用される。また、リムルス試薬中のC因子の組換え体(リコンビナントC因子)とその合成基質(着色、蛍光、化学発光かの手段は問わない)の混合試薬などが使用される場合もある。さらに、リムルス試薬中のG因子の組換え体(リコンビナントG因子)とその合成基質(着色、蛍光、化学発光かの手段は問わない)の混合試薬などを使用することも可能である。
【0041】
エンドトキシンやβ−D−グルカンなどの所定生理活性物質とALとの反応に起因して変化する物理量は、試薬の種類に応じて選択すればよい。試料の光透過率または、濁度、散乱光強度、光散乱粒子数、吸光度、蛍光強度、化学発光強度などの光学的な物理量の変化を検出するか、試料のゲル化に伴う試料の粘性、電気伝導度などの物理量の変化を検出すればよい。これらの物理量の検出には、濁度計、吸光光度計、光散乱光度計、レーザー光散乱粒子計測計、蛍光光度計、フォトンカウンターなどの光学機器、ならびに、これらを応用した専用の測定装置を使用することができる。また、粘度計、電気伝導率計やこれらを応用した専用の測定装置を使用しても構わない。
【0042】
所定生理活性物質を定量する測定法としては前述のように攪拌比濁法ならびに光散乱法が挙げられる。図1に示すように、これらの測定法はALの酵素カスケード反応によって生成されるコアギュリンの会合物を前者は試料の濁りとして、後者は系内に生成されるゲルの微粒子の数として検出することで、高感度な測定を可能にしている。
【0043】
次に、本実施例において散乱光を取得するために使用した光散乱粒子計測装置について説明する。なお、以下の説明においては、所定生理活性物質としてエンドトキシンを例にとって説明するが、以下の説明はβ−D−グルカンなど他の生理活性物質にも適用可能である。図2には、本実施例におけるエンドトキシンの測定装置としての光散乱粒子計測装置1の概略構成を示す。光散乱粒子計測装置1に使用される光源2にはレーザー光源が用いられているが、他に、超高輝度LEDなどを用いてもよい。光源2から照射された光は、入射光学系3で絞られ、試料セル4に入射する。この試料セル4にはエンドトキシンの測定をすべき試料とAL試薬の混和液が保持されている。試料セル4に入射した光は、混和液中の粒子(コアギュロゲンモノマー、ならびに、コアギュロゲンオリゴマーなどの測定対象)で散乱される。
【0044】
試料セル4の、入射光軸の側方には出射光学系5が配置されている。また、出射光学系5の光軸の延長上には、試料セル4内の混和液中の粒子で散乱され出射光学系5で絞られた散乱光を受光し電気信号に変換する受光素子6が配置されている。受光素子6には、受光素子6で光電変換された電気信号を増幅する増幅回路7、増幅回路7によって増幅された電気信号からノイズを除去するためのフィルタ8、ノイズが除去された後の電気信号のピーク数からゲル粒子数を演算し、さらにゲル化検出時間を判定してエンドトキシンの濃度を導出する演算装置9及び、結果を表示する表示器10が電気的に接続されている。
【0045】
また、試料セル4には、外部から電磁力を及ぼすことで回転し、試料としての混和液を
攪拌する攪拌子11が備えられており、試料セル4の外部には、攪拌器12が備えられている。これらにより、攪拌の有無及び攪拌速度の調整が可能となっている。
【0046】
ここで、試料セル4は本実施例の混和液保持手段に相当する。光源2及び入射光学系3は光入射手段に相当する。攪拌子11及び攪拌器12は攪拌手段に相当する。出射光学系5及び受光素子6は受光手段に相当する。演算装置9は判定手段及び導出手段に相当する。
【0047】
上記の光散乱粒子計測装置1においては、リムルス反応の最終段階であるコアギュリンゲル粒子の出現時間(ゲル化検出時間=ゲル化時間)を測定し、エンドトキシン濃度とゲル化検出時間の間に成立する検量関係を用いて検体中のエンドトキシン濃度を算出する。
【0048】
図3に、エンドトキシン濃度とゲル化検出時間との関係及び検量線を示す。なお、図3においては、AL試薬100μLと10〜0.0001EU/mLのエンドトキシンを含む試料100μLを混和した混和液を測定に用いた。試料中のエンドトキシン濃度が10〜0.01EU/mLのとき、試料中のエンドトキシン濃度が低い程、ゲル化検出時間が明確に長くなる検量関係を示したが、0.01EU/mL以下では、エンドトキシン濃度によらず、ゲル化検出時間が14〜30分以内に観測された。結果として、0.01EU/mL以下のエンドトキシンを正確に測定することが困難であった。また検量線の直線性は、相関係数が0.974となり充分とは言えなかった。
【0049】
これは、攪拌子11及び攪拌器12による攪拌の刺激によって蛋白質が変性し不溶性の凝集体が生成し、このエンドトキシンに由来しない凝集物(ゲル粒子)が生成したためである。従って、0.01EU/mL以下の低濃度のエンドトキシンを正確に測定するには、上記のエンドトキシンに由来しない凝集を抑制する必要がある。これに対し、発明者らの鋭意研究により、Tweenなどの界面活性剤の添加によってエンドトキシンに由来しない凝集を抑制できることが分かった。本実施例においては、界面活性剤としてTween20およびTriton X-100を使用し、これによるエンドトキシンに由来しない凝集の抑制効果を調べた。なお、Tween20およびTriton X-100は、いずれもエンドトキシン含有量が少なく、そのまま用いることができたが、エンドトキシンを多く含む場合は予めオートクレーブ滅菌処理により、エンドトキシンを不活化させておけばよい。
【0050】
上記の測定の結果を以下に説明する。AL試薬100μLとTween20(0%、0.001%、0.01%、0.1%、1%)100μLを混和した混和液(すなわちTw
een20の最終濃度は0%、0.0005%、0.005%、0.05%、0.5%となる)を測定に供したときの反応曲線を図4に示す。図4の横軸は反応時間、縦軸はゲル粒子数である。Tween20が0%(すなわち未添加)および0.0005%のとき、ゲル粒子数は反応開始直後から時間の経過とともに急峻に増加し、80分〜100分程度をピークとして再び減少している。これは、反応直後から、攪拌子11及び攪拌器12による攪拌の刺激によって蛋白質が変性し不溶性の凝集体が生成し、このエンドトキシンに由来しない凝集物(ゲル粒子)を計測しているためと考えられる。
【0051】
これに対し、Tween20が0.005%以上含まれるとき、反応開始直後のゲル粒子数の急峻な増加が抑制され、測定されるゲル粒子数は安定的に増加していることが分かる。上記より、界面活性剤がTweenまたは同等品であるときは、最終濃度が0.005%以上0.5%以下であれば、確実に、反応開始直後のゲル粒子数の急峻な増加が抑制される効果が期待できる。エンドトキシンに由来しない凝集物の生成が、AL試薬の種類やメーカーおよびロットによって異なることを考慮すると、一般的には、界面活性剤が0.0001%以上10%以下であれば、程度の差はあるとしても、反応開始直後のゲル粒
子数の急峻な増加が抑制される効果が期待できる。
【0052】
次に、上記の測定の結果として得られたゲル化検出時間を図5に示す。Tween20が0.005%以上含まれるとき、ゲル化検出時間が遅くなる傾向があった。これにより、Tween20を適量添加すれば、エンドトキシンに由来しない凝集を抑制できることが示された。
【0053】
同様に、Tween20に代わって界面活性剤としてTriton X-100を用いたときの反応曲線を図6に示す。図6の横軸は反応時間、縦軸はゲル粒子数である。Triton X-100が0%(すなわち未添加)および0.0005%のとき、上記のエンドトキシンに由来しない凝集物(ゲル粒子)の生成により、ゲル粒子数は反応開始直後から時間の経過とともに急峻に増加した。これに対し、Triton X-100が0.005%以上含まれるとき、ゲル粒子数の反応開始直後の急峻な増加は抑制された。結果として得られたゲル化検出時間を図7に示す。Triton X-100が0.005%以上含まれるとき、ゲル化検出時間が遅くなる傾向があった。
【0054】
これにより、Triton X-100を適量添加することによっても、エンドトキシンに由来しない凝集を抑制できることが示された。上記より、界面活性剤がTriton
Xまたは同等品であるときは、最終濃度が0.005%以上0.5%以下であれば、確実に、反応開始直後のゲル粒子数の急峻な増加が抑制される効果が期待できる。エンドトキシンに由来しない凝集物の生成が、AL試薬の種類やメーカーおよびロットによって異なることを考慮すると、一般的には、界面活性剤が0.0001%以上10%以下であれば、程度の差はあるとしても、反応開始直後のゲル粒子数の急峻な増加が抑制される効果が期待できる。
【0055】
上記のように、Tween20やTriton X-100といった界面活性剤を混和液に添加することにより、エンドトキシンに由来しない凝集が抑制されることが認められたことを受け、Tween20を0.01%含むAL試薬を調製した。このAL試薬100μLと10〜0.0001EU/mLのエンドトキシンを含む試料100μLを混和した混和液(すなわちTween20の終濃度は0.005%)を測定に供した。得られたエンドトキシン濃度とゲル化検出時間との関係及び、検量線を図8に示す。
【0056】
図3に示したTween20が未添加の場合の検量線と図8とを比較して判るように、まず、Tween20を添加した場合には試料中のエンドトキシン濃度が10〜0.01EU/mLの範囲で、Tween20添加時のゲル化検出時間が未添加時より遅くなることはなかった。これは、Tween20がリムルス反応を阻害することはないことを示している。また、Tween20を添加した場合は、10〜0.0001EU/mLの範囲で相関係数0.993という、良好な直線性を有する検量線を得ることができた。これは、Tween20添加によりエンドトキシンに由来しない凝集が抑制された効果と考えられる。
【0057】
さらに、Tweenがエンドトキシンに由来しない凝集を抑制する作用機序を調べるため、安息香酸アミジノフェニル(以下、APBと記すことがある)の添加実験を行った。APBは、プロテアーゼ阻害剤の一つであり、リムルス反応の凝固酵素の活性を阻害する。別のAL試薬を用い、AL試薬100μLと0.1mMのAPB100μLを混和した混和液、および、AL試薬100μLと0.1%のTween20を100μL混和した混和液を測定に用いた場合の反応曲線を図9に示す。また、予め0.1mMのAPBを含むAL試薬100μLと0.1%のTween20を100μL混和した混和液を測定に供したときの反応曲線も図9に示した。
【0058】
図9から判るように、まず、APBを未添加の場合は、測定開始初期から、エンドトキシンに由来しない粒子数の急峻な増加が観察された。図4および図6と比べて粒子数の増加の程度が大きいのは、AL試薬が異なるためである。また、APBを添加した場合でも、上記のゲル粒子数の増加は抑制されることはなかった。これは、上記のエンドトキシンに由来しないゲル粒子数の急峻な増加は、攪拌の刺激による凝固酵素の活性化によるものではなく、蛋白質同士が凝集して生成した凝集体を計測していることを示している。そして、Tween20のみ、および、APBとTween20の両方を添加した場合では、上記のエンドトキシンに由来しないゲル粒子数の単調な増加は著しく抑制された。すなわちTween20が、蛋白質同士の凝集に対して大きな抑制効果を発揮していることが示された。
【0059】
また別のAL試薬を用い、AL試薬100μLと0.1mMのAPB100μLを混和した混和液、および、AL試薬100μLと0.1%のTween20を100μL混和した混和液を測定に用いた場合の反応曲線を図10に示す。図10から判るように、このAL試薬を用いて、APBを未添加の場合は、測定開始初期から粒子数の急峻な増加は観察されず、約100分以降で、エンドトキシンに由来しない粒子数の増加が観察された。図4、図6および図9と比べて粒子数の増加の仕方が異なるのは、AL試薬が異なるためである。そして、APBを添加した場合、上記のゲル粒子数の増加は明確に抑制された。これは、上記のエンドトキシンに由来しないゲル粒子数の増加は、攪拌の刺激による凝固酵素の活性化によるものであることを示している。しかしながら、Tween20を添加しても、上記のエンドトキシンに由来しないゲル粒子数の増加は抑制されなかった。すなわちTween20は、熱処理済みアルブミンとは異なり、攪拌刺激による凝固酵素の活性化に対しては抑制効果を有していないことが示された。
【0060】
このようにTweenは、主に攪拌の刺激による凝固酵素の活性化を抑制すると考えられている熱処理済みアルブミンとは作用機序が異なり、攪拌の刺激による蛋白質同士の凝集を抑制する。従って、熱処理済みアルブミンでは効果が期待できないようなAL試薬に対してもエンドトキシンに由来しない凝集を抑制する効果が期待できる。また、Tweenは、天然物のアルブミンとは異なり、化学的な合成が可能であるため、初期過程におけるエンドトキシンの混入を排除することが容易である。実際、Tweenはリムルス反応を阻害せず(図8)、Tweenの添加によりゲル化検出時間が遅くなったこと(図4および図5)は、本実施例で使用したTweenのエンドトキシン含有量が十分に低いことを示している。
【0061】
上記の実施例においては、本発明を、光散乱粒子計測装置1を用いた光散乱法によってエンドトキシン濃度を測定する場合に適用した例について説明したが、本発明が適用されるのは、光散乱法による場合だけでないことはもちろんである。例えば、攪拌比濁法によってエンドトキシン濃度を測定する場合に適用してもよい。以下に、攪拌比濁法に用いられる比濁計測装置について説明する。
【0062】
図11には、本実施例のエンドトキシンの測定装置の別の例としての比濁計測装置21の概略構成を示す。この比濁計測装置21では、攪拌比濁法によってエンドトキシンの測定を行う。比濁計測装置21においても、調製した希釈系列のエンドトキシンを含んだ試料を混和液保持手段としての測定用ガラス容器(以下、キュベット)22に移注する。キュベット22の周囲を囲うように保温器25が設けられている。この保温器25の内部には図示しない電熱線が備えられており、この電熱線に通電されることにより、キュベット22を約37℃に保温するようになっている。このキュベット22の中にはステンレス製の攪拌子23が備えられている。この攪拌子23は、キュベット22の下部に設置された攪拌器24の作用によってキュベット22の中で回転する。すなわち、攪拌器24はモータ24aとモータ24aの出力軸に設けられた永久磁石24bとからなっている。そして
、モータ24aに通電されることで永久磁石24bが回転する。この永久磁石24bからの磁界が回転するために、ステンレス製の攪拌子23が回転磁界の作用で回転する。この攪拌子23と攪拌器24とは攪拌手段に相当する。
【0063】
なお、比濁計測装置21には光入射手段としての光源26と受光手段としての受光素子29が設置されている。光源26から出射した光はアパーチャ27を通過した後、保温器25に設けられた入射孔25aを通過してキュベット22中の試料に入射される。キュベット22中の試料を透過した光は保温器25に設けられた出射孔25bから出射され、アパーチャ28を通過して受光素子29に照射される。受光素子29では、受光した光の強度に応じた光電信号を出力する。この光電信号の出力は、判定手段及び導出手段としての演算装置30に入力される。演算装置30においては、予め格納されたプログラム(アルゴリズム)に従い、反応開始時刻の判定及び、エンドトキシン濃度の導出が行われる。なお、この他に導出されたエンドトキシン濃度を表示する表示装置を含めて比濁計測装置21としてもよい。
【0064】
なお、上記の実施例では、混和液に添加する界面活性剤として、Tween20やTriton X-100を用いる例について説明したが、界面活性剤としては、商品名が異なっていたとしてもポリオキシエチレンソルビタンモノラウレート、ポリオキシエチレンソルビタンモノパルミテート、ポリオキシエチレンソルビタンモノステアレート、ポリオキシエチレンソルビタンモノオレエート、ポリオキシエチレンソルビタントリオレエート、ポリオキシエチレン−p−イソオクチルフェノール、などを使用してもよい。また、他の非イオン系界面活性剤、例えば、Pluronic、ポリエチレンオキシド/ポリプロピレンオキシドブロックポリマー、しょ糖脂肪酸エステルソルビタン脂肪酸エステル、ポリオキシエチレンソルビタン脂肪酸エステル、脂肪酸アルカノールアミド、ポリオキシエチレンアルキルエーテル、ポリオキシエチレンアルキルフェニルエーテルを用いても、同等の効果を期待することができる。また、界面活性剤であれば、非イオン系のものでなくとも蛋白質同士の凝集を抑制する効果が得られると考えられるので、非イオン系界面活性剤に、シリコーンオイルや植物油を乳化したエマルジョン型消泡剤を使用してもよい。また、陰イオン系界面活性剤、例えば、純石けん分(脂肪酸ナトリウム)、純石けん分(脂肪酸カリウム)、アルファスルホ脂肪酸エステルナトリウム、直鎖アルキルベンゼンスルホン酸ナトリウム、アルキル硫酸エステルナトリウム、アルキルエーテル硫酸エステルナトリウム、アルファオレフィンスルホン酸ナトリウム、アルキルスルホン酸ナトリウムを使用してもよい。また、両性イオン系界面活性剤、例えば、アルキルアミノ脂肪酸ナトリウム、アルキルベタイン、アルキルアミンオキシドを使用してもよい。また、陽イオン系界面活性剤、例えば、アルキルトリメチルアンモニウム塩、ジアルキルトリメチルアンモニウム塩を使用してもよい。また、上記した各種の界面活性剤を混合して使用してもよい。
【0065】
<実施例2>
上記の実施例1においては、一般的な光散乱粒子計測装置1及び、比濁計測装置21を用いて、試料とAL試薬の混和液に対してTween20やTriton X-100などの界面活性剤を添加する例について説明したが、本発明を実施するために、試料とAL試薬の混和液に対して自動的にTweenやTriton Xなどの界面活性剤を添加する
特別な光散乱粒子計測装置及び、比濁計測装置を用いることとしてもよい。
【0066】
図12には、試料とAL試薬の混和液に対してTweenやTriton Xなどの界
面活性剤を自動的に添加する界面活性剤添加装置13を備えた光散乱粒子計測装置31について示す。図2で説明した光散乱粒子計測装置1との相違点は、界面活性剤貯留部13aと、界面活性剤添加管13bを有している点である。この界面活性剤貯留部13aには、測定に先立ち、TweenやTriton Xなどの界面活性剤を精密に測定された量
だけ貯留しておく。そして、測定時に試料とAL試薬の混和液が測定位置にセットされた
際に、図示しないスイッチがONされ、例えば小型ポンプ13cによって、界面活性剤貯留部13aに空気圧が作用する。そして、界面活性剤貯留部13aに貯留されたTweenやTriton Xなどの界面活性剤が、界面活性剤添加管13bを介してキュベット
内に添加される。
【0067】
本実施例によれば、より簡単に、混和液を攪拌する場合に生じる、エンドトキシンに由来しない凝集を低減することができ、エンドトキシン測定の測定精度を向上することができる。上記の界面活性剤添加装置13は界面活性剤添加手段に相当する。
【0068】
なお、本実施例における界面活性剤添加装置13は、上記の構成によるものに限定されないことは当然である。例えば、精密に吐出量を制御可能な液体吐出装置によって、TweenやTriton Xなどの界面活性剤を、測定時に試料とAL試薬の混和液が測定
位置にセットされた際に、吐出するようにしてもよい。あるいは、TweenやTriton Xなどの界面活性剤を必要量吸い上げたスポイト、あるいはピペットをセットして
おき、それらの可撓性のポンプ部を圧縮することで、TweenやTriton Xなど
の界面活性剤を、ガラス製試料セル4内の混和液に添加するようにしてもよい。
【0069】
なお、TweenやTriton Xなどの界面活性剤を試料とAL試薬の混和液に添
加するタイミングは、攪拌子11による攪拌が開始する前であることが望ましい。これによって、より確実に、混和液を攪拌する場合に生じる、エンドトキシンに由来しない凝集を抑制することができる。しかしながら、攪拌子11による攪拌の開始と同時あるいは、攪拌が開始した後であっても、TweenやTriton Xなどの界面活性剤を試料と
AL試薬の混和液に添加することで、エンドトキシンに由来しない凝集を抑制する効果は得ることができる。
【0070】
図13には、同様に、試料とAL試薬の混和液に対してTweenやTriton X
などの界面活性剤を自動的に添加する界面活性剤添加装置33を備えた比濁計測装置41について示す。図11で説明した比濁計測装置21との相違点は、シリンジ33a、ピストン33b及びピストン押圧部33cからなる界面活性剤添加装置33を有している点である。ここでは、シリンジ33aには、TweenやTriton Xなどの界面活性剤
が必要量吸い上げられている。そして、測定時に試料とAL試薬の混和液を保持するキュベット22が測定位置にセットされた際に、図示しないスイッチがONされ、ピストン押圧部33cがピストン33bを押圧し、シリンジ33a内のTweenやTriton
Xなどの界面活性剤が、キュベット22内に添加される。このような比濁計測装置41によっても、より簡単に、混和液を攪拌する場合に生じる、エンドトキシンに由来しない凝集を低減することができ、エンドトキシン測定の測定精度を向上することができる。
【0071】
なお、本実施例における界面活性剤添加装置33も、上記の構成によるものに限定されないことは当然であり、同等の機能を有するものであれば、いかなる装置を使用してもよい。
【符号の説明】
【0072】
1・・・光散乱粒子計測装置
2・・・光源
3・・・入射光学系
4・・・試料セル
5・・・出射光学系
6・・・受光素子
7・・・増幅回路
8・・・ノイズ除去フィルタ
9・・・演算装置
10・・・表示器
11・・・攪拌子
12・・・攪拌器
13・・・界面活性剤添加装置
21・・・比濁計測装置
22・・・ガラス容器(キュベット)
23・・・攪拌子
24・・・攪拌器
24a・・・モータ
24b・・・磁石
25・・・保温器
25a・・・入射孔
25b・・・出射孔
26・・・光源
27・・・アパーチャ
28・・・アパーチャ
29・・・受光素子
30・・・演算装置
31・・・界面活性剤添加装置を備えた光散乱粒子計測装置
33・・・界面活性剤添加装置
41・・・界面活性剤添加装置を備えた比濁計測装置
【特許請求の範囲】
【請求項1】
カブトガニの血球抽出物であるALと所定の生物由来の生理活性物質を含む試料の混和液を生成し、該混和液を攪拌しつつ、該混和液におけるALと前記生理活性物質との反応に起因する蛋白質の凝集またはゲル化を検出することで、前記試料中の前記生理活性物質を検出しまたは前記生理活性物質の濃度を測定する、生物由来の生理活性物質の測定方法であって、
前記攪拌をする際には、前記混和液に、所定の界面活性剤を添加することで、前記混和液における前記生理活性物質に由来しない凝集またはゲル化を抑制することを特徴とする生物由来の生理活性物質の測定方法。
【請求項2】
前記所定の界面活性剤は、非イオン系界面活性剤であることを特徴とする請求項1に記載の生物由来の生理活性物質の測定方法。
【請求項3】
前記所定の界面活性剤は、Tween、Triton X、Pluronic、ポリオ
キシエチレンソルビタンモノラウレート、ポリオキシエチレンソルビタンモノパルミテート、ポリオキシエチレンソルビタンモノステアレート、ポリオキシエチレンソルビタンモノオレエート、ポリオキシエチレンソルビタントリオレエート、ポリオキシエチレン−p−イソオクチルフェノール、ポリエチレンオキシド/ポリプロピレンオキシドブロックポリマー、しょ糖脂肪酸エステルソルビタン脂肪酸エステル、ポリオキシエチレンソルビタン脂肪酸エステル、脂肪酸アルカノールアミド、ポリオキシエチレンアルキルエーテル、ポリオキシエチレンアルキルフェニルエーテルのうちの一種、あるいは二種以上を含むことを特徴とする請求項1に記載の生物由来の生理活性物質の測定方法。
【請求項4】
前記混和液に、所定の界面活性剤を添加する際の最終濃度は、0.0001%以上10%以下であることを特徴とする請求項1から3のいずれか一項に記載の生物由来の生理活性物質の測定方法。
【請求項5】
前記生物由来の生理活性物質は、エンドトキシンまたはβ−D−グルカンであることを特徴とする請求項1から4のいずれか一項に記載の生物由来の生理活性物質の測定方法。
【請求項6】
カブトガニの血球抽出物であるALを含み、所定の生物由来の生理活性物質を含む試料との混和液を生成し、該混和液を攪拌しつつ、前記生理活性物質に起因する蛋白質の凝集またはゲル化を検出することで、前記試料中の前記生理活性物質を検出しまたは前記生理活性物質の濃度を測定するための、生物由来の生理活性物質の測定用試薬であって、
所定の界面活性剤が添加され、前記混和液における前記生理活性物質に由来しない凝集またはゲル化を抑制可能としたこと特徴とする生物由来の生理活性物質の測定用試薬。
【請求項7】
前記所定の界面活性剤は、非イオン系界面活性剤であることを特徴とする請求項6に記載の生物由来の生理活性物質の測定用試薬。
【請求項8】
前記所定の界面活性剤は、Tween、Triton X、Pluronic、ポリオ
キシエチレンソルビタンモノラウレート、ポリオキシエチレンソルビタンモノパルミテート、ポリオキシエチレンソルビタンモノステアレート、ポリオキシエチレンソルビタンモノオレエート、ポリオキシエチレンソルビタントリオレエート、ポリオキシエチレン−p−イソオクチルフェノール、ポリエチレンオキシド/ポリプロピレンオキシドブロックポリマー、しょ糖脂肪酸エステルソルビタン脂肪酸エステル、ポリオキシエチレンソルビタン脂肪酸エステル、脂肪酸アルカノールアミド、ポリオキシエチレンアルキルエーテル、ポリオキシエチレンアルキルフェニルエーテルのうちの一種、あるいは二種以上を含むことを特徴とする請求項6に記載の生物由来の生理活性物質の測定用試薬。
【請求項9】
所定の生物由来の生理活性物質を含む試料とカブトガニの血球抽出物であるALとの混和液を光の入射が可能な状態に保持するとともに該混和液における反応を進行させる混和液保持手段と、
前記混和液保持手段中の前記混和液を攪拌する攪拌手段と、
前記混和液保持手段中の混和液に光を入射する光入射手段と、
前記入射光の前記混和液における透過光または散乱光を受光し電気信号に変換する受光手段と、
前記受光手段において変換された電気信号から前記試料中における前記生理活性物質とALとの反応開始時刻を判定する判定手段と、
予め定められた、前記反応開始時刻と前記生理活性物質の濃度との関係より、前記試料中の前記生理活性物質の存在または濃度を導出する導出手段と、を備える生物由来の生理活性物質の測定装置であって、
前記攪拌手段によって、前記混和液を攪拌する際に、所定の界面活性剤を前記混和液に添加する界面活性剤添加手段をさらに備えることを特徴とする生物由来の生理活性物質の測定装置。
【請求項10】
前記界面活性剤添加手段によって添加される界面活性剤は、非イオン系界面活性剤であることを特徴とする請求項9に記載の生物由来の生理活性物質の測定装置。
【請求項11】
前記界面活性剤添加手段によって添加される界面活性剤は、Tween、Triton
X、Pluronic、ポリオキシエチレンソルビタンモノラウレート、ポリオキシエ
チレンソルビタンモノパルミテート、ポリオキシエチレンソルビタンモノステアレート、ポリオキシエチレンソルビタンモノオレエート、ポリオキシエチレンソルビタントリオレエート、ポリオキシエチレン−p−イソオクチルフェノール、ポリエチレンオキシド/ポリプロピレンオキシドブロックポリマー、しょ糖脂肪酸エステルソルビタン脂肪酸エステル、ポリオキシエチレンソルビタン脂肪酸エステル、脂肪酸アルカノールアミド、ポリオキシエチレンアルキルエーテル、ポリオキシエチレンアルキルフェニルエーテルのうちの一種、あるいは二種以上を含むことを特徴とする請求項9に記載の生物由来の生理活性物質の測定装置。
【請求項12】
前記界面活性剤添加手段によって、前記混和液に所定の界面活性剤を添加する際の最終濃度は、0.0001%以上10%以下であることを特徴とする請求項9から11のいずれか一項に記載の生物由来の生理活性物質の測定装置。
【請求項13】
前記生物由来の生理活性物質は、エンドトキシンまたはβ−D−グルカンであることを特徴とする請求項9から12のいずれか一項に記載の生物由来の生理活性物質の測定装置。
【請求項1】
カブトガニの血球抽出物であるALと所定の生物由来の生理活性物質を含む試料の混和液を生成し、該混和液を攪拌しつつ、該混和液におけるALと前記生理活性物質との反応に起因する蛋白質の凝集またはゲル化を検出することで、前記試料中の前記生理活性物質を検出しまたは前記生理活性物質の濃度を測定する、生物由来の生理活性物質の測定方法であって、
前記攪拌をする際には、前記混和液に、所定の界面活性剤を添加することで、前記混和液における前記生理活性物質に由来しない凝集またはゲル化を抑制することを特徴とする生物由来の生理活性物質の測定方法。
【請求項2】
前記所定の界面活性剤は、非イオン系界面活性剤であることを特徴とする請求項1に記載の生物由来の生理活性物質の測定方法。
【請求項3】
前記所定の界面活性剤は、Tween、Triton X、Pluronic、ポリオ
キシエチレンソルビタンモノラウレート、ポリオキシエチレンソルビタンモノパルミテート、ポリオキシエチレンソルビタンモノステアレート、ポリオキシエチレンソルビタンモノオレエート、ポリオキシエチレンソルビタントリオレエート、ポリオキシエチレン−p−イソオクチルフェノール、ポリエチレンオキシド/ポリプロピレンオキシドブロックポリマー、しょ糖脂肪酸エステルソルビタン脂肪酸エステル、ポリオキシエチレンソルビタン脂肪酸エステル、脂肪酸アルカノールアミド、ポリオキシエチレンアルキルエーテル、ポリオキシエチレンアルキルフェニルエーテルのうちの一種、あるいは二種以上を含むことを特徴とする請求項1に記載の生物由来の生理活性物質の測定方法。
【請求項4】
前記混和液に、所定の界面活性剤を添加する際の最終濃度は、0.0001%以上10%以下であることを特徴とする請求項1から3のいずれか一項に記載の生物由来の生理活性物質の測定方法。
【請求項5】
前記生物由来の生理活性物質は、エンドトキシンまたはβ−D−グルカンであることを特徴とする請求項1から4のいずれか一項に記載の生物由来の生理活性物質の測定方法。
【請求項6】
カブトガニの血球抽出物であるALを含み、所定の生物由来の生理活性物質を含む試料との混和液を生成し、該混和液を攪拌しつつ、前記生理活性物質に起因する蛋白質の凝集またはゲル化を検出することで、前記試料中の前記生理活性物質を検出しまたは前記生理活性物質の濃度を測定するための、生物由来の生理活性物質の測定用試薬であって、
所定の界面活性剤が添加され、前記混和液における前記生理活性物質に由来しない凝集またはゲル化を抑制可能としたこと特徴とする生物由来の生理活性物質の測定用試薬。
【請求項7】
前記所定の界面活性剤は、非イオン系界面活性剤であることを特徴とする請求項6に記載の生物由来の生理活性物質の測定用試薬。
【請求項8】
前記所定の界面活性剤は、Tween、Triton X、Pluronic、ポリオ
キシエチレンソルビタンモノラウレート、ポリオキシエチレンソルビタンモノパルミテート、ポリオキシエチレンソルビタンモノステアレート、ポリオキシエチレンソルビタンモノオレエート、ポリオキシエチレンソルビタントリオレエート、ポリオキシエチレン−p−イソオクチルフェノール、ポリエチレンオキシド/ポリプロピレンオキシドブロックポリマー、しょ糖脂肪酸エステルソルビタン脂肪酸エステル、ポリオキシエチレンソルビタン脂肪酸エステル、脂肪酸アルカノールアミド、ポリオキシエチレンアルキルエーテル、ポリオキシエチレンアルキルフェニルエーテルのうちの一種、あるいは二種以上を含むことを特徴とする請求項6に記載の生物由来の生理活性物質の測定用試薬。
【請求項9】
所定の生物由来の生理活性物質を含む試料とカブトガニの血球抽出物であるALとの混和液を光の入射が可能な状態に保持するとともに該混和液における反応を進行させる混和液保持手段と、
前記混和液保持手段中の前記混和液を攪拌する攪拌手段と、
前記混和液保持手段中の混和液に光を入射する光入射手段と、
前記入射光の前記混和液における透過光または散乱光を受光し電気信号に変換する受光手段と、
前記受光手段において変換された電気信号から前記試料中における前記生理活性物質とALとの反応開始時刻を判定する判定手段と、
予め定められた、前記反応開始時刻と前記生理活性物質の濃度との関係より、前記試料中の前記生理活性物質の存在または濃度を導出する導出手段と、を備える生物由来の生理活性物質の測定装置であって、
前記攪拌手段によって、前記混和液を攪拌する際に、所定の界面活性剤を前記混和液に添加する界面活性剤添加手段をさらに備えることを特徴とする生物由来の生理活性物質の測定装置。
【請求項10】
前記界面活性剤添加手段によって添加される界面活性剤は、非イオン系界面活性剤であることを特徴とする請求項9に記載の生物由来の生理活性物質の測定装置。
【請求項11】
前記界面活性剤添加手段によって添加される界面活性剤は、Tween、Triton
X、Pluronic、ポリオキシエチレンソルビタンモノラウレート、ポリオキシエ
チレンソルビタンモノパルミテート、ポリオキシエチレンソルビタンモノステアレート、ポリオキシエチレンソルビタンモノオレエート、ポリオキシエチレンソルビタントリオレエート、ポリオキシエチレン−p−イソオクチルフェノール、ポリエチレンオキシド/ポリプロピレンオキシドブロックポリマー、しょ糖脂肪酸エステルソルビタン脂肪酸エステル、ポリオキシエチレンソルビタン脂肪酸エステル、脂肪酸アルカノールアミド、ポリオキシエチレンアルキルエーテル、ポリオキシエチレンアルキルフェニルエーテルのうちの一種、あるいは二種以上を含むことを特徴とする請求項9に記載の生物由来の生理活性物質の測定装置。
【請求項12】
前記界面活性剤添加手段によって、前記混和液に所定の界面活性剤を添加する際の最終濃度は、0.0001%以上10%以下であることを特徴とする請求項9から11のいずれか一項に記載の生物由来の生理活性物質の測定装置。
【請求項13】
前記生物由来の生理活性物質は、エンドトキシンまたはβ−D−グルカンであることを特徴とする請求項9から12のいずれか一項に記載の生物由来の生理活性物質の測定装置。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【公開番号】特開2012−215461(P2012−215461A)
【公開日】平成24年11月8日(2012.11.8)
【国際特許分類】
【出願番号】特願2011−80714(P2011−80714)
【出願日】平成23年3月31日(2011.3.31)
【出願人】(000163006)興和株式会社 (618)
【Fターム(参考)】
【公開日】平成24年11月8日(2012.11.8)
【国際特許分類】
【出願日】平成23年3月31日(2011.3.31)
【出願人】(000163006)興和株式会社 (618)
【Fターム(参考)】
[ Back to top ]

