生細胞、生細胞内の構造物等の単離及び採取方法
【課題】 本発明の目的は、多量の水分を含む標本中に低密度で分布する標的生細胞または細胞内構造物(標的部位)を標本から正確に単離し、かつこの単離された標的部位のみを正確に採取する技術を提供することにある。
【解決手段】 本発明は、標的生細胞または細胞内構造物を含む標本を作製する工程と、前記標本に液透過性を付与し、前記標本内の含水量を制御する工程と、前記標本に対してレーザーを照射し、前記標的生細胞または細胞内構造物を前記標本から切り離す工程と、を含む、標的生細胞または細胞内構造物の単離方法を提供する。
【解決手段】 本発明は、標的生細胞または細胞内構造物を含む標本を作製する工程と、前記標本に液透過性を付与し、前記標本内の含水量を制御する工程と、前記標本に対してレーザーを照射し、前記標的生細胞または細胞内構造物を前記標本から切り離す工程と、を含む、標的生細胞または細胞内構造物の単離方法を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生細胞、生細胞内の構造物等の単離及び採取方法に関する。
【背景技術】
【0002】
現在、病理学や分子生物学の分野では、生きている細胞(生細胞)または生きている細胞内に存在する様々な細胞内小器官(細胞内構造物)の挙動を解析することに研究の関心が集まっている。生細胞または細胞内構造物を直接解析することによって、細胞内で起こる病理メカニズムをより厳密に解析することができる。
【0003】
一方、採取された病理組織片は、実際には多くの正常細胞や解析対象外の細胞によって構成された非常に不均一な集合体であり、研究対象となる病変細胞(標的細胞)は極少数に限られる。この病理組織片内に低密度で分布する標的細胞を採取する方法としては、レーザーマイクロダイセクション法(LMD法)が有効である。LMD法は、顕微鏡にレーザー照射装置が接続された機器を使用して、顕微鏡下で組織片を観察しながら、高出力レーザーによって標的細胞を組織片から切り離す技術である(特許文献1〜3)。LMD法は、正常細胞と標的細胞が混在する病理組織片から標的細胞のみを単離することができるので、病原遺伝子の発現解析にとって極めて強力な技術であり、レーザキャプチャーマイクロダイゼクション(LCM)とも呼ばれている。
【0004】
ここで、切り離された標的細胞の採取方法が重要になってくる。標的細胞の採取方法としては、例えば、熱塑性フィルムを貼り付けた透明キャップを押し付ける方法(特許文献1)、ゼラチンコートされたスライドガラスを使用する方法(特許文献2)がある。また、LMDの時点で標的細胞の周辺部位を大きく取り除き、正確な採取を実現する方法が開示されている(特許文献3)。
【特許文献1】特開2000−266649号公報
【特許文献2】特開2002−156316号公報
【特許文献3】特許第3820227号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
しかし、多量の水分を含む生細胞に高出力レーザーを照射すると、水分がアブレーション効果によって急激な速度で蒸発飛散し、レーザー照射部位における正確な切断ができなくなる。上述した特許文献1〜3のLMD法は、すべて乾燥させた組織標本においてのみ適用可能であり、多量の水分を含む生細胞または細胞内構造物の単離には適用することができない。
【0006】
また、たとえ標的生細胞の輪郭から十分に距離をとってレーザーでトリミングしたとしても、多量の水分を含む生細胞は、一般に付着力が弱い傾向にあり、例えば、特許文献1および2に記載された方法での採取は難しい。また、そもそも、十分に距離をとってレーザーでトリミングした場合、多量の不純物が混入してしまう。特に、微小な細胞内構造物のみをターゲットに定めている場合、この問題はいっそう深刻になる。一方、特許文献3の方法は、周辺部位に多数の標的生細胞が散在している場合は採取効率が悪いので適用が困難である。
【0007】
本発明の目的は、多量の水分を含む標本中に低密度で分布する標的生細胞または細胞内構造物(標的部位)を標本から正確に単離し、かつこの単離された標的部位のみを正確に採取する技術を提供することにある。
【課題を解決するための手段】
【0008】
即ち、本発明は、標的生細胞または細胞内構造物を含む標本を作製する工程と、前記標本に液透過性を付与し、前記標本内の含水量を制御する工程と、前記標本に対してレーザーを照射し、前記標的生細胞または細胞内構造物を前記標本から切り離す工程と、を含む、標的生細胞または細胞内構造物の単離方法を提供する。ここで、前記含水量を制御する工程が、半乾燥状態の標本を得る工程を含むことにより、アブレーション時の不都合を好適に回避できる。前記含水量を制御する工程が、細胞膜に多数の微細孔を形成させる薬剤を前記標本に添加し、細胞内の液状成分を取り出すようなセミインタクト化を行う工程と、前記セミインタクト化された各細胞内の液状成分を細胞外に流出させる工程と、を含むことにより、細胞外のみでなく細胞内の含水量も適切に制御でき、より正確な単離が可能となる。前記切り離す工程が、前記標的生細胞または細胞内構造物に予め組み込まれた光マーカー物質からの光を発生させる工程と、前記光マーカー物質の発光に基づいてダイセクション箇所を決定する工程と、前記標本に対してレーザーを照射し、前記標的生細胞または細胞内構造物を前記標本から切り離す工程と、を含むことにより、観察している最中の所望の単離対象を光マーカで確認しながら容易に単離操作できる。前記標本を作製する工程は、前記標的生細胞または細胞内構造物に光マーカー遺伝子を組み込み、可視化する工程を含むことにより、遺伝学的活性を生きたまま単離操作できる。ここで、光マーカー物質を発光させる工程が、前記切り出し工程とは異なる波長の励起用光源(レーザーまたは水銀ランプスペクトル光等)であることにより、互いに光学的な干渉を受けずに同時操作できる。
【0009】
また、本発明の採取方法は、標的細胞または細胞内構造物を含む標本を作製する工程と、前記標本の含水量を制御する工程と、平坦な先端部を有する細径の採取棒を、レーザーによって切り離された標的生細胞または細胞内構造物に押し付ける工程と、前記平坦な先端部に付着した前記標的生細胞または細胞内構造物を、溶液の入った回収用容器内で遊離させる工程と、を含むことを特徴とする。
【0010】
また、本発明の採取方法は、標的細胞または細胞内構造物を含む標本を作製する工程と、前記標本の含水量を制御する工程と、前記標本に対してレーザーを照射し、前記標的細胞または細胞内構造物を前記標本から切り離す工程と、を含む、標的細胞または細胞内構造物の単離方法である。ここで、前記標本が予め凍結ないし乾燥処理されており、含水量を制御する工程が、凍結が解凍されて生じる融解液ないし乾燥状態から復元するための溶解液により、一旦、含水量を充分増加させた後に、低度の乾燥状態になるまで含水量を低減させることにより、培養細胞以外の各種保存状態の細胞にも本発明を適用できる。
【発明の効果】
【0011】
本発明の標的生細胞または細胞内構造物の単離方法によって、多量の水分を含む標本中に低密度で分布する標的生細胞または細胞内構造物を標本から正確に単離し、かつこの単離された標的部位のみを正確に採取することができる。
【発明を実施するための最良の形態】
【0012】
以下、図面を用いて本発明の実施態様について説明する。なお、以下に示す実施態様は、本発明の構成を詳細に説明するために例示的に示したものに過ぎない。従って、本発明は、以下の実施態様に記載された説明に基づいて限定解釈されるべきではない。本発明の範囲には、特許請求の範囲に記載された発明の範囲内にある限り、以下の実施態様の種々の変形、改良形態を含む全ての実施態様が含まれる。
【0013】
<第1の実施態様>
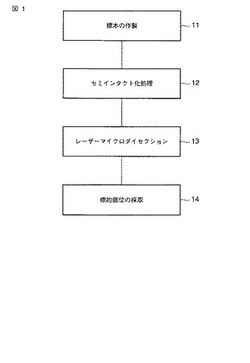
図1
図1は、第1の実施態様における方法を示したフローチャート図である。
【0014】
第1に、標的生細胞または細胞内構造物を含む標本を作製する(11)。
【0015】
「標的生細胞」とは、生きている細胞を意味する(以下、単に「標的細胞」ともいう)。標的細胞には、これらに限定されないが、任意の生物種または生体部位から入手可能な、病理組織片中に低密度で分散する各種異常細胞が含まれる。例えば、組織片の場合、組織片全体には多くの正常細胞が混在し、例えば特定の腫瘍細胞に特異的な遺伝子発現解析を行うためには、腫瘍組織片から目的の腫瘍細胞のみを採取する必要がある。なお、「標本」とは、病理組織片または組織片を解体して得た細胞分散系を意味する。
【0016】
「細胞内構造物」とは、細胞内凝集体や各種の細胞内小器官を意味する。細胞内小器官には、LMDが適用可能な任意の物質を含み、例えば、核、ミトコンドリア、リソソーム、小胞体、ゴルジ装置等の膜系構造体が含まれる。
【0017】
また、前記標本を作製する工程は、前記標的生細胞または細胞内構造物(以下、「標的部位」ともいう)に光マーカー遺伝子を組み込み、可視化する工程を含んでいてもよい。光マーカー物質によって標的部位を可視化することによって、以降のレーザーマイクロダイセクション処理において、標的部位のみを標本から確実かつ正確に切り出すことができる。
【0018】
光マーカー物質は後述する実施例のように、励起光により蛍光を発する蛍光タンパク質、例えばGFPが有用である。実施例で使用したGFPは、詳しくはクローンテック社製ベクターである、pEGFP-N1で、励起波長が488nmである。なお、光マーカー遺伝子には、酵素基質溶液などの化学的励起剤により光を発する発光タンパク遺伝子が含まれる。また、生物発光エネルギー共鳴転移(BRET)による蛍光を、蛍光タンパク遺伝子および/または発光タンパク遺伝子により発生させる場合も含まれる。なお、可視化という点では、蛍光マーカー遺伝子を組み込み可視化するだけでなく、目的のタンパク質と特異性を持った抗体に蛍光標識した二次抗体を反応させ(蛍光抗体法)、可視化させることも可能である。そして、蛍光抗体法によって標識された標的部位にLMD処理を行うことができる。
【0019】
第2に、標的生細胞または細胞内構造物を含む標本に液透過性を付与する(12)。
【0020】
「液透過性を付与する」とは、標本を構成する各細胞の細胞膜を、前記各細胞内の液状成分が細胞外に流出可能な状態に誘導することを意味する。液透過性を付与された細胞膜は、細胞内の液状成分の透過を許容するが、細胞内の細胞内構造物の透過を阻害する。従って、細胞内構造物は細胞内にインタクト(無傷に)とどまり、各種流動性の微小蛋白(グロブリン等)を含むような液状成分のみを流出させることができる。この技術は、一般には「セミインタクト」と呼ばれている。セミインタクト化された細胞(セミインタクト細胞)は、可溶性成分(イオンやタンパク質など)を含む液状成分を自由に出入りさせることができる一方、細胞膜、細胞骨格、細胞内オルガネラ間の相対的位置、つまり細胞内のトポロジーが保持された細胞である。セミインタクト細胞を用いることにより、タンパク質の機能や動態の解析を、タンパク質が本来機能する場所や空間において調べられる一方、「細胞を1個の試験管」に見立て、細胞質成分・低分子阻害剤等を除去または添加するような、生化学的な解析を効率的に行うことが可能となる。第1の実施態様では、この「セミインタクト」技術を、細胞内試験管としてではなく、標的生細胞または細胞内構造物を含む標本内の含水量を制御するための技術として使用する。
【0021】
一般に、標本のセミインタクト化は、細胞膜に透過性を付与する薬剤を前記標本に添加することによって行われる。細胞膜に液透過性を付与する薬剤としては、細胞に一つまたは複数の溶解孔を形成することのできる孔形成剤であるところの、チオール活性化溶血毒(thiol or sulfhydryl - activated toxins)、酸素感受性溶血毒(oxygen labile, oxygen sensitive hemolysin)と総称される細菌毒素が挙げられる。特に好ましくは、ストレプトリシンO(storeptolysin O)SLOが使用されるが、他にも使用可能な薬剤として、αHL、エアロリシン(aerolysin)、パーフリンゴリシン(perfringolysin)、ニューモリシン(pneumolysin)、リステリオリシン(listeriolysin)、バチルス・チューリンゲンシス(Bacillus thuringensis)毒素などの細菌外毒素、またはヘモリシン(hemolysin)やコリシン(colicin)のような大腸菌由来溶解性分子、またはデフェンシン(defensin)、マガイニン(magainin)、メリチン(mellitin)、コンプルメント(complement)、パーフォリン(perforin)、酵母キラー毒素(yeast killer toxin)、ヒストリシン(histolysin)のような真核細胞由来のものが挙げられる。本発明の方法は、特にこれら薬剤による化学的処理に限定されるわけではないが、例えば、ストレプトリシンOを添加し、標本を構成する各細胞をセミインタクト化することによって、細胞内の液状成分を排出させたり、生きたまま半乾燥状態を作り出したりすることができる。
【0022】
第3に、前記半乾燥状態の標本に対して高出力パルスレーザーを照射し、前記標的生細胞または細胞内構造物(標的部位)を前記標本から切り離す(13)。
【0023】
ここで使用する技術は、レーザーマイクロダイセクション(LMD)法である。LMD法は、顕微鏡にレーザー照射装置が接続された機器を使用して、顕微鏡下で組織片を観察しながら、組織片上の標的部位をレーザーによって特異的に切り出し、採取する方法である。LMD法は、正常細胞と病理細胞が混在する病理組織片から病理細胞のみを単離することができるので、病原遺伝子の発現解析にとって極めて強力な技術であり、レーザキャプチャーマイクロダイゼクション(LCM)とも呼ばれている。LMDに用いるレーザの波長および出力は公知であるので詳細な説明を省略する。
【0024】
LMD法を多量の水分を含む生細胞に適用すると、アブレーション効果によって水分が急激な速度で蒸発飛散し、レーザー照射部位における正確な切断ができなくなる。しかしながら、第1の実施態様では、セミインタクト化処理(12)によって標本が生きたまま半乾燥状態となっているので、アブレーション効果による水分の蒸発飛散が抑制され、LMD法による標的部位の正確な切り出しが可能になる。
【0025】
なお、一般に言われる「セミインタクト」の処理は、雑多な蛋白を含まない緩衝液等の交換用液体を元の細胞内液の代わりに含有させる工程を含んでいる。本発明においても、後述する実施例のように、適当な緩衝用バッファー溶液によりサイトソル成分等を洗い流すことで、細胞内構造物を保ったままの状態で細胞内に他の液体を収容させるようにしている。このように細胞内の液体を緩衝液等の他の液体と交換処理した場合にも、細胞の外側を半乾燥状態にすることにより、アブレーションによる上記作用効果を奏する。
【0026】
また、セミインタクト処理により細胞膜に生じた多数の微細孔を通じて、微細孔直径未満の蛋白質含有溶液を除去することにより、単離(または採取)時に余分な成分が残存する等の不都合を回避できるので作業の効率も高まる。さらに、セミインタクト処理による多数の微細孔が形成されたことにより、処理前の細胞よりも膨潤性が弱まって細胞内の液量が減るとともに、細胞内の液圧が外気圧に近づくので細胞膜が穿孔されても液体や細胞内構造物等が外部に吹き出すおそれが殆ど無くなるという作用効果も奏する。このように、生きた細胞から、ダメージなく所望の細胞内構造物のみを特異的に単離(または採取)可能な技術は存在しなかった。
【0027】
最後に、前記切り離された標的部位を採取する(14)。
【0028】
多量の水分を含む生細胞は、一般に付着力が弱い傾向にあり、採取が難しい。しかしながら、第1の実施態様では、セミインタクト化処理(12)後、レーザーマイクロダイセクション(13)によって切り出された標的部位は生きたまま半乾燥状態になっているので、標的部位の採取棒に対する付着性が良く、採取が容易になる。
【0029】
本発明者は、生きている標的部位の活性を損うことなく、いかに標的部位を採取するかについて鋭意研究を行ってきた。その結果、既存の採取方法とは全く異なる採取方法を開発するに至った。第1の実施態様における採取方法は、平坦な先端部を有する細径のガラス棒を、レーザーによって切り離された標的部位に押し付け、標的部位を前記平坦な先端部に付着させることによって、標的部位の活性を損なうことなく標的部位を採取する方法である。標的部位およびガラス管の先端部は画面上で容易に確認することができる。従って、標的部位のみの採取を正確かつ確実に行うことができる。
【0030】
図2
図2は、第1の実施態様におけるセミインタク化処理を行うための装置を模式的に示した図である。前記装置は、細胞膜に液透過性を付与する薬剤を格納した注入器21と、注入器21から射出された前記薬剤を、標的生細胞Aが播種・培養されたディッシュ22上に添加するマイクロピペッタ23と、マイクロピペッタ23によって吸引された培養液を回収するための回収用容器24、25と、これらの一連の操作を自動制御可能なCPU26により構成される。
【0031】
細胞膜に液透過性を付与する薬剤としては、特にこれに限定されるわけではないが、例えば、チオール活性化溶血毒(thiol 又は sulfhydryl - activated toxins)、酸素感受性溶血毒(oxygen labile, oxygen sensitive hemolysin)と総称される細菌毒素が挙げられる。なお、後述する実施例では、ストレプトリシンO(streptolysin O)(SLO)が有用であったが、対象となる細胞の種類ごとに最適な薬剤を選択したり、あるいは複数の異なる薬剤を組み合わせて使用するのが好ましい。
【0032】
図3
図3は、図2の装置を使用したセミインタクト化処理の手順を模式的に示した図である。先ず、標的生細胞Aが播種され、培養されたディッシュ22を用意する(図3a)。次に、注入器21に格納されたストレプトリンOをマイクロピペッタ23を使用して適量添加する(図3b)。ストレプトリシンOの添加量は、標本の種類によって異なるが、例えば1〜500ng/ml、好ましくは10〜100ng/ml、最も好ましくは40〜70ng/ml程度である。ストレプトリシンOに曝露された標的生細胞Aは液透過性を付与され、細胞内の液状成分を細胞外に流出可能な状態となる。続いて、マイクロピペッタ23を使用してディッシュ22内の培養液を吸引する(図3c)。このとき、液透過性を付与された標的生細胞Aの細胞膜から細胞内の液状成分が細胞外に流出し、前記培養液とともに吸引される。具体的には、サイトソル除去バッファを数回にわたってディッシュ22に添加し、インキュベーションおよび振盪によって液状成分を徐々に除去していく。標的生細胞AはストレプトリシンOの添加によってセミインタクト化され、その後の吸引操作によって液状成分を失うので、生きたまま半乾燥状態の標本となる。吸引された液状成分および培養液は四方バルブを通過して回収用容器24,25内に回収される。
【0033】
第1の実施態様では、標的生細胞Aの含水量は、例えば等張液等の自然環境中における標的生細胞Aの含水量に対して約50〜75重量%まで減少させることにより、半乾燥状態を生成できる。しかし、含水量を基準として計測するよりは、標本としての細胞表面が乾き始める状態を肉眼で確認することにより半乾燥状態かどうかを決定できる。好ましくは、複数の細胞が互いに離間するような分散状態で容器等の支持体上に載置されている場合には、注目する1以上の細胞の周縁部において支持体表面に何も水分が残っていない程度に乾いているか、たかだか細胞周縁部が若干乾き始めた状態を目安にすることができる。このような半乾燥状態は、画像による判定で実行してもよい。第1の実施態様では、このような低度の乾燥を示す半乾燥状態を作り出すことによって、細胞の活性を損なうことなく、かつ後工程のLMD法のアブレーション効果による水分の蒸発飛散を抑制することができる。例えば、SLOによるセミインタクト化は、上記含水量でいうと約60〜70%重量の低度の乾燥状態であるような生細胞が提供される。
【0034】
なお、説明の便宜上、標的生細胞Aのセミインタクト化について説明したが、実際にはセミインタクト化は標本全体で進行し、標的生細胞Aのみに限定されるものではない。
【0035】
図4
図4は、第1の実施態様におけるレーザーマイクロダイセクション(LMD)処理を行うためのLMD装置を模式的に示した図である。前記LMD装置は、標本に対してLMD処理を行うためのレーザー光学系41と、標本を観察するための観察用光学系42とで構成される。
【0036】
(レーザー光学系41)
照明用光源101から出力される可視光線は、視野絞り102、開口絞り103を通過し、ダイクロイックミラー104によって光軸pの下方に反射される。反射光は、レーザー用対物レンズ105に入り、集光されて標本Bに照射される。
【0037】
一方、UVレーザヘッド123内のレーザ光源123aから紫外領域の波長のパルスレーザビーム(以下、レーザビーム)が出力される。レーザビームは、可変スリット125およびUV結像レンズ124を通過し、レーザー用対物レンズ105に入り、標本Bに照射される。標本Bに照射されたレーザビームによって標的生細胞Aまたは細胞内構造物Cが切り出される。
【0038】
可変スリット125は、例えば円形または四辺形(例えば矩形)の開口部を有し、UVレーザヘッド123から出力されるレーザビームのスポットの形状および大きさを調節する。スリットの形状および大きさは適宜調節することができる。
【0039】
また、UVレーザヘッド123は、LED126を有する。LED126は、赤色のLED光を出力し、出力されたLED光は、ダイクロイックミラー127によって光軸p上に反射される。反射されたLED光は、標本Bにおけるレーザビームの照射位置と同一位置に照射される。標本B上に照射された赤色のLED光は、標本B上に照射するレーザビームの照射位置を表示する。
【0040】
なお、標本Bが入ったディッシュ108は、XYZ軸方向に駆動可能なステージ106上に載置され、標本B内に存在する標的生細胞Aおよび細胞内構造物Cを任意の場所に移動することができる。標的生細胞Aおよび細胞内構造物Cは、予め光マーカー物質によって標識し、標本B内における位置を可視化しておくとよい。その他、エアーブローおよびエアー吸引機などを標本B近傍に設置し、LMD処理後の標本の残骸等を処理してもよい。
【0041】
(観察用光学系42)
観察用対物レンズ110、ダイクロイックミラー111、UVバリアフィルタ112、結像レンズ113およびハーフミラー114が光軸p上に設けられている。
【0042】
標本Bからの反射光の一部はハーフミラー114を通過してミラー119で反射される。ミラー119で反射された光は、リレーレンズ120、UVカットフィルタ121および接眼レンズ122を通して観察者の視野に入る。一方、標本Bからの反射光の一部は、ハーフミラー114で反射され、CCDカメラ115に入る。CCDカメラ115は、結像レンズ113により結像された像を撮像して画像信号を出力する。
【0043】
画像処理およびステージ制御装置116は、CCDカメラ115から出力された画像信号から画像データを取得し、画像データをディスプレイ117に表示する。また、画像処理およびステージ制御装置116は、キーボートおよびマウスなどの操作部118が接続され、観察者によるステージ106の移動方向および移動量の操作指令を受信し、操作指令に従ったステージ106の移動制御信号をステージ駆動部109に送信する。
【0044】
また、光マーカー物質で標識された標的生細胞Aおよび細胞内構造物Cを可視化するための励起手段が設けられている。具体的には、蛍光励起用光源128およびUVバンドパスフィルタ129がダイクロイックミラー111の反射光路上に設けられ、蛍光励起用光源128から出力された励起光は、UVバンドパスフィルタ129を透過し、ダイクロイックミラー111で反射されて観察用対物レンズ110に入り、標本Bに照射される。蛍光励起用光源128から出力される励起光は、標的生細胞Aおよび細胞内構造物Cに予め標識された蛍光タンパクを励起する。ここで、透過照明光源101の光量を落として観察すると、明視野像として可視化されている細胞群の中で、光マーカーとしての蛍光タンパク遺伝子が組み込まれた細胞が光っていることを同時に観察できる。
【0045】
なお、図では観察光学系が標本の下側に配置する倒立型観察方法を採用しているが、レーザ光学系41と観察光学系42を上下反転した配置とする正立型観察方法を採用してもよい。
【0046】
図5
図5は、図4のLMD装置を使用して行われるLMDの様子を模式的に示した図である。観察者は、操作部118を操作し、ディスプレイ117に表示されている標本Bの画像とレーザビームの照射位置を示す色付け表示部とを確認しながら、LMD処理を行う。例えば、標的生細胞A内部の細胞内構造物Cを標的部位として標本Bから切り離す場合(図5a)、励起光で蛍光を発している細胞内構造物Cの周囲である上下左右に各1発ずつ矩形のレーザースポット51でレーザビームを照射する(図5b)。レーザーを照射された標本部位は消失して標的部位を囲む中央の領域のみが残存するので、細胞内構造物Cを標本Bから切り離すことができる。
【0047】
レーザースポット51は矩形である必要はなく、切り離す標的部位の形状および大きさに合わせて任意の形状とすることができる。例えば、様々な径の円形のレーザースポットでレーザビームを標的部位周囲で同様に照射することによって標的部位の輪郭に沿った正確な切断が可能になる。
【0048】
前述のレーザスポットにより囲まれる中央の領域の大きさは、1μm〜100μm、好ましくは5μm〜50μm、最も好ましくは7.5μm〜30μmの範囲内において、上下左右に照射するレーザスポット51の位置間隔を任意に変更することにより非照射部分の面積を連続的に変更することができ、これにより、標的部位の大きさに合せたスポッティングを適切に選択することができる。
【0049】
図6
図6は、第1の実施態様における採取処理を行うための採取装置を模式的に示した図である。
【0050】
前記採取装置は、操作アーム64と、前記操作アームの先端に取り付けられた採取手段63と、操作アーム64を任意の空間位置に移動可能な駆動手段とを具備する。
【0051】
採取手段63は、好ましくは操作アーム64の先端に鉛直方向に固定されている。また、採取手段63は、好ましくは平坦な先端部を有するガラス棒である。ガラス棒の平坦な先端部の直径は、1〜500μm、好ましくは5〜100μm、最も好ましくは10〜30μmである。
【0052】
前記駆動手段は、好ましくは採取部位を結像する撮像手段(カメラ)と、該カメラから出力された電気信号を画像データとして表示する画像表示手段(ディスプレイ)と、採取手段63を任意の位置に移動させる操作指令を入力する操作手段(コントローラ)と、操作指令に基づいて採取手段が固定された操作アームを駆動する駆動制御部とを具備する。
【0053】
前記採取装置はまた、標的部位を回収するための回収用容器62と、その固定手段65とを備えていてもよい。回収用容器62は透明容器であり、回収用容器62内に回収された標的部位を顕微鏡によって確認することができる。回収用容器62は、固定手段65によって固定される。
【0054】
回収用容器62の形状および大きさに特に制限はないが、一例として、PCRチューブのキャップ部をチューブ本体部から取りはずし、これを回収用容器として使用することができる。すなわち、PCRチューブのキャップ部を上向きに反転して固定することで、該キャップ内壁に形成される窪みに標的部位を回収する。この場合、回収後に、キャップ部とPCRチューブ本体部とを再接合することによってサンプリングが完了する。
【0055】
なお、本発明でPCRチューブのキャップ部を利用した背景として、(1)LDMの実作業は顕微鏡のステージ上で行われるため、対物レンズとステージの間の間隔が狭いため背の高いチューブ本体をステージ上に載置しにくい、(2)チューブ本体の底部は一般に細長い円錐形状であり曲率半径が小さい(1Rから3R)ので、ガラス棒の先端面に付着させた細胞等をステージ下側の対物からチューブの底部を透過して観察する場合、チューブ底の形状(曲率半径)によって収差が発生してしまい、付着しているかどうかを観察することができない、が挙げられる。これに対し、PCRチューブのキャップ部は、通常、十分な光透過性を有するプラスチック製であり、皿形状で背が低いためにステージ上への設置が容易で且つガラス棒の高さ移動を少なくできること、キャップ内壁の曲率半径が比較的大きいために、上記の収差が生じることなくガラス棒端面に付着した細胞等を観察可能であること、といった利点が有る。また、PCRチューブ全体としての特徴として、耐薬品性の材質であることと、採取した細胞等がチューブ内壁から剥がれ易いように付着防止用の表面処理が施されていることも利点として挙げられる。さらに、PCRチューブ本体部は遠心分離機等にセットするための形状を有しているので、回収後にキャップ部とチューブ本体部を再接合することにより、回収後の後処理へと迅速に続行することができるという利点も有る。
【0056】
図7
図7は、図6の固定手段65の線A-Aに沿った断面図である。固定手段65は、固定台71上に空洞部72および固定板73を備える。空洞部72にはめ込まれた回収用容器62は図中矢印方向に可動する固定板73によって固定される。空洞部72では、回収用容器の透明な底部が露出しているので、下方に設置された対物レンズによって回収用容器内の標的部位を確認することができる。なお、回収用容器62としてPCRチューブのキャップ部を使用する場合、標的部位の回収後、キャップ部にチューブ本体部を再接合することによって容易にサンプリングを完了することができる。
【0057】
なお、採取装置は、図4に示したLMD装置に付設させることによって、標的生細胞または細胞内構造物の単離および採取を一連の操作として行うことができる。採取装置をLMD装置に付設する場合、LMD装置の撮像手段(カメラ)、画像表示手段(ディスプレイ)および操作手段(コントローラ)を利用することができ、マニピュレータ(採取手段および駆動手段)のみを新たに設置すれば良く、コスト面で有利である。また、回収用容器62およびその固定手段65は、ステージ106上に設置すればよい。
【0058】
図8および図9
図8および図9は、図6および図7に示した採取装置を使用した標的部位の採取工程を模式的に示した図である。先ず、レーザー照射手段81によるマイクロダイセクション(LMD)処理によって、標本Bから標的生細胞A内の細胞内構造物Cがディッシュ108上で切り離される(図8a)。この細胞内構造物Cの上方に、先端が平坦なガラス棒63を移動させ、上方から細胞内構造物Cを押し付ける(図8b)。押し付けた後、ガラス棒63を上方に移動させると、ガラス棒の先端の平坦部に細胞内構造物Cが付着する(図8c)。次に、ガラス棒63を回収用容器62の上方に移動させ(図9d)、ガラス棒63を回収用容器62内に下降させる(図9e)。回収用容器62内には回収を容易にするための溶液(例えば、緩衝液)が微少量(例えば5から20μl)入っており、ガラス棒63を緩衝液中で下降させ、さらに回収用容器62の壁面(例えば底面)に対し、付着した細胞内構造物Cが破壊されない程度に軽く接触させる操作を適宜1回以上行うことにより、細胞内構造物Cがガラス棒の先端部から遊離する。細胞内構造物Cの遊離後にガラス棒63を上方に移動させ、サンプリングが完了する(図9f)。なお、採取手段としては、ガラス棒に限らず他の材質のものでも使用できる。また、採取手段はLMD装置を備えた各種顕微鏡装置に対して、マニュピレータ用の固定具及び3次元(xyz方向)駆動可能な操作つまみを介して取り付けることが可能であり、好ましくは、図4に図示されるように、LMD装置の対物レンズ等の光学系による光路から外れた位置となるように、斜めに傾けて標本B付近まで延長すると共に、採取棒の先端から約0.5〜3cmの長さ部分を上記光路と平行な軸(図では鉛直方向)に沿うような直線部分を設けることで、採取棒の先端面のみが観察されるようになり且つ標本Bへのアクセスを容易にすることが可能になる。
【0059】
図10および図11
図10および図11は、ディスプレイ上における標的部位の採取の様子を示した図である。
【0060】
ディスプレイ上には、標本Bが蛍光を発した状態で映し出されている。細胞内構造物Cを除く標的生細胞Aの各部位はLMD法によって除去され、細胞内構造物Cが標本Bから切り出されている(図10a)。細胞内構造物Cを採取するために、先端が平坦なガラス棒63を細胞内構造物Cの上方近傍まで移動させる。このとき、ガラス棒の先端部91がディスプレイ上に映し出されるので、容易に位置合わせをすることが可能である(図10b)。
【0061】
次に、ガラス棒の先端部91を細胞内構造物Cの上方からゆっくりと下降させることにより、細胞内構造物を破壊しない程度に容器底面に対し先端部91を押し付ける(図10c)。このとき、細胞内構造物Cは、上述したような半乾き状態でガラス棒の先端部91の中央付近に付着している。
【0062】
そして、ガラス棒63を上方に引き上げ、移動させると、ガラス棒の先端部91が移動したとき、細胞内構造物Cの蛍光画像が図示するように画面上から消えていれば(図11d)、細胞内構造物Cがガラス棒の先端部に付着し、且つ細胞外へ取り出されたことを確認することができる。このように細胞内構造物Cを細胞から取り出した後、この細胞内構造物Cをガラス棒先端部91に付着させたまま、所定の移送先へ向けてガラス棒63を移動し(図11e)、他の容器等に回収する。
【0063】
このように、操作者は、ディスプレイを見ながら採取手段を駆動(自動または手動)することにより、容易かつ確実に採取を実行できる。
【0064】
(第2の実施態様)
第2の実施態様における採取方法として、上述したLMD処理をした後にマニュピレータ型の吸引機を使用した採取方法が挙げられる。具体的には、3次元空間上の任意の位置に駆動制御可能な操作アームを備えたマニュピレータに吸引機(キュベット)を取り付けたものを使用する。生体標本に純水を滴下した上で、標本から切り離されたセミインタクト状態の標的細胞または細胞内構造物(標的部位)を顕微鏡で観察しながら、前記キュベットの吸引口を前記標的部位に近接させ、これを吸引する。その後、吸引した前記標的部位を緩衝液などが入ったPCR容器に吐出して回収する。
【0065】
(変形例)
第1の実施態様における「標本に液透過性を付与し、前記標本内の含水量を制御する工程」を、「標本の含水量を制御する工程」にまで拡張することによって、上述したセミインタクト化以外にも半乾燥状態を作り出し、水分を多量に含む死細胞についても本発明の方法を適用することができる。例えば、凍結保存された死細胞は多量の水分を含む。解凍時に死細胞の含水量を制御することによってLMD法が適用可能な死細胞を作製することができる。本発明において、半乾燥状態を得る方法としては、乾燥状態の気体を標本に吹き付けるエアドライ法や、容器等の標本用の各種支持体をヒータ加熱(但し、細胞を変質させない程度の高温)する加熱法等を利用できる。マイナス60度以下のような極低温で保存された生細胞(または生体組織)に同様に適用する場合には、生細胞のphを良好に保つような気体(例;炭酸ガス)環境下で含水量の制御を行うのが好ましい。従って、いったん凍結保存された病理組織片の解析についてもLMD法が適用可能になり、大量の病理組織片をいったん凍結保存し、後日、各病理組織片について網羅的に解析を進めることが可能になる。これとは逆に、凍結乾燥された細胞(または生体組織)に関して含水量を制御する場合には、一旦、充分量の溶解用溶液で細胞(または生体組織)を復元等して適宜蘇生させた後に、上述したような液透過性を付与する工程以降の処理を行うのが好ましい。
【実施例】
【0066】
実施例1
1.標的細胞へのプラスミドのトランスフェクション
<使用機器>
・CO2 INCUBATOR (ESPEC)
・50mm径、14mm測定ホールディッシュ(Mat Tek社 #P50G-O-14-F)
(ディッシュはあらかじめ、0.5mg/mlのPOLY-L-LYSINEでコートしておく)
<細胞、試薬等>
・細胞;マウス神経芽細胞腫Neuro-2a (ATCC # CCL-131)
・Plasmids;GFP-PrPc(Δ140-254)/pcDNA3.1
・Opti-MEM I(GIBCO #31985)
・LipofectAMINE2000(Invitrogen # 11668-019)
・抗生物質不含MEM培地(SIGMA # M5650)
・POLY-L-LYSINE(SIGMA # P6282)
<手順>
(1)培養細胞をディッシュにまく。
【0067】
(i)Transfection前日に、〜1500個/ディッシュとなるようマウス神経芽細胞腫Neuro-2a(N2a)細胞をまく。
【0068】
(ii)抗生物質不含MEM培地を3ml/ディッシュとなるよう入れ、CO2インキュベーターで37℃、24時間インキュベートする。(なお、この時点で30-50%コンフルになるよう、細胞をまいている)
(2)トランスフェクションを行う(*Lipofect AMINE2000付属のプロトコール通り)
(i)Lipofect AMINE2000 6μlにOpti-MEM I 300μlを加え、室温で10分インキュベートする。
【0069】
(ii)3μgのプラスミドに300μlのOpti-MEM Iを添加する。
【0070】
(iii)(i)および(ii)の両試薬を穏やかに混合し、室温で20分インキュベートする。
【0071】
(iv)20分のインキュベート中に培養細胞ディッシュの培地を新しい抗生物質不含MEM 3mlに交換する。
【0072】
(v)CO2インキュベーターで37℃、4時間インキュベートする。
【0073】
(vi)4時間後、新しい抗生物質不含MEM 3mlに交換し、CO2インキュベーターで37℃、24時間インキュベートする。
【0074】
2.ストレプトリシンO(streptolysin-O)によるセミインタクト化
<使用機器>
・Bouble Shaker NR-3 (TAITEC)
・Water Bath (TAITEC)
・LOW TEMP. INCUBATOR LTI-601SD(EYELA)
<細胞、試薬等>
・ガラスボトムdishに撒いた細胞
・streptolysin-O(SIGMA # S5265)
・5×KOAc Buffer(575mM KOAc, 125mM Hepes-KOH(ph7.4), 12.5mM MgCl2)
・1M DTT
・200mM EGTA
・サイトソル除去Buffer(1×KOAc Buffer, 1mM DTT 2mM EGTA)
・PBS(-)
<手順>
(1)10mM DTTを入れた1×KOAc Bufferに60ng/mlの濃度でストレプトリシンOを懸濁し、37℃のWater Bathで30分インキュベートする(ストレプトリシンOの活性化)。
【0075】
(使用直前に作る。間が空く時は4℃に置き、1時間以内に使う。小分けにして−80℃に保存可。)
(2)Activateした60ng/ml ストレプトリシンOを1.4ml/dishで添加し、4℃で10分インキュベートする。
【0076】
(3)ice-cold PBS(-)で2回washする。
【0077】
(4)あらかじめ37℃にしたサイトソル除去Bufferを3ml/dishで添加し、37℃で5分インキュベートする。
【0078】
(5)室温のサイトソル除去Bufferで2回washする。
【0079】
(6)室温のサイトソル除去Bufferを3ml/dishで添加し、室温で10分shake(30rpm/min)する。
【0080】
(7)室温のサイトソル除去Bufferで1回washする。
【0081】
(8)室温のサイトソル除去Bufferを3ml/dishで添加し、室温で10分shake(30rpm/min)する。
【0082】
(9)室温のPBS(-)で2回washする。
【0083】
3.半乾燥状態の作成
セミインタクト化後のディッシュをレーザーマイクロダイセクション装置(Laser System HCL-2100/HOYA)を備えた蛍光顕微鏡(蛍光顕微鏡IX71/OLYMPUS)の試料ステージに載置し、上述した半乾燥状態になるまで顕微鏡下の画像を目視判定した。
【0084】
4.レーザダイゼクション
上記の半乾燥状態になった時点で、所望の細胞を観察視野にステージ移動させ、蛍光画像をディスプレイ表示した。この状態で、細胞内でGFPにより光っているミトコンドリア凝集体を図4の説明と同様に操作してダイゼクションを行った。
【0085】
5.マニュピレータによる採取
上記ダイゼクション後の凝集体を図6〜図10で説明した方法および装置により採取を実行した。使用した具体的機器は、 (i) 「粗動用マニピュレーター ONM-1 /OLYMPUS・NARISHIGE JAPAN」、(ii) 「三次元ジョイスティック油圧マイクロマニピュレーター MNO-202N /NARISHIGE JAPAN」、(iii) 「Cell Tram Air 5176(一部使用) /eppendorf」である。先細ガラス棒は、先端より約2cmの部分が約120度の角度に折れ曲がり且つ下方に向けて直線形状の針となるように熱加工したものであり、上記LCM装置の上部対物レンズの側方位置に、手動で3次元微動操作が可能な市販のマニュピレータ用操作部ブロックに対し針部が鉛直となるように取り付けて、顕微鏡観察下で操作した。なお、細径ガラス棒の先端面に付着させる際、および回収用の容器へ離脱させる際は、適宜、ガラス棒の上下動作を繰り返すことで間違いなく採取されるのを画像上で追跡しながら進めた。ガラス棒への付着を終えた後の回収用容器は、市販のPCR用チューブ(BIO-BIK T-02)のキャップ部分を図6および図7に示した固定手段(発明者による製作)に固定し、5μlのPBS(SIGMA社 DULBECCO’S PHOSPHATE BUFFERED SALINE)を添加したものを使用した。この際、チューブ本体とキャップを連結するストラップ部は本体から切り離さずに固定し、固定した状態で、チューブ本体のみを指等で押し倒したり戻すようにしてキャップの開閉を行うことで、回収直後の回収容器の密閉を速やかに行った。
【0086】
3.結果
上記セミインタクト化によって半乾燥状態となったマウス神経芽細胞腫Neuro-2a内で形成された約5μm〜15μmの細胞内凝集体(GFP-PrPc(Δ140-254)およびミトコンドリアを含む)を、レーザーマイクロダイセクションにより正確に切り出すことができた。半乾燥状態は、細胞内構造物を光学的に観察するのに必要な液量を残しつつ、アブレーション時の水分蒸発を有効に低減する作用効果があるともいえる。これにより、生細胞内から目的の細胞内構造物を生きた状態の活性を維持しながら高精度に単離することができた。
【0087】
上記マニュピレータによる採取で回収された細胞内凝集体は、その後の分子生物学的な解析が可能であった。また、回収容器に収容した溶液内では、遊離した細胞内構造物C以外の物質(例えば細胞膜片)がガラス棒に付着していても別々に遊離されるか簡単に分別できるので、その後の使用に何ら支障が無かった。さらに、回収された細胞内凝集体からGFPによる蛍光が発していることが確認されたことから、生きた状態の活性を維持しながら正確な単離及び/または採取が可能であることが証明された。これら方法は、細胞内構造物について可能であることから、それよりも寸法が大きい細胞単体についても同様に適用できることはいうまでもない。また、形状が複雑な細胞(神経細胞、癌細胞等)や寸法が哺乳類より充分小さい各種細胞については、本発明の方法が有利である。
【0088】
他方、事前の検討において、マニュピレータ型の吸引機を用いてLMD処理後の細胞内構造物Cを吸引したところ吸引管内へ付着する場合があり回収し難かった。このため、あえてガラス製等の細径棒先端に付着させて採取する方法を採用して上記のように回収操作したことにより、所望の物質を確実かつ効率良く回収できた。
【0089】
このように本発明の方法は、細胞は勿論のこと、細胞内構造物を生きた活性を依然として維持しながら正確に単離および採取できることが確認できた。本発明の方法により採取された細胞または細胞内構造物等は、引き続き所定の容器内で前処理(可溶化、遠心分離等)され、各種解析(ウエスタンブロッティング、質量分析、2次元電気泳動、PCR反応等)することが可能である。また、細胞内構造物として細胞内で凝集体を形成するミトコンドリアを正確に単離および採取できたことにより、疾患関連凝集蛋白質構成成分の解析が本発明により初めて実現できるようになった。なお、実施例で扱ったPrPcはプリオン病関連蛋白(プリオン蛋白質)であり、本発明の方法(および上記説明による装置)が、神経学的な分子レベルの研究を生きた状態の活性を維持しながら行うことができ、研究、創薬、診断等の医療に大いに貢献できると期待される。
【0090】
以上、本発明を各種実施形態及び実施例に基づき説明したが、本発明はそれらに限定されることなく、上述した発明の主旨の範囲内において、種々の変更等が可能である。また、上記に説明した方法を実行するための装置も本発明に含まれ、これらも同様の主旨により種々変更等が可能である。さらに、上記に説明した方法を、上記方法を実行するための装置を用いて操作する操作方法または制御用プログラムも本発明に含まれる。
【図面の簡単な説明】
【0091】
【図1】第1の実施態様における方法を示したフローチャート図
【図2】第1の実施態様におけるセミインタク化処理を行うための装置を模式的に示した図
【図3】図2の装置を使用したセミインタクト化処理の手順を模式的に示した図
【図4】第1の実施態様におけるレーザーマイクロダイセクション(LMD)処理を行うためのLMD装置を模式的に示した図
【図5】図4のLMD装置を使用して行われるLMDの様子を模式的に示した図
【図6】第1の実施態様における採取処理を行うための採取システムを模式的に示した図
【図7】図6の固定手段65の線A-Aに沿った断面図
【図8】図6および図7に示した採取システムを使用した標的部位の採取工程を模式的に示した図
【図9】図6および図7に示した採取システムを使用した標的部位の採取工程を模式的に示した図
【図10】ディスプレイ上における標的部位の採取の様子を示した図
【図11】ディスプレイ上における標的部位の採取の様子を示した図
【符号の説明】
【0092】
11・・・標本の作製、12・・・セミインタクト化処理、13・・・レーザーマイクロダイセクション、14・・・標的部位の採取、21・・・注入器、22・・・ディッシュ、23・・・マイクロピペッタ、24、25・・・回収用容器、26・・・CPU、51・・・レーザースポット、62・・・回収用容器、63・・・ガラス棒、64・・・操作アーム、65・・・固定手段、71・・・固定台、72・・・空洞部、73・・・固定板、81・・・レーザー照射手段、91・・・ガラス棒の先端部、101・・・照明用光源、102・・・視野絞り、103・・・開口絞り、104・・・ダイクロイックミラー、105・・・レーザー用対物レンズ、106・・・ステージ、108・・・ディッシュ、109・・・ステージ駆動部、110・・・観察用対物レンズ、111・・・ダイクロイックミラー、112・・・UVバリアフィルタ、113・・・結像レンズ、114・・・ハーフミラー、115・・・CCDカメラ、116・・・画像処理およびステージ制御装置、117・・・ディスプレイ、118・・・操作部、119・・・ミラー、120・・・リレーレンズ、121・・・UVカットフィルタ、122・・・接眼レンズ、123・・・UVレーザヘッド、123a・・・レーザ光源、124・・・UV結像レンズ、125・・・可変スリット、126・・・LED、127・・・ダイクロイックミラー、A・・・標的生細胞、B・・・標本、C・・・細胞内構造物。
【技術分野】
【0001】
本発明は、生細胞、生細胞内の構造物等の単離及び採取方法に関する。
【背景技術】
【0002】
現在、病理学や分子生物学の分野では、生きている細胞(生細胞)または生きている細胞内に存在する様々な細胞内小器官(細胞内構造物)の挙動を解析することに研究の関心が集まっている。生細胞または細胞内構造物を直接解析することによって、細胞内で起こる病理メカニズムをより厳密に解析することができる。
【0003】
一方、採取された病理組織片は、実際には多くの正常細胞や解析対象外の細胞によって構成された非常に不均一な集合体であり、研究対象となる病変細胞(標的細胞)は極少数に限られる。この病理組織片内に低密度で分布する標的細胞を採取する方法としては、レーザーマイクロダイセクション法(LMD法)が有効である。LMD法は、顕微鏡にレーザー照射装置が接続された機器を使用して、顕微鏡下で組織片を観察しながら、高出力レーザーによって標的細胞を組織片から切り離す技術である(特許文献1〜3)。LMD法は、正常細胞と標的細胞が混在する病理組織片から標的細胞のみを単離することができるので、病原遺伝子の発現解析にとって極めて強力な技術であり、レーザキャプチャーマイクロダイゼクション(LCM)とも呼ばれている。
【0004】
ここで、切り離された標的細胞の採取方法が重要になってくる。標的細胞の採取方法としては、例えば、熱塑性フィルムを貼り付けた透明キャップを押し付ける方法(特許文献1)、ゼラチンコートされたスライドガラスを使用する方法(特許文献2)がある。また、LMDの時点で標的細胞の周辺部位を大きく取り除き、正確な採取を実現する方法が開示されている(特許文献3)。
【特許文献1】特開2000−266649号公報
【特許文献2】特開2002−156316号公報
【特許文献3】特許第3820227号公報
【発明の開示】
【発明が解決しようとする課題】
【0005】
しかし、多量の水分を含む生細胞に高出力レーザーを照射すると、水分がアブレーション効果によって急激な速度で蒸発飛散し、レーザー照射部位における正確な切断ができなくなる。上述した特許文献1〜3のLMD法は、すべて乾燥させた組織標本においてのみ適用可能であり、多量の水分を含む生細胞または細胞内構造物の単離には適用することができない。
【0006】
また、たとえ標的生細胞の輪郭から十分に距離をとってレーザーでトリミングしたとしても、多量の水分を含む生細胞は、一般に付着力が弱い傾向にあり、例えば、特許文献1および2に記載された方法での採取は難しい。また、そもそも、十分に距離をとってレーザーでトリミングした場合、多量の不純物が混入してしまう。特に、微小な細胞内構造物のみをターゲットに定めている場合、この問題はいっそう深刻になる。一方、特許文献3の方法は、周辺部位に多数の標的生細胞が散在している場合は採取効率が悪いので適用が困難である。
【0007】
本発明の目的は、多量の水分を含む標本中に低密度で分布する標的生細胞または細胞内構造物(標的部位)を標本から正確に単離し、かつこの単離された標的部位のみを正確に採取する技術を提供することにある。
【課題を解決するための手段】
【0008】
即ち、本発明は、標的生細胞または細胞内構造物を含む標本を作製する工程と、前記標本に液透過性を付与し、前記標本内の含水量を制御する工程と、前記標本に対してレーザーを照射し、前記標的生細胞または細胞内構造物を前記標本から切り離す工程と、を含む、標的生細胞または細胞内構造物の単離方法を提供する。ここで、前記含水量を制御する工程が、半乾燥状態の標本を得る工程を含むことにより、アブレーション時の不都合を好適に回避できる。前記含水量を制御する工程が、細胞膜に多数の微細孔を形成させる薬剤を前記標本に添加し、細胞内の液状成分を取り出すようなセミインタクト化を行う工程と、前記セミインタクト化された各細胞内の液状成分を細胞外に流出させる工程と、を含むことにより、細胞外のみでなく細胞内の含水量も適切に制御でき、より正確な単離が可能となる。前記切り離す工程が、前記標的生細胞または細胞内構造物に予め組み込まれた光マーカー物質からの光を発生させる工程と、前記光マーカー物質の発光に基づいてダイセクション箇所を決定する工程と、前記標本に対してレーザーを照射し、前記標的生細胞または細胞内構造物を前記標本から切り離す工程と、を含むことにより、観察している最中の所望の単離対象を光マーカで確認しながら容易に単離操作できる。前記標本を作製する工程は、前記標的生細胞または細胞内構造物に光マーカー遺伝子を組み込み、可視化する工程を含むことにより、遺伝学的活性を生きたまま単離操作できる。ここで、光マーカー物質を発光させる工程が、前記切り出し工程とは異なる波長の励起用光源(レーザーまたは水銀ランプスペクトル光等)であることにより、互いに光学的な干渉を受けずに同時操作できる。
【0009】
また、本発明の採取方法は、標的細胞または細胞内構造物を含む標本を作製する工程と、前記標本の含水量を制御する工程と、平坦な先端部を有する細径の採取棒を、レーザーによって切り離された標的生細胞または細胞内構造物に押し付ける工程と、前記平坦な先端部に付着した前記標的生細胞または細胞内構造物を、溶液の入った回収用容器内で遊離させる工程と、を含むことを特徴とする。
【0010】
また、本発明の採取方法は、標的細胞または細胞内構造物を含む標本を作製する工程と、前記標本の含水量を制御する工程と、前記標本に対してレーザーを照射し、前記標的細胞または細胞内構造物を前記標本から切り離す工程と、を含む、標的細胞または細胞内構造物の単離方法である。ここで、前記標本が予め凍結ないし乾燥処理されており、含水量を制御する工程が、凍結が解凍されて生じる融解液ないし乾燥状態から復元するための溶解液により、一旦、含水量を充分増加させた後に、低度の乾燥状態になるまで含水量を低減させることにより、培養細胞以外の各種保存状態の細胞にも本発明を適用できる。
【発明の効果】
【0011】
本発明の標的生細胞または細胞内構造物の単離方法によって、多量の水分を含む標本中に低密度で分布する標的生細胞または細胞内構造物を標本から正確に単離し、かつこの単離された標的部位のみを正確に採取することができる。
【発明を実施するための最良の形態】
【0012】
以下、図面を用いて本発明の実施態様について説明する。なお、以下に示す実施態様は、本発明の構成を詳細に説明するために例示的に示したものに過ぎない。従って、本発明は、以下の実施態様に記載された説明に基づいて限定解釈されるべきではない。本発明の範囲には、特許請求の範囲に記載された発明の範囲内にある限り、以下の実施態様の種々の変形、改良形態を含む全ての実施態様が含まれる。
【0013】
<第1の実施態様>
図1
図1は、第1の実施態様における方法を示したフローチャート図である。
【0014】
第1に、標的生細胞または細胞内構造物を含む標本を作製する(11)。
【0015】
「標的生細胞」とは、生きている細胞を意味する(以下、単に「標的細胞」ともいう)。標的細胞には、これらに限定されないが、任意の生物種または生体部位から入手可能な、病理組織片中に低密度で分散する各種異常細胞が含まれる。例えば、組織片の場合、組織片全体には多くの正常細胞が混在し、例えば特定の腫瘍細胞に特異的な遺伝子発現解析を行うためには、腫瘍組織片から目的の腫瘍細胞のみを採取する必要がある。なお、「標本」とは、病理組織片または組織片を解体して得た細胞分散系を意味する。
【0016】
「細胞内構造物」とは、細胞内凝集体や各種の細胞内小器官を意味する。細胞内小器官には、LMDが適用可能な任意の物質を含み、例えば、核、ミトコンドリア、リソソーム、小胞体、ゴルジ装置等の膜系構造体が含まれる。
【0017】
また、前記標本を作製する工程は、前記標的生細胞または細胞内構造物(以下、「標的部位」ともいう)に光マーカー遺伝子を組み込み、可視化する工程を含んでいてもよい。光マーカー物質によって標的部位を可視化することによって、以降のレーザーマイクロダイセクション処理において、標的部位のみを標本から確実かつ正確に切り出すことができる。
【0018】
光マーカー物質は後述する実施例のように、励起光により蛍光を発する蛍光タンパク質、例えばGFPが有用である。実施例で使用したGFPは、詳しくはクローンテック社製ベクターである、pEGFP-N1で、励起波長が488nmである。なお、光マーカー遺伝子には、酵素基質溶液などの化学的励起剤により光を発する発光タンパク遺伝子が含まれる。また、生物発光エネルギー共鳴転移(BRET)による蛍光を、蛍光タンパク遺伝子および/または発光タンパク遺伝子により発生させる場合も含まれる。なお、可視化という点では、蛍光マーカー遺伝子を組み込み可視化するだけでなく、目的のタンパク質と特異性を持った抗体に蛍光標識した二次抗体を反応させ(蛍光抗体法)、可視化させることも可能である。そして、蛍光抗体法によって標識された標的部位にLMD処理を行うことができる。
【0019】
第2に、標的生細胞または細胞内構造物を含む標本に液透過性を付与する(12)。
【0020】
「液透過性を付与する」とは、標本を構成する各細胞の細胞膜を、前記各細胞内の液状成分が細胞外に流出可能な状態に誘導することを意味する。液透過性を付与された細胞膜は、細胞内の液状成分の透過を許容するが、細胞内の細胞内構造物の透過を阻害する。従って、細胞内構造物は細胞内にインタクト(無傷に)とどまり、各種流動性の微小蛋白(グロブリン等)を含むような液状成分のみを流出させることができる。この技術は、一般には「セミインタクト」と呼ばれている。セミインタクト化された細胞(セミインタクト細胞)は、可溶性成分(イオンやタンパク質など)を含む液状成分を自由に出入りさせることができる一方、細胞膜、細胞骨格、細胞内オルガネラ間の相対的位置、つまり細胞内のトポロジーが保持された細胞である。セミインタクト細胞を用いることにより、タンパク質の機能や動態の解析を、タンパク質が本来機能する場所や空間において調べられる一方、「細胞を1個の試験管」に見立て、細胞質成分・低分子阻害剤等を除去または添加するような、生化学的な解析を効率的に行うことが可能となる。第1の実施態様では、この「セミインタクト」技術を、細胞内試験管としてではなく、標的生細胞または細胞内構造物を含む標本内の含水量を制御するための技術として使用する。
【0021】
一般に、標本のセミインタクト化は、細胞膜に透過性を付与する薬剤を前記標本に添加することによって行われる。細胞膜に液透過性を付与する薬剤としては、細胞に一つまたは複数の溶解孔を形成することのできる孔形成剤であるところの、チオール活性化溶血毒(thiol or sulfhydryl - activated toxins)、酸素感受性溶血毒(oxygen labile, oxygen sensitive hemolysin)と総称される細菌毒素が挙げられる。特に好ましくは、ストレプトリシンO(storeptolysin O)SLOが使用されるが、他にも使用可能な薬剤として、αHL、エアロリシン(aerolysin)、パーフリンゴリシン(perfringolysin)、ニューモリシン(pneumolysin)、リステリオリシン(listeriolysin)、バチルス・チューリンゲンシス(Bacillus thuringensis)毒素などの細菌外毒素、またはヘモリシン(hemolysin)やコリシン(colicin)のような大腸菌由来溶解性分子、またはデフェンシン(defensin)、マガイニン(magainin)、メリチン(mellitin)、コンプルメント(complement)、パーフォリン(perforin)、酵母キラー毒素(yeast killer toxin)、ヒストリシン(histolysin)のような真核細胞由来のものが挙げられる。本発明の方法は、特にこれら薬剤による化学的処理に限定されるわけではないが、例えば、ストレプトリシンOを添加し、標本を構成する各細胞をセミインタクト化することによって、細胞内の液状成分を排出させたり、生きたまま半乾燥状態を作り出したりすることができる。
【0022】
第3に、前記半乾燥状態の標本に対して高出力パルスレーザーを照射し、前記標的生細胞または細胞内構造物(標的部位)を前記標本から切り離す(13)。
【0023】
ここで使用する技術は、レーザーマイクロダイセクション(LMD)法である。LMD法は、顕微鏡にレーザー照射装置が接続された機器を使用して、顕微鏡下で組織片を観察しながら、組織片上の標的部位をレーザーによって特異的に切り出し、採取する方法である。LMD法は、正常細胞と病理細胞が混在する病理組織片から病理細胞のみを単離することができるので、病原遺伝子の発現解析にとって極めて強力な技術であり、レーザキャプチャーマイクロダイゼクション(LCM)とも呼ばれている。LMDに用いるレーザの波長および出力は公知であるので詳細な説明を省略する。
【0024】
LMD法を多量の水分を含む生細胞に適用すると、アブレーション効果によって水分が急激な速度で蒸発飛散し、レーザー照射部位における正確な切断ができなくなる。しかしながら、第1の実施態様では、セミインタクト化処理(12)によって標本が生きたまま半乾燥状態となっているので、アブレーション効果による水分の蒸発飛散が抑制され、LMD法による標的部位の正確な切り出しが可能になる。
【0025】
なお、一般に言われる「セミインタクト」の処理は、雑多な蛋白を含まない緩衝液等の交換用液体を元の細胞内液の代わりに含有させる工程を含んでいる。本発明においても、後述する実施例のように、適当な緩衝用バッファー溶液によりサイトソル成分等を洗い流すことで、細胞内構造物を保ったままの状態で細胞内に他の液体を収容させるようにしている。このように細胞内の液体を緩衝液等の他の液体と交換処理した場合にも、細胞の外側を半乾燥状態にすることにより、アブレーションによる上記作用効果を奏する。
【0026】
また、セミインタクト処理により細胞膜に生じた多数の微細孔を通じて、微細孔直径未満の蛋白質含有溶液を除去することにより、単離(または採取)時に余分な成分が残存する等の不都合を回避できるので作業の効率も高まる。さらに、セミインタクト処理による多数の微細孔が形成されたことにより、処理前の細胞よりも膨潤性が弱まって細胞内の液量が減るとともに、細胞内の液圧が外気圧に近づくので細胞膜が穿孔されても液体や細胞内構造物等が外部に吹き出すおそれが殆ど無くなるという作用効果も奏する。このように、生きた細胞から、ダメージなく所望の細胞内構造物のみを特異的に単離(または採取)可能な技術は存在しなかった。
【0027】
最後に、前記切り離された標的部位を採取する(14)。
【0028】
多量の水分を含む生細胞は、一般に付着力が弱い傾向にあり、採取が難しい。しかしながら、第1の実施態様では、セミインタクト化処理(12)後、レーザーマイクロダイセクション(13)によって切り出された標的部位は生きたまま半乾燥状態になっているので、標的部位の採取棒に対する付着性が良く、採取が容易になる。
【0029】
本発明者は、生きている標的部位の活性を損うことなく、いかに標的部位を採取するかについて鋭意研究を行ってきた。その結果、既存の採取方法とは全く異なる採取方法を開発するに至った。第1の実施態様における採取方法は、平坦な先端部を有する細径のガラス棒を、レーザーによって切り離された標的部位に押し付け、標的部位を前記平坦な先端部に付着させることによって、標的部位の活性を損なうことなく標的部位を採取する方法である。標的部位およびガラス管の先端部は画面上で容易に確認することができる。従って、標的部位のみの採取を正確かつ確実に行うことができる。
【0030】
図2
図2は、第1の実施態様におけるセミインタク化処理を行うための装置を模式的に示した図である。前記装置は、細胞膜に液透過性を付与する薬剤を格納した注入器21と、注入器21から射出された前記薬剤を、標的生細胞Aが播種・培養されたディッシュ22上に添加するマイクロピペッタ23と、マイクロピペッタ23によって吸引された培養液を回収するための回収用容器24、25と、これらの一連の操作を自動制御可能なCPU26により構成される。
【0031】
細胞膜に液透過性を付与する薬剤としては、特にこれに限定されるわけではないが、例えば、チオール活性化溶血毒(thiol 又は sulfhydryl - activated toxins)、酸素感受性溶血毒(oxygen labile, oxygen sensitive hemolysin)と総称される細菌毒素が挙げられる。なお、後述する実施例では、ストレプトリシンO(streptolysin O)(SLO)が有用であったが、対象となる細胞の種類ごとに最適な薬剤を選択したり、あるいは複数の異なる薬剤を組み合わせて使用するのが好ましい。
【0032】
図3
図3は、図2の装置を使用したセミインタクト化処理の手順を模式的に示した図である。先ず、標的生細胞Aが播種され、培養されたディッシュ22を用意する(図3a)。次に、注入器21に格納されたストレプトリンOをマイクロピペッタ23を使用して適量添加する(図3b)。ストレプトリシンOの添加量は、標本の種類によって異なるが、例えば1〜500ng/ml、好ましくは10〜100ng/ml、最も好ましくは40〜70ng/ml程度である。ストレプトリシンOに曝露された標的生細胞Aは液透過性を付与され、細胞内の液状成分を細胞外に流出可能な状態となる。続いて、マイクロピペッタ23を使用してディッシュ22内の培養液を吸引する(図3c)。このとき、液透過性を付与された標的生細胞Aの細胞膜から細胞内の液状成分が細胞外に流出し、前記培養液とともに吸引される。具体的には、サイトソル除去バッファを数回にわたってディッシュ22に添加し、インキュベーションおよび振盪によって液状成分を徐々に除去していく。標的生細胞AはストレプトリシンOの添加によってセミインタクト化され、その後の吸引操作によって液状成分を失うので、生きたまま半乾燥状態の標本となる。吸引された液状成分および培養液は四方バルブを通過して回収用容器24,25内に回収される。
【0033】
第1の実施態様では、標的生細胞Aの含水量は、例えば等張液等の自然環境中における標的生細胞Aの含水量に対して約50〜75重量%まで減少させることにより、半乾燥状態を生成できる。しかし、含水量を基準として計測するよりは、標本としての細胞表面が乾き始める状態を肉眼で確認することにより半乾燥状態かどうかを決定できる。好ましくは、複数の細胞が互いに離間するような分散状態で容器等の支持体上に載置されている場合には、注目する1以上の細胞の周縁部において支持体表面に何も水分が残っていない程度に乾いているか、たかだか細胞周縁部が若干乾き始めた状態を目安にすることができる。このような半乾燥状態は、画像による判定で実行してもよい。第1の実施態様では、このような低度の乾燥を示す半乾燥状態を作り出すことによって、細胞の活性を損なうことなく、かつ後工程のLMD法のアブレーション効果による水分の蒸発飛散を抑制することができる。例えば、SLOによるセミインタクト化は、上記含水量でいうと約60〜70%重量の低度の乾燥状態であるような生細胞が提供される。
【0034】
なお、説明の便宜上、標的生細胞Aのセミインタクト化について説明したが、実際にはセミインタクト化は標本全体で進行し、標的生細胞Aのみに限定されるものではない。
【0035】
図4
図4は、第1の実施態様におけるレーザーマイクロダイセクション(LMD)処理を行うためのLMD装置を模式的に示した図である。前記LMD装置は、標本に対してLMD処理を行うためのレーザー光学系41と、標本を観察するための観察用光学系42とで構成される。
【0036】
(レーザー光学系41)
照明用光源101から出力される可視光線は、視野絞り102、開口絞り103を通過し、ダイクロイックミラー104によって光軸pの下方に反射される。反射光は、レーザー用対物レンズ105に入り、集光されて標本Bに照射される。
【0037】
一方、UVレーザヘッド123内のレーザ光源123aから紫外領域の波長のパルスレーザビーム(以下、レーザビーム)が出力される。レーザビームは、可変スリット125およびUV結像レンズ124を通過し、レーザー用対物レンズ105に入り、標本Bに照射される。標本Bに照射されたレーザビームによって標的生細胞Aまたは細胞内構造物Cが切り出される。
【0038】
可変スリット125は、例えば円形または四辺形(例えば矩形)の開口部を有し、UVレーザヘッド123から出力されるレーザビームのスポットの形状および大きさを調節する。スリットの形状および大きさは適宜調節することができる。
【0039】
また、UVレーザヘッド123は、LED126を有する。LED126は、赤色のLED光を出力し、出力されたLED光は、ダイクロイックミラー127によって光軸p上に反射される。反射されたLED光は、標本Bにおけるレーザビームの照射位置と同一位置に照射される。標本B上に照射された赤色のLED光は、標本B上に照射するレーザビームの照射位置を表示する。
【0040】
なお、標本Bが入ったディッシュ108は、XYZ軸方向に駆動可能なステージ106上に載置され、標本B内に存在する標的生細胞Aおよび細胞内構造物Cを任意の場所に移動することができる。標的生細胞Aおよび細胞内構造物Cは、予め光マーカー物質によって標識し、標本B内における位置を可視化しておくとよい。その他、エアーブローおよびエアー吸引機などを標本B近傍に設置し、LMD処理後の標本の残骸等を処理してもよい。
【0041】
(観察用光学系42)
観察用対物レンズ110、ダイクロイックミラー111、UVバリアフィルタ112、結像レンズ113およびハーフミラー114が光軸p上に設けられている。
【0042】
標本Bからの反射光の一部はハーフミラー114を通過してミラー119で反射される。ミラー119で反射された光は、リレーレンズ120、UVカットフィルタ121および接眼レンズ122を通して観察者の視野に入る。一方、標本Bからの反射光の一部は、ハーフミラー114で反射され、CCDカメラ115に入る。CCDカメラ115は、結像レンズ113により結像された像を撮像して画像信号を出力する。
【0043】
画像処理およびステージ制御装置116は、CCDカメラ115から出力された画像信号から画像データを取得し、画像データをディスプレイ117に表示する。また、画像処理およびステージ制御装置116は、キーボートおよびマウスなどの操作部118が接続され、観察者によるステージ106の移動方向および移動量の操作指令を受信し、操作指令に従ったステージ106の移動制御信号をステージ駆動部109に送信する。
【0044】
また、光マーカー物質で標識された標的生細胞Aおよび細胞内構造物Cを可視化するための励起手段が設けられている。具体的には、蛍光励起用光源128およびUVバンドパスフィルタ129がダイクロイックミラー111の反射光路上に設けられ、蛍光励起用光源128から出力された励起光は、UVバンドパスフィルタ129を透過し、ダイクロイックミラー111で反射されて観察用対物レンズ110に入り、標本Bに照射される。蛍光励起用光源128から出力される励起光は、標的生細胞Aおよび細胞内構造物Cに予め標識された蛍光タンパクを励起する。ここで、透過照明光源101の光量を落として観察すると、明視野像として可視化されている細胞群の中で、光マーカーとしての蛍光タンパク遺伝子が組み込まれた細胞が光っていることを同時に観察できる。
【0045】
なお、図では観察光学系が標本の下側に配置する倒立型観察方法を採用しているが、レーザ光学系41と観察光学系42を上下反転した配置とする正立型観察方法を採用してもよい。
【0046】
図5
図5は、図4のLMD装置を使用して行われるLMDの様子を模式的に示した図である。観察者は、操作部118を操作し、ディスプレイ117に表示されている標本Bの画像とレーザビームの照射位置を示す色付け表示部とを確認しながら、LMD処理を行う。例えば、標的生細胞A内部の細胞内構造物Cを標的部位として標本Bから切り離す場合(図5a)、励起光で蛍光を発している細胞内構造物Cの周囲である上下左右に各1発ずつ矩形のレーザースポット51でレーザビームを照射する(図5b)。レーザーを照射された標本部位は消失して標的部位を囲む中央の領域のみが残存するので、細胞内構造物Cを標本Bから切り離すことができる。
【0047】
レーザースポット51は矩形である必要はなく、切り離す標的部位の形状および大きさに合わせて任意の形状とすることができる。例えば、様々な径の円形のレーザースポットでレーザビームを標的部位周囲で同様に照射することによって標的部位の輪郭に沿った正確な切断が可能になる。
【0048】
前述のレーザスポットにより囲まれる中央の領域の大きさは、1μm〜100μm、好ましくは5μm〜50μm、最も好ましくは7.5μm〜30μmの範囲内において、上下左右に照射するレーザスポット51の位置間隔を任意に変更することにより非照射部分の面積を連続的に変更することができ、これにより、標的部位の大きさに合せたスポッティングを適切に選択することができる。
【0049】
図6
図6は、第1の実施態様における採取処理を行うための採取装置を模式的に示した図である。
【0050】
前記採取装置は、操作アーム64と、前記操作アームの先端に取り付けられた採取手段63と、操作アーム64を任意の空間位置に移動可能な駆動手段とを具備する。
【0051】
採取手段63は、好ましくは操作アーム64の先端に鉛直方向に固定されている。また、採取手段63は、好ましくは平坦な先端部を有するガラス棒である。ガラス棒の平坦な先端部の直径は、1〜500μm、好ましくは5〜100μm、最も好ましくは10〜30μmである。
【0052】
前記駆動手段は、好ましくは採取部位を結像する撮像手段(カメラ)と、該カメラから出力された電気信号を画像データとして表示する画像表示手段(ディスプレイ)と、採取手段63を任意の位置に移動させる操作指令を入力する操作手段(コントローラ)と、操作指令に基づいて採取手段が固定された操作アームを駆動する駆動制御部とを具備する。
【0053】
前記採取装置はまた、標的部位を回収するための回収用容器62と、その固定手段65とを備えていてもよい。回収用容器62は透明容器であり、回収用容器62内に回収された標的部位を顕微鏡によって確認することができる。回収用容器62は、固定手段65によって固定される。
【0054】
回収用容器62の形状および大きさに特に制限はないが、一例として、PCRチューブのキャップ部をチューブ本体部から取りはずし、これを回収用容器として使用することができる。すなわち、PCRチューブのキャップ部を上向きに反転して固定することで、該キャップ内壁に形成される窪みに標的部位を回収する。この場合、回収後に、キャップ部とPCRチューブ本体部とを再接合することによってサンプリングが完了する。
【0055】
なお、本発明でPCRチューブのキャップ部を利用した背景として、(1)LDMの実作業は顕微鏡のステージ上で行われるため、対物レンズとステージの間の間隔が狭いため背の高いチューブ本体をステージ上に載置しにくい、(2)チューブ本体の底部は一般に細長い円錐形状であり曲率半径が小さい(1Rから3R)ので、ガラス棒の先端面に付着させた細胞等をステージ下側の対物からチューブの底部を透過して観察する場合、チューブ底の形状(曲率半径)によって収差が発生してしまい、付着しているかどうかを観察することができない、が挙げられる。これに対し、PCRチューブのキャップ部は、通常、十分な光透過性を有するプラスチック製であり、皿形状で背が低いためにステージ上への設置が容易で且つガラス棒の高さ移動を少なくできること、キャップ内壁の曲率半径が比較的大きいために、上記の収差が生じることなくガラス棒端面に付着した細胞等を観察可能であること、といった利点が有る。また、PCRチューブ全体としての特徴として、耐薬品性の材質であることと、採取した細胞等がチューブ内壁から剥がれ易いように付着防止用の表面処理が施されていることも利点として挙げられる。さらに、PCRチューブ本体部は遠心分離機等にセットするための形状を有しているので、回収後にキャップ部とチューブ本体部を再接合することにより、回収後の後処理へと迅速に続行することができるという利点も有る。
【0056】
図7
図7は、図6の固定手段65の線A-Aに沿った断面図である。固定手段65は、固定台71上に空洞部72および固定板73を備える。空洞部72にはめ込まれた回収用容器62は図中矢印方向に可動する固定板73によって固定される。空洞部72では、回収用容器の透明な底部が露出しているので、下方に設置された対物レンズによって回収用容器内の標的部位を確認することができる。なお、回収用容器62としてPCRチューブのキャップ部を使用する場合、標的部位の回収後、キャップ部にチューブ本体部を再接合することによって容易にサンプリングを完了することができる。
【0057】
なお、採取装置は、図4に示したLMD装置に付設させることによって、標的生細胞または細胞内構造物の単離および採取を一連の操作として行うことができる。採取装置をLMD装置に付設する場合、LMD装置の撮像手段(カメラ)、画像表示手段(ディスプレイ)および操作手段(コントローラ)を利用することができ、マニピュレータ(採取手段および駆動手段)のみを新たに設置すれば良く、コスト面で有利である。また、回収用容器62およびその固定手段65は、ステージ106上に設置すればよい。
【0058】
図8および図9
図8および図9は、図6および図7に示した採取装置を使用した標的部位の採取工程を模式的に示した図である。先ず、レーザー照射手段81によるマイクロダイセクション(LMD)処理によって、標本Bから標的生細胞A内の細胞内構造物Cがディッシュ108上で切り離される(図8a)。この細胞内構造物Cの上方に、先端が平坦なガラス棒63を移動させ、上方から細胞内構造物Cを押し付ける(図8b)。押し付けた後、ガラス棒63を上方に移動させると、ガラス棒の先端の平坦部に細胞内構造物Cが付着する(図8c)。次に、ガラス棒63を回収用容器62の上方に移動させ(図9d)、ガラス棒63を回収用容器62内に下降させる(図9e)。回収用容器62内には回収を容易にするための溶液(例えば、緩衝液)が微少量(例えば5から20μl)入っており、ガラス棒63を緩衝液中で下降させ、さらに回収用容器62の壁面(例えば底面)に対し、付着した細胞内構造物Cが破壊されない程度に軽く接触させる操作を適宜1回以上行うことにより、細胞内構造物Cがガラス棒の先端部から遊離する。細胞内構造物Cの遊離後にガラス棒63を上方に移動させ、サンプリングが完了する(図9f)。なお、採取手段としては、ガラス棒に限らず他の材質のものでも使用できる。また、採取手段はLMD装置を備えた各種顕微鏡装置に対して、マニュピレータ用の固定具及び3次元(xyz方向)駆動可能な操作つまみを介して取り付けることが可能であり、好ましくは、図4に図示されるように、LMD装置の対物レンズ等の光学系による光路から外れた位置となるように、斜めに傾けて標本B付近まで延長すると共に、採取棒の先端から約0.5〜3cmの長さ部分を上記光路と平行な軸(図では鉛直方向)に沿うような直線部分を設けることで、採取棒の先端面のみが観察されるようになり且つ標本Bへのアクセスを容易にすることが可能になる。
【0059】
図10および図11
図10および図11は、ディスプレイ上における標的部位の採取の様子を示した図である。
【0060】
ディスプレイ上には、標本Bが蛍光を発した状態で映し出されている。細胞内構造物Cを除く標的生細胞Aの各部位はLMD法によって除去され、細胞内構造物Cが標本Bから切り出されている(図10a)。細胞内構造物Cを採取するために、先端が平坦なガラス棒63を細胞内構造物Cの上方近傍まで移動させる。このとき、ガラス棒の先端部91がディスプレイ上に映し出されるので、容易に位置合わせをすることが可能である(図10b)。
【0061】
次に、ガラス棒の先端部91を細胞内構造物Cの上方からゆっくりと下降させることにより、細胞内構造物を破壊しない程度に容器底面に対し先端部91を押し付ける(図10c)。このとき、細胞内構造物Cは、上述したような半乾き状態でガラス棒の先端部91の中央付近に付着している。
【0062】
そして、ガラス棒63を上方に引き上げ、移動させると、ガラス棒の先端部91が移動したとき、細胞内構造物Cの蛍光画像が図示するように画面上から消えていれば(図11d)、細胞内構造物Cがガラス棒の先端部に付着し、且つ細胞外へ取り出されたことを確認することができる。このように細胞内構造物Cを細胞から取り出した後、この細胞内構造物Cをガラス棒先端部91に付着させたまま、所定の移送先へ向けてガラス棒63を移動し(図11e)、他の容器等に回収する。
【0063】
このように、操作者は、ディスプレイを見ながら採取手段を駆動(自動または手動)することにより、容易かつ確実に採取を実行できる。
【0064】
(第2の実施態様)
第2の実施態様における採取方法として、上述したLMD処理をした後にマニュピレータ型の吸引機を使用した採取方法が挙げられる。具体的には、3次元空間上の任意の位置に駆動制御可能な操作アームを備えたマニュピレータに吸引機(キュベット)を取り付けたものを使用する。生体標本に純水を滴下した上で、標本から切り離されたセミインタクト状態の標的細胞または細胞内構造物(標的部位)を顕微鏡で観察しながら、前記キュベットの吸引口を前記標的部位に近接させ、これを吸引する。その後、吸引した前記標的部位を緩衝液などが入ったPCR容器に吐出して回収する。
【0065】
(変形例)
第1の実施態様における「標本に液透過性を付与し、前記標本内の含水量を制御する工程」を、「標本の含水量を制御する工程」にまで拡張することによって、上述したセミインタクト化以外にも半乾燥状態を作り出し、水分を多量に含む死細胞についても本発明の方法を適用することができる。例えば、凍結保存された死細胞は多量の水分を含む。解凍時に死細胞の含水量を制御することによってLMD法が適用可能な死細胞を作製することができる。本発明において、半乾燥状態を得る方法としては、乾燥状態の気体を標本に吹き付けるエアドライ法や、容器等の標本用の各種支持体をヒータ加熱(但し、細胞を変質させない程度の高温)する加熱法等を利用できる。マイナス60度以下のような極低温で保存された生細胞(または生体組織)に同様に適用する場合には、生細胞のphを良好に保つような気体(例;炭酸ガス)環境下で含水量の制御を行うのが好ましい。従って、いったん凍結保存された病理組織片の解析についてもLMD法が適用可能になり、大量の病理組織片をいったん凍結保存し、後日、各病理組織片について網羅的に解析を進めることが可能になる。これとは逆に、凍結乾燥された細胞(または生体組織)に関して含水量を制御する場合には、一旦、充分量の溶解用溶液で細胞(または生体組織)を復元等して適宜蘇生させた後に、上述したような液透過性を付与する工程以降の処理を行うのが好ましい。
【実施例】
【0066】
実施例1
1.標的細胞へのプラスミドのトランスフェクション
<使用機器>
・CO2 INCUBATOR (ESPEC)
・50mm径、14mm測定ホールディッシュ(Mat Tek社 #P50G-O-14-F)
(ディッシュはあらかじめ、0.5mg/mlのPOLY-L-LYSINEでコートしておく)
<細胞、試薬等>
・細胞;マウス神経芽細胞腫Neuro-2a (ATCC # CCL-131)
・Plasmids;GFP-PrPc(Δ140-254)/pcDNA3.1
・Opti-MEM I(GIBCO #31985)
・LipofectAMINE2000(Invitrogen # 11668-019)
・抗生物質不含MEM培地(SIGMA # M5650)
・POLY-L-LYSINE(SIGMA # P6282)
<手順>
(1)培養細胞をディッシュにまく。
【0067】
(i)Transfection前日に、〜1500個/ディッシュとなるようマウス神経芽細胞腫Neuro-2a(N2a)細胞をまく。
【0068】
(ii)抗生物質不含MEM培地を3ml/ディッシュとなるよう入れ、CO2インキュベーターで37℃、24時間インキュベートする。(なお、この時点で30-50%コンフルになるよう、細胞をまいている)
(2)トランスフェクションを行う(*Lipofect AMINE2000付属のプロトコール通り)
(i)Lipofect AMINE2000 6μlにOpti-MEM I 300μlを加え、室温で10分インキュベートする。
【0069】
(ii)3μgのプラスミドに300μlのOpti-MEM Iを添加する。
【0070】
(iii)(i)および(ii)の両試薬を穏やかに混合し、室温で20分インキュベートする。
【0071】
(iv)20分のインキュベート中に培養細胞ディッシュの培地を新しい抗生物質不含MEM 3mlに交換する。
【0072】
(v)CO2インキュベーターで37℃、4時間インキュベートする。
【0073】
(vi)4時間後、新しい抗生物質不含MEM 3mlに交換し、CO2インキュベーターで37℃、24時間インキュベートする。
【0074】
2.ストレプトリシンO(streptolysin-O)によるセミインタクト化
<使用機器>
・Bouble Shaker NR-3 (TAITEC)
・Water Bath (TAITEC)
・LOW TEMP. INCUBATOR LTI-601SD(EYELA)
<細胞、試薬等>
・ガラスボトムdishに撒いた細胞
・streptolysin-O(SIGMA # S5265)
・5×KOAc Buffer(575mM KOAc, 125mM Hepes-KOH(ph7.4), 12.5mM MgCl2)
・1M DTT
・200mM EGTA
・サイトソル除去Buffer(1×KOAc Buffer, 1mM DTT 2mM EGTA)
・PBS(-)
<手順>
(1)10mM DTTを入れた1×KOAc Bufferに60ng/mlの濃度でストレプトリシンOを懸濁し、37℃のWater Bathで30分インキュベートする(ストレプトリシンOの活性化)。
【0075】
(使用直前に作る。間が空く時は4℃に置き、1時間以内に使う。小分けにして−80℃に保存可。)
(2)Activateした60ng/ml ストレプトリシンOを1.4ml/dishで添加し、4℃で10分インキュベートする。
【0076】
(3)ice-cold PBS(-)で2回washする。
【0077】
(4)あらかじめ37℃にしたサイトソル除去Bufferを3ml/dishで添加し、37℃で5分インキュベートする。
【0078】
(5)室温のサイトソル除去Bufferで2回washする。
【0079】
(6)室温のサイトソル除去Bufferを3ml/dishで添加し、室温で10分shake(30rpm/min)する。
【0080】
(7)室温のサイトソル除去Bufferで1回washする。
【0081】
(8)室温のサイトソル除去Bufferを3ml/dishで添加し、室温で10分shake(30rpm/min)する。
【0082】
(9)室温のPBS(-)で2回washする。
【0083】
3.半乾燥状態の作成
セミインタクト化後のディッシュをレーザーマイクロダイセクション装置(Laser System HCL-2100/HOYA)を備えた蛍光顕微鏡(蛍光顕微鏡IX71/OLYMPUS)の試料ステージに載置し、上述した半乾燥状態になるまで顕微鏡下の画像を目視判定した。
【0084】
4.レーザダイゼクション
上記の半乾燥状態になった時点で、所望の細胞を観察視野にステージ移動させ、蛍光画像をディスプレイ表示した。この状態で、細胞内でGFPにより光っているミトコンドリア凝集体を図4の説明と同様に操作してダイゼクションを行った。
【0085】
5.マニュピレータによる採取
上記ダイゼクション後の凝集体を図6〜図10で説明した方法および装置により採取を実行した。使用した具体的機器は、 (i) 「粗動用マニピュレーター ONM-1 /OLYMPUS・NARISHIGE JAPAN」、(ii) 「三次元ジョイスティック油圧マイクロマニピュレーター MNO-202N /NARISHIGE JAPAN」、(iii) 「Cell Tram Air 5176(一部使用) /eppendorf」である。先細ガラス棒は、先端より約2cmの部分が約120度の角度に折れ曲がり且つ下方に向けて直線形状の針となるように熱加工したものであり、上記LCM装置の上部対物レンズの側方位置に、手動で3次元微動操作が可能な市販のマニュピレータ用操作部ブロックに対し針部が鉛直となるように取り付けて、顕微鏡観察下で操作した。なお、細径ガラス棒の先端面に付着させる際、および回収用の容器へ離脱させる際は、適宜、ガラス棒の上下動作を繰り返すことで間違いなく採取されるのを画像上で追跡しながら進めた。ガラス棒への付着を終えた後の回収用容器は、市販のPCR用チューブ(BIO-BIK T-02)のキャップ部分を図6および図7に示した固定手段(発明者による製作)に固定し、5μlのPBS(SIGMA社 DULBECCO’S PHOSPHATE BUFFERED SALINE)を添加したものを使用した。この際、チューブ本体とキャップを連結するストラップ部は本体から切り離さずに固定し、固定した状態で、チューブ本体のみを指等で押し倒したり戻すようにしてキャップの開閉を行うことで、回収直後の回収容器の密閉を速やかに行った。
【0086】
3.結果
上記セミインタクト化によって半乾燥状態となったマウス神経芽細胞腫Neuro-2a内で形成された約5μm〜15μmの細胞内凝集体(GFP-PrPc(Δ140-254)およびミトコンドリアを含む)を、レーザーマイクロダイセクションにより正確に切り出すことができた。半乾燥状態は、細胞内構造物を光学的に観察するのに必要な液量を残しつつ、アブレーション時の水分蒸発を有効に低減する作用効果があるともいえる。これにより、生細胞内から目的の細胞内構造物を生きた状態の活性を維持しながら高精度に単離することができた。
【0087】
上記マニュピレータによる採取で回収された細胞内凝集体は、その後の分子生物学的な解析が可能であった。また、回収容器に収容した溶液内では、遊離した細胞内構造物C以外の物質(例えば細胞膜片)がガラス棒に付着していても別々に遊離されるか簡単に分別できるので、その後の使用に何ら支障が無かった。さらに、回収された細胞内凝集体からGFPによる蛍光が発していることが確認されたことから、生きた状態の活性を維持しながら正確な単離及び/または採取が可能であることが証明された。これら方法は、細胞内構造物について可能であることから、それよりも寸法が大きい細胞単体についても同様に適用できることはいうまでもない。また、形状が複雑な細胞(神経細胞、癌細胞等)や寸法が哺乳類より充分小さい各種細胞については、本発明の方法が有利である。
【0088】
他方、事前の検討において、マニュピレータ型の吸引機を用いてLMD処理後の細胞内構造物Cを吸引したところ吸引管内へ付着する場合があり回収し難かった。このため、あえてガラス製等の細径棒先端に付着させて採取する方法を採用して上記のように回収操作したことにより、所望の物質を確実かつ効率良く回収できた。
【0089】
このように本発明の方法は、細胞は勿論のこと、細胞内構造物を生きた活性を依然として維持しながら正確に単離および採取できることが確認できた。本発明の方法により採取された細胞または細胞内構造物等は、引き続き所定の容器内で前処理(可溶化、遠心分離等)され、各種解析(ウエスタンブロッティング、質量分析、2次元電気泳動、PCR反応等)することが可能である。また、細胞内構造物として細胞内で凝集体を形成するミトコンドリアを正確に単離および採取できたことにより、疾患関連凝集蛋白質構成成分の解析が本発明により初めて実現できるようになった。なお、実施例で扱ったPrPcはプリオン病関連蛋白(プリオン蛋白質)であり、本発明の方法(および上記説明による装置)が、神経学的な分子レベルの研究を生きた状態の活性を維持しながら行うことができ、研究、創薬、診断等の医療に大いに貢献できると期待される。
【0090】
以上、本発明を各種実施形態及び実施例に基づき説明したが、本発明はそれらに限定されることなく、上述した発明の主旨の範囲内において、種々の変更等が可能である。また、上記に説明した方法を実行するための装置も本発明に含まれ、これらも同様の主旨により種々変更等が可能である。さらに、上記に説明した方法を、上記方法を実行するための装置を用いて操作する操作方法または制御用プログラムも本発明に含まれる。
【図面の簡単な説明】
【0091】
【図1】第1の実施態様における方法を示したフローチャート図
【図2】第1の実施態様におけるセミインタク化処理を行うための装置を模式的に示した図
【図3】図2の装置を使用したセミインタクト化処理の手順を模式的に示した図
【図4】第1の実施態様におけるレーザーマイクロダイセクション(LMD)処理を行うためのLMD装置を模式的に示した図
【図5】図4のLMD装置を使用して行われるLMDの様子を模式的に示した図
【図6】第1の実施態様における採取処理を行うための採取システムを模式的に示した図
【図7】図6の固定手段65の線A-Aに沿った断面図
【図8】図6および図7に示した採取システムを使用した標的部位の採取工程を模式的に示した図
【図9】図6および図7に示した採取システムを使用した標的部位の採取工程を模式的に示した図
【図10】ディスプレイ上における標的部位の採取の様子を示した図
【図11】ディスプレイ上における標的部位の採取の様子を示した図
【符号の説明】
【0092】
11・・・標本の作製、12・・・セミインタクト化処理、13・・・レーザーマイクロダイセクション、14・・・標的部位の採取、21・・・注入器、22・・・ディッシュ、23・・・マイクロピペッタ、24、25・・・回収用容器、26・・・CPU、51・・・レーザースポット、62・・・回収用容器、63・・・ガラス棒、64・・・操作アーム、65・・・固定手段、71・・・固定台、72・・・空洞部、73・・・固定板、81・・・レーザー照射手段、91・・・ガラス棒の先端部、101・・・照明用光源、102・・・視野絞り、103・・・開口絞り、104・・・ダイクロイックミラー、105・・・レーザー用対物レンズ、106・・・ステージ、108・・・ディッシュ、109・・・ステージ駆動部、110・・・観察用対物レンズ、111・・・ダイクロイックミラー、112・・・UVバリアフィルタ、113・・・結像レンズ、114・・・ハーフミラー、115・・・CCDカメラ、116・・・画像処理およびステージ制御装置、117・・・ディスプレイ、118・・・操作部、119・・・ミラー、120・・・リレーレンズ、121・・・UVカットフィルタ、122・・・接眼レンズ、123・・・UVレーザヘッド、123a・・・レーザ光源、124・・・UV結像レンズ、125・・・可変スリット、126・・・LED、127・・・ダイクロイックミラー、A・・・標的生細胞、B・・・標本、C・・・細胞内構造物。
【特許請求の範囲】
【請求項1】
標的生細胞または細胞内構造物を含む標本を作製する工程と、
前記標本に液透過性を付与し、前記標本内の含水量を制御する工程と、
前記標本に対してレーザーを照射し、前記標的生細胞または細胞内構造物を前記標本から切り離す工程と、
を含む、標的生細胞または細胞内構造物の単離方法。
【請求項2】
前記含水量を制御する工程が、半乾燥状態の標本を得る工程を含むことを特徴とする、請求項1に記載の標的生細胞または細胞内構造物の単離方法。
【請求項3】
前記含水量を制御する工程が、
細胞膜に多数の微細孔を形成させる薬剤を前記標本に添加し、細胞内の液状成分を取り出すようなセミインタクト化を行う工程と、
前記セミインタクト化された各細胞内の液状成分を細胞外に流出させる工程と、
を含むことを特徴とする、請求項1または2に記載の標的生細胞または細胞内構造物の単離方法。
【請求項4】
前記切り離す工程が、
前記標的生細胞または細胞内構造物に予め組み込まれた光マーカー物質からの光を発生させる工程と、
前記光マーカー物質の発光に基づいてダイセクション箇所を決定する工程と、
前記標本に対してレーザーを照射し、前記標的生細胞または細胞内構造物を前記標本から切り離す工程と、
を含むことを特徴とする、請求項1〜3のいずれか1項に記載の標的生細胞または細胞内構造物の単離方法。
【請求項5】
前記標本を作製する工程が、
前記標的生細胞または細胞内構造物に光マーカー遺伝子を組み込み、可視化する工程を含むことを特徴とする、請求項4に記載の標的生細胞または細胞内構造物の単離方法。
【請求項6】
前記光マーカー物質が、蛍光マーカー物質であることを特徴とする、請求項4に記載の標的生細胞または細胞内構造物の単離方法。
【請求項7】
光マーカー物質を発光させる工程が、前記切り出し工程とは異なる波長の励起用光源であることを特徴とする、請求項4または5に記載の標的生細胞または細胞内構造物の単離方法。
【請求項8】
標的細胞または細胞内構造物を含む標本を作製する工程と、
前記標本の含水量を制御する工程と、
平坦な先端部を有する細径の採取棒を、レーザーによって切り離された標的生細胞または細胞内構造物に押し付ける工程と、
前記平坦な先端部に付着した前記標的生細胞または細胞内構造物を、溶液の入った回収用容器内で遊離させる工程と、
を含むことを特徴とする、標的生細胞または細胞内構造物の採取方法。
【請求項9】
標的細胞または細胞内構造物を含む標本を作製する工程と、
前記標本の含水量を制御する工程と、
前記標本に対してレーザーを照射し、前記標的細胞または細胞内構造物を前記標本から切り離す工程と、
を含む、標的細胞または細胞内構造物の単離方法。
【請求項10】
前記標本が予め凍結ないし乾燥処理されており、含水量を制御する工程が、凍結が解凍されて生じる融解液ないし乾燥状態から復元するための溶解液により、一旦、含水量を充分増加させた後に、低度の乾燥状態になるまで含水量を低減させることを特徴とする、請求項9に記載の標的細胞または細胞内構造物の単離方法。
【請求項1】
標的生細胞または細胞内構造物を含む標本を作製する工程と、
前記標本に液透過性を付与し、前記標本内の含水量を制御する工程と、
前記標本に対してレーザーを照射し、前記標的生細胞または細胞内構造物を前記標本から切り離す工程と、
を含む、標的生細胞または細胞内構造物の単離方法。
【請求項2】
前記含水量を制御する工程が、半乾燥状態の標本を得る工程を含むことを特徴とする、請求項1に記載の標的生細胞または細胞内構造物の単離方法。
【請求項3】
前記含水量を制御する工程が、
細胞膜に多数の微細孔を形成させる薬剤を前記標本に添加し、細胞内の液状成分を取り出すようなセミインタクト化を行う工程と、
前記セミインタクト化された各細胞内の液状成分を細胞外に流出させる工程と、
を含むことを特徴とする、請求項1または2に記載の標的生細胞または細胞内構造物の単離方法。
【請求項4】
前記切り離す工程が、
前記標的生細胞または細胞内構造物に予め組み込まれた光マーカー物質からの光を発生させる工程と、
前記光マーカー物質の発光に基づいてダイセクション箇所を決定する工程と、
前記標本に対してレーザーを照射し、前記標的生細胞または細胞内構造物を前記標本から切り離す工程と、
を含むことを特徴とする、請求項1〜3のいずれか1項に記載の標的生細胞または細胞内構造物の単離方法。
【請求項5】
前記標本を作製する工程が、
前記標的生細胞または細胞内構造物に光マーカー遺伝子を組み込み、可視化する工程を含むことを特徴とする、請求項4に記載の標的生細胞または細胞内構造物の単離方法。
【請求項6】
前記光マーカー物質が、蛍光マーカー物質であることを特徴とする、請求項4に記載の標的生細胞または細胞内構造物の単離方法。
【請求項7】
光マーカー物質を発光させる工程が、前記切り出し工程とは異なる波長の励起用光源であることを特徴とする、請求項4または5に記載の標的生細胞または細胞内構造物の単離方法。
【請求項8】
標的細胞または細胞内構造物を含む標本を作製する工程と、
前記標本の含水量を制御する工程と、
平坦な先端部を有する細径の採取棒を、レーザーによって切り離された標的生細胞または細胞内構造物に押し付ける工程と、
前記平坦な先端部に付着した前記標的生細胞または細胞内構造物を、溶液の入った回収用容器内で遊離させる工程と、
を含むことを特徴とする、標的生細胞または細胞内構造物の採取方法。
【請求項9】
標的細胞または細胞内構造物を含む標本を作製する工程と、
前記標本の含水量を制御する工程と、
前記標本に対してレーザーを照射し、前記標的細胞または細胞内構造物を前記標本から切り離す工程と、
を含む、標的細胞または細胞内構造物の単離方法。
【請求項10】
前記標本が予め凍結ないし乾燥処理されており、含水量を制御する工程が、凍結が解凍されて生じる融解液ないし乾燥状態から復元するための溶解液により、一旦、含水量を充分増加させた後に、低度の乾燥状態になるまで含水量を低減させることを特徴とする、請求項9に記載の標的細胞または細胞内構造物の単離方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公開番号】特開2010−2213(P2010−2213A)
【公開日】平成22年1月7日(2010.1.7)
【国際特許分類】
【出願番号】特願2008−159272(P2008−159272)
【出願日】平成20年6月18日(2008.6.18)
【出願人】(505457994)学校法人東京医科大学 (6)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
【公開日】平成22年1月7日(2010.1.7)
【国際特許分類】
【出願日】平成20年6月18日(2008.6.18)
【出願人】(505457994)学校法人東京医科大学 (6)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
[ Back to top ]

