生細胞表層分子解析方法及び部材
【課題】
細胞表層に存在するタンパク質、糖鎖、脂質などの分子の構造情報を、細胞を破壊せずに観察するためのアレイ基板の開発と、それを用いて簡便・迅速・安価に細胞表層のプロファイルを達成しうる新規操作手法の提供。
【解決手段】
本発明では、蛍光標識した生存状態の細胞を含んだ溶液をアレイ基板と接触させた後で、基板表面上に非特異的に吸着している余剰細胞を除去する工程を設けることで、細胞の表層分子の構造情報を細胞が生存した状態で観察できる。
さらに、生存状態の細胞内に蛍光色素を取り込ませる蛍光標識法、基板上の余剰細胞を沈降除去する方法と共に、低吸着性表面コート基板を効果的に組み合わせることにより、課題であった基板表面への細胞の非特異的結合を大幅に抑制し、蛍光観察時のスポット輝度値とバックグラウンド輝度値の蛍光強度比(S/N比)の劇的な改善を達成した。
細胞表層に存在するタンパク質、糖鎖、脂質などの分子の構造情報を、細胞を破壊せずに観察するためのアレイ基板の開発と、それを用いて簡便・迅速・安価に細胞表層のプロファイルを達成しうる新規操作手法の提供。
【解決手段】
本発明では、蛍光標識した生存状態の細胞を含んだ溶液をアレイ基板と接触させた後で、基板表面上に非特異的に吸着している余剰細胞を除去する工程を設けることで、細胞の表層分子の構造情報を細胞が生存した状態で観察できる。
さらに、生存状態の細胞内に蛍光色素を取り込ませる蛍光標識法、基板上の余剰細胞を沈降除去する方法と共に、低吸着性表面コート基板を効果的に組み合わせることにより、課題であった基板表面への細胞の非特異的結合を大幅に抑制し、蛍光観察時のスポット輝度値とバックグラウンド輝度値の蛍光強度比(S/N比)の劇的な改善を達成した。
【発明の詳細な説明】
【技術分野】
【0001】
本発明はマイクロアレイ法を利用した、細胞表層の糖鎖、タンパク質、脂質の解析方法及び該方法に使用する部材に関する。
【背景技術】
【0002】
エバネッセント波励起法を利用した蛍光観察手法は、顕微鏡の分野でタンパク質の1分子観察を可能とするなど、近年高い成果を挙げている技術である。エバネッセント波励起蛍光観察法では、まず蛍光標識した被検分子(以下プローブ分子)を含む溶液を基板上に接触させ、次にこの基板表面にて光を全反射させる。この時、界面近傍数百nmに限定的に発生するエバネッセント波により基板-液層界面近傍の蛍光標識プローブ分子のみを選択的に励起することが可能である。このとき基板上にプローブ分子と相互作用する分子を複数固定化すると、プローブ分子と固定化分子の相互作用の程度をアレイ基板上の蛍光強度にてモニタリングすることが可能となる(図1)。このエバネッセント波励起蛍光観察法をマイクロアレイに応用することで、液相中で多数の被験分子とアレイ基板上に固定した分子との結合状態を洗浄せずに観察することが可能になる。
本発明者らは入射光をスラブ型導波路基板端面より入射し、スライド基板内を繰り返し全反射させてエバネッセント波を発生させ、このエバネッセント波により励起されるプローブ分子が発する蛍光を観察することによって、複数種の分子を固定化したマイクロアレイスライド基板表面とプローブ分子間の相互作用観察方法を提供してきた(図2)。(特許文献1,2)。
【0003】
さらに本発明者らは、従来フローサイトメトリー等によって行われてきた細胞表面と結合性プローブ分子との結合解析を、さらに高速化し、より簡便・安価な方法を提供するための新たな方法として、エバネッセント波励起蛍光検出を用いたマイクロアレイ法に着目した。2005年には本発明者らは上記の方法が細胞表面におけるタンパクや糖鎖の提示状態の判別に使用できることを示し、世界に先駆け発表した(非特許文献1)。しかし非特許文献1にあるような細胞表層タンパク質のプロファイリング解析手法では、被検細胞の細胞表層を蛍光標識化後に、細胞を破壊して細胞抽出液としてマイクロアレイに接触・観察する工程(図3)を必須としていた。細胞表面には糖鎖、タンパク質、脂質の高次構造が構築され、その量だけでなく密度も生体機能に重要であることが知られている。細胞を破壊する工程を含む非特許文献1の方法では、上記の糖鎖、タンパク質、脂質の高次構造が破壊され、それらの構造情報が失われてしまうという内在的な問題があった。また、蛍光標識化されていない細胞内容物中の糖鎖やタンパク質などによる競合阻害反応や、プロテアーゼやグリコシダーゼによる分解作用などの影響が危惧されるなど、方法に多くの課題点が残っていた。
【特許文献1】特願2003-430848
【特許文献2】特願2005-184171
【非特許文献1】J Biochem (Tokyo). 2006 Mar;139(3):323-7.
【発明の開示】
【発明が解決しようとする課題】
【0004】
細胞の表層に露出している成分として知られるタンパク質、糖鎖、脂質等の量やその密度は、細胞の状態を克明に反映したいわば「表情」であり、発生・分化・癌化等の過程で特徴ある変化を起こすことが知られている。
本発明の課題は、この細胞表層上の変化を、細胞を破壊せずに観察することができるアレイ基板を提供することであり、また当該基板を用いて生存状態の細胞表層に存在するタンパク質、糖鎖、脂質のプロファイリングを簡便、迅速に行う手段を提供することである。
【課題を解決するための手段】
【0005】
本発明者らは、上記目的を達成できる基板及びプロファイリング手法を鋭意検討した結果、生存状態の細胞であっても、蛍光標識した当該細胞を含んだ溶液を、細胞結合能を有する複数の分子が固定化されたアレイ基板と接触させることで、アレイ基板上の特定の分子と特異的に結合することができ、基板上での蛍光標識観察が十分に可能であることを見い出した。
さらに、実用的な蛍光観察をするためには、アレイ基板の非スポット領域に対して細胞が非特異的に吸着してしまうことが最大の障害となることに着目し、披検細胞を基板表面に接触させた後で、基板表面上に非特異的に吸着している余剰細胞を除去する工程を設け、バックグラウンド蛍光を低下せしめることで実用的観察を可能にすることができた。その際の最も効果的な基板表面上の非特異的に吸着している余剰細胞の除去方法として、液浸状態のマイルドな条件下で、重力による沈降除去する手法(重力洗浄法)を開発した。
また、アレイ表面の非スポット領域への被検細胞の非特異的吸着を抑制するコーティングを施した低吸着基板を開発し、さらに、細胞表面に影響を与えない細胞蛍光標識法である内部標識法などを効果的に組み合わせることでS/N比の大幅な向上を達成することができた。
これらの知見に基づいて、生細胞をそのままアレイ基板表面で観察可能な、細胞表層のプロファイル変化の検出に必要な実用感度とS/N比を達成することができ、本発明の完成に至ったものである。
【0006】
すなわち本発明は以下のとおりである。
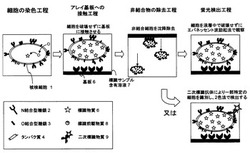
(1)披検細胞の細胞表層分子の構造情報を、披検細胞が生存している状態で観察する方法であって、以下の(a)〜(e)の工程を含む方法。操作工程の概略を図4に示す。
(a)表面に被検細胞と結合能を持つ分子を複数固定した基板を用意する工程、
(b)披検細胞を、生存状態のままで蛍光標識する工程、
(c)工程(a)で用意された基板に、工程(b)で蛍光標識した生存状態の被検細胞を含有する溶液を接触させ、披検細胞を上記基板表面上の分子と結合させる工程、
(d)工程(c)において、基板表面に非特異的に吸着している余剰な細胞を除去する工程、
(e)工程(d)において余剰細胞が除去された基板上の披検細胞からの蛍光強度を観察する工程。
(2)前記(e)の工程に先立ち、もしくは前記(e)の工程の後で、さらに下記の工程(f)及び(g)を設けることを特徴とする前記(1)に記載の方法。
(f)前記基板表面上の分子と結合した披検細胞に対して、当該細胞への結合能を持つ標識された第二の分子を含む溶液を基板に接触させる工程、
(g)工程(e)で用いた蛍光波長とは異なる蛍光波長を用いて上記第二の分子の蛍光強度を観察する工程。
(3)前記工程(e)及び/又は(g)における、基板上の蛍光強度の観察を、エバネッセント波励起蛍光観察法によって行うことを特徴とする前記(1)又は(2)に記載の方法。
(4)前記(a)の工程において、基板表面に被検細胞と結合能を持つ分子を複数固定した後、基板表面に残存する活性基をブロックする工程を設けることを特徴とする前記(1)ないし(3)のいずれかに記載の方法。
(5)前記基板表面に残存する活性基をブロックするためのブロッキング剤として、非タンパク性ブロッキング剤を用いる前記(4)に記載の方法。
(6)前記(b)の工程において、蛍光標識剤として用いる蛍光色素を、生存状態の被検細胞の細胞内に導入することを特徴とする、前記(1)ないし(5)のいずれかに記載の方法。
(7)蛍光標識剤として用いる蛍光色素が、代謝変換型蛍光色素である、前記(6)に記載の方法。
(8)前記(d)の工程を液浸状態で行うことを特徴とする前記(1)ないし(7)のいずれかに記載の方法。
(9)前記(d)の工程において、前記基板を液浸状態で180度回転させて下向きとすることにより、前記余剰細胞を重力により沈降除去することを特徴とする前記(8)に記載の方法。
(10)前記基板から前記余剰細胞を重力により沈降除去する際に、注水機構及び排水機構を有する貯留槽内に、両端に連動して回転する機構を備えたスライドホルダーが複数連設された装置を用い、各スライドホルダー上に、前記基板を装着し、スライドホルダーが液浸するまで注水した後、空気が混入しないようにすべてのスライドホルダーを180度回転させて下向きとし、前記余剰細胞が沈降除去されるのを待って、再度180度回転させて上向きとし、貯水槽内の液を排水した後、前記基板をスライドホルダーからはずすことを特徴とする、前記(9)に記載の方法。
(11)前記(5)ないし(10)のいずれかに記載の方法で用いられる基板であって、表面に被検細胞と結合能を持つ分子を複数固定した後で、基板表面に残存する活性基が非タンパク質ブロッキング剤によるブロッキング処理が施されている基板。
(12)前記基板が、乾燥状態で冷蔵又は冷凍して保存されている、前記(11)に記載の基板。
(13)基板そのものを導波路基板として利用し、エバネッセント波励起蛍光観察のために用いることを特徴とする、前記(11)又は(12)に記載の基板。
(14)前記導波路基板を挟み込むように表裏両面に反応槽形成部材を接着させ、裏面の反応層形成部材上に基板表面保護膜を具備することを特徴とする、前記(13)に記載の基板。
(15)前記(10)に記載の方法において用いられる装置であって、注水機構及び排水機構を有する貯留槽、及び当該貯水槽内に、基板を装着可能なスライドホルダーであり、かつ、両端に、連動して回転する機構を備えたスライドホルダーが複数連設されている、基板液浸用装置。
【発明の効果】
【0007】
本発明により、細胞表面に影響を与えることなく細胞を蛍光標識することができ、また本発明により、アレイ基板表面に非特異的に吸着している細胞を効果的に除去することができるので、細胞が結合したアレイ基板を蛍光強度による観察、例えばエバネッセント波励起蛍光法を用いて観察する際の最大の障害要因となる背景蛍光の発生を抑制し、これにより高いS/N比での蛍光観察が可能となる。結果として、液相中で非破壊状態の生きた細胞のアレイ結合プロファイル観察を簡便な操作にて、実用的感度で観察しうる手段と、それを可能にするために最適化された部材を提供することができる。
【発明を実施するための最良の形態】
【0008】
本発明は、生きた細胞を破壊せずに蛍光標識化した後に、これをそのままアレイ基板上に接触させ、基板上の細胞からの蛍光を観察するものであり、好ましくは、エバネッセント波励起蛍光観察方式を用いる細胞表層分子の解析手法に関するものである。
【0009】
(本発明における解析対象となる細胞表層分子)
本発明方法における解析対象となる細胞表層分子としては、細胞表層上に存在するタンパク質又は糖鎖又は複合糖質又は脂質などであり、その種類については特に制限はないが、タンパク質としては例えば、各種受容体、CD抗原、レセプターなどが挙げられる。
糖鎖として、例えば糖タンパク質系糖鎖(N-結合型糖鎖とO-結合型糖鎖)、糖脂質系糖鎖、グリコサミノグリカン系糖鎖、又は多糖類由来オリゴ糖鎖などが挙げられる。又、1)N-結合型糖鎖としては、高マンノース型・混成型・複合型からなるN-結合型糖鎖など、2)O-結合型糖鎖としては、ムチン型(O-GalNAc)・O-Fuc型・O-Man型・O-Glc型などからなるO-結合型糖鎖など、3)糖脂質系糖鎖としては、ガングリオ系列・グロボ系列・ラクト・ネオラクト系列糖鎖など、4)グリコサミノグリカン系糖鎖としては、ヒアルロン酸・ケラタン硫酸・ヘパリン・ヘパラン硫酸・コンドロイチン硫酸・デルマタン硫酸など、5)多糖類由来オリゴ糖鎖としては、キチン、セルロース、カードラン、ラミナリン、デキストラン、デンプン、グリコーゲン、アラビノガラクタン、アルギン酸、フルクタン、フコイダン、キシランなどに由来するオリゴ糖鎖などが例示できる。
またその他の糖鎖としては、M3・M5A・Hybrid (monoagalacto,bisect)・NA1・NA1(α1-6Fuc)・NA2 (monoagalacto)・NA2 (monoagalacto, bisect)・NA2・NA2 (α1-6Fuc)・A2・NA2(bisect)・NA3・NA3 (α1-6Fuc)・NA4・NA4 (α1-6Fuc)・NA5 (pentaagalacto, bisect)・Lactose・GA2・GA1・GM3-NeuAc・GM3-NeuGc・GM1・GM2・GD1a・GD1b・GD3・Gb3・Gb4・Forssman・LNnT・LNT・Galili pentasaccharide・B-hexasaccharide・LNFP-I・LNFP-II (Lea)・LNFP-III (LeX)・LNFP-II (Leb)・A-hexasaccharide・A-heptasaccharide・B-pentasaccharide・6'-Sialyl lactose・pLNH・βGalLac・βGal2Lac ・LN3・GN3・GN4・maltotriose・Sialyl LeXなどを挙げることができる。
また、本発明において、複合糖質とは、糖鎖を持つ生体内高分子の総称である。本発明の複合糖質としては、糖タンパク質(糖ペプチドも含む)、プロテオグリカン、糖脂質が挙げられる。
【0010】
(本発明における基板上に固定する細胞結合性分子)
本発明における基板上に固定する細胞結合性分子としては、上記本発明における解析対象となる細胞表層分子と結合性を有する分子であれば、どのような種類の分子でも良いが、好ましくは細胞結合性タンパク分子が用いられる。また、基板上に固定する際には、決められた位置に整然と固定してマイクロアレイ基板とすることが好ましい。
細胞結合性タンパク分子としては、例えば抗体や糖結合性タンパク質であるレクチン又は生体内レセプターなどが好ましく、これらを単独で用いても組み合わせて用いても良い。抗体としてはIgG、IgM、IgA、IgE、IgYなどのサブクラスを含む、ポリクローナル抗体又はモノクローナル抗体又は一本鎖抗体などが挙げられる。また基板に固定する細胞結合性タンパク質には、ポリペプチド鎖や上記タンパク質を部位特異的変異導入や化学修飾・糖鎖改変などの方法で物性や結合特異性、および親和力などを改変したものも挙げられ、本明細書でいう細胞結合性タンパク質としてはこのようなペプチド・タンパク質変異体も包含する。
レクチンとしては、動・植物、真菌、細菌、ウィルスなどから得られる様々な分子家系に属するレクチン、すなわち、細菌を含むすべての生物界で見出されるリシンB鎖関連の「R型レクチン」、真核生物全般に存在し糖タンパク質のフォールディングに関与する「カルネキシン・カルレティキュリン」、多細胞動物に広く存在し、「セレクチン」、「コレクチン」等代表的なレクチンを多く含むカルシウム要求性の「C型レクチン」、動物界に広く分布しガラクトースに特異性を示す「ガレクチン」、植物豆科で大きな家系を形成する「豆科レクチン」、およびこれと構造類似性をもち動物細胞内輸送に関わる「L型レクチン」、リソソーム酵素の細胞内輸送に関わるマンノース6-リン酸結合性の「P型レクチン」、グリコサミノグリカンをはじめとする酸性糖鎖に結合する「アネキシン」、免疫グロブリン超家系に属し「シグレック」を含む「I型レクチン」などが挙げられる。その他のレクチンとしては、ACA(センニンコクレクチン)・BPL (ムラサキモクワンジュレクチン)・ConA (タチナタマメレクチン)・DBA (Horsegramレクチン)・DSA (ヨウシュチョウセンアサガオレクチン)・ECA (デイゴマメレクチン)・EEL (Spindle Treeレクチン)・GNA (ユキノハナレクチン)・GSL I (グリフォニアマメレクチン)・GSL II (グリフォニアマメレクチン)・HHL (アマリリスレクチン)・ジャカリン(ジャックフルーツレクチン)・LBA (リママメレクチン)・LCA (レンズマメレクチン)・LEL (トマトレクチン)・LTL (ロータスマメレクチン)・MPA (アメリカハリグワレクチン)・NPA (ラッパズイセンレクチン)・PHA-E (インゲンマメレクチン)・PHA-L (インゲンマメレクチン)・PNA (ピーナッツレクチン)・PSA (エンドウレクチン)・PTL-I (シカクマメレクチン)・PTL-II (シカクマメレクチン)・PWM (ヨウシュヤマゴボウレクチン)・RCA120 (ヒママメレクチン)・SBA (ダイズレクチン)・SJA (エンジュレクチン)・SNA (セイヨウニワトコレクチン)・SSA (ニホンニワトコレクチン)・STL (ジャガイモレクチン)・TJA-I (キカラスウリレクチン)・TJA-II (キカラスウリレクチン)・UDA (Common Stinging Nettleレクチン)・UEA I (ハリエニシダレクチン)・VFA (ソラマメレクチン)・VVA (ヘアリーベッチレクチン)・WFA (フジレクチン)・WGA (パンコムギレクチン)などを挙げることができる。
以下、本発明を説明する際には、典型的な例として、細胞表層分子の各種糖鎖を認識し結合するレクチンを基板上に固定化する場合について、主に述べる。
なお、基板上に固定化した分子と、基板上の当該分子に結合した披検細胞表面にさらに結合させる第二の分子は、化合物群の種類も異なる方が好ましく、たとえば、各種レクチン群が固定化された基板を用いる場合には、通常、当該レクチンに結合している細胞表面上のタンパク抗原を認識する抗体や、細胞表面の受容体を認識するリガンド分子などが用いられる。
【0011】
(披検細胞の蛍光標識法)
本発明において、被験細胞表面を直接蛍光標識することもできるが、好ましくは細胞内に取り込ませて代謝後に蛍光色素として利用できる代謝変換型蛍光標識剤が用いられる。代謝変換型の蛍光標識剤としては、Invitrogen社のCell Trackerシリーズの色素を挙げることが出来るが、細胞内に取り込まれて代謝後に蛍光性をもつ物質であればこれらに限定されない。
【0012】
(基板の材料)
本発明における基板材料としては、細胞結合性分子を結合可能な、もしくは結合可能な状態に処理することができる材料であり、かつ細胞が発する蛍光を観察できる材料であれば何でも良いが、エバネッセント蛍光観察可能な材質であることが好ましい。すなわち、導光性を有し、エバネッセン波励起用照射手段により、その表面にエバネッセント波を発生できる材質が好ましく、硼珪酸ガラス、石英ガラス、合成石英ガラス、高屈折率光学ガラス(BK7、SFF03)などが例示できるが、これらに限定されるものではない。
また、本発明において、レクチンなど細胞結合性タンパク質の固定化に先立ち、あらかじめ基板表面を活性化させておくことが好ましい。その際に用いる化合物は、好ましくは、エポキシ基を活性基として有する化合物であるがこれに限定されるものではなく、ビニルスルホン基、活性エステル基、アルデヒド基、カルボキシル基、アミノ基、チオール基、イソチオシアネート基、ハイドロゲル層等がコートされた基板も同様に用いることができる。
【0013】
(基板の構造)
上記レクチンが固定化された基板は、複数の反応槽を形成させた基板であることが好ましい(図5)。より好ましくは、複数の穴を有するラバーを基板上面及び/又は下面に貼り付けることで、複数の反応槽を形成させた基板である。一例としては、図5記載のように、細胞表層分子に相互作用を示すタンパク質を固定化したスライドガラスに対し、本発明者らが設計・開発した8穴ラバーを所定の位置に貼り付け、8つの反応槽を作製させる。この8穴ラバーには8つの長方形の穴が規則正しく空いており、専用のアジャスター上でスライドガラスと密着させることによってスポット周囲に正確に蛍光標識化糖プローブ溶液を満たすことが可能となる。この反応槽に蛍光標識分子が封入された細胞を懸濁させた溶液を満たすことで、細胞に相互作用を示す固定化タンパク質との接触を円滑に行うことが可能になる。また反応槽は多数化することが好ましく、より好ましくは12, 16の反応槽を市販の96, 384ウェルプレートの規格と同じ間隔をおいて配置することが好ましい。
【0014】
(エバネッセント波励起蛍光観察用の基板)
本発明においては、生存状態の細胞表面の細胞表層分子と、基板表面に固定化された分子との結合状態を蛍光観察する際の観察手法として、エバネッセント波励起蛍光観察法を採用することが好ましく、その場合には、基板材料として上記したような導光性材料([0012])が用いられるが、該導光性材料基板の上面又は下面には反応槽形成ラバーが設けられている。
また、この反応槽形成ラバーには、基板全体を液浸した際に、導波路基板裏側を汚染から保護するために、図6に示されるように、反応槽を設けた方とは反対の側に保護シートを設けることが好ましい。保護シートの材質としては、基板を浸す溶媒が浸透しない材質であって、かつ光透過性の材質であればどのような素材でも良いが、サンプラテック社製プレートシール13314Eが好ましい。そして、図6に示されるような把持部を組み合わせることで、さらに取り扱い時の利便性を高めることができる。
【0015】
(基板上への細胞結合性分子の固定化)
本発明において使用する、抗体、レクチン等の細胞表層分子結合性タンパク質がその表面に複数種配置固定化された基板は、例えば、下記の方法で作製できる。
まずエポキシ基を活性基として有する化合物をコーティングした基板に、細胞結合性タンパク質をスポットし、細胞結合性タンパク質の有するアミノ基を利用して基板表面に固定化する。本発明においては、同一基板上に複数種の細胞結合性タンパクをスポットする。また、この際、複数種の細胞結合性タンパクは、その種類に応じて所定のパターンでスポットすることにより配置固定することが望ましい。これにより、被検細胞の異同判定、近似性判定が容易に行える。アレイの作製においては、市販のDNAマイクロアレイ作製用ピンタイプスポッターや非接触式インクジェットスポッターが利用できる。
【0016】
本発明の基板のうち、典型的なレクチンアレイについて述べると、当該基板上へのレクチンの固定化は、同一アレイスポットパターン内に同一種のレクチンスポットを複数個配置し、固定化することが望ましい。これにより同一種のレクチンに対する被験糖鎖あるいは複合糖質の相互作用に基づく蛍光強度の平均値を算出することが可能となり、スポットの大きさ・形状の不良や、基盤の不均一性に由来するレクチンの固定化量の相違、あるいはスポットに結合した標識プローブ分子数、励起光の不均一性や検出素子の電気的雑音等に由来する、測定したスポットシグナル強度のバラツキ等に起因する測定誤差を軽減できる。また、本発明の基板においては、糖タンパク質を解析する際に、レクチン等の糖鎖結合タンパク質を複数種配置固定するとともに、さらに糖タンパク質のタンパク質部分に対する抗体を配置固定することができる(ハイブリッドアレイの作製)。この基板によれば、糖タンパク質の糖鎖部分の解析とタンパク質部分の解析を同時に行うことができる。これによれば、タンパク質が異なるが糖鎖が同じもの、あるいは糖鎖が異なるが同じであるもの等を簡便に識別できる。
【0017】
(基板のブロッキング処理)
本発明においては、細胞結合性タンパク分子(レクチンなど)を固定化した基板を洗浄後、披検細胞の非特異的吸着を防止するために、基板上の非スポット領域の表面に残存する活性基(エポキシ基)をブロックする、ブロッキング操作工程を設けることが好ましい。
その際のブロッキング剤としては、エポキシ基と反応性を有する化合物を含むブロッキング剤であれば何でも良いが、タンパク質を含有しないブロッキング剤を用いることで、披検細胞の非スポット領域への非特異的吸着が大幅に減少し、バックグラウンド蛍光が大きく低下する。そのような非タンパク性ブロッキング剤としては、ポリエチレングリコールやトレハロースを含むブロッキング剤などが挙げられる、本願の実施例では、AR BROWN社製 StabilGuard Choice Biomolecule Stabilizerを用いた。
【0018】
(基板の保存方法)
本発明で得られた細胞結合性タンパク分子(レクチンなど)を固定化した基板は、固定化後すぐに、もしくはブロッキング工程の終了後、遠心機などを用いて基板上の水分を飛ばしてブロッキング剤など溶媒を除去した後に、冷蔵庫(4℃)などで低温保存するか、冷凍保存することにより、基板上の固定化タンパク質の活性を保持したまま長期保存することもできる。
【0019】
(基板表面の余剰細胞の除去/重力洗浄方法)
本発明において、アレイ基板表面の非スポット領域に、非特異的に吸着している細胞を除去するためには、重力を利用して沈降除去することが有効である。そして、細胞は、空気に接触すると気液界面摩擦がかかり、細胞の剥離や表面の障害に繋がるため、沈降除去工程においても、細胞が結合したアレイ基板表面が空気に接触されないことが求められる。
従って、本発明の沈降除去工程では、基板が十分に浸るだけの深さを持った洗浄槽に沈め、液浸状態のまま基板上面が下を向くように180度回転させた状態で静置し、非特異的な吸着細胞を重力を利用して沈降させる(図7)。沈降除去後、基板上面を元通り上面を向くように、基板を再度180度回転させた後で回収する工程を採用することが好ましい。ここで、上記洗浄槽中に満たす溶媒は、細胞の生育に影響を与えない水性溶媒が好ましく、たとえば、本願実施例で用いられたPBSバッファーが用いられる。
より好ましくは図8に記載の沈降除去用貯留槽を用いて簡便に実施することが出来る。この沈降除去用貯留槽は図8の3記載のトリガーの操作で基板の回転を制御できるのみならず図10の4,5に記載の注排水管を用いることにより、注排水工程も毎回均一に行うことが可能である。またより好ましい形態として、沈降除去用洗浄槽に具備された上記の部材が電動制御によって自動的に動き、一連の沈降除去工程を実施可能とする形態を挙げることができる。
【0020】
(披検細胞の蛍光観察法)
本発明においては、基板表面の非特異的に結合した余剰な細胞を除去した後、細胞に標識した蛍光分子を励起させて蛍光強度を、通常、基板上の位置情報のパターンとして観察する。
好ましくは、エバネッセント波励起法を利用した蛍光観察手法であり、上記非特許文献1などに記載されたエバネッセント波励起蛍光観察装置をそのまま用いることができる。具体的には基盤をステージ上にセットし、端面から適当なフィルターを通過した光を入射させ、基盤内部を全反射しながら通過する際に近接場ににじみ出てくるエバネッセント波を適当なフィルターをもつCCDカメラで撮影する。この手法を用いることで、基板上に固定化したレクチンと結合した細胞上の色素が選択的に励起され、結果、蛍光シグナルとして検出され、液相中における観察も可能になる。
本願の実施例では、エバネッセント蛍光観察法を用いており、当該手法を用いた場合について詳細に記載しているが、本発明は他のマイクロアレイ検出方式を用いる場合にも適用できる。たとえば、共焦点方式を用いて蛍光観察しても良く、顕微鏡による観察も可能である。
【0021】
上述したように、本発明は典型的には、まず、上記複数種のレクチン等の糖鎖結合性タンパク質を配置固定した基板を、タンパク質非含有ブロッキング剤で処理した後に、基板載置手段に載置し、該基板上に設けられた反応槽内において、細胞内部に蛍光標識分子を取り込ませた被検細胞含有試料と、基板上に固定化した各種糖鎖結合性タンパク質と被検細胞を接触させる。 次いで、液浸状態で基板表面の非特異的吸着細胞を沈降除去した後、披検細胞の結合の程度をエバネッセント波励起蛍光観察法などを用い、基板上の蛍光標識の強度を観察することによって、細胞表層分子の構造情報を観察する。
また、さらに、基板表面に結合した披検細胞に対して、当該細胞への結合能を持つ標識された第二の分子を含む溶液を基板に接触させ、上記蛍光波長とは異なる蛍光波長を用いて第二の分子の蛍光強度を観察することにより、さらに詳細な披検細胞の表層分子の構造情報を得ることができる。
たとえば、基板表面に固定化されたレクチンに対して細胞表層の糖鎖、複合糖鎖を介して結合した披検細胞の場合、当該糖鎖以外の細胞表層に存在するタンパク質を認識する抗体や、細胞表層の受容体タンパク質を認識するリガンド類を蛍光標識して、第二の分子として用いることができる。特に、癌マーカーとなるような特定タンパク質を認識するモノクローナル抗体を第二の分子として選択すれば、癌の診断にも有効である。
【実施例】
【0022】
以下に本発明の実施例を示すが、本発明はこれら実施例に限定されるものではない。
〔実施例1〕沈降除去工程の採用による、S/N比改善効果の観察(図9)
(1)マイクロアレイ基板の作成
本実施例ではアレイ上に細胞と相互作用する固定化タンパク質として、様々な糖結合特異性を持つタンパクで市販レクチンを43種類選択し、スライド基板上に固定化した。固定化した以下のレクチンの入手先は以下の通りである。LTL (ロータスマメレクチン)、UEA I (ハリエニシダレクチン)、AAL(ヒイロチャワンタケレクチン)、MAL(イヌエンジュレクチン)、SNA (セイヨウニワトコレクチン)、PHA(L) (インゲンマメレクチン)、PHA(E) (インゲンマメレクチン)、GSL II (グリフォニアマメレクチン)、NPA (ラッパズイセンレクチン)、GNA (ユキノハナレクチン)、HHL (アマリリスレクチン)、BPL (ムラサキモクワンジュレクチン)、EEL (Spindle Treeレクチン)、LEL (トマトレクチン)、STL (ジャガイモレクチン)、Jacalin(ジャックフルーツレクチン)、WFA (フジレクチン)、ACA(センニンコクレクチン)、MPA (アメリカハリグワレクチン)、VVA (ヘアリーベッチレクチン)、DBA (Horse gramレクチン)、GSL I (グリフォニアマメレクチン)、PTL-I (シカクマメレクチン)、MAH(イヌエンジュレクチン)、GSL IB4 (グリフォニアマメレクチン)はVECTOR社より購入したものを用いた。またPSA (エンドウレクチン)、LCA (レンズマメレクチン)、 TJA-I・TJA-II (キカラスウリレクチン)、 SSA (ニホンニワトコレクチン) 、RCA120 (ヒママメレクチン) 、ECA (デイゴマメレクチン)、 DSA (ヨウシュチョウセンアサガオレクチン)、 ConA (タチナタマメレクチン)、ABA(マッシュルームレクチン)、PWM (ヨウシュヤマゴボウレクチン)、PNA (ピーナッツレクチン)、SBA (ダイズレクチン)、WGA (パンコムギレクチン)は生化学工業社から、またUDA (Common Stinging Nettleレクチン)、GSL IA4 (グリフォニアマメレクチン)はEY Labolatories社から、AOL(コウジカビレクチン)は東京化成工業社から購入したものを用いた。
上記43種のタンパク質を松浪硝子工業社のマイクロアレイスポッティングバッファーを燐酸緩衝生理食塩水溶液(以下PBS)で2倍希釈した溶液を用いて、タンパク終濃度が0.5 mg/mLになるように溶解し、このスポット溶液をスライド基板に対し、非接触スポッター(Cartesian社Microsys4000)を用いて計43種の細胞結合性タンパク質分子を、湿度86%雰囲気内で直径450μmのスポットとして、スポット中心間間隔600μmの間隔をおいて横に3点ずつ配置されるよう基板表面にスポットした。次に基板への固定化反応を十分進行させる目的で飽和湿度を保った保湿箱中で24時間、固定化インキュベート反応を行った。次に本発明者らが設計・開発した8穴ラバーをスライド基板上の所定の位置に貼り付け、8つの反応槽を作製した(この8穴ラバーは厚さ1mmの黒色シリコンゴム製で、縦横9.5 × 7.5 mmからなる8つの長方形の穴が規則正しく空いており、スライド基板に貼り付けたときに8つの反応槽を形成する)。この反応槽は100 μLの試料溶液を反応槽内部に注入することで、反応槽内の基板表面を十分量の試料溶液で満たすことができる)。その後、基板を界面活性剤である1% Triton-X 100(ナカライテスク社)と500 mMグリシン(ナカライテスク社)を含有するトリス緩衝生理食塩水溶液で洗浄した。次に基板上の非スポットした領域の表面に残存する活性基(エポキシ基)をブロックして、細胞の非特異的吸着を防止するため、非スポット領域に対するブロッキング操作を行った。洗浄液を反応槽から除いた後に、タンパク非含有の表面ブロッキング剤であるStabilGuard Choice Biomolecule Stabilizer(AR BROWN社)を反応槽内に100 μL注入し、20 ℃で1時間静置した。ブロッキング工程が終わったら、次にスライドガラス用遠心機(スピンドライヤーミニ・和研薬工業)を用いて基板上の水分を飛ばしてブロッキング剤を除去した後に、基板上のタンパク活性が低下することを防ぐために冷蔵庫(4 ℃)内で基板を保管した。
【0023】
(2)CMRA標識CHO細胞懸濁液の調製とアレイ基板への注入
本発明者らの研究室で培養した3×106個のチャイニーズハムスター卵巣細胞(以下CHO細胞)を、遠心沈殿させて上清を捨てた後に、無血清培地を加えて0.3 mL中に懸濁させた。
次に37℃の水浴にて5分間湯せんをした後、細胞内に色素を取り込ませる作業へ移った。細胞内変換型色素であるCell Tracker Orange CMRA (Invtrogen社)を細胞懸濁液に終濃度5-10 μMになるように加え、37 ℃で30分インキュベートした。次に、遠心して細胞のみを回収した後に、1% BSAを含むPBS溶液を加え、遠心後に捨てて、再度1% BSAを含むPBS溶液に懸濁させた。この1% BSAを含むPBS溶液に懸濁させたCMRA標識細胞懸濁溶液をマイクロアレイ上の反応槽に100 μLずつ注入し、4 ℃の冷蔵庫内で1時間静置してインキュベートした。
【0024】
(3)沈降除去法の効果の確認
インキュベーション工程が終了した後にアレイ基板に対し、アレイ基板上の非スポット領域に非特異的に吸着している細胞を沈降除去させる工程を行った(図9)。具体的にはPBSバッファーを満たした沈降除去用反応槽中に基板上面に結合した細胞に空気が接触しないように十分な深さまで基板を沈め、次にPBSバッファー中で基板上面が下を向くように180度回転させた状態で、室温で30分間静置することで行った。回転は空気の泡が反応槽内に入らないよう留意して行った。30分の沈降反応後にPBSバッファー中で基板を再度180度回転させて、基板上面が元通り上面を向くように回転させた後に、基板をバッファー中より回収した。回収した基板は基板に付着した水滴をふき取った後に、エバネッセント波励起方式マイクロアレイスキャナーであるSC-profiler(モリテックス社製)を使用して基板端面より励起光を入射し、励起されて生じた蛍光発光を、基板から見て下方に配置されているCCDカメラで検出した。以下の実験時のカメラ感度パラメーターはGain「105倍」、積算回数「4回」、露光時間「199 msec」で統一した。
結果、図9に示すように、細胞沈降除去を行わない場合でも、蛍光観察は可能ではあるが、細胞沈降除去法を採用することでアレイ基板上の非スポット領域に非特異的に吸着している細胞が重力によって穏やかな条件下で除去される結果、アレイスキャン画像における背景蛍光が減少し、S/N比の著しい改善が確認された。この実験によって、沈降除去法の採用が実用上極めて有効に機能することが確認された。
【0025】
〔実施例2〕細胞内変換型色素であるCMRAの細胞との混合比の検討(図10)
(1)CMRAの細胞との混合比の検討
実施例1(2)に記載した被検細胞のCMRA標識工程において、被検細胞に対して共存させるCMRA濃度を0, 0.25, 0.5, 1、2.5, 5 μMと変化させて標識反応を行った後に、マイクロアレイを用いた生細胞表層糖鎖プロファイリングを行った(図10)。結果標識工程時のCMRA濃度依存的に各スポットの蛍光強度は増大することが分かった。CMRA標識工程における細胞に対して共存させる適切CMRA濃度は5 μM 程度であることが確認された。
【0026】
〔実施例3〕 43種のタンパク質を固定化したマイクロアレイに細胞内変換型蛍光色素で標識した細胞を破壊せずに接触・反応させた試験(図11)
(1)適切な細胞数の検討
上記実施例にて記載したCMRA標識した被検細胞懸濁液をアレイ基板と接触させる工程において、どの程度の細胞数をアレイ基板上の反応槽に注入するのが適切であるかの検討を行った。アレイ基板上の反応槽に注入するCMRA標識した被検細胞の細胞数を 0, 10000, 30000, 50000, 100000, 300000個と変化させて、上記実施例に記載のマイクロアレイを用いた細胞表層プロファイリング法を行った(図11)。結果CMRA標識した被検細胞懸濁液をアレイ基板と接触させる工程において、適切な細胞数は本実験条件においては各反応槽あたり1×105個程度であると確認された。
【0027】
〔実施例4〕 アレイ表面への低吸着表面ブロッキング処理工程の採用による、非スポット領域に対する被検標識細胞の非特異的吸着抑制効果を確認する検討(図12, 13)
(1)低吸着表面ブロッキング処理工程の効果の確認
表面ブロッキング処理工程の被検標識細胞の基板への非特異的吸着の程度への影響を観察することを目的として、タンパク非含有ブロッキング剤と、従来のマイクロアレイで汎用されている1%BSAを含有するPBS溶液の2種のブロッキング剤でブロッキング処理したスライド基板を作成し、非特異的吸着抑制効果を比較した(図12)。なお、タンパク非含有の表面ブロッキング剤にはStabilGuard Choice Biomolecule Stabilizer(AR BROWN社)を用い、BSA処理群・タンパク非含有ブロッキング剤処理群、共に反応槽内にブロッキング剤を100 μL満たした状態で20 ℃インキュベーター内に1時間静置し、非スポット領域のブロッキング操作を行った(図13)。このスライド基板を用いて上記実施例に従い、マイクロアレイ基板に対し被検細胞懸濁液を接触させて評価した。結果、従来のBSAブロッキング剤による処理ではなく、タンパク非含有の表面ブロッキング剤処理を行うことで、被検細胞の非特異的吸着抑制効果が飛躍的に増大することが確認された。
【0028】
〔実施例5〕 アレイ基板にヒトを含む動物由来のレクチンを固定化したマイクロアレイの試験(図14)
(1)マイクロアレイ基板の作成
本実施例ではアレイ上に細胞と相互作用する固定化タンパク質として、様々な糖結合特異性を持つタンパクである動物性レクチンであるガレクチン類5種(ヒトガレクチン(C2S)、海綿ガレクチン(GC1)、ニワトリガレクチン(C14)、ニワトリガレクチン(C16)、ヒトガレクチン-3(Gal-3))を固定化した。またポジティブコントロールとして植物レクチンである、リママメレクチン(RCA120)、セイヨウニワトコレクチン(SNA)を選択した(図14)。またネガティブコントロールとしてウシ血清アルブミン(BSA)を選択した。今回の実験ではガレクチン類5種は本発明者らの研究室で大腸菌にて発現・精製したものを用いた。SNAはVECTOR社より、BSAについてはSIGMA社より、RCA120は生化学工業より購入したものを用いた。上記タンパクを松浪硝子工業社のマイクロアレイスポッティングバッファーをPBSで2倍希釈した溶液を後いて、0.5 mg/mLになるように溶解した後、前述の非接触式スポッターにてスライドガラス上にスポットしアレイを作製した。
【0029】
(2)糖タンパクプローブの調製とアレイ基板への注入
蛍光標識化糖タンパク質プローブとして、550 nm付近に吸収極大波長を持つ蛍光色素であるCy3 Mono-reactive Dye(アマシャムファルマシア社、以下Cy3)で蛍光標識化したアシアロフェツイン(SIGMA社、以下ASF)を用いた。ASFは1分子あたりそれぞれ3本のN-結合型糖鎖とO-結合型糖鎖をもち、且つ糖鎖の非還元末端のシアル酸キャップが部分的に外れている糖鎖構造を持つことが知られている。このASFをPBSに終濃度1 mg/mLになるよう調製した後、1 mLについて1.0 mgのCy3色素粉末と混合させ、1時間、暗所で反応させた。次に担体としてSephadex G-25を用いたゲルろ過クロマトグラフィーにより、遊離のCy3とCy3-ASFを分離回収・精製した。
(1)の工程で作製したアレイ基板上のタンパク質が、生体内での機能活性を保持しているかを確認するために、上記の工程で調製したCy3-ASFを蛍光標識化糖タンパク質プローブとして(1)の工程で作製したアレイ基板上の反応槽に100 μLずつ加え、アレイ基板上のタンパク質との結合反応の観察を行った。Cy3-ASFは終濃度100 ng/mLになるよう1% Triton-X100、500 mMグリシンを含有するTBSに溶解したものを調製した。次に基板をレクチン-糖鎖間の反応が平衡に達するまで3時間、20 ℃でインキュベートした後に、エバネッセント波励起方式マイクロアレイスキャナー(Sc-profiler)を使用して、アレイ表面に結合したCy3-ASFの量を蛍光量で観察した。
結果、プローブ分子が持つ末端ラクトース構造に結合親和性を示すことが知られているガレクチン類5種(C2S、GC1、C14、C16、Gal-3)とポジティブコントロールであるリママメレクチン(RCA120)のスポットが光り、プローブ分子が持つ末端ラクトース構造に結合親和性をほとんど示さないセイヨウニワトコレクチン(SNA)とネガティブコントロールであるウシ血清アルブミン(BSA)のスポットは光らなかった(図14)。またこの結合反応は競合阻害糖である100 mMのラクトース共存下で特異的に阻害された。本実験の結果から、活性を保ったまま固定化することが難しいヒト由来を含む動物レクチンがその機能活性を保持したまま基板上に固定化されていることが確認された。
【0030】
(3)CMRA標識CHO細胞懸濁液の調製とアレイ基板への注入
CMRA標識CHO細胞懸濁液を、(1)の工程で作製したスライドに対し前述の方法に従った処理工程を行った後に、エバネッセント波励起マイクロアレイスキャナーで蛍光観察した。
この実験の結果、図14に示すように、細胞が、基板上に固定化した動物レクチンアレイに特異的に結合する様子が観察された。またこの結合反応は競合阻害糖である100 mMのラクトース共存下で阻害された。本実験の結果から、活性を保ったまま固定化することが難しいヒト由来を含む動物レクチンを固定化したマイクロアレイが、本発明である細胞表層観察アプリケーションにおいても有効に使用できることが確認された。
【0031】
〔実施例6〕 蛍光標識化抗体を用いることによる結合した細胞の同定試験
前述の方法に従いマウスリンパ球をCMRAで標識する工程を行った後、細胞を終濃度で5 ug/mlに調整したAlexafluor488標識CD45抗体と、暗所で4C、30分インキュベートした。遠心して細胞のみを回収した後、1% BSAを含むPBS溶液で細胞を洗浄後、再度1% BSAを含むPBS溶液に懸濁させた。前述の方法に従い細胞をアレイ基盤に反応させて洗浄後、エバネッセント波励起マイクロアレイスキャナーで2つの異なるフィルターを用いて蛍光観察した。
本実験の結果、T細胞とB細胞の混合物であるマウスリンパ球全体の糖鎖プロファイリングを行うと同時に、結合した細胞の一部がT細胞であることを同定することができ、細胞混合物に対して、更に特定タンパク質を認識するモノクローナル抗体を第二の分子として使用することにより、結合した披検細胞を同定することが可能となることが確認された。
【図面の簡単な説明】
【0032】
【図1】エバネッセント波励起蛍光観察法の原理を示す図である。
【図2】反応槽を具備した導波路基板をエバネッセント波励起蛍光観察する際の装置構成を示す図である。
【図3】従来の細胞を破壊してアレイに接触反応させ、アレイ結合プロファイルを得る方法の操作工程を示す図である。
【図4】本発明における細胞を生きたままアレイに接触反応させ、アレイ結合プロファイルを得る方法の操作工程を示す図である。
【図5】裏面への着水防止用保護シートの装備により、沈降洗浄時に着水から基板裏面を保護する機能を備える低吸着表面加工アレイ基板の外観の一例を示す図である。
【図6】低吸着表面加工アレイ基板の構造的特徴を示す側面図である。
【図7】沈降除去法の工程手順を示す図である。
【図8】沈降除去工程の操作をトリガーレバーの操作によりスライドガラスを液浸状態で回動させることで、簡易に操作を行う方法を提供するための器具の一例を示す図である。
【図9】沈降除去工程の採用による、S/N比の改善効果を示す図である。
【図10】細胞内変換型蛍光色素であるCMRAの配合量を検討した試験結果の一例を示す図である。
【図11】43種のタンパク質を固定化したマイクロアレイに細胞内変換型蛍光色素で標識した細胞を破壊せずに接触・反応させた試験結果を示す図である。
【図12】アレイ表面への低吸着表面ブロッキング処理工程の採用による、非スポット領域に対する細胞の非特異的吸着抑制効果を示す図である。
【図13】低吸着表面加工アレイ基板の乾燥保存法の工程手順を示す図である。
【図14】アレイ基板にヒトを含む動物由来のレクチンを固定化したマイクロアレイの試験例を示す図である。
【技術分野】
【0001】
本発明はマイクロアレイ法を利用した、細胞表層の糖鎖、タンパク質、脂質の解析方法及び該方法に使用する部材に関する。
【背景技術】
【0002】
エバネッセント波励起法を利用した蛍光観察手法は、顕微鏡の分野でタンパク質の1分子観察を可能とするなど、近年高い成果を挙げている技術である。エバネッセント波励起蛍光観察法では、まず蛍光標識した被検分子(以下プローブ分子)を含む溶液を基板上に接触させ、次にこの基板表面にて光を全反射させる。この時、界面近傍数百nmに限定的に発生するエバネッセント波により基板-液層界面近傍の蛍光標識プローブ分子のみを選択的に励起することが可能である。このとき基板上にプローブ分子と相互作用する分子を複数固定化すると、プローブ分子と固定化分子の相互作用の程度をアレイ基板上の蛍光強度にてモニタリングすることが可能となる(図1)。このエバネッセント波励起蛍光観察法をマイクロアレイに応用することで、液相中で多数の被験分子とアレイ基板上に固定した分子との結合状態を洗浄せずに観察することが可能になる。
本発明者らは入射光をスラブ型導波路基板端面より入射し、スライド基板内を繰り返し全反射させてエバネッセント波を発生させ、このエバネッセント波により励起されるプローブ分子が発する蛍光を観察することによって、複数種の分子を固定化したマイクロアレイスライド基板表面とプローブ分子間の相互作用観察方法を提供してきた(図2)。(特許文献1,2)。
【0003】
さらに本発明者らは、従来フローサイトメトリー等によって行われてきた細胞表面と結合性プローブ分子との結合解析を、さらに高速化し、より簡便・安価な方法を提供するための新たな方法として、エバネッセント波励起蛍光検出を用いたマイクロアレイ法に着目した。2005年には本発明者らは上記の方法が細胞表面におけるタンパクや糖鎖の提示状態の判別に使用できることを示し、世界に先駆け発表した(非特許文献1)。しかし非特許文献1にあるような細胞表層タンパク質のプロファイリング解析手法では、被検細胞の細胞表層を蛍光標識化後に、細胞を破壊して細胞抽出液としてマイクロアレイに接触・観察する工程(図3)を必須としていた。細胞表面には糖鎖、タンパク質、脂質の高次構造が構築され、その量だけでなく密度も生体機能に重要であることが知られている。細胞を破壊する工程を含む非特許文献1の方法では、上記の糖鎖、タンパク質、脂質の高次構造が破壊され、それらの構造情報が失われてしまうという内在的な問題があった。また、蛍光標識化されていない細胞内容物中の糖鎖やタンパク質などによる競合阻害反応や、プロテアーゼやグリコシダーゼによる分解作用などの影響が危惧されるなど、方法に多くの課題点が残っていた。
【特許文献1】特願2003-430848
【特許文献2】特願2005-184171
【非特許文献1】J Biochem (Tokyo). 2006 Mar;139(3):323-7.
【発明の開示】
【発明が解決しようとする課題】
【0004】
細胞の表層に露出している成分として知られるタンパク質、糖鎖、脂質等の量やその密度は、細胞の状態を克明に反映したいわば「表情」であり、発生・分化・癌化等の過程で特徴ある変化を起こすことが知られている。
本発明の課題は、この細胞表層上の変化を、細胞を破壊せずに観察することができるアレイ基板を提供することであり、また当該基板を用いて生存状態の細胞表層に存在するタンパク質、糖鎖、脂質のプロファイリングを簡便、迅速に行う手段を提供することである。
【課題を解決するための手段】
【0005】
本発明者らは、上記目的を達成できる基板及びプロファイリング手法を鋭意検討した結果、生存状態の細胞であっても、蛍光標識した当該細胞を含んだ溶液を、細胞結合能を有する複数の分子が固定化されたアレイ基板と接触させることで、アレイ基板上の特定の分子と特異的に結合することができ、基板上での蛍光標識観察が十分に可能であることを見い出した。
さらに、実用的な蛍光観察をするためには、アレイ基板の非スポット領域に対して細胞が非特異的に吸着してしまうことが最大の障害となることに着目し、披検細胞を基板表面に接触させた後で、基板表面上に非特異的に吸着している余剰細胞を除去する工程を設け、バックグラウンド蛍光を低下せしめることで実用的観察を可能にすることができた。その際の最も効果的な基板表面上の非特異的に吸着している余剰細胞の除去方法として、液浸状態のマイルドな条件下で、重力による沈降除去する手法(重力洗浄法)を開発した。
また、アレイ表面の非スポット領域への被検細胞の非特異的吸着を抑制するコーティングを施した低吸着基板を開発し、さらに、細胞表面に影響を与えない細胞蛍光標識法である内部標識法などを効果的に組み合わせることでS/N比の大幅な向上を達成することができた。
これらの知見に基づいて、生細胞をそのままアレイ基板表面で観察可能な、細胞表層のプロファイル変化の検出に必要な実用感度とS/N比を達成することができ、本発明の完成に至ったものである。
【0006】
すなわち本発明は以下のとおりである。
(1)披検細胞の細胞表層分子の構造情報を、披検細胞が生存している状態で観察する方法であって、以下の(a)〜(e)の工程を含む方法。操作工程の概略を図4に示す。
(a)表面に被検細胞と結合能を持つ分子を複数固定した基板を用意する工程、
(b)披検細胞を、生存状態のままで蛍光標識する工程、
(c)工程(a)で用意された基板に、工程(b)で蛍光標識した生存状態の被検細胞を含有する溶液を接触させ、披検細胞を上記基板表面上の分子と結合させる工程、
(d)工程(c)において、基板表面に非特異的に吸着している余剰な細胞を除去する工程、
(e)工程(d)において余剰細胞が除去された基板上の披検細胞からの蛍光強度を観察する工程。
(2)前記(e)の工程に先立ち、もしくは前記(e)の工程の後で、さらに下記の工程(f)及び(g)を設けることを特徴とする前記(1)に記載の方法。
(f)前記基板表面上の分子と結合した披検細胞に対して、当該細胞への結合能を持つ標識された第二の分子を含む溶液を基板に接触させる工程、
(g)工程(e)で用いた蛍光波長とは異なる蛍光波長を用いて上記第二の分子の蛍光強度を観察する工程。
(3)前記工程(e)及び/又は(g)における、基板上の蛍光強度の観察を、エバネッセント波励起蛍光観察法によって行うことを特徴とする前記(1)又は(2)に記載の方法。
(4)前記(a)の工程において、基板表面に被検細胞と結合能を持つ分子を複数固定した後、基板表面に残存する活性基をブロックする工程を設けることを特徴とする前記(1)ないし(3)のいずれかに記載の方法。
(5)前記基板表面に残存する活性基をブロックするためのブロッキング剤として、非タンパク性ブロッキング剤を用いる前記(4)に記載の方法。
(6)前記(b)の工程において、蛍光標識剤として用いる蛍光色素を、生存状態の被検細胞の細胞内に導入することを特徴とする、前記(1)ないし(5)のいずれかに記載の方法。
(7)蛍光標識剤として用いる蛍光色素が、代謝変換型蛍光色素である、前記(6)に記載の方法。
(8)前記(d)の工程を液浸状態で行うことを特徴とする前記(1)ないし(7)のいずれかに記載の方法。
(9)前記(d)の工程において、前記基板を液浸状態で180度回転させて下向きとすることにより、前記余剰細胞を重力により沈降除去することを特徴とする前記(8)に記載の方法。
(10)前記基板から前記余剰細胞を重力により沈降除去する際に、注水機構及び排水機構を有する貯留槽内に、両端に連動して回転する機構を備えたスライドホルダーが複数連設された装置を用い、各スライドホルダー上に、前記基板を装着し、スライドホルダーが液浸するまで注水した後、空気が混入しないようにすべてのスライドホルダーを180度回転させて下向きとし、前記余剰細胞が沈降除去されるのを待って、再度180度回転させて上向きとし、貯水槽内の液を排水した後、前記基板をスライドホルダーからはずすことを特徴とする、前記(9)に記載の方法。
(11)前記(5)ないし(10)のいずれかに記載の方法で用いられる基板であって、表面に被検細胞と結合能を持つ分子を複数固定した後で、基板表面に残存する活性基が非タンパク質ブロッキング剤によるブロッキング処理が施されている基板。
(12)前記基板が、乾燥状態で冷蔵又は冷凍して保存されている、前記(11)に記載の基板。
(13)基板そのものを導波路基板として利用し、エバネッセント波励起蛍光観察のために用いることを特徴とする、前記(11)又は(12)に記載の基板。
(14)前記導波路基板を挟み込むように表裏両面に反応槽形成部材を接着させ、裏面の反応層形成部材上に基板表面保護膜を具備することを特徴とする、前記(13)に記載の基板。
(15)前記(10)に記載の方法において用いられる装置であって、注水機構及び排水機構を有する貯留槽、及び当該貯水槽内に、基板を装着可能なスライドホルダーであり、かつ、両端に、連動して回転する機構を備えたスライドホルダーが複数連設されている、基板液浸用装置。
【発明の効果】
【0007】
本発明により、細胞表面に影響を与えることなく細胞を蛍光標識することができ、また本発明により、アレイ基板表面に非特異的に吸着している細胞を効果的に除去することができるので、細胞が結合したアレイ基板を蛍光強度による観察、例えばエバネッセント波励起蛍光法を用いて観察する際の最大の障害要因となる背景蛍光の発生を抑制し、これにより高いS/N比での蛍光観察が可能となる。結果として、液相中で非破壊状態の生きた細胞のアレイ結合プロファイル観察を簡便な操作にて、実用的感度で観察しうる手段と、それを可能にするために最適化された部材を提供することができる。
【発明を実施するための最良の形態】
【0008】
本発明は、生きた細胞を破壊せずに蛍光標識化した後に、これをそのままアレイ基板上に接触させ、基板上の細胞からの蛍光を観察するものであり、好ましくは、エバネッセント波励起蛍光観察方式を用いる細胞表層分子の解析手法に関するものである。
【0009】
(本発明における解析対象となる細胞表層分子)
本発明方法における解析対象となる細胞表層分子としては、細胞表層上に存在するタンパク質又は糖鎖又は複合糖質又は脂質などであり、その種類については特に制限はないが、タンパク質としては例えば、各種受容体、CD抗原、レセプターなどが挙げられる。
糖鎖として、例えば糖タンパク質系糖鎖(N-結合型糖鎖とO-結合型糖鎖)、糖脂質系糖鎖、グリコサミノグリカン系糖鎖、又は多糖類由来オリゴ糖鎖などが挙げられる。又、1)N-結合型糖鎖としては、高マンノース型・混成型・複合型からなるN-結合型糖鎖など、2)O-結合型糖鎖としては、ムチン型(O-GalNAc)・O-Fuc型・O-Man型・O-Glc型などからなるO-結合型糖鎖など、3)糖脂質系糖鎖としては、ガングリオ系列・グロボ系列・ラクト・ネオラクト系列糖鎖など、4)グリコサミノグリカン系糖鎖としては、ヒアルロン酸・ケラタン硫酸・ヘパリン・ヘパラン硫酸・コンドロイチン硫酸・デルマタン硫酸など、5)多糖類由来オリゴ糖鎖としては、キチン、セルロース、カードラン、ラミナリン、デキストラン、デンプン、グリコーゲン、アラビノガラクタン、アルギン酸、フルクタン、フコイダン、キシランなどに由来するオリゴ糖鎖などが例示できる。
またその他の糖鎖としては、M3・M5A・Hybrid (monoagalacto,bisect)・NA1・NA1(α1-6Fuc)・NA2 (monoagalacto)・NA2 (monoagalacto, bisect)・NA2・NA2 (α1-6Fuc)・A2・NA2(bisect)・NA3・NA3 (α1-6Fuc)・NA4・NA4 (α1-6Fuc)・NA5 (pentaagalacto, bisect)・Lactose・GA2・GA1・GM3-NeuAc・GM3-NeuGc・GM1・GM2・GD1a・GD1b・GD3・Gb3・Gb4・Forssman・LNnT・LNT・Galili pentasaccharide・B-hexasaccharide・LNFP-I・LNFP-II (Lea)・LNFP-III (LeX)・LNFP-II (Leb)・A-hexasaccharide・A-heptasaccharide・B-pentasaccharide・6'-Sialyl lactose・pLNH・βGalLac・βGal2Lac ・LN3・GN3・GN4・maltotriose・Sialyl LeXなどを挙げることができる。
また、本発明において、複合糖質とは、糖鎖を持つ生体内高分子の総称である。本発明の複合糖質としては、糖タンパク質(糖ペプチドも含む)、プロテオグリカン、糖脂質が挙げられる。
【0010】
(本発明における基板上に固定する細胞結合性分子)
本発明における基板上に固定する細胞結合性分子としては、上記本発明における解析対象となる細胞表層分子と結合性を有する分子であれば、どのような種類の分子でも良いが、好ましくは細胞結合性タンパク分子が用いられる。また、基板上に固定する際には、決められた位置に整然と固定してマイクロアレイ基板とすることが好ましい。
細胞結合性タンパク分子としては、例えば抗体や糖結合性タンパク質であるレクチン又は生体内レセプターなどが好ましく、これらを単独で用いても組み合わせて用いても良い。抗体としてはIgG、IgM、IgA、IgE、IgYなどのサブクラスを含む、ポリクローナル抗体又はモノクローナル抗体又は一本鎖抗体などが挙げられる。また基板に固定する細胞結合性タンパク質には、ポリペプチド鎖や上記タンパク質を部位特異的変異導入や化学修飾・糖鎖改変などの方法で物性や結合特異性、および親和力などを改変したものも挙げられ、本明細書でいう細胞結合性タンパク質としてはこのようなペプチド・タンパク質変異体も包含する。
レクチンとしては、動・植物、真菌、細菌、ウィルスなどから得られる様々な分子家系に属するレクチン、すなわち、細菌を含むすべての生物界で見出されるリシンB鎖関連の「R型レクチン」、真核生物全般に存在し糖タンパク質のフォールディングに関与する「カルネキシン・カルレティキュリン」、多細胞動物に広く存在し、「セレクチン」、「コレクチン」等代表的なレクチンを多く含むカルシウム要求性の「C型レクチン」、動物界に広く分布しガラクトースに特異性を示す「ガレクチン」、植物豆科で大きな家系を形成する「豆科レクチン」、およびこれと構造類似性をもち動物細胞内輸送に関わる「L型レクチン」、リソソーム酵素の細胞内輸送に関わるマンノース6-リン酸結合性の「P型レクチン」、グリコサミノグリカンをはじめとする酸性糖鎖に結合する「アネキシン」、免疫グロブリン超家系に属し「シグレック」を含む「I型レクチン」などが挙げられる。その他のレクチンとしては、ACA(センニンコクレクチン)・BPL (ムラサキモクワンジュレクチン)・ConA (タチナタマメレクチン)・DBA (Horsegramレクチン)・DSA (ヨウシュチョウセンアサガオレクチン)・ECA (デイゴマメレクチン)・EEL (Spindle Treeレクチン)・GNA (ユキノハナレクチン)・GSL I (グリフォニアマメレクチン)・GSL II (グリフォニアマメレクチン)・HHL (アマリリスレクチン)・ジャカリン(ジャックフルーツレクチン)・LBA (リママメレクチン)・LCA (レンズマメレクチン)・LEL (トマトレクチン)・LTL (ロータスマメレクチン)・MPA (アメリカハリグワレクチン)・NPA (ラッパズイセンレクチン)・PHA-E (インゲンマメレクチン)・PHA-L (インゲンマメレクチン)・PNA (ピーナッツレクチン)・PSA (エンドウレクチン)・PTL-I (シカクマメレクチン)・PTL-II (シカクマメレクチン)・PWM (ヨウシュヤマゴボウレクチン)・RCA120 (ヒママメレクチン)・SBA (ダイズレクチン)・SJA (エンジュレクチン)・SNA (セイヨウニワトコレクチン)・SSA (ニホンニワトコレクチン)・STL (ジャガイモレクチン)・TJA-I (キカラスウリレクチン)・TJA-II (キカラスウリレクチン)・UDA (Common Stinging Nettleレクチン)・UEA I (ハリエニシダレクチン)・VFA (ソラマメレクチン)・VVA (ヘアリーベッチレクチン)・WFA (フジレクチン)・WGA (パンコムギレクチン)などを挙げることができる。
以下、本発明を説明する際には、典型的な例として、細胞表層分子の各種糖鎖を認識し結合するレクチンを基板上に固定化する場合について、主に述べる。
なお、基板上に固定化した分子と、基板上の当該分子に結合した披検細胞表面にさらに結合させる第二の分子は、化合物群の種類も異なる方が好ましく、たとえば、各種レクチン群が固定化された基板を用いる場合には、通常、当該レクチンに結合している細胞表面上のタンパク抗原を認識する抗体や、細胞表面の受容体を認識するリガンド分子などが用いられる。
【0011】
(披検細胞の蛍光標識法)
本発明において、被験細胞表面を直接蛍光標識することもできるが、好ましくは細胞内に取り込ませて代謝後に蛍光色素として利用できる代謝変換型蛍光標識剤が用いられる。代謝変換型の蛍光標識剤としては、Invitrogen社のCell Trackerシリーズの色素を挙げることが出来るが、細胞内に取り込まれて代謝後に蛍光性をもつ物質であればこれらに限定されない。
【0012】
(基板の材料)
本発明における基板材料としては、細胞結合性分子を結合可能な、もしくは結合可能な状態に処理することができる材料であり、かつ細胞が発する蛍光を観察できる材料であれば何でも良いが、エバネッセント蛍光観察可能な材質であることが好ましい。すなわち、導光性を有し、エバネッセン波励起用照射手段により、その表面にエバネッセント波を発生できる材質が好ましく、硼珪酸ガラス、石英ガラス、合成石英ガラス、高屈折率光学ガラス(BK7、SFF03)などが例示できるが、これらに限定されるものではない。
また、本発明において、レクチンなど細胞結合性タンパク質の固定化に先立ち、あらかじめ基板表面を活性化させておくことが好ましい。その際に用いる化合物は、好ましくは、エポキシ基を活性基として有する化合物であるがこれに限定されるものではなく、ビニルスルホン基、活性エステル基、アルデヒド基、カルボキシル基、アミノ基、チオール基、イソチオシアネート基、ハイドロゲル層等がコートされた基板も同様に用いることができる。
【0013】
(基板の構造)
上記レクチンが固定化された基板は、複数の反応槽を形成させた基板であることが好ましい(図5)。より好ましくは、複数の穴を有するラバーを基板上面及び/又は下面に貼り付けることで、複数の反応槽を形成させた基板である。一例としては、図5記載のように、細胞表層分子に相互作用を示すタンパク質を固定化したスライドガラスに対し、本発明者らが設計・開発した8穴ラバーを所定の位置に貼り付け、8つの反応槽を作製させる。この8穴ラバーには8つの長方形の穴が規則正しく空いており、専用のアジャスター上でスライドガラスと密着させることによってスポット周囲に正確に蛍光標識化糖プローブ溶液を満たすことが可能となる。この反応槽に蛍光標識分子が封入された細胞を懸濁させた溶液を満たすことで、細胞に相互作用を示す固定化タンパク質との接触を円滑に行うことが可能になる。また反応槽は多数化することが好ましく、より好ましくは12, 16の反応槽を市販の96, 384ウェルプレートの規格と同じ間隔をおいて配置することが好ましい。
【0014】
(エバネッセント波励起蛍光観察用の基板)
本発明においては、生存状態の細胞表面の細胞表層分子と、基板表面に固定化された分子との結合状態を蛍光観察する際の観察手法として、エバネッセント波励起蛍光観察法を採用することが好ましく、その場合には、基板材料として上記したような導光性材料([0012])が用いられるが、該導光性材料基板の上面又は下面には反応槽形成ラバーが設けられている。
また、この反応槽形成ラバーには、基板全体を液浸した際に、導波路基板裏側を汚染から保護するために、図6に示されるように、反応槽を設けた方とは反対の側に保護シートを設けることが好ましい。保護シートの材質としては、基板を浸す溶媒が浸透しない材質であって、かつ光透過性の材質であればどのような素材でも良いが、サンプラテック社製プレートシール13314Eが好ましい。そして、図6に示されるような把持部を組み合わせることで、さらに取り扱い時の利便性を高めることができる。
【0015】
(基板上への細胞結合性分子の固定化)
本発明において使用する、抗体、レクチン等の細胞表層分子結合性タンパク質がその表面に複数種配置固定化された基板は、例えば、下記の方法で作製できる。
まずエポキシ基を活性基として有する化合物をコーティングした基板に、細胞結合性タンパク質をスポットし、細胞結合性タンパク質の有するアミノ基を利用して基板表面に固定化する。本発明においては、同一基板上に複数種の細胞結合性タンパクをスポットする。また、この際、複数種の細胞結合性タンパクは、その種類に応じて所定のパターンでスポットすることにより配置固定することが望ましい。これにより、被検細胞の異同判定、近似性判定が容易に行える。アレイの作製においては、市販のDNAマイクロアレイ作製用ピンタイプスポッターや非接触式インクジェットスポッターが利用できる。
【0016】
本発明の基板のうち、典型的なレクチンアレイについて述べると、当該基板上へのレクチンの固定化は、同一アレイスポットパターン内に同一種のレクチンスポットを複数個配置し、固定化することが望ましい。これにより同一種のレクチンに対する被験糖鎖あるいは複合糖質の相互作用に基づく蛍光強度の平均値を算出することが可能となり、スポットの大きさ・形状の不良や、基盤の不均一性に由来するレクチンの固定化量の相違、あるいはスポットに結合した標識プローブ分子数、励起光の不均一性や検出素子の電気的雑音等に由来する、測定したスポットシグナル強度のバラツキ等に起因する測定誤差を軽減できる。また、本発明の基板においては、糖タンパク質を解析する際に、レクチン等の糖鎖結合タンパク質を複数種配置固定するとともに、さらに糖タンパク質のタンパク質部分に対する抗体を配置固定することができる(ハイブリッドアレイの作製)。この基板によれば、糖タンパク質の糖鎖部分の解析とタンパク質部分の解析を同時に行うことができる。これによれば、タンパク質が異なるが糖鎖が同じもの、あるいは糖鎖が異なるが同じであるもの等を簡便に識別できる。
【0017】
(基板のブロッキング処理)
本発明においては、細胞結合性タンパク分子(レクチンなど)を固定化した基板を洗浄後、披検細胞の非特異的吸着を防止するために、基板上の非スポット領域の表面に残存する活性基(エポキシ基)をブロックする、ブロッキング操作工程を設けることが好ましい。
その際のブロッキング剤としては、エポキシ基と反応性を有する化合物を含むブロッキング剤であれば何でも良いが、タンパク質を含有しないブロッキング剤を用いることで、披検細胞の非スポット領域への非特異的吸着が大幅に減少し、バックグラウンド蛍光が大きく低下する。そのような非タンパク性ブロッキング剤としては、ポリエチレングリコールやトレハロースを含むブロッキング剤などが挙げられる、本願の実施例では、AR BROWN社製 StabilGuard Choice Biomolecule Stabilizerを用いた。
【0018】
(基板の保存方法)
本発明で得られた細胞結合性タンパク分子(レクチンなど)を固定化した基板は、固定化後すぐに、もしくはブロッキング工程の終了後、遠心機などを用いて基板上の水分を飛ばしてブロッキング剤など溶媒を除去した後に、冷蔵庫(4℃)などで低温保存するか、冷凍保存することにより、基板上の固定化タンパク質の活性を保持したまま長期保存することもできる。
【0019】
(基板表面の余剰細胞の除去/重力洗浄方法)
本発明において、アレイ基板表面の非スポット領域に、非特異的に吸着している細胞を除去するためには、重力を利用して沈降除去することが有効である。そして、細胞は、空気に接触すると気液界面摩擦がかかり、細胞の剥離や表面の障害に繋がるため、沈降除去工程においても、細胞が結合したアレイ基板表面が空気に接触されないことが求められる。
従って、本発明の沈降除去工程では、基板が十分に浸るだけの深さを持った洗浄槽に沈め、液浸状態のまま基板上面が下を向くように180度回転させた状態で静置し、非特異的な吸着細胞を重力を利用して沈降させる(図7)。沈降除去後、基板上面を元通り上面を向くように、基板を再度180度回転させた後で回収する工程を採用することが好ましい。ここで、上記洗浄槽中に満たす溶媒は、細胞の生育に影響を与えない水性溶媒が好ましく、たとえば、本願実施例で用いられたPBSバッファーが用いられる。
より好ましくは図8に記載の沈降除去用貯留槽を用いて簡便に実施することが出来る。この沈降除去用貯留槽は図8の3記載のトリガーの操作で基板の回転を制御できるのみならず図10の4,5に記載の注排水管を用いることにより、注排水工程も毎回均一に行うことが可能である。またより好ましい形態として、沈降除去用洗浄槽に具備された上記の部材が電動制御によって自動的に動き、一連の沈降除去工程を実施可能とする形態を挙げることができる。
【0020】
(披検細胞の蛍光観察法)
本発明においては、基板表面の非特異的に結合した余剰な細胞を除去した後、細胞に標識した蛍光分子を励起させて蛍光強度を、通常、基板上の位置情報のパターンとして観察する。
好ましくは、エバネッセント波励起法を利用した蛍光観察手法であり、上記非特許文献1などに記載されたエバネッセント波励起蛍光観察装置をそのまま用いることができる。具体的には基盤をステージ上にセットし、端面から適当なフィルターを通過した光を入射させ、基盤内部を全反射しながら通過する際に近接場ににじみ出てくるエバネッセント波を適当なフィルターをもつCCDカメラで撮影する。この手法を用いることで、基板上に固定化したレクチンと結合した細胞上の色素が選択的に励起され、結果、蛍光シグナルとして検出され、液相中における観察も可能になる。
本願の実施例では、エバネッセント蛍光観察法を用いており、当該手法を用いた場合について詳細に記載しているが、本発明は他のマイクロアレイ検出方式を用いる場合にも適用できる。たとえば、共焦点方式を用いて蛍光観察しても良く、顕微鏡による観察も可能である。
【0021】
上述したように、本発明は典型的には、まず、上記複数種のレクチン等の糖鎖結合性タンパク質を配置固定した基板を、タンパク質非含有ブロッキング剤で処理した後に、基板載置手段に載置し、該基板上に設けられた反応槽内において、細胞内部に蛍光標識分子を取り込ませた被検細胞含有試料と、基板上に固定化した各種糖鎖結合性タンパク質と被検細胞を接触させる。 次いで、液浸状態で基板表面の非特異的吸着細胞を沈降除去した後、披検細胞の結合の程度をエバネッセント波励起蛍光観察法などを用い、基板上の蛍光標識の強度を観察することによって、細胞表層分子の構造情報を観察する。
また、さらに、基板表面に結合した披検細胞に対して、当該細胞への結合能を持つ標識された第二の分子を含む溶液を基板に接触させ、上記蛍光波長とは異なる蛍光波長を用いて第二の分子の蛍光強度を観察することにより、さらに詳細な披検細胞の表層分子の構造情報を得ることができる。
たとえば、基板表面に固定化されたレクチンに対して細胞表層の糖鎖、複合糖鎖を介して結合した披検細胞の場合、当該糖鎖以外の細胞表層に存在するタンパク質を認識する抗体や、細胞表層の受容体タンパク質を認識するリガンド類を蛍光標識して、第二の分子として用いることができる。特に、癌マーカーとなるような特定タンパク質を認識するモノクローナル抗体を第二の分子として選択すれば、癌の診断にも有効である。
【実施例】
【0022】
以下に本発明の実施例を示すが、本発明はこれら実施例に限定されるものではない。
〔実施例1〕沈降除去工程の採用による、S/N比改善効果の観察(図9)
(1)マイクロアレイ基板の作成
本実施例ではアレイ上に細胞と相互作用する固定化タンパク質として、様々な糖結合特異性を持つタンパクで市販レクチンを43種類選択し、スライド基板上に固定化した。固定化した以下のレクチンの入手先は以下の通りである。LTL (ロータスマメレクチン)、UEA I (ハリエニシダレクチン)、AAL(ヒイロチャワンタケレクチン)、MAL(イヌエンジュレクチン)、SNA (セイヨウニワトコレクチン)、PHA(L) (インゲンマメレクチン)、PHA(E) (インゲンマメレクチン)、GSL II (グリフォニアマメレクチン)、NPA (ラッパズイセンレクチン)、GNA (ユキノハナレクチン)、HHL (アマリリスレクチン)、BPL (ムラサキモクワンジュレクチン)、EEL (Spindle Treeレクチン)、LEL (トマトレクチン)、STL (ジャガイモレクチン)、Jacalin(ジャックフルーツレクチン)、WFA (フジレクチン)、ACA(センニンコクレクチン)、MPA (アメリカハリグワレクチン)、VVA (ヘアリーベッチレクチン)、DBA (Horse gramレクチン)、GSL I (グリフォニアマメレクチン)、PTL-I (シカクマメレクチン)、MAH(イヌエンジュレクチン)、GSL IB4 (グリフォニアマメレクチン)はVECTOR社より購入したものを用いた。またPSA (エンドウレクチン)、LCA (レンズマメレクチン)、 TJA-I・TJA-II (キカラスウリレクチン)、 SSA (ニホンニワトコレクチン) 、RCA120 (ヒママメレクチン) 、ECA (デイゴマメレクチン)、 DSA (ヨウシュチョウセンアサガオレクチン)、 ConA (タチナタマメレクチン)、ABA(マッシュルームレクチン)、PWM (ヨウシュヤマゴボウレクチン)、PNA (ピーナッツレクチン)、SBA (ダイズレクチン)、WGA (パンコムギレクチン)は生化学工業社から、またUDA (Common Stinging Nettleレクチン)、GSL IA4 (グリフォニアマメレクチン)はEY Labolatories社から、AOL(コウジカビレクチン)は東京化成工業社から購入したものを用いた。
上記43種のタンパク質を松浪硝子工業社のマイクロアレイスポッティングバッファーを燐酸緩衝生理食塩水溶液(以下PBS)で2倍希釈した溶液を用いて、タンパク終濃度が0.5 mg/mLになるように溶解し、このスポット溶液をスライド基板に対し、非接触スポッター(Cartesian社Microsys4000)を用いて計43種の細胞結合性タンパク質分子を、湿度86%雰囲気内で直径450μmのスポットとして、スポット中心間間隔600μmの間隔をおいて横に3点ずつ配置されるよう基板表面にスポットした。次に基板への固定化反応を十分進行させる目的で飽和湿度を保った保湿箱中で24時間、固定化インキュベート反応を行った。次に本発明者らが設計・開発した8穴ラバーをスライド基板上の所定の位置に貼り付け、8つの反応槽を作製した(この8穴ラバーは厚さ1mmの黒色シリコンゴム製で、縦横9.5 × 7.5 mmからなる8つの長方形の穴が規則正しく空いており、スライド基板に貼り付けたときに8つの反応槽を形成する)。この反応槽は100 μLの試料溶液を反応槽内部に注入することで、反応槽内の基板表面を十分量の試料溶液で満たすことができる)。その後、基板を界面活性剤である1% Triton-X 100(ナカライテスク社)と500 mMグリシン(ナカライテスク社)を含有するトリス緩衝生理食塩水溶液で洗浄した。次に基板上の非スポットした領域の表面に残存する活性基(エポキシ基)をブロックして、細胞の非特異的吸着を防止するため、非スポット領域に対するブロッキング操作を行った。洗浄液を反応槽から除いた後に、タンパク非含有の表面ブロッキング剤であるStabilGuard Choice Biomolecule Stabilizer(AR BROWN社)を反応槽内に100 μL注入し、20 ℃で1時間静置した。ブロッキング工程が終わったら、次にスライドガラス用遠心機(スピンドライヤーミニ・和研薬工業)を用いて基板上の水分を飛ばしてブロッキング剤を除去した後に、基板上のタンパク活性が低下することを防ぐために冷蔵庫(4 ℃)内で基板を保管した。
【0023】
(2)CMRA標識CHO細胞懸濁液の調製とアレイ基板への注入
本発明者らの研究室で培養した3×106個のチャイニーズハムスター卵巣細胞(以下CHO細胞)を、遠心沈殿させて上清を捨てた後に、無血清培地を加えて0.3 mL中に懸濁させた。
次に37℃の水浴にて5分間湯せんをした後、細胞内に色素を取り込ませる作業へ移った。細胞内変換型色素であるCell Tracker Orange CMRA (Invtrogen社)を細胞懸濁液に終濃度5-10 μMになるように加え、37 ℃で30分インキュベートした。次に、遠心して細胞のみを回収した後に、1% BSAを含むPBS溶液を加え、遠心後に捨てて、再度1% BSAを含むPBS溶液に懸濁させた。この1% BSAを含むPBS溶液に懸濁させたCMRA標識細胞懸濁溶液をマイクロアレイ上の反応槽に100 μLずつ注入し、4 ℃の冷蔵庫内で1時間静置してインキュベートした。
【0024】
(3)沈降除去法の効果の確認
インキュベーション工程が終了した後にアレイ基板に対し、アレイ基板上の非スポット領域に非特異的に吸着している細胞を沈降除去させる工程を行った(図9)。具体的にはPBSバッファーを満たした沈降除去用反応槽中に基板上面に結合した細胞に空気が接触しないように十分な深さまで基板を沈め、次にPBSバッファー中で基板上面が下を向くように180度回転させた状態で、室温で30分間静置することで行った。回転は空気の泡が反応槽内に入らないよう留意して行った。30分の沈降反応後にPBSバッファー中で基板を再度180度回転させて、基板上面が元通り上面を向くように回転させた後に、基板をバッファー中より回収した。回収した基板は基板に付着した水滴をふき取った後に、エバネッセント波励起方式マイクロアレイスキャナーであるSC-profiler(モリテックス社製)を使用して基板端面より励起光を入射し、励起されて生じた蛍光発光を、基板から見て下方に配置されているCCDカメラで検出した。以下の実験時のカメラ感度パラメーターはGain「105倍」、積算回数「4回」、露光時間「199 msec」で統一した。
結果、図9に示すように、細胞沈降除去を行わない場合でも、蛍光観察は可能ではあるが、細胞沈降除去法を採用することでアレイ基板上の非スポット領域に非特異的に吸着している細胞が重力によって穏やかな条件下で除去される結果、アレイスキャン画像における背景蛍光が減少し、S/N比の著しい改善が確認された。この実験によって、沈降除去法の採用が実用上極めて有効に機能することが確認された。
【0025】
〔実施例2〕細胞内変換型色素であるCMRAの細胞との混合比の検討(図10)
(1)CMRAの細胞との混合比の検討
実施例1(2)に記載した被検細胞のCMRA標識工程において、被検細胞に対して共存させるCMRA濃度を0, 0.25, 0.5, 1、2.5, 5 μMと変化させて標識反応を行った後に、マイクロアレイを用いた生細胞表層糖鎖プロファイリングを行った(図10)。結果標識工程時のCMRA濃度依存的に各スポットの蛍光強度は増大することが分かった。CMRA標識工程における細胞に対して共存させる適切CMRA濃度は5 μM 程度であることが確認された。
【0026】
〔実施例3〕 43種のタンパク質を固定化したマイクロアレイに細胞内変換型蛍光色素で標識した細胞を破壊せずに接触・反応させた試験(図11)
(1)適切な細胞数の検討
上記実施例にて記載したCMRA標識した被検細胞懸濁液をアレイ基板と接触させる工程において、どの程度の細胞数をアレイ基板上の反応槽に注入するのが適切であるかの検討を行った。アレイ基板上の反応槽に注入するCMRA標識した被検細胞の細胞数を 0, 10000, 30000, 50000, 100000, 300000個と変化させて、上記実施例に記載のマイクロアレイを用いた細胞表層プロファイリング法を行った(図11)。結果CMRA標識した被検細胞懸濁液をアレイ基板と接触させる工程において、適切な細胞数は本実験条件においては各反応槽あたり1×105個程度であると確認された。
【0027】
〔実施例4〕 アレイ表面への低吸着表面ブロッキング処理工程の採用による、非スポット領域に対する被検標識細胞の非特異的吸着抑制効果を確認する検討(図12, 13)
(1)低吸着表面ブロッキング処理工程の効果の確認
表面ブロッキング処理工程の被検標識細胞の基板への非特異的吸着の程度への影響を観察することを目的として、タンパク非含有ブロッキング剤と、従来のマイクロアレイで汎用されている1%BSAを含有するPBS溶液の2種のブロッキング剤でブロッキング処理したスライド基板を作成し、非特異的吸着抑制効果を比較した(図12)。なお、タンパク非含有の表面ブロッキング剤にはStabilGuard Choice Biomolecule Stabilizer(AR BROWN社)を用い、BSA処理群・タンパク非含有ブロッキング剤処理群、共に反応槽内にブロッキング剤を100 μL満たした状態で20 ℃インキュベーター内に1時間静置し、非スポット領域のブロッキング操作を行った(図13)。このスライド基板を用いて上記実施例に従い、マイクロアレイ基板に対し被検細胞懸濁液を接触させて評価した。結果、従来のBSAブロッキング剤による処理ではなく、タンパク非含有の表面ブロッキング剤処理を行うことで、被検細胞の非特異的吸着抑制効果が飛躍的に増大することが確認された。
【0028】
〔実施例5〕 アレイ基板にヒトを含む動物由来のレクチンを固定化したマイクロアレイの試験(図14)
(1)マイクロアレイ基板の作成
本実施例ではアレイ上に細胞と相互作用する固定化タンパク質として、様々な糖結合特異性を持つタンパクである動物性レクチンであるガレクチン類5種(ヒトガレクチン(C2S)、海綿ガレクチン(GC1)、ニワトリガレクチン(C14)、ニワトリガレクチン(C16)、ヒトガレクチン-3(Gal-3))を固定化した。またポジティブコントロールとして植物レクチンである、リママメレクチン(RCA120)、セイヨウニワトコレクチン(SNA)を選択した(図14)。またネガティブコントロールとしてウシ血清アルブミン(BSA)を選択した。今回の実験ではガレクチン類5種は本発明者らの研究室で大腸菌にて発現・精製したものを用いた。SNAはVECTOR社より、BSAについてはSIGMA社より、RCA120は生化学工業より購入したものを用いた。上記タンパクを松浪硝子工業社のマイクロアレイスポッティングバッファーをPBSで2倍希釈した溶液を後いて、0.5 mg/mLになるように溶解した後、前述の非接触式スポッターにてスライドガラス上にスポットしアレイを作製した。
【0029】
(2)糖タンパクプローブの調製とアレイ基板への注入
蛍光標識化糖タンパク質プローブとして、550 nm付近に吸収極大波長を持つ蛍光色素であるCy3 Mono-reactive Dye(アマシャムファルマシア社、以下Cy3)で蛍光標識化したアシアロフェツイン(SIGMA社、以下ASF)を用いた。ASFは1分子あたりそれぞれ3本のN-結合型糖鎖とO-結合型糖鎖をもち、且つ糖鎖の非還元末端のシアル酸キャップが部分的に外れている糖鎖構造を持つことが知られている。このASFをPBSに終濃度1 mg/mLになるよう調製した後、1 mLについて1.0 mgのCy3色素粉末と混合させ、1時間、暗所で反応させた。次に担体としてSephadex G-25を用いたゲルろ過クロマトグラフィーにより、遊離のCy3とCy3-ASFを分離回収・精製した。
(1)の工程で作製したアレイ基板上のタンパク質が、生体内での機能活性を保持しているかを確認するために、上記の工程で調製したCy3-ASFを蛍光標識化糖タンパク質プローブとして(1)の工程で作製したアレイ基板上の反応槽に100 μLずつ加え、アレイ基板上のタンパク質との結合反応の観察を行った。Cy3-ASFは終濃度100 ng/mLになるよう1% Triton-X100、500 mMグリシンを含有するTBSに溶解したものを調製した。次に基板をレクチン-糖鎖間の反応が平衡に達するまで3時間、20 ℃でインキュベートした後に、エバネッセント波励起方式マイクロアレイスキャナー(Sc-profiler)を使用して、アレイ表面に結合したCy3-ASFの量を蛍光量で観察した。
結果、プローブ分子が持つ末端ラクトース構造に結合親和性を示すことが知られているガレクチン類5種(C2S、GC1、C14、C16、Gal-3)とポジティブコントロールであるリママメレクチン(RCA120)のスポットが光り、プローブ分子が持つ末端ラクトース構造に結合親和性をほとんど示さないセイヨウニワトコレクチン(SNA)とネガティブコントロールであるウシ血清アルブミン(BSA)のスポットは光らなかった(図14)。またこの結合反応は競合阻害糖である100 mMのラクトース共存下で特異的に阻害された。本実験の結果から、活性を保ったまま固定化することが難しいヒト由来を含む動物レクチンがその機能活性を保持したまま基板上に固定化されていることが確認された。
【0030】
(3)CMRA標識CHO細胞懸濁液の調製とアレイ基板への注入
CMRA標識CHO細胞懸濁液を、(1)の工程で作製したスライドに対し前述の方法に従った処理工程を行った後に、エバネッセント波励起マイクロアレイスキャナーで蛍光観察した。
この実験の結果、図14に示すように、細胞が、基板上に固定化した動物レクチンアレイに特異的に結合する様子が観察された。またこの結合反応は競合阻害糖である100 mMのラクトース共存下で阻害された。本実験の結果から、活性を保ったまま固定化することが難しいヒト由来を含む動物レクチンを固定化したマイクロアレイが、本発明である細胞表層観察アプリケーションにおいても有効に使用できることが確認された。
【0031】
〔実施例6〕 蛍光標識化抗体を用いることによる結合した細胞の同定試験
前述の方法に従いマウスリンパ球をCMRAで標識する工程を行った後、細胞を終濃度で5 ug/mlに調整したAlexafluor488標識CD45抗体と、暗所で4C、30分インキュベートした。遠心して細胞のみを回収した後、1% BSAを含むPBS溶液で細胞を洗浄後、再度1% BSAを含むPBS溶液に懸濁させた。前述の方法に従い細胞をアレイ基盤に反応させて洗浄後、エバネッセント波励起マイクロアレイスキャナーで2つの異なるフィルターを用いて蛍光観察した。
本実験の結果、T細胞とB細胞の混合物であるマウスリンパ球全体の糖鎖プロファイリングを行うと同時に、結合した細胞の一部がT細胞であることを同定することができ、細胞混合物に対して、更に特定タンパク質を認識するモノクローナル抗体を第二の分子として使用することにより、結合した披検細胞を同定することが可能となることが確認された。
【図面の簡単な説明】
【0032】
【図1】エバネッセント波励起蛍光観察法の原理を示す図である。
【図2】反応槽を具備した導波路基板をエバネッセント波励起蛍光観察する際の装置構成を示す図である。
【図3】従来の細胞を破壊してアレイに接触反応させ、アレイ結合プロファイルを得る方法の操作工程を示す図である。
【図4】本発明における細胞を生きたままアレイに接触反応させ、アレイ結合プロファイルを得る方法の操作工程を示す図である。
【図5】裏面への着水防止用保護シートの装備により、沈降洗浄時に着水から基板裏面を保護する機能を備える低吸着表面加工アレイ基板の外観の一例を示す図である。
【図6】低吸着表面加工アレイ基板の構造的特徴を示す側面図である。
【図7】沈降除去法の工程手順を示す図である。
【図8】沈降除去工程の操作をトリガーレバーの操作によりスライドガラスを液浸状態で回動させることで、簡易に操作を行う方法を提供するための器具の一例を示す図である。
【図9】沈降除去工程の採用による、S/N比の改善効果を示す図である。
【図10】細胞内変換型蛍光色素であるCMRAの配合量を検討した試験結果の一例を示す図である。
【図11】43種のタンパク質を固定化したマイクロアレイに細胞内変換型蛍光色素で標識した細胞を破壊せずに接触・反応させた試験結果を示す図である。
【図12】アレイ表面への低吸着表面ブロッキング処理工程の採用による、非スポット領域に対する細胞の非特異的吸着抑制効果を示す図である。
【図13】低吸着表面加工アレイ基板の乾燥保存法の工程手順を示す図である。
【図14】アレイ基板にヒトを含む動物由来のレクチンを固定化したマイクロアレイの試験例を示す図である。
【特許請求の範囲】
【請求項1】
披検細胞の細胞表層分子の構造情報を、披検細胞が生存している状態で観察する方法であって、以下の(a)〜(e)の工程を含む方法。
(a)表面に被検細胞と結合能を持つ分子を複数固定した基板を用意する工程、
(b)披検細胞を、生存状態のままで蛍光標識する工程、
(c)工程(a)で用意された基板に、工程(b)で蛍光標識した生存状態の被検細胞を含有する溶液を接触させ、披検細胞を上記基板表面上の分子と結合させる工程、
(d)工程(c)において、基板表面に非特異的に吸着している余剰な細胞を除去する工程、
(e)工程(d)において余剰細胞が除去された基板上の披検細胞からの蛍光強度を観察する工程。
【請求項2】
前記(e)の工程に先立ち、もしくは前記(e)の工程の後で、さらに下記の工程(f)及び(g)を設けることを特徴とする請求項1に記載の方法。
(f)前記基板表面上の分子と結合した披検細胞に対して、当該細胞への結合能を持つ標識された第二の分子を含む溶液を基板に接触させる工程、
(g)工程(e)で用いた蛍光波長とは異なる蛍光波長を用いて上記第二の分子の蛍光強度を観察する工程。
【請求項3】
前記工程(e)及び/又は(g)における、基板上の蛍光強度の観察を、エバネッセント波励起蛍光観察法によって行うことを特徴とする請求項1又は2に記載の方法。
【請求項4】
前記(a)の工程において、基板表面に被検細胞と結合能を持つ分子を複数固定した後、基板表面に残存する活性基をブロックする工程を設けることを特徴とする請求項1ないし3のいずれかに記載の方法。
【請求項5】
前記基板表面に残存する活性基をブロックするためのブロッキング剤として、非タンパク性ブロッキング剤を用いる請求項4に記載の方法。
【請求項6】
前記(b)の工程において、蛍光標識剤として用いる蛍光色素を、生存状態の被検細胞の細胞内に導入することを特徴とする、請求項1ないし5のいずれかに記載の方法。
【請求項7】
蛍光標識剤として用いる蛍光色素が、代謝変換型蛍光色素である、請求項6に記載の方法。
【請求項8】
前記(d)の工程を液浸状態で行うことを特徴とする請求項1ないし7のいずれかに記載の方法。
【請求項9】
前記(d)の工程において、前記基板を液浸状態で180度回転させて下向きとすることにより、前記余剰細胞を重力により沈降除去することを特徴とする請求項8に記載の方法。
【請求項10】
前記基板から前記余剰細胞を重力により沈降除去する際に、注水機構及び排水機構を有する貯留槽内に、両端に連動して回転する機構を備えたスライドホルダーが複数連設された装置を用い、各スライドホルダー上に、前記基板を装着し、スライドホルダーが液浸するまで注水した後、空気が混入しないようにすべてのスライドホルダーを180度回転させて下向きとし、前記余剰細胞が沈降除去されるのを待って、再度180度回転させて上向きとし、貯水槽内の液を排水した後、前記基板をスライドホルダーからはずすことを特徴とする、請求項9に記載の方法。
【請求項11】
前記請求項5ないし10のいずれかに記載の方法で用いられる基板であって、表面に被検細胞と結合能を持つ分子を複数固定した後で、基板表面に残存する活性基に対して非タンパク質ブロッキング剤によるブロッキング処理が施されている基板。
【請求項12】
前記基板が、乾燥状態で冷蔵又は冷凍して保存されている、請求項11に記載の基板。
【請求項13】
基板そのものを導波路基板として利用し、エバネッセント波励起蛍光観察のために用いることを特徴とする、請求項11又は12に記載の基板。
【請求項14】
前記導波路基板を挟み込むように表裏両面に反応槽形成部材を接着させ、裏面の反応層形成部材上に基板表面保護膜を具備することを特徴とする、請求項13に記載の基板。
【請求項15】
請求項10に記載の方法において用いられる装置であって、注水機構及び排水機構を有する貯留槽、及び当該貯水槽内に、基板を装着可能なスライドホルダーであり、かつ、両端に、連動して回転する機構を備えたスライドホルダーが複数連設されている、基板液浸用装置。
【請求項1】
披検細胞の細胞表層分子の構造情報を、披検細胞が生存している状態で観察する方法であって、以下の(a)〜(e)の工程を含む方法。
(a)表面に被検細胞と結合能を持つ分子を複数固定した基板を用意する工程、
(b)披検細胞を、生存状態のままで蛍光標識する工程、
(c)工程(a)で用意された基板に、工程(b)で蛍光標識した生存状態の被検細胞を含有する溶液を接触させ、披検細胞を上記基板表面上の分子と結合させる工程、
(d)工程(c)において、基板表面に非特異的に吸着している余剰な細胞を除去する工程、
(e)工程(d)において余剰細胞が除去された基板上の披検細胞からの蛍光強度を観察する工程。
【請求項2】
前記(e)の工程に先立ち、もしくは前記(e)の工程の後で、さらに下記の工程(f)及び(g)を設けることを特徴とする請求項1に記載の方法。
(f)前記基板表面上の分子と結合した披検細胞に対して、当該細胞への結合能を持つ標識された第二の分子を含む溶液を基板に接触させる工程、
(g)工程(e)で用いた蛍光波長とは異なる蛍光波長を用いて上記第二の分子の蛍光強度を観察する工程。
【請求項3】
前記工程(e)及び/又は(g)における、基板上の蛍光強度の観察を、エバネッセント波励起蛍光観察法によって行うことを特徴とする請求項1又は2に記載の方法。
【請求項4】
前記(a)の工程において、基板表面に被検細胞と結合能を持つ分子を複数固定した後、基板表面に残存する活性基をブロックする工程を設けることを特徴とする請求項1ないし3のいずれかに記載の方法。
【請求項5】
前記基板表面に残存する活性基をブロックするためのブロッキング剤として、非タンパク性ブロッキング剤を用いる請求項4に記載の方法。
【請求項6】
前記(b)の工程において、蛍光標識剤として用いる蛍光色素を、生存状態の被検細胞の細胞内に導入することを特徴とする、請求項1ないし5のいずれかに記載の方法。
【請求項7】
蛍光標識剤として用いる蛍光色素が、代謝変換型蛍光色素である、請求項6に記載の方法。
【請求項8】
前記(d)の工程を液浸状態で行うことを特徴とする請求項1ないし7のいずれかに記載の方法。
【請求項9】
前記(d)の工程において、前記基板を液浸状態で180度回転させて下向きとすることにより、前記余剰細胞を重力により沈降除去することを特徴とする請求項8に記載の方法。
【請求項10】
前記基板から前記余剰細胞を重力により沈降除去する際に、注水機構及び排水機構を有する貯留槽内に、両端に連動して回転する機構を備えたスライドホルダーが複数連設された装置を用い、各スライドホルダー上に、前記基板を装着し、スライドホルダーが液浸するまで注水した後、空気が混入しないようにすべてのスライドホルダーを180度回転させて下向きとし、前記余剰細胞が沈降除去されるのを待って、再度180度回転させて上向きとし、貯水槽内の液を排水した後、前記基板をスライドホルダーからはずすことを特徴とする、請求項9に記載の方法。
【請求項11】
前記請求項5ないし10のいずれかに記載の方法で用いられる基板であって、表面に被検細胞と結合能を持つ分子を複数固定した後で、基板表面に残存する活性基に対して非タンパク質ブロッキング剤によるブロッキング処理が施されている基板。
【請求項12】
前記基板が、乾燥状態で冷蔵又は冷凍して保存されている、請求項11に記載の基板。
【請求項13】
基板そのものを導波路基板として利用し、エバネッセント波励起蛍光観察のために用いることを特徴とする、請求項11又は12に記載の基板。
【請求項14】
前記導波路基板を挟み込むように表裏両面に反応槽形成部材を接着させ、裏面の反応層形成部材上に基板表面保護膜を具備することを特徴とする、請求項13に記載の基板。
【請求項15】
請求項10に記載の方法において用いられる装置であって、注水機構及び排水機構を有する貯留槽、及び当該貯水槽内に、基板を装着可能なスライドホルダーであり、かつ、両端に、連動して回転する機構を備えたスライドホルダーが複数連設されている、基板液浸用装置。
【図1】


【図2】


【図3】


【図4】


【図6】


【図7】


【図8】


【図5】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】




【図2】


【図3】


【図4】


【図6】


【図7】


【図8】


【図5】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【公開番号】特開2008−187932(P2008−187932A)
【公開日】平成20年8月21日(2008.8.21)
【国際特許分類】
【出願番号】特願2007−23754(P2007−23754)
【出願日】平成19年2月2日(2007.2.2)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成18年度 独立行政法人新エネルギー・産業技術総合開発機構委託研究「健康安心プログラム/糖鎖機能活用技術開発」産業活力再生特別措置法第30条の適用を受ける特許出願
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
【公開日】平成20年8月21日(2008.8.21)
【国際特許分類】
【出願日】平成19年2月2日(2007.2.2)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成18年度 独立行政法人新エネルギー・産業技術総合開発機構委託研究「健康安心プログラム/糖鎖機能活用技術開発」産業活力再生特別措置法第30条の適用を受ける特許出願
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
[ Back to top ]

