甲殻類動物、及び他の無脊椎動物における、dsRNAで誘導された特異的、及び非特異的免疫、及びそこで使用する生物送達媒体
【課題】甲殻類動物、及び他の無脊椎動物における、dsRNAで誘導された特異的、及び非特異的免疫、及びそこで使用する生物送媒体を提供する。
【解決手段】少なくとも1種のdsRNAを投与することによる、無脊椎動物、例えば、軟体動物門、海綿動物門、有櫛動物門、棘皮動物門、海洋ミミズ、刺胞動物門、好ましくは甲殻類動物における、全身性非特異的、及び/配列特異的免疫応答を誘導する方法であって、該dsRNAが病原体に対する免疫を与えるか、成長、生殖、及び健康一般、又は"ロバスト性"に関与するような遺伝子の発現を調節する、前記の方法が提供される。また、発現が病原体に対する非特異的(全身性)免疫応答の誘導に関与する、甲殻類動物遺伝子などの、無脊椎動物遺伝子を同定する方法を提供する。また、甲殻類動物に、少なくとも1種のdsRNAを恒常的に投与する、好ましい送達系、及び方法であって、該dsRNAが、注入、浸漬、餌料、又は栄養媒体を経て投与されるか、或いdsRNAを発現し、かつエビなどの甲殻類動物により摂取可能である、例えば、酵母菌又は微細藻類のような微生物に含まれる方法を開示する。
【解決手段】少なくとも1種のdsRNAを投与することによる、無脊椎動物、例えば、軟体動物門、海綿動物門、有櫛動物門、棘皮動物門、海洋ミミズ、刺胞動物門、好ましくは甲殻類動物における、全身性非特異的、及び/配列特異的免疫応答を誘導する方法であって、該dsRNAが病原体に対する免疫を与えるか、成長、生殖、及び健康一般、又は"ロバスト性"に関与するような遺伝子の発現を調節する、前記の方法が提供される。また、発現が病原体に対する非特異的(全身性)免疫応答の誘導に関与する、甲殻類動物遺伝子などの、無脊椎動物遺伝子を同定する方法を提供する。また、甲殻類動物に、少なくとも1種のdsRNAを恒常的に投与する、好ましい送達系、及び方法であって、該dsRNAが、注入、浸漬、餌料、又は栄養媒体を経て投与されるか、或いdsRNAを発現し、かつエビなどの甲殻類動物により摂取可能である、例えば、酵母菌又は微細藻類のような微生物に含まれる方法を開示する。
【発明の詳細な説明】
【技術分野】
【0001】
この出願は、2004年4月22日に出願された米国特許仮出願第60/564,295号、2003年7月2日に出願された米国特許第60/484,531号、2003年9月25日に出願され、「甲殻類動物、及び他の無脊椎動物における、非特異的免疫応答を誘導する方法、及び組成物」という名称の仮出願依頼人整理番号第100383.52749PV号(出願番号第60/505,715号)、及び2003年8月29日に出願された米国特許仮出願第60/498,603号の優先権を主張する。これら全ての文献の内容は、その全体が、引用により、本明細書に取り込まれるものとする。
【0002】
また、この出願は、下記の授与された助成に関するものである。1)USDAによる、オーシャニック研究所管掌米国海洋エビ養殖プログラム、及びサウスカロライナ天然資源省 FY03湾岸エビプロジェクトへの助成、USDAICSREES受賞番号2002-38808-01345、2)米国国立科学財団による、サウスカロライナ医科大学への助成、受賞番号MCB 0315393、3)米国国立海洋漁業局による、サウスカロライナ天然資源省(Soへの助成、受賞番号NA03NMF4720362、及びNAO7FL0498である。
【0003】
(発明の分野)
本発明は、無脊椎動物の免疫、好ましくは、甲殻類動物などの海洋無脊椎動物の免疫、及び特に、無脊椎動物の抗ウイルス免疫のより深い理解を提供する。さらに、本発明は、少なくとも1種の二本鎖RNAの投与による、無脊椎動物、好ましくは、甲殻類動物(エビ、ロブスター、カニなど)、軟体動物(ウミウシ、貝、イカなど)、又は他の無脊椎動物における、非特異的(全身性)免疫応答誘導方法、及び物質を提供する。
【0004】
また、本発明は、少なくとも1種の、長鎖、又は短鎖二本鎖RNAの投与による、甲殻類動物、又は別の無脊椎動物における、非特異的(全身性)免疫応答、及び配列特異的RNA干渉応答の、いずれか、又は両方を誘導する方法、及び物質を提供する。
【0005】
また、本発明は、dsRNAとハイブリダイズする配列を含む、遺伝子の標的抑制を提供する配列をもつ、少なくとも1種のdsRNAを、非特異的dsRNAと共投与することにより、RNA干渉応答を増強させる方法、及び物質を提供する。ここで、該非特異的dsRNAは、"アジュバント"として作用し、その投与は、第一の配列特異的dsRNAの投与により免疫応答を促進(増強)する。該共投与は、該配列特異的dsRNA、及び配列非特異的dsRNAの併合投与、又はいずれかの順での、個別投与を含む。
【0006】
また特に、本発明は、海洋無脊椎動物内在性遺伝子の発現を調整するdsRNA の使用に関するものである。例を挙げると、免疫、成長、生殖、及び健康一般、又は"ロバスト性"に関与するような軟体動物遺伝子、又は甲殻類動物遺伝子であり、同様に、海洋無脊椎動物、好ましくは軟体動物、及び甲殻類動物に感染する病原体の必須遺伝子がある。また、STAT、IKB、及び、NFKB、及び STATシグナル経路の他の推定上の構成要素のような遺伝子も含む。また、神経伝達物質、脱皮抑制ホルモン、生殖腺抑制ホルモン、及び甲殻類高血糖ホルモン含む、ホルモン、及び代謝経路をコードする遺伝子も含まれる。また、クラスチン、及びペナエイジン(penaeidin)などの、抗菌ペプチド、又はそのようなペプチドの産生調節因子をコードする遺伝子を含む。場合によっては、dsRNAを使用して、軟体動物、又は甲殻類動物のような海洋無脊椎動物の、任意の所望される遺伝子の発現を、減少させることができる。例えば、推定上の標的遺伝子は、コントロール、及びウイルス(WSSV、又はTSV)感染エビ組織を用いて作製される、サプレッションサブトラクティブハイブリダイゼーションライブラリーなどの、ゲノムライブラリー中で同定することができる。他の可能な標的遺伝子の具体例は、VP28、リボヌクレオチド還元酵素、へモシアニン、VP26、VP19、チミジル酸キナーゼ、及びDNA ポリメラーゼなどである。
【0007】
好ましくは、本発明は、甲殻類動物遺伝子、又は通常、甲殻類動物に感染する病原体遺伝子と同一であるか、或いは例えば少なくとも75%、さらに好ましくは、少なくとも85〜90%、さらに好ましくは、90〜99%同一である、高い配列同一性を示す配列をもつdsRNAを投与を含む。エビの場合、病原体の例を挙げると、ホワイトスポットシンドロームウイルス、タウラシンドロームウイルス、伝染性皮下造血器壊死ウイルス(IHHNV)、ペナエイドシュリンプ(Penaeid Shrimp)のバキュロウイルス(BP)、ペナエイドシュリンプのラブドウイルス(RPS)、鰓関連ウイルス (GAV)、イエローヘッドウイルス(YHV)、リンパ器官関連ウイルス(Lymphoid Organ-Associated Virus)(LOVV);リンパ器官パボ様ウイルス疾患(Lymphoidal parvolike viral disease)(LPV)、肝膵臓パボウイルス(Hepatopancreatic Parvovirus)(HPV)、バキュロウイルス中腸腺壊死ウイルス(Baculovirus midgut gland necrosis virus)(BMN)、モノドン型バキュロウイルス(Monodon baculovirus)(MBV)、レオ様ウイルス疾患(Reo like virus diseases)(REO)、及びラブドウイルス(RPS)、及び新生ウイルスがあり、その必須遺伝子は、当業者に利用可能な任意の手段を通じて、同定され、かつ配列決定され得る。(新生ウイルスとは、今までのところ同定されていない、或いは後に、公知のウイルスから、組み換え、突然変異などにより生じたウイルスのことを言う。該新生ウイルスは、単離され、かつサブトラクティブハイブリダイゼーションを用いるなどして、例えば公知のウイルスゲノム、及び野生型エビゲノムと比較して、同定することができる。)
【0008】
さらに具体的に述べると、本発明は、無脊椎動物、具体的には、海洋甲殻類動物、リトペナエウス バンナメイ(Litopenaeus vannamei)、及び他のエビにおける、配列非依存性の、一般的な抗ウイルス防御性を誘導する方法、及び物質を提供する。場合によっては、バクテリア、菌類、微胞子虫類、略胞子虫類、及びグレガリナ類のような他の寄生生物に対する防御性である。
さらに、本発明は、脊椎動物の免疫系のアナログの、無脊椎動物の免疫系が、dsRNAをウイルス関連分子パターンとして認識でき、生得的抗ウイルス応答の活性化をもたらす、最初の実証を提供する。
【0009】
さらに、本発明は、甲殻類動物、軟体動物、又は他の無脊椎動物、好ましくは、エビへ、少なくとも1種のdsRNAを送達する生物送達媒体を提供する。該生物送達媒体は、該dsRNAを恒常的に、又は一時的に発現し、かつ甲殻類、又は他の無脊椎動物に安全に摂食され得る、酵母菌、又は微細藻類のような微生物である。好ましい態様において、本発明は、誘導性、又は恒常的プロモーターのコントロール下で、少なくとも1種の異種dsRNAを発現する、組み換え酵母菌、例えば、サッカロミセス属、又は組み換え微細藻類、例えば、クラミドモナス属、クロレラ属、アルスロスピラ属(スピルリナ属)などを提供する。
【背景技術】
【0010】
(従来の技術の説明)
本発明は、dsRNA分子の使用による、遺伝子発現を調節する、好ましくは抑制する、標的、及び非標的方法に関するものである。遺伝子発現の抑制を達成する方法は、当技術分野においてよく知られている。例を挙げると、アンチセンス核酸、三重らせんアプローチ、共抑制、及びRNA干渉、又はRNAサイレンシングの使用がある。
【0011】
(干渉に係わるアンチセンス核酸の使用)
アンチセンステクノロジーは、遺伝子特異的干渉を達成するプロトコルの中で、最も一般的に記載されたアプローチである。アンチセンスストラテジーでは、ストキメトリック(stochiometric)な量の、目的の遺伝子のメッセンジャーRNAに相補的な一本鎖核酸を、細胞に導入する。アンチセンスに基づくアプローチのいくつかの難点は、送達、安定性、及び必須投与量である。一般に、細胞は一本鎖核酸を取り込むメカニズムをもたず、従って、改質されていない一本鎖物質の取り込みは、非常に非効率的である。細胞への取り込みを待っている間に、該一本鎖物質は、分解されやすい。アンチセンス干渉は、干渉する物質が比較的高い濃度で(内在性mRNAの濃度、又はそれ以上で)蓄積することが必須なので、送達するのに必須な量が、効率の主要な制約要因である。結果として、アンチセンス技術の開発における取り組みの大半は、ヌクレアーゼ分解に安定であり、かつ細胞内に容易に拡散できる、改質核酸の産生に重点が置かれてきた。遺伝子治療、又は生物全体への適用のための、アンチセンス干渉の使用は、限定されている。それは、非天然アナログから合成されることが必要な、多量のオリゴヌクレオチド、その合成の経費、及び高投与量でさえ、各細胞に、十分濃縮され、かつ単一の干渉物質の貯留を維持することが難しいためである。
【0012】
(干渉に係わる三重らせんアプローチ)
第二の工学的干渉の方法は、三重らせん核酸構造に基づいている。このアプローチは、特定な核酸群の、三本鎖構造を示す稀な能力に依存する。生理条件下で、事実上、核酸は全て一本鎖、又は二本鎖であり、かつ三本鎖はめったに形成されない。しかしながら、特定の単純なプリン、又はピリミジンが豊富な配列が、極端なpH条件下で(すなわち、試験管内で)三本鎖分子を形成し得ることは、知られて久しい。一般に、そのような構造は生理条件下でごく一時的であり、従って三本鎖を産生するように設計された、非改質核酸の単純な送達では、干渉をもたらさない。アンチセンスと同様に、インビボで使用する三本鎖技術の開発は、より安定であり、かつインビボで細胞に容易に吸収される、改質核酸の開発に重点が置かれてきた。この技術の開発におけるさらなる目標は、該三本鎖物質の形成が生理的pH で効率的に進行するように、改質核酸を産生することであった。
【0013】
(共抑制現象、及び遺伝子工学におけるその使用)
第三の遺伝子特異的干渉のアプローチは、"共抑制"の名称下でグループ化される、一連の操作手段である。最初に、このアプローチは植物で記載されており、非連鎖であるが相同性をもつ遺伝子のサイレンシングをもたらす、導入遺伝子の能力のことを言う。ごく最近、共抑制と同様の現象が、2種の動物:線虫、及びショウジョウバエにおいて報告されている。最初に、共抑制は、導入遺伝子を使って、潜在的に有用性のある遺伝子座の過剰発現を試みようと導入遺伝子を使っているグループからの報告で、偶然見い出された。該過剰発現が成功した場合もあったが、多くの場合は、結果は予想と反対であった。それらの場合において、実際には、トランスジェニック植物の方が、より低い内在遺伝子の発現を示した。これまでに、様々な植物における導入遺伝子を介した共抑制のメカニズムが提唱されてきた;全てのこれらのメカニズムの提唱は、依然として仮説であり、かつそのプロセスの決定的なメカニズムの記載は示されてきていない。共抑制を説明するために提唱されているモデルは、2つの異なったカテゴリーに分類することができる。一連の提唱において、2つの異なった染色体部位間の、DNA、又はクロマチンレベルでの 直接的物理的相互作用が起こることが仮説となっている。その後、まだ同定されていないメカニズムが、デノボメチル化、及びその後の遺伝子発現の抑制につながるのであろう。
【0014】
(RNA干渉、又は RNAサイレンシング)
細胞、又は動物における標的遺伝子の発現を抑制する、さらなるプロセスはRNA 干渉(RNAi)、又はRNAサイレンシングである。該プロセスは、部分的、又は完全に二重鎖形質をもつRNA(dsRNA)の、細胞へ、又はその細胞外環境への導入を含む。抑制は、該二本鎖抑制RNAを産生するために選択された、標的遺伝子の一部分からのヌクレオチド配列に特異的である。この工程は、(1)遺伝子発現の抑制を実現するのに効果的であり、(2)標的遺伝子に特異的であり、かつ、(3)多くの異なった種類の標的遺伝子の発現の抑制をもたらす。
【0015】
例えば、該標的遺伝子は、該細胞から由来の遺伝子、内在性遺伝子、導入遺伝子、又は、その感染後に細胞に存在する病原体遺伝子であり得る。具体的な標的遺伝子、及び送達する二本鎖RNA物質の投与量に応じて、該手法は、該標的遺伝子の機能の部分的、又は完全消失を提供し得る。
RNA干渉、又は RNAサイレンシングによる、標的遺伝子の発現抑制に用いる方法、及び物質は、様々な発行された特許、及び多くの最近公表された特許出願書類に報告されている。例えば、Fireらによる米国特許第6,506,559号;Liuらによる米国特許6,326,193号;Grahamらによる国際公開第99/49029号;Grahamらによる米国特許第6,573,099を参照されたい。
【0016】
上記に関して、Graham(Benitecに委譲)によって特許を受けた該RNA干渉方法、及び物質には、標的遺伝子に相当する配列の少なくとも2コピーを含む、単離されたDNAコンストラクトの使用が必要である。ここで、標的遺伝子の発現は、遅らせる、抑圧される、或いは抑制されるべきものであり、操作上、両コピーは、センス方向で単一のプロモーターに連結される。反対に、Fireの特許の中に出てくる該RNA干渉方法では、任意の二本鎖分子の使用を挙げている。ここで、本質的に、第一のRNA鎖は、該標的遺伝子のヌクレオチド配列に相当するリボヌクレオチド鎖からなり、かつ第2のDNA鎖は、該標的遺伝子のヌクレオチド配列に相補的であり、これらの二本鎖は、ハイブリダイズされ、標的遺伝子の発現抑制する二本鎖RNAを形成する。
【0017】
RNA干渉は、メカニズム的に2工程からなるプロセスである。その第一の工程において、dsRNAはサイレンシング応答を引き起こし、dsRNA は21〜23ヌクレオチドの小さい干渉RNAに切断される。この切断は、ダイサー(Dicer)というRNアーゼIIIファミリーヌクレアーゼファミリーヌクレアーゼにより、遂行される。第二の工程において、siRNAは、標的複合体、RISC(RNA誘導サイレンシング複合体)に取り込まれ、RISCは、その肝要なsiRNAに相同であるmRNAsを破壊する(Silver らの論文、 Trends in Mol. Med. 8 (11): 505-508 (2002))。
【0018】
最近、RNA干渉が、遺伝子機能を調べる有力な手段であり、かつ新規な抗ウイルス治療を開発する可能性があると報告されている(Silver らの論文、同上)。しかしながら、該RNAi経路が保存された生物学的プロセスと認識されているとはいえ、まだ完全に理解されておらず、かつ異なった種においてさまざまな効果を及ぼす。例えば、dsRNA は、一部の原生動物、動物、植物、及び菌類を含む生物体においては、相同RNAの分解を誘導し、転写後の遺伝子サイレンシングをもたらす一方;一部の種では、その代わりに、RNAを介したプロセスが、翻訳抑制、DNAメチル化、ヘテロクロマチンの形成、及びDNA消失をもたらす。場合によっては、効果的なサイレンシングのために、該「引き金」二本鎖RNAの増幅が必須である(Ceruttiらの論文、Trends in Genetics 19 (1) : 39-46 (2003))。
【0019】
今日まで、多くのRNAiの研究は、標的遺伝子の発現レベルにおけるdsRNAの配列特異的効果に焦点を置いてきている。しかしながら、また、dsRNAの投与は、脊椎動物において、全身性(配列非特異的)免疫応答を起こすことが知られている。例えば、Sledz ら(Nature Biol. オンライン先行発表)は、短鎖干渉RNAの投与による、哺乳動物系におけるインターフェロン系の活性化を報告した。具体的に、Sledzら(同上文献)は、ラミン、及びGAPDH遺伝子に特異的な、21ヌクレオチド鎖長のdsRNAを作製し、それがインターフェロンを介したJAK-Stat経路の活性化、及びIFN刺激応答遺伝子の発現増大を誘導したことを報告した(同上文献)。この全身性応答効果は、該dsRNA依存性プロテインキナーゼ(PKR)により介されたと報告されていたが、siRNAにより活性化され、かつsiRNAに応答したIFN-の発現増大に必須である。
【0020】
無脊椎動物の免疫系は、抗細菌、及び抗菌応答との関連でかなり研究されてきているが、ウイルスに対する無脊椎動物の免疫応答に関しては、細胞、又は分子レベルの情報はない。反対に、哺乳動物においては、抗ウイルス、及び抗バクテリアの生得的応答は、部分的に重複するが、最も顕著な抗ウイルス応答を含むインターフェロン系で、相異なる経路を含む。
【0021】
インターフェロン(IFN)が、ウイルス感染、及び他の傷害に応答して発現されるサイトカインファミリーを含み、かつウイルス増殖を制御する無数の細胞、及び全身性応答を調節することはよく知られている(総説としては、Levy らの論文、Cytokine Growth Factor Rev. 12: 143-156 (2001)、及びGoodburnらの論文、J. Gen. Virol. 81 : 2341-2364 (2000) を参照されたい)。IFNを循環させることによる細胞の誘導で、ヤヌスキナーゼ(Janus kinase)/シグナル伝達性転写因子(Signal Transducer and Activator of Transcription)(JAK/STAT) 系のシグナル伝達が何百もの遺伝子の誘導をもたらす(de Veerらの論文、L. Leuc. Proc. Biol. 69: ; 912-20 (2001); Ehrtらの論文、J. Exp. Med. 194: 1123-40 (2001))。IFNにより誘導される遺伝子は、RNA依存性プロテインキナーゼ(PKR)、Mxタンパク質、オリゴアデニル酸合成酵素 (OAS)、及びIFN自身をコードするものを含む。この自己増殖系は、IFNによってだけでなく、ウイルス成分によっても、直接引き起こされ得る。IFN応答の有力な誘導因子は、ウイルス感染中、ウイルスのゲノム複製、及び大規模な二次構造をもつウイルスRNAの結果としてしばしば生じる、二本鎖RNAである分子である(Jacobs らの総説、Virology 219: 339-49 (1996))。 哺乳動物では、dsRNAはTLR3レセプターにより認識され、骨髄分化因子88(Myd88)依存性、及び非依存性シグナル伝達カスケードを活性化し、IFN の発現をもたらす。また、dsRNAは、直接PKRを活性化することにより、細胞内に抗ウイルス応答を誘導し、真核生物翻訳開始因子2a (eIF2a)のリン酸化を介して、細胞、及びウイルスタンパク質合成 の抑制をもたらす(Meurs らの論文、Cell 62: 379-90 (1999) )。dsRNA 誘導型免疫応答が無脊椎動物に存在しないことは、一般に受け入れられており、この結論は、いくつかの完全に配列決定された無脊椎動物のゲノムにおける、IFNに、又はIFN応答の主要エフェクター(例えば、PKR、Mx、OAS)に相同な構造をもつ遺伝子の欠如によって支持されている(Adamsらの論文、Science 287: 2187-95 (2000); C. elegans 配列決定グループの論文、Science 282 : 2012-80 (1998) ; Deholらの論文、Science 298: 2157-2167 (2002);Hot らの論文、Science 298: 129-49 (2002))。
【0022】
最近、dsRNAを介した転写後の遺伝子サイレンシング(PTGS、又はRNAi)の発見で、インビボにおけるdsRNAの生物特性の複雑性が、より理解されてきた。この現象は、植物、及び動物、脊椎動物、及び線虫などの一部の無脊椎動物(Fireらの論文、Nature 391: 806-11 (1998))、及び昆虫類(Misquittaらの論文、Proc. Natl. Acad. Sci. USA 9-0: 451-6 (1999))、及び哺乳動物(Svobodaらの論文、Devel. 127: 4147- 56 (2000))で観察された。このプロセスは、RNアーゼ IIIダイサー(Dicer)により、短鎖干渉RNA(siRNA)として知られている、短い21-25塩基対鎖長の二本鎖に加工されるdsRNAを含む(Burnsteinらの論文、Nature 409: 363-6 (2001))。これらのsiRNAは、相同のmRNAを認識するのに使われ、RNA 誘導型サイレンシング複合体(RISC)に結合したRNアーゼ活性によるその分解を引き起こす(Hammondらの論文、Nature 404: 293-6 (2000); Hammondらの論文、Science 293: 1146-50 (2001))。RNAi は、感染された細胞における、ウイルス遺伝子産物の発現を抑制するために使われた、古代の抗ウイルスメカニズムであると提唱されてきている。それは、ウイルスdsRNAs が、感染の過程でしばしば生じるからである。例えば、植物、及び動物両ウイルスには、該RNAi経路を回避するウイルスのストラテジーが存在する(Li らの論文、Science 296: 1319-21 (2002); Liらの論文、 Proc. Natl. Acad. Sci., USA 101: 1350-5 (2004); 及びSilhavyらの論文、EMBO J., 21 : 3070-80 (2002))。
【0023】
内在性RNA分解をもたらす、dsRNAの配列特異的効果は広範囲に保存されており、おそらく多くの無脊椎動物にも存在するのに対して、長い間、dsRNAによる配列非特異的な、抗ウイルス免疫の誘導は、脊椎動物だけに限定されていると考えられてきた。
かなり予想外に、本発明者らは、非特異的dsRNA(いかなる公知の無脊椎動物の内在性遺伝子とも相同性をもたないdsRNA)の投与が、少なくとも海洋エビ、リトペナエウス バンナメイにおいて、一般的抗ウイルス応答を生じさせることを発見した。これらの結果に基づくと、おそらく、他の甲殻類動物、及び無脊椎動物においても同様であろう。この発明は、無脊椎動物が、真正のウイルス関連分子構造(dsRNA)に応答して、誘導性抗ウイルス免疫を示すことができる、初めての証拠を提供する。該独創的発見は、無脊椎動物の生得的抗ウイルス免疫が、dsRNAにより誘導される免疫応答も含め、いくつかの脊椎動物抗ウイルス応答の分子特性を共有することを示唆する。
【0024】
最近、Timmonsら(Mol. Biol. Of the Cell 13: 2972-2983 (July 2003))は、無脊椎動物系において、dsRNAが全身性の特性も持つ、遺伝子特異的RNA干渉応答を起こすことができること、例えば、dsRNAの送達部位から遠位の細胞において、遺伝子発現のサイレンシングが観察されることを報告した。線虫系において、Timmonsらは(同上文献)、組織特異的プロモーターからdsRNAを転写させる、トランスジェニック型線虫では、広範囲の全身性RNA干渉表現型を示さないことを報告した。さらに、彼らは、無関係なdsRNA分子の外因性送達が、検出可能な、全身性RNAサイレンシング表現型を生じさせたが、fed-1、又はfed-2欠損動物では、摂取されたdsRNAに対する、強い全身性サイレンシング応答は起こせなかったことを報告した。Timmonsら(同上文献)は、これが、細胞への取り込み、及びRNAサイレンシングシグナルの放出のための、複合的、及び/又は組織特異的メカニズムの可能性を提議することを示唆した。
【0025】
本発明の前に、甲殻類の免疫メカニズムは, ほとんど知られていなかった。特に、甲殻類が、いくつかの基本的な体液性、及び細胞性防御メカニズムを有することは知られていた。体液性免疫反応には、血液凝固、フェノール酸化酵素前駆体カスケードの活性化、及びいくつかのバクテリア、又は菌類に対して有効である、抗菌ペプチドの産生、及び放出が含まれる。細胞防御メカニズムは、主として、不溶化、食作用、及び病原体の細胞内殺菌に関与する、循環している血球を含む。甲殻類の食細胞血球は、典型的な呼吸バーストを示し、活性化酸素種の産生をもたらす。また、細胞が数種の効果的な抗菌分子を合成することは知られていた。 特に、ブルークラブ(カリネクテス サピドゥス(Callinectes sapidus))、及び海洋エビ(ペナエウス モノドン(Penaeus monodon))の鰓は、説明できない分子経路を経て、血液から数種の異質タンパク質を取り除く。また、最近、Toll/NFKB経路の推定上の構成要素が、カキ、及びカブトガ二に存在することが報告された。しかしながら、これらの遺伝子の機能は、あるとしても依然として未知であり、かつ証拠欠如のため、特に異種におけるToll/NFKB遺伝子の機能の広がりを考慮すると予測できない。
【0026】
しかしながら、甲殻類動物、又は他の無脊椎動物がdsRNAの配列非特異的免疫応答を引き起こせたと、示唆した研究はなかった。実際に、Lee、及びSoderhallの最近の総説論文(Fish & Shellfish Immunol. 14: 421-437 (2002))では、甲殻類動物の生得的免疫に関して、現在何がわかっているかの詳細な概観を載せているが、dsRNAが関与している示唆は全くない(同上文献)。さらに、Smithらの最近の論文(Fish & Shellfish Immunol. 10: 1-20 (2003))では、抗ウイルス防御手段として、甲殻類動物の免疫刺激の効果を疑問視しており、推定上の免疫刺激の使用による、飼育動物の健康への潜在的危険性を指摘した。同様に、この論文は、甲殻類動物の免疫に関与していると考えられる重要なタンパク質に言及している一方、甲殻類動物がdsRNAに応答できるという示唆を含まない。
実際に、本発明に先立ち、甲殻類動物、及び無脊椎動物種の全身性効果は知られていなかった。さらに、本発明に先立ち、甲殻類動物、特にエビ、及びおそらく他の海洋無脊椎動物が、RNA干渉応答を起こす必須細胞機構を有することは知られていなかった。
【発明の開示】
【発明が解決しようとする課題】
【0027】
甲殻類動物、及び他の無脊椎動物における、dsRNAで誘導された特異的、及び非特異的免疫、及びそこで使用する生物送媒体を提供する。
【課題を解決するための手段】
【0028】
(本発明の目的)
従って、本発明の目的は、無脊椎動物免疫、例えば、甲殻類動物免疫の理解を深めることである。本発明は、その実験項では甲殻類動物、特にエビにおける対象発見を例示するが、その対象方法は、他の無脊椎動物においても有用であることが予想される。特に、甲殻類に近縁関係にある無脊椎動物、例えば、他の海洋無脊椎動物である。例を挙げると、イカ、貝、タコ、ウミウシ、巻き貝などの有殻、又は無殻軟体動物;海綿動物門(カイメン);刺胞動物門(クラゲ、サンゴ、ヒドロ虫)、有櫛動物門(クシクラゲ)、棘皮動物門(ヒトデ、クモヒトデ)、及び海洋ミミズ(marine worm)がある。しかしながら、本発明は、一例として昆虫類、蛛形類、唇脚類、及び多足類を含む、他の無脊椎動物を含む。
【0029】
本発明のもう一つの目的は、無脊椎動物における、遺伝子発現を抑制する、かつ/或いは、全身性免疫応答を誘導する新規方法を提供することである。特に、少なくとも1種の二本鎖RNAの投与による、全身性抗ウイルス免疫、又はバクテリア、菌類、などの無脊椎動物を感染する他の寄生生物に対する免疫である。
【0030】
本発明のさらに具体的な目的は、少なくとも1種の二本鎖RNAの投与により、無脊椎動物、好ましくは、海洋無脊椎動物、さらに好ましくは、エビにおいて、非特異的(全身性)免疫応答を誘導する方法を提供することである。ここで二本鎖RNAは、無脊椎動物を感染する種々の病原体、例えば、ウイルス、バクテリア、菌類、線虫、マイコプラズマ、微胞子虫類、略胞子虫類、グレガリナ類、及びより好ましくは、甲殻類関連ウイルス(crustacean associated viruses)などのウイルスに対する、非特異性(全身性)防御応答を誘導する。
【0031】
また、本発明の目的は、少なくとも1種の長鎖二本鎖RNAの投与により、甲殻類動物、好ましくは、エビにおいて、該甲殻類動物内在性の標的遺伝子、又は該甲殻類動物に感染する病原体に含まれる必須遺伝子の発現を抑制する、配列特異的dsRNAを介した応答を誘導する方法を提供する。ここで、二本鎖RNAは、該配列特異的免疫応答が、ウイルスなどの寄生生物に対する配列特異的防御性をもたらす、該甲殻類動物、又はウイルスなどの病原体に含まれる、標的遺伝子にかなり相当する配列を有する。
【0032】
さらに、本発明の目的は、エビなどの甲殻類動物において、非特異的(全身性)免疫応答、及び標的遺伝子の発現を抑制する、或いは妨げる、配列特異的RNA干渉応答の両方を誘導することである。ここで、標的遺伝子は、甲殻類動物遺伝子、又は病原体必須遺伝子であり、かつ少なくとも1種の二重鎖RNAの投与により、前記全身性免疫応答、及び前記配列特異的dsRNA 応答の組合せは、通常、前記甲殻類動物を感染する病原体、例えば、ウイルス、バクテリア、菌類、線虫、マイコプラズマ、微胞子虫類、略胞子虫類、又はグレガリナ類に対する防御性を与える。ここで、少なくとも1種の前記投与されたdsRNAは、甲殻類動物、又は前記甲殻類動物に感染する病原体に含まれる標的遺伝子に含まれる配列と、かなり相同な、又は同一である配列を含む。例えば、推定上の標的遺伝子は、コントロール、及びウイルス(WSSV、又はTSV)感染エビ組織を用いて作製される、サプレッションサブトラクティブハイブリダイゼーションライブラリーのようなゲノムライブラリー中で、同定することができる。他の潜在的な標的遺伝子の具体例は、VP28、リボヌクレオチド還元酵素、へモシアニン、VP26、VP19、チミジル酸キナーゼ、及びDNA ポリメラーゼなどである。
【0033】
その具体例を挙げると、免疫、成長、生殖、及び健康一般、又は"ロバスト性"に関与するような甲殻類動物遺伝子に相同であるdsRNAを含む。STAT、IKB、及び、NFKB、及び STATシグナル経路の他の推定上の構成要素のような遺伝子も含まれる。また、神経伝達物質、脱皮抑制ホルモン、生殖腺抑制ホルモン、及び甲殻類高血糖ホルモン含む、ホルモン、及び代謝経路をコードする遺伝子も含まれる。また、クラスチン及びペナエイジンなどの、抗菌ペプチド、又は、そのようなペプチドの産生調節因子をコードする遺伝子を含む。場合によっては、dsRNAを使用して、任意の所望される甲殻類動物遺伝子の発現を、減少させることができる。
【0034】
もう一つの好ましい目的は、非特異的dsRNA(例えば、ポリC: G)、及び特異的(特定の遺伝子を標的にする)dsRNAを共投与することにより、RNA干渉の有効性を高めることである。それにより、該非特異的dsRNAは、"アジュバント"として作用し、標的遺伝子の発現における該配列特異的dsRNAの効果を増大させる。
【0035】
好ましい態様において、dsRNAは、甲殻類動物、又は他の海洋無脊椎動物、好ましくはエビに投与される。病原体はエビウイルスであり、例を挙げると、ホワイトスポットシンドロームウイルス、タウラシンドロームウイルス、伝染性皮下造血器壊死ウイルス(IHHNV)、ペナエイドシュリンプのバキュロウイルス(BP)、ペナエイドシュリンプのラブドウイルス(RPS)、鰓関連ウイルス(GAV)、イエローヘッドウイルス(YHV)、リンパ器官関連ウイルス(LOVV);リンパ器官パボ様ウイルス疾患(LPV)、肝膵臓パボウイルス(HPV)、バキュロウイルス中腸腺壊死ウイルス(BMN)、モノドン型バキュロウイルス(MBV)、レオ様ウイルス疾患(REO)、及びラブドウイルス(RPS)、及び新生ウイルスがあり、その必須遺伝子は、当業者に利用可能な任意の手段を通じて、同定され、かつ配列決定され得る。前述のように、ウイルスとは、今までのところ同定されていない、或いは後で、組み換え、突然変異などにより生じたウイルスのことを言う。新生ウイルスは、単離され、(サブトラクティブハイブリダイゼーションを用いるなどして、)野生型エビゲノムとの比較して、同定することができる。
【0036】
また、本発明の目的は、機能ゲノム学を使用して、無脊椎動物免疫、特に海洋無脊椎動物免疫、好ましくは、甲殻類動物(例えば、エビ)免疫応答、成長、生殖、及び健康一般、又は"ロバスト性"に関与するような遺伝子の、推定上のオーソログ、特にエビの免疫応答のSTAT様、及びI-KB キナーゼ様遺伝子などを同定することである。
【0037】
本発明の具体的な目的は、推定上の免疫調節遺伝子の発現を低下させた、又は欠失させた、無脊椎動物細胞、又は動物、好ましくは、甲殻類動物細胞、又は動物を産生し、ウイルス、及び/又は内在性寄生生物に対する防御性をもたらす、遺伝子機能、及びその役割を裏付けることである。
【0038】
本発明のもう一つの目的は、海洋無脊椎動物に、例えば、甲殻類動物免疫、成長、生殖、及び健康一般、又は"ロバスト性"に関与する遺伝子、例えばSTAT様、及びI-KB キナーゼ様遺伝子、を発現増大、又は発現減少させる化合物を同定し、甲殻類の抗ウイルス免疫、及び炎症におけるこれらの遺伝子の役割を確認することである。
【0039】
さらに、本発明のもう一つの目的は、少なくとも1種の二本鎖RNA、又はウイルス感染により起こされる、非特異的(全身性)免疫応答後の誘導後、発現増大、又は発現低下する、特定の無脊椎動物遺伝子、好ましくは、海洋無脊椎動物で、例えば甲殻類動物遺伝子、より好ましくは、エビ遺伝子を同定することである。これらの遺伝子、例えば、STAT様、Toll、NFKB、及び"サイトカイニン様"遺伝子の機能解析は、無脊椎動物の生得的免疫、特に甲殻類免疫のより深い理解を促すであろう。さらに、そのような遺伝子の発現を調整する、化合物の同定が可能になり、従って、無脊椎動物免疫応答を調整するために使用できるであろう。
【0040】
本発明のもう一つの目的は、生物送達媒体、好ましくは、異種dsRNAを発現し、かつ/或いは一般的な免疫応答を生じさせる、少なくとも1種の長鎖dsRNAを発現する、微細藻類、又は酵母菌のような微生物生物送達媒体を作製することである。例えば、ここで、該異種dsRNAは、甲殻類関連ウイルス、バクテリア、微胞子虫類、略胞子虫類、又はグレガリナ類などの、甲殻類動物に感染する病原体の必須遺伝子、又は、免疫、成長、生殖、及び健康一般、又は"ロバスト性"に関与する遺伝子などの、甲殻類内在性遺伝子に特異的である。
【0041】
本発明の具体的な目的は、少なくとも1種のdsRNAを発現し、かつ/或いは一般的な免疫応答を生じさせる、少なくとも1種の長鎖dsRNAを発現する、酵母菌(好ましくは、サッカロミセス属)、又は微細藻類を提供することである。ここで、該dsRNAは、甲殻類関連ウイルス、バクテリア、微胞子虫類、略胞子虫類、又はグレガリナ類などの、甲殻類動物に感染する病原体の必須遺伝子、又は、免疫、成長、生殖、及び健康一般、又は"ロバスト性"に関与する遺伝子などの、甲殻類動物内在性遺伝子に特異的であるものである。発現が、誘導性プロモーターのコントロール下であるものが好ましい。
【0042】
本発明のもう一つの目的は、所望されるdsRNAを、甲殻類動物、又は軟体動物などの海洋無脊椎動物、好ましくは、エビへ送達することであって、エビなどの該甲殻類動物を、該dsRNAを養殖媒体に接触させること、又は該dsRNAを発現する、かつ/或いは一般的な免疫応答を起こす、少なくとも1種の長鎖dsRNAを発現する、少なくとも1種の微生物、好ましくは、酵母菌、又は微細藻類を含む餌料による。ここで、該dsRNAは、甲殻類関連ウイルス、バクテリア、微胞子虫類、略胞子虫類、又はグレガリナ類などの、甲殻類動物に感染する病原体の必須遺伝子、又は、免疫、成長、生殖、及び健康一般、又は"ロバスト性"に関与する遺伝子などの、甲殻類動物内在性遺伝子に特異的であるものである。発現が、誘導プロモーターのコントロール下であるものが好ましい。
【発明を実施するための最良の形態】
【0043】
(本発明の詳細な説明)
本発明をより詳細に記載するに先立ち、下記の定義を与える。その他の点では、全ての用語、及び慣用句は、関係同業者により、解釈されるものとする。
【0044】
本発明は、化合物、特にdsRNA、オリゴヌクレオチド、その改質された誘導体を、標的遺伝子をコードする核酸分子の機能、又は効果を調整するために使用する。これは、具体的に、標的遺伝子をコードする1種以上の核酸分子とハイブリダイズするdsRNA、又は標的遺伝子に相同な領域を含むかどうかわからない、かつ一般的な免疫応答が生じさせられる、長鎖dsRNA(50くらいのヌクレオチド鎖長、好ましくは、100ヌクレオチド鎖長以上)を提供することにより実現される。本明細書中において、"標的核酸"、及び"標的遺伝子をコードする核酸分子"という用語は、便宜上、そのようなDNA から転写された、mRNA前駆体、及びmRNA(又は、その一部)を含める、DNAがコードする核酸、及びまた、そのようなRNAから由来したcDNAも網羅するために使用されている。
【0045】
干渉されるべきDNA の機能は、複製、及び転写を含むことができる。例えば、複製、及び転写は、内在性細胞鋳型、ベクター、プラスミドコントラクト、又はそれ以外の由来であり得る。干渉されるべきRNA の機能は、例を挙げると、該RNA のタンパク質翻訳部位への転位、該RNAのRNA合成部位から離れた細胞内転位、タンパク質の該RNAからの転位、1種以上のRNA種を生じる該RNAのスプライシング、及び該RNAによって展開される、又は円滑になる、該RNAが関与している触媒作用、又は複合体形成などがある。該標的遺伝子の発現調整は、標的核酸機能での干渉の好ましい結果の1つである。本発明の文脈において、"調整"、及び"発現の調整"は、該遺伝子をコードする、DNA、又はRNAのような、核酸分子の量、又はレベルにおける、増加(促進)、又は減少(抑制)のいずれかを意味する。多くの場合、発現調整の好ましい形態は、抑制であり、かつ多くの場合、好ましい標的核酸は、mRNA である。
【0046】
この発明の文脈中、"ハイブリダイゼーション"は、オリゴマー化合物の相補的な鎖間の対合を意味する。本発明において、好ましい対合のメカニズムは、水素結合を含み、オリゴマー化合物の鎖の、相補的なヌクレオシド、又はヌクレオチド塩基(核酸塩基)間の、ワトソンクリック型、フーグステン型、又は逆フーグステン型水素結合を含む。例えば、アデニン、及びチミンは、水素結合の形成を通じて対合する相補的な核酸塩基である。ハイブリダイゼーションは、様々な状況下、例えば、高い、低い、及び緩やかなストリンジェンシー条件で、起こり得る。
【0047】
"低いストリンジェンシー条件"の例は、2種の核酸配列を10% ホルムアルデヒド、5倍濃縮デンハルト溶液、6xSSPE、0.2% SDS溶液中において、42℃でハイブリダイズさせることである。
"緩やかなストリンジェンシー条件"は、ハイブリダイゼーションが50% ホルムアルデヒド、5Xデンハルト溶液、5xSSPE、0.2% SDS溶液中、42℃で起こり、続いて0.2XSSPE、0.2% SDS 中、65℃で洗浄することを意味する。
【0048】
"高いストリンジェンシー条件"は、ハイブリダイゼーションが50% ホルムアルデヒド、5Xデンハルト溶液、5xSSPE、0.2% SDS溶液中、42℃で起こり、続いて0.1XSSPE、0.2% SDS 中、65℃で洗浄することを意味する。
具体的に、dsRNA化合物がハイブリダイズしやすいのは、該化合物の該標的核酸への結合が、該標的核酸の正常機能を干渉し、活性の低下を起こし、かつ、十分な程度の相補性があり、特異的結合が所望される条件下で、アンチセンス化合物の非標的核酸配列への非特異的結合が生じない場合である。上記所望される条件の例を挙げると、インビボ測定、及び治療上の処置の場合の生理的条件、及びインビトロ測定の場合に測定を行う条件がある。
【0049】
"非特異的"、又は"配列非特異的"dsRNAは、それを投与する無脊椎動物のゲノム配列に、又は前記無脊椎動物に感染する寄生生物に対して、有意な公知の配列同一性を有しないdsRNAのことを言う。ここで、無脊椎動物は、甲殻類動物、軟体動物、好ましくはエビなどの海洋無脊椎動物である。例は、ポリC: Gである。好ましくは、該"非特異的"dsRNAは、長鎖、例えば、少なくとも50ヌクレオチド鎖長、より好ましくは、少なくとも200〜500ヌクレオチド鎖長か、それ以上であろう。好ましい態様において、該dsRNAは、甲殻類動物遺伝子、又は甲殻類動物を感染させる寄生生物の必須遺伝子などの、特定な標的遺伝子の発現を標的にする(抑制する)配列特異的dsRNAにより起こされた、RNA干渉応答を促進(増強)する機能をもつであろう。
【0050】
本発明において、"ストリンジェントなハイブリダイゼーション条件"、又は"ストリンジェントな条件"の慣用句は、本発明の化合物が、その標的配列の他に、最少限の他の配列へハイブリダイズするであろう条件のことを言う。ストリンジェントな条件は、配列依存性であり、様々な状況で異なるであろう。この発明の文脈において、オリゴマー化合物が標的配列へハイブリダイズする"ストリンジェントな条件"は、オリゴマー化合物の性質、及び組成、及びそれらが調べられる測定法により決定される。典型的なストリンジェントなハイブリダイゼーション条件は、上記に提供される。
【0051】
本明細書中に使われている"相補的な"は、オリゴマー化合物の2種の核酸塩基間の、正確な対合性のことを言う。例えば、もし、オリゴヌクレオチド(オリゴマー化合物)の特定部位の核酸塩基が、標的核酸の特定位置の核酸塩基と水素結合でき、前記核酸が、DNA、RNA、又はオリゴヌクレオチド分子であるなら、該オリゴヌクレオチドと該標的核酸間の水素結合の位置は、相補的な位置であると考えられる。各分子の十分な数の相補的な位置が、互いに水素結合できる核酸塩基によって占められるとき、該ヌクレオチド、及びさらなるDNA、RNA、又はオリゴヌクレオチド分子は、互いに相補的である。従って、"特にハイブリダイズ可能な"、及び"相補的な"は、オリゴヌクレオチド、及び標的核酸間で、安定した特異的な結合が起こるような、十分な程度の正確な対合性、又は十分な数の核酸塩基の相補性を示唆するのに使用される用語である。
【0052】
本発明によると、dsRNAの配列は、特異的にハイブリダイズ可能な、その標的核酸の配列と100%相補的である必要がないことは、技術的に理解されている。さらに、オリゴヌクレオチドは、介在している、又は隣接した断片が、ハイブリダイゼーション事象に関与していないような、1種以上の断片とハイブリダイズし得る(例えば、ループ構造、又はヘアピン構造)。本発明のdsRNA は、標的核酸の標的領域へ少なくとも70%の配列相補性を含む、より好ましくは、90%の配列相補性を含む、さらにより好ましくは、標的とされる該標的核酸内の該標的領域へ95%の相補性を含むことが好ましい。例えば、dsRNA化合物が、該化合物の20核酸塩基のうち18が標的領域に相補的であり、それゆえ特異的にハイブリダイズする場合は、90%相補性に相当する。この例において、残りの非相補的な核酸塩基は、集合しているか、或いは相補的核酸塩基が組み入れられていてもよく、かつ相互に、又は相補的核酸塩基に隣接している必要はない。同様に、dsRNA化合物が、18核酸塩基鎖長であり、該標的核酸に完全相補性の2つの領域により、側面に位置される4非相補性核酸塩基からなる場合は、総合的に、該標的核酸と77. 8%の相補性をもち、本発明の範囲内にある。日常的に、アンチセンス化合物の、標的核酸の領域とのパーセント相補性は、当技術において公知である、BLAST プログラム(塩基局所アライメント検索ツール)、及びPowerBLASTプログラムを使用して決定することができる(Altschulらの論文、 J. Mol. Biol., 1990, 215, 403-410; Zhang、及びMaddenの論文、Genome Res., 1997, 7, 649- 656)。
【0053】
この発明の文脈において、"オリゴマーの化合物"、又は"オリゴマーの核酸分子"という用語は、複数のモノマー単位を含むポリマー、又はオリゴマーのことを言う。この発明の文脈において、"オリゴヌクレオチド"という用語は、リボ核酸(RNA)、又は核酸(DNA)、又はその模倣物、キメラ、アナログ、及びホモログの、オリゴマー、又はポリマーのことを言う。この用語は、天然に存在する核酸塩基、糖類、及びヌクレオシド内(骨格)共有結合から成るオリゴヌクレオチドと同様、機能は同様であるが、天然に存在しない部分からなるオリゴヌクレオチドも含む。多くの場合、そのような改質された、又は置換されたオリゴヌクレオチドは、所望される特性のため、天然型より好まれる。そのような特性の例を挙げると、増強された細胞取り込み、増強された標的核酸への親和性、及び高められたヌクレアーゼの存在での安定性である。
【0054】
dsRNAオリゴヌクレオチドが、この発明の化合物の好ましい形態であるが、本発明は、下記記載のように、オリゴヌクレオチドアナログ、及びその模倣改良物を網羅する。
この発明の文脈において、dsRNA化合物が特定の核酸分子を"標的にすること"は,多工程プロセスであり得る。通常、該工程は、その機能が調整されるべき標的核酸の同定から始まる。この標的核酸の例を挙げると、発現が特定の障害、又は疾患に関連している、細胞性遺伝子(又は、該遺伝子から転写されたmRNA)、又は好ましくは、感染性因子(例えば、ウイルス)由来の核酸分子があり得る。
【0055】
また、通常、標的工程は、発現の調整などの、所望の効果がもたらされるようなことが起こる、結合相互作用のための標的核酸内の、少なくとも1種の標的領域、断片、又は部位の決定を含む。本発明の文脈内で、"領域"という用語は、少なくとも1種の同定可能な構造、機能、又は特性からなる標的核酸の一部分と定義される。断片は、標的核酸の領域内にある。"断片"は、標的核酸内の、より小さい、又は部分的な領域と定義される。本明細書中で使われる"部位"は、標的核酸内の位置として定義される。
【0056】
当技術分野で公知のように、典型的に、翻訳開始コドンは、5'-AUG (転写されたmRNA分子において;該相当するDNA分子においては5'-ATG)であるので、該翻訳開始コドンは、また"AUG コドン"、該"開始コドン"、又は"AUG 開始コドン"と言われる。少数の遺伝子は、5'-GUG、5'-WG、5'- CUGの RNA 配列からなる、翻訳開始コドンを持ち、かつ5'-AUA、5'-ACG 、及び5'-CUG はインビボで機能することが示されている。従って、一般的に、どの場合でも開始アミノ酸は、メチオニン(真核生物の場合)、又はホルミルメチオニン(原核生物の場合)であるにしても、"翻訳開始コドン"、又は"開始コドン"の用語は、多くのコドン配列を網羅することができる。また、真核、及び原核動物遺伝子が、2種以上の代わりに使える開始コドンを持つことができ、そのうちのいずれかが、特定の細胞型、又は組織における、又は特定な条件下の翻訳開始に選択的に使用され得ることは、当技術分野において知られている。本発明の文脈において、"開始コドン"、及び"翻訳開始コドン"は、そのようなコドンの配列にかかわらず、インビボで使用され、遺伝子から転写されたmRNA の翻訳を開始するコドン、または複数のコドンのことを言う。また、遺伝子の翻訳終止コドン(又は、"終止コドン")は、3種の配列、すなわち5'-UAA、5'-UAG、及び5'-UGA(その相当するDNA配列は、各々、5'-TAA、5'-TAG、及び5'-TGAである)のうち1種をもち得ることは、当技術分野において知られている。
【0057】
"開始コドン領域"、及び"翻訳開始コドン領域"の用語は、翻訳開始コドンからいずれかの方向(5'、又は3')に、約25から約50の隣接したヌクレオチドを網羅するような、mRMA、又は遺伝子の一部分のことを言う。同様に、"終止コドン領域"、及び"翻訳終止コドン領域"は、翻訳終止コドンからいずれかの方向(5'、又は3')に、約25から約50の隣接したヌクレオチドを網羅するような、mRMA、又は遺伝子の一部分のことを言う。従って、"開始コドン領域"(又は、"翻訳開始コドン領域")、及び"終止コドン領域"("翻訳終止コドン領域")は、本発明のアンチセンス化合物で効果的に標的され得る、全ての領域である。
【0058】
当技術分野においてよく知られているタンパク質コード領域(ORF)、又は"コード領域"は、翻訳開始コドン、及び翻訳終止コドン間の領域のことを言うことが、また、効果的に標的にされる領域である。本発明の文脈中で、好ましい領域は、遺伝子のタンパク質コード領域(ORF)の翻訳開始、又は終止コドンを網羅する、該遺伝子内領域である。
【0059】
他の標的領域は、当技術分野においてよく知られている5'非翻訳領域(5'UTR)は、翻訳開始コドンから5'方向のmRNAの部分のことを言い、従って、mRNA(又は、該遺伝子の相当するヌクレオチド)の該5'キャップ部位、及び該翻訳開始コドン間のヌクレオチドを含んでいる領域、及び3'非翻訳領域(3'UTR)という、当技術分野において公知であり、翻訳終止コドンから3'方向のmRNAの一部分のことを言い、かつ従って、mRNA(又は、該遺伝子の相当するヌクレオチド)の翻訳終止コドン、及び3'末端間のヌクレオチドを含んでいる領域、である。mRNA の5'キャップ部位は、5'の大部分の残基に5'-5'リン酸結合によって結合する、N7メチル化型グアニン残基を含む。mRNA の該5'キャップ領域は、5'構造自体と同様、該キャップ部位に隣接した最初の50 ヌクレオチドが含まれると考えられている。また、5'キャップ領域を標的にすることは好ましい。
【0060】
数種の真核生物のmRNA 転写産物は、直接翻訳されるが、多くは、1種以上の"イントロン"として知られている領域を含み、それは、翻訳される前に、転写産物から切り取られる。その残りの(かつ、その後翻訳される)領域は、"エクソン"として知られており、共に接合され、連続的なmRNA 配列を形成する。また、スプライス部位、すなわち、イントロン‐エクソン接合部、又はエクソン‐イントロン接合部を標的にすることは、疾患に異常なスプライシングが関与している、又は疾患に特定のスプライス産物の過剰産生が関与している状況において、特に有用であり得る。また、転位、又は欠失による異常な融合接合部は、好ましい標的部位である。異なった遺伝子源から、2種(又はそれ以上)のmRNAのスプライシングプロセスを経て、産生されるmRNA転写産物は、"融合転写産物"として知られている。また、イントロンが、例えば、DNA、又はmRNA前駆体を標的にする、アンチセンス化合物を使用して、効果的に標的にされることが知られている。
【0061】
また、当技術分野において、代わりになるRNA転写産物が、DNAの同一ゲノム領域から産生され得ることが知られている。一般に、これらの代わりになる転写産物は、"変異体"として知られている。より具体的には、"mRNA 前駆体変異体"は、該同一ゲノムDNA から産生した転写産物であり、該同一ゲノムDNA から産生した他の転写産物と、その開始、又は終止位置のいずれかが異なり、かつイントロン、及びエクソン両方の配列を含む。
【0062】
スプライシング中の、1種以上のエクソン、又はイントロン領域、又はその一部分の切り出しにあたり、mRNA前駆体変異体は、より小さい"mRNA変異体"を産生する。従って、mRNA変異体は、mRNA前駆体変異体から処理され、かつ各々の独特なmRNAは、スプライシングの結果として、常に独特なmRNA変異体を産生せざるを得ない。また、これらのmRNA変異体は、代替スプライス変異体(alternative splice variants)として知られている。mRNA前駆体変異体のスプライシングが起きない場合は、該mRNA前駆体変異体は、mRNA変異体と同一である。
【0063】
また、変異体が、転写開始する、又は終止する、代わりになるシグナルを通じて産生され得ること、及びmRNA前駆体、又はmRNAが1種以上の開始コドン、又は終止コドンを有し得ることは、当技術分野において知られている。代わりになる開始コドンを使用する、mRNA前駆体、又はmRNAから由来する変異体は、"代替開始変異体(alternative start variants)"として知られている。代わりになる終止コドンを使用するそのような転写産物は、RNA前駆体、又はmRNAの"代替終止変異体(alternative stop variants)"として知られている。代替終止変異体の具体的な型の1種は、産生された複数の転写産物が、転写機能による"ポリA終止シグナル"の1つである、代わりになる選択に由来する"ポリA変異体"であり、従って、独特のポリA部位で終止される転写産物が産生される。また、本発明の文脈において、本明細書中に記載される変異体の型は、好ましい標的核酸である。
【0064】
該好ましいアンチセンス化合物がハイブリダイズする、標的核酸上の位置は、本明細書中、以下"好ましい標的断片"と呼ばれる。本明細書中において、"好ましい標的断片"の用語は、dsRNA化合物に標的とされる、標的領域の少なくとも8核酸塩基部分と定義される。理論によってとらわれることを望んでいるわけではないが、現在、これらの標的断片は、ハイブリダイゼーションに利用しやすい、該標的核酸の一部分を意味する。
【0065】
数種の好ましい標的断片の特異的配列は、本明細書中に示されるが、当業者は、これらが、本発明の範囲内の特定の態様を例証し、かつ記載するのに役立つこと認識。さらなる好ましい標的断片は、当業者により同定され得る。
【0066】
該例示の好ましい標的断片内から選択される、少なくとも隣接した8核酸塩基の伸張を含む、8〜80核酸塩基鎖長の標的断片は、同様に標的に適していると考えられる。標的断片は、該例示の好ましい標的断片の1種の5'末端から、少なくとも該隣接した8核酸塩基を含む、DNA、又はRNA配列を含み得る(その残りの核酸塩基は、該同一のDNA、又はRNAの隣接した伸張であって、該標的断片の5'末端のすぐ上流から始まり、該DNA,又はRNAが、約8から約80核酸塩基を含むまで連続する)。同様に、好ましい標的断片は、該例示の好ましい標的断片の1種の3'末端から、少なくとも該隣接した8核酸塩基を含む、DNA、又はRNA配列により示される(その残りの核酸塩基は、該同一のDNA、又はRNAの隣接した伸張であって、該標的断片の3'末端のすぐ下流から始まり、該DNA,又はRNAが、約8から約80核酸塩基を含むまで連続する)。本明細書中に記載された、該好ましい標的断片を提供された当業者は、不要な実験をすることなく、さらなる好ましい標的断片を同定できる。
【0067】
本発明の該二本鎖RNA 化合物は化学修飾の対象になる得る(Fireらの論文、Nature, 1998,391, 806-811;Timmons、及びFireの論文、Nature 1998,395, 854;Timmonsらの論文、Gene, 2001, 263,103-112;Tabaraらの論文、Science, 1998, 282, 430-431;Montgomeryらの論文、Proc. Natl. Acad. Sci. USA, 1998, 95, 15502-15507;Tuschl らの論文、Genes Dev., 1999,13, 3191-3197;Elbashirらの論文、Nature, 2001,411, 494-498;Elbashirらの論文、Genes Dev. 2001,15, 188-200)。当技術分野において公知のように、ヌクレオシドは塩基‐糖類の組合せである。通常、ヌクレオシドの塩基部分は、複素環塩基である。そのような複素環の、最も一般的な2種の分類は、プリン類、及びピリミジン類である。ヌクレオチドは、さらに、ヌクレオシドの糖類部分に共有結合されるリン酸基を含む、ヌクレオシドである。ペントフラノシル糖を含むヌクレオシドには、該リン酸基は、該糖の2'、3'、又は5'のいずれかに結合され得る。オリゴヌクレオチドの形成において、該リン酸基は、お互いに隣接したヌクレオシドに共有結合し、直線状ポリマーの化合物を形成する。順々に、さらに、この直線状ポリマーの化合物の各々の末端が結合され、環状化合物を形成することができる。しかしながら、一般的に、直線上化合物が好ましい。さらに、直線状化合物は、内在的な相補性を持つことができ、従って、完全に、又は部分的に二本鎖化合物を産生する方法で折り重なることができる。オリゴヌクレオチド内では、一般に、該リン酸基は、オリゴヌクレオチドのヌクレオシド内骨格を形成すると言われている。RNA、及びDNAの骨格の通常の結合は、3'から5'へのリン酸エステル結合である。
【0068】
この発明に有用である、改質dsRNA化合物の具体例は、改質された骨格、又は非天然ヌクレオシド内結合を含む、オリゴヌクレオチドを含む。この明細書で定義されたように、改質した骨格を持つオリゴヌクレオチドは、該骨格内にリン原子を保持するもの、及び該骨格内にリン原子を持たないものを含む。この明細書の目的で、かつ時々当技術分野で引用されるように、また、そのヌクレオシド骨格にリン原子を持たないオリゴヌクレオチドは、オリゴヌクレオシドとして考えられ得る。
【0069】
リン原子をその中に含む、改質されたオリゴヌクレオチド骨格の、好ましい例を挙げると、チオリン酸、キラルチオリン酸、ジチオリン酸、リン酸トリエステル、アミノアルキルリン酸トリエステル、例えば、3'-アルキレンホスホン酸メチル、5'-アルキレンホスホン酸メチル、及びキラルホスホン酸などのメチル、及び他のアルキルホスホン酸、ホスフィン酸、例えば、3'-アミノホスホルアミド酸、及びアミノアルキルホスホルアミド酸、などのホスホルアミド酸、チノホスホルアミド酸、チノアルキルホスホン酸、チノアルキルリン酸トリエステル、セレノリン酸、及びボラノリン酸であって、正常な3'-5'結合、これらの2'-5'結合アナログを持つもの、及び1種以上のインターヌクレオチド結合が、3'-3'、5'-5'、又は2'-2'結合である逆極性を持つものがある。好ましい、逆極性をもつオリゴヌクレオチドは、3'-の多くのインターヌクレオチド結合で、単一の3'-3'結合、すなわち、単一の反転されたヌクレオチドを持ち、脱塩基性であり得る(該核酸塩基は欠失しているか、或いはその場所に水酸基をもつ)。また、多様な塩、混合塩、及び遊離酸が含まれる。
【0070】
上記リン含有結合の調製を教示する、典型的な米国特許は、下記の文献を含むが、これらに限定されない。米国特許第3,687,808号;第4,469,863号;第4,476,301号;第5,023,243号;第5,177,196号;第5,188,897号;第5,264,423号;第5,276,019号;第5,278,302号;第5,286,717号;第5,321,131号;第5,399,676号;第5,405,939号;第5,453,496号;第5,455,233号;第5,466,677号;第5,476,925号;第5,519,126号;第5,536,821号;第5,541,306号;第5,550,111号;第5,563,253号;第5,571,799号;第5,587,361号;第5,194,599号;第5,565,555号;第5,527,899号;第5,721,218号;第5,672,697号、及び第5,625,050号であり、その各々は、引用により、本明細書に取り込まれる。
【0071】
リン原子を含まない、改質された、オリゴヌクレオチドの骨格の例を挙げると、短鎖アルキル、又はシクロアルキルインターヌクレオチド結合、混合されたヘテロ原子、及びアルキル、又はシクロアルキルインターヌクレオチド結合、又は1種以上の短鎖へテロ原子、又は複素環インターヌクレオチド結合により形成される骨格がある。これらは、モルフォリノ結合(ヌクレオシドの糖類部分の部分的に形成される);シロキサン骨格、スルフィド、スルホキシド、及びスルホン骨格; ホルムアセチル、及びチオホルムアセチル骨格;メチレンホルムアセチル、及びチオホルムアセチル骨格;リボアセチル骨格;アルケン含有骨格; スルファミン酸骨格;メチレンイミノ、及びメチレンヒドラジノ骨格; スルホン酸、及びスルホンアミド骨格;アミド骨格;及び混合したN、O、S及びCH2構成要素をもつ他のものを含む。
【0072】
上記オリゴヌクレオシドの調製を教示する、典型的な米国特許は、下記の文献を含むが、これらに限定されない。米国特許第5,034,506号;第5,166,315号;第5,185,444号;第5,214,134号;第5,216,141号;第5,235,033号;第5,264,562号;第5,264,564号;第5,405,938号;第5,434,257号;第5,466,677号;第5,470,967号;第5,489,677号;第5,541,307号;第5,561,225号;第5,596,086号;第5,602,240号;第5,610,289号;第5,602,240号;第5,608,046号;第5,610,289号;第5,618,704号;第5,623,070号;第5,663,312号;第5,633,360号;第5,677,437号;第5,792,608号;第5,646,269号、及び第5,677,439,であり、その各々は、引用により、本明細書に取り込まれる。
【0073】
その他にも、いくつかのヌクレオチド単位の、糖類とインターヌクレオチド結合(すなわち、骨格)の両方が新規の基に置換される、オリゴヌクレオチド模倣物がある。核酸塩基単位は、適切な標的核酸とのハイブリダイゼーションのために保存される。そのような化合物の1種で、優れたハイブリダイゼーション特性をもつことが示されているオリゴヌクレオチドは、ペプチド核酸(PNA)と言われる。PNA化合物では、オリゴヌクレオチドの糖骨格が、アミド含有骨格に、具体的には、アミノエチレングリシン骨格に置換されている。該核酸塩基は、保持され、かつ該骨格のアミド部分のアザ窒素原子に、直接的に、又は間接的に結合される。PNA化合物の調製を教示する、典型的な米国特許は、下記の文献を含むが、これらに限定されない。米国特許第5,539,082号;第5,714,331号、及び第5,719,262号であり、その各々は、引用により、本明細書に取り込まれる。さらなるPNA の教示される内容は、Nielsenらの論文(Science, 1991,254, 1497-1500)に見い出される。
【0074】
例えば、本発明によると、dsRNAは、チオリン酸骨格にもつオリゴヌクレオチド、及びヘテロ原子骨格をもつオリゴヌクレオシドを含むことができる。具体的には、--CH2--NH--O--CH2--、--CH2--N (CH3)--O--CH2-- [メチレン(メチルイミノ)、又はMMI骨格として公知]、--CH2--O-- N (CH2)--CH. 置換. 2-、-CH2-N (CH3)-N (CH3)-CH2-、及び上記の米国特許第5,489,677号の-0-N (CH3)-CH2- CH2-- [この中で、その本来のリン酸ジエステル骨格は、--O--P--O-- CH2-と示される]、上記米国特許第5,602,240号のアミド骨格、及び米国特許第5,034,506号において開示されている、モルフォリノ骨格をもつオリゴヌクレオチドがある。
【0075】
さらに、また、本発明によると、改質したオリゴヌクレオチドは、1種以上の置換された糖部分を含むことができる。例を挙げると、オリゴヌクレオチドは、その2'位に、下記の1つを含むことができる:OH;F; 0-、S-、又はN-アルキル; O-、S-、又はN-アルケニル; O-、S-、又はN-アルキニル;又はO-アルキル-O-アルキル、その中で、該アルキル、アルケニル、及びアルキニルは、置換され得る、又は非置換であり得る、Cl〜C10アルキル、又は C2〜C10アルケニル、及びアルキニルであり、さらに具体的には、O [(CH2) nO] mCH3 O (CH2) nOCH3、O (CH2) nNH2, O (CH2) nCH3、 O (CH2) nONH2、及びO (CH2) nON [ (CH2) nCH3] 2であり、式中n、及びmは1〜約10である。さらに、好ましいオリゴヌクレオチドは、該2'位に、下記の1つを含む:Cl〜C10の低級アルキル、置換された低級アルキル、アルケニル、アルキニル、アルカリール、アラルキル、0-アルカリール、0-アラルキル、SH、SCH3、OCN、Cl、Br、CN, CF3 OCF3 SOCH3 S02CH3 ON02 N02 N3 NH2 ヘテロシクロアルキル、ヘテロシクロアルカリール、アミノアルキルアミノ、ポリアルキルアミノ、置換されたシリル、RNA切断基、リポーター基、インターカラター(intercalator)基、オリゴヌクレオチドの薬物動態学的特性を改良するための基、オリゴヌクレオチドの薬効学的特性を改良するための基、及び同様の特性をもつ他の置換基である。
【0076】
他の可能な改質は、2'-メトキシ(2'-O--CH3)、2'- アミノプロポキシ(2'-OCH2CH2CH2NH2)、2'-アリル(2'-CH2-CH=CH2)、2'-O-アリル(2'- O--CH2-CH=CH2)、及び2'-フルオロ(2'-F)である。該2'改質は、アラビノの(上の)位置、又はリボ(下の)位置にあり得る。また、同様の改変は、該オリゴヌクレオチドの他の位置、特に、3'末端ヌクレオチド上、又は2'-5'結合しているヌクレオチドにおける、糖類の3'位置、及び5'末端ヌクレオチドの5'位置に施され得る。また、オリゴヌクレオチドは、ペントフラノシル糖の代わりにシクロブチルのような糖模倣物をもつ。そのような改質された糖構造の調製を教示する、典型的な米国特許は、下記の文献を含むが、これらに限定されない。米国特許第4, 981,957号;第5,118,800号;第5,319,080号;第5,359,044号;第5,393,878号;第5,446,137号;第5,466, 786号;第5,514,785号;第5,519,134号;第5,567,811号;第5,576,427号;第5,591,722号;第5,597,909号;第5,610,300号;第5,627,053号;第5,639,873号;第5,646,265号;第5,658,873号;第5,670,633号;第5,792,747号;及び第5,700,920号であり、その各々は、引用により、その全体が本明細書に取り込まれる。
【0077】
もう一つの該糖類の可能な改良は、ロックト核酸(Locked Nucleic Acid)(LNA)を含み、その中で2'水酸基が、該糖環の3'、又は4'炭素原子と結合されて、それにより、二環性糖部分を形成する。好ましくは、該結合は、2'酸素原子、及び4' 炭素原子を架橋する、メチレン(--CH2) nグループであり、式中nは1、又は2である。LNA、及びその調製は、国際公開第98/39352号、及び国際公開第99/14226号に記載されている。
【0078】
また、オリゴヌクレオチドは、核酸塩基(多くの場合、当技術分野において、単に"塩基"と言われる)の改質、又は置換を含む。本明細書中では、"改質されていない"、又は"天然の"核酸塩基は、プリン塩基のアデニン(A)、及びグアニン(G)、及びピリミジン塩基のチミン(T)、シトシン(C)、ウラシル(U)を含む。 改質された核酸塩基は、他の合成、及び天然の核酸塩基を含む。例を挙げると、5-メチルシトシン (5-me-C)、5-ヒドロキシメチルシトシン、キサンチン、ヒポキサンチン、2- アミノ-アデニン、アデニン、及びグアニンの6-メチル、及び他のアルキル誘導体、アデニン、及びグアニンの2-プロピル、及び他のアルキル誘導体、2-チオウラシル、2- チオチミン、及び2-チオシトシン、5-ハロウラシル、及びシトシン、5-プロピニル(--C-C- CH3)ウラシル、及びシトシン、及びピリミジン塩基の他のアルキニル誘導体、6-アゾウラシル、シトシン、及びチミン、5-ウラシル(擬似ウラシル)、4-チオウラシル、 8-ハロ、8-アミノ、8-チオール、8-チオアルキル、8-ヒドロキシ、及び他の8-置換アデニン、及びグアニン、5-ハロ、特に5-ブロモ、5-トリフルオロメチル、及び他の5-置換ウラシル、及びシトシン、7-メチルグアニン、7-メチルアデニン、2-F-アデニン、2-アミノ-アデニン、8-アザグアニン、及び 8-アザアデニン、7-デアザグアニン、及び7-デアザアデニン、及び3-デアザグアニン、及び3-デアザアデニンがある。さらなる改質された核酸塩基は、三環性ピリミジンを含む。例を挙げると、フェノキサジンシチジン(lH- ピリミド [5, 4-b] [1, 4] ベンゾキサジン-2 (3H) オン)、フェノチアジンシチジン(1H- ピリミド [5,4-b] [1, 4] ベンゾチアジン- 2 (3H) オン)、置換されたフェノキサジンシチジン(例えば、9- (2-アミノエトキシ)-H-ピリミド [5, 4-b] [1, 4] ベンゾキサジン-2 (3H) オン)、カルバゾールシチジン(2H-ピリミド [4, 5-b] インドール-2-オン)、ピリドインドールシチジン(H-ピリド[3', 2' : 4,5] ピロロ [2,3-d] ピリミジン-2-オン)がある。また、改質された核酸塩基は、該プリン、又はピリミジン塩基が他の複素環に置換されるものを含む。例を挙げると、7-デアザアデニン、7-デアザグアノシン、2-アミノピリジン、及び2-ピリドである。さらなる核酸塩基は、下記に記載されているものを含む。米国特許第3,687,808号に開示されているもの、Kroschwitz, J. I.編集"ポリマー科学、及び工学のコンサイス百科事典"(The Concise Encyclopedia Of Polymer Science And Engineering、John Wiley & Sons社、1990年)858〜859ページに開示されているもの、Englischらの論文(Angewandte Chemie, International Edition, 1991,30, 613)により開示されているもの、"アンチセンス研究、及び適用"(Antisense Research and Applications、Crooke, S. T.、及びLebleu, B編集、CRC Press社、1993年)中のSanghvi, Y. S.の第15章(289〜302ページ)により開示されているものが挙げられる。特に、これらの核酸の特定の種は、本発明の該化合物の結合親和性を増大させるのに有用である。これらは、5-置換されたピリミジン、6-アザピリミジン、及び例えば2-アミノプロピルアデニン、5-プロピニルウラシル、及び5-プロピニルシトシンを含む、N-2、N-6、及び0-6置換されたプリンである。5-メチルシトシン置換は、0.6から1.2℃の差で核酸二本鎖の安定性を増大することが示されており、かつ現在、好ましい塩基置換である。特に2'-O-メトキシエチルの糖の改質と組合せると、さらに好ましい。
【0079】
上記記載の、改質された核酸塩基の特定の種と同様、他の改質された核酸塩基の調製を教示する、典型的な米国特許は、下記の文献を含むが、これらに限定されない。該上記記載の米国特許第3,687,808号と同様、米国特許第4,845,205号;第5,130,302号;第5,134,066号;第5,175,273号;第5,367,066号;第5,432,272号;第5,457,187号;第5,459,255号;第5,484,908号;第5,502,177号;第5,525,711号;第5,552,540号;第5,587,469号;第5,594,121号;第5,596,091号;第5,614,617号;第5,645,985号;第5,830,653号;第5,763,588号;第6,005,096号;及び第5,681,941号であり、その各々は、引用により、本明細書に取り込まれる。
【0080】
さらに、本発明の該オリゴヌクレオチドは、該オリゴヌクレオチドの活性、細胞局在、又は細胞の取り込みを増大させる、1種以上の部分、又は共役体と化学的に結合し得る。これらの部分、又は共役体は、例えば、第一級、又は第二級ヒドロキシル基などの官能基に共有結合している、共役体基を含むことができる。本発明の共役体基は、インターカラター、リポーター分子、ポリアミン、ポリアミド、ポリエチレングリコール、ポリエーテル、オリゴマーの薬効学的特性を高める基、及びオリゴマーの薬物動態学的特性を高める基を含む。典型的な共役体基は、コレステロール、脂質、リン脂質、ビオチン、フェナジン、葉酸、フェナントリジン、アントラキノン、アクリジン、フルオレセイン、ローダミン、クマリン、及び色素である。本発明の文脈において、薬効学的特性を高める基を挙げると、取り込みを改良する、分解に対する耐性を高める、かつ/或いは該標的核酸との配列特異的ハイブリダイゼーションを高める基がある。本発明の文脈において、薬物動態学的特性を高める基は、本発明の該化合物の取り込み、分布、代謝,又は排出を改良する基である。典型的な共役体基は、1992年10月23日に出願された、国際特許出願PCT/US92/09196、及び米国特許第6,287,860号に開示されており、その開示全体が、引用により、本明細書に取り込まれる。共役体部分は下記の部分を含むが、これらに限定されない。 コレステロール部分などの脂質部分、コール酸、例えばヘキシル-S-トリチルチオールなどのチオエーテル、チオコレステロール、例えばドデカンジオール、又はウンデシル残基などの脂肪族鎖、例えばジヘキサデシル-rac-グリセロール、又は1,2-ジ-O-ヘキサデシル-rac-グリセロ-3-H-ホスホン酸トリエチルアンモニウム塩などのリン脂質、ポリアミン、又はポリエチレングリコール鎖、又はアダマンタン酢酸、パルミチル部分、又はオクタデシルアミン、又はヘキシルアミノ-カルボニル-オキシコレステロール部分である。
【0081】
また、本発明の該dsRNA化合物は、取り込み、分布、及び/又は、吸収を助けるために、混合、カプセル封入、共役、或いはそうでなければ、他の分子、分子構造、又は化合物混合物に関連させることができる。例を挙げると、リポソーム、レセプター標的分子、経口、直腸、局所、又は他の製剤である。そのような取り込み、分布、及び/又は吸収を助ける製剤の調整を教示する、典型的な米国特許は、下記の文献を含むが、これらに限定されない。米国特許第5,108,921号;第5,354,844号;第5,416,016号;第5,459,127号;第5,521,291号;第5,543,158号;第5,547,932号;第5,583,020号;第5,591,721号;第4,426,330号;第4,534,899号;第5,013,556号;第5,108,921号;第5,213,804号;第5,227,170号;第5,264,221号;第5,356,633号;第5,395,619号;第5,416,016号;第5,417,978号;第5,462,854号;第5,469,854号;第5,512,295号;第5,527,528号;第5,534,259号;第5,543,152号;第5,556,948号;第5,530,575号;及び第5,595,756号であり、その各々は、引用により、本明細書に取り込まれる。
【0082】
さらに、本発明の該化合物は、任意の生物として許容される塩、エステル、又はそのようなエステルの塩、又は無脊椎動物への投与時に、(直接、又は間接的に)生物活性代謝物、又はその残留物を提供できる他の化合物を含む。
"生物として許容される塩"という用語は、本発明の該化合物の生理的に、かつ医薬として許容される塩のことを言う:すなわち、該親化合物の所望される生物活性を保持し、それに所望しない毒性効果を与えない塩である。
【0083】
また、本発明は、本発明の該dsRNA化合物を含む、生物組成物、及び製剤を含む。本発明の医薬組成物は、所望されるのが、局所、又は全身処置かどうか、及び処置される部位によって、様々な方法で投与され得る。投与は、局所、経口、又は非経口であり得る。非経口投与は、注入、又は浸漬を含む。
本発明の文脈において、"共投与"は、2種の異なる化合物、好ましくは、dsRNAの、個別、又は組合せての、いずれかの順での投与を意味する。好ましくは、そのようなdsRNAが、下記記載の生物送達媒体に含まれる。
【0084】
本発明のdsRNA製剤は、溶液、乳濁液、泡、及びリポソーム含有製剤を含むが、それらに限定されない。本発明の医薬組成物、及び製剤は、1種以上の浸透エンハンサー、担体、賦形剤、又は他の活性、又は不活性成分を含むことができる。
一般的に、エマルジョンは、一方の液体が他方に、通常直径0.1 μmを超える液滴状に分散している、不均一系である。乳濁液は、該分散相に加えて、さらなる成分を含むことができ、活性薬物は溶液として、該水相、油相、又はそれ自身が別の相として存在し得る。マイクロエマルジョンは、本発明の態様として含まれる。エマルジョン、及びその使用は、当技術分野において十分知られている。さらに、米国特許第6,287,860号に記載されており、その全体が本明細書に取り込まれる。
【0085】
本発明の製剤は、リポソーム製剤を含む。本明細書で使用する、"リポソーム"の用語は、球状二重層、又は二重層膜に両親媒性脂質を配置させた、小胞を意味する。リポソームは、単層、又は多重小胞であり、脂肪親和性材から形成される膜、及び送達されるべき該組成物を含む、水性内容物をもつ。カチオン性リボソームは、正に帯電されており、負に帯電されている核酸分子と相互作用し、安定な複合体を形成すると考えられている。pH依存性の、又は負に荷電されたリポソームは、核酸分子と複合体を作るより、むしろ核酸分子を封入すると考えられる。カチオン性、及び非カチオン性の両リポソームが、細胞に核酸を送達するのに使用されている。
【0086】
また、リポソームは、"立体的に安定化した"リポソームを含む。本明細書中で使用する、その用語は、1種以上の特殊化された脂質を含み、リポソームに組み入れられるときに、そのような特殊化された脂質が欠けているリポソームに比べて、長い循環寿命もたらす。立体的に安定化したリポソームの例は、該リポソームの小胞形成脂質部分の一部が、1種以上の糖脂質を含む、或いは、ポリエチレングリコール(PEG)部分などの、1種以上の親水性ポリマーで誘導体化されるものである。さらに、リポソーム、及びその使用は、米国特許第6,287,860号に記載されており、その全体が本明細書に取り込まれる。
【0087】
また、本発明の製剤、及び組成物は、界面活性剤を含むことができる。薬物製品、製剤、及びエマルジョンにおける、界面活性剤の使用は、当技術分野においてよく知られている。さらに、界面活性剤、及びその使用は、米国特許第6,287,860号に記載されており、その全体が本明細書に取り込まれる。
【0088】
本発明の該dsRNA製剤は、様々な浸透エンハンサーの使用を講じ、核酸、特にオリゴヌクレオチドの効率的な送達をもたらし得る。また、浸透エンハンサーは、非親油性薬物の細胞膜にわたっての拡散を補助に加えて、親油性薬物の浸透性も増強する。浸透エンハンサーは、5つの広いカテゴリーの1つに属しているものとして分類できる。すなわち、界面活性剤、脂肪酸、胆汁塩、キレート剤、及び、キレートしない非界面活性剤である。さらに、浸透エンハンサー、及びその使用は、米国特許第6,287,860号に記載されており、その全体が本明細書に取り込まれる。
当業者は、製剤が、通常、その目的とされる使用、すなわち投与経路に応じて、設計されることを認識するであろう。
【0089】
好ましい局所投与製剤は、本発明の該オリゴヌクレオチドが、脂質、リポソーム、脂肪酸、脂肪酸エステル、ステロイド、キレート剤、及び界面活性剤などの局所送達剤と混合物に存在するようなものを含む。好ましい脂質、及びリポソームは、中性(例えば、ジオレオイルホスファチジルエタノールアミン(DOPE)、ジミリストイルホスファチジルコリン(DMPC)、ジステアロイルホスファチジルコリン)、陰性(例えば、ジミリストイルホスファチジルグリセロール(DMPG))、及びカチオン性(例えば、ジオレオイルテトラメチルアミノプロピル(DOTAP)、及びジオレオイルホスファチジルエタノールアミン(DOTMA))である。
【0090】
局所、及び他の投与のために、本発明のオリゴヌクレオチドは、リポソーム内にカプセル封入され得る、或いは、リポソーム、特にカチオン性リポソームへ複合体を形成し得る。その他にも、オリゴヌクレオチドは、脂質、特にカチオン性脂質へ複合体を形成できる。
【0091】
経口投与のための組成物、及び製剤は、粉剤、又は顆粒剤、微粒子剤、ナノ粒子剤、水、又は水性でない溶媒中の懸濁剤、又は溶液剤、カプセル剤、ゲルカプセル剤、小袋剤、錠剤、又は小型錠剤を含む。増粘剤、着香料、希釈剤、乳化剤、分散補助剤、又は結合剤が、所望できる。
非経口投与のための組成物、又は製剤は、滅菌水性溶液を含むことができ、また緩衝剤、希釈剤、及び下記のような他の適切な添加剤を含む。浸透増強剤、担体化合物、及び他の医薬として許容し得る担体、又は賦形剤であるが、これらに限定されない。
【0092】
さらに、本発明の該dsRNA組成物は、1種以上のdsRNA化合物を含むことができる。例を挙げると、第一の核酸を標的にする、第一のdsRNA、及び第二の標的核酸を標的にする、1種以上のさらなるdsRNA化合物、又は標的をもたないdsRNA(標的遺伝子へ公知の相同性をもたない配列)がある。また、本発明の組成物は、同一標的核酸の異なった領域を標的にする、2種以上のdsRNA化合物を含むことができる。2種以上の複合化合物は、共に、又は順次に使用できる。
【0093】
dsRNAが、甲殻類動物などの少なくとも海洋無脊椎動物、及びおそらく他の無脊椎動物において、免疫応答を引き起こすという発見は、下記の実験を起端とする。無脊椎動物の免疫のより深い理解、及びより具体的には、甲殻類動物遺伝子発現、及び免疫を調節する遺伝子、及び経路の理解を深めるために考えられた実験、及び又、配列特異的免疫応答が、通常エビを感染する、ウイルス病原体に対する防御性をもたらす手段として、潜在的に引き起こされているという発想で考えられた実験である。それらのウイルス病原体の例を挙げると、ホワイトスポットシンドロームウイルス(WSSV)、タウラシンドロームウイルス(TSV)、伝染性皮下造血器壊死ウイルス(IHHNV)、ペナエイドシュリンプのバキュロウイルス(BP)、ペナエイドシュリンプのラブドウイルス(RPS)、鰓関連ウイルス(GAV)、イエローヘッドウイルス(YHV)、リンパ器官関連ウイルス(LOVV)、リンパ器官パボ様ウイルス疾患(LPV)、肝膵臓パボウイルス(HPV)、バキュロウイルス型中腸腺壊死ウイルス(BMN)、モノドン型バキュロウイルス(MBV)、レオ様ウイルス疾患(REO)、ラブドウイルス(RPS)、及び新生ウイルスがある。
【0094】
具体的に、本発明者らは、特にWSSV、及びTSVなどの、エビウイルスの標的遺伝子に相当するdsRNAの合成、及び投与により、実験を行い、通常甲殻類動物、特にエビに感染する、数種のウイルスに含まれる、様々な遺伝子の役割を評価した。また、本発明者は、実験を行い、エビ免疫に推定的に関与している、遺伝子に相当する配列をもつdsRNAの投与により、特定のエビ遺伝子、NFKB、及びSTATシグナル経路の推定上構成要素、及び他の内在性遺伝子が調整(抑制)され得るかどうかを検討した。さらに、本発明者らは、実験を行い、dsRNAを甲殻類動物に導入する手段として、特定の生物送達媒体、特に酵母菌の実現可能性を評価した。
【0095】
具体的に、本発明者らは、全身性感染プロセスにおいて、WSSVの外殻タンパク質VP28、及び他の選択された遺伝子の発現を標的とする、dsRNAの効果を研究した。最初に、該VP28遺伝子が選択されたのは、VP28が、ポリペプチドの残留部分を該ウイルス粒子の外側に露呈したまま、推定上の膜貫通領域により、WSSVの外殻に固定されると考えられているからである。VP28の一次構造に基づき、この理論は、感染性WSSV調製の、VP28抗体での処置は、L. バンナメイへの注入時に、その効力を抑えるという観察により、支持される。従って、この遺伝子の発現は、WSSVが甲殻類動物、すなわちエビを感染する能力に必須である。
【0096】
しかしながら、この遺伝子は典型的であるが、本発明は、内在性遺伝子の発現、又は他の海洋性無脊椎動物、及び無脊椎動物寄生生物、好ましくは甲殻類動物寄生動物に含まれる、必須遺伝子を特異的、又は全身的に調製する、dsRNA の使用を幅広く含む。例を挙げると、STAT、IKB、及び、NFKB、及び STATシグナル経路の他の推定上の構成要素のような、免疫、成長、生殖、及び健康一般、又はロバスト性に関与する、甲殻類動物遺伝子に相当するdsRNAである。また、神経伝達物質、脱皮抑制ホルモン、生殖腺抑制ホルモン、及び甲殻類高血糖ホルモンを含む、ホルモン、及び代謝経路をコードする遺伝子も含まれる。また、クラスチン及びペナエイジンなどの、抗菌ペプチド、又はペプチドの産生調節因子をコードする遺伝子を含む。場合によっては、dsRNAを使用して、甲殻類動物のような海洋無脊椎動物の、任意の所望される遺伝子の発現を、減少させることができる。例えば、推定上の標的遺伝子は、コントロール、及びウイルス(WSSV、又はTSV)感染エビ組織を用いて作製したサプレッションサブトラクティブハイブリダイゼーションライブラリーのような、ゲノムライブラリー中で同定することができる。他の可能な標的遺伝子の具体例は、VP28、リボヌクレオチド還元酵素、へモシアニン、VP26、VP19、チミジル酸キナーゼ、及びDNA ポリメラーゼを含む。
【0097】
特に、最初に、本発明者らは、実験を行い、WSSVチャレンジ実験から調製されたサブトラクティブハイブリダイゼーションライブラリー(PCRセレクト、Clontech社)を含む、L. バンネメイESTコレクションにおいて同定された、WSSV 、及びエビ発現遺伝子に相当するdsRNAの注入の、推定される抗ウイルス効果を検討した。これらの実験は、エビIKBK 遺伝子、STAT 遺伝子、及びヘモシアニン遺伝子、及び該WSSV VP28、リボヌクレオチド還元酵素小サブユニット、及びDNAポリメラーゼ遺伝子に相当する、dsRNAs のコンストラクション、及び注入と同様に、アナスプラテュリュンコス(Anas platyrhynchos)アヒルの免疫グロブリン□の部分をコードする、(dsRNAの推定される配列非依存性の効果を評価するための)コントロールdsRNAを含んだ。
【0098】
初めて、これらの[該実施例で詳細に考察された]dsRNA研究の結果は、ウイルス病原体(WSSV)に含まれる遺伝子に相当するdsRNAでの、甲殻類動物、すなわち、エビの処理が、前記エビのウイルス(WSSV)感染に対して、効率的に防御することを示した。また、さらに、これらのdsRNA研究は、標的エビ内在性遺伝子(ヘモシアニン、STAT、IカッパBキナーゼ触媒サブユニット)が、前記遺伝子を標的にするdsRNAの投与により、配列特異的に発現減少することを確立した。これらの発現減少の配列特異性は、全てのdsRNA処理エビにおけるコントロール遺伝子(リボソームタンパク質mRNA)の影響を受けない発現、及びSTAT dsRNA処理動物におけるIKBK mRNAの正常発現、及びその逆も同様であることにより示された。
【0099】
これらの実験結果は、初めて、エビにおけるRNAiの存在を示し、かつ甲殻類水産養殖などの、海洋無脊椎動物水産養殖における、dsRNA関連治療を用いる抗ウイルス方策の実現可能性を確立する。この発見が、商業上大きな影響力をもつ理由は、20種以上の病原性ウイルスが、エビ種を感染し、かつ世界中でエビ水産養殖に大きな経済損失をもたらすことが、よく知られているからである。従って、そのようなエビ病原性ウイルスを全滅させる、又は軽減する実行可能なストラテジーは、(ウイルス関連のエビ損害は、年間何十億ドルに及ぶので)商業的に大変重要であると思われる。
【0100】
しかしながら、また、前記のように、本発明者らは、これらdsRNA研究において、幅広い目標をもった;特に、彼らは、該海洋エビ、リトペナエウスバナメイ、及びそのの該研究により、甲殻類動物などの無脊椎動物の免疫システム、及びタウラシンドロームウイルス(TSV)、及びホワイトスポットシンドロームウイルス(WSSV)の2種のウイルスによる感染に応答する、dsRNAの効果の理解を深めたかった。
【0101】
これらの研究の原理は、部分的に下記の観察に基づいている:1)甲殻類動物は、海洋(沿岸)環境に必須構成要素である;2)特定の甲殻類動物種、特に海洋エビは、商業的に意義があり、かつ広く水産養殖されている;3)甲殻類動物は、多数のウイルス感染に対して高い感受性を示し、それは水産養殖に壊滅的な影響をもち、かつ環境に未知の結果をもたらす;及び4)甲殻類動物の、ウイルスへの免疫反応に関しては、ほとんど知られていない、である。
【0102】
本発明前に、甲殻類動物の免疫については、ほとんど知られていなかったので、本発明者らは、機能ゲノムアプローチを用い、エビの免疫応答を生じさせるのに重要と思われる、エビ遺伝子のゲノム情報を速やかに得た。特に、機能ゲノム研究の結果に基づき、研究には、STAT様遺伝子、及びI-KBキナーゼ様遺伝子(IKK)の2つの遺伝子が、これらの遺伝子の免疫機能を同定する目標で行われる、RNAi研究の重点と同様に、選択された。これらの遺伝子は、その推定上オーソログが、哺乳動物、及び昆虫類などの他の動物において、免疫応答に大変重要なシグナル伝達経路における役割がよく知られているため、選択された。
【0103】
それらの結果に基づいて、これら2種のエビ遺伝子が、脊椎動物で発現される、STAT様ファミリーメンバー、及びIKBキナーゼ複合体の触媒サブユニットのオーソログであり、エビの免疫応答の構成要素、より具体的には、エビ抗ウイルス応答の構成要素をコードすることが仮定された。この仮説を検証するために、これらの遺伝子の発現がノックダウンされる可能性のあるRNA干渉実験を行い、エビの免疫生理、及びウイルス感染への耐性における効果を細かく調べた。甲殻類動物が、RNA干渉経路を経て、dsRNAに応答できるかどうかでさえ、当時知られていなかったので、遺伝子発現が壊滅されかどうかは予想できなかった。
【0104】
これらのdsRNA実験の結果は、これらのエビ内在性STAT、及びIKBK遺伝子が、dsRNAの投与により、配列特異的に、効果的に発現減少されることを示した。この発現減少は、(STAT、及びIKBKの両方のmRNAsの痕跡が、RT-PCRにより検出されたので)完全でなかったが、これらの結果は、初めて、RNA干渉が、甲殻類動物、特にエビにおいて、推定上生得的免疫応答に関与する遺伝子などの、特定の甲殻類動物遺伝子の機能を調べる、又は壊滅させる手段として使用できることを示した。また、これらの結果は、RNA干渉を使用し、ある内在性遺伝子の発現を低下させた、又は欠失させた、エビなどの甲殻類動物のような、海洋無脊椎動物を産生できることを示した。
【0105】
さらに、かなり予想外に、これらの実験は、少なくとも1種の長鎖二本鎖RNAで、すなわち、21〜25ヌクレオチド、好ましくは50ヌクレオチド以上で、いずれのエビ、及びエビウイルスの内在性遺伝子に公知の相同性をもつ、配列を有しないものの投与が、様々なウイルス病原体に対して一般的な防御性を与える全身性免疫応答、すなわち、様々な病原体に対する防御性を与える免疫応答もたらした。言い換えると、該dsRNAは、配列非特異的に、様々な病原体に対する一般的な防御性を与えた。
【0106】
また、予想外に、他の実験は、長鎖非特異的dsRNA(例えば、ポリC: G)、及び配列特異的dsRNA(例えば、相同な配列を含み、標的遺伝子の発現を調整するもの)の共投与は、該配列特異的dsRNAにより生じる該RNAi応答を増強することを示した。これは、低下させた濃度の配列特異的dsRNAの投与でも、該所望される遺伝子調節応答を引き起こすことができるはずなので、有利である。そのような利点は、所望するdsRNAを合成するのに関連する多大な費用を考慮すると、有意に、商業的に重要である。また、それが、より長期のRNAi応答をもたらし得るので、この発見は有益である。
【0107】
エビなどの無脊椎動物におけるdsRNAの全身性抗ウイルス効果は、海洋エビ、リトペナエウスバナメイの免疫応答のRNA干渉研究中に、最初に観察された。選択されたエビ、及びウイルス遺伝子、及び非特異的コントロールである遺伝子(例えば、アヒル免疫グロブリン遺伝子)に相当するdsRNAを注入し、かつ該動物にウイルスチャレンジをかけたときである。全く予想外に、任意のdsRNA、すなわち、標的ウイルス、又は宿主遺伝子に特異的なdsRNAだけでなく、いかなる公知の甲殻類、又はウイルス遺伝子とも相同性をもたないdsRNAも、タウラシンドロームウイルス(TSV)、又はホワイトスポットシンドロームウイルス(WSSV)への感染において、生存増加をもたらした。これらの結果が、かなり驚きであるというのは、脊椎動物は、大部分がdsRNAによるインターフェロンの活性化による、ウイルス感染に対する強い生得的な免疫応答を備えていることが知られているが、脊椎動物インターフェロンに同様な、一般的に誘導される抗ウイルス防衛メカニズムが、無脊椎動物に存在することは、これまでに考えられておらず、また推測すらされていなかった。本発明の結果は、dsRNAが、抗ウイルス応答の古くからのエリシターであること、及びdsRNAが、無脊椎動物、及び特にエビなどの甲殻類動物において、全身性免疫を生じさせ得ることを示唆する。
【0108】
さらに詳しく、L.バナメイのTSV、及びWSSVに対する抗ウイルス応答を、標的ウイルス遺伝子に特異的なdsRNA、及びいかなる公知の標的ウイルス、又は宿主遺伝子とも特異的でないdsRNAの投与後に比較した。アヒル(アナスプラテュリュンコス)の免疫グロブリンυ重鎖の部分をコードし、いかなるエビ、TSV、又はWSSV遺伝子とも公知の相同性をもたないdsRNAが、TSV、及びWSSVの両方に対して免疫応答が誘導したことが観察された。反対に、dsRNA、及び一本鎖RNA(ポリC)は、そのような応答を生じさせなかったか、或いは抗ウイルス防御性を与えなかった。さらに、この全身性配列非特異的な、dsRNAへの応答の存在の有効性を確認するために、本発明者らは、様々な脊椎動物免疫グロブリン遺伝子(アヒルυ、ブタγ)をコードするdsRNA、魚類の非コードゲノムDNA、バクテリアベクター配列、及び合成dsRNAを投与した。
【0109】
再び驚いたことに、これらのdsRNA全てが、抗ウイルス防衛性応答を誘導することが、観察された。反対に、ポリIC (シトシンと対合したイノシン塩基をもつdsRNA)、dsDNA、及びssRNA (ポリC)、及びRNアーゼ処理dsRNAは、ウイルス防御性を与えなかった。ポリICが、エビに抗ウイルス防御性を誘導できなかったことは、dsRNAへの認識、及び免疫応答を生じさせる、無脊椎動物の該免疫メカニズムが、脊椎動物のものとは異なることを示唆する。これらの結果に基づき、甲殻類動物などの無脊椎動物は、脊椎動物に存在するものに類似しているが、根本的な相違点を有する、dsRNA媒介免疫応答により、dsRNAに対して生得的免疫応答を生じさせることが、仮定される。
【0110】
観察された類似点は、1)様々なウイルスに対して活性がある、及び2) dsRNAにより、配列非特異的に引き起こされる、などがある。少なくとも1つの相違点は、甲殻類系で観察された該免疫応答は、インターフェロン系を伴っていないように思われる。
【0111】
具体的に、脊椎動物において、dsRNAは、Toll様レセプター3(TLR-3)により認識され、少なくとも部分的にインターフェロンBプロモーターを介して、インターフェロン系が活性化される。最終的に、このインターフェロン応答が、抗ウイルス活性をもつものもあり、細胞成長を調節して、かつ適応免疫応答を調整するものもある、何百もの遺伝子の誘導をもたらす。また、哺乳動物では、dsRNAが、RNA依存性プロテインキナーゼ(PKR)に結合し、直接活性化し、真核生物の翻訳開始因子2a(eIF2a)のリン酸化を介して、タンパク質合成の抑制をもたらす。しかしながら、無脊椎動物は、インターフェロン免疫系を有しない。従って、甲殻類動物における、dsRNAに対して生じる該免疫応答は、異なった免疫調節系を含むはずであるが、まだ完全にわかっていない。
【0112】
エビなどの甲殻類動物のような海洋無脊椎動物、及びおそらく他の無脊椎動物が、dsRNAの投与に、配列特異的、又は配列非特異的(全身性免疫応答)メカニズムを介して応答するという発見は、基礎研究、及び例えばエビなどの海洋水産養殖における疾患制御の効果的ストラテジーの両方に重要な応用がある。特に、標的遺伝子特異的なdsRNAは、エビにおける逆遺伝学的方法の手段として、生殖生物学、及び免疫学の研究などの分子医学的研究において使用され得る。さらに、dsRNAを基にした抗ウイルス治療を使用する技術の発展は、エビ、及び他の甲殻類動物の疾患、及び病原体、特にウイルス、バクテリア、菌類、微胞子虫類、略胞子虫類、及びグレガリナ類病原体を軽減する新しい手段を促進するであろう。また、dsRNAは、ウイルス、又は他の無脊椎動物病原体に対するような、全身性防御的免疫応答を誘導する。
【0113】
従って、前記のように、本発明は、幅広く、無脊椎動物、例えば、軟体動物、又は甲殻類動物のような海洋無脊椎動物、好ましくはエビにおける、全身性の配列非特異的免疫応答を誘導する、或いは/又は配列特異的な、遺伝子発現を調整する(抑制する)免疫応答を誘導する、dsRNAの使用を対象にする。
また、本発明は、幅広く、配列非特異的dsRNA、一般的に,共投与により、配列特異的dsRNAにより生じる該応答を増強する、長鎖dsRNAの使用を対象にする。
【0114】
一般に、本発明方法は、特定の疾患、又はウイルス、バクテリア、マイコプラズマ、又は菌類など病原体に対する、防御的RNAi、及び/又は免疫応答を生じるのに十分な量の、少なくとも1種のdsRNA、又はdsRNAの混合物の投与、又は共投与を含む。混合物の例を挙げると、標的遺伝子配列に相補的、又はハイブリダイズし、かつ少なくとも約21〜25ヌクレオチド鎖長であるもの、或いは標的遺伝子に公知の相同性を示さず、かつ好ましくは、少なくとも50〜100ヌクレオチド鎖長であり、かつ任意に改質したヌクレオチドを含むことができるものがある。考察したように、この発明の新規な一面は、全身性防御的免疫応答を生じるのに、或いは配列特異的dsRNAによリ生じる、特異的RNA干渉を増強するのに、十分な大きさのdsRNAは、任意の宿主遺伝子、又は病原体遺伝子に配列相同性をもつ、配列を有する必要がないことである。従って、該投与非特異的dsRNAは、例えば、ウイルス、バクテリア、又は他の無脊椎動物の出所、哺乳類、両生類、鳥類、爬虫類などの脊椎動物由来、植物出所由来の、任意の出所に由来し得る。或いは、それは、所望のヌクレオチドのホモポリマー、又はヘテロポリマーのような合成dsRNAであり得る。該実施例において、バクテリア、合成、及び様々な脊椎動物のdsRNAの全てが、エビに全身性免疫応答を生じさせること、及び非特異的dsRNA(ポリC: G )が、配列特異的(WSSV)dsRNAにより生じる該RNAi応答が増強したことが、示されている。
【0115】
非特異的免疫応答を生じさせる投与dsRNAは、好ましくは、長鎖dsRNA、すなわち好ましくは、少なくとも50ヌクレオチド鎖長、より好ましくは、少なくとも100-500ヌクレオチド鎖長、1000-5000ヌクレオチド鎖長で、上限は知られていない。その例は、ポリC: G、又は天然、又は改質されたヌクレオチドの、同様の別のポリマーである。反対に、配列特異的応答(標的遺伝子に相当する遺伝子の発現抑制)を生じさせるdsRNAは、21〜25ヌクレオチド鎖長ほど短いか、所望ならばそれ以上であり得る。
【0116】
好ましくは、甲殻類動物、又は他の海洋無脊椎動物に、配列特異的なRNAi応答を生じさせる投与dsRNAは、同定された、又は少なくとも70%〜80%、さらに好ましくは、少なくとも80〜90%、又は少なくとも、90〜95%のような、標的遺伝子と十分な配列同一性を示す配列を含む。具体的に、甲殻類動物遺伝子、又は甲殻類動物に感染する、寄生生物に含まれる遺伝子のような、標的遺伝子とハイブリダイズし、その発現を調整する、好ましくは、抑制、又は阻害する、前記dsRNAである。好ましくは、標的遺伝子の発現の調整が、所望する表現型効果を、又は特定の病原体に対する免疫を与える。好ましくは、配列特異的dsRNAは、この申請書において同定される標的遺伝子、より具体的には、本明細書中において具体的に同定される核酸配列に、前記のような十分な相同性を含む。
【0117】
dsRNAは、配列非特異的免疫応答、又は配列特異的な遺伝子発現減少を与えるのに十分な量で、投与される。例を挙げると、少なくとも、約.0001 mg〜.001 mg、より好ましくは、約.001〜.01 mg、さらに好ましくは、.1 mg〜.5 mgの範囲の投与量であり、上限は知られていない。100 μgもの大量なdsRNAをエビに注入しても、毒性が生じないことは知られている。投与の形態は、防御的免疫応答をもたらす任意の方法であろう。例を挙げると、該dsRNAは、(静脈内,皮下、筋肉内などに)注入され得る、経口投与され得る、浸漬を経て、又は経皮で送達され得る。物理的方法は、宿主細胞への直接の注入、又はエビの尾などの、無脊椎動物への細胞外注入を含む。
【0118】
特に好ましい送達の手段は、生物送達系である。例を挙げると、酵母菌、又は微細藻類、又は甲殻類動物が摂取可能な他の微生物細胞であって、例えば、甲殻類動物に感染するウイルスの遺伝子に特異的であるような、所望されるdsRNAを発現する該送達系である。例えば、サッカロマイセスは、WSSV、又はTSV遺伝子を標的にするdsRNAを発現するベクターで、形質転換され得る。同様に、クラミドモナス属、クロレラ属、アルスロスピラ属(スピルリナ属)、ヘマトコッカス属、ナンノクロロプシス属,スケレトネマ属、キートセロス属、テトラセルミス属、又はイソクリシス属などの、微細藻類は、その中にdsRNAの発現を与えるベクターで、形質転換され得る(Sineshchekarらの論文、 Proc. Natl. Acad. Sci., USA 99 (13): 86889-97 (June 25, 2002) ; Koblenzらの論文、 J. Cell Sci. 116 (Pt. 13): 2635-46 (July, 2003) を参照されたい)。該dsRNAは、餌料に含まれている、又は養殖媒体に導入される微生物を摂取する甲殻類動物、又は他の無脊椎動物により送達されるであろう。或いは、該dsRNAが、該生物送達媒体により該養殖媒体に分泌されるなら、該甲殻類動物により吸収され得る。酵母菌、又は微細藻類などの生物送達媒体の摂取は、甲殻類動物腸を通過し、甲殻類動物循環系への導入を提供し、それにより免疫応答が生じ得るので、dsRNA の安定性を助長する(内在性加水分解酵素により分解されにくい)であろう。
生物送達方法が好ましいが、本発明は、前記記載のような、他の送達系、及び組成物を含む。
【0119】
該対象dsRNAは、インビボ、又はインビトロで合成され得る。細胞の内在性RNAポリメラーゼは、インビボの転写を介在でき、或いはクローンRNAポリメラーゼを、インビボ、又はインビトロの転写に使うことができる。インビボの導入遺伝子、又は発現コンストラクトからの転写には、調節領域(例えば、プロモーター、エンハンサー、サイレンサー、スプライスドナー、及びアクセプター、ポリアデニル化)が使用でき、該RNA 鎖(又は複数鎖)を転写する。器官、組織、又は細胞型特異的;環境条件の刺激(感染、ストレス、温度、化学誘導因子);及び/又は任意の発達段階、又は年齢での工学的転写により、抑制を標的にできる。該RNA鎖は、ポリアデニル化されるかどうかわからない;該RNA鎖は、細胞の転写装置によりポリペプチドに転写されることができるかどうかはわからない。RNAは手動、又は自動化した反応により、科学的、又は酵素的に合成され得る。該RNAは、細胞のRNAポリメラーゼ、又はバクテリオファージのRNAポリメラーゼ(例えば、T3、T7、SP6)により合成され得る。発現コンストラクトの使用、及び作製は、当技術分野において公知である。sup. 32,33, 34 (国際公開第97/32016号;米国特許第5,593,874号、第5,698,425号、第5,712,135号、第5,789,214号、及び第5,804,693号;及びその中で引用される参考文献も参照されたい)。化学的に、又はインビボ酵素的合成により合成されるなら、該RNAを、細胞に導入する前に精製することができる。例えば、RNAは、溶媒、又は樹脂からの抽出、沈殿、電気泳動、クロマトグラフィー、又はその組み合わせにより、精製され得る。その代わりに、該RNAは、試料調製による損失を防ぐため、精製なし、又は最小限で使用できる。該RNAは、保存のために乾燥されたり、或いは水性溶液に溶解され得る。該溶液は、緩衝液、アニーリング、及び/又は二重鎖の安定化を促進する塩類を含むことができる。
【0120】
RNAは、直接細胞へ(すなわち、細胞内へ)導入され得る;或いは、細胞外に空洞、間質腔へ、生物の循環系へ導入、経口導入、或いは生物を該RNAを含む溶液に浸すことにより導入され得る。経口導入の方法は、該RNA の生物の餌料との直接混合と同様、工学的アプローチを含む。それは、餌料として使われる種(酵母菌、又は微細藻類)が、該RNA を発現するように操作し、その後影響を及ぼすべき生物に食べさせるアプローチである。或いは、該甲殻類動物、又は他の海洋無脊椎動物を、該dsRNAを含む淡水、又は生理食塩水に浸すことができる。核酸を導入する物理的方法、例えば、細胞への直接注入、又は細胞体への細胞外注入も使用できる。組み換えコンストラクト由来のRNA を発現する、遺伝子導入生物は、該コンストラクトを、受精卵、胚幹細胞、又は別の甲殻類動物由来の多機能性細胞に導入することにより、産生できる。
【0121】
酵母、及び微細藻類の両方に、異種の遺伝子を発現させる操作方法は、当技術分野においてよく知られている。しかしながら、本発明の前には、酵母菌における異種の外来dsRNAの発現は知られていなかった。そういう点で、酵母菌が、検出可能なレベルで、恒常的に発現できるかどうかは知られていなかった。dsRNAの発現は、dsRNAがインビボ(例えば、微生物内部)で不安定あり得るように、特に複雑である。なぜなら、一般に、細胞は、一本鎖核酸RNA(ssRNA) 、及びdsRNAの分解を含む、核酸代謝、及び遺伝子発現を調節するメカニズムとして、 複数の核酸分解酵素を発現している。例えば、S. セレビシエのゲノムにおいては、(Rppl、 Pan3、Pan2、Rnhl、Rnti、及びRnylのような)6種のリボヌクレアーゼが、単鎖及び/又は二本鎖RNA を分解し得ることが見い出された。大腸菌のような、他の微生物において、ssRNA、及び dsRNAの分解は、またリボヌクレアーゼにより影響されるが、大腸菌リボヌクレアーゼIIIだけが、dsRNAを分解できる(Calin-Jageman、及びNicholsonの論文、2003b ; Calin-Jageman、及びNicholsonの論文、2003a)。従って、大腸菌において、dsRNAの発現は、該大腸菌リボヌクレアーゼIII遺伝子の欠失で実現できる(Sunらの論文、2001)。驚いたことに、実施例に含まれる結果からも明らかなように、リボヌクレアーゼ遺伝子を変えていない、サッカロマイセス属細胞は、ガラクとース誘導条件下で、検出可能なレベルのdsRNA(WSSV dsRNA)を発現する。従って、サッカロマイセス属、及び他の酵母菌は、エビなどの甲殻類が安全に摂取可能であり、その点でdsRNA送達に適した手段のはずである。異種遺伝子の発現に適していることが知られている他の酵母菌の例は、ピキア属、ヤロウィア属、カンジダ属、ハンゼヌーラ属、シゾサッカロマイセス属、及びその同類である。
【0122】
本明細書中の実施例では、ガラクトース誘導性プロモーターがサッカロマイセス属におけるdsRNAの発現を調整するのに使用された。しかしながら、特定の宿主細胞において機能的である、任意のプロモーターが使用できる。酵母菌で機能的な恒常的、および調節可能なプロモーターは、PH081、PH02、PH04、及び他の酸性フォスファターゼ、及びアルカリフォスファターゼ誘導プロモーター、GLAl、GAL2、GAL4、GAL7、GAL10及び他のガラクトース調節プロモーター、フォスフォグリセロキナーゼプロモーター、及びその同類である。
【0123】
好ましい態様において、該酵母菌は、異なったdsRNAをコードする、2種の異なったベクターで形質転換、又は形質移入し、2つの遺伝子の発現を抑制され得るか、或いは同じ病原体遺伝子に特異的な、異なったdsRNAの投与に起因する付加的、又は相乗的な結果を得ることができる。本発明は、WSSV遺伝子に特異的なdsRNAで例示されているが、酵母菌送達系は、他の無脊椎動物などの他の動物、好ましくは他の海洋無脊椎動物へ、dsRNAを送達するために使用できることが予想される。
【0124】
同様に、微細藻類は、生物送達システムとして使用される時には、餌料、養殖媒体に導入されるか、或いは甲殻類動物に接触されるであろう。微細藻類は生物安定化剤として働き、所望されるdsRNAを、腸を経て標的循環系へ、例を挙げると、甲殻類動物、好ましくはエビの循環系へ、安定して送達させることが予想される。
【0125】
また、微細珪藻における、誘導の手段、及び異種の核酸配列を発現させるベクターは、当技術分野において十分知られている(例えば、2004年3月11日に公表された、米国特許第200400478281号;2003年1月30日に公表された、米国特許第20030022359号;2003年2月13日に公表された、米国特許第20030033626号;2003年10月2日に公表された、米国特許第20030186856号、及び2003年11月13日に公表された、米国特許第20030211089号を参照されたい。これら全ては、引用により、その全体が本明細書に取り込まれる。
【0126】
また、微細藻類の内在性遺伝子(ロドプシン、セントリン遺伝子)を、ノックダウンする、微細藻類におけるdsRNAの発現を教示する、Sineshchekovらの論文、Proc. Natl. Acad. Sci. , USA 99 (131: 8689- 94 (June 20,2002); Koblenzらの論文、J. Cell Sci., 116 (pt. 13): 2635-46 (2003)、及び微細藻類間におけるDNAの形質転換の手段の総説である、Leona Banaresらの論文、Trends Biotechnol. 22 (i): 43-52 (2004) を参照されたい。酵母菌と同様、微細藻類は、形質転換することができる。それにより、ウイルスなどの標的遺伝子に特異的である、1種、又は数種のdsRNAを発現できたり、或いは非特異的で、かつ一般的な抗ウイルス免疫などの一般的な(全身性)免疫応答を誘導する、長鎖dsRNAをコードすることができる。
【0127】
さらに、核酸を誘導する物理的な方法は、該RNA含有溶液の注入、該RNAにより覆われた粒子による衝撃、細胞、又は生物を該RNA溶液に浸漬すること、又は該RNAの存在下での細胞膜のエレクトロポレーションを含む。ウイルス粒子に詰められたウイルスコンストラクトは、発現コンストラクトの該細胞への効率的な導入、及び該発現コンストラクトによりコードされるRNAの転写の両方を達成するであろう。当技術分野で知られている、他の核酸を細胞に導入する方法も使用できる。例を挙げると、脂質介在キャリア輸送、リポソーム送達、リン酸カルシウムなどの化学介在輸送、キャリア部分への接着、及びその同類がある。従って、該RNAは、1種以上の下記の活性を担う構成要素とともに導入することができる:該細胞によるRNAの取り込みを増大する、該二本鎖のアニーリングを促進する、該アニールした鎖を安定させる、又は別の方法で該標的遺伝子の抑制を増加させる、活性である。
【0128】
本発明の重要な一面は、任意の配列のdsRNA、好ましくは、少なくとも50ヌクレオチド鎖長以上であり、改質、及び非天然のヌクレオチドを含み得るものが、甲殻類動物における全身性免疫応答を誘導するのに使用できるという発見である。しかし一方、本発明のもう一つの重要な面は、(甲殻類動物、又は病原体遺伝子を標的にする配列をもつ、干渉RNAの投与の中で)標的甲殻類動物遺伝子、又は通常、甲殻類動物に感染する病原体に含まれる遺伝子に同一であるか、或いは高度の配列同一性をもつdsRNAの、エビなどの甲殻類動物への投与に関するものである。好ましくは、該dsRNAは、少なくとも70%、好ましくは、少なくとも80〜90%、95%以上、ウイルス、又は内在性遺伝子などの、標的遺伝子の相当する領域に配列同一性を示す、少なくとも21〜25ヌクレオチドの領域を含む。
【0129】
その具体的な例は、免疫、成長、生殖、及び健康一般、又は"ロバスト性"に関与するような甲殻類動物遺伝子、又は病原体の必須遺伝子である。また、STAT、IKB、及び、NFKB、及び STATシグナル経路の他の推定上の構成要素のような 遺伝子も含まれる。また、神経伝達物質、脱皮抑制ホルモン、生殖腺抑制ホルモン、及び甲殻類高血糖ホルモン含む、ホルモン、及び代謝経路をコードする遺伝子も含まれる。また、クラスチン、及びペナエイジンなどの、抗菌ペプチド、又はペプチドの産生調節因子をコードする遺伝子を含む。場合によっては、dsRNAを使用して、任意の所望される甲殻類動物遺伝子の発現を、減少させることができる。例えば、推定上の標的遺伝子は、コントロール、及びウイルス(WSSV、又はTSV)感染エビ組織を用いて作製されるサプレッションサブトラクティブハイブリダイゼーションライブラリーのなどの、ゲノムライブラリー中で同定することができる。他の可能な標的遺伝子の具体例は、VP28、リボヌクレオチド還元酵素、へモシアニン、VP26、VP19、チミジル酸キナーゼ、及びDNA ポリメラーゼなどである。
【0130】
好ましくは、本発明は、甲殻類動物遺伝子、又は通常、甲殻類動物に感染する病原体遺伝子と同一であるか、或いは少なくとも75%、さらに好ましくは、少なくとも85〜90%、さらに好ましくは、90〜99%同一である、高い配列相同性を示す配列をもつ、dsRNAを投与することを含む。エビの場合、病原体の例を挙げると、ホワイトスポットシンドロームウイルス、タウラシンドロームウイルス、伝染性皮下造血器壊死ウイルス(IHHNV)、ペナエイドシュリンプのバキュロウイルス(BP)、ペナエイドシュリンプのラブドウイルス(RPS)、鰓関連ウイルス(GAV)、イエローヘッドウイルス(YHV)、リンパ器官関連ウイルス(LOVV)、リンパ器官パボ様ウイルス疾患(LPV)、肝膵臓パボウイルス(HPV)、バキュロウイルス中腸腺壊死ウイルス(BMN)、モノドン型バキュロウイルス(MBV)、レオ様ウイルス疾患(REO)、ラブドウイルス(RPS)、及び新生ウイルスがあり、その必須遺伝子は、当業者に利用可能な任意の手段を通じて、配列決定され得る。
【0131】
エビに感染するバクテリア病原体は、ビブリオ菌、マイコバクテリア菌、壊死性肝膵炎(NHP)、及びリケッチア、又はリケッチア様病原体を含む。エビに感染する菌類は、フサリウム オキシスポルム(Fusarium oxysporum)、ラゲニジウム属(Lagenidium)、又はシロルピジウム属(Sirolpidium)を含む。エビに感染する他の寄生生物は、微胞子虫類、略胞子虫類,及びグレガリナ類を含む。
該配列特異的dsRNAの効果的な、好ましい投与量は、前記記載と同様である。該配列特異的dsRNAの大きさは、少なくとも20〜50,000ヌクレオチド鎖長、より好ましくは、約20〜約5000ヌクレオチド鎖長、さらにより好ましくは、20〜500ヌクレオチド鎖長の範囲である。
【0132】
標的遺伝子に特異的なRNAは、甲殻類動物などの、任意の海洋無脊椎動物における遺伝子発現の、発現減少に使用できる。甲殻類動物は、一例として、エビ、カニ、クレイフィシュ、及びロブスターを含む。エビの具体例は、アキアミパストシュリンプ(Akiami past shrimp)、バルチックプローン(Baltic prawn)、テンジククルマエビ、ブルーシュリンプ(blue shrimp)、ブラインシュリンプ(brine shrimp)、ブラウンタイガープローン(brown tiger prawn)、カラモテプローン(caramote prawn)、イースタンキングプローン(eastern king prawn)、イースタンスクールシュリンプ(eastern School Shrimp)、タイショウエビ、淡水エビ、ジャイアントリバープローン(giant river prawn)、ブラックタイガー、ヨシエビ、クマエビ、カルマエビ(Karuma prawn)、メタペナエウス属エビ(metapenaeus shrimp)、ノーザンホワイトシュリンプ(northern white shrimp)、パラエモニドシュリンプ(palaemonid shrimp)、及びホワイトレッグシュリンプ(whiteleg shrimp)である。
【0133】
本発明により含まれる、カニ種の具体例は、ブルークラブ(blue crab)、チャイニーズリバークラブ(Chinese river crab)、ガザミ(Gazami crab)、インドパシフィックスワンプクラブ(Indo-Pacific swamp crab)、海洋カニ(marine crab)、ポルツヌス属スイムクラブ(portunus swimcrab)、スパイナススパイダークラブ(spinous spider crab)、及びスイムクラブ(swimcrab)である。
【0134】
本発明に含まれるクレイフィッシュの具体例は、ドナウクレイフィッシュ(Danube crayfish)、ユーロアメリカンクレイフィッシュ(Euro-American crayfish)、マロンクレイフィッシュ(Maron crayfish)、ノーブルクレイフィッシュ(Noble crayfish)、レッドクロウクレイフィッシュ(red claw crayfish)、レッドスワンプクレイフィッシュ(red swamp crayfish)、シグナルクレイフィッシュ(signal crayfish)、及びヤビークレイフィッシュ(yabby crayfish)である。
【0135】
最後に、本発明に含まれるロブスターの具体例は、ウチワエビモドキ、イセエビ、マドスパイニーロブスター(mud spiny lobster)、イセエビ科スパイニーロブスター(Palinurid Spiny lobster)、スパイニーロブスター(spiny lobster)、及びトロピカルスパイニーロブスター(tropical spiny lobster)である。
【0136】
本発明の好ましい態様において、エビなどの甲殻類動物を、非特異的(全身性)免疫を誘導する長鎖dsRNAと、標的遺伝子の発現をRNA干渉による配列特異的に抑制する、別のdsRNAとを組合せて処理することができる。
【0137】
本発明の、もう一つの好ましい態様において、エビのような甲殻類動物を、投与量コントロール条件下で、少なくとも1種の配列特異的dsRNA、及び別の非特異的dsRNAで処理することができる。それにより、該非特異的dsRNAが"アジュバント"として作用し、該配列特異的dsRNAにより生じる、該配列特異的遺伝子と同一であるか、或いはかなり同様である配列を含む遺伝子の発現における、該RNAi応答を増強する。好ましくは、配列特異的dsRNAに対する該非特異的dsRNAの量は、該配列特異的dsRNAにより生じる該応答を、少なくとも10倍増強し、それにより、有効性を妥協せずに、その投与量を減少させることができる量である。
【0138】
本発明のもう一つの有意義な面は、RNA干渉との機能ゲノミクスの使用し、免疫調節、及びウイルス免疫に関する甲殻類動物遺伝子を同定することを含む。例えば、公知のESTライブラリー由来の遺伝子を同定することができる。或いは、新規なライブラリー、例えば、ウイルス感染により発現増加、又は発現減少する遺伝子を含む、ウイルスに感染した甲殻類動物から作製されるライブラリー由来の遺伝子を、同定することができる。
【0139】
好ましい遺伝子の出所は、www.marinegenomics.org で報告されている該ESTライブラリーであり、現在数千のエビ遺伝子配列を含み、かつさらなるエビ遺伝子が知られてきているので、継続的に更新されている。これらの推定上の遺伝子の利用により、それらの遺伝子の発現を抑制するために使用できるdsRNAの設計し、かつその機能を同定することができる。好ましくは、選択される遺伝子は、哺乳動物、又は昆虫などの、他の動物において発現されている、免疫調節遺伝子のオーソログであろう。しかしながら、本発明は、RNA干渉の使用し、任意の標的海洋無脊椎動物、例えば甲殻類動物遺伝子の機能を解明することを幅広く含む。
【0140】
該遺伝子の機能は、表現型の変化を観察することなどにより評価することができる。例を挙げると、該遺伝子が干渉dsRNAにより発現減少されるときの、造血機能、炎症、成長、生殖、分化、ウイルス感染への耐性、色、及びその同類の変化がある。理想的には、該標的遺伝子の発現は、少なくとも80〜90%、さらに好ましくは95〜99%、抑制される。表現型の変化が観察した後、遺伝子の機能を仮定する。場合によっては、該特定遺伝子が欠失し、従って発現されない、トランスジェニック甲殻類動物の作製により、遺伝子の機能を確認することができる。
【0141】
標的遺伝子の機能を同定した後、該遺伝子、又はその相当する遺伝子産物は、それ自身を標的として使用し、抗体、小分子、その発現を調整する(発現増加させる、又は発現減少させる)核酸、及びタンパク質などの化合物を同定することができる。好ましい様態において、該標的遺伝子は、免疫調節遺伝子であり、かつ該化合物は、例えば、抗ウイルス免疫、又は疾患耐性を生じさせる、或いは促進させるなど、免疫を増強させるものである。
【0142】
マイクロアレイ技術を使用し、エビなどの甲殻類動物における、特定の条件下で発現増加、又は発現減少する遺伝子を同定することができる。条件の例を挙げると、dsRNAに晒されるか、ウイルスに感染された時、ストレス条件下、栄養欠乏、胚発生、及び生殖の間、及びその同類などがある。それらの遺伝子を、配列決定すると、その配列に基づき、dsRNAを作製し、該低下された発現により生じる、表現型の変化を評価できる。好ましい態様において、成長、分化、生殖、及び健康一般を促進する、甲殻類動物遺伝子を同定することができる。
【0143】
本発明の具体的な態様を例示するために、下記の実施例が提供される。しかしながら、本発明の実践は、いかなる手段においても、それらにより限定、又は制限されない。
【実施例】
【0144】
(材料、及び方法)
動物、及び実験的ウイルス感染:これらの研究に使用した生物測定系、実験動物、ホワイトスポットシンドロームウイルス(WSSV)、及びタウラシンドロームウイルス(TSV)接種は、別記されている。簡潔に述べると、エビ(L. バナメイ)を個々に260 ml組織培養フラスコに入れ、毎日100%の水交換(人工海水、Marine Environment社)をしながら、2〜3日間馴らした。餌は、市販餌料ペレットのほぼ半分を毎日与えた。記載の時(図2参照)は、エビを、一定水量、及び給気での再循環システムに結合している、10 ガロン水槽(10〜15 エビ/水槽)で 飼育した。馴化後、エビをdsRNAの筋肉注射で処置し、かつ感染エビの0. 45 μrnろ過抽出液の筋肉内注射により感染させた。TSV の場合は、最終希釈は1 x 10-8、又は1 x 10-5、かつWSSV の場合は、最終希釈は4〜6 x 10-8 (重量/体積 希釈)であった。1 x 10-8 (TSV用)、及び4〜6 x 10-8 (WSSVの場合)の該希釈は、多数の実験、及び滴定試験上で、常に60%と90%の間の死亡率をもたらす投与量として選んだ。ネガティブコントロールには、特定の病原体フリーのエビからの抽出液を、対応する希釈で注射した。特記されない限り、注入容量は、20 μlであった。死亡率を毎日記録し、かつ水交換、及び給餌法は、前記の通り行った。
【0145】
dsRNA: インビボで、T3、及びT7ファージRNAポリメラーゼ(Promega社)を使用し、線形型プラスミドコンストラクトから、ssRNA を転写させ、かつその後該DNA鋳型を、DNアーゼ I (Promega社) を1 U/μg鋳型の割合で付加し、分解した。その後、該転写物を、標準的方法を使用する有機溶媒抽出、又はシリカ充填剤吸着(RNイージー(RNeasy)、Qiagen)により精製した。400 mM NaCl、10 mM トリスCl、pH 7.4存在下で、相補的なRNA 鎖を混合し、75℃で15分間、65℃で 15分間、及び常温で15分間アニールさせた。dsRNAの形成は、アガロースゲル電気泳動のサイズ移動によりモニターした。インビトロ転写に使用したDNA 鋳型は、pブルースクリプト(pBluescript)ベクター(Stratagene 社)であり、下記のいずれかの部分に対応している;アヒル、アナス プラテュリュンコスの免疫グロブリンγ鎖(アクセッション番号AJ312200)の309塩基対部分; ナマズ、イクタルルス プンクタトゥスIgH 遺伝子座由来のクローンBAC6(アクセッション番号 CC936713)のゲノミクス非コード領域の1316 塩基対;ブタ、スス スクロファ(Sus scrofa)IgG cDNA(アクセッション番号U03778)の1079塩基対部分; 又はバクテリア人工染色体(BAC)クローニングベクターpBeloBACllの1184塩基対断片である。ポリC:G、ポリI:C、及びポリCは、市販のdsRNA、及びssRNAアナログである (Sigma- Aldrich社)。
【0146】
組織学、及び免疫組織化学:エビ全体を、ダビドソン溶液(Davidson's solution)(33% エタノール、22% ホルマリン、11.5% 酢酸)で24時間、固定し、その後、70%エタノールに移し、ヘマトキシリン/エオシン染色(33)、及び抗WSSVモノクローナル抗体検出系(Diagxotics社)を使用する免疫組織化学による組織学分析をするまで保存した。
【0147】
(dsRNA配列)
1) 非特異的なdsRNA 免疫誘導において検討されたもの
アヒルυ:
CTGGCAGGGCGGCGTGTCCTACGCCTGCATGGTGGTCCACGAAGGGTTGCCCATGAG
GT
TCACCCAACGGCCTCTCCAGAAGACCCCCGAGCTGGACATCTCCACCGCCCTCTGCC
CG
GACGCCGGCGACCAAGAACTGGACGGGCTCTGGGCCACCATCGCCGTCTTCATCACC
CT
CTTCCTCCTCAGCGTCTGCTACAGCGCCACCGTCACCTTCTTCAAGGTCAAGTGGCT
TT
TCTCCACCGTCCTGCAGCTGAAGAGCGCCGGCGGCCCCTACCGCAACGTCCTGAAGG
AG
GCGGCGTGAGCGGC
【0148】
ナマズゲノムDNA:
CTTTCTAGGGCTAGATATTGCAAACAATTTGGCAGTTTTATTCCTATATATATGGTT
TC
GATGGAAAATTCGATCCAATATCGATTCGTTATCAATATTTCATTTAAAATGTTAGT
TT
TGCAGGCACAGATTCCATGTTTTAATATAAATGCTGGTAACTGAAACCCTCCTGCTT
GG
CTACATTACTGAAATACACATTTACGTTACCAATAAGACCTGCACAATTATGTTTCA
TT
ACTTTTTACTTTTACTTTGAGTAACATTGTAAAAGGAAATCATAAATATGTGCATAC
AG
TGCACACAAGGTAAGCACAAATGGCACGTAATTGTAAAAAAACAAACAAAAAAACAA
AA
CATTTGTAAAAGTGCAACAGTGAAATTCATTAACAATTTGAAACGTGTTTAAGAAAT
AA
AACCATTTTCAAAATTCAGAACGTGAAAGAATCTGGAGATTATCTGTAGTGCTCCTC
GT
CCTGAAGGAGCACTATAGATAATATTCACATCCTCTCAAGTAAATCACACGCATTAA
GA
ATCGATTTAGGGATTTCCCAAATCCATATCATTTTGTTAAATTGCTdATCGAATAAA
AC
GGAGAATTGCTATTTTTTACCCAGCCCTAGTGCTTTTACACCTGGTTGTCAGTCCAC
CC
AGTCTGAATATGAGCAAAATTGGTACTTTTGCTTCATTTGCTATTTGGTTTGTTTTT
TC
ATCCACACTGCACATAGTTAATTGAGCAACAAAAAGTTGTCAGGGCTTGTACGTTCA
TC
AGTCTGAATTATCCTCAATGAAAAAAATTATAAGCAAACTTTATGCATATAAAATCT
CA
AAGATTACTTGAGCACAGAGAGCATGGAACCGGTGCTAAAGAATTAGGTAGTCTGTA
TA
AACAACTTTTTCTTTTGCGTGCCACATCCAGCTTTAATTTTCTCTTTTTGTTTGTCG
GA
CCAAATATTTAGAACATGTGGCATTTCTGTTGCGCTACAGTGGTAGTTCAGTGGTTA
AG
AAGTTAGACTACTGATCAGAAGCTTGTGAGTTCAAGTCCTAATACTGCTAACCTTCC
AC
TCTTCAGGCCTTGAGTAAGGCCCTTAACCCTCAACTGCTTTTTAAATTTTTTTTTTT
TT
TTACTTTATTAAAATATTAGAGTCCATATAAGTACATTTTTAAAGGCAAATCAATTG
TA
TACTGTAGTAAATTGTGTGCTGTGGTTCACATTTTGGCCTTGACCATGATTTAATTT
TT
TGTTGATGGAGCTGGGTGGACAGTGCACACTCAGCTCAAAACATCCAAGCCCAACTA
TA
TCACCCAAAACCATGTGG
【0149】
バクテリアベクター配列:
CGACGGCGACTCCCATCGGCAATTTCTATGACACCAGATACTCTTCGACCGAACGCC
GG
TGTCTGTTGACCAGTCAGTAGAAAAGAAGGGATGAGATCATCCAGTGCGTCCTCAGT
AA
GCAGCTCCTGGTCACGTTCATTACCTGACCATACCCGAGAGGTCTTCTCAACACTAT
CA
CCCCGGAGCACTTCAAGAGTAAACTTCACATCCCGACCACATACAGGCAAAGTAATG
GC
ATTACCGCGAGCCATTACTCCTACGCGCGCAATTAACGAATCCACCATCGGGGCAGC
TG
GTGTCGATAACGAAGTATCTTCAACCGGTTGAGTATTGAGCGTATGTTTTGGAATAA
CA
GGCGCACGCTTCATTATCTAATCTCCCAGCGTGGTTTAATCAGACGATCGAAAATTT
CA
TTGCAGACAGGTTCCCAAATAGAAAGAGCATTTCTCCAGGCACCAGTTGAAGAGCGT
TG
ATCAATGGCCTGTTCAAAAACAGTTCTCATCCGGATCTGACCTTTACCAACTTCATC
CG
TTTCACGTACAACATTTTTTAGAACCATGCTTCCCCAGGCATCCCGAATTTGCTCCT
CC
ATCCACGGGGACTGAGAGCCATTACTATTGCTGTATTTGGTAAGCAAAATACGTACA
TC
AGGCTCGAACCCTTTAAGATCAACGTTCTTGAGCAGATCACGAAGCATATCGAAAAA
CT
GCAGTGCGGAGGTGTAGTCAAACAACTCAGCAGGCGTGGGAACAATCAGCACATCAG
CA
GCACATACGACATTAATCGTGCCGATACCCAGGTTAGGCGCGCTGTCAATAACTATG
AC
ATCATAGTCATGAGCAACAGTTTCAATGGCCAGTCGGAGCATCAGGTGTGGATCGGT
GG
GCAGTTTACCTTCATCAAATTTGCCCATTAACTCAGTTTCAATACGGTGCAGAGCCA
GA
CAGGAAGGAATAATGTCAAGCCCCGGCCAGCAAGTGGGCTTTATTGCATAAGTGACA
TC
GTCCTTTTCCCCAAGATAGAAAGGCAGGAGAGTGTCTTCTGCATGAATATGAAGATC
TG
GTACCCATCCGTGATACATTGAGGCTGTTCCCTGGGGGTCGTTACCTTCCACGAGCA
AA
ACACGTAGCCCCTTCAGAGCCAGATCCTGAGCAAGATGAACAGAAACTGAGGTTTTG
TA
AAC
【0150】
ブタIgG:
GCCCCCAAGACGGCCCCATCGGTCTACCCTCTGGCCCCCTGCGGCAGGGACGTGTCT
GG
CCCTAACGTGGCCTTGGGCTGCCTGGCCTCAAGCTACTTCCCCGAGCCAGTGACCGT
GA
CCTGGAACTCGGGCGCCCTGACCAGTGGCGTGCACACCTTCCCATCCGTCCTGCAGC
CG
TCAGGGCTCTACTCCCTCAGCAGCATGGTGACCGTGCCGGCCAGCAGCCTGTCCAGC
AA
GAGCTACACCTGCAATGTCAACCACCCGGCCACCACCACCAAGGTGGACAAGCGTGT
TG
GAATACACCAGCCGCAAACATGTCCCATATGCCCAGGCTGTGAAGTGGCCGGGCCCT
CG
GTCTTCATCTTCCCTCCAAAACCCAAGGACACCCTCATGATCTCCCAGACCCCCGAG
GT
CACGTGCGTGGTGGTGGACGTCAGCAAGGAGCACGCCGAGGTCCAGTTCTCCTGGTA
CG
TGGACGGCGTAGAGGTGCACACGGCCGAGACGAGACCAAAGGAGGAGCAGTTCAACA
GC
ACCTACCGTGTGGTCAGCGTCCTGCCCATCCAGCACCAGGACTGGCTGAAGGGGAAG
GA
GTTCAAGTGCAAGGTCAACAACGTAGACCTCCCAGCCCCCATCACGAGGACCATCTC
CA
AGGCTATAGGGCAGAGCCGGGAGCCGCAGGTGTACACCCTGCCCCCACCCGCCGAGG
AG
CTGTCCAGGAGCAAAGTCACGCTAACCTGCCTGGTCATTGGCTTCTACCCACCTGAC
AT
CCATGTTGAGTGGAAGAGCAACGGACAGCCGGAGCCAGAGAACACATACCGCACCAC
CC
CGCCCCAGCAGGACGTGGACGGGACCTTCTTCCTGTACAGCAAACTCGCGGTGGACA
AG
GCAAGATGGGACCATGGAGACAAATTTGAGTGTGCGGTGATGCACGAGGCTCTGCAC
AA
CCACTACACCCAGAAGTCCATCTCCAAGACTCAGGGTAAATGAGCCACCCGCTGCAC
CC
CACGTGCTCTCGGGTCCCGCGAGCTCGCCTGAGCCCCAGCGCTGTGTACATACGTCC
CG
GGCCAGCATGAAATAAA
【0151】
2) 配列特異的RNAi の抗WSSV防御性において検討されたもの
RR (WSSVのリボヌクレオチド還元酵素の小ユニット):
ACATTTCCCAGAGATCTTCATGGACAATGGAGCGGGATACAAAACGGTTGGGGTTTT
CT
CTTGTAAGTAAGTGTTTAGACGTATCTACTTGCATAATGAGTTTTTTGGTGAATTTG
TC
AAACACTTCCTGGGCAATCCTCTTTTCCTCCTCGGTTTTATATTCTGACTTGATTTC
TT
CAGCCACTTGGTTGGCTTGCTCCATATTCAGACCAGTAACGGTGAACAGTTTGATTG
AC
TCCATTTCTGGGGTTGTTGGTATTATTGGAGTAATAATGGAAGTTGACGGTAGGACC
GA
TGACGAGGGAATGATGCTGTGGTGTGAGAAGTGGCCATATTTATACTCATGCGGCTG
AG
TCTGGAGGGGGGGGTTGCCATCAATCAGCCTTTTTAGTCGGTATCGGAATCAGTGTG
GC
CAATTCACAAACCATCTCTGCTCTTTATTTTGCAGACGGTCTCAAATACACCCTTCT
GG
TCTTGCAAGATCTCCTCAATAACTGGTCGATGTCTTCAATTTTTATGTAGGAAGTCT
TT
CATGGAAGATATTTNCTGGTTGTTCACAAANGCCCACAGTTCCTTATATCTGGT
【0152】
vp28(WSSVの外殻タンパク質):
ATGGATCTTTCTTTCACTCTTTCGGTCGTGTCGGCCATCCTCGCCATCACTGCTGTG
AT
TGCTGTATTTATTGTGATTTTTAGGTATCACAACACTGTGACCAAGACCATCGAAAC
CC
ACACAGACAATATCGAGACAAACATGGATGAAAACCTCCGCATTCCTGTGACTGCTG
AG
GTTGGATCAGGCTACTTCAAGATGACTGATGTGTCCTTTGACAGCGACACCTTGGGC
AA
AATCAAGATCCGCAATGGAAAGTCTGATGCACAGATGAAGGAAGAAGATGCGGATCT
TG
TCATCACTCCCGTGGAGGGCCGAGCACTCGAAGTGACTGTGGGGCAGAATCTCACCT
TT
GAGGGAACATTCAAGGTGTGGAACAACACATCAAGAAAGATCAACATCACTGGTATG
CA
GATGGTGCCAAAGATTAACCCATCAAAGGCCTTTGTCGGTAGCTCCAACACCTCCTC
CT
TCACCCCCGTCTCTATTGATGAGGATGAAGTTGGCACCTTTGTGTGTGGTACCACCT
TT
GGCGCACCAATTGCAGCTACCGCCGGTGGAAATCTTTTCGACATGTACGTGCACGTC
AC
CTACTCTGGCACTGAGACCGAGTAA
【0153】
(実施例1)
(海洋エビ、リトペナエウス バンナメイにおけるウイルス感染を防止する、dsRNA介在遺伝的干渉の使用)
この実施例において、WSSVのゲノムにおいてコードされる遺伝子に相当するdsRNAでのエビの処理が、WSSVの感染から効果的にエビを防御することが示される。これらの結果は、エビにおけるRNA干渉の最初の証拠を提供し、かつ水産養殖における、dsRNA関連治療法を使用する抗ウィルスストラテジーを開発する可能性を広げる。
【0154】
エビ、及びWSSV:これらの研究で使用した生物測定系、実験動物、WSSV接種は、別記されている。簡潔に述べると、リトペナエウス バンナメイ(1〜2 g)を個々に、260 mlの組織培養フラスコに入れ、毎日100%の水交換(人工海水、Marine Environment(登録商標))をしながら、3日間馴らした。餌としては、市販餌料ペレットの小片(約ペレット半分)が、毎日与えた。その後、記載のように、動物をdsRNAの筋内注射で処置し、かつ注射、又は経口投与のいずれかにより、WSSVを感染させた。死亡率を毎日記録し、かつ水交換、及び給餌法は、前記の通り行った。
【0155】
WSSV、及びエビEST、及びdsRNA の調製:WSSVチャレンジ実験から調製されたサプレッションサブトラクションライブラリー(PCR セレクト、Clontech社)を含むL. バンナメイのEST コレクション( http ://www. marinegenomics. org)を、WSSV、及びエビ発現の遺伝子の出所として使用した。この研究で使用された全てのESTは、国立バイオテクノロジー情報センター(NCBI)のデータベースに登録されていた。エビシグナル伝達性転写因子(STAT)の部分、及びIカッパB キナーゼ触媒サブユニット(IKBK)をコードするESTは、アクセッション番号CA991435、及びCA9914534を有する。へモシアニン、及PJV627様の部分に相当する配列は、 www. marinegenomics. org で入手可能である(各々、L. バンナメイ ID 番号 1405、及び1263)。PJV627は、マルスペナエウス ジャポニクス(Marsupenaeus japonicus)(クルマエビ)由来の、機能未知のESTである(Rojtinnakornの論文, 2002 #430)。また、WSSV遺伝子のvp28、リボヌクレオチド還元酵素の小サブユニット、及びDNA ポリメラーゼのESTは、www.marinegenomics.org で見い出すことができる(各々、L. バンナメイID 番号6321、6390、及び5789)。EST 挿入断片の全体、又は部分を、標準的条件下で、SP6、又はT3、及びT7ファージプロモーターを使用する、両方向インビトロ転写用に、pBluescript (Strategene)、pGEM-TEZ (Promega)、又はpCR4-TOPO (Invitrogen)へサブクローニングした。一本鎖RNA転写産物を、有機溶媒で抽出し、かつ標準的方法を使用してエタノール沈殿した。相補鎖を、10 mM Tris-Cl, 400mM NaCl, pH 7.5の溶液中、75℃で15分間、65℃で15分間、及び常温で15分間アニールさせた。dsRNAの形成は、アガロースゲル電気泳動のサイズの移動によりモニターし、dsRNAの濃度は、分光光学的に測定した。dsRNAを合成するために使用した該IKBKのEST断片は、CA991434の第15〜390番目の塩基に相当し、STAT dsRNAを作成するために使用したSTATのEST断片は、CA991435の第14〜383番目の塩基に相当する。該完全長のESTを使用し、ヘモシアニン、PJV627様、及び全てのWSSV遺伝子のdsRNAを作成した。dsRNA の配列非依存性の抗ウイルス効果のコントロールとして、アヒル、アナス プラテュリュンコスの免疫グロブリンυ(アクセッション番号 AJ312200)由来の309塩基対をコードするコンストラクトを使用した。
【0156】
発現解析:動物を犠牲にし、解剖し、組織はRNAレイター(Ambion社)に浸漬し、使用するまで、20℃で保存された。全RNAを、RNイージーキット (Qiagen社)を用いて単離した。ノーザン解析には、RNAをホルムアルデヒド-アガロース電気泳動で分離し、ナイロン膜に転写し、記載のとおり32P標識DNAでプローブした。ナイロン膜を標準的手法で洗浄し、データをオートグラフィーにより得た。プローブは、完全長のEST 挿入断片から調整した。RT-PCR には、一本cDNAをパワースクリプト RT(Powerscript RT)(Clontech社)を用いて調製し、オリゴdTを起点として反応が開始された。その後、該反応物を2倍に希釈し、1 μlを遺伝子特異的プライマーによるPCRの鋳型として使用した。PCRの条件は、94℃で2分間(94℃で30秒間、65℃で30秒間、72℃で1分間)の反応26 サイクル、72℃で 2分間であった。STAT mRNAは、下記プライマーで検出した:順方向、CTG TCT GAG CGA AAC TTC ACA、及び逆方向、AAG TCA GCG ATC ACA TCA GCT。IKBK mRNAは、下記プライマーで検出した:順方向、CCA GCA ACT AGA AGG CTC ACT、及び逆方向、CGG TTC TTG CTG CAT CTT GCA。リボソームタンパク質S3A mRNAは下記プライマーで検出したを用いて検出された:順方向、CCA GAA TGA GAC TGA TGC TGA、及び逆方向、CAC GGG TGA TAA TGT CTA CCA。
【0157】
(結果)
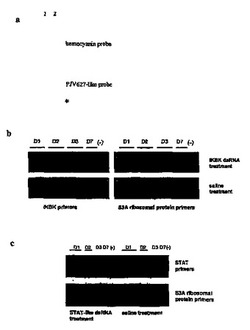
dsRNAは、エビにおける同起源細胞のmRNAの特異的消失を引き起こす:RNAi経路の幅広い保存に基づいて、我々は、RNAiに類似したメカニズムが L. バンナメイに存在するという仮説を立てた。これを調べるために、我々は、エビ遺伝子の部分へのdsRNAをエビに注入し、標的mRNAの相対的レベルをノーザンブロット解析と、RT-PCRにより解析した。図1aは、ヘモシアニンdsRNAの注入が、肝膵臓におけるヘモシアニンmRNAのレベルを劇的に低下させることを示している。このmRNAの消失が、ヘモシアニンの配列特異的であるのは、無関係な遺伝子(PJV627様)をコードするdsRNAの注入はヘモシアニンの発現に影響せず、ヘモシアニンのdsRNA注入エビは、この無関係なmRNAを、正常なレベルで発現するからである(図1a)。また、dsRNAで、この機能未知の遺伝子を標的にしても、その相当するmRNAの検出可能な消失をもたらさないことは、明らかである。この効果なく標的にされたmRNAに関連した、低分子のハイブリダイゼーションシグナルは観察できることは、中間体の分解産物が、推定上のRNAiメカニズムの活性化に由来することを示唆する。同様の中間体は、ショウジョウバエ細胞において、RNAiの誘導時に見い出されている。dsRNA誘導のmRNA消失が遺伝子特異的であり、かつ転写、及び翻訳の調節、細胞内細分化、及び、各々のmRNAに特異的な他の特徴により、影響を受け得ることは妥当であると思われる。
【0158】
さらに、我々は、特異的mRNAの発現低下が、該エビ系における他の遺伝子、及び他の組織においても達成できることを確認した(図1b、及びc)。我々は、エビのシグナル伝達性転写因子(STAT)、及びIカッパBキナーゼ触媒サブユニット(IKBK)のcDNAの部分に相当するdsRNAを注入した。生理的食塩水を注入された動物と比較した時、dsRNA処理動物の鰓から、それに相当するmRNAが消失することは、RT-PCRにより示される。この低下の該配列特異性は、全動物におけるリボゾームタンパク質のmRNAの発現が影響を受けないこと(図1b、及びc)、及びSTAT dsRNA処理動物におけるIKBK mRNAの正常な発現、及び逆もまた同様であること(データは図示せず)によって、示される。しかしながら、同起源dsRNAに誘導のmRNAの消失は、完全ではなく、かつdsRNA処理後のRT-PCRにより、STAT、及びIKBK の両方のmRNAsの痕跡が、依然として検出された。また、発現レベル、及びdsRNA誘導のmRNA消失の効率との両方に見られる多少の個体差がある。
【0159】
WSSV遺伝子の部分をコードするdsRNAは、WSSV感染を防御する:同起源dsRNAの注入の、特異的遺伝子発現における効果に関する我々のデータにより、L. バンナメイに、RNAi様経路が存在することが示唆される。ウイルス特異的遺伝子に対するdsRNAを使用し、そのような経路を誘導できるのであれば、複製、及び発症機序に必須の遺伝子産物の発現を妨げることによって、抗ウイルス防御性を実現できるのではないかと、推論した。図2aにより、WSSV遺伝子の部分をコードするdsRNAによって処理された動物が、ウイルス感染から強く防御されることが示されている。前記のように、dsRNAは、遺伝子配列非依存的に、エビにおいる抗ウイルス状態を誘導する;しかしながら、この防御性は限られたものであり、比較的高いウイルス投与量では、無効なものになり得る(図2のアヒルυを参照)。WSSV特異的遺伝子をコードするdsRNAの注入は、無関係なdsRNA処理動物より、かなり高い生存率をもたらす。これらのデータにより、dsRNAがエビにおけるRNAi経路を活性化し、ウイルス遺伝子の発現を妨げ、抗ウイルス防御性をもたらし得ることが示唆される。興味深いことに、これらの研究で調べた3種のWSSV遺伝子のどの1種の発現を妨げても、同様に強い抗ウィルス防御性を提供する。これら3種の候補遺伝子は、WSSVの生活環において必須であるらしいので選択した:ゲノム複製に重要な推定上の初期酵素として、リボヌクレオチド還元酵素(RR)の小サブユニット、及びとDNAポリメラーゼ、及びWSSV発症機序に重要であると示唆されてきた、外殻の構造上の構成成分として、vp28である。RNAiがエビにおいて全身的に作用しているようであるいう観察(図1)に一致して、RR用dsRNAの筋内注射は、同じ経路による感染を予防するだけでなく、動物にWSSV陽性の組織を給餌することにより負わされた感染からも、投与量依存的に予防する(図2b)。
【0160】
(実施例2)
(4種のWSSV遺伝子をコードするdsRNAによる抗WSSV防御性のさらなるキャラクタリゼーション)
課題1は、選択されたWSSV遺伝子の初期の比較を提供することを目的とする。ESTクローンの質、及びウイルス複製における、該遺伝子の予測される役割に基づいて、dsRNAの、防御効果を生じる有効性の違いを見い出し得る。これらの実験により、dsRNA作製方法が確立され、我々のWSSVのESTコレクション由来の最も重要なクローンのいくつかの評価が可能になるであろう。
【0161】
(4種のWSSV遺伝子(vp26、vp19、チミジル酸キナーゼ、DNAポリメラーゼ)のクローニング、及び長いdsRNAの作成)
(方法)
4種より、むしろ6種のWSSV遺伝子を使用した。これらは、vp19(外殻タンパク質、GenBankアクセッション番号AA069661);vp26(ヌクレオキャプシドタンパク質、GenBankアクセッション番号AA069663);vp28(外殻タンパク質、GenBankアクセッション番号AAL33423);VF(機能未知のウイルスタンパク質、GenBankアクセッション番号AAL33255)、DNAポリメラーゼ(ウイルスゲノムの複製に関与する酵素、GenBankアクセッション番号NP_478036)、及びZF(推定上のジンクフィンガー転写因子、フィンガー転写因子NP_477987)。これらの遺伝子を、それらの公知、又は推側される機能に基づいて、潜在的標的として選んだ;そのうち2種は(vp19、及びvp28)は、宿主細胞のウイルスの感染に関与し、かつワクチン作成のための標的であることが示唆されてきた外殻タンパク質である(Witteveldt J、 Vlak JM、及びVan Hulten MCの論文「WSSVのサブユニットワクチンを用いた、ペナエウス モノドンのホワイトスポットシンドロームウイルスに対する防御性」(Fish Shellfish Immunol. 2004 May ; 16 (5): 571-9));該vp26タンパク質はヌクレオキャプシドの構成要素として知られている;DNAポリメラーゼはウイルスゲノムの複製に必須であるはずである;かつ、ZFは、該WSSVゲノムの発現制御に推定上関与している。従って、これらの遺伝子は、WSSVの少なくとも4種の相異なる機能に相当し、それゆえ、RNAi介在発現低下による、感染に対する防御性のための標的範囲に相当する。該遺伝子を、我々のESTコレクションからPCRにより増幅し、互いに逆の方向性をもつファージプロモーターをもつベクター(対象の挿入断片がT7、及びT3の側面に位置される、Invitrogen 社のpCR4)へサブクローニングした。プラスミドDNAを精製し、直線化し、該RNAのインビトロ転写に使用した。そのRNAを精製し、アニールし、質をゲル電気泳動により調べ、かつ定量した。ミリグラム量のRNAの作成のため、合成反応の規模拡大を許容する、改質されたRNA合成プロトコルに従った。
【0162】
(結果、及び考察)
vp19、及びチミジン酸キナーゼを除く、上記同定遺伝子は、該ESTコレクションからうまく増幅され、対象となるベクターにクローニングされた。vp19をコードする遺伝子は、WSSV感染エビの組織からのPCR増幅によってクローニングされた。クローニングされた全ての遺伝子の同定は、配列決定により確認され、組み換えコンストラクトの機能性は、インビトロ転写により調べられた。一本鎖RNAと、アニールされたdsRNA産物は、図3に見られるように、アガロース電気泳動により分析された。典型的なインビトロ転写反応は、lμg DNA鋳型あたり、約25μg dsRNAの収率である。
結論:1. ウイルス遺伝子のクローニング、及びインビトロ転写の方法が応用され、かつ標準化されている。2. ここで応用された該技術を用いて、ESTクローンや配列情報が入手可能な、任意のエビウィルスの選択された対象の遺伝子から、dsRNAを作成することが可能であるはずである。
【0163】
(実施例3)
(WSSV感染に対する防御性のための、単独、及び組合せのdsRNAの調製)
(方法)
該先行実施例の5つの遺伝子の、WSSVによる感染からエビを防御する能力を調べた。行った実験は、下記のとおりであった:1) WSSV感染エビの組織(1日当たり体重の5%)を2日間給餌し、ウイルスの感染量を与えた。コントロール(非感染)動物には、非感染エビの組織(1日当たり5%)を、2日間給餌した。WSSVのLD90量の注入より、このウイルスの致死量の経口チャレンジを選択したのは、それが、現実の世界の環境における、ウイルスチャレンジのより典型であり、かつ該エビの耐性の、より一層ストリンジェントな試験を提供するからである。WSSV遺伝子の防御効果は、非特異的dsRNA(例えば、アヒルIgY)の効果と比較しなかった。非特異的刺激を用いた、この研究において得られた結果を、ウイルス特異的配列を用いた我々の初期の結果と比較すると、任意のWSSV遺伝子のdsRNAを用いて、数倍高い防御効果が達成され得ることが、かなり明らかであった。その上、特異的dsRNA(vp19)、及び非特異的dsRNA(ポリC:G)の防御効果の比較は、実施例5の表、及び図9に示された実験に含まれる。dsRNA(12 μg)の注入は、経口チャレンジを開始する4〜6時間前に、筋肉内に行った。Kruskal-Wallis方法を用いる一元配置ANOVAを使用して、統計解析を行った。
【0164】
全ての試行において、25個の水槽からなる再循環系で、該動物にウィルスチャレンジを行った。各水槽は、集水排水槽へと排水され、該水は、生物フィルターを通される前に、5 μmへろ過される。該水は、各水槽に戻る前に、1 μmへろ過され、40 W UV 滅菌機(9 x 105 W/cm2s)で処理される。動物には、1日に1〜2個の市販餌ペレットを給餌した。フィルターは定期的に交換した。塩分濃度は30pptに、温度は27℃に維持した。全てのウィルス接種に先立ち、48時間の馴化期間があった。毎日、死亡率をモニターし、死んだ動物は除去した。水槽当たりの動物(1〜3 g)は、10個体で、処理当たりの水槽は3個であった。
【0165】
(結果、及び考察)
該防御性実験において、5種の選択されたWSSV遺伝子の有効性は、多様であった(図4):該ZF、及びとvpl9遺伝子は、良好な防御性を示した(非感染動物より、より良好:80〜86%生存)のに対し、他の3種の遺伝子(vp26、vp28、及びVF)は、低い防御性を示した(40〜52%の間)。5種全てのdsRNAの混合物を調べたところ、10日間で70%の生存率という、中間の防御性を示した。全ての遺伝子、及びdsRNAの混合物は、VFを除いては、ポジティブコントロールから、有意に異なっていた(P=0.072)。vpl9、ZF、及びその混合物 (P<0.001) は、WSSVのポジティブ処理と比較して、ネガティブコントロールより、若干より有意な生存をもたらした(P=0.003)。該ネガティブグループの死亡率は、予想外であったが、PCRにより調べたところ、不慮のWSSV感染によるものではなかった。該ネガティブグループの死亡率は、該結果の解釈、又は有意性に影響を与えなかった。最も防御性の高い遺伝子、vpl9、及びZFは、最も防御性の低い遺伝子VFより、有意に異なっていた(各々、P=0.011、及び0.016)。
【0166】
結論:1. vpl9、及びZFをコードする12 μgマイクログラムのdsRNAの筋肉内注射による投与は、致死量の経口ウイルスチャレンジにに対して、本質的に完全な防御性ををもたらした。他の調べられた3種の遺伝子は、防御的ではあったが、有効性は低かった。
2. 5種のdsRNAの混合物は、5種の遺伝子が個々にもたらす効果の範囲の中間の防御性をもたらした。
【0167】
(実施例4)
(dsRNAは海洋性無脊椎動物(エビ)における、一般的な抗ウィルス免疫を誘導する)
最初に、我々が、エビへのdsRNAの注入が、抗ウイルス防御性をもたらすことを見い出したのは、タウラシンドロームウイルス(TSV)でのウイルスチャレンジの結果における、シグナル伝達経路のRNAi介在発現減少の影響を調べているときであった。我々の実験アプローチは、精製された同起源dsRNAを注射し、その後、動物をTSVでチャレンジし、対象の遺伝子が発現低下した動物が、ウイルス感受性の増大を示すかどうかを検討することである。驚いたことに、任意のdsRNAの注入が、エビの遺伝子に相当していようが、非特異的dsRNAコントロールであろうが、TSVチャレンジに対する生存増加をもたらした(図示せず)。この初期の観察が、脊椎動物においてと同様に、dsRNAが、エビにおいて抗ウイルスプログラムを誘導し得るという可能性に我々が取り組むきっかけになった。
【0168】
エビにおいて、dsRNAが一般的な抗ウイルス応答を誘導するかどうかを検討するために、一本鎖RNAウィルスであるTSV(Bonamiらの論文、J. Gen. Virol. 78 (Pt. 2): 313-319 (1997))での感染、及び複雑な外殻に包まれた二本鎖DNAウイルスであるWSSV(Mangらの論文、J. Virol. 75: 11811-20 (2001))での感染における、dsRNA処理の効果を分析した。dsRNAで処理した動物においては、偽処理動物に比べて、50〜75%の累積死亡率の減少が観察された(図1 a、及びb)。 エビが、有意に高いTSV量に晒された時は、抗ウイルス防御性レベルが低下した(約12%)(図5a)。このことは、任意の免疫応答のように、エビにおけるdsRNA誘導抗ウイルス防御性は、感染源の負荷を増大させることにより、無効なものになり得ることを示唆している。図3に要約された実験において、TSV、及びWSSV両方に対する防御に使用されたdsRNAは、アヒル免疫グロブリンγの重鎖の遺伝子から転写した。この配列は、いかなる公知のエビ遺伝子、又はWSSV(アクセッション番号NC_003225)、又はTSV(アクセッション番号NC-003005)の該ゲノムとも類似性をもたない。従って、アヒルdsRNAによって誘導される、該観察された抗ウイルス応答は、配列特異的なRNAi経路を含む可能性は低く、それゆえに、2つの無関連なウイルスに対して活性をもつ、より一般的な抗ウイルスメカニズムに相当し得る。
【0169】
培養媒体、及び飼育条件を含む、該実験で使用されたウイルスチャレンジ系を、高度に標準化したにもかかわらず、累積死亡率に相当する絶対値は、完全に一致しているわけではない。多様性は、使用されたエビのバッチ間の相違に起因し得ると考えられている。該実験は、比較的若いエビ(平均体重1〜3 g)を必要とするので、長期に渡って単一バッチ由来のエビを使用することは、実行不可能である。
【0170】
予備実験(データは図示せず)により、1 μg dsRNAが、WSSV感染に対する防御性を誘導するために必要な最低有効投与量に近いこと、及び100 μgまでの dsRNAが、明らかな毒性の徴候を生じずに、1〜2 gのエビに注入できることが示唆された。従って、ここで報告された該研究では、それ以降、中間投与量7〜15 μgを使用し、エビにおける、dsRNA誘導抗ウイルス応答の特徴を調べた。
【0171】
抗ウィルス防御性におけるdsRNA投与量の効果:下記の表に、WSSVでの感染に先立ち、異なる投与量のアヒルυdsRNAが注射された実験を要約する。最終的な累積死亡率(CPM)の値を示す。
【0172】
【表1】

【0173】
独立した実験において、より高いdsRNA 投与量の力価測定を行い、1 g以上のdsRNAが、WSSVチャレンジによる生存に(正か負かの)効果があるかどうかを判断した。得られた累積死亡率の値は、下記の表に要約する。
【0174】
【表2】

【0175】
該実験条件を同一に維持したにもかかわらず、これら2つの測定において、ポジティブコントロール、及び防御グループのCPMの絶対値は多少異なった。しかしながら、該dsRNAの防御効果は一致した。まとめると、これらの投与量依存性により、常に、約1 μg(アヒルυの)dsRNAが、1〜2 gのエビを、WSSVでの準LD100感染に対して防御することが示唆される。また、1 μgが防御性の閾値に近くであり得ることが示唆される。従って、毒性の徴候なく、100 μgまでのdsRNAを、エビに注入していたので、以後の実験では7〜15 μgを使用することに決定した。
【0176】
dsRNAによる抗ウイルス状態の誘導が、配列非依存性であることの立証を、4種の様々なタイプの無関係なdsRNA配列で処理後、エビをWSSVでウイルスチャレンジすることにより示した。脊椎動物の免疫グロブリン遺伝子(アヒル、及びブタ)、魚類の非コード領域のゲノムDNA、及び、バクテリアのベクター配列(pBeloBAC 11 ベクター)に由来する配列を使用した。これらの配列の各々は、WSSV感染に対する防御性を誘導した(図5b)。dsRNA処理がウィルスの感染を阻害するのか、或いは宿主におけるウィルスの蓄積に影響せず、WSSV誘導死亡率の減衰をもたらすのかを判断するために、dsRNAによる前処理の有無の場合にWSSVチャレンジされたエビにおいて、組織学的解析を行った。ウィルス感染後36、及び72時間に、コントロール、及びdsRNA処理エビの間でWSSVウィルス粒子の蓄積と古典的な組織損傷の存在を調べたところ、劇的な相違が観察された(データは図示せず、及び図5c)。コントロール感染動物の組織学切片では、胃とクチクラ表層組織の核(データは図示せず)において、造血組織(図5c)と同様に、大きな好塩基顆粒状のウィルス封入体が見られた。これらの特徴は、dsRNA処理で防御された動物には存在しなかった。これらの観察により、dsRNA処理エビにおいては、おそらく抗ウィルス防御系の誘導により、WSSVが有意に蓄積しないことがを示唆される。全体として、これらのデータにより、dsRNAが、配列に非依存的に、エビにおける抗ウィルス応答を誘導するという結論が支持される。
【0177】
(防御性のある最低投与量)
(方法)
WSSVチャレンジに対してもたらされる防御性における、dsRNAの投与量の効果を調べるために、下記の実験計画を採用した。最大、及び最小の防御性をもたらす2種のdsRNA、各々vp19、VFを、"最強"(10 μg)と、10倍毎の低い希釈(1、及び 0.1 μg)での実験に選んだ。該dsRNAを、WSSV感染組織での経口チャレンジの4〜6時間前に、筋肉内に注入し、10日間にわたり生存を評価した。Kruskal-Wallis法を使用し、統計的有意性を判断した。
【0178】
(結果、及び考察)
結果(図6)により、vp19がウイルスチャレンジに対して、より優れた防御物であったことが確認され、また、両遺伝子において該防御効果が希釈され得ることが示された。1 μg投与量のvp19は、10 μg投与量ほど良好な防御性をもたらした(80%対90%)が、0.1 μgでは、該防御性は、36%に落ちた。全てのvp19投与量(10、1、及び0.1 μg)は、統計的に、該ポジティブコントロールとは異なっていた(各々、P<0.001、<0.001、及び0.023)。該0.1 μg投与量は、他の2種の投与量より、有意に防御効果が低かった(P=0.002)。VF dsRNAの場合、3種の投与量での防御性は、各々、72%、46%、及び38%であった。また、これらの全ての投与量(10、1、及び0.1 μg)は、ポジティブコントロールとは有意に異なっていた(P<0.001、0.013、及び 0.016)。統計的解析により、VFの最高投与量は、vp19の高い投与量と同様である(10 μg P=0.009、及び1 μg P=0.010)こと、かつVFの低い投与量は、vp19の最低投与量とグループ化されることが示された(P=0.002〜0.003)。
【0179】
(結論)
1. 10、及び1 μg の投与量で、VFと比べて、vpl9のより優れた防御効果を確認した。
2. dsRNAによる防御性の有効性を、希釈による力価の評価を行い、0.1 μgではvp19、及びVF両方において、約36〜38%であった。
【0180】
抗ウイルス状態の誘導はRNAに起因する:生得的免疫の潜在的誘導因子には、感受性の高い細胞に対し、比較的低濃度で強い効果を及ぼすものもある。我々は、ウイルスチャレンジに対するdsRNA処理動物の相対的耐性が、有機溶媒抽出中にdsRNAと共精製され得る、該dsRNA調整品内の夾雑物(例えば、LPS、DNA)に起因するという可能性を考察した。さらに、我々は、dsRNA処理とウイルス注入の間に72時間経過するときでさえ、該RNA調製品内の該化合物が、我々の研究で使用された該ウイルスを、直接不活性化し得るという可能性を考察した。これらの問題に取り組むため、我々は、動物に、2工程dsRNA投与体制を受けさせる一連の実験を行った:最初に、以前に行われたように、ウイルスチャレンジの72時間前にdsRNAを注入し、かつその後、該ウイルス調製品と混合したdsRNAの追加投与量を与えた。もし、該dsRNA調製品内のの夾雑物が、該ウイルスの直接の不活性化の原因になっているのであれば、該dsRNAの調製品と混合されたウイルス接種物を注入されたエビにおいて、高い生存率が観察されるであろうと推論した。図7には、ウイルスチャッレンジ72時間前に与えられた1回のdsRNA投与量が、dsRNAの2回投与(感染72時間前、及びウイルス/dsRNA混合物の注入)と同程度に、WSSVに対してエビを防御することが示されている。さらに、dsRNAが、該ウイルス接種物との混合物としてのみ注入されたときは、72時間前処理、又はdsRNAでの二重の処理と比べて、弱い防御性(死亡率において10%以下の減少)が観察された。これらの結果は、dsRNAによる、或いは、推定上の夾雑物によるウイルスの直接の不活性化が、該観察された抗ウイルス防御性を説明できないことを示している。さらに、図7bより、RNアーゼ処理が我々の調製品によってもたらされる抗ウイルス防御性を損なったこと、かつ2種の異なる方法(有機溶媒抽出、又はシリカ充填剤による吸着)による、インビトロ転写反応から精製されたdsRNAが、同様の抗ウイルス応答誘導する能力もつことが示されている。まとめると、これらの結果により、(dsRNA調製品内に存在する他の化合物でなく)RNA自身が、エビにおける該観察された抗ウイルス免疫の誘導因子であることが示される。
【0181】
ポリC-Gは抗ウィルス状態を誘導するが、ポリI-C、又はポリCはしない:ポリI-Cは、脊椎動物における、生得的抗ウイルス応答の有力な誘導因子であり、かつこれらの系において、dsRNAの生物学を研究する一般的な実験ツールである。我々は、これ、又は他の市販合成RNAも、エビにおける抗ウイルス応答を誘導するという可能性について検討した。図8より、ポリI-CがWSSV感染に対する防御性を誘導しなかった一方で、別のdsRNAアナログ、ポリC-Gが抗ウイルス防御性の極めて効果的な誘導因子であったことが示される。この結果により、脊椎動物とエビの間のdsRNAの認識機構の相違が示唆され、かつdsRNAが、それが調整、又は精製される方法と無関係に、エビにおける抗ウイルス応答を誘導し得るという概念が裏付けられた。重要なことに、合成ssRNAであるポリCは、抗ウイルス防御性を誘導できなかったので、エビの抗ウイルス系は、その脊椎動物対応系のように、ssRNAとdsRNAを識別し得ることが示唆された。
【0182】
エビにおけるdsRNAにより誘導される抗ウイルス応答の、正確な分子の性質は、依然として不明である。無脊椎動物種における、dsRNAへの認識、及び応答の分子機構のキャラクタリゼーションは、生得的抗ウイルス免疫の進化の理解の手掛かりになるであろう。dsRNA誘導全身性抗ウイルス応答は、他の無脊椎動物にも存在するであろうと仮定されている。他の無脊椎動物において、この応答が広範囲に存在することは、無脊椎動物における逆遺伝学的解析に、RNAiの使用が重要な意味をもつであろう。
【0183】
(実施例5)
(特異的(WSSV)dsRNAにより生じた防御性における、非特異的dsRNAのアジュバント効果)
(方法)
遺伝子特異的dsRNAの調製の経費と複雑さは、商品化に対する重大な障害となりうるだろう。このため、非特異的dsRNA(ポリC:G)の添加が、希釈によって見られるWSSV特異的dsRNAの活性の消失を補償できるかを検討する、実験を計画した。従って、表1に示されるように、量が0.012〜1 μgの様々な量のvp19 dsRNAを、ポリC:Gと混合し、一定の投与量1 μgを保った。経口ウィルスチャレンジが開始される4〜6時間前に、エビにp19/ポリC:Gの混合物を注射し、かつ10日に渡って生存率をモニターした。Kruskal-Wallis方法を用いる一元配置ANOVAで、統計解析を行った。
【0184】
【表3】

【0185】
(結果)
図9に図示されるように、1 μg vpd19 dsRNAで処理したエビは、0.3331 μg vp19 dsRNAに0.6671 μgポリC:G添加と、本質的に等しい86〜92%の生存率を示した(P=0.574)。0.111 μg vp19 dsRNAで処理されたグループは70%の生存率を示し、0.037 μg、及び0.012 μg vp19 dsRNAで処理されたグループ(各々、0.963 μg、又は0.988 μg ポリC:G)は、20〜 30%の生存率を示したが、1 μgポリC:Gで処理した動物は、わずかな6%の生存率を示した。該vp19投与量を0.111 μgから0.037 μgへ減少させた時に、防御性の有意な低下が観察された(P<0.001)。
【0186】
(結論)
該実験実施例の累積された結果より、WSSV遺伝子をコードするdsRNAへのポリC:Gの添加が、ウイルスチャレンジ残存エビの割合を約2倍増加させることが示唆される。このことは、ウイルス遺伝子特異的dsRNAの生産経費が、ポリC:Gのものよりかなり高いと予想され得るので、非常に重要である。該増強効果の理由は不明であるが、全身性抗ウイルス応答の上昇に関連し得る。
【0187】
WSSV遺伝子(vp19)をコードするdsRNAの有効性が、非特異的dsRNA(ポリC:G)よりも高いことが、明らかに示された(有意性はP<0.001)。
【0188】
(実施例6)
(サッカロミセスにおける誘導的にウィルスdsRNAを発現する酵母発現ベクターの構築)
所望される遺伝子(WSSVのvp19、又はZFの配列)が操作上連結される、GAL1(ガラクトース誘導性プロモーター)、2種の選択マーカーURA(ウラシル遺伝子)、及びAMP(アンピシリン遺伝子)、該所望されるdsRNAに連結される所望される遺伝子を含む、プラスミドを構築した結果、サッカロミセスに導入されるときには、選択的条件下(ウラシル非存在下)で選択され得て、かつガラクトース誘導条件下で培養されるときには、該所望される遺伝子、及びdsRNAを発現するベクターが生じた(図10を参照)。図11に図式的に示すように、さらに、任意に酵母菌の実験が行い、発現の最適レベル、及びタイミング、及びdsRNAの収率を最適化するような培養の諸条件をもつ酵母株を選択する。
【0189】
図12に含まれる結果により示されるように、WSSVのVP19、又はZF配列を含む発現ベクターで形質転換された場合、サッカロミセス属酵母菌の形質転換体は、検出可能なレベルの、WSSVがコードしたdsRNAを発現する。該実例において、形質転換酵母菌から、10 μgトータルRNAを抽出し、vp19、ZF、及び(ポシティブコントロールとして)酵母アクチンのプローブを使用し、ノーザンブロットにより解析した。これらの結果により、WSSV関連RNAが酵母で発現していることが示され、かつ該ノーザン解析における検出特異性が明らかにされる。
【0190】
さらに、図13に含まれる該結果により示されるように、酵母菌は、WSSVのZF配列を含むベクターによって形質転換された場合、二重鎖RNAを発現する。これらの実験において、ZF発現ベクターでの形質転換体由来の10 μgトータルRNAを、ノーザンブロットにより解析した。該RNAの各鎖用のプローブ(アンチセンス、左、及びセンス、右)を用い、両方が、各々の標的を検出した。従って、これらの結果により、酵母菌が、WSSVのZF配列の両方の鎖を発現したことが確認された。さらに、図13に示されるように、内部標準(各ゲルの右の方)は、各試料中に存在する、WSSVのZF RNAの量(約50ナノグラム)の概算を可能にする。
【0191】
酵母菌が、所望されるdsRNAを、所望されるレベルで発現することが望まれていたが、結果は理論的には予期されたものではなかったのは、いかなる発現されたdsRNAも内在性RNアーゼによって分解され得るという有意な可能性のためである。これらの結果に基づき、酵母菌は、所望されるdsRNAをエビなどの甲殻類動物、及び他の無脊椎動物に送達するのに適した手段を提供するはずである。
【0192】
(実施例7)
(海洋エビにおける抗ウイルス免疫を調節するシグナル伝達経路への機能ゲノム学的アプローチ)
リトペナエウス バンナメイは、世界で最も幅広く養殖されているエビの種類で、甲殻類免疫の研究の重要なモデルである。十数の病原性ウイルスがエビに感染することが知られているので、生得的抗ウイルス応答、無脊椎動物免疫の従来軽視され一面の研究を行うの唯一の機会を提供する。これらのウイルス応答性遺伝子をキャラクタリゼーションすることにより、エビ‐ウイルス関係に関与する経路の種類に関する理解を得ることを目的とする。この目的へ向けて、我々は、コントロール、及びホワイトスポットシンドロームウイルス(WSSV)感染エビの組織を使用して、サプレッションサブトラクションライブラリー(SSH)を作製し、キャラクタリゼーションを行った。SSHライブラリー由来の単離クローンの発現解析により、推定上の免疫機能をもつ数種の遺伝子が、WSSV感染中に調節されていることが明らかにされる。エビ‐WSSV系を律する分子メカニズムの新規性は、配列解析に基づき機能がないとされている遺伝子の有意な割合により、強調される。我々は、2800種のエビ単一遺伝子を含む L. バンナメイのcDNAマイクロアレイを作成し、これらの動物における抗ウイルス応答に関連した遺伝子発現の変化を解析した。RNAiを使用する標的サイレンシングを組み合わせた、このエビcDNAマイクロアレイを用いる遺伝子発現の包括的解析は、甲殻類における、抗ウイルス応答と同様に、他の表現型応答を律する分子事象の理解の手掛かりになるであろう。
【0193】
(結論)
ここに示されるデータより、dsRNAが、海洋無脊椎動物における、ウイルス感染に対する防御性を誘導することが示される。これは、誘導性の一般的抗ウイルス免疫応答が、無脊椎動物において発現され得るという、最初の証拠を提供する。他の研究では、特定のウイルスタンパク質と同様に、微生物産物(例えば、LPS、及びβグルカン)が、エビにおける抗ウイルス耐性を増強できることが示唆されている(Changらの論文、Fish Shellfish Immunol. 15: 297-310 (2003); Hwangらの論文、Deu. Comp. Immunol. 23: 54552 (1999);Songらの論文、Dev. Biol. Stand. 900: 413-21 (1997);Takahashiらの論文、Fish Shellfish Immunol. 10: 555-8 (2000); Witteveldtらの論文、J. Virol. 78 : 2057-61 (2004))。しかしながら、我々の結果より、三様に、甲殻類における抗ウイルス免疫に関する我々の知識を向上させる。第一に、我々の結果より、2種の無関係なウイルス、TSV、及びWSSVに対して活性をもつ抗ウイルス免疫反応が示される。これらの結果をもとに提起される作業仮説は、dsRNAが、エビにおける一般的抗ウイルス応答を誘導するということである。第二に、エビの抗ウイルス免疫系は、(ポリI-Cの場合を除いて)その塩基配列、及び塩基組成にかかわらず、分子の型としてdsRNAに応答することが、示される。第三に、脊椎動物と、無脊椎動物との生得的抗ウイルス免疫間の、有力な進化的関連(dsRNAの認識)が示唆される。
【0194】
無脊椎動物、特に昆虫における抗バクテリア、及び抗菌類の分子基盤については、かなりのことが知られている(Hetroらの総説、J. Infect. Dis. 187 Suppl 2: 5227-334 (2003))が、いかなる無脊椎動物においても、ウイルス感染に対する免疫メカニズムに関する情報はない。4種類の完全な無脊椎動物ゲノム(すなわち、ドロソフィア メラノガスター(Drosophila melanogaster、キイロショウジョウバエ)、アノフェレス ガンビエ(Anopheles gambiae、ガンビエハマダラカ)、カエノラブディティス エレガンス(Caenorlzabditis elegans、線虫)、及びキオナ インテスティナリス(Ciona intestinalis、ユウレイボヤ))の解析に基づき、無脊椎動物が、脊椎動物のインターフェロンと相同な抗ウイルス系を欠如していることは明らかなようである。しかしながら、相同遺伝子の欠如は、脊椎動物に存在する系と類似の、無脊椎動物免疫系の存在を認めないわけではない。例えば、最近、寄生生物感染に関しては、抗原特異的免疫記憶の存在が、甲殻類で示されている( Kurtzらの論文、Nature, 425: 37-8 (2003) )。それが驚くべきことであるのは、T、及びBリンパ球、及び抗原受容体遺伝子の再編成に基づいた、該脊椎動物系に相同な真正な適応免疫系が無脊椎動物には存在しないからである。遺伝的多様化、及び後生動物亜門の進化中の新規遺伝子機能の獲得が、抗ウイルス免疫の進化収束をもたらしているのかもしれない。配列相同性より、機能に焦点を合せることが、抗ウイルス免疫を分子レベルで理解する鍵をにぎるであろう。
【0195】
dsRNAが無脊椎動物における抗ウイルスプログラムを誘導することの実証は、生得的免疫の新規な分子メカニズムの発見の可能性を広げる。もし、エビが、インターフェロン、或い例えばPKR、及びMxのような、インターフェロン誘導抗ウイルス免疫のエフェクタに相同な遺伝子をを発現していれば、驚くべきことであるのは、これらの遺伝子は、他の節足動物のゲノムに欠失しているからである。興味深いことに、免疫応答性オリゴアデニル酸合成酵素は、無脊椎動物群、海綿動物において同定されており(Grebenjokらの論文、 Eur. J. Biochem 269: 1382-92 (2002); Kuusksalvらの論文、Eur. J. Biochem 232: 351-7 (1995))、これらの遺伝子が甲殻類動物において存在し、かつ抗ウイルス免疫において関与する可能性は排除できない。一方、脊椎動物におけるインターフェロン応答を調節することが知られている経路と相同な、シグナル伝達経路が、節足動物においても存在する。ショウジョウバエにおいては、該JAK/STAT系は、造血,及び性決定を調節し(Ziedlerらの総説、Oncogene 19: 2598-606 (2000))、かつ数種の免疫機能遺伝子(例えば、チオールエステル含有タンパク質、及びツランドットA(Turandot A))の発現も制御する(Christophidesらの論文、Science 298 : 159-65 (2002))。A. ガンビエ においては、2種のSTAT相同物の存在が記載されており、そのうちの1種は、免疫チャッレンジに応じて、核に移行することが示されている( Barillas-Muryらの論文、EMBO. J. 18 : 959-6 (1999))。また、我々自身の研究が、エビにおいて、少なくとも1種のSTAT相同物を同定した(NCBI アクセッション番号 CA991435)。哺乳類のTLR-3がdsRNAを認識し、該インターフェロン応答の活性化をもたらすという発見は、TLR/NF-κB複合体もまた無脊椎動物の抗ウィルス免疫、及び具体的に、ここに記載されたdsRNA誘導応答に関与しているという可能性を広げる。
【0196】
他の無脊椎動物分類群における、dsRNA誘導免疫応答の幅広い存在は、まだ検討されていない重要な問題である。例えば、ヒト疾患の無脊椎動物媒介動物(例えば、蚊)の抗ウィルス防衛メカニズムの理解は、公衆衛生に重要な意味があるであろう。さらに、dsRNA介在遺伝的干渉(RNAi)は、多くの無脊椎動物モデルにおいて幅広く使用される、逆遺伝学的ツールである。dsRNAによる免疫応答の、起こり得る誘導は、RNAiを使用する研究を解釈するときに、考慮に入れられる必要があり得る。
【0197】
本発明が、本明細書中で記載された該態様、及び前記の該実施例に限定されないこと、かつ当業者により、添付の請求項の趣旨、及び範囲から離れることなく、様々な変更、及び調整が行われ得ることは明らかである。
(図面の詳細な説明)
【図面の簡単な説明】
【0198】
【図1】L. バンナメイにおける、dsRNAを介した、全身性、及び配列特異的なmRNAの消失:エビ(1-2g)に、25 μg dsRNA (パネルa)、又は10 μg dsRNA、又は生理食塩水(パネルb、又はc)を筋肉内注入した。パネルa :3匹のエビ(各1〜2 g)に、25 μg dsRNAを筋肉内注入した。注入後48時間の時点で、エビを犠牲にし、統合した肝膵臓トータルRNAを、ノーザンブロット法により解析した。レーン1は、へモシアニンdsRNAを注入した動物からのトータルRNAを含む。プローブを図のように使用し、ハイブリダイズさせ、ブロットを複製した。PJV627様mRNAsからの、推定上分解生成物を星(*)で示す。パネルb:エビ(1〜2 g)に、10 μgのIKBK EST クローンの376塩基対長のdsRNA、又は生理食塩水を注入し、その後、様々な 時点で、鰓トータルRNA抽出用にサンプリングした。RT-PCR中に増幅された転写産物の、335塩基対領域は、該dsRNAを合成するのに使用された領域とは重複しない。HaeIIIで消化されたφx174 DNAを標準として使用した。ネガティブコントロール(-)は、RNA鋳型、又逆転写酵素が含まれない、偽cDNA 試料であった。動物がサンプリングされた時点の注入後日数(D1からD7)は、各パネルで使用したプライマーと同様に示された。パネルC:エビ(1〜2 g)に、10 μg の370 bp of the STAT EST クローンの370塩基対にかかっているdsRNA、又は生理食塩水を注入し、その後、様々な時点で、鰓トータルRNA抽出用にサンプリングした。RT-PCR 中に増幅された転写物の、該314塩基対領域は、該dsRNAを合成するために使用された領域 とは重複しない。コントロール、及び表示は、パネルbと同様である。
【図2】WSSV 遺伝子に対するdsRNA は、L. バンナメイのWSSV感染に対して防御する:エビ(1〜2 g)に、生理食塩水、又は特異的dsRNAを、1: 3 百万 w/v希釈のWSSVを含む組織抽出物と共に筋肉内注入した。ネガティブコントロールには、特定病原体フリーエビ(SPF)抽出物を同様のw/v 希釈で注入した。経口感染では、動物に、dsRNA を注入し、その後0.01 g の、WSSV感染筋肉組織、又はSPF組織を、2時間給餌した。バネルaでは、アヒルリボヌクレオチド核酸酵素 (RR)、DNA ポリメラーゼ(DP)、又は vp28 (28) dsRNAを、動物当たり12 μgで使用した。パネルbでは、また、アヒルυ dsRNAを動物当たり12 μgで使用したが、RR dsRNAは、表示されたように、12、又は1.2 μgで使用した。
【図3】一本、又は二本鎖vpl9 RNAのアガロースゲル電気泳動実験。インビトロ転写により合成された、その2種の一本鎖(S1、及び S2)をアニールして、dsRNA(D)を形成した。各レーンに約2μgを載せた。
【図4】WSSV の5種の遺伝子をコードするdsRNA、又はそれらの混合物の、WSSVウイルスでのチャレンジを経た生存率における効果の比較。
【図5】dsRNA は、エビにおける抗ウイルス状態を誘導する。エビ(1〜2 g)に、図示されたように、生理食塩水(ポジティブ(―○―)、及びネガティブ(―■―)コントロール)、又は8 μgのdsRNAを筋肉内注入した。dsRNA注入72時間後に、動物 (n=38〜42)に、下記の材料、及び方法に記載のように、TSV(パネル a)、又はWSSV(パネル b、又はc)を筋肉内注入した。パネルaでは、ポジティブコントロール、及びdsRNA 処理エビの両方における、TSV 投与量1000倍増加(1x10-8 から 1x10-5 w/v希釈)の効果は、点線死亡率曲線でも示される。該dsRNA調製品は、アヒルIgυ(アクセッション番号AJ312200)の309塩基対部分(―△―); ナマズIgH 遺伝子座由来のクローンBAC6(アクセッション番号 CC936713)のゲノミクス非コード領域の1316 塩基対(―●―);ブタIgG cDNA(アクセッション番号U03778)の1079塩基対部分(―×―); 及びバクテリア人工染色体(BAC)クローニングベクターpBeloBACll(Kimらの論文、Genomics 34: 213-8 1996)の1184塩基対断片(―◇―)であった。カイ二乗検定を使用し、dsRNA処理群の最終累積死亡率を、ポジティブコントロールと比較することにより、観察された抗ウイルス防御性の有意性を評価した:パネル a) アヒルIgυ dsRNA (χ2=6.05、0.01<p<0.025);アヒルIgυ dsRNA TSVx1000 (χ2=0.75、非有意); panel b) アヒルIgυ dsRNA (χ2=5.29、0.01<p<0.005) ; ブタIG dsRNA (χ2=12. 93、p<0.001) ; pBeloBAC11 dsRNA (χ2=8.67、0.001<p<0.005); 魚類非コード dsRNAχ2=15.39、p<0.001)。
【図5c】パネルc では、コントロール感染エビ由来の造血組織のエオシン/ヘマトキシリン染色、及び抗WSSV 免疫染色が、dsRNA処理/WSSV 感染エビと比較して示される。図示した切片は、ウイルス感染72時間後に得られた。スケールバーは、20 μm である。
【図6】WSSV感染に対するdsRNAの防御的効果を、投与量で力価評価できることを示す実験。
【図7】該抗ウイルス状態の誘導は、RNA に起因する:エビ(2〜3 g)に、生理食塩水(ポジティブ(―○―)、及びネガティブ(―■―)コントロール)、又はdsRNAを筋肉内注入した。この最初の注入72時間後に、WSSVを単独、又はdsRNAと組合せて、動物に注入した。a) 動物(n=26-31)各々に、50 μlの、約10〜15 μgアヒルυ dsRNA含有溶液を注入し、かつWSSV陽性抽出液でウイルスチャレンジを行った。The 72-0処理群(―●―)には、ウイルス感染72時間、及び0時間(同時注入)前の両方でdsRNAが与えられ、72処理群(―▲―)には、感染の72時間前のみdsRNAが与えられ、0処理群(―○―)には、WSSV接種と混ぜた dsRNAのみが与えられた。b)エビ(n=20〜28)を、循環系(材料、及び方法を参照)で飼育し、ウイルスチャレンジ72時間前に注入し、その後WSSV陽性抽出液と混合させたdsRNAで再注入を行った。ポジティブ(―○―)、及びネガティブ(―■―)コントロールは、パネルaで記載のとおりだった。全ての場合で、アヒルυ dsRNAが使用され、注入当たり10〜15 μgで適用された。dsRNAは、フェノール、及びクロロホルム(―△―)、RNイージーカラム(Qiagen社) (―●―)で精製したか、或いはRNイージーカラムで精製し、かつRNアーゼ混合液 (Ambion社からのRNアーゼ A、RNアーゼ T1、及びRNアーゼ V1)で処理した(―□―)。フィッシャーの正確確立検定を使用し、dsRNA処理群の最終累積死亡率を、ポジティブコントロールと比較することにより、観察された抗ウイルス防御性の有意性を評価した: a) 72-0処理(p<0.0003) ; 72処理 (p=0.0001) ; panel b) dsRNA カラム (p=0.0017) ; dsRNA 溶媒(p=0.0003)。
【図8】ポリC-Gは抗ウィルス状態を誘導するが、ポリI-C、又はポリCはしない。エビ(1〜2 g)に、記載のように8 μg(パネルa)、又は7 μg(パネルb)の合成dsRNAアナログを注入し、かつd72時間後に、WSSVで感染させた。全てのRNA アナログは、Sigma-Aldrich社から購入し、400 mM NaCl、10 mM トリスCl、pH 7.4中で再構成し、下記の材料、及び方法に記載のように、アニールし、定量した。パネルbの実験には、比較のために、アヒルIgυdsRNA(7 μg)を含めた。カイ二乗検定を使用し、ポジティブコントロールと比較し、観察された抗ウイルス防御性の有意性を評価した:パネルa) ポリ CG (χ2=16.92、p<0.001) ;パネル b) アヒルIgυ dsRNA (χ2=32. 17、p<0.001 ; poly CG (χ2=35.05、p<0.001)。
【図9】vpl9 dsRNAへのポリC:Gの添加は、WSSV感染に対する防御性のレベルを増大することを示す実験結果。
【図10】誘導性(ガラクトース)プロモーターの調節コントロール下で発現されるdsRNA、選択マーカー(URA、AMP)、及び該所望される遺伝子を含む、ベクターの構築の図式。該ベクターのサッカロミセス属酵母菌へ導入、その後に、選択、及びガラクトース誘導条件下での、該所望される遺伝子、及びdsRNAを発現が続く。
【図11】図8に図示の酵母発現ベクターのサッカロミセス細胞への誘導、かつ、発現の時期、ガラクトース濃度、ターミネーターなどの発現の最適条件の選択、コントロールプラスミドの構築、及びAMP遺伝子の除去の図式化。
【図12】サッカロミセス属酵母菌は、WSSVのvp19、又はZF配列を含むベクターで形質転換された場合、WSSVがコードしたRNAを発現することを示す、ノーザン分析結果。これらの実験では、形質転換酵母菌から抽出された、10 μgトータルRNAを、vp19、ZF、及びポシティブコントロールとして酵母アクチンの、プローブを使用し、ノーザンブロットにより解析した。これらの結果により、酵母菌が、WSSV関連RNAを発現することが示される。
【図13】本発明に従い、dsRNAベクターで形質転換された酵母菌は、(ZF配列を含むベクターによって形質転換された場合)、dsRNAを発現することを示す、ノーザンブロット解析結果。これらの実験では、ZF発現ベクターで形質転換された酵母菌由来の10 μgトータルRNAを、ノーザンブロットにより解析した。該RNAの各鎖用のプローブ(アンチセンス、左、及びセンス、右)を使用し、ノーザンブロットの結果により示される様に、両方が、それぞれの標的を検出し、ZF特異的なdsRNAを発現していることが確認された。さらに、内部標準(各ゲルの右の方)は、各RNA試料中に存在する、WSSVのZF RNAの量(約50ナノグラム)の概算を可能にする。
【技術分野】
【0001】
この出願は、2004年4月22日に出願された米国特許仮出願第60/564,295号、2003年7月2日に出願された米国特許第60/484,531号、2003年9月25日に出願され、「甲殻類動物、及び他の無脊椎動物における、非特異的免疫応答を誘導する方法、及び組成物」という名称の仮出願依頼人整理番号第100383.52749PV号(出願番号第60/505,715号)、及び2003年8月29日に出願された米国特許仮出願第60/498,603号の優先権を主張する。これら全ての文献の内容は、その全体が、引用により、本明細書に取り込まれるものとする。
【0002】
また、この出願は、下記の授与された助成に関するものである。1)USDAによる、オーシャニック研究所管掌米国海洋エビ養殖プログラム、及びサウスカロライナ天然資源省 FY03湾岸エビプロジェクトへの助成、USDAICSREES受賞番号2002-38808-01345、2)米国国立科学財団による、サウスカロライナ医科大学への助成、受賞番号MCB 0315393、3)米国国立海洋漁業局による、サウスカロライナ天然資源省(Soへの助成、受賞番号NA03NMF4720362、及びNAO7FL0498である。
【0003】
(発明の分野)
本発明は、無脊椎動物の免疫、好ましくは、甲殻類動物などの海洋無脊椎動物の免疫、及び特に、無脊椎動物の抗ウイルス免疫のより深い理解を提供する。さらに、本発明は、少なくとも1種の二本鎖RNAの投与による、無脊椎動物、好ましくは、甲殻類動物(エビ、ロブスター、カニなど)、軟体動物(ウミウシ、貝、イカなど)、又は他の無脊椎動物における、非特異的(全身性)免疫応答誘導方法、及び物質を提供する。
【0004】
また、本発明は、少なくとも1種の、長鎖、又は短鎖二本鎖RNAの投与による、甲殻類動物、又は別の無脊椎動物における、非特異的(全身性)免疫応答、及び配列特異的RNA干渉応答の、いずれか、又は両方を誘導する方法、及び物質を提供する。
【0005】
また、本発明は、dsRNAとハイブリダイズする配列を含む、遺伝子の標的抑制を提供する配列をもつ、少なくとも1種のdsRNAを、非特異的dsRNAと共投与することにより、RNA干渉応答を増強させる方法、及び物質を提供する。ここで、該非特異的dsRNAは、"アジュバント"として作用し、その投与は、第一の配列特異的dsRNAの投与により免疫応答を促進(増強)する。該共投与は、該配列特異的dsRNA、及び配列非特異的dsRNAの併合投与、又はいずれかの順での、個別投与を含む。
【0006】
また特に、本発明は、海洋無脊椎動物内在性遺伝子の発現を調整するdsRNA の使用に関するものである。例を挙げると、免疫、成長、生殖、及び健康一般、又は"ロバスト性"に関与するような軟体動物遺伝子、又は甲殻類動物遺伝子であり、同様に、海洋無脊椎動物、好ましくは軟体動物、及び甲殻類動物に感染する病原体の必須遺伝子がある。また、STAT、IKB、及び、NFKB、及び STATシグナル経路の他の推定上の構成要素のような遺伝子も含む。また、神経伝達物質、脱皮抑制ホルモン、生殖腺抑制ホルモン、及び甲殻類高血糖ホルモン含む、ホルモン、及び代謝経路をコードする遺伝子も含まれる。また、クラスチン、及びペナエイジン(penaeidin)などの、抗菌ペプチド、又はそのようなペプチドの産生調節因子をコードする遺伝子を含む。場合によっては、dsRNAを使用して、軟体動物、又は甲殻類動物のような海洋無脊椎動物の、任意の所望される遺伝子の発現を、減少させることができる。例えば、推定上の標的遺伝子は、コントロール、及びウイルス(WSSV、又はTSV)感染エビ組織を用いて作製される、サプレッションサブトラクティブハイブリダイゼーションライブラリーなどの、ゲノムライブラリー中で同定することができる。他の可能な標的遺伝子の具体例は、VP28、リボヌクレオチド還元酵素、へモシアニン、VP26、VP19、チミジル酸キナーゼ、及びDNA ポリメラーゼなどである。
【0007】
好ましくは、本発明は、甲殻類動物遺伝子、又は通常、甲殻類動物に感染する病原体遺伝子と同一であるか、或いは例えば少なくとも75%、さらに好ましくは、少なくとも85〜90%、さらに好ましくは、90〜99%同一である、高い配列同一性を示す配列をもつdsRNAを投与を含む。エビの場合、病原体の例を挙げると、ホワイトスポットシンドロームウイルス、タウラシンドロームウイルス、伝染性皮下造血器壊死ウイルス(IHHNV)、ペナエイドシュリンプ(Penaeid Shrimp)のバキュロウイルス(BP)、ペナエイドシュリンプのラブドウイルス(RPS)、鰓関連ウイルス (GAV)、イエローヘッドウイルス(YHV)、リンパ器官関連ウイルス(Lymphoid Organ-Associated Virus)(LOVV);リンパ器官パボ様ウイルス疾患(Lymphoidal parvolike viral disease)(LPV)、肝膵臓パボウイルス(Hepatopancreatic Parvovirus)(HPV)、バキュロウイルス中腸腺壊死ウイルス(Baculovirus midgut gland necrosis virus)(BMN)、モノドン型バキュロウイルス(Monodon baculovirus)(MBV)、レオ様ウイルス疾患(Reo like virus diseases)(REO)、及びラブドウイルス(RPS)、及び新生ウイルスがあり、その必須遺伝子は、当業者に利用可能な任意の手段を通じて、同定され、かつ配列決定され得る。(新生ウイルスとは、今までのところ同定されていない、或いは後に、公知のウイルスから、組み換え、突然変異などにより生じたウイルスのことを言う。該新生ウイルスは、単離され、かつサブトラクティブハイブリダイゼーションを用いるなどして、例えば公知のウイルスゲノム、及び野生型エビゲノムと比較して、同定することができる。)
【0008】
さらに具体的に述べると、本発明は、無脊椎動物、具体的には、海洋甲殻類動物、リトペナエウス バンナメイ(Litopenaeus vannamei)、及び他のエビにおける、配列非依存性の、一般的な抗ウイルス防御性を誘導する方法、及び物質を提供する。場合によっては、バクテリア、菌類、微胞子虫類、略胞子虫類、及びグレガリナ類のような他の寄生生物に対する防御性である。
さらに、本発明は、脊椎動物の免疫系のアナログの、無脊椎動物の免疫系が、dsRNAをウイルス関連分子パターンとして認識でき、生得的抗ウイルス応答の活性化をもたらす、最初の実証を提供する。
【0009】
さらに、本発明は、甲殻類動物、軟体動物、又は他の無脊椎動物、好ましくは、エビへ、少なくとも1種のdsRNAを送達する生物送達媒体を提供する。該生物送達媒体は、該dsRNAを恒常的に、又は一時的に発現し、かつ甲殻類、又は他の無脊椎動物に安全に摂食され得る、酵母菌、又は微細藻類のような微生物である。好ましい態様において、本発明は、誘導性、又は恒常的プロモーターのコントロール下で、少なくとも1種の異種dsRNAを発現する、組み換え酵母菌、例えば、サッカロミセス属、又は組み換え微細藻類、例えば、クラミドモナス属、クロレラ属、アルスロスピラ属(スピルリナ属)などを提供する。
【背景技術】
【0010】
(従来の技術の説明)
本発明は、dsRNA分子の使用による、遺伝子発現を調節する、好ましくは抑制する、標的、及び非標的方法に関するものである。遺伝子発現の抑制を達成する方法は、当技術分野においてよく知られている。例を挙げると、アンチセンス核酸、三重らせんアプローチ、共抑制、及びRNA干渉、又はRNAサイレンシングの使用がある。
【0011】
(干渉に係わるアンチセンス核酸の使用)
アンチセンステクノロジーは、遺伝子特異的干渉を達成するプロトコルの中で、最も一般的に記載されたアプローチである。アンチセンスストラテジーでは、ストキメトリック(stochiometric)な量の、目的の遺伝子のメッセンジャーRNAに相補的な一本鎖核酸を、細胞に導入する。アンチセンスに基づくアプローチのいくつかの難点は、送達、安定性、及び必須投与量である。一般に、細胞は一本鎖核酸を取り込むメカニズムをもたず、従って、改質されていない一本鎖物質の取り込みは、非常に非効率的である。細胞への取り込みを待っている間に、該一本鎖物質は、分解されやすい。アンチセンス干渉は、干渉する物質が比較的高い濃度で(内在性mRNAの濃度、又はそれ以上で)蓄積することが必須なので、送達するのに必須な量が、効率の主要な制約要因である。結果として、アンチセンス技術の開発における取り組みの大半は、ヌクレアーゼ分解に安定であり、かつ細胞内に容易に拡散できる、改質核酸の産生に重点が置かれてきた。遺伝子治療、又は生物全体への適用のための、アンチセンス干渉の使用は、限定されている。それは、非天然アナログから合成されることが必要な、多量のオリゴヌクレオチド、その合成の経費、及び高投与量でさえ、各細胞に、十分濃縮され、かつ単一の干渉物質の貯留を維持することが難しいためである。
【0012】
(干渉に係わる三重らせんアプローチ)
第二の工学的干渉の方法は、三重らせん核酸構造に基づいている。このアプローチは、特定な核酸群の、三本鎖構造を示す稀な能力に依存する。生理条件下で、事実上、核酸は全て一本鎖、又は二本鎖であり、かつ三本鎖はめったに形成されない。しかしながら、特定の単純なプリン、又はピリミジンが豊富な配列が、極端なpH条件下で(すなわち、試験管内で)三本鎖分子を形成し得ることは、知られて久しい。一般に、そのような構造は生理条件下でごく一時的であり、従って三本鎖を産生するように設計された、非改質核酸の単純な送達では、干渉をもたらさない。アンチセンスと同様に、インビボで使用する三本鎖技術の開発は、より安定であり、かつインビボで細胞に容易に吸収される、改質核酸の開発に重点が置かれてきた。この技術の開発におけるさらなる目標は、該三本鎖物質の形成が生理的pH で効率的に進行するように、改質核酸を産生することであった。
【0013】
(共抑制現象、及び遺伝子工学におけるその使用)
第三の遺伝子特異的干渉のアプローチは、"共抑制"の名称下でグループ化される、一連の操作手段である。最初に、このアプローチは植物で記載されており、非連鎖であるが相同性をもつ遺伝子のサイレンシングをもたらす、導入遺伝子の能力のことを言う。ごく最近、共抑制と同様の現象が、2種の動物:線虫、及びショウジョウバエにおいて報告されている。最初に、共抑制は、導入遺伝子を使って、潜在的に有用性のある遺伝子座の過剰発現を試みようと導入遺伝子を使っているグループからの報告で、偶然見い出された。該過剰発現が成功した場合もあったが、多くの場合は、結果は予想と反対であった。それらの場合において、実際には、トランスジェニック植物の方が、より低い内在遺伝子の発現を示した。これまでに、様々な植物における導入遺伝子を介した共抑制のメカニズムが提唱されてきた;全てのこれらのメカニズムの提唱は、依然として仮説であり、かつそのプロセスの決定的なメカニズムの記載は示されてきていない。共抑制を説明するために提唱されているモデルは、2つの異なったカテゴリーに分類することができる。一連の提唱において、2つの異なった染色体部位間の、DNA、又はクロマチンレベルでの 直接的物理的相互作用が起こることが仮説となっている。その後、まだ同定されていないメカニズムが、デノボメチル化、及びその後の遺伝子発現の抑制につながるのであろう。
【0014】
(RNA干渉、又は RNAサイレンシング)
細胞、又は動物における標的遺伝子の発現を抑制する、さらなるプロセスはRNA 干渉(RNAi)、又はRNAサイレンシングである。該プロセスは、部分的、又は完全に二重鎖形質をもつRNA(dsRNA)の、細胞へ、又はその細胞外環境への導入を含む。抑制は、該二本鎖抑制RNAを産生するために選択された、標的遺伝子の一部分からのヌクレオチド配列に特異的である。この工程は、(1)遺伝子発現の抑制を実現するのに効果的であり、(2)標的遺伝子に特異的であり、かつ、(3)多くの異なった種類の標的遺伝子の発現の抑制をもたらす。
【0015】
例えば、該標的遺伝子は、該細胞から由来の遺伝子、内在性遺伝子、導入遺伝子、又は、その感染後に細胞に存在する病原体遺伝子であり得る。具体的な標的遺伝子、及び送達する二本鎖RNA物質の投与量に応じて、該手法は、該標的遺伝子の機能の部分的、又は完全消失を提供し得る。
RNA干渉、又は RNAサイレンシングによる、標的遺伝子の発現抑制に用いる方法、及び物質は、様々な発行された特許、及び多くの最近公表された特許出願書類に報告されている。例えば、Fireらによる米国特許第6,506,559号;Liuらによる米国特許6,326,193号;Grahamらによる国際公開第99/49029号;Grahamらによる米国特許第6,573,099を参照されたい。
【0016】
上記に関して、Graham(Benitecに委譲)によって特許を受けた該RNA干渉方法、及び物質には、標的遺伝子に相当する配列の少なくとも2コピーを含む、単離されたDNAコンストラクトの使用が必要である。ここで、標的遺伝子の発現は、遅らせる、抑圧される、或いは抑制されるべきものであり、操作上、両コピーは、センス方向で単一のプロモーターに連結される。反対に、Fireの特許の中に出てくる該RNA干渉方法では、任意の二本鎖分子の使用を挙げている。ここで、本質的に、第一のRNA鎖は、該標的遺伝子のヌクレオチド配列に相当するリボヌクレオチド鎖からなり、かつ第2のDNA鎖は、該標的遺伝子のヌクレオチド配列に相補的であり、これらの二本鎖は、ハイブリダイズされ、標的遺伝子の発現抑制する二本鎖RNAを形成する。
【0017】
RNA干渉は、メカニズム的に2工程からなるプロセスである。その第一の工程において、dsRNAはサイレンシング応答を引き起こし、dsRNA は21〜23ヌクレオチドの小さい干渉RNAに切断される。この切断は、ダイサー(Dicer)というRNアーゼIIIファミリーヌクレアーゼファミリーヌクレアーゼにより、遂行される。第二の工程において、siRNAは、標的複合体、RISC(RNA誘導サイレンシング複合体)に取り込まれ、RISCは、その肝要なsiRNAに相同であるmRNAsを破壊する(Silver らの論文、 Trends in Mol. Med. 8 (11): 505-508 (2002))。
【0018】
最近、RNA干渉が、遺伝子機能を調べる有力な手段であり、かつ新規な抗ウイルス治療を開発する可能性があると報告されている(Silver らの論文、同上)。しかしながら、該RNAi経路が保存された生物学的プロセスと認識されているとはいえ、まだ完全に理解されておらず、かつ異なった種においてさまざまな効果を及ぼす。例えば、dsRNA は、一部の原生動物、動物、植物、及び菌類を含む生物体においては、相同RNAの分解を誘導し、転写後の遺伝子サイレンシングをもたらす一方;一部の種では、その代わりに、RNAを介したプロセスが、翻訳抑制、DNAメチル化、ヘテロクロマチンの形成、及びDNA消失をもたらす。場合によっては、効果的なサイレンシングのために、該「引き金」二本鎖RNAの増幅が必須である(Ceruttiらの論文、Trends in Genetics 19 (1) : 39-46 (2003))。
【0019】
今日まで、多くのRNAiの研究は、標的遺伝子の発現レベルにおけるdsRNAの配列特異的効果に焦点を置いてきている。しかしながら、また、dsRNAの投与は、脊椎動物において、全身性(配列非特異的)免疫応答を起こすことが知られている。例えば、Sledz ら(Nature Biol. オンライン先行発表)は、短鎖干渉RNAの投与による、哺乳動物系におけるインターフェロン系の活性化を報告した。具体的に、Sledzら(同上文献)は、ラミン、及びGAPDH遺伝子に特異的な、21ヌクレオチド鎖長のdsRNAを作製し、それがインターフェロンを介したJAK-Stat経路の活性化、及びIFN刺激応答遺伝子の発現増大を誘導したことを報告した(同上文献)。この全身性応答効果は、該dsRNA依存性プロテインキナーゼ(PKR)により介されたと報告されていたが、siRNAにより活性化され、かつsiRNAに応答したIFN-の発現増大に必須である。
【0020】
無脊椎動物の免疫系は、抗細菌、及び抗菌応答との関連でかなり研究されてきているが、ウイルスに対する無脊椎動物の免疫応答に関しては、細胞、又は分子レベルの情報はない。反対に、哺乳動物においては、抗ウイルス、及び抗バクテリアの生得的応答は、部分的に重複するが、最も顕著な抗ウイルス応答を含むインターフェロン系で、相異なる経路を含む。
【0021】
インターフェロン(IFN)が、ウイルス感染、及び他の傷害に応答して発現されるサイトカインファミリーを含み、かつウイルス増殖を制御する無数の細胞、及び全身性応答を調節することはよく知られている(総説としては、Levy らの論文、Cytokine Growth Factor Rev. 12: 143-156 (2001)、及びGoodburnらの論文、J. Gen. Virol. 81 : 2341-2364 (2000) を参照されたい)。IFNを循環させることによる細胞の誘導で、ヤヌスキナーゼ(Janus kinase)/シグナル伝達性転写因子(Signal Transducer and Activator of Transcription)(JAK/STAT) 系のシグナル伝達が何百もの遺伝子の誘導をもたらす(de Veerらの論文、L. Leuc. Proc. Biol. 69: ; 912-20 (2001); Ehrtらの論文、J. Exp. Med. 194: 1123-40 (2001))。IFNにより誘導される遺伝子は、RNA依存性プロテインキナーゼ(PKR)、Mxタンパク質、オリゴアデニル酸合成酵素 (OAS)、及びIFN自身をコードするものを含む。この自己増殖系は、IFNによってだけでなく、ウイルス成分によっても、直接引き起こされ得る。IFN応答の有力な誘導因子は、ウイルス感染中、ウイルスのゲノム複製、及び大規模な二次構造をもつウイルスRNAの結果としてしばしば生じる、二本鎖RNAである分子である(Jacobs らの総説、Virology 219: 339-49 (1996))。 哺乳動物では、dsRNAはTLR3レセプターにより認識され、骨髄分化因子88(Myd88)依存性、及び非依存性シグナル伝達カスケードを活性化し、IFN の発現をもたらす。また、dsRNAは、直接PKRを活性化することにより、細胞内に抗ウイルス応答を誘導し、真核生物翻訳開始因子2a (eIF2a)のリン酸化を介して、細胞、及びウイルスタンパク質合成 の抑制をもたらす(Meurs らの論文、Cell 62: 379-90 (1999) )。dsRNA 誘導型免疫応答が無脊椎動物に存在しないことは、一般に受け入れられており、この結論は、いくつかの完全に配列決定された無脊椎動物のゲノムにおける、IFNに、又はIFN応答の主要エフェクター(例えば、PKR、Mx、OAS)に相同な構造をもつ遺伝子の欠如によって支持されている(Adamsらの論文、Science 287: 2187-95 (2000); C. elegans 配列決定グループの論文、Science 282 : 2012-80 (1998) ; Deholらの論文、Science 298: 2157-2167 (2002);Hot らの論文、Science 298: 129-49 (2002))。
【0022】
最近、dsRNAを介した転写後の遺伝子サイレンシング(PTGS、又はRNAi)の発見で、インビボにおけるdsRNAの生物特性の複雑性が、より理解されてきた。この現象は、植物、及び動物、脊椎動物、及び線虫などの一部の無脊椎動物(Fireらの論文、Nature 391: 806-11 (1998))、及び昆虫類(Misquittaらの論文、Proc. Natl. Acad. Sci. USA 9-0: 451-6 (1999))、及び哺乳動物(Svobodaらの論文、Devel. 127: 4147- 56 (2000))で観察された。このプロセスは、RNアーゼ IIIダイサー(Dicer)により、短鎖干渉RNA(siRNA)として知られている、短い21-25塩基対鎖長の二本鎖に加工されるdsRNAを含む(Burnsteinらの論文、Nature 409: 363-6 (2001))。これらのsiRNAは、相同のmRNAを認識するのに使われ、RNA 誘導型サイレンシング複合体(RISC)に結合したRNアーゼ活性によるその分解を引き起こす(Hammondらの論文、Nature 404: 293-6 (2000); Hammondらの論文、Science 293: 1146-50 (2001))。RNAi は、感染された細胞における、ウイルス遺伝子産物の発現を抑制するために使われた、古代の抗ウイルスメカニズムであると提唱されてきている。それは、ウイルスdsRNAs が、感染の過程でしばしば生じるからである。例えば、植物、及び動物両ウイルスには、該RNAi経路を回避するウイルスのストラテジーが存在する(Li らの論文、Science 296: 1319-21 (2002); Liらの論文、 Proc. Natl. Acad. Sci., USA 101: 1350-5 (2004); 及びSilhavyらの論文、EMBO J., 21 : 3070-80 (2002))。
【0023】
内在性RNA分解をもたらす、dsRNAの配列特異的効果は広範囲に保存されており、おそらく多くの無脊椎動物にも存在するのに対して、長い間、dsRNAによる配列非特異的な、抗ウイルス免疫の誘導は、脊椎動物だけに限定されていると考えられてきた。
かなり予想外に、本発明者らは、非特異的dsRNA(いかなる公知の無脊椎動物の内在性遺伝子とも相同性をもたないdsRNA)の投与が、少なくとも海洋エビ、リトペナエウス バンナメイにおいて、一般的抗ウイルス応答を生じさせることを発見した。これらの結果に基づくと、おそらく、他の甲殻類動物、及び無脊椎動物においても同様であろう。この発明は、無脊椎動物が、真正のウイルス関連分子構造(dsRNA)に応答して、誘導性抗ウイルス免疫を示すことができる、初めての証拠を提供する。該独創的発見は、無脊椎動物の生得的抗ウイルス免疫が、dsRNAにより誘導される免疫応答も含め、いくつかの脊椎動物抗ウイルス応答の分子特性を共有することを示唆する。
【0024】
最近、Timmonsら(Mol. Biol. Of the Cell 13: 2972-2983 (July 2003))は、無脊椎動物系において、dsRNAが全身性の特性も持つ、遺伝子特異的RNA干渉応答を起こすことができること、例えば、dsRNAの送達部位から遠位の細胞において、遺伝子発現のサイレンシングが観察されることを報告した。線虫系において、Timmonsらは(同上文献)、組織特異的プロモーターからdsRNAを転写させる、トランスジェニック型線虫では、広範囲の全身性RNA干渉表現型を示さないことを報告した。さらに、彼らは、無関係なdsRNA分子の外因性送達が、検出可能な、全身性RNAサイレンシング表現型を生じさせたが、fed-1、又はfed-2欠損動物では、摂取されたdsRNAに対する、強い全身性サイレンシング応答は起こせなかったことを報告した。Timmonsら(同上文献)は、これが、細胞への取り込み、及びRNAサイレンシングシグナルの放出のための、複合的、及び/又は組織特異的メカニズムの可能性を提議することを示唆した。
【0025】
本発明の前に、甲殻類の免疫メカニズムは, ほとんど知られていなかった。特に、甲殻類が、いくつかの基本的な体液性、及び細胞性防御メカニズムを有することは知られていた。体液性免疫反応には、血液凝固、フェノール酸化酵素前駆体カスケードの活性化、及びいくつかのバクテリア、又は菌類に対して有効である、抗菌ペプチドの産生、及び放出が含まれる。細胞防御メカニズムは、主として、不溶化、食作用、及び病原体の細胞内殺菌に関与する、循環している血球を含む。甲殻類の食細胞血球は、典型的な呼吸バーストを示し、活性化酸素種の産生をもたらす。また、細胞が数種の効果的な抗菌分子を合成することは知られていた。 特に、ブルークラブ(カリネクテス サピドゥス(Callinectes sapidus))、及び海洋エビ(ペナエウス モノドン(Penaeus monodon))の鰓は、説明できない分子経路を経て、血液から数種の異質タンパク質を取り除く。また、最近、Toll/NFKB経路の推定上の構成要素が、カキ、及びカブトガ二に存在することが報告された。しかしながら、これらの遺伝子の機能は、あるとしても依然として未知であり、かつ証拠欠如のため、特に異種におけるToll/NFKB遺伝子の機能の広がりを考慮すると予測できない。
【0026】
しかしながら、甲殻類動物、又は他の無脊椎動物がdsRNAの配列非特異的免疫応答を引き起こせたと、示唆した研究はなかった。実際に、Lee、及びSoderhallの最近の総説論文(Fish & Shellfish Immunol. 14: 421-437 (2002))では、甲殻類動物の生得的免疫に関して、現在何がわかっているかの詳細な概観を載せているが、dsRNAが関与している示唆は全くない(同上文献)。さらに、Smithらの最近の論文(Fish & Shellfish Immunol. 10: 1-20 (2003))では、抗ウイルス防御手段として、甲殻類動物の免疫刺激の効果を疑問視しており、推定上の免疫刺激の使用による、飼育動物の健康への潜在的危険性を指摘した。同様に、この論文は、甲殻類動物の免疫に関与していると考えられる重要なタンパク質に言及している一方、甲殻類動物がdsRNAに応答できるという示唆を含まない。
実際に、本発明に先立ち、甲殻類動物、及び無脊椎動物種の全身性効果は知られていなかった。さらに、本発明に先立ち、甲殻類動物、特にエビ、及びおそらく他の海洋無脊椎動物が、RNA干渉応答を起こす必須細胞機構を有することは知られていなかった。
【発明の開示】
【発明が解決しようとする課題】
【0027】
甲殻類動物、及び他の無脊椎動物における、dsRNAで誘導された特異的、及び非特異的免疫、及びそこで使用する生物送媒体を提供する。
【課題を解決するための手段】
【0028】
(本発明の目的)
従って、本発明の目的は、無脊椎動物免疫、例えば、甲殻類動物免疫の理解を深めることである。本発明は、その実験項では甲殻類動物、特にエビにおける対象発見を例示するが、その対象方法は、他の無脊椎動物においても有用であることが予想される。特に、甲殻類に近縁関係にある無脊椎動物、例えば、他の海洋無脊椎動物である。例を挙げると、イカ、貝、タコ、ウミウシ、巻き貝などの有殻、又は無殻軟体動物;海綿動物門(カイメン);刺胞動物門(クラゲ、サンゴ、ヒドロ虫)、有櫛動物門(クシクラゲ)、棘皮動物門(ヒトデ、クモヒトデ)、及び海洋ミミズ(marine worm)がある。しかしながら、本発明は、一例として昆虫類、蛛形類、唇脚類、及び多足類を含む、他の無脊椎動物を含む。
【0029】
本発明のもう一つの目的は、無脊椎動物における、遺伝子発現を抑制する、かつ/或いは、全身性免疫応答を誘導する新規方法を提供することである。特に、少なくとも1種の二本鎖RNAの投与による、全身性抗ウイルス免疫、又はバクテリア、菌類、などの無脊椎動物を感染する他の寄生生物に対する免疫である。
【0030】
本発明のさらに具体的な目的は、少なくとも1種の二本鎖RNAの投与により、無脊椎動物、好ましくは、海洋無脊椎動物、さらに好ましくは、エビにおいて、非特異的(全身性)免疫応答を誘導する方法を提供することである。ここで二本鎖RNAは、無脊椎動物を感染する種々の病原体、例えば、ウイルス、バクテリア、菌類、線虫、マイコプラズマ、微胞子虫類、略胞子虫類、グレガリナ類、及びより好ましくは、甲殻類関連ウイルス(crustacean associated viruses)などのウイルスに対する、非特異性(全身性)防御応答を誘導する。
【0031】
また、本発明の目的は、少なくとも1種の長鎖二本鎖RNAの投与により、甲殻類動物、好ましくは、エビにおいて、該甲殻類動物内在性の標的遺伝子、又は該甲殻類動物に感染する病原体に含まれる必須遺伝子の発現を抑制する、配列特異的dsRNAを介した応答を誘導する方法を提供する。ここで、二本鎖RNAは、該配列特異的免疫応答が、ウイルスなどの寄生生物に対する配列特異的防御性をもたらす、該甲殻類動物、又はウイルスなどの病原体に含まれる、標的遺伝子にかなり相当する配列を有する。
【0032】
さらに、本発明の目的は、エビなどの甲殻類動物において、非特異的(全身性)免疫応答、及び標的遺伝子の発現を抑制する、或いは妨げる、配列特異的RNA干渉応答の両方を誘導することである。ここで、標的遺伝子は、甲殻類動物遺伝子、又は病原体必須遺伝子であり、かつ少なくとも1種の二重鎖RNAの投与により、前記全身性免疫応答、及び前記配列特異的dsRNA 応答の組合せは、通常、前記甲殻類動物を感染する病原体、例えば、ウイルス、バクテリア、菌類、線虫、マイコプラズマ、微胞子虫類、略胞子虫類、又はグレガリナ類に対する防御性を与える。ここで、少なくとも1種の前記投与されたdsRNAは、甲殻類動物、又は前記甲殻類動物に感染する病原体に含まれる標的遺伝子に含まれる配列と、かなり相同な、又は同一である配列を含む。例えば、推定上の標的遺伝子は、コントロール、及びウイルス(WSSV、又はTSV)感染エビ組織を用いて作製される、サプレッションサブトラクティブハイブリダイゼーションライブラリーのようなゲノムライブラリー中で、同定することができる。他の潜在的な標的遺伝子の具体例は、VP28、リボヌクレオチド還元酵素、へモシアニン、VP26、VP19、チミジル酸キナーゼ、及びDNA ポリメラーゼなどである。
【0033】
その具体例を挙げると、免疫、成長、生殖、及び健康一般、又は"ロバスト性"に関与するような甲殻類動物遺伝子に相同であるdsRNAを含む。STAT、IKB、及び、NFKB、及び STATシグナル経路の他の推定上の構成要素のような遺伝子も含まれる。また、神経伝達物質、脱皮抑制ホルモン、生殖腺抑制ホルモン、及び甲殻類高血糖ホルモン含む、ホルモン、及び代謝経路をコードする遺伝子も含まれる。また、クラスチン及びペナエイジンなどの、抗菌ペプチド、又は、そのようなペプチドの産生調節因子をコードする遺伝子を含む。場合によっては、dsRNAを使用して、任意の所望される甲殻類動物遺伝子の発現を、減少させることができる。
【0034】
もう一つの好ましい目的は、非特異的dsRNA(例えば、ポリC: G)、及び特異的(特定の遺伝子を標的にする)dsRNAを共投与することにより、RNA干渉の有効性を高めることである。それにより、該非特異的dsRNAは、"アジュバント"として作用し、標的遺伝子の発現における該配列特異的dsRNAの効果を増大させる。
【0035】
好ましい態様において、dsRNAは、甲殻類動物、又は他の海洋無脊椎動物、好ましくはエビに投与される。病原体はエビウイルスであり、例を挙げると、ホワイトスポットシンドロームウイルス、タウラシンドロームウイルス、伝染性皮下造血器壊死ウイルス(IHHNV)、ペナエイドシュリンプのバキュロウイルス(BP)、ペナエイドシュリンプのラブドウイルス(RPS)、鰓関連ウイルス(GAV)、イエローヘッドウイルス(YHV)、リンパ器官関連ウイルス(LOVV);リンパ器官パボ様ウイルス疾患(LPV)、肝膵臓パボウイルス(HPV)、バキュロウイルス中腸腺壊死ウイルス(BMN)、モノドン型バキュロウイルス(MBV)、レオ様ウイルス疾患(REO)、及びラブドウイルス(RPS)、及び新生ウイルスがあり、その必須遺伝子は、当業者に利用可能な任意の手段を通じて、同定され、かつ配列決定され得る。前述のように、ウイルスとは、今までのところ同定されていない、或いは後で、組み換え、突然変異などにより生じたウイルスのことを言う。新生ウイルスは、単離され、(サブトラクティブハイブリダイゼーションを用いるなどして、)野生型エビゲノムとの比較して、同定することができる。
【0036】
また、本発明の目的は、機能ゲノム学を使用して、無脊椎動物免疫、特に海洋無脊椎動物免疫、好ましくは、甲殻類動物(例えば、エビ)免疫応答、成長、生殖、及び健康一般、又は"ロバスト性"に関与するような遺伝子の、推定上のオーソログ、特にエビの免疫応答のSTAT様、及びI-KB キナーゼ様遺伝子などを同定することである。
【0037】
本発明の具体的な目的は、推定上の免疫調節遺伝子の発現を低下させた、又は欠失させた、無脊椎動物細胞、又は動物、好ましくは、甲殻類動物細胞、又は動物を産生し、ウイルス、及び/又は内在性寄生生物に対する防御性をもたらす、遺伝子機能、及びその役割を裏付けることである。
【0038】
本発明のもう一つの目的は、海洋無脊椎動物に、例えば、甲殻類動物免疫、成長、生殖、及び健康一般、又は"ロバスト性"に関与する遺伝子、例えばSTAT様、及びI-KB キナーゼ様遺伝子、を発現増大、又は発現減少させる化合物を同定し、甲殻類の抗ウイルス免疫、及び炎症におけるこれらの遺伝子の役割を確認することである。
【0039】
さらに、本発明のもう一つの目的は、少なくとも1種の二本鎖RNA、又はウイルス感染により起こされる、非特異的(全身性)免疫応答後の誘導後、発現増大、又は発現低下する、特定の無脊椎動物遺伝子、好ましくは、海洋無脊椎動物で、例えば甲殻類動物遺伝子、より好ましくは、エビ遺伝子を同定することである。これらの遺伝子、例えば、STAT様、Toll、NFKB、及び"サイトカイニン様"遺伝子の機能解析は、無脊椎動物の生得的免疫、特に甲殻類免疫のより深い理解を促すであろう。さらに、そのような遺伝子の発現を調整する、化合物の同定が可能になり、従って、無脊椎動物免疫応答を調整するために使用できるであろう。
【0040】
本発明のもう一つの目的は、生物送達媒体、好ましくは、異種dsRNAを発現し、かつ/或いは一般的な免疫応答を生じさせる、少なくとも1種の長鎖dsRNAを発現する、微細藻類、又は酵母菌のような微生物生物送達媒体を作製することである。例えば、ここで、該異種dsRNAは、甲殻類関連ウイルス、バクテリア、微胞子虫類、略胞子虫類、又はグレガリナ類などの、甲殻類動物に感染する病原体の必須遺伝子、又は、免疫、成長、生殖、及び健康一般、又は"ロバスト性"に関与する遺伝子などの、甲殻類内在性遺伝子に特異的である。
【0041】
本発明の具体的な目的は、少なくとも1種のdsRNAを発現し、かつ/或いは一般的な免疫応答を生じさせる、少なくとも1種の長鎖dsRNAを発現する、酵母菌(好ましくは、サッカロミセス属)、又は微細藻類を提供することである。ここで、該dsRNAは、甲殻類関連ウイルス、バクテリア、微胞子虫類、略胞子虫類、又はグレガリナ類などの、甲殻類動物に感染する病原体の必須遺伝子、又は、免疫、成長、生殖、及び健康一般、又は"ロバスト性"に関与する遺伝子などの、甲殻類動物内在性遺伝子に特異的であるものである。発現が、誘導性プロモーターのコントロール下であるものが好ましい。
【0042】
本発明のもう一つの目的は、所望されるdsRNAを、甲殻類動物、又は軟体動物などの海洋無脊椎動物、好ましくは、エビへ送達することであって、エビなどの該甲殻類動物を、該dsRNAを養殖媒体に接触させること、又は該dsRNAを発現する、かつ/或いは一般的な免疫応答を起こす、少なくとも1種の長鎖dsRNAを発現する、少なくとも1種の微生物、好ましくは、酵母菌、又は微細藻類を含む餌料による。ここで、該dsRNAは、甲殻類関連ウイルス、バクテリア、微胞子虫類、略胞子虫類、又はグレガリナ類などの、甲殻類動物に感染する病原体の必須遺伝子、又は、免疫、成長、生殖、及び健康一般、又は"ロバスト性"に関与する遺伝子などの、甲殻類動物内在性遺伝子に特異的であるものである。発現が、誘導プロモーターのコントロール下であるものが好ましい。
【発明を実施するための最良の形態】
【0043】
(本発明の詳細な説明)
本発明をより詳細に記載するに先立ち、下記の定義を与える。その他の点では、全ての用語、及び慣用句は、関係同業者により、解釈されるものとする。
【0044】
本発明は、化合物、特にdsRNA、オリゴヌクレオチド、その改質された誘導体を、標的遺伝子をコードする核酸分子の機能、又は効果を調整するために使用する。これは、具体的に、標的遺伝子をコードする1種以上の核酸分子とハイブリダイズするdsRNA、又は標的遺伝子に相同な領域を含むかどうかわからない、かつ一般的な免疫応答が生じさせられる、長鎖dsRNA(50くらいのヌクレオチド鎖長、好ましくは、100ヌクレオチド鎖長以上)を提供することにより実現される。本明細書中において、"標的核酸"、及び"標的遺伝子をコードする核酸分子"という用語は、便宜上、そのようなDNA から転写された、mRNA前駆体、及びmRNA(又は、その一部)を含める、DNAがコードする核酸、及びまた、そのようなRNAから由来したcDNAも網羅するために使用されている。
【0045】
干渉されるべきDNA の機能は、複製、及び転写を含むことができる。例えば、複製、及び転写は、内在性細胞鋳型、ベクター、プラスミドコントラクト、又はそれ以外の由来であり得る。干渉されるべきRNA の機能は、例を挙げると、該RNA のタンパク質翻訳部位への転位、該RNAのRNA合成部位から離れた細胞内転位、タンパク質の該RNAからの転位、1種以上のRNA種を生じる該RNAのスプライシング、及び該RNAによって展開される、又は円滑になる、該RNAが関与している触媒作用、又は複合体形成などがある。該標的遺伝子の発現調整は、標的核酸機能での干渉の好ましい結果の1つである。本発明の文脈において、"調整"、及び"発現の調整"は、該遺伝子をコードする、DNA、又はRNAのような、核酸分子の量、又はレベルにおける、増加(促進)、又は減少(抑制)のいずれかを意味する。多くの場合、発現調整の好ましい形態は、抑制であり、かつ多くの場合、好ましい標的核酸は、mRNA である。
【0046】
この発明の文脈中、"ハイブリダイゼーション"は、オリゴマー化合物の相補的な鎖間の対合を意味する。本発明において、好ましい対合のメカニズムは、水素結合を含み、オリゴマー化合物の鎖の、相補的なヌクレオシド、又はヌクレオチド塩基(核酸塩基)間の、ワトソンクリック型、フーグステン型、又は逆フーグステン型水素結合を含む。例えば、アデニン、及びチミンは、水素結合の形成を通じて対合する相補的な核酸塩基である。ハイブリダイゼーションは、様々な状況下、例えば、高い、低い、及び緩やかなストリンジェンシー条件で、起こり得る。
【0047】
"低いストリンジェンシー条件"の例は、2種の核酸配列を10% ホルムアルデヒド、5倍濃縮デンハルト溶液、6xSSPE、0.2% SDS溶液中において、42℃でハイブリダイズさせることである。
"緩やかなストリンジェンシー条件"は、ハイブリダイゼーションが50% ホルムアルデヒド、5Xデンハルト溶液、5xSSPE、0.2% SDS溶液中、42℃で起こり、続いて0.2XSSPE、0.2% SDS 中、65℃で洗浄することを意味する。
【0048】
"高いストリンジェンシー条件"は、ハイブリダイゼーションが50% ホルムアルデヒド、5Xデンハルト溶液、5xSSPE、0.2% SDS溶液中、42℃で起こり、続いて0.1XSSPE、0.2% SDS 中、65℃で洗浄することを意味する。
具体的に、dsRNA化合物がハイブリダイズしやすいのは、該化合物の該標的核酸への結合が、該標的核酸の正常機能を干渉し、活性の低下を起こし、かつ、十分な程度の相補性があり、特異的結合が所望される条件下で、アンチセンス化合物の非標的核酸配列への非特異的結合が生じない場合である。上記所望される条件の例を挙げると、インビボ測定、及び治療上の処置の場合の生理的条件、及びインビトロ測定の場合に測定を行う条件がある。
【0049】
"非特異的"、又は"配列非特異的"dsRNAは、それを投与する無脊椎動物のゲノム配列に、又は前記無脊椎動物に感染する寄生生物に対して、有意な公知の配列同一性を有しないdsRNAのことを言う。ここで、無脊椎動物は、甲殻類動物、軟体動物、好ましくはエビなどの海洋無脊椎動物である。例は、ポリC: Gである。好ましくは、該"非特異的"dsRNAは、長鎖、例えば、少なくとも50ヌクレオチド鎖長、より好ましくは、少なくとも200〜500ヌクレオチド鎖長か、それ以上であろう。好ましい態様において、該dsRNAは、甲殻類動物遺伝子、又は甲殻類動物を感染させる寄生生物の必須遺伝子などの、特定な標的遺伝子の発現を標的にする(抑制する)配列特異的dsRNAにより起こされた、RNA干渉応答を促進(増強)する機能をもつであろう。
【0050】
本発明において、"ストリンジェントなハイブリダイゼーション条件"、又は"ストリンジェントな条件"の慣用句は、本発明の化合物が、その標的配列の他に、最少限の他の配列へハイブリダイズするであろう条件のことを言う。ストリンジェントな条件は、配列依存性であり、様々な状況で異なるであろう。この発明の文脈において、オリゴマー化合物が標的配列へハイブリダイズする"ストリンジェントな条件"は、オリゴマー化合物の性質、及び組成、及びそれらが調べられる測定法により決定される。典型的なストリンジェントなハイブリダイゼーション条件は、上記に提供される。
【0051】
本明細書中に使われている"相補的な"は、オリゴマー化合物の2種の核酸塩基間の、正確な対合性のことを言う。例えば、もし、オリゴヌクレオチド(オリゴマー化合物)の特定部位の核酸塩基が、標的核酸の特定位置の核酸塩基と水素結合でき、前記核酸が、DNA、RNA、又はオリゴヌクレオチド分子であるなら、該オリゴヌクレオチドと該標的核酸間の水素結合の位置は、相補的な位置であると考えられる。各分子の十分な数の相補的な位置が、互いに水素結合できる核酸塩基によって占められるとき、該ヌクレオチド、及びさらなるDNA、RNA、又はオリゴヌクレオチド分子は、互いに相補的である。従って、"特にハイブリダイズ可能な"、及び"相補的な"は、オリゴヌクレオチド、及び標的核酸間で、安定した特異的な結合が起こるような、十分な程度の正確な対合性、又は十分な数の核酸塩基の相補性を示唆するのに使用される用語である。
【0052】
本発明によると、dsRNAの配列は、特異的にハイブリダイズ可能な、その標的核酸の配列と100%相補的である必要がないことは、技術的に理解されている。さらに、オリゴヌクレオチドは、介在している、又は隣接した断片が、ハイブリダイゼーション事象に関与していないような、1種以上の断片とハイブリダイズし得る(例えば、ループ構造、又はヘアピン構造)。本発明のdsRNA は、標的核酸の標的領域へ少なくとも70%の配列相補性を含む、より好ましくは、90%の配列相補性を含む、さらにより好ましくは、標的とされる該標的核酸内の該標的領域へ95%の相補性を含むことが好ましい。例えば、dsRNA化合物が、該化合物の20核酸塩基のうち18が標的領域に相補的であり、それゆえ特異的にハイブリダイズする場合は、90%相補性に相当する。この例において、残りの非相補的な核酸塩基は、集合しているか、或いは相補的核酸塩基が組み入れられていてもよく、かつ相互に、又は相補的核酸塩基に隣接している必要はない。同様に、dsRNA化合物が、18核酸塩基鎖長であり、該標的核酸に完全相補性の2つの領域により、側面に位置される4非相補性核酸塩基からなる場合は、総合的に、該標的核酸と77. 8%の相補性をもち、本発明の範囲内にある。日常的に、アンチセンス化合物の、標的核酸の領域とのパーセント相補性は、当技術において公知である、BLAST プログラム(塩基局所アライメント検索ツール)、及びPowerBLASTプログラムを使用して決定することができる(Altschulらの論文、 J. Mol. Biol., 1990, 215, 403-410; Zhang、及びMaddenの論文、Genome Res., 1997, 7, 649- 656)。
【0053】
この発明の文脈において、"オリゴマーの化合物"、又は"オリゴマーの核酸分子"という用語は、複数のモノマー単位を含むポリマー、又はオリゴマーのことを言う。この発明の文脈において、"オリゴヌクレオチド"という用語は、リボ核酸(RNA)、又は核酸(DNA)、又はその模倣物、キメラ、アナログ、及びホモログの、オリゴマー、又はポリマーのことを言う。この用語は、天然に存在する核酸塩基、糖類、及びヌクレオシド内(骨格)共有結合から成るオリゴヌクレオチドと同様、機能は同様であるが、天然に存在しない部分からなるオリゴヌクレオチドも含む。多くの場合、そのような改質された、又は置換されたオリゴヌクレオチドは、所望される特性のため、天然型より好まれる。そのような特性の例を挙げると、増強された細胞取り込み、増強された標的核酸への親和性、及び高められたヌクレアーゼの存在での安定性である。
【0054】
dsRNAオリゴヌクレオチドが、この発明の化合物の好ましい形態であるが、本発明は、下記記載のように、オリゴヌクレオチドアナログ、及びその模倣改良物を網羅する。
この発明の文脈において、dsRNA化合物が特定の核酸分子を"標的にすること"は,多工程プロセスであり得る。通常、該工程は、その機能が調整されるべき標的核酸の同定から始まる。この標的核酸の例を挙げると、発現が特定の障害、又は疾患に関連している、細胞性遺伝子(又は、該遺伝子から転写されたmRNA)、又は好ましくは、感染性因子(例えば、ウイルス)由来の核酸分子があり得る。
【0055】
また、通常、標的工程は、発現の調整などの、所望の効果がもたらされるようなことが起こる、結合相互作用のための標的核酸内の、少なくとも1種の標的領域、断片、又は部位の決定を含む。本発明の文脈内で、"領域"という用語は、少なくとも1種の同定可能な構造、機能、又は特性からなる標的核酸の一部分と定義される。断片は、標的核酸の領域内にある。"断片"は、標的核酸内の、より小さい、又は部分的な領域と定義される。本明細書中で使われる"部位"は、標的核酸内の位置として定義される。
【0056】
当技術分野で公知のように、典型的に、翻訳開始コドンは、5'-AUG (転写されたmRNA分子において;該相当するDNA分子においては5'-ATG)であるので、該翻訳開始コドンは、また"AUG コドン"、該"開始コドン"、又は"AUG 開始コドン"と言われる。少数の遺伝子は、5'-GUG、5'-WG、5'- CUGの RNA 配列からなる、翻訳開始コドンを持ち、かつ5'-AUA、5'-ACG 、及び5'-CUG はインビボで機能することが示されている。従って、一般的に、どの場合でも開始アミノ酸は、メチオニン(真核生物の場合)、又はホルミルメチオニン(原核生物の場合)であるにしても、"翻訳開始コドン"、又は"開始コドン"の用語は、多くのコドン配列を網羅することができる。また、真核、及び原核動物遺伝子が、2種以上の代わりに使える開始コドンを持つことができ、そのうちのいずれかが、特定の細胞型、又は組織における、又は特定な条件下の翻訳開始に選択的に使用され得ることは、当技術分野において知られている。本発明の文脈において、"開始コドン"、及び"翻訳開始コドン"は、そのようなコドンの配列にかかわらず、インビボで使用され、遺伝子から転写されたmRNA の翻訳を開始するコドン、または複数のコドンのことを言う。また、遺伝子の翻訳終止コドン(又は、"終止コドン")は、3種の配列、すなわち5'-UAA、5'-UAG、及び5'-UGA(その相当するDNA配列は、各々、5'-TAA、5'-TAG、及び5'-TGAである)のうち1種をもち得ることは、当技術分野において知られている。
【0057】
"開始コドン領域"、及び"翻訳開始コドン領域"の用語は、翻訳開始コドンからいずれかの方向(5'、又は3')に、約25から約50の隣接したヌクレオチドを網羅するような、mRMA、又は遺伝子の一部分のことを言う。同様に、"終止コドン領域"、及び"翻訳終止コドン領域"は、翻訳終止コドンからいずれかの方向(5'、又は3')に、約25から約50の隣接したヌクレオチドを網羅するような、mRMA、又は遺伝子の一部分のことを言う。従って、"開始コドン領域"(又は、"翻訳開始コドン領域")、及び"終止コドン領域"("翻訳終止コドン領域")は、本発明のアンチセンス化合物で効果的に標的され得る、全ての領域である。
【0058】
当技術分野においてよく知られているタンパク質コード領域(ORF)、又は"コード領域"は、翻訳開始コドン、及び翻訳終止コドン間の領域のことを言うことが、また、効果的に標的にされる領域である。本発明の文脈中で、好ましい領域は、遺伝子のタンパク質コード領域(ORF)の翻訳開始、又は終止コドンを網羅する、該遺伝子内領域である。
【0059】
他の標的領域は、当技術分野においてよく知られている5'非翻訳領域(5'UTR)は、翻訳開始コドンから5'方向のmRNAの部分のことを言い、従って、mRNA(又は、該遺伝子の相当するヌクレオチド)の該5'キャップ部位、及び該翻訳開始コドン間のヌクレオチドを含んでいる領域、及び3'非翻訳領域(3'UTR)という、当技術分野において公知であり、翻訳終止コドンから3'方向のmRNAの一部分のことを言い、かつ従って、mRNA(又は、該遺伝子の相当するヌクレオチド)の翻訳終止コドン、及び3'末端間のヌクレオチドを含んでいる領域、である。mRNA の5'キャップ部位は、5'の大部分の残基に5'-5'リン酸結合によって結合する、N7メチル化型グアニン残基を含む。mRNA の該5'キャップ領域は、5'構造自体と同様、該キャップ部位に隣接した最初の50 ヌクレオチドが含まれると考えられている。また、5'キャップ領域を標的にすることは好ましい。
【0060】
数種の真核生物のmRNA 転写産物は、直接翻訳されるが、多くは、1種以上の"イントロン"として知られている領域を含み、それは、翻訳される前に、転写産物から切り取られる。その残りの(かつ、その後翻訳される)領域は、"エクソン"として知られており、共に接合され、連続的なmRNA 配列を形成する。また、スプライス部位、すなわち、イントロン‐エクソン接合部、又はエクソン‐イントロン接合部を標的にすることは、疾患に異常なスプライシングが関与している、又は疾患に特定のスプライス産物の過剰産生が関与している状況において、特に有用であり得る。また、転位、又は欠失による異常な融合接合部は、好ましい標的部位である。異なった遺伝子源から、2種(又はそれ以上)のmRNAのスプライシングプロセスを経て、産生されるmRNA転写産物は、"融合転写産物"として知られている。また、イントロンが、例えば、DNA、又はmRNA前駆体を標的にする、アンチセンス化合物を使用して、効果的に標的にされることが知られている。
【0061】
また、当技術分野において、代わりになるRNA転写産物が、DNAの同一ゲノム領域から産生され得ることが知られている。一般に、これらの代わりになる転写産物は、"変異体"として知られている。より具体的には、"mRNA 前駆体変異体"は、該同一ゲノムDNA から産生した転写産物であり、該同一ゲノムDNA から産生した他の転写産物と、その開始、又は終止位置のいずれかが異なり、かつイントロン、及びエクソン両方の配列を含む。
【0062】
スプライシング中の、1種以上のエクソン、又はイントロン領域、又はその一部分の切り出しにあたり、mRNA前駆体変異体は、より小さい"mRNA変異体"を産生する。従って、mRNA変異体は、mRNA前駆体変異体から処理され、かつ各々の独特なmRNAは、スプライシングの結果として、常に独特なmRNA変異体を産生せざるを得ない。また、これらのmRNA変異体は、代替スプライス変異体(alternative splice variants)として知られている。mRNA前駆体変異体のスプライシングが起きない場合は、該mRNA前駆体変異体は、mRNA変異体と同一である。
【0063】
また、変異体が、転写開始する、又は終止する、代わりになるシグナルを通じて産生され得ること、及びmRNA前駆体、又はmRNAが1種以上の開始コドン、又は終止コドンを有し得ることは、当技術分野において知られている。代わりになる開始コドンを使用する、mRNA前駆体、又はmRNAから由来する変異体は、"代替開始変異体(alternative start variants)"として知られている。代わりになる終止コドンを使用するそのような転写産物は、RNA前駆体、又はmRNAの"代替終止変異体(alternative stop variants)"として知られている。代替終止変異体の具体的な型の1種は、産生された複数の転写産物が、転写機能による"ポリA終止シグナル"の1つである、代わりになる選択に由来する"ポリA変異体"であり、従って、独特のポリA部位で終止される転写産物が産生される。また、本発明の文脈において、本明細書中に記載される変異体の型は、好ましい標的核酸である。
【0064】
該好ましいアンチセンス化合物がハイブリダイズする、標的核酸上の位置は、本明細書中、以下"好ましい標的断片"と呼ばれる。本明細書中において、"好ましい標的断片"の用語は、dsRNA化合物に標的とされる、標的領域の少なくとも8核酸塩基部分と定義される。理論によってとらわれることを望んでいるわけではないが、現在、これらの標的断片は、ハイブリダイゼーションに利用しやすい、該標的核酸の一部分を意味する。
【0065】
数種の好ましい標的断片の特異的配列は、本明細書中に示されるが、当業者は、これらが、本発明の範囲内の特定の態様を例証し、かつ記載するのに役立つこと認識。さらなる好ましい標的断片は、当業者により同定され得る。
【0066】
該例示の好ましい標的断片内から選択される、少なくとも隣接した8核酸塩基の伸張を含む、8〜80核酸塩基鎖長の標的断片は、同様に標的に適していると考えられる。標的断片は、該例示の好ましい標的断片の1種の5'末端から、少なくとも該隣接した8核酸塩基を含む、DNA、又はRNA配列を含み得る(その残りの核酸塩基は、該同一のDNA、又はRNAの隣接した伸張であって、該標的断片の5'末端のすぐ上流から始まり、該DNA,又はRNAが、約8から約80核酸塩基を含むまで連続する)。同様に、好ましい標的断片は、該例示の好ましい標的断片の1種の3'末端から、少なくとも該隣接した8核酸塩基を含む、DNA、又はRNA配列により示される(その残りの核酸塩基は、該同一のDNA、又はRNAの隣接した伸張であって、該標的断片の3'末端のすぐ下流から始まり、該DNA,又はRNAが、約8から約80核酸塩基を含むまで連続する)。本明細書中に記載された、該好ましい標的断片を提供された当業者は、不要な実験をすることなく、さらなる好ましい標的断片を同定できる。
【0067】
本発明の該二本鎖RNA 化合物は化学修飾の対象になる得る(Fireらの論文、Nature, 1998,391, 806-811;Timmons、及びFireの論文、Nature 1998,395, 854;Timmonsらの論文、Gene, 2001, 263,103-112;Tabaraらの論文、Science, 1998, 282, 430-431;Montgomeryらの論文、Proc. Natl. Acad. Sci. USA, 1998, 95, 15502-15507;Tuschl らの論文、Genes Dev., 1999,13, 3191-3197;Elbashirらの論文、Nature, 2001,411, 494-498;Elbashirらの論文、Genes Dev. 2001,15, 188-200)。当技術分野において公知のように、ヌクレオシドは塩基‐糖類の組合せである。通常、ヌクレオシドの塩基部分は、複素環塩基である。そのような複素環の、最も一般的な2種の分類は、プリン類、及びピリミジン類である。ヌクレオチドは、さらに、ヌクレオシドの糖類部分に共有結合されるリン酸基を含む、ヌクレオシドである。ペントフラノシル糖を含むヌクレオシドには、該リン酸基は、該糖の2'、3'、又は5'のいずれかに結合され得る。オリゴヌクレオチドの形成において、該リン酸基は、お互いに隣接したヌクレオシドに共有結合し、直線状ポリマーの化合物を形成する。順々に、さらに、この直線状ポリマーの化合物の各々の末端が結合され、環状化合物を形成することができる。しかしながら、一般的に、直線上化合物が好ましい。さらに、直線状化合物は、内在的な相補性を持つことができ、従って、完全に、又は部分的に二本鎖化合物を産生する方法で折り重なることができる。オリゴヌクレオチド内では、一般に、該リン酸基は、オリゴヌクレオチドのヌクレオシド内骨格を形成すると言われている。RNA、及びDNAの骨格の通常の結合は、3'から5'へのリン酸エステル結合である。
【0068】
この発明に有用である、改質dsRNA化合物の具体例は、改質された骨格、又は非天然ヌクレオシド内結合を含む、オリゴヌクレオチドを含む。この明細書で定義されたように、改質した骨格を持つオリゴヌクレオチドは、該骨格内にリン原子を保持するもの、及び該骨格内にリン原子を持たないものを含む。この明細書の目的で、かつ時々当技術分野で引用されるように、また、そのヌクレオシド骨格にリン原子を持たないオリゴヌクレオチドは、オリゴヌクレオシドとして考えられ得る。
【0069】
リン原子をその中に含む、改質されたオリゴヌクレオチド骨格の、好ましい例を挙げると、チオリン酸、キラルチオリン酸、ジチオリン酸、リン酸トリエステル、アミノアルキルリン酸トリエステル、例えば、3'-アルキレンホスホン酸メチル、5'-アルキレンホスホン酸メチル、及びキラルホスホン酸などのメチル、及び他のアルキルホスホン酸、ホスフィン酸、例えば、3'-アミノホスホルアミド酸、及びアミノアルキルホスホルアミド酸、などのホスホルアミド酸、チノホスホルアミド酸、チノアルキルホスホン酸、チノアルキルリン酸トリエステル、セレノリン酸、及びボラノリン酸であって、正常な3'-5'結合、これらの2'-5'結合アナログを持つもの、及び1種以上のインターヌクレオチド結合が、3'-3'、5'-5'、又は2'-2'結合である逆極性を持つものがある。好ましい、逆極性をもつオリゴヌクレオチドは、3'-の多くのインターヌクレオチド結合で、単一の3'-3'結合、すなわち、単一の反転されたヌクレオチドを持ち、脱塩基性であり得る(該核酸塩基は欠失しているか、或いはその場所に水酸基をもつ)。また、多様な塩、混合塩、及び遊離酸が含まれる。
【0070】
上記リン含有結合の調製を教示する、典型的な米国特許は、下記の文献を含むが、これらに限定されない。米国特許第3,687,808号;第4,469,863号;第4,476,301号;第5,023,243号;第5,177,196号;第5,188,897号;第5,264,423号;第5,276,019号;第5,278,302号;第5,286,717号;第5,321,131号;第5,399,676号;第5,405,939号;第5,453,496号;第5,455,233号;第5,466,677号;第5,476,925号;第5,519,126号;第5,536,821号;第5,541,306号;第5,550,111号;第5,563,253号;第5,571,799号;第5,587,361号;第5,194,599号;第5,565,555号;第5,527,899号;第5,721,218号;第5,672,697号、及び第5,625,050号であり、その各々は、引用により、本明細書に取り込まれる。
【0071】
リン原子を含まない、改質された、オリゴヌクレオチドの骨格の例を挙げると、短鎖アルキル、又はシクロアルキルインターヌクレオチド結合、混合されたヘテロ原子、及びアルキル、又はシクロアルキルインターヌクレオチド結合、又は1種以上の短鎖へテロ原子、又は複素環インターヌクレオチド結合により形成される骨格がある。これらは、モルフォリノ結合(ヌクレオシドの糖類部分の部分的に形成される);シロキサン骨格、スルフィド、スルホキシド、及びスルホン骨格; ホルムアセチル、及びチオホルムアセチル骨格;メチレンホルムアセチル、及びチオホルムアセチル骨格;リボアセチル骨格;アルケン含有骨格; スルファミン酸骨格;メチレンイミノ、及びメチレンヒドラジノ骨格; スルホン酸、及びスルホンアミド骨格;アミド骨格;及び混合したN、O、S及びCH2構成要素をもつ他のものを含む。
【0072】
上記オリゴヌクレオシドの調製を教示する、典型的な米国特許は、下記の文献を含むが、これらに限定されない。米国特許第5,034,506号;第5,166,315号;第5,185,444号;第5,214,134号;第5,216,141号;第5,235,033号;第5,264,562号;第5,264,564号;第5,405,938号;第5,434,257号;第5,466,677号;第5,470,967号;第5,489,677号;第5,541,307号;第5,561,225号;第5,596,086号;第5,602,240号;第5,610,289号;第5,602,240号;第5,608,046号;第5,610,289号;第5,618,704号;第5,623,070号;第5,663,312号;第5,633,360号;第5,677,437号;第5,792,608号;第5,646,269号、及び第5,677,439,であり、その各々は、引用により、本明細書に取り込まれる。
【0073】
その他にも、いくつかのヌクレオチド単位の、糖類とインターヌクレオチド結合(すなわち、骨格)の両方が新規の基に置換される、オリゴヌクレオチド模倣物がある。核酸塩基単位は、適切な標的核酸とのハイブリダイゼーションのために保存される。そのような化合物の1種で、優れたハイブリダイゼーション特性をもつことが示されているオリゴヌクレオチドは、ペプチド核酸(PNA)と言われる。PNA化合物では、オリゴヌクレオチドの糖骨格が、アミド含有骨格に、具体的には、アミノエチレングリシン骨格に置換されている。該核酸塩基は、保持され、かつ該骨格のアミド部分のアザ窒素原子に、直接的に、又は間接的に結合される。PNA化合物の調製を教示する、典型的な米国特許は、下記の文献を含むが、これらに限定されない。米国特許第5,539,082号;第5,714,331号、及び第5,719,262号であり、その各々は、引用により、本明細書に取り込まれる。さらなるPNA の教示される内容は、Nielsenらの論文(Science, 1991,254, 1497-1500)に見い出される。
【0074】
例えば、本発明によると、dsRNAは、チオリン酸骨格にもつオリゴヌクレオチド、及びヘテロ原子骨格をもつオリゴヌクレオシドを含むことができる。具体的には、--CH2--NH--O--CH2--、--CH2--N (CH3)--O--CH2-- [メチレン(メチルイミノ)、又はMMI骨格として公知]、--CH2--O-- N (CH2)--CH. 置換. 2-、-CH2-N (CH3)-N (CH3)-CH2-、及び上記の米国特許第5,489,677号の-0-N (CH3)-CH2- CH2-- [この中で、その本来のリン酸ジエステル骨格は、--O--P--O-- CH2-と示される]、上記米国特許第5,602,240号のアミド骨格、及び米国特許第5,034,506号において開示されている、モルフォリノ骨格をもつオリゴヌクレオチドがある。
【0075】
さらに、また、本発明によると、改質したオリゴヌクレオチドは、1種以上の置換された糖部分を含むことができる。例を挙げると、オリゴヌクレオチドは、その2'位に、下記の1つを含むことができる:OH;F; 0-、S-、又はN-アルキル; O-、S-、又はN-アルケニル; O-、S-、又はN-アルキニル;又はO-アルキル-O-アルキル、その中で、該アルキル、アルケニル、及びアルキニルは、置換され得る、又は非置換であり得る、Cl〜C10アルキル、又は C2〜C10アルケニル、及びアルキニルであり、さらに具体的には、O [(CH2) nO] mCH3 O (CH2) nOCH3、O (CH2) nNH2, O (CH2) nCH3、 O (CH2) nONH2、及びO (CH2) nON [ (CH2) nCH3] 2であり、式中n、及びmは1〜約10である。さらに、好ましいオリゴヌクレオチドは、該2'位に、下記の1つを含む:Cl〜C10の低級アルキル、置換された低級アルキル、アルケニル、アルキニル、アルカリール、アラルキル、0-アルカリール、0-アラルキル、SH、SCH3、OCN、Cl、Br、CN, CF3 OCF3 SOCH3 S02CH3 ON02 N02 N3 NH2 ヘテロシクロアルキル、ヘテロシクロアルカリール、アミノアルキルアミノ、ポリアルキルアミノ、置換されたシリル、RNA切断基、リポーター基、インターカラター(intercalator)基、オリゴヌクレオチドの薬物動態学的特性を改良するための基、オリゴヌクレオチドの薬効学的特性を改良するための基、及び同様の特性をもつ他の置換基である。
【0076】
他の可能な改質は、2'-メトキシ(2'-O--CH3)、2'- アミノプロポキシ(2'-OCH2CH2CH2NH2)、2'-アリル(2'-CH2-CH=CH2)、2'-O-アリル(2'- O--CH2-CH=CH2)、及び2'-フルオロ(2'-F)である。該2'改質は、アラビノの(上の)位置、又はリボ(下の)位置にあり得る。また、同様の改変は、該オリゴヌクレオチドの他の位置、特に、3'末端ヌクレオチド上、又は2'-5'結合しているヌクレオチドにおける、糖類の3'位置、及び5'末端ヌクレオチドの5'位置に施され得る。また、オリゴヌクレオチドは、ペントフラノシル糖の代わりにシクロブチルのような糖模倣物をもつ。そのような改質された糖構造の調製を教示する、典型的な米国特許は、下記の文献を含むが、これらに限定されない。米国特許第4, 981,957号;第5,118,800号;第5,319,080号;第5,359,044号;第5,393,878号;第5,446,137号;第5,466, 786号;第5,514,785号;第5,519,134号;第5,567,811号;第5,576,427号;第5,591,722号;第5,597,909号;第5,610,300号;第5,627,053号;第5,639,873号;第5,646,265号;第5,658,873号;第5,670,633号;第5,792,747号;及び第5,700,920号であり、その各々は、引用により、その全体が本明細書に取り込まれる。
【0077】
もう一つの該糖類の可能な改良は、ロックト核酸(Locked Nucleic Acid)(LNA)を含み、その中で2'水酸基が、該糖環の3'、又は4'炭素原子と結合されて、それにより、二環性糖部分を形成する。好ましくは、該結合は、2'酸素原子、及び4' 炭素原子を架橋する、メチレン(--CH2) nグループであり、式中nは1、又は2である。LNA、及びその調製は、国際公開第98/39352号、及び国際公開第99/14226号に記載されている。
【0078】
また、オリゴヌクレオチドは、核酸塩基(多くの場合、当技術分野において、単に"塩基"と言われる)の改質、又は置換を含む。本明細書中では、"改質されていない"、又は"天然の"核酸塩基は、プリン塩基のアデニン(A)、及びグアニン(G)、及びピリミジン塩基のチミン(T)、シトシン(C)、ウラシル(U)を含む。 改質された核酸塩基は、他の合成、及び天然の核酸塩基を含む。例を挙げると、5-メチルシトシン (5-me-C)、5-ヒドロキシメチルシトシン、キサンチン、ヒポキサンチン、2- アミノ-アデニン、アデニン、及びグアニンの6-メチル、及び他のアルキル誘導体、アデニン、及びグアニンの2-プロピル、及び他のアルキル誘導体、2-チオウラシル、2- チオチミン、及び2-チオシトシン、5-ハロウラシル、及びシトシン、5-プロピニル(--C-C- CH3)ウラシル、及びシトシン、及びピリミジン塩基の他のアルキニル誘導体、6-アゾウラシル、シトシン、及びチミン、5-ウラシル(擬似ウラシル)、4-チオウラシル、 8-ハロ、8-アミノ、8-チオール、8-チオアルキル、8-ヒドロキシ、及び他の8-置換アデニン、及びグアニン、5-ハロ、特に5-ブロモ、5-トリフルオロメチル、及び他の5-置換ウラシル、及びシトシン、7-メチルグアニン、7-メチルアデニン、2-F-アデニン、2-アミノ-アデニン、8-アザグアニン、及び 8-アザアデニン、7-デアザグアニン、及び7-デアザアデニン、及び3-デアザグアニン、及び3-デアザアデニンがある。さらなる改質された核酸塩基は、三環性ピリミジンを含む。例を挙げると、フェノキサジンシチジン(lH- ピリミド [5, 4-b] [1, 4] ベンゾキサジン-2 (3H) オン)、フェノチアジンシチジン(1H- ピリミド [5,4-b] [1, 4] ベンゾチアジン- 2 (3H) オン)、置換されたフェノキサジンシチジン(例えば、9- (2-アミノエトキシ)-H-ピリミド [5, 4-b] [1, 4] ベンゾキサジン-2 (3H) オン)、カルバゾールシチジン(2H-ピリミド [4, 5-b] インドール-2-オン)、ピリドインドールシチジン(H-ピリド[3', 2' : 4,5] ピロロ [2,3-d] ピリミジン-2-オン)がある。また、改質された核酸塩基は、該プリン、又はピリミジン塩基が他の複素環に置換されるものを含む。例を挙げると、7-デアザアデニン、7-デアザグアノシン、2-アミノピリジン、及び2-ピリドである。さらなる核酸塩基は、下記に記載されているものを含む。米国特許第3,687,808号に開示されているもの、Kroschwitz, J. I.編集"ポリマー科学、及び工学のコンサイス百科事典"(The Concise Encyclopedia Of Polymer Science And Engineering、John Wiley & Sons社、1990年)858〜859ページに開示されているもの、Englischらの論文(Angewandte Chemie, International Edition, 1991,30, 613)により開示されているもの、"アンチセンス研究、及び適用"(Antisense Research and Applications、Crooke, S. T.、及びLebleu, B編集、CRC Press社、1993年)中のSanghvi, Y. S.の第15章(289〜302ページ)により開示されているものが挙げられる。特に、これらの核酸の特定の種は、本発明の該化合物の結合親和性を増大させるのに有用である。これらは、5-置換されたピリミジン、6-アザピリミジン、及び例えば2-アミノプロピルアデニン、5-プロピニルウラシル、及び5-プロピニルシトシンを含む、N-2、N-6、及び0-6置換されたプリンである。5-メチルシトシン置換は、0.6から1.2℃の差で核酸二本鎖の安定性を増大することが示されており、かつ現在、好ましい塩基置換である。特に2'-O-メトキシエチルの糖の改質と組合せると、さらに好ましい。
【0079】
上記記載の、改質された核酸塩基の特定の種と同様、他の改質された核酸塩基の調製を教示する、典型的な米国特許は、下記の文献を含むが、これらに限定されない。該上記記載の米国特許第3,687,808号と同様、米国特許第4,845,205号;第5,130,302号;第5,134,066号;第5,175,273号;第5,367,066号;第5,432,272号;第5,457,187号;第5,459,255号;第5,484,908号;第5,502,177号;第5,525,711号;第5,552,540号;第5,587,469号;第5,594,121号;第5,596,091号;第5,614,617号;第5,645,985号;第5,830,653号;第5,763,588号;第6,005,096号;及び第5,681,941号であり、その各々は、引用により、本明細書に取り込まれる。
【0080】
さらに、本発明の該オリゴヌクレオチドは、該オリゴヌクレオチドの活性、細胞局在、又は細胞の取り込みを増大させる、1種以上の部分、又は共役体と化学的に結合し得る。これらの部分、又は共役体は、例えば、第一級、又は第二級ヒドロキシル基などの官能基に共有結合している、共役体基を含むことができる。本発明の共役体基は、インターカラター、リポーター分子、ポリアミン、ポリアミド、ポリエチレングリコール、ポリエーテル、オリゴマーの薬効学的特性を高める基、及びオリゴマーの薬物動態学的特性を高める基を含む。典型的な共役体基は、コレステロール、脂質、リン脂質、ビオチン、フェナジン、葉酸、フェナントリジン、アントラキノン、アクリジン、フルオレセイン、ローダミン、クマリン、及び色素である。本発明の文脈において、薬効学的特性を高める基を挙げると、取り込みを改良する、分解に対する耐性を高める、かつ/或いは該標的核酸との配列特異的ハイブリダイゼーションを高める基がある。本発明の文脈において、薬物動態学的特性を高める基は、本発明の該化合物の取り込み、分布、代謝,又は排出を改良する基である。典型的な共役体基は、1992年10月23日に出願された、国際特許出願PCT/US92/09196、及び米国特許第6,287,860号に開示されており、その開示全体が、引用により、本明細書に取り込まれる。共役体部分は下記の部分を含むが、これらに限定されない。 コレステロール部分などの脂質部分、コール酸、例えばヘキシル-S-トリチルチオールなどのチオエーテル、チオコレステロール、例えばドデカンジオール、又はウンデシル残基などの脂肪族鎖、例えばジヘキサデシル-rac-グリセロール、又は1,2-ジ-O-ヘキサデシル-rac-グリセロ-3-H-ホスホン酸トリエチルアンモニウム塩などのリン脂質、ポリアミン、又はポリエチレングリコール鎖、又はアダマンタン酢酸、パルミチル部分、又はオクタデシルアミン、又はヘキシルアミノ-カルボニル-オキシコレステロール部分である。
【0081】
また、本発明の該dsRNA化合物は、取り込み、分布、及び/又は、吸収を助けるために、混合、カプセル封入、共役、或いはそうでなければ、他の分子、分子構造、又は化合物混合物に関連させることができる。例を挙げると、リポソーム、レセプター標的分子、経口、直腸、局所、又は他の製剤である。そのような取り込み、分布、及び/又は吸収を助ける製剤の調整を教示する、典型的な米国特許は、下記の文献を含むが、これらに限定されない。米国特許第5,108,921号;第5,354,844号;第5,416,016号;第5,459,127号;第5,521,291号;第5,543,158号;第5,547,932号;第5,583,020号;第5,591,721号;第4,426,330号;第4,534,899号;第5,013,556号;第5,108,921号;第5,213,804号;第5,227,170号;第5,264,221号;第5,356,633号;第5,395,619号;第5,416,016号;第5,417,978号;第5,462,854号;第5,469,854号;第5,512,295号;第5,527,528号;第5,534,259号;第5,543,152号;第5,556,948号;第5,530,575号;及び第5,595,756号であり、その各々は、引用により、本明細書に取り込まれる。
【0082】
さらに、本発明の該化合物は、任意の生物として許容される塩、エステル、又はそのようなエステルの塩、又は無脊椎動物への投与時に、(直接、又は間接的に)生物活性代謝物、又はその残留物を提供できる他の化合物を含む。
"生物として許容される塩"という用語は、本発明の該化合物の生理的に、かつ医薬として許容される塩のことを言う:すなわち、該親化合物の所望される生物活性を保持し、それに所望しない毒性効果を与えない塩である。
【0083】
また、本発明は、本発明の該dsRNA化合物を含む、生物組成物、及び製剤を含む。本発明の医薬組成物は、所望されるのが、局所、又は全身処置かどうか、及び処置される部位によって、様々な方法で投与され得る。投与は、局所、経口、又は非経口であり得る。非経口投与は、注入、又は浸漬を含む。
本発明の文脈において、"共投与"は、2種の異なる化合物、好ましくは、dsRNAの、個別、又は組合せての、いずれかの順での投与を意味する。好ましくは、そのようなdsRNAが、下記記載の生物送達媒体に含まれる。
【0084】
本発明のdsRNA製剤は、溶液、乳濁液、泡、及びリポソーム含有製剤を含むが、それらに限定されない。本発明の医薬組成物、及び製剤は、1種以上の浸透エンハンサー、担体、賦形剤、又は他の活性、又は不活性成分を含むことができる。
一般的に、エマルジョンは、一方の液体が他方に、通常直径0.1 μmを超える液滴状に分散している、不均一系である。乳濁液は、該分散相に加えて、さらなる成分を含むことができ、活性薬物は溶液として、該水相、油相、又はそれ自身が別の相として存在し得る。マイクロエマルジョンは、本発明の態様として含まれる。エマルジョン、及びその使用は、当技術分野において十分知られている。さらに、米国特許第6,287,860号に記載されており、その全体が本明細書に取り込まれる。
【0085】
本発明の製剤は、リポソーム製剤を含む。本明細書で使用する、"リポソーム"の用語は、球状二重層、又は二重層膜に両親媒性脂質を配置させた、小胞を意味する。リポソームは、単層、又は多重小胞であり、脂肪親和性材から形成される膜、及び送達されるべき該組成物を含む、水性内容物をもつ。カチオン性リボソームは、正に帯電されており、負に帯電されている核酸分子と相互作用し、安定な複合体を形成すると考えられている。pH依存性の、又は負に荷電されたリポソームは、核酸分子と複合体を作るより、むしろ核酸分子を封入すると考えられる。カチオン性、及び非カチオン性の両リポソームが、細胞に核酸を送達するのに使用されている。
【0086】
また、リポソームは、"立体的に安定化した"リポソームを含む。本明細書中で使用する、その用語は、1種以上の特殊化された脂質を含み、リポソームに組み入れられるときに、そのような特殊化された脂質が欠けているリポソームに比べて、長い循環寿命もたらす。立体的に安定化したリポソームの例は、該リポソームの小胞形成脂質部分の一部が、1種以上の糖脂質を含む、或いは、ポリエチレングリコール(PEG)部分などの、1種以上の親水性ポリマーで誘導体化されるものである。さらに、リポソーム、及びその使用は、米国特許第6,287,860号に記載されており、その全体が本明細書に取り込まれる。
【0087】
また、本発明の製剤、及び組成物は、界面活性剤を含むことができる。薬物製品、製剤、及びエマルジョンにおける、界面活性剤の使用は、当技術分野においてよく知られている。さらに、界面活性剤、及びその使用は、米国特許第6,287,860号に記載されており、その全体が本明細書に取り込まれる。
【0088】
本発明の該dsRNA製剤は、様々な浸透エンハンサーの使用を講じ、核酸、特にオリゴヌクレオチドの効率的な送達をもたらし得る。また、浸透エンハンサーは、非親油性薬物の細胞膜にわたっての拡散を補助に加えて、親油性薬物の浸透性も増強する。浸透エンハンサーは、5つの広いカテゴリーの1つに属しているものとして分類できる。すなわち、界面活性剤、脂肪酸、胆汁塩、キレート剤、及び、キレートしない非界面活性剤である。さらに、浸透エンハンサー、及びその使用は、米国特許第6,287,860号に記載されており、その全体が本明細書に取り込まれる。
当業者は、製剤が、通常、その目的とされる使用、すなわち投与経路に応じて、設計されることを認識するであろう。
【0089】
好ましい局所投与製剤は、本発明の該オリゴヌクレオチドが、脂質、リポソーム、脂肪酸、脂肪酸エステル、ステロイド、キレート剤、及び界面活性剤などの局所送達剤と混合物に存在するようなものを含む。好ましい脂質、及びリポソームは、中性(例えば、ジオレオイルホスファチジルエタノールアミン(DOPE)、ジミリストイルホスファチジルコリン(DMPC)、ジステアロイルホスファチジルコリン)、陰性(例えば、ジミリストイルホスファチジルグリセロール(DMPG))、及びカチオン性(例えば、ジオレオイルテトラメチルアミノプロピル(DOTAP)、及びジオレオイルホスファチジルエタノールアミン(DOTMA))である。
【0090】
局所、及び他の投与のために、本発明のオリゴヌクレオチドは、リポソーム内にカプセル封入され得る、或いは、リポソーム、特にカチオン性リポソームへ複合体を形成し得る。その他にも、オリゴヌクレオチドは、脂質、特にカチオン性脂質へ複合体を形成できる。
【0091】
経口投与のための組成物、及び製剤は、粉剤、又は顆粒剤、微粒子剤、ナノ粒子剤、水、又は水性でない溶媒中の懸濁剤、又は溶液剤、カプセル剤、ゲルカプセル剤、小袋剤、錠剤、又は小型錠剤を含む。増粘剤、着香料、希釈剤、乳化剤、分散補助剤、又は結合剤が、所望できる。
非経口投与のための組成物、又は製剤は、滅菌水性溶液を含むことができ、また緩衝剤、希釈剤、及び下記のような他の適切な添加剤を含む。浸透増強剤、担体化合物、及び他の医薬として許容し得る担体、又は賦形剤であるが、これらに限定されない。
【0092】
さらに、本発明の該dsRNA組成物は、1種以上のdsRNA化合物を含むことができる。例を挙げると、第一の核酸を標的にする、第一のdsRNA、及び第二の標的核酸を標的にする、1種以上のさらなるdsRNA化合物、又は標的をもたないdsRNA(標的遺伝子へ公知の相同性をもたない配列)がある。また、本発明の組成物は、同一標的核酸の異なった領域を標的にする、2種以上のdsRNA化合物を含むことができる。2種以上の複合化合物は、共に、又は順次に使用できる。
【0093】
dsRNAが、甲殻類動物などの少なくとも海洋無脊椎動物、及びおそらく他の無脊椎動物において、免疫応答を引き起こすという発見は、下記の実験を起端とする。無脊椎動物の免疫のより深い理解、及びより具体的には、甲殻類動物遺伝子発現、及び免疫を調節する遺伝子、及び経路の理解を深めるために考えられた実験、及び又、配列特異的免疫応答が、通常エビを感染する、ウイルス病原体に対する防御性をもたらす手段として、潜在的に引き起こされているという発想で考えられた実験である。それらのウイルス病原体の例を挙げると、ホワイトスポットシンドロームウイルス(WSSV)、タウラシンドロームウイルス(TSV)、伝染性皮下造血器壊死ウイルス(IHHNV)、ペナエイドシュリンプのバキュロウイルス(BP)、ペナエイドシュリンプのラブドウイルス(RPS)、鰓関連ウイルス(GAV)、イエローヘッドウイルス(YHV)、リンパ器官関連ウイルス(LOVV)、リンパ器官パボ様ウイルス疾患(LPV)、肝膵臓パボウイルス(HPV)、バキュロウイルス型中腸腺壊死ウイルス(BMN)、モノドン型バキュロウイルス(MBV)、レオ様ウイルス疾患(REO)、ラブドウイルス(RPS)、及び新生ウイルスがある。
【0094】
具体的に、本発明者らは、特にWSSV、及びTSVなどの、エビウイルスの標的遺伝子に相当するdsRNAの合成、及び投与により、実験を行い、通常甲殻類動物、特にエビに感染する、数種のウイルスに含まれる、様々な遺伝子の役割を評価した。また、本発明者は、実験を行い、エビ免疫に推定的に関与している、遺伝子に相当する配列をもつdsRNAの投与により、特定のエビ遺伝子、NFKB、及びSTATシグナル経路の推定上構成要素、及び他の内在性遺伝子が調整(抑制)され得るかどうかを検討した。さらに、本発明者らは、実験を行い、dsRNAを甲殻類動物に導入する手段として、特定の生物送達媒体、特に酵母菌の実現可能性を評価した。
【0095】
具体的に、本発明者らは、全身性感染プロセスにおいて、WSSVの外殻タンパク質VP28、及び他の選択された遺伝子の発現を標的とする、dsRNAの効果を研究した。最初に、該VP28遺伝子が選択されたのは、VP28が、ポリペプチドの残留部分を該ウイルス粒子の外側に露呈したまま、推定上の膜貫通領域により、WSSVの外殻に固定されると考えられているからである。VP28の一次構造に基づき、この理論は、感染性WSSV調製の、VP28抗体での処置は、L. バンナメイへの注入時に、その効力を抑えるという観察により、支持される。従って、この遺伝子の発現は、WSSVが甲殻類動物、すなわちエビを感染する能力に必須である。
【0096】
しかしながら、この遺伝子は典型的であるが、本発明は、内在性遺伝子の発現、又は他の海洋性無脊椎動物、及び無脊椎動物寄生生物、好ましくは甲殻類動物寄生動物に含まれる、必須遺伝子を特異的、又は全身的に調製する、dsRNA の使用を幅広く含む。例を挙げると、STAT、IKB、及び、NFKB、及び STATシグナル経路の他の推定上の構成要素のような、免疫、成長、生殖、及び健康一般、又はロバスト性に関与する、甲殻類動物遺伝子に相当するdsRNAである。また、神経伝達物質、脱皮抑制ホルモン、生殖腺抑制ホルモン、及び甲殻類高血糖ホルモンを含む、ホルモン、及び代謝経路をコードする遺伝子も含まれる。また、クラスチン及びペナエイジンなどの、抗菌ペプチド、又はペプチドの産生調節因子をコードする遺伝子を含む。場合によっては、dsRNAを使用して、甲殻類動物のような海洋無脊椎動物の、任意の所望される遺伝子の発現を、減少させることができる。例えば、推定上の標的遺伝子は、コントロール、及びウイルス(WSSV、又はTSV)感染エビ組織を用いて作製したサプレッションサブトラクティブハイブリダイゼーションライブラリーのような、ゲノムライブラリー中で同定することができる。他の可能な標的遺伝子の具体例は、VP28、リボヌクレオチド還元酵素、へモシアニン、VP26、VP19、チミジル酸キナーゼ、及びDNA ポリメラーゼを含む。
【0097】
特に、最初に、本発明者らは、実験を行い、WSSVチャレンジ実験から調製されたサブトラクティブハイブリダイゼーションライブラリー(PCRセレクト、Clontech社)を含む、L. バンネメイESTコレクションにおいて同定された、WSSV 、及びエビ発現遺伝子に相当するdsRNAの注入の、推定される抗ウイルス効果を検討した。これらの実験は、エビIKBK 遺伝子、STAT 遺伝子、及びヘモシアニン遺伝子、及び該WSSV VP28、リボヌクレオチド還元酵素小サブユニット、及びDNAポリメラーゼ遺伝子に相当する、dsRNAs のコンストラクション、及び注入と同様に、アナスプラテュリュンコス(Anas platyrhynchos)アヒルの免疫グロブリン□の部分をコードする、(dsRNAの推定される配列非依存性の効果を評価するための)コントロールdsRNAを含んだ。
【0098】
初めて、これらの[該実施例で詳細に考察された]dsRNA研究の結果は、ウイルス病原体(WSSV)に含まれる遺伝子に相当するdsRNAでの、甲殻類動物、すなわち、エビの処理が、前記エビのウイルス(WSSV)感染に対して、効率的に防御することを示した。また、さらに、これらのdsRNA研究は、標的エビ内在性遺伝子(ヘモシアニン、STAT、IカッパBキナーゼ触媒サブユニット)が、前記遺伝子を標的にするdsRNAの投与により、配列特異的に発現減少することを確立した。これらの発現減少の配列特異性は、全てのdsRNA処理エビにおけるコントロール遺伝子(リボソームタンパク質mRNA)の影響を受けない発現、及びSTAT dsRNA処理動物におけるIKBK mRNAの正常発現、及びその逆も同様であることにより示された。
【0099】
これらの実験結果は、初めて、エビにおけるRNAiの存在を示し、かつ甲殻類水産養殖などの、海洋無脊椎動物水産養殖における、dsRNA関連治療を用いる抗ウイルス方策の実現可能性を確立する。この発見が、商業上大きな影響力をもつ理由は、20種以上の病原性ウイルスが、エビ種を感染し、かつ世界中でエビ水産養殖に大きな経済損失をもたらすことが、よく知られているからである。従って、そのようなエビ病原性ウイルスを全滅させる、又は軽減する実行可能なストラテジーは、(ウイルス関連のエビ損害は、年間何十億ドルに及ぶので)商業的に大変重要であると思われる。
【0100】
しかしながら、また、前記のように、本発明者らは、これらdsRNA研究において、幅広い目標をもった;特に、彼らは、該海洋エビ、リトペナエウスバナメイ、及びそのの該研究により、甲殻類動物などの無脊椎動物の免疫システム、及びタウラシンドロームウイルス(TSV)、及びホワイトスポットシンドロームウイルス(WSSV)の2種のウイルスによる感染に応答する、dsRNAの効果の理解を深めたかった。
【0101】
これらの研究の原理は、部分的に下記の観察に基づいている:1)甲殻類動物は、海洋(沿岸)環境に必須構成要素である;2)特定の甲殻類動物種、特に海洋エビは、商業的に意義があり、かつ広く水産養殖されている;3)甲殻類動物は、多数のウイルス感染に対して高い感受性を示し、それは水産養殖に壊滅的な影響をもち、かつ環境に未知の結果をもたらす;及び4)甲殻類動物の、ウイルスへの免疫反応に関しては、ほとんど知られていない、である。
【0102】
本発明前に、甲殻類動物の免疫については、ほとんど知られていなかったので、本発明者らは、機能ゲノムアプローチを用い、エビの免疫応答を生じさせるのに重要と思われる、エビ遺伝子のゲノム情報を速やかに得た。特に、機能ゲノム研究の結果に基づき、研究には、STAT様遺伝子、及びI-KBキナーゼ様遺伝子(IKK)の2つの遺伝子が、これらの遺伝子の免疫機能を同定する目標で行われる、RNAi研究の重点と同様に、選択された。これらの遺伝子は、その推定上オーソログが、哺乳動物、及び昆虫類などの他の動物において、免疫応答に大変重要なシグナル伝達経路における役割がよく知られているため、選択された。
【0103】
それらの結果に基づいて、これら2種のエビ遺伝子が、脊椎動物で発現される、STAT様ファミリーメンバー、及びIKBキナーゼ複合体の触媒サブユニットのオーソログであり、エビの免疫応答の構成要素、より具体的には、エビ抗ウイルス応答の構成要素をコードすることが仮定された。この仮説を検証するために、これらの遺伝子の発現がノックダウンされる可能性のあるRNA干渉実験を行い、エビの免疫生理、及びウイルス感染への耐性における効果を細かく調べた。甲殻類動物が、RNA干渉経路を経て、dsRNAに応答できるかどうかでさえ、当時知られていなかったので、遺伝子発現が壊滅されかどうかは予想できなかった。
【0104】
これらのdsRNA実験の結果は、これらのエビ内在性STAT、及びIKBK遺伝子が、dsRNAの投与により、配列特異的に、効果的に発現減少されることを示した。この発現減少は、(STAT、及びIKBKの両方のmRNAsの痕跡が、RT-PCRにより検出されたので)完全でなかったが、これらの結果は、初めて、RNA干渉が、甲殻類動物、特にエビにおいて、推定上生得的免疫応答に関与する遺伝子などの、特定の甲殻類動物遺伝子の機能を調べる、又は壊滅させる手段として使用できることを示した。また、これらの結果は、RNA干渉を使用し、ある内在性遺伝子の発現を低下させた、又は欠失させた、エビなどの甲殻類動物のような、海洋無脊椎動物を産生できることを示した。
【0105】
さらに、かなり予想外に、これらの実験は、少なくとも1種の長鎖二本鎖RNAで、すなわち、21〜25ヌクレオチド、好ましくは50ヌクレオチド以上で、いずれのエビ、及びエビウイルスの内在性遺伝子に公知の相同性をもつ、配列を有しないものの投与が、様々なウイルス病原体に対して一般的な防御性を与える全身性免疫応答、すなわち、様々な病原体に対する防御性を与える免疫応答もたらした。言い換えると、該dsRNAは、配列非特異的に、様々な病原体に対する一般的な防御性を与えた。
【0106】
また、予想外に、他の実験は、長鎖非特異的dsRNA(例えば、ポリC: G)、及び配列特異的dsRNA(例えば、相同な配列を含み、標的遺伝子の発現を調整するもの)の共投与は、該配列特異的dsRNAにより生じる該RNAi応答を増強することを示した。これは、低下させた濃度の配列特異的dsRNAの投与でも、該所望される遺伝子調節応答を引き起こすことができるはずなので、有利である。そのような利点は、所望するdsRNAを合成するのに関連する多大な費用を考慮すると、有意に、商業的に重要である。また、それが、より長期のRNAi応答をもたらし得るので、この発見は有益である。
【0107】
エビなどの無脊椎動物におけるdsRNAの全身性抗ウイルス効果は、海洋エビ、リトペナエウスバナメイの免疫応答のRNA干渉研究中に、最初に観察された。選択されたエビ、及びウイルス遺伝子、及び非特異的コントロールである遺伝子(例えば、アヒル免疫グロブリン遺伝子)に相当するdsRNAを注入し、かつ該動物にウイルスチャレンジをかけたときである。全く予想外に、任意のdsRNA、すなわち、標的ウイルス、又は宿主遺伝子に特異的なdsRNAだけでなく、いかなる公知の甲殻類、又はウイルス遺伝子とも相同性をもたないdsRNAも、タウラシンドロームウイルス(TSV)、又はホワイトスポットシンドロームウイルス(WSSV)への感染において、生存増加をもたらした。これらの結果が、かなり驚きであるというのは、脊椎動物は、大部分がdsRNAによるインターフェロンの活性化による、ウイルス感染に対する強い生得的な免疫応答を備えていることが知られているが、脊椎動物インターフェロンに同様な、一般的に誘導される抗ウイルス防衛メカニズムが、無脊椎動物に存在することは、これまでに考えられておらず、また推測すらされていなかった。本発明の結果は、dsRNAが、抗ウイルス応答の古くからのエリシターであること、及びdsRNAが、無脊椎動物、及び特にエビなどの甲殻類動物において、全身性免疫を生じさせ得ることを示唆する。
【0108】
さらに詳しく、L.バナメイのTSV、及びWSSVに対する抗ウイルス応答を、標的ウイルス遺伝子に特異的なdsRNA、及びいかなる公知の標的ウイルス、又は宿主遺伝子とも特異的でないdsRNAの投与後に比較した。アヒル(アナスプラテュリュンコス)の免疫グロブリンυ重鎖の部分をコードし、いかなるエビ、TSV、又はWSSV遺伝子とも公知の相同性をもたないdsRNAが、TSV、及びWSSVの両方に対して免疫応答が誘導したことが観察された。反対に、dsRNA、及び一本鎖RNA(ポリC)は、そのような応答を生じさせなかったか、或いは抗ウイルス防御性を与えなかった。さらに、この全身性配列非特異的な、dsRNAへの応答の存在の有効性を確認するために、本発明者らは、様々な脊椎動物免疫グロブリン遺伝子(アヒルυ、ブタγ)をコードするdsRNA、魚類の非コードゲノムDNA、バクテリアベクター配列、及び合成dsRNAを投与した。
【0109】
再び驚いたことに、これらのdsRNA全てが、抗ウイルス防衛性応答を誘導することが、観察された。反対に、ポリIC (シトシンと対合したイノシン塩基をもつdsRNA)、dsDNA、及びssRNA (ポリC)、及びRNアーゼ処理dsRNAは、ウイルス防御性を与えなかった。ポリICが、エビに抗ウイルス防御性を誘導できなかったことは、dsRNAへの認識、及び免疫応答を生じさせる、無脊椎動物の該免疫メカニズムが、脊椎動物のものとは異なることを示唆する。これらの結果に基づき、甲殻類動物などの無脊椎動物は、脊椎動物に存在するものに類似しているが、根本的な相違点を有する、dsRNA媒介免疫応答により、dsRNAに対して生得的免疫応答を生じさせることが、仮定される。
【0110】
観察された類似点は、1)様々なウイルスに対して活性がある、及び2) dsRNAにより、配列非特異的に引き起こされる、などがある。少なくとも1つの相違点は、甲殻類系で観察された該免疫応答は、インターフェロン系を伴っていないように思われる。
【0111】
具体的に、脊椎動物において、dsRNAは、Toll様レセプター3(TLR-3)により認識され、少なくとも部分的にインターフェロンBプロモーターを介して、インターフェロン系が活性化される。最終的に、このインターフェロン応答が、抗ウイルス活性をもつものもあり、細胞成長を調節して、かつ適応免疫応答を調整するものもある、何百もの遺伝子の誘導をもたらす。また、哺乳動物では、dsRNAが、RNA依存性プロテインキナーゼ(PKR)に結合し、直接活性化し、真核生物の翻訳開始因子2a(eIF2a)のリン酸化を介して、タンパク質合成の抑制をもたらす。しかしながら、無脊椎動物は、インターフェロン免疫系を有しない。従って、甲殻類動物における、dsRNAに対して生じる該免疫応答は、異なった免疫調節系を含むはずであるが、まだ完全にわかっていない。
【0112】
エビなどの甲殻類動物のような海洋無脊椎動物、及びおそらく他の無脊椎動物が、dsRNAの投与に、配列特異的、又は配列非特異的(全身性免疫応答)メカニズムを介して応答するという発見は、基礎研究、及び例えばエビなどの海洋水産養殖における疾患制御の効果的ストラテジーの両方に重要な応用がある。特に、標的遺伝子特異的なdsRNAは、エビにおける逆遺伝学的方法の手段として、生殖生物学、及び免疫学の研究などの分子医学的研究において使用され得る。さらに、dsRNAを基にした抗ウイルス治療を使用する技術の発展は、エビ、及び他の甲殻類動物の疾患、及び病原体、特にウイルス、バクテリア、菌類、微胞子虫類、略胞子虫類、及びグレガリナ類病原体を軽減する新しい手段を促進するであろう。また、dsRNAは、ウイルス、又は他の無脊椎動物病原体に対するような、全身性防御的免疫応答を誘導する。
【0113】
従って、前記のように、本発明は、幅広く、無脊椎動物、例えば、軟体動物、又は甲殻類動物のような海洋無脊椎動物、好ましくはエビにおける、全身性の配列非特異的免疫応答を誘導する、或いは/又は配列特異的な、遺伝子発現を調整する(抑制する)免疫応答を誘導する、dsRNAの使用を対象にする。
また、本発明は、幅広く、配列非特異的dsRNA、一般的に,共投与により、配列特異的dsRNAにより生じる該応答を増強する、長鎖dsRNAの使用を対象にする。
【0114】
一般に、本発明方法は、特定の疾患、又はウイルス、バクテリア、マイコプラズマ、又は菌類など病原体に対する、防御的RNAi、及び/又は免疫応答を生じるのに十分な量の、少なくとも1種のdsRNA、又はdsRNAの混合物の投与、又は共投与を含む。混合物の例を挙げると、標的遺伝子配列に相補的、又はハイブリダイズし、かつ少なくとも約21〜25ヌクレオチド鎖長であるもの、或いは標的遺伝子に公知の相同性を示さず、かつ好ましくは、少なくとも50〜100ヌクレオチド鎖長であり、かつ任意に改質したヌクレオチドを含むことができるものがある。考察したように、この発明の新規な一面は、全身性防御的免疫応答を生じるのに、或いは配列特異的dsRNAによリ生じる、特異的RNA干渉を増強するのに、十分な大きさのdsRNAは、任意の宿主遺伝子、又は病原体遺伝子に配列相同性をもつ、配列を有する必要がないことである。従って、該投与非特異的dsRNAは、例えば、ウイルス、バクテリア、又は他の無脊椎動物の出所、哺乳類、両生類、鳥類、爬虫類などの脊椎動物由来、植物出所由来の、任意の出所に由来し得る。或いは、それは、所望のヌクレオチドのホモポリマー、又はヘテロポリマーのような合成dsRNAであり得る。該実施例において、バクテリア、合成、及び様々な脊椎動物のdsRNAの全てが、エビに全身性免疫応答を生じさせること、及び非特異的dsRNA(ポリC: G )が、配列特異的(WSSV)dsRNAにより生じる該RNAi応答が増強したことが、示されている。
【0115】
非特異的免疫応答を生じさせる投与dsRNAは、好ましくは、長鎖dsRNA、すなわち好ましくは、少なくとも50ヌクレオチド鎖長、より好ましくは、少なくとも100-500ヌクレオチド鎖長、1000-5000ヌクレオチド鎖長で、上限は知られていない。その例は、ポリC: G、又は天然、又は改質されたヌクレオチドの、同様の別のポリマーである。反対に、配列特異的応答(標的遺伝子に相当する遺伝子の発現抑制)を生じさせるdsRNAは、21〜25ヌクレオチド鎖長ほど短いか、所望ならばそれ以上であり得る。
【0116】
好ましくは、甲殻類動物、又は他の海洋無脊椎動物に、配列特異的なRNAi応答を生じさせる投与dsRNAは、同定された、又は少なくとも70%〜80%、さらに好ましくは、少なくとも80〜90%、又は少なくとも、90〜95%のような、標的遺伝子と十分な配列同一性を示す配列を含む。具体的に、甲殻類動物遺伝子、又は甲殻類動物に感染する、寄生生物に含まれる遺伝子のような、標的遺伝子とハイブリダイズし、その発現を調整する、好ましくは、抑制、又は阻害する、前記dsRNAである。好ましくは、標的遺伝子の発現の調整が、所望する表現型効果を、又は特定の病原体に対する免疫を与える。好ましくは、配列特異的dsRNAは、この申請書において同定される標的遺伝子、より具体的には、本明細書中において具体的に同定される核酸配列に、前記のような十分な相同性を含む。
【0117】
dsRNAは、配列非特異的免疫応答、又は配列特異的な遺伝子発現減少を与えるのに十分な量で、投与される。例を挙げると、少なくとも、約.0001 mg〜.001 mg、より好ましくは、約.001〜.01 mg、さらに好ましくは、.1 mg〜.5 mgの範囲の投与量であり、上限は知られていない。100 μgもの大量なdsRNAをエビに注入しても、毒性が生じないことは知られている。投与の形態は、防御的免疫応答をもたらす任意の方法であろう。例を挙げると、該dsRNAは、(静脈内,皮下、筋肉内などに)注入され得る、経口投与され得る、浸漬を経て、又は経皮で送達され得る。物理的方法は、宿主細胞への直接の注入、又はエビの尾などの、無脊椎動物への細胞外注入を含む。
【0118】
特に好ましい送達の手段は、生物送達系である。例を挙げると、酵母菌、又は微細藻類、又は甲殻類動物が摂取可能な他の微生物細胞であって、例えば、甲殻類動物に感染するウイルスの遺伝子に特異的であるような、所望されるdsRNAを発現する該送達系である。例えば、サッカロマイセスは、WSSV、又はTSV遺伝子を標的にするdsRNAを発現するベクターで、形質転換され得る。同様に、クラミドモナス属、クロレラ属、アルスロスピラ属(スピルリナ属)、ヘマトコッカス属、ナンノクロロプシス属,スケレトネマ属、キートセロス属、テトラセルミス属、又はイソクリシス属などの、微細藻類は、その中にdsRNAの発現を与えるベクターで、形質転換され得る(Sineshchekarらの論文、 Proc. Natl. Acad. Sci., USA 99 (13): 86889-97 (June 25, 2002) ; Koblenzらの論文、 J. Cell Sci. 116 (Pt. 13): 2635-46 (July, 2003) を参照されたい)。該dsRNAは、餌料に含まれている、又は養殖媒体に導入される微生物を摂取する甲殻類動物、又は他の無脊椎動物により送達されるであろう。或いは、該dsRNAが、該生物送達媒体により該養殖媒体に分泌されるなら、該甲殻類動物により吸収され得る。酵母菌、又は微細藻類などの生物送達媒体の摂取は、甲殻類動物腸を通過し、甲殻類動物循環系への導入を提供し、それにより免疫応答が生じ得るので、dsRNA の安定性を助長する(内在性加水分解酵素により分解されにくい)であろう。
生物送達方法が好ましいが、本発明は、前記記載のような、他の送達系、及び組成物を含む。
【0119】
該対象dsRNAは、インビボ、又はインビトロで合成され得る。細胞の内在性RNAポリメラーゼは、インビボの転写を介在でき、或いはクローンRNAポリメラーゼを、インビボ、又はインビトロの転写に使うことができる。インビボの導入遺伝子、又は発現コンストラクトからの転写には、調節領域(例えば、プロモーター、エンハンサー、サイレンサー、スプライスドナー、及びアクセプター、ポリアデニル化)が使用でき、該RNA 鎖(又は複数鎖)を転写する。器官、組織、又は細胞型特異的;環境条件の刺激(感染、ストレス、温度、化学誘導因子);及び/又は任意の発達段階、又は年齢での工学的転写により、抑制を標的にできる。該RNA鎖は、ポリアデニル化されるかどうかわからない;該RNA鎖は、細胞の転写装置によりポリペプチドに転写されることができるかどうかはわからない。RNAは手動、又は自動化した反応により、科学的、又は酵素的に合成され得る。該RNAは、細胞のRNAポリメラーゼ、又はバクテリオファージのRNAポリメラーゼ(例えば、T3、T7、SP6)により合成され得る。発現コンストラクトの使用、及び作製は、当技術分野において公知である。sup. 32,33, 34 (国際公開第97/32016号;米国特許第5,593,874号、第5,698,425号、第5,712,135号、第5,789,214号、及び第5,804,693号;及びその中で引用される参考文献も参照されたい)。化学的に、又はインビボ酵素的合成により合成されるなら、該RNAを、細胞に導入する前に精製することができる。例えば、RNAは、溶媒、又は樹脂からの抽出、沈殿、電気泳動、クロマトグラフィー、又はその組み合わせにより、精製され得る。その代わりに、該RNAは、試料調製による損失を防ぐため、精製なし、又は最小限で使用できる。該RNAは、保存のために乾燥されたり、或いは水性溶液に溶解され得る。該溶液は、緩衝液、アニーリング、及び/又は二重鎖の安定化を促進する塩類を含むことができる。
【0120】
RNAは、直接細胞へ(すなわち、細胞内へ)導入され得る;或いは、細胞外に空洞、間質腔へ、生物の循環系へ導入、経口導入、或いは生物を該RNAを含む溶液に浸すことにより導入され得る。経口導入の方法は、該RNA の生物の餌料との直接混合と同様、工学的アプローチを含む。それは、餌料として使われる種(酵母菌、又は微細藻類)が、該RNA を発現するように操作し、その後影響を及ぼすべき生物に食べさせるアプローチである。或いは、該甲殻類動物、又は他の海洋無脊椎動物を、該dsRNAを含む淡水、又は生理食塩水に浸すことができる。核酸を導入する物理的方法、例えば、細胞への直接注入、又は細胞体への細胞外注入も使用できる。組み換えコンストラクト由来のRNA を発現する、遺伝子導入生物は、該コンストラクトを、受精卵、胚幹細胞、又は別の甲殻類動物由来の多機能性細胞に導入することにより、産生できる。
【0121】
酵母、及び微細藻類の両方に、異種の遺伝子を発現させる操作方法は、当技術分野においてよく知られている。しかしながら、本発明の前には、酵母菌における異種の外来dsRNAの発現は知られていなかった。そういう点で、酵母菌が、検出可能なレベルで、恒常的に発現できるかどうかは知られていなかった。dsRNAの発現は、dsRNAがインビボ(例えば、微生物内部)で不安定あり得るように、特に複雑である。なぜなら、一般に、細胞は、一本鎖核酸RNA(ssRNA) 、及びdsRNAの分解を含む、核酸代謝、及び遺伝子発現を調節するメカニズムとして、 複数の核酸分解酵素を発現している。例えば、S. セレビシエのゲノムにおいては、(Rppl、 Pan3、Pan2、Rnhl、Rnti、及びRnylのような)6種のリボヌクレアーゼが、単鎖及び/又は二本鎖RNA を分解し得ることが見い出された。大腸菌のような、他の微生物において、ssRNA、及び dsRNAの分解は、またリボヌクレアーゼにより影響されるが、大腸菌リボヌクレアーゼIIIだけが、dsRNAを分解できる(Calin-Jageman、及びNicholsonの論文、2003b ; Calin-Jageman、及びNicholsonの論文、2003a)。従って、大腸菌において、dsRNAの発現は、該大腸菌リボヌクレアーゼIII遺伝子の欠失で実現できる(Sunらの論文、2001)。驚いたことに、実施例に含まれる結果からも明らかなように、リボヌクレアーゼ遺伝子を変えていない、サッカロマイセス属細胞は、ガラクとース誘導条件下で、検出可能なレベルのdsRNA(WSSV dsRNA)を発現する。従って、サッカロマイセス属、及び他の酵母菌は、エビなどの甲殻類が安全に摂取可能であり、その点でdsRNA送達に適した手段のはずである。異種遺伝子の発現に適していることが知られている他の酵母菌の例は、ピキア属、ヤロウィア属、カンジダ属、ハンゼヌーラ属、シゾサッカロマイセス属、及びその同類である。
【0122】
本明細書中の実施例では、ガラクトース誘導性プロモーターがサッカロマイセス属におけるdsRNAの発現を調整するのに使用された。しかしながら、特定の宿主細胞において機能的である、任意のプロモーターが使用できる。酵母菌で機能的な恒常的、および調節可能なプロモーターは、PH081、PH02、PH04、及び他の酸性フォスファターゼ、及びアルカリフォスファターゼ誘導プロモーター、GLAl、GAL2、GAL4、GAL7、GAL10及び他のガラクトース調節プロモーター、フォスフォグリセロキナーゼプロモーター、及びその同類である。
【0123】
好ましい態様において、該酵母菌は、異なったdsRNAをコードする、2種の異なったベクターで形質転換、又は形質移入し、2つの遺伝子の発現を抑制され得るか、或いは同じ病原体遺伝子に特異的な、異なったdsRNAの投与に起因する付加的、又は相乗的な結果を得ることができる。本発明は、WSSV遺伝子に特異的なdsRNAで例示されているが、酵母菌送達系は、他の無脊椎動物などの他の動物、好ましくは他の海洋無脊椎動物へ、dsRNAを送達するために使用できることが予想される。
【0124】
同様に、微細藻類は、生物送達システムとして使用される時には、餌料、養殖媒体に導入されるか、或いは甲殻類動物に接触されるであろう。微細藻類は生物安定化剤として働き、所望されるdsRNAを、腸を経て標的循環系へ、例を挙げると、甲殻類動物、好ましくはエビの循環系へ、安定して送達させることが予想される。
【0125】
また、微細珪藻における、誘導の手段、及び異種の核酸配列を発現させるベクターは、当技術分野において十分知られている(例えば、2004年3月11日に公表された、米国特許第200400478281号;2003年1月30日に公表された、米国特許第20030022359号;2003年2月13日に公表された、米国特許第20030033626号;2003年10月2日に公表された、米国特許第20030186856号、及び2003年11月13日に公表された、米国特許第20030211089号を参照されたい。これら全ては、引用により、その全体が本明細書に取り込まれる。
【0126】
また、微細藻類の内在性遺伝子(ロドプシン、セントリン遺伝子)を、ノックダウンする、微細藻類におけるdsRNAの発現を教示する、Sineshchekovらの論文、Proc. Natl. Acad. Sci. , USA 99 (131: 8689- 94 (June 20,2002); Koblenzらの論文、J. Cell Sci., 116 (pt. 13): 2635-46 (2003)、及び微細藻類間におけるDNAの形質転換の手段の総説である、Leona Banaresらの論文、Trends Biotechnol. 22 (i): 43-52 (2004) を参照されたい。酵母菌と同様、微細藻類は、形質転換することができる。それにより、ウイルスなどの標的遺伝子に特異的である、1種、又は数種のdsRNAを発現できたり、或いは非特異的で、かつ一般的な抗ウイルス免疫などの一般的な(全身性)免疫応答を誘導する、長鎖dsRNAをコードすることができる。
【0127】
さらに、核酸を誘導する物理的な方法は、該RNA含有溶液の注入、該RNAにより覆われた粒子による衝撃、細胞、又は生物を該RNA溶液に浸漬すること、又は該RNAの存在下での細胞膜のエレクトロポレーションを含む。ウイルス粒子に詰められたウイルスコンストラクトは、発現コンストラクトの該細胞への効率的な導入、及び該発現コンストラクトによりコードされるRNAの転写の両方を達成するであろう。当技術分野で知られている、他の核酸を細胞に導入する方法も使用できる。例を挙げると、脂質介在キャリア輸送、リポソーム送達、リン酸カルシウムなどの化学介在輸送、キャリア部分への接着、及びその同類がある。従って、該RNAは、1種以上の下記の活性を担う構成要素とともに導入することができる:該細胞によるRNAの取り込みを増大する、該二本鎖のアニーリングを促進する、該アニールした鎖を安定させる、又は別の方法で該標的遺伝子の抑制を増加させる、活性である。
【0128】
本発明の重要な一面は、任意の配列のdsRNA、好ましくは、少なくとも50ヌクレオチド鎖長以上であり、改質、及び非天然のヌクレオチドを含み得るものが、甲殻類動物における全身性免疫応答を誘導するのに使用できるという発見である。しかし一方、本発明のもう一つの重要な面は、(甲殻類動物、又は病原体遺伝子を標的にする配列をもつ、干渉RNAの投与の中で)標的甲殻類動物遺伝子、又は通常、甲殻類動物に感染する病原体に含まれる遺伝子に同一であるか、或いは高度の配列同一性をもつdsRNAの、エビなどの甲殻類動物への投与に関するものである。好ましくは、該dsRNAは、少なくとも70%、好ましくは、少なくとも80〜90%、95%以上、ウイルス、又は内在性遺伝子などの、標的遺伝子の相当する領域に配列同一性を示す、少なくとも21〜25ヌクレオチドの領域を含む。
【0129】
その具体的な例は、免疫、成長、生殖、及び健康一般、又は"ロバスト性"に関与するような甲殻類動物遺伝子、又は病原体の必須遺伝子である。また、STAT、IKB、及び、NFKB、及び STATシグナル経路の他の推定上の構成要素のような 遺伝子も含まれる。また、神経伝達物質、脱皮抑制ホルモン、生殖腺抑制ホルモン、及び甲殻類高血糖ホルモン含む、ホルモン、及び代謝経路をコードする遺伝子も含まれる。また、クラスチン、及びペナエイジンなどの、抗菌ペプチド、又はペプチドの産生調節因子をコードする遺伝子を含む。場合によっては、dsRNAを使用して、任意の所望される甲殻類動物遺伝子の発現を、減少させることができる。例えば、推定上の標的遺伝子は、コントロール、及びウイルス(WSSV、又はTSV)感染エビ組織を用いて作製されるサプレッションサブトラクティブハイブリダイゼーションライブラリーのなどの、ゲノムライブラリー中で同定することができる。他の可能な標的遺伝子の具体例は、VP28、リボヌクレオチド還元酵素、へモシアニン、VP26、VP19、チミジル酸キナーゼ、及びDNA ポリメラーゼなどである。
【0130】
好ましくは、本発明は、甲殻類動物遺伝子、又は通常、甲殻類動物に感染する病原体遺伝子と同一であるか、或いは少なくとも75%、さらに好ましくは、少なくとも85〜90%、さらに好ましくは、90〜99%同一である、高い配列相同性を示す配列をもつ、dsRNAを投与することを含む。エビの場合、病原体の例を挙げると、ホワイトスポットシンドロームウイルス、タウラシンドロームウイルス、伝染性皮下造血器壊死ウイルス(IHHNV)、ペナエイドシュリンプのバキュロウイルス(BP)、ペナエイドシュリンプのラブドウイルス(RPS)、鰓関連ウイルス(GAV)、イエローヘッドウイルス(YHV)、リンパ器官関連ウイルス(LOVV)、リンパ器官パボ様ウイルス疾患(LPV)、肝膵臓パボウイルス(HPV)、バキュロウイルス中腸腺壊死ウイルス(BMN)、モノドン型バキュロウイルス(MBV)、レオ様ウイルス疾患(REO)、ラブドウイルス(RPS)、及び新生ウイルスがあり、その必須遺伝子は、当業者に利用可能な任意の手段を通じて、配列決定され得る。
【0131】
エビに感染するバクテリア病原体は、ビブリオ菌、マイコバクテリア菌、壊死性肝膵炎(NHP)、及びリケッチア、又はリケッチア様病原体を含む。エビに感染する菌類は、フサリウム オキシスポルム(Fusarium oxysporum)、ラゲニジウム属(Lagenidium)、又はシロルピジウム属(Sirolpidium)を含む。エビに感染する他の寄生生物は、微胞子虫類、略胞子虫類,及びグレガリナ類を含む。
該配列特異的dsRNAの効果的な、好ましい投与量は、前記記載と同様である。該配列特異的dsRNAの大きさは、少なくとも20〜50,000ヌクレオチド鎖長、より好ましくは、約20〜約5000ヌクレオチド鎖長、さらにより好ましくは、20〜500ヌクレオチド鎖長の範囲である。
【0132】
標的遺伝子に特異的なRNAは、甲殻類動物などの、任意の海洋無脊椎動物における遺伝子発現の、発現減少に使用できる。甲殻類動物は、一例として、エビ、カニ、クレイフィシュ、及びロブスターを含む。エビの具体例は、アキアミパストシュリンプ(Akiami past shrimp)、バルチックプローン(Baltic prawn)、テンジククルマエビ、ブルーシュリンプ(blue shrimp)、ブラインシュリンプ(brine shrimp)、ブラウンタイガープローン(brown tiger prawn)、カラモテプローン(caramote prawn)、イースタンキングプローン(eastern king prawn)、イースタンスクールシュリンプ(eastern School Shrimp)、タイショウエビ、淡水エビ、ジャイアントリバープローン(giant river prawn)、ブラックタイガー、ヨシエビ、クマエビ、カルマエビ(Karuma prawn)、メタペナエウス属エビ(metapenaeus shrimp)、ノーザンホワイトシュリンプ(northern white shrimp)、パラエモニドシュリンプ(palaemonid shrimp)、及びホワイトレッグシュリンプ(whiteleg shrimp)である。
【0133】
本発明により含まれる、カニ種の具体例は、ブルークラブ(blue crab)、チャイニーズリバークラブ(Chinese river crab)、ガザミ(Gazami crab)、インドパシフィックスワンプクラブ(Indo-Pacific swamp crab)、海洋カニ(marine crab)、ポルツヌス属スイムクラブ(portunus swimcrab)、スパイナススパイダークラブ(spinous spider crab)、及びスイムクラブ(swimcrab)である。
【0134】
本発明に含まれるクレイフィッシュの具体例は、ドナウクレイフィッシュ(Danube crayfish)、ユーロアメリカンクレイフィッシュ(Euro-American crayfish)、マロンクレイフィッシュ(Maron crayfish)、ノーブルクレイフィッシュ(Noble crayfish)、レッドクロウクレイフィッシュ(red claw crayfish)、レッドスワンプクレイフィッシュ(red swamp crayfish)、シグナルクレイフィッシュ(signal crayfish)、及びヤビークレイフィッシュ(yabby crayfish)である。
【0135】
最後に、本発明に含まれるロブスターの具体例は、ウチワエビモドキ、イセエビ、マドスパイニーロブスター(mud spiny lobster)、イセエビ科スパイニーロブスター(Palinurid Spiny lobster)、スパイニーロブスター(spiny lobster)、及びトロピカルスパイニーロブスター(tropical spiny lobster)である。
【0136】
本発明の好ましい態様において、エビなどの甲殻類動物を、非特異的(全身性)免疫を誘導する長鎖dsRNAと、標的遺伝子の発現をRNA干渉による配列特異的に抑制する、別のdsRNAとを組合せて処理することができる。
【0137】
本発明の、もう一つの好ましい態様において、エビのような甲殻類動物を、投与量コントロール条件下で、少なくとも1種の配列特異的dsRNA、及び別の非特異的dsRNAで処理することができる。それにより、該非特異的dsRNAが"アジュバント"として作用し、該配列特異的dsRNAにより生じる、該配列特異的遺伝子と同一であるか、或いはかなり同様である配列を含む遺伝子の発現における、該RNAi応答を増強する。好ましくは、配列特異的dsRNAに対する該非特異的dsRNAの量は、該配列特異的dsRNAにより生じる該応答を、少なくとも10倍増強し、それにより、有効性を妥協せずに、その投与量を減少させることができる量である。
【0138】
本発明のもう一つの有意義な面は、RNA干渉との機能ゲノミクスの使用し、免疫調節、及びウイルス免疫に関する甲殻類動物遺伝子を同定することを含む。例えば、公知のESTライブラリー由来の遺伝子を同定することができる。或いは、新規なライブラリー、例えば、ウイルス感染により発現増加、又は発現減少する遺伝子を含む、ウイルスに感染した甲殻類動物から作製されるライブラリー由来の遺伝子を、同定することができる。
【0139】
好ましい遺伝子の出所は、www.marinegenomics.org で報告されている該ESTライブラリーであり、現在数千のエビ遺伝子配列を含み、かつさらなるエビ遺伝子が知られてきているので、継続的に更新されている。これらの推定上の遺伝子の利用により、それらの遺伝子の発現を抑制するために使用できるdsRNAの設計し、かつその機能を同定することができる。好ましくは、選択される遺伝子は、哺乳動物、又は昆虫などの、他の動物において発現されている、免疫調節遺伝子のオーソログであろう。しかしながら、本発明は、RNA干渉の使用し、任意の標的海洋無脊椎動物、例えば甲殻類動物遺伝子の機能を解明することを幅広く含む。
【0140】
該遺伝子の機能は、表現型の変化を観察することなどにより評価することができる。例を挙げると、該遺伝子が干渉dsRNAにより発現減少されるときの、造血機能、炎症、成長、生殖、分化、ウイルス感染への耐性、色、及びその同類の変化がある。理想的には、該標的遺伝子の発現は、少なくとも80〜90%、さらに好ましくは95〜99%、抑制される。表現型の変化が観察した後、遺伝子の機能を仮定する。場合によっては、該特定遺伝子が欠失し、従って発現されない、トランスジェニック甲殻類動物の作製により、遺伝子の機能を確認することができる。
【0141】
標的遺伝子の機能を同定した後、該遺伝子、又はその相当する遺伝子産物は、それ自身を標的として使用し、抗体、小分子、その発現を調整する(発現増加させる、又は発現減少させる)核酸、及びタンパク質などの化合物を同定することができる。好ましい様態において、該標的遺伝子は、免疫調節遺伝子であり、かつ該化合物は、例えば、抗ウイルス免疫、又は疾患耐性を生じさせる、或いは促進させるなど、免疫を増強させるものである。
【0142】
マイクロアレイ技術を使用し、エビなどの甲殻類動物における、特定の条件下で発現増加、又は発現減少する遺伝子を同定することができる。条件の例を挙げると、dsRNAに晒されるか、ウイルスに感染された時、ストレス条件下、栄養欠乏、胚発生、及び生殖の間、及びその同類などがある。それらの遺伝子を、配列決定すると、その配列に基づき、dsRNAを作製し、該低下された発現により生じる、表現型の変化を評価できる。好ましい態様において、成長、分化、生殖、及び健康一般を促進する、甲殻類動物遺伝子を同定することができる。
【0143】
本発明の具体的な態様を例示するために、下記の実施例が提供される。しかしながら、本発明の実践は、いかなる手段においても、それらにより限定、又は制限されない。
【実施例】
【0144】
(材料、及び方法)
動物、及び実験的ウイルス感染:これらの研究に使用した生物測定系、実験動物、ホワイトスポットシンドロームウイルス(WSSV)、及びタウラシンドロームウイルス(TSV)接種は、別記されている。簡潔に述べると、エビ(L. バナメイ)を個々に260 ml組織培養フラスコに入れ、毎日100%の水交換(人工海水、Marine Environment社)をしながら、2〜3日間馴らした。餌は、市販餌料ペレットのほぼ半分を毎日与えた。記載の時(図2参照)は、エビを、一定水量、及び給気での再循環システムに結合している、10 ガロン水槽(10〜15 エビ/水槽)で 飼育した。馴化後、エビをdsRNAの筋肉注射で処置し、かつ感染エビの0. 45 μrnろ過抽出液の筋肉内注射により感染させた。TSV の場合は、最終希釈は1 x 10-8、又は1 x 10-5、かつWSSV の場合は、最終希釈は4〜6 x 10-8 (重量/体積 希釈)であった。1 x 10-8 (TSV用)、及び4〜6 x 10-8 (WSSVの場合)の該希釈は、多数の実験、及び滴定試験上で、常に60%と90%の間の死亡率をもたらす投与量として選んだ。ネガティブコントロールには、特定の病原体フリーのエビからの抽出液を、対応する希釈で注射した。特記されない限り、注入容量は、20 μlであった。死亡率を毎日記録し、かつ水交換、及び給餌法は、前記の通り行った。
【0145】
dsRNA: インビボで、T3、及びT7ファージRNAポリメラーゼ(Promega社)を使用し、線形型プラスミドコンストラクトから、ssRNA を転写させ、かつその後該DNA鋳型を、DNアーゼ I (Promega社) を1 U/μg鋳型の割合で付加し、分解した。その後、該転写物を、標準的方法を使用する有機溶媒抽出、又はシリカ充填剤吸着(RNイージー(RNeasy)、Qiagen)により精製した。400 mM NaCl、10 mM トリスCl、pH 7.4存在下で、相補的なRNA 鎖を混合し、75℃で15分間、65℃で 15分間、及び常温で15分間アニールさせた。dsRNAの形成は、アガロースゲル電気泳動のサイズ移動によりモニターした。インビトロ転写に使用したDNA 鋳型は、pブルースクリプト(pBluescript)ベクター(Stratagene 社)であり、下記のいずれかの部分に対応している;アヒル、アナス プラテュリュンコスの免疫グロブリンγ鎖(アクセッション番号AJ312200)の309塩基対部分; ナマズ、イクタルルス プンクタトゥスIgH 遺伝子座由来のクローンBAC6(アクセッション番号 CC936713)のゲノミクス非コード領域の1316 塩基対;ブタ、スス スクロファ(Sus scrofa)IgG cDNA(アクセッション番号U03778)の1079塩基対部分; 又はバクテリア人工染色体(BAC)クローニングベクターpBeloBACllの1184塩基対断片である。ポリC:G、ポリI:C、及びポリCは、市販のdsRNA、及びssRNAアナログである (Sigma- Aldrich社)。
【0146】
組織学、及び免疫組織化学:エビ全体を、ダビドソン溶液(Davidson's solution)(33% エタノール、22% ホルマリン、11.5% 酢酸)で24時間、固定し、その後、70%エタノールに移し、ヘマトキシリン/エオシン染色(33)、及び抗WSSVモノクローナル抗体検出系(Diagxotics社)を使用する免疫組織化学による組織学分析をするまで保存した。
【0147】
(dsRNA配列)
1) 非特異的なdsRNA 免疫誘導において検討されたもの
アヒルυ:
CTGGCAGGGCGGCGTGTCCTACGCCTGCATGGTGGTCCACGAAGGGTTGCCCATGAG
GT
TCACCCAACGGCCTCTCCAGAAGACCCCCGAGCTGGACATCTCCACCGCCCTCTGCC
CG
GACGCCGGCGACCAAGAACTGGACGGGCTCTGGGCCACCATCGCCGTCTTCATCACC
CT
CTTCCTCCTCAGCGTCTGCTACAGCGCCACCGTCACCTTCTTCAAGGTCAAGTGGCT
TT
TCTCCACCGTCCTGCAGCTGAAGAGCGCCGGCGGCCCCTACCGCAACGTCCTGAAGG
AG
GCGGCGTGAGCGGC
【0148】
ナマズゲノムDNA:
CTTTCTAGGGCTAGATATTGCAAACAATTTGGCAGTTTTATTCCTATATATATGGTT
TC
GATGGAAAATTCGATCCAATATCGATTCGTTATCAATATTTCATTTAAAATGTTAGT
TT
TGCAGGCACAGATTCCATGTTTTAATATAAATGCTGGTAACTGAAACCCTCCTGCTT
GG
CTACATTACTGAAATACACATTTACGTTACCAATAAGACCTGCACAATTATGTTTCA
TT
ACTTTTTACTTTTACTTTGAGTAACATTGTAAAAGGAAATCATAAATATGTGCATAC
AG
TGCACACAAGGTAAGCACAAATGGCACGTAATTGTAAAAAAACAAACAAAAAAACAA
AA
CATTTGTAAAAGTGCAACAGTGAAATTCATTAACAATTTGAAACGTGTTTAAGAAAT
AA
AACCATTTTCAAAATTCAGAACGTGAAAGAATCTGGAGATTATCTGTAGTGCTCCTC
GT
CCTGAAGGAGCACTATAGATAATATTCACATCCTCTCAAGTAAATCACACGCATTAA
GA
ATCGATTTAGGGATTTCCCAAATCCATATCATTTTGTTAAATTGCTdATCGAATAAA
AC
GGAGAATTGCTATTTTTTACCCAGCCCTAGTGCTTTTACACCTGGTTGTCAGTCCAC
CC
AGTCTGAATATGAGCAAAATTGGTACTTTTGCTTCATTTGCTATTTGGTTTGTTTTT
TC
ATCCACACTGCACATAGTTAATTGAGCAACAAAAAGTTGTCAGGGCTTGTACGTTCA
TC
AGTCTGAATTATCCTCAATGAAAAAAATTATAAGCAAACTTTATGCATATAAAATCT
CA
AAGATTACTTGAGCACAGAGAGCATGGAACCGGTGCTAAAGAATTAGGTAGTCTGTA
TA
AACAACTTTTTCTTTTGCGTGCCACATCCAGCTTTAATTTTCTCTTTTTGTTTGTCG
GA
CCAAATATTTAGAACATGTGGCATTTCTGTTGCGCTACAGTGGTAGTTCAGTGGTTA
AG
AAGTTAGACTACTGATCAGAAGCTTGTGAGTTCAAGTCCTAATACTGCTAACCTTCC
AC
TCTTCAGGCCTTGAGTAAGGCCCTTAACCCTCAACTGCTTTTTAAATTTTTTTTTTT
TT
TTACTTTATTAAAATATTAGAGTCCATATAAGTACATTTTTAAAGGCAAATCAATTG
TA
TACTGTAGTAAATTGTGTGCTGTGGTTCACATTTTGGCCTTGACCATGATTTAATTT
TT
TGTTGATGGAGCTGGGTGGACAGTGCACACTCAGCTCAAAACATCCAAGCCCAACTA
TA
TCACCCAAAACCATGTGG
【0149】
バクテリアベクター配列:
CGACGGCGACTCCCATCGGCAATTTCTATGACACCAGATACTCTTCGACCGAACGCC
GG
TGTCTGTTGACCAGTCAGTAGAAAAGAAGGGATGAGATCATCCAGTGCGTCCTCAGT
AA
GCAGCTCCTGGTCACGTTCATTACCTGACCATACCCGAGAGGTCTTCTCAACACTAT
CA
CCCCGGAGCACTTCAAGAGTAAACTTCACATCCCGACCACATACAGGCAAAGTAATG
GC
ATTACCGCGAGCCATTACTCCTACGCGCGCAATTAACGAATCCACCATCGGGGCAGC
TG
GTGTCGATAACGAAGTATCTTCAACCGGTTGAGTATTGAGCGTATGTTTTGGAATAA
CA
GGCGCACGCTTCATTATCTAATCTCCCAGCGTGGTTTAATCAGACGATCGAAAATTT
CA
TTGCAGACAGGTTCCCAAATAGAAAGAGCATTTCTCCAGGCACCAGTTGAAGAGCGT
TG
ATCAATGGCCTGTTCAAAAACAGTTCTCATCCGGATCTGACCTTTACCAACTTCATC
CG
TTTCACGTACAACATTTTTTAGAACCATGCTTCCCCAGGCATCCCGAATTTGCTCCT
CC
ATCCACGGGGACTGAGAGCCATTACTATTGCTGTATTTGGTAAGCAAAATACGTACA
TC
AGGCTCGAACCCTTTAAGATCAACGTTCTTGAGCAGATCACGAAGCATATCGAAAAA
CT
GCAGTGCGGAGGTGTAGTCAAACAACTCAGCAGGCGTGGGAACAATCAGCACATCAG
CA
GCACATACGACATTAATCGTGCCGATACCCAGGTTAGGCGCGCTGTCAATAACTATG
AC
ATCATAGTCATGAGCAACAGTTTCAATGGCCAGTCGGAGCATCAGGTGTGGATCGGT
GG
GCAGTTTACCTTCATCAAATTTGCCCATTAACTCAGTTTCAATACGGTGCAGAGCCA
GA
CAGGAAGGAATAATGTCAAGCCCCGGCCAGCAAGTGGGCTTTATTGCATAAGTGACA
TC
GTCCTTTTCCCCAAGATAGAAAGGCAGGAGAGTGTCTTCTGCATGAATATGAAGATC
TG
GTACCCATCCGTGATACATTGAGGCTGTTCCCTGGGGGTCGTTACCTTCCACGAGCA
AA
ACACGTAGCCCCTTCAGAGCCAGATCCTGAGCAAGATGAACAGAAACTGAGGTTTTG
TA
AAC
【0150】
ブタIgG:
GCCCCCAAGACGGCCCCATCGGTCTACCCTCTGGCCCCCTGCGGCAGGGACGTGTCT
GG
CCCTAACGTGGCCTTGGGCTGCCTGGCCTCAAGCTACTTCCCCGAGCCAGTGACCGT
GA
CCTGGAACTCGGGCGCCCTGACCAGTGGCGTGCACACCTTCCCATCCGTCCTGCAGC
CG
TCAGGGCTCTACTCCCTCAGCAGCATGGTGACCGTGCCGGCCAGCAGCCTGTCCAGC
AA
GAGCTACACCTGCAATGTCAACCACCCGGCCACCACCACCAAGGTGGACAAGCGTGT
TG
GAATACACCAGCCGCAAACATGTCCCATATGCCCAGGCTGTGAAGTGGCCGGGCCCT
CG
GTCTTCATCTTCCCTCCAAAACCCAAGGACACCCTCATGATCTCCCAGACCCCCGAG
GT
CACGTGCGTGGTGGTGGACGTCAGCAAGGAGCACGCCGAGGTCCAGTTCTCCTGGTA
CG
TGGACGGCGTAGAGGTGCACACGGCCGAGACGAGACCAAAGGAGGAGCAGTTCAACA
GC
ACCTACCGTGTGGTCAGCGTCCTGCCCATCCAGCACCAGGACTGGCTGAAGGGGAAG
GA
GTTCAAGTGCAAGGTCAACAACGTAGACCTCCCAGCCCCCATCACGAGGACCATCTC
CA
AGGCTATAGGGCAGAGCCGGGAGCCGCAGGTGTACACCCTGCCCCCACCCGCCGAGG
AG
CTGTCCAGGAGCAAAGTCACGCTAACCTGCCTGGTCATTGGCTTCTACCCACCTGAC
AT
CCATGTTGAGTGGAAGAGCAACGGACAGCCGGAGCCAGAGAACACATACCGCACCAC
CC
CGCCCCAGCAGGACGTGGACGGGACCTTCTTCCTGTACAGCAAACTCGCGGTGGACA
AG
GCAAGATGGGACCATGGAGACAAATTTGAGTGTGCGGTGATGCACGAGGCTCTGCAC
AA
CCACTACACCCAGAAGTCCATCTCCAAGACTCAGGGTAAATGAGCCACCCGCTGCAC
CC
CACGTGCTCTCGGGTCCCGCGAGCTCGCCTGAGCCCCAGCGCTGTGTACATACGTCC
CG
GGCCAGCATGAAATAAA
【0151】
2) 配列特異的RNAi の抗WSSV防御性において検討されたもの
RR (WSSVのリボヌクレオチド還元酵素の小ユニット):
ACATTTCCCAGAGATCTTCATGGACAATGGAGCGGGATACAAAACGGTTGGGGTTTT
CT
CTTGTAAGTAAGTGTTTAGACGTATCTACTTGCATAATGAGTTTTTTGGTGAATTTG
TC
AAACACTTCCTGGGCAATCCTCTTTTCCTCCTCGGTTTTATATTCTGACTTGATTTC
TT
CAGCCACTTGGTTGGCTTGCTCCATATTCAGACCAGTAACGGTGAACAGTTTGATTG
AC
TCCATTTCTGGGGTTGTTGGTATTATTGGAGTAATAATGGAAGTTGACGGTAGGACC
GA
TGACGAGGGAATGATGCTGTGGTGTGAGAAGTGGCCATATTTATACTCATGCGGCTG
AG
TCTGGAGGGGGGGGTTGCCATCAATCAGCCTTTTTAGTCGGTATCGGAATCAGTGTG
GC
CAATTCACAAACCATCTCTGCTCTTTATTTTGCAGACGGTCTCAAATACACCCTTCT
GG
TCTTGCAAGATCTCCTCAATAACTGGTCGATGTCTTCAATTTTTATGTAGGAAGTCT
TT
CATGGAAGATATTTNCTGGTTGTTCACAAANGCCCACAGTTCCTTATATCTGGT
【0152】
vp28(WSSVの外殻タンパク質):
ATGGATCTTTCTTTCACTCTTTCGGTCGTGTCGGCCATCCTCGCCATCACTGCTGTG
AT
TGCTGTATTTATTGTGATTTTTAGGTATCACAACACTGTGACCAAGACCATCGAAAC
CC
ACACAGACAATATCGAGACAAACATGGATGAAAACCTCCGCATTCCTGTGACTGCTG
AG
GTTGGATCAGGCTACTTCAAGATGACTGATGTGTCCTTTGACAGCGACACCTTGGGC
AA
AATCAAGATCCGCAATGGAAAGTCTGATGCACAGATGAAGGAAGAAGATGCGGATCT
TG
TCATCACTCCCGTGGAGGGCCGAGCACTCGAAGTGACTGTGGGGCAGAATCTCACCT
TT
GAGGGAACATTCAAGGTGTGGAACAACACATCAAGAAAGATCAACATCACTGGTATG
CA
GATGGTGCCAAAGATTAACCCATCAAAGGCCTTTGTCGGTAGCTCCAACACCTCCTC
CT
TCACCCCCGTCTCTATTGATGAGGATGAAGTTGGCACCTTTGTGTGTGGTACCACCT
TT
GGCGCACCAATTGCAGCTACCGCCGGTGGAAATCTTTTCGACATGTACGTGCACGTC
AC
CTACTCTGGCACTGAGACCGAGTAA
【0153】
(実施例1)
(海洋エビ、リトペナエウス バンナメイにおけるウイルス感染を防止する、dsRNA介在遺伝的干渉の使用)
この実施例において、WSSVのゲノムにおいてコードされる遺伝子に相当するdsRNAでのエビの処理が、WSSVの感染から効果的にエビを防御することが示される。これらの結果は、エビにおけるRNA干渉の最初の証拠を提供し、かつ水産養殖における、dsRNA関連治療法を使用する抗ウィルスストラテジーを開発する可能性を広げる。
【0154】
エビ、及びWSSV:これらの研究で使用した生物測定系、実験動物、WSSV接種は、別記されている。簡潔に述べると、リトペナエウス バンナメイ(1〜2 g)を個々に、260 mlの組織培養フラスコに入れ、毎日100%の水交換(人工海水、Marine Environment(登録商標))をしながら、3日間馴らした。餌としては、市販餌料ペレットの小片(約ペレット半分)が、毎日与えた。その後、記載のように、動物をdsRNAの筋内注射で処置し、かつ注射、又は経口投与のいずれかにより、WSSVを感染させた。死亡率を毎日記録し、かつ水交換、及び給餌法は、前記の通り行った。
【0155】
WSSV、及びエビEST、及びdsRNA の調製:WSSVチャレンジ実験から調製されたサプレッションサブトラクションライブラリー(PCR セレクト、Clontech社)を含むL. バンナメイのEST コレクション( http ://www. marinegenomics. org)を、WSSV、及びエビ発現の遺伝子の出所として使用した。この研究で使用された全てのESTは、国立バイオテクノロジー情報センター(NCBI)のデータベースに登録されていた。エビシグナル伝達性転写因子(STAT)の部分、及びIカッパB キナーゼ触媒サブユニット(IKBK)をコードするESTは、アクセッション番号CA991435、及びCA9914534を有する。へモシアニン、及PJV627様の部分に相当する配列は、 www. marinegenomics. org で入手可能である(各々、L. バンナメイ ID 番号 1405、及び1263)。PJV627は、マルスペナエウス ジャポニクス(Marsupenaeus japonicus)(クルマエビ)由来の、機能未知のESTである(Rojtinnakornの論文, 2002 #430)。また、WSSV遺伝子のvp28、リボヌクレオチド還元酵素の小サブユニット、及びDNA ポリメラーゼのESTは、www.marinegenomics.org で見い出すことができる(各々、L. バンナメイID 番号6321、6390、及び5789)。EST 挿入断片の全体、又は部分を、標準的条件下で、SP6、又はT3、及びT7ファージプロモーターを使用する、両方向インビトロ転写用に、pBluescript (Strategene)、pGEM-TEZ (Promega)、又はpCR4-TOPO (Invitrogen)へサブクローニングした。一本鎖RNA転写産物を、有機溶媒で抽出し、かつ標準的方法を使用してエタノール沈殿した。相補鎖を、10 mM Tris-Cl, 400mM NaCl, pH 7.5の溶液中、75℃で15分間、65℃で15分間、及び常温で15分間アニールさせた。dsRNAの形成は、アガロースゲル電気泳動のサイズの移動によりモニターし、dsRNAの濃度は、分光光学的に測定した。dsRNAを合成するために使用した該IKBKのEST断片は、CA991434の第15〜390番目の塩基に相当し、STAT dsRNAを作成するために使用したSTATのEST断片は、CA991435の第14〜383番目の塩基に相当する。該完全長のESTを使用し、ヘモシアニン、PJV627様、及び全てのWSSV遺伝子のdsRNAを作成した。dsRNA の配列非依存性の抗ウイルス効果のコントロールとして、アヒル、アナス プラテュリュンコスの免疫グロブリンυ(アクセッション番号 AJ312200)由来の309塩基対をコードするコンストラクトを使用した。
【0156】
発現解析:動物を犠牲にし、解剖し、組織はRNAレイター(Ambion社)に浸漬し、使用するまで、20℃で保存された。全RNAを、RNイージーキット (Qiagen社)を用いて単離した。ノーザン解析には、RNAをホルムアルデヒド-アガロース電気泳動で分離し、ナイロン膜に転写し、記載のとおり32P標識DNAでプローブした。ナイロン膜を標準的手法で洗浄し、データをオートグラフィーにより得た。プローブは、完全長のEST 挿入断片から調整した。RT-PCR には、一本cDNAをパワースクリプト RT(Powerscript RT)(Clontech社)を用いて調製し、オリゴdTを起点として反応が開始された。その後、該反応物を2倍に希釈し、1 μlを遺伝子特異的プライマーによるPCRの鋳型として使用した。PCRの条件は、94℃で2分間(94℃で30秒間、65℃で30秒間、72℃で1分間)の反応26 サイクル、72℃で 2分間であった。STAT mRNAは、下記プライマーで検出した:順方向、CTG TCT GAG CGA AAC TTC ACA、及び逆方向、AAG TCA GCG ATC ACA TCA GCT。IKBK mRNAは、下記プライマーで検出した:順方向、CCA GCA ACT AGA AGG CTC ACT、及び逆方向、CGG TTC TTG CTG CAT CTT GCA。リボソームタンパク質S3A mRNAは下記プライマーで検出したを用いて検出された:順方向、CCA GAA TGA GAC TGA TGC TGA、及び逆方向、CAC GGG TGA TAA TGT CTA CCA。
【0157】
(結果)
dsRNAは、エビにおける同起源細胞のmRNAの特異的消失を引き起こす:RNAi経路の幅広い保存に基づいて、我々は、RNAiに類似したメカニズムが L. バンナメイに存在するという仮説を立てた。これを調べるために、我々は、エビ遺伝子の部分へのdsRNAをエビに注入し、標的mRNAの相対的レベルをノーザンブロット解析と、RT-PCRにより解析した。図1aは、ヘモシアニンdsRNAの注入が、肝膵臓におけるヘモシアニンmRNAのレベルを劇的に低下させることを示している。このmRNAの消失が、ヘモシアニンの配列特異的であるのは、無関係な遺伝子(PJV627様)をコードするdsRNAの注入はヘモシアニンの発現に影響せず、ヘモシアニンのdsRNA注入エビは、この無関係なmRNAを、正常なレベルで発現するからである(図1a)。また、dsRNAで、この機能未知の遺伝子を標的にしても、その相当するmRNAの検出可能な消失をもたらさないことは、明らかである。この効果なく標的にされたmRNAに関連した、低分子のハイブリダイゼーションシグナルは観察できることは、中間体の分解産物が、推定上のRNAiメカニズムの活性化に由来することを示唆する。同様の中間体は、ショウジョウバエ細胞において、RNAiの誘導時に見い出されている。dsRNA誘導のmRNA消失が遺伝子特異的であり、かつ転写、及び翻訳の調節、細胞内細分化、及び、各々のmRNAに特異的な他の特徴により、影響を受け得ることは妥当であると思われる。
【0158】
さらに、我々は、特異的mRNAの発現低下が、該エビ系における他の遺伝子、及び他の組織においても達成できることを確認した(図1b、及びc)。我々は、エビのシグナル伝達性転写因子(STAT)、及びIカッパBキナーゼ触媒サブユニット(IKBK)のcDNAの部分に相当するdsRNAを注入した。生理的食塩水を注入された動物と比較した時、dsRNA処理動物の鰓から、それに相当するmRNAが消失することは、RT-PCRにより示される。この低下の該配列特異性は、全動物におけるリボゾームタンパク質のmRNAの発現が影響を受けないこと(図1b、及びc)、及びSTAT dsRNA処理動物におけるIKBK mRNAの正常な発現、及び逆もまた同様であること(データは図示せず)によって、示される。しかしながら、同起源dsRNAに誘導のmRNAの消失は、完全ではなく、かつdsRNA処理後のRT-PCRにより、STAT、及びIKBK の両方のmRNAsの痕跡が、依然として検出された。また、発現レベル、及びdsRNA誘導のmRNA消失の効率との両方に見られる多少の個体差がある。
【0159】
WSSV遺伝子の部分をコードするdsRNAは、WSSV感染を防御する:同起源dsRNAの注入の、特異的遺伝子発現における効果に関する我々のデータにより、L. バンナメイに、RNAi様経路が存在することが示唆される。ウイルス特異的遺伝子に対するdsRNAを使用し、そのような経路を誘導できるのであれば、複製、及び発症機序に必須の遺伝子産物の発現を妨げることによって、抗ウイルス防御性を実現できるのではないかと、推論した。図2aにより、WSSV遺伝子の部分をコードするdsRNAによって処理された動物が、ウイルス感染から強く防御されることが示されている。前記のように、dsRNAは、遺伝子配列非依存的に、エビにおいる抗ウイルス状態を誘導する;しかしながら、この防御性は限られたものであり、比較的高いウイルス投与量では、無効なものになり得る(図2のアヒルυを参照)。WSSV特異的遺伝子をコードするdsRNAの注入は、無関係なdsRNA処理動物より、かなり高い生存率をもたらす。これらのデータにより、dsRNAがエビにおけるRNAi経路を活性化し、ウイルス遺伝子の発現を妨げ、抗ウイルス防御性をもたらし得ることが示唆される。興味深いことに、これらの研究で調べた3種のWSSV遺伝子のどの1種の発現を妨げても、同様に強い抗ウィルス防御性を提供する。これら3種の候補遺伝子は、WSSVの生活環において必須であるらしいので選択した:ゲノム複製に重要な推定上の初期酵素として、リボヌクレオチド還元酵素(RR)の小サブユニット、及びとDNAポリメラーゼ、及びWSSV発症機序に重要であると示唆されてきた、外殻の構造上の構成成分として、vp28である。RNAiがエビにおいて全身的に作用しているようであるいう観察(図1)に一致して、RR用dsRNAの筋内注射は、同じ経路による感染を予防するだけでなく、動物にWSSV陽性の組織を給餌することにより負わされた感染からも、投与量依存的に予防する(図2b)。
【0160】
(実施例2)
(4種のWSSV遺伝子をコードするdsRNAによる抗WSSV防御性のさらなるキャラクタリゼーション)
課題1は、選択されたWSSV遺伝子の初期の比較を提供することを目的とする。ESTクローンの質、及びウイルス複製における、該遺伝子の予測される役割に基づいて、dsRNAの、防御効果を生じる有効性の違いを見い出し得る。これらの実験により、dsRNA作製方法が確立され、我々のWSSVのESTコレクション由来の最も重要なクローンのいくつかの評価が可能になるであろう。
【0161】
(4種のWSSV遺伝子(vp26、vp19、チミジル酸キナーゼ、DNAポリメラーゼ)のクローニング、及び長いdsRNAの作成)
(方法)
4種より、むしろ6種のWSSV遺伝子を使用した。これらは、vp19(外殻タンパク質、GenBankアクセッション番号AA069661);vp26(ヌクレオキャプシドタンパク質、GenBankアクセッション番号AA069663);vp28(外殻タンパク質、GenBankアクセッション番号AAL33423);VF(機能未知のウイルスタンパク質、GenBankアクセッション番号AAL33255)、DNAポリメラーゼ(ウイルスゲノムの複製に関与する酵素、GenBankアクセッション番号NP_478036)、及びZF(推定上のジンクフィンガー転写因子、フィンガー転写因子NP_477987)。これらの遺伝子を、それらの公知、又は推側される機能に基づいて、潜在的標的として選んだ;そのうち2種は(vp19、及びvp28)は、宿主細胞のウイルスの感染に関与し、かつワクチン作成のための標的であることが示唆されてきた外殻タンパク質である(Witteveldt J、 Vlak JM、及びVan Hulten MCの論文「WSSVのサブユニットワクチンを用いた、ペナエウス モノドンのホワイトスポットシンドロームウイルスに対する防御性」(Fish Shellfish Immunol. 2004 May ; 16 (5): 571-9));該vp26タンパク質はヌクレオキャプシドの構成要素として知られている;DNAポリメラーゼはウイルスゲノムの複製に必須であるはずである;かつ、ZFは、該WSSVゲノムの発現制御に推定上関与している。従って、これらの遺伝子は、WSSVの少なくとも4種の相異なる機能に相当し、それゆえ、RNAi介在発現低下による、感染に対する防御性のための標的範囲に相当する。該遺伝子を、我々のESTコレクションからPCRにより増幅し、互いに逆の方向性をもつファージプロモーターをもつベクター(対象の挿入断片がT7、及びT3の側面に位置される、Invitrogen 社のpCR4)へサブクローニングした。プラスミドDNAを精製し、直線化し、該RNAのインビトロ転写に使用した。そのRNAを精製し、アニールし、質をゲル電気泳動により調べ、かつ定量した。ミリグラム量のRNAの作成のため、合成反応の規模拡大を許容する、改質されたRNA合成プロトコルに従った。
【0162】
(結果、及び考察)
vp19、及びチミジン酸キナーゼを除く、上記同定遺伝子は、該ESTコレクションからうまく増幅され、対象となるベクターにクローニングされた。vp19をコードする遺伝子は、WSSV感染エビの組織からのPCR増幅によってクローニングされた。クローニングされた全ての遺伝子の同定は、配列決定により確認され、組み換えコンストラクトの機能性は、インビトロ転写により調べられた。一本鎖RNAと、アニールされたdsRNA産物は、図3に見られるように、アガロース電気泳動により分析された。典型的なインビトロ転写反応は、lμg DNA鋳型あたり、約25μg dsRNAの収率である。
結論:1. ウイルス遺伝子のクローニング、及びインビトロ転写の方法が応用され、かつ標準化されている。2. ここで応用された該技術を用いて、ESTクローンや配列情報が入手可能な、任意のエビウィルスの選択された対象の遺伝子から、dsRNAを作成することが可能であるはずである。
【0163】
(実施例3)
(WSSV感染に対する防御性のための、単独、及び組合せのdsRNAの調製)
(方法)
該先行実施例の5つの遺伝子の、WSSVによる感染からエビを防御する能力を調べた。行った実験は、下記のとおりであった:1) WSSV感染エビの組織(1日当たり体重の5%)を2日間給餌し、ウイルスの感染量を与えた。コントロール(非感染)動物には、非感染エビの組織(1日当たり5%)を、2日間給餌した。WSSVのLD90量の注入より、このウイルスの致死量の経口チャレンジを選択したのは、それが、現実の世界の環境における、ウイルスチャレンジのより典型であり、かつ該エビの耐性の、より一層ストリンジェントな試験を提供するからである。WSSV遺伝子の防御効果は、非特異的dsRNA(例えば、アヒルIgY)の効果と比較しなかった。非特異的刺激を用いた、この研究において得られた結果を、ウイルス特異的配列を用いた我々の初期の結果と比較すると、任意のWSSV遺伝子のdsRNAを用いて、数倍高い防御効果が達成され得ることが、かなり明らかであった。その上、特異的dsRNA(vp19)、及び非特異的dsRNA(ポリC:G)の防御効果の比較は、実施例5の表、及び図9に示された実験に含まれる。dsRNA(12 μg)の注入は、経口チャレンジを開始する4〜6時間前に、筋肉内に行った。Kruskal-Wallis方法を用いる一元配置ANOVAを使用して、統計解析を行った。
【0164】
全ての試行において、25個の水槽からなる再循環系で、該動物にウィルスチャレンジを行った。各水槽は、集水排水槽へと排水され、該水は、生物フィルターを通される前に、5 μmへろ過される。該水は、各水槽に戻る前に、1 μmへろ過され、40 W UV 滅菌機(9 x 105 W/cm2s)で処理される。動物には、1日に1〜2個の市販餌ペレットを給餌した。フィルターは定期的に交換した。塩分濃度は30pptに、温度は27℃に維持した。全てのウィルス接種に先立ち、48時間の馴化期間があった。毎日、死亡率をモニターし、死んだ動物は除去した。水槽当たりの動物(1〜3 g)は、10個体で、処理当たりの水槽は3個であった。
【0165】
(結果、及び考察)
該防御性実験において、5種の選択されたWSSV遺伝子の有効性は、多様であった(図4):該ZF、及びとvpl9遺伝子は、良好な防御性を示した(非感染動物より、より良好:80〜86%生存)のに対し、他の3種の遺伝子(vp26、vp28、及びVF)は、低い防御性を示した(40〜52%の間)。5種全てのdsRNAの混合物を調べたところ、10日間で70%の生存率という、中間の防御性を示した。全ての遺伝子、及びdsRNAの混合物は、VFを除いては、ポジティブコントロールから、有意に異なっていた(P=0.072)。vpl9、ZF、及びその混合物 (P<0.001) は、WSSVのポジティブ処理と比較して、ネガティブコントロールより、若干より有意な生存をもたらした(P=0.003)。該ネガティブグループの死亡率は、予想外であったが、PCRにより調べたところ、不慮のWSSV感染によるものではなかった。該ネガティブグループの死亡率は、該結果の解釈、又は有意性に影響を与えなかった。最も防御性の高い遺伝子、vpl9、及びZFは、最も防御性の低い遺伝子VFより、有意に異なっていた(各々、P=0.011、及び0.016)。
【0166】
結論:1. vpl9、及びZFをコードする12 μgマイクログラムのdsRNAの筋肉内注射による投与は、致死量の経口ウイルスチャレンジにに対して、本質的に完全な防御性ををもたらした。他の調べられた3種の遺伝子は、防御的ではあったが、有効性は低かった。
2. 5種のdsRNAの混合物は、5種の遺伝子が個々にもたらす効果の範囲の中間の防御性をもたらした。
【0167】
(実施例4)
(dsRNAは海洋性無脊椎動物(エビ)における、一般的な抗ウィルス免疫を誘導する)
最初に、我々が、エビへのdsRNAの注入が、抗ウイルス防御性をもたらすことを見い出したのは、タウラシンドロームウイルス(TSV)でのウイルスチャレンジの結果における、シグナル伝達経路のRNAi介在発現減少の影響を調べているときであった。我々の実験アプローチは、精製された同起源dsRNAを注射し、その後、動物をTSVでチャレンジし、対象の遺伝子が発現低下した動物が、ウイルス感受性の増大を示すかどうかを検討することである。驚いたことに、任意のdsRNAの注入が、エビの遺伝子に相当していようが、非特異的dsRNAコントロールであろうが、TSVチャレンジに対する生存増加をもたらした(図示せず)。この初期の観察が、脊椎動物においてと同様に、dsRNAが、エビにおいて抗ウイルスプログラムを誘導し得るという可能性に我々が取り組むきっかけになった。
【0168】
エビにおいて、dsRNAが一般的な抗ウイルス応答を誘導するかどうかを検討するために、一本鎖RNAウィルスであるTSV(Bonamiらの論文、J. Gen. Virol. 78 (Pt. 2): 313-319 (1997))での感染、及び複雑な外殻に包まれた二本鎖DNAウイルスであるWSSV(Mangらの論文、J. Virol. 75: 11811-20 (2001))での感染における、dsRNA処理の効果を分析した。dsRNAで処理した動物においては、偽処理動物に比べて、50〜75%の累積死亡率の減少が観察された(図1 a、及びb)。 エビが、有意に高いTSV量に晒された時は、抗ウイルス防御性レベルが低下した(約12%)(図5a)。このことは、任意の免疫応答のように、エビにおけるdsRNA誘導抗ウイルス防御性は、感染源の負荷を増大させることにより、無効なものになり得ることを示唆している。図3に要約された実験において、TSV、及びWSSV両方に対する防御に使用されたdsRNAは、アヒル免疫グロブリンγの重鎖の遺伝子から転写した。この配列は、いかなる公知のエビ遺伝子、又はWSSV(アクセッション番号NC_003225)、又はTSV(アクセッション番号NC-003005)の該ゲノムとも類似性をもたない。従って、アヒルdsRNAによって誘導される、該観察された抗ウイルス応答は、配列特異的なRNAi経路を含む可能性は低く、それゆえに、2つの無関連なウイルスに対して活性をもつ、より一般的な抗ウイルスメカニズムに相当し得る。
【0169】
培養媒体、及び飼育条件を含む、該実験で使用されたウイルスチャレンジ系を、高度に標準化したにもかかわらず、累積死亡率に相当する絶対値は、完全に一致しているわけではない。多様性は、使用されたエビのバッチ間の相違に起因し得ると考えられている。該実験は、比較的若いエビ(平均体重1〜3 g)を必要とするので、長期に渡って単一バッチ由来のエビを使用することは、実行不可能である。
【0170】
予備実験(データは図示せず)により、1 μg dsRNAが、WSSV感染に対する防御性を誘導するために必要な最低有効投与量に近いこと、及び100 μgまでの dsRNAが、明らかな毒性の徴候を生じずに、1〜2 gのエビに注入できることが示唆された。従って、ここで報告された該研究では、それ以降、中間投与量7〜15 μgを使用し、エビにおける、dsRNA誘導抗ウイルス応答の特徴を調べた。
【0171】
抗ウィルス防御性におけるdsRNA投与量の効果:下記の表に、WSSVでの感染に先立ち、異なる投与量のアヒルυdsRNAが注射された実験を要約する。最終的な累積死亡率(CPM)の値を示す。
【0172】
【表1】

【0173】
独立した実験において、より高いdsRNA 投与量の力価測定を行い、1 g以上のdsRNAが、WSSVチャレンジによる生存に(正か負かの)効果があるかどうかを判断した。得られた累積死亡率の値は、下記の表に要約する。
【0174】
【表2】

【0175】
該実験条件を同一に維持したにもかかわらず、これら2つの測定において、ポジティブコントロール、及び防御グループのCPMの絶対値は多少異なった。しかしながら、該dsRNAの防御効果は一致した。まとめると、これらの投与量依存性により、常に、約1 μg(アヒルυの)dsRNAが、1〜2 gのエビを、WSSVでの準LD100感染に対して防御することが示唆される。また、1 μgが防御性の閾値に近くであり得ることが示唆される。従って、毒性の徴候なく、100 μgまでのdsRNAを、エビに注入していたので、以後の実験では7〜15 μgを使用することに決定した。
【0176】
dsRNAによる抗ウイルス状態の誘導が、配列非依存性であることの立証を、4種の様々なタイプの無関係なdsRNA配列で処理後、エビをWSSVでウイルスチャレンジすることにより示した。脊椎動物の免疫グロブリン遺伝子(アヒル、及びブタ)、魚類の非コード領域のゲノムDNA、及び、バクテリアのベクター配列(pBeloBAC 11 ベクター)に由来する配列を使用した。これらの配列の各々は、WSSV感染に対する防御性を誘導した(図5b)。dsRNA処理がウィルスの感染を阻害するのか、或いは宿主におけるウィルスの蓄積に影響せず、WSSV誘導死亡率の減衰をもたらすのかを判断するために、dsRNAによる前処理の有無の場合にWSSVチャレンジされたエビにおいて、組織学的解析を行った。ウィルス感染後36、及び72時間に、コントロール、及びdsRNA処理エビの間でWSSVウィルス粒子の蓄積と古典的な組織損傷の存在を調べたところ、劇的な相違が観察された(データは図示せず、及び図5c)。コントロール感染動物の組織学切片では、胃とクチクラ表層組織の核(データは図示せず)において、造血組織(図5c)と同様に、大きな好塩基顆粒状のウィルス封入体が見られた。これらの特徴は、dsRNA処理で防御された動物には存在しなかった。これらの観察により、dsRNA処理エビにおいては、おそらく抗ウィルス防御系の誘導により、WSSVが有意に蓄積しないことがを示唆される。全体として、これらのデータにより、dsRNAが、配列に非依存的に、エビにおける抗ウィルス応答を誘導するという結論が支持される。
【0177】
(防御性のある最低投与量)
(方法)
WSSVチャレンジに対してもたらされる防御性における、dsRNAの投与量の効果を調べるために、下記の実験計画を採用した。最大、及び最小の防御性をもたらす2種のdsRNA、各々vp19、VFを、"最強"(10 μg)と、10倍毎の低い希釈(1、及び 0.1 μg)での実験に選んだ。該dsRNAを、WSSV感染組織での経口チャレンジの4〜6時間前に、筋肉内に注入し、10日間にわたり生存を評価した。Kruskal-Wallis法を使用し、統計的有意性を判断した。
【0178】
(結果、及び考察)
結果(図6)により、vp19がウイルスチャレンジに対して、より優れた防御物であったことが確認され、また、両遺伝子において該防御効果が希釈され得ることが示された。1 μg投与量のvp19は、10 μg投与量ほど良好な防御性をもたらした(80%対90%)が、0.1 μgでは、該防御性は、36%に落ちた。全てのvp19投与量(10、1、及び0.1 μg)は、統計的に、該ポジティブコントロールとは異なっていた(各々、P<0.001、<0.001、及び0.023)。該0.1 μg投与量は、他の2種の投与量より、有意に防御効果が低かった(P=0.002)。VF dsRNAの場合、3種の投与量での防御性は、各々、72%、46%、及び38%であった。また、これらの全ての投与量(10、1、及び0.1 μg)は、ポジティブコントロールとは有意に異なっていた(P<0.001、0.013、及び 0.016)。統計的解析により、VFの最高投与量は、vp19の高い投与量と同様である(10 μg P=0.009、及び1 μg P=0.010)こと、かつVFの低い投与量は、vp19の最低投与量とグループ化されることが示された(P=0.002〜0.003)。
【0179】
(結論)
1. 10、及び1 μg の投与量で、VFと比べて、vpl9のより優れた防御効果を確認した。
2. dsRNAによる防御性の有効性を、希釈による力価の評価を行い、0.1 μgではvp19、及びVF両方において、約36〜38%であった。
【0180】
抗ウイルス状態の誘導はRNAに起因する:生得的免疫の潜在的誘導因子には、感受性の高い細胞に対し、比較的低濃度で強い効果を及ぼすものもある。我々は、ウイルスチャレンジに対するdsRNA処理動物の相対的耐性が、有機溶媒抽出中にdsRNAと共精製され得る、該dsRNA調整品内の夾雑物(例えば、LPS、DNA)に起因するという可能性を考察した。さらに、我々は、dsRNA処理とウイルス注入の間に72時間経過するときでさえ、該RNA調製品内の該化合物が、我々の研究で使用された該ウイルスを、直接不活性化し得るという可能性を考察した。これらの問題に取り組むため、我々は、動物に、2工程dsRNA投与体制を受けさせる一連の実験を行った:最初に、以前に行われたように、ウイルスチャレンジの72時間前にdsRNAを注入し、かつその後、該ウイルス調製品と混合したdsRNAの追加投与量を与えた。もし、該dsRNA調製品内のの夾雑物が、該ウイルスの直接の不活性化の原因になっているのであれば、該dsRNAの調製品と混合されたウイルス接種物を注入されたエビにおいて、高い生存率が観察されるであろうと推論した。図7には、ウイルスチャッレンジ72時間前に与えられた1回のdsRNA投与量が、dsRNAの2回投与(感染72時間前、及びウイルス/dsRNA混合物の注入)と同程度に、WSSVに対してエビを防御することが示されている。さらに、dsRNAが、該ウイルス接種物との混合物としてのみ注入されたときは、72時間前処理、又はdsRNAでの二重の処理と比べて、弱い防御性(死亡率において10%以下の減少)が観察された。これらの結果は、dsRNAによる、或いは、推定上の夾雑物によるウイルスの直接の不活性化が、該観察された抗ウイルス防御性を説明できないことを示している。さらに、図7bより、RNアーゼ処理が我々の調製品によってもたらされる抗ウイルス防御性を損なったこと、かつ2種の異なる方法(有機溶媒抽出、又はシリカ充填剤による吸着)による、インビトロ転写反応から精製されたdsRNAが、同様の抗ウイルス応答誘導する能力もつことが示されている。まとめると、これらの結果により、(dsRNA調製品内に存在する他の化合物でなく)RNA自身が、エビにおける該観察された抗ウイルス免疫の誘導因子であることが示される。
【0181】
ポリC-Gは抗ウィルス状態を誘導するが、ポリI-C、又はポリCはしない:ポリI-Cは、脊椎動物における、生得的抗ウイルス応答の有力な誘導因子であり、かつこれらの系において、dsRNAの生物学を研究する一般的な実験ツールである。我々は、これ、又は他の市販合成RNAも、エビにおける抗ウイルス応答を誘導するという可能性について検討した。図8より、ポリI-CがWSSV感染に対する防御性を誘導しなかった一方で、別のdsRNAアナログ、ポリC-Gが抗ウイルス防御性の極めて効果的な誘導因子であったことが示される。この結果により、脊椎動物とエビの間のdsRNAの認識機構の相違が示唆され、かつdsRNAが、それが調整、又は精製される方法と無関係に、エビにおける抗ウイルス応答を誘導し得るという概念が裏付けられた。重要なことに、合成ssRNAであるポリCは、抗ウイルス防御性を誘導できなかったので、エビの抗ウイルス系は、その脊椎動物対応系のように、ssRNAとdsRNAを識別し得ることが示唆された。
【0182】
エビにおけるdsRNAにより誘導される抗ウイルス応答の、正確な分子の性質は、依然として不明である。無脊椎動物種における、dsRNAへの認識、及び応答の分子機構のキャラクタリゼーションは、生得的抗ウイルス免疫の進化の理解の手掛かりになるであろう。dsRNA誘導全身性抗ウイルス応答は、他の無脊椎動物にも存在するであろうと仮定されている。他の無脊椎動物において、この応答が広範囲に存在することは、無脊椎動物における逆遺伝学的解析に、RNAiの使用が重要な意味をもつであろう。
【0183】
(実施例5)
(特異的(WSSV)dsRNAにより生じた防御性における、非特異的dsRNAのアジュバント効果)
(方法)
遺伝子特異的dsRNAの調製の経費と複雑さは、商品化に対する重大な障害となりうるだろう。このため、非特異的dsRNA(ポリC:G)の添加が、希釈によって見られるWSSV特異的dsRNAの活性の消失を補償できるかを検討する、実験を計画した。従って、表1に示されるように、量が0.012〜1 μgの様々な量のvp19 dsRNAを、ポリC:Gと混合し、一定の投与量1 μgを保った。経口ウィルスチャレンジが開始される4〜6時間前に、エビにp19/ポリC:Gの混合物を注射し、かつ10日に渡って生存率をモニターした。Kruskal-Wallis方法を用いる一元配置ANOVAで、統計解析を行った。
【0184】
【表3】

【0185】
(結果)
図9に図示されるように、1 μg vpd19 dsRNAで処理したエビは、0.3331 μg vp19 dsRNAに0.6671 μgポリC:G添加と、本質的に等しい86〜92%の生存率を示した(P=0.574)。0.111 μg vp19 dsRNAで処理されたグループは70%の生存率を示し、0.037 μg、及び0.012 μg vp19 dsRNAで処理されたグループ(各々、0.963 μg、又は0.988 μg ポリC:G)は、20〜 30%の生存率を示したが、1 μgポリC:Gで処理した動物は、わずかな6%の生存率を示した。該vp19投与量を0.111 μgから0.037 μgへ減少させた時に、防御性の有意な低下が観察された(P<0.001)。
【0186】
(結論)
該実験実施例の累積された結果より、WSSV遺伝子をコードするdsRNAへのポリC:Gの添加が、ウイルスチャレンジ残存エビの割合を約2倍増加させることが示唆される。このことは、ウイルス遺伝子特異的dsRNAの生産経費が、ポリC:Gのものよりかなり高いと予想され得るので、非常に重要である。該増強効果の理由は不明であるが、全身性抗ウイルス応答の上昇に関連し得る。
【0187】
WSSV遺伝子(vp19)をコードするdsRNAの有効性が、非特異的dsRNA(ポリC:G)よりも高いことが、明らかに示された(有意性はP<0.001)。
【0188】
(実施例6)
(サッカロミセスにおける誘導的にウィルスdsRNAを発現する酵母発現ベクターの構築)
所望される遺伝子(WSSVのvp19、又はZFの配列)が操作上連結される、GAL1(ガラクトース誘導性プロモーター)、2種の選択マーカーURA(ウラシル遺伝子)、及びAMP(アンピシリン遺伝子)、該所望されるdsRNAに連結される所望される遺伝子を含む、プラスミドを構築した結果、サッカロミセスに導入されるときには、選択的条件下(ウラシル非存在下)で選択され得て、かつガラクトース誘導条件下で培養されるときには、該所望される遺伝子、及びdsRNAを発現するベクターが生じた(図10を参照)。図11に図式的に示すように、さらに、任意に酵母菌の実験が行い、発現の最適レベル、及びタイミング、及びdsRNAの収率を最適化するような培養の諸条件をもつ酵母株を選択する。
【0189】
図12に含まれる結果により示されるように、WSSVのVP19、又はZF配列を含む発現ベクターで形質転換された場合、サッカロミセス属酵母菌の形質転換体は、検出可能なレベルの、WSSVがコードしたdsRNAを発現する。該実例において、形質転換酵母菌から、10 μgトータルRNAを抽出し、vp19、ZF、及び(ポシティブコントロールとして)酵母アクチンのプローブを使用し、ノーザンブロットにより解析した。これらの結果により、WSSV関連RNAが酵母で発現していることが示され、かつ該ノーザン解析における検出特異性が明らかにされる。
【0190】
さらに、図13に含まれる該結果により示されるように、酵母菌は、WSSVのZF配列を含むベクターによって形質転換された場合、二重鎖RNAを発現する。これらの実験において、ZF発現ベクターでの形質転換体由来の10 μgトータルRNAを、ノーザンブロットにより解析した。該RNAの各鎖用のプローブ(アンチセンス、左、及びセンス、右)を用い、両方が、各々の標的を検出した。従って、これらの結果により、酵母菌が、WSSVのZF配列の両方の鎖を発現したことが確認された。さらに、図13に示されるように、内部標準(各ゲルの右の方)は、各試料中に存在する、WSSVのZF RNAの量(約50ナノグラム)の概算を可能にする。
【0191】
酵母菌が、所望されるdsRNAを、所望されるレベルで発現することが望まれていたが、結果は理論的には予期されたものではなかったのは、いかなる発現されたdsRNAも内在性RNアーゼによって分解され得るという有意な可能性のためである。これらの結果に基づき、酵母菌は、所望されるdsRNAをエビなどの甲殻類動物、及び他の無脊椎動物に送達するのに適した手段を提供するはずである。
【0192】
(実施例7)
(海洋エビにおける抗ウイルス免疫を調節するシグナル伝達経路への機能ゲノム学的アプローチ)
リトペナエウス バンナメイは、世界で最も幅広く養殖されているエビの種類で、甲殻類免疫の研究の重要なモデルである。十数の病原性ウイルスがエビに感染することが知られているので、生得的抗ウイルス応答、無脊椎動物免疫の従来軽視され一面の研究を行うの唯一の機会を提供する。これらのウイルス応答性遺伝子をキャラクタリゼーションすることにより、エビ‐ウイルス関係に関与する経路の種類に関する理解を得ることを目的とする。この目的へ向けて、我々は、コントロール、及びホワイトスポットシンドロームウイルス(WSSV)感染エビの組織を使用して、サプレッションサブトラクションライブラリー(SSH)を作製し、キャラクタリゼーションを行った。SSHライブラリー由来の単離クローンの発現解析により、推定上の免疫機能をもつ数種の遺伝子が、WSSV感染中に調節されていることが明らかにされる。エビ‐WSSV系を律する分子メカニズムの新規性は、配列解析に基づき機能がないとされている遺伝子の有意な割合により、強調される。我々は、2800種のエビ単一遺伝子を含む L. バンナメイのcDNAマイクロアレイを作成し、これらの動物における抗ウイルス応答に関連した遺伝子発現の変化を解析した。RNAiを使用する標的サイレンシングを組み合わせた、このエビcDNAマイクロアレイを用いる遺伝子発現の包括的解析は、甲殻類における、抗ウイルス応答と同様に、他の表現型応答を律する分子事象の理解の手掛かりになるであろう。
【0193】
(結論)
ここに示されるデータより、dsRNAが、海洋無脊椎動物における、ウイルス感染に対する防御性を誘導することが示される。これは、誘導性の一般的抗ウイルス免疫応答が、無脊椎動物において発現され得るという、最初の証拠を提供する。他の研究では、特定のウイルスタンパク質と同様に、微生物産物(例えば、LPS、及びβグルカン)が、エビにおける抗ウイルス耐性を増強できることが示唆されている(Changらの論文、Fish Shellfish Immunol. 15: 297-310 (2003); Hwangらの論文、Deu. Comp. Immunol. 23: 54552 (1999);Songらの論文、Dev. Biol. Stand. 900: 413-21 (1997);Takahashiらの論文、Fish Shellfish Immunol. 10: 555-8 (2000); Witteveldtらの論文、J. Virol. 78 : 2057-61 (2004))。しかしながら、我々の結果より、三様に、甲殻類における抗ウイルス免疫に関する我々の知識を向上させる。第一に、我々の結果より、2種の無関係なウイルス、TSV、及びWSSVに対して活性をもつ抗ウイルス免疫反応が示される。これらの結果をもとに提起される作業仮説は、dsRNAが、エビにおける一般的抗ウイルス応答を誘導するということである。第二に、エビの抗ウイルス免疫系は、(ポリI-Cの場合を除いて)その塩基配列、及び塩基組成にかかわらず、分子の型としてdsRNAに応答することが、示される。第三に、脊椎動物と、無脊椎動物との生得的抗ウイルス免疫間の、有力な進化的関連(dsRNAの認識)が示唆される。
【0194】
無脊椎動物、特に昆虫における抗バクテリア、及び抗菌類の分子基盤については、かなりのことが知られている(Hetroらの総説、J. Infect. Dis. 187 Suppl 2: 5227-334 (2003))が、いかなる無脊椎動物においても、ウイルス感染に対する免疫メカニズムに関する情報はない。4種類の完全な無脊椎動物ゲノム(すなわち、ドロソフィア メラノガスター(Drosophila melanogaster、キイロショウジョウバエ)、アノフェレス ガンビエ(Anopheles gambiae、ガンビエハマダラカ)、カエノラブディティス エレガンス(Caenorlzabditis elegans、線虫)、及びキオナ インテスティナリス(Ciona intestinalis、ユウレイボヤ))の解析に基づき、無脊椎動物が、脊椎動物のインターフェロンと相同な抗ウイルス系を欠如していることは明らかなようである。しかしながら、相同遺伝子の欠如は、脊椎動物に存在する系と類似の、無脊椎動物免疫系の存在を認めないわけではない。例えば、最近、寄生生物感染に関しては、抗原特異的免疫記憶の存在が、甲殻類で示されている( Kurtzらの論文、Nature, 425: 37-8 (2003) )。それが驚くべきことであるのは、T、及びBリンパ球、及び抗原受容体遺伝子の再編成に基づいた、該脊椎動物系に相同な真正な適応免疫系が無脊椎動物には存在しないからである。遺伝的多様化、及び後生動物亜門の進化中の新規遺伝子機能の獲得が、抗ウイルス免疫の進化収束をもたらしているのかもしれない。配列相同性より、機能に焦点を合せることが、抗ウイルス免疫を分子レベルで理解する鍵をにぎるであろう。
【0195】
dsRNAが無脊椎動物における抗ウイルスプログラムを誘導することの実証は、生得的免疫の新規な分子メカニズムの発見の可能性を広げる。もし、エビが、インターフェロン、或い例えばPKR、及びMxのような、インターフェロン誘導抗ウイルス免疫のエフェクタに相同な遺伝子をを発現していれば、驚くべきことであるのは、これらの遺伝子は、他の節足動物のゲノムに欠失しているからである。興味深いことに、免疫応答性オリゴアデニル酸合成酵素は、無脊椎動物群、海綿動物において同定されており(Grebenjokらの論文、 Eur. J. Biochem 269: 1382-92 (2002); Kuusksalvらの論文、Eur. J. Biochem 232: 351-7 (1995))、これらの遺伝子が甲殻類動物において存在し、かつ抗ウイルス免疫において関与する可能性は排除できない。一方、脊椎動物におけるインターフェロン応答を調節することが知られている経路と相同な、シグナル伝達経路が、節足動物においても存在する。ショウジョウバエにおいては、該JAK/STAT系は、造血,及び性決定を調節し(Ziedlerらの総説、Oncogene 19: 2598-606 (2000))、かつ数種の免疫機能遺伝子(例えば、チオールエステル含有タンパク質、及びツランドットA(Turandot A))の発現も制御する(Christophidesらの論文、Science 298 : 159-65 (2002))。A. ガンビエ においては、2種のSTAT相同物の存在が記載されており、そのうちの1種は、免疫チャッレンジに応じて、核に移行することが示されている( Barillas-Muryらの論文、EMBO. J. 18 : 959-6 (1999))。また、我々自身の研究が、エビにおいて、少なくとも1種のSTAT相同物を同定した(NCBI アクセッション番号 CA991435)。哺乳類のTLR-3がdsRNAを認識し、該インターフェロン応答の活性化をもたらすという発見は、TLR/NF-κB複合体もまた無脊椎動物の抗ウィルス免疫、及び具体的に、ここに記載されたdsRNA誘導応答に関与しているという可能性を広げる。
【0196】
他の無脊椎動物分類群における、dsRNA誘導免疫応答の幅広い存在は、まだ検討されていない重要な問題である。例えば、ヒト疾患の無脊椎動物媒介動物(例えば、蚊)の抗ウィルス防衛メカニズムの理解は、公衆衛生に重要な意味があるであろう。さらに、dsRNA介在遺伝的干渉(RNAi)は、多くの無脊椎動物モデルにおいて幅広く使用される、逆遺伝学的ツールである。dsRNAによる免疫応答の、起こり得る誘導は、RNAiを使用する研究を解釈するときに、考慮に入れられる必要があり得る。
【0197】
本発明が、本明細書中で記載された該態様、及び前記の該実施例に限定されないこと、かつ当業者により、添付の請求項の趣旨、及び範囲から離れることなく、様々な変更、及び調整が行われ得ることは明らかである。
(図面の詳細な説明)
【図面の簡単な説明】
【0198】
【図1】L. バンナメイにおける、dsRNAを介した、全身性、及び配列特異的なmRNAの消失:エビ(1-2g)に、25 μg dsRNA (パネルa)、又は10 μg dsRNA、又は生理食塩水(パネルb、又はc)を筋肉内注入した。パネルa :3匹のエビ(各1〜2 g)に、25 μg dsRNAを筋肉内注入した。注入後48時間の時点で、エビを犠牲にし、統合した肝膵臓トータルRNAを、ノーザンブロット法により解析した。レーン1は、へモシアニンdsRNAを注入した動物からのトータルRNAを含む。プローブを図のように使用し、ハイブリダイズさせ、ブロットを複製した。PJV627様mRNAsからの、推定上分解生成物を星(*)で示す。パネルb:エビ(1〜2 g)に、10 μgのIKBK EST クローンの376塩基対長のdsRNA、又は生理食塩水を注入し、その後、様々な 時点で、鰓トータルRNA抽出用にサンプリングした。RT-PCR中に増幅された転写産物の、335塩基対領域は、該dsRNAを合成するのに使用された領域とは重複しない。HaeIIIで消化されたφx174 DNAを標準として使用した。ネガティブコントロール(-)は、RNA鋳型、又逆転写酵素が含まれない、偽cDNA 試料であった。動物がサンプリングされた時点の注入後日数(D1からD7)は、各パネルで使用したプライマーと同様に示された。パネルC:エビ(1〜2 g)に、10 μg の370 bp of the STAT EST クローンの370塩基対にかかっているdsRNA、又は生理食塩水を注入し、その後、様々な時点で、鰓トータルRNA抽出用にサンプリングした。RT-PCR 中に増幅された転写物の、該314塩基対領域は、該dsRNAを合成するために使用された領域 とは重複しない。コントロール、及び表示は、パネルbと同様である。
【図2】WSSV 遺伝子に対するdsRNA は、L. バンナメイのWSSV感染に対して防御する:エビ(1〜2 g)に、生理食塩水、又は特異的dsRNAを、1: 3 百万 w/v希釈のWSSVを含む組織抽出物と共に筋肉内注入した。ネガティブコントロールには、特定病原体フリーエビ(SPF)抽出物を同様のw/v 希釈で注入した。経口感染では、動物に、dsRNA を注入し、その後0.01 g の、WSSV感染筋肉組織、又はSPF組織を、2時間給餌した。バネルaでは、アヒルリボヌクレオチド核酸酵素 (RR)、DNA ポリメラーゼ(DP)、又は vp28 (28) dsRNAを、動物当たり12 μgで使用した。パネルbでは、また、アヒルυ dsRNAを動物当たり12 μgで使用したが、RR dsRNAは、表示されたように、12、又は1.2 μgで使用した。
【図3】一本、又は二本鎖vpl9 RNAのアガロースゲル電気泳動実験。インビトロ転写により合成された、その2種の一本鎖(S1、及び S2)をアニールして、dsRNA(D)を形成した。各レーンに約2μgを載せた。
【図4】WSSV の5種の遺伝子をコードするdsRNA、又はそれらの混合物の、WSSVウイルスでのチャレンジを経た生存率における効果の比較。
【図5】dsRNA は、エビにおける抗ウイルス状態を誘導する。エビ(1〜2 g)に、図示されたように、生理食塩水(ポジティブ(―○―)、及びネガティブ(―■―)コントロール)、又は8 μgのdsRNAを筋肉内注入した。dsRNA注入72時間後に、動物 (n=38〜42)に、下記の材料、及び方法に記載のように、TSV(パネル a)、又はWSSV(パネル b、又はc)を筋肉内注入した。パネルaでは、ポジティブコントロール、及びdsRNA 処理エビの両方における、TSV 投与量1000倍増加(1x10-8 から 1x10-5 w/v希釈)の効果は、点線死亡率曲線でも示される。該dsRNA調製品は、アヒルIgυ(アクセッション番号AJ312200)の309塩基対部分(―△―); ナマズIgH 遺伝子座由来のクローンBAC6(アクセッション番号 CC936713)のゲノミクス非コード領域の1316 塩基対(―●―);ブタIgG cDNA(アクセッション番号U03778)の1079塩基対部分(―×―); 及びバクテリア人工染色体(BAC)クローニングベクターpBeloBACll(Kimらの論文、Genomics 34: 213-8 1996)の1184塩基対断片(―◇―)であった。カイ二乗検定を使用し、dsRNA処理群の最終累積死亡率を、ポジティブコントロールと比較することにより、観察された抗ウイルス防御性の有意性を評価した:パネル a) アヒルIgυ dsRNA (χ2=6.05、0.01<p<0.025);アヒルIgυ dsRNA TSVx1000 (χ2=0.75、非有意); panel b) アヒルIgυ dsRNA (χ2=5.29、0.01<p<0.005) ; ブタIG dsRNA (χ2=12. 93、p<0.001) ; pBeloBAC11 dsRNA (χ2=8.67、0.001<p<0.005); 魚類非コード dsRNAχ2=15.39、p<0.001)。
【図5c】パネルc では、コントロール感染エビ由来の造血組織のエオシン/ヘマトキシリン染色、及び抗WSSV 免疫染色が、dsRNA処理/WSSV 感染エビと比較して示される。図示した切片は、ウイルス感染72時間後に得られた。スケールバーは、20 μm である。
【図6】WSSV感染に対するdsRNAの防御的効果を、投与量で力価評価できることを示す実験。
【図7】該抗ウイルス状態の誘導は、RNA に起因する:エビ(2〜3 g)に、生理食塩水(ポジティブ(―○―)、及びネガティブ(―■―)コントロール)、又はdsRNAを筋肉内注入した。この最初の注入72時間後に、WSSVを単独、又はdsRNAと組合せて、動物に注入した。a) 動物(n=26-31)各々に、50 μlの、約10〜15 μgアヒルυ dsRNA含有溶液を注入し、かつWSSV陽性抽出液でウイルスチャレンジを行った。The 72-0処理群(―●―)には、ウイルス感染72時間、及び0時間(同時注入)前の両方でdsRNAが与えられ、72処理群(―▲―)には、感染の72時間前のみdsRNAが与えられ、0処理群(―○―)には、WSSV接種と混ぜた dsRNAのみが与えられた。b)エビ(n=20〜28)を、循環系(材料、及び方法を参照)で飼育し、ウイルスチャレンジ72時間前に注入し、その後WSSV陽性抽出液と混合させたdsRNAで再注入を行った。ポジティブ(―○―)、及びネガティブ(―■―)コントロールは、パネルaで記載のとおりだった。全ての場合で、アヒルυ dsRNAが使用され、注入当たり10〜15 μgで適用された。dsRNAは、フェノール、及びクロロホルム(―△―)、RNイージーカラム(Qiagen社) (―●―)で精製したか、或いはRNイージーカラムで精製し、かつRNアーゼ混合液 (Ambion社からのRNアーゼ A、RNアーゼ T1、及びRNアーゼ V1)で処理した(―□―)。フィッシャーの正確確立検定を使用し、dsRNA処理群の最終累積死亡率を、ポジティブコントロールと比較することにより、観察された抗ウイルス防御性の有意性を評価した: a) 72-0処理(p<0.0003) ; 72処理 (p=0.0001) ; panel b) dsRNA カラム (p=0.0017) ; dsRNA 溶媒(p=0.0003)。
【図8】ポリC-Gは抗ウィルス状態を誘導するが、ポリI-C、又はポリCはしない。エビ(1〜2 g)に、記載のように8 μg(パネルa)、又は7 μg(パネルb)の合成dsRNAアナログを注入し、かつd72時間後に、WSSVで感染させた。全てのRNA アナログは、Sigma-Aldrich社から購入し、400 mM NaCl、10 mM トリスCl、pH 7.4中で再構成し、下記の材料、及び方法に記載のように、アニールし、定量した。パネルbの実験には、比較のために、アヒルIgυdsRNA(7 μg)を含めた。カイ二乗検定を使用し、ポジティブコントロールと比較し、観察された抗ウイルス防御性の有意性を評価した:パネルa) ポリ CG (χ2=16.92、p<0.001) ;パネル b) アヒルIgυ dsRNA (χ2=32. 17、p<0.001 ; poly CG (χ2=35.05、p<0.001)。
【図9】vpl9 dsRNAへのポリC:Gの添加は、WSSV感染に対する防御性のレベルを増大することを示す実験結果。
【図10】誘導性(ガラクトース)プロモーターの調節コントロール下で発現されるdsRNA、選択マーカー(URA、AMP)、及び該所望される遺伝子を含む、ベクターの構築の図式。該ベクターのサッカロミセス属酵母菌へ導入、その後に、選択、及びガラクトース誘導条件下での、該所望される遺伝子、及びdsRNAを発現が続く。
【図11】図8に図示の酵母発現ベクターのサッカロミセス細胞への誘導、かつ、発現の時期、ガラクトース濃度、ターミネーターなどの発現の最適条件の選択、コントロールプラスミドの構築、及びAMP遺伝子の除去の図式化。
【図12】サッカロミセス属酵母菌は、WSSVのvp19、又はZF配列を含むベクターで形質転換された場合、WSSVがコードしたRNAを発現することを示す、ノーザン分析結果。これらの実験では、形質転換酵母菌から抽出された、10 μgトータルRNAを、vp19、ZF、及びポシティブコントロールとして酵母アクチンの、プローブを使用し、ノーザンブロットにより解析した。これらの結果により、酵母菌が、WSSV関連RNAを発現することが示される。
【図13】本発明に従い、dsRNAベクターで形質転換された酵母菌は、(ZF配列を含むベクターによって形質転換された場合)、dsRNAを発現することを示す、ノーザンブロット解析結果。これらの実験では、ZF発現ベクターで形質転換された酵母菌由来の10 μgトータルRNAを、ノーザンブロットにより解析した。該RNAの各鎖用のプローブ(アンチセンス、左、及びセンス、右)を使用し、ノーザンブロットの結果により示される様に、両方が、それぞれの標的を検出し、ZF特異的なdsRNAを発現していることが確認された。さらに、内部標準(各ゲルの右の方)は、各RNA試料中に存在する、WSSVのZF RNAの量(約50ナノグラム)の概算を可能にする。
【特許請求の範囲】
【請求項1】
海洋無脊椎動物の内在性遺伝子、又は該海洋無脊椎動物に感染する、病原体に含まれる内在性遺伝子の発現を調整する方法であって、該海洋無脊椎動物の内在性遺伝子、又は該病原体の内在性遺伝子に相当な配列相同性を持つ配列を含む少なくとも1種のdsRNAを、該海洋無脊椎動物の内在性遺伝子、又は該病原体内在性遺伝子の発現を調整するに十分な条件下、かつ量で、海洋無脊椎動物に投与することを含む、前記方法。
【請求項2】
前記海洋無脊椎動物が、甲殻類動物、海綿動物、軟体動物、棘皮動物、海洋ミミズである、請求項1記載の方法。
【請求項3】
前記甲殻類動物が、エビ、カニ、クレイフィッシュ、及びロブスターからなる群から選択される、請求項2記載の方法。
【請求項4】
前記dsRNAが、少なくとも20〜40ヌクレオチド鎖長である、請求項1記載の方法。
【請求項5】
前記dsRNAが、少なくとも20〜100ヌクレオチド鎖長である、請求項1記載の方法。
【請求項6】
前記エビが、アキカミパストシュリンプ(Akikami past shrimp)、バルチックプローン、テンジククルマエビ、ブルーシュリンプ、ブラインシュリンプ、ブラウンタイガープローン、カラモテプローン、イースタンキングプローン、イースタンスクールシュリンプ、タイショウエビ、淡水エビ、ジャイアントリバープローン、ブラックタイガー、ヨシエビ、クマエビ、インディアンホワイトプローン、カルマエビ、メタペナエウス属エビ、ノーザンホワイトシュリンプ、カルマエビ、パラエモニドシュリンプ、アカオエビ(Redtail prawn)、サザンホワイトシュリンプ(Southern White Shrimp)、パシフィックホワイトシュリンプ(Pacific White Shrimp)、アトランティックホワイトシュリンプ(Atlantic White Shrimp)、及びホワイトレッグシュリンプからなる群から選択される、請求項3記載の方法。
【請求項7】
前記甲殻類動物が、リトペナエウス バナメイ、又はペンゲウス モノドンである、請求項1記載の方法。
【請求項8】
前記クレイフィッシュが、ドナウクレイフィッシュ、ユーロアメリカンクレイフィッシュ、ノーブルクレイフィッシュ、マロンクレイフィッシュ、レッドクロウクレイフィッシュ、レッドスワンプクレイフィッシュ、シグナルクレイフィッシュ、及びヤビークレイフィッシュからなる群から選択される、請求項3記載の方法。
【請求項9】
前記カニが、ブルークラブ、チャイニーズリバークラブ、ガザミ、スパイナススパイダークラブ、インドパシフィックスワンプクラブ、海洋カニ、スイムクラブ、及びポルツヌス属スイムクラブからなる群から選択される、請求項3記載の方法。
【請求項10】
前記ロブスターが、ウチワエビモドキ、イセエビ、マドスパイニーロブスター、パリヌリドスパイニーロブスター、及びトロピカルスパイニーロブスターからなる群から選択される、請求項3記載の方法。
【請求項11】
該病原体が、ウイルス、バクテリア、菌類、マイコプラズマ、微胞子虫類、略胞子虫類、及びグレガリナ類からなる群から選択される、請求項1記載の方法。
【請求項12】
該無脊椎動物が、伝染性皮下造血器壊死ウイルス(IHHNV);ペナエイドシュリンプのバキュロウイルス(BP)、ホワイトスポットシンドロームウイルス(WSSV);タウラシンドロームウイルス(TSV);ペナエイドシュリンプのラブドウイルス;鰓関連ウイルス(GAV);イエローヘッドウイルス(YHV);リンパ器官関連ウイルス(LOV);肝膵臓パボウイルス(HPV)、バキュロウイルス中腸壊死ウイルス(BMN)、モノドン型バキュロウイルス(MBV)、レオ様ウイルス疾患ウイルス(REO)、及びラブドウイルス(RPS)からなる群から選択される、請求項1記載の方法。
【請求項13】
該無脊椎動物がエビであり、かつ、該病原体がビブリオ菌、マイコバクテリア菌、壊死性肝膵炎、リケッチア、リケッチア様病原体、又は別の細胞内病原体から選択される、請求項1記載の方法。
【請求項14】
該無脊椎動物がエビであり、かつ、その寄生生物が菌類である、請求項1記載の方法。
【請求項15】
該菌類が、フサリウム オキシスポルム、ラゲニジウム属、又はシロルピジウム属である、請求項14記載の方法。
【請求項16】
該無脊椎動物がエビであり、かつその寄生生物が微胞子虫類、略胞子虫類、及びグレガリナ類からなる群から選択される、請求項1記載の方法。
【請求項17】
前記dsRNAが、注入により投与される、請求項1記載の方法。
【請求項18】
前記dsRNAが、浸漬により投与される、請求項1記載の方法。
【請求項19】
前記dsRNAが、フィードストック中に投与される、請求項1記載の方法。
【請求項20】
前記dsRNAが、前記dsRNAを発現する微生物、又は微細藻類中に投与される、請求項1記載の方法。
【請求項21】
前記dsRNAが、VP26、VP28、VP19、リボヌクレオチド還元酵素、チミジル酸キナーゼ、DNAポリメラーゼ、STAT、IKB、神経伝達物質遺伝子、ホルモン遺伝子、代謝経路遺伝子、脱皮抑制ホルモン遺伝子、生殖腺抑制ホルモン遺伝子、甲殻類動物高血糖遺伝子、抗菌性ペプチド遺伝子、クラスチン遺伝子、及びペナエイジン遺伝子からなる群から選択される、海洋無脊椎動物の内在遺伝子を標的にする、請求項1記載の方法。
【請求項22】
前記dsRNAが、免疫、又は抗炎症応答を生じさせる、エビ遺伝子の発現を抑制する、請求項1の方法。
【請求項23】
前記dsRNAが、甲殻類動物の寄生生物に対する防御性を生じさせる、請求項1記載の方法。
【請求項24】
前記寄生生物が、ウイルス、バクテリア、菌類、マイコプラズマ、略胞子虫類、微胞子虫類、及びグレガリナ類から選択される、請求項23記載の方法。
【請求項25】
異なったdsRNAの混合液を投与する、請求項1記載の方法。
【請求項26】
無脊椎動物に、配列非特異的(全身性)免疫応答を誘導する方法であって、通常、該無脊椎動物に感染する病原体に対する防御的免疫応答を与える、又は高める、配列非特異的免疫応答を誘導するのに有効な量の、少なくとも1種の二本鎖RNAを投与することを含む、前記方法。
【請求項27】
前記二本鎖RNAが、少なくとも20〜40のヌクレオチド鎖長である、請求項26記載の方法。
【請求項28】
該二本鎖RNAが、少なくとも50〜100のヌクレオチド鎖長である、請求項27記載の方法。
【請求項29】
該二本鎖RNAが、少なくとも300〜500のヌクレオチド鎖長である、請求項27記載の方法。
【請求項30】
該無脊椎動物が、昆虫、蛛形類動物、唇脚類動物、多足類動物、ミミズ、有殻軟体動物、及び無殻軟体動物から選択される、請求項26記載の方法。
【請求項31】
該無脊椎動物が、海洋無脊椎動物である、請求項26記載の方法。
【請求項32】
前記海洋無脊椎動物が、海綿動物門、刺胞動物門、有櫛動物門、軟体動物門、節足動物門、棘皮動物門、及び海洋ミミズからなる群から選択される、請求項31記載の方法。
【請求項33】
前記軟体動物門が、カキ、ムール貝、貝、イカ、巻貝、ウミウシ、及びタコからなる群から選択される、請求項32の方法。
【請求項34】
前記刺胞動物門が、クラゲ、サンゴ、及びヒドロ虫からなる群から選択される、請求項32記載の方法。
【請求項35】
前記棘皮動物門が、ウニ、ヒトデ、及びクモヒトデからなる群から選択される、請求項32記載の方法。
【請求項36】
前記海洋ミミズが、多毛類、貧毛類、及びハオリムシ類からなる群から選択される、請求項32記載の方法。
【請求項37】
該無脊椎動物が、甲殻類動物である、請求項26記載の方法。
【請求項38】
前記甲殻類動物が、エビ、クレイフィッシュ、カニ、及びロブスターからなる群から選択される、請求項37記載の方法。
【請求項39】
前記エビが、アキカミパストシュリンプ、バルチックプローン、テンジククルマエビ、ブルーシュリンプ、ブラインシュリンプ、ブラウンタイガープローン、カラモテプローン、イースタンキングプローン、イースタンスクールシュリンプ、タイショウエビ、淡水エビ、ジャイアントリバープローン、ブラックタイガー、ヨシエビ、インディアンホワイトプローン、カルマエビ、メタペナエウス属エビ、ノーザンホワイトシュリンプ、パラエモニドシュリンプ、アカオエビ、サザンホワイトシュリンプ、パシフィックホワイトシュリンプ、アトランティックホワイトシュリンプ、及びホワイトレッグシュリンプからなる群から選択される、請求項38記載の方法。
【請求項40】
該甲殻類動物が、リトペナエウス バナメイ、又はペナエウス モノドンである、請求項37記載の方法。
【請求項41】
該カニが、ブルークラブ、チャイニーズリバークラブ、ガザミ、スパイナススパイダークラブ、インドパシフィックスワンプクラブ、海洋カニ、スイムクラブ、及びポルツヌス属スイムクラブからなる群から選択される、請求項38記載の方法。
【請求項42】
前記クレイフィッシュが、ドナウクレイフィッシュ、ユーロアメリカンクレイフィッシュ、ノーブルクレイフィッシュ、マロンクレイフィッシュ、レッドクロウクレイフィッシュ、レッドスワンプクレイフィッシュ、シグナルクレイフィッシュ、及びヤビークレイフィッシュから選択される、請求項38記載の方法。
【請求項43】
該ロブスターが、ウチワエビモドキ、イセエビ、マドスパイニーロブスター、パリヌリドスパイニーロブスター、及びトロピカルスパイニーロブスターからなる群から選択される、請求項38記載の方法。
【請求項44】
該病原体が、ウイルス、バクテリア、菌類、マイコプラズマ、微胞子虫類、略胞子虫類、及びグレガリナ類から選択される、請求項26記載の方法。
【請求項45】
該無脊椎動物がエビであり、かつ病原体が伝染性皮下造血器壊死ウイルス(IHHNV);ペナエイドシュリンプのバキュロウイルス(BP);ホワイトスポットシンドロームウイルス(WSSV);タウラシンドロームウイルス(TSV);ペナエイドシュリンプのラブドウイルス;鰓関連ウイルス (GAV);イエローヘッドウイルス(YHV);リンパ器官関連ウイルス (LOV);肝膵臓パボウイルス(HPV)、バキュロウイルス中腸壊死ウイルス(BMN)、モノドン型バキュロウイルス(MBV)、レオ様ウイルス疾患ウイルス(REO)、ラブドウイルス(RPS)、又は別の細胞内病原体からなる群から選択される、請求項26記載の方法。
【請求項46】
該病原体がビブリオ菌、マイコバクテリア菌、壊死性肝膵炎、リケッチア、及びリケッチア様病原体、又は別の細胞内病原体から選択される、請求項26記載の方法。
【請求項47】
該無脊椎動物がエビであり、かつ該寄生生物が菌類である、請求項26記載の方法。
【請求項48】
前記菌類が、フサリウム オキシスポルム、ラゲニジウム属、又はシロルピジウム属である、請求項47記載の方法。
【請求項49】
該無脊椎動物がエビであり、かつ該寄生生物が微胞子虫類、略胞子虫類、又はグレガリナ類である、請求項26記載の方法。
【請求項50】
該二本鎖RNAが、無脊椎動物とは異なる種に由来する、請求項26記載の方法。
【請求項51】
該二本鎖RNAが、脊椎動物、植物、バクテリア、菌類、又はウイルスに由来する、或いは、天然に存在しない合成dsRNAである、請求項26の方法。
【請求項52】
該二本鎖RNAが、爬虫類、鳥類、哺乳類、魚類、又は両生類に由来する、請求項26記載の方法。
【請求項53】
該二本鎖RNAが、アヒル免疫グロブリン遺伝子である、請求項26記載の方法。
【請求項54】
該二本鎖RNAが、天然に存在しないヌクレオチドを含む、請求項26記載の方法。
【請求項55】
該二本鎖RNAがホモポリマーである、請求項26記載の方法。
【請求項56】
前記二本鎖RNAが、特に特異的にハイブリダイズしない、又は公知のいずれの宿主、又は病原体遺伝子とも有意な配列同一性を示さない、請求項26記載の方法。
【請求項57】
前記二本鎖RNAが、バクテリア遺伝子と配列同一性を示す、請求項26記載の方法。
【請求項58】
該二本鎖RNAが、魚類遺伝子と配列同一性を示す、請求項26記載の方法。
【請求項59】
該二本鎖RNAが、哺乳動物Ig配列と配列同一性を示す、請求項26記載の方法。
【請求項60】
無脊椎動物に、配列特異的な免疫応答、及び配列非特異的な(全身性)免疫応答を誘導する方法であって:(i)該無脊椎動物に、配列非特異的な免疫応答を誘導するのに有効な量の二本鎖RNAを投与すること、ここで、該二本鎖RNAは、特異的にハイブリダイズしないか、或いは該病原体、又は該無脊椎動物の公知の遺伝子のいずれとも有意な配列同一性を示さない;及び(ii)該病原体,又は無脊椎動物に含まれる、標的遺伝子に有意な配列同一性を示す配列を含む第2の二本鎖RNAを投与し、それが、特異的に標的遺伝子にハイブリダイズし、それにより、該標的遺伝子の発現が抑制されること;及び (iii)工程(i)及び(ii)の該RNAが、個別に、又は組合せて、及びいずれかの順で投与され、かつ該dsRNAの投与が、通常該無脊椎動物に感染する病原体に対する防御性を与え、かつ/或いは、無脊椎動物の内在性遺伝子の発現を調整することを含む、前記方法。
【請求項61】
該配列特異的dsRNAの少なくとも一部分と、かなりの配列同一性をもつ標的遺伝子の発現を調整する、配列特異的dsRNAにより生じる無脊椎動物のRNAi応答を高める方法であって、該配列特異的dsRNAを、配列非特異的dsRNAと共に、該配列特異的dsRNAにより生じる該RNAi応答が増大されるような条件下で投与する、前記方法。
【請求項62】
前記dsRNAが個別に投与される、請求項60記載の方法。
【請求項63】
前記dsRNAが個別に投与される、請求項61記載の方法。
【請求項64】
dsRNAが組合せて投与される、請求項60記載の方法。
【請求項65】
前記dsRNAが組合せて投与される、請求項61記載の方法。
【請求項66】
該無脊椎動物がエビであり、かつ該dsRNAが注入により投与される、請求項1記載の方法。
【請求項67】
該無脊椎動物がエビであり、かつ該dsRNAが注入により投与される、請求項26記載の方法。
【請求項68】
該無脊椎動物がエビであり、かつ該dsRNAが注入により投与される、請求項60記載の方法。
【請求項69】
該無脊椎動物がエビであり、かつ該dsRNAが注入により投与される、請求項61記載の方法。
【請求項70】
該無脊椎動物がエビであり、かつ該dsRNAが経口的に、又は浸漬により投与される、請求項26記載の方法。
【請求項71】
該無脊椎動物がエビであり、かつ該dsRNAが経口的に、又は浸漬により投与される、請求項60記載の方法。
【請求項72】
該無脊椎動物がエビであり、かつ該dsRNAが経口的に、又は浸漬によりで投与される、請求項61記載の方法。
【請求項73】
非特異的免疫応答を誘導するdsRNAが、前記無脊椎動物、又は病原体に含まれる遺伝子と明らかな配列同一性を含まない、請求項60記載の方法。
【請求項74】
非特異的免疫応答を誘導するdsRNAが、前記無脊椎動物、又は病原体に含まれる遺伝子と明らかな配列同一性を含まない、請求項61記載の方法。
【請求項75】
配列特異的免疫応答を誘導するdsRNA (ii)が、前記無脊椎動物、又は病原体に含まれる遺伝子に特異的にハイブリダイズする配列を含み、かつ該遺伝子の発現の抑制、又は完全停止をもたらす、請求項60記載の方法。
【請求項76】
配列特異的免疫応答を誘導するdsRNA (ii)が、該無脊椎動物、又は病原体に含まれる遺伝子に特異的にハイブリダイズする配列を含み、かつ該遺伝子の発現の抑制、又は完全停止をもたらす、請求項61記載の方法。
【請求項77】
該無脊椎動物が甲殻類動物である、請求項60記載の方法。
【請求項78】
該無脊椎動物が甲殻類動物である、請求項61記載の方法。
【請求項79】
該甲殻類動物が、エビ、ロブスター、クレイフィッシュ、又はカニである、請求項74の方法。
【請求項80】
該甲殻類動物が、エビ、ロブスター、クレイフィッシュ、又はカニである、請求項78の方法。
【請求項81】
該エビが、アキカミパストシュリンプ、バルチックプローン、テンジククルマエビ、ブラインシュリンプ、ブラウンタイガープローン、イースタンスクールシュリンプ、イースタンキングプローン、タイショウエビ、淡水エビ、ジャイアントリバープローン、ブラックタイガー、ヨシエビ、クマエビ、インディアンホワイトプローン、カルマエビ、メタペナエウス属エビ、ノーザンホワイトシュリンプ、パラエモニドシュリンプ、ペナエウス属エビ、アカオエビ、サザンホワイトシュリンプ、及びホワイトレッグシュリンプから選択される、請求項79記載の方法。
【請求項82】
該エビが、アキカミパストシュリンプ、バルチックプローン、テンジククルマエビ、ブラインシュリンプ、ブラウンタイガープローン、イースタンスクールシュリンプ、イースタンキングプローン、タイショウエビ、淡水エビ、エビ、ジャイアントリバープローン、ブラックタイガー、ヨシエビ、クマエビ、インディアンホワイトプローン、カルマエビ、メタペナエウス属エビ、ノーザンホワイトシュリンプ、パラエモニドシュリンプ、ペナエウス属エビ、アカオエビ、サザンホワイトシュリンプ、及びホワイトレッグシュリンプから選択される、請求項80記載の方法。
【請求項83】
該クレイフィッシュが、ドナウクレイフィッシュ、ユーロアメリカンクレイフィッシュ、ノーブルクレイフィッシュ、マロンクレイフィッシュ、レッドクロウクレイフィッシュ、レッドスワンプクレイフィッシュ、シグナルクレイフィッシュ、及びヤビークレイフィッシュから選択される、請求項79記載の方法。
【請求項84】
該クレイフィッシュが、ドナウクレイフィッシュ、ユーロアメリカンクレイフィッシュ、ノーブルクレイフィッシュ、マロンクレイフィッシュ、レッドクロウクレイフィッシュ、レッドスワンプクレイフィッシュ、シグナルクレイフィッシュ、及びヤビークレイフィッシュから選択される、請求項80記載の方法。
【請求項85】
該ロブスターが、ウチワエビモドキ、イセエビ、マドスパイニーロブスター、パリヌリドスパイニーロブスター、及びトロピカルスパイニーロブスターから選択される、請求項79記載の方法。
【請求項86】
該ロブスターが、ウチワエビモドキ、イセエビ、マドスパイニーロブスター、パリヌリドスパイニーロブスター、及びトロピカルスパイニーロブスターから選択される、請求項80記載の方法。
【請求項87】
該カニが、ブルークラブ、チャイニーズリバークラブ、スパイナススパイダークラブ、インドパシフィックスワンプクラブ、海洋カニ、スイムクラブ、及びガザミから選択される、請求項79記載の方法。
【請求項88】
該カニが、ブルークラブ、チャイニーズリバークラブ、スパイナススパイダークラブ、インドパシフィックスワンプクラブ、海洋カニ、スイムクラブ、及びガザミから選択される、請求項80記載の方法。
【請求項89】
該病原体が、ウイルス、バクテリア、菌類、マイコプラズマ、微胞子虫類、略胞子虫類、又はグレガリナ類である、請求項60記載の方法。
【請求項90】
該病原体が、ウイルス、バクテリア、菌類、マイコプラズマ、微胞子虫類、略胞子虫類、又はグレガリナ類である、請求項61記載の方法。
【請求項91】
該ウイルスが、伝染性皮下造血器壊死ウイルス(IHHNV);ペナエイドシュリンプのバキュロウイルス(BP);ホワイトスポットシンドロームウイルス(WSSV);タウラシンドロームウイルス(TSV);ペナエイドシュリンプのラブドウイルス;鰓関連ウイルス(GAV);イエローヘッドウイルス(YHV);リンパ器官関連ウイルス(LOV);肝膵臓パボウイルス(HPV);伝染性皮下造血器壊死ウイルス(IHHNV)、ペナエイドシュリンプのバキュロウイルス(BP)、ペナエイドシュリンプのラブドウイルス(RPS)、鰓関連ウイルス(GAV)、イエローヘッドウイルス(YHV)、リンパ器官関連ウイルス(LOV)、リンパ器官パボ様ウイルス疾患(LPV)、肝膵臓パボウイルス(HPV)、バキュロウイルス中腸腺壊死ウイルス(BMN)、モノドン型バキュロウイルス (MBV)、レオ様ウイルス疾患(REO)、ラブドウイルス(RPS)、及び新生ウイルスから選択される、請求項89記載の方法。
【請求項92】
該ウイルスが、伝染性皮下造血器壊死ウイルス(IHHNV);ペナエイドシュリンプのバキュロウイルス(BP);ホワイトスポットシンドロームウイルス(WSSV);タウラシンドロームウイルス(TSV);ペナエイドシュリンプのラブドウイルス;鰓関連ウイルス(GAV);イエローヘッドウイルス(YHV);リンパ器官関連ウイルス(LOV);肝膵臓パボウイルス(HPV);リンパ器官パボ様ウイルス疾患(LPV)、バキュロウイルス中腸腺壊死ウイルス(BMN)、モノドン型バキュロウイルス(MBV)、レオ様ウイルス疾患(REO)、ラブドウイルス(RPS)、及び新生ウイルスから選択される、請求項90記載の方法。
【請求項93】
該菌類が、フサリウム オキシスポルム、ラゲニジウム属、又はシロルピジウム属である、請求項89記載の方法。
【請求項94】
該菌類が、フサリウム オキシスポルム、ラゲニジウム属、又はシロルピジウム属である、請求項90記載の方法。
【請求項95】
該病原体がビブリオ菌、マイコバクテリア菌、壊死性肝膵炎(NHP)、リケッチア、リケッチア様病原体である、請求項89記載の方法。
【請求項96】
全身性免疫応答を生じさせる前記dsRNAが、植物、脊椎動物、バクテリア、菌類、又はウイルスに由来する、或いは、天然に存在しない合成dsRNAである、請求項60記載の方法。
【請求項97】
前記dsRNA (i)が、両生類、爬虫類、鳥類、哺乳類、又は魚類配列を含む、請求項96記載の方法。
【請求項98】
さらに、該無脊椎動物の非特異的免疫応答中に、発現増加、又は発現減少する、特異的な核酸配列の同定を含む、請求項26記載の方法。
【請求項99】
前記同定が、サブトラクションハイブリダイゼーションを経て、或いはゲノミクスにより達成される、請求項98記載の方法。
【請求項100】
前記非特異的免疫応答中に転写される核酸配列の、マイクロアレイを作製することを含む、請求項90記載の方法。
【請求項101】
前記マイクロアレイを、脊椎動物、又は他の無脊椎動物の免疫調節遺伝子をコードする核酸配列に接触させ、オーソログを同定する、請求項99記載の方法。
【請求項102】
前記免疫調節遺伝子が、サイトカイン様分子をコードする、請求項99記載の方法。
【請求項103】
前記サイトカイン様分子が、dsRNAに対する無脊椎動物の免疫応答に関与する他の遺伝子の、発現増加、または発現減少をもたらす、請求項102記載の方法。
【請求項104】
病原体に対する非特異的な防御性に必須である、エビ遺伝子を同定する方法であって、(i)エビを、エビ遺伝子に相当するdsRNAに接触させること;及び(ii)該遺伝子の阻害、又は抑制が、該エビの、該dsRNAに対する非特異的免疫応答を生じさせられなくするかを調べることを含む、前記方法。
【請求項105】
前記dsRNAが、該無脊椎動物に感染する細菌ベクターに含まれる、請求項1記載の方法。
【請求項106】
前記dsRNAが、該無脊椎動物に感染する細菌ベクターに含まれる、請求項60記載の方法。
【請求項107】
前記dsRNAが、該無脊椎動物に感染する細菌ベクターに含まれる、請求項61記載の方法。
【請求項108】
前記dsRNAが人工送達系内にある、請求項1記載の方法。
【請求項109】
前記dsRNAが人工送達系内にある、請求項60記載の方法。
【請求項110】
前記dsRNAが人工送達系内にある、請求項61記載の方法。
【請求項111】
前記送達系がカプセル、ポリマー、又は液体である、請求項108記載の方法。
【請求項112】
前記送達系がカプセル、ポリマー、又は液体である、請求項109記載の方法。
【請求項113】
前記送達系がカプセル、ポリマー、又は液体である、請求項110記載の方法。
【請求項114】
前記dsRNAがプラスミドを含む、請求項26記載の方法。
【請求項115】
前記dsRNAがプラスミドを含む、請求項60記載の方法。
【請求項116】
前記dsRNAがプラスミドを含む、請求項61記載の方法。
【請求項117】
前記dsRNAがヘアピンループを含む、請求項1記載の方法。
【請求項118】
前記dsRNAが人工餌料に含まれる、請求項1記載の方法。
【請求項119】
前記dsRNAが組み換え微生物に含まれる、請求項1記載の方法。
【請求項120】
ウイルスフリーのエビ種親を生産するために用いられる、請求項1記載の方法。
【請求項121】
ウイルスフリーのエビ種親を生産するために用いられる、請求項26記載の方法。
【請求項122】
ウイルスフリーのエビ種親を生産するために用いられる、請求項60記載の方法。
【請求項123】
ウイルスフリーのエビ種親を生産するために用いられる、請求項61記載の方法。
【請求項124】
ウイルスフリーのエビ幼生を生産するために用いられる、請求項1記載の方法。
【請求項125】
ウイルスフリーのエビ幼生を生産するために用いられる、請求項26記載の方法。
【請求項126】
ウイルスフリーのエビ幼生を生産するために用いられる、請求項60記載の方法。
【請求項127】
ウイルスフリーのエビ幼生を生産するために用いられる、請求項61記載の方法。
【請求項128】
該無脊椎動物がエビであり、かつウイルス耐性のエビ系統が生産される、請求項1記載の方法。
【請求項129】
該無脊椎動物がエビであり、かつウイルス耐性のエビ系統が生産される、請求項26記載の方法。
【請求項130】
該無脊椎動物がエビであり、かつウイルス耐性のエビ系統が生産される、請求項60記載の方法。
【請求項131】
該無脊椎動物がエビであり、かつウイルス耐性のエビ系統を生産される、請求項61記載の方法。
【請求項132】
異なる無脊椎動物、又は無脊椎動物病原体遺伝子を標的にする、複数の異なるdsRNAが投与される、請求項1記載の方法。
【請求項133】
前記配列特異的dsRNAが、VP26、VP28、VP19、リボヌクレオチド還元酵素、チミジル酸キナーゼ、DNAポリメラーゼ;STAT、IKB、神経伝達物質遺伝子、ホルモン遺伝子、代謝経路遺伝子、脱皮抑制ホルモン遺伝子、生殖腺抑制ホルモン遺伝子、甲殻類動物高血糖遺伝子、抗菌性遺伝子、クラスチン遺伝子、及びペナエイジン遺伝子から選択される遺伝子を標的にする、請求項60記載の方法。
【請求項134】
前記配列特異的dsRNAが、VP26、VP28、VP19、リボヌクレオチド還元酵素、チミジル酸キナーゼ、DNAポリメラーゼ;STAT、IKB、神経伝達物質遺伝子、ホルモン遺伝子、代謝経路遺伝子、脱皮抑制ホルモン遺伝子、生殖腺抑制ホルモン遺伝子、甲殻類動物高血糖遺伝子、抗菌性遺伝子、クラスチン遺伝子、及びペナエイジン遺伝子から選択される遺伝子を標的にする、請求項61記載の方法。
【請求項135】
該無脊椎動物がエビであり、かつエビ遺伝子の該抑制発現が、抗炎症応答、及び/又は免疫機能の抑制をもたらす、請求項1記載の方法。
【請求項136】
該dsRNAが造血機能障害、及び/又は免疫機能の抑制をもたらす、請求項1記載の方法。
【請求項137】
甲殻類動物内在性遺伝子、又は該甲殻類動物に感染する病原体に含まれる必須遺伝子の発現を抑制する手段としての、甲殻類動物へのdsRNA送達方法であって、恒常的に該dsRNAを発現する微生物、むき出しのdsRNAを投与すること、該dsRNAを含む人工送達系、又は該微生物が該甲殻類動物により内在化される条件下での、該dsRNAを含むベクター、又はプラスミドを含む、前記方法。
【請求項138】
前記dsRNAが前記甲殻類動物に注入される、請求項137記載の方法。
【請求項139】
前記dsRNAが、浸漬を経て投与される、請求項137記載の方法。
【請求項140】
該微生物が、酵母菌、又は微細藻類であり、かつ前記甲殻類動物により経口的に摂取される、請求項137記載の方法。
【請求項141】
該酵母菌が、サッカロミセス属、シゾサッカロミセス属、ハンゼヌーラ属、カンジダ属、ピキア属、ヤロウィア属からなる群から選択される、請求項140記載の方法。
【請求項142】
該酵母菌がサッカロミセス セレビシエである、請求項141記載の方法。
【請求項143】
該微生物が、少なくとも1種のdsRNAをコードする異なるなベクターによって、遺伝子導入、或いは形質転換されている、請求項137記載の方法。
【請求項144】
該微生物が、誘導性プロモーターのコントロール下で、該dsRNAを発現する、請求項137記載の方法。
【請求項145】
該微生物がサッカロミセス属酵母菌であり、かつ該誘導性プロモーターが、ガラクトース、又はリン酸誘導性プロモーターである、請求項144記載の方法。
【請求項146】
該微生物が甲殻類動物養殖媒体に含まれる、請求項137記載の方法。
【請求項147】
該微生物が、甲殻類動物餌料組成物に含まれる、請求項137記載の方法。
【請求項148】
該微生物が微細藻類である、請求項137記載の方法。
【請求項149】
前記微細藻類が、クロレラ属、ヘマトコッカス属、アルスロスピラ属(スピルリナ属)、ナンノクロロプシス属、スケレトネマ属、キートセロス属、テトラセルミス属、イソクリシス属、及びクラミドモナス属からなる群から選択される、請求項148記載の方法。
【請求項150】
該甲殻類動物がエビである、請求項137記載の方法。
【請求項151】
抑制される遺伝子が、該甲殻類動物に感染するウイルスに含まれる遺伝子である、請求項137記載の方法。
【請求項152】
該微細藻類がクラミドモナス レインハルディ(Chlamydomonas reinhardtii、コナミドリムシ)である、請求項140記載の方法。
【請求項153】
少なくとも1種の、甲殻類動物にとって毒性のない微生物を含む、甲殻類動物による摂食に適した栄養組成物であって、該微生物が少なくとも1種のdsRNAを恒常的に発現する前記組成物。
【請求項154】
該微生物が、酵母菌、又は微細藻類である、請求項153記載の栄養組成物。
【請求項155】
該酵母菌がサッカロミセス属酵母菌である、請求項141記載の方法。
【請求項156】
該微細藻類が、クロレラ属、ヘマトコッカス属、アルスロスピラ属、ナンノクロロプシス属、スケレトネマ属、キートセロス属、テトラセルミス属、イソクリシス属、及びクラミドモナス属からなる群から選択される、請求項154記載の方法。
【請求項157】
前記微細藻類が、甲殻類動物に感染するウイルスに含まれる遺伝子の発現を抑制する、少なくとも1種のdsRNAを発現する、請求項155記載の栄養組成物。
【請求項158】
前記甲殻類動物がエビであり、かつ該ウイルスがホワイトスポットシンドロームウイルス、又はタウラシンドロームウイルスである、請求項157記載の栄養組成物。
【請求項159】
前記微生物が、サッカロミセス属酵母菌であり、甲殻類動物に感染するウイルスに含まれる遺伝子の発現を抑制する、少なくとも1種のdsRNAを発現する、請求項157記載の栄養組成物。
【請求項160】
前記甲殻類動物がエビであり、かつ該ウイルスがホワイトスポットシンドロームウイルス、又はタウラシンドロームウイルスである、請求項159記載の方法。
【請求項161】
該サッカロミセス属酵母菌が、サッカロミセス セレビシエである、請求項158記載の方法。
【請求項1】
海洋無脊椎動物の内在性遺伝子、又は該海洋無脊椎動物に感染する、病原体に含まれる内在性遺伝子の発現を調整する方法であって、該海洋無脊椎動物の内在性遺伝子、又は該病原体の内在性遺伝子に相当な配列相同性を持つ配列を含む少なくとも1種のdsRNAを、該海洋無脊椎動物の内在性遺伝子、又は該病原体内在性遺伝子の発現を調整するに十分な条件下、かつ量で、海洋無脊椎動物に投与することを含む、前記方法。
【請求項2】
前記海洋無脊椎動物が、甲殻類動物、海綿動物、軟体動物、棘皮動物、海洋ミミズである、請求項1記載の方法。
【請求項3】
前記甲殻類動物が、エビ、カニ、クレイフィッシュ、及びロブスターからなる群から選択される、請求項2記載の方法。
【請求項4】
前記dsRNAが、少なくとも20〜40ヌクレオチド鎖長である、請求項1記載の方法。
【請求項5】
前記dsRNAが、少なくとも20〜100ヌクレオチド鎖長である、請求項1記載の方法。
【請求項6】
前記エビが、アキカミパストシュリンプ(Akikami past shrimp)、バルチックプローン、テンジククルマエビ、ブルーシュリンプ、ブラインシュリンプ、ブラウンタイガープローン、カラモテプローン、イースタンキングプローン、イースタンスクールシュリンプ、タイショウエビ、淡水エビ、ジャイアントリバープローン、ブラックタイガー、ヨシエビ、クマエビ、インディアンホワイトプローン、カルマエビ、メタペナエウス属エビ、ノーザンホワイトシュリンプ、カルマエビ、パラエモニドシュリンプ、アカオエビ(Redtail prawn)、サザンホワイトシュリンプ(Southern White Shrimp)、パシフィックホワイトシュリンプ(Pacific White Shrimp)、アトランティックホワイトシュリンプ(Atlantic White Shrimp)、及びホワイトレッグシュリンプからなる群から選択される、請求項3記載の方法。
【請求項7】
前記甲殻類動物が、リトペナエウス バナメイ、又はペンゲウス モノドンである、請求項1記載の方法。
【請求項8】
前記クレイフィッシュが、ドナウクレイフィッシュ、ユーロアメリカンクレイフィッシュ、ノーブルクレイフィッシュ、マロンクレイフィッシュ、レッドクロウクレイフィッシュ、レッドスワンプクレイフィッシュ、シグナルクレイフィッシュ、及びヤビークレイフィッシュからなる群から選択される、請求項3記載の方法。
【請求項9】
前記カニが、ブルークラブ、チャイニーズリバークラブ、ガザミ、スパイナススパイダークラブ、インドパシフィックスワンプクラブ、海洋カニ、スイムクラブ、及びポルツヌス属スイムクラブからなる群から選択される、請求項3記載の方法。
【請求項10】
前記ロブスターが、ウチワエビモドキ、イセエビ、マドスパイニーロブスター、パリヌリドスパイニーロブスター、及びトロピカルスパイニーロブスターからなる群から選択される、請求項3記載の方法。
【請求項11】
該病原体が、ウイルス、バクテリア、菌類、マイコプラズマ、微胞子虫類、略胞子虫類、及びグレガリナ類からなる群から選択される、請求項1記載の方法。
【請求項12】
該無脊椎動物が、伝染性皮下造血器壊死ウイルス(IHHNV);ペナエイドシュリンプのバキュロウイルス(BP)、ホワイトスポットシンドロームウイルス(WSSV);タウラシンドロームウイルス(TSV);ペナエイドシュリンプのラブドウイルス;鰓関連ウイルス(GAV);イエローヘッドウイルス(YHV);リンパ器官関連ウイルス(LOV);肝膵臓パボウイルス(HPV)、バキュロウイルス中腸壊死ウイルス(BMN)、モノドン型バキュロウイルス(MBV)、レオ様ウイルス疾患ウイルス(REO)、及びラブドウイルス(RPS)からなる群から選択される、請求項1記載の方法。
【請求項13】
該無脊椎動物がエビであり、かつ、該病原体がビブリオ菌、マイコバクテリア菌、壊死性肝膵炎、リケッチア、リケッチア様病原体、又は別の細胞内病原体から選択される、請求項1記載の方法。
【請求項14】
該無脊椎動物がエビであり、かつ、その寄生生物が菌類である、請求項1記載の方法。
【請求項15】
該菌類が、フサリウム オキシスポルム、ラゲニジウム属、又はシロルピジウム属である、請求項14記載の方法。
【請求項16】
該無脊椎動物がエビであり、かつその寄生生物が微胞子虫類、略胞子虫類、及びグレガリナ類からなる群から選択される、請求項1記載の方法。
【請求項17】
前記dsRNAが、注入により投与される、請求項1記載の方法。
【請求項18】
前記dsRNAが、浸漬により投与される、請求項1記載の方法。
【請求項19】
前記dsRNAが、フィードストック中に投与される、請求項1記載の方法。
【請求項20】
前記dsRNAが、前記dsRNAを発現する微生物、又は微細藻類中に投与される、請求項1記載の方法。
【請求項21】
前記dsRNAが、VP26、VP28、VP19、リボヌクレオチド還元酵素、チミジル酸キナーゼ、DNAポリメラーゼ、STAT、IKB、神経伝達物質遺伝子、ホルモン遺伝子、代謝経路遺伝子、脱皮抑制ホルモン遺伝子、生殖腺抑制ホルモン遺伝子、甲殻類動物高血糖遺伝子、抗菌性ペプチド遺伝子、クラスチン遺伝子、及びペナエイジン遺伝子からなる群から選択される、海洋無脊椎動物の内在遺伝子を標的にする、請求項1記載の方法。
【請求項22】
前記dsRNAが、免疫、又は抗炎症応答を生じさせる、エビ遺伝子の発現を抑制する、請求項1の方法。
【請求項23】
前記dsRNAが、甲殻類動物の寄生生物に対する防御性を生じさせる、請求項1記載の方法。
【請求項24】
前記寄生生物が、ウイルス、バクテリア、菌類、マイコプラズマ、略胞子虫類、微胞子虫類、及びグレガリナ類から選択される、請求項23記載の方法。
【請求項25】
異なったdsRNAの混合液を投与する、請求項1記載の方法。
【請求項26】
無脊椎動物に、配列非特異的(全身性)免疫応答を誘導する方法であって、通常、該無脊椎動物に感染する病原体に対する防御的免疫応答を与える、又は高める、配列非特異的免疫応答を誘導するのに有効な量の、少なくとも1種の二本鎖RNAを投与することを含む、前記方法。
【請求項27】
前記二本鎖RNAが、少なくとも20〜40のヌクレオチド鎖長である、請求項26記載の方法。
【請求項28】
該二本鎖RNAが、少なくとも50〜100のヌクレオチド鎖長である、請求項27記載の方法。
【請求項29】
該二本鎖RNAが、少なくとも300〜500のヌクレオチド鎖長である、請求項27記載の方法。
【請求項30】
該無脊椎動物が、昆虫、蛛形類動物、唇脚類動物、多足類動物、ミミズ、有殻軟体動物、及び無殻軟体動物から選択される、請求項26記載の方法。
【請求項31】
該無脊椎動物が、海洋無脊椎動物である、請求項26記載の方法。
【請求項32】
前記海洋無脊椎動物が、海綿動物門、刺胞動物門、有櫛動物門、軟体動物門、節足動物門、棘皮動物門、及び海洋ミミズからなる群から選択される、請求項31記載の方法。
【請求項33】
前記軟体動物門が、カキ、ムール貝、貝、イカ、巻貝、ウミウシ、及びタコからなる群から選択される、請求項32の方法。
【請求項34】
前記刺胞動物門が、クラゲ、サンゴ、及びヒドロ虫からなる群から選択される、請求項32記載の方法。
【請求項35】
前記棘皮動物門が、ウニ、ヒトデ、及びクモヒトデからなる群から選択される、請求項32記載の方法。
【請求項36】
前記海洋ミミズが、多毛類、貧毛類、及びハオリムシ類からなる群から選択される、請求項32記載の方法。
【請求項37】
該無脊椎動物が、甲殻類動物である、請求項26記載の方法。
【請求項38】
前記甲殻類動物が、エビ、クレイフィッシュ、カニ、及びロブスターからなる群から選択される、請求項37記載の方法。
【請求項39】
前記エビが、アキカミパストシュリンプ、バルチックプローン、テンジククルマエビ、ブルーシュリンプ、ブラインシュリンプ、ブラウンタイガープローン、カラモテプローン、イースタンキングプローン、イースタンスクールシュリンプ、タイショウエビ、淡水エビ、ジャイアントリバープローン、ブラックタイガー、ヨシエビ、インディアンホワイトプローン、カルマエビ、メタペナエウス属エビ、ノーザンホワイトシュリンプ、パラエモニドシュリンプ、アカオエビ、サザンホワイトシュリンプ、パシフィックホワイトシュリンプ、アトランティックホワイトシュリンプ、及びホワイトレッグシュリンプからなる群から選択される、請求項38記載の方法。
【請求項40】
該甲殻類動物が、リトペナエウス バナメイ、又はペナエウス モノドンである、請求項37記載の方法。
【請求項41】
該カニが、ブルークラブ、チャイニーズリバークラブ、ガザミ、スパイナススパイダークラブ、インドパシフィックスワンプクラブ、海洋カニ、スイムクラブ、及びポルツヌス属スイムクラブからなる群から選択される、請求項38記載の方法。
【請求項42】
前記クレイフィッシュが、ドナウクレイフィッシュ、ユーロアメリカンクレイフィッシュ、ノーブルクレイフィッシュ、マロンクレイフィッシュ、レッドクロウクレイフィッシュ、レッドスワンプクレイフィッシュ、シグナルクレイフィッシュ、及びヤビークレイフィッシュから選択される、請求項38記載の方法。
【請求項43】
該ロブスターが、ウチワエビモドキ、イセエビ、マドスパイニーロブスター、パリヌリドスパイニーロブスター、及びトロピカルスパイニーロブスターからなる群から選択される、請求項38記載の方法。
【請求項44】
該病原体が、ウイルス、バクテリア、菌類、マイコプラズマ、微胞子虫類、略胞子虫類、及びグレガリナ類から選択される、請求項26記載の方法。
【請求項45】
該無脊椎動物がエビであり、かつ病原体が伝染性皮下造血器壊死ウイルス(IHHNV);ペナエイドシュリンプのバキュロウイルス(BP);ホワイトスポットシンドロームウイルス(WSSV);タウラシンドロームウイルス(TSV);ペナエイドシュリンプのラブドウイルス;鰓関連ウイルス (GAV);イエローヘッドウイルス(YHV);リンパ器官関連ウイルス (LOV);肝膵臓パボウイルス(HPV)、バキュロウイルス中腸壊死ウイルス(BMN)、モノドン型バキュロウイルス(MBV)、レオ様ウイルス疾患ウイルス(REO)、ラブドウイルス(RPS)、又は別の細胞内病原体からなる群から選択される、請求項26記載の方法。
【請求項46】
該病原体がビブリオ菌、マイコバクテリア菌、壊死性肝膵炎、リケッチア、及びリケッチア様病原体、又は別の細胞内病原体から選択される、請求項26記載の方法。
【請求項47】
該無脊椎動物がエビであり、かつ該寄生生物が菌類である、請求項26記載の方法。
【請求項48】
前記菌類が、フサリウム オキシスポルム、ラゲニジウム属、又はシロルピジウム属である、請求項47記載の方法。
【請求項49】
該無脊椎動物がエビであり、かつ該寄生生物が微胞子虫類、略胞子虫類、又はグレガリナ類である、請求項26記載の方法。
【請求項50】
該二本鎖RNAが、無脊椎動物とは異なる種に由来する、請求項26記載の方法。
【請求項51】
該二本鎖RNAが、脊椎動物、植物、バクテリア、菌類、又はウイルスに由来する、或いは、天然に存在しない合成dsRNAである、請求項26の方法。
【請求項52】
該二本鎖RNAが、爬虫類、鳥類、哺乳類、魚類、又は両生類に由来する、請求項26記載の方法。
【請求項53】
該二本鎖RNAが、アヒル免疫グロブリン遺伝子である、請求項26記載の方法。
【請求項54】
該二本鎖RNAが、天然に存在しないヌクレオチドを含む、請求項26記載の方法。
【請求項55】
該二本鎖RNAがホモポリマーである、請求項26記載の方法。
【請求項56】
前記二本鎖RNAが、特に特異的にハイブリダイズしない、又は公知のいずれの宿主、又は病原体遺伝子とも有意な配列同一性を示さない、請求項26記載の方法。
【請求項57】
前記二本鎖RNAが、バクテリア遺伝子と配列同一性を示す、請求項26記載の方法。
【請求項58】
該二本鎖RNAが、魚類遺伝子と配列同一性を示す、請求項26記載の方法。
【請求項59】
該二本鎖RNAが、哺乳動物Ig配列と配列同一性を示す、請求項26記載の方法。
【請求項60】
無脊椎動物に、配列特異的な免疫応答、及び配列非特異的な(全身性)免疫応答を誘導する方法であって:(i)該無脊椎動物に、配列非特異的な免疫応答を誘導するのに有効な量の二本鎖RNAを投与すること、ここで、該二本鎖RNAは、特異的にハイブリダイズしないか、或いは該病原体、又は該無脊椎動物の公知の遺伝子のいずれとも有意な配列同一性を示さない;及び(ii)該病原体,又は無脊椎動物に含まれる、標的遺伝子に有意な配列同一性を示す配列を含む第2の二本鎖RNAを投与し、それが、特異的に標的遺伝子にハイブリダイズし、それにより、該標的遺伝子の発現が抑制されること;及び (iii)工程(i)及び(ii)の該RNAが、個別に、又は組合せて、及びいずれかの順で投与され、かつ該dsRNAの投与が、通常該無脊椎動物に感染する病原体に対する防御性を与え、かつ/或いは、無脊椎動物の内在性遺伝子の発現を調整することを含む、前記方法。
【請求項61】
該配列特異的dsRNAの少なくとも一部分と、かなりの配列同一性をもつ標的遺伝子の発現を調整する、配列特異的dsRNAにより生じる無脊椎動物のRNAi応答を高める方法であって、該配列特異的dsRNAを、配列非特異的dsRNAと共に、該配列特異的dsRNAにより生じる該RNAi応答が増大されるような条件下で投与する、前記方法。
【請求項62】
前記dsRNAが個別に投与される、請求項60記載の方法。
【請求項63】
前記dsRNAが個別に投与される、請求項61記載の方法。
【請求項64】
dsRNAが組合せて投与される、請求項60記載の方法。
【請求項65】
前記dsRNAが組合せて投与される、請求項61記載の方法。
【請求項66】
該無脊椎動物がエビであり、かつ該dsRNAが注入により投与される、請求項1記載の方法。
【請求項67】
該無脊椎動物がエビであり、かつ該dsRNAが注入により投与される、請求項26記載の方法。
【請求項68】
該無脊椎動物がエビであり、かつ該dsRNAが注入により投与される、請求項60記載の方法。
【請求項69】
該無脊椎動物がエビであり、かつ該dsRNAが注入により投与される、請求項61記載の方法。
【請求項70】
該無脊椎動物がエビであり、かつ該dsRNAが経口的に、又は浸漬により投与される、請求項26記載の方法。
【請求項71】
該無脊椎動物がエビであり、かつ該dsRNAが経口的に、又は浸漬により投与される、請求項60記載の方法。
【請求項72】
該無脊椎動物がエビであり、かつ該dsRNAが経口的に、又は浸漬によりで投与される、請求項61記載の方法。
【請求項73】
非特異的免疫応答を誘導するdsRNAが、前記無脊椎動物、又は病原体に含まれる遺伝子と明らかな配列同一性を含まない、請求項60記載の方法。
【請求項74】
非特異的免疫応答を誘導するdsRNAが、前記無脊椎動物、又は病原体に含まれる遺伝子と明らかな配列同一性を含まない、請求項61記載の方法。
【請求項75】
配列特異的免疫応答を誘導するdsRNA (ii)が、前記無脊椎動物、又は病原体に含まれる遺伝子に特異的にハイブリダイズする配列を含み、かつ該遺伝子の発現の抑制、又は完全停止をもたらす、請求項60記載の方法。
【請求項76】
配列特異的免疫応答を誘導するdsRNA (ii)が、該無脊椎動物、又は病原体に含まれる遺伝子に特異的にハイブリダイズする配列を含み、かつ該遺伝子の発現の抑制、又は完全停止をもたらす、請求項61記載の方法。
【請求項77】
該無脊椎動物が甲殻類動物である、請求項60記載の方法。
【請求項78】
該無脊椎動物が甲殻類動物である、請求項61記載の方法。
【請求項79】
該甲殻類動物が、エビ、ロブスター、クレイフィッシュ、又はカニである、請求項74の方法。
【請求項80】
該甲殻類動物が、エビ、ロブスター、クレイフィッシュ、又はカニである、請求項78の方法。
【請求項81】
該エビが、アキカミパストシュリンプ、バルチックプローン、テンジククルマエビ、ブラインシュリンプ、ブラウンタイガープローン、イースタンスクールシュリンプ、イースタンキングプローン、タイショウエビ、淡水エビ、ジャイアントリバープローン、ブラックタイガー、ヨシエビ、クマエビ、インディアンホワイトプローン、カルマエビ、メタペナエウス属エビ、ノーザンホワイトシュリンプ、パラエモニドシュリンプ、ペナエウス属エビ、アカオエビ、サザンホワイトシュリンプ、及びホワイトレッグシュリンプから選択される、請求項79記載の方法。
【請求項82】
該エビが、アキカミパストシュリンプ、バルチックプローン、テンジククルマエビ、ブラインシュリンプ、ブラウンタイガープローン、イースタンスクールシュリンプ、イースタンキングプローン、タイショウエビ、淡水エビ、エビ、ジャイアントリバープローン、ブラックタイガー、ヨシエビ、クマエビ、インディアンホワイトプローン、カルマエビ、メタペナエウス属エビ、ノーザンホワイトシュリンプ、パラエモニドシュリンプ、ペナエウス属エビ、アカオエビ、サザンホワイトシュリンプ、及びホワイトレッグシュリンプから選択される、請求項80記載の方法。
【請求項83】
該クレイフィッシュが、ドナウクレイフィッシュ、ユーロアメリカンクレイフィッシュ、ノーブルクレイフィッシュ、マロンクレイフィッシュ、レッドクロウクレイフィッシュ、レッドスワンプクレイフィッシュ、シグナルクレイフィッシュ、及びヤビークレイフィッシュから選択される、請求項79記載の方法。
【請求項84】
該クレイフィッシュが、ドナウクレイフィッシュ、ユーロアメリカンクレイフィッシュ、ノーブルクレイフィッシュ、マロンクレイフィッシュ、レッドクロウクレイフィッシュ、レッドスワンプクレイフィッシュ、シグナルクレイフィッシュ、及びヤビークレイフィッシュから選択される、請求項80記載の方法。
【請求項85】
該ロブスターが、ウチワエビモドキ、イセエビ、マドスパイニーロブスター、パリヌリドスパイニーロブスター、及びトロピカルスパイニーロブスターから選択される、請求項79記載の方法。
【請求項86】
該ロブスターが、ウチワエビモドキ、イセエビ、マドスパイニーロブスター、パリヌリドスパイニーロブスター、及びトロピカルスパイニーロブスターから選択される、請求項80記載の方法。
【請求項87】
該カニが、ブルークラブ、チャイニーズリバークラブ、スパイナススパイダークラブ、インドパシフィックスワンプクラブ、海洋カニ、スイムクラブ、及びガザミから選択される、請求項79記載の方法。
【請求項88】
該カニが、ブルークラブ、チャイニーズリバークラブ、スパイナススパイダークラブ、インドパシフィックスワンプクラブ、海洋カニ、スイムクラブ、及びガザミから選択される、請求項80記載の方法。
【請求項89】
該病原体が、ウイルス、バクテリア、菌類、マイコプラズマ、微胞子虫類、略胞子虫類、又はグレガリナ類である、請求項60記載の方法。
【請求項90】
該病原体が、ウイルス、バクテリア、菌類、マイコプラズマ、微胞子虫類、略胞子虫類、又はグレガリナ類である、請求項61記載の方法。
【請求項91】
該ウイルスが、伝染性皮下造血器壊死ウイルス(IHHNV);ペナエイドシュリンプのバキュロウイルス(BP);ホワイトスポットシンドロームウイルス(WSSV);タウラシンドロームウイルス(TSV);ペナエイドシュリンプのラブドウイルス;鰓関連ウイルス(GAV);イエローヘッドウイルス(YHV);リンパ器官関連ウイルス(LOV);肝膵臓パボウイルス(HPV);伝染性皮下造血器壊死ウイルス(IHHNV)、ペナエイドシュリンプのバキュロウイルス(BP)、ペナエイドシュリンプのラブドウイルス(RPS)、鰓関連ウイルス(GAV)、イエローヘッドウイルス(YHV)、リンパ器官関連ウイルス(LOV)、リンパ器官パボ様ウイルス疾患(LPV)、肝膵臓パボウイルス(HPV)、バキュロウイルス中腸腺壊死ウイルス(BMN)、モノドン型バキュロウイルス (MBV)、レオ様ウイルス疾患(REO)、ラブドウイルス(RPS)、及び新生ウイルスから選択される、請求項89記載の方法。
【請求項92】
該ウイルスが、伝染性皮下造血器壊死ウイルス(IHHNV);ペナエイドシュリンプのバキュロウイルス(BP);ホワイトスポットシンドロームウイルス(WSSV);タウラシンドロームウイルス(TSV);ペナエイドシュリンプのラブドウイルス;鰓関連ウイルス(GAV);イエローヘッドウイルス(YHV);リンパ器官関連ウイルス(LOV);肝膵臓パボウイルス(HPV);リンパ器官パボ様ウイルス疾患(LPV)、バキュロウイルス中腸腺壊死ウイルス(BMN)、モノドン型バキュロウイルス(MBV)、レオ様ウイルス疾患(REO)、ラブドウイルス(RPS)、及び新生ウイルスから選択される、請求項90記載の方法。
【請求項93】
該菌類が、フサリウム オキシスポルム、ラゲニジウム属、又はシロルピジウム属である、請求項89記載の方法。
【請求項94】
該菌類が、フサリウム オキシスポルム、ラゲニジウム属、又はシロルピジウム属である、請求項90記載の方法。
【請求項95】
該病原体がビブリオ菌、マイコバクテリア菌、壊死性肝膵炎(NHP)、リケッチア、リケッチア様病原体である、請求項89記載の方法。
【請求項96】
全身性免疫応答を生じさせる前記dsRNAが、植物、脊椎動物、バクテリア、菌類、又はウイルスに由来する、或いは、天然に存在しない合成dsRNAである、請求項60記載の方法。
【請求項97】
前記dsRNA (i)が、両生類、爬虫類、鳥類、哺乳類、又は魚類配列を含む、請求項96記載の方法。
【請求項98】
さらに、該無脊椎動物の非特異的免疫応答中に、発現増加、又は発現減少する、特異的な核酸配列の同定を含む、請求項26記載の方法。
【請求項99】
前記同定が、サブトラクションハイブリダイゼーションを経て、或いはゲノミクスにより達成される、請求項98記載の方法。
【請求項100】
前記非特異的免疫応答中に転写される核酸配列の、マイクロアレイを作製することを含む、請求項90記載の方法。
【請求項101】
前記マイクロアレイを、脊椎動物、又は他の無脊椎動物の免疫調節遺伝子をコードする核酸配列に接触させ、オーソログを同定する、請求項99記載の方法。
【請求項102】
前記免疫調節遺伝子が、サイトカイン様分子をコードする、請求項99記載の方法。
【請求項103】
前記サイトカイン様分子が、dsRNAに対する無脊椎動物の免疫応答に関与する他の遺伝子の、発現増加、または発現減少をもたらす、請求項102記載の方法。
【請求項104】
病原体に対する非特異的な防御性に必須である、エビ遺伝子を同定する方法であって、(i)エビを、エビ遺伝子に相当するdsRNAに接触させること;及び(ii)該遺伝子の阻害、又は抑制が、該エビの、該dsRNAに対する非特異的免疫応答を生じさせられなくするかを調べることを含む、前記方法。
【請求項105】
前記dsRNAが、該無脊椎動物に感染する細菌ベクターに含まれる、請求項1記載の方法。
【請求項106】
前記dsRNAが、該無脊椎動物に感染する細菌ベクターに含まれる、請求項60記載の方法。
【請求項107】
前記dsRNAが、該無脊椎動物に感染する細菌ベクターに含まれる、請求項61記載の方法。
【請求項108】
前記dsRNAが人工送達系内にある、請求項1記載の方法。
【請求項109】
前記dsRNAが人工送達系内にある、請求項60記載の方法。
【請求項110】
前記dsRNAが人工送達系内にある、請求項61記載の方法。
【請求項111】
前記送達系がカプセル、ポリマー、又は液体である、請求項108記載の方法。
【請求項112】
前記送達系がカプセル、ポリマー、又は液体である、請求項109記載の方法。
【請求項113】
前記送達系がカプセル、ポリマー、又は液体である、請求項110記載の方法。
【請求項114】
前記dsRNAがプラスミドを含む、請求項26記載の方法。
【請求項115】
前記dsRNAがプラスミドを含む、請求項60記載の方法。
【請求項116】
前記dsRNAがプラスミドを含む、請求項61記載の方法。
【請求項117】
前記dsRNAがヘアピンループを含む、請求項1記載の方法。
【請求項118】
前記dsRNAが人工餌料に含まれる、請求項1記載の方法。
【請求項119】
前記dsRNAが組み換え微生物に含まれる、請求項1記載の方法。
【請求項120】
ウイルスフリーのエビ種親を生産するために用いられる、請求項1記載の方法。
【請求項121】
ウイルスフリーのエビ種親を生産するために用いられる、請求項26記載の方法。
【請求項122】
ウイルスフリーのエビ種親を生産するために用いられる、請求項60記載の方法。
【請求項123】
ウイルスフリーのエビ種親を生産するために用いられる、請求項61記載の方法。
【請求項124】
ウイルスフリーのエビ幼生を生産するために用いられる、請求項1記載の方法。
【請求項125】
ウイルスフリーのエビ幼生を生産するために用いられる、請求項26記載の方法。
【請求項126】
ウイルスフリーのエビ幼生を生産するために用いられる、請求項60記載の方法。
【請求項127】
ウイルスフリーのエビ幼生を生産するために用いられる、請求項61記載の方法。
【請求項128】
該無脊椎動物がエビであり、かつウイルス耐性のエビ系統が生産される、請求項1記載の方法。
【請求項129】
該無脊椎動物がエビであり、かつウイルス耐性のエビ系統が生産される、請求項26記載の方法。
【請求項130】
該無脊椎動物がエビであり、かつウイルス耐性のエビ系統が生産される、請求項60記載の方法。
【請求項131】
該無脊椎動物がエビであり、かつウイルス耐性のエビ系統を生産される、請求項61記載の方法。
【請求項132】
異なる無脊椎動物、又は無脊椎動物病原体遺伝子を標的にする、複数の異なるdsRNAが投与される、請求項1記載の方法。
【請求項133】
前記配列特異的dsRNAが、VP26、VP28、VP19、リボヌクレオチド還元酵素、チミジル酸キナーゼ、DNAポリメラーゼ;STAT、IKB、神経伝達物質遺伝子、ホルモン遺伝子、代謝経路遺伝子、脱皮抑制ホルモン遺伝子、生殖腺抑制ホルモン遺伝子、甲殻類動物高血糖遺伝子、抗菌性遺伝子、クラスチン遺伝子、及びペナエイジン遺伝子から選択される遺伝子を標的にする、請求項60記載の方法。
【請求項134】
前記配列特異的dsRNAが、VP26、VP28、VP19、リボヌクレオチド還元酵素、チミジル酸キナーゼ、DNAポリメラーゼ;STAT、IKB、神経伝達物質遺伝子、ホルモン遺伝子、代謝経路遺伝子、脱皮抑制ホルモン遺伝子、生殖腺抑制ホルモン遺伝子、甲殻類動物高血糖遺伝子、抗菌性遺伝子、クラスチン遺伝子、及びペナエイジン遺伝子から選択される遺伝子を標的にする、請求項61記載の方法。
【請求項135】
該無脊椎動物がエビであり、かつエビ遺伝子の該抑制発現が、抗炎症応答、及び/又は免疫機能の抑制をもたらす、請求項1記載の方法。
【請求項136】
該dsRNAが造血機能障害、及び/又は免疫機能の抑制をもたらす、請求項1記載の方法。
【請求項137】
甲殻類動物内在性遺伝子、又は該甲殻類動物に感染する病原体に含まれる必須遺伝子の発現を抑制する手段としての、甲殻類動物へのdsRNA送達方法であって、恒常的に該dsRNAを発現する微生物、むき出しのdsRNAを投与すること、該dsRNAを含む人工送達系、又は該微生物が該甲殻類動物により内在化される条件下での、該dsRNAを含むベクター、又はプラスミドを含む、前記方法。
【請求項138】
前記dsRNAが前記甲殻類動物に注入される、請求項137記載の方法。
【請求項139】
前記dsRNAが、浸漬を経て投与される、請求項137記載の方法。
【請求項140】
該微生物が、酵母菌、又は微細藻類であり、かつ前記甲殻類動物により経口的に摂取される、請求項137記載の方法。
【請求項141】
該酵母菌が、サッカロミセス属、シゾサッカロミセス属、ハンゼヌーラ属、カンジダ属、ピキア属、ヤロウィア属からなる群から選択される、請求項140記載の方法。
【請求項142】
該酵母菌がサッカロミセス セレビシエである、請求項141記載の方法。
【請求項143】
該微生物が、少なくとも1種のdsRNAをコードする異なるなベクターによって、遺伝子導入、或いは形質転換されている、請求項137記載の方法。
【請求項144】
該微生物が、誘導性プロモーターのコントロール下で、該dsRNAを発現する、請求項137記載の方法。
【請求項145】
該微生物がサッカロミセス属酵母菌であり、かつ該誘導性プロモーターが、ガラクトース、又はリン酸誘導性プロモーターである、請求項144記載の方法。
【請求項146】
該微生物が甲殻類動物養殖媒体に含まれる、請求項137記載の方法。
【請求項147】
該微生物が、甲殻類動物餌料組成物に含まれる、請求項137記載の方法。
【請求項148】
該微生物が微細藻類である、請求項137記載の方法。
【請求項149】
前記微細藻類が、クロレラ属、ヘマトコッカス属、アルスロスピラ属(スピルリナ属)、ナンノクロロプシス属、スケレトネマ属、キートセロス属、テトラセルミス属、イソクリシス属、及びクラミドモナス属からなる群から選択される、請求項148記載の方法。
【請求項150】
該甲殻類動物がエビである、請求項137記載の方法。
【請求項151】
抑制される遺伝子が、該甲殻類動物に感染するウイルスに含まれる遺伝子である、請求項137記載の方法。
【請求項152】
該微細藻類がクラミドモナス レインハルディ(Chlamydomonas reinhardtii、コナミドリムシ)である、請求項140記載の方法。
【請求項153】
少なくとも1種の、甲殻類動物にとって毒性のない微生物を含む、甲殻類動物による摂食に適した栄養組成物であって、該微生物が少なくとも1種のdsRNAを恒常的に発現する前記組成物。
【請求項154】
該微生物が、酵母菌、又は微細藻類である、請求項153記載の栄養組成物。
【請求項155】
該酵母菌がサッカロミセス属酵母菌である、請求項141記載の方法。
【請求項156】
該微細藻類が、クロレラ属、ヘマトコッカス属、アルスロスピラ属、ナンノクロロプシス属、スケレトネマ属、キートセロス属、テトラセルミス属、イソクリシス属、及びクラミドモナス属からなる群から選択される、請求項154記載の方法。
【請求項157】
前記微細藻類が、甲殻類動物に感染するウイルスに含まれる遺伝子の発現を抑制する、少なくとも1種のdsRNAを発現する、請求項155記載の栄養組成物。
【請求項158】
前記甲殻類動物がエビであり、かつ該ウイルスがホワイトスポットシンドロームウイルス、又はタウラシンドロームウイルスである、請求項157記載の栄養組成物。
【請求項159】
前記微生物が、サッカロミセス属酵母菌であり、甲殻類動物に感染するウイルスに含まれる遺伝子の発現を抑制する、少なくとも1種のdsRNAを発現する、請求項157記載の栄養組成物。
【請求項160】
前記甲殻類動物がエビであり、かつ該ウイルスがホワイトスポットシンドロームウイルス、又はタウラシンドロームウイルスである、請求項159記載の方法。
【請求項161】
該サッカロミセス属酵母菌が、サッカロミセス セレビシエである、請求項158記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図5c】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】




【図2】


【図3】


【図4】


【図5】


【図5c】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【公表番号】特表2007−530414(P2007−530414A)
【公表日】平成19年11月1日(2007.11.1)
【国際特許分類】
【出願番号】特願2006−518782(P2006−518782)
【出願日】平成16年7月2日(2004.7.2)
【国際出願番号】PCT/US2004/021271
【国際公開番号】WO2005/005613
【国際公開日】平成17年1月20日(2005.1.20)
【出願人】(506243345)エムユーエスシー ファウンデイション フォー リサーチ デべロップメント (2)
【Fターム(参考)】
【公表日】平成19年11月1日(2007.11.1)
【国際特許分類】
【出願日】平成16年7月2日(2004.7.2)
【国際出願番号】PCT/US2004/021271
【国際公開番号】WO2005/005613
【国際公開日】平成17年1月20日(2005.1.20)
【出願人】(506243345)エムユーエスシー ファウンデイション フォー リサーチ デべロップメント (2)
【Fターム(参考)】
[ Back to top ]

