甲虫類ルシフェラーゼ
【課題】 高いルシフェラーゼ活性および適切なKM値を有する変異型甲虫類ルシフェラーゼおよびそれを利用した優れた細胞内ATP濃度測定方法を提供する。
【解決手段】 酵素反応をミカエリス−メンテンのモデルによって解析したときに、ATPに対するミカエリス定数KMが0.3mM以上であり、且つkcatが野生型または変異導入前の甲虫類ルシフェラーゼのkcatの50%以上の値である変異型甲虫類ルシフェラーゼ。
【解決手段】 酵素反応をミカエリス−メンテンのモデルによって解析したときに、ATPに対するミカエリス定数KMが0.3mM以上であり、且つkcatが野生型または変異導入前の甲虫類ルシフェラーゼのkcatの50%以上の値である変異型甲虫類ルシフェラーゼ。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、甲虫類ルシフェラーゼおよびそれを利用したATP濃度測定方法に関する。
【背景技術】
【0002】
甲虫類ルシフェラーゼタンパク質は、ホタル、鉄道虫、ヒカリコメツキ等の甲虫類が持つ発光タンパク質である。甲虫類ルシフェラーゼタンパク質は、D−ルシフェリン、酸素分子およびATPを基質として、電子励起状態のオキシルシフェリンを生成する酸化反応を触媒する。生成された電子励起状態のオキシルシフェリンは、基底状態に戻るときに可視光としてエネルギーを放出する。なお、本願では、甲虫類ルシフェラーゼタンパク質を総称して「ルシフェラーゼ」と呼ぶ場合があり、また、ルシフェラーゼが触媒する酸化反応および引き続き起こるオキシルシフェリンの化学発光をあわせた一連の反応に対して「ルシフェラーゼ活性」または「発光活性」という用語を使用する場合がある。
【0003】
ルシフェラーゼは発光イメージングに利用さている。例えば、ルシフェラーゼを発現する細胞または組織をイメージングするための、高感度CCDカメラおよび明るい光学系を含む発光イメージング装置が現在市販されている。
【0004】
発光イメージングは、GFP等の蛍光タンパク質による蛍光イメージングに勝る点が多い。発光イメージングは、観察の際に励起光を必要としないため、蛍光イメージングの場合に生じる蛍光分子の退色や光毒性による細胞へのダメージが無いため、数日間以上の長期間にわたって定量的な観察が可能である。また、蛍光イメージングでは生体内の様々な色素分子に由来する自家蛍光が観察の障害となるが、発光イメージングではこれが生じない。以上の点から、細胞、組織および個体といった幅広い範囲で、様々な用途に発光イメージング法が活用されている。
【0005】
また、ルシフェラーゼは、ATPの定量的検出のために利用されている。ATPは、細胞内でのエネルギー通貨であるとともに、シグナル伝達系のリン酸化反応の基質でもあり、細胞内で非常に重要な役割を担っている。そのため、細胞内のATP濃度の測定は細胞機能解析にとって重要である。ルシフェラーゼの濃度が一定で、試料内の基質(D−ルシフェリンおよびATP)のうち一方の濃度が十分に高い場合、ルシフェラーゼの発光強度は他方の基質の濃度に依存する。すなわち、恒常的に発現するプロモーターによってルシフェラーゼを発現させ、D−ルシフェリンを培地中に十分に添加することによって、細胞を生かしたままで細胞内のATP濃度を経時的に計測することが可能となる。このような原理に基づき、高感度な光検出装置を用いることで10−12M程度の微量なATPを定量的に検出することが可能となっており、そのような測定を実現するための試薬キットも市販されている。
【0006】
非特許文献1および非特許文献2には、既存のホタルルシフェラーゼを用いた、生きた細胞においてATP濃度を測定する方法が記載されている。これらの方法でも、当該ホタルルシフェラーゼの発光強度を測定する。しかしながら、既存のホタルルシフェラーゼは、細胞内のATP濃度ですでに飽和しており、少量のATP濃度の変化では発光強度の変化が小さく、信頼性の高い測定を行うのが困難である。また、発光タンパク質の発光強度は蛍光タンパク質と比較して極めて弱いため、これらの方法では、鮮明な画像を取得するために長期間の露出を要するという制約が存在する。例えば、現在利用可能な、高感度CCDカメラおよび明るい光学系を備えた発光顕微鏡システム(オリンパス製LV200等)を用いても、細胞内のルシフェラーゼの微弱な発光を画像として取得するには、典型的に数分の露光時間を要する。外部刺激に対する細胞内ATP濃度変化の応答時間は、培地に呼吸系の阻害剤を添加した場合等の極端な例で2分程度と報告されている(非特許文献3)。この点から、細胞内ATP濃度変化を経時的に精度良く測定するためには、露光時間を現在の数分のオーダーからさらに伸ばすことは望ましくない。また、現在の市販の高感度CCDカメラ(浜松ホトニクス社製ImagEM等)の量子効率がルシフェラーゼの発光波長帯において90%以上に達していることから、大きなブレークスルーが無い限り測定装置の改良によって現在の露光時間を大幅に短縮することは望めない。そのため、例えば発光イメージングによって細胞内ATP濃度およびその時間変化を高感度に検出するためには、ルシフェラーゼ活性が高く且つATPに対する応答性が高いルシフェラーゼが必要である。
【0007】
ルシフェラーゼ活性およびATPに対する応答性は、酵素学的パラメータを用いて議論される。すなわち、ルシフェラーゼの活性は、ミカエリス−メンテンのモデルに基づいて解析される。D−ルシフェリンの濃度が十分に高く、反応開始時のATP濃度が[ATP]0であるとき、初期反応速度v0は、
【0008】
【数1】

と表すことができる。ここで、KMはATPに対するミカエリス定数である。また、v0は、発生する光子数、すなわち発光強度と比例関係にある。Vmaxは、ルシフェラーゼの濃度[LUC]totalに比例する。すなわち、
【0009】
【数2】

という関係が成り立つ。ここで、[LUC]totalと表記したのは、ATPと結合したルシフェラーゼと結合していないルシフェラーゼとを区別せずに、反応系に存在するすべてのルシフェラーゼの濃度であることを示すためである。kcatは、基質が十分に存在する時の、ルシフェラーゼの単位時間および単位濃度あたりの発光活性に対応しており、「ルシフェラーゼの明るさ」と考えることができる。
【0010】
図1は、KMが異なる2つのルシフェラーゼについて、発光強度とATP濃度との関係を式1から求めてプロットしたものである。図1中に示される縦軸に平行な2本の破線は、それぞれの曲線のKMを表す線である。すなわち、左の破線が実線からなる曲線についてのKMを表し、右の破線が破線からなる曲線についてのKMを表す。図1からわかるように、ルシフェラーゼの発光強度は、ATP濃度が上昇するに従って急速に上昇する。ATP濃度がKMに比べて低濃度のとき、ATP濃度と発光強度とは比例に近い関係を示している。しかし、ATP濃度がKMよりも大きくなると、ATP濃度の変化量に対して発光強度の変化量は小さくなる。例えば、ATP濃度がKMの値の3倍に達すると、ルシフェラーゼの発光強度はすでに最大発光強度の75%に達しており、ATP濃度がそれ以上に上昇しても発光強度の変化は小さい。このような濃度範囲では、ATP濃度を測定することが困難となる。
【0011】
以上より、ルシフェラーゼ活性が高く且つATPに対する応答性が高いというルシフェラーゼの好ましい条件は、kcatが可能な限り大きく且つKMの値を3倍した値が測定したいATP濃度範囲より大きいという条件に言い換えることができる。
【0012】
生体組織中のATP濃度は、その由来となった臓器および動物種によって違いがあるものの、ヒトの場合約2.1mMであると報告されており(非特許文献4)、培養細胞については1〜1.3mMとの報告がある(非特許文献2および非特許文献5)。したがって、上述したKMの条件を考慮すれば、これらの細胞のATP濃度の測定に適したKMの下限値は0.3mM〜0.7mMである。
【0013】
しかしながら、現在までに報告されている野生型甲虫類ルシフェラーゼのKMは0.2mMよりも低い。そこで、野生型甲虫類ルシフェラーゼに変異を導入してKMを上昇させた変異体が作製されている(非特許文献6および特許文献1)。しかし、非特許文献6に記載される変異体では基質結合部位から5Å以内の範囲に変異が導入されており、そのほとんどにおいて発光活性(すなわちkcatの値)が大幅に低下していた。また、特許文献1にはkcatについての具体的な記載がないものの、非特許文献6の場合と同様に、変異導入部位が基質結合部位に近い部分に存在する。そのため、特許文献1に記載の変異型ルシフェラーゼにおいても、発光活性が大幅に低下していることが予想される。したがって、現在までに公知となっている野生型または変異型ルシフェラーゼを用いて、理想的なATP濃度測定を行うことは困難である。
【先行技術文献】
【特許文献】
【0014】
【特許文献1】米国特許第6265177号明細書
【非特許文献】
【0015】
【非特許文献1】Ainskow, E. K. et al. (2002), Dynamic imaging of free cytosolic ATP concentration during fuel sensing by rat hypothalamic neurones: evidence for ATP-independent control of ATP-sensitive K+ channels, Journal of Physiology, 544.2, 429-445.
【非特許文献2】Kennedy, H. J. et al. (1999), Glucose generates sub-plasma membrane ATP microdomains in single islet β-cells, Journal of Biological Chemistry, 274, 13281-13291.
【非特許文献3】Imamura, H. et al. (2009), Visualization of ATP levels inside single living cells with fluorescence resonance energy transfer-based genetically encoded indicators, Proceedings of the National Academy of Science of the United States of America, 106, 15651-15656.
【非特許文献4】Traut, T. W. (1994), Physiological concentrations of purines and pyrimidines, Molecular and Cellular Biochemistry, 140, 1-22.
【非特許文献5】Zamaraeva, M. V. et al. (2005), Cells die with increased cytosolic ATP during apoptosis: a bioluminescence study with intracellular luciferase, Cell Death and Differentiation, 12, 1390-1397.
【非特許文献6】Branchini, B. R. et al. (2003), A mutagenesis study of the putative luciferin binding site residues of firefly luciferase, Biochemistry, 42, 10429-10436.
【発明の概要】
【発明が解決しようとする課題】
【0016】
本発明の目的は、高いルシフェラーゼ活性および適切なKM値を有する変異型甲虫類ルシフェラーゼおよびそれを利用した優れた細胞内ATP濃度測定方法を提供することにある。
【課題を解決するための手段】
【0017】
本発明の実施態様によれば、酵素反応をミカエリス−メンテンのモデルによって解析したときに、ATPに対するミカエリス定数KMが0.3mM以上であり、且つkcatが野生型または変異導入前の甲虫類ルシフェラーゼのkcatの50%以上の値である変異型甲虫類ルシフェラーゼが提供される。
【発明の効果】
【0018】
本発明によれば、露光時間が短縮され、且つ精度の高いATP濃度測定が可能となる。
【図面の簡単な説明】
【0019】
【図1】KMが異なる2つのルシフェラーゼの触媒反応における、発光強度とATP濃度との関係を示す図。
【図2】ヤエヤマヒメボタルルシフェラーゼの立体構造モデルを示す図。
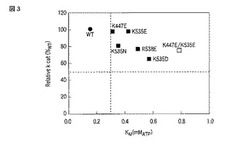
【図3】様々なヤエヤマヒメボタル変異型ルシフェラーゼにおける、KMとkcatとの関係を示す図。
【図4】GL3ルシフェラーゼおよびその変異体の発光強度のATP濃度依存性およびミカエリス−メンテンのモデルによる解析結果を示す図。
【発明を実施するための形態】
【0020】
本発明の一態様は、酵素反応をミカエリス−メンテンのモデルによって解析したときに、ATPに対するミカエリス定数KMが0.3mM以上であり、且つkcatが野生型または変異導入前の甲虫類ルシフェラーゼのkcatの50%以上の値である変異型甲虫類ルシフェラーゼである。そのような、変異型甲虫類ルシフェラーゼでは、タンパク質の立体構造において、基質結合部位から5Å以上離れた部位に変異が導入されていてよい。さらに、変異が導入されている前記部位は、変異導入前において、少なくとも1つの塩基性アミノ酸残基であってよい。
【0021】
(発明に至る経緯)
まず、本発明者が本発明に至った経緯を説明する。
上述のように、非特許文献6では、基質結合部位付近に変異を導入した結果、ATPに対するKMが上昇すると同時にkcatが低下、あるいはD−ルシフェリンに対するKMが上昇している。本発明者は、このような現象について、基質結合部位付近に変異を導入することで基質が反応に好ましい配置を採ることを妨げられ、ATPに対するKMを上昇させるという好ましい変化と同時に、発光活性(kcat)の低下およびD−ルシフェリンに対するKMの上昇が起こったと考察した。
【0022】
一方、本発明者は、ルシフェラーゼは、高効率に発光するために、すなわち反応効率を上げるために、ATPおよびルシフェリンといった基質を活性部位に集めるように進化してきたと仮定した。例えば、ルシフェラーゼ表面に接触したATPおよびルシフェリンを反応の場となる活性部位に向けて集約する機構を有していると考えた。そのような機構を実現するため、分子の表面且つ活性部位(すなわち基質結合部位)から離れた位置に、ATPとの結合に適した部位(例えばアミノ酸残基の側鎖)が存在すると考えた。そして、このような仮定が正しければ、この部位に変異を導入することで、ATPを取り込む効率(すなわちKMの値)を下げることができ、同時に活性部位に到達した基質同士の反応の進行は野生型と同程度に維持できる(すなわち高いkcatが得られる)と考えた。
【0023】
ATPは生理的な溶液中でMgATP2−として存在し、負電荷を帯びている。そのため、上記のATPが好む側鎖として、正電荷を帯びた塩基性アミノ酸残基の側鎖、例えばアルギニンおよびリジンの側鎖を検討した。また、このようなアミノ酸残基のタンパク質立体構造上の位置は、タンパク質の表面であって、基質が結合するくぼみを中心とする側の半球に位置すると予想した。
【0024】
ホタルルシフェラーゼの立体構造は、北米ボタル(Photinus pyralis)(Conti E. et al. (1996), Crystal structure of firefly luciferase throws light on a superfamily of adenylate-forming enzymes, Structure, 4, 287-298)およびゲンジボタル(Luciola cruciata)(Nakatsu, T. et al. (2006), Structural basis for the spectral difference in luciferase bioluminescence, Nature, 440, 372-376)について報告されている。北米ボタルルシフェラーゼとゲンジボタルルシフェラーゼは、アミノ酸配列上では68%の相同性を有するが、フレキシブルなリンカーで繋がれた2つの主要なドメイン同士の位置関係を除き、これらのホタルルシフェラーゼの構造は良く一致している。このことから、フォールドおよびドメイン構造等の全体的な構造については、甲虫類ルシフェラーゼにおいて共通していると推測される。
【0025】
本発明者は、基質アナログと結合した結晶構造が既知であるゲンジボタルルシフェラーゼの立体構造をテンプレートとして、ヤエヤマヒメボタルルシフェラーゼ(YaeLUC)の構造モデルを作製し(図2)、その構造モデルをもとに、上述のようなATP結合部位を探索した。YaeLUCは、秋吉らによってヤエヤマヒメボタル(Luciola filiformis yayeyamana)からクローニングされたホタルルシフェラーゼ(配列番号1)であり(国際公開第2009/075306号)、北米ボタルルシフェラーゼとの間で66%、ゲンジボタルルシフェラーゼとの間で81%の相同性を有している。この点に着目し、相同性に基づく構造モデルの構築および基質近傍のアミノ酸残基の位置の特定のために利用した。
【0026】
以上のような戦略のもと、本発明者が、様々な部位に対する変異体を設計および作製し、ATPに対する親和性および発光活性を調べた結果、本発明者の予想通り、ATPに対する親和性が低下し、同時に発光活性が高く維持された変異型ルシフェラーゼを得ることができた。例えば、YaeLUCの447位のリジン(K447)、535位のリジン(K535)または538位のアルギニン(R538)を、中性または酸性のアミノ酸残基に置換した変異体は、発光活性(kcat値)が野生型に対して50%以上の高い値を維持しつつ、ATPに対するKM値は0.3mM以上となった。
【0027】
変異を導入したこれらの部位は、構造モデル上で基質結合部位(ATPが存在する部位)から5Å以上離れて位置しており(図2)、ATPとルシフェリンとの反応およびその後の発光を直接には阻害しないことが合理的に理解される。また、これらの変異を組み合わせた多重変異体では、発光活性を高く維持し且つATPに対するKMを下げるという効果が相乗的に得られることがわかった。
【0028】
(変異型甲虫類ルシフェラーゼ)
次に、本発明の態様について説明する。
本発明の一態様は、酵素反応をミカエリス−メンテンのモデルによって解析したときに、ATPに対するミカエリス定数KMが0.3mM以上であり、且つkcatが野生型または変異導入前の甲虫類ルシフェラーゼのkcatの50%以上の値である変異型甲虫類ルシフェラーゼである。
【0029】
本発明の一態様に係るルシフェラーゼは甲虫類に由来する。甲虫類とは甲虫綱コウチュウ目に分類される昆虫の総称であり、例えば、ホタル(Lampyridae)科、フェンゴディダエ(Phengodidae)科またはコメツキムシ(Elateroidae)科に属する昆虫である。ホタル科に属する昆虫とは、例えば、ヤエヤマヒメボタル(Luciola filiformis yayeyamana)、ゲンジボタル(Luciola cruciata)、ヘイケボタル(Luciola lateralis)、北米ボタル(Photinus pyralis)である。フェンゴディダエ科に属する昆虫とは、例えば、鉄道虫(Phrixothrix hirtus)である。コメツキムシ科に属する昆虫とは、例えば、ヒカリコメツキ(Pyrophorus plagiophthalamus)である。
【0030】
本発明の一態様に係るルシフェラーゼは、変異型ルシフェラーゼである。すなわち、既知の野生型甲虫類ルシフェラーゼもしくはその変異体または新規に同定された野生型甲虫類ルシフェラーゼもしくはその変異体に対して変異を導入することで得られるルシフェラーゼである。既知の野生型甲虫類ルシフェラーゼまたはその変異体は、市販されているルシフェラーゼであってよい。ここにおいて、変異とは、例えば、アミノ酸配列におけるアミノ酸の置換、欠失もしくは付加等またはこれらの組み合わせを意味する。この変異は、野生型ルシフェラーゼのアミノ酸配列において、1つのアミノ酸残基に生じた変異であってよく、2つのアミノ酸残基に生じた変異であってよく、3つのアミノ酸残基に生じた変異であってよく、または4以上のアミノ酸残基に生じた変異であってよい。複数のアミノ酸残基における変異は、連続したアミノ酸残基に生じたものであっても、互いに離れたアミノ酸残基に生じたものであってもよい。変異型ルシフェラーゼは、その野生型ルシフェラーゼとの間で、75%以上、80%以上、85%以上、90%以上、95%以上、96%以上、97%以上、98%以上または99%以上の相同性を有してよい。
【0031】
そのような変異は、関連する技術分野において一般的な方法によって導入されたものであってよい。例えば、ルシフェラーゼタンパク質をコードするDNAに変異を導入することで得られたものであってよい。そのような導入方法の例は、変異を導入したいルシフェラーゼ遺伝子の塩基配列を含むDNAにおいて、変異を導入しようとするアミノ酸配列に対応する核酸に変異を導入するという方法である。DNAにおける変異の導入は、QuikChange II Site−Directed Mutagenesis Kit(Stratagene)等の市販のキット類を用いて容易に行うことが出来る。変異型ルシフェラーゼは、野生型ルシフェラーゼ全長に対応するものであってよく、または野生型ルシフェラーゼの一部を欠損したタンパク質に対応するものであってもよい。また、変異型ルシフェラーゼは、野生型ルシフェラーゼ以外のタンパク質の一部または全部を含んでよい。例えば、変異型ルシフェラーゼが、野生型ルシフェラーゼに由来するタンパク質とその他のタンパク質に由来するタンパク質とが融合したタンパク質であってよい。
【0032】
本発明の一態様のルシフェラーゼにおいて、ATPに対するミカエリス定数KMは0.3mM以上であり、好ましくは0.7mM以上である。ここにいう、ATPに対するミカエリス定数KMとは、ルシフェラーゼによって触媒されるATPとルシフェリンとの反応において、ルシフェリンが十分に存在している場合に、ATP濃度と反応速度との関係を示すミカエリス−メンテン式におけるKMである。すなわち、以下の式3に示されるミカエリス−メンテン式におけるKMである。
【0033】
【数3】

この式において、vは反応速度または発光強度を意味し、[ATP]はATP濃度を意味する。また、VmaxはATPが十分量存在するときの反応速度を意味する。図1は、この式から算出されるATP濃度と反応速度との関係を、ATP濃度を横軸とし発光強度を縦軸としてプロットしたものである。この図には、Vmaxは同一であるが、KMが異なる2つの曲線が示される。すなわち、これらの曲線のKMは、一方が0.1mMであり、他方が1.0mMである。この図からわかるように、ATP濃度の増大とともに発光強度が増大するものの、ATP濃度が一定値を超えると発光強度が飽和してしまい、ほとんど増大しなくなる。このように発光強度が飽和した範囲では、ATP濃度を測定することが困難であり、発光強度が飽和する前の範囲が、ATP濃度の測定に適していることがわかる。KMの異なる2つの曲線を比較した場合、KMが大きいルシフェラーゼの方が測定に適した範囲(飽和前の範囲)が広いことがわかる。図1によれば、KMが0.1mMの場合、例えば0.5mMを超えるATP濃度の範囲にて測定を行うことは困難であるが、KMが1.0mMの場合には、図示される最大のATP濃度である2.0mM付近でも測定可能であることがわかる。上述の通り、ヒトの細胞ではATP濃度が約2.1mMと報告され、培養細胞では1〜1.3mMと報告されているが、KMが0.3mM以上であれば1mM付近の測定に利用でき、0.7mM以上であれば2.1mM付近の測定にも利用できる。
【0034】
本発明の一態様に係る変異型甲虫類ルシフェラーゼでは、kcatが、野生型または変異導入前の甲虫類ルシフェラーゼのkcatの50%以上の値であり、好ましくは60%以上である。すなわち、本発明の一態様の変異型甲虫類ルシフェラーゼについて、その変異導入前のルシフェラーゼとの間でkcatを比較した場合、変異型甲虫類ルシフェラーゼのkcatが、変異導入前のルシフェラーゼのkcatの50%以上の値となる。kcatとは、基質が十分に存在する時の、ルシフェラーゼの単位時間および単位濃度あたりの発光活性であり、次の式4を満たす。
【0035】
【数4】

ここにおいて、[LUC]totalとは、反応系に存在する全てのルシフェラーゼの濃度である。kcatが発光活性の最大値Vmaxと比例することを考えれば、kcatが50%以上であるという特定は、変異型ルシフェラーゼの発光活性が野生型ルシフェラーゼの発光活性の50%以上であることを意味する。また、変異型ルシフェラーゼのkcatは、野生型甲虫類ルシフェラーゼのkcatの100%以上であってもよい。すなわち、変異型ルシフェラーゼの方が、野生型ルシフェラーゼよりも高い発光活性を示してもよい。例えば、変異型ルシフェラーゼが、ATPの応答性に関する変異に加えて、発光活性を高めるような変異を含むことで、野生型よりも強く光るルシフェラーゼであってよい。
【0036】
本発明の一態様の変異型甲虫類ルシフェラーゼは、野生型と比較してATPに対する親和性が低いものの、発光活性を高く維持している。このようなルシフェラーゼを使用することで、既存のルシフェラーゼでは測定できない濃度範囲における測定が可能となり、また測定可能であっても発光強度が低いために実用的でない範囲における測定が可能となる。さらに、ATP濃度の測定だけでなく、変異型甲虫類ルシフェラーゼの特性を利用した様々な応用が期待できる。
【0037】
本発明の一態様の変異型甲虫類ルシフェラーゼは、タンパク質の立体構造において、基質結合部位から5Å以上離れた部位に変異が導入されていてよい。すなわち、当該ルシフェラーゼにおける変異の少なくとも1つが、基質結合部位から5Å以上離れた部位に存在してよい。基質結合部位とは、ATPとルシフェリンとの反応が生じるときに、ATPが安定的に配置するルシフェラーゼ内の部位のことである。換言すれば、基質結合部位は活性部位である。変異が基質結合部位から5Å以上離れた部位に存在することで、発光活性に対する悪影響を最小化し(すなわちkcatの低下を抑制し)、ATP応答性を上げる(すなわちKMを大きくする)ことができる。また、変異は、基質結合部位から5Å以上離れ且つルシフェラーゼタンパク質の表面に導入されていてよい。
【0038】
基質結合部位からの距離の算出は、例えば、基質または基質アナログとの共結晶の結晶構造が既知のルシフェラーゼを利用して行うことができる。例えば、ゲンジボタルルシフェラーゼの結晶構造が既知であるため、これが利用される(Nakatsu, T. et al. (2006), Structural basis for the spectral difference in luciferase bioluminescence, Nature, 440, 372-376)。まず、ゲンジボタルルシフェラーゼにおいて、基質結合部位から5Å以上離れた部位を特定する。次に、本発明の一態様に係るルシフェラーゼとゲンジボタルルシフェラーゼとの間のアミノ酸配列の相同性を考慮して、本発明の一態様に係るルシフェラーゼにおける5Å以上離れた部位を特定することができる。
【0039】
あるいは、本発明の一態様に係るルシフェラーゼの構造モデルを作製し、モデル上で5Å以上離れた部位を特定することもできる。具体的には、構造既知のタンパク質との配列相同性に基づいた構造予測によって構造モデルを作製し、そのモデル上で基質結合部位との距離を算出する。構造モデルの作製には、例えば、SWISS−MODEL(http://swissmodel.expasy.org/)といったオンラインサービスを利用することが可能である。図2には、このサービスを利用して作成した野生型ヤエヤマヒメボタルルシフェラーゼの構造モデルを示す。この構造モデルは、ゲンジボタルルシフェラーゼと、基質アナログである5’−O−[N−(デヒドロルシフェリル)−スルファモイル]アデノシン(DLSA)との共結晶の構造(PDB ID:2D1S)をテンプレート構造として作成した。この構造モデルに対して、テンプレート構造におけるDLSAを重ね合わせることで、野生型ヤエヤマヒメボタルルシフェラーゼの構造モデルにおける基質結合部位を推定することができる。
【0040】
本発明の一態様の変異型甲虫類ルシフェラーゼにおいて、変異が導入されている部位は、変異導入前において、少なくとも1つの塩基性アミノ酸残基であってよい。すなわち、変異型甲虫類ルシフェラーゼは、この塩基性アミノ酸残基に対して変異を導入することで得られたルシフェラーゼであってよい。塩基性アミノ酸残基は1つである場合に限らず、複数であってもよい。ここにいう変異導入前とは、変異導入前のタンパク質が、野生型ルシフェラーゼだけでなく、既に何らかの変異が導入されているルシフェラーゼをも含むことを意味する。塩基性アミノ酸とは、例えば2つ以上のアミノ基を有することで塩基性を有したアミノ酸のことであり、例えば、リジン、アルギニンまたはヒスチジンである。なお、このような変異型甲虫類ルシフェラーゼでは、塩基性アミノ酸残基に加えて、その他の残基に変異が導入されていてもよい。
【0041】
本発明の一態様の変異型甲虫類ルシフェラーゼにおいて、変異が導入される塩基性アミノ酸残基は、相同性に基づく配列比較において、野生型ヤエヤマヒメボタルルシフェラーゼの447位のリジンに相当するアミノ酸残基、535位のリジンに相当するアミノ酸残基または538位のアルギニンに相当するアミノ酸残基であってよい。すなわち、任意の甲虫類ルシフェラーゼについて、野生型ヤエヤマヒメボタルルシフェラーゼとの間でアミノ酸配列の相同性を検討したとき、野生型ヤエヤマヒメボタルルシフェラーゼの447位のリジン、535位のリジンまたは538位のアルギニンに相当する、任意の甲虫類ルシフェラーゼにおけるアミノ酸残基に対して変異が導入されてよい。
【0042】
甲虫類のルシフェラーゼ同士は、一般的に相同性が高いことが知られている。例えば、ヒカリコメツキとホタルとは、分類学上の科は違うにも関わらず、ルシフェラーゼ同士では50%程度の相同性がある。また、全ての甲虫類ルシフェラーゼ間において完全に保存されている部位が多数存在する。したがって、野生型ヤエヤマヒメボタルルシフェラーゼの特定のアミノ酸残基(例えば447位のリジン残基)に相当するアミノ酸残基を、別の種に由来するルシフェラーゼにおいて特定することは技術的に容易である。
【0043】
そのような特定は、例えば、ClustalW(http://www.clustal.org/)といった既知の配列比較プログラムを用いて行うことができる。この場合、比較を行いたい2つのルシフェラーゼの配列を入力してプログラムを実行することによって、配列比較を行うことができる。ここで、野生型ヤエヤマヒメボタルルシフェラーゼを2つの配列の1つとして入力すれば、野生型ヤエヤマヒメボタルルシフェラーゼの特定位置の残基が、他のルシフェラーゼにおいてどの位置に対応するかを容易に特定できる。
【0044】
あるいは、基質または基質アナログとの共結晶の結晶構造が知られているルシフェラーゼ(例えば、ゲンジボタルルシフェラーゼ(Nakatsu, T. et al. (2006), Structural basis for the spectral difference in luciferase bioluminescence, Nature, 440, 372-376))との間で配列比較を行うことによって、任意のルシフェラーゼの特定の残基が、既知のルシフェラーゼタンパク質立体構造上でどこに対応するかを特定できる。
【0045】
図2には、ヤエヤマヒメボタルルシフェラーゼの立体構造のモデルが示される。この図には、447位のリジン、535位のリジンおよび538位のアルギニンが示されている。この図からわかるように、これらの残基は基質結合部位(DLSAが位置する部位)から離れており且つタンパク質の表面付近に位置することがわかる。一方、特許文献1に開示される変異型北米ボタルルシフェラーゼでは、その245位および318位の残基に変異が導入されている。これらの位置は、相同性検索によれば、ヤエヤマヒメボタルルシフェラーゼの247位および320位に相当し、図2に示されるように基質結合部位付近に位置する。すなわち、447位のリジン、535位のリジンおよび538位のアルギニンという位置は、少なくとも基質結合部位からの距離に関して、既知の変異型ルシフェラーゼにおける変異導入部位と大きく異なる。
【0046】
以下の表1に、代表的な甲虫類ルシフェラーゼにおける、ヤエヤマヒメボタルの447位のリジン残基、535位のリジン残基および538位のアルギニン残基に相当する残基を示す。
【0047】
【表1】

既知の各ルシフェラーゼについて、表1に示される残基に変異を導入することで本発明の一態様に係る変異型甲虫類ルシフェラーゼを作製することができる。
【0048】
導入する変異としては、もとのアミノ酸残基の有する電気的性質を打ち消すような変異であることが好ましい。もとのアミノ酸残基が塩基性残基であれば、その正電荷を帯びているという性質を打ち消す変異が好ましく、すなわち、その塩基性残基を酸性残基または中性残基に置換する変異であることが好ましい。ATPとの親和性を低下させるためには、すなわちKMを増大させるためには、塩基性残基を酸性残基に置換することがより好ましい。例えば、グルタミン酸、アスパラギン酸またはアスパラギンへの置換であることが好ましい。しかしながら、測定に適したKM値およびkcat値、ルシフェラーゼの安定性等に応じて適宜選択することができる。
【0049】
本発明の一態様の変異型甲虫類ルシフェラーゼは、上述したような変異を複数含んでよい。すなわち、変異が導入される塩基性アミノ酸残基は、相同性に基づく配列比較において、野生型ヤエヤマヒメボタルルシフェラーゼの447位のリジンに相当するアミノ酸残基、535位のリジンに相当するアミノ酸残基および538位のアルギニンに相当するアミノ酸残基から成る群から選択される2以上のアミノ酸残基であってよい。このように、複数の塩基性アミノ酸残基に対して変異が導入された変異型ルシフェラーゼでは、相乗的にKMが増大する。
【0050】
本発明の一態様の変異型甲虫類ルシフェラーゼの具体的な例は、K447E変異体(配列番号3)、K535D変異体(配列番号5)、K535E変異体(配列番号7)、K535N変異体(配列番号9)、R538E変異体(配列番号11)およびK447E/K535E変異体(配列番号13)である。これらはいずれも、野生型ヤエヤマヒメボタルルシフェラーゼにおいて特定のアミノ酸残基を置換することで得られた変異体である。すなわち、K447E変異体とは447位のリジン残基をグルタミン酸に置換した変異体であり、K535D変異体とは535位のリジン残基をアスパラギン酸に置換した変異体であり、K535E変異体とは535位のリジン残基をグルタミン酸に置換した変異体であり、K535N変異体とは、535位のリジン残基をアスパラギンに置換した変異体であり、R538E変異体とは、538位のアルギニンをグルタミン酸に置換した変異体であり、K447E/K535E変異体とは、447位のリジン残基をグルタミン酸に置換し且つ535位のリジン残基をグルタミン酸に置換した変異体である。これらの変異体において変異を導入した447位、535位および538位は、図2に示されるように、基質結合部位から離れて位置する。
【0051】
(核酸)
本発明の別の態様は、変異型甲虫類ルシフェラーゼタンパク質をコードする塩基配列を含む核酸である。このような塩基配列は、甲虫類に由来する塩基配列であってよい。ここにおける「由来する」とは、ここに規定される塩基配列には、甲虫類に属す生物が本来有する野生型の塩基配列だけでなく、それに変異が生じた塩基配列が含まれることを意味する。また、ここにおける変異とは、塩基配列中の特定の塩基の置換、欠失および/または付加等を指す。塩基配列の変異には、コードされるアミノ酸配列に変化を生じさせない変異をも含む。また、核酸とは、特に、DNAまたはRNAを指す。
【0052】
このような核酸の好ましい例は、K447E変異体をコードする塩基配列(配列番号4)、K535D変異体をコードする塩基配列(配列番号6)、K535E変異体をコードする塩基配列(配列番号8)、K535N変異体をコードする塩基配列(配列番号10)、R538E変異体をコードする塩基配列(配列番号12)またはK447E/K535E変異体(配列番号14)をコードする塩基配列を含む核酸である。
【0053】
また、本発明のさらに別の態様はこのような核酸を含むベクターである。当該ベクターには、ルシフェラーゼをコードする核酸以外に、発現を調節するための配列またはマーカー遺伝子の配列を含む核酸等を含んでよい。また、その他のタンパク質の遺伝子を含んでもよい。当該ベクターは、例えば発現ベクターである。
【0054】
(形質転換体および形質導入体)
本発明の別の態様は、上述のような核酸を含む形質転換体または形質導入体である。形質転換体とは、外部から核酸を取り込んだ生物(特に細胞)を意味する。当該細胞は、本発明の一態様に係る変異型甲虫類ルシフェラーゼの遺伝子を含んだ核酸が導入され、その結果、そのような遺伝子を含む核酸を保持している。そのような細胞とは、例えば、動物細胞、植物細胞、酵母細胞であってよい。形質転換体は、関連する技術分野において一般的な方法によって作製することが可能であり、例えば、リン酸カルシウム法、リポフェクションまたはエレクトロポレーション等によって、細胞等に核酸を導入することができる。また、形質導入体とは、バクテリオファージの感染によって、外部から核酸が導入された細菌を意味する。形質導入体は、関連する技術分野において一般的な方法によって作製することが可能であり、例えば、予め目的とする核酸を保有するバクテリオファージを作製し、それを細菌に感染させることで導入することができる。そのような細菌とは、例えば大腸菌である。
【0055】
(製造方法)
本発明の別の態様は、変異型甲虫類ルシフェラーゼの製造方法である。当該製造方法は、上述のような形質転換体もしくは形質導入体にて変異型甲虫類ルシフェラーゼを発現させる工程、または無細胞発現系にて変異型甲虫類ルシフェラーゼを合成する工程を含む。形質転換体または形質導入体を用いる場合、それらをタンパク質の発現に適した条件下で培養することで変異型甲虫類ルシフェラーゼを発現させる。その後、必要に応じて、変異型甲虫類ルシフェラーゼを精製する。これらの具体的な方法は、関連する技術分野において一般的なものを使用することができる。また、無細胞発現系においても、関連する技術分野において一般的なものを使用することができ、例えば、翻訳に必要となるリボソームやアミノ酸等を含む緩衝液に、変異体ルシフェラーゼをコードするRNAを添加してルシフェラーゼを合成する。
【実施例】
【0056】
[実施例1]
種々の変異型ヤエヤマヒメボタルルシフェラーゼを作製し、ATPに対する応答性および発光活性を調べた。
【0057】
(発現ベクターの作製)
文献(Sambrook, J and Russell, D. W. (2001), Molecular Cloning: a laboratory manual, 3rd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York)に記載の方法に従って、cDNAライブラリからクローニングしたヤエヤマヒメボタルルシフェラーゼ(YaeLUC)をコードする塩基配列(配列番号2)(国際公開第2009/075306号)を含むDNAを、pRSET−Bベクター(Invitrogen)のBamHIおよびEcoRIサイト間に挿入することで、YaeLUC発現ベクターを作製した。当該発現ベクターからは、野生型ヤエヤマヒメボタルルシフェラーゼ(配列番号1)が発現する。
【0058】
その野生型ルシフェラーゼのDNAに変異を導入して、変異型ルシフェラーゼの発現ベクターを作製した。具体的には、対象となる部位に変異を持つ一組の相補的なオリゴDNAおよびQuikChange II Site−Directed Mutagenesis Kit(Stratagene)を用いて、同キットのマニュアルに示された方法に従って作製した。以下の表2に、作製した変異体、使用したオリゴDNAのセット、導入された変異、得られた塩基配列およびアミノ酸配列をまとめる。
【0059】
【表2】

なお、K447E/K535E変異体については、K447E変異体の発現ベクターを作製した後、さらにK535Eの変異を導入することで作製した。
【0060】
各変異体の塩基配列を、BigDye Terminator v3.1 Cycle Sequencing Kit(Applied Biosystems)および3130XLジェネティックアナライザ(Applied Biosystems)を使用して確認し、タンパク質をコードする領域に目的の変異が導入されていることおよびPCRエラーに起因する意図しない変異が無いことを確認した。
【0061】
(ルシフェラーゼタンパク質の精製)
次に、上記の通り作製した発現ベクターを用いて、大腸菌内にて変異型ルシフェラーゼタンパク質を作製した。
【0062】
まず、上記の通り作製した各発現ベクターを、発現用の大腸菌に形質転換した。大腸菌株JM109(DE3)のコンピテントセル50μLに、ルシフェラーゼ発現ベクター0.5μL(DNA約10ng)を加え、氷上に30分間静置し、続いて42℃の熱浴で45秒間処理した後、再び氷上に2分間静置した。そこへLB培地を0.5mL加え、37℃で20分間振盪培養を行った後、培養液の100μLを、アンピシリンを含むLB培地プレートに塗布した。プレートを37℃で一晩静置培養し、生じたコロニーを任意に1つ選び、2mLのアンピシリンを含むLB培地に植菌し、37℃で130rpmの振盪培養を行った。4〜6時間後に目視で大腸菌の増殖が確認できた段階で250mLのアンピシリンを含むLB培地に植え継ぎ、30℃で100rpmの振盪培養を一晩行った(14〜18時間)。培養終了後、4℃、8000rpmの条件で10分間遠心分離を行うことで、大腸菌を集菌した。得られた菌体ペーストを、25mLの洗菌バッファ(50mM Tris−HCl、150mM NaCl、1mM DTT、0.1mM EDTA、pH7.5)に懸濁し、再び4℃、8000rpmの条件で10分間遠心分離を行った。得られた菌体(湿重量約1g)を精製作業まで−80℃で凍結保存した。
【0063】
凍結した菌体を、10mLの破砕バッファ(50mM Tris−HCl、150mM NaCl、25mM イミダゾール、1mM DTT、0.5mM PMSF、pH7.5)に懸濁し、サンプルを氷上に置いて超音波破砕を行った。超音波破砕は、タイテック社製超音波式ホモジナイザーVP−050を用いて、出力パワー50%での5秒間の処理とその後の5秒間の休止とから成るサイクルを15分間行った。破砕後、懸濁液を30mL遠心管に移し、4℃、15000rpmの条件で30分間遠心分離を行った。遠心後の上清を、破砕バッファで平衡化した0.5mLのNi−NTAアガロース樹脂(Qiagen)に懸濁し、4℃で転倒撹拌(約6rpm)を1時間行った。
【0064】
次に、Ni−NTAアガロース樹脂懸濁液をφ10mm×50mmのオープンカラム(Bio−rad)に注ぎ、樹脂をカラム下部に積層させた。懸濁液がすべてカラムを通過した後、10mLの破砕バッファを数回に分けてカラムに注ぎ、樹脂を洗浄した。1.2mLの溶出バッファ(50mM Tris−HCl、150mM NaCl、500mM イミダゾール、1mM DTT、pH7.5)を静かにカラム上部から加え、溶出液を約180μLずつ分画した。溶出後の分画は、直ちに氷上にて保存した。Bradford法プロテインアッセイキット(Bio−rad)によって各画分のタンパク質濃度を算定し、最も濃度が濃い2〜3画分をNi−NTA溶出画分として回収した。回収画分を決定後、直ちにゲル濾過による脱塩を行った。脱塩バッファ(50mM Tris−HCl、150mM NaCl、1mM DTT、pH7.5)で平衡化したNAP−10カラム(GE Healthcare)にNi−NTA溶出画分サンプルを供して、サンプルがすべてゲルに浸み込むまで待機した。サンプルとの合計が1mLとなるように脱塩バッファを加え、バッファが浸み込むまで待機した後、1.5mLの脱塩バッファを加え、溶出液を約200μLずつ分画した。溶出後の分画は、直ちに氷上にて保存した。Bradford法プロテインアッセイキットによって各画分のタンパク質濃度を算定し、最も濃度の濃い画分を脱塩溶出画分として回収した。溶出画分と等量の保存バッファ(50mM Tris−HCl、150mM NaCl、10mM DTT、90%v/vグリセロール、pH7.5)を加え、−30℃の冷凍庫で保存した。
【0065】
(発光活性測定)
精製した各ルシフェラーゼについて発光活性を測定した。
ATP溶液は、以下の様に調製した。ATP二ナトリウム塩三水和物(Roche #519979)0.3gを3.5mLの水に溶かし、pHを測定しながら1M NaOH溶液を加え、pHを7.0に調整した。259nmにおける吸光度を測定し、ATPの消光係数ε=15400(M−1cm−1)を用いて濃度が100mMになるように水を加えて最終調整した。黒色の96穴アッセイプレート(Thermo Fisher Scientific)のウェル中に、25μLの基質溶液(100mM Tris−HCl、20mM MgSO4、800μM D−(−)−ルシフェリン、0〜20mM ATP、pH8.0)を入れておき、ルシフェラーゼ溶液(2μg/mL ルシフェラーゼ、100mM Tris−HCl、pH8.0)を75μL加えた時点から、発光強度を経時的に測定した。25μLの基質溶液に75μLのルシフェラーゼ溶液を加えた直後の100μLの反応溶液は、100mM Tris−HCl、5mM MgSO4、200μM D−(−)−ルシフェリン、1.5μg/mL(25nM)ルシフェラーゼを含み、ATPは連続する8ウェルにそれぞれ0mM、0.001mM、0.005mM、0.02mM、0.1mM、0.5mM、2.5mMおよび5mM含まれるように調製した。ルシフェラーゼ溶液の自動分注および発光強度の測定は、自動分注器および光電子増倍管を備えたATTO社製Luminescencer JNR−IIを用いた。
【0066】
(発光強度データの解析)
ATPに対するルシフェラーゼの酵素学的パラメータを算出するために、式3に示したミカエリス・メンテンのモデルによって発光活性データを評価した。KM値およびVmax値の導出には、各ATP濃度での発光強度の経時変化のピーク付近の値をv0として、異なるATP濃度に対するv0値のデータに式3を当てはめてパラメータを導出した。式の当てはめには、レベンバーク−マーカート法による非線形最小二乗法を用いた。
【0067】
(結果)
各変異体において求めたKM値および相対kcat値を表3にまとめる。さらに、図3に、KMを横軸とし相対kcatを縦軸としてプロットする。図3中、横軸に平行な破線は相対kcat値が50%である線を意味し、縦軸に平行な破線はKM値が0.3mMである線を意味する。
【0068】
【表3】

表3および図3の結果から、各変異体のKM値は野生型ルシフェラーゼと比較して増大しており、一方で、kcat値は野生型ルシフェラーゼと比較して高い水準に維持されていることがわかる。また、K447E/K535E変異体は、K447E変異体およびK535変異体と比較してKM値が増大している。このことは、変異を二重で導入することで、相乗的にKM値を増大する効果が得られることを意味する。
【0069】
[実施例2]
GL3ルシフェラーゼの変異体を作製し、ATPに対する応答性および発光活性を調べた。なお、GL3ルシフェラーゼは、北米ボタルルシフェラーゼに対して、N50D/N119G/S548I/K549A/L550Vの変異を導入して性質を改変したものであるから、以下の実施例は、北米ボタルルシフェラーゼ変異体に対して追加の変異を導入した実施例でもある。
【0070】
(発現ベクターの作製)
pGL3−Basic(Promega)ベクターに組み込まれているルシフェラーゼをコードする遺伝子部分(配列番号25)を実施例1と同様の方法で、pRSET−Bベクター(Invitrogen)のBamHIおよびEcoRIサイト間に挿入して、GL3発現ベクターを作製した。当該発現ベクターからは、GL3ルシフェラーゼ(配列番号26)が発現する。
【0071】
そのGL3ルシフェラーゼのDNAに変異を導入して、変異型GL3発現ベクターを作製した。具体的には、GL3のK445およびR533の部位に変異を持ち、センス鎖と相補的な二種類のオリゴDNAを同時に用いて、QuikChange Multi Site−Directed Mutagenesis Kit(Stratagene)によって作製した。K445E変異導入オリゴDNA配列を配列番号27に、R533E変異導入オリゴDNA配列を配列番号28にそれぞれ示す。得られた変異型GL3の塩基配列は配列番号29に、そのアミノ酸配列は配列番号30に示す。
【0072】
各変異体の塩基配列を、BigDye Terminator v3.1 Cycle Sequencing Kit(Applied Biosystems)および3130XLジェネティックアナライザ(Applied Biosystems)を使用して確認し、タンパク質をコードする領域に目的の変異が導入されていることおよびPCRエラーに起因する意図しない変異が無いことを確認した。
【0073】
(ルシフェラーゼタンパク質の精製)
上記GL3および変異型GL3発現ベクターを用いて、実施例1に記載の方法でルシフェラーゼタンパク質を作製し、精製を行った。
【0074】
(発光活性測定)
精製したGL3および変異型GL3タンパク質について、実施例1に記載の方法で発光活性を測定した。25μLの基質溶液に75μLのルシフェラーゼ溶液を加えた直後の100μLの反応溶液は、100mM Tris−HCl、5mM MgSO4、200μM D−(−)−ルシフェリン、1.5μg/mL(25nM)ルシフェラーゼを含み、ATPは二列の隣り合う16のウェルにそれぞれ0mM、0.0002mM、0.0005mM、0.001mM、0.002mM、0.005mM、0.01mM、0.04mM、0.1mM、0.2mM、0.5mM、1mM、2mM、4mMおよび5mM含まれるように調製した。
【0075】
(発光強度データの解析)
図4に、上記ATP濃度条件におけるGL3ルシフェラーゼおよびその変異体の発光強度をまとめる。また、式3を測定結果に当てはめた結果を図4の実線で示した。式の当てはめによって得られたパラメータを表4にまとめた。
【0076】
【表4】

【技術分野】
【0001】
本発明は、甲虫類ルシフェラーゼおよびそれを利用したATP濃度測定方法に関する。
【背景技術】
【0002】
甲虫類ルシフェラーゼタンパク質は、ホタル、鉄道虫、ヒカリコメツキ等の甲虫類が持つ発光タンパク質である。甲虫類ルシフェラーゼタンパク質は、D−ルシフェリン、酸素分子およびATPを基質として、電子励起状態のオキシルシフェリンを生成する酸化反応を触媒する。生成された電子励起状態のオキシルシフェリンは、基底状態に戻るときに可視光としてエネルギーを放出する。なお、本願では、甲虫類ルシフェラーゼタンパク質を総称して「ルシフェラーゼ」と呼ぶ場合があり、また、ルシフェラーゼが触媒する酸化反応および引き続き起こるオキシルシフェリンの化学発光をあわせた一連の反応に対して「ルシフェラーゼ活性」または「発光活性」という用語を使用する場合がある。
【0003】
ルシフェラーゼは発光イメージングに利用さている。例えば、ルシフェラーゼを発現する細胞または組織をイメージングするための、高感度CCDカメラおよび明るい光学系を含む発光イメージング装置が現在市販されている。
【0004】
発光イメージングは、GFP等の蛍光タンパク質による蛍光イメージングに勝る点が多い。発光イメージングは、観察の際に励起光を必要としないため、蛍光イメージングの場合に生じる蛍光分子の退色や光毒性による細胞へのダメージが無いため、数日間以上の長期間にわたって定量的な観察が可能である。また、蛍光イメージングでは生体内の様々な色素分子に由来する自家蛍光が観察の障害となるが、発光イメージングではこれが生じない。以上の点から、細胞、組織および個体といった幅広い範囲で、様々な用途に発光イメージング法が活用されている。
【0005】
また、ルシフェラーゼは、ATPの定量的検出のために利用されている。ATPは、細胞内でのエネルギー通貨であるとともに、シグナル伝達系のリン酸化反応の基質でもあり、細胞内で非常に重要な役割を担っている。そのため、細胞内のATP濃度の測定は細胞機能解析にとって重要である。ルシフェラーゼの濃度が一定で、試料内の基質(D−ルシフェリンおよびATP)のうち一方の濃度が十分に高い場合、ルシフェラーゼの発光強度は他方の基質の濃度に依存する。すなわち、恒常的に発現するプロモーターによってルシフェラーゼを発現させ、D−ルシフェリンを培地中に十分に添加することによって、細胞を生かしたままで細胞内のATP濃度を経時的に計測することが可能となる。このような原理に基づき、高感度な光検出装置を用いることで10−12M程度の微量なATPを定量的に検出することが可能となっており、そのような測定を実現するための試薬キットも市販されている。
【0006】
非特許文献1および非特許文献2には、既存のホタルルシフェラーゼを用いた、生きた細胞においてATP濃度を測定する方法が記載されている。これらの方法でも、当該ホタルルシフェラーゼの発光強度を測定する。しかしながら、既存のホタルルシフェラーゼは、細胞内のATP濃度ですでに飽和しており、少量のATP濃度の変化では発光強度の変化が小さく、信頼性の高い測定を行うのが困難である。また、発光タンパク質の発光強度は蛍光タンパク質と比較して極めて弱いため、これらの方法では、鮮明な画像を取得するために長期間の露出を要するという制約が存在する。例えば、現在利用可能な、高感度CCDカメラおよび明るい光学系を備えた発光顕微鏡システム(オリンパス製LV200等)を用いても、細胞内のルシフェラーゼの微弱な発光を画像として取得するには、典型的に数分の露光時間を要する。外部刺激に対する細胞内ATP濃度変化の応答時間は、培地に呼吸系の阻害剤を添加した場合等の極端な例で2分程度と報告されている(非特許文献3)。この点から、細胞内ATP濃度変化を経時的に精度良く測定するためには、露光時間を現在の数分のオーダーからさらに伸ばすことは望ましくない。また、現在の市販の高感度CCDカメラ(浜松ホトニクス社製ImagEM等)の量子効率がルシフェラーゼの発光波長帯において90%以上に達していることから、大きなブレークスルーが無い限り測定装置の改良によって現在の露光時間を大幅に短縮することは望めない。そのため、例えば発光イメージングによって細胞内ATP濃度およびその時間変化を高感度に検出するためには、ルシフェラーゼ活性が高く且つATPに対する応答性が高いルシフェラーゼが必要である。
【0007】
ルシフェラーゼ活性およびATPに対する応答性は、酵素学的パラメータを用いて議論される。すなわち、ルシフェラーゼの活性は、ミカエリス−メンテンのモデルに基づいて解析される。D−ルシフェリンの濃度が十分に高く、反応開始時のATP濃度が[ATP]0であるとき、初期反応速度v0は、
【0008】
【数1】

と表すことができる。ここで、KMはATPに対するミカエリス定数である。また、v0は、発生する光子数、すなわち発光強度と比例関係にある。Vmaxは、ルシフェラーゼの濃度[LUC]totalに比例する。すなわち、
【0009】
【数2】

という関係が成り立つ。ここで、[LUC]totalと表記したのは、ATPと結合したルシフェラーゼと結合していないルシフェラーゼとを区別せずに、反応系に存在するすべてのルシフェラーゼの濃度であることを示すためである。kcatは、基質が十分に存在する時の、ルシフェラーゼの単位時間および単位濃度あたりの発光活性に対応しており、「ルシフェラーゼの明るさ」と考えることができる。
【0010】
図1は、KMが異なる2つのルシフェラーゼについて、発光強度とATP濃度との関係を式1から求めてプロットしたものである。図1中に示される縦軸に平行な2本の破線は、それぞれの曲線のKMを表す線である。すなわち、左の破線が実線からなる曲線についてのKMを表し、右の破線が破線からなる曲線についてのKMを表す。図1からわかるように、ルシフェラーゼの発光強度は、ATP濃度が上昇するに従って急速に上昇する。ATP濃度がKMに比べて低濃度のとき、ATP濃度と発光強度とは比例に近い関係を示している。しかし、ATP濃度がKMよりも大きくなると、ATP濃度の変化量に対して発光強度の変化量は小さくなる。例えば、ATP濃度がKMの値の3倍に達すると、ルシフェラーゼの発光強度はすでに最大発光強度の75%に達しており、ATP濃度がそれ以上に上昇しても発光強度の変化は小さい。このような濃度範囲では、ATP濃度を測定することが困難となる。
【0011】
以上より、ルシフェラーゼ活性が高く且つATPに対する応答性が高いというルシフェラーゼの好ましい条件は、kcatが可能な限り大きく且つKMの値を3倍した値が測定したいATP濃度範囲より大きいという条件に言い換えることができる。
【0012】
生体組織中のATP濃度は、その由来となった臓器および動物種によって違いがあるものの、ヒトの場合約2.1mMであると報告されており(非特許文献4)、培養細胞については1〜1.3mMとの報告がある(非特許文献2および非特許文献5)。したがって、上述したKMの条件を考慮すれば、これらの細胞のATP濃度の測定に適したKMの下限値は0.3mM〜0.7mMである。
【0013】
しかしながら、現在までに報告されている野生型甲虫類ルシフェラーゼのKMは0.2mMよりも低い。そこで、野生型甲虫類ルシフェラーゼに変異を導入してKMを上昇させた変異体が作製されている(非特許文献6および特許文献1)。しかし、非特許文献6に記載される変異体では基質結合部位から5Å以内の範囲に変異が導入されており、そのほとんどにおいて発光活性(すなわちkcatの値)が大幅に低下していた。また、特許文献1にはkcatについての具体的な記載がないものの、非特許文献6の場合と同様に、変異導入部位が基質結合部位に近い部分に存在する。そのため、特許文献1に記載の変異型ルシフェラーゼにおいても、発光活性が大幅に低下していることが予想される。したがって、現在までに公知となっている野生型または変異型ルシフェラーゼを用いて、理想的なATP濃度測定を行うことは困難である。
【先行技術文献】
【特許文献】
【0014】
【特許文献1】米国特許第6265177号明細書
【非特許文献】
【0015】
【非特許文献1】Ainskow, E. K. et al. (2002), Dynamic imaging of free cytosolic ATP concentration during fuel sensing by rat hypothalamic neurones: evidence for ATP-independent control of ATP-sensitive K+ channels, Journal of Physiology, 544.2, 429-445.
【非特許文献2】Kennedy, H. J. et al. (1999), Glucose generates sub-plasma membrane ATP microdomains in single islet β-cells, Journal of Biological Chemistry, 274, 13281-13291.
【非特許文献3】Imamura, H. et al. (2009), Visualization of ATP levels inside single living cells with fluorescence resonance energy transfer-based genetically encoded indicators, Proceedings of the National Academy of Science of the United States of America, 106, 15651-15656.
【非特許文献4】Traut, T. W. (1994), Physiological concentrations of purines and pyrimidines, Molecular and Cellular Biochemistry, 140, 1-22.
【非特許文献5】Zamaraeva, M. V. et al. (2005), Cells die with increased cytosolic ATP during apoptosis: a bioluminescence study with intracellular luciferase, Cell Death and Differentiation, 12, 1390-1397.
【非特許文献6】Branchini, B. R. et al. (2003), A mutagenesis study of the putative luciferin binding site residues of firefly luciferase, Biochemistry, 42, 10429-10436.
【発明の概要】
【発明が解決しようとする課題】
【0016】
本発明の目的は、高いルシフェラーゼ活性および適切なKM値を有する変異型甲虫類ルシフェラーゼおよびそれを利用した優れた細胞内ATP濃度測定方法を提供することにある。
【課題を解決するための手段】
【0017】
本発明の実施態様によれば、酵素反応をミカエリス−メンテンのモデルによって解析したときに、ATPに対するミカエリス定数KMが0.3mM以上であり、且つkcatが野生型または変異導入前の甲虫類ルシフェラーゼのkcatの50%以上の値である変異型甲虫類ルシフェラーゼが提供される。
【発明の効果】
【0018】
本発明によれば、露光時間が短縮され、且つ精度の高いATP濃度測定が可能となる。
【図面の簡単な説明】
【0019】
【図1】KMが異なる2つのルシフェラーゼの触媒反応における、発光強度とATP濃度との関係を示す図。
【図2】ヤエヤマヒメボタルルシフェラーゼの立体構造モデルを示す図。
【図3】様々なヤエヤマヒメボタル変異型ルシフェラーゼにおける、KMとkcatとの関係を示す図。
【図4】GL3ルシフェラーゼおよびその変異体の発光強度のATP濃度依存性およびミカエリス−メンテンのモデルによる解析結果を示す図。
【発明を実施するための形態】
【0020】
本発明の一態様は、酵素反応をミカエリス−メンテンのモデルによって解析したときに、ATPに対するミカエリス定数KMが0.3mM以上であり、且つkcatが野生型または変異導入前の甲虫類ルシフェラーゼのkcatの50%以上の値である変異型甲虫類ルシフェラーゼである。そのような、変異型甲虫類ルシフェラーゼでは、タンパク質の立体構造において、基質結合部位から5Å以上離れた部位に変異が導入されていてよい。さらに、変異が導入されている前記部位は、変異導入前において、少なくとも1つの塩基性アミノ酸残基であってよい。
【0021】
(発明に至る経緯)
まず、本発明者が本発明に至った経緯を説明する。
上述のように、非特許文献6では、基質結合部位付近に変異を導入した結果、ATPに対するKMが上昇すると同時にkcatが低下、あるいはD−ルシフェリンに対するKMが上昇している。本発明者は、このような現象について、基質結合部位付近に変異を導入することで基質が反応に好ましい配置を採ることを妨げられ、ATPに対するKMを上昇させるという好ましい変化と同時に、発光活性(kcat)の低下およびD−ルシフェリンに対するKMの上昇が起こったと考察した。
【0022】
一方、本発明者は、ルシフェラーゼは、高効率に発光するために、すなわち反応効率を上げるために、ATPおよびルシフェリンといった基質を活性部位に集めるように進化してきたと仮定した。例えば、ルシフェラーゼ表面に接触したATPおよびルシフェリンを反応の場となる活性部位に向けて集約する機構を有していると考えた。そのような機構を実現するため、分子の表面且つ活性部位(すなわち基質結合部位)から離れた位置に、ATPとの結合に適した部位(例えばアミノ酸残基の側鎖)が存在すると考えた。そして、このような仮定が正しければ、この部位に変異を導入することで、ATPを取り込む効率(すなわちKMの値)を下げることができ、同時に活性部位に到達した基質同士の反応の進行は野生型と同程度に維持できる(すなわち高いkcatが得られる)と考えた。
【0023】
ATPは生理的な溶液中でMgATP2−として存在し、負電荷を帯びている。そのため、上記のATPが好む側鎖として、正電荷を帯びた塩基性アミノ酸残基の側鎖、例えばアルギニンおよびリジンの側鎖を検討した。また、このようなアミノ酸残基のタンパク質立体構造上の位置は、タンパク質の表面であって、基質が結合するくぼみを中心とする側の半球に位置すると予想した。
【0024】
ホタルルシフェラーゼの立体構造は、北米ボタル(Photinus pyralis)(Conti E. et al. (1996), Crystal structure of firefly luciferase throws light on a superfamily of adenylate-forming enzymes, Structure, 4, 287-298)およびゲンジボタル(Luciola cruciata)(Nakatsu, T. et al. (2006), Structural basis for the spectral difference in luciferase bioluminescence, Nature, 440, 372-376)について報告されている。北米ボタルルシフェラーゼとゲンジボタルルシフェラーゼは、アミノ酸配列上では68%の相同性を有するが、フレキシブルなリンカーで繋がれた2つの主要なドメイン同士の位置関係を除き、これらのホタルルシフェラーゼの構造は良く一致している。このことから、フォールドおよびドメイン構造等の全体的な構造については、甲虫類ルシフェラーゼにおいて共通していると推測される。
【0025】
本発明者は、基質アナログと結合した結晶構造が既知であるゲンジボタルルシフェラーゼの立体構造をテンプレートとして、ヤエヤマヒメボタルルシフェラーゼ(YaeLUC)の構造モデルを作製し(図2)、その構造モデルをもとに、上述のようなATP結合部位を探索した。YaeLUCは、秋吉らによってヤエヤマヒメボタル(Luciola filiformis yayeyamana)からクローニングされたホタルルシフェラーゼ(配列番号1)であり(国際公開第2009/075306号)、北米ボタルルシフェラーゼとの間で66%、ゲンジボタルルシフェラーゼとの間で81%の相同性を有している。この点に着目し、相同性に基づく構造モデルの構築および基質近傍のアミノ酸残基の位置の特定のために利用した。
【0026】
以上のような戦略のもと、本発明者が、様々な部位に対する変異体を設計および作製し、ATPに対する親和性および発光活性を調べた結果、本発明者の予想通り、ATPに対する親和性が低下し、同時に発光活性が高く維持された変異型ルシフェラーゼを得ることができた。例えば、YaeLUCの447位のリジン(K447)、535位のリジン(K535)または538位のアルギニン(R538)を、中性または酸性のアミノ酸残基に置換した変異体は、発光活性(kcat値)が野生型に対して50%以上の高い値を維持しつつ、ATPに対するKM値は0.3mM以上となった。
【0027】
変異を導入したこれらの部位は、構造モデル上で基質結合部位(ATPが存在する部位)から5Å以上離れて位置しており(図2)、ATPとルシフェリンとの反応およびその後の発光を直接には阻害しないことが合理的に理解される。また、これらの変異を組み合わせた多重変異体では、発光活性を高く維持し且つATPに対するKMを下げるという効果が相乗的に得られることがわかった。
【0028】
(変異型甲虫類ルシフェラーゼ)
次に、本発明の態様について説明する。
本発明の一態様は、酵素反応をミカエリス−メンテンのモデルによって解析したときに、ATPに対するミカエリス定数KMが0.3mM以上であり、且つkcatが野生型または変異導入前の甲虫類ルシフェラーゼのkcatの50%以上の値である変異型甲虫類ルシフェラーゼである。
【0029】
本発明の一態様に係るルシフェラーゼは甲虫類に由来する。甲虫類とは甲虫綱コウチュウ目に分類される昆虫の総称であり、例えば、ホタル(Lampyridae)科、フェンゴディダエ(Phengodidae)科またはコメツキムシ(Elateroidae)科に属する昆虫である。ホタル科に属する昆虫とは、例えば、ヤエヤマヒメボタル(Luciola filiformis yayeyamana)、ゲンジボタル(Luciola cruciata)、ヘイケボタル(Luciola lateralis)、北米ボタル(Photinus pyralis)である。フェンゴディダエ科に属する昆虫とは、例えば、鉄道虫(Phrixothrix hirtus)である。コメツキムシ科に属する昆虫とは、例えば、ヒカリコメツキ(Pyrophorus plagiophthalamus)である。
【0030】
本発明の一態様に係るルシフェラーゼは、変異型ルシフェラーゼである。すなわち、既知の野生型甲虫類ルシフェラーゼもしくはその変異体または新規に同定された野生型甲虫類ルシフェラーゼもしくはその変異体に対して変異を導入することで得られるルシフェラーゼである。既知の野生型甲虫類ルシフェラーゼまたはその変異体は、市販されているルシフェラーゼであってよい。ここにおいて、変異とは、例えば、アミノ酸配列におけるアミノ酸の置換、欠失もしくは付加等またはこれらの組み合わせを意味する。この変異は、野生型ルシフェラーゼのアミノ酸配列において、1つのアミノ酸残基に生じた変異であってよく、2つのアミノ酸残基に生じた変異であってよく、3つのアミノ酸残基に生じた変異であってよく、または4以上のアミノ酸残基に生じた変異であってよい。複数のアミノ酸残基における変異は、連続したアミノ酸残基に生じたものであっても、互いに離れたアミノ酸残基に生じたものであってもよい。変異型ルシフェラーゼは、その野生型ルシフェラーゼとの間で、75%以上、80%以上、85%以上、90%以上、95%以上、96%以上、97%以上、98%以上または99%以上の相同性を有してよい。
【0031】
そのような変異は、関連する技術分野において一般的な方法によって導入されたものであってよい。例えば、ルシフェラーゼタンパク質をコードするDNAに変異を導入することで得られたものであってよい。そのような導入方法の例は、変異を導入したいルシフェラーゼ遺伝子の塩基配列を含むDNAにおいて、変異を導入しようとするアミノ酸配列に対応する核酸に変異を導入するという方法である。DNAにおける変異の導入は、QuikChange II Site−Directed Mutagenesis Kit(Stratagene)等の市販のキット類を用いて容易に行うことが出来る。変異型ルシフェラーゼは、野生型ルシフェラーゼ全長に対応するものであってよく、または野生型ルシフェラーゼの一部を欠損したタンパク質に対応するものであってもよい。また、変異型ルシフェラーゼは、野生型ルシフェラーゼ以外のタンパク質の一部または全部を含んでよい。例えば、変異型ルシフェラーゼが、野生型ルシフェラーゼに由来するタンパク質とその他のタンパク質に由来するタンパク質とが融合したタンパク質であってよい。
【0032】
本発明の一態様のルシフェラーゼにおいて、ATPに対するミカエリス定数KMは0.3mM以上であり、好ましくは0.7mM以上である。ここにいう、ATPに対するミカエリス定数KMとは、ルシフェラーゼによって触媒されるATPとルシフェリンとの反応において、ルシフェリンが十分に存在している場合に、ATP濃度と反応速度との関係を示すミカエリス−メンテン式におけるKMである。すなわち、以下の式3に示されるミカエリス−メンテン式におけるKMである。
【0033】
【数3】

この式において、vは反応速度または発光強度を意味し、[ATP]はATP濃度を意味する。また、VmaxはATPが十分量存在するときの反応速度を意味する。図1は、この式から算出されるATP濃度と反応速度との関係を、ATP濃度を横軸とし発光強度を縦軸としてプロットしたものである。この図には、Vmaxは同一であるが、KMが異なる2つの曲線が示される。すなわち、これらの曲線のKMは、一方が0.1mMであり、他方が1.0mMである。この図からわかるように、ATP濃度の増大とともに発光強度が増大するものの、ATP濃度が一定値を超えると発光強度が飽和してしまい、ほとんど増大しなくなる。このように発光強度が飽和した範囲では、ATP濃度を測定することが困難であり、発光強度が飽和する前の範囲が、ATP濃度の測定に適していることがわかる。KMの異なる2つの曲線を比較した場合、KMが大きいルシフェラーゼの方が測定に適した範囲(飽和前の範囲)が広いことがわかる。図1によれば、KMが0.1mMの場合、例えば0.5mMを超えるATP濃度の範囲にて測定を行うことは困難であるが、KMが1.0mMの場合には、図示される最大のATP濃度である2.0mM付近でも測定可能であることがわかる。上述の通り、ヒトの細胞ではATP濃度が約2.1mMと報告され、培養細胞では1〜1.3mMと報告されているが、KMが0.3mM以上であれば1mM付近の測定に利用でき、0.7mM以上であれば2.1mM付近の測定にも利用できる。
【0034】
本発明の一態様に係る変異型甲虫類ルシフェラーゼでは、kcatが、野生型または変異導入前の甲虫類ルシフェラーゼのkcatの50%以上の値であり、好ましくは60%以上である。すなわち、本発明の一態様の変異型甲虫類ルシフェラーゼについて、その変異導入前のルシフェラーゼとの間でkcatを比較した場合、変異型甲虫類ルシフェラーゼのkcatが、変異導入前のルシフェラーゼのkcatの50%以上の値となる。kcatとは、基質が十分に存在する時の、ルシフェラーゼの単位時間および単位濃度あたりの発光活性であり、次の式4を満たす。
【0035】
【数4】

ここにおいて、[LUC]totalとは、反応系に存在する全てのルシフェラーゼの濃度である。kcatが発光活性の最大値Vmaxと比例することを考えれば、kcatが50%以上であるという特定は、変異型ルシフェラーゼの発光活性が野生型ルシフェラーゼの発光活性の50%以上であることを意味する。また、変異型ルシフェラーゼのkcatは、野生型甲虫類ルシフェラーゼのkcatの100%以上であってもよい。すなわち、変異型ルシフェラーゼの方が、野生型ルシフェラーゼよりも高い発光活性を示してもよい。例えば、変異型ルシフェラーゼが、ATPの応答性に関する変異に加えて、発光活性を高めるような変異を含むことで、野生型よりも強く光るルシフェラーゼであってよい。
【0036】
本発明の一態様の変異型甲虫類ルシフェラーゼは、野生型と比較してATPに対する親和性が低いものの、発光活性を高く維持している。このようなルシフェラーゼを使用することで、既存のルシフェラーゼでは測定できない濃度範囲における測定が可能となり、また測定可能であっても発光強度が低いために実用的でない範囲における測定が可能となる。さらに、ATP濃度の測定だけでなく、変異型甲虫類ルシフェラーゼの特性を利用した様々な応用が期待できる。
【0037】
本発明の一態様の変異型甲虫類ルシフェラーゼは、タンパク質の立体構造において、基質結合部位から5Å以上離れた部位に変異が導入されていてよい。すなわち、当該ルシフェラーゼにおける変異の少なくとも1つが、基質結合部位から5Å以上離れた部位に存在してよい。基質結合部位とは、ATPとルシフェリンとの反応が生じるときに、ATPが安定的に配置するルシフェラーゼ内の部位のことである。換言すれば、基質結合部位は活性部位である。変異が基質結合部位から5Å以上離れた部位に存在することで、発光活性に対する悪影響を最小化し(すなわちkcatの低下を抑制し)、ATP応答性を上げる(すなわちKMを大きくする)ことができる。また、変異は、基質結合部位から5Å以上離れ且つルシフェラーゼタンパク質の表面に導入されていてよい。
【0038】
基質結合部位からの距離の算出は、例えば、基質または基質アナログとの共結晶の結晶構造が既知のルシフェラーゼを利用して行うことができる。例えば、ゲンジボタルルシフェラーゼの結晶構造が既知であるため、これが利用される(Nakatsu, T. et al. (2006), Structural basis for the spectral difference in luciferase bioluminescence, Nature, 440, 372-376)。まず、ゲンジボタルルシフェラーゼにおいて、基質結合部位から5Å以上離れた部位を特定する。次に、本発明の一態様に係るルシフェラーゼとゲンジボタルルシフェラーゼとの間のアミノ酸配列の相同性を考慮して、本発明の一態様に係るルシフェラーゼにおける5Å以上離れた部位を特定することができる。
【0039】
あるいは、本発明の一態様に係るルシフェラーゼの構造モデルを作製し、モデル上で5Å以上離れた部位を特定することもできる。具体的には、構造既知のタンパク質との配列相同性に基づいた構造予測によって構造モデルを作製し、そのモデル上で基質結合部位との距離を算出する。構造モデルの作製には、例えば、SWISS−MODEL(http://swissmodel.expasy.org/)といったオンラインサービスを利用することが可能である。図2には、このサービスを利用して作成した野生型ヤエヤマヒメボタルルシフェラーゼの構造モデルを示す。この構造モデルは、ゲンジボタルルシフェラーゼと、基質アナログである5’−O−[N−(デヒドロルシフェリル)−スルファモイル]アデノシン(DLSA)との共結晶の構造(PDB ID:2D1S)をテンプレート構造として作成した。この構造モデルに対して、テンプレート構造におけるDLSAを重ね合わせることで、野生型ヤエヤマヒメボタルルシフェラーゼの構造モデルにおける基質結合部位を推定することができる。
【0040】
本発明の一態様の変異型甲虫類ルシフェラーゼにおいて、変異が導入されている部位は、変異導入前において、少なくとも1つの塩基性アミノ酸残基であってよい。すなわち、変異型甲虫類ルシフェラーゼは、この塩基性アミノ酸残基に対して変異を導入することで得られたルシフェラーゼであってよい。塩基性アミノ酸残基は1つである場合に限らず、複数であってもよい。ここにいう変異導入前とは、変異導入前のタンパク質が、野生型ルシフェラーゼだけでなく、既に何らかの変異が導入されているルシフェラーゼをも含むことを意味する。塩基性アミノ酸とは、例えば2つ以上のアミノ基を有することで塩基性を有したアミノ酸のことであり、例えば、リジン、アルギニンまたはヒスチジンである。なお、このような変異型甲虫類ルシフェラーゼでは、塩基性アミノ酸残基に加えて、その他の残基に変異が導入されていてもよい。
【0041】
本発明の一態様の変異型甲虫類ルシフェラーゼにおいて、変異が導入される塩基性アミノ酸残基は、相同性に基づく配列比較において、野生型ヤエヤマヒメボタルルシフェラーゼの447位のリジンに相当するアミノ酸残基、535位のリジンに相当するアミノ酸残基または538位のアルギニンに相当するアミノ酸残基であってよい。すなわち、任意の甲虫類ルシフェラーゼについて、野生型ヤエヤマヒメボタルルシフェラーゼとの間でアミノ酸配列の相同性を検討したとき、野生型ヤエヤマヒメボタルルシフェラーゼの447位のリジン、535位のリジンまたは538位のアルギニンに相当する、任意の甲虫類ルシフェラーゼにおけるアミノ酸残基に対して変異が導入されてよい。
【0042】
甲虫類のルシフェラーゼ同士は、一般的に相同性が高いことが知られている。例えば、ヒカリコメツキとホタルとは、分類学上の科は違うにも関わらず、ルシフェラーゼ同士では50%程度の相同性がある。また、全ての甲虫類ルシフェラーゼ間において完全に保存されている部位が多数存在する。したがって、野生型ヤエヤマヒメボタルルシフェラーゼの特定のアミノ酸残基(例えば447位のリジン残基)に相当するアミノ酸残基を、別の種に由来するルシフェラーゼにおいて特定することは技術的に容易である。
【0043】
そのような特定は、例えば、ClustalW(http://www.clustal.org/)といった既知の配列比較プログラムを用いて行うことができる。この場合、比較を行いたい2つのルシフェラーゼの配列を入力してプログラムを実行することによって、配列比較を行うことができる。ここで、野生型ヤエヤマヒメボタルルシフェラーゼを2つの配列の1つとして入力すれば、野生型ヤエヤマヒメボタルルシフェラーゼの特定位置の残基が、他のルシフェラーゼにおいてどの位置に対応するかを容易に特定できる。
【0044】
あるいは、基質または基質アナログとの共結晶の結晶構造が知られているルシフェラーゼ(例えば、ゲンジボタルルシフェラーゼ(Nakatsu, T. et al. (2006), Structural basis for the spectral difference in luciferase bioluminescence, Nature, 440, 372-376))との間で配列比較を行うことによって、任意のルシフェラーゼの特定の残基が、既知のルシフェラーゼタンパク質立体構造上でどこに対応するかを特定できる。
【0045】
図2には、ヤエヤマヒメボタルルシフェラーゼの立体構造のモデルが示される。この図には、447位のリジン、535位のリジンおよび538位のアルギニンが示されている。この図からわかるように、これらの残基は基質結合部位(DLSAが位置する部位)から離れており且つタンパク質の表面付近に位置することがわかる。一方、特許文献1に開示される変異型北米ボタルルシフェラーゼでは、その245位および318位の残基に変異が導入されている。これらの位置は、相同性検索によれば、ヤエヤマヒメボタルルシフェラーゼの247位および320位に相当し、図2に示されるように基質結合部位付近に位置する。すなわち、447位のリジン、535位のリジンおよび538位のアルギニンという位置は、少なくとも基質結合部位からの距離に関して、既知の変異型ルシフェラーゼにおける変異導入部位と大きく異なる。
【0046】
以下の表1に、代表的な甲虫類ルシフェラーゼにおける、ヤエヤマヒメボタルの447位のリジン残基、535位のリジン残基および538位のアルギニン残基に相当する残基を示す。
【0047】
【表1】

既知の各ルシフェラーゼについて、表1に示される残基に変異を導入することで本発明の一態様に係る変異型甲虫類ルシフェラーゼを作製することができる。
【0048】
導入する変異としては、もとのアミノ酸残基の有する電気的性質を打ち消すような変異であることが好ましい。もとのアミノ酸残基が塩基性残基であれば、その正電荷を帯びているという性質を打ち消す変異が好ましく、すなわち、その塩基性残基を酸性残基または中性残基に置換する変異であることが好ましい。ATPとの親和性を低下させるためには、すなわちKMを増大させるためには、塩基性残基を酸性残基に置換することがより好ましい。例えば、グルタミン酸、アスパラギン酸またはアスパラギンへの置換であることが好ましい。しかしながら、測定に適したKM値およびkcat値、ルシフェラーゼの安定性等に応じて適宜選択することができる。
【0049】
本発明の一態様の変異型甲虫類ルシフェラーゼは、上述したような変異を複数含んでよい。すなわち、変異が導入される塩基性アミノ酸残基は、相同性に基づく配列比較において、野生型ヤエヤマヒメボタルルシフェラーゼの447位のリジンに相当するアミノ酸残基、535位のリジンに相当するアミノ酸残基および538位のアルギニンに相当するアミノ酸残基から成る群から選択される2以上のアミノ酸残基であってよい。このように、複数の塩基性アミノ酸残基に対して変異が導入された変異型ルシフェラーゼでは、相乗的にKMが増大する。
【0050】
本発明の一態様の変異型甲虫類ルシフェラーゼの具体的な例は、K447E変異体(配列番号3)、K535D変異体(配列番号5)、K535E変異体(配列番号7)、K535N変異体(配列番号9)、R538E変異体(配列番号11)およびK447E/K535E変異体(配列番号13)である。これらはいずれも、野生型ヤエヤマヒメボタルルシフェラーゼにおいて特定のアミノ酸残基を置換することで得られた変異体である。すなわち、K447E変異体とは447位のリジン残基をグルタミン酸に置換した変異体であり、K535D変異体とは535位のリジン残基をアスパラギン酸に置換した変異体であり、K535E変異体とは535位のリジン残基をグルタミン酸に置換した変異体であり、K535N変異体とは、535位のリジン残基をアスパラギンに置換した変異体であり、R538E変異体とは、538位のアルギニンをグルタミン酸に置換した変異体であり、K447E/K535E変異体とは、447位のリジン残基をグルタミン酸に置換し且つ535位のリジン残基をグルタミン酸に置換した変異体である。これらの変異体において変異を導入した447位、535位および538位は、図2に示されるように、基質結合部位から離れて位置する。
【0051】
(核酸)
本発明の別の態様は、変異型甲虫類ルシフェラーゼタンパク質をコードする塩基配列を含む核酸である。このような塩基配列は、甲虫類に由来する塩基配列であってよい。ここにおける「由来する」とは、ここに規定される塩基配列には、甲虫類に属す生物が本来有する野生型の塩基配列だけでなく、それに変異が生じた塩基配列が含まれることを意味する。また、ここにおける変異とは、塩基配列中の特定の塩基の置換、欠失および/または付加等を指す。塩基配列の変異には、コードされるアミノ酸配列に変化を生じさせない変異をも含む。また、核酸とは、特に、DNAまたはRNAを指す。
【0052】
このような核酸の好ましい例は、K447E変異体をコードする塩基配列(配列番号4)、K535D変異体をコードする塩基配列(配列番号6)、K535E変異体をコードする塩基配列(配列番号8)、K535N変異体をコードする塩基配列(配列番号10)、R538E変異体をコードする塩基配列(配列番号12)またはK447E/K535E変異体(配列番号14)をコードする塩基配列を含む核酸である。
【0053】
また、本発明のさらに別の態様はこのような核酸を含むベクターである。当該ベクターには、ルシフェラーゼをコードする核酸以外に、発現を調節するための配列またはマーカー遺伝子の配列を含む核酸等を含んでよい。また、その他のタンパク質の遺伝子を含んでもよい。当該ベクターは、例えば発現ベクターである。
【0054】
(形質転換体および形質導入体)
本発明の別の態様は、上述のような核酸を含む形質転換体または形質導入体である。形質転換体とは、外部から核酸を取り込んだ生物(特に細胞)を意味する。当該細胞は、本発明の一態様に係る変異型甲虫類ルシフェラーゼの遺伝子を含んだ核酸が導入され、その結果、そのような遺伝子を含む核酸を保持している。そのような細胞とは、例えば、動物細胞、植物細胞、酵母細胞であってよい。形質転換体は、関連する技術分野において一般的な方法によって作製することが可能であり、例えば、リン酸カルシウム法、リポフェクションまたはエレクトロポレーション等によって、細胞等に核酸を導入することができる。また、形質導入体とは、バクテリオファージの感染によって、外部から核酸が導入された細菌を意味する。形質導入体は、関連する技術分野において一般的な方法によって作製することが可能であり、例えば、予め目的とする核酸を保有するバクテリオファージを作製し、それを細菌に感染させることで導入することができる。そのような細菌とは、例えば大腸菌である。
【0055】
(製造方法)
本発明の別の態様は、変異型甲虫類ルシフェラーゼの製造方法である。当該製造方法は、上述のような形質転換体もしくは形質導入体にて変異型甲虫類ルシフェラーゼを発現させる工程、または無細胞発現系にて変異型甲虫類ルシフェラーゼを合成する工程を含む。形質転換体または形質導入体を用いる場合、それらをタンパク質の発現に適した条件下で培養することで変異型甲虫類ルシフェラーゼを発現させる。その後、必要に応じて、変異型甲虫類ルシフェラーゼを精製する。これらの具体的な方法は、関連する技術分野において一般的なものを使用することができる。また、無細胞発現系においても、関連する技術分野において一般的なものを使用することができ、例えば、翻訳に必要となるリボソームやアミノ酸等を含む緩衝液に、変異体ルシフェラーゼをコードするRNAを添加してルシフェラーゼを合成する。
【実施例】
【0056】
[実施例1]
種々の変異型ヤエヤマヒメボタルルシフェラーゼを作製し、ATPに対する応答性および発光活性を調べた。
【0057】
(発現ベクターの作製)
文献(Sambrook, J and Russell, D. W. (2001), Molecular Cloning: a laboratory manual, 3rd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York)に記載の方法に従って、cDNAライブラリからクローニングしたヤエヤマヒメボタルルシフェラーゼ(YaeLUC)をコードする塩基配列(配列番号2)(国際公開第2009/075306号)を含むDNAを、pRSET−Bベクター(Invitrogen)のBamHIおよびEcoRIサイト間に挿入することで、YaeLUC発現ベクターを作製した。当該発現ベクターからは、野生型ヤエヤマヒメボタルルシフェラーゼ(配列番号1)が発現する。
【0058】
その野生型ルシフェラーゼのDNAに変異を導入して、変異型ルシフェラーゼの発現ベクターを作製した。具体的には、対象となる部位に変異を持つ一組の相補的なオリゴDNAおよびQuikChange II Site−Directed Mutagenesis Kit(Stratagene)を用いて、同キットのマニュアルに示された方法に従って作製した。以下の表2に、作製した変異体、使用したオリゴDNAのセット、導入された変異、得られた塩基配列およびアミノ酸配列をまとめる。
【0059】
【表2】

なお、K447E/K535E変異体については、K447E変異体の発現ベクターを作製した後、さらにK535Eの変異を導入することで作製した。
【0060】
各変異体の塩基配列を、BigDye Terminator v3.1 Cycle Sequencing Kit(Applied Biosystems)および3130XLジェネティックアナライザ(Applied Biosystems)を使用して確認し、タンパク質をコードする領域に目的の変異が導入されていることおよびPCRエラーに起因する意図しない変異が無いことを確認した。
【0061】
(ルシフェラーゼタンパク質の精製)
次に、上記の通り作製した発現ベクターを用いて、大腸菌内にて変異型ルシフェラーゼタンパク質を作製した。
【0062】
まず、上記の通り作製した各発現ベクターを、発現用の大腸菌に形質転換した。大腸菌株JM109(DE3)のコンピテントセル50μLに、ルシフェラーゼ発現ベクター0.5μL(DNA約10ng)を加え、氷上に30分間静置し、続いて42℃の熱浴で45秒間処理した後、再び氷上に2分間静置した。そこへLB培地を0.5mL加え、37℃で20分間振盪培養を行った後、培養液の100μLを、アンピシリンを含むLB培地プレートに塗布した。プレートを37℃で一晩静置培養し、生じたコロニーを任意に1つ選び、2mLのアンピシリンを含むLB培地に植菌し、37℃で130rpmの振盪培養を行った。4〜6時間後に目視で大腸菌の増殖が確認できた段階で250mLのアンピシリンを含むLB培地に植え継ぎ、30℃で100rpmの振盪培養を一晩行った(14〜18時間)。培養終了後、4℃、8000rpmの条件で10分間遠心分離を行うことで、大腸菌を集菌した。得られた菌体ペーストを、25mLの洗菌バッファ(50mM Tris−HCl、150mM NaCl、1mM DTT、0.1mM EDTA、pH7.5)に懸濁し、再び4℃、8000rpmの条件で10分間遠心分離を行った。得られた菌体(湿重量約1g)を精製作業まで−80℃で凍結保存した。
【0063】
凍結した菌体を、10mLの破砕バッファ(50mM Tris−HCl、150mM NaCl、25mM イミダゾール、1mM DTT、0.5mM PMSF、pH7.5)に懸濁し、サンプルを氷上に置いて超音波破砕を行った。超音波破砕は、タイテック社製超音波式ホモジナイザーVP−050を用いて、出力パワー50%での5秒間の処理とその後の5秒間の休止とから成るサイクルを15分間行った。破砕後、懸濁液を30mL遠心管に移し、4℃、15000rpmの条件で30分間遠心分離を行った。遠心後の上清を、破砕バッファで平衡化した0.5mLのNi−NTAアガロース樹脂(Qiagen)に懸濁し、4℃で転倒撹拌(約6rpm)を1時間行った。
【0064】
次に、Ni−NTAアガロース樹脂懸濁液をφ10mm×50mmのオープンカラム(Bio−rad)に注ぎ、樹脂をカラム下部に積層させた。懸濁液がすべてカラムを通過した後、10mLの破砕バッファを数回に分けてカラムに注ぎ、樹脂を洗浄した。1.2mLの溶出バッファ(50mM Tris−HCl、150mM NaCl、500mM イミダゾール、1mM DTT、pH7.5)を静かにカラム上部から加え、溶出液を約180μLずつ分画した。溶出後の分画は、直ちに氷上にて保存した。Bradford法プロテインアッセイキット(Bio−rad)によって各画分のタンパク質濃度を算定し、最も濃度が濃い2〜3画分をNi−NTA溶出画分として回収した。回収画分を決定後、直ちにゲル濾過による脱塩を行った。脱塩バッファ(50mM Tris−HCl、150mM NaCl、1mM DTT、pH7.5)で平衡化したNAP−10カラム(GE Healthcare)にNi−NTA溶出画分サンプルを供して、サンプルがすべてゲルに浸み込むまで待機した。サンプルとの合計が1mLとなるように脱塩バッファを加え、バッファが浸み込むまで待機した後、1.5mLの脱塩バッファを加え、溶出液を約200μLずつ分画した。溶出後の分画は、直ちに氷上にて保存した。Bradford法プロテインアッセイキットによって各画分のタンパク質濃度を算定し、最も濃度の濃い画分を脱塩溶出画分として回収した。溶出画分と等量の保存バッファ(50mM Tris−HCl、150mM NaCl、10mM DTT、90%v/vグリセロール、pH7.5)を加え、−30℃の冷凍庫で保存した。
【0065】
(発光活性測定)
精製した各ルシフェラーゼについて発光活性を測定した。
ATP溶液は、以下の様に調製した。ATP二ナトリウム塩三水和物(Roche #519979)0.3gを3.5mLの水に溶かし、pHを測定しながら1M NaOH溶液を加え、pHを7.0に調整した。259nmにおける吸光度を測定し、ATPの消光係数ε=15400(M−1cm−1)を用いて濃度が100mMになるように水を加えて最終調整した。黒色の96穴アッセイプレート(Thermo Fisher Scientific)のウェル中に、25μLの基質溶液(100mM Tris−HCl、20mM MgSO4、800μM D−(−)−ルシフェリン、0〜20mM ATP、pH8.0)を入れておき、ルシフェラーゼ溶液(2μg/mL ルシフェラーゼ、100mM Tris−HCl、pH8.0)を75μL加えた時点から、発光強度を経時的に測定した。25μLの基質溶液に75μLのルシフェラーゼ溶液を加えた直後の100μLの反応溶液は、100mM Tris−HCl、5mM MgSO4、200μM D−(−)−ルシフェリン、1.5μg/mL(25nM)ルシフェラーゼを含み、ATPは連続する8ウェルにそれぞれ0mM、0.001mM、0.005mM、0.02mM、0.1mM、0.5mM、2.5mMおよび5mM含まれるように調製した。ルシフェラーゼ溶液の自動分注および発光強度の測定は、自動分注器および光電子増倍管を備えたATTO社製Luminescencer JNR−IIを用いた。
【0066】
(発光強度データの解析)
ATPに対するルシフェラーゼの酵素学的パラメータを算出するために、式3に示したミカエリス・メンテンのモデルによって発光活性データを評価した。KM値およびVmax値の導出には、各ATP濃度での発光強度の経時変化のピーク付近の値をv0として、異なるATP濃度に対するv0値のデータに式3を当てはめてパラメータを導出した。式の当てはめには、レベンバーク−マーカート法による非線形最小二乗法を用いた。
【0067】
(結果)
各変異体において求めたKM値および相対kcat値を表3にまとめる。さらに、図3に、KMを横軸とし相対kcatを縦軸としてプロットする。図3中、横軸に平行な破線は相対kcat値が50%である線を意味し、縦軸に平行な破線はKM値が0.3mMである線を意味する。
【0068】
【表3】

表3および図3の結果から、各変異体のKM値は野生型ルシフェラーゼと比較して増大しており、一方で、kcat値は野生型ルシフェラーゼと比較して高い水準に維持されていることがわかる。また、K447E/K535E変異体は、K447E変異体およびK535変異体と比較してKM値が増大している。このことは、変異を二重で導入することで、相乗的にKM値を増大する効果が得られることを意味する。
【0069】
[実施例2]
GL3ルシフェラーゼの変異体を作製し、ATPに対する応答性および発光活性を調べた。なお、GL3ルシフェラーゼは、北米ボタルルシフェラーゼに対して、N50D/N119G/S548I/K549A/L550Vの変異を導入して性質を改変したものであるから、以下の実施例は、北米ボタルルシフェラーゼ変異体に対して追加の変異を導入した実施例でもある。
【0070】
(発現ベクターの作製)
pGL3−Basic(Promega)ベクターに組み込まれているルシフェラーゼをコードする遺伝子部分(配列番号25)を実施例1と同様の方法で、pRSET−Bベクター(Invitrogen)のBamHIおよびEcoRIサイト間に挿入して、GL3発現ベクターを作製した。当該発現ベクターからは、GL3ルシフェラーゼ(配列番号26)が発現する。
【0071】
そのGL3ルシフェラーゼのDNAに変異を導入して、変異型GL3発現ベクターを作製した。具体的には、GL3のK445およびR533の部位に変異を持ち、センス鎖と相補的な二種類のオリゴDNAを同時に用いて、QuikChange Multi Site−Directed Mutagenesis Kit(Stratagene)によって作製した。K445E変異導入オリゴDNA配列を配列番号27に、R533E変異導入オリゴDNA配列を配列番号28にそれぞれ示す。得られた変異型GL3の塩基配列は配列番号29に、そのアミノ酸配列は配列番号30に示す。
【0072】
各変異体の塩基配列を、BigDye Terminator v3.1 Cycle Sequencing Kit(Applied Biosystems)および3130XLジェネティックアナライザ(Applied Biosystems)を使用して確認し、タンパク質をコードする領域に目的の変異が導入されていることおよびPCRエラーに起因する意図しない変異が無いことを確認した。
【0073】
(ルシフェラーゼタンパク質の精製)
上記GL3および変異型GL3発現ベクターを用いて、実施例1に記載の方法でルシフェラーゼタンパク質を作製し、精製を行った。
【0074】
(発光活性測定)
精製したGL3および変異型GL3タンパク質について、実施例1に記載の方法で発光活性を測定した。25μLの基質溶液に75μLのルシフェラーゼ溶液を加えた直後の100μLの反応溶液は、100mM Tris−HCl、5mM MgSO4、200μM D−(−)−ルシフェリン、1.5μg/mL(25nM)ルシフェラーゼを含み、ATPは二列の隣り合う16のウェルにそれぞれ0mM、0.0002mM、0.0005mM、0.001mM、0.002mM、0.005mM、0.01mM、0.04mM、0.1mM、0.2mM、0.5mM、1mM、2mM、4mMおよび5mM含まれるように調製した。
【0075】
(発光強度データの解析)
図4に、上記ATP濃度条件におけるGL3ルシフェラーゼおよびその変異体の発光強度をまとめる。また、式3を測定結果に当てはめた結果を図4の実線で示した。式の当てはめによって得られたパラメータを表4にまとめた。
【0076】
【表4】

【特許請求の範囲】
【請求項1】
酵素反応をミカエリス−メンテンのモデルによって解析したときに、ATPに対するミカエリス定数KMが0.3mM以上であり、且つkcatが野生型または変異導入前の甲虫類ルシフェラーゼのkcatの50%以上の値である変異型甲虫類ルシフェラーゼ。
【請求項2】
タンパク質の立体構造において、基質結合部位から5Å以上離れた部位に変異が導入されている請求項1に記載の変異型甲虫類ルシフェラーゼ。
【請求項3】
変異が導入されている前記部位は、変異導入前において、少なくとも1つの塩基性アミノ酸残基である請求項2に記載の変異型甲虫類ルシフェラーゼ。
【請求項4】
前記塩基性アミノ酸残基は、相同性に基づく配列比較において、野生型ヤエヤマヒメボタルルシフェラーゼの447位のリジン残基に相当するアミノ酸残基である請求項3に記載の変異型甲虫類ルシフェラーゼ。
【請求項5】
前記塩基性アミノ酸残基は、相同性に基づく配列比較において、野生型ヤエヤマヒメボタルルシフェラーゼの535位のリジン残基に相当するアミノ酸残基である請求項3に記載の変異型甲虫類ルシフェラーゼ。
【請求項6】
前記塩基性アミノ酸残基は、相同性に基づく配列比較において、野生型ヤエヤマヒメボタルルシフェラーゼの538位のアルギニン残基に相当するアミノ酸残基である請求項3に記載の変異型甲虫類ルシフェラーゼ。
【請求項7】
前記塩基性アミノ酸残基は、相同性に基づく配列比較において、野生型ヤエヤマヒメボタルルシフェラーゼの447位のリジン残基に相当するアミノ酸残基、535位のリジン残基に相当するアミノ酸残基および538位のアルギニン残基に相当するアミノ酸残基から成る群から選択される2以上のアミノ酸残基である請求項3に記載の変異型甲虫類ルシフェラーゼ。
【請求項8】
請求項1から7の何れか1項に記載の変異型甲虫類ルシフェラーゼタンパク質をコードする塩基配列を含む核酸。
【請求項9】
請求項8に記載の核酸を含む形質転換体。
【請求項10】
請求項8に記載の核酸を含む形質導入体。
【請求項11】
請求項9に記載の形質転換体もしくは請求項10に記載の形質導入体にて変異型甲虫類ルシフェラーゼを発現させる工程、または無細胞発現系にて変異型甲虫類ルシフェラーゼを合成する工程を含む請求項1から7の何れか1項に記載の変異型甲虫類ルシフェラーゼの製造方法。
【請求項1】
酵素反応をミカエリス−メンテンのモデルによって解析したときに、ATPに対するミカエリス定数KMが0.3mM以上であり、且つkcatが野生型または変異導入前の甲虫類ルシフェラーゼのkcatの50%以上の値である変異型甲虫類ルシフェラーゼ。
【請求項2】
タンパク質の立体構造において、基質結合部位から5Å以上離れた部位に変異が導入されている請求項1に記載の変異型甲虫類ルシフェラーゼ。
【請求項3】
変異が導入されている前記部位は、変異導入前において、少なくとも1つの塩基性アミノ酸残基である請求項2に記載の変異型甲虫類ルシフェラーゼ。
【請求項4】
前記塩基性アミノ酸残基は、相同性に基づく配列比較において、野生型ヤエヤマヒメボタルルシフェラーゼの447位のリジン残基に相当するアミノ酸残基である請求項3に記載の変異型甲虫類ルシフェラーゼ。
【請求項5】
前記塩基性アミノ酸残基は、相同性に基づく配列比較において、野生型ヤエヤマヒメボタルルシフェラーゼの535位のリジン残基に相当するアミノ酸残基である請求項3に記載の変異型甲虫類ルシフェラーゼ。
【請求項6】
前記塩基性アミノ酸残基は、相同性に基づく配列比較において、野生型ヤエヤマヒメボタルルシフェラーゼの538位のアルギニン残基に相当するアミノ酸残基である請求項3に記載の変異型甲虫類ルシフェラーゼ。
【請求項7】
前記塩基性アミノ酸残基は、相同性に基づく配列比較において、野生型ヤエヤマヒメボタルルシフェラーゼの447位のリジン残基に相当するアミノ酸残基、535位のリジン残基に相当するアミノ酸残基および538位のアルギニン残基に相当するアミノ酸残基から成る群から選択される2以上のアミノ酸残基である請求項3に記載の変異型甲虫類ルシフェラーゼ。
【請求項8】
請求項1から7の何れか1項に記載の変異型甲虫類ルシフェラーゼタンパク質をコードする塩基配列を含む核酸。
【請求項9】
請求項8に記載の核酸を含む形質転換体。
【請求項10】
請求項8に記載の核酸を含む形質導入体。
【請求項11】
請求項9に記載の形質転換体もしくは請求項10に記載の形質導入体にて変異型甲虫類ルシフェラーゼを発現させる工程、または無細胞発現系にて変異型甲虫類ルシフェラーゼを合成する工程を含む請求項1から7の何れか1項に記載の変異型甲虫類ルシフェラーゼの製造方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2012−125216(P2012−125216A)
【公開日】平成24年7月5日(2012.7.5)
【国際特許分類】
【出願番号】特願2010−281503(P2010−281503)
【出願日】平成22年12月17日(2010.12.17)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
【公開日】平成24年7月5日(2012.7.5)
【国際特許分類】
【出願日】平成22年12月17日(2010.12.17)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
[ Back to top ]

