画像解析
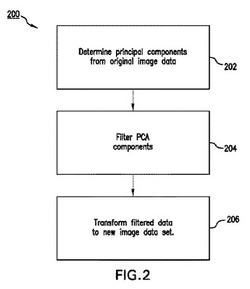
本発明の様々な実施形態は、画像解析のためのシステム100及び方法200に関する。詳細には、本発明の様々な実施形態は、原画像フレーム502、504、506、508、510のシーケンスに対応するデータを含む画像データセットから低強度フィーチャを抽出する、システム100及び方法200に関する。そのような一方法200は、原画像フレームに対応する画像データセットから複数の主成分PC1、PC2、PC3、PC4、PC5、PC6を決定し202、複数の主成分PC1、PC2、PC3、PC4、PC5、PC6に主成分分析(PCA)フィルタを適用して、複数の主成分PC1、PC2、PC3、PC4、PC5、PC6から1つ以上の主成分PC1を破棄することによって、フィルタ処理データセットを決定し204、フィルタ処理データセットを変換して、低強度フィーチャが強調されたフィルタ処理複数の画像フレーム402、404、406、408、410を作り出す206ことを含んでなる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、画像解析に関する。より詳細には、本発明は、例えば陽電子放射断層撮影(PET)画像データを使用する、医療診断のための改善された画像解析技術に関する。
【背景技術】
【0002】
例えば疾病の解剖学的又は機能的徴候によって引き起こされる病的状態を臨床医が診断するのを支援するための、様々な医療用画像化技術が存在する。そのような多くの技術は、患者の解剖学的特性及び/又は機能的特性の様々な時間的変化を臨床医に対して強調表示するために使用できる、画像フレームのシーケンスを作り出す。
【0003】
例えば、患者の解剖学的構造、例えば心臓や脳などが、経時的にどのように変化するかを示す画像フレームのシーケンスを提供する、磁気共鳴画像法(MRI)スキャン、機能的磁気共鳴画像法(fMRI)スキャン、コンピュータ断層撮影(CT)スキャン、又は単光子放射断層撮影(SPECT)スキャンを実施することができる。そのような時間的変化は、1回のスキャン中に検出されることもあり、且つ/又は、例えば継続的な通院時に実施される複数回のスキャンの間に検出されることもある。
【0004】
他の例として、PET画像法を使用して、例えば、患者の器官、例えば脳などの生理学的機能的特性が経時的にどのように変化するかを示す、画像フレームのシーケンスを得ることができる。
【0005】
PETは、生化学物質に組み込まれた人工導入された放射性核種が崩壊して陽電子を放出するときのガンマ線を検出した結果として、断層撮影法を使用して体内の機能的プロセスの3次元画像又はマップをコンピュータ生成する、公知の画像化技術である。これらの陽電子の消滅から検出される光子の分析を用いて断層撮影画像フレームを生成し、その断層撮影画像フレームを、カラースケールを使用して定量化し、組織中の生化学物質の拡散を示し、それによって代謝プロセス及び/又は生理学的プロセスの局在を示すことができる。
【0006】
例えば、PETで使用される放射性核種は、フッ素−18、酸素−15、窒素−13、及び炭素−11(半減期が約110分〜約20分にわたる)など、短寿命の放射性同位体とすることができる。放射性核種は、身体によって通常使用される化合物などの生化学物質に組み込むことができ、それらの物質には、例えば、糖、水、及び/又はアンモニアを含めることができる。次いで、それらの生化学物質を体内に(例えば血流中に)注入又は吸入することができ、体内で、それらの物質(例えば、糖)は、関心組織に集まり、放射性核種が陽電子を放出することによって崩壊する。これらの陽電子は、近くの電子と衝突してガンマ線光子を生成し、それらのガンマ線光子を、検出し、記録し、それによって、放射性核種がどこで身体に取り込まれたかを示すことができる。このデータのセットを使用して、人体における解剖学的情報、生理学的情報、及び代謝情報のうちの1つ以上を調べ、描き出すことができる。
【0007】
被検者に投与できる放射線の量に制限があり、放射性核種の半減期が一般に短く、特定の記録システムの感度が限られているので、動的PETデータは、通常、かなり高いレベルのノイズを特徴とする。他の制限要因は、信号を弱め、ノイズを増大させる、関心分子の代謝分解である。これは、標的への非特異的結合のレベルが高いこと、及び健康な部位と病変部との間の標的発現の差が小さい場合があることとともに、使用される放射性核種又は実施されるスキャンのタイプにかかわらず動的PETデータの解析を困難にするおそれのある要因である。これは、個々の画像フレームが、一般に、臨床医による解剖学的構造及び病理の解析及び可視化に最適とはいえないことを意味する。
【0008】
したがって、PETスキャンから作り出される時間的に連続した動的画像フレームの画像品質を改善しようとする様々な技術が開発されてきた。
【0009】
動的PETデータにおいてノイズの低減及び量的推定のために使用される標準的な方法の1つは、シーケンスの全体又は一部分の画像フレームの合計、平均(average又はmean)を得ることである。ただし、合計、平均処理された画像は、ノイズの低減には有効なことがあるが、この手法は、異なる動態挙動を備えた領域間に検出される相違を弱めることになり、したがって、有意性のない臨床的フィーチャと潜在的に有意な臨床的フィーチャとの間のコントラストを低下させることになる。
【0010】
動的PETデータの解析に使用される他の方法は、正常な領域と病的領域との区別を強調できる特定の運動学的特性を備えた部位を抽出することを目的として、パラメトリック画像の生成を伴う動態モデリングを使用する。
【0011】
パラメータ推定に使用される、そのような1つの動態モデリング方法は、Patlak法(又は、時にGjedde法)[非特許文献1]として知られる。標的領域と基準放射線濃度との比は、選択された時間までの基準放射線濃度の時間積分をこの時点での放射線濃度によって除したものとして得られる、修正された時間に対してプロットされる。トレーサの蓄積を不可逆的なものとして記述できる場合、トレーサ動態のPatlakグラフ表示は、蓄積速度に比例した傾きをもつ直線となる。この方法は、動的画像化フレームシーケンスにおいて容易に各ピクセルに別個に適用でき、蓄積速度を表すパラメトリック画像の生成を可能にする。
【0012】
しかし、動態モデリングを使用するときの1つの問題は、生成されるパラメトリック画像が低品質であり、同時に画像のノイズがかなり多いことである。この点に関して、Patlak法[非特許文献1]などの動態モデリング方法は、動的データからの生理学的パラメータの測定中に信号対ノイズ比(SNR)を最適化しない。
【0013】
また、他のタイプのモデリングに基づいた、パラメトリック画像の生成のための代替的な方法も存在する。例えば、Loganプロット、コンパートメントモデリング、又は因子分析やスペクトル解析におけるような成分の抽出がある[非特許文献2]。また、反復2段階(ITS:iterative two stage)方法が用いられる集団ベースの手法など、他の代替的な技術も提案されている[非特許文献3]。
【0014】
動的PETデータは、また、主成分分析(PCA:principal component analysis)など、多種多様な多変量統計技術を使用して解析することができる[4、5、6]。PCAは、データセットの次元を低減するためにデータ中の分散共分散構造を同時に見つけるために用いられる。PCAの結果は、様々な目的で、例えば、因子分析、回帰分析、入力/生画像フレームデータなどの前処理を実施するために使用することができる。
【先行技術文献】
【非特許文献】
【0015】
【非特許文献1】A. M. Peters, Graphical Analysis of Dynamic Data: The Patlak-Rutland Plot, Nuclear Medicine Communications, 15:669・672, 1994
【非特許文献2】J. Logan, J. S. Fowler, N. D. Volkow, G-J. Wang, Y-S. Ding, D. L. Alexoff, Distribution Volume Ratios without Blood Sampling from Graphical Analysis of PET Data, Journal of Cerebral Blood Flow Metabolism, 16:834-840, 1986
【非特許文献3】A. Bertoldo, G. Sparacino, C. Cobelli, Population Approach Improves Parameter Estimation of Kinetic Models from Dynamic PET Data, IEEE Transactions on Medical Imaging, vol. 23, no3, pp. 297-306, 2004, ISSN 0278-0062
【非特許文献4】R. C. Gonzalez and R. E. Woods, Digital Image Processing, Second Edition, Chapter 11, Prentice Hall, New Jersey, USA
【非特許文献5】Lindsay I Smith, A tutorial on Principal Components Analysis, 26 February 2002, http://www.cs.otago.ac.nz/cosc453/student#tutorials/principal#components.pdf
【非特許文献6】Pasha Razifar, Novel Approaches for Application of Principal Component Analysis on PET Images for Improvement of Image Quality and Clinical Diagnosis, PhD thesis, Uppsala University, ISSN 1651-6214, ISBN 91-554-6387-8
【非特許文献7】C. S. Patlak and R. G. Blasberg, Graphical Evaluation of Blood-to-Brain Transfer Constants from Multiple-Time Uptake Data, Journal of Cerebral Blood Flow Metabolism, 5:584-590, 1985
【非特許文献8】RAZIFAR et al: "A new application of pre-normalized principal component analysis for improvement of image quality and clinical diagnosis in human brain PET studies", NEUROIMAGE, ACADEMIC PRESS, ORLANDO, FL, US, vol.33, no.2,2 November 2006 (2006-11-02), pages 588-598, XP005732086, ISSN:1053-8119, page 590-page 596; figures 3-6
【発明の概要】
【発明が解決しようとする課題】
【0016】
しかし、要約すれば、連続画像フレームの解釈は、困難なままであり、臨床医に強調表示するために臨床的に有意なフィーチャをより確実に抽出できる技術が依然として必要とされている。
【課題を解決するための手段】
【0017】
したがって、従来技術に付随した前述の問題及び欠点を念頭において、本発明の様々な態様及び実施形態を考案した。
【0018】
本発明の第1の態様によれば、原画像フレームのシーケンスに対応するデータを含む画像データセットから低強度フィーチャを抽出する方法が提供される。この方法は、原画像フレームに対応する画像データセットから複数の主成分(PC)を決定し、複数の主成分に主成分分析(PCA)フィルタを適用して、複数の主成分から1つ以上の主成分(PC)を破棄することによって、フィルタ処理データセットを決定し、フィルタ処理データセットを変換して、低強度フィーチャが強調されたフィルタ処理複数の画像フレームを作り出すことを含んでなる。
【0019】
本発明のこの態様による方法は、従来技術を上回る様々な改善を提供する。例えば、この方法は、臨床的に有意な可能性のある画像中の低強度フィーチャを強調するだけでなく、また、例えば、画像フレームデータが特にノイズの多いものとなり得るPETスキャン中のトレーサ取込みを描出するような画像フレームの時間的シーケンスを見るときに、ノイズを低減し、より良好な時間的画像の可視化を可能にする。
【0020】
本発明の第2の態様によれば、本発明の第1の態様による方法を実装するようにデータ処理装置を構成するコンピュータコードを含む、コンピュータプログラム製品が提供される。
【0021】
そのようなコンピュータプログラム製品を使用して、例えば、低強度フィーチャが強調された改善された画像シーケンスを従来の医療用画像化システムが提供できるように、それらの従来の医療用画像化システムの機能をアップグレードすることができる。
【0022】
本発明の第3の態様によれば、原画像フレームのシーケンスに対応するデータを含む画像データセットから低強度フィーチャを表示するシステムが提供される。このシステムは、原画像フレームのシーケンスを取得するように動作可能な画像取得モジュールを含む。そのシステムは、また、a)原画像フレームに対応する画像データセットから複数の主成分を決定し、b)複数の主成分に主成分分析(PCA)フィルタを適用して、複数の主成分から1つ以上の主成分を破棄することによって、フィルタ処理データセットを決定し、c)フィルタ処理データセットを変換して、低強度フィーチャが強調されたフィルタ処理複数の画像フレームを作り出すように動作可能な、画像解析装置を含む。そのシステムは、フィルタ処理画像フレームを、例えば、臨床医が後で解釈できるようにその臨床医に表示するように動作可能な、ディスプレイをさらに含む。
【0023】
このようなシステムの諸要素が、互いに遠隔に位置することができ、必ずしもともに同一の物理的又は地理的場所に見出されるわけではないことが理解される。
【図面の簡単な説明】
【0024】
【図1】本発明の一実施形態による被検者の臨床診断のためのシステムを示す図である。
【図2】本発明の様々な実施形態による動的な連続画像データセットから低強度フィーチャを抽出する方法を示す図である。
【図3】本発明の一態様にしたがって実施された実験的な17フレーム動的PET脳画像化研究から得られた主成分分析画像を示す図である。
【図4】実験的な17フレーム動的PET脳画像化研究からのフィルタ処理フレーム11〜15を示す図である。
【図5】実験的な17フレーム動的PET脳画像化研究からのフィルタ処理されていない原フレーム11〜15を示す図である。
【図6】本発明の様々な実施形態とともに使用するためのグラフィカルユーザインターフェース(GUI)から得られた第1のスクリーンショットを示す図である。
【図7】図6と同一の、ただし操作パラメータセットが異なるGUIを使用して得られた、他のスクリーンショットを示す図である。
【図8】図6と同一の、ただし操作パラメータセットが異なるGUIを使用して得られた、残差画像のスクリーンショットを示す図である。
【発明を実施するための形態】
【0025】
図1は、本発明の一実施形態による被検者の臨床診断のためのシステム100を示す。システム100は、様々なインターフェース123、126、画像取得モジュール122、及び画像解析装置124を提供するように構成された、データ処理装置120を含む。インターフェース123、126、画像取得モジュール122、及び画像解析装置124は、中央処理装置(図示せず)の制御下でデータバス125を通じて論理的につなぎ合わせることができる。
【0026】
データ処理装置120は、データ処理装置120を外部コンポーネントにインターフェース接続する、第1の汎用インターフェース126を提供する。この実施形態では、外部コンポーネントには、1つ以上のユーザ入力デバイス128(例えば、マウス/キーボードなど)に結合された入力データリンク127、インターネット142に結合されたネットワークデータリンク143、及びディスプレイ130に結合されたディスプレイデータリンク129が含まれる。さらに、汎用インターフェース126は、また、システム100のユーザがそれを通じてデータやコマンドなどを入力し、ディスプレイ130を見ることによって視覚的情報を受け取ることのできる、GUI123を提供する。
【0027】
GUI123は、被検者の様々な解剖学的部分の2次元及び/又は3次元表現を作り出すように動作可能である。そのような表現には、例えば、各領域における物質の取込み又は使用に応じたそれらの領域のカラーコーディングを含めることができる。これによって、システム100のユーザが容易に視認できるようになる。さらに、様々な実施形態では、ユーザは、また、入力デバイス128を使用してGUI123を操作することによって、画像を回転させ、且つ/又は3D画像をスライスすることができる。
【0028】
様々な実施形態では、データ処理装置120は、例えば、パーソナルコンピュータ(PC)などの汎用コンピュータによって提供することができる。このような汎用コンピュータは、ソフトウェアモジュールを使用して画像取得モジュール122と画像解析装置124との両方を提供することができ、したがって、ソフトウェアアップグレードを用いて既存の機器の機能的能力をアップグレードすることによって実装することができる。例えば、コンピュータコードを含むコンピュータプログラム製品144を、リモートサーバ(図示せず)からインターネット142を経由してネットワークデータリンク143を通じてデータ処理装置120へと送信することもでき、又は、例えば、CD、DVD、磁気ディスク、ROM、フラッシュメモリデバイスなど、物理的媒体上で提供することもできる。
【0029】
システム100は、また、データリンク139によってデータ処理装置120に結合された任意の陽電子放射断層撮影(PET)スキャナ140と、データリンク131によってデータ処理装置120に結合された任意のデータストア132とを含む。PETスキャナ140及び/又はデータストア132は、画像データを画像取得モジュール122に提供するように構成することができる。例えば、PETスキャナを設けない場合、画像データは、予め生成された画像データをその中に格納できるデータストア132から提供することができる。そのような予め生成された画像データは、システム100から遠隔で(例えば、適切な画像データ生成施設が利用可能な遠隔の病院内などで)生成し、続いてデータストア132へと転送することができ、そのデータストア132からそのような予め生成された画像データを画像取得モジュール122によって検索することができる。画像取得モジュール122は、さらに、PETスキャナ140によって生成された画像データをアーカイビング目的でデータストア132へと転送するように動作可能である。
【0030】
画像解析装置124は、画像データに対して画像解析を実施するように動作可能である。そのような画像データは、例えば、被検者の解剖学的構造の特定の部分から得られる画像の時間的シーケンスに対応する、画像フレームのシーケンスの形態で提供することができる。例えば、画像フレームは、PETスキャンから得られる、被検者の脳や心臓などにおける放射性同位体標識分子の取込みを示す、画像の時間シーケンスに対応することができる。代替的に、又は追加的に、画像フレームは、磁気共鳴画像法(MRI)から(例えば、様々なスキャンシーケンス、動的研究、及び/若しくは機能的画像化から)、光学的画像化から(例えば、様々な波長で)、並びに/又はX線画像化から(例えば、動的研究やCTスキャンなどを実施するときに)得ることもできる。
【0031】
図2は、本発明の様々な実施形態による動的な連続画像データセットから低強度フィーチャを抽出する方法200を示す。画像データは、単一スライスの動的シーケンス(2次元画像)の形態とすることもでき、又は体積の動的シーケンス(1つのエンティティとして扱われる画像の3次元スタック)の形態とすることもできる。以下の説明は、2次元画像シーケンスを想定する。画像シーケンスのフィルタ処理は、スライス位置ごとに実施することができる。方法200は、例えば、図1に示し、前述した、画像解析装置124を使用して実施することができる。
【0032】
当該方法は、連続画像データセットにおいてフレームを形成する各画像に対応するデータから主成分を決定する第1の段階202を含む。
【0033】
【数1】

他の正規化技術、例えば、Razifar[非特許文献6]によって記載された正規化技術が有用と判明する可能性もあるが、前述の方法は、ロバストであり、すべてのフレームからのデータに等しく加重するので、信頼性が高いことが知られている。
【0034】
【数2】

共分散行列Cを決定したら、次いで、その共分散行列Cについての単位固有ベクトルを従来の方法[4,5]で決定する。
【0035】
こうして決定された固有ベクトルを、それらのそれぞれの固有値にしたがって並べる、すなわち、最高の固有値を有する固有ベクトル(最上位成分(PC1))から始まって、最低の固有値を有する固有ベクトル(最下位成分(PCn))へと進む。こうして並べられた固有ベクトルPC1〜PCnは、したがって、それぞれの画像フレームについて画像データセットの主成分に対応するn個の固有ベクトルのセットを提供する。
【0036】
主成分を決定したら、方法200の次の段階は、段階204において、主成分にPCAフィルタを適用して、フィルタ処理データセットを決定する段階である。
【0037】
PCAフィルタを適用して1つ以上の主成分を破棄するために、様々な技術を使用することができ、これらの技術のうちのいくつかについて以下でさらに説明する。定義のために、本明細書で使用する破棄に関する表現は、1つ以上の主成分の大きさ(magnitude)を低減することを意味するものと理解され、したがって、破棄には、1つ以上の主成分に、0≦α<1となるような重み付け係数αを乗じることが含まれる。
【0038】
破棄する主成分は、より高次の主成分であってもより低次の主成分であってもよく、より高次の主成分は、最上位成分PC1に向かって分類された、その最上位成分PC1を含む主成分であり、より低次の主成分は、最下位成分PCnに向かって分類された、その最下位成分PCnを含む主成分である。そのような、より低次のノイズ成分を除去すると、ノイズが低減される。
【0039】
様々な実施形態では、破棄する、より高次の1つ以上の主成分は、最上位成分PC1を単に除去することによって決定される。様々な画像化技術では、PC1は、血液の動的挙動を特定することになる。したがって、より高次の1つ以上の主成分の除去を使用して、異なる動態挙動をもつ、よりぼんやりしたフィーチャをマスクしかねない真のフィーチャ(すなわち、ノイズではない)を除去することができる。
【0040】
追加的に、又は代替的に、破棄すべき1つ以上の主成分は、1つ以上の分散寄与閾値を動的に設定し、例えば対応する固有値に基づいたそのパーセンテージ分散寄与がそれぞれの分散寄与閾値未満である又はそれぞれの分散寄与閾値を超える主成分を破棄することによって、決定することもできる。
【0041】
本発明の様々な実施形態は、さらに、例えばスクリープロット分析を使用して、破棄する1以上のより低次の主成分を決定することができる。
【0042】
スクリープロットは、主成分がx軸上にプロットされ、各主成分についての対応するパーセンテージ分散値がy軸上にプロットされた、図的分析技術である。一般に、スクリープロットは、より高次の主成分から急速に低下し、「ニー(knee)」に到達し、次いで横ばいになる。
【0043】
スクリープロットは、主成分の分散寄与(例えば、主成分のそれぞれの固有値によって定義される)がどこで横ばいになってノイズフロアに達するかを決定するために適用され、ノイズフロアを下回る成分を破棄する。ノイズフロアは、様々な方法で決定することができ、データに依存する。例えば、より低い分散寄与閾値をスクリープロットのニーのすぐ下の値に設定することができ、その閾値を下回る分散値を有するすべての主成分を破棄する。
【0044】
追加的に、又は代替的に、破棄する1つ以上の主成分は、破棄すべき1つ以上の主成分を動的に設定し、フィルタ処理画像の残差(residual)解析によって決定することもできる。すなわち、フィルタ処理画像と原画像との相違は、視覚的に又はコンピュータアルゴリズムによって解析される。残差画像は、破棄されるより低次の主成分を選択する(フィルタ処理のために)、PCAフィルタを使用して、計算することができる。すなわち、画像を作成するために使用される主成分は、残差画像については破棄される。図8は、図6からのフィルタ処理画像の残差画像の一例を示す。
【0045】
原画像は、検出器対間の同時計数に対応するPETスキャンから得られた生データを含むことがある。各検出器対について記録された事象のカウントは、生データであり、それをヒストグラム化してサイノグラムを得ることができる。サイノグラムは、各検出器対についてのカウントの画像と見なすことができ、画像を提供するように変換(例えば、再構築)することができる。したがって、様々な実施形態では、画像を変換又は再構築する前に、生データをフィルタ処理することができる。
【0046】
本発明による方法の様々な実施形態は、複数の主成分を決定する前に画像データセットからバックグラウンドピクセルをフィルタ処理することをさらに含むことができる。
【0047】
これは、画像フレームからの入力を使用して有意な生理学的特性を計算する薬物動態モデリングに特に有用であり、それは、特定の状況下で、これらの特性をピクセルごとに計算するために使用されるアルゴリズムがロバストではなく、むしろノイズを追加して質の悪い画像を作り出すという既存の問題に対処するからである。そのようなモデリングアルゴリズムを使用する前にフィルタ処理段階を実施することによって、本発明の様々な実施形態は、この問題に対処する。
【0048】
例えば、Patlakモデル[非特許文献7]を使用してパラメトリック画像を作り出すことができる。ただし、これは、非常にノイズの多い画像を生成する。それゆえ、この問題に対処するために、本発明の様々な実施形態によるPCAフィルタの適用を使用して、Patlak技術[非特許文献7]を使用した画像を作成する前にノイズを除去し、これにより、大きく改善された画像をもたらす。
【0049】
通常、薬理学的研究では、被検者に何度も放射性物質を注入する必要がある。したがって、同じ被検者に何度もスキャンを実施すること(例えば、異なる条件下で)は、現在、最大許容放射線量の制限によって阻まれている。したがって、本発明の様々な実施形態のノイズフィルタリング技術を用いて(例えば、また、有意性の低い成分だけを除去することによって)、1人の人間に対して実施可能な研究の数を有用に拡大することができる。
【0050】
後者のノイズフィルタリング技術は、また、PETスキャニングが使用されるときに有用である。例えば、そのノイズフィルタリング技術は、残留放射能が崩壊するのを待つ必要なしに(例えば、ほぼ2時間の半減期のフッ素−18の場合、きわめて非実用的となる)、身体の様々な部分に実施されたPETスキャンによって取得された連続画像からの、より良好な定量的及び定性的情報の抽出を可能にすることができる。そのような技術では、従来、注入される放射性物質の量を漸増させる必要があり、したがって、その前に注入された各線量からの残留信号は、その後に注入された線量によって生成されるより大きな信号によってマスクされる。
【0051】
段階204で主成分にPCAフィルタを適用してフィルタ処理データセットを決定したら、方法200の次の段階206は、フィルタ処理データセットを新しい画像データセットNewDataSetに変換する段階である。新しい画像データセットを使用して、臨床的に有意な可能性のある低強度フィーチャが強調され、またさらに可視化改善のために画像ノイズが低減された、フィルタ処理複数の画像フレームを提供することができる。
【0052】
フィルタ処理データセットは、フィーチャベクトルFeatureVectorを使用して計算される。フィーチャベクトルは、選ばれた主成分(固有ベクトル)を含むベクトルの行列であるので、次式の通りとなる。
【0053】
【数3】

式中、αiは、PCAフィルタによってi番目の固有ベクトルに適用されるそれぞれの重み付け係数である。0又は1であるαi値についてデータがどのように処理されるか、以下で説明する。また、他のαi値も使用することができる。
【0054】
原フレーム画像データは、以下の方法で修正される。すなわち、
初めに、画像データを主成分(固有ベクトル)の座標系へと回転させ、次元を選択された成分の数へと切り捨てる。
【0055】
【数4】

式中、FeatureVectorTは、FeatureVectorの転置であり、DataAdjustTは、正規化された原画像データベクトルの転置である。したがって、FinalDataは、PCA画像を表す。
【0056】
2番目に、切り捨てたデータを、以下の操作を使用して変換し、元の次元に戻す。
【0057】
【数5】

3番目に、NewDataSetの正規化を元に戻す。これは、通常、標準偏差を乗じ、平均値を加えることによって行い、例えば、以上で正規化に使用したのと同じ値の標準偏差及び平均値を使用して行う。
【0058】
最後に、NewDataSetを再フォーマットして画像を提供し、原画像セットと同数のフレームを備えたフィルタ処理画像セットをもたらす。この再フォーマットプロセスは、NewDataSet内の1次元データベクトルから2次元画像を再形成することができる。
【0059】
図3は、実験的な17フレーム動的PET脳画像化研究から得られた主成分分析画像300を示しており、それらの11番目から15番目までの原フレームが図5に示されている。
【0060】
この実験では、General Electric Discovery ST PET/CTカメラを使用し、トレーサは、脳障害の研究に提供される実験用トレーサとした。スキャン時間は、初めの数分間で取得されるフレームについては10秒に設定し、90分後に取得されるフレームについて最大15分という徐々に長い取得時間を、フレームに対して使用した。次いで、すべてのフレームをPCAフィルタリング解析で使用した。
【0061】
最上位主成分PC1は、主成分の分散に83%寄与する。2番目に高次の主成分PC2は、主成分の分散に8%寄与する。3番目の主成分PC3は、主成分の分散に4%寄与する。4番目の主成分PC4は、主成分の分散に0.9%寄与する。5番目の主成分PC5は、主成分の分散に0.8%寄与する。6番目の主成分PC6は、主成分の分散に0.6%寄与する。
【0062】
図4は、実験的な17フレーム動的PET脳画像化研究からのフィルタ処理フレーム11〜15を示す。フィルタ処理フレームは、図2の方法を図5に示した原画像フレームに適用することによって得られる。
【0063】
この事例では、PCAフィルタを適用して、主成分PC1、PC2及びPC7〜PC17を完全に除去した(すなわち、α1=α2=α7=...α17=0)。次いで、以上の式(5)にしたがってフィーチャベクトルを作り出し、次いで、式(6a)及び(6b)にしたがってフィーチャベクトルから新しい画像データセットを作り出した。
【0064】
ここに表示した新しい画像データのサブセットは、図4に示したように、フィルタ処理11番目の画像フレーム402、フィルタ処理12番目の画像フレーム404、フィルタ処理13番目の画像フレーム406、フィルタ処理14番目の画像フレーム408、及びフィルタ処理15番目の画像フレーム410を含む。
【0065】
図5は、実験的な17フレーム動的PET脳画像化研究からの原画像フレーム11〜15を示す。図5は、比較しやすいように図4の隣に示されている。
【0066】
図4と図5を比較すると、フィルタ処理画像フレーム12〜15の画像の右上の象限に、臨床的に関心の高いフィーチャをはっきりと視認できることが明らかである。これは、図5を見ると容易には明らかにならないが、組織の動的アーチファクトの結果としての干渉がほとんど又は全くない、非常にはっきりと輪郭が描かれた低強度フィーチャである。本発明者らによるさらなる研究で、この技術の結果として検出された低強度フィーチャが、X線コンピュータ断層撮影など、代替的な技術を使用して見出された結果とよく一致することが確認された。
【0067】
図6は、本発明の一実施形態によるGUIによって提供される第1のスクリーンショット600を示す。スクリーンショット600は、例えば、図1に概略的に示したGUI123の操作から得ることができる。
【0068】
スクリーンショット600は、本発明の様々な態様による方法を適用することによって得られた、フィルタ処理画像フレーム610を示す。スクリーンショット600は、また、ユーザが操作可能な第1のスライダ604及び第2のスライダ606を含む、PCAフィルタ制御セクション602を示す。
【0069】
第1のスライダ604は、フィルタ処理データセットを作り出すときに、より高次のどの主成分を破棄するかを決定する、第1の分散寄与閾値を設定するために使用することができる。ここに示した事例では、分散寄与閾値は、「3」に設定されており、それによって、フィルタ処理データセットを作り出すときに1番目の主成分及び2番目の主成分(PC1及びPC2)が破棄されるようにしている。
【0070】
第2のスライダ606は、フィルタ処理データセットを作り出すときに、より低次のどの主成分を破棄するかを決定する、第2の分散寄与閾値を設定するために使用することができる。ここに示した事例では、分散寄与閾値は、「5」に設定されており、フィルタ処理データセットを作り出すために3番目〜5番目の主成分(PC3〜PC5)が選択され、より低次の他のすべての成分(この事例ではPC6〜PC17)が破棄されるようにしている。
【0071】
フィルタ処理画像フレーム610は、本発明を適用することによって低強度フィーチャが強調された画像を示す。
【0072】
図7は、図6と同一の、ただし異なる操作パラメータが設定されたGUIの操作から得られた、他のスクリーンショット700を示す。
【0073】
スクリーンショット700は、原画像フレームのシーケンスから決定されたすべての主成分を使用して得られた、フィルタ処理されていない画像フレーム710を示す。
【0074】
スクリーンショット700は、また、ユーザが操作可能な第1のスライダ604及び第2のスライダ606を含む、PCAフィルタ制御セクション602を示す。ただし、この事例では、第1のスライダ604は、「1」に設定されており、したがって、変換するためのデータセットを作り出すときに、より高次の主成分が破棄されないようにしている。さらに、第2のスライダ606は、「17」に設定されており、それによって、データセットを作り出すときにすべての主成分(PC1〜PC17)が選択されるようにしている。
【0075】
図6の画像フレーム610と図7の画像フレーム710とを比較すると、やはり、本発明の様々な態様を適用することによって臨床的に関心の高いフィーチャがよりはっきりと視認可能になることが明らかである。
【0076】
したがって、本発明者らの調査から、本発明の様々な態様及び実施形態によって提供される本明細書に記載の画像解析技術が、従来の画像解析技術を上回る有用な改善をもたらすことが明らかと考えられている。
【0077】
図8は、異なる操作パラメータが設定された図6と同一のGUIを使用して得られた、残差画像810のスクリーンショット800を示す。残差画像810は、破棄される(フィルタ処理のため)より低次の主成分を選択することによって、前述のPCAフィルタを使用して計算される。
【0078】
本発明について様々な態様及び好ましい実施形態にしたがって記載したが、本発明の範囲がそれらだけに限定されるものとは見なされず、それらのすべての変形形態及び均等物がやはり特許請求の範囲内に入るものと本出願人らが意図していることを、理解すべきである。
【0079】
本明細書で引用した文献の開示内容は援用によって本明細書の内容の一部をなす。
【技術分野】
【0001】
本発明は、画像解析に関する。より詳細には、本発明は、例えば陽電子放射断層撮影(PET)画像データを使用する、医療診断のための改善された画像解析技術に関する。
【背景技術】
【0002】
例えば疾病の解剖学的又は機能的徴候によって引き起こされる病的状態を臨床医が診断するのを支援するための、様々な医療用画像化技術が存在する。そのような多くの技術は、患者の解剖学的特性及び/又は機能的特性の様々な時間的変化を臨床医に対して強調表示するために使用できる、画像フレームのシーケンスを作り出す。
【0003】
例えば、患者の解剖学的構造、例えば心臓や脳などが、経時的にどのように変化するかを示す画像フレームのシーケンスを提供する、磁気共鳴画像法(MRI)スキャン、機能的磁気共鳴画像法(fMRI)スキャン、コンピュータ断層撮影(CT)スキャン、又は単光子放射断層撮影(SPECT)スキャンを実施することができる。そのような時間的変化は、1回のスキャン中に検出されることもあり、且つ/又は、例えば継続的な通院時に実施される複数回のスキャンの間に検出されることもある。
【0004】
他の例として、PET画像法を使用して、例えば、患者の器官、例えば脳などの生理学的機能的特性が経時的にどのように変化するかを示す、画像フレームのシーケンスを得ることができる。
【0005】
PETは、生化学物質に組み込まれた人工導入された放射性核種が崩壊して陽電子を放出するときのガンマ線を検出した結果として、断層撮影法を使用して体内の機能的プロセスの3次元画像又はマップをコンピュータ生成する、公知の画像化技術である。これらの陽電子の消滅から検出される光子の分析を用いて断層撮影画像フレームを生成し、その断層撮影画像フレームを、カラースケールを使用して定量化し、組織中の生化学物質の拡散を示し、それによって代謝プロセス及び/又は生理学的プロセスの局在を示すことができる。
【0006】
例えば、PETで使用される放射性核種は、フッ素−18、酸素−15、窒素−13、及び炭素−11(半減期が約110分〜約20分にわたる)など、短寿命の放射性同位体とすることができる。放射性核種は、身体によって通常使用される化合物などの生化学物質に組み込むことができ、それらの物質には、例えば、糖、水、及び/又はアンモニアを含めることができる。次いで、それらの生化学物質を体内に(例えば血流中に)注入又は吸入することができ、体内で、それらの物質(例えば、糖)は、関心組織に集まり、放射性核種が陽電子を放出することによって崩壊する。これらの陽電子は、近くの電子と衝突してガンマ線光子を生成し、それらのガンマ線光子を、検出し、記録し、それによって、放射性核種がどこで身体に取り込まれたかを示すことができる。このデータのセットを使用して、人体における解剖学的情報、生理学的情報、及び代謝情報のうちの1つ以上を調べ、描き出すことができる。
【0007】
被検者に投与できる放射線の量に制限があり、放射性核種の半減期が一般に短く、特定の記録システムの感度が限られているので、動的PETデータは、通常、かなり高いレベルのノイズを特徴とする。他の制限要因は、信号を弱め、ノイズを増大させる、関心分子の代謝分解である。これは、標的への非特異的結合のレベルが高いこと、及び健康な部位と病変部との間の標的発現の差が小さい場合があることとともに、使用される放射性核種又は実施されるスキャンのタイプにかかわらず動的PETデータの解析を困難にするおそれのある要因である。これは、個々の画像フレームが、一般に、臨床医による解剖学的構造及び病理の解析及び可視化に最適とはいえないことを意味する。
【0008】
したがって、PETスキャンから作り出される時間的に連続した動的画像フレームの画像品質を改善しようとする様々な技術が開発されてきた。
【0009】
動的PETデータにおいてノイズの低減及び量的推定のために使用される標準的な方法の1つは、シーケンスの全体又は一部分の画像フレームの合計、平均(average又はmean)を得ることである。ただし、合計、平均処理された画像は、ノイズの低減には有効なことがあるが、この手法は、異なる動態挙動を備えた領域間に検出される相違を弱めることになり、したがって、有意性のない臨床的フィーチャと潜在的に有意な臨床的フィーチャとの間のコントラストを低下させることになる。
【0010】
動的PETデータの解析に使用される他の方法は、正常な領域と病的領域との区別を強調できる特定の運動学的特性を備えた部位を抽出することを目的として、パラメトリック画像の生成を伴う動態モデリングを使用する。
【0011】
パラメータ推定に使用される、そのような1つの動態モデリング方法は、Patlak法(又は、時にGjedde法)[非特許文献1]として知られる。標的領域と基準放射線濃度との比は、選択された時間までの基準放射線濃度の時間積分をこの時点での放射線濃度によって除したものとして得られる、修正された時間に対してプロットされる。トレーサの蓄積を不可逆的なものとして記述できる場合、トレーサ動態のPatlakグラフ表示は、蓄積速度に比例した傾きをもつ直線となる。この方法は、動的画像化フレームシーケンスにおいて容易に各ピクセルに別個に適用でき、蓄積速度を表すパラメトリック画像の生成を可能にする。
【0012】
しかし、動態モデリングを使用するときの1つの問題は、生成されるパラメトリック画像が低品質であり、同時に画像のノイズがかなり多いことである。この点に関して、Patlak法[非特許文献1]などの動態モデリング方法は、動的データからの生理学的パラメータの測定中に信号対ノイズ比(SNR)を最適化しない。
【0013】
また、他のタイプのモデリングに基づいた、パラメトリック画像の生成のための代替的な方法も存在する。例えば、Loganプロット、コンパートメントモデリング、又は因子分析やスペクトル解析におけるような成分の抽出がある[非特許文献2]。また、反復2段階(ITS:iterative two stage)方法が用いられる集団ベースの手法など、他の代替的な技術も提案されている[非特許文献3]。
【0014】
動的PETデータは、また、主成分分析(PCA:principal component analysis)など、多種多様な多変量統計技術を使用して解析することができる[4、5、6]。PCAは、データセットの次元を低減するためにデータ中の分散共分散構造を同時に見つけるために用いられる。PCAの結果は、様々な目的で、例えば、因子分析、回帰分析、入力/生画像フレームデータなどの前処理を実施するために使用することができる。
【先行技術文献】
【非特許文献】
【0015】
【非特許文献1】A. M. Peters, Graphical Analysis of Dynamic Data: The Patlak-Rutland Plot, Nuclear Medicine Communications, 15:669・672, 1994
【非特許文献2】J. Logan, J. S. Fowler, N. D. Volkow, G-J. Wang, Y-S. Ding, D. L. Alexoff, Distribution Volume Ratios without Blood Sampling from Graphical Analysis of PET Data, Journal of Cerebral Blood Flow Metabolism, 16:834-840, 1986
【非特許文献3】A. Bertoldo, G. Sparacino, C. Cobelli, Population Approach Improves Parameter Estimation of Kinetic Models from Dynamic PET Data, IEEE Transactions on Medical Imaging, vol. 23, no3, pp. 297-306, 2004, ISSN 0278-0062
【非特許文献4】R. C. Gonzalez and R. E. Woods, Digital Image Processing, Second Edition, Chapter 11, Prentice Hall, New Jersey, USA
【非特許文献5】Lindsay I Smith, A tutorial on Principal Components Analysis, 26 February 2002, http://www.cs.otago.ac.nz/cosc453/student#tutorials/principal#components.pdf
【非特許文献6】Pasha Razifar, Novel Approaches for Application of Principal Component Analysis on PET Images for Improvement of Image Quality and Clinical Diagnosis, PhD thesis, Uppsala University, ISSN 1651-6214, ISBN 91-554-6387-8
【非特許文献7】C. S. Patlak and R. G. Blasberg, Graphical Evaluation of Blood-to-Brain Transfer Constants from Multiple-Time Uptake Data, Journal of Cerebral Blood Flow Metabolism, 5:584-590, 1985
【非特許文献8】RAZIFAR et al: "A new application of pre-normalized principal component analysis for improvement of image quality and clinical diagnosis in human brain PET studies", NEUROIMAGE, ACADEMIC PRESS, ORLANDO, FL, US, vol.33, no.2,2 November 2006 (2006-11-02), pages 588-598, XP005732086, ISSN:1053-8119, page 590-page 596; figures 3-6
【発明の概要】
【発明が解決しようとする課題】
【0016】
しかし、要約すれば、連続画像フレームの解釈は、困難なままであり、臨床医に強調表示するために臨床的に有意なフィーチャをより確実に抽出できる技術が依然として必要とされている。
【課題を解決するための手段】
【0017】
したがって、従来技術に付随した前述の問題及び欠点を念頭において、本発明の様々な態様及び実施形態を考案した。
【0018】
本発明の第1の態様によれば、原画像フレームのシーケンスに対応するデータを含む画像データセットから低強度フィーチャを抽出する方法が提供される。この方法は、原画像フレームに対応する画像データセットから複数の主成分(PC)を決定し、複数の主成分に主成分分析(PCA)フィルタを適用して、複数の主成分から1つ以上の主成分(PC)を破棄することによって、フィルタ処理データセットを決定し、フィルタ処理データセットを変換して、低強度フィーチャが強調されたフィルタ処理複数の画像フレームを作り出すことを含んでなる。
【0019】
本発明のこの態様による方法は、従来技術を上回る様々な改善を提供する。例えば、この方法は、臨床的に有意な可能性のある画像中の低強度フィーチャを強調するだけでなく、また、例えば、画像フレームデータが特にノイズの多いものとなり得るPETスキャン中のトレーサ取込みを描出するような画像フレームの時間的シーケンスを見るときに、ノイズを低減し、より良好な時間的画像の可視化を可能にする。
【0020】
本発明の第2の態様によれば、本発明の第1の態様による方法を実装するようにデータ処理装置を構成するコンピュータコードを含む、コンピュータプログラム製品が提供される。
【0021】
そのようなコンピュータプログラム製品を使用して、例えば、低強度フィーチャが強調された改善された画像シーケンスを従来の医療用画像化システムが提供できるように、それらの従来の医療用画像化システムの機能をアップグレードすることができる。
【0022】
本発明の第3の態様によれば、原画像フレームのシーケンスに対応するデータを含む画像データセットから低強度フィーチャを表示するシステムが提供される。このシステムは、原画像フレームのシーケンスを取得するように動作可能な画像取得モジュールを含む。そのシステムは、また、a)原画像フレームに対応する画像データセットから複数の主成分を決定し、b)複数の主成分に主成分分析(PCA)フィルタを適用して、複数の主成分から1つ以上の主成分を破棄することによって、フィルタ処理データセットを決定し、c)フィルタ処理データセットを変換して、低強度フィーチャが強調されたフィルタ処理複数の画像フレームを作り出すように動作可能な、画像解析装置を含む。そのシステムは、フィルタ処理画像フレームを、例えば、臨床医が後で解釈できるようにその臨床医に表示するように動作可能な、ディスプレイをさらに含む。
【0023】
このようなシステムの諸要素が、互いに遠隔に位置することができ、必ずしもともに同一の物理的又は地理的場所に見出されるわけではないことが理解される。
【図面の簡単な説明】
【0024】
【図1】本発明の一実施形態による被検者の臨床診断のためのシステムを示す図である。
【図2】本発明の様々な実施形態による動的な連続画像データセットから低強度フィーチャを抽出する方法を示す図である。
【図3】本発明の一態様にしたがって実施された実験的な17フレーム動的PET脳画像化研究から得られた主成分分析画像を示す図である。
【図4】実験的な17フレーム動的PET脳画像化研究からのフィルタ処理フレーム11〜15を示す図である。
【図5】実験的な17フレーム動的PET脳画像化研究からのフィルタ処理されていない原フレーム11〜15を示す図である。
【図6】本発明の様々な実施形態とともに使用するためのグラフィカルユーザインターフェース(GUI)から得られた第1のスクリーンショットを示す図である。
【図7】図6と同一の、ただし操作パラメータセットが異なるGUIを使用して得られた、他のスクリーンショットを示す図である。
【図8】図6と同一の、ただし操作パラメータセットが異なるGUIを使用して得られた、残差画像のスクリーンショットを示す図である。
【発明を実施するための形態】
【0025】
図1は、本発明の一実施形態による被検者の臨床診断のためのシステム100を示す。システム100は、様々なインターフェース123、126、画像取得モジュール122、及び画像解析装置124を提供するように構成された、データ処理装置120を含む。インターフェース123、126、画像取得モジュール122、及び画像解析装置124は、中央処理装置(図示せず)の制御下でデータバス125を通じて論理的につなぎ合わせることができる。
【0026】
データ処理装置120は、データ処理装置120を外部コンポーネントにインターフェース接続する、第1の汎用インターフェース126を提供する。この実施形態では、外部コンポーネントには、1つ以上のユーザ入力デバイス128(例えば、マウス/キーボードなど)に結合された入力データリンク127、インターネット142に結合されたネットワークデータリンク143、及びディスプレイ130に結合されたディスプレイデータリンク129が含まれる。さらに、汎用インターフェース126は、また、システム100のユーザがそれを通じてデータやコマンドなどを入力し、ディスプレイ130を見ることによって視覚的情報を受け取ることのできる、GUI123を提供する。
【0027】
GUI123は、被検者の様々な解剖学的部分の2次元及び/又は3次元表現を作り出すように動作可能である。そのような表現には、例えば、各領域における物質の取込み又は使用に応じたそれらの領域のカラーコーディングを含めることができる。これによって、システム100のユーザが容易に視認できるようになる。さらに、様々な実施形態では、ユーザは、また、入力デバイス128を使用してGUI123を操作することによって、画像を回転させ、且つ/又は3D画像をスライスすることができる。
【0028】
様々な実施形態では、データ処理装置120は、例えば、パーソナルコンピュータ(PC)などの汎用コンピュータによって提供することができる。このような汎用コンピュータは、ソフトウェアモジュールを使用して画像取得モジュール122と画像解析装置124との両方を提供することができ、したがって、ソフトウェアアップグレードを用いて既存の機器の機能的能力をアップグレードすることによって実装することができる。例えば、コンピュータコードを含むコンピュータプログラム製品144を、リモートサーバ(図示せず)からインターネット142を経由してネットワークデータリンク143を通じてデータ処理装置120へと送信することもでき、又は、例えば、CD、DVD、磁気ディスク、ROM、フラッシュメモリデバイスなど、物理的媒体上で提供することもできる。
【0029】
システム100は、また、データリンク139によってデータ処理装置120に結合された任意の陽電子放射断層撮影(PET)スキャナ140と、データリンク131によってデータ処理装置120に結合された任意のデータストア132とを含む。PETスキャナ140及び/又はデータストア132は、画像データを画像取得モジュール122に提供するように構成することができる。例えば、PETスキャナを設けない場合、画像データは、予め生成された画像データをその中に格納できるデータストア132から提供することができる。そのような予め生成された画像データは、システム100から遠隔で(例えば、適切な画像データ生成施設が利用可能な遠隔の病院内などで)生成し、続いてデータストア132へと転送することができ、そのデータストア132からそのような予め生成された画像データを画像取得モジュール122によって検索することができる。画像取得モジュール122は、さらに、PETスキャナ140によって生成された画像データをアーカイビング目的でデータストア132へと転送するように動作可能である。
【0030】
画像解析装置124は、画像データに対して画像解析を実施するように動作可能である。そのような画像データは、例えば、被検者の解剖学的構造の特定の部分から得られる画像の時間的シーケンスに対応する、画像フレームのシーケンスの形態で提供することができる。例えば、画像フレームは、PETスキャンから得られる、被検者の脳や心臓などにおける放射性同位体標識分子の取込みを示す、画像の時間シーケンスに対応することができる。代替的に、又は追加的に、画像フレームは、磁気共鳴画像法(MRI)から(例えば、様々なスキャンシーケンス、動的研究、及び/若しくは機能的画像化から)、光学的画像化から(例えば、様々な波長で)、並びに/又はX線画像化から(例えば、動的研究やCTスキャンなどを実施するときに)得ることもできる。
【0031】
図2は、本発明の様々な実施形態による動的な連続画像データセットから低強度フィーチャを抽出する方法200を示す。画像データは、単一スライスの動的シーケンス(2次元画像)の形態とすることもでき、又は体積の動的シーケンス(1つのエンティティとして扱われる画像の3次元スタック)の形態とすることもできる。以下の説明は、2次元画像シーケンスを想定する。画像シーケンスのフィルタ処理は、スライス位置ごとに実施することができる。方法200は、例えば、図1に示し、前述した、画像解析装置124を使用して実施することができる。
【0032】
当該方法は、連続画像データセットにおいてフレームを形成する各画像に対応するデータから主成分を決定する第1の段階202を含む。
【0033】
【数1】

他の正規化技術、例えば、Razifar[非特許文献6]によって記載された正規化技術が有用と判明する可能性もあるが、前述の方法は、ロバストであり、すべてのフレームからのデータに等しく加重するので、信頼性が高いことが知られている。
【0034】
【数2】

共分散行列Cを決定したら、次いで、その共分散行列Cについての単位固有ベクトルを従来の方法[4,5]で決定する。
【0035】
こうして決定された固有ベクトルを、それらのそれぞれの固有値にしたがって並べる、すなわち、最高の固有値を有する固有ベクトル(最上位成分(PC1))から始まって、最低の固有値を有する固有ベクトル(最下位成分(PCn))へと進む。こうして並べられた固有ベクトルPC1〜PCnは、したがって、それぞれの画像フレームについて画像データセットの主成分に対応するn個の固有ベクトルのセットを提供する。
【0036】
主成分を決定したら、方法200の次の段階は、段階204において、主成分にPCAフィルタを適用して、フィルタ処理データセットを決定する段階である。
【0037】
PCAフィルタを適用して1つ以上の主成分を破棄するために、様々な技術を使用することができ、これらの技術のうちのいくつかについて以下でさらに説明する。定義のために、本明細書で使用する破棄に関する表現は、1つ以上の主成分の大きさ(magnitude)を低減することを意味するものと理解され、したがって、破棄には、1つ以上の主成分に、0≦α<1となるような重み付け係数αを乗じることが含まれる。
【0038】
破棄する主成分は、より高次の主成分であってもより低次の主成分であってもよく、より高次の主成分は、最上位成分PC1に向かって分類された、その最上位成分PC1を含む主成分であり、より低次の主成分は、最下位成分PCnに向かって分類された、その最下位成分PCnを含む主成分である。そのような、より低次のノイズ成分を除去すると、ノイズが低減される。
【0039】
様々な実施形態では、破棄する、より高次の1つ以上の主成分は、最上位成分PC1を単に除去することによって決定される。様々な画像化技術では、PC1は、血液の動的挙動を特定することになる。したがって、より高次の1つ以上の主成分の除去を使用して、異なる動態挙動をもつ、よりぼんやりしたフィーチャをマスクしかねない真のフィーチャ(すなわち、ノイズではない)を除去することができる。
【0040】
追加的に、又は代替的に、破棄すべき1つ以上の主成分は、1つ以上の分散寄与閾値を動的に設定し、例えば対応する固有値に基づいたそのパーセンテージ分散寄与がそれぞれの分散寄与閾値未満である又はそれぞれの分散寄与閾値を超える主成分を破棄することによって、決定することもできる。
【0041】
本発明の様々な実施形態は、さらに、例えばスクリープロット分析を使用して、破棄する1以上のより低次の主成分を決定することができる。
【0042】
スクリープロットは、主成分がx軸上にプロットされ、各主成分についての対応するパーセンテージ分散値がy軸上にプロットされた、図的分析技術である。一般に、スクリープロットは、より高次の主成分から急速に低下し、「ニー(knee)」に到達し、次いで横ばいになる。
【0043】
スクリープロットは、主成分の分散寄与(例えば、主成分のそれぞれの固有値によって定義される)がどこで横ばいになってノイズフロアに達するかを決定するために適用され、ノイズフロアを下回る成分を破棄する。ノイズフロアは、様々な方法で決定することができ、データに依存する。例えば、より低い分散寄与閾値をスクリープロットのニーのすぐ下の値に設定することができ、その閾値を下回る分散値を有するすべての主成分を破棄する。
【0044】
追加的に、又は代替的に、破棄する1つ以上の主成分は、破棄すべき1つ以上の主成分を動的に設定し、フィルタ処理画像の残差(residual)解析によって決定することもできる。すなわち、フィルタ処理画像と原画像との相違は、視覚的に又はコンピュータアルゴリズムによって解析される。残差画像は、破棄されるより低次の主成分を選択する(フィルタ処理のために)、PCAフィルタを使用して、計算することができる。すなわち、画像を作成するために使用される主成分は、残差画像については破棄される。図8は、図6からのフィルタ処理画像の残差画像の一例を示す。
【0045】
原画像は、検出器対間の同時計数に対応するPETスキャンから得られた生データを含むことがある。各検出器対について記録された事象のカウントは、生データであり、それをヒストグラム化してサイノグラムを得ることができる。サイノグラムは、各検出器対についてのカウントの画像と見なすことができ、画像を提供するように変換(例えば、再構築)することができる。したがって、様々な実施形態では、画像を変換又は再構築する前に、生データをフィルタ処理することができる。
【0046】
本発明による方法の様々な実施形態は、複数の主成分を決定する前に画像データセットからバックグラウンドピクセルをフィルタ処理することをさらに含むことができる。
【0047】
これは、画像フレームからの入力を使用して有意な生理学的特性を計算する薬物動態モデリングに特に有用であり、それは、特定の状況下で、これらの特性をピクセルごとに計算するために使用されるアルゴリズムがロバストではなく、むしろノイズを追加して質の悪い画像を作り出すという既存の問題に対処するからである。そのようなモデリングアルゴリズムを使用する前にフィルタ処理段階を実施することによって、本発明の様々な実施形態は、この問題に対処する。
【0048】
例えば、Patlakモデル[非特許文献7]を使用してパラメトリック画像を作り出すことができる。ただし、これは、非常にノイズの多い画像を生成する。それゆえ、この問題に対処するために、本発明の様々な実施形態によるPCAフィルタの適用を使用して、Patlak技術[非特許文献7]を使用した画像を作成する前にノイズを除去し、これにより、大きく改善された画像をもたらす。
【0049】
通常、薬理学的研究では、被検者に何度も放射性物質を注入する必要がある。したがって、同じ被検者に何度もスキャンを実施すること(例えば、異なる条件下で)は、現在、最大許容放射線量の制限によって阻まれている。したがって、本発明の様々な実施形態のノイズフィルタリング技術を用いて(例えば、また、有意性の低い成分だけを除去することによって)、1人の人間に対して実施可能な研究の数を有用に拡大することができる。
【0050】
後者のノイズフィルタリング技術は、また、PETスキャニングが使用されるときに有用である。例えば、そのノイズフィルタリング技術は、残留放射能が崩壊するのを待つ必要なしに(例えば、ほぼ2時間の半減期のフッ素−18の場合、きわめて非実用的となる)、身体の様々な部分に実施されたPETスキャンによって取得された連続画像からの、より良好な定量的及び定性的情報の抽出を可能にすることができる。そのような技術では、従来、注入される放射性物質の量を漸増させる必要があり、したがって、その前に注入された各線量からの残留信号は、その後に注入された線量によって生成されるより大きな信号によってマスクされる。
【0051】
段階204で主成分にPCAフィルタを適用してフィルタ処理データセットを決定したら、方法200の次の段階206は、フィルタ処理データセットを新しい画像データセットNewDataSetに変換する段階である。新しい画像データセットを使用して、臨床的に有意な可能性のある低強度フィーチャが強調され、またさらに可視化改善のために画像ノイズが低減された、フィルタ処理複数の画像フレームを提供することができる。
【0052】
フィルタ処理データセットは、フィーチャベクトルFeatureVectorを使用して計算される。フィーチャベクトルは、選ばれた主成分(固有ベクトル)を含むベクトルの行列であるので、次式の通りとなる。
【0053】
【数3】

式中、αiは、PCAフィルタによってi番目の固有ベクトルに適用されるそれぞれの重み付け係数である。0又は1であるαi値についてデータがどのように処理されるか、以下で説明する。また、他のαi値も使用することができる。
【0054】
原フレーム画像データは、以下の方法で修正される。すなわち、
初めに、画像データを主成分(固有ベクトル)の座標系へと回転させ、次元を選択された成分の数へと切り捨てる。
【0055】
【数4】

式中、FeatureVectorTは、FeatureVectorの転置であり、DataAdjustTは、正規化された原画像データベクトルの転置である。したがって、FinalDataは、PCA画像を表す。
【0056】
2番目に、切り捨てたデータを、以下の操作を使用して変換し、元の次元に戻す。
【0057】
【数5】

3番目に、NewDataSetの正規化を元に戻す。これは、通常、標準偏差を乗じ、平均値を加えることによって行い、例えば、以上で正規化に使用したのと同じ値の標準偏差及び平均値を使用して行う。
【0058】
最後に、NewDataSetを再フォーマットして画像を提供し、原画像セットと同数のフレームを備えたフィルタ処理画像セットをもたらす。この再フォーマットプロセスは、NewDataSet内の1次元データベクトルから2次元画像を再形成することができる。
【0059】
図3は、実験的な17フレーム動的PET脳画像化研究から得られた主成分分析画像300を示しており、それらの11番目から15番目までの原フレームが図5に示されている。
【0060】
この実験では、General Electric Discovery ST PET/CTカメラを使用し、トレーサは、脳障害の研究に提供される実験用トレーサとした。スキャン時間は、初めの数分間で取得されるフレームについては10秒に設定し、90分後に取得されるフレームについて最大15分という徐々に長い取得時間を、フレームに対して使用した。次いで、すべてのフレームをPCAフィルタリング解析で使用した。
【0061】
最上位主成分PC1は、主成分の分散に83%寄与する。2番目に高次の主成分PC2は、主成分の分散に8%寄与する。3番目の主成分PC3は、主成分の分散に4%寄与する。4番目の主成分PC4は、主成分の分散に0.9%寄与する。5番目の主成分PC5は、主成分の分散に0.8%寄与する。6番目の主成分PC6は、主成分の分散に0.6%寄与する。
【0062】
図4は、実験的な17フレーム動的PET脳画像化研究からのフィルタ処理フレーム11〜15を示す。フィルタ処理フレームは、図2の方法を図5に示した原画像フレームに適用することによって得られる。
【0063】
この事例では、PCAフィルタを適用して、主成分PC1、PC2及びPC7〜PC17を完全に除去した(すなわち、α1=α2=α7=...α17=0)。次いで、以上の式(5)にしたがってフィーチャベクトルを作り出し、次いで、式(6a)及び(6b)にしたがってフィーチャベクトルから新しい画像データセットを作り出した。
【0064】
ここに表示した新しい画像データのサブセットは、図4に示したように、フィルタ処理11番目の画像フレーム402、フィルタ処理12番目の画像フレーム404、フィルタ処理13番目の画像フレーム406、フィルタ処理14番目の画像フレーム408、及びフィルタ処理15番目の画像フレーム410を含む。
【0065】
図5は、実験的な17フレーム動的PET脳画像化研究からの原画像フレーム11〜15を示す。図5は、比較しやすいように図4の隣に示されている。
【0066】
図4と図5を比較すると、フィルタ処理画像フレーム12〜15の画像の右上の象限に、臨床的に関心の高いフィーチャをはっきりと視認できることが明らかである。これは、図5を見ると容易には明らかにならないが、組織の動的アーチファクトの結果としての干渉がほとんど又は全くない、非常にはっきりと輪郭が描かれた低強度フィーチャである。本発明者らによるさらなる研究で、この技術の結果として検出された低強度フィーチャが、X線コンピュータ断層撮影など、代替的な技術を使用して見出された結果とよく一致することが確認された。
【0067】
図6は、本発明の一実施形態によるGUIによって提供される第1のスクリーンショット600を示す。スクリーンショット600は、例えば、図1に概略的に示したGUI123の操作から得ることができる。
【0068】
スクリーンショット600は、本発明の様々な態様による方法を適用することによって得られた、フィルタ処理画像フレーム610を示す。スクリーンショット600は、また、ユーザが操作可能な第1のスライダ604及び第2のスライダ606を含む、PCAフィルタ制御セクション602を示す。
【0069】
第1のスライダ604は、フィルタ処理データセットを作り出すときに、より高次のどの主成分を破棄するかを決定する、第1の分散寄与閾値を設定するために使用することができる。ここに示した事例では、分散寄与閾値は、「3」に設定されており、それによって、フィルタ処理データセットを作り出すときに1番目の主成分及び2番目の主成分(PC1及びPC2)が破棄されるようにしている。
【0070】
第2のスライダ606は、フィルタ処理データセットを作り出すときに、より低次のどの主成分を破棄するかを決定する、第2の分散寄与閾値を設定するために使用することができる。ここに示した事例では、分散寄与閾値は、「5」に設定されており、フィルタ処理データセットを作り出すために3番目〜5番目の主成分(PC3〜PC5)が選択され、より低次の他のすべての成分(この事例ではPC6〜PC17)が破棄されるようにしている。
【0071】
フィルタ処理画像フレーム610は、本発明を適用することによって低強度フィーチャが強調された画像を示す。
【0072】
図7は、図6と同一の、ただし異なる操作パラメータが設定されたGUIの操作から得られた、他のスクリーンショット700を示す。
【0073】
スクリーンショット700は、原画像フレームのシーケンスから決定されたすべての主成分を使用して得られた、フィルタ処理されていない画像フレーム710を示す。
【0074】
スクリーンショット700は、また、ユーザが操作可能な第1のスライダ604及び第2のスライダ606を含む、PCAフィルタ制御セクション602を示す。ただし、この事例では、第1のスライダ604は、「1」に設定されており、したがって、変換するためのデータセットを作り出すときに、より高次の主成分が破棄されないようにしている。さらに、第2のスライダ606は、「17」に設定されており、それによって、データセットを作り出すときにすべての主成分(PC1〜PC17)が選択されるようにしている。
【0075】
図6の画像フレーム610と図7の画像フレーム710とを比較すると、やはり、本発明の様々な態様を適用することによって臨床的に関心の高いフィーチャがよりはっきりと視認可能になることが明らかである。
【0076】
したがって、本発明者らの調査から、本発明の様々な態様及び実施形態によって提供される本明細書に記載の画像解析技術が、従来の画像解析技術を上回る有用な改善をもたらすことが明らかと考えられている。
【0077】
図8は、異なる操作パラメータが設定された図6と同一のGUIを使用して得られた、残差画像810のスクリーンショット800を示す。残差画像810は、破棄される(フィルタ処理のため)より低次の主成分を選択することによって、前述のPCAフィルタを使用して計算される。
【0078】
本発明について様々な態様及び好ましい実施形態にしたがって記載したが、本発明の範囲がそれらだけに限定されるものとは見なされず、それらのすべての変形形態及び均等物がやはり特許請求の範囲内に入るものと本出願人らが意図していることを、理解すべきである。
【0079】
本明細書で引用した文献の開示内容は援用によって本明細書の内容の一部をなす。
【特許請求の範囲】
【請求項1】
原画像フレーム(502、504、506、508、510)のシーケンスに対応するデータを含む画像データセットから低強度フィーチャを抽出する方法(200)であって、
前記原画像フレームに対応する前記画像データセットから複数の主成分(PC1、PC2、PC3、PC4、PC5、PC6)を決定し(202)、
前記複数の主成分(PC1、PC2、PC3、PC4、PC5、PC6)に主成分分析(PCA)フィルタを適用して、前記複数の主成分(PC1、PC2、PC3、PC4、PC5、PC6)から1つ以上の主成分(PC)を破棄することによって、フィルタ処理データセットを決定し(204)、
前記フィルタ処理データセットを変換して、低強度フィーチャが強調されたフィルタ処理複数の画像フレーム(402、404、406、408、410)を作り出す(206)
ことを含んでなる方法(200)。
【請求項2】
破棄する1つ以上の前記主成分(PC1、PC2、PC3、PC4、PC5、PC6)が、より高次の主成分(PC1)である、請求項1記載の方法(200)。
【請求項3】
破棄する前記より高次の1つ以上の主成分(PC1)が、最上位主成分を除去することによって、且つ/又は、第1の分散寄与閾値を動的に設定し、全主成分分散に対するそのパーセンテージ分散寄与が前記第1の分散寄与閾値未満である主成分を破棄することによって決定される、請求項2記載の方法(200)。
【請求項4】
破棄する1つ以上の前記主成分(PC1、PC2、PC3、PC4、PC5、PC6)が、より低次の主成分(PC6)である、請求項1乃至請求項3のいずれか1項記載の方法(200)。
【請求項5】
破棄する前記より低次の1つ以上の主成分(PC6)が、第2の分散寄与閾値を動的に設定し、全主成分分散に対するそのパーセンテージ分散寄与が前記第2の分散寄与閾値未満である主成分を破棄することによって、且つ/又は、スクリープロットを適用して、主成分の分散寄与がどこで横ばいになってノイズフロアに達するかを決定し、ノイズフロアを下回る成分を破棄することによって決定される、請求項4記載の方法(200)。
【請求項6】
破棄する1つ以上の前記主成分(PC1、PC2、PC3、PC4、PC5、PC6)が、破棄すべき1つ以上の主成分を動的に設定することによって決定され、且つ/又は、フィルタ処理1つ以上の画像フレーム(402、404、406、408、410)の1つ以上の残差を解析することによって決定される、請求項1乃至請求項5のいずれか1項記載の方法(200)。
【請求項7】
前記画像データセットから前記複数の主成分(PC1、PC2、PC3、PC4、PC5、PC6)を決定する(202)前に、前記画像データセットからバックグラウンドピクセルをフィルタ処理することをさらに含む、請求項1乃至請求項6のいずれか1項記載の方法(200)。
【請求項8】
前記画像データが、陽電子放射断層撮影(PET)スキャンから得られたデータを含む、請求項1乃至請求項7のいずれか1項記載の方法(200)。
【請求項9】
前記原画像フレーム(502、504、506、508、510)が、前記生データセットから前記複数の主成分(PC1、PC2、PC3、PC4、PC5、PC6)を決定する(202)前にフィルタ処理された生データを含んでおり、前記フィルタ処理生データが、次いで、フィルタ処理画像データセットを提供するように再構築される、請求項1乃至請求項8のいずれか1項記載の方法(200)。
【請求項10】
請求項1乃至請求項9のいずれか1項記載の前記方法(200)の前記段階(202、204、206)のうちの1つ以上を実装するようにデータ処理装置(120)を構成するコンピュータコードを含んでなる、コンピュータプログラム製品(144)。
【請求項11】
ユーザにグラフィカルユーザインターフェース(123)(GUI)を提供するようにさらに動作可能である、請求項10記載のコンピュータプログラム製品(144)。
【請求項12】
前記GUI(123)が、第1の分散寄与閾値及び第2の分散寄与閾値のうちの1つ以上を設定するように動作可能なフィルタ制御セクション(602)を含む、請求項11記載のコンピュータプログラム製品(144)。
【請求項13】
前記フィルタ制御セクション(602)が、それぞれの分散寄与閾値を設定するようにそれぞれ動作可能な1つ以上のスライダ(604、606)を含む、請求項12記載のコンピュータプログラム製品(144)。
【請求項14】
原画像フレーム(502、504、506、508、510)のシーケンスに対応するデータを含む画像データセットから低強度フィーチャを表示するシステム(100)であって、
前記原画像フレーム(502、504、506、508、510)のシーケンスを取得するように動作可能な画像取得モジュール(122)と、
a)前記原画像フレーム(502、504、506、508、510)に対応する前記画像データセットから複数の主成分(PC1、PC2、PC3、PC4、PC5、PC6)を決定し、b)前記複数の主成分(PC1、PC2、PC3、PC4、PC5、PC6)に主成分分析(PCA)フィルタを適用して、前記複数の主成分(PC1、PC2、PC3、PC4、PC5、PC6)から1つ以上の主成分を破棄することによって、フィルタ処理データセットを決定し、c)前記フィルタ処理データセットを変換して、低強度フィーチャが強調されたフィルタ処理複数の画像フレーム(402、404、406、408、410)を作り出すように動作可能な、画像解析装置(124)と、
前記フィルタ処理画像フレーム(402、404、406、408、410)を表示するように動作可能なディスプレイ(130)と
を備えてなるシステム(100)。
【請求項15】
1つ以上の前記主成分(PC1、PC2、PC3、PC4、PC5、PC6)が、より高次の主成分(PC1)である、請求項14記載のシステム(100)。
【請求項16】
前記画像解析装置(124)が、最上位主成分を除去することによって、且つ/又は、第1の分散寄与閾値を動的に設定し、全主成分分散に対するそのパーセンテージ分散寄与が前記第1の分散寄与閾値未満である主成分を破棄することによって、破棄する、より高次の1つ以上の主成分(PC1)を決定するように構成される、請求項15記載のシステム(100)。
【請求項17】
1つ以上の前記主成分(PC1、PC2、PC3、PC4、PC5、PC6)が、より低次の主成分(PC6)である、請求項14乃至請求項16のいずれか1項記載のシステム(100)。
【請求項18】
前記画像解析装置(124)が、第2の分散寄与閾値を動的に設定し、全主成分分散に対するそのパーセンテージ分散寄与が前記第2の分散寄与閾値未満である主成分を破棄することによって、且つ/又は、スクリープロットを適用して、主成分の分散寄与がどこで横ばいになってノイズフロアに達するかを決定し、ノイズフロアを下回る成分を破棄することによって、破棄する、より低次の1つ以上の主成分(PC6)を決定するように構成される、請求項17記載のシステム(100)。
【請求項19】
前記画像解析装置(124)が、破棄すべき1つ以上の主成分を動的に設定することによって、破棄する1つ以上の前記主成分(PC1、PC2、PC3、PC4、PC5、PC6)を決定するようにさらに構成され、且つ/又は、前記フィルタ処理1つ以上の画像フレーム(402、404、406、408、410)の1つ以上の残差を解析することによって、破棄する1つ以上の前記主成分(PC1、PC2、PC3、PC4、PC5、PC6)を決定するようにさらに構成される、請求項14乃至請求項18のいずれか1項記載のシステム(100)。
【請求項20】
前記画像解析装置(124)が、前記画像データセットから前記複数の主成分(PC1、PC2、PC3、PC4、PC5、PC6)を決定する前に、前記画像データセットからバックグラウンドピクセルをフィルタ処理するようにさらに構成される、請求項14乃至請求項19のいずれか1項記載のシステム(100)。
【請求項21】
前記画像解析装置(124)が、前記生データセットから前記複数の主成分(PC1、PC2、PC3、PC4、PC5、PC6)を決定する(202)前に前記原画像フレーム(502、504、506、508、510)の生データをフィルタ処理し、前記フィルタ処理生データからフィルタ処理画像データセットを再構築するようにさらに構成される、請求項14乃至請求項20のいずれか1項記載のシステム(100)。
【請求項22】
前記画像取得モジュール(122)に動作可能に結合されたPETスキャナ(140)をさらに含む、請求項14乃至請求項21のいずれか1項記載のシステム(100)。
【請求項1】
原画像フレーム(502、504、506、508、510)のシーケンスに対応するデータを含む画像データセットから低強度フィーチャを抽出する方法(200)であって、
前記原画像フレームに対応する前記画像データセットから複数の主成分(PC1、PC2、PC3、PC4、PC5、PC6)を決定し(202)、
前記複数の主成分(PC1、PC2、PC3、PC4、PC5、PC6)に主成分分析(PCA)フィルタを適用して、前記複数の主成分(PC1、PC2、PC3、PC4、PC5、PC6)から1つ以上の主成分(PC)を破棄することによって、フィルタ処理データセットを決定し(204)、
前記フィルタ処理データセットを変換して、低強度フィーチャが強調されたフィルタ処理複数の画像フレーム(402、404、406、408、410)を作り出す(206)
ことを含んでなる方法(200)。
【請求項2】
破棄する1つ以上の前記主成分(PC1、PC2、PC3、PC4、PC5、PC6)が、より高次の主成分(PC1)である、請求項1記載の方法(200)。
【請求項3】
破棄する前記より高次の1つ以上の主成分(PC1)が、最上位主成分を除去することによって、且つ/又は、第1の分散寄与閾値を動的に設定し、全主成分分散に対するそのパーセンテージ分散寄与が前記第1の分散寄与閾値未満である主成分を破棄することによって決定される、請求項2記載の方法(200)。
【請求項4】
破棄する1つ以上の前記主成分(PC1、PC2、PC3、PC4、PC5、PC6)が、より低次の主成分(PC6)である、請求項1乃至請求項3のいずれか1項記載の方法(200)。
【請求項5】
破棄する前記より低次の1つ以上の主成分(PC6)が、第2の分散寄与閾値を動的に設定し、全主成分分散に対するそのパーセンテージ分散寄与が前記第2の分散寄与閾値未満である主成分を破棄することによって、且つ/又は、スクリープロットを適用して、主成分の分散寄与がどこで横ばいになってノイズフロアに達するかを決定し、ノイズフロアを下回る成分を破棄することによって決定される、請求項4記載の方法(200)。
【請求項6】
破棄する1つ以上の前記主成分(PC1、PC2、PC3、PC4、PC5、PC6)が、破棄すべき1つ以上の主成分を動的に設定することによって決定され、且つ/又は、フィルタ処理1つ以上の画像フレーム(402、404、406、408、410)の1つ以上の残差を解析することによって決定される、請求項1乃至請求項5のいずれか1項記載の方法(200)。
【請求項7】
前記画像データセットから前記複数の主成分(PC1、PC2、PC3、PC4、PC5、PC6)を決定する(202)前に、前記画像データセットからバックグラウンドピクセルをフィルタ処理することをさらに含む、請求項1乃至請求項6のいずれか1項記載の方法(200)。
【請求項8】
前記画像データが、陽電子放射断層撮影(PET)スキャンから得られたデータを含む、請求項1乃至請求項7のいずれか1項記載の方法(200)。
【請求項9】
前記原画像フレーム(502、504、506、508、510)が、前記生データセットから前記複数の主成分(PC1、PC2、PC3、PC4、PC5、PC6)を決定する(202)前にフィルタ処理された生データを含んでおり、前記フィルタ処理生データが、次いで、フィルタ処理画像データセットを提供するように再構築される、請求項1乃至請求項8のいずれか1項記載の方法(200)。
【請求項10】
請求項1乃至請求項9のいずれか1項記載の前記方法(200)の前記段階(202、204、206)のうちの1つ以上を実装するようにデータ処理装置(120)を構成するコンピュータコードを含んでなる、コンピュータプログラム製品(144)。
【請求項11】
ユーザにグラフィカルユーザインターフェース(123)(GUI)を提供するようにさらに動作可能である、請求項10記載のコンピュータプログラム製品(144)。
【請求項12】
前記GUI(123)が、第1の分散寄与閾値及び第2の分散寄与閾値のうちの1つ以上を設定するように動作可能なフィルタ制御セクション(602)を含む、請求項11記載のコンピュータプログラム製品(144)。
【請求項13】
前記フィルタ制御セクション(602)が、それぞれの分散寄与閾値を設定するようにそれぞれ動作可能な1つ以上のスライダ(604、606)を含む、請求項12記載のコンピュータプログラム製品(144)。
【請求項14】
原画像フレーム(502、504、506、508、510)のシーケンスに対応するデータを含む画像データセットから低強度フィーチャを表示するシステム(100)であって、
前記原画像フレーム(502、504、506、508、510)のシーケンスを取得するように動作可能な画像取得モジュール(122)と、
a)前記原画像フレーム(502、504、506、508、510)に対応する前記画像データセットから複数の主成分(PC1、PC2、PC3、PC4、PC5、PC6)を決定し、b)前記複数の主成分(PC1、PC2、PC3、PC4、PC5、PC6)に主成分分析(PCA)フィルタを適用して、前記複数の主成分(PC1、PC2、PC3、PC4、PC5、PC6)から1つ以上の主成分を破棄することによって、フィルタ処理データセットを決定し、c)前記フィルタ処理データセットを変換して、低強度フィーチャが強調されたフィルタ処理複数の画像フレーム(402、404、406、408、410)を作り出すように動作可能な、画像解析装置(124)と、
前記フィルタ処理画像フレーム(402、404、406、408、410)を表示するように動作可能なディスプレイ(130)と
を備えてなるシステム(100)。
【請求項15】
1つ以上の前記主成分(PC1、PC2、PC3、PC4、PC5、PC6)が、より高次の主成分(PC1)である、請求項14記載のシステム(100)。
【請求項16】
前記画像解析装置(124)が、最上位主成分を除去することによって、且つ/又は、第1の分散寄与閾値を動的に設定し、全主成分分散に対するそのパーセンテージ分散寄与が前記第1の分散寄与閾値未満である主成分を破棄することによって、破棄する、より高次の1つ以上の主成分(PC1)を決定するように構成される、請求項15記載のシステム(100)。
【請求項17】
1つ以上の前記主成分(PC1、PC2、PC3、PC4、PC5、PC6)が、より低次の主成分(PC6)である、請求項14乃至請求項16のいずれか1項記載のシステム(100)。
【請求項18】
前記画像解析装置(124)が、第2の分散寄与閾値を動的に設定し、全主成分分散に対するそのパーセンテージ分散寄与が前記第2の分散寄与閾値未満である主成分を破棄することによって、且つ/又は、スクリープロットを適用して、主成分の分散寄与がどこで横ばいになってノイズフロアに達するかを決定し、ノイズフロアを下回る成分を破棄することによって、破棄する、より低次の1つ以上の主成分(PC6)を決定するように構成される、請求項17記載のシステム(100)。
【請求項19】
前記画像解析装置(124)が、破棄すべき1つ以上の主成分を動的に設定することによって、破棄する1つ以上の前記主成分(PC1、PC2、PC3、PC4、PC5、PC6)を決定するようにさらに構成され、且つ/又は、前記フィルタ処理1つ以上の画像フレーム(402、404、406、408、410)の1つ以上の残差を解析することによって、破棄する1つ以上の前記主成分(PC1、PC2、PC3、PC4、PC5、PC6)を決定するようにさらに構成される、請求項14乃至請求項18のいずれか1項記載のシステム(100)。
【請求項20】
前記画像解析装置(124)が、前記画像データセットから前記複数の主成分(PC1、PC2、PC3、PC4、PC5、PC6)を決定する前に、前記画像データセットからバックグラウンドピクセルをフィルタ処理するようにさらに構成される、請求項14乃至請求項19のいずれか1項記載のシステム(100)。
【請求項21】
前記画像解析装置(124)が、前記生データセットから前記複数の主成分(PC1、PC2、PC3、PC4、PC5、PC6)を決定する(202)前に前記原画像フレーム(502、504、506、508、510)の生データをフィルタ処理し、前記フィルタ処理生データからフィルタ処理画像データセットを再構築するようにさらに構成される、請求項14乃至請求項20のいずれか1項記載のシステム(100)。
【請求項22】
前記画像取得モジュール(122)に動作可能に結合されたPETスキャナ(140)をさらに含む、請求項14乃至請求項21のいずれか1項記載のシステム(100)。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公表番号】特表2011−509697(P2011−509697A)
【公表日】平成23年3月31日(2011.3.31)
【国際特許分類】
【出願番号】特願2010−537020(P2010−537020)
【出願日】平成20年12月3日(2008.12.3)
【国際出願番号】PCT/US2008/085295
【国際公開番号】WO2009/073672
【国際公開日】平成21年6月11日(2009.6.11)
【出願人】(305040710)ジーイー・ヘルスケア・リミテッド (99)
【Fターム(参考)】
【公表日】平成23年3月31日(2011.3.31)
【国際特許分類】
【出願日】平成20年12月3日(2008.12.3)
【国際出願番号】PCT/US2008/085295
【国際公開番号】WO2009/073672
【国際公開日】平成21年6月11日(2009.6.11)
【出願人】(305040710)ジーイー・ヘルスケア・リミテッド (99)
【Fターム(参考)】
[ Back to top ]

