異常な細胞増殖を治療する方法
【課題】ROS遺伝子に関係する融合および欠失においてROSキナーゼ活性の活性を緩和するように機能し得るROSの阻害薬を発見すること。
【解決手段】本発明は、哺乳動物において異常な細胞増殖を治療するためのROSキナーゼ阻害薬の使用に関する。詳細には、本発明は、少なくとも1つの遺伝子変化ROSによって媒介されるがんを患っている哺乳動物を治療する方法を提供する。詳細には、本発明は、クリゾチニブの投与によって、少なくとも1つの遺伝子変化ROSによって媒介されるがんを患っている哺乳動物を治療する方法を提供する。
【解決手段】本発明は、哺乳動物において異常な細胞増殖を治療するためのROSキナーゼ阻害薬の使用に関する。詳細には、本発明は、少なくとも1つの遺伝子変化ROSによって媒介されるがんを患っている哺乳動物を治療する方法を提供する。詳細には、本発明は、クリゾチニブの投与によって、少なくとも1つの遺伝子変化ROSによって媒介されるがんを患っている哺乳動物を治療する方法を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本出願は、その内容全体が参照によって本明細書に組み込まれる2011年8月2日出願の米国特許仮出願第61/514,386号の利益を主張する。
【0002】
本発明は、哺乳動物において異常な細胞増殖を治療するためのROS阻害薬の使用に関する。詳細には、本発明は、がんを患っている哺乳動物を治療する方法を提供する。
【背景技術】
【0003】
ヒトのがんには、世界中の先進国において総じて主な死亡原因の一つである多様な数々の疾患が含まれる(American Cancer Society、Cancer Facts and Figures 2005.Atlanta:American Cancer Society;2005)。がんの進行は、遺伝子突然変異、染色体転座および核型異常を包含する複雑な一連の多数の遺伝子的および分子的事象に起因する(Hanahanら、Cell 100:57〜70(2000))。ベースにあるがんの遺伝子的原因は、多様であり複雑であるが、それぞれのがん型が、その進行を容易にする共通の特色および獲得能力を示すことが観察されている。これらの獲得能力には、細胞増殖の調節異常、血管補充が持続的に可能なこと(即ち、血管形成)および腫瘍細胞が局所的に広がり、さらに二次的臓器部位へ転移することが可能なことが包含される(Hanahanら、Cell(2000))。したがって、1)がんの進行の間に変化する分子標的を阻害するか、または2)様々な腫瘍においてがんの進行に共通する多数のプロセスを標的とする新規な治療薬を同定することは、未だ可能でなく、非常に必要とされている。
【0004】
v−ros UR2肉腫ウイルス発癌遺伝子相同体1(ROS−1またはROS)は、インスリン受容体サブファミリーに属し、細胞増殖および分化プロセスに関与している癌原遺伝子受容体チロシンキナーゼである(Nagarajanら、Proc Natl Acad Sci 83:6568〜6572(1986))。ROSはヒトにおいては、様々な種々の組織の上皮細胞において発現される。ROS発現および/または活性化の欠失が、神経膠芽細胞腫、さらに中枢神経系の腫瘍において見出されている(Charestら、Genes Chromos.Can.37(1):58〜71(2003))。神経膠芽細胞腫(Charestら(2003);Birchmeierら、Proc Natl Acad Sci 84:9270〜9274(1987))およびNSCLC(Rimkunasら、Clin Cancer Res epub、Jun 1.(2012))におけるFIG−ROS欠失転座、NSCLCにおけるSLC34A2−ROS転座(Rikovaら、Cell 131:1190〜1203(2007))、NSCLC(Rikovaら、(2007))および胆管癌(Guら、PLoS ONE 6(1):e15640(2011))におけるCD74−ROS転座ならびにマウスにおいて腫瘍成長を促進することが知られているROSの切断された活性型(Birchmeierら、Mol.Cell.Bio.6(9):3109〜3115(1986))を包含する、ROSキナーゼの異常な融合タンパク質をもたらすROSに関係する遺伝子変化が記載されている。TPM3−ROS1、SDC4−ROS1、EZR−ROS1およびLRIG3−ROS1を包含する追加的な融合が、肺がん患者の腫瘍試料において報告されている(Takeuchiら、Nature Medicine(2012))。
【0005】
ナトリウム依存性ホスフェートトランスポーターアイソフォームNaPi−3bタンパク質(SLC34A2)は、690アミノ酸ホスフェートトランスポータータンパク質であり、これは、ヒトの肺および小腸で発現され、ナトリウム依存性活性を有する。SLC34A2発現および/または活性の欠失は、卵巣がんにおいて見出されている(Rangelら、Oncogene22(46):7225〜7232(2003))。CD74は、MIF免疫サイトカインに対して高い親和性を有するMHCクラスIIシャペロンタンパク質として機能する内在性膜タンパク質である(Lengら、J.Exp.Med.197:1467〜1476(2003))。FIG(Fused in Glioblastoma)は、PSD−95、Disc Large、ZO−1(PDZ)ドメイン、2つのコイルドコイル領域およびロイシンジッパーを包含する454アミノ酸タンパク質をコードする遺伝子である。FIGは、その第2のコイルドコイルドメインを介してSNAREタンパク質と相互作用することによって、ゴルジ体と末梢で関連していることが判明しており、したがって、Golgi媒介小胞輸送において役割を果たしていると仮定されている(Charestら、(2003))。
【0006】
SLC34A2−ROS転座は、染色体(4p15)と染色体(6q22)との間で生じ、ナトリウム依存性ホスフェートトランスポーターアイソフォームNaPi−3bタンパク質(SLC34A2)のN末端と、癌原遺伝子チロシンタンパク質キナーゼROS前駆体(ROS)キナーゼの膜貫通およびキナーゼドメインとを組み合わせる2つの融合タンパク質変異体をもたらす(WO2007/084631)。現在までに、それぞれ724アミノ酸(SLC34A2−ROS(L);ロング型変異体)および621アミノ酸(SLC34A2−ROS(S);ショート型変異体)であるSLC34A2−ROS融合タンパク質の2つの変異体が同定されている(WO2007/084631)。SLC34A2−ROS転座はまた、ROS遺伝子とSLC34A2遺伝子との融合として記載することもでき、これは続いて、SLC34A2−ROS融合遺伝子によってコードされるタンパク質配列によって特徴付けられる異常なSLC34A2−ROS融合タンパク質をもたらす。
【0007】
CD74−ROS転座は、染色体(5q32)と染色体(6q22)との間で生じ、CD74のN末端と、癌原遺伝子チロシンタンパク質キナーゼROS前駆体(ROS)キナーゼの膜貫通およびキナーゼドメインとを組み合わせる融合タンパク質をもたらす。その結果生じたCD74−ROS融合タンパク質は、703アミノ酸タンパク質である(WO2009/051846)。CD74−ROS転座はまた、ROS遺伝子およびCD74遺伝子の融合として記載することもでき、これは続いて、CD74−ROS融合遺伝子によってコードされるタンパク質配列によって特徴付けられる異常なCD74−ROS融合タンパク質をもたらす。
【0008】
FIG−ROS欠失転座は、染色体(6q21)での240キロベースの染色体内ホモ接合性欠失によって生じ、構成的活性化チロシンキナーゼをもたらす(Charestら、(2003))。それぞれ878アミノ酸(FIG−ROS(L);ロング型変異体)および630アミノ酸(FIG−ROS(S);ショート型変異体)であるFIG−ROS融合タンパク質の変異体が報告されている(Guら、(2011);米国特許出願公開第2011/0287445号)。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】米国特許仮出願第61/514,386号
【特許文献2】WO2007/084631
【特許文献3】WO2009/051846
【特許文献4】米国特許出願公開第2011/0287445号
【特許文献5】米国特許第4,727,022号
【特許文献6】米国特許第4,659,678号
【特許文献7】米国特許第4,376,110号
【特許文献8】米国特許出願公開第2010/0221737号
【特許文献9】米国特許第7,468,252号
【特許文献10】米国特許第7230098号
【特許文献11】米国特許第7,858,643号
【特許文献12】WO2006/021881
【特許文献13】国際特許公開WO2006/021884
【特許文献14】米国特許出願公開第2006/0046991号
【特許文献15】米国特許出願公開第2006/0128724号
【特許文献16】米国特許第6,106,864号
【特許文献17】WO00/35298
【特許文献18】PCT公開WO91/11172
【特許文献19】PCT公開WO94/02518
【特許文献20】PCT公開WO98/55148
【非特許文献】
【0010】
【非特許文献1】American Cancer Society、Cancer Facts and Figures 2005.Atlanta:American Cancer Society;2005
【非特許文献2】Hanahanら、Cell 100:57〜70(2000)
【非特許文献3】Nagarajanら、Proc Natl Acad Sci 83:6568〜6572(1986)
【非特許文献4】Charestら、Genes Chromos.Can.37(1):58〜71(2003)
【非特許文献5】Birchmeierら、Proc Natl Acad Sci 84:9270〜9274(1987)
【非特許文献6】Rimkunasら、Clin Cancer Res epub、Jun 1.(2012)
【非特許文献7】Rikovaら、Cell 131:1190〜1203(2007)
【非特許文献8】Guら、PLoS ONE 6(1):e15640(2011)
【非特許文献9】Birchmeierら、Mol.Cell.Bio. 6(9):3109〜3115(1986)
【非特許文献10】Takeuchiら、Nature Medicine(2012)
【非特許文献11】Rangelら、Oncogene22(46):7225〜7232(2003)
【非特許文献12】Lengら、J.Exp.Med.197:1467〜1476(2003)
【非特許文献13】StahlおよびWermuthによる「Handbook of Pharmaceutical Salts:Properties,Selection,and Use」(Wiley−VCH、Weinheim、Germany、2002)
【非特許文献14】HaleblianによるJ Pharm Sci、64(8)、1269〜1288(1975年8月)
【非特許文献15】K.Barovsky、Nanotech. Law & Bus.1(2):Article 14(2004)
【非特許文献16】E.Maggio、Enzyme−Immunoassay(1980)(CRC Press,Inc.、Boca Raton、Fla.)
【非特許文献17】Chowら、Cytometry(Communications in Clinical Cytometry)46:72〜78(2001)
【非特許文献18】ANTIBODIES:A LABORATORY MANUAL、Chapter 10、Harlow & Lane Eds.、Cold Spring Harbor Laboratory(1988)
【非特許文献19】J.M.PolakおよびS.Van Noorden(1997) INTRODUCTION TO IMMUNOCYTOCHEMISTRY、第2版;ROYAL MICROSCOPY SOCIETY MICROSCOPY HANDBOOK 37、BioScientific/Springer−Verlag
【非特許文献20】MOLECULAR CLONING、A LABORATORY MANUAL、第2版、Sambrook,J.、Fritsch,E.F.およびManiatis,T.編、Cold Spring Harbor Laboratory Press、Cold Spring Harbor、N.Y.(1989)
【非特許文献21】Melbyら、J.Immunol.Methods、159:235〜244(1993)
【非特許文献22】Duplaaら、Anal.Biochem.229〜236(1993)
【非特許文献23】Price,C.M.、Blood Rev.7:127〜134(1993)
【非特許文献24】Trask,B.J.、Trends Genet.7:149〜154(1991)
【非特許文献25】Vermaら、HUMAN CHROMOSOMES:A MANUAL OF BASIC TECHNIQUES、Pergamon Press、New York、N.Y.(1988)
【非特許文献26】1994 Genome Issue of Science(265:1981〜)
【非特許文献27】McDermott,U.ら、Proc.Natl.Acad.Sci.104、19936〜19941(2007)
【非特許文献28】LiangおよびChenによるExpert Opinion in Therapeutic Patents、11(6)、981〜986(2001)
【非特許文献29】H.LiebermanおよびL.Lachmanによる「Pharmaceutical Dosage Forms:Tablets」、Vol.1、Marcel Dekker、N.Y、N.Y、1980(ISBN 0−8247−6918−X)
【非特許文献30】Vermaらによる「Pharmaceutical Technology On−line」、25(2)、1〜14(2001)
【非特許文献31】FinninおよびMorganによるJ.Pharm.Sci、88(10)、955〜958(1999年10月)
【発明の概要】
【発明が解決しようとする課題】
【0011】
ROS遺伝子に関係する融合および欠失は、ヒトがんの病因に関与しているので、そのような融合および欠失においてROSキナーゼ活性の活性を緩和するように機能し得るROSの阻害薬を発見することが、がんの治療において未だ達成されておらず非常に必要とされている。
【課題を解決するための手段】
【0012】
一態様では、本発明は、そのような治療を必要とするヒトにおいて、少なくとも1つの遺伝子変化ROSによって媒介されるがんを治療する方法を提供し、この方法は、前記ヒトに、治療的有効量の式1のROSキナーゼ阻害薬または薬学的に許容できるその塩を投与するステップを含む:
【0013】
【化1】

式1の化合物は本明細書において、その一般名であるクリゾチニブによって、またはその化学名である3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンによって様々に称され得る。
【0014】
本発明のこの態様の一実施形態では、少なくとも1つの遺伝子変化ROSは、ROSの融合遺伝子である。この態様の他の実施形態では、ROSの融合遺伝子は、SLC34A2−ROS遺伝子またはCD74−ROS遺伝子である。この態様の他の実施形態では、少なくとも1つの遺伝子変化ROSは、ROSキナーゼに関係する遺伝子欠失である。この態様の他の実施形態では、遺伝子欠失は、FIG−ROS遺伝子である。この態様の他の実施形態では、少なくとも1つの遺伝子変化ROSは、遺伝子変化ROSキナーゼである。この態様の他の実施形態では、遺伝子変化ROSキナーゼは、ROS融合である。この態様の他の実施形態では、ROS融合は、SLC34A2−ROSキナーゼまたはCD74−ROSキナーゼである。この態様の他の実施形態では、少なくとも1つの遺伝子変化ROSは、ROSキナーゼに関係する欠失タンパク質である。この態様の他の実施形態では、欠失タンパク質は、FIG−ROSキナーゼである。
【0015】
この態様の他の実施形態では、がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。この態様の他の実施形態では、がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。この態様の他の実施形態では、がんは非小細胞肺がん(NSCLC)である。この態様の他の実施形態では、がんは神経膠芽細胞腫である。この態様の他の実施形態では、式1の化合物を、式1の化合物と少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。この態様の他の実施形態では、式1の化合物または薬学的に許容できるその塩を、式1の化合物または薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0016】
他の態様では、本発明は、ROSキナーゼによって媒介される異常な細胞増殖を有する哺乳動物に、治療的有効量のROSキナーゼ阻害薬を投与するステップを含む方法を提供する。本発明のこの態様の一実施形態では、異常な細胞増殖は、少なくとも1つの遺伝子変化ROSキナーゼによって媒介される。他の実施形態では、異常な細胞増殖は、ROSキナーゼの融合遺伝子によって媒介される。他の実施形態では、異常な細胞増殖は、ROSキナーゼに関係する遺伝子欠失によって媒介される。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、異常な細胞増殖は、ROSキナーゼの融合タンパク質によって媒介される。他の実施形態では、異常な細胞増殖は、ROSキナーゼに関係する欠失タンパク質によって媒介される。他の実施形態では、融合タンパク質は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、欠失タンパク質はFIG−ROSである。この態様のうちの一部のそのような実施形態では、方法は、ROSキナーゼによって媒介される異常な細胞増殖を有する前記哺乳動物に、治療的有効量のROSキナーゼ阻害薬を投与し、それによって、前記の異常な細胞増殖を治療するステップを含む。
【0017】
この態様の他の実施形態では、ROSキナーゼ阻害薬は、ROSキナーゼの低分子阻害薬である。他の実施形態では、ROSキナーゼ阻害薬は、アミノ−ピリジン化合物またはアミノ−ピラジン化合物である。
【0018】
本発明の前述の各態様の他の実施形態では、ROSキナーゼ阻害薬は、式1の化合物または薬学的に許容できるその塩である:
【0019】
【化2】

【0020】
本発明のこの態様の他の実施形態では、異常な細胞増殖はがんである。本発明の前述の各態様の他の実施形態では、がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。
【0021】
本発明のこの態様のさらに他の実施形態では、がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。本発明の前述の各態様のさらに他の実施形態では、がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、がんは神経膠芽細胞腫である。
【0022】
本発明のこの態様のさらに他の実施形態では、化合物または薬学的に許容できるその塩を、式1の化合物と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。この態様の他の実施形態では、式1の化合物または薬学的に許容できるその塩を、式1の化合物または薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0023】
他の態様では、本発明は、ROSキナーゼによって媒介されるがんを有する哺乳動物に、治療的有効量のROSキナーゼ阻害薬を投与するステップを含む方法を提供する。本発明のこの態様の一実施形態では、がんは、少なくとも1つの遺伝子変化ROSキナーゼによって媒介される。他の実施形態では、がんは、ROSキナーゼの融合遺伝子によって媒介される。他の実施形態では、異常な細胞増殖は、ROSキナーゼに関係する遺伝子欠失によって媒介される。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、異常な細胞増殖は、ROSキナーゼの融合タンパク質によって媒介される。他の実施形態では、異常な細胞増殖は、ROSキナーゼに関係する欠失タンパク質によって媒介される。他の実施形態では、融合タンパク質は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、欠失タンパク質はFIG−ROSである。この態様のうちの一部のそのような実施形態では、方法は、ROSキナーゼによって媒介されるがんを有する前記哺乳動物に、治療的有効量のROSキナーゼ阻害薬を投与し、それによって、前記がんを治療するステップを含む。
【0024】
この態様の他の実施形態では、ROSキナーゼ阻害薬は、ROSキナーゼの低分子阻害薬である。他の実施形態では、ROSキナーゼ阻害薬は、アミノ−ピリジン化合物またはアミノ−ピラジン化合物である。本発明の前述の各態様の他の実施形態では、ROSキナーゼ阻害薬は、式1の化合物または薬学的に許容できるその塩である:
【0025】
【化3】

【0026】
他の実施形態では、がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。
【0027】
本発明のこの態様のさらに他の実施形態では、がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。さらに他の実施形態では、がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、がんは神経膠芽細胞腫である。
【0028】
本発明のこの態様のさらに他の実施形態では、化合物または薬学的に許容できるその塩を、式1の化合物と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。この態様の他の実施形態では、式1の化合物または薬学的に許容できるその塩を、式1の化合物または薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0029】
他の態様では、本発明は、少なくとも1種のROSキナーゼによって媒介されるがんを、そのような治療を必要とする哺乳動物において、治療的有効量のROSキナーゼ阻害薬を投与することによって治療するステップを含む方法を提供する。本発明のこの態様の一実施形態では、がんは、少なくとも1つの遺伝子変化ROSキナーゼによって媒介される。他の実施形態では、がんは、ROSキナーゼの融合遺伝子によって媒介される。他の実施形態では、がんは、ROSキナーゼに関係する遺伝子欠失によって媒介される。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、異常な細胞増殖は、ROSキナーゼの融合タンパク質によって媒介される。他の実施形態では、異常な細胞増殖は、ROSキナーゼに関係する欠失タンパク質によって媒介される。他の実施形態では、融合タンパク質は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、欠失タンパク質はFIG−ROSである。
【0030】
この態様の他の実施形態では、ROSキナーゼ阻害薬は、ROSキナーゼの低分子阻害薬である。他の実施形態では、ROSキナーゼ阻害薬は、アミノ−ピリジン化合物またはアミノ−ピラジン化合物である。本発明の前述の各態様の他の実施形態では、ROSキナーゼ阻害薬は、式1の化合物または薬学的に許容できるその塩である:
【0031】
【化4】

【0032】
他の実施形態では、がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。
【0033】
本発明のこの態様のさらに他の実施形態では、がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。さらに他の実施形態では、がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、がんは神経膠芽細胞腫である。
【0034】
本発明のこの態様のさらに他の実施形態では、化合物または薬学的に許容できるその塩を、式1の化合物と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。この態様の他の実施形態では、式1の化合物または薬学的に許容できるその塩を、式1の化合物または薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0035】
他の態様では、本発明は、異常な細胞増殖を、そのような治療を必要とする哺乳動物において治療する方法を提供し、この方法は、前記哺乳動物に、治療的有効量のROSキナーゼ阻害薬を投与するステップを含む。本発明のこの態様の一実施形態では、異常な細胞増殖は、少なくとも1つの遺伝子変化ROSキナーゼによって媒介される。他の実施形態では、異常な細胞増殖は、ROSキナーゼの融合遺伝子によって媒介される。他の実施形態では、異常な細胞増殖は、ROSキナーゼに関係する遺伝子欠失によって媒介される。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、異常な細胞増殖は、ROSキナーゼの融合タンパク質によって媒介される。他の実施形態では、異常な細胞増殖は、ROSキナーゼに関係する欠失タンパク質によって媒介される。他の実施形態では、融合タンパク質はCD74−ROSである。他の実施形態では、融合タンパク質はSLC34A2−ROSである。他の実施形態では、欠失タンパク質はFIG−ROSである。
【0036】
この態様の他の実施形態では、ROSキナーゼ阻害薬は、ROSキナーゼの低分子阻害薬である。他の実施形態では、ROSキナーゼ阻害薬は、アミノ−ピリジン化合物またはアミノ−ピラジン化合物である。本発明の前述の各態様の他の実施形態では、ROSキナーゼ阻害薬は、式1の化合物または薬学的に許容できるその塩である:
【0037】
【化5】

【0038】
本発明のこの態様の他の実施形態では、異常な細胞増殖はがんである。本発明の前述の各態様の他の実施形態では、がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。
【0039】
本発明のこの態様のさらに他の実施形態では、がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。本発明の前述の各態様のさらに他の実施形態では、がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、がんは神経膠芽細胞腫である。
【0040】
本発明のこの態様のさらに他の実施形態では、化合物または薬学的に許容できるその塩を、式1の化合物と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。この態様の他の実施形態では、式1の化合物または薬学的に許容できるその塩を、式1の化合物または薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0041】
本発明の前述の各態様の一実施形態では、哺乳動物はヒトである。本発明の前述の各態様の他の実施形態では、哺乳動物はイヌである。
【0042】
他の態様では、本発明は、少なくとも1つの遺伝子変化ROSキナーゼについて陽性であることが判明しているがんを、そのような治療を必要とする哺乳動物において治療する方法を提供し、この方法は、前記哺乳動物に、治療的有効量のROSキナーゼ阻害薬を投与するステップを含む。本発明のこの態様の一実施形態では、遺伝子変化ROSキナーゼは、ROSの融合遺伝子である。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合遺伝子はSLC34A2−ROSである。他の実施形態では、融合遺伝子はCD74−ROSである。他の実施形態では、遺伝子変化ROSキナーゼは、ROSキナーゼに関係する遺伝子欠失である。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、遺伝子変化ROSキナーゼは、ROSキナーゼの融合タンパク質である。他の実施形態では、遺伝子変化ROSキナーゼは、ROSキナーゼに関係する欠失タンパク質である。他の実施形態では、融合タンパク質は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合タンパク質はCD74−ROSである。他の実施形態では、融合タンパク質はSLC34A2−ROSである。他の実施形態では、欠失タンパク質はFIG−ROSである。
【0043】
この態様の他の実施形態では、ROSキナーゼ阻害薬は、ROSキナーゼの低分子阻害薬である。他の実施形態では、ROSキナーゼ阻害薬は、アミノ−ピリジン化合物またはアミノ−ピラジン化合物である。本発明の前述の各態様の他の実施形態では、ROSキナーゼ阻害薬は、式1の化合物または薬学的に許容できるその塩である:
【0044】
【化6】

【0045】
他の実施形態では、がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。
【0046】
本発明のこの態様のさらに他の実施形態では、がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。さらに他の実施形態では、がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、がんは神経膠芽細胞腫である。
【0047】
本発明のこの態様のさらに他の実施形態では、化合物または薬学的に許容できるその塩を、式1の化合物と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。この態様の他の実施形態では、式1の化合物または薬学的に許容できるその塩を、式1の化合物または薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0048】
他の態様では、本発明は、ROS陽性がんを治療する方法を提供し、この方法は、そのような治療を必要とする哺乳動物に、治療的有効量のROSキナーゼ阻害薬を投与するステップを含む。本発明のこの態様の一実施形態では、ROS陽性がんは、ROSの融合遺伝子によって媒介される。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合遺伝子はSLC34A2−ROSである。他の実施形態では、融合遺伝子はCD74−ROSである。他の実施形態では、ROS陽性がんは、ROSキナーゼに関係する遺伝子欠失によって媒介される。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、ROS陽性がんは、ROSキナーゼの融合タンパク質によって媒介される。他の実施形態では、ROS陽性がんは、ROSキナーゼに関係する欠失タンパク質によって媒介される。他の実施形態では、ROSキナーゼの融合タンパク質は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、ROSキナーゼの融合タンパク質はCD74−ROSである。他の実施形態では、ROSキナーゼの融合タンパク質はSLC34A2−ROSである。他の実施形態では、ROSキナーゼの欠失タンパク質はFIG−ROSである。
【0049】
この態様の他の実施形態では、ROSキナーゼ阻害薬は、ROSキナーゼの低分子阻害薬である。他の実施形態では、ROSキナーゼ阻害薬は、アミノ−ピリジン化合物またはアミノ−ピラジン化合物である。本発明の前述の各態様の他の実施形態では、ROSキナーゼ阻害薬は、式1の化合物または薬学的に許容できるその塩である:
【0050】
【化7】

【0051】
他の実施形態では、ROS陽性がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。
【0052】
本発明のこの態様のさらに他の実施形態では、ROS陽性がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。さらに他の実施形態では、ROS陽性がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、ROS陽性がんは神経膠芽細胞腫である。
【0053】
この態様の一部の実施形態では、式1の化合物または薬学的に許容できるその塩を、式1の化合物または薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0054】
他の態様では、本発明は、ROSキナーゼによって媒介される異常な細胞増殖を有する哺乳動物に、治療的有効量のROSキナーゼ阻害薬を投与するステップを含む方法を提供する。本発明のこの態様の一実施形態では、異常な細胞増殖は、少なくとも1つの遺伝子変化ROSキナーゼによって媒介される。他の実施形態では、異常な細胞増殖は、ROSキナーゼの融合遺伝子によって媒介される。他の実施形態では、異常な細胞増殖は、ROSキナーゼに関係する遺伝子欠失によって媒介される。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、異常な細胞増殖は、ROSキナーゼの融合タンパク質によって媒介される。他の実施形態では、異常な細胞増殖は、ROSキナーゼに関係する欠失タンパク質によって媒介される。他の実施形態では、融合タンパク質は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、欠失タンパク質はFIG−ROSである。
【0055】
この態様の他の実施形態では、ROSキナーゼ阻害薬は、ROSキナーゼの低分子阻害薬である。他の実施形態では、ROSキナーゼ阻害薬は、アミノ−ピリジン化合物またはアミノ−ピラジン化合物である。本発明の前述の各態様の他の実施形態では、ROSキナーゼ阻害薬は、式1の化合物または薬学的に許容できるその塩である:
【0056】
【化8】

【0057】
本発明のこの態様の他の実施形態では、異常な細胞増殖はがんである。他の実施形態では、がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。
【0058】
本発明のこの態様のさらに他の実施形態では、がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。さらに他の実施形態では、がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、がんは神経膠芽細胞腫である。
【0059】
本発明のこの態様のさらに他の実施形態では、化合物または薬学的に許容できるその塩を、式1の化合物と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。この態様の他の実施形態では、式1の化合物または薬学的に許容できるその塩を、式1の化合物または薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0060】
本発明のこの態様のさらに他の実施形態では、化合物または薬学的に許容できるその塩を、式1の化合物と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。この態様の他の実施形態では、式1の化合物または薬学的に許容できるその塩を、式1の化合物または薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0061】
他の態様では、本発明は、治療的有効量のROSキナーゼ阻害薬を、ROS陽性であることが分かっている患者に投与するステップを含む方法を提供する。一実施形態では、患者は、少なくとも1つの遺伝子変化ROSキナーゼによって媒介されるがんを有する。他の実施形態では、がんは、ROSキナーゼの融合遺伝子によって媒介される。他の実施形態では、がんは、ROSキナーゼに関係する遺伝子欠失によって媒介される。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、がんは、ROSキナーゼの融合タンパク質によって媒介される。他の実施形態では、がんは、ROSキナーゼに関係する欠失タンパク質によって媒介される。他の実施形態では、融合タンパク質は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、欠失タンパク質はFIG−ROSである。
【0062】
この態様の他の実施形態では、ROSキナーゼ阻害薬は、ROSキナーゼの低分子阻害薬である。他の実施形態では、ROSキナーゼ阻害薬は、アミノ−ピリジン化合物またはアミノ−ピラジン化合物である。本発明の前述の各態様の他の実施形態では、ROSキナーゼ阻害薬は、式1の化合物または薬学的に許容できるその塩である:
【0063】
【化9】

【0064】
他の実施形態では、がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。
【0065】
本発明のこの態様のさらに他の実施形態では、がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。本発明の前述の各態様のさらに他の実施形態では、がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、がんは神経膠芽細胞腫である。
【0066】
本発明のこの態様のさらに他の実施形態では、化合物または薬学的に許容できるその塩を、式1の化合物と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0067】
本発明のこの態様のさらに他の実施形態では、化合物または薬学的に許容できるその塩を、式1の化合物と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。この態様の他の実施形態では、式1の化合物または薬学的に許容できるその塩を、式1の化合物または薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0068】
他の態様では、本発明は、
i.少なくとも1つの遺伝子変化ROSキナーゼについて陽性であることが判明しているがんを有する患者を同定するステップと;
ii.前記患者に、治療的有効量のROSキナーゼ阻害薬を投与するステップとを含む方法を提供する。
【0069】
本発明のこの態様の一実施形態では、前記遺伝子変化ROSキナーゼは、ROSの融合遺伝子である。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合遺伝子はSLC34A2−ROSである。他の実施形態では、融合遺伝子はCD74−ROSである。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼに関係する遺伝子欠失である。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼの融合タンパク質である。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼに関係する欠失タンパク質である。他の実施形態では、融合タンパク質は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合タンパク質はSLC34A2−ROSである。他の実施形態では、融合タンパク質はCD74−ROSである。他の実施形態では、欠失タンパク質はFIG−ROSである。この態様のうちの一部のそのような実施形態では、方法は、(i)少なくとも1つの遺伝子変化ROSキナーゼについて陽性であることが判明しているがんを有する患者を同定するステップと;(ii)前記患者に、治療的有効量のROSキナーゼ阻害薬を投与し、それによって前記がんを治療するステップとを含む。この態様の一部の実施形態では、前記治療は、がんの進行の逆転または阻害をもたらす。
【0070】
この態様の他の実施形態では、ROSキナーゼ阻害薬は、ROSキナーゼの低分子阻害薬である。他の実施形態では、ROSキナーゼ阻害薬は、アミノ−ピリジン化合物またはアミノ−ピラジン化合物である。本発明の前述の各態様の他の実施形態では、ROSキナーゼ阻害薬は、式1の化合物または薬学的に許容できるその塩である:
【0071】
【化10】

【0072】
本発明のこの態様の他の実施形態では、異常な細胞増殖はがんである。本発明の前述の各態様の他の実施形態では、がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。
【0073】
本発明のこの態様のさらに他の実施形態では、がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。本発明の前述の各態様のさらに他の実施形態では、がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、がんは神経膠芽細胞腫である。
【0074】
本発明のこの態様のさらに他の実施形態では、化合物または薬学的に許容できるその塩を、式1の化合物と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。この態様の他の実施形態では、式1の化合物または薬学的に許容できるその塩を、式1の化合物または薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0075】
一態様では、本発明は、そのような治療を必要とするヒトにおいて、少なくとも1つの遺伝子変化ROSによって媒介されるがんを治療するのに有用な医薬品を調製するためのROSキナーゼ阻害薬の使用を提供し、その使用は、前記哺乳動物に、治療的有効量の式1のROSキナーゼ阻害薬または薬学的に許容できるその塩を投与するステップを含む。
【0076】
【化11】

本発明のこの態様の一実施形態では、がんは、ROSの融合遺伝子によって媒介される。この態様の他の実施形態では、ROSの融合遺伝子は、SLC34A2−ROS遺伝子またはCD74−ROS遺伝子である。この態様の他の実施形態では、がんは、ROSキナーゼに関係する遺伝子欠失によって媒介される。この態様の他の実施形態では、遺伝子欠失は、FIG−ROS遺伝子である。この態様の他の実施形態では、がんは、遺伝子変化ROSキナーゼによって媒介される。この態様の他の実施形態では、遺伝子変化ROSキナーゼは、ROS融合である。この態様の他の実施形態では、ROS融合は、SLC34A2−ROSキナーゼまたはCD74−ROSキナーゼである。この態様の他の実施形態では、がんは、ROSキナーゼに関係する欠失タンパク質によって媒介される。この態様の他の実施形態では、欠失タンパク質は、FIG−ROSキナーゼである。
【0077】
この態様の他の実施形態では、がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。この態様の他の実施形態では、がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。この態様の他の実施形態では、がんは非小細胞肺がん(NSCLC)である。この態様の他の実施形態では、がんは神経膠芽細胞腫である。この態様の他の実施形態では、式1の化合物を、式1の化合物と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0078】
他の態様では、本発明は、少なくとも1つの遺伝子変化ROSキナーゼによって媒介されるがんを治療する際に有用な医薬品を調製するためのROSキナーゼ阻害薬の使用を提供する。一実施形態では、ROSキナーゼ阻害薬は、ROSキナーゼの低分子阻害薬である。他の実施形態では、ROSキナーゼ阻害薬は、アミノ−ピリジン化合物またはアミノ−ピラジン化合物である。他の実施形態では、ROSキナーゼ阻害薬は、式1の化合物または薬学的に許容できるその塩である:
【0079】
【化12】

本発明のこの態様の一実施形態では、前記遺伝子変化ROSキナーゼは、ROSの融合遺伝子である。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合遺伝子はSLC34A2−ROSである。他の実施形態では、融合遺伝子はCD74−ROSである。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼに関係する遺伝子欠失である。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼの融合タンパク質である。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼに関係する欠失タンパク質である。他の実施形態では、融合タンパク質は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合タンパク質はSLC34A2−ROSである。他の実施形態では、融合タンパク質はCD74−ROSである。他の実施形態では、欠失タンパク質はFIG−ROSである。本発明のこの態様のさらに他の実施形態では、ROS陽性がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、ROS陽性がんは神経膠芽細胞腫である。
【0080】
他の態様では、本発明は、ROS陽性がんを治療する際に有用な医薬品を調製するためのROSキナーゼ阻害薬の使用を提供する。一実施形態では、ROSキナーゼ阻害薬は、ROSキナーゼの低分子阻害薬である。他の実施形態では、ROSキナーゼ阻害薬は、アミノ−ピリジン化合物またはアミノ−ピラジン化合物である。他の実施形態では、ROSキナーゼ阻害薬は、式1の化合物または薬学的に許容できるその塩である:
【0081】
【化13】

本発明のこの態様の一実施形態では、前記遺伝子変化ROSキナーゼは、ROSの融合遺伝子である。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合遺伝子はSLC34A2−ROSである。他の実施形態では、融合遺伝子はCD74−ROSである。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼに関係する遺伝子欠失である。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼの融合タンパク質である。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼに関係する欠失タンパク質である。他の実施形態では、融合タンパク質は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合タンパク質はSLC34A2−ROSである。他の実施形態では、融合タンパク質はCD74−ROSである。他の実施形態では、欠失タンパク質はFIG−ROSである。本発明のこの態様のさらに他の実施形態では、ROS陽性がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、ROS陽性がんは神経膠芽細胞腫である。
【0082】
他の態様では、本発明は、ROSキナーゼ阻害薬の医薬組成物と、前記医薬組成物をROS陽性がんを有する患者に投与するための説明書セットとを含むキットを提供する。本発明のこの態様の一実施形態では、ROS陽性がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。本発明のこの態様のさらに他の実施形態では、ROS陽性がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、ROS陽性がんは神経膠芽細胞腫である。
【0083】
他の態様では、本発明は、ROSキナーゼ阻害薬の医薬組成物と、前記医薬組成物をROS陽性がんを有する患者に投与するための説明書セットとを含むキットを提供する。一実施形態では、前記ROS陽性がんは、少なくとも1つの遺伝子変化ROSキナーゼによって媒介される。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSの融合遺伝子である。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合遺伝子はSLC34A2−ROSである。他の実施形態では、融合遺伝子はCD74−ROSである。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼに関係する遺伝子欠失である。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼの融合タンパク質である。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼに関係する欠失タンパク質である。他の実施形態では、融合タンパク質は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合タンパク質はSLC34A2−ROSである。他の実施形態では、融合タンパク質はCD74−ROSである。他の実施形態では、欠失タンパク質はFIG−ROSである。本発明のこの態様の一実施形態では、ROS陽性がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。本発明のこの態様のさらに他の実施形態では、ROS陽性がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、ROS陽性がんは神経膠芽細胞腫である。
【0084】
他の態様では、本発明は、クリゾチニブの医薬組成物と、前記医薬組成物をROS陽性がんを有する患者に投与するための説明書セットとを含むキットを提供する。一実施形態では、前記ROS陽性がんは、少なくとも1つの遺伝子変化ROSキナーゼによって媒介される。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSの融合遺伝子である。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合遺伝子はSLC34A2−ROSである。他の実施形態では、融合遺伝子はCD74−ROSである。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼに関係する遺伝子欠失である。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼの融合タンパク質である。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼに関係する欠失タンパク質である。他の実施形態では、融合タンパク質は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合タンパク質はSLC34A2−ROSである。他の実施形態では、融合タンパク質はCD74−ROSである。本発明のこの態様の一実施形態では、ROS陽性がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。本発明のこの態様のさらに他の実施形態では、ROS陽性がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、ROS陽性がんは神経膠芽細胞腫である。
【0085】
さらに他の態様では、本発明は、式1の化合物または薬学的に許容できるその塩を投与することによって、細胞におけるROSキナーゼ活性を阻害する方法を提供する:
【0086】
【化14】

【0087】
他の態様では、本発明は、哺乳動物において、少なくとも1つの遺伝子変化ROSによって媒介されるがんを治療する方法を提供し、この方法は、前記哺乳動物に、治療的有効量の3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩を投与するステップを含む。一部のそのような実施形態では、少なくとも1つの遺伝子変化ROSは、遺伝子変化ROS遺伝子または遺伝子変化ROSタンパク質である。
【0088】
この態様の一部の実施形態では、前記治療は、がんの進行の逆転または阻害をもたらす。この態様の多くの実施形態では、哺乳動物はヒトである。
【0089】
この態様の多くの実施形態では、少なくとも1つの遺伝子変化ROSは、ROS融合遺伝子などの遺伝子変化ROS遺伝子である。一部のそのような実施形態では、ROS融合遺伝子は、SLC34A2−ROS遺伝子またはCD74−ROS遺伝子である。他のそのような実施形態では、ROS融合遺伝子はFIG−ROS遺伝子である。
【0090】
この態様の多くの実施形態では、少なくとも1つの遺伝子変化ROSは、ROS融合タンパク質などの遺伝子変化ROSタンパク質である。一部のそのような実施形態では、ROS融合タンパク質は、SLC34A2−ROSキナーゼまたはCD74−ROSキナーゼである。他のそのような実施形態では、ROS融合タンパク質はFIG−ROSキナーゼである。
【0091】
この態様の一部の実施形態では、本発明は、哺乳動物において、ROS融合遺伝子によって媒介されるがんの進行を逆転または阻害する方法を提供し、この方法は、前記哺乳動物に、治療的有効量の3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩を投与するステップを包含する。一部のそのような実施形態では、ROS融合遺伝子はSLC34A2−ROS遺伝子である。他のそのような実施形態では、ROS融合遺伝子はCD74−ROS遺伝子である。さらに他のそのような実施形態では、ROS融合遺伝子はFIG−ROS遺伝子である。ある種の実施形態では、ROS融合遺伝子は、SLC34A2−ROS遺伝子、CD74−ROS遺伝子およびFIG−ROS遺伝子からなる群から選択される。
【0092】
この態様の他の実施形態では、本発明は、哺乳動物において、ROS融合タンパク質によって媒介されるがんの進行を逆転または阻害する方法を提供し、この方法は、前記哺乳動物に、治療的有効量の3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩を投与するステップを含む。一部のそのような実施形態では、ROS融合タンパク質はSLC34A2−ROSキナーゼである。他のそのような実施形態では、ROS融合タンパク質はCD74−ROSキナーゼである。さらに他のそのような実施形態では、ROS融合タンパク質はFIG−ROSキナーゼである。ある種の実施形態では、ROS融合タンパク質は、SLC34A2−ROSキナーゼ、CD74−ROSキナーゼおよびFIG−ROSキナーゼからなる群から選択される。
【0093】
この態様の一部の実施形態では、がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。
【0094】
この態様の他の実施形態では、がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。この態様の一部の実施形態では、がんは非小細胞肺がん(NSCLC)である。この態様の他の実施形態では、がんは神経膠芽細胞腫である。
【0095】
この態様の多くの実施形態では、3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩を、3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0096】
この態様の一部の実施形態では、方法はさらに、前記投与ステップの前に、遺伝子変化ROS遺伝子または遺伝子変化ROSタンパク質などの少なくとも1つの遺伝子変化ROSによって特徴付けられるがんを有する哺乳動物を同定するステップを含む。一部のそのような実施形態では、がんは、遺伝子変化ROSポリヌクレオチドおよび/または遺伝子変化ROSポリペプチドを有すると特徴付けられる。
【0097】
さらに他の態様では、本発明は、(i)少なくとも1つの遺伝子変化ROSによって特徴付けられるがんを有する哺乳動物を同定するステップと;(ii)前記哺乳動物に、治療的有効量の3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩を投与するステップとを含む、哺乳動物においてがんを治療する方法を提供する。一部のそのような実施形態では、少なくとも1つの遺伝子変化ROSは、遺伝子変化ROS遺伝子または遺伝子変化ROSタンパク質である。
【0098】
この態様の一部の実施形態では、前記治療は、がんの進行の逆転または阻害をもたらす。この態様の多くの実施形態では、哺乳動物はヒトである。
【0099】
この態様の一部の実施形態では、少なくとも1つの遺伝子変化ROSは、遺伝子変化ROS遺伝子、例えば、ROS融合遺伝子である。一部のそのような実施形態では、ROS融合遺伝子は、SLC34A2−ROS遺伝子またはCD74−ROS遺伝子である。他のそのような実施形態では、ROS融合遺伝子はFIG−ROS遺伝子である。
【0100】
この態様の一部の実施形態では、少なくとも1つの遺伝子変化ROSは、遺伝子変化ROSタンパク質、例えば、ROS融合タンパク質である。一部のそのような実施形態では、ROS融合タンパク質は、SLC34A2−ROSキナーゼまたはCD74−ROSキナーゼである。他のそのような実施形態では、ROS融合タンパク質はFIG−ROSキナーゼである。
【0101】
この態様の一部の実施形態では、本発明は、哺乳動物においてがんの進行を逆転または阻害する方法を提供し、この方法は、(i)少なくとも1つのROS融合遺伝子によって特徴付けられるがんを有する哺乳動物を同定するステップと;(ii)前記哺乳動物に、治療的有効量の3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩を投与するステップとを含む。一部のそのような実施形態では、ROS融合遺伝子はSLC34A2−ROS遺伝子である。他のそのような実施形態では、ROS融合遺伝子はCD74−ROS遺伝子である。さらに他のそのような実施形態では、ROS融合遺伝子はFIG−ROS遺伝子である。ある種の実施形態では、ROS融合遺伝子は、SLC34A2−ROS遺伝子、CD74−ROS遺伝子およびFIG−ROS遺伝子からなる群から選択される。
【0102】
この態様の一部の実施形態では、本発明は、哺乳動物においてがんの進行を逆転または阻害する方法を提供し、この方法は、(i)少なくとも1つのROS融合タンパク質によって特徴付けられるがんを有する哺乳動物を同定するステップと;(ii)前記哺乳動物に、治療的有効量の3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩を投与するステップとを含む。一部のそのような実施形態では、ROS融合タンパク質はSLC34A2−ROSキナーゼである。他のそのような実施形態では、ROS融合タンパク質はCD74−ROSキナーゼである。さらに他のそのような実施形態では、ROS融合タンパク質はFIG−ROSキナーゼである。ある種の実施形態では、ROS融合タンパク質は、SLC34A2−ROSキナーゼ、CD74−ROSキナーゼおよびFIG−ROSキナーゼからなる群から選択される。
【0103】
この態様の一部の実施形態では、がんは、遺伝子変化ROSポリヌクレオチドおよび/または遺伝子変化ROSポリペプチドを有すると特徴付けられる。
【0104】
この態様の一部の実施形態では、がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。
【0105】
この態様の他の実施形態では、がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。この態様の一部の実施形態では、がんは非小細胞肺がん(NSCLC)である。この態様の他の実施形態では、がんは神経膠芽細胞腫である。
【0106】
この態様の多くの実施形態では、3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩を、3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【図面の簡単な説明】
【0107】
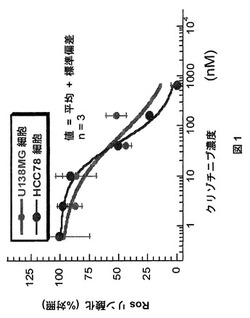
【図1】クリゾチニブによるU138MG細胞およびHCC78細胞におけるSLC34A2−ROSリン酸化の濃度依存的阻害を示すグラフである。
【図2】クリゾチニブによるHCC78細胞生存力の濃度依存的阻害を示すグラフである。
【図3】HCC78ヒトNSCLC細胞におけるクリゾチニブによるSLC34A2−ROSリン酸化およびROS媒介シグナル伝達の濃度依存的阻害を示すグラフである。
【図4】SLC34A2−ROS融合を内包するHCC78ヒトNSCLC細胞における切断Caspase3レベルのクリゾチニブによる用量依存的上昇を示す図である。
【図5】ヌードマウスにおけるヒトCD74−ROS、SLC34A2−ROS(L)、SLC34A2−ROS(S)、FIG−ROS(L)およびFIG−ROS(S)を内包するROS融合操作3T3−ROS腫瘍モデルのパネルでのクリゾチニブの細胞減少性効果を示すグラフである。
【図6】ヌードマウスにおける3T3−CD74−ROS異種移植片モデルでのROSリン酸化(A)および腫瘍増殖(B)のクリゾチニブによる用量依存的阻害を示す図である。
【図7】ヌードマウスにおける3T3−SLC34A2−ROS(L)異種移植片モデルでのクリゾチニブによる腫瘍増殖の用量依存的阻害を示す図である。
【発明を実施するための形態】
【0108】
別段に示されていない限り、本発明の化合物に関する本明細書中の全ての言及には、多形、立体異性体および同位体標識されたそのバージョンを包含するその塩、溶媒和物、水和物および複合体ならびにその塩の溶媒和物、水和物および複合体に対する言及が包含される。
【0109】
定義
別段に定義されていない限り、本明細書で使用される技術および化学用語は全て、本発明が属する分野の当業者が一般に理解している意味と同じ意味を有する。本明細書に記載されているものと同様または同等の任意の方法および物質を本発明の実施または試験において使用することができるが、好ましい方法および材料が、本明細書では記載されている。実施形態の記載および本発明の請求において、ある種の専門用語を、下記の定義に従って使用する。
【0110】
本明細書で使用される場合、単数形「a」、「an」および「the」は、文脈で別段に明示されていない限り、複数の言及を包含する。したがって、例えば、「the method」という言及には、本明細書に記載されていて、かつ/または本開示を読めば当業者には明らかになる種類の1種または複数の方法および/またはステップが包含される。
【0111】
本明細書で使用される場合、別段に示されていない限り、「異常な細胞増殖」という用語は、正常な調節機構から独立(例えば接触阻害を喪失)した細胞増殖を指す。
【0112】
本明細書で使用される場合、別段に示されていない限り、「投与すること」という用語は、患者が自分自身の努力によって、本明細書に記載されている治療薬を摂取する自己投与の行為、患者が他者(例えば、医師、看護士、家族またはIV)の努力を介して本明細書に記載されている治療薬を摂取する投与行為を指す。投与はまた、本明細書に記載されている治療薬を処方する動作を包含する。「投与」という用語は、本明細書で使用される場合、別段に示されていない限り、「投与」が直前で定義されているとおり、治療行為を指す。
【0113】
本明細書で使用される場合、「抗体(antibody)」または「抗体(antibodies)」は、Fabまたはその抗原認識断片を包含し、キメラ、ポリクローナルおよびモノクローナル抗体を包含するIgG、IgM、IgA、IgDおよびIgEを包含する全ての種類の免疫グロブリンを指す。「ヒト化抗体」という用語は、本明細書で使用される場合、ヒト抗体により緊密に似せるために、アミノ酸が非抗原結合領域において置き換えられているが、元の結合性はまだ残している抗体分子を指す。
【0114】
「生体試料」という用語は本明細書では、その最も広範な意味で使用されており、SLC34A2−ROS融合、CD74−ROS融合、FIG−ROS融合または切断されたROSポリヌクレオチドもしくはポリペプチドまたはその断片を含有すると考えられる任意の生体試料を意味し、細胞、細胞から単離された染色体(例えば、中期染色体のスプレッド)、ゲノムDNA(溶液中、またはサザン分析などのために固体支持体に結合)、RNA(溶液中、またはノーザン分析などのために固体支持体に結合)、cDNA(溶液中、または固体支持体に結合)、細胞からの抽出物、血液、尿、骨髄または組織などを含んでよい。
【0115】
本明細書で使用される場合、「欠失遺伝子」という用語は、ゲノム内の同じ染色体上の異なる位置からの2つの遺伝子が、2つの遺伝子の間にあるヌクレオチドの欠失を介して融合する遺伝子事象(「遺伝子欠失」とも称される)から生じている遺伝子を指す。欠失遺伝子には、これらに限られないが、上記のFIG−ROS遺伝子が包含される。
【0116】
本明細書で使用される場合、「融合遺伝子」という用語は、ゲノム内の異なる位置からの2つの遺伝子が、融合、転座または転化して、新たな遺伝子を作る遺伝子事象から生じている遺伝子を指す。融合遺伝子の具体的な例には、これらに限られないが、SLC34A2−ROS遺伝子を形成するSLC34A2遺伝子とROS遺伝子との融合およびCD74−ROS遺伝子を形成するCD74遺伝子とROS遺伝子との融合が包含される。
【0117】
本明細書で使用される場合、「遺伝子変化ROS」という用語は、ゲノムDNA、ヌクレオチド、タンパク質またはポリペプチドかどうかに関わらず、本明細書に記載のROS融合または欠失のいずれかを指す。「遺伝子変化ROSポリヌクレオチド」という用語は、本明細書に記載の遺伝子変化ROSタンパク質のいずれかをコードするポリヌクレオチドを指す。「遺伝子変化ROSタンパク質」という用語は、本明細書に記載の融合、欠失、トランケーションまたは突然変異のいずれかを指す。「遺伝子変化ROSタンパク質」という用語は、本明細書で使用される場合、「遺伝子変化ROSポリペプチド」と互換的に使用される。好ましい遺伝子変化ROSタンパク質には、「ROS融合」が包含される。好ましいROS融合には、これらに限られないが、SLC34A2−ROS融合タンパク質およびCD74−ROS融合タンパク質が包含される。好ましい遺伝子変化ROSポリペプチドには、SLC34A2−ROS融合ポリペプチドおよびCD74−ROS融合ポリペプチドが包含される。
【0118】
本明細書で使用される場合、「ROSキナーゼ」は、ROSタンパク質のキナーゼ部分を含有する本明細書に記載されている任意のタンパク質を指す。ROSキナーゼには、これらに限られないが、本明細書に記載の遺伝子変化ROSタンパク質および野生型ROSタンパク質が包含される。「遺伝子変化ROSキナーゼ」という用語は、遺伝子変化ROSポリヌクレオチドによってコードされるタンパク質またはポリペプチドを指す。
【0119】
本明細書で使用される場合、「ROSポリペプチド特異的試薬」という用語は、抗体、AQUAペプチド、核酸プローブ、核酸プライマーなど、本明細書に記載されているROSキナーゼのいずれかに特異的な任意の試薬を指す。例えば、好ましい「ROSポリペプチド特異的試薬」は、本明細書に記載の遺伝子変化ROSキナーゼのいずれかに特異的な抗体である。より好ましくは、本明細書で使用される場合、「ROSポリペプチド特異的試薬」は、SLC34A2−ROS融合ポリペプチドおよび/またはCD74−ROS融合ポリペプチドおよび/またはFIG−ROS融合ポリペプチドに特異的な抗体である。「ROSポリペプチド特異的試薬」が抗体である場合、試薬は、「ROSポリペプチド特異的抗体」として本明細書では称され得る。そのようなROSポリペプチド特異的抗体は例えば、「SLC34A2−ROS融合ポリペプチド抗体」、「SLC34A2−ROS融合タンパク質抗体」または「FIG−ROS融合タンパク質抗体」である。
【0120】
本明細書で使用される場合、別段に示されていない限り、「治療すること」という用語は、そのような用語が適用されている障害もしくは状態またはそのような障害もしくは状態の1つもしくは複数の症状の進行の逆転、緩和、阻害を意味する。「治療」という用語は、本明細書で使用される場合、別段に示されていない限り、「治療すること」が直前で定義されているとおり、治療行為を指す。「治療」という用語には、上記のとおりの「投与すること」または「投与」が包含される。
【0121】
本明細書で使用される場合、「薬学的に許容できる塩」という用語には、酸付加塩および塩基塩(二塩を包含)が包含される。
【0122】
適切な酸付加塩は、非毒性の塩を形成する酸から形成される。例には、酢酸塩、アスパラギン酸塩、安息香酸塩、ベシル酸塩、重炭酸塩/炭酸塩、重硫酸塩/硫酸塩、ホウ酸塩、カンシル酸塩、クエン酸塩、エジシル酸塩、エシル酸塩、ギ酸塩、フマル酸塩、グルセプ酸塩、グルコン酸塩、グルクロン酸塩、ヘキサフルオロリン酸塩、ヒベンズ酸塩、塩酸塩/塩化物、臭化水素酸塩/臭化物、ヨウ化水素酸塩/ヨウ化物、イセチオン酸塩、乳酸塩、リンゴ酸塩、マレイン酸塩、マロン酸塩、メタンスルホン酸塩、メチル硫酸塩、ナフチル酸塩、2−ナプシル酸塩、ニコチン酸塩、硝酸塩、オロチン酸塩、シュウ酸塩、パルミチン酸塩、パモ酸塩、リン酸/リン酸水素塩/リン酸二水素塩、サッカリン酸塩、ステアリン酸塩、コハク酸塩、酒石酸塩、トシル酸塩およびトリフルオロ酢酸が包含される。
【0123】
適切な塩基塩は、非毒性の塩を形成する塩基から形成される。例には、アルミニウム、アルギニン、ベンザチン、カルシウム、コリン、ジエチルアミン、ジオラミン、グリシン、リシン、マグネシウム、メグルミン、オラミン、カリウム、ナトリウム、トロメタミンおよび亜鉛塩が包含される。
【0124】
適切な薬学的に許容できる塩についての総説に関しては、その開示全体が参照によって本明細書に組み込まれるStahlおよびWermuthによる「Handbook of Pharmaceutical Salts:Properties,Selection,and Use」(Wiley−VCH、Weinheim、Germany、2002)を参照されたい。
【0125】
本発明の化合物の薬学的に許容できる塩は、化合物の溶液および所望の酸または塩基を適切に一緒に混合することによって容易に調製することができる。塩を溶液から沈殿させ、濾過によって集めるか、または溶媒を蒸発させることによって回収することができる。塩の電離度は、完全なイオン化からほぼ非イオン化まで変動し得る。
【0126】
本発明の化合物は、非溶媒和および溶媒和形態の両方で存在し得る。「溶媒和物」という用語は本明細書では、本発明の化合物および1個または複数の薬学的に許容できる溶媒分子、例えば、エタノールを含む分子複合体を記載するために使用されている。「水和物」という用語は、溶媒が水である場合に使用されている。本発明による薬学的に許容できる溶媒和物には、結晶化の溶媒が同位体置換されている水和物および溶媒和物が包含される(例えば、D2O、d6−アセトン、d6−DMSO)。
【0127】
本発明はまた、式1の化合物と同一であるが、但し、1個または複数の原子が、自然に通常は存在する原子質量または質量数とは異なる原子質量または質量数を有する原子に置き換えられている、同位体標識されている化合物を包含する。本発明の化合物に導入することができる同位体の例には、それぞれ2H、3H、13C、14C、15N、18O、17O、31P、32P、35S、18Fおよび36Clなどの水素、炭素、窒素、酸素、リン、硫黄、フッ素および塩素の同位体が包含される。前記の同位体および/または他の原子の他の同位体を含有する本発明の化合物および前記化合物の薬学的に許容できる塩も、本発明の範囲内である。本発明のある種の同位体標識された化合物、例えば、3Hおよび14Cなどの放射性同位体が導入されたものは、薬物および/または基質組織分布アッセイで有用である。トリチウム、即ち、3Hおよび炭素−14、即ち14C同位体が、その調製の容易さおよび検出性により特に好ましい。さらに、ジュウテリウム、即ち2Hなどの重い同位体での置換は、より大きな代謝安定性、例えば、in vivo半減期の上昇または投薬量要求の減少から生じるある種の治療上の利点をもたらすことができ、したがって、場合によっては好ましいことがある。非同位体標識試薬を容易に利用可能な同位体標識試薬に代えて、非標識化合物のために記載された手順を実施することによって、同位体標識された本発明の式1の化合物を一般に調製することができる。
【0128】
包接化合物、薬物−ホスト包接複合体などの複合体も、本発明の範囲内に包含され、ここで、上記の溶媒和物とは対照的に、薬物およびホストは、化学量論的量または非化学量論的量で存在する。また、化学量論的量または非化学量論的量であってよい2種以上の有機および/または無機成分を含有する薬物の複合体も包含される。生じる複合体は、電離しているか、部分的に電離しているか、非電離であってよい。このような複合体の総説に関しては、その開示全体が参照によって本明細書に組み込まれるHaleblianによるJ Pharm Sci、64(8)、1269〜1288(1975年8月)を参照されたい。
【0129】
診断検査
本発明に関連して、生体試料に遺伝子変化ROSが存在するか、または存在しないかを決定するための診断検査として、当業者に知られているいくつかのアッセイフォーマットを使用することができる。診断検査が、生体試料が遺伝子変化ROSを含有することを示す検査結果を返してきた場合に、その生体試料を得た患者をROS陽性とみなす。同様に、診断検査が、生体試料ががん腫瘍生検である場合に、生体試料が遺伝子変化ROSを含有することを示す試験結果を返してきた場合、そのがんをROS陽性がんとみなす。詳細には、生体試料ががん細胞を含む場合、そのがんは、当業者に知られているか、または本明細書に記載されている技術を使用して遺伝子変化ROSポリヌクレオチドおよび/またはポリペプチドの存在を検出することによって、ROS融合遺伝子またはROS融合タンパク質などの遺伝子変化ROS遺伝子または遺伝子変化ROSタンパク質を含有すると特徴付けられ得る。
【0130】
イムノアッセイ
本発明の方法を実施する際に有用なイムノアッセイは、ホモジニアスイムノアッセイまたはヘテロジニアスイムノアッセイであってよい。ホモジニアスアッセイでは、免疫反応は通常、変異型ROSポリペプチド特異的試薬(例えば、SLC34A2−ROS融合ポリペプチド特異的抗体、CD74−ROS融合ポリペプチド特異的抗体またはFIG−ROS融合ポリペプチド特異的抗体)、標識された分析物および該当する生体試料を必要とする。標識から生じるシグナルは、抗体が標識された分析物に結合すると、直接か、または間接的に変化する。免疫反応およびその規模の検出の両方を、ホモジニアス溶液中で実施する。使用することができる免疫化学的標識には、遊離ラジカル、放射性同位体、蛍光染料、酵素、バクテリオファージ、補酵素などが包含される。半導体ナノ結晶標識または「量子ドット」もまた、有利に使用することができ、その調製および使用は、十分に記載されている(一般には、K.Barovsky、Nanotech. Law & Bus.1(2):Article 14(2004)およびそこに挙げられている特許を参照されたい)。
【0131】
ヘテロジニアスアッセイ手法では、試薬は通常、生体試料、変異型ROSキナーゼポリペプチド特異的試薬(例えば、抗体)および検出可能なシグナルを生じさせるために適した手段である。下記でさらに記載されているとおりの生体試料を使用することができる。抗体を一般に、ビーズ、プレートまたはスライドなどの支持体に固定化し、抗原を含有すると考えられる試料と液相で接触させる。次いで支持体を液相から分離し、支持体相または液相を検出可能なシグナルについて、そのようなシグナルを生じさせる手段を使用して検査する。シグナルは、生体試料中の分析物の存在に関連している。検出可能なシグナルを生じさせるための手段には、放射性標識、蛍光標識、酵素標識、量子ドットなどの使用が包含される。例えば、検出される抗原が、第2結合部位を含有する場合、分離ステップの前に、その部位に結合する抗体を、検出可能な基に結合させ、液相反応溶液に加えることができる。固体支持体上での検出可能な基の存在は、検査試料中に抗原が存在することを示している。適切なイムノアッセイの例は、ラジオイムノアッセイ、免疫蛍光法、酵素結合イムノアッセイなどである。
【0132】
本明細書に開示されている方法を実施するために有用であり得るイムノアッセイフォーマットおよびその変形形態は、当分野でよく知られている(一般には、E.Maggio、Enzyme−Immunoassay(1980)(CRC Press,Inc.、Boca Raton、Fla.)を参照されたい;また例えば、米国特許第4,727,022号(Skoldら、「Methods for Modulating Ligand−Receptor Interactions and their Application」);米国特許第4,659,678号(Forrestら、「Immunoassay of Antigens」);米国特許第4,376,110号(Davidら、「Immunometric Assays Using Monoclonal Antibodies」)も参照されたい)。試薬−抗体複合体を形成するために適した条件は、当業者によく知られている。検出可能な試薬の濃度は、SLC34A2−ROS融合ポリペプチドの結合を、背景に対して検出することができる程度に十分であるべきである。
【0133】
本明細書に開示されている方法(例えば、IHC、ウェスタンブロット、免疫蛍光およびフローサイトメトリー)を実施する際に有用な抗体には、限定ではないが、特に全長SLC34A2またはCD74(例えば、タンパク質のN末端に結合)または全長ROS(例えば、ROSのキナーゼドメイン中のエピトープに結合)のいずれかに特異的に結合する抗体が包含される。そのような抗体は市販されていることがある(例えば、Abcam,Inc.、Cambridge MAによって製品ab5512として販売されているROS特異的ポリクローナル抗体)。使用される抗体がウェスタンブロット分析またはフローサイトメトリーなどにおいて、全長ROSまたは全長SLC34A2に特異的に結合する場合、本発明の変異型ROSポリペプチドまたはポリヌクレオチド(例えば、SLC34A2−ROSポリペプチドまたはポリヌクレオチド)の存在を検出するための追加的な方法を同じ試料で使用することができる。例えば、透過処理された細胞でのフローサイトメトリーをAbcamのab5512抗体で行い、その後、細胞を溶解させ、遺伝子物質(例えば、mRNAまたはゲノムDNA)を、SLC34A2またはCD74をコードするcDNAの5’末端(例えば、フォワードプライマー)およびROSをコードするcDNAの3’末端の補体(例えば、リバースプライマー)に特異的な(即ちハイブリダイズする)PCRプライマーを使用してPCR分析する。
【0134】
本発明の方法で使用するための抗体は全て、診断アッセイに適した固体支持体(例えば、ラテックスまたはポリスチレンなどの材料から形成されたビーズ、プレート、スライドまたはウェル)に、沈殿などの知られている技術に従って結合されていてよい。抗体または他のROSポリペプチド特異的試薬は同様に、放射性標識(例えば、35S、1251、1311)、酵素標識(例えば、ホースラディッシュペルオキシダーゼ、アルカリホスファターゼ)および蛍光標識(例えば、フルオレセイン)などの検出可能な基に、知られている技術に従って結合されていてよい。
【0135】
フローサイトメトリー(FC)、免疫組織化学(IHC)または免疫蛍光(IF)などの細胞ベースのアッセイが、本発明の方法を実施する際には特に望ましい。それというのも、そのようなアッセイフォーマットは、臨床的に適していて、遺伝子変化ROSタンパク質発現の検出をin vivoで可能にし、抽出物を得るために例えば腫瘍試料から得られた細胞の操作によって生じる活性の人為的変化の危険性を回避するためである。したがって、一部の好ましい実施形態では、本発明の方法を、フローサイトメトリー(FC)、免疫組織化学(IHC)または免疫蛍光(IF)アッセイフォーマットで実施する。
【0136】
フローサイトメトリー(FC)は、ROSキナーゼ活性の阻害をターゲットとする薬物での治療前、その間およびその後に、哺乳動物腫瘍における遺伝子変化ROSタンパク質の発現を決定するために使用することができる。例えば、微細針吸引液からの腫瘍細胞を、フローサイトメトリーによって、SLC34A2−ROS融合ポリペプチド発現またはCD74−ROS融合ポリペプチド発現および/または活性化について、さらに所望ならば、がん細胞型などを同定するためのマーカーについて分析することができる。フローサイトメトリーは、標準的な方法に従って実施することができる。例えば、Chowら、Cytometry(Communications in Clinical Cytometry)46:72〜78(2001)を参照されたい。簡単には例えば、サイトメトリー分析のための次のプロトコルを使用することができる:細胞を2%パラホルムアルデヒドで37℃で10分間固定し、続いて、90%メタノール中、氷上で30分間、透過処理する。次いで、細胞を一次ROSポリペプチド特異的抗体で染色し、洗浄し、蛍光標識二次抗体で標識することができる。次いで、細胞をフローサイトメーター(例えば、Beckman Coulter FC500)で、使用される装置の特異的なプロトコルに従って分析する。そのような分析によって、腫瘍において発現されたSLC34A2−ROS融合ポリペプチドまたはCD74−ROS融合ポリペプチドのレベルを同定する。ROS阻害治療薬で腫瘍を治療した後の同様の分析によって、ROSキナーゼの標的阻害薬に対するSLC34A2−ROS融合ポリペプチド発現腫瘍またはCD74−ROS融合ポリペプチド発現腫瘍の応答性が明らかになるであろう。
【0137】
免疫組織化学的(IHC)染色もまた、ROSキナーゼ活性の阻害をターゲットとする薬物での治療前、その間およびその後に、哺乳動物のがん(例えば、NSCLC)における遺伝子変化ROSタンパク質の発現および/または活性化状態を決定するために使用することができる。IHCは、よく知られている技術に従って実施することができる(例えば、ANTIBODIES:A LABORATORY MANUAL、Chapter 10、Harlow & Lane Eds.、Cold Spring Harbor Laboratory(1988)を参照されたい)。簡単には例えば、パラフィン包埋組織(例えば、生検からの腫瘍組織)を免疫組織化学的染色のために、キシレンで、続いて、エタノールで組織切片を脱パラフィン処理し;水中、次いで、PBS中で水和させ;クエン酸ナトリウム緩衝液中でスライドを加熱することによって抗原をアンマスク処理し;過酸化水素中で切片をインキュベートし;ブロッキング溶液中でブロッキングし;一次抗SLC34A2−ROS融合ポリペプチド抗体または抗CD74−ROS融合ポリペプチド抗体および二次抗体中でスライドをインキュベートし;かつ最後に、製造者の指示に従って、ABCアビジン/ビオチン方法を使用して検出することによって調製する。免疫蛍光(IF)アッセイもまた、ROSキナーゼ活性の阻害をターゲットとする薬物での治療前、その間およびその後に、哺乳動物のがんにおけるSLC34A2−ROS融合ポリペプチドまたはCD74−ROS融合ポリペプチドの発現および/または活性化状態を決定するために使用することができる。IFは、よく知られている技術に従って実施することができる。例えば、J.M.PolakおよびS.Van Noorden(1997) INTRODUCTION TO IMMUNOCYTOCHEMISTRY、第2版;ROYAL MICROSCOPY SOCIETY MICROSCOPY HANDBOOK 37、BioScientific/Springer−Verlagを参照されたい。簡単には例えば、患者試料をパラホルムアルデヒド中、続いて、メタノール中で固定し、ウマ血清などのブロッキング溶液でブロックし、SLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドまたはFIG−ROS融合ポリペプチドに対する一次抗体で、続いて、Alexa 488などの蛍光染料で標識された二次抗体と共にインキュベートし、落射蛍光顕微鏡で分析することができる。
【0138】
上記アッセイで使用される抗体を有利には他のシグナル伝達(EGFR、ホスホ−AKT、ホスホ−Erk1/2)および/または細胞マーカー(サイトケラチン)抗体と共にマルチパラメトリック分析において使用するために、蛍光染料(例えば、Alexa488、PE)または量子ドットなどの他の標識に結合させることができる。遺伝子変化ROSポリペプチドを測定するための酵素結合免疫吸着検定法(ELISA)、ラジオイムノアッセイ(RIA)および蛍光標識細胞分取(FACS)を包含する様々な他のプロトコルが当分野では知られており、SLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドまたはFIG−ROS融合ポリペプチド発現レベルの変化または異常を診断するための基礎を提供している。SLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドまたはFIG−ROS融合ポリペプチド発現の正常または標準的な値は、正常な哺乳動物対象、好ましくはヒトから採取された体液または細胞抽出物と、複合体形成に適した条件下でのSLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドまたはFIG−ROS融合ポリペプチドに対する抗体との組み合わせによって確立される。標準的な複合体形成の量は、様々な方法によって、しかし好ましくは測光の手段によって定量化され得る。対象、対照および生検組織からの疾患試料において発現されるSLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドまたはFIG−ROS融合ポリペプチドの量を標準的な値と比較する。標準値と対象値との偏差によって、疾患を診断するためのパラメーターが確立される。
【0139】
ペプチドおよびヌクレオチドアッセイ
上記のSection Eにおいて詳述したとおりに、同様に、腫瘍からの細胞を含む生体試料中で発現される遺伝子変化ROSポリペプチドを検出/定量化するためのAQUAペプチドを調製し、標準的なAQUAアッセイにおいて使用することができる。したがって、本発明の方法の一部の好ましい実施形態では、ROSポリペプチド特異的試薬は、SLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドまたはFIG−ROS融合ポリペプチドの融合結合を含むペプチド配列に対応する重同位体標識ホスホペプチド(AQUAペプチド)を含む。本発明の方法を実施する際に有用なROSポリペプチド特異的試薬はまた、生体試料において融合または切断されたポリペプチド発現転写物に直接ハイブリダイズし、検出し得るmRNA、オリゴヌクレオチドまたはDNAプローブであってよい。
【0140】
簡単には例えば、ホルマリン固定、パラフィン包埋患者試料を、フルオレセイン標識されたRNAプローブでプローブし、続いて、ホルムアミド、SSCおよびPBSで洗浄し、蛍光顕微鏡で分析することができる。遺伝子変化ROSポリペプチドをコードするポリヌクレオチドもまた、診断目的で使用することができる。使用することができるポリヌクレオチドには、オリゴヌクレオチド配列、アンチセンスRNAおよびDNA分子ならびにPNAが包含される。ポリヌクレオチドを使用して、SLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドまたは欠失ROSポリペプチドの発現が疾患と相関し得る生検組織において、遺伝子発現を検出および定量することができる。診断アッセイを使用して、SLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドまたは欠失ROSポリペプチドの不在、存在および過剰発現を区別し、治療的に介入している間のSLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドまたは欠失ROSポリペプチドレベルの調節を監視することができる。好ましい一実施形態では、SLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドもしくはFIG−ROS融合ポリペプチドまたは近縁の分子をコードするゲノム配列を包含するポリヌクレオチド配列を検出することができるPCRプローブとのハイブリダイゼーションを使用して、遺伝子変化ROSポリペプチドをコードする核酸配列を同定することができる。そのようなプローブの構築および使用は当業者に知られており、米国特許出願公開第2010/0221737号に記載されている。
【0141】
高度に特異的な領域、例えば、融合結合に特有のヌクレオチドまたは特異性の低い領域、例えば、3’コーディング領域からなるかどうかのプローブの特異性と、ハイブリダイゼーションまたは増幅の厳密性(最大、高度、中程度、低度)とによって、そのプローブが遺伝子変化ROSポリペプチドをコードする天然に生じる配列、対立遺伝子または関連配列のみを同定するかどうかが決定される。プローブはまた、関連配列を検出するためにも使用することができ、好ましくは、遺伝子変化ROSポリペプチドをコードする配列のいずれかに由来するヌクレオチドのうちの少なくとも50%を含有すべきである。
【0142】
SLC34A2−ROS融合ポリヌクレオチド、CD74−ROS融合ポリヌクレオチドまたは欠失ROSポリヌクレオチドを、サザンまたはノーザン分析、ドットブロットまたは他の膜ベースの技術で;PCR技術で;または患者生検からの液体または組織を利用するディップスティック、ピン、ELISAまたはチップアッセイで使用して、遺伝子変化ROSポリペプチド発現を検出することができる。そのような定性または定量方法は、当分野でよく知られている。特定の態様では、遺伝子変化ROSポリペプチドをコードするヌクレオチド配列は、NSCLCを包含する肺がんを包含する様々ながんの活性化または誘発を検出するアッセイにおいて有用であり得る。遺伝子変化ROSポリヌクレオチドを標準的な方法によって標識し、ハイブリダイゼーション複合体を形成するために適した条件下で患者からの液体または組織試料に加えることができる。適切なインキュベーション期間の後に、試料を洗浄し、シグナルを定量し、標準的な値と比較する。生検または抽出試料中でのシグナルの量が比較可能な対照試料の量から有意に変化していたら、ヌクレオチド配列は試料中のヌクレオチド配列とハイブリダイズしていて、試料においてSLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドまたは欠失ROSポリペプチドをコードするヌクレオチド配列のレベル変化が存在することは、関連する疾患の存在を示している。そのようなアッセイはまた、動物研究、臨床試験または個々の患者の治療の監視において特定の治療的処置レジメンの効力を評価するために使用することができる。
【0143】
遺伝子変化ROSポリペプチドの発現によって特徴付けられる疾患を診断するためのベースを得るために、発現に関する正常または標準プロファイルを確立する。これは、動物またはヒトのいずれかの正常な対象から採取された体液または細胞抽出物を、SLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドまたは欠失ROSポリペプチド(例えば、FIG−ROS融合ポリペプチド)をコードする配列またはその断片と、ハイブリダイゼーションまたは増幅に適した条件下で組み合わせることによって達成され得る。標準的なハイブリダイゼーションは、正常な対象から得られた値と、実験からの値とを比較することによって定量化することができ、その際、既知の量の十分に精製されたポリヌクレオチドを使用する。正常な試料から得られた標準的な値を、疾患の症候を有する患者からの試料から得られた値と比較することができる。標準と対象との値の偏差を使用して、疾患の存在を確認する。
【0144】
疾患を確認し、治療プロトコルを開始したら、ハイブリダイゼーションアッセイを定期的に繰り返して、患者における発現レベルが、正常患者において観察されるレベルに近づき始めているかどうかを評価することができる。連続したアッセイから得られた結果を使用して、数日から数ヶ月の範囲の期間にわたって治療の効果を見ることができる。
【0145】
遺伝子変化ROSポリヌクレオチドに関する追加的な診断用の使用は、ポリメラーゼ連鎖反応(PCR)、当業者には標準的な他の好ましいアッセイフォーマットを使用することを必要とすることがある(例えば、MOLECULAR CLONING、A LABORATORY MANUAL、第2版、Sambrook,J.、Fritsch,E.F.およびManiatis,T.編、Cold Spring Harbor Laboratory Press、Cold Spring Harbor、N.Y.(1989)を参照されたい)。PCRオリゴマーは、化学的に合成するか、酵素によって生じさせるか、または組換え源から製造することができる。オリゴマーは好ましくは、一方はセンスオリエンテーション(5’から3’)を有し、他方はアンチセンス(3’から5’)を有する2つのヌクレオチド配列からなり、特異的遺伝子または状態を同定するために最適化された条件下で使用される。同じ2つのオリゴマー、重なったオリゴマーセットまたはオリゴマーの変性プール(degenerate pool)を近縁のDNAまたはRNA配列を検出および/または定量するために、厳密性の低い条件下で使用することができる。
【0146】
SLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドまたは欠失ROSポリペプチドの発現を定量するために使用することもできる方法には、ヌクレオチドの放射性標識またはビオチン化、対照核酸の同時増幅および実験結果が挿入される標準曲線が包含される(Melbyら、J.Immunol.Methods、159:235〜244(1993);Duplaaら、Anal.Biochem.229〜236(1993))。多数の試料を定量する速度を、該当するオリゴマーが様々な希釈で与えられ、分光光度計または比色計の応答が迅速な定量をもたらすELISAフォーマットでアッセイを作動させることによって加速することができる。
【0147】
遺伝子変化ROSポリヌクレオチドを使用して、天然に生じるゲノム配列をマッピングするために有用なハイブリダイゼーションプローブを生じさせることができる。よく知られている技術を使用して、配列を、特定の染色体または特定の染色体領域にマッピングすることができる。そのような技術には、蛍光in−situハイブリダイゼーション(FISH)、FACSまたは酵母人工染色体、細菌人工染色体、細菌P1構造もしくは単一染色体cDNAライブラリなどの人工染色体構造が包含され、Price,C.M.、Blood Rev.7:127〜134(1993)およびTrask,B.J.、Trends Genet.7:149〜154(1991)に概説されている。非限定的な一実施形態では、FISHを使用し(Vermaら、HUMAN CHROMOSOMES:A MANUAL OF BASIC TECHNIQUES、Pergamon Press、New York、N.Y.(1988)に記載されているとおり)、他の物理的染色体マッピング技術および遺伝子地図データと相関させることができる。遺伝子地図データの例は、1994 Genome Issue of Science(265:1981〜)において見出すことができる。物理的染色体地図上でのSLC34A2−ROS融合ポリヌクレオチド、CD74−ROS融合ポリヌクレオチドまたは欠失ROSポリヌクレオチドをコードする遺伝子の位置と具体的な疾患との相関または具体的な疾患に対する素因が、その遺伝的疾患に関連するDNAの領域を区切るのに役立ち得る。ヌクレオチド配列を使用して、正常か、保因者か、または罹患している個体における遺伝子配列の差違を検出することができる。
【0148】
染色体標本のin situハイブリダイゼーションおよび確立されている染色体マーカーを使用する連関分析などの物理的マッピング技術を使用して、遺伝子地図を拡大することができる。多くの場合に、マウスなどの他の哺乳動物種の染色体に遺伝子を置くと、特定のヒト染色体の数またはアームが未知の場合にも、関連マーカーを明らかにすることができる。物理的マッピングによって、新たな配列を、染色体アームまたはその一部に割り当てることができる。これは、ポジショナルクローニングまたは他の遺伝子発見技術を使用して疾患遺伝子をサーチしている研究者に価値ある情報を提供する。
【0149】
遺伝子変化ROSポリヌクレオチドを検出する方法(例えば、PCRおよびFISH)は全て、遺伝子変化ROSポリヌクレオチドまたは遺伝子変化ROSポリペプチドを検出する他の方法と組み合わせることができることは理解されるであろう。例えば、生体試料(例えば、循環腫瘍細胞)の遺伝子材料におけるSLC34A2−ROSポリヌクレオチドの検出に、試料のタンパク質のウェスタンブロット分析または免疫組織化学(IHC)分析を続けて、SLC34A2−ROSポリヌクレオチドが生体試料においてSLC34A2−ROSポリペプチドとして実際に発現されているかどうかを決定することができる。そのようなウェスタンブロットまたはIHC分析は、検出されたSLC34A2−ROSポリヌクレオチドによってコードされるポリペプチドに特異的に結合する抗体を使用して行うことができるか、または分析は、全長SLC34A2(例えば、タンパク質のN末端に結合)または全長ROS(例えば、ROSのキナーゼドメインのエピトープに結合)のいずれかに特異的に結合する抗体を使用して行うことができる。そのようなアッセイは、当分野で知られている(例えば、米国特許第7,468,252号を参照されたい)。
【0150】
ROSキナーゼ治療薬
遺伝子変化ROSポリペプチドは、ヒトNSCLCの少なくとも1つのサブグループにおいて生じることが判明している(Rikovaら、Cell 131:1190〜1203(2007)を参照されたい)。したがって、少なくとも1つのROS融合タンパク質(例えばSLC34A2−ROS融合タンパク質)が発現される哺乳動物のがん(例えばNSCLC)の進行は、そのようながんにおけるROSキナーゼの活性を阻害することによって、またはそのようながんにおけるROSキナーゼの発現を阻害することによってin vivoで阻害することができる。突然変異ROSキナーゼの発現によって特徴付けられるがんにおけるROS活性は、がん(例えば腫瘍)をROSキナーゼ治療薬と接触させることによって阻害することができる。
【0151】
ROSキナーゼ治療薬は、下記のROSキナーゼ阻害薬化合物を包含するROSキナーゼの発現および/または活性をin vivoで直接的または間接的に阻害する少なくとも1つの化合物、生物学的製剤または化学的製剤を含む任意の組成物であってよい。そのような化合物には、ROSキナーゼ自体に、またはROSの活性を変えるタンパク質もしくは分子に直接働くか、またはROSの発現を阻害することによって間接的に働く治療薬が包含される。そのような組成物にはまた、単一のROSキナーゼ阻害性化合物のみを含む組成物、さらに、化学療法薬または一般的な転写阻害薬などの非特異的治療薬も包含してよい多数の治療薬(他のRTKに対するものを包含)を含む組成物も包含される。
【0152】
低分子ROSキナーゼ阻害薬
本発明の方法を実施する際に有用なROSキナーゼ治療薬は、低分子ROSキナーゼ阻害薬である。低分子キナーゼ阻害薬は典型的には、酵素の触媒部位に特異的に、かつ多くの場合に不可逆的に結合することによって、かつ/または酵素内のATP結合溝または他の結合部位に結合して、酵素がその活性に必要な構造を取り込むことを妨げることによってその標的酵素の活性を阻害する一群の分子である。低分子ROSキナーゼ阻害薬は、ROSキナーゼ三次元構造のX線結晶学的またはコンピューターモデリングを使用して合理的に設計することができるか、またはROSを阻害するための化合物ライブラリのハイスループットスクリーニングによって見出すことができる。そのような方法は、当分野でよく知られており、記載されている。ROS阻害の特異性は例えば、キナーゼのパネルにおいてそのような化合物が他のキナーゼ活性ではなく、ROS活性を阻害する能力を検査することによって、かつ/またはROS融合タンパク質を発現することが知られているか、または発現が変化している腫瘍細胞を含む生体試料においてROS活性の阻害を検査することによって確認することができる。
【0153】
ROSキナーゼ治療薬として有用であることが本明細書で示されている低分子ROS阻害薬の例には、それらが開示しているその全体がそれぞれ参照によって本明細書に組み込まれる米国特許第7230098号、米国特許第7,858,643号およびWO2006/021881に開示されている種類のアミノ−ピリジンおよびアミノ−ピラジン化合物が包含される。特に、ROSキナーゼ治療薬として本発明に関連して有用なアミノ−ピリジンおよびアミノ−ピラジン化合物には、下記一般式の化合物または薬学的に許容できるその塩が包含される:
【0154】
【化15】

[式中、Y、R1、R2およびA1は、米国特許第7,230,098号に記載されている一般的な意味を有する]。より具体的には、ROSキナーゼ治療薬として本発明に関連して有用なアミノ−ピリジンおよびアミノ−ピラジン化合物には、下記一般式の化合物または薬学的に許容できるその塩が包含される:
【0155】
【化16】

[式中、Y、R1およびR2は、米国特許第7,858,643号に記載されているとおりの一般的な意味を有する]。上記の種類のアミノ−ピリジンおよびアミノ−ピラジン化合物は、ROSキナーゼ阻害薬であることが判明しており、したがって、本発明に関連してROSキナーゼ治療薬として有用である。特に、がんが遺伝子変化ROSキナーゼ(例えば、SLC34A2−ROS、CD74−ROSまたはFIG−ROS)について陽性であると判明している場合、そのような化合物は、がんの治療を必要とする患者に投与することができる。
【0156】
特に好ましい化合物の1種は、その調製が米国特許第7,858,643号に記載されている式1によって表される化合物3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミン(クリゾチニブ)である:
【0157】
【化17】

(McDermott,U.ら、Proc.Natl.Acad.Sci.104、19936〜19941(2007)も参照されたい)。式1の化合物は、それぞれその内容全体が、参照によって本明細書に組み込まれる国際特許公開WO2006/021884および米国特許出願公開第2006/0046991号に開示されている。加えて、式1の化合物のラセミ化合物は、それぞれその内容全体が、参照によって本明細書に組み込まれる国際特許公開WO2006/021881および米国特許出願公開第2006/0128724号に開示されている。
【0158】
c−Met/HGFR阻害薬としてもともとは設計されたクリゾチニブは本明細書において、ROSキナーゼに対して活性であり、したがって、本明細書に記載されているROS融合タンパク質およびROS欠失タンパク質に対して活性であることが判明した。クリゾチニブは、ROS触媒活性でのその効果について、酵素および細胞ベースアッセイの両方において評価された。本明細書に示されているデータは、クリゾチニブが、組換えヒトROS−1キナーゼ(触媒ドメイン)の有効なATP拮抗阻害薬であることを示している。
【0159】
下記のROS−1酵素アッセイによって、0.097nMの平均Ki値(n=4)が得られた。クリゾチニブは、構成的に活性なSLC34A2−ROS融合タンパク質の発現をもたらす4p15、6q22染色体転座事象を示すHCC78細胞(Rikovaら、(2007))において、41nMの平均IC50値(n=11)でROSリン酸化を用量依存的に阻害した(表1、図1)。クリゾチニブはまた、FIG−ROS融合を内包するU138MGヒト神経膠芽細胞腫細胞(Charestら、(2003))において、49nMの平均IC50値(n=2)でROSリン酸化を用量依存的に阻害した(表1、図1)。
【0160】
CD74−ROS、FIG−ROS(S)、FIG−ROS(L)、SLC34A2−ROS(S)およびSLC34A2−ROS(L)を包含する様々なROS−融合タンパク質を発現するように操作された3T3細胞系のパネルにおいて、クリゾチニブは、3.4nMから36nMの範囲のIC50値でROSリン酸化を阻害した(表1)。
【0161】
クリゾチニブを、構成的に活性なSLC34A2−ROS融合タンパク質の発現をもたらす4p15、6q22染色体転座事象を示すHCC78(Rikovaら、(2007))の細胞生存力に対するその効果について評価した。クリゾチニブは、HCC78細胞生存力の濃度依存的阻害を示した(図2)。HCC78細胞生存力の阻害に関して算出されたIC50値は、ほぼ59nMであった。これらの結果は、HCC78細胞が細胞増殖および生存力に関してROS融合に依存していること、およびクリゾチニブがROS依存性細胞の増殖および生存力の有効な阻害薬であることを示唆している。
【0162】
分子レベルでは、構成的に活性化されたROS融合キナーゼは、RTK触媒活性および制御基質のドッキングを調節する細胞内領域で多数のチロシン残基のリン酸化を誘発する。抗腫瘍作用機構のさらなる理解を得、ROSキナーゼ活性の阻害が下方のシグナル伝達と相関していることを確認するために、クリゾチニブを、HCC78ヒトNSCLC細胞におけるSLC34A2−ROS依存性シグナル伝達経路を阻害するその能力について評価した。クリゾチニブはHCC78細胞においてin vitroで、ROSリン酸化(活性化ループ)、さらに、SHP2、STAT3、AKTおよびERK1/2を包含する下方のアダプターまたはシグナル伝達分子を用量依存的に阻害した(図3)。これらの結果は、重要なシグナル伝達経路とクリゾチニブの有効な用量との相関を示している。
【0163】
クリゾチニブを、HCC78ヒトNSCLC細胞において細胞アポトーシスを誘発するその能力についてさらに評価した。クリゾチニブは、HCC78NSCLC細胞において活性化カスパーゼ3レベルの用量依存的誘発を示したが(図4)、このことは、アポトーシスの上昇はまた、有効な用量レベルと相関していることを示している。
【0164】
クリゾチニブの抗腫瘍効力を、ROS融合操作された腫瘍異種移植片モデルのパネルにおいて評価した。CD74−ROS、ヒトNSCLCで同定されているSLC34A2−ROSのロング型およびショート型変異体ならびにヒトNSCLC、神経膠芽細胞腫および胆管がんで同定されているFig−ROSのロング型およびショート型変異体を包含するROS染色体転座が関与しているヒトがん適応症を代表する腫瘍異種移植片をNIH3T3細胞において操作した(Rimkunasら(2012);Guら、(2011))。クリゾチニブは、75/mg PO BIDの投与レジメンで、3T3−ROS操作された腫瘍モデルの全てにおいて有意な細胞減少性効果を示した(図5)。
【0165】
in vivoでROSリン酸化および腫瘍増殖を阻害するクリゾチニブの能力を、ヌードマウスにおいて3T3−CD74−ROSおよび3T3−SLC34A2−ROS(L)異種移植片モデルで評価した。クリゾチニブは、160mg/kg/日(80mg/kg BID)、80mg/kg/日(40mg/kg BID)、40mg/kg/日(20mg/kg BID)および20mg/kg/日(10mg/kg BID)の用量で、3T3−CD74−Ros腫瘍異種移植片において腫瘍増殖の用量依存的阻害を示した(図6B)。クリゾチニブはまた、全ての治療群にわたって3T3−CD74−Ros腫瘍でのROSリン酸化の有意な阻害を示した(図6A)。クリゾチニブによる同様の抗腫瘍効力が、3T3−SLC34A2−ROS(L)異種移植片モデルにおいて観察された(図7)。
【0166】
投与経路および剤形
経口投与
本発明の化合物は、経口投与することができる。経口投与は、化合物が胃腸管に入るような嚥下を伴ってもよいか、または化合物が口から直接、血流に入る頬側または舌下投与を使用することもできる。
【0167】
経口投与に適している製剤には、錠剤などの固体製剤、微粒子、液体または粉末を含有するカプセル剤、ロゼンジ剤(液体充填を包含)、チューイング剤、マルチおよびナノ粒子剤、ゲル剤、固溶体、リポソーム剤、フィルム剤(粘膜付着剤を包含)、膣坐剤、噴霧剤、液体製剤が包含される。
【0168】
液体製剤には、懸濁剤、液剤、シロップ剤およびエリキシル剤が包含される。そのような製剤は、軟質カプセルまたは硬質カプセル中の充填剤として使用することもでき、典型的には、薬学的に許容できる担体、例えば水、エタノール、ポリエチレングリコール、プロピレングリコール、メチルセルロースまたは適切なオイルならびに1種または複数の乳化剤および/または懸濁化剤を包含する。液体製剤はまた、固体、例えばサシェからの再構成によって調製することもできる。
【0169】
本発明の化合物はまた、その開示全体が参照によって本明細書に組み込まれるLiangおよびChenによるExpert Opinion in Therapeutic Patents、11(6)、981〜986(2001)に記載されている剤形などの急速溶解、急速分解剤形で使用することもできる。
【0170】
錠剤剤形では、用量に応じて、薬物は、剤形の1重量%から80重量%、より典型的には剤形の5重量%から60重量%を構成していてよい。薬物に加えて、錠剤は通常、崩壊剤を含有する。崩壊剤の例には、デンプングリコール酸ナトリウム、カルボキシメチルセルロースナトリウム、カルボキシメチルセルロースカルシウム、クロスカルメロースナトリウム、クロスポビドン、ポリビニルピロリドン、メチルセルロース、微結晶性セルロース、低級アルキル置換ヒドロキシプロピルセルロース、デンプン、α化デンプンおよびアルギン酸ナトリウムが包含される。通常、崩壊剤は、剤形の1重量%から25重量%、好ましくは5重量%から20重量%を構成している。
【0171】
通常は結合剤を使用して、錠剤製剤に粘着性を付与する。適切な結合剤には、微結晶性セルロース、ゼラチン、糖、ポリエチレングリコール、天然および合成ゴム、ポリビニルピロリドン、α化デンプン、ヒドロキシプロピルセルロースならびにヒドロキシプロピルメチルセルロースが包含される。錠剤はまた、ラクトース(一水和物、噴霧乾燥一水和物、無水物など)、マンニトール、キシリトール、デキストロース、スクロース、ソルビトール、微結晶性セルロース、デンプンおよび二塩基性リン酸カルシウム二水和物などの希釈剤を含有してもよい。
【0172】
錠剤はまた、ラウリル硫酸ナトリウムおよびポリソルベート80などの界面活性剤ならびに二酸化ケイ素およびタルクなどの流動促進剤を包含してもよい。存在する場合には、界面活性剤は典型的には、錠剤の0.2重量%から5重量%の量であり、流動促進剤は典型的には、錠剤の0.2重量%から1重量%の量である。
【0173】
また錠剤は通常、ステアリン酸マグネシウム、ステアリン酸カルシウム、ステアリン酸亜鉛、ステアリルフマル酸ナトリウムおよびステアリン酸マグネシウムとラウリル硫酸ナトリウムとの混合物などの滑沢剤を含有する。滑沢剤は通常、錠剤の0.25重量%から10重量%、好ましくは0.5重量%から3重量%の量で存在する。
【0174】
他の慣用の成分には、抗酸化剤、着色剤、香味剤、保存剤および矯味剤が包含される。
【0175】
例示的な錠剤は、薬物約80重量%まで、結合剤約10重量%から約90重量%、希釈剤約0重量%から約85重量%、崩壊剤約2重量%から約10重量%および滑沢剤約0.25重量%から約10重量%を含有する。
【0176】
錠剤ブレンドを、直接か、またはローラーによって圧縮して、錠剤を形成することができる。別法では、錠剤ブレンドまたは一部のブレンドを湿潤、乾燥または溶融顆粒化するか、溶融凝固させるか、または押し出し、その後に製錠することができる。最終製剤は、1つまたは複数の層を包含してよく、コーティングされているか、もしくはコーティングされてなくてよいか、またはカプセル封入されていてよい。
【0177】
錠剤の製剤は、その開示全体が参照によって本明細書に組み込まれるH.LiebermanおよびL.Lachmanによる「Pharmaceutical Dosage Forms:Tablets」、Vol.1、Marcel Dekker、N.Y、N.Y、1980(ISBN 0−8247−6918−X)で詳細に検討されている。
【0178】
経口投与のための固体製剤は、即時および/または変更放出であるように製剤化することができる。変更放出製剤には、遅延放出、持続放出、パルス放出、調節放出、ターゲット放出およびプログラム放出が包含される。
【0179】
適切な変更放出製剤は、米国特許第6,106,864号に記載されている。高エネルギー分散液および浸透性のコーティングされた粒子などの他の適切な放出技術の詳細は、Vermaらによる「Pharmaceutical Technology On−line」、25(2)、1〜14(2001)に見出すことができる。調節放出を達成するためにチューインガムを使用することは、WO00/35298に記載されている。これらの参照文献の開示はその全体が参照によって本明細書に組み込まれる。
【0180】
非経口投与
本発明の化合物はまた、血流中、筋肉中または内臓に直接投与することもできる。非経口投与に適している手段には、静脈内、動脈内、腹腔内、クモ膜下、心室内、尿管内、胸骨内、頭蓋内、筋肉内および皮下が包含される。非経口投与のための適切なデバイスには、針(微細針を包含する)注射器、無針注射器および点滴技術が包含される。
【0181】
非経口製剤は典型的には、塩、炭水化物および緩衝剤(好ましくはpH3から9に)などの添加剤を含有してよい水溶液であるが、いくつかの用途では、これらをより適切に、無菌非水溶液として、または無菌の発熱物質不含水などの適切なビヒクルと共に使用される乾燥形態として製剤化することができる。
【0182】
例えば、凍結乾燥による無菌条件下での非経口製剤の調製は、当業者によく知られている標準的な製薬技術を使用して容易に達成することができる。
【0183】
非経口溶液を調製する際に使用される本発明の化合物の溶解性は、溶解性増強剤を導入するなどの適切な製剤技術を使用することによって高めることができる。
【0184】
非経口投与のための製剤は、即時および/または変更放出であるように製剤化することができる。変更放出製剤には、遅延放出、持続放出、パルス放出、調節放出、ターゲット放出およびプログラム放出が包含される。したがって本発明の化合物を、活性化合物の変更放出をもたらす移植デポーとして投与するための固体、半固体もしくはチキソトロピー液として製剤化することができる。そのような製剤の例には、薬物コーティングされたステントおよびPGLAマイクロスフェアが包含される。
【0185】
局所投与
本発明の化合物はまた、皮膚または粘膜に局所で、即ち皮膚または経皮で投与することもできる。この目的のための典型的な製剤には、ゲル剤、ヒドロゲル剤、ローション剤、液剤、クリーム剤、軟膏剤、散布剤、包帯、フォーム剤、フィルム剤、皮膚パッチ剤、ウェハ剤、インプラント剤、スポンジ、繊維、帯具およびマイクロエマルション剤が包含される。リポソームもまた使用することができる。典型的な担体には、アルコール、水、鉱油、流動ワセリン、白色ワセリン、グリセリン、ポリエチレングリコールおよびプロピレングリコールが包含される。透過促進剤を導入することもできる。例えば、FinninおよびMorganによるJ.Pharm.Sci、88(10)、955〜958(1999年10月)を参照されたい。局所投与の他の手段には、電気穿孔法、イオン導入法、音波泳動法、音泳動法および微細針または無針(例えば、Powderject(商標)、Bioject(商標)など)注射による送達が包含される。これらの参照文献の開示はその全体が、参照によって本明細書に組み込まれる。
【0186】
局所投与のための製剤は、即時および/または変更放出であるように製剤化することができる。変更放出製剤には、遅延放出、持続放出、パルス放出、調節放出、ターゲット放出およびプログラム放出が包含される。
【0187】
吸入/鼻腔内投与
本発明の化合物はまた、鼻腔内または吸入により、典型的には乾燥粉末の形態(単独で、混合物として、例えば、ラクトースとの乾燥ブレンドで、または混合成分粒子として、例えば、ホスファチジルコリンなどのリン脂質と混合して)で、乾燥粉末吸入器から、またはエアロゾルスプレーとして、加圧容器、ポンプ、スプレー、噴霧器(好ましくは、微細な霧を生じさせるために電磁流体力学を使用する噴霧器)またはネブライザから、1,1,1,2−テトラフルオロエタンまたは1,1,1,2,3,3,3−ヘプタフルオロプロパンなどの適切な噴射剤を使用して、もしくは使用せずに投与することができる。鼻腔内使用では、散剤は、生体用粘着剤、例えば、キトサンまたはシクロデキストリンを包含してもよい。
【0188】
加圧容器、ポンプ、スプレー、噴霧器またはネブライザは、例えば、エタノール、エタノール水溶液または活性剤の分散、可溶化もしくはその放出の延長のために適している別の薬剤、溶媒としての噴射剤およびトリオレイン酸ソルビタン、オレイン酸もしくはオリゴ乳酸などの任意選択の界面活性剤を含む本発明の化合物(複数可)の溶液または懸濁液を含有する。
【0189】
乾燥散剤または懸濁液製剤で使用する前に、薬物生成物を、吸入により送達するために適したサイズ(典型的には5ミクロン未満)まで超微粉砕する。これは、スパイラルジェット粉砕、流動床ジェット粉砕、ナノ粒子を形成するための臨界液体処理、高圧均一化または噴霧乾燥などの任意の適切な粉砕方法により達成することができる。
【0190】
吸入器または注入器で使用するためのカプセル(例えば、ゼラチンまたはHPMC製)、ブリスターおよびカートリッジを、本発明の化合物、ラクトースまたはデンプンなどの適切な散剤基剤およびl−ロイシン、マンニトールまたはステアリン酸マグネシウムなどの性能改良剤の粉末混合物を含有するように製剤化することができる。ラクトースは、無水であってよいか、または一水和物の形態であってよいが、後者が好ましい。他の適切な賦形剤には、デキストラン、グルコース、マルトース、ソルビトール、キシリトール、フルクトース、スクロースおよびトレハロースが包含される。
【0191】
微細な霧を発生させるために電磁流体力学を使用する噴霧器で使用するために適している液剤は、動作1回当たり本発明の化合物1μgから20mgを含有してよく、その動作体積は、1μlから100μlまで変動してよい。典型的な製剤は、本発明の化合物、プロピレングリコール、無菌水、エタノールおよび塩化ナトリウムを包含する。プロピレングリコールの代わりに使用することができる別の溶媒には、グリセロールおよびポリエチレングリコールが包含される。
【0192】
メントールおよびレボメントールなどの適切な香味剤またはサッカリンもしくはサッカリンナトリウムなどの甘味剤を、吸入/鼻腔内投与を意図されている本発明の製剤に加えることができる。
【0193】
吸入/鼻腔内投与のための製剤は、例えば、ポリ(DL−乳酸−グリコール酸共重合体(PGLA)を使用して、即時および/または変更放出であるように製剤化することができる。変更放出製剤には、遅延放出、持続放出、パルス放出、調節放出、ターゲット放出およびプログラム放出が包含される。
【0194】
乾燥散剤吸入器およびエアロゾルの場合、投薬単位は、計測量を送達するバルブ手段により決定される。本発明による単位は典型的には、所望の量の本発明の化合物を含有する計測用量または「パフ」を投与するように設計される。全1日用量を単回用量で、またはより通常は、1日を通して分けた用量として投与することができる。
【0195】
直腸/膣内投与
本発明の化合物は、例えば、坐剤、膣坐剤または浣腸剤の形態で直腸または膣投与することができる。カカオバターは、慣用的な坐剤基剤であるが、様々な代替物を適宜使用することができる。
【0196】
直腸/膣投与のための製剤を、即時および/または変更放出であるように製剤化することができる。変更放出製剤には、遅延放出、持続放出、パルス放出、調節放出、ターゲット放出およびプログラム放出が包含される。
【0197】
眼投与
本発明の化合物はまた、典型的には等張性pH調節無菌食塩水中の超微粉砕された懸濁液または溶液の液滴の形態で、眼または耳に直接投与することもできる。眼および耳投与に適している他の製剤には、軟膏剤、生分解性(例えば、吸収性ゲルスポンジ、コラーゲン)および非生分解性(例えば、シリコーン)インプラント、ウェハ、レンズならびに粒子またはニオソームもしくはリポソームなどの小胞系が包含される。架橋ポリアクリル酸、ポリビニルアルコール、ヒアルロン酸、セルロース系ポリマー、例えば、ヒドロキシプロピルメチルセルロース、ヒドロキシエチルセルロースもしくはメチルセルロースまたはヘテロ多糖ポリマー、例えば、ゲランゴムなどのポリマーを、塩化ベンザルコニウムなどの保存剤と共に導入することができる。そのような製剤はまた、イオン泳動法によって送達することができる。
【0198】
眼/耳投与のための製剤は、即時および/または変更放出であるように製剤化することができる。変更放出製剤には、遅延放出、持続放出、パルス放出、調節放出、ターゲット放出またはプログラム放出が包含される。
【0199】
他の技術
前記の投与方法のいずれかで使用するために、本発明の化合物を、シクロデキストリンおよび適切なその誘導体などの溶解性高分子成分またはポリエチレングリコール含有ポリマーと組み合わせて、その溶解性、溶解速度、矯味、生物学的利用率および/または安定性を改良することができる。
【0200】
例えば、薬物−シクロデキストリン複合体は通常、多くの剤形および投与経路に有用であることが判明している。包接複合体と非包接複合体の両方を使用することができる。薬物との直接的な複合化の代わりに、シクロデキストリンを補助的添加剤、即ち、担体、希釈剤または可溶化剤として使用することができる。これらの目的のために最も一般的に使用されるのは、アルファ−、ベータ−およびガンマ−シクロデキストリンであり、この例は、その開示全体が参照によって本明細書に組み込まれるPCT公開WO91/11172、PCT公開WO94/02518およびPCT公開WO98/55148に見出すことができる。
【0201】
投薬
投与される活性化合物の量は、治療される対象、障害または状態の重症度、投与速度、化合物の素質および処方する医師の裁量に左右される。しかしながら、有効投薬量は典型的に、単回または分割用量で、体重1kg当たり1日当たり約0.001から約100mg、好ましくは約0.01から約35mg/kg/日の範囲である。70kgのヒトでは、これは、約0.07から約7000mg/日、好ましくは約0.7から約2500mg/日になる。場合によっては、前記の範囲の下限未満の投薬量レベルが、より適切であることもあり、他の場合では、有害な副作用を何ら誘発することなく、さらに多い用量を使用することもできるが、但し、そのようなさらに多い用量は典型的に、投与のために一日を通して複数のより小さな用量に分割される。
【0202】
パーツキット
例えば、特定の疾患または状態を治療する目的で、活性化合物の組み合わせを投与することが望ましい限り、そのうちの少なくとも1種は本発明による化合物を含有する2種以上の医薬組成物を簡便に、組成物を同時投与するのに適したキットの形態で組み合わせることができることは、本発明の範囲内である。したがって、本発明のキットは、そのうちの少なくとも1種は本発明による化合物を含有する2種以上の別々の医薬組成物と、コンテナ、分離ボトルまたは分離フォイルパケットなどの前記組成物を別々に保持するための手段とを包含する。そのようなキットの例は、錠剤、カプセル剤などをパッケージングするために使用される普通のブリスターパックである。
【0203】
本発明のキットは、例えば、経口および非経口の種々の剤形を投与するために、別々の組成物を異なる投薬間隔で投与するために、または相互に別々の組成物を力価測定するために特に適している。服薬遵守を補助するために、キットは典型的には、投与のための指示書または説明書を包含し、記憶補助体と共に提供され得る。そのような指示書または説明書は、「ラベル」またはパンフレットの形であってよい。さらにそのような指示書または説明書は、がんがROS陽性であるかどうか、または患者がROS陽性であるかどうかを決定するための診断検査に関連する情報を含有してよい。
【実施例】
【0204】
in−vitroアッセイ
材料および方法
In−Vitro方法
ROS−1酵素アッセイ
ROS−1酵素の阻害を、マイクロフルイディック移動度シフトアッセイを使用して測定した。反応を50μL体積で96ウェルプレート中で行ったが、これは、0.25nMのGST標識された組換えヒトROS−1触媒ドメイン(aa 1883−2347)(Invitrogen Inc)、1.5μMのホスホルアクセプターペプチド5’FAM−KKSRGDYMTMQIG−CONH2(Caliper LifeSciences)、試験化合物(11種の用量、3倍連続希釈、最終2%DMSO)またはDMSOのみ、1mMのDTT、0.002%のTween−20および5mMのMgCl2を25mMのHepes、pH7.1中に含有し、20分間の予備インキュベーションの後にATP(56μMの最終濃度、ほぼKmレベル)を加えることによって開始した。反応物を室温で1時間インキュベートし、次いで、0.1MのEDTA(pH8)を加えることによって停止した。反応の完了程度(DMSOで約5%の変換率)を、LabChip EZ Reader II(Caliper LifeSciences)で蛍光標識されたペプチド基質とリン酸化生成物とを電気泳動によって分離した後に決定した。各試験でのKi値を、非線形回帰方法(GraphPad Prism、GraphPad Software、San Diego、CA)および実験によって測定されたATP Km=56μMを使用して、変換%を拮抗的阻害に関する式に当てはめることによって算出した。4つの試験からなるパネルによって、0.097nMの平均Ki値が得られた。
【0205】
細胞系
HCC78細胞は、非小細胞肺癌と種別された肺腺癌を有する65歳の男性の胸膜滲出液から樹立されたヒト非小細胞肺癌細胞系である。HCC78細胞は、DSMZ cell bank(Braunschweig、Germany)から購入した。U138細胞およびNIH3T3細胞は、American Tissue Culture Corporation TCCから購入した。
【0206】
NIH3T3−ROS融合細胞系の作製
NIH3T3 ROS融合操作された細胞系を自家で作製した。ROS融合変異体SLC34A2−ROS(L)、SLC34A2−ROS(S)、CD74−ROS(L)、FIG−ROS(L)およびFIG−ROS(S)をレトロウイルスベクターpMSCV puro(Clontech)にクローニングした。pMSCVベクターおよびパッケージングプラスミドpC10A1を同時トランスフェクションすることによって、EML4−ALK遺伝子を担うレトロウイルスを293T細胞で生じさせた。レトロウイルス上清を使用して、NIH3T3細胞を形質導入し、貯留された集団を2μg/mlのピュロマイシンで5日間選択し、DNA塩基配列決定によって確認した後に、後続の実験で使用した。
【0207】
細胞でのキナーゼリン酸化アッセイ
クリゾチニブがリガンド依存性または構成的キナーゼリン酸化を阻害する能力を直接的に決定するために使用される細胞アッセイ(即ち、ELISAまたは免疫ブロット)を、様々な血清飢餓細胞を使用して行った。
【0208】
細胞ベースのホスホ−ROSELISAアッセイ
様々な種類のROS融合を内包する細胞系からなるパネルを使用して、ROSリン酸化に対するクリゾチニブの効力を決定した。細胞を増殖培地100μl中、20,000細胞/ウェルの密度で96ウェルプレートに播いた。ROS融合陰性細胞ウェルをバックグラウンドとして使用した。播かれた細胞を一晩付着させた。翌日、増殖培地を除去し、細胞を血清不含培地(0.04%のBSAを有する)中で培養した。クリゾチニブの連続希釈を行い、適切な対照または指定濃度のクリゾチニブを各ウェルに加え、細胞を37℃で1時間インキュベートした。細胞溶解産物を生じさせ、PathScan(登録商標)Phospho−Ros(panTyr)Sandwich ELISA Kit(Cell Signaling、Cat#:7093)を製造者のプロトコルに記載されているとおりに使用することによって、HCC78細胞におけるSLC34A2−ROSの全ホスホ−チロシンレベルを決定した。EC50値を、4パラメーター分析法を利用する濃度反応曲線フィッティングによって算出した。
【0209】
SLC34A2−ROSについての細胞ベースのホスホ−ROS ELISAアッセイ
SLC34A2−ROS融合を内包するHCC78細胞を使用して、ROSリン酸化に対するクリゾチニブの効力を決定した。HCC78細胞を、10%FBSおよびペニシリン/ストレプトマイシンを有するRPMI培地100μl中、20,000細胞/ウェルの密度で96ウェルプレートに播いた。細胞を含まないウェルをバックグラウンドとして使用した。播かれた細胞を一晩付着させた。翌日、増殖培地を除去し、細胞を血清不含培地(0.04%のBSAを有する)中で培養した。クリゾチニブの連続希釈を行い、適切な対照または指定濃度のクリゾチニブを各ウェルに加え、細胞を37℃で1時間インキュベートした。細胞溶解産物を生じさせ、PathScan(登録商標)Phospho−Ros(panTyr)Sandwich ELISA Kit(Cell Signaling、Cat#:7093)を製造者のプロトコルに記載されているとおりに使用することによって、HCC78細胞におけるSLC34A2−ROSの全ホスホ−チロシンレベルを決定した。IC50値を、4パラメーター分析法を利用する濃度反応曲線フィッティングによって算出した。細胞ベースのホスホ−ROS ELISAアッセイによって、45nMの平均IC50値(n=8)が得られた。
【0210】
免疫ブロット法
免疫ブロット法も使用して、HCC78細胞および3T3−CD74−ROS腫瘍溶解産物における相対的なキナーゼリン酸化状態および全タンパク質レベルを該当するタンパク質について決定した。in vitro研究では、HCC78細胞を様々な用量レベルのクリゾチニブで3時間処理した。細胞を冷1×Cell Lysis Buffer(Cell Signaling Technologies、Boston MT)中で溶解させた。
【0211】
in vivo研究では、腫瘍を持つマウスをクリゾチニブで、75mg/kg PO BIDで10日間処置した。研究の終了時に、最後の投与の7時間後に、腫瘍を切除した。切除された腫瘍をドライアイス上でスナップ冷凍し、液体窒素で冷却された冷却乳鉢(cryomortar)および乳棒を使用して微粉砕し、冷1×Cell Lysis Buffer(Cell Signaling Technologies、Boston MT)中で溶解させた。タンパク質を細胞および腫瘍溶解産物から抽出し、BSAアッセイ(Pierce、Rockford、IL)使用してタンパク質濃度を決定した。細胞および腫瘍溶解産物の両方から抽出されたタンパク質試料をSDS−PAGEによって分離し、ナイロン膜に移し、該当するタンパク質についての免疫ブロットハイブリダイゼーションを次の抗体で行った。
【0212】
免疫ブロット研究で利用された抗体は全て、Cell Signaling Technology(Danvers、Massachusetts、United States)製であり、次のとおり列挙される:抗全ROS(catalog#:3266)、抗ホスホROS(catalog#:3078)、抗ホスホSHP2(catalog#:5431)、抗ホスホSTAT3(catalog#:9131)、抗全AKT(catalog#:9272)、抗ホスホ−AKT S473(catalog#:4161)、抗全−MAPK44/42(catalog#:9102)、抗ホスホ−MAPK44/42(catalog#:4370)、切断Caspapse−3(catalog#:9661)。
【0213】
細胞生存力、増殖および生存アッセイ
細胞生存力アッセイ
スクリーニングの正規化が可能である限り、培養HCC78細胞を10%FBSおよびペニシリン/ストレプトマイシン(Invitrogen)を有するRPMI増殖培地(Invitrogen、Carlsbad、CA)に適応させた。特殊な培地を必要とする一部の細胞は、供給者が推奨する培地中で増殖させた。細胞をトリプシン処理し、3000〜5000細胞/ウェルの密度で96ウェルプレート(Corning Costar #3904プレート、Kennebunk、ME)に播き、一晩付着させた。翌日、細胞を、9種の連続濃度(10μMから152pMへと連続して4倍比で低下させて、完全なS字状曲線をもたらす)で投与される単一の薬物で2回処置した。37℃でさらに3〜5日間インキュベートした後に(細胞集密度が約70〜80%に達するまで)、製造者が推奨する体積のCell Titer Glo(Promega、Madison、WI)の1/5を加えて、Envision multi−reader(Perkin−Elmer、Waltham、MA)を使用して細胞生存力/増殖を間接的に測定した。ベースラインの細胞数読み取りをまた、細胞播種の1日後、かつ薬物治療の前に、細胞プレートから取った。ベースラインの数を最終細胞数から引き、PRISM(Graphpad、La Jolla、CA)またはXLFIT(IDBS、Surrey、UK)でプロットした。HCC78細胞生存力の阻害について算出されたIC50値は、約59nMであった。
【0214】
細胞増殖/生存アッセイ
細胞を96ウェルプレートに低密度で、増殖培地(2%、5%または10%のウシ胎児血清−FBSを補足されている培地)に播き、37℃で一晩培養した。翌日、連続希釈のクリゾチニブまたは適切な対照を指定されたウェルに加え、細胞を37℃で72時間インキュベートした。次いで、Cell Titer Gloアッセイ(Promega、Madison、WI)を行って、相対細胞数を決定した。4パラメーター分析法を利用する濃度反応曲線フィッティングによって、EC50値を算出した。
【0215】
in vivo方法
無胸腺マウスでの皮下異種移植片モデル
雌のnu/nuマウス(5〜8週齢)をCharles River(Wilmington、MA)から得た。クリーンルーム条件下、HEPA濾過換気孔を設けたラック上に置いたAlpha−Dri/bed−o−cob櫛型ベッドを備えた殺菌フィルタートップケージ中で、動物を維持した。動物に、無菌のげっ歯類用餌および水を自由に摂取させた。胸腺欠損マウスへの移植のために指定された細胞を回収し、450×gで5〜10分間、遠心分離することによってペレット化した。細胞ペレットを1回洗浄し、無血清培地に再懸濁させた。細胞に50%Matrigel(BD Biosciences、San Jose、CA)を補足して、腫瘍の獲得を促進した。各実験で化合物を投与する前に、細胞(100μl中、5×106)をマウスの後側腹部にSC移植し、所定の大きさに成長させた。電子キャリパーで測定することによって、腫瘍の大きさを決定し、腫瘍体積を、長さ×幅2×0.4の積として算出した。
【0216】
データおよび結果
【実施例1】
【0217】
クリゾチニブによる生化学酵素アッセイにおけるROS1キナーゼ活性の阻害
酵素および細胞ベースのアッセイの両方で、ROS触媒活性に対するその効果についてクリゾチニブを評価した。クリゾチニブは、0.097nMの平均Ki値(n=4)で、組換えヒトROS1キナーゼ(触媒ドメイン)の有効なATP拮抗阻害薬であることが示された。
【実施例2】
【0218】
細胞ベースのアッセイにおけるクリゾチニブのキナーゼ活性
クリゾチニブは、構成的に活性なSLC34A2−ROS融合タンパク質の発現をこれらの細胞においてもたらす4p15、6q22染色体転座事象を示すHCC78細胞(Rikovaら、(2007))において、41nMの平均IC50値(n=11)でROSリン酸化を用量依存的に阻害した(表1、図1)。
【0219】
クリゾチニブはまた、FIG−ROS融合を内包するU138MGヒト神経膠芽細胞腫細胞(Charestら、(2003))においてROSリン酸化を49nMの平均IC50値(n=2)で阻害した(表1、図1)。
【0220】
様々なROS−融合タンパク質を発現するように操作された3T3細胞系のパネルにおいて、クリゾチニブは、ROSリン酸化をこれらの細胞において3.4nMから36nMの範囲のIC50値で阻害した(表1)。
【0221】
【表1】

【実施例3】
【0222】
HCC78ヒトNSCLC細胞におけるin vitroでのROS媒介シグナル伝達の阻害および細胞アポトーシスの誘発
クリゾチニブを、HCC78細胞においてSLC34A2−ROS依存性シグナル伝達経路を阻害するその能力について評価した。
【0223】
図3のイムノブロットに示されているとおり、クリゾチニブは、ROSリン酸化(活性化ループ)、さらに、SHP2、STAT3、AKTおよびERK1/2を包含する下方のアダプターまたはシグナル伝達分子を薬物処置の3時間後には、HCC78細胞においてin vitroで用量依存的に阻害した。これらのデータは、重要なシグナル伝達経路とクリゾチニブの有効な用量との相関を示した。
【0224】
ウェスタンブロット分析を利用して、クリゾチニブを、アポトーシスのカスパーゼ−3マーカーのその用量依存的モジュレーションについて評価した。薬物処置の3時間後に、活性化カスパーゼ−3レベルの有意な用量依存的誘発がHCC78NSCLC細胞において観察されたが(図4)、このことは、アポトーシスの上昇もまた、有効な用量レベルと相関していることを示している。
【実施例4】
【0225】
ヌードマウスにおける発癌性ROS融合変異体操作された異種移植片腫瘍モデルのパネルでの経口投与後のクリゾチニブの細胞減少効果
クリゾチニブの抗腫瘍効力を、CD74−ROS、ヒトNSCLCで同定されたSLC34A2−ROSの2つの形態およびヒトNSCLC、神経膠芽細胞腫および胆管がんで同定されたFIG−ROSの2つの形態を包含するROS染色体転座が関与しているヒトがん適応症を代表するNIH3T3細胞において、ROS融合操作された腫瘍異種移植片モデルのパネルで評価した(Rimkunasら、(2012) Clin Cancer Res.Jun 1.[印刷前にEpub]);Guら、(2011) PLoS One.6(1):e15640)。
【0226】
図5に示されているとおり、クリゾチニブは、ヒト発癌性ROS融合変異体を内包する3T3−ROS操作された腫瘍モデルの5種全てにおいて、75/mg PO BIDの投与レジメンで、有意な細胞減少効果を示した。腫瘍体積が約200mm3に達したときに、マウスはクリゾチニブ処置を受け始め、約4から5日の薬物治療で、腫瘍は、5から10mm3のサイズへと迅速に退行した。対照腫瘍は、投与開始後約7日で1500mm3の大きさに達し、この研究での平均クリゾチニブ処置期間は約10日であった。
【実施例5】
【0227】
クリゾチニブによる、ヌードマウスにおける3T3−CD74−ROSおよび3T3−SLC34A2−ROS(L)異種移植片モデルでのROSリン酸化および腫瘍増殖の用量依存的阻害
クリゾチニブによるROSキナーゼ活性および腫瘍増殖の薬力学的阻害を評価するために、3T3−CD74−ROS腫瘍異種移植片研究をヌードマウスにおいて、複数の用量レベルで投与される経口BIDで行った。研究を通して、電子バーニヤキャリパーを利用して腫瘍体積を測定し、10日間のクリゾチニブの経口投与の後、7時間目に腫瘍試料を採取した(定常状態)。腫瘍におけるROSリン酸化状態をELISAによって定量した。
【0228】
図6Bに示されているとおり、クリゾチニブは、腫瘍増殖において用量依存的阻害を示した。94%および61%の腫瘍退縮が160mg/kg/日群(80mg/kg BID)および80mg/kg/日群(40mg/kg BID)でそれぞれ観察され、78%および54%の腫瘍増殖阻害が、40mg/kg/日群(20mg/kg BID)および20mg/kg/日群(10mg/kg BID)でそれぞれ観察された。
【0229】
最後のクリゾチニブ経口投与後7時間目に、3T3−CD74−ROS腫瘍におけるROSリン酸化の有意な阻害が全ての治療群で観察された(図6A)。
【0230】
3T3−SLC34A2−ROS(L)モデルにおいても同程度のクリゾチニブによる抗腫瘍効力が観察された(図7)。
【実施例6】
【0231】
式1の化合物(クリゾチニブ)の合成
PLEは、一般的にはPLE−ASとして知られている、ブタ肝臓からの粗製エステラーゼ製剤としてRocheによって製造され、Biocatalytics Inc.を介して販売されている酵素である(BiocatalyticsからICR−123として購入、硫酸アンモニウム懸濁液として販売)。この酵素は、CAS登録では「カルボキシル酸エステルヒドロラーゼ、CAS番号9016−18−6」と分類されている。対応する酵素分類番号は、EC3.1.1.1である。酵素は、幅広い範囲のエステルの加水分解に対して広い基質特異性を有することが知られている。pH滴定器中での酪酸エチルの加水分解に基づく方法を使用して、リパーゼ活性を決定する。1LU(リパーゼ単位)は22℃、pH8.2で1分当たりに、滴定可能な酪酸1μmolを遊離する酵素の量である。本明細書に報告されている製剤(PLE−AS、懸濁液として)は通常、45LU/mgより高い公表されている活性(タンパク質含有率は約40mg/mL)を有する不透明な茶色から緑色の液体として出荷される。
【0232】
(1S)−1−(2,6−ジクロロ−3−フルオロフェニル)エタノール
下記スキーム中に化合物(S−1)として示されている(1S)−1−(2,6−ジクロロ−3−フルオロフェニル)エタノールをスキームBに従って、ラセミ体1−(2,6−ジクロロ−3−フルオロフェニル)エチルアセテートの酵素加水分解、エステル化および転位を伴う化学的加水分解の組み合わせによって調製した。ラセミ体1−(2,6−ジクロロ−3−フルオロフェニル)エチルアセテート(化合物A2)は、スキームAに従って調製した。
【0233】
【化18】

1−(2,6−ジクロロ−3−フルオロフェニル)エタノール(A1):ホウ水素化ナトリウム(90mg、2.4mmol)を、2’,6’−ジクロロ−3’−フルオロ−アセトフェノン(Aldrich、catalog#52,294−5)(207mg、1mmol)の無水CH3OH2mL中の溶液に加えた。反応混合物を室温で1時間撹拌し、次いで、蒸発させて、無色のオイル残渣を得た。残渣をフラッシュクロマトグラフィー(ヘキサン中0→10%のEtOAcで溶離)によって精製して、化合物A1を無色のオイル(180mg;0.88mmol;収率86.5%)として得た;MS (APCI) (M-H)- 208; 1H NMR (400 MHz, クロロホルム-D) δ ppm 1.64 (d, J=6.82 Hz, 3 H) 3.02 (d, J=9.85 Hz, 1 H) 6.97 - 7.07
(m, 1 H) 7.19 - 7.33 (m, 1 H).
【0234】
1−(2,6−ジクロロ−3−フルオロフェニル)エチルアセテート(A2):無水酢酸(1.42mL、15mmol)およびピリジン(1.7mL、21mmol)を、化合物A1(2.2g、10.5mmol)のCH2Cl220mL中の溶液に順次加えた。反応混合物を室温で12時間撹拌し、次いで、蒸発させて、黄色がかったオイル残渣を得た。残渣をフラッシュクロマトグラフィー(ヘキサン中7→9%のEtOAcで溶離)によって精製して、化合物A2を無色のオイル(2.26g;9.0mmol;収率85.6%)として得た;1H NMR (400 MHz, クロロホルム-D) δppm 1.88 (d,
J=6.82 Hz, 3 H) 2.31 (s, 3 H) 6.62 (q, J=6.82 Hz, 1 H) 7.25 (t, J=8.46 Hz, 1 H)
7.49 (dd, J=8.84, 5.05 Hz, 1 H).
【0235】
【化19】

pH電極、オーバーヘッド撹拌機および塩基添加導管(1MのNaOH)を備えた50mLジャケット付きフラスコに、100mMのリン酸カリウム緩衝液(pH7.0)1.2mLおよびPLE AS懸濁液0.13mLを加えた。次いで、化合物A2(0.13g、0.5mmol、1.00当量)を滴加し、生じた混合物を室温で20時間撹拌したが、その際、1MのNaOHを使用して、反応のpHを7.0に一定に維持した。反応の変換率および鏡像異性体過剰率(ee’s)をRP−HPLCによって監視し、出発物質50%が消費された後に(これらの条件下で約17時間後に)停止した。次いで、混合物を酢酸エチル10mLで3回抽出して、エステルおよびアルコールの両方をR−1およびS−2の混合物として回収した。
【0236】
塩化メタンスルホニル(0.06mL、0.6mmol)を、R−1およびS−2の混合物(0.48mmol)のピリジン4mL中の溶液に窒素雰囲気下で加えた。反応混合物を室温で3時間撹拌し、次いで、蒸発させてオイルを得た。水(20mL)を混合物に加え、次いで、EtOAc(20mL×2)を加えて、水溶液を抽出した。有機層を合わせ、乾燥させ、濾過し、蒸発させて、R−3およびS−2の混合物を得た。この混合物をさらに精製することなく、次のステップ反応で使用した。1H NMR (400 MHz, クロロホルム-D) δ ppm 1.66 (d, J=7.1 Hz, 3 H) 1.84 (d, J=7.1 Hz, 3 H) 2.09 (s, 3 H)
2.92 (s, 3 H) 6.39 (q, J=7.0 Hz, 1 H) 6.46 (q, J=6.8 Hz, 1 H) 6.98 - 7.07 (m, 1
H) 7.07 - 7.17 (m, 1 H) 7.23 - 7.30 (m, 1 H) 7.34 (dd, J=8.8, 4.80 Hz, 1 H).
【0237】
酢酸カリウム(0.027g、0.26mmol)をDMF4mL中のR−3およびS−2の混合物(0.48mmol)に、窒素雰囲気下で加えた。反応混合物を100℃に12時間加熱した。水(20mL)を反応混合物に加え、EtOAc(20mL×2)を加えて、水溶液を抽出した。合わせた有機層を乾燥させ、濾過し、蒸発させて、S−2のオイル(72mg、2ステップで収率61%)を得た。キラリティーee:97.6%。1H NMR (400 MHz, クロロホルム-D) δ ppm 1.66 (d, J=7.1 Hz, 3 H) 2.09 (s, 3 H) 6.39 (q, J=6.8 Hz, 1 H)
7.02 (t, J=8.5 Hz, 1 H) 7.22 - 7.30 (m, 1 H).
【0238】
ナトリウムメトキシド(19mmol;メタノール中0.5M)を化合物S−2(4.64g、18.8mmol)に窒素雰囲気下、0℃で徐々に加えた。生じた混合物を室温で4時間撹拌した。溶媒を蒸発させ、H2O(100mL)を加えた。冷却された反応混合物を酢酸ナトリウム−酢酸緩衝溶液でpH7まで中和した。酢酸エチル(100mL×2)を加えて、水溶液を抽出した。合わせた有機層をNa2SO4上で乾燥させ、濾過し、蒸発させて、S−1を白色の固体(4.36g、収率94.9%)として得た;SFC−MS:97%ee。1H NMR (400 MHz, クロロホルム-D) δ ppm 1.65 (d, J=6.8 Hz, 3 H) 5.58 (q, J=6.9 Hz, 1 H) 6.96 - 7.10 (m,
1 H) 7.22 - 7.36 (m, 1 H).
【0239】
5−ブロモ−3−[1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−ピリジン−2−イルアミン(ラセミ化合物):
【0240】
【化20】

1. 氷浴を使用して、2,6−ジクロロ−3−フルオロアセトフェノン(15g、0.072mol)をTHF(150mL、0.5M)中、0℃で10分間撹拌した。水素化アルミニウムリチウム(2.75g、0.072mol)を徐々に加えた。反応物を周囲温度で3時間撹拌した。反応物を氷浴中で冷却し、水(3mL)を滴加し、続いて、15%NaOH(3mL)を徐々に加えた。混合物を周囲温度で30分間撹拌した。15%NaOH(9mL)、MgSO4を加え、混合物を濾過して、固体を除去した。固体をTHF(50mL)で洗浄し、濾液を濃縮して、1−(2,6−ジクロロ−3−フルオロ−フェニル)−エタノール(14.8gm、収率95%)を黄色のオイルとして得た。1H NMR (400 MHz, DMSO-d6) δ 1.45 (d, 3H), 5.42 (m, 2H), 7.32 (m, 1H),
7.42 (m, 1H).
【0241】
2. トリフェニルホスフィン(8.2g、0.03mol)およびDEAD(トルエン中40%の溶液13.65mL)のTHF(200mL)中の撹拌溶液に0℃で、1−(2,6−ジクロロ−3−フルオロ−フェニル)−エタノール(4.55g、0.021mol)および3−ヒドロキシ−ニトロピリジン(3.35g、0.023mol)のTHF(200mL)中の溶液を加えた。生じた明オレンジ色の溶液を窒素雰囲気下、周囲温度で4時間撹拌したが、その時点で、全ての出発物質が消費されていた。溶媒を除去し、粗製物質をシリカゲルに乾燥状態でロードし、酢酸エチル−ヘキサン(20:80)で溶離して、3−(2,6−ジクロロ−3−フルオロ−ベンジルオキシ)−2−ニトロ−ピリジン(6.21g、0.021mol、98%)をピンク色の固体として得た。1H NMR (CDCl3, 300 MHz) δ 1.8-1.85 (d, 3H), 6.0-6.15 (q, 1H),
7.0-7.1 (t, 1H), 7.2-7.21 (d, 1H), 7.25-7.5 (m, 2H), 8.0-8.05 (d, 1H).
【0242】
3. AcOH(650mL)およびEtOH(500mL)の撹拌混合物に、3−(2,6−ジクロロ−3−フルオロ−ベンジルオキシ)−2−ニトロ−ピリジン(9.43g、0.028mol)および鉄チップ(15.7g、0.28mol)を懸濁させた。反応物を徐々に加熱して還流させ、1時間撹拌した。反応物を室温に冷却し、次いで、ジエチルエーテル(500mL)および水(500mL)を加えた。炭酸ナトリウムを加えることによって、溶液を慎重に中和した。合わせた有機抽出物を飽和NaHCO3(2×100mL)、H2O(2×100mL)およびブライン(1×100mL)で洗浄し、次いで、乾燥させ(Na2SO4)、濾過し、乾燥するまで真空下で濃縮して、3−(2,6−ジクロロ−3−フルオロ−ベンジルオキシ)−ピリジン−2−イルアミン(9.04g、0.027mol、99%)を薄ピンク色の固体として得た。1H NMR (CDCl3, 300 MHz) δ 1.8-1.85 (d, 3H), 4.9-5.2 (brs, 2H),
6.7-6.84 (q, 1H), 7.0-7.1 (m, 1H), 7.2-7.3 (m, 1H), 7.6-7.7 (m, 1H).
【0243】
4. 氷浴を使用して、3−(2,6−ジクロロ−3−フルオロ−ベンジルオキシ)−ピリジン−2−イルアミン(9.07g、0.03mol)のアセトニトリル中の撹拌溶液を0℃に冷却した。この溶液に、N−ブロモスクシンイミド(NBS)(5.33g、0.03mol)を少量ずつ加えた。反応物を0℃で15分間撹拌した。反応物を乾燥するまで真空下で濃縮した。生じた暗色のオイルをEtOAc(500mL)に溶かし、シリカゲルクロマトグラフィーを介して精製した。次いで、溶媒を真空除去して、5−ブロモ−3−(2,6−ジクロロ−3−フルオロ−ベンジルオキシ)−ピリジン−2−イルアミン(5.8g、0.015mol、51%)を白色の結晶質の固体として得た。1H NMR (CDCl3, 300 MHz) δ 1.85-1.95 (d, 3H), 4.7-5.0 (brs, 2H),
5.9-6.01 (q, 1H), 6.8-6.95 (d, 1H), 7.01-7.2 (t, 1H), 7.4-7.45 (m, 1H),
7.8-7.85 (d, 1H).
【0244】
5−ブロモ−3−[1(R)−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−ピリジン−2−イルアミン:
【0245】
【化21】

鏡像異性的に純粋なR異性体をラセミ化合物に関しての上記のとおり調製したが、その際、上記の鏡像異性的に純粋な出発物質を使用した。1H NMR (400 MHz, DMSO-d6) δ 1.74 (d, 3H), 6.40 (m, 1H), 6.52 (br s,
2H), 7.30 (m, 1H), 7.48 (m, 1H), 7.56 (s, 1H); MS m/z 382 (M+1).
【0246】
4−メタンスルホニルオキシ−ピペリジン−1−カルボン酸tert−ブチルエステル(2)
【0247】
【化22】

0℃に冷却されている4−ヒドロキシ−ピペリジン−1−カルボン酸tert−ブチルエステル(7.94g、39.45mmol)のCH2Cl2(100mL)中の撹拌溶液に、NEt3(5.54mL、39.45mmol)を、続いて、メタンスルホニルクロリド(3.06mL、39.45mmol)およびDMAP(48mg、0.39mmol)を徐々に加えた。混合物を室温で一晩撹拌した。混合物に水(30mL)を加えた。CH2Cl2(3×30mL)で抽出し、続いて、乾燥させ(Na2SO4)、溶媒を真空中で除去して、4−メタンスルホニルオキシ−ピペリジン−1−カルボン酸tert−ブチルエステルを白色の固体(11.00g、収率>99%)として得た。1H NMR (CDCl3, 400 MHz) δ4.89 (m, 1H), 3.69 (m, 2H), 3.31 (m, 2H),
3.04 (s, 3H), 1.95 (m, 2H), 1.83 (m, 2H), 1.46 (s, 9H).
【0248】
tert−ブチル−4−[4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−1H−ピラゾール−1−イル]ピペリジン−1−カルボキシレート
【0249】
【化23】

tert−ブチル4−(4−ヨード−1H−ピラゾール−1−イル)ピペリジン−1−カルボキシレート(3)
NaH(1.2当量、0.68mmol)を4−ヨードピラゾール(0.57mmol)のDMF(2L)中の撹拌溶液に4℃で少量ずつ加えた。生じた混合物を4℃で1時間撹拌し、次いで、4−メタンスルホニルオキシ−ピペリジン−1−カルボン酸tert−ブチルエステル、化合物2(1.1当量、0.63mmol)を加えた。生じた混合物を100℃に12時間加熱した。反応物をH2Oでクエンチし、EtOAcで複数回抽出した。合わせた有機層を乾燥させ、濾過し、濃縮して、オレンジ色のオイルを得た。残渣をシリカゲルクロマトグラフィー(ペンタン中5%のEtOAcで溶離)によって精製して、化合物3を白色の固体(140g、66%)として得た。
【0250】
tert−ブチル−4−[4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−1H−ピラゾール−1−イル]ピペリジン−1−カルボキシレート(4)
ビス(ピナコラト)ジボロン(1.4当量、134g、0.52mol)および酢酸カリウム(4当量、145g、1.48mol)を化合物3(140g、0.37mol)のDMSO1.5L中の溶液に順次加えた。混合物を窒素で数回パージし、次いで、ジクロロビス(トリフェニルホスフィノ)パラジウム(II)(0.05当量、12.9g、0.018mol)を加えた。生じた混合物を80℃で2時間加熱した。反応混合物を室温に冷却し、Celite(登録商標)ベッドで濾過し、EtOAcで洗浄した。濾液を飽和NaCl(500mL×2)で洗浄し、Na2SO4上で乾燥させ、濾過し、濃縮した。残渣をシリカゲルクロマトグラフィー(ヘキサン中5%のEtOAcで溶離)によって精製して、化合物4を白色の固体(55g、40%)として得た。
【0251】
3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミン(1)
【0252】
【化24】

3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(4,4,5,5−テトラメチル−[1,3,2]ジオキサボロラン−2−イル)−ピリジン−2−イルアミン(15.22g、35.64mmol)および4−(4−ブロモ−ピラゾール−1−イル)−ピペリジン−1−カルボン酸tert−ブチルエステル(14.12g、42.77mmol)のDME(143mL)中の撹拌溶液に、Na2CO3(11.33g、10692mmol)の水(36mL)溶液を加えた。溶液を脱ガスし、窒素を3回充填した。溶液に、Pd(PPh3)2Cl2(1.25mg、1.782mmol)を加えた。反応溶液を脱ガスし、再び窒素を3回充填した。反応溶液を87℃の油浴で約16時間(またはボランピナコールエステルが消費されるまで)撹拌し、周囲温度に冷却し、EtOAc(600mL)で希釈した。反応混合物をCelite(登録商標)パッドで濾過し、EtOAcで洗浄した。EtOAc溶液をブラインで洗浄し、Na2SO4で乾燥させ、濃縮した。粗製の生成物をシリカゲルカラムで、EtOAc/ヘキサン系(Biotage 90+ Column:平衡100%ヘキサン600mL、セグメント1:50%EtOAc/ヘキサン2250mL、直線、セグメント2:75%EtOAc/ヘキサン4500mL、直線、セグメント3:100%EtOAc4500mL)で溶離して精製して、4−(4−{6−アミノ−5−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−ピリジン−3−イル}−ピラゾール−1−イル)−ピペリジン−1−カルボン酸tert−ブチルエステル(11.8g、収率60%、純度約95%)を0.15のRfで得た(50%EtOAc/ヘキサン)。MS m/e 550(M+1)+。
【0253】
4−(4−{6−アミノ−5−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−ピリジン−3−イル}−ピラゾール−1−イル)−ピペリジン−1−カルボン酸tert−ブチルエステル(11.8g、21.45mmol)のCH2Cl2(59mL、0.2M)中の溶液に、4NのHCl/ジオキサン(21mL)を加えた。溶液を一晩撹拌して、固体を形成した。固体をガラス棒で十分に粉砕し、音波処理して、固体中に捕捉されている出発物質を遊離した。追加の4NのHCl/ジオキサン(21mL)を加え、室温でさらに2時間撹拌すると、LCMSは出発物質を示さなかった。懸濁液を濾紙でライニングされたブフナー漏斗で濾過した。5%未満の生成物を含有するので、母液を取っておいた。固体を500mLビーカーに移し、固体が完全に溶けるまで、HPLC水を加えた。固体Na2CO3を加えることで、pHを10に調節した。またはLCMSが水性層中に生成物を示さなくなるまで、水溶液をCH2Cl2(5×200mL)で抽出した。CH2Cl2溶液をNa2SO4上で乾燥させ、濃縮した。CH2Cl2(10mL)およびMeOH(1mL)に再び溶かした粗製の生成物をシリカゲルカラムで、CH2Cl2/MeoH/NEt3系(Biotage 40+Column:平衡100%CH2Cl2600mL、副生成物の取得、セグメント1:10%MeOH/CH2Cl21200mL、直線、セグメント2:10%MeOH/CH2Cl22400mL、ステップ、セグメント3:9%MeOH/1%NEt3/CH2Cl22400mL)で溶離して精製した。所望の画分を集めて、3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミン(7.19g、合わせた収率75%、白色の固体)を得た。MS m/e 450 (M+1)+. 1H NMR (DMSO-d6,
400 MHz) δ7.92 (s, 1H), 7.76
(s, 1H), 7.58 (m, 1H), 7.53 (s, 1H), 7.45 (m, 1H), 6.90 (s, 1H), 6.10 (m, 1H),
5.55 (bs, 2H), 4.14 (m, 1H), 3.05 (m, 2H), 2.58 (m, 2H), 1.94 (m, 2H), 1.80 (d,
3H), 1.76 (m, 2H).
【0254】
固体生成物3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンをジクロロメタンに溶かし、溶媒を徐々に蒸発させて、微細な結晶質固体を生じさせた。高真空乾燥の後に、試料が、194℃の融点を有する単結晶多形形態Aであることが確認された。
【技術分野】
【0001】
本出願は、その内容全体が参照によって本明細書に組み込まれる2011年8月2日出願の米国特許仮出願第61/514,386号の利益を主張する。
【0002】
本発明は、哺乳動物において異常な細胞増殖を治療するためのROS阻害薬の使用に関する。詳細には、本発明は、がんを患っている哺乳動物を治療する方法を提供する。
【背景技術】
【0003】
ヒトのがんには、世界中の先進国において総じて主な死亡原因の一つである多様な数々の疾患が含まれる(American Cancer Society、Cancer Facts and Figures 2005.Atlanta:American Cancer Society;2005)。がんの進行は、遺伝子突然変異、染色体転座および核型異常を包含する複雑な一連の多数の遺伝子的および分子的事象に起因する(Hanahanら、Cell 100:57〜70(2000))。ベースにあるがんの遺伝子的原因は、多様であり複雑であるが、それぞれのがん型が、その進行を容易にする共通の特色および獲得能力を示すことが観察されている。これらの獲得能力には、細胞増殖の調節異常、血管補充が持続的に可能なこと(即ち、血管形成)および腫瘍細胞が局所的に広がり、さらに二次的臓器部位へ転移することが可能なことが包含される(Hanahanら、Cell(2000))。したがって、1)がんの進行の間に変化する分子標的を阻害するか、または2)様々な腫瘍においてがんの進行に共通する多数のプロセスを標的とする新規な治療薬を同定することは、未だ可能でなく、非常に必要とされている。
【0004】
v−ros UR2肉腫ウイルス発癌遺伝子相同体1(ROS−1またはROS)は、インスリン受容体サブファミリーに属し、細胞増殖および分化プロセスに関与している癌原遺伝子受容体チロシンキナーゼである(Nagarajanら、Proc Natl Acad Sci 83:6568〜6572(1986))。ROSはヒトにおいては、様々な種々の組織の上皮細胞において発現される。ROS発現および/または活性化の欠失が、神経膠芽細胞腫、さらに中枢神経系の腫瘍において見出されている(Charestら、Genes Chromos.Can.37(1):58〜71(2003))。神経膠芽細胞腫(Charestら(2003);Birchmeierら、Proc Natl Acad Sci 84:9270〜9274(1987))およびNSCLC(Rimkunasら、Clin Cancer Res epub、Jun 1.(2012))におけるFIG−ROS欠失転座、NSCLCにおけるSLC34A2−ROS転座(Rikovaら、Cell 131:1190〜1203(2007))、NSCLC(Rikovaら、(2007))および胆管癌(Guら、PLoS ONE 6(1):e15640(2011))におけるCD74−ROS転座ならびにマウスにおいて腫瘍成長を促進することが知られているROSの切断された活性型(Birchmeierら、Mol.Cell.Bio.6(9):3109〜3115(1986))を包含する、ROSキナーゼの異常な融合タンパク質をもたらすROSに関係する遺伝子変化が記載されている。TPM3−ROS1、SDC4−ROS1、EZR−ROS1およびLRIG3−ROS1を包含する追加的な融合が、肺がん患者の腫瘍試料において報告されている(Takeuchiら、Nature Medicine(2012))。
【0005】
ナトリウム依存性ホスフェートトランスポーターアイソフォームNaPi−3bタンパク質(SLC34A2)は、690アミノ酸ホスフェートトランスポータータンパク質であり、これは、ヒトの肺および小腸で発現され、ナトリウム依存性活性を有する。SLC34A2発現および/または活性の欠失は、卵巣がんにおいて見出されている(Rangelら、Oncogene22(46):7225〜7232(2003))。CD74は、MIF免疫サイトカインに対して高い親和性を有するMHCクラスIIシャペロンタンパク質として機能する内在性膜タンパク質である(Lengら、J.Exp.Med.197:1467〜1476(2003))。FIG(Fused in Glioblastoma)は、PSD−95、Disc Large、ZO−1(PDZ)ドメイン、2つのコイルドコイル領域およびロイシンジッパーを包含する454アミノ酸タンパク質をコードする遺伝子である。FIGは、その第2のコイルドコイルドメインを介してSNAREタンパク質と相互作用することによって、ゴルジ体と末梢で関連していることが判明しており、したがって、Golgi媒介小胞輸送において役割を果たしていると仮定されている(Charestら、(2003))。
【0006】
SLC34A2−ROS転座は、染色体(4p15)と染色体(6q22)との間で生じ、ナトリウム依存性ホスフェートトランスポーターアイソフォームNaPi−3bタンパク質(SLC34A2)のN末端と、癌原遺伝子チロシンタンパク質キナーゼROS前駆体(ROS)キナーゼの膜貫通およびキナーゼドメインとを組み合わせる2つの融合タンパク質変異体をもたらす(WO2007/084631)。現在までに、それぞれ724アミノ酸(SLC34A2−ROS(L);ロング型変異体)および621アミノ酸(SLC34A2−ROS(S);ショート型変異体)であるSLC34A2−ROS融合タンパク質の2つの変異体が同定されている(WO2007/084631)。SLC34A2−ROS転座はまた、ROS遺伝子とSLC34A2遺伝子との融合として記載することもでき、これは続いて、SLC34A2−ROS融合遺伝子によってコードされるタンパク質配列によって特徴付けられる異常なSLC34A2−ROS融合タンパク質をもたらす。
【0007】
CD74−ROS転座は、染色体(5q32)と染色体(6q22)との間で生じ、CD74のN末端と、癌原遺伝子チロシンタンパク質キナーゼROS前駆体(ROS)キナーゼの膜貫通およびキナーゼドメインとを組み合わせる融合タンパク質をもたらす。その結果生じたCD74−ROS融合タンパク質は、703アミノ酸タンパク質である(WO2009/051846)。CD74−ROS転座はまた、ROS遺伝子およびCD74遺伝子の融合として記載することもでき、これは続いて、CD74−ROS融合遺伝子によってコードされるタンパク質配列によって特徴付けられる異常なCD74−ROS融合タンパク質をもたらす。
【0008】
FIG−ROS欠失転座は、染色体(6q21)での240キロベースの染色体内ホモ接合性欠失によって生じ、構成的活性化チロシンキナーゼをもたらす(Charestら、(2003))。それぞれ878アミノ酸(FIG−ROS(L);ロング型変異体)および630アミノ酸(FIG−ROS(S);ショート型変異体)であるFIG−ROS融合タンパク質の変異体が報告されている(Guら、(2011);米国特許出願公開第2011/0287445号)。
【先行技術文献】
【特許文献】
【0009】
【特許文献1】米国特許仮出願第61/514,386号
【特許文献2】WO2007/084631
【特許文献3】WO2009/051846
【特許文献4】米国特許出願公開第2011/0287445号
【特許文献5】米国特許第4,727,022号
【特許文献6】米国特許第4,659,678号
【特許文献7】米国特許第4,376,110号
【特許文献8】米国特許出願公開第2010/0221737号
【特許文献9】米国特許第7,468,252号
【特許文献10】米国特許第7230098号
【特許文献11】米国特許第7,858,643号
【特許文献12】WO2006/021881
【特許文献13】国際特許公開WO2006/021884
【特許文献14】米国特許出願公開第2006/0046991号
【特許文献15】米国特許出願公開第2006/0128724号
【特許文献16】米国特許第6,106,864号
【特許文献17】WO00/35298
【特許文献18】PCT公開WO91/11172
【特許文献19】PCT公開WO94/02518
【特許文献20】PCT公開WO98/55148
【非特許文献】
【0010】
【非特許文献1】American Cancer Society、Cancer Facts and Figures 2005.Atlanta:American Cancer Society;2005
【非特許文献2】Hanahanら、Cell 100:57〜70(2000)
【非特許文献3】Nagarajanら、Proc Natl Acad Sci 83:6568〜6572(1986)
【非特許文献4】Charestら、Genes Chromos.Can.37(1):58〜71(2003)
【非特許文献5】Birchmeierら、Proc Natl Acad Sci 84:9270〜9274(1987)
【非特許文献6】Rimkunasら、Clin Cancer Res epub、Jun 1.(2012)
【非特許文献7】Rikovaら、Cell 131:1190〜1203(2007)
【非特許文献8】Guら、PLoS ONE 6(1):e15640(2011)
【非特許文献9】Birchmeierら、Mol.Cell.Bio. 6(9):3109〜3115(1986)
【非特許文献10】Takeuchiら、Nature Medicine(2012)
【非特許文献11】Rangelら、Oncogene22(46):7225〜7232(2003)
【非特許文献12】Lengら、J.Exp.Med.197:1467〜1476(2003)
【非特許文献13】StahlおよびWermuthによる「Handbook of Pharmaceutical Salts:Properties,Selection,and Use」(Wiley−VCH、Weinheim、Germany、2002)
【非特許文献14】HaleblianによるJ Pharm Sci、64(8)、1269〜1288(1975年8月)
【非特許文献15】K.Barovsky、Nanotech. Law & Bus.1(2):Article 14(2004)
【非特許文献16】E.Maggio、Enzyme−Immunoassay(1980)(CRC Press,Inc.、Boca Raton、Fla.)
【非特許文献17】Chowら、Cytometry(Communications in Clinical Cytometry)46:72〜78(2001)
【非特許文献18】ANTIBODIES:A LABORATORY MANUAL、Chapter 10、Harlow & Lane Eds.、Cold Spring Harbor Laboratory(1988)
【非特許文献19】J.M.PolakおよびS.Van Noorden(1997) INTRODUCTION TO IMMUNOCYTOCHEMISTRY、第2版;ROYAL MICROSCOPY SOCIETY MICROSCOPY HANDBOOK 37、BioScientific/Springer−Verlag
【非特許文献20】MOLECULAR CLONING、A LABORATORY MANUAL、第2版、Sambrook,J.、Fritsch,E.F.およびManiatis,T.編、Cold Spring Harbor Laboratory Press、Cold Spring Harbor、N.Y.(1989)
【非特許文献21】Melbyら、J.Immunol.Methods、159:235〜244(1993)
【非特許文献22】Duplaaら、Anal.Biochem.229〜236(1993)
【非特許文献23】Price,C.M.、Blood Rev.7:127〜134(1993)
【非特許文献24】Trask,B.J.、Trends Genet.7:149〜154(1991)
【非特許文献25】Vermaら、HUMAN CHROMOSOMES:A MANUAL OF BASIC TECHNIQUES、Pergamon Press、New York、N.Y.(1988)
【非特許文献26】1994 Genome Issue of Science(265:1981〜)
【非特許文献27】McDermott,U.ら、Proc.Natl.Acad.Sci.104、19936〜19941(2007)
【非特許文献28】LiangおよびChenによるExpert Opinion in Therapeutic Patents、11(6)、981〜986(2001)
【非特許文献29】H.LiebermanおよびL.Lachmanによる「Pharmaceutical Dosage Forms:Tablets」、Vol.1、Marcel Dekker、N.Y、N.Y、1980(ISBN 0−8247−6918−X)
【非特許文献30】Vermaらによる「Pharmaceutical Technology On−line」、25(2)、1〜14(2001)
【非特許文献31】FinninおよびMorganによるJ.Pharm.Sci、88(10)、955〜958(1999年10月)
【発明の概要】
【発明が解決しようとする課題】
【0011】
ROS遺伝子に関係する融合および欠失は、ヒトがんの病因に関与しているので、そのような融合および欠失においてROSキナーゼ活性の活性を緩和するように機能し得るROSの阻害薬を発見することが、がんの治療において未だ達成されておらず非常に必要とされている。
【課題を解決するための手段】
【0012】
一態様では、本発明は、そのような治療を必要とするヒトにおいて、少なくとも1つの遺伝子変化ROSによって媒介されるがんを治療する方法を提供し、この方法は、前記ヒトに、治療的有効量の式1のROSキナーゼ阻害薬または薬学的に許容できるその塩を投与するステップを含む:
【0013】
【化1】

式1の化合物は本明細書において、その一般名であるクリゾチニブによって、またはその化学名である3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンによって様々に称され得る。
【0014】
本発明のこの態様の一実施形態では、少なくとも1つの遺伝子変化ROSは、ROSの融合遺伝子である。この態様の他の実施形態では、ROSの融合遺伝子は、SLC34A2−ROS遺伝子またはCD74−ROS遺伝子である。この態様の他の実施形態では、少なくとも1つの遺伝子変化ROSは、ROSキナーゼに関係する遺伝子欠失である。この態様の他の実施形態では、遺伝子欠失は、FIG−ROS遺伝子である。この態様の他の実施形態では、少なくとも1つの遺伝子変化ROSは、遺伝子変化ROSキナーゼである。この態様の他の実施形態では、遺伝子変化ROSキナーゼは、ROS融合である。この態様の他の実施形態では、ROS融合は、SLC34A2−ROSキナーゼまたはCD74−ROSキナーゼである。この態様の他の実施形態では、少なくとも1つの遺伝子変化ROSは、ROSキナーゼに関係する欠失タンパク質である。この態様の他の実施形態では、欠失タンパク質は、FIG−ROSキナーゼである。
【0015】
この態様の他の実施形態では、がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。この態様の他の実施形態では、がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。この態様の他の実施形態では、がんは非小細胞肺がん(NSCLC)である。この態様の他の実施形態では、がんは神経膠芽細胞腫である。この態様の他の実施形態では、式1の化合物を、式1の化合物と少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。この態様の他の実施形態では、式1の化合物または薬学的に許容できるその塩を、式1の化合物または薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0016】
他の態様では、本発明は、ROSキナーゼによって媒介される異常な細胞増殖を有する哺乳動物に、治療的有効量のROSキナーゼ阻害薬を投与するステップを含む方法を提供する。本発明のこの態様の一実施形態では、異常な細胞増殖は、少なくとも1つの遺伝子変化ROSキナーゼによって媒介される。他の実施形態では、異常な細胞増殖は、ROSキナーゼの融合遺伝子によって媒介される。他の実施形態では、異常な細胞増殖は、ROSキナーゼに関係する遺伝子欠失によって媒介される。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、異常な細胞増殖は、ROSキナーゼの融合タンパク質によって媒介される。他の実施形態では、異常な細胞増殖は、ROSキナーゼに関係する欠失タンパク質によって媒介される。他の実施形態では、融合タンパク質は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、欠失タンパク質はFIG−ROSである。この態様のうちの一部のそのような実施形態では、方法は、ROSキナーゼによって媒介される異常な細胞増殖を有する前記哺乳動物に、治療的有効量のROSキナーゼ阻害薬を投与し、それによって、前記の異常な細胞増殖を治療するステップを含む。
【0017】
この態様の他の実施形態では、ROSキナーゼ阻害薬は、ROSキナーゼの低分子阻害薬である。他の実施形態では、ROSキナーゼ阻害薬は、アミノ−ピリジン化合物またはアミノ−ピラジン化合物である。
【0018】
本発明の前述の各態様の他の実施形態では、ROSキナーゼ阻害薬は、式1の化合物または薬学的に許容できるその塩である:
【0019】
【化2】

【0020】
本発明のこの態様の他の実施形態では、異常な細胞増殖はがんである。本発明の前述の各態様の他の実施形態では、がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。
【0021】
本発明のこの態様のさらに他の実施形態では、がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。本発明の前述の各態様のさらに他の実施形態では、がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、がんは神経膠芽細胞腫である。
【0022】
本発明のこの態様のさらに他の実施形態では、化合物または薬学的に許容できるその塩を、式1の化合物と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。この態様の他の実施形態では、式1の化合物または薬学的に許容できるその塩を、式1の化合物または薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0023】
他の態様では、本発明は、ROSキナーゼによって媒介されるがんを有する哺乳動物に、治療的有効量のROSキナーゼ阻害薬を投与するステップを含む方法を提供する。本発明のこの態様の一実施形態では、がんは、少なくとも1つの遺伝子変化ROSキナーゼによって媒介される。他の実施形態では、がんは、ROSキナーゼの融合遺伝子によって媒介される。他の実施形態では、異常な細胞増殖は、ROSキナーゼに関係する遺伝子欠失によって媒介される。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、異常な細胞増殖は、ROSキナーゼの融合タンパク質によって媒介される。他の実施形態では、異常な細胞増殖は、ROSキナーゼに関係する欠失タンパク質によって媒介される。他の実施形態では、融合タンパク質は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、欠失タンパク質はFIG−ROSである。この態様のうちの一部のそのような実施形態では、方法は、ROSキナーゼによって媒介されるがんを有する前記哺乳動物に、治療的有効量のROSキナーゼ阻害薬を投与し、それによって、前記がんを治療するステップを含む。
【0024】
この態様の他の実施形態では、ROSキナーゼ阻害薬は、ROSキナーゼの低分子阻害薬である。他の実施形態では、ROSキナーゼ阻害薬は、アミノ−ピリジン化合物またはアミノ−ピラジン化合物である。本発明の前述の各態様の他の実施形態では、ROSキナーゼ阻害薬は、式1の化合物または薬学的に許容できるその塩である:
【0025】
【化3】

【0026】
他の実施形態では、がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。
【0027】
本発明のこの態様のさらに他の実施形態では、がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。さらに他の実施形態では、がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、がんは神経膠芽細胞腫である。
【0028】
本発明のこの態様のさらに他の実施形態では、化合物または薬学的に許容できるその塩を、式1の化合物と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。この態様の他の実施形態では、式1の化合物または薬学的に許容できるその塩を、式1の化合物または薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0029】
他の態様では、本発明は、少なくとも1種のROSキナーゼによって媒介されるがんを、そのような治療を必要とする哺乳動物において、治療的有効量のROSキナーゼ阻害薬を投与することによって治療するステップを含む方法を提供する。本発明のこの態様の一実施形態では、がんは、少なくとも1つの遺伝子変化ROSキナーゼによって媒介される。他の実施形態では、がんは、ROSキナーゼの融合遺伝子によって媒介される。他の実施形態では、がんは、ROSキナーゼに関係する遺伝子欠失によって媒介される。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、異常な細胞増殖は、ROSキナーゼの融合タンパク質によって媒介される。他の実施形態では、異常な細胞増殖は、ROSキナーゼに関係する欠失タンパク質によって媒介される。他の実施形態では、融合タンパク質は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、欠失タンパク質はFIG−ROSである。
【0030】
この態様の他の実施形態では、ROSキナーゼ阻害薬は、ROSキナーゼの低分子阻害薬である。他の実施形態では、ROSキナーゼ阻害薬は、アミノ−ピリジン化合物またはアミノ−ピラジン化合物である。本発明の前述の各態様の他の実施形態では、ROSキナーゼ阻害薬は、式1の化合物または薬学的に許容できるその塩である:
【0031】
【化4】

【0032】
他の実施形態では、がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。
【0033】
本発明のこの態様のさらに他の実施形態では、がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。さらに他の実施形態では、がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、がんは神経膠芽細胞腫である。
【0034】
本発明のこの態様のさらに他の実施形態では、化合物または薬学的に許容できるその塩を、式1の化合物と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。この態様の他の実施形態では、式1の化合物または薬学的に許容できるその塩を、式1の化合物または薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0035】
他の態様では、本発明は、異常な細胞増殖を、そのような治療を必要とする哺乳動物において治療する方法を提供し、この方法は、前記哺乳動物に、治療的有効量のROSキナーゼ阻害薬を投与するステップを含む。本発明のこの態様の一実施形態では、異常な細胞増殖は、少なくとも1つの遺伝子変化ROSキナーゼによって媒介される。他の実施形態では、異常な細胞増殖は、ROSキナーゼの融合遺伝子によって媒介される。他の実施形態では、異常な細胞増殖は、ROSキナーゼに関係する遺伝子欠失によって媒介される。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、異常な細胞増殖は、ROSキナーゼの融合タンパク質によって媒介される。他の実施形態では、異常な細胞増殖は、ROSキナーゼに関係する欠失タンパク質によって媒介される。他の実施形態では、融合タンパク質はCD74−ROSである。他の実施形態では、融合タンパク質はSLC34A2−ROSである。他の実施形態では、欠失タンパク質はFIG−ROSである。
【0036】
この態様の他の実施形態では、ROSキナーゼ阻害薬は、ROSキナーゼの低分子阻害薬である。他の実施形態では、ROSキナーゼ阻害薬は、アミノ−ピリジン化合物またはアミノ−ピラジン化合物である。本発明の前述の各態様の他の実施形態では、ROSキナーゼ阻害薬は、式1の化合物または薬学的に許容できるその塩である:
【0037】
【化5】

【0038】
本発明のこの態様の他の実施形態では、異常な細胞増殖はがんである。本発明の前述の各態様の他の実施形態では、がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。
【0039】
本発明のこの態様のさらに他の実施形態では、がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。本発明の前述の各態様のさらに他の実施形態では、がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、がんは神経膠芽細胞腫である。
【0040】
本発明のこの態様のさらに他の実施形態では、化合物または薬学的に許容できるその塩を、式1の化合物と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。この態様の他の実施形態では、式1の化合物または薬学的に許容できるその塩を、式1の化合物または薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0041】
本発明の前述の各態様の一実施形態では、哺乳動物はヒトである。本発明の前述の各態様の他の実施形態では、哺乳動物はイヌである。
【0042】
他の態様では、本発明は、少なくとも1つの遺伝子変化ROSキナーゼについて陽性であることが判明しているがんを、そのような治療を必要とする哺乳動物において治療する方法を提供し、この方法は、前記哺乳動物に、治療的有効量のROSキナーゼ阻害薬を投与するステップを含む。本発明のこの態様の一実施形態では、遺伝子変化ROSキナーゼは、ROSの融合遺伝子である。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合遺伝子はSLC34A2−ROSである。他の実施形態では、融合遺伝子はCD74−ROSである。他の実施形態では、遺伝子変化ROSキナーゼは、ROSキナーゼに関係する遺伝子欠失である。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、遺伝子変化ROSキナーゼは、ROSキナーゼの融合タンパク質である。他の実施形態では、遺伝子変化ROSキナーゼは、ROSキナーゼに関係する欠失タンパク質である。他の実施形態では、融合タンパク質は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合タンパク質はCD74−ROSである。他の実施形態では、融合タンパク質はSLC34A2−ROSである。他の実施形態では、欠失タンパク質はFIG−ROSである。
【0043】
この態様の他の実施形態では、ROSキナーゼ阻害薬は、ROSキナーゼの低分子阻害薬である。他の実施形態では、ROSキナーゼ阻害薬は、アミノ−ピリジン化合物またはアミノ−ピラジン化合物である。本発明の前述の各態様の他の実施形態では、ROSキナーゼ阻害薬は、式1の化合物または薬学的に許容できるその塩である:
【0044】
【化6】

【0045】
他の実施形態では、がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。
【0046】
本発明のこの態様のさらに他の実施形態では、がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。さらに他の実施形態では、がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、がんは神経膠芽細胞腫である。
【0047】
本発明のこの態様のさらに他の実施形態では、化合物または薬学的に許容できるその塩を、式1の化合物と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。この態様の他の実施形態では、式1の化合物または薬学的に許容できるその塩を、式1の化合物または薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0048】
他の態様では、本発明は、ROS陽性がんを治療する方法を提供し、この方法は、そのような治療を必要とする哺乳動物に、治療的有効量のROSキナーゼ阻害薬を投与するステップを含む。本発明のこの態様の一実施形態では、ROS陽性がんは、ROSの融合遺伝子によって媒介される。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合遺伝子はSLC34A2−ROSである。他の実施形態では、融合遺伝子はCD74−ROSである。他の実施形態では、ROS陽性がんは、ROSキナーゼに関係する遺伝子欠失によって媒介される。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、ROS陽性がんは、ROSキナーゼの融合タンパク質によって媒介される。他の実施形態では、ROS陽性がんは、ROSキナーゼに関係する欠失タンパク質によって媒介される。他の実施形態では、ROSキナーゼの融合タンパク質は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、ROSキナーゼの融合タンパク質はCD74−ROSである。他の実施形態では、ROSキナーゼの融合タンパク質はSLC34A2−ROSである。他の実施形態では、ROSキナーゼの欠失タンパク質はFIG−ROSである。
【0049】
この態様の他の実施形態では、ROSキナーゼ阻害薬は、ROSキナーゼの低分子阻害薬である。他の実施形態では、ROSキナーゼ阻害薬は、アミノ−ピリジン化合物またはアミノ−ピラジン化合物である。本発明の前述の各態様の他の実施形態では、ROSキナーゼ阻害薬は、式1の化合物または薬学的に許容できるその塩である:
【0050】
【化7】

【0051】
他の実施形態では、ROS陽性がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。
【0052】
本発明のこの態様のさらに他の実施形態では、ROS陽性がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。さらに他の実施形態では、ROS陽性がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、ROS陽性がんは神経膠芽細胞腫である。
【0053】
この態様の一部の実施形態では、式1の化合物または薬学的に許容できるその塩を、式1の化合物または薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0054】
他の態様では、本発明は、ROSキナーゼによって媒介される異常な細胞増殖を有する哺乳動物に、治療的有効量のROSキナーゼ阻害薬を投与するステップを含む方法を提供する。本発明のこの態様の一実施形態では、異常な細胞増殖は、少なくとも1つの遺伝子変化ROSキナーゼによって媒介される。他の実施形態では、異常な細胞増殖は、ROSキナーゼの融合遺伝子によって媒介される。他の実施形態では、異常な細胞増殖は、ROSキナーゼに関係する遺伝子欠失によって媒介される。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、異常な細胞増殖は、ROSキナーゼの融合タンパク質によって媒介される。他の実施形態では、異常な細胞増殖は、ROSキナーゼに関係する欠失タンパク質によって媒介される。他の実施形態では、融合タンパク質は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、欠失タンパク質はFIG−ROSである。
【0055】
この態様の他の実施形態では、ROSキナーゼ阻害薬は、ROSキナーゼの低分子阻害薬である。他の実施形態では、ROSキナーゼ阻害薬は、アミノ−ピリジン化合物またはアミノ−ピラジン化合物である。本発明の前述の各態様の他の実施形態では、ROSキナーゼ阻害薬は、式1の化合物または薬学的に許容できるその塩である:
【0056】
【化8】

【0057】
本発明のこの態様の他の実施形態では、異常な細胞増殖はがんである。他の実施形態では、がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。
【0058】
本発明のこの態様のさらに他の実施形態では、がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。さらに他の実施形態では、がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、がんは神経膠芽細胞腫である。
【0059】
本発明のこの態様のさらに他の実施形態では、化合物または薬学的に許容できるその塩を、式1の化合物と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。この態様の他の実施形態では、式1の化合物または薬学的に許容できるその塩を、式1の化合物または薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0060】
本発明のこの態様のさらに他の実施形態では、化合物または薬学的に許容できるその塩を、式1の化合物と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。この態様の他の実施形態では、式1の化合物または薬学的に許容できるその塩を、式1の化合物または薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0061】
他の態様では、本発明は、治療的有効量のROSキナーゼ阻害薬を、ROS陽性であることが分かっている患者に投与するステップを含む方法を提供する。一実施形態では、患者は、少なくとも1つの遺伝子変化ROSキナーゼによって媒介されるがんを有する。他の実施形態では、がんは、ROSキナーゼの融合遺伝子によって媒介される。他の実施形態では、がんは、ROSキナーゼに関係する遺伝子欠失によって媒介される。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、がんは、ROSキナーゼの融合タンパク質によって媒介される。他の実施形態では、がんは、ROSキナーゼに関係する欠失タンパク質によって媒介される。他の実施形態では、融合タンパク質は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、欠失タンパク質はFIG−ROSである。
【0062】
この態様の他の実施形態では、ROSキナーゼ阻害薬は、ROSキナーゼの低分子阻害薬である。他の実施形態では、ROSキナーゼ阻害薬は、アミノ−ピリジン化合物またはアミノ−ピラジン化合物である。本発明の前述の各態様の他の実施形態では、ROSキナーゼ阻害薬は、式1の化合物または薬学的に許容できるその塩である:
【0063】
【化9】

【0064】
他の実施形態では、がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。
【0065】
本発明のこの態様のさらに他の実施形態では、がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。本発明の前述の各態様のさらに他の実施形態では、がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、がんは神経膠芽細胞腫である。
【0066】
本発明のこの態様のさらに他の実施形態では、化合物または薬学的に許容できるその塩を、式1の化合物と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0067】
本発明のこの態様のさらに他の実施形態では、化合物または薬学的に許容できるその塩を、式1の化合物と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。この態様の他の実施形態では、式1の化合物または薬学的に許容できるその塩を、式1の化合物または薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0068】
他の態様では、本発明は、
i.少なくとも1つの遺伝子変化ROSキナーゼについて陽性であることが判明しているがんを有する患者を同定するステップと;
ii.前記患者に、治療的有効量のROSキナーゼ阻害薬を投与するステップとを含む方法を提供する。
【0069】
本発明のこの態様の一実施形態では、前記遺伝子変化ROSキナーゼは、ROSの融合遺伝子である。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合遺伝子はSLC34A2−ROSである。他の実施形態では、融合遺伝子はCD74−ROSである。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼに関係する遺伝子欠失である。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼの融合タンパク質である。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼに関係する欠失タンパク質である。他の実施形態では、融合タンパク質は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合タンパク質はSLC34A2−ROSである。他の実施形態では、融合タンパク質はCD74−ROSである。他の実施形態では、欠失タンパク質はFIG−ROSである。この態様のうちの一部のそのような実施形態では、方法は、(i)少なくとも1つの遺伝子変化ROSキナーゼについて陽性であることが判明しているがんを有する患者を同定するステップと;(ii)前記患者に、治療的有効量のROSキナーゼ阻害薬を投与し、それによって前記がんを治療するステップとを含む。この態様の一部の実施形態では、前記治療は、がんの進行の逆転または阻害をもたらす。
【0070】
この態様の他の実施形態では、ROSキナーゼ阻害薬は、ROSキナーゼの低分子阻害薬である。他の実施形態では、ROSキナーゼ阻害薬は、アミノ−ピリジン化合物またはアミノ−ピラジン化合物である。本発明の前述の各態様の他の実施形態では、ROSキナーゼ阻害薬は、式1の化合物または薬学的に許容できるその塩である:
【0071】
【化10】

【0072】
本発明のこの態様の他の実施形態では、異常な細胞増殖はがんである。本発明の前述の各態様の他の実施形態では、がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。
【0073】
本発明のこの態様のさらに他の実施形態では、がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。本発明の前述の各態様のさらに他の実施形態では、がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、がんは神経膠芽細胞腫である。
【0074】
本発明のこの態様のさらに他の実施形態では、化合物または薬学的に許容できるその塩を、式1の化合物と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。この態様の他の実施形態では、式1の化合物または薬学的に許容できるその塩を、式1の化合物または薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0075】
一態様では、本発明は、そのような治療を必要とするヒトにおいて、少なくとも1つの遺伝子変化ROSによって媒介されるがんを治療するのに有用な医薬品を調製するためのROSキナーゼ阻害薬の使用を提供し、その使用は、前記哺乳動物に、治療的有効量の式1のROSキナーゼ阻害薬または薬学的に許容できるその塩を投与するステップを含む。
【0076】
【化11】

本発明のこの態様の一実施形態では、がんは、ROSの融合遺伝子によって媒介される。この態様の他の実施形態では、ROSの融合遺伝子は、SLC34A2−ROS遺伝子またはCD74−ROS遺伝子である。この態様の他の実施形態では、がんは、ROSキナーゼに関係する遺伝子欠失によって媒介される。この態様の他の実施形態では、遺伝子欠失は、FIG−ROS遺伝子である。この態様の他の実施形態では、がんは、遺伝子変化ROSキナーゼによって媒介される。この態様の他の実施形態では、遺伝子変化ROSキナーゼは、ROS融合である。この態様の他の実施形態では、ROS融合は、SLC34A2−ROSキナーゼまたはCD74−ROSキナーゼである。この態様の他の実施形態では、がんは、ROSキナーゼに関係する欠失タンパク質によって媒介される。この態様の他の実施形態では、欠失タンパク質は、FIG−ROSキナーゼである。
【0077】
この態様の他の実施形態では、がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。この態様の他の実施形態では、がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。この態様の他の実施形態では、がんは非小細胞肺がん(NSCLC)である。この態様の他の実施形態では、がんは神経膠芽細胞腫である。この態様の他の実施形態では、式1の化合物を、式1の化合物と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0078】
他の態様では、本発明は、少なくとも1つの遺伝子変化ROSキナーゼによって媒介されるがんを治療する際に有用な医薬品を調製するためのROSキナーゼ阻害薬の使用を提供する。一実施形態では、ROSキナーゼ阻害薬は、ROSキナーゼの低分子阻害薬である。他の実施形態では、ROSキナーゼ阻害薬は、アミノ−ピリジン化合物またはアミノ−ピラジン化合物である。他の実施形態では、ROSキナーゼ阻害薬は、式1の化合物または薬学的に許容できるその塩である:
【0079】
【化12】

本発明のこの態様の一実施形態では、前記遺伝子変化ROSキナーゼは、ROSの融合遺伝子である。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合遺伝子はSLC34A2−ROSである。他の実施形態では、融合遺伝子はCD74−ROSである。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼに関係する遺伝子欠失である。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼの融合タンパク質である。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼに関係する欠失タンパク質である。他の実施形態では、融合タンパク質は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合タンパク質はSLC34A2−ROSである。他の実施形態では、融合タンパク質はCD74−ROSである。他の実施形態では、欠失タンパク質はFIG−ROSである。本発明のこの態様のさらに他の実施形態では、ROS陽性がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、ROS陽性がんは神経膠芽細胞腫である。
【0080】
他の態様では、本発明は、ROS陽性がんを治療する際に有用な医薬品を調製するためのROSキナーゼ阻害薬の使用を提供する。一実施形態では、ROSキナーゼ阻害薬は、ROSキナーゼの低分子阻害薬である。他の実施形態では、ROSキナーゼ阻害薬は、アミノ−ピリジン化合物またはアミノ−ピラジン化合物である。他の実施形態では、ROSキナーゼ阻害薬は、式1の化合物または薬学的に許容できるその塩である:
【0081】
【化13】

本発明のこの態様の一実施形態では、前記遺伝子変化ROSキナーゼは、ROSの融合遺伝子である。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合遺伝子はSLC34A2−ROSである。他の実施形態では、融合遺伝子はCD74−ROSである。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼに関係する遺伝子欠失である。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼの融合タンパク質である。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼに関係する欠失タンパク質である。他の実施形態では、融合タンパク質は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合タンパク質はSLC34A2−ROSである。他の実施形態では、融合タンパク質はCD74−ROSである。他の実施形態では、欠失タンパク質はFIG−ROSである。本発明のこの態様のさらに他の実施形態では、ROS陽性がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、ROS陽性がんは神経膠芽細胞腫である。
【0082】
他の態様では、本発明は、ROSキナーゼ阻害薬の医薬組成物と、前記医薬組成物をROS陽性がんを有する患者に投与するための説明書セットとを含むキットを提供する。本発明のこの態様の一実施形態では、ROS陽性がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。本発明のこの態様のさらに他の実施形態では、ROS陽性がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、ROS陽性がんは神経膠芽細胞腫である。
【0083】
他の態様では、本発明は、ROSキナーゼ阻害薬の医薬組成物と、前記医薬組成物をROS陽性がんを有する患者に投与するための説明書セットとを含むキットを提供する。一実施形態では、前記ROS陽性がんは、少なくとも1つの遺伝子変化ROSキナーゼによって媒介される。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSの融合遺伝子である。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合遺伝子はSLC34A2−ROSである。他の実施形態では、融合遺伝子はCD74−ROSである。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼに関係する遺伝子欠失である。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼの融合タンパク質である。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼに関係する欠失タンパク質である。他の実施形態では、融合タンパク質は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合タンパク質はSLC34A2−ROSである。他の実施形態では、融合タンパク質はCD74−ROSである。他の実施形態では、欠失タンパク質はFIG−ROSである。本発明のこの態様の一実施形態では、ROS陽性がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。本発明のこの態様のさらに他の実施形態では、ROS陽性がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、ROS陽性がんは神経膠芽細胞腫である。
【0084】
他の態様では、本発明は、クリゾチニブの医薬組成物と、前記医薬組成物をROS陽性がんを有する患者に投与するための説明書セットとを含むキットを提供する。一実施形態では、前記ROS陽性がんは、少なくとも1つの遺伝子変化ROSキナーゼによって媒介される。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSの融合遺伝子である。他の実施形態では、融合遺伝子は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合遺伝子はSLC34A2−ROSである。他の実施形態では、融合遺伝子はCD74−ROSである。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼに関係する遺伝子欠失である。他の実施形態では、遺伝子欠失はFIG−ROSである。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼの融合タンパク質である。他の実施形態では、前記遺伝子変化ROSキナーゼは、ROSキナーゼに関係する欠失タンパク質である。他の実施形態では、融合タンパク質は、SLC34A2−ROSまたはCD74−ROSである。他の実施形態では、融合タンパク質はSLC34A2−ROSである。他の実施形態では、融合タンパク質はCD74−ROSである。本発明のこの態様の一実施形態では、ROS陽性がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。本発明のこの態様のさらに他の実施形態では、ROS陽性がんは非小細胞肺がん(NSCLC)である。さらに他の実施形態では、ROS陽性がんは神経膠芽細胞腫である。
【0085】
さらに他の態様では、本発明は、式1の化合物または薬学的に許容できるその塩を投与することによって、細胞におけるROSキナーゼ活性を阻害する方法を提供する:
【0086】
【化14】

【0087】
他の態様では、本発明は、哺乳動物において、少なくとも1つの遺伝子変化ROSによって媒介されるがんを治療する方法を提供し、この方法は、前記哺乳動物に、治療的有効量の3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩を投与するステップを含む。一部のそのような実施形態では、少なくとも1つの遺伝子変化ROSは、遺伝子変化ROS遺伝子または遺伝子変化ROSタンパク質である。
【0088】
この態様の一部の実施形態では、前記治療は、がんの進行の逆転または阻害をもたらす。この態様の多くの実施形態では、哺乳動物はヒトである。
【0089】
この態様の多くの実施形態では、少なくとも1つの遺伝子変化ROSは、ROS融合遺伝子などの遺伝子変化ROS遺伝子である。一部のそのような実施形態では、ROS融合遺伝子は、SLC34A2−ROS遺伝子またはCD74−ROS遺伝子である。他のそのような実施形態では、ROS融合遺伝子はFIG−ROS遺伝子である。
【0090】
この態様の多くの実施形態では、少なくとも1つの遺伝子変化ROSは、ROS融合タンパク質などの遺伝子変化ROSタンパク質である。一部のそのような実施形態では、ROS融合タンパク質は、SLC34A2−ROSキナーゼまたはCD74−ROSキナーゼである。他のそのような実施形態では、ROS融合タンパク質はFIG−ROSキナーゼである。
【0091】
この態様の一部の実施形態では、本発明は、哺乳動物において、ROS融合遺伝子によって媒介されるがんの進行を逆転または阻害する方法を提供し、この方法は、前記哺乳動物に、治療的有効量の3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩を投与するステップを包含する。一部のそのような実施形態では、ROS融合遺伝子はSLC34A2−ROS遺伝子である。他のそのような実施形態では、ROS融合遺伝子はCD74−ROS遺伝子である。さらに他のそのような実施形態では、ROS融合遺伝子はFIG−ROS遺伝子である。ある種の実施形態では、ROS融合遺伝子は、SLC34A2−ROS遺伝子、CD74−ROS遺伝子およびFIG−ROS遺伝子からなる群から選択される。
【0092】
この態様の他の実施形態では、本発明は、哺乳動物において、ROS融合タンパク質によって媒介されるがんの進行を逆転または阻害する方法を提供し、この方法は、前記哺乳動物に、治療的有効量の3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩を投与するステップを含む。一部のそのような実施形態では、ROS融合タンパク質はSLC34A2−ROSキナーゼである。他のそのような実施形態では、ROS融合タンパク質はCD74−ROSキナーゼである。さらに他のそのような実施形態では、ROS融合タンパク質はFIG−ROSキナーゼである。ある種の実施形態では、ROS融合タンパク質は、SLC34A2−ROSキナーゼ、CD74−ROSキナーゼおよびFIG−ROSキナーゼからなる群から選択される。
【0093】
この態様の一部の実施形態では、がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。
【0094】
この態様の他の実施形態では、がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。この態様の一部の実施形態では、がんは非小細胞肺がん(NSCLC)である。この態様の他の実施形態では、がんは神経膠芽細胞腫である。
【0095】
この態様の多くの実施形態では、3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩を、3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【0096】
この態様の一部の実施形態では、方法はさらに、前記投与ステップの前に、遺伝子変化ROS遺伝子または遺伝子変化ROSタンパク質などの少なくとも1つの遺伝子変化ROSによって特徴付けられるがんを有する哺乳動物を同定するステップを含む。一部のそのような実施形態では、がんは、遺伝子変化ROSポリヌクレオチドおよび/または遺伝子変化ROSポリペプチドを有すると特徴付けられる。
【0097】
さらに他の態様では、本発明は、(i)少なくとも1つの遺伝子変化ROSによって特徴付けられるがんを有する哺乳動物を同定するステップと;(ii)前記哺乳動物に、治療的有効量の3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩を投与するステップとを含む、哺乳動物においてがんを治療する方法を提供する。一部のそのような実施形態では、少なくとも1つの遺伝子変化ROSは、遺伝子変化ROS遺伝子または遺伝子変化ROSタンパク質である。
【0098】
この態様の一部の実施形態では、前記治療は、がんの進行の逆転または阻害をもたらす。この態様の多くの実施形態では、哺乳動物はヒトである。
【0099】
この態様の一部の実施形態では、少なくとも1つの遺伝子変化ROSは、遺伝子変化ROS遺伝子、例えば、ROS融合遺伝子である。一部のそのような実施形態では、ROS融合遺伝子は、SLC34A2−ROS遺伝子またはCD74−ROS遺伝子である。他のそのような実施形態では、ROS融合遺伝子はFIG−ROS遺伝子である。
【0100】
この態様の一部の実施形態では、少なくとも1つの遺伝子変化ROSは、遺伝子変化ROSタンパク質、例えば、ROS融合タンパク質である。一部のそのような実施形態では、ROS融合タンパク質は、SLC34A2−ROSキナーゼまたはCD74−ROSキナーゼである。他のそのような実施形態では、ROS融合タンパク質はFIG−ROSキナーゼである。
【0101】
この態様の一部の実施形態では、本発明は、哺乳動物においてがんの進行を逆転または阻害する方法を提供し、この方法は、(i)少なくとも1つのROS融合遺伝子によって特徴付けられるがんを有する哺乳動物を同定するステップと;(ii)前記哺乳動物に、治療的有効量の3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩を投与するステップとを含む。一部のそのような実施形態では、ROS融合遺伝子はSLC34A2−ROS遺伝子である。他のそのような実施形態では、ROS融合遺伝子はCD74−ROS遺伝子である。さらに他のそのような実施形態では、ROS融合遺伝子はFIG−ROS遺伝子である。ある種の実施形態では、ROS融合遺伝子は、SLC34A2−ROS遺伝子、CD74−ROS遺伝子およびFIG−ROS遺伝子からなる群から選択される。
【0102】
この態様の一部の実施形態では、本発明は、哺乳動物においてがんの進行を逆転または阻害する方法を提供し、この方法は、(i)少なくとも1つのROS融合タンパク質によって特徴付けられるがんを有する哺乳動物を同定するステップと;(ii)前記哺乳動物に、治療的有効量の3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩を投与するステップとを含む。一部のそのような実施形態では、ROS融合タンパク質はSLC34A2−ROSキナーゼである。他のそのような実施形態では、ROS融合タンパク質はCD74−ROSキナーゼである。さらに他のそのような実施形態では、ROS融合タンパク質はFIG−ROSキナーゼである。ある種の実施形態では、ROS融合タンパク質は、SLC34A2−ROSキナーゼ、CD74−ROSキナーゼおよびFIG−ROSキナーゼからなる群から選択される。
【0103】
この態様の一部の実施形態では、がんは、遺伝子変化ROSポリヌクレオチドおよび/または遺伝子変化ROSポリペプチドを有すると特徴付けられる。
【0104】
この態様の一部の実施形態では、がんは、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される。
【0105】
この態様の他の実施形態では、がんは、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される。この態様の一部の実施形態では、がんは非小細胞肺がん(NSCLC)である。この態様の他の実施形態では、がんは神経膠芽細胞腫である。
【0106】
この態様の多くの実施形態では、3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩を、3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する。
【図面の簡単な説明】
【0107】
【図1】クリゾチニブによるU138MG細胞およびHCC78細胞におけるSLC34A2−ROSリン酸化の濃度依存的阻害を示すグラフである。
【図2】クリゾチニブによるHCC78細胞生存力の濃度依存的阻害を示すグラフである。
【図3】HCC78ヒトNSCLC細胞におけるクリゾチニブによるSLC34A2−ROSリン酸化およびROS媒介シグナル伝達の濃度依存的阻害を示すグラフである。
【図4】SLC34A2−ROS融合を内包するHCC78ヒトNSCLC細胞における切断Caspase3レベルのクリゾチニブによる用量依存的上昇を示す図である。
【図5】ヌードマウスにおけるヒトCD74−ROS、SLC34A2−ROS(L)、SLC34A2−ROS(S)、FIG−ROS(L)およびFIG−ROS(S)を内包するROS融合操作3T3−ROS腫瘍モデルのパネルでのクリゾチニブの細胞減少性効果を示すグラフである。
【図6】ヌードマウスにおける3T3−CD74−ROS異種移植片モデルでのROSリン酸化(A)および腫瘍増殖(B)のクリゾチニブによる用量依存的阻害を示す図である。
【図7】ヌードマウスにおける3T3−SLC34A2−ROS(L)異種移植片モデルでのクリゾチニブによる腫瘍増殖の用量依存的阻害を示す図である。
【発明を実施するための形態】
【0108】
別段に示されていない限り、本発明の化合物に関する本明細書中の全ての言及には、多形、立体異性体および同位体標識されたそのバージョンを包含するその塩、溶媒和物、水和物および複合体ならびにその塩の溶媒和物、水和物および複合体に対する言及が包含される。
【0109】
定義
別段に定義されていない限り、本明細書で使用される技術および化学用語は全て、本発明が属する分野の当業者が一般に理解している意味と同じ意味を有する。本明細書に記載されているものと同様または同等の任意の方法および物質を本発明の実施または試験において使用することができるが、好ましい方法および材料が、本明細書では記載されている。実施形態の記載および本発明の請求において、ある種の専門用語を、下記の定義に従って使用する。
【0110】
本明細書で使用される場合、単数形「a」、「an」および「the」は、文脈で別段に明示されていない限り、複数の言及を包含する。したがって、例えば、「the method」という言及には、本明細書に記載されていて、かつ/または本開示を読めば当業者には明らかになる種類の1種または複数の方法および/またはステップが包含される。
【0111】
本明細書で使用される場合、別段に示されていない限り、「異常な細胞増殖」という用語は、正常な調節機構から独立(例えば接触阻害を喪失)した細胞増殖を指す。
【0112】
本明細書で使用される場合、別段に示されていない限り、「投与すること」という用語は、患者が自分自身の努力によって、本明細書に記載されている治療薬を摂取する自己投与の行為、患者が他者(例えば、医師、看護士、家族またはIV)の努力を介して本明細書に記載されている治療薬を摂取する投与行為を指す。投与はまた、本明細書に記載されている治療薬を処方する動作を包含する。「投与」という用語は、本明細書で使用される場合、別段に示されていない限り、「投与」が直前で定義されているとおり、治療行為を指す。
【0113】
本明細書で使用される場合、「抗体(antibody)」または「抗体(antibodies)」は、Fabまたはその抗原認識断片を包含し、キメラ、ポリクローナルおよびモノクローナル抗体を包含するIgG、IgM、IgA、IgDおよびIgEを包含する全ての種類の免疫グロブリンを指す。「ヒト化抗体」という用語は、本明細書で使用される場合、ヒト抗体により緊密に似せるために、アミノ酸が非抗原結合領域において置き換えられているが、元の結合性はまだ残している抗体分子を指す。
【0114】
「生体試料」という用語は本明細書では、その最も広範な意味で使用されており、SLC34A2−ROS融合、CD74−ROS融合、FIG−ROS融合または切断されたROSポリヌクレオチドもしくはポリペプチドまたはその断片を含有すると考えられる任意の生体試料を意味し、細胞、細胞から単離された染色体(例えば、中期染色体のスプレッド)、ゲノムDNA(溶液中、またはサザン分析などのために固体支持体に結合)、RNA(溶液中、またはノーザン分析などのために固体支持体に結合)、cDNA(溶液中、または固体支持体に結合)、細胞からの抽出物、血液、尿、骨髄または組織などを含んでよい。
【0115】
本明細書で使用される場合、「欠失遺伝子」という用語は、ゲノム内の同じ染色体上の異なる位置からの2つの遺伝子が、2つの遺伝子の間にあるヌクレオチドの欠失を介して融合する遺伝子事象(「遺伝子欠失」とも称される)から生じている遺伝子を指す。欠失遺伝子には、これらに限られないが、上記のFIG−ROS遺伝子が包含される。
【0116】
本明細書で使用される場合、「融合遺伝子」という用語は、ゲノム内の異なる位置からの2つの遺伝子が、融合、転座または転化して、新たな遺伝子を作る遺伝子事象から生じている遺伝子を指す。融合遺伝子の具体的な例には、これらに限られないが、SLC34A2−ROS遺伝子を形成するSLC34A2遺伝子とROS遺伝子との融合およびCD74−ROS遺伝子を形成するCD74遺伝子とROS遺伝子との融合が包含される。
【0117】
本明細書で使用される場合、「遺伝子変化ROS」という用語は、ゲノムDNA、ヌクレオチド、タンパク質またはポリペプチドかどうかに関わらず、本明細書に記載のROS融合または欠失のいずれかを指す。「遺伝子変化ROSポリヌクレオチド」という用語は、本明細書に記載の遺伝子変化ROSタンパク質のいずれかをコードするポリヌクレオチドを指す。「遺伝子変化ROSタンパク質」という用語は、本明細書に記載の融合、欠失、トランケーションまたは突然変異のいずれかを指す。「遺伝子変化ROSタンパク質」という用語は、本明細書で使用される場合、「遺伝子変化ROSポリペプチド」と互換的に使用される。好ましい遺伝子変化ROSタンパク質には、「ROS融合」が包含される。好ましいROS融合には、これらに限られないが、SLC34A2−ROS融合タンパク質およびCD74−ROS融合タンパク質が包含される。好ましい遺伝子変化ROSポリペプチドには、SLC34A2−ROS融合ポリペプチドおよびCD74−ROS融合ポリペプチドが包含される。
【0118】
本明細書で使用される場合、「ROSキナーゼ」は、ROSタンパク質のキナーゼ部分を含有する本明細書に記載されている任意のタンパク質を指す。ROSキナーゼには、これらに限られないが、本明細書に記載の遺伝子変化ROSタンパク質および野生型ROSタンパク質が包含される。「遺伝子変化ROSキナーゼ」という用語は、遺伝子変化ROSポリヌクレオチドによってコードされるタンパク質またはポリペプチドを指す。
【0119】
本明細書で使用される場合、「ROSポリペプチド特異的試薬」という用語は、抗体、AQUAペプチド、核酸プローブ、核酸プライマーなど、本明細書に記載されているROSキナーゼのいずれかに特異的な任意の試薬を指す。例えば、好ましい「ROSポリペプチド特異的試薬」は、本明細書に記載の遺伝子変化ROSキナーゼのいずれかに特異的な抗体である。より好ましくは、本明細書で使用される場合、「ROSポリペプチド特異的試薬」は、SLC34A2−ROS融合ポリペプチドおよび/またはCD74−ROS融合ポリペプチドおよび/またはFIG−ROS融合ポリペプチドに特異的な抗体である。「ROSポリペプチド特異的試薬」が抗体である場合、試薬は、「ROSポリペプチド特異的抗体」として本明細書では称され得る。そのようなROSポリペプチド特異的抗体は例えば、「SLC34A2−ROS融合ポリペプチド抗体」、「SLC34A2−ROS融合タンパク質抗体」または「FIG−ROS融合タンパク質抗体」である。
【0120】
本明細書で使用される場合、別段に示されていない限り、「治療すること」という用語は、そのような用語が適用されている障害もしくは状態またはそのような障害もしくは状態の1つもしくは複数の症状の進行の逆転、緩和、阻害を意味する。「治療」という用語は、本明細書で使用される場合、別段に示されていない限り、「治療すること」が直前で定義されているとおり、治療行為を指す。「治療」という用語には、上記のとおりの「投与すること」または「投与」が包含される。
【0121】
本明細書で使用される場合、「薬学的に許容できる塩」という用語には、酸付加塩および塩基塩(二塩を包含)が包含される。
【0122】
適切な酸付加塩は、非毒性の塩を形成する酸から形成される。例には、酢酸塩、アスパラギン酸塩、安息香酸塩、ベシル酸塩、重炭酸塩/炭酸塩、重硫酸塩/硫酸塩、ホウ酸塩、カンシル酸塩、クエン酸塩、エジシル酸塩、エシル酸塩、ギ酸塩、フマル酸塩、グルセプ酸塩、グルコン酸塩、グルクロン酸塩、ヘキサフルオロリン酸塩、ヒベンズ酸塩、塩酸塩/塩化物、臭化水素酸塩/臭化物、ヨウ化水素酸塩/ヨウ化物、イセチオン酸塩、乳酸塩、リンゴ酸塩、マレイン酸塩、マロン酸塩、メタンスルホン酸塩、メチル硫酸塩、ナフチル酸塩、2−ナプシル酸塩、ニコチン酸塩、硝酸塩、オロチン酸塩、シュウ酸塩、パルミチン酸塩、パモ酸塩、リン酸/リン酸水素塩/リン酸二水素塩、サッカリン酸塩、ステアリン酸塩、コハク酸塩、酒石酸塩、トシル酸塩およびトリフルオロ酢酸が包含される。
【0123】
適切な塩基塩は、非毒性の塩を形成する塩基から形成される。例には、アルミニウム、アルギニン、ベンザチン、カルシウム、コリン、ジエチルアミン、ジオラミン、グリシン、リシン、マグネシウム、メグルミン、オラミン、カリウム、ナトリウム、トロメタミンおよび亜鉛塩が包含される。
【0124】
適切な薬学的に許容できる塩についての総説に関しては、その開示全体が参照によって本明細書に組み込まれるStahlおよびWermuthによる「Handbook of Pharmaceutical Salts:Properties,Selection,and Use」(Wiley−VCH、Weinheim、Germany、2002)を参照されたい。
【0125】
本発明の化合物の薬学的に許容できる塩は、化合物の溶液および所望の酸または塩基を適切に一緒に混合することによって容易に調製することができる。塩を溶液から沈殿させ、濾過によって集めるか、または溶媒を蒸発させることによって回収することができる。塩の電離度は、完全なイオン化からほぼ非イオン化まで変動し得る。
【0126】
本発明の化合物は、非溶媒和および溶媒和形態の両方で存在し得る。「溶媒和物」という用語は本明細書では、本発明の化合物および1個または複数の薬学的に許容できる溶媒分子、例えば、エタノールを含む分子複合体を記載するために使用されている。「水和物」という用語は、溶媒が水である場合に使用されている。本発明による薬学的に許容できる溶媒和物には、結晶化の溶媒が同位体置換されている水和物および溶媒和物が包含される(例えば、D2O、d6−アセトン、d6−DMSO)。
【0127】
本発明はまた、式1の化合物と同一であるが、但し、1個または複数の原子が、自然に通常は存在する原子質量または質量数とは異なる原子質量または質量数を有する原子に置き換えられている、同位体標識されている化合物を包含する。本発明の化合物に導入することができる同位体の例には、それぞれ2H、3H、13C、14C、15N、18O、17O、31P、32P、35S、18Fおよび36Clなどの水素、炭素、窒素、酸素、リン、硫黄、フッ素および塩素の同位体が包含される。前記の同位体および/または他の原子の他の同位体を含有する本発明の化合物および前記化合物の薬学的に許容できる塩も、本発明の範囲内である。本発明のある種の同位体標識された化合物、例えば、3Hおよび14Cなどの放射性同位体が導入されたものは、薬物および/または基質組織分布アッセイで有用である。トリチウム、即ち、3Hおよび炭素−14、即ち14C同位体が、その調製の容易さおよび検出性により特に好ましい。さらに、ジュウテリウム、即ち2Hなどの重い同位体での置換は、より大きな代謝安定性、例えば、in vivo半減期の上昇または投薬量要求の減少から生じるある種の治療上の利点をもたらすことができ、したがって、場合によっては好ましいことがある。非同位体標識試薬を容易に利用可能な同位体標識試薬に代えて、非標識化合物のために記載された手順を実施することによって、同位体標識された本発明の式1の化合物を一般に調製することができる。
【0128】
包接化合物、薬物−ホスト包接複合体などの複合体も、本発明の範囲内に包含され、ここで、上記の溶媒和物とは対照的に、薬物およびホストは、化学量論的量または非化学量論的量で存在する。また、化学量論的量または非化学量論的量であってよい2種以上の有機および/または無機成分を含有する薬物の複合体も包含される。生じる複合体は、電離しているか、部分的に電離しているか、非電離であってよい。このような複合体の総説に関しては、その開示全体が参照によって本明細書に組み込まれるHaleblianによるJ Pharm Sci、64(8)、1269〜1288(1975年8月)を参照されたい。
【0129】
診断検査
本発明に関連して、生体試料に遺伝子変化ROSが存在するか、または存在しないかを決定するための診断検査として、当業者に知られているいくつかのアッセイフォーマットを使用することができる。診断検査が、生体試料が遺伝子変化ROSを含有することを示す検査結果を返してきた場合に、その生体試料を得た患者をROS陽性とみなす。同様に、診断検査が、生体試料ががん腫瘍生検である場合に、生体試料が遺伝子変化ROSを含有することを示す試験結果を返してきた場合、そのがんをROS陽性がんとみなす。詳細には、生体試料ががん細胞を含む場合、そのがんは、当業者に知られているか、または本明細書に記載されている技術を使用して遺伝子変化ROSポリヌクレオチドおよび/またはポリペプチドの存在を検出することによって、ROS融合遺伝子またはROS融合タンパク質などの遺伝子変化ROS遺伝子または遺伝子変化ROSタンパク質を含有すると特徴付けられ得る。
【0130】
イムノアッセイ
本発明の方法を実施する際に有用なイムノアッセイは、ホモジニアスイムノアッセイまたはヘテロジニアスイムノアッセイであってよい。ホモジニアスアッセイでは、免疫反応は通常、変異型ROSポリペプチド特異的試薬(例えば、SLC34A2−ROS融合ポリペプチド特異的抗体、CD74−ROS融合ポリペプチド特異的抗体またはFIG−ROS融合ポリペプチド特異的抗体)、標識された分析物および該当する生体試料を必要とする。標識から生じるシグナルは、抗体が標識された分析物に結合すると、直接か、または間接的に変化する。免疫反応およびその規模の検出の両方を、ホモジニアス溶液中で実施する。使用することができる免疫化学的標識には、遊離ラジカル、放射性同位体、蛍光染料、酵素、バクテリオファージ、補酵素などが包含される。半導体ナノ結晶標識または「量子ドット」もまた、有利に使用することができ、その調製および使用は、十分に記載されている(一般には、K.Barovsky、Nanotech. Law & Bus.1(2):Article 14(2004)およびそこに挙げられている特許を参照されたい)。
【0131】
ヘテロジニアスアッセイ手法では、試薬は通常、生体試料、変異型ROSキナーゼポリペプチド特異的試薬(例えば、抗体)および検出可能なシグナルを生じさせるために適した手段である。下記でさらに記載されているとおりの生体試料を使用することができる。抗体を一般に、ビーズ、プレートまたはスライドなどの支持体に固定化し、抗原を含有すると考えられる試料と液相で接触させる。次いで支持体を液相から分離し、支持体相または液相を検出可能なシグナルについて、そのようなシグナルを生じさせる手段を使用して検査する。シグナルは、生体試料中の分析物の存在に関連している。検出可能なシグナルを生じさせるための手段には、放射性標識、蛍光標識、酵素標識、量子ドットなどの使用が包含される。例えば、検出される抗原が、第2結合部位を含有する場合、分離ステップの前に、その部位に結合する抗体を、検出可能な基に結合させ、液相反応溶液に加えることができる。固体支持体上での検出可能な基の存在は、検査試料中に抗原が存在することを示している。適切なイムノアッセイの例は、ラジオイムノアッセイ、免疫蛍光法、酵素結合イムノアッセイなどである。
【0132】
本明細書に開示されている方法を実施するために有用であり得るイムノアッセイフォーマットおよびその変形形態は、当分野でよく知られている(一般には、E.Maggio、Enzyme−Immunoassay(1980)(CRC Press,Inc.、Boca Raton、Fla.)を参照されたい;また例えば、米国特許第4,727,022号(Skoldら、「Methods for Modulating Ligand−Receptor Interactions and their Application」);米国特許第4,659,678号(Forrestら、「Immunoassay of Antigens」);米国特許第4,376,110号(Davidら、「Immunometric Assays Using Monoclonal Antibodies」)も参照されたい)。試薬−抗体複合体を形成するために適した条件は、当業者によく知られている。検出可能な試薬の濃度は、SLC34A2−ROS融合ポリペプチドの結合を、背景に対して検出することができる程度に十分であるべきである。
【0133】
本明細書に開示されている方法(例えば、IHC、ウェスタンブロット、免疫蛍光およびフローサイトメトリー)を実施する際に有用な抗体には、限定ではないが、特に全長SLC34A2またはCD74(例えば、タンパク質のN末端に結合)または全長ROS(例えば、ROSのキナーゼドメイン中のエピトープに結合)のいずれかに特異的に結合する抗体が包含される。そのような抗体は市販されていることがある(例えば、Abcam,Inc.、Cambridge MAによって製品ab5512として販売されているROS特異的ポリクローナル抗体)。使用される抗体がウェスタンブロット分析またはフローサイトメトリーなどにおいて、全長ROSまたは全長SLC34A2に特異的に結合する場合、本発明の変異型ROSポリペプチドまたはポリヌクレオチド(例えば、SLC34A2−ROSポリペプチドまたはポリヌクレオチド)の存在を検出するための追加的な方法を同じ試料で使用することができる。例えば、透過処理された細胞でのフローサイトメトリーをAbcamのab5512抗体で行い、その後、細胞を溶解させ、遺伝子物質(例えば、mRNAまたはゲノムDNA)を、SLC34A2またはCD74をコードするcDNAの5’末端(例えば、フォワードプライマー)およびROSをコードするcDNAの3’末端の補体(例えば、リバースプライマー)に特異的な(即ちハイブリダイズする)PCRプライマーを使用してPCR分析する。
【0134】
本発明の方法で使用するための抗体は全て、診断アッセイに適した固体支持体(例えば、ラテックスまたはポリスチレンなどの材料から形成されたビーズ、プレート、スライドまたはウェル)に、沈殿などの知られている技術に従って結合されていてよい。抗体または他のROSポリペプチド特異的試薬は同様に、放射性標識(例えば、35S、1251、1311)、酵素標識(例えば、ホースラディッシュペルオキシダーゼ、アルカリホスファターゼ)および蛍光標識(例えば、フルオレセイン)などの検出可能な基に、知られている技術に従って結合されていてよい。
【0135】
フローサイトメトリー(FC)、免疫組織化学(IHC)または免疫蛍光(IF)などの細胞ベースのアッセイが、本発明の方法を実施する際には特に望ましい。それというのも、そのようなアッセイフォーマットは、臨床的に適していて、遺伝子変化ROSタンパク質発現の検出をin vivoで可能にし、抽出物を得るために例えば腫瘍試料から得られた細胞の操作によって生じる活性の人為的変化の危険性を回避するためである。したがって、一部の好ましい実施形態では、本発明の方法を、フローサイトメトリー(FC)、免疫組織化学(IHC)または免疫蛍光(IF)アッセイフォーマットで実施する。
【0136】
フローサイトメトリー(FC)は、ROSキナーゼ活性の阻害をターゲットとする薬物での治療前、その間およびその後に、哺乳動物腫瘍における遺伝子変化ROSタンパク質の発現を決定するために使用することができる。例えば、微細針吸引液からの腫瘍細胞を、フローサイトメトリーによって、SLC34A2−ROS融合ポリペプチド発現またはCD74−ROS融合ポリペプチド発現および/または活性化について、さらに所望ならば、がん細胞型などを同定するためのマーカーについて分析することができる。フローサイトメトリーは、標準的な方法に従って実施することができる。例えば、Chowら、Cytometry(Communications in Clinical Cytometry)46:72〜78(2001)を参照されたい。簡単には例えば、サイトメトリー分析のための次のプロトコルを使用することができる:細胞を2%パラホルムアルデヒドで37℃で10分間固定し、続いて、90%メタノール中、氷上で30分間、透過処理する。次いで、細胞を一次ROSポリペプチド特異的抗体で染色し、洗浄し、蛍光標識二次抗体で標識することができる。次いで、細胞をフローサイトメーター(例えば、Beckman Coulter FC500)で、使用される装置の特異的なプロトコルに従って分析する。そのような分析によって、腫瘍において発現されたSLC34A2−ROS融合ポリペプチドまたはCD74−ROS融合ポリペプチドのレベルを同定する。ROS阻害治療薬で腫瘍を治療した後の同様の分析によって、ROSキナーゼの標的阻害薬に対するSLC34A2−ROS融合ポリペプチド発現腫瘍またはCD74−ROS融合ポリペプチド発現腫瘍の応答性が明らかになるであろう。
【0137】
免疫組織化学的(IHC)染色もまた、ROSキナーゼ活性の阻害をターゲットとする薬物での治療前、その間およびその後に、哺乳動物のがん(例えば、NSCLC)における遺伝子変化ROSタンパク質の発現および/または活性化状態を決定するために使用することができる。IHCは、よく知られている技術に従って実施することができる(例えば、ANTIBODIES:A LABORATORY MANUAL、Chapter 10、Harlow & Lane Eds.、Cold Spring Harbor Laboratory(1988)を参照されたい)。簡単には例えば、パラフィン包埋組織(例えば、生検からの腫瘍組織)を免疫組織化学的染色のために、キシレンで、続いて、エタノールで組織切片を脱パラフィン処理し;水中、次いで、PBS中で水和させ;クエン酸ナトリウム緩衝液中でスライドを加熱することによって抗原をアンマスク処理し;過酸化水素中で切片をインキュベートし;ブロッキング溶液中でブロッキングし;一次抗SLC34A2−ROS融合ポリペプチド抗体または抗CD74−ROS融合ポリペプチド抗体および二次抗体中でスライドをインキュベートし;かつ最後に、製造者の指示に従って、ABCアビジン/ビオチン方法を使用して検出することによって調製する。免疫蛍光(IF)アッセイもまた、ROSキナーゼ活性の阻害をターゲットとする薬物での治療前、その間およびその後に、哺乳動物のがんにおけるSLC34A2−ROS融合ポリペプチドまたはCD74−ROS融合ポリペプチドの発現および/または活性化状態を決定するために使用することができる。IFは、よく知られている技術に従って実施することができる。例えば、J.M.PolakおよびS.Van Noorden(1997) INTRODUCTION TO IMMUNOCYTOCHEMISTRY、第2版;ROYAL MICROSCOPY SOCIETY MICROSCOPY HANDBOOK 37、BioScientific/Springer−Verlagを参照されたい。簡単には例えば、患者試料をパラホルムアルデヒド中、続いて、メタノール中で固定し、ウマ血清などのブロッキング溶液でブロックし、SLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドまたはFIG−ROS融合ポリペプチドに対する一次抗体で、続いて、Alexa 488などの蛍光染料で標識された二次抗体と共にインキュベートし、落射蛍光顕微鏡で分析することができる。
【0138】
上記アッセイで使用される抗体を有利には他のシグナル伝達(EGFR、ホスホ−AKT、ホスホ−Erk1/2)および/または細胞マーカー(サイトケラチン)抗体と共にマルチパラメトリック分析において使用するために、蛍光染料(例えば、Alexa488、PE)または量子ドットなどの他の標識に結合させることができる。遺伝子変化ROSポリペプチドを測定するための酵素結合免疫吸着検定法(ELISA)、ラジオイムノアッセイ(RIA)および蛍光標識細胞分取(FACS)を包含する様々な他のプロトコルが当分野では知られており、SLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドまたはFIG−ROS融合ポリペプチド発現レベルの変化または異常を診断するための基礎を提供している。SLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドまたはFIG−ROS融合ポリペプチド発現の正常または標準的な値は、正常な哺乳動物対象、好ましくはヒトから採取された体液または細胞抽出物と、複合体形成に適した条件下でのSLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドまたはFIG−ROS融合ポリペプチドに対する抗体との組み合わせによって確立される。標準的な複合体形成の量は、様々な方法によって、しかし好ましくは測光の手段によって定量化され得る。対象、対照および生検組織からの疾患試料において発現されるSLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドまたはFIG−ROS融合ポリペプチドの量を標準的な値と比較する。標準値と対象値との偏差によって、疾患を診断するためのパラメーターが確立される。
【0139】
ペプチドおよびヌクレオチドアッセイ
上記のSection Eにおいて詳述したとおりに、同様に、腫瘍からの細胞を含む生体試料中で発現される遺伝子変化ROSポリペプチドを検出/定量化するためのAQUAペプチドを調製し、標準的なAQUAアッセイにおいて使用することができる。したがって、本発明の方法の一部の好ましい実施形態では、ROSポリペプチド特異的試薬は、SLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドまたはFIG−ROS融合ポリペプチドの融合結合を含むペプチド配列に対応する重同位体標識ホスホペプチド(AQUAペプチド)を含む。本発明の方法を実施する際に有用なROSポリペプチド特異的試薬はまた、生体試料において融合または切断されたポリペプチド発現転写物に直接ハイブリダイズし、検出し得るmRNA、オリゴヌクレオチドまたはDNAプローブであってよい。
【0140】
簡単には例えば、ホルマリン固定、パラフィン包埋患者試料を、フルオレセイン標識されたRNAプローブでプローブし、続いて、ホルムアミド、SSCおよびPBSで洗浄し、蛍光顕微鏡で分析することができる。遺伝子変化ROSポリペプチドをコードするポリヌクレオチドもまた、診断目的で使用することができる。使用することができるポリヌクレオチドには、オリゴヌクレオチド配列、アンチセンスRNAおよびDNA分子ならびにPNAが包含される。ポリヌクレオチドを使用して、SLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドまたは欠失ROSポリペプチドの発現が疾患と相関し得る生検組織において、遺伝子発現を検出および定量することができる。診断アッセイを使用して、SLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドまたは欠失ROSポリペプチドの不在、存在および過剰発現を区別し、治療的に介入している間のSLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドまたは欠失ROSポリペプチドレベルの調節を監視することができる。好ましい一実施形態では、SLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドもしくはFIG−ROS融合ポリペプチドまたは近縁の分子をコードするゲノム配列を包含するポリヌクレオチド配列を検出することができるPCRプローブとのハイブリダイゼーションを使用して、遺伝子変化ROSポリペプチドをコードする核酸配列を同定することができる。そのようなプローブの構築および使用は当業者に知られており、米国特許出願公開第2010/0221737号に記載されている。
【0141】
高度に特異的な領域、例えば、融合結合に特有のヌクレオチドまたは特異性の低い領域、例えば、3’コーディング領域からなるかどうかのプローブの特異性と、ハイブリダイゼーションまたは増幅の厳密性(最大、高度、中程度、低度)とによって、そのプローブが遺伝子変化ROSポリペプチドをコードする天然に生じる配列、対立遺伝子または関連配列のみを同定するかどうかが決定される。プローブはまた、関連配列を検出するためにも使用することができ、好ましくは、遺伝子変化ROSポリペプチドをコードする配列のいずれかに由来するヌクレオチドのうちの少なくとも50%を含有すべきである。
【0142】
SLC34A2−ROS融合ポリヌクレオチド、CD74−ROS融合ポリヌクレオチドまたは欠失ROSポリヌクレオチドを、サザンまたはノーザン分析、ドットブロットまたは他の膜ベースの技術で;PCR技術で;または患者生検からの液体または組織を利用するディップスティック、ピン、ELISAまたはチップアッセイで使用して、遺伝子変化ROSポリペプチド発現を検出することができる。そのような定性または定量方法は、当分野でよく知られている。特定の態様では、遺伝子変化ROSポリペプチドをコードするヌクレオチド配列は、NSCLCを包含する肺がんを包含する様々ながんの活性化または誘発を検出するアッセイにおいて有用であり得る。遺伝子変化ROSポリヌクレオチドを標準的な方法によって標識し、ハイブリダイゼーション複合体を形成するために適した条件下で患者からの液体または組織試料に加えることができる。適切なインキュベーション期間の後に、試料を洗浄し、シグナルを定量し、標準的な値と比較する。生検または抽出試料中でのシグナルの量が比較可能な対照試料の量から有意に変化していたら、ヌクレオチド配列は試料中のヌクレオチド配列とハイブリダイズしていて、試料においてSLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドまたは欠失ROSポリペプチドをコードするヌクレオチド配列のレベル変化が存在することは、関連する疾患の存在を示している。そのようなアッセイはまた、動物研究、臨床試験または個々の患者の治療の監視において特定の治療的処置レジメンの効力を評価するために使用することができる。
【0143】
遺伝子変化ROSポリペプチドの発現によって特徴付けられる疾患を診断するためのベースを得るために、発現に関する正常または標準プロファイルを確立する。これは、動物またはヒトのいずれかの正常な対象から採取された体液または細胞抽出物を、SLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドまたは欠失ROSポリペプチド(例えば、FIG−ROS融合ポリペプチド)をコードする配列またはその断片と、ハイブリダイゼーションまたは増幅に適した条件下で組み合わせることによって達成され得る。標準的なハイブリダイゼーションは、正常な対象から得られた値と、実験からの値とを比較することによって定量化することができ、その際、既知の量の十分に精製されたポリヌクレオチドを使用する。正常な試料から得られた標準的な値を、疾患の症候を有する患者からの試料から得られた値と比較することができる。標準と対象との値の偏差を使用して、疾患の存在を確認する。
【0144】
疾患を確認し、治療プロトコルを開始したら、ハイブリダイゼーションアッセイを定期的に繰り返して、患者における発現レベルが、正常患者において観察されるレベルに近づき始めているかどうかを評価することができる。連続したアッセイから得られた結果を使用して、数日から数ヶ月の範囲の期間にわたって治療の効果を見ることができる。
【0145】
遺伝子変化ROSポリヌクレオチドに関する追加的な診断用の使用は、ポリメラーゼ連鎖反応(PCR)、当業者には標準的な他の好ましいアッセイフォーマットを使用することを必要とすることがある(例えば、MOLECULAR CLONING、A LABORATORY MANUAL、第2版、Sambrook,J.、Fritsch,E.F.およびManiatis,T.編、Cold Spring Harbor Laboratory Press、Cold Spring Harbor、N.Y.(1989)を参照されたい)。PCRオリゴマーは、化学的に合成するか、酵素によって生じさせるか、または組換え源から製造することができる。オリゴマーは好ましくは、一方はセンスオリエンテーション(5’から3’)を有し、他方はアンチセンス(3’から5’)を有する2つのヌクレオチド配列からなり、特異的遺伝子または状態を同定するために最適化された条件下で使用される。同じ2つのオリゴマー、重なったオリゴマーセットまたはオリゴマーの変性プール(degenerate pool)を近縁のDNAまたはRNA配列を検出および/または定量するために、厳密性の低い条件下で使用することができる。
【0146】
SLC34A2−ROS融合ポリペプチド、CD74−ROS融合ポリペプチドまたは欠失ROSポリペプチドの発現を定量するために使用することもできる方法には、ヌクレオチドの放射性標識またはビオチン化、対照核酸の同時増幅および実験結果が挿入される標準曲線が包含される(Melbyら、J.Immunol.Methods、159:235〜244(1993);Duplaaら、Anal.Biochem.229〜236(1993))。多数の試料を定量する速度を、該当するオリゴマーが様々な希釈で与えられ、分光光度計または比色計の応答が迅速な定量をもたらすELISAフォーマットでアッセイを作動させることによって加速することができる。
【0147】
遺伝子変化ROSポリヌクレオチドを使用して、天然に生じるゲノム配列をマッピングするために有用なハイブリダイゼーションプローブを生じさせることができる。よく知られている技術を使用して、配列を、特定の染色体または特定の染色体領域にマッピングすることができる。そのような技術には、蛍光in−situハイブリダイゼーション(FISH)、FACSまたは酵母人工染色体、細菌人工染色体、細菌P1構造もしくは単一染色体cDNAライブラリなどの人工染色体構造が包含され、Price,C.M.、Blood Rev.7:127〜134(1993)およびTrask,B.J.、Trends Genet.7:149〜154(1991)に概説されている。非限定的な一実施形態では、FISHを使用し(Vermaら、HUMAN CHROMOSOMES:A MANUAL OF BASIC TECHNIQUES、Pergamon Press、New York、N.Y.(1988)に記載されているとおり)、他の物理的染色体マッピング技術および遺伝子地図データと相関させることができる。遺伝子地図データの例は、1994 Genome Issue of Science(265:1981〜)において見出すことができる。物理的染色体地図上でのSLC34A2−ROS融合ポリヌクレオチド、CD74−ROS融合ポリヌクレオチドまたは欠失ROSポリヌクレオチドをコードする遺伝子の位置と具体的な疾患との相関または具体的な疾患に対する素因が、その遺伝的疾患に関連するDNAの領域を区切るのに役立ち得る。ヌクレオチド配列を使用して、正常か、保因者か、または罹患している個体における遺伝子配列の差違を検出することができる。
【0148】
染色体標本のin situハイブリダイゼーションおよび確立されている染色体マーカーを使用する連関分析などの物理的マッピング技術を使用して、遺伝子地図を拡大することができる。多くの場合に、マウスなどの他の哺乳動物種の染色体に遺伝子を置くと、特定のヒト染色体の数またはアームが未知の場合にも、関連マーカーを明らかにすることができる。物理的マッピングによって、新たな配列を、染色体アームまたはその一部に割り当てることができる。これは、ポジショナルクローニングまたは他の遺伝子発見技術を使用して疾患遺伝子をサーチしている研究者に価値ある情報を提供する。
【0149】
遺伝子変化ROSポリヌクレオチドを検出する方法(例えば、PCRおよびFISH)は全て、遺伝子変化ROSポリヌクレオチドまたは遺伝子変化ROSポリペプチドを検出する他の方法と組み合わせることができることは理解されるであろう。例えば、生体試料(例えば、循環腫瘍細胞)の遺伝子材料におけるSLC34A2−ROSポリヌクレオチドの検出に、試料のタンパク質のウェスタンブロット分析または免疫組織化学(IHC)分析を続けて、SLC34A2−ROSポリヌクレオチドが生体試料においてSLC34A2−ROSポリペプチドとして実際に発現されているかどうかを決定することができる。そのようなウェスタンブロットまたはIHC分析は、検出されたSLC34A2−ROSポリヌクレオチドによってコードされるポリペプチドに特異的に結合する抗体を使用して行うことができるか、または分析は、全長SLC34A2(例えば、タンパク質のN末端に結合)または全長ROS(例えば、ROSのキナーゼドメインのエピトープに結合)のいずれかに特異的に結合する抗体を使用して行うことができる。そのようなアッセイは、当分野で知られている(例えば、米国特許第7,468,252号を参照されたい)。
【0150】
ROSキナーゼ治療薬
遺伝子変化ROSポリペプチドは、ヒトNSCLCの少なくとも1つのサブグループにおいて生じることが判明している(Rikovaら、Cell 131:1190〜1203(2007)を参照されたい)。したがって、少なくとも1つのROS融合タンパク質(例えばSLC34A2−ROS融合タンパク質)が発現される哺乳動物のがん(例えばNSCLC)の進行は、そのようながんにおけるROSキナーゼの活性を阻害することによって、またはそのようながんにおけるROSキナーゼの発現を阻害することによってin vivoで阻害することができる。突然変異ROSキナーゼの発現によって特徴付けられるがんにおけるROS活性は、がん(例えば腫瘍)をROSキナーゼ治療薬と接触させることによって阻害することができる。
【0151】
ROSキナーゼ治療薬は、下記のROSキナーゼ阻害薬化合物を包含するROSキナーゼの発現および/または活性をin vivoで直接的または間接的に阻害する少なくとも1つの化合物、生物学的製剤または化学的製剤を含む任意の組成物であってよい。そのような化合物には、ROSキナーゼ自体に、またはROSの活性を変えるタンパク質もしくは分子に直接働くか、またはROSの発現を阻害することによって間接的に働く治療薬が包含される。そのような組成物にはまた、単一のROSキナーゼ阻害性化合物のみを含む組成物、さらに、化学療法薬または一般的な転写阻害薬などの非特異的治療薬も包含してよい多数の治療薬(他のRTKに対するものを包含)を含む組成物も包含される。
【0152】
低分子ROSキナーゼ阻害薬
本発明の方法を実施する際に有用なROSキナーゼ治療薬は、低分子ROSキナーゼ阻害薬である。低分子キナーゼ阻害薬は典型的には、酵素の触媒部位に特異的に、かつ多くの場合に不可逆的に結合することによって、かつ/または酵素内のATP結合溝または他の結合部位に結合して、酵素がその活性に必要な構造を取り込むことを妨げることによってその標的酵素の活性を阻害する一群の分子である。低分子ROSキナーゼ阻害薬は、ROSキナーゼ三次元構造のX線結晶学的またはコンピューターモデリングを使用して合理的に設計することができるか、またはROSを阻害するための化合物ライブラリのハイスループットスクリーニングによって見出すことができる。そのような方法は、当分野でよく知られており、記載されている。ROS阻害の特異性は例えば、キナーゼのパネルにおいてそのような化合物が他のキナーゼ活性ではなく、ROS活性を阻害する能力を検査することによって、かつ/またはROS融合タンパク質を発現することが知られているか、または発現が変化している腫瘍細胞を含む生体試料においてROS活性の阻害を検査することによって確認することができる。
【0153】
ROSキナーゼ治療薬として有用であることが本明細書で示されている低分子ROS阻害薬の例には、それらが開示しているその全体がそれぞれ参照によって本明細書に組み込まれる米国特許第7230098号、米国特許第7,858,643号およびWO2006/021881に開示されている種類のアミノ−ピリジンおよびアミノ−ピラジン化合物が包含される。特に、ROSキナーゼ治療薬として本発明に関連して有用なアミノ−ピリジンおよびアミノ−ピラジン化合物には、下記一般式の化合物または薬学的に許容できるその塩が包含される:
【0154】
【化15】

[式中、Y、R1、R2およびA1は、米国特許第7,230,098号に記載されている一般的な意味を有する]。より具体的には、ROSキナーゼ治療薬として本発明に関連して有用なアミノ−ピリジンおよびアミノ−ピラジン化合物には、下記一般式の化合物または薬学的に許容できるその塩が包含される:
【0155】
【化16】

[式中、Y、R1およびR2は、米国特許第7,858,643号に記載されているとおりの一般的な意味を有する]。上記の種類のアミノ−ピリジンおよびアミノ−ピラジン化合物は、ROSキナーゼ阻害薬であることが判明しており、したがって、本発明に関連してROSキナーゼ治療薬として有用である。特に、がんが遺伝子変化ROSキナーゼ(例えば、SLC34A2−ROS、CD74−ROSまたはFIG−ROS)について陽性であると判明している場合、そのような化合物は、がんの治療を必要とする患者に投与することができる。
【0156】
特に好ましい化合物の1種は、その調製が米国特許第7,858,643号に記載されている式1によって表される化合物3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミン(クリゾチニブ)である:
【0157】
【化17】

(McDermott,U.ら、Proc.Natl.Acad.Sci.104、19936〜19941(2007)も参照されたい)。式1の化合物は、それぞれその内容全体が、参照によって本明細書に組み込まれる国際特許公開WO2006/021884および米国特許出願公開第2006/0046991号に開示されている。加えて、式1の化合物のラセミ化合物は、それぞれその内容全体が、参照によって本明細書に組み込まれる国際特許公開WO2006/021881および米国特許出願公開第2006/0128724号に開示されている。
【0158】
c−Met/HGFR阻害薬としてもともとは設計されたクリゾチニブは本明細書において、ROSキナーゼに対して活性であり、したがって、本明細書に記載されているROS融合タンパク質およびROS欠失タンパク質に対して活性であることが判明した。クリゾチニブは、ROS触媒活性でのその効果について、酵素および細胞ベースアッセイの両方において評価された。本明細書に示されているデータは、クリゾチニブが、組換えヒトROS−1キナーゼ(触媒ドメイン)の有効なATP拮抗阻害薬であることを示している。
【0159】
下記のROS−1酵素アッセイによって、0.097nMの平均Ki値(n=4)が得られた。クリゾチニブは、構成的に活性なSLC34A2−ROS融合タンパク質の発現をもたらす4p15、6q22染色体転座事象を示すHCC78細胞(Rikovaら、(2007))において、41nMの平均IC50値(n=11)でROSリン酸化を用量依存的に阻害した(表1、図1)。クリゾチニブはまた、FIG−ROS融合を内包するU138MGヒト神経膠芽細胞腫細胞(Charestら、(2003))において、49nMの平均IC50値(n=2)でROSリン酸化を用量依存的に阻害した(表1、図1)。
【0160】
CD74−ROS、FIG−ROS(S)、FIG−ROS(L)、SLC34A2−ROS(S)およびSLC34A2−ROS(L)を包含する様々なROS−融合タンパク質を発現するように操作された3T3細胞系のパネルにおいて、クリゾチニブは、3.4nMから36nMの範囲のIC50値でROSリン酸化を阻害した(表1)。
【0161】
クリゾチニブを、構成的に活性なSLC34A2−ROS融合タンパク質の発現をもたらす4p15、6q22染色体転座事象を示すHCC78(Rikovaら、(2007))の細胞生存力に対するその効果について評価した。クリゾチニブは、HCC78細胞生存力の濃度依存的阻害を示した(図2)。HCC78細胞生存力の阻害に関して算出されたIC50値は、ほぼ59nMであった。これらの結果は、HCC78細胞が細胞増殖および生存力に関してROS融合に依存していること、およびクリゾチニブがROS依存性細胞の増殖および生存力の有効な阻害薬であることを示唆している。
【0162】
分子レベルでは、構成的に活性化されたROS融合キナーゼは、RTK触媒活性および制御基質のドッキングを調節する細胞内領域で多数のチロシン残基のリン酸化を誘発する。抗腫瘍作用機構のさらなる理解を得、ROSキナーゼ活性の阻害が下方のシグナル伝達と相関していることを確認するために、クリゾチニブを、HCC78ヒトNSCLC細胞におけるSLC34A2−ROS依存性シグナル伝達経路を阻害するその能力について評価した。クリゾチニブはHCC78細胞においてin vitroで、ROSリン酸化(活性化ループ)、さらに、SHP2、STAT3、AKTおよびERK1/2を包含する下方のアダプターまたはシグナル伝達分子を用量依存的に阻害した(図3)。これらの結果は、重要なシグナル伝達経路とクリゾチニブの有効な用量との相関を示している。
【0163】
クリゾチニブを、HCC78ヒトNSCLC細胞において細胞アポトーシスを誘発するその能力についてさらに評価した。クリゾチニブは、HCC78NSCLC細胞において活性化カスパーゼ3レベルの用量依存的誘発を示したが(図4)、このことは、アポトーシスの上昇はまた、有効な用量レベルと相関していることを示している。
【0164】
クリゾチニブの抗腫瘍効力を、ROS融合操作された腫瘍異種移植片モデルのパネルにおいて評価した。CD74−ROS、ヒトNSCLCで同定されているSLC34A2−ROSのロング型およびショート型変異体ならびにヒトNSCLC、神経膠芽細胞腫および胆管がんで同定されているFig−ROSのロング型およびショート型変異体を包含するROS染色体転座が関与しているヒトがん適応症を代表する腫瘍異種移植片をNIH3T3細胞において操作した(Rimkunasら(2012);Guら、(2011))。クリゾチニブは、75/mg PO BIDの投与レジメンで、3T3−ROS操作された腫瘍モデルの全てにおいて有意な細胞減少性効果を示した(図5)。
【0165】
in vivoでROSリン酸化および腫瘍増殖を阻害するクリゾチニブの能力を、ヌードマウスにおいて3T3−CD74−ROSおよび3T3−SLC34A2−ROS(L)異種移植片モデルで評価した。クリゾチニブは、160mg/kg/日(80mg/kg BID)、80mg/kg/日(40mg/kg BID)、40mg/kg/日(20mg/kg BID)および20mg/kg/日(10mg/kg BID)の用量で、3T3−CD74−Ros腫瘍異種移植片において腫瘍増殖の用量依存的阻害を示した(図6B)。クリゾチニブはまた、全ての治療群にわたって3T3−CD74−Ros腫瘍でのROSリン酸化の有意な阻害を示した(図6A)。クリゾチニブによる同様の抗腫瘍効力が、3T3−SLC34A2−ROS(L)異種移植片モデルにおいて観察された(図7)。
【0166】
投与経路および剤形
経口投与
本発明の化合物は、経口投与することができる。経口投与は、化合物が胃腸管に入るような嚥下を伴ってもよいか、または化合物が口から直接、血流に入る頬側または舌下投与を使用することもできる。
【0167】
経口投与に適している製剤には、錠剤などの固体製剤、微粒子、液体または粉末を含有するカプセル剤、ロゼンジ剤(液体充填を包含)、チューイング剤、マルチおよびナノ粒子剤、ゲル剤、固溶体、リポソーム剤、フィルム剤(粘膜付着剤を包含)、膣坐剤、噴霧剤、液体製剤が包含される。
【0168】
液体製剤には、懸濁剤、液剤、シロップ剤およびエリキシル剤が包含される。そのような製剤は、軟質カプセルまたは硬質カプセル中の充填剤として使用することもでき、典型的には、薬学的に許容できる担体、例えば水、エタノール、ポリエチレングリコール、プロピレングリコール、メチルセルロースまたは適切なオイルならびに1種または複数の乳化剤および/または懸濁化剤を包含する。液体製剤はまた、固体、例えばサシェからの再構成によって調製することもできる。
【0169】
本発明の化合物はまた、その開示全体が参照によって本明細書に組み込まれるLiangおよびChenによるExpert Opinion in Therapeutic Patents、11(6)、981〜986(2001)に記載されている剤形などの急速溶解、急速分解剤形で使用することもできる。
【0170】
錠剤剤形では、用量に応じて、薬物は、剤形の1重量%から80重量%、より典型的には剤形の5重量%から60重量%を構成していてよい。薬物に加えて、錠剤は通常、崩壊剤を含有する。崩壊剤の例には、デンプングリコール酸ナトリウム、カルボキシメチルセルロースナトリウム、カルボキシメチルセルロースカルシウム、クロスカルメロースナトリウム、クロスポビドン、ポリビニルピロリドン、メチルセルロース、微結晶性セルロース、低級アルキル置換ヒドロキシプロピルセルロース、デンプン、α化デンプンおよびアルギン酸ナトリウムが包含される。通常、崩壊剤は、剤形の1重量%から25重量%、好ましくは5重量%から20重量%を構成している。
【0171】
通常は結合剤を使用して、錠剤製剤に粘着性を付与する。適切な結合剤には、微結晶性セルロース、ゼラチン、糖、ポリエチレングリコール、天然および合成ゴム、ポリビニルピロリドン、α化デンプン、ヒドロキシプロピルセルロースならびにヒドロキシプロピルメチルセルロースが包含される。錠剤はまた、ラクトース(一水和物、噴霧乾燥一水和物、無水物など)、マンニトール、キシリトール、デキストロース、スクロース、ソルビトール、微結晶性セルロース、デンプンおよび二塩基性リン酸カルシウム二水和物などの希釈剤を含有してもよい。
【0172】
錠剤はまた、ラウリル硫酸ナトリウムおよびポリソルベート80などの界面活性剤ならびに二酸化ケイ素およびタルクなどの流動促進剤を包含してもよい。存在する場合には、界面活性剤は典型的には、錠剤の0.2重量%から5重量%の量であり、流動促進剤は典型的には、錠剤の0.2重量%から1重量%の量である。
【0173】
また錠剤は通常、ステアリン酸マグネシウム、ステアリン酸カルシウム、ステアリン酸亜鉛、ステアリルフマル酸ナトリウムおよびステアリン酸マグネシウムとラウリル硫酸ナトリウムとの混合物などの滑沢剤を含有する。滑沢剤は通常、錠剤の0.25重量%から10重量%、好ましくは0.5重量%から3重量%の量で存在する。
【0174】
他の慣用の成分には、抗酸化剤、着色剤、香味剤、保存剤および矯味剤が包含される。
【0175】
例示的な錠剤は、薬物約80重量%まで、結合剤約10重量%から約90重量%、希釈剤約0重量%から約85重量%、崩壊剤約2重量%から約10重量%および滑沢剤約0.25重量%から約10重量%を含有する。
【0176】
錠剤ブレンドを、直接か、またはローラーによって圧縮して、錠剤を形成することができる。別法では、錠剤ブレンドまたは一部のブレンドを湿潤、乾燥または溶融顆粒化するか、溶融凝固させるか、または押し出し、その後に製錠することができる。最終製剤は、1つまたは複数の層を包含してよく、コーティングされているか、もしくはコーティングされてなくてよいか、またはカプセル封入されていてよい。
【0177】
錠剤の製剤は、その開示全体が参照によって本明細書に組み込まれるH.LiebermanおよびL.Lachmanによる「Pharmaceutical Dosage Forms:Tablets」、Vol.1、Marcel Dekker、N.Y、N.Y、1980(ISBN 0−8247−6918−X)で詳細に検討されている。
【0178】
経口投与のための固体製剤は、即時および/または変更放出であるように製剤化することができる。変更放出製剤には、遅延放出、持続放出、パルス放出、調節放出、ターゲット放出およびプログラム放出が包含される。
【0179】
適切な変更放出製剤は、米国特許第6,106,864号に記載されている。高エネルギー分散液および浸透性のコーティングされた粒子などの他の適切な放出技術の詳細は、Vermaらによる「Pharmaceutical Technology On−line」、25(2)、1〜14(2001)に見出すことができる。調節放出を達成するためにチューインガムを使用することは、WO00/35298に記載されている。これらの参照文献の開示はその全体が参照によって本明細書に組み込まれる。
【0180】
非経口投与
本発明の化合物はまた、血流中、筋肉中または内臓に直接投与することもできる。非経口投与に適している手段には、静脈内、動脈内、腹腔内、クモ膜下、心室内、尿管内、胸骨内、頭蓋内、筋肉内および皮下が包含される。非経口投与のための適切なデバイスには、針(微細針を包含する)注射器、無針注射器および点滴技術が包含される。
【0181】
非経口製剤は典型的には、塩、炭水化物および緩衝剤(好ましくはpH3から9に)などの添加剤を含有してよい水溶液であるが、いくつかの用途では、これらをより適切に、無菌非水溶液として、または無菌の発熱物質不含水などの適切なビヒクルと共に使用される乾燥形態として製剤化することができる。
【0182】
例えば、凍結乾燥による無菌条件下での非経口製剤の調製は、当業者によく知られている標準的な製薬技術を使用して容易に達成することができる。
【0183】
非経口溶液を調製する際に使用される本発明の化合物の溶解性は、溶解性増強剤を導入するなどの適切な製剤技術を使用することによって高めることができる。
【0184】
非経口投与のための製剤は、即時および/または変更放出であるように製剤化することができる。変更放出製剤には、遅延放出、持続放出、パルス放出、調節放出、ターゲット放出およびプログラム放出が包含される。したがって本発明の化合物を、活性化合物の変更放出をもたらす移植デポーとして投与するための固体、半固体もしくはチキソトロピー液として製剤化することができる。そのような製剤の例には、薬物コーティングされたステントおよびPGLAマイクロスフェアが包含される。
【0185】
局所投与
本発明の化合物はまた、皮膚または粘膜に局所で、即ち皮膚または経皮で投与することもできる。この目的のための典型的な製剤には、ゲル剤、ヒドロゲル剤、ローション剤、液剤、クリーム剤、軟膏剤、散布剤、包帯、フォーム剤、フィルム剤、皮膚パッチ剤、ウェハ剤、インプラント剤、スポンジ、繊維、帯具およびマイクロエマルション剤が包含される。リポソームもまた使用することができる。典型的な担体には、アルコール、水、鉱油、流動ワセリン、白色ワセリン、グリセリン、ポリエチレングリコールおよびプロピレングリコールが包含される。透過促進剤を導入することもできる。例えば、FinninおよびMorganによるJ.Pharm.Sci、88(10)、955〜958(1999年10月)を参照されたい。局所投与の他の手段には、電気穿孔法、イオン導入法、音波泳動法、音泳動法および微細針または無針(例えば、Powderject(商標)、Bioject(商標)など)注射による送達が包含される。これらの参照文献の開示はその全体が、参照によって本明細書に組み込まれる。
【0186】
局所投与のための製剤は、即時および/または変更放出であるように製剤化することができる。変更放出製剤には、遅延放出、持続放出、パルス放出、調節放出、ターゲット放出およびプログラム放出が包含される。
【0187】
吸入/鼻腔内投与
本発明の化合物はまた、鼻腔内または吸入により、典型的には乾燥粉末の形態(単独で、混合物として、例えば、ラクトースとの乾燥ブレンドで、または混合成分粒子として、例えば、ホスファチジルコリンなどのリン脂質と混合して)で、乾燥粉末吸入器から、またはエアロゾルスプレーとして、加圧容器、ポンプ、スプレー、噴霧器(好ましくは、微細な霧を生じさせるために電磁流体力学を使用する噴霧器)またはネブライザから、1,1,1,2−テトラフルオロエタンまたは1,1,1,2,3,3,3−ヘプタフルオロプロパンなどの適切な噴射剤を使用して、もしくは使用せずに投与することができる。鼻腔内使用では、散剤は、生体用粘着剤、例えば、キトサンまたはシクロデキストリンを包含してもよい。
【0188】
加圧容器、ポンプ、スプレー、噴霧器またはネブライザは、例えば、エタノール、エタノール水溶液または活性剤の分散、可溶化もしくはその放出の延長のために適している別の薬剤、溶媒としての噴射剤およびトリオレイン酸ソルビタン、オレイン酸もしくはオリゴ乳酸などの任意選択の界面活性剤を含む本発明の化合物(複数可)の溶液または懸濁液を含有する。
【0189】
乾燥散剤または懸濁液製剤で使用する前に、薬物生成物を、吸入により送達するために適したサイズ(典型的には5ミクロン未満)まで超微粉砕する。これは、スパイラルジェット粉砕、流動床ジェット粉砕、ナノ粒子を形成するための臨界液体処理、高圧均一化または噴霧乾燥などの任意の適切な粉砕方法により達成することができる。
【0190】
吸入器または注入器で使用するためのカプセル(例えば、ゼラチンまたはHPMC製)、ブリスターおよびカートリッジを、本発明の化合物、ラクトースまたはデンプンなどの適切な散剤基剤およびl−ロイシン、マンニトールまたはステアリン酸マグネシウムなどの性能改良剤の粉末混合物を含有するように製剤化することができる。ラクトースは、無水であってよいか、または一水和物の形態であってよいが、後者が好ましい。他の適切な賦形剤には、デキストラン、グルコース、マルトース、ソルビトール、キシリトール、フルクトース、スクロースおよびトレハロースが包含される。
【0191】
微細な霧を発生させるために電磁流体力学を使用する噴霧器で使用するために適している液剤は、動作1回当たり本発明の化合物1μgから20mgを含有してよく、その動作体積は、1μlから100μlまで変動してよい。典型的な製剤は、本発明の化合物、プロピレングリコール、無菌水、エタノールおよび塩化ナトリウムを包含する。プロピレングリコールの代わりに使用することができる別の溶媒には、グリセロールおよびポリエチレングリコールが包含される。
【0192】
メントールおよびレボメントールなどの適切な香味剤またはサッカリンもしくはサッカリンナトリウムなどの甘味剤を、吸入/鼻腔内投与を意図されている本発明の製剤に加えることができる。
【0193】
吸入/鼻腔内投与のための製剤は、例えば、ポリ(DL−乳酸−グリコール酸共重合体(PGLA)を使用して、即時および/または変更放出であるように製剤化することができる。変更放出製剤には、遅延放出、持続放出、パルス放出、調節放出、ターゲット放出およびプログラム放出が包含される。
【0194】
乾燥散剤吸入器およびエアロゾルの場合、投薬単位は、計測量を送達するバルブ手段により決定される。本発明による単位は典型的には、所望の量の本発明の化合物を含有する計測用量または「パフ」を投与するように設計される。全1日用量を単回用量で、またはより通常は、1日を通して分けた用量として投与することができる。
【0195】
直腸/膣内投与
本発明の化合物は、例えば、坐剤、膣坐剤または浣腸剤の形態で直腸または膣投与することができる。カカオバターは、慣用的な坐剤基剤であるが、様々な代替物を適宜使用することができる。
【0196】
直腸/膣投与のための製剤を、即時および/または変更放出であるように製剤化することができる。変更放出製剤には、遅延放出、持続放出、パルス放出、調節放出、ターゲット放出およびプログラム放出が包含される。
【0197】
眼投与
本発明の化合物はまた、典型的には等張性pH調節無菌食塩水中の超微粉砕された懸濁液または溶液の液滴の形態で、眼または耳に直接投与することもできる。眼および耳投与に適している他の製剤には、軟膏剤、生分解性(例えば、吸収性ゲルスポンジ、コラーゲン)および非生分解性(例えば、シリコーン)インプラント、ウェハ、レンズならびに粒子またはニオソームもしくはリポソームなどの小胞系が包含される。架橋ポリアクリル酸、ポリビニルアルコール、ヒアルロン酸、セルロース系ポリマー、例えば、ヒドロキシプロピルメチルセルロース、ヒドロキシエチルセルロースもしくはメチルセルロースまたはヘテロ多糖ポリマー、例えば、ゲランゴムなどのポリマーを、塩化ベンザルコニウムなどの保存剤と共に導入することができる。そのような製剤はまた、イオン泳動法によって送達することができる。
【0198】
眼/耳投与のための製剤は、即時および/または変更放出であるように製剤化することができる。変更放出製剤には、遅延放出、持続放出、パルス放出、調節放出、ターゲット放出またはプログラム放出が包含される。
【0199】
他の技術
前記の投与方法のいずれかで使用するために、本発明の化合物を、シクロデキストリンおよび適切なその誘導体などの溶解性高分子成分またはポリエチレングリコール含有ポリマーと組み合わせて、その溶解性、溶解速度、矯味、生物学的利用率および/または安定性を改良することができる。
【0200】
例えば、薬物−シクロデキストリン複合体は通常、多くの剤形および投与経路に有用であることが判明している。包接複合体と非包接複合体の両方を使用することができる。薬物との直接的な複合化の代わりに、シクロデキストリンを補助的添加剤、即ち、担体、希釈剤または可溶化剤として使用することができる。これらの目的のために最も一般的に使用されるのは、アルファ−、ベータ−およびガンマ−シクロデキストリンであり、この例は、その開示全体が参照によって本明細書に組み込まれるPCT公開WO91/11172、PCT公開WO94/02518およびPCT公開WO98/55148に見出すことができる。
【0201】
投薬
投与される活性化合物の量は、治療される対象、障害または状態の重症度、投与速度、化合物の素質および処方する医師の裁量に左右される。しかしながら、有効投薬量は典型的に、単回または分割用量で、体重1kg当たり1日当たり約0.001から約100mg、好ましくは約0.01から約35mg/kg/日の範囲である。70kgのヒトでは、これは、約0.07から約7000mg/日、好ましくは約0.7から約2500mg/日になる。場合によっては、前記の範囲の下限未満の投薬量レベルが、より適切であることもあり、他の場合では、有害な副作用を何ら誘発することなく、さらに多い用量を使用することもできるが、但し、そのようなさらに多い用量は典型的に、投与のために一日を通して複数のより小さな用量に分割される。
【0202】
パーツキット
例えば、特定の疾患または状態を治療する目的で、活性化合物の組み合わせを投与することが望ましい限り、そのうちの少なくとも1種は本発明による化合物を含有する2種以上の医薬組成物を簡便に、組成物を同時投与するのに適したキットの形態で組み合わせることができることは、本発明の範囲内である。したがって、本発明のキットは、そのうちの少なくとも1種は本発明による化合物を含有する2種以上の別々の医薬組成物と、コンテナ、分離ボトルまたは分離フォイルパケットなどの前記組成物を別々に保持するための手段とを包含する。そのようなキットの例は、錠剤、カプセル剤などをパッケージングするために使用される普通のブリスターパックである。
【0203】
本発明のキットは、例えば、経口および非経口の種々の剤形を投与するために、別々の組成物を異なる投薬間隔で投与するために、または相互に別々の組成物を力価測定するために特に適している。服薬遵守を補助するために、キットは典型的には、投与のための指示書または説明書を包含し、記憶補助体と共に提供され得る。そのような指示書または説明書は、「ラベル」またはパンフレットの形であってよい。さらにそのような指示書または説明書は、がんがROS陽性であるかどうか、または患者がROS陽性であるかどうかを決定するための診断検査に関連する情報を含有してよい。
【実施例】
【0204】
in−vitroアッセイ
材料および方法
In−Vitro方法
ROS−1酵素アッセイ
ROS−1酵素の阻害を、マイクロフルイディック移動度シフトアッセイを使用して測定した。反応を50μL体積で96ウェルプレート中で行ったが、これは、0.25nMのGST標識された組換えヒトROS−1触媒ドメイン(aa 1883−2347)(Invitrogen Inc)、1.5μMのホスホルアクセプターペプチド5’FAM−KKSRGDYMTMQIG−CONH2(Caliper LifeSciences)、試験化合物(11種の用量、3倍連続希釈、最終2%DMSO)またはDMSOのみ、1mMのDTT、0.002%のTween−20および5mMのMgCl2を25mMのHepes、pH7.1中に含有し、20分間の予備インキュベーションの後にATP(56μMの最終濃度、ほぼKmレベル)を加えることによって開始した。反応物を室温で1時間インキュベートし、次いで、0.1MのEDTA(pH8)を加えることによって停止した。反応の完了程度(DMSOで約5%の変換率)を、LabChip EZ Reader II(Caliper LifeSciences)で蛍光標識されたペプチド基質とリン酸化生成物とを電気泳動によって分離した後に決定した。各試験でのKi値を、非線形回帰方法(GraphPad Prism、GraphPad Software、San Diego、CA)および実験によって測定されたATP Km=56μMを使用して、変換%を拮抗的阻害に関する式に当てはめることによって算出した。4つの試験からなるパネルによって、0.097nMの平均Ki値が得られた。
【0205】
細胞系
HCC78細胞は、非小細胞肺癌と種別された肺腺癌を有する65歳の男性の胸膜滲出液から樹立されたヒト非小細胞肺癌細胞系である。HCC78細胞は、DSMZ cell bank(Braunschweig、Germany)から購入した。U138細胞およびNIH3T3細胞は、American Tissue Culture Corporation TCCから購入した。
【0206】
NIH3T3−ROS融合細胞系の作製
NIH3T3 ROS融合操作された細胞系を自家で作製した。ROS融合変異体SLC34A2−ROS(L)、SLC34A2−ROS(S)、CD74−ROS(L)、FIG−ROS(L)およびFIG−ROS(S)をレトロウイルスベクターpMSCV puro(Clontech)にクローニングした。pMSCVベクターおよびパッケージングプラスミドpC10A1を同時トランスフェクションすることによって、EML4−ALK遺伝子を担うレトロウイルスを293T細胞で生じさせた。レトロウイルス上清を使用して、NIH3T3細胞を形質導入し、貯留された集団を2μg/mlのピュロマイシンで5日間選択し、DNA塩基配列決定によって確認した後に、後続の実験で使用した。
【0207】
細胞でのキナーゼリン酸化アッセイ
クリゾチニブがリガンド依存性または構成的キナーゼリン酸化を阻害する能力を直接的に決定するために使用される細胞アッセイ(即ち、ELISAまたは免疫ブロット)を、様々な血清飢餓細胞を使用して行った。
【0208】
細胞ベースのホスホ−ROSELISAアッセイ
様々な種類のROS融合を内包する細胞系からなるパネルを使用して、ROSリン酸化に対するクリゾチニブの効力を決定した。細胞を増殖培地100μl中、20,000細胞/ウェルの密度で96ウェルプレートに播いた。ROS融合陰性細胞ウェルをバックグラウンドとして使用した。播かれた細胞を一晩付着させた。翌日、増殖培地を除去し、細胞を血清不含培地(0.04%のBSAを有する)中で培養した。クリゾチニブの連続希釈を行い、適切な対照または指定濃度のクリゾチニブを各ウェルに加え、細胞を37℃で1時間インキュベートした。細胞溶解産物を生じさせ、PathScan(登録商標)Phospho−Ros(panTyr)Sandwich ELISA Kit(Cell Signaling、Cat#:7093)を製造者のプロトコルに記載されているとおりに使用することによって、HCC78細胞におけるSLC34A2−ROSの全ホスホ−チロシンレベルを決定した。EC50値を、4パラメーター分析法を利用する濃度反応曲線フィッティングによって算出した。
【0209】
SLC34A2−ROSについての細胞ベースのホスホ−ROS ELISAアッセイ
SLC34A2−ROS融合を内包するHCC78細胞を使用して、ROSリン酸化に対するクリゾチニブの効力を決定した。HCC78細胞を、10%FBSおよびペニシリン/ストレプトマイシンを有するRPMI培地100μl中、20,000細胞/ウェルの密度で96ウェルプレートに播いた。細胞を含まないウェルをバックグラウンドとして使用した。播かれた細胞を一晩付着させた。翌日、増殖培地を除去し、細胞を血清不含培地(0.04%のBSAを有する)中で培養した。クリゾチニブの連続希釈を行い、適切な対照または指定濃度のクリゾチニブを各ウェルに加え、細胞を37℃で1時間インキュベートした。細胞溶解産物を生じさせ、PathScan(登録商標)Phospho−Ros(panTyr)Sandwich ELISA Kit(Cell Signaling、Cat#:7093)を製造者のプロトコルに記載されているとおりに使用することによって、HCC78細胞におけるSLC34A2−ROSの全ホスホ−チロシンレベルを決定した。IC50値を、4パラメーター分析法を利用する濃度反応曲線フィッティングによって算出した。細胞ベースのホスホ−ROS ELISAアッセイによって、45nMの平均IC50値(n=8)が得られた。
【0210】
免疫ブロット法
免疫ブロット法も使用して、HCC78細胞および3T3−CD74−ROS腫瘍溶解産物における相対的なキナーゼリン酸化状態および全タンパク質レベルを該当するタンパク質について決定した。in vitro研究では、HCC78細胞を様々な用量レベルのクリゾチニブで3時間処理した。細胞を冷1×Cell Lysis Buffer(Cell Signaling Technologies、Boston MT)中で溶解させた。
【0211】
in vivo研究では、腫瘍を持つマウスをクリゾチニブで、75mg/kg PO BIDで10日間処置した。研究の終了時に、最後の投与の7時間後に、腫瘍を切除した。切除された腫瘍をドライアイス上でスナップ冷凍し、液体窒素で冷却された冷却乳鉢(cryomortar)および乳棒を使用して微粉砕し、冷1×Cell Lysis Buffer(Cell Signaling Technologies、Boston MT)中で溶解させた。タンパク質を細胞および腫瘍溶解産物から抽出し、BSAアッセイ(Pierce、Rockford、IL)使用してタンパク質濃度を決定した。細胞および腫瘍溶解産物の両方から抽出されたタンパク質試料をSDS−PAGEによって分離し、ナイロン膜に移し、該当するタンパク質についての免疫ブロットハイブリダイゼーションを次の抗体で行った。
【0212】
免疫ブロット研究で利用された抗体は全て、Cell Signaling Technology(Danvers、Massachusetts、United States)製であり、次のとおり列挙される:抗全ROS(catalog#:3266)、抗ホスホROS(catalog#:3078)、抗ホスホSHP2(catalog#:5431)、抗ホスホSTAT3(catalog#:9131)、抗全AKT(catalog#:9272)、抗ホスホ−AKT S473(catalog#:4161)、抗全−MAPK44/42(catalog#:9102)、抗ホスホ−MAPK44/42(catalog#:4370)、切断Caspapse−3(catalog#:9661)。
【0213】
細胞生存力、増殖および生存アッセイ
細胞生存力アッセイ
スクリーニングの正規化が可能である限り、培養HCC78細胞を10%FBSおよびペニシリン/ストレプトマイシン(Invitrogen)を有するRPMI増殖培地(Invitrogen、Carlsbad、CA)に適応させた。特殊な培地を必要とする一部の細胞は、供給者が推奨する培地中で増殖させた。細胞をトリプシン処理し、3000〜5000細胞/ウェルの密度で96ウェルプレート(Corning Costar #3904プレート、Kennebunk、ME)に播き、一晩付着させた。翌日、細胞を、9種の連続濃度(10μMから152pMへと連続して4倍比で低下させて、完全なS字状曲線をもたらす)で投与される単一の薬物で2回処置した。37℃でさらに3〜5日間インキュベートした後に(細胞集密度が約70〜80%に達するまで)、製造者が推奨する体積のCell Titer Glo(Promega、Madison、WI)の1/5を加えて、Envision multi−reader(Perkin−Elmer、Waltham、MA)を使用して細胞生存力/増殖を間接的に測定した。ベースラインの細胞数読み取りをまた、細胞播種の1日後、かつ薬物治療の前に、細胞プレートから取った。ベースラインの数を最終細胞数から引き、PRISM(Graphpad、La Jolla、CA)またはXLFIT(IDBS、Surrey、UK)でプロットした。HCC78細胞生存力の阻害について算出されたIC50値は、約59nMであった。
【0214】
細胞増殖/生存アッセイ
細胞を96ウェルプレートに低密度で、増殖培地(2%、5%または10%のウシ胎児血清−FBSを補足されている培地)に播き、37℃で一晩培養した。翌日、連続希釈のクリゾチニブまたは適切な対照を指定されたウェルに加え、細胞を37℃で72時間インキュベートした。次いで、Cell Titer Gloアッセイ(Promega、Madison、WI)を行って、相対細胞数を決定した。4パラメーター分析法を利用する濃度反応曲線フィッティングによって、EC50値を算出した。
【0215】
in vivo方法
無胸腺マウスでの皮下異種移植片モデル
雌のnu/nuマウス(5〜8週齢)をCharles River(Wilmington、MA)から得た。クリーンルーム条件下、HEPA濾過換気孔を設けたラック上に置いたAlpha−Dri/bed−o−cob櫛型ベッドを備えた殺菌フィルタートップケージ中で、動物を維持した。動物に、無菌のげっ歯類用餌および水を自由に摂取させた。胸腺欠損マウスへの移植のために指定された細胞を回収し、450×gで5〜10分間、遠心分離することによってペレット化した。細胞ペレットを1回洗浄し、無血清培地に再懸濁させた。細胞に50%Matrigel(BD Biosciences、San Jose、CA)を補足して、腫瘍の獲得を促進した。各実験で化合物を投与する前に、細胞(100μl中、5×106)をマウスの後側腹部にSC移植し、所定の大きさに成長させた。電子キャリパーで測定することによって、腫瘍の大きさを決定し、腫瘍体積を、長さ×幅2×0.4の積として算出した。
【0216】
データおよび結果
【実施例1】
【0217】
クリゾチニブによる生化学酵素アッセイにおけるROS1キナーゼ活性の阻害
酵素および細胞ベースのアッセイの両方で、ROS触媒活性に対するその効果についてクリゾチニブを評価した。クリゾチニブは、0.097nMの平均Ki値(n=4)で、組換えヒトROS1キナーゼ(触媒ドメイン)の有効なATP拮抗阻害薬であることが示された。
【実施例2】
【0218】
細胞ベースのアッセイにおけるクリゾチニブのキナーゼ活性
クリゾチニブは、構成的に活性なSLC34A2−ROS融合タンパク質の発現をこれらの細胞においてもたらす4p15、6q22染色体転座事象を示すHCC78細胞(Rikovaら、(2007))において、41nMの平均IC50値(n=11)でROSリン酸化を用量依存的に阻害した(表1、図1)。
【0219】
クリゾチニブはまた、FIG−ROS融合を内包するU138MGヒト神経膠芽細胞腫細胞(Charestら、(2003))においてROSリン酸化を49nMの平均IC50値(n=2)で阻害した(表1、図1)。
【0220】
様々なROS−融合タンパク質を発現するように操作された3T3細胞系のパネルにおいて、クリゾチニブは、ROSリン酸化をこれらの細胞において3.4nMから36nMの範囲のIC50値で阻害した(表1)。
【0221】
【表1】

【実施例3】
【0222】
HCC78ヒトNSCLC細胞におけるin vitroでのROS媒介シグナル伝達の阻害および細胞アポトーシスの誘発
クリゾチニブを、HCC78細胞においてSLC34A2−ROS依存性シグナル伝達経路を阻害するその能力について評価した。
【0223】
図3のイムノブロットに示されているとおり、クリゾチニブは、ROSリン酸化(活性化ループ)、さらに、SHP2、STAT3、AKTおよびERK1/2を包含する下方のアダプターまたはシグナル伝達分子を薬物処置の3時間後には、HCC78細胞においてin vitroで用量依存的に阻害した。これらのデータは、重要なシグナル伝達経路とクリゾチニブの有効な用量との相関を示した。
【0224】
ウェスタンブロット分析を利用して、クリゾチニブを、アポトーシスのカスパーゼ−3マーカーのその用量依存的モジュレーションについて評価した。薬物処置の3時間後に、活性化カスパーゼ−3レベルの有意な用量依存的誘発がHCC78NSCLC細胞において観察されたが(図4)、このことは、アポトーシスの上昇もまた、有効な用量レベルと相関していることを示している。
【実施例4】
【0225】
ヌードマウスにおける発癌性ROS融合変異体操作された異種移植片腫瘍モデルのパネルでの経口投与後のクリゾチニブの細胞減少効果
クリゾチニブの抗腫瘍効力を、CD74−ROS、ヒトNSCLCで同定されたSLC34A2−ROSの2つの形態およびヒトNSCLC、神経膠芽細胞腫および胆管がんで同定されたFIG−ROSの2つの形態を包含するROS染色体転座が関与しているヒトがん適応症を代表するNIH3T3細胞において、ROS融合操作された腫瘍異種移植片モデルのパネルで評価した(Rimkunasら、(2012) Clin Cancer Res.Jun 1.[印刷前にEpub]);Guら、(2011) PLoS One.6(1):e15640)。
【0226】
図5に示されているとおり、クリゾチニブは、ヒト発癌性ROS融合変異体を内包する3T3−ROS操作された腫瘍モデルの5種全てにおいて、75/mg PO BIDの投与レジメンで、有意な細胞減少効果を示した。腫瘍体積が約200mm3に達したときに、マウスはクリゾチニブ処置を受け始め、約4から5日の薬物治療で、腫瘍は、5から10mm3のサイズへと迅速に退行した。対照腫瘍は、投与開始後約7日で1500mm3の大きさに達し、この研究での平均クリゾチニブ処置期間は約10日であった。
【実施例5】
【0227】
クリゾチニブによる、ヌードマウスにおける3T3−CD74−ROSおよび3T3−SLC34A2−ROS(L)異種移植片モデルでのROSリン酸化および腫瘍増殖の用量依存的阻害
クリゾチニブによるROSキナーゼ活性および腫瘍増殖の薬力学的阻害を評価するために、3T3−CD74−ROS腫瘍異種移植片研究をヌードマウスにおいて、複数の用量レベルで投与される経口BIDで行った。研究を通して、電子バーニヤキャリパーを利用して腫瘍体積を測定し、10日間のクリゾチニブの経口投与の後、7時間目に腫瘍試料を採取した(定常状態)。腫瘍におけるROSリン酸化状態をELISAによって定量した。
【0228】
図6Bに示されているとおり、クリゾチニブは、腫瘍増殖において用量依存的阻害を示した。94%および61%の腫瘍退縮が160mg/kg/日群(80mg/kg BID)および80mg/kg/日群(40mg/kg BID)でそれぞれ観察され、78%および54%の腫瘍増殖阻害が、40mg/kg/日群(20mg/kg BID)および20mg/kg/日群(10mg/kg BID)でそれぞれ観察された。
【0229】
最後のクリゾチニブ経口投与後7時間目に、3T3−CD74−ROS腫瘍におけるROSリン酸化の有意な阻害が全ての治療群で観察された(図6A)。
【0230】
3T3−SLC34A2−ROS(L)モデルにおいても同程度のクリゾチニブによる抗腫瘍効力が観察された(図7)。
【実施例6】
【0231】
式1の化合物(クリゾチニブ)の合成
PLEは、一般的にはPLE−ASとして知られている、ブタ肝臓からの粗製エステラーゼ製剤としてRocheによって製造され、Biocatalytics Inc.を介して販売されている酵素である(BiocatalyticsからICR−123として購入、硫酸アンモニウム懸濁液として販売)。この酵素は、CAS登録では「カルボキシル酸エステルヒドロラーゼ、CAS番号9016−18−6」と分類されている。対応する酵素分類番号は、EC3.1.1.1である。酵素は、幅広い範囲のエステルの加水分解に対して広い基質特異性を有することが知られている。pH滴定器中での酪酸エチルの加水分解に基づく方法を使用して、リパーゼ活性を決定する。1LU(リパーゼ単位)は22℃、pH8.2で1分当たりに、滴定可能な酪酸1μmolを遊離する酵素の量である。本明細書に報告されている製剤(PLE−AS、懸濁液として)は通常、45LU/mgより高い公表されている活性(タンパク質含有率は約40mg/mL)を有する不透明な茶色から緑色の液体として出荷される。
【0232】
(1S)−1−(2,6−ジクロロ−3−フルオロフェニル)エタノール
下記スキーム中に化合物(S−1)として示されている(1S)−1−(2,6−ジクロロ−3−フルオロフェニル)エタノールをスキームBに従って、ラセミ体1−(2,6−ジクロロ−3−フルオロフェニル)エチルアセテートの酵素加水分解、エステル化および転位を伴う化学的加水分解の組み合わせによって調製した。ラセミ体1−(2,6−ジクロロ−3−フルオロフェニル)エチルアセテート(化合物A2)は、スキームAに従って調製した。
【0233】
【化18】

1−(2,6−ジクロロ−3−フルオロフェニル)エタノール(A1):ホウ水素化ナトリウム(90mg、2.4mmol)を、2’,6’−ジクロロ−3’−フルオロ−アセトフェノン(Aldrich、catalog#52,294−5)(207mg、1mmol)の無水CH3OH2mL中の溶液に加えた。反応混合物を室温で1時間撹拌し、次いで、蒸発させて、無色のオイル残渣を得た。残渣をフラッシュクロマトグラフィー(ヘキサン中0→10%のEtOAcで溶離)によって精製して、化合物A1を無色のオイル(180mg;0.88mmol;収率86.5%)として得た;MS (APCI) (M-H)- 208; 1H NMR (400 MHz, クロロホルム-D) δ ppm 1.64 (d, J=6.82 Hz, 3 H) 3.02 (d, J=9.85 Hz, 1 H) 6.97 - 7.07
(m, 1 H) 7.19 - 7.33 (m, 1 H).
【0234】
1−(2,6−ジクロロ−3−フルオロフェニル)エチルアセテート(A2):無水酢酸(1.42mL、15mmol)およびピリジン(1.7mL、21mmol)を、化合物A1(2.2g、10.5mmol)のCH2Cl220mL中の溶液に順次加えた。反応混合物を室温で12時間撹拌し、次いで、蒸発させて、黄色がかったオイル残渣を得た。残渣をフラッシュクロマトグラフィー(ヘキサン中7→9%のEtOAcで溶離)によって精製して、化合物A2を無色のオイル(2.26g;9.0mmol;収率85.6%)として得た;1H NMR (400 MHz, クロロホルム-D) δppm 1.88 (d,
J=6.82 Hz, 3 H) 2.31 (s, 3 H) 6.62 (q, J=6.82 Hz, 1 H) 7.25 (t, J=8.46 Hz, 1 H)
7.49 (dd, J=8.84, 5.05 Hz, 1 H).
【0235】
【化19】

pH電極、オーバーヘッド撹拌機および塩基添加導管(1MのNaOH)を備えた50mLジャケット付きフラスコに、100mMのリン酸カリウム緩衝液(pH7.0)1.2mLおよびPLE AS懸濁液0.13mLを加えた。次いで、化合物A2(0.13g、0.5mmol、1.00当量)を滴加し、生じた混合物を室温で20時間撹拌したが、その際、1MのNaOHを使用して、反応のpHを7.0に一定に維持した。反応の変換率および鏡像異性体過剰率(ee’s)をRP−HPLCによって監視し、出発物質50%が消費された後に(これらの条件下で約17時間後に)停止した。次いで、混合物を酢酸エチル10mLで3回抽出して、エステルおよびアルコールの両方をR−1およびS−2の混合物として回収した。
【0236】
塩化メタンスルホニル(0.06mL、0.6mmol)を、R−1およびS−2の混合物(0.48mmol)のピリジン4mL中の溶液に窒素雰囲気下で加えた。反応混合物を室温で3時間撹拌し、次いで、蒸発させてオイルを得た。水(20mL)を混合物に加え、次いで、EtOAc(20mL×2)を加えて、水溶液を抽出した。有機層を合わせ、乾燥させ、濾過し、蒸発させて、R−3およびS−2の混合物を得た。この混合物をさらに精製することなく、次のステップ反応で使用した。1H NMR (400 MHz, クロロホルム-D) δ ppm 1.66 (d, J=7.1 Hz, 3 H) 1.84 (d, J=7.1 Hz, 3 H) 2.09 (s, 3 H)
2.92 (s, 3 H) 6.39 (q, J=7.0 Hz, 1 H) 6.46 (q, J=6.8 Hz, 1 H) 6.98 - 7.07 (m, 1
H) 7.07 - 7.17 (m, 1 H) 7.23 - 7.30 (m, 1 H) 7.34 (dd, J=8.8, 4.80 Hz, 1 H).
【0237】
酢酸カリウム(0.027g、0.26mmol)をDMF4mL中のR−3およびS−2の混合物(0.48mmol)に、窒素雰囲気下で加えた。反応混合物を100℃に12時間加熱した。水(20mL)を反応混合物に加え、EtOAc(20mL×2)を加えて、水溶液を抽出した。合わせた有機層を乾燥させ、濾過し、蒸発させて、S−2のオイル(72mg、2ステップで収率61%)を得た。キラリティーee:97.6%。1H NMR (400 MHz, クロロホルム-D) δ ppm 1.66 (d, J=7.1 Hz, 3 H) 2.09 (s, 3 H) 6.39 (q, J=6.8 Hz, 1 H)
7.02 (t, J=8.5 Hz, 1 H) 7.22 - 7.30 (m, 1 H).
【0238】
ナトリウムメトキシド(19mmol;メタノール中0.5M)を化合物S−2(4.64g、18.8mmol)に窒素雰囲気下、0℃で徐々に加えた。生じた混合物を室温で4時間撹拌した。溶媒を蒸発させ、H2O(100mL)を加えた。冷却された反応混合物を酢酸ナトリウム−酢酸緩衝溶液でpH7まで中和した。酢酸エチル(100mL×2)を加えて、水溶液を抽出した。合わせた有機層をNa2SO4上で乾燥させ、濾過し、蒸発させて、S−1を白色の固体(4.36g、収率94.9%)として得た;SFC−MS:97%ee。1H NMR (400 MHz, クロロホルム-D) δ ppm 1.65 (d, J=6.8 Hz, 3 H) 5.58 (q, J=6.9 Hz, 1 H) 6.96 - 7.10 (m,
1 H) 7.22 - 7.36 (m, 1 H).
【0239】
5−ブロモ−3−[1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−ピリジン−2−イルアミン(ラセミ化合物):
【0240】
【化20】

1. 氷浴を使用して、2,6−ジクロロ−3−フルオロアセトフェノン(15g、0.072mol)をTHF(150mL、0.5M)中、0℃で10分間撹拌した。水素化アルミニウムリチウム(2.75g、0.072mol)を徐々に加えた。反応物を周囲温度で3時間撹拌した。反応物を氷浴中で冷却し、水(3mL)を滴加し、続いて、15%NaOH(3mL)を徐々に加えた。混合物を周囲温度で30分間撹拌した。15%NaOH(9mL)、MgSO4を加え、混合物を濾過して、固体を除去した。固体をTHF(50mL)で洗浄し、濾液を濃縮して、1−(2,6−ジクロロ−3−フルオロ−フェニル)−エタノール(14.8gm、収率95%)を黄色のオイルとして得た。1H NMR (400 MHz, DMSO-d6) δ 1.45 (d, 3H), 5.42 (m, 2H), 7.32 (m, 1H),
7.42 (m, 1H).
【0241】
2. トリフェニルホスフィン(8.2g、0.03mol)およびDEAD(トルエン中40%の溶液13.65mL)のTHF(200mL)中の撹拌溶液に0℃で、1−(2,6−ジクロロ−3−フルオロ−フェニル)−エタノール(4.55g、0.021mol)および3−ヒドロキシ−ニトロピリジン(3.35g、0.023mol)のTHF(200mL)中の溶液を加えた。生じた明オレンジ色の溶液を窒素雰囲気下、周囲温度で4時間撹拌したが、その時点で、全ての出発物質が消費されていた。溶媒を除去し、粗製物質をシリカゲルに乾燥状態でロードし、酢酸エチル−ヘキサン(20:80)で溶離して、3−(2,6−ジクロロ−3−フルオロ−ベンジルオキシ)−2−ニトロ−ピリジン(6.21g、0.021mol、98%)をピンク色の固体として得た。1H NMR (CDCl3, 300 MHz) δ 1.8-1.85 (d, 3H), 6.0-6.15 (q, 1H),
7.0-7.1 (t, 1H), 7.2-7.21 (d, 1H), 7.25-7.5 (m, 2H), 8.0-8.05 (d, 1H).
【0242】
3. AcOH(650mL)およびEtOH(500mL)の撹拌混合物に、3−(2,6−ジクロロ−3−フルオロ−ベンジルオキシ)−2−ニトロ−ピリジン(9.43g、0.028mol)および鉄チップ(15.7g、0.28mol)を懸濁させた。反応物を徐々に加熱して還流させ、1時間撹拌した。反応物を室温に冷却し、次いで、ジエチルエーテル(500mL)および水(500mL)を加えた。炭酸ナトリウムを加えることによって、溶液を慎重に中和した。合わせた有機抽出物を飽和NaHCO3(2×100mL)、H2O(2×100mL)およびブライン(1×100mL)で洗浄し、次いで、乾燥させ(Na2SO4)、濾過し、乾燥するまで真空下で濃縮して、3−(2,6−ジクロロ−3−フルオロ−ベンジルオキシ)−ピリジン−2−イルアミン(9.04g、0.027mol、99%)を薄ピンク色の固体として得た。1H NMR (CDCl3, 300 MHz) δ 1.8-1.85 (d, 3H), 4.9-5.2 (brs, 2H),
6.7-6.84 (q, 1H), 7.0-7.1 (m, 1H), 7.2-7.3 (m, 1H), 7.6-7.7 (m, 1H).
【0243】
4. 氷浴を使用して、3−(2,6−ジクロロ−3−フルオロ−ベンジルオキシ)−ピリジン−2−イルアミン(9.07g、0.03mol)のアセトニトリル中の撹拌溶液を0℃に冷却した。この溶液に、N−ブロモスクシンイミド(NBS)(5.33g、0.03mol)を少量ずつ加えた。反応物を0℃で15分間撹拌した。反応物を乾燥するまで真空下で濃縮した。生じた暗色のオイルをEtOAc(500mL)に溶かし、シリカゲルクロマトグラフィーを介して精製した。次いで、溶媒を真空除去して、5−ブロモ−3−(2,6−ジクロロ−3−フルオロ−ベンジルオキシ)−ピリジン−2−イルアミン(5.8g、0.015mol、51%)を白色の結晶質の固体として得た。1H NMR (CDCl3, 300 MHz) δ 1.85-1.95 (d, 3H), 4.7-5.0 (brs, 2H),
5.9-6.01 (q, 1H), 6.8-6.95 (d, 1H), 7.01-7.2 (t, 1H), 7.4-7.45 (m, 1H),
7.8-7.85 (d, 1H).
【0244】
5−ブロモ−3−[1(R)−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−ピリジン−2−イルアミン:
【0245】
【化21】

鏡像異性的に純粋なR異性体をラセミ化合物に関しての上記のとおり調製したが、その際、上記の鏡像異性的に純粋な出発物質を使用した。1H NMR (400 MHz, DMSO-d6) δ 1.74 (d, 3H), 6.40 (m, 1H), 6.52 (br s,
2H), 7.30 (m, 1H), 7.48 (m, 1H), 7.56 (s, 1H); MS m/z 382 (M+1).
【0246】
4−メタンスルホニルオキシ−ピペリジン−1−カルボン酸tert−ブチルエステル(2)
【0247】
【化22】

0℃に冷却されている4−ヒドロキシ−ピペリジン−1−カルボン酸tert−ブチルエステル(7.94g、39.45mmol)のCH2Cl2(100mL)中の撹拌溶液に、NEt3(5.54mL、39.45mmol)を、続いて、メタンスルホニルクロリド(3.06mL、39.45mmol)およびDMAP(48mg、0.39mmol)を徐々に加えた。混合物を室温で一晩撹拌した。混合物に水(30mL)を加えた。CH2Cl2(3×30mL)で抽出し、続いて、乾燥させ(Na2SO4)、溶媒を真空中で除去して、4−メタンスルホニルオキシ−ピペリジン−1−カルボン酸tert−ブチルエステルを白色の固体(11.00g、収率>99%)として得た。1H NMR (CDCl3, 400 MHz) δ4.89 (m, 1H), 3.69 (m, 2H), 3.31 (m, 2H),
3.04 (s, 3H), 1.95 (m, 2H), 1.83 (m, 2H), 1.46 (s, 9H).
【0248】
tert−ブチル−4−[4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−1H−ピラゾール−1−イル]ピペリジン−1−カルボキシレート
【0249】
【化23】

tert−ブチル4−(4−ヨード−1H−ピラゾール−1−イル)ピペリジン−1−カルボキシレート(3)
NaH(1.2当量、0.68mmol)を4−ヨードピラゾール(0.57mmol)のDMF(2L)中の撹拌溶液に4℃で少量ずつ加えた。生じた混合物を4℃で1時間撹拌し、次いで、4−メタンスルホニルオキシ−ピペリジン−1−カルボン酸tert−ブチルエステル、化合物2(1.1当量、0.63mmol)を加えた。生じた混合物を100℃に12時間加熱した。反応物をH2Oでクエンチし、EtOAcで複数回抽出した。合わせた有機層を乾燥させ、濾過し、濃縮して、オレンジ色のオイルを得た。残渣をシリカゲルクロマトグラフィー(ペンタン中5%のEtOAcで溶離)によって精製して、化合物3を白色の固体(140g、66%)として得た。
【0250】
tert−ブチル−4−[4−(4,4,5,5−テトラメチル−1,3,2−ジオキサボロラン−2−イル)−1H−ピラゾール−1−イル]ピペリジン−1−カルボキシレート(4)
ビス(ピナコラト)ジボロン(1.4当量、134g、0.52mol)および酢酸カリウム(4当量、145g、1.48mol)を化合物3(140g、0.37mol)のDMSO1.5L中の溶液に順次加えた。混合物を窒素で数回パージし、次いで、ジクロロビス(トリフェニルホスフィノ)パラジウム(II)(0.05当量、12.9g、0.018mol)を加えた。生じた混合物を80℃で2時間加熱した。反応混合物を室温に冷却し、Celite(登録商標)ベッドで濾過し、EtOAcで洗浄した。濾液を飽和NaCl(500mL×2)で洗浄し、Na2SO4上で乾燥させ、濾過し、濃縮した。残渣をシリカゲルクロマトグラフィー(ヘキサン中5%のEtOAcで溶離)によって精製して、化合物4を白色の固体(55g、40%)として得た。
【0251】
3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミン(1)
【0252】
【化24】

3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(4,4,5,5−テトラメチル−[1,3,2]ジオキサボロラン−2−イル)−ピリジン−2−イルアミン(15.22g、35.64mmol)および4−(4−ブロモ−ピラゾール−1−イル)−ピペリジン−1−カルボン酸tert−ブチルエステル(14.12g、42.77mmol)のDME(143mL)中の撹拌溶液に、Na2CO3(11.33g、10692mmol)の水(36mL)溶液を加えた。溶液を脱ガスし、窒素を3回充填した。溶液に、Pd(PPh3)2Cl2(1.25mg、1.782mmol)を加えた。反応溶液を脱ガスし、再び窒素を3回充填した。反応溶液を87℃の油浴で約16時間(またはボランピナコールエステルが消費されるまで)撹拌し、周囲温度に冷却し、EtOAc(600mL)で希釈した。反応混合物をCelite(登録商標)パッドで濾過し、EtOAcで洗浄した。EtOAc溶液をブラインで洗浄し、Na2SO4で乾燥させ、濃縮した。粗製の生成物をシリカゲルカラムで、EtOAc/ヘキサン系(Biotage 90+ Column:平衡100%ヘキサン600mL、セグメント1:50%EtOAc/ヘキサン2250mL、直線、セグメント2:75%EtOAc/ヘキサン4500mL、直線、セグメント3:100%EtOAc4500mL)で溶離して精製して、4−(4−{6−アミノ−5−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−ピリジン−3−イル}−ピラゾール−1−イル)−ピペリジン−1−カルボン酸tert−ブチルエステル(11.8g、収率60%、純度約95%)を0.15のRfで得た(50%EtOAc/ヘキサン)。MS m/e 550(M+1)+。
【0253】
4−(4−{6−アミノ−5−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−ピリジン−3−イル}−ピラゾール−1−イル)−ピペリジン−1−カルボン酸tert−ブチルエステル(11.8g、21.45mmol)のCH2Cl2(59mL、0.2M)中の溶液に、4NのHCl/ジオキサン(21mL)を加えた。溶液を一晩撹拌して、固体を形成した。固体をガラス棒で十分に粉砕し、音波処理して、固体中に捕捉されている出発物質を遊離した。追加の4NのHCl/ジオキサン(21mL)を加え、室温でさらに2時間撹拌すると、LCMSは出発物質を示さなかった。懸濁液を濾紙でライニングされたブフナー漏斗で濾過した。5%未満の生成物を含有するので、母液を取っておいた。固体を500mLビーカーに移し、固体が完全に溶けるまで、HPLC水を加えた。固体Na2CO3を加えることで、pHを10に調節した。またはLCMSが水性層中に生成物を示さなくなるまで、水溶液をCH2Cl2(5×200mL)で抽出した。CH2Cl2溶液をNa2SO4上で乾燥させ、濃縮した。CH2Cl2(10mL)およびMeOH(1mL)に再び溶かした粗製の生成物をシリカゲルカラムで、CH2Cl2/MeoH/NEt3系(Biotage 40+Column:平衡100%CH2Cl2600mL、副生成物の取得、セグメント1:10%MeOH/CH2Cl21200mL、直線、セグメント2:10%MeOH/CH2Cl22400mL、ステップ、セグメント3:9%MeOH/1%NEt3/CH2Cl22400mL)で溶離して精製した。所望の画分を集めて、3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミン(7.19g、合わせた収率75%、白色の固体)を得た。MS m/e 450 (M+1)+. 1H NMR (DMSO-d6,
400 MHz) δ7.92 (s, 1H), 7.76
(s, 1H), 7.58 (m, 1H), 7.53 (s, 1H), 7.45 (m, 1H), 6.90 (s, 1H), 6.10 (m, 1H),
5.55 (bs, 2H), 4.14 (m, 1H), 3.05 (m, 2H), 2.58 (m, 2H), 1.94 (m, 2H), 1.80 (d,
3H), 1.76 (m, 2H).
【0254】
固体生成物3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンをジクロロメタンに溶かし、溶媒を徐々に蒸発させて、微細な結晶質固体を生じさせた。高真空乾燥の後に、試料が、194℃の融点を有する単結晶多形形態Aであることが確認された。
【特許請求の範囲】
【請求項1】
哺乳動物において、少なくとも1つの遺伝子変化ROSによって媒介されるがんを治療する方法であって、前記哺乳動物に、治療的有効量の3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩を投与するステップを含む方法。
【請求項2】
前記哺乳動物がヒトである、請求項1に記載の方法。
【請求項3】
前記少なくとも1つの遺伝子変化ROSが遺伝子変化ROS遺伝子である、請求項1に記載の方法。
【請求項4】
前記遺伝子変化ROS遺伝子が、ROS融合遺伝子である、請求項3に記載の方法。
【請求項5】
前記ROS融合遺伝子が、SLC34A2−ROS遺伝子またはCD74−ROS遺伝子である、請求項4に記載の方法。
【請求項6】
前記ROS融合遺伝子がFIG−ROS遺伝子である、請求項4に記載の方法。
【請求項7】
前記少なくとも1つの遺伝子変化ROSがROS融合タンパク質である、請求項1に記載の方法。
【請求項8】
前記ROS融合タンパク質がSLC34A2−ROSキナーゼである、請求項7に記載の方法。
【請求項9】
前記ROS融合タンパク質がCD74−ROSキナーゼである、請求項7に記載の方法。
【請求項10】
前記ROS融合タンパク質がFIG−ROSキナーゼである、請求項7に記載の方法。
【請求項11】
前記がんが、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される、請求項1から10のいずれか一項に記載の方法。
【請求項12】
前記がんが、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される、請求項1から10のいずれか一項に記載の方法。
【請求項13】
前記がんが非小細胞肺がん(NSCLC)である、請求項1から10のいずれか一項に記載の方法。
【請求項14】
前記がんが神経膠芽細胞腫である、請求項1から10のいずれか一項に記載の方法。
【請求項15】
3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩を、3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する、請求項1から14のいずれか一項に記載の方法。
【請求項1】
哺乳動物において、少なくとも1つの遺伝子変化ROSによって媒介されるがんを治療する方法であって、前記哺乳動物に、治療的有効量の3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩を投与するステップを含む方法。
【請求項2】
前記哺乳動物がヒトである、請求項1に記載の方法。
【請求項3】
前記少なくとも1つの遺伝子変化ROSが遺伝子変化ROS遺伝子である、請求項1に記載の方法。
【請求項4】
前記遺伝子変化ROS遺伝子が、ROS融合遺伝子である、請求項3に記載の方法。
【請求項5】
前記ROS融合遺伝子が、SLC34A2−ROS遺伝子またはCD74−ROS遺伝子である、請求項4に記載の方法。
【請求項6】
前記ROS融合遺伝子がFIG−ROS遺伝子である、請求項4に記載の方法。
【請求項7】
前記少なくとも1つの遺伝子変化ROSがROS融合タンパク質である、請求項1に記載の方法。
【請求項8】
前記ROS融合タンパク質がSLC34A2−ROSキナーゼである、請求項7に記載の方法。
【請求項9】
前記ROS融合タンパク質がCD74−ROSキナーゼである、請求項7に記載の方法。
【請求項10】
前記ROS融合タンパク質がFIG−ROSキナーゼである、請求項7に記載の方法。
【請求項11】
前記がんが、肺がん、骨がん、膵臓がん、皮膚がん、頭部または頚部のがん、皮膚または眼球内黒色腫、子宮がん、卵巣がん、直腸がん、肛門部のがん、胃がん、結腸がん、乳がん、ファロピウス管の癌、子宮内膜癌、子宮頸癌、膣癌、外陰癌、ホジキン病、食道がん、小腸がん、内分泌系のがん、甲状腺がん、副甲状腺がん、副腎がん、軟部組織の肉腫、尿道がん、陰茎がん、前立腺がん、慢性または急性白血病、リンパ球性リンパ腫、膀胱がん、腎臓または尿管のがん、腎細胞癌、腎盂癌、中枢神経系(CNS)の新生物、原発性CNSリンパ腫、脊髄軸腫瘍、脳幹膠腫、下垂体腺腫およびこれらの組み合わせから選択される、請求項1から10のいずれか一項に記載の方法。
【請求項12】
前記がんが、非小細胞肺がん(NSCLC)、神経膠芽細胞腫、扁平上皮細胞癌、ホルモン不応性前立腺がん、乳頭状腎細胞癌、結腸直腸腺癌、神経芽細胞腫、未分化大細胞リンパ腫(ALCL)および胃がんからなる群から選択される、請求項1から10のいずれか一項に記載の方法。
【請求項13】
前記がんが非小細胞肺がん(NSCLC)である、請求項1から10のいずれか一項に記載の方法。
【請求項14】
前記がんが神経膠芽細胞腫である、請求項1から10のいずれか一項に記載の方法。
【請求項15】
3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩を、3−[(R)−1−(2,6−ジクロロ−3−フルオロ−フェニル)−エトキシ]−5−(1−ピペリジン−4−イル−1H−ピラゾール−4−イル)−ピリジン−2−イルアミンまたは薬学的に許容できるその塩と、少なくとも1種の薬学的に許容できる担体とを含む医薬組成物として投与する、請求項1から14のいずれか一項に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6−1】


【図6−2】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6−1】


【図6−2】


【図7】


【公開番号】特開2013−32355(P2013−32355A)
【公開日】平成25年2月14日(2013.2.14)
【国際特許分類】
【外国語出願】
【出願番号】特願2012−165368(P2012−165368)
【出願日】平成24年7月26日(2012.7.26)
【出願人】(593141953)ファイザー・インク (302)
【Fターム(参考)】
【公開日】平成25年2月14日(2013.2.14)
【国際特許分類】
【出願番号】特願2012−165368(P2012−165368)
【出願日】平成24年7月26日(2012.7.26)
【出願人】(593141953)ファイザー・インク (302)
【Fターム(参考)】
[ Back to top ]

