異常プリオンの電気化学的検出方法
【課題】BSEの問題は食用肉の安全性に関わるものであり、また食肉牛の頭数などからして、より迅速かつ簡便に検査方法が求められている。本発明は、より迅速且つ簡便な異常プリオンの検出方法、およびこれに好適な検出器具を提供することを課題とするものである。
【解決手段】異常プリオンを捕捉する異常プリオン捕捉電極を、検査の対象とする検体溶液に浸漬する工程と、異常プリオン捕捉電極を電解質溶液に浸漬して電気化学的応答を測定する測定工程と、異常プリオンに吸着し且つ電気化学的に検出可能な指標試薬を含む指標溶液に異常プリオン捕捉電極を浸漬する工程とを適宜組み合わせて異常プリオンを電気化学的に検出する。
【解決手段】異常プリオンを捕捉する異常プリオン捕捉電極を、検査の対象とする検体溶液に浸漬する工程と、異常プリオン捕捉電極を電解質溶液に浸漬して電気化学的応答を測定する測定工程と、異常プリオンに吸着し且つ電気化学的に検出可能な指標試薬を含む指標溶液に異常プリオン捕捉電極を浸漬する工程とを適宜組み合わせて異常プリオンを電気化学的に検出する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、異常プリオンの電気化学的検出方法に関するものであり、より詳しくは異常プリオンを迅速に検出可能な電気化学的方法およびこの方法に好適な検出キット等に関する。
【背景技術】
【0002】
牛海綿状脳症(以下、BSE(Bovine Spongiform Encephalopathy)ともいう)、Bovine Spongiform Encephalopathy)は、TSE(伝達性海綿状脳症:Transmissible Spongiform Encephalopathy)という未だ十分に解明されていない伝達因子(病気を伝えるもの)と関係する病気のひとつで、牛の脳の組織にスポンジ状の変化を起こし、起立不能等の症状を示す遅発性かつ悪性の中枢神経系の疾病である。BSEの原因についてはプリオンといわれるタンパク質の異常化が挙げられている。
【0003】
2001年に国内でも初めてBSEの感染牛が発見されて以来、食用肉に関する不安は広まっている。このため、食肉用牛に関しては徹底したBSE検査が必要である。国内においては今後も120万頭から130万頭の食肉用牛、および2万頭から3万頭の死亡牛がBSE検査対象となるため、BSEの原因となる異常プリオンを迅速かつ簡便に検出する方法が求められている。
【0004】
これまでのBSEの検査方法は、ELISAなどの抗体を用いたアッセイにより行われてきた。しかし、BSEはプリオンの構造がα−へリックスからβ−シートに構造変化しているというタンパク質の二次構造の変化によると考えられており、異常プリオンを十分特異的に識別する抗体の作製は困難なのが現状である。そこで、検出精度を向上させるため、イムノアッセイを用いる場合、正常プリオンをプロテアーゼにより分解するという前処理をした後に抗体を用いたアッセイを行っている。
【0005】
BSEの検査方法としては例えば G. Safar et al., Nature Biotechnology., 20, 1147-1150(2002)(非特許文献1)等に報告されている。
【0006】
【非特許文献1】G. Safar et al., Nature Biotechnology., 20, 1147-1150(2002)
【発明の開示】
【発明が解決しようとする課題】
【0007】
上記のようにBSEの問題は食用肉の安全性に関わるものであり、また食肉牛の頭数などからして、より迅速かつ簡便な検査方法が求められている。上記のような状況のもと、本発明は、より迅速且つ簡便な異常プリオンの検出方法、およびこれに好適な検出器具を提供することを課題とするものである。
【課題を解決するための手段】
【0008】
本発明者らは、より迅速かつ簡便な方法として、検体を電気化学的に検出する方法に着目し研究を進めたところ、異常プリオンを捕捉しやすい物質を見だし、さらにこれらの物質を用い、電気化学的な応答の相違として異常プリオンを検出可能であることを見いだした。本発明者らは、かかる知見に基づき、異常プリオンを捕捉する電極、異常プリオンに吸着しかつ電気化学的に検出可能な指標試薬などを開発し、従来と異なる電気化学的分析手法によって異常プリオンを検出する方法を完成させた。本発明は、下記検出方法、検出キットおよび指標試薬等を提供するものである。
【0009】
〔1〕異常プリオンを捕捉する異常プリオン捕捉電極を、検査の対象とする検体溶液に浸漬する検体付着工程と、
異常プリオンに吸着しかつ電気化学的に検出可能な指標試薬を含む指標溶液を異常プリオン捕捉電極に付着させる指標付着工程と、
異常プリオン捕捉電極を電解質溶液に浸漬して電気化学的応答を測定する測定工程と、
を含む、異常プリオンの電気化学的検出方法。
〔2〕前記異常プリオン捕捉電極が、異常プリオンを捕捉する異常プリオン受容体が固定された電極である上記〔1〕に記載の異常プリオンの電気化学的検出方法。
〔3〕前記異常プリオン受容体が、異常プリオンと結合する抗体、およびプリオンの一部または全部からなる群より選ばれる、上記〔1〕または〔2〕に記載の異常プリオンの電気化学的検出方法。
〔4〕前記指標試薬がフェロセニルナフタレンジイミド誘導体である上記〔1〕から〔3〕のいずれか一項に記載の異常プリオンの検出方法。
〔5〕前記フェロセニルナフタレンジイミド誘導体が一般式(1)で示される化合物である上記〔4〕に記載の異常プリオンの検出方法。
【化1】

〔6〕シリカおよび/またはタングステン酸を含む被覆層を表面に備える異常プリオン捕捉電極を、検査の対象とする検体溶液に浸漬する検体付着工程と、
異常プリオン捕捉電極を電解質溶液に浸漬して電気化学的応答を測定する測定工程と、
を含む、異常プリオンの電気化学的検出方法。
〔7〕異常プリオンに吸着しかつ電気化学的に検出可能な指標試薬と、異常プリオンを捕捉する異常プリオン受容体が固定された異常プリオン捕捉電極とを備える異常プリオンの検出キット。
〔8〕前記指標試薬がフェロセニルナフタレンジイミド誘導体である上記〔7〕に記載の異常プリオン検出キット。
〔9〕前記フェロセニルナフタレンジイミド誘導体が一般式(1)で示される化合物である上記〔8〕に記載の異常プリオンの検出キット。
【化2】

〔10〕前記異常プリオン受容体が、異常プリオンと結合する抗体、およびプリオンの一部または全部からなる群より選ばれる1種または2種以上である、上記〔7〕から〔9〕のいずれか一項に記載の異常プリオンの検出キット。
〔11〕シリカおよび/またはタングステン酸を含む被覆層を表面に備える異常プリオン捕捉電極を備える異常プリオンの検出キット。
〔12〕異常プリオン結合部位と電気化学的活性部位とを有する化合物からなる異常プリオン検出試薬。
〔13〕フェロセニルナフタレンジイミド誘導体からなる異常プリオン検出用指標試薬。
〔14〕前記フェロセニルナフタレンジイミド誘導体が一般式(1)で示される化合物である上記〔13〕に記載の異常プリオン検出用指標試薬。
【化3】

【発明の効果】
【0010】
本発明によれば、異常プリオンを迅速かつ簡便に検出することができる。本発明の方法は電気化学的な方法であり、測定の安定性も優れている。また、本発明の電気化学的な検出方法は、高価な設備を用いずとも実施可能であり、BSE診断の経費節減に寄与することが期待される。
【発明を実施するための最良の形態】
【0011】
以下、本発明の実施の形態について説明する。
1.本発明の異常プリオン検出方法
本発明の異常プリオン検出方法(以下、「本発明の検出方法」という)においては、電気化学的な応答を測定することにより異常プリオンを検出することを特徴とする。本発明の検出方法は、指標試薬を用いる実施形態とACインピーダンス測定を実施する形態が含まれる。
【0012】
1−1.指標試薬を用いる異常プリオン検出方法
本発明の1つの実施形態として、まず指標試薬を用いる実施形態について説明する。指標試薬を用いる形態では、3つの工程、すなわち、検体付着工程、指標付着工程および測定工程が実施される。
【0013】
検体付着工程では、異常プリオンを捕捉する異常プリオン捕捉電極を、検査の対象とする検体溶液に浸漬する。検体溶液に浸漬することにより、検体溶液中に異常プリオンが含まれている場合に、異常プリオンを異常プリオン捕捉電極に付着させることになる。異常プリオン捕捉電極の浸漬は、電極の表面に十分に検体溶液が浸みわたる程度に行えば足りるが、より好ましくは容器等に検体溶液を貯め、電極を溶液中に挿入して浸漬する形態が採用される。
【0014】
異常プリオン捕捉電極は、溶液中に存在する異常プリオンを捕捉すると共に、測定工程における電気的応答を測定するための作用極である。異常プリオンを捕捉する電極としては、例えば、異常プリオンを捕捉する異常プリオン受容体が固定された電極などが好適である。異常プリオン受容体としては、好ましくは異常プリオンと結合する抗体、プリオンの一部または全部など挙げられ、より好ましくは、プリオンの一部または全部などが例示される。プリオンには異常プリオンに吸着しやすいものがある。一つの例としては、配列番号1に示すアミノ酸配列を含むペプチド鎖などが例示される。配列番号1に示すアミノ酸配列を有するペプチド鎖は異常プリオンと選択的に吸着しやすい傾向が強く、本発明の検出方法に特に好適に用い得る。異常プリオン捕捉電極は、形状等に特に限定はない。具体例としては、棒状の電極の一方の端部に異常プリオン受容体を固定化した作用端を備える棒状の電極でもよいし、あるいは板状の基盤の上面に作用端を有するチップ状の電極としてもよい。
【0015】
指標付着工程では、異常プリオンを捕捉する異常プリオン捕捉電極を、異常プリオンに吸着しかつ電気化学的に検出可能な指標試薬を含む指標溶液に浸漬する。指標付着工程は、指標試薬を異常プリオンに吸着させることを一つの目的とする。
【0016】
指標試薬は、異常プリオン結合部位と電気化学的活性部位を有する化合物などが好適である。異常プリオン結合部位と電気化学的活性部位とは同一部位でも異なる部位でもよい。また、異常プリオン結合部位と電気化学的活性部位とをリンカーにより結びつけた複合体などでもよい。電気化学的活性部位としては、例えば酸化還元反応をしやすい化学構造を有する物質などが用いられ得る。異常プリオン結合部位は、例えば異常プリオンが有するβ−シートとβ−シートとの間に嵌り得る構造を有するものなどが好適である。
【0017】
指標試薬としては、好ましいものの1つとしてフェロセニルナフタレンジイミド(Ferrocenyl Naphthalene Diimide、以下FNDとも示す)誘導体が例示される。FND誘導体は、多環式化合物であるナフタレンジイミドに有機化合物系の酸化還元活性化合物であるフェロセンを結合させた化合物群である。必ずしも明確ではないが、FND誘導体と異常プリオンとは疎水的な作用により相互に吸着しやすい性質を示すものと推測される。上記のように、異常プリオンを捕捉電極とFND誘導体に代表される指標試薬を用いることにより、精度よく異常プリオンを検出することができる。
【0018】
FND誘導体として好ましくは一般式(2)で示される化合物が例示される。
【0019】
【化4】

【0020】
一般式(2)においてR1およびR2は同一でも異なっていてもよい。R1およびR2は、一般式(3)〜(9)からなる群より選ばれるFND誘導体が好適である。
【0021】
【化5】

【0022】
【化6】

【0023】
【化7】

【0024】
【化8】

【0025】
【化9】

【0026】
【化10】

【0027】
【化11】

【0028】
【化12】

【0029】
一般式(3)〜(9)においてFcはフェロセン(式(10))を表す。また、指標試薬としてさらに好ましくは、R1およびR2が共に一般式(6)で示される一般式(2)のFND誘導体が挙げられる。R1およびR2が共に一般式(6)で示される一般式(2)のFND誘導体は式(1)で示される化合物である。FND誘導体は1種を単独で用いてもよいし、また複数種を混合して用いてもよい。
【0030】
また、さらに他の好ましい指標試薬としては、下記式(11)から(14)に示される化合物および図1−4に記載の化合物などが例示される。図1−4の指標試薬は異常プリオン結合部42aとリンカー部42bと電気化学的活性部位43cから構成された複合体である。異常プリオン結合部42aにはペプチド鎖またはヌクレオチド鎖などを異常プリオンと結合・吸着する性質の化合物を用い得る。異常プリオン結合部に用い得るペプチドとしては、例えばPrP106-126(プリオンタンパク質アミノ酸配列における106番目のアミノ酸残基から126番目のアミノ酸残基までのアミノ酸配列からなるポリペプチド断片)などが、ヌクレオチドとしては、例えば異常プリオンを認識するアプタマーなどが挙げられる。電気化学的活性部位としては例えばフェロセンを備える化合物などを用い得る。
【0031】
【化13】

【0032】
【化14】

【0033】
【化15】

【0034】
【化16】

【0035】
【化17】

【0036】
指標付着工程においては、指標試薬溶液を異常プリオン捕捉電極に浸漬させる。異常プリオン捕捉電極の浸漬は、指標試薬溶液が異常プリオン捕捉電極の表面に十分浸みわたる程度で足りるが、より好ましくは容器に貯めた指標溶液中に電極を挿入して浸漬する形態が採用され得る。
【0037】
指標溶液中の指標試薬の濃度は、指標試薬等の条件に応じて適宜調整してよい。調整の幅としてはサブmMレベルから数百mM程度までが例示される。FND誘導体などの場合、約1mM程度が例示される。
【0038】
測定工程では、異常プリオン捕捉電極を電解質溶液に浸漬して電気化学的応答を測定する。電気化学的な応答の測定は、指標試薬の量に応じて生じる電気化学的な変化を把握できるものであれば特に限定はなく、各種の電気化学的な分析手法を採用することができる。電気化学的な応答の測定としては、異常プリオン受容体を固定した電極を用いる場合、好ましくはCV(サイクリックボルタンメトリ)測定法、DPV(ディファレンシャルパルスボルタンメトリ)測定法、SWV(方型波ボルタンメトリー)測定法、交流インピーダンス法などが例示される。電極の浸漬は、電気的応答を測定可能な程度に異常プリオン捕捉電極の表面を十分覆う程度で足りるが、好ましくは容器に貯めた指標溶液中に電極を挿入して浸漬する形態が採用され得る。また、電解質溶液は、電解質が溶解した溶液であえれば特段限定されないが、好ましい例としては、リン酸緩衝液、トリス緩衝液などが挙げられる。
【0039】
指標試薬を用いる形態においては、各工程は少なくとも1回実施され、また検体付着工程の後に少なくとも1回は測定工程は実施する。各工程の順序は、好ましくは、i)検体付着工程、ii)指標付着工程、iii)測定工程の順に行うことが好ましい。
【0040】
また、他の好ましい形態としては、i)指標付着工程、ii)測定工程、iii)検体付着工程、iv)指標付着工程、v)測定工程の順に実施する形態が挙げられる。異常プリオン受容体は異常プリオンに選択性を有するものが好適であるが、異常プリオン受容体としてのプリオンにFND誘導体が吸着する場合もあり得る。そこで、指標付着工程を先に実施しておき、予め異常プリオン受容体が吸着する容量のFND誘導体を吸着させておき、そのときの電気化学的な応答を測定しておく。そして、検体溶液に異常プリオン捕捉電極を浸漬し、再度FND誘導体を付着させてから電気化学的な応答を再度測定し、再度の測定値から1回目の測定値を引く。このように電気的応答を検体付着の前後で行い電気的応答を測定することにより、異常プリオンが存在しない検体である場合と、電極の不具合などにより異常プリオンが捕捉できなかった場合とを区別することができる。
【0041】
1−2.ACインピーダンスを測定する検出方法
次に、本発明の他の実施形態として、ACインピーダンスを測定する検出方法について説明する。ACインピーダンスを測定する形態では、検体付着工程と測定工程とが含まれる。
【0042】
ACインピーダンスを測定する形態では、異常プリオン捕捉電極として、好ましくはシリカおよび/またはタングステン酸を含む被覆層を表面に備える電極が用いられる。これらの材料で電極表面をコーティングすることにより異常プリオンと相互作用しやすい電極とすることができる。
【0043】
異常プリオンが検体溶液に含まれていると、異常プリオンが異常プリオン捕捉電極に付着し、電解質溶液のACインピーダンスが上昇する現象を生じる。ACインピーダンスの変化を測定することにより異常プリオンを検出することができる。
【0044】
ACインピーダンスを測定する工程の場合、検体付着工程および測定工程を同時期に行い経時的な変化を測定してもよいし、また検体付着工程の前に電解質溶液のACインピーダンスを測定しておき、検体付着工程により検体を異常プリオン捕捉電極に付着させ、その後再度電解質溶液に浸漬させてACインピーダンスを測定して、検体付着工程の前後でのACインピーダンスの測定値の相違から異常プリオンを検出するようにしてもよい。
【0045】
電解質溶液など他の条件は、溶液試料についてACインピーダンスを測定する場合の定法により適宜調整してよい。例えば、リン酸緩衝液、トリス緩衝液など、電極等を用いて電気化学的変化を測定するために通常用いられるものを採用し得る。
【0046】
上記のように本発明の電気化学的な検出方法は、従来のように抗体を用いた前処理等を要せずとも、感度良く測定可能である。しかしながら、抗体を用いた従来の方法と本発明の電気化学的な検出方法とを組み合わせて実施し、さらにBSE検査の精度を向上させることも可能である。
【0047】
2.本発明の検出キットおよび指標試薬
本発明は、上記本発明の検出方法において好適に用いられる検出キットおよび指標試薬をも提供する。
【0048】
本発明の検出キットは、1つの実施形態としては、異常プリオンに吸着しかつ電気化学的に検出可能な指標試薬と、異常プリオンを捕捉する異常プリオン受容体が固定された異常プリオン捕捉電極とを備える。また、他の実施形態としては、シリカおよび/またはタングステン酸を含む被覆層を表面に備える異常プリオン捕捉電極を備える異常プリオンの検出キットが例示される。
【0049】
指標試薬および異常プリオン捕捉電極についての詳細は、上記「1.本発明の検出方法」において説明したとおりである。また、本発明の検出キットには、本発明の検出方法を実施するために好適な他の部材、試薬類をさらに追加してもよい。例えば、異常プリオン捕捉電極の他に、電気化学的な測定に用いる対極、参照電極などの他の電極、電解質溶液、これに添加する緩衝剤など、電気化学的測定において用いられるものなどが例示される。また、異常プリオン捕捉電極を支持基盤などに固定した検出チップなどの形態をとることもできる。
【0050】
本発明の異常プリオン検出用試薬はFND誘導体からなる。FND誘導体の詳細は上記「1.本発明の検出方法」において説明したとおりである。
【0051】
3.具体的な実施形態
次に、図1〜3と共に本発明の実施形態についてより具体的に説明する。図1から3は本発明の実施形態を模式的に示したものである。
【0052】
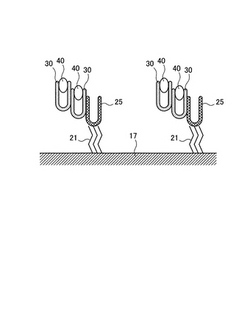
図1−1、1−2、1−3に本発明の第1の実施形態を示す。図1−1に異常プリオン捕捉電極1を示す。異常プリオン捕捉電極1には端子15が備えられ不図示の測定器に接続可能である。端子15はポリマー性の胴体に覆われている。また、異常プリオン捕捉電極1の他方の端部には作用端16が設けられている。作用端16は、電気化学的な変化の受信部位であり、グラシーカーボンや金など電極の受信部位に用いられる材料の表面に、異常プリオン受容体(抗体20など)が固定されている(図1−2など)。異常プリオン捕捉電極10を検体溶液に浸漬させると、異常プリオン30が抗体20に結合する。図1から3において異常プリオン30は模式的にU字型で示している。これは異常プリオンの特徴部であるβ−シート構造をイメージして描いたものである。
【0053】
本発明の検出方法の検出感度が優れる理由の1つとして、必ずしも明確ではないが、次のような現象が推測される。図1−2に示すように、異常プリオン分子同士は相互に凝集しやすい傾向がある。そのため、抗体20に1つの異常プリオン30の分子が結合すると、その異常プリオン(30)分子の周りに他の異常プリオン(30)分子が凝集しやすいため(図1−2)、本発明の検出方法は検出感度が優れるものと推測される。また、異常プリオン捕捉電極10の表面において、異常プリオン受容体20以外の露出部に、マスキング剤によるコーティングを施すことにより、より感度を向上させることもできる。マスキング剤としては、金電極を利用する場合には、例えばメルカプトアルカノール(メルカプトエタノール、メルカプトヘキサノール、メルカプトオクタノール)、ポリエチレングリコールを有するアルカンチオールなどが好適である。また、グラシーカーボン電極の場合には表面を酸化してカルボン酸にしてもよく、その場合アミノ基を末端に有するポリエチレングリコールなどがマスキング剤として好適である。
【0054】
検体溶液に浸漬した後、緩衝溶液をもちいて異常プリオン捕捉電極10の表面を軽く洗浄し、抗体20に捕捉された異常プリオン30以外の余剰物質を除去する。次に、FND誘導体40を含む溶液に異常プリオン捕捉電極を浸漬させる。FND誘導体40は、異常プリオン30に吸着する(図1−3)。必ずしも明確ではないが、FND誘導体は異常プリオンを構成するβ―シート同士の間隙に挟み込まれるようにして吸着されるものと推測される。
【0055】
FND誘導体40を付着させた後、電気化学的な応答を測定し、異常プリオン30の有無による電気化学的な測定値の相違から異常プリオンを検出する。
【0056】
指標試薬の他の実施形態として、例えば図1−4に示す形態の指標試薬が挙げられる。図1−4の指標試薬は異常プリオン結合部42aとリンカー部42bと電気化学的活性部位43cから構成された複合体である。より具体的な例としては、図1−5に示す指標試薬を用い得る。図1−5に示す指標試薬は、異常プリオン結合部42dとしてペプチド鎖(例えばPrP106-126など)またはヌクレオチド(例えば異常プリオンを認識するアプタマーなど)と、リンカー42bとフェロセン(Fc)とを備える化合物である。
【0057】
次に本発明の第2の実施形態について、図2と共に説明する。上記第1の実施形態と同じ構成には同じ符号を付け、その説明は省略する。
【0058】
第2の実施形態では、異常プリオン捕捉電極11に、結合子21を介して正常プリオン25が固定されている。正常プリオン25は異常プリオン受容体として機能し、正常プリオン25に異常プリオン30が付着または結合し、異常プリオン30にFND誘導体40が吸着する。吸着したFND誘導体40の量に応じた電気化学的な応答の相違により異常プリオン30を検出する。
【0059】
第3の実施形態について、図3−1および3―2と共に説明する。第3の実施形態では、上記第1の実施形態と同じ構成には同じ符号を付け、その説明は省略する。第3の実施形態では、異常プリオン捕捉電極として、シリコンを表面にコーティングした異常プリオン捕捉電極12を用いる。異常プリオン捕捉電極12を検体溶液に浸漬させると、異常プリオン捕捉電極12の表面に異常プリオン30が付着する。異常プリオン30が付着することにより陰イオン分子41の移動が阻害され、ACインピーダンスは上昇する。すなわち、ACインピーダンスの変化により、異常プリオンを検出することができる。なお、本実施形態では陰イオン分子41の移動を検知しているが、電気化学的変化として検知可能なものであれば陽イオンであっても中性の分子であってもよい。
【実施例】
【0060】
以下、本発明について実施例を示しより詳細に説明するが、本発明が下記の実施例に限定されるものではない。
【0061】
1.PrP106-126の合成
プリオンタンパク質アミノ酸配列における106番目のアミノ酸残基から126番目のアミノ酸残基までのアミノ酸配列からなるポリペプチド断片PrP106-126をPrPScのモデルとして用いることとした。PrPScフラグメントペプチドであるPrP106-126は、次のようにして合成した。当該配列を配列表の配列番号1に示す。なお、アミノ酸残基の番号は翻訳開始点のメチオニンを1番目と数える。また、プリオンタンパク質のアミノ酸配列は、例えば、PDB(米国 Protain Data Bank運営グループ RCSB: Research Collaboratory for Structural Bioinformaticsによるデータベース)において1DX1として参照可能である。
【0062】
PrP106-126は、ペプチド自動合成機(433A Applied Biosystems instrument)を用いて常法のFmoc固相ペプチド合成法によってペプチド鎖の伸長反応を行った。次に固相担体を取り出してスクリュー管に移し、Cleavage cocktail(TFA : EDT : water : TIS = 92.5 : 2.5 : 2.5 : 2.5 (v/v/v/v))を注ぎ室温で2時間撹拌して固相担体からのペプチドの切り出しおよび脱保護を行った。得られた粗ペプチドは逆相HPLCによる精製、MALDI-TOF-MASSによる同定を行った。
【0063】
合成したペプチド鎖は次の通りである。
配列番号1;H-Lys-Thr-Asn-Met-Lys-His-Met-Ala-Gly-Ala-Ala-Ala-Ala-Gly-Ala-Val-Val-Gly-Gly-Leu-Gly-OH
【0064】
2.PrP106-126のβ化によるPrPScの作製
上記「1.」のようにして得られたペプチドを50 mM potassium phosphate buffer (pH 7.4)に溶かして濃度を20μMとした。ロータリーシェーカーでゆっくりと振倒させながら(85回/min.)37℃でインキュベーションした。4日後、ペプチド溶液中に糸状の浮遊物が確認できた。この溶液を超音波照射して、β化されたPrP106-126を含む検体溶液とした。
【0065】
3.PrPSc受容体(PrP121-231)の金電極への固定化
PrPSc捕捉する分子としてPrP121-231(mouse recombinant)を用いた。これを図4−1から図4−4に示す方法にしたがって金電極へ固定化した。具体的な実験操作は次の通りである。
【0066】
(A)まず、金電極を前処理し、bareな金表面を調整した(図4−1)。(B)次に、金電極を10 mM 11−メルカプトウンデカン酸エタノール溶液(11-mercaptoundecanoic acid EtOH溶液)に室温で1時間浸漬し、末端にカルボン酸を有する自己組織化膜(SAM)を形成させた(図4−2)。(C)さらに、100 mg/ml 水溶性カルボジイミド塩酸塩水溶液と100 mg/ml 無水コハク酸イミド水溶液を等量ずつ混合した溶液に、上記(B)で作製した電極を室温で30 min.浸漬させ、末端カルボン酸を活性エステル化した(図4−3)。(D)0.15 mg/ml PrP121-231 mouse recombinant PBS buffer(pH 7.0)溶液を上記(C)の電極に添加し、加湿容器中、5℃で終夜静置し、PrP121-231 mouse recombinantのリジン側鎖アミノ基を介して共有結合により金電極に固定化した(図4−4)。
【0067】
4.PrP121-231固定化電極の評価
金電極の化学修飾情報(PrP121-231の固定化確認)を得ることを目的として、PrP121-231固定化前後におけるCyclic Voltanmetry測定を行った。すなわち、上記「3.」で作製した電極を用い、測定溶液として100 mM potassium phosphate buffer, 100 mM KCl, 5 mM [Fe(CN)6]4-/3-を用いてCV測定を行った。
【0068】
その結果を図5−1、図5−2に示す。図5−1は(A)、(B)および(D)全てのステップにおけるサイクリックボルタモグラムを、図5−2はそれを拡大したものを示す。金電極の修飾と共にフェリシアン/フェロシアンイオンに由来する酸化還元波の減少が見られる。これはステップ(B)および(D)によって金電極が化合物で被覆されフェリシアン/フェロシアンイオンの電極への拡散が阻害されたものであると考えられる。さらに右図を見るとステップ(D)の方がステップ(B)よりも減少の度合いが大きい。これはサイズの大きな蛋白質が金電極へ固定化され、よりフェリシアン/フェロシアンイオンの電極への拡散が阻害されたものであると考えられ、この結果よりPrP121-231は金電極へ固定化されていることが示された。
【0069】
5.PrP121-231固定化電極を用いたPrPScの電気化学的検出
化学合成したPrPScモデルペプチドPrP106-126を検体としてPrPScの電気化学的検出実験を行った。図6に示す操作手順によりDPV測定を行った。また、電解セルは図7に示す三電極系を用いた。電極(Electrode)およびバッファーは次の通りである。また、検出器として電気化学装置 ALS/chi Electrochemical Analyzer Model 650A(BAS社製)を用いた。
Working Electrode (WE): Au
Reference Electrode (RE): Ag/AgCl
Counter Electrode (CE): Pt
Buffer:
100 mM Potassium Phosphate buffer pH 7.4
100 mM KCl
【0070】
上記「3.」に従って作製した三本の電極X、Y、Zを用意し(Electrode X, Y, Z)について同様の操作を行った。結果を図8に示した。いずれのボルタモグラムにおいてフェロセンの酸化反応に由来する酸化電流ピークが0.4 V付近に見られた。さらに、PrP106-126溶液浸漬後のDPV(ii)ではいずれの電極においてもDPV(i)のピーク電流値よりも増加する結果となった。これはPrP106-126が金電極へ捕捉されたことにより、より多くのFNDが金電極へ濃縮された効果であると考えられる。この結果は、PrPScの電気化学的検出が可能であることを示している。
【0071】
ここで、DPV(ii)の電流値がDPV(i)より大きくなった原因として、前述したことが起きているのではなく、単にFND溶液に二回浸漬させたことが原因とも考えられる。そこで、ネガティブコントロールとしてDPV(i)を測定した後、PrP溶液に電極を浸漬させることなくそのまま二回目のFND溶液へ浸漬させてDPV(ii)の測定を行った。測定は電極X’およびY’の2本を用意した。
【0072】
測定結果を図8に示した。この実験からはPrP溶液に浸漬させた時のような有意の電流値増加は見られなかった。電極Y’では逆に電流値の減少が見られた。一回目に過剰に濃縮されていたFNDの量が二回目の洗浄操作によって減少した為であると考えられる。以上のことより,図9のシグナルは、PrPが電極に濃縮され、これにFNDが結合することにより電気化学的応答が出ていることを示している。(ここでの電気化学的シグナルは,PrP特異的である)。
【0073】
6.ACインピーダンス(AC Impedance)測定によるPrPScの電気化学的検出
ACインピーダンス測定により電極界面の電気化学反応抵抗を簡便に求めることができる。インピーダンス測定で得られて結果はNyquist Plotで図示される。図10に典型的なNyquist Plot(複素平面表示)を示した。インピーダンス(Z)は、Z=Z’+jZ”で示される。図10は実数成分Z’をx軸に、虚数成分Z”をy軸として示した図である。図10において、半円部の頂点が−Z”=Rs+Rct/2となる点である。図10の半円の半径から電極界面の電気化学反応抵抗(Rct)を算出することができる。
【0074】
PrPScは自発的に凝集する性質を有している。この性質を利用してPrPScを電極上で凝集させた時、電極界面にPrPScが堆積する。これは電荷移動抵抗の増加を引き起こすと考えられる。したがってPrPScの電極界面への体積に伴うイオン移動抵抗をACインピーダンス測定により求めることでPrPScの検出が可能であると考えられる。ここで、電極上でPrPScが凝集した場合、イオン移動抵抗が増加することが予測される。
【0075】
上記の予測を検証するために以下の実験を行った。
1)グラッシーカーボン電極(以下GC電極)をアルミナペーストにより研磨した。
2)GC電極を超純水中でsonication(10 min. 2回)した。
3)電解質溶液中でACインピーダンス測定した。
4)GC電極を洗浄後、20μM PrP106-126溶液中に浸漬し、1時間静置した。
5)上記3)と同条件でACインピーダンス測定した。
6)ACインピーダンスは電気化学装置 ALS/chi Electrochemical Analyzer Model 650A(BAS社製)を用いて測定した。
【0076】
測定条件は次の通りである。
作用極(作用端)(WE): グラッシーカーボン電極
参照電極(RE): Ag/AgCl電極
対極(CE) : Pt
Init E:0.235 V
High Freq.:10000 Hz
Low Freq.:0.1 Hz
Amplitude:5 mV
Buffer:0.1 M Pottasium phosphate buffer (pH 7.4),0.1 M KCl,5 mM Fe[C/N]4-/3-
【0077】
測定結果を図11に示す。PrP106-126溶液に浸漬前(図11中Before PrP)と浸漬後(図11中After PrP)とを比較すると、上記の予測通り、PrPペプチドの電極上への凝集に伴う、電荷移動抵抗の増加が確認された。この減少はPrPに限った現象ではなく、他の蛋白質(例えばPrPC)も電極上へ疎水性相互作用により吸着し、同様の電荷移動抵抗の増加が確認されると考えられる。本手法によりPrPを検出する際には、選択性をより向上させるために、PrP固有の性質、すなわち、Proteinase K耐性や界面活性剤に対する耐性を利用することが好適であると考えられる。
【産業上の利用可能性】
【0078】
以上のように、本発明はBSEの検出に有用であり、牛肉の安全性確認などに寄与するものである。
【図面の簡単な説明】
【0079】
【図1−1】第1の実施形態の原理を模式的に示す図である。
【図1−2】第1の実施形態の原理を模式的に示す図である。
【図1−3】第1の実施形態の原理を模式的に示す図である。
【図1−4】指標試薬の他の実施形態を示す図である。
【図1−5】指標試薬の他の実施形態を示す図である。
【図2】第2の実施形態の原理を模式的に示す図である。
【図3−1】第3の実施形態の原理を模式的に示す図である。
【図3−2】第3の実施形態の原理を模式的に示す図である。
【図4−1】金電極表面にPrP121-231を固定化する処理の一部を模式的に示す図である。
【図4−2】金電極表面にPrP121-231を固定化する処理の一部を模式的に示す図である。
【図4−3】金電極表面にPrP121-231を固定化する処理の一部を模式的に示す図である。
【図4−4】金電極表面にPrP121-231を固定化する処理の一部を模式的に示す図である。
【図5−1】金修飾電極によるCV測定の結果を示す図である。
【図5−2】金修飾電極によるCV測定の結果を示す図である。
【図6】金修飾電極によるDPV測定の手順を示す図である。
【図7】DPV測定において用いた電解セルを示す図である。
【図8】DPV測定の結果を示す図である。
【図9】DPV測定の補助的実験の結果を示す図である。
【図10】ACインピーダンス測定から得たNyquist Plotの典型例を示す図である。
【図11】ACインピーダンス測定の結果を示す図である。
【符号の説明】
【0080】
10、11、12 異常プリオン捕捉電極
15 端子
16、17 作用端
WE 作用極
RE 参照電極
CE 対極
20 抗体(異常プリオン受容体)
21 結合子
25 正常プリオン(異常プリオン受容体)
30 異常プリオン
40 FND誘導体
41 陰イオン分子
42 指標試薬
42a 異常プリオン結合部
42b リンカー部
43c 電気化学的活性部位
43d ペプチド鎖またはヌクレオチド鎖
Fc フェロセン
50 電解質溶液
90 基板
【技術分野】
【0001】
本発明は、異常プリオンの電気化学的検出方法に関するものであり、より詳しくは異常プリオンを迅速に検出可能な電気化学的方法およびこの方法に好適な検出キット等に関する。
【背景技術】
【0002】
牛海綿状脳症(以下、BSE(Bovine Spongiform Encephalopathy)ともいう)、Bovine Spongiform Encephalopathy)は、TSE(伝達性海綿状脳症:Transmissible Spongiform Encephalopathy)という未だ十分に解明されていない伝達因子(病気を伝えるもの)と関係する病気のひとつで、牛の脳の組織にスポンジ状の変化を起こし、起立不能等の症状を示す遅発性かつ悪性の中枢神経系の疾病である。BSEの原因についてはプリオンといわれるタンパク質の異常化が挙げられている。
【0003】
2001年に国内でも初めてBSEの感染牛が発見されて以来、食用肉に関する不安は広まっている。このため、食肉用牛に関しては徹底したBSE検査が必要である。国内においては今後も120万頭から130万頭の食肉用牛、および2万頭から3万頭の死亡牛がBSE検査対象となるため、BSEの原因となる異常プリオンを迅速かつ簡便に検出する方法が求められている。
【0004】
これまでのBSEの検査方法は、ELISAなどの抗体を用いたアッセイにより行われてきた。しかし、BSEはプリオンの構造がα−へリックスからβ−シートに構造変化しているというタンパク質の二次構造の変化によると考えられており、異常プリオンを十分特異的に識別する抗体の作製は困難なのが現状である。そこで、検出精度を向上させるため、イムノアッセイを用いる場合、正常プリオンをプロテアーゼにより分解するという前処理をした後に抗体を用いたアッセイを行っている。
【0005】
BSEの検査方法としては例えば G. Safar et al., Nature Biotechnology., 20, 1147-1150(2002)(非特許文献1)等に報告されている。
【0006】
【非特許文献1】G. Safar et al., Nature Biotechnology., 20, 1147-1150(2002)
【発明の開示】
【発明が解決しようとする課題】
【0007】
上記のようにBSEの問題は食用肉の安全性に関わるものであり、また食肉牛の頭数などからして、より迅速かつ簡便な検査方法が求められている。上記のような状況のもと、本発明は、より迅速且つ簡便な異常プリオンの検出方法、およびこれに好適な検出器具を提供することを課題とするものである。
【課題を解決するための手段】
【0008】
本発明者らは、より迅速かつ簡便な方法として、検体を電気化学的に検出する方法に着目し研究を進めたところ、異常プリオンを捕捉しやすい物質を見だし、さらにこれらの物質を用い、電気化学的な応答の相違として異常プリオンを検出可能であることを見いだした。本発明者らは、かかる知見に基づき、異常プリオンを捕捉する電極、異常プリオンに吸着しかつ電気化学的に検出可能な指標試薬などを開発し、従来と異なる電気化学的分析手法によって異常プリオンを検出する方法を完成させた。本発明は、下記検出方法、検出キットおよび指標試薬等を提供するものである。
【0009】
〔1〕異常プリオンを捕捉する異常プリオン捕捉電極を、検査の対象とする検体溶液に浸漬する検体付着工程と、
異常プリオンに吸着しかつ電気化学的に検出可能な指標試薬を含む指標溶液を異常プリオン捕捉電極に付着させる指標付着工程と、
異常プリオン捕捉電極を電解質溶液に浸漬して電気化学的応答を測定する測定工程と、
を含む、異常プリオンの電気化学的検出方法。
〔2〕前記異常プリオン捕捉電極が、異常プリオンを捕捉する異常プリオン受容体が固定された電極である上記〔1〕に記載の異常プリオンの電気化学的検出方法。
〔3〕前記異常プリオン受容体が、異常プリオンと結合する抗体、およびプリオンの一部または全部からなる群より選ばれる、上記〔1〕または〔2〕に記載の異常プリオンの電気化学的検出方法。
〔4〕前記指標試薬がフェロセニルナフタレンジイミド誘導体である上記〔1〕から〔3〕のいずれか一項に記載の異常プリオンの検出方法。
〔5〕前記フェロセニルナフタレンジイミド誘導体が一般式(1)で示される化合物である上記〔4〕に記載の異常プリオンの検出方法。
【化1】

〔6〕シリカおよび/またはタングステン酸を含む被覆層を表面に備える異常プリオン捕捉電極を、検査の対象とする検体溶液に浸漬する検体付着工程と、
異常プリオン捕捉電極を電解質溶液に浸漬して電気化学的応答を測定する測定工程と、
を含む、異常プリオンの電気化学的検出方法。
〔7〕異常プリオンに吸着しかつ電気化学的に検出可能な指標試薬と、異常プリオンを捕捉する異常プリオン受容体が固定された異常プリオン捕捉電極とを備える異常プリオンの検出キット。
〔8〕前記指標試薬がフェロセニルナフタレンジイミド誘導体である上記〔7〕に記載の異常プリオン検出キット。
〔9〕前記フェロセニルナフタレンジイミド誘導体が一般式(1)で示される化合物である上記〔8〕に記載の異常プリオンの検出キット。
【化2】

〔10〕前記異常プリオン受容体が、異常プリオンと結合する抗体、およびプリオンの一部または全部からなる群より選ばれる1種または2種以上である、上記〔7〕から〔9〕のいずれか一項に記載の異常プリオンの検出キット。
〔11〕シリカおよび/またはタングステン酸を含む被覆層を表面に備える異常プリオン捕捉電極を備える異常プリオンの検出キット。
〔12〕異常プリオン結合部位と電気化学的活性部位とを有する化合物からなる異常プリオン検出試薬。
〔13〕フェロセニルナフタレンジイミド誘導体からなる異常プリオン検出用指標試薬。
〔14〕前記フェロセニルナフタレンジイミド誘導体が一般式(1)で示される化合物である上記〔13〕に記載の異常プリオン検出用指標試薬。
【化3】

【発明の効果】
【0010】
本発明によれば、異常プリオンを迅速かつ簡便に検出することができる。本発明の方法は電気化学的な方法であり、測定の安定性も優れている。また、本発明の電気化学的な検出方法は、高価な設備を用いずとも実施可能であり、BSE診断の経費節減に寄与することが期待される。
【発明を実施するための最良の形態】
【0011】
以下、本発明の実施の形態について説明する。
1.本発明の異常プリオン検出方法
本発明の異常プリオン検出方法(以下、「本発明の検出方法」という)においては、電気化学的な応答を測定することにより異常プリオンを検出することを特徴とする。本発明の検出方法は、指標試薬を用いる実施形態とACインピーダンス測定を実施する形態が含まれる。
【0012】
1−1.指標試薬を用いる異常プリオン検出方法
本発明の1つの実施形態として、まず指標試薬を用いる実施形態について説明する。指標試薬を用いる形態では、3つの工程、すなわち、検体付着工程、指標付着工程および測定工程が実施される。
【0013】
検体付着工程では、異常プリオンを捕捉する異常プリオン捕捉電極を、検査の対象とする検体溶液に浸漬する。検体溶液に浸漬することにより、検体溶液中に異常プリオンが含まれている場合に、異常プリオンを異常プリオン捕捉電極に付着させることになる。異常プリオン捕捉電極の浸漬は、電極の表面に十分に検体溶液が浸みわたる程度に行えば足りるが、より好ましくは容器等に検体溶液を貯め、電極を溶液中に挿入して浸漬する形態が採用される。
【0014】
異常プリオン捕捉電極は、溶液中に存在する異常プリオンを捕捉すると共に、測定工程における電気的応答を測定するための作用極である。異常プリオンを捕捉する電極としては、例えば、異常プリオンを捕捉する異常プリオン受容体が固定された電極などが好適である。異常プリオン受容体としては、好ましくは異常プリオンと結合する抗体、プリオンの一部または全部など挙げられ、より好ましくは、プリオンの一部または全部などが例示される。プリオンには異常プリオンに吸着しやすいものがある。一つの例としては、配列番号1に示すアミノ酸配列を含むペプチド鎖などが例示される。配列番号1に示すアミノ酸配列を有するペプチド鎖は異常プリオンと選択的に吸着しやすい傾向が強く、本発明の検出方法に特に好適に用い得る。異常プリオン捕捉電極は、形状等に特に限定はない。具体例としては、棒状の電極の一方の端部に異常プリオン受容体を固定化した作用端を備える棒状の電極でもよいし、あるいは板状の基盤の上面に作用端を有するチップ状の電極としてもよい。
【0015】
指標付着工程では、異常プリオンを捕捉する異常プリオン捕捉電極を、異常プリオンに吸着しかつ電気化学的に検出可能な指標試薬を含む指標溶液に浸漬する。指標付着工程は、指標試薬を異常プリオンに吸着させることを一つの目的とする。
【0016】
指標試薬は、異常プリオン結合部位と電気化学的活性部位を有する化合物などが好適である。異常プリオン結合部位と電気化学的活性部位とは同一部位でも異なる部位でもよい。また、異常プリオン結合部位と電気化学的活性部位とをリンカーにより結びつけた複合体などでもよい。電気化学的活性部位としては、例えば酸化還元反応をしやすい化学構造を有する物質などが用いられ得る。異常プリオン結合部位は、例えば異常プリオンが有するβ−シートとβ−シートとの間に嵌り得る構造を有するものなどが好適である。
【0017】
指標試薬としては、好ましいものの1つとしてフェロセニルナフタレンジイミド(Ferrocenyl Naphthalene Diimide、以下FNDとも示す)誘導体が例示される。FND誘導体は、多環式化合物であるナフタレンジイミドに有機化合物系の酸化還元活性化合物であるフェロセンを結合させた化合物群である。必ずしも明確ではないが、FND誘導体と異常プリオンとは疎水的な作用により相互に吸着しやすい性質を示すものと推測される。上記のように、異常プリオンを捕捉電極とFND誘導体に代表される指標試薬を用いることにより、精度よく異常プリオンを検出することができる。
【0018】
FND誘導体として好ましくは一般式(2)で示される化合物が例示される。
【0019】
【化4】

【0020】
一般式(2)においてR1およびR2は同一でも異なっていてもよい。R1およびR2は、一般式(3)〜(9)からなる群より選ばれるFND誘導体が好適である。
【0021】
【化5】

【0022】
【化6】

【0023】
【化7】

【0024】
【化8】

【0025】
【化9】

【0026】
【化10】

【0027】
【化11】

【0028】
【化12】

【0029】
一般式(3)〜(9)においてFcはフェロセン(式(10))を表す。また、指標試薬としてさらに好ましくは、R1およびR2が共に一般式(6)で示される一般式(2)のFND誘導体が挙げられる。R1およびR2が共に一般式(6)で示される一般式(2)のFND誘導体は式(1)で示される化合物である。FND誘導体は1種を単独で用いてもよいし、また複数種を混合して用いてもよい。
【0030】
また、さらに他の好ましい指標試薬としては、下記式(11)から(14)に示される化合物および図1−4に記載の化合物などが例示される。図1−4の指標試薬は異常プリオン結合部42aとリンカー部42bと電気化学的活性部位43cから構成された複合体である。異常プリオン結合部42aにはペプチド鎖またはヌクレオチド鎖などを異常プリオンと結合・吸着する性質の化合物を用い得る。異常プリオン結合部に用い得るペプチドとしては、例えばPrP106-126(プリオンタンパク質アミノ酸配列における106番目のアミノ酸残基から126番目のアミノ酸残基までのアミノ酸配列からなるポリペプチド断片)などが、ヌクレオチドとしては、例えば異常プリオンを認識するアプタマーなどが挙げられる。電気化学的活性部位としては例えばフェロセンを備える化合物などを用い得る。
【0031】
【化13】

【0032】
【化14】

【0033】
【化15】

【0034】
【化16】

【0035】
【化17】

【0036】
指標付着工程においては、指標試薬溶液を異常プリオン捕捉電極に浸漬させる。異常プリオン捕捉電極の浸漬は、指標試薬溶液が異常プリオン捕捉電極の表面に十分浸みわたる程度で足りるが、より好ましくは容器に貯めた指標溶液中に電極を挿入して浸漬する形態が採用され得る。
【0037】
指標溶液中の指標試薬の濃度は、指標試薬等の条件に応じて適宜調整してよい。調整の幅としてはサブmMレベルから数百mM程度までが例示される。FND誘導体などの場合、約1mM程度が例示される。
【0038】
測定工程では、異常プリオン捕捉電極を電解質溶液に浸漬して電気化学的応答を測定する。電気化学的な応答の測定は、指標試薬の量に応じて生じる電気化学的な変化を把握できるものであれば特に限定はなく、各種の電気化学的な分析手法を採用することができる。電気化学的な応答の測定としては、異常プリオン受容体を固定した電極を用いる場合、好ましくはCV(サイクリックボルタンメトリ)測定法、DPV(ディファレンシャルパルスボルタンメトリ)測定法、SWV(方型波ボルタンメトリー)測定法、交流インピーダンス法などが例示される。電極の浸漬は、電気的応答を測定可能な程度に異常プリオン捕捉電極の表面を十分覆う程度で足りるが、好ましくは容器に貯めた指標溶液中に電極を挿入して浸漬する形態が採用され得る。また、電解質溶液は、電解質が溶解した溶液であえれば特段限定されないが、好ましい例としては、リン酸緩衝液、トリス緩衝液などが挙げられる。
【0039】
指標試薬を用いる形態においては、各工程は少なくとも1回実施され、また検体付着工程の後に少なくとも1回は測定工程は実施する。各工程の順序は、好ましくは、i)検体付着工程、ii)指標付着工程、iii)測定工程の順に行うことが好ましい。
【0040】
また、他の好ましい形態としては、i)指標付着工程、ii)測定工程、iii)検体付着工程、iv)指標付着工程、v)測定工程の順に実施する形態が挙げられる。異常プリオン受容体は異常プリオンに選択性を有するものが好適であるが、異常プリオン受容体としてのプリオンにFND誘導体が吸着する場合もあり得る。そこで、指標付着工程を先に実施しておき、予め異常プリオン受容体が吸着する容量のFND誘導体を吸着させておき、そのときの電気化学的な応答を測定しておく。そして、検体溶液に異常プリオン捕捉電極を浸漬し、再度FND誘導体を付着させてから電気化学的な応答を再度測定し、再度の測定値から1回目の測定値を引く。このように電気的応答を検体付着の前後で行い電気的応答を測定することにより、異常プリオンが存在しない検体である場合と、電極の不具合などにより異常プリオンが捕捉できなかった場合とを区別することができる。
【0041】
1−2.ACインピーダンスを測定する検出方法
次に、本発明の他の実施形態として、ACインピーダンスを測定する検出方法について説明する。ACインピーダンスを測定する形態では、検体付着工程と測定工程とが含まれる。
【0042】
ACインピーダンスを測定する形態では、異常プリオン捕捉電極として、好ましくはシリカおよび/またはタングステン酸を含む被覆層を表面に備える電極が用いられる。これらの材料で電極表面をコーティングすることにより異常プリオンと相互作用しやすい電極とすることができる。
【0043】
異常プリオンが検体溶液に含まれていると、異常プリオンが異常プリオン捕捉電極に付着し、電解質溶液のACインピーダンスが上昇する現象を生じる。ACインピーダンスの変化を測定することにより異常プリオンを検出することができる。
【0044】
ACインピーダンスを測定する工程の場合、検体付着工程および測定工程を同時期に行い経時的な変化を測定してもよいし、また検体付着工程の前に電解質溶液のACインピーダンスを測定しておき、検体付着工程により検体を異常プリオン捕捉電極に付着させ、その後再度電解質溶液に浸漬させてACインピーダンスを測定して、検体付着工程の前後でのACインピーダンスの測定値の相違から異常プリオンを検出するようにしてもよい。
【0045】
電解質溶液など他の条件は、溶液試料についてACインピーダンスを測定する場合の定法により適宜調整してよい。例えば、リン酸緩衝液、トリス緩衝液など、電極等を用いて電気化学的変化を測定するために通常用いられるものを採用し得る。
【0046】
上記のように本発明の電気化学的な検出方法は、従来のように抗体を用いた前処理等を要せずとも、感度良く測定可能である。しかしながら、抗体を用いた従来の方法と本発明の電気化学的な検出方法とを組み合わせて実施し、さらにBSE検査の精度を向上させることも可能である。
【0047】
2.本発明の検出キットおよび指標試薬
本発明は、上記本発明の検出方法において好適に用いられる検出キットおよび指標試薬をも提供する。
【0048】
本発明の検出キットは、1つの実施形態としては、異常プリオンに吸着しかつ電気化学的に検出可能な指標試薬と、異常プリオンを捕捉する異常プリオン受容体が固定された異常プリオン捕捉電極とを備える。また、他の実施形態としては、シリカおよび/またはタングステン酸を含む被覆層を表面に備える異常プリオン捕捉電極を備える異常プリオンの検出キットが例示される。
【0049】
指標試薬および異常プリオン捕捉電極についての詳細は、上記「1.本発明の検出方法」において説明したとおりである。また、本発明の検出キットには、本発明の検出方法を実施するために好適な他の部材、試薬類をさらに追加してもよい。例えば、異常プリオン捕捉電極の他に、電気化学的な測定に用いる対極、参照電極などの他の電極、電解質溶液、これに添加する緩衝剤など、電気化学的測定において用いられるものなどが例示される。また、異常プリオン捕捉電極を支持基盤などに固定した検出チップなどの形態をとることもできる。
【0050】
本発明の異常プリオン検出用試薬はFND誘導体からなる。FND誘導体の詳細は上記「1.本発明の検出方法」において説明したとおりである。
【0051】
3.具体的な実施形態
次に、図1〜3と共に本発明の実施形態についてより具体的に説明する。図1から3は本発明の実施形態を模式的に示したものである。
【0052】
図1−1、1−2、1−3に本発明の第1の実施形態を示す。図1−1に異常プリオン捕捉電極1を示す。異常プリオン捕捉電極1には端子15が備えられ不図示の測定器に接続可能である。端子15はポリマー性の胴体に覆われている。また、異常プリオン捕捉電極1の他方の端部には作用端16が設けられている。作用端16は、電気化学的な変化の受信部位であり、グラシーカーボンや金など電極の受信部位に用いられる材料の表面に、異常プリオン受容体(抗体20など)が固定されている(図1−2など)。異常プリオン捕捉電極10を検体溶液に浸漬させると、異常プリオン30が抗体20に結合する。図1から3において異常プリオン30は模式的にU字型で示している。これは異常プリオンの特徴部であるβ−シート構造をイメージして描いたものである。
【0053】
本発明の検出方法の検出感度が優れる理由の1つとして、必ずしも明確ではないが、次のような現象が推測される。図1−2に示すように、異常プリオン分子同士は相互に凝集しやすい傾向がある。そのため、抗体20に1つの異常プリオン30の分子が結合すると、その異常プリオン(30)分子の周りに他の異常プリオン(30)分子が凝集しやすいため(図1−2)、本発明の検出方法は検出感度が優れるものと推測される。また、異常プリオン捕捉電極10の表面において、異常プリオン受容体20以外の露出部に、マスキング剤によるコーティングを施すことにより、より感度を向上させることもできる。マスキング剤としては、金電極を利用する場合には、例えばメルカプトアルカノール(メルカプトエタノール、メルカプトヘキサノール、メルカプトオクタノール)、ポリエチレングリコールを有するアルカンチオールなどが好適である。また、グラシーカーボン電極の場合には表面を酸化してカルボン酸にしてもよく、その場合アミノ基を末端に有するポリエチレングリコールなどがマスキング剤として好適である。
【0054】
検体溶液に浸漬した後、緩衝溶液をもちいて異常プリオン捕捉電極10の表面を軽く洗浄し、抗体20に捕捉された異常プリオン30以外の余剰物質を除去する。次に、FND誘導体40を含む溶液に異常プリオン捕捉電極を浸漬させる。FND誘導体40は、異常プリオン30に吸着する(図1−3)。必ずしも明確ではないが、FND誘導体は異常プリオンを構成するβ―シート同士の間隙に挟み込まれるようにして吸着されるものと推測される。
【0055】
FND誘導体40を付着させた後、電気化学的な応答を測定し、異常プリオン30の有無による電気化学的な測定値の相違から異常プリオンを検出する。
【0056】
指標試薬の他の実施形態として、例えば図1−4に示す形態の指標試薬が挙げられる。図1−4の指標試薬は異常プリオン結合部42aとリンカー部42bと電気化学的活性部位43cから構成された複合体である。より具体的な例としては、図1−5に示す指標試薬を用い得る。図1−5に示す指標試薬は、異常プリオン結合部42dとしてペプチド鎖(例えばPrP106-126など)またはヌクレオチド(例えば異常プリオンを認識するアプタマーなど)と、リンカー42bとフェロセン(Fc)とを備える化合物である。
【0057】
次に本発明の第2の実施形態について、図2と共に説明する。上記第1の実施形態と同じ構成には同じ符号を付け、その説明は省略する。
【0058】
第2の実施形態では、異常プリオン捕捉電極11に、結合子21を介して正常プリオン25が固定されている。正常プリオン25は異常プリオン受容体として機能し、正常プリオン25に異常プリオン30が付着または結合し、異常プリオン30にFND誘導体40が吸着する。吸着したFND誘導体40の量に応じた電気化学的な応答の相違により異常プリオン30を検出する。
【0059】
第3の実施形態について、図3−1および3―2と共に説明する。第3の実施形態では、上記第1の実施形態と同じ構成には同じ符号を付け、その説明は省略する。第3の実施形態では、異常プリオン捕捉電極として、シリコンを表面にコーティングした異常プリオン捕捉電極12を用いる。異常プリオン捕捉電極12を検体溶液に浸漬させると、異常プリオン捕捉電極12の表面に異常プリオン30が付着する。異常プリオン30が付着することにより陰イオン分子41の移動が阻害され、ACインピーダンスは上昇する。すなわち、ACインピーダンスの変化により、異常プリオンを検出することができる。なお、本実施形態では陰イオン分子41の移動を検知しているが、電気化学的変化として検知可能なものであれば陽イオンであっても中性の分子であってもよい。
【実施例】
【0060】
以下、本発明について実施例を示しより詳細に説明するが、本発明が下記の実施例に限定されるものではない。
【0061】
1.PrP106-126の合成
プリオンタンパク質アミノ酸配列における106番目のアミノ酸残基から126番目のアミノ酸残基までのアミノ酸配列からなるポリペプチド断片PrP106-126をPrPScのモデルとして用いることとした。PrPScフラグメントペプチドであるPrP106-126は、次のようにして合成した。当該配列を配列表の配列番号1に示す。なお、アミノ酸残基の番号は翻訳開始点のメチオニンを1番目と数える。また、プリオンタンパク質のアミノ酸配列は、例えば、PDB(米国 Protain Data Bank運営グループ RCSB: Research Collaboratory for Structural Bioinformaticsによるデータベース)において1DX1として参照可能である。
【0062】
PrP106-126は、ペプチド自動合成機(433A Applied Biosystems instrument)を用いて常法のFmoc固相ペプチド合成法によってペプチド鎖の伸長反応を行った。次に固相担体を取り出してスクリュー管に移し、Cleavage cocktail(TFA : EDT : water : TIS = 92.5 : 2.5 : 2.5 : 2.5 (v/v/v/v))を注ぎ室温で2時間撹拌して固相担体からのペプチドの切り出しおよび脱保護を行った。得られた粗ペプチドは逆相HPLCによる精製、MALDI-TOF-MASSによる同定を行った。
【0063】
合成したペプチド鎖は次の通りである。
配列番号1;H-Lys-Thr-Asn-Met-Lys-His-Met-Ala-Gly-Ala-Ala-Ala-Ala-Gly-Ala-Val-Val-Gly-Gly-Leu-Gly-OH
【0064】
2.PrP106-126のβ化によるPrPScの作製
上記「1.」のようにして得られたペプチドを50 mM potassium phosphate buffer (pH 7.4)に溶かして濃度を20μMとした。ロータリーシェーカーでゆっくりと振倒させながら(85回/min.)37℃でインキュベーションした。4日後、ペプチド溶液中に糸状の浮遊物が確認できた。この溶液を超音波照射して、β化されたPrP106-126を含む検体溶液とした。
【0065】
3.PrPSc受容体(PrP121-231)の金電極への固定化
PrPSc捕捉する分子としてPrP121-231(mouse recombinant)を用いた。これを図4−1から図4−4に示す方法にしたがって金電極へ固定化した。具体的な実験操作は次の通りである。
【0066】
(A)まず、金電極を前処理し、bareな金表面を調整した(図4−1)。(B)次に、金電極を10 mM 11−メルカプトウンデカン酸エタノール溶液(11-mercaptoundecanoic acid EtOH溶液)に室温で1時間浸漬し、末端にカルボン酸を有する自己組織化膜(SAM)を形成させた(図4−2)。(C)さらに、100 mg/ml 水溶性カルボジイミド塩酸塩水溶液と100 mg/ml 無水コハク酸イミド水溶液を等量ずつ混合した溶液に、上記(B)で作製した電極を室温で30 min.浸漬させ、末端カルボン酸を活性エステル化した(図4−3)。(D)0.15 mg/ml PrP121-231 mouse recombinant PBS buffer(pH 7.0)溶液を上記(C)の電極に添加し、加湿容器中、5℃で終夜静置し、PrP121-231 mouse recombinantのリジン側鎖アミノ基を介して共有結合により金電極に固定化した(図4−4)。
【0067】
4.PrP121-231固定化電極の評価
金電極の化学修飾情報(PrP121-231の固定化確認)を得ることを目的として、PrP121-231固定化前後におけるCyclic Voltanmetry測定を行った。すなわち、上記「3.」で作製した電極を用い、測定溶液として100 mM potassium phosphate buffer, 100 mM KCl, 5 mM [Fe(CN)6]4-/3-を用いてCV測定を行った。
【0068】
その結果を図5−1、図5−2に示す。図5−1は(A)、(B)および(D)全てのステップにおけるサイクリックボルタモグラムを、図5−2はそれを拡大したものを示す。金電極の修飾と共にフェリシアン/フェロシアンイオンに由来する酸化還元波の減少が見られる。これはステップ(B)および(D)によって金電極が化合物で被覆されフェリシアン/フェロシアンイオンの電極への拡散が阻害されたものであると考えられる。さらに右図を見るとステップ(D)の方がステップ(B)よりも減少の度合いが大きい。これはサイズの大きな蛋白質が金電極へ固定化され、よりフェリシアン/フェロシアンイオンの電極への拡散が阻害されたものであると考えられ、この結果よりPrP121-231は金電極へ固定化されていることが示された。
【0069】
5.PrP121-231固定化電極を用いたPrPScの電気化学的検出
化学合成したPrPScモデルペプチドPrP106-126を検体としてPrPScの電気化学的検出実験を行った。図6に示す操作手順によりDPV測定を行った。また、電解セルは図7に示す三電極系を用いた。電極(Electrode)およびバッファーは次の通りである。また、検出器として電気化学装置 ALS/chi Electrochemical Analyzer Model 650A(BAS社製)を用いた。
Working Electrode (WE): Au
Reference Electrode (RE): Ag/AgCl
Counter Electrode (CE): Pt
Buffer:
100 mM Potassium Phosphate buffer pH 7.4
100 mM KCl
【0070】
上記「3.」に従って作製した三本の電極X、Y、Zを用意し(Electrode X, Y, Z)について同様の操作を行った。結果を図8に示した。いずれのボルタモグラムにおいてフェロセンの酸化反応に由来する酸化電流ピークが0.4 V付近に見られた。さらに、PrP106-126溶液浸漬後のDPV(ii)ではいずれの電極においてもDPV(i)のピーク電流値よりも増加する結果となった。これはPrP106-126が金電極へ捕捉されたことにより、より多くのFNDが金電極へ濃縮された効果であると考えられる。この結果は、PrPScの電気化学的検出が可能であることを示している。
【0071】
ここで、DPV(ii)の電流値がDPV(i)より大きくなった原因として、前述したことが起きているのではなく、単にFND溶液に二回浸漬させたことが原因とも考えられる。そこで、ネガティブコントロールとしてDPV(i)を測定した後、PrP溶液に電極を浸漬させることなくそのまま二回目のFND溶液へ浸漬させてDPV(ii)の測定を行った。測定は電極X’およびY’の2本を用意した。
【0072】
測定結果を図8に示した。この実験からはPrP溶液に浸漬させた時のような有意の電流値増加は見られなかった。電極Y’では逆に電流値の減少が見られた。一回目に過剰に濃縮されていたFNDの量が二回目の洗浄操作によって減少した為であると考えられる。以上のことより,図9のシグナルは、PrPが電極に濃縮され、これにFNDが結合することにより電気化学的応答が出ていることを示している。(ここでの電気化学的シグナルは,PrP特異的である)。
【0073】
6.ACインピーダンス(AC Impedance)測定によるPrPScの電気化学的検出
ACインピーダンス測定により電極界面の電気化学反応抵抗を簡便に求めることができる。インピーダンス測定で得られて結果はNyquist Plotで図示される。図10に典型的なNyquist Plot(複素平面表示)を示した。インピーダンス(Z)は、Z=Z’+jZ”で示される。図10は実数成分Z’をx軸に、虚数成分Z”をy軸として示した図である。図10において、半円部の頂点が−Z”=Rs+Rct/2となる点である。図10の半円の半径から電極界面の電気化学反応抵抗(Rct)を算出することができる。
【0074】
PrPScは自発的に凝集する性質を有している。この性質を利用してPrPScを電極上で凝集させた時、電極界面にPrPScが堆積する。これは電荷移動抵抗の増加を引き起こすと考えられる。したがってPrPScの電極界面への体積に伴うイオン移動抵抗をACインピーダンス測定により求めることでPrPScの検出が可能であると考えられる。ここで、電極上でPrPScが凝集した場合、イオン移動抵抗が増加することが予測される。
【0075】
上記の予測を検証するために以下の実験を行った。
1)グラッシーカーボン電極(以下GC電極)をアルミナペーストにより研磨した。
2)GC電極を超純水中でsonication(10 min. 2回)した。
3)電解質溶液中でACインピーダンス測定した。
4)GC電極を洗浄後、20μM PrP106-126溶液中に浸漬し、1時間静置した。
5)上記3)と同条件でACインピーダンス測定した。
6)ACインピーダンスは電気化学装置 ALS/chi Electrochemical Analyzer Model 650A(BAS社製)を用いて測定した。
【0076】
測定条件は次の通りである。
作用極(作用端)(WE): グラッシーカーボン電極
参照電極(RE): Ag/AgCl電極
対極(CE) : Pt
Init E:0.235 V
High Freq.:10000 Hz
Low Freq.:0.1 Hz
Amplitude:5 mV
Buffer:0.1 M Pottasium phosphate buffer (pH 7.4),0.1 M KCl,5 mM Fe[C/N]4-/3-
【0077】
測定結果を図11に示す。PrP106-126溶液に浸漬前(図11中Before PrP)と浸漬後(図11中After PrP)とを比較すると、上記の予測通り、PrPペプチドの電極上への凝集に伴う、電荷移動抵抗の増加が確認された。この減少はPrPに限った現象ではなく、他の蛋白質(例えばPrPC)も電極上へ疎水性相互作用により吸着し、同様の電荷移動抵抗の増加が確認されると考えられる。本手法によりPrPを検出する際には、選択性をより向上させるために、PrP固有の性質、すなわち、Proteinase K耐性や界面活性剤に対する耐性を利用することが好適であると考えられる。
【産業上の利用可能性】
【0078】
以上のように、本発明はBSEの検出に有用であり、牛肉の安全性確認などに寄与するものである。
【図面の簡単な説明】
【0079】
【図1−1】第1の実施形態の原理を模式的に示す図である。
【図1−2】第1の実施形態の原理を模式的に示す図である。
【図1−3】第1の実施形態の原理を模式的に示す図である。
【図1−4】指標試薬の他の実施形態を示す図である。
【図1−5】指標試薬の他の実施形態を示す図である。
【図2】第2の実施形態の原理を模式的に示す図である。
【図3−1】第3の実施形態の原理を模式的に示す図である。
【図3−2】第3の実施形態の原理を模式的に示す図である。
【図4−1】金電極表面にPrP121-231を固定化する処理の一部を模式的に示す図である。
【図4−2】金電極表面にPrP121-231を固定化する処理の一部を模式的に示す図である。
【図4−3】金電極表面にPrP121-231を固定化する処理の一部を模式的に示す図である。
【図4−4】金電極表面にPrP121-231を固定化する処理の一部を模式的に示す図である。
【図5−1】金修飾電極によるCV測定の結果を示す図である。
【図5−2】金修飾電極によるCV測定の結果を示す図である。
【図6】金修飾電極によるDPV測定の手順を示す図である。
【図7】DPV測定において用いた電解セルを示す図である。
【図8】DPV測定の結果を示す図である。
【図9】DPV測定の補助的実験の結果を示す図である。
【図10】ACインピーダンス測定から得たNyquist Plotの典型例を示す図である。
【図11】ACインピーダンス測定の結果を示す図である。
【符号の説明】
【0080】
10、11、12 異常プリオン捕捉電極
15 端子
16、17 作用端
WE 作用極
RE 参照電極
CE 対極
20 抗体(異常プリオン受容体)
21 結合子
25 正常プリオン(異常プリオン受容体)
30 異常プリオン
40 FND誘導体
41 陰イオン分子
42 指標試薬
42a 異常プリオン結合部
42b リンカー部
43c 電気化学的活性部位
43d ペプチド鎖またはヌクレオチド鎖
Fc フェロセン
50 電解質溶液
90 基板
【特許請求の範囲】
【請求項1】
異常プリオンを捕捉する異常プリオン捕捉電極を、検査の対象とする検体溶液に浸漬する検体付着工程と、
異常プリオンに吸着しかつ電気化学的に検出可能な指標試薬を含む指標溶液に異常プリオン捕捉電極を浸漬する指標付着工程と、
異常プリオン捕捉電極を電解質溶液に浸漬して電気化学的応答を測定する測定工程と、
を含む、異常プリオンの電気化学的検出方法。
【請求項2】
前記異常プリオン捕捉電極が、異常プリオンを捕捉する異常プリオン受容体が固定された電極である請求項1に記載の異常プリオンの電気化学的検出方法。
【請求項3】
前記異常プリオン受容体が、異常プリオンと結合する抗体、およびプリオンの一部または全部からなる群より選ばれる、請求項1または2に記載の異常プリオンの電気化学的検出方法。
【請求項4】
前記指標試薬がフェロセニルナフタレンジイミド誘導体である請求項1から3のいずれか一項に記載の異常プリオンの検出方法。
【請求項5】
前記フェロセニルナフタレンジイミド誘導体が一般式(1)で示される化合物である請求項4に記載の異常プリオンの検出方法。
【化1】

【請求項6】
シリカおよび/またはタングステン酸を含む被覆層を表面に備える異常プリオン捕捉電極を、検査の対象とする検体溶液に浸漬する検体付着工程と、
異常プリオン捕捉電極を電解質溶液に浸漬して電気化学的応答を測定する測定工程と、
を含む、異常プリオンの電気化学的検出方法。
【請求項7】
異常プリオンに吸着しかつ電気化学的に検出可能な指標試薬と、異常プリオンを捕捉する異常プリオン受容体が固定された異常プリオン捕捉電極とを備える異常プリオンの検出キット。
【請求項8】
前記指標試薬がフェロセニルナフタレンジイミド誘導体である請求項7に記載の異常プリオン検出キット。
【請求項9】
前記フェロセニルナフタレンジイミド誘導体が一般式(1)で示される化合物である請求項8に記載の異常プリオンの検出キット。
【化2】

【請求項10】
前記異常プリオン受容体が、異常プリオンと結合する抗体、およびプリオンの一部または全部からなる群より選ばれる1種または2種以上である、請求項7から9のいずれか一項に記載の異常プリオンの検出キット。
【請求項11】
シリカおよび/またはタングステン酸を含む被覆層を表面に備える異常プリオン捕捉電極を備える異常プリオンの検出キット。
【請求項12】
異常プリオン結合部位と電気化学的活性部位とを有する化合物からなる異常プリオン検出試薬。
【請求項13】
フェロセニルナフタレンジイミド誘導体からなる異常プリオン検出用指標試薬。
【請求項14】
前記フェロセニルナフタレンジイミド誘導体が一般式(1)で示される化合物である請求項12に記載の異常プリオン検出用指標試薬。
【化3】

【請求項1】
異常プリオンを捕捉する異常プリオン捕捉電極を、検査の対象とする検体溶液に浸漬する検体付着工程と、
異常プリオンに吸着しかつ電気化学的に検出可能な指標試薬を含む指標溶液に異常プリオン捕捉電極を浸漬する指標付着工程と、
異常プリオン捕捉電極を電解質溶液に浸漬して電気化学的応答を測定する測定工程と、
を含む、異常プリオンの電気化学的検出方法。
【請求項2】
前記異常プリオン捕捉電極が、異常プリオンを捕捉する異常プリオン受容体が固定された電極である請求項1に記載の異常プリオンの電気化学的検出方法。
【請求項3】
前記異常プリオン受容体が、異常プリオンと結合する抗体、およびプリオンの一部または全部からなる群より選ばれる、請求項1または2に記載の異常プリオンの電気化学的検出方法。
【請求項4】
前記指標試薬がフェロセニルナフタレンジイミド誘導体である請求項1から3のいずれか一項に記載の異常プリオンの検出方法。
【請求項5】
前記フェロセニルナフタレンジイミド誘導体が一般式(1)で示される化合物である請求項4に記載の異常プリオンの検出方法。
【化1】

【請求項6】
シリカおよび/またはタングステン酸を含む被覆層を表面に備える異常プリオン捕捉電極を、検査の対象とする検体溶液に浸漬する検体付着工程と、
異常プリオン捕捉電極を電解質溶液に浸漬して電気化学的応答を測定する測定工程と、
を含む、異常プリオンの電気化学的検出方法。
【請求項7】
異常プリオンに吸着しかつ電気化学的に検出可能な指標試薬と、異常プリオンを捕捉する異常プリオン受容体が固定された異常プリオン捕捉電極とを備える異常プリオンの検出キット。
【請求項8】
前記指標試薬がフェロセニルナフタレンジイミド誘導体である請求項7に記載の異常プリオン検出キット。
【請求項9】
前記フェロセニルナフタレンジイミド誘導体が一般式(1)で示される化合物である請求項8に記載の異常プリオンの検出キット。
【化2】

【請求項10】
前記異常プリオン受容体が、異常プリオンと結合する抗体、およびプリオンの一部または全部からなる群より選ばれる1種または2種以上である、請求項7から9のいずれか一項に記載の異常プリオンの検出キット。
【請求項11】
シリカおよび/またはタングステン酸を含む被覆層を表面に備える異常プリオン捕捉電極を備える異常プリオンの検出キット。
【請求項12】
異常プリオン結合部位と電気化学的活性部位とを有する化合物からなる異常プリオン検出試薬。
【請求項13】
フェロセニルナフタレンジイミド誘導体からなる異常プリオン検出用指標試薬。
【請求項14】
前記フェロセニルナフタレンジイミド誘導体が一般式(1)で示される化合物である請求項12に記載の異常プリオン検出用指標試薬。
【化3】

【図1−1】


【図1−2】


【図1−3】


【図1−4】


【図1−5】


【図2】


【図3−1】


【図3−2】


【図4−1】


【図4−2】


【図4−3】


【図4−4】


【図5−1】


【図5−2】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図1−2】


【図1−3】


【図1−4】


【図1−5】


【図2】


【図3−1】


【図3−2】


【図4−1】


【図4−2】


【図4−3】


【図4−4】


【図5−1】


【図5−2】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公開番号】特開2006−98342(P2006−98342A)
【公開日】平成18年4月13日(2006.4.13)
【国際特許分類】
【出願番号】特願2004−287562(P2004−287562)
【出願日】平成16年9月30日(2004.9.30)
【出願人】(504145342)国立大学法人九州大学 (960)
【出願人】(504157024)国立大学法人東北大学 (2,297)
【Fターム(参考)】
【公開日】平成18年4月13日(2006.4.13)
【国際特許分類】
【出願日】平成16年9月30日(2004.9.30)
【出願人】(504145342)国立大学法人九州大学 (960)
【出願人】(504157024)国立大学法人東北大学 (2,297)
【Fターム(参考)】
[ Back to top ]

