異常型プリオンの検出方法
【課題】 従前の方法に比して迅速に異常型プリオンを検出することのできる方法を提供すること。
【解決手段】 本発明の方法は、異常型プリオンを含むか否かが検査されるべき被検試料と、蛍光標識された正常型プリオンとを混合して、その被検試料溶液を異常型プリオンが正常型プリオンを異常型プリオンへ転換する反応条件に曝す。その後、被検試料溶液中の蛍光標識された正常型プリオンに付加された蛍光標識の蛍光強度を測定し、その蛍光強度に基づいて蛍光標識された正常型プリオンが被検試料溶液中に於いて単独で存在しているか又は凝集体に組み込まれているかを判定する。蛍光標識された正常型プリオンが凝集体に組み込まれていると判定されたときには、被検試料に異常型プリオンが含まれていたと判定する。
【解決手段】 本発明の方法は、異常型プリオンを含むか否かが検査されるべき被検試料と、蛍光標識された正常型プリオンとを混合して、その被検試料溶液を異常型プリオンが正常型プリオンを異常型プリオンへ転換する反応条件に曝す。その後、被検試料溶液中の蛍光標識された正常型プリオンに付加された蛍光標識の蛍光強度を測定し、その蛍光強度に基づいて蛍光標識された正常型プリオンが被検試料溶液中に於いて単独で存在しているか又は凝集体に組み込まれているかを判定する。蛍光標識された正常型プリオンが凝集体に組み込まれていると判定されたときには、被検試料に異常型プリオンが含まれていたと判定する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、異常型プリオンを検出する方法に係り、より詳細には、蛍光測定により異常型プリオンの存在を検出して、任意の生体試料又は生体由来の試料中に異常型プリオンが含まれているか否かを判定する方法に係る。
【背景技術】
【0002】
異常型プリオンは、動物(哺乳類)の脳がスポンジ状になる牛海綿状脳症(BSE)、クロイツフェルトヤコブ病(CJD)などのプリオン病(伝染性(伝達性)海綿状脳症)に於いて、そのスポンジ状になった組織に観察される凝集性(凝集体を形成する)タンパク質である。プリオン病発症のメカニズムについて、現在最も有力な「プリオン仮説」によれば、異常型プリオン自体が、プリオン病の病原体であり、動物の体内に侵入して、脳又は中枢神経系の神経細胞に普通に存在する正常型のプリオン(分子量約3.3〜3.5万(33〜35kDa)の糖タンパク質)を次々に異常型プリオンに転換し、異常型へ転換されたプリオンが特定の部位に於いて徐々に凝集して蓄積し、脳に於いては、凝集したプリオンにより組織をスポンジ状に変化させる(プリオン病が発症する)と考えられている。実際、異常型プリオンと正常型プリオンとの混合物に対してインキュベーションと超音波による分散処理とを繰り返し施すことにより、正常型プリオンが徐々に異常型プリオンへ転換され、これにより、異常型プリオン(の量)が増幅されることが報告されている(異常型プリオンの増幅方法は、PMCA:Protein misfolding cyclic amplificationと称されている。例えば、非特許文献1、2参照)。また、異常型プリオンは、異常型プリオンに感染した動物由来の食物や移植組織、異常型プリオンに感染した動物の体液等で汚染された医療器具などを通じて、別の動物個体の体内へ侵入し、これによりプリオン病を発症する伝染性を有すると考えられており、従って、プリオン病の蔓延を防止するため、異常型プリオン又はそのキャリアを早期に発見し(例えば、BSE問題に於ける食用牛の全頭検査など)、異常型プリオンの別の動物個体への伝達経路を遮断してプリオン病の感染を阻止することが試みられている。
【0003】
上記の如き目的を達成すべく異常型プリオンの検出を行う場合、現在のところ、一般的には、抗原抗体反応を利用した方法が採用されている。例えば、食肉牛の全頭検査などに於いては、ELISA(固相酵素免疫検定法。例えば、特許文献1)やウェスタンブロット法(イムノブロット法。例えば、非特許文献3)などの伝統的な抗原抗体反応の検出方法に従って、動物の死亡後に脳、脊髄などの異常型プリオンの凝集体が多量に蓄積する部位から採取される組織試料標本に異常型プリオンを抗原とする抗体を与え、抗原抗体反応が発生するか否かを検出することにより、動物体内に異常型プリオンが存在していたか否か、即ち、その動物が異常型プリオンのキャリアであったか否かが判定される。また、近年、特定部位の組織を使用しない検出方法として、上記の非特許文献1、2では、動物の血液中に微量に存在する異常型プリオンをPMCAにより増幅した後、上記の如き抗原抗体反応による検出方法を用いることにより、血液などの生体試料中の微量の異常型プリオンの存否を確認する方法が報告されている。更に、上記の古典的な抗原抗体反応の検出方法に代えて、特許文献2では、異常型プリオンに対する抗体を蛍光標識し、かかる抗体と検査されるべき試料とを混合して、異常型プリオン(抗原)と抗体との抗原抗体反応が生じたか否かを蛍光相関分光法を用いて検出することにより、任意の試料中の異常型プリオンの存在を検出する方法が開示されている。
【0004】
上記の如き抗原抗体反応を用いずに異常型プリオンの検出に利用可能な方法としては、特許文献3に於いて、被検試料を直接に蛍光色素にて標識し、蛍光相関分光法により、被検試料中に凝集し沈着するタンパク質の存否を検出・判定する方法が提案されている(厳密に言えば、この方法は、異常型プリオンを検出するのではなく、被検試料中のタンパク質が凝集する性質を有しているか否かを判定する方法である。)。
【特許文献1】米国特許第4806627号公報明細書
【特許文献2】特開2005−345311公報
【特許文献3】特表2001−517800公報
【非特許文献1】サボリオ等外2名、ネイチャー 411巻 810−813頁、2001年
【非特許文献2】サア等外2名、サイエンス 313巻 92−94頁、2006年
【非特許文献3】バリー及びプルシナー、ジャーナル・オブ・インフェクシャス・ディゼィーズ 154巻 518−521頁、1986年
【非特許文献4】リー等 ゲノム・リサーチ(Genome Res.) 1998年 8巻 1022−1037頁
【非特許文献5】パン等外2名 プロテイン・サイエンス(Protein Sci.)1992年 1巻 1343−1352頁
【発明の開示】
【発明が解決しようとする課題】
【0005】
異常型プリオンの検出を、研究室レベルの規模ではなく大規模に実施する場合、例えば、臨床診断のために行う場合或いは食肉用牛の全頭検査などの多数の検体を検査する場合などでは、検出方法は、精度が良いだけでなく、個々の検体の検査がより迅速に実施できることが望ましい。しかしながら、現在利用されている上記の如き抗原抗体反応による古典的な検出方法の場合、処理操作が多く、検査結果が得られるまでに時間がかかる。
【0006】
また、従前の抗原抗体反応を利用した方法により十分な精度にて検出対象物質の存否を検出するためには、一般に、被検試料中に相当量の検出対象物質が含有していることを要するので、異常型プリオンを検出する場合にも、相当に高い含有量にて異常型プリオンを含む試料を準備する必要がある。この点に関し、正常型プリオンと異常型プリオンについては、両者を精度よく区別して認識する抗体を作成することは困難であり、上記の如き抗原抗体反応を用いた検査方法により異常型プリオンを検出しようとする場合、実際には、抗原抗体反応を起こさせる前に(被検試料に抗体を作用させる前に)、被検試料中の正常型プリオンをプロテアーゼKやその他の薬剤により正常型プリオンを除去するといった処理が必要となっている。その場合、被検試料から正常型プリオンを除去する処理する間に、相当量の異常型プリオンを損失してしまう可能性があり、従って、精度よく検査を実行するためには、被検試料の処理操作で損失する分を見越して、(通常の物質の抗原抗体反応による検出方法の場合よりも)多量の異常型プリオンを含む被検試料を準備する必要がある。上記の特許文献3の方法の場合には、抗原抗体反応を用いていないが、被検試料又は凝集性の有無を判定されるべき対象物質を直接に蛍光色素にて標識するという処理操作を要し、かかる処理操作中に相当量の検査対象物質が損失してしまう可能性がある。
【0007】
かくして、現在利用可能な異常型プリオンの検出方法は、多くの処理操作と長い処理時間を要するとともに、相当量の検査対象物質、即ち、異常型プリオンを含む被検試料でなければ、信頼性のある検出結果を得ることが困難となっている。もし従前より短時間に、試料中の異常型プリオンの含有量が微量でも異常型プリオンを検出できる方法があれば、異常型プリオンの検出を大規模に実施する場合に非常に有利であろう。
【0008】
かくして、本発明の一つの課題は、異常型プリオンの検出方法であって、抗原抗体反応を用いずに従前に比して極めて迅速に異常型プリオンを検出することのできる方法を提供することである。
【0009】
また、本発明のもう一つの課題は、異常型プリオンの存否が検出又は判定されるべき被検試料の処理をできるだけ少なくして処理中に検出対象である異常型プリオンを損失してしまう危険性を低減し、或いはまた、異常型プリオンの含有量が微量であっても異常型プリオンを検出することのできる方法を提供することである。
【0010】
また、本発明の更にもう一つの課題は、上記の如き異常型プリオンの検出方法であって、蛍光測定・分析を用いて異常型プリオンを検出する方法を提供することである。
【課題を解決するための手段】
【0011】
本発明によれば、抗原抗体反応を用いずに、被検試料中の異常型プリオンが微量であっても、有利に異常型プリオンを検出することのできる方法が提供される。本発明の異常型プリオンの検出方法は、異常型プリオンを含むか否かが検査されるべき被検試料と、蛍光標識された正常型プリオンとを混合して被検試料溶液を調製する過程と、被検試料溶液を異常型プリオンが正常型プリオンを異常型プリオンへ転換する反応条件に曝す過程と、かかる反応条件に曝された被検試料溶液中の蛍光標識された正常型プリオンに付加された蛍光標識の蛍光強度を測定する過程と、その蛍光強度に基づいて蛍光標識された正常型プリオンが被検試料溶液中に於いて単独で存在しているか又は凝集体に組み込まれているかを判定する過程とを含む。そして、蛍光標識された正常型プリオンが凝集体に組み込まれていると判定されたときには、被検試料に蛍光標識された正常型プリオンを異常型プリオンへ転換する異常型プリオンが含まれていたと判定する。
【0012】
上記の本発明の構成によれば、まず、異常型プリオンを含むか否かが検査されるべき被検試料と蛍光標識された正常型プリオンとが混合され、その混合物(被検試料溶液)が異常型プリオンへ転換する反応条件に曝される。前記のプリオン仮説に於いて又は非特許文献1に於いて示されている如く、もし被検試料に異常型プリオンが含まれていれば、正常型プリオンが異常型プリオンへ転換され、異常型プリオンの凝集体が形成されることとなるので、異常型プリオンと混合される前、単独に運動していた蛍光標識された正常型プリオン分子も、異常型プリオンとの混合後、(蛍光標識された)異常型プリオンとなり、凝集体に組み込まれる。
【0013】
蛍光標識された正常型であったプリオン分子が異常型に変換され凝集体に組み込まれた否かは、その分子に付加された蛍光標識の蛍光強度を通じて判定することができる。当業者にとって理解される如く、或るタンパク質などの分子に蛍光標識を付加しておけば、その分子の構造、大きさ、運動の変化が蛍光標識の蛍光強度に基づいて検出できる。本発明の場合、単分子として運動していたプリオン分子が凝集体に組み込まれ、凝集体と一体的に運動することとなるので、かかる状態の変化に伴う運動の変化がプリオン分子に付加された蛍光標識の蛍光強度の種々の挙動(揺らぎ)の変化に反映され、かくして、正常型プリオン分子が異常型プリオン分子に転換されたか否か、即ち、被検試料に異常型プリオン分子が存在していたか否かが判定されることとなる。要するに、本発明は、正常型プリオンに異常型プリオンが混合されると、正常型プリオンが異常型プリオンへ転換され、異常型プリオンの凝集体に組み込まれることとなるという異常型プリオン独特の活性を蛍光測定により検出し、これにより異常型プリオンの存否を検出するというものである。
【0014】
非特許文献1、2に於いて示されている如く、プリオン病に感染した動物の組織又は体液に異常型プリオンが存在する場合には、所定の条件に於いて、in vitroの系でも、正常型プリオンが異常型プリオンへ転換することが分かっている。従って、上記の本発明の構成に於いて、被検試料としては、動物より採取された動物の組織又は体液であってよい。特に、非特許文献2の知見によれば、プリオン病に感染した動物の血液に微量に存在する異常型プリオンにより、in vitroの系で正常型プリオンから異常型プリオンへ転換反応が生ずることが見出されており、従って、本発明の方法に於いて、典型的には、かかる動物の組織又は体液試料は、採取が容易な動物の血液又はその一部の成分が有利に用いられる。また、正常型プリオンから異常型プリオンへの転換反応は、正常型プリオンを含む動物の体液試料の存在下で進行することが確かめられている。従って、例えば、被検試料中に十分な正常型プリオンが存在しておらず、被検試料と蛍光標識されたプリオンだけでは転換反応が進まないと想定される場合には、正常型プリオンを含む動物の体液試料が被検試料溶液へ更に混合されることが好ましい。特に、正常型プリオンから異常型プリオンへの転換反応が進むよう添加される正常型プリオンを含む動物の体液試料は、プリオン病未感染の動物から採取された脳組織から調製された試料であってよい。ただし、被検試料と蛍光標識されたプリオンとの混合物でも転換反応が進むことが予備実験等で見出されている場合には、正常型プリオンを含む動物の体液試料若しくは脳組織から調製された試料を混合する必要はなく、そのような場合も本発明の範囲に属する。
【0015】
上記の方法の被検試料溶液を異常型プリオンが正常型プリオンを異常型プリオンへ転換する反応条件に曝す過程に於ける具体的な条件は、当業者により本発明の方法による検査の実施に先立って、予備実験等により見出すことができることは理解されるべきである。正常型プリオンから異常型プリオンへの転換反応の条件は、動物の種などによって変化する可能性があるが、異常型プリオンが含まれていることが分かっている試料標本を被検試料として用い、上記の本発明の方法の過程を実施することにより、正常型プリオンから異常型プリオンへの転換反応を起すための条件は、見出すことが可能である。なお、非特許文献1、2の知見によれば、典型的には、反応条件は、被検試料溶液を少なくとも30分間37℃にてインキュベーションすることである。
【0016】
上記の本発明の方法に於いて、蛍光標識されたプリオン分子の状態を観測するための蛍光強度の測定は、所謂「一分子蛍光分析技術」、即ち、蛍光一分子からの蛍光を測定し、その時間変化又は揺らぎを解析して蛍光一分子の状態又は運動を観測する蛍光分析法により有利に実行することができる。そのような一分子蛍光分析技術としては、蛍光相関分光法(Fluorescence Correlation Spectroscopy:FCS)、蛍光強度分布分析法(Fluorescence-Intensity Distribution Analysis:FIDA)、蛍光相互相関分光法(Fluorescence cross-correlation Spectroscopy:FCCS)など、レーザー共焦点顕微鏡の光学系に超高感度光検出装置を組み合わせた蛍光測定装置により実施されるいずれか任意のものであってよい(本発明の構成により各々の蛍光分析方法に於いて蛍光測定・分析の結果がどのようになるかは、実施の形態の説明の欄に於いて説明される。)。また、その他の分子の構造・状態・運動の変化を観測できる任意の蛍光分析法、例えば、蛍光偏光解消法(Fluorescence Depolarization Spectroscopy:FDS)などが用いられてもよい(この場合、一分子蛍光分析を実行する装置ではなく、通常の蛍光偏光解消測定装置であってもよい。)。理解されるべきことは、或る蛍光標識された分子(プリオン分子)が単独で運動しているのか又は凝集体を形成しているのかを検出できる蛍光分析方法であれば任意のものであってよく、そのような場合も本発明の範囲に属する。
【発明の効果】
【0017】
上記の説明から理解される如く、本発明は、正常型プリオンを蛍光標識したものをプローブとして用い、そのプローブが異常型プリオンに転換する現象を検出して、異常型プリオンの検出をするものであり、異常型プリオンの存在の検出のために抗原抗体反応を用いていない。従って、異常型プリオンと正常型プリオンとを精度よく区別して認識する抗体を産生する必要はなく、また、正常型プリオンを被検試料から除去する処理も必要としないので(本発明の場合、プリオンの正常型から異常型への転換反応を検出するので、被検試料中に正常型プリオンが存在している方が望ましい。)、従前の抗原抗体反応を用いた検出方法に於いて、異常型プリオンを特異的に認識する抗体の産生が困難であることに起因する種々の問題は、気にする必要がなくなる。
【0018】
また、本発明に於いては、蛍光標識された正常型プリオンを予め準備しておく必要があるが、個々の被検体の検査に於ける処理は、被検試料と蛍光標識された正常型プリオンとを混合し、蛍光標識された正常型プリオンが転換反応を起す条件に保持し、しかる後に蛍光測定を行うだけでよいので、従前に比して極めて短時間で完了することが可能である。正常型プリオンを被検試料から除去する処理や被検試料を蛍光標識する処理など、被検試料中の物質を化学的に改変する処理を行わなくてよいので、そのような処理中に被検試料中の検出対象である異常型プリオンを、処理操作中に損失してしまうこともなく、従って、そのような処理中に異常型プリオンが失われることにより検出結果が擬陰性となってしまうなどの問題が解消される。また、被検試料を化学的に改変する処理をすることなく、蛍光測定により蛍光標識された正常型プリオンが異常型プリオンへ転換する反応を検出する態様によれば、被検試料中に含まれている異常型プリオンは、従前に比して、極めて微量であってもよく、従って、動物の体液中に微量に含まれる異常型プリオンでもその存否が判定できることになる。即ち、被検試料として動物の脳、脊髄などの異常型プリオンが多量に蓄積した組織の採取や、PMCAによる異常型プリオンの増幅を行う必要はない。
【0019】
かくして、本発明によれば、微量又は少量の被検試料を用いて短時間に異常型プリオンの検出ができる。本発明は、被検試料が動物の血液等の低侵襲に採取可能な試料でよいので、プリオン病発症前(異常型プリオンが特定部位に蓄積する前)の早期の段階の異常型プリオンのキャリアの判定又は食肉牛の全頭検査など大規模な検査としての利用が期待される。
【0020】
本発明のその他の目的及び利点は、以下の本発明の好ましい実施形態の説明により明らかになるであろう。
【発明を実施するための最良の形態】
【0021】
以下に添付の図を参照しつつ、本発明を幾つかの好ましい実施形態について詳細に説明する。
【0022】
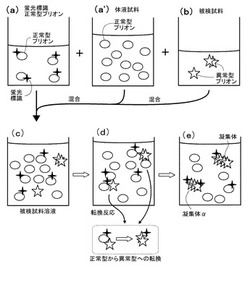
図1は、本発明の異常型プリオンを検出する方法の好ましい実施形態に於ける処理過程をフローチャートの形式で表したものであり、図2は、図1の処理に於いて想定される分子の状態の変化を模式的に示したものである。同図を参照して、本発明の方法による検査に於いては、まず、蛍光標識された正常型プリオンと被検試料とが混合され、被検試料溶液が調製される(ステップ10)。
【0023】
プローブとして用いられる蛍光標識された正常型プリオン(図2(a))は、予め、当業者にとって任意の公知の方法にてなされてよい(実施例の欄参照)。正常型プリオンは、典型的には、検査の対象となる動物と同種のプリオン病に未感染の動物の組織、例えば、脳、脊髄等から当業者にとって任意の公知の方法にて抽出されたものであってよい。また、正常型プリオンの蛍光標識は、例えば、正常型プリオンの調製後、プリオン中の特定の基を標的にしたケミカルラベリング法により、蛍光分子がプリオンに付加することにより為されてよい。蛍光色素としては、この分野で通常使われる任意の蛍光色素、例えば、TAMRA(carboxymethylrhodamine)、TMR(tetramethylrhodamine)、Alexa647、Rhodamine
Green、Alexa488などであってよいが、これらに限定されない。なお、後に説明する如く、蛍光測定をFIDAにて実行する場合には、個々のプリオン分子に付加される蛍光標識(蛍光色素分子)の数は揃っていることが望ましい。ケミカルラベリング法にて蛍光標識を行う場合、蛍光色素は、NHSエステル体、マレイミド体などの化学標識蛍光標識用の蛍光色素試薬が用いられてよい。また、可能であれば、蛍光標識された正常型プリオンの調製は、プリオンのcDNAを用い細胞内や無細胞タンパク合成系に於いて、より精度よく特定の基に蛍光色素が付加されるようタンパク質を生成するピンポイント蛍光標識技術やGFP等の蛍光タンパク質を融合させた正常型プリオンを調製する方法を用いて、蛍光色素が決められた数にて正常型プリオンに標識されるように為されてよい。また更に、後に説明する如く、蛍光測定をFCCSにて実行する場合には、別々の蛍光色素にて標識された正常型プリオンが、少なくとも2種類、上記と同様に準備される。蛍光標識された正常型プリオンは、変性しないように任意の方法で保存されてよく、その場合、検査の際に必要な量だけが使用されるようになっていてよい。
【0024】
被検試料、即ち、異常型プリオンが含有しているか否かが検査される試料(図2(b))は、異常型プリオンが含有している可能性のある物質、例えば、動物の脳、脊椎等の組織、血液、尿などの体液、食物、移植用組織等の任意のものであってよい。或る動物についてプリオン病に感染しているか否か、或いは、異常型プリオンのキャリアであるか否かを判定する場合には(プリオン病の早期診断)、その動物の血液であってよい。この点に関し、プリオンは血液を遠心分画して得られるバフィーコートに存在することが知られているので、血液を被検試料とする場合には、好適には、かかるバフィーコートのみ使用される。
【0025】
また、更に、被検試料溶液には、好適には、検査の対象となる動物と同種のプリオン病に未感染の動物の組織、例えば、脳、脊髄のホモジネート液等の(蛍光標識されていない)正常型プリオンを多量に含む生体から得られる体液試料(図2(a’))が混合される。厳密な理由は解明されていないが、異常型プリオンは、脳、脊髄のホモジネート液等の正常型プリオンを多量に含む体液中に於いて正常型プリオンを異常型プリオンに転換することが報告されている(例えば、非特許文献2)。そこで、被検試料と蛍光標識された正常型プリオンのみでは、転換反応が進行しないと想定される場合には、前記の如き正常型プリオンを多量に含む体液を更に追加して転換反応が進行する条件が成立されるようにしてよい。なお、被検試料のみでも転換反応が進行すると考えられる場合、或いは、蛍光標識された正常型プリオンが遺伝子組換えなどにより動物に発現した蛍光タンパク質融合プリオンであり、もし異常型プリオンが混入すれば、転換反応が進行すると考えられる場合には、(蛍光標識されていない)正常型プリオンを多量に含む体液は混合されなくてもよいであろう。
【0026】
かくして、ステップ10にて調製された被検試料溶液(図2(c))は、転換反応が進行する所定の条件に所定時間曝される(ステップ20)。PMCAについて記載する非特許文献1、2の知見によれば、動物がハムスターの場合、37℃にて30分程度インキュベーションすることにより、或る程度の正常型プリオンが異常型プリオンに転換され(図2(d))、小さな異常型プリオンの凝集体を形成することが見出されている(厳密なメカニズムは解明されていないが、そのままインキュベーションしただけでは、試料溶液中の正常型プリオンの全てが一気に異常型に転換されるのではなく、凝集体が大きくなると転換反応が遅くなると考えられている。)。なお、前記の転換反応を進行させる所定の条件及び所定時間は、当業者に於いて、異常型プリオンを含むことが分かっている被検試料を用いて、予備実験を行い、蛍光標識された正常型プリオンが異常型に転換される条件を見出すことにより決定できることは理解されるべきである。
【0027】
かくして、ステップ20に於いて、もし被検試料に異常型プリオンが含有していると、図2(e)に模式的に示されている如く、蛍光標識された正常型プリオンを含む正常型プリオンのいくつかが異常型プリオンに転換され、凝集体を形成することとなる。そして、被検試料との混合前に単独で運動していた蛍光標識された正常型プリオンが、凝集体に組み込まれると、プリオン分子に付加された蛍光標識のブラウン運動の状態が変化する。そこで、かかるプリオン分子の蛍光標識の運動状態の変化を検出できる任意の測定・分光分析方法により、ステップ20にて転換反応が進行する所定の条件に曝された被検試料溶液の蛍光強度の測定とその解析が実行される(ステップ30)。ここで採用される蛍光強度の測定方法は、例えば、レーザー共焦点顕微鏡の光学系に超高感度光検出装置を組み合わせた蛍光測定装置(一分子蛍光分析装置)を用いて行われるFCS、FDS、FIDA、FCCSのいずれかであってよい。
【0028】
FCS(蛍光相関分光法)では、微小の蛍光観察領域(レーザー共焦点顕微鏡の対物レンズの焦点領域)をブラウン運動により通過する分子又は粒子の移動(並進運動)の速さが観測される。分子又は粒子の並進運動の速さは、測定された蛍光強度の時間を変数とした自己相関関数の形状に反映される。分子又は粒子の並進運動の速さの指標としては、測定開始時から自己相関関数の値が半分になるまでの時間の長さ(並進拡散時間)が用いられる。分子又は粒子の移動は、その大きさが大きいほど、遅くなるので、並進拡散時間が長くなる。本発明の場合、図2(a)、(c)の如く、単独でブラウン運動していた正常型プリオン分子が、図2(d)、(e)の如く異常型に転換され、凝集体を形成すると、プリオン分子に付加された蛍光標識が凝集体上に拘束され、これと一体的に運動するので、図2(a)、(c)の場合に比して、蛍光色素の運動の速さが顕著に低減し、並進拡散時間の長さが長くなるので、蛍光標識された正常型プリオン分子が異常型に転換され凝集したか否かが検出される。
【0029】
FDS(蛍光偏光解消法)では、この分野に於いて知られている如く、分子の回転ブラウン運動(自転)の速さが観測される。分子の回転運動の速さは、測定された蛍光の縦偏光と横偏光の強度の割合又は偏光度に反映される。分子の回転は、分子の大きさが大きいほど、遅くなるので、偏光度が大きくなる。本発明の場合、前記のFCSと同様に、図2(e)の如く、蛍光標識されたプリオン分子が凝集体を形成すると、蛍光標識が凝集体に拘束され、従って、図2(a)、(c)の場合に比して、蛍光標識の回転運動の速さが顕著に低減し、偏光度が大きくなるので、蛍光標識された正常型プリオン分子が異常型に転換され凝集したか否かが検出される。
【0030】
FIDA(蛍光強度分布解析法)では、微小の蛍光観察領域内から発せられる光子の検出(フォトンカウンティング)を行い、単位時間当たりの光子が検出された頻度を統計的に処理することによって、微小の蛍光観察領域内の蛍光粒子の数密度と、一蛍光粒子当たりの蛍光強度が算出される。本発明の場合、蛍光標識されたプリオン分子が凝集体を形成し、特に、図2(e)中の凝集体αの如く、一つの凝集体に複数の蛍光標識が拘束されて、それらが一つの蛍光粒子として運動すると、蛍光粒子の数密度が低減する一方、凝集体に複数の蛍光標識が存在することにより一蛍光粒子当たりの蛍光強度が増大する。従って、蛍光粒子の数密度の低減と一蛍光粒子当たりの蛍光強度の増大から蛍光標識された正常型プリオン分子が異常型に転換され凝集したか否かが検出されることとなる。なお、この場合、感度よく一蛍光粒子当たりの蛍光強度の増大の有無を検出するためには、既に触れたように、蛍光標識された正常型プリオンに於いて、個々のプリオン分子に付加される蛍光標識の数は、一定であることが望ましい(プリオン一分子当たりの蛍光標識数にばらつきがあると一蛍光粒子当たりの蛍光強度の変化を検出しにくくなるためである。)。
【0031】
FCCS(蛍光相互相関分光法)では、二つの発光波長の異なる蛍光標識が微小の蛍光観察領域をブラウン運動により通過する際に、各々の標識の蛍光強度の変化から二つの蛍光標識の運動に相関があるか否かを判定することができる。もし二つの蛍光標識が一つの担体に存在する場合には、二つの蛍光強度の変化が一体的に変化するが、蛍光標識が別々の担体に存在する場合には、二つの蛍光強度の変化は、独立に変化することとなる。蛍光標識が一つの担体に乗っているか否かは、時間を変数とした二つの蛍光強度の相互相関関数から判定することができる。本発明に於いて互いに異なる蛍光標識A、Bが付加されたプリオン分子を用いた場合に、図3(a)−(c)に示されている如く、蛍光標識Aを担持するプリオン分子と蛍光標識Bを担持するプリオン分子とが一つの凝集体に組み込まれると、それらの互いに異なる蛍光標識A、Bが一体的に運動することとなり、プリオン分子が単独で独立にブラウン運動をしている場合に比して、相互相関関数が高くなるので、これにより、蛍光標識された正常型プリオン分子が異常型に転換され凝集したか否かが検出される。
【0032】
かくして、上記の蛍光測定により蛍光標識された正常型プリオン分子が異常型に転換され凝集したことが検出された場合(ステップ40)、被検試料に異常型プリオンが存在していると判定されることとなる。
【0033】
上記の方法に関して特記されるべきことは、蛍光標識された正常型プリオンが異常型へ転換されたことを検出するようになっているので、本発明の方法で検出される異常型プリオンは、正常型プリオンを異常型へ転換する活性を保持した、即ち、プリオン病の病原性を有する異常型プリオンが検出されるということである。この点に関し、従前の抗原抗体反応による検出方法又はタンパク質の凝集性を検出するだけの方法では、異常型プリオンの存否は検出可能であるが、検出された異常型プリオンが正常型プリオンに対する転換反応を有しているか否かは判断できない。
【0034】
また、一分子蛍光分析装置を用いて上記の一連の蛍光分析法のいずれかにより、検査を行う場合、一つの結果を検出するために要する試料量は、数十μl程度でよく、測定時間は、5−15秒程度の測定を数回繰り返す程度でよいので、従前の生化学的な手法に比べ、試料量と時間を大幅に低減することができる。この点に関し、上記の如き蛍光測定に於いては、プリオンが数分子程度の凝集体を形成したときの分子運動の状態の変化を検出できるので、従前の抗原抗体反応による検出方法に於いて検出可能な程度に異常型プリオンを増幅する必要はなく、従って、非特許文献1、2に記載されるPMCA、即ち、インキュベーションと超音波による分散とを何度も繰り返す処理は必ずしも行う必要はないことは理解されるべきである。被検試料にもよるが、本発明の方法に於ける転換反応処理は、PMCAに於ける最初のインキュベーションを行うだけでも検出可能な場合があると考えられる(勿論、被検試料溶液のインキュベーションと超音波分散処理を繰り返してもよい。)。更に、本発明の方法に於いては、被検試料を化学的に改変したり、被検試料から正常型プリオンを除去する処理を必要としていないので、蛍光測定前に被検試料中の異常型プリオンを損失してしまう可能性も極めて少ないので、検出可能な被検試料中の異常型プリオンの量は、従前の方法に比して更に低減される。
【0035】
上記の本発明の方法によれば、蛍光標識される正常型プリオンと、プリオン病未感染の脳、脊髄等のプリオンを豊富に含む組織又は体液試料が入手可能な任意の動物について異常型プリオンの存否の検出又は判定を行うことが可能となる。
【0036】
上記に説明した本発明の異常型プリオンの検出方法は、具体的には、以下の手順の如く行われてよい。なお、以下の実施例は、ハムスターの異常型プリオンの検出の例であるが、本発明の範囲を限定するものではないことは理解されるべきである。
【実施例1】
【0037】
1種類の蛍光色素により蛍光標識された正常型プリオンを用いた異常プリオンの検出
プローブ試料の調製
プローブ試料となる蛍光標識正常型プリオンは、非特許文献4に掲載のプリオン塩基配列に基づき、ピンポイント蛍光標識キット(オリンパス)を用いて蛍光色素TAMRAにて正常型プリオンを蛍光標識することにより得られる。調製された蛍光標識正常型プリオンは、希釈バッファ(PBS(sigma),1% Triton X-100, Complete Protease Inhibitor Cocktail(Roche))中で100nMとなるよう調製する(なお、蛍光標識正常型プリオンは、下記の実施例2の如く正常型プリオンを抽出精製後、ケミカルラベリング法により調製されてもよい。)。また、正常型プリオンを含有する体液は、試験管内に於いて、プリオン病未感染ハムスターの脳組織200mgに800μlの希釈バッファを加え、超音波破砕器で組織が均一な乳剤状になるまで超音波処理される。その後、乳化された脳組織溶液は、希釈バッファにより1%程度に希釈される(希釈脳乳化溶液)。
【0038】
被検試料の調製
被検動物よりEDTA入り採血管(ベクトン・ディッキンソン)を用いて採血された血液1mlが、25℃で500×g、5分間遠心されて、白血球層(バフィーコート)画分が採取される。採取されたバフィーコート画分は、凍結融解を3度繰り返し100000g 4℃ 1時間の条件で遠心される。その沈殿物が採取され被検試料として使用される。
【0039】
転換反応
採取した沈殿物全量(被検試料)に対し、100μlの希釈脳乳化溶液と10μlの蛍光標識正常型プリオン溶液を混合し(被検試料溶液)、37℃で30分インキュベーションする。
【0040】
蛍光測定・分析
(1)FCSによる測定・分析
反応させた被検試料溶液を希釈バッファで10倍に希釈し、そのうちの50μlの試料の蛍光強度を、一分子蛍光分析システムMF20(オリンパス)を用いて、FCSに従って計測する。一分子蛍光分析システムは、測定された蛍光強度の自己相関関数を内部のプログラムに従って計算し、並進拡散時間を算出する。蛍光標識正常型プリオンが溶液中で単独でブラウン運動している場合、その分子量(3.3〜3.5万)から推定して並進拡散時間は370μ秒程度となる。一方、蛍光標識正常型プリオンが50個程度の凝集体に組み込まれたとすると、そのときの蛍光強度の自己相関関数より算出される並進拡散時間は、1360μ秒程度となると推定される。かくして、もし被検試料に異常型プリオンが含まれており、転換反応により蛍光標識正常型プリオンが数個程度の凝集体に組み込まれたとすると、並進拡散時間が長くなり、蛍光標識正常型プリオンが異常型に転換され凝集していることが検出される。即ち、被検試料に異常型プリオンが含まれていることが検出される。
【0041】
(2)FIDAによる測定・分析
上記と同様の蛍光測定用の試料標本の蛍光強度をFIDAに従って一分子蛍光分析システムMF20(オリンパス)を用いて計測する。一分子蛍光分析システムは、内部のプログラムに従って蛍光のフォトンカウンティングを行い、時間を変数として得られる受容光子数のヒストグラムから溶液中の蛍光発光体の数密度と、一発光体当たりの蛍光強度(単位時間当たりの発光光子数)を算出する。蛍光標識正常型プリオンが溶液中で単独でブラウン運動している場合、蛍光標識正常型プリオンのみでの1分子あたりの蛍光強度は、35kHz程度となると推定される。一方、4〜5個程度の蛍光標識正常型プリオンが一つの凝集体に組み込まれたとすると、一発光粒子(凝集体)の蛍光強度は126.1kHzとなると推定される。かくして、もし被検試料に異常型プリオンが含まれており、転換反応により蛍光標識正常型プリオンが凝集体に組み込まれたとすると、蛍光強度(単位時間当たりの発光光子数)が蛍光一分子の場合よりも大きい発光粒子(凝集体)が検出され、蛍光標識正常型プリオンが異常型に転換され凝集していることが検出される。即ち、被検試料に異常型プリオンが含まれていることが検出される。
【実施例2】
【0042】
異なる蛍光色素により蛍光標識された2種類の蛍光標識正常型プリオンを用いた異常プリオンの検出
処理過程は、プローブ試料として二種類の蛍光標識正常型プリオンを用いる点を除いて、転換反応の過程までは、実施例1と同様である。プローブ試料としては、ローダミングリーン(インビトロジェン)が付加された蛍光標識正常型プリオンと、alexa647(インビトロジェン)が付加された蛍光標識正常型プリオンが用いられる。蛍光標識正常型プリオンの調製は、以下の通りに抽出精製した正常型プリオンに蛍光色素をケミカルラベリング法により付加することにより行われてよい。
【0043】
正常型プリオンの抽出精製の操作手順は以下の通りである(非特許文献5参照)。
(1)正常なハムスターの脳100gに900gのバッファー(ショ糖、0.1mg/ml TPCK(sigma)、1mM PMSF(sigma)、10mM リン酸ナトリウム(pH7.0)、0.15M NaCl)を加え、ポリトロンを用い組織を破砕し、しかる後、試料を3000×gで30分間遠心分離し、上澄みを回収する。
(2)回収した上澄みにPEG−8000を4%になるよう加え、4℃にて15分間攪拌し、しかる後、1400×gで10分間遠心分離し、沈降物を回収する。
(3)沈降物を、ZW3−12バッファー(0.15M NaCl、10mM リン酸ナトリウム(pH7.0)、0.1mg/ml TPCK、1mM PMSF、8% ZW3−12(N-Dodecyl-N,N-dimethyl-3-ammonio-1-propanesulfonate)(sigma))にて、ZW3−12の重量:沈降物の重量=10:1となるように希釈し、4℃で1時間攪拌した後、100000×gで1時間、遠心分離し、上澄みを回収する。
(4)回収した上澄みを、銅イオンを吸着させバッファーA(0.15M NaCl、10mM リン酸ナトリウム(pH7.0)、0.2% ZW3−12)で平衡化させたキレーティングセファロースファストフロー(Chelating Sepharose Fast Flow)カラム(GE Healthcare Life Sciences)に加える。
(5)(3)で回収された上澄みが与えられた(4)のカラムを、バッファーAに10mMイミダゾールを加えたバッファーで洗浄し、次いで、0.5M NaCl、0.2% ZW3−12のバッファーで洗浄し、最後に10mMリン酸ナトリウムバッファー(pH7.0)にて洗浄する。
(6)しかる後、50mM EDTA、0.2% ZW3−12、10mMリン酸ナトリウム、0.2M NaClを含むバッファーをカラムに適用すると、カラムから正常型プリオンが溶出される。
なお、蛍光標識正常型プリオンの調製に用いる正常型プリオンは、市販の抽出精製されたもの(例えば、JENA BIOSCIENCE社のNative PrPc hamster recombinant)を用いてもよい。
かくして、得られた正常型プリオンは、ケミカルラベリング法により上記の蛍光色素が付加される。
【0044】
蛍光測定・分析
上記と同様に調製された蛍光測定用の試料標本中の二つの蛍光色素の蛍光強度をFCCSに従って一分子蛍光分析システムMF20(オリンパス)を用いて計測する。一分子蛍光分析システムは、2種類(2つの波長帯)の蛍光強度の相互相関関数を内部のプログラムに従って計算する。蛍光標識正常型プリオンが溶液中で単独でブラウン運動している場合、相互相関関数の値は、実質的に1になるが、一つの凝集体に色の異なる色素が付加されたプリオンが組み込まれたとすると、相関関数は、1より大きい有意な値となる。かくして、もし被検試料に異常型プリオンが含まれており、転換反応により2種類の蛍光標識正常型プリオンが一つの凝集体に組み込まれたとすると、相互相関関数が1より大きくなり、蛍光標識正常型プリオンが異常型に転換され凝集していることが検出される。即ち、被検試料に異常型プリオンが含まれていることが検出される。
【図面の簡単な説明】
【0045】
【図1】図1は、本発明の方法の好ましい実施形態に於ける処理過程をフローチャートの形式にて示したものである。
【図2】図2は、被検試料に異常型プリオンが存在している場合の図1の実施形態の処理過程中に於けるプリオン分子の状態の変化を模式的に表したものである。(a)は、蛍光標識された正常型プリオン、(a’)は、任意に添加される正常型プリオン含有の体液試料、(b)は、被検試料を表している。(a)、(a’)、(b)が混合されて調製された被検試料溶液(c)が、転換反応が発生する条件(d)に曝されると、(d)の下図に示されている如く、正常型プリオンが異常型に転換し、凝集体を形成する(e)。
【図3】図3は、二つの異なる蛍光標識がそれぞれ別々に付加された正常型プリオンをプローブとして用いた場合の図2と同様の図である。
【技術分野】
【0001】
本発明は、異常型プリオンを検出する方法に係り、より詳細には、蛍光測定により異常型プリオンの存在を検出して、任意の生体試料又は生体由来の試料中に異常型プリオンが含まれているか否かを判定する方法に係る。
【背景技術】
【0002】
異常型プリオンは、動物(哺乳類)の脳がスポンジ状になる牛海綿状脳症(BSE)、クロイツフェルトヤコブ病(CJD)などのプリオン病(伝染性(伝達性)海綿状脳症)に於いて、そのスポンジ状になった組織に観察される凝集性(凝集体を形成する)タンパク質である。プリオン病発症のメカニズムについて、現在最も有力な「プリオン仮説」によれば、異常型プリオン自体が、プリオン病の病原体であり、動物の体内に侵入して、脳又は中枢神経系の神経細胞に普通に存在する正常型のプリオン(分子量約3.3〜3.5万(33〜35kDa)の糖タンパク質)を次々に異常型プリオンに転換し、異常型へ転換されたプリオンが特定の部位に於いて徐々に凝集して蓄積し、脳に於いては、凝集したプリオンにより組織をスポンジ状に変化させる(プリオン病が発症する)と考えられている。実際、異常型プリオンと正常型プリオンとの混合物に対してインキュベーションと超音波による分散処理とを繰り返し施すことにより、正常型プリオンが徐々に異常型プリオンへ転換され、これにより、異常型プリオン(の量)が増幅されることが報告されている(異常型プリオンの増幅方法は、PMCA:Protein misfolding cyclic amplificationと称されている。例えば、非特許文献1、2参照)。また、異常型プリオンは、異常型プリオンに感染した動物由来の食物や移植組織、異常型プリオンに感染した動物の体液等で汚染された医療器具などを通じて、別の動物個体の体内へ侵入し、これによりプリオン病を発症する伝染性を有すると考えられており、従って、プリオン病の蔓延を防止するため、異常型プリオン又はそのキャリアを早期に発見し(例えば、BSE問題に於ける食用牛の全頭検査など)、異常型プリオンの別の動物個体への伝達経路を遮断してプリオン病の感染を阻止することが試みられている。
【0003】
上記の如き目的を達成すべく異常型プリオンの検出を行う場合、現在のところ、一般的には、抗原抗体反応を利用した方法が採用されている。例えば、食肉牛の全頭検査などに於いては、ELISA(固相酵素免疫検定法。例えば、特許文献1)やウェスタンブロット法(イムノブロット法。例えば、非特許文献3)などの伝統的な抗原抗体反応の検出方法に従って、動物の死亡後に脳、脊髄などの異常型プリオンの凝集体が多量に蓄積する部位から採取される組織試料標本に異常型プリオンを抗原とする抗体を与え、抗原抗体反応が発生するか否かを検出することにより、動物体内に異常型プリオンが存在していたか否か、即ち、その動物が異常型プリオンのキャリアであったか否かが判定される。また、近年、特定部位の組織を使用しない検出方法として、上記の非特許文献1、2では、動物の血液中に微量に存在する異常型プリオンをPMCAにより増幅した後、上記の如き抗原抗体反応による検出方法を用いることにより、血液などの生体試料中の微量の異常型プリオンの存否を確認する方法が報告されている。更に、上記の古典的な抗原抗体反応の検出方法に代えて、特許文献2では、異常型プリオンに対する抗体を蛍光標識し、かかる抗体と検査されるべき試料とを混合して、異常型プリオン(抗原)と抗体との抗原抗体反応が生じたか否かを蛍光相関分光法を用いて検出することにより、任意の試料中の異常型プリオンの存在を検出する方法が開示されている。
【0004】
上記の如き抗原抗体反応を用いずに異常型プリオンの検出に利用可能な方法としては、特許文献3に於いて、被検試料を直接に蛍光色素にて標識し、蛍光相関分光法により、被検試料中に凝集し沈着するタンパク質の存否を検出・判定する方法が提案されている(厳密に言えば、この方法は、異常型プリオンを検出するのではなく、被検試料中のタンパク質が凝集する性質を有しているか否かを判定する方法である。)。
【特許文献1】米国特許第4806627号公報明細書
【特許文献2】特開2005−345311公報
【特許文献3】特表2001−517800公報
【非特許文献1】サボリオ等外2名、ネイチャー 411巻 810−813頁、2001年
【非特許文献2】サア等外2名、サイエンス 313巻 92−94頁、2006年
【非特許文献3】バリー及びプルシナー、ジャーナル・オブ・インフェクシャス・ディゼィーズ 154巻 518−521頁、1986年
【非特許文献4】リー等 ゲノム・リサーチ(Genome Res.) 1998年 8巻 1022−1037頁
【非特許文献5】パン等外2名 プロテイン・サイエンス(Protein Sci.)1992年 1巻 1343−1352頁
【発明の開示】
【発明が解決しようとする課題】
【0005】
異常型プリオンの検出を、研究室レベルの規模ではなく大規模に実施する場合、例えば、臨床診断のために行う場合或いは食肉用牛の全頭検査などの多数の検体を検査する場合などでは、検出方法は、精度が良いだけでなく、個々の検体の検査がより迅速に実施できることが望ましい。しかしながら、現在利用されている上記の如き抗原抗体反応による古典的な検出方法の場合、処理操作が多く、検査結果が得られるまでに時間がかかる。
【0006】
また、従前の抗原抗体反応を利用した方法により十分な精度にて検出対象物質の存否を検出するためには、一般に、被検試料中に相当量の検出対象物質が含有していることを要するので、異常型プリオンを検出する場合にも、相当に高い含有量にて異常型プリオンを含む試料を準備する必要がある。この点に関し、正常型プリオンと異常型プリオンについては、両者を精度よく区別して認識する抗体を作成することは困難であり、上記の如き抗原抗体反応を用いた検査方法により異常型プリオンを検出しようとする場合、実際には、抗原抗体反応を起こさせる前に(被検試料に抗体を作用させる前に)、被検試料中の正常型プリオンをプロテアーゼKやその他の薬剤により正常型プリオンを除去するといった処理が必要となっている。その場合、被検試料から正常型プリオンを除去する処理する間に、相当量の異常型プリオンを損失してしまう可能性があり、従って、精度よく検査を実行するためには、被検試料の処理操作で損失する分を見越して、(通常の物質の抗原抗体反応による検出方法の場合よりも)多量の異常型プリオンを含む被検試料を準備する必要がある。上記の特許文献3の方法の場合には、抗原抗体反応を用いていないが、被検試料又は凝集性の有無を判定されるべき対象物質を直接に蛍光色素にて標識するという処理操作を要し、かかる処理操作中に相当量の検査対象物質が損失してしまう可能性がある。
【0007】
かくして、現在利用可能な異常型プリオンの検出方法は、多くの処理操作と長い処理時間を要するとともに、相当量の検査対象物質、即ち、異常型プリオンを含む被検試料でなければ、信頼性のある検出結果を得ることが困難となっている。もし従前より短時間に、試料中の異常型プリオンの含有量が微量でも異常型プリオンを検出できる方法があれば、異常型プリオンの検出を大規模に実施する場合に非常に有利であろう。
【0008】
かくして、本発明の一つの課題は、異常型プリオンの検出方法であって、抗原抗体反応を用いずに従前に比して極めて迅速に異常型プリオンを検出することのできる方法を提供することである。
【0009】
また、本発明のもう一つの課題は、異常型プリオンの存否が検出又は判定されるべき被検試料の処理をできるだけ少なくして処理中に検出対象である異常型プリオンを損失してしまう危険性を低減し、或いはまた、異常型プリオンの含有量が微量であっても異常型プリオンを検出することのできる方法を提供することである。
【0010】
また、本発明の更にもう一つの課題は、上記の如き異常型プリオンの検出方法であって、蛍光測定・分析を用いて異常型プリオンを検出する方法を提供することである。
【課題を解決するための手段】
【0011】
本発明によれば、抗原抗体反応を用いずに、被検試料中の異常型プリオンが微量であっても、有利に異常型プリオンを検出することのできる方法が提供される。本発明の異常型プリオンの検出方法は、異常型プリオンを含むか否かが検査されるべき被検試料と、蛍光標識された正常型プリオンとを混合して被検試料溶液を調製する過程と、被検試料溶液を異常型プリオンが正常型プリオンを異常型プリオンへ転換する反応条件に曝す過程と、かかる反応条件に曝された被検試料溶液中の蛍光標識された正常型プリオンに付加された蛍光標識の蛍光強度を測定する過程と、その蛍光強度に基づいて蛍光標識された正常型プリオンが被検試料溶液中に於いて単独で存在しているか又は凝集体に組み込まれているかを判定する過程とを含む。そして、蛍光標識された正常型プリオンが凝集体に組み込まれていると判定されたときには、被検試料に蛍光標識された正常型プリオンを異常型プリオンへ転換する異常型プリオンが含まれていたと判定する。
【0012】
上記の本発明の構成によれば、まず、異常型プリオンを含むか否かが検査されるべき被検試料と蛍光標識された正常型プリオンとが混合され、その混合物(被検試料溶液)が異常型プリオンへ転換する反応条件に曝される。前記のプリオン仮説に於いて又は非特許文献1に於いて示されている如く、もし被検試料に異常型プリオンが含まれていれば、正常型プリオンが異常型プリオンへ転換され、異常型プリオンの凝集体が形成されることとなるので、異常型プリオンと混合される前、単独に運動していた蛍光標識された正常型プリオン分子も、異常型プリオンとの混合後、(蛍光標識された)異常型プリオンとなり、凝集体に組み込まれる。
【0013】
蛍光標識された正常型であったプリオン分子が異常型に変換され凝集体に組み込まれた否かは、その分子に付加された蛍光標識の蛍光強度を通じて判定することができる。当業者にとって理解される如く、或るタンパク質などの分子に蛍光標識を付加しておけば、その分子の構造、大きさ、運動の変化が蛍光標識の蛍光強度に基づいて検出できる。本発明の場合、単分子として運動していたプリオン分子が凝集体に組み込まれ、凝集体と一体的に運動することとなるので、かかる状態の変化に伴う運動の変化がプリオン分子に付加された蛍光標識の蛍光強度の種々の挙動(揺らぎ)の変化に反映され、かくして、正常型プリオン分子が異常型プリオン分子に転換されたか否か、即ち、被検試料に異常型プリオン分子が存在していたか否かが判定されることとなる。要するに、本発明は、正常型プリオンに異常型プリオンが混合されると、正常型プリオンが異常型プリオンへ転換され、異常型プリオンの凝集体に組み込まれることとなるという異常型プリオン独特の活性を蛍光測定により検出し、これにより異常型プリオンの存否を検出するというものである。
【0014】
非特許文献1、2に於いて示されている如く、プリオン病に感染した動物の組織又は体液に異常型プリオンが存在する場合には、所定の条件に於いて、in vitroの系でも、正常型プリオンが異常型プリオンへ転換することが分かっている。従って、上記の本発明の構成に於いて、被検試料としては、動物より採取された動物の組織又は体液であってよい。特に、非特許文献2の知見によれば、プリオン病に感染した動物の血液に微量に存在する異常型プリオンにより、in vitroの系で正常型プリオンから異常型プリオンへ転換反応が生ずることが見出されており、従って、本発明の方法に於いて、典型的には、かかる動物の組織又は体液試料は、採取が容易な動物の血液又はその一部の成分が有利に用いられる。また、正常型プリオンから異常型プリオンへの転換反応は、正常型プリオンを含む動物の体液試料の存在下で進行することが確かめられている。従って、例えば、被検試料中に十分な正常型プリオンが存在しておらず、被検試料と蛍光標識されたプリオンだけでは転換反応が進まないと想定される場合には、正常型プリオンを含む動物の体液試料が被検試料溶液へ更に混合されることが好ましい。特に、正常型プリオンから異常型プリオンへの転換反応が進むよう添加される正常型プリオンを含む動物の体液試料は、プリオン病未感染の動物から採取された脳組織から調製された試料であってよい。ただし、被検試料と蛍光標識されたプリオンとの混合物でも転換反応が進むことが予備実験等で見出されている場合には、正常型プリオンを含む動物の体液試料若しくは脳組織から調製された試料を混合する必要はなく、そのような場合も本発明の範囲に属する。
【0015】
上記の方法の被検試料溶液を異常型プリオンが正常型プリオンを異常型プリオンへ転換する反応条件に曝す過程に於ける具体的な条件は、当業者により本発明の方法による検査の実施に先立って、予備実験等により見出すことができることは理解されるべきである。正常型プリオンから異常型プリオンへの転換反応の条件は、動物の種などによって変化する可能性があるが、異常型プリオンが含まれていることが分かっている試料標本を被検試料として用い、上記の本発明の方法の過程を実施することにより、正常型プリオンから異常型プリオンへの転換反応を起すための条件は、見出すことが可能である。なお、非特許文献1、2の知見によれば、典型的には、反応条件は、被検試料溶液を少なくとも30分間37℃にてインキュベーションすることである。
【0016】
上記の本発明の方法に於いて、蛍光標識されたプリオン分子の状態を観測するための蛍光強度の測定は、所謂「一分子蛍光分析技術」、即ち、蛍光一分子からの蛍光を測定し、その時間変化又は揺らぎを解析して蛍光一分子の状態又は運動を観測する蛍光分析法により有利に実行することができる。そのような一分子蛍光分析技術としては、蛍光相関分光法(Fluorescence Correlation Spectroscopy:FCS)、蛍光強度分布分析法(Fluorescence-Intensity Distribution Analysis:FIDA)、蛍光相互相関分光法(Fluorescence cross-correlation Spectroscopy:FCCS)など、レーザー共焦点顕微鏡の光学系に超高感度光検出装置を組み合わせた蛍光測定装置により実施されるいずれか任意のものであってよい(本発明の構成により各々の蛍光分析方法に於いて蛍光測定・分析の結果がどのようになるかは、実施の形態の説明の欄に於いて説明される。)。また、その他の分子の構造・状態・運動の変化を観測できる任意の蛍光分析法、例えば、蛍光偏光解消法(Fluorescence Depolarization Spectroscopy:FDS)などが用いられてもよい(この場合、一分子蛍光分析を実行する装置ではなく、通常の蛍光偏光解消測定装置であってもよい。)。理解されるべきことは、或る蛍光標識された分子(プリオン分子)が単独で運動しているのか又は凝集体を形成しているのかを検出できる蛍光分析方法であれば任意のものであってよく、そのような場合も本発明の範囲に属する。
【発明の効果】
【0017】
上記の説明から理解される如く、本発明は、正常型プリオンを蛍光標識したものをプローブとして用い、そのプローブが異常型プリオンに転換する現象を検出して、異常型プリオンの検出をするものであり、異常型プリオンの存在の検出のために抗原抗体反応を用いていない。従って、異常型プリオンと正常型プリオンとを精度よく区別して認識する抗体を産生する必要はなく、また、正常型プリオンを被検試料から除去する処理も必要としないので(本発明の場合、プリオンの正常型から異常型への転換反応を検出するので、被検試料中に正常型プリオンが存在している方が望ましい。)、従前の抗原抗体反応を用いた検出方法に於いて、異常型プリオンを特異的に認識する抗体の産生が困難であることに起因する種々の問題は、気にする必要がなくなる。
【0018】
また、本発明に於いては、蛍光標識された正常型プリオンを予め準備しておく必要があるが、個々の被検体の検査に於ける処理は、被検試料と蛍光標識された正常型プリオンとを混合し、蛍光標識された正常型プリオンが転換反応を起す条件に保持し、しかる後に蛍光測定を行うだけでよいので、従前に比して極めて短時間で完了することが可能である。正常型プリオンを被検試料から除去する処理や被検試料を蛍光標識する処理など、被検試料中の物質を化学的に改変する処理を行わなくてよいので、そのような処理中に被検試料中の検出対象である異常型プリオンを、処理操作中に損失してしまうこともなく、従って、そのような処理中に異常型プリオンが失われることにより検出結果が擬陰性となってしまうなどの問題が解消される。また、被検試料を化学的に改変する処理をすることなく、蛍光測定により蛍光標識された正常型プリオンが異常型プリオンへ転換する反応を検出する態様によれば、被検試料中に含まれている異常型プリオンは、従前に比して、極めて微量であってもよく、従って、動物の体液中に微量に含まれる異常型プリオンでもその存否が判定できることになる。即ち、被検試料として動物の脳、脊髄などの異常型プリオンが多量に蓄積した組織の採取や、PMCAによる異常型プリオンの増幅を行う必要はない。
【0019】
かくして、本発明によれば、微量又は少量の被検試料を用いて短時間に異常型プリオンの検出ができる。本発明は、被検試料が動物の血液等の低侵襲に採取可能な試料でよいので、プリオン病発症前(異常型プリオンが特定部位に蓄積する前)の早期の段階の異常型プリオンのキャリアの判定又は食肉牛の全頭検査など大規模な検査としての利用が期待される。
【0020】
本発明のその他の目的及び利点は、以下の本発明の好ましい実施形態の説明により明らかになるであろう。
【発明を実施するための最良の形態】
【0021】
以下に添付の図を参照しつつ、本発明を幾つかの好ましい実施形態について詳細に説明する。
【0022】
図1は、本発明の異常型プリオンを検出する方法の好ましい実施形態に於ける処理過程をフローチャートの形式で表したものであり、図2は、図1の処理に於いて想定される分子の状態の変化を模式的に示したものである。同図を参照して、本発明の方法による検査に於いては、まず、蛍光標識された正常型プリオンと被検試料とが混合され、被検試料溶液が調製される(ステップ10)。
【0023】
プローブとして用いられる蛍光標識された正常型プリオン(図2(a))は、予め、当業者にとって任意の公知の方法にてなされてよい(実施例の欄参照)。正常型プリオンは、典型的には、検査の対象となる動物と同種のプリオン病に未感染の動物の組織、例えば、脳、脊髄等から当業者にとって任意の公知の方法にて抽出されたものであってよい。また、正常型プリオンの蛍光標識は、例えば、正常型プリオンの調製後、プリオン中の特定の基を標的にしたケミカルラベリング法により、蛍光分子がプリオンに付加することにより為されてよい。蛍光色素としては、この分野で通常使われる任意の蛍光色素、例えば、TAMRA(carboxymethylrhodamine)、TMR(tetramethylrhodamine)、Alexa647、Rhodamine
Green、Alexa488などであってよいが、これらに限定されない。なお、後に説明する如く、蛍光測定をFIDAにて実行する場合には、個々のプリオン分子に付加される蛍光標識(蛍光色素分子)の数は揃っていることが望ましい。ケミカルラベリング法にて蛍光標識を行う場合、蛍光色素は、NHSエステル体、マレイミド体などの化学標識蛍光標識用の蛍光色素試薬が用いられてよい。また、可能であれば、蛍光標識された正常型プリオンの調製は、プリオンのcDNAを用い細胞内や無細胞タンパク合成系に於いて、より精度よく特定の基に蛍光色素が付加されるようタンパク質を生成するピンポイント蛍光標識技術やGFP等の蛍光タンパク質を融合させた正常型プリオンを調製する方法を用いて、蛍光色素が決められた数にて正常型プリオンに標識されるように為されてよい。また更に、後に説明する如く、蛍光測定をFCCSにて実行する場合には、別々の蛍光色素にて標識された正常型プリオンが、少なくとも2種類、上記と同様に準備される。蛍光標識された正常型プリオンは、変性しないように任意の方法で保存されてよく、その場合、検査の際に必要な量だけが使用されるようになっていてよい。
【0024】
被検試料、即ち、異常型プリオンが含有しているか否かが検査される試料(図2(b))は、異常型プリオンが含有している可能性のある物質、例えば、動物の脳、脊椎等の組織、血液、尿などの体液、食物、移植用組織等の任意のものであってよい。或る動物についてプリオン病に感染しているか否か、或いは、異常型プリオンのキャリアであるか否かを判定する場合には(プリオン病の早期診断)、その動物の血液であってよい。この点に関し、プリオンは血液を遠心分画して得られるバフィーコートに存在することが知られているので、血液を被検試料とする場合には、好適には、かかるバフィーコートのみ使用される。
【0025】
また、更に、被検試料溶液には、好適には、検査の対象となる動物と同種のプリオン病に未感染の動物の組織、例えば、脳、脊髄のホモジネート液等の(蛍光標識されていない)正常型プリオンを多量に含む生体から得られる体液試料(図2(a’))が混合される。厳密な理由は解明されていないが、異常型プリオンは、脳、脊髄のホモジネート液等の正常型プリオンを多量に含む体液中に於いて正常型プリオンを異常型プリオンに転換することが報告されている(例えば、非特許文献2)。そこで、被検試料と蛍光標識された正常型プリオンのみでは、転換反応が進行しないと想定される場合には、前記の如き正常型プリオンを多量に含む体液を更に追加して転換反応が進行する条件が成立されるようにしてよい。なお、被検試料のみでも転換反応が進行すると考えられる場合、或いは、蛍光標識された正常型プリオンが遺伝子組換えなどにより動物に発現した蛍光タンパク質融合プリオンであり、もし異常型プリオンが混入すれば、転換反応が進行すると考えられる場合には、(蛍光標識されていない)正常型プリオンを多量に含む体液は混合されなくてもよいであろう。
【0026】
かくして、ステップ10にて調製された被検試料溶液(図2(c))は、転換反応が進行する所定の条件に所定時間曝される(ステップ20)。PMCAについて記載する非特許文献1、2の知見によれば、動物がハムスターの場合、37℃にて30分程度インキュベーションすることにより、或る程度の正常型プリオンが異常型プリオンに転換され(図2(d))、小さな異常型プリオンの凝集体を形成することが見出されている(厳密なメカニズムは解明されていないが、そのままインキュベーションしただけでは、試料溶液中の正常型プリオンの全てが一気に異常型に転換されるのではなく、凝集体が大きくなると転換反応が遅くなると考えられている。)。なお、前記の転換反応を進行させる所定の条件及び所定時間は、当業者に於いて、異常型プリオンを含むことが分かっている被検試料を用いて、予備実験を行い、蛍光標識された正常型プリオンが異常型に転換される条件を見出すことにより決定できることは理解されるべきである。
【0027】
かくして、ステップ20に於いて、もし被検試料に異常型プリオンが含有していると、図2(e)に模式的に示されている如く、蛍光標識された正常型プリオンを含む正常型プリオンのいくつかが異常型プリオンに転換され、凝集体を形成することとなる。そして、被検試料との混合前に単独で運動していた蛍光標識された正常型プリオンが、凝集体に組み込まれると、プリオン分子に付加された蛍光標識のブラウン運動の状態が変化する。そこで、かかるプリオン分子の蛍光標識の運動状態の変化を検出できる任意の測定・分光分析方法により、ステップ20にて転換反応が進行する所定の条件に曝された被検試料溶液の蛍光強度の測定とその解析が実行される(ステップ30)。ここで採用される蛍光強度の測定方法は、例えば、レーザー共焦点顕微鏡の光学系に超高感度光検出装置を組み合わせた蛍光測定装置(一分子蛍光分析装置)を用いて行われるFCS、FDS、FIDA、FCCSのいずれかであってよい。
【0028】
FCS(蛍光相関分光法)では、微小の蛍光観察領域(レーザー共焦点顕微鏡の対物レンズの焦点領域)をブラウン運動により通過する分子又は粒子の移動(並進運動)の速さが観測される。分子又は粒子の並進運動の速さは、測定された蛍光強度の時間を変数とした自己相関関数の形状に反映される。分子又は粒子の並進運動の速さの指標としては、測定開始時から自己相関関数の値が半分になるまでの時間の長さ(並進拡散時間)が用いられる。分子又は粒子の移動は、その大きさが大きいほど、遅くなるので、並進拡散時間が長くなる。本発明の場合、図2(a)、(c)の如く、単独でブラウン運動していた正常型プリオン分子が、図2(d)、(e)の如く異常型に転換され、凝集体を形成すると、プリオン分子に付加された蛍光標識が凝集体上に拘束され、これと一体的に運動するので、図2(a)、(c)の場合に比して、蛍光色素の運動の速さが顕著に低減し、並進拡散時間の長さが長くなるので、蛍光標識された正常型プリオン分子が異常型に転換され凝集したか否かが検出される。
【0029】
FDS(蛍光偏光解消法)では、この分野に於いて知られている如く、分子の回転ブラウン運動(自転)の速さが観測される。分子の回転運動の速さは、測定された蛍光の縦偏光と横偏光の強度の割合又は偏光度に反映される。分子の回転は、分子の大きさが大きいほど、遅くなるので、偏光度が大きくなる。本発明の場合、前記のFCSと同様に、図2(e)の如く、蛍光標識されたプリオン分子が凝集体を形成すると、蛍光標識が凝集体に拘束され、従って、図2(a)、(c)の場合に比して、蛍光標識の回転運動の速さが顕著に低減し、偏光度が大きくなるので、蛍光標識された正常型プリオン分子が異常型に転換され凝集したか否かが検出される。
【0030】
FIDA(蛍光強度分布解析法)では、微小の蛍光観察領域内から発せられる光子の検出(フォトンカウンティング)を行い、単位時間当たりの光子が検出された頻度を統計的に処理することによって、微小の蛍光観察領域内の蛍光粒子の数密度と、一蛍光粒子当たりの蛍光強度が算出される。本発明の場合、蛍光標識されたプリオン分子が凝集体を形成し、特に、図2(e)中の凝集体αの如く、一つの凝集体に複数の蛍光標識が拘束されて、それらが一つの蛍光粒子として運動すると、蛍光粒子の数密度が低減する一方、凝集体に複数の蛍光標識が存在することにより一蛍光粒子当たりの蛍光強度が増大する。従って、蛍光粒子の数密度の低減と一蛍光粒子当たりの蛍光強度の増大から蛍光標識された正常型プリオン分子が異常型に転換され凝集したか否かが検出されることとなる。なお、この場合、感度よく一蛍光粒子当たりの蛍光強度の増大の有無を検出するためには、既に触れたように、蛍光標識された正常型プリオンに於いて、個々のプリオン分子に付加される蛍光標識の数は、一定であることが望ましい(プリオン一分子当たりの蛍光標識数にばらつきがあると一蛍光粒子当たりの蛍光強度の変化を検出しにくくなるためである。)。
【0031】
FCCS(蛍光相互相関分光法)では、二つの発光波長の異なる蛍光標識が微小の蛍光観察領域をブラウン運動により通過する際に、各々の標識の蛍光強度の変化から二つの蛍光標識の運動に相関があるか否かを判定することができる。もし二つの蛍光標識が一つの担体に存在する場合には、二つの蛍光強度の変化が一体的に変化するが、蛍光標識が別々の担体に存在する場合には、二つの蛍光強度の変化は、独立に変化することとなる。蛍光標識が一つの担体に乗っているか否かは、時間を変数とした二つの蛍光強度の相互相関関数から判定することができる。本発明に於いて互いに異なる蛍光標識A、Bが付加されたプリオン分子を用いた場合に、図3(a)−(c)に示されている如く、蛍光標識Aを担持するプリオン分子と蛍光標識Bを担持するプリオン分子とが一つの凝集体に組み込まれると、それらの互いに異なる蛍光標識A、Bが一体的に運動することとなり、プリオン分子が単独で独立にブラウン運動をしている場合に比して、相互相関関数が高くなるので、これにより、蛍光標識された正常型プリオン分子が異常型に転換され凝集したか否かが検出される。
【0032】
かくして、上記の蛍光測定により蛍光標識された正常型プリオン分子が異常型に転換され凝集したことが検出された場合(ステップ40)、被検試料に異常型プリオンが存在していると判定されることとなる。
【0033】
上記の方法に関して特記されるべきことは、蛍光標識された正常型プリオンが異常型へ転換されたことを検出するようになっているので、本発明の方法で検出される異常型プリオンは、正常型プリオンを異常型へ転換する活性を保持した、即ち、プリオン病の病原性を有する異常型プリオンが検出されるということである。この点に関し、従前の抗原抗体反応による検出方法又はタンパク質の凝集性を検出するだけの方法では、異常型プリオンの存否は検出可能であるが、検出された異常型プリオンが正常型プリオンに対する転換反応を有しているか否かは判断できない。
【0034】
また、一分子蛍光分析装置を用いて上記の一連の蛍光分析法のいずれかにより、検査を行う場合、一つの結果を検出するために要する試料量は、数十μl程度でよく、測定時間は、5−15秒程度の測定を数回繰り返す程度でよいので、従前の生化学的な手法に比べ、試料量と時間を大幅に低減することができる。この点に関し、上記の如き蛍光測定に於いては、プリオンが数分子程度の凝集体を形成したときの分子運動の状態の変化を検出できるので、従前の抗原抗体反応による検出方法に於いて検出可能な程度に異常型プリオンを増幅する必要はなく、従って、非特許文献1、2に記載されるPMCA、即ち、インキュベーションと超音波による分散とを何度も繰り返す処理は必ずしも行う必要はないことは理解されるべきである。被検試料にもよるが、本発明の方法に於ける転換反応処理は、PMCAに於ける最初のインキュベーションを行うだけでも検出可能な場合があると考えられる(勿論、被検試料溶液のインキュベーションと超音波分散処理を繰り返してもよい。)。更に、本発明の方法に於いては、被検試料を化学的に改変したり、被検試料から正常型プリオンを除去する処理を必要としていないので、蛍光測定前に被検試料中の異常型プリオンを損失してしまう可能性も極めて少ないので、検出可能な被検試料中の異常型プリオンの量は、従前の方法に比して更に低減される。
【0035】
上記の本発明の方法によれば、蛍光標識される正常型プリオンと、プリオン病未感染の脳、脊髄等のプリオンを豊富に含む組織又は体液試料が入手可能な任意の動物について異常型プリオンの存否の検出又は判定を行うことが可能となる。
【0036】
上記に説明した本発明の異常型プリオンの検出方法は、具体的には、以下の手順の如く行われてよい。なお、以下の実施例は、ハムスターの異常型プリオンの検出の例であるが、本発明の範囲を限定するものではないことは理解されるべきである。
【実施例1】
【0037】
1種類の蛍光色素により蛍光標識された正常型プリオンを用いた異常プリオンの検出
プローブ試料の調製
プローブ試料となる蛍光標識正常型プリオンは、非特許文献4に掲載のプリオン塩基配列に基づき、ピンポイント蛍光標識キット(オリンパス)を用いて蛍光色素TAMRAにて正常型プリオンを蛍光標識することにより得られる。調製された蛍光標識正常型プリオンは、希釈バッファ(PBS(sigma),1% Triton X-100, Complete Protease Inhibitor Cocktail(Roche))中で100nMとなるよう調製する(なお、蛍光標識正常型プリオンは、下記の実施例2の如く正常型プリオンを抽出精製後、ケミカルラベリング法により調製されてもよい。)。また、正常型プリオンを含有する体液は、試験管内に於いて、プリオン病未感染ハムスターの脳組織200mgに800μlの希釈バッファを加え、超音波破砕器で組織が均一な乳剤状になるまで超音波処理される。その後、乳化された脳組織溶液は、希釈バッファにより1%程度に希釈される(希釈脳乳化溶液)。
【0038】
被検試料の調製
被検動物よりEDTA入り採血管(ベクトン・ディッキンソン)を用いて採血された血液1mlが、25℃で500×g、5分間遠心されて、白血球層(バフィーコート)画分が採取される。採取されたバフィーコート画分は、凍結融解を3度繰り返し100000g 4℃ 1時間の条件で遠心される。その沈殿物が採取され被検試料として使用される。
【0039】
転換反応
採取した沈殿物全量(被検試料)に対し、100μlの希釈脳乳化溶液と10μlの蛍光標識正常型プリオン溶液を混合し(被検試料溶液)、37℃で30分インキュベーションする。
【0040】
蛍光測定・分析
(1)FCSによる測定・分析
反応させた被検試料溶液を希釈バッファで10倍に希釈し、そのうちの50μlの試料の蛍光強度を、一分子蛍光分析システムMF20(オリンパス)を用いて、FCSに従って計測する。一分子蛍光分析システムは、測定された蛍光強度の自己相関関数を内部のプログラムに従って計算し、並進拡散時間を算出する。蛍光標識正常型プリオンが溶液中で単独でブラウン運動している場合、その分子量(3.3〜3.5万)から推定して並進拡散時間は370μ秒程度となる。一方、蛍光標識正常型プリオンが50個程度の凝集体に組み込まれたとすると、そのときの蛍光強度の自己相関関数より算出される並進拡散時間は、1360μ秒程度となると推定される。かくして、もし被検試料に異常型プリオンが含まれており、転換反応により蛍光標識正常型プリオンが数個程度の凝集体に組み込まれたとすると、並進拡散時間が長くなり、蛍光標識正常型プリオンが異常型に転換され凝集していることが検出される。即ち、被検試料に異常型プリオンが含まれていることが検出される。
【0041】
(2)FIDAによる測定・分析
上記と同様の蛍光測定用の試料標本の蛍光強度をFIDAに従って一分子蛍光分析システムMF20(オリンパス)を用いて計測する。一分子蛍光分析システムは、内部のプログラムに従って蛍光のフォトンカウンティングを行い、時間を変数として得られる受容光子数のヒストグラムから溶液中の蛍光発光体の数密度と、一発光体当たりの蛍光強度(単位時間当たりの発光光子数)を算出する。蛍光標識正常型プリオンが溶液中で単独でブラウン運動している場合、蛍光標識正常型プリオンのみでの1分子あたりの蛍光強度は、35kHz程度となると推定される。一方、4〜5個程度の蛍光標識正常型プリオンが一つの凝集体に組み込まれたとすると、一発光粒子(凝集体)の蛍光強度は126.1kHzとなると推定される。かくして、もし被検試料に異常型プリオンが含まれており、転換反応により蛍光標識正常型プリオンが凝集体に組み込まれたとすると、蛍光強度(単位時間当たりの発光光子数)が蛍光一分子の場合よりも大きい発光粒子(凝集体)が検出され、蛍光標識正常型プリオンが異常型に転換され凝集していることが検出される。即ち、被検試料に異常型プリオンが含まれていることが検出される。
【実施例2】
【0042】
異なる蛍光色素により蛍光標識された2種類の蛍光標識正常型プリオンを用いた異常プリオンの検出
処理過程は、プローブ試料として二種類の蛍光標識正常型プリオンを用いる点を除いて、転換反応の過程までは、実施例1と同様である。プローブ試料としては、ローダミングリーン(インビトロジェン)が付加された蛍光標識正常型プリオンと、alexa647(インビトロジェン)が付加された蛍光標識正常型プリオンが用いられる。蛍光標識正常型プリオンの調製は、以下の通りに抽出精製した正常型プリオンに蛍光色素をケミカルラベリング法により付加することにより行われてよい。
【0043】
正常型プリオンの抽出精製の操作手順は以下の通りである(非特許文献5参照)。
(1)正常なハムスターの脳100gに900gのバッファー(ショ糖、0.1mg/ml TPCK(sigma)、1mM PMSF(sigma)、10mM リン酸ナトリウム(pH7.0)、0.15M NaCl)を加え、ポリトロンを用い組織を破砕し、しかる後、試料を3000×gで30分間遠心分離し、上澄みを回収する。
(2)回収した上澄みにPEG−8000を4%になるよう加え、4℃にて15分間攪拌し、しかる後、1400×gで10分間遠心分離し、沈降物を回収する。
(3)沈降物を、ZW3−12バッファー(0.15M NaCl、10mM リン酸ナトリウム(pH7.0)、0.1mg/ml TPCK、1mM PMSF、8% ZW3−12(N-Dodecyl-N,N-dimethyl-3-ammonio-1-propanesulfonate)(sigma))にて、ZW3−12の重量:沈降物の重量=10:1となるように希釈し、4℃で1時間攪拌した後、100000×gで1時間、遠心分離し、上澄みを回収する。
(4)回収した上澄みを、銅イオンを吸着させバッファーA(0.15M NaCl、10mM リン酸ナトリウム(pH7.0)、0.2% ZW3−12)で平衡化させたキレーティングセファロースファストフロー(Chelating Sepharose Fast Flow)カラム(GE Healthcare Life Sciences)に加える。
(5)(3)で回収された上澄みが与えられた(4)のカラムを、バッファーAに10mMイミダゾールを加えたバッファーで洗浄し、次いで、0.5M NaCl、0.2% ZW3−12のバッファーで洗浄し、最後に10mMリン酸ナトリウムバッファー(pH7.0)にて洗浄する。
(6)しかる後、50mM EDTA、0.2% ZW3−12、10mMリン酸ナトリウム、0.2M NaClを含むバッファーをカラムに適用すると、カラムから正常型プリオンが溶出される。
なお、蛍光標識正常型プリオンの調製に用いる正常型プリオンは、市販の抽出精製されたもの(例えば、JENA BIOSCIENCE社のNative PrPc hamster recombinant)を用いてもよい。
かくして、得られた正常型プリオンは、ケミカルラベリング法により上記の蛍光色素が付加される。
【0044】
蛍光測定・分析
上記と同様に調製された蛍光測定用の試料標本中の二つの蛍光色素の蛍光強度をFCCSに従って一分子蛍光分析システムMF20(オリンパス)を用いて計測する。一分子蛍光分析システムは、2種類(2つの波長帯)の蛍光強度の相互相関関数を内部のプログラムに従って計算する。蛍光標識正常型プリオンが溶液中で単独でブラウン運動している場合、相互相関関数の値は、実質的に1になるが、一つの凝集体に色の異なる色素が付加されたプリオンが組み込まれたとすると、相関関数は、1より大きい有意な値となる。かくして、もし被検試料に異常型プリオンが含まれており、転換反応により2種類の蛍光標識正常型プリオンが一つの凝集体に組み込まれたとすると、相互相関関数が1より大きくなり、蛍光標識正常型プリオンが異常型に転換され凝集していることが検出される。即ち、被検試料に異常型プリオンが含まれていることが検出される。
【図面の簡単な説明】
【0045】
【図1】図1は、本発明の方法の好ましい実施形態に於ける処理過程をフローチャートの形式にて示したものである。
【図2】図2は、被検試料に異常型プリオンが存在している場合の図1の実施形態の処理過程中に於けるプリオン分子の状態の変化を模式的に表したものである。(a)は、蛍光標識された正常型プリオン、(a’)は、任意に添加される正常型プリオン含有の体液試料、(b)は、被検試料を表している。(a)、(a’)、(b)が混合されて調製された被検試料溶液(c)が、転換反応が発生する条件(d)に曝されると、(d)の下図に示されている如く、正常型プリオンが異常型に転換し、凝集体を形成する(e)。
【図3】図3は、二つの異なる蛍光標識がそれぞれ別々に付加された正常型プリオンをプローブとして用いた場合の図2と同様の図である。
【特許請求の範囲】
【請求項1】
異常型プリオンを検出する方法であって、
異常型プリオンを含むか否かが検査されるべき被検試料と、蛍光標識された正常型プリオンとを混合して被検試料溶液を調製する過程と、
前記被検試料溶液を異常型プリオンが正常型プリオンを異常型プリオンへ転換する反応条件に曝す過程と、
前記反応条件に曝された前記被検試料溶液中の前記蛍光標識された正常型プリオンに付加された蛍光標識の蛍光強度を測定する過程と、
前記蛍光強度に基づいて前記蛍光標識された正常型プリオンが前記被検試料溶液中に於いて単独で存在しているか又は凝集体に組み込まれているかを判定する過程とを含み、
前記蛍光標識された正常型プリオンが凝集体に組み込まれていると判定されたときには、前記蛍光標識された正常型プリオンを異常型プリオンへ転換する異常型プリオンが前記被検試料に含まれていたと判定する方法。
【請求項2】
請求項1の方法であって、前記被検試料溶液を調製する過程に於いて、更に、正常型プリオンを含む動物の体液試料を混合することを特徴とする方法。
【請求項3】
請求項2の方法であって、前記正常型プリオンを含む動物の体液試料がプリオン病未感染の動物から採取された脳組織から調製された試料であることを特徴とする方法。
【請求項4】
請求項1の方法であって、前記被検試料が動物より採取された動物の組織又は体液であることを特徴とする方法。
【請求項5】
請求項4の方法であって、前記被検試料が異常型プリオンを有するか否かが判定される動物より採取された該動物の血液であることを特徴とする方法。
【請求項6】
請求項1の方法であって、前記蛍光強度を測定する過程に於いて、前記蛍光強度の測定が蛍光相関分光法により行われることを特徴とする方法。
【請求項7】
請求項1の方法であって、前記蛍光強度を測定する過程に於いて、前記蛍光強度の測定が蛍光強度分布分析法により行われることを特徴とする方法。
【請求項8】
請求項7の方法であって、前記蛍光標識された正常型プリオンの各分子の蛍光標識の数が互いに等しいことを特徴とする方法。
【請求項9】
請求項1の方法であって、前記蛍光強度を測定する過程に於いて、前記蛍光強度の測定が蛍光偏光解消法により行われることを特徴とする方法。
【請求項10】
請求項1の方法であって、前記被検試料溶液を調製する過程に於いて前記被検試料溶液へ混合される前記蛍光標識された正常型プリオンが、少なくとも2種類の蛍光波長特性の異なる蛍光標識にて標識された別々の正常型プリオンを含み、前記蛍光強度を測定する過程に於いて、前記蛍光強度の測定が蛍光相互相関分光法により行われることを特徴とする方法。
【請求項11】
請求項1の方法であって、前記反応条件が前記被検試料溶液を少なくとも30分間37℃にてインキュベーションすることである方法。
【請求項1】
異常型プリオンを検出する方法であって、
異常型プリオンを含むか否かが検査されるべき被検試料と、蛍光標識された正常型プリオンとを混合して被検試料溶液を調製する過程と、
前記被検試料溶液を異常型プリオンが正常型プリオンを異常型プリオンへ転換する反応条件に曝す過程と、
前記反応条件に曝された前記被検試料溶液中の前記蛍光標識された正常型プリオンに付加された蛍光標識の蛍光強度を測定する過程と、
前記蛍光強度に基づいて前記蛍光標識された正常型プリオンが前記被検試料溶液中に於いて単独で存在しているか又は凝集体に組み込まれているかを判定する過程とを含み、
前記蛍光標識された正常型プリオンが凝集体に組み込まれていると判定されたときには、前記蛍光標識された正常型プリオンを異常型プリオンへ転換する異常型プリオンが前記被検試料に含まれていたと判定する方法。
【請求項2】
請求項1の方法であって、前記被検試料溶液を調製する過程に於いて、更に、正常型プリオンを含む動物の体液試料を混合することを特徴とする方法。
【請求項3】
請求項2の方法であって、前記正常型プリオンを含む動物の体液試料がプリオン病未感染の動物から採取された脳組織から調製された試料であることを特徴とする方法。
【請求項4】
請求項1の方法であって、前記被検試料が動物より採取された動物の組織又は体液であることを特徴とする方法。
【請求項5】
請求項4の方法であって、前記被検試料が異常型プリオンを有するか否かが判定される動物より採取された該動物の血液であることを特徴とする方法。
【請求項6】
請求項1の方法であって、前記蛍光強度を測定する過程に於いて、前記蛍光強度の測定が蛍光相関分光法により行われることを特徴とする方法。
【請求項7】
請求項1の方法であって、前記蛍光強度を測定する過程に於いて、前記蛍光強度の測定が蛍光強度分布分析法により行われることを特徴とする方法。
【請求項8】
請求項7の方法であって、前記蛍光標識された正常型プリオンの各分子の蛍光標識の数が互いに等しいことを特徴とする方法。
【請求項9】
請求項1の方法であって、前記蛍光強度を測定する過程に於いて、前記蛍光強度の測定が蛍光偏光解消法により行われることを特徴とする方法。
【請求項10】
請求項1の方法であって、前記被検試料溶液を調製する過程に於いて前記被検試料溶液へ混合される前記蛍光標識された正常型プリオンが、少なくとも2種類の蛍光波長特性の異なる蛍光標識にて標識された別々の正常型プリオンを含み、前記蛍光強度を測定する過程に於いて、前記蛍光強度の測定が蛍光相互相関分光法により行われることを特徴とする方法。
【請求項11】
請求項1の方法であって、前記反応条件が前記被検試料溶液を少なくとも30分間37℃にてインキュベーションすることである方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2010−43865(P2010−43865A)
【公開日】平成22年2月25日(2010.2.25)
【国際特許分類】
【出願番号】特願2006−334300(P2006−334300)
【出願日】平成18年12月12日(2006.12.12)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
【公開日】平成22年2月25日(2010.2.25)
【国際特許分類】
【出願日】平成18年12月12日(2006.12.12)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
[ Back to top ]

