異常細胞検出システム及び方法
正常な細胞の成長、発達及び機能時には同一細胞内に発生しない、又はめったに発生しない2種以上の生物学的マーカーが、前新生物又は新生物病変が存在している可能性のある局所的部分の一部である細胞の存在を示すことについて、細胞のクラスターを調査するシステム及び方法。細胞間の関係は、細胞のクラスターを調査する間、維持されて、想定される形成異常の存在についての調査及び特定が容易になる。
【発明の詳細な説明】
【技術分野】
【0001】
本開示は、概して、身体内、例えば頚部内の異常組織の検出に用いられる細胞サンプリング及びスクリーニングに関する。より詳細には、本開示は、収集された細胞のクラスターの空間的配置が保たれるように収集し、2つ以上の特徴の発現に関して、そのようなクラスターの生物学的な特性を調べるシステム及び方法に関する。
【背景技術】
【0002】
多くの疾患及び異常について、スクリーニングを行ない、それらを検出し、それらの根本的な治療を行うため、多くの場合、患者から様々な細胞サンプルを収集することが必要である。細胞サンプル収集の主な理由の1つは、癌について患者のスクリーニングを行なうためである。例えば、固形腫瘍の存在を示唆する異常細胞の存在に関し、尿、痰、乳頭及び細針吸引物、及び子宮頚部の剥離細胞が、細胞スクリーニング技師及び病理学者によってスクリーニングされる。そのような疑わしい細胞が発見された場合、病変ではないかと思われる組織のサンプルを切除し、そのサンプルを病理学者による調査に委ねることにより、より決定的な診断に至る。
【0003】
あらゆるスクリーニング試験又は予備診断試験についての重要な問題は、疾病を検出するのに充分な感度を有しながらも、精神的又は身体的負担を与えるほどの高頻度で非罹患者を分類しないだけの充分な特有性を有する必要があることである。このことは、疾病の存在を疑うためのより高度な指標を考慮せず、多くの人々に日常的に適用されている、(一般的にパップ試験と呼ばれる)頚部細胞診といったようなスクリーニング試験について特に当てはまる。
【0004】
一般に、癌の最も早期段階での診断は、効果的な治療の好機をもたらすと認められている。従って、固形腫瘍を早期に診断することは、細胞レベルでは周囲の組織とそれ程異ならない局所的な異常を認識することに相当する。このことは、隣接する細胞とのあらゆる関連及び比較が失われた細胞サンプルのスクリーニングについて、課題を呈する。この問題への1つの取り組み方は、要素、すなわち、より密接に近似した無傷の組織要素である細胞群に的を絞ることである。実際、そのような細胞のクラスターの存在それ自体が、前癌又は癌症状を示唆すると考えることができる。しかし、正常な組織要素が、細胞学的分析のために収集されたサンプル中で細胞クラスターとなり得ることも事実である。
【0005】
前新生物の病変は、特異な生物学的特徴を呈する。新生物の進行の初期段階である形成異常は、同一組織内に存在する正常細胞とは個々に最小限にしか異ならない細胞を含む。形成異常病変と、形状が変化している(化生)又は活発に増殖している(過形成)正常組織要素との主な相違点は、異常細胞成長及び回転を含む、特徴的な蛋白質を発現する細胞の画分における不均衡である。正常成長及び機能を示す形態学的(例えば、有糸分裂像)又は生化学的(例えば、Ki−67増殖抗原)マーカーと、アポトーシス過程による細胞回転を示す形態学的(例えば、アポトーシス小体)又は生化学的(例えば、活性型カスパーゼ3)インジケーターとの混合が形成異常の特性を示すことは、無傷組織を調べる病理学者によって充分に認識されている。
【発明の開示】
【発明が解決しようとする課題】
【0006】
今日のスクリーニング手順において用いられる従来のサンプリング法は、病変から細胞を採取するが、その後、これらの細胞を、典型的には、ずっと数の多い、病変の境界外から得た正常細胞の中に分散させるものである。この分散により、サンプルの評価は、希少事象の検出の実習、すなわち、非常に多数(例えば、50,000〜300,000)の正常細胞からなる背景内の1つ又は僅かの異常細胞の発見に終わってしまう。また、そして恐らく最も重要なことに、分散により、前新生物の病変であるかもしれない小部分の生物学的特性を求めることから得ることができる情報が排除されてしまう。この極めて重要な情報は、細胞間の関係に存在し、組織内の近隣の細胞から孤立した個々の細胞を調べることによっては識別できない。また、分散により、サンプルを用いて患者の病変の位置を特定することも妨げられる。
【0007】
従って、サンプル組織における形成異常を示す細胞クラスターの存在に関して、前新生物の病変の特異な生物学的特徴を、細胞のクラスターを収集し、分析し、細胞サンプルのスクリーニングを行なう手段と組み合わせることも望ましいであろう。
【課題を解決するための手段】
【0008】
本発明は、サンプル組織における形成異常を示す細胞クラスターの存在に関して、細胞サンプルのスクリーニングを行なうシステム及び方法に関する。細胞のクラスターを、正常な細胞の成長、発達及び機能時には同一細胞内に発生しない、又はめったに発生しない2種以上の生物学的マーカーが、前新生物又は新生物病変(以下、「形成異常」)が存在している可能性のある局所的部分の一部である細胞の存在を示すことについて調査する。細胞間の関係は、細胞のクラスターを調査する間、維持されて、想定される組織の形成異常の存在についての調査及び特定が容易になる。
【0009】
ここに述べる概念は、同一細胞内に共発現せず、又はめったに共発現せず、その発現が、形成異常において不均衡になる生物学的マーカーを用いて実施することができる。スクリーニングされる2種以上のマーカーは、異常細胞成長及び回転を含む特徴的な蛋白質を発現する細胞の断片における不均衡から得ることができる。例えば、正常成長及び機能を示す形態学的(例えば、有糸分裂像)又は生化学的(例えば、Ki−67増殖抗原)マーカーと、アポトーシス過程による細胞回転を示す形態学的(例えば、アポトーシス小体)又は生化学的(例えば、活性型カスパーゼ3)インジケーターとの混合が形成異常の特性を示す。
【0010】
ここに述べる概念は、身体の多くの部位、例えば、頚部、膀胱、肺、結腸、卵巣、及び乳房における形成異常についてのスクリーニングに用いることができる。細胞のクラスターは、自然発生したものを分析することも、組織、尿、誘発痰、乳房の分泌物、卵巣由来の洗浄細胞等を、好適な収集器を用いて収集したものを分析することもできる。
【0011】
細胞収集器は、好ましくは、細胞クラスター又は凝集塊の完全性を維持し、収集された細胞のクラスターの、受け構造体、例えば、スライド上への移着を容易にする収集器の性能を向上させるように設計される。一実施形態において、収集器の材料と、収集器の収集表面の質感と、収集時に収集器の拡張及び回転を用いることとを組み合わせることにより、細胞のクラスターの収集が容易になる。好ましくは、収集器は、子宮内頚部及び子宮外頚部の部位から得た細胞クラスターが、次に続く受け構造体への移着のため、概ね共通の平面上にあるように、移着時に拡張させることができる。好ましくは、細胞のクラスターは、サンプリング前にクラスター内の細胞間に存在していた空間的関係を維持するように、収集器から受け構造体へ移着させる。収集器及び受け構造体上の位置合わせ指標は、移着時、空間的関係を維持するのに役立つ。
【0012】
収集器は、収集時及び細胞の移着時に拡張される。収集及び移着時の拡張は、空気の使用、機械的拡張システム、又は空気と機械的システムとの組み合わせによって起すことができる。
【発明を実施するための最良の形態】
【0013】
I.概説
癌は、細胞ではなく組織の疾患である。病理学者による固形腫瘍の診断は、病変の構成、具体的には、病変内の細胞が周囲の正常細胞とどのように異なるかの認識によって決まる。用いられる基準には、形態学、細胞構造を認識するための細胞化学染色、及び細胞遺伝物質の発現パターン及び組織を特定するための抗体及び核酸プローブの使用が含まれていた。
【0014】
新生物の進行は、発生期の腫瘍内の細胞が、正常な調節シグナル及び因子に応答することなく、より一層増殖し、周囲の組織要素を侵略し、血管化され、転移することを可能にする遺伝的及び後成的変化が増大することに相当する。ところが、この過程の最も早い段階において、周囲の正常細胞と最小限にしか異なっていなかった前駆体細胞のクローン増殖により、形成異常の病変が発生する。
【0015】
癌についての、その最も早い段階におけるスクリーニングでは、その数が、物理的に識別可能又は臨床的に発症するところまではクローン増殖していない希少な形成異常細胞を認識する必要がある。そのような細胞を認識するための手段は、これらの細胞と近隣の正常細胞とが最小限にしか異ならないというまさにその本質により、形態学的及び生物学的基準に関して限定される。
【0016】
本発明の概念は、細胞のクラスターを分析して、正常組織内の任意の1箇所における同一細胞においてめったに共発現しない2種以上の生物学的マーカーを探すことによって、形成異常の前癌性病変を正常組織要素と区別することができるというものである。例えば、細胞のクラスターを、形成異常が存在している可能性がある局所的部分の一部である個々の細胞の存在を示す2種以上の生物学的マーカーについて調査することができる。以下の記述及び実施例において、概念を説明する目的で、成長及びアポトーシスを2種以上の生物学的マーカーとする。しかしながら、同一細胞においてめったに共発現しない2種以上のその他の生物学的マーカーを用いることができ、マーカーとしての細胞成長及びアポトーシスと共に用いることもできるであろうことが理解されるべきである。
【0017】
ここに述べる概念は、身体の多くの部位に由来する形成異常の前癌性病変についてのスクリーニングに用いることができる。説明する目的で、子宮頚癌についてスクリーニングを行なうために頚部から細胞のクラスターを収集することに関し、発明概念を以下に述べる。しかし、発明概念は、身体のその他の部位、例えば、膀胱癌についてのスクリーニングのために膀胱、肺癌についてのスクリーニングのために肺、結腸癌についてのスクリーニングのために結腸、そして卵巣癌についてのスクリーニングのために卵巣に由来する細胞のクラスターを調べることにより、形成異常に関してスクリーニングを行なうことに用いられ得ることが理解されるべきである。細胞のクラスターは、組織、尿、誘発痰、卵巣由来の洗浄細胞等から収集することができる。
【0018】
細胞のクラスターは、細胞のクラスター又は凝集塊を採集し、収集された細胞のクラスターの受け構造体、例えば、スライド上への移着を容易にする収集器の能力を向上させるよう設計された収集器を用いて収集される。一実施形態において、収集器の材料と、収集器の収集表面の質感と、収集時に収集器の拡張及び回転を用いることとを組み合わせることにより、細胞クラスターの収集が容易になる。好ましくは、細胞のクラスターは、サンプリング前にクラスター内の細胞間に存在していた空間的関係を維持するように、収集器から受け構造体へ移着させる。収集器及び受け構造体上の位置合わせマークは、移着時、空間的関係を維持するのに役立つ。
【0019】
頚部上の形成異常の病変の場合、本発明の概念に係る頚部分析システムは、細胞収集器、収集された細胞のクラスターを収集器からそこへ移着させる受け構造体、試薬及びスキャナー装置を包含し、これらは統合的に、(1)頚部である子宮内頚部及び子宮外頚部の部分から細胞のクラスターを得、(2)収集器上と受け構造体に移着させた際の、収集された細胞クラスター間の空間的関係を維持し、(3)細胞に何らかの異常の徴候がある場合に確立される細胞クラスターの分子的特性を調べ、そして(4)これを、臨床医が、頚部のどこに形成異常の病変が存在している可能性があるのか確認することができるように行なう。
【0020】
頚部分析システムは、試料に存在する細胞クラスターのスクリーニングに対する取り組み方の一実施形態であり、近隣の細胞の生物学的特性における特徴的な不均衡を明らかにするバイオマーカーを適用することにより、形成異常の病変を確認するために行うものである。
【0021】
図1A〜1Cは、子宮頚部50から細胞クラスターを収集する概念を示す。図1Aは、子宮52によって形成される頚部50を示しており、頚部は、子宮頚管60、子宮内頚部56、子宮外頚部62、及び子宮外頚部から子宮内頚部へ延びる陰影を付けて示した移行ゾーン58を含む。頚部である子宮内頚部56における移行ゾーン58内に、例示的な病変54が示されている。
【0022】
図1Bは、頚部50から細胞及び細胞クラスターを収集するのに用いることができる細胞収集器100の概念を示す。収集器100は、表面104を有し、表面104は、頚部の輪郭に適合することができ、子宮外頚部及び子宮内頚部62及び56の両方から細胞のクラスターを表面104によって収集して、収集された細胞クラスター間の空間的関係を保ちながら、移行ゾーン58から確実に細胞クラスターを収集する特性を有する。
【0023】
更に、収集器100は、視覚的に認識可能な位置合わせマーク106を有しており、細胞のクラスターを収集している個人が、頚部のサンプリングを行なう際、収集器の位置を合わせ、続いて細胞クラスターを、図1Cに示すような対応する位置合わせマーク108を同様に含む受け構造体101に移着させる際に、その位置を維持することを可能にする。細胞クラスターは、表面104上に付着したままではなく、表面104を、細胞クラスターが構造体101に移着するように構成された受け構造体101に接触させることによって、受け構造体101に移着させることができる。移着時、位置合わせマーク106及び108は位置合わせされており、その結果、構造体101上の細胞クラスターは、一旦移着させた後、それらが収集器100上で有していたのと同じ空間的関係を有する。その後、細胞クラスターを分析して、潜在的異常についてスクリーニングを行なうことができる。
【0024】
細胞収集器100は、子宮内頚部及び子宮外頚部56及び62の両方から細胞のクラスターを収集して、移行ゾーン58からの細胞クラスターの収集を確実に行なうことができる限り、多くの異なった構成を有し得る。一実施形態において、収集器表面104の材料と、収集器表面104の質感と、収集時に収集器表面の拡張及び回転を用いることとを組み合わせることにより、細胞のクラスターの収集が容易になる。
【0025】
II.実施形態1
A.収集
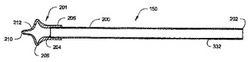
さて、図2A〜2Cは、本発明の概念を具現化する頚部細胞収集器アッセンブリ150の詳細を示している。収集器アッセンブリ150は、拡張可能収集先端部201に取り外し可能に連結された中空のチューブ200を含む。チューブ200は、例えば、プラスチック又は厚紙で作られる。収集器150の細胞収集領域でもある拡張可能先端部201は、例えば、イリノイ州、マクヘンリー(McHenry)のGLS社(GLS Corporation)から入手可能なヴァーサフレックス(Versaflex)(登録商標)CL30のような熱可塑性エラストマー混合物であるエラストマー材料でできた弾性的可撓性のある構造体である。拡張可能先端部201は、好ましくは、先端部201の拡張及び回転の際、移行ゾーン58から細胞のクラスターを収集する収集器の能力を向上させる質感を有する。例えば、先端部201は、MT−11010の質感を有し得る。先端部201には、その他のエラストマー材料、例えば、微孔質ポリ酢酸ビニル、ニトリルゴム、ニトリルフォーム、ウレタンフォーム、シリコーンゴム、ラテックスゴム、ポリウレタン、及び細胞クラスターの収集を促進する低いデュロメーター硬度、高い伸び率及び適切な質感を有するその他のエラストマーを用いることができるであろう。
【0026】
チューブ200は、一般に、一端部202から他端部204まで中空であり、チューブ200の端部202は開口している。特に図2Cに関し、拡張可能先端部201は、その形成時の状態で、チューブ200の端部204に取り外し可能に連結された首部206、中央延伸肩部208、先端部領域210、及び肩部208と先端部領域210との間に延びる移行部分212を含む。図9に示すように、チューブ200上に先端部201を保持するのに役立つように、収集先端部201の首部206の周りにOリング214を嵌めることができる。
【0027】
図3〜5は、細胞サンプルを採取するのに用いられる収集器ハンドルアッセンブリ303上に配置された頚部細胞収集器アッセンブリを示す。アッセンブリ303は、内側ケーシング308と外側ケーシング307とを含み、チューブ200が外側ケーシング307の周りに嵌装され、外側ケーシング307が内側ケーシング308上に摺動可能に配置されている。探針306は、内側ケーシング308の内側から前方に、拡張可能先端部201の内部へと突出している。エキスパンダー探針305は、探針306を包囲して、アッセンブリ303の端部に配置され、探針305の端部320は、外側ケーシング307内の外側ケーシング308の端部に配置されている。探針の反対側の端部322は、延出されており、肩部324を含む。
【0028】
探針306は、およそ2mmの直径を有し、エキスパンダー探針305の端部を越えておよそ8から10mmまでの間の距離だけ突出することができる。肩部324より前方のエキスパンダー探針305の本体の直径はおよそ6mmであり、一方、肩部324の直径はおよそ10mmである。
【0029】
コイルばね326は、エキスパンダー探針305を、図3及び図5A〜5Cにおける左側へ偏らせるために、肩部324と外側ケーシング307の端部との間に配置されている。更に、コイルばね328が、内側ケーシング308の内側に、探針306の端部と内側ケーシング内に配置された固定リング330との間に配置されている。ばね328は、探針306を、図3及び図5A〜5Cにおける左側へ偏らせる。
【0030】
外側チューブ307は、チューブロック309も含む。チューブロック309は、外側チューブ307に固定された弾性部材を含み、この弾性部材は、収集器150のチューブ200に形成された開口332(図2B参照)を通って上方に突出している。チューブロック309と開口332とは協同してチューブ200をハンドルアッセンブリ303の外側チューブ307に固定する。
【0031】
図3に戻って、外側チューブ307内に、内側チューブ308の端部と、外側チューブ307の端部に配置されたばねキャップ311との間に、戻しばね310が配置されている。ばね310は、外側チューブ307を、図3における右側に向かって偏らせ、一方、内側チューブ308を左側に向かって偏らせて、外側及び内側チューブ307及び308を図3に示す定位置に戻す。
【0032】
ハンドル312は、内側チューブ308に連結された支持体313に固定されている。ハンドル312は、図3に示す位置と、ハンドル312がケーシング307及び308と概ね平行となる折り畳み位置との間で回転できるように、ピボット314によって支持体313に回転可能に固定されている。外側チューブ307は、外側チューブ307と支持体313との間の相対的な摺動運動を可能にするスロット315と共に形成されている。スロット315は、図3において、支持体313の右側にキャップ311まで延びている。
【0033】
図3及び4において最もよく分かるように、外側チューブ307の直径は、収集器150のチューブ200を受けるよう設計された小径部分から、ハンドル213に近接し、図3において支持体313の右側に延びる大径部分まで変化する。小径部分と大径部分との間の変化によって、チューブ200の端部がそこで止まる肩部216(図4)が形成される。望ましい場合、チューブ200の端部202は、肩部216によって形成される角度と一致するように角度を付けることができる(図16〜18参照)。肩部216の角度とチューブ200上の角度は、収集器アッセンブリ150のハンドルアッセンブリ303上での適正な位置合わせを確実に行うのに役立つように、収集器アッセンブリ150をハンドルアッセンブリ303上に摺動させる際に位置合わせすることができる。
【0034】
図4は、ばねキャップ311を親指で押した状態でハンドル312を保持する手の模式図である。図5A〜5C及び図6A〜6Cは図4と共に、細胞収集器アッセンブリ150を用いた収集過程を示す。使用者は、初めに、細胞収集器アッセンブリ150をハンドルアッセンブリ303に挿着する。それを行なう際、探針306の端部は、拡張可能先端部201の先端部領域210に嵌合し、それによって、図5A及び6Aに示すように、拡張可能先端部は平らに延ばされ、先端部201上の肩部208が一時的に縮小する。これによって、頚部内へ収集器を挿入するための使用者の視線が向上する。
【0035】
使用者は、その後、図4に示すように、親指又は他の指でばねキャップ311上を押す。これによって、図5Bに示すように、外側ケーシング307が、エキスパンダー探針305と共に前方に移動する。探針305が前方に移動すると、それによって、図5B及び6Bに示すように、拡張可能先端部201の肩部208が、その平らな状態から外に向かって拡張する。エキスパンダー探針305は、図5Bに示すように、およそ8から10mm移動した後、探針306の端部と面一になると底に達する。エキスパンダー探針305は、拡張可能先端部201が子宮内頚管に接触した状態で、子宮内頚管をおよそ6mm広げる。一旦、探針305が底に達した後、引き続き親指で押し続けると、外側ケーシング307が更におよそ3から4mm移動を続け、同時に、チューブ200が前方に押される。その結果、図6Cに示すように、肩部208及び/又は拡張可能先端部201の移行部分212は、子宮外頚部62に押し付けられる。
【0036】
エキスパンダー探針305は、その移動時、拡張可能先端部201の先端部領域210を広げて子宮内頚部56と嵌合状態にさせる。更に、肩部208及び/又は拡張可能先端部201の移行部分212は、頚部50の外表面を圧迫する。その結果、移行ゾーン58からの細胞を含む子宮内頚部及び子宮外頚部両方の細胞を収集することができる。
【0037】
また、先端部201の質感を利用して、移行ゾーン58からの細胞クラスターをせん断することによって、移行ゾーンから細胞のクラスターを収集するために、拡張可能先端部201を収集時に回転させる。先端部201は、例えば、20から30度回転させる。先端部201は、使用者が手動でハンドルアッセンブリ303及びそれに連結された収集器アッセンブリ150を回転させることによって回転させることができる。代替的には、先端部201は、一旦、先端部201の先端部領域210、肩部208及び移行部分212をハンドルアッセンブリ303によって拡張させて子宮内頚部及び子宮外頚部と接触させた後、先端部201を回転させる好適な機械的回転機構を用いて回転させることができる。
【0038】
図20Aから20Cに、機械的回転機構の例を示す。図20Aは、ハンドルアッセンブリ250上に配置された収集器アッセンブリ150を示す。アッセンブリ250は、U字型端部252及び拡張及び回転部254を含んでおり、拡張及び回転部254は、U字型端部252に回転可能に連結されて端部252に対する部分254の回転を可能にする。部分254の、先端部201に包囲されている端部は、図5A〜5Cに示したものと同様に構成される。部分254の反対側端部の外表面には、螺旋歯256が設けられている。
【0039】
握りスリーブ258は、部分252及び部分254上に、部分252と254とが連結する箇所を覆って摺動可能に配置されている。螺旋歯(図示せず)は、スリーブ258の内側表面上に、部分254上で歯256と噛合うよう配置されている。
【0040】
アッセンブリ250の使用時、収集器150をハンドルアッセンブリ250に装着後、使用者が探針を挿入すると、(図20A〜20Cに示された)探針305は前方に移動し、それによって、先端部201が拡張する(図20B)。使用者が引き続き押すことにより、先端部201は更に拡張して子宮外頚部に当たる(図20C)。子宮外頚部と嵌合状態になることにより、更なる挿入が防止され、それによって、握りスリーブ258が、図20Cの矢印の方向において前方に移動する。スリーブ258は、最終的に、螺旋歯256に接触するに足るだけ先まで移動する。スリーブ258が引き続き前進し、螺旋歯が噛合うことによって、図20Cに矢印で示すように、部分254が収集器150と共に回転する。
【0041】
挿入並びに細胞クラスター収集を実現するための拡張及び回転後、圧力が解除され、戻しばねが機構を元の位置に戻す。チューブロック309を押し下げ、その後、頚部細胞収集器150を取り外す。
【0042】
図21は、細胞収集器アッセンブリ150が装着された収集器ハンドルアッセンブリ400の別の実施形態を示す。アッセンブリ400は、その前端部にそらせ板404が連結された前部チューブ402を含む。ハンドルアッセンブリ400は、収集器アッセンブリ150のチューブ200をチューブ402の中に摺動させて収集器アッセンブリ150を装着するよう設計されている。収集器アッセンブリ150がアッセンブリ400に装着されると、そらせ板404が、先端部201上の肩部208を平らにして、収集時に挿入のための視線を向上させる。チューブ402は、その後端部付近にスロット406も含む。チューブ200がその周りに配置されるチューブ402の内部は、図5A〜5Cにおけるのと同様に構成されている。
【0043】
アッセンブリ400は、その前端部がチューブ402の後端部内に受けられた後部チューブ408も含む。スロット410が、後部チューブ408に形成され、ボタン412が、スロット410内に摺動可能に配置されている。ボタン412は、前部チューブ402のスロット406内に配置された突出部414に連結されている。
【0044】
ボタン412は、図20において、アッセンブリ400の挿着位置でもある定位置において示されている。適正に挿着後、使用者がボタン412を引き戻し、ボタン412がスロット410の端部の後部ボタン位置に移動する。ボタン412が、突出部414と連結しているため、突出部414も後方に移動し、これによって、前部チューブ402が、収集器アッセンブリ150に対して後方に引っぱられ、そらせ板404による収集先端部201のそれが解除される。続いて、使用者は、ボタン412を前方に押して、収集先端部201を拡張させる。ボタン412は、図5A〜5Cに示す拡張機構に、スロット410におけるボタンの定位置からボタンの最前方位置までに拡張が起こるように連結されている。
【0045】
一旦、ボタン412を最後まで前方に押して収集先端部を拡張させると、その後、先端部が回転する。先端部は、上述したように、後部チューブ408を手動で回転させることにより、手動で回転させることができる。代替的に、収集先端部を回転させるために、好適な機械的回転機構を設けることができる。
【0046】
B.移着
収集後、細胞収集アッセンブリ150を、次に続く細胞クラスターの分析のために、細胞クラスターを先端部201から受け構造体へ移着させるのに用いられる移着装置に装着する。好適な受け構造体の例としては、スライド、ペトリ皿、及び細胞クラスターを次に続く細胞クラスターの分析のために移着させてもよいその他の構造体が挙げられる。移着装置は、移着が、受け構造体から受け構造体へ等しい圧力で行なわれるよう構成される。また、受け構造体の表面は、先端部から受け構造体への細胞クラスターの移着を促進するため、細胞クラスターを含む先端部201の表面よりも大きい粘着力を有する。受け構造体がスライドである場合、スライドに、より大きな粘着力をもたらすコーティングを設けることができる。
【0047】
収集器アッセンブリ150の先端部201は、好ましくは、移着時、空気を用いて膨張させる。先端部201が、ヴァーサフレックス(Versaflex)(登録商標)CL30のような熱可塑性エラストマー混合物で作られている場合、エラストマーによって、膨張時、先端部の均等な拡張が可能になる。移着のための膨張時、先端部領域210及び移行部分212は実質的に消滅し(図7B参照)、その結果、次に続く細胞クラスターの受け構造体への移着に備えて、先端部領域210及び移行部分212上の細胞クラスターは概ね共通の平面上にあるようになる。このことは、細胞クラスターにおける細胞間の空間的関係を維持するのに役立つ。
【0048】
移着後、先端部201を、チューブ200から取り外し、先端部201上に残っている細胞クラスターを保存するための保存薬を含む容器に入れることができる。チューブ200はその後、廃棄でき、又は更なる収集のために、新たな先端部201に連結することができる。先端部201を保存する必要がない場合、先端部201は廃棄することができる。
【0049】
図7A〜7Kは、細胞収集器150を、収集された細胞のクラスターを示す着色マーカー及びマーキング液と共に用いた細胞クラスター移着の概念を示す。図7Aは、細胞収集器の先端部201を示し、先端部上に、収集された移行ゾーン細胞クラスターを示す着色マーカー500が付いている。図7Bは、膨張した先端部201を示し、着色マーカー500が微かではあるが、それでも視覚的に認識可能である。図7Cは、移着を視覚化するのに役立つように、移行ゾーン細胞クラスターを含むであろう箇所に添加されたマーキング液502を示す。図7Dは、スライド504の実際の大きさを表すために、膨張した先端部201が、マーキングされた紙上に押し付けられているところを示す。図7Eは、移着された細胞クラスターの痕跡を表すように、典型的なスライド504上に残った痕跡を示す。図7Fは、その元の大きさと形状に収縮した先端部201を示す。図7Gは、マーキング液(すなわち、細胞クラスターを表す)があった箇所及び移着されなかった箇所を示す先端部201の接写図である。図7Hに示すように、先端部201の先端部領域210及び移行ゾーン212の基部において、小範囲の「細胞クラスター」が移着しなかった。先端部領域210と移行ゾーン212との間に位置する臨界移行ゾーン「細胞クラスター」は、完全に移着した。図7I〜7Kは、マーキング液を用いた3つの別個の移着の結果を示す。
【0050】
図8は、細胞クラスター移着装置704の例を示す。この例において、頚部細胞収集器150のチューブ200上の開口322は、収集器150を移着装置上に位置合わせするために、移着装置704上の対応するマークと合わせされる位置合わせマークとしての役割を果たす。その生物学的特性及び細胞クラスターが収集された疑わしい箇所の解剖学的位置に基づいて認識された何らかの異常頚部細胞間の関係を維持するために正確な位置合わせが必要である。
【0051】
収集器150は、先端部201が、移着装置704の底部に置かれたコーティングされたスライド703の形態である受け構造体に面するように、装置704上に置かれる。装置704は、チューブ200を固定し、定位置に保持するクランプ機構705を含む。移着装置704は、先端部201を膨張させるために収集器150に空気を入れるよう構成された空気シリンダー装置701も含む。ハンドル702は、移着装置704に枢軸状に連結され、ロッド706は、空気シリンダー装置701内でピストンを作動させるために、ハンドルから空気シリンダー装置701内に延びている。使用者がハンドル702を押し下げると、空気シリンダー装置701内のピストンが作動し、先端部を膨張させるために、空気をチューブ200を通って収集器150内に、そして先端部201内に送り込む(図7B参照)。
【0052】
一旦、先端部201を膨張させた後、装置704に連結されたハンドル708を回転させる。ハンドル708の回転によって、収集器アッセンブリ150が装着された収集器装着機構が、ボール盤と同様に、スライド703に向かって移動する。最終的に、膨張した先端部は、図7Dに示したのと同様に、スライド703上に押し付けられる。その後、ハンドルを回転させて、収集器アッセンブリ150を後退させ、ハンドル703を開放して先端部201を収縮させる。
【0053】
図16〜19は、細胞クラスターの受け構造体上への移着の別の実施形態を示す。細胞収集器アッセンブリは、図17に示すように、装着プーリー1604の装着アーム1613上に摺動可能に配置される。装着アーム1613は、先端部201を膨張させるために、装着アーム1613の後端部を通って収集器150内へ空気を通過させるよう中空である。開口332は、装着アーム1613上の対応するマーク1606と合わせされて、細胞収集器をアーム1613上で位置合わせさせる。マーク1606は、開口332と嵌合するためのロックの一部を構成して、収集器を装着アーム1613上に固定する。
【0054】
装着プーリー1604は、ハンドル1610と、顕微鏡スライド1609を受ける支持表面とを有する回転台1608を含む。スライド1609は、好適な固定機構、例えば、クランプを用いて支持表面上の定位置に固定される。回転台1608は、支持プレート1611上に回転可能に取り付けられて、回転台1608のハンドル1610を用いた回転を可能にしている。支持アーム1607は、軸1612により、プレート1611に枢軸状に連結され、装着アーム1613が支持アーム1607から延びている。更に、空気ポンプ1650が支持アーム1607に連結され、空気ポンプ1650は、先端部201を膨張させるために装着アーム1613内に空気を入れるよう、装着アーム1613の後端部に流通連結されている。空気ポンプ1650は、電動又は使用者による手動で駆動することができるであろう。
【0055】
収集後、収集器を装着アーム1613上に装着し、定位置に固定する(図16)。その後、支持アーム1607を、下方に、反時計回りに、回転台1608上のスライド1609に向かって回転させる(図17)。スライドに接触する前に、収集器先端部1601を、空気ポンプ1650により適切な容積まで拡張させる。図18に示すように、先端部201は、細胞クラスター移着のための適正な角度で、スライド1609上で正確に位置合わせさせる。
【0056】
図19は、空気ポンプの他の具体化を示しており、先端部201は、プランジャ本体1903に規定されるプランジャ1901とプランジャチャンバ1902とを用いて拡張される。プランジャチャンバ1902は、支持アーム1607を、反時計回りに回転台1608に向かって回転させたとき、プランジャ1901及びプランジャ本体1902が圧縮されて、空気をプランジャチャンバ1902から装着アーム1613の背部内へと送り込んで、先端部201が、先端部をスライド1609に向かって下方に回転させるにつれて膨張するように、装着アーム1613の背部と流通している。
【0057】
一旦、先端部201が下方に回転してスライド1609と接触状態になった後、支持アーム1607を固定して、先端部201をスライド1609と接触したままの状態に維持する。その後、回転台1608を、ハンドル1610を用いて回転させる。支持アーム1607上に回転可能に取り付けられた駆動機構が、回転台1608と装着アーム1613との間に連結されて、装着アーム1613及びそれに固定された収集器150を回転させる。駆動機構は、一旦、収集器先端部201が完全一回転した後、回転台1608内のばねが機構を元の位置に戻すよう構成される。
【0058】
図1C、図8及び図16〜19に示すように、スライドは、細胞クラスターが移着される受け構造体として用いられる。スライドは、好ましくは、(i)細胞及び細胞クラスターが、収集器の表面に付着して残るのではなく、スライドに付着するように、一部又はその全表面をコーティングで処理し、(ii)収集器上の位置合わせマークに対して、唯一の位置合わせをさせることができるように構成されている。これらの特性は、患者が識別され、対応する収集器が記録され得るようにペイント又はエッチングした表面修飾ガラスによって実現できる。
【0059】
C.分析
図1に示すようなスライド101上に移着させた細胞及び細胞クラスターは、固定される。固定剤は、頚部細胞の形状及び生化学的特性を保存するであろうあらゆる液体又は煙霧剤であり得る。固定剤は、細胞学的試料を固定させるのに現在用いられている液体又は煙霧剤、又はこれらの配合物の変形例すなわち細胞構造の保存、若しくは分子プローブとの反応のようなその他の用途のために、材料を処理する能力を向上させる変形例のうちの1種であり得る。そのような煙霧固定剤の1例は、シャンドン・シトフィックス(Shandon CytoFix)である。
【0060】
細胞及び細胞クラスターに表示するために、形成異常の頚部上皮の特性を示すバイオマーカーと反応する1種以上の分子プローブを含む染色試薬を用いることができるであろう。評価可能なバイオマーカーには、蛋白質、特に、増殖性細胞で表される変性又は活性形態の分子が含まれる。図9A〜9Cは、新生物的に形質転換された細胞において不均衡な細胞周期をもたらすヒストン脱アセチル化酵素の阻害剤であるM344で処理された頚部細胞が、増殖性細胞において発現した蛋白質であるリン酸化リボソーム蛋白質S6(図9A)及びアポトーシスに特有のマーカーである切断サイトケラチン18(図9B)によって染色されている1例を示す。これは、頚部の形成異常に発現した一対のマーカーであるが、合成画像(図9C)に示すように、病変内の同一細胞において発現したものではない。増殖性及び細胞周期阻害剤のマーカーを含むその他のマーカー対を用いることができるであろう。増殖性マーカーの例は、Ki−67抗原及び増殖性細胞核抗原(PCNA)である。通常、活発に成長する細胞においては高レベルで発現しない細胞周期阻害剤には、p16、p21及びp27が含まれる。ここに述べるスクリーニング法を用いて、あらゆる所定のマーカー対がうまく適用されるか否かは、組織及びそれが適用される新生物の特定の生物学的特徴によって決まる。
【0061】
使用可能なその他のバイオマーカーには、核酸、形成異常の頚部細胞においてその発現が増進される遺伝子のメッセンジャーRNA分子、脂質並びにグリコシル化された形態の蛋白質及び脂質が含まれる。増殖性及び形成異常の細胞におけるこれら標的となる生体分子の機能には、細胞内シグナル伝達受容体(例えば、マイトジェン活性化蛋白質キナーゼ)、構造蛋白質(例えば、サイトケラチン)、及び核拡散関連遺伝子産物(例えば、Ki−67)を含むことができる。これらの蛋白質の発現は、例えば、異常増殖又はアポトーシスの機能であり得る。
【0062】
そのような生体分子の発現を確認するために、染色試薬が適用され、検出される方法は、抗体及び核酸プローブの蛍光色素分子(例えば、FITC)を用いた修飾、反応性標識(例えば、ビオチン)、又は分子のレポーター分子(例えば、西洋ワサビペルオキシダーゼ)との直接共役を含むことができる。これらのプローブの検出は、直接(例えば、落射蛍光照明によって)、酵素のレポーター分子(例えば、ストレプトアビジン共役アルカリホスファターゼ)との反応及び/又は、比色読み出しのための沈降基質(例えば、ニトロブルーテトラゾリウム及びブロモクロロインドリルホスフェート)の添加によるものであり得る。
【0063】
頚部上皮内病変を示す形成異常の細胞クラスターの存在を認識するために、ある対比染色の方法を用いることができる。これは、現在、免疫細胞化学及び免疫組織化学において細胞の可視化を容易にするために用いられている試薬(例えば、メチルグリーン又はヘマトキシリン)、主要な細胞特徴と反応する試薬(例えば、ファロイジン)、又は、一般的にPap染色と呼ばれているものを顕出させるのに用いられる試薬を用いて実現することができる。
【0064】
続いて、スキャニング装置を用いて、適切に検出されたプローブからの個々のシグナルの強度を測定し、収集され、染色されたサンプル全体に亘ってこれらのシグナルの割合がどのように変化するのかを特定する。スキャニングと分析とは、臨床医にとって形態学的に識別可能であり、組織学又は免疫組織化学によって確認可能な最小の前新生物病変に近似する箇所について、一体的に行われる。スキャニング装置は、多数のスライドが分析できるよう自動化してもよく、必要な分析ソフトをスキャナー内に常駐させることも、外部コンピュータ上に存在させることもできる。
【0065】
図10は、試料スライドを読み取るために用いることができるスキャナー装置1000の1例を示す。図10に示すスキャナー装置1000は、手動機器である。この例における手動機器は、固体平面照明器1006と合わせて用いられる従来の拡大鏡1002(例えば、3X又はそれより高倍)を含む。拡大鏡の視野の例示的な値は8mmであるが、使用者の必要性に応じてその他の値を用いることができる。
【0066】
スライドホルダー1004が連結された片持ち2軸手動ステージ1010によって、拡大鏡と照明器との間におけるスライドの位置決めをすることができる。差動4バーリンケージ1012は、拡大鏡の下におけるスライドの粗位置決めと細位置決めの両方を可能にするために設けられている。リンケージ1012は、操作棒1014とロック1016とを含むステージポジショナー1018に連結されている。励起及び放射フィルターを含むスライダー1008は、試料を白色光及び蛍光の両方で見ることを可能にするために設けられている。スライダー1008は、平面照明器とスライドホルダーとの間に挿入されている。手動装置1000は、使用者が拡大鏡1002の解像度を調整にすることを可能にするための焦点ノブを有することもできるであろう。
【0067】
照明器の電力供給には、電池又は電源アダプタを用いることができる。照明ユニット1006から得られる照明は、用いられる蛍光色素分子を飽和させるのに必要な励起光強度及び陽性細胞クラスターによってもたらされる放射強度によって決まるであろう。例示的な値には、吸収(励起)極大495nm及び放射極大519nm、又は吸収590nm及び放射617nmの色素が含まれる。
【0068】
図11は、試料スライドを読み取るために用いることができる機器1100の別の例を示す。図11に示された機器1100は、自動化ユニットである。自動化ユニットは、スライド画像を撮像するための「接触画像センサー」(CIS)1112、及びボールスライド上に取り付けられて、インプット昇降機1108とアウトプット昇降機1106との間の途中で、CIS 1112を越えてスライド1110を往復させる真空チャックを用いている。昇降機1106及び1108は、モーター1102及びギア1104によって駆動される。
【0069】
モーター1116によって駆動される緊張ベルト駆動部及びねじ案内駆動部1114は、シャトル1120として用いることができるであろう装置の2つの例である。シャトル1120は、線形軸受け1118上に載置されている。昇降機1106及び1108は、移動ベルト設計の1例である。別の例において、昇降機は、垂直ウォーキングビーム設計とすることができるであろう。昇降機の選択は、実装上の制約及び全体/バッチサイズの要件によって決まる。スキャン時間は、光源レベル及び用いられる特定のCISによって決まるであろう。
【0070】
CISは、各スライドからのバーコードデータの読み取りも司るであろう。バーコードは、レポートに印字され得る患者の人口統計学的データを含むであろう。バーコードデータを設けることによって、手動操作による誤差が減少するであろう。また、CLIAに準拠するため、陽性サンプルIDは必須である。
【0071】
典型的なCISリーダーは、バーコードを取り込む能力及び解読ソフト(例えば、コード128の8〜10文字)を有する。システムにおいて、200DPI CIS(例えば、ペリフェラル・イメージング・コーポレーション(Peripheral Imaging Corporation)製のPI216MC−DR)を用いることができる。特定の波長及びグレースケールに関する要件がある場合には、その他のCISモジュールを用いることができると考えられる。200DPI以上のモノクロ及びカラーCISモジュールが、多数の供給元から入手可能である。必要な場合、CISモジュールは、特定の用途用に変更することができる。例えば、波長選択フィルターを付加することが望ましいかもしれない。また、カバーガラスを取り除く、又は微小ピッチGRINレンズバーを共に用いることも望ましいかもしれない。単一カラーモジュールにおいてスペクトル反応を浄化するよりも、各色毎の2つのモノクロCISモジュールを用いることも望ましいかもしれない。この場合も、CISによって得られる照明は、用いられる蛍光色素分子を飽和させるのに必要な励起光強度及び陽性細胞クラスターによってもたらされる放射強度によって決まるであろう。例示的な値には、吸収(励起)極大495nm及び放射極大519nm、又は励起590nm及び放射617nmの色素が含まれる。
【0072】
自動化ユニットは、1例において、デスクトップ/ラップトップアプリケーションではなく、埋め込みシステムにおける使用向けに特に設計されたシングルボードコンピュータ(SBC)を用いて制御することができる。例示的なSBCは、シャープ(Sharp)、アムテル(Amtel)及びオーロン(Auron)製のものを含むが、それらに限定されない。SBCは、データ取得/処理及び印刷も司るであろう。SBCは、自動化システムを制御し、CISから受け取ったデータを取得し、処理する特定のアプリケーション用に、公知の方法でプログラムされる必要があるであろう。ウィンドウ内での全てのサンプルの結果の表示、複雑な印刷、又は生データの保存といった、重要なユーザーインタフェースの相互作用が要求される場合、USBインターフェース、又は、同様のデータ転送機構を用いることによって、データを、個人用又は大型汎用コンピュータに転送することができるであろう。
【0073】
自動化システムに用いられる電源は、多くの形態を取り得る。1例において、充電式電池を用いることができるであろう。プロセッサ及びLCDディスプレイの5VDCでの所要電力は、450mA以下である。そのような所要電力は、NiMH型電池を用いて満たすことができるであろう。例えば、3500mAHrの電池4つであれば、新しい電池1つあたり7時間の動作時間が得られるであろう。1500mAHr範囲の単三電池が用いられた場合は、新しい電池1つあたり3時間の動作時間が得られるであろう。
【0074】
最後に、「軽量」版の自動化システムを実施することもできるであろうと考えられる。そのような軽量版は、LCDスクリーン、一軸ステージ、CISセンサー、及び縮小された処理性能を有するであろう。使用者は、CISの下にスライドを位置させるであろう。使用者は、その後、ボタンを押してデータを取得することができ、そしてデータがLCDスクリーン上に表示されるであろう。
【0075】
III.実施形態2
さて、図12及び13は、子宮頚管100内の細胞を収集するための頚部細胞収集器10の別の実施形態を示している。この例において、頚部細胞収集器は、可撓性細胞サンプリング領域12及び当接剛体プッシャー22を含むアッセンブリで構成され、当接剛体プッシャー22内には、剛体コア素子14上に回転可能に装着された先端エキスパンダー16からなる第2アッセンブリが含まれ、先端エキスパンダーの1組の特徴要素31が、コア素子14の対応する作動特徴要素32と噛合っており、第2の組の特徴要素33が、プッシャーの合わせ特徴要素34と噛合っている。コア素子14の作動特徴要素32は、例えば、好適なピッチを有するねじ山として構成される。コア素子14に取り付けられたスタイレット18は、先端エキスパンダー16における開口20を貫通する。
【0076】
細胞サンプリング領域12は、微孔質ポリ酢酸ビニル、熱可塑性エラストマー、ニトリルゴム、ニトリルフォーム、ウレタンフォーム、シリコーンゴム、ラテックスゴム、ポリウレタン、又は、好適な低デュロメーター硬度、高い伸び率及び表面品質を有するあらゆる材料といった好適なエラストマー材料でできた弾力的可撓性のある構造体であり得る。
【0077】
図13A、13B、及び13Cに示唆されているように、頚部細胞収集器は、拡張状態(図13A)、中間状態(図13B)、及び圧潰状態(図13C)の間で移行し得る。臨床医が、図13Aに示すように、拡張状態の頚部収集器10の先端部を、子宮頚管100内の所望の深さ(先端部深さとして示されている)まで案内する。この状態において、プッシャー22は後退しており、細胞サンプリング部材12は、先端エキスパンダー16の外側表面に対して略一致している。一旦、臨床医が、子宮頚管100内に頚部細胞収集器10の先端部を適正に位置させた後は、コア素子14及びスタイレット18は固定されたまま、プッシャーが頚管口に向かって進められる。プッシャー22の特徴要素31及び34は、コア素子14及び先端エキスパンダー16の対応する特徴要素32及び33とそれぞれ噛合っているため、プッシャー22を進めることによって、先端エキスパンダー15が同様に頚管口に向かって進み、固定されたコア素子14の周りを回転する。同時に、プッシャー22が進むことによって、細胞サンプリング部材12に圧縮力がかかり、それによって、細胞サンプリング部材12が、図13B及び13Cに示すように、頚管口の外部に対して放射状に外に向かって変形する。先端エキスパンダー16を細胞サンプリング部材12の先端部内に進めることによって、細胞サンプリング部材12の先端部の直径が大きくなり、そのため、細胞サンプリング部材12の外側表面が子宮頚管100の壁に対して押し付けられる。先端エキスパンダー16の細胞サンプリング部材12の内側表面に対する回転運動によって、先端エキスパンダーの侵入、ひいては細胞サンプリング部材の拡張が容易になる。
【0078】
細胞サンプリング部材12が頚管口及び頚管100の表面に対して接触し、回転することによって、剥離した頚部細胞が、細胞サンプリング部材の外側表面に付着する。プッシャー232を後退させると、細胞サンプリング部材12の先端部から先端エキスパンダー16が退き、それによって、細胞サンプリング部材をその初期拡張状態に戻すことができる。その後、頚部細胞収集器10を、子宮頚管100及び膣から外し、細胞サンプリング部材の表面上に収集された細胞を、評価のために調製してもよい。
【0079】
細胞サンプリング領域12上に捕捉された細胞は、幾つかの手段によって評価のために調製してもよい。そのような手段の1つは、細胞収集表面を好適な保存媒質中に浸漬し、好ましくは攪拌することによって、保存媒質中の捕捉細胞の懸濁液を調製することである。得られる懸濁液の細胞を、従来の単層細胞調製の方法で、顕微鏡スライド又は同様の表面上に付着させ、確立された方法に従って染色し、評価してもよい。代替的に、懸濁細胞を、フローサイトメータを用いて評価してもよい。
【0080】
捕捉した細胞を評価のために調製する別の手段を、図14及び15に模式的に示す。この手段においては、剛体心棒114が、細胞サンプリング領域12内に挿入されることにより、細胞が付着する細胞サンプリング領域の部分は、押し込まれて図14に示すように心棒の形状を呈する。細胞サンプリング領域12及び心棒114上の合わせキー係合特徴要素112及び116によって、細胞サンプリング領域は、心棒に対して確実に規定の位置を維持する。これは、装置が子宮頚管内に挿入されていたときの装置の位置合わせを反映するために、スライド上の痕跡が、収集器上の特定のマークに対応するような方法で達成されてもよい。そのような痕跡付けによって、臨床医は、細胞の出所の部位を正確に識別することができる。
【0081】
図15に示すように、その後、細胞サンプリング領域の細胞担持表面を、顕微鏡スライド又は同様の適切に処理された表面と接触させ、細胞サンプリング領域の細胞担持表面全体が顕微鏡スライドに接触するように、この表面全体に渡って好適な弧に沿って回転させてもよい。細胞サンプリング領域の細胞担持表面が顕微鏡スライドに接触することによって、細胞が細胞サンプリング表面から顕微鏡スライドへ移着する。これらの移着させた細胞は、その後、確立された方法に従って染色し、評価されてもよい。この方法において、細胞の相対的な空間位置は保たれ、それによって、細胞が収集された頚部の近似的な位置を特定することができる。スライドには、一般に、カバーガラスがかけられる。用いられる封入剤の組成は、スライド上の材料が、頚部分析システム結果の調査後、何らかの他の方法で処理されるかにどうかによって決まるであろう。
【0082】
カバーガラスがかけられたスライドを、適切な照明を用いて調査する。それを、頚部サンプルのある箇所におけるシグナルの局所化の有無を特定するために詳細に調べる。候補の病変の位置が、収集された細胞の位置を示す頚部のマップにおいて示される。
【0083】
子宮外頚部及び子宮内頚部の細胞を、上記した特性を有する収集器を用いてサンプリングする。サンプルは、医師又は医療従事者によって収集されてもよい。代替的に、女性に自らのサンプルを収集するよう訓練を行って、頚部分析システムの目的を達成することができるであろう。
【0084】
本発明を、好ましい実施形態と組み合わせて説明してきたが、本発明の認識範囲及び範囲内で、本発明について、本発明のその他の目的及び改良がなされてもよいことは、当業者に自明であろう。
【0085】
本発明は、その様々な態様及び開示された形態において、述べられた目的の達成及び他の人々の利益に充分に適応するものである。開示された詳細は、本発明を限定するものと考えられるべきでない。
【図面の簡単な説明】
【0086】
【図1】図1A〜図1Cは、本発明の概念を用いた頚部分析システムの全体的な特徴を示す。
【図2】図2A及び図2Bは、それぞれ、本発明に係る細胞収集器アッセンブリの一実施形態の側面図及び、線A−Aに沿った断面図である。図2Cは、細胞収集器アッセンブリの拡張可能収集先端部の詳細図である。
【図3】図3は、収集器ハンドルアッセンブリに取り付けられた細胞収集器の断面図である。
【図4】図4は、収集器ハンドルアッセンブリに取り付けられた細胞収集器を持つ使用者の手の模式図である。
【図5】図5A〜5Cは、細胞クラスター収集時の細胞収集器の拡張を示す細胞収集器の先端部領域の断面図である。
【図6】図6A〜6Cは、細胞収集器を用いた頚部からの細胞クラスター収集工程を示す。
【図7】図7A〜7Kは、収集された細胞のクラスターをシュミレートする着色マーカー及びマーキング液と、細胞収集器を用いた細胞クラスター移着の過程を示す。
【図8】図8は、収集された細胞のクラスターを移着させるために細胞収集器が装着された細胞移着装置を示す。
【図9】図9A〜9Cは、マーカーによって標識した後の頚部細胞の接触前処理の図である。
【図10】図10は、収集された細胞のクラスターの分析に用いられる手動スキャナー装置の斜視図である。
【図11】図11は、収集された細胞のクラスターの分析に用いられる自動スキャナー装置の模式図である。
【図12】図12は、細胞収集器の別の実施形態を示す。
【図13】図13A〜13Cは、図12の細胞収集器の先端部領域が、収集時、どのように拡張し、回転するかを示す詳細図である。
【図14】図14A〜14Cは、細胞収集器の先端部の別の例を示す。
【図15】図15A〜15Bは、細胞クラスター移着を実現するための別の機構を示す。
【図16】図16は、図2A〜2Bの細胞収集器がどのように、細胞移着を実現するための機構の別の実施形態の装着プーリーに取り付けられるかを示す。
【図17】図17は、図16の装着プーリーに取り付けられた細胞収集器を示す。
【図18】図18は、収集された細胞クラスターの、スライドを備えた回転台上への移着時の、細胞収集器及び装着プーリーを示す。
【図19】図19は、細胞クラスターの移着を実現するための装着プーリーの別の実施形態の断面図である。
【図20】図20A〜20Cは、収集時に細胞収集器を回転させる機構を示す。
【図21】図21は、収集器ハンドルアッセンブリの別の実施形態を示す。
【図1A】

【図1B】

【図1C】

【図2A】

【図2B】

【図2C】

【技術分野】
【0001】
本開示は、概して、身体内、例えば頚部内の異常組織の検出に用いられる細胞サンプリング及びスクリーニングに関する。より詳細には、本開示は、収集された細胞のクラスターの空間的配置が保たれるように収集し、2つ以上の特徴の発現に関して、そのようなクラスターの生物学的な特性を調べるシステム及び方法に関する。
【背景技術】
【0002】
多くの疾患及び異常について、スクリーニングを行ない、それらを検出し、それらの根本的な治療を行うため、多くの場合、患者から様々な細胞サンプルを収集することが必要である。細胞サンプル収集の主な理由の1つは、癌について患者のスクリーニングを行なうためである。例えば、固形腫瘍の存在を示唆する異常細胞の存在に関し、尿、痰、乳頭及び細針吸引物、及び子宮頚部の剥離細胞が、細胞スクリーニング技師及び病理学者によってスクリーニングされる。そのような疑わしい細胞が発見された場合、病変ではないかと思われる組織のサンプルを切除し、そのサンプルを病理学者による調査に委ねることにより、より決定的な診断に至る。
【0003】
あらゆるスクリーニング試験又は予備診断試験についての重要な問題は、疾病を検出するのに充分な感度を有しながらも、精神的又は身体的負担を与えるほどの高頻度で非罹患者を分類しないだけの充分な特有性を有する必要があることである。このことは、疾病の存在を疑うためのより高度な指標を考慮せず、多くの人々に日常的に適用されている、(一般的にパップ試験と呼ばれる)頚部細胞診といったようなスクリーニング試験について特に当てはまる。
【0004】
一般に、癌の最も早期段階での診断は、効果的な治療の好機をもたらすと認められている。従って、固形腫瘍を早期に診断することは、細胞レベルでは周囲の組織とそれ程異ならない局所的な異常を認識することに相当する。このことは、隣接する細胞とのあらゆる関連及び比較が失われた細胞サンプルのスクリーニングについて、課題を呈する。この問題への1つの取り組み方は、要素、すなわち、より密接に近似した無傷の組織要素である細胞群に的を絞ることである。実際、そのような細胞のクラスターの存在それ自体が、前癌又は癌症状を示唆すると考えることができる。しかし、正常な組織要素が、細胞学的分析のために収集されたサンプル中で細胞クラスターとなり得ることも事実である。
【0005】
前新生物の病変は、特異な生物学的特徴を呈する。新生物の進行の初期段階である形成異常は、同一組織内に存在する正常細胞とは個々に最小限にしか異ならない細胞を含む。形成異常病変と、形状が変化している(化生)又は活発に増殖している(過形成)正常組織要素との主な相違点は、異常細胞成長及び回転を含む、特徴的な蛋白質を発現する細胞の画分における不均衡である。正常成長及び機能を示す形態学的(例えば、有糸分裂像)又は生化学的(例えば、Ki−67増殖抗原)マーカーと、アポトーシス過程による細胞回転を示す形態学的(例えば、アポトーシス小体)又は生化学的(例えば、活性型カスパーゼ3)インジケーターとの混合が形成異常の特性を示すことは、無傷組織を調べる病理学者によって充分に認識されている。
【発明の開示】
【発明が解決しようとする課題】
【0006】
今日のスクリーニング手順において用いられる従来のサンプリング法は、病変から細胞を採取するが、その後、これらの細胞を、典型的には、ずっと数の多い、病変の境界外から得た正常細胞の中に分散させるものである。この分散により、サンプルの評価は、希少事象の検出の実習、すなわち、非常に多数(例えば、50,000〜300,000)の正常細胞からなる背景内の1つ又は僅かの異常細胞の発見に終わってしまう。また、そして恐らく最も重要なことに、分散により、前新生物の病変であるかもしれない小部分の生物学的特性を求めることから得ることができる情報が排除されてしまう。この極めて重要な情報は、細胞間の関係に存在し、組織内の近隣の細胞から孤立した個々の細胞を調べることによっては識別できない。また、分散により、サンプルを用いて患者の病変の位置を特定することも妨げられる。
【0007】
従って、サンプル組織における形成異常を示す細胞クラスターの存在に関して、前新生物の病変の特異な生物学的特徴を、細胞のクラスターを収集し、分析し、細胞サンプルのスクリーニングを行なう手段と組み合わせることも望ましいであろう。
【課題を解決するための手段】
【0008】
本発明は、サンプル組織における形成異常を示す細胞クラスターの存在に関して、細胞サンプルのスクリーニングを行なうシステム及び方法に関する。細胞のクラスターを、正常な細胞の成長、発達及び機能時には同一細胞内に発生しない、又はめったに発生しない2種以上の生物学的マーカーが、前新生物又は新生物病変(以下、「形成異常」)が存在している可能性のある局所的部分の一部である細胞の存在を示すことについて調査する。細胞間の関係は、細胞のクラスターを調査する間、維持されて、想定される組織の形成異常の存在についての調査及び特定が容易になる。
【0009】
ここに述べる概念は、同一細胞内に共発現せず、又はめったに共発現せず、その発現が、形成異常において不均衡になる生物学的マーカーを用いて実施することができる。スクリーニングされる2種以上のマーカーは、異常細胞成長及び回転を含む特徴的な蛋白質を発現する細胞の断片における不均衡から得ることができる。例えば、正常成長及び機能を示す形態学的(例えば、有糸分裂像)又は生化学的(例えば、Ki−67増殖抗原)マーカーと、アポトーシス過程による細胞回転を示す形態学的(例えば、アポトーシス小体)又は生化学的(例えば、活性型カスパーゼ3)インジケーターとの混合が形成異常の特性を示す。
【0010】
ここに述べる概念は、身体の多くの部位、例えば、頚部、膀胱、肺、結腸、卵巣、及び乳房における形成異常についてのスクリーニングに用いることができる。細胞のクラスターは、自然発生したものを分析することも、組織、尿、誘発痰、乳房の分泌物、卵巣由来の洗浄細胞等を、好適な収集器を用いて収集したものを分析することもできる。
【0011】
細胞収集器は、好ましくは、細胞クラスター又は凝集塊の完全性を維持し、収集された細胞のクラスターの、受け構造体、例えば、スライド上への移着を容易にする収集器の性能を向上させるように設計される。一実施形態において、収集器の材料と、収集器の収集表面の質感と、収集時に収集器の拡張及び回転を用いることとを組み合わせることにより、細胞のクラスターの収集が容易になる。好ましくは、収集器は、子宮内頚部及び子宮外頚部の部位から得た細胞クラスターが、次に続く受け構造体への移着のため、概ね共通の平面上にあるように、移着時に拡張させることができる。好ましくは、細胞のクラスターは、サンプリング前にクラスター内の細胞間に存在していた空間的関係を維持するように、収集器から受け構造体へ移着させる。収集器及び受け構造体上の位置合わせ指標は、移着時、空間的関係を維持するのに役立つ。
【0012】
収集器は、収集時及び細胞の移着時に拡張される。収集及び移着時の拡張は、空気の使用、機械的拡張システム、又は空気と機械的システムとの組み合わせによって起すことができる。
【発明を実施するための最良の形態】
【0013】
I.概説
癌は、細胞ではなく組織の疾患である。病理学者による固形腫瘍の診断は、病変の構成、具体的には、病変内の細胞が周囲の正常細胞とどのように異なるかの認識によって決まる。用いられる基準には、形態学、細胞構造を認識するための細胞化学染色、及び細胞遺伝物質の発現パターン及び組織を特定するための抗体及び核酸プローブの使用が含まれていた。
【0014】
新生物の進行は、発生期の腫瘍内の細胞が、正常な調節シグナル及び因子に応答することなく、より一層増殖し、周囲の組織要素を侵略し、血管化され、転移することを可能にする遺伝的及び後成的変化が増大することに相当する。ところが、この過程の最も早い段階において、周囲の正常細胞と最小限にしか異なっていなかった前駆体細胞のクローン増殖により、形成異常の病変が発生する。
【0015】
癌についての、その最も早い段階におけるスクリーニングでは、その数が、物理的に識別可能又は臨床的に発症するところまではクローン増殖していない希少な形成異常細胞を認識する必要がある。そのような細胞を認識するための手段は、これらの細胞と近隣の正常細胞とが最小限にしか異ならないというまさにその本質により、形態学的及び生物学的基準に関して限定される。
【0016】
本発明の概念は、細胞のクラスターを分析して、正常組織内の任意の1箇所における同一細胞においてめったに共発現しない2種以上の生物学的マーカーを探すことによって、形成異常の前癌性病変を正常組織要素と区別することができるというものである。例えば、細胞のクラスターを、形成異常が存在している可能性がある局所的部分の一部である個々の細胞の存在を示す2種以上の生物学的マーカーについて調査することができる。以下の記述及び実施例において、概念を説明する目的で、成長及びアポトーシスを2種以上の生物学的マーカーとする。しかしながら、同一細胞においてめったに共発現しない2種以上のその他の生物学的マーカーを用いることができ、マーカーとしての細胞成長及びアポトーシスと共に用いることもできるであろうことが理解されるべきである。
【0017】
ここに述べる概念は、身体の多くの部位に由来する形成異常の前癌性病変についてのスクリーニングに用いることができる。説明する目的で、子宮頚癌についてスクリーニングを行なうために頚部から細胞のクラスターを収集することに関し、発明概念を以下に述べる。しかし、発明概念は、身体のその他の部位、例えば、膀胱癌についてのスクリーニングのために膀胱、肺癌についてのスクリーニングのために肺、結腸癌についてのスクリーニングのために結腸、そして卵巣癌についてのスクリーニングのために卵巣に由来する細胞のクラスターを調べることにより、形成異常に関してスクリーニングを行なうことに用いられ得ることが理解されるべきである。細胞のクラスターは、組織、尿、誘発痰、卵巣由来の洗浄細胞等から収集することができる。
【0018】
細胞のクラスターは、細胞のクラスター又は凝集塊を採集し、収集された細胞のクラスターの受け構造体、例えば、スライド上への移着を容易にする収集器の能力を向上させるよう設計された収集器を用いて収集される。一実施形態において、収集器の材料と、収集器の収集表面の質感と、収集時に収集器の拡張及び回転を用いることとを組み合わせることにより、細胞クラスターの収集が容易になる。好ましくは、細胞のクラスターは、サンプリング前にクラスター内の細胞間に存在していた空間的関係を維持するように、収集器から受け構造体へ移着させる。収集器及び受け構造体上の位置合わせマークは、移着時、空間的関係を維持するのに役立つ。
【0019】
頚部上の形成異常の病変の場合、本発明の概念に係る頚部分析システムは、細胞収集器、収集された細胞のクラスターを収集器からそこへ移着させる受け構造体、試薬及びスキャナー装置を包含し、これらは統合的に、(1)頚部である子宮内頚部及び子宮外頚部の部分から細胞のクラスターを得、(2)収集器上と受け構造体に移着させた際の、収集された細胞クラスター間の空間的関係を維持し、(3)細胞に何らかの異常の徴候がある場合に確立される細胞クラスターの分子的特性を調べ、そして(4)これを、臨床医が、頚部のどこに形成異常の病変が存在している可能性があるのか確認することができるように行なう。
【0020】
頚部分析システムは、試料に存在する細胞クラスターのスクリーニングに対する取り組み方の一実施形態であり、近隣の細胞の生物学的特性における特徴的な不均衡を明らかにするバイオマーカーを適用することにより、形成異常の病変を確認するために行うものである。
【0021】
図1A〜1Cは、子宮頚部50から細胞クラスターを収集する概念を示す。図1Aは、子宮52によって形成される頚部50を示しており、頚部は、子宮頚管60、子宮内頚部56、子宮外頚部62、及び子宮外頚部から子宮内頚部へ延びる陰影を付けて示した移行ゾーン58を含む。頚部である子宮内頚部56における移行ゾーン58内に、例示的な病変54が示されている。
【0022】
図1Bは、頚部50から細胞及び細胞クラスターを収集するのに用いることができる細胞収集器100の概念を示す。収集器100は、表面104を有し、表面104は、頚部の輪郭に適合することができ、子宮外頚部及び子宮内頚部62及び56の両方から細胞のクラスターを表面104によって収集して、収集された細胞クラスター間の空間的関係を保ちながら、移行ゾーン58から確実に細胞クラスターを収集する特性を有する。
【0023】
更に、収集器100は、視覚的に認識可能な位置合わせマーク106を有しており、細胞のクラスターを収集している個人が、頚部のサンプリングを行なう際、収集器の位置を合わせ、続いて細胞クラスターを、図1Cに示すような対応する位置合わせマーク108を同様に含む受け構造体101に移着させる際に、その位置を維持することを可能にする。細胞クラスターは、表面104上に付着したままではなく、表面104を、細胞クラスターが構造体101に移着するように構成された受け構造体101に接触させることによって、受け構造体101に移着させることができる。移着時、位置合わせマーク106及び108は位置合わせされており、その結果、構造体101上の細胞クラスターは、一旦移着させた後、それらが収集器100上で有していたのと同じ空間的関係を有する。その後、細胞クラスターを分析して、潜在的異常についてスクリーニングを行なうことができる。
【0024】
細胞収集器100は、子宮内頚部及び子宮外頚部56及び62の両方から細胞のクラスターを収集して、移行ゾーン58からの細胞クラスターの収集を確実に行なうことができる限り、多くの異なった構成を有し得る。一実施形態において、収集器表面104の材料と、収集器表面104の質感と、収集時に収集器表面の拡張及び回転を用いることとを組み合わせることにより、細胞のクラスターの収集が容易になる。
【0025】
II.実施形態1
A.収集
さて、図2A〜2Cは、本発明の概念を具現化する頚部細胞収集器アッセンブリ150の詳細を示している。収集器アッセンブリ150は、拡張可能収集先端部201に取り外し可能に連結された中空のチューブ200を含む。チューブ200は、例えば、プラスチック又は厚紙で作られる。収集器150の細胞収集領域でもある拡張可能先端部201は、例えば、イリノイ州、マクヘンリー(McHenry)のGLS社(GLS Corporation)から入手可能なヴァーサフレックス(Versaflex)(登録商標)CL30のような熱可塑性エラストマー混合物であるエラストマー材料でできた弾性的可撓性のある構造体である。拡張可能先端部201は、好ましくは、先端部201の拡張及び回転の際、移行ゾーン58から細胞のクラスターを収集する収集器の能力を向上させる質感を有する。例えば、先端部201は、MT−11010の質感を有し得る。先端部201には、その他のエラストマー材料、例えば、微孔質ポリ酢酸ビニル、ニトリルゴム、ニトリルフォーム、ウレタンフォーム、シリコーンゴム、ラテックスゴム、ポリウレタン、及び細胞クラスターの収集を促進する低いデュロメーター硬度、高い伸び率及び適切な質感を有するその他のエラストマーを用いることができるであろう。
【0026】
チューブ200は、一般に、一端部202から他端部204まで中空であり、チューブ200の端部202は開口している。特に図2Cに関し、拡張可能先端部201は、その形成時の状態で、チューブ200の端部204に取り外し可能に連結された首部206、中央延伸肩部208、先端部領域210、及び肩部208と先端部領域210との間に延びる移行部分212を含む。図9に示すように、チューブ200上に先端部201を保持するのに役立つように、収集先端部201の首部206の周りにOリング214を嵌めることができる。
【0027】
図3〜5は、細胞サンプルを採取するのに用いられる収集器ハンドルアッセンブリ303上に配置された頚部細胞収集器アッセンブリを示す。アッセンブリ303は、内側ケーシング308と外側ケーシング307とを含み、チューブ200が外側ケーシング307の周りに嵌装され、外側ケーシング307が内側ケーシング308上に摺動可能に配置されている。探針306は、内側ケーシング308の内側から前方に、拡張可能先端部201の内部へと突出している。エキスパンダー探針305は、探針306を包囲して、アッセンブリ303の端部に配置され、探針305の端部320は、外側ケーシング307内の外側ケーシング308の端部に配置されている。探針の反対側の端部322は、延出されており、肩部324を含む。
【0028】
探針306は、およそ2mmの直径を有し、エキスパンダー探針305の端部を越えておよそ8から10mmまでの間の距離だけ突出することができる。肩部324より前方のエキスパンダー探針305の本体の直径はおよそ6mmであり、一方、肩部324の直径はおよそ10mmである。
【0029】
コイルばね326は、エキスパンダー探針305を、図3及び図5A〜5Cにおける左側へ偏らせるために、肩部324と外側ケーシング307の端部との間に配置されている。更に、コイルばね328が、内側ケーシング308の内側に、探針306の端部と内側ケーシング内に配置された固定リング330との間に配置されている。ばね328は、探針306を、図3及び図5A〜5Cにおける左側へ偏らせる。
【0030】
外側チューブ307は、チューブロック309も含む。チューブロック309は、外側チューブ307に固定された弾性部材を含み、この弾性部材は、収集器150のチューブ200に形成された開口332(図2B参照)を通って上方に突出している。チューブロック309と開口332とは協同してチューブ200をハンドルアッセンブリ303の外側チューブ307に固定する。
【0031】
図3に戻って、外側チューブ307内に、内側チューブ308の端部と、外側チューブ307の端部に配置されたばねキャップ311との間に、戻しばね310が配置されている。ばね310は、外側チューブ307を、図3における右側に向かって偏らせ、一方、内側チューブ308を左側に向かって偏らせて、外側及び内側チューブ307及び308を図3に示す定位置に戻す。
【0032】
ハンドル312は、内側チューブ308に連結された支持体313に固定されている。ハンドル312は、図3に示す位置と、ハンドル312がケーシング307及び308と概ね平行となる折り畳み位置との間で回転できるように、ピボット314によって支持体313に回転可能に固定されている。外側チューブ307は、外側チューブ307と支持体313との間の相対的な摺動運動を可能にするスロット315と共に形成されている。スロット315は、図3において、支持体313の右側にキャップ311まで延びている。
【0033】
図3及び4において最もよく分かるように、外側チューブ307の直径は、収集器150のチューブ200を受けるよう設計された小径部分から、ハンドル213に近接し、図3において支持体313の右側に延びる大径部分まで変化する。小径部分と大径部分との間の変化によって、チューブ200の端部がそこで止まる肩部216(図4)が形成される。望ましい場合、チューブ200の端部202は、肩部216によって形成される角度と一致するように角度を付けることができる(図16〜18参照)。肩部216の角度とチューブ200上の角度は、収集器アッセンブリ150のハンドルアッセンブリ303上での適正な位置合わせを確実に行うのに役立つように、収集器アッセンブリ150をハンドルアッセンブリ303上に摺動させる際に位置合わせすることができる。
【0034】
図4は、ばねキャップ311を親指で押した状態でハンドル312を保持する手の模式図である。図5A〜5C及び図6A〜6Cは図4と共に、細胞収集器アッセンブリ150を用いた収集過程を示す。使用者は、初めに、細胞収集器アッセンブリ150をハンドルアッセンブリ303に挿着する。それを行なう際、探針306の端部は、拡張可能先端部201の先端部領域210に嵌合し、それによって、図5A及び6Aに示すように、拡張可能先端部は平らに延ばされ、先端部201上の肩部208が一時的に縮小する。これによって、頚部内へ収集器を挿入するための使用者の視線が向上する。
【0035】
使用者は、その後、図4に示すように、親指又は他の指でばねキャップ311上を押す。これによって、図5Bに示すように、外側ケーシング307が、エキスパンダー探針305と共に前方に移動する。探針305が前方に移動すると、それによって、図5B及び6Bに示すように、拡張可能先端部201の肩部208が、その平らな状態から外に向かって拡張する。エキスパンダー探針305は、図5Bに示すように、およそ8から10mm移動した後、探針306の端部と面一になると底に達する。エキスパンダー探針305は、拡張可能先端部201が子宮内頚管に接触した状態で、子宮内頚管をおよそ6mm広げる。一旦、探針305が底に達した後、引き続き親指で押し続けると、外側ケーシング307が更におよそ3から4mm移動を続け、同時に、チューブ200が前方に押される。その結果、図6Cに示すように、肩部208及び/又は拡張可能先端部201の移行部分212は、子宮外頚部62に押し付けられる。
【0036】
エキスパンダー探針305は、その移動時、拡張可能先端部201の先端部領域210を広げて子宮内頚部56と嵌合状態にさせる。更に、肩部208及び/又は拡張可能先端部201の移行部分212は、頚部50の外表面を圧迫する。その結果、移行ゾーン58からの細胞を含む子宮内頚部及び子宮外頚部両方の細胞を収集することができる。
【0037】
また、先端部201の質感を利用して、移行ゾーン58からの細胞クラスターをせん断することによって、移行ゾーンから細胞のクラスターを収集するために、拡張可能先端部201を収集時に回転させる。先端部201は、例えば、20から30度回転させる。先端部201は、使用者が手動でハンドルアッセンブリ303及びそれに連結された収集器アッセンブリ150を回転させることによって回転させることができる。代替的には、先端部201は、一旦、先端部201の先端部領域210、肩部208及び移行部分212をハンドルアッセンブリ303によって拡張させて子宮内頚部及び子宮外頚部と接触させた後、先端部201を回転させる好適な機械的回転機構を用いて回転させることができる。
【0038】
図20Aから20Cに、機械的回転機構の例を示す。図20Aは、ハンドルアッセンブリ250上に配置された収集器アッセンブリ150を示す。アッセンブリ250は、U字型端部252及び拡張及び回転部254を含んでおり、拡張及び回転部254は、U字型端部252に回転可能に連結されて端部252に対する部分254の回転を可能にする。部分254の、先端部201に包囲されている端部は、図5A〜5Cに示したものと同様に構成される。部分254の反対側端部の外表面には、螺旋歯256が設けられている。
【0039】
握りスリーブ258は、部分252及び部分254上に、部分252と254とが連結する箇所を覆って摺動可能に配置されている。螺旋歯(図示せず)は、スリーブ258の内側表面上に、部分254上で歯256と噛合うよう配置されている。
【0040】
アッセンブリ250の使用時、収集器150をハンドルアッセンブリ250に装着後、使用者が探針を挿入すると、(図20A〜20Cに示された)探針305は前方に移動し、それによって、先端部201が拡張する(図20B)。使用者が引き続き押すことにより、先端部201は更に拡張して子宮外頚部に当たる(図20C)。子宮外頚部と嵌合状態になることにより、更なる挿入が防止され、それによって、握りスリーブ258が、図20Cの矢印の方向において前方に移動する。スリーブ258は、最終的に、螺旋歯256に接触するに足るだけ先まで移動する。スリーブ258が引き続き前進し、螺旋歯が噛合うことによって、図20Cに矢印で示すように、部分254が収集器150と共に回転する。
【0041】
挿入並びに細胞クラスター収集を実現するための拡張及び回転後、圧力が解除され、戻しばねが機構を元の位置に戻す。チューブロック309を押し下げ、その後、頚部細胞収集器150を取り外す。
【0042】
図21は、細胞収集器アッセンブリ150が装着された収集器ハンドルアッセンブリ400の別の実施形態を示す。アッセンブリ400は、その前端部にそらせ板404が連結された前部チューブ402を含む。ハンドルアッセンブリ400は、収集器アッセンブリ150のチューブ200をチューブ402の中に摺動させて収集器アッセンブリ150を装着するよう設計されている。収集器アッセンブリ150がアッセンブリ400に装着されると、そらせ板404が、先端部201上の肩部208を平らにして、収集時に挿入のための視線を向上させる。チューブ402は、その後端部付近にスロット406も含む。チューブ200がその周りに配置されるチューブ402の内部は、図5A〜5Cにおけるのと同様に構成されている。
【0043】
アッセンブリ400は、その前端部がチューブ402の後端部内に受けられた後部チューブ408も含む。スロット410が、後部チューブ408に形成され、ボタン412が、スロット410内に摺動可能に配置されている。ボタン412は、前部チューブ402のスロット406内に配置された突出部414に連結されている。
【0044】
ボタン412は、図20において、アッセンブリ400の挿着位置でもある定位置において示されている。適正に挿着後、使用者がボタン412を引き戻し、ボタン412がスロット410の端部の後部ボタン位置に移動する。ボタン412が、突出部414と連結しているため、突出部414も後方に移動し、これによって、前部チューブ402が、収集器アッセンブリ150に対して後方に引っぱられ、そらせ板404による収集先端部201のそれが解除される。続いて、使用者は、ボタン412を前方に押して、収集先端部201を拡張させる。ボタン412は、図5A〜5Cに示す拡張機構に、スロット410におけるボタンの定位置からボタンの最前方位置までに拡張が起こるように連結されている。
【0045】
一旦、ボタン412を最後まで前方に押して収集先端部を拡張させると、その後、先端部が回転する。先端部は、上述したように、後部チューブ408を手動で回転させることにより、手動で回転させることができる。代替的に、収集先端部を回転させるために、好適な機械的回転機構を設けることができる。
【0046】
B.移着
収集後、細胞収集アッセンブリ150を、次に続く細胞クラスターの分析のために、細胞クラスターを先端部201から受け構造体へ移着させるのに用いられる移着装置に装着する。好適な受け構造体の例としては、スライド、ペトリ皿、及び細胞クラスターを次に続く細胞クラスターの分析のために移着させてもよいその他の構造体が挙げられる。移着装置は、移着が、受け構造体から受け構造体へ等しい圧力で行なわれるよう構成される。また、受け構造体の表面は、先端部から受け構造体への細胞クラスターの移着を促進するため、細胞クラスターを含む先端部201の表面よりも大きい粘着力を有する。受け構造体がスライドである場合、スライドに、より大きな粘着力をもたらすコーティングを設けることができる。
【0047】
収集器アッセンブリ150の先端部201は、好ましくは、移着時、空気を用いて膨張させる。先端部201が、ヴァーサフレックス(Versaflex)(登録商標)CL30のような熱可塑性エラストマー混合物で作られている場合、エラストマーによって、膨張時、先端部の均等な拡張が可能になる。移着のための膨張時、先端部領域210及び移行部分212は実質的に消滅し(図7B参照)、その結果、次に続く細胞クラスターの受け構造体への移着に備えて、先端部領域210及び移行部分212上の細胞クラスターは概ね共通の平面上にあるようになる。このことは、細胞クラスターにおける細胞間の空間的関係を維持するのに役立つ。
【0048】
移着後、先端部201を、チューブ200から取り外し、先端部201上に残っている細胞クラスターを保存するための保存薬を含む容器に入れることができる。チューブ200はその後、廃棄でき、又は更なる収集のために、新たな先端部201に連結することができる。先端部201を保存する必要がない場合、先端部201は廃棄することができる。
【0049】
図7A〜7Kは、細胞収集器150を、収集された細胞のクラスターを示す着色マーカー及びマーキング液と共に用いた細胞クラスター移着の概念を示す。図7Aは、細胞収集器の先端部201を示し、先端部上に、収集された移行ゾーン細胞クラスターを示す着色マーカー500が付いている。図7Bは、膨張した先端部201を示し、着色マーカー500が微かではあるが、それでも視覚的に認識可能である。図7Cは、移着を視覚化するのに役立つように、移行ゾーン細胞クラスターを含むであろう箇所に添加されたマーキング液502を示す。図7Dは、スライド504の実際の大きさを表すために、膨張した先端部201が、マーキングされた紙上に押し付けられているところを示す。図7Eは、移着された細胞クラスターの痕跡を表すように、典型的なスライド504上に残った痕跡を示す。図7Fは、その元の大きさと形状に収縮した先端部201を示す。図7Gは、マーキング液(すなわち、細胞クラスターを表す)があった箇所及び移着されなかった箇所を示す先端部201の接写図である。図7Hに示すように、先端部201の先端部領域210及び移行ゾーン212の基部において、小範囲の「細胞クラスター」が移着しなかった。先端部領域210と移行ゾーン212との間に位置する臨界移行ゾーン「細胞クラスター」は、完全に移着した。図7I〜7Kは、マーキング液を用いた3つの別個の移着の結果を示す。
【0050】
図8は、細胞クラスター移着装置704の例を示す。この例において、頚部細胞収集器150のチューブ200上の開口322は、収集器150を移着装置上に位置合わせするために、移着装置704上の対応するマークと合わせされる位置合わせマークとしての役割を果たす。その生物学的特性及び細胞クラスターが収集された疑わしい箇所の解剖学的位置に基づいて認識された何らかの異常頚部細胞間の関係を維持するために正確な位置合わせが必要である。
【0051】
収集器150は、先端部201が、移着装置704の底部に置かれたコーティングされたスライド703の形態である受け構造体に面するように、装置704上に置かれる。装置704は、チューブ200を固定し、定位置に保持するクランプ機構705を含む。移着装置704は、先端部201を膨張させるために収集器150に空気を入れるよう構成された空気シリンダー装置701も含む。ハンドル702は、移着装置704に枢軸状に連結され、ロッド706は、空気シリンダー装置701内でピストンを作動させるために、ハンドルから空気シリンダー装置701内に延びている。使用者がハンドル702を押し下げると、空気シリンダー装置701内のピストンが作動し、先端部を膨張させるために、空気をチューブ200を通って収集器150内に、そして先端部201内に送り込む(図7B参照)。
【0052】
一旦、先端部201を膨張させた後、装置704に連結されたハンドル708を回転させる。ハンドル708の回転によって、収集器アッセンブリ150が装着された収集器装着機構が、ボール盤と同様に、スライド703に向かって移動する。最終的に、膨張した先端部は、図7Dに示したのと同様に、スライド703上に押し付けられる。その後、ハンドルを回転させて、収集器アッセンブリ150を後退させ、ハンドル703を開放して先端部201を収縮させる。
【0053】
図16〜19は、細胞クラスターの受け構造体上への移着の別の実施形態を示す。細胞収集器アッセンブリは、図17に示すように、装着プーリー1604の装着アーム1613上に摺動可能に配置される。装着アーム1613は、先端部201を膨張させるために、装着アーム1613の後端部を通って収集器150内へ空気を通過させるよう中空である。開口332は、装着アーム1613上の対応するマーク1606と合わせされて、細胞収集器をアーム1613上で位置合わせさせる。マーク1606は、開口332と嵌合するためのロックの一部を構成して、収集器を装着アーム1613上に固定する。
【0054】
装着プーリー1604は、ハンドル1610と、顕微鏡スライド1609を受ける支持表面とを有する回転台1608を含む。スライド1609は、好適な固定機構、例えば、クランプを用いて支持表面上の定位置に固定される。回転台1608は、支持プレート1611上に回転可能に取り付けられて、回転台1608のハンドル1610を用いた回転を可能にしている。支持アーム1607は、軸1612により、プレート1611に枢軸状に連結され、装着アーム1613が支持アーム1607から延びている。更に、空気ポンプ1650が支持アーム1607に連結され、空気ポンプ1650は、先端部201を膨張させるために装着アーム1613内に空気を入れるよう、装着アーム1613の後端部に流通連結されている。空気ポンプ1650は、電動又は使用者による手動で駆動することができるであろう。
【0055】
収集後、収集器を装着アーム1613上に装着し、定位置に固定する(図16)。その後、支持アーム1607を、下方に、反時計回りに、回転台1608上のスライド1609に向かって回転させる(図17)。スライドに接触する前に、収集器先端部1601を、空気ポンプ1650により適切な容積まで拡張させる。図18に示すように、先端部201は、細胞クラスター移着のための適正な角度で、スライド1609上で正確に位置合わせさせる。
【0056】
図19は、空気ポンプの他の具体化を示しており、先端部201は、プランジャ本体1903に規定されるプランジャ1901とプランジャチャンバ1902とを用いて拡張される。プランジャチャンバ1902は、支持アーム1607を、反時計回りに回転台1608に向かって回転させたとき、プランジャ1901及びプランジャ本体1902が圧縮されて、空気をプランジャチャンバ1902から装着アーム1613の背部内へと送り込んで、先端部201が、先端部をスライド1609に向かって下方に回転させるにつれて膨張するように、装着アーム1613の背部と流通している。
【0057】
一旦、先端部201が下方に回転してスライド1609と接触状態になった後、支持アーム1607を固定して、先端部201をスライド1609と接触したままの状態に維持する。その後、回転台1608を、ハンドル1610を用いて回転させる。支持アーム1607上に回転可能に取り付けられた駆動機構が、回転台1608と装着アーム1613との間に連結されて、装着アーム1613及びそれに固定された収集器150を回転させる。駆動機構は、一旦、収集器先端部201が完全一回転した後、回転台1608内のばねが機構を元の位置に戻すよう構成される。
【0058】
図1C、図8及び図16〜19に示すように、スライドは、細胞クラスターが移着される受け構造体として用いられる。スライドは、好ましくは、(i)細胞及び細胞クラスターが、収集器の表面に付着して残るのではなく、スライドに付着するように、一部又はその全表面をコーティングで処理し、(ii)収集器上の位置合わせマークに対して、唯一の位置合わせをさせることができるように構成されている。これらの特性は、患者が識別され、対応する収集器が記録され得るようにペイント又はエッチングした表面修飾ガラスによって実現できる。
【0059】
C.分析
図1に示すようなスライド101上に移着させた細胞及び細胞クラスターは、固定される。固定剤は、頚部細胞の形状及び生化学的特性を保存するであろうあらゆる液体又は煙霧剤であり得る。固定剤は、細胞学的試料を固定させるのに現在用いられている液体又は煙霧剤、又はこれらの配合物の変形例すなわち細胞構造の保存、若しくは分子プローブとの反応のようなその他の用途のために、材料を処理する能力を向上させる変形例のうちの1種であり得る。そのような煙霧固定剤の1例は、シャンドン・シトフィックス(Shandon CytoFix)である。
【0060】
細胞及び細胞クラスターに表示するために、形成異常の頚部上皮の特性を示すバイオマーカーと反応する1種以上の分子プローブを含む染色試薬を用いることができるであろう。評価可能なバイオマーカーには、蛋白質、特に、増殖性細胞で表される変性又は活性形態の分子が含まれる。図9A〜9Cは、新生物的に形質転換された細胞において不均衡な細胞周期をもたらすヒストン脱アセチル化酵素の阻害剤であるM344で処理された頚部細胞が、増殖性細胞において発現した蛋白質であるリン酸化リボソーム蛋白質S6(図9A)及びアポトーシスに特有のマーカーである切断サイトケラチン18(図9B)によって染色されている1例を示す。これは、頚部の形成異常に発現した一対のマーカーであるが、合成画像(図9C)に示すように、病変内の同一細胞において発現したものではない。増殖性及び細胞周期阻害剤のマーカーを含むその他のマーカー対を用いることができるであろう。増殖性マーカーの例は、Ki−67抗原及び増殖性細胞核抗原(PCNA)である。通常、活発に成長する細胞においては高レベルで発現しない細胞周期阻害剤には、p16、p21及びp27が含まれる。ここに述べるスクリーニング法を用いて、あらゆる所定のマーカー対がうまく適用されるか否かは、組織及びそれが適用される新生物の特定の生物学的特徴によって決まる。
【0061】
使用可能なその他のバイオマーカーには、核酸、形成異常の頚部細胞においてその発現が増進される遺伝子のメッセンジャーRNA分子、脂質並びにグリコシル化された形態の蛋白質及び脂質が含まれる。増殖性及び形成異常の細胞におけるこれら標的となる生体分子の機能には、細胞内シグナル伝達受容体(例えば、マイトジェン活性化蛋白質キナーゼ)、構造蛋白質(例えば、サイトケラチン)、及び核拡散関連遺伝子産物(例えば、Ki−67)を含むことができる。これらの蛋白質の発現は、例えば、異常増殖又はアポトーシスの機能であり得る。
【0062】
そのような生体分子の発現を確認するために、染色試薬が適用され、検出される方法は、抗体及び核酸プローブの蛍光色素分子(例えば、FITC)を用いた修飾、反応性標識(例えば、ビオチン)、又は分子のレポーター分子(例えば、西洋ワサビペルオキシダーゼ)との直接共役を含むことができる。これらのプローブの検出は、直接(例えば、落射蛍光照明によって)、酵素のレポーター分子(例えば、ストレプトアビジン共役アルカリホスファターゼ)との反応及び/又は、比色読み出しのための沈降基質(例えば、ニトロブルーテトラゾリウム及びブロモクロロインドリルホスフェート)の添加によるものであり得る。
【0063】
頚部上皮内病変を示す形成異常の細胞クラスターの存在を認識するために、ある対比染色の方法を用いることができる。これは、現在、免疫細胞化学及び免疫組織化学において細胞の可視化を容易にするために用いられている試薬(例えば、メチルグリーン又はヘマトキシリン)、主要な細胞特徴と反応する試薬(例えば、ファロイジン)、又は、一般的にPap染色と呼ばれているものを顕出させるのに用いられる試薬を用いて実現することができる。
【0064】
続いて、スキャニング装置を用いて、適切に検出されたプローブからの個々のシグナルの強度を測定し、収集され、染色されたサンプル全体に亘ってこれらのシグナルの割合がどのように変化するのかを特定する。スキャニングと分析とは、臨床医にとって形態学的に識別可能であり、組織学又は免疫組織化学によって確認可能な最小の前新生物病変に近似する箇所について、一体的に行われる。スキャニング装置は、多数のスライドが分析できるよう自動化してもよく、必要な分析ソフトをスキャナー内に常駐させることも、外部コンピュータ上に存在させることもできる。
【0065】
図10は、試料スライドを読み取るために用いることができるスキャナー装置1000の1例を示す。図10に示すスキャナー装置1000は、手動機器である。この例における手動機器は、固体平面照明器1006と合わせて用いられる従来の拡大鏡1002(例えば、3X又はそれより高倍)を含む。拡大鏡の視野の例示的な値は8mmであるが、使用者の必要性に応じてその他の値を用いることができる。
【0066】
スライドホルダー1004が連結された片持ち2軸手動ステージ1010によって、拡大鏡と照明器との間におけるスライドの位置決めをすることができる。差動4バーリンケージ1012は、拡大鏡の下におけるスライドの粗位置決めと細位置決めの両方を可能にするために設けられている。リンケージ1012は、操作棒1014とロック1016とを含むステージポジショナー1018に連結されている。励起及び放射フィルターを含むスライダー1008は、試料を白色光及び蛍光の両方で見ることを可能にするために設けられている。スライダー1008は、平面照明器とスライドホルダーとの間に挿入されている。手動装置1000は、使用者が拡大鏡1002の解像度を調整にすることを可能にするための焦点ノブを有することもできるであろう。
【0067】
照明器の電力供給には、電池又は電源アダプタを用いることができる。照明ユニット1006から得られる照明は、用いられる蛍光色素分子を飽和させるのに必要な励起光強度及び陽性細胞クラスターによってもたらされる放射強度によって決まるであろう。例示的な値には、吸収(励起)極大495nm及び放射極大519nm、又は吸収590nm及び放射617nmの色素が含まれる。
【0068】
図11は、試料スライドを読み取るために用いることができる機器1100の別の例を示す。図11に示された機器1100は、自動化ユニットである。自動化ユニットは、スライド画像を撮像するための「接触画像センサー」(CIS)1112、及びボールスライド上に取り付けられて、インプット昇降機1108とアウトプット昇降機1106との間の途中で、CIS 1112を越えてスライド1110を往復させる真空チャックを用いている。昇降機1106及び1108は、モーター1102及びギア1104によって駆動される。
【0069】
モーター1116によって駆動される緊張ベルト駆動部及びねじ案内駆動部1114は、シャトル1120として用いることができるであろう装置の2つの例である。シャトル1120は、線形軸受け1118上に載置されている。昇降機1106及び1108は、移動ベルト設計の1例である。別の例において、昇降機は、垂直ウォーキングビーム設計とすることができるであろう。昇降機の選択は、実装上の制約及び全体/バッチサイズの要件によって決まる。スキャン時間は、光源レベル及び用いられる特定のCISによって決まるであろう。
【0070】
CISは、各スライドからのバーコードデータの読み取りも司るであろう。バーコードは、レポートに印字され得る患者の人口統計学的データを含むであろう。バーコードデータを設けることによって、手動操作による誤差が減少するであろう。また、CLIAに準拠するため、陽性サンプルIDは必須である。
【0071】
典型的なCISリーダーは、バーコードを取り込む能力及び解読ソフト(例えば、コード128の8〜10文字)を有する。システムにおいて、200DPI CIS(例えば、ペリフェラル・イメージング・コーポレーション(Peripheral Imaging Corporation)製のPI216MC−DR)を用いることができる。特定の波長及びグレースケールに関する要件がある場合には、その他のCISモジュールを用いることができると考えられる。200DPI以上のモノクロ及びカラーCISモジュールが、多数の供給元から入手可能である。必要な場合、CISモジュールは、特定の用途用に変更することができる。例えば、波長選択フィルターを付加することが望ましいかもしれない。また、カバーガラスを取り除く、又は微小ピッチGRINレンズバーを共に用いることも望ましいかもしれない。単一カラーモジュールにおいてスペクトル反応を浄化するよりも、各色毎の2つのモノクロCISモジュールを用いることも望ましいかもしれない。この場合も、CISによって得られる照明は、用いられる蛍光色素分子を飽和させるのに必要な励起光強度及び陽性細胞クラスターによってもたらされる放射強度によって決まるであろう。例示的な値には、吸収(励起)極大495nm及び放射極大519nm、又は励起590nm及び放射617nmの色素が含まれる。
【0072】
自動化ユニットは、1例において、デスクトップ/ラップトップアプリケーションではなく、埋め込みシステムにおける使用向けに特に設計されたシングルボードコンピュータ(SBC)を用いて制御することができる。例示的なSBCは、シャープ(Sharp)、アムテル(Amtel)及びオーロン(Auron)製のものを含むが、それらに限定されない。SBCは、データ取得/処理及び印刷も司るであろう。SBCは、自動化システムを制御し、CISから受け取ったデータを取得し、処理する特定のアプリケーション用に、公知の方法でプログラムされる必要があるであろう。ウィンドウ内での全てのサンプルの結果の表示、複雑な印刷、又は生データの保存といった、重要なユーザーインタフェースの相互作用が要求される場合、USBインターフェース、又は、同様のデータ転送機構を用いることによって、データを、個人用又は大型汎用コンピュータに転送することができるであろう。
【0073】
自動化システムに用いられる電源は、多くの形態を取り得る。1例において、充電式電池を用いることができるであろう。プロセッサ及びLCDディスプレイの5VDCでの所要電力は、450mA以下である。そのような所要電力は、NiMH型電池を用いて満たすことができるであろう。例えば、3500mAHrの電池4つであれば、新しい電池1つあたり7時間の動作時間が得られるであろう。1500mAHr範囲の単三電池が用いられた場合は、新しい電池1つあたり3時間の動作時間が得られるであろう。
【0074】
最後に、「軽量」版の自動化システムを実施することもできるであろうと考えられる。そのような軽量版は、LCDスクリーン、一軸ステージ、CISセンサー、及び縮小された処理性能を有するであろう。使用者は、CISの下にスライドを位置させるであろう。使用者は、その後、ボタンを押してデータを取得することができ、そしてデータがLCDスクリーン上に表示されるであろう。
【0075】
III.実施形態2
さて、図12及び13は、子宮頚管100内の細胞を収集するための頚部細胞収集器10の別の実施形態を示している。この例において、頚部細胞収集器は、可撓性細胞サンプリング領域12及び当接剛体プッシャー22を含むアッセンブリで構成され、当接剛体プッシャー22内には、剛体コア素子14上に回転可能に装着された先端エキスパンダー16からなる第2アッセンブリが含まれ、先端エキスパンダーの1組の特徴要素31が、コア素子14の対応する作動特徴要素32と噛合っており、第2の組の特徴要素33が、プッシャーの合わせ特徴要素34と噛合っている。コア素子14の作動特徴要素32は、例えば、好適なピッチを有するねじ山として構成される。コア素子14に取り付けられたスタイレット18は、先端エキスパンダー16における開口20を貫通する。
【0076】
細胞サンプリング領域12は、微孔質ポリ酢酸ビニル、熱可塑性エラストマー、ニトリルゴム、ニトリルフォーム、ウレタンフォーム、シリコーンゴム、ラテックスゴム、ポリウレタン、又は、好適な低デュロメーター硬度、高い伸び率及び表面品質を有するあらゆる材料といった好適なエラストマー材料でできた弾力的可撓性のある構造体であり得る。
【0077】
図13A、13B、及び13Cに示唆されているように、頚部細胞収集器は、拡張状態(図13A)、中間状態(図13B)、及び圧潰状態(図13C)の間で移行し得る。臨床医が、図13Aに示すように、拡張状態の頚部収集器10の先端部を、子宮頚管100内の所望の深さ(先端部深さとして示されている)まで案内する。この状態において、プッシャー22は後退しており、細胞サンプリング部材12は、先端エキスパンダー16の外側表面に対して略一致している。一旦、臨床医が、子宮頚管100内に頚部細胞収集器10の先端部を適正に位置させた後は、コア素子14及びスタイレット18は固定されたまま、プッシャーが頚管口に向かって進められる。プッシャー22の特徴要素31及び34は、コア素子14及び先端エキスパンダー16の対応する特徴要素32及び33とそれぞれ噛合っているため、プッシャー22を進めることによって、先端エキスパンダー15が同様に頚管口に向かって進み、固定されたコア素子14の周りを回転する。同時に、プッシャー22が進むことによって、細胞サンプリング部材12に圧縮力がかかり、それによって、細胞サンプリング部材12が、図13B及び13Cに示すように、頚管口の外部に対して放射状に外に向かって変形する。先端エキスパンダー16を細胞サンプリング部材12の先端部内に進めることによって、細胞サンプリング部材12の先端部の直径が大きくなり、そのため、細胞サンプリング部材12の外側表面が子宮頚管100の壁に対して押し付けられる。先端エキスパンダー16の細胞サンプリング部材12の内側表面に対する回転運動によって、先端エキスパンダーの侵入、ひいては細胞サンプリング部材の拡張が容易になる。
【0078】
細胞サンプリング部材12が頚管口及び頚管100の表面に対して接触し、回転することによって、剥離した頚部細胞が、細胞サンプリング部材の外側表面に付着する。プッシャー232を後退させると、細胞サンプリング部材12の先端部から先端エキスパンダー16が退き、それによって、細胞サンプリング部材をその初期拡張状態に戻すことができる。その後、頚部細胞収集器10を、子宮頚管100及び膣から外し、細胞サンプリング部材の表面上に収集された細胞を、評価のために調製してもよい。
【0079】
細胞サンプリング領域12上に捕捉された細胞は、幾つかの手段によって評価のために調製してもよい。そのような手段の1つは、細胞収集表面を好適な保存媒質中に浸漬し、好ましくは攪拌することによって、保存媒質中の捕捉細胞の懸濁液を調製することである。得られる懸濁液の細胞を、従来の単層細胞調製の方法で、顕微鏡スライド又は同様の表面上に付着させ、確立された方法に従って染色し、評価してもよい。代替的に、懸濁細胞を、フローサイトメータを用いて評価してもよい。
【0080】
捕捉した細胞を評価のために調製する別の手段を、図14及び15に模式的に示す。この手段においては、剛体心棒114が、細胞サンプリング領域12内に挿入されることにより、細胞が付着する細胞サンプリング領域の部分は、押し込まれて図14に示すように心棒の形状を呈する。細胞サンプリング領域12及び心棒114上の合わせキー係合特徴要素112及び116によって、細胞サンプリング領域は、心棒に対して確実に規定の位置を維持する。これは、装置が子宮頚管内に挿入されていたときの装置の位置合わせを反映するために、スライド上の痕跡が、収集器上の特定のマークに対応するような方法で達成されてもよい。そのような痕跡付けによって、臨床医は、細胞の出所の部位を正確に識別することができる。
【0081】
図15に示すように、その後、細胞サンプリング領域の細胞担持表面を、顕微鏡スライド又は同様の適切に処理された表面と接触させ、細胞サンプリング領域の細胞担持表面全体が顕微鏡スライドに接触するように、この表面全体に渡って好適な弧に沿って回転させてもよい。細胞サンプリング領域の細胞担持表面が顕微鏡スライドに接触することによって、細胞が細胞サンプリング表面から顕微鏡スライドへ移着する。これらの移着させた細胞は、その後、確立された方法に従って染色し、評価されてもよい。この方法において、細胞の相対的な空間位置は保たれ、それによって、細胞が収集された頚部の近似的な位置を特定することができる。スライドには、一般に、カバーガラスがかけられる。用いられる封入剤の組成は、スライド上の材料が、頚部分析システム結果の調査後、何らかの他の方法で処理されるかにどうかによって決まるであろう。
【0082】
カバーガラスがかけられたスライドを、適切な照明を用いて調査する。それを、頚部サンプルのある箇所におけるシグナルの局所化の有無を特定するために詳細に調べる。候補の病変の位置が、収集された細胞の位置を示す頚部のマップにおいて示される。
【0083】
子宮外頚部及び子宮内頚部の細胞を、上記した特性を有する収集器を用いてサンプリングする。サンプルは、医師又は医療従事者によって収集されてもよい。代替的に、女性に自らのサンプルを収集するよう訓練を行って、頚部分析システムの目的を達成することができるであろう。
【0084】
本発明を、好ましい実施形態と組み合わせて説明してきたが、本発明の認識範囲及び範囲内で、本発明について、本発明のその他の目的及び改良がなされてもよいことは、当業者に自明であろう。
【0085】
本発明は、その様々な態様及び開示された形態において、述べられた目的の達成及び他の人々の利益に充分に適応するものである。開示された詳細は、本発明を限定するものと考えられるべきでない。
【図面の簡単な説明】
【0086】
【図1】図1A〜図1Cは、本発明の概念を用いた頚部分析システムの全体的な特徴を示す。
【図2】図2A及び図2Bは、それぞれ、本発明に係る細胞収集器アッセンブリの一実施形態の側面図及び、線A−Aに沿った断面図である。図2Cは、細胞収集器アッセンブリの拡張可能収集先端部の詳細図である。
【図3】図3は、収集器ハンドルアッセンブリに取り付けられた細胞収集器の断面図である。
【図4】図4は、収集器ハンドルアッセンブリに取り付けられた細胞収集器を持つ使用者の手の模式図である。
【図5】図5A〜5Cは、細胞クラスター収集時の細胞収集器の拡張を示す細胞収集器の先端部領域の断面図である。
【図6】図6A〜6Cは、細胞収集器を用いた頚部からの細胞クラスター収集工程を示す。
【図7】図7A〜7Kは、収集された細胞のクラスターをシュミレートする着色マーカー及びマーキング液と、細胞収集器を用いた細胞クラスター移着の過程を示す。
【図8】図8は、収集された細胞のクラスターを移着させるために細胞収集器が装着された細胞移着装置を示す。
【図9】図9A〜9Cは、マーカーによって標識した後の頚部細胞の接触前処理の図である。
【図10】図10は、収集された細胞のクラスターの分析に用いられる手動スキャナー装置の斜視図である。
【図11】図11は、収集された細胞のクラスターの分析に用いられる自動スキャナー装置の模式図である。
【図12】図12は、細胞収集器の別の実施形態を示す。
【図13】図13A〜13Cは、図12の細胞収集器の先端部領域が、収集時、どのように拡張し、回転するかを示す詳細図である。
【図14】図14A〜14Cは、細胞収集器の先端部の別の例を示す。
【図15】図15A〜15Bは、細胞クラスター移着を実現するための別の機構を示す。
【図16】図16は、図2A〜2Bの細胞収集器がどのように、細胞移着を実現するための機構の別の実施形態の装着プーリーに取り付けられるかを示す。
【図17】図17は、図16の装着プーリーに取り付けられた細胞収集器を示す。
【図18】図18は、収集された細胞クラスターの、スライドを備えた回転台上への移着時の、細胞収集器及び装着プーリーを示す。
【図19】図19は、細胞クラスターの移着を実現するための装着プーリーの別の実施形態の断面図である。
【図20】図20A〜20Cは、収集時に細胞収集器を回転させる機構を示す。
【図21】図21は、収集器ハンドルアッセンブリの別の実施形態を示す。
【図1A】

【図1B】

【図1C】

【図2A】

【図2B】

【図2C】

【特許請求の範囲】
【請求項1】
頚部内の異常組織を検出するためのシステムであって、
頚部である子宮外頚部及び子宮内頚部の部位から、空間的に配置された細胞のクラスターを収集するための収集器であって、前記収集器上に収集された細胞のクラスターの空間的完全性を維持する収集器と、
前記収集器から移着された細胞のクラスターを受ける受け構造体であって、前記受け構造体及び前記収集器が、前記受け構造体に移着された細胞のクラスターの空間的完全性を維持するように構成されている受け構造体と、
調査のために、前記受け構造体に移着された細胞のクラスターを調製するためのアッセイと、
形成異常の状態で現われる2種以上の細胞発現特性の不均衡が存在する可能性があるかどうかを検知するために、前記アッセイによって調製された細胞のクラスターを検出するためのスキャナー装置とを含むシステム。
【請求項2】
前記収集された細胞及び移着された細胞の空間的完全性のそれぞれを維持するのに役立つように、前記収集器及び前記受け構造体のそれぞれは、それらの上に配置された少なくとも1つの位置合わせ指標を含む請求項1に記載のシステム。
【請求項3】
前記収集器は、本体と、前記本体の一端部に近接して配置された弾性表面とを更に含み、前記弾性表面は、頚部である前記子宮外頚部及び子宮内頚部の部位から細胞のクラスターを収集するのに適した触感を有し、前記弾性表面は、前記弾性表面の均一な拡張を可能にする材料でできており、前記弾性表面は回転可能であってもよく、
前記弾性表面が拡張し、回転するとき、前記弾性表面の触感によって、前記弾性表面による前記子宮外頚部及び子宮内頚部の部位からの細胞のクラスターの収集が促進される請求項1に記載のシステム。
【請求項4】
前記弾性表面の材料は、熱可塑性エラストマー混合物を含む請求項3に記載のシステム。
【請求項5】
前記触感は、MT−11010を含む請求項3に記載のシステム。
【請求項6】
前記アッセイが、第1の細胞発現特性のマーカーとしての第1の試薬と、第2の細胞発現特性のマーカーとしての第2の試薬とを含む細胞学的検出カクテルを更に含む請求項1に記載のシステム。
【請求項7】
異常組織を検出するためのシステムであって、
2種以上の細胞発現特性の潜在的な不均衡が形成異常の状態で現われる可能性がある組織の局所的部分から細胞のクラスターを収集するための収集器と、
前記収集器から移着された細胞のクラスターを受ける受け構造体と、
調査のために、前記受け構造体に移着された細胞のクラスターを調製するためのアッセイと、
形成異常の状態で現われる2種以上の細胞発現特性の不均衡が存在する可能性があるかどうかを検知するために、前記アッセイによって調製された細胞のクラスターを検出するためのスキャナー装置とを含むシステム。
【請求項8】
頚部内の異常組織を検出する方法であって、
(a)収集器を用いて、前記頚部である子宮外頚部及び子宮内頚部の部位から、細胞のクラスターを、前記収集器上に収集された細胞のクラスターの空間的完全性を維持しながら収集する工程と、
(b)受け構造体に、前記収集器によって収集された細胞のクラスターの少なくとも一部を、前記受け構造体に移着された細胞のクラスターの空間的完全性を維持しながら移着させる工程と、
(c)前記受け構造体に移着された細胞のクラスターに、細胞学的検出カクテルを添加する工程と、
(d)2種以上の細胞発現特性の不均衡について前記細胞のクラスターを分析する工程とを含む方法。
【請求項9】
前記収集され、移着された細胞のクラスターの空間的完全性が、前記収集器上及び前記受け構造体上の、それぞれの少なくとも1つの位置合わせ指標によって維持される請求項8に記載の方法。
【請求項10】
前記収集工程は、
前記子宮外頚部及び子宮内頚部の部位における細胞のクラスターに接触する工程であって、前記細胞のクラスターが、前記子宮外頚部及び子宮内頚部の部位から細胞のクラスターを収集するのに適した触感を有する収集器の弾性表面に接触する工程と、
前記収集器の弾性表面を拡張させる工程と、
前記弾性表面を、前記子宮外頚部及び子宮内頚部の部位に対して回転させる工程とを更に含み、
前記弾性表面が拡張し、回転するとき、前記弾性表面の触感によって、前記弾性表面による前記子宮外頚部及び子宮内頚部の部位からの細胞のクラスターの収集が促進される請求項8に記載の方法。
【請求項11】
前記拡張工程は、前記収集器を機械的に拡張させる工程を含む請求項10に記載の方法。
【請求項12】
前記弾性表面を手動で回転させる工程を含む請求項10に記載の方法。
【請求項13】
前記弾性表面を機械的に回転させる工程を含む請求項10に記載の方法。
【請求項14】
前記弾性表面をおよそ20から30度回転させる工程を含む請求項10に記載の方法。
【請求項15】
前記弾性表面を拡張させた後、前記弾性表面を回転させる工程を含む請求項10に記載の方法。
【請求項16】
前記移着工程は、前記収集器を空気圧により拡張させる工程を更に含む請求項8に記載の方法。
【請求項17】
前記収集器を、前記子宮外頚部及び子宮内頚部の部位からの細胞クラスターが概ね共通の平面上にあるようになる程度まで拡張させる請求項16に記載の方法。
【請求項18】
前記細胞学的カクテルを添加する工程は、第1の細胞発現特性のマーカーとしての第1の試薬を添加する工程と、第2の細胞発現特性のマーカーとしての第2の試薬を添加する工程とを更に含む請求項8に記載の方法。
【請求項19】
前記細胞学的検出カクテルを添加する工程は、前記第1および第2の試薬を共に前記細胞のクラスターに添加する工程を含む請求項18に記載の方法。
【請求項20】
前記細胞のクラスターを分析する工程は、前記細胞のクラスターをスキャニングし、前記アッセイから検出された個々のシグナルの強度を測定し、前記細胞のクラスター全体に亘って前記シグナルの割合がどのように変化するのかを特定する工程を含む請求項8に記載の方法。
【請求項21】
異常組織を検出する方法であって、
(a)収集器を用いて、2種以上の細胞発現特性の潜在的な不均衡が形成異常の状態で現われる可能性のある組織の局所的部分からの細胞クラスターを含む細胞サンプルを収集する工程と、
(b)前記収集された細胞クラスターの少なくとも一部を、受け構造体に移着させる工程と、
(c)前記受け構造体に移着された細胞クラスターに、細胞学的検出カクテルを添加する工程と、
(d)2種以上の細胞発現特性の不均衡について前記移着された細胞クラスターを分析する工程とを含む方法。
【請求項22】
前記細胞学的検出カクテルを添加する工程は、第1の細胞発現特性のマーカーとしての第1の試薬を添加する工程と、第2の細胞発現特性のマーカーとしての第2の試薬を添加する工程とを含む請求項21に記載の方法。
【請求項23】
前記細胞学的検出カクテルを添加する工程は、前記第1及び第2の試薬を共に単一の細胞サンプルである前記移着された細胞に添加する工程を含む請求項22に記載の方法。
【請求項24】
前記分析工程は、前記細胞のクラスターを、スキャニング装置を用いてスキャニングする工程を更に含む請求項21に記載の方法。
【請求項25】
前新生物又は新生物病変が存在している可能性のある局所的部分の一部である細胞の存在を示すために細胞クラスターをスクリーニングする方法であって、
正常な細胞の成長、発達及び機能時には同一細胞内に通常発生しない2種以上の生物学的マーカーについて前記細胞クラスターを調査する工程を含む方法。
【請求項1】
頚部内の異常組織を検出するためのシステムであって、
頚部である子宮外頚部及び子宮内頚部の部位から、空間的に配置された細胞のクラスターを収集するための収集器であって、前記収集器上に収集された細胞のクラスターの空間的完全性を維持する収集器と、
前記収集器から移着された細胞のクラスターを受ける受け構造体であって、前記受け構造体及び前記収集器が、前記受け構造体に移着された細胞のクラスターの空間的完全性を維持するように構成されている受け構造体と、
調査のために、前記受け構造体に移着された細胞のクラスターを調製するためのアッセイと、
形成異常の状態で現われる2種以上の細胞発現特性の不均衡が存在する可能性があるかどうかを検知するために、前記アッセイによって調製された細胞のクラスターを検出するためのスキャナー装置とを含むシステム。
【請求項2】
前記収集された細胞及び移着された細胞の空間的完全性のそれぞれを維持するのに役立つように、前記収集器及び前記受け構造体のそれぞれは、それらの上に配置された少なくとも1つの位置合わせ指標を含む請求項1に記載のシステム。
【請求項3】
前記収集器は、本体と、前記本体の一端部に近接して配置された弾性表面とを更に含み、前記弾性表面は、頚部である前記子宮外頚部及び子宮内頚部の部位から細胞のクラスターを収集するのに適した触感を有し、前記弾性表面は、前記弾性表面の均一な拡張を可能にする材料でできており、前記弾性表面は回転可能であってもよく、
前記弾性表面が拡張し、回転するとき、前記弾性表面の触感によって、前記弾性表面による前記子宮外頚部及び子宮内頚部の部位からの細胞のクラスターの収集が促進される請求項1に記載のシステム。
【請求項4】
前記弾性表面の材料は、熱可塑性エラストマー混合物を含む請求項3に記載のシステム。
【請求項5】
前記触感は、MT−11010を含む請求項3に記載のシステム。
【請求項6】
前記アッセイが、第1の細胞発現特性のマーカーとしての第1の試薬と、第2の細胞発現特性のマーカーとしての第2の試薬とを含む細胞学的検出カクテルを更に含む請求項1に記載のシステム。
【請求項7】
異常組織を検出するためのシステムであって、
2種以上の細胞発現特性の潜在的な不均衡が形成異常の状態で現われる可能性がある組織の局所的部分から細胞のクラスターを収集するための収集器と、
前記収集器から移着された細胞のクラスターを受ける受け構造体と、
調査のために、前記受け構造体に移着された細胞のクラスターを調製するためのアッセイと、
形成異常の状態で現われる2種以上の細胞発現特性の不均衡が存在する可能性があるかどうかを検知するために、前記アッセイによって調製された細胞のクラスターを検出するためのスキャナー装置とを含むシステム。
【請求項8】
頚部内の異常組織を検出する方法であって、
(a)収集器を用いて、前記頚部である子宮外頚部及び子宮内頚部の部位から、細胞のクラスターを、前記収集器上に収集された細胞のクラスターの空間的完全性を維持しながら収集する工程と、
(b)受け構造体に、前記収集器によって収集された細胞のクラスターの少なくとも一部を、前記受け構造体に移着された細胞のクラスターの空間的完全性を維持しながら移着させる工程と、
(c)前記受け構造体に移着された細胞のクラスターに、細胞学的検出カクテルを添加する工程と、
(d)2種以上の細胞発現特性の不均衡について前記細胞のクラスターを分析する工程とを含む方法。
【請求項9】
前記収集され、移着された細胞のクラスターの空間的完全性が、前記収集器上及び前記受け構造体上の、それぞれの少なくとも1つの位置合わせ指標によって維持される請求項8に記載の方法。
【請求項10】
前記収集工程は、
前記子宮外頚部及び子宮内頚部の部位における細胞のクラスターに接触する工程であって、前記細胞のクラスターが、前記子宮外頚部及び子宮内頚部の部位から細胞のクラスターを収集するのに適した触感を有する収集器の弾性表面に接触する工程と、
前記収集器の弾性表面を拡張させる工程と、
前記弾性表面を、前記子宮外頚部及び子宮内頚部の部位に対して回転させる工程とを更に含み、
前記弾性表面が拡張し、回転するとき、前記弾性表面の触感によって、前記弾性表面による前記子宮外頚部及び子宮内頚部の部位からの細胞のクラスターの収集が促進される請求項8に記載の方法。
【請求項11】
前記拡張工程は、前記収集器を機械的に拡張させる工程を含む請求項10に記載の方法。
【請求項12】
前記弾性表面を手動で回転させる工程を含む請求項10に記載の方法。
【請求項13】
前記弾性表面を機械的に回転させる工程を含む請求項10に記載の方法。
【請求項14】
前記弾性表面をおよそ20から30度回転させる工程を含む請求項10に記載の方法。
【請求項15】
前記弾性表面を拡張させた後、前記弾性表面を回転させる工程を含む請求項10に記載の方法。
【請求項16】
前記移着工程は、前記収集器を空気圧により拡張させる工程を更に含む請求項8に記載の方法。
【請求項17】
前記収集器を、前記子宮外頚部及び子宮内頚部の部位からの細胞クラスターが概ね共通の平面上にあるようになる程度まで拡張させる請求項16に記載の方法。
【請求項18】
前記細胞学的カクテルを添加する工程は、第1の細胞発現特性のマーカーとしての第1の試薬を添加する工程と、第2の細胞発現特性のマーカーとしての第2の試薬を添加する工程とを更に含む請求項8に記載の方法。
【請求項19】
前記細胞学的検出カクテルを添加する工程は、前記第1および第2の試薬を共に前記細胞のクラスターに添加する工程を含む請求項18に記載の方法。
【請求項20】
前記細胞のクラスターを分析する工程は、前記細胞のクラスターをスキャニングし、前記アッセイから検出された個々のシグナルの強度を測定し、前記細胞のクラスター全体に亘って前記シグナルの割合がどのように変化するのかを特定する工程を含む請求項8に記載の方法。
【請求項21】
異常組織を検出する方法であって、
(a)収集器を用いて、2種以上の細胞発現特性の潜在的な不均衡が形成異常の状態で現われる可能性のある組織の局所的部分からの細胞クラスターを含む細胞サンプルを収集する工程と、
(b)前記収集された細胞クラスターの少なくとも一部を、受け構造体に移着させる工程と、
(c)前記受け構造体に移着された細胞クラスターに、細胞学的検出カクテルを添加する工程と、
(d)2種以上の細胞発現特性の不均衡について前記移着された細胞クラスターを分析する工程とを含む方法。
【請求項22】
前記細胞学的検出カクテルを添加する工程は、第1の細胞発現特性のマーカーとしての第1の試薬を添加する工程と、第2の細胞発現特性のマーカーとしての第2の試薬を添加する工程とを含む請求項21に記載の方法。
【請求項23】
前記細胞学的検出カクテルを添加する工程は、前記第1及び第2の試薬を共に単一の細胞サンプルである前記移着された細胞に添加する工程を含む請求項22に記載の方法。
【請求項24】
前記分析工程は、前記細胞のクラスターを、スキャニング装置を用いてスキャニングする工程を更に含む請求項21に記載の方法。
【請求項25】
前新生物又は新生物病変が存在している可能性のある局所的部分の一部である細胞の存在を示すために細胞クラスターをスクリーニングする方法であって、
正常な細胞の成長、発達及び機能時には同一細胞内に通常発生しない2種以上の生物学的マーカーについて前記細胞クラスターを調査する工程を含む方法。
【図3】


【図4】


【図5A】


【図5B】


【図5C】


【図6A】


【図6B】


【図6C】


【図7A】


【図7B】


【図7C】


【図7D】


【図7E】


【図7F】


【図7G】


【図7H】


【図7I】


【図7J】


【図7K】


【図8】


【図9A】


【図9B】


【図9C】


【図10】


【図11】


【図12】


【図13A】


【図13B】


【図13C】


【図14A】


【図14B】


【図14C】


【図15A】


【図15B】


【図16】


【図17】


【図18】


【図19】


【図20A】


【図20B】


【図20C】


【図21】




【図4】


【図5A】


【図5B】


【図5C】


【図6A】


【図6B】


【図6C】


【図7A】


【図7B】


【図7C】


【図7D】


【図7E】


【図7F】


【図7G】


【図7H】


【図7I】


【図7J】


【図7K】


【図8】


【図9A】


【図9B】


【図9C】


【図10】


【図11】


【図12】


【図13A】


【図13B】


【図13C】


【図14A】


【図14B】


【図14C】


【図15A】


【図15B】


【図16】


【図17】


【図18】


【図19】


【図20A】


【図20B】


【図20C】


【図21】


【公表番号】特表2008−527349(P2008−527349A)
【公表日】平成20年7月24日(2008.7.24)
【国際特許分類】
【出願番号】特願2007−550416(P2007−550416)
【出願日】平成18年1月4日(2006.1.4)
【国際出願番号】PCT/US2006/000049
【国際公開番号】WO2006/074143
【国際公開日】平成18年7月13日(2006.7.13)
【出願人】(507230016)ダイアミクス、インク. (2)
【Fターム(参考)】
【公表日】平成20年7月24日(2008.7.24)
【国際特許分類】
【出願日】平成18年1月4日(2006.1.4)
【国際出願番号】PCT/US2006/000049
【国際公開番号】WO2006/074143
【国際公開日】平成18年7月13日(2006.7.13)
【出願人】(507230016)ダイアミクス、インク. (2)
【Fターム(参考)】
[ Back to top ]

