異常蛋白質除去用組成物
【課題】効果の高い異常蛋白質除去用組成物を提供すること、また蛋白質分解異常による疾患の予防及び治療等に寄与する組成物、剤、食品を提供する。
【解決手段】大豆サポニンBグループを主要成分とする異常蛋白質除去用組成物。
【解決手段】大豆サポニンBグループを主要成分とする異常蛋白質除去用組成物。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、異常蛋白質除去用組成物及び異常蛋白質蓄積を伴う疾病を予防する組成物に関する。
【背景技術】
【0002】
異常蛋白質は年齢とともに増加し、生体内に蓄積した蛋白質分解異常による疾患又は障害(アルツハイマー病、パーキンソン病、レビー小体病、トリプレットリピート病、筋萎縮性側索硬化症、白内障、動脈硬化、糖尿病性腎症、皮膚の光老化、皮膚におけるしわ等)等、多くの疾病に関与することが明らかとなってきた(非特許文献 BIO Clinica,11巻、第5号、1996年)。また、若年であっても、過度のストレス・紫外線等により生体内に慢性的に活性酸素が多量発生している場合、異常蛋白質の蓄積は加速する。現在では蛋白質分解異常に起因する疾病の予防及び治療が大きな課題となっているが、従来、異常蛋白質の生体内蓄積防御に関しては蛋白質の酸化修飾を防御する研究がなされてきた。即ち、酸化ストレスにより生体防御機構で対応できない程度まで生成した活性酸素を、抗酸化物質を摂取することで消去し、蛋白質の酸化を抑えるという試みである。代表的な抗酸化物質としてはトコフェノール類やカロテノイド類、そして多種の植物に含まれるフラボノイド類がある。
【0003】
しかしながら、抗酸化物質の摂取は、生体内で発生する活性酸素の消去に寄与するが、既に蓄積している異常蛋白質の除去には何ら寄与しない。従って、加齢に伴って生体内に蓄積した異常蛋白質が関与する種々の疾患の予防及び治療には異常蛋白質の除去が必須となる。
【0004】
一方、本発明者等は、大豆サポニンの作用機序について着目して継続して探求し、異常蛋白質除去機能(特許文献1:特開2002−179592号公報、特許文献2:特開2004−115438号公報)、紫外線傷害予防又は改善機能があること(特許文献3:特開2004−131431号公報)などを既に提案している。
他方、本発明者等は、異常蛋白質を除去する成分を探索した結果、大豆サポニン以外にケール(特許文献4:特開2004−91398号公報)にその効果を見出している。
異常蛋白質が関与する加齢に伴う種々の疾患の予防及び治療の目的に、上記大豆サポニンを用いると、通常の摂取量として負担量が多くなることが判明し、少ない量でもさらなる効果の高い成分の開発探求を行ってきた。
【0005】
【特許文献1】特開2002-179592号公報
【特許文献2】特開2004−115438号公報
【特許文献3】特開2004−131431号公報
【特許文献4】特開2004−91398号公報
【発明の開示】
【発明が解決しようとする課題】
【0006】
本発明の目的は、大豆サポニンに着目し、効果の高い異常蛋白質除去用組成物を特定し、提供すること、また蛋白質分解異常による疾患の予防及び治療等に寄与する組成物、剤、食品を提供することである。
【課題を解決するための手段】
【0007】
本発明者等は、上記の目的を達成するために、大豆サポニンの分画物を用いて、異常蛋白質を除去する成分を探索した。その結果、高純度大豆サポニンBグループに求める効果を見出し、本発明を完成するに至った。
本発明の主な構成は、以下のとおりである。
【0008】
(1)大豆サポニンBグループを主要成分とすることを特徴とする異常蛋白質除去用組成物。
(2)大豆サポニンBグループは、大豆抽出物100重量部のうち、大豆サポニンBグループを40〜100重量部含有する大豆抽出物であることを特徴とする(1)記載の異常蛋白質除去用組成物。
(3)大豆サポニンBグループが、SoyasaponinI、II、III、IV、Vあるいはそれらのアセチル体、大豆サポニンAグループがSoyasaponinA1、A2、A3、A4、A5、A6、Ac、Adあるいはそれらのアセチル体、もしくはそれらの混合物である請求項1又は2に記載の異常蛋白質除去用組成物。
(4)コラーゲン、ゼラチン、コラーゲン加水分解物、ゼラチン加水分解物から選択されるいずれか一種以上及び/又はシリマリンを含むことを特徴とする(1)〜(3)のいずれかに記載の異常蛋白質除去用組成物。
(5)(1)〜(4)のいずれかに記載の異常蛋白質除去用組成物を含有する紫外線障害予防・改善剤用組成物。
(6)(1)〜(4)のいずれかに記載の異常蛋白質除去用組成物又は(5)に記載の紫外線障害予防・改善剤用組成物を含有する抗老化食品。
(7)(1)〜(4)のいずれかに記載の異常蛋白質除去用組成物又は(5)に記載の紫外線障害予防・改善剤用組成物を含有するくすみ抑制又はしわ抑制又は保湿用食品。
(8)(1)〜(4)いずれかに記載の異常蛋白質除去用組成物又は(5)に記載の紫外線障害予防・改善剤用組成物を含有する抗老化化粧料。
(9)(1)〜(4)のいずれかに記載の異常蛋白質除去用組成物又は(5)に記載の紫外線障害予防・改善剤用組成物を含有するくすみ抑制又はしわ抑制又は保湿用化粧料。
(10)(1)〜(4)のいずれかに記載の異常蛋白質除去用組成物又は(5)に記載の紫外線障害予防・改善剤用組成物を含有する抗老化飼料又は動物薬。
(11)(1)〜(4)のいずれかに記載の異常蛋白質除去用組成物又は(5)に記載の紫外線障害予防・改善剤用組成物を含有するくすみ抑制又はしわ抑制又は保湿用飼料又は動物薬。
(12)(1)〜(4)のいずれかに記載の異常蛋白質除去用組成物又は(5)に記載の紫外線障害予防・改善剤用組成物を含有する抗老化ペット動物用化粧料。
(13)(1)〜(4)のいずれかに記載の異常蛋白質除去用組成物又は(5)に記載の紫外線障害予防・改善剤用組成物を含有するくすみ抑制又はしわ抑制又は保湿用ペット動物用化粧料。
【発明の効果】
【0009】
異常蛋白質除去用有効成分として、高純度大豆サポニンBグループを提供することで、これまでの大豆サポニンに比べ、さらに高い効果が得られ、通常の摂取量として負担のない目安量を設定できる。
本発明の異常蛋白質除去用組成物を用いれば、蓄積した異常蛋白質を除去することができる。従って、本発明の製剤は、蛋白質分解異常による疾患又は障害(アルツハイマー病、パーキンソン病、レビー小体病、トリプレットリピート病、筋萎縮性側索硬化症、白内障、動脈硬化、糖尿病性腎症、皮膚の光老化、皮膚におけるしわ)等蛋白質分解異常による疾病の予防又は治療において有効である。さらに、抗老化用の化粧料や食品としても有用である。
具体的には、抗老化効果、くすみ抑制効果、しわ抑制効果、保湿効果、紫外線障害予防・改善作用について効果が期待できる。
具体的な利用形態として、医薬、食品、化粧料、飼料などに利用できる。
【発明を実施するための最良の形態】
【0010】
以下に、本発明を詳細に説明する。
本発明において、異常蛋白質とは、一般に加齢に伴い、酸化又は糖化又はアルデヒド修飾を受けた蛋白質を言う。
大豆由来のサポニンは、大豆種子中の種皮、子葉、胚軸又は大豆植物体の葉、茎、根等に広く分布する。構造的にはグリチルリチンと類似の構造であるが、トリテルペノイド骨格に2〜5個の糖から成る糖鎖を持つ。大豆サポニンはアグリコン(非糖部)の構造によって4つのグループ(A、B、E及びDDMPグループ)に分類され、すべてのグループのサポニンが多種多様な糖鎖構造を有する。現在までにSoyasapogenol A 、B、E及びDDMPをそれぞれアグリコンとする8種類のAグループ、2種類のEグループ、5種類のBグループ、6種類のDDMPグループが同定されている(非特許文献Agric Biol Chem,55 315-322(1991))(非特許文献Agric Biol Chem,55 911-917(1991))(非特許文献Agric Biol Chem,57 546-550(1993))。
【0011】
AグループサポニンはSoyasapogenol AのC-3とC-22位の2箇所に糖鎖が結合したビスデスモサイド型サポニンで大豆の種子胚軸にのみ分布しており不快味(苦み、収斂味)の主因である。現在Aグループサポニンに関しては2通りの命名があり、SoyasaponinA1とSoyasaponinAbは同一化合物であり、同じくA2はAf、A3はAh、A4はAa、A5はAe 、A6はAgとなっている。Ac及びAdは別名が知られていない(非特許文献 BBB 62(12) 2291-2299,1998)。
【0012】
これに対してBグループ及びEグループサポニンは、C-3位にのみ糖鎖が1本結合したモノデスモサイド型サポニンである。DDMPグループサポニンは温和な条件下で抽出を行なうと精製できるが(非特許文献Agric Biol Chem,57 546-550(1993))、加熱条件下及びアルカリ条件下においてBグループサポニンに変換される。従って大豆中に存在するサポニンはそのほとんどがAグループサポニン及びDDMPグループサポニンであって、Bグループサポニンはわずかであり、Bグループサポニンはその多くが抽出の際にDDMPグループサポニンから生成するアーティファクト成分であると推定されている。Bグループサポニンは大豆
胚軸や子葉に多く存在し、現在Bグループサポニンに関しては2通りの命名があり、SoyasaponinIとSoyasaponinBbは同一化合物であり、同じくIIはBc、IIIはBb’、IVはBc’、VはBaとなっている(非特許文献 BBB 62(12) 2291-2299,1998)。
【0013】
また、これまで大豆サポニンの吸収動態については不明であったが、SoyasaponinIはヒトの腸ではそのまま吸収されず、腸内細菌によってアグリコンであるSoyasapogenol Bに分解され、濃度依存的に吸収されることが推測されており、他のBグループサポニンについてもアグリコン型として吸収されることが示唆されている(非特許文献J Nutr 134
1687-1873 (2004) )。よって、食品としてBグループサポニンを摂取する場合、その組成(配糖体又は、アグリコン又は/及びその誘導体等)如何に関わらずアグリコン型として同様に吸収されると推定できる。
【0014】
一般に、サポニンは溶血性を示すものが多い。しかし、大豆サポニンは溶血性をほとんど有しないという報告がなされている(非特許文献 基礎と臨床 Vol.15 No.5 1981)。また、本発明者等が大豆から得られた大豆サポニン類の家兎2%血液浮遊液に対する溶血指数を測定したところ、人参サポニンと同様100以下であり、他の報告同様溶血性を有しないことが判明した。
また、本発明者等が、大豆サポニンBグループの安全性を調べる為、変異原性及び急性毒性について試験したところ、いずれも異常なく、その安全性が高いことが証明された。
本発明の高含有大豆サポニンBグループは、以下の工程で得ることが出来る。
【0015】
[サポニンの抽出]
原料大豆胚軸は、有機溶媒等であらかじめ脱脂したもの、していないものいずれも使用可能であるが、サポニンの抽出効率から脱脂したものの方が有利である。原料大豆胚軸よりサポニンを抽出する方法は、室温から80℃において原料に対して5〜10倍容量の抽出溶媒を加えて攪拌するのが一般的な方法であるが、サポニンが十分に抽出できる条件であれば特に限定されない。
本発明におけるイオン交換樹脂は、3級アミンを含む弱塩基性陰イオン交換樹脂であれば特に制限はなく、粒径が不均一な樹脂、例えば、三菱化成製ダイヤイオンWA-30なども利用可能であるが、平均粒径±10%の範囲に90%以上の粒度分布をもつ均一粒径のものが好ましい。
【0016】
[サポニンの溶出・精製]
上記サポニン抽出液から、蒸留操作により溶媒を溜去し、水で希釈したサポニン溶液を上記イオン交換樹脂に吸着させた後、水、アルコールあるいは含水アルコールで樹脂を洗浄した後、酸又はアルカリを使って樹脂に吸着させたサポニンを溶出する。溶出したサポニン溶液をそのまま乾燥して得られる大豆サポニン粗精製物は純度20〜50重量%と低く、サポニン以外の不純物が多く、生理活性の高い大豆サポニンBグループの比率も20〜30重量%程度と低いものである。
サポニンの純度を高めるために、溶出したサポニンをそのまま水で希釈し、無極性の合成吸着剤にサポニンを吸着させる。無極性の合成吸着剤としては、スチレン・ジビニルベンゼン型樹脂などがあり、例えば、三菱化学製、ダイヤイオンHP-20やローム・アンド・ハース社製のアンバーライトXAD−2などが使用可能である。合成吸着剤に吸着させる際に使用する含水アルコール中のアルコール濃度はアルコールの種類によって異なるが、メタノールの場合は、0〜50重量%、エタノールの場合は、0〜30重量%が好ましい。次に、水あるいは含水エタノールで樹脂を洗浄した後、洗浄時よりアルコール濃度の高い含水アルコールで溶出させてサポニン高純度溶液を得ることができる。
【0017】
[後処理]
得られたサポニン高純度溶液を、必要に応じてpH調整剤を用いてpH調整した後、加熱乾燥、減圧加熱乾燥、スプレードライ、凍結乾燥などの方法で乾燥することにより高純度大豆サポニン粉末を得ることができる。
以上の工程で効率よく安価に、純度70重量%以上の高純度大豆サポニンを得ることができ、かつ、活性の高い大豆サポニンBグループを50%重量以上の濃度に濃縮できる他、総サポニン中の大豆サポニンBグループ比率を70重量%以上に高めることもできる。
【0018】
樹脂による精製を行なう順序としては、陰イオン交換樹脂による処理を行なった後に、無極性の合成吸着剤による精製を行なう。合成吸着剤で先に処理した場合、低極性物質などが合成吸着剤に強く吸着され、アルカリ処理など、通常の樹脂再生処理を行なっても樹脂の劣化が起こり、樹脂の能力が徐々に低下するが、これに対して、先に陰イオン交換樹脂で大豆サポニンを粗精製することにより、大豆イソフラボンやオリゴ糖の他、低極性物質を取り除くことができ、続く無極性の合成吸着剤の処理能力が向上し、劣化が起こり難くなるのである。その際には、陰イオン交換樹脂は、アルカリによる処理により何度も繰り返し使うことができる。
【0019】
大豆サポニンBグループをリッチに調整した組成物には、異常蛋白質除去作用、紫外線障害予防・改善作用、抗老化作用、くすみ抑制作用、しわ抑制作用及び保湿作用に優れた作用効果があることを訴求し、確認できた。
このような作用効果を利用する形態としては、医薬、食品、飲料、サプリメント、食品添加剤、化粧料、飼料、飼料添加剤、動物薬等である。経口あるいは非経口共提供可能である。
高純度大豆サポニンBグループは、そのままでも、様々な用途に使用できるが、目的に応じて予め様々な他の成分と混合、あるいは食品や飼料あるいは動物薬に添加することができる。
【0020】
食品としては、直接、又は種々の栄養成分を添加して使用できる。例えば、澱粉、乳糖、麦芽糖、植物油脂粉末、カカオ脂末、ステアリン酸などの適当な助剤を添加した後、慣用の手段を用いて、食用に適した形態、例えば、顆粒状、粒状、錠剤、カプセル、ペーストなどに成形して健康補助食品、保健機能食品などとして、食用に供してもよく、また種々の食品、例えば、ハム、ソーセージなどの食肉加工食品、かまぼこ、ちくわなどの水産加工食品、パン、菓子、バター、粉乳、発酵乳製品に添加して使用してもよく、水、果汁、牛乳、清涼飲料などの飲料に添加して使用してもよい。そのような剤、食品は、通常採用されている製剤化技術により製造することができる。
【0021】
化粧料としては、直接又は小麦胚芽油あるいはオリーブ油などに添加して、化粧料成分として使用し、これらを用いて化粧料を製造することができる。
【0022】
医薬としての適用方法は、経口投与又は非経口投与のいずれも採用することができる。投与に際しては、有効成分を経口投与、直腸内投与、注射などの投与方法に適した固体又は液体の医薬用無毒性担体と混合して、慣用の医薬製剤の形態で投与することができる。
【0023】
非経口適用の組成物は、例えば水溶液、油剤、乳液、懸濁液等の液剤、ゲル、クリーム等の半固形剤、粉末、顆粒、カプセル、マイクロカプセル、固形等の固形剤の形態で適用可能である。従来から公知の方法でこれらの形態に調製し、ローション剤、乳剤、ゲル剤、クリーム剤、軟膏、硬膏、ハップ剤、エアゾール剤、坐剤、注射剤、粉末剤等の種々の剤型とすることができる。これらを身体に塗布、貼付、噴霧等により適用することができる。特にこれら剤型の中で、ローション剤、乳剤、クリーム剤、軟膏剤、硬膏剤、ハップ剤、エアゾール剤等が皮膚外用剤に適している。化粧料としては、化粧水、乳液、クリーム、パック等の皮膚化粧料、メイクアップベースローション、メイクアップクリーム、乳液状又はクリーム状あるいは軟膏型のファンデーション、口紅、アイカラー、チークカラーといったメイクアップ化粧料、ハンドクリーム、レッグクリーム、ボディローション等の身体用化粧料等とすることができる。
【0024】
増量剤と混合した組成物の状態としておくと便利に使用できる。増量剤としては、グルコース、ラクトース、マルトース、ショ糖等の糖類、ソルビトール等の糖アルコール、デキストリン、サイクロデキストリン等の加工澱粉、小麦澱粉、コーンスターチ等の澱粉類、カゼイン、大豆蛋白質等の蛋白質、アラビアガム、アルギン酸ナトリウム、カゼインナトリウム、ゼラチン、ペクチン、粉末セルロース、カルボキシメチルセルロース等の高分子安定剤、レシチン、ショ糖脂肪酸エステル、プロピレングリコール脂肪酸エステル、グリセリン脂肪酸エステル等の乳化剤、カルシウム粉末等が使用できる。
【0025】
本発明の異常蛋白質除去用組成物は、上記高純度大豆サポニンBグループの他に抗酸化作用を有する化合物を含有させることができる。抗酸化作用を示す化合物は、特に限定されるものではないが、例えば各種ビタミン類、シリマリン等の各種ポリフェノール類、トコトリエノール、補酵素Q10及びそれらを含有する天然成分などが挙げられる。
本発明の異常蛋白質除去用組成物は、上記高純度大豆サポニンBグループの他に生体コラーゲン合成促進剤を有する化合物を含有させることができる。生体コラーゲン合成促進作用を示す化合物は、特に限定されるものではないが、例えばコラーゲン及びゼラチンの分解物、N末端にグリシンを含むトリペプチドを含有するペプチド混合物などが挙げられる。
【0026】
コラーゲンは、牛や豚や魚などの動物の皮膚、骨及び腱などの結合組織から抽出したもの、もしくはコラーゲンを熱変性したゼラチンなど全てのものが使用可能である。コラーゲン及び/又はゼラチンの分解物として、分子量が400以下のものを含有するポリペプチドを用いることが好ましい。より好ましくは、平均分子量が200〜300付近のものを高含有するポリペプチドが好ましい。分子量が400以下のもの、より好ましくは、平均分子量が200〜300付近のものを高含有するポリペプチドは、アミノ酸の分子量が100前後であることから、トリペプチドを高含有するポリペプチドに相当する。分子量が400以下のコラーゲン及び/又はゼラチンの分解物は精製したものでもよいが、精製しなくても差し支えない。例えば他のコラーゲン及び/又はゼラチンの分解物等の混合物
でもよい。
これに対してコラーゲン及び/又はゼラチンの分解物は、特定の有効成分として分子量で約400以下のペプチドを含むことにより、その加水分解処理により、生体内でのコラーゲン合成促進活性を向上させることに寄与できる。
【0027】
シリマリン(Silymarin;CAS No.65666−07−1)は、キク科マリアアザミ(別名オオアザミ、オオヒレアザミ、ミルクアザミ;CAS No.84604−20−6)から抽出されるフラボノリグナンの総称であり、確認されている主要成分はシリビン(Silybin;CAS No.22888−70−6)、シリジアニン(Silydianin;CAS No.29782−68−1)、シリクリスチン(Silychristin;CAS No.33889−69−9)、イソシリビン(Isosilybin;CAS No.72581−71−6)などがある(天然薬物事典、奥田拓男編)。シリマリンは古くからヨーロッパで肝臓疾患の予防及び治療を目的として使用されている。また、酸化防止剤として広く知られている。皮膚に対して有用な組成物として、乾癬及びアトピー性皮膚炎治療製剤(特許文献;特開平5−286864号公報)、フラボノリグナンとリン脂質との錯体を活性成分として含み、紅斑、火傷、皮膚又は粘膜のジストロフィー状態、皮膚炎等の治療、皮膚の老化防止及び放
射線、風、太陽などの外部環境からの刺激保護に有用な組成物(特許文献;特許第2948818号)、表皮透過バリア強化剤(特許文献;特開2000−169328)皮脂分泌抑制剤(特許文献;特開2000−169332)などが知られている。シリマリンは通常マリアアザミの種実からエタノール抽出し、スプレードライにより乾燥粉末として得られるエキス原料として市販されている。本発明に使用するシリマリンは市販されているシリマリンをそのまま用いることができる。また、マリアアザミからシリビン、シリジアニン、シリクリスチン、イソシリビンなどのシリマリンの構成成分を単離、精製した化合物を用いることができる。
【0028】
本発明の異常蛋白質除去用組成物は、抗老化用、抗紫外線障害用として使用することができる。さらに、異常蛋白質除去作用を示す化合物と抗酸化作用を有する化合物又は生体コラーゲン合成促進作用を有する化合物とともに含有する組成物は、抗老化作用を有し、異常蛋白質の蓄積防御及び異常蛋白質除去機能を持つ抗老化用組成物を提供することができる。
【0029】
異常蛋白質除去作用を有する化合物は、化粧料として使用することができ、その化粧料は、抗老化用、抗くすみ用、抗しわ用、保湿用の用途を有する。本発明の組成物は、経口又は溶血性のないものは注射剤として投与する等、非経口で投与することができる。経口で投与する場合、健康食品、美容食品のような食品の形態で投与してもよい。
【0030】
本発明の組成物は、例えば水溶液、油剤、乳液、懸濁液等の液剤、ゲル、クリーム等の半固形剤、散剤、顆粒剤、錠剤、カプセル剤等の固形剤の形態で適用可能である。従来から公知の方法でこれらの形態に調製し、種々の剤型とすることができる。ローション剤、乳剤、クリーム剤、軟膏剤、硬膏剤、ハップ剤、エアゾル剤等は、皮膚外用剤として適している。
【0031】
本発明の化粧料には、植物油のような油脂類、高級脂肪酸、高級アルコール、シリコーン、アニオン界面活性剤、カチオン界面活性剤、両性界面活性剤、非イオン界面活性剤、防腐剤、糖類、金属イオン封鎖剤、水溶性高分子のような高分子、増粘剤、粉体成分、紫外線吸収剤、紫外線遮断剤、ヒアルロン酸のような保湿剤、香料、pH調整剤等を含有させることができる。ビタミン類、皮膚賦活剤、血行促進剤、常在菌コントロール剤、活性酸素消去剤、抗炎症剤、抗癌剤、美白剤、殺菌剤等の他の薬効成分、生理活性成分を含有させることもできる。
【0032】
化粧料としては、化粧水、乳液、クリーム、パック等の皮膚化粧料、メイクアップベースローション、メイクアップクリーム、乳液状又はクリーム状あるいは軟膏型のファンデーション、ハンドクリーム、レッグクリーム、ボディローション等の身体用化粧料等、入浴剤、毛髪化粧料とすることができる。通常、化粧料において使用される製剤化方法にしたがって、これらの剤型として製造することができる。口紅、アイカラー、チークカラーといったメイクアップ化粧料とすることができる。
【0033】
本発明の異常蛋白質除去用組成物は、高純度大豆サポニンBグループを主要有効成分として含有する他に、必要に応じ薬学的に許容される希釈剤又は担体等の添加剤を含有することができる。また、本発明の組成物は、必要により、薬学的に活性な他の薬効成分を含有することができる。
【0034】
現在、蓄積した異常蛋白質がアルツハイマー病、パーキンソン病、レビー小体病、トリプレットリピート病、筋萎縮性側索硬化症、白内障、動脈硬化、糖尿病性腎症皮膚の光老化、くすみ又は皮膚のしわなどの疾患に関与することが知られている。従って、本発明の異常蛋白質除去用組成物を摂取することにより上記疾患を予防又は治療することが可能になると考えられる(非特許文献The FASEBJournal、9巻、1173〜1182頁、1995年)。
【0035】
本発明の組成物は、老化予防及び老化防止用化粧料又は健康食品、アンチエイジング化粧料又は美容食品、サビ予防及びサビ防止化粧料又は健康食品として有用である。本発明の異常蛋白質除去用組成物は、哺乳動物に対して、優れた作用を示し、且つ安全性が高い。
【0036】
本発明の組成物は、紫外線に暴露されるあるいは暴露された生体組織、特に皮膚に対して、紫外線による傷害を予防又は改善することのできる紫外線傷害予防又は改善用組成物として有用である。紫外線暴露により発生した活性酸素により産生された細胞内の変性蛋白質(異常蛋白質)を効率良く分解し、紫外線暴露による細胞傷害を抑制する。
【0037】
その他、用途や剤型に応じて次のようなものを添加することができる。
油脂類としては、例えば、ツバキ油、月見草油、マカデミアナッツ油、オリーブ油、ナタネ油、トウモロコシ油、ゴマ油、ホホバ油、胚芽油、小麦胚芽油、トリオクタン酸グリセリン、等の液体油脂、カカオ脂、ヤシ油、硬化ヤシ油、パーム油、パーム核油、モクロウ、モクロウ核油、硬化油、硬化ヒマシ油等の固体油脂、ミツロウ、キャンデリラロウ、綿ロウ、ヌカロウ、ラノリン、酢酸ラノリン、液状ラノリン、サトウキビロウ等のロウ類が挙げられる。
【0038】
炭化水素類としては、例えば、流動パラフィン、スクワレン、スクワラン、マイクロクリスタリンワックス等が挙げられる。
【0039】
高級脂肪酸として、例えば、ラウリン酸、ミリスチン酸、パルミチン酸、ステアリン酸、オレイン酸、リノール酸、リノレン酸、ドコサヘキサエン酸(DHA)、エイコサペンタエン酸(EPA)等が挙げられる。
【0040】
高級アルコールとして、例えば、ラウリルアルコール、ステアリルアルコール、セチルアルコール、セトステアリルアルコール等の直鎖アルコール、モノステアリルグリセリンエーテル、ラノリンアルコール、コレステロール、フィトステロール、オクチルドデカノール等の分枝鎖アルコール等が挙げられる。
【0041】
シリコーンとして、例えば、鎖状ポリシロキサンのジメチルポリシロキサン、メチルフェニルポリシロキサン等、環状ポリシロキサンのデカメチルシクロペンタシロキサン等が挙げられる。
【0042】
アニオン界面活性剤として、例えば、ラウリン酸ナトリウム等の脂肪酸塩、ラウリル硫酸ナトリウム等の高級アルキル硫酸エステル塩、POEラウリル硫酸トリエタノールアミン等のアルキルエーテル硫酸エステル塩、N−アシルサルコシン酸、スルホコハク酸塩、N−アシルアミノ酸塩等が挙げられる。
【0043】
カチオン界面活性剤として、例えば、塩化ステアリルトリメチルアンモニウム等のアルキルトリメチルアンモニウム塩、塩化ベンザルコニウム、塩化ベンゼトニウム等が挙げられる。
【0044】
両性界面活性剤として、例えば、アルキルベタイン、アミドベタイン等のベタイン系界面活性剤等が挙げられる。
【0045】
非イオン界面活性剤として、例えば、ソルビタンモノオレエート等のソルビタン脂肪酸エステル類、硬化ヒマシ油誘導体が挙げられる。
【0046】
防腐剤として、例えば、メチルパラベン、エチルパラベン等を挙げることができる。
金属イオン封鎖剤として、例えばエチレンジアミン四酢酸二ナトリウム、エデト酸、エデト酸ナトリウム塩等のエデト酸塩を挙げることができる。
【0047】
高分子として、例えば、アラビアゴム、トラガカントガム、ガラクタン、グアーガム、カラギーナン、ペクチン、寒天、クインスシード、デキストラン、プルラン、カルボキシメチルデンプン、コラーゲン、カゼイン、ゼラチン、メチルセルロース、メチルヒドロキシプロピルセルロース、ヒドロキシエチルセルロース、カルボキシメチルセルロースナトリウム(CMC)、アルギン酸ナトリウム、カルボキシビニルポリマー(CARBOPOL等)等のビニル系高分子、等を挙げることができる。
【0048】
増粘剤として、例えば、カラギーナン、トラガカントガム、クインスシード、カゼイン、デキストリン、ゼラチン、CMC、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、カルボキシビニルポリマー、グアーガム、キサンタンガム、ベントナイト等を挙げることができる。
【0049】
粉末成分としては、例えば、タルク、カオリン、雲母、シリカ、ゼオライト、ポリエチレン粉末、ポリスチレン粉末、セルロース粉末、無機白色顔料、無機赤色系顔料、酸化チタンコーテッドマイカ、酸化チタンコーテッドタルク、着色酸化チタンコーテッドマイカ等のパール顔料、赤色201号、赤色202号等の有機顔料を挙げることができる。
【0050】
紫外線吸収剤としては、例えば、パラアミノ安息香酸、サリチル酸フェニル、パラメトキシケイ皮酸イソプロピル、パラメトキシケイ皮酸オクチル、2,4−ジヒドロキシベンゾフェノン、等を挙げることができる。
【0051】
紫外線遮断剤として、例えば、酸化チタン、タルク、カルミン、ベントナイト、カオリン、酸化亜鉛等を挙げることができる。
【0052】
保湿剤として、例えば、ポリエチレングリコール、プロピレングリコール、ジプロピレングリコール、1,3−ブチレングリコール、1,2−ペンタンジオール、グリセリン、ジグリセリン、ポリグリセリン、キシリトール、マルチトール、マルトース、ソルビトール、ブドウ糖、果糖、コンドロイチン硫酸ナトリウム、ヒアルロン酸ナトリウム、乳酸ナトリウム、ピロリドンカルボン酸、シクロデキストリン等が挙げられる。
【0053】
薬効成分としては、例えば、ビタミンA油、レチノール等のビタミンA類、リボフラビン等のビタミンB2類、ピリドキシン塩酸塩等のB6類、L−アスコルビン酸、L−アスコルビン酸リン酸エステル、L−アスコルビン酸モノパルミチン酸エステル、L−アスコルビン酸ジパルミチン酸エステル、L−アスコルビン酸−2−グルコシド等のビタミンC類、パントテン酸カルシウム等のパントテン酸類、ビタミンD2、コレカルシフェロール等のビタミンD類;α−トコフェロール、酢酸トコフェロール、ニコチン酸DL−α−トコフェロール等のビタミンE類等のビタミン類を挙げることができる。
【0054】
プラセンタエキス、グルタチオン、ユキノシタ抽出物等の美白剤、ローヤルゼリー、ブナノキエキス等の皮膚賦活剤、カプサイシン、ジンゲロン、カンタリスチンキ、イクタモール、カフェイン、タンニン酸、γ−オリザノール等の血行促進剤、グリチルリチン酸誘導体、グリチルレチン酸誘導体、アズレン等の消炎剤、アルギニン、セリン、ロイシン、トリプトファン等のアミノ酸類、常在菌コントロール剤のマルトースショ糖縮合物、塩化リゾチーム等を挙げることができる。
【0055】
さらに、カミツレエキス、パセリエキス、ブナノキエキス、ワイン酵母エキス、グレープフルーツエキス、スイカズラエキス、コメエキス、ブドウエキス、ホップエキス、コメヌカエキス、ビワエキス、オウバクエキス、ヨクイニンエキス、センブリエキス、メリロートエキス、バーチエキス、カンゾウエキス、シャクヤクエキス、サボンソウエキス、ヘチマエキス、トウガラシエキス、レモンエキス、ゲンチアナエキス、シソエキス、アロエエキス、ローズマリーエキス、セージエキス、タイムエキス、茶エキス、海藻エキス、キューカンバーエキス、チョウジエキス、ニンジンエキス、マロニエエキス、ハマメリスエキス、クワエキス等の各種抽出物を挙げることができる。
【0056】
以下、実施例により本発明をさらに詳しく説明するが、本発明はこれらの実施例等に限定されるものではない。
【実施例1】
【0057】
ヘアレスマウスに大豆サポニンを70日間経口摂取させ、UVA及びUVBを照射し、高純度大豆サポニンBグループの有用性について検討を行った。
[高純度大豆サポニンBグループのUV照射マウスの皮膚への効果試験]
導入時6週齢のヘアレスマウス(Hos:HR-1 ♂)を用いて以下の条件で試験を行った。
1)試験対象物の調製及び投与
ヘアレスマウスの群分けは投与開始日に、一般状態が良好な動物を体重により、群間での差が無いように1群5匹に振り分けた。なお、各々の個体は1ゲージ/群で飼育とした。大豆サポニンクルード(大豆サポニンAグループ:14.9%、大豆サポニンBグループ:25.8%)は、蒸留水に懸濁して体重あたりの総サポニン量を50mg/kgとして((a)クルード原料として123mg/kg)、大豆サポニンBグループ(大豆サポニンAグループ:9.5%、大豆サポニンBグループ:69.4%)は、蒸留水に懸濁して体重あたりのサポニンBグループ量を50mg/kgとして((b)サポニンB原料として72mg/kg)それぞれ1日1回10週間、胃ゾンデを用いた強制経口投与にて摂取させた。UV照射を実施した日は照射2時間後に投与を行った。飼育条件を表1に示す。
【0058】
【表1】

【0059】
2)皮膚水分量の測定
水分量の測定は、モイスチャーチェッカーを用い、背部の尾付け根より首に向かい2cm、腰椎から右側に0.5cm部位を3回測定して平均を求めた。測定日は、試験開始日、中間観察日及び解剖日とした。
【0060】
3)皮膚弾力性の測定
皮膚弾力測定装置(非特許文献Cutometer SEM 575/Electronic Gmbh co.製)を用いて、背部の尾付け根より首に向かい2cm、腰椎から右側に0.5cm部位を3回測定して平均を求めた。測定日は解剖日とした。
【0061】
4)酸化蛋白質の測定
酸化蛋白質即ちカルボニル化蛋白質は、酸化障害により生じた蛋白質のカルボニル基に特異的に結合する2,4-ジニトロフェニルヒドラジン(DNPH)を用いてカルボニル化蛋白質を標識後、DNPHに特異的に結合する抗DNPH抗体を用いて検出した。具体的な方法は以下の通りである。UV照射部位の皮膚1cm2を切り取り、0.1Mトリスバッファー(pH 7.5)1mlを加えてホモジナイズし、10000rpm×15分間遠心し、その上清をフィルターろ過後解析を行った。蛋白質のジニトロフェニルヒドラジン(DNPH)化は公知の方法(非特許文献
Nakamura他、Journal of Biochemistry、119巻、768〜774頁、1996年)で行った。DNPH化した蛋白質をSDS−PAGEにより分離し、蛋白質転写装置を用いてPolyvinylidene difluoride(PVDF)膜に転写した。転写後の膜は2時間以上、5%スキムミルクを含むPBS(−)溶液中でブロッキングし、洗浄後抗DNPH抗体と2時間反応させ、洗浄後、ビオチン化抗ラビットイムノグルブリンG と1時間反応させた。洗浄後、蛍光検出キット(ECL PLUS)を用いてPVDF膜を感光し、医療用自動現像装置にて画像を転写した。画像解析はデンシト
メ−ターを用いて行なった。
【0062】
5)UV照射
UV照射時は、動物を専用のPCケージに移し、1群ずつUVB20mj/cm2及びUVA14j/cm2を照射した。照射は月、水及び金の週3日サイクルで10週間実施した。
【0063】
6)解剖
各群、本飼育期間終了翌日より18時間絶食後、ネンブタール(40mg/kg)腹腔内投与により麻酔を導入し解剖を実施した。この照射量、期間でヒトの光老化同様の皮膚のしわが形成されることが報告されている(非特許文献J of DermatologicalnScience 27519-525(2001))。
【0064】
7)統計処理
試験結果は平均値±標準誤差で表し、エクセル統計Student’s-t testにより有意差検定を行った。
【0065】
1.一般状態観察
第4週目頃よりUV照射動物において、頭部の皮膚の軽度褐色化や頸部のしわの深さならびに後肢背部のしわがUV非照射動物に比較して目立つようになった。
解剖時の外観観察にでは、UV照射動物で顔、頸部及び後肢背部のしわが明瞭に確認されたが、UV照射においても大豆サポニンクルード及び大豆サポニンBグループ摂取動物はその症状は軽度であり、特に大豆サポニンBグループ摂取動物のしわの深度が浅く、肉眼的にはしわの色が薄く観られた。また、大豆サポニンBグループ摂取動物は、Controlに比較して皮膚にしっとり感があり、特にUV+大豆サポニンBグループ摂取動物でその症状は顕著に感じられた。
【0066】
2.体重推移
体重推移は、各群大きな差異は認められなかった。
【0067】
3.摂餌量
摂餌量についても体重推移同様に大きな差異は認められなかった。
【0068】
4.肝臓重量
肝臓重量についても大きな差異は認められず異常な症状は観察されなかった。また、他の臓器についても異常は認められなかった。
【0069】
5.皮膚水分量
皮膚水分量はその数値が高いほど、皮膚中の水分が高い即ち保湿力が高いことが推測できる。UV照射により皮膚の水分量が低下することが一般的に知られており、本試験でも中間観察日、解剖日の水分量はコントロール群に比較してUV照射群では低くなっている。皮膚水分量の測定では、中間観察日で、UV 照射群に比較し、UV照射+大豆サポニン摂取動物は2群とも高い値を示した。解剖日の測定においては、UV照射群に比較してUV照射+大豆サポニンクルード群が低い値を示したものの、UV照射+大豆サポニンBグループ群では平均値において高い値を示し、コントロール群と同程度の値であった。結果を図1に示す。
【0070】
6.皮膚弾力性
皮膚弾力性は、その数値が高いほど、皮膚の弾力性が高いことが推測できる。UV照射により皮膚の弾力性が低下することが一般的に知られている。この結果を図2に示す。UV非照射群において、大豆サポニン Bグループ投与群は大豆サポニンクルード群と比較して弾力性が 有意に高かった。
【0071】
7.酸化蛋白質量
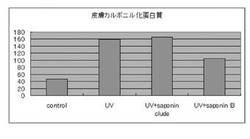
この結果を図3に示す。酸化蛋白質量はカルボニル化蛋白質量として検出される。カルボニル化蛋白質は、その数値が低いほど臓器における蓄積量が少ないことを示す。図3から明らかなように、酸化蛋白質量はUV照射によって、非照射に比べて著しく増加するものの、UV照射と並行して大豆サポニン Bグループを投与した群では有意に減少し、高純度大豆サポニンBグループの酸化蛋白質除去効果を示した。
特に、大豆サポニンクルード群では、UV 照射群と同程度であったのに対し、大豆サポニン Bグループでは、明確に減少しており、大豆サポニン Bの作用が発揮されていることが示されている。
【0072】
以上の結果より、高純度大豆サポニンBグループは、通常の大豆サポニンクルードやコントロール群に比べ、紫外線照射による皮膚ストレスに対しては水分量の減少を抑制し、さらに、かさつきやしわなどの生成を予防する効果を示す物質であることが確認された。また、高純度大豆サポニンBグループは、酸化蛋白質量を大豆サポニンクルードやコントロール群に比べ著しく減少させ、高純度大豆サポニンBグループの酸化蛋白質除去効果の有効性を示した。
さらに、高純度サポニンBグループ投与により皮膚弾力性が高まる事が明らかになった。高純度大豆サポニンBグループ50mg/kgのマウスへの投与は、体表面積換算式y=(3√x)2を用いてヒトへの投与量に換算すると約450mg/日/60kg体重に相当し、食品として無理なく摂取することが可能な量である。
【実施例2】
【0073】
[高純度大豆サポニンBグループのパラコートストレス負荷ラットへの効果試験]導入時6週齢のラット(Wistar/Cri ♂)を用いて以下の条件で試験を行った。
【0074】
1)試験対象物の調製及び投与
Wistar系ラットの群分けは投与開始日に、一般状態が良好な動物を体重により、群間での差が無いように1群5匹に振り分けた。なお、各々の個体は単独飼育とした。大豆サポニンクルード(大豆サポニンAグループ:14.9%、大豆サポニンBグループ:25.8%)は、混餌給餌とし、オリエンタル酵母社製MF飼料に混ぜ、体重あたりの総サポニン摂取量が15mg/kgとなるように給餌した。大豆サポニンBグループ(大豆サポニンAグループ:9.5%、大豆サポニンBグループ:69.4%)についても混餌給餌とし、オリエンタル酵母社製MF飼料に混ぜ、体重あたりの大豆サポニンBグループ摂取量が15mg/kgとなるように給餌した。パラコートは、パラコート1000mgを500mlの生理食塩水に溶解した注射溶液を、体重あたり10mg/kgのDoseにて週1回、2ヶ月間腹腔内に注射投与を行った。飼育条件を表2に示す。
【0075】
【表2】

【0076】
2)解剖
各群、本飼育期間終了翌日より18時間絶食後、ネンブタール(40mg/kg)腹腔内投与により麻酔を導入し解剖を実施した。
【0077】
3)統計処理
試験結果を図4〜6に示す。
【0078】
1.一般状態観察
パラコートは急性中毒も引き起こす強力な農薬であるため、投与直後には動物個体の体温低下や元気活力の低下及び軟便化が観察される。しかしながら、パラコート+大豆サポニン投与群ではその症状は軽く、投与後2日目にはコントロール群レベルに状態が回復していた。中でもパラコート+大豆サポニンBグループ摂取動物はその症状は軽度であり、投与期間の後半でも同様であった。
【0079】
2.体重推移
体重推移は、各群大きな差異は認められなかった。
【0080】
3.摂餌量
摂餌量についても体重推移同様に大きな差異は認められなかった。
【0081】
4.酸化蛋白質量の測定(皮膚/赤血球/肝臓)
採取した各サンプル(皮膚1cm2/血液100μl/肝臓 100mg)に0.1Mトリスバッファー(pH 7.5)1mlを加えてホモジナイズし、10000rpm×15分間遠心し、その上清をフィルターろ過後解析を行った。蛋白質のジニトロフェニルヒドラジン(DNPH)化は公知の方法(非特許文献Nakamura他、Journal of Biochemistry、119巻、768〜774頁、1996年)で行った。DNPH化した蛋白質をSDS−PAGEにより分離し、蛋白質転写装置を用いてPolyvinylidene
difluoride(PVDF)膜に転写した。転写後の膜は2時間以上、5%スキムミルクを含むPBS(−)溶液中でブロッキングし、洗浄後抗DNPH抗体と2時間反応させ、洗浄後、ビオチン化抗ラビットイムノグルブリンG と1時間反応させた。洗浄後、蛍光検出キット(ECL PLUS)を用いてPVDF膜を感光し、医療用自動現像装置にて画像を転写した。画像解析はデンシトメ−ターを用いて行なった。
【0082】
この結果を図4〜6に示す。酸化蛋白質量はカルボニル化蛋白質量として検出される。図4〜6で明らかなように、酸化蛋白質量はパラコート投与により著しく増加するが、パラコート+高純度大豆サポニンBグループ投与群でその増加は有意に抑えられ、その効果は大豆サポニンクルードと比較して優れていた。このことから高純度大豆サポニンBグループの酸化蛋白質除去効果が示された。
【0083】
以上の結果より、高純度大豆サポニンBは、一般的な大豆サポニンクルードやコントロール群に比べ、パラコート投与による、皮膚、肝臓、赤血球中の酸化蛋白質量を著しく減少させ、高純度大豆サポニンBの酸化蛋白質除去効果の有効性を示した。高純度大豆サポニンBグループ15mg/kgのラットへの投与は、体表面積換算式y=(3√x)2を用いてヒトへの投与量に換算すると約134mg/日/60kg体重に相当し、食品として無理なく摂取することが可能な量である。
【0084】
処方例1
[カプセル剤]
組成
大豆サポニン(大豆サポニB 50%含有)…50mg
トコトリエノール…30mg
ミツロウ…10mg
ぶどう種子オイル…110mg
上記成分を混合し、ゼラチン及びグリセリンを混合したカプセル基剤中に充填し、軟カプセルを得た。
【0085】
処方例2
[錠剤]
組成
大豆サポニン(大豆サポニB 50%含有)…25mg
マリアアザミ(シリマリン65%含有)…20mg
コラーゲン加水分解物…50mg
セルロース…40mg
デンプン・・・20mg
ショ糖脂肪酸エステル・・・2mg
上記成分を混合、打錠し、錠剤を得た。
【0086】
処方例3
〔ジュース〕
(組 成) (配合;質量%)
果糖ブトウ糖液糖 5.00
クエン酸 10.4
L−アスコルビン酸 0.20
香料 0.02
色素 0.10
ゼラチン分解物(平均分子量300) 1.00
大豆サポニン(大豆サポニB 50%含有) 1.00
水 82.28
【0087】
処方例4
〔クリーム〕
(1)ステアリルアルコール 6.0
(2)ステアリン酸 2.0
(3)水添ラノリン 4.0
(4)スクワラン 9.0
(5)オクチルドデカノール 10.0
(6)POE(25)セチルアルコールエーテル 3.0
(7)モノステアリン酸グリセリン 2.0
(8)ゼラチン分解物(平均分子量300) 1.00
(9)大豆サポニン(大豆サポニB 50%含有) 1.00
(10)防腐剤 適量
(11)香料 適量
(12)1,3ブチレングリコール 6.0
(13)PEG 1500 4.0
(14)精製水 残余
上記成分(1)〜(11)を80℃に加熱溶解し油相とする。成分(12)〜(14)を70℃に加熱溶解し水相とする。油相に水相を徐々に加え乳化し、攪拌しながら40℃まで冷却し、さらに30℃まで攪拌冷却してクリームを得た。
【図面の簡単な説明】
【0088】
【図1】UV照射試験におけるサポニン投与量と皮膚水分量の関係を表した図である。
【図2】UV照射試験におけるサポニン投与量と皮膚弾力性の関係を表した図である。
【図3】UV照射試験におけるサポニン投与量と皮膚カルボニル化蛋白質の関係を表した図である。
【図4】パラコート負荷時におけるサポニン投与量と皮膚カルボニル化蛋白質の関係を表した図である。
【図5】パラコート負荷時におけるサポニン投与量と肝臓カルボニル化蛋白質の関係を表した図である。
【図6】パラコート負荷時におけるサポニン投与量と赤血球カルボニル化蛋白質の関係を表した図である。
【技術分野】
【0001】
本発明は、異常蛋白質除去用組成物及び異常蛋白質蓄積を伴う疾病を予防する組成物に関する。
【背景技術】
【0002】
異常蛋白質は年齢とともに増加し、生体内に蓄積した蛋白質分解異常による疾患又は障害(アルツハイマー病、パーキンソン病、レビー小体病、トリプレットリピート病、筋萎縮性側索硬化症、白内障、動脈硬化、糖尿病性腎症、皮膚の光老化、皮膚におけるしわ等)等、多くの疾病に関与することが明らかとなってきた(非特許文献 BIO Clinica,11巻、第5号、1996年)。また、若年であっても、過度のストレス・紫外線等により生体内に慢性的に活性酸素が多量発生している場合、異常蛋白質の蓄積は加速する。現在では蛋白質分解異常に起因する疾病の予防及び治療が大きな課題となっているが、従来、異常蛋白質の生体内蓄積防御に関しては蛋白質の酸化修飾を防御する研究がなされてきた。即ち、酸化ストレスにより生体防御機構で対応できない程度まで生成した活性酸素を、抗酸化物質を摂取することで消去し、蛋白質の酸化を抑えるという試みである。代表的な抗酸化物質としてはトコフェノール類やカロテノイド類、そして多種の植物に含まれるフラボノイド類がある。
【0003】
しかしながら、抗酸化物質の摂取は、生体内で発生する活性酸素の消去に寄与するが、既に蓄積している異常蛋白質の除去には何ら寄与しない。従って、加齢に伴って生体内に蓄積した異常蛋白質が関与する種々の疾患の予防及び治療には異常蛋白質の除去が必須となる。
【0004】
一方、本発明者等は、大豆サポニンの作用機序について着目して継続して探求し、異常蛋白質除去機能(特許文献1:特開2002−179592号公報、特許文献2:特開2004−115438号公報)、紫外線傷害予防又は改善機能があること(特許文献3:特開2004−131431号公報)などを既に提案している。
他方、本発明者等は、異常蛋白質を除去する成分を探索した結果、大豆サポニン以外にケール(特許文献4:特開2004−91398号公報)にその効果を見出している。
異常蛋白質が関与する加齢に伴う種々の疾患の予防及び治療の目的に、上記大豆サポニンを用いると、通常の摂取量として負担量が多くなることが判明し、少ない量でもさらなる効果の高い成分の開発探求を行ってきた。
【0005】
【特許文献1】特開2002-179592号公報
【特許文献2】特開2004−115438号公報
【特許文献3】特開2004−131431号公報
【特許文献4】特開2004−91398号公報
【発明の開示】
【発明が解決しようとする課題】
【0006】
本発明の目的は、大豆サポニンに着目し、効果の高い異常蛋白質除去用組成物を特定し、提供すること、また蛋白質分解異常による疾患の予防及び治療等に寄与する組成物、剤、食品を提供することである。
【課題を解決するための手段】
【0007】
本発明者等は、上記の目的を達成するために、大豆サポニンの分画物を用いて、異常蛋白質を除去する成分を探索した。その結果、高純度大豆サポニンBグループに求める効果を見出し、本発明を完成するに至った。
本発明の主な構成は、以下のとおりである。
【0008】
(1)大豆サポニンBグループを主要成分とすることを特徴とする異常蛋白質除去用組成物。
(2)大豆サポニンBグループは、大豆抽出物100重量部のうち、大豆サポニンBグループを40〜100重量部含有する大豆抽出物であることを特徴とする(1)記載の異常蛋白質除去用組成物。
(3)大豆サポニンBグループが、SoyasaponinI、II、III、IV、Vあるいはそれらのアセチル体、大豆サポニンAグループがSoyasaponinA1、A2、A3、A4、A5、A6、Ac、Adあるいはそれらのアセチル体、もしくはそれらの混合物である請求項1又は2に記載の異常蛋白質除去用組成物。
(4)コラーゲン、ゼラチン、コラーゲン加水分解物、ゼラチン加水分解物から選択されるいずれか一種以上及び/又はシリマリンを含むことを特徴とする(1)〜(3)のいずれかに記載の異常蛋白質除去用組成物。
(5)(1)〜(4)のいずれかに記載の異常蛋白質除去用組成物を含有する紫外線障害予防・改善剤用組成物。
(6)(1)〜(4)のいずれかに記載の異常蛋白質除去用組成物又は(5)に記載の紫外線障害予防・改善剤用組成物を含有する抗老化食品。
(7)(1)〜(4)のいずれかに記載の異常蛋白質除去用組成物又は(5)に記載の紫外線障害予防・改善剤用組成物を含有するくすみ抑制又はしわ抑制又は保湿用食品。
(8)(1)〜(4)いずれかに記載の異常蛋白質除去用組成物又は(5)に記載の紫外線障害予防・改善剤用組成物を含有する抗老化化粧料。
(9)(1)〜(4)のいずれかに記載の異常蛋白質除去用組成物又は(5)に記載の紫外線障害予防・改善剤用組成物を含有するくすみ抑制又はしわ抑制又は保湿用化粧料。
(10)(1)〜(4)のいずれかに記載の異常蛋白質除去用組成物又は(5)に記載の紫外線障害予防・改善剤用組成物を含有する抗老化飼料又は動物薬。
(11)(1)〜(4)のいずれかに記載の異常蛋白質除去用組成物又は(5)に記載の紫外線障害予防・改善剤用組成物を含有するくすみ抑制又はしわ抑制又は保湿用飼料又は動物薬。
(12)(1)〜(4)のいずれかに記載の異常蛋白質除去用組成物又は(5)に記載の紫外線障害予防・改善剤用組成物を含有する抗老化ペット動物用化粧料。
(13)(1)〜(4)のいずれかに記載の異常蛋白質除去用組成物又は(5)に記載の紫外線障害予防・改善剤用組成物を含有するくすみ抑制又はしわ抑制又は保湿用ペット動物用化粧料。
【発明の効果】
【0009】
異常蛋白質除去用有効成分として、高純度大豆サポニンBグループを提供することで、これまでの大豆サポニンに比べ、さらに高い効果が得られ、通常の摂取量として負担のない目安量を設定できる。
本発明の異常蛋白質除去用組成物を用いれば、蓄積した異常蛋白質を除去することができる。従って、本発明の製剤は、蛋白質分解異常による疾患又は障害(アルツハイマー病、パーキンソン病、レビー小体病、トリプレットリピート病、筋萎縮性側索硬化症、白内障、動脈硬化、糖尿病性腎症、皮膚の光老化、皮膚におけるしわ)等蛋白質分解異常による疾病の予防又は治療において有効である。さらに、抗老化用の化粧料や食品としても有用である。
具体的には、抗老化効果、くすみ抑制効果、しわ抑制効果、保湿効果、紫外線障害予防・改善作用について効果が期待できる。
具体的な利用形態として、医薬、食品、化粧料、飼料などに利用できる。
【発明を実施するための最良の形態】
【0010】
以下に、本発明を詳細に説明する。
本発明において、異常蛋白質とは、一般に加齢に伴い、酸化又は糖化又はアルデヒド修飾を受けた蛋白質を言う。
大豆由来のサポニンは、大豆種子中の種皮、子葉、胚軸又は大豆植物体の葉、茎、根等に広く分布する。構造的にはグリチルリチンと類似の構造であるが、トリテルペノイド骨格に2〜5個の糖から成る糖鎖を持つ。大豆サポニンはアグリコン(非糖部)の構造によって4つのグループ(A、B、E及びDDMPグループ)に分類され、すべてのグループのサポニンが多種多様な糖鎖構造を有する。現在までにSoyasapogenol A 、B、E及びDDMPをそれぞれアグリコンとする8種類のAグループ、2種類のEグループ、5種類のBグループ、6種類のDDMPグループが同定されている(非特許文献Agric Biol Chem,55 315-322(1991))(非特許文献Agric Biol Chem,55 911-917(1991))(非特許文献Agric Biol Chem,57 546-550(1993))。
【0011】
AグループサポニンはSoyasapogenol AのC-3とC-22位の2箇所に糖鎖が結合したビスデスモサイド型サポニンで大豆の種子胚軸にのみ分布しており不快味(苦み、収斂味)の主因である。現在Aグループサポニンに関しては2通りの命名があり、SoyasaponinA1とSoyasaponinAbは同一化合物であり、同じくA2はAf、A3はAh、A4はAa、A5はAe 、A6はAgとなっている。Ac及びAdは別名が知られていない(非特許文献 BBB 62(12) 2291-2299,1998)。
【0012】
これに対してBグループ及びEグループサポニンは、C-3位にのみ糖鎖が1本結合したモノデスモサイド型サポニンである。DDMPグループサポニンは温和な条件下で抽出を行なうと精製できるが(非特許文献Agric Biol Chem,57 546-550(1993))、加熱条件下及びアルカリ条件下においてBグループサポニンに変換される。従って大豆中に存在するサポニンはそのほとんどがAグループサポニン及びDDMPグループサポニンであって、Bグループサポニンはわずかであり、Bグループサポニンはその多くが抽出の際にDDMPグループサポニンから生成するアーティファクト成分であると推定されている。Bグループサポニンは大豆
胚軸や子葉に多く存在し、現在Bグループサポニンに関しては2通りの命名があり、SoyasaponinIとSoyasaponinBbは同一化合物であり、同じくIIはBc、IIIはBb’、IVはBc’、VはBaとなっている(非特許文献 BBB 62(12) 2291-2299,1998)。
【0013】
また、これまで大豆サポニンの吸収動態については不明であったが、SoyasaponinIはヒトの腸ではそのまま吸収されず、腸内細菌によってアグリコンであるSoyasapogenol Bに分解され、濃度依存的に吸収されることが推測されており、他のBグループサポニンについてもアグリコン型として吸収されることが示唆されている(非特許文献J Nutr 134
1687-1873 (2004) )。よって、食品としてBグループサポニンを摂取する場合、その組成(配糖体又は、アグリコン又は/及びその誘導体等)如何に関わらずアグリコン型として同様に吸収されると推定できる。
【0014】
一般に、サポニンは溶血性を示すものが多い。しかし、大豆サポニンは溶血性をほとんど有しないという報告がなされている(非特許文献 基礎と臨床 Vol.15 No.5 1981)。また、本発明者等が大豆から得られた大豆サポニン類の家兎2%血液浮遊液に対する溶血指数を測定したところ、人参サポニンと同様100以下であり、他の報告同様溶血性を有しないことが判明した。
また、本発明者等が、大豆サポニンBグループの安全性を調べる為、変異原性及び急性毒性について試験したところ、いずれも異常なく、その安全性が高いことが証明された。
本発明の高含有大豆サポニンBグループは、以下の工程で得ることが出来る。
【0015】
[サポニンの抽出]
原料大豆胚軸は、有機溶媒等であらかじめ脱脂したもの、していないものいずれも使用可能であるが、サポニンの抽出効率から脱脂したものの方が有利である。原料大豆胚軸よりサポニンを抽出する方法は、室温から80℃において原料に対して5〜10倍容量の抽出溶媒を加えて攪拌するのが一般的な方法であるが、サポニンが十分に抽出できる条件であれば特に限定されない。
本発明におけるイオン交換樹脂は、3級アミンを含む弱塩基性陰イオン交換樹脂であれば特に制限はなく、粒径が不均一な樹脂、例えば、三菱化成製ダイヤイオンWA-30なども利用可能であるが、平均粒径±10%の範囲に90%以上の粒度分布をもつ均一粒径のものが好ましい。
【0016】
[サポニンの溶出・精製]
上記サポニン抽出液から、蒸留操作により溶媒を溜去し、水で希釈したサポニン溶液を上記イオン交換樹脂に吸着させた後、水、アルコールあるいは含水アルコールで樹脂を洗浄した後、酸又はアルカリを使って樹脂に吸着させたサポニンを溶出する。溶出したサポニン溶液をそのまま乾燥して得られる大豆サポニン粗精製物は純度20〜50重量%と低く、サポニン以外の不純物が多く、生理活性の高い大豆サポニンBグループの比率も20〜30重量%程度と低いものである。
サポニンの純度を高めるために、溶出したサポニンをそのまま水で希釈し、無極性の合成吸着剤にサポニンを吸着させる。無極性の合成吸着剤としては、スチレン・ジビニルベンゼン型樹脂などがあり、例えば、三菱化学製、ダイヤイオンHP-20やローム・アンド・ハース社製のアンバーライトXAD−2などが使用可能である。合成吸着剤に吸着させる際に使用する含水アルコール中のアルコール濃度はアルコールの種類によって異なるが、メタノールの場合は、0〜50重量%、エタノールの場合は、0〜30重量%が好ましい。次に、水あるいは含水エタノールで樹脂を洗浄した後、洗浄時よりアルコール濃度の高い含水アルコールで溶出させてサポニン高純度溶液を得ることができる。
【0017】
[後処理]
得られたサポニン高純度溶液を、必要に応じてpH調整剤を用いてpH調整した後、加熱乾燥、減圧加熱乾燥、スプレードライ、凍結乾燥などの方法で乾燥することにより高純度大豆サポニン粉末を得ることができる。
以上の工程で効率よく安価に、純度70重量%以上の高純度大豆サポニンを得ることができ、かつ、活性の高い大豆サポニンBグループを50%重量以上の濃度に濃縮できる他、総サポニン中の大豆サポニンBグループ比率を70重量%以上に高めることもできる。
【0018】
樹脂による精製を行なう順序としては、陰イオン交換樹脂による処理を行なった後に、無極性の合成吸着剤による精製を行なう。合成吸着剤で先に処理した場合、低極性物質などが合成吸着剤に強く吸着され、アルカリ処理など、通常の樹脂再生処理を行なっても樹脂の劣化が起こり、樹脂の能力が徐々に低下するが、これに対して、先に陰イオン交換樹脂で大豆サポニンを粗精製することにより、大豆イソフラボンやオリゴ糖の他、低極性物質を取り除くことができ、続く無極性の合成吸着剤の処理能力が向上し、劣化が起こり難くなるのである。その際には、陰イオン交換樹脂は、アルカリによる処理により何度も繰り返し使うことができる。
【0019】
大豆サポニンBグループをリッチに調整した組成物には、異常蛋白質除去作用、紫外線障害予防・改善作用、抗老化作用、くすみ抑制作用、しわ抑制作用及び保湿作用に優れた作用効果があることを訴求し、確認できた。
このような作用効果を利用する形態としては、医薬、食品、飲料、サプリメント、食品添加剤、化粧料、飼料、飼料添加剤、動物薬等である。経口あるいは非経口共提供可能である。
高純度大豆サポニンBグループは、そのままでも、様々な用途に使用できるが、目的に応じて予め様々な他の成分と混合、あるいは食品や飼料あるいは動物薬に添加することができる。
【0020】
食品としては、直接、又は種々の栄養成分を添加して使用できる。例えば、澱粉、乳糖、麦芽糖、植物油脂粉末、カカオ脂末、ステアリン酸などの適当な助剤を添加した後、慣用の手段を用いて、食用に適した形態、例えば、顆粒状、粒状、錠剤、カプセル、ペーストなどに成形して健康補助食品、保健機能食品などとして、食用に供してもよく、また種々の食品、例えば、ハム、ソーセージなどの食肉加工食品、かまぼこ、ちくわなどの水産加工食品、パン、菓子、バター、粉乳、発酵乳製品に添加して使用してもよく、水、果汁、牛乳、清涼飲料などの飲料に添加して使用してもよい。そのような剤、食品は、通常採用されている製剤化技術により製造することができる。
【0021】
化粧料としては、直接又は小麦胚芽油あるいはオリーブ油などに添加して、化粧料成分として使用し、これらを用いて化粧料を製造することができる。
【0022】
医薬としての適用方法は、経口投与又は非経口投与のいずれも採用することができる。投与に際しては、有効成分を経口投与、直腸内投与、注射などの投与方法に適した固体又は液体の医薬用無毒性担体と混合して、慣用の医薬製剤の形態で投与することができる。
【0023】
非経口適用の組成物は、例えば水溶液、油剤、乳液、懸濁液等の液剤、ゲル、クリーム等の半固形剤、粉末、顆粒、カプセル、マイクロカプセル、固形等の固形剤の形態で適用可能である。従来から公知の方法でこれらの形態に調製し、ローション剤、乳剤、ゲル剤、クリーム剤、軟膏、硬膏、ハップ剤、エアゾール剤、坐剤、注射剤、粉末剤等の種々の剤型とすることができる。これらを身体に塗布、貼付、噴霧等により適用することができる。特にこれら剤型の中で、ローション剤、乳剤、クリーム剤、軟膏剤、硬膏剤、ハップ剤、エアゾール剤等が皮膚外用剤に適している。化粧料としては、化粧水、乳液、クリーム、パック等の皮膚化粧料、メイクアップベースローション、メイクアップクリーム、乳液状又はクリーム状あるいは軟膏型のファンデーション、口紅、アイカラー、チークカラーといったメイクアップ化粧料、ハンドクリーム、レッグクリーム、ボディローション等の身体用化粧料等とすることができる。
【0024】
増量剤と混合した組成物の状態としておくと便利に使用できる。増量剤としては、グルコース、ラクトース、マルトース、ショ糖等の糖類、ソルビトール等の糖アルコール、デキストリン、サイクロデキストリン等の加工澱粉、小麦澱粉、コーンスターチ等の澱粉類、カゼイン、大豆蛋白質等の蛋白質、アラビアガム、アルギン酸ナトリウム、カゼインナトリウム、ゼラチン、ペクチン、粉末セルロース、カルボキシメチルセルロース等の高分子安定剤、レシチン、ショ糖脂肪酸エステル、プロピレングリコール脂肪酸エステル、グリセリン脂肪酸エステル等の乳化剤、カルシウム粉末等が使用できる。
【0025】
本発明の異常蛋白質除去用組成物は、上記高純度大豆サポニンBグループの他に抗酸化作用を有する化合物を含有させることができる。抗酸化作用を示す化合物は、特に限定されるものではないが、例えば各種ビタミン類、シリマリン等の各種ポリフェノール類、トコトリエノール、補酵素Q10及びそれらを含有する天然成分などが挙げられる。
本発明の異常蛋白質除去用組成物は、上記高純度大豆サポニンBグループの他に生体コラーゲン合成促進剤を有する化合物を含有させることができる。生体コラーゲン合成促進作用を示す化合物は、特に限定されるものではないが、例えばコラーゲン及びゼラチンの分解物、N末端にグリシンを含むトリペプチドを含有するペプチド混合物などが挙げられる。
【0026】
コラーゲンは、牛や豚や魚などの動物の皮膚、骨及び腱などの結合組織から抽出したもの、もしくはコラーゲンを熱変性したゼラチンなど全てのものが使用可能である。コラーゲン及び/又はゼラチンの分解物として、分子量が400以下のものを含有するポリペプチドを用いることが好ましい。より好ましくは、平均分子量が200〜300付近のものを高含有するポリペプチドが好ましい。分子量が400以下のもの、より好ましくは、平均分子量が200〜300付近のものを高含有するポリペプチドは、アミノ酸の分子量が100前後であることから、トリペプチドを高含有するポリペプチドに相当する。分子量が400以下のコラーゲン及び/又はゼラチンの分解物は精製したものでもよいが、精製しなくても差し支えない。例えば他のコラーゲン及び/又はゼラチンの分解物等の混合物
でもよい。
これに対してコラーゲン及び/又はゼラチンの分解物は、特定の有効成分として分子量で約400以下のペプチドを含むことにより、その加水分解処理により、生体内でのコラーゲン合成促進活性を向上させることに寄与できる。
【0027】
シリマリン(Silymarin;CAS No.65666−07−1)は、キク科マリアアザミ(別名オオアザミ、オオヒレアザミ、ミルクアザミ;CAS No.84604−20−6)から抽出されるフラボノリグナンの総称であり、確認されている主要成分はシリビン(Silybin;CAS No.22888−70−6)、シリジアニン(Silydianin;CAS No.29782−68−1)、シリクリスチン(Silychristin;CAS No.33889−69−9)、イソシリビン(Isosilybin;CAS No.72581−71−6)などがある(天然薬物事典、奥田拓男編)。シリマリンは古くからヨーロッパで肝臓疾患の予防及び治療を目的として使用されている。また、酸化防止剤として広く知られている。皮膚に対して有用な組成物として、乾癬及びアトピー性皮膚炎治療製剤(特許文献;特開平5−286864号公報)、フラボノリグナンとリン脂質との錯体を活性成分として含み、紅斑、火傷、皮膚又は粘膜のジストロフィー状態、皮膚炎等の治療、皮膚の老化防止及び放
射線、風、太陽などの外部環境からの刺激保護に有用な組成物(特許文献;特許第2948818号)、表皮透過バリア強化剤(特許文献;特開2000−169328)皮脂分泌抑制剤(特許文献;特開2000−169332)などが知られている。シリマリンは通常マリアアザミの種実からエタノール抽出し、スプレードライにより乾燥粉末として得られるエキス原料として市販されている。本発明に使用するシリマリンは市販されているシリマリンをそのまま用いることができる。また、マリアアザミからシリビン、シリジアニン、シリクリスチン、イソシリビンなどのシリマリンの構成成分を単離、精製した化合物を用いることができる。
【0028】
本発明の異常蛋白質除去用組成物は、抗老化用、抗紫外線障害用として使用することができる。さらに、異常蛋白質除去作用を示す化合物と抗酸化作用を有する化合物又は生体コラーゲン合成促進作用を有する化合物とともに含有する組成物は、抗老化作用を有し、異常蛋白質の蓄積防御及び異常蛋白質除去機能を持つ抗老化用組成物を提供することができる。
【0029】
異常蛋白質除去作用を有する化合物は、化粧料として使用することができ、その化粧料は、抗老化用、抗くすみ用、抗しわ用、保湿用の用途を有する。本発明の組成物は、経口又は溶血性のないものは注射剤として投与する等、非経口で投与することができる。経口で投与する場合、健康食品、美容食品のような食品の形態で投与してもよい。
【0030】
本発明の組成物は、例えば水溶液、油剤、乳液、懸濁液等の液剤、ゲル、クリーム等の半固形剤、散剤、顆粒剤、錠剤、カプセル剤等の固形剤の形態で適用可能である。従来から公知の方法でこれらの形態に調製し、種々の剤型とすることができる。ローション剤、乳剤、クリーム剤、軟膏剤、硬膏剤、ハップ剤、エアゾル剤等は、皮膚外用剤として適している。
【0031】
本発明の化粧料には、植物油のような油脂類、高級脂肪酸、高級アルコール、シリコーン、アニオン界面活性剤、カチオン界面活性剤、両性界面活性剤、非イオン界面活性剤、防腐剤、糖類、金属イオン封鎖剤、水溶性高分子のような高分子、増粘剤、粉体成分、紫外線吸収剤、紫外線遮断剤、ヒアルロン酸のような保湿剤、香料、pH調整剤等を含有させることができる。ビタミン類、皮膚賦活剤、血行促進剤、常在菌コントロール剤、活性酸素消去剤、抗炎症剤、抗癌剤、美白剤、殺菌剤等の他の薬効成分、生理活性成分を含有させることもできる。
【0032】
化粧料としては、化粧水、乳液、クリーム、パック等の皮膚化粧料、メイクアップベースローション、メイクアップクリーム、乳液状又はクリーム状あるいは軟膏型のファンデーション、ハンドクリーム、レッグクリーム、ボディローション等の身体用化粧料等、入浴剤、毛髪化粧料とすることができる。通常、化粧料において使用される製剤化方法にしたがって、これらの剤型として製造することができる。口紅、アイカラー、チークカラーといったメイクアップ化粧料とすることができる。
【0033】
本発明の異常蛋白質除去用組成物は、高純度大豆サポニンBグループを主要有効成分として含有する他に、必要に応じ薬学的に許容される希釈剤又は担体等の添加剤を含有することができる。また、本発明の組成物は、必要により、薬学的に活性な他の薬効成分を含有することができる。
【0034】
現在、蓄積した異常蛋白質がアルツハイマー病、パーキンソン病、レビー小体病、トリプレットリピート病、筋萎縮性側索硬化症、白内障、動脈硬化、糖尿病性腎症皮膚の光老化、くすみ又は皮膚のしわなどの疾患に関与することが知られている。従って、本発明の異常蛋白質除去用組成物を摂取することにより上記疾患を予防又は治療することが可能になると考えられる(非特許文献The FASEBJournal、9巻、1173〜1182頁、1995年)。
【0035】
本発明の組成物は、老化予防及び老化防止用化粧料又は健康食品、アンチエイジング化粧料又は美容食品、サビ予防及びサビ防止化粧料又は健康食品として有用である。本発明の異常蛋白質除去用組成物は、哺乳動物に対して、優れた作用を示し、且つ安全性が高い。
【0036】
本発明の組成物は、紫外線に暴露されるあるいは暴露された生体組織、特に皮膚に対して、紫外線による傷害を予防又は改善することのできる紫外線傷害予防又は改善用組成物として有用である。紫外線暴露により発生した活性酸素により産生された細胞内の変性蛋白質(異常蛋白質)を効率良く分解し、紫外線暴露による細胞傷害を抑制する。
【0037】
その他、用途や剤型に応じて次のようなものを添加することができる。
油脂類としては、例えば、ツバキ油、月見草油、マカデミアナッツ油、オリーブ油、ナタネ油、トウモロコシ油、ゴマ油、ホホバ油、胚芽油、小麦胚芽油、トリオクタン酸グリセリン、等の液体油脂、カカオ脂、ヤシ油、硬化ヤシ油、パーム油、パーム核油、モクロウ、モクロウ核油、硬化油、硬化ヒマシ油等の固体油脂、ミツロウ、キャンデリラロウ、綿ロウ、ヌカロウ、ラノリン、酢酸ラノリン、液状ラノリン、サトウキビロウ等のロウ類が挙げられる。
【0038】
炭化水素類としては、例えば、流動パラフィン、スクワレン、スクワラン、マイクロクリスタリンワックス等が挙げられる。
【0039】
高級脂肪酸として、例えば、ラウリン酸、ミリスチン酸、パルミチン酸、ステアリン酸、オレイン酸、リノール酸、リノレン酸、ドコサヘキサエン酸(DHA)、エイコサペンタエン酸(EPA)等が挙げられる。
【0040】
高級アルコールとして、例えば、ラウリルアルコール、ステアリルアルコール、セチルアルコール、セトステアリルアルコール等の直鎖アルコール、モノステアリルグリセリンエーテル、ラノリンアルコール、コレステロール、フィトステロール、オクチルドデカノール等の分枝鎖アルコール等が挙げられる。
【0041】
シリコーンとして、例えば、鎖状ポリシロキサンのジメチルポリシロキサン、メチルフェニルポリシロキサン等、環状ポリシロキサンのデカメチルシクロペンタシロキサン等が挙げられる。
【0042】
アニオン界面活性剤として、例えば、ラウリン酸ナトリウム等の脂肪酸塩、ラウリル硫酸ナトリウム等の高級アルキル硫酸エステル塩、POEラウリル硫酸トリエタノールアミン等のアルキルエーテル硫酸エステル塩、N−アシルサルコシン酸、スルホコハク酸塩、N−アシルアミノ酸塩等が挙げられる。
【0043】
カチオン界面活性剤として、例えば、塩化ステアリルトリメチルアンモニウム等のアルキルトリメチルアンモニウム塩、塩化ベンザルコニウム、塩化ベンゼトニウム等が挙げられる。
【0044】
両性界面活性剤として、例えば、アルキルベタイン、アミドベタイン等のベタイン系界面活性剤等が挙げられる。
【0045】
非イオン界面活性剤として、例えば、ソルビタンモノオレエート等のソルビタン脂肪酸エステル類、硬化ヒマシ油誘導体が挙げられる。
【0046】
防腐剤として、例えば、メチルパラベン、エチルパラベン等を挙げることができる。
金属イオン封鎖剤として、例えばエチレンジアミン四酢酸二ナトリウム、エデト酸、エデト酸ナトリウム塩等のエデト酸塩を挙げることができる。
【0047】
高分子として、例えば、アラビアゴム、トラガカントガム、ガラクタン、グアーガム、カラギーナン、ペクチン、寒天、クインスシード、デキストラン、プルラン、カルボキシメチルデンプン、コラーゲン、カゼイン、ゼラチン、メチルセルロース、メチルヒドロキシプロピルセルロース、ヒドロキシエチルセルロース、カルボキシメチルセルロースナトリウム(CMC)、アルギン酸ナトリウム、カルボキシビニルポリマー(CARBOPOL等)等のビニル系高分子、等を挙げることができる。
【0048】
増粘剤として、例えば、カラギーナン、トラガカントガム、クインスシード、カゼイン、デキストリン、ゼラチン、CMC、ヒドロキシエチルセルロース、ヒドロキシプロピルセルロース、カルボキシビニルポリマー、グアーガム、キサンタンガム、ベントナイト等を挙げることができる。
【0049】
粉末成分としては、例えば、タルク、カオリン、雲母、シリカ、ゼオライト、ポリエチレン粉末、ポリスチレン粉末、セルロース粉末、無機白色顔料、無機赤色系顔料、酸化チタンコーテッドマイカ、酸化チタンコーテッドタルク、着色酸化チタンコーテッドマイカ等のパール顔料、赤色201号、赤色202号等の有機顔料を挙げることができる。
【0050】
紫外線吸収剤としては、例えば、パラアミノ安息香酸、サリチル酸フェニル、パラメトキシケイ皮酸イソプロピル、パラメトキシケイ皮酸オクチル、2,4−ジヒドロキシベンゾフェノン、等を挙げることができる。
【0051】
紫外線遮断剤として、例えば、酸化チタン、タルク、カルミン、ベントナイト、カオリン、酸化亜鉛等を挙げることができる。
【0052】
保湿剤として、例えば、ポリエチレングリコール、プロピレングリコール、ジプロピレングリコール、1,3−ブチレングリコール、1,2−ペンタンジオール、グリセリン、ジグリセリン、ポリグリセリン、キシリトール、マルチトール、マルトース、ソルビトール、ブドウ糖、果糖、コンドロイチン硫酸ナトリウム、ヒアルロン酸ナトリウム、乳酸ナトリウム、ピロリドンカルボン酸、シクロデキストリン等が挙げられる。
【0053】
薬効成分としては、例えば、ビタミンA油、レチノール等のビタミンA類、リボフラビン等のビタミンB2類、ピリドキシン塩酸塩等のB6類、L−アスコルビン酸、L−アスコルビン酸リン酸エステル、L−アスコルビン酸モノパルミチン酸エステル、L−アスコルビン酸ジパルミチン酸エステル、L−アスコルビン酸−2−グルコシド等のビタミンC類、パントテン酸カルシウム等のパントテン酸類、ビタミンD2、コレカルシフェロール等のビタミンD類;α−トコフェロール、酢酸トコフェロール、ニコチン酸DL−α−トコフェロール等のビタミンE類等のビタミン類を挙げることができる。
【0054】
プラセンタエキス、グルタチオン、ユキノシタ抽出物等の美白剤、ローヤルゼリー、ブナノキエキス等の皮膚賦活剤、カプサイシン、ジンゲロン、カンタリスチンキ、イクタモール、カフェイン、タンニン酸、γ−オリザノール等の血行促進剤、グリチルリチン酸誘導体、グリチルレチン酸誘導体、アズレン等の消炎剤、アルギニン、セリン、ロイシン、トリプトファン等のアミノ酸類、常在菌コントロール剤のマルトースショ糖縮合物、塩化リゾチーム等を挙げることができる。
【0055】
さらに、カミツレエキス、パセリエキス、ブナノキエキス、ワイン酵母エキス、グレープフルーツエキス、スイカズラエキス、コメエキス、ブドウエキス、ホップエキス、コメヌカエキス、ビワエキス、オウバクエキス、ヨクイニンエキス、センブリエキス、メリロートエキス、バーチエキス、カンゾウエキス、シャクヤクエキス、サボンソウエキス、ヘチマエキス、トウガラシエキス、レモンエキス、ゲンチアナエキス、シソエキス、アロエエキス、ローズマリーエキス、セージエキス、タイムエキス、茶エキス、海藻エキス、キューカンバーエキス、チョウジエキス、ニンジンエキス、マロニエエキス、ハマメリスエキス、クワエキス等の各種抽出物を挙げることができる。
【0056】
以下、実施例により本発明をさらに詳しく説明するが、本発明はこれらの実施例等に限定されるものではない。
【実施例1】
【0057】
ヘアレスマウスに大豆サポニンを70日間経口摂取させ、UVA及びUVBを照射し、高純度大豆サポニンBグループの有用性について検討を行った。
[高純度大豆サポニンBグループのUV照射マウスの皮膚への効果試験]
導入時6週齢のヘアレスマウス(Hos:HR-1 ♂)を用いて以下の条件で試験を行った。
1)試験対象物の調製及び投与
ヘアレスマウスの群分けは投与開始日に、一般状態が良好な動物を体重により、群間での差が無いように1群5匹に振り分けた。なお、各々の個体は1ゲージ/群で飼育とした。大豆サポニンクルード(大豆サポニンAグループ:14.9%、大豆サポニンBグループ:25.8%)は、蒸留水に懸濁して体重あたりの総サポニン量を50mg/kgとして((a)クルード原料として123mg/kg)、大豆サポニンBグループ(大豆サポニンAグループ:9.5%、大豆サポニンBグループ:69.4%)は、蒸留水に懸濁して体重あたりのサポニンBグループ量を50mg/kgとして((b)サポニンB原料として72mg/kg)それぞれ1日1回10週間、胃ゾンデを用いた強制経口投与にて摂取させた。UV照射を実施した日は照射2時間後に投与を行った。飼育条件を表1に示す。
【0058】
【表1】

【0059】
2)皮膚水分量の測定
水分量の測定は、モイスチャーチェッカーを用い、背部の尾付け根より首に向かい2cm、腰椎から右側に0.5cm部位を3回測定して平均を求めた。測定日は、試験開始日、中間観察日及び解剖日とした。
【0060】
3)皮膚弾力性の測定
皮膚弾力測定装置(非特許文献Cutometer SEM 575/Electronic Gmbh co.製)を用いて、背部の尾付け根より首に向かい2cm、腰椎から右側に0.5cm部位を3回測定して平均を求めた。測定日は解剖日とした。
【0061】
4)酸化蛋白質の測定
酸化蛋白質即ちカルボニル化蛋白質は、酸化障害により生じた蛋白質のカルボニル基に特異的に結合する2,4-ジニトロフェニルヒドラジン(DNPH)を用いてカルボニル化蛋白質を標識後、DNPHに特異的に結合する抗DNPH抗体を用いて検出した。具体的な方法は以下の通りである。UV照射部位の皮膚1cm2を切り取り、0.1Mトリスバッファー(pH 7.5)1mlを加えてホモジナイズし、10000rpm×15分間遠心し、その上清をフィルターろ過後解析を行った。蛋白質のジニトロフェニルヒドラジン(DNPH)化は公知の方法(非特許文献
Nakamura他、Journal of Biochemistry、119巻、768〜774頁、1996年)で行った。DNPH化した蛋白質をSDS−PAGEにより分離し、蛋白質転写装置を用いてPolyvinylidene difluoride(PVDF)膜に転写した。転写後の膜は2時間以上、5%スキムミルクを含むPBS(−)溶液中でブロッキングし、洗浄後抗DNPH抗体と2時間反応させ、洗浄後、ビオチン化抗ラビットイムノグルブリンG と1時間反応させた。洗浄後、蛍光検出キット(ECL PLUS)を用いてPVDF膜を感光し、医療用自動現像装置にて画像を転写した。画像解析はデンシト
メ−ターを用いて行なった。
【0062】
5)UV照射
UV照射時は、動物を専用のPCケージに移し、1群ずつUVB20mj/cm2及びUVA14j/cm2を照射した。照射は月、水及び金の週3日サイクルで10週間実施した。
【0063】
6)解剖
各群、本飼育期間終了翌日より18時間絶食後、ネンブタール(40mg/kg)腹腔内投与により麻酔を導入し解剖を実施した。この照射量、期間でヒトの光老化同様の皮膚のしわが形成されることが報告されている(非特許文献J of DermatologicalnScience 27519-525(2001))。
【0064】
7)統計処理
試験結果は平均値±標準誤差で表し、エクセル統計Student’s-t testにより有意差検定を行った。
【0065】
1.一般状態観察
第4週目頃よりUV照射動物において、頭部の皮膚の軽度褐色化や頸部のしわの深さならびに後肢背部のしわがUV非照射動物に比較して目立つようになった。
解剖時の外観観察にでは、UV照射動物で顔、頸部及び後肢背部のしわが明瞭に確認されたが、UV照射においても大豆サポニンクルード及び大豆サポニンBグループ摂取動物はその症状は軽度であり、特に大豆サポニンBグループ摂取動物のしわの深度が浅く、肉眼的にはしわの色が薄く観られた。また、大豆サポニンBグループ摂取動物は、Controlに比較して皮膚にしっとり感があり、特にUV+大豆サポニンBグループ摂取動物でその症状は顕著に感じられた。
【0066】
2.体重推移
体重推移は、各群大きな差異は認められなかった。
【0067】
3.摂餌量
摂餌量についても体重推移同様に大きな差異は認められなかった。
【0068】
4.肝臓重量
肝臓重量についても大きな差異は認められず異常な症状は観察されなかった。また、他の臓器についても異常は認められなかった。
【0069】
5.皮膚水分量
皮膚水分量はその数値が高いほど、皮膚中の水分が高い即ち保湿力が高いことが推測できる。UV照射により皮膚の水分量が低下することが一般的に知られており、本試験でも中間観察日、解剖日の水分量はコントロール群に比較してUV照射群では低くなっている。皮膚水分量の測定では、中間観察日で、UV 照射群に比較し、UV照射+大豆サポニン摂取動物は2群とも高い値を示した。解剖日の測定においては、UV照射群に比較してUV照射+大豆サポニンクルード群が低い値を示したものの、UV照射+大豆サポニンBグループ群では平均値において高い値を示し、コントロール群と同程度の値であった。結果を図1に示す。
【0070】
6.皮膚弾力性
皮膚弾力性は、その数値が高いほど、皮膚の弾力性が高いことが推測できる。UV照射により皮膚の弾力性が低下することが一般的に知られている。この結果を図2に示す。UV非照射群において、大豆サポニン Bグループ投与群は大豆サポニンクルード群と比較して弾力性が 有意に高かった。
【0071】
7.酸化蛋白質量
この結果を図3に示す。酸化蛋白質量はカルボニル化蛋白質量として検出される。カルボニル化蛋白質は、その数値が低いほど臓器における蓄積量が少ないことを示す。図3から明らかなように、酸化蛋白質量はUV照射によって、非照射に比べて著しく増加するものの、UV照射と並行して大豆サポニン Bグループを投与した群では有意に減少し、高純度大豆サポニンBグループの酸化蛋白質除去効果を示した。
特に、大豆サポニンクルード群では、UV 照射群と同程度であったのに対し、大豆サポニン Bグループでは、明確に減少しており、大豆サポニン Bの作用が発揮されていることが示されている。
【0072】
以上の結果より、高純度大豆サポニンBグループは、通常の大豆サポニンクルードやコントロール群に比べ、紫外線照射による皮膚ストレスに対しては水分量の減少を抑制し、さらに、かさつきやしわなどの生成を予防する効果を示す物質であることが確認された。また、高純度大豆サポニンBグループは、酸化蛋白質量を大豆サポニンクルードやコントロール群に比べ著しく減少させ、高純度大豆サポニンBグループの酸化蛋白質除去効果の有効性を示した。
さらに、高純度サポニンBグループ投与により皮膚弾力性が高まる事が明らかになった。高純度大豆サポニンBグループ50mg/kgのマウスへの投与は、体表面積換算式y=(3√x)2を用いてヒトへの投与量に換算すると約450mg/日/60kg体重に相当し、食品として無理なく摂取することが可能な量である。
【実施例2】
【0073】
[高純度大豆サポニンBグループのパラコートストレス負荷ラットへの効果試験]導入時6週齢のラット(Wistar/Cri ♂)を用いて以下の条件で試験を行った。
【0074】
1)試験対象物の調製及び投与
Wistar系ラットの群分けは投与開始日に、一般状態が良好な動物を体重により、群間での差が無いように1群5匹に振り分けた。なお、各々の個体は単独飼育とした。大豆サポニンクルード(大豆サポニンAグループ:14.9%、大豆サポニンBグループ:25.8%)は、混餌給餌とし、オリエンタル酵母社製MF飼料に混ぜ、体重あたりの総サポニン摂取量が15mg/kgとなるように給餌した。大豆サポニンBグループ(大豆サポニンAグループ:9.5%、大豆サポニンBグループ:69.4%)についても混餌給餌とし、オリエンタル酵母社製MF飼料に混ぜ、体重あたりの大豆サポニンBグループ摂取量が15mg/kgとなるように給餌した。パラコートは、パラコート1000mgを500mlの生理食塩水に溶解した注射溶液を、体重あたり10mg/kgのDoseにて週1回、2ヶ月間腹腔内に注射投与を行った。飼育条件を表2に示す。
【0075】
【表2】

【0076】
2)解剖
各群、本飼育期間終了翌日より18時間絶食後、ネンブタール(40mg/kg)腹腔内投与により麻酔を導入し解剖を実施した。
【0077】
3)統計処理
試験結果を図4〜6に示す。
【0078】
1.一般状態観察
パラコートは急性中毒も引き起こす強力な農薬であるため、投与直後には動物個体の体温低下や元気活力の低下及び軟便化が観察される。しかしながら、パラコート+大豆サポニン投与群ではその症状は軽く、投与後2日目にはコントロール群レベルに状態が回復していた。中でもパラコート+大豆サポニンBグループ摂取動物はその症状は軽度であり、投与期間の後半でも同様であった。
【0079】
2.体重推移
体重推移は、各群大きな差異は認められなかった。
【0080】
3.摂餌量
摂餌量についても体重推移同様に大きな差異は認められなかった。
【0081】
4.酸化蛋白質量の測定(皮膚/赤血球/肝臓)
採取した各サンプル(皮膚1cm2/血液100μl/肝臓 100mg)に0.1Mトリスバッファー(pH 7.5)1mlを加えてホモジナイズし、10000rpm×15分間遠心し、その上清をフィルターろ過後解析を行った。蛋白質のジニトロフェニルヒドラジン(DNPH)化は公知の方法(非特許文献Nakamura他、Journal of Biochemistry、119巻、768〜774頁、1996年)で行った。DNPH化した蛋白質をSDS−PAGEにより分離し、蛋白質転写装置を用いてPolyvinylidene
difluoride(PVDF)膜に転写した。転写後の膜は2時間以上、5%スキムミルクを含むPBS(−)溶液中でブロッキングし、洗浄後抗DNPH抗体と2時間反応させ、洗浄後、ビオチン化抗ラビットイムノグルブリンG と1時間反応させた。洗浄後、蛍光検出キット(ECL PLUS)を用いてPVDF膜を感光し、医療用自動現像装置にて画像を転写した。画像解析はデンシトメ−ターを用いて行なった。
【0082】
この結果を図4〜6に示す。酸化蛋白質量はカルボニル化蛋白質量として検出される。図4〜6で明らかなように、酸化蛋白質量はパラコート投与により著しく増加するが、パラコート+高純度大豆サポニンBグループ投与群でその増加は有意に抑えられ、その効果は大豆サポニンクルードと比較して優れていた。このことから高純度大豆サポニンBグループの酸化蛋白質除去効果が示された。
【0083】
以上の結果より、高純度大豆サポニンBは、一般的な大豆サポニンクルードやコントロール群に比べ、パラコート投与による、皮膚、肝臓、赤血球中の酸化蛋白質量を著しく減少させ、高純度大豆サポニンBの酸化蛋白質除去効果の有効性を示した。高純度大豆サポニンBグループ15mg/kgのラットへの投与は、体表面積換算式y=(3√x)2を用いてヒトへの投与量に換算すると約134mg/日/60kg体重に相当し、食品として無理なく摂取することが可能な量である。
【0084】
処方例1
[カプセル剤]
組成
大豆サポニン(大豆サポニB 50%含有)…50mg
トコトリエノール…30mg
ミツロウ…10mg
ぶどう種子オイル…110mg
上記成分を混合し、ゼラチン及びグリセリンを混合したカプセル基剤中に充填し、軟カプセルを得た。
【0085】
処方例2
[錠剤]
組成
大豆サポニン(大豆サポニB 50%含有)…25mg
マリアアザミ(シリマリン65%含有)…20mg
コラーゲン加水分解物…50mg
セルロース…40mg
デンプン・・・20mg
ショ糖脂肪酸エステル・・・2mg
上記成分を混合、打錠し、錠剤を得た。
【0086】
処方例3
〔ジュース〕
(組 成) (配合;質量%)
果糖ブトウ糖液糖 5.00
クエン酸 10.4
L−アスコルビン酸 0.20
香料 0.02
色素 0.10
ゼラチン分解物(平均分子量300) 1.00
大豆サポニン(大豆サポニB 50%含有) 1.00
水 82.28
【0087】
処方例4
〔クリーム〕
(1)ステアリルアルコール 6.0
(2)ステアリン酸 2.0
(3)水添ラノリン 4.0
(4)スクワラン 9.0
(5)オクチルドデカノール 10.0
(6)POE(25)セチルアルコールエーテル 3.0
(7)モノステアリン酸グリセリン 2.0
(8)ゼラチン分解物(平均分子量300) 1.00
(9)大豆サポニン(大豆サポニB 50%含有) 1.00
(10)防腐剤 適量
(11)香料 適量
(12)1,3ブチレングリコール 6.0
(13)PEG 1500 4.0
(14)精製水 残余
上記成分(1)〜(11)を80℃に加熱溶解し油相とする。成分(12)〜(14)を70℃に加熱溶解し水相とする。油相に水相を徐々に加え乳化し、攪拌しながら40℃まで冷却し、さらに30℃まで攪拌冷却してクリームを得た。
【図面の簡単な説明】
【0088】
【図1】UV照射試験におけるサポニン投与量と皮膚水分量の関係を表した図である。
【図2】UV照射試験におけるサポニン投与量と皮膚弾力性の関係を表した図である。
【図3】UV照射試験におけるサポニン投与量と皮膚カルボニル化蛋白質の関係を表した図である。
【図4】パラコート負荷時におけるサポニン投与量と皮膚カルボニル化蛋白質の関係を表した図である。
【図5】パラコート負荷時におけるサポニン投与量と肝臓カルボニル化蛋白質の関係を表した図である。
【図6】パラコート負荷時におけるサポニン投与量と赤血球カルボニル化蛋白質の関係を表した図である。
【特許請求の範囲】
【請求項1】
大豆サポニンBグループを主要成分とすることを特徴とする異常蛋白質除去用組成物。
【請求項2】
大豆サポニンBグループは、大豆抽出物100重量部のうち、大豆サポニンBグループを40〜100重量部含有する大豆抽出物であることを特徴とする請求項1記載の異常蛋白質除去用組成物。
【請求項3】
大豆サポニンBグループが、SoyasaponinI、II、III、IV、Vあるいはそれらのアセチル体、大豆サポニンAグループがSoyasaponin A1、A2、A3、A4、A5、A6、Ac、Adあるいはそれらのアセチル体、もしくはそれらの混合物である請求項1又は2に記載の異常蛋白質除去用組成物。
【請求項4】
コラーゲン、ゼラチン、コラーゲン加水分解物、ゼラチン加水分解物から選択されるいずれか一種以上及び/又はシリマリンを含むことを特徴とする請求項1〜3のいずれかに記載の異常蛋白質除去用組成物。
【請求項5】
請求項1〜4のいずれかに記載の異常蛋白質除去用組成物を含有する紫外線障害予防・改善剤用組成物。
【請求項6】
請求項1〜4のいずれかに記載の異常蛋白質除去用組成物又は請求項5に記載の紫外線障害予防・改善剤用組成物を含有する抗老化食品。
【請求項7】
請求項1〜4のいずれかに記載の異常蛋白質除去用組成物又は請求項5に記載の紫外線障害予防・改善剤用組成物を含有するくすみ抑制又はしわ抑制又は保湿用食品。
【請求項8】
請求項1〜4いずれかに記載の異常蛋白質除去用組成物又は請求項5に記載の紫外線障害予防・改善剤用組成物を含有する抗老化化粧料。
【請求項9】
請求項1〜4のいずれかに記載の異常蛋白質除去用組成物又は請求項5に記載の紫外線障害予防・改善剤用組成物を含有するくすみ抑制又はしわ抑制又は保湿用化粧料。
【請求項10】
請求項1〜4のいずれかに記載の異常蛋白質除去用組成物又は請求項5に記載の紫外線障害予防・改善剤用組成物を含有する抗老化飼料又は動物薬。
【請求項11】
請求項1〜4のいずれかに記載の異常蛋白質除去用組成物又は請求項5に記載の紫外線障害予防・改善剤用組成物を含有するくすみ抑制又はしわ抑制又は保湿用飼料又は動物薬。
【請求項12】
請求項1〜4のいずれかに記載の異常蛋白質除去用組成物又は請求項5に記載の紫外線障害予防・改善剤用組成物を含有する抗老化ペット動物用化粧料。
【請求項13】
請求項1〜4のいずれかに記載の異常蛋白質除去用組成物又は請求項5に記載の紫外線障害予防・改善剤用組成物を含有するくすみ抑制又はしわ抑制又は保湿用ペット動物用化粧料。
【請求項1】
大豆サポニンBグループを主要成分とすることを特徴とする異常蛋白質除去用組成物。
【請求項2】
大豆サポニンBグループは、大豆抽出物100重量部のうち、大豆サポニンBグループを40〜100重量部含有する大豆抽出物であることを特徴とする請求項1記載の異常蛋白質除去用組成物。
【請求項3】
大豆サポニンBグループが、SoyasaponinI、II、III、IV、Vあるいはそれらのアセチル体、大豆サポニンAグループがSoyasaponin A1、A2、A3、A4、A5、A6、Ac、Adあるいはそれらのアセチル体、もしくはそれらの混合物である請求項1又は2に記載の異常蛋白質除去用組成物。
【請求項4】
コラーゲン、ゼラチン、コラーゲン加水分解物、ゼラチン加水分解物から選択されるいずれか一種以上及び/又はシリマリンを含むことを特徴とする請求項1〜3のいずれかに記載の異常蛋白質除去用組成物。
【請求項5】
請求項1〜4のいずれかに記載の異常蛋白質除去用組成物を含有する紫外線障害予防・改善剤用組成物。
【請求項6】
請求項1〜4のいずれかに記載の異常蛋白質除去用組成物又は請求項5に記載の紫外線障害予防・改善剤用組成物を含有する抗老化食品。
【請求項7】
請求項1〜4のいずれかに記載の異常蛋白質除去用組成物又は請求項5に記載の紫外線障害予防・改善剤用組成物を含有するくすみ抑制又はしわ抑制又は保湿用食品。
【請求項8】
請求項1〜4いずれかに記載の異常蛋白質除去用組成物又は請求項5に記載の紫外線障害予防・改善剤用組成物を含有する抗老化化粧料。
【請求項9】
請求項1〜4のいずれかに記載の異常蛋白質除去用組成物又は請求項5に記載の紫外線障害予防・改善剤用組成物を含有するくすみ抑制又はしわ抑制又は保湿用化粧料。
【請求項10】
請求項1〜4のいずれかに記載の異常蛋白質除去用組成物又は請求項5に記載の紫外線障害予防・改善剤用組成物を含有する抗老化飼料又は動物薬。
【請求項11】
請求項1〜4のいずれかに記載の異常蛋白質除去用組成物又は請求項5に記載の紫外線障害予防・改善剤用組成物を含有するくすみ抑制又はしわ抑制又は保湿用飼料又は動物薬。
【請求項12】
請求項1〜4のいずれかに記載の異常蛋白質除去用組成物又は請求項5に記載の紫外線障害予防・改善剤用組成物を含有する抗老化ペット動物用化粧料。
【請求項13】
請求項1〜4のいずれかに記載の異常蛋白質除去用組成物又は請求項5に記載の紫外線障害予防・改善剤用組成物を含有するくすみ抑制又はしわ抑制又は保湿用ペット動物用化粧料。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2008−308505(P2008−308505A)
【公開日】平成20年12月25日(2008.12.25)
【国際特許分類】
【出願番号】特願2008−204993(P2008−204993)
【出願日】平成20年8月8日(2008.8.8)
【分割の表示】特願2004−314871(P2004−314871)の分割
【原出願日】平成16年10月28日(2004.10.28)
【出願人】(593106918)株式会社ファンケル (310)
【Fターム(参考)】
【公開日】平成20年12月25日(2008.12.25)
【国際特許分類】
【出願日】平成20年8月8日(2008.8.8)
【分割の表示】特願2004−314871(P2004−314871)の分割
【原出願日】平成16年10月28日(2004.10.28)
【出願人】(593106918)株式会社ファンケル (310)
【Fターム(参考)】
[ Back to top ]

