異常造血の検出及び制御
ZFP36L2の異常発現に基づく、対象における異常造血の検出方法、対象におけるZFP36L2タンパク質のレベル又は活性を変えることによる、対象における造血を制御する方法、ZFP36L2発現の変化に基づく、造血を調節する化合物のスクリーニング方法、及びそれにより同定される化合物。
【発明の詳細な説明】
【背景技術】
【0001】
発明の背景
【0002】
造血疾患は、不十分な又は過度の血球産生が存在する状態を含む。このような疾患には多くの原因があり得、しばしば他の一次的疾患に対する二次的状態である。造血疾患及び関連する状態の治療方法は存在するが、このような方法の一部は副作用及び健康リスクと関連付けられている。したがって、造血疾患及びそれと関連する状態を治療し、検出し、モニタリングし、又は制御するために有用な、さらなる方法及び化合物に対する要望が依然として存在する。
【発明の概要】
【0003】
本発明は、対象における異常造血又はそれと関連する状態の検出方法を提供する。本発明の一態様によれば、本方法は、対象におけるジンクフィンガータンパク質36 C3H型様2(Zinc Finger Protein 36 C3H type-like 2)(ZFP36L2)の異常発現を検出する工程を含み、ここで対象における異常なZFP36L2発現は異常造血又はそれと関連する状態を示す。本発明の別の態様によれば、本方法は、対象におけるZFP36L2遺伝子内の変異を検出する工程を含み、ここで対象におけるZFP36L2遺伝子内の変異は異常造血又はそれと関連する状態を示す。
【0004】
本発明は、造血を調節する化合物のスクリーニング方法であって、(a)試験化合物をZFP36L2を発現する細胞に投与する工程、及び(b)試験化合物の存在下、対照と比較して該細胞におけるZFP36L2発現の変化を検出する工程を含み、ここで該細胞におけるZFP36L2発現の変化は、試験化合物が造血を調節し得ることを示す、スクリーニング方法も提供する。
【0005】
本発明はさらに、対象におけるZFP36L2タンパク質のレベル又は活性を調節する工程を含む、対象における造血の制御方法を提供する。
【図面の簡単な説明】
【0006】
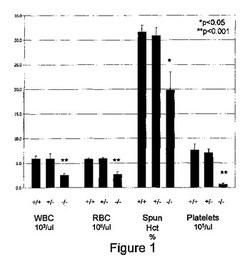
【図1】図1は、対照(+/+)、部分的ZFP36L2ノックアウト(+/−)、及び完全ZFP36L2ノックアウト(−/−)マウスにおける、白血球(WBC)、赤血球(RBC)、スパンヘマトクリット(spun hematocrit)(スパンHCT)(パーセンテージとして表される)、及び血小板の数のグラフである。
【図2】図2は、対照(+/+)、部分的ZFP36L2ノックアウト(+/−)、及び完全ZFP36L2ノックアウト(−/−)マウスにおける、白血球(WBC)、好中球、リンパ球、単球、及び好酸球の数のグラフである。
【図3】図3は、対照(+/+)、部分的ZFP36L2ノックアウト(+/−)、及び完全ZFP36L2ノックアウト(−/−)マウスにおける、胎生14.5日の胎仔肝臓中の造血前駆細胞の数のグラフである。
【図4】図4は、対照(+/+)、部分的ZFP36L2ノックアウト(+/−)、及び完全ZFP36L2ノックアウト(−/−)マウスにおける、胎生11.5日の卵黄嚢中の造血前駆細胞の数のグラフである。
【図5】図5は、対照(+/+)、部分的ZFP36L2ノックアウト(+/−)、及び完全ZFP36L2ノックアウト(−/−)マウスにおける、胎生11.5日の大動脈・性腺・中腎(AGM)領域中の造血前駆細胞の数のグラフである。
【図6】図6は、正常マウス(+/+)及び完全ZFP36L2ノックアウトマウス(−/−)における、移植後1及び2ヶ月の再増殖胎仔肝細胞の移植率のグラフである。
【発明を実施するための形態】
【0007】
発明の詳細な説明
【0008】
ジンクフィンガータンパク質36様タイプ−2(Zinc finger protein 36 like type-2)(ZFP36L2、またBRF2、ERF2、ERF−2、TIS11D、及びRNF162Cとしても知られる)は、3つのシステイン及びそれに続く1つのヒスチジン(CCCH)により特徴付けられる、タンデムの亜鉛結合モチーフを含む、ジンクフィンガータンパク質のファミリーに属する。ジンクフィンガーを介して、これらのタンパク質は、クラスII AUリッチエレメントを含むmRNAに、一般的にはそれらの3’非翻訳領域において結合し得、その後標的mRNAの分解が起こる。いかなる特定の理論にも制約されることを望まないが、ZFP36L2が造血に関わる1以上のタンパク質をコードするmRNA種と相互作用すること、及びそれによるZFP36L2の発現の増加又は減少が造血を調節することが信じられている。ZFP36L2タンパク質をコードするヒトゲノム配列は、およそ、第二染色体の22271678−22264639の位置、NT_22184.14遺伝子座に位置する。ZFP36L2タンパク質及びmRNA配列は、それぞれRefSeqアクセション番号NP_008818(タンパク質)及びNM_006887(mRNA)と関連付けられる。他種の対応する配列は当分野において公知である。
【0009】
一実施形態において、本発明は、対象における異常なZFP36L2発現を検出することによる、対象における異常造血、又はそれと関連する状態の検出方法を提供し、ここで対象における異常なZFP36L2発現は異常造血又はそれと関連する状態を示す。より具体的には、異常に高いZFP36L2発現は異常に高い造血又はそれと関連する状態を示し、異常に低いZFP36L2は異常に低い造血又はそれと関連する状態を示す。
【0010】
対象は、典型的には哺乳動物などの動物、好ましくはヒトであり、その場合異常なZFP36L2発現は、対象からの適切な試料(例えば体液(例えば、血液)又は組織試料など)において検出され得る。しかし、対象は、研究の関連の中で有用であり得るように、単離された細胞(例えば、細胞培養物)でもあり得る。例えば、細胞は造血若しくは間質細胞、又はZFP36L2を通常発現する種類の別の細胞であり得る。適切な細胞としては、ZFP36L2を発現するように、又は変異ZFP36L2を含むように操作された細胞も挙げられる。
【0011】
所定の対象における異常造血は、所定の種類の対象において「正常」とみなされる造血レベルよりも、一般的には臨床的に有意な程度まで高い又は低い造血レベルを包含する。対象における正常及び異常造血レベルについてのガイダンスは、当業者によって確かめられ得る。ヒト対象に関しては、このような情報は、例えばthe Physicians' Desk Reference, 61st ed. Montvale, NJ (2007)を参照することにより入手可能である。
【0012】
異常に高い造血と関連する状態としては、多血症、白血病を含む癌若しくは腫瘍、又はそれらの組み合わせが挙げられるが、それらに限定されない。異常に低い造血と関連する状態としては、貧血、血小板減少症、骨髄異形成症候群、又はそれらの組み合わせが挙げられるが、それらに限定されない。さらに、前述の状態のいずれも、一次的状態であり得、又は他の状態(例えば癌、癌化学治療、感染症、透析、その他など)に対して二次的であり得る。異常造血と関連する状態としては、本発明の目的のためには、異常造血又はそれに関連する任意の状態を発症する素因も挙げられる。造血は、典型的には骨髄細胞系列のものである。
【0013】
対象におけるZFP36L2の異常発現は、同じ種類の正常な、罹患していない対象におけるZFP36L2発現よりも高い又は低いZFP36L2発現を意味する。一般的には、所定の対象におけるZFP36L2の異常発現は、正常な、罹患していない対象のものよりも有意に高く又は低く、それゆえそれは生理的な又は表現型上の影響を引き起こす。
【0014】
異常なZFP36L2発現は任意の方法によって検出され得る。一般的には、異常なZFP36L2発現は、対象におけるZFP36L2発現レベルを対照と比較することにより検出される。対照は、例えば、同じ種類の正常な、罹患していない対象におけるZFP36L2発現レベル、又はこのような対象におけるZFP36L2の正常な発現レベルを表すあらかじめ確立された基準であり得る。
【0015】
ZFP36L2発現は、任意の基準に基づき検出及び比較され得る。例えば、異常なZFP36L2発現は、ZFP36L2タンパク質のレベル又は活性の基準に基づき検出され得る。タンパク質のレベル又は活性を検出、定量、及び/又は比較するための任意の技術が使用され得、タンパク質免疫染色、免疫沈降、ウェスタンブロット、スペクトロスコピー、酵素アッセイ、クロマトグラフィー、ブラッドフォードタンパク質アッセイ、及びゲル電気泳動技術が挙げられるが、これらに限定されない。
【0016】
免疫染色は、試料中の特定のタンパク質を検出するための、抗体に基づく方法の任意の使用に適用される、生化学における一般用語である。細胞又は組織切片の免疫組織化学又はIHC染色は、おそらく最も一般的に適用される免疫染色技術である。IHC染色の最初のケースでは、蛍光色素を使用した(免疫蛍光を参照のこと)のに対し、ペルオキシダーゼ(免疫ペルオキシダーゼ染色を参照のこと)及びアルカリホスファターゼなどの酵素を使用する他の非蛍光法が現在使用される。これらの酵素は、光学顕微鏡により容易に検出可能な着色生成物を与える反応を触媒することができる。あるいは、放射性元素が標識として使用され得、免疫反応はオートラジオグラフィーにより可視化され得る。
【0017】
免疫沈降(IP)は、抗原を、その抗原に特異的な抗体を使用して、溶液から沈殿させる技術である。この過程は、所定のタンパク質をある程度の純度まで濃縮するために使用され得る。免疫共沈降(「プルダウン」としても知られる)は、細胞抽出物中に存在する、相互作用するタンパク質又はタンパク質複合体を同定し得る:複合体中に存在するとみられる1タンパク質を沈殿させることにより、複合体の更なるメンバーが同様に捕捉され、同定され得る。タンパク質複合体は、特異的抗体に結合すると、アガロースビーズなどの固体支持体に結合した抗体結合タンパク質による捕捉により、バルク溶液から除去される。洗浄後、沈殿したタンパク質は溶出され、ゲル電気泳動、質量分析、ウェスタンブロッティング、又は複合体中の構成因子を同定するための、任意の数の他の方法を使用して分析される。
【0018】
ブラッドフォードアッセイ(比色タンパク質アッセイ)は、タンパク質中に存在するアルギニン及び疎水性アミノ酸残基に結合するときの色素クマシーにおける吸光度シフトに基づく。(結合)形態の色素は青色であり、歴史的に595nmであると考えられている吸収スペクトル極大を有する。陰イオン性(非結合)形態は緑色及び赤色である。595nmにおける吸光度の増大は、結合色素の量に比例し、したがって、試料中に存在するタンパク質の量(濃度)に比例する。他のタンパク質アッセイとは異なり、ブラッドフォードタンパク質アッセイは、タンパク質試料中に存在し得る種々の化合物による干渉に左右されにくい。
【0019】
ゲル電気泳動も、試料中のタンパク質の検出のために有用である。タンパク質は様々な電荷及び複雑な形状を有し得、したがって、試料に負から正の電磁場をかける場合、それらはゲル内へ同様の速度では(又は全く)移動しないかもしれない。したがってタンパク質は、通常、タンパク質を負電荷で覆う、ドデシル硫酸ナトリウム/ドデシルリン酸ナトリウム(SDS/SDP)などの界面活性剤の存在下で変性される。一般的に、結合するSDSの量は、タンパク質の大きさに関連し(通常タンパク質グラム当たり1.4g SDS)、それゆえ結果として生成する変性タンパク質は、全体として負電荷を有し、全てのタンパク質は同様の電荷質量比を有する。変性タンパク質は、複雑な三次形状を有するものではなく、長い棒のように振る舞うため、結果として生成するSDSで覆われたタンパク質がゲル中を移動する速度は、その大きさにのみ関連し、その電荷又は形状には関連しない。タンパク質は通常、ドデシル硫酸ナトリウムポリアクリルアミドゲル電気泳動(SDS−PAGE)により、ネイティブゲル電気泳動により、定量分取ネイティブ連続的ポリアクリルアミドゲル電気泳動(QPNC−PAGE)により、又は二次元電気泳動により、分析される。
【0020】
ウェスタンブロット(イムノブロットとも呼ばれる)は、組織ホモジネート又は抽出物の所定の試料中の特定のタンパク質を検出する方法である。天然又は変性タンパク質をポリペプチドの長さによって(変性条件)、又はタンパク質の三次元構造によって(天然/非変性条件)分離するために、ゲル電気泳動を使用する。次いでタンパク質は、膜(典型的にはニトロセルロース又はPVDF)に移され、そこでそれらは標的タンパク質に特異的な抗体を使用して調べられる(検出される)。
【0021】
異常なZFP36L2発現はまた、mRNAレベルに基づき検出され得る。細胞中のZFP36L2 mRNAの存在及び発現レベルを決定するための適切な技術は、当分野における技術の範囲内である。例えば、全細胞RNAは核酸抽出緩衝液の存在下でのホモジナイズと、その後の遠心により、試料から精製され得る。核酸は沈殿され、DNAは、デオキシリボヌクレアーゼでの処理及び沈殿を伴う処理により除去される。RNA分子は次いで、標準技術に従い、アガロースゲル上のゲル電気泳動によって分離され、例えばいわゆる「ノーザン」ブロッティング技術により、ニトロセルロースフィルターに移される。RNAは次いで、加熱によりフィルター上に固定される。特定のRNAの検出及び定量は、問題のRNAに相補的な、適切に標識されたDNA又はRNAプローブを使用して達成される。例えば、Molecular Cloning: A Laboratory Manual, J. Sambrook et al., eds., 2nd edition, Cold Spring Harbor Laboratory Press, 1989, Chapter 7を参照のこと(その開示全体が参照により組み込まれる)。
【0022】
標識DNA及びRNAプローブの調製方法、及びそれらの標的ヌクレオチド配列へのハイブリダイゼーションのための条件は、Molecular Cloning: A Laboratory Manual, J. Sambrook et al., eds., 2nd edition, Cold Spring Harbor Laboratory Press, 1989, Chapters 10及び11に記載されており、その開示は参照により本明細書中に組み込まれる。例えば核酸プローブは、例えば、3H、32P、33P、14C、若しくは35Sなどの放射性核種;重金属;又は標識リガンド(例えば、ビオチン、アビジン又は抗体)、蛍光分子、化学発光分子、酵素などに対する特異的結合対メンバーとして機能することができるリガンドで、標識され得る。
【0023】
プローブは、Rigby et al, J. Mol. Biol., 113:237-251(1977)のニックトランスレーション法、又はFienberg, Anal. Biochem., 132:6-13 (1983)のランダムプライミング法のいずれかにより、高比活性に標識され得る(これらの開示全体が参照により本明細書中に組み込まれる)。後者は、RNA鋳型からの高比活性の32P標識プローブを合成するための方法であり得る。例えば、ニックトランスレーション法に従って高放射性ヌクレオチドで既に存在するヌクレオチドを置換することにより、108cpm/μgを十分に上回る比活性を有する32P標識核酸プローブを調製することが可能である。次いで、ハイブリダイゼーションのオートラジオグラフィーによる検出、ハイブリダイズしたフィルターを写真フィルムに露光することにより実施できる。ハイブリダイズしたフィルターにより露光された写真フィルムのデンシトメトリースキャニングは、RNAレベルの正確な測定を提供する。別のアプローチを使用して、RNAレベルは、Molecular Dynamics 400-B 2D Phosphorimager(Amersham Biosciences、ピスカタウェイ、N.J)のようなコンピュータ制御のイメージングシステムにより定量され得る。
【0024】
DNA又はRNAプローブの放射性核種標識が実際的でない場合、ランダムプライマー法を使用して、アナログ、例えば、dTTPアナログ5−(N−(N−ビオチニル−イプシロン−アミノカプロイル)−3−アミノアリル)デオキシウリジン三リン酸塩をプローブ分子へと組み込み得る。ビオチン化プローブオリゴヌクレオチドは、蛍光色素又は呈色反応を起こす酵素に結合されたビオチン結合タンパク質(例えばアビジン、ストレプトアビジン、及び抗体(例えば、抗ビオチン抗体)など)との反応により検出され得る。
【0025】
ノーザン及び他のRNAブロッティングハイブリダイゼーション技術のほか、RNA転写産物のレベルの決定は、in situハイブリダイゼーションを使用して達成され得る。この技術は、ノーザンブロッティング技術よりも少ない細胞を必要とし、顕微鏡カバーガラス上に全細胞を沈着させること、及び放射性又は別の方法で標識された核酸(例えば、cDNA又はRNA)プローブを含む溶液で細胞の核酸含量を調べることを含む。この技術は、対象からの組織生検試料を分析するために特に適切である。in situハイブリダイゼーション技術の実際は、米国特許第5,427,916号により詳細に記載されており、その開示全体が参照により本明細書中に組み込まれる。
【0026】
RNA転写産物レベルは、アレイ(例えば、マイクロアレイ又は遺伝子チップ(異なる既知の位置において基材の表面に結合された複数の核酸プローブを含む))を使用して決定され得る。アレイは、ZFP36L2mRNA転写産物に結合し定量することのできる、1以上の基材に結合されたプローブを含む。マイクロアレイは、例えば、米国特許第5,143,854号、第5,242,974号、第5,252,743号、第5,324,633号、第5,384,261号、第5,424,186号、第5,445,934号、第5,451,683号、第5,482,867号、第5,491,074号、第5,527,681号、第5,550,215号、第5,571,639号、第5,578,832号、第5,593,839号、第5,599,695号、第5,624,711号、第5,631,734号、第5,677,195号、第5,744,305号、第5,795,716号、第5,800,992号、第5,831,070号、第5,837,832号、第5,856,101号、第5,858,659号、第5,936,324号、第5,968,740号、第5,974,164号、第5,981,185号、第5,981,956号、第6,025,601号、第6,033,860号、第6,040,193号、第6,090,555号、及び第6,410,229号、米国特許出願公開番号20030104411、及びFodor et al., Science, 251: 767-777 (1991)に、当分野において一般的に記載されている。これらの各参考文献は、参照によりその全体が本明細書中に組み込まれる。
【0027】
細胞内のmRNA転写産物の相対数はまた、mRNA転写産物の逆転写と、その後の逆転写された転写産物のポリメラーゼ連鎖反応(RT−PCR)による増幅によって決定され得る。mRNA転写産物のレベルは、内部標準(例えば、同じ試料中に存在する標準遺伝子からのmRNAのレベル)と比較して定量され得る。内部標準としての使用に適した遺伝子としては、例えば、ミオシン又はグリセルアルデヒド−3−リン酸デヒドロゲナーゼ(G3PDH)が挙げられる。定量RT−PCRのための方法及びその変法は、当分野における技術の範囲内である。
【0028】
別の態様において、異常造血の検出方法は、対象におけるZFP36L2遺伝子内の変異を検出する工程を含み、ここでZFP36L2遺伝子内の変異は異常造血又はそれと関連する状態を示す。変異は、ZFP36L2 mRNA又はそのタンパク質産物の適切な機能を妨げる任意の変異であり得、例えば、ZFP36L2遺伝子の転写の減少、ZFP36L2 mRNAの安定性の低下、又は非変異ZFP36L2タンパク質と比較して活性が低下している変異ZFP36L2タンパク質をもたらす変異である。このような変異としては、ZFP36L2mRNAへと未成熟終止コドン(PTC)を導入するものが、説明のために挙げられる。ZFP36L2遺伝子内の変異は、任意の技術により、例えば対象のZFP36L2遺伝子及び既知の「正常」ZFP36L2遺伝子のものの間の差異を検出することなどにより、検出され得る。
【0029】
対象中の造血の検出方法は、任意の目的のために使用され得る。このような使用の非限定的な例としては、造血又はそれと関連する状態のスクリーニング又は診断、このような疾患及び状態の治療の評価及び開発、並びにこのような疾患及び状態の機序及びこのような疾患及び状態のための新たな治療の発見に関する研究が挙げられる。本方法はまた、ホルモン性造血を制御する方法又はそれと関連する状態を治療する方法と併せて使用され得る。このような方法としては、当分野において公知のもの、及び本明細書中に記載される方法が挙げられる。
【0030】
本発明は、造血を調節する化合物のスクリーニング方法も提供する。本方法は、(a)試験化合物をZFP36L2を発現する細胞に投与する工程、及び(b)対照と比較した、ZFP36L2を発現する細胞内のZFP36L2発現における変化を検出する工程を含む。対照と比較した、ZFP36L2を発現する細胞内のZFP36L2発現における変化は、試験化合物が造血を調節し得ることを示す。本方法はまた、異常造血の制御方法又は異常造血と関連する状態の治療方法と併せて使用され得る。このような方法としては、当分野で公知のもの及び本明細書中に記載される方法が挙げられる。
【0031】
ZFP36L2を発現する任意の細胞が使用され得、内因性にZFP36L2を発現する細胞及びZFP36L2を発現するように操作された細胞を含む。適切な細胞種類としては、例えば、造血細胞及び間質細胞、又はZFP36L2を発現するように安定的にトランスフェクトされ得る任意の種類の細胞が挙げられる。
【0032】
ZFP36L2の発現における変化は任意の適切な方法により、例えば、細胞内のZFP36L2転写のレベル、ZFP36L2 mRNAのレベル、又はZFP36L2タンパク質のレベル又は活性における変化を検出することにより検出され得る。さらに、このようなレベルは直接的に検出され得、又は種々のマーカー又はタグを使用して間接的に検出され得る。例として、細胞は、マーカータンパク質をコードする核酸に融合されたZFP36L2をコードする核酸を含む核酸コンストラクトを含み得、ここでZFP36L2の発現における変化は、マーカータンパク質の発現における変化を検出することにより検出される。マーカータンパク質をコードするこのような核酸は、例えば、ZFP36L2 mRNAの3’末端に融合され得、それによりZFP36L2 mRNAレベルへの変化は、マーカータンパク質に基づき検出され得る。あるいは、マーカータンパク質をコードする核酸はZFP36L2遺伝子プロモーターに融合され得、それゆえマーカータンパク質の発現はZFP36L2転写により起こり、ZFP36L2転写レベルへの変化は、マーカータンパク質に基づき検出され得る。適切なマーカータンパク質としては、緑色蛍光タンパク質(GFP)、ルシフェラーゼ、β−ガラクトシダーゼ、及び当分野において公知の他のものが挙げられるが、これらに限定されない。このようなマーカータンパク質を使用するための具体的なプロトコールは当分野において公知であり、それらの一部は本発明の他の態様に関して本明細書中で議論される。
【0033】
対照は、それによりZFP36L2発現を比較し、このような発現における変化を検出するために許容可能な基準を提供する、任意の対照であり得る。例えば、対照は、試験化合物の非存在下における、その細胞(又は同じ種類の細胞)内のZFP36L2発現であり得る。あるいは、対照は、(例えば、所定の細胞種類に関する)あらかじめ確立された基準のZFP36L2発現レベルであり得る。
【0034】
本発明は、いかなる特定のクラス又は種類の試験化合物に関しても限定されない。むしろ、任意の試験化合物が使用され得、RNA、DNA、ペプチド、ペプチド模倣体、抗体及びその断片、並びに有機小分子を含むが、これらに限定されない。
【0035】
いかなる特定の理論により制約されることも望まないが、造血を調節し得る化合物は、ZFP36L2 DNA(例えば、ZFP36L2プロモーター)、ZFP36L2 mRNA、又はZFP36L2タンパク質に結合するものであると信じられている。したがって、造血を調節する化合物のスクリーニング方法は、試験化合物をZFP36L2を発現する細胞に投与する工程の前に、(a)ZFP36L2 mRNA、(b)ZFP36L2タンパク質、又は(c)ZFP36L2プロモーターに結合する試験化合物を選択する工程をさらに含み得る。このような選択は、任意の適切な技術により、例えば基材上に(a)〜(c)の1以上を固定化すること、基材を試験化合物又は試験化合物ライブラリーと接触させること、及び固定化されたDNA、mRNA、又はタンパク質と試験化合物との間の結合を検出することなどにより、実施され得る。あるいは、任意の(a)〜(c)いずれか1以上は、試験化合物ライブラリー(例えば、固定化された試験化合物)をパニング又はスキャンするために使用し得、(a)〜(c)を結合する化合物が選択され得る。このような結合アッセイの具体的なプロトコールは、当分野において公知である。
【0036】
本発明は、本明細書中に記載されるスクリーニング方法により同定される化合物、及びこのような化合物を含む組成物をさらに提供し、それらは、対象においてZFP36L2発現及び造血を調節するために有用である。
【0037】
別の実施形態において、本発明は、対象におけるZFP36L2タンパク質のレベル又は活性を調節することによる、対象における造血の制御方法を提供する。ZFP36L2のレベル又は活性は、対象の造血状態及び求められる結果に基づき、所望のように増加又は減少させ得る。例えば、異常に低い造血に関連する疾患又は状態を有する対象においては、ZFP36L2タンパク質のレベル又は活性を増加させ、それにより造血を増加させることが一般的には望ましい。一方、異常に高い造血に関連する疾患又は状態を有する対象においては、ZFP36L2タンパク質のレベル又は活性を減少させ、それにより造血を減少させることが一般的には望ましい。異常に高い又は低い造血を有する対象において造血を制御することにより、異常な造血状態及びそれと関連する他の状態が治療され得、又はこのような状態の症状が全体において又は一部において緩和され得る。
【0038】
ZFP36L2タンパク質のレベル又は活性は、任意の方法により調節され得る。例えば、ZFP36L2タンパク質のレベル又は活性は、(a)ZFP36L2をコードする核酸の転写を増加又は減少させること、(b)ZFP36L2 mRNAの安定性を増加又は減少させること、(c)細胞のZFP36L2の合成を増加又は減少させること、(d)細胞のZFP36L2タンパク質又はmRNAの分解を増加又は減少させること、及び(e)それらの組み合わせ、により増加又は減少させ得る。あるいは、又は組み合わせて、例えばZFP36L2をコードする外因性核酸を対象、又は対象の細胞内に導入することにより、外因性ZFP36L2タンパク質を対象に投与し、ZFP36L2タンパク質レベルを増加させ得る。最後に、ZFP36L2又は造血を調節する他の化合物(例えば、本明細書中に記載されるこのような化合物のスクリーニング方法により同定される化合物など)が、造血を制御するために対象に投与され得る。
【0039】
遺伝子発現並びにmRNA安定性及び翻訳を変える方法は、当業者に周知であり、アンチセンス、マイクロRNA、siRNA、ネイキッド核酸、及び発現系の使用が挙げられる。
【0040】
転写から翻訳後修飾までの、遺伝子発現の任意の段階が調節され得る。例えば、所定の遺伝子の発現は、単離した二本鎖RNA(「dsRNA」)分子(遺伝子産物の少なくとも一部と、少なくとも90%、例えば95%、98%、99%又は100%の配列相同性を有する)を用いて、その遺伝子のRNA干渉を誘導することにより阻害され得る。好ましい実施形態において、dsRNA分子は「短い又は小さい干渉RNA」又は「siRNA」である。
【0041】
本発明において有用なsiRNAは、約17ヌクレオチドから約29ヌクレオチドの長さの、好ましくは約19から約25ヌクレオチドの長さの短い二本鎖RNAを含む。siRNAは、標準的なワトソン・クリック塩基対合相互作用により一緒にアニールされた(以下「塩基対合された」)、センスRNA鎖及び相補的なアンチセンスRNA鎖を含む。センス鎖は、標的遺伝子産物内に含まれる核酸配列に実質的に同一の核酸配列を含む。
【0042】
本明細書において使用される場合、siRNAは、標的核酸配列(nucleic sequence)内に含まれる標的配列に「実質的に同一」であり、標的配列と同一の、又は標的配列から1又は2ヌクレオチド異なる核酸配列である。siRNAのセンス及びアンチセンス鎖は、2つの相補的な一本鎖RNA分子を含み得、又は、2つの相補的な部分が塩基対合され、一本鎖「ヘアピン」領域により共有結合されている単一分子を含み得る。
【0043】
siRNAはまた、1以上のヌクレオチドの付加、欠失、置換及び/又は改変により、天然に存在するRNAとは異なる改変されたRNAであり得る。このような改変としては、siRNAの末端への若しくはsiRNAの1以上の内部ヌクレオチドなどへの非ヌクレオチド物質の付加、又はsiRNAをヌクレアーゼ消化に抵抗性にする修飾、又はデオキシリボヌクレオチドを有するsiRNAにおける1以上のヌクレオチドの置換が挙げられ得る。ZFP36L2を対象にする化学的に修飾されたsiRNAは、例えば、Applied Biosystems(フォスターシティー、CA)からのSILENCER siRNA及び、インビトロジェン(カールスバッド、カリフォルニア)からのSTEALTH siRNAとして、商業的に入手可能である。
【0044】
siRNAの一方又は両方の鎖は、3’突出(3’オーバーハング)も含み得る。本明細書において使用される場合、「3’突出」は、二本鎖RNA鎖の3’末端から伸びる少なくとも1の不対ヌクレオチドを言う。したがって、一実施形態において、siRNAは、1から約6ヌクレオチド(リボヌクレオチド又はデオキシリボヌクレオチドを含む)の長さの、好ましくは1から約5ヌクレオチドの長さの、より好ましくは1から約4ヌクレオチドの長さの、及び特に好ましくは約2から約4ヌクレオチドの長さの、少なくとも1の3’突出を含む。好ましい実施形態において、3’突出は、siRNAの両方の鎖に存在し、2ヌクレオチドの長さである。例えば、siRNAの各鎖は、ジチミジル酸(「TT」)又はジウリジル酸(「uu」)の3’突出を含み得る。
【0045】
siRNAは、化学的に又は生物学的に製造され得、又は単離した遺伝子産物について上記するように、組換えプラスミド又はウイルスベクターから発現され得る。dsRNA又はsiRNA分子を製造及び試験するための典型的な方法は、米国公開特許出願番号2002/0173478及び米国特許第7,148,342号に記載されており、それらの開示全体は参照により本明細書中に組み込まれる。
【0046】
所定の遺伝子の発現はまた、アンチセンス核酸により阻害され得る。本明細書において使用される場合、「アンチセンス核酸」は、RNA−RNA又はRNA−DNA又はRNA−ペプチド核酸相互作用によって標的RNAに結合する核酸分子を言い、それは標的RNAの活性を変える。本方法における使用に適したアンチセンス核酸は、遺伝子産物中の連続的な核酸配列に相補的な核酸配列を一般的には含む一本鎖核酸(例えば、RNA、DNA、RNA−DNAキメラ、PNA)である。好ましくは、アンチセンス核酸は、遺伝子産物中の連続的な核酸配列に、50〜100%相補的、より好ましくは75〜100%相補的、及び最も好ましくは95〜100%相補的な核酸配列を含む。
【0047】
アンチセンス核酸はまた、核酸主鎖への又は糖及び塩基部分(又はそれらと同等のもの)への修飾を含み、標的特異性、ヌクレアーゼ抵抗性、送達又は分子の効果に関する他の特性を促進し得る。このような修飾としては、コレステロール部分、アクリジンなどの二本鎖挿入剤又は1以上のヌクレアーゼ抵抗性基の包含が挙げられる。
【0048】
アンチセンス核酸は、化学的に又は生物学的に製造され得、又は単離した遺伝子産物について上記するように、組換えプラスミド又はウイルスベクターから発現され得る。製造及び試験のための典型的な方法は、当分野における技術の範囲内である;例えば、Stein, Science, 261:1004 (1993)及びWoolfらへの米国特許第5,849,902号を参照のこと(それらの開示全体が参照により本明細書中に組み込まれる)。
【0049】
所定の遺伝子の発現はまた、酵素的核酸により阻害され得る。本明細書において使用される場合、「酵素的核酸」は、遺伝子産物の連続的な核酸配列に対する相補性を有する基質結合領域を含む核酸であって、遺伝子産物を特異的に切断することができる核酸をいう。好ましくは、酵素的核酸基質結合領域は、遺伝子産物中の連続的な核酸配列に、50〜100%相補的、より好ましくは75〜100%相補的、及び最も好ましくは95〜100%相補的である。酵素的核酸は、塩基、糖、及び/又はリン酸基における修飾も含む。本方法における使用のための典型的な酵素的核酸は、リボザイムである。
【0050】
酵素的核酸は、化学的に又は生物学的に製造され得、又は単離した遺伝子産物について上記するように、組換えプラスミド又はウイルスベクターから発現され得る。dsRNA又はsiRNA分子の製造及び試験のための典型的な方法は、Werner, Nucl. Acids Res., 23:2092-96 (1995);Hammann, Antisense and Nucleic Acid Drug Dev., 9:25-31 (1999);及び米国特許第4,987,071号に記載されており、それらの開示全体が参照により本明細書中に組み込まれる。
【0051】
遺伝子発現はまた、遺伝子産物の発現を促進又は抑制する発現系を対象に投与することにより影響され得る。発現系は、遺伝子、プロモーター、エンハンサー、リプレッサー、その他を含み得、このような技術は当分野において周知である。好ましくは、対象の細胞は、少なくとも1の遺伝子産物(例えば、ZFP36L2タンパク質)をコードする配列又は遺伝子発現阻害組成物を含む、プラスミド又はウイルスベクターでトランスフェクトされる。
【0052】
真核細胞のトランスフェクション法は、当分野において周知であり、例えば、細胞の核又は前核への核酸の直接注射;エレクトロポーレーション;リポソーム導入又は親油性物質を介した導入;受容体媒介核酸送達;バイオバリスティック又は粒子加速;リン酸カルシウム沈殿、及びウイルスベクターを介したトランスフェクションが挙げられる。
【0053】
例えば、細胞は、リポソーム導入組成物、例えば、DOTAP(N−[1−(2,3−ジオレオイルオキシ)プロピル]−N,N,N−トリメチル−アンモニウムメチルサルフェート、Boehringer−Mannheim)又は、同等のもの(例えばLIPOFECTINなど)でトランスフェクトされ得る。使用される核酸の量は、本発明の実施に決定的ではない;許容可能な結果は、0.1〜100μgの核酸/105細胞で達成され得る。例えば、105細胞当たり、3μgのDOTAP中の約0.5μgのプラスミドベクターの割合が使用され得る。
【0054】
また、本発明のスクリーニング方法により同定される化合物は、ZFP36L2発現又は造血を調節するために効果的な量で、対象に投与され得る。当業者は、対象の大きさ及び重さ;疾患の侵入の度合い;対象の年齢、健康及び性別;投与経路;及び投与が局所であるか全身であるかなどの要因を考慮して、所定の対象に投与されるべき刺激又は阻害組成物の効果的な量を容易に決定し得る。
【0055】
当業者はまた、組成物を投与するための適切な投薬レジメンを容易に決定し得る。例えば、組成物は、対象に1回(例えば、単一の注射又はデポジション(deposition)として)投与され得る。あるいは、組成物は、約3から約1ヶ月の期間、対象に毎日1回又は2回投与され得る。特定の場合においては、対象は、長期的に、すなわち、数週間、数ヶ月間、数年、又は無期限に、組成物を取ることを要求され得る。投薬レジメンが複数回投与を含む場合、対象に投与される組成物の効果的な量は、投薬レジメン全体にわたって投与される組成物の総量を含み得ることが理解される。
【0056】
組成物はまた、任意の適切な経腸又は非経口投与経路により対象に投与され得る。本方法に適した経腸投与経路としては、例えば、経口、直腸、又は経鼻送達が挙げられる。適切な非経口投与経路としては、例えば、血管内投与(例えば、静脈内ボーラス注射、静脈内点滴、動脈内ボーラス注射、動脈内点滴、及び血管系へのカテーテル点滴);組織周辺及び組織内注射;皮下注射又はデポジション((浸透圧ポンプなどによる)皮下点滴を含む);例えばカテーテル又は他の配置装置(例えば、レチナールペレット(retinal pellet)又は坐薬又は、多孔性の、非多孔性の、若しくはゼラチン状の物質を含む植込錠)による目的の組織への直接的な施用;及び吸入が挙げられる。
【0057】
本方法において、組成物は、送達試薬と組み合わせてネイキッドRNAとして、又は遺伝子産物を発現する配列若しくは発現阻害組成物を含む核酸(例えば、組換えプラスミド又はウイルスベクター)として、対象に投与され得る。適切な送達試薬としては、例えば、Mirus Transit TKO親油性試薬;リポフェクチン;リポフェクタミン;セルフェクチン;ポリカチオン(例えばポリリジン)、及びリポソームが挙げられる。
【0058】
遺伝子発現阻害組成物を発現する配列を含む組換えプラスミド及びウイルスベクター、並びにこのようなプラスミド及びベクターを癌細胞に送達する技術は、上記で議論される。
【0059】
好ましい実施形態においては、リポソームを使用して、遺伝子発現阻害組成物(又はそれらをコードする配列を含む核酸)を対象に送達する。リポソームはまた、遺伝子産物又は核酸の血中半減期を増加させ得る。
【0060】
本発明における使用に適したリポソームは、標準的なベシクル形成脂質から形成され得、一般的には中性の又は負に荷電したリン脂質及びステロール(例えばコレステロールなど)を含む。脂質の選択は、一般的には、所望のリポソームの大きさ及び血流中のリポソームの半減期などの要因を考慮することにより、導かれる。例えば、Szoka, Ann. Rev. Biophys. Bioeng., 9:467 (1980);並びに米国特許第4,235,871号、第4,501,728号、第4,837,028号、及び第5,019,369号に記載されるように、リポソームを調製するための種々の方法が公知である(それらの開示全体が参照により本明細書中に組み込まれる)。
【0061】
本方法における使用のためのリポソームは、リポソームを癌細胞に標的化するリガンド分子を含み得る。癌細胞において一般的な受容体に結合するリガンド(例えば腫瘍細胞抗原に結合するモノクローナル抗体など)が好ましい。
【0062】
本発明の組成物は、医薬上許容可能な担体を含み得る。本明細書において使用される用語「医薬上許容可能な担体」は、ヒト若しくは獣医の患者への投与に適した、1以上の適合性の固体又は液体の増量剤、希釈剤、他の賦形剤、又は封入物質を意味する。用語「担体」は、施用を容易にするために活性成分が合わせられる、天然の又は合成の、有機又は無機成分を意味する。医薬組成物の構成成分はまた、所望の医薬効果を実質的に損なわないような様式で、本発明の分子と、及び互いに、混合されることが可能である。「医薬上許容可能な」物質は、吐き気、めまい、発疹、又は胃の不調などの望ましくない生理学的効果を生じさせることなく、患者への投与が可能である。例えば、治療目的でヒト患者に投与される場合、医薬上許容可能な賦形剤を含む治療組成物が、免疫原性でないことが望ましい。
【0063】
医薬組成物は、適切な緩衝剤を含み得、塩の状態の酢酸;塩の状態のクエン酸;塩の状態のホウ酸;及び塩の状態のリン酸が挙げられる。医薬組成物はまた、塩化ベンザルコニウム、クロロブタノール、パラベン類、及びチメロサールなどの、適切な保存剤を随意に含み得る。
【0064】
医薬組成物は、便宜上、単位用量形態で提供され得、薬学の分野において周知の任意の方法により調製され得る。全ての方法は、活性薬剤を、1以上の補助成分を構成する担体と合わせる工程を含む。一般的には、組成物は、活性組成物を液体担体、細かく分けられた固体担体、又は両方と、均一に且つ完全に合わせ、次いで、必要であれば、製品を成形することにより調製される。
【0065】
非経口投与に適した組成物は、便宜上、好ましくは受容者の血液と等張である本発明の組成物の無菌水性調製物を含む。この水性調製物は、適切な分散剤又は湿潤剤及び懸濁剤を使用する公知の方法に従って製剤化され得る。無菌の注射可能な調製物も、無毒の非経口的に許容可能な希釈剤又は溶媒中の無菌の注射可能な溶液又は懸濁液であり得る(例えば1,3−ブタンジオール中の溶液として)。使用され得る許容可能なビヒクル及び溶媒の中には、水、リンガー溶液、及び等張塩化ナトリウム溶液がある。また、無菌の固定油が、便宜上、溶媒又は懸濁媒体として使用される。この目的のために、合成モノ又はジグリセリドを含む、任意の無菌性の固定油が使用され得る。また、オレイン酸などの脂肪酸が、注射剤の調製において使用され得る。経口、皮下、静脈内、筋肉内、その他の投与に適した担体製剤は、Remington's Pharmaceutical Sciences、Mack Publishing Co.、イーストン、PA(参照によりその全体が本明細書中に組み込まれる)に見出され得る。
【0066】
本発明の送達システムは、本発明の組成物の送達が、治療されるべき部位の感作の前に、該感作を引き起こすのに十分な時間起こるような、徐放性、遅延放出性又は持続放出性の送達システムを含むよう設計される。本発明の組成物は、他の治療剤又は治療と共に使用され得る。このようなシステムは、本発明の組成物の反復投与を回避し得、対象及び医者の利便性を向上させ、本発明の特定の組成物に特に適切であり得る。
【0067】
多くの種類の放出送達システムが利用可能であり、当業者に公知である。それらとしては、ポリ(ラクチド−グリコリド)、コポリシュウ酸塩(copolyoxalates)、ポリカプロラクトン、ポリエステルアミド、ポリオルトエステル、ポリヒドロキシ酪酸、及びポリ酸無水物などのポリマーベースシステムが挙げられる。ドラッグ(drags)を含む前記ポリマーのマイクロカプセルは、例えば、米国特許第5,075,109号に記載されている。送達システムとしては、以下の非ポリマーシステムも挙げられる:コレステロール、コレステロールエステルなどのステロール及び脂肪酸を含む脂質、又はモノ−ジ−及びトリ−グリセリドなどの中性脂肪;ヒドロゲル放出システム;シラスティック(sylastic)システム;ペプチドベースのシステム;ワックス被覆剤;常套的な結合剤及び賦形剤を使用する圧縮錠剤;部分的に融合した注入剤;など。具体的な例としては、(a)活性組成物が、米国特許第4,452,775号、第4,667,014号、第4,748,034号及び第5,239,660号に記載のものなどのマトリクス内の形態で含まれる浸食システム、及び(b)活性成分が、米国特許第3,832,253号及び第3,854,480号に記載されるようなポリマーから制御された速度で浸透する拡散システムが挙げられるが、これらに限定されない。また、ポンプに基づく機器送達システムが使用され得、それらの一部は注入に採用される。
【0068】
以下の実施例はさらに本発明を説明するが、当然ながら、その範囲を限定するものとは決して解釈されるべきではない。
【実施例1】
【0069】
この実施例は、ZFP36L2が造血を制御することを実証する。
【0070】
ZFP36L2タンパク質の血球数への影響を、ZFP36L2ノックアウトマウスの全血球数(CBC)及び白血球数(WBC)を野生型マウスのものと比較することにより分析した。末梢血を、2週齢ZFP36L2野生型マウス(全6個体)及びZFP36L2ノックアウトマウス(ヘテロ接合性の7個体、及び完全ノックアウト6個体)から採取し、血液をHemavet 950 hematology analyzer(Drew Scientific、ダラス、TX)を使用して分析した。結果を図1及び2に示し、ここで結果を平均値±S.E.M.として示す。平均値はスチューデントt検定により比較した。
【0071】
結果は、ZFP36L2ノックアウトマウスは、野生型又はヘテロ接合性のマウスのいずれよりも有意に低い血球数を有することを示し、ZFP36L2発現が造血を制御することを示す。
【実施例2】
【0072】
この実施例は、ZFP36L2が造血を制御することをさらに実証する。
【0073】
ZFP36L2タンパク質の造血前駆細胞への影響を、野生型、部分的ZFP36L2ノックアウト、及び完全ZFP36L2ノックアウトマウスの胎仔肝臓における、造血前駆細胞数を比較することにより分析した。胎生14.5日における胎仔肝臓(E14.5;図3)、胎生11.5日における卵黄嚢(E11.5;図4)及び胎生11.5日におけるAGM(大動脈・性腺・中腎)領域(図5)について分析を実施した。表示した組織からの細胞を、30%ウシ胎仔血清、0.1mMヘミン、1U/ml組換えヒトエリスロポイエチン、5%vol/volヤマゴボウマイトジェンマウス脾臓細胞馴化培地、及び50ng/ml幹細胞因子を含む、1%メチルセルロース培養培地において培養した。低(5%)O2、5%CO2における7日のインキュベーションの後、コロニーを記録した。器官当たりの前駆細胞の絶対数の計算は、それぞれ個別に評価した胚について、顆粒球、赤血球、単球、巨核球コロニー形成単位(CFU−GEMM)、赤芽球バースト形成単位(BFU−E)、及び顆粒球、マクロファージコロニー形成単位(CFU−GM)についての有核細胞質及びコロニー数に基づいた。結果(図3〜5に示す)は、8野生型、9ヘテロ接合性及び7ノックアウト胚(胎仔肝臓)、5野生型、10へテロ接合性及び5ノックアウト胚(卵黄嚢)、並びに5野生型、13へテロ接合性及び6ノックアウト胚(AGM領域)からの平均値±S.E.M.として表した。平均値はスチューデントt検定により比較した。
【0074】
結果は、ZFP36L2完全ノックアウトマウスが、野生型又はヘテロ接合性マウスのいずれよりも有意に少ない造血前駆細胞を有し、ヘテロ接合性マウスが、ほとんどのカテゴリーにおいて野生型マウスよりも有意に少ない造血前駆細胞を有することを示す。これらの結果は、ZFP36L2が造血を制御することを示す。
【実施例3】
【0075】
この実施例は、ZFP36L2発現が造血を制御することをさらに実証する。
【0076】
ZFP36L2タンパク質の胎仔肝細胞の競合的再増殖への影響を、野生型マウスからの胎仔肝細胞のこのような再増殖を、ZFP36L2ノックアウトマウスからの胎仔肝細胞の再増殖と比較することにより分析した。致死的に照射したマウスを、野生型又はノックアウト胚のいずれかから単離したE14.5胎仔肝細胞で再構成した。5,000の変異細胞を、500,000の競合細胞(遺伝的に異なるマウス株由来)と混合し、照射した受容マウスに注射した。ドナー由来細胞の再構成(移植率)を、注射後1及び2ヶ月において、株特異的マーカーによる血球細胞の染色により観察した。結果を図6に示す。
【0077】
結果は、ZFP36L2ノックアウトマウスの胎仔肝臓から単離した細胞が、野生型マウスの胎仔肝臓から単離した細胞よりも有意に低いレベルで再増殖したことを示す。これらの結果は、ZFP36L2が造血を制御することを示す。
【0078】
本明細書中に引用される全ての参考文献(刊行物、特許出願、及び特許を含む)は、各参考文献が参照により組み込まれることが個々に且つ具体的に示され、その全体が本明細書中で説明されたのと同程度まで、参照により本明細書に組み込まれる。
【0079】
本発明(特に添付の特許請求の範囲に関して)を記載することに関して、用語「a」及び「an」及び「the」並びに同様の指示対象の使用は、本明細書中に別途示されない限り、又は文脈により明らかに矛盾しない限り、単数及び複数の両方を含むと解釈されるべきである。用語「含む(comprising)」、「有する(having)」、「含む(including)」、及び「含む(containing)」は、別途言及されない限り、オープンエンドの用語(すなわち、「含むが、それに限定されない」を意味する)と解釈されるべきである。本明細書中の値の範囲の列挙は、本明細書中に別途示されない限り、この範囲内に入る各個別の値に個々に言及することの省略方法として機能することを意図するに過ぎず、各個別の値は、それが本明細書中に個々に列挙されたかのように、本明細書中に組み込まれる。本明細書中に記載される全ての方法は、本明細書中に別途示されない限り、又はさもなくば文脈により明らかに矛盾しない限り、任意の適切な順序で実施され得る。本明細書中に提供されるあらゆる全ての例、又は例示的語句(例えば、「など(such as)」)の使用は、本発明をより明確にすることを意図するに過ぎず、別途主張されない限り、本発明の範囲を限定しない。本明細書中のいかなる語句も、主張されていない任意の要素を本発明の実施に必須なものとして示していると解釈されるべきではない。
【0080】
本発明を実施するための本発明者らが知る最良の形態を含む本発明の好ましい実施形態が本明細書中に記載されている。それらの好ましい実施形態のバリエーションは、前述の記載を読めば、当業者に明らかになり得る。本発明者らは、当業者が必要に応じてこのようなバリエーションを使用することを予期し、また本発明者らは、本明細書中に具体的に記載されたもの以外の方法で、本発明が実施されることを意図する。したがって、本発明は、適用法により許容されるように、本明細書に添付された特許請求の範囲に列挙された対象の全ての改変物及び均等物を含む。さらに、上記要素の全ての可能なバリエーションの中で、上記要素の任意の組み合わせが、本明細書中に別途示されない限り、又はさもなくば文脈により明らかに矛盾しない限り、本発明により包含される。
【背景技術】
【0001】
発明の背景
【0002】
造血疾患は、不十分な又は過度の血球産生が存在する状態を含む。このような疾患には多くの原因があり得、しばしば他の一次的疾患に対する二次的状態である。造血疾患及び関連する状態の治療方法は存在するが、このような方法の一部は副作用及び健康リスクと関連付けられている。したがって、造血疾患及びそれと関連する状態を治療し、検出し、モニタリングし、又は制御するために有用な、さらなる方法及び化合物に対する要望が依然として存在する。
【発明の概要】
【0003】
本発明は、対象における異常造血又はそれと関連する状態の検出方法を提供する。本発明の一態様によれば、本方法は、対象におけるジンクフィンガータンパク質36 C3H型様2(Zinc Finger Protein 36 C3H type-like 2)(ZFP36L2)の異常発現を検出する工程を含み、ここで対象における異常なZFP36L2発現は異常造血又はそれと関連する状態を示す。本発明の別の態様によれば、本方法は、対象におけるZFP36L2遺伝子内の変異を検出する工程を含み、ここで対象におけるZFP36L2遺伝子内の変異は異常造血又はそれと関連する状態を示す。
【0004】
本発明は、造血を調節する化合物のスクリーニング方法であって、(a)試験化合物をZFP36L2を発現する細胞に投与する工程、及び(b)試験化合物の存在下、対照と比較して該細胞におけるZFP36L2発現の変化を検出する工程を含み、ここで該細胞におけるZFP36L2発現の変化は、試験化合物が造血を調節し得ることを示す、スクリーニング方法も提供する。
【0005】
本発明はさらに、対象におけるZFP36L2タンパク質のレベル又は活性を調節する工程を含む、対象における造血の制御方法を提供する。
【図面の簡単な説明】
【0006】
【図1】図1は、対照(+/+)、部分的ZFP36L2ノックアウト(+/−)、及び完全ZFP36L2ノックアウト(−/−)マウスにおける、白血球(WBC)、赤血球(RBC)、スパンヘマトクリット(spun hematocrit)(スパンHCT)(パーセンテージとして表される)、及び血小板の数のグラフである。
【図2】図2は、対照(+/+)、部分的ZFP36L2ノックアウト(+/−)、及び完全ZFP36L2ノックアウト(−/−)マウスにおける、白血球(WBC)、好中球、リンパ球、単球、及び好酸球の数のグラフである。
【図3】図3は、対照(+/+)、部分的ZFP36L2ノックアウト(+/−)、及び完全ZFP36L2ノックアウト(−/−)マウスにおける、胎生14.5日の胎仔肝臓中の造血前駆細胞の数のグラフである。
【図4】図4は、対照(+/+)、部分的ZFP36L2ノックアウト(+/−)、及び完全ZFP36L2ノックアウト(−/−)マウスにおける、胎生11.5日の卵黄嚢中の造血前駆細胞の数のグラフである。
【図5】図5は、対照(+/+)、部分的ZFP36L2ノックアウト(+/−)、及び完全ZFP36L2ノックアウト(−/−)マウスにおける、胎生11.5日の大動脈・性腺・中腎(AGM)領域中の造血前駆細胞の数のグラフである。
【図6】図6は、正常マウス(+/+)及び完全ZFP36L2ノックアウトマウス(−/−)における、移植後1及び2ヶ月の再増殖胎仔肝細胞の移植率のグラフである。
【発明を実施するための形態】
【0007】
発明の詳細な説明
【0008】
ジンクフィンガータンパク質36様タイプ−2(Zinc finger protein 36 like type-2)(ZFP36L2、またBRF2、ERF2、ERF−2、TIS11D、及びRNF162Cとしても知られる)は、3つのシステイン及びそれに続く1つのヒスチジン(CCCH)により特徴付けられる、タンデムの亜鉛結合モチーフを含む、ジンクフィンガータンパク質のファミリーに属する。ジンクフィンガーを介して、これらのタンパク質は、クラスII AUリッチエレメントを含むmRNAに、一般的にはそれらの3’非翻訳領域において結合し得、その後標的mRNAの分解が起こる。いかなる特定の理論にも制約されることを望まないが、ZFP36L2が造血に関わる1以上のタンパク質をコードするmRNA種と相互作用すること、及びそれによるZFP36L2の発現の増加又は減少が造血を調節することが信じられている。ZFP36L2タンパク質をコードするヒトゲノム配列は、およそ、第二染色体の22271678−22264639の位置、NT_22184.14遺伝子座に位置する。ZFP36L2タンパク質及びmRNA配列は、それぞれRefSeqアクセション番号NP_008818(タンパク質)及びNM_006887(mRNA)と関連付けられる。他種の対応する配列は当分野において公知である。
【0009】
一実施形態において、本発明は、対象における異常なZFP36L2発現を検出することによる、対象における異常造血、又はそれと関連する状態の検出方法を提供し、ここで対象における異常なZFP36L2発現は異常造血又はそれと関連する状態を示す。より具体的には、異常に高いZFP36L2発現は異常に高い造血又はそれと関連する状態を示し、異常に低いZFP36L2は異常に低い造血又はそれと関連する状態を示す。
【0010】
対象は、典型的には哺乳動物などの動物、好ましくはヒトであり、その場合異常なZFP36L2発現は、対象からの適切な試料(例えば体液(例えば、血液)又は組織試料など)において検出され得る。しかし、対象は、研究の関連の中で有用であり得るように、単離された細胞(例えば、細胞培養物)でもあり得る。例えば、細胞は造血若しくは間質細胞、又はZFP36L2を通常発現する種類の別の細胞であり得る。適切な細胞としては、ZFP36L2を発現するように、又は変異ZFP36L2を含むように操作された細胞も挙げられる。
【0011】
所定の対象における異常造血は、所定の種類の対象において「正常」とみなされる造血レベルよりも、一般的には臨床的に有意な程度まで高い又は低い造血レベルを包含する。対象における正常及び異常造血レベルについてのガイダンスは、当業者によって確かめられ得る。ヒト対象に関しては、このような情報は、例えばthe Physicians' Desk Reference, 61st ed. Montvale, NJ (2007)を参照することにより入手可能である。
【0012】
異常に高い造血と関連する状態としては、多血症、白血病を含む癌若しくは腫瘍、又はそれらの組み合わせが挙げられるが、それらに限定されない。異常に低い造血と関連する状態としては、貧血、血小板減少症、骨髄異形成症候群、又はそれらの組み合わせが挙げられるが、それらに限定されない。さらに、前述の状態のいずれも、一次的状態であり得、又は他の状態(例えば癌、癌化学治療、感染症、透析、その他など)に対して二次的であり得る。異常造血と関連する状態としては、本発明の目的のためには、異常造血又はそれに関連する任意の状態を発症する素因も挙げられる。造血は、典型的には骨髄細胞系列のものである。
【0013】
対象におけるZFP36L2の異常発現は、同じ種類の正常な、罹患していない対象におけるZFP36L2発現よりも高い又は低いZFP36L2発現を意味する。一般的には、所定の対象におけるZFP36L2の異常発現は、正常な、罹患していない対象のものよりも有意に高く又は低く、それゆえそれは生理的な又は表現型上の影響を引き起こす。
【0014】
異常なZFP36L2発現は任意の方法によって検出され得る。一般的には、異常なZFP36L2発現は、対象におけるZFP36L2発現レベルを対照と比較することにより検出される。対照は、例えば、同じ種類の正常な、罹患していない対象におけるZFP36L2発現レベル、又はこのような対象におけるZFP36L2の正常な発現レベルを表すあらかじめ確立された基準であり得る。
【0015】
ZFP36L2発現は、任意の基準に基づき検出及び比較され得る。例えば、異常なZFP36L2発現は、ZFP36L2タンパク質のレベル又は活性の基準に基づき検出され得る。タンパク質のレベル又は活性を検出、定量、及び/又は比較するための任意の技術が使用され得、タンパク質免疫染色、免疫沈降、ウェスタンブロット、スペクトロスコピー、酵素アッセイ、クロマトグラフィー、ブラッドフォードタンパク質アッセイ、及びゲル電気泳動技術が挙げられるが、これらに限定されない。
【0016】
免疫染色は、試料中の特定のタンパク質を検出するための、抗体に基づく方法の任意の使用に適用される、生化学における一般用語である。細胞又は組織切片の免疫組織化学又はIHC染色は、おそらく最も一般的に適用される免疫染色技術である。IHC染色の最初のケースでは、蛍光色素を使用した(免疫蛍光を参照のこと)のに対し、ペルオキシダーゼ(免疫ペルオキシダーゼ染色を参照のこと)及びアルカリホスファターゼなどの酵素を使用する他の非蛍光法が現在使用される。これらの酵素は、光学顕微鏡により容易に検出可能な着色生成物を与える反応を触媒することができる。あるいは、放射性元素が標識として使用され得、免疫反応はオートラジオグラフィーにより可視化され得る。
【0017】
免疫沈降(IP)は、抗原を、その抗原に特異的な抗体を使用して、溶液から沈殿させる技術である。この過程は、所定のタンパク質をある程度の純度まで濃縮するために使用され得る。免疫共沈降(「プルダウン」としても知られる)は、細胞抽出物中に存在する、相互作用するタンパク質又はタンパク質複合体を同定し得る:複合体中に存在するとみられる1タンパク質を沈殿させることにより、複合体の更なるメンバーが同様に捕捉され、同定され得る。タンパク質複合体は、特異的抗体に結合すると、アガロースビーズなどの固体支持体に結合した抗体結合タンパク質による捕捉により、バルク溶液から除去される。洗浄後、沈殿したタンパク質は溶出され、ゲル電気泳動、質量分析、ウェスタンブロッティング、又は複合体中の構成因子を同定するための、任意の数の他の方法を使用して分析される。
【0018】
ブラッドフォードアッセイ(比色タンパク質アッセイ)は、タンパク質中に存在するアルギニン及び疎水性アミノ酸残基に結合するときの色素クマシーにおける吸光度シフトに基づく。(結合)形態の色素は青色であり、歴史的に595nmであると考えられている吸収スペクトル極大を有する。陰イオン性(非結合)形態は緑色及び赤色である。595nmにおける吸光度の増大は、結合色素の量に比例し、したがって、試料中に存在するタンパク質の量(濃度)に比例する。他のタンパク質アッセイとは異なり、ブラッドフォードタンパク質アッセイは、タンパク質試料中に存在し得る種々の化合物による干渉に左右されにくい。
【0019】
ゲル電気泳動も、試料中のタンパク質の検出のために有用である。タンパク質は様々な電荷及び複雑な形状を有し得、したがって、試料に負から正の電磁場をかける場合、それらはゲル内へ同様の速度では(又は全く)移動しないかもしれない。したがってタンパク質は、通常、タンパク質を負電荷で覆う、ドデシル硫酸ナトリウム/ドデシルリン酸ナトリウム(SDS/SDP)などの界面活性剤の存在下で変性される。一般的に、結合するSDSの量は、タンパク質の大きさに関連し(通常タンパク質グラム当たり1.4g SDS)、それゆえ結果として生成する変性タンパク質は、全体として負電荷を有し、全てのタンパク質は同様の電荷質量比を有する。変性タンパク質は、複雑な三次形状を有するものではなく、長い棒のように振る舞うため、結果として生成するSDSで覆われたタンパク質がゲル中を移動する速度は、その大きさにのみ関連し、その電荷又は形状には関連しない。タンパク質は通常、ドデシル硫酸ナトリウムポリアクリルアミドゲル電気泳動(SDS−PAGE)により、ネイティブゲル電気泳動により、定量分取ネイティブ連続的ポリアクリルアミドゲル電気泳動(QPNC−PAGE)により、又は二次元電気泳動により、分析される。
【0020】
ウェスタンブロット(イムノブロットとも呼ばれる)は、組織ホモジネート又は抽出物の所定の試料中の特定のタンパク質を検出する方法である。天然又は変性タンパク質をポリペプチドの長さによって(変性条件)、又はタンパク質の三次元構造によって(天然/非変性条件)分離するために、ゲル電気泳動を使用する。次いでタンパク質は、膜(典型的にはニトロセルロース又はPVDF)に移され、そこでそれらは標的タンパク質に特異的な抗体を使用して調べられる(検出される)。
【0021】
異常なZFP36L2発現はまた、mRNAレベルに基づき検出され得る。細胞中のZFP36L2 mRNAの存在及び発現レベルを決定するための適切な技術は、当分野における技術の範囲内である。例えば、全細胞RNAは核酸抽出緩衝液の存在下でのホモジナイズと、その後の遠心により、試料から精製され得る。核酸は沈殿され、DNAは、デオキシリボヌクレアーゼでの処理及び沈殿を伴う処理により除去される。RNA分子は次いで、標準技術に従い、アガロースゲル上のゲル電気泳動によって分離され、例えばいわゆる「ノーザン」ブロッティング技術により、ニトロセルロースフィルターに移される。RNAは次いで、加熱によりフィルター上に固定される。特定のRNAの検出及び定量は、問題のRNAに相補的な、適切に標識されたDNA又はRNAプローブを使用して達成される。例えば、Molecular Cloning: A Laboratory Manual, J. Sambrook et al., eds., 2nd edition, Cold Spring Harbor Laboratory Press, 1989, Chapter 7を参照のこと(その開示全体が参照により組み込まれる)。
【0022】
標識DNA及びRNAプローブの調製方法、及びそれらの標的ヌクレオチド配列へのハイブリダイゼーションのための条件は、Molecular Cloning: A Laboratory Manual, J. Sambrook et al., eds., 2nd edition, Cold Spring Harbor Laboratory Press, 1989, Chapters 10及び11に記載されており、その開示は参照により本明細書中に組み込まれる。例えば核酸プローブは、例えば、3H、32P、33P、14C、若しくは35Sなどの放射性核種;重金属;又は標識リガンド(例えば、ビオチン、アビジン又は抗体)、蛍光分子、化学発光分子、酵素などに対する特異的結合対メンバーとして機能することができるリガンドで、標識され得る。
【0023】
プローブは、Rigby et al, J. Mol. Biol., 113:237-251(1977)のニックトランスレーション法、又はFienberg, Anal. Biochem., 132:6-13 (1983)のランダムプライミング法のいずれかにより、高比活性に標識され得る(これらの開示全体が参照により本明細書中に組み込まれる)。後者は、RNA鋳型からの高比活性の32P標識プローブを合成するための方法であり得る。例えば、ニックトランスレーション法に従って高放射性ヌクレオチドで既に存在するヌクレオチドを置換することにより、108cpm/μgを十分に上回る比活性を有する32P標識核酸プローブを調製することが可能である。次いで、ハイブリダイゼーションのオートラジオグラフィーによる検出、ハイブリダイズしたフィルターを写真フィルムに露光することにより実施できる。ハイブリダイズしたフィルターにより露光された写真フィルムのデンシトメトリースキャニングは、RNAレベルの正確な測定を提供する。別のアプローチを使用して、RNAレベルは、Molecular Dynamics 400-B 2D Phosphorimager(Amersham Biosciences、ピスカタウェイ、N.J)のようなコンピュータ制御のイメージングシステムにより定量され得る。
【0024】
DNA又はRNAプローブの放射性核種標識が実際的でない場合、ランダムプライマー法を使用して、アナログ、例えば、dTTPアナログ5−(N−(N−ビオチニル−イプシロン−アミノカプロイル)−3−アミノアリル)デオキシウリジン三リン酸塩をプローブ分子へと組み込み得る。ビオチン化プローブオリゴヌクレオチドは、蛍光色素又は呈色反応を起こす酵素に結合されたビオチン結合タンパク質(例えばアビジン、ストレプトアビジン、及び抗体(例えば、抗ビオチン抗体)など)との反応により検出され得る。
【0025】
ノーザン及び他のRNAブロッティングハイブリダイゼーション技術のほか、RNA転写産物のレベルの決定は、in situハイブリダイゼーションを使用して達成され得る。この技術は、ノーザンブロッティング技術よりも少ない細胞を必要とし、顕微鏡カバーガラス上に全細胞を沈着させること、及び放射性又は別の方法で標識された核酸(例えば、cDNA又はRNA)プローブを含む溶液で細胞の核酸含量を調べることを含む。この技術は、対象からの組織生検試料を分析するために特に適切である。in situハイブリダイゼーション技術の実際は、米国特許第5,427,916号により詳細に記載されており、その開示全体が参照により本明細書中に組み込まれる。
【0026】
RNA転写産物レベルは、アレイ(例えば、マイクロアレイ又は遺伝子チップ(異なる既知の位置において基材の表面に結合された複数の核酸プローブを含む))を使用して決定され得る。アレイは、ZFP36L2mRNA転写産物に結合し定量することのできる、1以上の基材に結合されたプローブを含む。マイクロアレイは、例えば、米国特許第5,143,854号、第5,242,974号、第5,252,743号、第5,324,633号、第5,384,261号、第5,424,186号、第5,445,934号、第5,451,683号、第5,482,867号、第5,491,074号、第5,527,681号、第5,550,215号、第5,571,639号、第5,578,832号、第5,593,839号、第5,599,695号、第5,624,711号、第5,631,734号、第5,677,195号、第5,744,305号、第5,795,716号、第5,800,992号、第5,831,070号、第5,837,832号、第5,856,101号、第5,858,659号、第5,936,324号、第5,968,740号、第5,974,164号、第5,981,185号、第5,981,956号、第6,025,601号、第6,033,860号、第6,040,193号、第6,090,555号、及び第6,410,229号、米国特許出願公開番号20030104411、及びFodor et al., Science, 251: 767-777 (1991)に、当分野において一般的に記載されている。これらの各参考文献は、参照によりその全体が本明細書中に組み込まれる。
【0027】
細胞内のmRNA転写産物の相対数はまた、mRNA転写産物の逆転写と、その後の逆転写された転写産物のポリメラーゼ連鎖反応(RT−PCR)による増幅によって決定され得る。mRNA転写産物のレベルは、内部標準(例えば、同じ試料中に存在する標準遺伝子からのmRNAのレベル)と比較して定量され得る。内部標準としての使用に適した遺伝子としては、例えば、ミオシン又はグリセルアルデヒド−3−リン酸デヒドロゲナーゼ(G3PDH)が挙げられる。定量RT−PCRのための方法及びその変法は、当分野における技術の範囲内である。
【0028】
別の態様において、異常造血の検出方法は、対象におけるZFP36L2遺伝子内の変異を検出する工程を含み、ここでZFP36L2遺伝子内の変異は異常造血又はそれと関連する状態を示す。変異は、ZFP36L2 mRNA又はそのタンパク質産物の適切な機能を妨げる任意の変異であり得、例えば、ZFP36L2遺伝子の転写の減少、ZFP36L2 mRNAの安定性の低下、又は非変異ZFP36L2タンパク質と比較して活性が低下している変異ZFP36L2タンパク質をもたらす変異である。このような変異としては、ZFP36L2mRNAへと未成熟終止コドン(PTC)を導入するものが、説明のために挙げられる。ZFP36L2遺伝子内の変異は、任意の技術により、例えば対象のZFP36L2遺伝子及び既知の「正常」ZFP36L2遺伝子のものの間の差異を検出することなどにより、検出され得る。
【0029】
対象中の造血の検出方法は、任意の目的のために使用され得る。このような使用の非限定的な例としては、造血又はそれと関連する状態のスクリーニング又は診断、このような疾患及び状態の治療の評価及び開発、並びにこのような疾患及び状態の機序及びこのような疾患及び状態のための新たな治療の発見に関する研究が挙げられる。本方法はまた、ホルモン性造血を制御する方法又はそれと関連する状態を治療する方法と併せて使用され得る。このような方法としては、当分野において公知のもの、及び本明細書中に記載される方法が挙げられる。
【0030】
本発明は、造血を調節する化合物のスクリーニング方法も提供する。本方法は、(a)試験化合物をZFP36L2を発現する細胞に投与する工程、及び(b)対照と比較した、ZFP36L2を発現する細胞内のZFP36L2発現における変化を検出する工程を含む。対照と比較した、ZFP36L2を発現する細胞内のZFP36L2発現における変化は、試験化合物が造血を調節し得ることを示す。本方法はまた、異常造血の制御方法又は異常造血と関連する状態の治療方法と併せて使用され得る。このような方法としては、当分野で公知のもの及び本明細書中に記載される方法が挙げられる。
【0031】
ZFP36L2を発現する任意の細胞が使用され得、内因性にZFP36L2を発現する細胞及びZFP36L2を発現するように操作された細胞を含む。適切な細胞種類としては、例えば、造血細胞及び間質細胞、又はZFP36L2を発現するように安定的にトランスフェクトされ得る任意の種類の細胞が挙げられる。
【0032】
ZFP36L2の発現における変化は任意の適切な方法により、例えば、細胞内のZFP36L2転写のレベル、ZFP36L2 mRNAのレベル、又はZFP36L2タンパク質のレベル又は活性における変化を検出することにより検出され得る。さらに、このようなレベルは直接的に検出され得、又は種々のマーカー又はタグを使用して間接的に検出され得る。例として、細胞は、マーカータンパク質をコードする核酸に融合されたZFP36L2をコードする核酸を含む核酸コンストラクトを含み得、ここでZFP36L2の発現における変化は、マーカータンパク質の発現における変化を検出することにより検出される。マーカータンパク質をコードするこのような核酸は、例えば、ZFP36L2 mRNAの3’末端に融合され得、それによりZFP36L2 mRNAレベルへの変化は、マーカータンパク質に基づき検出され得る。あるいは、マーカータンパク質をコードする核酸はZFP36L2遺伝子プロモーターに融合され得、それゆえマーカータンパク質の発現はZFP36L2転写により起こり、ZFP36L2転写レベルへの変化は、マーカータンパク質に基づき検出され得る。適切なマーカータンパク質としては、緑色蛍光タンパク質(GFP)、ルシフェラーゼ、β−ガラクトシダーゼ、及び当分野において公知の他のものが挙げられるが、これらに限定されない。このようなマーカータンパク質を使用するための具体的なプロトコールは当分野において公知であり、それらの一部は本発明の他の態様に関して本明細書中で議論される。
【0033】
対照は、それによりZFP36L2発現を比較し、このような発現における変化を検出するために許容可能な基準を提供する、任意の対照であり得る。例えば、対照は、試験化合物の非存在下における、その細胞(又は同じ種類の細胞)内のZFP36L2発現であり得る。あるいは、対照は、(例えば、所定の細胞種類に関する)あらかじめ確立された基準のZFP36L2発現レベルであり得る。
【0034】
本発明は、いかなる特定のクラス又は種類の試験化合物に関しても限定されない。むしろ、任意の試験化合物が使用され得、RNA、DNA、ペプチド、ペプチド模倣体、抗体及びその断片、並びに有機小分子を含むが、これらに限定されない。
【0035】
いかなる特定の理論により制約されることも望まないが、造血を調節し得る化合物は、ZFP36L2 DNA(例えば、ZFP36L2プロモーター)、ZFP36L2 mRNA、又はZFP36L2タンパク質に結合するものであると信じられている。したがって、造血を調節する化合物のスクリーニング方法は、試験化合物をZFP36L2を発現する細胞に投与する工程の前に、(a)ZFP36L2 mRNA、(b)ZFP36L2タンパク質、又は(c)ZFP36L2プロモーターに結合する試験化合物を選択する工程をさらに含み得る。このような選択は、任意の適切な技術により、例えば基材上に(a)〜(c)の1以上を固定化すること、基材を試験化合物又は試験化合物ライブラリーと接触させること、及び固定化されたDNA、mRNA、又はタンパク質と試験化合物との間の結合を検出することなどにより、実施され得る。あるいは、任意の(a)〜(c)いずれか1以上は、試験化合物ライブラリー(例えば、固定化された試験化合物)をパニング又はスキャンするために使用し得、(a)〜(c)を結合する化合物が選択され得る。このような結合アッセイの具体的なプロトコールは、当分野において公知である。
【0036】
本発明は、本明細書中に記載されるスクリーニング方法により同定される化合物、及びこのような化合物を含む組成物をさらに提供し、それらは、対象においてZFP36L2発現及び造血を調節するために有用である。
【0037】
別の実施形態において、本発明は、対象におけるZFP36L2タンパク質のレベル又は活性を調節することによる、対象における造血の制御方法を提供する。ZFP36L2のレベル又は活性は、対象の造血状態及び求められる結果に基づき、所望のように増加又は減少させ得る。例えば、異常に低い造血に関連する疾患又は状態を有する対象においては、ZFP36L2タンパク質のレベル又は活性を増加させ、それにより造血を増加させることが一般的には望ましい。一方、異常に高い造血に関連する疾患又は状態を有する対象においては、ZFP36L2タンパク質のレベル又は活性を減少させ、それにより造血を減少させることが一般的には望ましい。異常に高い又は低い造血を有する対象において造血を制御することにより、異常な造血状態及びそれと関連する他の状態が治療され得、又はこのような状態の症状が全体において又は一部において緩和され得る。
【0038】
ZFP36L2タンパク質のレベル又は活性は、任意の方法により調節され得る。例えば、ZFP36L2タンパク質のレベル又は活性は、(a)ZFP36L2をコードする核酸の転写を増加又は減少させること、(b)ZFP36L2 mRNAの安定性を増加又は減少させること、(c)細胞のZFP36L2の合成を増加又は減少させること、(d)細胞のZFP36L2タンパク質又はmRNAの分解を増加又は減少させること、及び(e)それらの組み合わせ、により増加又は減少させ得る。あるいは、又は組み合わせて、例えばZFP36L2をコードする外因性核酸を対象、又は対象の細胞内に導入することにより、外因性ZFP36L2タンパク質を対象に投与し、ZFP36L2タンパク質レベルを増加させ得る。最後に、ZFP36L2又は造血を調節する他の化合物(例えば、本明細書中に記載されるこのような化合物のスクリーニング方法により同定される化合物など)が、造血を制御するために対象に投与され得る。
【0039】
遺伝子発現並びにmRNA安定性及び翻訳を変える方法は、当業者に周知であり、アンチセンス、マイクロRNA、siRNA、ネイキッド核酸、及び発現系の使用が挙げられる。
【0040】
転写から翻訳後修飾までの、遺伝子発現の任意の段階が調節され得る。例えば、所定の遺伝子の発現は、単離した二本鎖RNA(「dsRNA」)分子(遺伝子産物の少なくとも一部と、少なくとも90%、例えば95%、98%、99%又は100%の配列相同性を有する)を用いて、その遺伝子のRNA干渉を誘導することにより阻害され得る。好ましい実施形態において、dsRNA分子は「短い又は小さい干渉RNA」又は「siRNA」である。
【0041】
本発明において有用なsiRNAは、約17ヌクレオチドから約29ヌクレオチドの長さの、好ましくは約19から約25ヌクレオチドの長さの短い二本鎖RNAを含む。siRNAは、標準的なワトソン・クリック塩基対合相互作用により一緒にアニールされた(以下「塩基対合された」)、センスRNA鎖及び相補的なアンチセンスRNA鎖を含む。センス鎖は、標的遺伝子産物内に含まれる核酸配列に実質的に同一の核酸配列を含む。
【0042】
本明細書において使用される場合、siRNAは、標的核酸配列(nucleic sequence)内に含まれる標的配列に「実質的に同一」であり、標的配列と同一の、又は標的配列から1又は2ヌクレオチド異なる核酸配列である。siRNAのセンス及びアンチセンス鎖は、2つの相補的な一本鎖RNA分子を含み得、又は、2つの相補的な部分が塩基対合され、一本鎖「ヘアピン」領域により共有結合されている単一分子を含み得る。
【0043】
siRNAはまた、1以上のヌクレオチドの付加、欠失、置換及び/又は改変により、天然に存在するRNAとは異なる改変されたRNAであり得る。このような改変としては、siRNAの末端への若しくはsiRNAの1以上の内部ヌクレオチドなどへの非ヌクレオチド物質の付加、又はsiRNAをヌクレアーゼ消化に抵抗性にする修飾、又はデオキシリボヌクレオチドを有するsiRNAにおける1以上のヌクレオチドの置換が挙げられ得る。ZFP36L2を対象にする化学的に修飾されたsiRNAは、例えば、Applied Biosystems(フォスターシティー、CA)からのSILENCER siRNA及び、インビトロジェン(カールスバッド、カリフォルニア)からのSTEALTH siRNAとして、商業的に入手可能である。
【0044】
siRNAの一方又は両方の鎖は、3’突出(3’オーバーハング)も含み得る。本明細書において使用される場合、「3’突出」は、二本鎖RNA鎖の3’末端から伸びる少なくとも1の不対ヌクレオチドを言う。したがって、一実施形態において、siRNAは、1から約6ヌクレオチド(リボヌクレオチド又はデオキシリボヌクレオチドを含む)の長さの、好ましくは1から約5ヌクレオチドの長さの、より好ましくは1から約4ヌクレオチドの長さの、及び特に好ましくは約2から約4ヌクレオチドの長さの、少なくとも1の3’突出を含む。好ましい実施形態において、3’突出は、siRNAの両方の鎖に存在し、2ヌクレオチドの長さである。例えば、siRNAの各鎖は、ジチミジル酸(「TT」)又はジウリジル酸(「uu」)の3’突出を含み得る。
【0045】
siRNAは、化学的に又は生物学的に製造され得、又は単離した遺伝子産物について上記するように、組換えプラスミド又はウイルスベクターから発現され得る。dsRNA又はsiRNA分子を製造及び試験するための典型的な方法は、米国公開特許出願番号2002/0173478及び米国特許第7,148,342号に記載されており、それらの開示全体は参照により本明細書中に組み込まれる。
【0046】
所定の遺伝子の発現はまた、アンチセンス核酸により阻害され得る。本明細書において使用される場合、「アンチセンス核酸」は、RNA−RNA又はRNA−DNA又はRNA−ペプチド核酸相互作用によって標的RNAに結合する核酸分子を言い、それは標的RNAの活性を変える。本方法における使用に適したアンチセンス核酸は、遺伝子産物中の連続的な核酸配列に相補的な核酸配列を一般的には含む一本鎖核酸(例えば、RNA、DNA、RNA−DNAキメラ、PNA)である。好ましくは、アンチセンス核酸は、遺伝子産物中の連続的な核酸配列に、50〜100%相補的、より好ましくは75〜100%相補的、及び最も好ましくは95〜100%相補的な核酸配列を含む。
【0047】
アンチセンス核酸はまた、核酸主鎖への又は糖及び塩基部分(又はそれらと同等のもの)への修飾を含み、標的特異性、ヌクレアーゼ抵抗性、送達又は分子の効果に関する他の特性を促進し得る。このような修飾としては、コレステロール部分、アクリジンなどの二本鎖挿入剤又は1以上のヌクレアーゼ抵抗性基の包含が挙げられる。
【0048】
アンチセンス核酸は、化学的に又は生物学的に製造され得、又は単離した遺伝子産物について上記するように、組換えプラスミド又はウイルスベクターから発現され得る。製造及び試験のための典型的な方法は、当分野における技術の範囲内である;例えば、Stein, Science, 261:1004 (1993)及びWoolfらへの米国特許第5,849,902号を参照のこと(それらの開示全体が参照により本明細書中に組み込まれる)。
【0049】
所定の遺伝子の発現はまた、酵素的核酸により阻害され得る。本明細書において使用される場合、「酵素的核酸」は、遺伝子産物の連続的な核酸配列に対する相補性を有する基質結合領域を含む核酸であって、遺伝子産物を特異的に切断することができる核酸をいう。好ましくは、酵素的核酸基質結合領域は、遺伝子産物中の連続的な核酸配列に、50〜100%相補的、より好ましくは75〜100%相補的、及び最も好ましくは95〜100%相補的である。酵素的核酸は、塩基、糖、及び/又はリン酸基における修飾も含む。本方法における使用のための典型的な酵素的核酸は、リボザイムである。
【0050】
酵素的核酸は、化学的に又は生物学的に製造され得、又は単離した遺伝子産物について上記するように、組換えプラスミド又はウイルスベクターから発現され得る。dsRNA又はsiRNA分子の製造及び試験のための典型的な方法は、Werner, Nucl. Acids Res., 23:2092-96 (1995);Hammann, Antisense and Nucleic Acid Drug Dev., 9:25-31 (1999);及び米国特許第4,987,071号に記載されており、それらの開示全体が参照により本明細書中に組み込まれる。
【0051】
遺伝子発現はまた、遺伝子産物の発現を促進又は抑制する発現系を対象に投与することにより影響され得る。発現系は、遺伝子、プロモーター、エンハンサー、リプレッサー、その他を含み得、このような技術は当分野において周知である。好ましくは、対象の細胞は、少なくとも1の遺伝子産物(例えば、ZFP36L2タンパク質)をコードする配列又は遺伝子発現阻害組成物を含む、プラスミド又はウイルスベクターでトランスフェクトされる。
【0052】
真核細胞のトランスフェクション法は、当分野において周知であり、例えば、細胞の核又は前核への核酸の直接注射;エレクトロポーレーション;リポソーム導入又は親油性物質を介した導入;受容体媒介核酸送達;バイオバリスティック又は粒子加速;リン酸カルシウム沈殿、及びウイルスベクターを介したトランスフェクションが挙げられる。
【0053】
例えば、細胞は、リポソーム導入組成物、例えば、DOTAP(N−[1−(2,3−ジオレオイルオキシ)プロピル]−N,N,N−トリメチル−アンモニウムメチルサルフェート、Boehringer−Mannheim)又は、同等のもの(例えばLIPOFECTINなど)でトランスフェクトされ得る。使用される核酸の量は、本発明の実施に決定的ではない;許容可能な結果は、0.1〜100μgの核酸/105細胞で達成され得る。例えば、105細胞当たり、3μgのDOTAP中の約0.5μgのプラスミドベクターの割合が使用され得る。
【0054】
また、本発明のスクリーニング方法により同定される化合物は、ZFP36L2発現又は造血を調節するために効果的な量で、対象に投与され得る。当業者は、対象の大きさ及び重さ;疾患の侵入の度合い;対象の年齢、健康及び性別;投与経路;及び投与が局所であるか全身であるかなどの要因を考慮して、所定の対象に投与されるべき刺激又は阻害組成物の効果的な量を容易に決定し得る。
【0055】
当業者はまた、組成物を投与するための適切な投薬レジメンを容易に決定し得る。例えば、組成物は、対象に1回(例えば、単一の注射又はデポジション(deposition)として)投与され得る。あるいは、組成物は、約3から約1ヶ月の期間、対象に毎日1回又は2回投与され得る。特定の場合においては、対象は、長期的に、すなわち、数週間、数ヶ月間、数年、又は無期限に、組成物を取ることを要求され得る。投薬レジメンが複数回投与を含む場合、対象に投与される組成物の効果的な量は、投薬レジメン全体にわたって投与される組成物の総量を含み得ることが理解される。
【0056】
組成物はまた、任意の適切な経腸又は非経口投与経路により対象に投与され得る。本方法に適した経腸投与経路としては、例えば、経口、直腸、又は経鼻送達が挙げられる。適切な非経口投与経路としては、例えば、血管内投与(例えば、静脈内ボーラス注射、静脈内点滴、動脈内ボーラス注射、動脈内点滴、及び血管系へのカテーテル点滴);組織周辺及び組織内注射;皮下注射又はデポジション((浸透圧ポンプなどによる)皮下点滴を含む);例えばカテーテル又は他の配置装置(例えば、レチナールペレット(retinal pellet)又は坐薬又は、多孔性の、非多孔性の、若しくはゼラチン状の物質を含む植込錠)による目的の組織への直接的な施用;及び吸入が挙げられる。
【0057】
本方法において、組成物は、送達試薬と組み合わせてネイキッドRNAとして、又は遺伝子産物を発現する配列若しくは発現阻害組成物を含む核酸(例えば、組換えプラスミド又はウイルスベクター)として、対象に投与され得る。適切な送達試薬としては、例えば、Mirus Transit TKO親油性試薬;リポフェクチン;リポフェクタミン;セルフェクチン;ポリカチオン(例えばポリリジン)、及びリポソームが挙げられる。
【0058】
遺伝子発現阻害組成物を発現する配列を含む組換えプラスミド及びウイルスベクター、並びにこのようなプラスミド及びベクターを癌細胞に送達する技術は、上記で議論される。
【0059】
好ましい実施形態においては、リポソームを使用して、遺伝子発現阻害組成物(又はそれらをコードする配列を含む核酸)を対象に送達する。リポソームはまた、遺伝子産物又は核酸の血中半減期を増加させ得る。
【0060】
本発明における使用に適したリポソームは、標準的なベシクル形成脂質から形成され得、一般的には中性の又は負に荷電したリン脂質及びステロール(例えばコレステロールなど)を含む。脂質の選択は、一般的には、所望のリポソームの大きさ及び血流中のリポソームの半減期などの要因を考慮することにより、導かれる。例えば、Szoka, Ann. Rev. Biophys. Bioeng., 9:467 (1980);並びに米国特許第4,235,871号、第4,501,728号、第4,837,028号、及び第5,019,369号に記載されるように、リポソームを調製するための種々の方法が公知である(それらの開示全体が参照により本明細書中に組み込まれる)。
【0061】
本方法における使用のためのリポソームは、リポソームを癌細胞に標的化するリガンド分子を含み得る。癌細胞において一般的な受容体に結合するリガンド(例えば腫瘍細胞抗原に結合するモノクローナル抗体など)が好ましい。
【0062】
本発明の組成物は、医薬上許容可能な担体を含み得る。本明細書において使用される用語「医薬上許容可能な担体」は、ヒト若しくは獣医の患者への投与に適した、1以上の適合性の固体又は液体の増量剤、希釈剤、他の賦形剤、又は封入物質を意味する。用語「担体」は、施用を容易にするために活性成分が合わせられる、天然の又は合成の、有機又は無機成分を意味する。医薬組成物の構成成分はまた、所望の医薬効果を実質的に損なわないような様式で、本発明の分子と、及び互いに、混合されることが可能である。「医薬上許容可能な」物質は、吐き気、めまい、発疹、又は胃の不調などの望ましくない生理学的効果を生じさせることなく、患者への投与が可能である。例えば、治療目的でヒト患者に投与される場合、医薬上許容可能な賦形剤を含む治療組成物が、免疫原性でないことが望ましい。
【0063】
医薬組成物は、適切な緩衝剤を含み得、塩の状態の酢酸;塩の状態のクエン酸;塩の状態のホウ酸;及び塩の状態のリン酸が挙げられる。医薬組成物はまた、塩化ベンザルコニウム、クロロブタノール、パラベン類、及びチメロサールなどの、適切な保存剤を随意に含み得る。
【0064】
医薬組成物は、便宜上、単位用量形態で提供され得、薬学の分野において周知の任意の方法により調製され得る。全ての方法は、活性薬剤を、1以上の補助成分を構成する担体と合わせる工程を含む。一般的には、組成物は、活性組成物を液体担体、細かく分けられた固体担体、又は両方と、均一に且つ完全に合わせ、次いで、必要であれば、製品を成形することにより調製される。
【0065】
非経口投与に適した組成物は、便宜上、好ましくは受容者の血液と等張である本発明の組成物の無菌水性調製物を含む。この水性調製物は、適切な分散剤又は湿潤剤及び懸濁剤を使用する公知の方法に従って製剤化され得る。無菌の注射可能な調製物も、無毒の非経口的に許容可能な希釈剤又は溶媒中の無菌の注射可能な溶液又は懸濁液であり得る(例えば1,3−ブタンジオール中の溶液として)。使用され得る許容可能なビヒクル及び溶媒の中には、水、リンガー溶液、及び等張塩化ナトリウム溶液がある。また、無菌の固定油が、便宜上、溶媒又は懸濁媒体として使用される。この目的のために、合成モノ又はジグリセリドを含む、任意の無菌性の固定油が使用され得る。また、オレイン酸などの脂肪酸が、注射剤の調製において使用され得る。経口、皮下、静脈内、筋肉内、その他の投与に適した担体製剤は、Remington's Pharmaceutical Sciences、Mack Publishing Co.、イーストン、PA(参照によりその全体が本明細書中に組み込まれる)に見出され得る。
【0066】
本発明の送達システムは、本発明の組成物の送達が、治療されるべき部位の感作の前に、該感作を引き起こすのに十分な時間起こるような、徐放性、遅延放出性又は持続放出性の送達システムを含むよう設計される。本発明の組成物は、他の治療剤又は治療と共に使用され得る。このようなシステムは、本発明の組成物の反復投与を回避し得、対象及び医者の利便性を向上させ、本発明の特定の組成物に特に適切であり得る。
【0067】
多くの種類の放出送達システムが利用可能であり、当業者に公知である。それらとしては、ポリ(ラクチド−グリコリド)、コポリシュウ酸塩(copolyoxalates)、ポリカプロラクトン、ポリエステルアミド、ポリオルトエステル、ポリヒドロキシ酪酸、及びポリ酸無水物などのポリマーベースシステムが挙げられる。ドラッグ(drags)を含む前記ポリマーのマイクロカプセルは、例えば、米国特許第5,075,109号に記載されている。送達システムとしては、以下の非ポリマーシステムも挙げられる:コレステロール、コレステロールエステルなどのステロール及び脂肪酸を含む脂質、又はモノ−ジ−及びトリ−グリセリドなどの中性脂肪;ヒドロゲル放出システム;シラスティック(sylastic)システム;ペプチドベースのシステム;ワックス被覆剤;常套的な結合剤及び賦形剤を使用する圧縮錠剤;部分的に融合した注入剤;など。具体的な例としては、(a)活性組成物が、米国特許第4,452,775号、第4,667,014号、第4,748,034号及び第5,239,660号に記載のものなどのマトリクス内の形態で含まれる浸食システム、及び(b)活性成分が、米国特許第3,832,253号及び第3,854,480号に記載されるようなポリマーから制御された速度で浸透する拡散システムが挙げられるが、これらに限定されない。また、ポンプに基づく機器送達システムが使用され得、それらの一部は注入に採用される。
【0068】
以下の実施例はさらに本発明を説明するが、当然ながら、その範囲を限定するものとは決して解釈されるべきではない。
【実施例1】
【0069】
この実施例は、ZFP36L2が造血を制御することを実証する。
【0070】
ZFP36L2タンパク質の血球数への影響を、ZFP36L2ノックアウトマウスの全血球数(CBC)及び白血球数(WBC)を野生型マウスのものと比較することにより分析した。末梢血を、2週齢ZFP36L2野生型マウス(全6個体)及びZFP36L2ノックアウトマウス(ヘテロ接合性の7個体、及び完全ノックアウト6個体)から採取し、血液をHemavet 950 hematology analyzer(Drew Scientific、ダラス、TX)を使用して分析した。結果を図1及び2に示し、ここで結果を平均値±S.E.M.として示す。平均値はスチューデントt検定により比較した。
【0071】
結果は、ZFP36L2ノックアウトマウスは、野生型又はヘテロ接合性のマウスのいずれよりも有意に低い血球数を有することを示し、ZFP36L2発現が造血を制御することを示す。
【実施例2】
【0072】
この実施例は、ZFP36L2が造血を制御することをさらに実証する。
【0073】
ZFP36L2タンパク質の造血前駆細胞への影響を、野生型、部分的ZFP36L2ノックアウト、及び完全ZFP36L2ノックアウトマウスの胎仔肝臓における、造血前駆細胞数を比較することにより分析した。胎生14.5日における胎仔肝臓(E14.5;図3)、胎生11.5日における卵黄嚢(E11.5;図4)及び胎生11.5日におけるAGM(大動脈・性腺・中腎)領域(図5)について分析を実施した。表示した組織からの細胞を、30%ウシ胎仔血清、0.1mMヘミン、1U/ml組換えヒトエリスロポイエチン、5%vol/volヤマゴボウマイトジェンマウス脾臓細胞馴化培地、及び50ng/ml幹細胞因子を含む、1%メチルセルロース培養培地において培養した。低(5%)O2、5%CO2における7日のインキュベーションの後、コロニーを記録した。器官当たりの前駆細胞の絶対数の計算は、それぞれ個別に評価した胚について、顆粒球、赤血球、単球、巨核球コロニー形成単位(CFU−GEMM)、赤芽球バースト形成単位(BFU−E)、及び顆粒球、マクロファージコロニー形成単位(CFU−GM)についての有核細胞質及びコロニー数に基づいた。結果(図3〜5に示す)は、8野生型、9ヘテロ接合性及び7ノックアウト胚(胎仔肝臓)、5野生型、10へテロ接合性及び5ノックアウト胚(卵黄嚢)、並びに5野生型、13へテロ接合性及び6ノックアウト胚(AGM領域)からの平均値±S.E.M.として表した。平均値はスチューデントt検定により比較した。
【0074】
結果は、ZFP36L2完全ノックアウトマウスが、野生型又はヘテロ接合性マウスのいずれよりも有意に少ない造血前駆細胞を有し、ヘテロ接合性マウスが、ほとんどのカテゴリーにおいて野生型マウスよりも有意に少ない造血前駆細胞を有することを示す。これらの結果は、ZFP36L2が造血を制御することを示す。
【実施例3】
【0075】
この実施例は、ZFP36L2発現が造血を制御することをさらに実証する。
【0076】
ZFP36L2タンパク質の胎仔肝細胞の競合的再増殖への影響を、野生型マウスからの胎仔肝細胞のこのような再増殖を、ZFP36L2ノックアウトマウスからの胎仔肝細胞の再増殖と比較することにより分析した。致死的に照射したマウスを、野生型又はノックアウト胚のいずれかから単離したE14.5胎仔肝細胞で再構成した。5,000の変異細胞を、500,000の競合細胞(遺伝的に異なるマウス株由来)と混合し、照射した受容マウスに注射した。ドナー由来細胞の再構成(移植率)を、注射後1及び2ヶ月において、株特異的マーカーによる血球細胞の染色により観察した。結果を図6に示す。
【0077】
結果は、ZFP36L2ノックアウトマウスの胎仔肝臓から単離した細胞が、野生型マウスの胎仔肝臓から単離した細胞よりも有意に低いレベルで再増殖したことを示す。これらの結果は、ZFP36L2が造血を制御することを示す。
【0078】
本明細書中に引用される全ての参考文献(刊行物、特許出願、及び特許を含む)は、各参考文献が参照により組み込まれることが個々に且つ具体的に示され、その全体が本明細書中で説明されたのと同程度まで、参照により本明細書に組み込まれる。
【0079】
本発明(特に添付の特許請求の範囲に関して)を記載することに関して、用語「a」及び「an」及び「the」並びに同様の指示対象の使用は、本明細書中に別途示されない限り、又は文脈により明らかに矛盾しない限り、単数及び複数の両方を含むと解釈されるべきである。用語「含む(comprising)」、「有する(having)」、「含む(including)」、及び「含む(containing)」は、別途言及されない限り、オープンエンドの用語(すなわち、「含むが、それに限定されない」を意味する)と解釈されるべきである。本明細書中の値の範囲の列挙は、本明細書中に別途示されない限り、この範囲内に入る各個別の値に個々に言及することの省略方法として機能することを意図するに過ぎず、各個別の値は、それが本明細書中に個々に列挙されたかのように、本明細書中に組み込まれる。本明細書中に記載される全ての方法は、本明細書中に別途示されない限り、又はさもなくば文脈により明らかに矛盾しない限り、任意の適切な順序で実施され得る。本明細書中に提供されるあらゆる全ての例、又は例示的語句(例えば、「など(such as)」)の使用は、本発明をより明確にすることを意図するに過ぎず、別途主張されない限り、本発明の範囲を限定しない。本明細書中のいかなる語句も、主張されていない任意の要素を本発明の実施に必須なものとして示していると解釈されるべきではない。
【0080】
本発明を実施するための本発明者らが知る最良の形態を含む本発明の好ましい実施形態が本明細書中に記載されている。それらの好ましい実施形態のバリエーションは、前述の記載を読めば、当業者に明らかになり得る。本発明者らは、当業者が必要に応じてこのようなバリエーションを使用することを予期し、また本発明者らは、本明細書中に具体的に記載されたもの以外の方法で、本発明が実施されることを意図する。したがって、本発明は、適用法により許容されるように、本明細書に添付された特許請求の範囲に列挙された対象の全ての改変物及び均等物を含む。さらに、上記要素の全ての可能なバリエーションの中で、上記要素の任意の組み合わせが、本明細書中に別途示されない限り、又はさもなくば文脈により明らかに矛盾しない限り、本発明により包含される。
【特許請求の範囲】
【請求項1】
対象における異常造血、又はそれと関連する状態の検出方法であって、該対象における異常なZFP36L2発現を検出する工程を含み、ここで該対象における異常なZFP36L2発現は異常造血又はそれと関連する状態を示す、検出方法。
【請求項2】
異常に高いZFP36L2発現が異常に高い造血又はそれと関連する状態を示す、請求項1に記載の方法。
【請求項3】
異常に高い造血と関連する状態が一次的若しくは二次的な多血症、白血病を含む癌若しくは腫瘍、又はそれらの組み合わせである、請求項3に記載の方法。
【請求項4】
方法が、異常に高い造血と関連する状態について対象を治療する工程をさらに含む、請求項2に記載の方法。
【請求項5】
異常に低いZFP36L2発現が異常に低い造血を示す、請求項1に記載の方法。
【請求項6】
異常に低い造血と関連する状態が、一次的若しくは二次的な貧血、血小板減少症、骨髄異形成症候群、又はそれらの組み合わせである、請求項5に記載の方法。
【請求項7】
方法が、異常に低い造血と関連する状態について対象を治療する工程をさらに含む、請求項5に記載の方法。
【請求項8】
異常なZFP36L2発現が、対象、又は該対象から採取される試料におけるZFP36L2 mRNA又はZFP36L2タンパク質のレベルを、対照と比較することにより検出される、請求項1〜7のいずれか1項に記載の方法。
【請求項9】
造血が骨髄細胞系列のものである、請求項1〜8のいずれか1項に記載の方法。
【請求項10】
異常なZFP36L2発現が、造血細胞又は間質細胞において検出される、請求項1〜9のいずれか1項に記載の方法。
【請求項11】
対象における異常造血、又はそれと関連する状態の検出方法であって、該対象におけるZFP36L2遺伝子内の変異を検出する工程を含み、ここで該対象におけるZFP36L2遺伝子内の変異は異常造血又はそれと関連する状態を示す、検出方法。
【請求項12】
対象におけるZFP36L2タンパク質のレベル又は活性を調節する工程を含む、該対象における造血の制御方法。
【請求項13】
対象におけるZFP36L2タンパク質のレベル又は活性が増加する、請求項12に記載の方法。
【請求項14】
ZFP36L2遺伝子の転写を増加させること、ZFP36L2 mRNA転写産物の安定性を増加させること、細胞のZFP36L2の合成を増加させること、細胞のZFP36L2タンパク質の分解を減少させること、対象にZFP36L2タンパク質を投与すること、又はそれらの組み合わせ、によりZFP36L2タンパク質のレベルが増加する、請求項13に記載の方法。
【請求項15】
対象における造血が促進される、請求項13又は14に記載の方法。
【請求項16】
対象が、異常に低い造血と関連する状態を有する、請求項13〜15のいずれか1項に記載の方法。
【請求項17】
状態が、一次的若しくは二次的な貧血、血小板減少症、骨髄異形成症候群、又はそれらの組み合わせである、請求項16に記載の方法。
【請求項18】
対象におけるZFP36L2タンパク質のレベル又は活性が減少する、請求項12に記載の方法。
【請求項19】
ZFP36L2遺伝子の転写を減少させること、ZFP36L2 mRNA転写産物の安定性を低下させること、細胞のZFP36L2の合成を減少させること、細胞のZFP36L2の分解を増加させること、又はそれらの組み合わせ、によりZFP36L2タンパク質のレベルが減少する、請求項18に記載の方法。
【請求項20】
対象における造血が阻害される、請求項18又は19に記載の方法。
【請求項21】
対象が、異常に高い造血と関連する状態を有する、請求項18〜19のいずれか1項に記載の方法。
【請求項22】
状態が、一次的若しくは二次的な多血症、白血病を含む癌若しくは腫瘍、又はそれらの組み合わせである、請求項21に記載の方法。
【請求項23】
造血が骨髄細胞系列のものである、請求項12〜22のいずれか1項に記載の方法。
【請求項24】
ZFP36L2タンパク質のレベル又は活性が造血細胞又は間質細胞において調節される、請求項12〜23のいずれか1項に記載の方法。
【請求項25】
造血を調節する化合物のスクリーニング方法であって、
(a)試験化合物をZFP36L2を発現する細胞に投与する工程、及び
(b)試験化合物の存在下、対照と比較して該細胞におけるZFP36L2発現の変化を検出する工程、を含み、
ここで該細胞におけるZFP36L2発現の変化は、試験化合物が造血を調節し得ることを示す、スクリーニング方法。
【請求項26】
細胞が内因性にZFP36L2を発現する、又はZFP36L2を発現するよう操作されている、請求項25に記載の方法。
【請求項27】
ZFP36L2の発現における変化が、(a)ZFP36L2遺伝子の転写レベル、(b)ZFP36L2 mRNA量、(c)ZFP36L2タンパク質の量又は活性における変化を検出することにより検出される、請求項25又は26に記載の発明。
【請求項28】
細胞が、マーカータンパク質をコードする核酸に融合されたZFP36L2をコードする核酸を含み、且つZFP36L2の発現における変化が、マーカータンパク質のレベル又は活性における変化を検出することにより検出される、請求項25〜27のいずれか1項に記載の方法。
【請求項29】
マーカータンパク質をコードする核酸が、ZFP36L2 mRNAの3’末端に融合されている、請求項28に記載の方法。
【請求項30】
マーカータンパク質をコードする核酸が、ZFP36L2プロモーターに融合されている、請求項28に記載の方法。
【請求項31】
マーカータンパク質が、GFP、ルシフェラーゼ、又はβ−ガラクトシダーゼである、請求項28〜30のいずれか1項に記載の方法。
【請求項32】
対照が、(a)試験化合物非存在下における、該細胞、若しくは同じ種類の細胞中のZFP36L2発現、又は(b)あらかじめ確立された基準のZFP36L2発現レベルである、請求項25〜31のいずれか1項に記載の方法。
【請求項33】
方法が、ZFP36L2を発現する細胞に試験化合物を投与する前に、(a)ZFP36L2 mRNA、(b)ZFP36L2タンパク質、又は(c)ZFP36L2プロモーターに結合する試験化合物を選択する工程をさらに含む、請求項25〜32のいずれか1項に記載の方法。
【請求項34】
請求項25〜33のいずれか1項に記載の方法により同定される造血を調節する化合物。
【請求項1】
対象における異常造血、又はそれと関連する状態の検出方法であって、該対象における異常なZFP36L2発現を検出する工程を含み、ここで該対象における異常なZFP36L2発現は異常造血又はそれと関連する状態を示す、検出方法。
【請求項2】
異常に高いZFP36L2発現が異常に高い造血又はそれと関連する状態を示す、請求項1に記載の方法。
【請求項3】
異常に高い造血と関連する状態が一次的若しくは二次的な多血症、白血病を含む癌若しくは腫瘍、又はそれらの組み合わせである、請求項3に記載の方法。
【請求項4】
方法が、異常に高い造血と関連する状態について対象を治療する工程をさらに含む、請求項2に記載の方法。
【請求項5】
異常に低いZFP36L2発現が異常に低い造血を示す、請求項1に記載の方法。
【請求項6】
異常に低い造血と関連する状態が、一次的若しくは二次的な貧血、血小板減少症、骨髄異形成症候群、又はそれらの組み合わせである、請求項5に記載の方法。
【請求項7】
方法が、異常に低い造血と関連する状態について対象を治療する工程をさらに含む、請求項5に記載の方法。
【請求項8】
異常なZFP36L2発現が、対象、又は該対象から採取される試料におけるZFP36L2 mRNA又はZFP36L2タンパク質のレベルを、対照と比較することにより検出される、請求項1〜7のいずれか1項に記載の方法。
【請求項9】
造血が骨髄細胞系列のものである、請求項1〜8のいずれか1項に記載の方法。
【請求項10】
異常なZFP36L2発現が、造血細胞又は間質細胞において検出される、請求項1〜9のいずれか1項に記載の方法。
【請求項11】
対象における異常造血、又はそれと関連する状態の検出方法であって、該対象におけるZFP36L2遺伝子内の変異を検出する工程を含み、ここで該対象におけるZFP36L2遺伝子内の変異は異常造血又はそれと関連する状態を示す、検出方法。
【請求項12】
対象におけるZFP36L2タンパク質のレベル又は活性を調節する工程を含む、該対象における造血の制御方法。
【請求項13】
対象におけるZFP36L2タンパク質のレベル又は活性が増加する、請求項12に記載の方法。
【請求項14】
ZFP36L2遺伝子の転写を増加させること、ZFP36L2 mRNA転写産物の安定性を増加させること、細胞のZFP36L2の合成を増加させること、細胞のZFP36L2タンパク質の分解を減少させること、対象にZFP36L2タンパク質を投与すること、又はそれらの組み合わせ、によりZFP36L2タンパク質のレベルが増加する、請求項13に記載の方法。
【請求項15】
対象における造血が促進される、請求項13又は14に記載の方法。
【請求項16】
対象が、異常に低い造血と関連する状態を有する、請求項13〜15のいずれか1項に記載の方法。
【請求項17】
状態が、一次的若しくは二次的な貧血、血小板減少症、骨髄異形成症候群、又はそれらの組み合わせである、請求項16に記載の方法。
【請求項18】
対象におけるZFP36L2タンパク質のレベル又は活性が減少する、請求項12に記載の方法。
【請求項19】
ZFP36L2遺伝子の転写を減少させること、ZFP36L2 mRNA転写産物の安定性を低下させること、細胞のZFP36L2の合成を減少させること、細胞のZFP36L2の分解を増加させること、又はそれらの組み合わせ、によりZFP36L2タンパク質のレベルが減少する、請求項18に記載の方法。
【請求項20】
対象における造血が阻害される、請求項18又は19に記載の方法。
【請求項21】
対象が、異常に高い造血と関連する状態を有する、請求項18〜19のいずれか1項に記載の方法。
【請求項22】
状態が、一次的若しくは二次的な多血症、白血病を含む癌若しくは腫瘍、又はそれらの組み合わせである、請求項21に記載の方法。
【請求項23】
造血が骨髄細胞系列のものである、請求項12〜22のいずれか1項に記載の方法。
【請求項24】
ZFP36L2タンパク質のレベル又は活性が造血細胞又は間質細胞において調節される、請求項12〜23のいずれか1項に記載の方法。
【請求項25】
造血を調節する化合物のスクリーニング方法であって、
(a)試験化合物をZFP36L2を発現する細胞に投与する工程、及び
(b)試験化合物の存在下、対照と比較して該細胞におけるZFP36L2発現の変化を検出する工程、を含み、
ここで該細胞におけるZFP36L2発現の変化は、試験化合物が造血を調節し得ることを示す、スクリーニング方法。
【請求項26】
細胞が内因性にZFP36L2を発現する、又はZFP36L2を発現するよう操作されている、請求項25に記載の方法。
【請求項27】
ZFP36L2の発現における変化が、(a)ZFP36L2遺伝子の転写レベル、(b)ZFP36L2 mRNA量、(c)ZFP36L2タンパク質の量又は活性における変化を検出することにより検出される、請求項25又は26に記載の発明。
【請求項28】
細胞が、マーカータンパク質をコードする核酸に融合されたZFP36L2をコードする核酸を含み、且つZFP36L2の発現における変化が、マーカータンパク質のレベル又は活性における変化を検出することにより検出される、請求項25〜27のいずれか1項に記載の方法。
【請求項29】
マーカータンパク質をコードする核酸が、ZFP36L2 mRNAの3’末端に融合されている、請求項28に記載の方法。
【請求項30】
マーカータンパク質をコードする核酸が、ZFP36L2プロモーターに融合されている、請求項28に記載の方法。
【請求項31】
マーカータンパク質が、GFP、ルシフェラーゼ、又はβ−ガラクトシダーゼである、請求項28〜30のいずれか1項に記載の方法。
【請求項32】
対照が、(a)試験化合物非存在下における、該細胞、若しくは同じ種類の細胞中のZFP36L2発現、又は(b)あらかじめ確立された基準のZFP36L2発現レベルである、請求項25〜31のいずれか1項に記載の方法。
【請求項33】
方法が、ZFP36L2を発現する細胞に試験化合物を投与する前に、(a)ZFP36L2 mRNA、(b)ZFP36L2タンパク質、又は(c)ZFP36L2プロモーターに結合する試験化合物を選択する工程をさらに含む、請求項25〜32のいずれか1項に記載の方法。
【請求項34】
請求項25〜33のいずれか1項に記載の方法により同定される造血を調節する化合物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公表番号】特表2010−532486(P2010−532486A)
【公表日】平成22年10月7日(2010.10.7)
【国際特許分類】
【出願番号】特願2010−515237(P2010−515237)
【出願日】平成20年7月1日(2008.7.1)
【国際出願番号】PCT/US2008/068900
【国際公開番号】WO2009/006468
【国際公開日】平成21年1月8日(2009.1.8)
【出願人】(304048296)アメリカ合衆国 (18)
【Fターム(参考)】
【公表日】平成22年10月7日(2010.10.7)
【国際特許分類】
【出願日】平成20年7月1日(2008.7.1)
【国際出願番号】PCT/US2008/068900
【国際公開番号】WO2009/006468
【国際公開日】平成21年1月8日(2009.1.8)
【出願人】(304048296)アメリカ合衆国 (18)
【Fターム(参考)】
[ Back to top ]

