疎水性ポリマー膜を有する電気泳動用支持体及びそれを用いた泳動分離方法
【課題】タンパク質、糖タンパク質或いは多糖を電気泳動法によって分離した後、電気泳動に用いた膜のまま糖鎖遊離処理を行い、多糖及び糖タンパク質の糖鎖分析を可能とする膜電気泳動法、あるいは抗体を利用する免疫染色によって検出することを可能とする膜電気泳動法を提供する。
【解決手段】疎水性ポリマー膜全面に親水性のポリマーを塗布する、或いは疎水性ポリマー膜を親水性のポリマー溶液中に浸漬する等により、疎水性ポリマー膜上に親水性ポリマーからなる層を形成して、電気泳動用支持体とする。
【解決手段】疎水性ポリマー膜全面に親水性のポリマーを塗布する、或いは疎水性ポリマー膜を親水性のポリマー溶液中に浸漬する等により、疎水性ポリマー膜上に親水性ポリマーからなる層を形成して、電気泳動用支持体とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、生体由来試料のような複雑なタンパク質混合物中に存在するタンパク質、糖タンパク質或いはムコ多糖を泳動分離する方法、該方法に用いる電気泳動用支持体に関する。
【背景技術】
【0002】
生体内に存在するタンパク質は、癌などの疾患時にその発現量が変化することが知られており、疾患により変化した分子群を捕えることで、新規診断マーカーとしての応用が期待できる。特に糖タンパク質は、疾患時の量的変化に加え、その糖鎖構造も変化することが知られており、疾患により変化した糖鎖構造やそれらを含む分子群を捕えることで、より優れた新規診断マーカーとして利用できる可能性がある。そのため、特定の性質によって分類される糖タンパク質群の選択的な分離分析法は、疾患の診断や治療にとって大切な臨床検査の1つとなる可能性が高い。例えば、セルロースアセテート膜電気泳動法は血清タンパク質の分離に使用され、分離パターンの変化や特定の分画の量的変化が臨床検査法として疾患の診断に利用されている。
【0003】
ムチン様糖タンパク質は粘液中または粘膜上に存在し、セリン又はトレオニンのヒドロキシル基にO−グリコシド結合したN−アセチルガラクトサミンを介してムチン型糖鎖が結合していることを特徴とする糖タンパク質である。また、ムチン様糖タンパク質は糖含量が高い高分子量糖タンパク質として知られている。一方、ムコ多糖の代表であるグリコサミノグリカンは、動物の結合組織を中心にあらゆる組織に普遍的に存在し、多くの場合、プロテオグリカンとしてタンパク質に付加した形で存在している。プロテオグリカン型糖タンパク質は、セリンのヒドロキシル基にO−グリコシド結合したキシロースを介してグリコサミノグリカン鎖を持つことを特徴とする糖タンパク質である。また、タンパク質に結合してないグリコサミノグリカンとしてはヒアルロン酸が知られている。ヒアルロン酸は細胞外マトリクスに存在し、中皮腫のマーカー分子としても知られている。これらの糖タンパク質およびムコ多糖群はともに、疾患との関連が報告されており、新規診断マーカーのターゲット分子として重要である。また、肝癌マーカーや前立腺癌マーカーとして知られるαフェトプロテインや前立腺特異抗原(PSA)などは、血清中に含まれる糖タンパク質である。このように、血清糖タンパク質もまた新規診断マーカーのターゲット分子として重要である。
従来、これらの糖タンパク質を分離する技術としては、分離状態を視覚的にとらえることができる電気泳動法が好ましく用いられており、具体的には、血清糖タンパク質を例にした場合、SDS−ポリアクリルアミドゲル電気泳動、セルロースアセテート膜電気泳動、等電点ゲル電気泳動とSDS−ポリアクリルアミドゲル電気泳動を組み合わせた2次元電気泳動等がある。また、ムチン様糖タンパク質やプロテオグリカン型糖タンパク質を例にした場合、アガロースゲル或いはアガロース/ポリアクリルアミド混成ゲルを用いた電気泳動(非特許文献1,2参照)、又はセルロースアセテート膜電気泳動(非特許文献3参照)等がある。
さらに、電気泳動法により分離した糖タンパク質の糖鎖を解析するためには、従来公知の転写法が適用できる。すなわち、電気泳動法により分離された糖タンパク質を、ゲルからポリビニリデンジフルオリド(PVDF,polyvinylidene difluoride)膜に転写した後、該膜上での酵素反応やアルカリ処理によるβ−エリミネーション(β-elimination)反応により糖鎖を切り出し、切り出された糖鎖を質量分析計で解析する方法が用いられる(非特許文献2)。
【0004】
一方、電気泳動法による蛋白質の分離分析方法においては、特許文献1に、分子量4万〜200万のデキストラン等の親水性高分子を含有させたセルロースアセテート膜を用いて電気泳動法により検体中のリポ蛋白質を分離する方法、及び分離したリポ蛋白質VLDL、LDL、HDLのサブクラスの存在形態を確認することにより、脂質代謝異常に起因する疾患を検出することが提案されている。
【特許文献1】特開2007−248131号公報
【非特許文献1】Spurr-Michaud S et al. Assay of mucins in human tear fluid. Exp. Eye Res. 2007, 84, 939-950
【非特許文献2】Thomsson KA, Schulz BL, Packer NH, Karlsson NG. MUC5B glycosylation in human saliva reflects blood group and secretor status. Glycobiology 2005, 15, 791-804.
【非特許文献3】Yasueda SI, Yamakawa K, Nakanishi Y, Kinoshita M, Kakehi K. Decreased mucin concentrations in tear fluids of contact lens wearers. J. Pharm. Biomed. Anal. 2005, 39, 187-195.
【発明の開示】
【発明が解決しようとする課題】
【0005】
しかしながら、従来公知のSDS−ポリアクリルアミドゲル電気泳動、等電点ゲル電気泳動とSDS−ポリアクリルアミドゲル電気泳動を組み合わせた2次元電気泳動、または非特許文献1,2に記載されたアガロースゲル或いはアガロース/ポリアクリルアミド混成ゲルを用いた電気泳動法は、糖タンパク質を分離した後にPVDF膜に転写する工程を経るため、スループット性に欠け、臨床での診断法としての応用は困難である。また、転写効率に起因する定量性の低下などが問題となる。
また、特許文献1に記載の方法は、リポ蛋白質に関するものであって、糖タンパク質またはムコ多糖については何ら記載がないばかりでなく、この方法においても、電気泳動後のリポ蛋白質を、PVDF膜、ニトロセルロース膜等に転写した後、転写膜上のリポ蛋白質を確認しているため、非特許文献1、2に記載された方法の場合と同様の問題がある。
【0006】
一方、非特許文献3に記載されたセルロースアセテート膜電気泳動は、膜上でのムチン様糖タンパク質及びプロテオグリカン型糖タンパク質の分離が可能であり、転写工程の省略が期待できる。しかしながら、β−エリミネーション反応により生じる膜由来のセルロース誘導体が後の糖鎖分析の妨害となるため、この方法ではムチン様糖タンパク質及びプロテオグリカン型糖タンパク質の糖鎖構造情報を得ることができない。
【0007】
以上のとおり、糖タンパク質またはムコ多糖を電気泳動法によって分離した後、電気泳動に用いた膜のまま糖鎖遊離処理を行い、糖タンパク質またはムコ多糖の糖鎖分析を可能とする膜電気泳動法はこれまでなかった。また、電気泳動に用いた膜のまま抗体を利用する免疫染色によって検出することを可能とする膜電気泳動法はこれまでなかった。
本発明は、以上のような事情に鑑みてなされたものであって、マーカー探索や臨床現場での疾患診断に利用できる簡便なタンパク質またはムコ多糖の分離・分析法を提供することを目的とするものである。
【課題を解決するための手段】
【0008】
上述のように、PVDF膜を用いれば、膜上でのアルカリ処理によるβ−エリミネーション反応により糖タンパク質の糖鎖を切り出すことができ、切り出された糖鎖を質量分析計で解析することが可能である。また、抗体を用いて特定のタンパク質を特異的に染色し、検出することも可能である。
そこで、本発明者らは、PVDF膜を、電気泳動の支持体として利用することができれば課題を解決できると考え、PVDF膜を電気泳動支持体としてタンパク質またはムコ多糖を分離する方法について鋭意検討した結果、PVDF膜全面を親水性ポリマーの溶液でコーティングし、その膜を電気泳動の支持体として利用することにより、タンパク質またはムコ多糖を泳動・分離できることを見出した。
さらにPVDF膜の他、従来、電気泳動には使用されてこなかったタンパク質固定化用の疎水性ポリマー膜を用いたタンパク質、糖タンパク質或いはムコ多糖の分離について検討した結果、ポリテトラフルオロエチレン膜(PTFE)、ナイロン膜(Nylon)を親水性ポリマーの水溶液でコーティングした膜を用いた電気泳動によってもタンパク質、糖タンパク質或いはムコ多糖を泳動・分離できることを見出した。
【0009】
本発明は、これらの知見に基づいて完成に至ったものであり、以下のとおりのものである。
[1]疎水性ポリマー膜上に親水性ポリマー層を有することを特徴とする電気泳動用支持体。
[2]前記親水性ポリマーが、ポリビニルピロリドン、ポリビニルアルコール、ポリエチレングリコール、ポリエチレンオキシド、ポリ2−ヒドロキシエチルメタクリレートから選ばれる少なくとも一種であることを特徴とする[1]の電気泳動用支持体。
[3]前記疎水性のポリマー膜が、ポリビニリデンジフルオリド、ナイロン、ポリテトラフルオロエチレンから選ばれる少なくとも一種であることを特徴とする[1]又は[2]の電気泳動用支持体。
[4]タンパク質またはムコ多糖の分離用であることを特徴とする[1]〜[3]のいずれかの電気泳動用支持体。
[5][1]〜[3]のいずれかの電気泳動用支持体を用い、電気泳動によりタンパク質を分離することを特徴とするタンパク質の分離方法。
[6]前記タンパク質が、ムチン様糖タンパク質であることを特徴とする[5]のタンパク質の分離方法。
[7]前記タンパク質が、プロテオグリカン型糖タンパク質であることを特徴とする[5]のタンパク質の分離方法。
[8][1]〜[3]の電気泳動用支持体を用い、電気泳動によりムコ多糖を分離することを特徴とする多糖の分離方法。
[9]電気泳動によりタンパク質またはムコ多糖を分離するのに用いるキットであって、[1]〜[3]に記載の電気泳動用支持体を備えることを特徴とするタンパク質またはムコ多糖の分離用キット。
[10]検体中に含まれるタンパク質を[5]〜[7]の分離方法により分離し、次いで分離された膜上のタンパク質に一次抗体として抗タンパク質抗体を反応させた後、酵素により標識した二次抗体を反応させ、発色試薬を用いて検出することを特徴とするタンパク質の分離検出方法。
[11]検体中に含まれる糖タンパク質またはムコ多糖を[6]〜[8]の分離方法により分離し、次いで膜上の分離された糖タンパク質またはムコ多糖の糖鎖を過ヨウ素酸により酸化した後、色素を標識したアミン誘導体を反応させ検出することを特徴とする糖タンパク質またはムコ多糖の分離検出方法。
[12][6]〜[8]のタンパク質またはムコ多糖の分離方法により分離された糖タンパク質またはムコ多糖から糖鎖を遊離する方法であって、電気泳動に用いた支持体上で糖鎖遊離処理をおこなうことを特徴とする糖鎖の遊離方法。
[13]電気泳動に用いた支持体上で糖鎖遊離処理をおこなうことによって、電気泳動により分離された糖タンパク質または多糖から糖鎖を遊離するのに用いるキットであって、[1]〜[3]の電気泳動用支持体を備えることを特徴とする糖鎖遊離用キット。
[14][13]の遊離方法で遊離された糖鎖を用いて、前記電気泳動により分離された糖タンパク質またはムコ多糖中の糖鎖構造を解析することを特徴とする糖鎖構造の解析方法。
[15]電気泳動に用いた支持体上で糖鎖遊離処理をおこなうことによって、電気泳動により分離された糖タンパク質またはムコ多糖から糖鎖を遊離し、該遊離された糖鎖を用いて、前記電気泳動により分離された糖タンパク質またはムコ多糖中の糖鎖構造を解析するのに用いるキットであって、[1]〜[3]のいずれか1項に記載の電気泳動用支持体を備えることを特徴とする糖鎖構造の解析用キット。
【発明の効果】
【0010】
本発明によれば、タンパク質固定化に用いられる疎水性の高いポリマー上でタンパク質、糖タンパク質或いはムコ多糖を泳動分離できることから、転写の工程を省略することができ、従来法に比べて分析のスループットが向上する。また、本発明は、迅速・簡便であり、抗体染色や糖鎖解析も可能であるため、タンパク質、糖タンパク質或いは多糖上の疾患関連糖鎖を指標とする診断キットへの応用が期待できる。
【発明を実施するための最良の形態】
【0011】
本発明の、タンパク質、糖タンパク質或いはムコ多糖の分離分析法は、親水性ポリマー層を形成した疎水性のポリマー膜を用いた電気泳動法によるものである。
本発明に用いる疎水性のポリマー膜とは、タンパク質を疎水性相互作用によって強く結合保持する性質を有するポリマー膜であって、特にPVDF膜、ポリテトラフルオロエチレン膜(PTFE)、ナイロン膜(Nylon)を挙げることができるが、分解能の点からPVDF膜が最も好ましい。
これらの疎水性のポリマー膜とは、特許文献1、非特許文献2に記載されているように、本来、この膜に、精製したタンパク質溶液を添加するか、又はゲル電気泳動によって分離したタンパク質を転写し、膜上で糖タンパクや抗原タンパクなどの同定をおこなうために、もっぱら、タンパク質固定化用に用いられているものである。
【0012】
本発明においては、前記の疎水性のポリマー膜上に親水性ポリマー層を形成した電気泳動用支持体を用いることにより、タンパク質、糖タンパク質或いはムコ多糖を、分離することが可能となるものである。
また、分離されたタンパク質、糖タンパク質或いはムコ多糖は、親水性ポリマー層を有する疎水性のポリマー膜上にあるため、疎水性のポリマーに非セルロース系のものを用いれば、膜のままβ−エリミネーション反応をおこなっても、従来のセルロース膜のようにβ−エリミネーション反応による膜由来のセルロース誘導体が後の糖鎖分析の妨害となるようなことがない。すなわち、本発明のタンパク質、糖タンパク質或いはムコ多糖の分析方法によれば、転写工程を必要としない、簡便な方法でタンパク質、糖タンパク質或いはムコ多糖或いは糖タンパク質の分析が可能となるものである。
【0013】
本発明に用いる疎水性のポリマー膜には、従来、電気泳動法により分離されたタンパク質を転写する膜として用いられているものをそのまま使用できる。
該疎水性のポリマー膜上に、親水性のポリマー層を形成する方法としては、具体的には、疎水性のポリマー膜を親水性ポリマー溶液中に浸漬する方法、疎水性のポリマー膜上に親水性ポリマーを塗布する方法、親水性ポリマーフィルムを積層する等の方法が挙げられる。
【0014】
本発明において、親水性の層を形成するポリマーとしては、ポリマーの構成ユニットに酸素や窒素のようなヘテロ原子を少なくとも一つ含むポリマーであって水接触角が60°以下の水との親和性を有するポリマーである。例としてポリビニルピロリドン、ポリビニルアルコール、ポリアクリルアミド、ポリエチレングリコール、ポリエチレンオキシドなどが挙げられるが、特に、ポリビニルピロリドン、ポリビニルアルコール、ポリエチレングリコールが、分離能の点から好ましく、最も好ましいのは、ポリビニルアルコールである。
なお、本発明の目的からみて、本発明に用いる親水性ポリマーには、デキストリン等の多糖系のポリマーが含まれないことは当然のことである。
また、本発明において用いられる親水性ポリマーの分子量としては、1,000〜4,000,000が好ましい。
【0015】
本発明に用いる装置としては、従来のセルロースアセテート膜電気泳動装置をそのまま用いることができ、具体的には、EPC105AA型セルロースアセテート膜電気泳動装置(アドバンテック)などが使用できる。
本発明の前記電気泳動用支持体を用いた電気泳動は、「蛋白質・酵素の基礎実験法」(南江堂)、「新生化学実験講座3・糖質II」(東京化学同人)等に記載された手法に従っておこなう。
すなわち、電気泳動用緩衝液としては、ベロナール緩衝液、トリス緩衝液、ピリジン−ギ酸緩衝液等を使用する。タンパク質および糖タンパク質の分離にはベロナール緩衝液やトリス緩衝液を中性付近のpHで使用するのが好ましい。ムチン様糖タンパク質およびプロテオグリカン型糖タンパク質に対してより明確な分離を行うにはピリジン−ギ酸緩衝液(pH3.0〜pH5.0)が好ましい。また、検体の塗布量は、一般的には、1スポットあたり、あるいは幅1cmあたり、0.8〜2.4μLとされており、通電条件としては、幅1cmあたり0.5〜1.5mA程度の電流を流すことが好ましい。また、電気泳動中の支持体の温度は、一般的に10〜20℃の範囲において、一定とする。
【0016】
前述のとおり、本発明の前記電気泳動用支持体は、さらに別の膜に転写することなく、そのまま、糖鎖遊離処理をおこなうことができるものであるが、本発明における糖鎖遊離処理として、酵素を用いる遊離反応や、前記非特許文献2に記載されたβ−エリミネーション反応が用いられる。
具体的には、酵素による遊離反応の場合、糖タンパク質を含むスポットあるいはバンドを切り取った膜片に、N−グリカナーゼなどの糖鎖切断酵素を含む溶液を加え、37℃で一晩反応させる。反応後、塩類を除去することで遊離した糖鎖を得る。β−エリミネーション反応の場合、糖タンパク質を含むスポットあるいはバンドを切り取った膜片に、水酸化ナトリウムなどのアルカリと水素化ホウ素ナトリウムなどの還元剤を含む水溶液を加え45℃で16時間反応させる。反応後、酸で中和し、塩類を除去することで遊離した糖鎖を得る。
【0017】
さらに、遊離された糖鎖の糖鎖構造を分析する方法としては、高速液体クロマトグラフィー(HPLC)、核磁気共鳴分析法(NMR)、質量分析などがあるが、特に、質量分析法によるのが、感度、精度、そして簡便性の観点から好ましい。
また、前述のとおり、本発明の前記電気泳動用支持体は、さらに別の膜に転写することなく、そのまま、抗体染色により特定のタンパク質を検出することができるものである。
【実施例】
【0018】
以下、本発明を実施例によってさらに具体的に説明するが、本発明はこれら実施例により何ら限定されるものではない。
〈実施例1〉
本実施例では、ウシ顎下線ムチン(BSM)、ブタ胃ムチン(PSM)、及び血漿由来タンパク質を用いて電気泳動をおこなった。
【0019】
(親水性ポリマーでコーティングしたPVDF膜の作成)
市販のPVDF膜(Immobilon-P, ミリポア社製)を適した大きさに切り取り、メタノールに数分間浸した。ついで、該PVDF膜をメタノールから取りだし、0.25%ポリビニルアルコール(PVA)を含む泳動用緩衝液(0.1Mピリジン−ギ酸緩衝液、pH4.0)に30分間浸した。
試料をスポットする直前に、前記泳動用緩衝液から膜を取りだし、膜に付着した過剰の溶液をろ紙でかるく拭き取った後、使用した。
【0020】
(分析試料の前処理)
BSM(50μg)、PSM(100μg)、血漿由来タンパク質(血漿を脱塩して凍結乾燥したもの、約50μg)を20mMジチオトレイトールおよび8M尿素を含む0.1Mトリス−塩酸緩衝液(pH8.6、10μl)に溶解し、100℃で20分間反応させた。これを室温にて放冷後、250mMヨードアセタミド水溶液(1μl、最終濃度25mM)を加え、室温で1時間、暗所にて反応させた。
反応後、試料溶液の一部(1μl)を、前記のPVAでコーティングしたPVDF膜上にスポットし、電気泳動に供した。
【0021】
(電気泳動)
泳動槽には、セルロースアセテート膜電気泳動装置(EPC105AA型、アドバンテック社製)を使用した。通電条件は、膜の幅1cmあたり1.0mAとし、泳動時間は30分間とした。
【0022】
(染色方法)
BSM及びPSMの染色には、0.1%酢酸に溶解した0.1%アルシアンブルー8GX溶液を使用した。また、血漿由来タンパク質の染色には、40%エタノール/10%酢酸水溶液に溶解した0.008%のダイレクトブルー71溶液を使用した。
【0023】
(泳動結果)
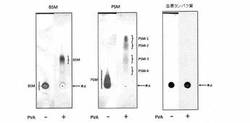
泳動結果を図1に示す。左から順に、BSM、PSM、及び血漿由来タンパク質の結果であり、それぞれ、左側が、PVAコーティングなしの支持体を用いた結果(比較例)、右側が、本発明の支持体を用いた結果を示している。
図1から、明らかなように、PVAコーティングしていないPVDF膜を用いて泳動した場合(比較例)、BSM、血漿由来タンパク質は原点からほとんど泳動されなかった。また、PSMは僅かに泳動されたが、スポットのテーリングが観察され完全な分離には至らなかった。
一方、PVAコーティングしたPVDF膜を用いた場合(本発明)、BSMは単一の成分として泳動され、PSMでは4種類の成分として泳動分離された。しかし、血漿由来タンパク質はPVAコーティングした場合においても原点から泳動されなかった。
このことから、本発明のPVAコーティングしたPVDF膜を電気泳動支持体として用いることで、ムチン様糖タンパク質が選択的に泳動分離されることが分かった。
【0024】
(糖鎖の遊離)
次に、前記の本発明の方法により泳動分離されたBSM及びPSMの各スポットを切り取り、膜ごとアルカリによるβ−エリミネーション反応を行い、ムチンのコアタンパク質から糖鎖を遊離させた。得られた糖鎖の完全メチル化誘導体を質量分析計で測定した結果を図2及び3に示す。
図2に示すとおり、BSMでは主要な成分として4種類の糖鎖ピークが検出され、これらの質量数は報告されているBSM中の主要な糖鎖構造の質量数と一致した。
従って、本発明はムチン様糖タンパク質を分離した後の糖鎖解析にも使用できることが分かった。
さらに、図3に示すとおり、4種類の成分として分離されたPSMでは、3と4の成分から糖鎖ピークが検出された。これらの2種類の成分のうち、早く泳動された成分3は硫酸化糖鎖の割合が多く、遅く泳動された成分4は中性糖の割合が多いことが分かった。このように本発明により分離されたPSM中の各成分は異なる糖鎖構造パターンを示したことから、本発明はムチン様糖タンパク質の中に複数存在している、糖鎖構造が異なる分子群を分離できることが分かった。
【0025】
(分解酵素で処理した試料の泳動)
図4に、コンドロイチナーゼABC及びヒアルロニダーゼで処理した後のPSMをPVAコーティングしたPVDF膜で電気泳動した結果を示す。なお、参考として、処理しないPSMの結果を図4aに示す。
図4bに示すように、コンドロイチン硫酸類の分解酵素であるコンドロイチナーゼABCで予め処理した試料を泳動した場合、PSM中の各成分のうち、より早く泳動された成分である1はスポットがほぼ消失した。従って、これらの成分はPSM中に混在しているコンドロイチン硫酸型プロテオグリカンであることが示唆された。
また、図4cに示すように、ヒアルロン酸の分解酵素であるヒアルロニダーゼで予め処理した試料を泳動した場合、PSM中の各成分のうち、より早く泳動された成分である2のスポットが消失した。従って、これらの成分はPSM中に混在しているヒアルロン酸であることが示唆された。
このことから、本発明はムチン様糖タンパク質のみならず、グリコサミノグリカン等のムコ多糖およびプロテオグリカン型糖タンパク質の解析にも応用できることが分かった。
【0026】
〈実施例2〉
本実施例では、ヒト唾液中ムチンの本発明による分離、および糖鎖の過ヨウ素酸酸化を利用する糖タンパク質の染色と抗体による免疫染色を行った。
【0027】
(PVAでコーティングしたPVDF膜の作成)
実施例1と同様の手順により作成した。
【0028】
(分析試料の前処理)
ヒト唾液約500μlを10000gで5分間遠心分離し、上清を限外ろ過膜(100kDaカット)により脱塩・濃縮した後、凍結乾燥したものを粗ムチン分画とした。凍結乾燥標品を20mMジチオトレイトールおよび8M尿素を含む0.1Mトリス−塩酸緩衝液(pH8.6、20μl)に溶解し、100℃で20分間反応させた。これを室温にて放冷後、250mMヨードアセタミド水溶液(2μl、最終濃度25mM)を加え、室温で1時間、暗所にて反応させた。
反応後、試料溶液を、8M尿素を含む0.1Mトリス−塩酸緩衝液(pH8.6)で2倍希釈し、その一部(1μl)を、前記のPVAでコーティングしたPVDF膜上にスポットし、電気泳動に供した。
【0029】
(電気泳動)
実施例1と同様の手順により行った。
【0030】
(染色方法)
アルシアンブルーによる染色は実施例1と同様に行った。糖鎖の過ヨウ素酸酸化を利用する糖タンパク質の染色にはPro−Q Emerald(Molecular Probes社)を使用した。抗体による免疫染色は、泳動後の膜を5%酢酸/メタノール中で30分間振とうし、糖タンパク質を膜へ固定化した後、従来公知の方法に従い実施した。すなわち、固定化後の膜をPBS−Tで振とう洗浄し、1%BSAを含むPBS−T中で1時間振とうしてブロッキングした。膜をPBS−Tで振とう洗浄後、抗MUC7ヤギIgGをPBS−Tで200倍希釈した溶液に浸し、3時間振とうした。膜をPBS−Tで振とう洗浄後、西洋ワサビペルオキシダーゼ標識抗ヤギIgGをPBS−Tで1000倍希釈した溶液に浸し、1時間振とうした。PBS−Tで振とう洗浄後、ECL法により検出した。
【0031】
(泳動・染色結果)
ヒト唾液中ムチンの泳動結果ならびに各染色法により染色した結果を図5に示す。
ヒト唾液中のムチンを本発明により泳動した後、アルシアンブルーで染色した結果、図のようにブロードなバンドとして観察された(左の図)。一方、Pro−Q Emeraldで染色した場合、アルシアンブルーで染色した場合と同様の染色パターンが得られた(中央の図)。抗MUC7抗体による免疫染色では、原点のタンパク質に対する顕著な抗体の非特異吸着が見られたものの、アルシアンブルーとPro−Q Emeraldにより染色された部位が主に染色された(右の図)。また、免疫染色した時にのみ、速く泳動される成分がわずかに検出された。
以上の結果から、本発明による親水性ポリマーでコーティングされたPVDF膜を用いる電気泳動によって分離された糖タンパク質は、糖鎖の過ヨウ素酸酸化を利用する糖タンパク質の染色や抗体による免疫染色によっても検出することが可能であることが分かった。
【0032】
〈実施例3〉
(他の親水性ポリマーによる検討)
PVA以外の親水性ポリマーを用いて、実施例1と同様の手順によりPVDF膜をコーティングし、BSM、PSM、及び血漿由来タンパク質を泳動した結果を図6に示す。左から順に、ポリビニルピロリドン、ポリエチレングリコール、ポリ2−ヒドロキシエチルメタクリレートによりコーティングしたPVDF膜を用いた結果を示している。
図6から明らかなように、PVA以外の親水性ポリマーによってコーティングを行ってもPVAの場合と同等の効果が得られ、グリコサミノグリカンおよびムチン様糖タンパク質が選択的に泳動分離されることが分かった。
【0033】
〈実施例4〉
(血漿タンパク質の分離)
本発明は電気泳動に用いる緩衝液の種類を変えることによって、血漿タンパク質のような複雑なタンパク質混合物の分離にも使用することができる。泳動用緩衝液に0.06Mバルビタールナトリウム緩衝液(pH8.6)を用いて、本発明により血漿タンパク質を泳動した。また、比較としてセルロースアセテート膜電気泳動を行った。図7には、セルロースアセテート膜で電気泳動した結果と、本発明により泳動した結果を示して比較している。図7に示すようにセルロースアセテート膜電気泳動では血漿たんぱく質が6個の分画に分離されたのに対して、本発明では9個の分画に分離された。従って本発明は従来法に比べて分解能が高いことが分かった。
【0034】
〈実施例5〉
(他の疎水性高分子膜による検討)
PVDF膜以外の疎水性ポリマー膜についても実施例1と同様の手順によって、PVAによりコーティングし、これらの膜を用いて血漿タンパク質を分離した例を図8に示す。左からPVDF膜、ポリテトラフルオロエチレン膜(PTFE)、ナイロン膜(Nylon)を用いた結果を示している。使用する疎水性高分子膜によって泳動パターンは異なったが、電気泳動による分離が認められた。したがって、図8は本発明で使用する疎水性ポリマー膜がPVDF膜に限定されるものではないことを示している。
【0035】
〈実施例6〉
(血漿中のハプトグロビンの抗体染色)
実施例4と同様の手順により、本発明により血漿タンパク質を泳動した。ハプトグロビン抗体による免疫染色は、泳動後の膜をアセトン中で15分間振とうし、血漿タンパク質を膜へ固定化した後、従来公知の方法に従い実施した。すなわち、固定化後の膜を1%BSAを含むPBS中で1時間振とうしてブロッキングした。膜をPBS−T(0.05% tween)で5分間洗浄し、この洗浄操作を合計3回繰り返した。振とう洗浄後、ウサギ抗ヒトハプトグロビン抗体(IgG、1mg/mL)をPBS−Tで2000倍希釈した溶液に浸し、1時間振とうした。その後、膜をPBS−T(0.05% tween)で5分間洗浄し、この洗浄操作を合計3回繰り返した後、西洋ワサビペルオキシダーゼ標識されたヤギ抗ウサギIgG抗体をPBS−Tで2000倍希釈した溶液に浸し、1時間振とうした。その後、膜をPBS−T(0.05% tween)で5分間洗浄し、この洗浄操作を合計3回繰り返した後、コニカイムノステインキット(イムノステインHRP-1000、コニカミノルタ社製)により検出した。
【0036】
(染色結果)
ヒト血漿タンパク質の泳動結果ならびに抗ヒトハプトグロビンにより染色した結果を図9に示す。
ヒト血漿タンパク質を本発明により泳動した後、DB−71で染色した結果、図9のように9本のバンドとして観察された(図9−左)。一方、抗ハプトグロビン抗体で染色した場合、1本のバンドの染色パターンが得られた(図9−右)。ハプトグロビンは、従来用いられてきたセルロースアセテート膜電気泳動による血漿タンパク質のデータ(標準臨床検査医学 第2版 医学書院)との類似性から、バンド4に存在すると推定される。抗ハプトグロビン抗体にて染色されたバンドは、バンド4に一致することから、本手法により血漿中のハプトグロビンを特異的に染色できたと考えられる。
【0037】
以上の結果から、本発明による親水性ポリマーでコーティングされたPVDF膜を用いる電気泳動によって分離されたタンパク質は、タンパク質固定化用の疎水性膜に転写することなく、抗体による免疫染色によって特異的に検出することが可能であることが分かった。
【産業上の利用可能性】
【0038】
本発明の疎水性ポリマー膜上に親水性ポリマー層を有する電気泳動用支持体を用いると、タンパク質、糖タンパク質或いはムコ多糖を選択的に、明確に分離することができ、また、該支持体上で分離された糖タンパク質またはムコ多糖に、そのまま、糖鎖の遊離反応をさせて、糖タンパク質またはムコ多糖の中に存在する糖鎖構造の解析が可能となる。また、該支持体上で分離されたタンパク質、糖タンパク質或いはムコ多糖は、特異的抗体を用いた免疫染色法や、糖鎖の過ヨウ素酸酸化を利用する糖タンパク質の染色法による検出も可能である。これらのことから、本発明は疾患の検知に用いる検査キットとしての利用が期待される。
【図面の簡単な説明】
【0039】
【図1】BSM、PSM及び血漿由来タンパク質を、それぞれ、PVAコーティングしていないPVDF膜、及びPVAコーティングしたPVDF膜で電気泳動した結果を示す図。
【図2】PVAコーティングしたPVDF膜で分離したBSMから糖鎖を遊離し、質量分析により解析した結果を示す図。
【図3】PVAコーティングしたPVDF膜で分離したPSMから糖鎖を遊離し、質量分析により解析した結果を示す図。
【図4】コンドロイチナーゼABCで処理する前のPSMと処理した後のPSMをPVAコーティングしたPVDF膜で電気泳動した結果を示す図。
【図5】ヒト唾液中のムチンをPVAコーティングしたPVDF膜により電気泳動した後、アルシアンブルー、Pro−Q Emerald、免疫染色により染色した結果を示す図。
【図6】BSM、PSM及び血漿由来タンパク質を、それぞれ、ポリビニルピロリドン、ポリエチレングリコール、ポリ2-ヒドロキシエチルメタクリレートによりコーティングしたPVDF膜で電気泳動した結果を示す図。
【図7】血漿由来タンパク質をセルロースアセテート膜とPVAコーティングしたPVDF膜で電気泳動した結果を示す図。
【図8】PVAコーティングしたPVDF膜、ポリテトラフルオロエチレン膜(PTFE)、ナイロン膜(Nylon)を用いて血漿由来タンパク質を電気泳動した結果を示す図。
【図9】ヒト血漿タンパク質の泳動結果ならびに抗ヒトハプトグロビンにより染色した結果を示す図。
【技術分野】
【0001】
本発明は、生体由来試料のような複雑なタンパク質混合物中に存在するタンパク質、糖タンパク質或いはムコ多糖を泳動分離する方法、該方法に用いる電気泳動用支持体に関する。
【背景技術】
【0002】
生体内に存在するタンパク質は、癌などの疾患時にその発現量が変化することが知られており、疾患により変化した分子群を捕えることで、新規診断マーカーとしての応用が期待できる。特に糖タンパク質は、疾患時の量的変化に加え、その糖鎖構造も変化することが知られており、疾患により変化した糖鎖構造やそれらを含む分子群を捕えることで、より優れた新規診断マーカーとして利用できる可能性がある。そのため、特定の性質によって分類される糖タンパク質群の選択的な分離分析法は、疾患の診断や治療にとって大切な臨床検査の1つとなる可能性が高い。例えば、セルロースアセテート膜電気泳動法は血清タンパク質の分離に使用され、分離パターンの変化や特定の分画の量的変化が臨床検査法として疾患の診断に利用されている。
【0003】
ムチン様糖タンパク質は粘液中または粘膜上に存在し、セリン又はトレオニンのヒドロキシル基にO−グリコシド結合したN−アセチルガラクトサミンを介してムチン型糖鎖が結合していることを特徴とする糖タンパク質である。また、ムチン様糖タンパク質は糖含量が高い高分子量糖タンパク質として知られている。一方、ムコ多糖の代表であるグリコサミノグリカンは、動物の結合組織を中心にあらゆる組織に普遍的に存在し、多くの場合、プロテオグリカンとしてタンパク質に付加した形で存在している。プロテオグリカン型糖タンパク質は、セリンのヒドロキシル基にO−グリコシド結合したキシロースを介してグリコサミノグリカン鎖を持つことを特徴とする糖タンパク質である。また、タンパク質に結合してないグリコサミノグリカンとしてはヒアルロン酸が知られている。ヒアルロン酸は細胞外マトリクスに存在し、中皮腫のマーカー分子としても知られている。これらの糖タンパク質およびムコ多糖群はともに、疾患との関連が報告されており、新規診断マーカーのターゲット分子として重要である。また、肝癌マーカーや前立腺癌マーカーとして知られるαフェトプロテインや前立腺特異抗原(PSA)などは、血清中に含まれる糖タンパク質である。このように、血清糖タンパク質もまた新規診断マーカーのターゲット分子として重要である。
従来、これらの糖タンパク質を分離する技術としては、分離状態を視覚的にとらえることができる電気泳動法が好ましく用いられており、具体的には、血清糖タンパク質を例にした場合、SDS−ポリアクリルアミドゲル電気泳動、セルロースアセテート膜電気泳動、等電点ゲル電気泳動とSDS−ポリアクリルアミドゲル電気泳動を組み合わせた2次元電気泳動等がある。また、ムチン様糖タンパク質やプロテオグリカン型糖タンパク質を例にした場合、アガロースゲル或いはアガロース/ポリアクリルアミド混成ゲルを用いた電気泳動(非特許文献1,2参照)、又はセルロースアセテート膜電気泳動(非特許文献3参照)等がある。
さらに、電気泳動法により分離した糖タンパク質の糖鎖を解析するためには、従来公知の転写法が適用できる。すなわち、電気泳動法により分離された糖タンパク質を、ゲルからポリビニリデンジフルオリド(PVDF,polyvinylidene difluoride)膜に転写した後、該膜上での酵素反応やアルカリ処理によるβ−エリミネーション(β-elimination)反応により糖鎖を切り出し、切り出された糖鎖を質量分析計で解析する方法が用いられる(非特許文献2)。
【0004】
一方、電気泳動法による蛋白質の分離分析方法においては、特許文献1に、分子量4万〜200万のデキストラン等の親水性高分子を含有させたセルロースアセテート膜を用いて電気泳動法により検体中のリポ蛋白質を分離する方法、及び分離したリポ蛋白質VLDL、LDL、HDLのサブクラスの存在形態を確認することにより、脂質代謝異常に起因する疾患を検出することが提案されている。
【特許文献1】特開2007−248131号公報
【非特許文献1】Spurr-Michaud S et al. Assay of mucins in human tear fluid. Exp. Eye Res. 2007, 84, 939-950
【非特許文献2】Thomsson KA, Schulz BL, Packer NH, Karlsson NG. MUC5B glycosylation in human saliva reflects blood group and secretor status. Glycobiology 2005, 15, 791-804.
【非特許文献3】Yasueda SI, Yamakawa K, Nakanishi Y, Kinoshita M, Kakehi K. Decreased mucin concentrations in tear fluids of contact lens wearers. J. Pharm. Biomed. Anal. 2005, 39, 187-195.
【発明の開示】
【発明が解決しようとする課題】
【0005】
しかしながら、従来公知のSDS−ポリアクリルアミドゲル電気泳動、等電点ゲル電気泳動とSDS−ポリアクリルアミドゲル電気泳動を組み合わせた2次元電気泳動、または非特許文献1,2に記載されたアガロースゲル或いはアガロース/ポリアクリルアミド混成ゲルを用いた電気泳動法は、糖タンパク質を分離した後にPVDF膜に転写する工程を経るため、スループット性に欠け、臨床での診断法としての応用は困難である。また、転写効率に起因する定量性の低下などが問題となる。
また、特許文献1に記載の方法は、リポ蛋白質に関するものであって、糖タンパク質またはムコ多糖については何ら記載がないばかりでなく、この方法においても、電気泳動後のリポ蛋白質を、PVDF膜、ニトロセルロース膜等に転写した後、転写膜上のリポ蛋白質を確認しているため、非特許文献1、2に記載された方法の場合と同様の問題がある。
【0006】
一方、非特許文献3に記載されたセルロースアセテート膜電気泳動は、膜上でのムチン様糖タンパク質及びプロテオグリカン型糖タンパク質の分離が可能であり、転写工程の省略が期待できる。しかしながら、β−エリミネーション反応により生じる膜由来のセルロース誘導体が後の糖鎖分析の妨害となるため、この方法ではムチン様糖タンパク質及びプロテオグリカン型糖タンパク質の糖鎖構造情報を得ることができない。
【0007】
以上のとおり、糖タンパク質またはムコ多糖を電気泳動法によって分離した後、電気泳動に用いた膜のまま糖鎖遊離処理を行い、糖タンパク質またはムコ多糖の糖鎖分析を可能とする膜電気泳動法はこれまでなかった。また、電気泳動に用いた膜のまま抗体を利用する免疫染色によって検出することを可能とする膜電気泳動法はこれまでなかった。
本発明は、以上のような事情に鑑みてなされたものであって、マーカー探索や臨床現場での疾患診断に利用できる簡便なタンパク質またはムコ多糖の分離・分析法を提供することを目的とするものである。
【課題を解決するための手段】
【0008】
上述のように、PVDF膜を用いれば、膜上でのアルカリ処理によるβ−エリミネーション反応により糖タンパク質の糖鎖を切り出すことができ、切り出された糖鎖を質量分析計で解析することが可能である。また、抗体を用いて特定のタンパク質を特異的に染色し、検出することも可能である。
そこで、本発明者らは、PVDF膜を、電気泳動の支持体として利用することができれば課題を解決できると考え、PVDF膜を電気泳動支持体としてタンパク質またはムコ多糖を分離する方法について鋭意検討した結果、PVDF膜全面を親水性ポリマーの溶液でコーティングし、その膜を電気泳動の支持体として利用することにより、タンパク質またはムコ多糖を泳動・分離できることを見出した。
さらにPVDF膜の他、従来、電気泳動には使用されてこなかったタンパク質固定化用の疎水性ポリマー膜を用いたタンパク質、糖タンパク質或いはムコ多糖の分離について検討した結果、ポリテトラフルオロエチレン膜(PTFE)、ナイロン膜(Nylon)を親水性ポリマーの水溶液でコーティングした膜を用いた電気泳動によってもタンパク質、糖タンパク質或いはムコ多糖を泳動・分離できることを見出した。
【0009】
本発明は、これらの知見に基づいて完成に至ったものであり、以下のとおりのものである。
[1]疎水性ポリマー膜上に親水性ポリマー層を有することを特徴とする電気泳動用支持体。
[2]前記親水性ポリマーが、ポリビニルピロリドン、ポリビニルアルコール、ポリエチレングリコール、ポリエチレンオキシド、ポリ2−ヒドロキシエチルメタクリレートから選ばれる少なくとも一種であることを特徴とする[1]の電気泳動用支持体。
[3]前記疎水性のポリマー膜が、ポリビニリデンジフルオリド、ナイロン、ポリテトラフルオロエチレンから選ばれる少なくとも一種であることを特徴とする[1]又は[2]の電気泳動用支持体。
[4]タンパク質またはムコ多糖の分離用であることを特徴とする[1]〜[3]のいずれかの電気泳動用支持体。
[5][1]〜[3]のいずれかの電気泳動用支持体を用い、電気泳動によりタンパク質を分離することを特徴とするタンパク質の分離方法。
[6]前記タンパク質が、ムチン様糖タンパク質であることを特徴とする[5]のタンパク質の分離方法。
[7]前記タンパク質が、プロテオグリカン型糖タンパク質であることを特徴とする[5]のタンパク質の分離方法。
[8][1]〜[3]の電気泳動用支持体を用い、電気泳動によりムコ多糖を分離することを特徴とする多糖の分離方法。
[9]電気泳動によりタンパク質またはムコ多糖を分離するのに用いるキットであって、[1]〜[3]に記載の電気泳動用支持体を備えることを特徴とするタンパク質またはムコ多糖の分離用キット。
[10]検体中に含まれるタンパク質を[5]〜[7]の分離方法により分離し、次いで分離された膜上のタンパク質に一次抗体として抗タンパク質抗体を反応させた後、酵素により標識した二次抗体を反応させ、発色試薬を用いて検出することを特徴とするタンパク質の分離検出方法。
[11]検体中に含まれる糖タンパク質またはムコ多糖を[6]〜[8]の分離方法により分離し、次いで膜上の分離された糖タンパク質またはムコ多糖の糖鎖を過ヨウ素酸により酸化した後、色素を標識したアミン誘導体を反応させ検出することを特徴とする糖タンパク質またはムコ多糖の分離検出方法。
[12][6]〜[8]のタンパク質またはムコ多糖の分離方法により分離された糖タンパク質またはムコ多糖から糖鎖を遊離する方法であって、電気泳動に用いた支持体上で糖鎖遊離処理をおこなうことを特徴とする糖鎖の遊離方法。
[13]電気泳動に用いた支持体上で糖鎖遊離処理をおこなうことによって、電気泳動により分離された糖タンパク質または多糖から糖鎖を遊離するのに用いるキットであって、[1]〜[3]の電気泳動用支持体を備えることを特徴とする糖鎖遊離用キット。
[14][13]の遊離方法で遊離された糖鎖を用いて、前記電気泳動により分離された糖タンパク質またはムコ多糖中の糖鎖構造を解析することを特徴とする糖鎖構造の解析方法。
[15]電気泳動に用いた支持体上で糖鎖遊離処理をおこなうことによって、電気泳動により分離された糖タンパク質またはムコ多糖から糖鎖を遊離し、該遊離された糖鎖を用いて、前記電気泳動により分離された糖タンパク質またはムコ多糖中の糖鎖構造を解析するのに用いるキットであって、[1]〜[3]のいずれか1項に記載の電気泳動用支持体を備えることを特徴とする糖鎖構造の解析用キット。
【発明の効果】
【0010】
本発明によれば、タンパク質固定化に用いられる疎水性の高いポリマー上でタンパク質、糖タンパク質或いはムコ多糖を泳動分離できることから、転写の工程を省略することができ、従来法に比べて分析のスループットが向上する。また、本発明は、迅速・簡便であり、抗体染色や糖鎖解析も可能であるため、タンパク質、糖タンパク質或いは多糖上の疾患関連糖鎖を指標とする診断キットへの応用が期待できる。
【発明を実施するための最良の形態】
【0011】
本発明の、タンパク質、糖タンパク質或いはムコ多糖の分離分析法は、親水性ポリマー層を形成した疎水性のポリマー膜を用いた電気泳動法によるものである。
本発明に用いる疎水性のポリマー膜とは、タンパク質を疎水性相互作用によって強く結合保持する性質を有するポリマー膜であって、特にPVDF膜、ポリテトラフルオロエチレン膜(PTFE)、ナイロン膜(Nylon)を挙げることができるが、分解能の点からPVDF膜が最も好ましい。
これらの疎水性のポリマー膜とは、特許文献1、非特許文献2に記載されているように、本来、この膜に、精製したタンパク質溶液を添加するか、又はゲル電気泳動によって分離したタンパク質を転写し、膜上で糖タンパクや抗原タンパクなどの同定をおこなうために、もっぱら、タンパク質固定化用に用いられているものである。
【0012】
本発明においては、前記の疎水性のポリマー膜上に親水性ポリマー層を形成した電気泳動用支持体を用いることにより、タンパク質、糖タンパク質或いはムコ多糖を、分離することが可能となるものである。
また、分離されたタンパク質、糖タンパク質或いはムコ多糖は、親水性ポリマー層を有する疎水性のポリマー膜上にあるため、疎水性のポリマーに非セルロース系のものを用いれば、膜のままβ−エリミネーション反応をおこなっても、従来のセルロース膜のようにβ−エリミネーション反応による膜由来のセルロース誘導体が後の糖鎖分析の妨害となるようなことがない。すなわち、本発明のタンパク質、糖タンパク質或いはムコ多糖の分析方法によれば、転写工程を必要としない、簡便な方法でタンパク質、糖タンパク質或いはムコ多糖或いは糖タンパク質の分析が可能となるものである。
【0013】
本発明に用いる疎水性のポリマー膜には、従来、電気泳動法により分離されたタンパク質を転写する膜として用いられているものをそのまま使用できる。
該疎水性のポリマー膜上に、親水性のポリマー層を形成する方法としては、具体的には、疎水性のポリマー膜を親水性ポリマー溶液中に浸漬する方法、疎水性のポリマー膜上に親水性ポリマーを塗布する方法、親水性ポリマーフィルムを積層する等の方法が挙げられる。
【0014】
本発明において、親水性の層を形成するポリマーとしては、ポリマーの構成ユニットに酸素や窒素のようなヘテロ原子を少なくとも一つ含むポリマーであって水接触角が60°以下の水との親和性を有するポリマーである。例としてポリビニルピロリドン、ポリビニルアルコール、ポリアクリルアミド、ポリエチレングリコール、ポリエチレンオキシドなどが挙げられるが、特に、ポリビニルピロリドン、ポリビニルアルコール、ポリエチレングリコールが、分離能の点から好ましく、最も好ましいのは、ポリビニルアルコールである。
なお、本発明の目的からみて、本発明に用いる親水性ポリマーには、デキストリン等の多糖系のポリマーが含まれないことは当然のことである。
また、本発明において用いられる親水性ポリマーの分子量としては、1,000〜4,000,000が好ましい。
【0015】
本発明に用いる装置としては、従来のセルロースアセテート膜電気泳動装置をそのまま用いることができ、具体的には、EPC105AA型セルロースアセテート膜電気泳動装置(アドバンテック)などが使用できる。
本発明の前記電気泳動用支持体を用いた電気泳動は、「蛋白質・酵素の基礎実験法」(南江堂)、「新生化学実験講座3・糖質II」(東京化学同人)等に記載された手法に従っておこなう。
すなわち、電気泳動用緩衝液としては、ベロナール緩衝液、トリス緩衝液、ピリジン−ギ酸緩衝液等を使用する。タンパク質および糖タンパク質の分離にはベロナール緩衝液やトリス緩衝液を中性付近のpHで使用するのが好ましい。ムチン様糖タンパク質およびプロテオグリカン型糖タンパク質に対してより明確な分離を行うにはピリジン−ギ酸緩衝液(pH3.0〜pH5.0)が好ましい。また、検体の塗布量は、一般的には、1スポットあたり、あるいは幅1cmあたり、0.8〜2.4μLとされており、通電条件としては、幅1cmあたり0.5〜1.5mA程度の電流を流すことが好ましい。また、電気泳動中の支持体の温度は、一般的に10〜20℃の範囲において、一定とする。
【0016】
前述のとおり、本発明の前記電気泳動用支持体は、さらに別の膜に転写することなく、そのまま、糖鎖遊離処理をおこなうことができるものであるが、本発明における糖鎖遊離処理として、酵素を用いる遊離反応や、前記非特許文献2に記載されたβ−エリミネーション反応が用いられる。
具体的には、酵素による遊離反応の場合、糖タンパク質を含むスポットあるいはバンドを切り取った膜片に、N−グリカナーゼなどの糖鎖切断酵素を含む溶液を加え、37℃で一晩反応させる。反応後、塩類を除去することで遊離した糖鎖を得る。β−エリミネーション反応の場合、糖タンパク質を含むスポットあるいはバンドを切り取った膜片に、水酸化ナトリウムなどのアルカリと水素化ホウ素ナトリウムなどの還元剤を含む水溶液を加え45℃で16時間反応させる。反応後、酸で中和し、塩類を除去することで遊離した糖鎖を得る。
【0017】
さらに、遊離された糖鎖の糖鎖構造を分析する方法としては、高速液体クロマトグラフィー(HPLC)、核磁気共鳴分析法(NMR)、質量分析などがあるが、特に、質量分析法によるのが、感度、精度、そして簡便性の観点から好ましい。
また、前述のとおり、本発明の前記電気泳動用支持体は、さらに別の膜に転写することなく、そのまま、抗体染色により特定のタンパク質を検出することができるものである。
【実施例】
【0018】
以下、本発明を実施例によってさらに具体的に説明するが、本発明はこれら実施例により何ら限定されるものではない。
〈実施例1〉
本実施例では、ウシ顎下線ムチン(BSM)、ブタ胃ムチン(PSM)、及び血漿由来タンパク質を用いて電気泳動をおこなった。
【0019】
(親水性ポリマーでコーティングしたPVDF膜の作成)
市販のPVDF膜(Immobilon-P, ミリポア社製)を適した大きさに切り取り、メタノールに数分間浸した。ついで、該PVDF膜をメタノールから取りだし、0.25%ポリビニルアルコール(PVA)を含む泳動用緩衝液(0.1Mピリジン−ギ酸緩衝液、pH4.0)に30分間浸した。
試料をスポットする直前に、前記泳動用緩衝液から膜を取りだし、膜に付着した過剰の溶液をろ紙でかるく拭き取った後、使用した。
【0020】
(分析試料の前処理)
BSM(50μg)、PSM(100μg)、血漿由来タンパク質(血漿を脱塩して凍結乾燥したもの、約50μg)を20mMジチオトレイトールおよび8M尿素を含む0.1Mトリス−塩酸緩衝液(pH8.6、10μl)に溶解し、100℃で20分間反応させた。これを室温にて放冷後、250mMヨードアセタミド水溶液(1μl、最終濃度25mM)を加え、室温で1時間、暗所にて反応させた。
反応後、試料溶液の一部(1μl)を、前記のPVAでコーティングしたPVDF膜上にスポットし、電気泳動に供した。
【0021】
(電気泳動)
泳動槽には、セルロースアセテート膜電気泳動装置(EPC105AA型、アドバンテック社製)を使用した。通電条件は、膜の幅1cmあたり1.0mAとし、泳動時間は30分間とした。
【0022】
(染色方法)
BSM及びPSMの染色には、0.1%酢酸に溶解した0.1%アルシアンブルー8GX溶液を使用した。また、血漿由来タンパク質の染色には、40%エタノール/10%酢酸水溶液に溶解した0.008%のダイレクトブルー71溶液を使用した。
【0023】
(泳動結果)
泳動結果を図1に示す。左から順に、BSM、PSM、及び血漿由来タンパク質の結果であり、それぞれ、左側が、PVAコーティングなしの支持体を用いた結果(比較例)、右側が、本発明の支持体を用いた結果を示している。
図1から、明らかなように、PVAコーティングしていないPVDF膜を用いて泳動した場合(比較例)、BSM、血漿由来タンパク質は原点からほとんど泳動されなかった。また、PSMは僅かに泳動されたが、スポットのテーリングが観察され完全な分離には至らなかった。
一方、PVAコーティングしたPVDF膜を用いた場合(本発明)、BSMは単一の成分として泳動され、PSMでは4種類の成分として泳動分離された。しかし、血漿由来タンパク質はPVAコーティングした場合においても原点から泳動されなかった。
このことから、本発明のPVAコーティングしたPVDF膜を電気泳動支持体として用いることで、ムチン様糖タンパク質が選択的に泳動分離されることが分かった。
【0024】
(糖鎖の遊離)
次に、前記の本発明の方法により泳動分離されたBSM及びPSMの各スポットを切り取り、膜ごとアルカリによるβ−エリミネーション反応を行い、ムチンのコアタンパク質から糖鎖を遊離させた。得られた糖鎖の完全メチル化誘導体を質量分析計で測定した結果を図2及び3に示す。
図2に示すとおり、BSMでは主要な成分として4種類の糖鎖ピークが検出され、これらの質量数は報告されているBSM中の主要な糖鎖構造の質量数と一致した。
従って、本発明はムチン様糖タンパク質を分離した後の糖鎖解析にも使用できることが分かった。
さらに、図3に示すとおり、4種類の成分として分離されたPSMでは、3と4の成分から糖鎖ピークが検出された。これらの2種類の成分のうち、早く泳動された成分3は硫酸化糖鎖の割合が多く、遅く泳動された成分4は中性糖の割合が多いことが分かった。このように本発明により分離されたPSM中の各成分は異なる糖鎖構造パターンを示したことから、本発明はムチン様糖タンパク質の中に複数存在している、糖鎖構造が異なる分子群を分離できることが分かった。
【0025】
(分解酵素で処理した試料の泳動)
図4に、コンドロイチナーゼABC及びヒアルロニダーゼで処理した後のPSMをPVAコーティングしたPVDF膜で電気泳動した結果を示す。なお、参考として、処理しないPSMの結果を図4aに示す。
図4bに示すように、コンドロイチン硫酸類の分解酵素であるコンドロイチナーゼABCで予め処理した試料を泳動した場合、PSM中の各成分のうち、より早く泳動された成分である1はスポットがほぼ消失した。従って、これらの成分はPSM中に混在しているコンドロイチン硫酸型プロテオグリカンであることが示唆された。
また、図4cに示すように、ヒアルロン酸の分解酵素であるヒアルロニダーゼで予め処理した試料を泳動した場合、PSM中の各成分のうち、より早く泳動された成分である2のスポットが消失した。従って、これらの成分はPSM中に混在しているヒアルロン酸であることが示唆された。
このことから、本発明はムチン様糖タンパク質のみならず、グリコサミノグリカン等のムコ多糖およびプロテオグリカン型糖タンパク質の解析にも応用できることが分かった。
【0026】
〈実施例2〉
本実施例では、ヒト唾液中ムチンの本発明による分離、および糖鎖の過ヨウ素酸酸化を利用する糖タンパク質の染色と抗体による免疫染色を行った。
【0027】
(PVAでコーティングしたPVDF膜の作成)
実施例1と同様の手順により作成した。
【0028】
(分析試料の前処理)
ヒト唾液約500μlを10000gで5分間遠心分離し、上清を限外ろ過膜(100kDaカット)により脱塩・濃縮した後、凍結乾燥したものを粗ムチン分画とした。凍結乾燥標品を20mMジチオトレイトールおよび8M尿素を含む0.1Mトリス−塩酸緩衝液(pH8.6、20μl)に溶解し、100℃で20分間反応させた。これを室温にて放冷後、250mMヨードアセタミド水溶液(2μl、最終濃度25mM)を加え、室温で1時間、暗所にて反応させた。
反応後、試料溶液を、8M尿素を含む0.1Mトリス−塩酸緩衝液(pH8.6)で2倍希釈し、その一部(1μl)を、前記のPVAでコーティングしたPVDF膜上にスポットし、電気泳動に供した。
【0029】
(電気泳動)
実施例1と同様の手順により行った。
【0030】
(染色方法)
アルシアンブルーによる染色は実施例1と同様に行った。糖鎖の過ヨウ素酸酸化を利用する糖タンパク質の染色にはPro−Q Emerald(Molecular Probes社)を使用した。抗体による免疫染色は、泳動後の膜を5%酢酸/メタノール中で30分間振とうし、糖タンパク質を膜へ固定化した後、従来公知の方法に従い実施した。すなわち、固定化後の膜をPBS−Tで振とう洗浄し、1%BSAを含むPBS−T中で1時間振とうしてブロッキングした。膜をPBS−Tで振とう洗浄後、抗MUC7ヤギIgGをPBS−Tで200倍希釈した溶液に浸し、3時間振とうした。膜をPBS−Tで振とう洗浄後、西洋ワサビペルオキシダーゼ標識抗ヤギIgGをPBS−Tで1000倍希釈した溶液に浸し、1時間振とうした。PBS−Tで振とう洗浄後、ECL法により検出した。
【0031】
(泳動・染色結果)
ヒト唾液中ムチンの泳動結果ならびに各染色法により染色した結果を図5に示す。
ヒト唾液中のムチンを本発明により泳動した後、アルシアンブルーで染色した結果、図のようにブロードなバンドとして観察された(左の図)。一方、Pro−Q Emeraldで染色した場合、アルシアンブルーで染色した場合と同様の染色パターンが得られた(中央の図)。抗MUC7抗体による免疫染色では、原点のタンパク質に対する顕著な抗体の非特異吸着が見られたものの、アルシアンブルーとPro−Q Emeraldにより染色された部位が主に染色された(右の図)。また、免疫染色した時にのみ、速く泳動される成分がわずかに検出された。
以上の結果から、本発明による親水性ポリマーでコーティングされたPVDF膜を用いる電気泳動によって分離された糖タンパク質は、糖鎖の過ヨウ素酸酸化を利用する糖タンパク質の染色や抗体による免疫染色によっても検出することが可能であることが分かった。
【0032】
〈実施例3〉
(他の親水性ポリマーによる検討)
PVA以外の親水性ポリマーを用いて、実施例1と同様の手順によりPVDF膜をコーティングし、BSM、PSM、及び血漿由来タンパク質を泳動した結果を図6に示す。左から順に、ポリビニルピロリドン、ポリエチレングリコール、ポリ2−ヒドロキシエチルメタクリレートによりコーティングしたPVDF膜を用いた結果を示している。
図6から明らかなように、PVA以外の親水性ポリマーによってコーティングを行ってもPVAの場合と同等の効果が得られ、グリコサミノグリカンおよびムチン様糖タンパク質が選択的に泳動分離されることが分かった。
【0033】
〈実施例4〉
(血漿タンパク質の分離)
本発明は電気泳動に用いる緩衝液の種類を変えることによって、血漿タンパク質のような複雑なタンパク質混合物の分離にも使用することができる。泳動用緩衝液に0.06Mバルビタールナトリウム緩衝液(pH8.6)を用いて、本発明により血漿タンパク質を泳動した。また、比較としてセルロースアセテート膜電気泳動を行った。図7には、セルロースアセテート膜で電気泳動した結果と、本発明により泳動した結果を示して比較している。図7に示すようにセルロースアセテート膜電気泳動では血漿たんぱく質が6個の分画に分離されたのに対して、本発明では9個の分画に分離された。従って本発明は従来法に比べて分解能が高いことが分かった。
【0034】
〈実施例5〉
(他の疎水性高分子膜による検討)
PVDF膜以外の疎水性ポリマー膜についても実施例1と同様の手順によって、PVAによりコーティングし、これらの膜を用いて血漿タンパク質を分離した例を図8に示す。左からPVDF膜、ポリテトラフルオロエチレン膜(PTFE)、ナイロン膜(Nylon)を用いた結果を示している。使用する疎水性高分子膜によって泳動パターンは異なったが、電気泳動による分離が認められた。したがって、図8は本発明で使用する疎水性ポリマー膜がPVDF膜に限定されるものではないことを示している。
【0035】
〈実施例6〉
(血漿中のハプトグロビンの抗体染色)
実施例4と同様の手順により、本発明により血漿タンパク質を泳動した。ハプトグロビン抗体による免疫染色は、泳動後の膜をアセトン中で15分間振とうし、血漿タンパク質を膜へ固定化した後、従来公知の方法に従い実施した。すなわち、固定化後の膜を1%BSAを含むPBS中で1時間振とうしてブロッキングした。膜をPBS−T(0.05% tween)で5分間洗浄し、この洗浄操作を合計3回繰り返した。振とう洗浄後、ウサギ抗ヒトハプトグロビン抗体(IgG、1mg/mL)をPBS−Tで2000倍希釈した溶液に浸し、1時間振とうした。その後、膜をPBS−T(0.05% tween)で5分間洗浄し、この洗浄操作を合計3回繰り返した後、西洋ワサビペルオキシダーゼ標識されたヤギ抗ウサギIgG抗体をPBS−Tで2000倍希釈した溶液に浸し、1時間振とうした。その後、膜をPBS−T(0.05% tween)で5分間洗浄し、この洗浄操作を合計3回繰り返した後、コニカイムノステインキット(イムノステインHRP-1000、コニカミノルタ社製)により検出した。
【0036】
(染色結果)
ヒト血漿タンパク質の泳動結果ならびに抗ヒトハプトグロビンにより染色した結果を図9に示す。
ヒト血漿タンパク質を本発明により泳動した後、DB−71で染色した結果、図9のように9本のバンドとして観察された(図9−左)。一方、抗ハプトグロビン抗体で染色した場合、1本のバンドの染色パターンが得られた(図9−右)。ハプトグロビンは、従来用いられてきたセルロースアセテート膜電気泳動による血漿タンパク質のデータ(標準臨床検査医学 第2版 医学書院)との類似性から、バンド4に存在すると推定される。抗ハプトグロビン抗体にて染色されたバンドは、バンド4に一致することから、本手法により血漿中のハプトグロビンを特異的に染色できたと考えられる。
【0037】
以上の結果から、本発明による親水性ポリマーでコーティングされたPVDF膜を用いる電気泳動によって分離されたタンパク質は、タンパク質固定化用の疎水性膜に転写することなく、抗体による免疫染色によって特異的に検出することが可能であることが分かった。
【産業上の利用可能性】
【0038】
本発明の疎水性ポリマー膜上に親水性ポリマー層を有する電気泳動用支持体を用いると、タンパク質、糖タンパク質或いはムコ多糖を選択的に、明確に分離することができ、また、該支持体上で分離された糖タンパク質またはムコ多糖に、そのまま、糖鎖の遊離反応をさせて、糖タンパク質またはムコ多糖の中に存在する糖鎖構造の解析が可能となる。また、該支持体上で分離されたタンパク質、糖タンパク質或いはムコ多糖は、特異的抗体を用いた免疫染色法や、糖鎖の過ヨウ素酸酸化を利用する糖タンパク質の染色法による検出も可能である。これらのことから、本発明は疾患の検知に用いる検査キットとしての利用が期待される。
【図面の簡単な説明】
【0039】
【図1】BSM、PSM及び血漿由来タンパク質を、それぞれ、PVAコーティングしていないPVDF膜、及びPVAコーティングしたPVDF膜で電気泳動した結果を示す図。
【図2】PVAコーティングしたPVDF膜で分離したBSMから糖鎖を遊離し、質量分析により解析した結果を示す図。
【図3】PVAコーティングしたPVDF膜で分離したPSMから糖鎖を遊離し、質量分析により解析した結果を示す図。
【図4】コンドロイチナーゼABCで処理する前のPSMと処理した後のPSMをPVAコーティングしたPVDF膜で電気泳動した結果を示す図。
【図5】ヒト唾液中のムチンをPVAコーティングしたPVDF膜により電気泳動した後、アルシアンブルー、Pro−Q Emerald、免疫染色により染色した結果を示す図。
【図6】BSM、PSM及び血漿由来タンパク質を、それぞれ、ポリビニルピロリドン、ポリエチレングリコール、ポリ2-ヒドロキシエチルメタクリレートによりコーティングしたPVDF膜で電気泳動した結果を示す図。
【図7】血漿由来タンパク質をセルロースアセテート膜とPVAコーティングしたPVDF膜で電気泳動した結果を示す図。
【図8】PVAコーティングしたPVDF膜、ポリテトラフルオロエチレン膜(PTFE)、ナイロン膜(Nylon)を用いて血漿由来タンパク質を電気泳動した結果を示す図。
【図9】ヒト血漿タンパク質の泳動結果ならびに抗ヒトハプトグロビンにより染色した結果を示す図。
【特許請求の範囲】
【請求項1】
疎水性ポリマー膜上に親水性ポリマー層を有することを特徴とする電気泳動用支持体。
【請求項2】
前記親水性ポリマーが、ポリビニルピロリドン、ポリビニルアルコール、ポリエチレングリコール、ポリエチレンオキシド、ポリ2−ヒドロキシエチルメタクリレートから選ばれる少なくとも一種であることを特徴とする請求項1に記載の電気泳動用支持体。
【請求項3】
前記疎水性のポリマー膜が、ポリビニリデンジフルオリド、ナイロン、ポリテトラフルオロエチレンから選ばれる少なくとも一種であることを特徴とする請求項1又は2に記載の電気泳動用支持体。
【請求項4】
タンパク質またはムコ多糖の分離用であることを特徴とする請求項1〜3のいずれか1項に記載の電気泳動用支持体。
【請求項5】
請求項1〜3のいずれか1項に記載の電気泳動用支持体を用い、電気泳動によりタンパク質を分離することを特徴とするタンパク質の分離方法。
【請求項6】
前記タンパク質が、ムチン様糖タンパク質であることを特徴とする請求項5に記載のタンパク質の分離方法。
【請求項7】
前記タンパク質が、プロテオグリカン型糖タンパク質であることを特徴とする請求項5に記載のタンパク質の分離方法。
【請求項8】
請求項1〜3のいずれか1項に記載の電気泳動用支持体を用い、電気泳動によりムコ多糖を分離することを特徴とするムコ多糖の分離方法。
【請求項9】
電気泳動によりタンパク質またはムコ多糖を分離するのに用いるキットであって、請求項1〜3のいずれか1項に記載の電気泳動用支持体を備えることを特徴とするタンパク質またはムコ多糖の分離用キット。
【請求項10】
検体中に含まれるタンパク質を請求項5〜7のいずれか1項に記載の分離方法により分離し、次いで分離された膜上のタンパク質に一次抗体として抗タンパク質抗体を反応させた後、酵素により標識した二次抗体を反応させ、発色試薬を用いて検出することを特徴とするタンパク質の分離検出方法。
【請求項11】
検体中に含まれる糖タンパク質またはムコ多糖を請求項6〜8いずれか1項に記載の分離方法により分離し、次いで膜上の分離された糖タンパク質またはムコ多糖の糖鎖を過ヨウ素酸により酸化した後、色素を標識したアミン誘導体を反応させ検出することを特徴とする糖タンパク質またはムコ多糖の分離検出方法。
【請求項12】
請求項6〜8のいずれか1項に記載のタンパク質またはムコ多糖の分離方法により分離された糖タンパク質またはムコ多糖から糖鎖を遊離する方法であって、電気泳動に用いた支持体上で糖鎖遊離処理をおこなうことを特徴とする糖鎖の遊離方法。
【請求項13】
電気泳動に用いた支持体上で糖鎖遊離処理をおこなうことによって、電気泳動により分離された糖タンパク質またはムコ多糖から糖鎖を遊離するのに用いるキットであって、請求項1〜3のいずれか1項に記載の電気泳動用支持体を備えることを特徴とする糖鎖遊離用キット。
【請求項14】
請求項13に記載の遊離方法で遊離された糖鎖を用いて、前記電気泳動により分離された糖タンパク質またはムコ多糖中の糖鎖構造を解析することを特徴とする糖鎖構造の解析方法。
【請求項15】
電気泳動に用いた支持体上で糖鎖遊離処理をおこなうことによって、電気泳動により分離された糖タンパク質またはムコ多糖から糖鎖を遊離し、該遊離された糖鎖を用いて、前記電気泳動により分離された糖タンパク質またはムコ多糖中の糖鎖構造を解析するのに用いるキットであって、請求項1〜3のいずれか1項に記載の電気泳動用支持体を備えることを特徴とする糖鎖構造の解析用キット。
【請求項1】
疎水性ポリマー膜上に親水性ポリマー層を有することを特徴とする電気泳動用支持体。
【請求項2】
前記親水性ポリマーが、ポリビニルピロリドン、ポリビニルアルコール、ポリエチレングリコール、ポリエチレンオキシド、ポリ2−ヒドロキシエチルメタクリレートから選ばれる少なくとも一種であることを特徴とする請求項1に記載の電気泳動用支持体。
【請求項3】
前記疎水性のポリマー膜が、ポリビニリデンジフルオリド、ナイロン、ポリテトラフルオロエチレンから選ばれる少なくとも一種であることを特徴とする請求項1又は2に記載の電気泳動用支持体。
【請求項4】
タンパク質またはムコ多糖の分離用であることを特徴とする請求項1〜3のいずれか1項に記載の電気泳動用支持体。
【請求項5】
請求項1〜3のいずれか1項に記載の電気泳動用支持体を用い、電気泳動によりタンパク質を分離することを特徴とするタンパク質の分離方法。
【請求項6】
前記タンパク質が、ムチン様糖タンパク質であることを特徴とする請求項5に記載のタンパク質の分離方法。
【請求項7】
前記タンパク質が、プロテオグリカン型糖タンパク質であることを特徴とする請求項5に記載のタンパク質の分離方法。
【請求項8】
請求項1〜3のいずれか1項に記載の電気泳動用支持体を用い、電気泳動によりムコ多糖を分離することを特徴とするムコ多糖の分離方法。
【請求項9】
電気泳動によりタンパク質またはムコ多糖を分離するのに用いるキットであって、請求項1〜3のいずれか1項に記載の電気泳動用支持体を備えることを特徴とするタンパク質またはムコ多糖の分離用キット。
【請求項10】
検体中に含まれるタンパク質を請求項5〜7のいずれか1項に記載の分離方法により分離し、次いで分離された膜上のタンパク質に一次抗体として抗タンパク質抗体を反応させた後、酵素により標識した二次抗体を反応させ、発色試薬を用いて検出することを特徴とするタンパク質の分離検出方法。
【請求項11】
検体中に含まれる糖タンパク質またはムコ多糖を請求項6〜8いずれか1項に記載の分離方法により分離し、次いで膜上の分離された糖タンパク質またはムコ多糖の糖鎖を過ヨウ素酸により酸化した後、色素を標識したアミン誘導体を反応させ検出することを特徴とする糖タンパク質またはムコ多糖の分離検出方法。
【請求項12】
請求項6〜8のいずれか1項に記載のタンパク質またはムコ多糖の分離方法により分離された糖タンパク質またはムコ多糖から糖鎖を遊離する方法であって、電気泳動に用いた支持体上で糖鎖遊離処理をおこなうことを特徴とする糖鎖の遊離方法。
【請求項13】
電気泳動に用いた支持体上で糖鎖遊離処理をおこなうことによって、電気泳動により分離された糖タンパク質またはムコ多糖から糖鎖を遊離するのに用いるキットであって、請求項1〜3のいずれか1項に記載の電気泳動用支持体を備えることを特徴とする糖鎖遊離用キット。
【請求項14】
請求項13に記載の遊離方法で遊離された糖鎖を用いて、前記電気泳動により分離された糖タンパク質またはムコ多糖中の糖鎖構造を解析することを特徴とする糖鎖構造の解析方法。
【請求項15】
電気泳動に用いた支持体上で糖鎖遊離処理をおこなうことによって、電気泳動により分離された糖タンパク質またはムコ多糖から糖鎖を遊離し、該遊離された糖鎖を用いて、前記電気泳動により分離された糖タンパク質またはムコ多糖中の糖鎖構造を解析するのに用いるキットであって、請求項1〜3のいずれか1項に記載の電気泳動用支持体を備えることを特徴とする糖鎖構造の解析用キット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【公開番号】特開2009−265078(P2009−265078A)
【公開日】平成21年11月12日(2009.11.12)
【国際特許分類】
【出願番号】特願2008−283318(P2008−283318)
【出願日】平成20年11月4日(2008.11.4)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年5月1日 日本質量分析学会発行の「第56回質量分析総合討論会(2008)講演要旨集」に発表
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年7月29日 日本糖質学会発行の「第28回日本糖質学会年会要旨集」に発表
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年10月15日 第28回日本分子腫瘍マーカー研究会事務局発行の「第28回日本分子腫瘍マーカー研究会プログラム・講演抄録」に発表
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成19年度独立行政法人新エネルギー・産業技術総合開発機構委託研究「健康安心プログラム/糖鎖機能活用技術開発」産業技術力強化法第19条の適用を受ける特許出願
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
【公開日】平成21年11月12日(2009.11.12)
【国際特許分類】
【出願日】平成20年11月4日(2008.11.4)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年5月1日 日本質量分析学会発行の「第56回質量分析総合討論会(2008)講演要旨集」に発表
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年7月29日 日本糖質学会発行の「第28回日本糖質学会年会要旨集」に発表
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成20年10月15日 第28回日本分子腫瘍マーカー研究会事務局発行の「第28回日本分子腫瘍マーカー研究会プログラム・講演抄録」に発表
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成19年度独立行政法人新エネルギー・産業技術総合開発機構委託研究「健康安心プログラム/糖鎖機能活用技術開発」産業技術力強化法第19条の適用を受ける特許出願
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
[ Back to top ]

