疼痛の予防および/または治療剤のスクリーニング方法並びにこれに用いるためのキット
【課題】疼痛の予防および/または治療剤をスクリーニングするための新規な手段を提供する。
【解決手段】本発明のいくつかの形態により、以下のものが提供される:BDNF遺伝子および/またはCGRP遺伝子の発現を抑制する物質を探索する工程を含む、疼痛の予防および/または治療剤のスクリーニング方法;当該スクリーニング方法に用いられる疼痛の予防および/または治療剤のスクリーニング用キットであって、BDNFタンパク質をコードするポリヌクレオチドおよび/またはCGRPタンパク質をコードするポリヌクレオチドを含む、キット;BDNFタンパク質および/またはCGRPタンパク質の発現を抑制する物質を探索する工程を含む、疼痛の予防および/または治療剤のスクリーニング方法;並びに、当該スクリーニング方法に用いられる疼痛の予防および/または治療剤のスクリーニング用キットであって、BDNFタンパク質および/またはCGRPタンパク質を含む、キット。
【解決手段】本発明のいくつかの形態により、以下のものが提供される:BDNF遺伝子および/またはCGRP遺伝子の発現を抑制する物質を探索する工程を含む、疼痛の予防および/または治療剤のスクリーニング方法;当該スクリーニング方法に用いられる疼痛の予防および/または治療剤のスクリーニング用キットであって、BDNFタンパク質をコードするポリヌクレオチドおよび/またはCGRPタンパク質をコードするポリヌクレオチドを含む、キット;BDNFタンパク質および/またはCGRPタンパク質の発現を抑制する物質を探索する工程を含む、疼痛の予防および/または治療剤のスクリーニング方法;並びに、当該スクリーニング方法に用いられる疼痛の予防および/または治療剤のスクリーニング用キットであって、BDNFタンパク質および/またはCGRPタンパク質を含む、キット。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、疼痛の予防および/または治療剤のスクリーニング方法並びにこれに用いるためのキットに関する。
【背景技術】
【0002】
生体組織が損傷を受けると、痛みとして感じることで損傷を認識する。炎症などによる過度な痛みは患者に苦痛となるばかりで、生物学的な意義が少なく、よってこの痛み(疼痛)を早急に緩和することが望ましい。しかし、疼痛を感じる機構については種々の報告がなされているが、その機構は複雑であり未解明な部分も多い。
【0003】
現在、疼痛を抑制することを目的として、各種の鎮痛剤や麻薬などが用いられているが、これらの薬剤が疼痛抑制効果を示さない疼痛もある。従来の薬物療法において使用されてきた鎮痛剤としては、モルヒネに代表される中枢性オピオイド受容体作動薬、インドメタシンに代表される非ステロイド系抗炎症薬(NSAIDs)などがある。しかしながら、これらの鎮痛剤は、有用性、安全性、常習性などの面で問題があることから、疼痛を予防および/または治療するための新規な薬剤の開発が依然として喫緊の課題として存在する。
【0004】
開発を希望する薬剤の属性に応じて、きわめて多様なスクリーニング方法がこれまでに研究・報告されている。そして、疼痛の予防および/または治療剤のスクリーニング方法に関連するものとしては、例えば特許文献1に、全身性疼痛疾患の治療薬のスクリーニング方法が開示されている。しかしながら、この方法は、拘束ストレス等のストレスを負荷することによって作出された非ヒト動物モデルを用いるものであることから、多大な時間およびコストを必要とするという問題がある。
【0005】
一方、動物モデルを用いないスクリーニング方法として、例えば特許文献2には、被験物質をニューロトロフィン受容体p75(p75NTR)と接触させ、当該被験物質がproNGF(神経成長因子の前駆物質)とp75NTRとの結合を阻害する場合に、当該被験物質は鎮痛剤の候補物質であると判定する方法が開示されている。
【0006】
ところで、疼痛に関与する因子として、神経成長因子(NGF;Nerve Growth Factor)が知られている。このNGFは、種々の急性または慢性の疼痛において痛みの発生に重要な役割を果たしており、当初は発生の過程で感覚ニューロンおよび交感神経節前ニューロンの生存および分化を促進する分子として同定された、ニューロトロフィンファミリーの中で最も主要な因子である。
【0007】
このNGFに関連した技術として、例えば特許文献3には、NGFとTrkA受容体との結合を阻害する物質(例えば、抗NGF抗体)を、慢性疼痛の予防および/または治療剤として用いる技術が開示されている。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2009−195200号公報
【特許文献2】再表2007/026567号公報
【特許文献3】特表2008−542439号公報
【発明の概要】
【発明が解決しようとする課題】
【0009】
上述したように、疼痛の予防および/または治療剤をスクリーニングする方法はこれまでにもいくつか提案されているが、疼痛の予防および/または治療剤として決定的に有効なものは依然として開発されてはいないのが現状である。また、疼痛の種類やその重篤度に応じた予防および/または治療剤のラインアップを充実させるという観点からも、数多くのスクリーニング方法を開発することの意義は大きい。
【0010】
そこで本発明は、疼痛の予防および/または治療剤をスクリーニングするための新規な手段を提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明者らは、研究を行う過程で、マウス由来後根神経節細胞の初代培養系にNGFを投与すると、疼痛関連遺伝子であるBDNF(脳由来神経栄養因子;Brain-Derived Neutrophic Factor)遺伝子およびCGRP(カルシトニン遺伝子関連ペプチド;Calcitonin Gene-Related Peptide)遺伝子の発現がコントロールと比較して2〜3倍に増加することを見出した。そして、かような遺伝子の発現誘導がNGF投与によるものであることも確認した。これらの知見に基づき、本発明者らは、BDNF遺伝子および/またはCGRP遺伝子、あるいはこれらの遺伝子によってコードされるタンパク質の発現を指標とすることにより、疼痛の予防および/または治療剤をスクリーニングするための手段が提供されうることを確信し、本発明を完成させるに至ったのである。
【0012】
すなわち、本発明の一形態によれば、BDNF遺伝子(例えば、配列番号:1に記載の塩基配列からなるもの)および/またはCGRP遺伝子(例えば、配列番号:3に記載の塩基配列からなるもの)の発現を抑制する物質を探索する工程を含む、疼痛の予防および/または治療剤のスクリーニング方法が提供される。
【0013】
ここで、前記疼痛は、好ましくは神経成長因子(NGF)惹起性の疼痛である。そして、前記物質を探索する工程は、以下の工程(I)〜(III):
(I)BDNF遺伝子および/またはCGRP遺伝子を発現可能な細胞と、被験物質とを接触させる工程、
(II)前記被験物質を接触させた前記細胞における、BDNF遺伝子および/またはCGRP遺伝子の発現量を測定する工程、および、
(III)前記発現量を前記被験物質に接触させない対照細胞における発現量と比較して、BDNF遺伝子および/またはCGRP遺伝子の発現量を減少させる被験物質を候補物質として選択する工程、
を含むことが好ましい。より好ましくは、前記疼痛が神経成長因子(NGF)惹起性の疼痛である場合に、前記工程(I)を神経成長因子(NGF)の存在下で行う。
【0014】
また、本発明の他の形態によれば、上述したスクリーニング方法に用いられる疼痛の予防および/または治療剤のスクリーニング用キットであって、BDNFタンパク質をコードするポリヌクレオチドおよび/またはCGRPタンパク質をコードするポリヌクレオチドを含むものが提供される。
【0015】
一方、本発明のさらに他の形態によれば、BDNFタンパク質(例えば、配列番号:2に記載のアミノ酸配列からなるもの)および/またはCGRPタンパク質(例えば、配列番号:4に記載のアミノ酸配列からなるもの)の発現を抑制する物質を探索する工程を含む、疼痛の予防および/または治療剤のスクリーニング方法が提供される。
【0016】
ここで、前記疼痛は、好ましくは神経成長因子(NGF)惹起性の疼痛である。そして、前記物質を探索する工程は、以下の工程(I)〜(III):
(I)BDNFタンパク質および/またはCGRPタンパク質を発現可能な細胞または前記細胞から調製した細胞画分と、被験物質とを接触させる工程、
(II)前記被験物質を接触させた前記細胞または前記細胞画分における、BDNFタンパク質および/またはCGRPタンパク質の発現量を測定する工程、および、
(III)前記発現量を前記被験物質に接触させない対照細胞または前記対照細胞から調製した対照細胞画分における発現量と比較して、BDNFタンパク質および/またはCGRPタンパク質の発現量を減少させる被験物質を候補物質として選択する工程、
を含むことが好ましい。より好ましくは、前記疼痛が神経成長因子(NGF)惹起性の疼痛であり、前記工程(I)を神経成長因子(NGF)の存在下で行う。
【0017】
また、本発明のさらに他の形態によれば、上述したスクリーニング方法に用いられる疼痛の予防および/または治療剤のスクリーニング用キットであって、BDNFタンパク質および/またはCGRPタンパク質を含むものが提供される。
【発明の効果】
【0018】
本発明によれば、疼痛の予防および/または治療剤をスクリーニングするための新規な手段が提供されうる。そして、本発明により提供されるスクリーニング手段によれば、マウス個体を用いた従来の疼痛モデルによる結果と同様の結果が得られることから、より簡便なスクリーニング手段を提供するものとして、きわめて優位性の高いものである。本発明により提供されるスクリーニング技術を利用することで、新規な疼痛の予防および/または治療剤の候補物質の発見とその後の研究開発がより一層活発に行われることが期待される。
【図面の簡単な説明】
【0019】
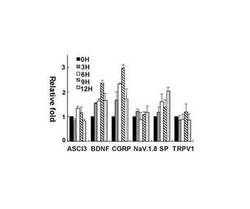
【図1】実施例において、C57/BL6マウス成体より分離した後根神経節(DRG;Dorsal Root Ganglion)の初代培養細胞にNGFを投与し、所定時間後にサンプルを回収してリアルタイムPCRによって6種の疼痛関連遺伝子(ASCI3、BDNF、CGRP、NaV.1.8、Substance P、TRPV1)の発現誘導を解析した結果を示すグラフである。
【図2】実施例において、BDNF遺伝子およびCGRP遺伝子の発現がNGF投与によって誘導されることを示す目的で、抗NGF抗体投与後にNGFを投与し、所定時間後にサンプルを回収してリアルタイムPCRによってBDNF遺伝子およびCGRP遺伝子の発現を解析した結果を示すグラフである。
【図3】実施例において、本発明により提供されるスクリーニング手段が従来の疼痛モデルと同様の結果を示すことを検証する目的で、NGFとともにアルブミンを投与したC57/BL6マウス成体より所定時間後に分離した後根神経節からサンプルを調製してリアルタイムPCRによって2種の疼痛関連遺伝子(BDNF、CGRP)の発現誘導を解析した結果を示すグラフである。
【発明を実施するための形態】
【0020】
本発明の一形態は、BDNF遺伝子および/またはCGRP遺伝子の発現を抑制する物質を探索する工程を含む、疼痛の予防および/または治療剤のスクリーニング方法である。
【0021】
BDNF(brain-derived neurotrophic factor)遺伝子の塩基配列は、ヒトおよびマウスについて、GenBankに登録されている(アクセッション番号:M37762.1(ヒト;配列番号:1)、BC034862.1(マウス))。また、これらの遺伝子によってコードされるBDNFタンパク質のアミノ酸配列もまた、ヒトおよびマウスについて、GenBankに登録されている(アクセッション番号:AAA51820.1(ヒト;配列番号:2)、AAH34862.1(マウス))。なお、配列番号:1に記載の塩基配列からなるポリヌクレオチドは、例えば、文献(Proc. Natl. Acad. Sci. U.S.A. 87 (20), 8060-8064 (1990))に記載の手法により得ることができる。
【0022】
同様に、CGRP遺伝子の塩基配列もまた、ヒトおよびマウスについて、GenBankに登録されている(アクセッション番号:NM_001033953.2(ヒト;配列番号:3)、NM_001033954.3(マウス))。さらに、これらの遺伝子によってコードされるCGRPタンパク質のアミノ酸配列もまた、ヒトおよびマウスについて、GenBankに登録されている(アクセッション番号:NP_001029125.1(ヒト;配列番号:4)、NP_001029126.1(マウス))。なお、配列番号:3に記載の塩基配列からなるポリヌクレオチドは、例えば、文献(J. Biol. Chem. 266 (36), 24627-24631 (1991))に記載の手法により得ることができる。
【0023】
本発明において、「BDNF遺伝子」および「CGRP遺伝子」には、それぞれ、特定の塩基配列(配列番号:1および配列番号:3)に記載の塩基配列からなる遺伝子のみならず、これらによりコードされるタンパク質と生物学的機能が同等であるタンパク質(例えば、同族体等)をコードする遺伝子が含まれる。具体的には、「BDNF遺伝子」には、以下のような遺伝子が含まれる。
(A)配列番号:1に記載の塩基配列からなる遺伝子
(B)前記(A)の塩基配列において、1個〜30個、好ましくは1個〜10個、より好ましくは1個〜5個の塩基が欠失、置換または付加された塩基配列からなり、かつ、NGFによって発現が誘導されるBDNFタンパク質をコードする遺伝子
(C)前記(A)の塩基配列において1個〜30個、好ましくは1個〜10個、より好ましくは1個〜5個の塩基が欠失、置換または付加された塩基配列からなり、前記(A)のDNAとストリンジェントな条件下でハイブリダイズする遺伝子
(D)前記(A)の塩基配列において1個〜30個、好ましくは1個〜10個、より好ましくは1個〜5個の塩基が欠失、置換または付加された塩基配列からなり、配列番号:1に記載の塩基配列との相同性が少なくとも60%以上、好ましくは80%以上、より好ましくは95%以上である遺伝子。
(E)前記(A)〜(D)のいずれかの遺伝子と相補的な塩基配列からなる遺伝子
同様に、「CGRP遺伝子」には、以下のような遺伝子が含まれる。
(A)配列番号:3に記載の塩基配列からなる遺伝子
(B)前記(A)の塩基配列において、1個〜30個、好ましくは1個〜10個、より好ましくは1個〜5個の塩基が欠失、置換または付加された塩基配列からなり、かつ、NGFによって発現が誘導されるCGRPタンパク質をコードする遺伝子
(C)前記(A)の塩基配列において1個〜30個、好ましくは1個〜10個、より好ましくは1個〜5個の塩基が欠失、置換または付加された塩基配列からなり、前記(A)のDNAとストリンジェントな条件下でハイブリダイズする遺伝子
(D)前記(A)の塩基配列において1個〜30個、好ましくは1個〜10個、より好ましくは1個〜5個の塩基が欠失、置換または付加された塩基配列からなり、配列番号:1に記載の塩基配列との相同性が少なくとも60%以上、好ましくは80%以上、より好ましくは95%以上である遺伝子。
(E)前記(A)〜(D)のいずれかの遺伝子と相補的な塩基配列からなる遺伝子
上述の(C)において、ハイブリダイズのストリンジェントな条件としては、当該技術分野における標準の条件が挙げられるが、例えば、温度条件は、配列番号:1で示された塩基配列のTm値の±5℃、好ましくは±2℃、より好ましくは±1℃である。条件の具体例として、5×SSC溶液、10×Denhardt溶液、100μg/mlサケ精子DNAおよび1%SDS中、65℃でのハイブリダイゼーション、0.2×SSCおよび1%SDS中、65℃、30分の洗浄(2回)、続いて、0.2×SSCおよび0.1%SDS中、65℃、30分の洗浄(2回)が挙げられる。
【0024】
なお、添付の配列表の配列番号:2に記載のアミノ酸配列からなるタンパク質は、配列番号:1に記載の塩基配列からなる遺伝子によってコードされるものである。また、添付の配列表の配列番号:4に記載のアミノ酸配列からなるタンパク質は、配列番号:3に記載の塩基配列からなる遺伝子によってコードされるものである。
【0025】
本発明において、用語「タンパク質」には、特定のアミノ酸配列で示されるタンパク質のみならず、これらと生物学的機能が同等である断片、同族体、誘導体および変異体を含む。例えば、上述のBDNFタンパク質には、配列番号:2に記載のアミノ酸配列からなるタンパク質のみならず、その相同体や変異体も含む。具体的には、当該BDNFタンパク質には、以下のようなタンパク質が含まれる。
(A)配列番号:2に記載のアミノ酸配列からなるタンパク質
(B)前記(A)のアミノ酸配列において、1個〜30個、好ましくは1個〜10個、より好ましくは1個〜5個のアミノ酸が欠失、置換または付加されたアミノ酸配列からなり、かつ、NGFによって発現が誘導されるタンパク質
(C)前記(A)のアミノ酸配列において1個〜30個、好ましくは1個〜10個、より好ましくは1個〜5個のアミノ酸が欠失、置換または付加されたアミノ酸配列からなり、配列番号:2に記載のアミノ酸配列との相同性が少なくとも60%以上、好ましくは80%以上、より好ましくは95%以上であるタンパク質。
【0026】
同様に、CGRPタンパク質には、以下のようなタンパク質が含まれる。
(A)配列番号:4に記載のアミノ酸配列からなるタンパク質
(B)前記(A)のアミノ酸配列において、1個〜30個、好ましくは1個〜10個、より好ましくは1個〜5個のアミノ酸が欠失、置換または付加されたアミノ酸配列からなり、かつ、NGFによって発現が誘導されるタンパク質
(C)前記(A)のアミノ酸配列において1個〜30個、好ましくは1個〜10個、より好ましくは1個〜5個のアミノ酸が欠失、置換または付加されたアミノ酸配列からなり、配列番号:4に記載のアミノ酸配列との相同性が少なくとも60%以上、好ましくは80%以上、より好ましくは95%以上であるタンパク質。
【0027】
これらのタンパク質の調製方法は、特に制限されないが、例えば、前記タンパク質をコードするポリヌクレオチドを、適当な発現ベクターに組み込み、大腸菌等の原核生物、酵母、昆虫細胞、哺乳類細胞等の真核生物細胞、または、インビトロで前記タンパク質を発現させ、単離する方法が挙げられる。これらの方法は、当業者であれば、適宜選択して実施できる。
【0028】
以下、本発明のスクリーニング方法の一例を具体的に説明する。
【0029】
(1)BDNF遺伝子および/またはCGRP遺伝子の発現抑制活性を指標とする疼痛の予防および/または治療剤のスクリーニング方法
まず、本発明の第1のスクリーニング方法について詳細に説明する。第1のスクリーニング方法は、上述のように、BDNF遺伝子および/またはCGRP遺伝子の発現を抑制する物質を探索する工程を含む、疼痛の予防および/または治療剤のスクリーニング方法である。
【0030】
本明細書において、「疼痛」とは、特に制限されず「痛み」一般を意味し、例えば、炎症による急性痛、慢性炎症に伴う痛み、急性炎症に伴う痛み、術後痛(切開創の痛み、深部痛、内臓痛、術後慢性痛など)、筋肉痛(慢性痛疾患に伴う筋肉痛、肩こりなど)、関節痛、歯痛、顎関節痛、頭痛(偏頭痛、緊張型頭痛、発熱に伴う頭痛、高血圧に伴う頭痛)、内臓痛(心臓痛、狭心痛、腹痛、腎臓の痛み、尿管の痛み、膀胱の痛み)、産婦人科領域の痛み(中間痛、月経困難、陣痛)、神経痛(椎間板ヘルニア、神経根痛、帯状疱疹後神経痛、三叉神経痛)、癌性疼痛、反射性交感神経性萎縮症、複雑局所痛症候群などが挙げられる。なかでも、本発明において好ましくは、疼痛は神経成長因子(NGF)惹起性の疼痛である。ここで、疼痛が「NGF惹起性である」とは、NGFによって痛みが引き起こされる場合だけでなく、もともとあった痛みがNGFによって増強される場合をも意味する概念である。上記で列挙したもののうち、NGF惹起性の疼痛としては、炎症による急性痛、慢性炎症に伴う痛み、急性炎症に伴う痛み、神経痛、癌性疼痛などが挙げられる。
【0031】
このスクリーニング方法において、「物質を探索する工程」は、以下の工程(I)〜(III):
(I)BDNF遺伝子および/またはCGRP遺伝子を発現可能な細胞と、被験物質とを接触させる工程、
(II)前記被験物質を接触させた前記細胞における、BDNF遺伝子および/またはCGRP遺伝子の発現量を測定する工程、および、
(III)前記発現量を前記被験物質に接触させない対照細胞における発現量と比較して、BDNF遺伝子および/またはCGRP遺伝子の発現量を減少させる被験物質を候補物質として選択する工程、
を含むことが好ましい。
【0032】
このスクリーニングに用いられる細胞としては、BDNF遺伝子および/またはCGRP遺伝子を発現可能な細胞であれば特に限定はないが、例えば、後根神経節から調製した細胞が挙げられる。そのほかにも、例えば、大脳皮質顆粒細胞、神経芽腫、褐色細胞腫由来の細胞もまた、用いられうる。
【0033】
本発明の第1のスクリーニング方法のより好ましい形態では、疼痛が神経成長因子(NGF)惹起性の疼痛である場合に、上述した工程(I)を神経成長因子(NGF)の存在下で行う。また、本発明の第1のスクリーニング方法の好ましい一実施形態では、スクリーニング方法に用いられるBDNF遺伝子が配列番号:1に記載の塩基配列からなる遺伝子である。同様に、本発明の第1のスクリーニング方法の他の好ましい一実施形態では、スクリーニング方法に用いられるCGRP遺伝子が配列番号:3に記載の塩基配列からなる遺伝子である。なお、本発明の第1のスクリーニング方法においては、BDNF遺伝子およびCGRP遺伝子のいずれか一方のみを用いてもよいし、双方を併用してもよい。
【0034】
被験物質としては、特に制限されないが、核酸、ペプチド、タンパク質、有機化合物、無機化合物などが挙げられる。スクリーニングは、これらの被験物質を含む試料(被験試料)を上述の細胞と接触させて行うことができる。被験試料としては、特に制限されないが、細胞抽出液、遺伝子ライブラリーの発現産物、合成低分子化合物、合成ペプチド、天然化合物などが挙げられる。
【0035】
前記工程(I)において、BDNF遺伝子および/またはCGRP遺伝子を発現可能な細胞と被験物質との接触は、例えば37℃で、5分〜720時間の条件で行うことができる。
【0036】
また、上述の細胞と被験物質との接触は、当該細胞が成育可能な条件下で培養しながら行ってもよい。また、当該細胞と被験物質とを接触させる条件は、特に制限されないが、細胞が死滅しないように、その培養条件(pH、温度、培地等)を選択することができる。
【0037】
被験物質と接触させる際の上記細胞の細胞数は、例えば98ウェルプレートを用いる場合、例えば1.0×103〜1.0×107個/ウェル、好ましくは1.0×104〜1.0×106個/ウェル、より好ましくは1.0×105〜1.0×106個/ウェルである。
【0038】
対照細胞とは、工程(I)で用いられるBDNF遺伝子および/またはCGRP遺伝子を発現可能な細胞において、被験物質を接触させない細胞を意味する。被験物質を接触させない場合とは、前記被験物質の代わりに前記被験物質と同量の溶媒(ブランク)を添加する場合や、これらの遺伝子の発現に影響を与えないコントロール物質を添加する場合などがある。
【0039】
工程(II)において、BDNF遺伝子および/またはCGRP遺伝子の発現量を測定する方法としては、上記細胞から調製したRNAまたはRNAから転写された相補的なポリヌクレオチドを用いる、in situハイブリダイゼーション、ノーザンブロッティング、ドットプロット、RNaseプロテクションアッセイ等のほか、マイクロアレイを用いる方法、リアルタイムPCR法等のPCRを利用する方法、RNA鎖を直接測定する方法等の迅速な測定が可能な方法が挙げられる。
【0040】
工程(III)では、工程(I)および工程(II)を経て検出・定量したBDNF遺伝子および/またはCGRP遺伝子の発現レベルに基づき、BDNF遺伝子および/またはCGRP遺伝子の発現を抑制する被験物質を、疼痛の予防および/または治療剤の候補物質として選択することができる。具体的には、例えば、被験物質を添加した細胞におけるBDNF遺伝子および/またはCGRP遺伝子の発現量が、対照細胞における発現量と比較して、減少している場合(好ましくは70%以下、より好ましくは50%以下、さらに好ましくは10%以下に減少している場合)に、被験物質を、疼痛の予防および/または治療剤の候補物質として選択することができる。
【0041】
また、本発明の他の形態によれば、上述した第1のスクリーニング方法に用いられる、疼痛の予防および/または治療剤のスクリーニング用キットもまた、提供される。当該キットは、具体的には、BDNFタンパク質をコードするポリヌクレオチドおよび/またはCGRPタンパク質をコードするポリヌクレオチドを含むものでありうる。かような構成とすることで、当該キットは、例えば、キットに含まれるプローブを選択的に使用してマイクロアレイを製造する場合や、リアルタイムPCR法により検出する場合などに利用されうる。
【0042】
(2)BDNFタンパク質および/またはCGRPタンパク質の発現抑制活性を指標とする疼痛の予防および/または治療剤のスクリーニング方法
次に、本発明の第2のスクリーニング方法について説明する。第2のスクリーニング方法は、上述のように、BDNFタンパク質および/またはCGRPタンパク質の発現を抑制する物質を探索する工程を含む、疼痛の予防および/または治療剤のスクリーニング方法である。
【0043】
このスクリーニング方法において、「物質を探索する工程」は、以下の工程(I)〜(III):
(I)BDNFタンパク質および/またはCGRPタンパク質を発現可能な細胞または前記細胞から調製した細胞画分と、被験物質とを接触させる工程、
(II)前記被験物質を接触させた前記細胞または前記細胞画分における、BDNFタンパク質および/またはCGRPタンパク質の発現量を測定する工程、および、
(III)前記発現量を前記被験物質に接触させない対照細胞または前記対照細胞から調製した対照細胞画分における発現量と比較して、BDNFタンパク質および/またはCGRPタンパク質の発現量を減少させる被験物質を候補物質として選択する工程、
を含むことが好ましい。
【0044】
このスクリーニングに用いられる細胞としては、BDNFタンパク質および/またはCGRPタンパク質を発現可能な細胞であれば特に限定はない。具体的には、上記(1)の第1のスクリーニング方法の欄に記載の細胞が同様に用いられうる。
【0045】
本発明の第1のスクリーニング方法のより好ましい形態では、疼痛が神経成長因子(NGF)惹起性の疼痛である場合に、上述した工程(I)を神経成長因子(NGF)の存在下で行う。また、本発明の第1のスクリーニング方法の好ましい一実施形態では、スクリーニング方法に用いられるBDNFタンパク質が配列番号:2に記載のアミノ酸配列からなるタンパク質遺伝子である。同様に、本発明の第1のスクリーニング方法の他の好ましい一実施形態では、スクリーニング方法に用いられるCGRPタンパク質が配列番号:4に記載のアミノ酸配列からなるタンパク質である。なお、本発明の第2のスクリーニング方法においては、BDNFタンパク質およびCGRPタンパク質のいずれか一方のみを用いてもよいし、双方を併用してもよい。
【0046】
本発明の第2のスクリーニング方法において、BDNFタンパク質および/またはCGRPタンパク質の発現は、BDNF遺伝子および/またはCGRP遺伝子の発現産物であるタンパク質を検出することにより、確認することができる。
【0047】
BDNFタンパク質および/またはCGRPタンパク質を検出する方法としては、特に制限されないが、例えば、BDNFタンパク質および/またはCGRPタンパク質に特異的な抗体を用いた免疫学的測定方法が挙げられる。前記免疫学的測定方法としては、ウエスタンブロット、ELISA、サンドウィッチELISA等が挙げられる。前記抗体は、BDNFタンパク質および/またはCGRPタンパク質を用いて従来公知の方法で作製でき、ポリクローナル抗体であってもよいし、モノクローナル抗体であってもよい。また、BDNFタンパク質および/またはCGRPタンパク質の調製方法は、特に制限されないが、例えば、これらのタンパク質をコードするポリヌクレオチドを、適当な発現ベクターに組み込み、大腸菌等の原核生物、酵母、昆虫細胞、哺乳類細胞等の真核生物細胞、または、インビトロで前記ポリペプチドを発現させ、単離する方法が挙げられる。これらの方法は、当業者であれば、適宜選択して実施できる。
【0048】
被験物質としては、上記(1)の第1のスクリーニング方法の欄に記載の物質が同様に用いられうる。また、対照細胞の定義は、上記(1)の第1のスクリーニング方法における定義と同じである。
【0049】
また、本発明の他の形態によれば、上述した第2のスクリーニング方法に用いられる、疼痛の予防および/または治療剤のスクリーニング用キットもまた、提供される。当該キットは、具体的には、BDNFタンパク質および/またはCGRPタンパク質を含むものでありうる。当該キットは、BDNFタンパク質および/またはCGRPタンパク質に特異的な抗体等を含んでもよい。
【実施例】
【0050】
以下、実施例を用いて本発明を詳述するが、本発明は以下の実施例に限定されるものではない。
【0051】
≪初代培養後根神経節の培養≫
C57/BL6マウス成体(8〜12週齢)より後根神経節(DRG)を分離し、コラゲナーゼタイプIV(500U/mL)(Worthington Biochemicals、cat #CLS3)およびDNAse I(0.12μg/mL、タカラバイオ株式会社、cat #P75454)を含むDMEM培地(Dulbecco's Modified Eagle's Medium)(和光純薬工業株式会社、cat #043-30085)で2時間(37℃)培養した(文献:Komagiri Y, Kitamura N: Effect of intracellular dialysis of ATP on the hyperpolarization-activated cation current in rat dorsal root ganglion neurons. J Neurophysiol (2003) 90:2115-2122を参照)。その後、トリプシン(0.25%wt/vol)(ライフテクノロジーズジャパン株式会社、cat #15400054)を加えたDMEM培地で15分間(37℃)培養し、1mLのピペットチューブ(greiner bio-one Co., Ltd、cat #741045)で撹拌し、1500回転にて3分間遠心分離して上清を取り除いた。分離した細胞は、B27添加物(ライフテクノロジーズジャパン株式会社、cat #17504-044)、ペニシリン(100U/mL)、およびストレプトマイシン(100μg/mL)(ライフテクノロジーズジャパン株式会社、cat #15070-063)を加えたDMEM培地で、ポリ−L−リジン(Sigma-Aldrich Co.、cat #P-1524)でコーティングした24穴細胞皿(greiner bio-one Co., Ltd.、cat #662160)を用いて、37℃ 5%CO2培養器(ASTEC、cat #SCA-165D)の中で3日間培養し、実験に用いた。
【0052】
≪NGFの投与≫
上述した手法により培養した後根神経節の初代培養細胞に、200ng/mLの濃度のNGF(Nerve Growth Factor)(Sigma-Aldrich Co.、cat #N6009)を投与し、投与後0、3、6、9、および12時間後にサンプルを回収して、解析に用いた。なお、コントロールとしては、NGFを投与しなかったこと以外は同様に培養・回収した細胞を用いた。
【0053】
≪リアルタイムPCRを用いた疼痛関連遺伝子の発現誘導解析≫
上述した手法により回収した初代培養後根神経節の細胞から、TRIZOL(ライフテクノロジーズジャパン株式会社、cat #15596-026)を用いてRNAを抽出し、cDNA合成キット(ABI High Capacity cDNA Reverse Transcription Kit、ライフテクノロジーズジャパン株式会社、cat #4368814)により、First strand cDNAを合成した。これを鋳型としてTHUNDERBIRD(商標)SYBR(登録商標)qPCR Mix(東洋紡績株式会社、cat #QPK-201)を用いて、7300 Real-Time PCR System (ライフテクノロジーズジャパン株式会社)によりリアルタイムPCRを施行し、6種の疼痛関連遺伝子(ASCI3、BDNF、CGRP、NaV.1.8、Substance P、TRPV1)の発現誘導を解析した。リアルタイムPCRの反応条件は、50℃×2分間(1サイクル)、95℃×10分間(1サイクル)、95℃×20秒間→60℃×1分間(40サイクル)を用いた。
【0054】
各遺伝子の相対的発現比を、GAPDH(glyceraldehyde-3-phosphate dehydrogenase)のmRNA発現量を標準にしてΔΔCt法を用いて計算した。なお、各遺伝子の増幅のためのプライマーの塩基配列としては、文献(Bretagne S, Durand R, Olivi M, Garin JF, Sulahian A, Rivollet D, Vidaud M, Deniau M: Real-time PCR as a new tool for quantifying Leishmania infantum in liver in infected mice. Clin Diagn Lab Immunol (2001) 8:828-831;Goss JR, Goins WF, Lacomis D, Mata M, Glorioso JC, Fink DJ: Herpes simplex-mediated gene transfer of nerve growth factor protects against peripheral neuropathy in streptozotocin-induced diabetes in the mouse. Diabetes (2002) 51:2227-2232;Yen YT, Tu PH, Chen CJ, Lin YW, Hsieh ST, Chen CC: Role of acid-sensing ion channel 3 in sub-acute-phase inflammation.. Mol Pain (2009) 5:1)のいずれかに記載されているものを採用した。
【0055】
結果を図1に示す。なお、図1において、横軸はNGF投与後0〜12時間の各疼痛関連遺伝子の種類(ASCI3、BDNF、CGRP、NaV.1.8、SP、TRPV1)を示し、縦軸はGAPDH発現量に対する各遺伝子の発現量の相対値を示す。また、グラフの各値は、5回の実験結果についての(平均値±標準誤差)である。
【0056】
図1に示すように、NGF投与から6〜9時間後(6H、9H)において、BDNF遺伝子およびCGRP遺伝子では約2〜3倍の発現誘導が認められた。これに対し、これら以外の遺伝子(ASCI3、NaV.1.8、SP、TRPV1)の発現誘導はわずかであった。
【0057】
≪NGF中和抗体前処理時のBDNF遺伝子およびCGRP遺伝子の発現誘導抑制≫
上述した発現誘導実験において、NGF(200ng/mL)投与の30分前に、NGF中和抗体(Sigma-Aldrich Co.、cat #N6655)(1,000倍希釈)を投与し、NGF投与後0、6、9時間の時点でサンプルを回収して、リアルタイムPCRを施行した。コントロール(Mock)としては、Rabbit serum(Sigma-Aldrich Co.、cat #R9133)を同濃度投与した。
【0058】
結果を図2に示す。なお、図2において、横軸はMock(コントロール群)またはAnti-NGF(NGF中和抗体投与群)のそれぞれに対するBDNF(NGF投与後0,3,6時間)またはCGRP(NGF投与後0,3,6時間)を示し、縦軸はGAPDH発現量に対する各遺伝子の発現量の相対値を示す。また、グラフの各値は、3回の実験結果についての(平均値±標準誤差)である。
【0059】
図2に示すように、左の2つのレーン(Mock(コントロール群))と比較して、右の2つのレーン(Anti-NGF(NGF中和抗体投与号))では、BDNF遺伝子およびCGRP遺伝子の発現誘導は抑制された。このことから、BDNF遺伝子およびCGRP遺伝子はNGF投与により発現が誘導されることが示された。
【0060】
≪マウス疼痛モデルによる検証≫
NGF(Sigma-Aldrich Co.、cat #N6009)を、0.1%アルブミン(Sigma-Aldrich Co.、cat #A7906)とともに生理食塩水に溶解し(0.1μg/μL濃度)、10μLをマウス(C57/BL6、6〜8週齢オス)の後肢の肉球に投与した。文献(Journal of Neuroscience Research 86:3566-3574 (2008))によれば、NGFが投与されたマウスは、投与後1〜24時間以内は有意に熱刺激に対する感受性が増加する。NGF投与後、3時間後および6時間後に、第3、4、5腰椎の後根神経節を取り出した(各時間、それぞれ計4匹のマウスより)。一方、コントロール群として、0.1%アルブミンのみを生理食塩水に溶解した溶液10μLを同様に後肢の肉球に投与したマウス(C57/BL6, 6-8週齢♂)を用いた。
【0061】
各群のマウスの後根神経節から、TRIZOL(ライフテクノロジーズジャパン株式会社、cat #15596-026)を用いてRNAを抽出し、cDNA合成キット(ABI High Capacity cDNA Reverse Transcription Kit、ライフテクノロジーズジャパン株式会社、cat #4368814)により、First strand cDNAを合成した。これを鋳型としてTHUNDERBIRD(商標)SYBR(登録商標)qPCR Mix(東洋紡績株式会社、cat #QPK-201)を用いて、7300 Real-Time PCR System (ライフテクノロジーズジャパン株式会社)によりリアルタイムPCRを施行し、2種の疼痛関連遺伝子(BDNF、CGRP)の発現誘導を各群間で比較した。リアルタイムPCRの反応条件は、50℃×2分間(1サイクル)、95℃×10分間(1サイクル)、95℃×20秒間→60℃×1分間(40サイクル)を用いた。
【0062】
各遺伝子の相対的発現比を、GAPDHのmRNA発現量を標準にしてΔΔCt法を用いて計算した。なお、各遺伝子の増幅のためのプライマーの塩基配列としては、上述した≪リアルタイムPCRを用いた疼痛関連遺伝子の発現誘導解析≫の欄に記載の文献のいずれかに記載されているものを採用した。
【0063】
結果を図3に示す。図3に示すように、NGF投与から6時間後(6h)において、BDNF遺伝子およびCGRP遺伝子ではコントロール群に対して約2〜3倍のmRNA発現誘導が認められた。
【0064】
以上のことから、例えばマウス成体の初代培養後根神経節(DRG)の細胞を用い、NGF投与後6〜9時間のBDNF遺伝子および/またはCGRP遺伝子の発現誘導を指標とすることで、疼痛(好ましくはNGF惹起性の疼痛)の予防および/または治療剤をスクリーニングするための手段(スクリーニング方法やこれに用いるためのキット)が提供されうる。そして、本発明により提供されるスクリーニング手段によれば、マウス個体を用いた従来の疼痛モデルによる結果と同様の結果が得られることから、より簡便なスクリーニング手段を提供するものとして、きわめて優位性の高いものである。
【配列表フリーテキスト】
【0065】
〔配列番号:1〕
BDNF遺伝子(アクセッション番号:M37762.1)の塩基配列を表す。
〔配列番号:2〕
BDNF遺伝子によってコードされるBDNFタンパク質(アクセッション番号:AAA51820.1)のアミノ酸配列を表す。
〔配列番号:3〕
CGRP遺伝子(アクセッション番号:NM_001033953.2)の塩基配列を表す。
〔配列番号:4〕
CGRP遺伝子によってコードされるCGRPタンパク質(アクセッション番号:NP_001029125.1)のアミノ酸配列を表す。
【技術分野】
【0001】
本発明は、疼痛の予防および/または治療剤のスクリーニング方法並びにこれに用いるためのキットに関する。
【背景技術】
【0002】
生体組織が損傷を受けると、痛みとして感じることで損傷を認識する。炎症などによる過度な痛みは患者に苦痛となるばかりで、生物学的な意義が少なく、よってこの痛み(疼痛)を早急に緩和することが望ましい。しかし、疼痛を感じる機構については種々の報告がなされているが、その機構は複雑であり未解明な部分も多い。
【0003】
現在、疼痛を抑制することを目的として、各種の鎮痛剤や麻薬などが用いられているが、これらの薬剤が疼痛抑制効果を示さない疼痛もある。従来の薬物療法において使用されてきた鎮痛剤としては、モルヒネに代表される中枢性オピオイド受容体作動薬、インドメタシンに代表される非ステロイド系抗炎症薬(NSAIDs)などがある。しかしながら、これらの鎮痛剤は、有用性、安全性、常習性などの面で問題があることから、疼痛を予防および/または治療するための新規な薬剤の開発が依然として喫緊の課題として存在する。
【0004】
開発を希望する薬剤の属性に応じて、きわめて多様なスクリーニング方法がこれまでに研究・報告されている。そして、疼痛の予防および/または治療剤のスクリーニング方法に関連するものとしては、例えば特許文献1に、全身性疼痛疾患の治療薬のスクリーニング方法が開示されている。しかしながら、この方法は、拘束ストレス等のストレスを負荷することによって作出された非ヒト動物モデルを用いるものであることから、多大な時間およびコストを必要とするという問題がある。
【0005】
一方、動物モデルを用いないスクリーニング方法として、例えば特許文献2には、被験物質をニューロトロフィン受容体p75(p75NTR)と接触させ、当該被験物質がproNGF(神経成長因子の前駆物質)とp75NTRとの結合を阻害する場合に、当該被験物質は鎮痛剤の候補物質であると判定する方法が開示されている。
【0006】
ところで、疼痛に関与する因子として、神経成長因子(NGF;Nerve Growth Factor)が知られている。このNGFは、種々の急性または慢性の疼痛において痛みの発生に重要な役割を果たしており、当初は発生の過程で感覚ニューロンおよび交感神経節前ニューロンの生存および分化を促進する分子として同定された、ニューロトロフィンファミリーの中で最も主要な因子である。
【0007】
このNGFに関連した技術として、例えば特許文献3には、NGFとTrkA受容体との結合を阻害する物質(例えば、抗NGF抗体)を、慢性疼痛の予防および/または治療剤として用いる技術が開示されている。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2009−195200号公報
【特許文献2】再表2007/026567号公報
【特許文献3】特表2008−542439号公報
【発明の概要】
【発明が解決しようとする課題】
【0009】
上述したように、疼痛の予防および/または治療剤をスクリーニングする方法はこれまでにもいくつか提案されているが、疼痛の予防および/または治療剤として決定的に有効なものは依然として開発されてはいないのが現状である。また、疼痛の種類やその重篤度に応じた予防および/または治療剤のラインアップを充実させるという観点からも、数多くのスクリーニング方法を開発することの意義は大きい。
【0010】
そこで本発明は、疼痛の予防および/または治療剤をスクリーニングするための新規な手段を提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明者らは、研究を行う過程で、マウス由来後根神経節細胞の初代培養系にNGFを投与すると、疼痛関連遺伝子であるBDNF(脳由来神経栄養因子;Brain-Derived Neutrophic Factor)遺伝子およびCGRP(カルシトニン遺伝子関連ペプチド;Calcitonin Gene-Related Peptide)遺伝子の発現がコントロールと比較して2〜3倍に増加することを見出した。そして、かような遺伝子の発現誘導がNGF投与によるものであることも確認した。これらの知見に基づき、本発明者らは、BDNF遺伝子および/またはCGRP遺伝子、あるいはこれらの遺伝子によってコードされるタンパク質の発現を指標とすることにより、疼痛の予防および/または治療剤をスクリーニングするための手段が提供されうることを確信し、本発明を完成させるに至ったのである。
【0012】
すなわち、本発明の一形態によれば、BDNF遺伝子(例えば、配列番号:1に記載の塩基配列からなるもの)および/またはCGRP遺伝子(例えば、配列番号:3に記載の塩基配列からなるもの)の発現を抑制する物質を探索する工程を含む、疼痛の予防および/または治療剤のスクリーニング方法が提供される。
【0013】
ここで、前記疼痛は、好ましくは神経成長因子(NGF)惹起性の疼痛である。そして、前記物質を探索する工程は、以下の工程(I)〜(III):
(I)BDNF遺伝子および/またはCGRP遺伝子を発現可能な細胞と、被験物質とを接触させる工程、
(II)前記被験物質を接触させた前記細胞における、BDNF遺伝子および/またはCGRP遺伝子の発現量を測定する工程、および、
(III)前記発現量を前記被験物質に接触させない対照細胞における発現量と比較して、BDNF遺伝子および/またはCGRP遺伝子の発現量を減少させる被験物質を候補物質として選択する工程、
を含むことが好ましい。より好ましくは、前記疼痛が神経成長因子(NGF)惹起性の疼痛である場合に、前記工程(I)を神経成長因子(NGF)の存在下で行う。
【0014】
また、本発明の他の形態によれば、上述したスクリーニング方法に用いられる疼痛の予防および/または治療剤のスクリーニング用キットであって、BDNFタンパク質をコードするポリヌクレオチドおよび/またはCGRPタンパク質をコードするポリヌクレオチドを含むものが提供される。
【0015】
一方、本発明のさらに他の形態によれば、BDNFタンパク質(例えば、配列番号:2に記載のアミノ酸配列からなるもの)および/またはCGRPタンパク質(例えば、配列番号:4に記載のアミノ酸配列からなるもの)の発現を抑制する物質を探索する工程を含む、疼痛の予防および/または治療剤のスクリーニング方法が提供される。
【0016】
ここで、前記疼痛は、好ましくは神経成長因子(NGF)惹起性の疼痛である。そして、前記物質を探索する工程は、以下の工程(I)〜(III):
(I)BDNFタンパク質および/またはCGRPタンパク質を発現可能な細胞または前記細胞から調製した細胞画分と、被験物質とを接触させる工程、
(II)前記被験物質を接触させた前記細胞または前記細胞画分における、BDNFタンパク質および/またはCGRPタンパク質の発現量を測定する工程、および、
(III)前記発現量を前記被験物質に接触させない対照細胞または前記対照細胞から調製した対照細胞画分における発現量と比較して、BDNFタンパク質および/またはCGRPタンパク質の発現量を減少させる被験物質を候補物質として選択する工程、
を含むことが好ましい。より好ましくは、前記疼痛が神経成長因子(NGF)惹起性の疼痛であり、前記工程(I)を神経成長因子(NGF)の存在下で行う。
【0017】
また、本発明のさらに他の形態によれば、上述したスクリーニング方法に用いられる疼痛の予防および/または治療剤のスクリーニング用キットであって、BDNFタンパク質および/またはCGRPタンパク質を含むものが提供される。
【発明の効果】
【0018】
本発明によれば、疼痛の予防および/または治療剤をスクリーニングするための新規な手段が提供されうる。そして、本発明により提供されるスクリーニング手段によれば、マウス個体を用いた従来の疼痛モデルによる結果と同様の結果が得られることから、より簡便なスクリーニング手段を提供するものとして、きわめて優位性の高いものである。本発明により提供されるスクリーニング技術を利用することで、新規な疼痛の予防および/または治療剤の候補物質の発見とその後の研究開発がより一層活発に行われることが期待される。
【図面の簡単な説明】
【0019】
【図1】実施例において、C57/BL6マウス成体より分離した後根神経節(DRG;Dorsal Root Ganglion)の初代培養細胞にNGFを投与し、所定時間後にサンプルを回収してリアルタイムPCRによって6種の疼痛関連遺伝子(ASCI3、BDNF、CGRP、NaV.1.8、Substance P、TRPV1)の発現誘導を解析した結果を示すグラフである。
【図2】実施例において、BDNF遺伝子およびCGRP遺伝子の発現がNGF投与によって誘導されることを示す目的で、抗NGF抗体投与後にNGFを投与し、所定時間後にサンプルを回収してリアルタイムPCRによってBDNF遺伝子およびCGRP遺伝子の発現を解析した結果を示すグラフである。
【図3】実施例において、本発明により提供されるスクリーニング手段が従来の疼痛モデルと同様の結果を示すことを検証する目的で、NGFとともにアルブミンを投与したC57/BL6マウス成体より所定時間後に分離した後根神経節からサンプルを調製してリアルタイムPCRによって2種の疼痛関連遺伝子(BDNF、CGRP)の発現誘導を解析した結果を示すグラフである。
【発明を実施するための形態】
【0020】
本発明の一形態は、BDNF遺伝子および/またはCGRP遺伝子の発現を抑制する物質を探索する工程を含む、疼痛の予防および/または治療剤のスクリーニング方法である。
【0021】
BDNF(brain-derived neurotrophic factor)遺伝子の塩基配列は、ヒトおよびマウスについて、GenBankに登録されている(アクセッション番号:M37762.1(ヒト;配列番号:1)、BC034862.1(マウス))。また、これらの遺伝子によってコードされるBDNFタンパク質のアミノ酸配列もまた、ヒトおよびマウスについて、GenBankに登録されている(アクセッション番号:AAA51820.1(ヒト;配列番号:2)、AAH34862.1(マウス))。なお、配列番号:1に記載の塩基配列からなるポリヌクレオチドは、例えば、文献(Proc. Natl. Acad. Sci. U.S.A. 87 (20), 8060-8064 (1990))に記載の手法により得ることができる。
【0022】
同様に、CGRP遺伝子の塩基配列もまた、ヒトおよびマウスについて、GenBankに登録されている(アクセッション番号:NM_001033953.2(ヒト;配列番号:3)、NM_001033954.3(マウス))。さらに、これらの遺伝子によってコードされるCGRPタンパク質のアミノ酸配列もまた、ヒトおよびマウスについて、GenBankに登録されている(アクセッション番号:NP_001029125.1(ヒト;配列番号:4)、NP_001029126.1(マウス))。なお、配列番号:3に記載の塩基配列からなるポリヌクレオチドは、例えば、文献(J. Biol. Chem. 266 (36), 24627-24631 (1991))に記載の手法により得ることができる。
【0023】
本発明において、「BDNF遺伝子」および「CGRP遺伝子」には、それぞれ、特定の塩基配列(配列番号:1および配列番号:3)に記載の塩基配列からなる遺伝子のみならず、これらによりコードされるタンパク質と生物学的機能が同等であるタンパク質(例えば、同族体等)をコードする遺伝子が含まれる。具体的には、「BDNF遺伝子」には、以下のような遺伝子が含まれる。
(A)配列番号:1に記載の塩基配列からなる遺伝子
(B)前記(A)の塩基配列において、1個〜30個、好ましくは1個〜10個、より好ましくは1個〜5個の塩基が欠失、置換または付加された塩基配列からなり、かつ、NGFによって発現が誘導されるBDNFタンパク質をコードする遺伝子
(C)前記(A)の塩基配列において1個〜30個、好ましくは1個〜10個、より好ましくは1個〜5個の塩基が欠失、置換または付加された塩基配列からなり、前記(A)のDNAとストリンジェントな条件下でハイブリダイズする遺伝子
(D)前記(A)の塩基配列において1個〜30個、好ましくは1個〜10個、より好ましくは1個〜5個の塩基が欠失、置換または付加された塩基配列からなり、配列番号:1に記載の塩基配列との相同性が少なくとも60%以上、好ましくは80%以上、より好ましくは95%以上である遺伝子。
(E)前記(A)〜(D)のいずれかの遺伝子と相補的な塩基配列からなる遺伝子
同様に、「CGRP遺伝子」には、以下のような遺伝子が含まれる。
(A)配列番号:3に記載の塩基配列からなる遺伝子
(B)前記(A)の塩基配列において、1個〜30個、好ましくは1個〜10個、より好ましくは1個〜5個の塩基が欠失、置換または付加された塩基配列からなり、かつ、NGFによって発現が誘導されるCGRPタンパク質をコードする遺伝子
(C)前記(A)の塩基配列において1個〜30個、好ましくは1個〜10個、より好ましくは1個〜5個の塩基が欠失、置換または付加された塩基配列からなり、前記(A)のDNAとストリンジェントな条件下でハイブリダイズする遺伝子
(D)前記(A)の塩基配列において1個〜30個、好ましくは1個〜10個、より好ましくは1個〜5個の塩基が欠失、置換または付加された塩基配列からなり、配列番号:1に記載の塩基配列との相同性が少なくとも60%以上、好ましくは80%以上、より好ましくは95%以上である遺伝子。
(E)前記(A)〜(D)のいずれかの遺伝子と相補的な塩基配列からなる遺伝子
上述の(C)において、ハイブリダイズのストリンジェントな条件としては、当該技術分野における標準の条件が挙げられるが、例えば、温度条件は、配列番号:1で示された塩基配列のTm値の±5℃、好ましくは±2℃、より好ましくは±1℃である。条件の具体例として、5×SSC溶液、10×Denhardt溶液、100μg/mlサケ精子DNAおよび1%SDS中、65℃でのハイブリダイゼーション、0.2×SSCおよび1%SDS中、65℃、30分の洗浄(2回)、続いて、0.2×SSCおよび0.1%SDS中、65℃、30分の洗浄(2回)が挙げられる。
【0024】
なお、添付の配列表の配列番号:2に記載のアミノ酸配列からなるタンパク質は、配列番号:1に記載の塩基配列からなる遺伝子によってコードされるものである。また、添付の配列表の配列番号:4に記載のアミノ酸配列からなるタンパク質は、配列番号:3に記載の塩基配列からなる遺伝子によってコードされるものである。
【0025】
本発明において、用語「タンパク質」には、特定のアミノ酸配列で示されるタンパク質のみならず、これらと生物学的機能が同等である断片、同族体、誘導体および変異体を含む。例えば、上述のBDNFタンパク質には、配列番号:2に記載のアミノ酸配列からなるタンパク質のみならず、その相同体や変異体も含む。具体的には、当該BDNFタンパク質には、以下のようなタンパク質が含まれる。
(A)配列番号:2に記載のアミノ酸配列からなるタンパク質
(B)前記(A)のアミノ酸配列において、1個〜30個、好ましくは1個〜10個、より好ましくは1個〜5個のアミノ酸が欠失、置換または付加されたアミノ酸配列からなり、かつ、NGFによって発現が誘導されるタンパク質
(C)前記(A)のアミノ酸配列において1個〜30個、好ましくは1個〜10個、より好ましくは1個〜5個のアミノ酸が欠失、置換または付加されたアミノ酸配列からなり、配列番号:2に記載のアミノ酸配列との相同性が少なくとも60%以上、好ましくは80%以上、より好ましくは95%以上であるタンパク質。
【0026】
同様に、CGRPタンパク質には、以下のようなタンパク質が含まれる。
(A)配列番号:4に記載のアミノ酸配列からなるタンパク質
(B)前記(A)のアミノ酸配列において、1個〜30個、好ましくは1個〜10個、より好ましくは1個〜5個のアミノ酸が欠失、置換または付加されたアミノ酸配列からなり、かつ、NGFによって発現が誘導されるタンパク質
(C)前記(A)のアミノ酸配列において1個〜30個、好ましくは1個〜10個、より好ましくは1個〜5個のアミノ酸が欠失、置換または付加されたアミノ酸配列からなり、配列番号:4に記載のアミノ酸配列との相同性が少なくとも60%以上、好ましくは80%以上、より好ましくは95%以上であるタンパク質。
【0027】
これらのタンパク質の調製方法は、特に制限されないが、例えば、前記タンパク質をコードするポリヌクレオチドを、適当な発現ベクターに組み込み、大腸菌等の原核生物、酵母、昆虫細胞、哺乳類細胞等の真核生物細胞、または、インビトロで前記タンパク質を発現させ、単離する方法が挙げられる。これらの方法は、当業者であれば、適宜選択して実施できる。
【0028】
以下、本発明のスクリーニング方法の一例を具体的に説明する。
【0029】
(1)BDNF遺伝子および/またはCGRP遺伝子の発現抑制活性を指標とする疼痛の予防および/または治療剤のスクリーニング方法
まず、本発明の第1のスクリーニング方法について詳細に説明する。第1のスクリーニング方法は、上述のように、BDNF遺伝子および/またはCGRP遺伝子の発現を抑制する物質を探索する工程を含む、疼痛の予防および/または治療剤のスクリーニング方法である。
【0030】
本明細書において、「疼痛」とは、特に制限されず「痛み」一般を意味し、例えば、炎症による急性痛、慢性炎症に伴う痛み、急性炎症に伴う痛み、術後痛(切開創の痛み、深部痛、内臓痛、術後慢性痛など)、筋肉痛(慢性痛疾患に伴う筋肉痛、肩こりなど)、関節痛、歯痛、顎関節痛、頭痛(偏頭痛、緊張型頭痛、発熱に伴う頭痛、高血圧に伴う頭痛)、内臓痛(心臓痛、狭心痛、腹痛、腎臓の痛み、尿管の痛み、膀胱の痛み)、産婦人科領域の痛み(中間痛、月経困難、陣痛)、神経痛(椎間板ヘルニア、神経根痛、帯状疱疹後神経痛、三叉神経痛)、癌性疼痛、反射性交感神経性萎縮症、複雑局所痛症候群などが挙げられる。なかでも、本発明において好ましくは、疼痛は神経成長因子(NGF)惹起性の疼痛である。ここで、疼痛が「NGF惹起性である」とは、NGFによって痛みが引き起こされる場合だけでなく、もともとあった痛みがNGFによって増強される場合をも意味する概念である。上記で列挙したもののうち、NGF惹起性の疼痛としては、炎症による急性痛、慢性炎症に伴う痛み、急性炎症に伴う痛み、神経痛、癌性疼痛などが挙げられる。
【0031】
このスクリーニング方法において、「物質を探索する工程」は、以下の工程(I)〜(III):
(I)BDNF遺伝子および/またはCGRP遺伝子を発現可能な細胞と、被験物質とを接触させる工程、
(II)前記被験物質を接触させた前記細胞における、BDNF遺伝子および/またはCGRP遺伝子の発現量を測定する工程、および、
(III)前記発現量を前記被験物質に接触させない対照細胞における発現量と比較して、BDNF遺伝子および/またはCGRP遺伝子の発現量を減少させる被験物質を候補物質として選択する工程、
を含むことが好ましい。
【0032】
このスクリーニングに用いられる細胞としては、BDNF遺伝子および/またはCGRP遺伝子を発現可能な細胞であれば特に限定はないが、例えば、後根神経節から調製した細胞が挙げられる。そのほかにも、例えば、大脳皮質顆粒細胞、神経芽腫、褐色細胞腫由来の細胞もまた、用いられうる。
【0033】
本発明の第1のスクリーニング方法のより好ましい形態では、疼痛が神経成長因子(NGF)惹起性の疼痛である場合に、上述した工程(I)を神経成長因子(NGF)の存在下で行う。また、本発明の第1のスクリーニング方法の好ましい一実施形態では、スクリーニング方法に用いられるBDNF遺伝子が配列番号:1に記載の塩基配列からなる遺伝子である。同様に、本発明の第1のスクリーニング方法の他の好ましい一実施形態では、スクリーニング方法に用いられるCGRP遺伝子が配列番号:3に記載の塩基配列からなる遺伝子である。なお、本発明の第1のスクリーニング方法においては、BDNF遺伝子およびCGRP遺伝子のいずれか一方のみを用いてもよいし、双方を併用してもよい。
【0034】
被験物質としては、特に制限されないが、核酸、ペプチド、タンパク質、有機化合物、無機化合物などが挙げられる。スクリーニングは、これらの被験物質を含む試料(被験試料)を上述の細胞と接触させて行うことができる。被験試料としては、特に制限されないが、細胞抽出液、遺伝子ライブラリーの発現産物、合成低分子化合物、合成ペプチド、天然化合物などが挙げられる。
【0035】
前記工程(I)において、BDNF遺伝子および/またはCGRP遺伝子を発現可能な細胞と被験物質との接触は、例えば37℃で、5分〜720時間の条件で行うことができる。
【0036】
また、上述の細胞と被験物質との接触は、当該細胞が成育可能な条件下で培養しながら行ってもよい。また、当該細胞と被験物質とを接触させる条件は、特に制限されないが、細胞が死滅しないように、その培養条件(pH、温度、培地等)を選択することができる。
【0037】
被験物質と接触させる際の上記細胞の細胞数は、例えば98ウェルプレートを用いる場合、例えば1.0×103〜1.0×107個/ウェル、好ましくは1.0×104〜1.0×106個/ウェル、より好ましくは1.0×105〜1.0×106個/ウェルである。
【0038】
対照細胞とは、工程(I)で用いられるBDNF遺伝子および/またはCGRP遺伝子を発現可能な細胞において、被験物質を接触させない細胞を意味する。被験物質を接触させない場合とは、前記被験物質の代わりに前記被験物質と同量の溶媒(ブランク)を添加する場合や、これらの遺伝子の発現に影響を与えないコントロール物質を添加する場合などがある。
【0039】
工程(II)において、BDNF遺伝子および/またはCGRP遺伝子の発現量を測定する方法としては、上記細胞から調製したRNAまたはRNAから転写された相補的なポリヌクレオチドを用いる、in situハイブリダイゼーション、ノーザンブロッティング、ドットプロット、RNaseプロテクションアッセイ等のほか、マイクロアレイを用いる方法、リアルタイムPCR法等のPCRを利用する方法、RNA鎖を直接測定する方法等の迅速な測定が可能な方法が挙げられる。
【0040】
工程(III)では、工程(I)および工程(II)を経て検出・定量したBDNF遺伝子および/またはCGRP遺伝子の発現レベルに基づき、BDNF遺伝子および/またはCGRP遺伝子の発現を抑制する被験物質を、疼痛の予防および/または治療剤の候補物質として選択することができる。具体的には、例えば、被験物質を添加した細胞におけるBDNF遺伝子および/またはCGRP遺伝子の発現量が、対照細胞における発現量と比較して、減少している場合(好ましくは70%以下、より好ましくは50%以下、さらに好ましくは10%以下に減少している場合)に、被験物質を、疼痛の予防および/または治療剤の候補物質として選択することができる。
【0041】
また、本発明の他の形態によれば、上述した第1のスクリーニング方法に用いられる、疼痛の予防および/または治療剤のスクリーニング用キットもまた、提供される。当該キットは、具体的には、BDNFタンパク質をコードするポリヌクレオチドおよび/またはCGRPタンパク質をコードするポリヌクレオチドを含むものでありうる。かような構成とすることで、当該キットは、例えば、キットに含まれるプローブを選択的に使用してマイクロアレイを製造する場合や、リアルタイムPCR法により検出する場合などに利用されうる。
【0042】
(2)BDNFタンパク質および/またはCGRPタンパク質の発現抑制活性を指標とする疼痛の予防および/または治療剤のスクリーニング方法
次に、本発明の第2のスクリーニング方法について説明する。第2のスクリーニング方法は、上述のように、BDNFタンパク質および/またはCGRPタンパク質の発現を抑制する物質を探索する工程を含む、疼痛の予防および/または治療剤のスクリーニング方法である。
【0043】
このスクリーニング方法において、「物質を探索する工程」は、以下の工程(I)〜(III):
(I)BDNFタンパク質および/またはCGRPタンパク質を発現可能な細胞または前記細胞から調製した細胞画分と、被験物質とを接触させる工程、
(II)前記被験物質を接触させた前記細胞または前記細胞画分における、BDNFタンパク質および/またはCGRPタンパク質の発現量を測定する工程、および、
(III)前記発現量を前記被験物質に接触させない対照細胞または前記対照細胞から調製した対照細胞画分における発現量と比較して、BDNFタンパク質および/またはCGRPタンパク質の発現量を減少させる被験物質を候補物質として選択する工程、
を含むことが好ましい。
【0044】
このスクリーニングに用いられる細胞としては、BDNFタンパク質および/またはCGRPタンパク質を発現可能な細胞であれば特に限定はない。具体的には、上記(1)の第1のスクリーニング方法の欄に記載の細胞が同様に用いられうる。
【0045】
本発明の第1のスクリーニング方法のより好ましい形態では、疼痛が神経成長因子(NGF)惹起性の疼痛である場合に、上述した工程(I)を神経成長因子(NGF)の存在下で行う。また、本発明の第1のスクリーニング方法の好ましい一実施形態では、スクリーニング方法に用いられるBDNFタンパク質が配列番号:2に記載のアミノ酸配列からなるタンパク質遺伝子である。同様に、本発明の第1のスクリーニング方法の他の好ましい一実施形態では、スクリーニング方法に用いられるCGRPタンパク質が配列番号:4に記載のアミノ酸配列からなるタンパク質である。なお、本発明の第2のスクリーニング方法においては、BDNFタンパク質およびCGRPタンパク質のいずれか一方のみを用いてもよいし、双方を併用してもよい。
【0046】
本発明の第2のスクリーニング方法において、BDNFタンパク質および/またはCGRPタンパク質の発現は、BDNF遺伝子および/またはCGRP遺伝子の発現産物であるタンパク質を検出することにより、確認することができる。
【0047】
BDNFタンパク質および/またはCGRPタンパク質を検出する方法としては、特に制限されないが、例えば、BDNFタンパク質および/またはCGRPタンパク質に特異的な抗体を用いた免疫学的測定方法が挙げられる。前記免疫学的測定方法としては、ウエスタンブロット、ELISA、サンドウィッチELISA等が挙げられる。前記抗体は、BDNFタンパク質および/またはCGRPタンパク質を用いて従来公知の方法で作製でき、ポリクローナル抗体であってもよいし、モノクローナル抗体であってもよい。また、BDNFタンパク質および/またはCGRPタンパク質の調製方法は、特に制限されないが、例えば、これらのタンパク質をコードするポリヌクレオチドを、適当な発現ベクターに組み込み、大腸菌等の原核生物、酵母、昆虫細胞、哺乳類細胞等の真核生物細胞、または、インビトロで前記ポリペプチドを発現させ、単離する方法が挙げられる。これらの方法は、当業者であれば、適宜選択して実施できる。
【0048】
被験物質としては、上記(1)の第1のスクリーニング方法の欄に記載の物質が同様に用いられうる。また、対照細胞の定義は、上記(1)の第1のスクリーニング方法における定義と同じである。
【0049】
また、本発明の他の形態によれば、上述した第2のスクリーニング方法に用いられる、疼痛の予防および/または治療剤のスクリーニング用キットもまた、提供される。当該キットは、具体的には、BDNFタンパク質および/またはCGRPタンパク質を含むものでありうる。当該キットは、BDNFタンパク質および/またはCGRPタンパク質に特異的な抗体等を含んでもよい。
【実施例】
【0050】
以下、実施例を用いて本発明を詳述するが、本発明は以下の実施例に限定されるものではない。
【0051】
≪初代培養後根神経節の培養≫
C57/BL6マウス成体(8〜12週齢)より後根神経節(DRG)を分離し、コラゲナーゼタイプIV(500U/mL)(Worthington Biochemicals、cat #CLS3)およびDNAse I(0.12μg/mL、タカラバイオ株式会社、cat #P75454)を含むDMEM培地(Dulbecco's Modified Eagle's Medium)(和光純薬工業株式会社、cat #043-30085)で2時間(37℃)培養した(文献:Komagiri Y, Kitamura N: Effect of intracellular dialysis of ATP on the hyperpolarization-activated cation current in rat dorsal root ganglion neurons. J Neurophysiol (2003) 90:2115-2122を参照)。その後、トリプシン(0.25%wt/vol)(ライフテクノロジーズジャパン株式会社、cat #15400054)を加えたDMEM培地で15分間(37℃)培養し、1mLのピペットチューブ(greiner bio-one Co., Ltd、cat #741045)で撹拌し、1500回転にて3分間遠心分離して上清を取り除いた。分離した細胞は、B27添加物(ライフテクノロジーズジャパン株式会社、cat #17504-044)、ペニシリン(100U/mL)、およびストレプトマイシン(100μg/mL)(ライフテクノロジーズジャパン株式会社、cat #15070-063)を加えたDMEM培地で、ポリ−L−リジン(Sigma-Aldrich Co.、cat #P-1524)でコーティングした24穴細胞皿(greiner bio-one Co., Ltd.、cat #662160)を用いて、37℃ 5%CO2培養器(ASTEC、cat #SCA-165D)の中で3日間培養し、実験に用いた。
【0052】
≪NGFの投与≫
上述した手法により培養した後根神経節の初代培養細胞に、200ng/mLの濃度のNGF(Nerve Growth Factor)(Sigma-Aldrich Co.、cat #N6009)を投与し、投与後0、3、6、9、および12時間後にサンプルを回収して、解析に用いた。なお、コントロールとしては、NGFを投与しなかったこと以外は同様に培養・回収した細胞を用いた。
【0053】
≪リアルタイムPCRを用いた疼痛関連遺伝子の発現誘導解析≫
上述した手法により回収した初代培養後根神経節の細胞から、TRIZOL(ライフテクノロジーズジャパン株式会社、cat #15596-026)を用いてRNAを抽出し、cDNA合成キット(ABI High Capacity cDNA Reverse Transcription Kit、ライフテクノロジーズジャパン株式会社、cat #4368814)により、First strand cDNAを合成した。これを鋳型としてTHUNDERBIRD(商標)SYBR(登録商標)qPCR Mix(東洋紡績株式会社、cat #QPK-201)を用いて、7300 Real-Time PCR System (ライフテクノロジーズジャパン株式会社)によりリアルタイムPCRを施行し、6種の疼痛関連遺伝子(ASCI3、BDNF、CGRP、NaV.1.8、Substance P、TRPV1)の発現誘導を解析した。リアルタイムPCRの反応条件は、50℃×2分間(1サイクル)、95℃×10分間(1サイクル)、95℃×20秒間→60℃×1分間(40サイクル)を用いた。
【0054】
各遺伝子の相対的発現比を、GAPDH(glyceraldehyde-3-phosphate dehydrogenase)のmRNA発現量を標準にしてΔΔCt法を用いて計算した。なお、各遺伝子の増幅のためのプライマーの塩基配列としては、文献(Bretagne S, Durand R, Olivi M, Garin JF, Sulahian A, Rivollet D, Vidaud M, Deniau M: Real-time PCR as a new tool for quantifying Leishmania infantum in liver in infected mice. Clin Diagn Lab Immunol (2001) 8:828-831;Goss JR, Goins WF, Lacomis D, Mata M, Glorioso JC, Fink DJ: Herpes simplex-mediated gene transfer of nerve growth factor protects against peripheral neuropathy in streptozotocin-induced diabetes in the mouse. Diabetes (2002) 51:2227-2232;Yen YT, Tu PH, Chen CJ, Lin YW, Hsieh ST, Chen CC: Role of acid-sensing ion channel 3 in sub-acute-phase inflammation.. Mol Pain (2009) 5:1)のいずれかに記載されているものを採用した。
【0055】
結果を図1に示す。なお、図1において、横軸はNGF投与後0〜12時間の各疼痛関連遺伝子の種類(ASCI3、BDNF、CGRP、NaV.1.8、SP、TRPV1)を示し、縦軸はGAPDH発現量に対する各遺伝子の発現量の相対値を示す。また、グラフの各値は、5回の実験結果についての(平均値±標準誤差)である。
【0056】
図1に示すように、NGF投与から6〜9時間後(6H、9H)において、BDNF遺伝子およびCGRP遺伝子では約2〜3倍の発現誘導が認められた。これに対し、これら以外の遺伝子(ASCI3、NaV.1.8、SP、TRPV1)の発現誘導はわずかであった。
【0057】
≪NGF中和抗体前処理時のBDNF遺伝子およびCGRP遺伝子の発現誘導抑制≫
上述した発現誘導実験において、NGF(200ng/mL)投与の30分前に、NGF中和抗体(Sigma-Aldrich Co.、cat #N6655)(1,000倍希釈)を投与し、NGF投与後0、6、9時間の時点でサンプルを回収して、リアルタイムPCRを施行した。コントロール(Mock)としては、Rabbit serum(Sigma-Aldrich Co.、cat #R9133)を同濃度投与した。
【0058】
結果を図2に示す。なお、図2において、横軸はMock(コントロール群)またはAnti-NGF(NGF中和抗体投与群)のそれぞれに対するBDNF(NGF投与後0,3,6時間)またはCGRP(NGF投与後0,3,6時間)を示し、縦軸はGAPDH発現量に対する各遺伝子の発現量の相対値を示す。また、グラフの各値は、3回の実験結果についての(平均値±標準誤差)である。
【0059】
図2に示すように、左の2つのレーン(Mock(コントロール群))と比較して、右の2つのレーン(Anti-NGF(NGF中和抗体投与号))では、BDNF遺伝子およびCGRP遺伝子の発現誘導は抑制された。このことから、BDNF遺伝子およびCGRP遺伝子はNGF投与により発現が誘導されることが示された。
【0060】
≪マウス疼痛モデルによる検証≫
NGF(Sigma-Aldrich Co.、cat #N6009)を、0.1%アルブミン(Sigma-Aldrich Co.、cat #A7906)とともに生理食塩水に溶解し(0.1μg/μL濃度)、10μLをマウス(C57/BL6、6〜8週齢オス)の後肢の肉球に投与した。文献(Journal of Neuroscience Research 86:3566-3574 (2008))によれば、NGFが投与されたマウスは、投与後1〜24時間以内は有意に熱刺激に対する感受性が増加する。NGF投与後、3時間後および6時間後に、第3、4、5腰椎の後根神経節を取り出した(各時間、それぞれ計4匹のマウスより)。一方、コントロール群として、0.1%アルブミンのみを生理食塩水に溶解した溶液10μLを同様に後肢の肉球に投与したマウス(C57/BL6, 6-8週齢♂)を用いた。
【0061】
各群のマウスの後根神経節から、TRIZOL(ライフテクノロジーズジャパン株式会社、cat #15596-026)を用いてRNAを抽出し、cDNA合成キット(ABI High Capacity cDNA Reverse Transcription Kit、ライフテクノロジーズジャパン株式会社、cat #4368814)により、First strand cDNAを合成した。これを鋳型としてTHUNDERBIRD(商標)SYBR(登録商標)qPCR Mix(東洋紡績株式会社、cat #QPK-201)を用いて、7300 Real-Time PCR System (ライフテクノロジーズジャパン株式会社)によりリアルタイムPCRを施行し、2種の疼痛関連遺伝子(BDNF、CGRP)の発現誘導を各群間で比較した。リアルタイムPCRの反応条件は、50℃×2分間(1サイクル)、95℃×10分間(1サイクル)、95℃×20秒間→60℃×1分間(40サイクル)を用いた。
【0062】
各遺伝子の相対的発現比を、GAPDHのmRNA発現量を標準にしてΔΔCt法を用いて計算した。なお、各遺伝子の増幅のためのプライマーの塩基配列としては、上述した≪リアルタイムPCRを用いた疼痛関連遺伝子の発現誘導解析≫の欄に記載の文献のいずれかに記載されているものを採用した。
【0063】
結果を図3に示す。図3に示すように、NGF投与から6時間後(6h)において、BDNF遺伝子およびCGRP遺伝子ではコントロール群に対して約2〜3倍のmRNA発現誘導が認められた。
【0064】
以上のことから、例えばマウス成体の初代培養後根神経節(DRG)の細胞を用い、NGF投与後6〜9時間のBDNF遺伝子および/またはCGRP遺伝子の発現誘導を指標とすることで、疼痛(好ましくはNGF惹起性の疼痛)の予防および/または治療剤をスクリーニングするための手段(スクリーニング方法やこれに用いるためのキット)が提供されうる。そして、本発明により提供されるスクリーニング手段によれば、マウス個体を用いた従来の疼痛モデルによる結果と同様の結果が得られることから、より簡便なスクリーニング手段を提供するものとして、きわめて優位性の高いものである。
【配列表フリーテキスト】
【0065】
〔配列番号:1〕
BDNF遺伝子(アクセッション番号:M37762.1)の塩基配列を表す。
〔配列番号:2〕
BDNF遺伝子によってコードされるBDNFタンパク質(アクセッション番号:AAA51820.1)のアミノ酸配列を表す。
〔配列番号:3〕
CGRP遺伝子(アクセッション番号:NM_001033953.2)の塩基配列を表す。
〔配列番号:4〕
CGRP遺伝子によってコードされるCGRPタンパク質(アクセッション番号:NP_001029125.1)のアミノ酸配列を表す。
【特許請求の範囲】
【請求項1】
BDNF(脳由来神経栄養因子;Brain-Derived Neutrophic Factor)遺伝子および/またはCGRP(カルシトニン遺伝子関連ペプチド;Calcitonin Gene-Related Peptide)遺伝子の発現を抑制する物質を探索する工程を含む、疼痛の予防および/または治療剤のスクリーニング方法。
【請求項2】
BDNF遺伝子および/またはCGRP遺伝子の発現を抑制する物質を探索する工程を含む、神経成長因子(NGF)惹起性の疼痛の予防および/または治療剤のスクリーニング方法。
【請求項3】
BDNF遺伝子および/またはCGRP遺伝子の発現を抑制する物質を探索する工程を含み、前記物質を探索する工程が、以下の工程(I)〜(III):
(I)BDNF遺伝子および/またはCGRP遺伝子を発現可能な細胞と、被験物質とを接触させる工程、
(II)前記被験物質を接触させた前記細胞における、BDNF遺伝子および/またはCGRP遺伝子の発現量を測定する工程、および、
(III)前記発現量を前記被験物質に接触させない対照細胞における発現量と比較して、BDNF遺伝子および/またはCGRP遺伝子の発現量を減少させる被験物質を候補物質として選択する工程、
を含む、疼痛の予防および/または治療剤のスクリーニング方法。
【請求項4】
BDNF遺伝子および/またはCGRP遺伝子の発現を抑制する物質を探索する工程を含み、前記物質を探索する工程が、以下の工程(I)〜(III):
(I)BDNF遺伝子および/またはCGRP遺伝子を発現可能な細胞と、被験物質とを神経成長因子(NGF)の存在下で接触させる工程、
(II)前記被験物質を接触させた前記細胞における、BDNF遺伝子および/またはCGRP遺伝子の発現量を測定する工程、および、
(III)前記発現量を前記被験物質に接触させない対照細胞における発現量と比較して、BDNF遺伝子および/またはCGRP遺伝子の発現量を減少させる被験物質を候補物質として選択する工程、
を含む、神経成長因子(NGF)惹起性の疼痛の予防および/または治療剤のスクリーニング方法。
【請求項5】
BDNF遺伝子が、配列番号:1に記載の塩基配列からなる遺伝子である、請求項1〜4のいずれか1項に記載のスクリーニング方法。
【請求項6】
CGRP遺伝子が、配列番号:3に記載の塩基配列からなる遺伝子である、請求項1〜5のいずれか1項に記載のスクリーニング方法。
【請求項7】
請求項1〜6のいずれか1項に記載のスクリーニング方法に用いられる疼痛の予防および/または治療剤のスクリーニング用キットであって、BDNFタンパク質をコードするポリヌクレオチドおよび/またはCGRPタンパク質をコードするポリヌクレオチドを含む、キット。
【請求項8】
BDNFタンパク質および/またはCGRPタンパク質の発現を抑制する物質を探索する工程を含む、疼痛の予防および/または治療剤のスクリーニング方法。
【請求項9】
前記疼痛が、神経成長因子(NGF)惹起性の疼痛である、請求項8に記載のスクリーニング方法。
【請求項10】
前記物質を探索する工程が、以下の工程(I)〜(III):
(I)BDNFタンパク質および/またはCGRPタンパク質を発現可能な細胞または前記細胞から調製した細胞画分と、被験物質とを接触させる工程、
(II)前記被験物質を接触させた前記細胞または前記細胞画分における、BDNFタンパク質および/またはCGRPタンパク質の発現量を測定する工程、および、
(III)前記発現量を前記被験物質に接触させない対照細胞または前記対照細胞から調製した対照細胞画分における発現量と比較して、BDNFタンパク質および/またはCGRPタンパク質の発現量を減少させる被験物質を候補物質として選択する工程、
を含む、請求項8または9に記載のスクリーニング方法。
【請求項11】
前記疼痛が、神経成長因子(NGF)惹起性の疼痛であり、前記工程(I)を神経成長因子(NGF)の存在下で行う、請求項10に記載のスクリーニング方法。
【請求項12】
BDNFタンパク質が、配列番号:2に記載のアミノ酸配列からなるタンパク質である、請求項8〜11のいずれか1項に記載のスクリーニング方法。
【請求項13】
CGRPタンパク質が、配列番号:4に記載のアミノ酸配列からなるタンパク質である、請求項8〜12のいずれか1項に記載のスクリーニング方法。
【請求項14】
請求項8〜13のいずれか1項に記載のスクリーニング方法に用いられる疼痛の予防および/または治療剤のスクリーニング用キットであって、BDNFタンパク質および/またはCGRPタンパク質を含む、キット。
【請求項1】
BDNF(脳由来神経栄養因子;Brain-Derived Neutrophic Factor)遺伝子および/またはCGRP(カルシトニン遺伝子関連ペプチド;Calcitonin Gene-Related Peptide)遺伝子の発現を抑制する物質を探索する工程を含む、疼痛の予防および/または治療剤のスクリーニング方法。
【請求項2】
BDNF遺伝子および/またはCGRP遺伝子の発現を抑制する物質を探索する工程を含む、神経成長因子(NGF)惹起性の疼痛の予防および/または治療剤のスクリーニング方法。
【請求項3】
BDNF遺伝子および/またはCGRP遺伝子の発現を抑制する物質を探索する工程を含み、前記物質を探索する工程が、以下の工程(I)〜(III):
(I)BDNF遺伝子および/またはCGRP遺伝子を発現可能な細胞と、被験物質とを接触させる工程、
(II)前記被験物質を接触させた前記細胞における、BDNF遺伝子および/またはCGRP遺伝子の発現量を測定する工程、および、
(III)前記発現量を前記被験物質に接触させない対照細胞における発現量と比較して、BDNF遺伝子および/またはCGRP遺伝子の発現量を減少させる被験物質を候補物質として選択する工程、
を含む、疼痛の予防および/または治療剤のスクリーニング方法。
【請求項4】
BDNF遺伝子および/またはCGRP遺伝子の発現を抑制する物質を探索する工程を含み、前記物質を探索する工程が、以下の工程(I)〜(III):
(I)BDNF遺伝子および/またはCGRP遺伝子を発現可能な細胞と、被験物質とを神経成長因子(NGF)の存在下で接触させる工程、
(II)前記被験物質を接触させた前記細胞における、BDNF遺伝子および/またはCGRP遺伝子の発現量を測定する工程、および、
(III)前記発現量を前記被験物質に接触させない対照細胞における発現量と比較して、BDNF遺伝子および/またはCGRP遺伝子の発現量を減少させる被験物質を候補物質として選択する工程、
を含む、神経成長因子(NGF)惹起性の疼痛の予防および/または治療剤のスクリーニング方法。
【請求項5】
BDNF遺伝子が、配列番号:1に記載の塩基配列からなる遺伝子である、請求項1〜4のいずれか1項に記載のスクリーニング方法。
【請求項6】
CGRP遺伝子が、配列番号:3に記載の塩基配列からなる遺伝子である、請求項1〜5のいずれか1項に記載のスクリーニング方法。
【請求項7】
請求項1〜6のいずれか1項に記載のスクリーニング方法に用いられる疼痛の予防および/または治療剤のスクリーニング用キットであって、BDNFタンパク質をコードするポリヌクレオチドおよび/またはCGRPタンパク質をコードするポリヌクレオチドを含む、キット。
【請求項8】
BDNFタンパク質および/またはCGRPタンパク質の発現を抑制する物質を探索する工程を含む、疼痛の予防および/または治療剤のスクリーニング方法。
【請求項9】
前記疼痛が、神経成長因子(NGF)惹起性の疼痛である、請求項8に記載のスクリーニング方法。
【請求項10】
前記物質を探索する工程が、以下の工程(I)〜(III):
(I)BDNFタンパク質および/またはCGRPタンパク質を発現可能な細胞または前記細胞から調製した細胞画分と、被験物質とを接触させる工程、
(II)前記被験物質を接触させた前記細胞または前記細胞画分における、BDNFタンパク質および/またはCGRPタンパク質の発現量を測定する工程、および、
(III)前記発現量を前記被験物質に接触させない対照細胞または前記対照細胞から調製した対照細胞画分における発現量と比較して、BDNFタンパク質および/またはCGRPタンパク質の発現量を減少させる被験物質を候補物質として選択する工程、
を含む、請求項8または9に記載のスクリーニング方法。
【請求項11】
前記疼痛が、神経成長因子(NGF)惹起性の疼痛であり、前記工程(I)を神経成長因子(NGF)の存在下で行う、請求項10に記載のスクリーニング方法。
【請求項12】
BDNFタンパク質が、配列番号:2に記載のアミノ酸配列からなるタンパク質である、請求項8〜11のいずれか1項に記載のスクリーニング方法。
【請求項13】
CGRPタンパク質が、配列番号:4に記載のアミノ酸配列からなるタンパク質である、請求項8〜12のいずれか1項に記載のスクリーニング方法。
【請求項14】
請求項8〜13のいずれか1項に記載のスクリーニング方法に用いられる疼痛の予防および/または治療剤のスクリーニング用キットであって、BDNFタンパク質および/またはCGRPタンパク質を含む、キット。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2012−143200(P2012−143200A)
【公開日】平成24年8月2日(2012.8.2)
【国際特許分類】
【出願番号】特願2011−4991(P2011−4991)
【出願日】平成23年1月13日(2011.1.13)
【出願人】(304021831)国立大学法人 千葉大学 (601)
【Fターム(参考)】
【公開日】平成24年8月2日(2012.8.2)
【国際特許分類】
【出願日】平成23年1月13日(2011.1.13)
【出願人】(304021831)国立大学法人 千葉大学 (601)
【Fターム(参考)】
[ Back to top ]

