疼痛の治療剤
【課題】神経因性などの難治性疼痛に対して、既存の麻薬、消炎鎮痛剤などの神経ブロック注射などに比べて、効果が持続し、頻回の投与を軽減化しうる新規治療剤を提供する。さらに、新規疼痛治療剤のスクリーニング方法を提供する。
【解決手段】細痛み刺激により後根神経節(DRG)に存在する知覚神経(一次ニューロン)やグリア細胞などから放出された脳由来神経栄養因子(BDNF)は、脊髄後角のシナプス後膜上に存在する受容体に結合し、その痛みシグナルは二次ニューロンに伝えられ、二次ニューロンはその信号を脳に伝達すると考えられる。BDNFとその受容体との結合を阻害しうる物質を有効成分として含むことを特徴とする、疼痛治療剤による。さらには、BDNFとその受容体との結合を阻害しうる物質を選別することを特徴とする新規疼痛治療剤のスクリーニング方法による。
【解決手段】細痛み刺激により後根神経節(DRG)に存在する知覚神経(一次ニューロン)やグリア細胞などから放出された脳由来神経栄養因子(BDNF)は、脊髄後角のシナプス後膜上に存在する受容体に結合し、その痛みシグナルは二次ニューロンに伝えられ、二次ニューロンはその信号を脳に伝達すると考えられる。BDNFとその受容体との結合を阻害しうる物質を有効成分として含むことを特徴とする、疼痛治療剤による。さらには、BDNFとその受容体との結合を阻害しうる物質を選別することを特徴とする新規疼痛治療剤のスクリーニング方法による。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、神経因性などの難治性疼痛に対する新規な治療剤に関する。さらには、新規疼痛治療剤のスクリーニング方法に関する。
【背景技術】
【0002】
痛みは持続期間によって、急性疼痛と慢性疼痛とに分類される。急性疼痛は組織障害に伴う痛みでその持続期間は限られる。慢性疼痛は組織障害の治癒後にも続き、はっきりとした器質的原因を有さないことが多い。慢性疼痛における急性増悪期の痛みは急性疼痛と類似しており、内因性発痛物質が深く関わると考えられている。慢性疼痛として、交通事故又は手術後の後遺症、末期がん又は糖尿病などの耐え難い慢性的な痛みが挙げられる。また、痛みは原因によって、侵害受容性疼痛、神経因性疼痛(neuropathic pain)、心因性疼痛に分類される。これらの独立した痛みは時間の経過とともに徐々に融合し、分類が困難な慢性の難治性疼痛となる。
【0003】
神経因性疼痛は1994年のISAP (International Association for the Study of Pain)の慢性痛分類において、末梢神経及び中枢神経の障害又は機能異常による難治性の痛みであると定義されている。神経因性疼痛は、末梢神経及び中枢神経系の圧迫、変性、損傷に起因しているが、単一の病理的プロセスでは説明し得ない複雑な症候群から成り立っており、その発生機序はまだ解明されていない。よって、神経因性疼痛に関する治療効果に基づく指針も、一部を除いて有効性が保障されていない。
【0004】
神経因性疼痛は、創傷などによる初期の痛み(急性痛)とは異なり、創傷が治癒した後に新たに発生する痛みである。神経因性疼痛として、通常であれば痛みを引き起こさない程度の刺激によっても激烈な痛みを誘発する症状(「アロディニア」とよばれる。)が知られている。急性疼痛に対して有効な非ステロイド系消炎鎮痛剤及び麻薬系鎮痛薬剤などは、神経因性疼痛には効果を示さず、決定的な治療法は未だ知られていない。神経因性疼痛を抑制することができれば、臨床面において患者の肉体的苦痛の緩和及びQOLの向上をもたらすことが可能となる。
【0005】
従来、神経因性疼痛などの難治性疼痛に対しては、既存の麻薬、消炎鎮痛剤などと、神経ブロック注射(麻酔薬)を組み合わせて行なっている。しかし、何れの方法も効果は不十分である。例えば、神経障害性疼痛モデルであるL5-SNLラットを用いて、ノイロトロピン(Neurotropin:NTP)と疼痛疾患治療に用いられる消炎鎮痛薬及び抗うつ薬の効果を比較検討した報告がある(非特許文献1)。ここでは、ノイロトロピン(R)及びミルナシプランでは、薬剤投与後2時間のみ鎮痛効果が認められたことが報告されているものの、効果の持続性において十分とはいえない。
【0006】
末梢に加えた痛みは、後根神経節(dorsalroot ganglion: DRG)に存在する知覚神経(一次ニューロン)を通じて脊髄後角に伝達され、脊髄後角I層及びII層に存在する二次ニューロンにシナプスを介して伝えられ、二次ニューロンはその信号を中枢(脳)に伝達する。ラットの脊髄第5腰髄神経の後根神経節末梢側を結紮した慢性疼痛モデル、及びアレルギー反応を引き起こす結核菌の死菌 (Complete Freund's Adjuvant: CFA) をラットの足底に注射した急性疼痛モデルを作製し、後根神経節でのイベントを詳細に解析した報告がある。そこでは、CFA刺激によって、シナプス伝達を補完及び増強する役割を担っている脳由来神経栄養因子(brain-derived neurotrophic factor: 以下単に「BDNF」ともいう。)のmRNAの発現量が増加していること、特にエクソン1バリアントが顕著に増加したことが報告されている(非特許文献2)。ラットの脊髄第5腰髄神経を結紮した慢性疼痛モデル、及び、CFAをラットの足底に注射した急性疼痛モデルに、BDNFのエクソン1バリアントの発現を抑制するデコイDNAをくも膜下投与することにより、ラットが痛みを感じなくなることを見出したことが開示されている(特許文献1)。前記は、BDNFは脊髄での痛みの伝達を増強する働きを有している可能性があることから、この発現を抑制すれば痛みを抑え得るかもしれない、すなわち、一次ニューロンで合成されるBDNFを抑えることができれば末梢にて加えた痛みが軽減されるかもしれないとの考えに基づくものである。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】日本ペインクリニック学会誌 Vol.15 No.4, 407-413 (2008)
【非特許文献2】Kobayashi et al., Brain Res. 1206. 13-19 (2008)
【特許文献】
【0008】
【特許文献1】国際公開WO2009/145067号パンフレット
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明は、神経因性などの難治性疼痛に対して、既存の麻薬、消炎鎮痛剤などの神経ブロック注射などに比べて、効果が持続し、頻回の投与を軽減化しうる新規治療剤を提供することを課題とする。さらには、新規疼痛治療剤のスクリーニング方法を提供することを課題とする。
【課題を解決するための手段】
【0010】
痛み刺激により後根神経節(DRG)に存在する知覚神経(一次ニューロン)やグリア細胞などから放出された脳由来神経栄養因子(BDNF)は、脊髄後角のシナプス後膜上に存在する受容体に結合し、その痛みシグナルは二次ニューロンに伝えられ、二次ニューロンはその信号を脳に伝達すると考えられる。本発明者らは、BDNFが受容体に結合するのを抑制することが可能となれば、末梢の痛みは軽減されるかもしれないと考えた。そこで、上記課題を解決するために鋭意研究を重ねた結果、BDNFの受容体(TrkB: tyrosine kinase receptor B、別名はNTRK2: Neurotrophic Tyrosine Kinase, Receptor, type 2及びNGFR(p75))の改変型蛋白質をコードする遺伝子、すなわちポリヌクレオチドを作製し、慢性疼痛モデルラットに導入・発現させることにより、当該慢性疼痛ラットの痛みを軽減しうることを見出し、本発明を完成した。
【0011】
すなわち本発明は、以下よりなる。
1.脳由来神経栄養因子(BDNF)とその受容体との結合を阻害しうる物質を有効成分として含むことを特徴とする、疼痛治療剤。
2.BDNFが、脊髄後角に放出されるBDNFである、前項1に記載の疼痛治療剤。
3.BDNFが、知覚神経及び/又はグリア細胞より放出されるBDNFである、前項1又は2に記載の疼痛治療剤。
4.BDNFとその受容体との結合を阻害しうる物質が、改変型のBDNF受容体である、前項1〜3のいずれか1に記載の疼痛治療剤。
5.改変型のBDNF受容体が、分泌型TrkB、膜結合型TrkB及び分泌型NGFR(p75)から選択されるいずれかである、前項4に記載の疼痛治療剤。
6.改変型のBDNF受容体が、以下に示すいずれかのアミノ酸配列からなる、前項4又は5に記載の疼痛治療剤:
1)配列表の配列番号2、4、6、8、10又は12のいずれかに示すアミノ酸配列;
2)上記1)に示すアミノ酸配列のうち、1〜複数個のアミノ酸が、置換、欠失、付加又は導入されてなるアミノ酸配列。
7.BDNFとその受容体との結合を阻害しうる物質が、分泌型TrkB、膜結合型TrkB及び分泌型NGFR(p75)から選択されるいずれかをコードするポリヌクレオチドである、前項5又は6に記載の疼痛治療剤。
8.分泌型TrkB、膜結合型TrkB及び分泌型NGFR(p75)から選択されるいずれかをコードするポリヌクレオチドが、以下に示すいずれかの塩基配列からなるポリヌクレオチドである、前項7に記載に疼痛治療剤:
1)配列表の配列番号1、3、5、7、9又は11のいずれかに示す塩基配列からなるポリヌクレオチド;
2)上記1)に示すポリヌクレオチドに対して相補的な塩基配列からなるポリヌクレオチド;
3)上記1)又は2)に示すポリヌクレオチドに対して、ストリンジェントな条件下でハイブリダイズしうるポリヌクレオチド;
4)上記1)又は2)に示すポリヌクレオチドのうち、1〜複数個のヌクレオチドが、置換、欠失、付加又は導入されてなるポリヌクレオチド。
9.前項7又は8に記載のいずれかのポリヌクレオチドが組み込まれたベクターを含む、前項7又は8に記載の疼痛治療剤。
10.BDNFとその受容体との結合を阻害しうる物質を選別することを特徴とする新規疼痛治療剤のスクリーニング方法。
11.以下の1)及び2)の工程を含む、前項10に記載の新規疼痛治療剤のスクリーニング方法:
1)膜貫通ドメインを有するBDNF受容体を発現しうる細胞を、候補物質及びBDNFと共に培養する工程;
2)前記細胞の表面上に結合したBDNFを確認する工程。
12.以下の1)〜3)の工程を含む、前項10に記載の新規疼痛治療剤のスクリーニング方法:
1)膜貫通ドメインを有するBDNF受容体を発現しうる細胞を、候補物質と共に培養する工程;
2)上記培養系に、さらにBDNFを添加する工程;
3)前記細胞の表面上に結合したBDNFを確認する工程。
【発明の効果】
【0012】
BDNFとその受容体との結合を阻害しうる物質として、当該受容体であるTrkB若しくはNGFR(p75)の改変型蛋白質、又は当該改変型蛋白質を発現する遺伝子により、慢性疼痛ラットにおいて、疼痛軽減効果が認められた。具体的には、膜貫通ドメインを有さない分泌型TrkB遺伝子発現ベクターpCMVscript-tTrkB(-)Tm-EGFP、又は膜貫通ドメインを有する膜結合型受容体遺伝子発現ベクターpCMVscript-tTrkB(+)Tm-EGFPを導入した慢性疼痛ラットにおいて、各蛋白質を発現していることが確認され、3〜4日間持続的に疼痛軽減効果が認められた。したがって、BDNF受容体(TrkB及び/又はNGFR(p75))の改変型蛋白質をコードする遺伝子を生体内で発現させることで、生体内でBDNFがその受容体に結合するのを防ぐことができ、痛みを軽減しうる。
【0013】
さらに、本発明の疼痛治療剤の作用メカニズムが、脳由来神経栄養因子とその受容体との結合を阻害しうる作用によるものであることから、脳由来神経栄養因子とその受容体との結合を阻害しうる物質を選別することで、新規疼痛治療剤をスクリーニングすることができる。
【図面の簡単な説明】
【0014】
【図1】分泌型TrkB、膜結合型TrkB及び分泌型NGFR(p75)の概念図である。
【図2】改変型TrkB遺伝子発現ベクターの作製模式図である。(実施例1−1)
【図3】改変型NGFR(p75)遺伝子発現ベクターの作製模式図である。(実施例1−2)
【図4】培養細胞系における改変型TrkB及び改変型NGFR(p75)の発現確認実験結果を示す図である。(実験例1−1)
【図5】培養細胞系における分泌型BDNF受容体(改変型TrkB、改変型NGFR(p75))の発現確認実験結果を示す図である。(実験例1−2)
【図6】培養細胞系における分泌型BDNF受容体(改変型TrkB、改変型NGFR(p75))のBDNF結合能の確認実験結果を示す図である。(実験例1−3)
【図7】培養細胞系における膜結合型BDNF受容体(改変型TrkB)のBDNF結合能の確認実験結果を示す図である。(実験例1−4)
【図8】慢性疼痛ラットの疼痛行動評価スケジュールを示す図である。(実験例1−5)
【図9】分泌型TrkBによる慢性疼痛ラットの疼痛抑制データを示す図である。(実験例1−5)
【図10】膜結合型TrkBによる慢性疼痛ラットの疼痛抑制データを示す図である。(実験例1−5)
【図11】慢性疼痛ラットにおける改変型TrkB遺伝子の発現確認実験結果を示す図である。(実験例1−6)
【図12】疼痛治療剤をスクリーニングするシステムの実験結果を示す図である。(実施例2)
【発明を実施するための形態】
【0015】
本発明はBDNFとその受容体との結合を阻害しうる物質を有効成分として含むことを特徴とする、疼痛治療剤に関する。本発明の有効成分としての、「BDNFとその受容体との結合を阻害しうる物質」は、好ましくはBDNFのうち脊髄後角に作用するBDNF、より具体的には知覚神経及び/又はグリア細胞などより放出されるBDNFついて、その受容体との結合を阻害しうる。
【0016】
ここで、好ましくは脊髄後角に作用するBDNF、より具体的には知覚神経及び/又はグリア細胞などより放出されるBDNFとするのは、本発明の疼痛治療剤に含まれる有効成分が疼痛に関連するBDNFに作用することで、疼痛を軽減し、治療することができるからである。BDNFは、分子量13.5kDよりなる分泌性蛋白質であり、ホモ2量体を形成している。BDNFは、その受容体である標的細胞表面上にある特異的受容体TrkBと高親和性に結合し、細胞内のシグナル伝達機構を介してその生理作用を発揮する。BDNFは、海馬に高濃度に存在することも知られている。BDNFは脊髄後角で痛みの伝達を増強する働きを有している可能性があることから、本発明では、BDNFとその受容体との結合を抑制すれば痛みを抑え得ると考えられた。
【0017】
本発明において、BDNFとその受容体との結合を阻害しうる物質とは、改変型のBDNF受容体であることを特徴とする。知覚神経及び/又はグリア細胞などより放出されるBDNFが改変型のBDNF受容体と結合することで、当該BDNFが標的細胞表面上にある特異的受容体(TrkB又はNGFR(p75))と結合することが抑制され、その結果、BDNFと特異的受容体が結合することによる細胞内のシグナル伝達機構を介してその生理作用を発揮するのを抑制するためである。そのような、改変型のBDNF受容体としては、分泌型TrkB、膜結合型TrkB及び分泌型NGFR(p75)から選択されるいずれか1種又複数種とすることができる(図1参照)。
【0018】
上記において、改変型のBDNF受容体としての分泌型TrkBは、正常型TrkBの膜貫通ドメインの直前までのアミノ酸配列からなり、膜貫通ドメインを有さないTrkBの細胞外側蛋白質であり、細胞外に分泌され、BDNFを捕獲しうる(図1、2参照)。同様に、膜結合型TrkBは、正常型TrkBの膜貫通ドメインを含むアミノ酸配列からなり、少なくとも膜貫通ドメインの直後までのアミノ酸を含む細胞外側蛋白質で、細胞膜上でBDNFを捕獲しうる(図1、2参照)。膜結合型TrkBは、細胞内にシグナル伝達機構を介して生理作用を発揮しえないものであればよく、特に限定されない。例えば、遺伝子組換技術により膜結合型TrkBを作製する場合に、遺伝子増幅のために好ましいアミノ酸を含むものであっても良い。具体的には、膜貫通ドメインの直後から、1〜20程度、好ましくは1〜13程度のアミノ酸を含むものであってもよい。分泌型NGFR(p75)は、正常型NGFR(p75)の膜貫通ドメインの直前までのアミノ酸配列からなり、膜貫通ドメインを有さないNGFR(p75) の細胞外側蛋白質で、細胞外に分泌され、BDNFを捕獲しうる(図1〜3参照)。
【0019】
上記において、ヒトTrkBをコードする遺伝子は、GenBank Accession number=NM_006180に示す塩基配列で特定され、相当するラットTrkBをコードする遺伝子は、GenBank Accession number=NM_012731に示す塩基配列で特定される。また、ヒトNGFR(p75)をコードする遺伝子は、GenBank Accession number=NM_002507に示す塩基配列で特定され、相当するラットNGFR(p75)をコードする遺伝子は、GenBank Accession number=NM_012610に示す塩基配列で特定される。
【0020】
本発明における改変型BDNF受容体(分泌型TrkB、膜結合型TrkB及び分泌型NGFR(p75))の塩基配列及びアミノ酸配列の骨子は以下の表1に示すとおりである。
【表1】

【0021】
上記において、分泌型TrkBについて、正常型TrkBの膜貫通ドメインの直前までの改変型蛋白質をコードする遺伝子は、ヒトTrkBの場合、GenBank Accession number=NM_006180に示す塩基配列の939〜2227番目の塩基配列で特定され(配列番号1)、ラットの場合にはGenBank Accession number=NM_012731に示す塩基配列の662〜1947番目の塩基配列で特定される(配列番号3)。同様に、膜結合型TrkBについて、正常型TrkBの膜貫通ドメインの直後までの改変型蛋白質をコードする遺伝子は、ヒトTrkBの場合、GenBank Accession number=NM_006180に示す塩基配列の939〜2300番目の塩基配列で特定され(配列番号5)、ラットの場合にはGenBank Accession number=NM_012731に示す塩基配列の662〜2020番目の塩基配列で特定される(配列番号7)。さらに、分泌型NGFR(p75)について、正常型NGFR(p75)の膜貫通ドメインの直前までの改変型蛋白質をコードする遺伝子は、ヒトTrkBの場合、GenBank Accession number=NM_002507に示す塩基配列の126〜875番目の塩基配列で特定され(配列番号9)、ラットの場合にはGenBank Accession number=NM_012610に示す塩基配列の114〜866番目の塩基配列で特定される(配列番号11)。
【0022】
本発明の改変型のBDNF受容体は、より具体的には、以下に示すいずれかのアミノ酸配列からなる。
1)配列表の配列番号2、4、6、8、10及び12から選択されるいずれかに示すアミノ酸配列;
2)上記1)に示すアミノ酸配列のうち、1〜複数個のアミノ酸が、置換、欠失、付加又は導入されてなるアミノ酸配列。
上記において、表1に示す如く、配列番号2、6及び10は、ヒト由来蛋白質に基づき、配列番号4、8及び12はラット由来蛋白質に基づく。
【0023】
本発明において、上記に示す分泌型TrkB、膜結合型TrkB及び分泌型NGFR(p75)から選択されるいずれか1種又は複数種を有効成分として含む疼痛治療剤は、改変型のBDNF受容体(蛋白質)を含有するものであり、蛋白質製剤として使用することができる。
【0024】
本発明の蛋白質製剤には、薬学的に許容しうる担体を含めることができる。また、そのような蛋白質製剤は、通常非経口的投与経路により投与することができ、例えば注射剤(皮下注、静注、筋注、腹腔内注など)として投与することができる他、経皮、経粘膜、経鼻、経肺などで投与することができる。このような蛋白質製剤は、溶液製剤であっても、使用前に溶解再構成するために凍結乾燥したものであってもよい。凍結乾燥のための賦形剤としては例えばマンニトール、ブドウ糖などの糖アルコールや糖類を使用することが出来る。溶液製剤である場合には、通常密封、滅菌されたプラスチック又はガラス製のバイアル、アンプル、注射器のような規定容量の形状の容器、ならびに瓶のような大容量の形状の容器で供給することができる。このような製剤中に含まれる有効成分としての蛋白質の量は、重症度、投与部位、投与回数、所望治療期間、患者の年齢、体重等により異なり、適宜決定することができる。本願蛋白質を有効成分とする疼痛治療剤が溶液製剤の場合には、一般的には、溶液製剤の全体量に対して、0.01μg〜200mg/ml、好ましくは0.5μg〜100mg/mlの蛋白質を含むことができる。
【0025】
本発明では、上記のBDNF受容体の改変型蛋白質をコードする遺伝子、すなわち改変型のBDNF受容体を発現可能とするポリヌクレオチドも、本発明の疼痛治療剤の有効成分とすることができる。そのようなポリヌクレオチドとして、分泌型TrkB、膜結合型TrkB及び分泌型NGFR(p75)から選択されるいずれかの改変型蛋白質をコードするポリヌクレオチドが挙げられる。本明細書中で使用される場合、用語「ポリヌクレオチド」は、「遺伝子」、「核酸」又は「核酸分子」と交換可能に使用され、ヌクレオチドの重合体が意図される。本明細書中で使用される場合、用語塩基配列は、「核酸配列」又は「ヌクレオチド配列」と交換可能に使用され、デオキシリボヌクレオチド(A,G,C及びTと略称される。)の配列として示される。ただし、本明細書中で使用される塩基配列はA,G,C及びTと略称されるが、デオキシリボヌクレオチドのみならず、それに対応するリボヌクレオチドとしても使用されることを意味しており、ヌクレオチドの重合体としてはデオキシリボヌクレオチド、リボヌクレオチド、もしくはその混合型が意図される。
【0026】
分泌型TrkB、膜結合型TrkB及び分泌型NGFR(p75)から選択されるいずれかの改変型蛋白質をコードするポリヌクレオチドは、以下に示すいずれかの塩基配列からなるポリヌクレオチドである:
1)配列表の配列番号1、3、5、7、9及び11から選択されるいずれかに示す塩基配列からなるポリヌクレオチド;
2)上記1)に示すポリヌクレオチドに対して相補的な塩基配列からなるポリヌクレオチド;
3)上記1)又は2)に示すポリヌクレオチドに対して、ストリンジェントな条件下でハイブリダイズしうるポリヌクレオチド;
4)上記1)又は2)に示すポリヌクレオチドのうち、1〜複数個のヌクレオチドが、置換、欠失、付加又は導入されてなるポリヌクレオチド。
さらに、本発明のポリヌクレオチドは、コドンの変換により、配列表の配列番号2、4、6、8、10及び12に示すアミノ酸配列のいずれかを発現可能な塩基配列を有していてもよい。
上記において、配列番号1、5及び9は、ヒト由来遺伝子に基づき、配列番号3、7及び11はラット由来遺伝子に基づく。
【0027】
上記において、ストリンジェントなハイブリダイゼーション条件は一般に知られたものを選択することができる。その一例としては、50%ホルムアミド、5×SSC(150mM NaCl、15mM クエン酸三ナトリウム)、50mMリン酸ナトリウム、pH7.6、5×デンハーツ溶液、10%デキストラン硫酸、及び20μg/mlのDNAを含む溶液中、42℃で一晩ハイブリダイゼーションした後、室温で2×SSC・0.1%SDS中で一次洗浄し、次いで、約65℃において0.1×SSC・0.1%SDSで二次洗浄といった条件があげられる。
【0028】
上記のポリヌクレオチドを用いた遺伝子工学又は生物工学の基本操作については、市販の実験書、例えば、遺伝子マニュアル 講談社、高木康敬編 遺伝子操作実験法 講談社、モレキュラー・クローニング(Molecular Cloning)、コールド・スプリング・ハーバー・ラボラトリー(Cold Spring harbor Laboratory)(1982)、モレキュラー・クローニング第2版(Molecular Cloning, 2nd ed.)、コールドスプリング・ハーバーラボラトリー(Cold Spring harbor Laboratory)(1989)、メッソッズ・イン・エンザイモロジー(Methods in Enzymol.),194 (1991)、実験医学別冊・酵母による遺伝子実験法 羊土社(1994)等に記載された方法に従って行うことができる。
【0029】
上述のポリヌクレオチドを、本発明の疼痛治療剤の有効成分として用いる場合、遺伝子治療に用いることができる。遺伝子治療に用いる際には、ヒトを含む哺乳動物の細胞内で蛋白質を発現することができ、かつ、安全性の高いDNA若しくはRNAウイルスベクター又はプラスミドベクターを用いるのが好ましい。遺伝子治療において好ましいウイルスベクターとしては、アデノウイルス、アデノ随伴ウイルス(AAV)、レトロウイルス、ポックスウイルス、ヘルペスウイルス、単純ヘルペスウイルス、レンチウイルス、センダイウイルス、エプスタイン−バーウイルス(EBV)、ワクシニアウイルス、ポリオウイルス、シンビスウイルス、SV40等が挙げられる。より好ましくは、アデノ随伴ウイルス(AAV)若しくはアデノウイルスが挙げられる。アデノウイルスには種々の血清型が存在するが、本発明では2型若しくは5型ヒトアデノウイルスを使用することが好ましい。アデノウイルスは、感染効率が他のウイルスベクターに比べて高いこと、分裂していない細胞に感染することができること及び細胞のゲノムに組み込まれないことが知られており、この観点からアデノウイルスベクターを用いることはさらに好ましい。
【0030】
上記のウイルスベクターに、上述のいずれかのポリヌクレオチドを導入し、生体内又は細胞に感染させることによって、生体内又は細胞内に遺伝子を導入することが可能である。ウイルスベクターの作製法、遺伝子の導入方法は、別冊実験医学、遺伝子治療の基礎技術、羊土社(1996)、あるいは、別冊実験医学、遺伝子導入&発現解析実験法、羊土社(1997)等を参照することができる。
【0031】
発現ベクターを裸のプラスミドとしてin vivoに導入することもできる。遺伝子治療において好ましいプラスミドとしては、pCAGGS[Gene,108,193-200(1991)]、pBK-CMV、pcDNA3.1、pZeoSV(インビトロゲン社、ストラジーン社)等を使用することができる。遺伝子治療用の裸のプラスミドは、例えば、トランスフェクション、エレクトロポレーション、マイクロインジェクション、形質導入、細胞融合、DEAEデキストラン、リン酸カルシウム沈殿、遺伝子銃で担体(金属粒子)とともにDNAを細胞内に導入する方法等、自体公知の方法により細胞に導入することができる[Wu et al., J. Blol. Chem. 267, 963-967(1992)、Wu et al., J. Blol. Chem. 263, 14621-14624, (1988)、Proc. Natl. Acad. Sci., USA, 88, 2726-2730 (1991)]。
【0032】
また、人工的なベクターとしては、リポソーム、マイクロカプセル、サイトフェクチン、DNA-蛋白質複合体、バイオポリマー等が挙げられる。リポソームを用いてDNAを導入する方法には、リポソーム法、HVJ-リポソーム法、陽イオン性リポソーム法、リポフェクチン法、リポフェクトアミン法等が挙げられる。マイクロカプセルはフィルムコートされた粒子であり、膜形成ポリマー誘導体、疎水性可塑剤、表面活性剤又は/及び潤滑剤窒素含有ポリマーの混合物からなるコーティング材料でコートされた粒子等で構成される。
【0033】
上述の遺伝子治療剤の製剤形態としては、上記の各投与形態にあった種々の製剤形態を適用することができる。例えば、有効成分である本発明のポリヌクレオチドを含有する注射剤とした場合、当該注射剤は常法により調製することができる。遺伝子治療剤に用いる基剤としては、通常注射剤に用いる基剤であれば、特に制限されず、蒸留水、塩化ナトリウム、又は塩化ナトリウムと無機塩等との混合物の塩溶液、マンニトール、ラクトース、デキストラン、グルコース等の溶液、グリシン、アルギニン等のアミノ酸溶液、有機酸溶液又は塩溶液とグルコース溶液との混合溶液等が挙げられ得る。また、常法に従い、これらの基剤に浸透圧調整剤、pH調整剤、ゴマ油、ダイズ油等の植物油又はレシチン若しくは非イオン性界面活性剤等の界面活性剤等の助剤を用いて、溶液、懸濁液、分散液として注射剤を調整してもよい。これらの注射剤を粉末化、凍結乾燥等の操作により用事溶解用製剤とすることもできる。製剤中のポリヌクレオチドの含量は、投与部位、投与回数、所望治療期間、患者の年齢、体重等により異なり、適宜調整することができる。
【0034】
本発明の疼痛治療剤として使用される製剤、例えば蛋白質製剤又は遺伝子治療剤のいずれの場合においても、製剤化に際して、好ましくは安定化剤が添加される。安定化剤としては、例えば、アルブミン、グロブリン、ゼラチン、マンニトール、グルコース、デキストラン、エチレングリコール等が挙げられる。さらに、本発明の製剤は製剤化に必要な添加物、例えば、賦形剤、溶解補助剤、酸化防止剤、無痛化剤、等張化剤等と配合してもよい。液状製剤とした場合は、凍結保存又は凍結乾燥等により水分を除去して保存するのが望ましい。凍結乾燥剤は、用事に注射用蒸留水等を加え、再溶解して使用される。また、徐放剤とした場合は、徐放用担体として例えば、可溶性コラーゲン又は可溶性コラーゲン誘導体、ゼラチン等の蛋白質、セラミックス多孔体、ポリアミノ酸、ポリ乳酸、キチン又はキチン誘導体、水膨潤性高分子ゲル等を使用することができる。
【0035】
本発明は、BDNFとその受容体との結合を阻害しうる物質を選別することを特徴とする新規疼痛治療剤のスクリーニング方法にも及ぶ。痛み刺激によりBDNFが分泌され、神経細胞膜上のBDNF受容体に結合する結果、痛みシグナルが中枢神経へ伝達されることになる。BDNFとその受容体との結合を阻害しうる物質、例えば改変型のTrkB、より具体的には分泌型TrkB、膜結合型TrkB、分泌型NGFR(p75)等が、痛み刺激により分泌されたBDNFと結合し、神経細胞膜上のBDNF受容体とBDNFが結合するのを阻害することで、疼痛抑制効果を示すことが本発明において明らかになった。そこで、BDNFとその受容体との結合に着目し、BDNFとBDNF受容体とが結合するのを阻害する物質を選別することを特徴とするスクリーニング方法に係る発明を完成した。
【0036】
本発明のスクリーニング方法は、以下の1)及び2)の工程を含む方法による。
1)膜貫通ドメインを有するBDNF受容体を発現しうる細胞を、候補物質及びBDNFと共に培養する工程;
2)前記細胞の表面上に結合したBDNFを確認する工程。
上記において、候補物質とBDNFの培養液への添加の順序については同時に添加してもよいし、候補物質の添加後にBDNFを添加してもよい。例えば、以下の1’)〜3’)の工程を含む方法によることができる。
1’)膜貫通ドメインを有するBDNF受容体を発現しうる細胞を、候補物質と共に培養する工程;
2’)上記培養系に、さらにBDNFを添加する工程;
3’)前記細胞表面上のBDNFを確認する工程。
【0037】
上記において、新規疼痛治療剤となりうる候補物質は、低分子化合物であってもよいし、ポリペプチドや蛋白質であってもよい。蛋白質の例として、改変型のBDNF受容体が挙げられ、具体的には分泌型TrkB、膜結合型TrkBや分泌型NGFR(p75)等が挙げられる。
【0038】
上記において、膜貫通ドメインを有するBDNF受容体とは、細胞膜上でBDNFを捕獲しうる受容体であればよく、特に限定されない。例えば上述の膜結合型TrkBであってもよい。本発明の膜結合型TrkBのアミノ酸配列や、コードするポリヌクレオチドの塩基配列は、上述した。
【0039】
膜貫通ドメインを有するBDNF受容体を発現しうる細胞は、スクリーニングを行う際に作製してもよいが、予め作製したものであってもよい。膜貫通ドメインを有するBDNF受容体を発現しうる細胞は、例えば膜結合型TrkBをコードする遺伝子を挿入したベクターを導入した細胞とすることができる。細胞の種類としては、前記ベクターを導入しうる細胞であればよく特に限定されない。例えば、哺乳動物由来の細胞が挙げられ、具体的にはHEK293細胞やCHO細胞などを例示することができるが、これらに限定されるものではない。
【0040】
膜貫通ドメインを有するBDNF受容体を発現しうる細胞を候補物質と共に培養する工程では、予め前記細胞を培養容器内で培養した後に候補物質を加えて培養してもよいし、前記細胞と候補物質を培養容器に加えて培養してもよい。
【0041】
上記培養系に、さらにBDNFを添加し、細胞膜上に発現したBDNF受容体とBDNFとを結合させる。BDNF受容体と結合したBDNFを確認し、BDNF受容体へのBDNFの結合を阻害しうる物質を選別することで、本発明の新規疼痛治療剤のスクリーニングを行うことができる。BDNF受容体へ結合したBDNFの確認は、例えば抗BDNF抗体を作用させることで確認することができる。具体的には、標識抗BDNF抗体をBDNF受容体へ結合したBDNFと反応させることで、BDNFを確認することができる。あるいは、抗BDNF抗体をBDNF受容体へ結合したBDNFと反応させ、さらに抗BDNF抗体に対する標識抗体を用いることで確認することもできる。標識は、自体公知の標識物質であればよく、特に限定されない。例えば蛍光物質や発光物質などが挙げられる。また、標識蛋白とBDNFを融合させた、標識蛋白融合型BDNFを用いてもよい。例えば緑色蛍光タンパク質(GFP)などの蛍光蛋白とBDNFを融合させた、蛍光蛋白融合型BDNFを用いることができる。候補物質と共に培養する工程とBDNFを添加する工程では、予め候補物質を培養容器内に添加した後にBDNFを加えて培養してもよいし、同時に候補物質とBDNFを培養容器に加えて培養してもよい。
【0042】
例えば、マルチタイタープレートの各ウェルに異なる候補物質を含む系を用いて、前記膜貫通ドメインを有するBDNF受容体を発現しうる細胞を培養し、上記の手順に従った場合、標識が検出されなければ添加した候補物質はBDNFが膜上の受容体に結合するのを阻害する物質であると判断され、疼痛治療剤になり得ると考えられる。
【実施例】
【0043】
本発明の理解を助けるために、実施例、実験例等を示して具体的に本発明を説明するが、本発明はこれらに限定されるものでないことはいうまでもない。
【0044】
(実施例1−1)改変型TrkB発現ベクターの作製
ヒトのTrkB遺伝子(GenBank Accession number=NM_006180)に相当するラットTrkB遺伝子(GenBank Accession number=NM_012731)を基に、PCRを用いて改変型遺伝子を作製した(図2)。ラットの脳組織よりmRNAを抽出後、逆転写酵素(reverse transcriptase)を用いて逆転写して1本鎖cDNAを合成した。蛋白質合成開始領域に設定したセンスプライマー(配列番号13、制限酵素BamHI認識配列を含む)、及び、膜貫通ドメインの直前に設定したアンチセンスプライマー(配列番号14、制限酵素EcoRI認識配列を含む)を用いて、ラット1本鎖cDNAを用いたPCRにより TrkBの膜貫通ドメインの直前までをコードする遺伝子領域を増幅した。
【0045】
また、蛋白質合成開始領域に設定したセンスプライマー(配列番号13)、及び、膜貫通ドメインの直後に設定したアンチセンスプライマー(配列番号15、制限酵素EcoRI認識配列を含む)を用いて、ラット1本鎖cDNAを用いたPCRにより TrkBの膜貫通ドメインの直後までをコードする遺伝子領域を増幅した。
【0046】
センスプライマー:GGATCCGCCATGTCGCCCTGGCCGAGGTG(配列番号13)
アンチセンスプライマー:GAATTCATGCTCCCGATTGGTTTGGTC(配列番号14)
アンチセンスプライマー:GAATTCTGGGCCTTTCATGCCAAACTTG(配列番号15)
【0047】
各PCR増幅産物は、制限酵素EcoRVにより平滑末端処理されたpBluescript(R) KS(STRATAGENE社)にクローニングされ、シークエンシング解析により正しいポリヌクレオチドの塩基配列であることが確認された。その後、制限酵素BamHIとEcoRIにより各TrkB遺伝子は切り出され、BamHIとEcoRIにより切断されたpCMVscript-EGFP(蛍光蛋白質EGFP、FLAG-tag、S-tagが挿入されたpCMVscript(R)ベクター(STRATAGENE社))に挿入された。シークエンシング解析により、挿入された各TrkB遺伝子の領域は、蛍光蛋白質EGFP、FLAG-tag、S-tagにアミノ酸フレームが一致していること、すなわち、融合蛋白質として正しく発現されることが確認された。
【0048】
正常型TrkBの膜貫通ドメインを有さないTrkBの細胞外側蛋白質(truncated TrkB (-)Transmembrane type; tTrkB(-)Tm)を発現させるための、正常型TrkBの膜貫通ドメインの直前までのアミノ酸及びその後ろ側に蛍光蛋白質EGFPが融合した融合蛋白質をコードする遺伝子を挿入したベクターをpCMVscript-tTrkB(-)Tm-EGFPとした。以下、膜貫通ドメインを有さないTrkBを、「分泌型TrkB」ということとする。当該分泌型TrkBは、配列番号4に示すアミノ酸配列からなり、当該分泌型TrkBをコードする遺伝子は、配列番号3に示す塩基配列からなる。
【0049】
同様に、膜貫通ドメインを有するTrkBの細胞外側蛋白質(truncated TrkB (+)Transmembrane type; tTrkB(+)Tm)を発現させるために、正常型TrkBの膜貫通ドメイン直後から13のアミノ酸を含むアミノ酸配列及びその後ろ側に蛍光蛋白質EGFPが融合した融合蛋白質をコードする遺伝子を挿入したベクターをpCMVscript-tTrkB(+)Tm-EGFPとした。以下、膜貫通ドメインを有するTrkBを、「膜結合型TrkB」ということとする。当該膜結合型TrkBは、配列番号8に示すアミノ酸配列を含み、当該膜結合型TrkBをコードする遺伝子は、配列番号7に示す塩基酸配列を含む。
【0050】
(実施例1−2)改変型NGFR(p75)発現ベクターの作製
ヒトのNGFR(p75)遺伝子(GenBank Accession number=NM_002507)に相当するラットNGFR(p75)遺伝子(GenBank Accession number=NM_012610)を基に、PCRを用いて改変型遺伝子を作製した(図3)。蛋白質合成開始領域に設定したセンスプライマー(配列番号16、制限酵素EcoRI認識配列を含む)、及び、膜貫通ドメインの直前に設定したアンチセンスプライマー(配列番号17、制限酵素XhoI認識配列を含む)を用いて、ラット1本鎖cDNAを用いたPCRにより NGFR(p75)の膜貫通ドメインの直前までをコードする遺伝子領域を増幅した。
【0051】
センスプライマー:GAATTCACCATGAGGAGGGCAGGTGCTGCC(配列番号16)
アンチセンスプライマー:CTCGAGGTTGTCGGTGGTGCCG(配列番号17)
【0052】
PCR増幅産物は、制限酵素EcoRVにより平滑末端処理されたpBluescript(R) KS(STRATAGENE社)にクローニングされ、シークエンシング解析により正しいポリヌクレオチドの塩基配列であることが確認された。その後、制限酵素EcoRIとXhoIによりNGFR(p75)遺伝子は切り出され、EcoRIとXhoIにより切断されたpCM-Vscript-EGFP(蛍光蛋白質EGFP、FLAG-tag、S-tagを含むpCMVscript(R)ベクター(STRATAGENE社))に挿入された。シークエンシング解析により、挿入されたNGFR(p75)遺伝子領域は蛍光蛋白質EGFP、FLAG-tag、S-tagにアミノ酸フレームが一致していること、すなわち、融合蛋白質として正しく発現されることが確認された。ここで、膜貫通ドメインを有さないNGFR(p75)の細胞外側蛋白質をコードする遺伝子の発現ベクターをpCMVscript-tNGFR(-)Tm-EGFPとした。以下、膜貫通ドメインを有さないNGFR(p75)を、「分泌型NGFR(p75)」ということとする。当該分泌型NGFR(p75)のアミノ酸配列は配列番号12に示され、当該分泌型NGFR(p75)をコードする遺伝子は、配列表の配列番号11に示す塩基配列からなる。
【0053】
(実験例1−1)培養細胞系における改変型受容体の発現確認実験
本実験例では、各改変型の受容体が、細胞においてどのように発現するかを培養細胞系により観察した。実施例1−1及び1−2で作製した改変型受容体の発現ベクター pCMVscript-tTrkB(-)Tm-EGFP、pCMVscript-tTrkB(+)Tm-EGFP、pCMVscript-tNGFR(-)Tm-EGFP、又はコントロールベクター pCMVscript-EGFPを、遺伝子導入試薬であるLipofectamineTM 2000(インビトロジェン社)を用いて各々ヒト正常細胞HEK293に導入した。導入24時間後に、オリンパスIXL71倒立型蛍光顕微鏡にて、蛍光蛋白質EGFP融合型の各改変型受容体の発現を観察した。
【0054】
その結果、コントロールベクター pCMVscript-EGFPを導入した細胞では蛍光蛋白質EGFPは細胞全体に発現していることが観察された(図4左上)。膜結合型TrkBの発現ベクターpCMVscript-tTrkB(+)Tm-EGFPを導入した細胞では蛍光蛋白質EGFPが細胞膜付近に局在していることが観察された(図4右上)。このことは、膜結合型TrkBが確かに細胞膜に発現していると考えられた。
【0055】
一方、分泌型TrkB発現ベクター pCMVscript-tTrkB(-)Tm-EGFP及び分泌型NGFR(p75)発現ベクター pCMVscript-tNGFR(-)Tm-EGFPを導入した細胞では、細胞内に蛍光蛋白質EGFPはほとんど観察されなかった(図4左右下)。このことは、膜貫通ドメインを有さない改変型のtTrkB(-)Tm及びtNGFR(-)Tmは、細胞外へ分泌されており、その結果、細胞内の蛍光蛋白質が減少しているものと考えられた。
【0056】
(実験例1−2)培養細胞系における分泌型受容体の分泌確認実験
本実験例では、分泌型TrkB及び分泌型NGFR(p75)が細胞外へ分泌されているかについて、確認実験を行った。
【0057】
分泌型の改変型受容体発現ベクター pCMVscript-tTrkB(-)Tm-EGFP、pCMVscript-tNGFR(-)Tm-EGFP、又はコントロールベクター pCMVscript-EGFPを、遺伝子導入試薬であるLipofectamineTM 2000(インビトロジェン社)を用いて各々8μgヒト正常細胞HEK293(90mm dish)に導入し、6時間後に新しい培地と交換した。遺伝子導入72時間後に培養液(上清)を15 mlコニカルチューブに回収し、3000回転にて5分間遠心分離を行い、細胞を除去後、上清を新しいコニカルチューブに移し、本実験例の試料液とした。
【0058】
上記各試料液1 mlをエッペンドルフチューブに採取し、10μlのProtease inhibitor(Sigma社)と50μl S-proteinアガロースビーズ(Novagen社)を加え、4℃で16時間、ローテーターで回転させた。5000回転にて3分間遠心分離を行い、S-proteinアガロースビーズに結合しているS-tag及びS-tag融合型受容体の単離(Pull-Down)を行った。沈殿物を1 mlのリン酸緩衝液(PBS)で洗浄後、同様に遠心分離を行った。これを4回繰り返した。沈殿物にSDS-Sample Buffer を50μl加え、100℃で5分加熱後、10μlを12% SDSポリアクリルアミドゲルにて電気泳動し、iBlotTMゲルトランスファーシステム(Invitrogen社)にてPVDF((Polyvinylidene difluoride)膜に蛋白質のブロッティングを行った。転写されたPVDF膜をブロッキング緩衝液(3% BSA, 0.5% Tween20, 1xPBS)でブロッキングしたのちに、FLAG-tagに対する抗FLAGマウスモノクローナル抗体M2(Sigma社)を反応させた。洗浄後、抗マウスVecstain(R) ABC-AP kit(Vector Laboratories)で標識し、アルカリホスファターゼ(ALP)の基質であるCDP-star(R)(Roche社)を添加し、生じた蛍光をルミノ・イメージアナライザーLAS-1000(FUJIFILM社製)にて取り込んだ。
【0059】
その結果、pCMVscript-tTrkB(-)Tm-EGFP及びpCMVscript-tNGFR(-)Tm-EGFPを導入した細胞の培養液には、推定サイズ付近にバンドが検出されたが、コントロールベクター導入細胞の培養液にはバンドは検出されなかった(図5)。このことより、改変型受容体遺伝子が導入された細胞の培養液から分泌型TrkB及び分泌型NGFR(p75)が回収され、細胞外へ分泌されていることが明らかとなった。
【0060】
(実験例1−3)培養細胞系における分泌型受容体のBDNF結合能の確認実験
本実験例では、分泌型TrkB及び分泌型NGFR(p75)について、BDNFとの結合性について確認実験を行った。
実験例2で調製した試料液各1 mlをエッペンドルフチューブに採取し、10μl のProtease inhibitor(Sigma社)と0.5μgのBDNF(Abcom社、mature型)を加え4℃で16時間ローテーターで回転させた。その後、50μlの S-protein アガロースビーズ(Novagen社)を加え4℃で3時間、ローテーターで回転させた。5000回転にて3分間遠心分離を行い、S-proteinアガロースビーズ(Novagen社)に結合しているS-tag及びS-tag融合型受容体の単離(Pull-Down)を行った。当該分泌型受容体にBDNFが結合するのであれば、分泌型受容体を単離するとBDNFが検出される。沈殿物を1 mlのPBSで洗浄後、同様に遠心分離を行った。これを4回繰り返した。沈殿物にSDS-Sample Bufferを50μl加え、100℃で5分加熱後、10μlを12% SDSポリアクリルアミドゲルにて電気泳動し、iBlotTMゲルトランスファーシステム(Invitrogen社)にてPVDF膜に蛋白質のブロッティングを行った。転写されたPVDF膜はブロッキング緩衝液(3% BSA, 0.5% Tween20, 1xPBS)でブロッキングしたのちに、BDNFに対する抗BDNF-rabbit抗体(Abcom)を反応させた。洗浄後、抗ウサギVecstain(R) ABC-AP kit(Vector Laboratories)で標識し、アルカリホスファターゼの基質であるCDP-star(R)(Roche社)を添加し、生じた蛍光をルミノ・イメージアナライザーLAS-1000(FUJIFILM社製)にて取り込んだ。
【0061】
その結果、pCMVscript-tTrkB(-)Tm-EGFP及びpCMVscript-tNGFR(-)Tm-EGFPを導入した系から分泌型TrkB又は分泌型NGFR(p75)を単離するとBDNFが検出されたが、コントロールベクターを導入した系ではBDNFは検出されなかった(図6)。このことより、遺伝子導入により発現された分泌型TrkB及び分泌型NGFR(p75)は確かに細胞外へ分泌されてBDNFと結合することが証明された。また、このことは、BDNFを標的とした蛋白質製剤の有効成分として、分泌型TrkB又は分泌型NGFR(p75)を利用することが可能であるといえる。
【0062】
さらに、分泌型NGFR(p75)とBDNFの結合は、分泌型TrkBとBDNFの結合に比べて弱いことが示された。このことは、確かにNGFR(p75)とBDNFの結合が低親和性であることと一致していた。
【0063】
(実験例1−4)培養細胞系における膜結合型受容体のBDNF結合能の確認実験
本実験例では、膜結合型TrkBとBDNFとの結合性について確認実験を行った。
膜結合型TrkBの発現ベクター pCMVscript-tTrkB(+)Tm-EGFP又はコントロールベクター pCMVscript-EGFPを、HEK293細胞(35mm dish)に各々2μgトランスフェクション行い、翌日、一部を8 チャンバースライドガラスに移し培養した。翌日、細胞にBDNF(Abcom社、mature型)を加え培養(50ng/100μl)した。1 時間後、PBSで洗浄し、抗BDNFウサギ抗体(Abcom社)(1;1000希釈)、Cy3標識抗ウサギ抗体(1;1000希釈)、及び、10%FBSを含むOPTI培養液(インビトロジェン社)で3時間培養した。その後、オリンパスIXL71倒立型蛍光顕微鏡にて蛍光観察を行った(図7)。
【0064】
図7のA-Bはコントロールベクター pCMVscript-EGFP導入細胞を、C-Fは膜結合型TrkBの発現ベクター pCMVscript-tTrkB(+)Tm-EGFP導入細胞を示しており、番号1はEGFP蛍光蛋白質(緑色)の局在を、番号2はBDNF(赤色)の局在を示している。膜結合型TrkBは、確かにBDNFを細胞膜表面で捕まえることができることが明らかになった。
【0065】
(実験例1−5)慢性疼痛モデルラットにおける改変型受容体遺伝子の疼痛軽減効果の確認実験
分泌型TrkB発現ベクター pCMVscript-tTrkB(-)Tm-EGFP、膜結合型TrkB発現ベクター pCMVscript-tTrkB (+)Tm-EGFP、又は、コントロールベクター pCMVscript-EGFPを慢性疼痛モデルラット(各6匹)に投与し、疼痛軽減効果を確認した。
ラットの左脊髄第5腰髄神経の後根神経節(DRG)の末梢側を結紮して慢性疼痛モデルラットを作製すると同時に、カテーテルの先端を脊髄内第4腰髄神経終末付近に留置した。カテーテルの他端は皮下を通して後頭部から体外に出した。手術日を0日目とした。
【0066】
神経結紮による痛覚過敏の成立を確認した後、5日目、6日目、及び7日目に、トランスフェクション試薬GenomeONETMを用いて各プラスミド溶液(3μg/μl)を調製し、14μl(42μg)をカテーテルからクモ膜下に注入した。投与後、15μlの生理食塩水でカテーテル内の残薬を押し出した。
【0067】
ラットの疼痛行動観察は、慢性疼痛モデル作製以前から7日目の投薬3回目(最終)投与後もさらに1 週間にわたって行った(図8)。疼痛行動は、機械的刺激に対する疼痛閾値(50%反応域値)により評価した。具体的には、ラットを10×20cm四方の壁に囲まれた金網の上にのせ、安静になるまで30分以上放置した。金網の下から、太さの異なる5種類のナイロンフィラメント(von Freyフィラメント)を、細いものから順に後肢足底の中心にそっと押し当て、刺激による逃避行動の有無を観察した。逃避行動を示す閾値をChaplanらの方法(Chaplan SR, Bach FW, Pogrel JW, Chung JM, Yaksh TL. Quantitative assessment of tactile allodynia in the rat paw. J Neurosci Methods. 53(1):55-63, (1994))により求めた。閾値はフィラメントの堅さをgramで表示しており、数値が低いほど痛みに敏感に反応することを示している。
【0068】
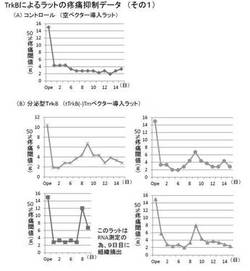
その結果、コントロールベクター投与群において、結紮した左足(患足)は疼痛閾値の低下を示しており、痛みを感じていることが確認されたが、結紮していない右足(健足)は痛みを感じていないことが確認された。分泌型TrkB発現ベクターpCMVscript-tTrkB(-)Tm-EGFPの投与群では、患足で8日目から9日目にかけて疼痛の抑制が観察された(図9)。膜結合型TrkBの発現ベクターpCMVscript-tTrkB(+)Tm-EGFPの投与群では、患足で10日目から15日目にかけて疼痛の抑制が観察された(図10)。
上記結果より、本改変型受容体遺伝子の投与により疼痛抑制が可能となること、及び、遺伝子投与は健側の行動評価に対しては何等影響を及ぼさないことが明らかになった。
【0069】
一方、非特許文献1(L5 脊髄神経結紮ラットにおけるワクシニアウイルス接種家兎炎症皮膚抽出液(ノイロトロピン(R))と消炎鎮痛薬および抗うつ薬との抗アロディニア作用の比較.日本ペインクリニック学会誌 Vol.15 No.4, 407-413 (2008))に記載の場合では、ノイロトロピン(R)及びミルナシプランでは、薬剤投与後2時間のみ鎮痛効果が認められたことが報告されているが、その効果は持続しておらず、本発明の疼痛の治療剤のほうが、疼痛抑制効果が持続することが確認された。
【0070】
(実験例1−6)慢性疼痛ラットにおける改変型受容体遺伝子の発現確認実験
ラット組織内での導入遺伝子発現の確認を行うために、実験例5と同様に慢性疼痛ラットを作製した。分泌型TrkB発現ベクター pCMVscript-tTrkB(-)Tm-EGFP、膜結合型TrkB発現ベクター pCMVscript-tTrkB(+)Tm-EGFP又はコントロールベクター pCMVscript-EGFPを投与した慢性疼痛ラット、遺伝子導入試薬GenomeOneTM(石原産業)のみを投与したコントロール慢性疼痛ラット、何も投与していないコントロール正常ラット(非結紮)について、結紮手術後9日から21日の間に左右の第2〜6腰髄神経DRGを摘出した。摘出後、すぐに組織を組織保存用試薬であるRNAlater(R)(Qiagen社)存在下で、-80℃フリーザーにて保管した。ホモジナイザーで組織を粉砕後、RNA抽出試薬としてISOGEN(ニッポンジーン社)にてRNAを抽出した。得られたRNAからReverTra Ace(R) cDNA合成キット(TOYOBO社)を用いてcDNAを合成した。EGFP検出用プライマー(配列番号18、19)とインターナルコントロール遺伝子GAPDH(配列番号20、21)を用いて反応液を調製後、Applied Biosystems(R) 7300 リアルタイムPCRシステム(Applied Biosystems社)にて導入遺伝子の発現量の定量を行った。インターナルコントロール遺伝子GAPDHに対するEGFP遺伝子の発現比を算出し、全DRGの平均値として表した(図11)。
【0071】
EGFP検出用プライマー
センスプライマー;GGGCCCACCATGGTGAGCAAGG(配列番号18)
アンチセンスプライマー;GATGAACTTCAGGGTCAGCTTG(配列番号19)
インターナルコントロール遺伝子(GAPDH)
センスプライマー;GACAACTTTGGCATCGTGGA(配列番号20)
アンチセンスプライマー;ATGCAGGGATGATGTTCTGG(配列番号21)
【0072】
(実施例2)新規疼痛治療剤のスクリーニング方法
本実施例では、新規疼痛治療剤のスクリーニングの系について示した。スクリーニングは、以下の1)及び2)の工程を含む系により実施した。
1)膜貫通ドメインを有するBDNF受容体を発現しうる細胞を、候補物質及びBDNFと共に培養する工程。
2)前記細胞の表面上に結合したBDNFを確認する工程。
【0073】
上記1)の膜貫通ドメインを有するBDNF受容体として、膜結合型TrkBを用いた。膜貫通ドメインを有するBDNF受容体を発現しうる細胞は、上述の実施例1−1の膜結合型TrkBの発現ベクター pCMVscript-tTrkB(+)Tm-EGFPを、上述の実験例1−1に従いHEK293細胞にトランスフェクションして構築した。前記細胞を10%FBSを含むOPTI-MEMを用いて径60mmのディッシュで72時間培養した。
【0074】
上記1)の候補物質として、本実施例では分泌型TrkBを用いた。分泌型TrkBを含む試料(候補物質(+))は、実験例1−2に従い、分泌型TrkBを発現しうるtTrkB(-)Tm発現ベクターをHEK293細胞に導入し、導入72時間後に培養液(上清)を15 mlコニカルチューブに回収し、3000回転にて5分間遠心分離後の上清とした。また、対照としての候補物質を含まない(候補物質(-))試料は、遺伝子を導入していない空の発現ベクターを同様にHEK293細胞に導入し、培養、遠心分離後の上清とした。候補物質(+)又は候補物質(-)を前記培養系に2ml添加した。各培養系に、さらにBDNF(Abcom社、mature型)(100ng/ml)を添加した。
【0075】
上記2)の細胞の表面上に結合したBDNFの確認は、候補物質及びBDNFを添加1時間後、抗BDNFウサギ抗体(Abcom社)(1;1000希釈)、及び、Cy3標識抗ウサギ抗体(1;1000希釈)をさらに添加し、3時間培養した後に、オリンパスIXL71倒立型蛍光顕微鏡にて蛍光観察により行った。
【0076】
図12において、C-Dには、候補物質のポジティブコントロールとして分泌型TrkBを添加した結果を示し、A-Bにはその対照実験結果を示した。番号1にはTrkB-EGFP蛍光蛋白質の局在を示し、番号2にはBDNFの局在を示した。BDNFの局在を確認することにより、BDNFとその受容体の結合を阻害する物質を選別することが可能であることが明らかになった。この系を利用して、BDNFと受容体の結合阻害物質、すなわち、新規疼痛治療剤をスクニーニングすることが可能となった。候補物質とBDNFの培養液への添加の順番に関しては、同時に添加しても、候補物質添加1時間後にBDNFを添加しても、同じ結果が観察された。
【産業上の利用可能性】
【0077】
以上詳述したように、各遺伝子発現ベクターを作製後、in vitroの培養細胞系での発現確認実験、BDNFを捕獲できるかどうかの確認実験を行った結果、確かに上記の改変型受容体産物はBDNFを捕獲可能であることが判明した。in vivoの疼痛モデルラット系に投与実験を行った結果、膜貫通ドメインを有さない分泌型TrkBをコードする遺伝子又は膜貫通ドメインを有する膜結合型TrkBをコードする遺伝子を投与すると、慢性疼痛ラットの痛みが軽減できることが確認された。したがって、BDNF受容体(TrkB及び/又はNGFR(p75))の改変型蛋白質をコードする遺伝子を生体内で発現させることで、生体内でBDNFがその受容体に結合するのを防ぐことができ、痛みを軽減しうる。その効果は、既存の鎮痛薬等が2時間程度の効果であったのに対して、3〜4日持続されていた。このことから、BDNFの受容体改変型蛋白質、すなわち、分泌型TrkB、膜結合型TrkB及び/又は分泌型NGFR(p75)は慢性の疼痛に対して、効果があると考えられた。したがって、分泌型TrkB、膜結合型TrkB及び/又は分泌型NGFR(p75)は、BDNFを標的とした蛋白質製剤の有効成分として利用することも可能であるといえる。
【0078】
さらに、本発明の疼痛治療剤の作用メカニズムが、脳由来神経栄養因子とその受容体との結合を阻害しうる作用によるものであることから、脳由来神経栄養因子とその受容体との結合を阻害しうる物質を選別することで、新規疼痛治療剤をスクリーニングすることができる。
【技術分野】
【0001】
本発明は、神経因性などの難治性疼痛に対する新規な治療剤に関する。さらには、新規疼痛治療剤のスクリーニング方法に関する。
【背景技術】
【0002】
痛みは持続期間によって、急性疼痛と慢性疼痛とに分類される。急性疼痛は組織障害に伴う痛みでその持続期間は限られる。慢性疼痛は組織障害の治癒後にも続き、はっきりとした器質的原因を有さないことが多い。慢性疼痛における急性増悪期の痛みは急性疼痛と類似しており、内因性発痛物質が深く関わると考えられている。慢性疼痛として、交通事故又は手術後の後遺症、末期がん又は糖尿病などの耐え難い慢性的な痛みが挙げられる。また、痛みは原因によって、侵害受容性疼痛、神経因性疼痛(neuropathic pain)、心因性疼痛に分類される。これらの独立した痛みは時間の経過とともに徐々に融合し、分類が困難な慢性の難治性疼痛となる。
【0003】
神経因性疼痛は1994年のISAP (International Association for the Study of Pain)の慢性痛分類において、末梢神経及び中枢神経の障害又は機能異常による難治性の痛みであると定義されている。神経因性疼痛は、末梢神経及び中枢神経系の圧迫、変性、損傷に起因しているが、単一の病理的プロセスでは説明し得ない複雑な症候群から成り立っており、その発生機序はまだ解明されていない。よって、神経因性疼痛に関する治療効果に基づく指針も、一部を除いて有効性が保障されていない。
【0004】
神経因性疼痛は、創傷などによる初期の痛み(急性痛)とは異なり、創傷が治癒した後に新たに発生する痛みである。神経因性疼痛として、通常であれば痛みを引き起こさない程度の刺激によっても激烈な痛みを誘発する症状(「アロディニア」とよばれる。)が知られている。急性疼痛に対して有効な非ステロイド系消炎鎮痛剤及び麻薬系鎮痛薬剤などは、神経因性疼痛には効果を示さず、決定的な治療法は未だ知られていない。神経因性疼痛を抑制することができれば、臨床面において患者の肉体的苦痛の緩和及びQOLの向上をもたらすことが可能となる。
【0005】
従来、神経因性疼痛などの難治性疼痛に対しては、既存の麻薬、消炎鎮痛剤などと、神経ブロック注射(麻酔薬)を組み合わせて行なっている。しかし、何れの方法も効果は不十分である。例えば、神経障害性疼痛モデルであるL5-SNLラットを用いて、ノイロトロピン(Neurotropin:NTP)と疼痛疾患治療に用いられる消炎鎮痛薬及び抗うつ薬の効果を比較検討した報告がある(非特許文献1)。ここでは、ノイロトロピン(R)及びミルナシプランでは、薬剤投与後2時間のみ鎮痛効果が認められたことが報告されているものの、効果の持続性において十分とはいえない。
【0006】
末梢に加えた痛みは、後根神経節(dorsalroot ganglion: DRG)に存在する知覚神経(一次ニューロン)を通じて脊髄後角に伝達され、脊髄後角I層及びII層に存在する二次ニューロンにシナプスを介して伝えられ、二次ニューロンはその信号を中枢(脳)に伝達する。ラットの脊髄第5腰髄神経の後根神経節末梢側を結紮した慢性疼痛モデル、及びアレルギー反応を引き起こす結核菌の死菌 (Complete Freund's Adjuvant: CFA) をラットの足底に注射した急性疼痛モデルを作製し、後根神経節でのイベントを詳細に解析した報告がある。そこでは、CFA刺激によって、シナプス伝達を補完及び増強する役割を担っている脳由来神経栄養因子(brain-derived neurotrophic factor: 以下単に「BDNF」ともいう。)のmRNAの発現量が増加していること、特にエクソン1バリアントが顕著に増加したことが報告されている(非特許文献2)。ラットの脊髄第5腰髄神経を結紮した慢性疼痛モデル、及び、CFAをラットの足底に注射した急性疼痛モデルに、BDNFのエクソン1バリアントの発現を抑制するデコイDNAをくも膜下投与することにより、ラットが痛みを感じなくなることを見出したことが開示されている(特許文献1)。前記は、BDNFは脊髄での痛みの伝達を増強する働きを有している可能性があることから、この発現を抑制すれば痛みを抑え得るかもしれない、すなわち、一次ニューロンで合成されるBDNFを抑えることができれば末梢にて加えた痛みが軽減されるかもしれないとの考えに基づくものである。
【先行技術文献】
【非特許文献】
【0007】
【非特許文献1】日本ペインクリニック学会誌 Vol.15 No.4, 407-413 (2008)
【非特許文献2】Kobayashi et al., Brain Res. 1206. 13-19 (2008)
【特許文献】
【0008】
【特許文献1】国際公開WO2009/145067号パンフレット
【発明の開示】
【発明が解決しようとする課題】
【0009】
本発明は、神経因性などの難治性疼痛に対して、既存の麻薬、消炎鎮痛剤などの神経ブロック注射などに比べて、効果が持続し、頻回の投与を軽減化しうる新規治療剤を提供することを課題とする。さらには、新規疼痛治療剤のスクリーニング方法を提供することを課題とする。
【課題を解決するための手段】
【0010】
痛み刺激により後根神経節(DRG)に存在する知覚神経(一次ニューロン)やグリア細胞などから放出された脳由来神経栄養因子(BDNF)は、脊髄後角のシナプス後膜上に存在する受容体に結合し、その痛みシグナルは二次ニューロンに伝えられ、二次ニューロンはその信号を脳に伝達すると考えられる。本発明者らは、BDNFが受容体に結合するのを抑制することが可能となれば、末梢の痛みは軽減されるかもしれないと考えた。そこで、上記課題を解決するために鋭意研究を重ねた結果、BDNFの受容体(TrkB: tyrosine kinase receptor B、別名はNTRK2: Neurotrophic Tyrosine Kinase, Receptor, type 2及びNGFR(p75))の改変型蛋白質をコードする遺伝子、すなわちポリヌクレオチドを作製し、慢性疼痛モデルラットに導入・発現させることにより、当該慢性疼痛ラットの痛みを軽減しうることを見出し、本発明を完成した。
【0011】
すなわち本発明は、以下よりなる。
1.脳由来神経栄養因子(BDNF)とその受容体との結合を阻害しうる物質を有効成分として含むことを特徴とする、疼痛治療剤。
2.BDNFが、脊髄後角に放出されるBDNFである、前項1に記載の疼痛治療剤。
3.BDNFが、知覚神経及び/又はグリア細胞より放出されるBDNFである、前項1又は2に記載の疼痛治療剤。
4.BDNFとその受容体との結合を阻害しうる物質が、改変型のBDNF受容体である、前項1〜3のいずれか1に記載の疼痛治療剤。
5.改変型のBDNF受容体が、分泌型TrkB、膜結合型TrkB及び分泌型NGFR(p75)から選択されるいずれかである、前項4に記載の疼痛治療剤。
6.改変型のBDNF受容体が、以下に示すいずれかのアミノ酸配列からなる、前項4又は5に記載の疼痛治療剤:
1)配列表の配列番号2、4、6、8、10又は12のいずれかに示すアミノ酸配列;
2)上記1)に示すアミノ酸配列のうち、1〜複数個のアミノ酸が、置換、欠失、付加又は導入されてなるアミノ酸配列。
7.BDNFとその受容体との結合を阻害しうる物質が、分泌型TrkB、膜結合型TrkB及び分泌型NGFR(p75)から選択されるいずれかをコードするポリヌクレオチドである、前項5又は6に記載の疼痛治療剤。
8.分泌型TrkB、膜結合型TrkB及び分泌型NGFR(p75)から選択されるいずれかをコードするポリヌクレオチドが、以下に示すいずれかの塩基配列からなるポリヌクレオチドである、前項7に記載に疼痛治療剤:
1)配列表の配列番号1、3、5、7、9又は11のいずれかに示す塩基配列からなるポリヌクレオチド;
2)上記1)に示すポリヌクレオチドに対して相補的な塩基配列からなるポリヌクレオチド;
3)上記1)又は2)に示すポリヌクレオチドに対して、ストリンジェントな条件下でハイブリダイズしうるポリヌクレオチド;
4)上記1)又は2)に示すポリヌクレオチドのうち、1〜複数個のヌクレオチドが、置換、欠失、付加又は導入されてなるポリヌクレオチド。
9.前項7又は8に記載のいずれかのポリヌクレオチドが組み込まれたベクターを含む、前項7又は8に記載の疼痛治療剤。
10.BDNFとその受容体との結合を阻害しうる物質を選別することを特徴とする新規疼痛治療剤のスクリーニング方法。
11.以下の1)及び2)の工程を含む、前項10に記載の新規疼痛治療剤のスクリーニング方法:
1)膜貫通ドメインを有するBDNF受容体を発現しうる細胞を、候補物質及びBDNFと共に培養する工程;
2)前記細胞の表面上に結合したBDNFを確認する工程。
12.以下の1)〜3)の工程を含む、前項10に記載の新規疼痛治療剤のスクリーニング方法:
1)膜貫通ドメインを有するBDNF受容体を発現しうる細胞を、候補物質と共に培養する工程;
2)上記培養系に、さらにBDNFを添加する工程;
3)前記細胞の表面上に結合したBDNFを確認する工程。
【発明の効果】
【0012】
BDNFとその受容体との結合を阻害しうる物質として、当該受容体であるTrkB若しくはNGFR(p75)の改変型蛋白質、又は当該改変型蛋白質を発現する遺伝子により、慢性疼痛ラットにおいて、疼痛軽減効果が認められた。具体的には、膜貫通ドメインを有さない分泌型TrkB遺伝子発現ベクターpCMVscript-tTrkB(-)Tm-EGFP、又は膜貫通ドメインを有する膜結合型受容体遺伝子発現ベクターpCMVscript-tTrkB(+)Tm-EGFPを導入した慢性疼痛ラットにおいて、各蛋白質を発現していることが確認され、3〜4日間持続的に疼痛軽減効果が認められた。したがって、BDNF受容体(TrkB及び/又はNGFR(p75))の改変型蛋白質をコードする遺伝子を生体内で発現させることで、生体内でBDNFがその受容体に結合するのを防ぐことができ、痛みを軽減しうる。
【0013】
さらに、本発明の疼痛治療剤の作用メカニズムが、脳由来神経栄養因子とその受容体との結合を阻害しうる作用によるものであることから、脳由来神経栄養因子とその受容体との結合を阻害しうる物質を選別することで、新規疼痛治療剤をスクリーニングすることができる。
【図面の簡単な説明】
【0014】
【図1】分泌型TrkB、膜結合型TrkB及び分泌型NGFR(p75)の概念図である。
【図2】改変型TrkB遺伝子発現ベクターの作製模式図である。(実施例1−1)
【図3】改変型NGFR(p75)遺伝子発現ベクターの作製模式図である。(実施例1−2)
【図4】培養細胞系における改変型TrkB及び改変型NGFR(p75)の発現確認実験結果を示す図である。(実験例1−1)
【図5】培養細胞系における分泌型BDNF受容体(改変型TrkB、改変型NGFR(p75))の発現確認実験結果を示す図である。(実験例1−2)
【図6】培養細胞系における分泌型BDNF受容体(改変型TrkB、改変型NGFR(p75))のBDNF結合能の確認実験結果を示す図である。(実験例1−3)
【図7】培養細胞系における膜結合型BDNF受容体(改変型TrkB)のBDNF結合能の確認実験結果を示す図である。(実験例1−4)
【図8】慢性疼痛ラットの疼痛行動評価スケジュールを示す図である。(実験例1−5)
【図9】分泌型TrkBによる慢性疼痛ラットの疼痛抑制データを示す図である。(実験例1−5)
【図10】膜結合型TrkBによる慢性疼痛ラットの疼痛抑制データを示す図である。(実験例1−5)
【図11】慢性疼痛ラットにおける改変型TrkB遺伝子の発現確認実験結果を示す図である。(実験例1−6)
【図12】疼痛治療剤をスクリーニングするシステムの実験結果を示す図である。(実施例2)
【発明を実施するための形態】
【0015】
本発明はBDNFとその受容体との結合を阻害しうる物質を有効成分として含むことを特徴とする、疼痛治療剤に関する。本発明の有効成分としての、「BDNFとその受容体との結合を阻害しうる物質」は、好ましくはBDNFのうち脊髄後角に作用するBDNF、より具体的には知覚神経及び/又はグリア細胞などより放出されるBDNFついて、その受容体との結合を阻害しうる。
【0016】
ここで、好ましくは脊髄後角に作用するBDNF、より具体的には知覚神経及び/又はグリア細胞などより放出されるBDNFとするのは、本発明の疼痛治療剤に含まれる有効成分が疼痛に関連するBDNFに作用することで、疼痛を軽減し、治療することができるからである。BDNFは、分子量13.5kDよりなる分泌性蛋白質であり、ホモ2量体を形成している。BDNFは、その受容体である標的細胞表面上にある特異的受容体TrkBと高親和性に結合し、細胞内のシグナル伝達機構を介してその生理作用を発揮する。BDNFは、海馬に高濃度に存在することも知られている。BDNFは脊髄後角で痛みの伝達を増強する働きを有している可能性があることから、本発明では、BDNFとその受容体との結合を抑制すれば痛みを抑え得ると考えられた。
【0017】
本発明において、BDNFとその受容体との結合を阻害しうる物質とは、改変型のBDNF受容体であることを特徴とする。知覚神経及び/又はグリア細胞などより放出されるBDNFが改変型のBDNF受容体と結合することで、当該BDNFが標的細胞表面上にある特異的受容体(TrkB又はNGFR(p75))と結合することが抑制され、その結果、BDNFと特異的受容体が結合することによる細胞内のシグナル伝達機構を介してその生理作用を発揮するのを抑制するためである。そのような、改変型のBDNF受容体としては、分泌型TrkB、膜結合型TrkB及び分泌型NGFR(p75)から選択されるいずれか1種又複数種とすることができる(図1参照)。
【0018】
上記において、改変型のBDNF受容体としての分泌型TrkBは、正常型TrkBの膜貫通ドメインの直前までのアミノ酸配列からなり、膜貫通ドメインを有さないTrkBの細胞外側蛋白質であり、細胞外に分泌され、BDNFを捕獲しうる(図1、2参照)。同様に、膜結合型TrkBは、正常型TrkBの膜貫通ドメインを含むアミノ酸配列からなり、少なくとも膜貫通ドメインの直後までのアミノ酸を含む細胞外側蛋白質で、細胞膜上でBDNFを捕獲しうる(図1、2参照)。膜結合型TrkBは、細胞内にシグナル伝達機構を介して生理作用を発揮しえないものであればよく、特に限定されない。例えば、遺伝子組換技術により膜結合型TrkBを作製する場合に、遺伝子増幅のために好ましいアミノ酸を含むものであっても良い。具体的には、膜貫通ドメインの直後から、1〜20程度、好ましくは1〜13程度のアミノ酸を含むものであってもよい。分泌型NGFR(p75)は、正常型NGFR(p75)の膜貫通ドメインの直前までのアミノ酸配列からなり、膜貫通ドメインを有さないNGFR(p75) の細胞外側蛋白質で、細胞外に分泌され、BDNFを捕獲しうる(図1〜3参照)。
【0019】
上記において、ヒトTrkBをコードする遺伝子は、GenBank Accession number=NM_006180に示す塩基配列で特定され、相当するラットTrkBをコードする遺伝子は、GenBank Accession number=NM_012731に示す塩基配列で特定される。また、ヒトNGFR(p75)をコードする遺伝子は、GenBank Accession number=NM_002507に示す塩基配列で特定され、相当するラットNGFR(p75)をコードする遺伝子は、GenBank Accession number=NM_012610に示す塩基配列で特定される。
【0020】
本発明における改変型BDNF受容体(分泌型TrkB、膜結合型TrkB及び分泌型NGFR(p75))の塩基配列及びアミノ酸配列の骨子は以下の表1に示すとおりである。
【表1】

【0021】
上記において、分泌型TrkBについて、正常型TrkBの膜貫通ドメインの直前までの改変型蛋白質をコードする遺伝子は、ヒトTrkBの場合、GenBank Accession number=NM_006180に示す塩基配列の939〜2227番目の塩基配列で特定され(配列番号1)、ラットの場合にはGenBank Accession number=NM_012731に示す塩基配列の662〜1947番目の塩基配列で特定される(配列番号3)。同様に、膜結合型TrkBについて、正常型TrkBの膜貫通ドメインの直後までの改変型蛋白質をコードする遺伝子は、ヒトTrkBの場合、GenBank Accession number=NM_006180に示す塩基配列の939〜2300番目の塩基配列で特定され(配列番号5)、ラットの場合にはGenBank Accession number=NM_012731に示す塩基配列の662〜2020番目の塩基配列で特定される(配列番号7)。さらに、分泌型NGFR(p75)について、正常型NGFR(p75)の膜貫通ドメインの直前までの改変型蛋白質をコードする遺伝子は、ヒトTrkBの場合、GenBank Accession number=NM_002507に示す塩基配列の126〜875番目の塩基配列で特定され(配列番号9)、ラットの場合にはGenBank Accession number=NM_012610に示す塩基配列の114〜866番目の塩基配列で特定される(配列番号11)。
【0022】
本発明の改変型のBDNF受容体は、より具体的には、以下に示すいずれかのアミノ酸配列からなる。
1)配列表の配列番号2、4、6、8、10及び12から選択されるいずれかに示すアミノ酸配列;
2)上記1)に示すアミノ酸配列のうち、1〜複数個のアミノ酸が、置換、欠失、付加又は導入されてなるアミノ酸配列。
上記において、表1に示す如く、配列番号2、6及び10は、ヒト由来蛋白質に基づき、配列番号4、8及び12はラット由来蛋白質に基づく。
【0023】
本発明において、上記に示す分泌型TrkB、膜結合型TrkB及び分泌型NGFR(p75)から選択されるいずれか1種又は複数種を有効成分として含む疼痛治療剤は、改変型のBDNF受容体(蛋白質)を含有するものであり、蛋白質製剤として使用することができる。
【0024】
本発明の蛋白質製剤には、薬学的に許容しうる担体を含めることができる。また、そのような蛋白質製剤は、通常非経口的投与経路により投与することができ、例えば注射剤(皮下注、静注、筋注、腹腔内注など)として投与することができる他、経皮、経粘膜、経鼻、経肺などで投与することができる。このような蛋白質製剤は、溶液製剤であっても、使用前に溶解再構成するために凍結乾燥したものであってもよい。凍結乾燥のための賦形剤としては例えばマンニトール、ブドウ糖などの糖アルコールや糖類を使用することが出来る。溶液製剤である場合には、通常密封、滅菌されたプラスチック又はガラス製のバイアル、アンプル、注射器のような規定容量の形状の容器、ならびに瓶のような大容量の形状の容器で供給することができる。このような製剤中に含まれる有効成分としての蛋白質の量は、重症度、投与部位、投与回数、所望治療期間、患者の年齢、体重等により異なり、適宜決定することができる。本願蛋白質を有効成分とする疼痛治療剤が溶液製剤の場合には、一般的には、溶液製剤の全体量に対して、0.01μg〜200mg/ml、好ましくは0.5μg〜100mg/mlの蛋白質を含むことができる。
【0025】
本発明では、上記のBDNF受容体の改変型蛋白質をコードする遺伝子、すなわち改変型のBDNF受容体を発現可能とするポリヌクレオチドも、本発明の疼痛治療剤の有効成分とすることができる。そのようなポリヌクレオチドとして、分泌型TrkB、膜結合型TrkB及び分泌型NGFR(p75)から選択されるいずれかの改変型蛋白質をコードするポリヌクレオチドが挙げられる。本明細書中で使用される場合、用語「ポリヌクレオチド」は、「遺伝子」、「核酸」又は「核酸分子」と交換可能に使用され、ヌクレオチドの重合体が意図される。本明細書中で使用される場合、用語塩基配列は、「核酸配列」又は「ヌクレオチド配列」と交換可能に使用され、デオキシリボヌクレオチド(A,G,C及びTと略称される。)の配列として示される。ただし、本明細書中で使用される塩基配列はA,G,C及びTと略称されるが、デオキシリボヌクレオチドのみならず、それに対応するリボヌクレオチドとしても使用されることを意味しており、ヌクレオチドの重合体としてはデオキシリボヌクレオチド、リボヌクレオチド、もしくはその混合型が意図される。
【0026】
分泌型TrkB、膜結合型TrkB及び分泌型NGFR(p75)から選択されるいずれかの改変型蛋白質をコードするポリヌクレオチドは、以下に示すいずれかの塩基配列からなるポリヌクレオチドである:
1)配列表の配列番号1、3、5、7、9及び11から選択されるいずれかに示す塩基配列からなるポリヌクレオチド;
2)上記1)に示すポリヌクレオチドに対して相補的な塩基配列からなるポリヌクレオチド;
3)上記1)又は2)に示すポリヌクレオチドに対して、ストリンジェントな条件下でハイブリダイズしうるポリヌクレオチド;
4)上記1)又は2)に示すポリヌクレオチドのうち、1〜複数個のヌクレオチドが、置換、欠失、付加又は導入されてなるポリヌクレオチド。
さらに、本発明のポリヌクレオチドは、コドンの変換により、配列表の配列番号2、4、6、8、10及び12に示すアミノ酸配列のいずれかを発現可能な塩基配列を有していてもよい。
上記において、配列番号1、5及び9は、ヒト由来遺伝子に基づき、配列番号3、7及び11はラット由来遺伝子に基づく。
【0027】
上記において、ストリンジェントなハイブリダイゼーション条件は一般に知られたものを選択することができる。その一例としては、50%ホルムアミド、5×SSC(150mM NaCl、15mM クエン酸三ナトリウム)、50mMリン酸ナトリウム、pH7.6、5×デンハーツ溶液、10%デキストラン硫酸、及び20μg/mlのDNAを含む溶液中、42℃で一晩ハイブリダイゼーションした後、室温で2×SSC・0.1%SDS中で一次洗浄し、次いで、約65℃において0.1×SSC・0.1%SDSで二次洗浄といった条件があげられる。
【0028】
上記のポリヌクレオチドを用いた遺伝子工学又は生物工学の基本操作については、市販の実験書、例えば、遺伝子マニュアル 講談社、高木康敬編 遺伝子操作実験法 講談社、モレキュラー・クローニング(Molecular Cloning)、コールド・スプリング・ハーバー・ラボラトリー(Cold Spring harbor Laboratory)(1982)、モレキュラー・クローニング第2版(Molecular Cloning, 2nd ed.)、コールドスプリング・ハーバーラボラトリー(Cold Spring harbor Laboratory)(1989)、メッソッズ・イン・エンザイモロジー(Methods in Enzymol.),194 (1991)、実験医学別冊・酵母による遺伝子実験法 羊土社(1994)等に記載された方法に従って行うことができる。
【0029】
上述のポリヌクレオチドを、本発明の疼痛治療剤の有効成分として用いる場合、遺伝子治療に用いることができる。遺伝子治療に用いる際には、ヒトを含む哺乳動物の細胞内で蛋白質を発現することができ、かつ、安全性の高いDNA若しくはRNAウイルスベクター又はプラスミドベクターを用いるのが好ましい。遺伝子治療において好ましいウイルスベクターとしては、アデノウイルス、アデノ随伴ウイルス(AAV)、レトロウイルス、ポックスウイルス、ヘルペスウイルス、単純ヘルペスウイルス、レンチウイルス、センダイウイルス、エプスタイン−バーウイルス(EBV)、ワクシニアウイルス、ポリオウイルス、シンビスウイルス、SV40等が挙げられる。より好ましくは、アデノ随伴ウイルス(AAV)若しくはアデノウイルスが挙げられる。アデノウイルスには種々の血清型が存在するが、本発明では2型若しくは5型ヒトアデノウイルスを使用することが好ましい。アデノウイルスは、感染効率が他のウイルスベクターに比べて高いこと、分裂していない細胞に感染することができること及び細胞のゲノムに組み込まれないことが知られており、この観点からアデノウイルスベクターを用いることはさらに好ましい。
【0030】
上記のウイルスベクターに、上述のいずれかのポリヌクレオチドを導入し、生体内又は細胞に感染させることによって、生体内又は細胞内に遺伝子を導入することが可能である。ウイルスベクターの作製法、遺伝子の導入方法は、別冊実験医学、遺伝子治療の基礎技術、羊土社(1996)、あるいは、別冊実験医学、遺伝子導入&発現解析実験法、羊土社(1997)等を参照することができる。
【0031】
発現ベクターを裸のプラスミドとしてin vivoに導入することもできる。遺伝子治療において好ましいプラスミドとしては、pCAGGS[Gene,108,193-200(1991)]、pBK-CMV、pcDNA3.1、pZeoSV(インビトロゲン社、ストラジーン社)等を使用することができる。遺伝子治療用の裸のプラスミドは、例えば、トランスフェクション、エレクトロポレーション、マイクロインジェクション、形質導入、細胞融合、DEAEデキストラン、リン酸カルシウム沈殿、遺伝子銃で担体(金属粒子)とともにDNAを細胞内に導入する方法等、自体公知の方法により細胞に導入することができる[Wu et al., J. Blol. Chem. 267, 963-967(1992)、Wu et al., J. Blol. Chem. 263, 14621-14624, (1988)、Proc. Natl. Acad. Sci., USA, 88, 2726-2730 (1991)]。
【0032】
また、人工的なベクターとしては、リポソーム、マイクロカプセル、サイトフェクチン、DNA-蛋白質複合体、バイオポリマー等が挙げられる。リポソームを用いてDNAを導入する方法には、リポソーム法、HVJ-リポソーム法、陽イオン性リポソーム法、リポフェクチン法、リポフェクトアミン法等が挙げられる。マイクロカプセルはフィルムコートされた粒子であり、膜形成ポリマー誘導体、疎水性可塑剤、表面活性剤又は/及び潤滑剤窒素含有ポリマーの混合物からなるコーティング材料でコートされた粒子等で構成される。
【0033】
上述の遺伝子治療剤の製剤形態としては、上記の各投与形態にあった種々の製剤形態を適用することができる。例えば、有効成分である本発明のポリヌクレオチドを含有する注射剤とした場合、当該注射剤は常法により調製することができる。遺伝子治療剤に用いる基剤としては、通常注射剤に用いる基剤であれば、特に制限されず、蒸留水、塩化ナトリウム、又は塩化ナトリウムと無機塩等との混合物の塩溶液、マンニトール、ラクトース、デキストラン、グルコース等の溶液、グリシン、アルギニン等のアミノ酸溶液、有機酸溶液又は塩溶液とグルコース溶液との混合溶液等が挙げられ得る。また、常法に従い、これらの基剤に浸透圧調整剤、pH調整剤、ゴマ油、ダイズ油等の植物油又はレシチン若しくは非イオン性界面活性剤等の界面活性剤等の助剤を用いて、溶液、懸濁液、分散液として注射剤を調整してもよい。これらの注射剤を粉末化、凍結乾燥等の操作により用事溶解用製剤とすることもできる。製剤中のポリヌクレオチドの含量は、投与部位、投与回数、所望治療期間、患者の年齢、体重等により異なり、適宜調整することができる。
【0034】
本発明の疼痛治療剤として使用される製剤、例えば蛋白質製剤又は遺伝子治療剤のいずれの場合においても、製剤化に際して、好ましくは安定化剤が添加される。安定化剤としては、例えば、アルブミン、グロブリン、ゼラチン、マンニトール、グルコース、デキストラン、エチレングリコール等が挙げられる。さらに、本発明の製剤は製剤化に必要な添加物、例えば、賦形剤、溶解補助剤、酸化防止剤、無痛化剤、等張化剤等と配合してもよい。液状製剤とした場合は、凍結保存又は凍結乾燥等により水分を除去して保存するのが望ましい。凍結乾燥剤は、用事に注射用蒸留水等を加え、再溶解して使用される。また、徐放剤とした場合は、徐放用担体として例えば、可溶性コラーゲン又は可溶性コラーゲン誘導体、ゼラチン等の蛋白質、セラミックス多孔体、ポリアミノ酸、ポリ乳酸、キチン又はキチン誘導体、水膨潤性高分子ゲル等を使用することができる。
【0035】
本発明は、BDNFとその受容体との結合を阻害しうる物質を選別することを特徴とする新規疼痛治療剤のスクリーニング方法にも及ぶ。痛み刺激によりBDNFが分泌され、神経細胞膜上のBDNF受容体に結合する結果、痛みシグナルが中枢神経へ伝達されることになる。BDNFとその受容体との結合を阻害しうる物質、例えば改変型のTrkB、より具体的には分泌型TrkB、膜結合型TrkB、分泌型NGFR(p75)等が、痛み刺激により分泌されたBDNFと結合し、神経細胞膜上のBDNF受容体とBDNFが結合するのを阻害することで、疼痛抑制効果を示すことが本発明において明らかになった。そこで、BDNFとその受容体との結合に着目し、BDNFとBDNF受容体とが結合するのを阻害する物質を選別することを特徴とするスクリーニング方法に係る発明を完成した。
【0036】
本発明のスクリーニング方法は、以下の1)及び2)の工程を含む方法による。
1)膜貫通ドメインを有するBDNF受容体を発現しうる細胞を、候補物質及びBDNFと共に培養する工程;
2)前記細胞の表面上に結合したBDNFを確認する工程。
上記において、候補物質とBDNFの培養液への添加の順序については同時に添加してもよいし、候補物質の添加後にBDNFを添加してもよい。例えば、以下の1’)〜3’)の工程を含む方法によることができる。
1’)膜貫通ドメインを有するBDNF受容体を発現しうる細胞を、候補物質と共に培養する工程;
2’)上記培養系に、さらにBDNFを添加する工程;
3’)前記細胞表面上のBDNFを確認する工程。
【0037】
上記において、新規疼痛治療剤となりうる候補物質は、低分子化合物であってもよいし、ポリペプチドや蛋白質であってもよい。蛋白質の例として、改変型のBDNF受容体が挙げられ、具体的には分泌型TrkB、膜結合型TrkBや分泌型NGFR(p75)等が挙げられる。
【0038】
上記において、膜貫通ドメインを有するBDNF受容体とは、細胞膜上でBDNFを捕獲しうる受容体であればよく、特に限定されない。例えば上述の膜結合型TrkBであってもよい。本発明の膜結合型TrkBのアミノ酸配列や、コードするポリヌクレオチドの塩基配列は、上述した。
【0039】
膜貫通ドメインを有するBDNF受容体を発現しうる細胞は、スクリーニングを行う際に作製してもよいが、予め作製したものであってもよい。膜貫通ドメインを有するBDNF受容体を発現しうる細胞は、例えば膜結合型TrkBをコードする遺伝子を挿入したベクターを導入した細胞とすることができる。細胞の種類としては、前記ベクターを導入しうる細胞であればよく特に限定されない。例えば、哺乳動物由来の細胞が挙げられ、具体的にはHEK293細胞やCHO細胞などを例示することができるが、これらに限定されるものではない。
【0040】
膜貫通ドメインを有するBDNF受容体を発現しうる細胞を候補物質と共に培養する工程では、予め前記細胞を培養容器内で培養した後に候補物質を加えて培養してもよいし、前記細胞と候補物質を培養容器に加えて培養してもよい。
【0041】
上記培養系に、さらにBDNFを添加し、細胞膜上に発現したBDNF受容体とBDNFとを結合させる。BDNF受容体と結合したBDNFを確認し、BDNF受容体へのBDNFの結合を阻害しうる物質を選別することで、本発明の新規疼痛治療剤のスクリーニングを行うことができる。BDNF受容体へ結合したBDNFの確認は、例えば抗BDNF抗体を作用させることで確認することができる。具体的には、標識抗BDNF抗体をBDNF受容体へ結合したBDNFと反応させることで、BDNFを確認することができる。あるいは、抗BDNF抗体をBDNF受容体へ結合したBDNFと反応させ、さらに抗BDNF抗体に対する標識抗体を用いることで確認することもできる。標識は、自体公知の標識物質であればよく、特に限定されない。例えば蛍光物質や発光物質などが挙げられる。また、標識蛋白とBDNFを融合させた、標識蛋白融合型BDNFを用いてもよい。例えば緑色蛍光タンパク質(GFP)などの蛍光蛋白とBDNFを融合させた、蛍光蛋白融合型BDNFを用いることができる。候補物質と共に培養する工程とBDNFを添加する工程では、予め候補物質を培養容器内に添加した後にBDNFを加えて培養してもよいし、同時に候補物質とBDNFを培養容器に加えて培養してもよい。
【0042】
例えば、マルチタイタープレートの各ウェルに異なる候補物質を含む系を用いて、前記膜貫通ドメインを有するBDNF受容体を発現しうる細胞を培養し、上記の手順に従った場合、標識が検出されなければ添加した候補物質はBDNFが膜上の受容体に結合するのを阻害する物質であると判断され、疼痛治療剤になり得ると考えられる。
【実施例】
【0043】
本発明の理解を助けるために、実施例、実験例等を示して具体的に本発明を説明するが、本発明はこれらに限定されるものでないことはいうまでもない。
【0044】
(実施例1−1)改変型TrkB発現ベクターの作製
ヒトのTrkB遺伝子(GenBank Accession number=NM_006180)に相当するラットTrkB遺伝子(GenBank Accession number=NM_012731)を基に、PCRを用いて改変型遺伝子を作製した(図2)。ラットの脳組織よりmRNAを抽出後、逆転写酵素(reverse transcriptase)を用いて逆転写して1本鎖cDNAを合成した。蛋白質合成開始領域に設定したセンスプライマー(配列番号13、制限酵素BamHI認識配列を含む)、及び、膜貫通ドメインの直前に設定したアンチセンスプライマー(配列番号14、制限酵素EcoRI認識配列を含む)を用いて、ラット1本鎖cDNAを用いたPCRにより TrkBの膜貫通ドメインの直前までをコードする遺伝子領域を増幅した。
【0045】
また、蛋白質合成開始領域に設定したセンスプライマー(配列番号13)、及び、膜貫通ドメインの直後に設定したアンチセンスプライマー(配列番号15、制限酵素EcoRI認識配列を含む)を用いて、ラット1本鎖cDNAを用いたPCRにより TrkBの膜貫通ドメインの直後までをコードする遺伝子領域を増幅した。
【0046】
センスプライマー:GGATCCGCCATGTCGCCCTGGCCGAGGTG(配列番号13)
アンチセンスプライマー:GAATTCATGCTCCCGATTGGTTTGGTC(配列番号14)
アンチセンスプライマー:GAATTCTGGGCCTTTCATGCCAAACTTG(配列番号15)
【0047】
各PCR増幅産物は、制限酵素EcoRVにより平滑末端処理されたpBluescript(R) KS(STRATAGENE社)にクローニングされ、シークエンシング解析により正しいポリヌクレオチドの塩基配列であることが確認された。その後、制限酵素BamHIとEcoRIにより各TrkB遺伝子は切り出され、BamHIとEcoRIにより切断されたpCMVscript-EGFP(蛍光蛋白質EGFP、FLAG-tag、S-tagが挿入されたpCMVscript(R)ベクター(STRATAGENE社))に挿入された。シークエンシング解析により、挿入された各TrkB遺伝子の領域は、蛍光蛋白質EGFP、FLAG-tag、S-tagにアミノ酸フレームが一致していること、すなわち、融合蛋白質として正しく発現されることが確認された。
【0048】
正常型TrkBの膜貫通ドメインを有さないTrkBの細胞外側蛋白質(truncated TrkB (-)Transmembrane type; tTrkB(-)Tm)を発現させるための、正常型TrkBの膜貫通ドメインの直前までのアミノ酸及びその後ろ側に蛍光蛋白質EGFPが融合した融合蛋白質をコードする遺伝子を挿入したベクターをpCMVscript-tTrkB(-)Tm-EGFPとした。以下、膜貫通ドメインを有さないTrkBを、「分泌型TrkB」ということとする。当該分泌型TrkBは、配列番号4に示すアミノ酸配列からなり、当該分泌型TrkBをコードする遺伝子は、配列番号3に示す塩基配列からなる。
【0049】
同様に、膜貫通ドメインを有するTrkBの細胞外側蛋白質(truncated TrkB (+)Transmembrane type; tTrkB(+)Tm)を発現させるために、正常型TrkBの膜貫通ドメイン直後から13のアミノ酸を含むアミノ酸配列及びその後ろ側に蛍光蛋白質EGFPが融合した融合蛋白質をコードする遺伝子を挿入したベクターをpCMVscript-tTrkB(+)Tm-EGFPとした。以下、膜貫通ドメインを有するTrkBを、「膜結合型TrkB」ということとする。当該膜結合型TrkBは、配列番号8に示すアミノ酸配列を含み、当該膜結合型TrkBをコードする遺伝子は、配列番号7に示す塩基酸配列を含む。
【0050】
(実施例1−2)改変型NGFR(p75)発現ベクターの作製
ヒトのNGFR(p75)遺伝子(GenBank Accession number=NM_002507)に相当するラットNGFR(p75)遺伝子(GenBank Accession number=NM_012610)を基に、PCRを用いて改変型遺伝子を作製した(図3)。蛋白質合成開始領域に設定したセンスプライマー(配列番号16、制限酵素EcoRI認識配列を含む)、及び、膜貫通ドメインの直前に設定したアンチセンスプライマー(配列番号17、制限酵素XhoI認識配列を含む)を用いて、ラット1本鎖cDNAを用いたPCRにより NGFR(p75)の膜貫通ドメインの直前までをコードする遺伝子領域を増幅した。
【0051】
センスプライマー:GAATTCACCATGAGGAGGGCAGGTGCTGCC(配列番号16)
アンチセンスプライマー:CTCGAGGTTGTCGGTGGTGCCG(配列番号17)
【0052】
PCR増幅産物は、制限酵素EcoRVにより平滑末端処理されたpBluescript(R) KS(STRATAGENE社)にクローニングされ、シークエンシング解析により正しいポリヌクレオチドの塩基配列であることが確認された。その後、制限酵素EcoRIとXhoIによりNGFR(p75)遺伝子は切り出され、EcoRIとXhoIにより切断されたpCM-Vscript-EGFP(蛍光蛋白質EGFP、FLAG-tag、S-tagを含むpCMVscript(R)ベクター(STRATAGENE社))に挿入された。シークエンシング解析により、挿入されたNGFR(p75)遺伝子領域は蛍光蛋白質EGFP、FLAG-tag、S-tagにアミノ酸フレームが一致していること、すなわち、融合蛋白質として正しく発現されることが確認された。ここで、膜貫通ドメインを有さないNGFR(p75)の細胞外側蛋白質をコードする遺伝子の発現ベクターをpCMVscript-tNGFR(-)Tm-EGFPとした。以下、膜貫通ドメインを有さないNGFR(p75)を、「分泌型NGFR(p75)」ということとする。当該分泌型NGFR(p75)のアミノ酸配列は配列番号12に示され、当該分泌型NGFR(p75)をコードする遺伝子は、配列表の配列番号11に示す塩基配列からなる。
【0053】
(実験例1−1)培養細胞系における改変型受容体の発現確認実験
本実験例では、各改変型の受容体が、細胞においてどのように発現するかを培養細胞系により観察した。実施例1−1及び1−2で作製した改変型受容体の発現ベクター pCMVscript-tTrkB(-)Tm-EGFP、pCMVscript-tTrkB(+)Tm-EGFP、pCMVscript-tNGFR(-)Tm-EGFP、又はコントロールベクター pCMVscript-EGFPを、遺伝子導入試薬であるLipofectamineTM 2000(インビトロジェン社)を用いて各々ヒト正常細胞HEK293に導入した。導入24時間後に、オリンパスIXL71倒立型蛍光顕微鏡にて、蛍光蛋白質EGFP融合型の各改変型受容体の発現を観察した。
【0054】
その結果、コントロールベクター pCMVscript-EGFPを導入した細胞では蛍光蛋白質EGFPは細胞全体に発現していることが観察された(図4左上)。膜結合型TrkBの発現ベクターpCMVscript-tTrkB(+)Tm-EGFPを導入した細胞では蛍光蛋白質EGFPが細胞膜付近に局在していることが観察された(図4右上)。このことは、膜結合型TrkBが確かに細胞膜に発現していると考えられた。
【0055】
一方、分泌型TrkB発現ベクター pCMVscript-tTrkB(-)Tm-EGFP及び分泌型NGFR(p75)発現ベクター pCMVscript-tNGFR(-)Tm-EGFPを導入した細胞では、細胞内に蛍光蛋白質EGFPはほとんど観察されなかった(図4左右下)。このことは、膜貫通ドメインを有さない改変型のtTrkB(-)Tm及びtNGFR(-)Tmは、細胞外へ分泌されており、その結果、細胞内の蛍光蛋白質が減少しているものと考えられた。
【0056】
(実験例1−2)培養細胞系における分泌型受容体の分泌確認実験
本実験例では、分泌型TrkB及び分泌型NGFR(p75)が細胞外へ分泌されているかについて、確認実験を行った。
【0057】
分泌型の改変型受容体発現ベクター pCMVscript-tTrkB(-)Tm-EGFP、pCMVscript-tNGFR(-)Tm-EGFP、又はコントロールベクター pCMVscript-EGFPを、遺伝子導入試薬であるLipofectamineTM 2000(インビトロジェン社)を用いて各々8μgヒト正常細胞HEK293(90mm dish)に導入し、6時間後に新しい培地と交換した。遺伝子導入72時間後に培養液(上清)を15 mlコニカルチューブに回収し、3000回転にて5分間遠心分離を行い、細胞を除去後、上清を新しいコニカルチューブに移し、本実験例の試料液とした。
【0058】
上記各試料液1 mlをエッペンドルフチューブに採取し、10μlのProtease inhibitor(Sigma社)と50μl S-proteinアガロースビーズ(Novagen社)を加え、4℃で16時間、ローテーターで回転させた。5000回転にて3分間遠心分離を行い、S-proteinアガロースビーズに結合しているS-tag及びS-tag融合型受容体の単離(Pull-Down)を行った。沈殿物を1 mlのリン酸緩衝液(PBS)で洗浄後、同様に遠心分離を行った。これを4回繰り返した。沈殿物にSDS-Sample Buffer を50μl加え、100℃で5分加熱後、10μlを12% SDSポリアクリルアミドゲルにて電気泳動し、iBlotTMゲルトランスファーシステム(Invitrogen社)にてPVDF((Polyvinylidene difluoride)膜に蛋白質のブロッティングを行った。転写されたPVDF膜をブロッキング緩衝液(3% BSA, 0.5% Tween20, 1xPBS)でブロッキングしたのちに、FLAG-tagに対する抗FLAGマウスモノクローナル抗体M2(Sigma社)を反応させた。洗浄後、抗マウスVecstain(R) ABC-AP kit(Vector Laboratories)で標識し、アルカリホスファターゼ(ALP)の基質であるCDP-star(R)(Roche社)を添加し、生じた蛍光をルミノ・イメージアナライザーLAS-1000(FUJIFILM社製)にて取り込んだ。
【0059】
その結果、pCMVscript-tTrkB(-)Tm-EGFP及びpCMVscript-tNGFR(-)Tm-EGFPを導入した細胞の培養液には、推定サイズ付近にバンドが検出されたが、コントロールベクター導入細胞の培養液にはバンドは検出されなかった(図5)。このことより、改変型受容体遺伝子が導入された細胞の培養液から分泌型TrkB及び分泌型NGFR(p75)が回収され、細胞外へ分泌されていることが明らかとなった。
【0060】
(実験例1−3)培養細胞系における分泌型受容体のBDNF結合能の確認実験
本実験例では、分泌型TrkB及び分泌型NGFR(p75)について、BDNFとの結合性について確認実験を行った。
実験例2で調製した試料液各1 mlをエッペンドルフチューブに採取し、10μl のProtease inhibitor(Sigma社)と0.5μgのBDNF(Abcom社、mature型)を加え4℃で16時間ローテーターで回転させた。その後、50μlの S-protein アガロースビーズ(Novagen社)を加え4℃で3時間、ローテーターで回転させた。5000回転にて3分間遠心分離を行い、S-proteinアガロースビーズ(Novagen社)に結合しているS-tag及びS-tag融合型受容体の単離(Pull-Down)を行った。当該分泌型受容体にBDNFが結合するのであれば、分泌型受容体を単離するとBDNFが検出される。沈殿物を1 mlのPBSで洗浄後、同様に遠心分離を行った。これを4回繰り返した。沈殿物にSDS-Sample Bufferを50μl加え、100℃で5分加熱後、10μlを12% SDSポリアクリルアミドゲルにて電気泳動し、iBlotTMゲルトランスファーシステム(Invitrogen社)にてPVDF膜に蛋白質のブロッティングを行った。転写されたPVDF膜はブロッキング緩衝液(3% BSA, 0.5% Tween20, 1xPBS)でブロッキングしたのちに、BDNFに対する抗BDNF-rabbit抗体(Abcom)を反応させた。洗浄後、抗ウサギVecstain(R) ABC-AP kit(Vector Laboratories)で標識し、アルカリホスファターゼの基質であるCDP-star(R)(Roche社)を添加し、生じた蛍光をルミノ・イメージアナライザーLAS-1000(FUJIFILM社製)にて取り込んだ。
【0061】
その結果、pCMVscript-tTrkB(-)Tm-EGFP及びpCMVscript-tNGFR(-)Tm-EGFPを導入した系から分泌型TrkB又は分泌型NGFR(p75)を単離するとBDNFが検出されたが、コントロールベクターを導入した系ではBDNFは検出されなかった(図6)。このことより、遺伝子導入により発現された分泌型TrkB及び分泌型NGFR(p75)は確かに細胞外へ分泌されてBDNFと結合することが証明された。また、このことは、BDNFを標的とした蛋白質製剤の有効成分として、分泌型TrkB又は分泌型NGFR(p75)を利用することが可能であるといえる。
【0062】
さらに、分泌型NGFR(p75)とBDNFの結合は、分泌型TrkBとBDNFの結合に比べて弱いことが示された。このことは、確かにNGFR(p75)とBDNFの結合が低親和性であることと一致していた。
【0063】
(実験例1−4)培養細胞系における膜結合型受容体のBDNF結合能の確認実験
本実験例では、膜結合型TrkBとBDNFとの結合性について確認実験を行った。
膜結合型TrkBの発現ベクター pCMVscript-tTrkB(+)Tm-EGFP又はコントロールベクター pCMVscript-EGFPを、HEK293細胞(35mm dish)に各々2μgトランスフェクション行い、翌日、一部を8 チャンバースライドガラスに移し培養した。翌日、細胞にBDNF(Abcom社、mature型)を加え培養(50ng/100μl)した。1 時間後、PBSで洗浄し、抗BDNFウサギ抗体(Abcom社)(1;1000希釈)、Cy3標識抗ウサギ抗体(1;1000希釈)、及び、10%FBSを含むOPTI培養液(インビトロジェン社)で3時間培養した。その後、オリンパスIXL71倒立型蛍光顕微鏡にて蛍光観察を行った(図7)。
【0064】
図7のA-Bはコントロールベクター pCMVscript-EGFP導入細胞を、C-Fは膜結合型TrkBの発現ベクター pCMVscript-tTrkB(+)Tm-EGFP導入細胞を示しており、番号1はEGFP蛍光蛋白質(緑色)の局在を、番号2はBDNF(赤色)の局在を示している。膜結合型TrkBは、確かにBDNFを細胞膜表面で捕まえることができることが明らかになった。
【0065】
(実験例1−5)慢性疼痛モデルラットにおける改変型受容体遺伝子の疼痛軽減効果の確認実験
分泌型TrkB発現ベクター pCMVscript-tTrkB(-)Tm-EGFP、膜結合型TrkB発現ベクター pCMVscript-tTrkB (+)Tm-EGFP、又は、コントロールベクター pCMVscript-EGFPを慢性疼痛モデルラット(各6匹)に投与し、疼痛軽減効果を確認した。
ラットの左脊髄第5腰髄神経の後根神経節(DRG)の末梢側を結紮して慢性疼痛モデルラットを作製すると同時に、カテーテルの先端を脊髄内第4腰髄神経終末付近に留置した。カテーテルの他端は皮下を通して後頭部から体外に出した。手術日を0日目とした。
【0066】
神経結紮による痛覚過敏の成立を確認した後、5日目、6日目、及び7日目に、トランスフェクション試薬GenomeONETMを用いて各プラスミド溶液(3μg/μl)を調製し、14μl(42μg)をカテーテルからクモ膜下に注入した。投与後、15μlの生理食塩水でカテーテル内の残薬を押し出した。
【0067】
ラットの疼痛行動観察は、慢性疼痛モデル作製以前から7日目の投薬3回目(最終)投与後もさらに1 週間にわたって行った(図8)。疼痛行動は、機械的刺激に対する疼痛閾値(50%反応域値)により評価した。具体的には、ラットを10×20cm四方の壁に囲まれた金網の上にのせ、安静になるまで30分以上放置した。金網の下から、太さの異なる5種類のナイロンフィラメント(von Freyフィラメント)を、細いものから順に後肢足底の中心にそっと押し当て、刺激による逃避行動の有無を観察した。逃避行動を示す閾値をChaplanらの方法(Chaplan SR, Bach FW, Pogrel JW, Chung JM, Yaksh TL. Quantitative assessment of tactile allodynia in the rat paw. J Neurosci Methods. 53(1):55-63, (1994))により求めた。閾値はフィラメントの堅さをgramで表示しており、数値が低いほど痛みに敏感に反応することを示している。
【0068】
その結果、コントロールベクター投与群において、結紮した左足(患足)は疼痛閾値の低下を示しており、痛みを感じていることが確認されたが、結紮していない右足(健足)は痛みを感じていないことが確認された。分泌型TrkB発現ベクターpCMVscript-tTrkB(-)Tm-EGFPの投与群では、患足で8日目から9日目にかけて疼痛の抑制が観察された(図9)。膜結合型TrkBの発現ベクターpCMVscript-tTrkB(+)Tm-EGFPの投与群では、患足で10日目から15日目にかけて疼痛の抑制が観察された(図10)。
上記結果より、本改変型受容体遺伝子の投与により疼痛抑制が可能となること、及び、遺伝子投与は健側の行動評価に対しては何等影響を及ぼさないことが明らかになった。
【0069】
一方、非特許文献1(L5 脊髄神経結紮ラットにおけるワクシニアウイルス接種家兎炎症皮膚抽出液(ノイロトロピン(R))と消炎鎮痛薬および抗うつ薬との抗アロディニア作用の比較.日本ペインクリニック学会誌 Vol.15 No.4, 407-413 (2008))に記載の場合では、ノイロトロピン(R)及びミルナシプランでは、薬剤投与後2時間のみ鎮痛効果が認められたことが報告されているが、その効果は持続しておらず、本発明の疼痛の治療剤のほうが、疼痛抑制効果が持続することが確認された。
【0070】
(実験例1−6)慢性疼痛ラットにおける改変型受容体遺伝子の発現確認実験
ラット組織内での導入遺伝子発現の確認を行うために、実験例5と同様に慢性疼痛ラットを作製した。分泌型TrkB発現ベクター pCMVscript-tTrkB(-)Tm-EGFP、膜結合型TrkB発現ベクター pCMVscript-tTrkB(+)Tm-EGFP又はコントロールベクター pCMVscript-EGFPを投与した慢性疼痛ラット、遺伝子導入試薬GenomeOneTM(石原産業)のみを投与したコントロール慢性疼痛ラット、何も投与していないコントロール正常ラット(非結紮)について、結紮手術後9日から21日の間に左右の第2〜6腰髄神経DRGを摘出した。摘出後、すぐに組織を組織保存用試薬であるRNAlater(R)(Qiagen社)存在下で、-80℃フリーザーにて保管した。ホモジナイザーで組織を粉砕後、RNA抽出試薬としてISOGEN(ニッポンジーン社)にてRNAを抽出した。得られたRNAからReverTra Ace(R) cDNA合成キット(TOYOBO社)を用いてcDNAを合成した。EGFP検出用プライマー(配列番号18、19)とインターナルコントロール遺伝子GAPDH(配列番号20、21)を用いて反応液を調製後、Applied Biosystems(R) 7300 リアルタイムPCRシステム(Applied Biosystems社)にて導入遺伝子の発現量の定量を行った。インターナルコントロール遺伝子GAPDHに対するEGFP遺伝子の発現比を算出し、全DRGの平均値として表した(図11)。
【0071】
EGFP検出用プライマー
センスプライマー;GGGCCCACCATGGTGAGCAAGG(配列番号18)
アンチセンスプライマー;GATGAACTTCAGGGTCAGCTTG(配列番号19)
インターナルコントロール遺伝子(GAPDH)
センスプライマー;GACAACTTTGGCATCGTGGA(配列番号20)
アンチセンスプライマー;ATGCAGGGATGATGTTCTGG(配列番号21)
【0072】
(実施例2)新規疼痛治療剤のスクリーニング方法
本実施例では、新規疼痛治療剤のスクリーニングの系について示した。スクリーニングは、以下の1)及び2)の工程を含む系により実施した。
1)膜貫通ドメインを有するBDNF受容体を発現しうる細胞を、候補物質及びBDNFと共に培養する工程。
2)前記細胞の表面上に結合したBDNFを確認する工程。
【0073】
上記1)の膜貫通ドメインを有するBDNF受容体として、膜結合型TrkBを用いた。膜貫通ドメインを有するBDNF受容体を発現しうる細胞は、上述の実施例1−1の膜結合型TrkBの発現ベクター pCMVscript-tTrkB(+)Tm-EGFPを、上述の実験例1−1に従いHEK293細胞にトランスフェクションして構築した。前記細胞を10%FBSを含むOPTI-MEMを用いて径60mmのディッシュで72時間培養した。
【0074】
上記1)の候補物質として、本実施例では分泌型TrkBを用いた。分泌型TrkBを含む試料(候補物質(+))は、実験例1−2に従い、分泌型TrkBを発現しうるtTrkB(-)Tm発現ベクターをHEK293細胞に導入し、導入72時間後に培養液(上清)を15 mlコニカルチューブに回収し、3000回転にて5分間遠心分離後の上清とした。また、対照としての候補物質を含まない(候補物質(-))試料は、遺伝子を導入していない空の発現ベクターを同様にHEK293細胞に導入し、培養、遠心分離後の上清とした。候補物質(+)又は候補物質(-)を前記培養系に2ml添加した。各培養系に、さらにBDNF(Abcom社、mature型)(100ng/ml)を添加した。
【0075】
上記2)の細胞の表面上に結合したBDNFの確認は、候補物質及びBDNFを添加1時間後、抗BDNFウサギ抗体(Abcom社)(1;1000希釈)、及び、Cy3標識抗ウサギ抗体(1;1000希釈)をさらに添加し、3時間培養した後に、オリンパスIXL71倒立型蛍光顕微鏡にて蛍光観察により行った。
【0076】
図12において、C-Dには、候補物質のポジティブコントロールとして分泌型TrkBを添加した結果を示し、A-Bにはその対照実験結果を示した。番号1にはTrkB-EGFP蛍光蛋白質の局在を示し、番号2にはBDNFの局在を示した。BDNFの局在を確認することにより、BDNFとその受容体の結合を阻害する物質を選別することが可能であることが明らかになった。この系を利用して、BDNFと受容体の結合阻害物質、すなわち、新規疼痛治療剤をスクニーニングすることが可能となった。候補物質とBDNFの培養液への添加の順番に関しては、同時に添加しても、候補物質添加1時間後にBDNFを添加しても、同じ結果が観察された。
【産業上の利用可能性】
【0077】
以上詳述したように、各遺伝子発現ベクターを作製後、in vitroの培養細胞系での発現確認実験、BDNFを捕獲できるかどうかの確認実験を行った結果、確かに上記の改変型受容体産物はBDNFを捕獲可能であることが判明した。in vivoの疼痛モデルラット系に投与実験を行った結果、膜貫通ドメインを有さない分泌型TrkBをコードする遺伝子又は膜貫通ドメインを有する膜結合型TrkBをコードする遺伝子を投与すると、慢性疼痛ラットの痛みが軽減できることが確認された。したがって、BDNF受容体(TrkB及び/又はNGFR(p75))の改変型蛋白質をコードする遺伝子を生体内で発現させることで、生体内でBDNFがその受容体に結合するのを防ぐことができ、痛みを軽減しうる。その効果は、既存の鎮痛薬等が2時間程度の効果であったのに対して、3〜4日持続されていた。このことから、BDNFの受容体改変型蛋白質、すなわち、分泌型TrkB、膜結合型TrkB及び/又は分泌型NGFR(p75)は慢性の疼痛に対して、効果があると考えられた。したがって、分泌型TrkB、膜結合型TrkB及び/又は分泌型NGFR(p75)は、BDNFを標的とした蛋白質製剤の有効成分として利用することも可能であるといえる。
【0078】
さらに、本発明の疼痛治療剤の作用メカニズムが、脳由来神経栄養因子とその受容体との結合を阻害しうる作用によるものであることから、脳由来神経栄養因子とその受容体との結合を阻害しうる物質を選別することで、新規疼痛治療剤をスクリーニングすることができる。
【特許請求の範囲】
【請求項1】
脳由来神経栄養因子とその受容体との結合を阻害しうる物質を有効成分として含むことを特徴とする、疼痛治療剤。
【請求項2】
脳由来神経栄養因子が、脊髄後角に放出される脳由来神経栄養因子である、請求項1に記載の疼痛治療剤。
【請求項3】
脳由来神経栄養因子が、知覚神経及び/又はグリア細胞より放出される脳由来神経栄養因子である、請求項1又は2に記載の疼痛治療剤。
【請求項4】
脳由来神経栄養因子とその受容体との結合を阻害しうる物質が、改変型の脳由来神経栄養因子受容体である、請求項1〜3のいずれか1に記載の疼痛治療剤。
【請求項5】
改変型の脳由来神経栄養因子受容体が、分泌型TrkB、膜結合型TrkB及び分泌型NGFR(p75)から選択されるいずれかである、請求項4に記載の疼痛治療剤。
【請求項6】
改変型の脳由来神経栄養因子受容体が、以下に示すいずれかのアミノ酸配列からなる、請求項4又は5に記載の疼痛治療剤:
1)配列表の配列番号2、4、6、8、10又は12のいずれかに示すアミノ酸配列;
2)上記1)に示すアミノ酸配列のうち、1〜複数個のアミノ酸が、置換、欠失、付加又は導入されてなるアミノ酸配列。
【請求項7】
脳由来神経栄養因子とその受容体との結合を阻害しうる物質が、分泌型TrkB、膜結合型TrkB及び分泌型NGFR(p75)から選択されるいずれかをコードするポリヌクレオチドである、請求項5又は6に記載の疼痛治療剤。
【請求項8】
分泌型TrkB、膜結合型TrkB及び分泌型NGFR(p75)から選択されるいずれかをコードするポリヌクレオチドが、以下に示すいずれかの塩基配列からなるポリヌクレオチドである、請求項7に記載に疼痛治療剤:
1)配列表の配列番号1、3、5、7、9又は11のいずれかに示す塩基配列からなるポリヌクレオチド;
2)上記1)に示すポリヌクレオチドに対して相補的な塩基配列からなるポリヌクレオチド;
3)上記1)又は2)に示すポリヌクレオチドに対して、ストリンジェントな条件下でハイブリダイズしうるポリヌクレオチド;
4)上記1)又は2)に示すポリヌクレオチドのうち、1〜複数個のヌクレオチドが、置換、欠失、付加又は導入されてなるポリヌクレオチド。
【請求項9】
請求項7又は8に記載のいずれかのポリヌクレオチドが組み込まれたベクターを含む、請求項7又は8に記載の疼痛治療剤。
【請求項10】
脳由来神経栄養因子とその受容体との結合を阻害しうる物質を選別することを特徴とする新規疼痛治療剤のスクリーニング方法。
【請求項11】
以下の1)及び2)の工程を含む、請求項10に記載の新規疼痛治療剤のスクリーニング方法:
1)膜貫通ドメインを有する脳由来神経栄養因子受容体を発現しうる細胞を、候補物質及び脳由来神経栄養因子と共に培養する工程;
2)前記細胞の表面上に結合した脳由来神経栄養因子を確認する工程。
【請求項12】
以下の1)〜3)の工程を含む、請求項10に記載の新規疼痛治療剤のスクリーニング方法:
1)膜貫通ドメインを有する脳由来神経栄養因子受容体を発現しうる細胞を、候補物質と共に培養する工程;
2)上記培養系に、さらに脳由来神経栄養因子を添加する工程;
3)前記細胞の表面上に結合した脳由来神経栄養因子を確認する工程。
【請求項1】
脳由来神経栄養因子とその受容体との結合を阻害しうる物質を有効成分として含むことを特徴とする、疼痛治療剤。
【請求項2】
脳由来神経栄養因子が、脊髄後角に放出される脳由来神経栄養因子である、請求項1に記載の疼痛治療剤。
【請求項3】
脳由来神経栄養因子が、知覚神経及び/又はグリア細胞より放出される脳由来神経栄養因子である、請求項1又は2に記載の疼痛治療剤。
【請求項4】
脳由来神経栄養因子とその受容体との結合を阻害しうる物質が、改変型の脳由来神経栄養因子受容体である、請求項1〜3のいずれか1に記載の疼痛治療剤。
【請求項5】
改変型の脳由来神経栄養因子受容体が、分泌型TrkB、膜結合型TrkB及び分泌型NGFR(p75)から選択されるいずれかである、請求項4に記載の疼痛治療剤。
【請求項6】
改変型の脳由来神経栄養因子受容体が、以下に示すいずれかのアミノ酸配列からなる、請求項4又は5に記載の疼痛治療剤:
1)配列表の配列番号2、4、6、8、10又は12のいずれかに示すアミノ酸配列;
2)上記1)に示すアミノ酸配列のうち、1〜複数個のアミノ酸が、置換、欠失、付加又は導入されてなるアミノ酸配列。
【請求項7】
脳由来神経栄養因子とその受容体との結合を阻害しうる物質が、分泌型TrkB、膜結合型TrkB及び分泌型NGFR(p75)から選択されるいずれかをコードするポリヌクレオチドである、請求項5又は6に記載の疼痛治療剤。
【請求項8】
分泌型TrkB、膜結合型TrkB及び分泌型NGFR(p75)から選択されるいずれかをコードするポリヌクレオチドが、以下に示すいずれかの塩基配列からなるポリヌクレオチドである、請求項7に記載に疼痛治療剤:
1)配列表の配列番号1、3、5、7、9又は11のいずれかに示す塩基配列からなるポリヌクレオチド;
2)上記1)に示すポリヌクレオチドに対して相補的な塩基配列からなるポリヌクレオチド;
3)上記1)又は2)に示すポリヌクレオチドに対して、ストリンジェントな条件下でハイブリダイズしうるポリヌクレオチド;
4)上記1)又は2)に示すポリヌクレオチドのうち、1〜複数個のヌクレオチドが、置換、欠失、付加又は導入されてなるポリヌクレオチド。
【請求項9】
請求項7又は8に記載のいずれかのポリヌクレオチドが組み込まれたベクターを含む、請求項7又は8に記載の疼痛治療剤。
【請求項10】
脳由来神経栄養因子とその受容体との結合を阻害しうる物質を選別することを特徴とする新規疼痛治療剤のスクリーニング方法。
【請求項11】
以下の1)及び2)の工程を含む、請求項10に記載の新規疼痛治療剤のスクリーニング方法:
1)膜貫通ドメインを有する脳由来神経栄養因子受容体を発現しうる細胞を、候補物質及び脳由来神経栄養因子と共に培養する工程;
2)前記細胞の表面上に結合した脳由来神経栄養因子を確認する工程。
【請求項12】
以下の1)〜3)の工程を含む、請求項10に記載の新規疼痛治療剤のスクリーニング方法:
1)膜貫通ドメインを有する脳由来神経栄養因子受容体を発現しうる細胞を、候補物質と共に培養する工程;
2)上記培養系に、さらに脳由来神経栄養因子を添加する工程;
3)前記細胞の表面上に結合した脳由来神経栄養因子を確認する工程。
【図11】


【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図12】




【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図12】


【公開番号】特開2012−67081(P2012−67081A)
【公開日】平成24年4月5日(2012.4.5)
【国際特許分類】
【出願番号】特願2011−172529(P2011−172529)
【出願日】平成23年8月8日(2011.8.8)
【出願人】(504147243)国立大学法人 岡山大学 (444)
【Fターム(参考)】
【公開日】平成24年4月5日(2012.4.5)
【国際特許分類】
【出願日】平成23年8月8日(2011.8.8)
【出願人】(504147243)国立大学法人 岡山大学 (444)
【Fターム(参考)】
[ Back to top ]

