疾患の予防および制御のための寄生虫性生物剤の使用
【課題】制御性T細胞機能に影響を及ぼす蠕虫性寄生虫調製物をスクリーニングする方法、および寄生虫調製物の投与を介して制御性T細胞活性を変化させることにより疾患を治療する方法の提供。
【解決手段】方法は以下のステップ、すなわち、(a)蠕虫性寄生虫調製物を得るステップ、(b)蠕虫性寄生虫調製物を標的と接触させるステップ、および(c)接触後の標的において内部マーカーとしての転写因子、制御性T細胞のための細胞表面マーカーまたは分泌マーカーのレベルを測定するステップを含み、ここで、接触後の細胞表面マーカーのレベルの変化は、制御性T細胞活性を変化させる蠕虫性寄生虫調製物の指標となる。
【解決手段】方法は以下のステップ、すなわち、(a)蠕虫性寄生虫調製物を得るステップ、(b)蠕虫性寄生虫調製物を標的と接触させるステップ、および(c)接触後の標的において内部マーカーとしての転写因子、制御性T細胞のための細胞表面マーカーまたは分泌マーカーのレベルを測定するステップを含み、ここで、接触後の細胞表面マーカーのレベルの変化は、制御性T細胞活性を変化させる蠕虫性寄生虫調製物の指標となる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、寄生虫組成物、ならびに免疫応答の変化に起因する状態もしくは病態の予防および/または治療におけるその使用に関する。
【背景技術】
【0002】
寄生虫は、それらの生活環のある部分を他の生物上または他の生物内で過ごす生物であり、宿主から栄養を得ている。腸に生息する寄生虫は、粘膜免疫系との複雑な相互作用を有する。それらは生存するために宿主の粘膜防御との安定した関係を確立しなければならない。
【0003】
異常なTh1またはTh2応答を引き起こす免疫系の調節異常は、いくつかのヒト疾患の原因となりうる。優勢なTh1応答によるいくつかの疾患は、IBD、関節リウマチ、サルコイドーシス、多発性硬化症、およびインスリン依存性糖尿病を含む。Th2関連疾患はアレルギー性疾患および癌を含む。
【0004】
最近、寄生虫暴露が実験的自己免疫性脳脊髄炎(EAE)の重症度を減少させることが示された(Sewellら、2003, International Immunology, 15: 59-69)。実験的自己免疫性脳脊髄炎(EAE)は、中枢神経系(CNS)の慢性炎症性脱髄を特徴とする多発性硬化症(MS)についての動物モデルである。Sewellは、マウスにおけるSchistosoma mansoniの卵子による免疫によって、EAEの重症度が、臨床スコアおよびCNS細胞浸潤物の減少によって測定されるように減少することを報告した。末梢におけるIFN-ガンマの減少、ならびにIL-4、形質転換成長因子-ベータ、およびIL-10レベルの増加があり、IL-4産生性神経抗原特異的T細胞の頻度は脳において増加する。
【0005】
クローン病は、Tヘルパー(Th)1型粘膜炎症の調節異常に起因する。クローン病は熱帯諸国では稀であるが、温帯気候の先進国では一般的であり、その発生率は1940年以降に上昇した。対照的に、蠕虫性寄生虫への暴露は熱帯諸国では一般的であるが、先進国では稀である。Elliottら(2003, Am. J. Physiol. Gastrointest. Liver Physiol., 284:G385-G391)は、蠕虫が過剰なTh1型炎症を軽減しうることを実証した。その仮説を検証するため、マウスを蠕虫Schistosoma mansoniの卵に暴露し、その後、大腸炎を誘発するためにトリニトロベンゼンスルホン酸(TNBS)を直腸投与した。住血吸虫卵暴露はTNBS大腸炎を軽減し、マウスを致死的な炎症から保護した。住血吸虫卵暴露は、TNBS処理されたマウスの抗CD3刺激した脾臓および腸間膜リンパ節細胞からのIFN-ガンマを減少させ、IL-4産生を上昇させた。住血吸虫卵暴露は、TNBS処理されたマウスにおいて、大腸のIFN-ガンマを減少させたが、IL-10 mRNAの発現を増加させた。大腸炎の軽減のためには、完全なシグナル伝達および転写活性化因子 6が必要とされた。この著者らは、蠕虫への暴露がマウスの大腸の炎症を減少させ得ることを示した。
【0006】
de Jongら(2002, J. Immunol., 168: 1704-1709)は、蠕虫Schistosoma mansoniに由来するタンパク質抽出物がOX40リガンドの発現の向上を介してTh2細胞の発達を促進するDC2の発達を誘導することを実証した。同様に、細胞外細菌Vibrio cholerae由来の毒素もまたDC2の発達を誘導するが、OX40リガンド非依存的な、未知の機構を介する。対照的に、細胞内細菌Bordetella pertussis由来の毒素はIL-12 産生の増加を伴うDC1の発達を誘導し、Th1細胞の発達を促進する。ポリ(I:C)(ウイルスを模倣したdsRNA)は、IL-12産生の増加を伴わずに非常に強力なTh1誘導性DC1の発達を誘導した。
【0007】
米国特許出願2003/0103938 A1は、Th1/Th2比を調節することによるヒトもしくは動物におけるTh1細胞またはTh2細胞関連疾患の予防または治療のための、IL-4およびSDF-1α、あるいはIL-2およびSDF-1αからなる医薬組成物を開示する。
【0008】
Doetzeら(2000, International Immunology, 12: 623-630)は、免疫があると推定される(PI)個体からのPBMCと比較した、慢性的な蠕虫感染を有する、すなわち、全身性回旋糸状虫症(GEO)の個体からの末梢血単核細胞(PBMC)によるOv抗原(OvAg)に対するT細胞増殖の低応答性を研究した。この研究では、GEOにおけるこの細胞の低応答性を仲介する機構が研究され、GEO個体からのPBMCにおける低い増殖応答は、PI個体からのものと比較した、IL-4産生の不足および有意に低いIL-5の産生と関連し、これは低応答性の原因である一般的なT(h)2応答へのシフトとは相反していた。対照的に、T(h)3応答に関連する2つのサイトカインであるIL-10および形質転換成長因子(TGF)-ベータは低応答性を仲介すると思われ、GEOの個体からのPBMCは有意に多くのIL-10を産生し、この群におけるT細胞増殖の低応答性は抗IL-10抗体および抗TGF-ベータ抗体の添加によって逆転され得た。この著者らは、低応答性がOvAgに特異的であり、近縁の線虫抗原による刺激では観察されないことを示し、これはT細胞を介したOv特異的なダウンレギュレーションを支持している。Ov特異的なT細胞はGEO PBMCからクローニングすることができ、それは進行中の炎症を抑制することが知られているT細胞サブセット(T(h)3およびT(r)1)と同様の、独特のサイトカインプロフィール(IL-2はないが、高いIL-10および/またはTGF-ベータを産生する)を有し、今のところ感染症では見いだされていないこの細胞種がOv特異的な低応答性の維持に関与しうることを示した。
【0009】
Th3細胞は制御性T細胞のサブセットであり、もともとは経口でMBPに対して寛容化されたマウスにおいて産生および同定され、TGF-b依存性の機構によって実験的自己免疫性脳脊髄炎(EAE)の誘導を抑制した(Chenら、1994, Science, 265: 1237-1240)。最近の研究は、制御性T細胞が細菌性、ウイルス性および寄生虫抗原に対してin vivoで誘導され得、防御性Th1応答を抑制することによって、自己免疫疾患、感染誘導性の免疫病理または病原体持続の延長を防止するかもしれないことを示唆する(例えば、McGuirkおよびMills, 2002, Trends in Immunology, 23: 450-455; Tungら、2001, Immunological Reviews, 182: 135-148;ならびにMaloyおよびPowrie, 2001, Nature Immunology, 2: 816-822参照)。
【0010】
制御性T細胞は一般的に、免疫応答、すなわち、抗体媒介性および/または細胞媒介性免疫の両方を抑制するリンパ球として記載されている(例えば、概説として、McGuirk P, Mills KH. Pathogen-specific regulatory T cells provoke a shift in the Th1/Th2 paradigm in immunity to infectious diseases. Trends Immunol 2002; 23 (9): 450-5; Field, A. C., L. Caccavelli, M. F. Bloch,および B. Bellon. 2003. Regulatory CD8+ T cells control neonatal tolerance to a Th2-mediated autoimmunity. Journal of Immunology. 170: 2508-2515; von Herrath MG, Harrison LC. Antigen-induced regulatory T cells in autoimmunity. Nat Rev Immunol. 2003 Mar; 3 (3): 223-32; Francois Bach J. Regulatory T cells under scrutiny. Nat Rev Immunol. 2003 Mar; 3 (3): 189-98; Curotto de Lafaille MA, Lafaille JJ. CD4 (+) regulatory T cells in autoimmunity and allergy. Curr Opin Immunol. 2002 Dec; 14 (6):771-8; McGuirk P, Mills KH. Pathogen-specific regulatory T cells provoke a shift in the Th1/Th2 paradigm in immunity to infectious diseases. Trends Immunol. 2002 Sep; 23 (9): 450-5; Tung KS, Agersborg SS, Alard P, Garza KM, Lou YH. Regulatory T-cell, endogenous antigen and neonatal environment in the prevention and induction of autoimmune disease. Immunol Rev. 2001 Aug; 182: 135-48; Read S, Powrie F. CD4 (+) regulatory T cells. Curr Opin Immunol. 2001 Dec; 13 (6): 644-9; Yssel H, Lecart S, Pene J. Regulatory T cells and allergic asthma. Microbes Infect. 2001 Sep; 3(11) : 899-904参照)。これらの制御性T細胞(Tr細胞)は、インターロイキン-2(IL-2)の受容体のアルファ鎖である(CD25と呼ばれる)膜貫通タンパク質を発現する。他のT細胞と同様に、それらはまた、抗原に対するαβ(アルファ-ベータ)T細胞受容体(TCR)を発現し、それが特異的なペプチド-クラスII MHC分子に、またはCD8制御性細胞の場合にはクラスI MHCに結合した場合にのみ、活性化され得る。しかし、活性化された場合には、それらは多量のインターロイキン10(IL-10)を分泌しはじめ、しばしば更にいくらかの形質転換成長因子-ベータ(TGF-β)を分泌しはじめる。これらの両リンフォカインは、細胞媒介性免疫および炎症のためのTh1の支援、抗体産生のためのTh2の支援、ならびに場合によっては、CD8+細胞傷害性Tリンパ球(CTL)の作用を阻害する強力な免疫抑制物質である。いくつかの他の制御性T細胞は、Tr細胞とは異なる。例えば、Tr1細胞は、それらの表面に多量のCD25を発現しないけれども、いくつかの点でTr細胞と類似している。それらはその形成のためにIL-10を必要とし、一旦成熟すると、大量のそれを分泌する。Th3細胞の主要なリンフォカインはTGF-βである。
【0011】
制御性T細胞が蠕虫性寄生虫調製物を用いたTh1もしくはTh2関連疾患の予防または治療において役割を果たすかどうかは依然として不明である。
【発明の概要】
【0012】
本発明は、寄生虫調製物がTh1またはTh2関連疾患の治療において制御性T細胞の活性を変化させ得るという発見に基づく。
【0013】
1つの実施形態では、本発明は、制御性T細胞活性を変化させる蠕虫性寄生虫調製物をスクリーニングする方法を提供し、その方法は以下のステップ、すなわち、(a)蠕虫性寄生虫調製物を得るステップ、(b)蠕虫性寄生虫調製物を標的と接触させるステップ、および(c)接触後の標的において制御性T細胞活性のための内部マーカーのレベルを測定するステップを含み、ここで、接触後の内部マーカーのレベルの変化は、制御性T細胞活性を変化させる蠕虫性寄生虫調製物の指標となる。
【0014】
別の実施形態では、本発明は、制御性T細胞活性を変化させる蠕虫性寄生虫調製物をスクリーニングする方法を提供し、その方法は以下のステップ、すなわち、(a)蠕虫性寄生虫調製物を得るステップ、(b)蠕虫性寄生虫調製物を標的と接触させるステップ、および(c)接触後の標的において制御性T細胞のための細胞表面マーカーのレベルを測定するステップを含み、ここで、接触後の細胞表面マーカーのレベルの変化は、制御性T細胞活性を変化させる蠕虫性寄生虫調製物の指標となる。
【0015】
別の実施形態では、本発明は、制御性T細胞活性を変化させる蠕虫性寄生虫調製物を動物に投与することにより、Th1またはTh2関連疾患を有する動物を治療する方法を提供する。
【0016】
別の実施形態では、本発明は、動物における自己免疫疾患またはアレルギー疾患に対する蠕虫性寄生虫調製物の治療効果を測定する方法を提供し、その方法は、(a)蠕虫性寄生虫調製物もしくはその画分を含む組成物を動物に投与すること、および(b)投与後の動物において制御性T細胞活性のレベルを測定することを含み、ここで、投与後の制御性T細胞活性のレベルの増加は、蠕虫性寄生虫調製物の治療効果の指標となる。
【0017】
好ましくは、治療される疾患は、炎症性腸疾患、関節リウマチ、狼瘡、若年性インスリン依存性糖尿病(1型)、サルコイドーシス、多発性硬化症、喘息およびアレルギー性鼻炎からなる群より選択されるものの1つである。
【0018】
制御性T細胞のマーカーは、内部マーカー、細胞表面マーカー、または分泌マーカーでありうる。
【0019】
好ましくは、内部マーカーは、Scurfin、Smad7、Gata3、Tbet(Tbx21)である。
【0020】
また好ましくは、細胞表面マーカーは、CD4、CD45RBlo、CD45Rc、細胞傷害性Tリンパ球関連抗原4(CTLA-4)、CD25、CD103、CD62L、αEβインテグリン、潜伏関連ペプチド(LAP)またはグルココルチコイド誘導性TNF受容体ファミリー関連タンパク質(GITR)、実験的アレルギー性脳炎(EAE)、ケモカイン受容体CCR5、TI-ST2からなる群より選択される。
【0021】
また好ましくは、分泌マーカーは、IL-5、IL-10またはTGFβである。
【図面の簡単な説明】
【0022】
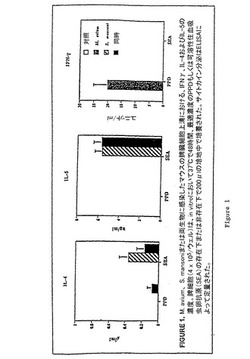
【図1】図1は、本発明の1つの実施形態に従ってM. avium、 S. mansoniまたは両生物に感染したマウスの脾臓細胞上清において測定された、IFNγ、IL-4およびIL-5の濃度を示す。脾細胞(4 x 105/ウェル)は、in vitroにおいて37℃で48時間、最適濃度のPPDもしくはSEAの存在下または非存在下で200μlの培地中で培養された。サイトカイン分泌はELISAによって定量された。
【図2】図2は、本発明の1つの実施形態に従ってM. avium、 S. mansoniまたは両生物に感染したマウスの肉芽腫細胞上清におけるIFNγおよびIL-4の濃度を示す。200μlの培地中の肉芽腫細胞(4 x 105/ウェル)は、in vitroにおいて37℃で48時間、最適濃度のPPDもしくはSEAの存在下または非存在下で培養された。サイトカインはELISAによって定量された。
【図3】図3は、本発明の1つの実施形態に従ってM. avium、 S. mansoniまたは両方(同時)に感染したマウスにおいて測定された、血清IgG1、IgEおよびIgG2aレベルを示す。免疫グロブリン濃度はELISAによって測定された。
【図4】図4は、IL-4処理が、本発明の1つの実施形態に従った慢性H. polygyrus感染のマウスを治療できることを示す。マウスは、屠殺の12日前に開始するIL-4複合体の3回の注射を受けた。データは多重測定の平均値+/-SEである。
【図5】図5のデータは、本発明の1つの実施形態に従った>4 WTマウス/群を解析した3回の個別の実験からの平均炎症スコア±SDを示す。
【図6】本発明の1つの実施形態に従って、IBDのないWTマウスをH. polygyrusに感染させた。対照は偽投与を受けた。TIからLPMCを単離し、in vitroにおいて48時間、抗CD3/抗CD28刺激の存在下または非存在下で培養した。上清中のIFNγはELISAを用いて測定された。データは2回の独立実験からの6回の測定の平均値±SEである。
【図7】本発明の1つの実施形態に従って、WTマウスを図2でのように処理した。単離したLPMCをin vitroにおいて48時間、CpGオリゴとともに培養し、IL12産生を促進した。IL12はELISAを用いて測定された。データは2回の独立実験からの6回の測定の平均値±SEである。
【図8】本発明の1つの実施形態に従って、IBDのないWTマウスをH. polygyrusに感染させた。対照は偽投与を受けた。2週間後図2でのようにLPMCを単離し、培養した。データは2回の独立実験からの6回の測定の平均値±SEである。
【図9】本発明の1つの実施形態に従って、WTマウスをH. polygyrusに感染させた。LPMCを単離し、in vitroにおいて48時間、抗CD3/抗CD28 +/- αIL10R mAbとともに培養した。上清中のIFNγはELISAを用いて測定された。データは3回の独立実験の平均値±SEである。
【図10】本発明の1つの実施形態に従って、IBDのないWTマウスをH. polygyrusに感染させた。対照は偽投与を受けた。2週間後図2でのようにLPMCを単離し、培養した。データは2回の独立実験からの6回の測定の平均値±SEである。
【図11】本発明の1つの実施形態に従って、IBDのないWTマウスをH. polygyrusに感染させた。対照は偽投与を受けた。2週間後図2でのようにLPMCを単離し、培養した。データは2回の独立実験からの6回の測定の平均値±SEである。
【図12】本発明の1つの実施形態に従って、IBDのないWTマウスをH. polygyrusに感染させた。対照は偽投与を受けた。2週間後図2でのようにLPMCを単離し、培養した。LPMCをTIから単離し、in vitroにおいて48時間、LPS刺激の存在下または非存在下で培養した。データは3回の独立実験からの9回の測定の平均値±SEである。
【図13】本発明の1つの実施形態に従って、分散させた腸管LPMCから磁気ビーズを用いてT細胞を単離した。T細胞濃縮(T cells)画分およびT細胞除去(non T)画分を、上清中のIFNγをアッセイする前に、in vitroにおいて48時間、抗CD3/抗CD28刺激の存在下または非存在下で培養した。データは2回の独立実験からの6回の測定の平均値±SEである。
【図14】本発明の1つの実施形態に従って、WT非感染マウスに、H. polygyrusに感染したマウスから2 x 107 のMLN細胞を与えた。1週間後、これらのレシピエントからLPMCを単離し、上清中のIFNγをアッセイする前に、48時間、抗CD3/抗CD28刺激の存在下または非存在下で培養した。データは2回の独立実験からの6回の測定の平均値±SEである。
【図15】本発明の1つの実施形態に従って、GFP WTマウスをH. polygyrusに感染させた。2週間後、これらの蠕虫馴化GFPマウス由来のMLN細胞を正常なC57BL/6マウスにI. P.注射によって移植した。7日後、固有層を分散させ、蛍光顕微鏡下でGFP+ T細胞について検査した。A)GFP+ LP T細胞。B)光学顕微鏡下での同一視野。
【図16】本発明の1つの実施形態に従って、IL10-/-動物に5週齢からピロキシカムを含む飼料を与えた。処理の2週間後、ピロキシカムを止め、2週間後に大腸炎を評価した。週齢を適合させたIL10-/-対照にはピロキシカムを与えなかった(対照)。大腸炎は、組織切片において0〜4点制を用いて盲検の計測者によってスコアされた。A)対照IL10-/-マウスの大腸。B)ピロキシカム処理後の週齢を適合させたIL10-/-マウスの大腸。C)大腸固有層のピロキシカム後のCD4+ T細胞による浸潤(H&E 10X, IHC 20X)。グラフデータは、各5〜6マウス/群の5回の個別の実験からの平均値である。
【図17】本発明の1つの実施形態に従って、パネルA、BおよびCは、H. polygyrusを受けていなかったピロキシカム処理マウスにおける典型的な大腸の炎症を示す。D、EおよびFは、H. polygyrusを受けた2週間後の大腸炎の改善を示す(すべてH&E, 4X)。大腸炎は0〜4点制でスコアされた。データは2回の個別の実験において研究された11動物の平均値±SEである。
【図18】本発明の1つの実施形態に従って、大腸炎のIL10-/-マウスは、図12に記載されるようにH. polygyrusまたは偽投与を受けた。2週間後、LPMCを単離し、in vitroにおいて48時間、抗CD3/抗CD28刺激(IFNγ)の存在下もしくは非存在下で、またはCpGオリゴ(IL12)の存在下で培養した。データは3回の独立実験からの8〜9回の測定の平均値±SEである。
【図19】本発明の1つの実施形態に従って、大腸炎のIL10-/-マウスを図13でのように処理した。データは3回の独立実験からの9回の測定の平均値±SEである。
【図20】本発明の1つの実施形態に従って、A)H. polygyrusまたは偽(対照)投与を受けた2週間後のIL10-/-マウスから単離したMLN細胞を、i. p. 注射によってピロキシカム処理マウスに移植した(20 x 106)。移植2週間後、大腸炎を図12でのように評価した。B)対照マウスまたは感染マウスから単離したMLN T細胞を大腸炎のマウスに移植した(5 x 106)。データは2回の個別の実験における9マウス/群からの平均値±SEである。
【図21】本発明の1つの実施形態に従って、偽投与またはH. polygyrus投与の2週間後、2週間の偽処理またはピロキシカム処理を行ったIL10-/-マウスから単離したMLN細胞から、mRNAを抽出した。Foxp3のリアルタイムPCRはHPRT mRNAで標準化された(方法)。注記:発現が高ければ高いほど、閾値に達するためにより少ないPCRサイクルを必要とする。データは各4マウス/群を用いた3回の独立実験からの平均値±SEである。
【図22】本発明の1つの実施形態に従って、偽投与またはH. polygyrus投与の2週間後、IL10-/-マウスのMLN細胞からmRNAを抽出した。発現が低ければ低いほど、閾値に達するためにより多くのPCRサイクルを必要とする。データは各4マウス/群を用いた3回の独立実験からの平均値±SEである。
【図23】図23は、本発明の1つの実施形態に従った抗原調製方法の概略図である。
【発明を実施するための形態】
【0023】
<発明の詳細な説明>
本発明は制御性T細胞活性を変化させる寄生虫調製物をスクリーニングする方法を含む。
【0024】
本明細書において用いられる場合、「蠕虫性寄生虫調製物」という用語は、寄生虫全体、寄生虫抽出物、寄生虫卵子、寄生虫卵子抽出物、寄生虫卵、寄生虫卵抽出物、寄生虫幼虫、寄生虫幼虫抽出物、寄生虫セルカリアおよび寄生虫セルカリア抽出物の任意の1つを含むが、それらに限定されない。「寄生虫調製物」はまた、寄生虫およびその抽出物に由来する単離されたタンパク質、ポリヌクレオチド、糖質または脂質でありうる。
【0025】
本明細書において用いられる場合、「特定病原体を含まない」という用語は、その動物が標的動物またはヒトにおいて疾患の原因となり得る特定の病原微生物を含まないことが知られている場合に、本発明における使用のために飼育された動物に対して適用された。病原体を含まない動物を飼育する方法は当技術分野において知られており、例えば、http://www.ctsa.org/upload/publication/CTSA_116631681202959092495.pdfで入手可能なBrownら、A Bibliography on the Culture and Maintenance Specific Pathogen-Free Organisms(参照により本明細書に組み入れられる)に従った参考文献を参照せよ。Brownらは、異なる家畜および実験動物をSPF環境で飼育するための参考文献、ならびに建築設計および管理における手順および必要条件を提供する。また、SPFの手順およびいくつかの懸念される潜在的なヒトウイルス性および細菌性病原体のリストについては、M. Michael Swindle(J. Invest. Surg., 9: 267-271,1996、参照により本明細書に組み入れられる)を参照せよ。
【0026】
本明細書において用いられる場合、「制御性T細胞」という用語は、ナイーブT細胞と比較して、少なくとも2倍に増加した(例えば、3倍、4倍、5倍、6倍、8倍、10倍もしくはそれ以上の)IL-10および/またはTGFβを分泌するリンパ球集団を指す。IL-10またはTGFβ分泌の測定は当技術分野において知られている。例えば、それは、細胞をin vitroにおいて24もしくは48(時間)、抗CD3のようなT細胞刺激物質の存在下または非存在下で培養し、その後、培養上清をこれらのサイトカインについてサイトカイン特異的ELISAを用いてアッセイすることにより測定されうる。加えて、本発明の制御性T細胞はまた、他の種類のT細胞(例えば、ナイーブT細胞)と比較して、高レベルのFoxP3転写産物を特徴とする。「高レベルのFoxP3転写産物」とは、他の種類のT細胞と比較して少なくとも4倍に増加したレベルを指す。FoxP3は、(例えば、Hori, S., T. Nomura,およびS. Sakaguchi. 2003. Control of regulatory T cell development by the transcription factor Foxp3. Science. 299: 1057-1061に記載されるような、PCRプライマーCCCAGGAAAGACAGCAACCTT、TTCTCACAACCAGGCCACTTG(配列番号1)、および標識プローブ6FAM-ATCCTACCCACTGCTGGCAAATGGAGTC-TAMRA(配列番号2)を用いた)リアルタイムPCRまたは定量PCRの使用によって検出可能である。値は、ハウスキーピング遺伝子であるHPRT発現に対して標準化される。あるいは、FoxP3タンパク質産物であるScurfinは、例えば、ヤギ抗FoxP 3(FoxP3)ポリクローナル抗体(カタログ番号ab2481, Novus Biologicals, Littleton, CO)を用いて、当技術分野において知られているようなウェスタンブロッティング解析によって検出され得る。状況に応じて、制御性T細胞はまた、他の種類のT細胞(例えば、ナイーブT細胞)と比較してずっと少ない、すなわち、少なくとも2倍、好ましくは3倍、4倍、5倍、6倍、7倍、8倍、10倍またはそれ以下のIFNγを産生しうる。また状況に応じて、制御性T細胞はまた、IL 10および/またはTGFβを発現するがIFNγをほとんどもしくはまったく発現しないT細胞を検出するための、細胞質内流量解析の使用によっても検出され得る。本明細書の下記に記載されるような更なる任意のマーカーもまた、制御性T細胞または制御性T細胞の活性の検出のために使用されうる。
【0027】
本明細書において用いられる場合、「ナイーブT細胞」という用語は、骨髄において免疫系の新しい細胞の産生から生じるT細胞を指す。ナイーブT細胞は、以前に免疫系が処理したことがない抗原を含む新たに遭遇した病原体に応答する。ナイーブT細胞は、当技術分野において既知の方法によって同定されうる(概説として、例えば、Toughら、1999, Immunol Rev. 170: 39-47; Itanoら、2003, Nat Immunol. 4(8) : 733-9; Berardら、2002, Immunology. 106 (2):127-38参照)。
【0028】
本明細書において用いられる場合、「制御性T細胞活性を変化させる寄生虫調製物」という用語は、寄生虫調製物と接触していない標的における制御性T細胞活性と比較して、標的との接触で、標的における制御性T細胞の活性を少なくとも40%、例えば、50%、80%、100%、2 倍、4倍、6倍、8倍、10倍、またはそれ以上にまで変化させる寄生虫調製物を指す。制御性T細胞の活性は、制御性T細胞の内部マーカー(例えば、FoxP3 mRNAもしくはそのタンパク質産物Scurfin、Smad7、Gata3、またはTbet(Tbx21)などの転写因子)、あるいは制御性T細胞の表面マーカー(例えば、CD4、CD45RBlo、CD45Rc、細胞傷害性Tリンパ球関連抗原4(CTLA-4)、Ox40、4-1BB、CD25、CD103、CD62L、αEβインテグリン、潜伏関連ペプチド(LAP)またはグルココルチコイド誘導性TNF受容体ファミリー関連タンパク質(GITR)、実験的アレルギー性脳炎(EAE)、ケモカイン受容体CCR5、TI-ST2)、あるいは分泌マーカー(例えば、IL4、IL13、IL-5、IL-10、TGFβ)のレベルを観察することによって測定されうる。制御性T細胞活性の増加は、制御性T細胞のマーカーのレベルにおける少なくとも40%、例えば、50%、80%、100%、2 倍、4倍、6倍、8倍、10倍、またはそれ以上までの増加(例えば、FoxP3、Ox40、4-1BB、CD4、CTLA-4、CD25、CD103、CD62L、αEβインテグリン、LAP、GITR、EAE、CCR5、TI-ST2、IL-10、TGFβ)または減少(例えば、D45Rc)によって示され、当技術分野において既知の方法に従って、本明細書に記載されるように測定されうる。
【0029】
好ましくは、制御性T細胞活性を変化させる寄生虫調製物は、本明細書の上記に記載される2つ以上のマーカーのレベルを変化させる。
【0030】
本明細書において用いられる場合、「制御性T細胞マーカーのレベル」という用語は、例えば、マイクログラムまたはモル濃度の量で測定される、標的における特定の制御性T細胞マーカーの量を指す。通常、制御性T細胞マーカーはタンパク質であり、その量はタンパク質定量のために当技術分野において既知の任意の方法、例えば、ELISA、ウェスタンブロット、免疫沈降、ラジオイムノアッセイ、またはFACS解析(例えば、Innisら、(1990) Academic Press, Inc.; Molecular Cloning, A Laboratory Manual (第二版、Sambrook,ら(1989);およびCurrent Protocols in Molecular Biology (1997, Ausubelら、John Weley & Sons, Inc.)によって測定されうる。タンパク質マーカーのレベルはまた、当技術分野において既知の方法に従って、例えば、ノーザンブロット、定量RT-PCR、マイクロアレイ解析(例えば、Innisら、(1990) Academic Press, Inc.; Molecular Cloning, A Laboratory Manual (第二版、Sambrook,ら(1989);およびCurrent Protocols in Molecular Biology (1997, Ausubelら、John Weley & Sons, Inc.)により、そのmRNAレベルでも測定されうる。
【0031】
本明細書において用いられる場合、「標的」という用語は、in vitroでの系(例えば、培養組織もしくは細胞、転写/翻訳抽出物)またはin vivoでの系(例えば、動物)を指す。
【0032】
好ましくは、標的は、ヒト細胞を含む動物細胞を含んでいるin vivoでの系である。より好ましくは、標的は動物である。なお好ましくは、標的は哺乳動物である。更により好ましくは、標的はヒトである。
【0033】
本発明はまた、動物における疾患を予防または治療するために十分な量の蠕虫性寄生虫調製物を投与することを含んでいる、動物における免疫応答の変化によって起こる疾患を予防または治療する方法を含む。
【0034】
本明細書において用いられる場合、「免疫応答の変化によって起こる疾患」という用語は、動物(例えば、ヒト)が、疾患を持たない動物と比較して、その免疫応答の違いのために発症する疾患を指す。例えば、疾患動物は、正常な疾患を持たない動物における同一抗原への応答と比較して、異常な(例えば、過剰なまたは不十分な)抗原(例えば、自己抗原または非自己抗原)への免疫応答を有しうる。本発明の「免疫応答の変化によって起こる疾患」は、本明細書に記載されるようなTh1関連疾患またはTh2関連疾患を含むが、それらに限定されない。
【0035】
本明細書において用いられる場合、「Th1関連疾患」という用語は、Th1細胞が疾患過程を支持する、疾患過程の原因となる、もしくは疾患過程を媒介する、またはTh1細胞が疾患の症状の治癒もしくは軽減に関与する疾患を指し、それはTh1活性の向上または低下によってもたらされうる。「向上した」とは、疾患を持たない別の動物と比較して、罹患動物が、そのTh1活性の増加(例えば、少なくとも2倍、あるいは5倍、6倍、8倍、10倍、またはそれ以上)を有することを意味する。Th1活性の向上は、分泌されるサイトカイン(例えば、IL-2、IFN-γ、TNFα、IgG2a、IL-12、IL-18、IL-23)のレベルの増加、または分泌されるサイトカイン(例えば、IL-4、IL-13)のレベルの減少によって、当技術分野において既知の方法に従って測定されうる。「低下した」とは、疾患を持たない別の動物と比較して、罹患動物が、そのTh1活性の減少(例えば、少なくとも50%低い、または2倍、あるいは5倍、6倍、8倍、10倍、またはそれ以下)を有することを意味する。Th1活性の低下は、分泌されるサイトカイン(例えば、IFN-γ、TNFα、IgG2a)のレベルの減少、または分泌されるサイトカイン(例えば、IL-4、IL-13)のレベルの増加によって、当技術分野において既知の方法に従い、ならびに本明細書および出願番号第09/209,732号および第09/362,598号の米国特許出願(それぞれの全体が参照により組み入れられる)に記載されるように測定されうる。
【0036】
本明細書において用いられる場合、「低下した」という用語は「減少した」という用語と同義的に使用され、「増加した」という用語は「向上した」という用語と同義的に使用される。
【0037】
本明細書において用いられる場合、「Th2関連疾患」という用語は、Th2細胞が疾患過程を支持する、疾患過程の原因となる、もしくは疾患過程を媒介する、またはTh2細胞が疾患の症状の治癒もしくは軽減に関与する任意の疾患を指し、それはTh2活性の向上または低下によってもたらされうる。「向上した」とは、疾患を持たない別の動物と比較して、罹患動物が、そのTh2活性の増加(例えば、少なくとも2倍、あるいは5倍、6倍、8倍、10倍、またはそれ以上)を有することを意味する。Th2活性の向上は、分泌されるサイトカインおよび抗体(例えば、IL-4、IL-5、IgEおよびIgG1)のレベルの増加によって、当技術分野において既知の方法に従って測定されうる。「低下した」とは、疾患を持たない別の動物と比較して、罹患動物が、そのTh2応答の減少(例えば、少なくとも50%、2倍、あるいは5倍、6倍、8倍、10倍、またはそれ以下)を有することを意味する。Th2活性の低下は、分泌されるサイトカインおよび抗体(例えば、IL-4、IL-5、IgEおよびIgG1)のレベルの減少によって、当技術分野において既知の方法に従い、ならびに本明細書および出願番号第09/209,732号および第09/362,598号の米国特許出願(それぞれの全体が参照により組み入れられる)に記載されるように測定されうる。
【0038】
本明細書において用いられる場合、「治療効果」という用語は、寄生虫調製物を用いた疾患の治療の有効性を指す。「治療効果」は通常、動物が寄生虫調製物によって治療されたまたは治療されている、特定の疾患に対する臨床反応によって測定される。
【0039】
<本発明に有用な蠕虫性寄生虫>
有用な蠕虫性寄生虫は、2つの群を含むがそれらに限定されない。第一群は本来ヒトに感染する蠕虫性寄生虫であり、第二群は動物に感染するがヒトを保護しうる蠕虫性寄生虫である。
【0040】
第一群では、蠕虫性寄生虫は、複雑な生活環および発生を有する精巧な多細胞寄生虫である。線虫(体節を持たない線形動物)および扁形動物(flat worms)はヒトの腸に感染する蠕虫の2つの群である。本発明に従って、本来ヒトまたは動物に感染する多数の蠕虫性寄生虫のうちの任意の1つが、意図した結果を提供するであろう。
【0041】
ヒトの消化管にしばしば生息する線虫は、Ascaris lumbricoides、Enterobius vermicularis(蟯虫)、Trichuris trichiura(鞭虫)、Ancylostoma duodenale およびNecator americanus(鉤虫)、ならびにStrongyloides stercoralisである。Trichinella spiralisは小腸に短期間寄生する。
【0042】
扁形動物は吸虫および条虫を含む。ヒトの腸に存在する最も一般的な成体の吸虫は、Fasciolopsis、EchinostomaおよびHeterophyesの種である。胆管系で生活するものは、Clonorchis sinensis、Opisthorchis viverriniおよびfelineus、ならびにFasciola hepaticaを含む。Schistosomaは静脈系に生息するが、いくつかの種は腸壁を介した卵の通過によって慢性的に消化管に影響を及ぼす。一般的にヒトに感染する成体の条虫は、Diphyllobothriumの種(広節裂頭条虫)、Taenia saginata(無鉤条虫)、Taenia solium(有鉤条虫)およびHymenolepsis nana(小形条虫)である。
【0043】
対象となる他の蠕虫は、寄生糸状虫および肺吸虫を含む。これらは消化管段階を持たないが、強力なTh2型応答を活性化する。
【0044】
本発明において利用され得る蠕虫性寄生虫の第二の一般的な群は、動物に感染するが、免疫性疾患に対するヒトの防御に影響を及ぼしうる蠕虫を含む。これらは、Trichuris muris(マウス鞭虫)、Trichinella spiralis、Nippostrongylus brasiliensis、Heligmonsomoides polygyrusおよびHymenolepsis nanaを含み、それらはすべてマウスに感染する腸管寄生蠕虫である。加えて、Angiostrongylusはラットの蠕虫である。Trichuris suisおよびAscaris suumは、ヒトに感染し得るブタの蠕虫である。Trichuris vulpis、Toxocaraの種、Gnathostoma、およびAncylostomaは、ヒトにも感染し得るイヌまたはネコの蠕虫である。AnisakisおよびPseudoterranovaは、ヒトに感染し得る海洋哺乳動物の線虫である。鳥類の住血吸虫は一過性にヒトに感染し得る。このような住血吸虫は、S. douthitti、Trichobilharzia ocellata、T. stagnicolae、T. physellae、およびGigantobilharzia huronensisを含む。
【0045】
蠕虫調製物は、本来ヒトに感染する蠕虫、および動物に感染するが免疫応答の変化によって起こる疾患からヒトまたは動物を保護しうる蠕虫からなる群より選択されうる。
【0046】
本発明のいくつかの実施形態では、蠕虫性寄生虫は線虫であり、Ascaris lumbricoides、Enterobius vermicularis、Trichuris trichiura、Ancylostoma duodenaleおよびNecator americanus、Strongyloides stercoralisおよびTrichinella spiralisなどの群より選択されうる。
【0047】
本発明の他の実施形態では、蠕虫性寄生虫は扁形動物であり、Fasciolopsis、EchinostomaおよびHeterophyesの種、Clonorchis sinensis、Opisthorchis viverrini、Opisthorchis felineus、Fasciola hepatica、Schistosomaの種、Diphyllobothriumの種、Taenia saginata、Taenia soliumおよびHymenolepsis nanaなどの吸虫ならびに条虫からなる群より選択されうる。
【0048】
他の実施形態では、蠕虫性寄生虫は、寄生糸状虫および肺吸虫からなる群より選択される。
【0049】
好ましい実施形態では、蠕虫性寄生虫は、Trichuris muris、Trichinella spiralis、Nippostrongylus prasiliensis、Heligmonsomoides polygyrus、Hymenolepsis nanan、Angiostrongylusの種、Trichuris suis、Ascaris suum、Trichuris vulpis、Toxocaraの種、Gnathostomaの種、Ancylostomaの種、Anisakisの種およびPseudoterranovaの種からなる群より選択される。
【0050】
寄生虫の産生および調製のための準備用動物は、特定病原体を含まない(SPF)(例えば、特定のヒト病原体を含まない)環境において飼育されることが好ましい。
【0051】
本発明によって治療可能な疾患
本発明によって治療可能な疾患の例は、Th1またはTh2に関連した癌を含むTh1関連疾患およびTh2関連疾患を含むが、それらに限定されない。
【0052】
Th1関連疾患
Th1関連疾患は、以下の疾患群、すなわち、感染性疾患、自己免疫疾患、遅延型過敏症および癌を含む。
【0053】
感染性疾患の群は、寄生虫およびHIVのようなウイルスに起因する疾患を含む。
【0054】
自己免疫疾患の群は、脳脊髄障害性、脱髄性および他の自己免疫疾患を含む。
【0055】
脳脊髄障害性疾患の例は、多発性硬化症(MS)、散在性硬化症(disseminated sclerosis)、巣状硬化症、島状硬化症(insular sclerosis)、脊髄癆(後硬化症)、MSの動物モデルである急性および慢性実験的アレルギー性(または自己免疫性)脳脊髄炎(EAE)、ギラン・バレー症候群、実験的アレルギー性神経炎(ギラン・バレー症候群の動物モデル)、急性散在性脳脊髄炎、(良性および流行性)筋痛性脳脊髄炎、ウイルス性脳脊髄炎、肉芽腫性脳脊髄炎等を含むが、それらに限定されない。イヌジステンパー、ネコジステンパー、(東部、ベネズエラ、および西部)ウマ脳脊髄炎、トリ脳脊髄炎、ブタ脳脊髄炎、ウシ脳脊髄炎、マウス脳脊髄炎等の動物疾患もまた含まれるが、それらに限定されない。
【0056】
脱髄疾患の例は、多発性硬化症(MS)、散在性硬化症(DS)、急性散在性脳脊髄炎、進行性多病巣性白質脳障害(PML)、および亜急性硬化性全脳炎(SSPE)を含むが、それらに限定されない。
【0057】
他の自己免疫疾患の例は、多発性硬化症(MS)、結節性多発性動脈炎、喘息、過敏性肺臓炎、間質性肺炎、サルコイドーシス、特発性肺線維症、クローン病または潰瘍性大腸炎またはウィップル病と関連した間質性肺炎、ヴェーゲナー肉芽腫症または過敏性血管炎と関連した間質性肺炎、
血管炎症候群、ヘノッホ・シェーンライン紫斑病、グッドパスチャー症候群、ヴェーゲナー肉芽腫症、
急性糸球体腎炎におけるような抗体媒介性の糸球体症、全身性紅斑性狼瘡(SLE)に関連した腎炎、ヴェーゲナー肉芽腫症およびグッドパスチャー症候群および混合性結合組織病などの他の全身性疾患に関連した腎炎、慢性間質性腎炎、慢性糸球体腎炎、などの腎疾患
クローン病、潰瘍性大腸炎、セリアック病、ウィップル病、コラーゲン蓄積大腸炎、好酸球性大腸炎、リンパ球性大腸炎、などの胃腸疾患(例えばIBD)、
自己免疫性肝炎、アルコール性肝炎、門脈周囲の線維化、原発性胆汁性肝硬変、硬化性胆管炎などの肝胆汁性疾患、
乾癬、アトピー性皮膚炎、湿疹、アレルギー性皮膚疾患、全身性進行性硬化症(強皮症)、剥脱性皮膚炎、尋常性天疱瘡などの皮膚疾患、
関節リウマチ(RA)、強直性脊椎炎、乾癬または炎症性腸疾患に関連した関節炎などの関節疾患、
重症筋無力症(MG)、多発性筋炎などの筋骨格疾患、
インスリン依存性糖尿病(IDDM)、自己免疫性甲状腺炎(橋本病)、甲状腺中毒症、甲状腺機能亢進症(グレーブス病)などの内分泌疾患、
自己免疫性貧血、自己免疫性血小板減少症、自己免疫性再生不良性貧血などの造血器系疾患、
心筋症、血管炎、全身性紅斑性狼瘡、結節性多発動脈炎、関節リウマチ、強皮症、サルコイドーシスのような全身性疾患に関連した循環器疾患などの循環器疾患を含む。
【0058】
自己免疫疾患の注目すべき特徴は、それらの家族集積性であり、特定の遺伝子、具体的にはクラスIおよびクラスII主要組織適合複合体(MHC)の遺伝子の発現と関連する。例えば、MS患者の大部分はHLA-DR2ハプロタイプを有する(Beall S S, Concannon P, Charmley P,ら、J. Neuroimmunol., v 21, p 59-66, 1989)。感受性遺伝子型を有するすべての患者が自己免疫疾患を発症するわけではないので、環境因子もまた重要な役割を果たすと考えられる。例えば、MSは温帯気候地域に住む患者においてより一般的であると思われる(Multiple Sclerosis, Hallpike J F, Adams C W M, Tourtelotte W W, 編、Williams and Wilkins, Baltimore, Md., 1983, p 49-95におけるKurtzke J F)。自己免疫疾患の環境因子はウイルスのような感染物質でありうると長らく推測されていた。いくつかのヒトおよび動物の疾患の病因は、ウイルス感染が原因となり得る。例えば、タイラーマウス脳脊髄炎は、EAEに類似した臨床的徴候および病理学的徴候を有する脱髄疾患である。抗体は自己免疫疾患のいくつかのエフェクター応答に関与するが、ほとんどの場合、引き金となる出来事はB細胞の成熟およびクローン性増殖に必要とされるCD4 T細胞の活性化から始まる。
【0059】
遅延型過敏症の群は、低分子量物質に対する接触過敏症を引き起こす。
【0060】
A. 炎症性腸疾患(CDおよびUC):
疫学データは、クローン病(CD)および潰瘍性大腸炎(UC)への遺伝的感受性を示唆する。工業化社会におけるCDの発生率は、1950年代から1980年代中頃まで増加しており、現在は毎年100,000人に1〜8人である。これは、我々の環境における未知の変化がCDの頻度に影響していることを示唆する。
【0061】
IBDの原因は依然として未決定のままだが、腸管粘膜免疫系の調節異常に起因すると推測される。粘膜における炎症細胞は通常、我々を腸管の内容物から保護する。この非常に効果的な慢性炎症は、組織の損傷を制限するために厳密に制御される。IBDは腸管内の因子への不適切に激しい免疫応答によって生じうる。CDは、IFN-γおよびTNFαを産生する過度に激しいTh1型の炎症であると考えられる。UCの性質はあまり明確に定義されていない。
【0062】
潰瘍性大腸炎(UC)およびクローン病(CD)は、あまり明確に定義されていない環境暴露および、少なくともいくつかの事例では、感受性遺伝子の遺伝的形質の相互作用に起因する複雑な起源の疾患である。IBDの遺伝的素因の証拠として、この症状を有する患者の家族ではIBDの予想される発現率より高いこと、および西洋諸国のユダヤ人集団におけるこの疾患の高い有病率がしばしば挙げられる(Roth MP, Petersen GM, McElree CらGeographic origins of Jewish patients with inflammatory bowel disease. Gastroenterology 1989; 97 (4): 900-4)。しかし、IBDは、同様の民族的起源を有する(Grossman A, Fireman Z, Lilos PらEpidemiology of ulcerative colitis in the Jewish population of central Israel 1970-1980. Hepato-Gastroenterology 1989; 36 (4): 193-7)イスラエルのユダヤ人集団ではそれほど見られない(Fireman Z, Grossman A, Lilos PらEpidemiology of Crohn's disease in the Jewish population of central Israel, 1970-1980. Am J Gastro 1989 ; 84 (3): 255-8)。双生児研究は、少なくともCDについて遺伝的素因の証拠を示す(Halfvarson J, Bodin L, Tysk CらInflammatory bowel disease in a Swedish twin cohort: a long-term follow-up of concordance and clinical characteristics. Gastroenterology 2003; 124 (7): 1767-73.)。細菌の生成物ムラミルジペプチドを感知する細胞内タンパク質である、CARD15/NOD2における遺伝子欠損(Inohara M, Ogura Y, Fontalba AらHost r
ecognition of bacterial muramyl dipeptide mediated through NOD2: implications for Crohn's disease. J Biol Chem 2003; Girardin SE, Boneca IG, Viala JらNod2 is a general sensor of peptidoglycan through muramyl dipeptide (MDP) detection. J Biol Chem 2003)によって、CDにより罹りやすくなる人々もいる。様々な他の遺伝子変化がIBDの危険因子として提唱されている。しかし、遺伝的素因は疾患の発生率の急激な増加を説明しない。
【0063】
例えばElliotらに報告されたような、いくつかの慢性的腸炎の動物モデルがある(The Autoimmune Diseases, 第三版、N. R. RoseおよびI. R. MacKay,編Academic Press, San Diego, CAにおける、Elliottら、1998, Inflammatory Bowel Disease and Celiac Disease.)。重要な進歩は、遺伝子操作による遺伝子の欠失を有するマウスの中にIBDと同様の慢性的腸炎を発症し得るものがあるという最近の発見である(Elsonら、1995, Gastroenterology 109: 1344を参照せよ)。これらは、中でもIL-2、IL-10、MHCクラスIIまたはTCR遺伝子に標的化された欠失を有する突然変異マウスを含む。いくつかのモデルを用いて、Bergら、1996, J. of Clin. Investigation 98:1010, Ludvikssonら、1997, J. of Immunol. 158: 104、およびMombaertsら、1993, Cell 75: 274は、免疫系自体の調節異常が腸管障害を媒介し得ることを示した。これらのモデルのいくつかの粘膜炎症は、多量のIFN-γおよびTNF-αを産生し、Th1型サイトカインの過剰産生が疾患の病因の基礎をなす1つの共通機序であることを示唆している。またTh1回路の遮断は炎症を妨げる。CDはTh1応答である。従って、これらのモデルは、このヒト疾患過程の免疫病理学について直接的な関係を有するかもしれない。
【0064】
B. 関節リウマチ(RA):
RAは持続的な炎症性滑膜炎を特徴とする慢性疾患であり、通常、対称に分布する末梢関節に関わる。この炎症は骨浸食、軟骨損傷および関節破壊を引き起こし得る。それは人口の約1%の疾患である。その有病率は加齢に伴って増加し、女性は男性より高い頻度で罹患する。RAの拡大はCD4+ Th1細胞による免疫を介した事象である。
【0065】
C. インスリン依存性、若年性糖尿病(DM)(1型):
1型 DMは、通常早期成人期に発症し、血糖の増加に応答したインスリン産生の不能に起因する疾患である。この持続的な高血糖および適切なグルコース代謝の不能は、ひいては目、腎臓、心臓および他の器官に損傷を与える代謝障害を引き起こす。非経口的なインスリンの摂取は、部分的にこれらの代謝障害を制御し得る。1型 DMは、インスリンを産生する膵臓ベータ細胞に対する自己免疫性攻撃に起因する。活性化されたマクロファージおよび細胞傷害性T細胞は、膵臓ベータ細胞を取り囲み、破壊する。遺伝的感受性およびあまり明確に定義されていない環境事象が疾患過程の引き金となる。
【0066】
D. 紅斑性狼瘡(LE):
LEは、早期から中期成人期の女性において最も頻度の高い全身性自己免疫疾患である。組織の損傷は自己抗体および過敏な制御性T細胞によって引き起こされる。異常な免疫応答は、病因となる自己抗体および免疫複合体の持続的な産生を可能にする。これが筋骨格系、皮膚、血液、腎臓系および他の系の損傷を引き起こす。異常な免疫応答は、おそらく複数の遺伝的要因および環境要因の相互作用に依存する。
【0067】
E. サルコイドーシス:
サルコイドーシスは原因不明の肺および他の器官の慢性肉芽腫症である。ほとんどの患者は20〜40歳の間である。最も頻繁に見られる症状は息切れである。疾患は、おそらくは限られた数の抗原に対する、過剰なTh1型の細胞性免疫応答に起因する。サルコイドーシスは世界中で発現し、すべての人種を苦しめている。しかし、特定の民族および人種集団の間で、サルコイドーシスの有病率に著しい多様性がある。例えば、この疾患はポーランド、東南アジアおよびインドでは稀である。
【0068】
F. 多発性硬化症(MS):
MSは、局所脱髄および脳の瘢痕化を引き起こす、慢性再発性、多発性の中枢神経系の炎症性疾患である。それは約350,000人のアメリカ人に影響を及ぼすよく見られる疾患であり、早期から中期成人期の間に発症する。MSは、少なくとも部分的にTh1細胞によって媒介される自己免疫疾患である。MSの損傷は、活性化されたT細胞およびマクロファージを含む遅延型過敏反応によって誘導されるものと似ている。それは温帯気候の疾患であり、赤道からの距離とともに有病率が増加する。
【0069】
<Th2関連疾患>
Th2関連疾患は以下の群の疾患、すなわちアレルギー性疾患および癌を含む。
【0070】
遺伝的な素因のある個体は、その個体が暴露される様々な環境要因に由来する抗原に敏感になる(アレルギー体質を持つ)ことがよく知られている。アレルギー反応は、以前に感作された個体が同一のまたは相同のアレルゲンに再暴露された場合に起こる。アレルギー反応は、花粉症、鼻結膜炎、鼻炎および喘息から、例えばハナバチもしくはスズメバチに刺されることまたは虫刺されへの応答による全身性アナフィラキシーおよび死亡に及ぶ。その反応は迅速であり、草、木、雑草、昆虫、(ハウスダスト)ダニ、食物、薬物、化学物質および香料に由来する化合物などの様々なアトピー性アレルゲンによって起こり得る。
【0071】
アレルギー性疾患の群は、花粉症、鼻結膜炎、鼻炎および喘息を含む。
【0072】
アレルギー反応を起こす最も一般的なアレルゲンは、木、草、ハーブ、菌類、ハウスダストダニ、貯蔵庫ダニ、ゴキブリ、ならびに動物の毛、羽、およびふけなどに由来する吸入アレルゲンを含む。木、草およびハーブ由来の重要な花粉アレルゲンは、カバノキ(Betula)、ハンノキ(Alnus)、ハシバミ(Corylus)、シデ(Carpinus)およびオリーブ(Olea)などを含むブナ目、モクセイ目ならびにマツ目の分類目、Lolium、Phleum、Poa、Cynodon、DactylisおよびSecale属のイネ科植物などを含むイネ目、AmbrosiaおよびArtemisia属のハーブなどを含むキク目ならびにイラクサ目に由来するものなどである。菌類由来の重要な吸入アレルゲンは、AlternariaおよびCladosporium属に由来するものなどである。他の重要な吸入アレルゲンは、Dermatophagoides属のハウスダストダニ、Lepidoglyphys destructor属の貯蔵庫ダニに由来するもの、ゴキブリに由来するもの、ならびにネコ、イヌ、ウマ、ウシなどの哺乳動物、およびトリに由来するものである。また、ハナバチ、カリバチ、およびアリを含む膜翅目の分類目に由来するものなどの昆虫に刺されるまたは咬まれることによるアレルギー反応も、一般的に観察される。特異的なアレルゲン成分は当業者に知られており、例えば、ブナ目のBet v 1(B. verrucosa, カバノキ)、Aln g 1(Alnus glutinosa, ハンノキ)、Cor a 1(Corylus avelana, ハシバミ)およびCar b 1(Carpinus betulus, シデ)を含む。他には、最も一般的なものを挙げると、Cry j 1(マツ目)、Amb a 1および2、Art v 1(キク目)、Par j 1(イラクサ目)、Ole e 1(モクセイ目)、Ave e 1、Cyn d 1、Dac g 1、Fes p 1、Hol l 1、Lol p 1および5、Pas n 1、Phi p 1および5、Poa p 1、2および5、Sec c 1および5、ならびにSor h 1(様々な植物花粉)、Alt a 1およびCha h 1(菌類)、Derf 1および2、Der p 1および2(それぞれ、ハウスダストダニ、D. farinaeおよびD. pteronyssinus)、Lep d 1、Bla g 1および2、Per a 1(それぞれ、ゴキブリ、Blatella germanicaおよびPeriplaneta americana)、Fel d 1(ネコ)、Can f 1(イヌ)、Equ c 1、2および3(ウマ)、Apis m 1および2(ミツバチ)、Ves g 1、2および5、Pol a 1、2および5 (すべてのカリバチ)、ならびにSol i 1、2、3および4(ハリアリ)である。
【0073】
A. 喘息
多くの人々において、喘息は、動物のふけ、花粉、またはチリダニおよびゴキブリの老廃物などの、通常空気から吸い込まれる物質に対するアレルギー反応であると考えられる。これらの物質の総称であるアレルゲンとは、アレルギー反応を誘発するすべてのものを指す。ある人々は特定のアレルゲンに反応する遺伝的素因を有する。1998年には、推定1700万人のアメリカ人、すなわち人口の6.4パーセントが喘息に罹っていた。子供は、喘息に罹っているアメリカ人のうち480万人を占めている。動物モデルならびにヒト喘息の病理学における臨床情報の両方から得られた実験情報および臨床情報は、この疾患の病理学においてTh2細胞を示唆する。
【0074】
<Th1およびTh2による癌>
通常、癌細胞は癌細胞によって特異的に発現される抗原に対する免疫応答を引き起こしうる。Th1およびTh2の両方の免疫応答は組織の細胞傷害性除去を引き起こす強力な炎症反応を促進しうるため、Th1またはTh2免疫応答の調節は癌の治療に使用されうる。
【0075】
本発明の組成物によって治療され得る癌は、組織発生学的に、癌腫および腺癌を含む悪性上皮性腫瘍として、ならびに、脂肪肉腫、線維肉腫、軟骨肉腫、骨肉腫、平滑筋肉腫、横紋筋肉腫、神経膠腫、神経芽細胞腫、髄芽腫、悪性黒色腫、悪性髄膜腫、様々な白血病、様々な骨髄増殖性疾患、様々なリンパ腫(ホジキンリンパ腫および非ホジキンリンパ腫)、血管肉腫、カポジ肉腫、リンパ管肉腫、悪性奇形腫、未分化胚細胞腫、精上皮腫、および絨毛癌を含む悪性非上皮性腫瘍として分類され得る。癌腫および腺癌は最も多く(癌による死亡の約90%を占める)、従って、本発明によって治療/予防するための興味深い標的疾患である。最も重要な癌腫および腺癌は、気道(特に気管支)、胸、結腸直腸および胃の癌腫および腺癌である。しかしまた、前立腺、卵巣、リンパ組織および骨髄、子宮、膵臓、食道、膀胱、ならびに腎臓の癌腫および腺癌も多数の死の原因となり、従って興味深い。
【0076】
癌疾患の群は更に、セザリー症候群、皮膚T細胞性リンパ腫、肝臓癌および肺癌を含む。
【0077】
<Th1またはTh2関連疾患における制御性T細胞>
制御性T細胞は、末梢寛容を誘導し、粘膜反応性を制限し得る(McGuirk P, Mills KH. Pathogen-specific regulatory T cells provoke a shift in the Th1/Th2 paradigm in immunity to infectious diseases. Trends Immunol 2002; 23 (9): 450-5)。様々な動物モデルにおいて、いくつかの制御性T細胞表現型が報告されている。制御性T細胞は様々なマーカーを発現し、異なる疾患に関与することが示唆されている(例えば、Field, A. C., L. Caccavelli, M. F. Bloch,およびB. Bellon. 2003. Regulatory CD8+ T cells control neonatal tolerance to a Th2-mediated autoimmunity. Journal of Immunology. 170:2508-2515; von Herrath MG, Harrison LC. Antigen-induced regulatory T cells in autoimmunity. Nat Rev Immunol. 2003 Mar; 3 (3): 223-32; Francois Bach J. Regulatory T cells under scrutiny. Nat Rev Immunol. 2003 Mar; 3 (3): 189-98; Curotto de Lafaille MA, Lafaille JJ. CD4(+) regulatory T cells in autoimmunity and allergy. Curr Opin Immunol. 2002 Dec; 14 (6):771-8; McGuirk P, Mills KH. Pathogen-specific regulatory T cells provoke a shift in the Th1/Th2 paradigm in immunity to infectious diseases. Trends Immunol. 2002 Sep; 23 (9): 450-5; Tung KS, Ag
ersborg SS, Alard P, Garza KM, Lou YH. Regulatory T-cell, endogenous antigen and neonatal environment in the prevention and induction of autoimmune disease. Immunol Rev. 2001 Aug; 182: 135-48; Read S, Powrie F. CD4 (+) regulatory T cells. Curr Opin Immunol. 2001 Dec; 13 (6): 644-9; Yssel H, Lecart S, Pene J. Regulatory T cells and allergic asthma. Microbes Infect. 2001 Sep; 3 (11) : 899-904を参照せよ)。いくつかの系では、それらはCD25(Shevach, E. M. 2002. CD4+ CD25+ suppressor T cells: more questions than answers. Nature Reviews. Immunology. 2:389-400)、CD45RB(Annacker, O.およびF. Powrie. 2002. Homeostasis of intestinal immune regulation. Microbes & Infection. 4: 567-574)、およびCTLA-4(Read, S., V. Malmstrom,およびF. Powrie. 2000. Cytotoxic T lymphocyte-associated antigen 4 plays an essential role in the function of CD25(+) CD4(+) regulatory cells that control intestinal inflammation. J. Exp. Med. 192: 295-302)のような表面分子の差次的発現によって区別される。この細胞表面タンパク質発現のパターンは、それらが感作されたエフェクター状態またはメモリー状態にありうることを示唆する。これらの制御性細胞は、IL10およびTGFβの産生を介してそれらの作用のいくつかを媒介しうる。高レベルのIL10およびTGFβを産生するアネルギー性の制御性T細胞(Tr1)が記載される。Th3と呼ばれる別の細胞は、主としてTGFβの産生を介して実験的自己免疫性脳脊髄炎の誘発を抑制する。また他のものは、可溶性のIL10またはTGFβに依存しないが、代わりにそれらの表面に、TGFβ前駆体ペプチドのアミノ末端ドメインである潜伏関連ペプチドを発現する(Oida T, Zhang X, Goto MらCD4+CD25- T cells that express latency-associated peptide on the surface suppress CD4+CD45RB high-induced colitis by a TGF-beta-dependent mechanism. J Immunol 2003; 170(5):2516-22)。制御性T細胞についての内部細胞マーカーもまた報告されている(Schubert LA, Jeffery E, Zhang Y, Ramsdell F, Ziegler SF, Scurfin (FOXP3) acts as a repressor of transcription and regulates T cell activation. J Biol Chem. 2001 Oct 5;276(40):37672-9)。すべての参考文献は参照により本明細書に組み入れられる。
【0078】
CD4+、CD45high T細胞によって再構成されたRagマウスは、重度の大腸炎を発症し得、それはCD4+、CD45low T細胞の共移植によって回避され得る(Annacker O, Powrie F, Homeostasis of intestinal immune regulation. Microbes & Infection 2002;4(5):567-74)。TGFβおよびIL10は、制御過程においてこれらのサイトカインの役割を示唆している保護のために必要とされる。
【0079】
<本発明の蠕虫性寄生虫調製物>
蠕虫は、種に応じて、宿主の腸管腔、血流または筋肉のような部位に生息する寄生動物(寄生虫)である。これらの生物は世界人口の1/3以上に感染している。蠕虫感染は、温暖な気候で生活する貧弱な公衆衛生にさらされた子供において最も一般的である。これらの生物の感染形は、汚染された土壌、食物または水との接触を介して拡大する。1940年代以前には、米国の多くの子供および大人は蠕虫を保有していた。寄生虫保有は、南部の農村地域および主要都市の貧困集団において特に多く見られた(Elliott DE, Urban JF, Jr., Argo CKらDoes the failure to acquire helminthic parasites predispose to Crohn's disease? FASEB J 2000; 14(12):1848-55)。米国および欧州では、蠕虫感染は徐々に減少している。それらは、発展途上国からの最近の移住者(Salas SD, Heifetz R, Barrett-Connor E. Intestinal parasites in Central American immigrants in the United States. Arch Intern Med 1990; 150(7):1514-6)およびインディアン保留地のような米国の十分なサービスを受けていない地域で生活する経済的に不利な人々(Healy GR, Gleason NN, Bokat RらPrevalence of ascariasis and amebiasis in Cherokee Indian school children. Public Health Rep 1969;84(10):907-14)において見いだされる。蠕虫の有病率は、温暖な気候ならびに、過密状態、貧弱な公衆衛生および、不潔な食糧供給にさらされた人々において最も高い。炎症性腸疾患(IBD)、関節リウマチおよび自己免疫疾患は、これらの同じ地域においては稀である。
【0080】
ヒトの消化管にしばしば生息する線虫は、Ascaris lumbricoides、Enterobius vermicularis(蟯虫)、Trichuris trichiura(鞭虫)、Ancylostoma duodenale およびNecator americanus(鉤虫)、ならびにStrongyloides stercoralisである。Trichinella spiralisは小腸に短期間寄生する。
【0081】
扁形動物は吸虫および条虫を含む。ヒトの腸に存在する最も一般的な成体の吸虫は、Fasciolopsis、EchinostomaおよびHeterophyesの種である。胆管系で生活するものは、Clonorchis sinensis、Opisthorchis viverriniおよびfelineus、ならびにFasciola hepaticaを含む。Schistosomaは静脈系に生息するが、いくつかの種は腸壁を介した卵の通過によって慢性的に消化管に影響を及ぼす。一般的にヒトに感染している成体の条虫は、Diphyllobothriumの種(広節裂頭条虫)、Taenia saginata(無鉤条虫)、Taenia solium(有鉤条虫)およびHymenolepsis nana(小形条虫)である。
【0082】
宿主は、感染形の寄生虫に汚染された土壌、食物または水との接触を介して、様々な種の蠕虫に感染する。子供は、土壌と密に接触し、次善の衛生習慣しかないため、最も高頻度で蠕虫感染を有する。蠕虫は腸内のTh2応答を誘発し、それは寄生虫の排除を引き起こすか、または感染の規模を制限し得る。非工業国に住むほとんどの子供は、これらの寄生虫を有する。多くの種の蠕虫は、消化管、胆道系または腸間膜静脈内で何年も生存し、毎日何千もの卵を産んでいる。従って、幼少期から、これらの寄生虫および/またはそれらの卵子は、何年も腸管粘膜表面を曝す分子を放出して、Th2型炎症を誘発している。
【0083】
A. 生存生物ワクチン:
生存能力のある蠕虫性寄生生物は、成分ワクチンと比較して相対的に長い持続性のために、最も強い粘膜の条件付けを与えうる。生存能力のある生物は、蠕虫に応じて、卵、幼虫、セルカリア、または被嚢幼虫のいずれかの形態で投与され得る。ヒトおよび準備用動物に感染し得る蠕虫が利用されうる。
【0084】
準備用動物は蠕虫による高い開通性を可能にするための操作を必要としうる。このような操作は、グルココルチコイドまたはアザチオプリンのような免疫抑制性の薬剤、抗ヒスタミン剤、抗サイトカイン、または組換えサイトカインのようなTh2作用を妨げる薬剤、および抗コリン作用薬または鎮静剤のような腸運動に影響を及ぼす薬剤による処理を含み得る。動物の飼料は粗繊維含量を減らすように変更されるであろう。動物は、ラット、ブタ、ハムスター、トリまたは他の準備用動物でありうる。
【0085】
準備用動物は、当技術分野において既知の方法に従って、特定病原体を含まない(SPF)(例えば、特定のヒト病原体を含まない)環境において飼育される。それらは、ヒトの細菌性、マイコバクテリア性、およびウイルス性病原体を含まないことを確実にするために検査される。動物をSPF環境で飼育する方法およびその利点は、当技術分野において、例えば、M. Michael Swindle(J. Invest. Surg., 9: 267-271,1996、参照により本明細書に組み入れられる)によって記載される。Swindleもまた、対象となるいくつかの可能性のあるヒトのウイルス性および細菌性病原体を記載する。従って、特定のヒト病原体を含まない環境で飼育された動物に由来する寄生虫調製物は、これらのヒト病原体を含まず、それ自体は任意のSPF環境で飼育された動物から調製された寄生虫調製物とは特許性が異なる。
【0086】
卵: いくつかの腸管寄生蠕虫は生存能力のある卵の摂取によって獲得される。蠕虫はSPF準備用動物、例えば、SPF ブタにおいて維持される。卵を採取するために、動物に粗繊維の少ない特別食を与える。動物に経口下剤を与えて、排便を促進する。便を回収し、酵素的に消化して、卵を遊離させる。卵を液化した便から密度勾配での浮遊、スクリーンろ過、Visserろ過、または遠心水簸によって単離する。卵の保存は使用される蠕虫によって異なる。乾燥に耐性のある蠕虫の卵は、乾燥され、不活性物質と混合され、腸溶カプセルに組み込まれ、冷蔵される。乾燥に感受性の蠕虫の卵は、液体培地中での冷蔵によって、または抗凍結剤の添加および液体窒素での冷凍によって保存される。生存能力のある卵は、洗浄され、送達の場所で、冷却したラクトースを含まないプディングまたは他のベヒクルと混合される。グリセロールベースの抗凍結剤で保存された卵は洗浄を必要としないかもしれない。有効な投与量を決定するために、各ロットの卵の孵化率を検査する。各ロットの卵は、細菌性およびウイルス性病原体がないことを検査される。
【0087】
幼虫: いくつかの蠕虫(鉤虫など)は、それらがヒトに感染できるようになる前に土壌成熟期を必要とする。これらのもの由来の卵は、胚を成熟させるために、または卵が孵化して幼虫形態を呈するために最適な条件下で培養されるであろう。患者は、生存能力のある幼虫の皮下注射または経口摂取によって接種され得る。
【0088】
セルカリア: いくつかの蠕虫は、中間宿主を利用する複雑な生活環を有する。中間宿主は、ヒトに感染できる形態を排出する。セルカリアは、カタツムリのような中間宿主によって排出される吸虫性蠕虫(すなわち吸虫)の形態である。SPF条件で飼育された感染カタツムリからセルカリアを単離する。セルカリアを洗浄する。これらは抗凍結剤の添加および液体窒素での冷凍によって保存されうる。解凍したまたは新鮮なセルカリアは、洗浄され、患者に接種するために皮下注射される。各ロットのサンプルは、病原体がないことについて検査され、および有効な投与量を決定するために検査される。
【0089】
被嚢幼虫: いくつかの蠕虫(例えば条虫)は中間宿主において被嚢幼虫または嚢尾虫を形成する。ヒトへの感染を起こすのは被嚢幼虫形である。被嚢幼虫は、例えば、SPF条件で生育した家畜または魚類または植物のような中間宿主から取り出される。嚢胞は、残存する宿主組織を含まないように洗浄される。嚢胞は、抗凍結剤の添加および液体窒素での冷凍によって保存されうる。嚢胞は、解凍され、または新鮮なものが使用され、洗浄され、送達の場所で、冷却したラクトースを含まないプディングもしくは他のベヒクルと混合され、個体に投与される。各ロットのサンプルは、病原体がないことについて検査され、および有効な投与量を決定するために検査される。
【0090】
B. 非生存成分ワクチン:
蠕虫性寄生虫の非生存成分は、Th1を介した病変を予防するために、免疫応答の十分なTh2条件付けをもたらす。非生存成分は、卵、幼虫または成虫に由来する。
【0091】
生存能力のない無傷の住血吸虫の卵は、強力なTh2応答を引き起こす。卵はSPF条件下で飼育された準備用動物(ハムスターなど)の肝臓から単離される。卵は、本来CokerおよびLichtenberg, 1956, Proceedings of the Soc. For Exp. Biol. & Med. 92: 780によって記載されたものを改変した方法によって単離される。その改変は、インキュベーションのために1.7%生理食塩水の代わりにグルコースを含むリン酸緩衝生理食塩水を使用すること、および自己分解的消化時間の減少を伴う洗浄ステップからなる。これらの変更は生存能力のある卵の単離を向上させる。その方法は以下の通りである。
【0092】
ゴールデンハムスターを1000〜1500匹のセルカリアで感染させる。その感染を成熟させる(6〜7週間)。動物から肝臓を摘出し、5%グルコース、100 U/ml ペニシリンおよび100 mg/ml ストレプトマイシンを含む600 mOsmの滅菌したリン酸緩衝生理食塩水に浸す。肝臓を24時間室温で自己消化させる。肝臓を低速で3分間、冷却したワーリングブレンダーでパルスホモジナイズする。ホモジネートをコラゲナーゼ(2 mg/ml)およびトリプシン(2 mg/ml)とともに32℃で1時間インキュベーションする。ホモジネートを50および80〜100メッシュ篩によってろ過し、組織塊および残渣を除去する。325メッシュ篩を通過させることによって、ろ液から卵を回収する。卵はそのスクリーンを通過しない。卵をスクリーンから50 mlポリプロピレン遠心管に洗い流す。5%グルコースを含む滅菌したリン酸緩衝生理食塩水中での低速(400 x g)遠心分離のくり返しによって、卵を洗浄する。卵はいずれのコラーゲン残渣も含まないはずである。卵の一部を1 ml のセドウィック チェンバー(Sedwick chamber)中で数えて、全卵数を測定する。
【0093】
単離した卵を生理食塩水に懸濁し、抗凍結剤を含まずに液体窒素で急速冷凍する。これによって卵は死滅する。強力なTh2応答を誘導するために、解凍した卵を、皮下、筋肉内もしくは静脈内、またはTh1炎症部位に注射する。他の蠕虫由来の卵もまた利用されうる。
【0094】
寄生虫卵から単離されたタンパク質、脂質、または糖質を用いる成分ワクチンもまた使用されうる。例としては住血吸虫可溶性卵抗原(SEA)がある。住血吸虫卵抗原を調製する方法は、以前にBorosおよびWarren, 1970, J. of Experimental Med. 132: 488によって記載されており、下記に簡潔に示される。
【0095】
洗浄した卵をリン酸緩衝生理食塩水に50,000卵/mlで再懸濁する。これをガラス製組織ホモジナイザーに移す。卵を氷上でホモジナイズする。すべての卵殻が破壊されミラシジウムが破砕されたことを保証するために、一部(5 ml)を顕微鏡観察のために取り出す。ホモジネートを超遠心管に移す。100,000 x gで2時間、4℃で遠心分離する。水溶性画分(SEA)を回収し、タンパク質含量を測定する。SEAを少量ずつ等分して-70℃で保存する。この方法は、最も強力にTh2条件付けを促進する寄生虫卵産物を単離するための、すなわち、最適な有効濃度(100μg SEAまたは10,000卵子/動物)を達成するための改変を必要とするかもしれない。卵または可溶性卵成分は、Th2応答を開始するために、または以前に生存能力のある蠕虫への感染によって開始されたTh2応答を増強するために使用される。卵または卵成分は、病原体および内毒素がないことを確認するために検査される。
【0096】
成分ワクチンはまた、蠕虫性寄生虫の幼虫および成虫からも作製され得る。幼虫または寄生虫は、SPF条件で飼育された準備用動物から単離される。生存能力のない無傷の生物、または蠕虫から単離されたタンパク質、脂質、もしくは糖質を用いるワクチンは、蠕虫の卵について前述されたものと同様の方法で調製および利用される。
【0097】
例えば、Williamsら、1994, Leukocytes of patients with Schistosoma mansoni respond with a Th2 pattern of a cytokine production to mitogen or egg antigens but with a Th0 pattern to worm antigens. J. Infect. Dis. 170: 946; Xu-Amanoら、1993, Helper T cell subsets for immunoglobulin A responses: oral immunization with tetanus toxoid and cholera toxin as adjuvant selectively induces Th2 cells in mucosa associated tissues. J. Exp. Med. 178: 1309; Ausielloら、2000, Cell mediated immunity and antibody responses to Bordetella pertussis antigens in children with a history of pertussis infection and in recipients of an acellular pertussis vaccine. J. infect. Dis., 181:1989に記載されるような、当技術分野において既知の方法に従った、蠕虫性寄生虫の画分または副画分を含むワクチン、ならびに蠕虫性寄生虫に由来する単離されたタンパク質、ポリヌクレオチド、糖質、脂質等を含むワクチンもまた、本発明に含まれる。
【0098】
例えば、画分または副画分は、Thaumaturgoら(2001, Preliminary Analysis of Sm14 in Distinct Factions of Schistosoma mansoni Adult Worm Extract, Mem. Inst. Oswaldo Cruz vol. 96 suppl. Vol. 96, Suppl.: 79-83, その全体が参照により本明細書に組み入れられる)に記載された方法に従って調製されうる。この方法では、S. mansoni寄生虫は、感染45日後にヘパリン添加生理食塩水(0.85% NaCl溶液)を用いた逆行性灌流によって得られ(PellegrinoおよびSiqueira 1956, Tecnica de perfusao para colheita de Schistosoma mansoni em cobaias experimentalmente infectadas. Rev Bras Mal D Trop 8:589-597)、様々な抽出物の調製に用いられた。
【0099】
--成虫由来抽出物(SE)の調製- 寄生虫をPBSで洗浄した。その後、生きている寄生虫を室温(28℃〜30℃)で新しいPBS(リン酸緩衝生理食塩水)中に2〜3時間置いておき、-20℃で冷凍した。解凍後、寄生虫のPBS懸濁液(1 g寄生虫/10 ml PBS)をワイヤーメッシュでろ過し、10,000 gで1時間、4℃で遠心分離した(TendlerおよびScapin 1981, Schistosoma mansoni antigenic extracts obtained by different extraction procedures. Mem Inst Oswaldo Cruz 76: 103-109; Tendlerら1982, Immunogene and protective activity of an extract of Schistosoma mansoni. Mem Inst Oswaldo Cruz 77: 275-283)。SEのタンパク質含量をローリー法(Lowryら1951)によって評価し、1 mg/mlを含むストック バッチ(stock batches)を-20℃で保存した。灌流後直ちに分離した寄生虫を用いて、オスおよびメスの抽出物を同一の方法に従って調製した。
【0100】
成虫由来抽出物の迅速に放出される「画分」(SEi)の調製- SEiの調製はSEの最初のステップに相当した。すなわち、SEについて記載したように灌流した後、生きている寄生虫を室温(28℃〜30℃)で2〜3時間、PBS中でインキュベーションした。その後、成虫をインキュベーション溶液(SEi)からワイヤーメッシュ内にろ過した。
【0101】
SE2の調製- SE初期調製物から残された成虫を、PBS中で1週間(1 g寄生虫/10 ml PBS)再び冷凍保存した(-20℃)。解凍後、PBS懸濁液をワイヤーメッシュでろ過し、10,000 gで1時間、4℃で遠心分離した。
【0102】
寄生虫抗原はまた、Thaumaturgoら(上述)の図1に記載された(図23として再現された)ように抽出され得る。あるいは、寄生虫抗原は、Deelderら(1980. Applicability of different antigen preparations in the enzyme-linked immunosorbent assay for schistosomiasis mansoni. Am. J. Trop. Med. Hyg. 29: 401-410)に記載されるように調製されうる。例えば、抗原は、それぞれの生活環段階の緩衝生理食塩水ホモジネートからの可溶性上清液として調製されるSWAPから調製されうる(Goesら1989, Production and characterization of human monoclonal antibodies against Schistosoma mansoni. Parasite Immunol 11: 695-711)。SWAPは、以前に記載されたように(HirschおよびGoes 1996, Characterization of fractionated Schistosoma mansoni soluble adult worm antigens that elicit human cell proliferation and granuloma formation in vitro. Parasitology 112: 529-535)、FPLC(高速タンパク質液体クロマトグラフィー)において陰イオン交換クロマトグラフィーによって分画された。簡潔には、20 mM Tris-HCl, pH 9.6を用いて、0、100、280、450、600および750 mMでの勾配保留間隔によって中断される最大1 M NaClまでの多段階の漸増勾配で、タンパク質を溶出した。流出画分を凍結乾燥によって濃縮した。濃縮した物質を0.15 Mリン酸緩衝生理食塩水(PBS)、pH 7.4で透析し、ろ過滅菌し、-70℃で保存した。タンパク質含量をブラッドフォードマイクロアッセイに従って測定した(Bradford 1976, A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding. Analyt Biochem 72: 248-254,その全体が参照により本明細書に組み入れられる)。10% SDS-PAGE(ドデシル硫酸ナトリウムポリアクリルアミドゲル電気泳動)により還元条件下で分離された(Laemmli 1970, Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227: 680-685,その全体が参照により本明細書に組み入れられる)6画分の解析は、多数のタンパク質バンドを示し、画分IIIは高分子量(97および160 KDa)、中間分子量(52および56 KDa)ならびに低分子量(28および36 KDa)のタンパク質を含んでいた。この画分はPIIIと呼ばれ、様々な免疫アッセイに用いられた。
【0103】
脂質もまた、当技術分野において、例えば、van der Kleijらに記載されるように調製されうる(1999, Recognition of Schistosome Glycolipids by Immunoglobulin E: Possible Role in Immunity Infection and Immunity, 67: 5946-5950,その全体が参照により本明細書に組み入れられる)。
【0104】
1つの実施形態では、S. mansoni成虫(12 g [湿重量])および卵(1.6 g [湿重量])の脂質が、BlighおよびDyerに記載された方法によって抽出された(1959. A rapid method of total lipid extraction and purification. Can. J. Biochem. Physiol. 37: 911-917)。有機相をロータリーエバポレーターによって乾燥させ、10 mlのクロロホルムに溶解し、ヒドロキシル型に変換された陰イオン交換TEAEセルロース(Serva, Heidelberg, Germany)の20-mlカラムにアプライした。Rouserらによって記載されたように、脂質を溶出した(1969. Diethylaminoethyl and triethylaminoethyl cellulose column chromatographic procedures for phospholipids, glycolipids, and pigments. Methods Enzymol. 14: 272-317)。このプロトコールによると、画分は以下の脂質を含む。すなわち、画分1、コレステロール、グリセリド、および他の中性脂質; 画分2、セレブロシド、グリセロールジグリセリド、ホスファチジルコリン、およびスフィンゴミエリン; 画分3、セラミドポリヘキソシド; 画分4、無機物質; 画分5、ホスファチジルエタノールアミンおよび遊離脂肪酸; 画分6、ホスファチジルセリン; 画分7、なし(洗浄ステップ); ならびに画分8、ホスファチジン酸、カルジオリピン、ホスファチジルグリセロール、ホスファチジルイノシトール、および他の酸性脂質である。画分2および3における糖脂質の存在を、HPTLCプレートでの脂質画分のオルシノール染色によって確認した(1956. Quantitative estimation of cerebrosides in nervous tissue. J. Neurochem. 1: 42-53)。
【0105】
C. 蠕虫生物の維持:
蠕虫は、SPF条件で飼育された中間宿主および準備用動物を循環する。蠕虫個体群のサンプルは、感染率、繁殖力、および駆虫薬に対する感受性などの表現型の安定性を確実にするために検査される。
【0106】
<投与量、投与法および医薬製剤>
治療を必要とする個体は、選択された寄生虫の天然の生活環に応じて、経口または非経口で寄生虫の感染形(卵、セルカリアもしくは幼虫)を投与される。別法として、TH2応答を誘導するために、可溶性の寄生虫または卵の抽出物が経口または非経口で投与され得る。
【0107】
腸および肝臓の蠕虫および住血吸虫に関して、それらは、接種の約30〜60日後に便中に現れる卵を産生し始める。便中の卵の定量は、感染の妥当性および強度の評価をするのに十分であることを示す。便の一部をショ糖浮遊法によって処理し、各検体中の全卵数を測定する。ショ糖溶液での浮遊は、KoontzおよびWeinstock, 1996, Gastroenterology Clinics of N. America, 25: 435によって報告されるように、正確な計数のために便から卵を単離するのにしばしば用いられる方法である。
【0108】
本発明の蠕虫性寄生虫化合物は、任意の便利な方法での投与のために製剤化されでもよく、従って、本発明はその範囲内に、ヒトにおける使用に適した本発明の蠕虫性寄生虫化合物を含む医薬組成物を含む。このような組成物は、任意の必要な医薬担体または賦形剤を用いて従来の方法での使用に供されうる。
【0109】
本発明の蠕虫性寄生虫化合物は、注射用に、従って、ワクチン用途に製剤化されでもよく、必要であれば防腐剤を添加した、アンプルでの単位投与剤型、または複数回投与容器で提供されうる。組成物はまた、油性もしくは水性ベヒクルの懸濁液、溶液、または乳液のような形態を取ってもよく、懸濁化剤、安定化剤、および/または分散剤などの製剤化物質を含みうる。あるいは、蠕虫性寄生虫は、粉末形態であってよく、または使用前に、例えば滅菌した発熱物質を含まない水などの適切なベヒクルによって再構成されうる。
【0110】
必要に応じて、このような粉末製剤は、粉末が水で再構成され、その結果生じる水性製剤のpHが生理学的に許容されうることを確実にするために、適切な非毒性基剤を含みうる。
【0111】
蠕虫性寄生虫化合物はまた、例えばカカオ脂または他のグリセリドなどの従来の坐薬基剤を含む坐薬として製剤化されうる。
【0112】
蠕虫性寄生虫化合物はまた、従来の充填剤、担体、および賦形剤とともに経口投与のために製剤化されうる。それを必要とする個体に投与される寄生虫の量は、自己免疫疾患を予防または治療するために十分な量である。この量は、治療または予防される疾患、および蠕虫性寄生虫、それが無傷で、または卵、幼虫、抽出物もしくはセルカリアとして投与されるかどうかに応じて変化しうる。
【0113】
一般的に、寄生虫が本明細書において議論されるすべての自己免疫疾患に対して投与される場合、その量は約50〜約50,000の範囲である。より詳細には、この量は約500〜約5,000の範囲でありうる。卵が利用される場合には、約500〜約5,000が、本明細書に開示される自己免疫疾患を治療するために利用されうる。抽出物が投与される場合には、約100μg〜約10,000μgが、自己免疫疾患を治療するために利用される。幼虫およびセルカリアが投与される場合には、投与量は、それぞれの場合において約500〜約5,000の範囲でありうる。
【0114】
予防またはワクチン用途のためには、寄生虫の量は500〜5,000でありうる。
【0115】
寄生虫調製物の投与量は、Th1、Th2または制御性細胞の応答を測定することによって測定されうる。あるいは、投与量は、当技術分野において知られているか、もしくは本明細書に記載されるような特定の疾患の病変または症状を評価することによって測定されうる。
【0116】
A. Th1およびTh2応答の測定
本発明の効果を示すために、Th1およびTh2応答が区別されうる。Metawaliら、1996, J. of Immunol. 157: 4546は、マウスにおいて、組織学的解析ならびにサイトカインおよび免疫グロブリンプロフィールの解析によってTh1応答をTh2応答と区別することが可能であることを示した。更に、Sandorら、1990, J. of Exp. Med. 171: 2171は、Fcg3およびMHCクラスII分子の細胞表面での発現が区別を可能にすることを示した。この方法では、粘膜炎症、好酸球増多および肥満細胞症の程度を測定するために、小腸および大腸が組織学的に検査される。後者の細胞型はTh2応答の指標となる。腸間膜リンパ節(MLN)および脾臓は、マイクロウェルプレートでのin vitro培養のために単細胞懸濁液に分離され得る。完全RPMI培地中の細胞(1〜2 x 106/ウェル)を、寄生虫抗原もしくは抗CD3の存在下または非存在下で最大72時間まで培養し、その後、その上清をサイトカインおよび免疫グロブリンについてアッセイする。IFN-γ、TNFαおよびIgG2aはTh1応答を特徴付けるが、一方、IL-4、IL-5、IgEおよびIgG1はTh2反応の特徴を表す。また、血清もサイトカインおよび免疫グロブリンプ濃度についてアッセイされ得る。更に、分散された炎症性白血球は、フローサイトメトリーによって、マクロファージ上でのFcγ3発現(Th1)およびB細胞上でのMHCクラスII発現(Th2)について検査される。対照は、寄生虫の宿主ではない、適切な、年齢を適合させた同腹子マウス由来の血清、MLNおよび脾臓を含む。
【0117】
同様の解析はヒトのTh1とTh2応答を区別することができる。炎症の部位および末梢血液細胞からの炎症組織、単離された白血球が検査される。白血球は、in vitroにおいて単独で、またはサイトカイン放出を刺激するための寄生虫抗原もしくは分裂促進剤の存在下で培養される。IgG2はIgG2aの代わりになる。
【0118】
B. 制御性T細胞活性の測定
in vitro培養物または動物から制御性T細胞を単離する方法は、当技術分野において知られており、例えば、McGuirk P, Mills KH. Pathogen-specific regulatory T cells provoke a shift in the Th1/Th2 paradigm in immunity to infectious diseases. Trends Immunol 2002; 23 (9): 450-5; Field, A. C., L. Caccavelli, M. F. Bloch,および B. Bellon. 2003. Regulatory CD8+ T cells control neonatal tolerance to a Th2-mediated autoimmunity. Journal of Immunology. 170: 2508-2515; von Herrath MG, Harrison LC. Antigen-induced regulatory T cells in autoimmunity. Nat Rev Immunol. 2003 Mar ; 3 (3): 223-32; Francois Bach J. Regulatory T cells under scrutiny. Nat Rev Immunol. 2003 Mar; 3 (3): 189-98; Curotto de Lafaille MA, Lafaille JJ. CD4(+) regulatory T cells in autoimmunity and allergy. Curr Opin Immunol. 2002 Dec; 14 (6): 771-8; McGuirk P, Mills KH. Pathogen-specific regulatory T cells provoke a shift in the Th1/Th2 paradigm in immunity to infectious diseases. Trends Immunol. 2002 Sep; 23 (9): 450-5; Tung KS, Agersborg SS, Alard P, Garza KM, Lou YH. Regulatory T-cell, endogenous antigen and neonatal environment in the prevention and induction of autoimmune disease. Immunol Rev. 2001 Aug; 182: 135-48; Read S, Powrie F. CD4(+) regulatory T cells. Curr Opin Immunol. 2001 Dec; 13 (6): 644-9; Yssel H, Lecart S, Pene J. Regulatory T cells and allergic asthma. Microbes Infect. 2001 Sep; 3(11): 899-904; Shevach, E. M. 2002. CD4+ CD25+ suppressor T cells: more questions than answers. Nature Reviews. Immunology. 2: 389-400; Annacker, O.およびF. Powrie. 2002. Homeostasis of intestinal immune regulation. Microbes & Infection. 4: 567-574; Read, S., V. Malmstrom,およびF. Powrie. 2000. Cytotoxic T lymphocyte-associated antigen 4 plays an essential role in the function of CD25(+)CD4(+) regulatory cells that control intestinal inflammation. J. Exp. Med. 192: 295-302に記載される通りである。
【0119】
制御性T細胞の応答または活性は、本明細書に記載されるような内部マーカー、細胞表面マーカー、または分泌マーカーによって測定されうる。
【0120】
制御性T細胞のための有用な内部マーカーは、Scurfin、Smad7、Gata3、Tbet(Tbx21)などの転写因子を含むが、それらに限定されない。
【0121】
制御性T細胞のための有用な表面マーカーは、CD4、CD45RBlo、CD45Rc、細胞傷害性T リンパ球関連抗原4(CTLA-4)、CD25、CD103、Ox40、4-1BB、CD62L、αEβインテグリン、潜伏関連ペプチド(LAP)またはグルココルチコイド誘導性TNF受容体ファミリー関連タンパク質(GITR)、ケモカイン受容体CCR5、TI-ST2を含むが、それらに限定されない。
【0122】
制御性T細胞のための有用な分泌マーカーは、IL-5、IL-10およびTGFβを含むが、それらに限定されない。
【0123】
C. マーカーの量をin vitroにおいて測定する方法の非限定的な例
フローサイトメトリーによるサイトカイン検出: RPMI完全培地中の脾細胞、MLNまたは腸の炎症細胞を、24ウェルの組織培養プレートに2 x 106細胞/ウェルで播種する。細胞を4〜6時間、抗CD3または適切な抗原の存在下または非存在下で、10μg/mlのブレフェルジンAとともに培養する。ブレフェルジンはタンパク質のエキソサイトーシスを妨げ、サイトカインの細胞内での蓄積を促進する。細胞質サイトカインの検出のために、細胞を室温で5分間、2%パラホルムアルデヒドで固定し、続いて細胞のサブタイプを区別するために表面染色する。細胞を洗浄し、50μlのPBS 0.2%サポニンおよび1μg抗サイトカイン抗体に再懸濁し、室温で20分間インキュベーションする。次に、細胞をサポニンで2回洗浄し、PBS/FCSに再懸濁する。細胞を同一のアイソタイプおよびサイトカイン特異性の過剰な非共役性抗体を用いて前もってブロッキングすることにより、または、細胞を組換えサイトカインの存在下でインキュベーションすることにより、サイトカイン抗体染色の特異性を確認する。フィコエリトリン(PE)標識された無関係の抗体対照もまた、バックグラウンド染色を評価するために含まれる。細胞はフローサイトメトリーを用いて解析される。
【0124】
ELISA: ELISAは、マイクロタイタープレート中で培養され、上述のように操作された細胞からの細胞上清におけるサイトカインおよび抗体濃度を測定する。多くのこれらのアッセイは既に本発明者らの研究室で使用可能である。サイトカインは、2つのモノクローナル抗体(mAb)を用いて、二部位サンドイッチELISAでアッセイされる。抗サイトカインmAbは、アンモニウム沈殿によって、抗体を分泌しているハイブリドーマクローンの上清から精製される。マイクロタイタープレートを、Tween 20を含む50μlのPBS(PBS-T)中1μg/mlのコーティング抗体によってコーティングし、4℃で一晩インキュベーションする。その後、ウェルに150μlのPBS中10%FCSを添加し、37℃で30分間インキュベーションすることによってブロッキングする。標準は、組換えサイトカイン、または住血吸虫症感染マウス由来の分裂促進剤活性化脾臓細胞もしくは抗原活性化脾臓細胞からのサイトカインを含んでいる上清を含む。サンプルおよび標準希釈物を、10%FCSを含むRPMI(完全RPMI)中で別の96ウェル平底マイクロタイタープレートにおいて調製し、50μlの量を、PBS-Tで3回洗浄したELISAプレートに移す。サンプルをアッセイプレートにおいて1時間37℃でインキュベーションする。適切なmAbはビオチンにコンジュゲートされる。PBS-Tで3回洗浄した後、各ウェルに50μlの1%BSA/PBS-T中0.5μg/mlの抗体-ビオチンコンジュゲートを加える。プレートを室温で1時間インキュベーションし、その後、PBS-Tで3回洗浄する。ストレプトアビジン-ホースラディッシュペルオキシダーゼコンジュゲート(75μl)を、1%BSA/PBS-T中1μg/mlで添加し、室温で1時間インキュベーションする。プレートを新しいPBS-Tで10回洗浄し、44 mM Na2HPO4、28 mMクエン酸、および0.003%H2O2中、100μlの1 mg/mlの基質(2,2'-アジノ(3-エチルベンズチアゾリンスルホン酸))を加える。有色生成物を、マルチスキャンマイクロプレートリーダーを用いて、490 nmの参照波長とともに405 nmの波長で測定する。
【0125】
免疫グロブリンは、抗アイソタイプ特異的ELISAを用いて定量される。アフィニティー精製されたヤギ抗IgM、IgG1、IgG2a、IgG2b、IgG3、IgAおよびIgEを捕捉抗体として使用し、軟質ポリビニルマイクロタイターディッシュに10μg/mlで吸着させる。培養上清の添加、インキュベーション、洗浄の後、適切なアイソタイプのアルカリホスファターゼコンジュゲートヤギ抗免疫グロブリンを用いて、プレートに結合した全マウス免疫グロブリンを検出する。標準曲線は精製された免疫グロブリンを用いて作製される。寄生虫抗原特異的抗体を測定するために、可溶性抗原をビオチン化し、結合したマウス免疫グロブリンを検出するために使用する。プレートをELISAリーダーにおいて410 nmで解析し、全免疫グロブリンの濃度を標準曲線および最良適合解析ソフトウェアを用いて測定する。可溶性寄生虫抗原は正確な定量を可能にする定義された抗原ではないため、抗原特異的抗体濃度はO.D.測定値と相対的に比較される。
【0126】
ELISPOTアッセイ: ELISPOTアッセイは、ポリクローナル抗体またはサイトカインのいずれかを分泌しているリンパ球を計数するために確立される。96ウェルのニトロセルロース支持マイクロタイタープレートを、PBS-T中1μg/mlの抗免疫グロブリンまたは抗サイトカイン抗体のいずれかによって、4℃で一晩コーティングする。その後、プレートを10%FCSを含むPBSでブロッキングし、PBS-Tで十分に洗浄する。
【0127】
5 x 104細胞/ウェルから始まる単細胞懸濁液の希釈系列を、プレート上で5時間37℃で、加湿した5%CO2雰囲気下でインキュベーションする。プレートをPBS-Tで洗浄し、ビオチン化抗免疫グロブリンまたは抗サイトカイン抗体を4℃で一晩重層する。次に、プレートを洗浄し、ストレプトアビジン-グルコースオキシダーゼコンジュゲートで2時間処理し、再度洗浄する。
【0128】
単一細胞によって分泌された抗体またはサイトカインを基質によって可視化する。比色反応を洗浄によって30分後に停止し、スポットを30X倍率で数える。10〜50スポット/ウェルを生じる細胞の希釈物を、サンプル当たりの分泌細胞の総数を計算するために使用する。対照は、不適切なヤギ抗体もしくは不適切な抗原でコーティングされたウェル、またはコーティングされないままのウェルを含む。
【0129】
ウェルをコーティングするために可溶性抗原を用いたアッセイの改変は、寄生虫抗原特異的な免疫グロブリン分泌B細胞の定量をも可能にする。簡潔には、例えば、プレートを0.25μg/ウェルの成虫T. Muris抗原または適切な無関係の対照抗原でコーティングする。洗浄後に細胞をウェルに添加する。適切なインキュベーションの後、プレートを再度洗浄し、上述のように処理する。
【0130】
D. 疾患病変の評価
自己免疫疾患の存在およびその治癒または改善の証拠は、治療の必要性を決定するために、および治療過程を観察するために必要とされる。以下の方法は、注目される疾患の臨床パラメータを測定するために利用される。
【0131】
1. 炎症性腸疾患
炎症の評価: マウスでは、疾患の臨床所見は、体重減少、下痢、直腸脱および腸の炎症の組織学的徴候を含む。従って、これらのパラメータの改善は、疾患の改善を意味すると思われる。
【0132】
動物モデルにおいて腸の炎症を評価するために、組織を摘出し、スイスロールのように巻き(Swiss-rolled)、標準的な方法に従ってパラフィン包埋する。切片をヘマトキシリンおよびエオジンで染色する。大腸の炎症の程度は、本発明者らの通常の標準化方法を用いて、1人の病理学者による盲検で0〜4まで半定量的に評価される。すなわち、0=炎症なし、1=低レベルの炎症、2=中間レベルの炎症、3=壁肥厚を伴う高レベルの炎症、ならびに4=貫壁性浸潤、および壁肥厚を伴う杯細胞の喪失。
【0133】
肥満細胞を数えるために、個々のマウスからの腸組織サンプルをスイスロール法(Swiss-roll technique)によって処理し、カルノア固定液で固定し、パラフィン包埋して、アルシアンブルーおよびサフラニンによる染色のために処理する。与えられた切片の隣接した50視野を、固有層および筋層中の粘膜肥満細胞について検査する。肥満細胞は、それらの特徴的なアルシアンブルーによる細胞内顆粒染色によって同定される。すべてのサンプルは盲検で評価される。
【0134】
ヒトでの疾患活動性は、様々な臨床的基準、実験室での基準および組織学的基準を用いて観察される。下痢および腹痛の頻度のような臨床パラメータを観察する、いくつかの十分に確立されたIBD疾患活動性の指標がある。クローン病の評価のための1つの特に有用な指標は、クローン病活動性指数、すなわちCDAIである(Bestら、1976, Gastroenterology 70: 439)。CDAIは、疾患活動性に関連する8つの変数を取り入れ、最新のクローン病の治療薬の研究に用いられている。それは、液状または非常に軟らかい便の回数、腹痛または腹部の痙攣の重症度、一般的な健康、疾患の腸管外の徴候の存在、腹部腫瘤の有無、抗下痢薬の使用、ヘマトクリット、および体重を含む。複合スコアは0〜約600の範囲である。150以下のスコアは寛解を示し、450以上のスコアは重度の疾患を示す。
【0135】
検査済みの、認められた、疾患特異的な生活の質アンケートもまた、治療の進行を評価するために治療前後に施行されうる。アービン炎症性腸疾患アンケートは、32項目のアンケートである(Irvineら、1996, The Short Inflammatory Bowel Disease Questionnaire: a quality of life instrumeht for community physicians managing inflammatory bowel disease. CCRPT Investigators. Canadian Crohh's Relapse Prevention Trial. Am J Gastroenterol. 1996 91 (8): 1571-8)。それは、腸機能(例えば軟便および腹痛)、全身症状(疲労および睡眠パターンの変化)、社会的機能(仕事への参加および社交行事を取り消す必要性)ならびに情動状態(怒り、憂うつ、または苛立ち)に関する生活の質を評価する。スコアは32〜224の範囲であり、高スコアはより良い生活の質を示す。寛解期の患者は通常170以上のスコアである。
【0136】
腸疾患活動性の内視鏡、x線および組織学的評価もまた、評価のために使用されうる。C反応性タンパク質レベルおよび血球沈降速度もまた、炎症の全身性指標として観察されうる。
【0137】
2. 関節リウマチ
炎症の評価: コラーゲン誘発関節炎のマウスでは、マウスは1日おきに検査され、それらの足は以下のようにスコアされる。すなわち、0, 正常; 1, 紅斑および足首の関節またはつま先に限局した軽度の腫れ; 2, 紅斑および足首から中足部まで拡大した軽度の腫れ; 3, 紅斑および足首から中足関節まで拡大した重度の腫れ; ならびに4, 関節腫脹を伴う強直性変形である。これらの4つのパラメータは、関節炎の関節における組織学的変化と相関し得る。治療の成功は、組織学上の改善とともに関節炎スコアの減少をもたらす(Anthony DD. Haqqi TM., Collagen-induced arthritis in mice: an animal model to study the pathogenesis of rheumatoid arthritis. Clinical & Experimental Rheumatology. 17 (2): 240-4,1999)。
【0138】
プリスタン誘発関節炎では、関節は腫れを検出するためにマイクロメータで測定されうる。ヒトでは、RAは、関節腫脹、紅斑、運動制限および痛みの測定によってスコアされる。あるいは、サイトカインおよび炎症性タンパク質濃度について、ならびに白血球の組成および機能について、当技術分野において既知の方法に従って、滑液が解析されうる。滑膜生検は、当技術分野において既知の方法による組織学的解析のための組織を提供する(Felson DT. Anderson JJ. Boers M. Bombardier C. Furst D. Goldsmith C. Katz LM. Lightfoot R Jr. Paulus H. Strand V.らAmerican College of Rheumatology. Preliminary definition of improvement in rheumatoid arthritis. Arthritis & Rheumatism. 38(6): 727-35, 1995 Schiff M. A rationale for the use of summary measurements for the assessment of the effects of rheumatoid arthritis therapies. Clinical Therapeutics. 25(3): 993-1001,2003)。
【0139】
3. 狼瘡
炎症の評価: 免疫系の正常な発達および機能は、アポトーシスと呼ばれる過程による望ましくない細胞の除去に大いに依存する。特異的な細胞表面分子およびそれらの受容体を介した細胞間相互作用はしばしば、この過程を誘導する。このような系の1つは、FASおよびFASリガンドと呼ばれる。FAS(LPR-/-)またはFASリガンド(GLD-/-)のいずれかに欠損のあるマウスは、狼瘡のような自己免疫疾患を発症する(Reilly CM. Gilkeson GS. Use of genetic knockouts to modulate disease expression in a murine model of lupus, MRL/lpr mice. Immunologic Research. 25(2): 143-53, 2002)。
【0140】
LPRまたはGLDマウスの集団は、特定病原体を含まない条件下のマイクロアイソレーターケージで維持される。これらのマウスは自然に自己免疫を発症し得るが、人為的な誘発後はより予測可能になる。疾患を誘発するために、8週齢のマウスにプリスタンのような薬剤を注射する。2ヶ月以内に、マウスは自己免疫疾患になる。マウスおよびヒトの両方において疾患の誘発および改善を判定するために有用な、多くの臨床的、組織学的ならびに免疫学的基準は、当技術分野においてよく知られている(Satoh M. Richards HB. Shaheen VM. Yoshida H. Shaw M. Naim JO. Wooley PH. Reeves WH. Widespread susceptibility among inbred mouse strains to the induction of lupus autoantibodies by pristane. Clinical & Experimental Immunology. 121(2): 399-405, 2000)。
【0141】
4. 若年性インスリン依存性糖尿病(1型)
炎症の評価: NODマウスは、膵臓β細胞の自己免疫性破壊によりヒトと同様の1型糖尿病を発症する。当技術分野において既知の方法に従った臨床的、生化学的、免疫学的および組織学的検査は、マウスにおける疾患の誘発および改善の評価を可能にする(例えば、Adorini L. Gregori S. Harrison LC. Understanding autoimmune diabetes: insights from mouse models. Trends in Molecular Medicine. 8(1): 31-8, 2002を参照せよ)。
【0142】
5. サルコイドーシス
炎症の評価: 肺の炎症のビーズ塞栓モデルにおいて、抗原(すなわちTh1またはTh2)はセファロースビーズと結合され、それは尾静脈内への注射によってマウスの肺を閉塞する。その動物は通常、結合抗原に事前に感作される。宿主の免疫系は、障害を起こすビーズに対して活発な免疫応答を開始する。数週間持続し得るこれらの局所性炎症反応は、組織学的にサイズについて検査され得る。また、それらは組織から分離され、細胞組成およびサイトカイン産生について研究され得る。更に、肺門リンパ節および脾臓は、容易に実験のために利用できる。例えば、Kunkel SL. Lukacs NW. Strieter RM. Chensue SW. Animal models of granulomatous inflammation. Seminars in Respiratory Infections. 13(3): 221-8, 1998を参照せよ。
【0143】
ヒトの疾患であるサルコイドーシスは、通常は肺に関与する。サルコイドーシスおよび疾患の範囲の判定は、当技術分野において既知の方法によって行われうる。肺機能検査は、肺のコンプライアンスおよび機能を評価し得る。また、気管支洗浄は、炎症過程の間に気管支樹に浸潤した炎症細胞を得る。これらの細胞は、組成および機能について研究され得る。肺浸潤および肺門リンパ節腫脹はサルコイドーシスの特徴である。従って、定期的な胸部x線またはCTスキャンは、疾患活動性の評価を支援し得る。当技術分野において既知の方法によるアンジオテンシン変換酵素活性の測定のような血清検査は、疾患の範囲および活動性を評価するために使用され得る。例えば、Hunninghake GW. Costabel U. Ando M. Baughman R. Cordier JF. du Bois R. Eklund A. Kitaichi M. Lynch J. Rizzato G. Rose C. Selroos O. Semenzato G. Sharma OP. ATS/ERS/WASOG statement on sarcoidosis. American Thoracic Society/European Respiratory Society/World Association of Sarcoidosis and other Granulomatous Disorders. Sarcoidosis Vasculitis & Diffuse Lung Diseases. 16(2): 149-73, 1999を参照せよ。
【0144】
6. 多発性硬化症
炎症の評価: 実験的自己免疫性脳脊髄炎は、感受性マウスにおいて適切な感作ミエリン抗原の反復注射によって誘発される。マウスは以下の基準に従って臨床的に評価される。すなわち、0, 疾患なし; 1, 尾の弛緩; 2, 後肢衰弱; 3, 後肢麻痺; 4, 後肢麻痺および前肢麻痺または衰弱; 5, 瀕死である。組織学的解析のために、脊髄および脳を摘出し、ホルマリンで固定する。パラフィン包埋切片を染色し、光学顕微鏡下で検査する。分散させた脾細胞および他の部位からの細胞は、上記に概説されたようにin-vitroにおいて研究され得る。これらのパラメータは、疾患の改善または回復の測定を支援し得る(例えば、Sewell, Diane, Zing Qing, Emily Reinke, David Elliott, Joel Weinstock, Matyas Sandor, and Zsuzsa Fabry. Immunomodulation of experimental autoimmune encephalomyelitis by helminth ova immunization. International Immunol. 15: 59-69, 2003)。
【0145】
ヒトでは、MS疾患活動性は、神経学的徴候および症状の進行および一時的な改善の観察によって評価される。最も広く用いられる結果測定は、総合障害度(Expanded Disability Status Scale)と呼ばれる。当技術分野において既知の方法によって解析される脳脊髄液のタンパク質組成および細胞含量もまた、疾患活動性を観察するために使用されうる。更に、連続的なMRI研究は、新たなガドリニウム増強脳病変を示す(McDonald WI, Compston A, Edan G, Goodkin D, Hartung HP, Lublin FD, McFarland HF, Paty DW, Polman CH, Reingold SC, Sandberg-Wollheim M, Sibley W, Thompson A, van den Noort S, Weinshenker BY, Wolinsky JS. Recommended diagnostic criteria for multiple sclerosis: Guidelines from the International Panel on the Diagnosis of Multiple Sclerosis Ann Neurol 50(1):121-7. 2001. Poser CM, Paty DW, Scheinberg L,ら"New Diagnostic Criteria For Multiple Sclerosis: Guidelines For Research Protocols". Ann Neurol 1983; 13 : 227-231)。
【0146】
統計的方法: いくつかのデータは、平均値がゼロとは有意に異なるかどうかを決定するために、1標本t検定によって解析される。対応のあるt検定は、群平均間の違いを解析するために用いられる。分散分析およびダネットt検定は、多数の比較データを解析するために用いられる。
【0147】
<本発明に有用な動物モデル>
以下の表1は、本発明に有用な動物モデルの非限定的な例を説明する。更なる非限定的な例は、例えば、Current Protocols in Immunology (2001, John E. Coligan, Ada M. Kruisbeek, David H. Margulies, Ethan M. Shevach, Warren Strober編、John Wiley & Sons出版)に記載されるように、当技術分野において見いだされうる。
【表1】

【実施例】
【0148】
本発明は、以下の材料および方法を用いる以下の非限定的な実施例によって説明される。以下で引用されるそれぞれの参考文献の開示全体は、参照により本明細書に組み入れられる。
【0149】
〔実施例1〕
一般的な方法:
動物: 129/SV IL-10-/-突然変異マウスの集団、および適切な対照動物を維持し、標準的な方法に従って特定病原体を含まない環境を維持する施設において飼育する。
【0150】
寄生虫の維持、動物の感染、住血吸虫卵の調製: T. murisの維持および感染のために用いられる方法は、ElseおよびWakelin, 1990, Parasitology, vol. 100, part 3: 479に記載された通りである。
【0151】
住血吸虫卵を、住血吸虫感染ハムスターの肝臓から採集し、Elliott, 1996, Methods: A Companion to Methods in Enzymology, 9: 255に記載されるように保存した。5匹の感染ハムスターから約2 x 106の卵が採集される。
【0152】
T. suis卵の調製: T. suis卵の調製および採集において、以下の方法が用いられた。T. suis卵の実験的接種に暴露した後7〜8週間のブタの大腸からT. suis成虫を単離した。成虫をin vitroで培養することにより幼虫形成卵を得て、その後、培地から遠心分離によって分離された排出卵を22℃で5〜6週間バブリングしながら0.2%二クロム酸カリウム溶液中に置き、感染型初期幼虫を得た。卵を1200 x g で10分間の遠心分離によって滅菌水で2回洗浄し、数を数え、2,500の計算された用量に基づいて必要量の生理食塩水に再懸濁した。これらの卵を被検体での使用のために保存した。卵は冷蔵庫で少なくとも1年間安定である。感染力を保証するために、本発明者らは、感染後の便への卵の出現について患者を観察した。便中の卵の数は、寄生の強度に比例する。また、本発明者らは、持続的な感染力を保証するために、時々、ブタを保存した卵で感染させる。
【0153】
M. aviumへの感染: 106コロニー形成単位(CFU)のMycobacterium avium(ATCC 25291)を腹腔内に注射することにより、マウスを感染させた。感染60日目に、数匹のマウスにはまた、35匹のS. mansoniセルカリアを与え、二重感染を誘導した。
【0154】
住血吸虫感染および卵子の単離: いくつかの実験には、8〜9週間S. mansoniに感染したマウス(18〜20g)を使用した。マウスを、皮下投与によってプエルトリコ系統由来の40匹のセルカリアに感染させた。
【0155】
肉芽腫の分離および分散: 肉芽腫は、天然の卵の蓄積のために、住血吸虫感染マウスにおいて形成され、それは感染の6週目から始まる。M. aviumもまた肉芽腫を誘導する。本発明者らは、記載されたように(Elliott, 1996, 上述)感染マウスから分離された肝臓の肉芽腫を研究する。肉芽腫を分散させ、単細胞懸濁液を調製した。分離した肉芽腫を、5 mg/mlコラゲナーゼを含むRPMI培地中で、35分間37℃の水浴振盪機において振盪した。残りの肉芽腫を1 mlの注射器によって吸い上げ、吹き出させて、更に分散させた。その結果生じた細胞懸濁液をガーゼを通してろ過し、3回洗浄した。細胞の生存率をEosin-Y排除法によって測定した。この方法は、保存された表面分子の発現を示す高収量の生存能力のある炎症細胞をもたらした。
【0156】
脾臓およびMLNの分散: 脾細胞およびMLNは、引き裂いてステンレス製メッシュを通して組織を洗浄することによって分散される。混入しているRBCをH2Oで溶血させ、細胞を使用前にRPMIで3回洗浄した。
【0157】
TNBS大腸炎の誘発: 大腸炎は、Neurathら、1995, J. Exp. Med., 182: 1281に記載されるように、トリニトロベンゼンスルホン酸(TNBS)の直腸注入により誘発された。簡潔には、対照または寄生虫暴露BALB/cマウスを30時間絶食させ、その後メトキシフルランで麻酔した。1.2 mmのカテーテルを4 cm大腸内に前進させ、0.1 mlのTNBS溶液(50%エタノール中5 mg/ml TNBS(Sigma))を注入した。動物を尾で3分間吊り下げて、大腸粘膜への均一な接触を確保した。
【0158】
粘膜炎症の評価: 腸の炎症を評価するために、表示された時点で組織を摘出し、スイスロールのように巻き、標準的な方法に従ってパラフィンに包埋した。切片をヘマトキシリンおよびエオジンで染色した。大腸の炎症の程度は、本発明者らの通常の標準化方法を用いて、1人の病理学者による盲検で0〜4まで半定量的に評価された(1 9)。0=炎症なし、1=低レベルの炎症、2=中間レベルの炎症、3=壁肥厚を伴う高レベルの炎症、4=貫壁性浸潤、杯細胞の喪失、壁肥厚。
【0159】
細胞の単離およびT細胞の濃縮: Th1、Th2および制御性T細胞は、例えば、Current Protocols in Immunology(2001, John E. Coligan, Ada M. Kruisbeek, David H. Margulies, Ethan M. Shevach, Warren Strober編、John Wiley & Sons出版)に記載されるような、当技術分野において既知の方法によって単離されうる。
【0160】
1つの実施形態では、MLNの単細胞懸濁液は、RPMI 1640培地(GIBCO, Grand Island, NY)中で穏やかに引き裂くことによって調製された。その細胞を短時間蒸留水に再懸濁し、RBCを溶血した。その後、MLNを多量のRPMIで3回洗浄した。
【0161】
消化管LPMCは下記のように単離された。腸組織をRPMIで十分に洗浄し、すべての目に見えるパイエル板をはさみで除去した。その腸を縦方向に開き、5 mm片に切断し、その後、上皮内リンパ球および上皮細胞を遊離させるために、カルシウムおよびマグネシウムを含まないハンクス液中の0.5 mM EDTAで、20分間37℃で振盪しながらインキュベーションした。十分な洗浄の後、これをくり返した。その後、組織を、10% FCS、25 mM HEPESバッファー、2 mM L-グルタミン、5x105 M β-メルカプトエタノール、1 mMピルビン酸ナトリウム、100 U/mlペニシリン、5 mg/mlゲンタマイシン、および100 mg/mlストレプトマイシン(すべてGIBCO)、ならびに 1 mg/mlコラゲナーゼ(Sigma #CO130)を含む20 ml RPMI中で20分間37℃でインキュベーションした。インキュベーションの最後に、1 mlの注射器を用いて、組織に更なる機械的破砕を加えた。残渣を除去するために、LPMC調製物を、事前に湿らせて漏斗に重ねたガーゼを通してRPMIで洗浄した。その後、LPMCを1回洗浄し、10 ml注射器に穏やかに充填し事前に湿らせた2 cmのナイロンウールカラムを通して篩過した。洗浄後、細胞(最大2 x 107まで)を30:70%勾配を有するパーコールのカラムに重層した。細胞を室温で20分間2200xGで回転させた。30:70の界面から回収されたLPMCを洗浄し、使用するまで氷上に維持した。細胞の生存率はEosin-Y排除法による測定では90%であった。
【0162】
細胞移植実験のために、製造メーカーによって記載されたように、抗体コート高密度粒子を用いるSpinSep濃縮法を用いた陰性選択によって(#17031, #17032, Stem Cell Technologies, Vancouver, Canada)、MLN T細胞を単離した。それぞれの分離後、フローサイトメトリーを使用して、Thy+ T細胞の適切な回収率および純度(> 98%)を確認した。
【0163】
細胞移植: MLN細胞を、2週間 H. polygyrusに感染させたIL10-/-マウスから、または週齢を適合させたこのような感染のない健康なIL10-/-マウスから単離した。その後、これらの分画していない分散させたMLN細胞(2x107細胞/マウス)またはMLN T細胞(5x106細胞/マウス)を、ピロキシカム処理の中止後2日の大腸炎IL10-/-マウスにip注射によって移植した。14日後に大腸炎を評価した。
【0164】
<制御性T細胞の調製のための更なる方法>
本発明のいくつかの実施形態では、制御性T細胞は、例えば、米国特許出願第2003/0170648号、2003/0157057号、 2003/0133936号、2003/0064067号、2003/0049696号、2002/0182730号、2002/0090724号、2002/0090357号(その全体が参照により本明細書に組み入れられる)に記載されるような、当技術分野において既知の方法に従った更なる解析のために、培養細胞または動物から調製されうる。
【0165】
細胞源として有用なin vivoでの細胞集団の源は、末梢血、白血球分離血液製剤、血液成分分離血液製剤、末梢リンパ節、消化管関連リンパ系組織、脾臓、胸腺、臍帯血、腸間膜リンパ節、肝臓、免疫学的損傷部位、例えば滑液、膵臓、脳脊髄液、腫瘍サンプル等を含むが、それらに限定されない。ドナーは好ましくはヒトであり、胎児、新生児、子供、成人であり得、正常、罹患、または対象となる疾患に感受性でありうる。
【0166】
例えば、本発明の制御性T細胞は細胞表面マーカーの発現に基づき濃縮され得る。1つの実施形態では、細胞はCD4およびCD25の発現に対して陽性選択され、CD45RAの欠如に対して陰性選択され得る。任意選択で、Treg細胞の亜集団を更に分離するために、CD69、CCR6、CD30、CTLA-4、CD62L、CD45RB、およびCD45ROを含む他のマーカーが使用され得る。その方法は、他の細胞特異的マーカーに対する陽性選択による細胞単離のための更なる濃縮もしくは精製の方法またはステップを含み得る。
【0167】
別の実施形態では、制御性T細胞は、CD4+CD25+および任意でCD45RA-であるという特性を有する細胞について濃縮する技術によって、細胞の複合混合物から分離される。組織から細胞を単離するために、適切な溶液が分散または懸濁のために使用されうる。このような溶液は通常、低濃度の、一般的には5〜25 mMの許容されうるバッファーとともに、ウシ胎仔血清、BSA、正常ヤギ血清、または他の天然由来の因子が都合よく添加された、平衡塩類溶液、例えば生理食塩水、PBS、ハンクス平衡塩類溶液等である。都合の良いバッファーは、HEPES、リン酸バッファー、乳酸バッファー等を含む。
【0168】
別の実施形態では、制御性T細胞集団の分離は、十分に純粋な集団を提供するために、その後、アフィニティー分離を用いる。アフィニティー分離のための技術は、抗体コート磁気ビーズを用いる磁気分離法、アフィニティークロマトグラフィー、モノクローナル抗体と結合したもしくはモノクローナル抗体と連結して使用される(例えば補体および細胞毒素などの)細胞毒性物質、ならびに、例えばプレートなどの固体マトリックスに結合された抗体との「パニング」、または他の都合の良い技術を含みうる。正確な分離を提供する技術は蛍光活性化細胞選別装置を含み、それは複数のカラーチャネル、低角度および鈍感な光散乱検出チャネル、インピーダンスチャネル等の、様々な程度の精巧さを有することができる。細胞は、死細胞と関連する色素(ヨウ化プロピジウム、LDS)を用いることによって死細胞と選別されうる。選択された細胞の生存率に過度の害を及ぼさない任意の技術が使用されうる。
【0169】
アフィニティー試薬は上記の細胞表面分子に対する特異的受容体またはリガンドでありうる。抗体試薬に加えて、ペプチド-MHC抗原およびT細胞受容体の対、ペプチドリガンドおよび受容体、エフェクターおよび受容体分子等が使用されうる。抗体およびT細胞受容体はモノクローナルまたはポリクローナルであってもよく、トランスジェニック動物、免疫動物、不死化されたヒトまたは動物のB細胞、抗体またはT細胞受容体をコードするDNAベクターでトランスフェクトされた細胞等によって産生されうる。抗体の作製、および特異的結合因子として使用するためのそれらの適合性の詳細は、当業者によく知られている。
【0170】
特に関心を持たれるのは、アフィニティー試薬としての抗体の使用である。都合の良いことに、これらの抗体は、分離に使用するための標識とコンジュゲートされる。標識は、直接分離を可能にする磁気ビーズ、担体に結合されたアビジンまたはストレプトアビジンによって分離できるビオチン、蛍光活性化細胞選別装置とともに使用され得る蛍光色素等を含み、特定の細胞型の分離を簡略化することを可能にする。用途を見いだす蛍光色素は、例えばフィコエリトリンおよびアロフィコシアニンなどのフィコビリタンパク質、フルオレセインならびにテキサスレッドを含む。それぞれのマーカーに対して独立の選別を可能にするために、しばしばそれぞれの抗体は異なる蛍光色素によって標識される。
【0171】
1つの実施形態では、抗体は細胞の懸濁液に添加され、利用可能な細胞表面抗原と結合するのに十分な期間インキュベーションされる。インキュベーションは、通常少なくとも約5分であり、通常約30分以下である。分離の効率が抗体の不足によって制限されないように、すなわち、飽和量の抗体を用いて、反応混合物において十分な濃度の抗体を含むことが望ましい。その適切な濃度は滴定によっても決定され得る。細胞を分離する培地は、細胞の生存を維持する任意の培地である。好ましい培地は0.1〜0.5% BSAを含むリン酸緩衝生理食塩水である。様々な培地が市販されており、細胞の性質に応じて使用され、それらはしばしばウシ胎仔血清、BSA、HSA等を添加された、ダルベッコ改変イーグル培地(dMEM)、ハンクス平衡塩類溶液(HBSS)、ダルベッコリン酸緩衝生理食塩水(dPBS)、RPMI、イスコフ培地、5 mM EDTAを含むPBS等を含む。
【0172】
細胞の染色強度は、レーザーが定量的なレベルの蛍光色素を検出するフローサイトメトリーによって測定され得る(それは抗体によって結合された細胞表面抗原の量に比例する)。フローサイトメトリーまたはFACSはまた、抗体染色の強度、ならびに細胞サイズおよび光散乱などの他のパラメータに基づいて細胞集団を分離するために使用され得る。染色の絶対値は、特定の蛍光色素および抗体調製によって異なるかもしれないが、データは対照に対して標準化され得る。
【0173】
標識された細胞はその後、CD4およびCD25の発現に応じて分離される。分離された細胞は、通常回収チューブの底に血清の緩衝材を含む、細胞の生存を維持する任意の適切な培地中に回収されうる。様々な培地が市販されており、細胞の性質に応じて使用され、それらはしばしばウシ胎仔血清を添加された、dMEM、HBSS、dPBS、RPMI、イスコフ培地等を含む。
【0174】
ヒトTreg活性を高度に濃縮した組成物は、このような方法で獲得されうる。対象集団は、約70%またはそれ以上の細胞組成物、通常は約90%またはそれ以上の細胞組成物であり、約95%またはそれ以上の細胞組成物でありうる。濃縮された細胞集団は直ちに使用されうる。細胞はまた冷凍することもでき、分離処置の前に細胞を冷凍することが好ましいが、液体窒素温度で冷凍されて長期間保存されてもよく、解凍して再利用することが可能である。細胞は通常、培地、グルコース等とともにDMSOおよび/またはFCS中で保存される。解凍したら直ちに、細胞は、成長因子、抗原、刺激、樹状細胞等の使用によって増殖および分化のために展開されうる。
【0175】
細胞培養: サイトカイン分析のために、細胞を48時間96ウェルマイクロタイタープレート(Corning, Cambridge, MA)中で、200μlの培地とともに(5 x 105細胞/ウェル)37℃で培養した。培地は、10% FCS、25 mM HEPESバッファー、2 mM L-グルタミン、5x105 M β-メルカプトエタノール、1 mMピルビン酸ナトリウム、100 U/mlペニシリン、5 mg/mlゲンタマイシン、および100 mg/mlストレプトマイシン(すべてGIBCO)を含むRPMIであった。ほとんどの実験において、細胞は単独で、または(それぞれ1μg/mlで)抗CD3(2C11, ATCC)および抗CD28 mAb(Pharminogen, San Diego, CA)とともに培養された。単離したT細胞を、事前に抗CD3および抗CD28 mAbによって一晩コーティングしたウェルで培養した。IL12分析のためには、Coley Pharmaceutical Group (Wellesley, MA)によって提供され、産生を刺激するために0.6μg/mlで用いられる2つ(下線)の免疫活性化CpGモチーフ(13;14)を含む合成ホスホロチオエート骨格オリゴヌクレオチドODN 1826(TCCATGACGTTCCTGACGTT)(配列番号3)とともに、細胞を培養した。
【0176】
マウスサイトカインについてのELISA: ELISAは上記のVI項に記載されるように行われた。
【0177】
〔実施例2〕
S. mansoniへのTh2応答は、関連のない細菌性Th1誘導性抗原への進行中のTh1応答をダウンレギュレートする:
Th細胞の免疫応答がTh1またはTh2パターンへと二極化し得ることは、十分に証明されている。この二極化は、Th1細胞からのIFNγがTh2細胞の増殖を阻害する一方で、Th2細胞からのIL-4およびIL-10がTh1細胞の増殖を阻害するために起こる。以下の実験は、住血吸虫症が、確立されたマイコバクテリア感染へのマウスTh1応答を変化させることを実証した。
【0178】
マウスをM. aviumおよびS. mansoniに重感染させ、これらの明らかに異なるTh1およびTh2炎症性刺激に対する宿主の応答を評価した。BALB/cAnNマウスは、M. avium(106 CFU)を注射した場合、慢性的なM. avium感染を発症する。マイコバクテリア感染の確立の60日後に、マウスをS. mansoni(40セルカリア)に感染させた。60日後、マウスを屠殺した。対照群は、M. aviumのみに120日間、またはS. mansoniのみに60日間感染したマウスを含んだ。これらの動物由来の分散させた脾細胞または単離した肉芽腫細胞を、in vitroで(4 x 105細胞/ウェル)48時間、最適濃度で使用される住血吸虫卵抗原(SEA、強力なTh2抗原)またはマイコバクテリア抗原精製タンパク質誘導体(PPD、強力なTh1誘導性抗原)の存在下または非存在下で培養した。インキュベーション後、サイトカインまたは免疫グロブリン産生について、ELISAを用いて上清をアッセイした。図1〜3のデータは、3回の個別の実験の平均値+/-SDである。
【0179】
M. aviumのみに感染したマウスからの脾細胞は、PPD(Th1抗原)による刺激後、多量のIFNγを分泌した。非感染対照マウスからの脾臓細胞は何も産生しなかった。最も重要なことに、IFNγは、同時に感染させたマウスからの脾臓細胞培養物では検出されなかった(M. avium単独感染対同時感染、P<.001、図1)。可溶性住血吸虫卵抗原(SEA、Th2抗原)は、S. mansoni感染動物の脾細胞からのIL-4およびIL-5放出のみを促進した。単独でM. aviumに感染したマウスは、PPDもしくはSEAに応答してIL-4またはIL-5を産生しなかった。しかし、重感染した動物からの脾細胞は、PPD刺激後、いくらかのIL-4を分泌した(図1)。
【0180】
M. aviumもしくはS. mansoniに感染したマウスの肝臓から、または同時感染を有する動物から、肉芽腫を分離した。同時感染した動物は、住血吸虫卵およびマイコバクテリアの両方を含み、組織学的実験で容易に認められる肝臓肉芽腫を発症する。これらの動物からの分散させた肉芽腫細胞を、in vitroで48時間、最適濃度で使用されるSEAもしくはPPDの存在下または非存在下で培養した。M. aviumのみに感染したマウスからの肉芽腫細胞は、PPDによる刺激後、多量のIFNγを分泌した。同時感染したマウスからの肉芽腫細胞培養物では、IFNγは検出されなかった(M. avium単独対その他、P<.001)(図2)。SEAはS. mansoni感染動物の肉芽腫細胞からのIL-4放出を促進した。SEAはいずれの場合にもIFNγ分泌を促進しなかった。単独でM. aviumに感染したマウスは、PPDに応答してIL-4を産生しなかった。しかし、重感染した動物からの肉芽腫細胞は、PPD刺激後、いくらかのIL-4を分泌した(図2)。
【0181】
Th1応答はIgG2a産生を促進するが、一方、Th2反応はIgG1およびIgEを向上させる。図3は、M. aviumに感染したマウスが高い血清IgG2aレベルを有することを示す。しかし、重感染動物は正常の血清IgG2a濃度を有するが、IgG1およびIgEレベルの増加を示す。これらのデータを総合すると、蠕虫感染へのTh2応答は、M. aviumのような強力なTh1誘導性生物への進行中の宿主応答であってもダウンレギュレートできることを示す。
【0182】
〔実施例3〕
腸管寄生蠕虫への感染またはそれらの卵子への暴露は、マウスのTNBS誘導性大腸炎におけるTh1型の消化管炎症を軽減する:
50%エタノール中のTNBSの直腸注入は、マウスにおいてクローン病と共通した特徴を有する大腸炎を引き起こす。大腸の炎症は、IFNγmRNA発現の上昇を伴うCD4+ T細胞の浸潤を特徴とする。TNBS処理マウスからの固有層T細胞は、対照からのT細胞より50倍多いIFNγを分泌し、5倍少ないIL4を分泌する(Neurathら、1995、上述)。固有層単核細胞は、対照マウスからの細胞より30倍多いTNFαを分泌する(Neurathら、1997, Eur. J. Immunol., 27: 1743)。重要なことには、TNBS大腸炎は抗IL-12(Neurathら、1995、上述)、抗TNFα(Neurathら、1997、上述)、またはrIL-10(Duchmannら、1996, Eur. J. Immunol., 26: 934)を用いた治療によって予防または改善され得る。TNBS誘導性大腸炎はまた、事前のハプテンへの経口暴露によっても(Elsonら、1996, J. Immunol., 157: 2174)、おそらく粘膜IL-4、IL-10およびTGFβ応答の増加によって(Neurathら、1996, J. Exp. Med., 183 : 2605)予防され得る。
【0183】
BALB/c マウスを用いたTNBS大腸炎モデルが確立される。50%エタノール中のTNBS(0.1 mlの5 mg/mlストック)の直腸投与は、これらの動物に再現性良く大腸炎を引き起こす。後述されるそれぞれのTNBS実験のために、寄生虫暴露動物および対照動物は、同一のTNBS調製物を同じ日に、処理群を知らない同じ手技者によって投与された。
【0184】
A. 住血吸虫症はTNBS 処理マウスのMLNおよび脾臓細胞からのIFNγ放出を阻害する。
住血吸虫感染がTNBS処理動物大腸炎モデルマウスにおけるTh1応答を変化させるかどうかを研究した。マウスをsc.注射によって35匹のS. mansoniセルカリアに感染させた。寄生虫は感染の開始後約6週間で成熟し、産卵し始める。2週間後(感染の8週目)に、マウスをTNBSで処理した。T細胞刺激(抗CD3)に応答してIFNγを産生するMLNおよび脾臓細胞の能力を、数日後に検査した。表2に示されるように、天然の住血吸虫感染は、TNBS処理マウスの腸間膜リンパ節(MLN)および脾臓細胞からのIFNγ放出を強力に阻害する。
【表2】

【0185】
B. 住血吸虫卵への暴露はTNBS 処理マウスのMLNおよび脾臓細胞からのIFNγ放出を阻害する。
住血吸虫症では、Th2応答を引き起こすのは、成虫よりもむしろ寄生虫卵への暴露である。住血吸虫感染は、寄生虫が成熟し産卵し始めるまでは、強力なTh2応答を引き起こさない(Grzychら、1991, J. Immunol., 146: 1322)。自然感染を伴わずに無傷の住血吸虫卵に暴露されたマウスは、強力なTh2応答を示す(Oswaldら、1994, J. Immunol., 153: 1707)。これらの観察は、自然感染を伴わない住血吸虫卵への暴露がTh2応答を誘導しTh1応答を抑制しうることを示唆する。
【0186】
住血吸虫卵への事前の暴露が、成虫による感染を必要とせずにTh1応答を阻害するかどうかを調べるために、マウスに、2回、104個の住血吸虫卵をTNBSによる直腸投与の14日前および4日前に、腹腔内(ip)注射によって接種した。これらの時間は、天然の感染において起こる持続的な産卵を模して選択された。寄生虫卵に暴露されないがTNBSで処理されたマウスを対照とした。卵は事前に冷凍され、注射時には生存能力を持たなかった。今回も、T細胞刺激(抗CD3)に応答してIFNγを産生するMLNおよび脾臓細胞の能力を、TNBS注入の数日後に検査した。天然の住血吸虫感染と同様に(表1)、ip.による卵暴露は、表3に示されるように、TNBS処理マウスのMLNおよび脾臓T細胞からのIFNγ産生を阻害した。
【表3】

【0187】
C. 住血吸虫卵への暴露はTNBS誘導性大腸炎からマウスを保護する。
粘膜のTh1応答の発生を阻害することは、TNBS誘導性大腸炎を軽減し得る。住血吸虫卵への事前の暴露は、MLNおよび脾臓T細胞によるTh1サイトカイン分泌を阻害する。住血吸虫卵のip注射がTNBS誘導性大腸炎を阻害するかどうかを調べるために、卵を上述のように注射し、続いてTNBS処理を行った。卵処理は、3回の個別の実験において、対照群での60%(16/27)から卵暴露マウスでの22%(6/27)へと、累積死亡率を劇的に減少させた。腸の炎症は、上記の一般的な方法に詳述されたように4点制でスコアされた。生き残ったマウスにおいて、卵処理は腸の炎症を、対照群での3.1±0.5(平均±SD)から卵暴露マウスでの1.3±0.3まで軽減した(p<0.05、図4)。次の実験は、群間での最大の差異がTNBS処理後3日で明白になることを示した。TNBS注入の14日後に行われた他の実験は、卵暴露が持続的な保護を与えることを示した。これらのデータは、住血吸虫卵が粘膜のTh1応答を阻害することによって致死的な大腸炎の発症からマウスを保護することを示唆する。
【0188】
D. 腸管寄生蠕虫は宿主のTh2応答を誘導する。
S. mansoni以外の蠕虫性寄生虫が宿主のTh1応答を調節できるかどうかが調べられた。腸内線虫に対する防御免疫の発現はCD4 T細胞依存性である。マウスはTh2応答を増加させることによって寄生虫を駆除し、または感染を制限する。寄生虫の駆除は、腸の好酸球増多だけに依存するのではなく、粘膜の肥満細胞症だけに依存するのでもないと思われる。抗IL-4または抗IL-4受容体遮断mAbによる処理は寄生虫の保持を促進する(Elseら、1994, J. Exp. Med. , 179: 347)ので、IL-4は寄生虫の駆除に重要な役割を有するのかもしれない。反対に、IL-4による処理は寄生虫の除去を促進する(図4)。
【0189】
T. murisはマウス宿主の大腸に生息する。それは、Trichuris trichiuraという、それらの生息中にほぼ10億人の人々によって媒介される寄生虫と近縁である(Grencisら、1996, Gastroenterology Clinics of North America, 25: 579)。卵の摂取が感染を開始する。卵は盲腸上皮を貫通する幼虫を放出する。それらはその後、成虫へと成熟する。その寄生虫は、我々が感染の強度を制御することが可能な宿主内では複製しない(Bancroftら、1994, Eur. J. Immunol., 24: 3113)。
【0190】
T. murisは腸のTh1応答性をダウンレギュレートするために使用された。T. muris感染は、生存能力のある幼虫を含む250個の幼虫形成卵の経口投与によって確立される。BALB/cマウスはT. murisを寄生させ、感染の4週間以内に寄生虫を自然に駆除することができる。T. muris感染マウスまたは偽感染マウスを、感染開始の4週間後にTNBSの直腸注入によって処理した。T. murisによる事前感染は、2回の個別の実験において、偽感染群での58%(7/12)から寄生虫暴露群での21%(3/14)へと、累積死亡率を減少させた。更に、事前にT. murisに感染したマウスは、偽感染マウス(3.13±0.63、p<0.05)と比較してTNBS大腸炎の軽減(0.92±0.5、平均±SD)を呈する。これらのデータは、腸内寄生虫(T. muris)への事前暴露が重度のTh1媒介性大腸炎の発症からマウスを保護することを示す。
【0191】
〔実施例4〕
IL-10遺伝子破壊は、宿主/寄生虫相互作用を有意に変化させない。
IL-10は、マクロファージの活性化およびアクセサリー細胞の機能を抑制する重要な免疫調節サイトカインである(Mooreら、1993, Ann. Rev. Immunol., 11: 165)。標的化遺伝子破壊によってIL-10を欠損させたマウス(IL-10-/-)は、結腸細菌叢に影響される慢性腸炎を発症する(Kuhnら、1993, Cell, 75: 263)。腸の炎症は抗IFNγ抗体による治療によって軽減され、その大腸炎は結腸内容物に対する過度のTh1応答に起因することを示している(Berg,ら、1996, J. Clin. Invest., 98: 1010)。これらのマウスは、クローン病のそれと類似した自然発症大腸炎のための優れたモデルとして役立つ。この実施例では、129およびC57Bl/6バックグラウンドのIL-10-/-マウスが用いられた。
【0192】
A. IL-10-/-マウスは寄生虫へのTh2応答を増加させることができる。
腸内線虫N. brasiliensisに感染したマウスは、IL-4、IL-5およびIL-10の産生を伴う寄生虫に対するTh2型炎症を発現する。N. brasiliensisはIL-10-/-マウスに感染し、適切な腸のTh2応答を活性化することができる(Kuhnら、1993、上述)。それらがTH2応答を増加させるかどうかを調べるために、IL-10-/-マウスをS. mansoniに感染させた。
【0193】
表4は、S. mansoniに8週間感染したIL-10遺伝子破壊マウスからの脾細胞が、住血吸虫卵抗原(SEA)または抗CD3による刺激によって多量のIL-4を分泌することを示す。これらのマウスにおける住血吸虫卵を包囲する肉芽腫は、通常の高い割合(45〜50%)の好酸球を含み、IL-4およびIL-5を産生する。このように、それらは効果的なTh2応答を示す。これらのデータは、S. mansoniのような蠕虫性寄生虫への暴露がIL-10の非存在下においても強力なTh2応答を誘導することを示す。
【表4】

【0194】
B. 蠕虫のTh2条件付けはIL-10-/-マウスにおける粘膜炎症の自然発症を阻害する。
IL-10欠損マウスは蠕虫性寄生虫を寄生させ、強力なTh2応答を誘導することができた。IL-10-/-マウスはTh2応答を発現でき、腸内寄生虫を寄生させることができるため、それらは自然発症の大腸炎または持続的な大腸炎に対する寄生虫暴露の効果を研究するための優れたモデルとして役立つ。IL-10は重要な抗炎症性サイトカインである。この必須の免疫調節回路の破壊は、寄生虫による粘膜のTh2条件付けを妨げる可能性がある。現在の証拠は、T. murisへの感染がIL-10-/-マウスにおいて発症する自然発症大腸炎を妨げることを示唆する。T. muris感染または偽感染を受けた動物(6週齢)を6週間後に屠殺した。T. muris感染または偽感染したIL-10-/-マウスの大腸の炎症を、上記の一般的な方法に詳述されたように4点制でスコアした。T. murisによる事前の感染は、腸の炎症を、偽感染群での3.0±0.3(平均±SE)から寄生虫暴露IL-10-/-マウスでの2.2±0.1(p<0.05)へと軽減した。これらのデータは、蠕虫性寄生虫への事前暴露がIL-10欠損マウスにおける自然発症大腸炎を軽減することを実証する。
【0195】
〔実施例6〕
Trichuris suis による腸管感染はクローン病の患者における疾患活動性をダウンレギュレートする。
クローン病の患者をTrichuris suisに感染させ、疾患活動性の改善を評価する。ブタの鞭虫であるT. suisは、発展途上国において一般的なヒトの腸管寄生蠕虫であるT. trichiuraの近縁種である。この鞭虫は治療のための潜在的因子である。天然のヒト寄生虫であるTrichuris trichiuraは、粘膜への付着によって大腸に存在する非常に小さい生物である。通常の感染はたいてい、宿主に症状を引き起こさず、健康上の問題を起こさない。これは世界中で感染した何百万の人々の場合であるが、少数派では、重度の感染は、下痢、出血および鉄欠乏性貧血を引き起こす。その寄生虫の生活環は宿主が自己感染しないようになっていることが興味深い。卵は感染型になるための成熟に土壌相を必要とし、その後、個体への寄生負荷を増やすために再摂取されなければならない。従って、土壌中の卵が摂取されない限り、T. trichiura感染は宿主内で増加しない。その病因は3日間メベンダゾールを用いて容易かつ効果的に治療される。ヒトの鞭虫は宿主を感染させるために使用され、クローン病における免疫の作用を改変するための実験薬として検討されるかもしれない。
【0196】
しかし、Trichuris trichiuraは宿主に潜在的な健康上の問題をもたらす。ヒトは唯一の自然宿主であるため、実験的用途のための卵は、他のヒトから採集しなければならず、他のヒト感染症を実験の被験者に伝染させる可能性を生じる。従って、近縁動物の寄生虫が使用された。ブタの鞭虫(Trichuris suis)は、症状や疾患、共に感染する疾患または公衆衛生被害を起こすことなく、ヒト宿主を一次的に感染させる潜在能力を有する。
【0197】
ブタの鞭虫はヒトに感染する種の近縁種である。2つの生物は同じ科であり、形態的に類似しているが、それらは異なる種に属し、形態学的、発生学的および臨床的に区別され得る。ブタの鞭虫の卵は少し大きく、異なる形の棘を有し、卵から成虫への発達速度はTrichuris trichiuraより遅い(Beer, 1976, Res. Vet. Sci., 20: 47)。重要なことに、本発明者らは感染性の寄生虫卵をSPF動物から得ることができる。
【0198】
感染性のT. suis卵の供給は上述のように調製された。腸内病原体(例えばShigella、Salmonella、Campylobacter、Yersinia、および病原性E. coli)ならびにウイルス(例えばCMV、HSV、VZV、アデノウイルスおよびエンテロウイルス)による汚染のないことを確認するために、卵を検査した。
【0199】
進行性の薬物治療抵抗性クローン病の2人の患者をT. suisに感染させた。彼らは、この生物に起因する症状をほとんどまたはまったく伴わずに寄生虫を許容した。表5は、患者の感染の実現後に、両参加者のCDAI値、下痢、および炎症の指標が低下したことを示す。この結果は、蠕虫がクローン病を含むがそれに限定されない異常な免疫応答を調節するために有用であることを示唆する。
【表5】

【0200】
〔実施例7〕
炎症性腸疾患の予防および治療におけるH. polygyrus:
炎症性疾患に対する防御を誘導した寄生虫における制御性T細胞の役割を研究するために、更なる実験を行った。
【0201】
実験にはマウス腸管寄生蠕虫H. polygyrusが用いられた。H. polygyrusは、回腸末端もしくは大腸に炎症または損傷を引き起こすことなく、宿主の十二指腸に生息する。アルコール中のTNBSは、マウスの直腸内に注入された場合、大腸炎を誘発する。図5は、この生物がTNBS誘導性大腸炎からマウスを保護することを示す。感染は200匹の生存能力のある幼虫の経口投与によって確立された。マウスは感染開始後約2週間で寄生虫を駆除する。H. polygyrus感染または偽感染マウスを、寄生虫感染の開始の4週間後に0.1 mlのTNBS(50%エタノール中5mg/ml)の直腸注入によって処理した。大腸炎の誘発の3日後に、染色した組織切片で炎症を評価した。
【0202】
蠕虫感染が、IFNγ、TNFαおよびIL12のようなTh1サイトカインの腸内産生を制限することによって、TNBS誘導性IBDからマウスを保護するかどうかを検査するために、実験を行った。図6および7は、IBDのない健康なWTマウスのH. polygyrusへの暴露が、遠位腸粘膜のIFNγおよびIL12産生の能力を低下させることを示す。
【0203】
IL10、TGFβおよびPgE2のような制御性サイトカインは、「Th1」細胞機能を制限することができる。H. polygyrusが腸粘膜内でのこれらの制御性サイトカインの産生を促進するかどうかを測定した。図8は、この寄生虫が粘膜のIL10産生を誘導することを示す。IL10は、TNFα、IL6およびIL12のような一連の前炎症性メディエーターをダウンレギュレートする。従って、腸粘膜で産生されたIL10が「Th1」細胞機能を制限すると仮定することは妥当である。図9は、H. polygyrusを用いたマウスからのLPMCが、阻害性の抗IL10R mAbとともに培養された場合、実質的により多くのIFNγを産生することを示し、この仮説を支持している。
【0204】
疾患から保護することができる潜在的に重要な免疫調節サイトカインは、プロスタグランジンE2(PgE2)、IL4、IL5、IL13およびTGFβを含む。図10〜12は、蠕虫が腸粘膜において防御性サイトカインE2(PgE2)、IL4、IL5、IL13およびTGFβの産生を誘導することを示す。
【0205】
T細胞は腸粘膜でのIFNγの主要な供給源である(図13)。IFNγはTNBS大腸炎の誘発に重要である。
【0206】
腸管寄生蠕虫は、粘膜の免疫反応を局所的に制御するために腸に移動するMLN中の制御性T細胞を誘導する。実験は、未処理の非感染WTマウスからのLPMCが、寄生虫感染マウスからのMLN T細胞の移植後、IFNγを産生する能力の低下を呈することを示した(図14)。
【0207】
いくつかの実験では、MLN制御性T細胞サブセットが腸固有層に入り、続いて制御性サイトカインを産生したかどうかを決定する養子免疫伝達実験のために、緑色蛍光タンパク質(GFP)トランスジェニックマウスを使用した。図15に見られるように、H. polygyrusを有するGFP+マウスからの推定MLN制御性T細胞は、健康なWTレシピエントの腸粘膜に入る。
【0208】
この実験は、どのようにして蠕虫が疾患から保護するかを示す。臨床試験において、蠕虫感染が活動性IBDを改善することが発見された。どのようにしてH. polygyrusによる感染が進行性のマウス大腸炎を逆転させるかもまた、検査された。
【0209】
IL10-/-マウスは、動物が年を取るにつれて徐々に悪化する慢性のTh1大腸炎を発症する。しかし、ほとんどの自然発症疾患のIBDモデルに当てはまるように、SPF施設のIL10-/-マウスはわずか数ヶ月後に様々な表現型の大腸炎を発症する。それを実験のためにより有用になるように、IBDモデルを改良した。5週齢のIL10-/-マウスを2週間 NSAID(ピロキシカム)で飼育することは、薬剤を止めた後でも無期限に持続する重度のTh1大腸炎を誘発することが発見された。炎症はマウス間で高度に予測可能であり、均一な重症度の大腸およびTIを有する(図16)。WTマウスはピロキシカム処理による大腸炎を発症しない。
【0210】
IL10-/-マウスのH. polygyrusによる感染は、以前に確立された大腸炎を解消させることが発見された(図17)。5週齢のC57BL/6 IL10-/-マウスにピロキシカム(80mg/250g飼料)を与えた。2週間後、ピロキシカムを中止した。この時点で、すべてのマウスは大腸炎であった。ピロキシカムを中止して2日後に、数匹のマウスを胃への強制投与によって200匹のH. polygyrusに感染させ、一方、他のマウスに偽処理を行った。感染の2週間後、大腸炎スコアは、対照での3.6±0.4(SE)から感染マウスでの0.55±0.5(p=0.001)へと低下した。
【0211】
確立された大腸炎のH. polygyrusによる治癒は、LPMCのサイトカイン産生の変化に関連する。
【0212】
未処理の(ピロキシカムなしの)マウスから、または大腸炎の偽感染マウスから単離されたLPMCは、抗CD3/抗CD28による刺激に応じて多量のIFNγを放出し(図18)、CpGオリゴヌクレオチド(0.6μg #1826/ml)による刺激に応じてIL12を放出する。ピロキシカム処理したH. polygyrus感染IL10-/-マウスからのLPMCは、高感度の(30pg/ml)ELISAによって検出可能なIFNγをほとんどまたはまったく産生せず、IL12の放出の抑制を示す(図18)。未処理または大腸炎のIL10-/-マウスからのLPMCは、IL4を産生せず、IL13をほとんど産生しない(図19)。対照的に、H. polygyrus感染マウスからのLPMCは、いくらかのIL4および多量のIL13を産生する。蠕虫感染は大腸の炎症を逆転させるが、LPMCサイトカインプロフィールは、単に未処理のIL10-/-マウスのそれに戻るわけではない。むしろ、感染は、大腸炎の治癒に関連する新たなサイトカインプロフィールをもたらす。
【0213】
H. polygyrus感染はIL10-/-マウスのLPMCでの調節回路を活性化する。大腸炎のIL10-/-マウスからのIFNγを産生しているLPMCとH. polygyrus感染マウスからのLPMCとの1:1の混合は、IFNγ産生を阻害された共培養物をもたらす。
【0214】
H. polygyrusは十二指腸に生息するが、大腸炎を逆転させ、遠位のLPMCサイトカインプロフィールを変化させる調節回路を開始する。蠕虫感染は、H. polygyrus感染マウスのMLN T細胞区画内に存在する循環制御性細胞を誘導または活性化することが示された。H. polygyrus感染IL10-/-マウスからの20x106 MLN細胞または5x106 MLN T細胞の、確立されたIL10-/-大腸炎を有する動物への移植は、炎症の解消をもたらす(図20)。
【0215】
Scurfinはfoxp3遺伝子によってコードされる転写因子であり、制御性T細胞の増殖または活性に重要である。Foxp3転写産物は、リアルタイムRT-PCRによって定量されるように、寄生虫のないIL10-/-マウスと比較してH. polygyrus感染マウスのMLNにおいて増加する(図21)。1回1回のPCRサイクル閾値の減少は、HPRT mRNAに対して標準化された2倍のFoxp3含量に相当する。蠕虫感染は、MLN細胞において3〜5倍のFoxp3発現の増加を引き起こす。Foxp3はまた、寄生虫のない対照と比較して、H. polygyrus感染IL10-/-マウスのLPMCにおいても増加する(3倍)。制御性T細胞のみが、Foxp3を発現することが知られている(Hori, S. , T. Nomura,およびS. Sakaguchi. 2003. Control of regulatory T cell development by the transcription factor Foxp3. Science. 299: 1057-1061)。MLNおよびLPMCにおけるFoxp3発現の増加は、蠕虫が、確立された大腸炎の解消を指揮する制御性T細胞を誘導するという仮説を支持する。
【0216】
他の免疫調節因子の転写産物は、H. polygyrusへの感染によって変化する。Smad7はTGFβシグナル伝達を遮断する転写因子である。H. polygyrusへの感染は、リアルタイムRT-PCRによって測定されるように、MLN細胞のSmad7発現を4.5倍減少させる(図22)。Smad7転写産物はまた、LPMCにおいても減少する。Smad7の減少は、細胞が免疫調節性TGFβに対してより応答性になることを可能にする。更に、Smad7発現の減少は、複数の調節機構がおそらくIL10-/-大腸炎を解消するために機能していることを示す。
【0217】
Smad7のためのプライマーおよびプローブは、TCCTGCTGTGCAAAGTGTTC(配列番号4)、GAGTAAGGAGGAGGGGGAGA(配列番号5)、およびFAM-TTGATCTTCCCGTAAGATTCACAGCAACA-TAMRA(配列番号6)である。Foxp3およびSmad7 mRNAの発現は、HPRTに対して標準化される。HPRTのためのプライマーおよびプローブは、TGAAGAGCTACTGTAATGATCAGTCAAC(配列番号7)、GCAAGCTTGCAACCTTAACCAT(配列番号8)、およびTET-TGCTTTCCCTGGTTAAGCAGTACAGCCC-TAMRA(配列番号9)である。
【0218】
<他の実施形態>
上述の実施例は、本発明の作出および実施において、本発明者らによって行われ、企図された実験の実例を説明する。これらの実施例は、本発明の実施方法を知らせるため、およびその有用性を証明するための両方の目的を果たす技術の開示を含むと考えられる。本明細書において開示される技術および実施形態は単に好ましい実施形態であり、一般的に多数の同等の方法および技術が同様の結果を得るために使用されうることは、当業者によって認識されるであろう。
【0219】
本明細書の上記に特定された参考文献はすべて、それらが、本発明の1以上の実施形態の実施に重要でありうる組成物および/または方法の基礎を記載し、説明し、提供し、それを可能にする範囲で、ここで明確に参照により本明細書に組み入れられる。
【技術分野】
【0001】
本発明は、寄生虫組成物、ならびに免疫応答の変化に起因する状態もしくは病態の予防および/または治療におけるその使用に関する。
【背景技術】
【0002】
寄生虫は、それらの生活環のある部分を他の生物上または他の生物内で過ごす生物であり、宿主から栄養を得ている。腸に生息する寄生虫は、粘膜免疫系との複雑な相互作用を有する。それらは生存するために宿主の粘膜防御との安定した関係を確立しなければならない。
【0003】
異常なTh1またはTh2応答を引き起こす免疫系の調節異常は、いくつかのヒト疾患の原因となりうる。優勢なTh1応答によるいくつかの疾患は、IBD、関節リウマチ、サルコイドーシス、多発性硬化症、およびインスリン依存性糖尿病を含む。Th2関連疾患はアレルギー性疾患および癌を含む。
【0004】
最近、寄生虫暴露が実験的自己免疫性脳脊髄炎(EAE)の重症度を減少させることが示された(Sewellら、2003, International Immunology, 15: 59-69)。実験的自己免疫性脳脊髄炎(EAE)は、中枢神経系(CNS)の慢性炎症性脱髄を特徴とする多発性硬化症(MS)についての動物モデルである。Sewellは、マウスにおけるSchistosoma mansoniの卵子による免疫によって、EAEの重症度が、臨床スコアおよびCNS細胞浸潤物の減少によって測定されるように減少することを報告した。末梢におけるIFN-ガンマの減少、ならびにIL-4、形質転換成長因子-ベータ、およびIL-10レベルの増加があり、IL-4産生性神経抗原特異的T細胞の頻度は脳において増加する。
【0005】
クローン病は、Tヘルパー(Th)1型粘膜炎症の調節異常に起因する。クローン病は熱帯諸国では稀であるが、温帯気候の先進国では一般的であり、その発生率は1940年以降に上昇した。対照的に、蠕虫性寄生虫への暴露は熱帯諸国では一般的であるが、先進国では稀である。Elliottら(2003, Am. J. Physiol. Gastrointest. Liver Physiol., 284:G385-G391)は、蠕虫が過剰なTh1型炎症を軽減しうることを実証した。その仮説を検証するため、マウスを蠕虫Schistosoma mansoniの卵に暴露し、その後、大腸炎を誘発するためにトリニトロベンゼンスルホン酸(TNBS)を直腸投与した。住血吸虫卵暴露はTNBS大腸炎を軽減し、マウスを致死的な炎症から保護した。住血吸虫卵暴露は、TNBS処理されたマウスの抗CD3刺激した脾臓および腸間膜リンパ節細胞からのIFN-ガンマを減少させ、IL-4産生を上昇させた。住血吸虫卵暴露は、TNBS処理されたマウスにおいて、大腸のIFN-ガンマを減少させたが、IL-10 mRNAの発現を増加させた。大腸炎の軽減のためには、完全なシグナル伝達および転写活性化因子 6が必要とされた。この著者らは、蠕虫への暴露がマウスの大腸の炎症を減少させ得ることを示した。
【0006】
de Jongら(2002, J. Immunol., 168: 1704-1709)は、蠕虫Schistosoma mansoniに由来するタンパク質抽出物がOX40リガンドの発現の向上を介してTh2細胞の発達を促進するDC2の発達を誘導することを実証した。同様に、細胞外細菌Vibrio cholerae由来の毒素もまたDC2の発達を誘導するが、OX40リガンド非依存的な、未知の機構を介する。対照的に、細胞内細菌Bordetella pertussis由来の毒素はIL-12 産生の増加を伴うDC1の発達を誘導し、Th1細胞の発達を促進する。ポリ(I:C)(ウイルスを模倣したdsRNA)は、IL-12産生の増加を伴わずに非常に強力なTh1誘導性DC1の発達を誘導した。
【0007】
米国特許出願2003/0103938 A1は、Th1/Th2比を調節することによるヒトもしくは動物におけるTh1細胞またはTh2細胞関連疾患の予防または治療のための、IL-4およびSDF-1α、あるいはIL-2およびSDF-1αからなる医薬組成物を開示する。
【0008】
Doetzeら(2000, International Immunology, 12: 623-630)は、免疫があると推定される(PI)個体からのPBMCと比較した、慢性的な蠕虫感染を有する、すなわち、全身性回旋糸状虫症(GEO)の個体からの末梢血単核細胞(PBMC)によるOv抗原(OvAg)に対するT細胞増殖の低応答性を研究した。この研究では、GEOにおけるこの細胞の低応答性を仲介する機構が研究され、GEO個体からのPBMCにおける低い増殖応答は、PI個体からのものと比較した、IL-4産生の不足および有意に低いIL-5の産生と関連し、これは低応答性の原因である一般的なT(h)2応答へのシフトとは相反していた。対照的に、T(h)3応答に関連する2つのサイトカインであるIL-10および形質転換成長因子(TGF)-ベータは低応答性を仲介すると思われ、GEOの個体からのPBMCは有意に多くのIL-10を産生し、この群におけるT細胞増殖の低応答性は抗IL-10抗体および抗TGF-ベータ抗体の添加によって逆転され得た。この著者らは、低応答性がOvAgに特異的であり、近縁の線虫抗原による刺激では観察されないことを示し、これはT細胞を介したOv特異的なダウンレギュレーションを支持している。Ov特異的なT細胞はGEO PBMCからクローニングすることができ、それは進行中の炎症を抑制することが知られているT細胞サブセット(T(h)3およびT(r)1)と同様の、独特のサイトカインプロフィール(IL-2はないが、高いIL-10および/またはTGF-ベータを産生する)を有し、今のところ感染症では見いだされていないこの細胞種がOv特異的な低応答性の維持に関与しうることを示した。
【0009】
Th3細胞は制御性T細胞のサブセットであり、もともとは経口でMBPに対して寛容化されたマウスにおいて産生および同定され、TGF-b依存性の機構によって実験的自己免疫性脳脊髄炎(EAE)の誘導を抑制した(Chenら、1994, Science, 265: 1237-1240)。最近の研究は、制御性T細胞が細菌性、ウイルス性および寄生虫抗原に対してin vivoで誘導され得、防御性Th1応答を抑制することによって、自己免疫疾患、感染誘導性の免疫病理または病原体持続の延長を防止するかもしれないことを示唆する(例えば、McGuirkおよびMills, 2002, Trends in Immunology, 23: 450-455; Tungら、2001, Immunological Reviews, 182: 135-148;ならびにMaloyおよびPowrie, 2001, Nature Immunology, 2: 816-822参照)。
【0010】
制御性T細胞は一般的に、免疫応答、すなわち、抗体媒介性および/または細胞媒介性免疫の両方を抑制するリンパ球として記載されている(例えば、概説として、McGuirk P, Mills KH. Pathogen-specific regulatory T cells provoke a shift in the Th1/Th2 paradigm in immunity to infectious diseases. Trends Immunol 2002; 23 (9): 450-5; Field, A. C., L. Caccavelli, M. F. Bloch,および B. Bellon. 2003. Regulatory CD8+ T cells control neonatal tolerance to a Th2-mediated autoimmunity. Journal of Immunology. 170: 2508-2515; von Herrath MG, Harrison LC. Antigen-induced regulatory T cells in autoimmunity. Nat Rev Immunol. 2003 Mar; 3 (3): 223-32; Francois Bach J. Regulatory T cells under scrutiny. Nat Rev Immunol. 2003 Mar; 3 (3): 189-98; Curotto de Lafaille MA, Lafaille JJ. CD4 (+) regulatory T cells in autoimmunity and allergy. Curr Opin Immunol. 2002 Dec; 14 (6):771-8; McGuirk P, Mills KH. Pathogen-specific regulatory T cells provoke a shift in the Th1/Th2 paradigm in immunity to infectious diseases. Trends Immunol. 2002 Sep; 23 (9): 450-5; Tung KS, Agersborg SS, Alard P, Garza KM, Lou YH. Regulatory T-cell, endogenous antigen and neonatal environment in the prevention and induction of autoimmune disease. Immunol Rev. 2001 Aug; 182: 135-48; Read S, Powrie F. CD4 (+) regulatory T cells. Curr Opin Immunol. 2001 Dec; 13 (6): 644-9; Yssel H, Lecart S, Pene J. Regulatory T cells and allergic asthma. Microbes Infect. 2001 Sep; 3(11) : 899-904参照)。これらの制御性T細胞(Tr細胞)は、インターロイキン-2(IL-2)の受容体のアルファ鎖である(CD25と呼ばれる)膜貫通タンパク質を発現する。他のT細胞と同様に、それらはまた、抗原に対するαβ(アルファ-ベータ)T細胞受容体(TCR)を発現し、それが特異的なペプチド-クラスII MHC分子に、またはCD8制御性細胞の場合にはクラスI MHCに結合した場合にのみ、活性化され得る。しかし、活性化された場合には、それらは多量のインターロイキン10(IL-10)を分泌しはじめ、しばしば更にいくらかの形質転換成長因子-ベータ(TGF-β)を分泌しはじめる。これらの両リンフォカインは、細胞媒介性免疫および炎症のためのTh1の支援、抗体産生のためのTh2の支援、ならびに場合によっては、CD8+細胞傷害性Tリンパ球(CTL)の作用を阻害する強力な免疫抑制物質である。いくつかの他の制御性T細胞は、Tr細胞とは異なる。例えば、Tr1細胞は、それらの表面に多量のCD25を発現しないけれども、いくつかの点でTr細胞と類似している。それらはその形成のためにIL-10を必要とし、一旦成熟すると、大量のそれを分泌する。Th3細胞の主要なリンフォカインはTGF-βである。
【0011】
制御性T細胞が蠕虫性寄生虫調製物を用いたTh1もしくはTh2関連疾患の予防または治療において役割を果たすかどうかは依然として不明である。
【発明の概要】
【0012】
本発明は、寄生虫調製物がTh1またはTh2関連疾患の治療において制御性T細胞の活性を変化させ得るという発見に基づく。
【0013】
1つの実施形態では、本発明は、制御性T細胞活性を変化させる蠕虫性寄生虫調製物をスクリーニングする方法を提供し、その方法は以下のステップ、すなわち、(a)蠕虫性寄生虫調製物を得るステップ、(b)蠕虫性寄生虫調製物を標的と接触させるステップ、および(c)接触後の標的において制御性T細胞活性のための内部マーカーのレベルを測定するステップを含み、ここで、接触後の内部マーカーのレベルの変化は、制御性T細胞活性を変化させる蠕虫性寄生虫調製物の指標となる。
【0014】
別の実施形態では、本発明は、制御性T細胞活性を変化させる蠕虫性寄生虫調製物をスクリーニングする方法を提供し、その方法は以下のステップ、すなわち、(a)蠕虫性寄生虫調製物を得るステップ、(b)蠕虫性寄生虫調製物を標的と接触させるステップ、および(c)接触後の標的において制御性T細胞のための細胞表面マーカーのレベルを測定するステップを含み、ここで、接触後の細胞表面マーカーのレベルの変化は、制御性T細胞活性を変化させる蠕虫性寄生虫調製物の指標となる。
【0015】
別の実施形態では、本発明は、制御性T細胞活性を変化させる蠕虫性寄生虫調製物を動物に投与することにより、Th1またはTh2関連疾患を有する動物を治療する方法を提供する。
【0016】
別の実施形態では、本発明は、動物における自己免疫疾患またはアレルギー疾患に対する蠕虫性寄生虫調製物の治療効果を測定する方法を提供し、その方法は、(a)蠕虫性寄生虫調製物もしくはその画分を含む組成物を動物に投与すること、および(b)投与後の動物において制御性T細胞活性のレベルを測定することを含み、ここで、投与後の制御性T細胞活性のレベルの増加は、蠕虫性寄生虫調製物の治療効果の指標となる。
【0017】
好ましくは、治療される疾患は、炎症性腸疾患、関節リウマチ、狼瘡、若年性インスリン依存性糖尿病(1型)、サルコイドーシス、多発性硬化症、喘息およびアレルギー性鼻炎からなる群より選択されるものの1つである。
【0018】
制御性T細胞のマーカーは、内部マーカー、細胞表面マーカー、または分泌マーカーでありうる。
【0019】
好ましくは、内部マーカーは、Scurfin、Smad7、Gata3、Tbet(Tbx21)である。
【0020】
また好ましくは、細胞表面マーカーは、CD4、CD45RBlo、CD45Rc、細胞傷害性Tリンパ球関連抗原4(CTLA-4)、CD25、CD103、CD62L、αEβインテグリン、潜伏関連ペプチド(LAP)またはグルココルチコイド誘導性TNF受容体ファミリー関連タンパク質(GITR)、実験的アレルギー性脳炎(EAE)、ケモカイン受容体CCR5、TI-ST2からなる群より選択される。
【0021】
また好ましくは、分泌マーカーは、IL-5、IL-10またはTGFβである。
【図面の簡単な説明】
【0022】
【図1】図1は、本発明の1つの実施形態に従ってM. avium、 S. mansoniまたは両生物に感染したマウスの脾臓細胞上清において測定された、IFNγ、IL-4およびIL-5の濃度を示す。脾細胞(4 x 105/ウェル)は、in vitroにおいて37℃で48時間、最適濃度のPPDもしくはSEAの存在下または非存在下で200μlの培地中で培養された。サイトカイン分泌はELISAによって定量された。
【図2】図2は、本発明の1つの実施形態に従ってM. avium、 S. mansoniまたは両生物に感染したマウスの肉芽腫細胞上清におけるIFNγおよびIL-4の濃度を示す。200μlの培地中の肉芽腫細胞(4 x 105/ウェル)は、in vitroにおいて37℃で48時間、最適濃度のPPDもしくはSEAの存在下または非存在下で培養された。サイトカインはELISAによって定量された。
【図3】図3は、本発明の1つの実施形態に従ってM. avium、 S. mansoniまたは両方(同時)に感染したマウスにおいて測定された、血清IgG1、IgEおよびIgG2aレベルを示す。免疫グロブリン濃度はELISAによって測定された。
【図4】図4は、IL-4処理が、本発明の1つの実施形態に従った慢性H. polygyrus感染のマウスを治療できることを示す。マウスは、屠殺の12日前に開始するIL-4複合体の3回の注射を受けた。データは多重測定の平均値+/-SEである。
【図5】図5のデータは、本発明の1つの実施形態に従った>4 WTマウス/群を解析した3回の個別の実験からの平均炎症スコア±SDを示す。
【図6】本発明の1つの実施形態に従って、IBDのないWTマウスをH. polygyrusに感染させた。対照は偽投与を受けた。TIからLPMCを単離し、in vitroにおいて48時間、抗CD3/抗CD28刺激の存在下または非存在下で培養した。上清中のIFNγはELISAを用いて測定された。データは2回の独立実験からの6回の測定の平均値±SEである。
【図7】本発明の1つの実施形態に従って、WTマウスを図2でのように処理した。単離したLPMCをin vitroにおいて48時間、CpGオリゴとともに培養し、IL12産生を促進した。IL12はELISAを用いて測定された。データは2回の独立実験からの6回の測定の平均値±SEである。
【図8】本発明の1つの実施形態に従って、IBDのないWTマウスをH. polygyrusに感染させた。対照は偽投与を受けた。2週間後図2でのようにLPMCを単離し、培養した。データは2回の独立実験からの6回の測定の平均値±SEである。
【図9】本発明の1つの実施形態に従って、WTマウスをH. polygyrusに感染させた。LPMCを単離し、in vitroにおいて48時間、抗CD3/抗CD28 +/- αIL10R mAbとともに培養した。上清中のIFNγはELISAを用いて測定された。データは3回の独立実験の平均値±SEである。
【図10】本発明の1つの実施形態に従って、IBDのないWTマウスをH. polygyrusに感染させた。対照は偽投与を受けた。2週間後図2でのようにLPMCを単離し、培養した。データは2回の独立実験からの6回の測定の平均値±SEである。
【図11】本発明の1つの実施形態に従って、IBDのないWTマウスをH. polygyrusに感染させた。対照は偽投与を受けた。2週間後図2でのようにLPMCを単離し、培養した。データは2回の独立実験からの6回の測定の平均値±SEである。
【図12】本発明の1つの実施形態に従って、IBDのないWTマウスをH. polygyrusに感染させた。対照は偽投与を受けた。2週間後図2でのようにLPMCを単離し、培養した。LPMCをTIから単離し、in vitroにおいて48時間、LPS刺激の存在下または非存在下で培養した。データは3回の独立実験からの9回の測定の平均値±SEである。
【図13】本発明の1つの実施形態に従って、分散させた腸管LPMCから磁気ビーズを用いてT細胞を単離した。T細胞濃縮(T cells)画分およびT細胞除去(non T)画分を、上清中のIFNγをアッセイする前に、in vitroにおいて48時間、抗CD3/抗CD28刺激の存在下または非存在下で培養した。データは2回の独立実験からの6回の測定の平均値±SEである。
【図14】本発明の1つの実施形態に従って、WT非感染マウスに、H. polygyrusに感染したマウスから2 x 107 のMLN細胞を与えた。1週間後、これらのレシピエントからLPMCを単離し、上清中のIFNγをアッセイする前に、48時間、抗CD3/抗CD28刺激の存在下または非存在下で培養した。データは2回の独立実験からの6回の測定の平均値±SEである。
【図15】本発明の1つの実施形態に従って、GFP WTマウスをH. polygyrusに感染させた。2週間後、これらの蠕虫馴化GFPマウス由来のMLN細胞を正常なC57BL/6マウスにI. P.注射によって移植した。7日後、固有層を分散させ、蛍光顕微鏡下でGFP+ T細胞について検査した。A)GFP+ LP T細胞。B)光学顕微鏡下での同一視野。
【図16】本発明の1つの実施形態に従って、IL10-/-動物に5週齢からピロキシカムを含む飼料を与えた。処理の2週間後、ピロキシカムを止め、2週間後に大腸炎を評価した。週齢を適合させたIL10-/-対照にはピロキシカムを与えなかった(対照)。大腸炎は、組織切片において0〜4点制を用いて盲検の計測者によってスコアされた。A)対照IL10-/-マウスの大腸。B)ピロキシカム処理後の週齢を適合させたIL10-/-マウスの大腸。C)大腸固有層のピロキシカム後のCD4+ T細胞による浸潤(H&E 10X, IHC 20X)。グラフデータは、各5〜6マウス/群の5回の個別の実験からの平均値である。
【図17】本発明の1つの実施形態に従って、パネルA、BおよびCは、H. polygyrusを受けていなかったピロキシカム処理マウスにおける典型的な大腸の炎症を示す。D、EおよびFは、H. polygyrusを受けた2週間後の大腸炎の改善を示す(すべてH&E, 4X)。大腸炎は0〜4点制でスコアされた。データは2回の個別の実験において研究された11動物の平均値±SEである。
【図18】本発明の1つの実施形態に従って、大腸炎のIL10-/-マウスは、図12に記載されるようにH. polygyrusまたは偽投与を受けた。2週間後、LPMCを単離し、in vitroにおいて48時間、抗CD3/抗CD28刺激(IFNγ)の存在下もしくは非存在下で、またはCpGオリゴ(IL12)の存在下で培養した。データは3回の独立実験からの8〜9回の測定の平均値±SEである。
【図19】本発明の1つの実施形態に従って、大腸炎のIL10-/-マウスを図13でのように処理した。データは3回の独立実験からの9回の測定の平均値±SEである。
【図20】本発明の1つの実施形態に従って、A)H. polygyrusまたは偽(対照)投与を受けた2週間後のIL10-/-マウスから単離したMLN細胞を、i. p. 注射によってピロキシカム処理マウスに移植した(20 x 106)。移植2週間後、大腸炎を図12でのように評価した。B)対照マウスまたは感染マウスから単離したMLN T細胞を大腸炎のマウスに移植した(5 x 106)。データは2回の個別の実験における9マウス/群からの平均値±SEである。
【図21】本発明の1つの実施形態に従って、偽投与またはH. polygyrus投与の2週間後、2週間の偽処理またはピロキシカム処理を行ったIL10-/-マウスから単離したMLN細胞から、mRNAを抽出した。Foxp3のリアルタイムPCRはHPRT mRNAで標準化された(方法)。注記:発現が高ければ高いほど、閾値に達するためにより少ないPCRサイクルを必要とする。データは各4マウス/群を用いた3回の独立実験からの平均値±SEである。
【図22】本発明の1つの実施形態に従って、偽投与またはH. polygyrus投与の2週間後、IL10-/-マウスのMLN細胞からmRNAを抽出した。発現が低ければ低いほど、閾値に達するためにより多くのPCRサイクルを必要とする。データは各4マウス/群を用いた3回の独立実験からの平均値±SEである。
【図23】図23は、本発明の1つの実施形態に従った抗原調製方法の概略図である。
【発明を実施するための形態】
【0023】
<発明の詳細な説明>
本発明は制御性T細胞活性を変化させる寄生虫調製物をスクリーニングする方法を含む。
【0024】
本明細書において用いられる場合、「蠕虫性寄生虫調製物」という用語は、寄生虫全体、寄生虫抽出物、寄生虫卵子、寄生虫卵子抽出物、寄生虫卵、寄生虫卵抽出物、寄生虫幼虫、寄生虫幼虫抽出物、寄生虫セルカリアおよび寄生虫セルカリア抽出物の任意の1つを含むが、それらに限定されない。「寄生虫調製物」はまた、寄生虫およびその抽出物に由来する単離されたタンパク質、ポリヌクレオチド、糖質または脂質でありうる。
【0025】
本明細書において用いられる場合、「特定病原体を含まない」という用語は、その動物が標的動物またはヒトにおいて疾患の原因となり得る特定の病原微生物を含まないことが知られている場合に、本発明における使用のために飼育された動物に対して適用された。病原体を含まない動物を飼育する方法は当技術分野において知られており、例えば、http://www.ctsa.org/upload/publication/CTSA_116631681202959092495.pdfで入手可能なBrownら、A Bibliography on the Culture and Maintenance Specific Pathogen-Free Organisms(参照により本明細書に組み入れられる)に従った参考文献を参照せよ。Brownらは、異なる家畜および実験動物をSPF環境で飼育するための参考文献、ならびに建築設計および管理における手順および必要条件を提供する。また、SPFの手順およびいくつかの懸念される潜在的なヒトウイルス性および細菌性病原体のリストについては、M. Michael Swindle(J. Invest. Surg., 9: 267-271,1996、参照により本明細書に組み入れられる)を参照せよ。
【0026】
本明細書において用いられる場合、「制御性T細胞」という用語は、ナイーブT細胞と比較して、少なくとも2倍に増加した(例えば、3倍、4倍、5倍、6倍、8倍、10倍もしくはそれ以上の)IL-10および/またはTGFβを分泌するリンパ球集団を指す。IL-10またはTGFβ分泌の測定は当技術分野において知られている。例えば、それは、細胞をin vitroにおいて24もしくは48(時間)、抗CD3のようなT細胞刺激物質の存在下または非存在下で培養し、その後、培養上清をこれらのサイトカインについてサイトカイン特異的ELISAを用いてアッセイすることにより測定されうる。加えて、本発明の制御性T細胞はまた、他の種類のT細胞(例えば、ナイーブT細胞)と比較して、高レベルのFoxP3転写産物を特徴とする。「高レベルのFoxP3転写産物」とは、他の種類のT細胞と比較して少なくとも4倍に増加したレベルを指す。FoxP3は、(例えば、Hori, S., T. Nomura,およびS. Sakaguchi. 2003. Control of regulatory T cell development by the transcription factor Foxp3. Science. 299: 1057-1061に記載されるような、PCRプライマーCCCAGGAAAGACAGCAACCTT、TTCTCACAACCAGGCCACTTG(配列番号1)、および標識プローブ6FAM-ATCCTACCCACTGCTGGCAAATGGAGTC-TAMRA(配列番号2)を用いた)リアルタイムPCRまたは定量PCRの使用によって検出可能である。値は、ハウスキーピング遺伝子であるHPRT発現に対して標準化される。あるいは、FoxP3タンパク質産物であるScurfinは、例えば、ヤギ抗FoxP 3(FoxP3)ポリクローナル抗体(カタログ番号ab2481, Novus Biologicals, Littleton, CO)を用いて、当技術分野において知られているようなウェスタンブロッティング解析によって検出され得る。状況に応じて、制御性T細胞はまた、他の種類のT細胞(例えば、ナイーブT細胞)と比較してずっと少ない、すなわち、少なくとも2倍、好ましくは3倍、4倍、5倍、6倍、7倍、8倍、10倍またはそれ以下のIFNγを産生しうる。また状況に応じて、制御性T細胞はまた、IL 10および/またはTGFβを発現するがIFNγをほとんどもしくはまったく発現しないT細胞を検出するための、細胞質内流量解析の使用によっても検出され得る。本明細書の下記に記載されるような更なる任意のマーカーもまた、制御性T細胞または制御性T細胞の活性の検出のために使用されうる。
【0027】
本明細書において用いられる場合、「ナイーブT細胞」という用語は、骨髄において免疫系の新しい細胞の産生から生じるT細胞を指す。ナイーブT細胞は、以前に免疫系が処理したことがない抗原を含む新たに遭遇した病原体に応答する。ナイーブT細胞は、当技術分野において既知の方法によって同定されうる(概説として、例えば、Toughら、1999, Immunol Rev. 170: 39-47; Itanoら、2003, Nat Immunol. 4(8) : 733-9; Berardら、2002, Immunology. 106 (2):127-38参照)。
【0028】
本明細書において用いられる場合、「制御性T細胞活性を変化させる寄生虫調製物」という用語は、寄生虫調製物と接触していない標的における制御性T細胞活性と比較して、標的との接触で、標的における制御性T細胞の活性を少なくとも40%、例えば、50%、80%、100%、2 倍、4倍、6倍、8倍、10倍、またはそれ以上にまで変化させる寄生虫調製物を指す。制御性T細胞の活性は、制御性T細胞の内部マーカー(例えば、FoxP3 mRNAもしくはそのタンパク質産物Scurfin、Smad7、Gata3、またはTbet(Tbx21)などの転写因子)、あるいは制御性T細胞の表面マーカー(例えば、CD4、CD45RBlo、CD45Rc、細胞傷害性Tリンパ球関連抗原4(CTLA-4)、Ox40、4-1BB、CD25、CD103、CD62L、αEβインテグリン、潜伏関連ペプチド(LAP)またはグルココルチコイド誘導性TNF受容体ファミリー関連タンパク質(GITR)、実験的アレルギー性脳炎(EAE)、ケモカイン受容体CCR5、TI-ST2)、あるいは分泌マーカー(例えば、IL4、IL13、IL-5、IL-10、TGFβ)のレベルを観察することによって測定されうる。制御性T細胞活性の増加は、制御性T細胞のマーカーのレベルにおける少なくとも40%、例えば、50%、80%、100%、2 倍、4倍、6倍、8倍、10倍、またはそれ以上までの増加(例えば、FoxP3、Ox40、4-1BB、CD4、CTLA-4、CD25、CD103、CD62L、αEβインテグリン、LAP、GITR、EAE、CCR5、TI-ST2、IL-10、TGFβ)または減少(例えば、D45Rc)によって示され、当技術分野において既知の方法に従って、本明細書に記載されるように測定されうる。
【0029】
好ましくは、制御性T細胞活性を変化させる寄生虫調製物は、本明細書の上記に記載される2つ以上のマーカーのレベルを変化させる。
【0030】
本明細書において用いられる場合、「制御性T細胞マーカーのレベル」という用語は、例えば、マイクログラムまたはモル濃度の量で測定される、標的における特定の制御性T細胞マーカーの量を指す。通常、制御性T細胞マーカーはタンパク質であり、その量はタンパク質定量のために当技術分野において既知の任意の方法、例えば、ELISA、ウェスタンブロット、免疫沈降、ラジオイムノアッセイ、またはFACS解析(例えば、Innisら、(1990) Academic Press, Inc.; Molecular Cloning, A Laboratory Manual (第二版、Sambrook,ら(1989);およびCurrent Protocols in Molecular Biology (1997, Ausubelら、John Weley & Sons, Inc.)によって測定されうる。タンパク質マーカーのレベルはまた、当技術分野において既知の方法に従って、例えば、ノーザンブロット、定量RT-PCR、マイクロアレイ解析(例えば、Innisら、(1990) Academic Press, Inc.; Molecular Cloning, A Laboratory Manual (第二版、Sambrook,ら(1989);およびCurrent Protocols in Molecular Biology (1997, Ausubelら、John Weley & Sons, Inc.)により、そのmRNAレベルでも測定されうる。
【0031】
本明細書において用いられる場合、「標的」という用語は、in vitroでの系(例えば、培養組織もしくは細胞、転写/翻訳抽出物)またはin vivoでの系(例えば、動物)を指す。
【0032】
好ましくは、標的は、ヒト細胞を含む動物細胞を含んでいるin vivoでの系である。より好ましくは、標的は動物である。なお好ましくは、標的は哺乳動物である。更により好ましくは、標的はヒトである。
【0033】
本発明はまた、動物における疾患を予防または治療するために十分な量の蠕虫性寄生虫調製物を投与することを含んでいる、動物における免疫応答の変化によって起こる疾患を予防または治療する方法を含む。
【0034】
本明細書において用いられる場合、「免疫応答の変化によって起こる疾患」という用語は、動物(例えば、ヒト)が、疾患を持たない動物と比較して、その免疫応答の違いのために発症する疾患を指す。例えば、疾患動物は、正常な疾患を持たない動物における同一抗原への応答と比較して、異常な(例えば、過剰なまたは不十分な)抗原(例えば、自己抗原または非自己抗原)への免疫応答を有しうる。本発明の「免疫応答の変化によって起こる疾患」は、本明細書に記載されるようなTh1関連疾患またはTh2関連疾患を含むが、それらに限定されない。
【0035】
本明細書において用いられる場合、「Th1関連疾患」という用語は、Th1細胞が疾患過程を支持する、疾患過程の原因となる、もしくは疾患過程を媒介する、またはTh1細胞が疾患の症状の治癒もしくは軽減に関与する疾患を指し、それはTh1活性の向上または低下によってもたらされうる。「向上した」とは、疾患を持たない別の動物と比較して、罹患動物が、そのTh1活性の増加(例えば、少なくとも2倍、あるいは5倍、6倍、8倍、10倍、またはそれ以上)を有することを意味する。Th1活性の向上は、分泌されるサイトカイン(例えば、IL-2、IFN-γ、TNFα、IgG2a、IL-12、IL-18、IL-23)のレベルの増加、または分泌されるサイトカイン(例えば、IL-4、IL-13)のレベルの減少によって、当技術分野において既知の方法に従って測定されうる。「低下した」とは、疾患を持たない別の動物と比較して、罹患動物が、そのTh1活性の減少(例えば、少なくとも50%低い、または2倍、あるいは5倍、6倍、8倍、10倍、またはそれ以下)を有することを意味する。Th1活性の低下は、分泌されるサイトカイン(例えば、IFN-γ、TNFα、IgG2a)のレベルの減少、または分泌されるサイトカイン(例えば、IL-4、IL-13)のレベルの増加によって、当技術分野において既知の方法に従い、ならびに本明細書および出願番号第09/209,732号および第09/362,598号の米国特許出願(それぞれの全体が参照により組み入れられる)に記載されるように測定されうる。
【0036】
本明細書において用いられる場合、「低下した」という用語は「減少した」という用語と同義的に使用され、「増加した」という用語は「向上した」という用語と同義的に使用される。
【0037】
本明細書において用いられる場合、「Th2関連疾患」という用語は、Th2細胞が疾患過程を支持する、疾患過程の原因となる、もしくは疾患過程を媒介する、またはTh2細胞が疾患の症状の治癒もしくは軽減に関与する任意の疾患を指し、それはTh2活性の向上または低下によってもたらされうる。「向上した」とは、疾患を持たない別の動物と比較して、罹患動物が、そのTh2活性の増加(例えば、少なくとも2倍、あるいは5倍、6倍、8倍、10倍、またはそれ以上)を有することを意味する。Th2活性の向上は、分泌されるサイトカインおよび抗体(例えば、IL-4、IL-5、IgEおよびIgG1)のレベルの増加によって、当技術分野において既知の方法に従って測定されうる。「低下した」とは、疾患を持たない別の動物と比較して、罹患動物が、そのTh2応答の減少(例えば、少なくとも50%、2倍、あるいは5倍、6倍、8倍、10倍、またはそれ以下)を有することを意味する。Th2活性の低下は、分泌されるサイトカインおよび抗体(例えば、IL-4、IL-5、IgEおよびIgG1)のレベルの減少によって、当技術分野において既知の方法に従い、ならびに本明細書および出願番号第09/209,732号および第09/362,598号の米国特許出願(それぞれの全体が参照により組み入れられる)に記載されるように測定されうる。
【0038】
本明細書において用いられる場合、「治療効果」という用語は、寄生虫調製物を用いた疾患の治療の有効性を指す。「治療効果」は通常、動物が寄生虫調製物によって治療されたまたは治療されている、特定の疾患に対する臨床反応によって測定される。
【0039】
<本発明に有用な蠕虫性寄生虫>
有用な蠕虫性寄生虫は、2つの群を含むがそれらに限定されない。第一群は本来ヒトに感染する蠕虫性寄生虫であり、第二群は動物に感染するがヒトを保護しうる蠕虫性寄生虫である。
【0040】
第一群では、蠕虫性寄生虫は、複雑な生活環および発生を有する精巧な多細胞寄生虫である。線虫(体節を持たない線形動物)および扁形動物(flat worms)はヒトの腸に感染する蠕虫の2つの群である。本発明に従って、本来ヒトまたは動物に感染する多数の蠕虫性寄生虫のうちの任意の1つが、意図した結果を提供するであろう。
【0041】
ヒトの消化管にしばしば生息する線虫は、Ascaris lumbricoides、Enterobius vermicularis(蟯虫)、Trichuris trichiura(鞭虫)、Ancylostoma duodenale およびNecator americanus(鉤虫)、ならびにStrongyloides stercoralisである。Trichinella spiralisは小腸に短期間寄生する。
【0042】
扁形動物は吸虫および条虫を含む。ヒトの腸に存在する最も一般的な成体の吸虫は、Fasciolopsis、EchinostomaおよびHeterophyesの種である。胆管系で生活するものは、Clonorchis sinensis、Opisthorchis viverriniおよびfelineus、ならびにFasciola hepaticaを含む。Schistosomaは静脈系に生息するが、いくつかの種は腸壁を介した卵の通過によって慢性的に消化管に影響を及ぼす。一般的にヒトに感染する成体の条虫は、Diphyllobothriumの種(広節裂頭条虫)、Taenia saginata(無鉤条虫)、Taenia solium(有鉤条虫)およびHymenolepsis nana(小形条虫)である。
【0043】
対象となる他の蠕虫は、寄生糸状虫および肺吸虫を含む。これらは消化管段階を持たないが、強力なTh2型応答を活性化する。
【0044】
本発明において利用され得る蠕虫性寄生虫の第二の一般的な群は、動物に感染するが、免疫性疾患に対するヒトの防御に影響を及ぼしうる蠕虫を含む。これらは、Trichuris muris(マウス鞭虫)、Trichinella spiralis、Nippostrongylus brasiliensis、Heligmonsomoides polygyrusおよびHymenolepsis nanaを含み、それらはすべてマウスに感染する腸管寄生蠕虫である。加えて、Angiostrongylusはラットの蠕虫である。Trichuris suisおよびAscaris suumは、ヒトに感染し得るブタの蠕虫である。Trichuris vulpis、Toxocaraの種、Gnathostoma、およびAncylostomaは、ヒトにも感染し得るイヌまたはネコの蠕虫である。AnisakisおよびPseudoterranovaは、ヒトに感染し得る海洋哺乳動物の線虫である。鳥類の住血吸虫は一過性にヒトに感染し得る。このような住血吸虫は、S. douthitti、Trichobilharzia ocellata、T. stagnicolae、T. physellae、およびGigantobilharzia huronensisを含む。
【0045】
蠕虫調製物は、本来ヒトに感染する蠕虫、および動物に感染するが免疫応答の変化によって起こる疾患からヒトまたは動物を保護しうる蠕虫からなる群より選択されうる。
【0046】
本発明のいくつかの実施形態では、蠕虫性寄生虫は線虫であり、Ascaris lumbricoides、Enterobius vermicularis、Trichuris trichiura、Ancylostoma duodenaleおよびNecator americanus、Strongyloides stercoralisおよびTrichinella spiralisなどの群より選択されうる。
【0047】
本発明の他の実施形態では、蠕虫性寄生虫は扁形動物であり、Fasciolopsis、EchinostomaおよびHeterophyesの種、Clonorchis sinensis、Opisthorchis viverrini、Opisthorchis felineus、Fasciola hepatica、Schistosomaの種、Diphyllobothriumの種、Taenia saginata、Taenia soliumおよびHymenolepsis nanaなどの吸虫ならびに条虫からなる群より選択されうる。
【0048】
他の実施形態では、蠕虫性寄生虫は、寄生糸状虫および肺吸虫からなる群より選択される。
【0049】
好ましい実施形態では、蠕虫性寄生虫は、Trichuris muris、Trichinella spiralis、Nippostrongylus prasiliensis、Heligmonsomoides polygyrus、Hymenolepsis nanan、Angiostrongylusの種、Trichuris suis、Ascaris suum、Trichuris vulpis、Toxocaraの種、Gnathostomaの種、Ancylostomaの種、Anisakisの種およびPseudoterranovaの種からなる群より選択される。
【0050】
寄生虫の産生および調製のための準備用動物は、特定病原体を含まない(SPF)(例えば、特定のヒト病原体を含まない)環境において飼育されることが好ましい。
【0051】
本発明によって治療可能な疾患
本発明によって治療可能な疾患の例は、Th1またはTh2に関連した癌を含むTh1関連疾患およびTh2関連疾患を含むが、それらに限定されない。
【0052】
Th1関連疾患
Th1関連疾患は、以下の疾患群、すなわち、感染性疾患、自己免疫疾患、遅延型過敏症および癌を含む。
【0053】
感染性疾患の群は、寄生虫およびHIVのようなウイルスに起因する疾患を含む。
【0054】
自己免疫疾患の群は、脳脊髄障害性、脱髄性および他の自己免疫疾患を含む。
【0055】
脳脊髄障害性疾患の例は、多発性硬化症(MS)、散在性硬化症(disseminated sclerosis)、巣状硬化症、島状硬化症(insular sclerosis)、脊髄癆(後硬化症)、MSの動物モデルである急性および慢性実験的アレルギー性(または自己免疫性)脳脊髄炎(EAE)、ギラン・バレー症候群、実験的アレルギー性神経炎(ギラン・バレー症候群の動物モデル)、急性散在性脳脊髄炎、(良性および流行性)筋痛性脳脊髄炎、ウイルス性脳脊髄炎、肉芽腫性脳脊髄炎等を含むが、それらに限定されない。イヌジステンパー、ネコジステンパー、(東部、ベネズエラ、および西部)ウマ脳脊髄炎、トリ脳脊髄炎、ブタ脳脊髄炎、ウシ脳脊髄炎、マウス脳脊髄炎等の動物疾患もまた含まれるが、それらに限定されない。
【0056】
脱髄疾患の例は、多発性硬化症(MS)、散在性硬化症(DS)、急性散在性脳脊髄炎、進行性多病巣性白質脳障害(PML)、および亜急性硬化性全脳炎(SSPE)を含むが、それらに限定されない。
【0057】
他の自己免疫疾患の例は、多発性硬化症(MS)、結節性多発性動脈炎、喘息、過敏性肺臓炎、間質性肺炎、サルコイドーシス、特発性肺線維症、クローン病または潰瘍性大腸炎またはウィップル病と関連した間質性肺炎、ヴェーゲナー肉芽腫症または過敏性血管炎と関連した間質性肺炎、
血管炎症候群、ヘノッホ・シェーンライン紫斑病、グッドパスチャー症候群、ヴェーゲナー肉芽腫症、
急性糸球体腎炎におけるような抗体媒介性の糸球体症、全身性紅斑性狼瘡(SLE)に関連した腎炎、ヴェーゲナー肉芽腫症およびグッドパスチャー症候群および混合性結合組織病などの他の全身性疾患に関連した腎炎、慢性間質性腎炎、慢性糸球体腎炎、などの腎疾患
クローン病、潰瘍性大腸炎、セリアック病、ウィップル病、コラーゲン蓄積大腸炎、好酸球性大腸炎、リンパ球性大腸炎、などの胃腸疾患(例えばIBD)、
自己免疫性肝炎、アルコール性肝炎、門脈周囲の線維化、原発性胆汁性肝硬変、硬化性胆管炎などの肝胆汁性疾患、
乾癬、アトピー性皮膚炎、湿疹、アレルギー性皮膚疾患、全身性進行性硬化症(強皮症)、剥脱性皮膚炎、尋常性天疱瘡などの皮膚疾患、
関節リウマチ(RA)、強直性脊椎炎、乾癬または炎症性腸疾患に関連した関節炎などの関節疾患、
重症筋無力症(MG)、多発性筋炎などの筋骨格疾患、
インスリン依存性糖尿病(IDDM)、自己免疫性甲状腺炎(橋本病)、甲状腺中毒症、甲状腺機能亢進症(グレーブス病)などの内分泌疾患、
自己免疫性貧血、自己免疫性血小板減少症、自己免疫性再生不良性貧血などの造血器系疾患、
心筋症、血管炎、全身性紅斑性狼瘡、結節性多発動脈炎、関節リウマチ、強皮症、サルコイドーシスのような全身性疾患に関連した循環器疾患などの循環器疾患を含む。
【0058】
自己免疫疾患の注目すべき特徴は、それらの家族集積性であり、特定の遺伝子、具体的にはクラスIおよびクラスII主要組織適合複合体(MHC)の遺伝子の発現と関連する。例えば、MS患者の大部分はHLA-DR2ハプロタイプを有する(Beall S S, Concannon P, Charmley P,ら、J. Neuroimmunol., v 21, p 59-66, 1989)。感受性遺伝子型を有するすべての患者が自己免疫疾患を発症するわけではないので、環境因子もまた重要な役割を果たすと考えられる。例えば、MSは温帯気候地域に住む患者においてより一般的であると思われる(Multiple Sclerosis, Hallpike J F, Adams C W M, Tourtelotte W W, 編、Williams and Wilkins, Baltimore, Md., 1983, p 49-95におけるKurtzke J F)。自己免疫疾患の環境因子はウイルスのような感染物質でありうると長らく推測されていた。いくつかのヒトおよび動物の疾患の病因は、ウイルス感染が原因となり得る。例えば、タイラーマウス脳脊髄炎は、EAEに類似した臨床的徴候および病理学的徴候を有する脱髄疾患である。抗体は自己免疫疾患のいくつかのエフェクター応答に関与するが、ほとんどの場合、引き金となる出来事はB細胞の成熟およびクローン性増殖に必要とされるCD4 T細胞の活性化から始まる。
【0059】
遅延型過敏症の群は、低分子量物質に対する接触過敏症を引き起こす。
【0060】
A. 炎症性腸疾患(CDおよびUC):
疫学データは、クローン病(CD)および潰瘍性大腸炎(UC)への遺伝的感受性を示唆する。工業化社会におけるCDの発生率は、1950年代から1980年代中頃まで増加しており、現在は毎年100,000人に1〜8人である。これは、我々の環境における未知の変化がCDの頻度に影響していることを示唆する。
【0061】
IBDの原因は依然として未決定のままだが、腸管粘膜免疫系の調節異常に起因すると推測される。粘膜における炎症細胞は通常、我々を腸管の内容物から保護する。この非常に効果的な慢性炎症は、組織の損傷を制限するために厳密に制御される。IBDは腸管内の因子への不適切に激しい免疫応答によって生じうる。CDは、IFN-γおよびTNFαを産生する過度に激しいTh1型の炎症であると考えられる。UCの性質はあまり明確に定義されていない。
【0062】
潰瘍性大腸炎(UC)およびクローン病(CD)は、あまり明確に定義されていない環境暴露および、少なくともいくつかの事例では、感受性遺伝子の遺伝的形質の相互作用に起因する複雑な起源の疾患である。IBDの遺伝的素因の証拠として、この症状を有する患者の家族ではIBDの予想される発現率より高いこと、および西洋諸国のユダヤ人集団におけるこの疾患の高い有病率がしばしば挙げられる(Roth MP, Petersen GM, McElree CらGeographic origins of Jewish patients with inflammatory bowel disease. Gastroenterology 1989; 97 (4): 900-4)。しかし、IBDは、同様の民族的起源を有する(Grossman A, Fireman Z, Lilos PらEpidemiology of ulcerative colitis in the Jewish population of central Israel 1970-1980. Hepato-Gastroenterology 1989; 36 (4): 193-7)イスラエルのユダヤ人集団ではそれほど見られない(Fireman Z, Grossman A, Lilos PらEpidemiology of Crohn's disease in the Jewish population of central Israel, 1970-1980. Am J Gastro 1989 ; 84 (3): 255-8)。双生児研究は、少なくともCDについて遺伝的素因の証拠を示す(Halfvarson J, Bodin L, Tysk CらInflammatory bowel disease in a Swedish twin cohort: a long-term follow-up of concordance and clinical characteristics. Gastroenterology 2003; 124 (7): 1767-73.)。細菌の生成物ムラミルジペプチドを感知する細胞内タンパク質である、CARD15/NOD2における遺伝子欠損(Inohara M, Ogura Y, Fontalba AらHost r
ecognition of bacterial muramyl dipeptide mediated through NOD2: implications for Crohn's disease. J Biol Chem 2003; Girardin SE, Boneca IG, Viala JらNod2 is a general sensor of peptidoglycan through muramyl dipeptide (MDP) detection. J Biol Chem 2003)によって、CDにより罹りやすくなる人々もいる。様々な他の遺伝子変化がIBDの危険因子として提唱されている。しかし、遺伝的素因は疾患の発生率の急激な増加を説明しない。
【0063】
例えばElliotらに報告されたような、いくつかの慢性的腸炎の動物モデルがある(The Autoimmune Diseases, 第三版、N. R. RoseおよびI. R. MacKay,編Academic Press, San Diego, CAにおける、Elliottら、1998, Inflammatory Bowel Disease and Celiac Disease.)。重要な進歩は、遺伝子操作による遺伝子の欠失を有するマウスの中にIBDと同様の慢性的腸炎を発症し得るものがあるという最近の発見である(Elsonら、1995, Gastroenterology 109: 1344を参照せよ)。これらは、中でもIL-2、IL-10、MHCクラスIIまたはTCR遺伝子に標的化された欠失を有する突然変異マウスを含む。いくつかのモデルを用いて、Bergら、1996, J. of Clin. Investigation 98:1010, Ludvikssonら、1997, J. of Immunol. 158: 104、およびMombaertsら、1993, Cell 75: 274は、免疫系自体の調節異常が腸管障害を媒介し得ることを示した。これらのモデルのいくつかの粘膜炎症は、多量のIFN-γおよびTNF-αを産生し、Th1型サイトカインの過剰産生が疾患の病因の基礎をなす1つの共通機序であることを示唆している。またTh1回路の遮断は炎症を妨げる。CDはTh1応答である。従って、これらのモデルは、このヒト疾患過程の免疫病理学について直接的な関係を有するかもしれない。
【0064】
B. 関節リウマチ(RA):
RAは持続的な炎症性滑膜炎を特徴とする慢性疾患であり、通常、対称に分布する末梢関節に関わる。この炎症は骨浸食、軟骨損傷および関節破壊を引き起こし得る。それは人口の約1%の疾患である。その有病率は加齢に伴って増加し、女性は男性より高い頻度で罹患する。RAの拡大はCD4+ Th1細胞による免疫を介した事象である。
【0065】
C. インスリン依存性、若年性糖尿病(DM)(1型):
1型 DMは、通常早期成人期に発症し、血糖の増加に応答したインスリン産生の不能に起因する疾患である。この持続的な高血糖および適切なグルコース代謝の不能は、ひいては目、腎臓、心臓および他の器官に損傷を与える代謝障害を引き起こす。非経口的なインスリンの摂取は、部分的にこれらの代謝障害を制御し得る。1型 DMは、インスリンを産生する膵臓ベータ細胞に対する自己免疫性攻撃に起因する。活性化されたマクロファージおよび細胞傷害性T細胞は、膵臓ベータ細胞を取り囲み、破壊する。遺伝的感受性およびあまり明確に定義されていない環境事象が疾患過程の引き金となる。
【0066】
D. 紅斑性狼瘡(LE):
LEは、早期から中期成人期の女性において最も頻度の高い全身性自己免疫疾患である。組織の損傷は自己抗体および過敏な制御性T細胞によって引き起こされる。異常な免疫応答は、病因となる自己抗体および免疫複合体の持続的な産生を可能にする。これが筋骨格系、皮膚、血液、腎臓系および他の系の損傷を引き起こす。異常な免疫応答は、おそらく複数の遺伝的要因および環境要因の相互作用に依存する。
【0067】
E. サルコイドーシス:
サルコイドーシスは原因不明の肺および他の器官の慢性肉芽腫症である。ほとんどの患者は20〜40歳の間である。最も頻繁に見られる症状は息切れである。疾患は、おそらくは限られた数の抗原に対する、過剰なTh1型の細胞性免疫応答に起因する。サルコイドーシスは世界中で発現し、すべての人種を苦しめている。しかし、特定の民族および人種集団の間で、サルコイドーシスの有病率に著しい多様性がある。例えば、この疾患はポーランド、東南アジアおよびインドでは稀である。
【0068】
F. 多発性硬化症(MS):
MSは、局所脱髄および脳の瘢痕化を引き起こす、慢性再発性、多発性の中枢神経系の炎症性疾患である。それは約350,000人のアメリカ人に影響を及ぼすよく見られる疾患であり、早期から中期成人期の間に発症する。MSは、少なくとも部分的にTh1細胞によって媒介される自己免疫疾患である。MSの損傷は、活性化されたT細胞およびマクロファージを含む遅延型過敏反応によって誘導されるものと似ている。それは温帯気候の疾患であり、赤道からの距離とともに有病率が増加する。
【0069】
<Th2関連疾患>
Th2関連疾患は以下の群の疾患、すなわちアレルギー性疾患および癌を含む。
【0070】
遺伝的な素因のある個体は、その個体が暴露される様々な環境要因に由来する抗原に敏感になる(アレルギー体質を持つ)ことがよく知られている。アレルギー反応は、以前に感作された個体が同一のまたは相同のアレルゲンに再暴露された場合に起こる。アレルギー反応は、花粉症、鼻結膜炎、鼻炎および喘息から、例えばハナバチもしくはスズメバチに刺されることまたは虫刺されへの応答による全身性アナフィラキシーおよび死亡に及ぶ。その反応は迅速であり、草、木、雑草、昆虫、(ハウスダスト)ダニ、食物、薬物、化学物質および香料に由来する化合物などの様々なアトピー性アレルゲンによって起こり得る。
【0071】
アレルギー性疾患の群は、花粉症、鼻結膜炎、鼻炎および喘息を含む。
【0072】
アレルギー反応を起こす最も一般的なアレルゲンは、木、草、ハーブ、菌類、ハウスダストダニ、貯蔵庫ダニ、ゴキブリ、ならびに動物の毛、羽、およびふけなどに由来する吸入アレルゲンを含む。木、草およびハーブ由来の重要な花粉アレルゲンは、カバノキ(Betula)、ハンノキ(Alnus)、ハシバミ(Corylus)、シデ(Carpinus)およびオリーブ(Olea)などを含むブナ目、モクセイ目ならびにマツ目の分類目、Lolium、Phleum、Poa、Cynodon、DactylisおよびSecale属のイネ科植物などを含むイネ目、AmbrosiaおよびArtemisia属のハーブなどを含むキク目ならびにイラクサ目に由来するものなどである。菌類由来の重要な吸入アレルゲンは、AlternariaおよびCladosporium属に由来するものなどである。他の重要な吸入アレルゲンは、Dermatophagoides属のハウスダストダニ、Lepidoglyphys destructor属の貯蔵庫ダニに由来するもの、ゴキブリに由来するもの、ならびにネコ、イヌ、ウマ、ウシなどの哺乳動物、およびトリに由来するものである。また、ハナバチ、カリバチ、およびアリを含む膜翅目の分類目に由来するものなどの昆虫に刺されるまたは咬まれることによるアレルギー反応も、一般的に観察される。特異的なアレルゲン成分は当業者に知られており、例えば、ブナ目のBet v 1(B. verrucosa, カバノキ)、Aln g 1(Alnus glutinosa, ハンノキ)、Cor a 1(Corylus avelana, ハシバミ)およびCar b 1(Carpinus betulus, シデ)を含む。他には、最も一般的なものを挙げると、Cry j 1(マツ目)、Amb a 1および2、Art v 1(キク目)、Par j 1(イラクサ目)、Ole e 1(モクセイ目)、Ave e 1、Cyn d 1、Dac g 1、Fes p 1、Hol l 1、Lol p 1および5、Pas n 1、Phi p 1および5、Poa p 1、2および5、Sec c 1および5、ならびにSor h 1(様々な植物花粉)、Alt a 1およびCha h 1(菌類)、Derf 1および2、Der p 1および2(それぞれ、ハウスダストダニ、D. farinaeおよびD. pteronyssinus)、Lep d 1、Bla g 1および2、Per a 1(それぞれ、ゴキブリ、Blatella germanicaおよびPeriplaneta americana)、Fel d 1(ネコ)、Can f 1(イヌ)、Equ c 1、2および3(ウマ)、Apis m 1および2(ミツバチ)、Ves g 1、2および5、Pol a 1、2および5 (すべてのカリバチ)、ならびにSol i 1、2、3および4(ハリアリ)である。
【0073】
A. 喘息
多くの人々において、喘息は、動物のふけ、花粉、またはチリダニおよびゴキブリの老廃物などの、通常空気から吸い込まれる物質に対するアレルギー反応であると考えられる。これらの物質の総称であるアレルゲンとは、アレルギー反応を誘発するすべてのものを指す。ある人々は特定のアレルゲンに反応する遺伝的素因を有する。1998年には、推定1700万人のアメリカ人、すなわち人口の6.4パーセントが喘息に罹っていた。子供は、喘息に罹っているアメリカ人のうち480万人を占めている。動物モデルならびにヒト喘息の病理学における臨床情報の両方から得られた実験情報および臨床情報は、この疾患の病理学においてTh2細胞を示唆する。
【0074】
<Th1およびTh2による癌>
通常、癌細胞は癌細胞によって特異的に発現される抗原に対する免疫応答を引き起こしうる。Th1およびTh2の両方の免疫応答は組織の細胞傷害性除去を引き起こす強力な炎症反応を促進しうるため、Th1またはTh2免疫応答の調節は癌の治療に使用されうる。
【0075】
本発明の組成物によって治療され得る癌は、組織発生学的に、癌腫および腺癌を含む悪性上皮性腫瘍として、ならびに、脂肪肉腫、線維肉腫、軟骨肉腫、骨肉腫、平滑筋肉腫、横紋筋肉腫、神経膠腫、神経芽細胞腫、髄芽腫、悪性黒色腫、悪性髄膜腫、様々な白血病、様々な骨髄増殖性疾患、様々なリンパ腫(ホジキンリンパ腫および非ホジキンリンパ腫)、血管肉腫、カポジ肉腫、リンパ管肉腫、悪性奇形腫、未分化胚細胞腫、精上皮腫、および絨毛癌を含む悪性非上皮性腫瘍として分類され得る。癌腫および腺癌は最も多く(癌による死亡の約90%を占める)、従って、本発明によって治療/予防するための興味深い標的疾患である。最も重要な癌腫および腺癌は、気道(特に気管支)、胸、結腸直腸および胃の癌腫および腺癌である。しかしまた、前立腺、卵巣、リンパ組織および骨髄、子宮、膵臓、食道、膀胱、ならびに腎臓の癌腫および腺癌も多数の死の原因となり、従って興味深い。
【0076】
癌疾患の群は更に、セザリー症候群、皮膚T細胞性リンパ腫、肝臓癌および肺癌を含む。
【0077】
<Th1またはTh2関連疾患における制御性T細胞>
制御性T細胞は、末梢寛容を誘導し、粘膜反応性を制限し得る(McGuirk P, Mills KH. Pathogen-specific regulatory T cells provoke a shift in the Th1/Th2 paradigm in immunity to infectious diseases. Trends Immunol 2002; 23 (9): 450-5)。様々な動物モデルにおいて、いくつかの制御性T細胞表現型が報告されている。制御性T細胞は様々なマーカーを発現し、異なる疾患に関与することが示唆されている(例えば、Field, A. C., L. Caccavelli, M. F. Bloch,およびB. Bellon. 2003. Regulatory CD8+ T cells control neonatal tolerance to a Th2-mediated autoimmunity. Journal of Immunology. 170:2508-2515; von Herrath MG, Harrison LC. Antigen-induced regulatory T cells in autoimmunity. Nat Rev Immunol. 2003 Mar; 3 (3): 223-32; Francois Bach J. Regulatory T cells under scrutiny. Nat Rev Immunol. 2003 Mar; 3 (3): 189-98; Curotto de Lafaille MA, Lafaille JJ. CD4(+) regulatory T cells in autoimmunity and allergy. Curr Opin Immunol. 2002 Dec; 14 (6):771-8; McGuirk P, Mills KH. Pathogen-specific regulatory T cells provoke a shift in the Th1/Th2 paradigm in immunity to infectious diseases. Trends Immunol. 2002 Sep; 23 (9): 450-5; Tung KS, Ag
ersborg SS, Alard P, Garza KM, Lou YH. Regulatory T-cell, endogenous antigen and neonatal environment in the prevention and induction of autoimmune disease. Immunol Rev. 2001 Aug; 182: 135-48; Read S, Powrie F. CD4 (+) regulatory T cells. Curr Opin Immunol. 2001 Dec; 13 (6): 644-9; Yssel H, Lecart S, Pene J. Regulatory T cells and allergic asthma. Microbes Infect. 2001 Sep; 3 (11) : 899-904を参照せよ)。いくつかの系では、それらはCD25(Shevach, E. M. 2002. CD4+ CD25+ suppressor T cells: more questions than answers. Nature Reviews. Immunology. 2:389-400)、CD45RB(Annacker, O.およびF. Powrie. 2002. Homeostasis of intestinal immune regulation. Microbes & Infection. 4: 567-574)、およびCTLA-4(Read, S., V. Malmstrom,およびF. Powrie. 2000. Cytotoxic T lymphocyte-associated antigen 4 plays an essential role in the function of CD25(+) CD4(+) regulatory cells that control intestinal inflammation. J. Exp. Med. 192: 295-302)のような表面分子の差次的発現によって区別される。この細胞表面タンパク質発現のパターンは、それらが感作されたエフェクター状態またはメモリー状態にありうることを示唆する。これらの制御性細胞は、IL10およびTGFβの産生を介してそれらの作用のいくつかを媒介しうる。高レベルのIL10およびTGFβを産生するアネルギー性の制御性T細胞(Tr1)が記載される。Th3と呼ばれる別の細胞は、主としてTGFβの産生を介して実験的自己免疫性脳脊髄炎の誘発を抑制する。また他のものは、可溶性のIL10またはTGFβに依存しないが、代わりにそれらの表面に、TGFβ前駆体ペプチドのアミノ末端ドメインである潜伏関連ペプチドを発現する(Oida T, Zhang X, Goto MらCD4+CD25- T cells that express latency-associated peptide on the surface suppress CD4+CD45RB high-induced colitis by a TGF-beta-dependent mechanism. J Immunol 2003; 170(5):2516-22)。制御性T細胞についての内部細胞マーカーもまた報告されている(Schubert LA, Jeffery E, Zhang Y, Ramsdell F, Ziegler SF, Scurfin (FOXP3) acts as a repressor of transcription and regulates T cell activation. J Biol Chem. 2001 Oct 5;276(40):37672-9)。すべての参考文献は参照により本明細書に組み入れられる。
【0078】
CD4+、CD45high T細胞によって再構成されたRagマウスは、重度の大腸炎を発症し得、それはCD4+、CD45low T細胞の共移植によって回避され得る(Annacker O, Powrie F, Homeostasis of intestinal immune regulation. Microbes & Infection 2002;4(5):567-74)。TGFβおよびIL10は、制御過程においてこれらのサイトカインの役割を示唆している保護のために必要とされる。
【0079】
<本発明の蠕虫性寄生虫調製物>
蠕虫は、種に応じて、宿主の腸管腔、血流または筋肉のような部位に生息する寄生動物(寄生虫)である。これらの生物は世界人口の1/3以上に感染している。蠕虫感染は、温暖な気候で生活する貧弱な公衆衛生にさらされた子供において最も一般的である。これらの生物の感染形は、汚染された土壌、食物または水との接触を介して拡大する。1940年代以前には、米国の多くの子供および大人は蠕虫を保有していた。寄生虫保有は、南部の農村地域および主要都市の貧困集団において特に多く見られた(Elliott DE, Urban JF, Jr., Argo CKらDoes the failure to acquire helminthic parasites predispose to Crohn's disease? FASEB J 2000; 14(12):1848-55)。米国および欧州では、蠕虫感染は徐々に減少している。それらは、発展途上国からの最近の移住者(Salas SD, Heifetz R, Barrett-Connor E. Intestinal parasites in Central American immigrants in the United States. Arch Intern Med 1990; 150(7):1514-6)およびインディアン保留地のような米国の十分なサービスを受けていない地域で生活する経済的に不利な人々(Healy GR, Gleason NN, Bokat RらPrevalence of ascariasis and amebiasis in Cherokee Indian school children. Public Health Rep 1969;84(10):907-14)において見いだされる。蠕虫の有病率は、温暖な気候ならびに、過密状態、貧弱な公衆衛生および、不潔な食糧供給にさらされた人々において最も高い。炎症性腸疾患(IBD)、関節リウマチおよび自己免疫疾患は、これらの同じ地域においては稀である。
【0080】
ヒトの消化管にしばしば生息する線虫は、Ascaris lumbricoides、Enterobius vermicularis(蟯虫)、Trichuris trichiura(鞭虫)、Ancylostoma duodenale およびNecator americanus(鉤虫)、ならびにStrongyloides stercoralisである。Trichinella spiralisは小腸に短期間寄生する。
【0081】
扁形動物は吸虫および条虫を含む。ヒトの腸に存在する最も一般的な成体の吸虫は、Fasciolopsis、EchinostomaおよびHeterophyesの種である。胆管系で生活するものは、Clonorchis sinensis、Opisthorchis viverriniおよびfelineus、ならびにFasciola hepaticaを含む。Schistosomaは静脈系に生息するが、いくつかの種は腸壁を介した卵の通過によって慢性的に消化管に影響を及ぼす。一般的にヒトに感染している成体の条虫は、Diphyllobothriumの種(広節裂頭条虫)、Taenia saginata(無鉤条虫)、Taenia solium(有鉤条虫)およびHymenolepsis nana(小形条虫)である。
【0082】
宿主は、感染形の寄生虫に汚染された土壌、食物または水との接触を介して、様々な種の蠕虫に感染する。子供は、土壌と密に接触し、次善の衛生習慣しかないため、最も高頻度で蠕虫感染を有する。蠕虫は腸内のTh2応答を誘発し、それは寄生虫の排除を引き起こすか、または感染の規模を制限し得る。非工業国に住むほとんどの子供は、これらの寄生虫を有する。多くの種の蠕虫は、消化管、胆道系または腸間膜静脈内で何年も生存し、毎日何千もの卵を産んでいる。従って、幼少期から、これらの寄生虫および/またはそれらの卵子は、何年も腸管粘膜表面を曝す分子を放出して、Th2型炎症を誘発している。
【0083】
A. 生存生物ワクチン:
生存能力のある蠕虫性寄生生物は、成分ワクチンと比較して相対的に長い持続性のために、最も強い粘膜の条件付けを与えうる。生存能力のある生物は、蠕虫に応じて、卵、幼虫、セルカリア、または被嚢幼虫のいずれかの形態で投与され得る。ヒトおよび準備用動物に感染し得る蠕虫が利用されうる。
【0084】
準備用動物は蠕虫による高い開通性を可能にするための操作を必要としうる。このような操作は、グルココルチコイドまたはアザチオプリンのような免疫抑制性の薬剤、抗ヒスタミン剤、抗サイトカイン、または組換えサイトカインのようなTh2作用を妨げる薬剤、および抗コリン作用薬または鎮静剤のような腸運動に影響を及ぼす薬剤による処理を含み得る。動物の飼料は粗繊維含量を減らすように変更されるであろう。動物は、ラット、ブタ、ハムスター、トリまたは他の準備用動物でありうる。
【0085】
準備用動物は、当技術分野において既知の方法に従って、特定病原体を含まない(SPF)(例えば、特定のヒト病原体を含まない)環境において飼育される。それらは、ヒトの細菌性、マイコバクテリア性、およびウイルス性病原体を含まないことを確実にするために検査される。動物をSPF環境で飼育する方法およびその利点は、当技術分野において、例えば、M. Michael Swindle(J. Invest. Surg., 9: 267-271,1996、参照により本明細書に組み入れられる)によって記載される。Swindleもまた、対象となるいくつかの可能性のあるヒトのウイルス性および細菌性病原体を記載する。従って、特定のヒト病原体を含まない環境で飼育された動物に由来する寄生虫調製物は、これらのヒト病原体を含まず、それ自体は任意のSPF環境で飼育された動物から調製された寄生虫調製物とは特許性が異なる。
【0086】
卵: いくつかの腸管寄生蠕虫は生存能力のある卵の摂取によって獲得される。蠕虫はSPF準備用動物、例えば、SPF ブタにおいて維持される。卵を採取するために、動物に粗繊維の少ない特別食を与える。動物に経口下剤を与えて、排便を促進する。便を回収し、酵素的に消化して、卵を遊離させる。卵を液化した便から密度勾配での浮遊、スクリーンろ過、Visserろ過、または遠心水簸によって単離する。卵の保存は使用される蠕虫によって異なる。乾燥に耐性のある蠕虫の卵は、乾燥され、不活性物質と混合され、腸溶カプセルに組み込まれ、冷蔵される。乾燥に感受性の蠕虫の卵は、液体培地中での冷蔵によって、または抗凍結剤の添加および液体窒素での冷凍によって保存される。生存能力のある卵は、洗浄され、送達の場所で、冷却したラクトースを含まないプディングまたは他のベヒクルと混合される。グリセロールベースの抗凍結剤で保存された卵は洗浄を必要としないかもしれない。有効な投与量を決定するために、各ロットの卵の孵化率を検査する。各ロットの卵は、細菌性およびウイルス性病原体がないことを検査される。
【0087】
幼虫: いくつかの蠕虫(鉤虫など)は、それらがヒトに感染できるようになる前に土壌成熟期を必要とする。これらのもの由来の卵は、胚を成熟させるために、または卵が孵化して幼虫形態を呈するために最適な条件下で培養されるであろう。患者は、生存能力のある幼虫の皮下注射または経口摂取によって接種され得る。
【0088】
セルカリア: いくつかの蠕虫は、中間宿主を利用する複雑な生活環を有する。中間宿主は、ヒトに感染できる形態を排出する。セルカリアは、カタツムリのような中間宿主によって排出される吸虫性蠕虫(すなわち吸虫)の形態である。SPF条件で飼育された感染カタツムリからセルカリアを単離する。セルカリアを洗浄する。これらは抗凍結剤の添加および液体窒素での冷凍によって保存されうる。解凍したまたは新鮮なセルカリアは、洗浄され、患者に接種するために皮下注射される。各ロットのサンプルは、病原体がないことについて検査され、および有効な投与量を決定するために検査される。
【0089】
被嚢幼虫: いくつかの蠕虫(例えば条虫)は中間宿主において被嚢幼虫または嚢尾虫を形成する。ヒトへの感染を起こすのは被嚢幼虫形である。被嚢幼虫は、例えば、SPF条件で生育した家畜または魚類または植物のような中間宿主から取り出される。嚢胞は、残存する宿主組織を含まないように洗浄される。嚢胞は、抗凍結剤の添加および液体窒素での冷凍によって保存されうる。嚢胞は、解凍され、または新鮮なものが使用され、洗浄され、送達の場所で、冷却したラクトースを含まないプディングもしくは他のベヒクルと混合され、個体に投与される。各ロットのサンプルは、病原体がないことについて検査され、および有効な投与量を決定するために検査される。
【0090】
B. 非生存成分ワクチン:
蠕虫性寄生虫の非生存成分は、Th1を介した病変を予防するために、免疫応答の十分なTh2条件付けをもたらす。非生存成分は、卵、幼虫または成虫に由来する。
【0091】
生存能力のない無傷の住血吸虫の卵は、強力なTh2応答を引き起こす。卵はSPF条件下で飼育された準備用動物(ハムスターなど)の肝臓から単離される。卵は、本来CokerおよびLichtenberg, 1956, Proceedings of the Soc. For Exp. Biol. & Med. 92: 780によって記載されたものを改変した方法によって単離される。その改変は、インキュベーションのために1.7%生理食塩水の代わりにグルコースを含むリン酸緩衝生理食塩水を使用すること、および自己分解的消化時間の減少を伴う洗浄ステップからなる。これらの変更は生存能力のある卵の単離を向上させる。その方法は以下の通りである。
【0092】
ゴールデンハムスターを1000〜1500匹のセルカリアで感染させる。その感染を成熟させる(6〜7週間)。動物から肝臓を摘出し、5%グルコース、100 U/ml ペニシリンおよび100 mg/ml ストレプトマイシンを含む600 mOsmの滅菌したリン酸緩衝生理食塩水に浸す。肝臓を24時間室温で自己消化させる。肝臓を低速で3分間、冷却したワーリングブレンダーでパルスホモジナイズする。ホモジネートをコラゲナーゼ(2 mg/ml)およびトリプシン(2 mg/ml)とともに32℃で1時間インキュベーションする。ホモジネートを50および80〜100メッシュ篩によってろ過し、組織塊および残渣を除去する。325メッシュ篩を通過させることによって、ろ液から卵を回収する。卵はそのスクリーンを通過しない。卵をスクリーンから50 mlポリプロピレン遠心管に洗い流す。5%グルコースを含む滅菌したリン酸緩衝生理食塩水中での低速(400 x g)遠心分離のくり返しによって、卵を洗浄する。卵はいずれのコラーゲン残渣も含まないはずである。卵の一部を1 ml のセドウィック チェンバー(Sedwick chamber)中で数えて、全卵数を測定する。
【0093】
単離した卵を生理食塩水に懸濁し、抗凍結剤を含まずに液体窒素で急速冷凍する。これによって卵は死滅する。強力なTh2応答を誘導するために、解凍した卵を、皮下、筋肉内もしくは静脈内、またはTh1炎症部位に注射する。他の蠕虫由来の卵もまた利用されうる。
【0094】
寄生虫卵から単離されたタンパク質、脂質、または糖質を用いる成分ワクチンもまた使用されうる。例としては住血吸虫可溶性卵抗原(SEA)がある。住血吸虫卵抗原を調製する方法は、以前にBorosおよびWarren, 1970, J. of Experimental Med. 132: 488によって記載されており、下記に簡潔に示される。
【0095】
洗浄した卵をリン酸緩衝生理食塩水に50,000卵/mlで再懸濁する。これをガラス製組織ホモジナイザーに移す。卵を氷上でホモジナイズする。すべての卵殻が破壊されミラシジウムが破砕されたことを保証するために、一部(5 ml)を顕微鏡観察のために取り出す。ホモジネートを超遠心管に移す。100,000 x gで2時間、4℃で遠心分離する。水溶性画分(SEA)を回収し、タンパク質含量を測定する。SEAを少量ずつ等分して-70℃で保存する。この方法は、最も強力にTh2条件付けを促進する寄生虫卵産物を単離するための、すなわち、最適な有効濃度(100μg SEAまたは10,000卵子/動物)を達成するための改変を必要とするかもしれない。卵または可溶性卵成分は、Th2応答を開始するために、または以前に生存能力のある蠕虫への感染によって開始されたTh2応答を増強するために使用される。卵または卵成分は、病原体および内毒素がないことを確認するために検査される。
【0096】
成分ワクチンはまた、蠕虫性寄生虫の幼虫および成虫からも作製され得る。幼虫または寄生虫は、SPF条件で飼育された準備用動物から単離される。生存能力のない無傷の生物、または蠕虫から単離されたタンパク質、脂質、もしくは糖質を用いるワクチンは、蠕虫の卵について前述されたものと同様の方法で調製および利用される。
【0097】
例えば、Williamsら、1994, Leukocytes of patients with Schistosoma mansoni respond with a Th2 pattern of a cytokine production to mitogen or egg antigens but with a Th0 pattern to worm antigens. J. Infect. Dis. 170: 946; Xu-Amanoら、1993, Helper T cell subsets for immunoglobulin A responses: oral immunization with tetanus toxoid and cholera toxin as adjuvant selectively induces Th2 cells in mucosa associated tissues. J. Exp. Med. 178: 1309; Ausielloら、2000, Cell mediated immunity and antibody responses to Bordetella pertussis antigens in children with a history of pertussis infection and in recipients of an acellular pertussis vaccine. J. infect. Dis., 181:1989に記載されるような、当技術分野において既知の方法に従った、蠕虫性寄生虫の画分または副画分を含むワクチン、ならびに蠕虫性寄生虫に由来する単離されたタンパク質、ポリヌクレオチド、糖質、脂質等を含むワクチンもまた、本発明に含まれる。
【0098】
例えば、画分または副画分は、Thaumaturgoら(2001, Preliminary Analysis of Sm14 in Distinct Factions of Schistosoma mansoni Adult Worm Extract, Mem. Inst. Oswaldo Cruz vol. 96 suppl. Vol. 96, Suppl.: 79-83, その全体が参照により本明細書に組み入れられる)に記載された方法に従って調製されうる。この方法では、S. mansoni寄生虫は、感染45日後にヘパリン添加生理食塩水(0.85% NaCl溶液)を用いた逆行性灌流によって得られ(PellegrinoおよびSiqueira 1956, Tecnica de perfusao para colheita de Schistosoma mansoni em cobaias experimentalmente infectadas. Rev Bras Mal D Trop 8:589-597)、様々な抽出物の調製に用いられた。
【0099】
--成虫由来抽出物(SE)の調製- 寄生虫をPBSで洗浄した。その後、生きている寄生虫を室温(28℃〜30℃)で新しいPBS(リン酸緩衝生理食塩水)中に2〜3時間置いておき、-20℃で冷凍した。解凍後、寄生虫のPBS懸濁液(1 g寄生虫/10 ml PBS)をワイヤーメッシュでろ過し、10,000 gで1時間、4℃で遠心分離した(TendlerおよびScapin 1981, Schistosoma mansoni antigenic extracts obtained by different extraction procedures. Mem Inst Oswaldo Cruz 76: 103-109; Tendlerら1982, Immunogene and protective activity of an extract of Schistosoma mansoni. Mem Inst Oswaldo Cruz 77: 275-283)。SEのタンパク質含量をローリー法(Lowryら1951)によって評価し、1 mg/mlを含むストック バッチ(stock batches)を-20℃で保存した。灌流後直ちに分離した寄生虫を用いて、オスおよびメスの抽出物を同一の方法に従って調製した。
【0100】
成虫由来抽出物の迅速に放出される「画分」(SEi)の調製- SEiの調製はSEの最初のステップに相当した。すなわち、SEについて記載したように灌流した後、生きている寄生虫を室温(28℃〜30℃)で2〜3時間、PBS中でインキュベーションした。その後、成虫をインキュベーション溶液(SEi)からワイヤーメッシュ内にろ過した。
【0101】
SE2の調製- SE初期調製物から残された成虫を、PBS中で1週間(1 g寄生虫/10 ml PBS)再び冷凍保存した(-20℃)。解凍後、PBS懸濁液をワイヤーメッシュでろ過し、10,000 gで1時間、4℃で遠心分離した。
【0102】
寄生虫抗原はまた、Thaumaturgoら(上述)の図1に記載された(図23として再現された)ように抽出され得る。あるいは、寄生虫抗原は、Deelderら(1980. Applicability of different antigen preparations in the enzyme-linked immunosorbent assay for schistosomiasis mansoni. Am. J. Trop. Med. Hyg. 29: 401-410)に記載されるように調製されうる。例えば、抗原は、それぞれの生活環段階の緩衝生理食塩水ホモジネートからの可溶性上清液として調製されるSWAPから調製されうる(Goesら1989, Production and characterization of human monoclonal antibodies against Schistosoma mansoni. Parasite Immunol 11: 695-711)。SWAPは、以前に記載されたように(HirschおよびGoes 1996, Characterization of fractionated Schistosoma mansoni soluble adult worm antigens that elicit human cell proliferation and granuloma formation in vitro. Parasitology 112: 529-535)、FPLC(高速タンパク質液体クロマトグラフィー)において陰イオン交換クロマトグラフィーによって分画された。簡潔には、20 mM Tris-HCl, pH 9.6を用いて、0、100、280、450、600および750 mMでの勾配保留間隔によって中断される最大1 M NaClまでの多段階の漸増勾配で、タンパク質を溶出した。流出画分を凍結乾燥によって濃縮した。濃縮した物質を0.15 Mリン酸緩衝生理食塩水(PBS)、pH 7.4で透析し、ろ過滅菌し、-70℃で保存した。タンパク質含量をブラッドフォードマイクロアッセイに従って測定した(Bradford 1976, A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding. Analyt Biochem 72: 248-254,その全体が参照により本明細書に組み入れられる)。10% SDS-PAGE(ドデシル硫酸ナトリウムポリアクリルアミドゲル電気泳動)により還元条件下で分離された(Laemmli 1970, Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227: 680-685,その全体が参照により本明細書に組み入れられる)6画分の解析は、多数のタンパク質バンドを示し、画分IIIは高分子量(97および160 KDa)、中間分子量(52および56 KDa)ならびに低分子量(28および36 KDa)のタンパク質を含んでいた。この画分はPIIIと呼ばれ、様々な免疫アッセイに用いられた。
【0103】
脂質もまた、当技術分野において、例えば、van der Kleijらに記載されるように調製されうる(1999, Recognition of Schistosome Glycolipids by Immunoglobulin E: Possible Role in Immunity Infection and Immunity, 67: 5946-5950,その全体が参照により本明細書に組み入れられる)。
【0104】
1つの実施形態では、S. mansoni成虫(12 g [湿重量])および卵(1.6 g [湿重量])の脂質が、BlighおよびDyerに記載された方法によって抽出された(1959. A rapid method of total lipid extraction and purification. Can. J. Biochem. Physiol. 37: 911-917)。有機相をロータリーエバポレーターによって乾燥させ、10 mlのクロロホルムに溶解し、ヒドロキシル型に変換された陰イオン交換TEAEセルロース(Serva, Heidelberg, Germany)の20-mlカラムにアプライした。Rouserらによって記載されたように、脂質を溶出した(1969. Diethylaminoethyl and triethylaminoethyl cellulose column chromatographic procedures for phospholipids, glycolipids, and pigments. Methods Enzymol. 14: 272-317)。このプロトコールによると、画分は以下の脂質を含む。すなわち、画分1、コレステロール、グリセリド、および他の中性脂質; 画分2、セレブロシド、グリセロールジグリセリド、ホスファチジルコリン、およびスフィンゴミエリン; 画分3、セラミドポリヘキソシド; 画分4、無機物質; 画分5、ホスファチジルエタノールアミンおよび遊離脂肪酸; 画分6、ホスファチジルセリン; 画分7、なし(洗浄ステップ); ならびに画分8、ホスファチジン酸、カルジオリピン、ホスファチジルグリセロール、ホスファチジルイノシトール、および他の酸性脂質である。画分2および3における糖脂質の存在を、HPTLCプレートでの脂質画分のオルシノール染色によって確認した(1956. Quantitative estimation of cerebrosides in nervous tissue. J. Neurochem. 1: 42-53)。
【0105】
C. 蠕虫生物の維持:
蠕虫は、SPF条件で飼育された中間宿主および準備用動物を循環する。蠕虫個体群のサンプルは、感染率、繁殖力、および駆虫薬に対する感受性などの表現型の安定性を確実にするために検査される。
【0106】
<投与量、投与法および医薬製剤>
治療を必要とする個体は、選択された寄生虫の天然の生活環に応じて、経口または非経口で寄生虫の感染形(卵、セルカリアもしくは幼虫)を投与される。別法として、TH2応答を誘導するために、可溶性の寄生虫または卵の抽出物が経口または非経口で投与され得る。
【0107】
腸および肝臓の蠕虫および住血吸虫に関して、それらは、接種の約30〜60日後に便中に現れる卵を産生し始める。便中の卵の定量は、感染の妥当性および強度の評価をするのに十分であることを示す。便の一部をショ糖浮遊法によって処理し、各検体中の全卵数を測定する。ショ糖溶液での浮遊は、KoontzおよびWeinstock, 1996, Gastroenterology Clinics of N. America, 25: 435によって報告されるように、正確な計数のために便から卵を単離するのにしばしば用いられる方法である。
【0108】
本発明の蠕虫性寄生虫化合物は、任意の便利な方法での投与のために製剤化されでもよく、従って、本発明はその範囲内に、ヒトにおける使用に適した本発明の蠕虫性寄生虫化合物を含む医薬組成物を含む。このような組成物は、任意の必要な医薬担体または賦形剤を用いて従来の方法での使用に供されうる。
【0109】
本発明の蠕虫性寄生虫化合物は、注射用に、従って、ワクチン用途に製剤化されでもよく、必要であれば防腐剤を添加した、アンプルでの単位投与剤型、または複数回投与容器で提供されうる。組成物はまた、油性もしくは水性ベヒクルの懸濁液、溶液、または乳液のような形態を取ってもよく、懸濁化剤、安定化剤、および/または分散剤などの製剤化物質を含みうる。あるいは、蠕虫性寄生虫は、粉末形態であってよく、または使用前に、例えば滅菌した発熱物質を含まない水などの適切なベヒクルによって再構成されうる。
【0110】
必要に応じて、このような粉末製剤は、粉末が水で再構成され、その結果生じる水性製剤のpHが生理学的に許容されうることを確実にするために、適切な非毒性基剤を含みうる。
【0111】
蠕虫性寄生虫化合物はまた、例えばカカオ脂または他のグリセリドなどの従来の坐薬基剤を含む坐薬として製剤化されうる。
【0112】
蠕虫性寄生虫化合物はまた、従来の充填剤、担体、および賦形剤とともに経口投与のために製剤化されうる。それを必要とする個体に投与される寄生虫の量は、自己免疫疾患を予防または治療するために十分な量である。この量は、治療または予防される疾患、および蠕虫性寄生虫、それが無傷で、または卵、幼虫、抽出物もしくはセルカリアとして投与されるかどうかに応じて変化しうる。
【0113】
一般的に、寄生虫が本明細書において議論されるすべての自己免疫疾患に対して投与される場合、その量は約50〜約50,000の範囲である。より詳細には、この量は約500〜約5,000の範囲でありうる。卵が利用される場合には、約500〜約5,000が、本明細書に開示される自己免疫疾患を治療するために利用されうる。抽出物が投与される場合には、約100μg〜約10,000μgが、自己免疫疾患を治療するために利用される。幼虫およびセルカリアが投与される場合には、投与量は、それぞれの場合において約500〜約5,000の範囲でありうる。
【0114】
予防またはワクチン用途のためには、寄生虫の量は500〜5,000でありうる。
【0115】
寄生虫調製物の投与量は、Th1、Th2または制御性細胞の応答を測定することによって測定されうる。あるいは、投与量は、当技術分野において知られているか、もしくは本明細書に記載されるような特定の疾患の病変または症状を評価することによって測定されうる。
【0116】
A. Th1およびTh2応答の測定
本発明の効果を示すために、Th1およびTh2応答が区別されうる。Metawaliら、1996, J. of Immunol. 157: 4546は、マウスにおいて、組織学的解析ならびにサイトカインおよび免疫グロブリンプロフィールの解析によってTh1応答をTh2応答と区別することが可能であることを示した。更に、Sandorら、1990, J. of Exp. Med. 171: 2171は、Fcg3およびMHCクラスII分子の細胞表面での発現が区別を可能にすることを示した。この方法では、粘膜炎症、好酸球増多および肥満細胞症の程度を測定するために、小腸および大腸が組織学的に検査される。後者の細胞型はTh2応答の指標となる。腸間膜リンパ節(MLN)および脾臓は、マイクロウェルプレートでのin vitro培養のために単細胞懸濁液に分離され得る。完全RPMI培地中の細胞(1〜2 x 106/ウェル)を、寄生虫抗原もしくは抗CD3の存在下または非存在下で最大72時間まで培養し、その後、その上清をサイトカインおよび免疫グロブリンについてアッセイする。IFN-γ、TNFαおよびIgG2aはTh1応答を特徴付けるが、一方、IL-4、IL-5、IgEおよびIgG1はTh2反応の特徴を表す。また、血清もサイトカインおよび免疫グロブリンプ濃度についてアッセイされ得る。更に、分散された炎症性白血球は、フローサイトメトリーによって、マクロファージ上でのFcγ3発現(Th1)およびB細胞上でのMHCクラスII発現(Th2)について検査される。対照は、寄生虫の宿主ではない、適切な、年齢を適合させた同腹子マウス由来の血清、MLNおよび脾臓を含む。
【0117】
同様の解析はヒトのTh1とTh2応答を区別することができる。炎症の部位および末梢血液細胞からの炎症組織、単離された白血球が検査される。白血球は、in vitroにおいて単独で、またはサイトカイン放出を刺激するための寄生虫抗原もしくは分裂促進剤の存在下で培養される。IgG2はIgG2aの代わりになる。
【0118】
B. 制御性T細胞活性の測定
in vitro培養物または動物から制御性T細胞を単離する方法は、当技術分野において知られており、例えば、McGuirk P, Mills KH. Pathogen-specific regulatory T cells provoke a shift in the Th1/Th2 paradigm in immunity to infectious diseases. Trends Immunol 2002; 23 (9): 450-5; Field, A. C., L. Caccavelli, M. F. Bloch,および B. Bellon. 2003. Regulatory CD8+ T cells control neonatal tolerance to a Th2-mediated autoimmunity. Journal of Immunology. 170: 2508-2515; von Herrath MG, Harrison LC. Antigen-induced regulatory T cells in autoimmunity. Nat Rev Immunol. 2003 Mar ; 3 (3): 223-32; Francois Bach J. Regulatory T cells under scrutiny. Nat Rev Immunol. 2003 Mar; 3 (3): 189-98; Curotto de Lafaille MA, Lafaille JJ. CD4(+) regulatory T cells in autoimmunity and allergy. Curr Opin Immunol. 2002 Dec; 14 (6): 771-8; McGuirk P, Mills KH. Pathogen-specific regulatory T cells provoke a shift in the Th1/Th2 paradigm in immunity to infectious diseases. Trends Immunol. 2002 Sep; 23 (9): 450-5; Tung KS, Agersborg SS, Alard P, Garza KM, Lou YH. Regulatory T-cell, endogenous antigen and neonatal environment in the prevention and induction of autoimmune disease. Immunol Rev. 2001 Aug; 182: 135-48; Read S, Powrie F. CD4(+) regulatory T cells. Curr Opin Immunol. 2001 Dec; 13 (6): 644-9; Yssel H, Lecart S, Pene J. Regulatory T cells and allergic asthma. Microbes Infect. 2001 Sep; 3(11): 899-904; Shevach, E. M. 2002. CD4+ CD25+ suppressor T cells: more questions than answers. Nature Reviews. Immunology. 2: 389-400; Annacker, O.およびF. Powrie. 2002. Homeostasis of intestinal immune regulation. Microbes & Infection. 4: 567-574; Read, S., V. Malmstrom,およびF. Powrie. 2000. Cytotoxic T lymphocyte-associated antigen 4 plays an essential role in the function of CD25(+)CD4(+) regulatory cells that control intestinal inflammation. J. Exp. Med. 192: 295-302に記載される通りである。
【0119】
制御性T細胞の応答または活性は、本明細書に記載されるような内部マーカー、細胞表面マーカー、または分泌マーカーによって測定されうる。
【0120】
制御性T細胞のための有用な内部マーカーは、Scurfin、Smad7、Gata3、Tbet(Tbx21)などの転写因子を含むが、それらに限定されない。
【0121】
制御性T細胞のための有用な表面マーカーは、CD4、CD45RBlo、CD45Rc、細胞傷害性T リンパ球関連抗原4(CTLA-4)、CD25、CD103、Ox40、4-1BB、CD62L、αEβインテグリン、潜伏関連ペプチド(LAP)またはグルココルチコイド誘導性TNF受容体ファミリー関連タンパク質(GITR)、ケモカイン受容体CCR5、TI-ST2を含むが、それらに限定されない。
【0122】
制御性T細胞のための有用な分泌マーカーは、IL-5、IL-10およびTGFβを含むが、それらに限定されない。
【0123】
C. マーカーの量をin vitroにおいて測定する方法の非限定的な例
フローサイトメトリーによるサイトカイン検出: RPMI完全培地中の脾細胞、MLNまたは腸の炎症細胞を、24ウェルの組織培養プレートに2 x 106細胞/ウェルで播種する。細胞を4〜6時間、抗CD3または適切な抗原の存在下または非存在下で、10μg/mlのブレフェルジンAとともに培養する。ブレフェルジンはタンパク質のエキソサイトーシスを妨げ、サイトカインの細胞内での蓄積を促進する。細胞質サイトカインの検出のために、細胞を室温で5分間、2%パラホルムアルデヒドで固定し、続いて細胞のサブタイプを区別するために表面染色する。細胞を洗浄し、50μlのPBS 0.2%サポニンおよび1μg抗サイトカイン抗体に再懸濁し、室温で20分間インキュベーションする。次に、細胞をサポニンで2回洗浄し、PBS/FCSに再懸濁する。細胞を同一のアイソタイプおよびサイトカイン特異性の過剰な非共役性抗体を用いて前もってブロッキングすることにより、または、細胞を組換えサイトカインの存在下でインキュベーションすることにより、サイトカイン抗体染色の特異性を確認する。フィコエリトリン(PE)標識された無関係の抗体対照もまた、バックグラウンド染色を評価するために含まれる。細胞はフローサイトメトリーを用いて解析される。
【0124】
ELISA: ELISAは、マイクロタイタープレート中で培養され、上述のように操作された細胞からの細胞上清におけるサイトカインおよび抗体濃度を測定する。多くのこれらのアッセイは既に本発明者らの研究室で使用可能である。サイトカインは、2つのモノクローナル抗体(mAb)を用いて、二部位サンドイッチELISAでアッセイされる。抗サイトカインmAbは、アンモニウム沈殿によって、抗体を分泌しているハイブリドーマクローンの上清から精製される。マイクロタイタープレートを、Tween 20を含む50μlのPBS(PBS-T)中1μg/mlのコーティング抗体によってコーティングし、4℃で一晩インキュベーションする。その後、ウェルに150μlのPBS中10%FCSを添加し、37℃で30分間インキュベーションすることによってブロッキングする。標準は、組換えサイトカイン、または住血吸虫症感染マウス由来の分裂促進剤活性化脾臓細胞もしくは抗原活性化脾臓細胞からのサイトカインを含んでいる上清を含む。サンプルおよび標準希釈物を、10%FCSを含むRPMI(完全RPMI)中で別の96ウェル平底マイクロタイタープレートにおいて調製し、50μlの量を、PBS-Tで3回洗浄したELISAプレートに移す。サンプルをアッセイプレートにおいて1時間37℃でインキュベーションする。適切なmAbはビオチンにコンジュゲートされる。PBS-Tで3回洗浄した後、各ウェルに50μlの1%BSA/PBS-T中0.5μg/mlの抗体-ビオチンコンジュゲートを加える。プレートを室温で1時間インキュベーションし、その後、PBS-Tで3回洗浄する。ストレプトアビジン-ホースラディッシュペルオキシダーゼコンジュゲート(75μl)を、1%BSA/PBS-T中1μg/mlで添加し、室温で1時間インキュベーションする。プレートを新しいPBS-Tで10回洗浄し、44 mM Na2HPO4、28 mMクエン酸、および0.003%H2O2中、100μlの1 mg/mlの基質(2,2'-アジノ(3-エチルベンズチアゾリンスルホン酸))を加える。有色生成物を、マルチスキャンマイクロプレートリーダーを用いて、490 nmの参照波長とともに405 nmの波長で測定する。
【0125】
免疫グロブリンは、抗アイソタイプ特異的ELISAを用いて定量される。アフィニティー精製されたヤギ抗IgM、IgG1、IgG2a、IgG2b、IgG3、IgAおよびIgEを捕捉抗体として使用し、軟質ポリビニルマイクロタイターディッシュに10μg/mlで吸着させる。培養上清の添加、インキュベーション、洗浄の後、適切なアイソタイプのアルカリホスファターゼコンジュゲートヤギ抗免疫グロブリンを用いて、プレートに結合した全マウス免疫グロブリンを検出する。標準曲線は精製された免疫グロブリンを用いて作製される。寄生虫抗原特異的抗体を測定するために、可溶性抗原をビオチン化し、結合したマウス免疫グロブリンを検出するために使用する。プレートをELISAリーダーにおいて410 nmで解析し、全免疫グロブリンの濃度を標準曲線および最良適合解析ソフトウェアを用いて測定する。可溶性寄生虫抗原は正確な定量を可能にする定義された抗原ではないため、抗原特異的抗体濃度はO.D.測定値と相対的に比較される。
【0126】
ELISPOTアッセイ: ELISPOTアッセイは、ポリクローナル抗体またはサイトカインのいずれかを分泌しているリンパ球を計数するために確立される。96ウェルのニトロセルロース支持マイクロタイタープレートを、PBS-T中1μg/mlの抗免疫グロブリンまたは抗サイトカイン抗体のいずれかによって、4℃で一晩コーティングする。その後、プレートを10%FCSを含むPBSでブロッキングし、PBS-Tで十分に洗浄する。
【0127】
5 x 104細胞/ウェルから始まる単細胞懸濁液の希釈系列を、プレート上で5時間37℃で、加湿した5%CO2雰囲気下でインキュベーションする。プレートをPBS-Tで洗浄し、ビオチン化抗免疫グロブリンまたは抗サイトカイン抗体を4℃で一晩重層する。次に、プレートを洗浄し、ストレプトアビジン-グルコースオキシダーゼコンジュゲートで2時間処理し、再度洗浄する。
【0128】
単一細胞によって分泌された抗体またはサイトカインを基質によって可視化する。比色反応を洗浄によって30分後に停止し、スポットを30X倍率で数える。10〜50スポット/ウェルを生じる細胞の希釈物を、サンプル当たりの分泌細胞の総数を計算するために使用する。対照は、不適切なヤギ抗体もしくは不適切な抗原でコーティングされたウェル、またはコーティングされないままのウェルを含む。
【0129】
ウェルをコーティングするために可溶性抗原を用いたアッセイの改変は、寄生虫抗原特異的な免疫グロブリン分泌B細胞の定量をも可能にする。簡潔には、例えば、プレートを0.25μg/ウェルの成虫T. Muris抗原または適切な無関係の対照抗原でコーティングする。洗浄後に細胞をウェルに添加する。適切なインキュベーションの後、プレートを再度洗浄し、上述のように処理する。
【0130】
D. 疾患病変の評価
自己免疫疾患の存在およびその治癒または改善の証拠は、治療の必要性を決定するために、および治療過程を観察するために必要とされる。以下の方法は、注目される疾患の臨床パラメータを測定するために利用される。
【0131】
1. 炎症性腸疾患
炎症の評価: マウスでは、疾患の臨床所見は、体重減少、下痢、直腸脱および腸の炎症の組織学的徴候を含む。従って、これらのパラメータの改善は、疾患の改善を意味すると思われる。
【0132】
動物モデルにおいて腸の炎症を評価するために、組織を摘出し、スイスロールのように巻き(Swiss-rolled)、標準的な方法に従ってパラフィン包埋する。切片をヘマトキシリンおよびエオジンで染色する。大腸の炎症の程度は、本発明者らの通常の標準化方法を用いて、1人の病理学者による盲検で0〜4まで半定量的に評価される。すなわち、0=炎症なし、1=低レベルの炎症、2=中間レベルの炎症、3=壁肥厚を伴う高レベルの炎症、ならびに4=貫壁性浸潤、および壁肥厚を伴う杯細胞の喪失。
【0133】
肥満細胞を数えるために、個々のマウスからの腸組織サンプルをスイスロール法(Swiss-roll technique)によって処理し、カルノア固定液で固定し、パラフィン包埋して、アルシアンブルーおよびサフラニンによる染色のために処理する。与えられた切片の隣接した50視野を、固有層および筋層中の粘膜肥満細胞について検査する。肥満細胞は、それらの特徴的なアルシアンブルーによる細胞内顆粒染色によって同定される。すべてのサンプルは盲検で評価される。
【0134】
ヒトでの疾患活動性は、様々な臨床的基準、実験室での基準および組織学的基準を用いて観察される。下痢および腹痛の頻度のような臨床パラメータを観察する、いくつかの十分に確立されたIBD疾患活動性の指標がある。クローン病の評価のための1つの特に有用な指標は、クローン病活動性指数、すなわちCDAIである(Bestら、1976, Gastroenterology 70: 439)。CDAIは、疾患活動性に関連する8つの変数を取り入れ、最新のクローン病の治療薬の研究に用いられている。それは、液状または非常に軟らかい便の回数、腹痛または腹部の痙攣の重症度、一般的な健康、疾患の腸管外の徴候の存在、腹部腫瘤の有無、抗下痢薬の使用、ヘマトクリット、および体重を含む。複合スコアは0〜約600の範囲である。150以下のスコアは寛解を示し、450以上のスコアは重度の疾患を示す。
【0135】
検査済みの、認められた、疾患特異的な生活の質アンケートもまた、治療の進行を評価するために治療前後に施行されうる。アービン炎症性腸疾患アンケートは、32項目のアンケートである(Irvineら、1996, The Short Inflammatory Bowel Disease Questionnaire: a quality of life instrumeht for community physicians managing inflammatory bowel disease. CCRPT Investigators. Canadian Crohh's Relapse Prevention Trial. Am J Gastroenterol. 1996 91 (8): 1571-8)。それは、腸機能(例えば軟便および腹痛)、全身症状(疲労および睡眠パターンの変化)、社会的機能(仕事への参加および社交行事を取り消す必要性)ならびに情動状態(怒り、憂うつ、または苛立ち)に関する生活の質を評価する。スコアは32〜224の範囲であり、高スコアはより良い生活の質を示す。寛解期の患者は通常170以上のスコアである。
【0136】
腸疾患活動性の内視鏡、x線および組織学的評価もまた、評価のために使用されうる。C反応性タンパク質レベルおよび血球沈降速度もまた、炎症の全身性指標として観察されうる。
【0137】
2. 関節リウマチ
炎症の評価: コラーゲン誘発関節炎のマウスでは、マウスは1日おきに検査され、それらの足は以下のようにスコアされる。すなわち、0, 正常; 1, 紅斑および足首の関節またはつま先に限局した軽度の腫れ; 2, 紅斑および足首から中足部まで拡大した軽度の腫れ; 3, 紅斑および足首から中足関節まで拡大した重度の腫れ; ならびに4, 関節腫脹を伴う強直性変形である。これらの4つのパラメータは、関節炎の関節における組織学的変化と相関し得る。治療の成功は、組織学上の改善とともに関節炎スコアの減少をもたらす(Anthony DD. Haqqi TM., Collagen-induced arthritis in mice: an animal model to study the pathogenesis of rheumatoid arthritis. Clinical & Experimental Rheumatology. 17 (2): 240-4,1999)。
【0138】
プリスタン誘発関節炎では、関節は腫れを検出するためにマイクロメータで測定されうる。ヒトでは、RAは、関節腫脹、紅斑、運動制限および痛みの測定によってスコアされる。あるいは、サイトカインおよび炎症性タンパク質濃度について、ならびに白血球の組成および機能について、当技術分野において既知の方法に従って、滑液が解析されうる。滑膜生検は、当技術分野において既知の方法による組織学的解析のための組織を提供する(Felson DT. Anderson JJ. Boers M. Bombardier C. Furst D. Goldsmith C. Katz LM. Lightfoot R Jr. Paulus H. Strand V.らAmerican College of Rheumatology. Preliminary definition of improvement in rheumatoid arthritis. Arthritis & Rheumatism. 38(6): 727-35, 1995 Schiff M. A rationale for the use of summary measurements for the assessment of the effects of rheumatoid arthritis therapies. Clinical Therapeutics. 25(3): 993-1001,2003)。
【0139】
3. 狼瘡
炎症の評価: 免疫系の正常な発達および機能は、アポトーシスと呼ばれる過程による望ましくない細胞の除去に大いに依存する。特異的な細胞表面分子およびそれらの受容体を介した細胞間相互作用はしばしば、この過程を誘導する。このような系の1つは、FASおよびFASリガンドと呼ばれる。FAS(LPR-/-)またはFASリガンド(GLD-/-)のいずれかに欠損のあるマウスは、狼瘡のような自己免疫疾患を発症する(Reilly CM. Gilkeson GS. Use of genetic knockouts to modulate disease expression in a murine model of lupus, MRL/lpr mice. Immunologic Research. 25(2): 143-53, 2002)。
【0140】
LPRまたはGLDマウスの集団は、特定病原体を含まない条件下のマイクロアイソレーターケージで維持される。これらのマウスは自然に自己免疫を発症し得るが、人為的な誘発後はより予測可能になる。疾患を誘発するために、8週齢のマウスにプリスタンのような薬剤を注射する。2ヶ月以内に、マウスは自己免疫疾患になる。マウスおよびヒトの両方において疾患の誘発および改善を判定するために有用な、多くの臨床的、組織学的ならびに免疫学的基準は、当技術分野においてよく知られている(Satoh M. Richards HB. Shaheen VM. Yoshida H. Shaw M. Naim JO. Wooley PH. Reeves WH. Widespread susceptibility among inbred mouse strains to the induction of lupus autoantibodies by pristane. Clinical & Experimental Immunology. 121(2): 399-405, 2000)。
【0141】
4. 若年性インスリン依存性糖尿病(1型)
炎症の評価: NODマウスは、膵臓β細胞の自己免疫性破壊によりヒトと同様の1型糖尿病を発症する。当技術分野において既知の方法に従った臨床的、生化学的、免疫学的および組織学的検査は、マウスにおける疾患の誘発および改善の評価を可能にする(例えば、Adorini L. Gregori S. Harrison LC. Understanding autoimmune diabetes: insights from mouse models. Trends in Molecular Medicine. 8(1): 31-8, 2002を参照せよ)。
【0142】
5. サルコイドーシス
炎症の評価: 肺の炎症のビーズ塞栓モデルにおいて、抗原(すなわちTh1またはTh2)はセファロースビーズと結合され、それは尾静脈内への注射によってマウスの肺を閉塞する。その動物は通常、結合抗原に事前に感作される。宿主の免疫系は、障害を起こすビーズに対して活発な免疫応答を開始する。数週間持続し得るこれらの局所性炎症反応は、組織学的にサイズについて検査され得る。また、それらは組織から分離され、細胞組成およびサイトカイン産生について研究され得る。更に、肺門リンパ節および脾臓は、容易に実験のために利用できる。例えば、Kunkel SL. Lukacs NW. Strieter RM. Chensue SW. Animal models of granulomatous inflammation. Seminars in Respiratory Infections. 13(3): 221-8, 1998を参照せよ。
【0143】
ヒトの疾患であるサルコイドーシスは、通常は肺に関与する。サルコイドーシスおよび疾患の範囲の判定は、当技術分野において既知の方法によって行われうる。肺機能検査は、肺のコンプライアンスおよび機能を評価し得る。また、気管支洗浄は、炎症過程の間に気管支樹に浸潤した炎症細胞を得る。これらの細胞は、組成および機能について研究され得る。肺浸潤および肺門リンパ節腫脹はサルコイドーシスの特徴である。従って、定期的な胸部x線またはCTスキャンは、疾患活動性の評価を支援し得る。当技術分野において既知の方法によるアンジオテンシン変換酵素活性の測定のような血清検査は、疾患の範囲および活動性を評価するために使用され得る。例えば、Hunninghake GW. Costabel U. Ando M. Baughman R. Cordier JF. du Bois R. Eklund A. Kitaichi M. Lynch J. Rizzato G. Rose C. Selroos O. Semenzato G. Sharma OP. ATS/ERS/WASOG statement on sarcoidosis. American Thoracic Society/European Respiratory Society/World Association of Sarcoidosis and other Granulomatous Disorders. Sarcoidosis Vasculitis & Diffuse Lung Diseases. 16(2): 149-73, 1999を参照せよ。
【0144】
6. 多発性硬化症
炎症の評価: 実験的自己免疫性脳脊髄炎は、感受性マウスにおいて適切な感作ミエリン抗原の反復注射によって誘発される。マウスは以下の基準に従って臨床的に評価される。すなわち、0, 疾患なし; 1, 尾の弛緩; 2, 後肢衰弱; 3, 後肢麻痺; 4, 後肢麻痺および前肢麻痺または衰弱; 5, 瀕死である。組織学的解析のために、脊髄および脳を摘出し、ホルマリンで固定する。パラフィン包埋切片を染色し、光学顕微鏡下で検査する。分散させた脾細胞および他の部位からの細胞は、上記に概説されたようにin-vitroにおいて研究され得る。これらのパラメータは、疾患の改善または回復の測定を支援し得る(例えば、Sewell, Diane, Zing Qing, Emily Reinke, David Elliott, Joel Weinstock, Matyas Sandor, and Zsuzsa Fabry. Immunomodulation of experimental autoimmune encephalomyelitis by helminth ova immunization. International Immunol. 15: 59-69, 2003)。
【0145】
ヒトでは、MS疾患活動性は、神経学的徴候および症状の進行および一時的な改善の観察によって評価される。最も広く用いられる結果測定は、総合障害度(Expanded Disability Status Scale)と呼ばれる。当技術分野において既知の方法によって解析される脳脊髄液のタンパク質組成および細胞含量もまた、疾患活動性を観察するために使用されうる。更に、連続的なMRI研究は、新たなガドリニウム増強脳病変を示す(McDonald WI, Compston A, Edan G, Goodkin D, Hartung HP, Lublin FD, McFarland HF, Paty DW, Polman CH, Reingold SC, Sandberg-Wollheim M, Sibley W, Thompson A, van den Noort S, Weinshenker BY, Wolinsky JS. Recommended diagnostic criteria for multiple sclerosis: Guidelines from the International Panel on the Diagnosis of Multiple Sclerosis Ann Neurol 50(1):121-7. 2001. Poser CM, Paty DW, Scheinberg L,ら"New Diagnostic Criteria For Multiple Sclerosis: Guidelines For Research Protocols". Ann Neurol 1983; 13 : 227-231)。
【0146】
統計的方法: いくつかのデータは、平均値がゼロとは有意に異なるかどうかを決定するために、1標本t検定によって解析される。対応のあるt検定は、群平均間の違いを解析するために用いられる。分散分析およびダネットt検定は、多数の比較データを解析するために用いられる。
【0147】
<本発明に有用な動物モデル>
以下の表1は、本発明に有用な動物モデルの非限定的な例を説明する。更なる非限定的な例は、例えば、Current Protocols in Immunology (2001, John E. Coligan, Ada M. Kruisbeek, David H. Margulies, Ethan M. Shevach, Warren Strober編、John Wiley & Sons出版)に記載されるように、当技術分野において見いだされうる。
【表1】

【実施例】
【0148】
本発明は、以下の材料および方法を用いる以下の非限定的な実施例によって説明される。以下で引用されるそれぞれの参考文献の開示全体は、参照により本明細書に組み入れられる。
【0149】
〔実施例1〕
一般的な方法:
動物: 129/SV IL-10-/-突然変異マウスの集団、および適切な対照動物を維持し、標準的な方法に従って特定病原体を含まない環境を維持する施設において飼育する。
【0150】
寄生虫の維持、動物の感染、住血吸虫卵の調製: T. murisの維持および感染のために用いられる方法は、ElseおよびWakelin, 1990, Parasitology, vol. 100, part 3: 479に記載された通りである。
【0151】
住血吸虫卵を、住血吸虫感染ハムスターの肝臓から採集し、Elliott, 1996, Methods: A Companion to Methods in Enzymology, 9: 255に記載されるように保存した。5匹の感染ハムスターから約2 x 106の卵が採集される。
【0152】
T. suis卵の調製: T. suis卵の調製および採集において、以下の方法が用いられた。T. suis卵の実験的接種に暴露した後7〜8週間のブタの大腸からT. suis成虫を単離した。成虫をin vitroで培養することにより幼虫形成卵を得て、その後、培地から遠心分離によって分離された排出卵を22℃で5〜6週間バブリングしながら0.2%二クロム酸カリウム溶液中に置き、感染型初期幼虫を得た。卵を1200 x g で10分間の遠心分離によって滅菌水で2回洗浄し、数を数え、2,500の計算された用量に基づいて必要量の生理食塩水に再懸濁した。これらの卵を被検体での使用のために保存した。卵は冷蔵庫で少なくとも1年間安定である。感染力を保証するために、本発明者らは、感染後の便への卵の出現について患者を観察した。便中の卵の数は、寄生の強度に比例する。また、本発明者らは、持続的な感染力を保証するために、時々、ブタを保存した卵で感染させる。
【0153】
M. aviumへの感染: 106コロニー形成単位(CFU)のMycobacterium avium(ATCC 25291)を腹腔内に注射することにより、マウスを感染させた。感染60日目に、数匹のマウスにはまた、35匹のS. mansoniセルカリアを与え、二重感染を誘導した。
【0154】
住血吸虫感染および卵子の単離: いくつかの実験には、8〜9週間S. mansoniに感染したマウス(18〜20g)を使用した。マウスを、皮下投与によってプエルトリコ系統由来の40匹のセルカリアに感染させた。
【0155】
肉芽腫の分離および分散: 肉芽腫は、天然の卵の蓄積のために、住血吸虫感染マウスにおいて形成され、それは感染の6週目から始まる。M. aviumもまた肉芽腫を誘導する。本発明者らは、記載されたように(Elliott, 1996, 上述)感染マウスから分離された肝臓の肉芽腫を研究する。肉芽腫を分散させ、単細胞懸濁液を調製した。分離した肉芽腫を、5 mg/mlコラゲナーゼを含むRPMI培地中で、35分間37℃の水浴振盪機において振盪した。残りの肉芽腫を1 mlの注射器によって吸い上げ、吹き出させて、更に分散させた。その結果生じた細胞懸濁液をガーゼを通してろ過し、3回洗浄した。細胞の生存率をEosin-Y排除法によって測定した。この方法は、保存された表面分子の発現を示す高収量の生存能力のある炎症細胞をもたらした。
【0156】
脾臓およびMLNの分散: 脾細胞およびMLNは、引き裂いてステンレス製メッシュを通して組織を洗浄することによって分散される。混入しているRBCをH2Oで溶血させ、細胞を使用前にRPMIで3回洗浄した。
【0157】
TNBS大腸炎の誘発: 大腸炎は、Neurathら、1995, J. Exp. Med., 182: 1281に記載されるように、トリニトロベンゼンスルホン酸(TNBS)の直腸注入により誘発された。簡潔には、対照または寄生虫暴露BALB/cマウスを30時間絶食させ、その後メトキシフルランで麻酔した。1.2 mmのカテーテルを4 cm大腸内に前進させ、0.1 mlのTNBS溶液(50%エタノール中5 mg/ml TNBS(Sigma))を注入した。動物を尾で3分間吊り下げて、大腸粘膜への均一な接触を確保した。
【0158】
粘膜炎症の評価: 腸の炎症を評価するために、表示された時点で組織を摘出し、スイスロールのように巻き、標準的な方法に従ってパラフィンに包埋した。切片をヘマトキシリンおよびエオジンで染色した。大腸の炎症の程度は、本発明者らの通常の標準化方法を用いて、1人の病理学者による盲検で0〜4まで半定量的に評価された(1 9)。0=炎症なし、1=低レベルの炎症、2=中間レベルの炎症、3=壁肥厚を伴う高レベルの炎症、4=貫壁性浸潤、杯細胞の喪失、壁肥厚。
【0159】
細胞の単離およびT細胞の濃縮: Th1、Th2および制御性T細胞は、例えば、Current Protocols in Immunology(2001, John E. Coligan, Ada M. Kruisbeek, David H. Margulies, Ethan M. Shevach, Warren Strober編、John Wiley & Sons出版)に記載されるような、当技術分野において既知の方法によって単離されうる。
【0160】
1つの実施形態では、MLNの単細胞懸濁液は、RPMI 1640培地(GIBCO, Grand Island, NY)中で穏やかに引き裂くことによって調製された。その細胞を短時間蒸留水に再懸濁し、RBCを溶血した。その後、MLNを多量のRPMIで3回洗浄した。
【0161】
消化管LPMCは下記のように単離された。腸組織をRPMIで十分に洗浄し、すべての目に見えるパイエル板をはさみで除去した。その腸を縦方向に開き、5 mm片に切断し、その後、上皮内リンパ球および上皮細胞を遊離させるために、カルシウムおよびマグネシウムを含まないハンクス液中の0.5 mM EDTAで、20分間37℃で振盪しながらインキュベーションした。十分な洗浄の後、これをくり返した。その後、組織を、10% FCS、25 mM HEPESバッファー、2 mM L-グルタミン、5x105 M β-メルカプトエタノール、1 mMピルビン酸ナトリウム、100 U/mlペニシリン、5 mg/mlゲンタマイシン、および100 mg/mlストレプトマイシン(すべてGIBCO)、ならびに 1 mg/mlコラゲナーゼ(Sigma #CO130)を含む20 ml RPMI中で20分間37℃でインキュベーションした。インキュベーションの最後に、1 mlの注射器を用いて、組織に更なる機械的破砕を加えた。残渣を除去するために、LPMC調製物を、事前に湿らせて漏斗に重ねたガーゼを通してRPMIで洗浄した。その後、LPMCを1回洗浄し、10 ml注射器に穏やかに充填し事前に湿らせた2 cmのナイロンウールカラムを通して篩過した。洗浄後、細胞(最大2 x 107まで)を30:70%勾配を有するパーコールのカラムに重層した。細胞を室温で20分間2200xGで回転させた。30:70の界面から回収されたLPMCを洗浄し、使用するまで氷上に維持した。細胞の生存率はEosin-Y排除法による測定では90%であった。
【0162】
細胞移植実験のために、製造メーカーによって記載されたように、抗体コート高密度粒子を用いるSpinSep濃縮法を用いた陰性選択によって(#17031, #17032, Stem Cell Technologies, Vancouver, Canada)、MLN T細胞を単離した。それぞれの分離後、フローサイトメトリーを使用して、Thy+ T細胞の適切な回収率および純度(> 98%)を確認した。
【0163】
細胞移植: MLN細胞を、2週間 H. polygyrusに感染させたIL10-/-マウスから、または週齢を適合させたこのような感染のない健康なIL10-/-マウスから単離した。その後、これらの分画していない分散させたMLN細胞(2x107細胞/マウス)またはMLN T細胞(5x106細胞/マウス)を、ピロキシカム処理の中止後2日の大腸炎IL10-/-マウスにip注射によって移植した。14日後に大腸炎を評価した。
【0164】
<制御性T細胞の調製のための更なる方法>
本発明のいくつかの実施形態では、制御性T細胞は、例えば、米国特許出願第2003/0170648号、2003/0157057号、 2003/0133936号、2003/0064067号、2003/0049696号、2002/0182730号、2002/0090724号、2002/0090357号(その全体が参照により本明細書に組み入れられる)に記載されるような、当技術分野において既知の方法に従った更なる解析のために、培養細胞または動物から調製されうる。
【0165】
細胞源として有用なin vivoでの細胞集団の源は、末梢血、白血球分離血液製剤、血液成分分離血液製剤、末梢リンパ節、消化管関連リンパ系組織、脾臓、胸腺、臍帯血、腸間膜リンパ節、肝臓、免疫学的損傷部位、例えば滑液、膵臓、脳脊髄液、腫瘍サンプル等を含むが、それらに限定されない。ドナーは好ましくはヒトであり、胎児、新生児、子供、成人であり得、正常、罹患、または対象となる疾患に感受性でありうる。
【0166】
例えば、本発明の制御性T細胞は細胞表面マーカーの発現に基づき濃縮され得る。1つの実施形態では、細胞はCD4およびCD25の発現に対して陽性選択され、CD45RAの欠如に対して陰性選択され得る。任意選択で、Treg細胞の亜集団を更に分離するために、CD69、CCR6、CD30、CTLA-4、CD62L、CD45RB、およびCD45ROを含む他のマーカーが使用され得る。その方法は、他の細胞特異的マーカーに対する陽性選択による細胞単離のための更なる濃縮もしくは精製の方法またはステップを含み得る。
【0167】
別の実施形態では、制御性T細胞は、CD4+CD25+および任意でCD45RA-であるという特性を有する細胞について濃縮する技術によって、細胞の複合混合物から分離される。組織から細胞を単離するために、適切な溶液が分散または懸濁のために使用されうる。このような溶液は通常、低濃度の、一般的には5〜25 mMの許容されうるバッファーとともに、ウシ胎仔血清、BSA、正常ヤギ血清、または他の天然由来の因子が都合よく添加された、平衡塩類溶液、例えば生理食塩水、PBS、ハンクス平衡塩類溶液等である。都合の良いバッファーは、HEPES、リン酸バッファー、乳酸バッファー等を含む。
【0168】
別の実施形態では、制御性T細胞集団の分離は、十分に純粋な集団を提供するために、その後、アフィニティー分離を用いる。アフィニティー分離のための技術は、抗体コート磁気ビーズを用いる磁気分離法、アフィニティークロマトグラフィー、モノクローナル抗体と結合したもしくはモノクローナル抗体と連結して使用される(例えば補体および細胞毒素などの)細胞毒性物質、ならびに、例えばプレートなどの固体マトリックスに結合された抗体との「パニング」、または他の都合の良い技術を含みうる。正確な分離を提供する技術は蛍光活性化細胞選別装置を含み、それは複数のカラーチャネル、低角度および鈍感な光散乱検出チャネル、インピーダンスチャネル等の、様々な程度の精巧さを有することができる。細胞は、死細胞と関連する色素(ヨウ化プロピジウム、LDS)を用いることによって死細胞と選別されうる。選択された細胞の生存率に過度の害を及ぼさない任意の技術が使用されうる。
【0169】
アフィニティー試薬は上記の細胞表面分子に対する特異的受容体またはリガンドでありうる。抗体試薬に加えて、ペプチド-MHC抗原およびT細胞受容体の対、ペプチドリガンドおよび受容体、エフェクターおよび受容体分子等が使用されうる。抗体およびT細胞受容体はモノクローナルまたはポリクローナルであってもよく、トランスジェニック動物、免疫動物、不死化されたヒトまたは動物のB細胞、抗体またはT細胞受容体をコードするDNAベクターでトランスフェクトされた細胞等によって産生されうる。抗体の作製、および特異的結合因子として使用するためのそれらの適合性の詳細は、当業者によく知られている。
【0170】
特に関心を持たれるのは、アフィニティー試薬としての抗体の使用である。都合の良いことに、これらの抗体は、分離に使用するための標識とコンジュゲートされる。標識は、直接分離を可能にする磁気ビーズ、担体に結合されたアビジンまたはストレプトアビジンによって分離できるビオチン、蛍光活性化細胞選別装置とともに使用され得る蛍光色素等を含み、特定の細胞型の分離を簡略化することを可能にする。用途を見いだす蛍光色素は、例えばフィコエリトリンおよびアロフィコシアニンなどのフィコビリタンパク質、フルオレセインならびにテキサスレッドを含む。それぞれのマーカーに対して独立の選別を可能にするために、しばしばそれぞれの抗体は異なる蛍光色素によって標識される。
【0171】
1つの実施形態では、抗体は細胞の懸濁液に添加され、利用可能な細胞表面抗原と結合するのに十分な期間インキュベーションされる。インキュベーションは、通常少なくとも約5分であり、通常約30分以下である。分離の効率が抗体の不足によって制限されないように、すなわち、飽和量の抗体を用いて、反応混合物において十分な濃度の抗体を含むことが望ましい。その適切な濃度は滴定によっても決定され得る。細胞を分離する培地は、細胞の生存を維持する任意の培地である。好ましい培地は0.1〜0.5% BSAを含むリン酸緩衝生理食塩水である。様々な培地が市販されており、細胞の性質に応じて使用され、それらはしばしばウシ胎仔血清、BSA、HSA等を添加された、ダルベッコ改変イーグル培地(dMEM)、ハンクス平衡塩類溶液(HBSS)、ダルベッコリン酸緩衝生理食塩水(dPBS)、RPMI、イスコフ培地、5 mM EDTAを含むPBS等を含む。
【0172】
細胞の染色強度は、レーザーが定量的なレベルの蛍光色素を検出するフローサイトメトリーによって測定され得る(それは抗体によって結合された細胞表面抗原の量に比例する)。フローサイトメトリーまたはFACSはまた、抗体染色の強度、ならびに細胞サイズおよび光散乱などの他のパラメータに基づいて細胞集団を分離するために使用され得る。染色の絶対値は、特定の蛍光色素および抗体調製によって異なるかもしれないが、データは対照に対して標準化され得る。
【0173】
標識された細胞はその後、CD4およびCD25の発現に応じて分離される。分離された細胞は、通常回収チューブの底に血清の緩衝材を含む、細胞の生存を維持する任意の適切な培地中に回収されうる。様々な培地が市販されており、細胞の性質に応じて使用され、それらはしばしばウシ胎仔血清を添加された、dMEM、HBSS、dPBS、RPMI、イスコフ培地等を含む。
【0174】
ヒトTreg活性を高度に濃縮した組成物は、このような方法で獲得されうる。対象集団は、約70%またはそれ以上の細胞組成物、通常は約90%またはそれ以上の細胞組成物であり、約95%またはそれ以上の細胞組成物でありうる。濃縮された細胞集団は直ちに使用されうる。細胞はまた冷凍することもでき、分離処置の前に細胞を冷凍することが好ましいが、液体窒素温度で冷凍されて長期間保存されてもよく、解凍して再利用することが可能である。細胞は通常、培地、グルコース等とともにDMSOおよび/またはFCS中で保存される。解凍したら直ちに、細胞は、成長因子、抗原、刺激、樹状細胞等の使用によって増殖および分化のために展開されうる。
【0175】
細胞培養: サイトカイン分析のために、細胞を48時間96ウェルマイクロタイタープレート(Corning, Cambridge, MA)中で、200μlの培地とともに(5 x 105細胞/ウェル)37℃で培養した。培地は、10% FCS、25 mM HEPESバッファー、2 mM L-グルタミン、5x105 M β-メルカプトエタノール、1 mMピルビン酸ナトリウム、100 U/mlペニシリン、5 mg/mlゲンタマイシン、および100 mg/mlストレプトマイシン(すべてGIBCO)を含むRPMIであった。ほとんどの実験において、細胞は単独で、または(それぞれ1μg/mlで)抗CD3(2C11, ATCC)および抗CD28 mAb(Pharminogen, San Diego, CA)とともに培養された。単離したT細胞を、事前に抗CD3および抗CD28 mAbによって一晩コーティングしたウェルで培養した。IL12分析のためには、Coley Pharmaceutical Group (Wellesley, MA)によって提供され、産生を刺激するために0.6μg/mlで用いられる2つ(下線)の免疫活性化CpGモチーフ(13;14)を含む合成ホスホロチオエート骨格オリゴヌクレオチドODN 1826(TCCATGACGTTCCTGACGTT)(配列番号3)とともに、細胞を培養した。
【0176】
マウスサイトカインについてのELISA: ELISAは上記のVI項に記載されるように行われた。
【0177】
〔実施例2〕
S. mansoniへのTh2応答は、関連のない細菌性Th1誘導性抗原への進行中のTh1応答をダウンレギュレートする:
Th細胞の免疫応答がTh1またはTh2パターンへと二極化し得ることは、十分に証明されている。この二極化は、Th1細胞からのIFNγがTh2細胞の増殖を阻害する一方で、Th2細胞からのIL-4およびIL-10がTh1細胞の増殖を阻害するために起こる。以下の実験は、住血吸虫症が、確立されたマイコバクテリア感染へのマウスTh1応答を変化させることを実証した。
【0178】
マウスをM. aviumおよびS. mansoniに重感染させ、これらの明らかに異なるTh1およびTh2炎症性刺激に対する宿主の応答を評価した。BALB/cAnNマウスは、M. avium(106 CFU)を注射した場合、慢性的なM. avium感染を発症する。マイコバクテリア感染の確立の60日後に、マウスをS. mansoni(40セルカリア)に感染させた。60日後、マウスを屠殺した。対照群は、M. aviumのみに120日間、またはS. mansoniのみに60日間感染したマウスを含んだ。これらの動物由来の分散させた脾細胞または単離した肉芽腫細胞を、in vitroで(4 x 105細胞/ウェル)48時間、最適濃度で使用される住血吸虫卵抗原(SEA、強力なTh2抗原)またはマイコバクテリア抗原精製タンパク質誘導体(PPD、強力なTh1誘導性抗原)の存在下または非存在下で培養した。インキュベーション後、サイトカインまたは免疫グロブリン産生について、ELISAを用いて上清をアッセイした。図1〜3のデータは、3回の個別の実験の平均値+/-SDである。
【0179】
M. aviumのみに感染したマウスからの脾細胞は、PPD(Th1抗原)による刺激後、多量のIFNγを分泌した。非感染対照マウスからの脾臓細胞は何も産生しなかった。最も重要なことに、IFNγは、同時に感染させたマウスからの脾臓細胞培養物では検出されなかった(M. avium単独感染対同時感染、P<.001、図1)。可溶性住血吸虫卵抗原(SEA、Th2抗原)は、S. mansoni感染動物の脾細胞からのIL-4およびIL-5放出のみを促進した。単独でM. aviumに感染したマウスは、PPDもしくはSEAに応答してIL-4またはIL-5を産生しなかった。しかし、重感染した動物からの脾細胞は、PPD刺激後、いくらかのIL-4を分泌した(図1)。
【0180】
M. aviumもしくはS. mansoniに感染したマウスの肝臓から、または同時感染を有する動物から、肉芽腫を分離した。同時感染した動物は、住血吸虫卵およびマイコバクテリアの両方を含み、組織学的実験で容易に認められる肝臓肉芽腫を発症する。これらの動物からの分散させた肉芽腫細胞を、in vitroで48時間、最適濃度で使用されるSEAもしくはPPDの存在下または非存在下で培養した。M. aviumのみに感染したマウスからの肉芽腫細胞は、PPDによる刺激後、多量のIFNγを分泌した。同時感染したマウスからの肉芽腫細胞培養物では、IFNγは検出されなかった(M. avium単独対その他、P<.001)(図2)。SEAはS. mansoni感染動物の肉芽腫細胞からのIL-4放出を促進した。SEAはいずれの場合にもIFNγ分泌を促進しなかった。単独でM. aviumに感染したマウスは、PPDに応答してIL-4を産生しなかった。しかし、重感染した動物からの肉芽腫細胞は、PPD刺激後、いくらかのIL-4を分泌した(図2)。
【0181】
Th1応答はIgG2a産生を促進するが、一方、Th2反応はIgG1およびIgEを向上させる。図3は、M. aviumに感染したマウスが高い血清IgG2aレベルを有することを示す。しかし、重感染動物は正常の血清IgG2a濃度を有するが、IgG1およびIgEレベルの増加を示す。これらのデータを総合すると、蠕虫感染へのTh2応答は、M. aviumのような強力なTh1誘導性生物への進行中の宿主応答であってもダウンレギュレートできることを示す。
【0182】
〔実施例3〕
腸管寄生蠕虫への感染またはそれらの卵子への暴露は、マウスのTNBS誘導性大腸炎におけるTh1型の消化管炎症を軽減する:
50%エタノール中のTNBSの直腸注入は、マウスにおいてクローン病と共通した特徴を有する大腸炎を引き起こす。大腸の炎症は、IFNγmRNA発現の上昇を伴うCD4+ T細胞の浸潤を特徴とする。TNBS処理マウスからの固有層T細胞は、対照からのT細胞より50倍多いIFNγを分泌し、5倍少ないIL4を分泌する(Neurathら、1995、上述)。固有層単核細胞は、対照マウスからの細胞より30倍多いTNFαを分泌する(Neurathら、1997, Eur. J. Immunol., 27: 1743)。重要なことには、TNBS大腸炎は抗IL-12(Neurathら、1995、上述)、抗TNFα(Neurathら、1997、上述)、またはrIL-10(Duchmannら、1996, Eur. J. Immunol., 26: 934)を用いた治療によって予防または改善され得る。TNBS誘導性大腸炎はまた、事前のハプテンへの経口暴露によっても(Elsonら、1996, J. Immunol., 157: 2174)、おそらく粘膜IL-4、IL-10およびTGFβ応答の増加によって(Neurathら、1996, J. Exp. Med., 183 : 2605)予防され得る。
【0183】
BALB/c マウスを用いたTNBS大腸炎モデルが確立される。50%エタノール中のTNBS(0.1 mlの5 mg/mlストック)の直腸投与は、これらの動物に再現性良く大腸炎を引き起こす。後述されるそれぞれのTNBS実験のために、寄生虫暴露動物および対照動物は、同一のTNBS調製物を同じ日に、処理群を知らない同じ手技者によって投与された。
【0184】
A. 住血吸虫症はTNBS 処理マウスのMLNおよび脾臓細胞からのIFNγ放出を阻害する。
住血吸虫感染がTNBS処理動物大腸炎モデルマウスにおけるTh1応答を変化させるかどうかを研究した。マウスをsc.注射によって35匹のS. mansoniセルカリアに感染させた。寄生虫は感染の開始後約6週間で成熟し、産卵し始める。2週間後(感染の8週目)に、マウスをTNBSで処理した。T細胞刺激(抗CD3)に応答してIFNγを産生するMLNおよび脾臓細胞の能力を、数日後に検査した。表2に示されるように、天然の住血吸虫感染は、TNBS処理マウスの腸間膜リンパ節(MLN)および脾臓細胞からのIFNγ放出を強力に阻害する。
【表2】

【0185】
B. 住血吸虫卵への暴露はTNBS 処理マウスのMLNおよび脾臓細胞からのIFNγ放出を阻害する。
住血吸虫症では、Th2応答を引き起こすのは、成虫よりもむしろ寄生虫卵への暴露である。住血吸虫感染は、寄生虫が成熟し産卵し始めるまでは、強力なTh2応答を引き起こさない(Grzychら、1991, J. Immunol., 146: 1322)。自然感染を伴わずに無傷の住血吸虫卵に暴露されたマウスは、強力なTh2応答を示す(Oswaldら、1994, J. Immunol., 153: 1707)。これらの観察は、自然感染を伴わない住血吸虫卵への暴露がTh2応答を誘導しTh1応答を抑制しうることを示唆する。
【0186】
住血吸虫卵への事前の暴露が、成虫による感染を必要とせずにTh1応答を阻害するかどうかを調べるために、マウスに、2回、104個の住血吸虫卵をTNBSによる直腸投与の14日前および4日前に、腹腔内(ip)注射によって接種した。これらの時間は、天然の感染において起こる持続的な産卵を模して選択された。寄生虫卵に暴露されないがTNBSで処理されたマウスを対照とした。卵は事前に冷凍され、注射時には生存能力を持たなかった。今回も、T細胞刺激(抗CD3)に応答してIFNγを産生するMLNおよび脾臓細胞の能力を、TNBS注入の数日後に検査した。天然の住血吸虫感染と同様に(表1)、ip.による卵暴露は、表3に示されるように、TNBS処理マウスのMLNおよび脾臓T細胞からのIFNγ産生を阻害した。
【表3】

【0187】
C. 住血吸虫卵への暴露はTNBS誘導性大腸炎からマウスを保護する。
粘膜のTh1応答の発生を阻害することは、TNBS誘導性大腸炎を軽減し得る。住血吸虫卵への事前の暴露は、MLNおよび脾臓T細胞によるTh1サイトカイン分泌を阻害する。住血吸虫卵のip注射がTNBS誘導性大腸炎を阻害するかどうかを調べるために、卵を上述のように注射し、続いてTNBS処理を行った。卵処理は、3回の個別の実験において、対照群での60%(16/27)から卵暴露マウスでの22%(6/27)へと、累積死亡率を劇的に減少させた。腸の炎症は、上記の一般的な方法に詳述されたように4点制でスコアされた。生き残ったマウスにおいて、卵処理は腸の炎症を、対照群での3.1±0.5(平均±SD)から卵暴露マウスでの1.3±0.3まで軽減した(p<0.05、図4)。次の実験は、群間での最大の差異がTNBS処理後3日で明白になることを示した。TNBS注入の14日後に行われた他の実験は、卵暴露が持続的な保護を与えることを示した。これらのデータは、住血吸虫卵が粘膜のTh1応答を阻害することによって致死的な大腸炎の発症からマウスを保護することを示唆する。
【0188】
D. 腸管寄生蠕虫は宿主のTh2応答を誘導する。
S. mansoni以外の蠕虫性寄生虫が宿主のTh1応答を調節できるかどうかが調べられた。腸内線虫に対する防御免疫の発現はCD4 T細胞依存性である。マウスはTh2応答を増加させることによって寄生虫を駆除し、または感染を制限する。寄生虫の駆除は、腸の好酸球増多だけに依存するのではなく、粘膜の肥満細胞症だけに依存するのでもないと思われる。抗IL-4または抗IL-4受容体遮断mAbによる処理は寄生虫の保持を促進する(Elseら、1994, J. Exp. Med. , 179: 347)ので、IL-4は寄生虫の駆除に重要な役割を有するのかもしれない。反対に、IL-4による処理は寄生虫の除去を促進する(図4)。
【0189】
T. murisはマウス宿主の大腸に生息する。それは、Trichuris trichiuraという、それらの生息中にほぼ10億人の人々によって媒介される寄生虫と近縁である(Grencisら、1996, Gastroenterology Clinics of North America, 25: 579)。卵の摂取が感染を開始する。卵は盲腸上皮を貫通する幼虫を放出する。それらはその後、成虫へと成熟する。その寄生虫は、我々が感染の強度を制御することが可能な宿主内では複製しない(Bancroftら、1994, Eur. J. Immunol., 24: 3113)。
【0190】
T. murisは腸のTh1応答性をダウンレギュレートするために使用された。T. muris感染は、生存能力のある幼虫を含む250個の幼虫形成卵の経口投与によって確立される。BALB/cマウスはT. murisを寄生させ、感染の4週間以内に寄生虫を自然に駆除することができる。T. muris感染マウスまたは偽感染マウスを、感染開始の4週間後にTNBSの直腸注入によって処理した。T. murisによる事前感染は、2回の個別の実験において、偽感染群での58%(7/12)から寄生虫暴露群での21%(3/14)へと、累積死亡率を減少させた。更に、事前にT. murisに感染したマウスは、偽感染マウス(3.13±0.63、p<0.05)と比較してTNBS大腸炎の軽減(0.92±0.5、平均±SD)を呈する。これらのデータは、腸内寄生虫(T. muris)への事前暴露が重度のTh1媒介性大腸炎の発症からマウスを保護することを示す。
【0191】
〔実施例4〕
IL-10遺伝子破壊は、宿主/寄生虫相互作用を有意に変化させない。
IL-10は、マクロファージの活性化およびアクセサリー細胞の機能を抑制する重要な免疫調節サイトカインである(Mooreら、1993, Ann. Rev. Immunol., 11: 165)。標的化遺伝子破壊によってIL-10を欠損させたマウス(IL-10-/-)は、結腸細菌叢に影響される慢性腸炎を発症する(Kuhnら、1993, Cell, 75: 263)。腸の炎症は抗IFNγ抗体による治療によって軽減され、その大腸炎は結腸内容物に対する過度のTh1応答に起因することを示している(Berg,ら、1996, J. Clin. Invest., 98: 1010)。これらのマウスは、クローン病のそれと類似した自然発症大腸炎のための優れたモデルとして役立つ。この実施例では、129およびC57Bl/6バックグラウンドのIL-10-/-マウスが用いられた。
【0192】
A. IL-10-/-マウスは寄生虫へのTh2応答を増加させることができる。
腸内線虫N. brasiliensisに感染したマウスは、IL-4、IL-5およびIL-10の産生を伴う寄生虫に対するTh2型炎症を発現する。N. brasiliensisはIL-10-/-マウスに感染し、適切な腸のTh2応答を活性化することができる(Kuhnら、1993、上述)。それらがTH2応答を増加させるかどうかを調べるために、IL-10-/-マウスをS. mansoniに感染させた。
【0193】
表4は、S. mansoniに8週間感染したIL-10遺伝子破壊マウスからの脾細胞が、住血吸虫卵抗原(SEA)または抗CD3による刺激によって多量のIL-4を分泌することを示す。これらのマウスにおける住血吸虫卵を包囲する肉芽腫は、通常の高い割合(45〜50%)の好酸球を含み、IL-4およびIL-5を産生する。このように、それらは効果的なTh2応答を示す。これらのデータは、S. mansoniのような蠕虫性寄生虫への暴露がIL-10の非存在下においても強力なTh2応答を誘導することを示す。
【表4】

【0194】
B. 蠕虫のTh2条件付けはIL-10-/-マウスにおける粘膜炎症の自然発症を阻害する。
IL-10欠損マウスは蠕虫性寄生虫を寄生させ、強力なTh2応答を誘導することができた。IL-10-/-マウスはTh2応答を発現でき、腸内寄生虫を寄生させることができるため、それらは自然発症の大腸炎または持続的な大腸炎に対する寄生虫暴露の効果を研究するための優れたモデルとして役立つ。IL-10は重要な抗炎症性サイトカインである。この必須の免疫調節回路の破壊は、寄生虫による粘膜のTh2条件付けを妨げる可能性がある。現在の証拠は、T. murisへの感染がIL-10-/-マウスにおいて発症する自然発症大腸炎を妨げることを示唆する。T. muris感染または偽感染を受けた動物(6週齢)を6週間後に屠殺した。T. muris感染または偽感染したIL-10-/-マウスの大腸の炎症を、上記の一般的な方法に詳述されたように4点制でスコアした。T. murisによる事前の感染は、腸の炎症を、偽感染群での3.0±0.3(平均±SE)から寄生虫暴露IL-10-/-マウスでの2.2±0.1(p<0.05)へと軽減した。これらのデータは、蠕虫性寄生虫への事前暴露がIL-10欠損マウスにおける自然発症大腸炎を軽減することを実証する。
【0195】
〔実施例6〕
Trichuris suis による腸管感染はクローン病の患者における疾患活動性をダウンレギュレートする。
クローン病の患者をTrichuris suisに感染させ、疾患活動性の改善を評価する。ブタの鞭虫であるT. suisは、発展途上国において一般的なヒトの腸管寄生蠕虫であるT. trichiuraの近縁種である。この鞭虫は治療のための潜在的因子である。天然のヒト寄生虫であるTrichuris trichiuraは、粘膜への付着によって大腸に存在する非常に小さい生物である。通常の感染はたいてい、宿主に症状を引き起こさず、健康上の問題を起こさない。これは世界中で感染した何百万の人々の場合であるが、少数派では、重度の感染は、下痢、出血および鉄欠乏性貧血を引き起こす。その寄生虫の生活環は宿主が自己感染しないようになっていることが興味深い。卵は感染型になるための成熟に土壌相を必要とし、その後、個体への寄生負荷を増やすために再摂取されなければならない。従って、土壌中の卵が摂取されない限り、T. trichiura感染は宿主内で増加しない。その病因は3日間メベンダゾールを用いて容易かつ効果的に治療される。ヒトの鞭虫は宿主を感染させるために使用され、クローン病における免疫の作用を改変するための実験薬として検討されるかもしれない。
【0196】
しかし、Trichuris trichiuraは宿主に潜在的な健康上の問題をもたらす。ヒトは唯一の自然宿主であるため、実験的用途のための卵は、他のヒトから採集しなければならず、他のヒト感染症を実験の被験者に伝染させる可能性を生じる。従って、近縁動物の寄生虫が使用された。ブタの鞭虫(Trichuris suis)は、症状や疾患、共に感染する疾患または公衆衛生被害を起こすことなく、ヒト宿主を一次的に感染させる潜在能力を有する。
【0197】
ブタの鞭虫はヒトに感染する種の近縁種である。2つの生物は同じ科であり、形態的に類似しているが、それらは異なる種に属し、形態学的、発生学的および臨床的に区別され得る。ブタの鞭虫の卵は少し大きく、異なる形の棘を有し、卵から成虫への発達速度はTrichuris trichiuraより遅い(Beer, 1976, Res. Vet. Sci., 20: 47)。重要なことに、本発明者らは感染性の寄生虫卵をSPF動物から得ることができる。
【0198】
感染性のT. suis卵の供給は上述のように調製された。腸内病原体(例えばShigella、Salmonella、Campylobacter、Yersinia、および病原性E. coli)ならびにウイルス(例えばCMV、HSV、VZV、アデノウイルスおよびエンテロウイルス)による汚染のないことを確認するために、卵を検査した。
【0199】
進行性の薬物治療抵抗性クローン病の2人の患者をT. suisに感染させた。彼らは、この生物に起因する症状をほとんどまたはまったく伴わずに寄生虫を許容した。表5は、患者の感染の実現後に、両参加者のCDAI値、下痢、および炎症の指標が低下したことを示す。この結果は、蠕虫がクローン病を含むがそれに限定されない異常な免疫応答を調節するために有用であることを示唆する。
【表5】

【0200】
〔実施例7〕
炎症性腸疾患の予防および治療におけるH. polygyrus:
炎症性疾患に対する防御を誘導した寄生虫における制御性T細胞の役割を研究するために、更なる実験を行った。
【0201】
実験にはマウス腸管寄生蠕虫H. polygyrusが用いられた。H. polygyrusは、回腸末端もしくは大腸に炎症または損傷を引き起こすことなく、宿主の十二指腸に生息する。アルコール中のTNBSは、マウスの直腸内に注入された場合、大腸炎を誘発する。図5は、この生物がTNBS誘導性大腸炎からマウスを保護することを示す。感染は200匹の生存能力のある幼虫の経口投与によって確立された。マウスは感染開始後約2週間で寄生虫を駆除する。H. polygyrus感染または偽感染マウスを、寄生虫感染の開始の4週間後に0.1 mlのTNBS(50%エタノール中5mg/ml)の直腸注入によって処理した。大腸炎の誘発の3日後に、染色した組織切片で炎症を評価した。
【0202】
蠕虫感染が、IFNγ、TNFαおよびIL12のようなTh1サイトカインの腸内産生を制限することによって、TNBS誘導性IBDからマウスを保護するかどうかを検査するために、実験を行った。図6および7は、IBDのない健康なWTマウスのH. polygyrusへの暴露が、遠位腸粘膜のIFNγおよびIL12産生の能力を低下させることを示す。
【0203】
IL10、TGFβおよびPgE2のような制御性サイトカインは、「Th1」細胞機能を制限することができる。H. polygyrusが腸粘膜内でのこれらの制御性サイトカインの産生を促進するかどうかを測定した。図8は、この寄生虫が粘膜のIL10産生を誘導することを示す。IL10は、TNFα、IL6およびIL12のような一連の前炎症性メディエーターをダウンレギュレートする。従って、腸粘膜で産生されたIL10が「Th1」細胞機能を制限すると仮定することは妥当である。図9は、H. polygyrusを用いたマウスからのLPMCが、阻害性の抗IL10R mAbとともに培養された場合、実質的により多くのIFNγを産生することを示し、この仮説を支持している。
【0204】
疾患から保護することができる潜在的に重要な免疫調節サイトカインは、プロスタグランジンE2(PgE2)、IL4、IL5、IL13およびTGFβを含む。図10〜12は、蠕虫が腸粘膜において防御性サイトカインE2(PgE2)、IL4、IL5、IL13およびTGFβの産生を誘導することを示す。
【0205】
T細胞は腸粘膜でのIFNγの主要な供給源である(図13)。IFNγはTNBS大腸炎の誘発に重要である。
【0206】
腸管寄生蠕虫は、粘膜の免疫反応を局所的に制御するために腸に移動するMLN中の制御性T細胞を誘導する。実験は、未処理の非感染WTマウスからのLPMCが、寄生虫感染マウスからのMLN T細胞の移植後、IFNγを産生する能力の低下を呈することを示した(図14)。
【0207】
いくつかの実験では、MLN制御性T細胞サブセットが腸固有層に入り、続いて制御性サイトカインを産生したかどうかを決定する養子免疫伝達実験のために、緑色蛍光タンパク質(GFP)トランスジェニックマウスを使用した。図15に見られるように、H. polygyrusを有するGFP+マウスからの推定MLN制御性T細胞は、健康なWTレシピエントの腸粘膜に入る。
【0208】
この実験は、どのようにして蠕虫が疾患から保護するかを示す。臨床試験において、蠕虫感染が活動性IBDを改善することが発見された。どのようにしてH. polygyrusによる感染が進行性のマウス大腸炎を逆転させるかもまた、検査された。
【0209】
IL10-/-マウスは、動物が年を取るにつれて徐々に悪化する慢性のTh1大腸炎を発症する。しかし、ほとんどの自然発症疾患のIBDモデルに当てはまるように、SPF施設のIL10-/-マウスはわずか数ヶ月後に様々な表現型の大腸炎を発症する。それを実験のためにより有用になるように、IBDモデルを改良した。5週齢のIL10-/-マウスを2週間 NSAID(ピロキシカム)で飼育することは、薬剤を止めた後でも無期限に持続する重度のTh1大腸炎を誘発することが発見された。炎症はマウス間で高度に予測可能であり、均一な重症度の大腸およびTIを有する(図16)。WTマウスはピロキシカム処理による大腸炎を発症しない。
【0210】
IL10-/-マウスのH. polygyrusによる感染は、以前に確立された大腸炎を解消させることが発見された(図17)。5週齢のC57BL/6 IL10-/-マウスにピロキシカム(80mg/250g飼料)を与えた。2週間後、ピロキシカムを中止した。この時点で、すべてのマウスは大腸炎であった。ピロキシカムを中止して2日後に、数匹のマウスを胃への強制投与によって200匹のH. polygyrusに感染させ、一方、他のマウスに偽処理を行った。感染の2週間後、大腸炎スコアは、対照での3.6±0.4(SE)から感染マウスでの0.55±0.5(p=0.001)へと低下した。
【0211】
確立された大腸炎のH. polygyrusによる治癒は、LPMCのサイトカイン産生の変化に関連する。
【0212】
未処理の(ピロキシカムなしの)マウスから、または大腸炎の偽感染マウスから単離されたLPMCは、抗CD3/抗CD28による刺激に応じて多量のIFNγを放出し(図18)、CpGオリゴヌクレオチド(0.6μg #1826/ml)による刺激に応じてIL12を放出する。ピロキシカム処理したH. polygyrus感染IL10-/-マウスからのLPMCは、高感度の(30pg/ml)ELISAによって検出可能なIFNγをほとんどまたはまったく産生せず、IL12の放出の抑制を示す(図18)。未処理または大腸炎のIL10-/-マウスからのLPMCは、IL4を産生せず、IL13をほとんど産生しない(図19)。対照的に、H. polygyrus感染マウスからのLPMCは、いくらかのIL4および多量のIL13を産生する。蠕虫感染は大腸の炎症を逆転させるが、LPMCサイトカインプロフィールは、単に未処理のIL10-/-マウスのそれに戻るわけではない。むしろ、感染は、大腸炎の治癒に関連する新たなサイトカインプロフィールをもたらす。
【0213】
H. polygyrus感染はIL10-/-マウスのLPMCでの調節回路を活性化する。大腸炎のIL10-/-マウスからのIFNγを産生しているLPMCとH. polygyrus感染マウスからのLPMCとの1:1の混合は、IFNγ産生を阻害された共培養物をもたらす。
【0214】
H. polygyrusは十二指腸に生息するが、大腸炎を逆転させ、遠位のLPMCサイトカインプロフィールを変化させる調節回路を開始する。蠕虫感染は、H. polygyrus感染マウスのMLN T細胞区画内に存在する循環制御性細胞を誘導または活性化することが示された。H. polygyrus感染IL10-/-マウスからの20x106 MLN細胞または5x106 MLN T細胞の、確立されたIL10-/-大腸炎を有する動物への移植は、炎症の解消をもたらす(図20)。
【0215】
Scurfinはfoxp3遺伝子によってコードされる転写因子であり、制御性T細胞の増殖または活性に重要である。Foxp3転写産物は、リアルタイムRT-PCRによって定量されるように、寄生虫のないIL10-/-マウスと比較してH. polygyrus感染マウスのMLNにおいて増加する(図21)。1回1回のPCRサイクル閾値の減少は、HPRT mRNAに対して標準化された2倍のFoxp3含量に相当する。蠕虫感染は、MLN細胞において3〜5倍のFoxp3発現の増加を引き起こす。Foxp3はまた、寄生虫のない対照と比較して、H. polygyrus感染IL10-/-マウスのLPMCにおいても増加する(3倍)。制御性T細胞のみが、Foxp3を発現することが知られている(Hori, S. , T. Nomura,およびS. Sakaguchi. 2003. Control of regulatory T cell development by the transcription factor Foxp3. Science. 299: 1057-1061)。MLNおよびLPMCにおけるFoxp3発現の増加は、蠕虫が、確立された大腸炎の解消を指揮する制御性T細胞を誘導するという仮説を支持する。
【0216】
他の免疫調節因子の転写産物は、H. polygyrusへの感染によって変化する。Smad7はTGFβシグナル伝達を遮断する転写因子である。H. polygyrusへの感染は、リアルタイムRT-PCRによって測定されるように、MLN細胞のSmad7発現を4.5倍減少させる(図22)。Smad7転写産物はまた、LPMCにおいても減少する。Smad7の減少は、細胞が免疫調節性TGFβに対してより応答性になることを可能にする。更に、Smad7発現の減少は、複数の調節機構がおそらくIL10-/-大腸炎を解消するために機能していることを示す。
【0217】
Smad7のためのプライマーおよびプローブは、TCCTGCTGTGCAAAGTGTTC(配列番号4)、GAGTAAGGAGGAGGGGGAGA(配列番号5)、およびFAM-TTGATCTTCCCGTAAGATTCACAGCAACA-TAMRA(配列番号6)である。Foxp3およびSmad7 mRNAの発現は、HPRTに対して標準化される。HPRTのためのプライマーおよびプローブは、TGAAGAGCTACTGTAATGATCAGTCAAC(配列番号7)、GCAAGCTTGCAACCTTAACCAT(配列番号8)、およびTET-TGCTTTCCCTGGTTAAGCAGTACAGCCC-TAMRA(配列番号9)である。
【0218】
<他の実施形態>
上述の実施例は、本発明の作出および実施において、本発明者らによって行われ、企図された実験の実例を説明する。これらの実施例は、本発明の実施方法を知らせるため、およびその有用性を証明するための両方の目的を果たす技術の開示を含むと考えられる。本明細書において開示される技術および実施形態は単に好ましい実施形態であり、一般的に多数の同等の方法および技術が同様の結果を得るために使用されうることは、当業者によって認識されるであろう。
【0219】
本明細書の上記に特定された参考文献はすべて、それらが、本発明の1以上の実施形態の実施に重要でありうる組成物および/または方法の基礎を記載し、説明し、提供し、それを可能にする範囲で、ここで明確に参照により本明細書に組み入れられる。
【特許請求の範囲】
【請求項1】
制御性T細胞活性を変化させる蠕虫性寄生虫調製物をスクリーニングする方法であって、前記方法が、
(a)蠕虫性寄生虫調製物を得るステップ、
(b)前記蠕虫性寄生虫調製物を標的と接触させるステップ、および
(c)前記接触後の前記標的における制御性T細胞活性のための内部マーカーのレベルを測定するステップを含み、ここで前記接触後の前記内部マーカーの前記レベルの変化が制御性T細胞活性を変化させる前記蠕虫性寄生虫調製物の指標となる方法。
【請求項2】
前記内部マーカーが転写因子である、請求項1に記載の方法。
【請求項3】
前記転写因子がScurfin、Smad7、Gata3、またはTbet(Tbx21)である、請求項2に記載の方法。
【請求項4】
前記転写因子の前記レベルがそのタンパク質またはmRNAレベルで測定される、請求項2に記載の方法。
【請求項5】
制御性T細胞活性を変化させる蠕虫性寄生虫調製物をスクリーニングする方法であって、前記方法が、
(a)蠕虫性寄生虫調製物を得るステップ、
(b)前記蠕虫性寄生虫調製物を標的と接触させるステップ、および
(c)前記接触後の前記標的における制御性T細胞のための細胞表面マーカーのレベルを測定するステップを含み、ここで前記接触後の前記細胞表面マーカーの前記レベルの変化が制御性T細胞活性を変化させる前記蠕虫性寄生虫調製物の指標となる方法。
【請求項6】
前記細胞表面マーカーがCD4、CD45RBlo、CD45Rc、細胞傷害性Tリンパ球関連抗原4(CTLA-4)、Ox40、4-1BB、CD25、CD103、CD62L、αEβインテグリン、潜伏関連ペプチド(LAP)またはグルココルチコイド誘導性TNF受容体ファミリー関連タンパク質(GITR)、ケモカイン受容体CCR5、TI-ST2からなる群より選択される、請求項5に記載の方法。
【請求項7】
前記表面マーカーの前記レベルがそのタンパク質またはmRNAレベルで測定される、請求項6に記載の方法。
【請求項8】
Th1またはTh2関連疾患を有する動物を、制御性T細胞活性を変化させる蠕虫性寄生虫調製物の前記動物への投与によって治療する方法。
【請求項9】
動物における自己免疫疾患またはアレルギー疾患に対する蠕虫性寄生虫調製物の治療効果を測定する方法であって、
(a)蠕虫性寄生虫調製物もしくはその画分を含む組成物を前記動物に投与すること、および
(b)前記投与後の前記動物において制御性T細胞活性のレベルを測定することを含み、ここで前記投与後の前記制御性T細胞活性の前記レベルの増加が前記蠕虫性寄生虫調製物の治療効果の指標となる方法。
【請求項10】
前記制御性T細胞活性が制御性T細胞マーカーのレベルの測定によって測定される、請求項9に記載の方法。
【請求項11】
前記制御性T細胞マーカーが内部マーカーである、請求項10に記載の方法。
【請求項12】
前記内部マーカーがScurfin、Smad7、Gata3、またはTbet(Tbx21)である、請求項11に記載の方法。
【請求項13】
前記制御性T細胞マーカーが細胞表面マーカーである、請求項10に記載の方法。
【請求項14】
前記細胞表面マーカーがCD4、CD45RBlo、CD45Rc、細胞傷害性Tリンパ球関連抗原4(CTLA-4)、Ox40、4-1BB、CD25、CD103、CD62L、αEβインテグリン、潜伏関連ペプチド(LAP)またはグルココルチコイド誘導性TNF受容体ファミリー関連タンパク質(GITR)、ケモカイン受容体CCR5、TI-ST2からなる群より選択される、請求項13に記載の方法。
【請求項15】
前記制御性T細胞マーカーが分泌マーカーである、請求項10に記載の方法。
【請求項16】
前記分泌マーカーがIL4、IL13、IL-5、IL-10またはTGFβ、PgE2である、請求項15に記載の方法。
【請求項1】
制御性T細胞活性を変化させる蠕虫性寄生虫調製物をスクリーニングする方法であって、前記方法が、
(a)蠕虫性寄生虫調製物を得るステップ、
(b)前記蠕虫性寄生虫調製物を標的と接触させるステップ、および
(c)前記接触後の前記標的における制御性T細胞活性のための内部マーカーのレベルを測定するステップを含み、ここで前記接触後の前記内部マーカーの前記レベルの変化が制御性T細胞活性を変化させる前記蠕虫性寄生虫調製物の指標となる方法。
【請求項2】
前記内部マーカーが転写因子である、請求項1に記載の方法。
【請求項3】
前記転写因子がScurfin、Smad7、Gata3、またはTbet(Tbx21)である、請求項2に記載の方法。
【請求項4】
前記転写因子の前記レベルがそのタンパク質またはmRNAレベルで測定される、請求項2に記載の方法。
【請求項5】
制御性T細胞活性を変化させる蠕虫性寄生虫調製物をスクリーニングする方法であって、前記方法が、
(a)蠕虫性寄生虫調製物を得るステップ、
(b)前記蠕虫性寄生虫調製物を標的と接触させるステップ、および
(c)前記接触後の前記標的における制御性T細胞のための細胞表面マーカーのレベルを測定するステップを含み、ここで前記接触後の前記細胞表面マーカーの前記レベルの変化が制御性T細胞活性を変化させる前記蠕虫性寄生虫調製物の指標となる方法。
【請求項6】
前記細胞表面マーカーがCD4、CD45RBlo、CD45Rc、細胞傷害性Tリンパ球関連抗原4(CTLA-4)、Ox40、4-1BB、CD25、CD103、CD62L、αEβインテグリン、潜伏関連ペプチド(LAP)またはグルココルチコイド誘導性TNF受容体ファミリー関連タンパク質(GITR)、ケモカイン受容体CCR5、TI-ST2からなる群より選択される、請求項5に記載の方法。
【請求項7】
前記表面マーカーの前記レベルがそのタンパク質またはmRNAレベルで測定される、請求項6に記載の方法。
【請求項8】
Th1またはTh2関連疾患を有する動物を、制御性T細胞活性を変化させる蠕虫性寄生虫調製物の前記動物への投与によって治療する方法。
【請求項9】
動物における自己免疫疾患またはアレルギー疾患に対する蠕虫性寄生虫調製物の治療効果を測定する方法であって、
(a)蠕虫性寄生虫調製物もしくはその画分を含む組成物を前記動物に投与すること、および
(b)前記投与後の前記動物において制御性T細胞活性のレベルを測定することを含み、ここで前記投与後の前記制御性T細胞活性の前記レベルの増加が前記蠕虫性寄生虫調製物の治療効果の指標となる方法。
【請求項10】
前記制御性T細胞活性が制御性T細胞マーカーのレベルの測定によって測定される、請求項9に記載の方法。
【請求項11】
前記制御性T細胞マーカーが内部マーカーである、請求項10に記載の方法。
【請求項12】
前記内部マーカーがScurfin、Smad7、Gata3、またはTbet(Tbx21)である、請求項11に記載の方法。
【請求項13】
前記制御性T細胞マーカーが細胞表面マーカーである、請求項10に記載の方法。
【請求項14】
前記細胞表面マーカーがCD4、CD45RBlo、CD45Rc、細胞傷害性Tリンパ球関連抗原4(CTLA-4)、Ox40、4-1BB、CD25、CD103、CD62L、αEβインテグリン、潜伏関連ペプチド(LAP)またはグルココルチコイド誘導性TNF受容体ファミリー関連タンパク質(GITR)、ケモカイン受容体CCR5、TI-ST2からなる群より選択される、請求項13に記載の方法。
【請求項15】
前記制御性T細胞マーカーが分泌マーカーである、請求項10に記載の方法。
【請求項16】
前記分泌マーカーがIL4、IL13、IL-5、IL-10またはTGFβ、PgE2である、請求項15に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【公開番号】特開2012−8133(P2012−8133A)
【公開日】平成24年1月12日(2012.1.12)
【国際特許分類】
【外国語出願】
【出願番号】特願2011−166246(P2011−166246)
【出願日】平成23年7月29日(2011.7.29)
【分割の表示】特願2006−539540(P2006−539540)の分割
【原出願日】平成16年10月22日(2004.10.22)
【出願人】(304051252)ユニバーシティー オブ アイオワ リサーチ ファウンデーション (11)
【Fターム(参考)】
【公開日】平成24年1月12日(2012.1.12)
【国際特許分類】
【出願番号】特願2011−166246(P2011−166246)
【出願日】平成23年7月29日(2011.7.29)
【分割の表示】特願2006−539540(P2006−539540)の分割
【原出願日】平成16年10月22日(2004.10.22)
【出願人】(304051252)ユニバーシティー オブ アイオワ リサーチ ファウンデーション (11)
【Fターム(参考)】
[ Back to top ]

