疾患の治療における脂質コンジュゲートの使用
【課題】リン脂質で構成される脂質コンジュゲートを医薬として利用する。;
【解決手段】本発明のリン脂質化合物(PL−コンジュゲート)は、一般的な式:[ホスファチジルエタノールアミン−Y−]n−X、[ホスファチジルセリン−Y−]n−X、[ホスファチジルコリン−Y−]n−X、[ホスファチジルイノシトール−Y−]n−X、[ホスファチジルグリセロール−Y−]n−X<式中 Yは存在しないか又は長さ2から30原子の範囲のスペーサー基であり;そしてXは生理学的に許容しうるモノマー、ダイマー、又はオリゴマーいずれかであって、nは1から1,000の数である>として記載され、酵素、ホスホリパーゼA2の細胞外型を阻害する能力に加え、多数のそして強力な薬理学的効果の特異な組み合わせを持つ。
【解決手段】本発明のリン脂質化合物(PL−コンジュゲート)は、一般的な式:[ホスファチジルエタノールアミン−Y−]n−X、[ホスファチジルセリン−Y−]n−X、[ホスファチジルコリン−Y−]n−X、[ホスファチジルイノシトール−Y−]n−X、[ホスファチジルグリセロール−Y−]n−X<式中 Yは存在しないか又は長さ2から30原子の範囲のスペーサー基であり;そしてXは生理学的に許容しうるモノマー、ダイマー、又はオリゴマーいずれかであって、nは1から1,000の数である>として記載され、酵素、ホスホリパーゼA2の細胞外型を阻害する能力に加え、多数のそして強力な薬理学的効果の特異な組み合わせを持つ。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、閉塞性呼吸疾患、大腸炎、クローン病、中枢神経系発作、多発性硬化症、接触皮膚炎、乾癬、侵襲処置の予防を含む心臓血管疾患、浸潤性細胞増殖障害、抗酸化剤療法、溶血症候群、敗血症、急性呼吸困難症候群、組織移植拒絶症候群、自己免疫疾患、ウイルス感染、クラミジア(chlamydia)感染、および過敏性結膜炎を含む疾患の治療に向けられる、薬学的に活性である脂質コンジュゲート化合物種を提供する。
【背景技術】
【0002】
いくつかの高分子量コンジュゲート、特にコンジュゲート部分が、ドデカンジオイック、デキストラン、デキストランアミド、カルボキシメチルセルロース、カルボキシメチルセルロース−アシル、ポリ−D−グルタミン酸、ポリアクリル酸、ポリエチレングリコール、ヒドロキシエチルデンプン、ヘパリン、ヒアルロン酸、およびポリグレアチン(polygleatin)(「ヘマセル」)であるものが、特許文献1、および本明細書に引用される刊行物に記載されてきているが、これらの化合物は、広範囲の薬理学的有効性を有することが知られていなかった。これらの化合物は、sn−2位でのリン脂質の分解を触媒し、脂肪酸およびリゾリン脂質を生じる酵素、ホスホリパーゼA2(PLA2、EC 3.1.1.4)を阻害する薬理学的活性を有することが知られている。この酵素の活性は、多様な細胞機能と、特に開口分泌などの分泌過程およびエイコサノイド産生(プロスタグランジン、トロンボキサンおよびロイコトリエン)と相関してきている。これらの大部分がリン脂質である誘導体に帰せられる生物学的活性は、血小板凝集、トロンボキサン分泌、およびホスホリパーゼA2の選択的阻害に限定された。したがって、PLA2阻害剤の使用は、アレルギーおよび炎症におけるなど、増進された細胞分泌と関連する疾患の治療のため、提唱された。したがって、高分子量のホスファチジルエタノールアミン−コンジュゲート(PE−コンジュゲート)、および関連するリン脂質コンジュゲート化合物(PL−コンジュゲート)は、特にその相対的に高分子量である大きさが、細胞膜レベルで、この加水分解酵素活性の選択的阻害剤として、該化合物自体を有用にするため、PLA2関連異常の治療に有用であると判断された。したがって、これらの化合物の推定される医学的使用は、必然的に、PLA2に関連する病理学的異常の治療に限定された。その発端から、PL−コンジュゲートは、多因子性起源であり、世界中で、かなりの罹患率および死亡率を占め続ける、一般的であるが重症の疾患を治療する新規方法を確立することに向けた、集中的な実験室研究に供されてきた。これらの研究から、PL−コンジュゲートに関し、広範囲の強力でそして有用な生物学的作用が明らかになってきており、そして特定の疾患の治療の点から見ると、これらの化合物の役割は、医学業にこれまで導入されてきていない。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】米国特許第5,064,817号明細書
【発明の開示】
【発明が解決しようとする課題】
【0004】
本発明は、主に、ホスファチジルエタノールアミンなどのリン脂質、およびホスファチジルセリンなどの関連リン脂質で構成される、脂質コンジュゲートであって、生理学的に適合するモノマー、ダイマー、オリゴマー又はポリマー部分へのコンジュゲート化によって、適切に調製された際、予期されなかった広範囲および効力の薬理学的活性を示す、前記脂質コンジュゲートを提供する。これらの化合物の投与は、閉塞性呼吸疾患、大腸炎、クローン病、中枢神経系発作、多発性硬化症、接触皮膚炎、乾癬、侵襲処置の予防を含む心臓血管疾患、浸潤性細胞増殖障害、抗酸化剤療法、溶血症候群、敗血症、急性呼吸困難症候群、組織移植拒絶症候群、自己免疫疾患、ウイルス感染、クラミジア感染、および過敏性結膜炎を含む疾患に罹患した被験者の有効な治療を含む。これらの疾患のため、薬理学的療法としてのPL−コンジュゲートの使用は、新たな種類の薬剤に相当し、現在、医師に処方された慣用的措置に厳密に追従しているにもかかわらず、罹患に苦しみ続けている多くの患者に利点を与える。
【課題を解決するための手段】
【0005】
本発明の1つの態様において、PL−コンジュゲートは、抗腫瘍壊死因子(TNF)剤として、このサイトカインの調節不全を患う被験者に投与する。
別の態様において、PL−コンジュゲートは、平滑筋増殖の抗増殖剤として、そして抗血管形成剤として、血管疾患又は転移性癌増殖において、起こる可能性があるような、平滑筋増殖又は血管形成の調節不全を患う被験者に投与する。
【0006】
別の態様において、PL−コンジュゲートは、鎮痙(anti−spasmic)、抗サイトカイン、免疫抑制、および抗浸潤剤として、喘息および慢性閉塞性肺疾患を含む、閉塞性呼吸疾患に罹患した被験者に投与する。
【0007】
別の態様において、PL−コンジュゲートは、細胞保護、抗サイトカインおよび免疫抑制剤として、大腸炎又はクローン病に罹患した被験者に投与する。
別の態様において、PL−コンジュゲートは、抗一酸化窒素、抗ドーパミン、抗酸化、抗サイトカイン、および血液脳関門安定化神経保護剤として、虚血性脳卒中、腫瘍、外傷、感染、および多発性硬化症を含む、急性又は変性脳発作に罹患した被験者に投与する。
【0008】
別の態様において、PL−コンジュゲートは、免疫抑制、抗増殖、抗サイトカイン、血液脳関門安定化および神経保護剤として、多発性硬化症に罹患した被験者に投与する。
【0009】
別の態様において、PL−コンジュゲートは、免疫抑制および抗サイトカイン剤として、接触皮膚炎を含む、皮膚過敏反応に罹患した被験者に投与する。
別の態様において、PL−コンジュゲートは、抗増殖および抗サイトカイン剤として、乾癬に罹患した被験者に投与する。
【0010】
別の態様において、PL−コンジュゲートは、抗増殖、抗酸化、抗遊走、および抗アテローム発生剤として、急性又は慢性虚血性血管疾患、散在性アテローム性動脈硬化病変、および虚血事象に関連する再灌流損傷を含む、心臓血管疾患に罹患した被験者に投与する。
【0011】
別の態様において、PL−コンジュゲートは、抗狭窄剤として、侵襲性医学処置、特に動脈又は静脈カテーテル処置を経験する被験者に投与する。
別の態様において、PL−コンジュゲートは、抗増殖、抗血管形成、抗サイトカイン、抗細胞マトリックス分解、および抗遊走剤として、転移又は転移前癌を含む侵襲性細胞増殖障害に罹患した被験者に投与する。
【0012】
別の態様において、PL−コンジュゲートは、生理学的ストレス、照射、および加齢に関連する損傷を含む、酸化組織損傷の予防法として、抗酸化剤として、被験者に投与する。
【0013】
別の態様において、PL−コンジュゲートは、膜安定化および抗酸化剤として、毒性、感染性、又は遺伝的起源の溶血性貧血を含む、溶血に罹患した被験者に投与する。
【0014】
別の態様において、PL−コンジュゲートは、抗ケモカイン、抗サイトカイン剤、および抗一酸化窒素剤として、敗血症に罹患した被験者に投与する。
別の態様において、PL−コンジュゲートは、抗ケモカインおよび抗痙攣剤として、急性呼吸困難症候群に罹患した被験者に投与する。
【0015】
別の態様において、PL−コンジュゲートは、免疫抑制、細胞保護、抗サイトカインおよび抗再灌流病変剤として、組織又は臓器移植を受ける被験者に投与する。
【0016】
別の態様において、PL−コンジュゲートは、免疫抑制、抗サイトカインおよび抗増殖剤として、自己免疫疾患に罹患した被験者に投与する。
別の態様において、PL−コンジュゲートは、抗ウイルス療法として、HIVとして知られるレトロウイルスを含む、ウイルス感染に罹患した被験者に投与する。
【0017】
別の態様において、PL−コンジュゲートは、抗サイトカイン剤として、過敏性結膜炎に罹患した被験者に投与する。
別の態様において、PL−コンジュゲートは、保存剤として、保存又は移植の目的のため、体から除去された組織又は臓器に添加する。
【0018】
別の態様において、PL−コンジュゲートは、療法剤として、クラミジア感染に罹患した被験者に投与する。
投与経路および投与されるPL−コンジュゲートの投薬量は、疾患の性質および治療される患者の医学的状態に応じて、熟練した医師が、容易に決定することが可能である。いくつかの場合、1種類より多いPL−コンジュゲートが、1以上の異なる投与経路を通じて、リスクがある被験者に対する予防法として、又は疾患の徴候および症状の出現に反応して、投与されるであろう。疾患の治療におけるPL−コンジュゲートの使用は、療法のさらなる方式を排除せず、そしてPL−コンジュゲートの同時投与は、さらなる修飾、例えば処方された他の医薬品の投薬量の減少を可能にする可能性があると期待できる。
【0019】
本発明の別の側面において、低分子量PL−コンジュゲート、特に極性頭基を通じて、単糖又は二糖、カルボキシ二糖、モノカルボン酸又はジカルボン酸、サリチレート、アミノ酸、ジペプチド、オリゴペプチド、胆汁酸、脂肪酸、コレステリルヘミスクシネート、三糖、あるいはヘパリン、ヘパラン硫酸、ヒアルロン酸、デキストラン、コンドロイチン、コンドロイチン−4−硫酸、コンドロイチン−6−硫酸、ケラチン、ケラタン硫酸、ダーマチン(dermatin)、およびダーマタン(dermatan)硫酸の反復単位を含む、ポリグリコサミノグリカンの二糖又は三糖単位モノマーに結合されたリン脂質に相当する、新規化合物が提供される。低分子量のPL−コンジュゲート種の代表としてのこれらの新規化合物は、本明細書に記載される、より高分子量のPL−コンジュゲートに明示されるのと、同じ広範囲および強度の薬学的活性を示す。これらの新規化合物が本明細書に紹介されることによって、特定の疾患の治療における新規療法薬剤として有用なPL−コンジュゲートの範囲が広がる。
【0020】
本発明の別の態様において、ホスファチジルセリンは、療法化合物の調製および使用において、ホスファチジルエタノールアミンの代替物として使用することが可能であり、ここでリン脂質は、極性頭基を通じて、生理学的に許容しうるモノマー又はポリマーに結合されている。
【0021】
本発明の別の態様において、ホスファチジルコリン、ホスファチジルイノシトール、ホスファチジルグリセロール、および関連する極性リン脂質は、療法化合物の調製および使用において、ホスファチジルエタノールアミンの代替物として使用することが可能であり、ここでリン脂質は、極性頭基を通じて、生理学的に許容しうるモノマー又はポリマーに結合されている。モノアシルグリセロール、ジアシルグリセロール、およびトリアシルグリセロールなどのアシルグリセロールを用いる場合、極性頭基はヒドロキシル基である。本発明の方法を可能にする他の脂質は、スフィンゴミエリン、スフィンゴシン、およびセラミドである。
【0022】
本発明の別の態様において、リン脂質のグリセロール主鎖のC1およびC2位に、エステル結合の代わりにエーテル又はアルキル結合を持つ、リン脂質誘導体を、療法リン脂質−コンジュゲート化合物として用いることが可能である。
【0023】
本発明の別の側面において、本明細書に記載されるPL−コンジュゲートは、閉塞性呼吸疾患、大腸炎、クローン病、中枢神経系発作、多発性硬化症、接触皮膚炎、乾癬、侵襲処置の予防を含む心臓血管疾患、浸潤性細胞増殖障害、抗酸化剤療法、溶血症候群、敗血症、急性呼吸困難症候群、組織移植拒絶症候群、自己免疫疾患、ウイルス感染、クラミジア感染、又は過敏性結膜炎に罹患している被験者を治療するための薬剤組成物製造法に用いる。
【0024】
別の態様において、本明細書に記載されるPL−コンジュゲートは、保存又は移植の目的のため、体から除去される組織又は臓器を保存するための薬剤組成物製造法に用いる。
【0025】
伝統的に病因学および疫学において関連しないとみなされている多くの疾患が、今や、薬剤療法に受け入れられる可能性があるという本開示の性質に基づき、さらなる実験によって、本発明のより広い範囲が導かれ、PL−コンジュゲートでの生物学的組織および生存被験者の治療に基づいて、さらなる医薬様式が可能になるであろうと予期するのは合理的である。
【図面の簡単な説明】
【0026】
【図1】気管収縮アッセイ
【図2】HYPEによる気管収縮の阻害
【図3】HYPEによる気管収縮の阻害対ヒアルロン酸による阻害
【図4】HYPEおよびCMPEの皮下投与による、喘息ラットにおける呼吸器機能の改善
【図5】HYPEのエアロゾル投与による、喘息ラットにおける呼吸器機能の改善
【図6】HYPE吸入によって治療された慢性喘息のラット肺の病理対デキサメタゾンによって治療されたラット肺の病理
【図7】大腸炎型およびクローン病型大腸および小腸病理における、CMPEによる腸損傷スコアの減少
【図8A】クローン病型小腸疾患の粘膜損傷の改善
【図8B】クローン病型小腸疾患の粘膜損傷の改善
【図9】大腸炎型およびクローン病型大腸および小腸傷害における、CMPEによる腸浸透の減少
【図10】大腸炎におけるHYPEによる疾患スコアの改善
【図11】大腸炎におけるHYPEによる腸の長さの改善
【図12】CMPEおよびHYPEによるグリア細胞PGE2産生の阻害
【図13】CMPEおよびHEPEによるPC−12細胞PGE2産生の阻害
【図14】CMPE、HEPPE、およびHYPEによるグリア細胞一酸化窒素産生の阻害
【図15】HYPEによるマクロファージ一酸化窒素産生の阻害
【図16】CMPE、HEPPE、およびHYPEによるグリア細胞からのホスホリパーゼ放出の阻害
【図17】CMPEによるPC−12細胞オレイン酸放出の阻害
【図18】CMPEによるマクロファージ・オレイン酸放出の阻害
【図19】CMPEによるPC−12細胞ドーパミン放出の阻害
【図20】CMPEおよびHEPEによるPC−12 5−HETE放出の阻害
【図21】DEXPEおよびCMPEによる、内皮単層を通じたT細胞浸透の阻害
【図22】CMPEによる乾癬性線維芽細胞増殖の阻害
【図23】HYPEによる平滑筋細胞増殖の阻害
【図24】HYPEによる、刺激された平滑筋細胞増殖の阻害
【図25】HEPPEによる平滑筋細胞増殖の阻害
【図26】HYPEによるin vivo酸化LDL取り込みの阻害
【図27】CMPE、HEPPE、およびHYPEによるLDL関連ホスホリパーゼの阻害
【図28】赤血球接着によって判断されるような、CMPEおよびDEXPEによる内皮の保護
【図29】HEPPEおよびHYPEによる腫瘍細胞浸潤の阻害
【図30】HYPEによるヒアルロニダーゼの阻害
【図31】HYPEによるコラゲナーゼの阻害
【図32】CMPEおよびHYPEによるヘパリナーゼの阻害
【図33】HEPPEおよびCMPEによる内皮細胞増殖の阻害
【図34】アラキドン酸放出によって判断されるような、CMPEによる酸化傷害からの細胞の保護
【図35】硫酸放出によって判断されるような、CMPEによる酸化傷害からの細胞の保護
【図36】HYPEによるLDLの銅誘導酸化の阻害
【図37】HEPPEおよびHYPEによる、照射および保存条件に対する赤血球の保護
【図38】HYPEによる全血中のTNF−α産生の減少
【図38A】TNFの発現に対するPL−コンジュゲートの影響
【図39】HYPEによる、マクロファージ中のTNF−α産生の減少
【図40A】HYPEによる、肺内皮中のケモカイン産生の抑制
【図40B】HYPEによる、肺内皮中のケモカイン産生の抑制
【図40C】HYPEによる、肺内皮中のケモカイン産生の抑制
【図41】図41a−c:HYPEによるケモカイン遺伝子発現の抑制、図41d−e:IL−8発現に対するPL−コンジュゲートの影響、図41f:NF−κBの発現に対するPL−コンジュゲートの影響
【図42】近位尿細管内皮細胞における、HYPEによる主要組織適合性抗原およびインターフェロン刺激の抑制
【図43】近位尿細管内皮細胞における、HYPEによる主要組織適合性抗原およびインターフェロン刺激の抑制−濃度依存性
【図44】臍静脈内皮細胞における、HYPEによる主要組織適合性抗原およびインターフェロン刺激の抑制
【図45】自己免疫疾患における、CMPEによるリンパ球増殖の阻害
【図46】虚血/再灌流における白血球接着の抑制−HYPEおよびHEPEによって誘導される血管傷害
【図47】虚血/再灌流における白血球血管外遊走の抑制−HYPEおよびHEPEによって誘導される血管傷害
【図48】HYPEおよびHEPEによるレトロウイルス(HIV)力価の減少
【図49】CMPEによる、過敏性結膜炎における吸入誘発直後の角膜乳白度の減少
【図50】CMPEによる、過敏性結膜炎における吸入誘発後後期の角膜乳白度の減少
【図51】過敏性結膜炎における角膜プロスタグランジンおよびロイコトリエンB4レベル
【図52】クラミジアによるHeLa細胞の注入に対するPL−コンジュゲートの影響
【図53】HeLa細胞のクラミジア誘導アポトーシスに対するPL−コンジュゲートの影響
【発明を実施するための形態】
【0027】
本発明は、広範囲でそして特異な組み合わせの細胞保護薬理学的活性を示す、PL−コンジュゲートを提供する。これらの化合物は、喘息において気道閉塞を軽減し、胃腸疾患において粘膜組織を保護し、免疫反応を抑制し、皮膚過敏反応を軽減し、血管傷害および免疫学的反応に関連する細胞増殖を阻害し、血管および中枢神経系疾患に関連する細胞遊走を阻害し、組織タンパク質および細胞膜に対する酸化損傷を減弱し、ウイルス伝播に干渉し、組織破壊酵素活性を減少させ、そしてケモカインおよびサイトカインの細胞内レベルを減少させることが可能である。したがって、これらの化合物は、閉塞性呼吸疾患、大腸炎、クローン病、中枢神経系発作、多発性硬化症、接触皮膚炎、乾癬、心臓血管疾患、侵襲性医学処置、浸潤性細胞増殖障害、抗酸化剤療法、溶血症候群、敗血症、急性呼吸困難症候群、組織移植拒絶症候群、自己免疫疾患、ウイルス感染、および過敏性結膜炎を含む、多様な疾患状態の治療に有用である。
【0028】
閉塞性呼吸疾患は、呼吸困難、頻呼吸症、あるいは気道閉塞の聴診又は放射線学的徴候によって特徴付けられる、肺中の管腔通過の疾患である。喘息は、閉塞性呼吸疾患の原型疾患であるが、この異常は、臨床的にまた、急性肺感染、急性呼吸困難症候群においても、そして慢性閉塞性肺疾患としても直面される。病態生理は、気道管腔平滑筋の収縮および気道管腔内および管腔周囲の浸潤物の集積による、気流の閉塞に起因する。
【0029】
大腸炎は、腹部不快感、下痢、および放射線学的又は組織学的診断に際しての上皮裸出を含む粘膜損傷の特徴的な徴候によって特徴付けられる、胃腸管腔の慢性疾患である。クローン病は、典型的には小腸に影響を及ぼす関連障害であるが、胃腸管のいかなる領域を巻き込む可能性もある。
【0030】
多発性硬化症は、通常、脊椎液解析又は磁気共鳴画像によって診断される、運動の弱さ又は感覚障害、あるいは両方によって特徴付けられる、白質の疾患である。盲目を含む視覚的障害もまた、一般的である。疾患活性領域において、脳血管関門が損なわれる。
【0031】
皮膚過敏反応は、そうでなければ接触皮膚炎としても知られ、局所の赤み、腫脹、およびかゆみなどの組織過敏の外的徴候によって特徴付けられる。実質的にいかなる物質も該異常を生じる可能性があり、そしてこれは皮膚科医によって診断される、最も一般的な病訴の1つである。
【0032】
乾癬もまた、最も一般的な皮膚科疾患の1つであり、1から2パーセントの人々が冒される。関与の最も一般的な領域は、肘、膝、殿裂、および頭皮である。乾癬の活性病変では、上皮細胞複製速度が加速される。局所グルココルチコイドの長期使用は、しばしば、有効性の損失を伴う。
【0033】
心臓血管疾患は、血管管腔狭窄障害と共に、それから生じる、心臓、腎臓、および脳などの、これらの血管が供給する標的臓器の虚血症候群を指す。虚血、又は減少した血液供給は、血管狭窄から生じる。心臓血管疾患の徴候および症状には、とりわけ、狭心症、虚弱、呼吸困難、一過性虚血発作、脳卒中、および腎不全が含まれる。診断は、血液試験、心電図、超音波検査、および血管造影などの、付属の診断試験と組み合わせた、臨床的立場に基づく。アテローム性動脈硬化症は、血管管腔の狭窄が、反応性、遊走性、および増殖性細胞から、そして血液脂肪、コレステロール、およびリポタンパク質の局所取り込みから形成される、瘢痕様斑のためである、心臓血管疾患の一般的な要素である。この観点で特に重要なのは、酸化による損傷を受けた際、加速する可能性がある、低密度リポタンパク質(LDL)の集積である。斑は、急性および慢性狭窄病変両方の部位であるとみなされ、ここでは組織虚血のリスクが上昇する。
【0034】
血管の狭窄病変は、アテローム性動脈硬化症のみでなく、他の全身性心臓血管障害でもまた、生じる。これらの中には、動脈高血圧、移植臓器に関連する脈管炎を含む脈管炎、および凝固障害がある。これらの障害の多く、特に高血圧、アテローム性動脈硬化症、および脈管炎は、同一の患者で同時に発生する。
【0035】
再灌流傷害は、以前虚血であった組織への血流の回復後の組織傷害および壊死の開始を指す。この現象は、特に脳および心臓組織への、虚血および虚血後型傷害の重要な構成要素と認識される。再灌流において優勢である病態生理学的機構の1つは、そうでなければ酸化損傷又はフリーラジカル傷害として知られる、活性酸素種の損傷効果である。一酸化窒素およびそのラジカルもまた、病態生理に関連する。これらの有害な化学種の産生は、病変部位での白血球の局所集積、接着、および遊出に起因する。
【0036】
動脈又は静脈のカテーテル処置、あるいは開胸手術などの侵襲性医学処置は、しばしば、血管傷害と共に再灌流傷害のための組織虚血に関連し、これらはどちらも、侵襲処置の過程で生じる可能性がある。したがって、血管開存性(patency)の保持および再灌流傷害の予防は、医学において、集中的な研究の対象である。こうした方法は、診断および療法目的両方のために行われ、そして血管傷害又は狭窄の合併症を防ぐため、一般的に、佐剤が処方される。これらの病変の形成は、血液の凝固要素、血液細胞、並びに血管管腔壁の構造要素および細胞を含む、多数の関与物質を伴う。例えば、バルーン血管形成術成功後に現れる動脈再狭窄は、しばしば、バルーン血管形成によって引き起こされる過敏領域における平滑筋細胞の増殖によって、動脈の内径が狭窄するためである。この新規狭窄病変はまた、遊走および局所増殖の過程を通じて、病変部位に集積する、白血球を含む他の細胞種でも構成される可能性がある。2つの事象(細胞遊走および増殖)は、ほぼ間違いなく、おそらく、元来の組織傷害部位にマクロファージが初期に集積することによって放出される、いくつかの異なるサイトカインの協調した相互作用のためである。したがって、白血球は、遊走、局所増殖、内皮関門通過、コレステロール豊富なリポタンパク質の集積、泡沫細胞への変換、およびサイトカインの分泌を通じて、狭窄病変の形成に貢献する。この細胞増殖および血管管腔狭窄はしかし、冠状動脈又は脳循環に制限されも限定されもしない。これはまた、例えば末梢血管系において、手術後に発生し、再狭窄を引き起こす可能性もある。
【0037】
本発明の文脈において、用語、心臓血管疾患は、アテローム性動脈硬化症、脈管炎、侵襲処置、特に動脈又は静脈のカテーテル処置、およびそれらに関連する虚血症候群を生じる、血管管腔狭窄を指す。
【0038】
組織、移植片、および臓器の移植は、しばしば、宿主対移植片および移植片対宿主疾患の出現によって複雑になり、これらはどちらも移植片のレシピエントにおいて、急性又は慢性に発生する可能性がある。移植片の供給源は、同種間(同一種由来)であってもよいし、又は異種間(別の種由来)であってもよい。誘導された機能亢進免疫反応のための合併症としてであっても、又は別の機構を通じた合併症としてであっても、脈管炎は、いまだに組織移植処置でしばしば直面される合併症である。さらに、再灌流傷害のための血管損傷は、組織および臓器移植片の手術後機能不全の主要な要因であるとみなされる。
【0039】
自己免疫疾患は、被験者の臨床状態の変化が、異常な細胞性および/又は体液性免疫反応に起因する異常である。米国において最も一般的な自己免疫疾患は、若年性糖尿病、橋本およびグレーブ甲状腺炎、慢性関節リウマチ、クローン病および潰瘍性大腸炎、慢性活動性肝炎、白斑(vitaligo)、糸球体腎炎、ブドウ膜炎、多発性硬化症、強皮症、溶血性貧血、特発性血小板減少性紫斑病、重症筋無力症、全身性エリテマトーデス、および天疱瘡である。
【0040】
原発臓器部位又は伝播した他の部位(転移)で生じる癌細胞などの、過剰増殖細胞障害は、米国における死の主な原因の1つである。癌はしばしば、強力な抗増殖薬剤および放射線での療法を含む、すべての型の治療に、非常に抵抗性である。医学コミュニティーはますます、疾患の原発および転移型両方に関連する脈管構造が果たす、必須の役割に気づいてきている。いかなる細胞クラスターとも同様に、癌細胞は、信頼できる血液供給に依存し、そして実際、癌細胞は、内皮細胞および平滑筋細胞に作用して、新規血管を形成し、こうして癌性増殖に供給する、増殖因子の生成を通じて、新規の血管新生過程を促進することが知られている。
【0041】
異所部位への癌細胞の伝播である転移もやはり、しばしば、脈管構造依存過程であり、しばしば血行性伝播と称される。内皮細胞および基底膜物質などの要素で構成される、血管壁に課せられる生理学的障壁は、通常、細胞の通過に対して非常に選択的である。しかし、転移細胞は、いくつかが科学文献に確立されている、多様な機構を使用してこの障壁を抑止する。例えば、こうした異常な細胞は、コラゲナーゼ、ヘパリナーゼ、およびヒアルロニダーゼなどの、細胞外マトリックスおよび血管障壁に関連する構成要素を分解する、加水分解酵素を産生する。したがって、転移過程における重要な要因は、癌細胞が、血管管腔壁を通じて侵入するか、又は該壁に浸透し、こうして、循環を通じた移動後に、新規組織部位に到着して侵入する能力である。癌細胞はまた、血管形成を含む多くの側面から、転移過程を可能にする、サイトカインおよびケモカインとして知られるメッセンジャー化学物質も産生する。
【0042】
サイトカインおよびケモカインの細胞性生成は、健康において、重要な制御機能を果たす;しかし、ストレス又は疾患に対する機能亢進性反応が誘発された際、これらのタンパク質は、過剰に存在し、そして組織を損傷し、それによって、疾患状態をさらに悪化に追いやる可能性がある。これが起こる2つの例は、全身性感染であり、特に、血液運搬細菌(敗血症)のためのもの、および急性(又は成人)呼吸困難症候群(ARDS)として知られる肺異常におけるものである。ARDSでは、肺空間が液体で満たされ、ガス交換を妨げ、そして呼吸不全を生じる。血小板凝集が起こるが、主な犯罪者は、内皮表面に接着し、そして呼吸器破裂を経て、酸化傷害を負わせ、そしてロイコトリエン、トロンボキサン、およびプロスタグランジンに加え、Groα、ENA−78、CX3XおよびMCP−1などのケモカインを放出する、単球貪食細胞および白血球であるようである。単球貪食細胞は、肺胞では主にマクロファージで、そして脈管構造を裏打ちするものであり、該細胞はまた、内皮細胞を直接損傷し、そして白血球にリソソーム酵素を放出させる、オキシダント、仲介因子、および一連の分解酵素も放出する。死亡率は50%を越える。ARDSの最も一般的な原因は、感染、吸引、喫煙および毒素吸入と共に、細菌性敗血症を含む、肺外部で始まる全身性過程である。敗血症症候群およびショックは、血液中の多様な微生物産物、特にグラム陰性内毒素と、宿主仲介因子系の相互作用によって誘発される。その発生は、米国のみで、年間500,000例に達すると概算され、この数字は、抗生物質耐性生物の蔓延増加のため、上昇しているとみなされる。多様な宿主仲介因子が、敗血症および敗血症ショック(本明細書において、集合的に敗血症と称される)の病因に関連付けられてきており、これらには、刺激された細胞から放出される因子、特に、とりわけ、サイトカイン、腫瘍壊死因子−α(TNF)、Groα、ENA−78、CX3XおよびMCP−1、NFκB転写因子、リソソーム酵素および白血球由来のオキシダント、並びにアラキドン酸代謝産物が含まれる。
【0043】
赤血球溶解、又は溶血は、遺伝又は後天性障害である可能性があり、貧血、鉄欠乏、又は黄疸を生じさせる。後天性症候群の中に、ヘビのかみ傷、又はウイルス、細菌および寄生虫病因、特にマラリアを含む、感染性病原体の直接の毒性効果のため;食物摂取又は疾患を通じた酸化物質への曝露のため;あるいは異常な血管内の機械的外傷の結果としての膜異常がある。後者の異常は、微小血管障害溶血として知られ、機構において、心臓弁などの補綴移植物を通じた血液通過から生じる溶血に関連しているとみなされている。遺伝赤血球膜脆弱性は、しばしば、グルコース6−ホスファターゼ欠損、鎌形赤血球貧血、および地中海貧血症などの、血球内酵素および構造的欠損のため、発生する。赤血球溶解は、特に、γ−照射などの、フリーラジカル形成光力学性ウイルス破壊処理に供した際、血液産物の貯蔵寿命を限定する要因の1つである。
【0044】
後天性免疫不全症候群は、迅速に増加する地球規模の流行病であるとみなされ、そして伝播の1つの経路は、汚染された血液産物を通じるものである。この疾患の伝染および進行は、ヒト免疫不全ウイルスの感染活性に応じる。現在の療法は、主に、非常に高価で、そして患者許容度が低い薬剤である、逆転写酵素阻害剤の投与に限定されている。
【0045】
酸化傷害は、体組織に対する過酸化およびフリーラジカル産生の影響を指す。ある程度まで、過酸化物の産生は正常であり、例えば免疫防御の役割に起因される、生理学的過程である。しかし、ストレスおよび疾患状態において、又は時間の天然経過に渡り、生理学的老化におけるように、これらの不安定な化学部分の、膜構成要素および血液タンパク質を含む組織構造への集積的付加は、傷害の不可逆的パターンにつながる。抗酸化剤として作用する剤は、酸化損傷に対して保護することが可能である。こうした保護は、多くの科学的刊行物の主題になってきている。
【0046】
本発明は、極性頭基を通じて、生理学的に許容しうる化学部分に共有的にコンジュゲート化したリン脂質であって、高分子量でも低分子量でもよい前記リン脂質の投与に基づく、疾患治療法を提供する。
【0047】
本発明のリン脂質化合物(PL−コンジュゲート)は、一般的な式:
[ホスファチジルエタノールアミン−Y−]n−X
[ホスファチジルセリン−Y−]n−X
[ホスファチジルコリン−Y−]n−X
[ホスファチジルイノシトール−Y−]n−X
[ホスファチジルグリセロール−Y−]n−X
<式中
Yは存在しないか又は長さ2から30原子の範囲のスペーサー基であり;そしてXは生理学的に許容しうるモノマー、ダイマー、又はオリゴマーいずれかであって
nは単一体(unity)、又は生理学的に許容しうるポリマーであり、nは1から1,000の数である>によって記載される。
【0048】
本明細書において、リン脂質コンジュゲート(PL−コンジュゲート)として知られるこれらのリン脂質化合物は、ここで、酵素、ホスホリパーゼA2の細胞外型を阻害する能力に加え、多数のそして強力な薬理学的効果の特異な組み合わせを持つことが開示されている。生理学的に許容しうるモノマー又はポリマーに共有結合したホスファチジルエタノールアミンを含む化合物組は、本明細書において、PE−コンジュゲートと称される。ホスファチジルセリン、ホスファチジルコリン、ホスファチジルイノシトール、又はホスファチジルグリセロールいずれかが、リン脂質部分として、ホスファチジルエタノールアミンの代わりに使用されている、関連する誘導体は、PL−コンジュゲートに関して以下に記載されている生物学的実験およびこれらの化合物に共有される構造的類似性に基づいて、同等な療法的結果を提供する。本発明に適した他のリン脂質−コンジュゲート誘導体は、グリセロール主鎖の位C1又はC2のリン脂質部分の脂肪酸基の少なくとも1つが、エステル連結よりもエーテル又はアルキル結合いずれかで付着している長鎖アルキル基に置換されている、PL−コンジュゲートである。
【0049】
PL−コンジュゲートに関して本明細書に提供される構造式に定義されるように、これらの化合物は、単一の生理学的に許容しうるポリマー分子に結合した、1から1000の間のリン脂質部分を含む可能性がある。
【0050】
疾患の多様な動物および細胞モデルにおけるPL−コンジュゲートの投与は、顕著で、そして予期されない、疾患治療に有用な細胞保護効果を発動する。これらはまた、生物学的膜を安定化し;細胞増殖を阻害し;フリーラジカル産生を抑制し;一酸化窒素産生を抑制し;生物学的障壁を渡る細胞遊走を減少させ;MCP−1、ENA−78、Groα、およびCX3Cを含むケモカインレベルに影響を及ぼし;遺伝子転写に影響を及ぼし、そしてMHC抗原の発現を修飾し;細胞膜に直接結合し、そして細胞表面での水構造を変化させ;酸化リポタンパク質の取り込みを阻害し;気道平滑筋収縮を妨げ;神経伝達物質放出を抑制し;腫瘍壊死因子−α(TNF−α)の発現を減少させ;NFκBなどの転写因子の発現を修飾し;PLA2に加え、コラゲナーゼ、ヘパリナーゼ、ヒアルロニダーゼを含む、細胞外分解酵素を阻害し;そして白血球のウイルス感染を阻害することが可能である。したがって、PL−コンジュゲートは、組織損傷を統括する1以上の病態生理機構が、膜脆弱性を生じさせる、酸化発作;血管組織における狭窄斑形成、血管形成および良性又は悪性癌疾患、あるいは乾癬を生じさせる、細胞の過剰増殖作用;脳傷害又は腫瘍細胞転移を生じさせる、異常な細胞遊走;中枢神経系(CNS)発作、敗血症、ARDS、又は免疫学的疾患に関連するケモカインおよびサイトカインの過剰発現;CNS発作、CVS疾患、又は溶血を生じさせる、細胞膜損傷;アテローム性動脈硬化症又は再灌流傷害を生じさせる、血液タンパク質および細胞膜の過酸化;CNS発作、再灌流傷害、および敗血症ショックを生じさせる、過剰な一酸化窒素産生;移植拒絶などの、自己免疫疾患および同種免疫症候群に関連する主要組織適合性抗原(MHC)との相互作用いずれかを含む疾患を患う生物に対し、遠大な細胞保護効果を提供する。
【0051】
本発明において、PL−コンジュゲートの有用な薬理学的特性は、臨床使用に限定され、そして疾患治療法として本明細書に開示される。これらの方法の生物学的基礎は、以下に記載されるように疾患の標準的細胞および動物モデルによって、容易に立証することが可能である。
【0052】
本明細書に記載されるPL−コンジュゲートの薬理学的活性は、部分的にリン脂質部分の性質のためである可能性があるが、PL−コンジュゲートに関して観察される、多数のそして多様な組み合わせの薬理学的特性は、1つの化学実体において、本質的にいくつかの異なる薬剤として作用する化合物構造の能力を明らかにする。したがって、例えば、大腸炎又はクローン病において発生する可能性があるような、内部粘膜傷害は、免疫抑制、抗炎症、抗酸化、一酸化窒素産生、又は膜安定化の薬剤活性のいかなる1つ又はすべてによっても、減弱されることが可能である。アテローム性動脈硬化症において発生する可能性があるような管腔周囲の損傷からの血管の保護は、抗増殖、抗ケモカイン、抗酸化、又は抗遊走効果からの活性を含む可能性がある。閉塞性呼吸疾患の治療は、一酸化窒素の抑制、抗ケモカイン、抗増殖、又は膜安定化効果の範囲の、PL−コンジュゲートの多くの活性のいかなる1つを伴う可能性もある。
【0053】
血管組織の増殖は、硬化性斑のアテローム発生と共に、原発および転移性癌病変増殖の特徴の両方の要素である。生物学的膜の安定化は、溶血と共に粘膜腸傷害を妨げる可能性がある。ケモカインレベルの減弱は、ARDSを改善すると共に、アテローム発生を妨げる可能性がある。抗酸化活性は、再灌流傷害と共にCNS発作、アテローム性動脈硬化症、および溶血に対して保護する可能性がある。本発明のこれらおよび他の利点は、以下の説明に基づき、当業者に明らかになるであろう。
【0054】
別の態様において、本発明は、クラミジア感染に罹患した被験者を治療する方法であって、被験者に、生理学的に許容しうるモノマー、ダイマー、オリゴマー、又はポリマーに結合した脂質又はリン脂質部分の有効量を投与し、それにより、クラミジア感染に罹患した被験者を治療する工程を含む、前記方法を提供する。
【0055】
別の態様において、本発明は、クラミジア感染に罹患した被験者を治療する方法であって、被験者に、生理学的に許容しうるモノマー、ダイマー、オリゴマー、又はポリマーに結合した脂質又はリン脂質部分の有効量を投与する工程を含み、生理学的に許容しうるモノマーが、サリチレート、サリチル酸、アスピリン、単糖、ラクトビオン酸、マルトース、アミノ酸、グリシン、カルボン酸、酢酸、酪酸、ジカルボン酸、グルタル酸、コハク酸、脂肪酸、ドデカン酸、ジドデカン酸、胆汁酸、コール酸、コレステリルヘミスクシネートであるか;又は生理学的に許容しうるダイマー又はオリゴマーが、ジペプチド、二糖、三糖、オリゴペプチド、あるいはヘパリンの、ヘパラン硫酸、ケラチン、ケラタン硫酸、コンドロイチン、コンドロイチン−6−硫酸、コンドロイチン−4−硫酸、ダーマチン、ダーマタン硫酸、デキストラン、又はヒアルロン酸二糖又は三糖モノマー単位であるか;又は生理学的に許容しうるポリマーが、グリコサミノグリカン、ポリジェリン(polygelin)(「ヘマセル」)、アルギネート、ヒドロキシエチルデンプン(ヘタスターチ(hetastarch))、ポリエチレングリコール、ポリカルボキシル化ポリエチレングリコール、コンドロイチン−6−硫酸、コンドロイチン−4−硫酸、ケラチン、ケラチン硫酸、ヘパラン硫酸、ダーマチン、ダーマタン硫酸、カルボキシメチルセルロース、ヘパリン、デキストラン、又はヒアルロン酸である、前記方法を提供する。
【0056】
別の態様において、本発明は、クラミジア感染に罹患した被験者を治療する方法であって、被験者に、生理学的に許容しうるモノマー、ダイマー、オリゴマー、又はポリマーに結合した脂質又はリン脂質部分の有効量を投与する工程を含み、脂質又はリン脂質部分が、ホスファチジル酸、アシルグリセロール、モノアシルグリセロール、ジアシルグリセロール、トリアシルグリセロール、スフィンゴシン、スフィンゴミエリン、コンドロイチン−4−硫酸、コンドロイチン−6−硫酸、セラミド、ホスファチジルエタノールアミン、ホスファチジルセリン、ホスファチジルコリン、ホスファチジルイノシトール、又はホスファチジルグリセロール、あるいはそれらのエーテル又はアルキルリン脂質誘導体いずれかであり、そして生理学的に許容しうるモノマー又はポリマー部分が、アスピリン、ラクトビオン酸、マルトース、グルタル酸、ポリエチレングリコール、カルボキシメチルセルロース、ヘパリン、デキストラン、ヘマセル、ヘタスターチ、又はヒアルロン酸である、前記方法を提供する。
【0057】
強力な抗酸化、膜安定化、抗増殖、抗ケモカイン、抗遊走、および抗炎症活性を持つ単一の化学実体を使用すると、各々、単一の活性を持つ、いくつかの異なる剤の使用に比較して、増加した細胞保護が提供される。複数の異なる剤の組み合わせよりも、多数の活性を有する単一の剤の使用は、活性分子の均質な搬送を提供し、それにより、薬剤代謝、毒性および搬送の問題を単純化する。本発明の化合物はまた、組み合わせた分子にのみ存在し、個々の構成要素には存在しない特性も示す。
【0058】
化合物は、一時的な異常の急性治療のために用いてもよいし、又は、特に進行性、再発性、又は変性疾患の場合、慢性に投与してもよい。化合物の濃度は、治療しようとする異常の性質、患者の状態、投与経路、および組成物の個々の許容度を含む多様な要因に応じるであろう。
【0059】
本発明はまた、先に開示されておらず、そして薬理学的活性を持つことが知られていなかった、一般式
ホスファチジルエタノールアミン−Y−X
ホスファチジルセリン−Y−X
ホスファチジルコリン−Y−X
ホスファチジルイノシトール−Y−X
ホスファチジルグリセロール−Y−X
式中
Yは存在していないか、又は長さ2から30原子の範囲のスペーサー基であり;そして
Xは単糖又は二糖、カルボキシル化単糖又は二糖、モノ又はジカルボン酸、サリチレート、サリチル酸、アスピリン、アミノ酸、ジペプチド、又はオリゴペプチド、胆汁酸、脂肪酸、あるいはヘパリン、ヘパラン硫酸、ヒアルロン酸、コンドロイチン、コンドロイチン−6−硫酸、コンドロイチン−4−硫酸、ダーマチン、ダーマタン硫酸、ケラチン、又はケラタン硫酸の二糖又は三糖モノマー単位いずれかである
の低分子量リン脂質−コンジュゲートも提供する。
【0060】
これらの低分子量PL−コンジュゲート誘導体もまた、広範囲の薬理学的活性を持ち、そして疾患を治療するために投与される薬学的剤として、高分子量ポリマーで構成されるPL−コンジュゲートに類似であるとみなされる。本発明に適した他のリン脂質−コンジュゲート誘導体は、グリセロール主鎖の位C1又はC2の2つの長鎖アルキル基の少なくとも1つが、エステル連結よりもエーテル又はアルキル結合いずれかで付着している、リン脂質部分である。
【0061】
本発明は、療法PL−コンジュゲート化合物、その化学的調製、その抗疾患活性、および疾患の治療における薬剤組成物としての使用法の以下の例にさらに例示される。
【0062】
好ましい化合物
本発明の方法において、患者に投与するPL−コンジュゲートは、極性頭部基の原子を介して低分子量又は高分子量のモノマー又はポリマー部分(本明細書においてコンジュゲートした部分と呼ぶ)と共有結合した少なくとも1つのリン脂質部分から構成される。希望する場合、所望により架橋部分を使用して、PL部分をモノマー又はポリマー部分と結合させることができる。コンジュゲートした部分は、低分子量カルボン酸、ジカルボン酸、脂肪酸、ジカルボキシル化脂肪酸(dicarboxylic fatty acid)、アセチルサリチル酸、コール酸、コレステリルヘミスクシネート、又は単糖若しくは二糖、アミノ酸若しくはジペプチド、オリゴペプチド、糖タンパク質混合物、グリコサミノグリカンの二糖若しくは三糖モノマー単位の例えばヘパリン、ヘパラン硫酸、ヒアルロン酸、コンドロチン硫酸、デルマタン、ケラタン硫酸の反復単位、或いはより高分子量のペプチド若しくはオリゴペプチド、多糖、ポリグリカン、タンパク質、グリコサミノグリカン、又は糖タンパク質混合物としてよい。組成物という態様からは、高分子量のリン脂質−コンジュゲート及び関連類似体は、米国特許第5,064,817号(特許文献1)、並びに本明細書中に引用される刊行物の主題である。
【0063】
コンジュゲートしたキャリア部分がポリマーである場合、共有結合したPL部分の比は、ポリマーの性質及び用いる反応条件に依存して、1〜1000個までのPL残基/ポリマー分子の範囲にわたってよい。例えば、各出発物質の相対的な量又は反応時間の範囲を修正して、希望通りに高い又は低い比のPL残基/ポリマーを有するPL−コンジュゲート生成物を得てよい。
【0064】
“部分”という用語は、共有結合によって満たされた原子価を有する化合物に他の場合なら相当する化学物質を意味する。
本発明の方法において使用するためのPL−コンジュゲートの製造のためにコンジュゲートした部分として用いることができるポリマーの例は生理学的に許容可能なポリマーであり、これには様々な分子量及び様々な化学的タイプの水分散可能な又は水溶性のポリマーが含まれ、主に、血漿増量剤、食品及び薬物添加剤、天然及び合成ポリグリコサミノグリカンであり、こうしたものとしては、“ヘマクセル(Hemaccell)”(“ベーリング”によって製造されている、尿素架橋を経て架橋した分解済みゼラチンポリペプチド)、“ヒドロキシエチルデンプン”(HES)、ポリアミノ酸、炭化水素ポリマー(例えばポリエチレン)、ポリスチレン、ポリエステル、ポリアミド、ポリエチレンオキシド(例えばポリエチレングリコール、ポリカルボキシエチレングリコール)、ポリビニルピロリドン、多糖類、可溶性セルロース誘導体(例えばメチルセルロース、カルボキシメチルセルロース)、アルジネート、同化性ガム(例えばキサンタンガム)、ペプチド、注射可能な血液タンパク質(例えば血清アルブミン)、デキストラン、シクロデキストリン、ヒアルロン酸、ヘパリン、ヘパリン硫酸、コンドロチン硫酸、コンドロイチン−6−硫酸、コンドロイチン−4−硫酸、ケラチン硫酸、デルマチン硫酸及びこれらの誘導体を含む。
【0065】
本発明の方法において使用するためのPL−コンジュゲートの製造のためにコンジュゲートした部分として用いることができるモノマー、ダイマー、及びオリゴマーの例は、単糖又は二糖、カルボン酸、ジカルボン酸、脂肪酸、ジカルボキシル化脂肪酸、アセチルサリチル酸、コール酸、コレステリルヘミスクシネート、並びにヘパリン、ヘパラン硫酸、ヒアルロン酸、コンドロチン、コンドロイチン−6−硫酸、コンドロイチン−4−硫酸、デルマチン、デルマタン硫酸、ケラチン、ケラタン硫酸を含むグリコサミノグリカン、又はデキストランの二糖及び三糖単位モノマーである。
【0066】
場合によっては、PL−コンジュゲートの製造のために選択されるモノマー又はポリマーは、それ自体が選択された生物学的特性を有してよい。例えば、ヘパリン及びヒアルロン酸は両方とも、周知の生理学的機能を有する材料である。しかしながら本発明においては、出発物質としてのこうした物質から形成されたPL−コンジュゲートは、共有結合によってリン脂質と結合していないヘパリン又はヒアルロン酸の投与から予測されると思われるよりも新規でより幅広い組の薬学的活性を示す。PE−カルボキシメチルセルロース(CMPEと呼ぶ)、PE−ヒアルロン酸(HYPEと呼ぶ)及びPE−ヘパリン(HEPPEと呼ぶ)は、効力及び有用な薬学的活性の範囲という点で、それぞれカルボキシメチルセルロース(CMC)、ヘパリン、又はヒアルロン酸よりもはるかに優れているということを、下記に説明するように標準的な比較実験によって示すことができる。実際に、こうした最後の2つの物質は一般に、本明細書において説明する疾患の大部分の治療のための方法において有用とはみなされておらず、また、虚血性血管障害等のその使用が医学的に処方される特定の場合には、薬物として使用するための濃度は数桁高い。従って、リン脂質の例えばホスファチジルエタノールアミン又は極性頭部基が異なる関連リン脂質の例えばホスファチジルセリン(PS)、ホスファチジルコリン(PC)、ホスファチジルイノシトール(PI)、及びホスファチジルグリセロール(PG)の組合せは、出発物質単独と比較した場合に新規な薬理学的特性を有する化合物の形成をもたらす。
【0067】
本明細書において説明する生理学的に活性なリン脂質−コンジュゲートは、広範囲の分子量を有することができ、例えば、PL−コンジュゲートを脈管系内に保持することが望ましい場合、50,000を超え(数十万まで)、脈管外系を目標とすることが望ましい場合、50,000未満である。コンジュゲート部分の分子量及び化学構造に対する唯一の制限は、所望の生理活性を欠いたPL−コンジュゲートを生じず、本明細書において説明する使用方法においてPL−コンジュゲートを薬物として無効にする程度まで化学的、生理学的不安定性を生じないという点である。
【0068】
本明細書において、PE−コンジュゲートを、構造:
【0069】
【化1】

[式中、R1は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
R2は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
Yは、存在しないか、又は、長さが2〜30個の原子の範囲にわたるスペーサー基であり;
Xは、生理学的に許容可能なモノマー、ダイマー、オリゴマー(ここでnは1である)か、又は、生理学的に許容可能なポリマー(ここでnは1〜1,000の数である)である。]
を有する化合物と定義する。
【0070】
本発明の方法において使用するための好ましい化合物は、コンジュゲート部分Xとして以下のもののうちの1つを含む:アセテート、ブチレート、グルタレート、スクシネート、ドデカノエート、ジドデカノエート、マルトース、ラクトビオン酸、デキストラン、アルジネート、アスピリン、コーレート、コレステリルヘミスクシネート、カルボキシメチルセルロース、ヘパリン、ヒアルロン酸、ヘマクセル、ポリエチレングリコール、及びポリカルボキシル化ポリエチレングリコール。PE−コンジュゲートを製造するための出発物質として使用されるポリマーは、分子量が1〜2,000kDaで変化してよい。
【0071】
ホスファチジルエタノールアミン(PE)部分の例は、リン脂質の類似体であって、この類似体において、リン脂質のグリセロール主鎖と結合した2つの脂肪酸基の鎖長は2〜30個の炭素原子の長さで変化し、こうした脂肪酸鎖は飽和及び/又は不飽和炭素原子を含む。脂肪酸鎖の代わりに、リン脂質のグリセロール主鎖と直接に又はエーテル結合を経て結合したアルキル鎖は、PEの類似体として含まれる。
【0072】
ホスファチジルエタノールアミン及びこの類似体を様々な源から得てよく、これには、天然、合成、及び半合成誘導体並びにこれらの異性体が含まれる。
PE部分の代わりに用いることができるリン脂質は、共有結合によってN−メチル−PEのアミノ基を介して結合するN−メチル−PE誘導体及びこの類似体;共有結合によってN,N−ジメチル−PEのアミノ基を介して結合するN,N−ジメチル−PE誘導体及びこの類似体、ホスファチジルセリン(PS)及びこの類似体の例えばパルミトイル−ステアロイル−PS、様々な源から得られる天然PS、半合成PS、合成、天然及び人工PS並びにこれらの異性体である。本発明においてコンジュゲート部分として有用な他のリン脂質は、ホスファチジルコリン(PC)、ホスファチジルイノシトール(PI)、及びホスファチジルグリセロール(PG)、並びに、これらの誘導体の例としてリン脂質、リゾリン脂質、ホスファチジル酸、スフィンゴミエリン、リゾスフィンゴミエリン、セラミド、及びスフィンゴシンである。
【0073】
PE及びPS−コンジュゲートの場合、リン脂質は、リン脂質の極性頭部基の窒素原子を介してコンジュゲートしたモノマー又はポリマー部分と直接に又はスペーサー基を経て結合する。PC、PI、及びPG−コンジュゲートの場合、リン脂質は、極性頭部基の窒素又は酸素原子のうちの1つを介してコンジュゲートしたモノマー又はポリマー部分と直接に又はスペーサー基を経て結合する。
【0074】
本明細書において、PS−コンジュゲートを、構造:
【0075】
【化2】

[式中、R1は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
R2は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
Yは、存在しないか、又は、長さが2〜30個の原子の範囲にわたるスペーサー基であり;
Xは、生理学的に許容可能なモノマー、ダイマー、オリゴマーか、又は、生理学的に許容可能なポリマー(ここでnは1〜1,000の数である)である。]
を有する化合物と定義する。
【0076】
本明細書において、PC、PI、及びPG−コンジュゲートを、一般構造:
【0077】
【化3】

[式中、R1は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
R2は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
Zは、イノシトール、コリン、又はグリセロールであり;
Yは、存在しないか、又は、長さが2〜30個の原子の範囲にわたるスペーサー基であり;
Xは、生理学的に許容可能なモノマー、ダイマー、オリゴマー(ここでnは1である)か、又は、生理学的に許容可能なポリマー(ここでnは1〜1,000の数である)である。]
を有する化合物と定義する。
【0078】
所望により架橋基Yを形成する適切な二価の基の例は、例えば、2個以上、好ましくは4〜30個の炭素原子を有する直鎖又は枝分れ鎖アルキレン、−CO−アルキレン−CO、−NH−アルキレン−NH−、−CO−アルキレン−NH−、シクロアルキレン(ここで各場合に、アルキレンは直鎖又は枝分れ鎖であり、鎖中に2個以上、好ましくは2〜30個の原子を含む)、−(−O−CH(CH3)CH2−)X−(ここでxは1以上の整数である)である。
【0079】
従来のリン脂質構造に加えて、本発明において使用するための関連誘導体は、C1又はC2位において修正されて、エステル結合の代わりにエーテル又はアルキル結合を含むリン脂質である。アルキルリン脂質誘導体及びエーテルリン脂質誘導体を、一般式:
【0080】
【化4】

又は
【化5】

[式中、R1は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
R2は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
Zは、エタノールアミン、セリン、イノシトール、コリン、又はグリセロールであり;
Yは、存在しないか、又は、長さが2〜30個の原子の範囲にわたるスペーサー基であり;
Xは、生理学的に許容可能なモノマー、ダイマー、オリゴマー(ここでnは1である)か、又は、生理学的に許容可能なポリマー(ここでnは1〜1,000の数である)である。]
によって例示する。
【0081】
本発明の方法において使用するための好ましいPL−コンジュゲートの例示は、PL部分が下記に列記する架橋部分を介して直接に又は間接的に結合するようなものである。

【0082】
本発明の特に好ましい態様においては、投与する化合物は、ヘマセル(hemacell)−PE、ヘタスターチ−PE、コンドロチン硫酸−PE、スピリン(spirin)−PE、ヒアルロン酸−PE、CMPE、HEPE、HYPE、及びDEXPE、並びにこれらの薬学的に許容可能な塩であり、これらを生理学的に許容可能なキャリア又は溶媒と組み合わせる。こうしたポリマーは、コンジュゲート部分として選択した場合、分子量が500〜2,000,000ドルトンで変化してよい。様々な分子量の化学種が、下記の節に示すように所望の生物学的効果を有することが示された。
【0083】
実施例の化合物に加えて、本発明のさらなる例示化合物を下記の節で述べる。
新規な化合物
コンジュゲート部分が、モノマーの例えばサリシレート、胆汁酸、若しくはコレステリルヘミスクシネート、又はポリグリコサミノグリカンの例えばヘパリン、ヘパラン硫酸、コンドロイチン−6−硫酸、コンドロイチン−4−硫酸、ヒアルロン酸、ケラチン、ケラタン硫酸、デルマチン、若しくはデルマタン硫酸の二糖若しくは三糖単位モノマーであるような低分子量PL−コンジュゲートは、先に説明されなかった。こうした新規な化合物は、他のPL−コンジュゲートに関して下記に証明するのと同様の生理活性プロフィルを示し、一般式:
ホスファチジルエタノールアミン−Y−X
ホスファチジルセリン−Y−X
ホスファチジルコリン−Y−X
ホスファチジルイノシトール−Y−X
ホスファチジルグリセロール−Y−X
[式中、Yは、存在しないか、又は、長さが2〜30個の原子の範囲にわたるスペーサー基であり;
Xは、単糖若しくは二糖、カルボキシル化二糖、モノカルボン酸若しくはジカルボン酸、サリシレート、アセチルサリシレート、アスピリン、アミノ酸、ジアミノ酸、オリゴペプチド、胆汁酸、脂肪酸、又はヘパリン、ヘパラン硫酸、ヒアルロン酸、コンドロイチン−6−硫酸、コンドロイチン−4−硫酸、デルマタン、デルマタン硫酸、ケラチン、若しくはケラタン硫酸の二糖若しくは三糖モノマー単位である。]
を有する。
【0084】
本明細書において、低分子量PE−コンジュゲートを、構造:
【0085】
【化6】

[式中、R1は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
R2は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
Yは、存在しないか、又は、長さが2〜30個の原子の範囲にわたるスペーサー基であり;
Xは、単糖若しくは二糖、カルボキシル化二糖、モノカルボン酸若しくはジカルボン酸、サリシレート、アセチルサリシレート、アスピリン、アミノ酸、ジアミノ酸、若しくはオリゴペプチド、胆汁酸、脂肪酸、又はヘパリン、ヘパラン硫酸、ヒアルロン酸、コンドロイチン−6−硫酸、デルマタン、若しくはケラタン硫酸の二糖若しくは三糖モノマー単位である。]
を有する化合物と定義する。
【0086】
本明細書において、低分子量PS−コンジュゲートを、構造:
【0087】
【化7】

[式中、R1は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
R2は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
Yは、存在しないか、又は、長さが2〜30個の原子の範囲にわたるスペーサー基であり;
Xは、単糖若しくは二糖、カルボキシル化二糖、モノカルボン酸若しくはジカルボン酸、サリシレート、アセチルサリシレート、アスピリン、アミノ酸、ジアミノ酸、若しくはオリゴペプチド、胆汁酸、脂肪酸、又はヘパリン、ヘパラン硫酸、ヒアルロン酸、コンドロイチン−6−硫酸、デルマタン、若しくはケラタン硫酸の二糖若しくは三糖モノマー単位である。]
を有する化合物と定義する。
【0088】
本明細書において、低分子量PC、PI、及びPG−コンジュゲートを、一般構造:
【0089】
【化8】

[式中、R1は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
R2は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
Zは、イノシトール、コリン、又はグリセロールであり;
Yは、存在しないか、又は、長さが2〜30個の原子の範囲にわたるスペーサー基であり;
Xは、単糖若しくは二糖、カルボキシル化二糖、モノカルボン酸若しくはジカルボン酸、サリシレート、アセチルサリシレート、アスピリン、アミノ酸、ジアミノ酸、若しくはオリゴペプチド、胆汁酸、脂肪酸、又はヘパリン、ヘパラン硫酸、ヒアルロン酸、コンドロイチン−6−硫酸、デルマタン、若しくはケラタン硫酸の二糖若しくは三糖モノマー単位である。]
を有する化合物と定義する。
【0090】
所望により架橋基Yを形成する適切な二価の基の例は、例えば、2個以上、好ましくは4〜18個の炭素原子を有する直鎖又は枝分れ鎖アルキレン、−CO−アルキレン−CO、−NH−アルキレン−NH−、−CO−アルキレン−NH−、シクロアルキレン(ここで各場合に、アルキレンは直鎖又は枝分れ鎖であり、鎖中に2個以上、好ましくは2〜18個の炭素原子を含む)、−(−O−CH(CH3)CH2−)X−(ここでxは1以上の整数である)である。
【0091】
従来のリン脂質構造に加えて、本発明において使用するための関連誘導体は、C1又はC2位において修正されて、エステル結合の代わりにエーテル又はアルキル結合を含むリン脂質である。こうした誘導体を、一般式:
【0092】
【化9】

又は
【化10】

[式中、R1は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
R2は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
Zは、エタノールアミン、セリン、イノシトール、コリン、又はグリセロールであり;
Yは、存在しないか、又は、長さが2〜30個の原子の範囲にわたるスペーサー基であり;
Xは、単糖若しくは二糖、カルボキシル化二糖、モノカルボン酸若しくはジカルボン酸、サリシレート、アセチルサリシレート、アスピリン、アミノ酸、ジアミノ酸、若しくはオリゴペプチド、胆汁酸、脂肪酸、又はヘパリン、ヘパラン硫酸、ヒアルロン酸、コンドロイチン−6−硫酸、デルマタン、若しくはケラタン硫酸の二糖若しくは三糖モノマー単位である。]
によって例示する。
【0093】
化合物の製造
高分子量PL−コンジュゲートの製造は、本明細書において参考のために引用する米国特許第5,064,817号(特許文献1)の主題である。こうした合成法を下記に繰り返して述べるが、これは、当業者には容易に明らかな手順の修正を行えば、低分子量の、すなわちコンジュゲート部分としてモノマー及びダイマーを含むPL−コンジュゲートの製造にも同様に適用できるとみなされる。
【0094】
コンジュゲート部分のために選択した出発化合物が、出発PL化合物の置換基に対して反応性があるか又は反応性にできる置換基を有する場合、コンジュゲートしたキャリア部分は、PLと直接に結合してPL−コンジュゲートを生成できる。そうでない場合、二官能性結合出発物質を使用して、2つの分子を間接的に結合することができる。
【0095】
PL−コンジュゲートを製造するためには、米国特許第5,064,817号(特許文献1)に説明する全般的な反応スキームに従って、極性コンジュゲート、例えば、モノマー又はポリマーを、PL部分と直接に又は間接的に結合させる。
【0096】
例えば、PE−コンジュゲートのための前駆体として使用されるアシル化PEの場合、様々な長さのジカルボン酸をスペーサーとして使用できる。こうした酸は、天然、半合成又は合成PEと結合することができる。
【0097】
例えば、米国特許第5,064,817号(特許文献1)に説明するように、PEは、アミノデキストランと間接的に結合することができる。
カルボキシル基を有するポリマーの例えばポリアミノ酸、カルボキシメチルセルロース、又は脂肪酸が結合したポリマーは、米国特許第5,064,817号に説明するスキームに従ってPEと直接に結合できる。
【0098】
試薬及び方法の両方における多くの修正が当業者には可能と思われるので、上述した例を、説明のためにのみ与え、精神又は範囲において本発明を限定するものと解釈すべきではないことは理解できるはずである。PL−コンジュゲートによって示される広範囲の薬理学的特性に基づくと、上記に明白に説明した化合物に加えて、式I〜Xによって包含される化合物は、下記に説明する疾患を治療する方法において有用であることが証明される同じ貴重な生理活性を有することが見込まれる。
【0099】
PL−コンジュゲートに基づく、疾患を治療する方法
本明細書において説明するPL−コンジュゲートを使用して、多くの薬理学的活性のうちの1つを発揮することによって疾患を治療することができ、こうした薬理学的活性の中には、細胞膜を安定化することか;細胞及び血液成分に対する酸化的損傷を限定することか;細胞増殖、細胞遊出及び(腫瘍)細胞遊走行動を限定することか;免疫応答を抑制することか;又は高いケモカインレベルに表されるようなストレスに対する生理学的応答を弱めることによる、病的状態の間に生じる組織損傷の改善又は予防がある。こうした化合物の薬効は、薬物を使用することが望ましい特定の疾患の動物モデルを使用して容易に例示される。PL−コンジュゲートを投与すべきである患者は、疾患の症状を経験しているもの、疾患にかかる危険にさらされているもの、又は症状の再発若しくは疾患の増悪を経験しているものである。
【0100】
疾患の細胞又は動物モデルにおけるこうした化合物の効果を、下記の実施例で説明する。
リン脂質の特にホスファチジルエタノールアミン及びホスファチジルセリンと追加のモノマー又はポリマー部分とを組合せることは、従って、生成した化学組成物が所望の範囲の薬理学的特性を示すならば、医学的な目的で新規な薬物を製造するための実際的な経路である。本明細書において説明する例においては、単独で又は組み合わせて投与した場合、本化合物によって示される生理活性の多様性及び疾患における有効性は、出発物質自体の使用によって予想される特性をはるかに超える。しかしながら、PL−コンジュゲート化合物は、単独で又は組み合わせて、本明細書において具体的に説明する条件以外で疾患治療方法に適応させた場合に、貴重な薬物であることが明らかになることが見込まれる。
【0101】
用量及び投与経路
本発明の方法を、従来の賦形剤、すなわち、活性化合物と有害な反応をせず、非経口、経腸(例えば、経口)又は局所適用に適した薬学的に許容可能な有機又は無機キャリア物質と混和させたPL−コンジュゲートを含む治療組成物の使用に適応させることができる。適切な薬学的に許容可能なキャリアとしては以下のものが挙げられるがこれらに限定されるものではない:水、塩溶液、アルコール、アラビアゴム、植物油、ベンジルアルコール、ポリエチレングリコール、ゼラチン、炭水化物の例えばラクトース、アミロース又はデンプン、ステアリン酸マグネシウム、タルク、ケイ酸、粘稠なパラフィン、白色パラフィン、グリセロール、アルジネート、ヒアルロン酸、コラーゲン、香料油、脂肪酸モノグリセリド及びジグリセリド、ペンタエリトリトール脂肪酸エステル、ヒドロキシメチルセルロース、ポリビニルピロリドン等。処方剤を滅菌でき、希望するなら、活性化合物と有害な反応をしない補助剤の例えば滑沢剤、保存剤、安定剤、湿潤剤、乳化剤、浸透圧に影響を与えるための塩類、緩衝液、着色剤、香味料及び/又は芳香族性物質及びその他同様なものと混合できる。こうしたものはまた、希望する場合、他の活性剤の例えばビタミンと組合わせることができる。
【0102】
本明細書において提供する実施例は、皮下、腹腔内又は局所投与でのPL−コンジュゲートの使用を説明するが、説明される成功は、他の投与経路又は他の処方剤との組合せが少なくとも同様に成功すると思われると推定するための良好な証拠を与える。投与経路(例えば、局所、非経口、経腸、静脈内、膣、又は経口)及び投与計画は、治療する状態の正確な性質、状態の程度、患者の年齢及び全般的な身体的状態等の要因に基づいて、熟練した臨床家によって決定されよう。
【0103】
一般に、上記に説明した目的のために利用される用量は変化しようが、所望の抗疾患効果を発揮するために有効な量であろう。本明細書において使用する“薬学的に有効な量”という用語は、患者における疾患の症状又は徴候の所望の軽減をもたらすような、式I〜Xの化合物の量を指す。上記に説明した目的のいずれかのために利用される用量は一般に1〜約1000ミリグラム/体重キログラム(mg/kg)であり、1〜4回/日、又は連続的なIV注入によって投与される。本組成物を局所投与する場合、一般に0.1〜約10%w/vの濃度範囲内で1〜4回/日投与する。
【0104】
本明細書において使用する“薬学的に許容可能なキャリア”という用語は、安全であり、かつ、有効な量の本発明の少なくとも1種の化合物の所望の投与経路のための適切な送達を提供する任意の配合物を指す。このようなものとして、上記に説明した本発明の配合物の全ては、本明細書によって“薬学的に許容可能なキャリア”と呼ばれる。この用語は、pHが特定の所望の値に維持され、化合物及び投与経路の安定性に従ってpHが4.0〜9.0の範囲にわたるような緩衝化した配合物の使用も指す。
【0105】
非経口適用の場合、特に適切なものは、注射可能な無菌の液剤、好ましくは油性溶液若しくは水溶液、並びに懸濁液剤、エマルション、又は坐剤を含む植込み剤である。アンプルは便利な単位投与(unit dosage)である。
【0106】
吸入による適用の場合、特に気道閉塞又は鬱血の治療の場合、適切なキャリアの存在下で混合し、エアロゾル化又は噴霧する化合物の液剤又は懸濁液剤が適切である。
【0107】
局所適用の場合、特に接触性皮膚炎の治療の場合、本化合物と従来のクリーム又は遅延放出パッチとの組み合わせが許容可能である。
経腸適用の場合、特に適切なものは、錠剤、糖衣錠、液体、ドロップ、坐剤、又はカプセルである。甘味付けしたビヒクルを用いる場合、シロップ剤、エリキシル剤、又はその他同様なものを使用できる。指示された場合、坐剤又は浣腸製剤が推奨される投与経路かもしれない。
【0108】
徐放性又は指向性放出組成物を製剤化でき、例えば、リポソーム、又は活性化合物が差次的分解性コーティング(differentially degradable coating)によって、例えばマイクロカプセル封入、多数のコーティング等によって保護されているものがある。また、新規な化合物を凍結乾燥し、得られた凍結乾燥物を例えば注射用製品の製造のために使用することが可能である。
【0109】
特定の場合の活性化合物の実際の好ましい量は、利用する特定の化合物、製剤化する個々の組成物、適用の方式、並びに治療を受ける個々の位置及び生物によって変化することは了解されよう。所定の受容者のための用量は、従来の考慮すべき事柄によって、例えば、本化合物及び周知の薬剤の特質的な活性(differential activity)の通例の比較によって、例えば適切な従来の薬理学的プロトコールによって決定できる。
【0110】
さらに詳述することなく、当業者であれば、先の説明を使用して本発明を最大限に利用できるものと考えられる。従って、以下の好ましい具体的な実施例は単なる例示であって、本開示の残りをいかなる点でも限定するものではないと解釈すべきである。
【0111】
実施例1:閉塞性呼吸疾患
PE−コンジュゲートは閉塞性呼吸疾患の治療において有効である。これを、下記の実験1〜7において喘息に関して証明する。喘息において気流が妨げられるのは、肺の管腔性管(luminal vessel)の狭窄及び閉塞の結果である気道閉塞が原因である。気道狭窄を調べるための1つの広く受け入れられている実験系は、気道から単離した筋肉標本の収縮を、薬物が存在する場合及び存在しない場合に誘発することである。抗喘息薬の作用に関する別の広く受け入れられている試験は、喘息を有する生きている動物を使用することである。この疾患は、抗原に対し感作された動物中に存在し、体プレチスモグラフィーを使用して、増悪及び喘息性呼吸からの回復を観察できる。
【0112】
実験1〜4においては筋肉標本をラットから単離し、実験5においてはモルモットから単離した。筋収縮を測定するために、筋肉を、ばねによく似た働きをする圧力変換器と結合した。収縮の誘発は、アセチルコリン及びエンドセリン等の喘息誘発性物質を投与した場合に起きた。
【0113】
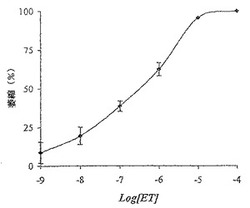
実験1:単離したラットの気管輪をKrebs-Hanselet緩衝液(Ph=7.4)中に浸漬し、張力変換器と結合した。ET−1を示された終濃度で加え、最終的な収縮を、張力変換器に加えられた力の変化によって決定した。各データ(図1)は4つの別個の実験(4匹のラット)の平均S.D.である。
【0114】
実験2:ラットの気管輪を、示された濃度のHYPEと共に1時間インキュベートした。ET−1を次に終濃度1μMで加え、輪収縮(図2)を実験1におけるように決定した。
【0115】
実験3:ラットの気管輪を、3μMのHYPE又はHAと共に1時間インキュベートした。ET−1を次に終濃度1μM(白い棒)又は10μM(斜線の棒)で加え、輪収縮(図3)を実験1におけるように決定した。
【0116】
実験4:モルモットの気管輪(直線的な配列で)をリンゲル浴中に浸漬し、輪の鎖の長さを測定する装置に接続した。示すように、Crotalus atrox(タイプII)の酵素又はエンドセリン−1による収縮の刺激の1時間前に、CMPEを浴に加えた(表1)。
【0117】
表1.CMPE及びHEPPEによる器官収縮の阻害
【表1】

【0118】
実験5〜7は、生きている動物においてPL−コンジュゲートが薬理学的効果を発揮する能力を証明する。この場合、ラットを感作するために、卵白アルブミンを注射し、次に、呼吸器経路を通して抗原に再度さらして喘息疾患に関して試験した。こうした実験の場合、1日目に卵白アルブミン(OA)と水酸化アルミニウムの皮下(S.C.)注射及び熱殺菌Bordatella Pertussisの腹腔内(I.P.)注射をすることで、喘息をドブネズミ(Brown Norway (BN) rat)に誘発した。気管支狭窄(チャレンジ)を、14、16及び18日目にOAのエアロゾル投与によって誘発した。チャレンジ後、18日目に5分間、各ラットにつきボディボックス(body-box)中で肺機能を試験した。
【0119】
実験5:PBS中に溶解させたPL−コンジュゲート又はビヒクル(対照)を用いた処理を、OAを用いたチャレンジの24時間及び1時間前にS.C.注射(10mg/体重100g)することで実行した(図4)。
【0120】
実験6:各群において、20Lの檻中の5匹のラットに、チャレンジの1日及び1時間前に、HYPEのエアロゾル処方剤を5分間吸入させた。各データは5匹のラットの平均±SEMである。*p<0.01。Penh(覚醒ラットにおける肺気流の閉塞)を、Hamelmann, et al.の方法を使用して決定した。束縛されていない覚醒ラットを、前置増幅器(モデルMAX2270、バクスコエレクトロニクス(model MAX2270, Buxco Electronics))に接続した全身プレチスモグラフ(バクスコエレクトロニクスInc.、トロイ、ニューヨーク、USA(Buxco Electronics Inc., Troy, New York, USA))中に入れた。増幅器からのアナログ信号を、ADカード(LPM−16、ナショナルインスツルメンツ、オースティン、テキサス、USA(LPM-16 National Instruments Austin, Texas, USA))によってディジタル信号に変換した。各呼吸の増強された休止(Penh)の計算を、気管支狭窄の測定として使用する。Penhは、式:Penh=(PEF/PIF)×((Te−Tr)/Tr)[式中、PEF=ピーク呼気流れ;PIF=ピーク吸気流れ;Te=呼気時間;Tr=弛緩時間[ibid.]]の結果である。各データは5匹のラットの平均±SEMである。*、**p<0.005。PL−コンジュゲートが喘息のラットに及ぼす影響は、上述の薬剤のうちの1種を、卵白アルブミン誘発喘息発作の前に投与することで証明してよい。有意に、PL−コンジュゲートは、非経口(図4)及びエアロゾル経路(図5)の両方で投与された場合に、喘息の治療において有効である。
【0121】
実験7:PL−コンジュゲートのインビボの影響を、病気の動物の呼吸窮迫の軽減によってのみならず、組織学的診断によっても証明する(図6)。PL−コンジュゲートの投与は、喘息疾患に伴う気道管腔の生理学的浸潤物をかなり低減し、この能力においては、標準的なステロイドを基にした薬物であるデキサメタゾンと少なくとも同程度に有効である。
【0122】
こうした実験は、PL−コンジュゲートを閉塞性呼吸疾患の治療のために使用してよく、これは、収縮の阻害及び気道閉塞浸潤物の低減を含む複数の機構によって気道狭小を軽減することを証明する。
【0123】
実施例2:大腸炎及びクローン病
PL−コンジュゲートは、胃腸管疾患が原因の粘膜層損傷の治療において有効である。これを、実験8〜11において証明する。大腸炎及びクローン病は、管を裏打ちする組織防壁が損傷する消化管疾患の2つの例である。このタイプのGI粘膜疾患の1つの一般に受け入れられているモデルは、高い用量の抗炎症薬であるインドメタシン(クローン病)、毒素であるトリニトロベンゼンスルホン酸(TNBS)(大腸炎)、又はデキストラン硫酸ナトリウム塩(DSS)として周知の腸刺激原(大腸炎)を消費する齧歯類動物において生じる、腸の生理学的な裏打ちに対する損傷である。実験プロトコールに関しては、材料及び方法を参照されたい。
【0124】
実験8及び9:腸損傷の重症の症例のラットは、組織損傷スコア(図7)及び組織学的診断(図8)によって証明されるように、発病の前のPL−コンジュゲートの投与によってかなり改善された。
【0125】
実験10:薬物又は毒素誘発損傷からの同様の回避効果(sparing effect)が、組織学的レベルのみならず機能上でも見られ、これは、PL−コンジュゲート処理による、蛍光染料に対する腸壁の防壁の保持によって証明される(図9)。加えて、PL−CMC処理は、生存している大腸炎のラットの結腸におけるミエロペルオキシダーゼ活性(MPO)をかなり低減することが見い出された。未処理群及びPL−CMC処理群のそれぞれのMPO活性は、19.1±2.6及び7.9±1.1単位/mgである。組織(平均±SEM、n=6、p<0.01)。動物が薬物を投与された全ての場合に、疾病は著しく改善され、これは、大部分のマウスが死亡せずに生存し続けたという事実によって証明される(表2及び表3)。
【0126】
表2.大腸炎におけるCMPEによる致死率の減少
【表2】

【0127】
表3.インドメタシン誘導の小腸損傷
【表3】

【0128】
実験11:デキストラン硫酸誘発大腸炎において、死亡率は変化しなかった(各場合に12匹中3匹のマウスが死亡した)が、疾患活性の他のパラメータはかなり改善され、これは、全疾患スコア(図10)及び結腸長さの保持(図11)によって証明される。投与したPL−コンジュゲートのこうした疾患回避効果は、この薬物が非経口によって提供されようと吸入経路によって提供されようと明らかである。
【0129】
こうした実験は、PL−コンジュゲートは、組織の構造上及び機能上の特徴の両方に及ぼす影響によって病的臓器の粘膜防壁を保持する能力に基づき、大腸炎及びクローン病の治療において有効な治療法であることを証明する。
【0130】
実施例3:中枢神経系の傷害
PL−コンジュゲートは神経毒性薬剤として有効であり、中枢神経系に対する生理学的傷害の後の組織損傷を予防する。これを、実験12〜22において証明する。虚血性発作、外傷、感染、癌転移、及び変性疾患は、脳組織損傷が重症であり不可逆となることがある生理学的傷害の具体例である。組織損傷は一般的に、ストレスに対する多数の生理学的応答を引き起こし、中枢神経系においては、支持組織によって放出される化学物質いう形態を取る。しかしながら、過剰のこうした潜在的に神経毒性のある“創傷”化学薬品の1種以上が、治癒過程をさらに妨げ、脳組織損傷の一因となるかもしれない。新規な薬物の神経保護能力を評価するための一般に受け入れられているモデルは、脳マトリックス細胞(例えばグリア細胞)、脳細胞から得られる細胞系(例えばP−12細胞)、及び遊走性血液細胞(マクロファージ及びリンパ球)の標本を用いるもので、こうした細胞は一般的に、損傷した脳組織の部位に補充される。CNS中の組織損傷はしばしば、最初の傷害の影響を悪化させ、組織損傷の拡大に至るかもしれない血液脳関門の局所的な混乱及びそれに続く遊走性血液細胞の通過によって構成される。無傷で混乱した血液脳関門を通る細胞運動は、内皮細胞層を通るT細胞運動の測定を用いてインシトゥでモデル化されている。
【0131】
ストレス及び切迫した損傷に伴う物質の例えば免疫原LPS、サイトカインTNF−α、神経毒パーダキシンに応答して、中枢神経系のマトリックス細胞は、多数の創傷応答物質の例えばPGE2、エンドセリン、酸素ラジカル、トロンボキサン、ドーパミン、一酸化窒素、5−HETE、及びPLA2を活性化する。過剰に表れると、こうした物質は、これ自体が神経毒性を有するか又は同時一過性(cotemporal)の神経毒性を示し、従ってその抑制はしばしば、神経保護薬を開発する目標として選択されている。
【0132】
実験12〜14は、プロスタグランジン(PGE2)放出のPL−コンジュゲートによる阻害を証明する。
実験12:全ての実験の前にグリア細胞培地を新しい培地と取り替え、10μg/mlのLPSを補足した。PL−コンジュゲートを30分間加え、その後LPSにさらした。組織培養を37℃で24時間さらにインキュベートした。次に培地を集め、LPS及びPL−コンジュゲートを含む新しい培地中でインキュベートした。さらに24時間後、上澄みを採取して、ELISAによってPGE2含量を測定した(図12)。
【0133】
実験13:PC−12細胞の場合、示されたPL−コンジュゲートと共にインキュベートした後、細胞を洗浄し、次にパーダキシン(PX)を用いて30分間刺激し、培地に放出されたPGE2の量をELISAによって測定した(図13)。
【0134】
実験14:モルモットの気管輪を、試験管中でCMPEと共に又はCMPE無しで30分間インキュベートし、その後刺激した。培地を30分後に集め、PGE2及びTXB2をラジオイムノアッセイによって測定した(表4)。(n.d.=検出限界未満)
【0135】
表4
【表4】

【0136】
実験15及び16:一酸化窒素生成のPL−コンジュゲートによる抑制を証明する。グリア細胞培地を新しい培地と取り替え、10μg/mlのLPSを補足した。PL−コンジュゲートを30分間加え、その後LPSにさらした。組織培養を37℃で24〜48時間さらにインキュベートした。24時間後、上澄みを採取して、グリース試薬を使用した比色測定によってNOを測定した(図14)。他に、一次マウス腹腔マクロファージを、示された濃度のPL−コンジュゲートを用いて30分間処理した(図15)。次にLPS(1μg/ml)を、直接に又はPL−コンジュゲートの洗浄後に培養物に加えた。一酸化窒素をGRIS熱量法によって測定した。
【0137】
実験17:グリア細胞からの可溶性ホスホリパーゼA2(sPLA2)放出のPL−コンジュゲートによる阻害を証明する(図16)。全ての実験の前にグリア細胞培地を新しい培地と取り替え、10μg/mlのLPSを補足した。PL−コンジュゲートを30分間加え、その後LPSにさらした。組織培養を37℃で24〜48時間さらにインキュベートした。培養基試料(24時間後)を採取して、大腸菌基質に対するPLA2活性を測定した。
【0138】
実験18及び19:オレイン酸放出として測定して、PL−コンジュゲートがホスホリパーゼ活性化を抑制する能力を証明する。脳組織の場合、PC12細胞を、3H−アラキドン酸(ArAr)又は3H−オレイン酸を用いて少なくとも6時間代謝標識し、次に洗浄し、示されるようにPL−コンジュゲートと共に30分間インキュベートした。細胞を次に洗浄し、パーダキシン(PX)を用いて30分間刺激し、培地に放出された3H−脂肪酸の量をシンチレーション計数管で測定した(図17)。マクロファージからのオレイン酸の放出の場合(図18)、下記の材料及び方法に説明するように、ネズミのP388D1細胞を標識し、様々な濃度のPL−コンジュゲートを用いて前処理した後、LPSが存在する場合(?)及び存在しない場合(0)にアッセイを行った。
【0139】
実験20:PL−コンジュゲートがドーパミン放出を抑制する能力を証明する。PC12細胞(集密で)に、放射性ドーパミン(DOPA)を4時間負荷させ、次に洗浄した(抗酸化剤の存在下で)。細胞を次に、示されたPL−コンジュゲートと共に30分インキュベートし、次いで洗浄し、PXを用いて15分間刺激した。培養基に放出された標識DOPAの量をシンチレーション計数管で測定した(図19)。
【0140】
実験21:5−HETE放出のPL−コンジュゲートによる抑制を証明する。PC−12細胞を、実験23と同一の条件下で、示されたPL−コンジュゲートと共にインキュベートし、続いてPXによって刺激した。放出された5−HETEの量をELISAによって測定した(図20)。
【0141】
実験22:内皮細胞障壁を通る細胞透過をPL−コンジュゲートが阻害する効力を証明する。T細胞経内皮移動アッセイを使用して(図21)、一次豚脳内皮細胞(PBEC)を、移動アッセイのためにコーティングしたコラーゲン上で平板培養した。ヒト末梢血T細胞を、Cabanas and Hogg (1993, PNAS 90: 5838-5842)に説明するように作製した。T細胞を、使用前に、組み換えヒトIL−2中に12日間まで維持した。約1×105個のT細胞を、集密的PBEC単層上のトランスウェル(Transwell)の上部チャンバに加え、37℃で5時間インキュベートした。試験用の化合物も、T細胞と同時にPBEC単層に加えた。この期間にわたって1時間毎に電気抵抗値を測定した。5時間目にトランスウェルを温かい培地中で簡単に濯ぎ、パラホルムアルデヒド中に固定した。フィルターの下側に(すなわちPBEC単層を通って)移動したT細胞の数を、報告に説明されているように計数した。
【0142】
こうした実験は、PL−コンジュゲートは効力のある神経保護剤であり、発作、腫瘍、外傷、感染及び変性疾患等の状況において脳損傷の治療のための治療法として投与された場合に有用であることを証明する。
【0143】
実施例4:多発性硬化症
PL-コンジュゲートは多発性硬化症の効果的治療法である。このことは下記実験23-24に示される。多発性硬化症は、神経学的機能の損失を特徴とする中枢神経系内白色組織の疾患である。本疾患に関して一般に受け入れられている動物モデルは、ミエリン塩基性蛋白質の様な神経系の抗原を皮下感作することで齧歯類に誘導される実験的アレルギー性脳炎(EAE)である。臨床パラメータは、後脚から前脚へ進行する麻痺により表される。
【0144】
実験23−24:EAE-誘導剤に曝されたラットが、PL-コンジュゲート投与により同時処理を受けた場合に麻痺性疾患を殆ど発症しないことを示す。両実験は不活性化結核菌0.4mg/mlで強化された0.1mlのCFA(PBSバッファー中1:1)中に乳化された5mgのマウス脊髄ホモジェーネートを脚部S.C.(皮下注射.)し、続いて48時間後に百日咳菌毒素200ngを含む0.2mlを尾静脈注射してEAEを誘導したラットのグループを使用した。(疾患重症度のスコア化については“材料と方法”を参照)。
【0145】
実験23では、ラットの1グループは実験初日より開始し2週間隔日に20mgのCMPEを投与された。別のグループは、実験第7日目からのみ同様の投与を受けた(T-細胞が活性化された後)。同時に各コントロールグループには生理食塩水が注射された(表5)。
【0146】
表5.CMPEによるEAE(多発性硬化症)の改善
【表5】

【0147】
実験24では、1グループには実験初日から14日目まで、隔日に2mgのCMPEが投与された。もう一方のラットグループには、実験7日目から14日目まで隔日に20mgが投与された(表6)。
【0148】
表6.CMPEによるEAE(多発性硬化症)の改善、低用量対高用量
【表6】

【0149】
両実験は、麻痺(頻度1)を示すラットのパーセンテージ、麻痺の程度と前脚への進展(重症度スコア2)および回復までの麻痺期間(期間3)から判断して、PL-コンジュゲートによる治療が疾患重症経過例を少なくし、そしてより完全な運動機能の回復をもたらすことを示している。さらに表6に示した結果は、PL-コンジュゲートの治療効果が用量依存的であることを示している。
【0150】
多発性硬化症に於けるPL-コンジュゲートの有効性を指示する更なるものは上記実験15、17および22に認められ、それらの実験ではPL-コンジュゲートの神経保護硬化が示されている。
【0151】
実施例5:接触性皮膚炎および乾癬
PL-コンジュゲートは皮膚の過敏症反応および乾癬の治療に有効である。この事は実験25-29に示されている。皮膚過敏反応は、実際には物質に対する反応の中で起こり、急性型と慢性型の両方がある。抗原の局所適用に続く全身感作は、接触性皮膚炎のメカニズムとなる遅延型過敏反応を惹起するもとのして広く受け入れられているシステムである。乾癬は伸筋表面に主に見られることが多い斑状形成を特徴とする一般的な皮膚炎であり、上皮細胞の増殖亢進性の障害であることから、一般には患者から得た培養細胞を使って薬物治療が検討される。
【0152】
実験25−28:予防的および急性治療法として、全身投与(表7)、皮下投与(表8)又は局所投与(表9−10)の何れに於いても、過敏反応に罹った動物の治療がPL-コンジュゲートの投与に容易に反応することを示す。
【0153】
3様式の投与法を実施した:1)PL-コンジュゲート生理食塩水液を0日より開始し6日まで毎日腹腔内注射した(表7);2)PL-コンジュゲート生理食塩水液をオキサザロン耳適用前2時間、又はオキサロゾン耳適用後1時間の2回、耳内皮下注射(誘発域近く)した(表8);3)EtOH:H2O、1:1溶液を0日より開始6日目まで両耳、誘発域上端に局所適用した(表9);4)20μLの0.1%EDXPEの50%EtOH又は20μlのDermovat(ステロイド軟膏)を用いて誘発を行った5-6時間後に、右耳のみに5回PL-コンジュゲートを局所適用した(表10)。いずれの実験でも、コントロールグループA(後感作のみ)では耳両側の膨張を測定する24時間前に、その部分にオキサロゾンが局所適用処理された。グループB(完全感作+生理食塩水又はEtOH50%)では、毛を剃った胃部がオキサロゾン処理され、その後6日目に耳の両側にオキサロゾンを局所適用した。膨張は処理後耳幅から、各マウスの正常時の耳幅を差し引き、0.1mm単位で測定された。阻害%は、PL-コンジュゲート処理耳の正味の膨張(コントロールグループAの膨張に対し)を完全に感作された耳の正味の膨張で除して計算された。いずれの場合もこの薬剤の局所投与は片側に行われたものであるにも関わらず明らかにステロイドは両耳に影響を及ぼしたが、一方局所適用されたPL-コンジュゲートは適用された耳にのみ作用しており、その意味において全身投与ではないことが示された。
【0154】
表7.CMPE−腹腔内投与による皮膚DTH反応の減弱
【表7】

【0155】
表8.CMPE−皮下投与による皮膚DTH反応の減弱
【表8】

【0156】
表9.CMPE−局所投与による皮膚DTH反応の減弱
【表9】

【0157】
表10.CMPE-による皮膚DTH反応の減弱−局所投与対ステロイド剤
【表10】

【0158】
実験29:PL-コンジュゲートが培養乾癬皮膚繊維芽細胞およびスイス(Swiss)3T3細胞の増殖を阻害することを示す。ヒト乾癬皮膚細胞(真皮)の繊維芽細胞、(?)又はスイス(Swiss)3T3細胞(0)を、細胞数測定後3日間指定濃度のCMPEで処理した(図22)。3日間のインキュベーション終了時点に於ける未処理群であるのコントロールの細胞数を100%とした。比較のためカルボキシメチルセルロースを単独で試験した(?)。
【0159】
これらの実験は、PL-標識体が皮膚過敏反応および乾癬を含む様々な皮膚炎の管理にとって効果的な治療薬であることを示している。
【0160】
実施例6:心臓血管疾患
PL-コンジュゲートは虚血性血管疾患、アテローム性動脈硬化症、再灌流傷害の有効な治療法である。このことは実験30-36により示される。
【0161】
アテローム性動脈硬化症の顕著な特徴は、LDLの様な血液脂質蛋白質が血管壁を裏打ちする細胞内に蓄積すること、および裏打ち細胞および平滑筋細胞といった血管壁細胞の増殖である。その結果生じるアテローム性動脈硬化障害部位に於ける血管腔狭窄が様々な程度に組織虚血を引き起こす。虚血現象は偶発的又は医療的介入により元に戻すことができるが、組織傷害のプロセスは酸化的損傷を含む複数のメカニズムによる再灌流傷害の段階を維持するため、一度虚血を起こした組織では損傷に対するリスクが高い。
【0162】
実験30−33はトロンビンにより刺激されていない、又は刺激された血管平滑筋細胞に対する、およびヒト静脈平滑筋細胞および大動脈内皮細胞の増殖に対するPL-コンジュゲートの抗増殖作用を示している。
【0163】
実験30:未刺激細胞については、ウシ大動脈平滑筋細胞を10%FCS添加したDMEM中、HYPE-40又はHYPE-80(PE強化)存在下又は非存在下に7・103細胞/ウエル(24-ウエルプレート)の割合に播種し、72時間増殖させた後コールターカウンターを使い細胞数を測定した(図23)。
【0164】
実験31:刺激細胞については、ウシ大動脈平滑筋細胞を、6時間表示の如くトロンビン、胎児ウシ血清、PL-コンジュゲート又はその両方と共に前インキュベーションした後、上記条件下にて48時間増殖させた。細胞増殖はチミジン取り込み量として表されている(図24)。
【0165】
実験32:ヒト静脈平滑筋細胞の増殖に対するPL-コンジュゲートの作用を調べるためにヒト伏在静脈由来の平滑筋細胞(SMC)を8×104/5mm培養皿中、5%ウシ胎児血清および5%ヒト血清を添加されたDMEMに接種された。1日後、細胞は洗浄され、PL-コンジュゲート(HEPE)又はそのポリマー性キャリアー(ヘパリン、HEPEと同一濃度)を含まない(コントロール)又は含む同一培地中にインキュベーションした。5日後、細胞を集め(トリプシン処理により)細胞数を計測した(図25)。各データは3重測定の平均SEMである(同一の結果は2回目の再現実験でも得られた)。*p<0.005。
【0166】
実験33−34:培養マクロファージによる、および動物そのものに於けるLDL取り込みの阻害を示すために、ヒトLDL(通常の浮揚法により単離された)をCu2+-誘導酸化にかけ、125Iにて標識した。集密状態のJ774マクロファージは100μMの125I-oLDLおよび所定濃度のPL-コンジュゲートを含む、0.5%BSAが添加されたPBS緩衝液(pH=7.4)と3時間インキュベーションされた。次に細胞は4回PBS/BSA緩衝液で洗浄され、0.1NのNaOHで30分間溶解され、細胞溶解物が集められ、125I含有量が放射線カウンターを使い測定された(表11)。
【0167】
表11.HYPEおよびHEPPEによるマクロファージ酸化LDL取り込みの阻害
【表11】

【0168】
体重200gのラットに250nmoleの125Iで標識されたCu2+-誘導酸化LDLおよび200nmoleのHYEPを含む溶液0.4mlを静脈注射した。血液サンプルを所定間隔で集め、血漿中の125I放射活性を測定した(図28)。
【0169】
実験35:LDL-付随ホスホリパーゼ活性のPL-コンジュゲートによる阻害を示すことを目的とし、LDL(0.1μM)を15分間所定濃度のHYPE、HEPPE又はCMPE非存在下又は存在下にインキュベーションした(図27)。ゼロ時間にC6-NBD-PC(0.5μM)を分散液中に加えた。これにより瞬間的に蛍光強度が上昇した(脂質コア内にNBDが取り込まれたことによる)。LDLを単独でインキュベーションした場合には、蛍光上昇に続いて時間依存的な蛍光強度の減少が起こったが、これはLDL-関連PLAの加水分解によるものであろう(および生じたNBO-カプロン酸がLDL粒子から水性媒体中にその後解離することによる)。LDLをHYPE、HEPPE又はCMPE存在下にインキュベーションした場合は、この時間依存的な減少は完全又は一部阻害された。
【0170】
実験36:内皮細胞に対するPL-コンジュゲートの保護作用を示すために、ウシ大動脈内皮細胞を腫瘍壊死因子(TNF-α)、ホスホリパーゼA2、アランキドン酸又は過酸化水素のいずれかに暴露し、続いて内皮細胞健全性の指標である赤血球の接着として細胞障害について調べた。ウシ大動脈内皮細胞(BAEC)は30分間5μMのCMPE又は20μMのDEXPEと前インキュベーションしてから洗浄され、18時間所定濃度のTNF、ArAr又はPLA2により刺激された。H2O2による刺激に関しては、細胞をH2O2で20分間処理してから洗浄し、ヒト赤血球(RBC)と30分間インキュベーションした。培養体は洗浄され、BAECに接着し続けているRBCの数を顕微鏡を使い計測した(図28)。
【0171】
これらの実験は、PL-コンジュゲートの投与が、血管平滑筋細胞増殖、リポ蛋白質の取り込み、および虚血および再灌流モデルに於ける白血球活性化を含む複数のメカニズムを通しアテローム性動脈硬化および再灌流傷害を含む心臓血管病の治療に有効な治療法であることを示している。
【0172】
実施例7:カテーテル導入を含む侵襲的外科手術手順の予防
PL-コンジュゲートは上記の如くアテローム性動脈硬化症を含む多くな状態の心臓血管病だけでなく再灌流傷害として知られる狭窄-再狭窄症の治療と予防にも有効である。さらにこれら薬物は血管臓器操作、特に血管カテーテル導入を含む侵襲的外科手術手順時に生ずることがある狭窄性傷害の形成予防に有効である。
【0173】
実験37−38:ラット頸動脈にバルーンを使い狭窄を誘導するプロトコールについて、PL-コンジュゲートの全身(表12)および静脈注入(表12)投与の有効性を示す。ラットは1日目、および傷害前1-2時間目に10mg/100g体重のHYPEのPBS溶液又はPBS液単独をI.P.注射され前処理された。傷害は標準的フォガティーカテーテルを使い起こされた。ラットには3日間は毎日、その後投与回数が8回になるまで隔日に同量の薬剤又は賦形剤が投与された。14日目にラットは屠殺され、標準的手順に従い動脈が処理された。ラットの半数にはブロモデオキシウリジン(BrdU)が注射され、フォルマリンとトリトンで固定され、BrdU染色向けに加工され、比較のため指定の血管構造の面積が測定された(表12)。頸部が正中切開され、遠位部左総頸動脈および外部頸動脈が露出された。左総頸動脈に関し、外部頸動脈より2Fフォガティーバルーンカテーテル(バクスター、サンタアナ、カリフォルニア州(Baxter、Santa Anna, CA))を導入して血管腔内を通し、内皮細胞を剥落した。カテーテルは、僅かな抵抗が発生するように生理食塩水によってバルーンを十分に膨張しながら3回通された。それからカテーテルを引き抜き、注射器に接続されたポリエチレンチューブ(PE-10)が総頸動脈内に導入された。頸動脈の断片をスライディング結紮と血管クランプを使って一次的に隔離した。10nmoleのCMPEを含む約50μlの溶液を隔離した動脈片に注入し、15分間放置した。次に薬液を吸い出し、外部頸動脈を結紮した。2週間後にラットは屠殺され、管腔狭窄の割合(損傷域内の)を中膜域に対する新生内膜の割合を組織学的に測定することで決定した(表12)。
【0174】
表12.ラットにバルーンで誘導された狭窄のPL-コンジュゲートによる阻害
【表12】

【0175】
これら実験はPL-コンジュゲートの投与が、侵襲性動脈手順、特にバルーン血管形成中に投与された場合、予防的および緊急的治療効果の両方を有することを示している。心臓血管病でのPL-コンジュゲート投与の治療効果を支持する更なる証拠は、実験48の中で示すLDL酸化の効果にも見ることができる。
【0176】
実施例8:侵襲性細胞増殖疾患
PL-コンジュゲートは癌の様な細胞増殖疾患の効果的治療法である。この事は上記実験30-33および下記実験39-43に示されている。癌拡大のプロセスは複数の事象を内含しており、細胞増殖の速度、血管内拡張速度、隣接又は非隣接(転移)組織への浸潤速度、および癌組織に供給する新規血管の生成速度を含む、各それぞれが阻害薬剤作用の標的となる。癌細胞はそれらの浸潤能を高めるのに役立つ細胞内マトリックス分解酵素を生成することが多い。即ち癌は組織浸潤、組織チャンネルを通した拡大、脈管新生および腫瘍血管新生を含む多相的疾患である。上記後半のプロセスは平滑筋および内皮細胞の増殖速度に依存している。
【0177】
実験39:基底膜を通る腫瘍細胞の浸潤をPL-コンジュゲートが阻害する能力を示すために、走化性浸潤アッセイを用いた(図29)。詳細は以下方法と材料を見よ。
【0178】
実験40−42:組織分解酵素の発現又は活性を阻害する薬物としてPL-コンジュゲートが作用する能力を示す。ヒアウロン酸(HyA)PBS液(0.75mg/ml)を指定濃度のHYPE非存在下又は存在下に1時間ヒアウロニダーゼ(15U/ml)処理した。ヒアウロン酸分解は溶液粘度の変化より決定された(図30)。PL-コンジュゲートを用いた同様の実験をコラゲナーゼ活性およびへパリナーゼ活性に関するアッセイを用いて実施した。HT-1080(繊維肉腫)細胞を指定濃度のHYPEと24時間インキュベーションした。次に培地を集め、そのコラゲナーゼ活性を酵素電気泳動アッセイにより決定した。各データは2プレートの平均値である(誤差約5%)(図31)。BMG細胞はウエル当たり50μCiの35SO42-で標識された。細胞は、5単位のヘパリナーゼIPBS液200μlで3時間処理される前に、PBSで3回洗浄された。培地が集められ、その35S含有量が計測された(図32)。
【0179】
上記実験30−33もまた、繊維芽細胞から平滑筋細胞、そして血管起源の内皮細胞に至る各種タイプの細胞の増殖を阻害するPL-コンジュゲートの抗増殖作用を示している。このことはPLコンジュゲートの抗血管新生能が腫瘍増殖および拡大の阻害に特に有意であることを示した。
【0180】
実験43:内皮細胞の増殖に対するPL-コンジュゲートの作用に関しては、ウシ大動脈内皮細胞が培養皿にて6時間平板培養され、続いて洗浄され未接着細胞が除かれた。残った接着細胞は指定濃度のPL-コンジュゲート非存在下(コントロール)又は存在下に48時間インキュベーションされた。次に細胞は洗浄され、トリプシン処理により集められ、コールターカウンターを用いて細胞数が測定された、結果は3回測定の平均値±標準偏差である。*p<0.005(図33)。
【0181】
これら実験は、PL-コンジュゲートの投与が、抗増殖、抗浸潤および抗血管新生を含む複数のメカニズムにより、癌の治療に効果的な治療法であることを示している。
【0182】
実験37−38
実施例9:抗酸化剤治療
PL-コンジュゲートは酸化損傷を防ぐのに適した効果的治療剤である。このことは実験45-47で示される。生組織への過酸化フリーラジカルの有害作用は酸化損傷として既知である。この損傷プロセスの標的が細胞膜である場合、膜の機能障害および不安定化が生じる。血液蛋白質、特に血液脂質蛋白質への酸化損傷は、血管を裏打ちする細胞内へのそれら物質の過剰蓄積をもたらし、その結果アテローム性動脈硬化症の原因となる。実際、酸化的細胞損傷は加齢又は老化のプロセスに関係する主要メカニズムである。
【0183】
蛋白質又は細胞膜に対する酸化損傷は、一般にはこれら組織をPLA2の様な追加の膜不安定化剤非存在下又は存在下に、酵素グルコースオキシダーゼ(GO)により作られた過酸化水素に曝すこと、又は銅の様な2価陽イオンに曝すことで評価される。
【0184】
実験44−47はアラキドン酸および低分子細胞内物質両方の細胞保持より判断される、酸化損傷から細胞を保護するPL-コンジュゲートの能力を示している。
【0185】
実験44:集密BGM(ミドリザル腎臓上皮細胞)を3H-アラキドン酸で標識した。この細胞は、GOとPLA2(0.5u/ml)で処理する前にCMPEにより30分間処理された。(図34)。
【0186】
実験45:BGM細胞を35SO4で一晩標識した。細胞をDMEM(10mg/mlのBSAを含む)PBS液にて4回洗浄した。次に細胞をGO(H2O2)を添加したDMEM中に90インキュベーションし、その培地を集めて35S放射活性を計測した。CMPEで処理する場合は、GO導入前に細胞を指定濃度CMPEと30分間インキュベーションした。各データは5重測定の平均値+SEMである。*p<0.005;**p<0.001(図35)。
【0187】
実験46:血液脂質蛋白質の酸化を阻害するPL-コンジュゲートの能力を示すことを目的とする。LDL(0.1μM)を各種濃度のHYPE又はHA非存在下又は存在下に、37℃にてイキュベーションした。0時において5μMのCuCl2が分散体に加えられ、そして混合体は245nmにて酸化産物について連続モニターされた(図36)。245nmの吸光度(OD単位)は時間の関数として描かれている(Shnitzerら、Free Radical Biol Med 24: 1924-1303, 1998)。
【0188】
実験47:有害な酸化保存状態にある、即ち光照射下に於ける赤血球細胞に対するPL-コンジュゲートの保護作用を示す。ヒトRBCは2μMのPc4(1mMPOPC、4mMシステインおよび0.5mMのL-カルニチン中)で処理され、表示の如くにPL-コンジュゲート非存在下又は存在下に15J/cm2の光を照射した(図37)。
【0189】
これら実験はPL-コンジュゲート投与が、脂質蛋白質酸化の阻害、酸化リポ蛋白質取り込みの阻害(図28、図29)を含む複数のメカニズム、および以下記載の様にアラキドン酸放出を阻害し、赤血球膜を含む細胞の膜の健全性を保存することによる、酸化的組織損傷予防の効果的な治療法であることを示している。
【0190】
実施例10:溶血
PL-コンジュゲートは溶血の治療および予防に効果的な治療剤である。このことは実験48に示されている。赤血球(RBC)が破壊する溶血はそれ自体が原発性疾患であるか、又はその他疾患又は生理学的障害に伴う症状である。一般に受け入れられている薬物による膜安定化作用評価法は、既知膜不安定化剤存在下に赤血球をインキュベーションし、細胞外媒体中へのヘモグロビンの放出を検出するものである。
【0191】
実験48:PL-コンジュゲートが膜を破壊する酵素剤に曝露されたヒト赤血球の安定性維持に役立つことを示すことを目的とする。ヒトRBCは生理食塩水で洗浄され、ハンクス(Hanks)緩衝液(-H7.4)中に懸濁された。溶血は指定の如くにPL-コンジュゲート(10μM)非存在下又は存在下に、ストレプトリジンO(SLO)5U/ml、ストレプトリジンS(SLS)25U/ml、又はリソホスファチジルコリンリパーゼ(Lyso-PC)5μg/mlで20分間誘導された。細胞膜は遠心して落とされ、540nmのODを測定することで上清のヘモグロビン含有量が決定された(表13)。
【0192】
表13.HYPE、CMPEおよびHEPPEによる溶血の防止
【表13】

【0193】
これら実験は、PL-コンジュゲートが溶血治療に有効な治療剤であり、血液製剤の保管の保存剤として価値あることを示している。(実験46)
【0194】
実施例11:敗血症
PL-コンジュゲートは敗血症としても知られるショックを伴う菌血症の治療に有効な治療剤である。このことは実験49-50に示されている。
【0195】
腫瘍壊死因子(TNF-α)は敗血性ショックの病因に関わる主要サイトカインであり、局所および全身性に放出され、組織健全性および全身の血液動態に有害且つ非可逆的な影響を及ぼす。細菌のリポポリサッカライド免疫源(LPS)に細胞を曝すとことは、敗血症状態に対するTNF-αをアッセイするために一般に使用されているモデルシステムの要素である。TNF-α以外の敗血症および敗血性ショックの病因に関連するケモカインはMCP-1、ENA-78、Gro-αおよびCX3Cである。
【0196】
実験49:ヒト組織中のTNF-α生成を阻害するPL-コンジュゲートの能力を例示するために、健康供血者より得たヘパリン(12.5U/ml)を加えたヒト静脈血を200mMのグルタミン、200U/mlのペニシリンおよい200U/mlのストレプトマイシンを添加されたRPMI-1640で1:3に希釈した。1:3希釈血液の一部(300μl)を24ウエルのマルチディスク(Multidis)プレート(Nunclon)に分配した。血液サンプルは、最終濃度100ng/mlの100μlのリポポリサッカライドE.coli026:B6(LPS)6%CO2を加える前に、加湿雰囲気中にて100μlの化合物又は溶媒と前インキュベーションされた。6時間インキュベーションした後、24ウエルプレートを遠心処理(2000rpm×10)し、ELISAを使ってサイトカイン含有量をアッセイした。各種HYPESのリン酸含有量は様々であった(図38及び図38a)。
【0197】
実験50:マウス細胞に於けるTNF-αの生成を阻害するPL-コンジュゲートの能力を示す。初代マウス腹膜マクロファージを指示濃度のPL-コンジュゲートで30分間処理した。次にLPS(1μg/ml)を培養体に直接、又はPL-コンジュゲートを洗い流した後に加えた。TNFはELISAにより決定された(図39)。
【0198】
MCP-1、ENA-78、Gro-αおよびCX3Cといったケモカインに及ぼすPL-コンジュゲートの作用は、下記実験53および54に示す。
これら実験は、PL-コンジュゲートの投与が敗血症の治療に有効な治療法であることを示している。
【0199】
実施例12:急性呼吸困難症候群(ARDS)
PL-供役体は急性呼吸困難症候群(ARDS)の治療に有効な治療剤である。このことは実験51および52に示されている。ARDSに於いて、この病気の病因と関連する4種類のケモカインはMCP-1、ENA-78、Gro-αおよびCX3Cであり、これらは例えばLPSの様な外来抗原による刺激に反応し、微小血管内皮細胞中に発現される。
【0200】
実験51:PL-供役体がヒト肺由来の微小血管上皮細胞に於けるケモカイン生成を阻害することを示す。HLMVECは指定濃度のHYPE非存在下又は存在下に1μg/mlのLPSと24時間インキュベーションされた。培地中に蓄積されたケモカインGro-α、ENA-78およびMCP-1はELISAにより決定された。ENA-78およびMCP-1の分泌は10μMのHYPEで既に阻止された(図40)。
【0201】
実験52:PL-供役体がヒト肺由来の微小血管上皮細胞に於けるケモカイン生成を阻害することを、遺伝子発現のレベルで示す(図41a-f)。
さらに上記実験1-8は、PL-供役体が収縮の阻害および気道浸潤障害物の減少を含む、複数のメカニズムにより気道狭窄を軽減し、障害性呼吸器疾患の治療に利用できることを示している。
【0202】
これら実験はPL-供役体がARDSの治療に有効な治療剤であることを示している。
【0203】
実施例13:移植臓器拒絶、同種免疫、および自己免疫疾患
PL-供役体は、組織移植に関する治療を含めた自己免疫および同種免疫疾患の治療に効果的な治療剤である。このことは下記実験53-58に示されている。自己免疫疾患は血液製剤および全臓器を含む組織をドナーからレシピエント移植した際の免疫反応に基づく組織損傷を含む。この反応はしばしば血管組織に向けられる。自己免疫疾患は、免疫を介した実質組織の直接的又は臓器脈管系を介した破壊された臓器を含む。病気の進行に於ける2つの重要事項は、リンパ細胞の増殖およびMHCグループ抗原が関係する免疫学的反応である。一般に受け入れられている薬物が提示する免疫抑制作用は、リンパ細胞の増殖を阻害する能力およびMHCグループ抗原の発現を阻害する能力である。
【0204】
実験53-55はPL供役体がヒトMHC抗原グループの発現を、基本レベルおよび刺激剤に曝された場合の両方において抑制することを示している。
実験53:ヒト内皮細胞増殖培地中に集密培養されたヒト近位尿細管内皮細胞(PTEC)を、指定時間HYPE非存在下又は存在下にコントロール培地又はIFNγ添加培地(10ng/ml)中にインキュベーションした。細胞は洗浄され、続いてトリプシン処理により可動化され、30分間FITCで蛍光標識された特異抗体とインキュベーションされた。MHC-1、MHC-2およびICAMの発現はFACSにより決定され、そして各細胞に関連した蛍光強度の中央値として表された(図42)。
【0205】
実験54:近位尿細管上皮細胞は72時間、図指定の濃度のHYPE非存在下又は存在下に培地中でインキュベーションされるか、又はIFNγ(10ng/ml)で刺激された(図42)。前表と同様の手順が用いられた。MHC-1の発現はFACSにより決定され、コントロール細胞について得られた値に対する相対値で表された(図43)。
【0206】
実験55:ヒト臍帯静脈内皮細胞を72時間、HYPE非存在下又は存在下に培地(コントロール)中で培養するか、又はIFNγで刺激した。前表と同じ手順が用いられた。MHC-1の発現はFACSにより決定され、各細胞関連蛍光強度の中央値として表された(図44)。
【0207】
実験56:PL-供役体が、各種刺激剤に反応し増殖する健康および病気の動物より得たリンパ細胞の能力を阻害することを示す。リンパ節細胞(LNC)のプールを3ないし4匹のマウスより調製した。LNCのインビトロ反応は96ウエルプレートで3重アッセイされた。(図44)。各ウエルに2.5×105のLNCをコンカナバリンA(ConA、1μg/ml)、プロテオリポ蛋白質(PLP、10μg/ml)およびLPS(50μg/ml)と共に、CMPE非存在下又は存在下に96時間加えた。最後の18時間に1μCi/ウエルの3[H]チミジンを各ウエルに加え、その後プレートをガラスファイバーフィルターに集め、液体シンチレーションを使って測定した(図45)。
【0208】
実験57−58:狭窄/再潅流実験プロトコールに於いて、PL-供役体の有効性を示す。PL-供役体の投与は虚血/再潅流が誘導する白血球の接着および血管外遊出を明瞭に抑制する。白血球はローダミン静脈注射によりインビボ標識された。露出したラット(インサイチュー)懸垂筋を90分間虚血状態にし、次に血流を再開して再潅流した。血管壁への蛍光標識白血球の接着(図46)およびそれらの血管外空間への遊出(図47)はビデオに撮られ、再潅流期間中の指定時間に数量測定された。PL-供役体(10mg.100g体重)は虚血誘導40分前および10分前に静脈注射された。図32の各データはHYPE処理した5匹のラット、およびHEPPE処理された2匹のラットの平均値±SEMである。いずれの処理もp<0.005である。図31では、5分および30分時のHYPE処理ラットはp<0.005であり、10分時はp<0.01、そして60分時はp<0.05である;HEPPE処理ラットでは、いずれの時点もp<0.01である。
【0209】
これら実験は、PL-供役体の投与が複数の免疫抑制メカニズムにより、同種免疫および自己免疫疾患の治療に有効な治療法であることを示している。
【0210】
実施例14:ウイルス感染
PL-供役体はウイルス感染、特にヒト免疫不全ウイルス(HIV)による感染の予防および治療に有効である。このことは下記実験59に示される。ウイルス感染のプロセスは、遊離ウイルス粒子が宿主細胞内に進入できる段階と病気の兆候を生じる段階を含む。薬物の抗ウイルス活性に関し一般に受け入れられているアッセイは、ウイルス剤の標本を薬物存在下にインキュベーションし、続いてヒト細胞株でのウイルス感染を試験するものである。
【0211】
実験59:PL-供役体がHIV病原体の細胞感染能力を有意に阻害することを示す。血液単位をHIVおよび指定のPL-供役体と30分間混合した。次に細胞を遠心分離して落とし、その上清についてMargolis-Nunnoら(Transfusion、36、743-750、1996)記載の様にHT4-1022細胞に対するHIV感染性を調べた。1mg/mlHEPE=50μM;1mg/mlHYPE=30μM(図48)。
【0212】
これら実験は、PL-供役体の投与が、ウイルス感染、特にHIV感染の有益な治療法であること、そして血液製剤を含む汚染物質よりウイルス粒子を根絶するのに有益であることを示している。
【0213】
実施例15:結膜炎
PL-供役体は遅延型過敏性免疫反応により誘導される過敏性結膜炎の治療に効果的である。このことは下記実験60に示される。
【0214】
実験60:10mgの卵アルブミンを0.5mlのPBSに溶解し、フレンドのアジュバントを添加した液を2回腹腔内注射し(注射の間を1週間空ける)モルモットを感作した。最初の感作から3週後に、5mgの卵アルブミンを25mlのPBSに溶解した液を滴下して第一回目のチャレンジを行い、初回チャレンジ以後3日目、4日目、5日目および6日目に再チャレンジを行った(図50)。治療を目的とし、PBS中に懸濁された薬剤(CMPE)を各動物の右目に、初回チャレンジ後3、4、5および6日目に滴下した。角膜透明度の臨床評価を5日目と6日目に行った。目のLTB4およびPGE2レベルはELISAより決定された(図51)。比較のため、ステロイド治療の効果も平行して評価された。
【0215】
実施例16:急性毒性試験
実験61:次の化合物を生きているマウスを用いた毒性アッセイで試験した:HyPE、CMPE、HeMPE、He SPEおよびCSAPE。化合物は1000、500および200mg/kg体重の1回投与量が腹腔内注射された。毒性は1週後の死亡率、体重、ヘマトクリット、血球数(赤血球および白血球)ならびに屠殺後の内臓の目視検査により評価された。これらは、未処置マウスであるコントロールと比較された。各群(上記各化合物により処理された)には6匹のマウスが使われた。
【0216】
HePPEを除く上記化合物による処理では、死亡例および上記判断基準の有意な変化は誘導されなかった。HePPE(へパリン結合PE)処理群では、3匹のマウスが出血により1週間以内に死亡した。
【0217】
HyPEはまた長期毒性についても調べられた;6匹1群に、30週間、隔日(3注射/週)に100mg/kg体重のHyPEを腹腔内注射、投与した(合計180mg/20gマウス)。毒性は上記同様に評価された。本処理による死亡例および上記基準に有意な変化は認められなかった。
【0218】
実施例17:クラミジア感染の治療
PL-供役体は細胞内細菌性寄生生物による感染、特にクラミジア種による感染症の予防および治療に有効である。このことは下記実験62ないし63に示されている。
【0219】
実験62:ヒト子宮頸部腺腫細胞株HeLa229(ATCC、マナサス(Manassas)、カリフォルニア州(CA))を培養し、30分間PL供役体(20マイクロモル)とインキュベーションされ、次にChlamydia psittaci(モルモット封入体結膜炎菌)と24時間インキュベーションした。感染細胞はFITC-標識抗クラミジア抗体(図52a)を用いたサイトフローメトリー(FACS)により検出された(図52a)。
【0220】
実験63:クラミジアによるHeLa細胞の感染に対するPL-供役体の阻害作用の用量反応を決定した(図52b):HeLa細胞は指示濃度のPL-供役体で処理され、実験62同様にクラミジアで感染させられた。
【0221】
実験64:HeLa細胞はPL-供役体で処理され、実験62同様にChlamydia psittaciaで感染させられた。アポトーシスを測定するために、界面活性剤透過処理された細胞をプロピジウムヨードで染色し、その蛍光をサイトフルオロメトリーを使い測定した(図53)。
【0222】
材料と方法
TNB-誘導大腸炎 (TNBS)シグマ(Sigma)、セントルイス(St.Louis)、ニューオリンズ(MO))を断食24時間後にヘブライ大学サブララット(Hebrew University Sabra rats)(200-250g)に直腸投与し(1mlの50%EtOH中に25mgを含む)、我々の予備実験およびこれまでの報告[ ]に習って2日間疾患の経過をモニターした。PL供役体群では、ラットに20mgのCMPE(1ml生理食塩水、体液中濃度10μMを得る量)が次の時点に腹腔内投与された:TNBS投与前18時間目、0.5時間目、投与後3時間目、18時間目および36時間目。コントロールの未処理ラットには賦形剤(生理食塩水)1mlが同時点に腹腔内投与された。このプロセスに生き残ったラットは屠殺され、10cmの遠位部結腸断片を顕微鏡を使い組織損傷について調べ、さらに縦に2分割した。一方は10%フォルマリンで固定され組織検査に用いられ、もう一方はミエロペルオキシダーゼ(MPO)活性の測定に供された。インドメタシンによる腸傷害では、動物モデルでの実験胃障害誘導に使用されるシクロオキシゲナーゼ阻害剤である(30,31)インドメタシン(シグマ(Sigma)、セントルイス(St.Louis)、ニューオリンズ(MO))を体重測定した(200-250g)ラットに腹腔内投与(1%NaHCO31ml中に6mg)が投与され、病気の発症と経過が我々の予備実験および従来の報告[29,30]に従って5日間モニターされた。CMPE処理群では、薬物(1mlの生理食塩水中に20mg)はインドメタシン投与1時間前、および6時間、24時間ならびに48時間後に投与された。コントロールの未処理ラットには同時点で1mlの賦形剤(生理食塩水)が投与された。この処理に生き残ったラットは屠殺され、十二指腸から盲腸までの肉眼および組織学的損傷について調べられた。組織学的損傷を検査するために20cmの空腸が取られた。腸損傷に関する0(損傷なし)から5(最大損傷)までの巨視的スコア化は、粘膜の変色、びらん、滲出、潰瘍形成、腸壁の肥厚および損傷領域のパーセンテージの肉眼検査により行われた。腸損傷の組織学的スコア化は0(損傷なし)から5(最大損傷)にランク付けされた5種類の判断基準:即ち潰瘍域の広さ、潰瘍の深さ、白血球浸潤の強さおよび範囲、および繊維化を肉眼で評価した平均である。腸透過性は、イヌリン-フルオロセイン(InF1、シグマ(Sigma)、セントルイス(St.Louis)、ニューオリンズ(MO))の直腸又は経口投与後[32]の、その血漿レベルを決定することで評価された。これまでの研究に於いて、我々はinF1が正常ラットの腸は透過しないが、病気のラットでは容易に吸収されることを見出している;大腸炎では血漿中のInF1により測定した腸透過性はTNBS投与後12時間目に最大となるが、小腸での傷害はインドメタシン投与後72時間目に最大となる[32]。従って大腸炎を誘導されたラットでは、TNBS投与12時間後にInF1(0.2ml生理食塩水中4mg)が直腸投与され、2時間後にエーテル麻酔したラットの尾状脈より血液サンプル(0.5ml)が採取された[32]。小腸に傷害を持つラットでは、同量のInF1がインドメタシン投与72時間後に経口投与され、それから3時間後に血液サンプルが採取された[32]。Inf1の血液レベルを決定するために、血漿が遠心分離により分離され、既報[32]に従い488nm(励起)と517nm(発光)で蛍光強度が決定された。組織ホモジェネート中のミエロペルオキシダーゼ活性はo-ジアニシジン/H2O2反応により分光光学的に決定された[19,33]。コントロールラットでは死亡率が高いことから、MPO、腸透過性および歴史損傷の決定は実験操作に胃に残ったラットに限定された。このことが、死亡したラットが最も重症の傷害を有していたにも関わらず、これらを処理および未処理動物間の比較に含めることができないという方法論的な問題を招いた。結果に記した様に、MPO活性およびInF1透過性のデータを分析する際にこの欠点を考慮した。統計分析:結果は平均値±SEMで表され、各種処理間の鎖はスチューデントt-試験により有意検定された。
【0223】
硫酸デキストランによりラットに誘導された大腸炎
3群のマウス(n=12)が対象となった。大腸炎は飲料水中4%硫酸デキストランナトリウム塩(DSS)(ICN、MW 36,000-44,000)により誘導された。ヒアウロン酸結合ホスファチジルエタノールアミン(HyPE),80μg/g体重を経口投与した(胃挿管による)。第1群では(DSS)、給餌は水道水に溶解された4%硫酸デキストランナトリウム(DSS)と共に7日間、続いて通常の水と共に7日間行われ、処理は溶媒(PBS)の経口投与により実施された。第2群(DDS+HyPE)では、給餌は水道水に溶解された4%硫酸デキストランナトリム(DDS)と共に7日間、続いて通常の水と共に7日間行われ、処理はHyPE(2×80μg/g;8mg/mlPBS保存溶液、pH=8)を経口投与し行われた。第3群(健康コントロール)は、14日間通常の水が与えられた。水は自由に摂取させた。体重は毎日測定された(処理前の実験第1日のコントロール体重から始まり、屠殺日が最終体重)。デキストラン処理はデキストラン/溶媒含有デキストラン群の体重の平均減少が3日後に一度変化するまで続けられた;水および水+デキストラン摂取量はデキストラン補給期間終了時、3日間後に決定された。Hemoccult(hemo FECR、ベーリンガーマンハイム(Boehringer Mannheim)、大きな血液の塊の存在(肛門周辺の血液凝塊(および前日が陽性でない場合には6日目に)および10日目。
【0224】
表14.疾患活動指数のスコア化の基準
【表14】

*疾患活動指数=(体重減少、便の硬さおよび出血に関するスコアの合計)/3
正常便=形のしっかりした顆粒状;軟便=肛門にこびり付かない、弛んだ便:下痢=肛門にこびり付く液状の便(Murrayら、1993)。
【0225】
血液学および肉眼検査では、動物はペントバルビツール(90mg/kg)により麻酔されてから開腹された。0.5mlの血液が腹部大動脈から採取され、血液学測定のためにK2EDTAの入ったMicrotainerRチューブに集められた。結腸の長さを決定するために、結腸を結腸-盲腸結合部から肛門にかけ切り取り、生理食塩水でフラッシュし、非吸収面の上に置いて結腸の長さを定規を使い測定した。組織学に関しては、遠位部結腸を中性緩衝化フォルムアルデヒドに最低3日間漬けた。各部分は4つの横断部分に切り分けられ、パラフィン包埋される前に通常に処理された。腺窩スコア化法(Murrayら、1993)は次の通りであった:等級O=無傷腺窩、1=腺窩の下1/3が消失、2=下2/3が消失、3=腺窩全体が消失するが表面の上皮が残る、4=粘膜の完全なビラン。%波及面積:1=1-25%、2=25-50%、3=51-75%、4=76-100%。等級値スコアに%波及スコアを乗じた(最大スコア=16)。傷害スコア化法(組織中のWBC、Murayら、1993)は次の通りであった:0=なし、1=軽度、2=中度、3=重度。%波及面積:1=1-25%、2=25-50%、3=51-75%、4=76-100%。各4部分について傷害スコアに%波及スコアを乗じた(最大スコア=12)。リンパ'節'の数=正常リンパ節を含む、リンパ細胞(切片当たり)の累積数:リンパ細胞数が20細胞より多い全ての群を一つにまとめ、1累積群とされた。Okayasuら、Gastroenterology、98、694(1990)。Murthyら、Dig Dis Sci, 38, 1722(1993)。
【0226】
疾患重症度のEAE-スコア化は、以下の尺度に基づいた実験動物の観察を通じ毎日実施された:
【0227】
【表15】

【0228】
遅延型過敏反応 メスの8-12週齢のbalb/cマウスを、0日目に毛を剃った胃部に2%オキサゾロンDMSO:生理食塩水/1:18液50μlを局所適用して感作し、6日後(第6日)に両側の両耳にオキサロゾン液を局所適用し(片側当たり5μL)チャレンジを実施した。試験対象のPL-コンジュゲートは、0日から6日目まで、対応する表に指定された投与量にて、以下概略示す洋式で投与された。過敏反応は抗原チャレンジ24時間後に、耳の腫れを測定すること(マイクロメーターを用いて)および結果を処理前に同一マウスより得た測定値と比較することで評価された。
【0229】
マクロファージからのアラキドン酸およびオレイン酸の放出.マクロファージに関しては、マウスP388D1細胞は[3H]オレイン酸で前標識され、そしてPL-コンジュゲートで30分間処理され、LPS存在下(?)又は非存在下(0)に20時間インキュベーションされた(図19)。イスコフ(Iscove)の改良ダルベッコ(Dulbecco's)培地(エンドトキシン<0.05ng/ml)はホイッタカーバイオプロダクツ(Whittaker Bioproducts)(ウォーカーズビル、マサチューセッツ州(Walkersville、MD)より得た。胎児ウシ血清はハイクローンラブス(Hyclone Labs.)(ローガン、ユタ州(Logan、UT))より得た。非必須アミノ酸はアーバインサイエンティフィック(Irvine Scientific)(サンタアナ、カリフォルニア州(Santa Ana, CA))より得た。[9,10-3H]オレイン酸(比活性55Ci/mmol)はニューイングランドヌクレアー(New England Nuclear)(ボストン、マサチューセッツ州(Boston, MA))より得た。LPS(E.coli 0111:B4)はシグマ(Sigma)(セントルイス、ニューオリンズ(St.Louis、NO))より得た。P388D1細胞(MAB)クローン(5,6)は90%空気と10%CO2の加湿外気中、37度にて、10%胎児ウシ血清、2mMグルタミン、100単位/mlペニシリン、100μg/mlストレプトマイシンおよび非必須アミノ酸が追加されたイスコフの改良型ダルベッコ培地中に維持された。P388D1細胞はウエル当たり106個接種され、一晩接着させられ、翌日実験に使用された。実験は全て無血清のイスコフ改良型ダルベッコ培地中にて実施された。P388D1細胞の[3H]OAによる放射線標識は、一晩の接着期間中(20h)に5μCi/mlの[3H]OAを加えることで達成された。細胞脂質に取り込まれなかった標識OAは細胞を6回、1mg/mlのアルブミンを含む無血清培地で洗浄することで取り除かれた。細胞外への[3H]オレイン酸放出を測定するために、細胞を0.5mg/mlのウシ血清アルブミン存在下、各種時間LPS又は外来性PL-標識体を添加する前に、無血清培地内に30分間置いた。上清を取り除き、剥がしとった細胞を遠心により清浄化し、液体シンチレーション測定により放射活性をアッセイした。LPS-刺激によるOA放出は、アゴニストおよび阻害剤非存在下で観察されたベースの率を差し引いて表された。これらバックグランド値は1000-2000cpmの範囲内であった。各実験セットは少なくとも3回繰り返され、同様の結果を得た。特記ない限り、提示データは代表実験のものである。
【0230】
腫瘍細胞浸潤アッセイ 走化性物質浸潤アッセイに関しては、ポリビニルピロリドンを含まないポリカーボネートファイバー製、8μMポアサイズを25μgお基底膜成分混合物(Matrigel)でコーティングし、改良型ボイデン(Boyden)チャンバー内に置いた。細胞(2×105)は短時間EDTA(1mM)に曝されことでそれらの培養皿より剥離され、遠心分離にかけられ、0.1%BSA/DMEMに再懸濁され、ボイデンチャンバーの上部コンパートメント内に入れられた。繊維芽細胞コンディショニング培地を走化性物質源として下部コンパートメントに入れた。37℃にて6時間インキュベーションした後、フィルターの下面上にある細胞をDiff-Quick(アメリカンサイエンティフックプロダクツ(American Scientific Products))で染色し、オリンパスCK2顕微鏡に備え付けられたイメージアナライザー(Optomax V)を使って定量化した。データはフィルター下面上の未処理細胞占有面積に対し表された。(Albiniら、A Rapid in Vitro Assay for Quantitating the Invasive Potential of Tumor Cells. Cancer Res. 47:3239-3245, 1987)。
【技術分野】
【0001】
本発明は、閉塞性呼吸疾患、大腸炎、クローン病、中枢神経系発作、多発性硬化症、接触皮膚炎、乾癬、侵襲処置の予防を含む心臓血管疾患、浸潤性細胞増殖障害、抗酸化剤療法、溶血症候群、敗血症、急性呼吸困難症候群、組織移植拒絶症候群、自己免疫疾患、ウイルス感染、クラミジア(chlamydia)感染、および過敏性結膜炎を含む疾患の治療に向けられる、薬学的に活性である脂質コンジュゲート化合物種を提供する。
【背景技術】
【0002】
いくつかの高分子量コンジュゲート、特にコンジュゲート部分が、ドデカンジオイック、デキストラン、デキストランアミド、カルボキシメチルセルロース、カルボキシメチルセルロース−アシル、ポリ−D−グルタミン酸、ポリアクリル酸、ポリエチレングリコール、ヒドロキシエチルデンプン、ヘパリン、ヒアルロン酸、およびポリグレアチン(polygleatin)(「ヘマセル」)であるものが、特許文献1、および本明細書に引用される刊行物に記載されてきているが、これらの化合物は、広範囲の薬理学的有効性を有することが知られていなかった。これらの化合物は、sn−2位でのリン脂質の分解を触媒し、脂肪酸およびリゾリン脂質を生じる酵素、ホスホリパーゼA2(PLA2、EC 3.1.1.4)を阻害する薬理学的活性を有することが知られている。この酵素の活性は、多様な細胞機能と、特に開口分泌などの分泌過程およびエイコサノイド産生(プロスタグランジン、トロンボキサンおよびロイコトリエン)と相関してきている。これらの大部分がリン脂質である誘導体に帰せられる生物学的活性は、血小板凝集、トロンボキサン分泌、およびホスホリパーゼA2の選択的阻害に限定された。したがって、PLA2阻害剤の使用は、アレルギーおよび炎症におけるなど、増進された細胞分泌と関連する疾患の治療のため、提唱された。したがって、高分子量のホスファチジルエタノールアミン−コンジュゲート(PE−コンジュゲート)、および関連するリン脂質コンジュゲート化合物(PL−コンジュゲート)は、特にその相対的に高分子量である大きさが、細胞膜レベルで、この加水分解酵素活性の選択的阻害剤として、該化合物自体を有用にするため、PLA2関連異常の治療に有用であると判断された。したがって、これらの化合物の推定される医学的使用は、必然的に、PLA2に関連する病理学的異常の治療に限定された。その発端から、PL−コンジュゲートは、多因子性起源であり、世界中で、かなりの罹患率および死亡率を占め続ける、一般的であるが重症の疾患を治療する新規方法を確立することに向けた、集中的な実験室研究に供されてきた。これらの研究から、PL−コンジュゲートに関し、広範囲の強力でそして有用な生物学的作用が明らかになってきており、そして特定の疾患の治療の点から見ると、これらの化合物の役割は、医学業にこれまで導入されてきていない。
【先行技術文献】
【特許文献】
【0003】
【特許文献1】米国特許第5,064,817号明細書
【発明の開示】
【発明が解決しようとする課題】
【0004】
本発明は、主に、ホスファチジルエタノールアミンなどのリン脂質、およびホスファチジルセリンなどの関連リン脂質で構成される、脂質コンジュゲートであって、生理学的に適合するモノマー、ダイマー、オリゴマー又はポリマー部分へのコンジュゲート化によって、適切に調製された際、予期されなかった広範囲および効力の薬理学的活性を示す、前記脂質コンジュゲートを提供する。これらの化合物の投与は、閉塞性呼吸疾患、大腸炎、クローン病、中枢神経系発作、多発性硬化症、接触皮膚炎、乾癬、侵襲処置の予防を含む心臓血管疾患、浸潤性細胞増殖障害、抗酸化剤療法、溶血症候群、敗血症、急性呼吸困難症候群、組織移植拒絶症候群、自己免疫疾患、ウイルス感染、クラミジア感染、および過敏性結膜炎を含む疾患に罹患した被験者の有効な治療を含む。これらの疾患のため、薬理学的療法としてのPL−コンジュゲートの使用は、新たな種類の薬剤に相当し、現在、医師に処方された慣用的措置に厳密に追従しているにもかかわらず、罹患に苦しみ続けている多くの患者に利点を与える。
【課題を解決するための手段】
【0005】
本発明の1つの態様において、PL−コンジュゲートは、抗腫瘍壊死因子(TNF)剤として、このサイトカインの調節不全を患う被験者に投与する。
別の態様において、PL−コンジュゲートは、平滑筋増殖の抗増殖剤として、そして抗血管形成剤として、血管疾患又は転移性癌増殖において、起こる可能性があるような、平滑筋増殖又は血管形成の調節不全を患う被験者に投与する。
【0006】
別の態様において、PL−コンジュゲートは、鎮痙(anti−spasmic)、抗サイトカイン、免疫抑制、および抗浸潤剤として、喘息および慢性閉塞性肺疾患を含む、閉塞性呼吸疾患に罹患した被験者に投与する。
【0007】
別の態様において、PL−コンジュゲートは、細胞保護、抗サイトカインおよび免疫抑制剤として、大腸炎又はクローン病に罹患した被験者に投与する。
別の態様において、PL−コンジュゲートは、抗一酸化窒素、抗ドーパミン、抗酸化、抗サイトカイン、および血液脳関門安定化神経保護剤として、虚血性脳卒中、腫瘍、外傷、感染、および多発性硬化症を含む、急性又は変性脳発作に罹患した被験者に投与する。
【0008】
別の態様において、PL−コンジュゲートは、免疫抑制、抗増殖、抗サイトカイン、血液脳関門安定化および神経保護剤として、多発性硬化症に罹患した被験者に投与する。
【0009】
別の態様において、PL−コンジュゲートは、免疫抑制および抗サイトカイン剤として、接触皮膚炎を含む、皮膚過敏反応に罹患した被験者に投与する。
別の態様において、PL−コンジュゲートは、抗増殖および抗サイトカイン剤として、乾癬に罹患した被験者に投与する。
【0010】
別の態様において、PL−コンジュゲートは、抗増殖、抗酸化、抗遊走、および抗アテローム発生剤として、急性又は慢性虚血性血管疾患、散在性アテローム性動脈硬化病変、および虚血事象に関連する再灌流損傷を含む、心臓血管疾患に罹患した被験者に投与する。
【0011】
別の態様において、PL−コンジュゲートは、抗狭窄剤として、侵襲性医学処置、特に動脈又は静脈カテーテル処置を経験する被験者に投与する。
別の態様において、PL−コンジュゲートは、抗増殖、抗血管形成、抗サイトカイン、抗細胞マトリックス分解、および抗遊走剤として、転移又は転移前癌を含む侵襲性細胞増殖障害に罹患した被験者に投与する。
【0012】
別の態様において、PL−コンジュゲートは、生理学的ストレス、照射、および加齢に関連する損傷を含む、酸化組織損傷の予防法として、抗酸化剤として、被験者に投与する。
【0013】
別の態様において、PL−コンジュゲートは、膜安定化および抗酸化剤として、毒性、感染性、又は遺伝的起源の溶血性貧血を含む、溶血に罹患した被験者に投与する。
【0014】
別の態様において、PL−コンジュゲートは、抗ケモカイン、抗サイトカイン剤、および抗一酸化窒素剤として、敗血症に罹患した被験者に投与する。
別の態様において、PL−コンジュゲートは、抗ケモカインおよび抗痙攣剤として、急性呼吸困難症候群に罹患した被験者に投与する。
【0015】
別の態様において、PL−コンジュゲートは、免疫抑制、細胞保護、抗サイトカインおよび抗再灌流病変剤として、組織又は臓器移植を受ける被験者に投与する。
【0016】
別の態様において、PL−コンジュゲートは、免疫抑制、抗サイトカインおよび抗増殖剤として、自己免疫疾患に罹患した被験者に投与する。
別の態様において、PL−コンジュゲートは、抗ウイルス療法として、HIVとして知られるレトロウイルスを含む、ウイルス感染に罹患した被験者に投与する。
【0017】
別の態様において、PL−コンジュゲートは、抗サイトカイン剤として、過敏性結膜炎に罹患した被験者に投与する。
別の態様において、PL−コンジュゲートは、保存剤として、保存又は移植の目的のため、体から除去された組織又は臓器に添加する。
【0018】
別の態様において、PL−コンジュゲートは、療法剤として、クラミジア感染に罹患した被験者に投与する。
投与経路および投与されるPL−コンジュゲートの投薬量は、疾患の性質および治療される患者の医学的状態に応じて、熟練した医師が、容易に決定することが可能である。いくつかの場合、1種類より多いPL−コンジュゲートが、1以上の異なる投与経路を通じて、リスクがある被験者に対する予防法として、又は疾患の徴候および症状の出現に反応して、投与されるであろう。疾患の治療におけるPL−コンジュゲートの使用は、療法のさらなる方式を排除せず、そしてPL−コンジュゲートの同時投与は、さらなる修飾、例えば処方された他の医薬品の投薬量の減少を可能にする可能性があると期待できる。
【0019】
本発明の別の側面において、低分子量PL−コンジュゲート、特に極性頭基を通じて、単糖又は二糖、カルボキシ二糖、モノカルボン酸又はジカルボン酸、サリチレート、アミノ酸、ジペプチド、オリゴペプチド、胆汁酸、脂肪酸、コレステリルヘミスクシネート、三糖、あるいはヘパリン、ヘパラン硫酸、ヒアルロン酸、デキストラン、コンドロイチン、コンドロイチン−4−硫酸、コンドロイチン−6−硫酸、ケラチン、ケラタン硫酸、ダーマチン(dermatin)、およびダーマタン(dermatan)硫酸の反復単位を含む、ポリグリコサミノグリカンの二糖又は三糖単位モノマーに結合されたリン脂質に相当する、新規化合物が提供される。低分子量のPL−コンジュゲート種の代表としてのこれらの新規化合物は、本明細書に記載される、より高分子量のPL−コンジュゲートに明示されるのと、同じ広範囲および強度の薬学的活性を示す。これらの新規化合物が本明細書に紹介されることによって、特定の疾患の治療における新規療法薬剤として有用なPL−コンジュゲートの範囲が広がる。
【0020】
本発明の別の態様において、ホスファチジルセリンは、療法化合物の調製および使用において、ホスファチジルエタノールアミンの代替物として使用することが可能であり、ここでリン脂質は、極性頭基を通じて、生理学的に許容しうるモノマー又はポリマーに結合されている。
【0021】
本発明の別の態様において、ホスファチジルコリン、ホスファチジルイノシトール、ホスファチジルグリセロール、および関連する極性リン脂質は、療法化合物の調製および使用において、ホスファチジルエタノールアミンの代替物として使用することが可能であり、ここでリン脂質は、極性頭基を通じて、生理学的に許容しうるモノマー又はポリマーに結合されている。モノアシルグリセロール、ジアシルグリセロール、およびトリアシルグリセロールなどのアシルグリセロールを用いる場合、極性頭基はヒドロキシル基である。本発明の方法を可能にする他の脂質は、スフィンゴミエリン、スフィンゴシン、およびセラミドである。
【0022】
本発明の別の態様において、リン脂質のグリセロール主鎖のC1およびC2位に、エステル結合の代わりにエーテル又はアルキル結合を持つ、リン脂質誘導体を、療法リン脂質−コンジュゲート化合物として用いることが可能である。
【0023】
本発明の別の側面において、本明細書に記載されるPL−コンジュゲートは、閉塞性呼吸疾患、大腸炎、クローン病、中枢神経系発作、多発性硬化症、接触皮膚炎、乾癬、侵襲処置の予防を含む心臓血管疾患、浸潤性細胞増殖障害、抗酸化剤療法、溶血症候群、敗血症、急性呼吸困難症候群、組織移植拒絶症候群、自己免疫疾患、ウイルス感染、クラミジア感染、又は過敏性結膜炎に罹患している被験者を治療するための薬剤組成物製造法に用いる。
【0024】
別の態様において、本明細書に記載されるPL−コンジュゲートは、保存又は移植の目的のため、体から除去される組織又は臓器を保存するための薬剤組成物製造法に用いる。
【0025】
伝統的に病因学および疫学において関連しないとみなされている多くの疾患が、今や、薬剤療法に受け入れられる可能性があるという本開示の性質に基づき、さらなる実験によって、本発明のより広い範囲が導かれ、PL−コンジュゲートでの生物学的組織および生存被験者の治療に基づいて、さらなる医薬様式が可能になるであろうと予期するのは合理的である。
【図面の簡単な説明】
【0026】
【図1】気管収縮アッセイ
【図2】HYPEによる気管収縮の阻害
【図3】HYPEによる気管収縮の阻害対ヒアルロン酸による阻害
【図4】HYPEおよびCMPEの皮下投与による、喘息ラットにおける呼吸器機能の改善
【図5】HYPEのエアロゾル投与による、喘息ラットにおける呼吸器機能の改善
【図6】HYPE吸入によって治療された慢性喘息のラット肺の病理対デキサメタゾンによって治療されたラット肺の病理
【図7】大腸炎型およびクローン病型大腸および小腸病理における、CMPEによる腸損傷スコアの減少
【図8A】クローン病型小腸疾患の粘膜損傷の改善
【図8B】クローン病型小腸疾患の粘膜損傷の改善
【図9】大腸炎型およびクローン病型大腸および小腸傷害における、CMPEによる腸浸透の減少
【図10】大腸炎におけるHYPEによる疾患スコアの改善
【図11】大腸炎におけるHYPEによる腸の長さの改善
【図12】CMPEおよびHYPEによるグリア細胞PGE2産生の阻害
【図13】CMPEおよびHEPEによるPC−12細胞PGE2産生の阻害
【図14】CMPE、HEPPE、およびHYPEによるグリア細胞一酸化窒素産生の阻害
【図15】HYPEによるマクロファージ一酸化窒素産生の阻害
【図16】CMPE、HEPPE、およびHYPEによるグリア細胞からのホスホリパーゼ放出の阻害
【図17】CMPEによるPC−12細胞オレイン酸放出の阻害
【図18】CMPEによるマクロファージ・オレイン酸放出の阻害
【図19】CMPEによるPC−12細胞ドーパミン放出の阻害
【図20】CMPEおよびHEPEによるPC−12 5−HETE放出の阻害
【図21】DEXPEおよびCMPEによる、内皮単層を通じたT細胞浸透の阻害
【図22】CMPEによる乾癬性線維芽細胞増殖の阻害
【図23】HYPEによる平滑筋細胞増殖の阻害
【図24】HYPEによる、刺激された平滑筋細胞増殖の阻害
【図25】HEPPEによる平滑筋細胞増殖の阻害
【図26】HYPEによるin vivo酸化LDL取り込みの阻害
【図27】CMPE、HEPPE、およびHYPEによるLDL関連ホスホリパーゼの阻害
【図28】赤血球接着によって判断されるような、CMPEおよびDEXPEによる内皮の保護
【図29】HEPPEおよびHYPEによる腫瘍細胞浸潤の阻害
【図30】HYPEによるヒアルロニダーゼの阻害
【図31】HYPEによるコラゲナーゼの阻害
【図32】CMPEおよびHYPEによるヘパリナーゼの阻害
【図33】HEPPEおよびCMPEによる内皮細胞増殖の阻害
【図34】アラキドン酸放出によって判断されるような、CMPEによる酸化傷害からの細胞の保護
【図35】硫酸放出によって判断されるような、CMPEによる酸化傷害からの細胞の保護
【図36】HYPEによるLDLの銅誘導酸化の阻害
【図37】HEPPEおよびHYPEによる、照射および保存条件に対する赤血球の保護
【図38】HYPEによる全血中のTNF−α産生の減少
【図38A】TNFの発現に対するPL−コンジュゲートの影響
【図39】HYPEによる、マクロファージ中のTNF−α産生の減少
【図40A】HYPEによる、肺内皮中のケモカイン産生の抑制
【図40B】HYPEによる、肺内皮中のケモカイン産生の抑制
【図40C】HYPEによる、肺内皮中のケモカイン産生の抑制
【図41】図41a−c:HYPEによるケモカイン遺伝子発現の抑制、図41d−e:IL−8発現に対するPL−コンジュゲートの影響、図41f:NF−κBの発現に対するPL−コンジュゲートの影響
【図42】近位尿細管内皮細胞における、HYPEによる主要組織適合性抗原およびインターフェロン刺激の抑制
【図43】近位尿細管内皮細胞における、HYPEによる主要組織適合性抗原およびインターフェロン刺激の抑制−濃度依存性
【図44】臍静脈内皮細胞における、HYPEによる主要組織適合性抗原およびインターフェロン刺激の抑制
【図45】自己免疫疾患における、CMPEによるリンパ球増殖の阻害
【図46】虚血/再灌流における白血球接着の抑制−HYPEおよびHEPEによって誘導される血管傷害
【図47】虚血/再灌流における白血球血管外遊走の抑制−HYPEおよびHEPEによって誘導される血管傷害
【図48】HYPEおよびHEPEによるレトロウイルス(HIV)力価の減少
【図49】CMPEによる、過敏性結膜炎における吸入誘発直後の角膜乳白度の減少
【図50】CMPEによる、過敏性結膜炎における吸入誘発後後期の角膜乳白度の減少
【図51】過敏性結膜炎における角膜プロスタグランジンおよびロイコトリエンB4レベル
【図52】クラミジアによるHeLa細胞の注入に対するPL−コンジュゲートの影響
【図53】HeLa細胞のクラミジア誘導アポトーシスに対するPL−コンジュゲートの影響
【発明を実施するための形態】
【0027】
本発明は、広範囲でそして特異な組み合わせの細胞保護薬理学的活性を示す、PL−コンジュゲートを提供する。これらの化合物は、喘息において気道閉塞を軽減し、胃腸疾患において粘膜組織を保護し、免疫反応を抑制し、皮膚過敏反応を軽減し、血管傷害および免疫学的反応に関連する細胞増殖を阻害し、血管および中枢神経系疾患に関連する細胞遊走を阻害し、組織タンパク質および細胞膜に対する酸化損傷を減弱し、ウイルス伝播に干渉し、組織破壊酵素活性を減少させ、そしてケモカインおよびサイトカインの細胞内レベルを減少させることが可能である。したがって、これらの化合物は、閉塞性呼吸疾患、大腸炎、クローン病、中枢神経系発作、多発性硬化症、接触皮膚炎、乾癬、心臓血管疾患、侵襲性医学処置、浸潤性細胞増殖障害、抗酸化剤療法、溶血症候群、敗血症、急性呼吸困難症候群、組織移植拒絶症候群、自己免疫疾患、ウイルス感染、および過敏性結膜炎を含む、多様な疾患状態の治療に有用である。
【0028】
閉塞性呼吸疾患は、呼吸困難、頻呼吸症、あるいは気道閉塞の聴診又は放射線学的徴候によって特徴付けられる、肺中の管腔通過の疾患である。喘息は、閉塞性呼吸疾患の原型疾患であるが、この異常は、臨床的にまた、急性肺感染、急性呼吸困難症候群においても、そして慢性閉塞性肺疾患としても直面される。病態生理は、気道管腔平滑筋の収縮および気道管腔内および管腔周囲の浸潤物の集積による、気流の閉塞に起因する。
【0029】
大腸炎は、腹部不快感、下痢、および放射線学的又は組織学的診断に際しての上皮裸出を含む粘膜損傷の特徴的な徴候によって特徴付けられる、胃腸管腔の慢性疾患である。クローン病は、典型的には小腸に影響を及ぼす関連障害であるが、胃腸管のいかなる領域を巻き込む可能性もある。
【0030】
多発性硬化症は、通常、脊椎液解析又は磁気共鳴画像によって診断される、運動の弱さ又は感覚障害、あるいは両方によって特徴付けられる、白質の疾患である。盲目を含む視覚的障害もまた、一般的である。疾患活性領域において、脳血管関門が損なわれる。
【0031】
皮膚過敏反応は、そうでなければ接触皮膚炎としても知られ、局所の赤み、腫脹、およびかゆみなどの組織過敏の外的徴候によって特徴付けられる。実質的にいかなる物質も該異常を生じる可能性があり、そしてこれは皮膚科医によって診断される、最も一般的な病訴の1つである。
【0032】
乾癬もまた、最も一般的な皮膚科疾患の1つであり、1から2パーセントの人々が冒される。関与の最も一般的な領域は、肘、膝、殿裂、および頭皮である。乾癬の活性病変では、上皮細胞複製速度が加速される。局所グルココルチコイドの長期使用は、しばしば、有効性の損失を伴う。
【0033】
心臓血管疾患は、血管管腔狭窄障害と共に、それから生じる、心臓、腎臓、および脳などの、これらの血管が供給する標的臓器の虚血症候群を指す。虚血、又は減少した血液供給は、血管狭窄から生じる。心臓血管疾患の徴候および症状には、とりわけ、狭心症、虚弱、呼吸困難、一過性虚血発作、脳卒中、および腎不全が含まれる。診断は、血液試験、心電図、超音波検査、および血管造影などの、付属の診断試験と組み合わせた、臨床的立場に基づく。アテローム性動脈硬化症は、血管管腔の狭窄が、反応性、遊走性、および増殖性細胞から、そして血液脂肪、コレステロール、およびリポタンパク質の局所取り込みから形成される、瘢痕様斑のためである、心臓血管疾患の一般的な要素である。この観点で特に重要なのは、酸化による損傷を受けた際、加速する可能性がある、低密度リポタンパク質(LDL)の集積である。斑は、急性および慢性狭窄病変両方の部位であるとみなされ、ここでは組織虚血のリスクが上昇する。
【0034】
血管の狭窄病変は、アテローム性動脈硬化症のみでなく、他の全身性心臓血管障害でもまた、生じる。これらの中には、動脈高血圧、移植臓器に関連する脈管炎を含む脈管炎、および凝固障害がある。これらの障害の多く、特に高血圧、アテローム性動脈硬化症、および脈管炎は、同一の患者で同時に発生する。
【0035】
再灌流傷害は、以前虚血であった組織への血流の回復後の組織傷害および壊死の開始を指す。この現象は、特に脳および心臓組織への、虚血および虚血後型傷害の重要な構成要素と認識される。再灌流において優勢である病態生理学的機構の1つは、そうでなければ酸化損傷又はフリーラジカル傷害として知られる、活性酸素種の損傷効果である。一酸化窒素およびそのラジカルもまた、病態生理に関連する。これらの有害な化学種の産生は、病変部位での白血球の局所集積、接着、および遊出に起因する。
【0036】
動脈又は静脈のカテーテル処置、あるいは開胸手術などの侵襲性医学処置は、しばしば、血管傷害と共に再灌流傷害のための組織虚血に関連し、これらはどちらも、侵襲処置の過程で生じる可能性がある。したがって、血管開存性(patency)の保持および再灌流傷害の予防は、医学において、集中的な研究の対象である。こうした方法は、診断および療法目的両方のために行われ、そして血管傷害又は狭窄の合併症を防ぐため、一般的に、佐剤が処方される。これらの病変の形成は、血液の凝固要素、血液細胞、並びに血管管腔壁の構造要素および細胞を含む、多数の関与物質を伴う。例えば、バルーン血管形成術成功後に現れる動脈再狭窄は、しばしば、バルーン血管形成によって引き起こされる過敏領域における平滑筋細胞の増殖によって、動脈の内径が狭窄するためである。この新規狭窄病変はまた、遊走および局所増殖の過程を通じて、病変部位に集積する、白血球を含む他の細胞種でも構成される可能性がある。2つの事象(細胞遊走および増殖)は、ほぼ間違いなく、おそらく、元来の組織傷害部位にマクロファージが初期に集積することによって放出される、いくつかの異なるサイトカインの協調した相互作用のためである。したがって、白血球は、遊走、局所増殖、内皮関門通過、コレステロール豊富なリポタンパク質の集積、泡沫細胞への変換、およびサイトカインの分泌を通じて、狭窄病変の形成に貢献する。この細胞増殖および血管管腔狭窄はしかし、冠状動脈又は脳循環に制限されも限定されもしない。これはまた、例えば末梢血管系において、手術後に発生し、再狭窄を引き起こす可能性もある。
【0037】
本発明の文脈において、用語、心臓血管疾患は、アテローム性動脈硬化症、脈管炎、侵襲処置、特に動脈又は静脈のカテーテル処置、およびそれらに関連する虚血症候群を生じる、血管管腔狭窄を指す。
【0038】
組織、移植片、および臓器の移植は、しばしば、宿主対移植片および移植片対宿主疾患の出現によって複雑になり、これらはどちらも移植片のレシピエントにおいて、急性又は慢性に発生する可能性がある。移植片の供給源は、同種間(同一種由来)であってもよいし、又は異種間(別の種由来)であってもよい。誘導された機能亢進免疫反応のための合併症としてであっても、又は別の機構を通じた合併症としてであっても、脈管炎は、いまだに組織移植処置でしばしば直面される合併症である。さらに、再灌流傷害のための血管損傷は、組織および臓器移植片の手術後機能不全の主要な要因であるとみなされる。
【0039】
自己免疫疾患は、被験者の臨床状態の変化が、異常な細胞性および/又は体液性免疫反応に起因する異常である。米国において最も一般的な自己免疫疾患は、若年性糖尿病、橋本およびグレーブ甲状腺炎、慢性関節リウマチ、クローン病および潰瘍性大腸炎、慢性活動性肝炎、白斑(vitaligo)、糸球体腎炎、ブドウ膜炎、多発性硬化症、強皮症、溶血性貧血、特発性血小板減少性紫斑病、重症筋無力症、全身性エリテマトーデス、および天疱瘡である。
【0040】
原発臓器部位又は伝播した他の部位(転移)で生じる癌細胞などの、過剰増殖細胞障害は、米国における死の主な原因の1つである。癌はしばしば、強力な抗増殖薬剤および放射線での療法を含む、すべての型の治療に、非常に抵抗性である。医学コミュニティーはますます、疾患の原発および転移型両方に関連する脈管構造が果たす、必須の役割に気づいてきている。いかなる細胞クラスターとも同様に、癌細胞は、信頼できる血液供給に依存し、そして実際、癌細胞は、内皮細胞および平滑筋細胞に作用して、新規血管を形成し、こうして癌性増殖に供給する、増殖因子の生成を通じて、新規の血管新生過程を促進することが知られている。
【0041】
異所部位への癌細胞の伝播である転移もやはり、しばしば、脈管構造依存過程であり、しばしば血行性伝播と称される。内皮細胞および基底膜物質などの要素で構成される、血管壁に課せられる生理学的障壁は、通常、細胞の通過に対して非常に選択的である。しかし、転移細胞は、いくつかが科学文献に確立されている、多様な機構を使用してこの障壁を抑止する。例えば、こうした異常な細胞は、コラゲナーゼ、ヘパリナーゼ、およびヒアルロニダーゼなどの、細胞外マトリックスおよび血管障壁に関連する構成要素を分解する、加水分解酵素を産生する。したがって、転移過程における重要な要因は、癌細胞が、血管管腔壁を通じて侵入するか、又は該壁に浸透し、こうして、循環を通じた移動後に、新規組織部位に到着して侵入する能力である。癌細胞はまた、血管形成を含む多くの側面から、転移過程を可能にする、サイトカインおよびケモカインとして知られるメッセンジャー化学物質も産生する。
【0042】
サイトカインおよびケモカインの細胞性生成は、健康において、重要な制御機能を果たす;しかし、ストレス又は疾患に対する機能亢進性反応が誘発された際、これらのタンパク質は、過剰に存在し、そして組織を損傷し、それによって、疾患状態をさらに悪化に追いやる可能性がある。これが起こる2つの例は、全身性感染であり、特に、血液運搬細菌(敗血症)のためのもの、および急性(又は成人)呼吸困難症候群(ARDS)として知られる肺異常におけるものである。ARDSでは、肺空間が液体で満たされ、ガス交換を妨げ、そして呼吸不全を生じる。血小板凝集が起こるが、主な犯罪者は、内皮表面に接着し、そして呼吸器破裂を経て、酸化傷害を負わせ、そしてロイコトリエン、トロンボキサン、およびプロスタグランジンに加え、Groα、ENA−78、CX3XおよびMCP−1などのケモカインを放出する、単球貪食細胞および白血球であるようである。単球貪食細胞は、肺胞では主にマクロファージで、そして脈管構造を裏打ちするものであり、該細胞はまた、内皮細胞を直接損傷し、そして白血球にリソソーム酵素を放出させる、オキシダント、仲介因子、および一連の分解酵素も放出する。死亡率は50%を越える。ARDSの最も一般的な原因は、感染、吸引、喫煙および毒素吸入と共に、細菌性敗血症を含む、肺外部で始まる全身性過程である。敗血症症候群およびショックは、血液中の多様な微生物産物、特にグラム陰性内毒素と、宿主仲介因子系の相互作用によって誘発される。その発生は、米国のみで、年間500,000例に達すると概算され、この数字は、抗生物質耐性生物の蔓延増加のため、上昇しているとみなされる。多様な宿主仲介因子が、敗血症および敗血症ショック(本明細書において、集合的に敗血症と称される)の病因に関連付けられてきており、これらには、刺激された細胞から放出される因子、特に、とりわけ、サイトカイン、腫瘍壊死因子−α(TNF)、Groα、ENA−78、CX3XおよびMCP−1、NFκB転写因子、リソソーム酵素および白血球由来のオキシダント、並びにアラキドン酸代謝産物が含まれる。
【0043】
赤血球溶解、又は溶血は、遺伝又は後天性障害である可能性があり、貧血、鉄欠乏、又は黄疸を生じさせる。後天性症候群の中に、ヘビのかみ傷、又はウイルス、細菌および寄生虫病因、特にマラリアを含む、感染性病原体の直接の毒性効果のため;食物摂取又は疾患を通じた酸化物質への曝露のため;あるいは異常な血管内の機械的外傷の結果としての膜異常がある。後者の異常は、微小血管障害溶血として知られ、機構において、心臓弁などの補綴移植物を通じた血液通過から生じる溶血に関連しているとみなされている。遺伝赤血球膜脆弱性は、しばしば、グルコース6−ホスファターゼ欠損、鎌形赤血球貧血、および地中海貧血症などの、血球内酵素および構造的欠損のため、発生する。赤血球溶解は、特に、γ−照射などの、フリーラジカル形成光力学性ウイルス破壊処理に供した際、血液産物の貯蔵寿命を限定する要因の1つである。
【0044】
後天性免疫不全症候群は、迅速に増加する地球規模の流行病であるとみなされ、そして伝播の1つの経路は、汚染された血液産物を通じるものである。この疾患の伝染および進行は、ヒト免疫不全ウイルスの感染活性に応じる。現在の療法は、主に、非常に高価で、そして患者許容度が低い薬剤である、逆転写酵素阻害剤の投与に限定されている。
【0045】
酸化傷害は、体組織に対する過酸化およびフリーラジカル産生の影響を指す。ある程度まで、過酸化物の産生は正常であり、例えば免疫防御の役割に起因される、生理学的過程である。しかし、ストレスおよび疾患状態において、又は時間の天然経過に渡り、生理学的老化におけるように、これらの不安定な化学部分の、膜構成要素および血液タンパク質を含む組織構造への集積的付加は、傷害の不可逆的パターンにつながる。抗酸化剤として作用する剤は、酸化損傷に対して保護することが可能である。こうした保護は、多くの科学的刊行物の主題になってきている。
【0046】
本発明は、極性頭基を通じて、生理学的に許容しうる化学部分に共有的にコンジュゲート化したリン脂質であって、高分子量でも低分子量でもよい前記リン脂質の投与に基づく、疾患治療法を提供する。
【0047】
本発明のリン脂質化合物(PL−コンジュゲート)は、一般的な式:
[ホスファチジルエタノールアミン−Y−]n−X
[ホスファチジルセリン−Y−]n−X
[ホスファチジルコリン−Y−]n−X
[ホスファチジルイノシトール−Y−]n−X
[ホスファチジルグリセロール−Y−]n−X
<式中
Yは存在しないか又は長さ2から30原子の範囲のスペーサー基であり;そしてXは生理学的に許容しうるモノマー、ダイマー、又はオリゴマーいずれかであって
nは単一体(unity)、又は生理学的に許容しうるポリマーであり、nは1から1,000の数である>によって記載される。
【0048】
本明細書において、リン脂質コンジュゲート(PL−コンジュゲート)として知られるこれらのリン脂質化合物は、ここで、酵素、ホスホリパーゼA2の細胞外型を阻害する能力に加え、多数のそして強力な薬理学的効果の特異な組み合わせを持つことが開示されている。生理学的に許容しうるモノマー又はポリマーに共有結合したホスファチジルエタノールアミンを含む化合物組は、本明細書において、PE−コンジュゲートと称される。ホスファチジルセリン、ホスファチジルコリン、ホスファチジルイノシトール、又はホスファチジルグリセロールいずれかが、リン脂質部分として、ホスファチジルエタノールアミンの代わりに使用されている、関連する誘導体は、PL−コンジュゲートに関して以下に記載されている生物学的実験およびこれらの化合物に共有される構造的類似性に基づいて、同等な療法的結果を提供する。本発明に適した他のリン脂質−コンジュゲート誘導体は、グリセロール主鎖の位C1又はC2のリン脂質部分の脂肪酸基の少なくとも1つが、エステル連結よりもエーテル又はアルキル結合いずれかで付着している長鎖アルキル基に置換されている、PL−コンジュゲートである。
【0049】
PL−コンジュゲートに関して本明細書に提供される構造式に定義されるように、これらの化合物は、単一の生理学的に許容しうるポリマー分子に結合した、1から1000の間のリン脂質部分を含む可能性がある。
【0050】
疾患の多様な動物および細胞モデルにおけるPL−コンジュゲートの投与は、顕著で、そして予期されない、疾患治療に有用な細胞保護効果を発動する。これらはまた、生物学的膜を安定化し;細胞増殖を阻害し;フリーラジカル産生を抑制し;一酸化窒素産生を抑制し;生物学的障壁を渡る細胞遊走を減少させ;MCP−1、ENA−78、Groα、およびCX3Cを含むケモカインレベルに影響を及ぼし;遺伝子転写に影響を及ぼし、そしてMHC抗原の発現を修飾し;細胞膜に直接結合し、そして細胞表面での水構造を変化させ;酸化リポタンパク質の取り込みを阻害し;気道平滑筋収縮を妨げ;神経伝達物質放出を抑制し;腫瘍壊死因子−α(TNF−α)の発現を減少させ;NFκBなどの転写因子の発現を修飾し;PLA2に加え、コラゲナーゼ、ヘパリナーゼ、ヒアルロニダーゼを含む、細胞外分解酵素を阻害し;そして白血球のウイルス感染を阻害することが可能である。したがって、PL−コンジュゲートは、組織損傷を統括する1以上の病態生理機構が、膜脆弱性を生じさせる、酸化発作;血管組織における狭窄斑形成、血管形成および良性又は悪性癌疾患、あるいは乾癬を生じさせる、細胞の過剰増殖作用;脳傷害又は腫瘍細胞転移を生じさせる、異常な細胞遊走;中枢神経系(CNS)発作、敗血症、ARDS、又は免疫学的疾患に関連するケモカインおよびサイトカインの過剰発現;CNS発作、CVS疾患、又は溶血を生じさせる、細胞膜損傷;アテローム性動脈硬化症又は再灌流傷害を生じさせる、血液タンパク質および細胞膜の過酸化;CNS発作、再灌流傷害、および敗血症ショックを生じさせる、過剰な一酸化窒素産生;移植拒絶などの、自己免疫疾患および同種免疫症候群に関連する主要組織適合性抗原(MHC)との相互作用いずれかを含む疾患を患う生物に対し、遠大な細胞保護効果を提供する。
【0051】
本発明において、PL−コンジュゲートの有用な薬理学的特性は、臨床使用に限定され、そして疾患治療法として本明細書に開示される。これらの方法の生物学的基礎は、以下に記載されるように疾患の標準的細胞および動物モデルによって、容易に立証することが可能である。
【0052】
本明細書に記載されるPL−コンジュゲートの薬理学的活性は、部分的にリン脂質部分の性質のためである可能性があるが、PL−コンジュゲートに関して観察される、多数のそして多様な組み合わせの薬理学的特性は、1つの化学実体において、本質的にいくつかの異なる薬剤として作用する化合物構造の能力を明らかにする。したがって、例えば、大腸炎又はクローン病において発生する可能性があるような、内部粘膜傷害は、免疫抑制、抗炎症、抗酸化、一酸化窒素産生、又は膜安定化の薬剤活性のいかなる1つ又はすべてによっても、減弱されることが可能である。アテローム性動脈硬化症において発生する可能性があるような管腔周囲の損傷からの血管の保護は、抗増殖、抗ケモカイン、抗酸化、又は抗遊走効果からの活性を含む可能性がある。閉塞性呼吸疾患の治療は、一酸化窒素の抑制、抗ケモカイン、抗増殖、又は膜安定化効果の範囲の、PL−コンジュゲートの多くの活性のいかなる1つを伴う可能性もある。
【0053】
血管組織の増殖は、硬化性斑のアテローム発生と共に、原発および転移性癌病変増殖の特徴の両方の要素である。生物学的膜の安定化は、溶血と共に粘膜腸傷害を妨げる可能性がある。ケモカインレベルの減弱は、ARDSを改善すると共に、アテローム発生を妨げる可能性がある。抗酸化活性は、再灌流傷害と共にCNS発作、アテローム性動脈硬化症、および溶血に対して保護する可能性がある。本発明のこれらおよび他の利点は、以下の説明に基づき、当業者に明らかになるであろう。
【0054】
別の態様において、本発明は、クラミジア感染に罹患した被験者を治療する方法であって、被験者に、生理学的に許容しうるモノマー、ダイマー、オリゴマー、又はポリマーに結合した脂質又はリン脂質部分の有効量を投与し、それにより、クラミジア感染に罹患した被験者を治療する工程を含む、前記方法を提供する。
【0055】
別の態様において、本発明は、クラミジア感染に罹患した被験者を治療する方法であって、被験者に、生理学的に許容しうるモノマー、ダイマー、オリゴマー、又はポリマーに結合した脂質又はリン脂質部分の有効量を投与する工程を含み、生理学的に許容しうるモノマーが、サリチレート、サリチル酸、アスピリン、単糖、ラクトビオン酸、マルトース、アミノ酸、グリシン、カルボン酸、酢酸、酪酸、ジカルボン酸、グルタル酸、コハク酸、脂肪酸、ドデカン酸、ジドデカン酸、胆汁酸、コール酸、コレステリルヘミスクシネートであるか;又は生理学的に許容しうるダイマー又はオリゴマーが、ジペプチド、二糖、三糖、オリゴペプチド、あるいはヘパリンの、ヘパラン硫酸、ケラチン、ケラタン硫酸、コンドロイチン、コンドロイチン−6−硫酸、コンドロイチン−4−硫酸、ダーマチン、ダーマタン硫酸、デキストラン、又はヒアルロン酸二糖又は三糖モノマー単位であるか;又は生理学的に許容しうるポリマーが、グリコサミノグリカン、ポリジェリン(polygelin)(「ヘマセル」)、アルギネート、ヒドロキシエチルデンプン(ヘタスターチ(hetastarch))、ポリエチレングリコール、ポリカルボキシル化ポリエチレングリコール、コンドロイチン−6−硫酸、コンドロイチン−4−硫酸、ケラチン、ケラチン硫酸、ヘパラン硫酸、ダーマチン、ダーマタン硫酸、カルボキシメチルセルロース、ヘパリン、デキストラン、又はヒアルロン酸である、前記方法を提供する。
【0056】
別の態様において、本発明は、クラミジア感染に罹患した被験者を治療する方法であって、被験者に、生理学的に許容しうるモノマー、ダイマー、オリゴマー、又はポリマーに結合した脂質又はリン脂質部分の有効量を投与する工程を含み、脂質又はリン脂質部分が、ホスファチジル酸、アシルグリセロール、モノアシルグリセロール、ジアシルグリセロール、トリアシルグリセロール、スフィンゴシン、スフィンゴミエリン、コンドロイチン−4−硫酸、コンドロイチン−6−硫酸、セラミド、ホスファチジルエタノールアミン、ホスファチジルセリン、ホスファチジルコリン、ホスファチジルイノシトール、又はホスファチジルグリセロール、あるいはそれらのエーテル又はアルキルリン脂質誘導体いずれかであり、そして生理学的に許容しうるモノマー又はポリマー部分が、アスピリン、ラクトビオン酸、マルトース、グルタル酸、ポリエチレングリコール、カルボキシメチルセルロース、ヘパリン、デキストラン、ヘマセル、ヘタスターチ、又はヒアルロン酸である、前記方法を提供する。
【0057】
強力な抗酸化、膜安定化、抗増殖、抗ケモカイン、抗遊走、および抗炎症活性を持つ単一の化学実体を使用すると、各々、単一の活性を持つ、いくつかの異なる剤の使用に比較して、増加した細胞保護が提供される。複数の異なる剤の組み合わせよりも、多数の活性を有する単一の剤の使用は、活性分子の均質な搬送を提供し、それにより、薬剤代謝、毒性および搬送の問題を単純化する。本発明の化合物はまた、組み合わせた分子にのみ存在し、個々の構成要素には存在しない特性も示す。
【0058】
化合物は、一時的な異常の急性治療のために用いてもよいし、又は、特に進行性、再発性、又は変性疾患の場合、慢性に投与してもよい。化合物の濃度は、治療しようとする異常の性質、患者の状態、投与経路、および組成物の個々の許容度を含む多様な要因に応じるであろう。
【0059】
本発明はまた、先に開示されておらず、そして薬理学的活性を持つことが知られていなかった、一般式
ホスファチジルエタノールアミン−Y−X
ホスファチジルセリン−Y−X
ホスファチジルコリン−Y−X
ホスファチジルイノシトール−Y−X
ホスファチジルグリセロール−Y−X
式中
Yは存在していないか、又は長さ2から30原子の範囲のスペーサー基であり;そして
Xは単糖又は二糖、カルボキシル化単糖又は二糖、モノ又はジカルボン酸、サリチレート、サリチル酸、アスピリン、アミノ酸、ジペプチド、又はオリゴペプチド、胆汁酸、脂肪酸、あるいはヘパリン、ヘパラン硫酸、ヒアルロン酸、コンドロイチン、コンドロイチン−6−硫酸、コンドロイチン−4−硫酸、ダーマチン、ダーマタン硫酸、ケラチン、又はケラタン硫酸の二糖又は三糖モノマー単位いずれかである
の低分子量リン脂質−コンジュゲートも提供する。
【0060】
これらの低分子量PL−コンジュゲート誘導体もまた、広範囲の薬理学的活性を持ち、そして疾患を治療するために投与される薬学的剤として、高分子量ポリマーで構成されるPL−コンジュゲートに類似であるとみなされる。本発明に適した他のリン脂質−コンジュゲート誘導体は、グリセロール主鎖の位C1又はC2の2つの長鎖アルキル基の少なくとも1つが、エステル連結よりもエーテル又はアルキル結合いずれかで付着している、リン脂質部分である。
【0061】
本発明は、療法PL−コンジュゲート化合物、その化学的調製、その抗疾患活性、および疾患の治療における薬剤組成物としての使用法の以下の例にさらに例示される。
【0062】
好ましい化合物
本発明の方法において、患者に投与するPL−コンジュゲートは、極性頭部基の原子を介して低分子量又は高分子量のモノマー又はポリマー部分(本明細書においてコンジュゲートした部分と呼ぶ)と共有結合した少なくとも1つのリン脂質部分から構成される。希望する場合、所望により架橋部分を使用して、PL部分をモノマー又はポリマー部分と結合させることができる。コンジュゲートした部分は、低分子量カルボン酸、ジカルボン酸、脂肪酸、ジカルボキシル化脂肪酸(dicarboxylic fatty acid)、アセチルサリチル酸、コール酸、コレステリルヘミスクシネート、又は単糖若しくは二糖、アミノ酸若しくはジペプチド、オリゴペプチド、糖タンパク質混合物、グリコサミノグリカンの二糖若しくは三糖モノマー単位の例えばヘパリン、ヘパラン硫酸、ヒアルロン酸、コンドロチン硫酸、デルマタン、ケラタン硫酸の反復単位、或いはより高分子量のペプチド若しくはオリゴペプチド、多糖、ポリグリカン、タンパク質、グリコサミノグリカン、又は糖タンパク質混合物としてよい。組成物という態様からは、高分子量のリン脂質−コンジュゲート及び関連類似体は、米国特許第5,064,817号(特許文献1)、並びに本明細書中に引用される刊行物の主題である。
【0063】
コンジュゲートしたキャリア部分がポリマーである場合、共有結合したPL部分の比は、ポリマーの性質及び用いる反応条件に依存して、1〜1000個までのPL残基/ポリマー分子の範囲にわたってよい。例えば、各出発物質の相対的な量又は反応時間の範囲を修正して、希望通りに高い又は低い比のPL残基/ポリマーを有するPL−コンジュゲート生成物を得てよい。
【0064】
“部分”という用語は、共有結合によって満たされた原子価を有する化合物に他の場合なら相当する化学物質を意味する。
本発明の方法において使用するためのPL−コンジュゲートの製造のためにコンジュゲートした部分として用いることができるポリマーの例は生理学的に許容可能なポリマーであり、これには様々な分子量及び様々な化学的タイプの水分散可能な又は水溶性のポリマーが含まれ、主に、血漿増量剤、食品及び薬物添加剤、天然及び合成ポリグリコサミノグリカンであり、こうしたものとしては、“ヘマクセル(Hemaccell)”(“ベーリング”によって製造されている、尿素架橋を経て架橋した分解済みゼラチンポリペプチド)、“ヒドロキシエチルデンプン”(HES)、ポリアミノ酸、炭化水素ポリマー(例えばポリエチレン)、ポリスチレン、ポリエステル、ポリアミド、ポリエチレンオキシド(例えばポリエチレングリコール、ポリカルボキシエチレングリコール)、ポリビニルピロリドン、多糖類、可溶性セルロース誘導体(例えばメチルセルロース、カルボキシメチルセルロース)、アルジネート、同化性ガム(例えばキサンタンガム)、ペプチド、注射可能な血液タンパク質(例えば血清アルブミン)、デキストラン、シクロデキストリン、ヒアルロン酸、ヘパリン、ヘパリン硫酸、コンドロチン硫酸、コンドロイチン−6−硫酸、コンドロイチン−4−硫酸、ケラチン硫酸、デルマチン硫酸及びこれらの誘導体を含む。
【0065】
本発明の方法において使用するためのPL−コンジュゲートの製造のためにコンジュゲートした部分として用いることができるモノマー、ダイマー、及びオリゴマーの例は、単糖又は二糖、カルボン酸、ジカルボン酸、脂肪酸、ジカルボキシル化脂肪酸、アセチルサリチル酸、コール酸、コレステリルヘミスクシネート、並びにヘパリン、ヘパラン硫酸、ヒアルロン酸、コンドロチン、コンドロイチン−6−硫酸、コンドロイチン−4−硫酸、デルマチン、デルマタン硫酸、ケラチン、ケラタン硫酸を含むグリコサミノグリカン、又はデキストランの二糖及び三糖単位モノマーである。
【0066】
場合によっては、PL−コンジュゲートの製造のために選択されるモノマー又はポリマーは、それ自体が選択された生物学的特性を有してよい。例えば、ヘパリン及びヒアルロン酸は両方とも、周知の生理学的機能を有する材料である。しかしながら本発明においては、出発物質としてのこうした物質から形成されたPL−コンジュゲートは、共有結合によってリン脂質と結合していないヘパリン又はヒアルロン酸の投与から予測されると思われるよりも新規でより幅広い組の薬学的活性を示す。PE−カルボキシメチルセルロース(CMPEと呼ぶ)、PE−ヒアルロン酸(HYPEと呼ぶ)及びPE−ヘパリン(HEPPEと呼ぶ)は、効力及び有用な薬学的活性の範囲という点で、それぞれカルボキシメチルセルロース(CMC)、ヘパリン、又はヒアルロン酸よりもはるかに優れているということを、下記に説明するように標準的な比較実験によって示すことができる。実際に、こうした最後の2つの物質は一般に、本明細書において説明する疾患の大部分の治療のための方法において有用とはみなされておらず、また、虚血性血管障害等のその使用が医学的に処方される特定の場合には、薬物として使用するための濃度は数桁高い。従って、リン脂質の例えばホスファチジルエタノールアミン又は極性頭部基が異なる関連リン脂質の例えばホスファチジルセリン(PS)、ホスファチジルコリン(PC)、ホスファチジルイノシトール(PI)、及びホスファチジルグリセロール(PG)の組合せは、出発物質単独と比較した場合に新規な薬理学的特性を有する化合物の形成をもたらす。
【0067】
本明細書において説明する生理学的に活性なリン脂質−コンジュゲートは、広範囲の分子量を有することができ、例えば、PL−コンジュゲートを脈管系内に保持することが望ましい場合、50,000を超え(数十万まで)、脈管外系を目標とすることが望ましい場合、50,000未満である。コンジュゲート部分の分子量及び化学構造に対する唯一の制限は、所望の生理活性を欠いたPL−コンジュゲートを生じず、本明細書において説明する使用方法においてPL−コンジュゲートを薬物として無効にする程度まで化学的、生理学的不安定性を生じないという点である。
【0068】
本明細書において、PE−コンジュゲートを、構造:
【0069】
【化1】

[式中、R1は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
R2は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
Yは、存在しないか、又は、長さが2〜30個の原子の範囲にわたるスペーサー基であり;
Xは、生理学的に許容可能なモノマー、ダイマー、オリゴマー(ここでnは1である)か、又は、生理学的に許容可能なポリマー(ここでnは1〜1,000の数である)である。]
を有する化合物と定義する。
【0070】
本発明の方法において使用するための好ましい化合物は、コンジュゲート部分Xとして以下のもののうちの1つを含む:アセテート、ブチレート、グルタレート、スクシネート、ドデカノエート、ジドデカノエート、マルトース、ラクトビオン酸、デキストラン、アルジネート、アスピリン、コーレート、コレステリルヘミスクシネート、カルボキシメチルセルロース、ヘパリン、ヒアルロン酸、ヘマクセル、ポリエチレングリコール、及びポリカルボキシル化ポリエチレングリコール。PE−コンジュゲートを製造するための出発物質として使用されるポリマーは、分子量が1〜2,000kDaで変化してよい。
【0071】
ホスファチジルエタノールアミン(PE)部分の例は、リン脂質の類似体であって、この類似体において、リン脂質のグリセロール主鎖と結合した2つの脂肪酸基の鎖長は2〜30個の炭素原子の長さで変化し、こうした脂肪酸鎖は飽和及び/又は不飽和炭素原子を含む。脂肪酸鎖の代わりに、リン脂質のグリセロール主鎖と直接に又はエーテル結合を経て結合したアルキル鎖は、PEの類似体として含まれる。
【0072】
ホスファチジルエタノールアミン及びこの類似体を様々な源から得てよく、これには、天然、合成、及び半合成誘導体並びにこれらの異性体が含まれる。
PE部分の代わりに用いることができるリン脂質は、共有結合によってN−メチル−PEのアミノ基を介して結合するN−メチル−PE誘導体及びこの類似体;共有結合によってN,N−ジメチル−PEのアミノ基を介して結合するN,N−ジメチル−PE誘導体及びこの類似体、ホスファチジルセリン(PS)及びこの類似体の例えばパルミトイル−ステアロイル−PS、様々な源から得られる天然PS、半合成PS、合成、天然及び人工PS並びにこれらの異性体である。本発明においてコンジュゲート部分として有用な他のリン脂質は、ホスファチジルコリン(PC)、ホスファチジルイノシトール(PI)、及びホスファチジルグリセロール(PG)、並びに、これらの誘導体の例としてリン脂質、リゾリン脂質、ホスファチジル酸、スフィンゴミエリン、リゾスフィンゴミエリン、セラミド、及びスフィンゴシンである。
【0073】
PE及びPS−コンジュゲートの場合、リン脂質は、リン脂質の極性頭部基の窒素原子を介してコンジュゲートしたモノマー又はポリマー部分と直接に又はスペーサー基を経て結合する。PC、PI、及びPG−コンジュゲートの場合、リン脂質は、極性頭部基の窒素又は酸素原子のうちの1つを介してコンジュゲートしたモノマー又はポリマー部分と直接に又はスペーサー基を経て結合する。
【0074】
本明細書において、PS−コンジュゲートを、構造:
【0075】
【化2】

[式中、R1は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
R2は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
Yは、存在しないか、又は、長さが2〜30個の原子の範囲にわたるスペーサー基であり;
Xは、生理学的に許容可能なモノマー、ダイマー、オリゴマーか、又は、生理学的に許容可能なポリマー(ここでnは1〜1,000の数である)である。]
を有する化合物と定義する。
【0076】
本明細書において、PC、PI、及びPG−コンジュゲートを、一般構造:
【0077】
【化3】

[式中、R1は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
R2は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
Zは、イノシトール、コリン、又はグリセロールであり;
Yは、存在しないか、又は、長さが2〜30個の原子の範囲にわたるスペーサー基であり;
Xは、生理学的に許容可能なモノマー、ダイマー、オリゴマー(ここでnは1である)か、又は、生理学的に許容可能なポリマー(ここでnは1〜1,000の数である)である。]
を有する化合物と定義する。
【0078】
所望により架橋基Yを形成する適切な二価の基の例は、例えば、2個以上、好ましくは4〜30個の炭素原子を有する直鎖又は枝分れ鎖アルキレン、−CO−アルキレン−CO、−NH−アルキレン−NH−、−CO−アルキレン−NH−、シクロアルキレン(ここで各場合に、アルキレンは直鎖又は枝分れ鎖であり、鎖中に2個以上、好ましくは2〜30個の原子を含む)、−(−O−CH(CH3)CH2−)X−(ここでxは1以上の整数である)である。
【0079】
従来のリン脂質構造に加えて、本発明において使用するための関連誘導体は、C1又はC2位において修正されて、エステル結合の代わりにエーテル又はアルキル結合を含むリン脂質である。アルキルリン脂質誘導体及びエーテルリン脂質誘導体を、一般式:
【0080】
【化4】

又は
【化5】

[式中、R1は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
R2は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
Zは、エタノールアミン、セリン、イノシトール、コリン、又はグリセロールであり;
Yは、存在しないか、又は、長さが2〜30個の原子の範囲にわたるスペーサー基であり;
Xは、生理学的に許容可能なモノマー、ダイマー、オリゴマー(ここでnは1である)か、又は、生理学的に許容可能なポリマー(ここでnは1〜1,000の数である)である。]
によって例示する。
【0081】
本発明の方法において使用するための好ましいPL−コンジュゲートの例示は、PL部分が下記に列記する架橋部分を介して直接に又は間接的に結合するようなものである。

【0082】
本発明の特に好ましい態様においては、投与する化合物は、ヘマセル(hemacell)−PE、ヘタスターチ−PE、コンドロチン硫酸−PE、スピリン(spirin)−PE、ヒアルロン酸−PE、CMPE、HEPE、HYPE、及びDEXPE、並びにこれらの薬学的に許容可能な塩であり、これらを生理学的に許容可能なキャリア又は溶媒と組み合わせる。こうしたポリマーは、コンジュゲート部分として選択した場合、分子量が500〜2,000,000ドルトンで変化してよい。様々な分子量の化学種が、下記の節に示すように所望の生物学的効果を有することが示された。
【0083】
実施例の化合物に加えて、本発明のさらなる例示化合物を下記の節で述べる。
新規な化合物
コンジュゲート部分が、モノマーの例えばサリシレート、胆汁酸、若しくはコレステリルヘミスクシネート、又はポリグリコサミノグリカンの例えばヘパリン、ヘパラン硫酸、コンドロイチン−6−硫酸、コンドロイチン−4−硫酸、ヒアルロン酸、ケラチン、ケラタン硫酸、デルマチン、若しくはデルマタン硫酸の二糖若しくは三糖単位モノマーであるような低分子量PL−コンジュゲートは、先に説明されなかった。こうした新規な化合物は、他のPL−コンジュゲートに関して下記に証明するのと同様の生理活性プロフィルを示し、一般式:
ホスファチジルエタノールアミン−Y−X
ホスファチジルセリン−Y−X
ホスファチジルコリン−Y−X
ホスファチジルイノシトール−Y−X
ホスファチジルグリセロール−Y−X
[式中、Yは、存在しないか、又は、長さが2〜30個の原子の範囲にわたるスペーサー基であり;
Xは、単糖若しくは二糖、カルボキシル化二糖、モノカルボン酸若しくはジカルボン酸、サリシレート、アセチルサリシレート、アスピリン、アミノ酸、ジアミノ酸、オリゴペプチド、胆汁酸、脂肪酸、又はヘパリン、ヘパラン硫酸、ヒアルロン酸、コンドロイチン−6−硫酸、コンドロイチン−4−硫酸、デルマタン、デルマタン硫酸、ケラチン、若しくはケラタン硫酸の二糖若しくは三糖モノマー単位である。]
を有する。
【0084】
本明細書において、低分子量PE−コンジュゲートを、構造:
【0085】
【化6】

[式中、R1は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
R2は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
Yは、存在しないか、又は、長さが2〜30個の原子の範囲にわたるスペーサー基であり;
Xは、単糖若しくは二糖、カルボキシル化二糖、モノカルボン酸若しくはジカルボン酸、サリシレート、アセチルサリシレート、アスピリン、アミノ酸、ジアミノ酸、若しくはオリゴペプチド、胆汁酸、脂肪酸、又はヘパリン、ヘパラン硫酸、ヒアルロン酸、コンドロイチン−6−硫酸、デルマタン、若しくはケラタン硫酸の二糖若しくは三糖モノマー単位である。]
を有する化合物と定義する。
【0086】
本明細書において、低分子量PS−コンジュゲートを、構造:
【0087】
【化7】

[式中、R1は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
R2は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
Yは、存在しないか、又は、長さが2〜30個の原子の範囲にわたるスペーサー基であり;
Xは、単糖若しくは二糖、カルボキシル化二糖、モノカルボン酸若しくはジカルボン酸、サリシレート、アセチルサリシレート、アスピリン、アミノ酸、ジアミノ酸、若しくはオリゴペプチド、胆汁酸、脂肪酸、又はヘパリン、ヘパラン硫酸、ヒアルロン酸、コンドロイチン−6−硫酸、デルマタン、若しくはケラタン硫酸の二糖若しくは三糖モノマー単位である。]
を有する化合物と定義する。
【0088】
本明細書において、低分子量PC、PI、及びPG−コンジュゲートを、一般構造:
【0089】
【化8】

[式中、R1は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
R2は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
Zは、イノシトール、コリン、又はグリセロールであり;
Yは、存在しないか、又は、長さが2〜30個の原子の範囲にわたるスペーサー基であり;
Xは、単糖若しくは二糖、カルボキシル化二糖、モノカルボン酸若しくはジカルボン酸、サリシレート、アセチルサリシレート、アスピリン、アミノ酸、ジアミノ酸、若しくはオリゴペプチド、胆汁酸、脂肪酸、又はヘパリン、ヘパラン硫酸、ヒアルロン酸、コンドロイチン−6−硫酸、デルマタン、若しくはケラタン硫酸の二糖若しくは三糖モノマー単位である。]
を有する化合物と定義する。
【0090】
所望により架橋基Yを形成する適切な二価の基の例は、例えば、2個以上、好ましくは4〜18個の炭素原子を有する直鎖又は枝分れ鎖アルキレン、−CO−アルキレン−CO、−NH−アルキレン−NH−、−CO−アルキレン−NH−、シクロアルキレン(ここで各場合に、アルキレンは直鎖又は枝分れ鎖であり、鎖中に2個以上、好ましくは2〜18個の炭素原子を含む)、−(−O−CH(CH3)CH2−)X−(ここでxは1以上の整数である)である。
【0091】
従来のリン脂質構造に加えて、本発明において使用するための関連誘導体は、C1又はC2位において修正されて、エステル結合の代わりにエーテル又はアルキル結合を含むリン脂質である。こうした誘導体を、一般式:
【0092】
【化9】

又は
【化10】

[式中、R1は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
R2は、長さが2〜30個の炭素原子の範囲にわたる、線状、飽和、モノ−不飽和、又はポリ−不飽和アルキル鎖であり;
Zは、エタノールアミン、セリン、イノシトール、コリン、又はグリセロールであり;
Yは、存在しないか、又は、長さが2〜30個の原子の範囲にわたるスペーサー基であり;
Xは、単糖若しくは二糖、カルボキシル化二糖、モノカルボン酸若しくはジカルボン酸、サリシレート、アセチルサリシレート、アスピリン、アミノ酸、ジアミノ酸、若しくはオリゴペプチド、胆汁酸、脂肪酸、又はヘパリン、ヘパラン硫酸、ヒアルロン酸、コンドロイチン−6−硫酸、デルマタン、若しくはケラタン硫酸の二糖若しくは三糖モノマー単位である。]
によって例示する。
【0093】
化合物の製造
高分子量PL−コンジュゲートの製造は、本明細書において参考のために引用する米国特許第5,064,817号(特許文献1)の主題である。こうした合成法を下記に繰り返して述べるが、これは、当業者には容易に明らかな手順の修正を行えば、低分子量の、すなわちコンジュゲート部分としてモノマー及びダイマーを含むPL−コンジュゲートの製造にも同様に適用できるとみなされる。
【0094】
コンジュゲート部分のために選択した出発化合物が、出発PL化合物の置換基に対して反応性があるか又は反応性にできる置換基を有する場合、コンジュゲートしたキャリア部分は、PLと直接に結合してPL−コンジュゲートを生成できる。そうでない場合、二官能性結合出発物質を使用して、2つの分子を間接的に結合することができる。
【0095】
PL−コンジュゲートを製造するためには、米国特許第5,064,817号(特許文献1)に説明する全般的な反応スキームに従って、極性コンジュゲート、例えば、モノマー又はポリマーを、PL部分と直接に又は間接的に結合させる。
【0096】
例えば、PE−コンジュゲートのための前駆体として使用されるアシル化PEの場合、様々な長さのジカルボン酸をスペーサーとして使用できる。こうした酸は、天然、半合成又は合成PEと結合することができる。
【0097】
例えば、米国特許第5,064,817号(特許文献1)に説明するように、PEは、アミノデキストランと間接的に結合することができる。
カルボキシル基を有するポリマーの例えばポリアミノ酸、カルボキシメチルセルロース、又は脂肪酸が結合したポリマーは、米国特許第5,064,817号に説明するスキームに従ってPEと直接に結合できる。
【0098】
試薬及び方法の両方における多くの修正が当業者には可能と思われるので、上述した例を、説明のためにのみ与え、精神又は範囲において本発明を限定するものと解釈すべきではないことは理解できるはずである。PL−コンジュゲートによって示される広範囲の薬理学的特性に基づくと、上記に明白に説明した化合物に加えて、式I〜Xによって包含される化合物は、下記に説明する疾患を治療する方法において有用であることが証明される同じ貴重な生理活性を有することが見込まれる。
【0099】
PL−コンジュゲートに基づく、疾患を治療する方法
本明細書において説明するPL−コンジュゲートを使用して、多くの薬理学的活性のうちの1つを発揮することによって疾患を治療することができ、こうした薬理学的活性の中には、細胞膜を安定化することか;細胞及び血液成分に対する酸化的損傷を限定することか;細胞増殖、細胞遊出及び(腫瘍)細胞遊走行動を限定することか;免疫応答を抑制することか;又は高いケモカインレベルに表されるようなストレスに対する生理学的応答を弱めることによる、病的状態の間に生じる組織損傷の改善又は予防がある。こうした化合物の薬効は、薬物を使用することが望ましい特定の疾患の動物モデルを使用して容易に例示される。PL−コンジュゲートを投与すべきである患者は、疾患の症状を経験しているもの、疾患にかかる危険にさらされているもの、又は症状の再発若しくは疾患の増悪を経験しているものである。
【0100】
疾患の細胞又は動物モデルにおけるこうした化合物の効果を、下記の実施例で説明する。
リン脂質の特にホスファチジルエタノールアミン及びホスファチジルセリンと追加のモノマー又はポリマー部分とを組合せることは、従って、生成した化学組成物が所望の範囲の薬理学的特性を示すならば、医学的な目的で新規な薬物を製造するための実際的な経路である。本明細書において説明する例においては、単独で又は組み合わせて投与した場合、本化合物によって示される生理活性の多様性及び疾患における有効性は、出発物質自体の使用によって予想される特性をはるかに超える。しかしながら、PL−コンジュゲート化合物は、単独で又は組み合わせて、本明細書において具体的に説明する条件以外で疾患治療方法に適応させた場合に、貴重な薬物であることが明らかになることが見込まれる。
【0101】
用量及び投与経路
本発明の方法を、従来の賦形剤、すなわち、活性化合物と有害な反応をせず、非経口、経腸(例えば、経口)又は局所適用に適した薬学的に許容可能な有機又は無機キャリア物質と混和させたPL−コンジュゲートを含む治療組成物の使用に適応させることができる。適切な薬学的に許容可能なキャリアとしては以下のものが挙げられるがこれらに限定されるものではない:水、塩溶液、アルコール、アラビアゴム、植物油、ベンジルアルコール、ポリエチレングリコール、ゼラチン、炭水化物の例えばラクトース、アミロース又はデンプン、ステアリン酸マグネシウム、タルク、ケイ酸、粘稠なパラフィン、白色パラフィン、グリセロール、アルジネート、ヒアルロン酸、コラーゲン、香料油、脂肪酸モノグリセリド及びジグリセリド、ペンタエリトリトール脂肪酸エステル、ヒドロキシメチルセルロース、ポリビニルピロリドン等。処方剤を滅菌でき、希望するなら、活性化合物と有害な反応をしない補助剤の例えば滑沢剤、保存剤、安定剤、湿潤剤、乳化剤、浸透圧に影響を与えるための塩類、緩衝液、着色剤、香味料及び/又は芳香族性物質及びその他同様なものと混合できる。こうしたものはまた、希望する場合、他の活性剤の例えばビタミンと組合わせることができる。
【0102】
本明細書において提供する実施例は、皮下、腹腔内又は局所投与でのPL−コンジュゲートの使用を説明するが、説明される成功は、他の投与経路又は他の処方剤との組合せが少なくとも同様に成功すると思われると推定するための良好な証拠を与える。投与経路(例えば、局所、非経口、経腸、静脈内、膣、又は経口)及び投与計画は、治療する状態の正確な性質、状態の程度、患者の年齢及び全般的な身体的状態等の要因に基づいて、熟練した臨床家によって決定されよう。
【0103】
一般に、上記に説明した目的のために利用される用量は変化しようが、所望の抗疾患効果を発揮するために有効な量であろう。本明細書において使用する“薬学的に有効な量”という用語は、患者における疾患の症状又は徴候の所望の軽減をもたらすような、式I〜Xの化合物の量を指す。上記に説明した目的のいずれかのために利用される用量は一般に1〜約1000ミリグラム/体重キログラム(mg/kg)であり、1〜4回/日、又は連続的なIV注入によって投与される。本組成物を局所投与する場合、一般に0.1〜約10%w/vの濃度範囲内で1〜4回/日投与する。
【0104】
本明細書において使用する“薬学的に許容可能なキャリア”という用語は、安全であり、かつ、有効な量の本発明の少なくとも1種の化合物の所望の投与経路のための適切な送達を提供する任意の配合物を指す。このようなものとして、上記に説明した本発明の配合物の全ては、本明細書によって“薬学的に許容可能なキャリア”と呼ばれる。この用語は、pHが特定の所望の値に維持され、化合物及び投与経路の安定性に従ってpHが4.0〜9.0の範囲にわたるような緩衝化した配合物の使用も指す。
【0105】
非経口適用の場合、特に適切なものは、注射可能な無菌の液剤、好ましくは油性溶液若しくは水溶液、並びに懸濁液剤、エマルション、又は坐剤を含む植込み剤である。アンプルは便利な単位投与(unit dosage)である。
【0106】
吸入による適用の場合、特に気道閉塞又は鬱血の治療の場合、適切なキャリアの存在下で混合し、エアロゾル化又は噴霧する化合物の液剤又は懸濁液剤が適切である。
【0107】
局所適用の場合、特に接触性皮膚炎の治療の場合、本化合物と従来のクリーム又は遅延放出パッチとの組み合わせが許容可能である。
経腸適用の場合、特に適切なものは、錠剤、糖衣錠、液体、ドロップ、坐剤、又はカプセルである。甘味付けしたビヒクルを用いる場合、シロップ剤、エリキシル剤、又はその他同様なものを使用できる。指示された場合、坐剤又は浣腸製剤が推奨される投与経路かもしれない。
【0108】
徐放性又は指向性放出組成物を製剤化でき、例えば、リポソーム、又は活性化合物が差次的分解性コーティング(differentially degradable coating)によって、例えばマイクロカプセル封入、多数のコーティング等によって保護されているものがある。また、新規な化合物を凍結乾燥し、得られた凍結乾燥物を例えば注射用製品の製造のために使用することが可能である。
【0109】
特定の場合の活性化合物の実際の好ましい量は、利用する特定の化合物、製剤化する個々の組成物、適用の方式、並びに治療を受ける個々の位置及び生物によって変化することは了解されよう。所定の受容者のための用量は、従来の考慮すべき事柄によって、例えば、本化合物及び周知の薬剤の特質的な活性(differential activity)の通例の比較によって、例えば適切な従来の薬理学的プロトコールによって決定できる。
【0110】
さらに詳述することなく、当業者であれば、先の説明を使用して本発明を最大限に利用できるものと考えられる。従って、以下の好ましい具体的な実施例は単なる例示であって、本開示の残りをいかなる点でも限定するものではないと解釈すべきである。
【0111】
実施例1:閉塞性呼吸疾患
PE−コンジュゲートは閉塞性呼吸疾患の治療において有効である。これを、下記の実験1〜7において喘息に関して証明する。喘息において気流が妨げられるのは、肺の管腔性管(luminal vessel)の狭窄及び閉塞の結果である気道閉塞が原因である。気道狭窄を調べるための1つの広く受け入れられている実験系は、気道から単離した筋肉標本の収縮を、薬物が存在する場合及び存在しない場合に誘発することである。抗喘息薬の作用に関する別の広く受け入れられている試験は、喘息を有する生きている動物を使用することである。この疾患は、抗原に対し感作された動物中に存在し、体プレチスモグラフィーを使用して、増悪及び喘息性呼吸からの回復を観察できる。
【0112】
実験1〜4においては筋肉標本をラットから単離し、実験5においてはモルモットから単離した。筋収縮を測定するために、筋肉を、ばねによく似た働きをする圧力変換器と結合した。収縮の誘発は、アセチルコリン及びエンドセリン等の喘息誘発性物質を投与した場合に起きた。
【0113】
実験1:単離したラットの気管輪をKrebs-Hanselet緩衝液(Ph=7.4)中に浸漬し、張力変換器と結合した。ET−1を示された終濃度で加え、最終的な収縮を、張力変換器に加えられた力の変化によって決定した。各データ(図1)は4つの別個の実験(4匹のラット)の平均S.D.である。
【0114】
実験2:ラットの気管輪を、示された濃度のHYPEと共に1時間インキュベートした。ET−1を次に終濃度1μMで加え、輪収縮(図2)を実験1におけるように決定した。
【0115】
実験3:ラットの気管輪を、3μMのHYPE又はHAと共に1時間インキュベートした。ET−1を次に終濃度1μM(白い棒)又は10μM(斜線の棒)で加え、輪収縮(図3)を実験1におけるように決定した。
【0116】
実験4:モルモットの気管輪(直線的な配列で)をリンゲル浴中に浸漬し、輪の鎖の長さを測定する装置に接続した。示すように、Crotalus atrox(タイプII)の酵素又はエンドセリン−1による収縮の刺激の1時間前に、CMPEを浴に加えた(表1)。
【0117】
表1.CMPE及びHEPPEによる器官収縮の阻害
【表1】

【0118】
実験5〜7は、生きている動物においてPL−コンジュゲートが薬理学的効果を発揮する能力を証明する。この場合、ラットを感作するために、卵白アルブミンを注射し、次に、呼吸器経路を通して抗原に再度さらして喘息疾患に関して試験した。こうした実験の場合、1日目に卵白アルブミン(OA)と水酸化アルミニウムの皮下(S.C.)注射及び熱殺菌Bordatella Pertussisの腹腔内(I.P.)注射をすることで、喘息をドブネズミ(Brown Norway (BN) rat)に誘発した。気管支狭窄(チャレンジ)を、14、16及び18日目にOAのエアロゾル投与によって誘発した。チャレンジ後、18日目に5分間、各ラットにつきボディボックス(body-box)中で肺機能を試験した。
【0119】
実験5:PBS中に溶解させたPL−コンジュゲート又はビヒクル(対照)を用いた処理を、OAを用いたチャレンジの24時間及び1時間前にS.C.注射(10mg/体重100g)することで実行した(図4)。
【0120】
実験6:各群において、20Lの檻中の5匹のラットに、チャレンジの1日及び1時間前に、HYPEのエアロゾル処方剤を5分間吸入させた。各データは5匹のラットの平均±SEMである。*p<0.01。Penh(覚醒ラットにおける肺気流の閉塞)を、Hamelmann, et al.の方法を使用して決定した。束縛されていない覚醒ラットを、前置増幅器(モデルMAX2270、バクスコエレクトロニクス(model MAX2270, Buxco Electronics))に接続した全身プレチスモグラフ(バクスコエレクトロニクスInc.、トロイ、ニューヨーク、USA(Buxco Electronics Inc., Troy, New York, USA))中に入れた。増幅器からのアナログ信号を、ADカード(LPM−16、ナショナルインスツルメンツ、オースティン、テキサス、USA(LPM-16 National Instruments Austin, Texas, USA))によってディジタル信号に変換した。各呼吸の増強された休止(Penh)の計算を、気管支狭窄の測定として使用する。Penhは、式:Penh=(PEF/PIF)×((Te−Tr)/Tr)[式中、PEF=ピーク呼気流れ;PIF=ピーク吸気流れ;Te=呼気時間;Tr=弛緩時間[ibid.]]の結果である。各データは5匹のラットの平均±SEMである。*、**p<0.005。PL−コンジュゲートが喘息のラットに及ぼす影響は、上述の薬剤のうちの1種を、卵白アルブミン誘発喘息発作の前に投与することで証明してよい。有意に、PL−コンジュゲートは、非経口(図4)及びエアロゾル経路(図5)の両方で投与された場合に、喘息の治療において有効である。
【0121】
実験7:PL−コンジュゲートのインビボの影響を、病気の動物の呼吸窮迫の軽減によってのみならず、組織学的診断によっても証明する(図6)。PL−コンジュゲートの投与は、喘息疾患に伴う気道管腔の生理学的浸潤物をかなり低減し、この能力においては、標準的なステロイドを基にした薬物であるデキサメタゾンと少なくとも同程度に有効である。
【0122】
こうした実験は、PL−コンジュゲートを閉塞性呼吸疾患の治療のために使用してよく、これは、収縮の阻害及び気道閉塞浸潤物の低減を含む複数の機構によって気道狭小を軽減することを証明する。
【0123】
実施例2:大腸炎及びクローン病
PL−コンジュゲートは、胃腸管疾患が原因の粘膜層損傷の治療において有効である。これを、実験8〜11において証明する。大腸炎及びクローン病は、管を裏打ちする組織防壁が損傷する消化管疾患の2つの例である。このタイプのGI粘膜疾患の1つの一般に受け入れられているモデルは、高い用量の抗炎症薬であるインドメタシン(クローン病)、毒素であるトリニトロベンゼンスルホン酸(TNBS)(大腸炎)、又はデキストラン硫酸ナトリウム塩(DSS)として周知の腸刺激原(大腸炎)を消費する齧歯類動物において生じる、腸の生理学的な裏打ちに対する損傷である。実験プロトコールに関しては、材料及び方法を参照されたい。
【0124】
実験8及び9:腸損傷の重症の症例のラットは、組織損傷スコア(図7)及び組織学的診断(図8)によって証明されるように、発病の前のPL−コンジュゲートの投与によってかなり改善された。
【0125】
実験10:薬物又は毒素誘発損傷からの同様の回避効果(sparing effect)が、組織学的レベルのみならず機能上でも見られ、これは、PL−コンジュゲート処理による、蛍光染料に対する腸壁の防壁の保持によって証明される(図9)。加えて、PL−CMC処理は、生存している大腸炎のラットの結腸におけるミエロペルオキシダーゼ活性(MPO)をかなり低減することが見い出された。未処理群及びPL−CMC処理群のそれぞれのMPO活性は、19.1±2.6及び7.9±1.1単位/mgである。組織(平均±SEM、n=6、p<0.01)。動物が薬物を投与された全ての場合に、疾病は著しく改善され、これは、大部分のマウスが死亡せずに生存し続けたという事実によって証明される(表2及び表3)。
【0126】
表2.大腸炎におけるCMPEによる致死率の減少
【表2】

【0127】
表3.インドメタシン誘導の小腸損傷
【表3】

【0128】
実験11:デキストラン硫酸誘発大腸炎において、死亡率は変化しなかった(各場合に12匹中3匹のマウスが死亡した)が、疾患活性の他のパラメータはかなり改善され、これは、全疾患スコア(図10)及び結腸長さの保持(図11)によって証明される。投与したPL−コンジュゲートのこうした疾患回避効果は、この薬物が非経口によって提供されようと吸入経路によって提供されようと明らかである。
【0129】
こうした実験は、PL−コンジュゲートは、組織の構造上及び機能上の特徴の両方に及ぼす影響によって病的臓器の粘膜防壁を保持する能力に基づき、大腸炎及びクローン病の治療において有効な治療法であることを証明する。
【0130】
実施例3:中枢神経系の傷害
PL−コンジュゲートは神経毒性薬剤として有効であり、中枢神経系に対する生理学的傷害の後の組織損傷を予防する。これを、実験12〜22において証明する。虚血性発作、外傷、感染、癌転移、及び変性疾患は、脳組織損傷が重症であり不可逆となることがある生理学的傷害の具体例である。組織損傷は一般的に、ストレスに対する多数の生理学的応答を引き起こし、中枢神経系においては、支持組織によって放出される化学物質いう形態を取る。しかしながら、過剰のこうした潜在的に神経毒性のある“創傷”化学薬品の1種以上が、治癒過程をさらに妨げ、脳組織損傷の一因となるかもしれない。新規な薬物の神経保護能力を評価するための一般に受け入れられているモデルは、脳マトリックス細胞(例えばグリア細胞)、脳細胞から得られる細胞系(例えばP−12細胞)、及び遊走性血液細胞(マクロファージ及びリンパ球)の標本を用いるもので、こうした細胞は一般的に、損傷した脳組織の部位に補充される。CNS中の組織損傷はしばしば、最初の傷害の影響を悪化させ、組織損傷の拡大に至るかもしれない血液脳関門の局所的な混乱及びそれに続く遊走性血液細胞の通過によって構成される。無傷で混乱した血液脳関門を通る細胞運動は、内皮細胞層を通るT細胞運動の測定を用いてインシトゥでモデル化されている。
【0131】
ストレス及び切迫した損傷に伴う物質の例えば免疫原LPS、サイトカインTNF−α、神経毒パーダキシンに応答して、中枢神経系のマトリックス細胞は、多数の創傷応答物質の例えばPGE2、エンドセリン、酸素ラジカル、トロンボキサン、ドーパミン、一酸化窒素、5−HETE、及びPLA2を活性化する。過剰に表れると、こうした物質は、これ自体が神経毒性を有するか又は同時一過性(cotemporal)の神経毒性を示し、従ってその抑制はしばしば、神経保護薬を開発する目標として選択されている。
【0132】
実験12〜14は、プロスタグランジン(PGE2)放出のPL−コンジュゲートによる阻害を証明する。
実験12:全ての実験の前にグリア細胞培地を新しい培地と取り替え、10μg/mlのLPSを補足した。PL−コンジュゲートを30分間加え、その後LPSにさらした。組織培養を37℃で24時間さらにインキュベートした。次に培地を集め、LPS及びPL−コンジュゲートを含む新しい培地中でインキュベートした。さらに24時間後、上澄みを採取して、ELISAによってPGE2含量を測定した(図12)。
【0133】
実験13:PC−12細胞の場合、示されたPL−コンジュゲートと共にインキュベートした後、細胞を洗浄し、次にパーダキシン(PX)を用いて30分間刺激し、培地に放出されたPGE2の量をELISAによって測定した(図13)。
【0134】
実験14:モルモットの気管輪を、試験管中でCMPEと共に又はCMPE無しで30分間インキュベートし、その後刺激した。培地を30分後に集め、PGE2及びTXB2をラジオイムノアッセイによって測定した(表4)。(n.d.=検出限界未満)
【0135】
表4
【表4】

【0136】
実験15及び16:一酸化窒素生成のPL−コンジュゲートによる抑制を証明する。グリア細胞培地を新しい培地と取り替え、10μg/mlのLPSを補足した。PL−コンジュゲートを30分間加え、その後LPSにさらした。組織培養を37℃で24〜48時間さらにインキュベートした。24時間後、上澄みを採取して、グリース試薬を使用した比色測定によってNOを測定した(図14)。他に、一次マウス腹腔マクロファージを、示された濃度のPL−コンジュゲートを用いて30分間処理した(図15)。次にLPS(1μg/ml)を、直接に又はPL−コンジュゲートの洗浄後に培養物に加えた。一酸化窒素をGRIS熱量法によって測定した。
【0137】
実験17:グリア細胞からの可溶性ホスホリパーゼA2(sPLA2)放出のPL−コンジュゲートによる阻害を証明する(図16)。全ての実験の前にグリア細胞培地を新しい培地と取り替え、10μg/mlのLPSを補足した。PL−コンジュゲートを30分間加え、その後LPSにさらした。組織培養を37℃で24〜48時間さらにインキュベートした。培養基試料(24時間後)を採取して、大腸菌基質に対するPLA2活性を測定した。
【0138】
実験18及び19:オレイン酸放出として測定して、PL−コンジュゲートがホスホリパーゼ活性化を抑制する能力を証明する。脳組織の場合、PC12細胞を、3H−アラキドン酸(ArAr)又は3H−オレイン酸を用いて少なくとも6時間代謝標識し、次に洗浄し、示されるようにPL−コンジュゲートと共に30分間インキュベートした。細胞を次に洗浄し、パーダキシン(PX)を用いて30分間刺激し、培地に放出された3H−脂肪酸の量をシンチレーション計数管で測定した(図17)。マクロファージからのオレイン酸の放出の場合(図18)、下記の材料及び方法に説明するように、ネズミのP388D1細胞を標識し、様々な濃度のPL−コンジュゲートを用いて前処理した後、LPSが存在する場合(?)及び存在しない場合(0)にアッセイを行った。
【0139】
実験20:PL−コンジュゲートがドーパミン放出を抑制する能力を証明する。PC12細胞(集密で)に、放射性ドーパミン(DOPA)を4時間負荷させ、次に洗浄した(抗酸化剤の存在下で)。細胞を次に、示されたPL−コンジュゲートと共に30分インキュベートし、次いで洗浄し、PXを用いて15分間刺激した。培養基に放出された標識DOPAの量をシンチレーション計数管で測定した(図19)。
【0140】
実験21:5−HETE放出のPL−コンジュゲートによる抑制を証明する。PC−12細胞を、実験23と同一の条件下で、示されたPL−コンジュゲートと共にインキュベートし、続いてPXによって刺激した。放出された5−HETEの量をELISAによって測定した(図20)。
【0141】
実験22:内皮細胞障壁を通る細胞透過をPL−コンジュゲートが阻害する効力を証明する。T細胞経内皮移動アッセイを使用して(図21)、一次豚脳内皮細胞(PBEC)を、移動アッセイのためにコーティングしたコラーゲン上で平板培養した。ヒト末梢血T細胞を、Cabanas and Hogg (1993, PNAS 90: 5838-5842)に説明するように作製した。T細胞を、使用前に、組み換えヒトIL−2中に12日間まで維持した。約1×105個のT細胞を、集密的PBEC単層上のトランスウェル(Transwell)の上部チャンバに加え、37℃で5時間インキュベートした。試験用の化合物も、T細胞と同時にPBEC単層に加えた。この期間にわたって1時間毎に電気抵抗値を測定した。5時間目にトランスウェルを温かい培地中で簡単に濯ぎ、パラホルムアルデヒド中に固定した。フィルターの下側に(すなわちPBEC単層を通って)移動したT細胞の数を、報告に説明されているように計数した。
【0142】
こうした実験は、PL−コンジュゲートは効力のある神経保護剤であり、発作、腫瘍、外傷、感染及び変性疾患等の状況において脳損傷の治療のための治療法として投与された場合に有用であることを証明する。
【0143】
実施例4:多発性硬化症
PL-コンジュゲートは多発性硬化症の効果的治療法である。このことは下記実験23-24に示される。多発性硬化症は、神経学的機能の損失を特徴とする中枢神経系内白色組織の疾患である。本疾患に関して一般に受け入れられている動物モデルは、ミエリン塩基性蛋白質の様な神経系の抗原を皮下感作することで齧歯類に誘導される実験的アレルギー性脳炎(EAE)である。臨床パラメータは、後脚から前脚へ進行する麻痺により表される。
【0144】
実験23−24:EAE-誘導剤に曝されたラットが、PL-コンジュゲート投与により同時処理を受けた場合に麻痺性疾患を殆ど発症しないことを示す。両実験は不活性化結核菌0.4mg/mlで強化された0.1mlのCFA(PBSバッファー中1:1)中に乳化された5mgのマウス脊髄ホモジェーネートを脚部S.C.(皮下注射.)し、続いて48時間後に百日咳菌毒素200ngを含む0.2mlを尾静脈注射してEAEを誘導したラットのグループを使用した。(疾患重症度のスコア化については“材料と方法”を参照)。
【0145】
実験23では、ラットの1グループは実験初日より開始し2週間隔日に20mgのCMPEを投与された。別のグループは、実験第7日目からのみ同様の投与を受けた(T-細胞が活性化された後)。同時に各コントロールグループには生理食塩水が注射された(表5)。
【0146】
表5.CMPEによるEAE(多発性硬化症)の改善
【表5】

【0147】
実験24では、1グループには実験初日から14日目まで、隔日に2mgのCMPEが投与された。もう一方のラットグループには、実験7日目から14日目まで隔日に20mgが投与された(表6)。
【0148】
表6.CMPEによるEAE(多発性硬化症)の改善、低用量対高用量
【表6】

【0149】
両実験は、麻痺(頻度1)を示すラットのパーセンテージ、麻痺の程度と前脚への進展(重症度スコア2)および回復までの麻痺期間(期間3)から判断して、PL-コンジュゲートによる治療が疾患重症経過例を少なくし、そしてより完全な運動機能の回復をもたらすことを示している。さらに表6に示した結果は、PL-コンジュゲートの治療効果が用量依存的であることを示している。
【0150】
多発性硬化症に於けるPL-コンジュゲートの有効性を指示する更なるものは上記実験15、17および22に認められ、それらの実験ではPL-コンジュゲートの神経保護硬化が示されている。
【0151】
実施例5:接触性皮膚炎および乾癬
PL-コンジュゲートは皮膚の過敏症反応および乾癬の治療に有効である。この事は実験25-29に示されている。皮膚過敏反応は、実際には物質に対する反応の中で起こり、急性型と慢性型の両方がある。抗原の局所適用に続く全身感作は、接触性皮膚炎のメカニズムとなる遅延型過敏反応を惹起するもとのして広く受け入れられているシステムである。乾癬は伸筋表面に主に見られることが多い斑状形成を特徴とする一般的な皮膚炎であり、上皮細胞の増殖亢進性の障害であることから、一般には患者から得た培養細胞を使って薬物治療が検討される。
【0152】
実験25−28:予防的および急性治療法として、全身投与(表7)、皮下投与(表8)又は局所投与(表9−10)の何れに於いても、過敏反応に罹った動物の治療がPL-コンジュゲートの投与に容易に反応することを示す。
【0153】
3様式の投与法を実施した:1)PL-コンジュゲート生理食塩水液を0日より開始し6日まで毎日腹腔内注射した(表7);2)PL-コンジュゲート生理食塩水液をオキサザロン耳適用前2時間、又はオキサロゾン耳適用後1時間の2回、耳内皮下注射(誘発域近く)した(表8);3)EtOH:H2O、1:1溶液を0日より開始6日目まで両耳、誘発域上端に局所適用した(表9);4)20μLの0.1%EDXPEの50%EtOH又は20μlのDermovat(ステロイド軟膏)を用いて誘発を行った5-6時間後に、右耳のみに5回PL-コンジュゲートを局所適用した(表10)。いずれの実験でも、コントロールグループA(後感作のみ)では耳両側の膨張を測定する24時間前に、その部分にオキサロゾンが局所適用処理された。グループB(完全感作+生理食塩水又はEtOH50%)では、毛を剃った胃部がオキサロゾン処理され、その後6日目に耳の両側にオキサロゾンを局所適用した。膨張は処理後耳幅から、各マウスの正常時の耳幅を差し引き、0.1mm単位で測定された。阻害%は、PL-コンジュゲート処理耳の正味の膨張(コントロールグループAの膨張に対し)を完全に感作された耳の正味の膨張で除して計算された。いずれの場合もこの薬剤の局所投与は片側に行われたものであるにも関わらず明らかにステロイドは両耳に影響を及ぼしたが、一方局所適用されたPL-コンジュゲートは適用された耳にのみ作用しており、その意味において全身投与ではないことが示された。
【0154】
表7.CMPE−腹腔内投与による皮膚DTH反応の減弱
【表7】

【0155】
表8.CMPE−皮下投与による皮膚DTH反応の減弱
【表8】

【0156】
表9.CMPE−局所投与による皮膚DTH反応の減弱
【表9】

【0157】
表10.CMPE-による皮膚DTH反応の減弱−局所投与対ステロイド剤
【表10】

【0158】
実験29:PL-コンジュゲートが培養乾癬皮膚繊維芽細胞およびスイス(Swiss)3T3細胞の増殖を阻害することを示す。ヒト乾癬皮膚細胞(真皮)の繊維芽細胞、(?)又はスイス(Swiss)3T3細胞(0)を、細胞数測定後3日間指定濃度のCMPEで処理した(図22)。3日間のインキュベーション終了時点に於ける未処理群であるのコントロールの細胞数を100%とした。比較のためカルボキシメチルセルロースを単独で試験した(?)。
【0159】
これらの実験は、PL-標識体が皮膚過敏反応および乾癬を含む様々な皮膚炎の管理にとって効果的な治療薬であることを示している。
【0160】
実施例6:心臓血管疾患
PL-コンジュゲートは虚血性血管疾患、アテローム性動脈硬化症、再灌流傷害の有効な治療法である。このことは実験30-36により示される。
【0161】
アテローム性動脈硬化症の顕著な特徴は、LDLの様な血液脂質蛋白質が血管壁を裏打ちする細胞内に蓄積すること、および裏打ち細胞および平滑筋細胞といった血管壁細胞の増殖である。その結果生じるアテローム性動脈硬化障害部位に於ける血管腔狭窄が様々な程度に組織虚血を引き起こす。虚血現象は偶発的又は医療的介入により元に戻すことができるが、組織傷害のプロセスは酸化的損傷を含む複数のメカニズムによる再灌流傷害の段階を維持するため、一度虚血を起こした組織では損傷に対するリスクが高い。
【0162】
実験30−33はトロンビンにより刺激されていない、又は刺激された血管平滑筋細胞に対する、およびヒト静脈平滑筋細胞および大動脈内皮細胞の増殖に対するPL-コンジュゲートの抗増殖作用を示している。
【0163】
実験30:未刺激細胞については、ウシ大動脈平滑筋細胞を10%FCS添加したDMEM中、HYPE-40又はHYPE-80(PE強化)存在下又は非存在下に7・103細胞/ウエル(24-ウエルプレート)の割合に播種し、72時間増殖させた後コールターカウンターを使い細胞数を測定した(図23)。
【0164】
実験31:刺激細胞については、ウシ大動脈平滑筋細胞を、6時間表示の如くトロンビン、胎児ウシ血清、PL-コンジュゲート又はその両方と共に前インキュベーションした後、上記条件下にて48時間増殖させた。細胞増殖はチミジン取り込み量として表されている(図24)。
【0165】
実験32:ヒト静脈平滑筋細胞の増殖に対するPL-コンジュゲートの作用を調べるためにヒト伏在静脈由来の平滑筋細胞(SMC)を8×104/5mm培養皿中、5%ウシ胎児血清および5%ヒト血清を添加されたDMEMに接種された。1日後、細胞は洗浄され、PL-コンジュゲート(HEPE)又はそのポリマー性キャリアー(ヘパリン、HEPEと同一濃度)を含まない(コントロール)又は含む同一培地中にインキュベーションした。5日後、細胞を集め(トリプシン処理により)細胞数を計測した(図25)。各データは3重測定の平均SEMである(同一の結果は2回目の再現実験でも得られた)。*p<0.005。
【0166】
実験33−34:培養マクロファージによる、および動物そのものに於けるLDL取り込みの阻害を示すために、ヒトLDL(通常の浮揚法により単離された)をCu2+-誘導酸化にかけ、125Iにて標識した。集密状態のJ774マクロファージは100μMの125I-oLDLおよび所定濃度のPL-コンジュゲートを含む、0.5%BSAが添加されたPBS緩衝液(pH=7.4)と3時間インキュベーションされた。次に細胞は4回PBS/BSA緩衝液で洗浄され、0.1NのNaOHで30分間溶解され、細胞溶解物が集められ、125I含有量が放射線カウンターを使い測定された(表11)。
【0167】
表11.HYPEおよびHEPPEによるマクロファージ酸化LDL取り込みの阻害
【表11】

【0168】
体重200gのラットに250nmoleの125Iで標識されたCu2+-誘導酸化LDLおよび200nmoleのHYEPを含む溶液0.4mlを静脈注射した。血液サンプルを所定間隔で集め、血漿中の125I放射活性を測定した(図28)。
【0169】
実験35:LDL-付随ホスホリパーゼ活性のPL-コンジュゲートによる阻害を示すことを目的とし、LDL(0.1μM)を15分間所定濃度のHYPE、HEPPE又はCMPE非存在下又は存在下にインキュベーションした(図27)。ゼロ時間にC6-NBD-PC(0.5μM)を分散液中に加えた。これにより瞬間的に蛍光強度が上昇した(脂質コア内にNBDが取り込まれたことによる)。LDLを単独でインキュベーションした場合には、蛍光上昇に続いて時間依存的な蛍光強度の減少が起こったが、これはLDL-関連PLAの加水分解によるものであろう(および生じたNBO-カプロン酸がLDL粒子から水性媒体中にその後解離することによる)。LDLをHYPE、HEPPE又はCMPE存在下にインキュベーションした場合は、この時間依存的な減少は完全又は一部阻害された。
【0170】
実験36:内皮細胞に対するPL-コンジュゲートの保護作用を示すために、ウシ大動脈内皮細胞を腫瘍壊死因子(TNF-α)、ホスホリパーゼA2、アランキドン酸又は過酸化水素のいずれかに暴露し、続いて内皮細胞健全性の指標である赤血球の接着として細胞障害について調べた。ウシ大動脈内皮細胞(BAEC)は30分間5μMのCMPE又は20μMのDEXPEと前インキュベーションしてから洗浄され、18時間所定濃度のTNF、ArAr又はPLA2により刺激された。H2O2による刺激に関しては、細胞をH2O2で20分間処理してから洗浄し、ヒト赤血球(RBC)と30分間インキュベーションした。培養体は洗浄され、BAECに接着し続けているRBCの数を顕微鏡を使い計測した(図28)。
【0171】
これらの実験は、PL-コンジュゲートの投与が、血管平滑筋細胞増殖、リポ蛋白質の取り込み、および虚血および再灌流モデルに於ける白血球活性化を含む複数のメカニズムを通しアテローム性動脈硬化および再灌流傷害を含む心臓血管病の治療に有効な治療法であることを示している。
【0172】
実施例7:カテーテル導入を含む侵襲的外科手術手順の予防
PL-コンジュゲートは上記の如くアテローム性動脈硬化症を含む多くな状態の心臓血管病だけでなく再灌流傷害として知られる狭窄-再狭窄症の治療と予防にも有効である。さらにこれら薬物は血管臓器操作、特に血管カテーテル導入を含む侵襲的外科手術手順時に生ずることがある狭窄性傷害の形成予防に有効である。
【0173】
実験37−38:ラット頸動脈にバルーンを使い狭窄を誘導するプロトコールについて、PL-コンジュゲートの全身(表12)および静脈注入(表12)投与の有効性を示す。ラットは1日目、および傷害前1-2時間目に10mg/100g体重のHYPEのPBS溶液又はPBS液単独をI.P.注射され前処理された。傷害は標準的フォガティーカテーテルを使い起こされた。ラットには3日間は毎日、その後投与回数が8回になるまで隔日に同量の薬剤又は賦形剤が投与された。14日目にラットは屠殺され、標準的手順に従い動脈が処理された。ラットの半数にはブロモデオキシウリジン(BrdU)が注射され、フォルマリンとトリトンで固定され、BrdU染色向けに加工され、比較のため指定の血管構造の面積が測定された(表12)。頸部が正中切開され、遠位部左総頸動脈および外部頸動脈が露出された。左総頸動脈に関し、外部頸動脈より2Fフォガティーバルーンカテーテル(バクスター、サンタアナ、カリフォルニア州(Baxter、Santa Anna, CA))を導入して血管腔内を通し、内皮細胞を剥落した。カテーテルは、僅かな抵抗が発生するように生理食塩水によってバルーンを十分に膨張しながら3回通された。それからカテーテルを引き抜き、注射器に接続されたポリエチレンチューブ(PE-10)が総頸動脈内に導入された。頸動脈の断片をスライディング結紮と血管クランプを使って一次的に隔離した。10nmoleのCMPEを含む約50μlの溶液を隔離した動脈片に注入し、15分間放置した。次に薬液を吸い出し、外部頸動脈を結紮した。2週間後にラットは屠殺され、管腔狭窄の割合(損傷域内の)を中膜域に対する新生内膜の割合を組織学的に測定することで決定した(表12)。
【0174】
表12.ラットにバルーンで誘導された狭窄のPL-コンジュゲートによる阻害
【表12】

【0175】
これら実験はPL-コンジュゲートの投与が、侵襲性動脈手順、特にバルーン血管形成中に投与された場合、予防的および緊急的治療効果の両方を有することを示している。心臓血管病でのPL-コンジュゲート投与の治療効果を支持する更なる証拠は、実験48の中で示すLDL酸化の効果にも見ることができる。
【0176】
実施例8:侵襲性細胞増殖疾患
PL-コンジュゲートは癌の様な細胞増殖疾患の効果的治療法である。この事は上記実験30-33および下記実験39-43に示されている。癌拡大のプロセスは複数の事象を内含しており、細胞増殖の速度、血管内拡張速度、隣接又は非隣接(転移)組織への浸潤速度、および癌組織に供給する新規血管の生成速度を含む、各それぞれが阻害薬剤作用の標的となる。癌細胞はそれらの浸潤能を高めるのに役立つ細胞内マトリックス分解酵素を生成することが多い。即ち癌は組織浸潤、組織チャンネルを通した拡大、脈管新生および腫瘍血管新生を含む多相的疾患である。上記後半のプロセスは平滑筋および内皮細胞の増殖速度に依存している。
【0177】
実験39:基底膜を通る腫瘍細胞の浸潤をPL-コンジュゲートが阻害する能力を示すために、走化性浸潤アッセイを用いた(図29)。詳細は以下方法と材料を見よ。
【0178】
実験40−42:組織分解酵素の発現又は活性を阻害する薬物としてPL-コンジュゲートが作用する能力を示す。ヒアウロン酸(HyA)PBS液(0.75mg/ml)を指定濃度のHYPE非存在下又は存在下に1時間ヒアウロニダーゼ(15U/ml)処理した。ヒアウロン酸分解は溶液粘度の変化より決定された(図30)。PL-コンジュゲートを用いた同様の実験をコラゲナーゼ活性およびへパリナーゼ活性に関するアッセイを用いて実施した。HT-1080(繊維肉腫)細胞を指定濃度のHYPEと24時間インキュベーションした。次に培地を集め、そのコラゲナーゼ活性を酵素電気泳動アッセイにより決定した。各データは2プレートの平均値である(誤差約5%)(図31)。BMG細胞はウエル当たり50μCiの35SO42-で標識された。細胞は、5単位のヘパリナーゼIPBS液200μlで3時間処理される前に、PBSで3回洗浄された。培地が集められ、その35S含有量が計測された(図32)。
【0179】
上記実験30−33もまた、繊維芽細胞から平滑筋細胞、そして血管起源の内皮細胞に至る各種タイプの細胞の増殖を阻害するPL-コンジュゲートの抗増殖作用を示している。このことはPLコンジュゲートの抗血管新生能が腫瘍増殖および拡大の阻害に特に有意であることを示した。
【0180】
実験43:内皮細胞の増殖に対するPL-コンジュゲートの作用に関しては、ウシ大動脈内皮細胞が培養皿にて6時間平板培養され、続いて洗浄され未接着細胞が除かれた。残った接着細胞は指定濃度のPL-コンジュゲート非存在下(コントロール)又は存在下に48時間インキュベーションされた。次に細胞は洗浄され、トリプシン処理により集められ、コールターカウンターを用いて細胞数が測定された、結果は3回測定の平均値±標準偏差である。*p<0.005(図33)。
【0181】
これら実験は、PL-コンジュゲートの投与が、抗増殖、抗浸潤および抗血管新生を含む複数のメカニズムにより、癌の治療に効果的な治療法であることを示している。
【0182】
実験37−38
実施例9:抗酸化剤治療
PL-コンジュゲートは酸化損傷を防ぐのに適した効果的治療剤である。このことは実験45-47で示される。生組織への過酸化フリーラジカルの有害作用は酸化損傷として既知である。この損傷プロセスの標的が細胞膜である場合、膜の機能障害および不安定化が生じる。血液蛋白質、特に血液脂質蛋白質への酸化損傷は、血管を裏打ちする細胞内へのそれら物質の過剰蓄積をもたらし、その結果アテローム性動脈硬化症の原因となる。実際、酸化的細胞損傷は加齢又は老化のプロセスに関係する主要メカニズムである。
【0183】
蛋白質又は細胞膜に対する酸化損傷は、一般にはこれら組織をPLA2の様な追加の膜不安定化剤非存在下又は存在下に、酵素グルコースオキシダーゼ(GO)により作られた過酸化水素に曝すこと、又は銅の様な2価陽イオンに曝すことで評価される。
【0184】
実験44−47はアラキドン酸および低分子細胞内物質両方の細胞保持より判断される、酸化損傷から細胞を保護するPL-コンジュゲートの能力を示している。
【0185】
実験44:集密BGM(ミドリザル腎臓上皮細胞)を3H-アラキドン酸で標識した。この細胞は、GOとPLA2(0.5u/ml)で処理する前にCMPEにより30分間処理された。(図34)。
【0186】
実験45:BGM細胞を35SO4で一晩標識した。細胞をDMEM(10mg/mlのBSAを含む)PBS液にて4回洗浄した。次に細胞をGO(H2O2)を添加したDMEM中に90インキュベーションし、その培地を集めて35S放射活性を計測した。CMPEで処理する場合は、GO導入前に細胞を指定濃度CMPEと30分間インキュベーションした。各データは5重測定の平均値+SEMである。*p<0.005;**p<0.001(図35)。
【0187】
実験46:血液脂質蛋白質の酸化を阻害するPL-コンジュゲートの能力を示すことを目的とする。LDL(0.1μM)を各種濃度のHYPE又はHA非存在下又は存在下に、37℃にてイキュベーションした。0時において5μMのCuCl2が分散体に加えられ、そして混合体は245nmにて酸化産物について連続モニターされた(図36)。245nmの吸光度(OD単位)は時間の関数として描かれている(Shnitzerら、Free Radical Biol Med 24: 1924-1303, 1998)。
【0188】
実験47:有害な酸化保存状態にある、即ち光照射下に於ける赤血球細胞に対するPL-コンジュゲートの保護作用を示す。ヒトRBCは2μMのPc4(1mMPOPC、4mMシステインおよび0.5mMのL-カルニチン中)で処理され、表示の如くにPL-コンジュゲート非存在下又は存在下に15J/cm2の光を照射した(図37)。
【0189】
これら実験はPL-コンジュゲート投与が、脂質蛋白質酸化の阻害、酸化リポ蛋白質取り込みの阻害(図28、図29)を含む複数のメカニズム、および以下記載の様にアラキドン酸放出を阻害し、赤血球膜を含む細胞の膜の健全性を保存することによる、酸化的組織損傷予防の効果的な治療法であることを示している。
【0190】
実施例10:溶血
PL-コンジュゲートは溶血の治療および予防に効果的な治療剤である。このことは実験48に示されている。赤血球(RBC)が破壊する溶血はそれ自体が原発性疾患であるか、又はその他疾患又は生理学的障害に伴う症状である。一般に受け入れられている薬物による膜安定化作用評価法は、既知膜不安定化剤存在下に赤血球をインキュベーションし、細胞外媒体中へのヘモグロビンの放出を検出するものである。
【0191】
実験48:PL-コンジュゲートが膜を破壊する酵素剤に曝露されたヒト赤血球の安定性維持に役立つことを示すことを目的とする。ヒトRBCは生理食塩水で洗浄され、ハンクス(Hanks)緩衝液(-H7.4)中に懸濁された。溶血は指定の如くにPL-コンジュゲート(10μM)非存在下又は存在下に、ストレプトリジンO(SLO)5U/ml、ストレプトリジンS(SLS)25U/ml、又はリソホスファチジルコリンリパーゼ(Lyso-PC)5μg/mlで20分間誘導された。細胞膜は遠心して落とされ、540nmのODを測定することで上清のヘモグロビン含有量が決定された(表13)。
【0192】
表13.HYPE、CMPEおよびHEPPEによる溶血の防止
【表13】

【0193】
これら実験は、PL-コンジュゲートが溶血治療に有効な治療剤であり、血液製剤の保管の保存剤として価値あることを示している。(実験46)
【0194】
実施例11:敗血症
PL-コンジュゲートは敗血症としても知られるショックを伴う菌血症の治療に有効な治療剤である。このことは実験49-50に示されている。
【0195】
腫瘍壊死因子(TNF-α)は敗血性ショックの病因に関わる主要サイトカインであり、局所および全身性に放出され、組織健全性および全身の血液動態に有害且つ非可逆的な影響を及ぼす。細菌のリポポリサッカライド免疫源(LPS)に細胞を曝すとことは、敗血症状態に対するTNF-αをアッセイするために一般に使用されているモデルシステムの要素である。TNF-α以外の敗血症および敗血性ショックの病因に関連するケモカインはMCP-1、ENA-78、Gro-αおよびCX3Cである。
【0196】
実験49:ヒト組織中のTNF-α生成を阻害するPL-コンジュゲートの能力を例示するために、健康供血者より得たヘパリン(12.5U/ml)を加えたヒト静脈血を200mMのグルタミン、200U/mlのペニシリンおよい200U/mlのストレプトマイシンを添加されたRPMI-1640で1:3に希釈した。1:3希釈血液の一部(300μl)を24ウエルのマルチディスク(Multidis)プレート(Nunclon)に分配した。血液サンプルは、最終濃度100ng/mlの100μlのリポポリサッカライドE.coli026:B6(LPS)6%CO2を加える前に、加湿雰囲気中にて100μlの化合物又は溶媒と前インキュベーションされた。6時間インキュベーションした後、24ウエルプレートを遠心処理(2000rpm×10)し、ELISAを使ってサイトカイン含有量をアッセイした。各種HYPESのリン酸含有量は様々であった(図38及び図38a)。
【0197】
実験50:マウス細胞に於けるTNF-αの生成を阻害するPL-コンジュゲートの能力を示す。初代マウス腹膜マクロファージを指示濃度のPL-コンジュゲートで30分間処理した。次にLPS(1μg/ml)を培養体に直接、又はPL-コンジュゲートを洗い流した後に加えた。TNFはELISAにより決定された(図39)。
【0198】
MCP-1、ENA-78、Gro-αおよびCX3Cといったケモカインに及ぼすPL-コンジュゲートの作用は、下記実験53および54に示す。
これら実験は、PL-コンジュゲートの投与が敗血症の治療に有効な治療法であることを示している。
【0199】
実施例12:急性呼吸困難症候群(ARDS)
PL-供役体は急性呼吸困難症候群(ARDS)の治療に有効な治療剤である。このことは実験51および52に示されている。ARDSに於いて、この病気の病因と関連する4種類のケモカインはMCP-1、ENA-78、Gro-αおよびCX3Cであり、これらは例えばLPSの様な外来抗原による刺激に反応し、微小血管内皮細胞中に発現される。
【0200】
実験51:PL-供役体がヒト肺由来の微小血管上皮細胞に於けるケモカイン生成を阻害することを示す。HLMVECは指定濃度のHYPE非存在下又は存在下に1μg/mlのLPSと24時間インキュベーションされた。培地中に蓄積されたケモカインGro-α、ENA-78およびMCP-1はELISAにより決定された。ENA-78およびMCP-1の分泌は10μMのHYPEで既に阻止された(図40)。
【0201】
実験52:PL-供役体がヒト肺由来の微小血管上皮細胞に於けるケモカイン生成を阻害することを、遺伝子発現のレベルで示す(図41a-f)。
さらに上記実験1-8は、PL-供役体が収縮の阻害および気道浸潤障害物の減少を含む、複数のメカニズムにより気道狭窄を軽減し、障害性呼吸器疾患の治療に利用できることを示している。
【0202】
これら実験はPL-供役体がARDSの治療に有効な治療剤であることを示している。
【0203】
実施例13:移植臓器拒絶、同種免疫、および自己免疫疾患
PL-供役体は、組織移植に関する治療を含めた自己免疫および同種免疫疾患の治療に効果的な治療剤である。このことは下記実験53-58に示されている。自己免疫疾患は血液製剤および全臓器を含む組織をドナーからレシピエント移植した際の免疫反応に基づく組織損傷を含む。この反応はしばしば血管組織に向けられる。自己免疫疾患は、免疫を介した実質組織の直接的又は臓器脈管系を介した破壊された臓器を含む。病気の進行に於ける2つの重要事項は、リンパ細胞の増殖およびMHCグループ抗原が関係する免疫学的反応である。一般に受け入れられている薬物が提示する免疫抑制作用は、リンパ細胞の増殖を阻害する能力およびMHCグループ抗原の発現を阻害する能力である。
【0204】
実験53-55はPL供役体がヒトMHC抗原グループの発現を、基本レベルおよび刺激剤に曝された場合の両方において抑制することを示している。
実験53:ヒト内皮細胞増殖培地中に集密培養されたヒト近位尿細管内皮細胞(PTEC)を、指定時間HYPE非存在下又は存在下にコントロール培地又はIFNγ添加培地(10ng/ml)中にインキュベーションした。細胞は洗浄され、続いてトリプシン処理により可動化され、30分間FITCで蛍光標識された特異抗体とインキュベーションされた。MHC-1、MHC-2およびICAMの発現はFACSにより決定され、そして各細胞に関連した蛍光強度の中央値として表された(図42)。
【0205】
実験54:近位尿細管上皮細胞は72時間、図指定の濃度のHYPE非存在下又は存在下に培地中でインキュベーションされるか、又はIFNγ(10ng/ml)で刺激された(図42)。前表と同様の手順が用いられた。MHC-1の発現はFACSにより決定され、コントロール細胞について得られた値に対する相対値で表された(図43)。
【0206】
実験55:ヒト臍帯静脈内皮細胞を72時間、HYPE非存在下又は存在下に培地(コントロール)中で培養するか、又はIFNγで刺激した。前表と同じ手順が用いられた。MHC-1の発現はFACSにより決定され、各細胞関連蛍光強度の中央値として表された(図44)。
【0207】
実験56:PL-供役体が、各種刺激剤に反応し増殖する健康および病気の動物より得たリンパ細胞の能力を阻害することを示す。リンパ節細胞(LNC)のプールを3ないし4匹のマウスより調製した。LNCのインビトロ反応は96ウエルプレートで3重アッセイされた。(図44)。各ウエルに2.5×105のLNCをコンカナバリンA(ConA、1μg/ml)、プロテオリポ蛋白質(PLP、10μg/ml)およびLPS(50μg/ml)と共に、CMPE非存在下又は存在下に96時間加えた。最後の18時間に1μCi/ウエルの3[H]チミジンを各ウエルに加え、その後プレートをガラスファイバーフィルターに集め、液体シンチレーションを使って測定した(図45)。
【0208】
実験57−58:狭窄/再潅流実験プロトコールに於いて、PL-供役体の有効性を示す。PL-供役体の投与は虚血/再潅流が誘導する白血球の接着および血管外遊出を明瞭に抑制する。白血球はローダミン静脈注射によりインビボ標識された。露出したラット(インサイチュー)懸垂筋を90分間虚血状態にし、次に血流を再開して再潅流した。血管壁への蛍光標識白血球の接着(図46)およびそれらの血管外空間への遊出(図47)はビデオに撮られ、再潅流期間中の指定時間に数量測定された。PL-供役体(10mg.100g体重)は虚血誘導40分前および10分前に静脈注射された。図32の各データはHYPE処理した5匹のラット、およびHEPPE処理された2匹のラットの平均値±SEMである。いずれの処理もp<0.005である。図31では、5分および30分時のHYPE処理ラットはp<0.005であり、10分時はp<0.01、そして60分時はp<0.05である;HEPPE処理ラットでは、いずれの時点もp<0.01である。
【0209】
これら実験は、PL-供役体の投与が複数の免疫抑制メカニズムにより、同種免疫および自己免疫疾患の治療に有効な治療法であることを示している。
【0210】
実施例14:ウイルス感染
PL-供役体はウイルス感染、特にヒト免疫不全ウイルス(HIV)による感染の予防および治療に有効である。このことは下記実験59に示される。ウイルス感染のプロセスは、遊離ウイルス粒子が宿主細胞内に進入できる段階と病気の兆候を生じる段階を含む。薬物の抗ウイルス活性に関し一般に受け入れられているアッセイは、ウイルス剤の標本を薬物存在下にインキュベーションし、続いてヒト細胞株でのウイルス感染を試験するものである。
【0211】
実験59:PL-供役体がHIV病原体の細胞感染能力を有意に阻害することを示す。血液単位をHIVおよび指定のPL-供役体と30分間混合した。次に細胞を遠心分離して落とし、その上清についてMargolis-Nunnoら(Transfusion、36、743-750、1996)記載の様にHT4-1022細胞に対するHIV感染性を調べた。1mg/mlHEPE=50μM;1mg/mlHYPE=30μM(図48)。
【0212】
これら実験は、PL-供役体の投与が、ウイルス感染、特にHIV感染の有益な治療法であること、そして血液製剤を含む汚染物質よりウイルス粒子を根絶するのに有益であることを示している。
【0213】
実施例15:結膜炎
PL-供役体は遅延型過敏性免疫反応により誘導される過敏性結膜炎の治療に効果的である。このことは下記実験60に示される。
【0214】
実験60:10mgの卵アルブミンを0.5mlのPBSに溶解し、フレンドのアジュバントを添加した液を2回腹腔内注射し(注射の間を1週間空ける)モルモットを感作した。最初の感作から3週後に、5mgの卵アルブミンを25mlのPBSに溶解した液を滴下して第一回目のチャレンジを行い、初回チャレンジ以後3日目、4日目、5日目および6日目に再チャレンジを行った(図50)。治療を目的とし、PBS中に懸濁された薬剤(CMPE)を各動物の右目に、初回チャレンジ後3、4、5および6日目に滴下した。角膜透明度の臨床評価を5日目と6日目に行った。目のLTB4およびPGE2レベルはELISAより決定された(図51)。比較のため、ステロイド治療の効果も平行して評価された。
【0215】
実施例16:急性毒性試験
実験61:次の化合物を生きているマウスを用いた毒性アッセイで試験した:HyPE、CMPE、HeMPE、He SPEおよびCSAPE。化合物は1000、500および200mg/kg体重の1回投与量が腹腔内注射された。毒性は1週後の死亡率、体重、ヘマトクリット、血球数(赤血球および白血球)ならびに屠殺後の内臓の目視検査により評価された。これらは、未処置マウスであるコントロールと比較された。各群(上記各化合物により処理された)には6匹のマウスが使われた。
【0216】
HePPEを除く上記化合物による処理では、死亡例および上記判断基準の有意な変化は誘導されなかった。HePPE(へパリン結合PE)処理群では、3匹のマウスが出血により1週間以内に死亡した。
【0217】
HyPEはまた長期毒性についても調べられた;6匹1群に、30週間、隔日(3注射/週)に100mg/kg体重のHyPEを腹腔内注射、投与した(合計180mg/20gマウス)。毒性は上記同様に評価された。本処理による死亡例および上記基準に有意な変化は認められなかった。
【0218】
実施例17:クラミジア感染の治療
PL-供役体は細胞内細菌性寄生生物による感染、特にクラミジア種による感染症の予防および治療に有効である。このことは下記実験62ないし63に示されている。
【0219】
実験62:ヒト子宮頸部腺腫細胞株HeLa229(ATCC、マナサス(Manassas)、カリフォルニア州(CA))を培養し、30分間PL供役体(20マイクロモル)とインキュベーションされ、次にChlamydia psittaci(モルモット封入体結膜炎菌)と24時間インキュベーションした。感染細胞はFITC-標識抗クラミジア抗体(図52a)を用いたサイトフローメトリー(FACS)により検出された(図52a)。
【0220】
実験63:クラミジアによるHeLa細胞の感染に対するPL-供役体の阻害作用の用量反応を決定した(図52b):HeLa細胞は指示濃度のPL-供役体で処理され、実験62同様にクラミジアで感染させられた。
【0221】
実験64:HeLa細胞はPL-供役体で処理され、実験62同様にChlamydia psittaciaで感染させられた。アポトーシスを測定するために、界面活性剤透過処理された細胞をプロピジウムヨードで染色し、その蛍光をサイトフルオロメトリーを使い測定した(図53)。
【0222】
材料と方法
TNB-誘導大腸炎 (TNBS)シグマ(Sigma)、セントルイス(St.Louis)、ニューオリンズ(MO))を断食24時間後にヘブライ大学サブララット(Hebrew University Sabra rats)(200-250g)に直腸投与し(1mlの50%EtOH中に25mgを含む)、我々の予備実験およびこれまでの報告[ ]に習って2日間疾患の経過をモニターした。PL供役体群では、ラットに20mgのCMPE(1ml生理食塩水、体液中濃度10μMを得る量)が次の時点に腹腔内投与された:TNBS投与前18時間目、0.5時間目、投与後3時間目、18時間目および36時間目。コントロールの未処理ラットには賦形剤(生理食塩水)1mlが同時点に腹腔内投与された。このプロセスに生き残ったラットは屠殺され、10cmの遠位部結腸断片を顕微鏡を使い組織損傷について調べ、さらに縦に2分割した。一方は10%フォルマリンで固定され組織検査に用いられ、もう一方はミエロペルオキシダーゼ(MPO)活性の測定に供された。インドメタシンによる腸傷害では、動物モデルでの実験胃障害誘導に使用されるシクロオキシゲナーゼ阻害剤である(30,31)インドメタシン(シグマ(Sigma)、セントルイス(St.Louis)、ニューオリンズ(MO))を体重測定した(200-250g)ラットに腹腔内投与(1%NaHCO31ml中に6mg)が投与され、病気の発症と経過が我々の予備実験および従来の報告[29,30]に従って5日間モニターされた。CMPE処理群では、薬物(1mlの生理食塩水中に20mg)はインドメタシン投与1時間前、および6時間、24時間ならびに48時間後に投与された。コントロールの未処理ラットには同時点で1mlの賦形剤(生理食塩水)が投与された。この処理に生き残ったラットは屠殺され、十二指腸から盲腸までの肉眼および組織学的損傷について調べられた。組織学的損傷を検査するために20cmの空腸が取られた。腸損傷に関する0(損傷なし)から5(最大損傷)までの巨視的スコア化は、粘膜の変色、びらん、滲出、潰瘍形成、腸壁の肥厚および損傷領域のパーセンテージの肉眼検査により行われた。腸損傷の組織学的スコア化は0(損傷なし)から5(最大損傷)にランク付けされた5種類の判断基準:即ち潰瘍域の広さ、潰瘍の深さ、白血球浸潤の強さおよび範囲、および繊維化を肉眼で評価した平均である。腸透過性は、イヌリン-フルオロセイン(InF1、シグマ(Sigma)、セントルイス(St.Louis)、ニューオリンズ(MO))の直腸又は経口投与後[32]の、その血漿レベルを決定することで評価された。これまでの研究に於いて、我々はinF1が正常ラットの腸は透過しないが、病気のラットでは容易に吸収されることを見出している;大腸炎では血漿中のInF1により測定した腸透過性はTNBS投与後12時間目に最大となるが、小腸での傷害はインドメタシン投与後72時間目に最大となる[32]。従って大腸炎を誘導されたラットでは、TNBS投与12時間後にInF1(0.2ml生理食塩水中4mg)が直腸投与され、2時間後にエーテル麻酔したラットの尾状脈より血液サンプル(0.5ml)が採取された[32]。小腸に傷害を持つラットでは、同量のInF1がインドメタシン投与72時間後に経口投与され、それから3時間後に血液サンプルが採取された[32]。Inf1の血液レベルを決定するために、血漿が遠心分離により分離され、既報[32]に従い488nm(励起)と517nm(発光)で蛍光強度が決定された。組織ホモジェネート中のミエロペルオキシダーゼ活性はo-ジアニシジン/H2O2反応により分光光学的に決定された[19,33]。コントロールラットでは死亡率が高いことから、MPO、腸透過性および歴史損傷の決定は実験操作に胃に残ったラットに限定された。このことが、死亡したラットが最も重症の傷害を有していたにも関わらず、これらを処理および未処理動物間の比較に含めることができないという方法論的な問題を招いた。結果に記した様に、MPO活性およびInF1透過性のデータを分析する際にこの欠点を考慮した。統計分析:結果は平均値±SEMで表され、各種処理間の鎖はスチューデントt-試験により有意検定された。
【0223】
硫酸デキストランによりラットに誘導された大腸炎
3群のマウス(n=12)が対象となった。大腸炎は飲料水中4%硫酸デキストランナトリウム塩(DSS)(ICN、MW 36,000-44,000)により誘導された。ヒアウロン酸結合ホスファチジルエタノールアミン(HyPE),80μg/g体重を経口投与した(胃挿管による)。第1群では(DSS)、給餌は水道水に溶解された4%硫酸デキストランナトリウム(DSS)と共に7日間、続いて通常の水と共に7日間行われ、処理は溶媒(PBS)の経口投与により実施された。第2群(DDS+HyPE)では、給餌は水道水に溶解された4%硫酸デキストランナトリム(DDS)と共に7日間、続いて通常の水と共に7日間行われ、処理はHyPE(2×80μg/g;8mg/mlPBS保存溶液、pH=8)を経口投与し行われた。第3群(健康コントロール)は、14日間通常の水が与えられた。水は自由に摂取させた。体重は毎日測定された(処理前の実験第1日のコントロール体重から始まり、屠殺日が最終体重)。デキストラン処理はデキストラン/溶媒含有デキストラン群の体重の平均減少が3日後に一度変化するまで続けられた;水および水+デキストラン摂取量はデキストラン補給期間終了時、3日間後に決定された。Hemoccult(hemo FECR、ベーリンガーマンハイム(Boehringer Mannheim)、大きな血液の塊の存在(肛門周辺の血液凝塊(および前日が陽性でない場合には6日目に)および10日目。
【0224】
表14.疾患活動指数のスコア化の基準
【表14】

*疾患活動指数=(体重減少、便の硬さおよび出血に関するスコアの合計)/3
正常便=形のしっかりした顆粒状;軟便=肛門にこびり付かない、弛んだ便:下痢=肛門にこびり付く液状の便(Murrayら、1993)。
【0225】
血液学および肉眼検査では、動物はペントバルビツール(90mg/kg)により麻酔されてから開腹された。0.5mlの血液が腹部大動脈から採取され、血液学測定のためにK2EDTAの入ったMicrotainerRチューブに集められた。結腸の長さを決定するために、結腸を結腸-盲腸結合部から肛門にかけ切り取り、生理食塩水でフラッシュし、非吸収面の上に置いて結腸の長さを定規を使い測定した。組織学に関しては、遠位部結腸を中性緩衝化フォルムアルデヒドに最低3日間漬けた。各部分は4つの横断部分に切り分けられ、パラフィン包埋される前に通常に処理された。腺窩スコア化法(Murrayら、1993)は次の通りであった:等級O=無傷腺窩、1=腺窩の下1/3が消失、2=下2/3が消失、3=腺窩全体が消失するが表面の上皮が残る、4=粘膜の完全なビラン。%波及面積:1=1-25%、2=25-50%、3=51-75%、4=76-100%。等級値スコアに%波及スコアを乗じた(最大スコア=16)。傷害スコア化法(組織中のWBC、Murayら、1993)は次の通りであった:0=なし、1=軽度、2=中度、3=重度。%波及面積:1=1-25%、2=25-50%、3=51-75%、4=76-100%。各4部分について傷害スコアに%波及スコアを乗じた(最大スコア=12)。リンパ'節'の数=正常リンパ節を含む、リンパ細胞(切片当たり)の累積数:リンパ細胞数が20細胞より多い全ての群を一つにまとめ、1累積群とされた。Okayasuら、Gastroenterology、98、694(1990)。Murthyら、Dig Dis Sci, 38, 1722(1993)。
【0226】
疾患重症度のEAE-スコア化は、以下の尺度に基づいた実験動物の観察を通じ毎日実施された:
【0227】
【表15】

【0228】
遅延型過敏反応 メスの8-12週齢のbalb/cマウスを、0日目に毛を剃った胃部に2%オキサゾロンDMSO:生理食塩水/1:18液50μlを局所適用して感作し、6日後(第6日)に両側の両耳にオキサロゾン液を局所適用し(片側当たり5μL)チャレンジを実施した。試験対象のPL-コンジュゲートは、0日から6日目まで、対応する表に指定された投与量にて、以下概略示す洋式で投与された。過敏反応は抗原チャレンジ24時間後に、耳の腫れを測定すること(マイクロメーターを用いて)および結果を処理前に同一マウスより得た測定値と比較することで評価された。
【0229】
マクロファージからのアラキドン酸およびオレイン酸の放出.マクロファージに関しては、マウスP388D1細胞は[3H]オレイン酸で前標識され、そしてPL-コンジュゲートで30分間処理され、LPS存在下(?)又は非存在下(0)に20時間インキュベーションされた(図19)。イスコフ(Iscove)の改良ダルベッコ(Dulbecco's)培地(エンドトキシン<0.05ng/ml)はホイッタカーバイオプロダクツ(Whittaker Bioproducts)(ウォーカーズビル、マサチューセッツ州(Walkersville、MD)より得た。胎児ウシ血清はハイクローンラブス(Hyclone Labs.)(ローガン、ユタ州(Logan、UT))より得た。非必須アミノ酸はアーバインサイエンティフィック(Irvine Scientific)(サンタアナ、カリフォルニア州(Santa Ana, CA))より得た。[9,10-3H]オレイン酸(比活性55Ci/mmol)はニューイングランドヌクレアー(New England Nuclear)(ボストン、マサチューセッツ州(Boston, MA))より得た。LPS(E.coli 0111:B4)はシグマ(Sigma)(セントルイス、ニューオリンズ(St.Louis、NO))より得た。P388D1細胞(MAB)クローン(5,6)は90%空気と10%CO2の加湿外気中、37度にて、10%胎児ウシ血清、2mMグルタミン、100単位/mlペニシリン、100μg/mlストレプトマイシンおよび非必須アミノ酸が追加されたイスコフの改良型ダルベッコ培地中に維持された。P388D1細胞はウエル当たり106個接種され、一晩接着させられ、翌日実験に使用された。実験は全て無血清のイスコフ改良型ダルベッコ培地中にて実施された。P388D1細胞の[3H]OAによる放射線標識は、一晩の接着期間中(20h)に5μCi/mlの[3H]OAを加えることで達成された。細胞脂質に取り込まれなかった標識OAは細胞を6回、1mg/mlのアルブミンを含む無血清培地で洗浄することで取り除かれた。細胞外への[3H]オレイン酸放出を測定するために、細胞を0.5mg/mlのウシ血清アルブミン存在下、各種時間LPS又は外来性PL-標識体を添加する前に、無血清培地内に30分間置いた。上清を取り除き、剥がしとった細胞を遠心により清浄化し、液体シンチレーション測定により放射活性をアッセイした。LPS-刺激によるOA放出は、アゴニストおよび阻害剤非存在下で観察されたベースの率を差し引いて表された。これらバックグランド値は1000-2000cpmの範囲内であった。各実験セットは少なくとも3回繰り返され、同様の結果を得た。特記ない限り、提示データは代表実験のものである。
【0230】
腫瘍細胞浸潤アッセイ 走化性物質浸潤アッセイに関しては、ポリビニルピロリドンを含まないポリカーボネートファイバー製、8μMポアサイズを25μgお基底膜成分混合物(Matrigel)でコーティングし、改良型ボイデン(Boyden)チャンバー内に置いた。細胞(2×105)は短時間EDTA(1mM)に曝されことでそれらの培養皿より剥離され、遠心分離にかけられ、0.1%BSA/DMEMに再懸濁され、ボイデンチャンバーの上部コンパートメント内に入れられた。繊維芽細胞コンディショニング培地を走化性物質源として下部コンパートメントに入れた。37℃にて6時間インキュベーションした後、フィルターの下面上にある細胞をDiff-Quick(アメリカンサイエンティフックプロダクツ(American Scientific Products))で染色し、オリンパスCK2顕微鏡に備え付けられたイメージアナライザー(Optomax V)を使って定量化した。データはフィルター下面上の未処理細胞占有面積に対し表された。(Albiniら、A Rapid in Vitro Assay for Quantitating the Invasive Potential of Tumor Cells. Cancer Res. 47:3239-3245, 1987)。
【特許請求の範囲】
【請求項1】
式:

[式中、
R1は、炭素原子2〜30の長さの線状、飽和、モノ−不飽和、又はポリ−不飽和、アルキル鎖であり;
R2は、炭素原子2〜30の長さの線状、飽和、モノ−不飽和、又はポリ−不飽和、アルキル鎖であり;
Yは、何もないか、又は原子2〜30の長さのスペーサー基のいずれかであって、ここで、前記スペーサーは−CO−アルキレン−NH−、−CO−アルキレン−CO−、又はそれらの組み合わせを含み;
Xは、生理学的に許容しうるモノマー、ダイマー、又はオリゴマーのいずれかであって、ここで、Xはグリコサミノグリカンであり;そして
nは1から1,000の数である]
で表される化合物。
【請求項2】
喘息を治療するために使用する組成物の製造における、請求項1に記載の化合物の使用。
【請求項3】
閉塞性呼吸疾患を治療するために使用する組成物の製造における、請求項1に記載の化合物の使用。
【請求項4】
皮膚科状態を治療するために使用する組成物の製造における、請求項1に記載の化合物の使用。
【請求項5】
腸疾患を治療するために使用する組成物の製造における、請求項1に記載の化合物の使用。
【請求項1】
式:

[式中、
R1は、炭素原子2〜30の長さの線状、飽和、モノ−不飽和、又はポリ−不飽和、アルキル鎖であり;
R2は、炭素原子2〜30の長さの線状、飽和、モノ−不飽和、又はポリ−不飽和、アルキル鎖であり;
Yは、何もないか、又は原子2〜30の長さのスペーサー基のいずれかであって、ここで、前記スペーサーは−CO−アルキレン−NH−、−CO−アルキレン−CO−、又はそれらの組み合わせを含み;
Xは、生理学的に許容しうるモノマー、ダイマー、又はオリゴマーのいずれかであって、ここで、Xはグリコサミノグリカンであり;そして
nは1から1,000の数である]
で表される化合物。
【請求項2】
喘息を治療するために使用する組成物の製造における、請求項1に記載の化合物の使用。
【請求項3】
閉塞性呼吸疾患を治療するために使用する組成物の製造における、請求項1に記載の化合物の使用。
【請求項4】
皮膚科状態を治療するために使用する組成物の製造における、請求項1に記載の化合物の使用。
【請求項5】
腸疾患を治療するために使用する組成物の製造における、請求項1に記載の化合物の使用。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8A】


【図8B】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】


【図37】


【図38】


【図38A】


【図39】


【図40A】


【図40B】


【図40C】


【図41】


【図42】


【図43】


【図44】


【図45】


【図46】


【図47】


【図48】


【図49】


【図50】


【図51】


【図52】


【図53】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8A】


【図8B】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【図23】


【図24】


【図25】


【図26】


【図27】


【図28】


【図29】


【図30】


【図31】


【図32】


【図33】


【図34】


【図35】


【図36】


【図37】


【図38】


【図38A】


【図39】


【図40A】


【図40B】


【図40C】


【図41】


【図42】


【図43】


【図44】


【図45】


【図46】


【図47】


【図48】


【図49】


【図50】


【図51】


【図52】


【図53】


【公開番号】特開2011−153323(P2011−153323A)
【公開日】平成23年8月11日(2011.8.11)
【国際特許分類】
【出願番号】特願2011−105921(P2011−105921)
【出願日】平成23年5月11日(2011.5.11)
【分割の表示】特願2001−551427(P2001−551427)の分割
【原出願日】平成13年1月10日(2001.1.10)
【出願人】(592024572)イッサム・リサーチ・ディベロップメント・カンパニー・オブ・ザ・ヘブルー・ユニバーシティ・オブ・エルサレム・リミテッド (6)
【Fターム(参考)】
【公開日】平成23年8月11日(2011.8.11)
【国際特許分類】
【出願日】平成23年5月11日(2011.5.11)
【分割の表示】特願2001−551427(P2001−551427)の分割
【原出願日】平成13年1月10日(2001.1.10)
【出願人】(592024572)イッサム・リサーチ・ディベロップメント・カンパニー・オブ・ザ・ヘブルー・ユニバーシティ・オブ・エルサレム・リミテッド (6)
【Fターム(参考)】
[ Back to top ]

