疾患を治療するのに有用なトリアゾール誘導体
本発明は、式(1)の化合物ならびにそのような誘導体を調製するためのプロセス、その誘導体の調製において使用される中間体、その誘導体を含有する組成物およびその誘導体の使用に関する。本発明による化合物は、多数の疾患、障害および状態、特に、炎症性、アレルギー性および呼吸性の疾患、障害および状態に有用である。
【化1】

【化1】

【発明の詳細な説明】
【技術分野】
【0001】
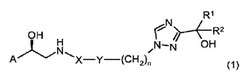
本発明は、一般式(1)
【0002】
【化1】

(式中、A、X、Y、n、R1およびR2は、下に示される意味を有する)の化合物、ならびにそのような誘導体を調製するためのプロセスおよび中間体、その誘導体を含有する組成物およびその誘導体の使用に関する。
【背景技術】
【0003】
β2アドレナリン作動性作動薬およびコリン作動性ムスカリン性拮抗薬は、COPDおよび喘息などの閉塞性呼吸性疾患を治療するための十分に確立した治療薬である。現在使用されている吸入β2作動薬は、サルブタモール(q.i.d.)、およびテルブタリン(t.i.d)などの短時間作用型薬剤とサルメテロールおよびフォルモテロール(q.i.d.)などの長時間作用型薬剤の両方を包含し、気道平滑筋上のアドレナリン作動性受容体の刺激を介して気管支拡張を引き起こす。臨床使用における吸入ムスカリン性拮抗薬は、短時間作用型のイプラトロピウムブロミド(q.i.d.)、オキシトロピウムブロミド(q.i.d)および長時間作用型のチオトロピウム(q.d.)を包含する。ムスカリン性拮抗薬は、主に、気道平滑筋上に存在するムスカリン性受容体に対するアセチルコリンの作用と拮抗することにより、気道のコリン作動性緊張を阻害することにより気管支拡張を引き起こす。多くの公表された研究は、閉塞性肺疾患患者への吸入β2作動薬と吸入ムスカリン性拮抗薬(短時間作用型か長時間作用型かに関わらず)の併用投与が、どちらか単一クラスの薬剤を単独で投与された患者と比較して肺機能、症状および生活の質の尺度における優れた改善をもたらすことを立証している。今日までの研究は、単一薬理作用の薬剤を用いた併用研究に限定されてきたが、単一分子内における2つの薬理の組合せは、単一薬剤と同様の治療係数で気管支拡張効果を増加させるか、または優れた治療係数で同様の効果をもたらす可能性があるために望ましいであろう。さらに、単一分子において2つの薬理作用を組み合わせることは、抗炎症薬と組み合わせる可能性を与え、単一吸入器からの3重療法をもたらすであろう。
【発明の概要】
【発明が解決しようとする課題】
【0004】
したがって、好ましくは吸入経路による、呼吸性疾患の治療に適している、β2受容体作動薬およびムスカリン性拮抗薬として活性な代替化合物が必要である。そのような化合物は、例えば、効力、薬物動態または作用持続時間に関して、適切な薬理学的プロファイルを有するであろう。さらに、これらの化合物は、喘息またはCOPDなどの慢性疾患を治療するために使用されることがあるため、これらの化合物は、同時投与される化合物と相互作用する可能性が低いことが好ましいであろう。
【課題を解決するための手段】
【0005】
本発明は、一般式(1)
【0006】
【化2】

(式中、
Aは、
【0007】
【化3】

(式中、*は、ヒドロキシを保有する炭素とのAの接続点を表す)から選択され、
Xは、−(CH2)m−(mは、7〜12(両端を含む)の整数である)であるか、式
【0008】
【化4】

であり、
Yは、
【0009】
【化5】

(式中、**および***は、接続点を表し、**は、Xと連結している)から選択され、
nは、0または1であり、
R1は、シクロペンチル、シクロヘキシル、フェニル、フラニルおよびチオフェニルから選択され、
R2は、フェニル、フラニルおよびチオフェニルから選択される)
の化合物、もしくは薬学的に許容できるその塩、または薬学的に許容できる前記化合物もしくは塩の溶媒和物に関する。
【0010】
式(1)の化合物は、特に吸入経路を介して投与される場合に、優れた効力を示すことにより、前記受容体が関わる疾患および/または状態を治療するのに特に有用であるβ2アドレナリン作動性受容体作動薬およびムスカリン性受容体拮抗薬である。
【0011】
式(1)の化合物は、様々な方法で調製することができる。下の経路は、A、X、Y、n、R1およびR2が、特に指定のない限り、式(1)の化合物について以前に定義されている通りであるこれらの化合物を調製する1つのそのような方法を例示している。当業者は、他の経路が同等に実行可能であり得ることを理解するであろう。
【0012】
式(1)
【0013】
【化6】

(1)
のアミン誘導体は、
式(2)
【0014】
【化7】

のアミンを、
式(3)
【0015】
【化8】

(式中、A1は、ベンジルなどの適当なフェノール保護基で保護されているAを表す)のブロミドと反応させることにより調製することができる。
【0016】
典型的手順において、式(2)のアミンを、12〜72時間にわたって80℃〜120℃の温度にて、場合により適当な塩基(例えば、トリエチルアミン、ジイソプロピルエチルアミン、炭酸カリウム、炭酸水素ナトリウム)の存在下、場合により溶媒または溶媒の混合物(例えば、ジメチルスルホキシド、トルエン、N,N−ジメチルホルムアミド、プロピオニトリル、アセトニトリル、ブチロニトリル、ジクロロメタン)の存在下、式(3)のブロミドと反応させる。次いで、tert−ブチルジメチルシリルおよびベンジルなどの保護基は、教科書T.W.Greene、Protective Groups in Organic Synthesis(Wiley−Interscience Publication、1981)中に見いだされるものなどの酸素保護基を切断するための標準的な方法論を使用して除去することができる。
【0017】
A1が下に表される式(3)の化合物は、下記の参考文献に開示されている方法に従って調製することができる。
【0018】
【化9】

【0019】
式(2)のアミンは、式(4)
【0020】
【化10】

(式中、RaおよびRbは、tert−ブトキシカルボニルなどの適当な保護基を表すか、一緒にフタルイミドを表す)の対応する保護されたアミンから調製することができる。
【0021】
典型的手順において、式(4)のアミンを、教科書T.W.Greene、Protective Groups in Organic Synthesis(Wiley−Interscience Publication、1981)中に見いだされるものなどの窒素保護基を切断するための標準的な方法論を使用して脱保護する。
【0022】
式(4)のアミンは、式(5)
【0023】
【化11】

(式中、pおよびqは、1または2から独立して選択される)の対応するアミンを、式(6)
【0024】
【化12】

(式中、RaおよびRbは、以前に定義されている通りであり、LGは、ブロミドまたはメシレートなどの適当な脱離基である)の化合物と反応させることにより調製することができる。
【0025】
典型的手順において、式(5)のアミンを、18〜48時間にわたって、50℃〜90℃の温度にて、適当な塩基(例えば、トリエチルアミン、ジイソプロピルエチルアミン)の存在下、および場合により求核性添加物(例えば、ヨウ化ナトリウム)の存在下、適当な溶媒(例えば、ジメチルスルホキシド、トルエン、N,N−ジメチルホルムアミド、プロピオニトリル、アセトニトリル、メチルエチルケトン)中で式(6)の化合物と反応させる。
【0026】
式(1)の化合物の調製にとってのそれらの有用性に加え、式(5)の化合物は、ムスカリン性拮抗薬として使用することもできる。特に、それらは、ムスカリン性受容体の活性の調節により軽減することができる疾患の治療にとって有用であり得る。
【0027】
LGがブロミドである式(6)の化合物は、対応するアミン求核試薬RaRbNHを、式(7)
【0028】
Br−X−Br (7)
の対応するジブロミドと反応させることにより調製することができる。
【0029】
典型的手順において、フタルイミドまたはジ−tert−ブチルイミノジカルボキシレート(RaRbNH)を、最長で1時間にわたって0℃〜室温の温度にて、N,N−ジメチルホルムアミドまたはテトラヒドロフランなどの適当な溶媒中、水素化ナトリウム(油中60%分散液)などの適当な塩基と反応させ、続いて、6〜48時間にわたって、0℃〜150℃の温度にて、式(7)のジブロミドを加える。
【0030】
式RaRbNHのアミンは、市販されている。
【0031】
Xが−(CH2)m−である式(7)の化合物は、市販されている。
【0032】
Xが、式
【0033】
【化13】

である式(7)の化合物は、Journal of Organic Chemistry、46(22)、4608〜10;1981に記載されているように調製することができる。
【0034】
あるいは、RaおよびRbが一緒にフタルイミドを表し、Xが、式
【0035】
【化14】

である式(6)の化合物は、下のスキーム1
【0036】
【化15】

(RaおよびRbは、一緒にフタルイミドを表す)に記載されているように調製することができる。
【0037】
式(8)および(9)の化合物は、市販されている。
【0038】
式(10)の化合物は、ヘック反応(プロセスステップ(i))により式(8)および(9)の化合物から調製することができる。典型的条件は、21時間にわたって90℃にて、アセトニトリルなどの適当な溶媒中、式(8)の化合物を化合物(9)、トリ−O−トリルホスフィン、酢酸パラジウム(II)およびジイソプロピルエチルアミンなどの適当な塩基と反応させることを含む。
【0039】
式(11)の化合物は、水素化(プロセスステップ(ii))により式(10)の化合物から調製することができる。典型的条件は、18時間にわたって80℃にて、酢酸エチルおよびエタノールなどの適当な溶媒中、式(10)の化合物をギ酸アンモニウムおよび30%炭素上水酸化パラジウムと反応させることを含む。代替条件は、24時間にわたって20psiおよび室温にて、酢酸エチルおよびエタノールなどの適当な溶媒中、式(10)の化合物を水素ガスおよび塩化トリス(トリフェニルホスフィン)ロジウムと反応させることを含む。
【0040】
LGがブロミドである式(6a)の化合物は、臭素化(プロセスステップ(iii))により式(11)の化合物から調製することができる。典型的条件は、4時間にわたって還流状態にて、トルエンなどの適当な溶媒中、式(11)の化合物を三臭化リンと反応させることを含む。
【0041】
LGがメシレートである式(6a)の化合物は、メシル化(プロセスステップ(iii))により式(11)の化合物から調製することができる。典型的条件は、1〜4時間にわたって0℃〜室温にて、トリエチルアミンなどの適当な塩基と共に、メチルエチルケトンなどの適当な溶媒中、式(11)の化合物を塩化メタンスルホニルと反応させることを含む。
【0042】
式(5)のアミンは、式(12)
【0043】
【化16】

(式中、Rcは、tert−ブトキシカルボニルまたはベンジルオキシカルボニルなどの適当な保護基を表す)の対応する保護されたアミンから調製することができる。
【0044】
典型的手順において、式(12)のアミンを、教科書T.W.Greene、Protective Groups in Organic Synthesis(Wiley−Interscience Publication、1981)中に見いだされるものなどの窒素保護基を切断するための標準的な方法論を使用して脱保護する。
【0045】
式(12)のアミンは、式(13)
【0046】
【化17】

(式中、LGは、ブロミドまたはメシレートなどの適当な脱離基である)の対応する化合物を、
式(14)
【0047】
【化18】

の化合物と反応させることにより調製することができる。
【0048】
典型的手順において、式(13)の化合物を、5〜48時間にわたって、70℃〜150℃の温度にて適当な塩基(例えば、炭酸カリウム、炭酸セシウム、トリエチルアミン、ジイソプロピルエチルアミン)の存在下、適当な溶媒(例えば、N,N−ジメチルホルムアミド、プロピオニトリル、アセトニトリル、アセトン)中で式(14)の化合物と反応させる。
【0049】
式(13)の化合物は、市販されているか、当業者に知られている方法に従って調製することができる。
【0050】
特に、Rcがtert−ブトキシカルボニルであり、pおよびqが、1または2を表し、nが0であり、LGがメシレートである式(13)の化合物は、市販されている。Rcがtert−ブトキシカルボニルであり、pおよびqが1であり、nが1であり、LGがメシレートである式(13)の化合物は、米国特許出願公開第2005101586号に記載されているように調製することができる。Rcがtert−ブトキシカルボニルであり、pが1であり、qが2であり、nが1であり、LGがブロミドまたはメシレートである式(13)の化合物は、市販されている。最後に、Rcがtert−ブトキシカルボニルまたはベンジルオキシカルボニルであり、pおよびqが2であり、nが1であり、LGがブロミドである式(13)の化合物は、市販されている。
【0051】
式(14)の化合物は、式(15)
【0052】
【化19】

の対応するアミドから調製することができる。
【0053】
典型的手順において、式(15)の化合物を、2時間にわたって90℃にてN,N−ジメチルホルムアミドジメチルアセタールと反応させる。過剰のN,N−ジメチルホルムアミドジメチルアセタールを真空中で除去し、残渣を、トルエンなどの適当な溶媒と共沸させる。ヒドラジン水和物と、続いて、氷酢酸を加え、2時間にわたって90℃にて加熱する。
【0054】
式(15)の化合物は、式(16)
【0055】
【化20】

の対応する酸から調製することができる。
【0056】
典型的手順において、式(16)の化合物を、1時間にわたって室温にてジクロロメタンまたはテトラヒドロフランなどの適当な溶媒中でカルボニルジイミダゾールと反応させ、続いて、18時間にわたって室温にて0.880アンモニア水溶液を加える。
【0057】
式(16)の化合物およびそれらの対応する単一鏡像異性体は、適切なように、市販されているか、文献で知られているか、文献に記載されているように、または文献中のものに類似した方法により調製することができるかのいずれかである。そのような情報またはそのような情報に言及している関連文献の例は、WO2002/053564、WO2006/048225、WO2001/04118、WO2003/057694、WO2004/052857、WO96/33973、Journal of Organic Chemistry、46(14)、2885〜9;1981、Journal of Organic Chemistry(1961)、26、1573〜7、Chimica Therapeutica(1966)、(4)、238〜45およびJournal of Medicinal Chemistry、44(20)、3244〜3253;2001を包含するが、これらに限定されるものではない。
【0058】
例えば、式(16a)
【0059】
【化21】

の化合物は、(2R)−2−シクロヘキシル−2−ヒドロキシ−2−フェニル酢酸として市販されている。
【0060】
あるいは、式(14)の化合物は、式(17)
【0061】
【化22】

の対応する化合物から調製することができる。
【0062】
典型的手順において、式(17)の化合物を、3時間にわたって、還流状態にて、エタノールなどの適当な溶媒中で水素化ホウ素ナトリウムと反応させる。
【0063】
式(17)の化合物は、式(18)
【0064】
【化23】

の化合物を、
式(19)
【0065】
【化24】

の化合物と反応させることにより調製することができる。
【0066】
典型的手順において、式(18)の化合物を、1時間にわたって−78℃〜室温にて、テトラヒドロフランなどの適当な溶媒中、n−ブチルリチウムなどの適当な塩基と反応させ、続いて、18時間にわたって−78℃〜室温の温度にてテトラヒドロフラン中の式(19)の化合物を加える。
【0067】
式(18)の化合物は、Tetrahedron:Asymmetry、8(9)、1491〜1500;1997に記載されているように調製することができる。
【0068】
式(19)の化合物は、市販されているか、文献に記載されているように、または文献中のものに類似した方法により調製することができるかのいずれかである。そのような情報の関連文献の例は、Tetrahedron Letters、49(11)、1884〜1888;2008、Tetrahedron Letters、46(44)、7627〜7630;2005、Synthesis、(13)、1970〜1978;2007、Journal of Organic Chemistry、55(4)、1286〜91;1990、米国特許第5969159号、Tetrahedron Letters、47(10)、1649〜1651;2006、Journal of Chemical Research、Synopses、(9)、280〜1;1984、Synthesis、(3)、242〜3;1991、Journal of Chemical Society、Perkin Transactions 2:Physical Organic Chemistry(1972〜1999)、(11)、1741〜51;1989、およびSynthetic Communications、34(23)、4249〜4256;2004を包含するが、これらに限定されるものではない。
【0069】
式(1)の化合物の調製は、すでに記載されている方法に加えて、潜在的な反応性官能基の保護を必要とすることがある。そのような場合に、適合する保護基の例ならびに保護および脱保護のそれらの特定の方法は、T.W.GreeneおよびP.Wutzによる「Protecting Groups in Organic Synthesis」(Wiley−Interscience Publication、1981)またはP.J.Kocienskiによる「Protecting groups」(Georg Thieme Verlag、1994)に記載されている。
【0070】
式(1)の化合物ならびにそれらを調製するための中間体は、様々なよく知られている方法、例えば、結晶化またはクロマトグラフィーに従って精製および単離することができる。
【0071】
下記の置換基、または下記の置換基の組合せを含有する式(1)の化合物のサブグループが好ましい。
【0072】
Aは、式
【0073】
【化25】

(式中、*は、ヒドロキシルを保有する炭素とのAの接続点を表す)であることが好ましい。
【0074】
Xは、(CH2)9であるか、式
【0075】
【化26】

であることが好ましい。
【0076】
好ましい実施形態において、Xは、(CH2)9である。
【0077】
別の好ましい実施形態において、Xは、式
【0078】
【化27】

である。
【0079】
Yは、式
【0080】
【化28】

(式中、**および***は、接続点を表し、**は、Xと連結している)であることが好ましい。
【0081】
R1は、フェニルまたはシクロヘキシルであることが好ましい。
【0082】
R2は、フェニルであることが好ましい。
【0083】
nは、1であることが好ましい。
【0084】
R1およびR2が異なる場合、これら2つの置換基を保有する炭素原子は、(R)または(S)立体配置であってよい。R1およびR2を保有する炭素原子は、R1およびR2が異なる場合に(R)立体配置であることが好ましい。
【0085】
Aが、式
【0086】
【化29】

(式中、*は、ヒドロキシを保有する炭素とのAの接続点を表す)であり、
Xが、−(CH2)9−であるか、式
【0087】
【化30】

であり、
Yが、式
【0088】
【化31】

(式中、**および***は、接続点を表し、**は、Xと連結している)であり、
nが1であり、
R1が、シクロヘキシルまたはフェニルであり、R2がフェニルである式(1)の化合物、もしくは薬学的に許容できるその塩、または薬学的に許容できる前記化合物もしくは塩の溶媒和物がさらに好ましい。
【0089】
下記の化合物がより好ましい。
5−[(1R)−2−({9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン、
5−[(1R)−2−({9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン ナフタレン−1,5−ジスルホン酸塩、
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン、
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン ナフタレン−1,5−ジスルホン酸塩、
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン コハク酸塩、
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン フマル酸塩、
5−[(1R)−2−({9−[4−({3−[シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン、
8−ヒドロキシ−5−[(1R)−1−ヒドロキシ−2−({9−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]キノリン−2(1H)−オン、および
8−ヒドロキシ−5−[(1R)−1−ヒドロキシ−2−{[2−(4−{2−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}エチル]キノリン−2(1H)−オン。
【0090】
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オンがさらにより好ましい。
【0091】
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン ナフタレン−1,5−ジスルホン酸塩が最も好ましい。
【0092】
式(1)の化合物の薬学的に許容できる塩は、それらの酸付加塩および塩基塩を包含する。適当な酸付加塩は、無毒性の塩を形成する酸から形成される。例は、酢酸塩、アスパラギン酸塩、安息香酸塩、ベシル酸塩、重炭酸塩/炭酸塩、重硫酸塩/硫酸塩、ホウ酸塩、カンシル酸塩、クエン酸塩、エジシル酸塩、エシル酸塩、ギ酸塩、フマル酸塩、グルセプト酸塩、グルコン酸塩、グルクロン酸塩、ヘキサフルオロリン酸塩、ヒベンズ酸塩、塩酸塩/塩化物、臭化水素酸塩/臭化物、ヨウ化水素酸塩/ヨウ化物、イセチオン酸塩、乳酸塩、リンゴ酸塩、マレイン酸塩、マロン酸塩、メシル酸塩、メチル硫酸塩、ナフチレート(naphthylate)、1,5−ナフタレンジスルホン酸塩、2−ナプシル酸塩、ニコチン酸塩、硝酸塩、オロチン酸塩、シュウ酸塩、パルミチン酸塩、パモ酸塩、リン酸塩/リン酸水素塩/リン酸二水素塩、糖酸塩、ステアリン酸塩、コハク酸塩、酒石酸塩、トシル酸塩およびトリフルオロ酢酸塩を包含する。適当な塩基塩は、無毒性の塩を形成する塩基から形成される。例は、アルミニウム、アルギニン、ベンザチン、カルシウム、コリン、ジエチルアミン、ジオラミン、グリシン、リシン、マグネシウム、メグルミン、オラミン、カリウム、ナトリウム、トロメタミンおよび亜鉛塩を包含する。酸および塩基のヘミ塩、例えば、ヘミ硫酸塩およびヘミカルシウム塩も形成することができる。適当な塩の総説については、StahlおよびWermuthによる「Handbook of Phamaceutical Salts:Properties,Selection,and Use」(Wiley−VCH、Weinheim、Germany、2002)を参照されたい。
【0093】
薬学的に許容できる式(1)の化合物の塩は、3つの方法のうちの1つまたは複数により、すなわち、
(i)式(1)の化合物を望ましい酸または塩基と反応させることにより、
(ii)望ましい酸または塩基を使用し、式(1)の化合物の適当な前駆体から酸もしくは塩基に不安定な保護基を除去するか、適当な環状前駆体、例えば、ラクトンもしくはラクタムを開環することにより、または
(iii)適切な酸もしくは塩基との反応により、または適当なイオン交換カラムによって、式(1)の化合物の1つの塩を別の塩に変換することにより調製することができる。3つの反応はすべて、典型的には、溶液中で行われる。得られる塩は、沈殿させて濾過により集めるか、溶媒の蒸発により回収することができる。得られる塩におけるイオン化の程度は、完全にイオン化されたものからほとんどイオン化されていないものまでと様々であってよい。
【0094】
本発明の化合物は、非溶媒和形態と溶媒和形態の両方で存在することがある。「溶媒和物」という用語は、本明細書において、本発明の化合物またはその塩および化学量論的量の1種または複数の薬学的に許容できる溶媒分子、例えばエタノールを含む分子錯体について記載するために使用される。「水和物」という用語は、前記溶媒が水である場合に用いられる。
【0095】
上述の溶媒和物と対照的に、薬物およびホストが化学量論的または非化学量論的な量で存在するクラスレート、薬物−ホスト包接錯体などの錯体も本発明の範囲内に包含される。化学量論的または非化学量論的な量であってよい2種以上の有機および/または無機構成成分を含有する薬物の錯体も包含される。得られる錯体は、イオン化、部分的イオン化、または非イオン化であってよい。そのような錯体の総説については、HaleblianによるJ Pharm Sci、64(8)、1269〜1288(August 1975)を参照されたい。
【0096】
本明細書では以後、式(1)の化合物へのすべての言及は、それらの塩、溶媒和物および錯体、ならびにそれらの塩の溶媒和物および錯体への言及を包含する。
【0097】
本発明の化合物は、それらのすべての多形体および晶癖、本明細書で後に定義するようなそれらのプロドラッグおよび異性体(光学異性体、幾何異性体および互変異性体を包含する)ならびに式(1)の同位体標識化合物を包含する本明細書で前に定義されているような式(1)の化合物を包含する。
【0098】
示すように、式(1)の化合物のいわゆる「プロドラッグ」も、本発明の範囲内にある。すなわち、それら自体が薬理学的活性をほとんど、またはまったく有していないことがある式(1)の化合物のある誘導体は、体内または体表に投与された場合、例えば加水分解切断により、望ましい活性を有する式(1)の化合物に変換されることがある。そのような誘導体は、「プロドラッグ」と呼ばれる。プロドラッグの使用に関するさらなる情報は、「Pro−drugs as Novel Delivery Systems、第14巻、ACS Symposium Series(T.HiguchiおよびW.Stella)および「Bioreversible Carriers in Drug Design」、Pergamon Press、1987(E.B.Roche編、American Pharmaceutical Association)中に見いだすことができる。
【0099】
本発明によるプロドラッグは、例えば、式(1)の化合物中に存在する適切な官能基を、例えば、H.Bundgaardによる「Design of Prodrugs」(Elsevier、1985)に記載の「プロモイエティ(pro−moiety)」として当業者に知られているある部分で置き換えることにより製造することができる。
【0100】
本発明によるプロドラッグの一部の例は、
(i)式(1)の化合物がアルコール官能基(−OH)を含有する場合はそのエーテル、例えば、式(1)の化合物のアルコール官能基の水素が、(C1〜C6)アルカノイルオキシメチルにより置き換えられている化合物、および
(ii)式(1)の化合物が一級または二級アミノ官能基(−NH2またはRがHではない−NHR)を含有する場合はそのアミド、例えば、場合によって、式(1)の化合物のアミノ官能基の一方または両方の水素が、(C1〜C10)アルカノイルにより置き換えられている化合物を包含する。
【0101】
上記の例および他のプロドラッグタイプの例による置換基のさらなる例は、上述の参考文献中に見いだすことができる。
【0102】
さらに、式(1)のある化合物は、それら自体で式(1)の他の化合物のプロドラッグとしての役割を果たすことがある。
【0103】
式(1)の化合物の代謝産物、すなわち、薬物の投与によってインビボで形成される化合物も本発明の範囲内に包含される。本発明による代謝産物の一部の例は、
(i)式(1)の化合物がメチル基を含有する場合はそのヒドロキシメチル誘導体(−CH3→−CH2OH)、
(ii)式(1)の化合物がアルコキシ基を含有する場合はそのヒドロキシ誘導体(−OR→−OH)、
(iii)式(1)の化合物が三級アミノ基を含有する場合はその二級アミノ誘導体(−NR1R2→−NHR1または−NHR2)、
(iv)式(1)の化合物が二級アミノ基を含有する場合はその一級誘導体(−NHR1→−NH2)、
(v)式(1)の化合物がフェニル部分を含有する場合はそのフェノール誘導体(−Ph→−PhOH)、および
(vi)式(1)の化合物がアミド基を含有する場合はそのカルボン酸誘導体(−CONH2→COOH)を包含する。
【0104】
R1およびR2が異なる式(1)の化合物は、立体異性体として存在することがある。構造異性体が、低いエネルギー障壁を介して相互変換可能である場合、互変異性(tautomeric isomerism)(「互変異性(tautomerism)」)が生じることがある。これは、例えば、イミノ、ケト、またはオキシム基を含有する式(1)の化合物におけるプロトン互変異性、または芳香族部分を含有する化合物におけるいわゆる原子価互変異性の形態をとることがある。したがって、単一の化合物が、2種以上のタイプの異性を示すことがある。特に、本発明は、トリアゾール部分が異なる位置異性体として存在することがある式(1)の化合物を包含する。
【0105】
2種以上のタイプの異性を示す化合物、およびそれらの1つまたは複数の混合物を包含する式(1)の化合物のすべての立体異性体、および互変異性体は、本発明の範囲内に包含される。対イオンが光学活性である、例えば、d−乳酸塩もしくはl−リシンであるか、またはラセミである、例えば、dl−酒石酸塩もしくはdl−アルギニンである酸付加塩または塩基塩も包含される。
【0106】
個々の鏡像異性体を調製/分離するための従来技法は、適当な光学的に純粋な前駆体からのキラル合成、または、例えば、キラル高速液体クロマトグラフィー(HPLC)を用いるラセミ体(または塩もしくは誘導体のラセミ体)の分割を包含する。
【0107】
あるいは、ラセミ体(またはラセミ前駆体)を、適当な光学活性化合物、例えばアルコールと、または、式(1)の化合物が酸性もしくは塩基性部分を含有する場合には、酒石酸もしくは1−フェニルエチルアミンなどの酸もしくは塩基と反応させることができる。得られるジアステレオマー混合物は、クロマトグラフィーおよび/または分別結晶により分離することができ、ジアステレオ異性体の一方または双方は、当業者によく知られている手段により対応する純粋な1つまたは複数の鏡像異性体に変換することができる。
【0108】
本発明のキラル化合物(およびそのキラル前駆体)は、イソプロパノール0〜50体積%、典型的には、2%〜20%、およびアルキルアミン0〜5体積%、典型的には、ジエチルアミン0.1%を含有する炭化水素、典型的には、ヘプタンまたはヘキサンからなる移動相による不斉樹脂上のクロマトグラフィー、典型的には、HPLCを使用し、鏡像異性的に富化された形態で得ることができる。溶出液を濃縮すると、富化された混合物が得られる。
【0109】
立体異性の集合体は、当業者に知られている従来技法により分離することができる。例えば、E.L.Elielによる「Stereochemistry of Organic Compounds」(Wiley、New York、1994)を参照されたい。
【0110】
本発明は、1個または複数の原子が、同じ原子番号であるが、自然において優位を占める原子質量または質量数と異なる原子質量または質量数を有する原子により置き換えられているすべての薬学的に許容できる式(1)の同位体標識化合物を包含する。
【0111】
本発明の化合物中に含めるのに適している同位体の例は、2Hおよび3Hなどの水素、11C、13Cおよび14Cなどの炭素、13Nおよび15Nなどの窒素、15O、17Oおよび18Oなどの酸素、ならびに35Sなどのイオウの同位体を包含する。
【0112】
式(1)のある同位体標識化合物、例えば、放射性同位体を組み入れた同位体標識化合物は、薬物および/または基質の組織分布研究において有用である。放射性同位体であるトリチウム、すなわち3H、および炭素−14、すなわち14Cは、それらを組み入れる容易さおよびそれらを検出する手段が用意されていることに鑑みてこの目的のために特に有用である。
【0113】
重水素、すなわち2Hなどのより重い同位体による置換は、より大きい代謝安定性に由来する特定の治療上の利点、例えば、インビボ半減期の増加または用量要件の軽減を提供することがあるため、一部の環境において好ましいことがある。
【0114】
11C、15Oおよび13Nなどのポジトロン放出同位体による置換は、基質受容体占有を調べるためのポジトロン放出断層撮影(PET)研究において有用なことがある。
【0115】
式(1)の同位体標識化合物は、一般的に、当業者に知られている従来技法により、または以前に用いた非標識試薬の代わりに適切な同位体標識試薬を使用し、添付の実施例および調製に記載されているものに類似したプロセスにより調製することができる。
【0116】
本発明による薬学的に許容できる溶媒和物は、結晶化の溶媒が、同位体置換されている、例えばD2O、d6−アセトン、d6−DMSOであってよい溶媒和物を包含する。
【0117】
式(1)の化合物、薬学的に許容できるそれらの塩および/または薬学的に許容できる前記化合物もしくは塩の溶媒和物は、β2受容体および/またはムスカリン性受容体が関与している多数の障害の治療および予防に適している価値ある薬学的に活性な化合物である。特に、これらの化合物は、β2受容体の作動作用およびムスカリン性受容体の拮抗作用が有益性をもたらすことがある多数の障害、特に、アレルギー性および非アレルギー性の気道疾患の治療および予防に有用である。
【0118】
薬学的使用を意図した本発明の化合物は、結晶性または非晶性製品として投与することができる。本発明の化合物は、沈殿、結晶化、凍結乾燥、噴霧乾燥、または蒸発乾燥などの方法により、例えば、固体プラグ剤(solid plug)、散剤、またはフィルム剤として得ることができる。この目的には、マイクロ波または高周波乾燥を使用することができる。
【0119】
本発明の化合物は、単独で、または1種もしくは複数の本発明の他の化合物と組み合わせて、または1種もしくは複数の他の薬物と組み合わせて(または、それらの任意の組合せとして)投与することができる。一般的に、本発明の化合物は、1種または複数の薬学的に許容できる賦形剤と共に製剤として投与されるはずである。「賦形剤」という用語は、本明細書において、本発明の1種または複数の化合物以外の任意の成分について記載するのに使用される。賦形剤の選択は、特定の投与方法、溶解度および安定性に対する賦形剤の影響、ならびに剤形の性質などの要素によって大きく左右されるであろう。
【0120】
本発明の化合物を送達するのに適している医薬組成物およびそれらを調製するための方法は、当業者には容易に明らかであろう。そのような組成物およびそれらを調製するための方法は、例えば、「Remington’s Pharmaceutical Sciences」、第19版(Mack Publishing Company、1995)中に見いだすことができる。
【0121】
本発明の化合物は、経口的に投与することができる。経口投与は、化合物が胃腸管に入るように嚥下するものであってよく、または、化合物が口から直接血流に入る口腔もしくは舌下投与が用いられることがある。
【0122】
経口投与に適している製剤は、錠剤、粒子剤、液剤、または散剤を含有するカプセル剤、ロゼンジ剤(液体入りを包含する)、咀嚼剤、多粒子剤およびナノ粒子剤、ゲル剤、固溶体、リポソーム、フィルム剤、膣坐剤、噴霧剤などの固形製剤ならびに液状製剤を包含する。
【0123】
液状製剤は、懸濁剤、液剤、シロップ剤およびエリキシル剤を包含する。そのような製剤は、軟質または硬質カプセル剤における充填剤として用いることができ、典型的には、担体、例えば、水、エタノール、ポリエチレングリコール、プロピレングリコール、メチルセルロース、または適当な油、ならびに1種または複数の乳化剤および/または懸濁化剤を含む。液状製剤は、例えばサシェから、固形物の再構成により調製することもできる。
【0124】
本発明の化合物は、LiangおよびChenによるExpert Opinion in Therapeutic Patents、11(6)、981〜986(2001)に記載されている剤形などの速溶解性、速崩壊性剤形においても使用することができる。
【0125】
錠剤剤形の場合、投与量に応じて、薬物は、剤形の1重量%〜80重量%、より典型的には、剤形の5重量%〜60重量%を占めることができる。薬物の他に、錠剤は、一般的に、崩壊剤を含有する。崩壊剤の例は、デンプングリコール酸ナトリウム、カルボキシメチルセルロースナトリウム、カルボキシメチルセルロースカルシウム、クロスカルメロースナトリウム、クロスポビドン、ポリビニルピロリドン、メチルセルロース、微結晶性セルロース、低級アルキル置換ヒドロキシプロピルセルロース、デンプン、アルファ化デンプンおよびアルギン酸ナトリウムを包含する。一般的に、崩壊剤は、剤形の1重量%〜25重量%、好ましくは、5重量%〜20重量%を占めるものとする。
【0126】
一般的に、錠剤製剤に凝集性を付与するために結合剤が使用される。適当な結合剤は、微結晶性セルロース、ゼラチン、糖、ポリエチレングリコール、天然および合成ゴム、ポリビニルピロリドン、アルファ化デンプン、ヒドロキシプロピルセルロースならびにヒドロキシプロピルメチルセルロースを包含する。錠剤は、ラクトース(一水和物、噴霧乾燥一水和物、無水など)、マンニトール、キシリトール、ブドウ糖、スクロース、ソルビトール、微結晶性セルロース、デンプンおよび二塩基性リン酸カルシウム二水和物などの希釈剤を含有することもある。
【0127】
また、錠剤は、ラウリル硫酸ナトリウムおよびポリソルベート80などの界面活性剤、ならびに二酸化ケイ素およびタルクなどの流動促進剤を含んでいてもよい。存在する場合、界面活性剤は、錠剤の0.2重量%〜5重量%を占め、流動促進剤は、錠剤の0.2重量%〜1重量%を占めることがある。
【0128】
また、錠剤は、一般的に、ステアリン酸マグネシウム、ステアリン酸カルシウム、ステアリン酸亜鉛、ステアリルフマル酸ナトリウム、およびステアリン酸マグネシウムとラウリル硫酸ナトリウムの混合物などの滑沢剤を含有する。滑沢剤は、一般的に、錠剤の0.25重量%〜10重量%、好ましくは、0.5重量%〜3重量%を占める。
【0129】
他の可能な成分は、抗酸化剤、着色剤、矯味剤、保存剤および味覚マスキング剤を包含する。
【0130】
例示的錠剤は、薬物約80%まで、結合剤約10重量%〜約90重量%、希釈剤約0重量%〜約85重量%、崩壊剤約2重量%〜約10重量%、および滑沢剤約0.25重量%〜約10重量%を含有する。
【0131】
錠剤ブレンドを直接、またはローラーにより圧縮し、錠剤を作製することができる。あるいは、錠剤ブレンドまたはブレンドの一部を、打錠前に湿式、乾式、もしくは融解式造粒するか、融解式凝結させるか、または押し出すことができる。最終製剤は、1つまたは複数の層を含み、コーティングされていてもされていなくてもよく、カプセル化されてもよい。
【0132】
錠剤の製剤化は、H.LiebermanおよびL.LachmanによるPharmaceutical Dosage Forms:Tablets、第1巻(Marcel Dekker、New York、1980)中で論じられている。
【0133】
ヒトまたは動物使用のために消費できる経口フィルム剤は、典型的には、速溶解性であるか、または粘膜付着性であってよい柔軟な水溶性または水膨潤性の薄膜剤形であり、典型的には、式(1)の化合物、フィルム形成ポリマー、結合剤、溶媒、湿潤剤、可塑剤、安定剤または乳化剤、粘度調整剤および溶媒を含む。製剤の一部の構成成分は、2つ以上の機能を果たすことがある。
【0134】
式(1)の化合物は、水溶性または不溶性であってよい。水溶性化合物は、典型的には、溶質の1重量%〜80重量%、より典型的には、20重量%〜50重量%を占める。難溶性化合物は、組成物の大部分、典型的には、溶質の88重量%までを占めることがある。あるいは、式(1)の化合物は、多粒子ビーズの形態であってよい。
【0135】
フィルム形成ポリマーは、天然多糖、タンパク質、または合成親水コロイドから選択することができ、典型的には、0.01〜99重量%の範囲、より典型的には、30〜80重量%の範囲で存在する。
【0136】
他の可能な成分は、抗酸化剤、着色剤、香味料および調味料、保存剤、唾液刺激剤、冷却剤、共溶媒(油を包含する)、緩和薬、充填剤、消泡剤、界面活性剤および味覚マスキング剤を包含する。
【0137】
本発明によるフィルム剤は、典型的には、剥離可能な裏打用の支持体または紙の上にコーティングされた薄い水性フィルムを蒸発乾燥させることにより調製される。これは、乾燥炉またはトンネル乾燥機、典型的には、複合コーター乾燥機中で、または凍結乾燥もしくは真空吸引により行うことができる。
【0138】
経口投与のための固形製剤は、即時放出および/または放出調節であるように製剤化することができる。放出調節製剤は、遅延放出、持続放出、パルス放出、制御放出、標的放出およびプログラム放出を包含する。
【0139】
本発明の目的に適している放出調節製剤については、米国特許第6,106,864号に記載されている。高エネルギー分散剤ならびに浸透および被覆粒子剤などの他の適当な放出技術の詳細は、VermaらによるPharmaceutical Technology On−line、25(2)、1〜14(2001)中に見いだすことができる。制御放出を実現するためのチューインガムの使用については、WO00/35298に記載されている。
【0140】
本発明の化合物は、血流中、筋肉中、または内臓中に直接投与することもできる。非経口投与に適している手段は、静脈内、動脈内、腹腔内、髄腔内、脳室内、尿道内、胸骨内、頭蓋内、筋肉内および皮下を包含する。非経口投与に適している装置は、針(極微針を包含する)注射器、無針注射器および注入技法を包含する。
【0141】
非経口製剤は、典型的には、塩、炭水化物および緩衝剤(3〜9のpHが好ましい)などの賦形剤を含有してもよい水溶液であるが、一部の応用例については、滅菌非水溶液として、または乾燥形態として製剤化し、滅菌した発熱物質を含まない水などの適当なビヒクルと併せて使用することがより適当である。
【0142】
無菌条件下、例えば、凍結乾燥による非経口製剤の調製は、当業者によく知られている標準的製薬技法を用いて容易に行うことができる。
【0143】
非経口液剤の調製において使用される式(1)の化合物の溶解性は、溶解性促進剤の組入れなどの適切な製剤技法の使用により高めることができる。
【0144】
非経口投与のための製剤は、即時放出および/または放出調節であるように製剤化することができる。放出調節製剤は、遅延放出、持続放出、パルス放出、制御放出、標的放出およびプログラム放出を包含する。すなわち、本発明の化合物は、活性化合物の放出調節を提供する埋込型デポー剤として投与するための固体、半固体、もしくはチキソトロピックな液体として製剤化することができる。そのような製剤の例は、薬物をコーティングしたステントおよびdl−乳酸/グリコール酸共重合体(PGLA)ミクロスフェアを包含する。
【0145】
本発明の化合物は、皮膚または粘膜へ局所的に、すなわち、皮膚にまたは経皮的に投与することもできる。この目的にとって典型的な製剤は、ゲル剤、ヒドロゲル剤、ローション剤、液剤、クリーム剤、軟膏剤、散布剤、包帯剤、フォーム剤、フィルム剤、皮膚用パッチ剤、ウエハー剤、インプラント剤、スポンジ剤、ファイバー剤、絆創膏剤およびマイクロエマルジョン剤を包含する。リポソーム剤も使用することができる。典型的な担体は、アルコール、水、鉱油、流動ワセリン、白色ワセリン、グリセリン、ポリエチレングリコールおよびプロピレングリコールを包含する。透過促進剤を組み入れることができる。例えば、FinninおよびMorganによるJ Pharm Sci、88(10)、955〜958(October 1999)を参照されたい。
【0146】
局所投与の他の手段は、エレクトロポレーション、イオントフォレーシス、フォノフォレーシス、ソノフォレーシスおよび極微針または無針(例えば、Powderject(商標)、Bioject(商標)など)注射による送達を包含する。
【0147】
局所投与のための製剤は、即時放出および/または放出調節であるように製剤化することができる。放出調節製剤は、遅延放出、持続放出、パルス放出、制御放出、標的放出およびプログラム放出を包含する。
【0148】
また、本発明の化合物は、鼻腔内に、または吸入により、典型的には、乾燥粉末吸入器から乾燥粉末(単独で、例えば、ラクトースとの乾燥ブレンドにおける混合物として、または、例えば、ホスファチジルコリンなどのリン脂質と混合された混合成分粒子として)の形態で、または1,1,1,2−テトラフルオロエタンもしくは1,1,1,2,3,3,3−ヘプタフルオロプロパンなどの適当な噴射剤の使用の有無に関わらず加圧容器、ポンプ、スプレー、アトマイザー(好ましくは、細かい霧を発生するための電気流体力学を用いるアトマイザー)、もしくはネブライザーからのエアゾールスプレーとして投与することができる。鼻腔内使用の場合、粉末は、生体接着剤、例えば、キトサンまたはシクロデキストリンを含むことができる。
【0149】
加圧容器、ポンプ、スプレー、アトマイザー、またはネブライザーは、例えば、エタノール、水性エタノール、または活性物質の分散、可溶化、または延長放出のための適当な代替試剤、溶媒としての1種または複数の噴射剤およびソルビタントリオレエート、オレイン酸、またはオリゴ乳酸などの任意選択の界面活性剤を含む本発明の1種または複数の化合物の溶液または懸濁液を含有する。
【0150】
乾燥粉末または懸濁液製剤における使用に先立って、薬物製品は、吸入による送達に適しているサイズ(典型的には、5ミクロン未満)まで微粉化される。これは、スパイラルジェットミリング、流動床ジェットミリング、ナノ粒子を形成するための超臨界流体プロセシング、高圧ホモジネート、または噴霧乾燥などの任意の適切な粉砕方法により行うことができる。
【0151】
吸入器またはインサフレーターにおいて使用するためのカプセル剤(例えば、ゼラチンまたはヒドロキシプロピルメチルセルロース製)、ブリスター剤およびカートリッジ剤は、本発明の化合物、ラクトースまたはデンプンなどの適当な粉末基剤およびl−ロイシン、マンニトール、またはステアリン酸マグネシウムなどの動作調整剤の粉末ミックスを含有するように製剤化することができる。ラクトースは、無水または一水和物の形態であってよく、後者であることが好ましい。他の適当な賦形剤は、デキストラン、グルコース、マルトース、ソルビトール、キシリトール、フルクトース、スクロースおよびトレハロースを包含する。
【0152】
細かい霧を発生するための電気流体力学を用いるアトマイザーにおいて使用するのに適している溶液製剤は、1動作につき本発明の化合物1μg〜20mgを含有することができ、動作容積は、1μlから100μlまでと様々であってよい。典型的な製剤は、式(I)の化合物、プロピレングリコール、滅菌水、エタノールおよび塩化ナトリウムを含むことができる。プロピレングリコールの代わりに使用することができる代替溶媒は、グリセロールおよびポリエチレングリコールを包含する。
【0153】
吸入/鼻腔内投与を意図した本発明の製剤には、メントールおよびレボメントールなどの適当な香料、またはサッカリンもしくはサッカリンナトリウムなどの甘味料を添加することができる。
【0154】
吸入/鼻腔内投与のための製剤は、即時放出および/または、例えば、PGLAを使用する放出調節であるように製剤化することができる。放出調節製剤は、遅延放出、持続放出、パルス放出、制御放出、標的放出およびプログラム放出を包含する。
【0155】
乾燥粉末吸入器およびエアゾール剤の場合、用量単位は、充填済みのカプセル、ブリスターもしくはポケットにより、または重量測定法で送り込む投薬槽(dosing chamber)を利用するシステムにより決定される。本発明による単位は、典型的には、一定量すなわち(ここでの化合物名)、またはその塩1〜5000μgを含有する「パフ」を投与するように配置される。1日総投与量は、典型的には、1回量で、またはより一般的には1日を通して分割量として投与することができる1μg〜20mgの範囲にあるであろう。
【0156】
式(1)の化合物は、吸入による、特に、乾燥粉末吸入器を使用する投与に特に適している。
【0157】
本発明の化合物は、例えば、坐薬、膣坐薬、または浣腸の形態で経直腸的または経膣的に投与することができる。カカオ脂は、伝統的な坐薬基剤であるが、必要に応じて様々な代替物を使用することができる。
【0158】
直腸/膣内投与のための製剤は、即時放出および/または放出調節であるように製剤化することができる。放出調節製剤は、遅延放出、持続放出、パルス放出、制御放出、標的放出およびプログラム放出を包含する。
【0159】
本発明の化合物は、典型的には、等張性のpH調整した滅菌食塩水中の微粉末化された懸濁液または溶液の点滴剤の形態で、眼または耳に直接投与することもできる。眼および耳投与に適している他の製剤は、軟膏剤、生分解性(例えば、吸収性ゲルスポンジ、コラーゲン)および非生分解性(例えば、シリコーン)インプラント剤、ウエハー剤、レンズ剤およびニオソームまたはリポソームなどの微粒子または小胞系を包含する。架橋ポリアクリル酸、ポリビニルアルコール、ヒアルロン酸、セルロースポリマー、例えば、ヒドロキシプロピルメチルセルロース、ヒドロキシエチルセルロース、もしくはメチルセルロース、またはヘテロ多糖ポリマー、例えば、ゲランガムなどのポリマーを、塩化ベンザルコニウムなどの保存剤と一緒に組み入れることができる。そのような製剤は、イオントフォレーシスにより送達することもできる。
【0160】
眼/耳投与のための製剤は、即時放出および/または放出調節であるように製剤化することができる。放出調節製剤は、遅延放出、持続放出、パルス放出、制御放出、標的放出およびプログラム放出を包含する。
【0161】
本発明の化合物は、シクロデキストリンおよび適当なその誘導体またはポリエチレングリコール含有ポリマーなどの可溶性高分子と混ぜ合わせ、前述の投与方法のうちのいずれかにおいて使用するために、それらの溶解性、溶出速度、味覚マスキング、生物学的利用能および/または安定性を改善することができる。
【0162】
例えば、薬物−シクロデキストリン錯体は、大部分の剤形および投与経路にとって一般的に有用であることが判明している。包接錯体と非包接錯体の両方を使用することができる。薬物との直接錯体化の代替法として、シクロデキストリンを、補助添加剤、すなわち担体、希釈剤、または可溶化剤として使用することができる。これらの目的のためにα−、β−およびγ−シクロデキストリンが最も一般的に使用され、その例は、国際特許出願第WO91/11172号、第WO94/02518号および第WO98/55148号中に見いだすことができる。
【0163】
例えば、特定の疾患または状態を治療する目的で、活性化合物の組合せを投与することが望ましいことがあるため、そのうちの少なくとも1つは本発明による化合物を含有する2つ以上の医薬組成物を、組成物の同時投与に適しているキットの形態で都合良く組み合わせ得ることは、本発明の範囲内にある。
【0164】
したがって、本発明のキットは、そのうちの少なくとも1つは本発明による式(1)の化合物を含有する2つ以上の別々の医薬組成物および容器、分かれたボトル、または分かれたホイルパケットなどの前記組成物を別々に保持するための手段を含む。そのようなキットの例は、錠剤、カプセル剤などの包装に使用されるよく知られているブリスターパックである。
【0165】
本発明のキットは、異なる剤形を、例えば、非経口的に投与するのに、異なる投与間隔で別々の組成物を投与するのに、またはお互いに対して別々の組成物を用量設定するのに特に適している。コンプライアンスを補助するため、キットは、典型的には、投与説明書を含み、いわゆる記憶補助を提供することができる。
【0166】
ヒト患者への投与の場合、本発明の化合物の1日総投与量は、典型的には、言うまでもなく投与方法に応じて、0.001mg〜5000mgの範囲にある。例えば、静脈内1日投与量は、0.001mg〜40mgを必要とするに過ぎないことがある。1日総投与量は、1回量または分割量で投与することができ、医師の裁量で、本明細書に示される典型的な範囲から外れることがある。
【0167】
これらの用量は、約65〜70kgの体重を有する平均的なヒト対象に基づいている。医師は、乳児および高齢者などの、体重がこの範囲から外れている対象に対する投与量を容易に決定することができるはずである。
【0168】
誤解を避けるために、本明細書における「治療」への言及は、治癒的、姑息的および予防的治療を包含する。
【0169】
本発明の別の実施形態によれば、式(1)の化合物、もしくは薬学的に許容できるそれらの塩および/または薬学的に許容できる前記化合物もしく塩の溶媒和物は、患者に同時投与される1種または複数の追加治療薬との組合せとして使用し、(i)気管支収縮、(ii)炎症、(iii)アレルギー、(iv)組織の破壊、(v)息切れ、咳などの徴候および症状を包含するがこれらに限定されない病態生理学的に関連する疾患プロセスの治療などの一部の特に望ましい治療的最終結果を得ることもできる。第二およびそれ以上の追加治療薬は、式(1)の化合物、もしくは薬学的に許容できるそれらの塩および/または薬学的に許容できる前記化合物もしく塩の溶媒和物であるか、当技術分野において知られている1種もしくは複数のβ2作動薬であってもよい。より典型的には、第二およびそれ以上の治療薬は、異なるクラスの治療薬から選択されるであろう。
【0170】
本明細書において使用されるように、「同時投与」、「同時投与される」および「と組み合わせて」という用語は、式(1)の化合物および1種または複数の他の治療薬に関して、下記の、
・治療を必要としている患者への式(1)の1種または複数の化合物と1種または複数の治療薬のそのような組合せの同時投与であって、そのような構成成分が、前記患者に対して実質的に同じ時間に前記構成成分を放出する単一の剤形に一緒に製剤化される場合の同時投与、
・治療を必要としている患者への式(1)の1種または複数の化合物と1種または複数の治療薬のそのような組合せの実質的な同時投与であって、そのような構成成分が、前記患者により実質的に同じ時間に摂取される別々の剤形にお互いとは別に製剤化され、前記構成成分が、前記患者に対して実質的に同じ時間に放出される場合の実質的な同時投与、
・治療を必要としている患者への式(1)の1種または複数の化合物と1種または複数の治療薬のそのような組合せの順次投与であって、そのような構成成分が、各投与間の有意な時間間隔で前記患者により連続した時間に摂取される別々の剤形にお互いとは別に製剤化され、前記構成成分が、前記患者に対して実質的に異なる時間に放出される場合の順次投与、および
・治療を必要としている患者への式(1)の1種または複数の化合物と1種または複数の治療薬のそのような組合せの順次投与であって、そのような構成成分が、制御された方法で前記構成成分を放出する単一の剤形に一緒に製剤化され、それらが、前記患者により同じかつ/または異なる時間に同時に、連続して、かつ/または重ねて投与される場合の順次投与であって、
各部分を、同じ経路か異なる経路のどちらかにより投与することができる投与を意味することが意図され、それらを指し、それらを包含する。
【0171】
式(1)の1種または複数の化合物、もしくは薬学的に許容できるそれらの塩および/または薬学的に許容できる前記化合物もしくは塩の溶媒和物と組み合わせて使用することができる他の治療薬の適当な例は、
(a)5−リポキシゲナーゼ(5−LO)阻害薬または5−リポキシゲナーゼ活性化タンパク質(FLAP)拮抗薬、
(b)LTB4、LTC4、LTD4、およびLTE4の拮抗薬を包含するロイコトリエン拮抗薬(LTRA)、
(c)H1およびH3拮抗薬を包含するヒスタミン受容体拮抗薬、
(d)鼻充血除去薬使用のためのα1−およびα2−アドレナリン受容体作動薬血管収縮交感神経様作用薬、
(e)PDE阻害薬、例えば、PDE3、PDE4およびPDE5阻害薬、
(f)β2受容体作動薬、
(g)ムスカリン性M3受容体拮抗薬または抗コリン作動薬、
(h)テオフィリン、
(i)クロモグリク酸ナトリウム、
(j)COX阻害薬、非選択的および選択的なCOX−1またはCOX−2阻害薬(NSAID)、
(k)プロスタグランジン受容体拮抗薬およびプロスタグランジン合成酵素の阻害薬、
(l)経口および吸入グルココルチコステロイド、
(m)コルチコイド受容体の解離性(dissociated)作動薬(DAGR)、
(n)内因性炎症性物質に対して活性なモノクローナル抗体、
(o)抗腫瘍壊死因子(抗TNF−α)薬、
(p)VLA−4拮抗薬を包含する接着分子阻害薬、
(q)キニン−B1−およびB2−受容体拮抗薬、
(r)IgE経路の阻害薬およびシクロスポリンを包含する免疫抑制薬、
(s)マトリックスメタロプロテアーゼ(MMP)の阻害薬、
(t)タキキニンNK1、NK2およびNK3受容体拮抗薬、
(u)エラスターゼ阻害薬などのプロテアーゼ阻害薬、
(v)アデノシンA2a受容体作動薬およびA2b拮抗薬、
(w)ウロキナーゼの阻害薬、
(x)D2作動薬などの、ドーパミン受容体に作用する化合物、
(y)IKK阻害薬などの、NFκβ経路のモジュレーター、
(z)p38MAPキナーゼ、PI3キナーゼ、JAKキナーゼ、sykキナーゼ、EGFRまたはMK−2などのサイトカインシグナル伝達経路のモジュレーター、
(aa)粘液溶解薬または鎮咳薬として分類することができる薬剤、
(bb)吸入コルチコステロイドに対する応答を亢進する薬剤、
(cc)気道にコロニーを形成することができる微生物に対して有効な抗生物質および抗ウイルス薬、
(dd)HDAC阻害薬、
(ee)CXCR2拮抗薬、
(ff)インテグリン拮抗薬、
(gg)ケモカイン、
(hh)上皮ナトリウムチャネル(ENaC)遮断薬または上皮ナトリウムチャネル(ENaC)阻害薬、
(ii)P2Y2作動薬および他のヌクレオチド受容体作動薬、
(jj)トロンボキサンの阻害薬、
(kk)PGD2合成およびPGD2受容体(DP1およびDP2/CRTH2)の阻害薬、
(ll)ナイアシン、ならびに
(mm)VLAM、ICAM、およびELAMを包含する接着因子
を包含するが、決してこれらに限定されるものではない。
【0172】
本発明によれば、式(1)の化合物と、
− H3拮抗薬、
− ムスカリン性M3受容体拮抗薬、
− PDE4阻害薬、
− グルココルチコステロイド、
− アデノシンA2a受容体作動薬、
− p38MAPキナーゼもしくはsykキナーゼなどのサイトカインシグナル伝達経路のモジュレーター、または
− LTB4、LTC4、LTD4、およびLTE4の拮抗薬を包含するロイコトリエン拮抗薬(LTRA)の組合せがさらに好ましい。
【0173】
本発明によれば、式(1)の化合物と、
− グルココルチコステロイド、特に、プレドニゾン、プレドニゾロン、フルニソリド、トリアムシノロンアセトニド、ジプロピオン酸ベクロメタゾン、ブデソニド、プロピオン酸フルチカゾン、シクレソニド、およびフランカルボン酸モメタゾンを包含する全身性副作用が軽減された吸入グルココルチコステロイド、または
− 特に、イプラトロピウム塩、すなわちブロミド、チオトロピウム塩、すなわちブロミド、オキシトロピウム塩、すなわちブロミド、ぺレンゼピン(perenzepine)、およびテレンゼピンを包含するムスカリン性M3受容体拮抗薬もしくはアドレナリン作動性薬剤の組合せがさらに好ましい。
【0174】
本明細書における治療へのすべての言及は、治癒的、姑息的および予防的治療を包含することを理解されたい。
【0175】
式(1)の化合物は、β2受容体およびコリン作動性ムスカリン性受容体と相互作用する能力を有し、それによって、β2受容体およびムスカリン性受容体がすべての哺乳動物の生理機能において果たす本質的な役割のために、以下にさらに記載されるように、広範囲な治療的応用例を有する。
【0176】
したがって、本発明のさらなる態様は、β2受容体および/またはムスカリン性受容体が関与する疾患、障害、および状態を治療するのに使用するための、式(1)の化合物、もしくは薬学的に許容できるそれらの塩および/または薬学的に許容できる前記化合物もしくは塩の溶媒和物に関する。より具体的には、本発明は、
・あらゆるタイプ、病因、または病原の喘息、特に、アトピー性喘息、非アトピー性喘息、アレルギー性喘息、アトピー性気管支IgE−仲介性喘息、気管支喘息、本態性喘息、真正喘息、病態生理学的かく乱により引き起こされる内因性喘息、環境要因により引き起こされる外因性喘息、知られていないまたは明らかでない原因の本態性喘息、非アトピー性喘息、気管支喘息、気腫性喘息、運動誘発性喘息、アレルゲン誘発性喘息、冷気誘発性喘息、職業喘息、細菌、真菌、原虫、またはウイルス感染症により引き起こされる感染型喘息、非アレルギー性喘息、初発性喘息、喘鳴乳児症候群および細気管支炎からなる群から選択されるメンバーである喘息、
・慢性または急性気管支収縮、慢性気管支炎、末梢気道閉塞、および気腫、
・あらゆるタイプ、病因または病原の閉塞性または炎症性気道疾患、特に、慢性好酸球性肺炎、慢性閉塞性肺疾患(COPD)、慢性気管支炎を包含するCOPD、COPDに関連した、もしくは関連しない肺気腫もしくは呼吸困難、不可逆的進行性気道閉塞を特徴とするCOPD、成人呼吸窮迫症候群(ARDS)、他の薬物療法の結果として生じる気道過敏性の悪化および肺性高血圧に関連した気道疾患からなる群から選択されるメンバーである閉塞性または炎症性気道疾患、
・あらゆるタイプ、病因または病原の気管支炎、特に、急性気管支炎、急性喉頭気管気管支炎、アラキン酸気管支炎、カタル性気管支炎、クループ性気管支炎、乾性気管支炎、感染性喘息性気管支炎、湿咳性気管支炎、ブドウ球菌性または連鎖球菌性気管支炎および肺胞性気管支炎からなる群から選択されるメンバーである気管支炎、
・急性肺傷害、
・あらゆるタイプ、病因または病原の気管支拡張症、特に、円柱状気管支拡張症、嚢状気管支拡張症、紡錘状気管支拡張症、毛細管性気管支拡張症、嚢胞状気管支拡張症、乾性気管支拡張症および濾胞性気管支拡張症からなる群から選択されるメンバーである気管支拡張症
からなる群から選択される疾患、障害、および状態を治療するのに使用するための、式(1)の化合物、もしくは薬学的に許容できるその塩および/または薬学的に許容できる前記化合物もしくは塩の溶媒和物にも関する。
【0177】
本発明のさらに他の態様は、β2作動薬活性およびM3拮抗薬活性を有する薬物を製造するための、式(1)の化合物、もしくは薬学的に許容できるその塩および/または薬学的に許容できる前記化合物もしくは塩の溶媒和物の使用にも関する。特に、本発明は、β2およびムスカリン性受容体が関わる疾患および/または状態、特に、上記に列挙されている疾患および/または状態を治療するための薬物を製造するための、式(1)の化合物、もしくは薬学的に許容できるその塩および/または薬学的に許容できる前記化合物もしくは塩の溶媒和物の使用に関する。
【0178】
結果として、本発明は、有効量の式(1)の化合物、もしくは薬学的に許容できるその塩および/または薬学的に許容できる前記化合物もしくは塩の溶媒和物でヒトを包含する哺乳動物を治療するための特に興味深い方法を提供する。より正確に言えば、本発明は、ヒトを包含する哺乳動物においてβ2およびムスカリン性受容体が関わるβ2仲介性の疾患および/または状態、特に、上記に列挙されている疾患および/または状態を治療するための特に興味深い方法であって、前記哺乳動物に、有効量の式(1)の化合物、その薬学的に許容できる塩および/または前記化合物もしくは塩の溶媒和物を投与することを含む方法を提供する。
【0179】
下記の実施例は、式(1)の化合物の調製を例示している。
【図面の簡単な説明】
【0180】
【図1】実施例2aのPXRDパターンを示す図である。
【発明を実施するための形態】
【0181】
プロトコル
下のすべての実施例について、下記の実験条件を使用した。
【0182】
粉末X線回折法(PXRD)
粉末X線回折パターンは、自動サンプルチェンジャー、θ−θゴニオメーター、自動ビーム発散スリット、およびPSD Vantec−1検出器を取り付けたBruker−AXS Ltd.のD4粉末X線回折計を使用して決定した。サンプルは、低バックグラウンドキャビティーシリコンウエハー試料台上に設置することにより分析用に調製した。得られたピークは、シリコン参照標準に対してアラインメントした。試料を、40kV/35mAで動作するX線管により銅のK−α1X線(波長=1.5406オングストローム)を照射しながら回転させた。分析は、2°〜55°の2θ範囲にわたり、0.018°のステップ毎に0.2秒カウントに設定した連続モードで実行するゴニオメーターで行った。
【0183】
調製
調製1
(2R)−2−シクロヘキシル−2−ヒドロキシ−2−フェニルアセトアミド
【0184】
【化32】

(2R)−2−シクロヘキシル−2−ヒドロキシ−2−フェニル酢酸(調製36、4.87g、20.8mmol)をジクロロメタン(150mL)に溶かし、カルボニルジイミダゾール(3.37g、20.8mmol)を一度に加えた。室温にて1時間にわたって撹拌した後、0.880アンモニア(21mL)を加え、撹拌を、18時間にわたって室温にて続けた。有機層を分離し、食塩水(50mL)で洗浄し、硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去すると、92%収率で白色の泡として表題化合物、4.56gが得られた。
LRMS: APCI ESI m/z 232 [M-H]-
1H NMR
(400 MHz, クロロホルム-d) δ = 0.92
(m, 1H), 1.15 (m, 5H), 1.76 (m, 4H), 2.40 (m, 1H), 5.38 (br.s, 1H), 6.52 (br.s,
1H), 7.28 (m, 1H), 7.37 (m, 2H), 7.62 (m, 2H) ppm.
【0185】
調製2
(R)−シクロヘキシル(フェニル)1H−1,2,4−トリアゾール−3−イルメタノール
【0186】
【化33】

(2R)−2−シクロヘキシル−2−ヒドロキシ−2−フェニルアセトアミド(調製1、4.497g、19.27mmol)をN,N−ジメチルホルムアミドジメチルアセタール(60ml)に溶かした。2時間にわたって90℃にて撹拌した後、溶媒を真空中で除去し、残渣を、トルエン(100ml)と共沸させると、黄色の油が得られた。ヒドラジン水和物(1.11ml、22.9mmol)と、続いて、氷酢酸(90ml)を加えた。2時間にわたって90℃にて撹拌した後、溶媒を真空中で除去し、残渣を、酢酸エチル(250ml)と飽和重炭酸ナトリウム水溶液(250mL)の間で分配した。有機層を分離し、硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去した。残渣を、酢酸エチルで溶出するシリカゲル上のカラムクロマトグラフィーにより精製すると、100%収率で白色の固体として表題化合物、4.9gが得られた。
LRMS: ESI m/z 256 [M-H]-
1H NMR
(400 MHz, クロロホルム-d) δ = 1.08
(m, 3H), 1.36 (m, 2H), 1.70 (m, 5H), 2.46 (m, 1H), 3.08 (br.s, 1H), 7.23 (m,
1H), 7.34 (m, 2H), 7.65 (m, 2H), 8.00(s, 1H) ppm.
鏡像異性体過剰率:99.3%、1ml/分の流速にて79%ヘプタン、31%イソプロピルアルコールで溶出するChiralpak AS−H Column(250×4.6mm)を使用して算出した。望ましい(R)鏡像異性体の保持時間13.61分、望ましくない(S)鏡像異性体の保持時間11.31分(ラセミ体から同定した)。
【0187】
調製3
tert−ブチル4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−カルボキシレート
【0188】
【化34】

tert−ブチル4−(ブロモメチル)ピペリジン−1−カルボキシレート(6.75g、24.2mmol)をDMF(62ml)に溶かし、(R)−シクロヘキシル(フェニル)1H−1,2,4−トリアゾール−3−イルメタノール(調製2、5.2g、20mmol)と、続いて、炭酸カリウム(5.58g、40.4mmol)を加えた。18時間にわたって70℃にて撹拌した後、溶媒を真空中で除去し、残渣を、酢酸エチル(150ml)と水(150mL)の間で分配した。有機層を分離し、硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去した。残渣を、酢酸エチル:ヘプタン(1:4〜1:1、体積比)で溶出するシリカゲル上のカラムクロマトグラフィーにより精製すると、51%収率で白色の泡として表題化合物、4.7gが得られた(他のトリアゾール位置異性体10%を含有する)。
LRMS: APCI ESI m/z 487 [M+H+MeOH]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.05-1.36 (m, 9H), 1.43 (s, 9H), 1.47-1.75 (m, 5H), 2.09 (m, 1H),
2.38 (m, 1H), 2.72 (m, 2H), 4.08 (m, 4H), 7.17 (m, 1H), 7.26 (m, 2H), 7.58 (d,
2H), 8.30 (s, 1H) ppm.
【0189】
あるいは、表題化合物を、下記の手順に従って調製した。
(R)−シクロヘキシル(フェニル)1H−1,2,4−トリアゾール−3−イルメタノール(調製2、3.0g、11.7mmol)をアセトン(60mL)に溶かし、tert−ブチル4−(ブロモメチル)ピペリジン−1−カルボキシレート(3.24g、11.7mmol)と、続いて、炭酸セシウム(7.60g、23.3mmol)を加えた。5時間にわたって70℃にて撹拌した後、反応物を室温まで冷却し、さらに16時間にわたって撹拌した。溶媒を真空中で除去し、残渣を、酢酸エチル(50mL)と水(50mL)の間で分配した。有機層を分離し、硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去した。この残渣100mgをアセトニトリル(0.5ml)に溶かし、ほぼ乾燥状態まで蒸発させると、その時点で、得られた油が結晶化し始めた。残渣の残りをアセトニトリル(55ml)に溶かし、上で得られた結晶性材料を接種した。結晶化を18時間にわたって起こさせ、得られた固体を濾過により集めると、64%収率で白色の固体として表題化合物、3.4gが得られた。
LRMS: APCI ESI m/z 487 [M+H+MeOH]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.05-1.36 (m, 9H), 1.43 (s, 9H), 1.47-1.75 (m, 5H), 2.09 (m, 1H),
2.38 (m, 1H), 2.72 (m, 2H), 4.08 (m, 4H), 7.17 (m, 1H), 7.26 (m, 2H), 7.58 (d,
2H), 8.30 (s, 1H) ppm.
【0190】
調製4
(R)−シクロヘキシル(フェニル)[1−(ピペリジン−4−イルメチル)−1H−1,2,4−トリアゾール−3−イル]メタノール
【0191】
【化35】

tert−ブチル4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−カルボキシレート(調製3、5.60g、12.3mmol)をDCM(31ml)に溶かし、エーテル中2M HCl(31ml、60mmol)を加えた。5時間にわたって室温にて撹拌した後、溶媒を真空中で除去し、残渣を、ジクロロメタン(200ml)と飽和重炭酸ナトリウム水溶液(200ml)の間で分配した。有機層を分離し、硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去すると、92%収率で白色の泡として表題化合物、4.03gが得られた(他のトリアゾール位置異性体10%を含有する)。
LRMS: APCI ESI m/z 377 [M+Na]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.04-1.36 (m, 9H), 1.38-1.57 (m, 2H), 1.58-1.81 (m, 3H), 2.00 (m,
1H), 2.38 (m, 1H), 2.58 (m, 2H), 3.06 (m, 2H), 4.06 (d, 2H), 7.17 (m, 1H), 7.25
(m, 2H), 7.58 (d, 2H), 8.31 (s, 1H) ppm.
【0192】
あるいは、表題化合物を、下記の手順に従って調製した。
tert−ブチル4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−カルボキシレート(調製3a、2.00g、4.40mmol)をジオキサン(11ml)に溶かし、激しく撹拌して可溶化を達成した。次いで、ジオキサン中4M HCl(5.54mL、22.1mmol)を加えた。24時間にわたって室温にて撹拌した後、溶媒を真空中で除去し、残渣を、ジクロロメタン(50mL)と飽和重炭酸ナトリウム水溶液(50mL)の間で分配した。有機層を分離し、硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去すると、96%収率で無色の油として表題化合物、1.5gが得られた。
LRMS: APCI ESI m/z 377 [M+Na]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.04-1.36 (m, 9H), 1.38-1.57 (m, 2H), 1.58-1.81 (m, 3H), 2.00 (m,
1H), 2.38 (m, 1H), 2.58 (m, 2H), 3.06 (m, 2H), 4.06 (d, 2H), 7.17 (m, 1H), 7.25
(m, 2H), 7.58 (d, 2H), 8.31 (s, 1H) ppm.
【0193】
調製5
ジ−tert−ブチル{9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}イミドジカーボネート
【0194】
【化36】

(R)−シクロヘキシル(フェニル)[1−(ピペリジン−4−イルメチル)−1H−1,2,4−トリアゾール−3−イル]メタノール(調製4、2.00g、5.64mmol)およびジ−tert−ブチル(9−ブロモノニル)イミドジカーボネート(米国特許第04167167号、2.38g、5.64mmol)をアセトニトリル(60ml)に溶かし、トリエチルアミン(2.35ml、16.9mmol)を加えた。18時間にわたって50℃にて撹拌した後、溶媒を真空中で除去し、残渣を、ジクロロメタン:メタノール:880アンモニア(98:2:0.2、体積比)で溶出するシリカゲル上のカラムクロマトグラフィーにより精製すると、60%収率で透明な油として表題化合物、2.6gが得られた(他のトリアゾール位置異性体10%を含有する)。
LRMS: APCI ESI m/z 696 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.14 (m, 4H), 1.25-1.38 (m, 18H) 1.41-1.51 (m, 18H), 1.51-1.75
(m, 6H), 1.99 (m, 2H), 2.14 (m, 2H), 2.42 (m, 2H), 3.06 (m, 2H), 3.55 (m, 2H),
4.09 (m, 2H), 7.16 (m, 1H), 7.26 (m, 2H), 7.58 (m, 2H), 8.32 (m, 1H) ppm.
【0195】
調製6
(R)−(1−{[1−(9−アミノノニル)ピペリジン−4−イル]メチル}−1H−1,2,4−トリアゾール−3−イル)(シクロヘキシル)フェニルメタノール
【0196】
【化37】

ジ−tert−ブチル{9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}イミドジカーボネート(調製5、2.6g、3.7mmol)をジクロロメタン(15ml)に溶かし、ジエチルエーテル中塩化水素(2M、15ml、30mmol)を加えた。5時間にわたって室温にて撹拌した後、溶媒を真空中で除去し、残渣を、ジクロロメタン(200ml)と飽和重炭酸ナトリウム水溶液(200ml)の間で分配した。有機層を分離し、硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去した。残渣を、ジクロロメタン:メタノール:880アンモニア(97.5:2.5:0.25、体積比)で溶出するシリカゲル上のカラムクロマトグラフィーにより精製すると、70%収率で透明な油として表題化合物、1.29gが得られた(他のトリアゾール位置異性体10%を含有する)。
LRMS: APCI m/z 496 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.12 (m, 4H), 1.23-1.34 (m, 18H), 1.49 (m, 6H), 1.64 (m, 2H),
1.94 (m, 2H), 2.31 (m, 2H), 2.63 (m, 2H), 2.93 (m, 2H), 4.07 (m, 2H), 7.16 (m,
1H), 7.25 (m, 2H), 7.58 (m, 2H), 8.31 (s, 1H) ppm.
【0197】
調製7
8−(ベンジルオキシ)−5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−({9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]キノリン−2(1H)−オン
【0198】
【化38】

(R)−(1−{[1−(9−アミノノニル)ピペリジン−4−イル]メチル}−1H−1,2,4−トリアゾール−3−イル)(シクロヘキシル)フェニルメタノール(調製6、350mg、0.706mg)、8−(ベンジルオキシ)−5−[(1R)−2−ブロモ−1−{[tert−ブチル(ジメチル)シリル]オキシ}エチル]キノリン−2(1H)−オン(WO200509286、345mg、0.706mmol)および炭酸水素ナトリウム(88.9mg、1.06mmol)をアセトニトリル(7mL)中で混ぜ合わせた。72時間にわたって90℃にて撹拌した後、溶媒を真空中で除去し、残渣を、ジクロロメタン(50ml)と飽和重炭酸ナトリウム水溶液(50mL)の間で分配した。有機層を分離し、硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去した。残渣を、ジクロロメタン:メタノール:880アンモニア(99:1:0.1〜95.5:5:0.5、体積比)で溶出するシリカゲル上のカラムクロマトグラフィーにより精製すると、37%収率で透明なガラスとして表題化合物、240mgが得られた(他のトリアゾール位置異性体10%を含有する)。
LRMS: APCI ESI m/z 904 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 0.07 (s, 3H), 0.37 (s, 3H), 1.17 (s, 9H), 1.37-1.49 (m, 4H),
1.52-1.63 (m, 18H), 1.76 (m, 6H), 1.92 (m, 2H), 2.20 (m, 2H), 2.60 (m, 2H),
2.88 (m, 2H), 3.01 (m, 1H), 3.18 (m, 3H), 4.35 (m, 2H), 5.50 (m, 1H), 5.61 (s,
2H), 6.95 (d, 1H), 7.41-7.70 (m, 8H), 7.79 (m, 2H), 7.86 (m, 2H), 8.59 (s, 1H),
8.74 (d, 1H) ppm.
【0199】
調製8
5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−({9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]−8−ヒドロキシキノリン−2(1H)−オン
【0200】
【化39】

8−(ベンジルオキシ)−5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−({9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]キノリン−2(1H)−オン(調製7、230mg、0.255mmol)をエタノール(10ml)に溶かし、水酸化パラジウム[炭素(湿った)上20wt.%(乾燥ベース)](5mg)と、続いて、ギ酸アンモニウム(161mg、2.55mmol)を加えた。1時間にわたって還流状態にて撹拌した後、反応混合物をarbocel(登録商標)に通して濾過し、溶媒を真空中で除去した。残渣を、ジクロロメタン:メタノール:880アンモニア(97.5:2.5:0.25〜90:10:1、体積比)で溶出するシリカゲル上のカラムクロマトグラフィーにより精製すると、87%収率でガラスとして表題化合物、180mgが得られた。
LRMS: APCI ESI m/z 813 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 0.00 (s, 3H), 0.30 (s, 3H), 1.10 (s, 9H), 1.45-1.94 (m, 28H),
2.21 (m, 3H), 2.58 (m, 3H ), 2.85 (m, 2H ), 2.95 (m, 1H), 3.17 (m, 3H), 4.29
(m, 2H), 5.42 (m, 1H), 6.85 (d, 1H), 7.14 (d, 1H), 7.32 -7.48 (m, 4H), 7.78 (m,
2H), 8.52 (s, 1H), 8.65 (d, 1H) ppm.
【0201】
調製9
2−{2−[4−(2−ヒドロキシ−エチル)−フェニル]−ビニル}−イソインドール−1,3−ジオン
【0202】
【化40】

アセトニトリル(480mL)中の2−(4−ブロモフェニル)エタノール(48.3g)の溶液に、ジイソプロピルエチルアミン(46.6g)、N−ビニルフタルイミド(43.7g)およびトリ−o−トリルホスフィン(7.31g)を加え、混合物を窒素ガスで3回パージした。酢酸パラジウム(2.7g)を加え、混合物を、窒素下で21時間にわたって90℃にて撹拌した。反応物を冷却し、沈殿した生成物を濾過により集めた。得られた固体をジクロロメタンおよび酢酸エチルに再び溶かし、シリカゲルに通して濾過した。濾液を真空中で濃縮すると、表題化合物、24gが得られた。
1H NMR
(400MHz, CDCl3) δ = 2.81-2.84 (t, 2H),
3.82-3.90 (t, 2H), 7.23-7.26 (d, 2H) 7.32-7.36 (d, 1H), 7.40-7.43 (d, 2H),
7.61-7.64 (d, 1H), 7.66-7.78 (d, 2H), 7.86-7.88 (d, 2H) ppm.
【0203】
調製10
2−{2−[4−(2−ヒドロキシ−エチル)−フェニル]−エチル}−イソインドール−1,3−ジオン
【0204】
【化41】

エタノールおよび酢酸エチル(各350mL)中の2−{2−[4−(2−ヒドロキシ−エチル)−フェニル]−ビニル}−イソインドール−1,3−ジオン(調製9、10g)の撹拌した溶液に、炭素上30%水酸化パラジウム(1.44g)と、続いて、ギ酸アンモニウム(21.5g)を加えた。反応物を4時間にわたって80℃まで加熱した。追加の炭素上水酸化パラジウム(1.44g)およびギ酸アンモニウム(21.5g)を加え、反応物を18時間にわたって80℃にて撹拌した。反応物を冷却し、Arbocel(商標)のパッドに通して濾過し、メタノールですすいだ。溶媒を減圧下で除去し、得られた白色の固体を、ジクロロメタン(200ml)と水(100ml)の間で分配した。水層を分離し、さらなるジクロロメタン(2×50mL)で抽出した。合わせた有機層を乾燥し(硫酸ナトリウム)、溶媒を真空中で除去すると、灰色がかった白色の固体として表題化合物、9.11gが得られた。
1H NMR
(400MHz, CDCl3) δ = 2.80-2.83 (t, 2H),
2.92-3.00 (t, 2H), 3.82-3.86 (t, 2H), 3.87-3.96 (t, 2H), 7.14-7.22 (2x d, 4H),
7.70-7.72 (dd, 2H), 7.82-7.84 (dd, 2H) ppm.
【0205】
あるいは、表題化合物を、下記の手順に従って調製することができる。
2−{2−[4−(2−ヒドロキシ−エチル)フェニル]−ビニル}−イソインドール−1,3−ジオン(調製9、62.0g、211.37mmol)を酢酸エチル(1200mL)に溶かした。これに、塩化トリス(トリフェニルホスフィン)ロジウム、(12.7g、13.7mmol)を加え、混合物を、24時間にわたって20psi、室温にて水素化した。反応物を濾過し、真空中で濃縮した。残渣を酢酸エチル(1000mL)に溶かし、シリカゲルのパッドを通過させ、酢酸エチルで洗浄した。溶媒を真空中で除去すると、淡褐色の固体が得られ、酢酸エチル:ヘプタン(4:1、体積比)から再結晶すると、85%収率で灰色がかった白色の固体として表題化合物、53gが得られた。
1H NMR
(400MHz, CDCl3) δ = 2.80-2.83 (t, 2H), 2.92-3.00
(t, 2H), 3.82-3.86 (t, 2H), 3.87-3.96 (t, 2H), 7.14-7.22 (2x d, 4H), 7.70-7.72
(dd, 2H), 7.82-7.84 (dd, 2H) ppm.
【0206】
調製11
2−{2−[4−(2−ブロモ−エチル)−フェニル]−エチル}−イソインドール−1,3−ジオン
【0207】
【化42】

トルエン(500mL)中の2−{2−[4−(2−ヒドロキシ−エチル)−フェニル]−エチル}−イソインドール−1,3−ジオン(調製10、22.37g)および三臭化リン(8.20g)の溶液を4時間にわたって還流した。混合物を室温まで冷却し、酢酸エチル(300mL)で希釈し、水(100mL)中の重亜硫酸ナトリウム/重炭酸ナトリウム(1:1)で注意深くクエンチした。有機層を分離し、水(100mL)中のさらなる重亜硫酸ナトリウム/重炭酸ナトリウム(1:1)で洗浄し、硫酸ナトリウムで乾燥し、真空中で濃縮した。得られた固体(24.26g)をヘプタン:tert−ブチルメチルエーテル(100mL;9:1、体積比)でトリチュレートすると、淡緑色の固体として表題化合物、17.94gが得られた。
1H NMR
(400MHz, CDCl3) δ = 2.93-3.00 (t, 2H),
3.07-3.18 (t, 2H), 3.53-3.59 (t, 2H), 3.88-3.94 (t, 2H), 7.13-7.23 (2xd, 4H),
7.70-7.73 (dd, 2H), 7.83-7.85 (dd, 2H) ppm.
【0208】
調製12
2−[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]−1H−イソインドール−1,3(2H)−ジオン
【0209】
【化43】

シクロヘキシル−フェニル−(1−ピペリジン−4−イルメチル−1H−[1,2,4]トリアゾール−3−イル)−メタノール(調製4、8.2g、2.98mmol)、2−{2−[4−(2−ブロモ−エチル)−フェニル]−エチル}−イソインドール−1,3−ジオン(調製11、7.56g、21.1mmol)およびトリエチルアミン(13.3ml、95.9mmol)をアセトニトリル(100ml)に溶かした。48時間にわたって90℃にて撹拌した後、溶媒を真空中で除去し、残渣を、ジクロロメタン(200ml)と水(200mL)の間で分配した。有機層を分離し、硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去した。残渣を、ジクロロメタン:メタノール:880アンモニア(98:2:0.2、体積比)で溶出するシリカゲル上のカラムクロマトグラフィーにより精製し、次いで、得られた材料をtert−ブチルメチルエーテル中でトリチュレートすると、28%収率で透明な固体として表題化合物、3.4gが得られた。
LRMS: APCI ESI m/z 632 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.13 (m, 3H), 1.22-1.37 (m, 5H), 1.43 (m, 1H), 1.50-1.74 (m, 5H),
1.94 (m, 1H), 2.03 (m, 2H), 2.38 (m, 1H), 2.52 (m, 2H), 2.73 (m, 2H), 2.90-3.02
(m, 4H), 3.86 (t, 2H), 4.08 (d, 2H), 7.06-7.17 (m, 5H), 7.25 (m, 2H), 7.58 (m,
2H), 7.78 (m, 4H), 8.32 (s, 1H) ppm.
【0210】
あるいは、表題化合物を、下記の手順に従って調製することができる。
シクロヘキシル−フェニル−(1−ピペリジン−4−イルメチル−1H−[1,2,4]トリアゾール−3−イル)−メタノール(調製4、0.40g、1.13mmol)および2−{2−[4−(2−ブロモ−エチル)−フェニル]−エチル}−イソインドール−1,3−ジオン(調製11、0.404g、1.13mmol)およびジイソプロピルエチルアミン(0.59ml、3.38mmol)をメチルエチルケトン(8mL)に溶かした。24時間にわたって90℃にて撹拌した後、反応物を室温までゆっくりと冷却した。結晶化が起こり、得られた固体を濾過により集め、真空中で乾燥すると、74%収率でクリーム色の固体として表題化合物、0.532gが得られた。
LRMS: APCI ESI m/z 632 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.13 (m, 3H), 1.22-1.37 (m, 5H), 1.43 (m, 1H), 1.50-1.74 (m, 5H),
1.94 (m, 1H), 2.03 (m, 2H), 2.38 (m, 1H), 2.52 (m, 2H), 2.73 (m, 2H), 2.90-3.02
(m, 4H), 3.86 (t, 2H), 4.08 (d, 2H), 7.06-7.17 (m, 5H), 7.25 (m, 2H), 7.58 (m,
2H), 7.78 (m, 4H), 8.32 (s, 1H) ppm.
【0211】
あるいは、表題化合物をまた、下記の手順に従って調製した。
メタンスルホン酸2−{4−[2−(1,3−ジオキソ−1,3−ジヒドロ−イソインドール−2−イル)−エチル]−フェニル}−エチルエステル(調製35、20.00g、53.56mmol)をアセトニトリル(80mL)に溶かし、室温にて撹拌した。ヨウ化ナトリウム(16.06g、107.12mmol)を少しずつ加え、得られたスラリーを18時間にわたって80℃まで加熱した。反応混合物を50℃まで冷却し、さらなるアセトニトリル(80mL)を加えた。この混合物に、シクロヘキシル−フェニル−(1−ピペリジン−4−イルメチル−1H−[1,2,4]トリアゾール−3−イル)−メタノール(調製4、15.87g、53.56mmol)およびジイソプロピルエチルアミン(9.79mL、56.24mmol)を加え、加熱を6時間にわたって続け、次いで、室温まで冷却した。水(160mL)を加え、得られたスラリーを室温にて一晩にわたって撹拌した。固体を濾過により集め、アセトニトリル(5×20mL)で洗浄し、次いで、8時間にわたって45℃にて真空中で乾燥すると、68%収率で褐色の固体として表題化合物、20.9gが得られた。
LRMS: APCI ESI m/z 632 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.13 (m, 3H), 1.22-1.37 (m, 5H), 1.43 (m, 1H), 1.50-1.74 (m, 5H),
1.94 (m, 1H), 2.03 (m, 2H), 2.38 (m, 1H), 2.52 (m, 2H), 2.73 (m, 2H), 2.90-3.02
(m, 4H), 3.86 (t, 2H), 4.08 (d, 2H), 7.06-7.17 (m, 5H), 7.25 (m, 2H), 7.58 (m,
2H), 7.78 (m, 4H), 8.32 (s, 1H) ppm.
【0212】
調製13
(R)−{1−[(1−{2−[4−(2−アミノエチル)フェニル]エチル}ピペリジン−4−イル)メチル]−1H−1,2,4−トリアゾール−3−イル}(シクロヘキシル)フェニルメタノール
【0213】
【化44】

2−[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]−1H−イソインドール−1,3(2H)−ジオン(調製12、3.4g、5.38mmol)をエタノール(20ml)中に懸濁し、ヒドラジン水和物(2.61ml、53.8ml)を加えた。2時間にわたって還流状態にて撹拌した後、反応物を室温まで冷却し、沈殿を濾過により集め、エタノール(200ml)で洗浄した。濾液を真空中で濃縮すると、81%収率で白色の固体として表題化合物、2.57gが得られた。
LRMS: ESI m/z 502 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.04-1.75 (m, 14H), 1.90-2.08 (m, 3H), 2.38 (m, 1H), 2.54 (m,
2H), 2.68 - 2.78 (m, 4H), 2.84 (m, 2H), 2.99 (m, 2H), 3.96 (d, 2H), 7.09-7.17
(m, 4H), 7.12 (m, 1H), 7.25 (m, 2H), 7.59 (m, 2H), 8.31 (s, 1H) ppm.
【0214】
調製14
8−(ベンジルオキシ)−5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}エチル]キノリン−2(1H)−オン
【0215】
【化45】

表題化合物を、調製7に記載されているのと同じ方法を使用して(R)−{1−[(1−{2−[4−(2−アミノエチル)フェニル]エチル}ピペリジン−4−イル)メチル]−1H−1,2,4−トリアゾール−3−イル}(シクロヘキシル)フェニルメタノール(調製13、2.57g、5.12mmol)および8−(ベンジルオキシ)−5−[(1R)−2−ブロモ−1−{[tert−ブチル(ジメチル)シリル]オキシ}エチル]キノリン−2(1H)−オン(WO2005/09286、2.50g、5.12mmol)から調製すると、40%収率で白色の固体、2.3gが得られた。
LRMS: ESI m/z 909 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = -0.28 (s, 3H), -0.04 (s, 3H), 0.76 (s, 9H), 1.04-1.76 (m, 14H),
1.93 (m, 3H), 2.39 (m, 1H), 2.53 (m, 2H), 2.64-2.79 (m, 5H), 2.79-2.94 (m, 3H),
2.99 (m, 2H), 4.07 (d, 2H), 5.15 (m, 1H), 5.30 (s, 2H), 6.65 (m, 1H), 7.06 (m,
4H), 7.15 (m, 3H), 7.20-7.43 (m, 5H), 7.49 (d, 2H), 7.59 (d, 2H), 8.32 (s, 1H),
8.39 (d,1H) ppm.
【0216】
調製15
5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}エチル]−8−ヒドロキシキノリン−2(1H)−オン
【0217】
【化46】

表題化合物を、調製8に記載されているのと同じ方法を使用して8−(ベンジルオキシ)−5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}エチル]キノリン−2(1H)−オン(調製14、2.30g、2.81mmol)から調製すると、91%収率で黄色の固体、2.10gが得られた。
LRMS: ESI m/z 819 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = -0.28 (s, 3H), -0.04 (s, 3H), 0.77 (s, 9H), 1.02-1.22 (m, 3H),
1.22-1.51 (m, 6H), 1.51-1.76 (m, 5H), 1.95 (m, 1H), 2.08 (m, 2H), 2.39 (m, 1H),
2.57 (m, 2H), 2.69 - 2.81 (m, 5H), 2.84 - 2.94 (m, 3H), 3.07 (m, 2H), 4.08 (d,
2H), 5.13 (m, 1H), 6.62 (d, 1H), 6.91 (d, 1H), 6.99-7.11 (m, 5H), 7.16 (m, 1H),
7.25 (m, 2H), 7.59 (d, 2H), 8.32 (s, 1H), 8.38 (d, 1H) ppm.
【0218】
調製16
1−(ピロリジン−1−イルメチル)−1H−1,2,4−トリアゾール
【0219】
【化47】

トリアゾール(10g、144.8mmol)およびピロリジン(11.3g、159.0mmol)をエタノール(60ml)に溶かし、ホルムアルデヒド(37%水溶液、12.9ml、159.0mmol)を加えた。4時間にわたって還流状態にて撹拌した後、反応物を18時間にわたって室温にて放置した。溶媒を真空中で除去し、残渣を、ジクロロメタン(150ml)と水(80mL)の間で分配した。水相を分離し、追加のジクロロメタン(80ml)で抽出した。合わせた有機層を食塩水(100ml)で洗浄し、硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去すると、55%収率で黄色の油として表題化合物、12.2gが得られた。
1H NMR
(400 MHz, クロロホルム-d) δ = 1.75
(m, 4H), 2.70 (m, 4H), 5.13 (s, 2H), 7.94 (s, 1H), 8.13 (s, 1H) ppm.
【0220】
調製17
シクロヘキシル(フェニル)[1−(ピロリジン−1−イルメチル)−1H−1,2,4−トリアゾール−5−イル]メタノール
【0221】
【化48】

1−(ピロリジン−1−イルメチル)−1H−1,2,4−トリアゾール(調製16、12.0g、78.84mmol)をテトラヒドロフラン(120mL)に溶かし、溶液を−78℃まで冷却した。次いで、n−ブチルリチウム(ヘキサン中2.5M、34.7ml、86.7mmol)を30分かけて滴下添加した。室温まで温め、1時間にわたって撹拌した後、反応混合物を−78℃まで冷却し、テトラヒドロフラン(30mL)中のシクロヘキシル(フェニル)メタノン(16.3g、86.7mmol)の溶液を滴下添加した。18時間かけて室温まで温めた後、水(100ml)を加え、溶媒を真空中で除去した。残渣を酢酸エチル(200ml)で分配し、水相を分離し、酢酸エチル(2×200ml)で再抽出した。合わせた有機層を硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去すると、100%収率で黄色の油として表題化合物、27.28gが得られた。
1H NMR
(400 MHz, クロロホルム-d) δ =
1.00-1.94 (m, 14H), 2.49 (m 1H), 2.71 (m, 4H), 5.08 (s, 2H), 7.19 (m, 1H), 7.30
(m, 2H), 7.72 (m, 2H), 8.00 (s, 1H) ppm.
【0222】
調製18
シクロヘキシル(フェニル)1H−1,2,4−トリアゾール−3−イルメタノール
【0223】
【化49】

シクロヘキシル(フェニル)[1−(ピロリジン−1−イルメチル)−1H−1,2,4−トリアゾール−5−イル]メタノール(調製17、27.28g、80.12mmol)をエタノール(400ml)に溶かし、水素化ホウ素ナトリウム(3.03g、80.1mmol)を少しずつ加えた。3時間にわたって還流状態にて撹拌した後、反応物を、18時間かけて室温まで冷却した。溶媒を真空中で除去し、残渣を、ペンタン:酢酸エチル(3:1〜0:1、体積比)で溶出するシリカゲル上のカラムクロマトグラフィーにより精製すると、79%収率で白色の泡として表題化合物、16.4gが得られた。
LRMS: APCI ESI m/z 256 [M-H]-1H
NMR (400 MHz, クロロホルム-d) δ =
0.90-1.80 (m, 10H), 2.46 (m 1H), 7.25 (m, 1H), 7.33 (m, 2H), 7.67 (m, 2H), 8.00
(s, 1H) ppm.
【0224】
調製19
tert−ブチル−4−({3−[シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−カルボキシレート
【0225】
【化50】

表題化合物を、調製3に記載されているのと同じ方法を使用してシクロヘキシル(フェニル)1H−1,2,4−トリアゾール−3−イルメタノール(調製18、500mg、1.94mmol)およびtert−ブチル4−(ブロモメチル)ピペリジン−1−カルボキシレート(649mg、2.33mmol)から調製すると、47%収率で透明な油、415mgが得られた。
LRMS: APCI ESI m/z 381 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.05-1.45 (m, 9H), 1.43 (s, 9H), 1.52 (m, 2H), 1.67 (m, 3H), 2.09
(m, 1H), 2.38 (m, 1H), 2.72 (m, 2H), 4.08 (m, 4H), 7.17 (m, 1H), 7.26 (m, 2H),
7.58 (d, 2H), 8.30 (s, 1H) ppm.
【0226】
調製20
シクロヘキシル(フェニル)[1−(ピペリジン−4−イルメチル)−1H−1,2,4−トリアゾール−3−イル]メタノール
【0227】
【化51】

表題化合物を、調製4に記載されているのと同じ方法を使用してtert−ブチル−4−({3−[シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−カルボキシレート(調製19、450mg、0.990mmol)から調製すると、91%収率で透明な油、320mgが得られた。
LRMS: APCI ESI m/z 378 [M+Na]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.04-1.35 (m, 9H), 1.39-1.55 (m, 2H), 1.59-1.75 (m, 3H), 2.03(m,
1H), 2.38 (m, 1H), 2.5 (m, 2H), 3.01 (m, 2H), 4.05 (d, 2H), 7.15 (m, 1H), 7.27
(m, 2H), 7.58 (d, 2H), 8.31 (s, 1H) ppm.
【0228】
調製21
ジ−tert−ブチル{9−[4−({3−[シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)−ピペリジン−1−イル]ノニル}イミドジカーボネート
【0229】
【化52】

表題化合物を、調製5に記載されているのと同じ方法を使用してシクロヘキシル(フェニル)[1−(ピペリジン−4−イルメチル)−1H−1,2,4−トリアゾール−3−イル]メタノール(調製20、300mg、0.846mmol)およびジ−tert−ブチル(9−ブロモノニル)イミドジカーボネート(US04167167、357mg、0.846mmol)から調製すると、61%収率で白色の泡、360mgが得られた。
LRMS: APCI ESI m/z 696 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.14 (m, 4H), 1.23 - 1.37 (m, 18H) 1.46-1.60 (m, 24H) 1.68 (m,
2H) 1.96 (m, 2H) 2.33 (m, 2H) 2.95(m, 2H) 3.55 (m, 2H) 4.07 (m, 2H) 7.16 (m,
1H) 7.26 (m, 2H) 7.58 (m, 2H) 8.31 (s, 1H) ppm.
【0230】
調製22
(1−{[1−(9−アミノノニル)ピペリジン−4−イル]メチル}−1H−1,2,4−トリアゾール−3−イル)(シクロヘキシル)フェニルメタノール
【0231】
【化53】

表題化合物を、調製6に記載されているのと同じ方法を使用してジ−tert−ブチル{9−[4−({3−[シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}イミドジカーボネート(調製21、360mg、0.57mmol)から調製すると、90%収率で透明な油、230mgが得られた。
LRMS: APCI m/z 496 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.12 (m, 4H), 1.22-1.39 (m, 18H), 1.39-1.58 (m, 6H), 1.64 (m,
2H), 1.94 (m, 2H), 2.31 (m, 2H), 2.65 (m, 2H), 2.93 (m, 2H), 4.06 (d, 2H), 7.16
(m, 1H), 7.25 (m, 2H), 7.58 (d, 2H), 8.31 (s, 1H) ppm.
【0232】
調製23
8−(ベンジルオキシ)−5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−({9−[4−({3−[シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}−アミノ)エチル]キノリン−2(1H)−オン
【0233】
【化54】

表題化合物を、調製7に記載されているのと同じ方法を使用して(1−{[1−(9−アミノノニル)ピペリジン−4−イル]メチル}−1H−1,2,4−トリアゾール−3−イル)(シクロヘキシル)フェニルメタノール(調製22、150mg、0.303mg)および8−(ベンジルオキシ)−5−[(1R)−2−ブロモ−1−{[tert−ブチル(ジメチル)シリル]オキシ}エチル]キノリン−2(1H)−オン(WO05/09286、148mg、0.303mmol)から調製すると、24%収率で透明な油、66mgが得られた。
LRMS: APCI m/z 904 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 0.07 (s, 3H), 0.37 (s, 3H), 1.15 (s, 9H), 1.32-1.65(m, 22H), 1.76
(m, 6H), 1.92 (m, 2H), 2.20 (m, 2H), 2.58 (m, 2H), 2.86 (m, 2H), 3.01 (m, 1H),
3.19 (m, 3H), 4.35 (m, 2H), 5.52 (m, 1H), 5.61 (s, 2H), 6.95 (d, 1H), 7.4-7.69
(m, 8H), 7.79 (m, 2H), 7.86 (m, 2H), 8.59 (s, 1H), 8.74 (d, 1H) ppm.
【0234】
調製24
5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−({9−[4−({3−[シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]−8−ヒドロキシキノリン−2(1H)−オン
【0235】
【化55】

表題化合物を、調製8に記載されているのと同じ方法を使用して8−(ベンジルオキシ)−5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−({9−[4−({3−[シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]キノリン−2(1H)−オン(調製23、60mg、0.066mmol)から調製すると、70%収率で透明なガラス、38mgが得られた。
LRMS: ESI m/z 813 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 0.05 (s, 3H), 0.35 (s, 3H), 1.16 (s, 9H), 1.35- 1.62 (m, 22H),
1.68-1.85 (m, 6H), 1.85-2.02 (m, 2H), 2.22 (m, 2H), 2.63 (m, 2H), 2.90 (m, 2H),
3.04 (m, 1H), 3.23 (m, 3H), 4.34 (m, 2H), 5.47 (m, 1H), 6.87 (d, 1H), 7.19 (d,
1H), 7.42 (m, 2H), 7.53 (m, 2H), 7.85 (m, 2H), 8.58 (s, 1H), 8.70 (d, 1H) ppm.
【0236】
調製25
ベンジル4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−カルボキシレート
【0237】
【化56】

ベンジル4−(ブロモメチル)ピペリジン−1−カルボキシレート(5g、16mmol)をジメチルホルムアミド(40ml)に溶かし、ジフェニル−(1H−[1,2,4]トリアゾール−3−イル)−メタノール(Tetrahedron:Asymmetry、8(9)、1491〜1500;1997;3.35g、13.65mmol)と、続いて、炭酸カリウム(3.69g、26.7mmol)を加えた。18時間にわたって70℃にて撹拌した後、溶媒を真空中で除去し、残渣を、酢酸エチル(150ml)と水(150mL)の間で分配した。有機層を分離し、硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去すると、81%収率で白色の固体として表題化合物、5.2gが得られた。
1H NMR
(400 MHz, クロロホルム-d) δ =
1.11-1.40 (m, 5H), 1.50-1.77 (m, 2H), 2.75 (m, 2H), 4.20 (m, 2H), 5.09(m, 2H),
7.23-7.46 (m, 15H), 8.01 (s, 1H) ppm.
【0238】
調製26
ジフェニル[1−(ピペリジン−4−イルメチル)−1H−1,2,4−トリアゾール−3−イル]メタノール
【0239】
【化57】

ベンジル4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−カルボキシレート(調製25、5.2g、16.78mmol)をエタノール(300ml)に溶かし、ギ酸アンモニウム(6g)および水酸化パラジウム[炭素(湿った)上20wt.%(乾燥ベース)](1g)を加えた。1時間にわたって還流状態にて撹拌した後、反応混合物を室温まで冷却し、arbocel(登録商標)に通して濾過した。溶媒を真空中で除去し、残渣を、ジクロロメタン(500ml)と水(500mL)の間で分配した。水層を分離し、次いで、水酸化ナトリウム水溶液(2N、200ml)で塩基性化し、ジクロロメタン(500ml)で抽出した。次いで、この有機層を硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去した。粗材料をアセトニトリルから再結晶すると、51%収率で白色の固体として表題化合物、1.9gが得られた。
1H NMR
(400 MHz, メタノール-d4) δ = 1.56 (m, 2H), 1.86 (m, 2H), 2.35 (m, 1H), 2.99 (m, 2H), 3.40 (m,
2H), 4.38 (m, 2H), 7.28-7.47 (m, 11H) ppm.
【0240】
調製27
ジ−tert−ブチル{9−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}イミドジカーボネート
【0241】
【化58】

表題化合物を、調製5に記載されているのと同じ方法を使用してジフェニル[1−(ピペリジン−4−イルメチル)−1H−1,2,4−トリアゾール−3−イル]メタノール(調製26、2.00g、5.740mmol)およびジ−tert−ブチル(9−ブロモノニル)イミドジカーボネート(US04167167、2.42g、5.740mmol)から調製すると、43%収率で透明な油、1.7gが得られた。
LRMS: APCI ESI m/z 691 [M+H]+
1H NMR
(400 MHz, クロロホルム-d) δ =
1.18-1.35 (m, 11H), 1.41 (m, 3H), 1.49 (s, 18H), 1.57 (m, 4H), 1.94 (m, 3H),
2.38 (m, 2H) 2.96 (m, 2H) 3.54 (m, 2H), 4.00 (m, 2H) 7.22-7.48 (m, 10H), 7.99
(s, 1H) ppm.
【0242】
調製28
(1−{[1−(9−アミノノニル)ピペリジン−4−イル]メチル}−1H−1,2,4−トリアゾール−3−イル)(ジフェニル)メタノール
【0243】
【化59】

ジ−tert−ブチル{9−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}イミドジカーボネート(調製27、1.7g、2.46mmol)をエタノール(30ml)に溶かし、エーテル中塩化水素(2M、30ml、60mmol)を加えた。18時間にわたって室温にて撹拌した後、溶媒を真空中で除去し、残渣を、ジクロロメタン(200ml)と飽和重炭酸ナトリウム水溶液(200ml)の間で分配した。有機層を分離し、硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去した。残渣を、ジクロロメタン:メタノール:880アンモニア(90:10:1〜80:20:2、体積比)で溶出するシリカゲル上のカラムクロマトグラフィーにより精製すると、60%収率で白色の固体として表題化合物、725mgが得られた。
1H NMR
(400 MHz, メタノール-d4) δ = 1.30 (m, 11H), 1.40-1.62 (m, 7H), 1.93 (m, 3H), 2.28 (m, 2H),
2.61 (m, 2H), 2.94 (m, 2H), 4.09 (m, 2H), 7.20-7.36 (m, 10H), 8.36 (s, 1H) ppm.
【0244】
調製29
8−(ベンジルオキシ)−5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−({9−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]キノリン−2(1H)−オン
【0245】
【化60】

(1−{[1−(9−アミノノニル)ピペリジン−4−イル]メチル}−1H−1,2,4−トリアゾール−3−イル)(ジフェニル)メタノール(調製28、710mg、1.45mmol)および8−(ベンジルオキシ)−5−[(1R)−2−ブロモ−1−{[tert−ブチル(ジメチル)シリル]オキシ}エチル]キノリン−2(1H)−オン(WO200509286、708mg、1.45mmol)をジクロロメタン(5ml)に溶かし、ジメチルスルホキシド(100μl)およびジイソプロピルエチルアミン(253μl)を加えた。48時間にわたって95℃にて密封容器中で撹拌した後、溶媒を真空中で除去した。残渣を、ジクロロメタン:メタノール:880アンモニア(90:10:1、体積比)で溶出するシリカゲル上のカラムクロマトグラフィーにより精製すると、38%収率で透明な油として表題化合物、500mgが得られた。
LRMS:APCI m/z 898[M+H]+
【0246】
調製30
5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−({9−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]−8−ヒドロキシキノリン−2(1H)−オン
【0247】
【化61】

表題化合物を、調製8に記載されているのと同じ方法を使用して8−(ベンジルオキシ)−5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−({9−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]キノリン−2(1H)−オン(調製29、500mg、0.056mmol)から調製すると、59%収率で黄色のガラス、267mgが得られた。
LRMS: ESI m/z 807 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 0.00 (s, 3H), 0.20(s, 3H), 1.00 (s, 9H), 1.06-1.82 (m, 18H), 2.19
(m, 3H), 2.55 (m, 2H), 2.63 (m, 1H), 2.73 (m, 1H ), 3.05 (m, 1H ), 3.13 (m,
1H), 3.25 (m, 2H), 4.17 (m, 2H), 5.22 (m, 1H), 6.78 (m, 2H), 7.13-7.48 (m, 7H),
7.58 (m, 4H), 8.17 (m, 1H), 8.50 (m, 1H) ppm.
【0248】
調製31
2−[2−(4−{2−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]−1H−イソインドール−1,3(2H)−ジオン
【0249】
【化62】

表題化合物を、調製12に記載されているのと同じ方法を使用してジフェニル[1−(ピペリジン−4−イルメチル)−1H−1,2,4−トリアゾール−3−イル]メタノール(調製26、778mg、2.23mmol)および2−{2−[4−(2−ブロモエチル)フェニル]エチル}−1H−イソインドール−1,3(2H)−ジオン(調製11、800mg、2.23mmol)から調製すると、71%収率で白色の固体、1.00gが得られた。
LRMS: ESI m/z 627 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.24-2.03 (m, 7H), 2.54 (m, 2H), 2.75 (m, 2H), 2.97 (m, 4H), 3.88
(m, 2H), 3.99 (m, 2H), 7.10 (m, 2H), 7.20 (m, 2H), 7.29 (m, 7H), 7.44 (m, 3H),
7.70 (m, 2H), 7.82 (m, 2H), 7.99 (s, 1H) ppm.
【0250】
調製32
{1−[(1−{2−[4−(2−アミノエチル)フェニル]エチル}ピペリジン−4−イル)メチル]−1H−1,2,4−トリアゾール−3−イル}(ジフェニル)メタノール
【0251】
【化63】

表題化合物を、調製13に記載されているのと同じ方法を使用して2−[2−(4−{2−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]−1H−イソインドール−1,3(2H)−ジオン(調製31、1.0g、1.59mmol)から調製すると、75%収率で無色の油、790mgが得られた。
LRMS: ESI m/z 497 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.37 (m, 2H) 1.58 (m, 2H) 1.93 (m, 1H) 2.05 (m, 2H) 2.54 (m, 2H)
2.73 (m, 4H) 2.83 (m, 2H) 3.02 (m, 2H) 4.09 (d, 2H) 7.13 (m, 4H) 7.26 (m, 6H)
7.33 (m, 4H), 8.38 (s, 1H) ppm.
【0252】
調製33
8−(ベンジルオキシ)−5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−{[2−(4−{2−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]−アミノ}エチル]キノリン−2(1H)−オン
【0253】
【化64】

表題化合物を、調製7に記載されているのと同じ方法を使用して{1−[(1−{2−[4−(2−アミノエチル)フェニル]エチル}ピペリジン−4−イル)メチル]−1H−1,2,4−トリアゾール−3−イル}(ジフェニル)メタノール(調製32、590mg、1.2mmol)および8−(ベンジルオキシ)−5−[(1R)−2−ブロモ−1−{[tert−ブチル(ジメチル)シリル]オキシ}エチル]キノリン−2(1H)−オン(WO2005/09286、581mg、1.19mmol)から調製すると、67%収率で白色の固体、740mgが得られた。
LRMS: ESI m/z 903 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = -0.28 (s, 3H), -0.04 (s, 3H), 0.76 (s, 9H), 1.38 (m, 2H), 1.59
(m, 2H), 1.92 (m, 1H), 2.05 (m, 2H), 2.54 (m, 2H), 2.69-2.94 (m, 8H), 3.03 (m,
2H), 4.11 (m, 2H), 5.15 (m, 1H), 5.32 (s, 2H), 6.65 (d, 1H), 7.08 (m, 4H), 7.16
(m, 2H), 7.27 (m, 6H), 7.35 (m, 7H), 7.50 (m, 2H), 8.40 (s,2H) ppm.
【0254】
調製34
5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−{[2−(4−{2−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}エチル]−8−ヒドロキシキノリン−2(1H)−オン
【0255】
【化65】

8−(ベンジルオキシ)−5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−{[2−(4−{2−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}エチル]キノリン−2(1H)−オン(調製33、740mg、0.82mmol)、水酸化パラジウム[炭素(湿った)上20wt.%(乾燥ベース)](23mg、0.164mmol)およびメチルシクロヘキシルジエン(methylcyclohexyldiene)(231mg、2.46mmol)をMeOH(20ml)に溶かした。18時間にわたって50℃にて撹拌した後、追加のメチルシクロヘキシルジエン(115.5mg、1.23mmol)を加え、撹拌を、さらに18時間にわたって50℃にて続けた。反応混合物を冷却し、arbocel(登録商標)に通して濾過し、溶媒を真空中で除去すると、87%収率で黄色の固体として表題化合物、580mgが得られた。
LRMS: ESI m/z 814 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = -0.28 (s, 3H), -0.04 (s, 3H), 0.77 (s, 9H), 1.38(m, 2H), 1.60 (m,
2H), 1.92 (m, 1H), 2.07 (m, 2H), 2.57 (m, 2H), 2.70-2.96 (m, 8H), 3.05 (m, 2H),
4.10 (m, 2H), 5.14 (m, 1H), 6.59 (d, 1H), 6.92 (d, 1H), 7.08 (m, 4H), 7.15 (m,
1H), 7.25 (m, 6H), 7.35 (m, 4H), 8.33 (d, 1H), 8.40 (s, 1H) ppm.
【0256】
調製35
メタンスルホン酸2−{4−[2−(1,3−ジオキソ−1,3−ジヒドロ−イソインドール−2−イル)−エチル]−フェニル}−エチルエステル
【0257】
【化66】

メチルエチルケトン(315mL)中の2−{2−[4−(2−ヒドロキシ−エチル)フェニル]−エチル}−イソインドール−1,3−ジオン(調製10、21.0g、71.25mmol)の溶液を0℃まで冷却した。トリエチルアミン(14.9mL、106.87mmol)を加え、続いて、塩化メタンスルホニル(6.07mL、78.37mmol)を滴下添加した。反応物を1時間にわたって0〜4℃にて撹拌し、次いで、室温まで温めた。炭酸カリウムの水溶液(1M、210mL)を加え、混合物を撹拌した。有機層と水層を分離し、水層をメチルエチルケトン(50mL)で再抽出した。合わせた有機層を蒸留により40mLまで濃縮した。tert−ブチルメチルエーテル(300mL)を熱溶液にゆっくりと加え、結晶化を起こさせた。混合物を室温まで冷却し、次いで、72時間にわたって撹拌した。固体を濾過により取り出し、tert−ブチルメチルエーテル(3×25mL)で洗浄した。固体を4時間にわたって45℃にて真空中で乾燥すると、92%収率で淡褐色の固体として表題化合物、24.6gが得られた。
1H NMR
(400MHz, CDCl3) δ = 2.82 (s, 3H), 2.96-3.02
(m, 4H), 3.89-3.93 (t, 2H), 4.37-4.40 (t, 2H), 7.13-7.23 (2xd, 4H), 7.70-7.72
(dd, 2H), 7.81-7.83 (dd, 2H) ppm.
【0258】
調製36
(2R)−シクロヘキシル−ヒドロキシ−フェニル−酢酸
【0259】
【化67】

アセトニトリル(810ml)および水(65ml)中のD−チロシンメチルエステル(90.0g、460mmol)のスラリーに、ラセミの2−シクロヘキシル−2−ヒドロキシ−2−フェニル酢酸(216.0g、921mmol)を加えた。混合物を1時間にわたって還流状態まで加熱し、次いで、一晩にわたって室温まで冷却した。混合物を4時間にわたって4℃までさらに冷却し、次いで、濾過し、冷アセトニトリル(400ml)で洗浄すると、白色の固体(169.9g)が得られた。この固体をメチルtert−ブチルエーテル(1.35L)と0.5M水性塩酸(765ml、1当量)の間で分配した。有機層を分離し、0.5M水性塩酸(380ml、0.5当量)で洗浄し、硫酸ナトリウムで乾燥し、濾過し、溶媒を真空中で除去すると、白色の固体として表題化合物、84.5gが得られた。
LRMS: APCI ESI m/z 233 [M-H]-
1H NMR
(400 MHz, DMSO-d6) δ = 0.95-1.14 (m, 4H), 1.19-1.29 (m,
1H), 1.32-1.42 (m, 1H), 1.49-1.63 (m, 3H), 1.69-1.78 (m, 1H), 2.11-2.19 (m,
1H), 7.21-7.25 (m, 1H), 7.30-7.34 (m, 2H), 7.57-7.60 (m, 2H) ppm.
【実施例】
【0260】
(実施例1)
5−[(1R)−2−({9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン
【0261】
【化68】

5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−({9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]−8−ヒドロキシキノリン−2(1H)−オン(調製8、13.06g、16.06mmol)をメタノール(430ml)に溶かし、フッ化アンモニウム(2.97g、80.3mmol)を加えた。18時間にわたって40℃にて撹拌した後、溶媒を真空中で除去し、残渣をジクロロメタン/メタノール(950ml/50ml)と飽和重炭酸ナトリウム水溶液(500mL)の間で分配した。有機層を分離し、水層をジクロロメタン/メタノール(450ml/50ml)でさらに抽出した。合わせた有機層を硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去した。残渣を、ジクロロメタン:メタノール:880アンモニア(90:10:1、体積比)で溶出するシリカゲル上のカラムクロマトグラフィーにより精製すると、72.3%収率で黄色の泡として表題化合物、8.12gが得られた。
LRMS: ESI m/z 699 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ =: 1.05-1.77 (m, 28H), 1.98 (m, 3H), 2.35 (m, 3H) 2.75 (m, 2H),
2.95 (m, 4H), 4.09 (m, 2H), 5.24 (m, 1H), 6.65 (d, 1H), 6.95 (d, 1H), 7.15-7.27
(m, 4H), 7.60 (m, 2H), 8.33 (s, 1H), 8.38 (d, 1H) ppm.
【0262】
(実施例1a)
5−[(1R)−2−({9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン ナフタレン−1,5−ジスルホン酸塩
【0263】
【化69】

5−[(1R)−2−({9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン(実施例1、2.0g、2.86mmol)をメタノール(15ml)に溶かし、水(3ml)中のナフタレン−1,5−ジスルホン酸(825.0mg、2.86mmol)の溶液を滴下添加した。混合物を一晩にわたって室温にて撹拌した。得られた固体を濾過により取り出し、真空中で乾燥すると、白色の固体2.03gが得られた。この材料50mgをメタノール:水(体積比70:30、1ml)で処理し、得られた懸濁液を70℃まで加熱し、次いで、24時間かけて20℃まで冷却した。固体を濾過により回収し、水で洗浄し、真空中で乾燥すると、結晶性の白色の固体として表題化合物、19mgが得られた。
1H NMR
(400 MHz, DMSO-d) δ =: 0.95-1.70 (m, 28H), 1.96-2.29
(m, 3H), 2.71-3.13 (m, 7H), 3.42 (m, 2H), 4.07 (m, 2H), 5.30 (m, 1H), 6.58 (d,
1H), 6.95 (d, 1H), 7.13 (m, 2H), 7.23 (m, 2H), 7.41 (m, 2H), 7.56 (m, 2H), 7.92
(m, 2H), 8.17 (d, 1H), 8.42 (s, 1H ), 8.89 (d, 2H) ppm.
【0264】
(実施例2)
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン
【0265】
【化70】

表題化合物を、実施例1に記載されているのと同じ方法を使用して5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}エチル]−8−ヒドロキシキノリン−2(1H)−オン(調製15、2.30g、2.81mmol)から調製すると、77%収率で黄色の固体、1.40gが得られた。
LRMS: ESI m/z 705[M+H]+
1H NMR
(400 MHz, メタノール-d4) δ= 1.08-1.48 (m, 9H), 1.48-1.81 (m, 5H), 1.94 (m, 1H), 2.08 (m, 2H),
2.38 (m, 1H), 2.54 (m, 2H), 2.66-2.97 (m, 8H), 3.04 (m, 2H), 4.07 (d, 2H), 5.18
(m, 1H), 6.61 (d, 1H), 6.92 (d, 1H), 7.07 (m, 4H), 7.15 (m, 2H), 7.25 (m, 2H),
7.56 (d, 2H), 8.31 (m, 2H) ppm.
【0266】
(実施例2a)
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン ナフタレン−1,5−ジスルホン酸塩
【0267】
【化71】

5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン(実施例2、935mg、1.33mmol)をメタノール(10mL)に溶かした。メタノール(5mL)中の1,5−ナフタレンジスルホン酸四水和物(478mg、1.33mmol)の溶液を加え、形成した沈殿を、水(5mL)を加えて加熱することにより再び溶かした。得られた溶液を真空中で蒸発させ、メタノール(50mL)中に再懸濁し、30秒にわたって還流状態まで加熱した。上清を残渣からデカントし、残渣をメタノール(50mL)中に再懸濁し、4日にわたって撹拌しながら還流状態にて加熱した。得られた沈殿を濾過により集め、真空下で乾燥すると、無色の結晶性固体として表題化合物、990mgが得られた。
1H NMR
(400 MHz, DMSO-d6) δ = 0.94-1.49 (m, 8H),
1.50-1.74 (m, 6H), 1.99-2.12 (m, 1H), 2.19-2.27 (m, 1H), 2.83-3.01 (m, 6H),
3.04-3.24 (m, 6H), 3.49-3.59 (m, 2H), 4.05-4.11 (d, 2H), 5.07 (s, 1H),
5.30-5.36 (m, 1H), 6.14-6.19 (d, 1H), 6.57-6.59 (d, 1H), 6.97-6.99 (d, 1H),
7.12-7.19 (m, 6H), 7.24-7.28 (t, 2H), 7.39-7.43 (t, 2H), 7.56-7.58 (d, 2H),
7.94-7.96 (d, 2H), 8.15-8.18 (d, 1H), 8.45 (s, 1H), 8.59-8.74 (bm, 2H),
8.88-8.90 (d, 2H), 9.04-9.19 (bm, 1H), 10.41 (s, 1H), 10.45 (s, 1H) ppm.
【0268】
上に記載されているプロセスにより製造される結晶性形態(形態1)は、図1/1の対応する粉末X線回折パターンにおいて示される特徴も有する。主な特徴的ピークは、12.7、18.1、21.0、22.2および23.6°2θ±0.1°2θにあり、下の表1でさらに示す。
【0269】
【表1】

【0270】
(実施例2b)
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン コハク酸塩
【0271】
【化72】

5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン(実施例2、50mg、0.07mmol)をメタノール(4mL)に溶かした。メタノール(1mL)中のコハク酸(8.4mg、0.07mmol)の溶液を加え、得られた濁った溶液を一晩にわたって放置して蒸発させた。得られたガムを、加熱しながらエタノール(2.5mL)および水(2.5mL)に再び溶かし、次いで、一晩にわたって撹拌しながら室温まで冷却した。得られた沈殿を濾過により集め、真空下で乾燥すると、無色の結晶性の固体として表題化合物、28mgが得られた。
1H NMR
(400 MHz, DMSO-d6) δ = 0.97-1.85 (m, 15H),
1.88-1.93 (m, 2H), 2.19-2.25 (m, 1H), 2.34 (s, 4H), 2.44-2.47 (m, 2H),
2.64-2.68 (m, 2H), 2.71-2.75 (m, 2H), 2.84-2.93 (m, 6H), 4.02 (d, 2H),
5.10-5.13 (m, 1H), 6.52 (d, 1H), 6.93 (d, 1H), 7.07-7.16 (m, 6H), 7.25 (t, 2H),
7.56 (d, 2H), 8.15 (d, 1H), 8.38 (s, 1H) ppm.
【0272】
(実施例2c)
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン フマル酸塩
【0273】
【化73】

5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン(実施例2、50mg、0.07mmol)をメタノール(4mL)に溶かした。メタノール(1mL)中のフマル酸(8.2mg、0.07mmol)の溶液を加え、得られた濁った溶液を一晩にわたって放置して蒸発させた。得られたガムを、加熱しながらエタノール(2.5mL)および水(2.5mL)に再び溶かし、次いで、一晩にわたって撹拌しながら室温まで冷却した。得られた沈殿を濾過により集め、真空下で乾燥すると、無色の結晶性の固体として表題化合物、38mgが得られた。
1H NMR
(400 MHz, DMSO-d6) δ = 0.99-1.84 (m, 15H),
1.91-1.98 (m, 2H), 2.18-2.24 (m, 1H), 2.46-2.49 (m, 2H), 2.65-2.69 (m, 2H),
2.78-2.82 (m, 2H), 2.90-3.02 (m, 6H), 4.03 (d, 2H), 5.19-5.22 (m, 1H), 6.51 (m,
3H), 6.95 (d, 1H), 7.09-7.16 (m, 6H), 7.23-7.27 (m, 2H), 7.56 (d, 2H), 8.18 (d,
1H), 8.39 (s, 1H) ppm.
【0274】
(実施例3)
5−[(1R)−2−({9−[4−({3−[シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン
【0275】
【化74】

表題化合物を、実施例1に記載されているのと同じ方法を使用して5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−({9−[4−({3−[シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]−8−ヒドロキシキノリン−2(1H)−オン(調製24、18mg、0.022mmol)から調製すると、65%収率で透明なガラス、10mgが得られた。
LRMS:APCI ESI m/z 699 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ =: 1.07-1.76 (m, 30H), 1.98 (m, 2H), 2.36 (m, 2H), 2.75 (m, 2H),
2.95 (m, 4H), 4.07 (m, 2H), 5.24 (m, 1H), 6.65 (d, 1H), 6.95 (d, 1H), 7.12-7.28
(m, 4H), 7.58 (m, 2H), 8.31 (s, 1H), 8.37 (d, 1H) ppm.
【0276】
(実施例4)
8−ヒドロキシ−5−[(1R)−1−ヒドロキシ−2−({9−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]キノリン−2(1H)−オン
【0277】
【化75】

表題化合物を、実施例1に記載されているのと同じ方法を使用して5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−({9−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]−8−ヒドロキシキノリン−2(1H)−オン(調製30、260mg、0.322mmol)から調製すると、49%収率で黄色のガラス、110mgが得られた。
LRMS:APCI ESI m/z 693 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ =: 1.24-1.39 (m, 12H), 1.42-1.62 (m, 6H), 1.87-2.03 (m, 3H), 2.34
(m, 2H), 2.74 (m, 2H), 2.93 (m, 4H), 4.07 (m, 2H), 5.24 (m, 1H), 6.63 (d, 1H),
6.95 (d, 1H), 7.17-7.30 (m, 7H), 7.30-7.37 (m, 4H), 8.35 (m, 2H) ppm.
【0278】
(実施例5)
8−ヒドロキシ−5−[(1R)−1−ヒドロキシ−2−{[2−(4−{2−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}エチル]キノリン−2(1H)−オン
【0279】
【化76】

表題化合物を、実施例1に記載されているのと同じ方法を使用して5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−{[2−(4−{2−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}エチル]−8−ヒドロキシキノリン−2(1H)−オン(調製34、580mg、0.71mmol)から調製すると、60%収率で黄色の固体、300mgが得られた。
LRMS:APCI ESI m/z 699 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.37(m, 2H), 1.58 (m, 2H), 1.91 (m, 1H), 2.07 (m, 2H), 2.54 (m,
2H), 2.82 (m, 8H), 3.04 (m, 2H), 4.11 (m, 2H), 5.18 (m, 1H), 6.62 (d, 1H), 6.92
(d, 1H), 7.05 (m, 4H), 7.15 (m, 1H), 7.25 (m, 6H), 7.34 (m, 4H), 8.33 (d, 1H),
8.38 (s, 1H) ppm.
【0280】
ヒト組換えM3ムスカリン性受容体における結合親和性評価
膜調製
ヒトムスカリン性M3受容体を組換えにより発現するCHO(チャイニーズハムスター卵巣)細胞からの細胞ペレットを20mM HEPES(pH7.4)中でホモジネートし、4℃にて20分にわたって48000×gにて遠心分離した。ペレットを、緩衝液中に再懸濁し、ホモジネートおよび遠心分離ステップを繰り返した。得られたペレットを、元の濃縮細胞体積1ml当たり緩衝液1ml中に再懸濁し、ホモジネートステップを繰り返した。タンパク質推定を懸濁液に対して行い、約1mg/mlのアリコート1mlを−80℃にて凍結させた。
【0281】
hM3競合結合アッセイプロトコル
膜(5μg/ウェル)を、1mlのポリスチレン96ウェルディープウェルブロック中でRT(室温)にて24時間にわたって3H−NMS(濃度5×KDにて)+/−試験化合物と共にインキュベートした。最終アッセイ体積は、+/−試験化合物20μl;3H−NMS(Perkin Elmer NEN636)20μlおよび膜溶液160μlからなる200μlとした。全結合は、0.1%DMSOで定義し、非特異的結合は、1μMアトロピンで定義した。アッセイ緩衝液は、20mM Hepes(pH7.4)とした。
【0282】
すべてのアッセイ構成成分が添加されたら、プレートを覆い、振盪しながら24時間にわたって室温にてインキュベートした。アッセイは、Packardフィルターメートハーベスターを使用し、0.5%ポリエチレンイミンに予め浸しておいたGF/B Unifilterプレートに通して素早く濾過することにより終了させ、次いで、フィルタープレートを、4℃のアッセイ緩衝液3×1mlで洗浄した。フィルタープレートを1時間にわたって45℃にて乾燥した。フィルタープレートの底部を密封し、Microscint「0」50μl/ウェルを加え、プレートの上部をTopsealで密封した。90分後、プレートを、NXT Topcountで読み取った(ウェル当たり読取り時間1分)。
【0283】
得られたデータは、特異的結合(特異的結合=全結合−非特異的結合)の割合として表された。特異的結合率対試験化合物濃度をプロットし、社内データ解析プログラムを使用してシグモイド曲線からIC50を決定した。IC50値は、Cheng−Prussoff式
【0284】
【数1】

(ここで、IC50は、特異的放射性リガンド結合を50%阻害する非標識薬物の濃度であり、[L]は、遊離放射性リガンド濃度であり、KDおよびKiは、それぞれ放射性リガンドおよび非標識薬物の平衡解離定数である)に当てはめることによりKi値に補正した。
【0285】
hβ2受容体を発現するCHO細胞における全細胞cAMPアッセイを使用する作動薬効力および有効性の機能評価
細胞培養
ヒトアドレナリン作動性β2受容体を組換えにより発現するCHO(チャイニーズハムスター卵巣)細胞を、10%ウシ胎児血清(FBS:Sigma F4135)、10μg/mlピューロマイシン(Sigma P8833)、0.1mg/mlジェネティシンG418(Sigma G7034)および2mM L−グルタミン(Sigma G7513)を含有するF12:DMEM(Gibco 21331−020)からなる増殖培地中に維持した。細胞を、5%CO2を含有する雰囲気中、37℃にて無菌条件中に保った。
【0286】
hβ2cAMPアッセイプロトコル
細胞が80〜90%の密集度に達したら、トリプシン0.25%(Sigma T4049)を使用して5%CO2を含有する雰囲気中で37℃にて5分にわたって細胞と共にインキュベートしてアッセイ用の細胞を収集した。剥離した細胞を、温めた増殖培地(上に記載されている組成)中に集め、アッセイ培地(1%ウシ胎児血清(FBS:Sigma F4135)および2mM L−グルタミン(Sigma G7513)を含有するF12:DMEM(Gibco 21331−020))中に再懸濁して、0.25×106細胞/mlの生細胞濃度とした。この懸濁液100μlを、組織培養処理した96ウェルビュープレート(PerkinElmer 6005181)の各ウェルに加え、プレートを、一晩にわたって37℃にて5%CO2を含有する雰囲気中でインキュベートした。翌日、細胞をリン酸緩衝溶液(PBS)で洗浄した(4×200μl、Skatron Skanstacker 300)。次いで、プレートを軽くたたいて水気を取り、培地を、50μl PBS+0.5mMイソブチルメチルキサンチン(IBMX)(Sigma I5879)で置き換えた後、30分にわたってインキュベーターに戻した。PBSプレート洗浄手順を繰り返し、続いて、50μl PBS+0.5mM IBMXおよび50μl PBS+2%DMSOを加え、プレートを、30分にわたってインキュベーターに戻した。試験化合物の濃度範囲は、2%DMSOを含有するPBS中で調製した。PBSプレート洗浄手順を繰り返し、次いで、50μl PBS+0.5mM IBMXをアッセイプレートに加え、続いて、各化合物試験濃度50μlを適切なウェルに加えた。2%DMSOまたは200nMフォルモテロールのウェル当たり50μlを対照ウェルに加え、1%DMSOまたは100nMフォルモテロールの最終アッセイ濃度を得た。プレートを、さらに30分にわたってインキュベーターに戻した。インキュベーション時間の終了時に、PBSプレート洗浄手順を、上に記載されているように最後に繰り返した。プレートを軽くたたいて水気を取り、PBSウェル当たり30μlと、続いて、cAMP II ED/Substrateミックスウェル当たり40μlおよびcAMP II EA−Ab/lysisミックスウェル当たり40μl(DiscoverX 90−0034−03)を加えた。次いで、プレートを、室温にて最低4時間にわたって暗所でインキュベートした。プレートを、Fusionプレートリーダーを使用して読み取った(発光プロトコル、各ウェルを1秒にわたって読み取った)。濃度効果曲線をプロットし、EC50およびEmax値を、社内データ解析プログラムを使用して作成された4−パラメーターシグモイドフィットを使用して決定した。フォルモテロールおよびサルメテロールを、参照標準としてすべてのアッセイで実行した。
【0287】
このようにして、上のアッセイで試験された本発明による式(1)の化合物は、下の表に列挙されているようにhβ2受容体作動薬活性およびhM3受容体拮抗薬活性を示すことが判明した。
【0288】
【表2】

【技術分野】
【0001】
本発明は、一般式(1)
【0002】
【化1】

(式中、A、X、Y、n、R1およびR2は、下に示される意味を有する)の化合物、ならびにそのような誘導体を調製するためのプロセスおよび中間体、その誘導体を含有する組成物およびその誘導体の使用に関する。
【背景技術】
【0003】
β2アドレナリン作動性作動薬およびコリン作動性ムスカリン性拮抗薬は、COPDおよび喘息などの閉塞性呼吸性疾患を治療するための十分に確立した治療薬である。現在使用されている吸入β2作動薬は、サルブタモール(q.i.d.)、およびテルブタリン(t.i.d)などの短時間作用型薬剤とサルメテロールおよびフォルモテロール(q.i.d.)などの長時間作用型薬剤の両方を包含し、気道平滑筋上のアドレナリン作動性受容体の刺激を介して気管支拡張を引き起こす。臨床使用における吸入ムスカリン性拮抗薬は、短時間作用型のイプラトロピウムブロミド(q.i.d.)、オキシトロピウムブロミド(q.i.d)および長時間作用型のチオトロピウム(q.d.)を包含する。ムスカリン性拮抗薬は、主に、気道平滑筋上に存在するムスカリン性受容体に対するアセチルコリンの作用と拮抗することにより、気道のコリン作動性緊張を阻害することにより気管支拡張を引き起こす。多くの公表された研究は、閉塞性肺疾患患者への吸入β2作動薬と吸入ムスカリン性拮抗薬(短時間作用型か長時間作用型かに関わらず)の併用投与が、どちらか単一クラスの薬剤を単独で投与された患者と比較して肺機能、症状および生活の質の尺度における優れた改善をもたらすことを立証している。今日までの研究は、単一薬理作用の薬剤を用いた併用研究に限定されてきたが、単一分子内における2つの薬理の組合せは、単一薬剤と同様の治療係数で気管支拡張効果を増加させるか、または優れた治療係数で同様の効果をもたらす可能性があるために望ましいであろう。さらに、単一分子において2つの薬理作用を組み合わせることは、抗炎症薬と組み合わせる可能性を与え、単一吸入器からの3重療法をもたらすであろう。
【発明の概要】
【発明が解決しようとする課題】
【0004】
したがって、好ましくは吸入経路による、呼吸性疾患の治療に適している、β2受容体作動薬およびムスカリン性拮抗薬として活性な代替化合物が必要である。そのような化合物は、例えば、効力、薬物動態または作用持続時間に関して、適切な薬理学的プロファイルを有するであろう。さらに、これらの化合物は、喘息またはCOPDなどの慢性疾患を治療するために使用されることがあるため、これらの化合物は、同時投与される化合物と相互作用する可能性が低いことが好ましいであろう。
【課題を解決するための手段】
【0005】
本発明は、一般式(1)
【0006】
【化2】

(式中、
Aは、
【0007】
【化3】

(式中、*は、ヒドロキシを保有する炭素とのAの接続点を表す)から選択され、
Xは、−(CH2)m−(mは、7〜12(両端を含む)の整数である)であるか、式
【0008】
【化4】

であり、
Yは、
【0009】
【化5】

(式中、**および***は、接続点を表し、**は、Xと連結している)から選択され、
nは、0または1であり、
R1は、シクロペンチル、シクロヘキシル、フェニル、フラニルおよびチオフェニルから選択され、
R2は、フェニル、フラニルおよびチオフェニルから選択される)
の化合物、もしくは薬学的に許容できるその塩、または薬学的に許容できる前記化合物もしくは塩の溶媒和物に関する。
【0010】
式(1)の化合物は、特に吸入経路を介して投与される場合に、優れた効力を示すことにより、前記受容体が関わる疾患および/または状態を治療するのに特に有用であるβ2アドレナリン作動性受容体作動薬およびムスカリン性受容体拮抗薬である。
【0011】
式(1)の化合物は、様々な方法で調製することができる。下の経路は、A、X、Y、n、R1およびR2が、特に指定のない限り、式(1)の化合物について以前に定義されている通りであるこれらの化合物を調製する1つのそのような方法を例示している。当業者は、他の経路が同等に実行可能であり得ることを理解するであろう。
【0012】
式(1)
【0013】
【化6】

(1)
のアミン誘導体は、
式(2)
【0014】
【化7】

のアミンを、
式(3)
【0015】
【化8】

(式中、A1は、ベンジルなどの適当なフェノール保護基で保護されているAを表す)のブロミドと反応させることにより調製することができる。
【0016】
典型的手順において、式(2)のアミンを、12〜72時間にわたって80℃〜120℃の温度にて、場合により適当な塩基(例えば、トリエチルアミン、ジイソプロピルエチルアミン、炭酸カリウム、炭酸水素ナトリウム)の存在下、場合により溶媒または溶媒の混合物(例えば、ジメチルスルホキシド、トルエン、N,N−ジメチルホルムアミド、プロピオニトリル、アセトニトリル、ブチロニトリル、ジクロロメタン)の存在下、式(3)のブロミドと反応させる。次いで、tert−ブチルジメチルシリルおよびベンジルなどの保護基は、教科書T.W.Greene、Protective Groups in Organic Synthesis(Wiley−Interscience Publication、1981)中に見いだされるものなどの酸素保護基を切断するための標準的な方法論を使用して除去することができる。
【0017】
A1が下に表される式(3)の化合物は、下記の参考文献に開示されている方法に従って調製することができる。
【0018】
【化9】

【0019】
式(2)のアミンは、式(4)
【0020】
【化10】

(式中、RaおよびRbは、tert−ブトキシカルボニルなどの適当な保護基を表すか、一緒にフタルイミドを表す)の対応する保護されたアミンから調製することができる。
【0021】
典型的手順において、式(4)のアミンを、教科書T.W.Greene、Protective Groups in Organic Synthesis(Wiley−Interscience Publication、1981)中に見いだされるものなどの窒素保護基を切断するための標準的な方法論を使用して脱保護する。
【0022】
式(4)のアミンは、式(5)
【0023】
【化11】

(式中、pおよびqは、1または2から独立して選択される)の対応するアミンを、式(6)
【0024】
【化12】

(式中、RaおよびRbは、以前に定義されている通りであり、LGは、ブロミドまたはメシレートなどの適当な脱離基である)の化合物と反応させることにより調製することができる。
【0025】
典型的手順において、式(5)のアミンを、18〜48時間にわたって、50℃〜90℃の温度にて、適当な塩基(例えば、トリエチルアミン、ジイソプロピルエチルアミン)の存在下、および場合により求核性添加物(例えば、ヨウ化ナトリウム)の存在下、適当な溶媒(例えば、ジメチルスルホキシド、トルエン、N,N−ジメチルホルムアミド、プロピオニトリル、アセトニトリル、メチルエチルケトン)中で式(6)の化合物と反応させる。
【0026】
式(1)の化合物の調製にとってのそれらの有用性に加え、式(5)の化合物は、ムスカリン性拮抗薬として使用することもできる。特に、それらは、ムスカリン性受容体の活性の調節により軽減することができる疾患の治療にとって有用であり得る。
【0027】
LGがブロミドである式(6)の化合物は、対応するアミン求核試薬RaRbNHを、式(7)
【0028】
Br−X−Br (7)
の対応するジブロミドと反応させることにより調製することができる。
【0029】
典型的手順において、フタルイミドまたはジ−tert−ブチルイミノジカルボキシレート(RaRbNH)を、最長で1時間にわたって0℃〜室温の温度にて、N,N−ジメチルホルムアミドまたはテトラヒドロフランなどの適当な溶媒中、水素化ナトリウム(油中60%分散液)などの適当な塩基と反応させ、続いて、6〜48時間にわたって、0℃〜150℃の温度にて、式(7)のジブロミドを加える。
【0030】
式RaRbNHのアミンは、市販されている。
【0031】
Xが−(CH2)m−である式(7)の化合物は、市販されている。
【0032】
Xが、式
【0033】
【化13】

である式(7)の化合物は、Journal of Organic Chemistry、46(22)、4608〜10;1981に記載されているように調製することができる。
【0034】
あるいは、RaおよびRbが一緒にフタルイミドを表し、Xが、式
【0035】
【化14】

である式(6)の化合物は、下のスキーム1
【0036】
【化15】

(RaおよびRbは、一緒にフタルイミドを表す)に記載されているように調製することができる。
【0037】
式(8)および(9)の化合物は、市販されている。
【0038】
式(10)の化合物は、ヘック反応(プロセスステップ(i))により式(8)および(9)の化合物から調製することができる。典型的条件は、21時間にわたって90℃にて、アセトニトリルなどの適当な溶媒中、式(8)の化合物を化合物(9)、トリ−O−トリルホスフィン、酢酸パラジウム(II)およびジイソプロピルエチルアミンなどの適当な塩基と反応させることを含む。
【0039】
式(11)の化合物は、水素化(プロセスステップ(ii))により式(10)の化合物から調製することができる。典型的条件は、18時間にわたって80℃にて、酢酸エチルおよびエタノールなどの適当な溶媒中、式(10)の化合物をギ酸アンモニウムおよび30%炭素上水酸化パラジウムと反応させることを含む。代替条件は、24時間にわたって20psiおよび室温にて、酢酸エチルおよびエタノールなどの適当な溶媒中、式(10)の化合物を水素ガスおよび塩化トリス(トリフェニルホスフィン)ロジウムと反応させることを含む。
【0040】
LGがブロミドである式(6a)の化合物は、臭素化(プロセスステップ(iii))により式(11)の化合物から調製することができる。典型的条件は、4時間にわたって還流状態にて、トルエンなどの適当な溶媒中、式(11)の化合物を三臭化リンと反応させることを含む。
【0041】
LGがメシレートである式(6a)の化合物は、メシル化(プロセスステップ(iii))により式(11)の化合物から調製することができる。典型的条件は、1〜4時間にわたって0℃〜室温にて、トリエチルアミンなどの適当な塩基と共に、メチルエチルケトンなどの適当な溶媒中、式(11)の化合物を塩化メタンスルホニルと反応させることを含む。
【0042】
式(5)のアミンは、式(12)
【0043】
【化16】

(式中、Rcは、tert−ブトキシカルボニルまたはベンジルオキシカルボニルなどの適当な保護基を表す)の対応する保護されたアミンから調製することができる。
【0044】
典型的手順において、式(12)のアミンを、教科書T.W.Greene、Protective Groups in Organic Synthesis(Wiley−Interscience Publication、1981)中に見いだされるものなどの窒素保護基を切断するための標準的な方法論を使用して脱保護する。
【0045】
式(12)のアミンは、式(13)
【0046】
【化17】

(式中、LGは、ブロミドまたはメシレートなどの適当な脱離基である)の対応する化合物を、
式(14)
【0047】
【化18】

の化合物と反応させることにより調製することができる。
【0048】
典型的手順において、式(13)の化合物を、5〜48時間にわたって、70℃〜150℃の温度にて適当な塩基(例えば、炭酸カリウム、炭酸セシウム、トリエチルアミン、ジイソプロピルエチルアミン)の存在下、適当な溶媒(例えば、N,N−ジメチルホルムアミド、プロピオニトリル、アセトニトリル、アセトン)中で式(14)の化合物と反応させる。
【0049】
式(13)の化合物は、市販されているか、当業者に知られている方法に従って調製することができる。
【0050】
特に、Rcがtert−ブトキシカルボニルであり、pおよびqが、1または2を表し、nが0であり、LGがメシレートである式(13)の化合物は、市販されている。Rcがtert−ブトキシカルボニルであり、pおよびqが1であり、nが1であり、LGがメシレートである式(13)の化合物は、米国特許出願公開第2005101586号に記載されているように調製することができる。Rcがtert−ブトキシカルボニルであり、pが1であり、qが2であり、nが1であり、LGがブロミドまたはメシレートである式(13)の化合物は、市販されている。最後に、Rcがtert−ブトキシカルボニルまたはベンジルオキシカルボニルであり、pおよびqが2であり、nが1であり、LGがブロミドである式(13)の化合物は、市販されている。
【0051】
式(14)の化合物は、式(15)
【0052】
【化19】

の対応するアミドから調製することができる。
【0053】
典型的手順において、式(15)の化合物を、2時間にわたって90℃にてN,N−ジメチルホルムアミドジメチルアセタールと反応させる。過剰のN,N−ジメチルホルムアミドジメチルアセタールを真空中で除去し、残渣を、トルエンなどの適当な溶媒と共沸させる。ヒドラジン水和物と、続いて、氷酢酸を加え、2時間にわたって90℃にて加熱する。
【0054】
式(15)の化合物は、式(16)
【0055】
【化20】

の対応する酸から調製することができる。
【0056】
典型的手順において、式(16)の化合物を、1時間にわたって室温にてジクロロメタンまたはテトラヒドロフランなどの適当な溶媒中でカルボニルジイミダゾールと反応させ、続いて、18時間にわたって室温にて0.880アンモニア水溶液を加える。
【0057】
式(16)の化合物およびそれらの対応する単一鏡像異性体は、適切なように、市販されているか、文献で知られているか、文献に記載されているように、または文献中のものに類似した方法により調製することができるかのいずれかである。そのような情報またはそのような情報に言及している関連文献の例は、WO2002/053564、WO2006/048225、WO2001/04118、WO2003/057694、WO2004/052857、WO96/33973、Journal of Organic Chemistry、46(14)、2885〜9;1981、Journal of Organic Chemistry(1961)、26、1573〜7、Chimica Therapeutica(1966)、(4)、238〜45およびJournal of Medicinal Chemistry、44(20)、3244〜3253;2001を包含するが、これらに限定されるものではない。
【0058】
例えば、式(16a)
【0059】
【化21】

の化合物は、(2R)−2−シクロヘキシル−2−ヒドロキシ−2−フェニル酢酸として市販されている。
【0060】
あるいは、式(14)の化合物は、式(17)
【0061】
【化22】

の対応する化合物から調製することができる。
【0062】
典型的手順において、式(17)の化合物を、3時間にわたって、還流状態にて、エタノールなどの適当な溶媒中で水素化ホウ素ナトリウムと反応させる。
【0063】
式(17)の化合物は、式(18)
【0064】
【化23】

の化合物を、
式(19)
【0065】
【化24】

の化合物と反応させることにより調製することができる。
【0066】
典型的手順において、式(18)の化合物を、1時間にわたって−78℃〜室温にて、テトラヒドロフランなどの適当な溶媒中、n−ブチルリチウムなどの適当な塩基と反応させ、続いて、18時間にわたって−78℃〜室温の温度にてテトラヒドロフラン中の式(19)の化合物を加える。
【0067】
式(18)の化合物は、Tetrahedron:Asymmetry、8(9)、1491〜1500;1997に記載されているように調製することができる。
【0068】
式(19)の化合物は、市販されているか、文献に記載されているように、または文献中のものに類似した方法により調製することができるかのいずれかである。そのような情報の関連文献の例は、Tetrahedron Letters、49(11)、1884〜1888;2008、Tetrahedron Letters、46(44)、7627〜7630;2005、Synthesis、(13)、1970〜1978;2007、Journal of Organic Chemistry、55(4)、1286〜91;1990、米国特許第5969159号、Tetrahedron Letters、47(10)、1649〜1651;2006、Journal of Chemical Research、Synopses、(9)、280〜1;1984、Synthesis、(3)、242〜3;1991、Journal of Chemical Society、Perkin Transactions 2:Physical Organic Chemistry(1972〜1999)、(11)、1741〜51;1989、およびSynthetic Communications、34(23)、4249〜4256;2004を包含するが、これらに限定されるものではない。
【0069】
式(1)の化合物の調製は、すでに記載されている方法に加えて、潜在的な反応性官能基の保護を必要とすることがある。そのような場合に、適合する保護基の例ならびに保護および脱保護のそれらの特定の方法は、T.W.GreeneおよびP.Wutzによる「Protecting Groups in Organic Synthesis」(Wiley−Interscience Publication、1981)またはP.J.Kocienskiによる「Protecting groups」(Georg Thieme Verlag、1994)に記載されている。
【0070】
式(1)の化合物ならびにそれらを調製するための中間体は、様々なよく知られている方法、例えば、結晶化またはクロマトグラフィーに従って精製および単離することができる。
【0071】
下記の置換基、または下記の置換基の組合せを含有する式(1)の化合物のサブグループが好ましい。
【0072】
Aは、式
【0073】
【化25】

(式中、*は、ヒドロキシルを保有する炭素とのAの接続点を表す)であることが好ましい。
【0074】
Xは、(CH2)9であるか、式
【0075】
【化26】

であることが好ましい。
【0076】
好ましい実施形態において、Xは、(CH2)9である。
【0077】
別の好ましい実施形態において、Xは、式
【0078】
【化27】

である。
【0079】
Yは、式
【0080】
【化28】

(式中、**および***は、接続点を表し、**は、Xと連結している)であることが好ましい。
【0081】
R1は、フェニルまたはシクロヘキシルであることが好ましい。
【0082】
R2は、フェニルであることが好ましい。
【0083】
nは、1であることが好ましい。
【0084】
R1およびR2が異なる場合、これら2つの置換基を保有する炭素原子は、(R)または(S)立体配置であってよい。R1およびR2を保有する炭素原子は、R1およびR2が異なる場合に(R)立体配置であることが好ましい。
【0085】
Aが、式
【0086】
【化29】

(式中、*は、ヒドロキシを保有する炭素とのAの接続点を表す)であり、
Xが、−(CH2)9−であるか、式
【0087】
【化30】

であり、
Yが、式
【0088】
【化31】

(式中、**および***は、接続点を表し、**は、Xと連結している)であり、
nが1であり、
R1が、シクロヘキシルまたはフェニルであり、R2がフェニルである式(1)の化合物、もしくは薬学的に許容できるその塩、または薬学的に許容できる前記化合物もしくは塩の溶媒和物がさらに好ましい。
【0089】
下記の化合物がより好ましい。
5−[(1R)−2−({9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン、
5−[(1R)−2−({9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン ナフタレン−1,5−ジスルホン酸塩、
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン、
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン ナフタレン−1,5−ジスルホン酸塩、
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン コハク酸塩、
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン フマル酸塩、
5−[(1R)−2−({9−[4−({3−[シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン、
8−ヒドロキシ−5−[(1R)−1−ヒドロキシ−2−({9−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]キノリン−2(1H)−オン、および
8−ヒドロキシ−5−[(1R)−1−ヒドロキシ−2−{[2−(4−{2−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}エチル]キノリン−2(1H)−オン。
【0090】
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オンがさらにより好ましい。
【0091】
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン ナフタレン−1,5−ジスルホン酸塩が最も好ましい。
【0092】
式(1)の化合物の薬学的に許容できる塩は、それらの酸付加塩および塩基塩を包含する。適当な酸付加塩は、無毒性の塩を形成する酸から形成される。例は、酢酸塩、アスパラギン酸塩、安息香酸塩、ベシル酸塩、重炭酸塩/炭酸塩、重硫酸塩/硫酸塩、ホウ酸塩、カンシル酸塩、クエン酸塩、エジシル酸塩、エシル酸塩、ギ酸塩、フマル酸塩、グルセプト酸塩、グルコン酸塩、グルクロン酸塩、ヘキサフルオロリン酸塩、ヒベンズ酸塩、塩酸塩/塩化物、臭化水素酸塩/臭化物、ヨウ化水素酸塩/ヨウ化物、イセチオン酸塩、乳酸塩、リンゴ酸塩、マレイン酸塩、マロン酸塩、メシル酸塩、メチル硫酸塩、ナフチレート(naphthylate)、1,5−ナフタレンジスルホン酸塩、2−ナプシル酸塩、ニコチン酸塩、硝酸塩、オロチン酸塩、シュウ酸塩、パルミチン酸塩、パモ酸塩、リン酸塩/リン酸水素塩/リン酸二水素塩、糖酸塩、ステアリン酸塩、コハク酸塩、酒石酸塩、トシル酸塩およびトリフルオロ酢酸塩を包含する。適当な塩基塩は、無毒性の塩を形成する塩基から形成される。例は、アルミニウム、アルギニン、ベンザチン、カルシウム、コリン、ジエチルアミン、ジオラミン、グリシン、リシン、マグネシウム、メグルミン、オラミン、カリウム、ナトリウム、トロメタミンおよび亜鉛塩を包含する。酸および塩基のヘミ塩、例えば、ヘミ硫酸塩およびヘミカルシウム塩も形成することができる。適当な塩の総説については、StahlおよびWermuthによる「Handbook of Phamaceutical Salts:Properties,Selection,and Use」(Wiley−VCH、Weinheim、Germany、2002)を参照されたい。
【0093】
薬学的に許容できる式(1)の化合物の塩は、3つの方法のうちの1つまたは複数により、すなわち、
(i)式(1)の化合物を望ましい酸または塩基と反応させることにより、
(ii)望ましい酸または塩基を使用し、式(1)の化合物の適当な前駆体から酸もしくは塩基に不安定な保護基を除去するか、適当な環状前駆体、例えば、ラクトンもしくはラクタムを開環することにより、または
(iii)適切な酸もしくは塩基との反応により、または適当なイオン交換カラムによって、式(1)の化合物の1つの塩を別の塩に変換することにより調製することができる。3つの反応はすべて、典型的には、溶液中で行われる。得られる塩は、沈殿させて濾過により集めるか、溶媒の蒸発により回収することができる。得られる塩におけるイオン化の程度は、完全にイオン化されたものからほとんどイオン化されていないものまでと様々であってよい。
【0094】
本発明の化合物は、非溶媒和形態と溶媒和形態の両方で存在することがある。「溶媒和物」という用語は、本明細書において、本発明の化合物またはその塩および化学量論的量の1種または複数の薬学的に許容できる溶媒分子、例えばエタノールを含む分子錯体について記載するために使用される。「水和物」という用語は、前記溶媒が水である場合に用いられる。
【0095】
上述の溶媒和物と対照的に、薬物およびホストが化学量論的または非化学量論的な量で存在するクラスレート、薬物−ホスト包接錯体などの錯体も本発明の範囲内に包含される。化学量論的または非化学量論的な量であってよい2種以上の有機および/または無機構成成分を含有する薬物の錯体も包含される。得られる錯体は、イオン化、部分的イオン化、または非イオン化であってよい。そのような錯体の総説については、HaleblianによるJ Pharm Sci、64(8)、1269〜1288(August 1975)を参照されたい。
【0096】
本明細書では以後、式(1)の化合物へのすべての言及は、それらの塩、溶媒和物および錯体、ならびにそれらの塩の溶媒和物および錯体への言及を包含する。
【0097】
本発明の化合物は、それらのすべての多形体および晶癖、本明細書で後に定義するようなそれらのプロドラッグおよび異性体(光学異性体、幾何異性体および互変異性体を包含する)ならびに式(1)の同位体標識化合物を包含する本明細書で前に定義されているような式(1)の化合物を包含する。
【0098】
示すように、式(1)の化合物のいわゆる「プロドラッグ」も、本発明の範囲内にある。すなわち、それら自体が薬理学的活性をほとんど、またはまったく有していないことがある式(1)の化合物のある誘導体は、体内または体表に投与された場合、例えば加水分解切断により、望ましい活性を有する式(1)の化合物に変換されることがある。そのような誘導体は、「プロドラッグ」と呼ばれる。プロドラッグの使用に関するさらなる情報は、「Pro−drugs as Novel Delivery Systems、第14巻、ACS Symposium Series(T.HiguchiおよびW.Stella)および「Bioreversible Carriers in Drug Design」、Pergamon Press、1987(E.B.Roche編、American Pharmaceutical Association)中に見いだすことができる。
【0099】
本発明によるプロドラッグは、例えば、式(1)の化合物中に存在する適切な官能基を、例えば、H.Bundgaardによる「Design of Prodrugs」(Elsevier、1985)に記載の「プロモイエティ(pro−moiety)」として当業者に知られているある部分で置き換えることにより製造することができる。
【0100】
本発明によるプロドラッグの一部の例は、
(i)式(1)の化合物がアルコール官能基(−OH)を含有する場合はそのエーテル、例えば、式(1)の化合物のアルコール官能基の水素が、(C1〜C6)アルカノイルオキシメチルにより置き換えられている化合物、および
(ii)式(1)の化合物が一級または二級アミノ官能基(−NH2またはRがHではない−NHR)を含有する場合はそのアミド、例えば、場合によって、式(1)の化合物のアミノ官能基の一方または両方の水素が、(C1〜C10)アルカノイルにより置き換えられている化合物を包含する。
【0101】
上記の例および他のプロドラッグタイプの例による置換基のさらなる例は、上述の参考文献中に見いだすことができる。
【0102】
さらに、式(1)のある化合物は、それら自体で式(1)の他の化合物のプロドラッグとしての役割を果たすことがある。
【0103】
式(1)の化合物の代謝産物、すなわち、薬物の投与によってインビボで形成される化合物も本発明の範囲内に包含される。本発明による代謝産物の一部の例は、
(i)式(1)の化合物がメチル基を含有する場合はそのヒドロキシメチル誘導体(−CH3→−CH2OH)、
(ii)式(1)の化合物がアルコキシ基を含有する場合はそのヒドロキシ誘導体(−OR→−OH)、
(iii)式(1)の化合物が三級アミノ基を含有する場合はその二級アミノ誘導体(−NR1R2→−NHR1または−NHR2)、
(iv)式(1)の化合物が二級アミノ基を含有する場合はその一級誘導体(−NHR1→−NH2)、
(v)式(1)の化合物がフェニル部分を含有する場合はそのフェノール誘導体(−Ph→−PhOH)、および
(vi)式(1)の化合物がアミド基を含有する場合はそのカルボン酸誘導体(−CONH2→COOH)を包含する。
【0104】
R1およびR2が異なる式(1)の化合物は、立体異性体として存在することがある。構造異性体が、低いエネルギー障壁を介して相互変換可能である場合、互変異性(tautomeric isomerism)(「互変異性(tautomerism)」)が生じることがある。これは、例えば、イミノ、ケト、またはオキシム基を含有する式(1)の化合物におけるプロトン互変異性、または芳香族部分を含有する化合物におけるいわゆる原子価互変異性の形態をとることがある。したがって、単一の化合物が、2種以上のタイプの異性を示すことがある。特に、本発明は、トリアゾール部分が異なる位置異性体として存在することがある式(1)の化合物を包含する。
【0105】
2種以上のタイプの異性を示す化合物、およびそれらの1つまたは複数の混合物を包含する式(1)の化合物のすべての立体異性体、および互変異性体は、本発明の範囲内に包含される。対イオンが光学活性である、例えば、d−乳酸塩もしくはl−リシンであるか、またはラセミである、例えば、dl−酒石酸塩もしくはdl−アルギニンである酸付加塩または塩基塩も包含される。
【0106】
個々の鏡像異性体を調製/分離するための従来技法は、適当な光学的に純粋な前駆体からのキラル合成、または、例えば、キラル高速液体クロマトグラフィー(HPLC)を用いるラセミ体(または塩もしくは誘導体のラセミ体)の分割を包含する。
【0107】
あるいは、ラセミ体(またはラセミ前駆体)を、適当な光学活性化合物、例えばアルコールと、または、式(1)の化合物が酸性もしくは塩基性部分を含有する場合には、酒石酸もしくは1−フェニルエチルアミンなどの酸もしくは塩基と反応させることができる。得られるジアステレオマー混合物は、クロマトグラフィーおよび/または分別結晶により分離することができ、ジアステレオ異性体の一方または双方は、当業者によく知られている手段により対応する純粋な1つまたは複数の鏡像異性体に変換することができる。
【0108】
本発明のキラル化合物(およびそのキラル前駆体)は、イソプロパノール0〜50体積%、典型的には、2%〜20%、およびアルキルアミン0〜5体積%、典型的には、ジエチルアミン0.1%を含有する炭化水素、典型的には、ヘプタンまたはヘキサンからなる移動相による不斉樹脂上のクロマトグラフィー、典型的には、HPLCを使用し、鏡像異性的に富化された形態で得ることができる。溶出液を濃縮すると、富化された混合物が得られる。
【0109】
立体異性の集合体は、当業者に知られている従来技法により分離することができる。例えば、E.L.Elielによる「Stereochemistry of Organic Compounds」(Wiley、New York、1994)を参照されたい。
【0110】
本発明は、1個または複数の原子が、同じ原子番号であるが、自然において優位を占める原子質量または質量数と異なる原子質量または質量数を有する原子により置き換えられているすべての薬学的に許容できる式(1)の同位体標識化合物を包含する。
【0111】
本発明の化合物中に含めるのに適している同位体の例は、2Hおよび3Hなどの水素、11C、13Cおよび14Cなどの炭素、13Nおよび15Nなどの窒素、15O、17Oおよび18Oなどの酸素、ならびに35Sなどのイオウの同位体を包含する。
【0112】
式(1)のある同位体標識化合物、例えば、放射性同位体を組み入れた同位体標識化合物は、薬物および/または基質の組織分布研究において有用である。放射性同位体であるトリチウム、すなわち3H、および炭素−14、すなわち14Cは、それらを組み入れる容易さおよびそれらを検出する手段が用意されていることに鑑みてこの目的のために特に有用である。
【0113】
重水素、すなわち2Hなどのより重い同位体による置換は、より大きい代謝安定性に由来する特定の治療上の利点、例えば、インビボ半減期の増加または用量要件の軽減を提供することがあるため、一部の環境において好ましいことがある。
【0114】
11C、15Oおよび13Nなどのポジトロン放出同位体による置換は、基質受容体占有を調べるためのポジトロン放出断層撮影(PET)研究において有用なことがある。
【0115】
式(1)の同位体標識化合物は、一般的に、当業者に知られている従来技法により、または以前に用いた非標識試薬の代わりに適切な同位体標識試薬を使用し、添付の実施例および調製に記載されているものに類似したプロセスにより調製することができる。
【0116】
本発明による薬学的に許容できる溶媒和物は、結晶化の溶媒が、同位体置換されている、例えばD2O、d6−アセトン、d6−DMSOであってよい溶媒和物を包含する。
【0117】
式(1)の化合物、薬学的に許容できるそれらの塩および/または薬学的に許容できる前記化合物もしくは塩の溶媒和物は、β2受容体および/またはムスカリン性受容体が関与している多数の障害の治療および予防に適している価値ある薬学的に活性な化合物である。特に、これらの化合物は、β2受容体の作動作用およびムスカリン性受容体の拮抗作用が有益性をもたらすことがある多数の障害、特に、アレルギー性および非アレルギー性の気道疾患の治療および予防に有用である。
【0118】
薬学的使用を意図した本発明の化合物は、結晶性または非晶性製品として投与することができる。本発明の化合物は、沈殿、結晶化、凍結乾燥、噴霧乾燥、または蒸発乾燥などの方法により、例えば、固体プラグ剤(solid plug)、散剤、またはフィルム剤として得ることができる。この目的には、マイクロ波または高周波乾燥を使用することができる。
【0119】
本発明の化合物は、単独で、または1種もしくは複数の本発明の他の化合物と組み合わせて、または1種もしくは複数の他の薬物と組み合わせて(または、それらの任意の組合せとして)投与することができる。一般的に、本発明の化合物は、1種または複数の薬学的に許容できる賦形剤と共に製剤として投与されるはずである。「賦形剤」という用語は、本明細書において、本発明の1種または複数の化合物以外の任意の成分について記載するのに使用される。賦形剤の選択は、特定の投与方法、溶解度および安定性に対する賦形剤の影響、ならびに剤形の性質などの要素によって大きく左右されるであろう。
【0120】
本発明の化合物を送達するのに適している医薬組成物およびそれらを調製するための方法は、当業者には容易に明らかであろう。そのような組成物およびそれらを調製するための方法は、例えば、「Remington’s Pharmaceutical Sciences」、第19版(Mack Publishing Company、1995)中に見いだすことができる。
【0121】
本発明の化合物は、経口的に投与することができる。経口投与は、化合物が胃腸管に入るように嚥下するものであってよく、または、化合物が口から直接血流に入る口腔もしくは舌下投与が用いられることがある。
【0122】
経口投与に適している製剤は、錠剤、粒子剤、液剤、または散剤を含有するカプセル剤、ロゼンジ剤(液体入りを包含する)、咀嚼剤、多粒子剤およびナノ粒子剤、ゲル剤、固溶体、リポソーム、フィルム剤、膣坐剤、噴霧剤などの固形製剤ならびに液状製剤を包含する。
【0123】
液状製剤は、懸濁剤、液剤、シロップ剤およびエリキシル剤を包含する。そのような製剤は、軟質または硬質カプセル剤における充填剤として用いることができ、典型的には、担体、例えば、水、エタノール、ポリエチレングリコール、プロピレングリコール、メチルセルロース、または適当な油、ならびに1種または複数の乳化剤および/または懸濁化剤を含む。液状製剤は、例えばサシェから、固形物の再構成により調製することもできる。
【0124】
本発明の化合物は、LiangおよびChenによるExpert Opinion in Therapeutic Patents、11(6)、981〜986(2001)に記載されている剤形などの速溶解性、速崩壊性剤形においても使用することができる。
【0125】
錠剤剤形の場合、投与量に応じて、薬物は、剤形の1重量%〜80重量%、より典型的には、剤形の5重量%〜60重量%を占めることができる。薬物の他に、錠剤は、一般的に、崩壊剤を含有する。崩壊剤の例は、デンプングリコール酸ナトリウム、カルボキシメチルセルロースナトリウム、カルボキシメチルセルロースカルシウム、クロスカルメロースナトリウム、クロスポビドン、ポリビニルピロリドン、メチルセルロース、微結晶性セルロース、低級アルキル置換ヒドロキシプロピルセルロース、デンプン、アルファ化デンプンおよびアルギン酸ナトリウムを包含する。一般的に、崩壊剤は、剤形の1重量%〜25重量%、好ましくは、5重量%〜20重量%を占めるものとする。
【0126】
一般的に、錠剤製剤に凝集性を付与するために結合剤が使用される。適当な結合剤は、微結晶性セルロース、ゼラチン、糖、ポリエチレングリコール、天然および合成ゴム、ポリビニルピロリドン、アルファ化デンプン、ヒドロキシプロピルセルロースならびにヒドロキシプロピルメチルセルロースを包含する。錠剤は、ラクトース(一水和物、噴霧乾燥一水和物、無水など)、マンニトール、キシリトール、ブドウ糖、スクロース、ソルビトール、微結晶性セルロース、デンプンおよび二塩基性リン酸カルシウム二水和物などの希釈剤を含有することもある。
【0127】
また、錠剤は、ラウリル硫酸ナトリウムおよびポリソルベート80などの界面活性剤、ならびに二酸化ケイ素およびタルクなどの流動促進剤を含んでいてもよい。存在する場合、界面活性剤は、錠剤の0.2重量%〜5重量%を占め、流動促進剤は、錠剤の0.2重量%〜1重量%を占めることがある。
【0128】
また、錠剤は、一般的に、ステアリン酸マグネシウム、ステアリン酸カルシウム、ステアリン酸亜鉛、ステアリルフマル酸ナトリウム、およびステアリン酸マグネシウムとラウリル硫酸ナトリウムの混合物などの滑沢剤を含有する。滑沢剤は、一般的に、錠剤の0.25重量%〜10重量%、好ましくは、0.5重量%〜3重量%を占める。
【0129】
他の可能な成分は、抗酸化剤、着色剤、矯味剤、保存剤および味覚マスキング剤を包含する。
【0130】
例示的錠剤は、薬物約80%まで、結合剤約10重量%〜約90重量%、希釈剤約0重量%〜約85重量%、崩壊剤約2重量%〜約10重量%、および滑沢剤約0.25重量%〜約10重量%を含有する。
【0131】
錠剤ブレンドを直接、またはローラーにより圧縮し、錠剤を作製することができる。あるいは、錠剤ブレンドまたはブレンドの一部を、打錠前に湿式、乾式、もしくは融解式造粒するか、融解式凝結させるか、または押し出すことができる。最終製剤は、1つまたは複数の層を含み、コーティングされていてもされていなくてもよく、カプセル化されてもよい。
【0132】
錠剤の製剤化は、H.LiebermanおよびL.LachmanによるPharmaceutical Dosage Forms:Tablets、第1巻(Marcel Dekker、New York、1980)中で論じられている。
【0133】
ヒトまたは動物使用のために消費できる経口フィルム剤は、典型的には、速溶解性であるか、または粘膜付着性であってよい柔軟な水溶性または水膨潤性の薄膜剤形であり、典型的には、式(1)の化合物、フィルム形成ポリマー、結合剤、溶媒、湿潤剤、可塑剤、安定剤または乳化剤、粘度調整剤および溶媒を含む。製剤の一部の構成成分は、2つ以上の機能を果たすことがある。
【0134】
式(1)の化合物は、水溶性または不溶性であってよい。水溶性化合物は、典型的には、溶質の1重量%〜80重量%、より典型的には、20重量%〜50重量%を占める。難溶性化合物は、組成物の大部分、典型的には、溶質の88重量%までを占めることがある。あるいは、式(1)の化合物は、多粒子ビーズの形態であってよい。
【0135】
フィルム形成ポリマーは、天然多糖、タンパク質、または合成親水コロイドから選択することができ、典型的には、0.01〜99重量%の範囲、より典型的には、30〜80重量%の範囲で存在する。
【0136】
他の可能な成分は、抗酸化剤、着色剤、香味料および調味料、保存剤、唾液刺激剤、冷却剤、共溶媒(油を包含する)、緩和薬、充填剤、消泡剤、界面活性剤および味覚マスキング剤を包含する。
【0137】
本発明によるフィルム剤は、典型的には、剥離可能な裏打用の支持体または紙の上にコーティングされた薄い水性フィルムを蒸発乾燥させることにより調製される。これは、乾燥炉またはトンネル乾燥機、典型的には、複合コーター乾燥機中で、または凍結乾燥もしくは真空吸引により行うことができる。
【0138】
経口投与のための固形製剤は、即時放出および/または放出調節であるように製剤化することができる。放出調節製剤は、遅延放出、持続放出、パルス放出、制御放出、標的放出およびプログラム放出を包含する。
【0139】
本発明の目的に適している放出調節製剤については、米国特許第6,106,864号に記載されている。高エネルギー分散剤ならびに浸透および被覆粒子剤などの他の適当な放出技術の詳細は、VermaらによるPharmaceutical Technology On−line、25(2)、1〜14(2001)中に見いだすことができる。制御放出を実現するためのチューインガムの使用については、WO00/35298に記載されている。
【0140】
本発明の化合物は、血流中、筋肉中、または内臓中に直接投与することもできる。非経口投与に適している手段は、静脈内、動脈内、腹腔内、髄腔内、脳室内、尿道内、胸骨内、頭蓋内、筋肉内および皮下を包含する。非経口投与に適している装置は、針(極微針を包含する)注射器、無針注射器および注入技法を包含する。
【0141】
非経口製剤は、典型的には、塩、炭水化物および緩衝剤(3〜9のpHが好ましい)などの賦形剤を含有してもよい水溶液であるが、一部の応用例については、滅菌非水溶液として、または乾燥形態として製剤化し、滅菌した発熱物質を含まない水などの適当なビヒクルと併せて使用することがより適当である。
【0142】
無菌条件下、例えば、凍結乾燥による非経口製剤の調製は、当業者によく知られている標準的製薬技法を用いて容易に行うことができる。
【0143】
非経口液剤の調製において使用される式(1)の化合物の溶解性は、溶解性促進剤の組入れなどの適切な製剤技法の使用により高めることができる。
【0144】
非経口投与のための製剤は、即時放出および/または放出調節であるように製剤化することができる。放出調節製剤は、遅延放出、持続放出、パルス放出、制御放出、標的放出およびプログラム放出を包含する。すなわち、本発明の化合物は、活性化合物の放出調節を提供する埋込型デポー剤として投与するための固体、半固体、もしくはチキソトロピックな液体として製剤化することができる。そのような製剤の例は、薬物をコーティングしたステントおよびdl−乳酸/グリコール酸共重合体(PGLA)ミクロスフェアを包含する。
【0145】
本発明の化合物は、皮膚または粘膜へ局所的に、すなわち、皮膚にまたは経皮的に投与することもできる。この目的にとって典型的な製剤は、ゲル剤、ヒドロゲル剤、ローション剤、液剤、クリーム剤、軟膏剤、散布剤、包帯剤、フォーム剤、フィルム剤、皮膚用パッチ剤、ウエハー剤、インプラント剤、スポンジ剤、ファイバー剤、絆創膏剤およびマイクロエマルジョン剤を包含する。リポソーム剤も使用することができる。典型的な担体は、アルコール、水、鉱油、流動ワセリン、白色ワセリン、グリセリン、ポリエチレングリコールおよびプロピレングリコールを包含する。透過促進剤を組み入れることができる。例えば、FinninおよびMorganによるJ Pharm Sci、88(10)、955〜958(October 1999)を参照されたい。
【0146】
局所投与の他の手段は、エレクトロポレーション、イオントフォレーシス、フォノフォレーシス、ソノフォレーシスおよび極微針または無針(例えば、Powderject(商標)、Bioject(商標)など)注射による送達を包含する。
【0147】
局所投与のための製剤は、即時放出および/または放出調節であるように製剤化することができる。放出調節製剤は、遅延放出、持続放出、パルス放出、制御放出、標的放出およびプログラム放出を包含する。
【0148】
また、本発明の化合物は、鼻腔内に、または吸入により、典型的には、乾燥粉末吸入器から乾燥粉末(単独で、例えば、ラクトースとの乾燥ブレンドにおける混合物として、または、例えば、ホスファチジルコリンなどのリン脂質と混合された混合成分粒子として)の形態で、または1,1,1,2−テトラフルオロエタンもしくは1,1,1,2,3,3,3−ヘプタフルオロプロパンなどの適当な噴射剤の使用の有無に関わらず加圧容器、ポンプ、スプレー、アトマイザー(好ましくは、細かい霧を発生するための電気流体力学を用いるアトマイザー)、もしくはネブライザーからのエアゾールスプレーとして投与することができる。鼻腔内使用の場合、粉末は、生体接着剤、例えば、キトサンまたはシクロデキストリンを含むことができる。
【0149】
加圧容器、ポンプ、スプレー、アトマイザー、またはネブライザーは、例えば、エタノール、水性エタノール、または活性物質の分散、可溶化、または延長放出のための適当な代替試剤、溶媒としての1種または複数の噴射剤およびソルビタントリオレエート、オレイン酸、またはオリゴ乳酸などの任意選択の界面活性剤を含む本発明の1種または複数の化合物の溶液または懸濁液を含有する。
【0150】
乾燥粉末または懸濁液製剤における使用に先立って、薬物製品は、吸入による送達に適しているサイズ(典型的には、5ミクロン未満)まで微粉化される。これは、スパイラルジェットミリング、流動床ジェットミリング、ナノ粒子を形成するための超臨界流体プロセシング、高圧ホモジネート、または噴霧乾燥などの任意の適切な粉砕方法により行うことができる。
【0151】
吸入器またはインサフレーターにおいて使用するためのカプセル剤(例えば、ゼラチンまたはヒドロキシプロピルメチルセルロース製)、ブリスター剤およびカートリッジ剤は、本発明の化合物、ラクトースまたはデンプンなどの適当な粉末基剤およびl−ロイシン、マンニトール、またはステアリン酸マグネシウムなどの動作調整剤の粉末ミックスを含有するように製剤化することができる。ラクトースは、無水または一水和物の形態であってよく、後者であることが好ましい。他の適当な賦形剤は、デキストラン、グルコース、マルトース、ソルビトール、キシリトール、フルクトース、スクロースおよびトレハロースを包含する。
【0152】
細かい霧を発生するための電気流体力学を用いるアトマイザーにおいて使用するのに適している溶液製剤は、1動作につき本発明の化合物1μg〜20mgを含有することができ、動作容積は、1μlから100μlまでと様々であってよい。典型的な製剤は、式(I)の化合物、プロピレングリコール、滅菌水、エタノールおよび塩化ナトリウムを含むことができる。プロピレングリコールの代わりに使用することができる代替溶媒は、グリセロールおよびポリエチレングリコールを包含する。
【0153】
吸入/鼻腔内投与を意図した本発明の製剤には、メントールおよびレボメントールなどの適当な香料、またはサッカリンもしくはサッカリンナトリウムなどの甘味料を添加することができる。
【0154】
吸入/鼻腔内投与のための製剤は、即時放出および/または、例えば、PGLAを使用する放出調節であるように製剤化することができる。放出調節製剤は、遅延放出、持続放出、パルス放出、制御放出、標的放出およびプログラム放出を包含する。
【0155】
乾燥粉末吸入器およびエアゾール剤の場合、用量単位は、充填済みのカプセル、ブリスターもしくはポケットにより、または重量測定法で送り込む投薬槽(dosing chamber)を利用するシステムにより決定される。本発明による単位は、典型的には、一定量すなわち(ここでの化合物名)、またはその塩1〜5000μgを含有する「パフ」を投与するように配置される。1日総投与量は、典型的には、1回量で、またはより一般的には1日を通して分割量として投与することができる1μg〜20mgの範囲にあるであろう。
【0156】
式(1)の化合物は、吸入による、特に、乾燥粉末吸入器を使用する投与に特に適している。
【0157】
本発明の化合物は、例えば、坐薬、膣坐薬、または浣腸の形態で経直腸的または経膣的に投与することができる。カカオ脂は、伝統的な坐薬基剤であるが、必要に応じて様々な代替物を使用することができる。
【0158】
直腸/膣内投与のための製剤は、即時放出および/または放出調節であるように製剤化することができる。放出調節製剤は、遅延放出、持続放出、パルス放出、制御放出、標的放出およびプログラム放出を包含する。
【0159】
本発明の化合物は、典型的には、等張性のpH調整した滅菌食塩水中の微粉末化された懸濁液または溶液の点滴剤の形態で、眼または耳に直接投与することもできる。眼および耳投与に適している他の製剤は、軟膏剤、生分解性(例えば、吸収性ゲルスポンジ、コラーゲン)および非生分解性(例えば、シリコーン)インプラント剤、ウエハー剤、レンズ剤およびニオソームまたはリポソームなどの微粒子または小胞系を包含する。架橋ポリアクリル酸、ポリビニルアルコール、ヒアルロン酸、セルロースポリマー、例えば、ヒドロキシプロピルメチルセルロース、ヒドロキシエチルセルロース、もしくはメチルセルロース、またはヘテロ多糖ポリマー、例えば、ゲランガムなどのポリマーを、塩化ベンザルコニウムなどの保存剤と一緒に組み入れることができる。そのような製剤は、イオントフォレーシスにより送達することもできる。
【0160】
眼/耳投与のための製剤は、即時放出および/または放出調節であるように製剤化することができる。放出調節製剤は、遅延放出、持続放出、パルス放出、制御放出、標的放出およびプログラム放出を包含する。
【0161】
本発明の化合物は、シクロデキストリンおよび適当なその誘導体またはポリエチレングリコール含有ポリマーなどの可溶性高分子と混ぜ合わせ、前述の投与方法のうちのいずれかにおいて使用するために、それらの溶解性、溶出速度、味覚マスキング、生物学的利用能および/または安定性を改善することができる。
【0162】
例えば、薬物−シクロデキストリン錯体は、大部分の剤形および投与経路にとって一般的に有用であることが判明している。包接錯体と非包接錯体の両方を使用することができる。薬物との直接錯体化の代替法として、シクロデキストリンを、補助添加剤、すなわち担体、希釈剤、または可溶化剤として使用することができる。これらの目的のためにα−、β−およびγ−シクロデキストリンが最も一般的に使用され、その例は、国際特許出願第WO91/11172号、第WO94/02518号および第WO98/55148号中に見いだすことができる。
【0163】
例えば、特定の疾患または状態を治療する目的で、活性化合物の組合せを投与することが望ましいことがあるため、そのうちの少なくとも1つは本発明による化合物を含有する2つ以上の医薬組成物を、組成物の同時投与に適しているキットの形態で都合良く組み合わせ得ることは、本発明の範囲内にある。
【0164】
したがって、本発明のキットは、そのうちの少なくとも1つは本発明による式(1)の化合物を含有する2つ以上の別々の医薬組成物および容器、分かれたボトル、または分かれたホイルパケットなどの前記組成物を別々に保持するための手段を含む。そのようなキットの例は、錠剤、カプセル剤などの包装に使用されるよく知られているブリスターパックである。
【0165】
本発明のキットは、異なる剤形を、例えば、非経口的に投与するのに、異なる投与間隔で別々の組成物を投与するのに、またはお互いに対して別々の組成物を用量設定するのに特に適している。コンプライアンスを補助するため、キットは、典型的には、投与説明書を含み、いわゆる記憶補助を提供することができる。
【0166】
ヒト患者への投与の場合、本発明の化合物の1日総投与量は、典型的には、言うまでもなく投与方法に応じて、0.001mg〜5000mgの範囲にある。例えば、静脈内1日投与量は、0.001mg〜40mgを必要とするに過ぎないことがある。1日総投与量は、1回量または分割量で投与することができ、医師の裁量で、本明細書に示される典型的な範囲から外れることがある。
【0167】
これらの用量は、約65〜70kgの体重を有する平均的なヒト対象に基づいている。医師は、乳児および高齢者などの、体重がこの範囲から外れている対象に対する投与量を容易に決定することができるはずである。
【0168】
誤解を避けるために、本明細書における「治療」への言及は、治癒的、姑息的および予防的治療を包含する。
【0169】
本発明の別の実施形態によれば、式(1)の化合物、もしくは薬学的に許容できるそれらの塩および/または薬学的に許容できる前記化合物もしく塩の溶媒和物は、患者に同時投与される1種または複数の追加治療薬との組合せとして使用し、(i)気管支収縮、(ii)炎症、(iii)アレルギー、(iv)組織の破壊、(v)息切れ、咳などの徴候および症状を包含するがこれらに限定されない病態生理学的に関連する疾患プロセスの治療などの一部の特に望ましい治療的最終結果を得ることもできる。第二およびそれ以上の追加治療薬は、式(1)の化合物、もしくは薬学的に許容できるそれらの塩および/または薬学的に許容できる前記化合物もしく塩の溶媒和物であるか、当技術分野において知られている1種もしくは複数のβ2作動薬であってもよい。より典型的には、第二およびそれ以上の治療薬は、異なるクラスの治療薬から選択されるであろう。
【0170】
本明細書において使用されるように、「同時投与」、「同時投与される」および「と組み合わせて」という用語は、式(1)の化合物および1種または複数の他の治療薬に関して、下記の、
・治療を必要としている患者への式(1)の1種または複数の化合物と1種または複数の治療薬のそのような組合せの同時投与であって、そのような構成成分が、前記患者に対して実質的に同じ時間に前記構成成分を放出する単一の剤形に一緒に製剤化される場合の同時投与、
・治療を必要としている患者への式(1)の1種または複数の化合物と1種または複数の治療薬のそのような組合せの実質的な同時投与であって、そのような構成成分が、前記患者により実質的に同じ時間に摂取される別々の剤形にお互いとは別に製剤化され、前記構成成分が、前記患者に対して実質的に同じ時間に放出される場合の実質的な同時投与、
・治療を必要としている患者への式(1)の1種または複数の化合物と1種または複数の治療薬のそのような組合せの順次投与であって、そのような構成成分が、各投与間の有意な時間間隔で前記患者により連続した時間に摂取される別々の剤形にお互いとは別に製剤化され、前記構成成分が、前記患者に対して実質的に異なる時間に放出される場合の順次投与、および
・治療を必要としている患者への式(1)の1種または複数の化合物と1種または複数の治療薬のそのような組合せの順次投与であって、そのような構成成分が、制御された方法で前記構成成分を放出する単一の剤形に一緒に製剤化され、それらが、前記患者により同じかつ/または異なる時間に同時に、連続して、かつ/または重ねて投与される場合の順次投与であって、
各部分を、同じ経路か異なる経路のどちらかにより投与することができる投与を意味することが意図され、それらを指し、それらを包含する。
【0171】
式(1)の1種または複数の化合物、もしくは薬学的に許容できるそれらの塩および/または薬学的に許容できる前記化合物もしくは塩の溶媒和物と組み合わせて使用することができる他の治療薬の適当な例は、
(a)5−リポキシゲナーゼ(5−LO)阻害薬または5−リポキシゲナーゼ活性化タンパク質(FLAP)拮抗薬、
(b)LTB4、LTC4、LTD4、およびLTE4の拮抗薬を包含するロイコトリエン拮抗薬(LTRA)、
(c)H1およびH3拮抗薬を包含するヒスタミン受容体拮抗薬、
(d)鼻充血除去薬使用のためのα1−およびα2−アドレナリン受容体作動薬血管収縮交感神経様作用薬、
(e)PDE阻害薬、例えば、PDE3、PDE4およびPDE5阻害薬、
(f)β2受容体作動薬、
(g)ムスカリン性M3受容体拮抗薬または抗コリン作動薬、
(h)テオフィリン、
(i)クロモグリク酸ナトリウム、
(j)COX阻害薬、非選択的および選択的なCOX−1またはCOX−2阻害薬(NSAID)、
(k)プロスタグランジン受容体拮抗薬およびプロスタグランジン合成酵素の阻害薬、
(l)経口および吸入グルココルチコステロイド、
(m)コルチコイド受容体の解離性(dissociated)作動薬(DAGR)、
(n)内因性炎症性物質に対して活性なモノクローナル抗体、
(o)抗腫瘍壊死因子(抗TNF−α)薬、
(p)VLA−4拮抗薬を包含する接着分子阻害薬、
(q)キニン−B1−およびB2−受容体拮抗薬、
(r)IgE経路の阻害薬およびシクロスポリンを包含する免疫抑制薬、
(s)マトリックスメタロプロテアーゼ(MMP)の阻害薬、
(t)タキキニンNK1、NK2およびNK3受容体拮抗薬、
(u)エラスターゼ阻害薬などのプロテアーゼ阻害薬、
(v)アデノシンA2a受容体作動薬およびA2b拮抗薬、
(w)ウロキナーゼの阻害薬、
(x)D2作動薬などの、ドーパミン受容体に作用する化合物、
(y)IKK阻害薬などの、NFκβ経路のモジュレーター、
(z)p38MAPキナーゼ、PI3キナーゼ、JAKキナーゼ、sykキナーゼ、EGFRまたはMK−2などのサイトカインシグナル伝達経路のモジュレーター、
(aa)粘液溶解薬または鎮咳薬として分類することができる薬剤、
(bb)吸入コルチコステロイドに対する応答を亢進する薬剤、
(cc)気道にコロニーを形成することができる微生物に対して有効な抗生物質および抗ウイルス薬、
(dd)HDAC阻害薬、
(ee)CXCR2拮抗薬、
(ff)インテグリン拮抗薬、
(gg)ケモカイン、
(hh)上皮ナトリウムチャネル(ENaC)遮断薬または上皮ナトリウムチャネル(ENaC)阻害薬、
(ii)P2Y2作動薬および他のヌクレオチド受容体作動薬、
(jj)トロンボキサンの阻害薬、
(kk)PGD2合成およびPGD2受容体(DP1およびDP2/CRTH2)の阻害薬、
(ll)ナイアシン、ならびに
(mm)VLAM、ICAM、およびELAMを包含する接着因子
を包含するが、決してこれらに限定されるものではない。
【0172】
本発明によれば、式(1)の化合物と、
− H3拮抗薬、
− ムスカリン性M3受容体拮抗薬、
− PDE4阻害薬、
− グルココルチコステロイド、
− アデノシンA2a受容体作動薬、
− p38MAPキナーゼもしくはsykキナーゼなどのサイトカインシグナル伝達経路のモジュレーター、または
− LTB4、LTC4、LTD4、およびLTE4の拮抗薬を包含するロイコトリエン拮抗薬(LTRA)の組合せがさらに好ましい。
【0173】
本発明によれば、式(1)の化合物と、
− グルココルチコステロイド、特に、プレドニゾン、プレドニゾロン、フルニソリド、トリアムシノロンアセトニド、ジプロピオン酸ベクロメタゾン、ブデソニド、プロピオン酸フルチカゾン、シクレソニド、およびフランカルボン酸モメタゾンを包含する全身性副作用が軽減された吸入グルココルチコステロイド、または
− 特に、イプラトロピウム塩、すなわちブロミド、チオトロピウム塩、すなわちブロミド、オキシトロピウム塩、すなわちブロミド、ぺレンゼピン(perenzepine)、およびテレンゼピンを包含するムスカリン性M3受容体拮抗薬もしくはアドレナリン作動性薬剤の組合せがさらに好ましい。
【0174】
本明細書における治療へのすべての言及は、治癒的、姑息的および予防的治療を包含することを理解されたい。
【0175】
式(1)の化合物は、β2受容体およびコリン作動性ムスカリン性受容体と相互作用する能力を有し、それによって、β2受容体およびムスカリン性受容体がすべての哺乳動物の生理機能において果たす本質的な役割のために、以下にさらに記載されるように、広範囲な治療的応用例を有する。
【0176】
したがって、本発明のさらなる態様は、β2受容体および/またはムスカリン性受容体が関与する疾患、障害、および状態を治療するのに使用するための、式(1)の化合物、もしくは薬学的に許容できるそれらの塩および/または薬学的に許容できる前記化合物もしくは塩の溶媒和物に関する。より具体的には、本発明は、
・あらゆるタイプ、病因、または病原の喘息、特に、アトピー性喘息、非アトピー性喘息、アレルギー性喘息、アトピー性気管支IgE−仲介性喘息、気管支喘息、本態性喘息、真正喘息、病態生理学的かく乱により引き起こされる内因性喘息、環境要因により引き起こされる外因性喘息、知られていないまたは明らかでない原因の本態性喘息、非アトピー性喘息、気管支喘息、気腫性喘息、運動誘発性喘息、アレルゲン誘発性喘息、冷気誘発性喘息、職業喘息、細菌、真菌、原虫、またはウイルス感染症により引き起こされる感染型喘息、非アレルギー性喘息、初発性喘息、喘鳴乳児症候群および細気管支炎からなる群から選択されるメンバーである喘息、
・慢性または急性気管支収縮、慢性気管支炎、末梢気道閉塞、および気腫、
・あらゆるタイプ、病因または病原の閉塞性または炎症性気道疾患、特に、慢性好酸球性肺炎、慢性閉塞性肺疾患(COPD)、慢性気管支炎を包含するCOPD、COPDに関連した、もしくは関連しない肺気腫もしくは呼吸困難、不可逆的進行性気道閉塞を特徴とするCOPD、成人呼吸窮迫症候群(ARDS)、他の薬物療法の結果として生じる気道過敏性の悪化および肺性高血圧に関連した気道疾患からなる群から選択されるメンバーである閉塞性または炎症性気道疾患、
・あらゆるタイプ、病因または病原の気管支炎、特に、急性気管支炎、急性喉頭気管気管支炎、アラキン酸気管支炎、カタル性気管支炎、クループ性気管支炎、乾性気管支炎、感染性喘息性気管支炎、湿咳性気管支炎、ブドウ球菌性または連鎖球菌性気管支炎および肺胞性気管支炎からなる群から選択されるメンバーである気管支炎、
・急性肺傷害、
・あらゆるタイプ、病因または病原の気管支拡張症、特に、円柱状気管支拡張症、嚢状気管支拡張症、紡錘状気管支拡張症、毛細管性気管支拡張症、嚢胞状気管支拡張症、乾性気管支拡張症および濾胞性気管支拡張症からなる群から選択されるメンバーである気管支拡張症
からなる群から選択される疾患、障害、および状態を治療するのに使用するための、式(1)の化合物、もしくは薬学的に許容できるその塩および/または薬学的に許容できる前記化合物もしくは塩の溶媒和物にも関する。
【0177】
本発明のさらに他の態様は、β2作動薬活性およびM3拮抗薬活性を有する薬物を製造するための、式(1)の化合物、もしくは薬学的に許容できるその塩および/または薬学的に許容できる前記化合物もしくは塩の溶媒和物の使用にも関する。特に、本発明は、β2およびムスカリン性受容体が関わる疾患および/または状態、特に、上記に列挙されている疾患および/または状態を治療するための薬物を製造するための、式(1)の化合物、もしくは薬学的に許容できるその塩および/または薬学的に許容できる前記化合物もしくは塩の溶媒和物の使用に関する。
【0178】
結果として、本発明は、有効量の式(1)の化合物、もしくは薬学的に許容できるその塩および/または薬学的に許容できる前記化合物もしくは塩の溶媒和物でヒトを包含する哺乳動物を治療するための特に興味深い方法を提供する。より正確に言えば、本発明は、ヒトを包含する哺乳動物においてβ2およびムスカリン性受容体が関わるβ2仲介性の疾患および/または状態、特に、上記に列挙されている疾患および/または状態を治療するための特に興味深い方法であって、前記哺乳動物に、有効量の式(1)の化合物、その薬学的に許容できる塩および/または前記化合物もしくは塩の溶媒和物を投与することを含む方法を提供する。
【0179】
下記の実施例は、式(1)の化合物の調製を例示している。
【図面の簡単な説明】
【0180】
【図1】実施例2aのPXRDパターンを示す図である。
【発明を実施するための形態】
【0181】
プロトコル
下のすべての実施例について、下記の実験条件を使用した。
【0182】
粉末X線回折法(PXRD)
粉末X線回折パターンは、自動サンプルチェンジャー、θ−θゴニオメーター、自動ビーム発散スリット、およびPSD Vantec−1検出器を取り付けたBruker−AXS Ltd.のD4粉末X線回折計を使用して決定した。サンプルは、低バックグラウンドキャビティーシリコンウエハー試料台上に設置することにより分析用に調製した。得られたピークは、シリコン参照標準に対してアラインメントした。試料を、40kV/35mAで動作するX線管により銅のK−α1X線(波長=1.5406オングストローム)を照射しながら回転させた。分析は、2°〜55°の2θ範囲にわたり、0.018°のステップ毎に0.2秒カウントに設定した連続モードで実行するゴニオメーターで行った。
【0183】
調製
調製1
(2R)−2−シクロヘキシル−2−ヒドロキシ−2−フェニルアセトアミド
【0184】
【化32】

(2R)−2−シクロヘキシル−2−ヒドロキシ−2−フェニル酢酸(調製36、4.87g、20.8mmol)をジクロロメタン(150mL)に溶かし、カルボニルジイミダゾール(3.37g、20.8mmol)を一度に加えた。室温にて1時間にわたって撹拌した後、0.880アンモニア(21mL)を加え、撹拌を、18時間にわたって室温にて続けた。有機層を分離し、食塩水(50mL)で洗浄し、硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去すると、92%収率で白色の泡として表題化合物、4.56gが得られた。
LRMS: APCI ESI m/z 232 [M-H]-
1H NMR
(400 MHz, クロロホルム-d) δ = 0.92
(m, 1H), 1.15 (m, 5H), 1.76 (m, 4H), 2.40 (m, 1H), 5.38 (br.s, 1H), 6.52 (br.s,
1H), 7.28 (m, 1H), 7.37 (m, 2H), 7.62 (m, 2H) ppm.
【0185】
調製2
(R)−シクロヘキシル(フェニル)1H−1,2,4−トリアゾール−3−イルメタノール
【0186】
【化33】

(2R)−2−シクロヘキシル−2−ヒドロキシ−2−フェニルアセトアミド(調製1、4.497g、19.27mmol)をN,N−ジメチルホルムアミドジメチルアセタール(60ml)に溶かした。2時間にわたって90℃にて撹拌した後、溶媒を真空中で除去し、残渣を、トルエン(100ml)と共沸させると、黄色の油が得られた。ヒドラジン水和物(1.11ml、22.9mmol)と、続いて、氷酢酸(90ml)を加えた。2時間にわたって90℃にて撹拌した後、溶媒を真空中で除去し、残渣を、酢酸エチル(250ml)と飽和重炭酸ナトリウム水溶液(250mL)の間で分配した。有機層を分離し、硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去した。残渣を、酢酸エチルで溶出するシリカゲル上のカラムクロマトグラフィーにより精製すると、100%収率で白色の固体として表題化合物、4.9gが得られた。
LRMS: ESI m/z 256 [M-H]-
1H NMR
(400 MHz, クロロホルム-d) δ = 1.08
(m, 3H), 1.36 (m, 2H), 1.70 (m, 5H), 2.46 (m, 1H), 3.08 (br.s, 1H), 7.23 (m,
1H), 7.34 (m, 2H), 7.65 (m, 2H), 8.00(s, 1H) ppm.
鏡像異性体過剰率:99.3%、1ml/分の流速にて79%ヘプタン、31%イソプロピルアルコールで溶出するChiralpak AS−H Column(250×4.6mm)を使用して算出した。望ましい(R)鏡像異性体の保持時間13.61分、望ましくない(S)鏡像異性体の保持時間11.31分(ラセミ体から同定した)。
【0187】
調製3
tert−ブチル4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−カルボキシレート
【0188】
【化34】

tert−ブチル4−(ブロモメチル)ピペリジン−1−カルボキシレート(6.75g、24.2mmol)をDMF(62ml)に溶かし、(R)−シクロヘキシル(フェニル)1H−1,2,4−トリアゾール−3−イルメタノール(調製2、5.2g、20mmol)と、続いて、炭酸カリウム(5.58g、40.4mmol)を加えた。18時間にわたって70℃にて撹拌した後、溶媒を真空中で除去し、残渣を、酢酸エチル(150ml)と水(150mL)の間で分配した。有機層を分離し、硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去した。残渣を、酢酸エチル:ヘプタン(1:4〜1:1、体積比)で溶出するシリカゲル上のカラムクロマトグラフィーにより精製すると、51%収率で白色の泡として表題化合物、4.7gが得られた(他のトリアゾール位置異性体10%を含有する)。
LRMS: APCI ESI m/z 487 [M+H+MeOH]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.05-1.36 (m, 9H), 1.43 (s, 9H), 1.47-1.75 (m, 5H), 2.09 (m, 1H),
2.38 (m, 1H), 2.72 (m, 2H), 4.08 (m, 4H), 7.17 (m, 1H), 7.26 (m, 2H), 7.58 (d,
2H), 8.30 (s, 1H) ppm.
【0189】
あるいは、表題化合物を、下記の手順に従って調製した。
(R)−シクロヘキシル(フェニル)1H−1,2,4−トリアゾール−3−イルメタノール(調製2、3.0g、11.7mmol)をアセトン(60mL)に溶かし、tert−ブチル4−(ブロモメチル)ピペリジン−1−カルボキシレート(3.24g、11.7mmol)と、続いて、炭酸セシウム(7.60g、23.3mmol)を加えた。5時間にわたって70℃にて撹拌した後、反応物を室温まで冷却し、さらに16時間にわたって撹拌した。溶媒を真空中で除去し、残渣を、酢酸エチル(50mL)と水(50mL)の間で分配した。有機層を分離し、硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去した。この残渣100mgをアセトニトリル(0.5ml)に溶かし、ほぼ乾燥状態まで蒸発させると、その時点で、得られた油が結晶化し始めた。残渣の残りをアセトニトリル(55ml)に溶かし、上で得られた結晶性材料を接種した。結晶化を18時間にわたって起こさせ、得られた固体を濾過により集めると、64%収率で白色の固体として表題化合物、3.4gが得られた。
LRMS: APCI ESI m/z 487 [M+H+MeOH]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.05-1.36 (m, 9H), 1.43 (s, 9H), 1.47-1.75 (m, 5H), 2.09 (m, 1H),
2.38 (m, 1H), 2.72 (m, 2H), 4.08 (m, 4H), 7.17 (m, 1H), 7.26 (m, 2H), 7.58 (d,
2H), 8.30 (s, 1H) ppm.
【0190】
調製4
(R)−シクロヘキシル(フェニル)[1−(ピペリジン−4−イルメチル)−1H−1,2,4−トリアゾール−3−イル]メタノール
【0191】
【化35】

tert−ブチル4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−カルボキシレート(調製3、5.60g、12.3mmol)をDCM(31ml)に溶かし、エーテル中2M HCl(31ml、60mmol)を加えた。5時間にわたって室温にて撹拌した後、溶媒を真空中で除去し、残渣を、ジクロロメタン(200ml)と飽和重炭酸ナトリウム水溶液(200ml)の間で分配した。有機層を分離し、硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去すると、92%収率で白色の泡として表題化合物、4.03gが得られた(他のトリアゾール位置異性体10%を含有する)。
LRMS: APCI ESI m/z 377 [M+Na]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.04-1.36 (m, 9H), 1.38-1.57 (m, 2H), 1.58-1.81 (m, 3H), 2.00 (m,
1H), 2.38 (m, 1H), 2.58 (m, 2H), 3.06 (m, 2H), 4.06 (d, 2H), 7.17 (m, 1H), 7.25
(m, 2H), 7.58 (d, 2H), 8.31 (s, 1H) ppm.
【0192】
あるいは、表題化合物を、下記の手順に従って調製した。
tert−ブチル4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−カルボキシレート(調製3a、2.00g、4.40mmol)をジオキサン(11ml)に溶かし、激しく撹拌して可溶化を達成した。次いで、ジオキサン中4M HCl(5.54mL、22.1mmol)を加えた。24時間にわたって室温にて撹拌した後、溶媒を真空中で除去し、残渣を、ジクロロメタン(50mL)と飽和重炭酸ナトリウム水溶液(50mL)の間で分配した。有機層を分離し、硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去すると、96%収率で無色の油として表題化合物、1.5gが得られた。
LRMS: APCI ESI m/z 377 [M+Na]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.04-1.36 (m, 9H), 1.38-1.57 (m, 2H), 1.58-1.81 (m, 3H), 2.00 (m,
1H), 2.38 (m, 1H), 2.58 (m, 2H), 3.06 (m, 2H), 4.06 (d, 2H), 7.17 (m, 1H), 7.25
(m, 2H), 7.58 (d, 2H), 8.31 (s, 1H) ppm.
【0193】
調製5
ジ−tert−ブチル{9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}イミドジカーボネート
【0194】
【化36】

(R)−シクロヘキシル(フェニル)[1−(ピペリジン−4−イルメチル)−1H−1,2,4−トリアゾール−3−イル]メタノール(調製4、2.00g、5.64mmol)およびジ−tert−ブチル(9−ブロモノニル)イミドジカーボネート(米国特許第04167167号、2.38g、5.64mmol)をアセトニトリル(60ml)に溶かし、トリエチルアミン(2.35ml、16.9mmol)を加えた。18時間にわたって50℃にて撹拌した後、溶媒を真空中で除去し、残渣を、ジクロロメタン:メタノール:880アンモニア(98:2:0.2、体積比)で溶出するシリカゲル上のカラムクロマトグラフィーにより精製すると、60%収率で透明な油として表題化合物、2.6gが得られた(他のトリアゾール位置異性体10%を含有する)。
LRMS: APCI ESI m/z 696 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.14 (m, 4H), 1.25-1.38 (m, 18H) 1.41-1.51 (m, 18H), 1.51-1.75
(m, 6H), 1.99 (m, 2H), 2.14 (m, 2H), 2.42 (m, 2H), 3.06 (m, 2H), 3.55 (m, 2H),
4.09 (m, 2H), 7.16 (m, 1H), 7.26 (m, 2H), 7.58 (m, 2H), 8.32 (m, 1H) ppm.
【0195】
調製6
(R)−(1−{[1−(9−アミノノニル)ピペリジン−4−イル]メチル}−1H−1,2,4−トリアゾール−3−イル)(シクロヘキシル)フェニルメタノール
【0196】
【化37】

ジ−tert−ブチル{9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}イミドジカーボネート(調製5、2.6g、3.7mmol)をジクロロメタン(15ml)に溶かし、ジエチルエーテル中塩化水素(2M、15ml、30mmol)を加えた。5時間にわたって室温にて撹拌した後、溶媒を真空中で除去し、残渣を、ジクロロメタン(200ml)と飽和重炭酸ナトリウム水溶液(200ml)の間で分配した。有機層を分離し、硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去した。残渣を、ジクロロメタン:メタノール:880アンモニア(97.5:2.5:0.25、体積比)で溶出するシリカゲル上のカラムクロマトグラフィーにより精製すると、70%収率で透明な油として表題化合物、1.29gが得られた(他のトリアゾール位置異性体10%を含有する)。
LRMS: APCI m/z 496 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.12 (m, 4H), 1.23-1.34 (m, 18H), 1.49 (m, 6H), 1.64 (m, 2H),
1.94 (m, 2H), 2.31 (m, 2H), 2.63 (m, 2H), 2.93 (m, 2H), 4.07 (m, 2H), 7.16 (m,
1H), 7.25 (m, 2H), 7.58 (m, 2H), 8.31 (s, 1H) ppm.
【0197】
調製7
8−(ベンジルオキシ)−5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−({9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]キノリン−2(1H)−オン
【0198】
【化38】

(R)−(1−{[1−(9−アミノノニル)ピペリジン−4−イル]メチル}−1H−1,2,4−トリアゾール−3−イル)(シクロヘキシル)フェニルメタノール(調製6、350mg、0.706mg)、8−(ベンジルオキシ)−5−[(1R)−2−ブロモ−1−{[tert−ブチル(ジメチル)シリル]オキシ}エチル]キノリン−2(1H)−オン(WO200509286、345mg、0.706mmol)および炭酸水素ナトリウム(88.9mg、1.06mmol)をアセトニトリル(7mL)中で混ぜ合わせた。72時間にわたって90℃にて撹拌した後、溶媒を真空中で除去し、残渣を、ジクロロメタン(50ml)と飽和重炭酸ナトリウム水溶液(50mL)の間で分配した。有機層を分離し、硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去した。残渣を、ジクロロメタン:メタノール:880アンモニア(99:1:0.1〜95.5:5:0.5、体積比)で溶出するシリカゲル上のカラムクロマトグラフィーにより精製すると、37%収率で透明なガラスとして表題化合物、240mgが得られた(他のトリアゾール位置異性体10%を含有する)。
LRMS: APCI ESI m/z 904 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 0.07 (s, 3H), 0.37 (s, 3H), 1.17 (s, 9H), 1.37-1.49 (m, 4H),
1.52-1.63 (m, 18H), 1.76 (m, 6H), 1.92 (m, 2H), 2.20 (m, 2H), 2.60 (m, 2H),
2.88 (m, 2H), 3.01 (m, 1H), 3.18 (m, 3H), 4.35 (m, 2H), 5.50 (m, 1H), 5.61 (s,
2H), 6.95 (d, 1H), 7.41-7.70 (m, 8H), 7.79 (m, 2H), 7.86 (m, 2H), 8.59 (s, 1H),
8.74 (d, 1H) ppm.
【0199】
調製8
5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−({9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]−8−ヒドロキシキノリン−2(1H)−オン
【0200】
【化39】

8−(ベンジルオキシ)−5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−({9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]キノリン−2(1H)−オン(調製7、230mg、0.255mmol)をエタノール(10ml)に溶かし、水酸化パラジウム[炭素(湿った)上20wt.%(乾燥ベース)](5mg)と、続いて、ギ酸アンモニウム(161mg、2.55mmol)を加えた。1時間にわたって還流状態にて撹拌した後、反応混合物をarbocel(登録商標)に通して濾過し、溶媒を真空中で除去した。残渣を、ジクロロメタン:メタノール:880アンモニア(97.5:2.5:0.25〜90:10:1、体積比)で溶出するシリカゲル上のカラムクロマトグラフィーにより精製すると、87%収率でガラスとして表題化合物、180mgが得られた。
LRMS: APCI ESI m/z 813 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 0.00 (s, 3H), 0.30 (s, 3H), 1.10 (s, 9H), 1.45-1.94 (m, 28H),
2.21 (m, 3H), 2.58 (m, 3H ), 2.85 (m, 2H ), 2.95 (m, 1H), 3.17 (m, 3H), 4.29
(m, 2H), 5.42 (m, 1H), 6.85 (d, 1H), 7.14 (d, 1H), 7.32 -7.48 (m, 4H), 7.78 (m,
2H), 8.52 (s, 1H), 8.65 (d, 1H) ppm.
【0201】
調製9
2−{2−[4−(2−ヒドロキシ−エチル)−フェニル]−ビニル}−イソインドール−1,3−ジオン
【0202】
【化40】

アセトニトリル(480mL)中の2−(4−ブロモフェニル)エタノール(48.3g)の溶液に、ジイソプロピルエチルアミン(46.6g)、N−ビニルフタルイミド(43.7g)およびトリ−o−トリルホスフィン(7.31g)を加え、混合物を窒素ガスで3回パージした。酢酸パラジウム(2.7g)を加え、混合物を、窒素下で21時間にわたって90℃にて撹拌した。反応物を冷却し、沈殿した生成物を濾過により集めた。得られた固体をジクロロメタンおよび酢酸エチルに再び溶かし、シリカゲルに通して濾過した。濾液を真空中で濃縮すると、表題化合物、24gが得られた。
1H NMR
(400MHz, CDCl3) δ = 2.81-2.84 (t, 2H),
3.82-3.90 (t, 2H), 7.23-7.26 (d, 2H) 7.32-7.36 (d, 1H), 7.40-7.43 (d, 2H),
7.61-7.64 (d, 1H), 7.66-7.78 (d, 2H), 7.86-7.88 (d, 2H) ppm.
【0203】
調製10
2−{2−[4−(2−ヒドロキシ−エチル)−フェニル]−エチル}−イソインドール−1,3−ジオン
【0204】
【化41】

エタノールおよび酢酸エチル(各350mL)中の2−{2−[4−(2−ヒドロキシ−エチル)−フェニル]−ビニル}−イソインドール−1,3−ジオン(調製9、10g)の撹拌した溶液に、炭素上30%水酸化パラジウム(1.44g)と、続いて、ギ酸アンモニウム(21.5g)を加えた。反応物を4時間にわたって80℃まで加熱した。追加の炭素上水酸化パラジウム(1.44g)およびギ酸アンモニウム(21.5g)を加え、反応物を18時間にわたって80℃にて撹拌した。反応物を冷却し、Arbocel(商標)のパッドに通して濾過し、メタノールですすいだ。溶媒を減圧下で除去し、得られた白色の固体を、ジクロロメタン(200ml)と水(100ml)の間で分配した。水層を分離し、さらなるジクロロメタン(2×50mL)で抽出した。合わせた有機層を乾燥し(硫酸ナトリウム)、溶媒を真空中で除去すると、灰色がかった白色の固体として表題化合物、9.11gが得られた。
1H NMR
(400MHz, CDCl3) δ = 2.80-2.83 (t, 2H),
2.92-3.00 (t, 2H), 3.82-3.86 (t, 2H), 3.87-3.96 (t, 2H), 7.14-7.22 (2x d, 4H),
7.70-7.72 (dd, 2H), 7.82-7.84 (dd, 2H) ppm.
【0205】
あるいは、表題化合物を、下記の手順に従って調製することができる。
2−{2−[4−(2−ヒドロキシ−エチル)フェニル]−ビニル}−イソインドール−1,3−ジオン(調製9、62.0g、211.37mmol)を酢酸エチル(1200mL)に溶かした。これに、塩化トリス(トリフェニルホスフィン)ロジウム、(12.7g、13.7mmol)を加え、混合物を、24時間にわたって20psi、室温にて水素化した。反応物を濾過し、真空中で濃縮した。残渣を酢酸エチル(1000mL)に溶かし、シリカゲルのパッドを通過させ、酢酸エチルで洗浄した。溶媒を真空中で除去すると、淡褐色の固体が得られ、酢酸エチル:ヘプタン(4:1、体積比)から再結晶すると、85%収率で灰色がかった白色の固体として表題化合物、53gが得られた。
1H NMR
(400MHz, CDCl3) δ = 2.80-2.83 (t, 2H), 2.92-3.00
(t, 2H), 3.82-3.86 (t, 2H), 3.87-3.96 (t, 2H), 7.14-7.22 (2x d, 4H), 7.70-7.72
(dd, 2H), 7.82-7.84 (dd, 2H) ppm.
【0206】
調製11
2−{2−[4−(2−ブロモ−エチル)−フェニル]−エチル}−イソインドール−1,3−ジオン
【0207】
【化42】

トルエン(500mL)中の2−{2−[4−(2−ヒドロキシ−エチル)−フェニル]−エチル}−イソインドール−1,3−ジオン(調製10、22.37g)および三臭化リン(8.20g)の溶液を4時間にわたって還流した。混合物を室温まで冷却し、酢酸エチル(300mL)で希釈し、水(100mL)中の重亜硫酸ナトリウム/重炭酸ナトリウム(1:1)で注意深くクエンチした。有機層を分離し、水(100mL)中のさらなる重亜硫酸ナトリウム/重炭酸ナトリウム(1:1)で洗浄し、硫酸ナトリウムで乾燥し、真空中で濃縮した。得られた固体(24.26g)をヘプタン:tert−ブチルメチルエーテル(100mL;9:1、体積比)でトリチュレートすると、淡緑色の固体として表題化合物、17.94gが得られた。
1H NMR
(400MHz, CDCl3) δ = 2.93-3.00 (t, 2H),
3.07-3.18 (t, 2H), 3.53-3.59 (t, 2H), 3.88-3.94 (t, 2H), 7.13-7.23 (2xd, 4H),
7.70-7.73 (dd, 2H), 7.83-7.85 (dd, 2H) ppm.
【0208】
調製12
2−[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]−1H−イソインドール−1,3(2H)−ジオン
【0209】
【化43】

シクロヘキシル−フェニル−(1−ピペリジン−4−イルメチル−1H−[1,2,4]トリアゾール−3−イル)−メタノール(調製4、8.2g、2.98mmol)、2−{2−[4−(2−ブロモ−エチル)−フェニル]−エチル}−イソインドール−1,3−ジオン(調製11、7.56g、21.1mmol)およびトリエチルアミン(13.3ml、95.9mmol)をアセトニトリル(100ml)に溶かした。48時間にわたって90℃にて撹拌した後、溶媒を真空中で除去し、残渣を、ジクロロメタン(200ml)と水(200mL)の間で分配した。有機層を分離し、硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去した。残渣を、ジクロロメタン:メタノール:880アンモニア(98:2:0.2、体積比)で溶出するシリカゲル上のカラムクロマトグラフィーにより精製し、次いで、得られた材料をtert−ブチルメチルエーテル中でトリチュレートすると、28%収率で透明な固体として表題化合物、3.4gが得られた。
LRMS: APCI ESI m/z 632 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.13 (m, 3H), 1.22-1.37 (m, 5H), 1.43 (m, 1H), 1.50-1.74 (m, 5H),
1.94 (m, 1H), 2.03 (m, 2H), 2.38 (m, 1H), 2.52 (m, 2H), 2.73 (m, 2H), 2.90-3.02
(m, 4H), 3.86 (t, 2H), 4.08 (d, 2H), 7.06-7.17 (m, 5H), 7.25 (m, 2H), 7.58 (m,
2H), 7.78 (m, 4H), 8.32 (s, 1H) ppm.
【0210】
あるいは、表題化合物を、下記の手順に従って調製することができる。
シクロヘキシル−フェニル−(1−ピペリジン−4−イルメチル−1H−[1,2,4]トリアゾール−3−イル)−メタノール(調製4、0.40g、1.13mmol)および2−{2−[4−(2−ブロモ−エチル)−フェニル]−エチル}−イソインドール−1,3−ジオン(調製11、0.404g、1.13mmol)およびジイソプロピルエチルアミン(0.59ml、3.38mmol)をメチルエチルケトン(8mL)に溶かした。24時間にわたって90℃にて撹拌した後、反応物を室温までゆっくりと冷却した。結晶化が起こり、得られた固体を濾過により集め、真空中で乾燥すると、74%収率でクリーム色の固体として表題化合物、0.532gが得られた。
LRMS: APCI ESI m/z 632 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.13 (m, 3H), 1.22-1.37 (m, 5H), 1.43 (m, 1H), 1.50-1.74 (m, 5H),
1.94 (m, 1H), 2.03 (m, 2H), 2.38 (m, 1H), 2.52 (m, 2H), 2.73 (m, 2H), 2.90-3.02
(m, 4H), 3.86 (t, 2H), 4.08 (d, 2H), 7.06-7.17 (m, 5H), 7.25 (m, 2H), 7.58 (m,
2H), 7.78 (m, 4H), 8.32 (s, 1H) ppm.
【0211】
あるいは、表題化合物をまた、下記の手順に従って調製した。
メタンスルホン酸2−{4−[2−(1,3−ジオキソ−1,3−ジヒドロ−イソインドール−2−イル)−エチル]−フェニル}−エチルエステル(調製35、20.00g、53.56mmol)をアセトニトリル(80mL)に溶かし、室温にて撹拌した。ヨウ化ナトリウム(16.06g、107.12mmol)を少しずつ加え、得られたスラリーを18時間にわたって80℃まで加熱した。反応混合物を50℃まで冷却し、さらなるアセトニトリル(80mL)を加えた。この混合物に、シクロヘキシル−フェニル−(1−ピペリジン−4−イルメチル−1H−[1,2,4]トリアゾール−3−イル)−メタノール(調製4、15.87g、53.56mmol)およびジイソプロピルエチルアミン(9.79mL、56.24mmol)を加え、加熱を6時間にわたって続け、次いで、室温まで冷却した。水(160mL)を加え、得られたスラリーを室温にて一晩にわたって撹拌した。固体を濾過により集め、アセトニトリル(5×20mL)で洗浄し、次いで、8時間にわたって45℃にて真空中で乾燥すると、68%収率で褐色の固体として表題化合物、20.9gが得られた。
LRMS: APCI ESI m/z 632 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.13 (m, 3H), 1.22-1.37 (m, 5H), 1.43 (m, 1H), 1.50-1.74 (m, 5H),
1.94 (m, 1H), 2.03 (m, 2H), 2.38 (m, 1H), 2.52 (m, 2H), 2.73 (m, 2H), 2.90-3.02
(m, 4H), 3.86 (t, 2H), 4.08 (d, 2H), 7.06-7.17 (m, 5H), 7.25 (m, 2H), 7.58 (m,
2H), 7.78 (m, 4H), 8.32 (s, 1H) ppm.
【0212】
調製13
(R)−{1−[(1−{2−[4−(2−アミノエチル)フェニル]エチル}ピペリジン−4−イル)メチル]−1H−1,2,4−トリアゾール−3−イル}(シクロヘキシル)フェニルメタノール
【0213】
【化44】

2−[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]−1H−イソインドール−1,3(2H)−ジオン(調製12、3.4g、5.38mmol)をエタノール(20ml)中に懸濁し、ヒドラジン水和物(2.61ml、53.8ml)を加えた。2時間にわたって還流状態にて撹拌した後、反応物を室温まで冷却し、沈殿を濾過により集め、エタノール(200ml)で洗浄した。濾液を真空中で濃縮すると、81%収率で白色の固体として表題化合物、2.57gが得られた。
LRMS: ESI m/z 502 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.04-1.75 (m, 14H), 1.90-2.08 (m, 3H), 2.38 (m, 1H), 2.54 (m,
2H), 2.68 - 2.78 (m, 4H), 2.84 (m, 2H), 2.99 (m, 2H), 3.96 (d, 2H), 7.09-7.17
(m, 4H), 7.12 (m, 1H), 7.25 (m, 2H), 7.59 (m, 2H), 8.31 (s, 1H) ppm.
【0214】
調製14
8−(ベンジルオキシ)−5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}エチル]キノリン−2(1H)−オン
【0215】
【化45】

表題化合物を、調製7に記載されているのと同じ方法を使用して(R)−{1−[(1−{2−[4−(2−アミノエチル)フェニル]エチル}ピペリジン−4−イル)メチル]−1H−1,2,4−トリアゾール−3−イル}(シクロヘキシル)フェニルメタノール(調製13、2.57g、5.12mmol)および8−(ベンジルオキシ)−5−[(1R)−2−ブロモ−1−{[tert−ブチル(ジメチル)シリル]オキシ}エチル]キノリン−2(1H)−オン(WO2005/09286、2.50g、5.12mmol)から調製すると、40%収率で白色の固体、2.3gが得られた。
LRMS: ESI m/z 909 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = -0.28 (s, 3H), -0.04 (s, 3H), 0.76 (s, 9H), 1.04-1.76 (m, 14H),
1.93 (m, 3H), 2.39 (m, 1H), 2.53 (m, 2H), 2.64-2.79 (m, 5H), 2.79-2.94 (m, 3H),
2.99 (m, 2H), 4.07 (d, 2H), 5.15 (m, 1H), 5.30 (s, 2H), 6.65 (m, 1H), 7.06 (m,
4H), 7.15 (m, 3H), 7.20-7.43 (m, 5H), 7.49 (d, 2H), 7.59 (d, 2H), 8.32 (s, 1H),
8.39 (d,1H) ppm.
【0216】
調製15
5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}エチル]−8−ヒドロキシキノリン−2(1H)−オン
【0217】
【化46】

表題化合物を、調製8に記載されているのと同じ方法を使用して8−(ベンジルオキシ)−5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}エチル]キノリン−2(1H)−オン(調製14、2.30g、2.81mmol)から調製すると、91%収率で黄色の固体、2.10gが得られた。
LRMS: ESI m/z 819 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = -0.28 (s, 3H), -0.04 (s, 3H), 0.77 (s, 9H), 1.02-1.22 (m, 3H),
1.22-1.51 (m, 6H), 1.51-1.76 (m, 5H), 1.95 (m, 1H), 2.08 (m, 2H), 2.39 (m, 1H),
2.57 (m, 2H), 2.69 - 2.81 (m, 5H), 2.84 - 2.94 (m, 3H), 3.07 (m, 2H), 4.08 (d,
2H), 5.13 (m, 1H), 6.62 (d, 1H), 6.91 (d, 1H), 6.99-7.11 (m, 5H), 7.16 (m, 1H),
7.25 (m, 2H), 7.59 (d, 2H), 8.32 (s, 1H), 8.38 (d, 1H) ppm.
【0218】
調製16
1−(ピロリジン−1−イルメチル)−1H−1,2,4−トリアゾール
【0219】
【化47】

トリアゾール(10g、144.8mmol)およびピロリジン(11.3g、159.0mmol)をエタノール(60ml)に溶かし、ホルムアルデヒド(37%水溶液、12.9ml、159.0mmol)を加えた。4時間にわたって還流状態にて撹拌した後、反応物を18時間にわたって室温にて放置した。溶媒を真空中で除去し、残渣を、ジクロロメタン(150ml)と水(80mL)の間で分配した。水相を分離し、追加のジクロロメタン(80ml)で抽出した。合わせた有機層を食塩水(100ml)で洗浄し、硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去すると、55%収率で黄色の油として表題化合物、12.2gが得られた。
1H NMR
(400 MHz, クロロホルム-d) δ = 1.75
(m, 4H), 2.70 (m, 4H), 5.13 (s, 2H), 7.94 (s, 1H), 8.13 (s, 1H) ppm.
【0220】
調製17
シクロヘキシル(フェニル)[1−(ピロリジン−1−イルメチル)−1H−1,2,4−トリアゾール−5−イル]メタノール
【0221】
【化48】

1−(ピロリジン−1−イルメチル)−1H−1,2,4−トリアゾール(調製16、12.0g、78.84mmol)をテトラヒドロフラン(120mL)に溶かし、溶液を−78℃まで冷却した。次いで、n−ブチルリチウム(ヘキサン中2.5M、34.7ml、86.7mmol)を30分かけて滴下添加した。室温まで温め、1時間にわたって撹拌した後、反応混合物を−78℃まで冷却し、テトラヒドロフラン(30mL)中のシクロヘキシル(フェニル)メタノン(16.3g、86.7mmol)の溶液を滴下添加した。18時間かけて室温まで温めた後、水(100ml)を加え、溶媒を真空中で除去した。残渣を酢酸エチル(200ml)で分配し、水相を分離し、酢酸エチル(2×200ml)で再抽出した。合わせた有機層を硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去すると、100%収率で黄色の油として表題化合物、27.28gが得られた。
1H NMR
(400 MHz, クロロホルム-d) δ =
1.00-1.94 (m, 14H), 2.49 (m 1H), 2.71 (m, 4H), 5.08 (s, 2H), 7.19 (m, 1H), 7.30
(m, 2H), 7.72 (m, 2H), 8.00 (s, 1H) ppm.
【0222】
調製18
シクロヘキシル(フェニル)1H−1,2,4−トリアゾール−3−イルメタノール
【0223】
【化49】

シクロヘキシル(フェニル)[1−(ピロリジン−1−イルメチル)−1H−1,2,4−トリアゾール−5−イル]メタノール(調製17、27.28g、80.12mmol)をエタノール(400ml)に溶かし、水素化ホウ素ナトリウム(3.03g、80.1mmol)を少しずつ加えた。3時間にわたって還流状態にて撹拌した後、反応物を、18時間かけて室温まで冷却した。溶媒を真空中で除去し、残渣を、ペンタン:酢酸エチル(3:1〜0:1、体積比)で溶出するシリカゲル上のカラムクロマトグラフィーにより精製すると、79%収率で白色の泡として表題化合物、16.4gが得られた。
LRMS: APCI ESI m/z 256 [M-H]-1H
NMR (400 MHz, クロロホルム-d) δ =
0.90-1.80 (m, 10H), 2.46 (m 1H), 7.25 (m, 1H), 7.33 (m, 2H), 7.67 (m, 2H), 8.00
(s, 1H) ppm.
【0224】
調製19
tert−ブチル−4−({3−[シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−カルボキシレート
【0225】
【化50】

表題化合物を、調製3に記載されているのと同じ方法を使用してシクロヘキシル(フェニル)1H−1,2,4−トリアゾール−3−イルメタノール(調製18、500mg、1.94mmol)およびtert−ブチル4−(ブロモメチル)ピペリジン−1−カルボキシレート(649mg、2.33mmol)から調製すると、47%収率で透明な油、415mgが得られた。
LRMS: APCI ESI m/z 381 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.05-1.45 (m, 9H), 1.43 (s, 9H), 1.52 (m, 2H), 1.67 (m, 3H), 2.09
(m, 1H), 2.38 (m, 1H), 2.72 (m, 2H), 4.08 (m, 4H), 7.17 (m, 1H), 7.26 (m, 2H),
7.58 (d, 2H), 8.30 (s, 1H) ppm.
【0226】
調製20
シクロヘキシル(フェニル)[1−(ピペリジン−4−イルメチル)−1H−1,2,4−トリアゾール−3−イル]メタノール
【0227】
【化51】

表題化合物を、調製4に記載されているのと同じ方法を使用してtert−ブチル−4−({3−[シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−カルボキシレート(調製19、450mg、0.990mmol)から調製すると、91%収率で透明な油、320mgが得られた。
LRMS: APCI ESI m/z 378 [M+Na]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.04-1.35 (m, 9H), 1.39-1.55 (m, 2H), 1.59-1.75 (m, 3H), 2.03(m,
1H), 2.38 (m, 1H), 2.5 (m, 2H), 3.01 (m, 2H), 4.05 (d, 2H), 7.15 (m, 1H), 7.27
(m, 2H), 7.58 (d, 2H), 8.31 (s, 1H) ppm.
【0228】
調製21
ジ−tert−ブチル{9−[4−({3−[シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)−ピペリジン−1−イル]ノニル}イミドジカーボネート
【0229】
【化52】

表題化合物を、調製5に記載されているのと同じ方法を使用してシクロヘキシル(フェニル)[1−(ピペリジン−4−イルメチル)−1H−1,2,4−トリアゾール−3−イル]メタノール(調製20、300mg、0.846mmol)およびジ−tert−ブチル(9−ブロモノニル)イミドジカーボネート(US04167167、357mg、0.846mmol)から調製すると、61%収率で白色の泡、360mgが得られた。
LRMS: APCI ESI m/z 696 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.14 (m, 4H), 1.23 - 1.37 (m, 18H) 1.46-1.60 (m, 24H) 1.68 (m,
2H) 1.96 (m, 2H) 2.33 (m, 2H) 2.95(m, 2H) 3.55 (m, 2H) 4.07 (m, 2H) 7.16 (m,
1H) 7.26 (m, 2H) 7.58 (m, 2H) 8.31 (s, 1H) ppm.
【0230】
調製22
(1−{[1−(9−アミノノニル)ピペリジン−4−イル]メチル}−1H−1,2,4−トリアゾール−3−イル)(シクロヘキシル)フェニルメタノール
【0231】
【化53】

表題化合物を、調製6に記載されているのと同じ方法を使用してジ−tert−ブチル{9−[4−({3−[シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}イミドジカーボネート(調製21、360mg、0.57mmol)から調製すると、90%収率で透明な油、230mgが得られた。
LRMS: APCI m/z 496 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.12 (m, 4H), 1.22-1.39 (m, 18H), 1.39-1.58 (m, 6H), 1.64 (m,
2H), 1.94 (m, 2H), 2.31 (m, 2H), 2.65 (m, 2H), 2.93 (m, 2H), 4.06 (d, 2H), 7.16
(m, 1H), 7.25 (m, 2H), 7.58 (d, 2H), 8.31 (s, 1H) ppm.
【0232】
調製23
8−(ベンジルオキシ)−5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−({9−[4−({3−[シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}−アミノ)エチル]キノリン−2(1H)−オン
【0233】
【化54】

表題化合物を、調製7に記載されているのと同じ方法を使用して(1−{[1−(9−アミノノニル)ピペリジン−4−イル]メチル}−1H−1,2,4−トリアゾール−3−イル)(シクロヘキシル)フェニルメタノール(調製22、150mg、0.303mg)および8−(ベンジルオキシ)−5−[(1R)−2−ブロモ−1−{[tert−ブチル(ジメチル)シリル]オキシ}エチル]キノリン−2(1H)−オン(WO05/09286、148mg、0.303mmol)から調製すると、24%収率で透明な油、66mgが得られた。
LRMS: APCI m/z 904 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 0.07 (s, 3H), 0.37 (s, 3H), 1.15 (s, 9H), 1.32-1.65(m, 22H), 1.76
(m, 6H), 1.92 (m, 2H), 2.20 (m, 2H), 2.58 (m, 2H), 2.86 (m, 2H), 3.01 (m, 1H),
3.19 (m, 3H), 4.35 (m, 2H), 5.52 (m, 1H), 5.61 (s, 2H), 6.95 (d, 1H), 7.4-7.69
(m, 8H), 7.79 (m, 2H), 7.86 (m, 2H), 8.59 (s, 1H), 8.74 (d, 1H) ppm.
【0234】
調製24
5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−({9−[4−({3−[シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]−8−ヒドロキシキノリン−2(1H)−オン
【0235】
【化55】

表題化合物を、調製8に記載されているのと同じ方法を使用して8−(ベンジルオキシ)−5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−({9−[4−({3−[シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]キノリン−2(1H)−オン(調製23、60mg、0.066mmol)から調製すると、70%収率で透明なガラス、38mgが得られた。
LRMS: ESI m/z 813 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 0.05 (s, 3H), 0.35 (s, 3H), 1.16 (s, 9H), 1.35- 1.62 (m, 22H),
1.68-1.85 (m, 6H), 1.85-2.02 (m, 2H), 2.22 (m, 2H), 2.63 (m, 2H), 2.90 (m, 2H),
3.04 (m, 1H), 3.23 (m, 3H), 4.34 (m, 2H), 5.47 (m, 1H), 6.87 (d, 1H), 7.19 (d,
1H), 7.42 (m, 2H), 7.53 (m, 2H), 7.85 (m, 2H), 8.58 (s, 1H), 8.70 (d, 1H) ppm.
【0236】
調製25
ベンジル4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−カルボキシレート
【0237】
【化56】

ベンジル4−(ブロモメチル)ピペリジン−1−カルボキシレート(5g、16mmol)をジメチルホルムアミド(40ml)に溶かし、ジフェニル−(1H−[1,2,4]トリアゾール−3−イル)−メタノール(Tetrahedron:Asymmetry、8(9)、1491〜1500;1997;3.35g、13.65mmol)と、続いて、炭酸カリウム(3.69g、26.7mmol)を加えた。18時間にわたって70℃にて撹拌した後、溶媒を真空中で除去し、残渣を、酢酸エチル(150ml)と水(150mL)の間で分配した。有機層を分離し、硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去すると、81%収率で白色の固体として表題化合物、5.2gが得られた。
1H NMR
(400 MHz, クロロホルム-d) δ =
1.11-1.40 (m, 5H), 1.50-1.77 (m, 2H), 2.75 (m, 2H), 4.20 (m, 2H), 5.09(m, 2H),
7.23-7.46 (m, 15H), 8.01 (s, 1H) ppm.
【0238】
調製26
ジフェニル[1−(ピペリジン−4−イルメチル)−1H−1,2,4−トリアゾール−3−イル]メタノール
【0239】
【化57】

ベンジル4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−カルボキシレート(調製25、5.2g、16.78mmol)をエタノール(300ml)に溶かし、ギ酸アンモニウム(6g)および水酸化パラジウム[炭素(湿った)上20wt.%(乾燥ベース)](1g)を加えた。1時間にわたって還流状態にて撹拌した後、反応混合物を室温まで冷却し、arbocel(登録商標)に通して濾過した。溶媒を真空中で除去し、残渣を、ジクロロメタン(500ml)と水(500mL)の間で分配した。水層を分離し、次いで、水酸化ナトリウム水溶液(2N、200ml)で塩基性化し、ジクロロメタン(500ml)で抽出した。次いで、この有機層を硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去した。粗材料をアセトニトリルから再結晶すると、51%収率で白色の固体として表題化合物、1.9gが得られた。
1H NMR
(400 MHz, メタノール-d4) δ = 1.56 (m, 2H), 1.86 (m, 2H), 2.35 (m, 1H), 2.99 (m, 2H), 3.40 (m,
2H), 4.38 (m, 2H), 7.28-7.47 (m, 11H) ppm.
【0240】
調製27
ジ−tert−ブチル{9−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}イミドジカーボネート
【0241】
【化58】

表題化合物を、調製5に記載されているのと同じ方法を使用してジフェニル[1−(ピペリジン−4−イルメチル)−1H−1,2,4−トリアゾール−3−イル]メタノール(調製26、2.00g、5.740mmol)およびジ−tert−ブチル(9−ブロモノニル)イミドジカーボネート(US04167167、2.42g、5.740mmol)から調製すると、43%収率で透明な油、1.7gが得られた。
LRMS: APCI ESI m/z 691 [M+H]+
1H NMR
(400 MHz, クロロホルム-d) δ =
1.18-1.35 (m, 11H), 1.41 (m, 3H), 1.49 (s, 18H), 1.57 (m, 4H), 1.94 (m, 3H),
2.38 (m, 2H) 2.96 (m, 2H) 3.54 (m, 2H), 4.00 (m, 2H) 7.22-7.48 (m, 10H), 7.99
(s, 1H) ppm.
【0242】
調製28
(1−{[1−(9−アミノノニル)ピペリジン−4−イル]メチル}−1H−1,2,4−トリアゾール−3−イル)(ジフェニル)メタノール
【0243】
【化59】

ジ−tert−ブチル{9−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}イミドジカーボネート(調製27、1.7g、2.46mmol)をエタノール(30ml)に溶かし、エーテル中塩化水素(2M、30ml、60mmol)を加えた。18時間にわたって室温にて撹拌した後、溶媒を真空中で除去し、残渣を、ジクロロメタン(200ml)と飽和重炭酸ナトリウム水溶液(200ml)の間で分配した。有機層を分離し、硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去した。残渣を、ジクロロメタン:メタノール:880アンモニア(90:10:1〜80:20:2、体積比)で溶出するシリカゲル上のカラムクロマトグラフィーにより精製すると、60%収率で白色の固体として表題化合物、725mgが得られた。
1H NMR
(400 MHz, メタノール-d4) δ = 1.30 (m, 11H), 1.40-1.62 (m, 7H), 1.93 (m, 3H), 2.28 (m, 2H),
2.61 (m, 2H), 2.94 (m, 2H), 4.09 (m, 2H), 7.20-7.36 (m, 10H), 8.36 (s, 1H) ppm.
【0244】
調製29
8−(ベンジルオキシ)−5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−({9−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]キノリン−2(1H)−オン
【0245】
【化60】

(1−{[1−(9−アミノノニル)ピペリジン−4−イル]メチル}−1H−1,2,4−トリアゾール−3−イル)(ジフェニル)メタノール(調製28、710mg、1.45mmol)および8−(ベンジルオキシ)−5−[(1R)−2−ブロモ−1−{[tert−ブチル(ジメチル)シリル]オキシ}エチル]キノリン−2(1H)−オン(WO200509286、708mg、1.45mmol)をジクロロメタン(5ml)に溶かし、ジメチルスルホキシド(100μl)およびジイソプロピルエチルアミン(253μl)を加えた。48時間にわたって95℃にて密封容器中で撹拌した後、溶媒を真空中で除去した。残渣を、ジクロロメタン:メタノール:880アンモニア(90:10:1、体積比)で溶出するシリカゲル上のカラムクロマトグラフィーにより精製すると、38%収率で透明な油として表題化合物、500mgが得られた。
LRMS:APCI m/z 898[M+H]+
【0246】
調製30
5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−({9−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]−8−ヒドロキシキノリン−2(1H)−オン
【0247】
【化61】

表題化合物を、調製8に記載されているのと同じ方法を使用して8−(ベンジルオキシ)−5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−({9−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]キノリン−2(1H)−オン(調製29、500mg、0.056mmol)から調製すると、59%収率で黄色のガラス、267mgが得られた。
LRMS: ESI m/z 807 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 0.00 (s, 3H), 0.20(s, 3H), 1.00 (s, 9H), 1.06-1.82 (m, 18H), 2.19
(m, 3H), 2.55 (m, 2H), 2.63 (m, 1H), 2.73 (m, 1H ), 3.05 (m, 1H ), 3.13 (m,
1H), 3.25 (m, 2H), 4.17 (m, 2H), 5.22 (m, 1H), 6.78 (m, 2H), 7.13-7.48 (m, 7H),
7.58 (m, 4H), 8.17 (m, 1H), 8.50 (m, 1H) ppm.
【0248】
調製31
2−[2−(4−{2−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]−1H−イソインドール−1,3(2H)−ジオン
【0249】
【化62】

表題化合物を、調製12に記載されているのと同じ方法を使用してジフェニル[1−(ピペリジン−4−イルメチル)−1H−1,2,4−トリアゾール−3−イル]メタノール(調製26、778mg、2.23mmol)および2−{2−[4−(2−ブロモエチル)フェニル]エチル}−1H−イソインドール−1,3(2H)−ジオン(調製11、800mg、2.23mmol)から調製すると、71%収率で白色の固体、1.00gが得られた。
LRMS: ESI m/z 627 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.24-2.03 (m, 7H), 2.54 (m, 2H), 2.75 (m, 2H), 2.97 (m, 4H), 3.88
(m, 2H), 3.99 (m, 2H), 7.10 (m, 2H), 7.20 (m, 2H), 7.29 (m, 7H), 7.44 (m, 3H),
7.70 (m, 2H), 7.82 (m, 2H), 7.99 (s, 1H) ppm.
【0250】
調製32
{1−[(1−{2−[4−(2−アミノエチル)フェニル]エチル}ピペリジン−4−イル)メチル]−1H−1,2,4−トリアゾール−3−イル}(ジフェニル)メタノール
【0251】
【化63】

表題化合物を、調製13に記載されているのと同じ方法を使用して2−[2−(4−{2−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]−1H−イソインドール−1,3(2H)−ジオン(調製31、1.0g、1.59mmol)から調製すると、75%収率で無色の油、790mgが得られた。
LRMS: ESI m/z 497 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.37 (m, 2H) 1.58 (m, 2H) 1.93 (m, 1H) 2.05 (m, 2H) 2.54 (m, 2H)
2.73 (m, 4H) 2.83 (m, 2H) 3.02 (m, 2H) 4.09 (d, 2H) 7.13 (m, 4H) 7.26 (m, 6H)
7.33 (m, 4H), 8.38 (s, 1H) ppm.
【0252】
調製33
8−(ベンジルオキシ)−5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−{[2−(4−{2−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]−アミノ}エチル]キノリン−2(1H)−オン
【0253】
【化64】

表題化合物を、調製7に記載されているのと同じ方法を使用して{1−[(1−{2−[4−(2−アミノエチル)フェニル]エチル}ピペリジン−4−イル)メチル]−1H−1,2,4−トリアゾール−3−イル}(ジフェニル)メタノール(調製32、590mg、1.2mmol)および8−(ベンジルオキシ)−5−[(1R)−2−ブロモ−1−{[tert−ブチル(ジメチル)シリル]オキシ}エチル]キノリン−2(1H)−オン(WO2005/09286、581mg、1.19mmol)から調製すると、67%収率で白色の固体、740mgが得られた。
LRMS: ESI m/z 903 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = -0.28 (s, 3H), -0.04 (s, 3H), 0.76 (s, 9H), 1.38 (m, 2H), 1.59
(m, 2H), 1.92 (m, 1H), 2.05 (m, 2H), 2.54 (m, 2H), 2.69-2.94 (m, 8H), 3.03 (m,
2H), 4.11 (m, 2H), 5.15 (m, 1H), 5.32 (s, 2H), 6.65 (d, 1H), 7.08 (m, 4H), 7.16
(m, 2H), 7.27 (m, 6H), 7.35 (m, 7H), 7.50 (m, 2H), 8.40 (s,2H) ppm.
【0254】
調製34
5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−{[2−(4−{2−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}エチル]−8−ヒドロキシキノリン−2(1H)−オン
【0255】
【化65】

8−(ベンジルオキシ)−5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−{[2−(4−{2−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}エチル]キノリン−2(1H)−オン(調製33、740mg、0.82mmol)、水酸化パラジウム[炭素(湿った)上20wt.%(乾燥ベース)](23mg、0.164mmol)およびメチルシクロヘキシルジエン(methylcyclohexyldiene)(231mg、2.46mmol)をMeOH(20ml)に溶かした。18時間にわたって50℃にて撹拌した後、追加のメチルシクロヘキシルジエン(115.5mg、1.23mmol)を加え、撹拌を、さらに18時間にわたって50℃にて続けた。反応混合物を冷却し、arbocel(登録商標)に通して濾過し、溶媒を真空中で除去すると、87%収率で黄色の固体として表題化合物、580mgが得られた。
LRMS: ESI m/z 814 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = -0.28 (s, 3H), -0.04 (s, 3H), 0.77 (s, 9H), 1.38(m, 2H), 1.60 (m,
2H), 1.92 (m, 1H), 2.07 (m, 2H), 2.57 (m, 2H), 2.70-2.96 (m, 8H), 3.05 (m, 2H),
4.10 (m, 2H), 5.14 (m, 1H), 6.59 (d, 1H), 6.92 (d, 1H), 7.08 (m, 4H), 7.15 (m,
1H), 7.25 (m, 6H), 7.35 (m, 4H), 8.33 (d, 1H), 8.40 (s, 1H) ppm.
【0256】
調製35
メタンスルホン酸2−{4−[2−(1,3−ジオキソ−1,3−ジヒドロ−イソインドール−2−イル)−エチル]−フェニル}−エチルエステル
【0257】
【化66】

メチルエチルケトン(315mL)中の2−{2−[4−(2−ヒドロキシ−エチル)フェニル]−エチル}−イソインドール−1,3−ジオン(調製10、21.0g、71.25mmol)の溶液を0℃まで冷却した。トリエチルアミン(14.9mL、106.87mmol)を加え、続いて、塩化メタンスルホニル(6.07mL、78.37mmol)を滴下添加した。反応物を1時間にわたって0〜4℃にて撹拌し、次いで、室温まで温めた。炭酸カリウムの水溶液(1M、210mL)を加え、混合物を撹拌した。有機層と水層を分離し、水層をメチルエチルケトン(50mL)で再抽出した。合わせた有機層を蒸留により40mLまで濃縮した。tert−ブチルメチルエーテル(300mL)を熱溶液にゆっくりと加え、結晶化を起こさせた。混合物を室温まで冷却し、次いで、72時間にわたって撹拌した。固体を濾過により取り出し、tert−ブチルメチルエーテル(3×25mL)で洗浄した。固体を4時間にわたって45℃にて真空中で乾燥すると、92%収率で淡褐色の固体として表題化合物、24.6gが得られた。
1H NMR
(400MHz, CDCl3) δ = 2.82 (s, 3H), 2.96-3.02
(m, 4H), 3.89-3.93 (t, 2H), 4.37-4.40 (t, 2H), 7.13-7.23 (2xd, 4H), 7.70-7.72
(dd, 2H), 7.81-7.83 (dd, 2H) ppm.
【0258】
調製36
(2R)−シクロヘキシル−ヒドロキシ−フェニル−酢酸
【0259】
【化67】

アセトニトリル(810ml)および水(65ml)中のD−チロシンメチルエステル(90.0g、460mmol)のスラリーに、ラセミの2−シクロヘキシル−2−ヒドロキシ−2−フェニル酢酸(216.0g、921mmol)を加えた。混合物を1時間にわたって還流状態まで加熱し、次いで、一晩にわたって室温まで冷却した。混合物を4時間にわたって4℃までさらに冷却し、次いで、濾過し、冷アセトニトリル(400ml)で洗浄すると、白色の固体(169.9g)が得られた。この固体をメチルtert−ブチルエーテル(1.35L)と0.5M水性塩酸(765ml、1当量)の間で分配した。有機層を分離し、0.5M水性塩酸(380ml、0.5当量)で洗浄し、硫酸ナトリウムで乾燥し、濾過し、溶媒を真空中で除去すると、白色の固体として表題化合物、84.5gが得られた。
LRMS: APCI ESI m/z 233 [M-H]-
1H NMR
(400 MHz, DMSO-d6) δ = 0.95-1.14 (m, 4H), 1.19-1.29 (m,
1H), 1.32-1.42 (m, 1H), 1.49-1.63 (m, 3H), 1.69-1.78 (m, 1H), 2.11-2.19 (m,
1H), 7.21-7.25 (m, 1H), 7.30-7.34 (m, 2H), 7.57-7.60 (m, 2H) ppm.
【実施例】
【0260】
(実施例1)
5−[(1R)−2−({9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン
【0261】
【化68】

5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−({9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]−8−ヒドロキシキノリン−2(1H)−オン(調製8、13.06g、16.06mmol)をメタノール(430ml)に溶かし、フッ化アンモニウム(2.97g、80.3mmol)を加えた。18時間にわたって40℃にて撹拌した後、溶媒を真空中で除去し、残渣をジクロロメタン/メタノール(950ml/50ml)と飽和重炭酸ナトリウム水溶液(500mL)の間で分配した。有機層を分離し、水層をジクロロメタン/メタノール(450ml/50ml)でさらに抽出した。合わせた有機層を硫酸マグネシウムで乾燥し、濾過し、溶媒を真空中で除去した。残渣を、ジクロロメタン:メタノール:880アンモニア(90:10:1、体積比)で溶出するシリカゲル上のカラムクロマトグラフィーにより精製すると、72.3%収率で黄色の泡として表題化合物、8.12gが得られた。
LRMS: ESI m/z 699 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ =: 1.05-1.77 (m, 28H), 1.98 (m, 3H), 2.35 (m, 3H) 2.75 (m, 2H),
2.95 (m, 4H), 4.09 (m, 2H), 5.24 (m, 1H), 6.65 (d, 1H), 6.95 (d, 1H), 7.15-7.27
(m, 4H), 7.60 (m, 2H), 8.33 (s, 1H), 8.38 (d, 1H) ppm.
【0262】
(実施例1a)
5−[(1R)−2−({9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン ナフタレン−1,5−ジスルホン酸塩
【0263】
【化69】

5−[(1R)−2−({9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン(実施例1、2.0g、2.86mmol)をメタノール(15ml)に溶かし、水(3ml)中のナフタレン−1,5−ジスルホン酸(825.0mg、2.86mmol)の溶液を滴下添加した。混合物を一晩にわたって室温にて撹拌した。得られた固体を濾過により取り出し、真空中で乾燥すると、白色の固体2.03gが得られた。この材料50mgをメタノール:水(体積比70:30、1ml)で処理し、得られた懸濁液を70℃まで加熱し、次いで、24時間かけて20℃まで冷却した。固体を濾過により回収し、水で洗浄し、真空中で乾燥すると、結晶性の白色の固体として表題化合物、19mgが得られた。
1H NMR
(400 MHz, DMSO-d) δ =: 0.95-1.70 (m, 28H), 1.96-2.29
(m, 3H), 2.71-3.13 (m, 7H), 3.42 (m, 2H), 4.07 (m, 2H), 5.30 (m, 1H), 6.58 (d,
1H), 6.95 (d, 1H), 7.13 (m, 2H), 7.23 (m, 2H), 7.41 (m, 2H), 7.56 (m, 2H), 7.92
(m, 2H), 8.17 (d, 1H), 8.42 (s, 1H ), 8.89 (d, 2H) ppm.
【0264】
(実施例2)
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン
【0265】
【化70】

表題化合物を、実施例1に記載されているのと同じ方法を使用して5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}エチル]−8−ヒドロキシキノリン−2(1H)−オン(調製15、2.30g、2.81mmol)から調製すると、77%収率で黄色の固体、1.40gが得られた。
LRMS: ESI m/z 705[M+H]+
1H NMR
(400 MHz, メタノール-d4) δ= 1.08-1.48 (m, 9H), 1.48-1.81 (m, 5H), 1.94 (m, 1H), 2.08 (m, 2H),
2.38 (m, 1H), 2.54 (m, 2H), 2.66-2.97 (m, 8H), 3.04 (m, 2H), 4.07 (d, 2H), 5.18
(m, 1H), 6.61 (d, 1H), 6.92 (d, 1H), 7.07 (m, 4H), 7.15 (m, 2H), 7.25 (m, 2H),
7.56 (d, 2H), 8.31 (m, 2H) ppm.
【0266】
(実施例2a)
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン ナフタレン−1,5−ジスルホン酸塩
【0267】
【化71】

5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン(実施例2、935mg、1.33mmol)をメタノール(10mL)に溶かした。メタノール(5mL)中の1,5−ナフタレンジスルホン酸四水和物(478mg、1.33mmol)の溶液を加え、形成した沈殿を、水(5mL)を加えて加熱することにより再び溶かした。得られた溶液を真空中で蒸発させ、メタノール(50mL)中に再懸濁し、30秒にわたって還流状態まで加熱した。上清を残渣からデカントし、残渣をメタノール(50mL)中に再懸濁し、4日にわたって撹拌しながら還流状態にて加熱した。得られた沈殿を濾過により集め、真空下で乾燥すると、無色の結晶性固体として表題化合物、990mgが得られた。
1H NMR
(400 MHz, DMSO-d6) δ = 0.94-1.49 (m, 8H),
1.50-1.74 (m, 6H), 1.99-2.12 (m, 1H), 2.19-2.27 (m, 1H), 2.83-3.01 (m, 6H),
3.04-3.24 (m, 6H), 3.49-3.59 (m, 2H), 4.05-4.11 (d, 2H), 5.07 (s, 1H),
5.30-5.36 (m, 1H), 6.14-6.19 (d, 1H), 6.57-6.59 (d, 1H), 6.97-6.99 (d, 1H),
7.12-7.19 (m, 6H), 7.24-7.28 (t, 2H), 7.39-7.43 (t, 2H), 7.56-7.58 (d, 2H),
7.94-7.96 (d, 2H), 8.15-8.18 (d, 1H), 8.45 (s, 1H), 8.59-8.74 (bm, 2H),
8.88-8.90 (d, 2H), 9.04-9.19 (bm, 1H), 10.41 (s, 1H), 10.45 (s, 1H) ppm.
【0268】
上に記載されているプロセスにより製造される結晶性形態(形態1)は、図1/1の対応する粉末X線回折パターンにおいて示される特徴も有する。主な特徴的ピークは、12.7、18.1、21.0、22.2および23.6°2θ±0.1°2θにあり、下の表1でさらに示す。
【0269】
【表1】

【0270】
(実施例2b)
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン コハク酸塩
【0271】
【化72】

5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン(実施例2、50mg、0.07mmol)をメタノール(4mL)に溶かした。メタノール(1mL)中のコハク酸(8.4mg、0.07mmol)の溶液を加え、得られた濁った溶液を一晩にわたって放置して蒸発させた。得られたガムを、加熱しながらエタノール(2.5mL)および水(2.5mL)に再び溶かし、次いで、一晩にわたって撹拌しながら室温まで冷却した。得られた沈殿を濾過により集め、真空下で乾燥すると、無色の結晶性の固体として表題化合物、28mgが得られた。
1H NMR
(400 MHz, DMSO-d6) δ = 0.97-1.85 (m, 15H),
1.88-1.93 (m, 2H), 2.19-2.25 (m, 1H), 2.34 (s, 4H), 2.44-2.47 (m, 2H),
2.64-2.68 (m, 2H), 2.71-2.75 (m, 2H), 2.84-2.93 (m, 6H), 4.02 (d, 2H),
5.10-5.13 (m, 1H), 6.52 (d, 1H), 6.93 (d, 1H), 7.07-7.16 (m, 6H), 7.25 (t, 2H),
7.56 (d, 2H), 8.15 (d, 1H), 8.38 (s, 1H) ppm.
【0272】
(実施例2c)
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン フマル酸塩
【0273】
【化73】

5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン(実施例2、50mg、0.07mmol)をメタノール(4mL)に溶かした。メタノール(1mL)中のフマル酸(8.2mg、0.07mmol)の溶液を加え、得られた濁った溶液を一晩にわたって放置して蒸発させた。得られたガムを、加熱しながらエタノール(2.5mL)および水(2.5mL)に再び溶かし、次いで、一晩にわたって撹拌しながら室温まで冷却した。得られた沈殿を濾過により集め、真空下で乾燥すると、無色の結晶性の固体として表題化合物、38mgが得られた。
1H NMR
(400 MHz, DMSO-d6) δ = 0.99-1.84 (m, 15H),
1.91-1.98 (m, 2H), 2.18-2.24 (m, 1H), 2.46-2.49 (m, 2H), 2.65-2.69 (m, 2H),
2.78-2.82 (m, 2H), 2.90-3.02 (m, 6H), 4.03 (d, 2H), 5.19-5.22 (m, 1H), 6.51 (m,
3H), 6.95 (d, 1H), 7.09-7.16 (m, 6H), 7.23-7.27 (m, 2H), 7.56 (d, 2H), 8.18 (d,
1H), 8.39 (s, 1H) ppm.
【0274】
(実施例3)
5−[(1R)−2−({9−[4−({3−[シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン
【0275】
【化74】

表題化合物を、実施例1に記載されているのと同じ方法を使用して5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−({9−[4−({3−[シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]−8−ヒドロキシキノリン−2(1H)−オン(調製24、18mg、0.022mmol)から調製すると、65%収率で透明なガラス、10mgが得られた。
LRMS:APCI ESI m/z 699 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ =: 1.07-1.76 (m, 30H), 1.98 (m, 2H), 2.36 (m, 2H), 2.75 (m, 2H),
2.95 (m, 4H), 4.07 (m, 2H), 5.24 (m, 1H), 6.65 (d, 1H), 6.95 (d, 1H), 7.12-7.28
(m, 4H), 7.58 (m, 2H), 8.31 (s, 1H), 8.37 (d, 1H) ppm.
【0276】
(実施例4)
8−ヒドロキシ−5−[(1R)−1−ヒドロキシ−2−({9−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]キノリン−2(1H)−オン
【0277】
【化75】

表題化合物を、実施例1に記載されているのと同じ方法を使用して5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−({9−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]−8−ヒドロキシキノリン−2(1H)−オン(調製30、260mg、0.322mmol)から調製すると、49%収率で黄色のガラス、110mgが得られた。
LRMS:APCI ESI m/z 693 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ =: 1.24-1.39 (m, 12H), 1.42-1.62 (m, 6H), 1.87-2.03 (m, 3H), 2.34
(m, 2H), 2.74 (m, 2H), 2.93 (m, 4H), 4.07 (m, 2H), 5.24 (m, 1H), 6.63 (d, 1H),
6.95 (d, 1H), 7.17-7.30 (m, 7H), 7.30-7.37 (m, 4H), 8.35 (m, 2H) ppm.
【0278】
(実施例5)
8−ヒドロキシ−5−[(1R)−1−ヒドロキシ−2−{[2−(4−{2−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}エチル]キノリン−2(1H)−オン
【0279】
【化76】

表題化合物を、実施例1に記載されているのと同じ方法を使用して5−[(1R)−1−{[tert−ブチル(ジメチル)シリル]オキシ}−2−{[2−(4−{2−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}エチル]−8−ヒドロキシキノリン−2(1H)−オン(調製34、580mg、0.71mmol)から調製すると、60%収率で黄色の固体、300mgが得られた。
LRMS:APCI ESI m/z 699 [M+H]+
1H NMR
(400 MHz, メタノール-d4) δ = 1.37(m, 2H), 1.58 (m, 2H), 1.91 (m, 1H), 2.07 (m, 2H), 2.54 (m,
2H), 2.82 (m, 8H), 3.04 (m, 2H), 4.11 (m, 2H), 5.18 (m, 1H), 6.62 (d, 1H), 6.92
(d, 1H), 7.05 (m, 4H), 7.15 (m, 1H), 7.25 (m, 6H), 7.34 (m, 4H), 8.33 (d, 1H),
8.38 (s, 1H) ppm.
【0280】
ヒト組換えM3ムスカリン性受容体における結合親和性評価
膜調製
ヒトムスカリン性M3受容体を組換えにより発現するCHO(チャイニーズハムスター卵巣)細胞からの細胞ペレットを20mM HEPES(pH7.4)中でホモジネートし、4℃にて20分にわたって48000×gにて遠心分離した。ペレットを、緩衝液中に再懸濁し、ホモジネートおよび遠心分離ステップを繰り返した。得られたペレットを、元の濃縮細胞体積1ml当たり緩衝液1ml中に再懸濁し、ホモジネートステップを繰り返した。タンパク質推定を懸濁液に対して行い、約1mg/mlのアリコート1mlを−80℃にて凍結させた。
【0281】
hM3競合結合アッセイプロトコル
膜(5μg/ウェル)を、1mlのポリスチレン96ウェルディープウェルブロック中でRT(室温)にて24時間にわたって3H−NMS(濃度5×KDにて)+/−試験化合物と共にインキュベートした。最終アッセイ体積は、+/−試験化合物20μl;3H−NMS(Perkin Elmer NEN636)20μlおよび膜溶液160μlからなる200μlとした。全結合は、0.1%DMSOで定義し、非特異的結合は、1μMアトロピンで定義した。アッセイ緩衝液は、20mM Hepes(pH7.4)とした。
【0282】
すべてのアッセイ構成成分が添加されたら、プレートを覆い、振盪しながら24時間にわたって室温にてインキュベートした。アッセイは、Packardフィルターメートハーベスターを使用し、0.5%ポリエチレンイミンに予め浸しておいたGF/B Unifilterプレートに通して素早く濾過することにより終了させ、次いで、フィルタープレートを、4℃のアッセイ緩衝液3×1mlで洗浄した。フィルタープレートを1時間にわたって45℃にて乾燥した。フィルタープレートの底部を密封し、Microscint「0」50μl/ウェルを加え、プレートの上部をTopsealで密封した。90分後、プレートを、NXT Topcountで読み取った(ウェル当たり読取り時間1分)。
【0283】
得られたデータは、特異的結合(特異的結合=全結合−非特異的結合)の割合として表された。特異的結合率対試験化合物濃度をプロットし、社内データ解析プログラムを使用してシグモイド曲線からIC50を決定した。IC50値は、Cheng−Prussoff式
【0284】
【数1】

(ここで、IC50は、特異的放射性リガンド結合を50%阻害する非標識薬物の濃度であり、[L]は、遊離放射性リガンド濃度であり、KDおよびKiは、それぞれ放射性リガンドおよび非標識薬物の平衡解離定数である)に当てはめることによりKi値に補正した。
【0285】
hβ2受容体を発現するCHO細胞における全細胞cAMPアッセイを使用する作動薬効力および有効性の機能評価
細胞培養
ヒトアドレナリン作動性β2受容体を組換えにより発現するCHO(チャイニーズハムスター卵巣)細胞を、10%ウシ胎児血清(FBS:Sigma F4135)、10μg/mlピューロマイシン(Sigma P8833)、0.1mg/mlジェネティシンG418(Sigma G7034)および2mM L−グルタミン(Sigma G7513)を含有するF12:DMEM(Gibco 21331−020)からなる増殖培地中に維持した。細胞を、5%CO2を含有する雰囲気中、37℃にて無菌条件中に保った。
【0286】
hβ2cAMPアッセイプロトコル
細胞が80〜90%の密集度に達したら、トリプシン0.25%(Sigma T4049)を使用して5%CO2を含有する雰囲気中で37℃にて5分にわたって細胞と共にインキュベートしてアッセイ用の細胞を収集した。剥離した細胞を、温めた増殖培地(上に記載されている組成)中に集め、アッセイ培地(1%ウシ胎児血清(FBS:Sigma F4135)および2mM L−グルタミン(Sigma G7513)を含有するF12:DMEM(Gibco 21331−020))中に再懸濁して、0.25×106細胞/mlの生細胞濃度とした。この懸濁液100μlを、組織培養処理した96ウェルビュープレート(PerkinElmer 6005181)の各ウェルに加え、プレートを、一晩にわたって37℃にて5%CO2を含有する雰囲気中でインキュベートした。翌日、細胞をリン酸緩衝溶液(PBS)で洗浄した(4×200μl、Skatron Skanstacker 300)。次いで、プレートを軽くたたいて水気を取り、培地を、50μl PBS+0.5mMイソブチルメチルキサンチン(IBMX)(Sigma I5879)で置き換えた後、30分にわたってインキュベーターに戻した。PBSプレート洗浄手順を繰り返し、続いて、50μl PBS+0.5mM IBMXおよび50μl PBS+2%DMSOを加え、プレートを、30分にわたってインキュベーターに戻した。試験化合物の濃度範囲は、2%DMSOを含有するPBS中で調製した。PBSプレート洗浄手順を繰り返し、次いで、50μl PBS+0.5mM IBMXをアッセイプレートに加え、続いて、各化合物試験濃度50μlを適切なウェルに加えた。2%DMSOまたは200nMフォルモテロールのウェル当たり50μlを対照ウェルに加え、1%DMSOまたは100nMフォルモテロールの最終アッセイ濃度を得た。プレートを、さらに30分にわたってインキュベーターに戻した。インキュベーション時間の終了時に、PBSプレート洗浄手順を、上に記載されているように最後に繰り返した。プレートを軽くたたいて水気を取り、PBSウェル当たり30μlと、続いて、cAMP II ED/Substrateミックスウェル当たり40μlおよびcAMP II EA−Ab/lysisミックスウェル当たり40μl(DiscoverX 90−0034−03)を加えた。次いで、プレートを、室温にて最低4時間にわたって暗所でインキュベートした。プレートを、Fusionプレートリーダーを使用して読み取った(発光プロトコル、各ウェルを1秒にわたって読み取った)。濃度効果曲線をプロットし、EC50およびEmax値を、社内データ解析プログラムを使用して作成された4−パラメーターシグモイドフィットを使用して決定した。フォルモテロールおよびサルメテロールを、参照標準としてすべてのアッセイで実行した。
【0287】
このようにして、上のアッセイで試験された本発明による式(1)の化合物は、下の表に列挙されているようにhβ2受容体作動薬活性およびhM3受容体拮抗薬活性を示すことが判明した。
【0288】
【表2】

【特許請求の範囲】
【請求項1】
一般式(1)
【化1】

(式中、
Aは、
【化2】

(式中、*は、ヒドロキシを保有する炭素とのAの接続点を表す)から選択され、
Xは、−(CH2)m−(mは、7〜12(両端を含む)の整数である)であるか、式
【化3】

であり、
Yは、
【化4】

(式中、**および***は、接続点を表し、**は、Xと連結している)から選択され、
nは、0または1であり、
R1は、シクロペンチル、シクロヘキシル、フェニル、フラニルおよびチオフェニルから選択され、
R2は、フェニル、フラニルおよびチオフェニルから選択される)の化合物、もしくは薬学的に許容できるその塩、または薬学的に許容できる前記化合物もしくは塩の溶媒和物。
【請求項2】
Aが、式
【化5】

(式中、*は、ヒドロキシルを保有する炭素とのAの接続点を表す)である、請求項1に記載の化合物、もしくは薬学的に許容できるその塩または薬学的に許容できる前記化合物もしくは塩の溶媒和物。
【請求項3】
Xが、−(CH2)9−であるか、式
【化6】

である、請求項1または2に記載の化合物、もしくは薬学的に許容できるその塩または薬学的に許容できる前記化合物もしくは塩の溶媒和物。
【請求項4】
Xが、式
【化7】

(式中、**および***は、接続点を表し、**は、Xと連結している)である、請求項1から3のいずれか一項に記載の化合物、もしくは薬学的に許容できるその塩または薬学的に許容できる前記化合物もしくは塩の溶媒和物。
【請求項5】
R1が、フェニルまたはシクロヘキシルである、請求項1から4のいずれか一項に記載の化合物、もしくは薬学的に許容できるその塩または薬学的に許容できる前記化合物もしくは塩の溶媒和物。
【請求項6】
R2が、フェニルである、請求項1から5のいずれか一項に記載の化合物、もしくは薬学的に許容できるその塩または薬学的に許容できる前記化合物もしくは塩の溶媒和物。
【請求項7】
nが、1である、請求項1から6のいずれか一項に記載の化合物、もしくは薬学的に許容できるその塩または薬学的に許容できる前記化合物もしくは塩の溶媒和物。
【請求項8】
Aが、式
【化8】

(式中、*は、ヒドロキシを保有する炭素とのAの接続点を表す)であり、
Xが、−(CH2)9−であるか、式
【化9】

であり、
Yが、式
【化10】

(式中、**および***は、接続点を表し、**は、Xと連結している)であり、
nが、1であり、
R1が、シクロヘキシルまたはフェニルであり、R2が、フェニルである、請求項1に記載の化合物、もしくは薬学的に許容できるその塩または薬学的に許容できる前記化合物もしくは塩の溶媒和物。
【請求項9】
5−[(1R)−2−({9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン、
5−[(1R)−2−({9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン ナフタレン−1,5−ジスルホン酸塩、
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン、
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン ナフタレン−1,5−ジスルホン酸塩、
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン コハク酸塩、
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン フマル酸塩、
5−[(1R)−2−({9−[4−({3−[シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン、
8−ヒドロキシ−5−[(1R)−1−ヒドロキシ−2−({9−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]キノリン−2(1H)−オン、および
8−ヒドロキシ−5−[(1R)−1−ヒドロキシ−2−{[2−(4−{2−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}エチル]キノリン−2(1H)−オン
からなる群から選択される、請求項1に記載の化合物。
【請求項10】
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン ナフタレン−1,5−ジスルホン酸塩である、請求項1に記載の化合物。
【請求項11】
少なくとも有効量の請求項1から10のいずれか一項に記載の式(1)の化合物もしくは薬学的に許容できるその塩または薬学的に許容できる前記化合物もしくは塩の溶媒和物を含む医薬組成物。
【請求項12】
医薬品として使用するための、請求項1から10のいずれか一項に記載の式(1)の化合物もしくは薬学的に許容できるその塩または薬学的に許容できる前記化合物もしくは塩の溶媒和物。
【請求項13】
・あらゆるタイプ、病因、または病原の喘息、特に、アトピー性喘息、非アトピー性喘息、アレルギー性喘息、アトピー性気管支IgE−仲介性喘息、気管支喘息、本態性喘息、真正喘息、病態生理学的かく乱により引き起こされる内因性喘息、環境要因により引き起こされる外因性喘息、知られていないまたは明らかでない原因の本態性喘息、非アトピー性喘息、気管支喘息、気腫性喘息、運動誘発性喘息、アレルゲン誘発性喘息、冷気誘発性喘息、職業喘息、細菌、真菌、原虫、またはウイルス感染症により引き起こされる感染型喘息、非アレルギー性喘息、初発性喘息、喘鳴乳児症候群および細気管支炎からなる群から選択されるメンバーである喘息、
・慢性または急性気管支収縮、慢性気管支炎、末梢気道閉塞、および気腫、
・あらゆるタイプ、病因または病原の閉塞性または炎症性気道疾患、特に、慢性好酸球性肺炎、慢性閉塞性肺疾患(COPD)、慢性気管支炎を包含するCOPD、COPDに関連した、もしくは関連しない肺気腫もしくは呼吸困難、不可逆的進行性気道閉塞を特徴とするCOPD、成人呼吸窮迫症候群(ARDS)、他の薬物療法の結果として生じる気道過敏性の悪化および肺性高血圧に関連した気道疾患からなる群から選択されるメンバーである閉塞性または炎症性気道疾患、
・あらゆるタイプ、病因または病原の気管支炎、特に、急性気管支炎、急性喉頭気管気管支炎、アラキン酸気管支炎、カタル性気管支炎、クループ性気管支炎、乾性気管支炎、感染性喘息性気管支炎、湿咳性気管支炎、ブドウ球菌性または連鎖球菌性気管支炎および肺胞性気管支炎からなる群から選択されるメンバーである気管支炎、
・急性肺傷害、
・あらゆるタイプ、病因または病原の気管支拡張症、特に、円柱状気管支拡張症、嚢状気管支拡張症、紡錘状気管支拡張症、毛細管性気管支拡張症、嚢胞状気管支拡張症、乾性気管支拡張症および濾胞性気管支拡張症からなる群から選択されるメンバーである気管支拡張症
からなる群から選択される疾患、障害、および状態を治療するのに使用するための、請求項1から10のいずれか一項に記載の式(1)の化合物もしくは薬学的に許容できるその塩または薬学的に許容できる前記化合物もしくは塩の溶媒和物。
【請求項14】
請求項1から10のいずれか一項に記載の化合物、もしくは薬学的に許容できるその塩または薬学的に許容できる前記化合物もしくは塩の溶媒和物と、
(a)5−リポキシゲナーゼ(5−LO)阻害薬または5−リポキシゲナーゼ活性化タンパク質(FLAP)拮抗薬、
(b)LTB4、LTC4、LTD4、およびLTE4の拮抗薬を包含するロイコトリエン拮抗薬(LTRA)、
(c)H1およびH3拮抗薬を包含するヒスタミン受容体拮抗薬、
(d)鼻充血除去薬使用のためのα1−およびα2−アドレナリン受容体作動薬血管収縮交感神経様作用薬、
(e)PDE阻害薬、例えば、PDE3、PDE4およびPDE5阻害薬、
(f)β2受容体作動薬、
(g)ムスカリン性M3受容体拮抗薬または抗コリン作動薬、
(h)β2作動薬およびムスカリンM3受容体拮抗薬として活性なデュアル化合物、
(i)テオフィリン、
(j)クロモグリク酸ナトリウム、
(k)COX阻害薬、非選択的および選択的なCOX−1またはCOX−2阻害薬(NSAID)、
(l)プロスタグランジン受容体拮抗薬およびプロスタグランジン合成酵素の阻害薬、
(m)経口および吸入グルココルチコステロイド、
(n)コルチコイド受容体の解離性作動薬(DAGR)、
(o)内因性炎症性物質に対して活性なモノクローナル抗体、
(p)抗腫瘍壊死因子(抗TNF−α)薬、
(q)VLA−4拮抗薬を包含する接着分子阻害薬、
(r)キニン−B1−およびB2−受容体拮抗薬、
(s)IgE経路の阻害薬およびシクロスポリンを包含する免疫抑制薬、
(t)マトリックスメタロプロテアーゼ(MMP)の阻害薬、
(u)タキキニンNK1、NK2およびNK3受容体拮抗薬、
(v)エラスターゼ阻害薬などのプロテアーゼ阻害薬、
(w)アデノシンA2a受容体作動薬およびA2b拮抗薬、
(x)ウロキナーゼの阻害薬、
(y)D2作動薬などのドーパミン受容体に作用する化合物、
(z)IKK阻害薬などのNFκβ経路のモジュレーター、
(aa)p38MAPキナーゼ、PI3キナーゼ、JAKキナーゼ、sykキナーゼ、EGFRまたはMK−2などのサイトカインシグナル伝達経路のモジュレーター、
(bb)粘液溶解薬または鎮咳薬として分類することができる薬剤、
(cc)吸入コルチコステロイドに対する応答を亢進する薬剤、
(dd)気道にコロニーを形成することができる微生物に対して有効な抗生物質および抗ウイルス薬、
(ee)HDAC阻害薬、
(ff)CXCR2拮抗薬、
(gg)インテグリン拮抗薬、
(hh)ケモカイン、
(ii)上皮ナトリウムチャネル(ENaC)遮断薬または上皮ナトリウムチャネル(ENaC)阻害薬、
(jj)P2Y2作動薬および他のヌクレオチド受容体作動薬、
(kk)トロンボキサンの阻害薬、
(ll)PGD2合成およびPGD2受容体(DP1およびDP2/CRTH2)の阻害薬、
(mm)ナイアシン、ならびに
(nn)VLAM、ICAM、およびELAMを包含する接着因子
から選択される他の1つまたは複数の治療薬との組合せ。
【請求項15】
式
【化11】

(式中、pおよびqは、1または2から独立して選択され、n、R1およびR2は、請求項1に定義されている通りである)の化合物。
【請求項1】
一般式(1)
【化1】

(式中、
Aは、
【化2】

(式中、*は、ヒドロキシを保有する炭素とのAの接続点を表す)から選択され、
Xは、−(CH2)m−(mは、7〜12(両端を含む)の整数である)であるか、式
【化3】

であり、
Yは、
【化4】

(式中、**および***は、接続点を表し、**は、Xと連結している)から選択され、
nは、0または1であり、
R1は、シクロペンチル、シクロヘキシル、フェニル、フラニルおよびチオフェニルから選択され、
R2は、フェニル、フラニルおよびチオフェニルから選択される)の化合物、もしくは薬学的に許容できるその塩、または薬学的に許容できる前記化合物もしくは塩の溶媒和物。
【請求項2】
Aが、式
【化5】

(式中、*は、ヒドロキシルを保有する炭素とのAの接続点を表す)である、請求項1に記載の化合物、もしくは薬学的に許容できるその塩または薬学的に許容できる前記化合物もしくは塩の溶媒和物。
【請求項3】
Xが、−(CH2)9−であるか、式
【化6】

である、請求項1または2に記載の化合物、もしくは薬学的に許容できるその塩または薬学的に許容できる前記化合物もしくは塩の溶媒和物。
【請求項4】
Xが、式
【化7】

(式中、**および***は、接続点を表し、**は、Xと連結している)である、請求項1から3のいずれか一項に記載の化合物、もしくは薬学的に許容できるその塩または薬学的に許容できる前記化合物もしくは塩の溶媒和物。
【請求項5】
R1が、フェニルまたはシクロヘキシルである、請求項1から4のいずれか一項に記載の化合物、もしくは薬学的に許容できるその塩または薬学的に許容できる前記化合物もしくは塩の溶媒和物。
【請求項6】
R2が、フェニルである、請求項1から5のいずれか一項に記載の化合物、もしくは薬学的に許容できるその塩または薬学的に許容できる前記化合物もしくは塩の溶媒和物。
【請求項7】
nが、1である、請求項1から6のいずれか一項に記載の化合物、もしくは薬学的に許容できるその塩または薬学的に許容できる前記化合物もしくは塩の溶媒和物。
【請求項8】
Aが、式
【化8】

(式中、*は、ヒドロキシを保有する炭素とのAの接続点を表す)であり、
Xが、−(CH2)9−であるか、式
【化9】

であり、
Yが、式
【化10】

(式中、**および***は、接続点を表し、**は、Xと連結している)であり、
nが、1であり、
R1が、シクロヘキシルまたはフェニルであり、R2が、フェニルである、請求項1に記載の化合物、もしくは薬学的に許容できるその塩または薬学的に許容できる前記化合物もしくは塩の溶媒和物。
【請求項9】
5−[(1R)−2−({9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン、
5−[(1R)−2−({9−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン ナフタレン−1,5−ジスルホン酸塩、
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン、
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン ナフタレン−1,5−ジスルホン酸塩、
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン コハク酸塩、
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン フマル酸塩、
5−[(1R)−2−({9−[4−({3−[シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン、
8−ヒドロキシ−5−[(1R)−1−ヒドロキシ−2−({9−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]ノニル}アミノ)エチル]キノリン−2(1H)−オン、および
8−ヒドロキシ−5−[(1R)−1−ヒドロキシ−2−{[2−(4−{2−[4−({3−[ヒドロキシ(ジフェニル)メチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}エチル]キノリン−2(1H)−オン
からなる群から選択される、請求項1に記載の化合物。
【請求項10】
5−[(1R)−2−{[2−(4−{2−[4−({3−[(R)−シクロヘキシル(ヒドロキシ)フェニルメチル]−1H−1,2,4−トリアゾール−1−イル}メチル)ピペリジン−1−イル]エチル}フェニル)エチル]アミノ}−1−ヒドロキシエチル]−8−ヒドロキシキノリン−2(1H)−オン ナフタレン−1,5−ジスルホン酸塩である、請求項1に記載の化合物。
【請求項11】
少なくとも有効量の請求項1から10のいずれか一項に記載の式(1)の化合物もしくは薬学的に許容できるその塩または薬学的に許容できる前記化合物もしくは塩の溶媒和物を含む医薬組成物。
【請求項12】
医薬品として使用するための、請求項1から10のいずれか一項に記載の式(1)の化合物もしくは薬学的に許容できるその塩または薬学的に許容できる前記化合物もしくは塩の溶媒和物。
【請求項13】
・あらゆるタイプ、病因、または病原の喘息、特に、アトピー性喘息、非アトピー性喘息、アレルギー性喘息、アトピー性気管支IgE−仲介性喘息、気管支喘息、本態性喘息、真正喘息、病態生理学的かく乱により引き起こされる内因性喘息、環境要因により引き起こされる外因性喘息、知られていないまたは明らかでない原因の本態性喘息、非アトピー性喘息、気管支喘息、気腫性喘息、運動誘発性喘息、アレルゲン誘発性喘息、冷気誘発性喘息、職業喘息、細菌、真菌、原虫、またはウイルス感染症により引き起こされる感染型喘息、非アレルギー性喘息、初発性喘息、喘鳴乳児症候群および細気管支炎からなる群から選択されるメンバーである喘息、
・慢性または急性気管支収縮、慢性気管支炎、末梢気道閉塞、および気腫、
・あらゆるタイプ、病因または病原の閉塞性または炎症性気道疾患、特に、慢性好酸球性肺炎、慢性閉塞性肺疾患(COPD)、慢性気管支炎を包含するCOPD、COPDに関連した、もしくは関連しない肺気腫もしくは呼吸困難、不可逆的進行性気道閉塞を特徴とするCOPD、成人呼吸窮迫症候群(ARDS)、他の薬物療法の結果として生じる気道過敏性の悪化および肺性高血圧に関連した気道疾患からなる群から選択されるメンバーである閉塞性または炎症性気道疾患、
・あらゆるタイプ、病因または病原の気管支炎、特に、急性気管支炎、急性喉頭気管気管支炎、アラキン酸気管支炎、カタル性気管支炎、クループ性気管支炎、乾性気管支炎、感染性喘息性気管支炎、湿咳性気管支炎、ブドウ球菌性または連鎖球菌性気管支炎および肺胞性気管支炎からなる群から選択されるメンバーである気管支炎、
・急性肺傷害、
・あらゆるタイプ、病因または病原の気管支拡張症、特に、円柱状気管支拡張症、嚢状気管支拡張症、紡錘状気管支拡張症、毛細管性気管支拡張症、嚢胞状気管支拡張症、乾性気管支拡張症および濾胞性気管支拡張症からなる群から選択されるメンバーである気管支拡張症
からなる群から選択される疾患、障害、および状態を治療するのに使用するための、請求項1から10のいずれか一項に記載の式(1)の化合物もしくは薬学的に許容できるその塩または薬学的に許容できる前記化合物もしくは塩の溶媒和物。
【請求項14】
請求項1から10のいずれか一項に記載の化合物、もしくは薬学的に許容できるその塩または薬学的に許容できる前記化合物もしくは塩の溶媒和物と、
(a)5−リポキシゲナーゼ(5−LO)阻害薬または5−リポキシゲナーゼ活性化タンパク質(FLAP)拮抗薬、
(b)LTB4、LTC4、LTD4、およびLTE4の拮抗薬を包含するロイコトリエン拮抗薬(LTRA)、
(c)H1およびH3拮抗薬を包含するヒスタミン受容体拮抗薬、
(d)鼻充血除去薬使用のためのα1−およびα2−アドレナリン受容体作動薬血管収縮交感神経様作用薬、
(e)PDE阻害薬、例えば、PDE3、PDE4およびPDE5阻害薬、
(f)β2受容体作動薬、
(g)ムスカリン性M3受容体拮抗薬または抗コリン作動薬、
(h)β2作動薬およびムスカリンM3受容体拮抗薬として活性なデュアル化合物、
(i)テオフィリン、
(j)クロモグリク酸ナトリウム、
(k)COX阻害薬、非選択的および選択的なCOX−1またはCOX−2阻害薬(NSAID)、
(l)プロスタグランジン受容体拮抗薬およびプロスタグランジン合成酵素の阻害薬、
(m)経口および吸入グルココルチコステロイド、
(n)コルチコイド受容体の解離性作動薬(DAGR)、
(o)内因性炎症性物質に対して活性なモノクローナル抗体、
(p)抗腫瘍壊死因子(抗TNF−α)薬、
(q)VLA−4拮抗薬を包含する接着分子阻害薬、
(r)キニン−B1−およびB2−受容体拮抗薬、
(s)IgE経路の阻害薬およびシクロスポリンを包含する免疫抑制薬、
(t)マトリックスメタロプロテアーゼ(MMP)の阻害薬、
(u)タキキニンNK1、NK2およびNK3受容体拮抗薬、
(v)エラスターゼ阻害薬などのプロテアーゼ阻害薬、
(w)アデノシンA2a受容体作動薬およびA2b拮抗薬、
(x)ウロキナーゼの阻害薬、
(y)D2作動薬などのドーパミン受容体に作用する化合物、
(z)IKK阻害薬などのNFκβ経路のモジュレーター、
(aa)p38MAPキナーゼ、PI3キナーゼ、JAKキナーゼ、sykキナーゼ、EGFRまたはMK−2などのサイトカインシグナル伝達経路のモジュレーター、
(bb)粘液溶解薬または鎮咳薬として分類することができる薬剤、
(cc)吸入コルチコステロイドに対する応答を亢進する薬剤、
(dd)気道にコロニーを形成することができる微生物に対して有効な抗生物質および抗ウイルス薬、
(ee)HDAC阻害薬、
(ff)CXCR2拮抗薬、
(gg)インテグリン拮抗薬、
(hh)ケモカイン、
(ii)上皮ナトリウムチャネル(ENaC)遮断薬または上皮ナトリウムチャネル(ENaC)阻害薬、
(jj)P2Y2作動薬および他のヌクレオチド受容体作動薬、
(kk)トロンボキサンの阻害薬、
(ll)PGD2合成およびPGD2受容体(DP1およびDP2/CRTH2)の阻害薬、
(mm)ナイアシン、ならびに
(nn)VLAM、ICAM、およびELAMを包含する接着因子
から選択される他の1つまたは複数の治療薬との組合せ。
【請求項15】
式
【化11】

(式中、pおよびqは、1または2から独立して選択され、n、R1およびR2は、請求項1に定義されている通りである)の化合物。
【図1】




【公表番号】特表2011−527672(P2011−527672A)
【公表日】平成23年11月4日(2011.11.4)
【国際特許分類】
【出願番号】特願2011−517301(P2011−517301)
【出願日】平成21年7月9日(2009.7.9)
【国際出願番号】PCT/IB2009/052986
【国際公開番号】WO2010/004517
【国際公開日】平成22年1月14日(2010.1.14)
【出願人】(597014501)ファイザー・リミテッド (107)
【氏名又は名称原語表記】Pfizer Limited
【住所又は居所原語表記】Ramsgate Road, Sandwich, Kent, England
【Fターム(参考)】
【公表日】平成23年11月4日(2011.11.4)
【国際特許分類】
【出願日】平成21年7月9日(2009.7.9)
【国際出願番号】PCT/IB2009/052986
【国際公開番号】WO2010/004517
【国際公開日】平成22年1月14日(2010.1.14)
【出願人】(597014501)ファイザー・リミテッド (107)
【氏名又は名称原語表記】Pfizer Limited
【住所又は居所原語表記】Ramsgate Road, Sandwich, Kent, England
【Fターム(参考)】
[ Back to top ]

