病変部位の解像および確認のための方法と装置
【課題】放射線治療のプランニングを目的とした病変または器官の解像、位置測定および治療位置の確認のための方法と装置を提供する。
【解決手段】位置感知システムの使用を通じて診断映像システムの座標空間に関する超音波映像の位置測定を確保するために、超音波映像システムと診断映像システムの組合せを使用する。本方法は、位置測定超音波映像内の病変の位置と患者が治療ユニットの処置台に横たわっている間に撮られる超音波映像内の病変の位置を比較し、病変をその対象治療位置に配置するための正しい方策を示唆し、かつ有資格者から得られる確認による補正を実行する。
【解決手段】位置感知システムの使用を通じて診断映像システムの座標空間に関する超音波映像の位置測定を確保するために、超音波映像システムと診断映像システムの組合せを使用する。本方法は、位置測定超音波映像内の病変の位置と患者が治療ユニットの処置台に横たわっている間に撮られる超音波映像内の病変の位置を比較し、病変をその対象治療位置に配置するための正しい方策を示唆し、かつ有資格者から得られる確認による補正を実行する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、放射線治療によって治療されるべき病変もしくは腫瘍の形態、形状、位置および構造がさらに優れた明確さで確認できることでその根絶のための治療プランがより良く設計される方法に関する。さらなる態様によると、本発明はまた、放射線治療の実施に先だつ放射線ビームもしくは複数ビームに関する病変の位置の確認のための方法と装置にも関する。本発明は、腫瘍のサイズ、場所および性質がその治療の前および期間中で判定され、更新され、追跡されることの可能な方法に関する。
【背景技術】
【0002】
癌性の腫瘍もしくは病変の現代の放射線治療の目標は腫瘍近辺の健全な組織および器官に対する最大量のあり得る損傷を回避しながら腫瘍を根絶することである。腫瘍の大多数は放射線反応性であるので、もしも充分な放射線投与が腫瘍に供給されるならば、それらは制御もしくは完全に根絶することができる。しかしながら、必要な殺腫瘍性の投与量の供給は腫瘍を取り巻く健全な組織の損傷に起因するかまたは腫瘍の近くに位置する他の健康な器官への損傷に起因する合併症に結びつく可能性がある。適合療法は、周囲の健全な組織または隣接する健全な器官への投与量を最少限にしながら腫瘍の外側表面で規定される領域に厳密に高い投与量の領域を合わせるために、正確な標的位置測定と焦点を絞った放射線の供給を組み合わせることを企てる放射線治療の手法である。様々な適合療法が当該技術でよく知られている。
【0003】
適合放射線治療はフォトン、電子またはその他の荷電粒子の高エネルギー放射ビームを発生することのできる専用の放射線ユニットを使用する。放射線ユニットは通常では放射線源を有し、それは放射線治療ユニットの回転可能な構台上に搭載される。構台の回転を通じて、放射線源が、通常では治療台に位置する患者の周りを回転させられ、治療すべき腫瘍もしくは病変に放射線ビームが向けられる。放射線治療ビームの形状が、患者の体を横切って腫瘍に至るときに放射線治療ビームで認められる腫瘍の輪郭をしっかりと取り囲むように合わせるために様々なタイプの装置が使用される。そのような装置の範例は、腫瘍の輪郭の形状をとるように放射線ビームの内外に個々に位置取り可能なコンピュータ制御された可動性の複数リーフもしくは複数フィンガーのセットから成るマルチリーフ・コリメータである。様々なタイプの放射線治療プランニング・システムが、いったん実行されると周囲の健全な組織または隣接する健全な器官を傷つけないで腫瘍に特定の投与量を供給する放射線治療プランを作成することができる。
【発明の開示】
【発明が解決しようとする課題】
【0004】
適合治療の基本的な問題は、(I)放射線治療プランの設計の前、および(II)放射線治療時に、標的、または病変もしくは腫瘍の場所あるいは場合によっては放射線ビームもしくは場の対象配置に関する健全な器官の場所を知ることである。放射線治療プランの設計に先だって、当該技術で知られているコンピュータ断層撮影(「CT」)映像装置、磁気共鳴映像(「MRI」)装置あるいは陽電子放射断層撮影(「PET」)映像装置といった従来の診断映像装置で患者の三次元映像を得ることによって患者内の標的容積の位置測定が実行される。これらの洗練された装置はGE Medical Systems、Marconi、Toshiba、Siemens、Phillipsその他のような様々な製造業者から入手できる可能性がある。
【0005】
現在のところ、治療が開始されると、放射線治療時の患者の位置と患者内の標的の位置の両方は治療プラン作成時点でそれらがあったのとほぼ同じであると想定される。しかしながら、(I)治療プラン作成前または(II)治療時にもしも標的容積の位置が正しく判定されない場合、放射線の適合投与量が患者体内の正しい場所に供給されない可能性があるという意味で治療の失敗が生じる可能性がある。もしも従来の映像モダリティーが当該の腫瘍もしくは病変あるいは器官の形状、場所および配向を完全に明らかにできないと、タイプ(I)の失敗が生じる可能性がある。すべての従来の診断映像装置が適切に、完全にもしくは充分に腫瘍の確かな形状、サイズおよび配向を判定するわけではなく、最新の診断映像装置を使用してもいくつかの腫瘍は充分に診断できないので、これは生じ得る。腫瘍の成長、体重減に起因する生理系の変化、または患者の呼吸といった様々な因子から生じることもあり得る器官の日々の移動(動き)の結果としてタイプ(II)の失敗が起こることもあり得る。タイプ(II)の失敗はまた、放射線治療ユニットの治療台上での患者の間違った位置取りから生じることもあり得る。
【0006】
上記の失敗を回避するために、現在の放射線治療プランは通常では放射の標的が患者の体内で実際よりも大きい空間を占めるように考慮し、それにより、より小さな腫瘍もしくは病変がその大きめの容積内に収まるであろう。結果として、腫瘍もしくは病変の周囲のある程度の健全な組織もしくは器官が腫瘍もしくは標的を対象とした最大放射線投与量で照射されるであろう。健全な組織または健全な器官の大きめの容積への最大放射線投与量の供給はこれらに損傷を与える危険性を増大させ、かつ、例えば、健全な周囲組織で将来の癌を促進する可能性がある。この理由のため、現在の適合放射線治療を用いる癌専門医は、非標的組織を傷つけないように標的器官のある程度の部分に不充分投与することによって治療の成功を譲歩する潜在的な欠点をもつ低めの放射線投与量を供給すると決定する可能性がある。
【0007】
前立腺癌の治療のために病変の位置測定を改善し、それによりタイプIの失敗を修正する試みで、或る方法がHolupkaらの米国特許第5,810,007号に開示され、それは経直腸プローブを利用して二次元超音波映像を発生するものである。その後、この映像はCTスキャンのような従来の診断映像装置で得られた映像に重畳される。上述の前記方法では、映像の登録は超音波映像と従来の診断映像装置で得られる映像の両方で少なくとも2つの目に見える基点の識別を必要とする。しかしながら、以下の欠点が上述の前記方法の利用性を制限する可能性がある。
【0008】
1.経直腸超音波プローブは病変もしくは器官をかなり移動させ、その結果、治療時にもしも経直腸プローブが再度挿入されない場合、病変の空間的位置について不正確な情報を供給する可能性がある。どのような事情であれ、治療開始前のプローブの挿入と取り外しは病変の移動、加えて腫瘍の位置測定に対するさらなる不確実性の原因となり得る。さらに、各治療期について経直腸プローブを挿入することは患者の有意な不快の原因となりかねず、この方法が医師の評判を得られない結果につながる。
【0009】
2.Holupkaは二次元映像だけを供給し、かつ2D超音波映像と従来の診断映像モダリティーで得られる映像が同じ平面で得られると想定している。このケースについては、両方の映像の2つの識別可能な基点は映像を登録および重畳するのに充分である。しかしながら、超音波映像と従来の診断映像装置から得られる映像が同じ映像平面にある映像を供給していることは確実ではなく、それゆえに、一方の映像が他方の平面から逸脱しているとこの方法の精度がかなり妥協的になる可能性がある。
【0010】
3.上述の前記方法は従来の診断映像モダリティーで得た二次元映像の上に二次元超音波映像を登録および重畳させる。したがって病変の超音波解像は単一の平面だけで実行される。三次元適合治療の目的については、病変の二次元解像は不完全であり、それゆえに、他の映像平面で病変の容積の範囲がさらに大きいかまたは小さいこともあり得るので不適当である。
【0011】
4.さらに、直腸、下部大腸、および前立腺といった極めて限定された数の腫瘍に関してのみ使用可能であるのでHolupkaは限定された出願である。それは他のタイプの腫瘍に使用することができない。
【0012】
タイプIIの失敗を修正する試みで、Carolの米国特許第5,411,026号によって、放射線治療期の前に標的もしくは病変の部分を確認するために別のシステムが提案された。そのシステムは患者体内の病変の少なくとも1つの超音波映像を得るための超音波映像装置、および放射線治療装置の位置に関する超音波映像発生装置もしくはプローブの位置を示す装置を含む。上述の前記システムは、少なくとも1つの超音波映像上に解像される病変の外側表面の輪郭をコンピュータ断層撮影(「CT」)または場合によっては磁気共鳴映像(「MRI」)装置によって得られて放射線治療プランの設計に使用される少なくとも1つの診断映像と比較することで、治療期直前の病変の実際の位置が放射線治療プランにある病変の所望の位置と一致することを確認する。しかしながら、以下の欠点が上述の前記システムの利用性を限定する可能性がある。
【0013】
1.超音波映像もしくは複数映像中の腫瘍または病変または器官の外見は従来の診断装置で得られる映像中の腫瘍または病変または器官のそれとは異なる外見を有する可能性がある。したがって、異なる映像装置で得られる映像に現れる腫瘍または病変または器官の外側表面の輪郭を比較する方法は、これらの表面が外見と範囲の両方で異なることもあり得るので不正確である可能性がある。言い換えると、Carolはリンゴとオレンジを比較し、それが腫瘍の不完全な評価に結びつく。適合治療の傾向は放射線の的確な投与量のさらに正確な空間的供給へと向いているので、この欠点は極めて重大である。
【0014】
2.Carolはまた、タイプIの失敗に対処しておらず、それによりコンピュータ断層撮影または磁気共鳴映像装置で得られる診断映像は、或る場所の或る腫瘍に関する前記装置の固有の制限のせいで、腫瘍または病変または器官の場所または範囲を完全に明らかにすることはない。さらに、もしもコンピュータ断層撮影または磁気共鳴診断映像が腫瘍または器官または病変を明らかにしないかまたは完全に明らかにしない場合、Carolは1つまたは複数の超音波映像上に輪郭の現れた腫瘍または病変または器官の外側表面との比較のための基準として役立つ外側表面の輪郭を示す手段に欠けているであろう。
【0015】
従来の技術の上述の説明の観点で、本発明の目的はしたがって、以上に規定したタイプIとタイプIIの失敗の発生率を低減させる放射線治療の改善された方法と装置を提供することである。
【0016】
放射線治療の準備に腫瘍の正確な位置測定、サイズ判定および解像のための新しい方法と装置を提供することが本発明の別の目的である。
【0017】
治療プランのプラン作成ステージで超音波映像化の使用法を提供することが本発明の目的である。
【0018】
標的の解像と位置測定のための超音波映像もしくは複数の超音波映像を確立し、かつこの映像もしくは複数の超音波映像をコンピュータ断層撮影(「CT」)映像装置、磁気共鳴映像(「MRI」)装置または陽電子放射映像装置(「PET」)といった従来の診断映像装置、あるいは、例えば、診断装置の将来のタイプのような何らかの他のタイプで得られる放射線治療のシミュレータ映像に相関付けるための改善された方法と装置を提供することが本発明のさらなる目的である。
【0019】
病変の三次元超音波映像をCTまたはMRIまたは別の超音波映像のような別の三次元病変映像に三次元的に重ね合わせるための新たな方法を提供することもやはり本発明の目的である。
【0020】
従来の診断映像の収集の直前または直後に得られる超音波映像もしくは複数の超音波映像の、放射線治療期直前に得られる超音波映像もしくは複数の超音波映像に対する登録に基づいて放射線治療ビームに関して標的を正確に位置決めするための改善された方法と装置を提供することが本発明のさらに別の目的である。
【0021】
本発明は、(a)放射線治療プランニングのための病変位置測定および腫瘍または病変または器官の解像、および(b)放射線治療中の病変位置の確認と修正のための方法と装置に関する。
【課題を解決するための手段】
【0022】
一態様によると、本発明は腫瘍または病変または器官または身体のいずれかの他の領域の位置測定、サイズ測定、解像および配向測定を向上させるためにいくつかのステップを含むことがあり得る。本発明がヒトの癌治療を考慮することもあり得るが、ヒトと動物両方の他の非癌性治療の医療用途にもやはり使用可能であることは理解される。
【0023】
一般的態様によると、腫瘍の位置測定、サイズ測定などは腫瘍の治療もしくは根絶、あるいは他のいずれかの必要もしくは要求のある医学的調査のための治療プランを考案するために必要となる可能性がある。それらのステップは、従来の診断映像装置の台上に患者を配置するステップ、例えばCT、MRIまたはPETスキャンといったいずれかの知られている従来の診断映像装置を使用して診断映像もしくは複数の診断映像を収集するステップを含むことがあり得る。前記収集は、診断映像もしくは複数映像の幾何学的配向が診断映像装置に関して決定可能となるように患者の表面に配置されたいくつかの基点の使用、発生する各超音波映像について診断映像装置に関して知られている幾何学的配向で配置された超音波映像発生手段による、診断映像を収集する直前または直後の超音波映像もしくは複数の超音波映像の入手、超音波映像もしくは複数映像と幾何学的配向に関して予め知見のある診断映像もしくは複数映像の重畳(当該技術で融合として知られている)または組合せ、超音波映像もしくは複数映像上への腫瘍または病変または器官の外側表面の輪郭形成および診断映像もしくは複数映像上への上述の前記外側表面の同時表示、腫瘍または病変または器官の外側表面の上述の前記輪郭の放射線治療プラン設計への使用を含むことがあり得る。
【0024】
放射線治療装置に関する腫瘍または病変または器官の位置の確認に関連して、本発明は、放射線治療装置の治療台に患者を配置するステップ、患者体内の病変の少なくとも1つの超音波すなわちUSの映像を知られている幾何学的配向で配置されたUS映像発生手段、つまりプローブで各々の発生US映像について発生させるステップ、上述の前記超音波映像もしくは複数映像を診断映像収集時に得られた超音波映像もしくは複数映像と比較し、それによって放射線治療装置に関する腫瘍または病変または器官の位置が確認可能となり、放射線治療プランにある腫瘍または病変または器官の所望の位置との一致を確立するステップを含むことがあり得る。
【0025】
本発明の別の特徴は、放射線治療期の直前に得られた超音波映像もしくは複数映像を診断映像収集の直前または直後に得られた超音波映像もしくは複数映像と比較または登録する方法を含み得る。この方法は、輪郭を必要としない階調映像補正あるいは場合によっては診断および放射線治療室で得られた超音波映像もしくは複数映像上に規定される腫瘍または病変または器官の外側表面の輪郭から成る(当該技術で知られているような)幾何学的目標物の登録を使用することがあり得る。
【0026】
上述の前記映像の比較の結果として、本発明の別の特徴は放射線治療プランによって処方された所望の位置に腫瘍または病変または器官を配置するために必要な腫瘍または病変または器官の配置を決定するステップである。本発明のさらなる特徴は、制限されないが、放射線治療装置に関して治療台を回転、放射線治療装置のコリメータを回転、ならびに放射線治療装置の構台を回転、あるいは以上を組み合わせた、放射線治療装置に関して治療台を移動させることによる上述の決まった腫瘍または病変または器官の移動を実行するステップを含むことがあり得る。
【0027】
したがって、本発明の一態様によると、
放射線治療のプランニングの目的のために腫瘍を空間的に位置測定する方法が供給され、その方法は、
CATスキャン、PETスキャン、CTスキャンを含むグループから選択される診断映像装置を使用して前記腫瘍の1つまたは複数の診断映像を発生するステップ、
絶対座標基準系を使用して第1の三次元座標に前記診断映像上の前記腫瘍を割り当てるステップ、
超音波装置を使用して前記腫瘍の1つまたは複数の超音波映像を発生するステップ、
前記絶対座標基準系を使用して第2の三次元座標に前記超音波映像上の前記腫瘍を割り当てるステップ、
腫瘍の正確な映像を得るために前記第1および前記第2の三次元座標を使用して前記超音波映像と前記映像を融合するステップを含む。
【0028】
さらなる実施形態によると、本発明は、
放射線治療のプランニングの目的のために腫瘍を空間的に位置測定する方法を供給し、その方法は、
前記腫瘍の予測位置近辺で患者に複数の基点を設置するステップ、
絶対座標系を使用して第1の三次元座標を前記複数基点に割り当てるステップ、
CATスキャン、PETスキャン、CTスキャンを含むグループから選択される診断映像装置を使用して前記腫瘍の1つまたは複数の診断映像を発生するステップを含み、前記少なくとも1つの診断映像がその上に前記腫瘍の映像を有してさらに前記複数基点を有し、
前記複数基点の前記第1の三次元座標を基準として使用して前記少なくとも1つの診断映像上の前記腫瘍を第2の三次元座標に割り当てるステップ、
超音波装置を使用して前記腫瘍の1つまたは複数の超音波映像を発生するステップを含み、前記少なくとも1つの超音波映像がその上に前記腫瘍の映像を有してさらに前記複数基点を有し、
前記複数基点の前記第1の三次元座標を基準として使用して前記超音波映像上の前記腫瘍を第3の三次元座標に割り当てるステップ、
腫瘍の正確な映像を得るために前記第2および前記第3の三次元座標を使用して前記超音波映像と前記映像を融合するステップを含む。
【0029】
本発明のまたさらなる態様によると、
放射線治療のプランニングの目的のために腫瘍を空間的に位置測定する方法が供給され、その方法は、
前記腫瘍の予測位置近辺で患者に複数の基点を設置するステップ、
絶対座標系を使用して第1の三次元座標を前記複数基点に割り当てるステップ、
CATスキャン、PETスキャン、CTスキャンを含むグループから選択される診断映像装置を使用して前記腫瘍の1つまたは複数の診断映像を発生するステップを含み、前記少なくとも1つの診断映像がその上に前記腫瘍の映像を有してさらに前記複数基点を有し、
前記複数基点の前記第1の三次元座標を基準として使用して前記少なくとも1つの診断映像上の前記腫瘍を第2の三次元座標に割り当てるステップ、
超音波装置を使用して前記腫瘍の1つまたは複数の超音波映像を発生するステップを含み、前記少なくとも1つの超音波映像がその上に前記腫瘍の映像を有し、
前記1つまたは複数の超音波映像の位置と配向を知ることができるように構成された位置測定システムを使用し、それによって前記1つまたは複数の超音波映像上の腫瘍が前記絶対座標基準系で第3の三次元座標を割り当てられることを可能にするステップ、
腫瘍の正確な映像を得るために前記第2および前記第3の三次元座標を使用して前記超音波映像と前記映像を融合するステップを含む。
【0030】
本発明のまた別の態様によると、
放射線治療のプランニングの目的のために腫瘍を空間的に位置測定するシステムが供給され、そのシステムは、
CATスキャン、PETスキャン、CTスキャンを含むグループから選択され、前記腫瘍の少なくとも1つの診断映像を発生するように構成された診断映像装置、
前記腫瘍の少なくとも1つの超音波映像を発生するように構成された超音波装置、
前記腫瘍が前記診断映像上では第1の三次元座標で、前記超音波映像上では第2の三次元座標で割り当てられるように絶対座標基準系を供給するための手段、 前記腫瘍の正確な映像を得るために前記第1の三次元座標および前記第2の三次元座標を使用して前記診断映像と前記超音波映像を融合するための手段を含む。
【発明を実施するための最良の形態】
【0031】
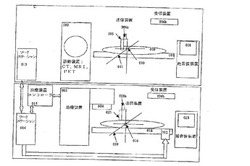
本発明の方法と装置の実施形態の例示は、図面から派生する装置と映像の構成要素で示される。図1の概略図に本発明の実施形態が概して図解されている。本発明の目的のうちの1つ、すなわち腫瘍010のサイズ、位置および配向の最も精度の高い解像度を得ることを達成するために、腫瘍010を含むと考えられる患者身体009の標的領域が2つの別個の診断装置を使用して走査または診断され、かつ結果的に得られる映像が比較されてもよいことが判明した。これはMRI、CTまたはPETを含むグループから選択される診断装置の使用を通じて入手される腫瘍010の映像をAcuson、GE Medical Systems、Siemens、Toshibaその他のそれらのような超音波装置で得られる腫瘍010の映像と比較することによって達成されることもあり得る。2つの映像が入手される順序は、それらの映像が、限定はされないが例えば他方の1時間以内の短時間内で入手される限り概して重要ではない。
【0032】
この態様によると、入手されることになる第1の映像は、例えば、診断装置002の使用を通じて収集されてもよく、それは例えばコンピュータ断層撮影(「CT」)スキャナ、磁気共鳴映像(「MRI」)スキャナ、または場合によっては陽電子放射断層撮影(「PET」)スキャナ、またはいずれかの他の同等の装置、またはいずれかの他の映像作成診断装置であってもよい。図2を参照すると、対象となる腫瘍または病変または器官010を有する患者009がその上に配置される可能性のある従来の映像台001を備えた(従来の)診断映像装置002が図式的に示されている。診断映像装置002は体組織の断層映像023または「スライス」を作成することが可能であり、そのような「スライス」は図示した対象となる腫瘍または病変または器官010でもって図4に図式的に描かれる。例えば図3に示したように、診断映像装置002のスライス入手空間017で診断映像装置002と患者009の間の相対的な動きを引き起こすことによっていくつかの診断映像023を入手することができる。図6は患者009の部分または断層面の(連続した)複数の診断映像023から形成または再構成される三次元映像027を描くものである。
【0033】
診断映像装置002で得られるような腫瘍010の映像は図1に示したような超音波装置005、008で撮られる同じ腫瘍の映像と比較されることになるので、腫瘍が参照される、すなわち前記比較を有効化することのできる座標のセットを与えられる必要がある。例えば、前記座標は診断映像装置002と超音波映像装置005、008の両方で別々であってもよい。しかしながら、座標系は、診断映像装置002で見られる腫瘍010の位置を超音波映像装置005、008で見られる腫瘍010の位置と相関付けることができなければならないこともあり得る。したがって、絶対座標系011が確立されることが必要となる可能性がある。
【0034】
その目的のために、絶対座標系011上の腫瘍010に絶対座標を割り当てる手段が供給されてもよく、その絶対座標が、例えば腫瘍010のCT映像をその超音波映像と相関付けるのに使用されてもよい。そうするために、基点としても知られるいくつかのマーカ、例えば、図5に例示したような3つの基点029が診断映像023の入手に先だって患者の身体上に病変の近辺もしくは周囲で設置されてもよい。1つの実践によると、基点029はすべて同じ平面に設置されてもよい。基点(それらは診断映像中で容易に見るかまたは識別することのできるいずれかの物理的マーカであってもよい)の位置は、その後、いずれかの知られているシステム、例えば計測システムの使用を通じて絶対座標系011内で確認されてもよい。
【0035】
計測システムはどのような知られている形状または形式をとってもよい。例えば、一実施形態では計測システムは1つまたは複数のレーザ、またはレーザ・システムを含み、それらのレーザは、例えば、診断映像装置002が配置される部屋の壁または天井に配置されてもよい。そのような計測システムは当該技術で知られており、例えばCamar Electricから市販入手される製品Cermaligne、モデル番号CL 505−CH2であってもよい。レーザまたはいずれかの他の適切な装置は複数基点に向けられ、基点を離れて供給源またはいずれかの他の計測装置へと跳ね返されたレーザ・ビームを通じて、基点の座標が判定され、割り当てられてもよい。結果として、基点が絶対座標、例えば図5に例示したようなX1、Y1、Z1を割り当てられてもよい。計測システムはその後、基点の前記絶対座標を診断映像装置にダウンロードするかまたは転送する。
【0036】
同じスライス上に基点029と腫瘍010の両方を示す図5に例示したスライス023から、その後、絶対座標系011の絶対座標を腫瘍010のいかなる点にも割り当てることができることもあり得る。これは映像スライス023に描いたような基点029と腫瘍010の相対位置に基づく単純な相関を通じて為されてもよく、かつスライス023の映像座標系030内で測定されてもよい。基点029の座標は絶対座標系011内であることが判っており、腫瘍010の相対的位置は図5のスライス023に示した情報から基点029に関して判っているので、腫瘍010のいずれかの点、例えばX2、Y2、Z2に絶対座標を割り当てるように変換マトリクスまたは座標変換を決定するのに、当業者に知られている適合化アルゴリズムを使用することができる。診断映像023または027内のいずれかの目標の座標(X,Y,Z)の判定はこの方式で達成可能であり、したがって絶対座標系011内で絶対座標を割り当てることができる。
【0037】
図4と図5は患者009を通して配置された絶対座標系011を有するように示されているが、前記絶対座標系011が身体009を通してではなく配置されてもよいことは理解される。
【0038】
腫瘍010のサイズ、場所および配向の判定での追加的なステップが図7で例示可能であり、そこでは病変010の少なくとも1つの超音波映像016を発生するための手段005、008が示される。少なくとも1つの超音波映像を発生するための前記手段008は診断映像装置002が設置される診断映像室に配置されてもよい。超音波映像016を発生するための前記手段008は従来の、市販入手可能な超音波プローブ005を利用してもよい。図8に例示したように、腫瘍または病変または器官010の超音波映像もしくは映像016を発生するために、超音波プローブ005は患者身体009との接触へと持ち込まれる。図9に例示したように、超音波プローブ005を移動、置き換えまたは回転させることによって、腫瘍または病変または器官010の複数の超音波映像016を様々な平面で得ることができる。図9では、病変010は、各々の超音波映像の平面が超音波映像収集時の超音波プローブ005の配向を表わす複数の超音波映像016内に配置されて示されている。見て判るように、それらの平面は必ずしも互いに平行である必要はない。複数の超音波映像016から超音波データの三次元容積もしくは像031(図10)の再構成を実行することができる。
【0039】
超音波データから正確に三次元容積031を再構成するため、および絶対座標系011で絶対座標を割り当てるために、絶対座標系011に関して超音波プローブ005の配向と位置(これ以降は配向と称する)が、腫瘍010の各超音波映像の作成時に判っていなければならない。これを達成するために、超音波プローブ005の(空間的)配向を表示するための手段006a、006bが使用されてもよく、特に、図7に示したように診断装置002の部屋に配置されてもよい。いかなる位置感知システムも超音波プローブ005の位置と配向を判定する手段006a、006bとして使用可能である。例えば、そのようなシステムはしばしば総称的に追跡システムと称されて当該技術では知られており、Ascension Technology Corporation、InterSense、Northern Digital Inc.、Motion Analysis Corp.その他から市販入手可能である。前記位置感知手段006aと006bの使用は絶対座標系011に関して前記プローブの位置の判定を可能にすることができる。例えば、限定されるものではないが、位置測定システムは、超音波プローブに装着された光放出もしくは反射マーカを見据える部屋に固定のカメラ・システム、プローブ005に装着される発射器および時間的測定とその結果得られる幾何学的三角法によってこれら発射器までの距離を測定して超音波プローブ005の位置と配向を判定する検出器を備えた超音波システム、超音波プローブ005が取り付けられた機械的アームを基礎にした位置測定システムを含んでもよい。超音波プローブ005と超音波プローブ005の幾何学的配向を示すための手段006a、006bのいずれも、診断映像装置002の台001に固定されねばならないわけでないことに留意すべきである。
【0040】
超音波プローブ005の座標と幾何学的配向を判定するための手段006a、006bは絶対座標系、例えばレーザに組み合わされ、位置合わせされ、接続され、または較正される。この位置合わせもしくは較正の結果として、超音波映像016内のいかなる点もしくは特徴の絶対座標基準系011内の座標(X,Y,Z)も確認可能となる。言い換えると、図10に例示したように、超音波映像で得られる腫瘍010の絶対座標を判定するのに絶対座標系011の基礎を形成し得るレーザが使用可能である。
【0041】
絶対座標系011は診断映像装置002と超音波装置005の両方に共通であるので、両方のシステムに関して腫瘍010の位置を正確に相関付けることが可能である。この知見で、再構成された容積031(図10)内の各点について超音波映像データの値が、当業者に知られている挿入アルゴリズムによって判定可能である。収集の制御と融合のソフトウェアは図1に例示したように専用のコンピュータまたはワークステーション013で実行されてもよい。病変の輪郭描写および表現の処理を容易にするのに、標準的な細分化およびその他の映像強調ツールが利用可能である。
【0042】
複数の超音波映像016の収集は複数の診断映像023の収集の前もしくは直ぐ後(すなわち直前または直後)に為されるので、超音波三次元映像データ031と診断三次元映像027は2つの時間的に極めて近い瞬間で患者の解剖学的構造の空間的にオーバーラップした容積または断層面の像を表わす。多数の解剖学的構造部位について、治療プランニングに必要な精度内でこれら2つの時間的に極めて近い瞬間の患者の解剖学的構造は変化せず、したがって超音波三次元映像データ031と診断三次元映像データ027の両方が時間的に同一で空間的にオーバーラップする同じ患者の解剖学的構造の断層面を表わす。超音波三次元映像データ031と診断三次元映像データ027の両方の位置と配向が診断装置022の絶対座標系011に関して各々判っていることを条件として、超音波三次元映像データ031と診断三次元映像データ027の両方は重畳、すなわち図11に例示したように正確に重畳され得る。
【0043】
超音波三次元映像データ031と診断三次元映像データ027が組み合わされると、病変010の外側表面の輪郭022は超音波三次元映像データ031または診断三次元映像データ027内で任意に選択可能(図12)となり、かつ超音波三次元映像データ031または診断三次元映像データ027内のそれらの正しい場所で表示可能となる。これらの輪郭022は診断三次元映像データ027内の病変の三次元表現021を実行するのに使用することができる(図13)。この方式で、病変010は(1)診断装置002の絶対座標基準系011に関して位置測定および規定され、(2)診断三次元映像データ027内で位置測定、規定および可視化される。上述の(1)と(2)が理由で、放射線治療プランが従来の方式で設計可能となり、必要な放射線を病変010に供給できる。たとえ病変010が診断映像装置002、または場合によっては超音波装置005で入手される映像もしくは複数映像023によって完全に可視化されていなくてもこれはそうである。しかしながら、それら2つを組み合わせることは腫瘍010のさらに正確な像を形成する。その後、それによって放射線ビームの形状が病変の空間的輪郭または外形022が合致するであろう例えば適合プランのような放射線治療プランが設計可能となる。
【0044】
加えて、もしも上述の手法で健全な器官010が位置測定および輪郭化されるならば、放射線治療プランは器官010への過剰な放射線損傷を回避するように設計されることが好ましいであろう。超音波三次元映像データ031、診断三次元映像データ027、病変010の外側表面の輪郭022および病変010の三次元表現021がそれから、図1に例示したようなワークステーション013から、やはり図1に例示したような放射線治療装置003の制御領域のコンピュータまたはワークステーション014へと伝送され、放射線治療期に先立つ腫瘍または病変または器官010の治療位置の確認のために基準データとして役立つこともあり得る。
【0045】
診断映像027と超音波映像031の間の上述の比較がこの後に説明する方法の必要ステップでないことは理解される。したがって、本発明の追加的な実施形態に従い、かつ上述のタイプIIの失敗を避けるためには、放射線治療の開始直前の腫瘍010を治療プランの中で規定された同じ腫瘍010と比較することが必要になる可能性がある。これは、腫瘍のあらゆる変化、すなわちそのサイズ、位置、配向などが、もしも必要であれば治療プランの変更を通じて考慮され得ることを確実化する。これを達成するために、腫瘍の超音波010は、全体を上述したように、超音波装置008と005を使用して治療プラン中にとられてもよい。診断段階での超音波の撮影と連係した絶対座標系011の使用が前記腫瘍010に絶対座標を割り当てるために必要となることもある。
【0046】
放射線治療期の始まりに先立って、腫瘍または病変または器官010の位置の確認が以下の方式で進行してもよい。図14を参照して、腫瘍または病変または器官010を持つ患者は、これ以降は線形加速装置と称する従来の治療装置003の治療台018上に配置されてもよい。ここで述べる方法がいずれの知られている、または将来の放射線治療装置、あるいはいずれの他のタイプの治療装置で使用されてもよいことは理解される。同じ患者は、ほんの少し前といった過去に、診断段階の間で腫瘍010のサイズ、形状および配向を判定するために実施された超音波を持っていて、全体は上述した。前記超音波の間で、前記腫瘍に絶対座標(X,Y,Z)が割り当てられた。図14に描いたように、治療室での治療期に、治療台018上の患者の腫瘍または病変または器官010の位置(できれば配向と形状を含む)、言い換えると絶対座標は、疑いなく、以前の診断段階の間で割り当てられた腫瘍010の絶対座標と異なるであろう。これは含まれる機械類の異なるサイズと形状、患者009の姿勢の違い、および腫瘍010それ自体が成長、縮退、または移動した可能性があるという事実を含む様々な因子に起因する可能性がある。
【0047】
したがって、腫瘍010の位置のこの違いを考慮に入れて補償できるようにすることが大切である。そうするために、共通の、すなわち超音波装置008と治療装置003に共通した絶対的な基準フレームまたは系が考え出され、超音波映像装置008で認識される腫瘍010と、おそらく異なる物理的配置に置かれる線形加速装置003で治療される前に超音波で認識される同じ腫瘍010の間の位置を相関付けることが可能にならねばならない。
【0048】
これは上述したような類似した測定システムの使用を通じて達成可能であり、そのシステムは、例えば、治療室の壁もしくは天井に配置されるレーザ(図1の019)を有してもよい。超音波008と005を備えて診断室で使用される測定システムは、厳密に必要でなくとも、治療室で使用される測定システムと同じであることもあり得る。しかしながら、両方のシステムは診断超音波装置008と治療装置003の両方に共通した基準フレームを与えるように較正されるべきである。結果として、超音波診断装置005の絶対座標基準系011と治療装置003の絶対座標系019が(図17に例示したように)両方に共通であって相関付け可能な座標を与えることがあり得る。結果として、病変010の対象となる治療位置032(できれば配向を含む)は、図2から図13で以前に説明および例示した位置測定と解像方法で超音波映像装置002によって前もって判定された病変010の空間座標および範囲から算出されてもよい。
【0049】
通常、治療プランニングの行程で4×4の変換マトリクスTが判定されることがあり、それは患者に適用されると、治療台018、治療装置コリメータ004ならびに治療装置構台007の機械的動きによって腫瘍または病変または器官010を所望の治療位置へと移動させる。もしも超音波診断装置002の絶対座標基準系011と治療装置003の絶対座標系019が同じでない場合、それら2つの間で一方の系にある腫瘍010の座標を他方の座標と相関付けるために所定の変換マトリクスもしくは座標変換が使用されてもよい。
【0050】
対象となる治療位置の確認に向けての第1のステップとして、腫瘍または病変または器官010の実際の位置の位置測定と解像が、超音波診断装置002の部屋で実施された腫瘍または病変または器官010の位置測定と解像と同様に従来の放射線治療装置003の部屋で実施される。病変010(図15)の少なくとも1つの超音波映像020を発生するための手段028(図15)が、図15に描いたように、治療室に配置される。少なくとも1つの超音波映像020を発生するための手段028は従来の市販入手可能な超音波プローブ025(図15)を利用することが好ましい。
【0051】
腫瘍または病変または器官010(図16)の超音波映像020を発生するために超音波プローブ025は患者身体009(図15)と接触させられる。超音波プローブ025を移動または回転させることによって、腫瘍または病変または器官010の複数の超音波映像020(図16)を得ることができる。図16では、病変010は、各超音波映像の平面が超音波映像収集時の超音波プローブ025の配向を表わす複数の超音波映像020内に配置して示される。複数の超音波映像020から超音波データの三次元容積または像033(図17)の再構成が、治療装置003の絶対座標系019内で実行される。再構成された容積033のサイズに応じて、再構成容積033の周辺部で超音波データを利用できない場所があり得ることに留意すべきである。
【0052】
複数の超音波映像020から超音波データの三次元容積033を正確に再構成するために、治療装置003の絶対座標系019に関する超音波プローブ025の配向と位置(これ以降は配向と称する)が、各々の入手超音波映像020について判っていなければならない。図15に示したように、超音波プローブ025の幾何学的配向を表示するための手段026a、026bが治療装置003の部屋に配置されてもよい。全体をさらに充分に上述したが、治療装置003の絶対座標系019に関する超音波プローブ025の位置と配向を判定するための手段026a、026bとして、いずれの従来型位置感知システムを使用してもよい。診断超音波装置008に関して上述した系と必ずしも同じである必要はないが、両方の系が同じであることが便利なことがあり得る。超音波プローブ025または超音波プローブ025の幾何学的配向を表示する手段026a、026bのどちらも治療装置003の台018に固定されねばならないわけではない。
【0053】
超音波プローブ025の幾何学的配向を表示する手段026a−026bは治療装置003の絶対座標基準系019で位置合わせされるか、または当該技術で知られているようにそれに較正される。この位置合わせまたは較正が理由で、複数の超音波映像から由来するいずれの点または特徴についても、いかなる点の座標(A,B,C)、すなわち治療装置003の絶対座標系019内の腫瘍010も判る。この知見でもって、再構成された容積033(図17)内の各々の点について超音波映像データの値は当業者に知られている挿入アルゴリズムによって判定することができる。さらに、超音波映像データの容積033(図17)内のいずれの点または特徴についても、治療装置003の絶対座標系019内の座標(X,Y,Z)が判る。したがって、三次元超音波データ033(図17)によって描かれる腫瘍または病変または器官010の位置測定は完全である。さらに、病変010の外側表面の輪郭024(図18)は超音波三次元データ033(図17)内の任意の平面で規定することができる。これらの輪郭024は治療装置003の座標系019で病変の三次元表現034(図19)を適切に実行するのに使用することができる。
【0054】
いったん腫瘍または病変または器官010が治療装置003の部屋で位置測定されると、治療台018の位置、治療装置コリメータ004の回転、ならびに治療装置構台007の回転の必要な調整は以下の2つの方法のいずれかによって実行することができる。図20を参照すると、第1の方法は、治療プランの前に超音波診断装置002で得られた三次元超音波位置測定データ031内で輪郭作成された病変010の三次元表面022または輪郭021を治療装置003内の超音波装置025と028で得られた三次元超音波位置測定データ033内で輪郭作成された病変010の三次元表面034または輪郭024に重畳または整合させることによって、超音波診断装置002の絶対座標系011と治療装置003の座標系019の間の座標変換(4×4変換マトリクス)Rを達成する。輪郭と表面の整合のための従来の方法はチャンファ整合法および「トップアンドハット」最小二乗距離整合法、ならびにいかなる他の必要または望ましい方法も含み得る。
【0055】
超音波診断装置002の絶対座標系011と治療装置003の座標系019の間の座標変換Rを達成するための別の選択肢となる方法は、所定の輪郭または表面に頼らないものであって、図21に例示されている。この選択肢では、治療期の前に治療装置003の部屋で入手された再構成三次元超音波位置測定データ033と治療プラン設計の前に診断装置002の部屋で入手された三次元超音波位置測定データ031の間で映像の相互相関がとられる。座標変換は2つの三次元データのセット033と031の間の相関値の最大ピークを生じるように選択される。その後、治療台018の位置、治療装置コリメータ004の回転、ならびに治療装置構台007の回転の必要な調整の判定が4×4変換マトリクスTR−1の当業者に知られているアルゴリズムによる分解によって実行される。上述の前記2つの方法のいずれかによる超音波診断装置002の絶対座標系011と治療装置003の座標系019の間の座標変換Rの後に、治療台018の位置、治療装置コリメータ004の回転、ならびに治療装置構台007の回転の上述の前記調整以外の調整が着手されてもよいことは留意すべきである。これらは、初期に意図した放射線ビームの形状の単純な変更からビーム強度の変更および異なるビーム配列を備えた完全に新たな治療プランにまですら範囲が広がることもある。これらの調整は、図1に例示したようなワークステーション014上を走るソフトウェアで算出され、治療装置003と治療台制御器012に対するインターフェースである治療装置制御器015によって実行される。
【0056】
本発明の特定の好ましい実施形態を示して説明してきたが、特許請求項で述べたような本発明の精神と範囲から逸脱することなく変更および改造が為され得ることは当業者にとって明白であろう。したがって、本発明は添付の特許請求項によってのみ限定される。
【図面の簡単な説明】
【0057】
【図1】本発明の一実施形態の機能ブロックを示す図である。
【図2】映像台上に図式的に描いた患者を備えた従来の診断映像装置の透視図である。
【図3】図2の映像装置のさらなる透視図である。
【図4】図2の映像装置によって発生し、患者の身体内の病変の位置を描く映像の範例を示す図である。
【図5】図2の映像装置によって発生し、診断映像装置に関して判っている位置にあって診断映像もしくは複数映像上で視認できる複数基点を描く映像の範例を示す図である。
【図6】図5に描いたそれのような多数の診断映像から再構成された三次元診断映像データを表わす図である。
【図7】患者身体で病変の超音波映像を発生する手段を含む、図2の従来型診断映像装置の透視概略図である。
【図8】腫瘍または病変または器官の超音波映像を表わす図である。
【図9】図7の超音波装置で病変を撮った多数の超音波映像を示す透視図である。
【図10】診断映像装置の部屋で入手され、図9に描いた多数の超音波映像から再構成された三次元超音波映像データを表わす図である。
【図11】重畳もしくは組み合わされた三次元超音波および診断映像データのセットを表わす図である。
【図12】三次元超音波データ内の病変の二次元超音波像の配列を、病変がその輪郭化された外側表面を有するようにして表わす図である。
【図13】図12に描いた病変の輪郭から調製した映像外形の三次元的表現を示す図である。
【図14】回転長椅子、コリメータおよび構台を含む従来の放射線療法治療装置、または線形加速装置の透視図である。
【図15】患者体内の病変の超音波映像を発生するための手段を有する線形加速装置の透視概略図である。
【図16】図15の超音波映像装置で病変を撮影される多数の超音波映像を示す図である。
【図17】治療装置の部屋で入手され、かつ図16に描いた多数の超音波映像から再構成された三次元超音波映像を表わす図である。
【図18】図17の病変が輪郭化された外側表面を有するようにして、いくつかの二次元超音波映像を表わす図である。
【図19】図18からの複数の映像から作成された画像の輪郭の三次元描写である。
【図20】輪郭または表面登録に基づいて処理セッションの前に処置設定(台位置、コリメータ、およびガントリ回転)で補正の必要があるかを判断する方法を示す図である。
【図21】映像の相互相関に基づいて処理セッションの前に処置設定(台位置、コリメータ、およびガントリ回転)で補正の必要があるかを判断する方法を示す図である。
【技術分野】
【0001】
本発明は、放射線治療によって治療されるべき病変もしくは腫瘍の形態、形状、位置および構造がさらに優れた明確さで確認できることでその根絶のための治療プランがより良く設計される方法に関する。さらなる態様によると、本発明はまた、放射線治療の実施に先だつ放射線ビームもしくは複数ビームに関する病変の位置の確認のための方法と装置にも関する。本発明は、腫瘍のサイズ、場所および性質がその治療の前および期間中で判定され、更新され、追跡されることの可能な方法に関する。
【背景技術】
【0002】
癌性の腫瘍もしくは病変の現代の放射線治療の目標は腫瘍近辺の健全な組織および器官に対する最大量のあり得る損傷を回避しながら腫瘍を根絶することである。腫瘍の大多数は放射線反応性であるので、もしも充分な放射線投与が腫瘍に供給されるならば、それらは制御もしくは完全に根絶することができる。しかしながら、必要な殺腫瘍性の投与量の供給は腫瘍を取り巻く健全な組織の損傷に起因するかまたは腫瘍の近くに位置する他の健康な器官への損傷に起因する合併症に結びつく可能性がある。適合療法は、周囲の健全な組織または隣接する健全な器官への投与量を最少限にしながら腫瘍の外側表面で規定される領域に厳密に高い投与量の領域を合わせるために、正確な標的位置測定と焦点を絞った放射線の供給を組み合わせることを企てる放射線治療の手法である。様々な適合療法が当該技術でよく知られている。
【0003】
適合放射線治療はフォトン、電子またはその他の荷電粒子の高エネルギー放射ビームを発生することのできる専用の放射線ユニットを使用する。放射線ユニットは通常では放射線源を有し、それは放射線治療ユニットの回転可能な構台上に搭載される。構台の回転を通じて、放射線源が、通常では治療台に位置する患者の周りを回転させられ、治療すべき腫瘍もしくは病変に放射線ビームが向けられる。放射線治療ビームの形状が、患者の体を横切って腫瘍に至るときに放射線治療ビームで認められる腫瘍の輪郭をしっかりと取り囲むように合わせるために様々なタイプの装置が使用される。そのような装置の範例は、腫瘍の輪郭の形状をとるように放射線ビームの内外に個々に位置取り可能なコンピュータ制御された可動性の複数リーフもしくは複数フィンガーのセットから成るマルチリーフ・コリメータである。様々なタイプの放射線治療プランニング・システムが、いったん実行されると周囲の健全な組織または隣接する健全な器官を傷つけないで腫瘍に特定の投与量を供給する放射線治療プランを作成することができる。
【発明の開示】
【発明が解決しようとする課題】
【0004】
適合治療の基本的な問題は、(I)放射線治療プランの設計の前、および(II)放射線治療時に、標的、または病変もしくは腫瘍の場所あるいは場合によっては放射線ビームもしくは場の対象配置に関する健全な器官の場所を知ることである。放射線治療プランの設計に先だって、当該技術で知られているコンピュータ断層撮影(「CT」)映像装置、磁気共鳴映像(「MRI」)装置あるいは陽電子放射断層撮影(「PET」)映像装置といった従来の診断映像装置で患者の三次元映像を得ることによって患者内の標的容積の位置測定が実行される。これらの洗練された装置はGE Medical Systems、Marconi、Toshiba、Siemens、Phillipsその他のような様々な製造業者から入手できる可能性がある。
【0005】
現在のところ、治療が開始されると、放射線治療時の患者の位置と患者内の標的の位置の両方は治療プラン作成時点でそれらがあったのとほぼ同じであると想定される。しかしながら、(I)治療プラン作成前または(II)治療時にもしも標的容積の位置が正しく判定されない場合、放射線の適合投与量が患者体内の正しい場所に供給されない可能性があるという意味で治療の失敗が生じる可能性がある。もしも従来の映像モダリティーが当該の腫瘍もしくは病変あるいは器官の形状、場所および配向を完全に明らかにできないと、タイプ(I)の失敗が生じる可能性がある。すべての従来の診断映像装置が適切に、完全にもしくは充分に腫瘍の確かな形状、サイズおよび配向を判定するわけではなく、最新の診断映像装置を使用してもいくつかの腫瘍は充分に診断できないので、これは生じ得る。腫瘍の成長、体重減に起因する生理系の変化、または患者の呼吸といった様々な因子から生じることもあり得る器官の日々の移動(動き)の結果としてタイプ(II)の失敗が起こることもあり得る。タイプ(II)の失敗はまた、放射線治療ユニットの治療台上での患者の間違った位置取りから生じることもあり得る。
【0006】
上記の失敗を回避するために、現在の放射線治療プランは通常では放射の標的が患者の体内で実際よりも大きい空間を占めるように考慮し、それにより、より小さな腫瘍もしくは病変がその大きめの容積内に収まるであろう。結果として、腫瘍もしくは病変の周囲のある程度の健全な組織もしくは器官が腫瘍もしくは標的を対象とした最大放射線投与量で照射されるであろう。健全な組織または健全な器官の大きめの容積への最大放射線投与量の供給はこれらに損傷を与える危険性を増大させ、かつ、例えば、健全な周囲組織で将来の癌を促進する可能性がある。この理由のため、現在の適合放射線治療を用いる癌専門医は、非標的組織を傷つけないように標的器官のある程度の部分に不充分投与することによって治療の成功を譲歩する潜在的な欠点をもつ低めの放射線投与量を供給すると決定する可能性がある。
【0007】
前立腺癌の治療のために病変の位置測定を改善し、それによりタイプIの失敗を修正する試みで、或る方法がHolupkaらの米国特許第5,810,007号に開示され、それは経直腸プローブを利用して二次元超音波映像を発生するものである。その後、この映像はCTスキャンのような従来の診断映像装置で得られた映像に重畳される。上述の前記方法では、映像の登録は超音波映像と従来の診断映像装置で得られる映像の両方で少なくとも2つの目に見える基点の識別を必要とする。しかしながら、以下の欠点が上述の前記方法の利用性を制限する可能性がある。
【0008】
1.経直腸超音波プローブは病変もしくは器官をかなり移動させ、その結果、治療時にもしも経直腸プローブが再度挿入されない場合、病変の空間的位置について不正確な情報を供給する可能性がある。どのような事情であれ、治療開始前のプローブの挿入と取り外しは病変の移動、加えて腫瘍の位置測定に対するさらなる不確実性の原因となり得る。さらに、各治療期について経直腸プローブを挿入することは患者の有意な不快の原因となりかねず、この方法が医師の評判を得られない結果につながる。
【0009】
2.Holupkaは二次元映像だけを供給し、かつ2D超音波映像と従来の診断映像モダリティーで得られる映像が同じ平面で得られると想定している。このケースについては、両方の映像の2つの識別可能な基点は映像を登録および重畳するのに充分である。しかしながら、超音波映像と従来の診断映像装置から得られる映像が同じ映像平面にある映像を供給していることは確実ではなく、それゆえに、一方の映像が他方の平面から逸脱しているとこの方法の精度がかなり妥協的になる可能性がある。
【0010】
3.上述の前記方法は従来の診断映像モダリティーで得た二次元映像の上に二次元超音波映像を登録および重畳させる。したがって病変の超音波解像は単一の平面だけで実行される。三次元適合治療の目的については、病変の二次元解像は不完全であり、それゆえに、他の映像平面で病変の容積の範囲がさらに大きいかまたは小さいこともあり得るので不適当である。
【0011】
4.さらに、直腸、下部大腸、および前立腺といった極めて限定された数の腫瘍に関してのみ使用可能であるのでHolupkaは限定された出願である。それは他のタイプの腫瘍に使用することができない。
【0012】
タイプIIの失敗を修正する試みで、Carolの米国特許第5,411,026号によって、放射線治療期の前に標的もしくは病変の部分を確認するために別のシステムが提案された。そのシステムは患者体内の病変の少なくとも1つの超音波映像を得るための超音波映像装置、および放射線治療装置の位置に関する超音波映像発生装置もしくはプローブの位置を示す装置を含む。上述の前記システムは、少なくとも1つの超音波映像上に解像される病変の外側表面の輪郭をコンピュータ断層撮影(「CT」)または場合によっては磁気共鳴映像(「MRI」)装置によって得られて放射線治療プランの設計に使用される少なくとも1つの診断映像と比較することで、治療期直前の病変の実際の位置が放射線治療プランにある病変の所望の位置と一致することを確認する。しかしながら、以下の欠点が上述の前記システムの利用性を限定する可能性がある。
【0013】
1.超音波映像もしくは複数映像中の腫瘍または病変または器官の外見は従来の診断装置で得られる映像中の腫瘍または病変または器官のそれとは異なる外見を有する可能性がある。したがって、異なる映像装置で得られる映像に現れる腫瘍または病変または器官の外側表面の輪郭を比較する方法は、これらの表面が外見と範囲の両方で異なることもあり得るので不正確である可能性がある。言い換えると、Carolはリンゴとオレンジを比較し、それが腫瘍の不完全な評価に結びつく。適合治療の傾向は放射線の的確な投与量のさらに正確な空間的供給へと向いているので、この欠点は極めて重大である。
【0014】
2.Carolはまた、タイプIの失敗に対処しておらず、それによりコンピュータ断層撮影または磁気共鳴映像装置で得られる診断映像は、或る場所の或る腫瘍に関する前記装置の固有の制限のせいで、腫瘍または病変または器官の場所または範囲を完全に明らかにすることはない。さらに、もしもコンピュータ断層撮影または磁気共鳴診断映像が腫瘍または器官または病変を明らかにしないかまたは完全に明らかにしない場合、Carolは1つまたは複数の超音波映像上に輪郭の現れた腫瘍または病変または器官の外側表面との比較のための基準として役立つ外側表面の輪郭を示す手段に欠けているであろう。
【0015】
従来の技術の上述の説明の観点で、本発明の目的はしたがって、以上に規定したタイプIとタイプIIの失敗の発生率を低減させる放射線治療の改善された方法と装置を提供することである。
【0016】
放射線治療の準備に腫瘍の正確な位置測定、サイズ判定および解像のための新しい方法と装置を提供することが本発明の別の目的である。
【0017】
治療プランのプラン作成ステージで超音波映像化の使用法を提供することが本発明の目的である。
【0018】
標的の解像と位置測定のための超音波映像もしくは複数の超音波映像を確立し、かつこの映像もしくは複数の超音波映像をコンピュータ断層撮影(「CT」)映像装置、磁気共鳴映像(「MRI」)装置または陽電子放射映像装置(「PET」)といった従来の診断映像装置、あるいは、例えば、診断装置の将来のタイプのような何らかの他のタイプで得られる放射線治療のシミュレータ映像に相関付けるための改善された方法と装置を提供することが本発明のさらなる目的である。
【0019】
病変の三次元超音波映像をCTまたはMRIまたは別の超音波映像のような別の三次元病変映像に三次元的に重ね合わせるための新たな方法を提供することもやはり本発明の目的である。
【0020】
従来の診断映像の収集の直前または直後に得られる超音波映像もしくは複数の超音波映像の、放射線治療期直前に得られる超音波映像もしくは複数の超音波映像に対する登録に基づいて放射線治療ビームに関して標的を正確に位置決めするための改善された方法と装置を提供することが本発明のさらに別の目的である。
【0021】
本発明は、(a)放射線治療プランニングのための病変位置測定および腫瘍または病変または器官の解像、および(b)放射線治療中の病変位置の確認と修正のための方法と装置に関する。
【課題を解決するための手段】
【0022】
一態様によると、本発明は腫瘍または病変または器官または身体のいずれかの他の領域の位置測定、サイズ測定、解像および配向測定を向上させるためにいくつかのステップを含むことがあり得る。本発明がヒトの癌治療を考慮することもあり得るが、ヒトと動物両方の他の非癌性治療の医療用途にもやはり使用可能であることは理解される。
【0023】
一般的態様によると、腫瘍の位置測定、サイズ測定などは腫瘍の治療もしくは根絶、あるいは他のいずれかの必要もしくは要求のある医学的調査のための治療プランを考案するために必要となる可能性がある。それらのステップは、従来の診断映像装置の台上に患者を配置するステップ、例えばCT、MRIまたはPETスキャンといったいずれかの知られている従来の診断映像装置を使用して診断映像もしくは複数の診断映像を収集するステップを含むことがあり得る。前記収集は、診断映像もしくは複数映像の幾何学的配向が診断映像装置に関して決定可能となるように患者の表面に配置されたいくつかの基点の使用、発生する各超音波映像について診断映像装置に関して知られている幾何学的配向で配置された超音波映像発生手段による、診断映像を収集する直前または直後の超音波映像もしくは複数の超音波映像の入手、超音波映像もしくは複数映像と幾何学的配向に関して予め知見のある診断映像もしくは複数映像の重畳(当該技術で融合として知られている)または組合せ、超音波映像もしくは複数映像上への腫瘍または病変または器官の外側表面の輪郭形成および診断映像もしくは複数映像上への上述の前記外側表面の同時表示、腫瘍または病変または器官の外側表面の上述の前記輪郭の放射線治療プラン設計への使用を含むことがあり得る。
【0024】
放射線治療装置に関する腫瘍または病変または器官の位置の確認に関連して、本発明は、放射線治療装置の治療台に患者を配置するステップ、患者体内の病変の少なくとも1つの超音波すなわちUSの映像を知られている幾何学的配向で配置されたUS映像発生手段、つまりプローブで各々の発生US映像について発生させるステップ、上述の前記超音波映像もしくは複数映像を診断映像収集時に得られた超音波映像もしくは複数映像と比較し、それによって放射線治療装置に関する腫瘍または病変または器官の位置が確認可能となり、放射線治療プランにある腫瘍または病変または器官の所望の位置との一致を確立するステップを含むことがあり得る。
【0025】
本発明の別の特徴は、放射線治療期の直前に得られた超音波映像もしくは複数映像を診断映像収集の直前または直後に得られた超音波映像もしくは複数映像と比較または登録する方法を含み得る。この方法は、輪郭を必要としない階調映像補正あるいは場合によっては診断および放射線治療室で得られた超音波映像もしくは複数映像上に規定される腫瘍または病変または器官の外側表面の輪郭から成る(当該技術で知られているような)幾何学的目標物の登録を使用することがあり得る。
【0026】
上述の前記映像の比較の結果として、本発明の別の特徴は放射線治療プランによって処方された所望の位置に腫瘍または病変または器官を配置するために必要な腫瘍または病変または器官の配置を決定するステップである。本発明のさらなる特徴は、制限されないが、放射線治療装置に関して治療台を回転、放射線治療装置のコリメータを回転、ならびに放射線治療装置の構台を回転、あるいは以上を組み合わせた、放射線治療装置に関して治療台を移動させることによる上述の決まった腫瘍または病変または器官の移動を実行するステップを含むことがあり得る。
【0027】
したがって、本発明の一態様によると、
放射線治療のプランニングの目的のために腫瘍を空間的に位置測定する方法が供給され、その方法は、
CATスキャン、PETスキャン、CTスキャンを含むグループから選択される診断映像装置を使用して前記腫瘍の1つまたは複数の診断映像を発生するステップ、
絶対座標基準系を使用して第1の三次元座標に前記診断映像上の前記腫瘍を割り当てるステップ、
超音波装置を使用して前記腫瘍の1つまたは複数の超音波映像を発生するステップ、
前記絶対座標基準系を使用して第2の三次元座標に前記超音波映像上の前記腫瘍を割り当てるステップ、
腫瘍の正確な映像を得るために前記第1および前記第2の三次元座標を使用して前記超音波映像と前記映像を融合するステップを含む。
【0028】
さらなる実施形態によると、本発明は、
放射線治療のプランニングの目的のために腫瘍を空間的に位置測定する方法を供給し、その方法は、
前記腫瘍の予測位置近辺で患者に複数の基点を設置するステップ、
絶対座標系を使用して第1の三次元座標を前記複数基点に割り当てるステップ、
CATスキャン、PETスキャン、CTスキャンを含むグループから選択される診断映像装置を使用して前記腫瘍の1つまたは複数の診断映像を発生するステップを含み、前記少なくとも1つの診断映像がその上に前記腫瘍の映像を有してさらに前記複数基点を有し、
前記複数基点の前記第1の三次元座標を基準として使用して前記少なくとも1つの診断映像上の前記腫瘍を第2の三次元座標に割り当てるステップ、
超音波装置を使用して前記腫瘍の1つまたは複数の超音波映像を発生するステップを含み、前記少なくとも1つの超音波映像がその上に前記腫瘍の映像を有してさらに前記複数基点を有し、
前記複数基点の前記第1の三次元座標を基準として使用して前記超音波映像上の前記腫瘍を第3の三次元座標に割り当てるステップ、
腫瘍の正確な映像を得るために前記第2および前記第3の三次元座標を使用して前記超音波映像と前記映像を融合するステップを含む。
【0029】
本発明のまたさらなる態様によると、
放射線治療のプランニングの目的のために腫瘍を空間的に位置測定する方法が供給され、その方法は、
前記腫瘍の予測位置近辺で患者に複数の基点を設置するステップ、
絶対座標系を使用して第1の三次元座標を前記複数基点に割り当てるステップ、
CATスキャン、PETスキャン、CTスキャンを含むグループから選択される診断映像装置を使用して前記腫瘍の1つまたは複数の診断映像を発生するステップを含み、前記少なくとも1つの診断映像がその上に前記腫瘍の映像を有してさらに前記複数基点を有し、
前記複数基点の前記第1の三次元座標を基準として使用して前記少なくとも1つの診断映像上の前記腫瘍を第2の三次元座標に割り当てるステップ、
超音波装置を使用して前記腫瘍の1つまたは複数の超音波映像を発生するステップを含み、前記少なくとも1つの超音波映像がその上に前記腫瘍の映像を有し、
前記1つまたは複数の超音波映像の位置と配向を知ることができるように構成された位置測定システムを使用し、それによって前記1つまたは複数の超音波映像上の腫瘍が前記絶対座標基準系で第3の三次元座標を割り当てられることを可能にするステップ、
腫瘍の正確な映像を得るために前記第2および前記第3の三次元座標を使用して前記超音波映像と前記映像を融合するステップを含む。
【0030】
本発明のまた別の態様によると、
放射線治療のプランニングの目的のために腫瘍を空間的に位置測定するシステムが供給され、そのシステムは、
CATスキャン、PETスキャン、CTスキャンを含むグループから選択され、前記腫瘍の少なくとも1つの診断映像を発生するように構成された診断映像装置、
前記腫瘍の少なくとも1つの超音波映像を発生するように構成された超音波装置、
前記腫瘍が前記診断映像上では第1の三次元座標で、前記超音波映像上では第2の三次元座標で割り当てられるように絶対座標基準系を供給するための手段、 前記腫瘍の正確な映像を得るために前記第1の三次元座標および前記第2の三次元座標を使用して前記診断映像と前記超音波映像を融合するための手段を含む。
【発明を実施するための最良の形態】
【0031】
本発明の方法と装置の実施形態の例示は、図面から派生する装置と映像の構成要素で示される。図1の概略図に本発明の実施形態が概して図解されている。本発明の目的のうちの1つ、すなわち腫瘍010のサイズ、位置および配向の最も精度の高い解像度を得ることを達成するために、腫瘍010を含むと考えられる患者身体009の標的領域が2つの別個の診断装置を使用して走査または診断され、かつ結果的に得られる映像が比較されてもよいことが判明した。これはMRI、CTまたはPETを含むグループから選択される診断装置の使用を通じて入手される腫瘍010の映像をAcuson、GE Medical Systems、Siemens、Toshibaその他のそれらのような超音波装置で得られる腫瘍010の映像と比較することによって達成されることもあり得る。2つの映像が入手される順序は、それらの映像が、限定はされないが例えば他方の1時間以内の短時間内で入手される限り概して重要ではない。
【0032】
この態様によると、入手されることになる第1の映像は、例えば、診断装置002の使用を通じて収集されてもよく、それは例えばコンピュータ断層撮影(「CT」)スキャナ、磁気共鳴映像(「MRI」)スキャナ、または場合によっては陽電子放射断層撮影(「PET」)スキャナ、またはいずれかの他の同等の装置、またはいずれかの他の映像作成診断装置であってもよい。図2を参照すると、対象となる腫瘍または病変または器官010を有する患者009がその上に配置される可能性のある従来の映像台001を備えた(従来の)診断映像装置002が図式的に示されている。診断映像装置002は体組織の断層映像023または「スライス」を作成することが可能であり、そのような「スライス」は図示した対象となる腫瘍または病変または器官010でもって図4に図式的に描かれる。例えば図3に示したように、診断映像装置002のスライス入手空間017で診断映像装置002と患者009の間の相対的な動きを引き起こすことによっていくつかの診断映像023を入手することができる。図6は患者009の部分または断層面の(連続した)複数の診断映像023から形成または再構成される三次元映像027を描くものである。
【0033】
診断映像装置002で得られるような腫瘍010の映像は図1に示したような超音波装置005、008で撮られる同じ腫瘍の映像と比較されることになるので、腫瘍が参照される、すなわち前記比較を有効化することのできる座標のセットを与えられる必要がある。例えば、前記座標は診断映像装置002と超音波映像装置005、008の両方で別々であってもよい。しかしながら、座標系は、診断映像装置002で見られる腫瘍010の位置を超音波映像装置005、008で見られる腫瘍010の位置と相関付けることができなければならないこともあり得る。したがって、絶対座標系011が確立されることが必要となる可能性がある。
【0034】
その目的のために、絶対座標系011上の腫瘍010に絶対座標を割り当てる手段が供給されてもよく、その絶対座標が、例えば腫瘍010のCT映像をその超音波映像と相関付けるのに使用されてもよい。そうするために、基点としても知られるいくつかのマーカ、例えば、図5に例示したような3つの基点029が診断映像023の入手に先だって患者の身体上に病変の近辺もしくは周囲で設置されてもよい。1つの実践によると、基点029はすべて同じ平面に設置されてもよい。基点(それらは診断映像中で容易に見るかまたは識別することのできるいずれかの物理的マーカであってもよい)の位置は、その後、いずれかの知られているシステム、例えば計測システムの使用を通じて絶対座標系011内で確認されてもよい。
【0035】
計測システムはどのような知られている形状または形式をとってもよい。例えば、一実施形態では計測システムは1つまたは複数のレーザ、またはレーザ・システムを含み、それらのレーザは、例えば、診断映像装置002が配置される部屋の壁または天井に配置されてもよい。そのような計測システムは当該技術で知られており、例えばCamar Electricから市販入手される製品Cermaligne、モデル番号CL 505−CH2であってもよい。レーザまたはいずれかの他の適切な装置は複数基点に向けられ、基点を離れて供給源またはいずれかの他の計測装置へと跳ね返されたレーザ・ビームを通じて、基点の座標が判定され、割り当てられてもよい。結果として、基点が絶対座標、例えば図5に例示したようなX1、Y1、Z1を割り当てられてもよい。計測システムはその後、基点の前記絶対座標を診断映像装置にダウンロードするかまたは転送する。
【0036】
同じスライス上に基点029と腫瘍010の両方を示す図5に例示したスライス023から、その後、絶対座標系011の絶対座標を腫瘍010のいかなる点にも割り当てることができることもあり得る。これは映像スライス023に描いたような基点029と腫瘍010の相対位置に基づく単純な相関を通じて為されてもよく、かつスライス023の映像座標系030内で測定されてもよい。基点029の座標は絶対座標系011内であることが判っており、腫瘍010の相対的位置は図5のスライス023に示した情報から基点029に関して判っているので、腫瘍010のいずれかの点、例えばX2、Y2、Z2に絶対座標を割り当てるように変換マトリクスまたは座標変換を決定するのに、当業者に知られている適合化アルゴリズムを使用することができる。診断映像023または027内のいずれかの目標の座標(X,Y,Z)の判定はこの方式で達成可能であり、したがって絶対座標系011内で絶対座標を割り当てることができる。
【0037】
図4と図5は患者009を通して配置された絶対座標系011を有するように示されているが、前記絶対座標系011が身体009を通してではなく配置されてもよいことは理解される。
【0038】
腫瘍010のサイズ、場所および配向の判定での追加的なステップが図7で例示可能であり、そこでは病変010の少なくとも1つの超音波映像016を発生するための手段005、008が示される。少なくとも1つの超音波映像を発生するための前記手段008は診断映像装置002が設置される診断映像室に配置されてもよい。超音波映像016を発生するための前記手段008は従来の、市販入手可能な超音波プローブ005を利用してもよい。図8に例示したように、腫瘍または病変または器官010の超音波映像もしくは映像016を発生するために、超音波プローブ005は患者身体009との接触へと持ち込まれる。図9に例示したように、超音波プローブ005を移動、置き換えまたは回転させることによって、腫瘍または病変または器官010の複数の超音波映像016を様々な平面で得ることができる。図9では、病変010は、各々の超音波映像の平面が超音波映像収集時の超音波プローブ005の配向を表わす複数の超音波映像016内に配置されて示されている。見て判るように、それらの平面は必ずしも互いに平行である必要はない。複数の超音波映像016から超音波データの三次元容積もしくは像031(図10)の再構成を実行することができる。
【0039】
超音波データから正確に三次元容積031を再構成するため、および絶対座標系011で絶対座標を割り当てるために、絶対座標系011に関して超音波プローブ005の配向と位置(これ以降は配向と称する)が、腫瘍010の各超音波映像の作成時に判っていなければならない。これを達成するために、超音波プローブ005の(空間的)配向を表示するための手段006a、006bが使用されてもよく、特に、図7に示したように診断装置002の部屋に配置されてもよい。いかなる位置感知システムも超音波プローブ005の位置と配向を判定する手段006a、006bとして使用可能である。例えば、そのようなシステムはしばしば総称的に追跡システムと称されて当該技術では知られており、Ascension Technology Corporation、InterSense、Northern Digital Inc.、Motion Analysis Corp.その他から市販入手可能である。前記位置感知手段006aと006bの使用は絶対座標系011に関して前記プローブの位置の判定を可能にすることができる。例えば、限定されるものではないが、位置測定システムは、超音波プローブに装着された光放出もしくは反射マーカを見据える部屋に固定のカメラ・システム、プローブ005に装着される発射器および時間的測定とその結果得られる幾何学的三角法によってこれら発射器までの距離を測定して超音波プローブ005の位置と配向を判定する検出器を備えた超音波システム、超音波プローブ005が取り付けられた機械的アームを基礎にした位置測定システムを含んでもよい。超音波プローブ005と超音波プローブ005の幾何学的配向を示すための手段006a、006bのいずれも、診断映像装置002の台001に固定されねばならないわけでないことに留意すべきである。
【0040】
超音波プローブ005の座標と幾何学的配向を判定するための手段006a、006bは絶対座標系、例えばレーザに組み合わされ、位置合わせされ、接続され、または較正される。この位置合わせもしくは較正の結果として、超音波映像016内のいかなる点もしくは特徴の絶対座標基準系011内の座標(X,Y,Z)も確認可能となる。言い換えると、図10に例示したように、超音波映像で得られる腫瘍010の絶対座標を判定するのに絶対座標系011の基礎を形成し得るレーザが使用可能である。
【0041】
絶対座標系011は診断映像装置002と超音波装置005の両方に共通であるので、両方のシステムに関して腫瘍010の位置を正確に相関付けることが可能である。この知見で、再構成された容積031(図10)内の各点について超音波映像データの値が、当業者に知られている挿入アルゴリズムによって判定可能である。収集の制御と融合のソフトウェアは図1に例示したように専用のコンピュータまたはワークステーション013で実行されてもよい。病変の輪郭描写および表現の処理を容易にするのに、標準的な細分化およびその他の映像強調ツールが利用可能である。
【0042】
複数の超音波映像016の収集は複数の診断映像023の収集の前もしくは直ぐ後(すなわち直前または直後)に為されるので、超音波三次元映像データ031と診断三次元映像027は2つの時間的に極めて近い瞬間で患者の解剖学的構造の空間的にオーバーラップした容積または断層面の像を表わす。多数の解剖学的構造部位について、治療プランニングに必要な精度内でこれら2つの時間的に極めて近い瞬間の患者の解剖学的構造は変化せず、したがって超音波三次元映像データ031と診断三次元映像データ027の両方が時間的に同一で空間的にオーバーラップする同じ患者の解剖学的構造の断層面を表わす。超音波三次元映像データ031と診断三次元映像データ027の両方の位置と配向が診断装置022の絶対座標系011に関して各々判っていることを条件として、超音波三次元映像データ031と診断三次元映像データ027の両方は重畳、すなわち図11に例示したように正確に重畳され得る。
【0043】
超音波三次元映像データ031と診断三次元映像データ027が組み合わされると、病変010の外側表面の輪郭022は超音波三次元映像データ031または診断三次元映像データ027内で任意に選択可能(図12)となり、かつ超音波三次元映像データ031または診断三次元映像データ027内のそれらの正しい場所で表示可能となる。これらの輪郭022は診断三次元映像データ027内の病変の三次元表現021を実行するのに使用することができる(図13)。この方式で、病変010は(1)診断装置002の絶対座標基準系011に関して位置測定および規定され、(2)診断三次元映像データ027内で位置測定、規定および可視化される。上述の(1)と(2)が理由で、放射線治療プランが従来の方式で設計可能となり、必要な放射線を病変010に供給できる。たとえ病変010が診断映像装置002、または場合によっては超音波装置005で入手される映像もしくは複数映像023によって完全に可視化されていなくてもこれはそうである。しかしながら、それら2つを組み合わせることは腫瘍010のさらに正確な像を形成する。その後、それによって放射線ビームの形状が病変の空間的輪郭または外形022が合致するであろう例えば適合プランのような放射線治療プランが設計可能となる。
【0044】
加えて、もしも上述の手法で健全な器官010が位置測定および輪郭化されるならば、放射線治療プランは器官010への過剰な放射線損傷を回避するように設計されることが好ましいであろう。超音波三次元映像データ031、診断三次元映像データ027、病変010の外側表面の輪郭022および病変010の三次元表現021がそれから、図1に例示したようなワークステーション013から、やはり図1に例示したような放射線治療装置003の制御領域のコンピュータまたはワークステーション014へと伝送され、放射線治療期に先立つ腫瘍または病変または器官010の治療位置の確認のために基準データとして役立つこともあり得る。
【0045】
診断映像027と超音波映像031の間の上述の比較がこの後に説明する方法の必要ステップでないことは理解される。したがって、本発明の追加的な実施形態に従い、かつ上述のタイプIIの失敗を避けるためには、放射線治療の開始直前の腫瘍010を治療プランの中で規定された同じ腫瘍010と比較することが必要になる可能性がある。これは、腫瘍のあらゆる変化、すなわちそのサイズ、位置、配向などが、もしも必要であれば治療プランの変更を通じて考慮され得ることを確実化する。これを達成するために、腫瘍の超音波010は、全体を上述したように、超音波装置008と005を使用して治療プラン中にとられてもよい。診断段階での超音波の撮影と連係した絶対座標系011の使用が前記腫瘍010に絶対座標を割り当てるために必要となることもある。
【0046】
放射線治療期の始まりに先立って、腫瘍または病変または器官010の位置の確認が以下の方式で進行してもよい。図14を参照して、腫瘍または病変または器官010を持つ患者は、これ以降は線形加速装置と称する従来の治療装置003の治療台018上に配置されてもよい。ここで述べる方法がいずれの知られている、または将来の放射線治療装置、あるいはいずれの他のタイプの治療装置で使用されてもよいことは理解される。同じ患者は、ほんの少し前といった過去に、診断段階の間で腫瘍010のサイズ、形状および配向を判定するために実施された超音波を持っていて、全体は上述した。前記超音波の間で、前記腫瘍に絶対座標(X,Y,Z)が割り当てられた。図14に描いたように、治療室での治療期に、治療台018上の患者の腫瘍または病変または器官010の位置(できれば配向と形状を含む)、言い換えると絶対座標は、疑いなく、以前の診断段階の間で割り当てられた腫瘍010の絶対座標と異なるであろう。これは含まれる機械類の異なるサイズと形状、患者009の姿勢の違い、および腫瘍010それ自体が成長、縮退、または移動した可能性があるという事実を含む様々な因子に起因する可能性がある。
【0047】
したがって、腫瘍010の位置のこの違いを考慮に入れて補償できるようにすることが大切である。そうするために、共通の、すなわち超音波装置008と治療装置003に共通した絶対的な基準フレームまたは系が考え出され、超音波映像装置008で認識される腫瘍010と、おそらく異なる物理的配置に置かれる線形加速装置003で治療される前に超音波で認識される同じ腫瘍010の間の位置を相関付けることが可能にならねばならない。
【0048】
これは上述したような類似した測定システムの使用を通じて達成可能であり、そのシステムは、例えば、治療室の壁もしくは天井に配置されるレーザ(図1の019)を有してもよい。超音波008と005を備えて診断室で使用される測定システムは、厳密に必要でなくとも、治療室で使用される測定システムと同じであることもあり得る。しかしながら、両方のシステムは診断超音波装置008と治療装置003の両方に共通した基準フレームを与えるように較正されるべきである。結果として、超音波診断装置005の絶対座標基準系011と治療装置003の絶対座標系019が(図17に例示したように)両方に共通であって相関付け可能な座標を与えることがあり得る。結果として、病変010の対象となる治療位置032(できれば配向を含む)は、図2から図13で以前に説明および例示した位置測定と解像方法で超音波映像装置002によって前もって判定された病変010の空間座標および範囲から算出されてもよい。
【0049】
通常、治療プランニングの行程で4×4の変換マトリクスTが判定されることがあり、それは患者に適用されると、治療台018、治療装置コリメータ004ならびに治療装置構台007の機械的動きによって腫瘍または病変または器官010を所望の治療位置へと移動させる。もしも超音波診断装置002の絶対座標基準系011と治療装置003の絶対座標系019が同じでない場合、それら2つの間で一方の系にある腫瘍010の座標を他方の座標と相関付けるために所定の変換マトリクスもしくは座標変換が使用されてもよい。
【0050】
対象となる治療位置の確認に向けての第1のステップとして、腫瘍または病変または器官010の実際の位置の位置測定と解像が、超音波診断装置002の部屋で実施された腫瘍または病変または器官010の位置測定と解像と同様に従来の放射線治療装置003の部屋で実施される。病変010(図15)の少なくとも1つの超音波映像020を発生するための手段028(図15)が、図15に描いたように、治療室に配置される。少なくとも1つの超音波映像020を発生するための手段028は従来の市販入手可能な超音波プローブ025(図15)を利用することが好ましい。
【0051】
腫瘍または病変または器官010(図16)の超音波映像020を発生するために超音波プローブ025は患者身体009(図15)と接触させられる。超音波プローブ025を移動または回転させることによって、腫瘍または病変または器官010の複数の超音波映像020(図16)を得ることができる。図16では、病変010は、各超音波映像の平面が超音波映像収集時の超音波プローブ025の配向を表わす複数の超音波映像020内に配置して示される。複数の超音波映像020から超音波データの三次元容積または像033(図17)の再構成が、治療装置003の絶対座標系019内で実行される。再構成された容積033のサイズに応じて、再構成容積033の周辺部で超音波データを利用できない場所があり得ることに留意すべきである。
【0052】
複数の超音波映像020から超音波データの三次元容積033を正確に再構成するために、治療装置003の絶対座標系019に関する超音波プローブ025の配向と位置(これ以降は配向と称する)が、各々の入手超音波映像020について判っていなければならない。図15に示したように、超音波プローブ025の幾何学的配向を表示するための手段026a、026bが治療装置003の部屋に配置されてもよい。全体をさらに充分に上述したが、治療装置003の絶対座標系019に関する超音波プローブ025の位置と配向を判定するための手段026a、026bとして、いずれの従来型位置感知システムを使用してもよい。診断超音波装置008に関して上述した系と必ずしも同じである必要はないが、両方の系が同じであることが便利なことがあり得る。超音波プローブ025または超音波プローブ025の幾何学的配向を表示する手段026a、026bのどちらも治療装置003の台018に固定されねばならないわけではない。
【0053】
超音波プローブ025の幾何学的配向を表示する手段026a−026bは治療装置003の絶対座標基準系019で位置合わせされるか、または当該技術で知られているようにそれに較正される。この位置合わせまたは較正が理由で、複数の超音波映像から由来するいずれの点または特徴についても、いかなる点の座標(A,B,C)、すなわち治療装置003の絶対座標系019内の腫瘍010も判る。この知見でもって、再構成された容積033(図17)内の各々の点について超音波映像データの値は当業者に知られている挿入アルゴリズムによって判定することができる。さらに、超音波映像データの容積033(図17)内のいずれの点または特徴についても、治療装置003の絶対座標系019内の座標(X,Y,Z)が判る。したがって、三次元超音波データ033(図17)によって描かれる腫瘍または病変または器官010の位置測定は完全である。さらに、病変010の外側表面の輪郭024(図18)は超音波三次元データ033(図17)内の任意の平面で規定することができる。これらの輪郭024は治療装置003の座標系019で病変の三次元表現034(図19)を適切に実行するのに使用することができる。
【0054】
いったん腫瘍または病変または器官010が治療装置003の部屋で位置測定されると、治療台018の位置、治療装置コリメータ004の回転、ならびに治療装置構台007の回転の必要な調整は以下の2つの方法のいずれかによって実行することができる。図20を参照すると、第1の方法は、治療プランの前に超音波診断装置002で得られた三次元超音波位置測定データ031内で輪郭作成された病変010の三次元表面022または輪郭021を治療装置003内の超音波装置025と028で得られた三次元超音波位置測定データ033内で輪郭作成された病変010の三次元表面034または輪郭024に重畳または整合させることによって、超音波診断装置002の絶対座標系011と治療装置003の座標系019の間の座標変換(4×4変換マトリクス)Rを達成する。輪郭と表面の整合のための従来の方法はチャンファ整合法および「トップアンドハット」最小二乗距離整合法、ならびにいかなる他の必要または望ましい方法も含み得る。
【0055】
超音波診断装置002の絶対座標系011と治療装置003の座標系019の間の座標変換Rを達成するための別の選択肢となる方法は、所定の輪郭または表面に頼らないものであって、図21に例示されている。この選択肢では、治療期の前に治療装置003の部屋で入手された再構成三次元超音波位置測定データ033と治療プラン設計の前に診断装置002の部屋で入手された三次元超音波位置測定データ031の間で映像の相互相関がとられる。座標変換は2つの三次元データのセット033と031の間の相関値の最大ピークを生じるように選択される。その後、治療台018の位置、治療装置コリメータ004の回転、ならびに治療装置構台007の回転の必要な調整の判定が4×4変換マトリクスTR−1の当業者に知られているアルゴリズムによる分解によって実行される。上述の前記2つの方法のいずれかによる超音波診断装置002の絶対座標系011と治療装置003の座標系019の間の座標変換Rの後に、治療台018の位置、治療装置コリメータ004の回転、ならびに治療装置構台007の回転の上述の前記調整以外の調整が着手されてもよいことは留意すべきである。これらは、初期に意図した放射線ビームの形状の単純な変更からビーム強度の変更および異なるビーム配列を備えた完全に新たな治療プランにまですら範囲が広がることもある。これらの調整は、図1に例示したようなワークステーション014上を走るソフトウェアで算出され、治療装置003と治療台制御器012に対するインターフェースである治療装置制御器015によって実行される。
【0056】
本発明の特定の好ましい実施形態を示して説明してきたが、特許請求項で述べたような本発明の精神と範囲から逸脱することなく変更および改造が為され得ることは当業者にとって明白であろう。したがって、本発明は添付の特許請求項によってのみ限定される。
【図面の簡単な説明】
【0057】
【図1】本発明の一実施形態の機能ブロックを示す図である。
【図2】映像台上に図式的に描いた患者を備えた従来の診断映像装置の透視図である。
【図3】図2の映像装置のさらなる透視図である。
【図4】図2の映像装置によって発生し、患者の身体内の病変の位置を描く映像の範例を示す図である。
【図5】図2の映像装置によって発生し、診断映像装置に関して判っている位置にあって診断映像もしくは複数映像上で視認できる複数基点を描く映像の範例を示す図である。
【図6】図5に描いたそれのような多数の診断映像から再構成された三次元診断映像データを表わす図である。
【図7】患者身体で病変の超音波映像を発生する手段を含む、図2の従来型診断映像装置の透視概略図である。
【図8】腫瘍または病変または器官の超音波映像を表わす図である。
【図9】図7の超音波装置で病変を撮った多数の超音波映像を示す透視図である。
【図10】診断映像装置の部屋で入手され、図9に描いた多数の超音波映像から再構成された三次元超音波映像データを表わす図である。
【図11】重畳もしくは組み合わされた三次元超音波および診断映像データのセットを表わす図である。
【図12】三次元超音波データ内の病変の二次元超音波像の配列を、病変がその輪郭化された外側表面を有するようにして表わす図である。
【図13】図12に描いた病変の輪郭から調製した映像外形の三次元的表現を示す図である。
【図14】回転長椅子、コリメータおよび構台を含む従来の放射線療法治療装置、または線形加速装置の透視図である。
【図15】患者体内の病変の超音波映像を発生するための手段を有する線形加速装置の透視概略図である。
【図16】図15の超音波映像装置で病変を撮影される多数の超音波映像を示す図である。
【図17】治療装置の部屋で入手され、かつ図16に描いた多数の超音波映像から再構成された三次元超音波映像を表わす図である。
【図18】図17の病変が輪郭化された外側表面を有するようにして、いくつかの二次元超音波映像を表わす図である。
【図19】図18からの複数の映像から作成された画像の輪郭の三次元描写である。
【図20】輪郭または表面登録に基づいて処理セッションの前に処置設定(台位置、コリメータ、およびガントリ回転)で補正の必要があるかを判断する方法を示す図である。
【図21】映像の相互相関に基づいて処理セッションの前に処置設定(台位置、コリメータ、およびガントリ回転)で補正の必要があるかを判断する方法を示す図である。
【特許請求の範囲】
【請求項1】
放射線治療の為に病変を空間的に規定する為のシステムであって、
第1および第2の座標基準系において、前記病変の時間的に離れた、計画段階で得られる第1の超音波映像および治療の直前に得られる第2の超音波映像の組を作成するために超音波装置を操作する手段と、
前記第1と第2の座標基準系を整合する手段と、
該整合に基づき、該病変について変化の識別を容易にする為に、計画段階における超音波映像の該第1組および治療段階における第2組を重ね合わせる手段と、
第3の座標基準系において、前記第2組の超音波映像と実質的に同時に、非超音波映像の組を作成するために非超音波診断映像装置を操作する手段と、
該第2と第3の座標基準系を整合し、該整合に基づき、該第2の超音波映像の組と前記非超音波映像の組とを整合し、該病変の一連の合成映像にする手段と
を含むシステム。
【請求項2】
前記第2の座標基準系を、放射線治療装置に対応付けられた第3の座標基準系に整合する手段と、
該整合に基づき、該第2座標基準系において、撮像された該病変に対して放射線をあてるために、該放射線治療装置を操作する手段と
をさらに含み、
前記第2の超音波映像の測定を治療装置内の超音波測定装置により行う請求項1に記載のシステム。
【請求項3】
前記非超音波映像装置が、CTスキャナー、PETスキャナーおよびMRIスキャナーから成るグループから選択される、請求項1に記載のシステム。
【請求項4】
前記操作手段が、校正されたレーザシステムを含む、請求項1に記載のシステム。
【請求項5】
前記第2の超音波映像の組と前記非超音波映像の組は、前記病変のスライスを表し、整合され、それぞれ前記病変のスライスの1つを表す複数の合成映像となる、請求項1に記載のシステム。
【請求項6】
前記第1と第2の座標系は、同一である、請求項1に記載のシステム。
【請求項7】
前記第1と第2の座標系は、異なるが、座標変換によって関係付けられている、請求項1に記載のシステム。
【請求項1】
放射線治療の為に病変を空間的に規定する為のシステムであって、
第1および第2の座標基準系において、前記病変の時間的に離れた、計画段階で得られる第1の超音波映像および治療の直前に得られる第2の超音波映像の組を作成するために超音波装置を操作する手段と、
前記第1と第2の座標基準系を整合する手段と、
該整合に基づき、該病変について変化の識別を容易にする為に、計画段階における超音波映像の該第1組および治療段階における第2組を重ね合わせる手段と、
第3の座標基準系において、前記第2組の超音波映像と実質的に同時に、非超音波映像の組を作成するために非超音波診断映像装置を操作する手段と、
該第2と第3の座標基準系を整合し、該整合に基づき、該第2の超音波映像の組と前記非超音波映像の組とを整合し、該病変の一連の合成映像にする手段と
を含むシステム。
【請求項2】
前記第2の座標基準系を、放射線治療装置に対応付けられた第3の座標基準系に整合する手段と、
該整合に基づき、該第2座標基準系において、撮像された該病変に対して放射線をあてるために、該放射線治療装置を操作する手段と
をさらに含み、
前記第2の超音波映像の測定を治療装置内の超音波測定装置により行う請求項1に記載のシステム。
【請求項3】
前記非超音波映像装置が、CTスキャナー、PETスキャナーおよびMRIスキャナーから成るグループから選択される、請求項1に記載のシステム。
【請求項4】
前記操作手段が、校正されたレーザシステムを含む、請求項1に記載のシステム。
【請求項5】
前記第2の超音波映像の組と前記非超音波映像の組は、前記病変のスライスを表し、整合され、それぞれ前記病変のスライスの1つを表す複数の合成映像となる、請求項1に記載のシステム。
【請求項6】
前記第1と第2の座標系は、同一である、請求項1に記載のシステム。
【請求項7】
前記第1と第2の座標系は、異なるが、座標変換によって関係付けられている、請求項1に記載のシステム。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【公開番号】特開2008−212691(P2008−212691A)
【公開日】平成20年9月18日(2008.9.18)
【国際特許分類】
【出願番号】特願2008−68612(P2008−68612)
【出願日】平成20年3月18日(2008.3.18)
【分割の表示】特願2006−271724(P2006−271724)の分割
【原出願日】平成13年7月31日(2001.7.31)
【特許番号】特許第4129053号(P4129053)
【特許公報発行日】平成20年7月30日(2008.7.30)
【出願人】(503040206)
【出願人】(503040217)
【Fターム(参考)】
【公開日】平成20年9月18日(2008.9.18)
【国際特許分類】
【出願日】平成20年3月18日(2008.3.18)
【分割の表示】特願2006−271724(P2006−271724)の分割
【原出願日】平成13年7月31日(2001.7.31)
【特許番号】特許第4129053号(P4129053)
【特許公報発行日】平成20年7月30日(2008.7.30)
【出願人】(503040206)

【出願人】(503040217)

【Fターム(参考)】
[ Back to top ]

