病態マーカー・治療薬となるペプチド、並びにその使用
【課題】アルツハイマーや軽度認知障害など脳においてAβの蓄積を生じる疾患の病態マーカーとなるペプチド、それをコードするDNA、ペプチドの製造方法、抗体、ペプチドに結合する化合物のスクリーニング方法、疾患の検査薬、疾患の検査方法、治療薬を提供すること。
【解決手段】下記(1)ないし(3)のいずれかの配列から成り、病態マーカーとなることを特徴とするペプチド。
(1)TLEIPGNSDPNMIPDGDFNSYVR ‥‥‥(DN1)
(2)VTASDPLDTLGSEGALSPGGVASLLR ‥‥‥(DN2)
(3)TLEIPGNSDPNMIPDGDFNSYVRVTASDPLDTLGSEGALSPGGVASLLR ‥‥(DN1+DN2)
【解決手段】下記(1)ないし(3)のいずれかの配列から成り、病態マーカーとなることを特徴とするペプチド。
(1)TLEIPGNSDPNMIPDGDFNSYVR ‥‥‥(DN1)
(2)VTASDPLDTLGSEGALSPGGVASLLR ‥‥‥(DN2)
(3)TLEIPGNSDPNMIPDGDFNSYVRVTASDPLDTLGSEGALSPGGVASLLR ‥‥(DN1+DN2)
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、アルツハイマー病(AD)や軽度認知障害(軽度認知機能障害)(MCI)などの病態マーカーとなるペプチド、並びに、それをコードするDNA、ペプチドの製造方法、抗体、ペプチドに結合する化合物のスクリーニング方法、疾患の検査薬、疾患の検査方法、治療薬に関する。
【背景技術】
【0002】
アルツハイマー病は脳皮質に生じる神経変性疾患であり、疾患の進行に伴って徐々にニューロンが消失することから最終的には痴呆に至る。主な神経病理学的所見は、脳萎縮、老人斑、神経原線維集積物及びアミロイドアンギオパシーである。アルツハイマー病と脳の正常老化のいずれにおいても、ニューロンの喪失と、老人斑及び脳血管性アミロイドの主要かつ必須な構成要素であるアミロイドβ蛋白(Aβ)の異常沈着が空間的に特有な様式で出現し、この種の病変は記憶と認知にかかわる海馬や嗅内皮質(enthorhinal cortex)といった大脳皮質の特定領域に主に認められる。
【0003】
Aβは、40−42(3)アミノ酸からなるペプチドであり(C端側のtruncationにより、他にも38、39など量的に多い分子種がある)、β-及びγ-セクレターゼの働きにより前駆体蛋白(APP: amyloid β protein precursor)から切り出されてくる。APPは、α-セクレターゼによっても切断されるが、この際にはAβは生じない。アルツハイマー病ではAβが凝集して不溶性の線維形成がなされてアミロイドとなり脳に沈着する。
【0004】
家族性アルツハイマー病や関連疾患の原因は、Aβの内部や周囲に生じたミスセンス変異であることが示唆されている(非特許文献1〜3)。家族性アルツハイマー病の原因となる2つの遺伝子は、小胞体及び/またはゴルジ複合体の内部で発現すると推定される類似した膜貫通タンパク質であるプレセニリン1及び2をコードすることが同定されている(非特許文献4〜5)。このようなタンパク質は、新たに合成されたAPPなどのタンパク質の修飾及びプロセッシングに関与すると思われる。脳内に認められるAβペプチドの中でも、Aβ1−42はアミロイド形成性が高く、神経細胞内での増加がアルツハイマー病の病態生理と直接関係している可能性がある(非特許文献6〜8)。Aβ1−42は小胞体で、Aβ1−40はトランスゴルジネットワークで産生されるというように、Aβが産生される神経細胞内の特定の部位が同定されている(非特許文献9〜10)。
【0005】
そのため、APP及びAβペプチドの修飾、プロセッシングまたは輸送における何らかの障害が、アルツハイマー病の病態生理に本質的に関係していることを強く示唆する。稀な家族性アルツハイマー病の症例では原因遺伝子及びタンパク質がいくつか同定されているが、アルツハイマー病患者の大半は孤発性であり、疾患過程の原因となる遺伝子やタンパク質はまだ同定されていない。個々のアルツハイマー病患者の主な原因が何であれ、アルツハイマー病の進行は脳内Aβの蓄積及び凝集をもたらし、それは最終的にはおそらくCaイオンチャネルの形成、ミクログリアによるフリーラジカルの生成及び/またはアポトーシス機構を介して神経死を誘発する(非特許文献11〜12)。
【0006】
Aβ分子種が生成されるタンパク質分解過程は未だ明らかになっていない。α、βまたはγ−セクレターゼ活性を有するプロテアーゼの候補は種々の種及び臓器から同定されているが、その大半は合成基質を用いた活性のアッセイによって調製されたものであり、このような候補プロテアーゼの中で天然型APP基質に対する活性を持つものはわずかに過ぎない。家族性アルツハイマー病の原因となる同定された遺伝子のいずれかをトランスジェニックマウスで誘導させ、ヒト脳内で認められる神経病理学的所見を得ようとの試みは成功していない。線維状Aβのマイクロインジェクションを行ったサル脳に関する所見からは、特に高等霊長類では、Aβのin vivo神経毒性が加齢脳で一種の病理反応を起こすことが示唆されている(非特許文献13)。
【0007】
C4dは、病態組織沈着をすることが確認されているが、血液中など体液中では発現しない。病態組織沈着することが確認されているのは、腎移植で拒絶反応を起こした移植腎のproximal tubular capillaryの内皮細胞と、AD/DS、PDC−Guan患者脳における海馬、enthorhinal cortexなどの病態部位のSP(老人斑)、dystrophic neuritis、neuronのみである。
【0008】
その極めて高い特異性の理由は明らかでないが、関係する状況として次が挙げられる。
補体C4系の活性化指標という観点からは、脳では、compact SP(Aβ1−42が主体)周辺での沈着が顕著であり、Aβペプチドは直接C1qに結合することで局所での補体系を活性化し、C1qは、Aβペプチドの凝集を促進しcompact SPの形成へ導く。一連の反応は、SP周辺の細胞障害(MAC:補体系の最終効果)に導きAD型病理の形成の一端であると考えられ得る。免疫組織化学解析結果を定量的に解釈すると、補体系活性化の初期的段階でとどまっている病像が主体であり、MAC形成至っているものは僅かである(非特許文献14〜15)。
なお、腎では、自己免疫的機序を伴う炎症性疾患、例えばSLEに伴うループス腎炎、ANCA病、抗糸球体基底膜病などの病態で当然確認されるはずであるが陰性であり、沈着は腎では移植腎に特異的である。抗体を介さないレクチン経路での沈着である可能性もある。
【0009】
本発明者は、家族性アルツハイマー病患者に由来するリンパ芽球細胞におけるAPP及びAβ含有ペプチドのプロセッシングを解析した(非特許文献16〜17)。家族性アルツハイマー病細胞の培地には、合成基質に対するβ−セクレターゼ様活性を示す68kDaのセリンプロテアーゼが認められた(非特許文献18)。このプロテアーゼは、リンパ芽球細胞(LAPP)から調製した天然型APP及びそのAβ含有断片を、Aβ−N末端の近傍部位で切断した(非特許文献19)。これらの所見を基に、APPプロセッシングにおいて生理的機能を果たす脳カルボキシペプターゼ(CPB)を単離し、アルツハイマー病に有用なカルボキシペプチターゼを提案した(非特許文献20、特許文献1)。更に、その細胞質発現が小胞体であること、C末端C14モジュールのペプチドライブラリー解析及び合成Aβのin vivo消化作用を確認し(非特許文献21)、CPBの髄液中での発現と類縁酵素群の血液中での発現を確認した(非特許文献22)。
【0010】
ADの病態マーカーとして、C4dも候補に挙げられている従来技術(特許文献2)はあるが、ADなど脳においてAβの蓄積を生じ得る疾患の病態マーカーや治療薬となるペプチドに関する情報は未だ不十分である。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】WO00/66717「ヒト脳カルボキシペプチダーゼB」
【特許文献2】特表平11−507821「トランスジェニック動物モデルを用いてアルツハイマー病治療薬を同定する方法」
【非特許文献】
【0012】
【非特許文献1】Chartier−Harlin,M.−C.et al.(1991)Nature,353,844−846
【非特許文献2】Haass,C.et al.(1995)Nature Med.,1,1291−1296
【非特許文献3】Van Broeckhoven,C.et al.(1990)Science,248,1120−1122)
【非特許文献4】Sherrington,R.et al.(1995)Nature 375:754−760
【非特許文献5】Levy−Lahad,E.etal.(1995)Science 269:970−977
【非特許文献6】Hardy,J.(1995)Trends.Neurosci,20,154−159
【非特許文献7】Beyreuther,K.and Masters,C.L.(1997)Nature,389,677−678
【非特許文献8】Younkin,S.G.(1995)Ann.Neurol.,37,287−288
【非特許文献9】Hartmann,T.et al.(1997)Nature Med.,3,1016−1020
【非特許文献10】Cook,D.G.et al.(1997)Nature Med.,3,1021−1023
【非特許文献11】Loo,D.T.et al.(1993)Proc.Natl.Acad.Sci.USA,90,7951−7955
【非特許文献12】Arispe,N.et al.(1993)Proc.Natl.Acad.Sci.USA,90,567−571
【非特許文献13】Geula,C.et al.(1998)Nature Med.,4,827−831
【非特許文献14】Stoltzner,S.E.et al.(2000)Am.J.Pathol.,156,489−499
【非特許文献15】Loeffler,D.A.et al.(2004)Neurobiol.Aging,25,1001−1007
【非特許文献16】Matsumoto,A.and Fujiwara,Y.(1993)Eur.J.Biochem.,217,21−27
【非特許文献17】Matsumoto,A.and Matsumoto,R.(1994)Eur.J.Biochem.,225,1055−1062
【非特許文献18】Matsumoto,A.and Fujiwara,Y.(1994)Biochemistry,33,3941−3948
【非特許文献19】Matsumoto,A.et al.(1995)Neurosci.Lett.,195,171−174
【非特許文献20】Matsumoto,A.et al.(2000)Eur.J.Neurosci.,12,227−238
【非特許文献21】Matsumoto,A.et al.(2001)Eur.J.Neurosci.,13,1653−1655
【非特許文献22】Matsumoto,A.et al.(2001)J.Neurosci.Res,39,313−317
【発明の概要】
【発明が解決しようとする課題】
【0013】
そこで、本発明は、ADやMCIなどの病態マーカーとなるペプチド、並びに、それをコードするDNA、ペプチドの製造方法、抗体、ペプチドに結合する化合物のスクリーニング方法、疾患の検査薬、疾患の検査方法、治療薬を提供することを課題とする。
【課題を解決するための手段】
【0014】
上記課題を解決するために、本発明は以下の構成を備える。
すなわち、本発明のペプチドは、下記(1)ないし(3)のいずれかの配列から成り、病態マーカーとなることを特徴とする。
(1)TLEIPGNSDPNMIPDGDFNSYVR ‥‥‥(DN1)
(2)VTASDPLDTLGSEGALSPGGVASLLR ‥‥‥(DN2)
(3)TLEIPGNSDPNMIPDGDFNSYVRVTASDPLDTLGSEGALSPGGVASLLR ‥‥(DN1+DN2)
【0015】
病態としては、脳においてAβの蓄積を生じ得る疾患に有用である。
【0016】
脳においてAβの蓄積を生じる疾患としては、アルツハイマー病、老人性痴呆症、軽度認知障害、ダウン症が挙げられる。
【0017】
なお、病態マーカーとなるペプチドであれば、前記(1)ないし(3)のいずれかの配列において、1もしくは複数のアミノ酸が、置換、欠失、挿入、及び/または付加した配列から成るペプチドでもよい。
【0018】
本発明のDNAは、前記のいずれかに記載のペプチドをコードすることを特徴とする。
【0019】
本発明のペプチドの製造方法は、前記のいずれかのペプチドを製造する方法であって、前記のDNAを挿入したベクターを調製するステップと、そのベクターを保持する宿主細胞を調製するステップと、その宿主細胞を培養し、その細胞内で発現した組み換えタンパク質を、その細胞または培養上清から回収するステップを含むことを特徴とする。
【0020】
本発明の抗体は、前記のいずれかのペプチドに対する抗体、またはそのペプチドを含むタンパク質に対する抗体であることを特徴とする。
【0021】
本発明のペプチドに結合する化合物のスクリーニング方法は、前記のいずれかのペプチドに結合する化合物のスクリーニング方法であって、前記のいずれかのペプチドまたはその部分ペプチドに被検試料を接触させるステップと、そのペプチドまたは部分ペプチドと被検試料との結合活性を検出するステップと、そのペプチドまたは部分ペプチドに結合する活性を有する化合物を選択するステップを含むことを特徴とする。
【0022】
本発明の検査薬は、前記の抗体、または、前記の本発明のペプチドに結合する化合物のスクリーニング方法によって得られた化合物を含み、脳においてAβの蓄積を生じる疾患を検査することを特徴とする。
【0023】
本発明の疾患の検査方法は、脳においてAβの蓄積を生じる疾患の検査方法であって、被検者から生体試料を調製するステップと、その試料に含まれる前記のいずれかのペプチドの量を検出するステップを含むことを特徴とする。
【0024】
本発明の治療薬は、脳においてAβの蓄積を生じる疾患の治療薬であって、前記(2)または(3)のいずれかの配列のペプチド、または、請求項7に記載の抗体を有効成分とすることを特徴とする。
【発明の効果】
【0025】
本発明によると、脳においてAβの蓄積を生じるAD等の病態マーカーやその治療薬が得られ、早期診断や治療に寄与する。
【図面の簡単な説明】
【0026】
【図1】正常群及びAD・MCI患者由来検体のC14EP1モノクローナル抗体免疫沈降物のマススペクトル
【図2】病態群由来免疫沈降物のPSD同定解析によるマススペクトル(独立して行った2回の解析結果(A,B)、同定に至ったマスコット解析結果(C))
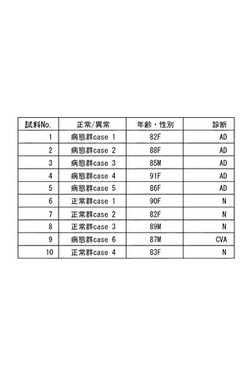
【図3】血液中病態複合体の生化学的検出手法に用いた検体の表
【図4】同、電気泳動結果の写真
【図5】ELISA解析における検体及び結果の表
【図6】海馬神経細胞におけるペプチド(DN1、DN2、DN1+DN2)の毒性を示すグラフ
【図7】大脳皮質細胞におけるペプチド(DN1、DN2、DN1+DN2)の毒性を示すグラフ
【図8】海馬神経細胞におけるペプチドDN2及びAβ(42)、Aβ(40)の毒性を示すグラフ
【発明を実施するための最良の形態】
【0027】
以下に、本発明の実施形態を説述する。なお、実施形態は、前記先行技術文献や従来公知の技術を援用して適宜設計変更可能である。
本発明者は、前記従来技術の関連研究を更に続け、C4d(957−1336)(補体活性化の組織マーカー)から切り離されたDNペプチドが、脳においてAβの蓄積を生じる老人性痴呆症、ダウン症等の病態マーカーやその治療薬になることを見出した。
【0028】
DNペプチド(957−1005)の配列は、下記の(3)であり、(1)DN1(957−979)(23−mer、2551dalton)と、(2)DN2(980−1005)(26−mer、2483dalton)とに分けられる。
(1)TLEIPGNSDPNMIPDGDFNSYVR ‥‥‥(DN1)
(2)VTASDPLDTLGSEGALSPGGVASLLR ‥‥‥(DN2)
(3)TLEIPGNSDPNMIPDGDFNSYVRVTASDPLDTLGSEGALSPGGVASLLR ‥‥(DN1+DN2)
【0029】
本ペプチドの発見の経緯は質量分析解析によるものであり、AD及びMCI患者由来の血清・血漿検体のC14EP1モノクローナル抗体免疫沈降物をMALDI−TOF型質量分析機で解析したところ、解析したすべてのAD及びMCI患者由来検体に発現するペプチドピークを確認した。図1は、そのうちの8名の被験者におけるC14−EP1免疫沈降物のマススペクトルプロファイリングである。A〜Cは正常高齢者血清、D〜EはMCI血清、F〜HはAD血清を用いた。その結果、病態群(D〜H)においては正常群(A〜C)に発現しない特有のペプチド(DN1)を見い出した。
更に、本ペプチドを同定する目的でMALDI−TOF−型質量分析機によりPSD(post-source decay)同定解析を行った。図2(A,B)は、そのうちの病態群サンプルにおける独立した2回のPSD解析のマススペクトルであり、その結果のマスコット解析結果(図2C)によりペプチド(DN1)が同定された。
【0030】
DNペプチドはC4dのN端フラグメントにあり、trypsin-type endo-proteinase(未同定)によりC4dから切り出される。殆ど複合体の形で血液中に発現し、血液中病態マーカーとしての必要条件をもっている。これは、DNペプチドがC4dのように、その分子中にthio−ester groupを持たないことが関連すると考えられる。
DNペプチドの発現は、主たる基質と推定されるC4dの高い病態発現特異性を基盤としているため、高度な病態特異性をもつものと考えられる。その影響因子として、C4dの切り出し酵素の活性制御と、血液中でDNペプチドと複合体を形成する分子が重要である。
DNペプチドの血液中からの検出は、限外濾過や免疫沈降などの前処理により、質量分析を用いた手法や、抗体の構築によるELISA法で解析できる。そのELISA的手法による定量解析には、既に作製されている抗C14EP1モノクローナル抗体や、抗DN1モノクローナル抗体のほか、ペプチド(DN1)のC端断端特異抗体の作製が有用である。
【0031】
DNペプチドは、血清や髄液試料において、特にはアルツハイマー型認知症の病態マーカーとして有用である。
病態マーカーとしては、前記(1)〜(3)のいずれもが利用できるが、特に、血液においては(1)DN1及び(3)DN1+DN2、髄液においては(3)DN1+DN2が有効である。なお、(3)(DN1+DN2)と同様に、(1)DN1と(2)DN2との混合物も利用可能である。
なお、後述するが、治療薬としては、(2)DN2が有用である。
C4dの隣接するペプチドでありながらDN1とDN2で異なる作用を示す事実は、少なくともいずれかの分子に対する受容体が細胞に存在するためであると考えられる。
【0032】
本発明によるDNペプチド、またはその部分ペプチド或いはそれを含むタンパク質は、脳においてAβの蓄積を生じ得る疾患の病態マーカーまたは治療薬となるものであれば、天然型と構造的に類似したものでもよい。このような構造的に類似したものには、変異体や他の生物由来も含まれる。アミノ酸の改変は、人為的に行うのであれば、通常、30アミノ酸以内、好ましくは10アミノ酸以内、さらに好ましくは5アミノ酸以内であり、置換、欠失、挿入、及び/または付加が可能である。その調製には、公知のハイブリダイゼーション技術が利用できる。
置換されるアミノ酸は、置換前のアミノ酸と似た性質を有するアミノ酸であることが好ましい。例えば、Ala、Val、Leu、Ile、Pro、Met、Phe、Trpは、共に非極性アミノ酸に分類されるため互いに似た性質を有し、非荷電性としては、Gly、Ser、Thr、Cys、Tyr、Asn、Glnが挙げられる。また、酸性アミノ酸としては、Asp及びGluが挙げられ、塩基性アミノ酸としては、Lys、Arg、Hisが挙げられる。
【0033】
また、本発明は、前記ペプチドをコードするDNAに関する。
DNAとしては、前記(1)〜(3)のいずれかのペプチドをコードしうるものであれば特に制限はなく、cDNA、ゲノムDNA、及び合成DNAが含まれる。また、遺伝暗号の縮重に基づく任意の塩基配列を有するDNAも含まれる。DNAの調製方法は、従来公知のスクリーニング法や合成法が利用できる。
ヒト以外の生物に由来するペプチドをコードするDNAは、通常、ヒトDNペプチドと高い相同性を有する。高い相同性とは、アミノ酸レベルで少なくとも40%以上、好ましくは55%以上、さらに好ましくは70%以上の配列の同一性を指す。DNAを単離するためのハイブリダイゼーションは、従来公知の条件で行える。
【0034】
DNAは、組換えタンパク質の生産に有用である。すなわち、DNAを発現ベクターに挿入し、そのベクターを適当な細胞に導入して得た形質転換体を培養し、発現させたタンパク質をその形質転換体またはその培養上清から生成することにより、組換えタンパク質として調製することが可能である。発現させるための宿主には制限はなく、公知のベクター系を用いて、酵母、昆虫細胞、哺乳動物細胞などで発現させることが可能である。神経細胞での発現であれば、例えば、SFVベクターを用いるシステムが利用できる。宿主細胞において発現させた組換えタンパク質は、従来公知の方法により精製することができる。
また、本発明のDNペプチドまたはタンパク質の発現異常や機能異常に起因する疾患の遺伝子治療に応用することも可能である。
【0035】
また、本発明は、前記ペプチドまたはそれを含むタンパク質に結合する抗体に関する。
抗体は、従来公知の方法により作製することが可能である。ポリクローナル抗体の調製は、例えば、海馬組織より調製した天然由来の本発明のタンパク質または組換えタンパク質を、アジュバントと共に、ウサギ、モルモット、ヤギ等の動物に免疫する。免疫を複数回行うことにより、抗体価を上昇させることができる。最終免疫後、免疫動物から採血を行うことにより抗血清が得られる。この抗血清に対し、例えば、硫酸アンモニウム沈殿や陰イオンクロマトグラフィーによる分画、プロテインAや固定化抗原を用いたアフィニティー精製を行うことにより、ポリクローナル抗体を調製することができる。抗原として、部分ペプチドを用いることも可能である。
一方、モノクローナル抗体の調製は、上記と同様に免疫動物に免疫し、最終免疫後、この免疫動物から脾臓またはリンパ節を採取する。この脾臓またはリンパ節に含まれる抗体産生細胞とミエローマ細胞とをポリエチレングリコールなどを用いて融合し、ハイブリドーマを調製する。目的のハイブリドーマをスクリーニングし、これを培養し、その培養上清からモノクローナル抗体を調製することができる。モノクローナル抗体の精製は、例えば、硫酸アンモニウム沈殿や陰イオンクロマトグラフィーによる分画、プロテインAや固定化抗原を用いたアフィニティー精製により行うことができる。
【0036】
抗体は、本発明のペプチドまたはタンパク質のアフィニティー精製のために用いられる他、例えば、発現異常や構造異常に起因する疾患の検査や診断、発現量の検出などに利用することも可能である。
本発明のDNペプチドは、血清及び髄液に検出されることから、これらの試料に含まれるペプチドを検出することにより、脳においてAβの蓄積を生じる疾患の検査・診断を行なうことができる。
【0037】
本発明の抗体を用いる脳におけるAβの蓄積を生じる疾患の検査は、被検者から試料を調製するステップと、その試料に含まれる本発明のペプチドまたはタンパク質の量を、抗体を用いて検出するステップとを含む方法により実施することができる。
検査の対象となる疾患としては、脳におけるAβの蓄積を生じる疾患であれば制限はなく、例えば、老人性痴呆、アルツハイマー病、ダウン症が挙げられる。
検査のために被験者から調製する試料としては、血清または髄液が好適であり、試料中に含まれるDNペプチドまたはタンパク質は、例えば、ウェスタンブロッティング、免疫沈降、ELISA等の方法で検出することが可能である。検出に用いられる抗体としては、モノクローナル抗体であっても、ポリクローナル抗体であってもよい。抗体を検査薬として用いる場合、pH緩衝液を用い、担体、防腐剤等を必要に応じて混合してもよい。
検出の結果、健常者と比較して、被検者試料中の抗体反応性ペプチドまたはタンパク質の量の増加または減少、分子量の異常、各分子量の量比の異常が認められれば、疾患にかかっている可能性があると判定される。
【0038】
本発明のペプチドまたはタンパク質の検出には、従来公知のマススペクトル解析(MALDI)も利用できる。
【0039】
アルツハイマー病患者の脳において、その病態発症の早い段階で特定の補体分子の沈着があることは確立しているので、本発明で発見したC4dのN端側断片が血液中で高発現であれば、病態との関連で裏付けられている。組織沈着分子であるC4dは、DNペプチドの後ろ側(C端側)にチオエステル結合部分があり、そこを介して内皮細胞などの組織に結合している。従って、そのN端側ペプチドが特異的プロテアーゼにより遊離されれば、中枢神経の末梢マーカー分子となりうる性質を備えている。
なお、C4dは、チオエステル結合部分があるために、血液中でfreeの断片として存在せず、組織沈着物として検出されるが、チオエステル結合部分を欠くDNペプチドはfreeでも存在し得ると考えられる。
【0040】
また、本発明は、脳においてAβの蓄積を生じる疾患の治療薬に関する。
その治療薬は、前記(2)または(3)のいずれかの配列のペプチド、または、前記の抗体を有効成分とする。治療薬としては、(2)DN2が有用であり、(1)DN1は上述のように病態マーカーに有用である。
ペプチドDN2が神経細胞保護作用を有するのは、補体活性化の制御によるものであり、ペプチドDN2に対する特異的なリセプターの存在が考えられる。
【0041】
治療薬の剤形は特に制限されず、通常使用され得る任意の剤形をとることができ、固形剤、半固形剤、液剤が可能である。また、本発明の効果及び製剤的な安定性などを損なわない限り上記成分の他に、用途あるいは剤形などに応じて、医薬品、医薬部外品、食品に通常使用され得る任意の成分を適宜配合してもよい。
配合できる成分としては、特に制限されないが、例えば、担体成分または添加剤などが挙げられ、固形剤における担体成分または添加剤としては、例えば、賦形剤、崩壊剤、結合剤、滑沢剤、抗酸化剤、コーティング剤、着色剤、矯味剤、界面活性剤、可塑剤、甘味剤、着香剤の他、崩壊補助剤、発泡剤、吸着剤、防腐剤、湿潤剤、帯電防止剤などが例示できる。また、液剤における担体成分または添加剤としては、例えば、溶剤、pH調整剤、清涼化剤、懸濁化剤、消泡剤、粘稠剤、溶解補助剤、前記界面活性剤、抗酸化剤、着色剤、甘味剤、着香剤の他、防腐・抗菌剤、キレート剤、可溶化剤または溶解補助剤、安定化剤、流動化剤、乳化剤、増粘剤、緩衝剤、等張化剤、分散剤などが例示できる。
【0042】
本発明は、また、本発明のペプチドまたはタンパク質に結合する化合物のスクリーニング方法に関する。
そのスクリーニング法は、本発明のペプチドまたはタンパク質またはその部分ペプチドに被検試料を接触させるステップ、被検試料との結合活性を検出するステップ、結合活性を有する化合物を選択するステップを含む。スクリーニングに用いる被検試料としては、例えば、細胞抽出液、遺伝子ライブラリーの発現産物、合成低分子化合物、合成ペプチド、修飾ペプチド、天然化合物などが挙げられる。スクリーニングに用いる被検試料は、必要に応じて適宜標識して用いられ、標識としては、例えば、放射標識、蛍光標識などが挙げられる。
得られた化合物は、前記の抗体と同様に、脳においてAβの蓄積を生じる疾患を検査する検査薬や、治療薬などの候補として利用可能である。
【実施例1】
【0043】
アルツハイマー病(AD)及び軽度認知障害(MCI)患者に特異的な血液中病態複合体の生化学的検出手法を確立した。
検体には、PBS(-)で4倍希釈した血清を用いた。抗体には、抗DN1モノクロナル抗体(IgG精製)を用いた。担体には、Protein G結合磁気ビーズ(NEB)を用い、NEB150μlに対して抗体1μlを結合(4℃一晩、または、室温3時間)させ、その結合ビーズについて希釈検体400μl(4℃一晩)と反応させて、免疫沈降を行った。磁気ラックを用いて反応液を除去しPBS(-)750μlで洗浄した。
【0044】
複合体の安定な遊離 (低pH)を行うために、ビーズを10mM Glicine−HCL2 pH2.0(13μl)に混和し、室温で5分攪拌し、磁気ラックを用い回収した液を4.5μlの50mM NaOH入りの新しいチューブに入れ中和した。回収液と等量のSDSバッファー(還元剤を含まない)を加え電気泳動サンプルとした(加熱処理は行わない)。
【0045】
図3は、実験に使用した検体を示す表であり、図4は、その電気泳動の結果を示す写真である。7.5%PAGゲルを用い、通常のSDSバッファーで分離(250V、14mA、160−180分)し、CBB染色した。
その結果、正常群(試料6〜8、10)及び脳梗塞患者(CVA)(試料9)には、DN1抗体のバンド(DN1と結合した蛋白)が検知されなかったが、アルツハイマー病患者(AD)(試料1〜5)には検知され、DN1抗体がアルツハイマー病の病態マーカーとなることが示された。
【実施例2】
【0046】
抗DN1モノクロナル抗体を用いたELISA解析を行った。
検体には、PBS(-)で10倍希釈した血清を用いた。定法に従いTMB 基質液を添加し450nMでの吸光度を測定した。なお、バッファーにはカルシウム及びマグネシウムイオンの含まれないPBS(-)を用いた。
その結果、図5の表に示すように、正常群(試料1、6〜7、10)に比べ、アルツハイマー病患者(AD)(試料2〜3)では吸光度が高く、軽度認知障害患者(MCI)(試料4〜5、8〜9)がその中間の値であり、DN1抗体がアルツハイマー病や軽度認知障害患者の病態マーカーとなることが示された。
【実施例3】
【0047】
海馬神経細胞及び大脳皮質細胞(詳しくは、胎児マウスの海馬由来初代培養細胞及び大脳皮質細胞)におけるペプチド(DN1、DN2、DN1+DN2)の毒性を評価した。
マウス15日齢胎児より海馬神経細胞及び大脳皮質細胞を採取し、Neuro basal(B27、L−glutamin、グルタミン酸を含む)で培養し、培養3日目に培養交換し6日目にLDHアッセイに使用した。
図6は、海馬神経細胞におけるペプチド(DN1、DN2、DN1+DN2)の毒性を示すグラフ、図7は、大脳皮質細胞におけるペプチド(DN1、DN2、DN1+DN2)の毒性を示すグラフである。それぞれ、上段がペプチド(DN1、DN2、DN1+DN2)による処理後24時間経過、下段が処理後48時間経過後の値である。なお、本実施例では、ペプチド(DN1+DN2)として、ペプチド(DN1)とペプチド(DN2)の混合物を用いた。
海馬神経細胞及び大脳皮質細胞のいずれの場合も、ペプチドDN2では5μMの投与(下限は2μM)で細胞毒性を示したが、ペプチドDN1では顕著な細胞毒性は示されなかった。
【実施例4】
【0048】
海馬神経細胞におけるペプチドDN2の保護作用を評価した。
マウス15日齢胎児より海馬神経細胞を採取し、Neuro basal(B27、L−glutamin、グルタミン酸を含む)で培養し、培養3日目に培養交換し6日目にLDHアッセイに使用した。
図8は、海馬神経細胞におけるペプチドDN2及びAβ(42)、Aβ(40)の毒性を示すグラフである。上段がペプチドDN2及びAβによる処理後48時間経過、下段が処理後72時間経過後の値である。
5μMのAβ(42)の投与により細胞毒性を示したが、2μM(下限は1μM)ペプチドDN2の投与により細胞毒性の低下、すなわち、Aβによる細胞毒性に対する保護作用が確認された。また、ペプチドDN2は、少量ではもともと毒性がないので、薬剤として有用である。
【産業上の利用可能性】
【0049】
本発明によると、脳においてAβの蓄積を生じるADやMCI等の診断や治療に寄与するので、産業上利用価値が高い。
【技術分野】
【0001】
本発明は、アルツハイマー病(AD)や軽度認知障害(軽度認知機能障害)(MCI)などの病態マーカーとなるペプチド、並びに、それをコードするDNA、ペプチドの製造方法、抗体、ペプチドに結合する化合物のスクリーニング方法、疾患の検査薬、疾患の検査方法、治療薬に関する。
【背景技術】
【0002】
アルツハイマー病は脳皮質に生じる神経変性疾患であり、疾患の進行に伴って徐々にニューロンが消失することから最終的には痴呆に至る。主な神経病理学的所見は、脳萎縮、老人斑、神経原線維集積物及びアミロイドアンギオパシーである。アルツハイマー病と脳の正常老化のいずれにおいても、ニューロンの喪失と、老人斑及び脳血管性アミロイドの主要かつ必須な構成要素であるアミロイドβ蛋白(Aβ)の異常沈着が空間的に特有な様式で出現し、この種の病変は記憶と認知にかかわる海馬や嗅内皮質(enthorhinal cortex)といった大脳皮質の特定領域に主に認められる。
【0003】
Aβは、40−42(3)アミノ酸からなるペプチドであり(C端側のtruncationにより、他にも38、39など量的に多い分子種がある)、β-及びγ-セクレターゼの働きにより前駆体蛋白(APP: amyloid β protein precursor)から切り出されてくる。APPは、α-セクレターゼによっても切断されるが、この際にはAβは生じない。アルツハイマー病ではAβが凝集して不溶性の線維形成がなされてアミロイドとなり脳に沈着する。
【0004】
家族性アルツハイマー病や関連疾患の原因は、Aβの内部や周囲に生じたミスセンス変異であることが示唆されている(非特許文献1〜3)。家族性アルツハイマー病の原因となる2つの遺伝子は、小胞体及び/またはゴルジ複合体の内部で発現すると推定される類似した膜貫通タンパク質であるプレセニリン1及び2をコードすることが同定されている(非特許文献4〜5)。このようなタンパク質は、新たに合成されたAPPなどのタンパク質の修飾及びプロセッシングに関与すると思われる。脳内に認められるAβペプチドの中でも、Aβ1−42はアミロイド形成性が高く、神経細胞内での増加がアルツハイマー病の病態生理と直接関係している可能性がある(非特許文献6〜8)。Aβ1−42は小胞体で、Aβ1−40はトランスゴルジネットワークで産生されるというように、Aβが産生される神経細胞内の特定の部位が同定されている(非特許文献9〜10)。
【0005】
そのため、APP及びAβペプチドの修飾、プロセッシングまたは輸送における何らかの障害が、アルツハイマー病の病態生理に本質的に関係していることを強く示唆する。稀な家族性アルツハイマー病の症例では原因遺伝子及びタンパク質がいくつか同定されているが、アルツハイマー病患者の大半は孤発性であり、疾患過程の原因となる遺伝子やタンパク質はまだ同定されていない。個々のアルツハイマー病患者の主な原因が何であれ、アルツハイマー病の進行は脳内Aβの蓄積及び凝集をもたらし、それは最終的にはおそらくCaイオンチャネルの形成、ミクログリアによるフリーラジカルの生成及び/またはアポトーシス機構を介して神経死を誘発する(非特許文献11〜12)。
【0006】
Aβ分子種が生成されるタンパク質分解過程は未だ明らかになっていない。α、βまたはγ−セクレターゼ活性を有するプロテアーゼの候補は種々の種及び臓器から同定されているが、その大半は合成基質を用いた活性のアッセイによって調製されたものであり、このような候補プロテアーゼの中で天然型APP基質に対する活性を持つものはわずかに過ぎない。家族性アルツハイマー病の原因となる同定された遺伝子のいずれかをトランスジェニックマウスで誘導させ、ヒト脳内で認められる神経病理学的所見を得ようとの試みは成功していない。線維状Aβのマイクロインジェクションを行ったサル脳に関する所見からは、特に高等霊長類では、Aβのin vivo神経毒性が加齢脳で一種の病理反応を起こすことが示唆されている(非特許文献13)。
【0007】
C4dは、病態組織沈着をすることが確認されているが、血液中など体液中では発現しない。病態組織沈着することが確認されているのは、腎移植で拒絶反応を起こした移植腎のproximal tubular capillaryの内皮細胞と、AD/DS、PDC−Guan患者脳における海馬、enthorhinal cortexなどの病態部位のSP(老人斑)、dystrophic neuritis、neuronのみである。
【0008】
その極めて高い特異性の理由は明らかでないが、関係する状況として次が挙げられる。
補体C4系の活性化指標という観点からは、脳では、compact SP(Aβ1−42が主体)周辺での沈着が顕著であり、Aβペプチドは直接C1qに結合することで局所での補体系を活性化し、C1qは、Aβペプチドの凝集を促進しcompact SPの形成へ導く。一連の反応は、SP周辺の細胞障害(MAC:補体系の最終効果)に導きAD型病理の形成の一端であると考えられ得る。免疫組織化学解析結果を定量的に解釈すると、補体系活性化の初期的段階でとどまっている病像が主体であり、MAC形成至っているものは僅かである(非特許文献14〜15)。
なお、腎では、自己免疫的機序を伴う炎症性疾患、例えばSLEに伴うループス腎炎、ANCA病、抗糸球体基底膜病などの病態で当然確認されるはずであるが陰性であり、沈着は腎では移植腎に特異的である。抗体を介さないレクチン経路での沈着である可能性もある。
【0009】
本発明者は、家族性アルツハイマー病患者に由来するリンパ芽球細胞におけるAPP及びAβ含有ペプチドのプロセッシングを解析した(非特許文献16〜17)。家族性アルツハイマー病細胞の培地には、合成基質に対するβ−セクレターゼ様活性を示す68kDaのセリンプロテアーゼが認められた(非特許文献18)。このプロテアーゼは、リンパ芽球細胞(LAPP)から調製した天然型APP及びそのAβ含有断片を、Aβ−N末端の近傍部位で切断した(非特許文献19)。これらの所見を基に、APPプロセッシングにおいて生理的機能を果たす脳カルボキシペプターゼ(CPB)を単離し、アルツハイマー病に有用なカルボキシペプチターゼを提案した(非特許文献20、特許文献1)。更に、その細胞質発現が小胞体であること、C末端C14モジュールのペプチドライブラリー解析及び合成Aβのin vivo消化作用を確認し(非特許文献21)、CPBの髄液中での発現と類縁酵素群の血液中での発現を確認した(非特許文献22)。
【0010】
ADの病態マーカーとして、C4dも候補に挙げられている従来技術(特許文献2)はあるが、ADなど脳においてAβの蓄積を生じ得る疾患の病態マーカーや治療薬となるペプチドに関する情報は未だ不十分である。
【先行技術文献】
【特許文献】
【0011】
【特許文献1】WO00/66717「ヒト脳カルボキシペプチダーゼB」
【特許文献2】特表平11−507821「トランスジェニック動物モデルを用いてアルツハイマー病治療薬を同定する方法」
【非特許文献】
【0012】
【非特許文献1】Chartier−Harlin,M.−C.et al.(1991)Nature,353,844−846
【非特許文献2】Haass,C.et al.(1995)Nature Med.,1,1291−1296
【非特許文献3】Van Broeckhoven,C.et al.(1990)Science,248,1120−1122)
【非特許文献4】Sherrington,R.et al.(1995)Nature 375:754−760
【非特許文献5】Levy−Lahad,E.etal.(1995)Science 269:970−977
【非特許文献6】Hardy,J.(1995)Trends.Neurosci,20,154−159
【非特許文献7】Beyreuther,K.and Masters,C.L.(1997)Nature,389,677−678
【非特許文献8】Younkin,S.G.(1995)Ann.Neurol.,37,287−288
【非特許文献9】Hartmann,T.et al.(1997)Nature Med.,3,1016−1020
【非特許文献10】Cook,D.G.et al.(1997)Nature Med.,3,1021−1023
【非特許文献11】Loo,D.T.et al.(1993)Proc.Natl.Acad.Sci.USA,90,7951−7955
【非特許文献12】Arispe,N.et al.(1993)Proc.Natl.Acad.Sci.USA,90,567−571
【非特許文献13】Geula,C.et al.(1998)Nature Med.,4,827−831
【非特許文献14】Stoltzner,S.E.et al.(2000)Am.J.Pathol.,156,489−499
【非特許文献15】Loeffler,D.A.et al.(2004)Neurobiol.Aging,25,1001−1007
【非特許文献16】Matsumoto,A.and Fujiwara,Y.(1993)Eur.J.Biochem.,217,21−27
【非特許文献17】Matsumoto,A.and Matsumoto,R.(1994)Eur.J.Biochem.,225,1055−1062
【非特許文献18】Matsumoto,A.and Fujiwara,Y.(1994)Biochemistry,33,3941−3948
【非特許文献19】Matsumoto,A.et al.(1995)Neurosci.Lett.,195,171−174
【非特許文献20】Matsumoto,A.et al.(2000)Eur.J.Neurosci.,12,227−238
【非特許文献21】Matsumoto,A.et al.(2001)Eur.J.Neurosci.,13,1653−1655
【非特許文献22】Matsumoto,A.et al.(2001)J.Neurosci.Res,39,313−317
【発明の概要】
【発明が解決しようとする課題】
【0013】
そこで、本発明は、ADやMCIなどの病態マーカーとなるペプチド、並びに、それをコードするDNA、ペプチドの製造方法、抗体、ペプチドに結合する化合物のスクリーニング方法、疾患の検査薬、疾患の検査方法、治療薬を提供することを課題とする。
【課題を解決するための手段】
【0014】
上記課題を解決するために、本発明は以下の構成を備える。
すなわち、本発明のペプチドは、下記(1)ないし(3)のいずれかの配列から成り、病態マーカーとなることを特徴とする。
(1)TLEIPGNSDPNMIPDGDFNSYVR ‥‥‥(DN1)
(2)VTASDPLDTLGSEGALSPGGVASLLR ‥‥‥(DN2)
(3)TLEIPGNSDPNMIPDGDFNSYVRVTASDPLDTLGSEGALSPGGVASLLR ‥‥(DN1+DN2)
【0015】
病態としては、脳においてAβの蓄積を生じ得る疾患に有用である。
【0016】
脳においてAβの蓄積を生じる疾患としては、アルツハイマー病、老人性痴呆症、軽度認知障害、ダウン症が挙げられる。
【0017】
なお、病態マーカーとなるペプチドであれば、前記(1)ないし(3)のいずれかの配列において、1もしくは複数のアミノ酸が、置換、欠失、挿入、及び/または付加した配列から成るペプチドでもよい。
【0018】
本発明のDNAは、前記のいずれかに記載のペプチドをコードすることを特徴とする。
【0019】
本発明のペプチドの製造方法は、前記のいずれかのペプチドを製造する方法であって、前記のDNAを挿入したベクターを調製するステップと、そのベクターを保持する宿主細胞を調製するステップと、その宿主細胞を培養し、その細胞内で発現した組み換えタンパク質を、その細胞または培養上清から回収するステップを含むことを特徴とする。
【0020】
本発明の抗体は、前記のいずれかのペプチドに対する抗体、またはそのペプチドを含むタンパク質に対する抗体であることを特徴とする。
【0021】
本発明のペプチドに結合する化合物のスクリーニング方法は、前記のいずれかのペプチドに結合する化合物のスクリーニング方法であって、前記のいずれかのペプチドまたはその部分ペプチドに被検試料を接触させるステップと、そのペプチドまたは部分ペプチドと被検試料との結合活性を検出するステップと、そのペプチドまたは部分ペプチドに結合する活性を有する化合物を選択するステップを含むことを特徴とする。
【0022】
本発明の検査薬は、前記の抗体、または、前記の本発明のペプチドに結合する化合物のスクリーニング方法によって得られた化合物を含み、脳においてAβの蓄積を生じる疾患を検査することを特徴とする。
【0023】
本発明の疾患の検査方法は、脳においてAβの蓄積を生じる疾患の検査方法であって、被検者から生体試料を調製するステップと、その試料に含まれる前記のいずれかのペプチドの量を検出するステップを含むことを特徴とする。
【0024】
本発明の治療薬は、脳においてAβの蓄積を生じる疾患の治療薬であって、前記(2)または(3)のいずれかの配列のペプチド、または、請求項7に記載の抗体を有効成分とすることを特徴とする。
【発明の効果】
【0025】
本発明によると、脳においてAβの蓄積を生じるAD等の病態マーカーやその治療薬が得られ、早期診断や治療に寄与する。
【図面の簡単な説明】
【0026】
【図1】正常群及びAD・MCI患者由来検体のC14EP1モノクローナル抗体免疫沈降物のマススペクトル
【図2】病態群由来免疫沈降物のPSD同定解析によるマススペクトル(独立して行った2回の解析結果(A,B)、同定に至ったマスコット解析結果(C))
【図3】血液中病態複合体の生化学的検出手法に用いた検体の表
【図4】同、電気泳動結果の写真
【図5】ELISA解析における検体及び結果の表
【図6】海馬神経細胞におけるペプチド(DN1、DN2、DN1+DN2)の毒性を示すグラフ
【図7】大脳皮質細胞におけるペプチド(DN1、DN2、DN1+DN2)の毒性を示すグラフ
【図8】海馬神経細胞におけるペプチドDN2及びAβ(42)、Aβ(40)の毒性を示すグラフ
【発明を実施するための最良の形態】
【0027】
以下に、本発明の実施形態を説述する。なお、実施形態は、前記先行技術文献や従来公知の技術を援用して適宜設計変更可能である。
本発明者は、前記従来技術の関連研究を更に続け、C4d(957−1336)(補体活性化の組織マーカー)から切り離されたDNペプチドが、脳においてAβの蓄積を生じる老人性痴呆症、ダウン症等の病態マーカーやその治療薬になることを見出した。
【0028】
DNペプチド(957−1005)の配列は、下記の(3)であり、(1)DN1(957−979)(23−mer、2551dalton)と、(2)DN2(980−1005)(26−mer、2483dalton)とに分けられる。
(1)TLEIPGNSDPNMIPDGDFNSYVR ‥‥‥(DN1)
(2)VTASDPLDTLGSEGALSPGGVASLLR ‥‥‥(DN2)
(3)TLEIPGNSDPNMIPDGDFNSYVRVTASDPLDTLGSEGALSPGGVASLLR ‥‥(DN1+DN2)
【0029】
本ペプチドの発見の経緯は質量分析解析によるものであり、AD及びMCI患者由来の血清・血漿検体のC14EP1モノクローナル抗体免疫沈降物をMALDI−TOF型質量分析機で解析したところ、解析したすべてのAD及びMCI患者由来検体に発現するペプチドピークを確認した。図1は、そのうちの8名の被験者におけるC14−EP1免疫沈降物のマススペクトルプロファイリングである。A〜Cは正常高齢者血清、D〜EはMCI血清、F〜HはAD血清を用いた。その結果、病態群(D〜H)においては正常群(A〜C)に発現しない特有のペプチド(DN1)を見い出した。
更に、本ペプチドを同定する目的でMALDI−TOF−型質量分析機によりPSD(post-source decay)同定解析を行った。図2(A,B)は、そのうちの病態群サンプルにおける独立した2回のPSD解析のマススペクトルであり、その結果のマスコット解析結果(図2C)によりペプチド(DN1)が同定された。
【0030】
DNペプチドはC4dのN端フラグメントにあり、trypsin-type endo-proteinase(未同定)によりC4dから切り出される。殆ど複合体の形で血液中に発現し、血液中病態マーカーとしての必要条件をもっている。これは、DNペプチドがC4dのように、その分子中にthio−ester groupを持たないことが関連すると考えられる。
DNペプチドの発現は、主たる基質と推定されるC4dの高い病態発現特異性を基盤としているため、高度な病態特異性をもつものと考えられる。その影響因子として、C4dの切り出し酵素の活性制御と、血液中でDNペプチドと複合体を形成する分子が重要である。
DNペプチドの血液中からの検出は、限外濾過や免疫沈降などの前処理により、質量分析を用いた手法や、抗体の構築によるELISA法で解析できる。そのELISA的手法による定量解析には、既に作製されている抗C14EP1モノクローナル抗体や、抗DN1モノクローナル抗体のほか、ペプチド(DN1)のC端断端特異抗体の作製が有用である。
【0031】
DNペプチドは、血清や髄液試料において、特にはアルツハイマー型認知症の病態マーカーとして有用である。
病態マーカーとしては、前記(1)〜(3)のいずれもが利用できるが、特に、血液においては(1)DN1及び(3)DN1+DN2、髄液においては(3)DN1+DN2が有効である。なお、(3)(DN1+DN2)と同様に、(1)DN1と(2)DN2との混合物も利用可能である。
なお、後述するが、治療薬としては、(2)DN2が有用である。
C4dの隣接するペプチドでありながらDN1とDN2で異なる作用を示す事実は、少なくともいずれかの分子に対する受容体が細胞に存在するためであると考えられる。
【0032】
本発明によるDNペプチド、またはその部分ペプチド或いはそれを含むタンパク質は、脳においてAβの蓄積を生じ得る疾患の病態マーカーまたは治療薬となるものであれば、天然型と構造的に類似したものでもよい。このような構造的に類似したものには、変異体や他の生物由来も含まれる。アミノ酸の改変は、人為的に行うのであれば、通常、30アミノ酸以内、好ましくは10アミノ酸以内、さらに好ましくは5アミノ酸以内であり、置換、欠失、挿入、及び/または付加が可能である。その調製には、公知のハイブリダイゼーション技術が利用できる。
置換されるアミノ酸は、置換前のアミノ酸と似た性質を有するアミノ酸であることが好ましい。例えば、Ala、Val、Leu、Ile、Pro、Met、Phe、Trpは、共に非極性アミノ酸に分類されるため互いに似た性質を有し、非荷電性としては、Gly、Ser、Thr、Cys、Tyr、Asn、Glnが挙げられる。また、酸性アミノ酸としては、Asp及びGluが挙げられ、塩基性アミノ酸としては、Lys、Arg、Hisが挙げられる。
【0033】
また、本発明は、前記ペプチドをコードするDNAに関する。
DNAとしては、前記(1)〜(3)のいずれかのペプチドをコードしうるものであれば特に制限はなく、cDNA、ゲノムDNA、及び合成DNAが含まれる。また、遺伝暗号の縮重に基づく任意の塩基配列を有するDNAも含まれる。DNAの調製方法は、従来公知のスクリーニング法や合成法が利用できる。
ヒト以外の生物に由来するペプチドをコードするDNAは、通常、ヒトDNペプチドと高い相同性を有する。高い相同性とは、アミノ酸レベルで少なくとも40%以上、好ましくは55%以上、さらに好ましくは70%以上の配列の同一性を指す。DNAを単離するためのハイブリダイゼーションは、従来公知の条件で行える。
【0034】
DNAは、組換えタンパク質の生産に有用である。すなわち、DNAを発現ベクターに挿入し、そのベクターを適当な細胞に導入して得た形質転換体を培養し、発現させたタンパク質をその形質転換体またはその培養上清から生成することにより、組換えタンパク質として調製することが可能である。発現させるための宿主には制限はなく、公知のベクター系を用いて、酵母、昆虫細胞、哺乳動物細胞などで発現させることが可能である。神経細胞での発現であれば、例えば、SFVベクターを用いるシステムが利用できる。宿主細胞において発現させた組換えタンパク質は、従来公知の方法により精製することができる。
また、本発明のDNペプチドまたはタンパク質の発現異常や機能異常に起因する疾患の遺伝子治療に応用することも可能である。
【0035】
また、本発明は、前記ペプチドまたはそれを含むタンパク質に結合する抗体に関する。
抗体は、従来公知の方法により作製することが可能である。ポリクローナル抗体の調製は、例えば、海馬組織より調製した天然由来の本発明のタンパク質または組換えタンパク質を、アジュバントと共に、ウサギ、モルモット、ヤギ等の動物に免疫する。免疫を複数回行うことにより、抗体価を上昇させることができる。最終免疫後、免疫動物から採血を行うことにより抗血清が得られる。この抗血清に対し、例えば、硫酸アンモニウム沈殿や陰イオンクロマトグラフィーによる分画、プロテインAや固定化抗原を用いたアフィニティー精製を行うことにより、ポリクローナル抗体を調製することができる。抗原として、部分ペプチドを用いることも可能である。
一方、モノクローナル抗体の調製は、上記と同様に免疫動物に免疫し、最終免疫後、この免疫動物から脾臓またはリンパ節を採取する。この脾臓またはリンパ節に含まれる抗体産生細胞とミエローマ細胞とをポリエチレングリコールなどを用いて融合し、ハイブリドーマを調製する。目的のハイブリドーマをスクリーニングし、これを培養し、その培養上清からモノクローナル抗体を調製することができる。モノクローナル抗体の精製は、例えば、硫酸アンモニウム沈殿や陰イオンクロマトグラフィーによる分画、プロテインAや固定化抗原を用いたアフィニティー精製により行うことができる。
【0036】
抗体は、本発明のペプチドまたはタンパク質のアフィニティー精製のために用いられる他、例えば、発現異常や構造異常に起因する疾患の検査や診断、発現量の検出などに利用することも可能である。
本発明のDNペプチドは、血清及び髄液に検出されることから、これらの試料に含まれるペプチドを検出することにより、脳においてAβの蓄積を生じる疾患の検査・診断を行なうことができる。
【0037】
本発明の抗体を用いる脳におけるAβの蓄積を生じる疾患の検査は、被検者から試料を調製するステップと、その試料に含まれる本発明のペプチドまたはタンパク質の量を、抗体を用いて検出するステップとを含む方法により実施することができる。
検査の対象となる疾患としては、脳におけるAβの蓄積を生じる疾患であれば制限はなく、例えば、老人性痴呆、アルツハイマー病、ダウン症が挙げられる。
検査のために被験者から調製する試料としては、血清または髄液が好適であり、試料中に含まれるDNペプチドまたはタンパク質は、例えば、ウェスタンブロッティング、免疫沈降、ELISA等の方法で検出することが可能である。検出に用いられる抗体としては、モノクローナル抗体であっても、ポリクローナル抗体であってもよい。抗体を検査薬として用いる場合、pH緩衝液を用い、担体、防腐剤等を必要に応じて混合してもよい。
検出の結果、健常者と比較して、被検者試料中の抗体反応性ペプチドまたはタンパク質の量の増加または減少、分子量の異常、各分子量の量比の異常が認められれば、疾患にかかっている可能性があると判定される。
【0038】
本発明のペプチドまたはタンパク質の検出には、従来公知のマススペクトル解析(MALDI)も利用できる。
【0039】
アルツハイマー病患者の脳において、その病態発症の早い段階で特定の補体分子の沈着があることは確立しているので、本発明で発見したC4dのN端側断片が血液中で高発現であれば、病態との関連で裏付けられている。組織沈着分子であるC4dは、DNペプチドの後ろ側(C端側)にチオエステル結合部分があり、そこを介して内皮細胞などの組織に結合している。従って、そのN端側ペプチドが特異的プロテアーゼにより遊離されれば、中枢神経の末梢マーカー分子となりうる性質を備えている。
なお、C4dは、チオエステル結合部分があるために、血液中でfreeの断片として存在せず、組織沈着物として検出されるが、チオエステル結合部分を欠くDNペプチドはfreeでも存在し得ると考えられる。
【0040】
また、本発明は、脳においてAβの蓄積を生じる疾患の治療薬に関する。
その治療薬は、前記(2)または(3)のいずれかの配列のペプチド、または、前記の抗体を有効成分とする。治療薬としては、(2)DN2が有用であり、(1)DN1は上述のように病態マーカーに有用である。
ペプチドDN2が神経細胞保護作用を有するのは、補体活性化の制御によるものであり、ペプチドDN2に対する特異的なリセプターの存在が考えられる。
【0041】
治療薬の剤形は特に制限されず、通常使用され得る任意の剤形をとることができ、固形剤、半固形剤、液剤が可能である。また、本発明の効果及び製剤的な安定性などを損なわない限り上記成分の他に、用途あるいは剤形などに応じて、医薬品、医薬部外品、食品に通常使用され得る任意の成分を適宜配合してもよい。
配合できる成分としては、特に制限されないが、例えば、担体成分または添加剤などが挙げられ、固形剤における担体成分または添加剤としては、例えば、賦形剤、崩壊剤、結合剤、滑沢剤、抗酸化剤、コーティング剤、着色剤、矯味剤、界面活性剤、可塑剤、甘味剤、着香剤の他、崩壊補助剤、発泡剤、吸着剤、防腐剤、湿潤剤、帯電防止剤などが例示できる。また、液剤における担体成分または添加剤としては、例えば、溶剤、pH調整剤、清涼化剤、懸濁化剤、消泡剤、粘稠剤、溶解補助剤、前記界面活性剤、抗酸化剤、着色剤、甘味剤、着香剤の他、防腐・抗菌剤、キレート剤、可溶化剤または溶解補助剤、安定化剤、流動化剤、乳化剤、増粘剤、緩衝剤、等張化剤、分散剤などが例示できる。
【0042】
本発明は、また、本発明のペプチドまたはタンパク質に結合する化合物のスクリーニング方法に関する。
そのスクリーニング法は、本発明のペプチドまたはタンパク質またはその部分ペプチドに被検試料を接触させるステップ、被検試料との結合活性を検出するステップ、結合活性を有する化合物を選択するステップを含む。スクリーニングに用いる被検試料としては、例えば、細胞抽出液、遺伝子ライブラリーの発現産物、合成低分子化合物、合成ペプチド、修飾ペプチド、天然化合物などが挙げられる。スクリーニングに用いる被検試料は、必要に応じて適宜標識して用いられ、標識としては、例えば、放射標識、蛍光標識などが挙げられる。
得られた化合物は、前記の抗体と同様に、脳においてAβの蓄積を生じる疾患を検査する検査薬や、治療薬などの候補として利用可能である。
【実施例1】
【0043】
アルツハイマー病(AD)及び軽度認知障害(MCI)患者に特異的な血液中病態複合体の生化学的検出手法を確立した。
検体には、PBS(-)で4倍希釈した血清を用いた。抗体には、抗DN1モノクロナル抗体(IgG精製)を用いた。担体には、Protein G結合磁気ビーズ(NEB)を用い、NEB150μlに対して抗体1μlを結合(4℃一晩、または、室温3時間)させ、その結合ビーズについて希釈検体400μl(4℃一晩)と反応させて、免疫沈降を行った。磁気ラックを用いて反応液を除去しPBS(-)750μlで洗浄した。
【0044】
複合体の安定な遊離 (低pH)を行うために、ビーズを10mM Glicine−HCL2 pH2.0(13μl)に混和し、室温で5分攪拌し、磁気ラックを用い回収した液を4.5μlの50mM NaOH入りの新しいチューブに入れ中和した。回収液と等量のSDSバッファー(還元剤を含まない)を加え電気泳動サンプルとした(加熱処理は行わない)。
【0045】
図3は、実験に使用した検体を示す表であり、図4は、その電気泳動の結果を示す写真である。7.5%PAGゲルを用い、通常のSDSバッファーで分離(250V、14mA、160−180分)し、CBB染色した。
その結果、正常群(試料6〜8、10)及び脳梗塞患者(CVA)(試料9)には、DN1抗体のバンド(DN1と結合した蛋白)が検知されなかったが、アルツハイマー病患者(AD)(試料1〜5)には検知され、DN1抗体がアルツハイマー病の病態マーカーとなることが示された。
【実施例2】
【0046】
抗DN1モノクロナル抗体を用いたELISA解析を行った。
検体には、PBS(-)で10倍希釈した血清を用いた。定法に従いTMB 基質液を添加し450nMでの吸光度を測定した。なお、バッファーにはカルシウム及びマグネシウムイオンの含まれないPBS(-)を用いた。
その結果、図5の表に示すように、正常群(試料1、6〜7、10)に比べ、アルツハイマー病患者(AD)(試料2〜3)では吸光度が高く、軽度認知障害患者(MCI)(試料4〜5、8〜9)がその中間の値であり、DN1抗体がアルツハイマー病や軽度認知障害患者の病態マーカーとなることが示された。
【実施例3】
【0047】
海馬神経細胞及び大脳皮質細胞(詳しくは、胎児マウスの海馬由来初代培養細胞及び大脳皮質細胞)におけるペプチド(DN1、DN2、DN1+DN2)の毒性を評価した。
マウス15日齢胎児より海馬神経細胞及び大脳皮質細胞を採取し、Neuro basal(B27、L−glutamin、グルタミン酸を含む)で培養し、培養3日目に培養交換し6日目にLDHアッセイに使用した。
図6は、海馬神経細胞におけるペプチド(DN1、DN2、DN1+DN2)の毒性を示すグラフ、図7は、大脳皮質細胞におけるペプチド(DN1、DN2、DN1+DN2)の毒性を示すグラフである。それぞれ、上段がペプチド(DN1、DN2、DN1+DN2)による処理後24時間経過、下段が処理後48時間経過後の値である。なお、本実施例では、ペプチド(DN1+DN2)として、ペプチド(DN1)とペプチド(DN2)の混合物を用いた。
海馬神経細胞及び大脳皮質細胞のいずれの場合も、ペプチドDN2では5μMの投与(下限は2μM)で細胞毒性を示したが、ペプチドDN1では顕著な細胞毒性は示されなかった。
【実施例4】
【0048】
海馬神経細胞におけるペプチドDN2の保護作用を評価した。
マウス15日齢胎児より海馬神経細胞を採取し、Neuro basal(B27、L−glutamin、グルタミン酸を含む)で培養し、培養3日目に培養交換し6日目にLDHアッセイに使用した。
図8は、海馬神経細胞におけるペプチドDN2及びAβ(42)、Aβ(40)の毒性を示すグラフである。上段がペプチドDN2及びAβによる処理後48時間経過、下段が処理後72時間経過後の値である。
5μMのAβ(42)の投与により細胞毒性を示したが、2μM(下限は1μM)ペプチドDN2の投与により細胞毒性の低下、すなわち、Aβによる細胞毒性に対する保護作用が確認された。また、ペプチドDN2は、少量ではもともと毒性がないので、薬剤として有用である。
【産業上の利用可能性】
【0049】
本発明によると、脳においてAβの蓄積を生じるADやMCI等の診断や治療に寄与するので、産業上利用価値が高い。
【特許請求の範囲】
【請求項1】
下記(1)ないし(3)のいずれかの配列から成り、病態マーカーとなる
ことを特徴とするペプチド。
(1)TLEIPGNSDPNMIPDGDFNSYVR ‥‥‥(DN1)
(2)VTASDPLDTLGSEGALSPGGVASLLR ‥‥‥(DN2)
(3)TLEIPGNSDPNMIPDGDFNSYVRVTASDPLDTLGSEGALSPGGVASLLR ‥‥(DN1+DN2)
【請求項2】
病態が、脳においてAβの蓄積を生じ得る疾患である
請求項1に記載のペプチド。
【請求項3】
脳においてAβの蓄積を生じる疾患が、アルツハイマー病、老人性痴呆症、軽度認知障害、ダウン症から成る群より選択されるいずれかである
請求項2に記載のペプチド。
【請求項4】
請求項1ないし3のいずれかに記載の病態マーカーとなるペプチドであって、
前記(1)ないし(3)のいずれかの配列において、1もしくは複数のアミノ酸が、置換、欠失、挿入、及び/または付加した配列から成るペプチド。
【請求項5】
請求項1ないし4のいずれかに記載のペプチドをコードする
ことを特徴とするDNA。
【請求項6】
請求項1ないし4のいずれかに記載のペプチド、またはそれを含むタンパク質に対する
ことを特徴とする抗体。
【請求項7】
請求項7に記載の抗体を含み、脳においてAβの蓄積を生じる疾患を検査する
ことを特徴とする検査薬。
【請求項8】
脳においてAβの蓄積を生じる疾患の検査方法であって、
被検者から生体試料を調製するステップと、
その試料に含まれる請求項1ないし4のいずれかに記載のペプチドの量を、検出するステップを含む
ことを特徴とする疾患の検査方法。
【請求項9】
脳においてAβの蓄積を生じる疾患の治療薬であって、
前記(2)または(3)のいずれかの配列のペプチドを有効成分とする
ことを特徴とする治療薬。
【請求項1】
下記(1)ないし(3)のいずれかの配列から成り、病態マーカーとなる
ことを特徴とするペプチド。
(1)TLEIPGNSDPNMIPDGDFNSYVR ‥‥‥(DN1)
(2)VTASDPLDTLGSEGALSPGGVASLLR ‥‥‥(DN2)
(3)TLEIPGNSDPNMIPDGDFNSYVRVTASDPLDTLGSEGALSPGGVASLLR ‥‥(DN1+DN2)
【請求項2】
病態が、脳においてAβの蓄積を生じ得る疾患である
請求項1に記載のペプチド。
【請求項3】
脳においてAβの蓄積を生じる疾患が、アルツハイマー病、老人性痴呆症、軽度認知障害、ダウン症から成る群より選択されるいずれかである
請求項2に記載のペプチド。
【請求項4】
請求項1ないし3のいずれかに記載の病態マーカーとなるペプチドであって、
前記(1)ないし(3)のいずれかの配列において、1もしくは複数のアミノ酸が、置換、欠失、挿入、及び/または付加した配列から成るペプチド。
【請求項5】
請求項1ないし4のいずれかに記載のペプチドをコードする
ことを特徴とするDNA。
【請求項6】
請求項1ないし4のいずれかに記載のペプチド、またはそれを含むタンパク質に対する
ことを特徴とする抗体。
【請求項7】
請求項7に記載の抗体を含み、脳においてAβの蓄積を生じる疾患を検査する
ことを特徴とする検査薬。
【請求項8】
脳においてAβの蓄積を生じる疾患の検査方法であって、
被検者から生体試料を調製するステップと、
その試料に含まれる請求項1ないし4のいずれかに記載のペプチドの量を、検出するステップを含む
ことを特徴とする疾患の検査方法。
【請求項9】
脳においてAβの蓄積を生じる疾患の治療薬であって、
前記(2)または(3)のいずれかの配列のペプチドを有効成分とする
ことを特徴とする治療薬。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【公開番号】特開2012−223107(P2012−223107A)
【公開日】平成24年11月15日(2012.11.15)
【国際特許分類】
【出願番号】特願2011−91528(P2011−91528)
【出願日】平成23年4月15日(2011.4.15)
【出願人】(599061121)
【Fターム(参考)】
【公開日】平成24年11月15日(2012.11.15)
【国際特許分類】
【出願日】平成23年4月15日(2011.4.15)
【出願人】(599061121)

【Fターム(参考)】
[ Back to top ]

