病理診断情報生成方法及び病理診断情報生成システム
【課題】高輝度の蛍光物質内包ナノ粒子を免疫組織化学法の蛍光標識材料に用いることにより、同一切片、同一蛍光視野で細胞等の形態情報とともに抗体分子情報を提供できるようにすることで、病理診断の工数低減、診断精度の向上を図る。
【解決手段】本発明によれば、組織切片に、特定抗原を認識する抗体と、当該抗体に結合した、複数の蛍光物質を内包するナノ粒子とを構成要素に含む蛍光標識材料による染色、及びHE(ヘマトキシリン−エオジン)染色を施し、前記染色を施された組織切片に所定波長の励起光を照射して前記組織切片に蛍光を発光させ、当該蛍光の像を顕微鏡により結像させることにより、前記組織切片における細胞形態情報及び前記特定抗原の分子の情報を同時に生成する。
【解決手段】本発明によれば、組織切片に、特定抗原を認識する抗体と、当該抗体に結合した、複数の蛍光物質を内包するナノ粒子とを構成要素に含む蛍光標識材料による染色、及びHE(ヘマトキシリン−エオジン)染色を施し、前記染色を施された組織切片に所定波長の励起光を照射して前記組織切片に蛍光を発光させ、当該蛍光の像を顕微鏡により結像させることにより、前記組織切片における細胞形態情報及び前記特定抗原の分子の情報を同時に生成する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、組織の自家蛍光またはHE(ヘマトキシリン−エオジン)染色に用いられるエオジンが発する自家蛍光と、蛍光物質内包ナノ粒子の発する蛍光とを利用することにより、組織の形態に関する情報と目的とする生体物質(代表的には抗原分子)に関する情報を同一視野で観察することのできる免疫組織化学法を利用した病理診断情報生成方法及び病理診断情報生成システムに関する。
【背景技術】
【0002】
病理診断では、まず採取した組織を固定するために脱水し、パラフィンによるブロック化といった処理を行った後、2〜8μmの厚さの薄片に切り、パラフィンを取り除き、染色して顕微鏡にセットして観察を行う。病理診断の分野では、特許文献1〜3に見られるように顕微鏡観察は広く用いられている手法であるが、病理医は、この顕微鏡観察において、細胞の核の大きさや形の変化、組織としてのパターンの変化等の形態学的な情報、染色情報をもとに診断を行っている。
また、画像のデジタル化技術の発達に伴い、病理診断の分野においても、顕微鏡及びデジタルカメラ等を用いて観察対象のデジタル画像(病理画像)を取得し、この病理画像から、病理医が病理診断を行う際に必要となる情報を抽出・計測して表示する自動化された病理診断支援装置が普及してきている。
【0003】
例えば、特許文献4には、病理画像から細胞核領域及び細胞質領域をそれぞれ特定する核・細胞質分布推定手段と、病理画像から腺腔領域(細胞をほとんど含まない領域)を特定する腺腔分布抽出手段と、癌細胞が存在するか否かを判定する癌部位推定手段と、癌の進行度を判定する進行度判定手段と、癌細胞の分布図や進行度等を表示する画像表示手段と、を有するし病理診断支援装置が開示されている。
【0004】
また、特許文献5には、正常部位と癌部位をそれぞれ選択的に染色するような2種類の染料で病理標本を染色し、更にスペクトル画像からランベルト・ベールの法則を用いて染色濃度を評価し、癌細胞の有無を判定する癌細胞の検出方法が開示されている。
【0005】
しかし、いずれの評価法を用いた場合でも、組織染色方法は従来の色素染色法(例えば、HE染色(ヘマトキシリン−エオジン染色)、酵素を用いた色素染色法(例えば、DAB染色)であり、その染色濃度は温度、時間等の環境条件により大きく左右され、病理診断支援装置の正確な定量測定性能を活かしきれていない。
【0006】
一方、特許文献6には、所定の励起波長において、組織切片が発する自家蛍光の波長域と近接しない蛍光波長を有する(自家蛍光のストークスシフトよりも(たとえば約80nm以上)長波長のストークスシフトを有する)蛍光物質を用いて染色することにより、自家蛍光と標的分子に由来する蛍光とを異なる色で区別して観察する方法が開示されている。しかしながら、この方法には、安価で好感度なモノクロカメラが使えない、適切な光学フィルターを用いることができず、励起光によるノイズが増大するという問題点があり、実用的な診断を行うことは実質的に不可能であった。
また、色素に代わる標識試薬として定量性能が高い蛍光色素が組織染色の研究に用いられているが(非特許文献1参照)、その発光輝度は組織の発する自家蛍光と比較して暗く、極微量のバイオマーカーを発光レベルによって自動判別することはできない。
【0007】
また、上記の従来の病理診断はいずれも、二枚以上のスライドで同一の部位を観察することとなる。複数のスライドを使用した診断は、例えば、次の手順で行われる。
まず、いわゆるHE染色を施された組織切片標本を載せたスライドと、HE染色された組織切片に隣接する組織切片を免疫組織化学染色法により染色することにより得られた組織切片標本を載せたスライドと、を用意し、病理医がHE染色を施された組織切片標本を顕微鏡観察することにより腫瘍判断を行う。
続いて、免疫組織化学染色法により染色することで得られた組織切片標本に、HE染色された標本で判定された腫瘍部分をてらし合わせ、腫瘍部分を判別する。そして、免疫組織化学染色した組織切片標本の腫瘍部分を顕微鏡観察する。
この観察は、非常な手間と熟練を有し、属人性が高く、病理診断における診断ばらつきの要因ともなり、標準化の妨げとなっている。また、顕微鏡を覗くこと自体が病理医の疲労を誘発し、作業効率や診断精度を低下させている。そこで、デジタルカメラ等のデジタル画像生成装置で顕微鏡観察される対象のデジタル画像を生成しビュワーに表示させることで、疲労低減を図る手法(例えば、特許文献7参照)、2枚の切片より得られた画像を重畳(合成)して1枚の画像とすることで診断効率の向上を図る手法(例えば、特許文献8参照)も知られている。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開平9−197290号公報
【特許文献2】特開2007−271503号公報
【特許文献3】特開2010−078377号公報
【特許文献4】特開2004−286666号公報
【特許文献5】特表2001−525580号公報
【特許文献6】国際公開WO2003/010542号パンフレット
【特許文献7】特開2006−153742号公報
【特許文献8】国際公開WO2008/108059号パンフレット
【非特許文献】
【0009】
【非特許文献1】「病理と臨床 Vol.25 2007年臨時増刊号 診断に役立つ免疫組織化学」文光堂 2007年
【発明の概要】
【発明が解決しようとする課題】
【0010】
近年、抗体医薬を中心とした分子標的薬治療の広がりに伴い、分子標的薬をより効果的に使用するため、正確な診断法の必要性が高まっている。病理診断においても、より正確に疾病の診断を行うため、極微量のバイオマーカーを組織切片上で定量的に検出することが求められている。また、病理診断に必要な工数の低減も求められている。
【0011】
本願発明者等は、免疫組織化学法における蛍光標識材料として、複数の蛍光物質を内包したナノ粒子(蛍光物質内包ナノ粒子と称する)を用い、この蛍光標識材料による染色及びHE染色された組織切片に適切な波長を有する励起光を照射することにより、細胞等の自家蛍光によりその組織又は細胞の形態情報(細胞形態情報)が得られると同時に、その自家蛍光に埋没することなく、蛍光物質内包ナノ粒子が発する蛍光により目的とする特定抗原の分子の情報(抗原分子情報)が得られることを見出した。
【0012】
本発明の課題は、高輝度の蛍光物質内包ナノ粒子を免疫組織化学法の蛍光標識材料に用いることにより、同一切片、同一蛍光視野で細胞等の形態情報とともに抗体分子情報(細胞機能情報)を提供できるようにすることで、病理診断の工数低減、診断精度の向上を図ることである。
【課題を解決するための手段】
【0013】
上記課題を解決するため、請求項1に記載の発明の病理診断情報生性方法は、
組織切片に、特定抗原を認識する抗体と、当該抗体に結合した、複数の蛍光物質を内包するナノ粒子とを構成要素に含む蛍光標識材料による染色、及びHE(ヘマトキシリン−エオジン)染色を施す工程と、
前記染色を施された組織切片に所定波長の励起光を照射して前記組織切片に蛍光を発光させ、当該蛍光に基づき、前記組織切片における組織又は細胞の形態情報、及び前記特定抗原の分子の情報を同時に生成する工程と、
を含む。
【0014】
請求項2に記載の発明は、請求項1に記載の発明において、
前記所定波長の励起光は、560〜630nmの範囲であり、前記蛍光物質は、前記励起光により580〜690nmの範囲にピークを有する蛍光を発するものである。
【0015】
請求項3に記載の発明は、請求項1又は2に記載の発明において、
前記組織又は細胞の形態情報、及び前記特定抗原の分子の情報が同一視野で得られる。
【0016】
請求項4に記載の発明は、請求項1〜3の何れか一項に記載の発明において、
前記組織又は細胞の形態情報、及び前記特定抗原の分子の情報は、前記蛍光の像を顕微鏡により結像することにより生成される。
【0017】
請求項5に記載の発明は、請求項1〜4の何れか一項に記載の発明において、
前記特定抗原の分子の情報は、ドット状の蛍光で表される。
【0018】
請求項6に記載の発明は、
特定抗原を認識する抗体と、当該抗体に結合した、複数の蛍光物質を内包するナノ粒子とを構成要素に含む蛍光標識材料による染色と、HE(ヘマトキシリン−エオジン)染色と、が施された組織切片が載置された一のスライドに、所定波長の励起光を照射する照射手段と、
前記照射手段による励起光の照射により前記組織切片から発光された蛍光の像を結像することにより前記組織切片における組織又は細胞の形態情報及び前記特定抗原の分子の情報を同時に生成する結像手段と、
を備える。
【0019】
請求項7に記載の発明は、請求項6に記載の発明において、
前記照射手段は、560〜630nmの範囲の波長の励起光を照射するものであり、
前記蛍光物質は、前記励起光により580〜690nmの範囲にピークを有する蛍光を発するものである。
【0020】
請求項8に記載の発明は、請求項6又は7に記載の発明において、
前記結像手段により結像された像を撮像してデジタル画像データを生成する撮像手段と、
前記撮像手段により生成された画像データに基づき表示用の画像を生成する画像処理手段と、
前記画像処理手段により生成された画像を表示する表示手段と、
を備える。
【0021】
請求項9に記載の発明は、請求項8に記載の発明において、
前記表示手段に表示する画像の切替を指示するための操作手段を有し、
前記画像処理手段は、前記撮像手段により生成された画像データから前記組織切片の特定抗原の分子の情報のみを抽出して抗原分子画像を生成する手段と、前記撮像手段により生成された画像データから前記組織切片の組織又は細胞の形態情報のみを抽出して細胞形態画像を生成する手段を有し、
前記表示手段は、前記操作手段からの切替指示に応じて前記抗原分子画像と前記細胞形態画像を切替表示する。
【発明の効果】
【0022】
本発明によれば、高輝度の蛍光物質内包ナノ粒子を免疫組織化学法の蛍光標識材料に用いることにより、同一切片、同一蛍光視野で、細胞等の形態情報とともに抗原分子の情報(細胞機能情報)を観察(顕微鏡鏡胴観察)できるため、病理医の診断精度の向上、利便性向上を図ることができる。
【0023】
また、本発明によれば、病理診断のための検査過程で使用するスライドは1部位に対し1枚のみですむので、顕微鏡へのスライドの着脱工数が低減され、更に保管するスライドも同様に1枚のみですみ、省スペース化も可能となる。
更に、本発明によれば、1枚のスライドの少なくとも1回の撮影で、組織切片の自家蛍光及びエオジンの自家蛍光の画像である細胞形態情報と、蛍光標識材料からの蛍光の画像である抗原分子情報を含む画像データを生成可能となるので、従来に比べて検査工数を削減することができる。
更に、本発明によれば、1回の撮影で細胞形態情報と抗原分子情報を含む画像データが得られるので、細胞形態情報と抗原分子情報を個別に撮影して重畳(合成)した画像データとは異なり、細胞形態情報と抗原分子情報の位置合わせ(病理医の記憶による位置合わせ、画像処理による位置合わせ)自体が不要である。そのため、位置合わせ精度に左右されずに正確な診断を行うことができる。また、顕微鏡鏡胴観察方式の他に、デジタル撮像系を用いて生成された画像データをビュワー等の表示手段に表示する構成とすることで、一人で、或いは複数人のカンファレンスで、標準化された画像で正確な診断を行うことができ、診断精度を向上させることができる。
更に、組織切片の細胞形態情報のみを抽出した画像、組織切片の抗原分子情報のみを抽出した画像や双方を含む画像を操作手段の指示に応じて切り替えて表示手段に表示する構成とすることで、病理医が何れかの情報(細胞形態情報又は抗原分子情報)の画像において任意の領域に注目した状態で、視線を動かさずに他方の情報を確認すること等ができ、また、個々の病理医の診断スタイルに応じたフローとすることができ、診断の利便性が向上する。
また、本発明を乳がんに適用した場合、本発明で得られる画像データは、従来より乳房画像診断用に普及しているモノクロのモニタを使用して出力表示することができるので、新たにカラー用モニタ等の設備投資が不要となる。
また、抗原分子情報は、細胞形態情報を表す組織の自家蛍光やエオジン蛍光に比べて高輝度なドット状の蛍光として表されるので、観察者が抗原分子情報を細胞形態情報と区別して容易に視認することができ、診断性能を向上させることができる。このような本発明の方法は、モノクロカメラを用いた場合にも、抗原分子に結合した蛍光物質内包ナノ粒子が発する高輝度の蛍光を、細胞等が発する自家蛍光から区別して認識することができる。また、光学フィルターを用いて励起光によるノイズをカットすることも妨げられないので、高感度の測定を維持することができる。
【図面の簡単な説明】
【0024】
【図1】エオジンの励起波長、発光波長と蛍光強度の関係を示す図である。
【図2】標識材料Dを用いた場合に顕微鏡設置カメラから取得した画像である。
【図3】標識材料Eを用いた場合に顕微鏡設置カメラから取得した画像である。
【図4】標識材料Aを用いた場合に顕微鏡設置カメラから取得した画像である。
【図5】標識材料Bを用いた場合に顕微鏡設置カメラから取得した画像である。
【図6】標識材料Cを用いた場合に顕微鏡設置カメラから取得した画像である。
【図7】本発明を適用した乳房診断システムの全体構成例を示す図である。
【発明を実施するための形態】
【0025】
−蛍光標識材料−
本発明の免疫組織化学法では、蛍光標識材料として、生体物質認識部位およびこれに結合した蛍光物質内包ナノ粒子とを構成要素として含むものを用いる。
【0026】
〔蛍光物質〕
蛍光物質内包ナノ粒子に内包される蛍光物質は、具体的には、蛍光有機色素または量子ドットである。200〜700nmの範囲内の波長の紫外〜近赤外光により励起されたときに、400〜900nmの範囲内の波長の可視〜近赤外光の発光を示す蛍光物質を用いることが好ましい。なお、蛍光物質の励起波長および発光波長は、蛍光物質内包ナノ粒子に内包させた場合もそうでない場合も、ほぼ同じである。蛍光物質内包ナノ粒子には、いずれか1種の蛍光物質のみを内包させてもよいし、2種以上の蛍光物質の混合物を内包させてもよい。
【0027】
ここで、組織およびエオジンの自家蛍光は、たとえば350nmの励起波長を照射した場合はおよそ400〜600nmにわたる(約440nmにピークを有する)波長の蛍光を発し、490nmの励起波長を照射した場合はおよそ500〜650nmにわたる(約540nmにピークを有する)波長の蛍光を発する。したがって、同じ波長の励起光を照射したときに組織およびエオジンの自家蛍光と波長が重複する蛍光を発するものを、蛍光標識材料のための蛍光物質として選択することにより、共通のカットフィルターを用いて、同一視野において、それらの蛍光を観察することが可能である。この場合、蛍光物質内包ナノ粒子が発する蛍光は高輝度なので、組織等の自家蛍光に埋もれることなく識別することができる。組織等の発する自家蛍光の強度および蛍光物質内包ナノ粒子が発する蛍光の強度は、それらの蛍光波長の重なり具合が好ましいものとなるような励起光の波長や蛍光物質を選択することにより、適切なバランスを有するものとなるよう調整することが好ましい。
【0028】
蛍光有機色素としては、フルオレセイン系色素分子、ローダミン系色素分子、Alexa Fluor(登録商標、インビトロジェン社製)系色素分子、BODIPY(登録商標、インビトロジェン社製)系色素分子、カスケード系色素分子、クマリン系色素分子、エオジン系色素分子、NBD系色素分子、ピレン系色素分子、Texas Red(登録商標)系色素分子、シアニン系色素分子、ペリレン系色素分子、オキサジン系色素分子等を挙げることができる。
【0029】
具体的には、5−カルボキシ−フルオレセイン、6−カルボキシ−フルオレセイン、5,6−ジカルボキシ−フルオレセイン、6−カルボキシ−2’,4,4’,5’,7,7’−ヘキサクロロフルオレセイン、6−カルボキシ−2’,4,7,7’−テトラクロロフルオレセイン、6−カルボキシ−4’,5’−ジクロロ−2’,7’−ジメトキシフルオレセイン、ナフトフルオレセイン、5−カルボキシ−ローダミン、6−カルボキシ−ローダミン、5,6−ジカルボキシ−ローダミン、ローダミン 6G、テトラメチルローダミン、X−ローダミン、及びAlexa Fluor 350,Alexa Fluor 405、Alexa Fluor 430、Alexa Fluor 488、Alexa Fluor 500、Alexa Fluor 514、Alexa Fluor 532、Alexa Fluor 546、Alexa Fluor 555、Alexa Fluor 568、Alexa Fluor 594、Alexa Fluor 610、Alexa Fluor 633、Alexa Fluor 635、Alexa Fluor 647、Alexa Fluor 660、Alexa Fluor 680、Alexa Fluor 700、Alexa Fluor 750、BODIPY FL,BODIPY TMR、BODIPY 493/503、BODIPY 530/550、BODIPY 558/568、BODIPY 564/570、BODIPY 576/589、BODIPY 581/591、BODIPY 630/650、BODIPY 650/665(以上インビトロジェン社製)、メトキシクマリン、エオジン、NBD、ピレン、Cy5、Cy5.5、Cy7等を挙げることができる。
【0030】
量子ドットとしては、II−VI族化合物、III−V族化合物、又はIV族元素を成分として含有する量子ドット(それぞれ、「II−VI族量子ドット」、「III−V族量子ドット」、「IV族量子ドット」ともいう。)のいずれかを用いることができる。
【0031】
具体例としては、CdSe、CdS、CdTe、ZnSe、ZnS、ZnTe、InP、InN、InAs、InGaP、GaP、GaAs、Si、Geが挙げられる。
上記量子ドットをコアとし、その上にシェルを設けた量子ドットを用いることもできる。以下本明細書中シェルを有する量子ドットの表記法として、コアがCdSe、シェルがZnSの場合、CdSe/ZnSと表記する。例えば、CdSe/ZnS、CdS/ZnS、InP/ZnS、InGaP/ZnS、Si/SiO2、Si/ZnS、Ge/GeO2、Ge/ZnSなどが挙げられる。
【0032】
量子ドットは必要に応じて、有機ポリマーなどにより表面処理が施されているものを用いてもよい。例えば、表面カルボキシ基を有するCdSe/ZnS(インビトロジェン社製)、表面アミノ基を有するCdSe/ZnS(インビトロジェン社製)などがあげられる。
【0033】
〔蛍光物質内包ナノ粒子の作製方法〕
蛍光物質内包ナノ粒子は、上述したような蛍光物質がナノ粒子内部に分散したものであり、蛍光物質はそれを被覆するナノ粒子と化学的に結合していても、していなくてもよい。
【0034】
ナノ粒子を構成する素材は特に限定されるものではなく、ポリスチレン、ポリ乳酸、シリカなどを挙げることができる。
蛍光物質内包ナノ粒子は、公知の方法により作製することができる。例えば、蛍光有機色素を内包したシリカナノ粒子は、ラングミュア8巻2921ページ(1992)に記載されているFITC内包シリカ粒子の合成を参考に合成することができる。FITCの代わりに所望の蛍光有機色素を用いることで種々の蛍光有機色素内包シリカナノ粒子が合成できる。
【0035】
量子ドットを内包したシリカナノ粒子は、ニュー・ジャーナル・オブ・ケミストリー33巻561ページ(2009)に記載されているCdTe内包シリカナノ粒子の合成を参考に合成することができる。
【0036】
蛍光有機色素を内包したポリスチレンナノ粒子は、米国特許第4326008号(1982)に記載されている重合性官能基をもつ有機色素を用いた共重合法や、米国特許第5326692号(1992)に記載されているポリスチレンナノ粒子への蛍光有機色素の含浸法を用いて作製することができる。
【0037】
量子ドットを内包したポリマーナノ粒子は、ネイチャー・バイオテクノロジー19巻631ページ(2001)に記載されているポリスチレンナノ粒子への量子ドットの含浸法を用いて作製することができる。
【0038】
蛍光物質内包ナノ粒子の平均粒径は特に限定されないが、通常は30〜800nm程度である。また、粒径のばらつきを示す変動係数も特に限定されないが、通常は20%程度である。ここでいう平均粒径は、走査型電子顕微鏡(SEM)を用いて電子顕微鏡写真を撮影し十分な数(たとえば1000個)の蛍光物質ナノ粒子について断面積を計測し、その計測値を相当する円の面積としたときの直径を粒径として求められる算術平均であり、変動係数は、上記のようにして測定した粒径分布から算出した値(100×粒径の標準偏差/平均粒径)である。
【0039】
〔蛍光標識材料の作製方法〕
蛍光標識材料における生体物質認識部位は、目的とする生体物質と特異的に結合する物質により構成される部位である。目的とする生体物質は、それと特異的に結合する物質が存在するものであれば特に限定されるものではないが、代表的にはタンパク質(ペプチド)および核酸(オリゴヌクレオチド、ポリヌクレオチド)が挙げられる。したがって、そのような目的とする生体物質に結合する物質としては、前記タンパク質を抗原として認識する抗体やそれに特異的に結合する他のタンパク質等、および前記核酸にハイブリダイズする塩基配列を有する核酸等が挙げられる。具体的には、細胞表面に存在するタンパク質であるヒト上皮細胞成長因子受容体2(HER2)に特異的に結合する抗HER2抗体、細胞核に存在するエストロゲン受容体(ER)に特異的に結合する抗ER抗体、細胞骨格を形成するアクチンに特異的に結合する抗アクチン抗体などが挙げられる。中でも抗HER2抗体および抗ER抗体は、免疫組織化学法を乳がんの投薬選定のために利用する際の好ましい生体物質認識部位である。
【0040】
生体物質認識部位と蛍光物質内包ナノ粒子の結合の態様としては特に限定されず、共有結合、イオン結合、水素結合、配位結合、物理吸着及び化学吸着等が挙げられる。結合の安定性から共有結合などの結合力の強い結合が好ましい。
【0041】
また生体物質認識部位と蛍光物質内包ナノ粒子の間を連結する有機分子があってもよい。例えば生体物質との非特異的吸着を抑制するためポリエチレングリコール鎖を用いることができ、例えばThermoScientific社製SM(PEG)12を用いることができる。
【0042】
蛍光物質内包シリカナノ粒子へ生体物質認識部位を結合させる場合、蛍光物質が蛍光有機色素の場合でも、量子ドットの場合でも同様の手順を適用することができる。例えば、無機物と有機物を結合させるために広く用いられている化合物であるシランカップリング剤を用いることができる。このシランカップリング剤は、分子の一端に加水分解でシラノール基を与えるアルコキシシリル基を有し、他端に、カルボキシル基、アミノ基、エポキシ基、アルデヒド基などの官能基を有する化合物であり、上記シラノール基の酸素原子を介して無機物と結合する。具体的には、メルカプトプロピルトリエトキシシラン、グリシドキシプロピルトリエトキシシラン、アミノプロピルトリエトキシシラン、ポリエチレングリコール鎖をもつシランカップリング剤(例えば、Gelest社製PEG−silane no.SIM6492.7)などがあげられる。
【0043】
蛍光物質内包シリカナノ粒子とシランカップリング剤との反応手順は、公知の手法を用いることができる。例えば、得られた蛍光色素内包シリカナノ粒子を純水中に分散させ、アミノプロピルトリエトキシシランを添加し、室温で12時間反応させる。反応終了後、遠心分離又はろ過により、表面がアミノプロピル基で修飾された蛍光物質内包シリカナノ粒子を得ることができる。続いてアミノ基と抗体中のカルボキシル基とを反応させることで、アミド結合を介して抗体を蛍光有機色素内包シリカナノ粒子と結合させることができる。必要に応じEDC(1-Ethyl-3-[3-Dimethylaminopropyl]carbodiimide Hydrochloride:Pierce社製)のような縮合剤を用いることもできる。
【0044】
必要により、有機分子修飾された蛍光物質内包シリカナノ粒子と直接結合しうる部位と、分子標的物質と結合しうる部位とを有するリンカー化合物を用いることができる。具体例として、アミノ基と選択的に反応する部位とメルカプト基と選択的に反応する部位の両方をもつsulfo−SMCC(Sulfosuccinimidyl 4[N-maleimidomethyl]-cyclohexane-1-carboxylate:Pierce社製)をリンカー化合物として用いて、アミノプロピルトリエトキシシランで修飾した蛍光物質内包シリカナノ粒子のアミノ基、および抗体中のメルカプト基のそれぞれと上記リンカー化合物の有する官能基とを反応させることにより、上記リンカー化合物を介して抗体が結合した蛍光物質内包シリカナノ粒子を作製することができる。
【0045】
蛍光物質内包ポリスチレンナノ粒子へ生体物質認識部位を結合させる場合、蛍光物質が蛍光有機色素の場合でも、量子ドットの場合でも同様の手順を適用することができる。すなわち、アミノ基など官能基をもつポリスチレンナノ粒子へ蛍光有機色素または量子ドットを含浸して、上記官能基をもつ蛍光物質内包ポリスチレンナノ粒子を作製し、以降前記と同様にEDCもしくはsulfo−SMCCを用いることで、抗体が結合した蛍光物質内包ポリスチレンナノ粒子ができる。
【0046】
−免疫組織化学法−
本発明の免疫組織化学法は、前述したような蛍光標識材料を用いて組織切片を染色する工程および必要に応じてHE染色を行う工程(「染色工程」と称する。)と、励起光を照射して所定の情報を得る工程(「観察工程」と称する。)とを含む。
【0047】
〔染色工程〕
本発明の免疫組織化学法における染色工程は上述したような特定の蛍光標識材料を用いて組織切片の染色を行う。染色する対象は病理切片組織に限定されず、細胞染色にも適用可能である。本発明の染色方法が適用できる切片の作製法は特に限定されるものではなく、公知の方法により作製された切片を用いることができる。たとえば、病理切片として汎用されているパラフィン包埋切片を用いる場合は、次のような手順で染色すればよい。
【0048】
1)脱パラフィン処理
キシレンを入れた容器に病理切片を浸漬させ、パラフィンを除去する。温度は特に限定されるものではないが、室温で行うことができる。浸漬時間は3分以上30分以下であることが好ましい。必要により浸漬途中でキシレンを交換してもよい。
【0049】
ついで、エタノールを入れた容器に病理切片を浸漬させ、キシレンを除去する。温度は特に限定されるものではないが、室温で行うことができる。浸漬時間は3分以上30分以下であることが好ましい。必要により浸漬途中でエタノールを交換してもよい。
【0050】
さらに、水を入れた容器に病理切片を浸漬させ、エタノールを除去する。温度は特に限定されるものではないが、室温で行うことができる。浸漬時間は3分以上30分以下であることが好ましい。必要により浸漬途中で水を交換してもよい。
【0051】
2)賦活化処理
公知の方法にならい、目的とする生体物質の賦活化処理を行う。賦活化条件に特に定めはないが、賦活液としては、0.01Mクエン酸緩衝液(pH6.0)、1mMEDTA溶液(pH8.0)、5%尿素、0.1Mトリス塩酸緩衝液などを用いることができる。加熱機器はオートクレーブ、マイクロウェーブ、圧力鍋、ウォーターバスなどを用いることができる。温度は50〜130℃、時間は5〜30分で行うことができる。
【0052】
ついで、PBSを入れた容器に賦活処理後の切片を浸漬させ、洗浄する。温度は特に限定されるものではないが、室温で行うことができる。浸漬時間は3分以上30分以下であることが好ましい。必要により浸漬途中でPBSを交換してもよい。
【0053】
3)蛍光標識材料による染色処理
生体物質認識部位および蛍光物質ナノ粒子を備えた蛍光標識材料のPBS分散液を調製し、病理切片に載せて、目的とする生体物質と反応させる。複数の生体物質を目的として染色する場合は、各生体物質に対応した生体物質認識部位および互いに異なる蛍光物質内包ナノ粒子を備えた蛍光標識材料のPBS分散液をそれぞれ調製し、それらを病理切片に載せて、それぞれ目的とする生体物質と反応させればよい。病理切片に載せる際には、それぞれの蛍光標識材料のPBS分散液をあらかじめ混合してもよいし、別々に順次載せてもよい。
【0054】
温度は特に限定されるものではないが、室温で行うことができる。反応時間は30分以上24時間以下であることが好ましい。なお、蛍光標識材料による染色を行う前に、BSA含有PBSなど公知のブロッキング剤を滴下することが好ましい。
【0055】
ついで、PBSを入れた容器に染色後の切片を浸漬させ、未反応蛍光物質内包ナノ粒子を除去する。温度は特に限定されるものではないが、室温で行うことができる。浸漬時間は3分以上30分以下であることが好ましい。必要により浸漬途中でPBSを交換してもよい。
【0056】
また、本発明では、細胞または組織自体が発する自家蛍光を利用してそれらの形態観察を行うことができるため、その他の染色液等を用いる必要はないが、光学顕微鏡による組織観察において汎用されているHE(ヘマトキシリン−エオジン)染色をあわせて行ってもよい。ヘマトキシリンは青紫色の色素であり、細胞核、骨組織、軟骨組織の一部、漿液成分など(好塩基性の組織等)を染色する。エオジンは赤〜ピンク色の色素であり、細胞質、軟部組織の結合組織、赤血球、線維素、内分泌顆粒など(好酸性の組織等)を染色する。このうちエオジンは自家蛍光を発するので、本発明における所定の蛍光標識材料による染色とともにHE染色を行った場合は、励起光を照射した際に、組織等が発する自家蛍光とともに細胞質等を染色したエオジンが発する自家蛍光により、細胞または組織の形態に関する情報をより取得しやすくなる。
染色処理後、カバーガラスを切片に載せて封入する。必要に応じて市販の封入剤を使用してもよい。
【0057】
〔観察工程〕
観察工程は、上記工程により染色された組織切片に励起光を照射することにより、組織の自家蛍光及びエオジンの自家蛍光に基づく細胞または組織の形態情報(細胞形態情報)を取得し、かつ前記蛍光標識材料による蛍光に基づく細胞または組織内の前記特定抗原分子の情報(抗原分子情報)を取得する工程である。
【0058】
励起光は、組織および必要に応じて用いられるエオジンが所望の波長の自家蛍光を発し、かつ蛍光標識材料中の蛍光物質が所望の波長の蛍光を発する、適切な波長を有するものであればよく、励起光の照射手段も特に限定されるものではない。たとえば、蛍光顕微鏡が備えるレーザ光源から、必要に応じて所定の波長を選択的に透過させるフィルターを用いて、適切な波長および出力の励起光を染色された組織切片に照射すればよい。
【0059】
図1に、エオジンの励起波長、発光波長と蛍光強度の関係を示す。
エオジンは蛍光物質であり、この蛍光は細胞形態情報の視認性向上に寄与するものである。しかし、エオジンの励起光吸収や蛍光の蛍光(発光)強度が大きくなるにつれて、抗原分子情報である蛍光標識材料からの蛍光の視認性が落ちてしまう。そこで、励起光波長としては、エオジン自体の過度の発光を抑制し、蛍光標識材料の視認性を上げる(両者の光量差を確保して両者を区別して認識可能とする)ために、エオジン自体が励起光を吸収しない又は励起光吸収し難い(従って、励起光によるエオジンの蛍光発光量が少ない)波長を選定することが好ましい。ここで、図1に示すように、励起光波長が560nm以上でエオジンの励起光の吸収はゼロとなり、一方、エオジンの蛍光がみられる限界(上限)は630nm付近である。従って、観察工程における励起光波長は560〜630nmの範囲のものを選択するのが好ましい。より好ましくは、エオジンの蛍光発光量がピークの1/3程度となる575nm付近である。また、前記蛍光物質としては当該励起光により580〜690nmの範囲、より好ましくは600〜630nmの範囲にピークを有する蛍光を発するものを用いる(したがってこの領域の発光波長を有する蛍光を測定するようにする)ことが好ましい。この範囲にピークを有する蛍光物質であれば、上記範囲の励起光を選択したときに、エオジンの蛍光と区別可能な程度の光量差を確保できるからである。
【0060】
細胞形態情報および抗原分子情報は、同一視野で取得する、すなわち、一枚の染色切片から得られる、組織の自家蛍光および蛍光標識材料が発する蛍光の両方が同一の視野に含まれるようにしつつも、それらを区別して認識し、それぞれに基づいて細胞形態情報および抗原分子情報を取得することが好適である。もちろん、必要であれば、たとえば組織の自家蛍光または蛍光標識材料が発する蛍光の一方を十分に低減しうる適切なフィルターを用いることにより、ある視野で細胞形態情報のみを取得するようにし、他の視野で抗原分子情報を取得するようにしてもよい。
【0061】
また、細胞形態情報および抗原分子情報は、迅速な観察が行えるよう(蛍光)顕微鏡の鏡筒から取得するようにしてもよいし、(蛍光)顕微鏡に設置されたカメラ(デジタル撮像手段)が撮影した画像を別途表示手段(モニタ等)に表示し、それを観察することにより取得するようにしてもよい。用いる蛍光物質によるが、顕微鏡の鏡筒からの目視により十分に抗原分子情報を取得することができなくても、カメラが撮影した画像から抗原分子情報を取得することが可能な場合もある。
【0062】
前記抗原分子情報を取得することとしては、たとえば、蛍光の輝点数または発光輝度を基に、一細胞あたりの標的抗原分子数もしくは標的抗原輝度を計測することが挙げられる。用いた蛍光物質の吸収極大波長および蛍光波長に対応した励起光源および蛍光検出用光学フィルターを選択すればよい。輝点数または発光輝度の計測には、市販の画像解析ソフト(例えば、株式会社ジーオングストローム社製全輝点自動計測ソフトG-Count)を用いることが好適であるが、計測手段は特に限定されるものではない。
【実施例】
【0063】
[合成例1]蛍光有機色素(Cy5)内包シリカナノ粒子の合成
下記工程(1)〜(4)の方法により、蛍光有機色素としてCy5を内包するシリカナノ粒子(以下「ナノ粒子A」と称する。)を作製した。
工程(1):Cy5のN−ヒドロキシスクシンイミドエステル誘導体(GEヘルスケア社製)1mg(0.00126mmol)とテトラエトキシシラン400μL(1.796mmol)を混合した。
工程(2):エタノール40mLと14%アンモニア水10mLを混合した。
工程(3):工程(2)で調製した混合液を室温下撹拌しているところに、工程(1)で調製した混合液を添加した。添加開始から12時間撹拌を行った。
工程(4):反応混合物を10000gで60分遠心分離を行い、上澄みを除去した。エタノールを加え、沈降物を分散させ、再度遠心分離を行った。同様の手順でエタノールと純水による洗浄を一回ずつ行った。
得られたナノ粒子Aの1000個について走査型電子顕微鏡(SEM;日立社製S−800型)観察を行ったところ、平均粒径は110nm、変動係数は12%であった。
【0064】
[合成例2]量子ドット(CdSe/ZnS)内包シリカナノ粒子の合成
下記工程(1)〜(4)の方法により、量子ドットとしてCdSe/ZnSを内包するシリカナノ粒子(以下「ナノ粒子B」と称する。)を作製した。なお、CdSe/ZnSの発光波長のピークは655nmである。
工程(1):CdSe/ZnSデカン分散液(インビトロジェン社Qdot655)10μLとテトラエトキシシラン40μLを混合した。
工程(2):エタノール4mLと14%アンモニア水1mLを混合した。
工程(3):工程(2)で調製した混合液を室温下で撹拌しているところに、工程(1)で調製した混合液を添加した。添加開始から12時間撹拌を行った。
工程(4):反応混合物を10000gで60分遠心分離を行い、上澄みを除去した。エタノールを加え、沈降物を分散させ、再度遠心分離を行った。同様の手順でエタノールと純水による洗浄を1回ずつ行った。
得られたナノ粒子Bの1000個についてSEM観察を行ったところ、平均粒径は130nm、変動係数は13%であった。
【0065】
[合成例3]蛍光有機色素(テキサスレッド)内包シリカナノ粒子の合成
工程(1)の原料としてCy5のN−ヒドロキシスクシンイミドエステル誘導体(GEヘルスケア社製)の代わりにテキサスレッドスルホニルクロライドを用いたこと以外は合成例1と同様にして、蛍光有機色素としてテキサスレッドを内包するシリカナノ粒子(以下「ナノ粒子C」と称する。)を作製した。
得られたナノ粒子Cの1000個について走査型電子顕微鏡(SEM;日立社製S−800型)観察を行ったところ、平均粒径は108nm、変動係数は11%であった。
【0066】
[作製例1]ナノ粒子Aに抗HER2抗体を結合させた標識材料の作製
上記合成例1で作製したナノ粒子Aに、以下の手順により抗HER2抗体を結合させ、標識材料(「標識材料A」と称する。)を作製した。
工程(1):ナノ粒子A1mgを純水5mLに分散させた。アミノプロピルトリエトキシシラン水分散液100μLを添加し、室温で12時間撹拌した。
工程(2):反応混合物を10000gで60分遠心分離を行い、上澄みを除去した。
工程(3):エタノールを加え、沈降物を分散させ、再度遠心分離を行った。同様の手順でエタノールと純水による洗浄を1回ずつ行った。生成物のFT−IR測定を行ったところ、アミノ基に由来する吸収が観測でき、ナノ粒子Aをアミノ基修飾できたことを確認できた。
工程(4):工程(3)で得られたアミノ基修飾したナノ粒子Aを、EDTA(エチレン
ジアミン四酢酸)を2mM含有したPBS(リン酸緩衝液生理的食塩水)を用いて3nM
に調整した。
工程(5):工程(4)で調製した溶液に、最終濃度10mMとなるようSM(PEG)12(サーモサイエンティフィック社製、succinimidyl-[(N-maleomidopropionamid)-dodecaethyleneglycol]ester)を混合し、1時間反応させた。
工程(6):反応混合液を10000gで60分遠心分離を行い、上澄みを除去した
工程(7):EDTAを2mM含有したPBSを加え、沈降物を分散させ、再度遠心分離を行った。同様の手順による洗浄を3回行った。最後に500μLPBSを用い再分散させた。
工程(8):抗HER2抗体を100μgを100μLのPBSに溶解させたところに、1Mジチオスレイトール(DTT)を添加し、30分反応させた。
工程(9):反応混合物についてゲルろ過カラムにより過剰のDTTを除去し、還元化抗HER2抗体溶液を得た。
工程(10):ナノ粒子Aを出発原料にして工程(7)で得られた粒子分散液と工程(9)で得られた還元化抗HER2抗体溶液とをPBS中で混合し、1時間反応させた。
工程(11):10mMメルカプトエタノール4μLを添加し、反応を停止させた。
工程(12):反応混合物を10000gで60分遠心分離を行い、上澄みを除去した後EDTAを2mM含有したPBSを加え、沈降物を分散させ、再度遠心分離を行った。同様の手順による洗浄を3回行った。最後に500μLPBSを用い再分散させた抗HER2抗体が結合したナノ粒子A(標識材料A)を得た。
【0067】
[作製例2]ナノ粒子Bに抗HER2抗体を結合させた標識材料の作製
ナノ粒子Aの代わりにナノ粒子Bを用いたこと以外は作製例1と同様の手順により、ナノ粒子Bに抗HER2抗体を結合させた標識材料(「標識材料B」と称する。)を作製した。
【0068】
[作製例3]ナノ粒子Cに抗HER2抗体を結合させた標識材料の作製
ナノ粒子Aの代わりにナノ粒子Cを用いたこと以外は作製例1と同様の手順により、ナノ粒子Cに抗HER2抗体を結合させた標識材料(「標識材料C」と称する。)を作製した。
【0069】
[作製例4]蛍光有機色素(Cy5)に抗HER2抗体を結合させた標識材料の作製
Cy5に抗HER2抗体を結合させた標識材料(「標識材料D」と称する。)を以下の手順により作製した。
工程(1):抗HER2抗体100μgを100μLのPBSに溶解させたところに、1Mジチオスレイトール(DTT)を添加し、30分反応させた。
工程(2):反応混合物についてゲルろ過カラムにより過剰のDTTを除去し、還元化抗HER2抗体溶液を得た。
工程(3):Cy5のN−ヒドロキシスクシンイミドエステル誘導体(GEヘルスケア社製)1mg(0.00126mmol)を、EDTA(エチレンジアミン四酢酸)を2mM含有したPBS(リン酸緩衝液生理的食塩水)を用いて3nMに調整した。
工程(4):工程(3)で調製した溶液に、最終濃度10mMとなるようSM(PEG)12(サーモサイエンティフィック社製、succinimidyl-[(N-maleomidopropionamid)-dodecaethyleneglycol]ester)を混合し、1時間反応させた。
工程(5):工程(4)で得られた反応混合物に工程(2)で得られた還元化抗HER2抗体溶液をPBS中で混合し、1時間反応させた。
工程(6):10mMメルカプトエタノール4μLを添加し、反応を停止させた。
工程(7):ゲルろ過カラムにより過剰のメルカプトエタノールを除去し、Cy5で標識化した還元化抗HER2抗体(標識材料D)溶液を得た。
【0070】
[作製例5]量子ドット(CdSe/ZnS)に抗HER2抗体を結合させた標識材料の作製
ライフテクノロジー社製Qdot Antibody Conjugation Kitのプロトコールに従って、量子ドット(CdSe/ZnS)に抗HER2抗体を結合させた標識材料(「標識材料E」と称する。)を作製した。具体的な手順は以下の通りである。抗HER2抗体を20mMジチオスレイトール(DTT)で還元処理を行い、ゲルろ過カラムにより過剰のDTTを除去することにより、還元化抗体溶液を得た。一方量子ドットはSMCCと反応後ゲルろ過カラムにより過剰のSMCCを除去することにより還元化抗体と反応可能なマレイミド化量子ドットを得た。得られた還元化抗体とマレイミド化量子ドットを混合1時間反応後100μMになるようメルカプトエタノールを加え反応を停止した。反応、反応停止後の溶液をゲル濾過する事で量子ドットを結合した抗HER2抗体を得た。
【0071】
<標識材料A〜Eを用いた組織免疫染色および観察>
上記作製例で作製した標識材料A〜Eを用い、下記の手順に従って、ヒト乳房組織の隣接切片の免疫染色を行った。この隣接切片は、コスモバイオ社製の組織アレイスライド(CB-A712)から選ばれた、あらかじめ測定したFISHスコアが1〜9までの24切片である。
1)キシレンを入れた容器に病理切片を30分浸漬させた。途中3回キシレンを交換した。
2)エタノールを入れた容器に病理切片を30分浸漬させた。途中3回エタノールを交換した。
3)水を入れた容器に、病理切片を30分浸漬させた。途中3回水を交換した。
4)10mMクエン酸緩衝液(pH6.0)に病理切片を30分浸漬させた。
5)121度10分オートクレーブ処理を行った。
6)PBSを入れた容器に、オートクレーブ処理後の切片を30分浸漬させた。
7)1%BSA含有PBSを組織に載せて、1時間放置した。
8)1%BSA含有PBSで0.05nMに希釈した抗HER2抗体結合した標識材料A〜Eを、各組織切片に載せて3時間放置した。
9)PBSを入れた容器に、染色後の切片をそれぞれ30分浸漬させた。
10)4%中性パラホルムアルデヒド溶液で10分間固定処理した後、HE染色を行った。
11)Merck Chemicals社製Aquatexを滴下後、カバーガラスを載せ封入した。
【0072】
上記手順により染色した切片について、カールツアイス社製正立顕微鏡Axio Imager M2を用いて、所定の波長を有する励起光を照射しながら、所定の波長を有する蛍光について、顕微鏡設置カメラ(モノクロ)からの画像の取得および顕微鏡鏡筒からの観察を行った。
なお、上記カメラは画素サイズ6.4μm×6.4μm、縦画素数1040個、横画素数1388個(撮像領域8.9mm×6.7mm)を有している。
励起波長および観察した蛍光の発光波長は、蛍光物質として(単体か、蛍光物質内包
ナノ粒子に内包されているかを問わない)Cy5を用いた場合はそれぞれ630nmおよび680nmであり、CdSe/ZnSを用いた場合はそれぞれ385nmおよび620nmであり、テキサスレッドを用いた場合はそれぞれ590nmおよび620nmである。蛍光標識からの蛍光の識別具合についての結果を表1に示す。
【0073】
【表1】

【0074】
また、図2〜図6に、上記顕微鏡設置カメラから取得した画像を示す。
図2は、標識材料Dを用いた場合に顕微鏡設置カメラから取得した画像である。
る。エオジン由来の微弱発光(自家蛍光)による細胞形態情報は観察できるが、抗原分子情報は細胞形態情報に埋もれて識別できない状態になっている。なお、顕微鏡鏡筒から観察した場合も同様の観察像となっている。
図3は、標識材料Eを用いた場合に顕微鏡設置カメラから取得した画像である。エオジン由来の微弱発光(自家蛍光)による細胞形態情報は観察できるが、抗原分子情報は細胞形態情報に埋もれて識別できない状態になっている。なお、顕微鏡鏡筒から観察した場合も同様の観察像となっている。
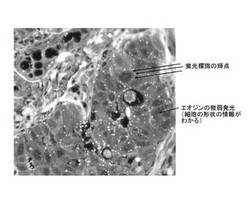
図4は、標識材料Aを用いた場合に顕微鏡設置カメラから取得した画像である。輝点状に見える抗原分子情報とゆるやかにつながるエオジン由来の微弱発光(自家蛍光)による細胞形態情報が識別可能な状態となっている。なお、顕微鏡鏡筒からは抗原分子情報と細胞形態情報は識別することができなかった。
図5は、標識材料Bを用いた場合に顕微鏡設置カメラから取得した画像である。輝点状に見える抗原分子情報とゆるやかにつながるエオジン由来の微弱発光(自家蛍光)による細胞形態情報が識別可能な状態となっている。なお、顕微鏡鏡筒から観察した場合も同様の観察像となっている。
図6は、標識材料Cを用いた場合に顕微鏡設置カメラから取得した画像である。輝点状に見える抗原分子情報とゆるやかにつながるエオジン由来の微弱発光(自家蛍光)による細胞形態情報が識別可能な状態となっている。なお、顕微鏡鏡筒から観察した場合も同様の観察像となっている。
【0075】
顕微鏡鏡筒からの観察では、表1に示すように、標識材料B及びCを用いた場合に、バックグラウンド(組織の自家蛍光+エオジンの自家蛍光)と蛍光標識材料からの蛍光とは明確に識別可能となっている。
しかも、細胞形態情報(組織の自家蛍光+エオジンの自家蛍光)と抗原分子情報(蛍光標識材料からの蛍光)とは、同一スライド上で観察されるので、本来の相対位置関係を保持した状態であり、病理医が従来のように複数のスライド上の像を自身の頭脳の中で重畳する必要がなく、また、例えば、特許文献8に記載のような、誤診を招かないように顕微鏡設置カメラから取得した画像から精度良い重畳画像を合成するコンピュータ処理も不要である。そのため、観察者やコンピュータによる位置合わせ精度に左右されずに診断を行うことができる。
【0076】
更に、抗原分子情報を示す蛍光標識からの蛍光はドット状の蛍光(輝点ドットという)で現れるので(図6参照)、抗原分子情報を確認(視認)するには輝点ドットを確認(視認)すればよく、極めて単純化される。従って、観察者は短時間に、且つ精確に、細胞形態情報と抗原分子情報を視認でき、疲労も大幅に低減され、自己の保持する診断能を長時間にわたって維持することが可能となる。また、被験者一人当たりに要する検査時間(組織の採取→染色→観察→診断)も大幅に短縮され、施設内の診断効率は大幅に向上する。
【0077】
一方、顕微鏡設置カメラ(モノクロ)により顕微鏡に装填された1枚のスライド上の組織切片の画像を取得し必要に応じた画像処理を施してモニタ等の表示装置に表示(ビュワー表示という)した場合、表1に示すように、標識材料B及びCに加え、標識材料Aを用いた場合においても、バックグラウンド(組織の自家蛍光+エオジン自家蛍光)と蛍光標識材料からの蛍光とは明確に識別可能となっている。
【0078】
従来はHE染色に基づく発光情報は色彩情報として単独に使用されていたが、本実施例のモノクロ出力方式においては、組織の自家蛍光とエオジン蛍光の合算値で細胞形態情報が表現されるので、図6に示すようにモノクロであっても細胞形態情報の視認性が向上している。
尚、本実施例においては、HE染色を行いエオジン発光と組織の自家蛍光の両方を細胞形態情報としているが、HE染色を行わずに組織の自家蛍光のみを細胞形態情報とすることも可能である。
【0079】
また、本実施例においては、モノクロタイプのデジタルカメラを使用しているが、顕微鏡に装着使用可能なカラータイプのデジタルカメラが準備されている場合には、顕微鏡へ装着するフィルターや励起光波長等を必要に応じてモノクロカメラ撮影時から条件変更するか、或いは、顕微鏡設定はそのままに、デジタルカメラで生成されたデジタル画像データに対する画像処理条件を変更するか、或いは、両者(撮影系及び画像処理系)の変更を行うことにより、図2〜図6と同様のモノクロで結果を得ることができる。
【0080】
また、HE染色画像を従来から見慣れた色合いで観察すべく、HE染色発光のみを対象としたカラー撮影を追加することも可能であるが、この場合には、1枚のスライドに対し2回の撮影、或いは顕微鏡鏡筒観察を行うこととなる。この場合には、それぞれの撮影毎(顕微鏡鏡筒からの観察毎)に顕微鏡の励起光やフィルターをそれぞれふさわしい設定に調整する必要がある。カラーのHE染色による細胞形態情報とモノクロ画像(後述する同時染色画像)とを対応付けて保存することも可能である。
【0081】
顕微鏡鏡筒からの直接観察方式に比べ、ビュワー表示は診断の即時性は低下するが、観察者である人間が視認できない波長域の蛍光標識材料の蛍光波長に対し、画像処理で波長変換して人間が視認できるようにすることが可能である。そのため、励起光波長の選定や蛍光標識材料の選択の自由度(設計自由度)を高めることが可能である。
【0082】
また、顕微鏡鏡筒を覗きながら、個々の切片を載せたスライド毎に診断を行う方式では、スライドに対する顕微鏡のピント合わせ〜細胞形態情報(バックグラウンド)視認〜抗原分子情報(輝点ドット)の視認という一連の操作確認を行う間に長時間観察者が顕微鏡を覗いている必要があり、目の筋肉の疲労を誘発し易い。特に、施設に備わっている顕微鏡の視野範囲は一般的にスライド上の採取細胞領域に比べて小さく、スライド固定ステージのx-yステージを移動させながら長い時間にわたって観察を行うのでこの傾向が強くなる。
これに対し、ビュワー表示方式では、観察者はピント調整の間のみ顕微鏡を覗き込めばよく、診断時には覗きこむ必要がないので、疲労度合いが低減される。
なお、放射線撮影技師と読影医との関係のように、役割分担を行うと診断効率を高めることができる。例えば、ピント調整自体(及びピント調整後の撮影画像取得)を診断医ではなく他の作業者が行い、診断医は複数人分の画像データを一人で、或いは複数人のカンファレンス形式で、ビュワーを見ながらまとめて行うように役割分担すれば、施設全体としての診断効率を高めることができる。
【0083】
−本発明を適用した乳房診断システムの例−
以下、本発明を適用した乳房診断システム100について説明する。
図7に、乳房診断システム100の全体構成例を示す。図7に示すように、乳房診断システム100は、乳房撮影装置1、画像処理装置2、表示装置3、顕微鏡4、顕微鏡設置カメラ5、画像処理装置6、サーバー装置7、HIS(Hospital Information System)/RIS(Radiology Information System)8を備えて構成されている。乳房撮影装置1、画像処理装置2、表示装置3、画像処理装置6、サーバー装置7、HIS/RIS8は、LAN(Local Area Network)等の通信ネットワークNを介してデータ送受信可能に接続されている。また、画像処理装置6は、顕微鏡設置カメラ5からの画像データを取得可能に接続されている。
【0084】
乳房診断システム100においては、まず、HIS/RIS8により登録された撮影オーダ情報(撮影対象の患者や部位に関する情報)に基づいてX線装置や超音波診断装置等の乳房撮影装置1によって乳房撮影が行われる。撮影により得られた乳房画像の画像データは画像処理装置2で画像処理が施された後、表示装置3に表示され、読影医による診断(一次診断)が行われる。そして、この診断において病変の疑いがある場合に、バイオプシー(生体検査)が実施され、顕微鏡4の鏡筒から、または顕微鏡設置カメラ5により取得された組織切片の画像データに基づいて病理医による診断(二次診断)が行われる。
ここで、画像処理装置2、画像処理装置6、表示装置3、サーバー装置7、HIS/RIS8は、CPU,RAM等により構成される制御部、キーボード、マウス等により構成される操作部、プログラムやデータ等を記憶する記憶部、モニタ等により構成される表示部、通信ネットワークNに接続されている装置とデータ送受信を行うための通信部等を備えるコンピュータ装置である。
【0085】
乳房撮影装置1においては、MLO(斜位方向)−L(左)、MLO−R(右)、CC(上下方向)−L、CC−Rの合計4枚の乳房画像が撮影されるのが一般的である。
撮影に際しては、特開2005−305137号公報に記載のようにCR(Computed Radiography)カセッテをしようする方式、或いは、特開2004−321783号公報に記載のようにFPD(Flat Panel Detector)を使用する方式の2種の方法に大別されるが、複数枚の撮影(上記のように4枚の撮影)が行われるので、両方式に共通しているのは、左右乳房の画像の取り違えが生じないように、乳房撮影装置1と画像処理装置2とが連携し、個々の撮影画像(乳房画像)と撮影オーダ情報、特に左右の部位情報との対応付けを正しく行うことである。MLO画像は画像自体から左右の判別は可能であるが、CC画像に対しては画像単体を見ても左右の判別がつかないからである。
【0086】
撮影に際しては、乳房を圧迫板で挟みこんだ状態でX線照射を行うため、連続して同じ乳房の撮影を行うと被験者に苦痛を与える。そこで、左右交互(L・R・L・R又は R・L・R・L)に撮影を行うのが一般的である。撮影により得られた乳房画像の画像データには、左右の部位情報や患者ID等の付帯情報が付帯される。
【0087】
また、生成された4枚の乳房画像の画像データは、画像処理装置2に出力され、当該画像処理装置2において表示装置3への表示用の画像データが生成される。例えば、画像処理装置2において左右の乳房画像の比較読影が可能となるように、MLO画像、CC画像毎に左右の胸壁を合わせるように配置されて出力されるのが一般的である。
この際には、例えば、特開2002−158862号公報に記載のように、個々の乳房画像に対応付けられた部位情報や撮影方向(撮影条件)に基づき画像の回転処理方向を予め定め、MLO、CCのそれぞれの方向の胸壁合わせの画像が自動的に生成される。マニュアル処理ではCC画像で左右を取り違える可能性があるので、マニュアルの操作は禁止される。同様に、左右の区別を示す付帯情報の安易な修正も禁止される。誤った生体検査が行われてしまうことを防止するためである。
更に、特開平09−238933号公報に記載のように、左右の乳房画像における乳房領域の上下方向の位置合わせを行い、読影医の左右乳房の比較読影を行い易いように、視線移動を水平方向のみに限定することが望ましい。
【0088】
また、上記のようなX線撮影の他に、特開2009−195613号公報に記載のように、超音波診断装置を使用した乳房診断も行われている。特開2009−195613号公報には、超音波画像を用いて病変部の候補領域の弾性を測定することで病変部位か否かを診断するものである。
【0089】
また、診断精度を向上させるため、乳房撮影装置1として、例えば、特開2002−328440号公報に記載のような位相コントラスト撮影を実施可能な撮影装置を用い、拡大撮影された画像データを画像処理装置2で縮小して診断医の見慣れたライフサイズ(等倍)の画像とするとともに、腫瘤等の病変の辺縁部の視認性を向上させ、診断精度を向上させる手法を用いることも可能である。
更に、特開2009−077780号公報に記載のように、X線撮影による乳房画像と乳房の超音波画像の両画像に基づき、より精度の高い診断を行うことも知られている。
【0090】
また、診断精度を高めるために、CAD(Computer-Aided Diagnosis)検出結果をセカンドオピニオンとして用いるケースもある。画像処理装置2には、異常陰影候補を検出するためのCADが搭載されており、腫瘤陰影や微小石灰化クラスタ等の異常陰影候補と推定される候補領域をCADにより乳房画像中から抽出し、その検出結果情報を取得する。乳房画像や異常陰影候補の検出結果は、表示装置3に表示され、読影医の診断に供される。異常陰影の領域候補の表示方法には、例えば、特開平08−294479号公報に記載のように、主画像+抽出された異常陰影領域の拡大画像を表示するもの、特開2005−124617号公報に記載のように主画像エリアはそのままに、縮小画像中に異常陰影候補領域を示すアノテーションを入れる方法とがあるが、医師の診断方式に応じて何れの方法を採用しても構わない。
【0091】
画像処理装置2において画像処理された乳房画像は、付帯情報とともにサーバー装置7に送信される。画像処理装置2においてCADによる異常陰影候補の検出が行われた場合には、異常陰影候補の検出結果情報も併せてサーバー装置7に送信される。
サーバー装置7においては、上述の付帯情報、乳房画像、CADによる検出結果情報が対応付けて記憶される。
【0092】
上記により得られた乳房画像の診断結果に基づき、次ステップではバイオプシー(生体検査)が実施される。
バイオプシーにおいて生体組織を採取するに際しては、生検針位置を被写体の関心領域に対して正しき位置合わせすることが重要であり、乳房の場合には、X線を使用したスカウト撮影、ステレオ撮影、3次元撮影等や超音波撮影等を行い、生検針の位置合わせを行う。例えば、乳房撮影装置1において、特開2010−115405号公報や特開2011−104117号公報等の手法を用いることができる。
また、CADにおいて、左乳房に異常陰影候補の検出結果が無く、右乳房に異常陰影候補が検出された場合には、右乳房の組織取得を行う筈である。従って、例えば、特開2008−000508号公報に記載のように、乳房撮影装置1の被写体台に左右の何れの乳房が載置されたかをレーザセンサ等により検知し、CADの検出結果と比べ、異なる場合には警告を出力することで、左右の取り違えと患者の苦痛を未然に防止することができる。また、バイオプシーの生検針の位置決め撮影時には、ガイド及び/又は検針の陰影が画像中に明確に現れるので、これを検知して左右の乳房の取り違えがあった場合には、警告を出力することで、誤診を防止することができる。
【0093】
また、画像処理装置2においてCADを使用することが可能な場合には、CADにおける検出アルゴリズムを2段階閾値方式とし、明白なTP(True Positive)ゾーン、明白なFP(False Positive)ゾーン、中間のグレーゾーンの3つのゾーンに分類し、グレーゾーンがTPかFPかの判別にバイオプシーを使用することが好ましい。投薬治療の結果を見る場合には、TPゾーンの組織を用いてバイオプシーを行うことになる。
【0094】
採取された組織は、所定の厚さの切片に切除されてガラス製スライド(スライド)上に載置され、上述の実施例における蛍光標識材料(顕微鏡からの観察の場合には標識材料B又はC、ビュワー表示の場合には標識材料A〜Cの何れか)を用いた染色及びHE染色が行われる。そして、染色された切片が顕微鏡4での観察に供される。観察は、顕微鏡4の鏡筒から直接、又は、顕微鏡設置カメラ5により取得された顕微鏡4の視野範囲の画像を表示装置3においてビュワー表示することにより行うことができる。
【0095】
顕微鏡4は、照射手段、結像手段を有し、照射手段によりスライドを載置するスライド固定ステージに載置されたスライド上の上記の染色が行われた組織切片に所定波長の励起光を照射し、結像手段により励起光の照射によって組織切片から発光された蛍光を結像する結像手段を有するものである。なお、照射手段が照射する励起光の波長は、上述のように560〜630nmの範囲であることが好ましく、前記蛍光物質としては当該励起光により580〜690nmの範囲、より好ましくは600〜630nmの範囲にピークを有する蛍光を発するものを用いることが好ましい。
顕微鏡設置カメラ5は、顕微鏡4の結像手段により結像面に結像される像を撮像してデジタル画像データを生成する撮像手段である。なお、顕微鏡設置カメラによる顕微鏡からの画像データ取得は周知であり、例えば、特許文献1に開示される手法を用いることができる。
【0096】
本願発明者等の分析によれば、乳房の場合、左右同時に腫瘤や微小石灰化を発症することは稀であり、また、左右の何れかの乳房に対し、複数の異常陰影候補が存在していた場合であっても、通常は1回の生検針により1箇所の乳房組織の採取が行われるのみである。本発明によれば、この採取された組織切片を染色して作成されるスライドも一枚である。従って、一人の患者に対し、1個のスライドという1:1方式となり、患者とスライドの対応付けが極めて容易となる。例えば、スライドの端部にスライドの識別IDを示すバーコード等を貼付しておき、患者の組織切片をスライドに載せる際に、画像処理装置6において患者名を選択し、画像処理装置6に接続されたバーコードリーダーで使用するスライドのバーコードを読み取ることで、患者情報とスライドIDを容易に対応付けることができる。また、顕微鏡4による観察後に画像処理装置6のバーコードリーダーによりスライドIDを読み取って、診断結果(TP、FP)を入力すれば、患者情報、スライドIDに診断結果を対応付けることができる。患者情報とスライドIDとの対応付けは、サーバー装置7に送信され、記憶される。
【0097】
また、本発明によれば、1回の生体検査においてスライドは1枚のみしか使用しないので、従来の2枚のスライドを使用する方式のように、本来顕微鏡4にセットすべきスライドと異なるスライドを装填してしまうような(例えば、細胞形態確認用のHE染色スライドと、免疫化学染色法により染色されたスライドと間違う)ミス自体発生しないので、尾幅な省力化を達成できる。
【0098】
顕微鏡4の鏡筒から観察する場合、顕微鏡4の光源(励起光)の波長を、まずは従来から見慣れたHE画像(カラー画像)を表示するように設定しておき、当該HE画像中の関心領域に視線を集中し、しかる後、光源波長を切り替えて、輝点ドットを発光させれば、視線を集中していた関心領域における輝点ドットの点在具合を一目で、短時間に視認判別することができる。
顕微鏡4の一度に見ることのできる視野範囲が比較的狭い場合、病理切片上の診断対象領域を数回に分けて観察することとなるが、複数の視野のうち所定の視野に注目して、当該視野が顕微鏡4の観察範囲となるように顕微鏡4のスライド固定ステージを調整し、光源波長を切り替えても、上記と同様の効果が得られる。
【0099】
また、最初に顕微鏡4のスライド固定ステージを順次x方向又はy方向に移動操作して、顕微鏡設置カメラ5により各視野の撮影を繰り返し、画像処理装置6において、撮影により得られた各視野の画像データから輝点ドット(数、或いは、数×輝度の積算値)を算出し、予め定められた法則、例えば、輝点ドットが多いほうから、或いは、少ないほうから、或いは、所定数の範囲にあるものから等に基づき画像を順に画像処理装置6の表示部に表示することとしてもよい。また、予め定められた順に表示部に表示された画像を診ながら、顕微鏡4において対応する視野位置となるようにスライド固定ステージを調整して、顕微鏡4の鏡筒より各視野の観察を行うことも可能である。つまり輝点ドット(数、或いは、数×輝度の積算値)という特徴量に応じて、細胞形態情報の観察すべき順番を可変制御することも可能である。
なお、撮影された画像からの輝点ドットの計測は、画像処理装置6に搭載された画像解析ソフトウエア(例えば、株式会社ジーオングストローム社製の全輝点自動計測ソフトG−Count等)により行うことができる。各画像データの輝点ドットが計測されると、輝点ドットの計測結果及び各画像が対応付けて予め定められた順に画像処理装置6の表示部に表示される。その中から、観察者(技師や病理医)は、診断に使用する画像データを画像処理装置6の操作部により選択することができる。或いは、輝点ドットの計測結果が最大となる画像データを診断用画像として画像処理装置6において自動的に決定することとしてもよい。診断用画像の画像データは、画像処理装置6において先に入力された患者情報及びスライドIDと対応付けてサーバー装置7に送信され保存される。更に、ビュワー表示方式の場合は、画像処理装置6において、診断用画像の画像データに基づいて以下に示す表示を行うための表示用の画像データが生成され、スライドID及び患者情報とともに表示装置3に送信される。そして、表示装置3のモニタ上に当該表示用画像が表示されることで病理医の診断に供される。なお、以下に示すいずれの表示を行うかは、予め設定しておくことができる。
表示装置3はモノクロであってもよい。本発明で得られる画像データは、従来より乳房画像診断用に普及しているモノクロのモニタを使用して出力表示することができるので、新たにカラー用モニタ等の設備投資が不要となる。
【0100】
上述のビュワー表示方式においては、診断効率を高めるためにいくつかの表示方法が考えられる。1番目の表示方法は、細胞形態情報(組織の自家蛍光+HE染色によるエオジンの自家蛍光)と抗原分子情報(蛍光標識材料からの蛍光による輝点ドット)とを1枚の画像で表示出力する方法である。この場合、顕微鏡設置カメラ5における1回の撮影により得られた画像データを表示するのみであり、この画像データに細胞形態情報と抗原分子情報が含まれているので、細胞形態情報と抗原分子情報との位置合わせが不要であり、撮影から表示出力までの診断準備期間が最短となるメリットがある。また、位置合わせの精度に依存せずに診断を行うことができる。勿論、細胞形態情報と抗原分子情報の相対位置関係は本来固有の状態に維持されているので視認による弁別確認も可能である。
【0101】
2番目の表示方法は、細胞形態情報を表す画像と抗原分子情報を表す画像とを分離して表示出力する方式である。
本発明における抗原分子情報のための蛍光標識材料は組織の自家蛍光やエオジンの自家蛍光に比べて大きな蛍光を発するようになされている。従って、細胞形態の確認時に抗原分子情報を表す輝点ドットはノイズとなる可能性がある。また、励起光の波長と蛍光標識材料の選定やビュワー(表示装置3)側のダイナミックレンジ及び画像処理条件等によっては、抗原分子情報を表す輝点ドット(蛍光)が観察者を幻惑し、細胞形態情報の視認に影響を及ぼすことも懸念される。
このような事態を防止するため、細胞形態情報を抽出した画像(細胞形態画像)と抗原分子情報を抽出した画像(抗原分子画像)とを表示装置3の操作部による切替指示に応じて切り替えて表示することが好ましい。具体的には、表示装置3のモニタ画面の同じ領域(画像表示領域)内に、操作部からの切替指示に応じて細胞形態画像と抗原分子画像がパラパラめくりのように切替表示する。本発明においては、顕微鏡4に装填した1枚のスライドの1回の撮影による画像データを使用するので、細胞形態情報と抗体分子情報とが相互の位置関係(本来の固有の位置関係)を保っている。従って、細胞形態情報と抗原分子情報の何れかを示す画像において任意の領域に着目し、当該領域に着目した状態で他の情報の画像に切り替えると、視線移動をすることなく診断に必要な情報を直ちに得ることができる。
【0102】
抗原分子情報はドット状の蛍光として画像上に現れており、全体画像の画像データ中から当該輝点ドット部分を視認することは容易である。同様に、画像処理により輝点ドットを抽出することは容易である。抗原分子画像の生成は、細胞形態情報と抗原分子情報を含む全体画像から輝点ドットのみを抽出して、それ以外の領域には一定の輝度値、例えば、黒のような最低輝度値を割り付けることで生成することができる。輝点ドットは、全体画像から予め定められた閾値以上の輝度値の領域を抽出することで取得することができる。
このように、輝点ドットのみを抽出した画像を生成することにより、輝点ドットの視認性が大幅に向上し、瞬時に全貌を把握することが可能となる。
【0103】
一方、細胞形態画像の生成は、細胞形態情報と抗原分子情報を含む全体画像から輝点ドットのみを抽出して、輝点ドットの領域に、隣接する細胞形態情報を表している画素の出力値を使用してx方向(又はy方向)の隣接値に基づく一次元補間値を割り付ける、或いは、輝点ドットの領域に、隣接する細胞形態情報を表している画素の出力値を使用してxy方向の隣接値に基づく二次元補間値を割り付ける等により生成することが好ましい。これは、輝点ドット部分と周囲の細胞形態情報との連続性を維持でき、観察時に違和感を与えることがないので好ましい。尚、輝点ドットの領域に一定の輝度値、例えば、グレーとなるような中間値を割り付けてもよい。
【0104】
細胞形態画像、抗原分子画像の何れを先に表示するかは、病理医の診断スタイルに応じて適宜設定することが可能である。
また、細胞形態画像、抗原分子画像に加えて、本来の両情報の位置関係を有した全体画像を加えた3種の画像を操作部からの切替指示に応じて切り替え表示することとしてもよい。この場合においても、表示順は診断スタイルに応じて、適宜設定することが可能である。
【0105】
また、本発明においては、抗原分子情報は全体画像中での視認性は十分確保されているので(図6参照)、抗原分子画像は使用せず、細胞形態画像と全体画像とを切り替えて表示することも可能である。従来の染色による診断ワークフローは、細胞形態情報(従来においては色味情報)を観察するフローであるので、当該診断フローと同様に、細胞形態画像を先に表示し、続いて全体画像を表示することが望ましい。
【0106】
また、一のスライドに対し、HE染色画像撮影(カラーによる撮影)も併せて実施している場合には、表示装置3の操作部からの切替指示に応じて、同一視野で撮影されたHE染色画像と上記の全体画像(HE染色画像に対して、同時染色画像と呼ぶ)とを表示装置3のモニタ上に切替表示することとしてもよい。HE染色画像(カラー)と同時染色画像(モノクロ)の切替は、同一スライドの顕微鏡4における同一視野範囲を撮影することにより得られた画像であるため、上述の細胞形態情報と抗原分子情報との切替表示時と同様に、位置合わせの画像処理が不要である。また、病理医が視認に基づく位置合わせをする必要がないことは勿論である。なお、この場合には、表示装置3のモニタとしてはカラーモニタを用いる。
この場合の表示態様としては、HE染色画像を先に表示するパターン1と、同時染色画像を先に表示するパターン2が考えられる。パターン1では、病理医が従来から診断に使用しているHE染色画像から表示するので、従来の観察方法との親和性が高く、特に経験の豊富な病理医にとって観察がし易い。パターン2では、抗原分子情報を容易に観察できる同時染色画像から表示するので、病理医の経験等に関係なく注目すべき範囲が容易に特定でき、診断の効率化を図ることができる。
両パターンとも、表示装置3の表示画面の同じ領域(画像表示領域)内において、操作部からの切替指示に応じてHE染色画像と同時染色画像がパラパラめくりのように切替表示される。ここで、上述のように、切替表示されるHE染色画像と同時染色画像とは同一スライドの顕微鏡4における同一視野範囲を撮影することにより得られた画像である。従って、病理医は視線を動かさずに、両画像の相対的位置関係を容易に把握して観察を行うことができる。
【0107】
また、表示する画像をHE染色画像とし、同一視野を撮影した同時染色画像から輝点の抽出を行い、抽出された輝点をHE染色画像に重畳表示してもよい。このようにすれば、病理医が見慣れたHE染色画像を観察しながら、視線を動かさずに、必要最低限の抗原分子情報を得ることができる。また、輝点の表示/非表示は、操作部により切り替えられる構成とすることが好ましい。
【0108】
また、上述のパターン1のように、初期表示をHE染色画像とし、操作部からの切替指示により同時染色画像に切り替える表示態様において、HE染色画像から公知の細胞核(H染色部)検出を行い、同時染色画像を表示する際に検出された細胞核の位置を重畳表示してもよい。このように、同時染色画像において細胞核の情報がわかると、病理医が細胞の位置を特定する際の支援となるので好ましい。この細胞核の表示/非表示は、操作部により切り替えられる構成とすることが好ましい。
【0109】
また、上述のパターン2のように、初期表示を同時染色画像とし、操作部からの切替指示によりHE染色画像に切り替える表示態様において、同時染色画像から輝点ドットが集中している部分を抽出してROI(関心領域)を設定し、HE染色画像に切り替えた際に、HE画像上にROIを示す枠を重畳表示することとしてもよい。ROIが複数ある場合は、同時に表示しても、操作部の所定のキーの押下に応じて輝点ドットの多い順に表示することとしてもよい。また、ROIの設定は、自動で緒行うこととしてもよいし、その表示された同時染色画像上から操作部を用いて病理医が指定することとしてもよい。このように、HE染色画像上で輝点ドットの集中しているROIを表示することで、病理医は、抗原分子情報の多い注目すべき領域を容易に認識することができ、注目すべき領域のみを観察することができる。また、抗原分子情報が集中している領域の細胞形態情報をしっかり確認することが可能となる。
【0110】
ビュワー表示方式の何れかの方法による観察後、観察された細胞組織における乳癌発症の有無(確定診断結果)が表示装置3において入力されると、入力された確定診断結果がスライドID及び患者情報に対応付けてサーバー装置7に送信され、サーバー装置7において確定診断結果がスライドID及び患者情報に対応付けて記憶される。また、患者情報を介して、患者情報に対応付けられている乳房画像(+CAD結果)に対し、確定診断結果が対応付けられる。なお、表示のために作成した個々の画像(細胞形態情報を抽出した画像、抗原分子情報を抽出した画像等)は全体画像に基づいて短時間で作成可能であるので、必要に応じて作成すればよい。従って、スライドから生成された画像については少なくとも全体画像を保存することとし、細胞形態情報や抗原分子情報の画像は保存しない。これにより、サーバー装置7のデータ容量の大幅な増加を抑えることができる。なお、診断の証拠として、スライドも施設内に保存する。
なお、表示用の画像データの生成(細胞形態情報の抽出、抗原分子情報の抽出、細胞核(H染色部)の検出を含む)は、画像処理装置6において行うこととして説明したが、表示装置3において行うこととしてもよい。また、画像処理装置2、表示装置3、画像処理装置6は一体としてもよい。
【0111】
上記実施の形態における記述内容は、本発明の好適な一例であり、これに限定されるものではなく、発明の趣旨を逸脱しない範囲で適宜変更可能である。
【符号の説明】
【0112】
100 乳房診断システム
1 乳房撮影装置
2 画像処理装置
3 表示装置
4 顕微鏡
5 顕微鏡設置カメラ
6 画像処理装置
7 サーバー装置
8 HIS/RIS
【技術分野】
【0001】
本発明は、組織の自家蛍光またはHE(ヘマトキシリン−エオジン)染色に用いられるエオジンが発する自家蛍光と、蛍光物質内包ナノ粒子の発する蛍光とを利用することにより、組織の形態に関する情報と目的とする生体物質(代表的には抗原分子)に関する情報を同一視野で観察することのできる免疫組織化学法を利用した病理診断情報生成方法及び病理診断情報生成システムに関する。
【背景技術】
【0002】
病理診断では、まず採取した組織を固定するために脱水し、パラフィンによるブロック化といった処理を行った後、2〜8μmの厚さの薄片に切り、パラフィンを取り除き、染色して顕微鏡にセットして観察を行う。病理診断の分野では、特許文献1〜3に見られるように顕微鏡観察は広く用いられている手法であるが、病理医は、この顕微鏡観察において、細胞の核の大きさや形の変化、組織としてのパターンの変化等の形態学的な情報、染色情報をもとに診断を行っている。
また、画像のデジタル化技術の発達に伴い、病理診断の分野においても、顕微鏡及びデジタルカメラ等を用いて観察対象のデジタル画像(病理画像)を取得し、この病理画像から、病理医が病理診断を行う際に必要となる情報を抽出・計測して表示する自動化された病理診断支援装置が普及してきている。
【0003】
例えば、特許文献4には、病理画像から細胞核領域及び細胞質領域をそれぞれ特定する核・細胞質分布推定手段と、病理画像から腺腔領域(細胞をほとんど含まない領域)を特定する腺腔分布抽出手段と、癌細胞が存在するか否かを判定する癌部位推定手段と、癌の進行度を判定する進行度判定手段と、癌細胞の分布図や進行度等を表示する画像表示手段と、を有するし病理診断支援装置が開示されている。
【0004】
また、特許文献5には、正常部位と癌部位をそれぞれ選択的に染色するような2種類の染料で病理標本を染色し、更にスペクトル画像からランベルト・ベールの法則を用いて染色濃度を評価し、癌細胞の有無を判定する癌細胞の検出方法が開示されている。
【0005】
しかし、いずれの評価法を用いた場合でも、組織染色方法は従来の色素染色法(例えば、HE染色(ヘマトキシリン−エオジン染色)、酵素を用いた色素染色法(例えば、DAB染色)であり、その染色濃度は温度、時間等の環境条件により大きく左右され、病理診断支援装置の正確な定量測定性能を活かしきれていない。
【0006】
一方、特許文献6には、所定の励起波長において、組織切片が発する自家蛍光の波長域と近接しない蛍光波長を有する(自家蛍光のストークスシフトよりも(たとえば約80nm以上)長波長のストークスシフトを有する)蛍光物質を用いて染色することにより、自家蛍光と標的分子に由来する蛍光とを異なる色で区別して観察する方法が開示されている。しかしながら、この方法には、安価で好感度なモノクロカメラが使えない、適切な光学フィルターを用いることができず、励起光によるノイズが増大するという問題点があり、実用的な診断を行うことは実質的に不可能であった。
また、色素に代わる標識試薬として定量性能が高い蛍光色素が組織染色の研究に用いられているが(非特許文献1参照)、その発光輝度は組織の発する自家蛍光と比較して暗く、極微量のバイオマーカーを発光レベルによって自動判別することはできない。
【0007】
また、上記の従来の病理診断はいずれも、二枚以上のスライドで同一の部位を観察することとなる。複数のスライドを使用した診断は、例えば、次の手順で行われる。
まず、いわゆるHE染色を施された組織切片標本を載せたスライドと、HE染色された組織切片に隣接する組織切片を免疫組織化学染色法により染色することにより得られた組織切片標本を載せたスライドと、を用意し、病理医がHE染色を施された組織切片標本を顕微鏡観察することにより腫瘍判断を行う。
続いて、免疫組織化学染色法により染色することで得られた組織切片標本に、HE染色された標本で判定された腫瘍部分をてらし合わせ、腫瘍部分を判別する。そして、免疫組織化学染色した組織切片標本の腫瘍部分を顕微鏡観察する。
この観察は、非常な手間と熟練を有し、属人性が高く、病理診断における診断ばらつきの要因ともなり、標準化の妨げとなっている。また、顕微鏡を覗くこと自体が病理医の疲労を誘発し、作業効率や診断精度を低下させている。そこで、デジタルカメラ等のデジタル画像生成装置で顕微鏡観察される対象のデジタル画像を生成しビュワーに表示させることで、疲労低減を図る手法(例えば、特許文献7参照)、2枚の切片より得られた画像を重畳(合成)して1枚の画像とすることで診断効率の向上を図る手法(例えば、特許文献8参照)も知られている。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開平9−197290号公報
【特許文献2】特開2007−271503号公報
【特許文献3】特開2010−078377号公報
【特許文献4】特開2004−286666号公報
【特許文献5】特表2001−525580号公報
【特許文献6】国際公開WO2003/010542号パンフレット
【特許文献7】特開2006−153742号公報
【特許文献8】国際公開WO2008/108059号パンフレット
【非特許文献】
【0009】
【非特許文献1】「病理と臨床 Vol.25 2007年臨時増刊号 診断に役立つ免疫組織化学」文光堂 2007年
【発明の概要】
【発明が解決しようとする課題】
【0010】
近年、抗体医薬を中心とした分子標的薬治療の広がりに伴い、分子標的薬をより効果的に使用するため、正確な診断法の必要性が高まっている。病理診断においても、より正確に疾病の診断を行うため、極微量のバイオマーカーを組織切片上で定量的に検出することが求められている。また、病理診断に必要な工数の低減も求められている。
【0011】
本願発明者等は、免疫組織化学法における蛍光標識材料として、複数の蛍光物質を内包したナノ粒子(蛍光物質内包ナノ粒子と称する)を用い、この蛍光標識材料による染色及びHE染色された組織切片に適切な波長を有する励起光を照射することにより、細胞等の自家蛍光によりその組織又は細胞の形態情報(細胞形態情報)が得られると同時に、その自家蛍光に埋没することなく、蛍光物質内包ナノ粒子が発する蛍光により目的とする特定抗原の分子の情報(抗原分子情報)が得られることを見出した。
【0012】
本発明の課題は、高輝度の蛍光物質内包ナノ粒子を免疫組織化学法の蛍光標識材料に用いることにより、同一切片、同一蛍光視野で細胞等の形態情報とともに抗体分子情報(細胞機能情報)を提供できるようにすることで、病理診断の工数低減、診断精度の向上を図ることである。
【課題を解決するための手段】
【0013】
上記課題を解決するため、請求項1に記載の発明の病理診断情報生性方法は、
組織切片に、特定抗原を認識する抗体と、当該抗体に結合した、複数の蛍光物質を内包するナノ粒子とを構成要素に含む蛍光標識材料による染色、及びHE(ヘマトキシリン−エオジン)染色を施す工程と、
前記染色を施された組織切片に所定波長の励起光を照射して前記組織切片に蛍光を発光させ、当該蛍光に基づき、前記組織切片における組織又は細胞の形態情報、及び前記特定抗原の分子の情報を同時に生成する工程と、
を含む。
【0014】
請求項2に記載の発明は、請求項1に記載の発明において、
前記所定波長の励起光は、560〜630nmの範囲であり、前記蛍光物質は、前記励起光により580〜690nmの範囲にピークを有する蛍光を発するものである。
【0015】
請求項3に記載の発明は、請求項1又は2に記載の発明において、
前記組織又は細胞の形態情報、及び前記特定抗原の分子の情報が同一視野で得られる。
【0016】
請求項4に記載の発明は、請求項1〜3の何れか一項に記載の発明において、
前記組織又は細胞の形態情報、及び前記特定抗原の分子の情報は、前記蛍光の像を顕微鏡により結像することにより生成される。
【0017】
請求項5に記載の発明は、請求項1〜4の何れか一項に記載の発明において、
前記特定抗原の分子の情報は、ドット状の蛍光で表される。
【0018】
請求項6に記載の発明は、
特定抗原を認識する抗体と、当該抗体に結合した、複数の蛍光物質を内包するナノ粒子とを構成要素に含む蛍光標識材料による染色と、HE(ヘマトキシリン−エオジン)染色と、が施された組織切片が載置された一のスライドに、所定波長の励起光を照射する照射手段と、
前記照射手段による励起光の照射により前記組織切片から発光された蛍光の像を結像することにより前記組織切片における組織又は細胞の形態情報及び前記特定抗原の分子の情報を同時に生成する結像手段と、
を備える。
【0019】
請求項7に記載の発明は、請求項6に記載の発明において、
前記照射手段は、560〜630nmの範囲の波長の励起光を照射するものであり、
前記蛍光物質は、前記励起光により580〜690nmの範囲にピークを有する蛍光を発するものである。
【0020】
請求項8に記載の発明は、請求項6又は7に記載の発明において、
前記結像手段により結像された像を撮像してデジタル画像データを生成する撮像手段と、
前記撮像手段により生成された画像データに基づき表示用の画像を生成する画像処理手段と、
前記画像処理手段により生成された画像を表示する表示手段と、
を備える。
【0021】
請求項9に記載の発明は、請求項8に記載の発明において、
前記表示手段に表示する画像の切替を指示するための操作手段を有し、
前記画像処理手段は、前記撮像手段により生成された画像データから前記組織切片の特定抗原の分子の情報のみを抽出して抗原分子画像を生成する手段と、前記撮像手段により生成された画像データから前記組織切片の組織又は細胞の形態情報のみを抽出して細胞形態画像を生成する手段を有し、
前記表示手段は、前記操作手段からの切替指示に応じて前記抗原分子画像と前記細胞形態画像を切替表示する。
【発明の効果】
【0022】
本発明によれば、高輝度の蛍光物質内包ナノ粒子を免疫組織化学法の蛍光標識材料に用いることにより、同一切片、同一蛍光視野で、細胞等の形態情報とともに抗原分子の情報(細胞機能情報)を観察(顕微鏡鏡胴観察)できるため、病理医の診断精度の向上、利便性向上を図ることができる。
【0023】
また、本発明によれば、病理診断のための検査過程で使用するスライドは1部位に対し1枚のみですむので、顕微鏡へのスライドの着脱工数が低減され、更に保管するスライドも同様に1枚のみですみ、省スペース化も可能となる。
更に、本発明によれば、1枚のスライドの少なくとも1回の撮影で、組織切片の自家蛍光及びエオジンの自家蛍光の画像である細胞形態情報と、蛍光標識材料からの蛍光の画像である抗原分子情報を含む画像データを生成可能となるので、従来に比べて検査工数を削減することができる。
更に、本発明によれば、1回の撮影で細胞形態情報と抗原分子情報を含む画像データが得られるので、細胞形態情報と抗原分子情報を個別に撮影して重畳(合成)した画像データとは異なり、細胞形態情報と抗原分子情報の位置合わせ(病理医の記憶による位置合わせ、画像処理による位置合わせ)自体が不要である。そのため、位置合わせ精度に左右されずに正確な診断を行うことができる。また、顕微鏡鏡胴観察方式の他に、デジタル撮像系を用いて生成された画像データをビュワー等の表示手段に表示する構成とすることで、一人で、或いは複数人のカンファレンスで、標準化された画像で正確な診断を行うことができ、診断精度を向上させることができる。
更に、組織切片の細胞形態情報のみを抽出した画像、組織切片の抗原分子情報のみを抽出した画像や双方を含む画像を操作手段の指示に応じて切り替えて表示手段に表示する構成とすることで、病理医が何れかの情報(細胞形態情報又は抗原分子情報)の画像において任意の領域に注目した状態で、視線を動かさずに他方の情報を確認すること等ができ、また、個々の病理医の診断スタイルに応じたフローとすることができ、診断の利便性が向上する。
また、本発明を乳がんに適用した場合、本発明で得られる画像データは、従来より乳房画像診断用に普及しているモノクロのモニタを使用して出力表示することができるので、新たにカラー用モニタ等の設備投資が不要となる。
また、抗原分子情報は、細胞形態情報を表す組織の自家蛍光やエオジン蛍光に比べて高輝度なドット状の蛍光として表されるので、観察者が抗原分子情報を細胞形態情報と区別して容易に視認することができ、診断性能を向上させることができる。このような本発明の方法は、モノクロカメラを用いた場合にも、抗原分子に結合した蛍光物質内包ナノ粒子が発する高輝度の蛍光を、細胞等が発する自家蛍光から区別して認識することができる。また、光学フィルターを用いて励起光によるノイズをカットすることも妨げられないので、高感度の測定を維持することができる。
【図面の簡単な説明】
【0024】
【図1】エオジンの励起波長、発光波長と蛍光強度の関係を示す図である。
【図2】標識材料Dを用いた場合に顕微鏡設置カメラから取得した画像である。
【図3】標識材料Eを用いた場合に顕微鏡設置カメラから取得した画像である。
【図4】標識材料Aを用いた場合に顕微鏡設置カメラから取得した画像である。
【図5】標識材料Bを用いた場合に顕微鏡設置カメラから取得した画像である。
【図6】標識材料Cを用いた場合に顕微鏡設置カメラから取得した画像である。
【図7】本発明を適用した乳房診断システムの全体構成例を示す図である。
【発明を実施するための形態】
【0025】
−蛍光標識材料−
本発明の免疫組織化学法では、蛍光標識材料として、生体物質認識部位およびこれに結合した蛍光物質内包ナノ粒子とを構成要素として含むものを用いる。
【0026】
〔蛍光物質〕
蛍光物質内包ナノ粒子に内包される蛍光物質は、具体的には、蛍光有機色素または量子ドットである。200〜700nmの範囲内の波長の紫外〜近赤外光により励起されたときに、400〜900nmの範囲内の波長の可視〜近赤外光の発光を示す蛍光物質を用いることが好ましい。なお、蛍光物質の励起波長および発光波長は、蛍光物質内包ナノ粒子に内包させた場合もそうでない場合も、ほぼ同じである。蛍光物質内包ナノ粒子には、いずれか1種の蛍光物質のみを内包させてもよいし、2種以上の蛍光物質の混合物を内包させてもよい。
【0027】
ここで、組織およびエオジンの自家蛍光は、たとえば350nmの励起波長を照射した場合はおよそ400〜600nmにわたる(約440nmにピークを有する)波長の蛍光を発し、490nmの励起波長を照射した場合はおよそ500〜650nmにわたる(約540nmにピークを有する)波長の蛍光を発する。したがって、同じ波長の励起光を照射したときに組織およびエオジンの自家蛍光と波長が重複する蛍光を発するものを、蛍光標識材料のための蛍光物質として選択することにより、共通のカットフィルターを用いて、同一視野において、それらの蛍光を観察することが可能である。この場合、蛍光物質内包ナノ粒子が発する蛍光は高輝度なので、組織等の自家蛍光に埋もれることなく識別することができる。組織等の発する自家蛍光の強度および蛍光物質内包ナノ粒子が発する蛍光の強度は、それらの蛍光波長の重なり具合が好ましいものとなるような励起光の波長や蛍光物質を選択することにより、適切なバランスを有するものとなるよう調整することが好ましい。
【0028】
蛍光有機色素としては、フルオレセイン系色素分子、ローダミン系色素分子、Alexa Fluor(登録商標、インビトロジェン社製)系色素分子、BODIPY(登録商標、インビトロジェン社製)系色素分子、カスケード系色素分子、クマリン系色素分子、エオジン系色素分子、NBD系色素分子、ピレン系色素分子、Texas Red(登録商標)系色素分子、シアニン系色素分子、ペリレン系色素分子、オキサジン系色素分子等を挙げることができる。
【0029】
具体的には、5−カルボキシ−フルオレセイン、6−カルボキシ−フルオレセイン、5,6−ジカルボキシ−フルオレセイン、6−カルボキシ−2’,4,4’,5’,7,7’−ヘキサクロロフルオレセイン、6−カルボキシ−2’,4,7,7’−テトラクロロフルオレセイン、6−カルボキシ−4’,5’−ジクロロ−2’,7’−ジメトキシフルオレセイン、ナフトフルオレセイン、5−カルボキシ−ローダミン、6−カルボキシ−ローダミン、5,6−ジカルボキシ−ローダミン、ローダミン 6G、テトラメチルローダミン、X−ローダミン、及びAlexa Fluor 350,Alexa Fluor 405、Alexa Fluor 430、Alexa Fluor 488、Alexa Fluor 500、Alexa Fluor 514、Alexa Fluor 532、Alexa Fluor 546、Alexa Fluor 555、Alexa Fluor 568、Alexa Fluor 594、Alexa Fluor 610、Alexa Fluor 633、Alexa Fluor 635、Alexa Fluor 647、Alexa Fluor 660、Alexa Fluor 680、Alexa Fluor 700、Alexa Fluor 750、BODIPY FL,BODIPY TMR、BODIPY 493/503、BODIPY 530/550、BODIPY 558/568、BODIPY 564/570、BODIPY 576/589、BODIPY 581/591、BODIPY 630/650、BODIPY 650/665(以上インビトロジェン社製)、メトキシクマリン、エオジン、NBD、ピレン、Cy5、Cy5.5、Cy7等を挙げることができる。
【0030】
量子ドットとしては、II−VI族化合物、III−V族化合物、又はIV族元素を成分として含有する量子ドット(それぞれ、「II−VI族量子ドット」、「III−V族量子ドット」、「IV族量子ドット」ともいう。)のいずれかを用いることができる。
【0031】
具体例としては、CdSe、CdS、CdTe、ZnSe、ZnS、ZnTe、InP、InN、InAs、InGaP、GaP、GaAs、Si、Geが挙げられる。
上記量子ドットをコアとし、その上にシェルを設けた量子ドットを用いることもできる。以下本明細書中シェルを有する量子ドットの表記法として、コアがCdSe、シェルがZnSの場合、CdSe/ZnSと表記する。例えば、CdSe/ZnS、CdS/ZnS、InP/ZnS、InGaP/ZnS、Si/SiO2、Si/ZnS、Ge/GeO2、Ge/ZnSなどが挙げられる。
【0032】
量子ドットは必要に応じて、有機ポリマーなどにより表面処理が施されているものを用いてもよい。例えば、表面カルボキシ基を有するCdSe/ZnS(インビトロジェン社製)、表面アミノ基を有するCdSe/ZnS(インビトロジェン社製)などがあげられる。
【0033】
〔蛍光物質内包ナノ粒子の作製方法〕
蛍光物質内包ナノ粒子は、上述したような蛍光物質がナノ粒子内部に分散したものであり、蛍光物質はそれを被覆するナノ粒子と化学的に結合していても、していなくてもよい。
【0034】
ナノ粒子を構成する素材は特に限定されるものではなく、ポリスチレン、ポリ乳酸、シリカなどを挙げることができる。
蛍光物質内包ナノ粒子は、公知の方法により作製することができる。例えば、蛍光有機色素を内包したシリカナノ粒子は、ラングミュア8巻2921ページ(1992)に記載されているFITC内包シリカ粒子の合成を参考に合成することができる。FITCの代わりに所望の蛍光有機色素を用いることで種々の蛍光有機色素内包シリカナノ粒子が合成できる。
【0035】
量子ドットを内包したシリカナノ粒子は、ニュー・ジャーナル・オブ・ケミストリー33巻561ページ(2009)に記載されているCdTe内包シリカナノ粒子の合成を参考に合成することができる。
【0036】
蛍光有機色素を内包したポリスチレンナノ粒子は、米国特許第4326008号(1982)に記載されている重合性官能基をもつ有機色素を用いた共重合法や、米国特許第5326692号(1992)に記載されているポリスチレンナノ粒子への蛍光有機色素の含浸法を用いて作製することができる。
【0037】
量子ドットを内包したポリマーナノ粒子は、ネイチャー・バイオテクノロジー19巻631ページ(2001)に記載されているポリスチレンナノ粒子への量子ドットの含浸法を用いて作製することができる。
【0038】
蛍光物質内包ナノ粒子の平均粒径は特に限定されないが、通常は30〜800nm程度である。また、粒径のばらつきを示す変動係数も特に限定されないが、通常は20%程度である。ここでいう平均粒径は、走査型電子顕微鏡(SEM)を用いて電子顕微鏡写真を撮影し十分な数(たとえば1000個)の蛍光物質ナノ粒子について断面積を計測し、その計測値を相当する円の面積としたときの直径を粒径として求められる算術平均であり、変動係数は、上記のようにして測定した粒径分布から算出した値(100×粒径の標準偏差/平均粒径)である。
【0039】
〔蛍光標識材料の作製方法〕
蛍光標識材料における生体物質認識部位は、目的とする生体物質と特異的に結合する物質により構成される部位である。目的とする生体物質は、それと特異的に結合する物質が存在するものであれば特に限定されるものではないが、代表的にはタンパク質(ペプチド)および核酸(オリゴヌクレオチド、ポリヌクレオチド)が挙げられる。したがって、そのような目的とする生体物質に結合する物質としては、前記タンパク質を抗原として認識する抗体やそれに特異的に結合する他のタンパク質等、および前記核酸にハイブリダイズする塩基配列を有する核酸等が挙げられる。具体的には、細胞表面に存在するタンパク質であるヒト上皮細胞成長因子受容体2(HER2)に特異的に結合する抗HER2抗体、細胞核に存在するエストロゲン受容体(ER)に特異的に結合する抗ER抗体、細胞骨格を形成するアクチンに特異的に結合する抗アクチン抗体などが挙げられる。中でも抗HER2抗体および抗ER抗体は、免疫組織化学法を乳がんの投薬選定のために利用する際の好ましい生体物質認識部位である。
【0040】
生体物質認識部位と蛍光物質内包ナノ粒子の結合の態様としては特に限定されず、共有結合、イオン結合、水素結合、配位結合、物理吸着及び化学吸着等が挙げられる。結合の安定性から共有結合などの結合力の強い結合が好ましい。
【0041】
また生体物質認識部位と蛍光物質内包ナノ粒子の間を連結する有機分子があってもよい。例えば生体物質との非特異的吸着を抑制するためポリエチレングリコール鎖を用いることができ、例えばThermoScientific社製SM(PEG)12を用いることができる。
【0042】
蛍光物質内包シリカナノ粒子へ生体物質認識部位を結合させる場合、蛍光物質が蛍光有機色素の場合でも、量子ドットの場合でも同様の手順を適用することができる。例えば、無機物と有機物を結合させるために広く用いられている化合物であるシランカップリング剤を用いることができる。このシランカップリング剤は、分子の一端に加水分解でシラノール基を与えるアルコキシシリル基を有し、他端に、カルボキシル基、アミノ基、エポキシ基、アルデヒド基などの官能基を有する化合物であり、上記シラノール基の酸素原子を介して無機物と結合する。具体的には、メルカプトプロピルトリエトキシシラン、グリシドキシプロピルトリエトキシシラン、アミノプロピルトリエトキシシラン、ポリエチレングリコール鎖をもつシランカップリング剤(例えば、Gelest社製PEG−silane no.SIM6492.7)などがあげられる。
【0043】
蛍光物質内包シリカナノ粒子とシランカップリング剤との反応手順は、公知の手法を用いることができる。例えば、得られた蛍光色素内包シリカナノ粒子を純水中に分散させ、アミノプロピルトリエトキシシランを添加し、室温で12時間反応させる。反応終了後、遠心分離又はろ過により、表面がアミノプロピル基で修飾された蛍光物質内包シリカナノ粒子を得ることができる。続いてアミノ基と抗体中のカルボキシル基とを反応させることで、アミド結合を介して抗体を蛍光有機色素内包シリカナノ粒子と結合させることができる。必要に応じEDC(1-Ethyl-3-[3-Dimethylaminopropyl]carbodiimide Hydrochloride:Pierce社製)のような縮合剤を用いることもできる。
【0044】
必要により、有機分子修飾された蛍光物質内包シリカナノ粒子と直接結合しうる部位と、分子標的物質と結合しうる部位とを有するリンカー化合物を用いることができる。具体例として、アミノ基と選択的に反応する部位とメルカプト基と選択的に反応する部位の両方をもつsulfo−SMCC(Sulfosuccinimidyl 4[N-maleimidomethyl]-cyclohexane-1-carboxylate:Pierce社製)をリンカー化合物として用いて、アミノプロピルトリエトキシシランで修飾した蛍光物質内包シリカナノ粒子のアミノ基、および抗体中のメルカプト基のそれぞれと上記リンカー化合物の有する官能基とを反応させることにより、上記リンカー化合物を介して抗体が結合した蛍光物質内包シリカナノ粒子を作製することができる。
【0045】
蛍光物質内包ポリスチレンナノ粒子へ生体物質認識部位を結合させる場合、蛍光物質が蛍光有機色素の場合でも、量子ドットの場合でも同様の手順を適用することができる。すなわち、アミノ基など官能基をもつポリスチレンナノ粒子へ蛍光有機色素または量子ドットを含浸して、上記官能基をもつ蛍光物質内包ポリスチレンナノ粒子を作製し、以降前記と同様にEDCもしくはsulfo−SMCCを用いることで、抗体が結合した蛍光物質内包ポリスチレンナノ粒子ができる。
【0046】
−免疫組織化学法−
本発明の免疫組織化学法は、前述したような蛍光標識材料を用いて組織切片を染色する工程および必要に応じてHE染色を行う工程(「染色工程」と称する。)と、励起光を照射して所定の情報を得る工程(「観察工程」と称する。)とを含む。
【0047】
〔染色工程〕
本発明の免疫組織化学法における染色工程は上述したような特定の蛍光標識材料を用いて組織切片の染色を行う。染色する対象は病理切片組織に限定されず、細胞染色にも適用可能である。本発明の染色方法が適用できる切片の作製法は特に限定されるものではなく、公知の方法により作製された切片を用いることができる。たとえば、病理切片として汎用されているパラフィン包埋切片を用いる場合は、次のような手順で染色すればよい。
【0048】
1)脱パラフィン処理
キシレンを入れた容器に病理切片を浸漬させ、パラフィンを除去する。温度は特に限定されるものではないが、室温で行うことができる。浸漬時間は3分以上30分以下であることが好ましい。必要により浸漬途中でキシレンを交換してもよい。
【0049】
ついで、エタノールを入れた容器に病理切片を浸漬させ、キシレンを除去する。温度は特に限定されるものではないが、室温で行うことができる。浸漬時間は3分以上30分以下であることが好ましい。必要により浸漬途中でエタノールを交換してもよい。
【0050】
さらに、水を入れた容器に病理切片を浸漬させ、エタノールを除去する。温度は特に限定されるものではないが、室温で行うことができる。浸漬時間は3分以上30分以下であることが好ましい。必要により浸漬途中で水を交換してもよい。
【0051】
2)賦活化処理
公知の方法にならい、目的とする生体物質の賦活化処理を行う。賦活化条件に特に定めはないが、賦活液としては、0.01Mクエン酸緩衝液(pH6.0)、1mMEDTA溶液(pH8.0)、5%尿素、0.1Mトリス塩酸緩衝液などを用いることができる。加熱機器はオートクレーブ、マイクロウェーブ、圧力鍋、ウォーターバスなどを用いることができる。温度は50〜130℃、時間は5〜30分で行うことができる。
【0052】
ついで、PBSを入れた容器に賦活処理後の切片を浸漬させ、洗浄する。温度は特に限定されるものではないが、室温で行うことができる。浸漬時間は3分以上30分以下であることが好ましい。必要により浸漬途中でPBSを交換してもよい。
【0053】
3)蛍光標識材料による染色処理
生体物質認識部位および蛍光物質ナノ粒子を備えた蛍光標識材料のPBS分散液を調製し、病理切片に載せて、目的とする生体物質と反応させる。複数の生体物質を目的として染色する場合は、各生体物質に対応した生体物質認識部位および互いに異なる蛍光物質内包ナノ粒子を備えた蛍光標識材料のPBS分散液をそれぞれ調製し、それらを病理切片に載せて、それぞれ目的とする生体物質と反応させればよい。病理切片に載せる際には、それぞれの蛍光標識材料のPBS分散液をあらかじめ混合してもよいし、別々に順次載せてもよい。
【0054】
温度は特に限定されるものではないが、室温で行うことができる。反応時間は30分以上24時間以下であることが好ましい。なお、蛍光標識材料による染色を行う前に、BSA含有PBSなど公知のブロッキング剤を滴下することが好ましい。
【0055】
ついで、PBSを入れた容器に染色後の切片を浸漬させ、未反応蛍光物質内包ナノ粒子を除去する。温度は特に限定されるものではないが、室温で行うことができる。浸漬時間は3分以上30分以下であることが好ましい。必要により浸漬途中でPBSを交換してもよい。
【0056】
また、本発明では、細胞または組織自体が発する自家蛍光を利用してそれらの形態観察を行うことができるため、その他の染色液等を用いる必要はないが、光学顕微鏡による組織観察において汎用されているHE(ヘマトキシリン−エオジン)染色をあわせて行ってもよい。ヘマトキシリンは青紫色の色素であり、細胞核、骨組織、軟骨組織の一部、漿液成分など(好塩基性の組織等)を染色する。エオジンは赤〜ピンク色の色素であり、細胞質、軟部組織の結合組織、赤血球、線維素、内分泌顆粒など(好酸性の組織等)を染色する。このうちエオジンは自家蛍光を発するので、本発明における所定の蛍光標識材料による染色とともにHE染色を行った場合は、励起光を照射した際に、組織等が発する自家蛍光とともに細胞質等を染色したエオジンが発する自家蛍光により、細胞または組織の形態に関する情報をより取得しやすくなる。
染色処理後、カバーガラスを切片に載せて封入する。必要に応じて市販の封入剤を使用してもよい。
【0057】
〔観察工程〕
観察工程は、上記工程により染色された組織切片に励起光を照射することにより、組織の自家蛍光及びエオジンの自家蛍光に基づく細胞または組織の形態情報(細胞形態情報)を取得し、かつ前記蛍光標識材料による蛍光に基づく細胞または組織内の前記特定抗原分子の情報(抗原分子情報)を取得する工程である。
【0058】
励起光は、組織および必要に応じて用いられるエオジンが所望の波長の自家蛍光を発し、かつ蛍光標識材料中の蛍光物質が所望の波長の蛍光を発する、適切な波長を有するものであればよく、励起光の照射手段も特に限定されるものではない。たとえば、蛍光顕微鏡が備えるレーザ光源から、必要に応じて所定の波長を選択的に透過させるフィルターを用いて、適切な波長および出力の励起光を染色された組織切片に照射すればよい。
【0059】
図1に、エオジンの励起波長、発光波長と蛍光強度の関係を示す。
エオジンは蛍光物質であり、この蛍光は細胞形態情報の視認性向上に寄与するものである。しかし、エオジンの励起光吸収や蛍光の蛍光(発光)強度が大きくなるにつれて、抗原分子情報である蛍光標識材料からの蛍光の視認性が落ちてしまう。そこで、励起光波長としては、エオジン自体の過度の発光を抑制し、蛍光標識材料の視認性を上げる(両者の光量差を確保して両者を区別して認識可能とする)ために、エオジン自体が励起光を吸収しない又は励起光吸収し難い(従って、励起光によるエオジンの蛍光発光量が少ない)波長を選定することが好ましい。ここで、図1に示すように、励起光波長が560nm以上でエオジンの励起光の吸収はゼロとなり、一方、エオジンの蛍光がみられる限界(上限)は630nm付近である。従って、観察工程における励起光波長は560〜630nmの範囲のものを選択するのが好ましい。より好ましくは、エオジンの蛍光発光量がピークの1/3程度となる575nm付近である。また、前記蛍光物質としては当該励起光により580〜690nmの範囲、より好ましくは600〜630nmの範囲にピークを有する蛍光を発するものを用いる(したがってこの領域の発光波長を有する蛍光を測定するようにする)ことが好ましい。この範囲にピークを有する蛍光物質であれば、上記範囲の励起光を選択したときに、エオジンの蛍光と区別可能な程度の光量差を確保できるからである。
【0060】
細胞形態情報および抗原分子情報は、同一視野で取得する、すなわち、一枚の染色切片から得られる、組織の自家蛍光および蛍光標識材料が発する蛍光の両方が同一の視野に含まれるようにしつつも、それらを区別して認識し、それぞれに基づいて細胞形態情報および抗原分子情報を取得することが好適である。もちろん、必要であれば、たとえば組織の自家蛍光または蛍光標識材料が発する蛍光の一方を十分に低減しうる適切なフィルターを用いることにより、ある視野で細胞形態情報のみを取得するようにし、他の視野で抗原分子情報を取得するようにしてもよい。
【0061】
また、細胞形態情報および抗原分子情報は、迅速な観察が行えるよう(蛍光)顕微鏡の鏡筒から取得するようにしてもよいし、(蛍光)顕微鏡に設置されたカメラ(デジタル撮像手段)が撮影した画像を別途表示手段(モニタ等)に表示し、それを観察することにより取得するようにしてもよい。用いる蛍光物質によるが、顕微鏡の鏡筒からの目視により十分に抗原分子情報を取得することができなくても、カメラが撮影した画像から抗原分子情報を取得することが可能な場合もある。
【0062】
前記抗原分子情報を取得することとしては、たとえば、蛍光の輝点数または発光輝度を基に、一細胞あたりの標的抗原分子数もしくは標的抗原輝度を計測することが挙げられる。用いた蛍光物質の吸収極大波長および蛍光波長に対応した励起光源および蛍光検出用光学フィルターを選択すればよい。輝点数または発光輝度の計測には、市販の画像解析ソフト(例えば、株式会社ジーオングストローム社製全輝点自動計測ソフトG-Count)を用いることが好適であるが、計測手段は特に限定されるものではない。
【実施例】
【0063】
[合成例1]蛍光有機色素(Cy5)内包シリカナノ粒子の合成
下記工程(1)〜(4)の方法により、蛍光有機色素としてCy5を内包するシリカナノ粒子(以下「ナノ粒子A」と称する。)を作製した。
工程(1):Cy5のN−ヒドロキシスクシンイミドエステル誘導体(GEヘルスケア社製)1mg(0.00126mmol)とテトラエトキシシラン400μL(1.796mmol)を混合した。
工程(2):エタノール40mLと14%アンモニア水10mLを混合した。
工程(3):工程(2)で調製した混合液を室温下撹拌しているところに、工程(1)で調製した混合液を添加した。添加開始から12時間撹拌を行った。
工程(4):反応混合物を10000gで60分遠心分離を行い、上澄みを除去した。エタノールを加え、沈降物を分散させ、再度遠心分離を行った。同様の手順でエタノールと純水による洗浄を一回ずつ行った。
得られたナノ粒子Aの1000個について走査型電子顕微鏡(SEM;日立社製S−800型)観察を行ったところ、平均粒径は110nm、変動係数は12%であった。
【0064】
[合成例2]量子ドット(CdSe/ZnS)内包シリカナノ粒子の合成
下記工程(1)〜(4)の方法により、量子ドットとしてCdSe/ZnSを内包するシリカナノ粒子(以下「ナノ粒子B」と称する。)を作製した。なお、CdSe/ZnSの発光波長のピークは655nmである。
工程(1):CdSe/ZnSデカン分散液(インビトロジェン社Qdot655)10μLとテトラエトキシシラン40μLを混合した。
工程(2):エタノール4mLと14%アンモニア水1mLを混合した。
工程(3):工程(2)で調製した混合液を室温下で撹拌しているところに、工程(1)で調製した混合液を添加した。添加開始から12時間撹拌を行った。
工程(4):反応混合物を10000gで60分遠心分離を行い、上澄みを除去した。エタノールを加え、沈降物を分散させ、再度遠心分離を行った。同様の手順でエタノールと純水による洗浄を1回ずつ行った。
得られたナノ粒子Bの1000個についてSEM観察を行ったところ、平均粒径は130nm、変動係数は13%であった。
【0065】
[合成例3]蛍光有機色素(テキサスレッド)内包シリカナノ粒子の合成
工程(1)の原料としてCy5のN−ヒドロキシスクシンイミドエステル誘導体(GEヘルスケア社製)の代わりにテキサスレッドスルホニルクロライドを用いたこと以外は合成例1と同様にして、蛍光有機色素としてテキサスレッドを内包するシリカナノ粒子(以下「ナノ粒子C」と称する。)を作製した。
得られたナノ粒子Cの1000個について走査型電子顕微鏡(SEM;日立社製S−800型)観察を行ったところ、平均粒径は108nm、変動係数は11%であった。
【0066】
[作製例1]ナノ粒子Aに抗HER2抗体を結合させた標識材料の作製
上記合成例1で作製したナノ粒子Aに、以下の手順により抗HER2抗体を結合させ、標識材料(「標識材料A」と称する。)を作製した。
工程(1):ナノ粒子A1mgを純水5mLに分散させた。アミノプロピルトリエトキシシラン水分散液100μLを添加し、室温で12時間撹拌した。
工程(2):反応混合物を10000gで60分遠心分離を行い、上澄みを除去した。
工程(3):エタノールを加え、沈降物を分散させ、再度遠心分離を行った。同様の手順でエタノールと純水による洗浄を1回ずつ行った。生成物のFT−IR測定を行ったところ、アミノ基に由来する吸収が観測でき、ナノ粒子Aをアミノ基修飾できたことを確認できた。
工程(4):工程(3)で得られたアミノ基修飾したナノ粒子Aを、EDTA(エチレン
ジアミン四酢酸)を2mM含有したPBS(リン酸緩衝液生理的食塩水)を用いて3nM
に調整した。
工程(5):工程(4)で調製した溶液に、最終濃度10mMとなるようSM(PEG)12(サーモサイエンティフィック社製、succinimidyl-[(N-maleomidopropionamid)-dodecaethyleneglycol]ester)を混合し、1時間反応させた。
工程(6):反応混合液を10000gで60分遠心分離を行い、上澄みを除去した
工程(7):EDTAを2mM含有したPBSを加え、沈降物を分散させ、再度遠心分離を行った。同様の手順による洗浄を3回行った。最後に500μLPBSを用い再分散させた。
工程(8):抗HER2抗体を100μgを100μLのPBSに溶解させたところに、1Mジチオスレイトール(DTT)を添加し、30分反応させた。
工程(9):反応混合物についてゲルろ過カラムにより過剰のDTTを除去し、還元化抗HER2抗体溶液を得た。
工程(10):ナノ粒子Aを出発原料にして工程(7)で得られた粒子分散液と工程(9)で得られた還元化抗HER2抗体溶液とをPBS中で混合し、1時間反応させた。
工程(11):10mMメルカプトエタノール4μLを添加し、反応を停止させた。
工程(12):反応混合物を10000gで60分遠心分離を行い、上澄みを除去した後EDTAを2mM含有したPBSを加え、沈降物を分散させ、再度遠心分離を行った。同様の手順による洗浄を3回行った。最後に500μLPBSを用い再分散させた抗HER2抗体が結合したナノ粒子A(標識材料A)を得た。
【0067】
[作製例2]ナノ粒子Bに抗HER2抗体を結合させた標識材料の作製
ナノ粒子Aの代わりにナノ粒子Bを用いたこと以外は作製例1と同様の手順により、ナノ粒子Bに抗HER2抗体を結合させた標識材料(「標識材料B」と称する。)を作製した。
【0068】
[作製例3]ナノ粒子Cに抗HER2抗体を結合させた標識材料の作製
ナノ粒子Aの代わりにナノ粒子Cを用いたこと以外は作製例1と同様の手順により、ナノ粒子Cに抗HER2抗体を結合させた標識材料(「標識材料C」と称する。)を作製した。
【0069】
[作製例4]蛍光有機色素(Cy5)に抗HER2抗体を結合させた標識材料の作製
Cy5に抗HER2抗体を結合させた標識材料(「標識材料D」と称する。)を以下の手順により作製した。
工程(1):抗HER2抗体100μgを100μLのPBSに溶解させたところに、1Mジチオスレイトール(DTT)を添加し、30分反応させた。
工程(2):反応混合物についてゲルろ過カラムにより過剰のDTTを除去し、還元化抗HER2抗体溶液を得た。
工程(3):Cy5のN−ヒドロキシスクシンイミドエステル誘導体(GEヘルスケア社製)1mg(0.00126mmol)を、EDTA(エチレンジアミン四酢酸)を2mM含有したPBS(リン酸緩衝液生理的食塩水)を用いて3nMに調整した。
工程(4):工程(3)で調製した溶液に、最終濃度10mMとなるようSM(PEG)12(サーモサイエンティフィック社製、succinimidyl-[(N-maleomidopropionamid)-dodecaethyleneglycol]ester)を混合し、1時間反応させた。
工程(5):工程(4)で得られた反応混合物に工程(2)で得られた還元化抗HER2抗体溶液をPBS中で混合し、1時間反応させた。
工程(6):10mMメルカプトエタノール4μLを添加し、反応を停止させた。
工程(7):ゲルろ過カラムにより過剰のメルカプトエタノールを除去し、Cy5で標識化した還元化抗HER2抗体(標識材料D)溶液を得た。
【0070】
[作製例5]量子ドット(CdSe/ZnS)に抗HER2抗体を結合させた標識材料の作製
ライフテクノロジー社製Qdot Antibody Conjugation Kitのプロトコールに従って、量子ドット(CdSe/ZnS)に抗HER2抗体を結合させた標識材料(「標識材料E」と称する。)を作製した。具体的な手順は以下の通りである。抗HER2抗体を20mMジチオスレイトール(DTT)で還元処理を行い、ゲルろ過カラムにより過剰のDTTを除去することにより、還元化抗体溶液を得た。一方量子ドットはSMCCと反応後ゲルろ過カラムにより過剰のSMCCを除去することにより還元化抗体と反応可能なマレイミド化量子ドットを得た。得られた還元化抗体とマレイミド化量子ドットを混合1時間反応後100μMになるようメルカプトエタノールを加え反応を停止した。反応、反応停止後の溶液をゲル濾過する事で量子ドットを結合した抗HER2抗体を得た。
【0071】
<標識材料A〜Eを用いた組織免疫染色および観察>
上記作製例で作製した標識材料A〜Eを用い、下記の手順に従って、ヒト乳房組織の隣接切片の免疫染色を行った。この隣接切片は、コスモバイオ社製の組織アレイスライド(CB-A712)から選ばれた、あらかじめ測定したFISHスコアが1〜9までの24切片である。
1)キシレンを入れた容器に病理切片を30分浸漬させた。途中3回キシレンを交換した。
2)エタノールを入れた容器に病理切片を30分浸漬させた。途中3回エタノールを交換した。
3)水を入れた容器に、病理切片を30分浸漬させた。途中3回水を交換した。
4)10mMクエン酸緩衝液(pH6.0)に病理切片を30分浸漬させた。
5)121度10分オートクレーブ処理を行った。
6)PBSを入れた容器に、オートクレーブ処理後の切片を30分浸漬させた。
7)1%BSA含有PBSを組織に載せて、1時間放置した。
8)1%BSA含有PBSで0.05nMに希釈した抗HER2抗体結合した標識材料A〜Eを、各組織切片に載せて3時間放置した。
9)PBSを入れた容器に、染色後の切片をそれぞれ30分浸漬させた。
10)4%中性パラホルムアルデヒド溶液で10分間固定処理した後、HE染色を行った。
11)Merck Chemicals社製Aquatexを滴下後、カバーガラスを載せ封入した。
【0072】
上記手順により染色した切片について、カールツアイス社製正立顕微鏡Axio Imager M2を用いて、所定の波長を有する励起光を照射しながら、所定の波長を有する蛍光について、顕微鏡設置カメラ(モノクロ)からの画像の取得および顕微鏡鏡筒からの観察を行った。
なお、上記カメラは画素サイズ6.4μm×6.4μm、縦画素数1040個、横画素数1388個(撮像領域8.9mm×6.7mm)を有している。
励起波長および観察した蛍光の発光波長は、蛍光物質として(単体か、蛍光物質内包
ナノ粒子に内包されているかを問わない)Cy5を用いた場合はそれぞれ630nmおよび680nmであり、CdSe/ZnSを用いた場合はそれぞれ385nmおよび620nmであり、テキサスレッドを用いた場合はそれぞれ590nmおよび620nmである。蛍光標識からの蛍光の識別具合についての結果を表1に示す。
【0073】
【表1】

【0074】
また、図2〜図6に、上記顕微鏡設置カメラから取得した画像を示す。
図2は、標識材料Dを用いた場合に顕微鏡設置カメラから取得した画像である。
る。エオジン由来の微弱発光(自家蛍光)による細胞形態情報は観察できるが、抗原分子情報は細胞形態情報に埋もれて識別できない状態になっている。なお、顕微鏡鏡筒から観察した場合も同様の観察像となっている。
図3は、標識材料Eを用いた場合に顕微鏡設置カメラから取得した画像である。エオジン由来の微弱発光(自家蛍光)による細胞形態情報は観察できるが、抗原分子情報は細胞形態情報に埋もれて識別できない状態になっている。なお、顕微鏡鏡筒から観察した場合も同様の観察像となっている。
図4は、標識材料Aを用いた場合に顕微鏡設置カメラから取得した画像である。輝点状に見える抗原分子情報とゆるやかにつながるエオジン由来の微弱発光(自家蛍光)による細胞形態情報が識別可能な状態となっている。なお、顕微鏡鏡筒からは抗原分子情報と細胞形態情報は識別することができなかった。
図5は、標識材料Bを用いた場合に顕微鏡設置カメラから取得した画像である。輝点状に見える抗原分子情報とゆるやかにつながるエオジン由来の微弱発光(自家蛍光)による細胞形態情報が識別可能な状態となっている。なお、顕微鏡鏡筒から観察した場合も同様の観察像となっている。
図6は、標識材料Cを用いた場合に顕微鏡設置カメラから取得した画像である。輝点状に見える抗原分子情報とゆるやかにつながるエオジン由来の微弱発光(自家蛍光)による細胞形態情報が識別可能な状態となっている。なお、顕微鏡鏡筒から観察した場合も同様の観察像となっている。
【0075】
顕微鏡鏡筒からの観察では、表1に示すように、標識材料B及びCを用いた場合に、バックグラウンド(組織の自家蛍光+エオジンの自家蛍光)と蛍光標識材料からの蛍光とは明確に識別可能となっている。
しかも、細胞形態情報(組織の自家蛍光+エオジンの自家蛍光)と抗原分子情報(蛍光標識材料からの蛍光)とは、同一スライド上で観察されるので、本来の相対位置関係を保持した状態であり、病理医が従来のように複数のスライド上の像を自身の頭脳の中で重畳する必要がなく、また、例えば、特許文献8に記載のような、誤診を招かないように顕微鏡設置カメラから取得した画像から精度良い重畳画像を合成するコンピュータ処理も不要である。そのため、観察者やコンピュータによる位置合わせ精度に左右されずに診断を行うことができる。
【0076】
更に、抗原分子情報を示す蛍光標識からの蛍光はドット状の蛍光(輝点ドットという)で現れるので(図6参照)、抗原分子情報を確認(視認)するには輝点ドットを確認(視認)すればよく、極めて単純化される。従って、観察者は短時間に、且つ精確に、細胞形態情報と抗原分子情報を視認でき、疲労も大幅に低減され、自己の保持する診断能を長時間にわたって維持することが可能となる。また、被験者一人当たりに要する検査時間(組織の採取→染色→観察→診断)も大幅に短縮され、施設内の診断効率は大幅に向上する。
【0077】
一方、顕微鏡設置カメラ(モノクロ)により顕微鏡に装填された1枚のスライド上の組織切片の画像を取得し必要に応じた画像処理を施してモニタ等の表示装置に表示(ビュワー表示という)した場合、表1に示すように、標識材料B及びCに加え、標識材料Aを用いた場合においても、バックグラウンド(組織の自家蛍光+エオジン自家蛍光)と蛍光標識材料からの蛍光とは明確に識別可能となっている。
【0078】
従来はHE染色に基づく発光情報は色彩情報として単独に使用されていたが、本実施例のモノクロ出力方式においては、組織の自家蛍光とエオジン蛍光の合算値で細胞形態情報が表現されるので、図6に示すようにモノクロであっても細胞形態情報の視認性が向上している。
尚、本実施例においては、HE染色を行いエオジン発光と組織の自家蛍光の両方を細胞形態情報としているが、HE染色を行わずに組織の自家蛍光のみを細胞形態情報とすることも可能である。
【0079】
また、本実施例においては、モノクロタイプのデジタルカメラを使用しているが、顕微鏡に装着使用可能なカラータイプのデジタルカメラが準備されている場合には、顕微鏡へ装着するフィルターや励起光波長等を必要に応じてモノクロカメラ撮影時から条件変更するか、或いは、顕微鏡設定はそのままに、デジタルカメラで生成されたデジタル画像データに対する画像処理条件を変更するか、或いは、両者(撮影系及び画像処理系)の変更を行うことにより、図2〜図6と同様のモノクロで結果を得ることができる。
【0080】
また、HE染色画像を従来から見慣れた色合いで観察すべく、HE染色発光のみを対象としたカラー撮影を追加することも可能であるが、この場合には、1枚のスライドに対し2回の撮影、或いは顕微鏡鏡筒観察を行うこととなる。この場合には、それぞれの撮影毎(顕微鏡鏡筒からの観察毎)に顕微鏡の励起光やフィルターをそれぞれふさわしい設定に調整する必要がある。カラーのHE染色による細胞形態情報とモノクロ画像(後述する同時染色画像)とを対応付けて保存することも可能である。
【0081】
顕微鏡鏡筒からの直接観察方式に比べ、ビュワー表示は診断の即時性は低下するが、観察者である人間が視認できない波長域の蛍光標識材料の蛍光波長に対し、画像処理で波長変換して人間が視認できるようにすることが可能である。そのため、励起光波長の選定や蛍光標識材料の選択の自由度(設計自由度)を高めることが可能である。
【0082】
また、顕微鏡鏡筒を覗きながら、個々の切片を載せたスライド毎に診断を行う方式では、スライドに対する顕微鏡のピント合わせ〜細胞形態情報(バックグラウンド)視認〜抗原分子情報(輝点ドット)の視認という一連の操作確認を行う間に長時間観察者が顕微鏡を覗いている必要があり、目の筋肉の疲労を誘発し易い。特に、施設に備わっている顕微鏡の視野範囲は一般的にスライド上の採取細胞領域に比べて小さく、スライド固定ステージのx-yステージを移動させながら長い時間にわたって観察を行うのでこの傾向が強くなる。
これに対し、ビュワー表示方式では、観察者はピント調整の間のみ顕微鏡を覗き込めばよく、診断時には覗きこむ必要がないので、疲労度合いが低減される。
なお、放射線撮影技師と読影医との関係のように、役割分担を行うと診断効率を高めることができる。例えば、ピント調整自体(及びピント調整後の撮影画像取得)を診断医ではなく他の作業者が行い、診断医は複数人分の画像データを一人で、或いは複数人のカンファレンス形式で、ビュワーを見ながらまとめて行うように役割分担すれば、施設全体としての診断効率を高めることができる。
【0083】
−本発明を適用した乳房診断システムの例−
以下、本発明を適用した乳房診断システム100について説明する。
図7に、乳房診断システム100の全体構成例を示す。図7に示すように、乳房診断システム100は、乳房撮影装置1、画像処理装置2、表示装置3、顕微鏡4、顕微鏡設置カメラ5、画像処理装置6、サーバー装置7、HIS(Hospital Information System)/RIS(Radiology Information System)8を備えて構成されている。乳房撮影装置1、画像処理装置2、表示装置3、画像処理装置6、サーバー装置7、HIS/RIS8は、LAN(Local Area Network)等の通信ネットワークNを介してデータ送受信可能に接続されている。また、画像処理装置6は、顕微鏡設置カメラ5からの画像データを取得可能に接続されている。
【0084】
乳房診断システム100においては、まず、HIS/RIS8により登録された撮影オーダ情報(撮影対象の患者や部位に関する情報)に基づいてX線装置や超音波診断装置等の乳房撮影装置1によって乳房撮影が行われる。撮影により得られた乳房画像の画像データは画像処理装置2で画像処理が施された後、表示装置3に表示され、読影医による診断(一次診断)が行われる。そして、この診断において病変の疑いがある場合に、バイオプシー(生体検査)が実施され、顕微鏡4の鏡筒から、または顕微鏡設置カメラ5により取得された組織切片の画像データに基づいて病理医による診断(二次診断)が行われる。
ここで、画像処理装置2、画像処理装置6、表示装置3、サーバー装置7、HIS/RIS8は、CPU,RAM等により構成される制御部、キーボード、マウス等により構成される操作部、プログラムやデータ等を記憶する記憶部、モニタ等により構成される表示部、通信ネットワークNに接続されている装置とデータ送受信を行うための通信部等を備えるコンピュータ装置である。
【0085】
乳房撮影装置1においては、MLO(斜位方向)−L(左)、MLO−R(右)、CC(上下方向)−L、CC−Rの合計4枚の乳房画像が撮影されるのが一般的である。
撮影に際しては、特開2005−305137号公報に記載のようにCR(Computed Radiography)カセッテをしようする方式、或いは、特開2004−321783号公報に記載のようにFPD(Flat Panel Detector)を使用する方式の2種の方法に大別されるが、複数枚の撮影(上記のように4枚の撮影)が行われるので、両方式に共通しているのは、左右乳房の画像の取り違えが生じないように、乳房撮影装置1と画像処理装置2とが連携し、個々の撮影画像(乳房画像)と撮影オーダ情報、特に左右の部位情報との対応付けを正しく行うことである。MLO画像は画像自体から左右の判別は可能であるが、CC画像に対しては画像単体を見ても左右の判別がつかないからである。
【0086】
撮影に際しては、乳房を圧迫板で挟みこんだ状態でX線照射を行うため、連続して同じ乳房の撮影を行うと被験者に苦痛を与える。そこで、左右交互(L・R・L・R又は R・L・R・L)に撮影を行うのが一般的である。撮影により得られた乳房画像の画像データには、左右の部位情報や患者ID等の付帯情報が付帯される。
【0087】
また、生成された4枚の乳房画像の画像データは、画像処理装置2に出力され、当該画像処理装置2において表示装置3への表示用の画像データが生成される。例えば、画像処理装置2において左右の乳房画像の比較読影が可能となるように、MLO画像、CC画像毎に左右の胸壁を合わせるように配置されて出力されるのが一般的である。
この際には、例えば、特開2002−158862号公報に記載のように、個々の乳房画像に対応付けられた部位情報や撮影方向(撮影条件)に基づき画像の回転処理方向を予め定め、MLO、CCのそれぞれの方向の胸壁合わせの画像が自動的に生成される。マニュアル処理ではCC画像で左右を取り違える可能性があるので、マニュアルの操作は禁止される。同様に、左右の区別を示す付帯情報の安易な修正も禁止される。誤った生体検査が行われてしまうことを防止するためである。
更に、特開平09−238933号公報に記載のように、左右の乳房画像における乳房領域の上下方向の位置合わせを行い、読影医の左右乳房の比較読影を行い易いように、視線移動を水平方向のみに限定することが望ましい。
【0088】
また、上記のようなX線撮影の他に、特開2009−195613号公報に記載のように、超音波診断装置を使用した乳房診断も行われている。特開2009−195613号公報には、超音波画像を用いて病変部の候補領域の弾性を測定することで病変部位か否かを診断するものである。
【0089】
また、診断精度を向上させるため、乳房撮影装置1として、例えば、特開2002−328440号公報に記載のような位相コントラスト撮影を実施可能な撮影装置を用い、拡大撮影された画像データを画像処理装置2で縮小して診断医の見慣れたライフサイズ(等倍)の画像とするとともに、腫瘤等の病変の辺縁部の視認性を向上させ、診断精度を向上させる手法を用いることも可能である。
更に、特開2009−077780号公報に記載のように、X線撮影による乳房画像と乳房の超音波画像の両画像に基づき、より精度の高い診断を行うことも知られている。
【0090】
また、診断精度を高めるために、CAD(Computer-Aided Diagnosis)検出結果をセカンドオピニオンとして用いるケースもある。画像処理装置2には、異常陰影候補を検出するためのCADが搭載されており、腫瘤陰影や微小石灰化クラスタ等の異常陰影候補と推定される候補領域をCADにより乳房画像中から抽出し、その検出結果情報を取得する。乳房画像や異常陰影候補の検出結果は、表示装置3に表示され、読影医の診断に供される。異常陰影の領域候補の表示方法には、例えば、特開平08−294479号公報に記載のように、主画像+抽出された異常陰影領域の拡大画像を表示するもの、特開2005−124617号公報に記載のように主画像エリアはそのままに、縮小画像中に異常陰影候補領域を示すアノテーションを入れる方法とがあるが、医師の診断方式に応じて何れの方法を採用しても構わない。
【0091】
画像処理装置2において画像処理された乳房画像は、付帯情報とともにサーバー装置7に送信される。画像処理装置2においてCADによる異常陰影候補の検出が行われた場合には、異常陰影候補の検出結果情報も併せてサーバー装置7に送信される。
サーバー装置7においては、上述の付帯情報、乳房画像、CADによる検出結果情報が対応付けて記憶される。
【0092】
上記により得られた乳房画像の診断結果に基づき、次ステップではバイオプシー(生体検査)が実施される。
バイオプシーにおいて生体組織を採取するに際しては、生検針位置を被写体の関心領域に対して正しき位置合わせすることが重要であり、乳房の場合には、X線を使用したスカウト撮影、ステレオ撮影、3次元撮影等や超音波撮影等を行い、生検針の位置合わせを行う。例えば、乳房撮影装置1において、特開2010−115405号公報や特開2011−104117号公報等の手法を用いることができる。
また、CADにおいて、左乳房に異常陰影候補の検出結果が無く、右乳房に異常陰影候補が検出された場合には、右乳房の組織取得を行う筈である。従って、例えば、特開2008−000508号公報に記載のように、乳房撮影装置1の被写体台に左右の何れの乳房が載置されたかをレーザセンサ等により検知し、CADの検出結果と比べ、異なる場合には警告を出力することで、左右の取り違えと患者の苦痛を未然に防止することができる。また、バイオプシーの生検針の位置決め撮影時には、ガイド及び/又は検針の陰影が画像中に明確に現れるので、これを検知して左右の乳房の取り違えがあった場合には、警告を出力することで、誤診を防止することができる。
【0093】
また、画像処理装置2においてCADを使用することが可能な場合には、CADにおける検出アルゴリズムを2段階閾値方式とし、明白なTP(True Positive)ゾーン、明白なFP(False Positive)ゾーン、中間のグレーゾーンの3つのゾーンに分類し、グレーゾーンがTPかFPかの判別にバイオプシーを使用することが好ましい。投薬治療の結果を見る場合には、TPゾーンの組織を用いてバイオプシーを行うことになる。
【0094】
採取された組織は、所定の厚さの切片に切除されてガラス製スライド(スライド)上に載置され、上述の実施例における蛍光標識材料(顕微鏡からの観察の場合には標識材料B又はC、ビュワー表示の場合には標識材料A〜Cの何れか)を用いた染色及びHE染色が行われる。そして、染色された切片が顕微鏡4での観察に供される。観察は、顕微鏡4の鏡筒から直接、又は、顕微鏡設置カメラ5により取得された顕微鏡4の視野範囲の画像を表示装置3においてビュワー表示することにより行うことができる。
【0095】
顕微鏡4は、照射手段、結像手段を有し、照射手段によりスライドを載置するスライド固定ステージに載置されたスライド上の上記の染色が行われた組織切片に所定波長の励起光を照射し、結像手段により励起光の照射によって組織切片から発光された蛍光を結像する結像手段を有するものである。なお、照射手段が照射する励起光の波長は、上述のように560〜630nmの範囲であることが好ましく、前記蛍光物質としては当該励起光により580〜690nmの範囲、より好ましくは600〜630nmの範囲にピークを有する蛍光を発するものを用いることが好ましい。
顕微鏡設置カメラ5は、顕微鏡4の結像手段により結像面に結像される像を撮像してデジタル画像データを生成する撮像手段である。なお、顕微鏡設置カメラによる顕微鏡からの画像データ取得は周知であり、例えば、特許文献1に開示される手法を用いることができる。
【0096】
本願発明者等の分析によれば、乳房の場合、左右同時に腫瘤や微小石灰化を発症することは稀であり、また、左右の何れかの乳房に対し、複数の異常陰影候補が存在していた場合であっても、通常は1回の生検針により1箇所の乳房組織の採取が行われるのみである。本発明によれば、この採取された組織切片を染色して作成されるスライドも一枚である。従って、一人の患者に対し、1個のスライドという1:1方式となり、患者とスライドの対応付けが極めて容易となる。例えば、スライドの端部にスライドの識別IDを示すバーコード等を貼付しておき、患者の組織切片をスライドに載せる際に、画像処理装置6において患者名を選択し、画像処理装置6に接続されたバーコードリーダーで使用するスライドのバーコードを読み取ることで、患者情報とスライドIDを容易に対応付けることができる。また、顕微鏡4による観察後に画像処理装置6のバーコードリーダーによりスライドIDを読み取って、診断結果(TP、FP)を入力すれば、患者情報、スライドIDに診断結果を対応付けることができる。患者情報とスライドIDとの対応付けは、サーバー装置7に送信され、記憶される。
【0097】
また、本発明によれば、1回の生体検査においてスライドは1枚のみしか使用しないので、従来の2枚のスライドを使用する方式のように、本来顕微鏡4にセットすべきスライドと異なるスライドを装填してしまうような(例えば、細胞形態確認用のHE染色スライドと、免疫化学染色法により染色されたスライドと間違う)ミス自体発生しないので、尾幅な省力化を達成できる。
【0098】
顕微鏡4の鏡筒から観察する場合、顕微鏡4の光源(励起光)の波長を、まずは従来から見慣れたHE画像(カラー画像)を表示するように設定しておき、当該HE画像中の関心領域に視線を集中し、しかる後、光源波長を切り替えて、輝点ドットを発光させれば、視線を集中していた関心領域における輝点ドットの点在具合を一目で、短時間に視認判別することができる。
顕微鏡4の一度に見ることのできる視野範囲が比較的狭い場合、病理切片上の診断対象領域を数回に分けて観察することとなるが、複数の視野のうち所定の視野に注目して、当該視野が顕微鏡4の観察範囲となるように顕微鏡4のスライド固定ステージを調整し、光源波長を切り替えても、上記と同様の効果が得られる。
【0099】
また、最初に顕微鏡4のスライド固定ステージを順次x方向又はy方向に移動操作して、顕微鏡設置カメラ5により各視野の撮影を繰り返し、画像処理装置6において、撮影により得られた各視野の画像データから輝点ドット(数、或いは、数×輝度の積算値)を算出し、予め定められた法則、例えば、輝点ドットが多いほうから、或いは、少ないほうから、或いは、所定数の範囲にあるものから等に基づき画像を順に画像処理装置6の表示部に表示することとしてもよい。また、予め定められた順に表示部に表示された画像を診ながら、顕微鏡4において対応する視野位置となるようにスライド固定ステージを調整して、顕微鏡4の鏡筒より各視野の観察を行うことも可能である。つまり輝点ドット(数、或いは、数×輝度の積算値)という特徴量に応じて、細胞形態情報の観察すべき順番を可変制御することも可能である。
なお、撮影された画像からの輝点ドットの計測は、画像処理装置6に搭載された画像解析ソフトウエア(例えば、株式会社ジーオングストローム社製の全輝点自動計測ソフトG−Count等)により行うことができる。各画像データの輝点ドットが計測されると、輝点ドットの計測結果及び各画像が対応付けて予め定められた順に画像処理装置6の表示部に表示される。その中から、観察者(技師や病理医)は、診断に使用する画像データを画像処理装置6の操作部により選択することができる。或いは、輝点ドットの計測結果が最大となる画像データを診断用画像として画像処理装置6において自動的に決定することとしてもよい。診断用画像の画像データは、画像処理装置6において先に入力された患者情報及びスライドIDと対応付けてサーバー装置7に送信され保存される。更に、ビュワー表示方式の場合は、画像処理装置6において、診断用画像の画像データに基づいて以下に示す表示を行うための表示用の画像データが生成され、スライドID及び患者情報とともに表示装置3に送信される。そして、表示装置3のモニタ上に当該表示用画像が表示されることで病理医の診断に供される。なお、以下に示すいずれの表示を行うかは、予め設定しておくことができる。
表示装置3はモノクロであってもよい。本発明で得られる画像データは、従来より乳房画像診断用に普及しているモノクロのモニタを使用して出力表示することができるので、新たにカラー用モニタ等の設備投資が不要となる。
【0100】
上述のビュワー表示方式においては、診断効率を高めるためにいくつかの表示方法が考えられる。1番目の表示方法は、細胞形態情報(組織の自家蛍光+HE染色によるエオジンの自家蛍光)と抗原分子情報(蛍光標識材料からの蛍光による輝点ドット)とを1枚の画像で表示出力する方法である。この場合、顕微鏡設置カメラ5における1回の撮影により得られた画像データを表示するのみであり、この画像データに細胞形態情報と抗原分子情報が含まれているので、細胞形態情報と抗原分子情報との位置合わせが不要であり、撮影から表示出力までの診断準備期間が最短となるメリットがある。また、位置合わせの精度に依存せずに診断を行うことができる。勿論、細胞形態情報と抗原分子情報の相対位置関係は本来固有の状態に維持されているので視認による弁別確認も可能である。
【0101】
2番目の表示方法は、細胞形態情報を表す画像と抗原分子情報を表す画像とを分離して表示出力する方式である。
本発明における抗原分子情報のための蛍光標識材料は組織の自家蛍光やエオジンの自家蛍光に比べて大きな蛍光を発するようになされている。従って、細胞形態の確認時に抗原分子情報を表す輝点ドットはノイズとなる可能性がある。また、励起光の波長と蛍光標識材料の選定やビュワー(表示装置3)側のダイナミックレンジ及び画像処理条件等によっては、抗原分子情報を表す輝点ドット(蛍光)が観察者を幻惑し、細胞形態情報の視認に影響を及ぼすことも懸念される。
このような事態を防止するため、細胞形態情報を抽出した画像(細胞形態画像)と抗原分子情報を抽出した画像(抗原分子画像)とを表示装置3の操作部による切替指示に応じて切り替えて表示することが好ましい。具体的には、表示装置3のモニタ画面の同じ領域(画像表示領域)内に、操作部からの切替指示に応じて細胞形態画像と抗原分子画像がパラパラめくりのように切替表示する。本発明においては、顕微鏡4に装填した1枚のスライドの1回の撮影による画像データを使用するので、細胞形態情報と抗体分子情報とが相互の位置関係(本来の固有の位置関係)を保っている。従って、細胞形態情報と抗原分子情報の何れかを示す画像において任意の領域に着目し、当該領域に着目した状態で他の情報の画像に切り替えると、視線移動をすることなく診断に必要な情報を直ちに得ることができる。
【0102】
抗原分子情報はドット状の蛍光として画像上に現れており、全体画像の画像データ中から当該輝点ドット部分を視認することは容易である。同様に、画像処理により輝点ドットを抽出することは容易である。抗原分子画像の生成は、細胞形態情報と抗原分子情報を含む全体画像から輝点ドットのみを抽出して、それ以外の領域には一定の輝度値、例えば、黒のような最低輝度値を割り付けることで生成することができる。輝点ドットは、全体画像から予め定められた閾値以上の輝度値の領域を抽出することで取得することができる。
このように、輝点ドットのみを抽出した画像を生成することにより、輝点ドットの視認性が大幅に向上し、瞬時に全貌を把握することが可能となる。
【0103】
一方、細胞形態画像の生成は、細胞形態情報と抗原分子情報を含む全体画像から輝点ドットのみを抽出して、輝点ドットの領域に、隣接する細胞形態情報を表している画素の出力値を使用してx方向(又はy方向)の隣接値に基づく一次元補間値を割り付ける、或いは、輝点ドットの領域に、隣接する細胞形態情報を表している画素の出力値を使用してxy方向の隣接値に基づく二次元補間値を割り付ける等により生成することが好ましい。これは、輝点ドット部分と周囲の細胞形態情報との連続性を維持でき、観察時に違和感を与えることがないので好ましい。尚、輝点ドットの領域に一定の輝度値、例えば、グレーとなるような中間値を割り付けてもよい。
【0104】
細胞形態画像、抗原分子画像の何れを先に表示するかは、病理医の診断スタイルに応じて適宜設定することが可能である。
また、細胞形態画像、抗原分子画像に加えて、本来の両情報の位置関係を有した全体画像を加えた3種の画像を操作部からの切替指示に応じて切り替え表示することとしてもよい。この場合においても、表示順は診断スタイルに応じて、適宜設定することが可能である。
【0105】
また、本発明においては、抗原分子情報は全体画像中での視認性は十分確保されているので(図6参照)、抗原分子画像は使用せず、細胞形態画像と全体画像とを切り替えて表示することも可能である。従来の染色による診断ワークフローは、細胞形態情報(従来においては色味情報)を観察するフローであるので、当該診断フローと同様に、細胞形態画像を先に表示し、続いて全体画像を表示することが望ましい。
【0106】
また、一のスライドに対し、HE染色画像撮影(カラーによる撮影)も併せて実施している場合には、表示装置3の操作部からの切替指示に応じて、同一視野で撮影されたHE染色画像と上記の全体画像(HE染色画像に対して、同時染色画像と呼ぶ)とを表示装置3のモニタ上に切替表示することとしてもよい。HE染色画像(カラー)と同時染色画像(モノクロ)の切替は、同一スライドの顕微鏡4における同一視野範囲を撮影することにより得られた画像であるため、上述の細胞形態情報と抗原分子情報との切替表示時と同様に、位置合わせの画像処理が不要である。また、病理医が視認に基づく位置合わせをする必要がないことは勿論である。なお、この場合には、表示装置3のモニタとしてはカラーモニタを用いる。
この場合の表示態様としては、HE染色画像を先に表示するパターン1と、同時染色画像を先に表示するパターン2が考えられる。パターン1では、病理医が従来から診断に使用しているHE染色画像から表示するので、従来の観察方法との親和性が高く、特に経験の豊富な病理医にとって観察がし易い。パターン2では、抗原分子情報を容易に観察できる同時染色画像から表示するので、病理医の経験等に関係なく注目すべき範囲が容易に特定でき、診断の効率化を図ることができる。
両パターンとも、表示装置3の表示画面の同じ領域(画像表示領域)内において、操作部からの切替指示に応じてHE染色画像と同時染色画像がパラパラめくりのように切替表示される。ここで、上述のように、切替表示されるHE染色画像と同時染色画像とは同一スライドの顕微鏡4における同一視野範囲を撮影することにより得られた画像である。従って、病理医は視線を動かさずに、両画像の相対的位置関係を容易に把握して観察を行うことができる。
【0107】
また、表示する画像をHE染色画像とし、同一視野を撮影した同時染色画像から輝点の抽出を行い、抽出された輝点をHE染色画像に重畳表示してもよい。このようにすれば、病理医が見慣れたHE染色画像を観察しながら、視線を動かさずに、必要最低限の抗原分子情報を得ることができる。また、輝点の表示/非表示は、操作部により切り替えられる構成とすることが好ましい。
【0108】
また、上述のパターン1のように、初期表示をHE染色画像とし、操作部からの切替指示により同時染色画像に切り替える表示態様において、HE染色画像から公知の細胞核(H染色部)検出を行い、同時染色画像を表示する際に検出された細胞核の位置を重畳表示してもよい。このように、同時染色画像において細胞核の情報がわかると、病理医が細胞の位置を特定する際の支援となるので好ましい。この細胞核の表示/非表示は、操作部により切り替えられる構成とすることが好ましい。
【0109】
また、上述のパターン2のように、初期表示を同時染色画像とし、操作部からの切替指示によりHE染色画像に切り替える表示態様において、同時染色画像から輝点ドットが集中している部分を抽出してROI(関心領域)を設定し、HE染色画像に切り替えた際に、HE画像上にROIを示す枠を重畳表示することとしてもよい。ROIが複数ある場合は、同時に表示しても、操作部の所定のキーの押下に応じて輝点ドットの多い順に表示することとしてもよい。また、ROIの設定は、自動で緒行うこととしてもよいし、その表示された同時染色画像上から操作部を用いて病理医が指定することとしてもよい。このように、HE染色画像上で輝点ドットの集中しているROIを表示することで、病理医は、抗原分子情報の多い注目すべき領域を容易に認識することができ、注目すべき領域のみを観察することができる。また、抗原分子情報が集中している領域の細胞形態情報をしっかり確認することが可能となる。
【0110】
ビュワー表示方式の何れかの方法による観察後、観察された細胞組織における乳癌発症の有無(確定診断結果)が表示装置3において入力されると、入力された確定診断結果がスライドID及び患者情報に対応付けてサーバー装置7に送信され、サーバー装置7において確定診断結果がスライドID及び患者情報に対応付けて記憶される。また、患者情報を介して、患者情報に対応付けられている乳房画像(+CAD結果)に対し、確定診断結果が対応付けられる。なお、表示のために作成した個々の画像(細胞形態情報を抽出した画像、抗原分子情報を抽出した画像等)は全体画像に基づいて短時間で作成可能であるので、必要に応じて作成すればよい。従って、スライドから生成された画像については少なくとも全体画像を保存することとし、細胞形態情報や抗原分子情報の画像は保存しない。これにより、サーバー装置7のデータ容量の大幅な増加を抑えることができる。なお、診断の証拠として、スライドも施設内に保存する。
なお、表示用の画像データの生成(細胞形態情報の抽出、抗原分子情報の抽出、細胞核(H染色部)の検出を含む)は、画像処理装置6において行うこととして説明したが、表示装置3において行うこととしてもよい。また、画像処理装置2、表示装置3、画像処理装置6は一体としてもよい。
【0111】
上記実施の形態における記述内容は、本発明の好適な一例であり、これに限定されるものではなく、発明の趣旨を逸脱しない範囲で適宜変更可能である。
【符号の説明】
【0112】
100 乳房診断システム
1 乳房撮影装置
2 画像処理装置
3 表示装置
4 顕微鏡
5 顕微鏡設置カメラ
6 画像処理装置
7 サーバー装置
8 HIS/RIS
【特許請求の範囲】
【請求項1】
組織切片に、特定抗原を認識する抗体と、当該抗体に結合した、複数の蛍光物質を内包するナノ粒子とを構成要素に含む蛍光標識材料による染色、及びHE(ヘマトキシリン−エオジン)染色を施す工程と、
前記染色を施された組織切片に所定波長の励起光を照射して前記組織切片に蛍光を発光させ、当該蛍光に基づき、前記組織切片における組織又は細胞の形態情報、及び前記特定抗原の分子の情報を同時に生成する工程と、
を含む病理診断情報生成方法。
【請求項2】
前記所定波長の励起光は、560〜630nmの範囲であり、前記蛍光物質は、前記励起光により580〜690nmの範囲にピークを有する蛍光を発するものである請求項1に記載の病理診断情報生成方法。
【請求項3】
前記組織又は細胞の形態情報、及び前記特定抗原の分子の情報が同一視野で得られる請求項1又は2に記載の病理診断情報生成方法。
【請求項4】
前記組織又は細胞の形態情報、及び前記特定抗原の分子の情報は、前記蛍光の像を顕微鏡により結像することにより生成される請求項1〜3の何れか一項に記載の病理診断情報生成方法。
【請求項5】
前記特定抗原の分子の情報は、ドット状の蛍光で表される請求項1〜4の何れか一項に記載の病理診断情報生成方法。
【請求項6】
特定抗原を認識する抗体と、当該抗体に結合した、複数の蛍光物質を内包するナノ粒子とを構成要素に含む蛍光標識材料による染色と、HE(ヘマトキシリン−エオジン)染色と、が施された組織切片が載置された一のスライドに、所定波長の励起光を照射する照射手段と、
前記照射手段による励起光の照射により前記組織切片から発光された蛍光の像を結像することにより前記組織切片における組織又は細胞の形態情報及び前記特定抗原の分子の情報を同時に生成する結像手段と、
を備える病理診断情報生成システム。
【請求項7】
前記照射手段は、560〜630nmの範囲の波長の励起光を照射するものであり、
前記蛍光物質は、前記励起光により580〜690nmの範囲にピークを有する蛍光を発するものである請求項6に記載の病理診断情報生成システム。
【請求項8】
前記結像手段により結像された像を撮像してデジタル画像データを生成する撮像手段と、
前記撮像手段により生成された画像データに基づき表示用の画像を生成する画像処理手段と、
前記画像処理手段により生成された画像を表示する表示手段と、
を備える請求項6又は7に記載の病理診断情報生成システム。
【請求項9】
前記表示手段に表示する画像の切替を指示するための操作手段を有し、
前記画像処理手段は、前記撮像手段により生成された画像データから前記組織切片の特定抗原の分子の情報のみを抽出して抗原分子画像を生成する手段と、前記撮像手段により生成された画像データから前記組織切片の組織又は細胞の形態情報のみを抽出して細胞形態画像を生成する手段を有し、
前記表示手段は、前記操作手段からの切替指示に応じて前記抗原分子画像と前記細胞形態画像を切替表示する請求項8に記載の病理診断情報生成システム。
【請求項1】
組織切片に、特定抗原を認識する抗体と、当該抗体に結合した、複数の蛍光物質を内包するナノ粒子とを構成要素に含む蛍光標識材料による染色、及びHE(ヘマトキシリン−エオジン)染色を施す工程と、
前記染色を施された組織切片に所定波長の励起光を照射して前記組織切片に蛍光を発光させ、当該蛍光に基づき、前記組織切片における組織又は細胞の形態情報、及び前記特定抗原の分子の情報を同時に生成する工程と、
を含む病理診断情報生成方法。
【請求項2】
前記所定波長の励起光は、560〜630nmの範囲であり、前記蛍光物質は、前記励起光により580〜690nmの範囲にピークを有する蛍光を発するものである請求項1に記載の病理診断情報生成方法。
【請求項3】
前記組織又は細胞の形態情報、及び前記特定抗原の分子の情報が同一視野で得られる請求項1又は2に記載の病理診断情報生成方法。
【請求項4】
前記組織又は細胞の形態情報、及び前記特定抗原の分子の情報は、前記蛍光の像を顕微鏡により結像することにより生成される請求項1〜3の何れか一項に記載の病理診断情報生成方法。
【請求項5】
前記特定抗原の分子の情報は、ドット状の蛍光で表される請求項1〜4の何れか一項に記載の病理診断情報生成方法。
【請求項6】
特定抗原を認識する抗体と、当該抗体に結合した、複数の蛍光物質を内包するナノ粒子とを構成要素に含む蛍光標識材料による染色と、HE(ヘマトキシリン−エオジン)染色と、が施された組織切片が載置された一のスライドに、所定波長の励起光を照射する照射手段と、
前記照射手段による励起光の照射により前記組織切片から発光された蛍光の像を結像することにより前記組織切片における組織又は細胞の形態情報及び前記特定抗原の分子の情報を同時に生成する結像手段と、
を備える病理診断情報生成システム。
【請求項7】
前記照射手段は、560〜630nmの範囲の波長の励起光を照射するものであり、
前記蛍光物質は、前記励起光により580〜690nmの範囲にピークを有する蛍光を発するものである請求項6に記載の病理診断情報生成システム。
【請求項8】
前記結像手段により結像された像を撮像してデジタル画像データを生成する撮像手段と、
前記撮像手段により生成された画像データに基づき表示用の画像を生成する画像処理手段と、
前記画像処理手段により生成された画像を表示する表示手段と、
を備える請求項6又は7に記載の病理診断情報生成システム。
【請求項9】
前記表示手段に表示する画像の切替を指示するための操作手段を有し、
前記画像処理手段は、前記撮像手段により生成された画像データから前記組織切片の特定抗原の分子の情報のみを抽出して抗原分子画像を生成する手段と、前記撮像手段により生成された画像データから前記組織切片の組織又は細胞の形態情報のみを抽出して細胞形態画像を生成する手段を有し、
前記表示手段は、前記操作手段からの切替指示に応じて前記抗原分子画像と前記細胞形態画像を切替表示する請求項8に記載の病理診断情報生成システム。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2012−208106(P2012−208106A)
【公開日】平成24年10月25日(2012.10.25)
【国際特許分類】
【出願番号】特願2011−229314(P2011−229314)
【出願日】平成23年10月19日(2011.10.19)
【国等の委託研究の成果に係る記載事項】(出願人による申告)国等の委託研究の成果に係る特許出願(平成22年度独立行政法人新エネルギー・産業技術総合開発機構「がん超早期診断・治療機器の総合研究開発/超早期高精度診断システムの研究開発:病理画像等認識技術の研究開発/病理画像等認識自動化システムの研究開発(1粒子蛍光ナノイメージングによる超高精度がん組織診断システム)」委託研究、産業技術力強化法第19条の適用を受ける特許出願)
【出願人】(303000420)コニカミノルタエムジー株式会社 (2,950)
【出願人】(504157024)国立大学法人東北大学 (2,297)
【Fターム(参考)】
【公開日】平成24年10月25日(2012.10.25)
【国際特許分類】
【出願日】平成23年10月19日(2011.10.19)
【国等の委託研究の成果に係る記載事項】(出願人による申告)国等の委託研究の成果に係る特許出願(平成22年度独立行政法人新エネルギー・産業技術総合開発機構「がん超早期診断・治療機器の総合研究開発/超早期高精度診断システムの研究開発:病理画像等認識技術の研究開発/病理画像等認識自動化システムの研究開発(1粒子蛍光ナノイメージングによる超高精度がん組織診断システム)」委託研究、産業技術力強化法第19条の適用を受ける特許出願)
【出願人】(303000420)コニカミノルタエムジー株式会社 (2,950)
【出願人】(504157024)国立大学法人東北大学 (2,297)
【Fターム(参考)】
[ Back to top ]

