痛みおよび/または炎症の処置のための可逆的相転移物質を有する埋め込み式薬物デポー
薬物デポーの可逆性相転移物質を利用する、痛みおよび/または炎症の有効な処置を提供する。熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギーがその可逆性相転移物質に適用された際、薬物デポーからの鎮痛剤および/または抗炎症剤の放出が増大する。
【発明の詳細な説明】
【背景技術】
【0001】
痛みの緩和は手術を受けた患者を処置する人ならば誰にとっても最も重要である。適切な痛みの緩和は患者に重要な生理的および精神的利益を与える。有効な痛みの緩和は医学的/外科的/外来患者用施設からのより早期の解放によるより順調でより快適な術後経過(例えば、気分、睡眠、生活の質等)を意味するだけでなく、それは慢性疼痛症候群(例えば線維筋痛症、筋肉痛等)の発症を低減する可能性もある。
【0002】
痛みは生物学的機能の役目を果たしている。それはしばしば体内の損傷または疾患の存在を知らせており、しばしば炎症(発赤、腫張、および/または焼灼(burning))を伴う。術後痛の場合、それは手術または例えば火傷もしくは非外科的外傷の後の急性の痛みの管理のような他の処置の結果である可能性がある。術後痛の管理の目標は、副作用を最小限しか、または全く引き起こさない薬物療法により痛みおよび不快感を低減または除去することである。
【0003】
手術の部位は患者が受ける可能性のある術後痛の程度に深い影響を有する。一般に、胸部および上腹部における手術は下腹部における手術よりも強い痛みを伴い、それは今度は四肢における末梢の手術よりも強い痛みを伴う。しかし、体腔、大きい関節の表面、脊椎または深部組織を含む全ての手術は痛みを伴うものと考えられるべきである。特に、胸部または上腹部における手術は肺機能における広範囲に及ぶ変化、腹筋緊張の増大、および関係する横隔膜機能の低下をもたらす可能性がある。その結果は、咳ができないことおよび分泌物を取り除けないことであると考えられ、それは肺虚脱および肺炎につながる可能性がある。長引く痛みは身体活動を低減させ、静脈うっ血ならびに深在静脈血栓症および結果的に肺塞栓の危険性の増大につながり得る。加えて、消化管および尿管の運動性に広範囲に及ぶ影響がある可能性があり、それは今度は術後イレウス、吐き気、嘔吐および尿貯留につながる可能性がある。これらの問題は患者にとって不愉快であり、入院を長引かせる可能性がある。中程度〜重篤な術後痛、外傷後痛および火傷の痛みを経験するほとんどの患者は、しばしば外傷または手術後の少なくとも最初の三日間は疼痛管理を必要とする。
【0004】
残念ながら、現在利用可能な痛みおよび/または抗炎症配合物は、術後痛を処置するのに有効ではあるが、必要に応じた4〜12時間ごとの頻繁な1回量投与を必要とする。しばしば1回量の投与に伴って、患者は突発痛および持続的な痛みの緩和を提供するための次の投与のための不安な“時計が気になる(clock−watching)”待ち時間を経験するであろう。これらの1回量配合物は不便であり、患者の術後の入院患者および/または通院患者の日中の活動ならびに夜間の睡眠および回復を妨げる可能性がある。
【発明の概要】
【発明が解決しようとする課題】
【0005】
痛みおよび/または炎症、特に術後の痛みおよび/または炎症を予防、処置または低減するために、新規の鎮痛および/または抗炎症組成物および方法が必要とされている。確実に突発痛のエピソードを低減、予防または処置し、さらに少なくとも1日の期間にわたって長時間作用性の鎮痛および抗炎症作用を提供する新規の鎮痛および/または抗炎症組成物および方法が必要とされている。
【課題を解決するための手段】
【0006】
望まれない突発痛および/または炎症を有効に低減、予防、または処置するための新規組成物および方法を提供する。その痛みおよび/または炎症を延長された期間の間低減することができる。
【0007】
様々な態様において、患者への最小限の身体的および精神的外傷を伴う鎮痛剤および/または抗炎症剤を含有する薬物デポー(drug depot)の正確かつ精密な埋め込みを容易に可能にすることができる新規の薬物デポー組成物および方法を提供する。その薬物デポー組成物の1つの利点は、可逆的相転移物質を用いることにより、その患者または開業医が、その鎮痛剤および/または抗炎症剤の増大された用量が標的組織部位(例えば脊椎、膝、肩、股関節部、腹部、滑膜性関節、脊柱またはその付近、外科的創傷または切開部、脊髄内等)で放出されるように、その薬物デポーの位置で、またはその付近で熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギーを提供することができることである。このようにして、例えば、突発痛を有効に低減、予防および/または処置することができる。
【0008】
1態様において、そのような処置を必要とする患者において痛みおよび/または炎症を低減、予防または処置するのに有用な埋め込み式薬物デポーを提供し、その埋め込み式薬物デポーは皮膚の下の部位に埋め込み可能であり、その薬物デポーの可逆的相転移物質内に配置された有効量の鎮痛剤および/または抗炎症剤を含み、ここでその可逆的相転移物質は熱、冷気または他の形のエネルギー、例えば超音波エネルギーが患者の皮膚に適用された際に大量瞬時投与量の鎮痛剤、筋弛緩剤および/または抗炎症剤を放出して痛みおよび/または炎症を低減、予防または処置することができる。
【0009】
別の態様において、そのような処置を必要とする患者において痛みおよび/または炎症を低減、予防または処置するのに有用な薬物デポーを提供し、その薬物デポーは患者の皮膚の下の部位に埋め込み可能であり、その薬物デポーの可逆的相転移ポリマーおよび生分解性ポリマー内に内に配置された有効量の鎮痛剤および/または抗炎症剤を含み、ここでその可逆的相転移物質は熱、冷気または他の形のエネルギーがその薬物デポーの位置に、またはその付近に適用された際にその薬物デポーに大量瞬時投与量の鎮痛剤、筋弛緩剤および/または抗炎症剤を放出させることができ、その生分解性ポリマーは少なくとも1日にわたってその鎮痛剤、筋弛緩剤および/または抗炎症剤を放出して痛みおよび/または炎症を低減、予防または処置することができる。
【0010】
さらに別の態様において、そのような処置を必要とする患者において痛みおよび/または炎症を処置または予防するための方法を提供し、その方法は、患者の皮膚の下の標的組織部位において薬物デポーの可逆的相転移物質内に配置された有効量の鎮痛剤および/または抗炎症剤を含む生分解性薬物デポーを埋め込むこと、ここでその可逆的相転移物質は熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギー、光、機械的エネルギー(例えば撹拌)、電気的、化学的、もしくは磁気エネルギーがその薬物デポーに、またはその付近に適用された際に大量瞬時投与量の鎮痛剤、筋弛緩剤および/または抗炎症剤を放出することができる;ならびに熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギーをその薬物デポーが埋め込まれている標的組織部位に、またはその付近に適用して大量瞬時投与量の鎮痛剤、筋弛緩剤および/または抗炎症剤を放出させて痛みおよび/または炎症を予防または処置することを含む。
【0011】
提供する組成物および方法は、手術、慢性炎症性疾患、慢性骨盤痛症候群(例えば間質性膀胱炎、慢性非細菌性前立腺炎、外陰部痛、子宮内膜症、過敏性腸疾患および結果として骨盤領域における慢性の痛みをもたらす他の病気)、滑液包炎、骨関節炎、骨溶解、腱炎、坐骨神経痛、椎間板ヘルニア、狭窄、ミオパシー、脊椎すべり症(spondilothesis)、腰痛、椎間関節痛、手根管症候群、足根管症候群、失敗した背部痛(failed back pain)等の結果として起こる炎症および/または痛みを含むがそれらに限定されない炎症および/または痛みを低減、予防または処置するために用いることができる。
【0012】
その医薬組成物は例えば薬物デポーの一部であってよい。その薬物デポーは:(i)鎮痛剤および/または抗炎症剤および可逆的相転移物質および/または生分解性ポリマー(単数または複数)からなる;または(ii)鎮痛剤および/または抗炎症剤および可逆的相転移物質および/または生分解性ポリマー(単数または複数)から本質的になる;または(iii)鎮痛剤および/または抗炎症剤および可逆的相転移物質および/または生分解性ポリマー(単数または複数)ならびに1種類以上の他の有効成分、界面活性剤、賦形剤もしくは他の成分もしくはそれらの組み合わせを含むことができる。他の有効成分、界面活性剤、賦形剤または他の成分またはそれらの組み合わせが配合物中に存在する場合、一部の態様において、これらの他の化合物またはそれらの組み合わせは、20重量%未満、19重量%未満、18重量%未満、17重量%未満、16重量%未満、15重量%未満、14重量%未満、13重量%未満、12重量%未満、11重量%未満、10重量%未満、9重量%未満、8重量%未満、7重量%未満、6重量%未満、5重量%未満、4重量%未満、3重量%未満、2重量%未満、1重量%未満または0.5重量%未満を構成する。
【0013】
様々な態様の追加の特徴および利点は、一部は以下の記述で述べられ、一部は記述から明らかであるか、または様々な態様の実施により学ぶことができる。様々な態様の目的および他の利点は、特にその記述および添付された特許請求の範囲において指摘されている要素および組み合わせにより実現および達成されるであろう。
【0014】
部分的に、以下の記述、添付された特許請求の範囲および添付の図面に関して、その態様の他の観点、特徴、利益および利点が明らかになるであろう;ここで:
【図面の簡単な説明】
【0015】
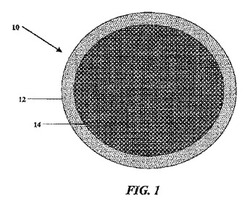
【図1】図1は、薬物デポー内部に鎮痛剤および/または抗炎症剤を保持する可逆的相転移物質の層を有する埋め込み式薬物デポーの態様の拡大した側断面図である。
【図2】図2は、熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギーをそれに適用した際に、粘性が低減した、または透過性が増大した状態に変化して、薬物デポーからの鎮痛剤および/または抗炎症剤の放出を引き起こす、可逆的相転移物質の層を有する埋め込み式薬物デポーの態様の拡大した側断面図である。
【図3】図3は、薬物デポーが埋め込まれている領域付近の皮膚に適用される冷または温パックを図説する1態様の透視図である。冷気または熱の適用は可逆的相転移物質の可逆的な相の変化を引き起こし(例えば、固体が液体に、固体が半固体に、半固体が液体に、水に不溶性のものが水溶性のものに、ガラス質がゴム状に、結晶質または半晶質が液体に、等)、大量瞬時投与量の鎮痛剤および/または抗炎症剤を放出させる。
【図4】図4は、患者内の痛みおよび/または炎症が起こり得る部位であり鎮痛剤、筋弛緩剤および/または抗炎症剤を含有する薬物デポーをそこに局所的に投与することができる部位である可能性のあるいくつかの一般的な位置を図説する。
【0016】
図面は一定の縮尺で描かれているわけではないことは理解されるべきである。さらに、図面中の物体間の関係も一定の縮尺ではない可能性があり、実際、大きさに関して逆の関係を有する可能性がある。図面は示されたそれぞれの対象の構造への理解および明確性をもたらすことを意図しており、従って、一部の特徴は構造の特定の特徴を図説するために誇張されている可能性がある。
【発明を実施するための形態】
【0017】
この明細書および添付された特許請求の範囲の目的のため、別途示さない限り、本明細書および特許請求の範囲で使用されている成分の量、材料の百分率または割合、反応条件、および他の数値を表す全ての数は、全ての場合において、用語“約”により修飾されていると理解されるべきである。従って、それとは反対の指示がない限り、以下の明細書および添付された特許請求の範囲において示されている数のパラメーターは近似値であり、それは本発明により得ようとしている望まれる特性に応じて変動してよい。少なくとも、特許請求の範囲に対する均等論の適用を制限しようと試みるのではなく、それぞれの数のパラメーターは少なくとも報告された有効桁の数を考慮して通常の丸め技法を適用することにより解釈されるべきである。
【0018】
本発明の広い範囲である本明細書で示される数の範囲およびパラメーターは近似値であるにもかかわらず、具体例な実施例において示される数値は可能な限り正確に報告されている。しかし、あらゆる数値は、それらのそれぞれの試験測定に見出される標準偏差の結果として必然的にもたらされる一定の誤差を本質的に含有する。さらに、本明細書で開示されるあらゆる範囲はその中に包含されるあらゆる、および全ての部分範囲を含むことは理解されるべきである。例えば、“1〜10”の範囲には、最小値1および最大値10の間(1および10を含む)のあらゆる、および全ての部分範囲、すなわち、1以上の最小値および10以下の最大値を有するあらゆる、および全ての部分範囲、例えば5.5〜10が含まれる。
【0019】
ここで、発明の特定の態様について詳細な参照がなされ、その例は添付の図面において図説される。本発明は図説された態様と関連して記述されるが、それらは本発明をそれらの態様に限定することを意図するものではないことは理解されるであろう。むしろ、本発明は、添付された特許請求の範囲により定められる通りの本発明の範囲内に含まれ得る全ての代替物、修正、および均等物を含むことを意図する。
【0020】
以下の見出しは本開示を制限することを意味するのでは決してなく;あらゆる1つの見出しの下の態様をあらゆる他の見出しの下の態様と共に用いてよい。
この明細書および添付された特許請求の範囲において用いられる際、単数形“a”、“an”および“the”は、明白かつ明確に1つの指示対象に限定されていない限り、複数の指示対象を含むことを特筆する。従って、例えば、“薬物デポー(a drug depot)”への言及には1、2、3またはより多くの薬物デポーが含まれる。
【0021】
略語“DLG”は、ポリ(DL−ラクチド−co−グリコリド)を指す。
略語“DL”は、ポリ(DL−ラクチド)を指す。
略語“LG”は、ポリ(L−ラクチド−co−グリコリド)を指す。
【0022】
略語“CL”は、ポリカプロラクトンを指す。
略語“DLCL”は、ポリ(DL−ラクチド−co−カプロラクトン)を指す。
略語“LCL”は、ポリ(L−ラクチド−co−カプロラクトン)を指す。
【0023】
略語“G”は、ポリグリコリドを指す。
略語“PEG”は、ポリ(エチレングリコール)を指す。
略語“PLGA”は、ポリ(乳酸−co−グリコール酸)としても知られるポリ(ラクチド−co−グリコリド)を指し、それらは互換的に用いられる。
【0024】
略語“PLA”は、ポリラクチドを指す。
略語“POE”は、ポリ(オルトエステル)を指す。
1態様において、そのような処置を必要とする患者において痛みおよび/または炎症を低減、予防または処置するのに有用な埋め込み式薬物デポーを提供し、その埋め込み式薬物デポーは皮膚の下の部位に埋め込み可能であり、その薬物デポーの可逆的相転移物質内に配置された有効量の鎮痛剤および/または抗炎症剤を含み、ここでその可逆的相転移物質は熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギー、光、機械的エネルギー(例えば撹拌、マッサージ等)、電気的、化学的、もしくは磁気エネルギーが患者の皮膚に適用された際に大量瞬時投与量の鎮痛剤、筋弛緩剤および/または抗炎症剤を放出して痛みおよび/または炎症を低減、予防または処置することができる。
【0025】
1態様において、その鎮痛剤、筋弛緩剤および/または抗炎症剤はラセミ混合物として用いることができる。さらに別の態様において、その鎮痛剤、筋弛緩剤および/または抗炎症剤は単一の立体異性体として用いられる。別の態様において、その鎮痛剤、筋弛緩剤および/または抗炎症剤は等しい(1:1)、または等しくない量の立体異性体を含有する立体異性体の混合物として用いられる。例えば、一部の態様において、その鎮痛剤、筋弛緩剤および/または抗炎症剤は(+)Rおよび(−)の鏡像異性体の混合物を含んでいてよい。様々な態様において、その鎮痛剤、筋弛緩剤および/または抗炎症剤はその鎮痛剤、筋弛緩剤および/または抗炎症剤の1:1ラセミ混合物を含んでいてよい。
【0026】
鎮痛剤、筋弛緩剤および/または抗炎症剤の送達に関して選択される標的組織部位は、とりわけ、処置される病気、患者において達成されるべき薬物の望まれる療法的濃度、および維持されなければならない薬物濃度の持続期間に依存する。
【0027】
一部の態様において、標的組織部位における、またはその付近での薬物デポーの局所投与は、通常の経口、静脈内、または筋肉内投与量よりも低い用量の鎮痛剤、筋弛緩剤および/または抗炎症剤を用いることを可能にする。例えば、その薬物デポーの局所投与は、通常の経口、静脈内、または筋肉内投与量の50%、45%、40%、35%、30%、25%、20%、15%、10%、5%、1%、0.5%、0.1%、0.01%である日用量を用いて成し遂げることができる。今度は、例えば肝トランスアミナーゼの上昇、肝炎、肝不全、ミオパシー、便秘等のような全身性の副作用を低減または排除することができる。
【0028】
その薬物デポー中に含まれる、および本明細書で記述する方法論において用いられる鎮痛剤および/または抗炎症剤の濃度は、痛みおよび/または炎症を予防、処置または低減する療法的作用をもたらすのに有効な濃度である。ヒトの患者において局所投与の際に鎮痛作用をもたらすための鎮痛剤および/または抗炎症剤、例えばクロニジンの投与量は、一部の態様において、典型的には1日あたり約150マイクログラムから800マイクログラムまでの間、または局所注入により3から12マイクログラム/時間までの範囲であることができる。
【0029】
しかし、当業者はこの開示を読んだ際に理解するであろうように、その有効濃度は選択される鎮痛剤および/または抗炎症剤、投与経路、投与頻度、投与される配合物、および処置される病気に応じて異なるであろう。
【0030】
1態様において、例えば手術、慢性炎症性疾患、慢性骨盤痛症候群(例えば間質性膀胱炎、慢性非細菌性前立腺炎、外陰部痛、子宮内膜症、過敏性腸疾患および結果として骨盤領域における慢性の痛みをもたらす他の病気)、滑液包炎、骨関節炎、骨溶解、腱炎、坐骨神経痛、椎間板ヘルニア、狭窄、ミオパシー、脊椎すべり症(spondilothesis)、腰痛、椎間関節痛、手根管症候群、足根管症候群、失敗した背部痛等の結果として起こる痛みおよび/または炎症を低減、予防または処置するために、その鎮痛剤、筋弛緩剤および/または抗炎症剤は約0.0001mg/kg/日〜約40mg/kg/日の量で投与される。別の態様において、その鎮痛剤、筋弛緩剤および/または抗炎症剤は約0.001mg/kg/日〜約4mg/kg/日の量で投与される。1態様において、その鎮痛剤、筋弛緩剤および/または抗炎症剤は約0.01mg/kg/日〜約0.4mg/kg/日の量で投与される。
【0031】
鎮痛剤および/または抗炎症剤
鎮痛剤は、痛みを低減、緩和または除去することができる薬剤または化合物を指す。鎮痛剤の例には、アセトアミノフェン、局所的麻酔薬、例えばリドカイン、ブピバカイン、ベンゾカイン、ロピバカイン、クロニジン、アミトリプチリン、カルバマゼピン、ガバペンチン(gabapentin)、プレガバリン(pregabalin)、オピオイド鎮痛薬、またはそれらの組み合わせが含まれるが、それらに限定されない。個々の麻酔薬には、例として、および限定ではなく、アリフルラン(aliflurane);バクロフェン(baclofen)、ベノキシネート(benoxinate)塩酸塩;ベンゾカイン;ビフェナミン塩酸塩;ブピバカイン塩酸塩;ブタンベン(butamben);ピクリン酸ブタンベン;クロニジン、クロニジン塩酸塩、クロロプロカイン塩酸塩;コカイン;コカイン塩酸塩;シクロプロパン;デスフルラン(desflurane);デキシバカイン(dexivacaine);シクラミン酸ジアモカイン;ジブカイン(dibucaine);ジブカイン塩酸塩;ディクロニン(dyclonine)塩酸塩;エンフルラン(enflurane);エーテル;塩化エチル;エチドカイン(etidocaine);エトキサドロール(etoxadrol)塩酸塩;ユープロシン(euprocin)塩酸塩;フルロキセン(fluroxene);ハロセン(halothane);イソブタンベン(isobutamben);イソフルラン(isoflurane);ケタミン(ketamine)塩酸塩;レボキサドロール(levoxadrol)塩酸塩;リドカイン;リドカイン塩酸塩;メピバカイン(mepivacaine)塩酸塩;メトヘキシタールナトリウム;メトキシフルラン;ミダゾラム(midazolam)塩酸塩;マレイン酸ミダゾラム;ミナキソロン(minaxolone);亜酸化窒素;ノルフルラン(norflurane);オクトドリン(octodrine);オキセサゼイン(oxethazaine);フェンシクリジン(phencyclidine)塩酸塩;プラモキシン(pramoxine)塩酸塩;プリロカイン(prilocaine)塩酸塩;プロカイン(procaine)塩酸塩;プロパニジド(propanidid);プロパラカイン(proparacaine)塩酸塩;プロポフォール(propofol);プロポキシカイン(propoxycaine)塩酸塩;ピロカイン(pyrrocaine);リソカイン(risocaine);ロドカイン(rodocaine);ロフルラン(roflurane);サリチルアルコール;セボフルラン(sevoflurane);テフルラン(teflurane);テトラカイン(tetracaine);テトラカイン塩酸塩;チアミラール(thiamylal);チアミラールナトリウム;チオペンタール(thiopental)ナトリウム;チレタミン(tiletamine)塩酸塩;ゾラミン(zolamine)塩酸塩;またはそれらの組み合わせが含まれる。
【0032】
オピオイド鎮痛薬には、アルフェンタニル(alfentanil)、アリルプロジン(allylprodine)、アルファプロジン(alphaprodine)、アニレリジン(anileridine)、ベンジルモルフィン(benzylmorphine)、ベジトラミド(bezitramide)、ブプレノルフィン(buprenorphine)、ブトルファノール(butorphanol)、クロニタゼン(clonitazene)、コデイン、デソモルフィン(desomorphine)、デキストロモラミド(dextromoramide)、デキストロプロポキシフェン(dextropropoxyphene)、デゾシン(dezocine)、ジアンプロミド(diampromide)、ジアモルホン(diamorphone)、ジヒドロコデイン、ジヒドロモルフィン、ジメノキサドール(dimenoxadol)、ジメフェプタノール(dimepheptanol)、ジメチルチアンブテン、酪酸ジオキサフェチル(dioxaphetyl butyrate)、ジピパノン(dipipanone)、エプタゾシン(eptazocine)、エトヘプタジン(ethoheptazine)、エチルメチルチアンブテン、エチルモルフィン、エトニタゼン(etonitazene)、フェンタニル(fentanyl)、フルピルチン(flupirtine)、ヘロイン、ヒドロコドン、ヒドロモルホン、ヒドロキシペチジン(hydroxypethidine)、イソメタドン(isomethadone)、ケトベミドン(ketobemidone)、レボルファノール、レボフェナシルモルファン(levophenacylmorphan)、ロフェンタニル(lofentanil)、メペリジン(meperidine)、メプタジノール(meptazinol)、メタゾシン(metazocine)、メタドン(methadone)、メトポン、モルヒネ、ミロフィン(myrophine)、ナルセイン(narceine)、ニコモルフィン(nicomorphine)、ノルレボルファノール(norlevorphanol)、ノルメタドン(normethadone)、ナロルフィン(nalorphine)、ナルブフェン(nalbuphene)、ノルモルフィン、ノルピパノン(norpipanone)、アヘン、オキシコドン、オキシモルホン、パパベレタム(papaveretum)、ペチジン(pethidine)、ペンタゾシン、フェナドキソン(phenadoxone)、フェノモルファン(phenomorphan)、フェナゾシン(phenazocine)、フェノピリジン(phenoperidine)、ピミノジン(piminodine)、ピリトラミド(piritramide)、プロフェプタジン(propheptazine)、プロメドール(promedol)、プロペリジン(properidine)、プロポキシフェン(propoxyphene)、レミフェンタニル(remifentanil)、スフェンタニル(sufentanil)、チリジン(tilidine)、トラマドールまたはそれらの組み合わせが含まれる。
【0033】
語句“抗炎症剤”は、抗炎症作用を有する薬剤または化合物を指す。これらの薬剤は炎症を低減することにより痛みを取り除くことができる。抗炎症剤の例には以下のものが含まれるが、それらに限定されない:スタチン(statin)、スリンダク(sulindac)、スルファサラジン(sulfasalazine)、グアニジノエチルジスルフィド、ナロキシン(naroxyn)、ジクロフェナク、インドメタシン、イブプロフェン、フルルビプロフェン、ケトプロフェン、アクロフェナク(aclofenac)、アロキシプリン(aloxiprin)、アプロキセン(aproxen)、アスピリン、ジフルニサール(diflunisal)、フェノプロフェン、メフェナム酸、ナプロキセン、フェニルブタゾン、ピロキシカム(piroxicam)、メロキシカム(meloxicam)、サリチルアミド、サリチル酸、デスオキシスリンダク(desoxysulindac)、テノキシカム(tenoxicam)、ケトロラック(ketoralac)、フルフェニサール(flufenisal)、サルサレート(salsalate)、サリチル酸トリエタノールアミン、アミノピリン(aminopyrine)、アンチピリン(antipyrine)、オキシフェンブタゾン、アパゾン(apazone)、シンタゾン(cintazone)、フルフェナム酸(flufenamic acid)、クロニキセリル(clonixeril)、クロニキシン(clonixin)、メクロフェナム酸(meclofenamic acid)、フルニキシン(flunixin)、コルヒチン(colchicine)、デメコルシン(demecolcine)、アロプリノール(allopurinol)、オキシプリノール(oxypurinol)、ベンジダミン塩酸塩、ジメファダン(dimefadane)、インドキソール(indoxole)、イントラゾール(intrazole)、ミムバン塩酸塩、パラニレン(paranylene)塩酸塩、テトリダミン(tetrydamine)、ベンジンドピリン(benzindopyrine)塩酸塩、フルプロフェン(fluprofen)、イブフェナク(ibufenac)、ナプロキソール、フェンブフェン(fenbufen)、シンコフェン(cinchophen)、ジフルミドン(diflumidone)ナトリウム、フェナモール(fenamole)、フルチアジン、メタザミド(metazamide)、レチミド(letimide)塩酸塩、ネキセリジン(nexeridine)塩酸塩、オクタザミド(octazamide)、モリナゾール(molinazole)、ネオシンコフェン(neocinchophen)、ニマゾール(nimazole)、クエン酸プロキサゾール、テシカム(tesicam)、テシミド(tesimide)、トルメチン(tolmetin)、トリフルミデート(triflumidate)、フェナメート類(メフェナム酸、メクロフェナム酸)、ナブメトン(nabumetone)、セレコキシブ(celecoxib)、エトドラク(etodolac)、ニメスリド(nimesulide)、アパゾン(apazone)、金、テポキサリン(tepoxalin);ジチオカルバメート、またはそれらの組み合わせ。抗炎症剤には、他の化合物、例えばステロイド類、例えばフルオシノロン(fluocinolone)、コルチゾール、コルチゾン、ヒドロコルチゾン、フルドロコルチゾン、プレドニゾン、プレドニゾロン、メチルプレドニゾロン、トリアムシノロン(triamcinolone)、ベタメタゾン、デキサメタゾン、ベクロメタゾン(beclomethasone)、フルオシノロン(fluocinolone)、フルチカゾン(fluticasone)、インターロイキン−1受容体拮抗薬、サリドマイド(TNF−α放出阻害剤)、サリドマイド類似体(マクロファージによるTNF−α産生を低減する)、骨形成タンパク質(BMP)2型またはBMP−4(TNF−α活性化因子であるカスパーゼ8の阻害剤)、キナプリル(TNF−αを上方制御するアンジオテンシンIIの阻害剤)、インターフェロン類、例えばIL−11(TNF−α受容体発現を調節する)、およびオーリントリカルボン酸(TNF−αを阻害する)、グアニジノエチルジスルフィド、またはそれらの組み合わせも含まれる。
【0034】
典型的な抗炎症剤には、例えば、ナプロキセン;ジクロフェナク;セレコキシブ;スリンダク;ジフルニサール;ピロキシカム;インドメタシン;エトドラク;メロキシカム;イブプロフェン;ケトプロフェン;r−フルルビプロフェン;メフェナム酸;ナブメトン;スルファサラジン、スリンダク、トルメチン、および前記のもののそれぞれのナトリウム塩;ケトロラックブロメタミン;ケトロラックトロメタミン;ケトロラック酸;コリンマグネシウムトリサリチレート;ロフェコキシブ(rofecoxib);バルデコキシブ(valdecoxib);ルミラコキシブ(lumiracoxib);エトリコキシブ(etoricoxib);アスピリン;サリチル酸およびそのナトリウム塩;アルファ、ベータ、ガンマ−トコフェロール類およびトコトリエノール類のサリチル酸エステル(および、全てのそれらのd、l、およびラセミ異性体);アセチルサリチル酸のメチル、エチル、プロピル、イソプロピル、n−ブチル、sec−ブチル、t−ブチルエステル類;テノキシカム;アセクロフェナク(aceclofenac);ニメスリド;ネパフェナク(nepafenac);アムフェナク(amfenac);ブロムフェナク(bromfenac);フルフェナメート(flufenamate);フェニルブタゾン、またはそれらの組み合わせが含まれる。
【0035】
抗炎症剤であると考えられる典型的なステロイド類には、例えば、21−アセトキシプレグネノロン(21−acetoxypregnenolone)、アルクロメタゾン(alclometasone)、アルゲストン(algestone)、アムシノニド(amcinonide)、ベクロメタゾン(beclomethasone)、ベタメタゾン、ブデソニド(budesonide)、クロロプレドニゾン、クロベタゾール(clobetasol)、クロベタゾン(clobetasone)、クロコルトロン(clocortolone)、クロプレドノール(cloprednol)、コルチコステロン、コルチゾン、コルチバゾール(cortivazol)、デフラザコート(deflazacort)、デソニド(desonide)、デソキシメタゾン(desoximetasone)、デキサメタゾン、デキサメタゾン21−アセテート、デキサメタゾン21−リン酸二ナトリウム塩、ジフロラゾン(diflorasone)、ジフルコルトロン(diflucortolone)、ジフルプレドネート(difluprednate)、エノキソロン(enoxolone)、フルアザコート(fluazacort)、フルクロロニド(flucloronide)、フルメタゾン(flumethasone)、フルニソリド(flunisolide)、フルオシノロンアセトニド(fluocinolone acetonide)、フルオシノニド(fluocinonide)、フルオコルチンブチル(fluocortin butyl)、フルオコルトロン(fluocortolone)、フルオロメトロン(fluorometholone)、酢酸フルペロロン(fluperolone)、酢酸フルプレドニデン(fluprednidene)、フルプレドニゾロン(fluprednisolone)、フルランドレノリド(flurandrenolide)、プロピオン酸フルチカゾン(fluticasone propionate)、フォルモコルタール(formocortal)、ハルシノニド(halcinonide)、プロピオン酸ハロベタゾール(halobetasol)、ハロメタゾン(halometasone)、酢酸ハロプレドン(halopredone)、ヒドロコルタメート(hydrocortamate)、ヒドロコルチゾン、エタボン酸ロテプレドノール(loteprednol etabonate)、マジプレドン(mazipredone)、メドリゾン(medrysone)、メプレドニゾン(meprednisone)、メチルプレドニゾロン、モメタゾンフロエート(mometasone furoate)、パラメタゾン、プレドニカルベート(prednicarbate)、プレドニゾロン、プレドニゾロン25−ジエチルアミノ−アセテート、リン酸プレドニゾロンナトリウム、プレドニゾン、プレドニバル(prednival)、プレドニリデン(prednylidene)、リメキソロン(rimexolone)、チキソコルトール(tixocortol)、トリアムシノロン、トリアムシノロンアセトニド、トリアムシノロンベネトニド、トリアムシノロンヘキサアセトニド、またはそれらの組み合わせが含まれる。
【0036】
痛みおよび/または炎症の処置に有用なスタチンの例には、アトルバスタチン(atorvastatin)、シンバスタチン(simvastatin)、プラバスタチン(pravastatin)、セリバスタチン(cerivastatin)、メバスタチン(mevastatin)(米国特許第3,883,140号を参照、その全開示を本明細書に援用する)、ベロスタチン(velostatin)(シンビノリン(synvinolin)とも呼ばれる;米国特許第4,448,784号および第4,450,171号参照、これらの全開示を本明細書に援用する)、フルバスタチン(fluvastatin)、ロバスタチン(lovastatin)、ロスバスタチン(rosuvastatin)、およびフルインドスタチン(fluindostatin)(Sandoz XU−62−320)、ダルバスタチン(dalvastain)(EP出願公開番号738510 A2、その全開示を本明細書に援用する)、エプタスタチン(eptastatin)、ピタバスタチン(pitavastatin)、またはそれらの医薬的に許容できる塩類、またはそれらの組み合わせが含まれるが、それらに限定されない。様々な態様において、スタチンにはスタチンの(+)Rおよび(−)−S鏡像異性体の混合物が含まれてよい。様々な態様において、スタチンにはスタチンの1:1ラセミ混合物が含まれてよい。
【0037】
抗炎症剤には、例えばアミトリプチリン、カルバマゼピン、ガバペンチン、プレガバリン、クロニジン、またはそれらの組み合わせのような、抗炎症特性を有する抗炎症剤も含まれる。
【0038】
別途明記しない限り、または文脈から明らかでない限り、この明細書およびそれに続く特許請求の範囲のセットが鎮痛剤、筋弛緩剤および/または抗炎症剤に言及する場合、本発明者は立体異性体が含まれるその鎮痛剤および/または抗炎症剤の医薬的に許容できる塩にも言及している。医薬的に許容できる塩類には、化合物の毒性を実質的に増大させない、塩を形成する酸および塩基が含まれる。適切である可能性のある塩類のいくつかの例には、アルカリ金属、例えばマグネシウム、カルシウム、ナトリウム、カリウム、およびアンモニウムの塩類、鉱酸、例えば塩酸、ヨウ化水素酸、臭化水素酸、リン酸、メタリン酸、硝酸、および硫酸の塩類、ならびに有機酸、例えば酒石酸、酢酸、クエン酸、リンゴ酸、安息香酸、グリコール酸、グルコン酸、グロン酸、コハク酸、アリールスルホン酸、例えば、p−トルエンスルホン酸、等の塩類が含まれる。
【0039】
“薬物デポー”は、少なくとも1種類の鎮痛剤および/または抗炎症剤が身体へ投与される組成物である。従って、薬物デポーは、望まれる部位(例えば、患者の椎間板腔、脊椎管、組織、特に手術の部位の組織もしくはその付近の組織、または他の炎症部位、等)における埋め込みまたは保持を促進する物理的構造を含んでよい。薬物デポーは薬物そのものも含む。用語“薬物”は、本明細書において使用される際、一般に、患者の生理機能を変化させるあらゆる物質を指すことを意味する。用語“薬物”は、本明細書において、用語“療法剤”、“療法上有効量”、および“有効医薬成分”または“API”と互換的に用いられてよい。別途明記しない限り、“薬物”配合物には1種類より多くの療法剤が含まれてよく、ここで典型的な療法剤の組み合わせには2種類以上の薬物の組み合わせが含まれることは理解されるであろう。薬物は、その部位への送達のためにその療法剤の濃度勾配を提供する。様々な態様において、薬物デポーは埋め込み部位から約0.1mm〜約5cmまでの距離でその療法剤の最適な薬物濃度勾配を提供し、少なくとも1種類の鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩を含む。
【0040】
“デポー”には、カプセル、マイクロスフェア、微粒子、マイクロカプセル、マイクロファイバー、粒子、ナノスフェア、ナノ粒子、コーティング、母材、ウェハー、丸剤、ペレット、エマルジョン、軟膏、リポソーム、ミセル、ゲル、繊維、細片、シートまたは他の医薬送達組成物、またはそれらの組み合わせが含まれるが、それらに限定されない。一部の態様において、その薬物デポーは、薬物のデポーからの放出を可能にする孔を有する。その薬物デポーはそのデポー中で体液が薬物を移動させることを可能にするであろう。しかし、デポー中への細胞浸潤は、デポーの孔の大きさにより妨げられるであろう。このように、一部の態様において、デポーは組織スキャフォールドとして機能して組織増殖を可能にするべきではない。むしろ、薬物デポーは薬物送達にのみ利用されるであろう。一部の態様において、薬物デポー中の孔は10〜50ミクロン未満であろう。この孔径は、細胞が薬物デポーに浸潤してスキャフォールドとなる細胞を敷設することを妨げるであろう。従って、この態様において、体液(fluid)が薬物デポーに入る際に薬物が薬物デポーから溶出されるであろうが、細胞は入ることを妨げられるであろう。一部の態様において、孔がほとんど、または全く無い場合、薬物は酵素の作用により、加水分解作用、拡散により、および/または人体中の他の類似の機構により、薬物デポーから溶出されるであろう。
【0041】
デポーに適した材料は、理想的には、好ましくはFDAに承認されている医薬的に許容できる生分解性および/またはあらゆる生体吸収性の材料、またはGRAS材料である。これらの材料はポリマー性または非ポリマー性であり、ならびに、合成によるもの、または天然に存在するもの、またはそれらの組み合わせであることができる。様々な態様において、薬物デポーは生分解性でなくてもよく、または生分解性でない材料を含んでいてよい。非生分解性ポリマーには、様々なセルロース誘導体(カルボキシメチルセルロース、酢酸セルロース、セルロースアセテートプロピオネート、エチルセルロース、ヒドロキシプロピルメチルセルロース、ヒドロキシアルキルメチルセルロース類、およびアルキルセルロース類)、シリコンおよびシリコンに基づくポリマー(例えばポリジメチルシロキサン)、ポリエチレン−co−(ビニルアセテート)、ポロキサマー、ポリビニルピロリドン、ポロキサミン(poloxamine)、ポリプロピレン、ポリアミド、ポリアセタール、ポリウレタン、ポリ(エステル−アミド)、ポリエステル、ポリエチレン−クロロトリフルオロエチレン、ポリテトラフルオロエチレン(PTFEまたは“Teflon(商標)”)、スチレンブタジエンゴム、ポリエチレン、ポリプロピレン、ポリフェニレンオキシド−ポリスチレン、ポリ−α−クロロ−p−キシレン、ポリメチルペンテン、ポリスルホン、非分解性エチレン−ビニルアセテート(例えば、エチレンビニルアセテートディスクおよびポリ(エチレン−co−ビニルアセテート))、ならびに他の関連する生体安定性(biostable)ポリマー、またはそれらの組み合わせが含まれるが、それらに限定されない。本出願における使用に適した薬物デポーが2008年4月18日に出願された米国仮出願第61/046,246号、2008年4月18日に出願された米国仮出願第61/046,218号、2008年4月18日に出願された米国仮出願第61/046,218号、2008年4月18日に出願された米国仮出願第61/046,201号、2008年4月18日に出願された米国一連番号12/105,864および2008年4月18日に出願された米国一連番号12/105,375において記述されている。これらの出願の全開示を本明細書において本出願中に援用する。
【0042】
薬物デポーは非吸収性ポリマーも含んでいてよい。これらの非吸収性ポリマーには、デルリン、ポリウレタン、シリコンおよびポリウレタンのコポリマー類、ポリオレフィン類(例えばポリイソブチレンおよびポリイソプレン)、アクリルアミド類(例えばポリアクリル酸およびポリ(アクリロニトリル−アクリル酸))、ネオプレン、ニトリル、アクリレート類(例えばポリアクリレート類、ポリ(2−ヒドロキシエチルメタクリレート)、メチルメタクリレート、2−ヒドロキシエチルメタクリレート、およびアクリレート類のN−ビニルピロリドンとのコポリマー類)、N−ビニルラクタム類、ポリアクリロニトリル、グルコマンナンゲル、加硫ゴム、およびそれらの組み合わせが含まれ得るが、それらに限定されない。ポリウレタン類の例には、熱可塑性ポリウレタン類、脂肪族ポリウレタン類、セグメント化ポリウレタン類、親水性ポリウレタン類、ポリエーテル−ウレタン、ポリカーボネート−ウレタンおよびシリコンポリエーテル−ウレタンが含まれる。典型的には、非分解性薬物デポーは除去される必要がある可能性がある。
【0043】
“可逆性相転移物質”には、例えば温度の変化のような外部刺激に反応して相または物理的状態を変化させる(例えば、固体が液体に、固体が半固体に、半固体が液体に、液体が固体に、液体が半固体に、または半固体が固体に、ガラス質−ゴム状、結晶質もしくは半晶質が融解体に、水に不溶性のものが水溶性のものに)物質が含まれる。可逆性相転移物質の相または物理的状態を変化させることの意図される作用は、その薬物デポー内の薬物の浸透の速度を増大させて薬物のデポーからの放出速度を増大させることである。可逆性は、その相変化物質が、その外部刺激を除去した後のある時点において、その最初の相または物理的状態に戻ることを意味する。その物質は非生分解性または生分解性のポリマー性および非ポリマー性物質を含むことができる。“療法上有効量”または“有効量”は、投与された際に、その薬物が結果として例えば炎症の抑制、痛みの低減または緩和、処置される疾患および/または病気の改善、等のような生物学的活動の改変をもたらすような量である。患者へ投与される投与量は、別途明記しない限り、または文脈から明らかでない限り、投与された薬物の薬物動態特性、投与経路、患者の状態および特徴(性別、年齢、体重、健康、サイズ、等)、症状の程度、併用処置、処置の頻度および望まれる作用を含む様々な要因に依存して、1回量または多数回用量としてのものである。一部の態様において、その配合物は、熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギー、光、機械的エネルギー(例えば撹拌)、電気的、化学的、もしくは磁気エネルギーの適用の際の即時放出のために設計される。他の態様において、その配合物は持続放出のために設計される。他の態様において、その配合物は1つ以上の即時放出表面または層および1つ以上の持続放出表面または層を含む。
【0044】
語句“持続(sustained)放出”または“継続(sustain)放出”(延長放出または制御放出とも呼ばれる)は、本明細書において、ヒトまたは他の哺乳類の身体の中に導入されて、予め決められた期間にわたって、およびその予め決められた期間全体を通して望まれる療法的作用を達成するのに十分な療法的レベルで、1種類以上の療法剤の流れを連続的に、または絶え間なく放出する、1種類以上の療法剤(単数または複数)を指して用いられる。連続的な、または絶え間ない放出の流れへの言及は、その薬物デポーまたはそれの構成要素のインビボでの生分解の結果として、または療法剤(単数または複数)もしくは療法剤(単数または複数)のコンジュゲートの代謝による変換もしくは溶解の結果として起こる放出を含むことを意図する。当業者は気付いているように、持続放出配合物は、例として、フィルム、スラブ、シート、ペレット、微粒子、マイクロスフェア、マイクロカプセル、球状体、成形された派生物、またはペーストとして作られてよい。その配合物は、等張生理食塩水、生理学的緩衝液、または患者の中への注入に許容できる他の溶液中での懸濁に適している形であってよい。さらに、その配合物は、非経口配合物、マイクロスフェア、マイクロカプセル、ゲル、ペースト、軟膏、クリーム、埋め込み可能な棒状の物(rods)、ペレット、プレートまたは繊維等が含まれるがそれらに限定されない本明細書における態様に関連して有用であると当業者に理解されるであろうあらゆる埋め込み可能な、挿入可能な、または注入可能なシステムと共に用いられてよい。一部の態様において、その薬物デポーは、鎮痛剤および/または抗炎症剤の持続放出を引き起こす物質(例えばポリマー)を含む。
【0045】
語句“即時放出”は、本明細書において、身体の中に導入されて、それが投与される部位において溶解する、またはそこで吸収されることが可能であり、その薬物の溶解または吸収を遅延させる、または延長する意図がない、1種類以上の療法剤(単数または複数)を指して用いられる。即時放出は、投与の後の短い期間内、例えば、一般に数分〜約1時間以内での薬物の放出を指す。一部の態様において、その薬物デポーは、その中に配置された鎮痛剤および/または抗炎症剤を有し、その鎮痛剤および/または抗炎症剤の即時放出を提供する。例えば、一部の態様において、その薬物デポーは、熱、冷気または別の適切な形のエネルギーがそのデポーに、またはそのデポーの付近(例えば、その薬物デポーが埋め込まれている場所の上の皮膚)に適用された際に相または物理的状態を変化させて、その鎮痛剤および/または抗炎症剤の放出の速度の増大を引き起こす、可逆的相転移ポリマーを含んでいてよい。
【0046】
用語“哺乳類(mammal)”は、分類学の綱“哺乳類(mammalian)”からの生物を指し、それにはヒト、他の霊長類、例えばチンパンジー、類人猿、オランウータン、およびサル、ラット、マウス、ネコ、イヌ、ウシ、ウマ、等が含まれるが、それらに限定されない。様々な態様において、その哺乳類はヒトの患者である。
【0047】
語句“放出速度プロフィール”は、一定の時間の単位にわたって放出される有効成分の割合、例えばmcg/時間、mcg/日、mg/時間、mg/日、10日間の間1日あたり10%、等を指す。当業者が知っているように、放出速度プロフィールは線形であってよいが、線形である必要はない。限定的ではない例として、その薬物デポーは、少なくとも1種類のアルファアドレナリン受容体作動薬をある期間にわたって放出するペレットであってよい。
【0048】
疾患または病気を処置することまたはその処置は、疾患/病気の徴候または症状を軽減する努力において、患者(正常またはそうではない状態のヒト、または他の哺乳類)に1種類以上の薬物を投与することを含んでいてよいプロトコルを実行することを指す。軽減は、疾患または病気の徴候または症状が出現する前に、ならびにそれらの出現の後に起こり得る。従って、“処置すること”または“処置”には、疾患または望まれない状態を“予防すること”またはその“予防”が含まれる。加えて、“処置すること”または“処置”は、徴候または症状の完全な軽減を必要とせず、治癒を必要とせず、そして具体的には、患者に対してわずかな効果しか有しないプロトコルも含まれる。“痛みおよび/または炎症を低減すること”には痛みおよび/または炎症の減少が含まれ、痛みおよび/または炎症の徴候または症状の完全な軽減を必要とせず、治癒を必要としない。様々な態様において、痛みおよび/または炎症を低減することには、痛みおよび/または炎症のわずかな減少さえ含まれる。例として、有効投与量の鎮痛剤および/または抗炎症剤の投与を用いて、様々な疾患または病気に関する痛みおよび/または炎症の症状を予防、処置、または緩和することができる。これらの疾患/病気は、術後痛および/または炎症、滑液包炎、腱炎、自己免疫疾患、例えば多発性硬化症、リウマチ性関節炎、骨関節炎、インスリン依存型糖尿病(I型糖尿病)、全身性紅斑性狼瘡および乾癬、蠕虫のような感染性因子により誘発される免疫病理(例えば、リーシュマニア症)、ならびにHIVが含まれる特定のウイルス感染症、ならびにライム病、結核、およびらい腫らいが含まれる細菌感染症、組織移植拒絶、移植片対宿主疾患、ならびにアトピー性の病気、例えば喘息およびアレルギー(アレルギー性鼻炎、食物アレルギーが含まれる胃腸アレルギー、好酸球増加症、結膜炎、または糸球体腎炎が含まれる)が含まれるがそれらに限定されない慢性炎症性疾患を含んでよい。
【0049】
1つの慢性的な病気は坐骨神経痛である。一般に、坐骨神経痛”は、侵害受容性の痛みから神経障害的な痛みへと移行し得る痛みの例である。坐骨神経痛は、脊髄の下部(腰部領域)から発して、脚の裏側を下行して足に至る坐骨神経と関係する痛みを指す。坐骨神経痛は一般に椎間板ヘルニアにより始まる。椎間板ヘルニア自体は局所的な免疫系の活性化をもたらす。椎間板ヘルニアは、神経根を締め付ける、または圧迫することによりそれを損傷し、その領域で追加の免疫系の活性化をもたらす可能性もある。様々な態様において、その鎮痛剤および/または抗炎症剤を用いて、その鎮痛剤および/または抗炎症剤を1箇所以上の標的組織部位(例えば、神経根、背根神経節、痛みが集中する部位、脊柱またはその付近、等)で局所投与することにより、坐骨神経の痛みおよび/または炎症を低減、処置、または予防することができる。
【0050】
“局在性の”送達には、1種類以上の薬物が組織、例えば神経系の神経根または脳の領域、またはそれらに非常に近接した領域(例えば、約10cm以内、または約5cm以内、または0.1cm以内)の内部に沈積される(deposited)送達が含まれる。“標的化された送達システム”は、標的部位またはその付近に沈積させることができるある量の療法剤を有する1種類以上の薬物デポー、ゲル、またはゲル中で分散したデポーの、痛み、炎症、または他の疾患もしくは病気の処置のための、必要に応じた送達を提供する。
【0051】
用語“生分解性”には、その薬物デポーの全部または一部が、酵素の作用により、加水分解作用により、および/または人体中の他の類似の機構により、時間の経過に伴って分解されるであろうことが含まれる。様々な態様において、“生分解性”には、療法剤が放出された後で、または放出されている間に、そのデポー(例えば、微粒子、マイクロスフェア、等)が体内で無毒の構成要素へと崩壊する、または分解されることができることが含まれる。“生侵食性(bioerodible)”は、そのデポーが、少なくとも部分的に、周囲の組織に見出される物質、体液との接触により、または細胞の作用により、時間の経過に伴って侵食または分解されるであろうことを意味する。“生体吸収性”は、そのデポーが人体内で、例えば細胞または組織により崩壊して吸収されるであろうことを意味する。“生体適合性”は、そのデポーが標的組織部位で実質的な組織刺激または壊死を引き起こさないであろうことを意味する。
【0052】
語句“疼痛管理薬物療法”には、痛みを予防、緩和、または完全に取り除くために投与される1種類以上の療法剤が含まれる。これらには、1種類以上の鎮痛剤および/または抗炎症剤が単独で、または筋弛緩剤、麻酔薬等、もしくはそれらの組み合わせとの組み合わせで含まれる。
【0053】
様々な態様において、そのデポーは埋め込み後の最初の24時間〜48時間以内に療法剤のバースト投与または大量瞬時投与を引き起こすように設計することができる。“初期バースト”または“バースト作用”または“大量瞬時投与”は、5、10、15、20、25、30、25、40、45、50、55、60、75、90、100、120、140、160、180分以内、または4〜6時間以内での、そのデポーからのある用量の療法剤の即時放出を指す。一部の態様において、その大量瞬時投与は、そのデポーが熱、冷気または他の適切な形のエネルギー、例えば超音波エネルギー、光、機械的エネルギー(例えば撹拌)、電気的、化学的、もしくは磁気エネルギーおよび水性の液体(例えば、血液、滑液、脳脊髄液、等)と接触した後、数分以内〜1時間以内に起こるであろう。このバースト作用または大量瞬時投与は、患者が突発痛および/または炎症を経験している場合の鎮痛および/または抗炎症に特に有益である。一部の態様において、熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギー、光、機械的エネルギー(例えば撹拌)、電気的、化学的、もしくは磁気エネルギーの適用により、その患者は大量瞬時投与およびそれらの鎮痛を制御することができる。“バースト作用”または“大量瞬時投与”は、療法剤のデポーからの放出の増大によるものであると信じられている。一部の態様において、その薬物デポーはその内部に配置された鎮痛剤および/または抗炎症剤を有し、その鎮痛剤および/または抗炎症剤の即時放出を提供する。例えば、一部の態様において、その薬物デポーは、熱および/または冷気のそのデポーへの、またはそのデポーの付近(例えば、それの5、4、3、2、1、0.5、0.1、0.01cm以内)への適用の際に相を変化させてその鎮痛剤および/または抗炎症剤の大量瞬時投与量の放出を引き起こす可逆的相転移ポリマーを含んでいてよい。典型的には、その大量瞬時投与量は、局所的に投与された日用量の10、20、30、40、50、60、70、80、90、または100%であることができるが、この用量は、24〜48時間以内の代わりに、5、10、15、20、25、30、25、40、45、50、55、60、75、90、100、120、140、160、180分以内、または4〜6時間以内に放出される。例えば、その薬物デポーが100μg/日のアルファ作動薬(例えばクロニジン)を放出するように設計されている場合、そのバースト作用または大量瞬時投与はその薬物デポーが5、10、15、20、25、30、25、40、45、50、55、60、75、90、100、120、140、160、または180分以内に100μgのそのアルファ作動薬を放出して痛みおよび/または炎症を軽減することを可能にするであろう。
【0054】
少なくとも1種類の鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩を含む薬物デポーは、筋弛緩剤と同時投与することができる。同時投与は、別々の薬物デポーで同時に投与すること、または同じ薬物デポー中に一緒に配合することを含んでよい。
【0055】
典型的な筋弛緩剤には、例として、限定ではなく、塩化アルクロニウム、アトラクリウムベシレート(atracurium bescylate)、バクロフェン(baclofen)、カルボロニウム(carbolonium)、カリソプロドール(carisoprodol)、カルバミン酸クロルフェネシン、クロルゾキサゾン、シクロベンザプリン、ダントロレン(dantrolene)、臭化デカメトニウム(decamethonium)、ファザジニウム(fazadinium)、ガラミントリエチオジド、ヘキサフルオレニウム、メラドラジン(meladrazine)、メフェンシン(mephensin)、メタキサロン、メトカルバモール、ヨウ化メトクリン(metocurine)、パンクロニウム(pancuronium)、メシル酸プリジノール、スチラメート(styramate)、スキサメトニウム(suxamethonium)、スキセトニウム(suxethonium)、チオコルチコシド(thiocolchicoside)、チザニジン(tizanidine)、トルペリゾン(tolperisone)、ツボクラリン(tubocuarine)、ベクロニウム(vecuronium)、またはそれらの組み合わせが含まれる。
【0056】
その薬物デポーは、鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩に加えて、またはその代わりに、他の療法剤または有効成分も含んでいてよい。適切な追加の療法剤には、インテグリン拮抗薬、アルファ−4 ベータ−7インテグリン拮抗薬、細胞接着阻害剤、インターフェロンガンマ拮抗薬、CTLA4−Ig作動薬/拮抗薬(BMS−188667)、CD40リガンド拮抗薬、ヒト化抗IL−6 mAb(MRA、トシリズマブ(Tocilizumab)、Chugai)、HMGB−1 mAb(Critical Therapeutics Inc.)、抗IL2R抗体(ダクリズマブ(daclizumab)、バシリシマブ(basilicimab))、ABX(抗IL−8抗体)、組換えヒトIL−10、またはHuMax IL−15(抗IL15抗体)が含まれるが、それらに限定されない。
【0057】
アルファアドレナリン作動性作動薬と同時投与することができる他の適切な療法剤には、IL−1阻害剤、例えばヒトのインターロイキン−1受容体拮抗薬(IL−1Ra)の組換え非グリコシル化型であるKineret(登録商標)(アナキンラ(anakinra))、またはIL−1の作用を妨害するモノクローナル抗体であるAMG108が含まれる。療法剤には、興奮性アミノ酸、例えばグルタミン酸およびアスパラギン酸、グルタミン酸のNMDA受容体、AMPA受容体、および/またはカイニン酸受容体への結合の拮抗薬または阻害剤も含まれる。望ましい場合は、上記のもののPEG化された形も用いてよいと考えられる。他の療法剤の例には、NFカッパB阻害剤、例えばグルココルチコイド類、または抗酸化剤、例えばジチオカルバメートが含まれる。
【0058】
使用に適した追加の療法剤の具体的な例には、同化成長因子または抗異化(anti−catabolic)成長因子、または骨誘導成長因子またはそれらの組み合わせが含まれるが、それらに限定されない。
【0059】
適切な同化成長または抗異化成長因子には、骨形成タンパク質、成長分化因子、LIM鉱化タンパク質、CDMPまたは前駆細胞またはそれらの組み合わせが含まれるが、それらに限定されない。
【0060】
それぞれの鎮痛剤および/または抗炎症剤に関して、一部の態様において、特にその薬剤(単数または複数)が生分解性ポリマー層中に配置されている場合、それはその薬物デポーに持続放出特性を与え、それぞれの化合物の放出は少なくとも1日間、少なくとも2日間、少なくとも3日間、少なくとも4日間、少なくとも5日間、少なくとも6日間、少なくとも7日間、少なくとも8日間、少なくとも9日間、少なくとも10日間、少なくとも11日間、少なくとも12日間、少なくとも13日間、少なくとも14日間、または少なくとも15日間、またはより長い間であってよい。一部の態様において、その薬物デポーは術後痛および/または炎症の軽減を約3日間〜約10日間提供する。
【0061】
その療法剤(例えば、鎮痛剤および/または抗炎症剤)には、その医薬的に許容できる塩も含まれる。本明細書で用いられる際、“医薬的に許容できる塩”は、開示する化合物(例えば、エステルまたはアミンが含まれる)の誘導体を指し、ここでその親化合物はその酸性または塩基性塩を作ることにより修飾されてよい。医薬的に許容できる塩の例には、アミンのような塩基性残基の鉱酸塩または有機酸塩;カルボン酸のような酸性残基のアルカリまたは有機塩が含まれるが、それらに限定されない。その医薬的に許容できる塩には、例えば、無毒性の無機または有機酸から形成される、親化合物の一般に用いられる無毒性の塩または第四級アンモニウム塩が含まれる。例えば、そのような一般に用いられる無毒性の塩には、無機酸、例えば塩酸、臭化水素酸、硫酸、スルファミン酸、リン酸、もしくは硝酸に由来する塩;または、有機酸、例えば酢酸、フオル(fuoric)酸、プロピオン酸、コハク酸、グリコール酸、ステアリン酸、乳酸、リンゴ酸、酒石酸、クエン酸、アスコルビン酸、パモ酸、マレイン酸、ヒドロキシマレイン酸、フェニル酢酸、グルタミン酸、安息香酸、サリチル酸、スルファニル酸、2−アセトキシ安息香酸、フマル酸、トルエンスルホン酸、メタンスルホン酸、エタンジスルホン酸、シュウ酸、イセチオン酸から調製される塩が含まれる。医薬的に許容できるものには、その療法剤のラセミ混合物((+)−Rおよび(−)−S鏡像異性体)または右旋性および左旋性異性体のそれぞれもそれぞれ含まれる。その療法剤は遊離酸もしくは塩基型であってよく、または長期の作用活性のためにPEG化されていてよい。
【0062】
クロニジン
1態様において、その鎮痛剤および/または抗炎症剤はクロニジンを含む。クロニジンに言及する場合、別途明記しない限り、または文脈から明らかでない限り、本発明者は医薬的に許容できる塩にも言及しているものと理解される。クロニジンに関する1つの周知の商業的に入手できる塩は、その塩酸塩である。医薬的に許容できる可能性のある塩のいくつかの他の例には、化合物の毒性を実質的に増大させない塩を形成する酸および塩基、例えばアルカリ金属、例えばマグネシウム、カリウムおよびアンモニウムの塩、鉱酸、例えばヨウ化水素酸、臭化水素酸、リン酸、メタリン酸、硝酸、および硫酸の塩、ならびに有機酸、例えば酒石酸、酢酸、クエン酸、リンゴ酸、安息香酸、グリコール酸、グルコン酸、グロン酸、コハク酸、アリールスルホン酸、例えば、p−トルエンスルホン酸、および同様のものの塩が含まれる。
【0063】
さらに、クロニジンに言及する際、その有効成分は、塩の形だけではなく、塩基の形(例えば遊離塩基)であってもよい。様々な態様において、それが塩基の形である場合、それはPLGAまたはPLAに関して起こる可能性のある加熱または溶媒処理の際に見られる可能性があるような重大なポリマー分解がない条件の下でポリマーと組み合わせられてよい。限定的でない例として、クロニジンをポリ(オルトエステル類)と共に配合する場合、クロニジン塩基配合物を用いることが望ましい可能性がある。対照的に、クロニジンをPLGAと共に配合する場合、HCl塩の形を用いることが望ましい可能性がある。
【0064】
1態様において、その薬物デポーは2,6−ジクロロ−N−2−イミダゾリジニリデンベンゼンアミン(2,6−dichloro−N−2−imidazolidinyldenebenzenamine)とも呼ばれるクロニジンを含む。クロニジンまたはその医薬的に許容できる塩は、例えば手術、慢性炎症性疾患、慢性炎症性腸疾患、滑液包炎、骨関節炎、骨溶解、腱炎、坐骨神経痛、椎間板ヘルニア、狭窄、ミオパシー、脊椎すべり症(spondilothesis)、腰痛、椎間関節痛、手根管症候群、足根管症候群、失敗した背部痛等の結果として起こる痛みおよび/または炎症を低減、予防または処置するために、様々な医薬製造業者より入手可能である。
【0065】
その投与量はおおよそ0.0005からおおよそ960μg/日までである。さらなるクロニジンの投与量には、おおよそ0.0005からおおよそ900μg/日まで;おおよそ0.0005からおおよそ500μg/日まで;おおよそ0.0005からおおよそ250μg/日まで;おおよそ0.0005からおおよそ100μg/日まで;おおよそ0.0005からおおよそ75μg/日まで;おおよそ0.001からおおよそ70μg/日まで;おおよそ0.001からおおよそ65μg/日まで;おおよそ0.001からおおよそ60μg/日まで;おおよそ0.001からおおよそ55μg/日まで;おおよそ0.001からおおよそ50μg/日まで;おおよそ0.001からおおよそ45μg/日まで;おおよそ0.001からおおよそ40μg/日まで;おおよそ0.001からおおよそ35μg/日まで;おおよそ0.0025からおおよそ30μg/日まで;おおよそ0.0025からおおよそ25μg/日まで;おおよそ0.0025からおおよそ20μg/日まで;おおよそ0.0025からおおよそ15μg/日まで;おおよそ0.0025からおおよそ10μg/日まで;おおよそ0.0025からおおよそ5μg/day;およびおおよそ0.0025からおおよそ2.5μg/日までが含まれる。別の態様において、クロニジンの投与量はおおよそ0.005からおおよそ15μg/日までである。別の態様において、クロニジンの投与量はおおよそ0.005からおおよそ10μg/日までである。別の態様において、クロニジンの投与量はおおよそ0.005からおおよそ5μg/日までである。別の態様において、クロニジンの投与量はおおよそ0.005から2.5μg/日までである。一部の態様において、クロニジンの量は40〜600μg/日である。一部の態様において、クロニジンの量は200〜400μg/日である。
【0066】
様々な態様において、クロニジンおよび少なくとも1種類の生分解性ポリマーを含む医薬配合物が存在し、ここでそのクロニジンはその配合物の約1重量%から約20重量%までを構成する。一部の態様において、そのクロニジンはその配合物の約3重量%から約20重量%まで、約3重量%から約18重量%まで、約5重量%から約15重量%まで、または約7.5重量%から約12.5重量%までを構成する。例として、5%〜15%クロニジン組成物を用いる場合、クロニジンのポリマーに対するモル比は、267グラム/モル比を有するおおよそ80キロダルトンのポリマーを用いる場合、おおよそ16から52までであろう。
【0067】
一部の態様において、その少なくとも1種類の生分解性ポリマーはポリ(乳酸−co−グリコリド)(PLGA)またはポリ(オルトエステル)(POE)、またはそれらの組み合わせを含む。ポリ(乳酸−co−グリコリド)はポリグリコリド(PGA)およびポリラクチドの混合物を含んでいてよく、一部の態様において、その混合物中に、ポリグリコリドより多くのポリラクチドが存在する。様々な態様において、100%のポリラクチドおよび0%のポリグリコリド;95%のポリラクチドおよび5%のポリグリコリド;90%のポリラクチドおよび10%のポリグリコリド;85%のポリラクチドおよび15%のポリグリコリド;80%のポリラクチドおよび20%のポリグリコリド;75%のポリラクチドおよび25%のポリグリコリド;70%のポリラクチドおよび30%のポリグリコリド;65%のポリラクチドおよび35%のポリグリコリド;60%のポリラクチドおよび40%のポリグリコリド;55%のポリラクチドおよび45%のポリグリコリド;50%のポリラクチドおよび50%のポリグリコリド;45%のポリラクチドおよび55%のポリグリコリド;40%のポリラクチドおよび60%のポリグリコリド;35%のポリラクチドおよび65%のポリグリコリド;30%のポリラクチドおよび70%のポリグリコリド;25%のポリラクチドおよび75%のポリグリコリド;20%のポリラクチドおよび80%のポリグリコリド;15%のポリラクチドおよび85%のポリグリコリド;10%のポリラクチドおよび90%のポリグリコリド;5%のポリラクチドおよび95%のポリグリコリド;ならびに0%のポリラクチドおよび100%ポリグリコリドが存在する。
【0068】
ポリラクチドおよびポリグリコリドの両方を含む様々な態様において、少なくとも95%のポリラクチド;少なくとも90%のポリラクチド;少なくとも85%のポリラクチド;少なくとも80%のポリラクチド;少なくとも75%のポリラクチド;少なくとも70%のポリラクチド;少なくとも65%のポリラクチド;少なくとも60%のポリラクチド;少なくとも55%;少なくとも50%のポリラクチド;少なくとも45%のポリラクチド;少なくとも40%のポリラクチド;少なくとも35%のポリラクチド;少なくとも30%のポリラクチド;少なくとも25%のポリラクチド;少なくとも20%のポリラクチド;少なくとも15%のポリラクチド;少なくとも10%のポリラクチド;または少なくとも5%のポリラクチドが存在し;そのバイオポリマーの残りの部分がポリグリコリドである。
【0069】
様々な態様において、その薬物デポーにおいて用いられる薬物の粒径は約5から30マイクロメートルまでであるが、様々な態様において、約1ミクロンから250ミクロンまでの範囲が用いられてよい。一部の態様において、その生分解性ポリマーはその配合物の少なくとも50重量%、少なくとも60重量%、少なくとも70重量%、その配合物の少なくとも80重量%、その配合物の少なくとも85重量%、その配合物の少なくとも90重量%、その配合物の少なくとも95重量%、またはその配合物の少なくとも97重量%を構成する。一部の態様において、その少なくとも1種類の生分解性ポリマーおよびクロニジンだけがその医薬配合物の構成要素である。
【0070】
一部の態様において、粒子の少なくとも75%が約10マイクロメートルから約200マイクロメートルまでの大きさを有する。一部の態様において、粒子の少なくとも85%が約10マイクロメートルから約200マイクロメートルまでの大きさを有する。一部の態様において、粒子の少なくとも95%が約10マイクロメートルから約200マイクロメートルまでの大きさを有する。一部の態様において、粒子の全てが約10マイクロメートルから約200マイクロメートルまでの大きさを有する。
【0071】
一部の態様において、粒子の少なくとも75%が約20マイクロメートルから約180マイクロメートルまでの大きさを有する。一部の態様において、粒子の少なくとも85%が約20マイクロメートルから約180マイクロメートルまでの大きさを有する。一部の態様において、粒子の少なくとも95%が約20マイクロメートルから約180マイクロメートルまでの大きさを有する。一部の態様において、粒子の全てが約20マイクロメートルから約180マイクロメートルまでの大きさを有する。
【0072】
一部の態様において、以下のものを含む薬物デポー中の医薬配合物が存在する:クロニジン(ここでそのクロニジンは塩酸塩の形であり、その配合物の約1重量%から約20重量%までを構成する)および少なくとも1種類の生分解性ポリマー(ここでその少なくとも1種類の生分解性ポリマーはポリ(ラクチド−co−グリコリド)(またはポリ(乳酸−co−グリコール酸))またはポリ(オルトエステル)、またはそれらの組み合わせを含み、前記の少なくとも1種類の生分解性ポリマーは前記の配合物の少なくとも80重量%を構成する)。
【0073】
一部の態様において、急性の痛みを処置するための方法が存在する。これらの方法は医薬組成物を生物に投与することを含み、ここで前記の医薬組成物は約1重量%から約20重量%までのその配合物および少なくとも1種類の生分解性ポリマーを含む。一部の態様において、その装填(loading)は約5重量%から約10重量%までである。一部の態様において、その装填は約10重量%から約20重量%までである。
【0074】
一部の態様において、クロニジンのより高い装填、例えば少なくとも20重量%、少なくとも30重量%、少なくとも40重量%、少なくとも50重量%、少なくとも60重量%、少なくとも70重量%、少なくとも80重量%、または少なくとも90重量%の装填が存在する。
【0075】
一部の態様において、その薬物デポーはクロニジンと共に賦形剤を含有する。生分解性ポリマーに加えてクロニジンと共に配合することができる典型的な賦形剤には、MgO(例えば、1重量%)、5050 DLG 6E、5050 DLG 1A、mPEG、TBO−Ac、mPEG、Span−65、Span−85、pluronic F127
、TBO−Ac、ソルビトール(sorbital)、シクロデキストリン、マルトデキストリン、pluronic F68、CaCl、5050 7A、およびそれらの組み合わせが含まれるが、それらに限定されない。一部の態様において、賦形剤は配合物の約0.001重量%から約50重量%までを構成する。一部の態様において、賦形剤は配合物の約0.001重量%から約40重量%までを構成する。一部の態様において、賦形剤は配合物の約0.001重量%から約30重量%までを構成する。一部の態様において、賦形剤は配合物の約0.001重量%から約20重量%までを構成する。一部の態様において、賦形剤は配合物の約0.001重量%から約10重量%までを構成する。一部の態様において、賦形剤は配合物の約0.001重量%から約50重量%までを構成する。一部の態様において、賦形剤は配合物の約0.001重量%から約2重量%までを構成する。
【0076】
これらの医薬配合物を投与する際、三角包囲(triangulation)の戦略が有効である可能性がある。このように、医薬配合物を含む複数(少なくとも2個、少なくとも3個、少なくとも4個、少なくとも5個、少なくとも6個、少なくとも7個、等)の薬物デポーを、標的組織部位(痛みの発生源(generator)または痛みの発生部位としても知られる)の周囲に、その標的組織部位が、2個の配合物が存在する場合はその配合物の間であるか、またはそれの周囲が複数の配合物のセットにより定められる領域の内側であるかのどちらかである領域内に入るように配置することができる。
【0077】
一部の態様において、その配合物はわずかに堅く、様々な長さ、幅、直径等を有する。例えば、ある配合物は0.50mmの直径および4mmの長さを有してよい。粒径は、乳鉢および乳棒、ジェット乾燥、またはジェット粉砕を用いるような技法により変化させることができることに留意すべきである。
【0078】
一部の態様において、クロニジンは少なくとも3日の期間の間、1日あたり2〜3μgの速度で放出される。一部の態様において、この放出速度が少なくとも10日間、少なくとも15日間、少なくとも25日間、少なくとも50日間、少なくとも90日間、少なくとも100日間、少なくとも135日間、少なくとも150日間、または少なくとも180日間続く。一部の態様に関して、バイオポリマーと共に配合された300〜425マイクログラムのクロニジンを人の中に、標的組織部位またはその付近に埋め込む。標的部位を三角包囲する(triangulate)多数の部位にクロニジンを埋め込む場合、一部の態様において、それぞれの部位におけるクロニジンの総量は、合計で300〜425マイクログラムを分けたもの(fraction)である。例えば、324マイクログラムの1回量を1つの部位に、または162マイクログラムの2つに分けた用量を2つの部位に、または108マイクログラムの3つに分けた用量を、標的部位を三角包囲する3つの部位に埋め込むことができる。総投与量をその生物にとって有害であろう量未満の量に制限することが重要である。しかし、一部の態様において、複数の部位がある場合に、それぞれの部位は単一の適用で投与されてよかった総用量(does)未満を含有していてよいが、それぞれの部位は独立して放出プロフィールを有しており、従ってそのバイオポリマーの濃度および物質を継続放出が十分な時間にわたって起こることを確実にするように調節すべきであることを覚えておくことが重要である。
【0079】
一部の態様において、クロニジンまたはクロニジン塩酸塩およびポリマーを含む薬物デポーが存在し、ここでそのポリマーは様々な態様の1種類以上であり、その薬物デポーはポリ(ラクチド−co−グリコリド)(PLGA)、ポリラクチド(PLA)、ポリグリコリド(PGA)、D−ラクチド、D,L−ラクチド、L−ラクチド、D,L−ラクチド−ε−カプロラクトン、D,L−ラクチド−グリコリド−ε−カプロラクトン、またはそれらの組み合わせを含む。
【0080】
1つの典型的な投薬計画では、ラットに0.240μg/日の継続放出を135日間提供するのに十分な生分解性ポリマー中のクロニジンを提供することができる。この期間にわたって投与されるクロニジンの総量は、おおよそ32.4μgであろう。別の典型的な投薬計画では、ヒトに2.4μg/日の継続放出を135日間提供するのに十分な生分解性ポリマー中のクロニジンを提供する。この期間にわたって投与されるクロニジンの総量は、おおよそ324μgであろう。
【0081】
複数のペレットを用いる場合、そのペレットの数は、適切な大きさ(即ち、直径0.5mm×長さ4mm)のペレット中に装填される薬物の量およびどの位の薬物が必要とされるか(例えば、おおよそ325μgのクロニジン(3個のペレット))に基づく。一部の態様において、大量瞬時投与量の化合物を、落ち着くまで最初の数日(約5日)にわたって放出し、2.5mg/日を135日間放出するポリマーが存在する。典型的な配合物は、5重量%のクロニジン、100 DL 5Eである。
【0082】
一部の態様において、本出願のポリマーデポーは、2.5倍より多くの薬物を送達する皮下注射剤と同等である有効成分の効力を提供することを可能にする。
ブピバカイン
その薬物デポーは鎮痛剤ブピバカインを含んでいてよい。ブピバカインに言及する場合、別途明記しない限り、または文脈から明らかでない限り、本発明者は医薬的に許容できる塩にも言及しているものと理解される。医薬的に許容できる可能性のある塩のいくつかの例には、その化合物の毒性を実質的に増大させない塩を形成する酸および塩基が含まれる。これらの塩のいくつかの例には、アルカリ金属、例えばマグネシウム、カリウムおよびアンモニウムの塩が含まれる。鉱酸、例えば塩酸、ヨウ化水素酸、臭化水素酸、リン酸、メタリン酸、硝酸、および硫酸の塩、ならびに有機酸、例えば酒石酸、酢酸、クエン酸、リンゴ酸、安息香酸、グリコール酸、グルコン酸、グロン酸、コハク酸、アリールスルホン酸、例えば、p−トルエンスルホン酸、および同様のものの塩。ブピバカインのこれらの塩を哺乳類への安全な投与のために作ることができる程度まで、それらは本発明の範囲内である。
【0083】
さらに、そのブピバカインは塩基の形で用いられてもよい。様々な態様において、その薬物デポーは約1mg〜30mg/日のブピバカインを1〜10日間または1日〜6ヶ月間放出する。一部の態様において、それは20〜360mg/日または40〜120mg/日または80〜180mg/日または120〜240mg/日または160〜300mg/日または200〜360mg/日またはブピバカインを放出する。この用量はしばしば、手術において神経ブロックを提供するために用いられる用量よりもはるかに低い。
【0084】
一部の態様において、ブピバカインの量は2mg/日〜1800mg/日または10〜1500mg/日である。ブピバカインの放出は、列挙した範囲で少なくとも3日間、少なくとも4日間、少なくとも5日間、少なくとも6日間、少なくとも7日間または少なくとも8日間であってよい。
【0085】
フルオシノロン
1態様において、その薬物デポー中の抗炎症剤は、フルオシノロンまたはその医薬的に許容できる塩、例えばアセトニド塩を含む。フルオシノロンは様々な医薬製造業者から入手することができる。フルオシノロンの投与量は、おおよそ0.0005からおおよそ100μg/日までであってよい。さらなるフルオシノロンの投与量には、おおよそ0.0005からおおよそ50μg/日まで;おおよそ0.0005からおおよそ25μg/日まで;おおよそ0.0005からおおよそ10μg/日まで;おおよそ0.0005からおおよそ5μg/日まで;おおよそ0.0005からおおよそ1μg/日まで;おおよそ0.0005からおおよそ0.75μg/日まで;おおよそ0.0005からおおよそ0.5μg/日まで;おおよそ0.0005からおおよそ0.25μg/日まで;おおよそ0.0005からおおよそ0.1μg/日まで;おおよそ0.0005からおおよそ0.075μg/日まで;おおよそ0.0005からおおよそ0.05μg/日まで;おおよそ0.001からおおよそ0.025μg/日まで;おおよそ0.001からおおよそ0.01μg/日まで;おおよそ0.001からおおよそ0.0075μg/日まで;おおよそ0.001からおおよそ0.005μg/日まで;おおよそ0.001からおおよそ0.025μg/日まで;およびおおよそ0.002μg/日が含まれる。別の態様において、フルオシノロンの投与量はおおよそ0.001からおおよそ15μg/日までである。別の態様において、フルオシノロンの投与量はおおよそ0.001からおおよそ10μg/日までである。別の態様において、フルオシノロンの投与量はおおよそ0.001からおおよそ5μg/日までである。別の態様において、フルオシノロンの投与量はおおよそ0.001から2.5μg/日までである。一部の態様において、フルオシノロンの量は40〜600μg/日である。一部の態様において、フルオシノロンの量は200〜400μg/日である。
【0086】
デキサメタゾン
1態様において、その薬物デポー中の抗炎症剤は8S,9R,10S,11S,13S,14S,16R,17R)−9−フルオロ−11,17−ジヒドロキシ−17−(2−ヒドロキシアセチル)−10,13,16−トリメチル−6,7,8,11,12,14,15,16オクタヒドロシクロペンタ[a]−フェナントレン−3−オン)とも呼ばれるデキサメタゾンの遊離塩基または酢酸デキサメタゾン、またはそれらの医薬的に許容できる塩であり、それは様々な製造業者から入手することができる。
【0087】
様々な態様において、デキサメタゾンはデポーから、約10pg〜約80mg/日、約2.4ng/日〜約50mg/日、約50ng/日〜約2.5mg/日、約250ng/日〜約250ug/日、約250ng/日〜約50ug/日、約250ng/日〜約25ug/日、約250ng/日〜約1ug/日、約300ng/日〜約750ng/日、または約0.50ug/日の用量で放出されてよい。様々な態様において、その用量は約0.01〜約10μg/日または約1ng〜約120μg/日であってよい。
【0088】
1つの典型的な態様において、そのデキサメタゾンはリン酸デキサメタゾンナトリウムである。
GED
1態様において、その薬物デポー中の抗炎症剤はGED(グアニジノエチルジスルフィド)であり、それは抗炎症特性を有する誘導性一酸化窒素シンターゼ阻害剤である。GEDはその炭酸水素塩の形であってよい。
【0089】
GEDの投与量はおおよそ0.0005μg/日からおおよそ100mg/日までである。さらなるGEDの投与量には、おおよそ0.0005μg/日からおおよそ50mg/日まで;おおよそ0.0005μg/日からおおよそ10mg/日まで;おおよそ0.0005μg/日からおおよそ1mg/日まで;おおよそ0.0005からおおよそ800μg/日まで;おおよそ0.0005からおおよそ50μg/日まで;おおよそ0.001からおおよそ45μg/日まで;おおよそ0.001からおおよそ40μg/日まで;おおよそ0.001からおおよそ35μg/日まで;おおよそ0.0025からおおよそ30μg/日まで;おおよそ0.0025からおおよそ25μg/日まで;おおよそ0.0025からおおよそ20μg/日まで;およびおおよそ0.0025からおおよそ15μg/日までが含まれる。別の態様において、GEDの投与量はおおよそ0.005からおおよそ15μg/日までである。別の態様において、GEDの投与量はおおよそ0.005からおおよそ10μg/日までである。別の態様において、GEDの投与量はおおよそ0.005からおおよそ5μg/日までである。別の態様において、GEDの投与量はおおよそ0.005から2.5μg/日までである。一部の態様において、GEDの量は40〜600μg/日である。一部の態様において、GEDの量は200〜400μg/日である。
【0090】
1つの典型的な態様において、GEDの投与量は0.5〜4mg/日である。別の典型的な態様において、GEDの投与量は0.75〜3.5mg/日である。
ロバスタチン
1つの典型的な態様において、その薬物デポー中の抗炎症剤はロバスタチンを含む。ロバスタチンは、様々な製造業者から様々な形(例えば、注射剤、粉末、等)で得ることができるスタチンである。例えば、ロバスタチンはMerckからMevacor(登録商標)(米国特許第4,231,938号を参照、その全開示を本明細書に援用する)として得ることができる。ロバスタチンの適切な医薬的に許容できる塩には、塩基、例えば水酸化ナトリウム、水酸化カリウム、水酸化リチウム、水酸化カルシウム、1−デオキシ−2−(メチルアミノ)−D−グルシトール、水酸化マグネシウム、水酸化亜鉛、水酸化アルミニウム、水酸化第一鉄もしくは第二鉄、水酸化アンモニウム、または有機アミン類、例えばN−メチルグルカミン、コリン、アルギニン、または同様のもの、またはそれらの組み合わせに由来する1種類以上の化合物が含まれる。ロバスタチンの適切な医薬的に許容できる塩には、そのリチウム、カルシウム、ヘミカルシウム、ナトリウム、カリウム、マグネシウム、アルミニウム、第一鉄もしくは第二鉄の塩、またはそれらの組み合わせが含まれる。
【0091】
様々な態様において、ロバスタチンの療法上有効量は、1日あたり約0.1pgから約2000mgまで、例えば、0.1ngから1000mgまで、500mg、100mg、50mg、25mg、10mg、1mg、50μg、25μg、10μg、1μg、500ng、250ng、100ng、75ng、50ng、25ng、15ng、10ng、5ng、または1ngのロバスタチンを含む。様々な態様において、その投与量は、例えば約3ng/日から約3μg/日までであってよい。
【0092】
モルヒネ
本発明の1態様において、その薬物デポー中の鎮痛剤はモルヒネである。モルヒネは(5α,6α)−7,8−ジデヒドロ−4,5−エポキシ−17−メチルモルフィナン−3,6−ジオールとも呼ばれ、化学式C17H19NO3を有する。モルヒネまたはその医薬的に許容できる塩は様々な製造業者から入手可能である。1つの典型的な態様において、そのモルヒネはモルヒネの硫酸塩または塩酸塩を含む。
【0093】
モルヒネの投与量は、1日あたり0.1mgから1000mgまでであってよい。例えば、モルヒネの投与量は、例えば1日あたり0.1mg〜2mg、5mg、10mg、15mg、20mg、25mg、30mg、35mg、40mg、45mg、50mg、55mg、60mg、65mg、70mg、75mg、75mg、80mg、85mg、90mg、95mg、100mg、120mg、130mg、140mg、150mg、160mg、170mg、180mg、190mg、200mgのモルヒネであってよい。
【0094】
トラマドール
1態様において、その薬物デポー中の鎮痛剤はトラマドールである。トラマドールは(±)シス−2−[(ジメチルアミノ)メチル]−1−(3−メトキシフェニル)シクロヘキサノール塩酸塩とも呼ばれ、化学式C16H25NO2を有する。トラマドールまたはその医薬的に許容できる塩は様々な製造業者から入手可能である。様々な態様において、トラマドールHCLを用いた。
【0095】
トラマドールの投与量は、1日あたり0.01mgから500mgまでであってよい。例えば、トラマドールの投与量は、例えば1日あたり0.1mg〜2mg、5mg、10mg、15mg、20mg、25mg、30mg、35mg、40mg、45mg、50mg、55mg、60mg、65mg、70mg、75mg、75mg、80mg、85mg、90mg、95mg、100mg、120mg、130mg、140mg、150mg、160mg、170mg、180mg、190mg、200mg、または500mgのトラマドールであってよい。
【0096】
1態様において、その薬物デポーは2.5〜30mg/kg/日を放出するのに十分なトラマドールを含有する。別の態様において、その薬物デポーは3〜27.5mg/kg/日を放出するのに十分なトラマドールを含有する。
【0097】
可逆性相転移物質
その薬物デポーは、可逆性相転移物質中に配置された鎮痛剤および/または抗炎症剤を含み、それは例えば温度の変化のような外部刺激に反応して相または物理的状態を変化させる(例えば、固体が液体に、固体が半固体に、半固体が液体に、液体が固体に、液体が半固体に、または半固体が固体に、ガラス質のものがゴム状のものに、結晶が融解体に、半結晶が融解体に、等)。例えば、その薬物デポーは、可逆性相転移物質中に配置された上記で論じたような鎮痛剤および/または抗炎症剤を有する可逆性相転移物質を、全体に、または1つ以上の層(単数または複数)中に含んでいてよい。熱がその薬物デポーに、またはその薬物デポーが埋め込まれている場所のすぐそばの皮膚に適用された際(例えば40℃〜45℃)、これは埋め込まれた薬物デポー中の可逆性相転移物質の、例えば固体から液体へ、または固体から半固体へ、または半固体から液体への変化を引き起こし、そうしてその薬物デポーを横切る薬物の拡散を増大させ、その薬物デポーからの鎮痛剤および/または抗炎症剤の大量瞬時投与量またはバースト用量の放出を引き起こすであろう。このようにして、突発痛および/または炎症を低減、予防または処置することができる。その可逆性相転移物質を薬物デポー全体に、またはその薬物デポーの1つ以上の層(単数または複数)中に配置することにより、バースト作用を成し遂げることができ、ここでその薬物デポーは、熱が適用されている間、または熱が適用された後5、10、15、20、25、30、25、40、45、50、55、60、75、90、100、120、140、160、または180分で大量瞬時投与量を放出し、標的組織部位において痛みおよび/または炎症を予防、低減および/または処置するであろう。一部の態様において、熱のその薬物デポーへの適用は、その薬物のポリマー中での可溶性を増大させると考えられ、これも放出を増大させることができる。
【0098】
別の例として、冷気がその薬物デポーに、またはその薬物デポーが埋め込まれている場所のすぐそばの皮膚(それはその薬物デポーから0.5mm〜5cm離れていてよい)に適用された際(例えば20℃〜25℃)、これは埋め込まれた薬物デポー中の可逆性相転移物質の、水に不溶性の相または固体の相から水溶性の相または液体への変化を引き起こすと考えられ、ここでその薬物は温度が低下した際に放出され得る。一部の態様において、そのより冷たい温度は可逆性相転移ポリマーのそのガラス転移温度への到達を引き起こし得るが、これは放出を遅くするであろう。
【0099】
一部の態様において、その相の変化は固体が液体に、または固体が半固体に、または半固体が液体に、または液体が半固体に、または液体が固体に、または半固体が固体にであることができ、そうして薬物の拡散を増大させ、薬物デポーからの鎮痛剤および/または抗炎症剤の大量瞬時投与量またはバースト用量の放出の増大を引き起こす。このようにして、突発痛および/または炎症を低減、予防または処置することができる。その可逆性相転移物質を薬物デポー全体に、またはその薬物デポーの1つ以上の層(単数または複数)中に配置することにより、バースト作用を成し遂げることができ、ここでその薬物デポーは、冷気が適用されている間、または冷気が適用された後5、10、15、20、25、30、25、40、45、50、55、60、75、90、100、120、140、160、または180分で大量瞬時投与量を放出し、標的組織部位において痛みおよび/または炎症を予防、低減および/または処置するであろう。
【0100】
その可逆性相転移物質は、生分解性ポリマー性および非ポリマー性物質を含むことができる。可逆性相転移物質としての使用に適した物質の例には、パラフィンろう、ポロキサマー類、ポリラクトン類、パラフィンろう、ポリ(N−イソプロピルアクリルアミド)ホモポリマー、ポリ(N−イソプロピルアクリルアミド)アクリルアミドコポリマー、[3−(メタクリロイルオキシ)プロピル]トリメトキシシラン、[2−(メタクリロイルオキシ)エトキシ]−トリメチルシランおよびメタクリロイルオキシ)トリメチルシランから選択されるシランモノマーを含有するポリ(N−イソプロピルアクリルアミド)のコポリマー、ポリ(ヒドロキシプロピルメタクリルアミド)のコポリマー、ジカルボキシメチルアミノプロピルメタクリルアミド、キシログルカン、エチル(ヒドロキシエチル)セルロース、ポリ(エチレンオキシド−b−プロピレンオキシド−b−エチレンオキシド)およびそのコポリマー、ポリ(エチレンオキシド)/(D,L−乳酸−co−グリコール酸)コポリマー類、キトサンおよびポリオール塩類の組み合わせ、ポリ(シラミン)(poly(silamine))、ならびにポリ(オルガノホスファゼン)、ポリ(α−ヒドロキシ酸類)、ポリ(ラクチド−co−グリコリド)(PLGAまたはPLG)、ポリラクチド(PLA)、ポリグリコリド(PG)、ポリエチレングリコール(PEG)、mPEG、ポリ(アルファ−ヒドロキシ酸類)のPEGコンジュゲート、ポリオルトエステル類、ポリアスピリン類、ポリホスファゲン類(polyphosphagenes)、コラーゲン、デンプン、予めゼラチン化されたデンプン、ヒアルロン酸、キトサン類、ゼラチン、アルギネート類、アルブミン、フィブリン、ビタミンE類似体、例えばアルファトコフェリルアセテート、d−アルファトコフェリルスクシネート、D,L−ラクチド、またはL−ラクチド−ε−カプロラクトン、デキストラン類、ビニルピロリドン、ポリビニルアルコール(PVA)、PVA−g−PLGA、PEGT−PBTコポリマー(polyactive)、メタクリレート類、ポリ(N−イソプロピルアクリルアミド)、PEO−PPO−PEO(pluronics)、PEO−PPO−PAAコポリマー類、PLGA−PEO−PLGA、PEG−PLG、PLA−PLGA、ポロキサマー407、PEG−PLGA−PEGトリブロックコポリマー類、SAIB(スクロースアセテートイソブチレート)またはそれらの組み合わせが含まれる。薬物デポーにおける使用に適した可逆性相転移物質が米国特許第5,226,902号において記述されている。この特許の全開示を本明細書により本出願中に援用する。
【0101】
一部の態様において、その可逆性相転移物質は、温度の変化に反応して膨張する、または縮む熱感受性ヒドロゲルを含む。例えば、特定の態様において、そのようなヒドロゲル中に組み込まれた鎮痛剤および/または抗炎症剤は、そのヒドロゲルが温度変化に反応して、例えば加熱により縮む際に放出されるであろう。逆に、そのようなヒドロゲルが続いてそれが再膨張する適切な温度まで冷却された場合、薬物デポー中の残りの薬物はヒドロゲル中に再度組み戻され、そうして放出は減少するであろう。また、この態様において、冷気が適用された際、薬物はそのポリマー中でより可溶性が低いと考えられ、薬物デポーからのより少ない放出が存在するであろう。従って、薬物のヒドロゲルからの利用可能性および/または放出を制御することができる。
【0102】
ヒドロゲルには、例えばゼラチン、ゼラチン、コラーゲン、絹、エラスチン、フィブリンのような天然ヒドロゲル、およびアガロースのような多糖類に由来するポリマー、およびキトサン、グルコマンナンゲル、ヒアルロン酸、多糖類、例えば架橋されたカルボキシル含有多糖類、またはそれらの組み合わせが含まれる。合成ヒドロゲルには、ポリビニルアルコール、アクリルアミド類、例えばポリアクリル酸およびポリ(アクリロニトリル−アクリル酸)、ポリウレタン類、ポリエチレングリコール(例えば、PEG 3350、PEG 4500、PEG 8000)、シリコン、ポリオレフィン類、例えばポリイソブチレンおよびポリイソプレン、シリコンおよびポリウレタンのコポリマー、ネオプレン、ニトリル、硫化ゴム、ポリ(N−ビニル−2−ピロリドン)、アクリレート類、例えばポリ(2−ヒドロキシエチルメタクリレート)、ならびにアクリレート類のN−ビニルピロリドン、N−ビニルラクタム類とのコポリマー、ポリアクリロニトリル、またはそれらの組み合わせから形成される合成ヒドロゲルが含まれるが、それらに限定されない。そのヒドロゲル材料はさらに、必要に応じてさらなる強度を提供するために架橋されてよい。異なるタイプのポリウレタン類の例には、熱可塑性もしくは熱硬化性ポリウレタン類、脂肪族もしくは芳香族ポリウレタン類、ポリエーテルウレタン、ポリカーボネート−ウレタン、またはシリコンポリエーテル−ウレタン、またはそれらの組み合わせが含まれる。
【0103】
様々な態様において、そのポリマー(可逆性相転移物質および/または継続放出ポリマーが含まれる)はその薬物デポーの少なくとも98または99.5重量%、少なくとも95重量%、少なくとも90重量%、少なくとも85重量%、少なくとも80重量%、少なくとも75重量%、少なくとも70重量%、少なくとも65重量%、少なくとも60重量%、少なくとも55重量%、少なくとも50重量%、少なくとも45重量%、少なくとも40重量%、少なくとも35重量%、少なくとも30重量%、少なくとも25重量%、少なくとも20重量%、少なくとも15重量%、少なくとも10重量%、少なくとも5重量%を構成してよい。
【0104】
一部の態様において、その可逆性相転移物質に関して、その物質に関するガラス転移温度(Tg)は、その鎮痛剤および/または抗炎症剤の標的化された制御された送達に必要な1つのパラメーターである可能性がある。その薬物デポーの温度がそのガラス転移温度Tgより上である場合、一部の態様において、そのポリマーはゴム状になり、そうしてその薬物の拡散係数およびその可逆性相転移物質の透過性を増大させ、それは可逆性相転移物質からの薬物の放出を、従ってその薬物デポーからの薬物の放出を増大させる。一部の態様において、その薬物デポーの温度がそのTgよりも下である場合、その可逆性相転移ポリマーはガラス質になり、これは薬物の拡散係数および透過性の減少を引き起こし、従ってその可逆性相転移物質およびその薬物デポーからの放出を減少させるであろう。一部の態様において、その可逆性相転移物質および/またはその薬物デポーは体温(36℃〜38℃)よりも低いTgを有する。一部の態様において、その可逆性相転移物質および/またはその薬物デポーは体温(36℃〜38℃)よりも高いTgを有する。
【0105】
一部の態様において、そのTgは、その転移が患者を火傷させない温度で達成され得るように、約30℃〜40℃である。そのポリマーに関する低すぎるTgは、そのポリマーが非常にゴム状であり、その領域を加熱することが放出速度の増大に限られた作用しか有しないであろうことを意味するであろう。
【0106】
その薬物デポーは可逆性相転移物質を1種類以上の生分解性ポリマーとの組み合わせで含むことができ、それは可逆性相転移に望まれる特性を与え、鎮痛剤および/または抗炎症剤に望まれる継続放出特性を与える。例えば、一部の態様において、その薬物デポーは1つ以上の層(単数または複数)中に可逆性相転移物質を有していてよく、それは大量瞬時投与量の鎮痛剤および/または抗炎症剤を、皮膚の下の部位において、熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギー、光、機械的エネルギー(例えば撹拌またはマッサージ)、電気的、化学的、もしくは磁気エネルギーがそれに適用された際に放出することができる。これは即時放出層(単数または複数)であると考えられ、薬物デポーは1つ以上の継続放出層(単数または複数)も有していてよく、それは生分解性であり、10日間までのより長い期間にわたって鎮痛剤および/または抗炎症剤を放出することができる。このようにして、術後痛および/または炎症および突発痛および/または炎症を同時に処置することができる。
【0107】
その使用はその薬物デポーからの鎮痛剤および/または抗炎症剤の標的化された制御された送達にプラスの相乗作用をもたらすことも見いだされた。患者が皮膚において鎮静(soothing)を感じるだけでなく、その薬物デポーからの放出が増大し、“割り増し用量(extra dose)”が提供されると考えられ、それは追加の軽減を提供するであろう。
【0108】
薬物デポーが埋め込まれた部位の付近の皮膚に、いずれかの冷気の源により冷気を適用することができる。その冷気の源は皮膚を通してその薬物デポーの周囲の領域に、およびその薬物デポー自体に冷気を伝え、可逆性相転移物質の変化(例えば、固体が液体に、固体が半固体に、半固体が液体に、液体が固体に、液体が半固体に、または半固体が固体に)を引き起こし、その薬物デポーからの鎮痛剤および/または抗炎症剤の放出の増大または減少を引き起こすであろう。適切な冷気の源には、アイスパック、冷パック、冷液、または吸熱冷パック、吸熱冷パッド、電気式冷パッドもしくは電気式冷パック、または同様のものが含まれる。その冷気(例えば0℃〜30℃)は皮膚の温度を体温よりも低くし、その薬物デポーが0℃〜30℃の温度に達した際、これはその薬物デポーからの薬物の放出の増大または減少を引き起こす。
【0109】
薬物デポーが埋め込まれた部位の付近の皮膚に、いずれかの熱源により熱を適用することができる。その熱源は皮膚を通してその薬物デポーの周囲の環境に、次いでその薬物デポー自体に熱を伝え、可逆性相転移物質の変化(例えば、固体が液体に、固体が半固体に、半固体が液体に、液体が固体に、液体が半固体に、または半固体が固体に)を引き起こし、それは薬物デポーからの鎮痛剤および/または抗炎症剤の放出の増大または減少を引き起こす。適切な熱源には、温パック、加温パッド、温液、または放熱温パック、放熱頭パッド(head pads)、電気式加温パッド、電気式加温パック、または同様のものが含まれる。その熱(例えば39℃より高い)は皮膚の温度を体温よりも高くし、その薬物デポーが39℃より高い温度(例えば40℃〜45℃)に達した際、これはその薬物デポーからの薬物の放出の増大または減少を引き起こす。
【0110】
図1は、薬物デポー内部に薬物14(例えば抗炎症剤、筋弛緩剤、および/または鎮痛剤)を保持する可逆性相転移物質12の層を有する埋め込み式薬物デポー10の態様の拡大した側断面図である。この図説された態様において、その薬物デポーには熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギーが適用されておらず、その薬物は時間の経過に伴う持続放出特性を示すであろう。
【0111】
熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギーはその薬物デポーが埋め込まれた部位の付近の患者の皮膚に適用される。その熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギーは、皮膚を通って、その埋め込まれた薬物デポーの周囲の環境に、次いでその薬物デポー自体に伝わるであろう。これはその薬物の大量瞬時投与量の放出またはバースト放出を引き起こすであろう。
【0112】
図2は、それに熱を適用した際に液体状態に変化して薬物デポーからの鎮痛剤および/または抗炎症剤14の放出を引き起こす可逆的相転移物質12の層を有する埋め込み式薬物デポー10の態様の拡大した側断面図である。その熱は、患者の皮膚を通って、その埋め込まれた薬物デポーの周囲の環境に、次いでその薬物デポー自体に伝わるであろう。これは標的組織部位において薬物16の大量瞬時投与量の放出またはバースト放出を引き起こし、患者に鎮痛剤および/または抗炎症剤の“割り増し用量”を提供すると考えられ、それはさらなる軽減を引き起こすであろう。そのような態様は、術後の突発痛を低減、処置または予防するのに特に有用である。例えば、手術の後、“突発痛”(連続的な“ベースラインの”痛みに加えて突然増大した、比較的短く続く痛み)が起こる可能性がある。温度で制御される薬物デポーの助けにより、突発痛を制御することができる。突発痛のエピソードが起こった際、より多くの鎮痛剤および/または抗炎症剤を標的組織部位に送達するため、患者または保健開業医は熱源(例えば温パッチ)または冷気の源(例えば冷パッチ)を患者の皮膚または薬物デポーが埋め込まれた部位に、その痛みおよび/または炎症が緩和されるまで適用する。その加温パッチまたは冷パッチの継続期間は、好ましくは十分な割り増しの鎮痛剤および/または抗炎症剤を送達するのに十分に長いが、患者に危険をもたらす可能性のある鎮痛剤および/または抗炎症剤の割り増し量を送達するほど十分に長くはないように設定される。その患者および/または保健開業医は、その突発痛が減少し始めた時に温パッチまたは冷パッチを取り外すこともできる。
【0113】
本出願は、患者に制御される鎮痛(以下“PCA”)における使用に適しており、ここで患者は彼/彼女が必要性を感じた時に彼自身または彼女自身に鎮痛剤および/または抗炎症剤の用量を与える。その用量および投与頻度の範囲は、通常は保健開業医(例えばケアをする医師、看護師等)により設定される。多くのPCAの状況において、患者はベースライン速度の鎮痛剤および/または抗炎症剤を与えられ、彼/彼女がそれが必要であると感じた時に割り増しの大量瞬時投与量の鎮痛剤および/または鎮痛剤を得る。本出願における技術はPCAのために用いることができ、ここで患者はその薬物デポーからベースライン用量を得て、その薬物デポーが埋め込まれた皮膚の領域を加熱または冷却することにより割り増し(“レスキュー”)用量または大量瞬時投与量を得る。例えば、その薬物デポーは表皮、真皮、または皮下組織の1〜5mm以内に埋め込まれてよく、熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギーをその皮膚に適用して鎮痛剤、筋弛緩剤および/または抗炎症剤のその薬物デポーからこの領域中への大量瞬時投与量の放出を引き起こす。このようにして、その薬物デポーは痛みおよび/または炎症の即時放出および持続放出処置を提供する。
【0114】
図3は、手の手術の後に手26に、薬物デポー28が皮膚22の下に埋め込まれた領域付近に適用された冷または温パック31を図説する1態様の透視図である。その冷または温パック31は手26を差し込むための開口部24を有し、ここで指21および25をその開口部の中に差し込むことができる。その冷または温パックは、場合により手をそれがパックの中にある間固定するためのスタンド30を有することができる。ここで、皮膚領域22への冷気または熱の適用は、熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギーを薬物デポーの周囲の環境および薬物デポー28に伝わらせ、それは可逆的相転移物質の相の変化を引き起こし(例えば、固体が液体に、固体が半固体に、半固体が液体に、等)、大量瞬時投与量または“レスキュー用量”または“割り増し用量”の鎮痛剤および/または抗炎症剤を患者に放出し、それは痛みおよび/または炎症のエピソードを低減、予防または処置するであろう。その患者は、その痛みおよび/または炎症が減少し始めた時に冷または温パックを取り外してもよく、その薬物デポーは予定された継続放出期間をかけての鎮痛剤および/または抗炎症剤の放出に戻るであろう。手の領域を示したが、その薬物デポーは、少なくとも1つの筋肉、靭帯、腱、軟骨、足、指、趾、手、手首、歯肉、顎、膝関節、椎間板、脊髄神経根付近の脊椎孔空間、または脊椎管を含むがそれらに限定されない皮膚の下のあらゆる部位に送達されることができる。
【0115】
典型的には、その薬物デポーは、生分解性であることができる生体適合性物質を含む固体または半固体の配合物であろう。用語“固体”は堅い物質を意味することを意図し、一方“半固体”はある程度の柔軟性を有し、それによりそのデポーが曲がって周囲の組織の要求に従うことを可能にする物質を意味することを意図する。半固体の物質の例はゲルである。液体という用語には、療法剤を含有する溶液、懸濁液および/またはスラリーが含まれる。
【0116】
様々な態様において、薬物デポーは生分解性でなくてよい。例えば、薬物デポーはポリウレタン、ポリ尿素、ポリエーテル(アミド)、PEBA、熱可塑性エラストマーオレフィン、コポリエステル、およびスチレン系熱可塑性エラストマー、鋼、アルミニウム、ステンレス鋼、チタン、高非鉄金属含有量および低相対比率の鉄を有する金属合金、炭素繊維、ガラス繊維、プラスチック、セラミックス、またはそれらの組み合わせを含んでいてよい。典型的には、これらのタイプの薬物デポーは取り除かれる必要がある可能性がある。
【0117】
生分解性デポー
ある場合では、薬物デポーを使用後に取り除かなければならないことを回避することが望ましい可能性がある。これらの場合において、そのデポーは生分解性材料を含んでいてよい。この目的に利用可能であり、標的組織またはその付近に配置された際に延長された期間にわたって分解または崩壊することができるという特徴を有する、数多くの材料が存在する。生分解性材料の化学的性質の関数として、その分解プロセスの機構は本質的に加水分解的または酵素的、または両方である可能性がある。様々な態様において、その分解は薬物送達系デポーの表面で(不均一な、または表面の侵食)、またはその全体にわたって均一に(均一な、または大部分の(bulk)侵食)のどちらかで起こり得る。
【0118】
様々な態様において、そのデポーは少なくとも1種類の鎮痛剤および/または少なくとも1種類の抗炎症剤の即時放出または持続放出を提供することができる、生体吸収性および/または生分解性のバイオポリマーを含んでいてよい。適切な持続放出バイオポリマーの例には以下のものが含まれるが、それらに限定されない:ポリ(アルファ−ヒドロキシ酸類)、ポリ(ラクチド−co−グリコリド)(PLGAまたはPLG)、ポリラクチド(PLA)、ポリグリコリド(PG)、ポリ(アルファ−ヒドロキシ酸類)のポリエチレングリコール(PEG)コンジュゲート、ポリオルトエステル類、ポリアスピリン類、ポリホスファゲン類(polyphosphagenes)、コラーゲン、デンプン、予めゼラチン化されたデンプン、ヒアルロン酸、キトサン類、ゼラチン、アルギネート類、アルブミン、フィブリン、ビタミンE類似体、例えばアルファトコフェリルアセテート、d−アルファトコフェリルスクシネート、D,L−ラクチド、またはL−ラクチド, ,−カプロラクトン、デキストラン類、ビニルピロリドン、ポリビニルアルコール(PVA)、PVA−g−PLGA、PEGT−PBTコポリマー(polyactive)、メタクリレート類、ポリ(N−イソプロピルアクリルアミド)、PEO−PPO−PEO(pluronics)、PEO−PPO−PAAコポリマー類、PLGA−PEO−PLGA、PEG−PLG、PLA−PLGA、ポロキサマー407、PEG−PLGA−PEGトリブロックコポリマー類、SAIB(スクロースアセテートイソブチレート)またはそれらの組み合わせ。当業者は気付いているように、PLGAの可塑剤としてmPEGを用いてよいが、同じ効果を達成するために他のポリマー/賦形剤を用いてもよい。mPEGは得られる配合物に可鍛性を付与する。
【0119】
ポリマーの異なる組み合わせを用いる場合(2元、3元(例えば、PLGA−PEO−PLGA)、またはターポリマー)、それらは様々なモル比、1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、または10:1で用いられてよい。様々な態様において、130日間の放出に関して、デポーは50:50 PLGA〜100 PLAを含む。分子量の範囲は0.45〜0.8dI/gである。
【0120】
様々な態様において、ポリマーの分子量は広い範囲の値であることができる。ポリマーの平均分子量は、約1000から約10,000,000まで;または約1,000から約1,000,000まで;または約5,000から約500,000まで;または約10,000から約100,000まで;または約20,000から50,000までであることができる。
【0121】
一部の態様において、その少なくとも1種類の生分解性ポリマーは、ポリ(乳酸−co−グリコール酸)(PLA)またはポリ(オルトエステル)(POE)、またはそれらの組み合わせを含む。そのポリ(乳酸−co−グリコール酸)はポリグリコリド(PGA)およびポリラクチドの混合物を含んでよく、一部の態様において、その混合物中にはポリグリコリドより多くのポリラクチドが存在する。様々な他の態様において、100%のポリラクチドおよび0%のポリグリコリド;95%のポリラクチドおよび5%のポリグリコリド;90%のポリラクチドおよび10%のポリグリコリド;85%のポリラクチドおよび15%のポリグリコリド;80%のポリラクチドおよび20%のポリグリコリド;75%のポリラクチドおよび25%のポリグリコリド;70%のポリラクチドおよび30%のポリグリコリド;65%のポリラクチドおよび35%のポリグリコリド;60%のポリラクチドおよび40%のポリグリコリド;55%のポリラクチドおよび45%のポリグリコリド;50%のポリラクチドおよび50%のポリグリコリド;45%のポリラクチドおよび55%のポリグリコリド;40%のポリラクチドおよび60%のポリグリコリド;35%のポリラクチドおよび65%のポリグリコリド;30%のポリラクチドおよび70%のポリグリコリド;25%のポリラクチドおよび75%のポリグリコリド;20%のポリラクチドおよび80%のポリグリコリド;15%のポリラクチドおよび85%のポリグリコリド;10%のポリラクチドおよび90%のポリグリコリド;5%のポリラクチドおよび95%のポリグリコリド;ならびに0%のポリラクチドおよび100%のポリグリコリドが存在する。
【0122】
ポリラクチドおよびポリグリコリドの両方を含む様々な態様において、少なくとも95%のポリラクチド;少なくとも90%のポリラクチド;少なくとも85%のポリラクチド;少なくとも80%のポリラクチド;少なくとも75%のポリラクチド;少なくとも70%のポリラクチド;少なくとも65%のポリラクチド;少なくとも60%のポリラクチド;少なくとも55%;少なくとも50%のポリラクチド;少なくとも45%のポリラクチド;少なくとも40%のポリラクチド;少なくとも35%のポリラクチド;少なくとも30%のポリラクチド;少なくとも25%のポリラクチド;少なくとも20%のポリラクチド;少なくとも15%のポリラクチド;少なくとも10%のポリラクチド;または少なくとも5%のポリラクチドが存在し;そのバイオポリマーの残りの部分がポリグリコリドである。
【0123】
様々な態様において、その薬物デポーはポリ(ラクチド−co−グリコリド)(PLGA)、ポリラクチド(PLA)、ポリグリコリド(PGA)、D−ラクチド、D,L−ラクチド、L−ラクチド、D,L−ラクチド−ε−カプロラクトン、D,L−ラクチド−グリコリド−ε−カプロラクトン、グリコリド−カプロラクトンまたはそれらの組み合わせを含む。
【0124】
当業者が気付くように、異なる末端基を有するポリマーのブレンドを有する埋め込み式エラストマー性デポー組成物を用いると、結果として得られる配合物はより低いバースト指数(burst index)および調節された送達期間を有するであろう。例えば、酸(例えば、カルボン酸)およびエステル末端基(例えば、ラウリル、メチル、またはエチルエステル末端基)を有するポリマーを用いてよい。
【0125】
加えて、ポリマーを形成する様々なモノマーのコモノマー比(例えば、所与のポリマーに関するL/G/CLまたはG/CL比)を変化させることにより、調節されたバースト指数および送達期間を有するデポー組成物が得られるであろう。例えば、L/G比が50:50であるポリマーを有するデポー組成物は、約2日から約1ヶ月までの範囲の短い送達期間を有する可能性があり;L/G比が65:35であるポリマーを有するデポー組成物は、約2ヶ月の送達期間を有する可能性があり;L/G比が75:25である、またはL/CL比が75:25であるポリマーを有するデポー組成物は、約3ヶ月〜約4ヶ月の送達期間を有する可能性があり;L/G比が85:15であるポリマー比を有するデポー組成物は、約5ヶ月の送達期間を有する可能性があり;L/CL比が25:75またはPLAであるポリマーを有するデポー組成物は、6ヶ月以上の送達期間を有する可能性があり;Gが50%より大きく、Lが10%より大きいCL/G/L(CLはカプロラクトンを指し、Gはグリコール酸を指し、そしてLは乳酸を指す)のターポリマーを有するデポー組成物は、約1ヶ月の送達期間を有する可能性があり、Gが50%未満でありLが10%未満であるCL/G/Lのターポリマーを有するデポー組成物は、6ヶ月までの期間を有する可能性がある。一般に、CL含有量に比してG含有量を高めると送達期間が短くなり、一方G含有量に比してCL含有量を高めると送達期間が長くなる。
【0126】
一部の態様において、その生分解性ポリマーはその配合物の少なくとも10重量%、少なくとも50重量%、少なくとも60重量%、少なくとも70重量%、少なくとも80重量%、少なくとも85重量%、少なくとも90重量%、少なくとも95重量%、または少なくとも99重量%を構成する。一部の態様において、少なくとも1種類の生分解性ポリマーおよび少なくとも1種類の鎮痛剤および/または抗炎症剤だけがその医薬配合物の構成要素である。
【0127】
一部の態様において、薬物デポー中の粒子の少なくとも75%が約1マイクロメートルから約200マイクロメートルまでの大きさを有する。一部の態様において、薬物デポー中の粒子の少なくとも85%が約1マイクロメートルから約100マイクロメートルまでの大きさを有する。一部の態様において、薬物デポー中の粒子の少なくとも95%が約5マイクロメートルから約50マイクロメートルまでの大きさを有する。一部の態様において、薬物デポー中の粒子の全てが約10マイクロメートルから約50マイクロメートルまでの大きさを有する。
【0128】
一部の態様において、薬物デポー中の粒子の少なくとも75%が約5マイクロメートルから約20マイクロメートルまでの大きさを有する。一部の態様において、薬物デポー中の粒子の少なくとも85%が約5マイクロメートルから約20マイクロメートルまでの大きさを有する。一部の態様において、薬物デポー中の粒子の少なくとも95%が約5マイクロメートルから約20マイクロメートルまでの大きさを有する。一部の態様において、薬物デポー中の粒子の全てが約5マイクロメートルから約20マイクロメートルまでの大きさを有する。
【0129】
そのデポーは場合により不活性な物質、例えば緩衝剤およびpH調節剤、例えば炭酸水素カリウム、炭酸カリウム、水酸化カリウム、酢酸ナトリウム、ホウ酸ナトリウム、炭酸水素ナトリウム、炭酸ナトリウム、水酸化ナトリウム、またはリン酸ナトリウム;分解/放出調節剤;薬物放出調整剤;乳化剤;保存剤、例えば塩化ベンザルコニウム、クロロブタノール、酢酸フェニル水銀および硝酸フェニル水銀、亜硫酸水素ナトリウム、硫酸水素ナトリウム、チオ硫酸ナトリウム、チメロサール、メチルパラベン、ポリビニルアルコールおよびフェニルエチルアルコール;溶解性調整剤;安定剤;および/または凝集調節剤を含有していてよい。これらの不活性な成分は、療法剤(単数または複数)を運ぶこと、安定化すること、およびその放出を制御することを含む多機能性の目的を有していてよい。例えば、持続放出目的は溶解−拡散機構によってよく、またはそれは侵食−持続(erosion−sustained)プロセスにより支配されてよい。典型的には、あらゆるそのような物質は0〜75重量%の範囲内で、より典型的には0〜30重量%の範囲内で存在するであろう。そのデポーを脊椎領域に配置する場合、様々な態様において、そのデポーは無菌で保存剤なしの物質を含んでいてよい。
【0130】
そのデポーは様々な大きさ、形状、および構成であることができる。薬物デポーの大きさ、形状、および構成の決定において、考慮することができるいくつかの因子が存在する。例えば、大きさおよび形状は共に、埋め込みまたは注射の部位として選択される標的組織部位に薬物デポーを配置することを容易にすることを可能にする可能性がある。加えて、その系の形状および大きさは、薬物デポーが埋め込みまたは注射の後で動くことを最小にする、または防ぐように選択されるべきである。様々な態様において、その薬物デポーは、ペレット、球、円柱、例えば棒もしくは繊維、平坦な表面、例えば円板、フィルム、もしくはシート、または同様のもののような形状にすることができる。柔軟性は、薬物デポーの配置を容易にするための考慮事項である可能性がある。様々な態様において、その薬物デポーは異なる大きさであることができ、例えば、その薬物デポーは約0.5mmから5mmまでの長さであってよく、約0.01から約2mmまでの直径を有していてよい。様々な態様において、その薬物デポーは約0.005から1.0mmまで、例えば0.05から0.75mmまでの層の厚さを有していてよい。
【0131】
様々な態様において、薬物デポーがペレットを含む場合、それは切開部位に、その部位を閉じる前に置かれてよい。そのペレットは、例えば熱可塑性材料から作ることができる。加えて、そのペレットにおける使用に関して好都合である可能性のある具体的な材料には、上記で持続放出バイオポリマーとして同定した化合物が含まれるが、それらに限定されない。その薬物デポーは、少なくとも1種類の鎮痛剤および/または抗炎症剤をそのポリマーと混合することにより形成されてよい。
【0132】
使用者が薬物デポーを患者の標的部位の中に正確に配置することを可能にするために、X線撮影用マーカーをその薬物デポーの上に含ませることができる。これらのX線撮影用マーカーは、使用者がデポーのその部位での動きおよび分解を経時的に追跡することも可能にするであろう。この態様において、使用者は、数多くの診断画像化手法のいずれかを用いてデポーをその部位において正確に配置することができる。そのような診断画像化手法には、例えばX線造影法または蛍光透視法が含まれる。そのようなX線撮影用マーカーの例には、バリウム、リン酸カルシウム、および/または金属のビーズまたは粒子が含まれるが、それらに限定されない。様々な態様において、そのX線撮影用マーカーはデポーを囲む球状の形状または輪であることができるであろう。
【0133】
ゲル
様々な態様において、その薬物デポーは約1〜約500センチポアズ(cps)、1〜約200cps、または1〜約100cpsの範囲の投薬前粘度を有するゲルを含む。そのゲルが標的部位へ投与された後、そのゲルの粘度は増大すると考えられ、そのゲルは約1×104〜約6×105ダイン/cm2、または2×104〜約5×105ダイン/cm2、または5×104〜約5×105ダイン/cm2の範囲の弾性係数(ヤング率)を有するであろう。
【0134】
1態様において、ゲル全体にわたって均等に分布している少なくとも1種類の鎮痛剤および/または抗炎症剤を含む接着性ゲルを含有するデポーを提供する。そのゲルは前に示したようなあらゆる適切なタイプのものであってよく、一度配置されたらそのゲルがその標的化された送達部位から移動することを防ぐために十分に粘稠であるべきであり;そのゲルはその標的化された組織部位に事実上“粘着”または接着するべきである。そのゲルは、例えば、標的化された組織との接触の際に、または標的化された送達系からの配置の後で固化してよい。その標的化された送達系は、例えば、注射器、カテーテル、針、またはカニューレ、またはあらゆる他の適切なデバイスであってよい。その標的化された送達系は、標的化された組織部位の中または上にゲルを注入することができる。療法剤は、標的化された組織部位にゲルが配置される前にゲルの中に混合されてよい。様々な態様において、そのゲルは2構成要素送達系の一部であってよく、その2種類の構成要素が混合された際に、化学的プロセスが活性化されてゲルを形成してそれの標的部位への粘着または接着を引き起こす。
【0135】
様々な態様において、送達後に硬化する、または堅くなるゲルを提供する。典型的には、硬化ゲル配合物は約1×104〜約3×105ダイン/cm2、または2×104〜約2×105ダイン/cm2、または5×104〜約1×105ダイン/cm2の範囲の投薬前弾性係数を有していてよい。投薬後(送達後)の硬化ゲルはゴムのような粘稠度を有していてよく、約1×104〜約2×106ダイン/cm2、または1×105〜約7×105ダイン/cm2、または2×105〜約5×105ダイン/cm2の範囲の弾性係数を有していてよい。
【0136】
様々な態様において、ポリマーを含有するゲル配合物に関して、ポリマー濃度がゲルが硬化する速度に影響を及ぼす可能性がある(例えば、より高濃度のポリマーを有するゲルは、より低濃度のポリマーを有するゲルよりも急速に凝固する可能性がある)。様々な態様において、ゲルが硬化する際、結果として得られるマトリックスは固体であるが、組織の不規則な表面(例えば骨の陥凹および/または突起)に従うこともできる。
【0137】
ゲル中に存在するポリマーの百分率は、ポリマー性組成物の粘度にも影響を及ぼす可能性がある。例えば、より高いポリマーの重量百分率を有する組成物は、典型的には、より低いポリマーの重量百分率を有する組成物よりも濃厚でより粘稠である。より粘稠な組成物は、よりゆっくり流動する傾向がある。従って、いくつかの場合では、より低い粘度を有する組成物が好ましい可能性がある。
【0138】
様々な態様において、そのゲルの分子量は、当技術で既知の多くの方法のいずれか1つにより変化させることができる。分子量を変化させる方法の選択は、典型的には、ゲルの組成(例えば、ポリマー対非ポリマー)により決定される。例えば、様々な態様において、ゲルが1種類以上のポリマーを含む場合、重合化の程度は、ポリマー開始剤(例えば、過酸化ベンゾイル)、有機溶媒または活性化剤(例えば、DMPT)、架橋剤、重合剤の量、および/または反応時間を変化させることにより制御することができる。
【0139】
適切なゲルポリマーは有機溶媒中で可溶性であってよい。ポリマーの溶媒中での溶解性は、ポリマーの結晶性、疎水性、水素結合および分子量によって様々である。より低い分子量のポリマーは通常有機溶媒中で高分子量のポリマーよりも容易に溶けるであろう。高分子量ポリマーが含まれるポリマーゲルは、低分子量ポリマーが含まれるポリマー組成物よりも急速に凝固または固化する傾向がある。高分子量ポリマーが含まれるポリマーゲル配合物は、低分子量ポリマーが含まれるポリマーゲルよりも高い溶液の粘度を有する傾向もある。
【0140】
そのゲルを流動可能なゲルであるように設計する場合、それは、ゲル中で用いられるポリマーの分子量および濃度に依存して、水の粘度に類似した低粘度からペーストの粘度に類似した高粘度まで様々であることができる。そのゲルの粘度は、そのポリマー組成物をあらゆる一般に用いられる技法により、例えばブラッシング、噴霧、滴下、注射、または塗布により患者の組織に摘要することができるように変化させることができる。ゲルの様々な粘度は、組成物を適用するために用いられる技法に依存するであろう。
【0141】
様々な態様において、そのゲルは、ゲルの分子量および分解時間の尺度である固有粘度(“I.V.”と略され、単位はデシリットル/グラムである)を有する(例えば、高い固有粘度を有するゲルは、より高い分子量およびより長い分解時間を有する)。典型的には、高分子量を有するゲルはより強いマトリックスを提供し、そのマトリックスは分解するのにより多くの時間がかかる。対照的に、低分子量を有するゲルはより急速に分解し、より軟らかいマトリックスを提供する。様々な態様において、そのゲルは約0.10dL/gから約1.2dL/gまで、または約0.10dL/gから約0.40dL/gまでの固有粘度により示されるような分子量を有する。
【0142】
様々な態様において、そのゲルは約300〜約5,000センチポアズ(cp)の粘度を有し得る。他の態様において、そのゲルは室温で約5から約300cpsまで、約10cpsから約50cpsまで、約15cpsから約75cpsまでの粘度を有し得る。そのゲルは場合により、例えばヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ヒドロキシエチルメチルセルロース、カルボキシメチルセルロースおよびその塩類、Carbopol、ポリ(ヒドロキシエチルメタクリレート)、ポリ(メトキシエチルメタクリレート)、ポリ(メトキシエトキシエチルメタクリレート)、ポリメチルメタクリレート(PMMA)、メチルメタクリレート(MMA)、ゼラチン、ポリビニルアルコール、プロピレングリコール、PEG 200、PEG 300、PEG 400、PEG 500、PEG 600、PEG 700、PEG 800、PEG 900、PEG 1000、PEG 1450、PEG 3350、PEG 4500、PEG 8000、またはそれらの組み合わせのような粘度増強剤を有していてよい。
【0143】
様々な態様において、ゲルにおいてポリマーが用いられる際、そのポリマー性組成物には約10重量%〜約90重量%または約30重量%〜約60重量%のポリマーが含まれる。
【0144】
様々な態様において、そのゲルは合成または天然起源の高分子量の生体適合性エラストマーポリマーから作られたヒドロゲルである。そのヒドロゲルが有するべき望ましい特性は、人体中で機械的ストレス、特に剪断および荷重に迅速に反応する能力である。
【0145】
天然源から得られたヒドロゲルは、それらがインビボでの適用のために生分解性かつ生体適合性である可能性がより高いため、特に魅力的である。適切なヒドロゲルには、例えばゼラチン、コラーゲン、絹、エラスチン、フィブリンのような天然ヒドロゲル、およびアガロースのような多糖類に由来するポリマー、およびキトサン、グルコマンナンゲル、ヒアルロン酸、多糖類、例えば架橋されたカルボキシル含有多糖類、またはそれらの組み合わせが含まれる。合成ヒドロゲルには、ポリビニルアルコール、アクリルアミド類、例えばポリアクリル酸およびポリ(アクリロニトリル−アクリル酸)、ポリウレタン類、ポリエチレングリコール(例えば、PEG 3350、PEG 4500、PEG 8000)、シリコン、ポリオレフィン類、例えばポリイソブチレンおよびポリイソプレン、シリコンおよびポリウレタンのコポリマー、ネオプレン、ニトリル、硫化ゴム、ポリ(N−ビニル−2−ピロリドン)、アクリレート類、例えばポリ(2−ヒドロキシエチルメタクリレート)、ならびにアクリレート類のN−ビニルピロリドン、N−ビニルラクタム類とのコポリマー、ポリアクリロニトリル、またはそれらの組み合わせから形成される合成ヒドロゲルが含まれるが、それらに限定されない。そのヒドロゲル材料はさらに、必要に応じてさらなる強度を提供するために架橋されてよい。異なるタイプのポリウレタン類の例には、熱可塑性もしくは熱硬化性ポリウレタン類、脂肪族もしくは芳香族ポリウレタン類、ポリエーテルウレタン、ポリカーボネート−ウレタン、またはシリコンポリエーテル−ウレタン、またはそれらの組み合わせが含まれる。
【0146】
様々な態様において、療法剤をゲルの中に直接混合するのではなく、マイクロスフェアをゲルの内部に分散させてよく、そのマイクロスフェアには少なくとも1種類の鎮痛剤および/または少なくとも1種類の抗炎症剤が装填される。1態様において、マイクロスフェアは少なくとも1種類の鎮痛剤および/または抗炎症剤の持続放出を提供する。さらに別の態様において、生分解性であるゲルはマイクロスフェアが少なくとも1種類の鎮痛剤および/または抗炎症剤を放出するのを妨げ;従ってそのマイクロスフェアはそれがゲルから放出されるまでその少なくとも1種類の鎮痛剤および/または抗炎症剤を放出しない。例えば、標的組織部位(例えば、神経根)の周囲にゲルを配置してよい。ゲルの内部には、望まれる療法剤を封入する(encapsulate)複数のマイクロスフェアが分散している。これらのマイクロスフェアのあるものは、一度ゲルから放出されると分解し、そうしてその少なくとも1種類の鎮痛剤および/または抗炎症剤を放出する。その鎮痛剤および/または抗炎症剤を別々のマイクロスフェアの中に入れてからそのマイクロスフェアを組み合わせてよく、またはまずその有効成分を組み合わせてからマイクロスフェアの中に一緒に入れることができる。
【0147】
マイクロスフェアは、周囲の組織のタイプに依存して、流体と同様に比較的急速に分散し、従って少なくとも1種類の鎮痛剤および少なくとも1種類の抗炎症剤を分散させることができる。一部の態様において、マイクロスフェアの直径は直径約10ミクロンから直径約200ミクロンまでの範囲である。一部の態様において、それらは直径約20から120ミクロンまでの範囲である。マイクロスフェアを作製する方法には、溶媒蒸発、相分離、および流動床コーティングが含まれるが、それらに限定されない。ある状況ではこれが望ましい可能性があり;他の状況では、少なくとも1種類の鎮痛剤および少なくとも1種類の抗炎症剤を明確に定められた標的部位にしっかりと束縛した状態を保つのがより望ましい可能性がある。
【0148】
本発明は、療法剤の分散をそのように束縛するための接着性ゲルの使用も意図している。これらのゲルは、例えば椎間板腔に、脊椎管に、または周囲の組織に配置されてよい。
カニューレおよび針
当業者には、デポーを、薬物送達デバイス、例えば注射器、銃式(gun)薬物送達デバイス、または標的となる器官もしくは解剖学的領域への薬物の適用に適したあらゆる医療用デバイスの一部であることができる“カニューレ”または“針”を用いて標的部位に投与することができることは理解されるであろう。薬物デポーデバイスのカニューレまたは針は、患者に対して肉体的および精神的な外傷を最小限しか引き起こさないように設計される。
【0149】
カニューレまたは針には、例えばポリウレタン、ポリ尿素、ポリエーテル(アミド)、PEBA、熱可塑性エラストマーオレフィン、コポリエステル、およびスチレン系熱可塑性エラストマー、鋼、アルミニウム、ステンレス鋼、チタン、高非鉄金属含有量および低相対比率の鉄を有する金属合金、炭素繊維、ガラス繊維、プラスチック、セラミックス、またはそれらの組み合わせのような材料から作製することができるチューブが含まれる。カニューレまたは針には場合により1箇所以上の先細り領域が含まれていてよい。様々な態様において、そのカニューレまたは針は斜めに切られていてよい。そのカニューレまたは針は、埋め込みのための部位に応じて、患者の正確な処置に必須の先端形式を有していてもよい。先端形式の例には、例えば、トレフィン(Trephine)、クールナン(Cournand)、ベレス(Veress)、フーバー(Huber)、セルジンガー(Seldinger)、チバ(Chiba)、フランシーヌ(Francine)、バイアス(Bias)、クロフォード(Crawford)、偏向先端、ヒューステッド(Hustead)、ランセット(Lancet)、またはTuoheyが含まれる。様々な態様において、そのカニューレまたは針はノンコアリングであり、望まれない針刺しを避けるためにそれを覆う鞘を有していてよい。
【0150】
中空のカニューレまたは針の寸法は、とりわけ埋め込みのための部位に依存するであろう。例えば、硬膜外腔の幅は胸部領域に関して約3〜5mmにすぎず、腰部領域に関して約5〜7mmである。従って、針またはカニューレは、様々な態様において、これらの特定の領域用に設計することができる。様々な態様において、カニューレまたは針は、経椎間孔(transforaminal)アプローチを用いて、例えば炎症した神経根に沿って脊椎孔空間に挿入されてよく、その状態を処置するために薬物デポーをこの部位に埋め込んでよい。典型的には、経椎間孔アプローチは椎間孔を通って椎間腔に接近することを伴う。
【0151】
カニューレまたは針の長さのいくつかの例には、約50から150mmまでの長さ、例えば硬膜外の小児使用に関しては約65mm、標準的な成人用では約85mm、および肥満の成人患者用では約110mmが含まれてよいが、それらに限定されない。カニューレまたは針の厚さも埋め込みの部位に依存するであろう。様々な態様において、その厚さには約0.05から約1.655までが含まれるが、それらに限定されない。カニューレまたは針のゲージは、ヒトまたは動物の身体の中への挿入に関しては、最も広い、もしくは最も小さい直径またはその間の直径であってよい。最も広い直径は典型的には約14ゲージであり、一方で最も小さい直径は約25ゲージである。様々な態様において、針またはカニューレのゲージは約18〜約22ゲージである。
【0152】
様々な態様において、薬物デポーおよび/またはゲルと同様に、カニューレまたは針には、使用者が数多くの診断画像化手法のいずれかを用いてデポーを皮膚の下の部位またはその付近に正確に配置できるように、その部位またはその付近での位置を示す線量X線撮影用マーカーが含まれる。そのような診断画像化手法には、例えばX線造影法または蛍光透視法が含まれる。そのようなX線撮影用マーカーの例には、バリウム、リン酸カルシウム、および/または金属のビーズまたは粒子が含まれるが、それらに限定されない。
【0153】
様々な態様において、針またはカニューレには超音波、蛍光透視法、X線、または他の画像化技法により可視化することができる透明または半透明の部分が含まれていてよい。そのような態様において、その透明または半透明の部分には、その材料または構造的特徴(topography)の非存在時と比較してその針またはカニューレのコントラストを高める、放射線不透過性材料または超音波応答性の構造的特徴が含まれていてよい。
【0154】
滅菌
薬物デポー、および/または薬物を投与するための医療用デバイスは、滅菌可能であってよい。様々な態様において、その薬物デポー、および/または薬物を投与するための医療用デバイスの1つ以上の構成要素は、最終包装時の最終滅菌工程において照射により滅菌される。製品の最終滅菌は、個々の製品の構成要素を別々に滅菌して、最終包装を無菌環境で組立てることが要求される無菌プロセスのようなプロセスからのものよりも大きな無菌状態の保証を提供する。
【0155】
典型的には、様々な態様において、最終滅菌工程においてガンマ線照射を使用し、それはデバイスに深く透過するガンマ線からのイオン化エネルギーを利用することを含む。ガンマ線は微生物を殺すのに非常に有効であり、それらは残留物を残さず、デバイスに放射活性を付与するのに十分なエネルギーも有しない。ガンマ線はそのデバイスが包装の中にある場合に用いることができ、ガンマ線滅菌は高圧も真空条件も必要とせず、従って包装の密封材および他の構成要素に応力がかからない。加えて、ガンマ線照射は透過可能な包装材料の必要性を排除する。
【0156】
様々な態様において、デバイスの1つ以上の構成要素を滅菌するために電子ビーム(e−ビーム)照射を用いてよい。e−ビーム照射は、一般に低い透過率および高い線量率を特徴とするイオン化エネルギーの形態を含む。e−ビーム照射は、微生物の生殖細胞を含め、様々な化学および分子結合を接触時に変化させる点で、ガンマ処理に類似している。e−ビーム滅菌のために生成されるビームは、電気の加速および変換により生成される濃縮された高荷電の電子の流れである。e−ビーム滅菌は、例えば薬物デポーがゲル中に含まれる場合に用いてよい。
【0157】
デポーおよび/またはデバイスの1つ以上の構成要素を滅菌するのに他の方法を用いてもよく、それには例えばエチレンオキシドを用いるようなガス滅菌または蒸気滅菌が含まれるが、それらに限定されない。
【0158】
キット
様々な態様において、キットを提供し、それには薬物デポーおよび/またはその薬物デポー(例えば、ペレット)を埋め込むために一緒に組み合わせて用いられる医療用デバイスと共に、追加の部品が含まれてよい。そのキットには、第一の区画に薬物デポーデバイスが含まれてよい。第二の区画には、薬物デポーおよび局所的な薬物送達に必要とされる他のあらゆる機器を保持するケースが含まれてよい。第三の区画には、埋め込みプロセスの無菌状態を維持するためのグローブ、ドレープ、創傷包帯、および他の手技用品、ならびに取扱説明書が含まれてよい。第四の区画には、追加のカニューレおよび/または針が含まれてよい。第五の区画には、X線造影のための薬剤が含まれてよい。それぞれの道具は、プラスチックの小袋に別々に包装して、それを照射滅菌することができる。キットのカバーには埋め込み手法の図説が含まれてよく、無菌状態を維持するために、その区画に透明なプラスチックカバーをかけてよい。
【0159】
投与
様々な態様において、その鎮痛剤および/または抗炎症剤は非経口的に投与されてよい。用語“非経口”は、本明細書で用いられる際、胃腸管を迂回する投与の形式を指し、例えば、局所化された静脈内、筋肉内の、連続的もしくは断続的な注入、腹腔内、胸骨内、皮下、手術中、髄腔内、椎間板内(intradiscally)、椎間板周囲(peridiscally)、硬膜外、脊椎周囲(perispinally)、関節内の注射、またはそれらの組み合わせが含まれる。
【0160】
本出願の方法は、カニューレを標的組織部位またはその付近に挿入して薬物デポーを患者の皮膚の下の標的部位に埋め込むこと、および薬物デポーを保持する、または標的部位へ接着させるためにゲルを標的部位にブラッシング、滴下、噴霧、注射、または塗布することを含む。このようにして、薬物デポーが標的部位から離れる望まれない移動を低減する、または排除する。
【0161】
様々な態様において、その鎮痛剤および/または抗炎症剤は局所投与されるので、療法上有効用量は他の経路(経口、局部、等)により投与される用量未満であってよい。例えば、薬物デポーから送達される薬物用量は、例えば経口投与量または注射可能な用量の10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、99%、または99.9%未満である可能性がある。一方で、例えば肝トランスアミナーゼ上昇、肝炎、肝不全、ミオパシー、便秘、等のような全身性の副作用を低減または除去することができる。
【0162】
様々な態様において、その中に分散した薬物デポーを有するゲルを望まれる部位に投与するために、初めにカニューレまたは針を皮膚および軟組織を通して標的組織部位に挿入し、ゲルを標的部位またはその付近に投与する(例えば、ブラッシングする、滴下する、注射する、または塗布する、等)ことができる。薬物デポーがゲルから分離している態様では、初めにカニューレまたは針を皮膚および軟組織を通して注射の部位に挿入することができ、1つ以上のゲルの基層(単数または複数)を標的部位に投与することができる。1つ以上の基層(単数または複数)の投与に続き、そのゲルがデポーを適所に保持する、または移動を低減することができるように、薬物デポーを基層(単数または複数)の上または中に埋め込むことができる。必要であれば、薬物デポーを囲んでそれをさらに適所に保持するために、次のゲルの層(単数または複数)をその薬物デポーの上に適用することができる。あるいは、薬物デポーを初めに埋め込み、次いで薬物デポーの周りに、それを適所に保持するためにゲルを配置する(例えば、ブラッシングする、滴下する、注射する、または塗布する、等)ことができる。ゲルを用いることにより、患者に対する肉体的および精神的な外傷を最小限にして、薬物デポーの正確かつ精密な埋め込みを成し遂げることができる。ゲルはまた、薬物デポーを標的部位へ縫合する必要性を回避して、患者に対する肉体的および精神的な外傷を低減する。
【0163】
様々な態様において、標的部位が脊椎領域を含む場合、初めに体液(例えば、脊髄液、等)の一部をカニューレまたは針を通して標的部位から吸引し、次いでデポーを投与する(例えば、配置する、滴下する、注射する、または埋め込む、等)ことができる。標的部位は再水和し(例えば、体液の補充)、この水性環境は薬物をデポーから放出させるであろう。
【0164】
図4は、炎症および/または痛みが生じ得る部位である可能性のある、患者内のいくつかの一般的な位置を図説する。図4で図説する位置は、炎症および/または痛みの部位であり得る患者内の多くの異なる位置の単に典型的なものであることは分かるであろう。例えば、炎症および/または痛みは、患者の膝21、股関節22、指23、親指24、首25、および脊椎26で起こる可能性がある。これらは熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギーをそこに適用して薬物デポーからの鎮痛剤および/または抗炎症剤の大量瞬時投与量の放出を引き起こし、患者に“割り増し用量”を提供することができる領域でもある。
【0165】
その鎮痛剤および/または抗炎症剤は、薬物デポー中で成形され、固体または液体であってよい適切な医薬的キャリヤーと共に投与され、望まれるように非経口または他の投与に適した形で配置されてよい。当業者は気付いているように、既知のキャリヤーには、水、ゼラチン、ラクトース、デンプン類、ステアリン酸、ステアリン酸マグネシウム、シカリル(sicaryl)アルコール、タルク、植物油、ベンジルアルコール類、ゴム、ワックス、プロピレングリコール、ポリアルキレングリコール類、および他の既知のキャリヤーが含まれるが、それらに限定されない。
【0166】
別の態様は、痛みおよび/または炎症で苦しむ哺乳類を処置するための方法を提供し、前記方法は、療法上有効量の少なくとも1種類の鎮痛剤および/または抗炎症剤を標的部位またはその付近の皮膚の下の標的部位に投与することを含む。その少なくとも鎮痛剤および/または抗炎症剤は、例えば薬物デポーとして標的組織部位に局所投与されてよい。
【0167】
一部の態様において、その療法上有効投与量(例えば鎮痛剤および/または抗炎症剤の用量)および放出速度プロフィールは、少なくとも1日、例えば、1〜90日、1〜10日、1〜3日、3〜7日、3〜12日;3〜14日、7〜10日、7〜14日、7〜21日、7〜30日、7〜50日、7〜90日、7〜140日、14〜140日、3日〜135日、3日〜150日、または3日〜6ヶ月の期間の間、手術、慢性炎症性疾患、慢性炎症性腸疾患、滑液包炎、骨関節炎、骨溶解、腱炎、坐骨神経痛、椎間板ヘルニア、狭窄、ミオパシー、脊椎すべり症(spondilothesis)、腰痛、椎間関節痛、手根管症候群、足根管症候群、失敗した背部痛等の結果として起こる炎症および/または痛みを低減するのに十分である。
【0168】
一部の態様において、標的組織部位に局所投与することが可能である有効量の少なくとも1種類の鎮痛剤および/または抗炎症剤を含む、炎症の処置に有用な組成物が存在する。例として、それらは脊椎孔(foraminal spine)、硬膜外腔、または脊髄の髄腔内空間に局所投与することができる。典型的な投与経路には、薬物ポンプ、1種類以上の局所注射、ポリマー放出、およびそれらの組み合わせが含まれるが、それらに限定されない。
【0169】
一部の態様において、その少なくとも1種類の鎮痛剤および/または抗炎症剤は、非経口的に、例えば注射により投与される。一部の態様において、その注射は髄腔内であり、それは脊椎管(脊髄を囲む髄腔内空間)中への注射を指す。注射は筋肉または他の組織の中にであってもよい。他の態様において、その鎮痛剤および/または抗炎症剤は、手術の間の患者の切開部(open patient cavity)中への配置により投与される。
【0170】
一部の態様において、その配合物は手術の時に手術部位の中に埋め込むことができる。次いで有効成分がデポーから持続様式での拡散により、例えば手術後1〜10日、3〜10日、3〜15日、5〜10日または7〜10日の期間にわたって放出されることができる。その薬物デポーは可逆性相転移ポリマーからの大量瞬時投与も可能にする。
【0171】
一部の態様において、薬物デポーは、薬物デポーに装填された少なくとも1種類の鎮痛剤および/または抗炎症剤の総量に対して、少なくとも1種類の鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩の5%、10%、15%、20%、25%、30%、40%、50%、60%、70%、80%、90%、95%、または99%を、その薬物デポーが標的組織部位に投与された後の3〜12日、5〜10日、または7〜10日の期間にわたって放出することができる。一部の態様において、その有効成分は、1種類以上の薬物の6ヶ月または1年まで(例えば、90、100、135、150、180日以上)の放出により、上記で論じたような慢性の疾患/病気に関してより長い期間の痛みおよび/または炎症の軽減を提供することができる。
【0172】
様々な態様において、そのような処置を必要とする患者において痛みおよび/または炎症を低減、予防または処置するのに有用な埋め込み式薬物デポーを提供し、その埋め込み式薬物デポーは療法上有効量の鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩を含み、そのデポーは、手術後の、または慢性炎症性疾患、慢性炎症性腸疾患、滑液包炎、骨関節炎、骨溶解、腱炎、坐骨神経痛、椎間板ヘルニア、狭窄、ミオパシー、脊椎すべり症(spondilothesis)、腰痛、椎間関節痛、手根管症候群、足根管症候群、失敗した背部痛等の結果として起こる痛みおよび/または炎症を低減、予防または処置するために皮膚の下の部位に埋め込むことができ、ここでその薬物デポーは(i)薬物デポーに装填された鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩の総量に対して約5%〜約20%の鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩を48時間までの第1期間にわたって放出することができる1つ以上の即時放出層(単数または複数)、および(ii)薬物デポーに装填された鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩の総量に対して約21%〜約99%の鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩を3日〜6ヶ月までの続く期間にわたって放出することができる1つ以上の継続放出層(単数または複数)を含む。
【0173】
限定的でない例として、その標的組織部位は、少なくとも1つの筋肉、靭帯、腱、軟骨、椎間板、脊髄神経根付近の脊椎孔空間、小関節面(facet)または脊椎管を含んでよい。また、例として、炎症は整形外科手術または脊椎手術、またはそれらの組み合わせと関係するものであってよい。さらなる例として、その手術は関節鏡手術、塊の切除、ヘルニアの修復、脊椎固定術、胸部、頚部、もしくは腰部手術、骨盤手術、またはそれらの組み合わせであってよい。一部の態様において、有効成分は、1〜90日、1〜10日、1〜3日、3〜7日、3〜12日;3〜14日、7〜10日、7〜14日、7〜21日、7〜30日、7〜50日、7〜90日、7〜140日、14〜140日、3日〜135日、3日〜150日、または3日〜6ヶ月の期間にわたる1種類以上の薬物の放出により、上記で論じたような慢性的な疾患/病気に関するより長い期間の痛みおよび/または炎症の軽減を提供することができる。
【0174】
一部の態様において、その少なくとも1種類の鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩は、ゲル中に懸濁された微粒子、マイクロスフェア、マイクロカプセル、および/またはマイクロファイバーを含む複数のデポー中に封入されている。
【0175】
一部の態様において、そのような処置を必要とする患者において手術後の、または慢性炎症性疾患、慢性炎症性腸疾患、滑液包炎、骨関節炎、骨溶解、腱炎、坐骨神経痛、椎間板ヘルニア、狭窄、ミオパシー、脊椎すべり症(spondilothesis)、腰痛、椎間関節痛、手根管症候群、足根管症候群、失敗した背部痛等の結果として起こる痛みおよび/または炎症を抑制する方法を提供し、その方法は、療法上有効量の少なくとも1種類の鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩を含む1つ以上の生分解性薬物デポーを皮膚の下の標的組織部位に、手術の前、間、または後に送達することを含み、ここでその薬物デポーは有効量の少なくとも1種類の鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩を3日〜6ヶ月の期間にわたって放出する。
【0176】
一部の態様において、埋込型薬物デポーを提供し、ここでその薬物デポーは(i)熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギーが皮膚の下の部位においてそれに適用された際に大量瞬時投与量の少なくとも1種類の鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩を放出する可逆性相転移ポリマーを含む1つ以上の即時放出層(単数または複数)、および(ii)有効量の少なくとも1種類の鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩を3〜12日または5〜10日または7〜10日または3日〜6ヶ月の期間にわたって放出する1つ以上の継続放出層(単数または複数)を含む。例として、その薬物デポーにおいて、その1つ以上の持続放出層はポリ(ラクチド−co−グリコリド)(PLGA)、ポリラクチド(PLA)、ポリグリコリド(PGA)、D−ラクチド、D,L−ラクチド、L−ラクチド、D,L−ラクチド−ε−カプロラクトン、D,L−ラクチド−グリコリド−ε−カプロラクトン、またはそれらの組み合わせを含み、即時放出層中の可逆性相転移物質はパラフィンろう、ポロキサマー類、ポリラクトン類、パラフィンろう、ポリ(N−イソプロピルアクリルアミド)ホモポリマー、ポリ(N−イソプロピルアクリルアミド)アクリルアミドコポリマー、[3−(メタクリロイルオキシ)プロピル]トリメトキシシラン、[2−(メタクリロイルオキシ)エトキシ]−トリメチルシランおよびメタクリロイルオキシ)トリメチルシランから選択されるシランモノマーを含有するポリ(N−イソプロピルアクリルアミド)のコポリマー、ポリ(ヒドロキシプロピルメタクリルアミド)のコポリマー、ジカルボキシメチルアミノプロピルメタクリルアミド、キシログルカン、エチル(ヒドロキシエチル)セルロース、ポリ(エチレンオキシド−b−プロピレンオキシド−b−エチレンオキシド)およびそのコポリマー、ポリ(エチレンオキシド)/(D,L−乳酸−co−グリコール酸)コポリマー類、キトサンおよびポリオール塩類の組み合わせ、ポリ(シラミン)(poly(silamine))、ならびにポリ(オルガノホスファゼン)またはそれらの組み合わせを含む。
【0177】
作製の方法
様々な態様において、有効成分(例えば、抗炎症剤)を含む薬物デポーは、生体適合性ポリマー(可逆性相転移ポリマー(単数または複数)および/または持続放出ポリマー(単数または複数))および療法上有効量の有効成分またはその医薬的に許容できる塩類を組み合わせ、その組み合わせから埋め込み式薬物デポーを形成することにより作製することができる。
【0178】
薬物デポーの少なくとも一部を生体適合性ポリマー(単数または複数)、療法剤(単数または複数)、および任意の材料から形成するために、溶液加工技法および/または熱可塑加工技法が含まれる様々な技法が利用可能である。溶液加工技法を使用する場合、溶媒系は典型的には、1種類以上の溶媒種を含有する溶媒系が選択される。溶媒系は一般的には注目される少なくとも1種類の構成要素、例えば、生体適合性ポリマーおよび/または療法剤にとって良好な溶媒である。その溶媒系を構成する個々の溶媒種は、乾燥速度および表面張力が含まれる他の特徴に基づいて選択することもできる。
【0179】
溶液加工技法には、溶媒キャスティング技法、スピンコーティング技法、ウェブコーティング技法、溶媒噴霧技法、浸漬技法、エアサスペンションが含まれる機械サスペンションによるコーティングを伴う技法(例えば、流動コーティング)、インクジェット技法、および静電技法が含まれる。適切な場合、望まれる放出速度および望まれる厚さを得るようにデポーを構築するために、上記で列挙した技法のような技法を繰り返す、または組み合わせることができる。
【0180】
様々な態様において、溶媒を含有する溶液と生体適合性ポリマーを組み合わせて、望まれる大きさおよび形状の型に入れる。このようにして、バリアー層、滑らかな層、等が含まれるポリマー領域を形成することができる。望まれるならば、その溶液はさらに以下のものの1種類以上を含むことができる:溶解した、または分散した形の他の療法剤(単数または複数)および他の任意の添加剤、例えばX線造影剤(単数または複数)等。これは結果として溶媒除去後にこれらの種を含有するポリマーマトリックス領域をもたらす。他の態様において、溶解または分散した療法剤を含む溶媒を含有する溶液を、溶液加工および熱可塑加工の技法が含まれる様々な技法を用いて成形することができる既存のポリマー領域に適用し、その際にその療法剤はポリマー領域中に吸収される。
【0181】
デポーまたはその一部を形成するための熱可塑加工技法には、成形技法(例えば、注入成形、回転成形、等)、押出技法(例えば、押出、共押出、多層押出、等)、および鋳造法が含まれる。
【0182】
様々な態様に従う熱可塑加工は、1つ以上の段階において、生体適合性ポリマー(単数または複数)および以下のものの1種類以上:有効成分(例えば、アルファ作動薬)、任意の追加の療法剤(単数または複数)、X線造影剤(単数または複数)、等を混合または調合することを含む。次いで、得られた混合物を埋め込み式薬物デポーへと成形する。この混合および成形の操作は、そのような目的のために当技術で既知の一般に用いられるデバイスのいずれを用いて実施してもよい。
【0183】
熱可塑加工の間、療法剤(単数または複数)には、例えば、そのような加工に伴う上昇した温度および/または機械的剪断により分解する可能性が存在する。例えば、特定の療法剤は、通常の熱可塑加工条件の下で、実質的な分解を受ける可能性がある。従って、加工は好ましくは療法剤(単数または複数)の実質的な分解を防ぐ修正された条件の下で実施される。熱可塑加工の間にはいくらかの分解が避けられない可能性があると理解されているが、分解は一般的には10%以下に制限される。療法剤(単数または複数)の実質的な分解を回避するために加工の間に制御することができる加工条件には、温度、適用される剪断速度、適用される剪断応力、療法剤を含有する混合物の滞留時間、ならびにそれによりポリマー性材料および療法剤(単数または複数)を混合する技法がある。
【0184】
生体適合性ポリマーを療法剤(単数または複数)およびあらゆる追加の添加剤と混合または調合してその実質的に均質な混合物を形成することは、当技術で既知の、およびポリマー性材料を添加剤と混合するために一般に用いられるあらゆるデバイスを用いて実施されてよい。
【0185】
熱可塑性材料が用いられる場合、様々な添加剤(例えば、療法剤(単数または複数)、不活性成分、等)と混合することができる生体適合性ポリマーを加熱することによりポリマー溶融物を形成して混合物を形成してよい。そのようにする一般的な方法は、生体適合性ポリマー(単数または複数)および添加剤(単数または複数)の混合物に機械的剪断を適用することである。この様式で生体適合性ポリマー(単数または複数)および添加剤(単数または複数)を混合することができるデバイスには、一軸式押出機、二軸押出機、バンバリーミキサー、高速ミキサー、rossケトル(ross kettle)等のデバイスが含まれる。
【0186】
生体適合性ポリマー(単数または複数)および様々な添加剤のいずれも、望まれるならば(例えば、数ある理由の中でも、療法剤の実質的な分解を防ぐために)、最終的な熱可塑性の混合および成形のプロセスの前に予め混合することができる。
【0187】
例えば、様々な態様において、それがあれば結果として療法剤の実質的な分解がもたらされるであろう温度および機械的剪断の条件の下で、生体適合性ポリマーをX線造影剤(例えば、放射線不透過剤)と予め調合する。次いでこの予め調合された材料を、より低い温度および機械的剪断の条件の下で療法剤(例えば、アルファ作動薬)と混合して、得られた混合物を有効成分含有薬物デポーへと成形する。逆に、別の態様では、生体適合性ポリマーを療法剤と、低減された温度および機械的剪断の条件の下で予め調合することができる。次いで、この予め調合された材料を、やはり低減された温度および機械的剪断の条件の下で、例えば放射線不透過剤と混合して、得られた混合物を薬物デポーへと成形する。
【0188】
生体適合性ポリマーおよび療法剤および他の添加剤の混合物を得るために使用する条件は、例えば、使用する特定の生体適合性ポリマー(単数または複数)および添加剤(単数または複数)、ならびに使用する混合デバイスのタイプが含まれる、いくつかの要因に依存するであろう。
【0189】
例として、異なる生体適合性ポリマーは典型的には異なる温度での混合を促進するために軟化させられるであろう。例えば、PLGAまたはPLAポリマー、放射線不透過剤(例えば、次炭酸ビスマス)、および加熱および/または機械的剪断により分解し易い療法剤(例えば、クロニジン)を含むデポーを形成する場合、様々な態様において、PGLAまたはPLAは例えば約150℃〜170℃の温度で放射線不透過剤と予め混合することができる。次いで、療法剤をその予め混合された組成物と組み合わせて、PGLAまたはPLA組成物に典型的であるよりも実質的に低い温度および機械的剪断の条件で、さらなる熱可塑加工を施す。例えば、押出機を用いる場合、バレル温度、容積測定出力(volumetric output)は、典型的には、剪断を制限し、従って療法剤(単数または複数)の実質的な分解を防ぐように制御される。例えば、その療法剤および予め混合された組成物は、二軸押出機を実質的により低い温度(例えば、100〜105℃)で用いて、実質的に低減された容積測定出力(例えば、全容量の30%未満、それは一般に200cc/分未満の容積測定出力に相当する)を用いて混合/調合することができる。この加工温度は、これらの温度での、またはそれより上の温度での加工は結果として実質的な療法剤の分解をもたらすと考えられるので、抗炎症剤および/または鎮痛剤(例えば、クロニジン)のような特定の有効成分の融点より十分に低いことを特筆する。さらに、特定の態様において、その加工温度は療法剤を含むその組成物内の全ての生理活性化合物の融点より下であろうことを特筆する。調合の後、結果として得られるデポーを、やはり低減された温度および剪断の条件の下で、望まれる形へと成形する。
【0190】
他の態様において、生分解性ポリマー(単数または複数)および1種類以上の療法剤を、非熱可塑性技法を用いて予め混合する。例えば、生体適合性ポリマーを1種類以上の溶媒種を含有する溶媒系中で溶解させることができる。あらゆる望まれる薬剤(例えば、放射線不透過剤、療法剤、または放射線不透過剤および療法剤の両方)もその溶媒系中で溶解または分散させることができる。次いで、得られた溶液/分散液から溶媒を除去し、固体物質を形成する。望まれるならば、得られた固体物質を、次いでさらなる熱可塑加工(例えば、押出)のために顆粒化することができる。
【0191】
別の例として、その療法剤は溶媒系中で溶解させる、または分散させることができ、次いでそれを既存の薬物デポー(その既存の薬物デポーは溶液および熱可塑加工技法が含まれる様々な技法を用いて形成することができ、それは放射線不透過剤および/または粘度増強剤が含まれる様々な添加剤を含むことができる)に適用し、その際にその療法剤は薬物デポーの上または中に吸収される。次いで、上記のように、得られた固体材料を、望まれるならばさらなる加工のために顆粒化することができる。
【0192】
典型的には、生体適合性ポリマー(単数または複数)、療法剤(単数または複数)、および放射線不透過剤(単数または複数)を含む薬物デポーを形成するために、押出プロセスを用いてよい。共押出法を用いてもよく、それは同じまたは異なる層または領域を含む薬物デポー(例えば、即時および/または持続薬物放出を可能にする流体に対する透過性を有する1つ以上のポリマーマトリックス層または領域を含む構造物)を生成するために用いることができる成形プロセスである。共注入または連続注入成形技術のような他の加工および成形技法により、多重領域デポーを形成することもできる。
【0193】
様々な態様において、熱可塑加工から生じる可能性のあるデポー(例えば、ペレット、細片、等)は冷却される。冷却プロセスの例には、空気冷却および/または冷却浴中に浸すことが含まれる。一部の態様において、押出されたデポーを冷却するために水浴が用いられる。しかし、有効成分のような水溶性の療法剤が用いられる場合、療法剤の槽中への不必要な損失を回避するため、浸す時間は最小限に保たれるべきである。
【0194】
様々な態様において、槽から出した後に、周囲温の、または暖かい空気ジェットの使用により、水または水分をすぐに除去することは、薬物のデポー表面上での再結晶も防ぎ、そうして埋め込みまたは挿入の際の高い薬物用量の“初期バースト”または“ボーラス用量”を、この放出プロフィールが望まれていない場合に制御または最小化するであろう。
【0195】
様々な態様において、薬物をポリマーと混合、またはポリマーと共に噴霧することにより薬物デポーを製造し、次いでそのデポーを望まれる形状に成形することができる。様々な態様において、有効成分をPLGAまたはPEG550ポリマーと共に使用して混合し、または噴霧し、得られたデポーを押出により成形して乾燥させてよい。
【0196】
薬物デポーは、生体適合性ポリマーおよび療法上有効量の少なくとも1種類の鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩を組み合わせて、その組み合わせから埋め込み式薬物デポーを形成することにより作製してもよい。
【0197】
当業者には、本明細書で記述された様々な態様に対して、本明細書の教示の精神または範囲から逸脱することなく様々な修正および変形をすることができることは明らかであろう。従って、様々な態様には本教示の範囲内の様々な態様の他の修正および変形が含まれることが意図される。
【符号の説明】
【0198】
10 薬物デポー
12 可逆性相転移物質
14 薬物
16 薬物
21 指
22 皮膚
24 開口部
25 指
26 手
28 薬物デポー
30 スタンド
31 冷または温パック
41 膝
42 股関節
43 指
44 親指
45 首
46 脊椎
【背景技術】
【0001】
痛みの緩和は手術を受けた患者を処置する人ならば誰にとっても最も重要である。適切な痛みの緩和は患者に重要な生理的および精神的利益を与える。有効な痛みの緩和は医学的/外科的/外来患者用施設からのより早期の解放によるより順調でより快適な術後経過(例えば、気分、睡眠、生活の質等)を意味するだけでなく、それは慢性疼痛症候群(例えば線維筋痛症、筋肉痛等)の発症を低減する可能性もある。
【0002】
痛みは生物学的機能の役目を果たしている。それはしばしば体内の損傷または疾患の存在を知らせており、しばしば炎症(発赤、腫張、および/または焼灼(burning))を伴う。術後痛の場合、それは手術または例えば火傷もしくは非外科的外傷の後の急性の痛みの管理のような他の処置の結果である可能性がある。術後痛の管理の目標は、副作用を最小限しか、または全く引き起こさない薬物療法により痛みおよび不快感を低減または除去することである。
【0003】
手術の部位は患者が受ける可能性のある術後痛の程度に深い影響を有する。一般に、胸部および上腹部における手術は下腹部における手術よりも強い痛みを伴い、それは今度は四肢における末梢の手術よりも強い痛みを伴う。しかし、体腔、大きい関節の表面、脊椎または深部組織を含む全ての手術は痛みを伴うものと考えられるべきである。特に、胸部または上腹部における手術は肺機能における広範囲に及ぶ変化、腹筋緊張の増大、および関係する横隔膜機能の低下をもたらす可能性がある。その結果は、咳ができないことおよび分泌物を取り除けないことであると考えられ、それは肺虚脱および肺炎につながる可能性がある。長引く痛みは身体活動を低減させ、静脈うっ血ならびに深在静脈血栓症および結果的に肺塞栓の危険性の増大につながり得る。加えて、消化管および尿管の運動性に広範囲に及ぶ影響がある可能性があり、それは今度は術後イレウス、吐き気、嘔吐および尿貯留につながる可能性がある。これらの問題は患者にとって不愉快であり、入院を長引かせる可能性がある。中程度〜重篤な術後痛、外傷後痛および火傷の痛みを経験するほとんどの患者は、しばしば外傷または手術後の少なくとも最初の三日間は疼痛管理を必要とする。
【0004】
残念ながら、現在利用可能な痛みおよび/または抗炎症配合物は、術後痛を処置するのに有効ではあるが、必要に応じた4〜12時間ごとの頻繁な1回量投与を必要とする。しばしば1回量の投与に伴って、患者は突発痛および持続的な痛みの緩和を提供するための次の投与のための不安な“時計が気になる(clock−watching)”待ち時間を経験するであろう。これらの1回量配合物は不便であり、患者の術後の入院患者および/または通院患者の日中の活動ならびに夜間の睡眠および回復を妨げる可能性がある。
【発明の概要】
【発明が解決しようとする課題】
【0005】
痛みおよび/または炎症、特に術後の痛みおよび/または炎症を予防、処置または低減するために、新規の鎮痛および/または抗炎症組成物および方法が必要とされている。確実に突発痛のエピソードを低減、予防または処置し、さらに少なくとも1日の期間にわたって長時間作用性の鎮痛および抗炎症作用を提供する新規の鎮痛および/または抗炎症組成物および方法が必要とされている。
【課題を解決するための手段】
【0006】
望まれない突発痛および/または炎症を有効に低減、予防、または処置するための新規組成物および方法を提供する。その痛みおよび/または炎症を延長された期間の間低減することができる。
【0007】
様々な態様において、患者への最小限の身体的および精神的外傷を伴う鎮痛剤および/または抗炎症剤を含有する薬物デポー(drug depot)の正確かつ精密な埋め込みを容易に可能にすることができる新規の薬物デポー組成物および方法を提供する。その薬物デポー組成物の1つの利点は、可逆的相転移物質を用いることにより、その患者または開業医が、その鎮痛剤および/または抗炎症剤の増大された用量が標的組織部位(例えば脊椎、膝、肩、股関節部、腹部、滑膜性関節、脊柱またはその付近、外科的創傷または切開部、脊髄内等)で放出されるように、その薬物デポーの位置で、またはその付近で熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギーを提供することができることである。このようにして、例えば、突発痛を有効に低減、予防および/または処置することができる。
【0008】
1態様において、そのような処置を必要とする患者において痛みおよび/または炎症を低減、予防または処置するのに有用な埋め込み式薬物デポーを提供し、その埋め込み式薬物デポーは皮膚の下の部位に埋め込み可能であり、その薬物デポーの可逆的相転移物質内に配置された有効量の鎮痛剤および/または抗炎症剤を含み、ここでその可逆的相転移物質は熱、冷気または他の形のエネルギー、例えば超音波エネルギーが患者の皮膚に適用された際に大量瞬時投与量の鎮痛剤、筋弛緩剤および/または抗炎症剤を放出して痛みおよび/または炎症を低減、予防または処置することができる。
【0009】
別の態様において、そのような処置を必要とする患者において痛みおよび/または炎症を低減、予防または処置するのに有用な薬物デポーを提供し、その薬物デポーは患者の皮膚の下の部位に埋め込み可能であり、その薬物デポーの可逆的相転移ポリマーおよび生分解性ポリマー内に内に配置された有効量の鎮痛剤および/または抗炎症剤を含み、ここでその可逆的相転移物質は熱、冷気または他の形のエネルギーがその薬物デポーの位置に、またはその付近に適用された際にその薬物デポーに大量瞬時投与量の鎮痛剤、筋弛緩剤および/または抗炎症剤を放出させることができ、その生分解性ポリマーは少なくとも1日にわたってその鎮痛剤、筋弛緩剤および/または抗炎症剤を放出して痛みおよび/または炎症を低減、予防または処置することができる。
【0010】
さらに別の態様において、そのような処置を必要とする患者において痛みおよび/または炎症を処置または予防するための方法を提供し、その方法は、患者の皮膚の下の標的組織部位において薬物デポーの可逆的相転移物質内に配置された有効量の鎮痛剤および/または抗炎症剤を含む生分解性薬物デポーを埋め込むこと、ここでその可逆的相転移物質は熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギー、光、機械的エネルギー(例えば撹拌)、電気的、化学的、もしくは磁気エネルギーがその薬物デポーに、またはその付近に適用された際に大量瞬時投与量の鎮痛剤、筋弛緩剤および/または抗炎症剤を放出することができる;ならびに熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギーをその薬物デポーが埋め込まれている標的組織部位に、またはその付近に適用して大量瞬時投与量の鎮痛剤、筋弛緩剤および/または抗炎症剤を放出させて痛みおよび/または炎症を予防または処置することを含む。
【0011】
提供する組成物および方法は、手術、慢性炎症性疾患、慢性骨盤痛症候群(例えば間質性膀胱炎、慢性非細菌性前立腺炎、外陰部痛、子宮内膜症、過敏性腸疾患および結果として骨盤領域における慢性の痛みをもたらす他の病気)、滑液包炎、骨関節炎、骨溶解、腱炎、坐骨神経痛、椎間板ヘルニア、狭窄、ミオパシー、脊椎すべり症(spondilothesis)、腰痛、椎間関節痛、手根管症候群、足根管症候群、失敗した背部痛(failed back pain)等の結果として起こる炎症および/または痛みを含むがそれらに限定されない炎症および/または痛みを低減、予防または処置するために用いることができる。
【0012】
その医薬組成物は例えば薬物デポーの一部であってよい。その薬物デポーは:(i)鎮痛剤および/または抗炎症剤および可逆的相転移物質および/または生分解性ポリマー(単数または複数)からなる;または(ii)鎮痛剤および/または抗炎症剤および可逆的相転移物質および/または生分解性ポリマー(単数または複数)から本質的になる;または(iii)鎮痛剤および/または抗炎症剤および可逆的相転移物質および/または生分解性ポリマー(単数または複数)ならびに1種類以上の他の有効成分、界面活性剤、賦形剤もしくは他の成分もしくはそれらの組み合わせを含むことができる。他の有効成分、界面活性剤、賦形剤または他の成分またはそれらの組み合わせが配合物中に存在する場合、一部の態様において、これらの他の化合物またはそれらの組み合わせは、20重量%未満、19重量%未満、18重量%未満、17重量%未満、16重量%未満、15重量%未満、14重量%未満、13重量%未満、12重量%未満、11重量%未満、10重量%未満、9重量%未満、8重量%未満、7重量%未満、6重量%未満、5重量%未満、4重量%未満、3重量%未満、2重量%未満、1重量%未満または0.5重量%未満を構成する。
【0013】
様々な態様の追加の特徴および利点は、一部は以下の記述で述べられ、一部は記述から明らかであるか、または様々な態様の実施により学ぶことができる。様々な態様の目的および他の利点は、特にその記述および添付された特許請求の範囲において指摘されている要素および組み合わせにより実現および達成されるであろう。
【0014】
部分的に、以下の記述、添付された特許請求の範囲および添付の図面に関して、その態様の他の観点、特徴、利益および利点が明らかになるであろう;ここで:
【図面の簡単な説明】
【0015】
【図1】図1は、薬物デポー内部に鎮痛剤および/または抗炎症剤を保持する可逆的相転移物質の層を有する埋め込み式薬物デポーの態様の拡大した側断面図である。
【図2】図2は、熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギーをそれに適用した際に、粘性が低減した、または透過性が増大した状態に変化して、薬物デポーからの鎮痛剤および/または抗炎症剤の放出を引き起こす、可逆的相転移物質の層を有する埋め込み式薬物デポーの態様の拡大した側断面図である。
【図3】図3は、薬物デポーが埋め込まれている領域付近の皮膚に適用される冷または温パックを図説する1態様の透視図である。冷気または熱の適用は可逆的相転移物質の可逆的な相の変化を引き起こし(例えば、固体が液体に、固体が半固体に、半固体が液体に、水に不溶性のものが水溶性のものに、ガラス質がゴム状に、結晶質または半晶質が液体に、等)、大量瞬時投与量の鎮痛剤および/または抗炎症剤を放出させる。
【図4】図4は、患者内の痛みおよび/または炎症が起こり得る部位であり鎮痛剤、筋弛緩剤および/または抗炎症剤を含有する薬物デポーをそこに局所的に投与することができる部位である可能性のあるいくつかの一般的な位置を図説する。
【0016】
図面は一定の縮尺で描かれているわけではないことは理解されるべきである。さらに、図面中の物体間の関係も一定の縮尺ではない可能性があり、実際、大きさに関して逆の関係を有する可能性がある。図面は示されたそれぞれの対象の構造への理解および明確性をもたらすことを意図しており、従って、一部の特徴は構造の特定の特徴を図説するために誇張されている可能性がある。
【発明を実施するための形態】
【0017】
この明細書および添付された特許請求の範囲の目的のため、別途示さない限り、本明細書および特許請求の範囲で使用されている成分の量、材料の百分率または割合、反応条件、および他の数値を表す全ての数は、全ての場合において、用語“約”により修飾されていると理解されるべきである。従って、それとは反対の指示がない限り、以下の明細書および添付された特許請求の範囲において示されている数のパラメーターは近似値であり、それは本発明により得ようとしている望まれる特性に応じて変動してよい。少なくとも、特許請求の範囲に対する均等論の適用を制限しようと試みるのではなく、それぞれの数のパラメーターは少なくとも報告された有効桁の数を考慮して通常の丸め技法を適用することにより解釈されるべきである。
【0018】
本発明の広い範囲である本明細書で示される数の範囲およびパラメーターは近似値であるにもかかわらず、具体例な実施例において示される数値は可能な限り正確に報告されている。しかし、あらゆる数値は、それらのそれぞれの試験測定に見出される標準偏差の結果として必然的にもたらされる一定の誤差を本質的に含有する。さらに、本明細書で開示されるあらゆる範囲はその中に包含されるあらゆる、および全ての部分範囲を含むことは理解されるべきである。例えば、“1〜10”の範囲には、最小値1および最大値10の間(1および10を含む)のあらゆる、および全ての部分範囲、すなわち、1以上の最小値および10以下の最大値を有するあらゆる、および全ての部分範囲、例えば5.5〜10が含まれる。
【0019】
ここで、発明の特定の態様について詳細な参照がなされ、その例は添付の図面において図説される。本発明は図説された態様と関連して記述されるが、それらは本発明をそれらの態様に限定することを意図するものではないことは理解されるであろう。むしろ、本発明は、添付された特許請求の範囲により定められる通りの本発明の範囲内に含まれ得る全ての代替物、修正、および均等物を含むことを意図する。
【0020】
以下の見出しは本開示を制限することを意味するのでは決してなく;あらゆる1つの見出しの下の態様をあらゆる他の見出しの下の態様と共に用いてよい。
この明細書および添付された特許請求の範囲において用いられる際、単数形“a”、“an”および“the”は、明白かつ明確に1つの指示対象に限定されていない限り、複数の指示対象を含むことを特筆する。従って、例えば、“薬物デポー(a drug depot)”への言及には1、2、3またはより多くの薬物デポーが含まれる。
【0021】
略語“DLG”は、ポリ(DL−ラクチド−co−グリコリド)を指す。
略語“DL”は、ポリ(DL−ラクチド)を指す。
略語“LG”は、ポリ(L−ラクチド−co−グリコリド)を指す。
【0022】
略語“CL”は、ポリカプロラクトンを指す。
略語“DLCL”は、ポリ(DL−ラクチド−co−カプロラクトン)を指す。
略語“LCL”は、ポリ(L−ラクチド−co−カプロラクトン)を指す。
【0023】
略語“G”は、ポリグリコリドを指す。
略語“PEG”は、ポリ(エチレングリコール)を指す。
略語“PLGA”は、ポリ(乳酸−co−グリコール酸)としても知られるポリ(ラクチド−co−グリコリド)を指し、それらは互換的に用いられる。
【0024】
略語“PLA”は、ポリラクチドを指す。
略語“POE”は、ポリ(オルトエステル)を指す。
1態様において、そのような処置を必要とする患者において痛みおよび/または炎症を低減、予防または処置するのに有用な埋め込み式薬物デポーを提供し、その埋め込み式薬物デポーは皮膚の下の部位に埋め込み可能であり、その薬物デポーの可逆的相転移物質内に配置された有効量の鎮痛剤および/または抗炎症剤を含み、ここでその可逆的相転移物質は熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギー、光、機械的エネルギー(例えば撹拌、マッサージ等)、電気的、化学的、もしくは磁気エネルギーが患者の皮膚に適用された際に大量瞬時投与量の鎮痛剤、筋弛緩剤および/または抗炎症剤を放出して痛みおよび/または炎症を低減、予防または処置することができる。
【0025】
1態様において、その鎮痛剤、筋弛緩剤および/または抗炎症剤はラセミ混合物として用いることができる。さらに別の態様において、その鎮痛剤、筋弛緩剤および/または抗炎症剤は単一の立体異性体として用いられる。別の態様において、その鎮痛剤、筋弛緩剤および/または抗炎症剤は等しい(1:1)、または等しくない量の立体異性体を含有する立体異性体の混合物として用いられる。例えば、一部の態様において、その鎮痛剤、筋弛緩剤および/または抗炎症剤は(+)Rおよび(−)の鏡像異性体の混合物を含んでいてよい。様々な態様において、その鎮痛剤、筋弛緩剤および/または抗炎症剤はその鎮痛剤、筋弛緩剤および/または抗炎症剤の1:1ラセミ混合物を含んでいてよい。
【0026】
鎮痛剤、筋弛緩剤および/または抗炎症剤の送達に関して選択される標的組織部位は、とりわけ、処置される病気、患者において達成されるべき薬物の望まれる療法的濃度、および維持されなければならない薬物濃度の持続期間に依存する。
【0027】
一部の態様において、標的組織部位における、またはその付近での薬物デポーの局所投与は、通常の経口、静脈内、または筋肉内投与量よりも低い用量の鎮痛剤、筋弛緩剤および/または抗炎症剤を用いることを可能にする。例えば、その薬物デポーの局所投与は、通常の経口、静脈内、または筋肉内投与量の50%、45%、40%、35%、30%、25%、20%、15%、10%、5%、1%、0.5%、0.1%、0.01%である日用量を用いて成し遂げることができる。今度は、例えば肝トランスアミナーゼの上昇、肝炎、肝不全、ミオパシー、便秘等のような全身性の副作用を低減または排除することができる。
【0028】
その薬物デポー中に含まれる、および本明細書で記述する方法論において用いられる鎮痛剤および/または抗炎症剤の濃度は、痛みおよび/または炎症を予防、処置または低減する療法的作用をもたらすのに有効な濃度である。ヒトの患者において局所投与の際に鎮痛作用をもたらすための鎮痛剤および/または抗炎症剤、例えばクロニジンの投与量は、一部の態様において、典型的には1日あたり約150マイクログラムから800マイクログラムまでの間、または局所注入により3から12マイクログラム/時間までの範囲であることができる。
【0029】
しかし、当業者はこの開示を読んだ際に理解するであろうように、その有効濃度は選択される鎮痛剤および/または抗炎症剤、投与経路、投与頻度、投与される配合物、および処置される病気に応じて異なるであろう。
【0030】
1態様において、例えば手術、慢性炎症性疾患、慢性骨盤痛症候群(例えば間質性膀胱炎、慢性非細菌性前立腺炎、外陰部痛、子宮内膜症、過敏性腸疾患および結果として骨盤領域における慢性の痛みをもたらす他の病気)、滑液包炎、骨関節炎、骨溶解、腱炎、坐骨神経痛、椎間板ヘルニア、狭窄、ミオパシー、脊椎すべり症(spondilothesis)、腰痛、椎間関節痛、手根管症候群、足根管症候群、失敗した背部痛等の結果として起こる痛みおよび/または炎症を低減、予防または処置するために、その鎮痛剤、筋弛緩剤および/または抗炎症剤は約0.0001mg/kg/日〜約40mg/kg/日の量で投与される。別の態様において、その鎮痛剤、筋弛緩剤および/または抗炎症剤は約0.001mg/kg/日〜約4mg/kg/日の量で投与される。1態様において、その鎮痛剤、筋弛緩剤および/または抗炎症剤は約0.01mg/kg/日〜約0.4mg/kg/日の量で投与される。
【0031】
鎮痛剤および/または抗炎症剤
鎮痛剤は、痛みを低減、緩和または除去することができる薬剤または化合物を指す。鎮痛剤の例には、アセトアミノフェン、局所的麻酔薬、例えばリドカイン、ブピバカイン、ベンゾカイン、ロピバカイン、クロニジン、アミトリプチリン、カルバマゼピン、ガバペンチン(gabapentin)、プレガバリン(pregabalin)、オピオイド鎮痛薬、またはそれらの組み合わせが含まれるが、それらに限定されない。個々の麻酔薬には、例として、および限定ではなく、アリフルラン(aliflurane);バクロフェン(baclofen)、ベノキシネート(benoxinate)塩酸塩;ベンゾカイン;ビフェナミン塩酸塩;ブピバカイン塩酸塩;ブタンベン(butamben);ピクリン酸ブタンベン;クロニジン、クロニジン塩酸塩、クロロプロカイン塩酸塩;コカイン;コカイン塩酸塩;シクロプロパン;デスフルラン(desflurane);デキシバカイン(dexivacaine);シクラミン酸ジアモカイン;ジブカイン(dibucaine);ジブカイン塩酸塩;ディクロニン(dyclonine)塩酸塩;エンフルラン(enflurane);エーテル;塩化エチル;エチドカイン(etidocaine);エトキサドロール(etoxadrol)塩酸塩;ユープロシン(euprocin)塩酸塩;フルロキセン(fluroxene);ハロセン(halothane);イソブタンベン(isobutamben);イソフルラン(isoflurane);ケタミン(ketamine)塩酸塩;レボキサドロール(levoxadrol)塩酸塩;リドカイン;リドカイン塩酸塩;メピバカイン(mepivacaine)塩酸塩;メトヘキシタールナトリウム;メトキシフルラン;ミダゾラム(midazolam)塩酸塩;マレイン酸ミダゾラム;ミナキソロン(minaxolone);亜酸化窒素;ノルフルラン(norflurane);オクトドリン(octodrine);オキセサゼイン(oxethazaine);フェンシクリジン(phencyclidine)塩酸塩;プラモキシン(pramoxine)塩酸塩;プリロカイン(prilocaine)塩酸塩;プロカイン(procaine)塩酸塩;プロパニジド(propanidid);プロパラカイン(proparacaine)塩酸塩;プロポフォール(propofol);プロポキシカイン(propoxycaine)塩酸塩;ピロカイン(pyrrocaine);リソカイン(risocaine);ロドカイン(rodocaine);ロフルラン(roflurane);サリチルアルコール;セボフルラン(sevoflurane);テフルラン(teflurane);テトラカイン(tetracaine);テトラカイン塩酸塩;チアミラール(thiamylal);チアミラールナトリウム;チオペンタール(thiopental)ナトリウム;チレタミン(tiletamine)塩酸塩;ゾラミン(zolamine)塩酸塩;またはそれらの組み合わせが含まれる。
【0032】
オピオイド鎮痛薬には、アルフェンタニル(alfentanil)、アリルプロジン(allylprodine)、アルファプロジン(alphaprodine)、アニレリジン(anileridine)、ベンジルモルフィン(benzylmorphine)、ベジトラミド(bezitramide)、ブプレノルフィン(buprenorphine)、ブトルファノール(butorphanol)、クロニタゼン(clonitazene)、コデイン、デソモルフィン(desomorphine)、デキストロモラミド(dextromoramide)、デキストロプロポキシフェン(dextropropoxyphene)、デゾシン(dezocine)、ジアンプロミド(diampromide)、ジアモルホン(diamorphone)、ジヒドロコデイン、ジヒドロモルフィン、ジメノキサドール(dimenoxadol)、ジメフェプタノール(dimepheptanol)、ジメチルチアンブテン、酪酸ジオキサフェチル(dioxaphetyl butyrate)、ジピパノン(dipipanone)、エプタゾシン(eptazocine)、エトヘプタジン(ethoheptazine)、エチルメチルチアンブテン、エチルモルフィン、エトニタゼン(etonitazene)、フェンタニル(fentanyl)、フルピルチン(flupirtine)、ヘロイン、ヒドロコドン、ヒドロモルホン、ヒドロキシペチジン(hydroxypethidine)、イソメタドン(isomethadone)、ケトベミドン(ketobemidone)、レボルファノール、レボフェナシルモルファン(levophenacylmorphan)、ロフェンタニル(lofentanil)、メペリジン(meperidine)、メプタジノール(meptazinol)、メタゾシン(metazocine)、メタドン(methadone)、メトポン、モルヒネ、ミロフィン(myrophine)、ナルセイン(narceine)、ニコモルフィン(nicomorphine)、ノルレボルファノール(norlevorphanol)、ノルメタドン(normethadone)、ナロルフィン(nalorphine)、ナルブフェン(nalbuphene)、ノルモルフィン、ノルピパノン(norpipanone)、アヘン、オキシコドン、オキシモルホン、パパベレタム(papaveretum)、ペチジン(pethidine)、ペンタゾシン、フェナドキソン(phenadoxone)、フェノモルファン(phenomorphan)、フェナゾシン(phenazocine)、フェノピリジン(phenoperidine)、ピミノジン(piminodine)、ピリトラミド(piritramide)、プロフェプタジン(propheptazine)、プロメドール(promedol)、プロペリジン(properidine)、プロポキシフェン(propoxyphene)、レミフェンタニル(remifentanil)、スフェンタニル(sufentanil)、チリジン(tilidine)、トラマドールまたはそれらの組み合わせが含まれる。
【0033】
語句“抗炎症剤”は、抗炎症作用を有する薬剤または化合物を指す。これらの薬剤は炎症を低減することにより痛みを取り除くことができる。抗炎症剤の例には以下のものが含まれるが、それらに限定されない:スタチン(statin)、スリンダク(sulindac)、スルファサラジン(sulfasalazine)、グアニジノエチルジスルフィド、ナロキシン(naroxyn)、ジクロフェナク、インドメタシン、イブプロフェン、フルルビプロフェン、ケトプロフェン、アクロフェナク(aclofenac)、アロキシプリン(aloxiprin)、アプロキセン(aproxen)、アスピリン、ジフルニサール(diflunisal)、フェノプロフェン、メフェナム酸、ナプロキセン、フェニルブタゾン、ピロキシカム(piroxicam)、メロキシカム(meloxicam)、サリチルアミド、サリチル酸、デスオキシスリンダク(desoxysulindac)、テノキシカム(tenoxicam)、ケトロラック(ketoralac)、フルフェニサール(flufenisal)、サルサレート(salsalate)、サリチル酸トリエタノールアミン、アミノピリン(aminopyrine)、アンチピリン(antipyrine)、オキシフェンブタゾン、アパゾン(apazone)、シンタゾン(cintazone)、フルフェナム酸(flufenamic acid)、クロニキセリル(clonixeril)、クロニキシン(clonixin)、メクロフェナム酸(meclofenamic acid)、フルニキシン(flunixin)、コルヒチン(colchicine)、デメコルシン(demecolcine)、アロプリノール(allopurinol)、オキシプリノール(oxypurinol)、ベンジダミン塩酸塩、ジメファダン(dimefadane)、インドキソール(indoxole)、イントラゾール(intrazole)、ミムバン塩酸塩、パラニレン(paranylene)塩酸塩、テトリダミン(tetrydamine)、ベンジンドピリン(benzindopyrine)塩酸塩、フルプロフェン(fluprofen)、イブフェナク(ibufenac)、ナプロキソール、フェンブフェン(fenbufen)、シンコフェン(cinchophen)、ジフルミドン(diflumidone)ナトリウム、フェナモール(fenamole)、フルチアジン、メタザミド(metazamide)、レチミド(letimide)塩酸塩、ネキセリジン(nexeridine)塩酸塩、オクタザミド(octazamide)、モリナゾール(molinazole)、ネオシンコフェン(neocinchophen)、ニマゾール(nimazole)、クエン酸プロキサゾール、テシカム(tesicam)、テシミド(tesimide)、トルメチン(tolmetin)、トリフルミデート(triflumidate)、フェナメート類(メフェナム酸、メクロフェナム酸)、ナブメトン(nabumetone)、セレコキシブ(celecoxib)、エトドラク(etodolac)、ニメスリド(nimesulide)、アパゾン(apazone)、金、テポキサリン(tepoxalin);ジチオカルバメート、またはそれらの組み合わせ。抗炎症剤には、他の化合物、例えばステロイド類、例えばフルオシノロン(fluocinolone)、コルチゾール、コルチゾン、ヒドロコルチゾン、フルドロコルチゾン、プレドニゾン、プレドニゾロン、メチルプレドニゾロン、トリアムシノロン(triamcinolone)、ベタメタゾン、デキサメタゾン、ベクロメタゾン(beclomethasone)、フルオシノロン(fluocinolone)、フルチカゾン(fluticasone)、インターロイキン−1受容体拮抗薬、サリドマイド(TNF−α放出阻害剤)、サリドマイド類似体(マクロファージによるTNF−α産生を低減する)、骨形成タンパク質(BMP)2型またはBMP−4(TNF−α活性化因子であるカスパーゼ8の阻害剤)、キナプリル(TNF−αを上方制御するアンジオテンシンIIの阻害剤)、インターフェロン類、例えばIL−11(TNF−α受容体発現を調節する)、およびオーリントリカルボン酸(TNF−αを阻害する)、グアニジノエチルジスルフィド、またはそれらの組み合わせも含まれる。
【0034】
典型的な抗炎症剤には、例えば、ナプロキセン;ジクロフェナク;セレコキシブ;スリンダク;ジフルニサール;ピロキシカム;インドメタシン;エトドラク;メロキシカム;イブプロフェン;ケトプロフェン;r−フルルビプロフェン;メフェナム酸;ナブメトン;スルファサラジン、スリンダク、トルメチン、および前記のもののそれぞれのナトリウム塩;ケトロラックブロメタミン;ケトロラックトロメタミン;ケトロラック酸;コリンマグネシウムトリサリチレート;ロフェコキシブ(rofecoxib);バルデコキシブ(valdecoxib);ルミラコキシブ(lumiracoxib);エトリコキシブ(etoricoxib);アスピリン;サリチル酸およびそのナトリウム塩;アルファ、ベータ、ガンマ−トコフェロール類およびトコトリエノール類のサリチル酸エステル(および、全てのそれらのd、l、およびラセミ異性体);アセチルサリチル酸のメチル、エチル、プロピル、イソプロピル、n−ブチル、sec−ブチル、t−ブチルエステル類;テノキシカム;アセクロフェナク(aceclofenac);ニメスリド;ネパフェナク(nepafenac);アムフェナク(amfenac);ブロムフェナク(bromfenac);フルフェナメート(flufenamate);フェニルブタゾン、またはそれらの組み合わせが含まれる。
【0035】
抗炎症剤であると考えられる典型的なステロイド類には、例えば、21−アセトキシプレグネノロン(21−acetoxypregnenolone)、アルクロメタゾン(alclometasone)、アルゲストン(algestone)、アムシノニド(amcinonide)、ベクロメタゾン(beclomethasone)、ベタメタゾン、ブデソニド(budesonide)、クロロプレドニゾン、クロベタゾール(clobetasol)、クロベタゾン(clobetasone)、クロコルトロン(clocortolone)、クロプレドノール(cloprednol)、コルチコステロン、コルチゾン、コルチバゾール(cortivazol)、デフラザコート(deflazacort)、デソニド(desonide)、デソキシメタゾン(desoximetasone)、デキサメタゾン、デキサメタゾン21−アセテート、デキサメタゾン21−リン酸二ナトリウム塩、ジフロラゾン(diflorasone)、ジフルコルトロン(diflucortolone)、ジフルプレドネート(difluprednate)、エノキソロン(enoxolone)、フルアザコート(fluazacort)、フルクロロニド(flucloronide)、フルメタゾン(flumethasone)、フルニソリド(flunisolide)、フルオシノロンアセトニド(fluocinolone acetonide)、フルオシノニド(fluocinonide)、フルオコルチンブチル(fluocortin butyl)、フルオコルトロン(fluocortolone)、フルオロメトロン(fluorometholone)、酢酸フルペロロン(fluperolone)、酢酸フルプレドニデン(fluprednidene)、フルプレドニゾロン(fluprednisolone)、フルランドレノリド(flurandrenolide)、プロピオン酸フルチカゾン(fluticasone propionate)、フォルモコルタール(formocortal)、ハルシノニド(halcinonide)、プロピオン酸ハロベタゾール(halobetasol)、ハロメタゾン(halometasone)、酢酸ハロプレドン(halopredone)、ヒドロコルタメート(hydrocortamate)、ヒドロコルチゾン、エタボン酸ロテプレドノール(loteprednol etabonate)、マジプレドン(mazipredone)、メドリゾン(medrysone)、メプレドニゾン(meprednisone)、メチルプレドニゾロン、モメタゾンフロエート(mometasone furoate)、パラメタゾン、プレドニカルベート(prednicarbate)、プレドニゾロン、プレドニゾロン25−ジエチルアミノ−アセテート、リン酸プレドニゾロンナトリウム、プレドニゾン、プレドニバル(prednival)、プレドニリデン(prednylidene)、リメキソロン(rimexolone)、チキソコルトール(tixocortol)、トリアムシノロン、トリアムシノロンアセトニド、トリアムシノロンベネトニド、トリアムシノロンヘキサアセトニド、またはそれらの組み合わせが含まれる。
【0036】
痛みおよび/または炎症の処置に有用なスタチンの例には、アトルバスタチン(atorvastatin)、シンバスタチン(simvastatin)、プラバスタチン(pravastatin)、セリバスタチン(cerivastatin)、メバスタチン(mevastatin)(米国特許第3,883,140号を参照、その全開示を本明細書に援用する)、ベロスタチン(velostatin)(シンビノリン(synvinolin)とも呼ばれる;米国特許第4,448,784号および第4,450,171号参照、これらの全開示を本明細書に援用する)、フルバスタチン(fluvastatin)、ロバスタチン(lovastatin)、ロスバスタチン(rosuvastatin)、およびフルインドスタチン(fluindostatin)(Sandoz XU−62−320)、ダルバスタチン(dalvastain)(EP出願公開番号738510 A2、その全開示を本明細書に援用する)、エプタスタチン(eptastatin)、ピタバスタチン(pitavastatin)、またはそれらの医薬的に許容できる塩類、またはそれらの組み合わせが含まれるが、それらに限定されない。様々な態様において、スタチンにはスタチンの(+)Rおよび(−)−S鏡像異性体の混合物が含まれてよい。様々な態様において、スタチンにはスタチンの1:1ラセミ混合物が含まれてよい。
【0037】
抗炎症剤には、例えばアミトリプチリン、カルバマゼピン、ガバペンチン、プレガバリン、クロニジン、またはそれらの組み合わせのような、抗炎症特性を有する抗炎症剤も含まれる。
【0038】
別途明記しない限り、または文脈から明らかでない限り、この明細書およびそれに続く特許請求の範囲のセットが鎮痛剤、筋弛緩剤および/または抗炎症剤に言及する場合、本発明者は立体異性体が含まれるその鎮痛剤および/または抗炎症剤の医薬的に許容できる塩にも言及している。医薬的に許容できる塩類には、化合物の毒性を実質的に増大させない、塩を形成する酸および塩基が含まれる。適切である可能性のある塩類のいくつかの例には、アルカリ金属、例えばマグネシウム、カルシウム、ナトリウム、カリウム、およびアンモニウムの塩類、鉱酸、例えば塩酸、ヨウ化水素酸、臭化水素酸、リン酸、メタリン酸、硝酸、および硫酸の塩類、ならびに有機酸、例えば酒石酸、酢酸、クエン酸、リンゴ酸、安息香酸、グリコール酸、グルコン酸、グロン酸、コハク酸、アリールスルホン酸、例えば、p−トルエンスルホン酸、等の塩類が含まれる。
【0039】
“薬物デポー”は、少なくとも1種類の鎮痛剤および/または抗炎症剤が身体へ投与される組成物である。従って、薬物デポーは、望まれる部位(例えば、患者の椎間板腔、脊椎管、組織、特に手術の部位の組織もしくはその付近の組織、または他の炎症部位、等)における埋め込みまたは保持を促進する物理的構造を含んでよい。薬物デポーは薬物そのものも含む。用語“薬物”は、本明細書において使用される際、一般に、患者の生理機能を変化させるあらゆる物質を指すことを意味する。用語“薬物”は、本明細書において、用語“療法剤”、“療法上有効量”、および“有効医薬成分”または“API”と互換的に用いられてよい。別途明記しない限り、“薬物”配合物には1種類より多くの療法剤が含まれてよく、ここで典型的な療法剤の組み合わせには2種類以上の薬物の組み合わせが含まれることは理解されるであろう。薬物は、その部位への送達のためにその療法剤の濃度勾配を提供する。様々な態様において、薬物デポーは埋め込み部位から約0.1mm〜約5cmまでの距離でその療法剤の最適な薬物濃度勾配を提供し、少なくとも1種類の鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩を含む。
【0040】
“デポー”には、カプセル、マイクロスフェア、微粒子、マイクロカプセル、マイクロファイバー、粒子、ナノスフェア、ナノ粒子、コーティング、母材、ウェハー、丸剤、ペレット、エマルジョン、軟膏、リポソーム、ミセル、ゲル、繊維、細片、シートまたは他の医薬送達組成物、またはそれらの組み合わせが含まれるが、それらに限定されない。一部の態様において、その薬物デポーは、薬物のデポーからの放出を可能にする孔を有する。その薬物デポーはそのデポー中で体液が薬物を移動させることを可能にするであろう。しかし、デポー中への細胞浸潤は、デポーの孔の大きさにより妨げられるであろう。このように、一部の態様において、デポーは組織スキャフォールドとして機能して組織増殖を可能にするべきではない。むしろ、薬物デポーは薬物送達にのみ利用されるであろう。一部の態様において、薬物デポー中の孔は10〜50ミクロン未満であろう。この孔径は、細胞が薬物デポーに浸潤してスキャフォールドとなる細胞を敷設することを妨げるであろう。従って、この態様において、体液(fluid)が薬物デポーに入る際に薬物が薬物デポーから溶出されるであろうが、細胞は入ることを妨げられるであろう。一部の態様において、孔がほとんど、または全く無い場合、薬物は酵素の作用により、加水分解作用、拡散により、および/または人体中の他の類似の機構により、薬物デポーから溶出されるであろう。
【0041】
デポーに適した材料は、理想的には、好ましくはFDAに承認されている医薬的に許容できる生分解性および/またはあらゆる生体吸収性の材料、またはGRAS材料である。これらの材料はポリマー性または非ポリマー性であり、ならびに、合成によるもの、または天然に存在するもの、またはそれらの組み合わせであることができる。様々な態様において、薬物デポーは生分解性でなくてもよく、または生分解性でない材料を含んでいてよい。非生分解性ポリマーには、様々なセルロース誘導体(カルボキシメチルセルロース、酢酸セルロース、セルロースアセテートプロピオネート、エチルセルロース、ヒドロキシプロピルメチルセルロース、ヒドロキシアルキルメチルセルロース類、およびアルキルセルロース類)、シリコンおよびシリコンに基づくポリマー(例えばポリジメチルシロキサン)、ポリエチレン−co−(ビニルアセテート)、ポロキサマー、ポリビニルピロリドン、ポロキサミン(poloxamine)、ポリプロピレン、ポリアミド、ポリアセタール、ポリウレタン、ポリ(エステル−アミド)、ポリエステル、ポリエチレン−クロロトリフルオロエチレン、ポリテトラフルオロエチレン(PTFEまたは“Teflon(商標)”)、スチレンブタジエンゴム、ポリエチレン、ポリプロピレン、ポリフェニレンオキシド−ポリスチレン、ポリ−α−クロロ−p−キシレン、ポリメチルペンテン、ポリスルホン、非分解性エチレン−ビニルアセテート(例えば、エチレンビニルアセテートディスクおよびポリ(エチレン−co−ビニルアセテート))、ならびに他の関連する生体安定性(biostable)ポリマー、またはそれらの組み合わせが含まれるが、それらに限定されない。本出願における使用に適した薬物デポーが2008年4月18日に出願された米国仮出願第61/046,246号、2008年4月18日に出願された米国仮出願第61/046,218号、2008年4月18日に出願された米国仮出願第61/046,218号、2008年4月18日に出願された米国仮出願第61/046,201号、2008年4月18日に出願された米国一連番号12/105,864および2008年4月18日に出願された米国一連番号12/105,375において記述されている。これらの出願の全開示を本明細書において本出願中に援用する。
【0042】
薬物デポーは非吸収性ポリマーも含んでいてよい。これらの非吸収性ポリマーには、デルリン、ポリウレタン、シリコンおよびポリウレタンのコポリマー類、ポリオレフィン類(例えばポリイソブチレンおよびポリイソプレン)、アクリルアミド類(例えばポリアクリル酸およびポリ(アクリロニトリル−アクリル酸))、ネオプレン、ニトリル、アクリレート類(例えばポリアクリレート類、ポリ(2−ヒドロキシエチルメタクリレート)、メチルメタクリレート、2−ヒドロキシエチルメタクリレート、およびアクリレート類のN−ビニルピロリドンとのコポリマー類)、N−ビニルラクタム類、ポリアクリロニトリル、グルコマンナンゲル、加硫ゴム、およびそれらの組み合わせが含まれ得るが、それらに限定されない。ポリウレタン類の例には、熱可塑性ポリウレタン類、脂肪族ポリウレタン類、セグメント化ポリウレタン類、親水性ポリウレタン類、ポリエーテル−ウレタン、ポリカーボネート−ウレタンおよびシリコンポリエーテル−ウレタンが含まれる。典型的には、非分解性薬物デポーは除去される必要がある可能性がある。
【0043】
“可逆性相転移物質”には、例えば温度の変化のような外部刺激に反応して相または物理的状態を変化させる(例えば、固体が液体に、固体が半固体に、半固体が液体に、液体が固体に、液体が半固体に、または半固体が固体に、ガラス質−ゴム状、結晶質もしくは半晶質が融解体に、水に不溶性のものが水溶性のものに)物質が含まれる。可逆性相転移物質の相または物理的状態を変化させることの意図される作用は、その薬物デポー内の薬物の浸透の速度を増大させて薬物のデポーからの放出速度を増大させることである。可逆性は、その相変化物質が、その外部刺激を除去した後のある時点において、その最初の相または物理的状態に戻ることを意味する。その物質は非生分解性または生分解性のポリマー性および非ポリマー性物質を含むことができる。“療法上有効量”または“有効量”は、投与された際に、その薬物が結果として例えば炎症の抑制、痛みの低減または緩和、処置される疾患および/または病気の改善、等のような生物学的活動の改変をもたらすような量である。患者へ投与される投与量は、別途明記しない限り、または文脈から明らかでない限り、投与された薬物の薬物動態特性、投与経路、患者の状態および特徴(性別、年齢、体重、健康、サイズ、等)、症状の程度、併用処置、処置の頻度および望まれる作用を含む様々な要因に依存して、1回量または多数回用量としてのものである。一部の態様において、その配合物は、熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギー、光、機械的エネルギー(例えば撹拌)、電気的、化学的、もしくは磁気エネルギーの適用の際の即時放出のために設計される。他の態様において、その配合物は持続放出のために設計される。他の態様において、その配合物は1つ以上の即時放出表面または層および1つ以上の持続放出表面または層を含む。
【0044】
語句“持続(sustained)放出”または“継続(sustain)放出”(延長放出または制御放出とも呼ばれる)は、本明細書において、ヒトまたは他の哺乳類の身体の中に導入されて、予め決められた期間にわたって、およびその予め決められた期間全体を通して望まれる療法的作用を達成するのに十分な療法的レベルで、1種類以上の療法剤の流れを連続的に、または絶え間なく放出する、1種類以上の療法剤(単数または複数)を指して用いられる。連続的な、または絶え間ない放出の流れへの言及は、その薬物デポーまたはそれの構成要素のインビボでの生分解の結果として、または療法剤(単数または複数)もしくは療法剤(単数または複数)のコンジュゲートの代謝による変換もしくは溶解の結果として起こる放出を含むことを意図する。当業者は気付いているように、持続放出配合物は、例として、フィルム、スラブ、シート、ペレット、微粒子、マイクロスフェア、マイクロカプセル、球状体、成形された派生物、またはペーストとして作られてよい。その配合物は、等張生理食塩水、生理学的緩衝液、または患者の中への注入に許容できる他の溶液中での懸濁に適している形であってよい。さらに、その配合物は、非経口配合物、マイクロスフェア、マイクロカプセル、ゲル、ペースト、軟膏、クリーム、埋め込み可能な棒状の物(rods)、ペレット、プレートまたは繊維等が含まれるがそれらに限定されない本明細書における態様に関連して有用であると当業者に理解されるであろうあらゆる埋め込み可能な、挿入可能な、または注入可能なシステムと共に用いられてよい。一部の態様において、その薬物デポーは、鎮痛剤および/または抗炎症剤の持続放出を引き起こす物質(例えばポリマー)を含む。
【0045】
語句“即時放出”は、本明細書において、身体の中に導入されて、それが投与される部位において溶解する、またはそこで吸収されることが可能であり、その薬物の溶解または吸収を遅延させる、または延長する意図がない、1種類以上の療法剤(単数または複数)を指して用いられる。即時放出は、投与の後の短い期間内、例えば、一般に数分〜約1時間以内での薬物の放出を指す。一部の態様において、その薬物デポーは、その中に配置された鎮痛剤および/または抗炎症剤を有し、その鎮痛剤および/または抗炎症剤の即時放出を提供する。例えば、一部の態様において、その薬物デポーは、熱、冷気または別の適切な形のエネルギーがそのデポーに、またはそのデポーの付近(例えば、その薬物デポーが埋め込まれている場所の上の皮膚)に適用された際に相または物理的状態を変化させて、その鎮痛剤および/または抗炎症剤の放出の速度の増大を引き起こす、可逆的相転移ポリマーを含んでいてよい。
【0046】
用語“哺乳類(mammal)”は、分類学の綱“哺乳類(mammalian)”からの生物を指し、それにはヒト、他の霊長類、例えばチンパンジー、類人猿、オランウータン、およびサル、ラット、マウス、ネコ、イヌ、ウシ、ウマ、等が含まれるが、それらに限定されない。様々な態様において、その哺乳類はヒトの患者である。
【0047】
語句“放出速度プロフィール”は、一定の時間の単位にわたって放出される有効成分の割合、例えばmcg/時間、mcg/日、mg/時間、mg/日、10日間の間1日あたり10%、等を指す。当業者が知っているように、放出速度プロフィールは線形であってよいが、線形である必要はない。限定的ではない例として、その薬物デポーは、少なくとも1種類のアルファアドレナリン受容体作動薬をある期間にわたって放出するペレットであってよい。
【0048】
疾患または病気を処置することまたはその処置は、疾患/病気の徴候または症状を軽減する努力において、患者(正常またはそうではない状態のヒト、または他の哺乳類)に1種類以上の薬物を投与することを含んでいてよいプロトコルを実行することを指す。軽減は、疾患または病気の徴候または症状が出現する前に、ならびにそれらの出現の後に起こり得る。従って、“処置すること”または“処置”には、疾患または望まれない状態を“予防すること”またはその“予防”が含まれる。加えて、“処置すること”または“処置”は、徴候または症状の完全な軽減を必要とせず、治癒を必要とせず、そして具体的には、患者に対してわずかな効果しか有しないプロトコルも含まれる。“痛みおよび/または炎症を低減すること”には痛みおよび/または炎症の減少が含まれ、痛みおよび/または炎症の徴候または症状の完全な軽減を必要とせず、治癒を必要としない。様々な態様において、痛みおよび/または炎症を低減することには、痛みおよび/または炎症のわずかな減少さえ含まれる。例として、有効投与量の鎮痛剤および/または抗炎症剤の投与を用いて、様々な疾患または病気に関する痛みおよび/または炎症の症状を予防、処置、または緩和することができる。これらの疾患/病気は、術後痛および/または炎症、滑液包炎、腱炎、自己免疫疾患、例えば多発性硬化症、リウマチ性関節炎、骨関節炎、インスリン依存型糖尿病(I型糖尿病)、全身性紅斑性狼瘡および乾癬、蠕虫のような感染性因子により誘発される免疫病理(例えば、リーシュマニア症)、ならびにHIVが含まれる特定のウイルス感染症、ならびにライム病、結核、およびらい腫らいが含まれる細菌感染症、組織移植拒絶、移植片対宿主疾患、ならびにアトピー性の病気、例えば喘息およびアレルギー(アレルギー性鼻炎、食物アレルギーが含まれる胃腸アレルギー、好酸球増加症、結膜炎、または糸球体腎炎が含まれる)が含まれるがそれらに限定されない慢性炎症性疾患を含んでよい。
【0049】
1つの慢性的な病気は坐骨神経痛である。一般に、坐骨神経痛”は、侵害受容性の痛みから神経障害的な痛みへと移行し得る痛みの例である。坐骨神経痛は、脊髄の下部(腰部領域)から発して、脚の裏側を下行して足に至る坐骨神経と関係する痛みを指す。坐骨神経痛は一般に椎間板ヘルニアにより始まる。椎間板ヘルニア自体は局所的な免疫系の活性化をもたらす。椎間板ヘルニアは、神経根を締め付ける、または圧迫することによりそれを損傷し、その領域で追加の免疫系の活性化をもたらす可能性もある。様々な態様において、その鎮痛剤および/または抗炎症剤を用いて、その鎮痛剤および/または抗炎症剤を1箇所以上の標的組織部位(例えば、神経根、背根神経節、痛みが集中する部位、脊柱またはその付近、等)で局所投与することにより、坐骨神経の痛みおよび/または炎症を低減、処置、または予防することができる。
【0050】
“局在性の”送達には、1種類以上の薬物が組織、例えば神経系の神経根または脳の領域、またはそれらに非常に近接した領域(例えば、約10cm以内、または約5cm以内、または0.1cm以内)の内部に沈積される(deposited)送達が含まれる。“標的化された送達システム”は、標的部位またはその付近に沈積させることができるある量の療法剤を有する1種類以上の薬物デポー、ゲル、またはゲル中で分散したデポーの、痛み、炎症、または他の疾患もしくは病気の処置のための、必要に応じた送達を提供する。
【0051】
用語“生分解性”には、その薬物デポーの全部または一部が、酵素の作用により、加水分解作用により、および/または人体中の他の類似の機構により、時間の経過に伴って分解されるであろうことが含まれる。様々な態様において、“生分解性”には、療法剤が放出された後で、または放出されている間に、そのデポー(例えば、微粒子、マイクロスフェア、等)が体内で無毒の構成要素へと崩壊する、または分解されることができることが含まれる。“生侵食性(bioerodible)”は、そのデポーが、少なくとも部分的に、周囲の組織に見出される物質、体液との接触により、または細胞の作用により、時間の経過に伴って侵食または分解されるであろうことを意味する。“生体吸収性”は、そのデポーが人体内で、例えば細胞または組織により崩壊して吸収されるであろうことを意味する。“生体適合性”は、そのデポーが標的組織部位で実質的な組織刺激または壊死を引き起こさないであろうことを意味する。
【0052】
語句“疼痛管理薬物療法”には、痛みを予防、緩和、または完全に取り除くために投与される1種類以上の療法剤が含まれる。これらには、1種類以上の鎮痛剤および/または抗炎症剤が単独で、または筋弛緩剤、麻酔薬等、もしくはそれらの組み合わせとの組み合わせで含まれる。
【0053】
様々な態様において、そのデポーは埋め込み後の最初の24時間〜48時間以内に療法剤のバースト投与または大量瞬時投与を引き起こすように設計することができる。“初期バースト”または“バースト作用”または“大量瞬時投与”は、5、10、15、20、25、30、25、40、45、50、55、60、75、90、100、120、140、160、180分以内、または4〜6時間以内での、そのデポーからのある用量の療法剤の即時放出を指す。一部の態様において、その大量瞬時投与は、そのデポーが熱、冷気または他の適切な形のエネルギー、例えば超音波エネルギー、光、機械的エネルギー(例えば撹拌)、電気的、化学的、もしくは磁気エネルギーおよび水性の液体(例えば、血液、滑液、脳脊髄液、等)と接触した後、数分以内〜1時間以内に起こるであろう。このバースト作用または大量瞬時投与は、患者が突発痛および/または炎症を経験している場合の鎮痛および/または抗炎症に特に有益である。一部の態様において、熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギー、光、機械的エネルギー(例えば撹拌)、電気的、化学的、もしくは磁気エネルギーの適用により、その患者は大量瞬時投与およびそれらの鎮痛を制御することができる。“バースト作用”または“大量瞬時投与”は、療法剤のデポーからの放出の増大によるものであると信じられている。一部の態様において、その薬物デポーはその内部に配置された鎮痛剤および/または抗炎症剤を有し、その鎮痛剤および/または抗炎症剤の即時放出を提供する。例えば、一部の態様において、その薬物デポーは、熱および/または冷気のそのデポーへの、またはそのデポーの付近(例えば、それの5、4、3、2、1、0.5、0.1、0.01cm以内)への適用の際に相を変化させてその鎮痛剤および/または抗炎症剤の大量瞬時投与量の放出を引き起こす可逆的相転移ポリマーを含んでいてよい。典型的には、その大量瞬時投与量は、局所的に投与された日用量の10、20、30、40、50、60、70、80、90、または100%であることができるが、この用量は、24〜48時間以内の代わりに、5、10、15、20、25、30、25、40、45、50、55、60、75、90、100、120、140、160、180分以内、または4〜6時間以内に放出される。例えば、その薬物デポーが100μg/日のアルファ作動薬(例えばクロニジン)を放出するように設計されている場合、そのバースト作用または大量瞬時投与はその薬物デポーが5、10、15、20、25、30、25、40、45、50、55、60、75、90、100、120、140、160、または180分以内に100μgのそのアルファ作動薬を放出して痛みおよび/または炎症を軽減することを可能にするであろう。
【0054】
少なくとも1種類の鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩を含む薬物デポーは、筋弛緩剤と同時投与することができる。同時投与は、別々の薬物デポーで同時に投与すること、または同じ薬物デポー中に一緒に配合することを含んでよい。
【0055】
典型的な筋弛緩剤には、例として、限定ではなく、塩化アルクロニウム、アトラクリウムベシレート(atracurium bescylate)、バクロフェン(baclofen)、カルボロニウム(carbolonium)、カリソプロドール(carisoprodol)、カルバミン酸クロルフェネシン、クロルゾキサゾン、シクロベンザプリン、ダントロレン(dantrolene)、臭化デカメトニウム(decamethonium)、ファザジニウム(fazadinium)、ガラミントリエチオジド、ヘキサフルオレニウム、メラドラジン(meladrazine)、メフェンシン(mephensin)、メタキサロン、メトカルバモール、ヨウ化メトクリン(metocurine)、パンクロニウム(pancuronium)、メシル酸プリジノール、スチラメート(styramate)、スキサメトニウム(suxamethonium)、スキセトニウム(suxethonium)、チオコルチコシド(thiocolchicoside)、チザニジン(tizanidine)、トルペリゾン(tolperisone)、ツボクラリン(tubocuarine)、ベクロニウム(vecuronium)、またはそれらの組み合わせが含まれる。
【0056】
その薬物デポーは、鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩に加えて、またはその代わりに、他の療法剤または有効成分も含んでいてよい。適切な追加の療法剤には、インテグリン拮抗薬、アルファ−4 ベータ−7インテグリン拮抗薬、細胞接着阻害剤、インターフェロンガンマ拮抗薬、CTLA4−Ig作動薬/拮抗薬(BMS−188667)、CD40リガンド拮抗薬、ヒト化抗IL−6 mAb(MRA、トシリズマブ(Tocilizumab)、Chugai)、HMGB−1 mAb(Critical Therapeutics Inc.)、抗IL2R抗体(ダクリズマブ(daclizumab)、バシリシマブ(basilicimab))、ABX(抗IL−8抗体)、組換えヒトIL−10、またはHuMax IL−15(抗IL15抗体)が含まれるが、それらに限定されない。
【0057】
アルファアドレナリン作動性作動薬と同時投与することができる他の適切な療法剤には、IL−1阻害剤、例えばヒトのインターロイキン−1受容体拮抗薬(IL−1Ra)の組換え非グリコシル化型であるKineret(登録商標)(アナキンラ(anakinra))、またはIL−1の作用を妨害するモノクローナル抗体であるAMG108が含まれる。療法剤には、興奮性アミノ酸、例えばグルタミン酸およびアスパラギン酸、グルタミン酸のNMDA受容体、AMPA受容体、および/またはカイニン酸受容体への結合の拮抗薬または阻害剤も含まれる。望ましい場合は、上記のもののPEG化された形も用いてよいと考えられる。他の療法剤の例には、NFカッパB阻害剤、例えばグルココルチコイド類、または抗酸化剤、例えばジチオカルバメートが含まれる。
【0058】
使用に適した追加の療法剤の具体的な例には、同化成長因子または抗異化(anti−catabolic)成長因子、または骨誘導成長因子またはそれらの組み合わせが含まれるが、それらに限定されない。
【0059】
適切な同化成長または抗異化成長因子には、骨形成タンパク質、成長分化因子、LIM鉱化タンパク質、CDMPまたは前駆細胞またはそれらの組み合わせが含まれるが、それらに限定されない。
【0060】
それぞれの鎮痛剤および/または抗炎症剤に関して、一部の態様において、特にその薬剤(単数または複数)が生分解性ポリマー層中に配置されている場合、それはその薬物デポーに持続放出特性を与え、それぞれの化合物の放出は少なくとも1日間、少なくとも2日間、少なくとも3日間、少なくとも4日間、少なくとも5日間、少なくとも6日間、少なくとも7日間、少なくとも8日間、少なくとも9日間、少なくとも10日間、少なくとも11日間、少なくとも12日間、少なくとも13日間、少なくとも14日間、または少なくとも15日間、またはより長い間であってよい。一部の態様において、その薬物デポーは術後痛および/または炎症の軽減を約3日間〜約10日間提供する。
【0061】
その療法剤(例えば、鎮痛剤および/または抗炎症剤)には、その医薬的に許容できる塩も含まれる。本明細書で用いられる際、“医薬的に許容できる塩”は、開示する化合物(例えば、エステルまたはアミンが含まれる)の誘導体を指し、ここでその親化合物はその酸性または塩基性塩を作ることにより修飾されてよい。医薬的に許容できる塩の例には、アミンのような塩基性残基の鉱酸塩または有機酸塩;カルボン酸のような酸性残基のアルカリまたは有機塩が含まれるが、それらに限定されない。その医薬的に許容できる塩には、例えば、無毒性の無機または有機酸から形成される、親化合物の一般に用いられる無毒性の塩または第四級アンモニウム塩が含まれる。例えば、そのような一般に用いられる無毒性の塩には、無機酸、例えば塩酸、臭化水素酸、硫酸、スルファミン酸、リン酸、もしくは硝酸に由来する塩;または、有機酸、例えば酢酸、フオル(fuoric)酸、プロピオン酸、コハク酸、グリコール酸、ステアリン酸、乳酸、リンゴ酸、酒石酸、クエン酸、アスコルビン酸、パモ酸、マレイン酸、ヒドロキシマレイン酸、フェニル酢酸、グルタミン酸、安息香酸、サリチル酸、スルファニル酸、2−アセトキシ安息香酸、フマル酸、トルエンスルホン酸、メタンスルホン酸、エタンジスルホン酸、シュウ酸、イセチオン酸から調製される塩が含まれる。医薬的に許容できるものには、その療法剤のラセミ混合物((+)−Rおよび(−)−S鏡像異性体)または右旋性および左旋性異性体のそれぞれもそれぞれ含まれる。その療法剤は遊離酸もしくは塩基型であってよく、または長期の作用活性のためにPEG化されていてよい。
【0062】
クロニジン
1態様において、その鎮痛剤および/または抗炎症剤はクロニジンを含む。クロニジンに言及する場合、別途明記しない限り、または文脈から明らかでない限り、本発明者は医薬的に許容できる塩にも言及しているものと理解される。クロニジンに関する1つの周知の商業的に入手できる塩は、その塩酸塩である。医薬的に許容できる可能性のある塩のいくつかの他の例には、化合物の毒性を実質的に増大させない塩を形成する酸および塩基、例えばアルカリ金属、例えばマグネシウム、カリウムおよびアンモニウムの塩、鉱酸、例えばヨウ化水素酸、臭化水素酸、リン酸、メタリン酸、硝酸、および硫酸の塩、ならびに有機酸、例えば酒石酸、酢酸、クエン酸、リンゴ酸、安息香酸、グリコール酸、グルコン酸、グロン酸、コハク酸、アリールスルホン酸、例えば、p−トルエンスルホン酸、および同様のものの塩が含まれる。
【0063】
さらに、クロニジンに言及する際、その有効成分は、塩の形だけではなく、塩基の形(例えば遊離塩基)であってもよい。様々な態様において、それが塩基の形である場合、それはPLGAまたはPLAに関して起こる可能性のある加熱または溶媒処理の際に見られる可能性があるような重大なポリマー分解がない条件の下でポリマーと組み合わせられてよい。限定的でない例として、クロニジンをポリ(オルトエステル類)と共に配合する場合、クロニジン塩基配合物を用いることが望ましい可能性がある。対照的に、クロニジンをPLGAと共に配合する場合、HCl塩の形を用いることが望ましい可能性がある。
【0064】
1態様において、その薬物デポーは2,6−ジクロロ−N−2−イミダゾリジニリデンベンゼンアミン(2,6−dichloro−N−2−imidazolidinyldenebenzenamine)とも呼ばれるクロニジンを含む。クロニジンまたはその医薬的に許容できる塩は、例えば手術、慢性炎症性疾患、慢性炎症性腸疾患、滑液包炎、骨関節炎、骨溶解、腱炎、坐骨神経痛、椎間板ヘルニア、狭窄、ミオパシー、脊椎すべり症(spondilothesis)、腰痛、椎間関節痛、手根管症候群、足根管症候群、失敗した背部痛等の結果として起こる痛みおよび/または炎症を低減、予防または処置するために、様々な医薬製造業者より入手可能である。
【0065】
その投与量はおおよそ0.0005からおおよそ960μg/日までである。さらなるクロニジンの投与量には、おおよそ0.0005からおおよそ900μg/日まで;おおよそ0.0005からおおよそ500μg/日まで;おおよそ0.0005からおおよそ250μg/日まで;おおよそ0.0005からおおよそ100μg/日まで;おおよそ0.0005からおおよそ75μg/日まで;おおよそ0.001からおおよそ70μg/日まで;おおよそ0.001からおおよそ65μg/日まで;おおよそ0.001からおおよそ60μg/日まで;おおよそ0.001からおおよそ55μg/日まで;おおよそ0.001からおおよそ50μg/日まで;おおよそ0.001からおおよそ45μg/日まで;おおよそ0.001からおおよそ40μg/日まで;おおよそ0.001からおおよそ35μg/日まで;おおよそ0.0025からおおよそ30μg/日まで;おおよそ0.0025からおおよそ25μg/日まで;おおよそ0.0025からおおよそ20μg/日まで;おおよそ0.0025からおおよそ15μg/日まで;おおよそ0.0025からおおよそ10μg/日まで;おおよそ0.0025からおおよそ5μg/day;およびおおよそ0.0025からおおよそ2.5μg/日までが含まれる。別の態様において、クロニジンの投与量はおおよそ0.005からおおよそ15μg/日までである。別の態様において、クロニジンの投与量はおおよそ0.005からおおよそ10μg/日までである。別の態様において、クロニジンの投与量はおおよそ0.005からおおよそ5μg/日までである。別の態様において、クロニジンの投与量はおおよそ0.005から2.5μg/日までである。一部の態様において、クロニジンの量は40〜600μg/日である。一部の態様において、クロニジンの量は200〜400μg/日である。
【0066】
様々な態様において、クロニジンおよび少なくとも1種類の生分解性ポリマーを含む医薬配合物が存在し、ここでそのクロニジンはその配合物の約1重量%から約20重量%までを構成する。一部の態様において、そのクロニジンはその配合物の約3重量%から約20重量%まで、約3重量%から約18重量%まで、約5重量%から約15重量%まで、または約7.5重量%から約12.5重量%までを構成する。例として、5%〜15%クロニジン組成物を用いる場合、クロニジンのポリマーに対するモル比は、267グラム/モル比を有するおおよそ80キロダルトンのポリマーを用いる場合、おおよそ16から52までであろう。
【0067】
一部の態様において、その少なくとも1種類の生分解性ポリマーはポリ(乳酸−co−グリコリド)(PLGA)またはポリ(オルトエステル)(POE)、またはそれらの組み合わせを含む。ポリ(乳酸−co−グリコリド)はポリグリコリド(PGA)およびポリラクチドの混合物を含んでいてよく、一部の態様において、その混合物中に、ポリグリコリドより多くのポリラクチドが存在する。様々な態様において、100%のポリラクチドおよび0%のポリグリコリド;95%のポリラクチドおよび5%のポリグリコリド;90%のポリラクチドおよび10%のポリグリコリド;85%のポリラクチドおよび15%のポリグリコリド;80%のポリラクチドおよび20%のポリグリコリド;75%のポリラクチドおよび25%のポリグリコリド;70%のポリラクチドおよび30%のポリグリコリド;65%のポリラクチドおよび35%のポリグリコリド;60%のポリラクチドおよび40%のポリグリコリド;55%のポリラクチドおよび45%のポリグリコリド;50%のポリラクチドおよび50%のポリグリコリド;45%のポリラクチドおよび55%のポリグリコリド;40%のポリラクチドおよび60%のポリグリコリド;35%のポリラクチドおよび65%のポリグリコリド;30%のポリラクチドおよび70%のポリグリコリド;25%のポリラクチドおよび75%のポリグリコリド;20%のポリラクチドおよび80%のポリグリコリド;15%のポリラクチドおよび85%のポリグリコリド;10%のポリラクチドおよび90%のポリグリコリド;5%のポリラクチドおよび95%のポリグリコリド;ならびに0%のポリラクチドおよび100%ポリグリコリドが存在する。
【0068】
ポリラクチドおよびポリグリコリドの両方を含む様々な態様において、少なくとも95%のポリラクチド;少なくとも90%のポリラクチド;少なくとも85%のポリラクチド;少なくとも80%のポリラクチド;少なくとも75%のポリラクチド;少なくとも70%のポリラクチド;少なくとも65%のポリラクチド;少なくとも60%のポリラクチド;少なくとも55%;少なくとも50%のポリラクチド;少なくとも45%のポリラクチド;少なくとも40%のポリラクチド;少なくとも35%のポリラクチド;少なくとも30%のポリラクチド;少なくとも25%のポリラクチド;少なくとも20%のポリラクチド;少なくとも15%のポリラクチド;少なくとも10%のポリラクチド;または少なくとも5%のポリラクチドが存在し;そのバイオポリマーの残りの部分がポリグリコリドである。
【0069】
様々な態様において、その薬物デポーにおいて用いられる薬物の粒径は約5から30マイクロメートルまでであるが、様々な態様において、約1ミクロンから250ミクロンまでの範囲が用いられてよい。一部の態様において、その生分解性ポリマーはその配合物の少なくとも50重量%、少なくとも60重量%、少なくとも70重量%、その配合物の少なくとも80重量%、その配合物の少なくとも85重量%、その配合物の少なくとも90重量%、その配合物の少なくとも95重量%、またはその配合物の少なくとも97重量%を構成する。一部の態様において、その少なくとも1種類の生分解性ポリマーおよびクロニジンだけがその医薬配合物の構成要素である。
【0070】
一部の態様において、粒子の少なくとも75%が約10マイクロメートルから約200マイクロメートルまでの大きさを有する。一部の態様において、粒子の少なくとも85%が約10マイクロメートルから約200マイクロメートルまでの大きさを有する。一部の態様において、粒子の少なくとも95%が約10マイクロメートルから約200マイクロメートルまでの大きさを有する。一部の態様において、粒子の全てが約10マイクロメートルから約200マイクロメートルまでの大きさを有する。
【0071】
一部の態様において、粒子の少なくとも75%が約20マイクロメートルから約180マイクロメートルまでの大きさを有する。一部の態様において、粒子の少なくとも85%が約20マイクロメートルから約180マイクロメートルまでの大きさを有する。一部の態様において、粒子の少なくとも95%が約20マイクロメートルから約180マイクロメートルまでの大きさを有する。一部の態様において、粒子の全てが約20マイクロメートルから約180マイクロメートルまでの大きさを有する。
【0072】
一部の態様において、以下のものを含む薬物デポー中の医薬配合物が存在する:クロニジン(ここでそのクロニジンは塩酸塩の形であり、その配合物の約1重量%から約20重量%までを構成する)および少なくとも1種類の生分解性ポリマー(ここでその少なくとも1種類の生分解性ポリマーはポリ(ラクチド−co−グリコリド)(またはポリ(乳酸−co−グリコール酸))またはポリ(オルトエステル)、またはそれらの組み合わせを含み、前記の少なくとも1種類の生分解性ポリマーは前記の配合物の少なくとも80重量%を構成する)。
【0073】
一部の態様において、急性の痛みを処置するための方法が存在する。これらの方法は医薬組成物を生物に投与することを含み、ここで前記の医薬組成物は約1重量%から約20重量%までのその配合物および少なくとも1種類の生分解性ポリマーを含む。一部の態様において、その装填(loading)は約5重量%から約10重量%までである。一部の態様において、その装填は約10重量%から約20重量%までである。
【0074】
一部の態様において、クロニジンのより高い装填、例えば少なくとも20重量%、少なくとも30重量%、少なくとも40重量%、少なくとも50重量%、少なくとも60重量%、少なくとも70重量%、少なくとも80重量%、または少なくとも90重量%の装填が存在する。
【0075】
一部の態様において、その薬物デポーはクロニジンと共に賦形剤を含有する。生分解性ポリマーに加えてクロニジンと共に配合することができる典型的な賦形剤には、MgO(例えば、1重量%)、5050 DLG 6E、5050 DLG 1A、mPEG、TBO−Ac、mPEG、Span−65、Span−85、pluronic F127
、TBO−Ac、ソルビトール(sorbital)、シクロデキストリン、マルトデキストリン、pluronic F68、CaCl、5050 7A、およびそれらの組み合わせが含まれるが、それらに限定されない。一部の態様において、賦形剤は配合物の約0.001重量%から約50重量%までを構成する。一部の態様において、賦形剤は配合物の約0.001重量%から約40重量%までを構成する。一部の態様において、賦形剤は配合物の約0.001重量%から約30重量%までを構成する。一部の態様において、賦形剤は配合物の約0.001重量%から約20重量%までを構成する。一部の態様において、賦形剤は配合物の約0.001重量%から約10重量%までを構成する。一部の態様において、賦形剤は配合物の約0.001重量%から約50重量%までを構成する。一部の態様において、賦形剤は配合物の約0.001重量%から約2重量%までを構成する。
【0076】
これらの医薬配合物を投与する際、三角包囲(triangulation)の戦略が有効である可能性がある。このように、医薬配合物を含む複数(少なくとも2個、少なくとも3個、少なくとも4個、少なくとも5個、少なくとも6個、少なくとも7個、等)の薬物デポーを、標的組織部位(痛みの発生源(generator)または痛みの発生部位としても知られる)の周囲に、その標的組織部位が、2個の配合物が存在する場合はその配合物の間であるか、またはそれの周囲が複数の配合物のセットにより定められる領域の内側であるかのどちらかである領域内に入るように配置することができる。
【0077】
一部の態様において、その配合物はわずかに堅く、様々な長さ、幅、直径等を有する。例えば、ある配合物は0.50mmの直径および4mmの長さを有してよい。粒径は、乳鉢および乳棒、ジェット乾燥、またはジェット粉砕を用いるような技法により変化させることができることに留意すべきである。
【0078】
一部の態様において、クロニジンは少なくとも3日の期間の間、1日あたり2〜3μgの速度で放出される。一部の態様において、この放出速度が少なくとも10日間、少なくとも15日間、少なくとも25日間、少なくとも50日間、少なくとも90日間、少なくとも100日間、少なくとも135日間、少なくとも150日間、または少なくとも180日間続く。一部の態様に関して、バイオポリマーと共に配合された300〜425マイクログラムのクロニジンを人の中に、標的組織部位またはその付近に埋め込む。標的部位を三角包囲する(triangulate)多数の部位にクロニジンを埋め込む場合、一部の態様において、それぞれの部位におけるクロニジンの総量は、合計で300〜425マイクログラムを分けたもの(fraction)である。例えば、324マイクログラムの1回量を1つの部位に、または162マイクログラムの2つに分けた用量を2つの部位に、または108マイクログラムの3つに分けた用量を、標的部位を三角包囲する3つの部位に埋め込むことができる。総投与量をその生物にとって有害であろう量未満の量に制限することが重要である。しかし、一部の態様において、複数の部位がある場合に、それぞれの部位は単一の適用で投与されてよかった総用量(does)未満を含有していてよいが、それぞれの部位は独立して放出プロフィールを有しており、従ってそのバイオポリマーの濃度および物質を継続放出が十分な時間にわたって起こることを確実にするように調節すべきであることを覚えておくことが重要である。
【0079】
一部の態様において、クロニジンまたはクロニジン塩酸塩およびポリマーを含む薬物デポーが存在し、ここでそのポリマーは様々な態様の1種類以上であり、その薬物デポーはポリ(ラクチド−co−グリコリド)(PLGA)、ポリラクチド(PLA)、ポリグリコリド(PGA)、D−ラクチド、D,L−ラクチド、L−ラクチド、D,L−ラクチド−ε−カプロラクトン、D,L−ラクチド−グリコリド−ε−カプロラクトン、またはそれらの組み合わせを含む。
【0080】
1つの典型的な投薬計画では、ラットに0.240μg/日の継続放出を135日間提供するのに十分な生分解性ポリマー中のクロニジンを提供することができる。この期間にわたって投与されるクロニジンの総量は、おおよそ32.4μgであろう。別の典型的な投薬計画では、ヒトに2.4μg/日の継続放出を135日間提供するのに十分な生分解性ポリマー中のクロニジンを提供する。この期間にわたって投与されるクロニジンの総量は、おおよそ324μgであろう。
【0081】
複数のペレットを用いる場合、そのペレットの数は、適切な大きさ(即ち、直径0.5mm×長さ4mm)のペレット中に装填される薬物の量およびどの位の薬物が必要とされるか(例えば、おおよそ325μgのクロニジン(3個のペレット))に基づく。一部の態様において、大量瞬時投与量の化合物を、落ち着くまで最初の数日(約5日)にわたって放出し、2.5mg/日を135日間放出するポリマーが存在する。典型的な配合物は、5重量%のクロニジン、100 DL 5Eである。
【0082】
一部の態様において、本出願のポリマーデポーは、2.5倍より多くの薬物を送達する皮下注射剤と同等である有効成分の効力を提供することを可能にする。
ブピバカイン
その薬物デポーは鎮痛剤ブピバカインを含んでいてよい。ブピバカインに言及する場合、別途明記しない限り、または文脈から明らかでない限り、本発明者は医薬的に許容できる塩にも言及しているものと理解される。医薬的に許容できる可能性のある塩のいくつかの例には、その化合物の毒性を実質的に増大させない塩を形成する酸および塩基が含まれる。これらの塩のいくつかの例には、アルカリ金属、例えばマグネシウム、カリウムおよびアンモニウムの塩が含まれる。鉱酸、例えば塩酸、ヨウ化水素酸、臭化水素酸、リン酸、メタリン酸、硝酸、および硫酸の塩、ならびに有機酸、例えば酒石酸、酢酸、クエン酸、リンゴ酸、安息香酸、グリコール酸、グルコン酸、グロン酸、コハク酸、アリールスルホン酸、例えば、p−トルエンスルホン酸、および同様のものの塩。ブピバカインのこれらの塩を哺乳類への安全な投与のために作ることができる程度まで、それらは本発明の範囲内である。
【0083】
さらに、そのブピバカインは塩基の形で用いられてもよい。様々な態様において、その薬物デポーは約1mg〜30mg/日のブピバカインを1〜10日間または1日〜6ヶ月間放出する。一部の態様において、それは20〜360mg/日または40〜120mg/日または80〜180mg/日または120〜240mg/日または160〜300mg/日または200〜360mg/日またはブピバカインを放出する。この用量はしばしば、手術において神経ブロックを提供するために用いられる用量よりもはるかに低い。
【0084】
一部の態様において、ブピバカインの量は2mg/日〜1800mg/日または10〜1500mg/日である。ブピバカインの放出は、列挙した範囲で少なくとも3日間、少なくとも4日間、少なくとも5日間、少なくとも6日間、少なくとも7日間または少なくとも8日間であってよい。
【0085】
フルオシノロン
1態様において、その薬物デポー中の抗炎症剤は、フルオシノロンまたはその医薬的に許容できる塩、例えばアセトニド塩を含む。フルオシノロンは様々な医薬製造業者から入手することができる。フルオシノロンの投与量は、おおよそ0.0005からおおよそ100μg/日までであってよい。さらなるフルオシノロンの投与量には、おおよそ0.0005からおおよそ50μg/日まで;おおよそ0.0005からおおよそ25μg/日まで;おおよそ0.0005からおおよそ10μg/日まで;おおよそ0.0005からおおよそ5μg/日まで;おおよそ0.0005からおおよそ1μg/日まで;おおよそ0.0005からおおよそ0.75μg/日まで;おおよそ0.0005からおおよそ0.5μg/日まで;おおよそ0.0005からおおよそ0.25μg/日まで;おおよそ0.0005からおおよそ0.1μg/日まで;おおよそ0.0005からおおよそ0.075μg/日まで;おおよそ0.0005からおおよそ0.05μg/日まで;おおよそ0.001からおおよそ0.025μg/日まで;おおよそ0.001からおおよそ0.01μg/日まで;おおよそ0.001からおおよそ0.0075μg/日まで;おおよそ0.001からおおよそ0.005μg/日まで;おおよそ0.001からおおよそ0.025μg/日まで;およびおおよそ0.002μg/日が含まれる。別の態様において、フルオシノロンの投与量はおおよそ0.001からおおよそ15μg/日までである。別の態様において、フルオシノロンの投与量はおおよそ0.001からおおよそ10μg/日までである。別の態様において、フルオシノロンの投与量はおおよそ0.001からおおよそ5μg/日までである。別の態様において、フルオシノロンの投与量はおおよそ0.001から2.5μg/日までである。一部の態様において、フルオシノロンの量は40〜600μg/日である。一部の態様において、フルオシノロンの量は200〜400μg/日である。
【0086】
デキサメタゾン
1態様において、その薬物デポー中の抗炎症剤は8S,9R,10S,11S,13S,14S,16R,17R)−9−フルオロ−11,17−ジヒドロキシ−17−(2−ヒドロキシアセチル)−10,13,16−トリメチル−6,7,8,11,12,14,15,16オクタヒドロシクロペンタ[a]−フェナントレン−3−オン)とも呼ばれるデキサメタゾンの遊離塩基または酢酸デキサメタゾン、またはそれらの医薬的に許容できる塩であり、それは様々な製造業者から入手することができる。
【0087】
様々な態様において、デキサメタゾンはデポーから、約10pg〜約80mg/日、約2.4ng/日〜約50mg/日、約50ng/日〜約2.5mg/日、約250ng/日〜約250ug/日、約250ng/日〜約50ug/日、約250ng/日〜約25ug/日、約250ng/日〜約1ug/日、約300ng/日〜約750ng/日、または約0.50ug/日の用量で放出されてよい。様々な態様において、その用量は約0.01〜約10μg/日または約1ng〜約120μg/日であってよい。
【0088】
1つの典型的な態様において、そのデキサメタゾンはリン酸デキサメタゾンナトリウムである。
GED
1態様において、その薬物デポー中の抗炎症剤はGED(グアニジノエチルジスルフィド)であり、それは抗炎症特性を有する誘導性一酸化窒素シンターゼ阻害剤である。GEDはその炭酸水素塩の形であってよい。
【0089】
GEDの投与量はおおよそ0.0005μg/日からおおよそ100mg/日までである。さらなるGEDの投与量には、おおよそ0.0005μg/日からおおよそ50mg/日まで;おおよそ0.0005μg/日からおおよそ10mg/日まで;おおよそ0.0005μg/日からおおよそ1mg/日まで;おおよそ0.0005からおおよそ800μg/日まで;おおよそ0.0005からおおよそ50μg/日まで;おおよそ0.001からおおよそ45μg/日まで;おおよそ0.001からおおよそ40μg/日まで;おおよそ0.001からおおよそ35μg/日まで;おおよそ0.0025からおおよそ30μg/日まで;おおよそ0.0025からおおよそ25μg/日まで;おおよそ0.0025からおおよそ20μg/日まで;およびおおよそ0.0025からおおよそ15μg/日までが含まれる。別の態様において、GEDの投与量はおおよそ0.005からおおよそ15μg/日までである。別の態様において、GEDの投与量はおおよそ0.005からおおよそ10μg/日までである。別の態様において、GEDの投与量はおおよそ0.005からおおよそ5μg/日までである。別の態様において、GEDの投与量はおおよそ0.005から2.5μg/日までである。一部の態様において、GEDの量は40〜600μg/日である。一部の態様において、GEDの量は200〜400μg/日である。
【0090】
1つの典型的な態様において、GEDの投与量は0.5〜4mg/日である。別の典型的な態様において、GEDの投与量は0.75〜3.5mg/日である。
ロバスタチン
1つの典型的な態様において、その薬物デポー中の抗炎症剤はロバスタチンを含む。ロバスタチンは、様々な製造業者から様々な形(例えば、注射剤、粉末、等)で得ることができるスタチンである。例えば、ロバスタチンはMerckからMevacor(登録商標)(米国特許第4,231,938号を参照、その全開示を本明細書に援用する)として得ることができる。ロバスタチンの適切な医薬的に許容できる塩には、塩基、例えば水酸化ナトリウム、水酸化カリウム、水酸化リチウム、水酸化カルシウム、1−デオキシ−2−(メチルアミノ)−D−グルシトール、水酸化マグネシウム、水酸化亜鉛、水酸化アルミニウム、水酸化第一鉄もしくは第二鉄、水酸化アンモニウム、または有機アミン類、例えばN−メチルグルカミン、コリン、アルギニン、または同様のもの、またはそれらの組み合わせに由来する1種類以上の化合物が含まれる。ロバスタチンの適切な医薬的に許容できる塩には、そのリチウム、カルシウム、ヘミカルシウム、ナトリウム、カリウム、マグネシウム、アルミニウム、第一鉄もしくは第二鉄の塩、またはそれらの組み合わせが含まれる。
【0091】
様々な態様において、ロバスタチンの療法上有効量は、1日あたり約0.1pgから約2000mgまで、例えば、0.1ngから1000mgまで、500mg、100mg、50mg、25mg、10mg、1mg、50μg、25μg、10μg、1μg、500ng、250ng、100ng、75ng、50ng、25ng、15ng、10ng、5ng、または1ngのロバスタチンを含む。様々な態様において、その投与量は、例えば約3ng/日から約3μg/日までであってよい。
【0092】
モルヒネ
本発明の1態様において、その薬物デポー中の鎮痛剤はモルヒネである。モルヒネは(5α,6α)−7,8−ジデヒドロ−4,5−エポキシ−17−メチルモルフィナン−3,6−ジオールとも呼ばれ、化学式C17H19NO3を有する。モルヒネまたはその医薬的に許容できる塩は様々な製造業者から入手可能である。1つの典型的な態様において、そのモルヒネはモルヒネの硫酸塩または塩酸塩を含む。
【0093】
モルヒネの投与量は、1日あたり0.1mgから1000mgまでであってよい。例えば、モルヒネの投与量は、例えば1日あたり0.1mg〜2mg、5mg、10mg、15mg、20mg、25mg、30mg、35mg、40mg、45mg、50mg、55mg、60mg、65mg、70mg、75mg、75mg、80mg、85mg、90mg、95mg、100mg、120mg、130mg、140mg、150mg、160mg、170mg、180mg、190mg、200mgのモルヒネであってよい。
【0094】
トラマドール
1態様において、その薬物デポー中の鎮痛剤はトラマドールである。トラマドールは(±)シス−2−[(ジメチルアミノ)メチル]−1−(3−メトキシフェニル)シクロヘキサノール塩酸塩とも呼ばれ、化学式C16H25NO2を有する。トラマドールまたはその医薬的に許容できる塩は様々な製造業者から入手可能である。様々な態様において、トラマドールHCLを用いた。
【0095】
トラマドールの投与量は、1日あたり0.01mgから500mgまでであってよい。例えば、トラマドールの投与量は、例えば1日あたり0.1mg〜2mg、5mg、10mg、15mg、20mg、25mg、30mg、35mg、40mg、45mg、50mg、55mg、60mg、65mg、70mg、75mg、75mg、80mg、85mg、90mg、95mg、100mg、120mg、130mg、140mg、150mg、160mg、170mg、180mg、190mg、200mg、または500mgのトラマドールであってよい。
【0096】
1態様において、その薬物デポーは2.5〜30mg/kg/日を放出するのに十分なトラマドールを含有する。別の態様において、その薬物デポーは3〜27.5mg/kg/日を放出するのに十分なトラマドールを含有する。
【0097】
可逆性相転移物質
その薬物デポーは、可逆性相転移物質中に配置された鎮痛剤および/または抗炎症剤を含み、それは例えば温度の変化のような外部刺激に反応して相または物理的状態を変化させる(例えば、固体が液体に、固体が半固体に、半固体が液体に、液体が固体に、液体が半固体に、または半固体が固体に、ガラス質のものがゴム状のものに、結晶が融解体に、半結晶が融解体に、等)。例えば、その薬物デポーは、可逆性相転移物質中に配置された上記で論じたような鎮痛剤および/または抗炎症剤を有する可逆性相転移物質を、全体に、または1つ以上の層(単数または複数)中に含んでいてよい。熱がその薬物デポーに、またはその薬物デポーが埋め込まれている場所のすぐそばの皮膚に適用された際(例えば40℃〜45℃)、これは埋め込まれた薬物デポー中の可逆性相転移物質の、例えば固体から液体へ、または固体から半固体へ、または半固体から液体への変化を引き起こし、そうしてその薬物デポーを横切る薬物の拡散を増大させ、その薬物デポーからの鎮痛剤および/または抗炎症剤の大量瞬時投与量またはバースト用量の放出を引き起こすであろう。このようにして、突発痛および/または炎症を低減、予防または処置することができる。その可逆性相転移物質を薬物デポー全体に、またはその薬物デポーの1つ以上の層(単数または複数)中に配置することにより、バースト作用を成し遂げることができ、ここでその薬物デポーは、熱が適用されている間、または熱が適用された後5、10、15、20、25、30、25、40、45、50、55、60、75、90、100、120、140、160、または180分で大量瞬時投与量を放出し、標的組織部位において痛みおよび/または炎症を予防、低減および/または処置するであろう。一部の態様において、熱のその薬物デポーへの適用は、その薬物のポリマー中での可溶性を増大させると考えられ、これも放出を増大させることができる。
【0098】
別の例として、冷気がその薬物デポーに、またはその薬物デポーが埋め込まれている場所のすぐそばの皮膚(それはその薬物デポーから0.5mm〜5cm離れていてよい)に適用された際(例えば20℃〜25℃)、これは埋め込まれた薬物デポー中の可逆性相転移物質の、水に不溶性の相または固体の相から水溶性の相または液体への変化を引き起こすと考えられ、ここでその薬物は温度が低下した際に放出され得る。一部の態様において、そのより冷たい温度は可逆性相転移ポリマーのそのガラス転移温度への到達を引き起こし得るが、これは放出を遅くするであろう。
【0099】
一部の態様において、その相の変化は固体が液体に、または固体が半固体に、または半固体が液体に、または液体が半固体に、または液体が固体に、または半固体が固体にであることができ、そうして薬物の拡散を増大させ、薬物デポーからの鎮痛剤および/または抗炎症剤の大量瞬時投与量またはバースト用量の放出の増大を引き起こす。このようにして、突発痛および/または炎症を低減、予防または処置することができる。その可逆性相転移物質を薬物デポー全体に、またはその薬物デポーの1つ以上の層(単数または複数)中に配置することにより、バースト作用を成し遂げることができ、ここでその薬物デポーは、冷気が適用されている間、または冷気が適用された後5、10、15、20、25、30、25、40、45、50、55、60、75、90、100、120、140、160、または180分で大量瞬時投与量を放出し、標的組織部位において痛みおよび/または炎症を予防、低減および/または処置するであろう。
【0100】
その可逆性相転移物質は、生分解性ポリマー性および非ポリマー性物質を含むことができる。可逆性相転移物質としての使用に適した物質の例には、パラフィンろう、ポロキサマー類、ポリラクトン類、パラフィンろう、ポリ(N−イソプロピルアクリルアミド)ホモポリマー、ポリ(N−イソプロピルアクリルアミド)アクリルアミドコポリマー、[3−(メタクリロイルオキシ)プロピル]トリメトキシシラン、[2−(メタクリロイルオキシ)エトキシ]−トリメチルシランおよびメタクリロイルオキシ)トリメチルシランから選択されるシランモノマーを含有するポリ(N−イソプロピルアクリルアミド)のコポリマー、ポリ(ヒドロキシプロピルメタクリルアミド)のコポリマー、ジカルボキシメチルアミノプロピルメタクリルアミド、キシログルカン、エチル(ヒドロキシエチル)セルロース、ポリ(エチレンオキシド−b−プロピレンオキシド−b−エチレンオキシド)およびそのコポリマー、ポリ(エチレンオキシド)/(D,L−乳酸−co−グリコール酸)コポリマー類、キトサンおよびポリオール塩類の組み合わせ、ポリ(シラミン)(poly(silamine))、ならびにポリ(オルガノホスファゼン)、ポリ(α−ヒドロキシ酸類)、ポリ(ラクチド−co−グリコリド)(PLGAまたはPLG)、ポリラクチド(PLA)、ポリグリコリド(PG)、ポリエチレングリコール(PEG)、mPEG、ポリ(アルファ−ヒドロキシ酸類)のPEGコンジュゲート、ポリオルトエステル類、ポリアスピリン類、ポリホスファゲン類(polyphosphagenes)、コラーゲン、デンプン、予めゼラチン化されたデンプン、ヒアルロン酸、キトサン類、ゼラチン、アルギネート類、アルブミン、フィブリン、ビタミンE類似体、例えばアルファトコフェリルアセテート、d−アルファトコフェリルスクシネート、D,L−ラクチド、またはL−ラクチド−ε−カプロラクトン、デキストラン類、ビニルピロリドン、ポリビニルアルコール(PVA)、PVA−g−PLGA、PEGT−PBTコポリマー(polyactive)、メタクリレート類、ポリ(N−イソプロピルアクリルアミド)、PEO−PPO−PEO(pluronics)、PEO−PPO−PAAコポリマー類、PLGA−PEO−PLGA、PEG−PLG、PLA−PLGA、ポロキサマー407、PEG−PLGA−PEGトリブロックコポリマー類、SAIB(スクロースアセテートイソブチレート)またはそれらの組み合わせが含まれる。薬物デポーにおける使用に適した可逆性相転移物質が米国特許第5,226,902号において記述されている。この特許の全開示を本明細書により本出願中に援用する。
【0101】
一部の態様において、その可逆性相転移物質は、温度の変化に反応して膨張する、または縮む熱感受性ヒドロゲルを含む。例えば、特定の態様において、そのようなヒドロゲル中に組み込まれた鎮痛剤および/または抗炎症剤は、そのヒドロゲルが温度変化に反応して、例えば加熱により縮む際に放出されるであろう。逆に、そのようなヒドロゲルが続いてそれが再膨張する適切な温度まで冷却された場合、薬物デポー中の残りの薬物はヒドロゲル中に再度組み戻され、そうして放出は減少するであろう。また、この態様において、冷気が適用された際、薬物はそのポリマー中でより可溶性が低いと考えられ、薬物デポーからのより少ない放出が存在するであろう。従って、薬物のヒドロゲルからの利用可能性および/または放出を制御することができる。
【0102】
ヒドロゲルには、例えばゼラチン、ゼラチン、コラーゲン、絹、エラスチン、フィブリンのような天然ヒドロゲル、およびアガロースのような多糖類に由来するポリマー、およびキトサン、グルコマンナンゲル、ヒアルロン酸、多糖類、例えば架橋されたカルボキシル含有多糖類、またはそれらの組み合わせが含まれる。合成ヒドロゲルには、ポリビニルアルコール、アクリルアミド類、例えばポリアクリル酸およびポリ(アクリロニトリル−アクリル酸)、ポリウレタン類、ポリエチレングリコール(例えば、PEG 3350、PEG 4500、PEG 8000)、シリコン、ポリオレフィン類、例えばポリイソブチレンおよびポリイソプレン、シリコンおよびポリウレタンのコポリマー、ネオプレン、ニトリル、硫化ゴム、ポリ(N−ビニル−2−ピロリドン)、アクリレート類、例えばポリ(2−ヒドロキシエチルメタクリレート)、ならびにアクリレート類のN−ビニルピロリドン、N−ビニルラクタム類とのコポリマー、ポリアクリロニトリル、またはそれらの組み合わせから形成される合成ヒドロゲルが含まれるが、それらに限定されない。そのヒドロゲル材料はさらに、必要に応じてさらなる強度を提供するために架橋されてよい。異なるタイプのポリウレタン類の例には、熱可塑性もしくは熱硬化性ポリウレタン類、脂肪族もしくは芳香族ポリウレタン類、ポリエーテルウレタン、ポリカーボネート−ウレタン、またはシリコンポリエーテル−ウレタン、またはそれらの組み合わせが含まれる。
【0103】
様々な態様において、そのポリマー(可逆性相転移物質および/または継続放出ポリマーが含まれる)はその薬物デポーの少なくとも98または99.5重量%、少なくとも95重量%、少なくとも90重量%、少なくとも85重量%、少なくとも80重量%、少なくとも75重量%、少なくとも70重量%、少なくとも65重量%、少なくとも60重量%、少なくとも55重量%、少なくとも50重量%、少なくとも45重量%、少なくとも40重量%、少なくとも35重量%、少なくとも30重量%、少なくとも25重量%、少なくとも20重量%、少なくとも15重量%、少なくとも10重量%、少なくとも5重量%を構成してよい。
【0104】
一部の態様において、その可逆性相転移物質に関して、その物質に関するガラス転移温度(Tg)は、その鎮痛剤および/または抗炎症剤の標的化された制御された送達に必要な1つのパラメーターである可能性がある。その薬物デポーの温度がそのガラス転移温度Tgより上である場合、一部の態様において、そのポリマーはゴム状になり、そうしてその薬物の拡散係数およびその可逆性相転移物質の透過性を増大させ、それは可逆性相転移物質からの薬物の放出を、従ってその薬物デポーからの薬物の放出を増大させる。一部の態様において、その薬物デポーの温度がそのTgよりも下である場合、その可逆性相転移ポリマーはガラス質になり、これは薬物の拡散係数および透過性の減少を引き起こし、従ってその可逆性相転移物質およびその薬物デポーからの放出を減少させるであろう。一部の態様において、その可逆性相転移物質および/またはその薬物デポーは体温(36℃〜38℃)よりも低いTgを有する。一部の態様において、その可逆性相転移物質および/またはその薬物デポーは体温(36℃〜38℃)よりも高いTgを有する。
【0105】
一部の態様において、そのTgは、その転移が患者を火傷させない温度で達成され得るように、約30℃〜40℃である。そのポリマーに関する低すぎるTgは、そのポリマーが非常にゴム状であり、その領域を加熱することが放出速度の増大に限られた作用しか有しないであろうことを意味するであろう。
【0106】
その薬物デポーは可逆性相転移物質を1種類以上の生分解性ポリマーとの組み合わせで含むことができ、それは可逆性相転移に望まれる特性を与え、鎮痛剤および/または抗炎症剤に望まれる継続放出特性を与える。例えば、一部の態様において、その薬物デポーは1つ以上の層(単数または複数)中に可逆性相転移物質を有していてよく、それは大量瞬時投与量の鎮痛剤および/または抗炎症剤を、皮膚の下の部位において、熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギー、光、機械的エネルギー(例えば撹拌またはマッサージ)、電気的、化学的、もしくは磁気エネルギーがそれに適用された際に放出することができる。これは即時放出層(単数または複数)であると考えられ、薬物デポーは1つ以上の継続放出層(単数または複数)も有していてよく、それは生分解性であり、10日間までのより長い期間にわたって鎮痛剤および/または抗炎症剤を放出することができる。このようにして、術後痛および/または炎症および突発痛および/または炎症を同時に処置することができる。
【0107】
その使用はその薬物デポーからの鎮痛剤および/または抗炎症剤の標的化された制御された送達にプラスの相乗作用をもたらすことも見いだされた。患者が皮膚において鎮静(soothing)を感じるだけでなく、その薬物デポーからの放出が増大し、“割り増し用量(extra dose)”が提供されると考えられ、それは追加の軽減を提供するであろう。
【0108】
薬物デポーが埋め込まれた部位の付近の皮膚に、いずれかの冷気の源により冷気を適用することができる。その冷気の源は皮膚を通してその薬物デポーの周囲の領域に、およびその薬物デポー自体に冷気を伝え、可逆性相転移物質の変化(例えば、固体が液体に、固体が半固体に、半固体が液体に、液体が固体に、液体が半固体に、または半固体が固体に)を引き起こし、その薬物デポーからの鎮痛剤および/または抗炎症剤の放出の増大または減少を引き起こすであろう。適切な冷気の源には、アイスパック、冷パック、冷液、または吸熱冷パック、吸熱冷パッド、電気式冷パッドもしくは電気式冷パック、または同様のものが含まれる。その冷気(例えば0℃〜30℃)は皮膚の温度を体温よりも低くし、その薬物デポーが0℃〜30℃の温度に達した際、これはその薬物デポーからの薬物の放出の増大または減少を引き起こす。
【0109】
薬物デポーが埋め込まれた部位の付近の皮膚に、いずれかの熱源により熱を適用することができる。その熱源は皮膚を通してその薬物デポーの周囲の環境に、次いでその薬物デポー自体に熱を伝え、可逆性相転移物質の変化(例えば、固体が液体に、固体が半固体に、半固体が液体に、液体が固体に、液体が半固体に、または半固体が固体に)を引き起こし、それは薬物デポーからの鎮痛剤および/または抗炎症剤の放出の増大または減少を引き起こす。適切な熱源には、温パック、加温パッド、温液、または放熱温パック、放熱頭パッド(head pads)、電気式加温パッド、電気式加温パック、または同様のものが含まれる。その熱(例えば39℃より高い)は皮膚の温度を体温よりも高くし、その薬物デポーが39℃より高い温度(例えば40℃〜45℃)に達した際、これはその薬物デポーからの薬物の放出の増大または減少を引き起こす。
【0110】
図1は、薬物デポー内部に薬物14(例えば抗炎症剤、筋弛緩剤、および/または鎮痛剤)を保持する可逆性相転移物質12の層を有する埋め込み式薬物デポー10の態様の拡大した側断面図である。この図説された態様において、その薬物デポーには熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギーが適用されておらず、その薬物は時間の経過に伴う持続放出特性を示すであろう。
【0111】
熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギーはその薬物デポーが埋め込まれた部位の付近の患者の皮膚に適用される。その熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギーは、皮膚を通って、その埋め込まれた薬物デポーの周囲の環境に、次いでその薬物デポー自体に伝わるであろう。これはその薬物の大量瞬時投与量の放出またはバースト放出を引き起こすであろう。
【0112】
図2は、それに熱を適用した際に液体状態に変化して薬物デポーからの鎮痛剤および/または抗炎症剤14の放出を引き起こす可逆的相転移物質12の層を有する埋め込み式薬物デポー10の態様の拡大した側断面図である。その熱は、患者の皮膚を通って、その埋め込まれた薬物デポーの周囲の環境に、次いでその薬物デポー自体に伝わるであろう。これは標的組織部位において薬物16の大量瞬時投与量の放出またはバースト放出を引き起こし、患者に鎮痛剤および/または抗炎症剤の“割り増し用量”を提供すると考えられ、それはさらなる軽減を引き起こすであろう。そのような態様は、術後の突発痛を低減、処置または予防するのに特に有用である。例えば、手術の後、“突発痛”(連続的な“ベースラインの”痛みに加えて突然増大した、比較的短く続く痛み)が起こる可能性がある。温度で制御される薬物デポーの助けにより、突発痛を制御することができる。突発痛のエピソードが起こった際、より多くの鎮痛剤および/または抗炎症剤を標的組織部位に送達するため、患者または保健開業医は熱源(例えば温パッチ)または冷気の源(例えば冷パッチ)を患者の皮膚または薬物デポーが埋め込まれた部位に、その痛みおよび/または炎症が緩和されるまで適用する。その加温パッチまたは冷パッチの継続期間は、好ましくは十分な割り増しの鎮痛剤および/または抗炎症剤を送達するのに十分に長いが、患者に危険をもたらす可能性のある鎮痛剤および/または抗炎症剤の割り増し量を送達するほど十分に長くはないように設定される。その患者および/または保健開業医は、その突発痛が減少し始めた時に温パッチまたは冷パッチを取り外すこともできる。
【0113】
本出願は、患者に制御される鎮痛(以下“PCA”)における使用に適しており、ここで患者は彼/彼女が必要性を感じた時に彼自身または彼女自身に鎮痛剤および/または抗炎症剤の用量を与える。その用量および投与頻度の範囲は、通常は保健開業医(例えばケアをする医師、看護師等)により設定される。多くのPCAの状況において、患者はベースライン速度の鎮痛剤および/または抗炎症剤を与えられ、彼/彼女がそれが必要であると感じた時に割り増しの大量瞬時投与量の鎮痛剤および/または鎮痛剤を得る。本出願における技術はPCAのために用いることができ、ここで患者はその薬物デポーからベースライン用量を得て、その薬物デポーが埋め込まれた皮膚の領域を加熱または冷却することにより割り増し(“レスキュー”)用量または大量瞬時投与量を得る。例えば、その薬物デポーは表皮、真皮、または皮下組織の1〜5mm以内に埋め込まれてよく、熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギーをその皮膚に適用して鎮痛剤、筋弛緩剤および/または抗炎症剤のその薬物デポーからこの領域中への大量瞬時投与量の放出を引き起こす。このようにして、その薬物デポーは痛みおよび/または炎症の即時放出および持続放出処置を提供する。
【0114】
図3は、手の手術の後に手26に、薬物デポー28が皮膚22の下に埋め込まれた領域付近に適用された冷または温パック31を図説する1態様の透視図である。その冷または温パック31は手26を差し込むための開口部24を有し、ここで指21および25をその開口部の中に差し込むことができる。その冷または温パックは、場合により手をそれがパックの中にある間固定するためのスタンド30を有することができる。ここで、皮膚領域22への冷気または熱の適用は、熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギーを薬物デポーの周囲の環境および薬物デポー28に伝わらせ、それは可逆的相転移物質の相の変化を引き起こし(例えば、固体が液体に、固体が半固体に、半固体が液体に、等)、大量瞬時投与量または“レスキュー用量”または“割り増し用量”の鎮痛剤および/または抗炎症剤を患者に放出し、それは痛みおよび/または炎症のエピソードを低減、予防または処置するであろう。その患者は、その痛みおよび/または炎症が減少し始めた時に冷または温パックを取り外してもよく、その薬物デポーは予定された継続放出期間をかけての鎮痛剤および/または抗炎症剤の放出に戻るであろう。手の領域を示したが、その薬物デポーは、少なくとも1つの筋肉、靭帯、腱、軟骨、足、指、趾、手、手首、歯肉、顎、膝関節、椎間板、脊髄神経根付近の脊椎孔空間、または脊椎管を含むがそれらに限定されない皮膚の下のあらゆる部位に送達されることができる。
【0115】
典型的には、その薬物デポーは、生分解性であることができる生体適合性物質を含む固体または半固体の配合物であろう。用語“固体”は堅い物質を意味することを意図し、一方“半固体”はある程度の柔軟性を有し、それによりそのデポーが曲がって周囲の組織の要求に従うことを可能にする物質を意味することを意図する。半固体の物質の例はゲルである。液体という用語には、療法剤を含有する溶液、懸濁液および/またはスラリーが含まれる。
【0116】
様々な態様において、薬物デポーは生分解性でなくてよい。例えば、薬物デポーはポリウレタン、ポリ尿素、ポリエーテル(アミド)、PEBA、熱可塑性エラストマーオレフィン、コポリエステル、およびスチレン系熱可塑性エラストマー、鋼、アルミニウム、ステンレス鋼、チタン、高非鉄金属含有量および低相対比率の鉄を有する金属合金、炭素繊維、ガラス繊維、プラスチック、セラミックス、またはそれらの組み合わせを含んでいてよい。典型的には、これらのタイプの薬物デポーは取り除かれる必要がある可能性がある。
【0117】
生分解性デポー
ある場合では、薬物デポーを使用後に取り除かなければならないことを回避することが望ましい可能性がある。これらの場合において、そのデポーは生分解性材料を含んでいてよい。この目的に利用可能であり、標的組織またはその付近に配置された際に延長された期間にわたって分解または崩壊することができるという特徴を有する、数多くの材料が存在する。生分解性材料の化学的性質の関数として、その分解プロセスの機構は本質的に加水分解的または酵素的、または両方である可能性がある。様々な態様において、その分解は薬物送達系デポーの表面で(不均一な、または表面の侵食)、またはその全体にわたって均一に(均一な、または大部分の(bulk)侵食)のどちらかで起こり得る。
【0118】
様々な態様において、そのデポーは少なくとも1種類の鎮痛剤および/または少なくとも1種類の抗炎症剤の即時放出または持続放出を提供することができる、生体吸収性および/または生分解性のバイオポリマーを含んでいてよい。適切な持続放出バイオポリマーの例には以下のものが含まれるが、それらに限定されない:ポリ(アルファ−ヒドロキシ酸類)、ポリ(ラクチド−co−グリコリド)(PLGAまたはPLG)、ポリラクチド(PLA)、ポリグリコリド(PG)、ポリ(アルファ−ヒドロキシ酸類)のポリエチレングリコール(PEG)コンジュゲート、ポリオルトエステル類、ポリアスピリン類、ポリホスファゲン類(polyphosphagenes)、コラーゲン、デンプン、予めゼラチン化されたデンプン、ヒアルロン酸、キトサン類、ゼラチン、アルギネート類、アルブミン、フィブリン、ビタミンE類似体、例えばアルファトコフェリルアセテート、d−アルファトコフェリルスクシネート、D,L−ラクチド、またはL−ラクチド, ,−カプロラクトン、デキストラン類、ビニルピロリドン、ポリビニルアルコール(PVA)、PVA−g−PLGA、PEGT−PBTコポリマー(polyactive)、メタクリレート類、ポリ(N−イソプロピルアクリルアミド)、PEO−PPO−PEO(pluronics)、PEO−PPO−PAAコポリマー類、PLGA−PEO−PLGA、PEG−PLG、PLA−PLGA、ポロキサマー407、PEG−PLGA−PEGトリブロックコポリマー類、SAIB(スクロースアセテートイソブチレート)またはそれらの組み合わせ。当業者は気付いているように、PLGAの可塑剤としてmPEGを用いてよいが、同じ効果を達成するために他のポリマー/賦形剤を用いてもよい。mPEGは得られる配合物に可鍛性を付与する。
【0119】
ポリマーの異なる組み合わせを用いる場合(2元、3元(例えば、PLGA−PEO−PLGA)、またはターポリマー)、それらは様々なモル比、1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、または10:1で用いられてよい。様々な態様において、130日間の放出に関して、デポーは50:50 PLGA〜100 PLAを含む。分子量の範囲は0.45〜0.8dI/gである。
【0120】
様々な態様において、ポリマーの分子量は広い範囲の値であることができる。ポリマーの平均分子量は、約1000から約10,000,000まで;または約1,000から約1,000,000まで;または約5,000から約500,000まで;または約10,000から約100,000まで;または約20,000から50,000までであることができる。
【0121】
一部の態様において、その少なくとも1種類の生分解性ポリマーは、ポリ(乳酸−co−グリコール酸)(PLA)またはポリ(オルトエステル)(POE)、またはそれらの組み合わせを含む。そのポリ(乳酸−co−グリコール酸)はポリグリコリド(PGA)およびポリラクチドの混合物を含んでよく、一部の態様において、その混合物中にはポリグリコリドより多くのポリラクチドが存在する。様々な他の態様において、100%のポリラクチドおよび0%のポリグリコリド;95%のポリラクチドおよび5%のポリグリコリド;90%のポリラクチドおよび10%のポリグリコリド;85%のポリラクチドおよび15%のポリグリコリド;80%のポリラクチドおよび20%のポリグリコリド;75%のポリラクチドおよび25%のポリグリコリド;70%のポリラクチドおよび30%のポリグリコリド;65%のポリラクチドおよび35%のポリグリコリド;60%のポリラクチドおよび40%のポリグリコリド;55%のポリラクチドおよび45%のポリグリコリド;50%のポリラクチドおよび50%のポリグリコリド;45%のポリラクチドおよび55%のポリグリコリド;40%のポリラクチドおよび60%のポリグリコリド;35%のポリラクチドおよび65%のポリグリコリド;30%のポリラクチドおよび70%のポリグリコリド;25%のポリラクチドおよび75%のポリグリコリド;20%のポリラクチドおよび80%のポリグリコリド;15%のポリラクチドおよび85%のポリグリコリド;10%のポリラクチドおよび90%のポリグリコリド;5%のポリラクチドおよび95%のポリグリコリド;ならびに0%のポリラクチドおよび100%のポリグリコリドが存在する。
【0122】
ポリラクチドおよびポリグリコリドの両方を含む様々な態様において、少なくとも95%のポリラクチド;少なくとも90%のポリラクチド;少なくとも85%のポリラクチド;少なくとも80%のポリラクチド;少なくとも75%のポリラクチド;少なくとも70%のポリラクチド;少なくとも65%のポリラクチド;少なくとも60%のポリラクチド;少なくとも55%;少なくとも50%のポリラクチド;少なくとも45%のポリラクチド;少なくとも40%のポリラクチド;少なくとも35%のポリラクチド;少なくとも30%のポリラクチド;少なくとも25%のポリラクチド;少なくとも20%のポリラクチド;少なくとも15%のポリラクチド;少なくとも10%のポリラクチド;または少なくとも5%のポリラクチドが存在し;そのバイオポリマーの残りの部分がポリグリコリドである。
【0123】
様々な態様において、その薬物デポーはポリ(ラクチド−co−グリコリド)(PLGA)、ポリラクチド(PLA)、ポリグリコリド(PGA)、D−ラクチド、D,L−ラクチド、L−ラクチド、D,L−ラクチド−ε−カプロラクトン、D,L−ラクチド−グリコリド−ε−カプロラクトン、グリコリド−カプロラクトンまたはそれらの組み合わせを含む。
【0124】
当業者が気付くように、異なる末端基を有するポリマーのブレンドを有する埋め込み式エラストマー性デポー組成物を用いると、結果として得られる配合物はより低いバースト指数(burst index)および調節された送達期間を有するであろう。例えば、酸(例えば、カルボン酸)およびエステル末端基(例えば、ラウリル、メチル、またはエチルエステル末端基)を有するポリマーを用いてよい。
【0125】
加えて、ポリマーを形成する様々なモノマーのコモノマー比(例えば、所与のポリマーに関するL/G/CLまたはG/CL比)を変化させることにより、調節されたバースト指数および送達期間を有するデポー組成物が得られるであろう。例えば、L/G比が50:50であるポリマーを有するデポー組成物は、約2日から約1ヶ月までの範囲の短い送達期間を有する可能性があり;L/G比が65:35であるポリマーを有するデポー組成物は、約2ヶ月の送達期間を有する可能性があり;L/G比が75:25である、またはL/CL比が75:25であるポリマーを有するデポー組成物は、約3ヶ月〜約4ヶ月の送達期間を有する可能性があり;L/G比が85:15であるポリマー比を有するデポー組成物は、約5ヶ月の送達期間を有する可能性があり;L/CL比が25:75またはPLAであるポリマーを有するデポー組成物は、6ヶ月以上の送達期間を有する可能性があり;Gが50%より大きく、Lが10%より大きいCL/G/L(CLはカプロラクトンを指し、Gはグリコール酸を指し、そしてLは乳酸を指す)のターポリマーを有するデポー組成物は、約1ヶ月の送達期間を有する可能性があり、Gが50%未満でありLが10%未満であるCL/G/Lのターポリマーを有するデポー組成物は、6ヶ月までの期間を有する可能性がある。一般に、CL含有量に比してG含有量を高めると送達期間が短くなり、一方G含有量に比してCL含有量を高めると送達期間が長くなる。
【0126】
一部の態様において、その生分解性ポリマーはその配合物の少なくとも10重量%、少なくとも50重量%、少なくとも60重量%、少なくとも70重量%、少なくとも80重量%、少なくとも85重量%、少なくとも90重量%、少なくとも95重量%、または少なくとも99重量%を構成する。一部の態様において、少なくとも1種類の生分解性ポリマーおよび少なくとも1種類の鎮痛剤および/または抗炎症剤だけがその医薬配合物の構成要素である。
【0127】
一部の態様において、薬物デポー中の粒子の少なくとも75%が約1マイクロメートルから約200マイクロメートルまでの大きさを有する。一部の態様において、薬物デポー中の粒子の少なくとも85%が約1マイクロメートルから約100マイクロメートルまでの大きさを有する。一部の態様において、薬物デポー中の粒子の少なくとも95%が約5マイクロメートルから約50マイクロメートルまでの大きさを有する。一部の態様において、薬物デポー中の粒子の全てが約10マイクロメートルから約50マイクロメートルまでの大きさを有する。
【0128】
一部の態様において、薬物デポー中の粒子の少なくとも75%が約5マイクロメートルから約20マイクロメートルまでの大きさを有する。一部の態様において、薬物デポー中の粒子の少なくとも85%が約5マイクロメートルから約20マイクロメートルまでの大きさを有する。一部の態様において、薬物デポー中の粒子の少なくとも95%が約5マイクロメートルから約20マイクロメートルまでの大きさを有する。一部の態様において、薬物デポー中の粒子の全てが約5マイクロメートルから約20マイクロメートルまでの大きさを有する。
【0129】
そのデポーは場合により不活性な物質、例えば緩衝剤およびpH調節剤、例えば炭酸水素カリウム、炭酸カリウム、水酸化カリウム、酢酸ナトリウム、ホウ酸ナトリウム、炭酸水素ナトリウム、炭酸ナトリウム、水酸化ナトリウム、またはリン酸ナトリウム;分解/放出調節剤;薬物放出調整剤;乳化剤;保存剤、例えば塩化ベンザルコニウム、クロロブタノール、酢酸フェニル水銀および硝酸フェニル水銀、亜硫酸水素ナトリウム、硫酸水素ナトリウム、チオ硫酸ナトリウム、チメロサール、メチルパラベン、ポリビニルアルコールおよびフェニルエチルアルコール;溶解性調整剤;安定剤;および/または凝集調節剤を含有していてよい。これらの不活性な成分は、療法剤(単数または複数)を運ぶこと、安定化すること、およびその放出を制御することを含む多機能性の目的を有していてよい。例えば、持続放出目的は溶解−拡散機構によってよく、またはそれは侵食−持続(erosion−sustained)プロセスにより支配されてよい。典型的には、あらゆるそのような物質は0〜75重量%の範囲内で、より典型的には0〜30重量%の範囲内で存在するであろう。そのデポーを脊椎領域に配置する場合、様々な態様において、そのデポーは無菌で保存剤なしの物質を含んでいてよい。
【0130】
そのデポーは様々な大きさ、形状、および構成であることができる。薬物デポーの大きさ、形状、および構成の決定において、考慮することができるいくつかの因子が存在する。例えば、大きさおよび形状は共に、埋め込みまたは注射の部位として選択される標的組織部位に薬物デポーを配置することを容易にすることを可能にする可能性がある。加えて、その系の形状および大きさは、薬物デポーが埋め込みまたは注射の後で動くことを最小にする、または防ぐように選択されるべきである。様々な態様において、その薬物デポーは、ペレット、球、円柱、例えば棒もしくは繊維、平坦な表面、例えば円板、フィルム、もしくはシート、または同様のもののような形状にすることができる。柔軟性は、薬物デポーの配置を容易にするための考慮事項である可能性がある。様々な態様において、その薬物デポーは異なる大きさであることができ、例えば、その薬物デポーは約0.5mmから5mmまでの長さであってよく、約0.01から約2mmまでの直径を有していてよい。様々な態様において、その薬物デポーは約0.005から1.0mmまで、例えば0.05から0.75mmまでの層の厚さを有していてよい。
【0131】
様々な態様において、薬物デポーがペレットを含む場合、それは切開部位に、その部位を閉じる前に置かれてよい。そのペレットは、例えば熱可塑性材料から作ることができる。加えて、そのペレットにおける使用に関して好都合である可能性のある具体的な材料には、上記で持続放出バイオポリマーとして同定した化合物が含まれるが、それらに限定されない。その薬物デポーは、少なくとも1種類の鎮痛剤および/または抗炎症剤をそのポリマーと混合することにより形成されてよい。
【0132】
使用者が薬物デポーを患者の標的部位の中に正確に配置することを可能にするために、X線撮影用マーカーをその薬物デポーの上に含ませることができる。これらのX線撮影用マーカーは、使用者がデポーのその部位での動きおよび分解を経時的に追跡することも可能にするであろう。この態様において、使用者は、数多くの診断画像化手法のいずれかを用いてデポーをその部位において正確に配置することができる。そのような診断画像化手法には、例えばX線造影法または蛍光透視法が含まれる。そのようなX線撮影用マーカーの例には、バリウム、リン酸カルシウム、および/または金属のビーズまたは粒子が含まれるが、それらに限定されない。様々な態様において、そのX線撮影用マーカーはデポーを囲む球状の形状または輪であることができるであろう。
【0133】
ゲル
様々な態様において、その薬物デポーは約1〜約500センチポアズ(cps)、1〜約200cps、または1〜約100cpsの範囲の投薬前粘度を有するゲルを含む。そのゲルが標的部位へ投与された後、そのゲルの粘度は増大すると考えられ、そのゲルは約1×104〜約6×105ダイン/cm2、または2×104〜約5×105ダイン/cm2、または5×104〜約5×105ダイン/cm2の範囲の弾性係数(ヤング率)を有するであろう。
【0134】
1態様において、ゲル全体にわたって均等に分布している少なくとも1種類の鎮痛剤および/または抗炎症剤を含む接着性ゲルを含有するデポーを提供する。そのゲルは前に示したようなあらゆる適切なタイプのものであってよく、一度配置されたらそのゲルがその標的化された送達部位から移動することを防ぐために十分に粘稠であるべきであり;そのゲルはその標的化された組織部位に事実上“粘着”または接着するべきである。そのゲルは、例えば、標的化された組織との接触の際に、または標的化された送達系からの配置の後で固化してよい。その標的化された送達系は、例えば、注射器、カテーテル、針、またはカニューレ、またはあらゆる他の適切なデバイスであってよい。その標的化された送達系は、標的化された組織部位の中または上にゲルを注入することができる。療法剤は、標的化された組織部位にゲルが配置される前にゲルの中に混合されてよい。様々な態様において、そのゲルは2構成要素送達系の一部であってよく、その2種類の構成要素が混合された際に、化学的プロセスが活性化されてゲルを形成してそれの標的部位への粘着または接着を引き起こす。
【0135】
様々な態様において、送達後に硬化する、または堅くなるゲルを提供する。典型的には、硬化ゲル配合物は約1×104〜約3×105ダイン/cm2、または2×104〜約2×105ダイン/cm2、または5×104〜約1×105ダイン/cm2の範囲の投薬前弾性係数を有していてよい。投薬後(送達後)の硬化ゲルはゴムのような粘稠度を有していてよく、約1×104〜約2×106ダイン/cm2、または1×105〜約7×105ダイン/cm2、または2×105〜約5×105ダイン/cm2の範囲の弾性係数を有していてよい。
【0136】
様々な態様において、ポリマーを含有するゲル配合物に関して、ポリマー濃度がゲルが硬化する速度に影響を及ぼす可能性がある(例えば、より高濃度のポリマーを有するゲルは、より低濃度のポリマーを有するゲルよりも急速に凝固する可能性がある)。様々な態様において、ゲルが硬化する際、結果として得られるマトリックスは固体であるが、組織の不規則な表面(例えば骨の陥凹および/または突起)に従うこともできる。
【0137】
ゲル中に存在するポリマーの百分率は、ポリマー性組成物の粘度にも影響を及ぼす可能性がある。例えば、より高いポリマーの重量百分率を有する組成物は、典型的には、より低いポリマーの重量百分率を有する組成物よりも濃厚でより粘稠である。より粘稠な組成物は、よりゆっくり流動する傾向がある。従って、いくつかの場合では、より低い粘度を有する組成物が好ましい可能性がある。
【0138】
様々な態様において、そのゲルの分子量は、当技術で既知の多くの方法のいずれか1つにより変化させることができる。分子量を変化させる方法の選択は、典型的には、ゲルの組成(例えば、ポリマー対非ポリマー)により決定される。例えば、様々な態様において、ゲルが1種類以上のポリマーを含む場合、重合化の程度は、ポリマー開始剤(例えば、過酸化ベンゾイル)、有機溶媒または活性化剤(例えば、DMPT)、架橋剤、重合剤の量、および/または反応時間を変化させることにより制御することができる。
【0139】
適切なゲルポリマーは有機溶媒中で可溶性であってよい。ポリマーの溶媒中での溶解性は、ポリマーの結晶性、疎水性、水素結合および分子量によって様々である。より低い分子量のポリマーは通常有機溶媒中で高分子量のポリマーよりも容易に溶けるであろう。高分子量ポリマーが含まれるポリマーゲルは、低分子量ポリマーが含まれるポリマー組成物よりも急速に凝固または固化する傾向がある。高分子量ポリマーが含まれるポリマーゲル配合物は、低分子量ポリマーが含まれるポリマーゲルよりも高い溶液の粘度を有する傾向もある。
【0140】
そのゲルを流動可能なゲルであるように設計する場合、それは、ゲル中で用いられるポリマーの分子量および濃度に依存して、水の粘度に類似した低粘度からペーストの粘度に類似した高粘度まで様々であることができる。そのゲルの粘度は、そのポリマー組成物をあらゆる一般に用いられる技法により、例えばブラッシング、噴霧、滴下、注射、または塗布により患者の組織に摘要することができるように変化させることができる。ゲルの様々な粘度は、組成物を適用するために用いられる技法に依存するであろう。
【0141】
様々な態様において、そのゲルは、ゲルの分子量および分解時間の尺度である固有粘度(“I.V.”と略され、単位はデシリットル/グラムである)を有する(例えば、高い固有粘度を有するゲルは、より高い分子量およびより長い分解時間を有する)。典型的には、高分子量を有するゲルはより強いマトリックスを提供し、そのマトリックスは分解するのにより多くの時間がかかる。対照的に、低分子量を有するゲルはより急速に分解し、より軟らかいマトリックスを提供する。様々な態様において、そのゲルは約0.10dL/gから約1.2dL/gまで、または約0.10dL/gから約0.40dL/gまでの固有粘度により示されるような分子量を有する。
【0142】
様々な態様において、そのゲルは約300〜約5,000センチポアズ(cp)の粘度を有し得る。他の態様において、そのゲルは室温で約5から約300cpsまで、約10cpsから約50cpsまで、約15cpsから約75cpsまでの粘度を有し得る。そのゲルは場合により、例えばヒドロキシプロピルセルロース、ヒドロキシプロピルメチルセルロース、ヒドロキシエチルメチルセルロース、カルボキシメチルセルロースおよびその塩類、Carbopol、ポリ(ヒドロキシエチルメタクリレート)、ポリ(メトキシエチルメタクリレート)、ポリ(メトキシエトキシエチルメタクリレート)、ポリメチルメタクリレート(PMMA)、メチルメタクリレート(MMA)、ゼラチン、ポリビニルアルコール、プロピレングリコール、PEG 200、PEG 300、PEG 400、PEG 500、PEG 600、PEG 700、PEG 800、PEG 900、PEG 1000、PEG 1450、PEG 3350、PEG 4500、PEG 8000、またはそれらの組み合わせのような粘度増強剤を有していてよい。
【0143】
様々な態様において、ゲルにおいてポリマーが用いられる際、そのポリマー性組成物には約10重量%〜約90重量%または約30重量%〜約60重量%のポリマーが含まれる。
【0144】
様々な態様において、そのゲルは合成または天然起源の高分子量の生体適合性エラストマーポリマーから作られたヒドロゲルである。そのヒドロゲルが有するべき望ましい特性は、人体中で機械的ストレス、特に剪断および荷重に迅速に反応する能力である。
【0145】
天然源から得られたヒドロゲルは、それらがインビボでの適用のために生分解性かつ生体適合性である可能性がより高いため、特に魅力的である。適切なヒドロゲルには、例えばゼラチン、コラーゲン、絹、エラスチン、フィブリンのような天然ヒドロゲル、およびアガロースのような多糖類に由来するポリマー、およびキトサン、グルコマンナンゲル、ヒアルロン酸、多糖類、例えば架橋されたカルボキシル含有多糖類、またはそれらの組み合わせが含まれる。合成ヒドロゲルには、ポリビニルアルコール、アクリルアミド類、例えばポリアクリル酸およびポリ(アクリロニトリル−アクリル酸)、ポリウレタン類、ポリエチレングリコール(例えば、PEG 3350、PEG 4500、PEG 8000)、シリコン、ポリオレフィン類、例えばポリイソブチレンおよびポリイソプレン、シリコンおよびポリウレタンのコポリマー、ネオプレン、ニトリル、硫化ゴム、ポリ(N−ビニル−2−ピロリドン)、アクリレート類、例えばポリ(2−ヒドロキシエチルメタクリレート)、ならびにアクリレート類のN−ビニルピロリドン、N−ビニルラクタム類とのコポリマー、ポリアクリロニトリル、またはそれらの組み合わせから形成される合成ヒドロゲルが含まれるが、それらに限定されない。そのヒドロゲル材料はさらに、必要に応じてさらなる強度を提供するために架橋されてよい。異なるタイプのポリウレタン類の例には、熱可塑性もしくは熱硬化性ポリウレタン類、脂肪族もしくは芳香族ポリウレタン類、ポリエーテルウレタン、ポリカーボネート−ウレタン、またはシリコンポリエーテル−ウレタン、またはそれらの組み合わせが含まれる。
【0146】
様々な態様において、療法剤をゲルの中に直接混合するのではなく、マイクロスフェアをゲルの内部に分散させてよく、そのマイクロスフェアには少なくとも1種類の鎮痛剤および/または少なくとも1種類の抗炎症剤が装填される。1態様において、マイクロスフェアは少なくとも1種類の鎮痛剤および/または抗炎症剤の持続放出を提供する。さらに別の態様において、生分解性であるゲルはマイクロスフェアが少なくとも1種類の鎮痛剤および/または抗炎症剤を放出するのを妨げ;従ってそのマイクロスフェアはそれがゲルから放出されるまでその少なくとも1種類の鎮痛剤および/または抗炎症剤を放出しない。例えば、標的組織部位(例えば、神経根)の周囲にゲルを配置してよい。ゲルの内部には、望まれる療法剤を封入する(encapsulate)複数のマイクロスフェアが分散している。これらのマイクロスフェアのあるものは、一度ゲルから放出されると分解し、そうしてその少なくとも1種類の鎮痛剤および/または抗炎症剤を放出する。その鎮痛剤および/または抗炎症剤を別々のマイクロスフェアの中に入れてからそのマイクロスフェアを組み合わせてよく、またはまずその有効成分を組み合わせてからマイクロスフェアの中に一緒に入れることができる。
【0147】
マイクロスフェアは、周囲の組織のタイプに依存して、流体と同様に比較的急速に分散し、従って少なくとも1種類の鎮痛剤および少なくとも1種類の抗炎症剤を分散させることができる。一部の態様において、マイクロスフェアの直径は直径約10ミクロンから直径約200ミクロンまでの範囲である。一部の態様において、それらは直径約20から120ミクロンまでの範囲である。マイクロスフェアを作製する方法には、溶媒蒸発、相分離、および流動床コーティングが含まれるが、それらに限定されない。ある状況ではこれが望ましい可能性があり;他の状況では、少なくとも1種類の鎮痛剤および少なくとも1種類の抗炎症剤を明確に定められた標的部位にしっかりと束縛した状態を保つのがより望ましい可能性がある。
【0148】
本発明は、療法剤の分散をそのように束縛するための接着性ゲルの使用も意図している。これらのゲルは、例えば椎間板腔に、脊椎管に、または周囲の組織に配置されてよい。
カニューレおよび針
当業者には、デポーを、薬物送達デバイス、例えば注射器、銃式(gun)薬物送達デバイス、または標的となる器官もしくは解剖学的領域への薬物の適用に適したあらゆる医療用デバイスの一部であることができる“カニューレ”または“針”を用いて標的部位に投与することができることは理解されるであろう。薬物デポーデバイスのカニューレまたは針は、患者に対して肉体的および精神的な外傷を最小限しか引き起こさないように設計される。
【0149】
カニューレまたは針には、例えばポリウレタン、ポリ尿素、ポリエーテル(アミド)、PEBA、熱可塑性エラストマーオレフィン、コポリエステル、およびスチレン系熱可塑性エラストマー、鋼、アルミニウム、ステンレス鋼、チタン、高非鉄金属含有量および低相対比率の鉄を有する金属合金、炭素繊維、ガラス繊維、プラスチック、セラミックス、またはそれらの組み合わせのような材料から作製することができるチューブが含まれる。カニューレまたは針には場合により1箇所以上の先細り領域が含まれていてよい。様々な態様において、そのカニューレまたは針は斜めに切られていてよい。そのカニューレまたは針は、埋め込みのための部位に応じて、患者の正確な処置に必須の先端形式を有していてもよい。先端形式の例には、例えば、トレフィン(Trephine)、クールナン(Cournand)、ベレス(Veress)、フーバー(Huber)、セルジンガー(Seldinger)、チバ(Chiba)、フランシーヌ(Francine)、バイアス(Bias)、クロフォード(Crawford)、偏向先端、ヒューステッド(Hustead)、ランセット(Lancet)、またはTuoheyが含まれる。様々な態様において、そのカニューレまたは針はノンコアリングであり、望まれない針刺しを避けるためにそれを覆う鞘を有していてよい。
【0150】
中空のカニューレまたは針の寸法は、とりわけ埋め込みのための部位に依存するであろう。例えば、硬膜外腔の幅は胸部領域に関して約3〜5mmにすぎず、腰部領域に関して約5〜7mmである。従って、針またはカニューレは、様々な態様において、これらの特定の領域用に設計することができる。様々な態様において、カニューレまたは針は、経椎間孔(transforaminal)アプローチを用いて、例えば炎症した神経根に沿って脊椎孔空間に挿入されてよく、その状態を処置するために薬物デポーをこの部位に埋め込んでよい。典型的には、経椎間孔アプローチは椎間孔を通って椎間腔に接近することを伴う。
【0151】
カニューレまたは針の長さのいくつかの例には、約50から150mmまでの長さ、例えば硬膜外の小児使用に関しては約65mm、標準的な成人用では約85mm、および肥満の成人患者用では約110mmが含まれてよいが、それらに限定されない。カニューレまたは針の厚さも埋め込みの部位に依存するであろう。様々な態様において、その厚さには約0.05から約1.655までが含まれるが、それらに限定されない。カニューレまたは針のゲージは、ヒトまたは動物の身体の中への挿入に関しては、最も広い、もしくは最も小さい直径またはその間の直径であってよい。最も広い直径は典型的には約14ゲージであり、一方で最も小さい直径は約25ゲージである。様々な態様において、針またはカニューレのゲージは約18〜約22ゲージである。
【0152】
様々な態様において、薬物デポーおよび/またはゲルと同様に、カニューレまたは針には、使用者が数多くの診断画像化手法のいずれかを用いてデポーを皮膚の下の部位またはその付近に正確に配置できるように、その部位またはその付近での位置を示す線量X線撮影用マーカーが含まれる。そのような診断画像化手法には、例えばX線造影法または蛍光透視法が含まれる。そのようなX線撮影用マーカーの例には、バリウム、リン酸カルシウム、および/または金属のビーズまたは粒子が含まれるが、それらに限定されない。
【0153】
様々な態様において、針またはカニューレには超音波、蛍光透視法、X線、または他の画像化技法により可視化することができる透明または半透明の部分が含まれていてよい。そのような態様において、その透明または半透明の部分には、その材料または構造的特徴(topography)の非存在時と比較してその針またはカニューレのコントラストを高める、放射線不透過性材料または超音波応答性の構造的特徴が含まれていてよい。
【0154】
滅菌
薬物デポー、および/または薬物を投与するための医療用デバイスは、滅菌可能であってよい。様々な態様において、その薬物デポー、および/または薬物を投与するための医療用デバイスの1つ以上の構成要素は、最終包装時の最終滅菌工程において照射により滅菌される。製品の最終滅菌は、個々の製品の構成要素を別々に滅菌して、最終包装を無菌環境で組立てることが要求される無菌プロセスのようなプロセスからのものよりも大きな無菌状態の保証を提供する。
【0155】
典型的には、様々な態様において、最終滅菌工程においてガンマ線照射を使用し、それはデバイスに深く透過するガンマ線からのイオン化エネルギーを利用することを含む。ガンマ線は微生物を殺すのに非常に有効であり、それらは残留物を残さず、デバイスに放射活性を付与するのに十分なエネルギーも有しない。ガンマ線はそのデバイスが包装の中にある場合に用いることができ、ガンマ線滅菌は高圧も真空条件も必要とせず、従って包装の密封材および他の構成要素に応力がかからない。加えて、ガンマ線照射は透過可能な包装材料の必要性を排除する。
【0156】
様々な態様において、デバイスの1つ以上の構成要素を滅菌するために電子ビーム(e−ビーム)照射を用いてよい。e−ビーム照射は、一般に低い透過率および高い線量率を特徴とするイオン化エネルギーの形態を含む。e−ビーム照射は、微生物の生殖細胞を含め、様々な化学および分子結合を接触時に変化させる点で、ガンマ処理に類似している。e−ビーム滅菌のために生成されるビームは、電気の加速および変換により生成される濃縮された高荷電の電子の流れである。e−ビーム滅菌は、例えば薬物デポーがゲル中に含まれる場合に用いてよい。
【0157】
デポーおよび/またはデバイスの1つ以上の構成要素を滅菌するのに他の方法を用いてもよく、それには例えばエチレンオキシドを用いるようなガス滅菌または蒸気滅菌が含まれるが、それらに限定されない。
【0158】
キット
様々な態様において、キットを提供し、それには薬物デポーおよび/またはその薬物デポー(例えば、ペレット)を埋め込むために一緒に組み合わせて用いられる医療用デバイスと共に、追加の部品が含まれてよい。そのキットには、第一の区画に薬物デポーデバイスが含まれてよい。第二の区画には、薬物デポーおよび局所的な薬物送達に必要とされる他のあらゆる機器を保持するケースが含まれてよい。第三の区画には、埋め込みプロセスの無菌状態を維持するためのグローブ、ドレープ、創傷包帯、および他の手技用品、ならびに取扱説明書が含まれてよい。第四の区画には、追加のカニューレおよび/または針が含まれてよい。第五の区画には、X線造影のための薬剤が含まれてよい。それぞれの道具は、プラスチックの小袋に別々に包装して、それを照射滅菌することができる。キットのカバーには埋め込み手法の図説が含まれてよく、無菌状態を維持するために、その区画に透明なプラスチックカバーをかけてよい。
【0159】
投与
様々な態様において、その鎮痛剤および/または抗炎症剤は非経口的に投与されてよい。用語“非経口”は、本明細書で用いられる際、胃腸管を迂回する投与の形式を指し、例えば、局所化された静脈内、筋肉内の、連続的もしくは断続的な注入、腹腔内、胸骨内、皮下、手術中、髄腔内、椎間板内(intradiscally)、椎間板周囲(peridiscally)、硬膜外、脊椎周囲(perispinally)、関節内の注射、またはそれらの組み合わせが含まれる。
【0160】
本出願の方法は、カニューレを標的組織部位またはその付近に挿入して薬物デポーを患者の皮膚の下の標的部位に埋め込むこと、および薬物デポーを保持する、または標的部位へ接着させるためにゲルを標的部位にブラッシング、滴下、噴霧、注射、または塗布することを含む。このようにして、薬物デポーが標的部位から離れる望まれない移動を低減する、または排除する。
【0161】
様々な態様において、その鎮痛剤および/または抗炎症剤は局所投与されるので、療法上有効用量は他の経路(経口、局部、等)により投与される用量未満であってよい。例えば、薬物デポーから送達される薬物用量は、例えば経口投与量または注射可能な用量の10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、99%、または99.9%未満である可能性がある。一方で、例えば肝トランスアミナーゼ上昇、肝炎、肝不全、ミオパシー、便秘、等のような全身性の副作用を低減または除去することができる。
【0162】
様々な態様において、その中に分散した薬物デポーを有するゲルを望まれる部位に投与するために、初めにカニューレまたは針を皮膚および軟組織を通して標的組織部位に挿入し、ゲルを標的部位またはその付近に投与する(例えば、ブラッシングする、滴下する、注射する、または塗布する、等)ことができる。薬物デポーがゲルから分離している態様では、初めにカニューレまたは針を皮膚および軟組織を通して注射の部位に挿入することができ、1つ以上のゲルの基層(単数または複数)を標的部位に投与することができる。1つ以上の基層(単数または複数)の投与に続き、そのゲルがデポーを適所に保持する、または移動を低減することができるように、薬物デポーを基層(単数または複数)の上または中に埋め込むことができる。必要であれば、薬物デポーを囲んでそれをさらに適所に保持するために、次のゲルの層(単数または複数)をその薬物デポーの上に適用することができる。あるいは、薬物デポーを初めに埋め込み、次いで薬物デポーの周りに、それを適所に保持するためにゲルを配置する(例えば、ブラッシングする、滴下する、注射する、または塗布する、等)ことができる。ゲルを用いることにより、患者に対する肉体的および精神的な外傷を最小限にして、薬物デポーの正確かつ精密な埋め込みを成し遂げることができる。ゲルはまた、薬物デポーを標的部位へ縫合する必要性を回避して、患者に対する肉体的および精神的な外傷を低減する。
【0163】
様々な態様において、標的部位が脊椎領域を含む場合、初めに体液(例えば、脊髄液、等)の一部をカニューレまたは針を通して標的部位から吸引し、次いでデポーを投与する(例えば、配置する、滴下する、注射する、または埋め込む、等)ことができる。標的部位は再水和し(例えば、体液の補充)、この水性環境は薬物をデポーから放出させるであろう。
【0164】
図4は、炎症および/または痛みが生じ得る部位である可能性のある、患者内のいくつかの一般的な位置を図説する。図4で図説する位置は、炎症および/または痛みの部位であり得る患者内の多くの異なる位置の単に典型的なものであることは分かるであろう。例えば、炎症および/または痛みは、患者の膝21、股関節22、指23、親指24、首25、および脊椎26で起こる可能性がある。これらは熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギーをそこに適用して薬物デポーからの鎮痛剤および/または抗炎症剤の大量瞬時投与量の放出を引き起こし、患者に“割り増し用量”を提供することができる領域でもある。
【0165】
その鎮痛剤および/または抗炎症剤は、薬物デポー中で成形され、固体または液体であってよい適切な医薬的キャリヤーと共に投与され、望まれるように非経口または他の投与に適した形で配置されてよい。当業者は気付いているように、既知のキャリヤーには、水、ゼラチン、ラクトース、デンプン類、ステアリン酸、ステアリン酸マグネシウム、シカリル(sicaryl)アルコール、タルク、植物油、ベンジルアルコール類、ゴム、ワックス、プロピレングリコール、ポリアルキレングリコール類、および他の既知のキャリヤーが含まれるが、それらに限定されない。
【0166】
別の態様は、痛みおよび/または炎症で苦しむ哺乳類を処置するための方法を提供し、前記方法は、療法上有効量の少なくとも1種類の鎮痛剤および/または抗炎症剤を標的部位またはその付近の皮膚の下の標的部位に投与することを含む。その少なくとも鎮痛剤および/または抗炎症剤は、例えば薬物デポーとして標的組織部位に局所投与されてよい。
【0167】
一部の態様において、その療法上有効投与量(例えば鎮痛剤および/または抗炎症剤の用量)および放出速度プロフィールは、少なくとも1日、例えば、1〜90日、1〜10日、1〜3日、3〜7日、3〜12日;3〜14日、7〜10日、7〜14日、7〜21日、7〜30日、7〜50日、7〜90日、7〜140日、14〜140日、3日〜135日、3日〜150日、または3日〜6ヶ月の期間の間、手術、慢性炎症性疾患、慢性炎症性腸疾患、滑液包炎、骨関節炎、骨溶解、腱炎、坐骨神経痛、椎間板ヘルニア、狭窄、ミオパシー、脊椎すべり症(spondilothesis)、腰痛、椎間関節痛、手根管症候群、足根管症候群、失敗した背部痛等の結果として起こる炎症および/または痛みを低減するのに十分である。
【0168】
一部の態様において、標的組織部位に局所投与することが可能である有効量の少なくとも1種類の鎮痛剤および/または抗炎症剤を含む、炎症の処置に有用な組成物が存在する。例として、それらは脊椎孔(foraminal spine)、硬膜外腔、または脊髄の髄腔内空間に局所投与することができる。典型的な投与経路には、薬物ポンプ、1種類以上の局所注射、ポリマー放出、およびそれらの組み合わせが含まれるが、それらに限定されない。
【0169】
一部の態様において、その少なくとも1種類の鎮痛剤および/または抗炎症剤は、非経口的に、例えば注射により投与される。一部の態様において、その注射は髄腔内であり、それは脊椎管(脊髄を囲む髄腔内空間)中への注射を指す。注射は筋肉または他の組織の中にであってもよい。他の態様において、その鎮痛剤および/または抗炎症剤は、手術の間の患者の切開部(open patient cavity)中への配置により投与される。
【0170】
一部の態様において、その配合物は手術の時に手術部位の中に埋め込むことができる。次いで有効成分がデポーから持続様式での拡散により、例えば手術後1〜10日、3〜10日、3〜15日、5〜10日または7〜10日の期間にわたって放出されることができる。その薬物デポーは可逆性相転移ポリマーからの大量瞬時投与も可能にする。
【0171】
一部の態様において、薬物デポーは、薬物デポーに装填された少なくとも1種類の鎮痛剤および/または抗炎症剤の総量に対して、少なくとも1種類の鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩の5%、10%、15%、20%、25%、30%、40%、50%、60%、70%、80%、90%、95%、または99%を、その薬物デポーが標的組織部位に投与された後の3〜12日、5〜10日、または7〜10日の期間にわたって放出することができる。一部の態様において、その有効成分は、1種類以上の薬物の6ヶ月または1年まで(例えば、90、100、135、150、180日以上)の放出により、上記で論じたような慢性の疾患/病気に関してより長い期間の痛みおよび/または炎症の軽減を提供することができる。
【0172】
様々な態様において、そのような処置を必要とする患者において痛みおよび/または炎症を低減、予防または処置するのに有用な埋め込み式薬物デポーを提供し、その埋め込み式薬物デポーは療法上有効量の鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩を含み、そのデポーは、手術後の、または慢性炎症性疾患、慢性炎症性腸疾患、滑液包炎、骨関節炎、骨溶解、腱炎、坐骨神経痛、椎間板ヘルニア、狭窄、ミオパシー、脊椎すべり症(spondilothesis)、腰痛、椎間関節痛、手根管症候群、足根管症候群、失敗した背部痛等の結果として起こる痛みおよび/または炎症を低減、予防または処置するために皮膚の下の部位に埋め込むことができ、ここでその薬物デポーは(i)薬物デポーに装填された鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩の総量に対して約5%〜約20%の鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩を48時間までの第1期間にわたって放出することができる1つ以上の即時放出層(単数または複数)、および(ii)薬物デポーに装填された鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩の総量に対して約21%〜約99%の鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩を3日〜6ヶ月までの続く期間にわたって放出することができる1つ以上の継続放出層(単数または複数)を含む。
【0173】
限定的でない例として、その標的組織部位は、少なくとも1つの筋肉、靭帯、腱、軟骨、椎間板、脊髄神経根付近の脊椎孔空間、小関節面(facet)または脊椎管を含んでよい。また、例として、炎症は整形外科手術または脊椎手術、またはそれらの組み合わせと関係するものであってよい。さらなる例として、その手術は関節鏡手術、塊の切除、ヘルニアの修復、脊椎固定術、胸部、頚部、もしくは腰部手術、骨盤手術、またはそれらの組み合わせであってよい。一部の態様において、有効成分は、1〜90日、1〜10日、1〜3日、3〜7日、3〜12日;3〜14日、7〜10日、7〜14日、7〜21日、7〜30日、7〜50日、7〜90日、7〜140日、14〜140日、3日〜135日、3日〜150日、または3日〜6ヶ月の期間にわたる1種類以上の薬物の放出により、上記で論じたような慢性的な疾患/病気に関するより長い期間の痛みおよび/または炎症の軽減を提供することができる。
【0174】
一部の態様において、その少なくとも1種類の鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩は、ゲル中に懸濁された微粒子、マイクロスフェア、マイクロカプセル、および/またはマイクロファイバーを含む複数のデポー中に封入されている。
【0175】
一部の態様において、そのような処置を必要とする患者において手術後の、または慢性炎症性疾患、慢性炎症性腸疾患、滑液包炎、骨関節炎、骨溶解、腱炎、坐骨神経痛、椎間板ヘルニア、狭窄、ミオパシー、脊椎すべり症(spondilothesis)、腰痛、椎間関節痛、手根管症候群、足根管症候群、失敗した背部痛等の結果として起こる痛みおよび/または炎症を抑制する方法を提供し、その方法は、療法上有効量の少なくとも1種類の鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩を含む1つ以上の生分解性薬物デポーを皮膚の下の標的組織部位に、手術の前、間、または後に送達することを含み、ここでその薬物デポーは有効量の少なくとも1種類の鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩を3日〜6ヶ月の期間にわたって放出する。
【0176】
一部の態様において、埋込型薬物デポーを提供し、ここでその薬物デポーは(i)熱、冷気または別の適切な形のエネルギー、例えば超音波エネルギーが皮膚の下の部位においてそれに適用された際に大量瞬時投与量の少なくとも1種類の鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩を放出する可逆性相転移ポリマーを含む1つ以上の即時放出層(単数または複数)、および(ii)有効量の少なくとも1種類の鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩を3〜12日または5〜10日または7〜10日または3日〜6ヶ月の期間にわたって放出する1つ以上の継続放出層(単数または複数)を含む。例として、その薬物デポーにおいて、その1つ以上の持続放出層はポリ(ラクチド−co−グリコリド)(PLGA)、ポリラクチド(PLA)、ポリグリコリド(PGA)、D−ラクチド、D,L−ラクチド、L−ラクチド、D,L−ラクチド−ε−カプロラクトン、D,L−ラクチド−グリコリド−ε−カプロラクトン、またはそれらの組み合わせを含み、即時放出層中の可逆性相転移物質はパラフィンろう、ポロキサマー類、ポリラクトン類、パラフィンろう、ポリ(N−イソプロピルアクリルアミド)ホモポリマー、ポリ(N−イソプロピルアクリルアミド)アクリルアミドコポリマー、[3−(メタクリロイルオキシ)プロピル]トリメトキシシラン、[2−(メタクリロイルオキシ)エトキシ]−トリメチルシランおよびメタクリロイルオキシ)トリメチルシランから選択されるシランモノマーを含有するポリ(N−イソプロピルアクリルアミド)のコポリマー、ポリ(ヒドロキシプロピルメタクリルアミド)のコポリマー、ジカルボキシメチルアミノプロピルメタクリルアミド、キシログルカン、エチル(ヒドロキシエチル)セルロース、ポリ(エチレンオキシド−b−プロピレンオキシド−b−エチレンオキシド)およびそのコポリマー、ポリ(エチレンオキシド)/(D,L−乳酸−co−グリコール酸)コポリマー類、キトサンおよびポリオール塩類の組み合わせ、ポリ(シラミン)(poly(silamine))、ならびにポリ(オルガノホスファゼン)またはそれらの組み合わせを含む。
【0177】
作製の方法
様々な態様において、有効成分(例えば、抗炎症剤)を含む薬物デポーは、生体適合性ポリマー(可逆性相転移ポリマー(単数または複数)および/または持続放出ポリマー(単数または複数))および療法上有効量の有効成分またはその医薬的に許容できる塩類を組み合わせ、その組み合わせから埋め込み式薬物デポーを形成することにより作製することができる。
【0178】
薬物デポーの少なくとも一部を生体適合性ポリマー(単数または複数)、療法剤(単数または複数)、および任意の材料から形成するために、溶液加工技法および/または熱可塑加工技法が含まれる様々な技法が利用可能である。溶液加工技法を使用する場合、溶媒系は典型的には、1種類以上の溶媒種を含有する溶媒系が選択される。溶媒系は一般的には注目される少なくとも1種類の構成要素、例えば、生体適合性ポリマーおよび/または療法剤にとって良好な溶媒である。その溶媒系を構成する個々の溶媒種は、乾燥速度および表面張力が含まれる他の特徴に基づいて選択することもできる。
【0179】
溶液加工技法には、溶媒キャスティング技法、スピンコーティング技法、ウェブコーティング技法、溶媒噴霧技法、浸漬技法、エアサスペンションが含まれる機械サスペンションによるコーティングを伴う技法(例えば、流動コーティング)、インクジェット技法、および静電技法が含まれる。適切な場合、望まれる放出速度および望まれる厚さを得るようにデポーを構築するために、上記で列挙した技法のような技法を繰り返す、または組み合わせることができる。
【0180】
様々な態様において、溶媒を含有する溶液と生体適合性ポリマーを組み合わせて、望まれる大きさおよび形状の型に入れる。このようにして、バリアー層、滑らかな層、等が含まれるポリマー領域を形成することができる。望まれるならば、その溶液はさらに以下のものの1種類以上を含むことができる:溶解した、または分散した形の他の療法剤(単数または複数)および他の任意の添加剤、例えばX線造影剤(単数または複数)等。これは結果として溶媒除去後にこれらの種を含有するポリマーマトリックス領域をもたらす。他の態様において、溶解または分散した療法剤を含む溶媒を含有する溶液を、溶液加工および熱可塑加工の技法が含まれる様々な技法を用いて成形することができる既存のポリマー領域に適用し、その際にその療法剤はポリマー領域中に吸収される。
【0181】
デポーまたはその一部を形成するための熱可塑加工技法には、成形技法(例えば、注入成形、回転成形、等)、押出技法(例えば、押出、共押出、多層押出、等)、および鋳造法が含まれる。
【0182】
様々な態様に従う熱可塑加工は、1つ以上の段階において、生体適合性ポリマー(単数または複数)および以下のものの1種類以上:有効成分(例えば、アルファ作動薬)、任意の追加の療法剤(単数または複数)、X線造影剤(単数または複数)、等を混合または調合することを含む。次いで、得られた混合物を埋め込み式薬物デポーへと成形する。この混合および成形の操作は、そのような目的のために当技術で既知の一般に用いられるデバイスのいずれを用いて実施してもよい。
【0183】
熱可塑加工の間、療法剤(単数または複数)には、例えば、そのような加工に伴う上昇した温度および/または機械的剪断により分解する可能性が存在する。例えば、特定の療法剤は、通常の熱可塑加工条件の下で、実質的な分解を受ける可能性がある。従って、加工は好ましくは療法剤(単数または複数)の実質的な分解を防ぐ修正された条件の下で実施される。熱可塑加工の間にはいくらかの分解が避けられない可能性があると理解されているが、分解は一般的には10%以下に制限される。療法剤(単数または複数)の実質的な分解を回避するために加工の間に制御することができる加工条件には、温度、適用される剪断速度、適用される剪断応力、療法剤を含有する混合物の滞留時間、ならびにそれによりポリマー性材料および療法剤(単数または複数)を混合する技法がある。
【0184】
生体適合性ポリマーを療法剤(単数または複数)およびあらゆる追加の添加剤と混合または調合してその実質的に均質な混合物を形成することは、当技術で既知の、およびポリマー性材料を添加剤と混合するために一般に用いられるあらゆるデバイスを用いて実施されてよい。
【0185】
熱可塑性材料が用いられる場合、様々な添加剤(例えば、療法剤(単数または複数)、不活性成分、等)と混合することができる生体適合性ポリマーを加熱することによりポリマー溶融物を形成して混合物を形成してよい。そのようにする一般的な方法は、生体適合性ポリマー(単数または複数)および添加剤(単数または複数)の混合物に機械的剪断を適用することである。この様式で生体適合性ポリマー(単数または複数)および添加剤(単数または複数)を混合することができるデバイスには、一軸式押出機、二軸押出機、バンバリーミキサー、高速ミキサー、rossケトル(ross kettle)等のデバイスが含まれる。
【0186】
生体適合性ポリマー(単数または複数)および様々な添加剤のいずれも、望まれるならば(例えば、数ある理由の中でも、療法剤の実質的な分解を防ぐために)、最終的な熱可塑性の混合および成形のプロセスの前に予め混合することができる。
【0187】
例えば、様々な態様において、それがあれば結果として療法剤の実質的な分解がもたらされるであろう温度および機械的剪断の条件の下で、生体適合性ポリマーをX線造影剤(例えば、放射線不透過剤)と予め調合する。次いでこの予め調合された材料を、より低い温度および機械的剪断の条件の下で療法剤(例えば、アルファ作動薬)と混合して、得られた混合物を有効成分含有薬物デポーへと成形する。逆に、別の態様では、生体適合性ポリマーを療法剤と、低減された温度および機械的剪断の条件の下で予め調合することができる。次いで、この予め調合された材料を、やはり低減された温度および機械的剪断の条件の下で、例えば放射線不透過剤と混合して、得られた混合物を薬物デポーへと成形する。
【0188】
生体適合性ポリマーおよび療法剤および他の添加剤の混合物を得るために使用する条件は、例えば、使用する特定の生体適合性ポリマー(単数または複数)および添加剤(単数または複数)、ならびに使用する混合デバイスのタイプが含まれる、いくつかの要因に依存するであろう。
【0189】
例として、異なる生体適合性ポリマーは典型的には異なる温度での混合を促進するために軟化させられるであろう。例えば、PLGAまたはPLAポリマー、放射線不透過剤(例えば、次炭酸ビスマス)、および加熱および/または機械的剪断により分解し易い療法剤(例えば、クロニジン)を含むデポーを形成する場合、様々な態様において、PGLAまたはPLAは例えば約150℃〜170℃の温度で放射線不透過剤と予め混合することができる。次いで、療法剤をその予め混合された組成物と組み合わせて、PGLAまたはPLA組成物に典型的であるよりも実質的に低い温度および機械的剪断の条件で、さらなる熱可塑加工を施す。例えば、押出機を用いる場合、バレル温度、容積測定出力(volumetric output)は、典型的には、剪断を制限し、従って療法剤(単数または複数)の実質的な分解を防ぐように制御される。例えば、その療法剤および予め混合された組成物は、二軸押出機を実質的により低い温度(例えば、100〜105℃)で用いて、実質的に低減された容積測定出力(例えば、全容量の30%未満、それは一般に200cc/分未満の容積測定出力に相当する)を用いて混合/調合することができる。この加工温度は、これらの温度での、またはそれより上の温度での加工は結果として実質的な療法剤の分解をもたらすと考えられるので、抗炎症剤および/または鎮痛剤(例えば、クロニジン)のような特定の有効成分の融点より十分に低いことを特筆する。さらに、特定の態様において、その加工温度は療法剤を含むその組成物内の全ての生理活性化合物の融点より下であろうことを特筆する。調合の後、結果として得られるデポーを、やはり低減された温度および剪断の条件の下で、望まれる形へと成形する。
【0190】
他の態様において、生分解性ポリマー(単数または複数)および1種類以上の療法剤を、非熱可塑性技法を用いて予め混合する。例えば、生体適合性ポリマーを1種類以上の溶媒種を含有する溶媒系中で溶解させることができる。あらゆる望まれる薬剤(例えば、放射線不透過剤、療法剤、または放射線不透過剤および療法剤の両方)もその溶媒系中で溶解または分散させることができる。次いで、得られた溶液/分散液から溶媒を除去し、固体物質を形成する。望まれるならば、得られた固体物質を、次いでさらなる熱可塑加工(例えば、押出)のために顆粒化することができる。
【0191】
別の例として、その療法剤は溶媒系中で溶解させる、または分散させることができ、次いでそれを既存の薬物デポー(その既存の薬物デポーは溶液および熱可塑加工技法が含まれる様々な技法を用いて形成することができ、それは放射線不透過剤および/または粘度増強剤が含まれる様々な添加剤を含むことができる)に適用し、その際にその療法剤は薬物デポーの上または中に吸収される。次いで、上記のように、得られた固体材料を、望まれるならばさらなる加工のために顆粒化することができる。
【0192】
典型的には、生体適合性ポリマー(単数または複数)、療法剤(単数または複数)、および放射線不透過剤(単数または複数)を含む薬物デポーを形成するために、押出プロセスを用いてよい。共押出法を用いてもよく、それは同じまたは異なる層または領域を含む薬物デポー(例えば、即時および/または持続薬物放出を可能にする流体に対する透過性を有する1つ以上のポリマーマトリックス層または領域を含む構造物)を生成するために用いることができる成形プロセスである。共注入または連続注入成形技術のような他の加工および成形技法により、多重領域デポーを形成することもできる。
【0193】
様々な態様において、熱可塑加工から生じる可能性のあるデポー(例えば、ペレット、細片、等)は冷却される。冷却プロセスの例には、空気冷却および/または冷却浴中に浸すことが含まれる。一部の態様において、押出されたデポーを冷却するために水浴が用いられる。しかし、有効成分のような水溶性の療法剤が用いられる場合、療法剤の槽中への不必要な損失を回避するため、浸す時間は最小限に保たれるべきである。
【0194】
様々な態様において、槽から出した後に、周囲温の、または暖かい空気ジェットの使用により、水または水分をすぐに除去することは、薬物のデポー表面上での再結晶も防ぎ、そうして埋め込みまたは挿入の際の高い薬物用量の“初期バースト”または“ボーラス用量”を、この放出プロフィールが望まれていない場合に制御または最小化するであろう。
【0195】
様々な態様において、薬物をポリマーと混合、またはポリマーと共に噴霧することにより薬物デポーを製造し、次いでそのデポーを望まれる形状に成形することができる。様々な態様において、有効成分をPLGAまたはPEG550ポリマーと共に使用して混合し、または噴霧し、得られたデポーを押出により成形して乾燥させてよい。
【0196】
薬物デポーは、生体適合性ポリマーおよび療法上有効量の少なくとも1種類の鎮痛剤および/または抗炎症剤またはその医薬的に許容できる塩を組み合わせて、その組み合わせから埋め込み式薬物デポーを形成することにより作製してもよい。
【0197】
当業者には、本明細書で記述された様々な態様に対して、本明細書の教示の精神または範囲から逸脱することなく様々な修正および変形をすることができることは明らかであろう。従って、様々な態様には本教示の範囲内の様々な態様の他の修正および変形が含まれることが意図される。
【符号の説明】
【0198】
10 薬物デポー
12 可逆性相転移物質
14 薬物
16 薬物
21 指
22 皮膚
24 開口部
25 指
26 手
28 薬物デポー
30 スタンド
31 冷または温パック
41 膝
42 股関節
43 指
44 親指
45 首
46 脊椎
【特許請求の範囲】
【請求項1】
そのような処置を必要とする患者において痛みおよび/または炎症を低減、予防または処置するのに有用な埋め込み式薬物デポーであって、その埋め込み式薬物デポーが皮膚の下の部位に埋め込み可能であり、その薬物デポーの可逆的相転移物質内に配置された有効量の鎮痛剤、筋弛緩剤および/または抗炎症剤を含み、その可逆的相転移物質が熱、冷気または他の適切なエネルギーの形が患者の皮膚に適用された際に大量瞬時投与量の鎮痛剤、筋弛緩剤および/または抗炎症剤を放出して痛みおよび/または炎症を低減、予防または処置することができる、前記埋め込み式薬物デポー。
【請求項2】
その薬物デポーが有効量の鎮痛剤、筋弛緩剤および/または抗炎症剤を3〜10日の期間にわたって放出して術後痛を処置する、請求項1に記載の埋め込み式薬物デポー。
【請求項3】
その皮膚の下の部位が少なくとも1つの真皮、結合組織、脂肪組織、筋肉、靭帯、腱、軟骨、椎間板、脊髄神経根付近の脊椎孔空間、椎間関節(facet joint)または滑膜関節、または脊椎管を含む、請求項1に記載の埋め込み式薬物デポー。
【請求項4】
その痛みまたは炎症がヘルニアの修復、整形外科もしくは脊椎手術またはそれらの組み合わせと関係している、請求項2に記載の埋め込み式薬物デポー。
【請求項5】
その術後痛が関節鏡手術、塊の切除、脊椎固定術、胸部、頚部、もしくは腰部手術、骨盤手術、またはそれらの組み合わせを含む1種類以上の外科的手法からのものである、請求項2に記載の埋め込み式薬物デポー。
【請求項6】
その薬物デポーがポリ(ラクチド−co−グリコリド)(PLGA)、ポリラクチド(PLA)、ポリグリコリド(PGA)、D−ラクチド、D,L−ラクチド、L−ラクチド、D,L−ラクチド−ε−カプロラクトン、D,L−ラクチド−グリコリド−ε−カプロラクトン、またはそれらの組み合わせの内の1種類以上を含む少なくとも1種類の生分解性ポリマーを含み、その可逆性相転移物質がパラフィンろう、ポロキサマー類、ポリラクトン類、ポリ(N−イソプロピルアクリルアミド)ホモポリマー、ポリ(N−イソプロピルアクリルアミド)アクリルアミドコポリマー、[3−(メタクリロイルオキシ)プロピル]トリメトキシシラン、[2−(メタクリロイルオキシ)エトキシ]−トリメチルシランおよびメタクリロイルオキシ)トリメチルシランから選択されるシランモノマーを含有するポリ(N−イソプロピルアクリルアミド)のコポリマー、ポリ(ヒドロキシプロピルメタクリルアミド)のコポリマー、ジカルボキシメチルアミノプロピルメタクリルアミド、キシログルカン、エチル(ヒドロキシエチル)セルロース、ポリ(エチレンオキシド−b−プロピレンオキシド−b−エチレンオキシド)およびそのコポリマー、ポリ(エチレンオキシド)/(D,L−乳酸−co−グリコール酸)コポリマー類、キトサンおよびポリオール塩類の組み合わせ、ポリ(シラミン)(poly(silamine))、ならびにポリ(オルガノホスファゼン)またはそれらの組み合わせを含む、請求項1に記載の埋め込み式薬物デポー。
【請求項7】
その可逆性相転移ポリマーがパラフィンろう、ポロキサマー類、ポリラクトン類、パラフィンろう、ポリ(N−イソプロピルアクリルアミド)ホモポリマー、ポリ(N−イソプロピルアクリルアミド)アクリルアミドコポリマー、[3−(メタクリロイルオキシ)プロピル]トリメトキシシラン、[2−(メタクリロイルオキシ)エトキシ]−トリメチルシランおよびメタクリロイルオキシ)トリメチルシランから選択されるシランモノマーを含有するポリ(N−イソプロピルアクリルアミド)のコポリマー、ポリ(ヒドロキシプロピルメタクリルアミド)のコポリマー、ジカルボキシメチルアミノプロピルメタクリルアミド、キシログルカン、エチル(ヒドロキシエチル)セルロース、ポリ(エチレンオキシド−b−プロピレンオキシド−b−エチレンオキシド)およびそのコポリマー、ポリ(エチレンオキシド)/(D,L−乳酸−co−グリコール酸)コポリマー類、キトサンおよびポリオール塩類の組み合わせ、ポリ(シラミン)(poly(silamine))、ならびにポリ(オルガノホスファゼン)またはそれらの組み合わせを含む少なくとも1種類の生分解性ポリマーを含む、請求項1に記載の埋め込み式薬物デポー。
【請求項8】
請求項1に記載の埋め込み式薬物デポーであって、その可逆性相転移ポリマーが薬物デポー中で層になっており、熱、冷気または他のエネルギーの形がその薬物デポーが埋め込まれた部位に非常に近い皮膚上の部位に適用された際に、その可逆性相転移ポリマーが固体から液体に変化して大量瞬時投与量の鎮痛剤、筋弛緩剤および/または抗炎症剤を放出する、前記埋め込み式薬物デポー。
【請求項9】
その可逆性相転移ポリマーがその薬物デポーの総重量%の約60%〜99%を構成する、請求項1に記載の埋め込み式薬物デポー。
【請求項10】
埋め込み式薬物デポー中の可逆性相転移物質を固体から液体に、または固体から半固体に、または半固体から液体に変化させるために皮膚に適用される熱が約40℃〜45℃より上である、請求項1に記載の埋め込み式薬物デポー。
【請求項11】
埋め込み式薬物デポー中の可逆性相転移物質を固体から液体に、または固体から半固体に、または半固体から液体に変化させるために皮膚に適用される冷気が20℃〜25℃より下である、請求項1に記載の埋め込み式薬物デポー。
【請求項12】
その薬物デポーが(i)大量瞬時投与量の鎮痛剤および/または抗炎症剤を皮膚の下の部位で3日までの期間にわたって、および(ii)有効量の鎮痛剤および/または抗炎症剤を6ヶ月までの期間にわたって放出する、請求項1に記載の埋め込み式薬物デポー。
【請求項13】
そのような処置を必要とする患者において痛みおよび/または炎症を低減、予防または処置するのに有用な薬物デポーであって、その薬物デポーが患者の皮膚の下の部位に埋め込み可能であり、その薬物デポーの可逆的相転移ポリマーおよび生分解性ポリマー内に配置された有効量の鎮痛剤、筋弛緩剤および/または抗炎症剤を含み、その可逆的相転移物質が熱、冷気または他のエネルギーの形がその薬物デポーまたはその付近に適用された際に大量瞬時投与量の鎮痛剤、筋弛緩剤および/または抗炎症剤を放出することができ、その生分解性ポリマーが鎮痛剤、筋弛緩剤および/または抗炎症剤を少なくとも1日にわたって放出して痛みおよび/または炎症を低減、予防または処置することができる、前記薬物デポー。
【請求項14】
その薬物デポーが表皮、真皮、または皮下組織の1mm以内に埋め込まれ、熱、冷気または他のエネルギーの形をその皮膚に適用して大量瞬時投与量の鎮痛剤、筋弛緩剤および/または抗炎症剤の放出を引き起こす、請求項13に記載の薬物デポー。
【請求項15】
その薬物デポーがペレットの形である、請求項13に記載の薬物デポー。
【請求項16】
その熱が薬物デポーの付近の患者の皮膚に、それが皮膚の下の部位に埋め込まれている場合に、約5分間〜約60分間適用される、請求項13に記載の薬物デポー。
【請求項17】
その冷気が薬物デポーの付近の患者の皮膚に、それが皮膚の下の部位に埋め込まれている場合に、約5分間〜約60分間適用される、請求項13に記載の薬物デポー。
【請求項18】
そのような処置を必要とする患者において痛みおよび/または炎症を処置または予防する方法であって、その方法が、患者の皮膚の下の標的組織部位において薬物デポーの可逆的相転移物質内に配置された有効量の鎮痛剤、筋弛緩剤および/または抗炎症剤を含む生分解性薬物デポーを埋め込むこと、ここでその可逆的相転移物質は熱、冷気または他のエネルギーの形がその薬物デポーに、またはその付近に適用された際に大量瞬時投与量の鎮痛剤、筋弛緩剤および/または抗炎症剤を放出することができる;ならびに熱、冷気または他のエネルギーの形をその薬物デポーが埋め込まれている標的組織部位に、またはその付近に適用して大量瞬時投与量の鎮痛剤、筋弛緩剤および/または抗炎症剤を放出させて痛みおよび/または炎症を予防または処置することを含む、前記方法。
【請求項19】
その薬物デポーがさらに生分解性ポリマーを含み、それが鎮痛剤、筋弛緩剤および/または抗炎症剤を少なくとも1日にわたって放出して痛みおよび/または炎症を予防または処置することができる、請求項18に記載の方法。
【請求項20】
請求項18に記載の方法であって、(i)大量瞬時投与量を放出するために可逆性相転移物質を固体から液体に、もしくは固体から半固体に、もしくは半固体から液体に変化させるために、患者の皮膚に熱を適用し、その熱が約40℃〜45℃より上である、または(ii)大量瞬時投与量を放出するために可逆性相転移物質を固体から液体に、もしくは固体から半固体に、もしくは半固体から液体に変化させるために、患者の皮膚に冷気を適用し、その冷気が約20℃〜25℃より下である、前記方法。
【請求項1】
そのような処置を必要とする患者において痛みおよび/または炎症を低減、予防または処置するのに有用な埋め込み式薬物デポーであって、その埋め込み式薬物デポーが皮膚の下の部位に埋め込み可能であり、その薬物デポーの可逆的相転移物質内に配置された有効量の鎮痛剤、筋弛緩剤および/または抗炎症剤を含み、その可逆的相転移物質が熱、冷気または他の適切なエネルギーの形が患者の皮膚に適用された際に大量瞬時投与量の鎮痛剤、筋弛緩剤および/または抗炎症剤を放出して痛みおよび/または炎症を低減、予防または処置することができる、前記埋め込み式薬物デポー。
【請求項2】
その薬物デポーが有効量の鎮痛剤、筋弛緩剤および/または抗炎症剤を3〜10日の期間にわたって放出して術後痛を処置する、請求項1に記載の埋め込み式薬物デポー。
【請求項3】
その皮膚の下の部位が少なくとも1つの真皮、結合組織、脂肪組織、筋肉、靭帯、腱、軟骨、椎間板、脊髄神経根付近の脊椎孔空間、椎間関節(facet joint)または滑膜関節、または脊椎管を含む、請求項1に記載の埋め込み式薬物デポー。
【請求項4】
その痛みまたは炎症がヘルニアの修復、整形外科もしくは脊椎手術またはそれらの組み合わせと関係している、請求項2に記載の埋め込み式薬物デポー。
【請求項5】
その術後痛が関節鏡手術、塊の切除、脊椎固定術、胸部、頚部、もしくは腰部手術、骨盤手術、またはそれらの組み合わせを含む1種類以上の外科的手法からのものである、請求項2に記載の埋め込み式薬物デポー。
【請求項6】
その薬物デポーがポリ(ラクチド−co−グリコリド)(PLGA)、ポリラクチド(PLA)、ポリグリコリド(PGA)、D−ラクチド、D,L−ラクチド、L−ラクチド、D,L−ラクチド−ε−カプロラクトン、D,L−ラクチド−グリコリド−ε−カプロラクトン、またはそれらの組み合わせの内の1種類以上を含む少なくとも1種類の生分解性ポリマーを含み、その可逆性相転移物質がパラフィンろう、ポロキサマー類、ポリラクトン類、ポリ(N−イソプロピルアクリルアミド)ホモポリマー、ポリ(N−イソプロピルアクリルアミド)アクリルアミドコポリマー、[3−(メタクリロイルオキシ)プロピル]トリメトキシシラン、[2−(メタクリロイルオキシ)エトキシ]−トリメチルシランおよびメタクリロイルオキシ)トリメチルシランから選択されるシランモノマーを含有するポリ(N−イソプロピルアクリルアミド)のコポリマー、ポリ(ヒドロキシプロピルメタクリルアミド)のコポリマー、ジカルボキシメチルアミノプロピルメタクリルアミド、キシログルカン、エチル(ヒドロキシエチル)セルロース、ポリ(エチレンオキシド−b−プロピレンオキシド−b−エチレンオキシド)およびそのコポリマー、ポリ(エチレンオキシド)/(D,L−乳酸−co−グリコール酸)コポリマー類、キトサンおよびポリオール塩類の組み合わせ、ポリ(シラミン)(poly(silamine))、ならびにポリ(オルガノホスファゼン)またはそれらの組み合わせを含む、請求項1に記載の埋め込み式薬物デポー。
【請求項7】
その可逆性相転移ポリマーがパラフィンろう、ポロキサマー類、ポリラクトン類、パラフィンろう、ポリ(N−イソプロピルアクリルアミド)ホモポリマー、ポリ(N−イソプロピルアクリルアミド)アクリルアミドコポリマー、[3−(メタクリロイルオキシ)プロピル]トリメトキシシラン、[2−(メタクリロイルオキシ)エトキシ]−トリメチルシランおよびメタクリロイルオキシ)トリメチルシランから選択されるシランモノマーを含有するポリ(N−イソプロピルアクリルアミド)のコポリマー、ポリ(ヒドロキシプロピルメタクリルアミド)のコポリマー、ジカルボキシメチルアミノプロピルメタクリルアミド、キシログルカン、エチル(ヒドロキシエチル)セルロース、ポリ(エチレンオキシド−b−プロピレンオキシド−b−エチレンオキシド)およびそのコポリマー、ポリ(エチレンオキシド)/(D,L−乳酸−co−グリコール酸)コポリマー類、キトサンおよびポリオール塩類の組み合わせ、ポリ(シラミン)(poly(silamine))、ならびにポリ(オルガノホスファゼン)またはそれらの組み合わせを含む少なくとも1種類の生分解性ポリマーを含む、請求項1に記載の埋め込み式薬物デポー。
【請求項8】
請求項1に記載の埋め込み式薬物デポーであって、その可逆性相転移ポリマーが薬物デポー中で層になっており、熱、冷気または他のエネルギーの形がその薬物デポーが埋め込まれた部位に非常に近い皮膚上の部位に適用された際に、その可逆性相転移ポリマーが固体から液体に変化して大量瞬時投与量の鎮痛剤、筋弛緩剤および/または抗炎症剤を放出する、前記埋め込み式薬物デポー。
【請求項9】
その可逆性相転移ポリマーがその薬物デポーの総重量%の約60%〜99%を構成する、請求項1に記載の埋め込み式薬物デポー。
【請求項10】
埋め込み式薬物デポー中の可逆性相転移物質を固体から液体に、または固体から半固体に、または半固体から液体に変化させるために皮膚に適用される熱が約40℃〜45℃より上である、請求項1に記載の埋め込み式薬物デポー。
【請求項11】
埋め込み式薬物デポー中の可逆性相転移物質を固体から液体に、または固体から半固体に、または半固体から液体に変化させるために皮膚に適用される冷気が20℃〜25℃より下である、請求項1に記載の埋め込み式薬物デポー。
【請求項12】
その薬物デポーが(i)大量瞬時投与量の鎮痛剤および/または抗炎症剤を皮膚の下の部位で3日までの期間にわたって、および(ii)有効量の鎮痛剤および/または抗炎症剤を6ヶ月までの期間にわたって放出する、請求項1に記載の埋め込み式薬物デポー。
【請求項13】
そのような処置を必要とする患者において痛みおよび/または炎症を低減、予防または処置するのに有用な薬物デポーであって、その薬物デポーが患者の皮膚の下の部位に埋め込み可能であり、その薬物デポーの可逆的相転移ポリマーおよび生分解性ポリマー内に配置された有効量の鎮痛剤、筋弛緩剤および/または抗炎症剤を含み、その可逆的相転移物質が熱、冷気または他のエネルギーの形がその薬物デポーまたはその付近に適用された際に大量瞬時投与量の鎮痛剤、筋弛緩剤および/または抗炎症剤を放出することができ、その生分解性ポリマーが鎮痛剤、筋弛緩剤および/または抗炎症剤を少なくとも1日にわたって放出して痛みおよび/または炎症を低減、予防または処置することができる、前記薬物デポー。
【請求項14】
その薬物デポーが表皮、真皮、または皮下組織の1mm以内に埋め込まれ、熱、冷気または他のエネルギーの形をその皮膚に適用して大量瞬時投与量の鎮痛剤、筋弛緩剤および/または抗炎症剤の放出を引き起こす、請求項13に記載の薬物デポー。
【請求項15】
その薬物デポーがペレットの形である、請求項13に記載の薬物デポー。
【請求項16】
その熱が薬物デポーの付近の患者の皮膚に、それが皮膚の下の部位に埋め込まれている場合に、約5分間〜約60分間適用される、請求項13に記載の薬物デポー。
【請求項17】
その冷気が薬物デポーの付近の患者の皮膚に、それが皮膚の下の部位に埋め込まれている場合に、約5分間〜約60分間適用される、請求項13に記載の薬物デポー。
【請求項18】
そのような処置を必要とする患者において痛みおよび/または炎症を処置または予防する方法であって、その方法が、患者の皮膚の下の標的組織部位において薬物デポーの可逆的相転移物質内に配置された有効量の鎮痛剤、筋弛緩剤および/または抗炎症剤を含む生分解性薬物デポーを埋め込むこと、ここでその可逆的相転移物質は熱、冷気または他のエネルギーの形がその薬物デポーに、またはその付近に適用された際に大量瞬時投与量の鎮痛剤、筋弛緩剤および/または抗炎症剤を放出することができる;ならびに熱、冷気または他のエネルギーの形をその薬物デポーが埋め込まれている標的組織部位に、またはその付近に適用して大量瞬時投与量の鎮痛剤、筋弛緩剤および/または抗炎症剤を放出させて痛みおよび/または炎症を予防または処置することを含む、前記方法。
【請求項19】
その薬物デポーがさらに生分解性ポリマーを含み、それが鎮痛剤、筋弛緩剤および/または抗炎症剤を少なくとも1日にわたって放出して痛みおよび/または炎症を予防または処置することができる、請求項18に記載の方法。
【請求項20】
請求項18に記載の方法であって、(i)大量瞬時投与量を放出するために可逆性相転移物質を固体から液体に、もしくは固体から半固体に、もしくは半固体から液体に変化させるために、患者の皮膚に熱を適用し、その熱が約40℃〜45℃より上である、または(ii)大量瞬時投与量を放出するために可逆性相転移物質を固体から液体に、もしくは固体から半固体に、もしくは半固体から液体に変化させるために、患者の皮膚に冷気を適用し、その冷気が約20℃〜25℃より下である、前記方法。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公表番号】特表2013−500334(P2013−500334A)
【公表日】平成25年1月7日(2013.1.7)
【国際特許分類】
【出願番号】特願2012−522826(P2012−522826)
【出願日】平成22年4月12日(2010.4.12)
【国際出願番号】PCT/US2010/030689
【国際公開番号】WO2011/016881
【国際公開日】平成23年2月10日(2011.2.10)
【出願人】(507020152)メドトロニック,インコーポレイテッド (20)
【Fターム(参考)】
【公表日】平成25年1月7日(2013.1.7)
【国際特許分類】
【出願日】平成22年4月12日(2010.4.12)
【国際出願番号】PCT/US2010/030689
【国際公開番号】WO2011/016881
【国際公開日】平成23年2月10日(2011.2.10)
【出願人】(507020152)メドトロニック,インコーポレイテッド (20)
【Fターム(参考)】
[ Back to top ]

