癌の検出方法
【課題】被検者の負担が少ない、EB1を利用した癌の検出方法を提供すること。
【解決手段】癌の検出方法は、生体から分離された血液サンプル中のEB1を定量することを含み、EB1の高値が癌の存在を示す。
【効果】本発明により、非侵襲的にEB1を定量することを利用した癌の検出方法が初めて提供された。本発明の方法によれば、癌の検出を非侵襲的に行うことができるので、被検者の負担が少なく、複数回の検査も容易であり、疾患のスクリーニング及びモニタリングに好適に利用することができる。
【解決手段】癌の検出方法は、生体から分離された血液サンプル中のEB1を定量することを含み、EB1の高値が癌の存在を示す。
【効果】本発明により、非侵襲的にEB1を定量することを利用した癌の検出方法が初めて提供された。本発明の方法によれば、癌の検出を非侵襲的に行うことができるので、被検者の負担が少なく、複数回の検査も容易であり、疾患のスクリーニング及びモニタリングに好適に利用することができる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、血液サンプルを用いた癌の検出方法に関する。
【背景技術】
【0002】
これまでに癌の検出に利用可能な種々の癌マーカーが知られている。EB1はEnd-binding protein 1又はAPC-binding protein EB1と呼ばれ、腫瘍抑制遺伝子産物APC(adenomatous polyposis coli)に結合するタンパク質として発見された公知のタンパク質である。EB1は、乳癌組織中で高発現していることが知られており(非特許文献1)、また、肝細胞癌の予後を判断するためのマーカーとして利用可能なことも報告されている(特許文献1)。
【0003】
EB1は、細胞骨格や染色体と結合し、細胞内に局在するタンパク質として知られている。このため、EB1の検出には、組織を用いた免疫組織染色が必要であった。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2009-156627
【0005】
【非特許文献1】J Pathol 2010: 361-369, 3 November 2009, Wilei InterScience
【発明の概要】
【発明が解決しようとする課題】
【0006】
公知の方法によりEB1を検出するためには、生検により組織を採取することが必要であり、被検者の負担が大きい。このため、複数回の検査は困難であり、また、疾患のスクリーニング及びモニタリングには不向きである。
【0007】
従って、本発明の目的は、被検者の負担が少ない、EB1を利用した癌の検出方法を提供することである。
【課題を解決するための手段】
【0008】
本願発明者らは、鋭意研究の結果、これまで細胞内に局在すると考えられていたEB1が、血液中にも存在し、かつ、免疫測定で定量可能な量が血液中に存在することを見出し、本発明を完成した。
【0009】
すなわち、本発明は、生体から分離された血液サンプル中のEB1を定量することを含み、EB1の高値が癌の存在を示す、癌の検出方法を提供する。
【発明の効果】
【0010】
本発明により、非侵襲的にEB1を定量することを利用した癌の検出方法が初めて提供された。本発明の方法によれば、癌の検出を非侵襲的に行うことができるので、被検者の負担が少なく、複数回の検査も容易であり、疾患のスクリーニング及びモニタリングに好適に利用することができる。
【図面の簡単な説明】
【0011】
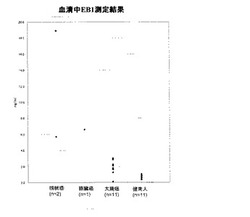
【図1】下記実施例において測定した、各種癌患者及び健常人の血清中のEB1の定量結果を示す図である。
【発明を実施するための形態】
【0012】
上記の通り、EB1は、周知のタンパク質であり、ヒトのEB1のアミノ酸配列は、例えば、GenBank Accession No. U24166に記載されている。そのアミノ酸配列を配列番号1にも示す。なお、EB1のアミノ酸配列は配列番号1に記載のものに限定されるものではなく、SNP等の結果、配列番号1のアミノ酸配列に対して1個〜数個のアミノ酸が置換し、欠失し、挿入され及び/又は付加されたアミノ酸配列を有する、天然に存在するタンパク質も本発明でいうEB1に包含される。
【0013】
本発明の方法では、血液サンプル中のEB1を定量する。血液サンプルとしては、全血、血清及び血漿サンプルを挙げることができ、これらのうち、定量の容易さから血清及び血漿サンプルが好ましい。
【0014】
下記実施例では、サンプルとして、大腸癌、膀胱癌及び膵臓癌患者の血清が用いられているが、EB1は、これらの癌以外にも肝細胞癌、乳癌、胃癌、食道癌等で高値になることが知られているので、本発明の方法は、これらの癌を包含する種々の癌の検出に利用可能である。
【0015】
EB1の定量は、EB1を定量できる方法であれば特に限定されないが、簡便に定量可能である点から、免疫測定が好ましい。免疫測定では、抗EB1抗体が用いられ、好ましくは抗EB1モノクローナル抗体が用いられる。EB1は、その遺伝子の塩基配列が公知であるので、周知の遺伝子工学的手法により生産することができ、これを免疫原として抗EB1抗体を得ることができる。また、抗EB1モノクローナル抗体は、EB1で免疫した動物の脾細胞のような抗体産生細胞と、マウスミエローマ細胞とを融合させてハイブリドーマを作製し、得られたハイブリドーマから抗EB1抗体を産生するハイブリドーマを選択してクローン化し、このハイブリドーマを培養してその培養上清から得ることができる。これらの方法は周知であり、下記実施例にも具体的に記載されている。
【0016】
免疫測定自体も種々のものが周知であり、周知のいずれの免疫測定をも利用することができる。周知の免疫測定法は、反応様式で分類すると、サンドイッチ法、凝集法、競合法等があり、用いる標識で分類すると、酵素免疫測定、蛍光免疫測定、放射免疫測定、等があるが、これらのいずれをも利用することができる。なお、これらのうち、簡便、高感度で危険な放射標識を用いない、酵素免疫測定法の一種であるELISAが好ましいが、これに限定されるものではない。
【0017】
下記実施例に具体的に記載するように、血液中のEB1濃度が健常人に比べて高値であれば、癌が存在する可能性が高い。カットオフ値は、検査の目的に応じ、ルーチンな調査により適切に決定することができるが、下記実施例の結果から、例えば、1.0 ng/mLとすることができる。もっとも、カットオフ値はこれに限定されるものではない。
【0018】
以下、本発明を実施例に基づきより具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【実施例】
【0019】
(1) 抗EB1モノクローナル抗体樹立
ヒト癌細胞よりクローニングしたEB1遺伝子から大腸菌を用いてEB1全長組換えタンパク質を合成した。この操作は具体的に次のようにして行った。
EB1遺伝子(配列番号1)は、ヒト癌細胞SW480から抽出した全RNAを用いて、RT-PCR法により単離した。すなわち、上記全RNAからoligo-dTプライマーによりcDNAを合成し、該cDNAを鋳型として、EB1-Fwd-1 5'-ttctcgagatggcagtgaacgtatac-3' (26 mer)(配列番号2)とEB1-Rev-804 5'-ggctcgagttaatactcttcttgctcctc-3' (30 mer)(配列番号3)をプライマーとして用いてPCRを行ない(94℃−15秒、55℃−30秒、68℃−1分を30サイクル、Pfx platinum DNAポリメラーゼ(インビトロジェン社)及び添付のバッファーを使用)、EB1 cDNAを増幅した。得られたEB1 cDNAにEx Taqを用いてPolyA付加を行い、pGEM-Teasy Vector System(Promega社)を用いてpGEM-Teasyベクター(Promega社)に挿入した。次に、EB1組換えタンパク質を作製するため、EB1遺伝子をN末端にGST配列を持つpWG6Aに組み換え、大腸菌BL21を用いてGST-EB1として組換えタンパク質を作製した。GST-EB1組換えタンパク質はグルタチオンセファロース4B(GEヘルスケア)カラムを用いて、電気泳動による単一のバンド(分子量約50 kDa)が得られるレベルにまで精製した。
【0020】
次に、通常の免疫法でマウスを免疫し、抗EB1モノクローナル抗体を樹立した。この操作は具体的に次のようにして行った。抗EB1モノクローナル抗体は、EB1全長組換えタンパク質をBALB/Cマウスのフットパットに免疫し、所属リンパ節リンパ球とミエローマ細胞を融合することにより作製した。即ち、BALB/Cマウスに対し、フロイント完全アジュバントでエマルジョン化したEB1全長組換えタンパク質を50μg/マウスでフットパットに初回免疫を行い、2週間後、フロイント不完全アジュバントでエマルジョン化したEB1全長組換えタンパク質(50μg/マウス)を追加免疫、2週間後、EB1全長組換えタンパク質(100μg/マウス)のみを追加免疫した。3日後、マウスの脾臓から脾細胞を取り出し、前もってRPMI-1640培地で培養していたマウスミエローマ細胞(P3U1)と脾細胞を1:3の比率で混合し、PEG(ベーリンガー社製)を用い細胞融合を行った。融合した細胞はHAT培地に浮遊した後、96ウェル培養プレートに分注し、37℃のCO2インキュベータで培養した。EB1特異抗体産生細胞のスクリーニングは抗原固相ELISA法にて行った。即ち、EB1全長組換えタンパク質を96ウェル ELISAプレート(ファルコン社製)に1μg/mlの濃度で50μl/ウェル分注し、4℃で一晩放置することにより吸着させた。1%スキムミルク(Difco社製)でブロッキングした後、洗浄緩衝液(0.05% Tween20(商品名)in PBS)で3回洗浄し、細胞融合を行ったプレートの培養上清50μlを加え、37℃で1時間反応させた。同様に、洗浄バッファーで3回洗浄後、POD標識抗マウスイムノグロブリン抗体(DACO社製)を加え、さらに37℃で1時間反応させた。洗浄緩衝液で4回洗浄後、基質ABTS(和光純薬社製)を加え発色の見られるウェルを選択した。この様にして抗EB1抗体産生細胞のウェルを選択した。最終的にEB1-105抗体産生細胞とEB1-126抗体産生細胞を確立し、これらの細胞から産生される抗体をELISA系の構築に用いた。
【0021】
(2) 免疫測定
抗EB1抗体産生細胞株EB1-105由来のモノクローナル抗体を固相に、ビオチン標識したEB1-126由来モノクロナール抗体(「Biotin標識EB1-126」と記載)を標識用いたELISAにより、大腸癌、膀胱癌及び膵臓癌患者並びに健常人の血清中のEB1を免疫測定した。この操作は以下のようにして行った。
【0022】
1)ELISAプレートの準備
NUNC社製ELISAプレート(POLYSORP) にEB1-105抗体を10μg/mlの濃度にPBSで希釈し、100μl/ウェルずつ入れ、4 ℃で一晩放置し吸着させた。次にブロッキング用スキムミルク(5%Skim milk、0.1% Tween20(商品名)、1% NaN3、0.15M NaCl in 0.05M PBS pH 7.4)を200μl/ウェル入れ、37℃で5時間放置しブロッキングを行った。
【0023】
2)標識抗体の準備
Biotin標識EB1-126は標識抗体希釈緩衝液(1% BSA、25μg/ml Mouse IgG(Mab)、0.15M NaCl、0.1% NaN3 in 0.05M Tris-HCl pH 7.4)で1μg/mlに調製し使用した。アルカリフォスファターゼ標識アビジン(DAKO社製)は1% BSA in PBS pH 7.4で2000倍希釈した。
【0024】
3)スタンダードの準備
スタンダードはEB1全長組換えタンパク質を20ng/mlから2n希釈して調製した。
【0025】
4)測定手順
1)で準備したELISAプレートをPBSで3回洗浄後、検体希釈緩衝液(5% CS、1% BSA、25μg/ml Mouse IgG(Mab)、0.15M NaCl、0.1% NaN3 in 0.05M PBS pH 7.4)で5倍希釈した血清、 及びスタンダードを100μlずつ各ウェルに入れ、37℃で1時間反応させた。洗浄緩衝液で3回洗浄後、Biotin標識EB1-126を100μl/ウェル入れ、37℃で1時間反応させた。洗浄緩衝液で充分洗浄し、3.7g/mlの基質PNPP溶液(WAKO社製)を100μl/ウェル入れ室温で2時間放置後、405nmの波長を測定した。
【0026】
5)血清EB1値の算出
スタンダード曲線(通常直線)に測定値を当てはめ血清EB1値を算出した。
【0027】
(3) 結果
結果を図1に示す。図1に示されるように、各癌患者の血清中のEB1濃度は、健常人の血清中のEB1濃度よりも高かった。この結果から、本発明の方法により各種癌の検出が可能であることが明らかになった。
【技術分野】
【0001】
本発明は、血液サンプルを用いた癌の検出方法に関する。
【背景技術】
【0002】
これまでに癌の検出に利用可能な種々の癌マーカーが知られている。EB1はEnd-binding protein 1又はAPC-binding protein EB1と呼ばれ、腫瘍抑制遺伝子産物APC(adenomatous polyposis coli)に結合するタンパク質として発見された公知のタンパク質である。EB1は、乳癌組織中で高発現していることが知られており(非特許文献1)、また、肝細胞癌の予後を判断するためのマーカーとして利用可能なことも報告されている(特許文献1)。
【0003】
EB1は、細胞骨格や染色体と結合し、細胞内に局在するタンパク質として知られている。このため、EB1の検出には、組織を用いた免疫組織染色が必要であった。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2009-156627
【0005】
【非特許文献1】J Pathol 2010: 361-369, 3 November 2009, Wilei InterScience
【発明の概要】
【発明が解決しようとする課題】
【0006】
公知の方法によりEB1を検出するためには、生検により組織を採取することが必要であり、被検者の負担が大きい。このため、複数回の検査は困難であり、また、疾患のスクリーニング及びモニタリングには不向きである。
【0007】
従って、本発明の目的は、被検者の負担が少ない、EB1を利用した癌の検出方法を提供することである。
【課題を解決するための手段】
【0008】
本願発明者らは、鋭意研究の結果、これまで細胞内に局在すると考えられていたEB1が、血液中にも存在し、かつ、免疫測定で定量可能な量が血液中に存在することを見出し、本発明を完成した。
【0009】
すなわち、本発明は、生体から分離された血液サンプル中のEB1を定量することを含み、EB1の高値が癌の存在を示す、癌の検出方法を提供する。
【発明の効果】
【0010】
本発明により、非侵襲的にEB1を定量することを利用した癌の検出方法が初めて提供された。本発明の方法によれば、癌の検出を非侵襲的に行うことができるので、被検者の負担が少なく、複数回の検査も容易であり、疾患のスクリーニング及びモニタリングに好適に利用することができる。
【図面の簡単な説明】
【0011】
【図1】下記実施例において測定した、各種癌患者及び健常人の血清中のEB1の定量結果を示す図である。
【発明を実施するための形態】
【0012】
上記の通り、EB1は、周知のタンパク質であり、ヒトのEB1のアミノ酸配列は、例えば、GenBank Accession No. U24166に記載されている。そのアミノ酸配列を配列番号1にも示す。なお、EB1のアミノ酸配列は配列番号1に記載のものに限定されるものではなく、SNP等の結果、配列番号1のアミノ酸配列に対して1個〜数個のアミノ酸が置換し、欠失し、挿入され及び/又は付加されたアミノ酸配列を有する、天然に存在するタンパク質も本発明でいうEB1に包含される。
【0013】
本発明の方法では、血液サンプル中のEB1を定量する。血液サンプルとしては、全血、血清及び血漿サンプルを挙げることができ、これらのうち、定量の容易さから血清及び血漿サンプルが好ましい。
【0014】
下記実施例では、サンプルとして、大腸癌、膀胱癌及び膵臓癌患者の血清が用いられているが、EB1は、これらの癌以外にも肝細胞癌、乳癌、胃癌、食道癌等で高値になることが知られているので、本発明の方法は、これらの癌を包含する種々の癌の検出に利用可能である。
【0015】
EB1の定量は、EB1を定量できる方法であれば特に限定されないが、簡便に定量可能である点から、免疫測定が好ましい。免疫測定では、抗EB1抗体が用いられ、好ましくは抗EB1モノクローナル抗体が用いられる。EB1は、その遺伝子の塩基配列が公知であるので、周知の遺伝子工学的手法により生産することができ、これを免疫原として抗EB1抗体を得ることができる。また、抗EB1モノクローナル抗体は、EB1で免疫した動物の脾細胞のような抗体産生細胞と、マウスミエローマ細胞とを融合させてハイブリドーマを作製し、得られたハイブリドーマから抗EB1抗体を産生するハイブリドーマを選択してクローン化し、このハイブリドーマを培養してその培養上清から得ることができる。これらの方法は周知であり、下記実施例にも具体的に記載されている。
【0016】
免疫測定自体も種々のものが周知であり、周知のいずれの免疫測定をも利用することができる。周知の免疫測定法は、反応様式で分類すると、サンドイッチ法、凝集法、競合法等があり、用いる標識で分類すると、酵素免疫測定、蛍光免疫測定、放射免疫測定、等があるが、これらのいずれをも利用することができる。なお、これらのうち、簡便、高感度で危険な放射標識を用いない、酵素免疫測定法の一種であるELISAが好ましいが、これに限定されるものではない。
【0017】
下記実施例に具体的に記載するように、血液中のEB1濃度が健常人に比べて高値であれば、癌が存在する可能性が高い。カットオフ値は、検査の目的に応じ、ルーチンな調査により適切に決定することができるが、下記実施例の結果から、例えば、1.0 ng/mLとすることができる。もっとも、カットオフ値はこれに限定されるものではない。
【0018】
以下、本発明を実施例に基づきより具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【実施例】
【0019】
(1) 抗EB1モノクローナル抗体樹立
ヒト癌細胞よりクローニングしたEB1遺伝子から大腸菌を用いてEB1全長組換えタンパク質を合成した。この操作は具体的に次のようにして行った。
EB1遺伝子(配列番号1)は、ヒト癌細胞SW480から抽出した全RNAを用いて、RT-PCR法により単離した。すなわち、上記全RNAからoligo-dTプライマーによりcDNAを合成し、該cDNAを鋳型として、EB1-Fwd-1 5'-ttctcgagatggcagtgaacgtatac-3' (26 mer)(配列番号2)とEB1-Rev-804 5'-ggctcgagttaatactcttcttgctcctc-3' (30 mer)(配列番号3)をプライマーとして用いてPCRを行ない(94℃−15秒、55℃−30秒、68℃−1分を30サイクル、Pfx platinum DNAポリメラーゼ(インビトロジェン社)及び添付のバッファーを使用)、EB1 cDNAを増幅した。得られたEB1 cDNAにEx Taqを用いてPolyA付加を行い、pGEM-Teasy Vector System(Promega社)を用いてpGEM-Teasyベクター(Promega社)に挿入した。次に、EB1組換えタンパク質を作製するため、EB1遺伝子をN末端にGST配列を持つpWG6Aに組み換え、大腸菌BL21を用いてGST-EB1として組換えタンパク質を作製した。GST-EB1組換えタンパク質はグルタチオンセファロース4B(GEヘルスケア)カラムを用いて、電気泳動による単一のバンド(分子量約50 kDa)が得られるレベルにまで精製した。
【0020】
次に、通常の免疫法でマウスを免疫し、抗EB1モノクローナル抗体を樹立した。この操作は具体的に次のようにして行った。抗EB1モノクローナル抗体は、EB1全長組換えタンパク質をBALB/Cマウスのフットパットに免疫し、所属リンパ節リンパ球とミエローマ細胞を融合することにより作製した。即ち、BALB/Cマウスに対し、フロイント完全アジュバントでエマルジョン化したEB1全長組換えタンパク質を50μg/マウスでフットパットに初回免疫を行い、2週間後、フロイント不完全アジュバントでエマルジョン化したEB1全長組換えタンパク質(50μg/マウス)を追加免疫、2週間後、EB1全長組換えタンパク質(100μg/マウス)のみを追加免疫した。3日後、マウスの脾臓から脾細胞を取り出し、前もってRPMI-1640培地で培養していたマウスミエローマ細胞(P3U1)と脾細胞を1:3の比率で混合し、PEG(ベーリンガー社製)を用い細胞融合を行った。融合した細胞はHAT培地に浮遊した後、96ウェル培養プレートに分注し、37℃のCO2インキュベータで培養した。EB1特異抗体産生細胞のスクリーニングは抗原固相ELISA法にて行った。即ち、EB1全長組換えタンパク質を96ウェル ELISAプレート(ファルコン社製)に1μg/mlの濃度で50μl/ウェル分注し、4℃で一晩放置することにより吸着させた。1%スキムミルク(Difco社製)でブロッキングした後、洗浄緩衝液(0.05% Tween20(商品名)in PBS)で3回洗浄し、細胞融合を行ったプレートの培養上清50μlを加え、37℃で1時間反応させた。同様に、洗浄バッファーで3回洗浄後、POD標識抗マウスイムノグロブリン抗体(DACO社製)を加え、さらに37℃で1時間反応させた。洗浄緩衝液で4回洗浄後、基質ABTS(和光純薬社製)を加え発色の見られるウェルを選択した。この様にして抗EB1抗体産生細胞のウェルを選択した。最終的にEB1-105抗体産生細胞とEB1-126抗体産生細胞を確立し、これらの細胞から産生される抗体をELISA系の構築に用いた。
【0021】
(2) 免疫測定
抗EB1抗体産生細胞株EB1-105由来のモノクローナル抗体を固相に、ビオチン標識したEB1-126由来モノクロナール抗体(「Biotin標識EB1-126」と記載)を標識用いたELISAにより、大腸癌、膀胱癌及び膵臓癌患者並びに健常人の血清中のEB1を免疫測定した。この操作は以下のようにして行った。
【0022】
1)ELISAプレートの準備
NUNC社製ELISAプレート(POLYSORP) にEB1-105抗体を10μg/mlの濃度にPBSで希釈し、100μl/ウェルずつ入れ、4 ℃で一晩放置し吸着させた。次にブロッキング用スキムミルク(5%Skim milk、0.1% Tween20(商品名)、1% NaN3、0.15M NaCl in 0.05M PBS pH 7.4)を200μl/ウェル入れ、37℃で5時間放置しブロッキングを行った。
【0023】
2)標識抗体の準備
Biotin標識EB1-126は標識抗体希釈緩衝液(1% BSA、25μg/ml Mouse IgG(Mab)、0.15M NaCl、0.1% NaN3 in 0.05M Tris-HCl pH 7.4)で1μg/mlに調製し使用した。アルカリフォスファターゼ標識アビジン(DAKO社製)は1% BSA in PBS pH 7.4で2000倍希釈した。
【0024】
3)スタンダードの準備
スタンダードはEB1全長組換えタンパク質を20ng/mlから2n希釈して調製した。
【0025】
4)測定手順
1)で準備したELISAプレートをPBSで3回洗浄後、検体希釈緩衝液(5% CS、1% BSA、25μg/ml Mouse IgG(Mab)、0.15M NaCl、0.1% NaN3 in 0.05M PBS pH 7.4)で5倍希釈した血清、 及びスタンダードを100μlずつ各ウェルに入れ、37℃で1時間反応させた。洗浄緩衝液で3回洗浄後、Biotin標識EB1-126を100μl/ウェル入れ、37℃で1時間反応させた。洗浄緩衝液で充分洗浄し、3.7g/mlの基質PNPP溶液(WAKO社製)を100μl/ウェル入れ室温で2時間放置後、405nmの波長を測定した。
【0026】
5)血清EB1値の算出
スタンダード曲線(通常直線)に測定値を当てはめ血清EB1値を算出した。
【0027】
(3) 結果
結果を図1に示す。図1に示されるように、各癌患者の血清中のEB1濃度は、健常人の血清中のEB1濃度よりも高かった。この結果から、本発明の方法により各種癌の検出が可能であることが明らかになった。
【特許請求の範囲】
【請求項1】
生体から分離された血液サンプル中のEB1を定量することを含み、EB1の高値が癌の存在を示す、癌の検出方法。
【請求項2】
前記癌が大腸癌、膀胱癌及び膵臓癌から成る群より選ばれる少なくとも1種である請求項1記載の方法。
【請求項3】
前記血液サンプルが血清又は血漿サンプルである請求項1又は2記載の方法。
【請求項4】
抗EB1抗体を用いた免疫測定によりEB1を定量する請求項1〜3のいずれか1項に記載の方法。
【請求項5】
抗EB1抗体がモノクローナル抗体である請求項4記載の方法。
【請求項6】
免疫測定がELISAである請求項4又は5記載の方法。
【請求項1】
生体から分離された血液サンプル中のEB1を定量することを含み、EB1の高値が癌の存在を示す、癌の検出方法。
【請求項2】
前記癌が大腸癌、膀胱癌及び膵臓癌から成る群より選ばれる少なくとも1種である請求項1記載の方法。
【請求項3】
前記血液サンプルが血清又は血漿サンプルである請求項1又は2記載の方法。
【請求項4】
抗EB1抗体を用いた免疫測定によりEB1を定量する請求項1〜3のいずれか1項に記載の方法。
【請求項5】
抗EB1抗体がモノクローナル抗体である請求項4記載の方法。
【請求項6】
免疫測定がELISAである請求項4又は5記載の方法。
【図1】




【公開番号】特開2012−141175(P2012−141175A)
【公開日】平成24年7月26日(2012.7.26)
【国際特許分類】
【出願番号】特願2010−292664(P2010−292664)
【出願日】平成22年12月28日(2010.12.28)
【出願人】(306008724)富士レビオ株式会社 (55)
【出願人】(510097747)独立行政法人国立がん研究センター (35)
【公開日】平成24年7月26日(2012.7.26)
【国際特許分類】
【出願日】平成22年12月28日(2010.12.28)
【出願人】(306008724)富士レビオ株式会社 (55)
【出願人】(510097747)独立行政法人国立がん研究センター (35)
[ Back to top ]

