癌の診断および治療方法および組成物
癌の発病を阻害し、癌の診断および治療のための方法および組成物が提供される。該治療法は、転写正因子4(PC4)のレベルまたは機能の阻害を含む。また、PC4の発現または機能の阻害に基づいて癌阻害剤をスクリーニングする方法が提供される。
【発明の詳細な説明】
【技術分野】
【0001】
(優先権主張)
本願は、2007年9月7日に提出された米国仮特許出願番号60/970,686の特典を主張する。
【0002】
本発明は、癌の発病阻害、癌診断および治療の方法および組成物に関する。具体的には、本発明は、悪性組織中の転写正補因子4(transcriptional positive cofactor)(PC4)の発現および制御に関する。
【背景技術】
【0003】
ヒトの転写正補因子4(PC4)(p14、p15、Subl相同体等としても知られる)は、N−末端付近にセリンリッチ領域を備えた127アミノ酸残基の一本鎖DNA結合タンパク質である。この補因子はクローニングされ、多くの配列特異的調節因子および細胞特異的調節因子と直接的に相互作用することにより多くの遺伝子の転写活性化を媒介する一般的な正補因子として同定されてきた[ゲ(Ge)およびレーダー(Roeder)、(1994)、クラスII遺伝子の転写活性化を媒介するヒトのコアクチベーターPC4の精製、クローニングおよび特性評価(Purification, cloning and characterization of a human coactivator, PC4, that mediates transcriptional activation of class II genes)。Cell78、513-523;クレッツシュマー(Kretzschmar) M.ら(1994)、ウィルス性即時転写調節因子と相同性を有する新規なクラスII遺伝子転写の媒介物質(A novel mediator of class II gene transcription with homology to viral immediate-early transcriptional regulators)。Cell78、525-534]。PC4によって媒介される調節因子は多数の核ホルモンレセプタ、腫瘍抑制遺伝子、癌タンパク質、ならびにその他、腫瘍形成およびその他のヒトの病気の病因にとって極めて重要な因子を含む。
【0004】
PC4の発現は腫瘍抑制タンパク質p53によって制御されている。p53は、転写レベルでPC4タンパク質自体と相互作用する。加えて、PC4は、細胞周期、アポトーシス、DNA修復、およびその他の細胞反応に関与する多数の遺伝子の転写を制御するp53の唯一のアクチベーターとして機能する[キショア(Kishore) A.H.ら、(2007)、p53は、自身のアクチベーター−転写コアクチベーターPC4を制御している(p53 regulates its own activator-transcriptional coactivator PC4: a new p53 responsive gene)。新p53応答性遺伝子(a new p53 responsive gene)。Biochem.J. BJ20070390;バナージー(Banerjee), Sら(2004)、一般的な転写コアクチベーターPC4はp53の機能を活性化する(General transcriptional coactivator PC4 activates p53 function)。Mol.Cell Bio. 24, 2052-2062]。PC4活性は、少なくともリン酸化およびアセチル化を含む翻訳後修飾によってさらに制御可能である。PC4のリン酸化は、ターゲティングされたアクチベーターと相互作用するという自身の活性を阻害し、自身のコアクチベーター機能を負の方向に制御する。質量分析法により、PC4のインビボの過剰リン酸化が主としてカゼインキナーゼIIによって媒介されN−末端セリンリッチ領域に限定されることが示唆されている[ゲ(Ge), Hら、(1994)、リン酸化がコアクチベーターPC4の機能を負の方向に制御する(Phosphorylation negatively regulates the function of coactivator)。Proc.Natl, Acad.Sci. USA91, 12691-12695]。PC4のアセチル化はp300によって媒介されリン酸化によって阻害される[クモール(Kumor), P.B.R.ら、(2001)、ヒト転写コアクチベーターPC4のp300−媒介アセチル化はリン酸化により阻害される(p300-mediated acetylation of human transcriptional coactivator PC4 is inhibited by phosphorylation)。J.Biol. Chem. 276, 16804-16809]。
【0005】
癌または腫瘍形成に関する調節遺伝子におけるPC4の役割は、これまでのところ明らかにされていない。高度な悪性腫瘍分子診断法が求められている。加えて、高度な腫瘍特異性を備え、かつ正常な細胞および組織に対する毒性が低い安全で効果的な癌阻害剤のみならず、癌阻害剤に関する高度なスクリーニング方法が求められている。
【発明の概要】
【課題を解決するための手段】
【0006】
したがって、本発明の目的の1つは、対象者から適切なサンプルを採集しPC4タンパク質のレベルを測定することにより対象者の腫瘍を診断する方法を提供することである。本発明の一実施態様では、テストサンプル中のPC4レベルがコントロールサンプルと比べて高いことが同定されれば、そのテストサンプルが腫瘍状であることが示される。別の実施態様では、テストサンプル中のPC4のレベルが高ければ、悪性腫瘍であることが示される。本発明の別の実施態様では、対象者の腫瘍を診断する方法は、そのテストサンプル中のDNAトポイソメラーゼIのレベルを測定することと、そのレベルをコントロールサンプル中のDNAトポイソメラーゼIのレベルと比較することを追加的に含む。したがって、テストサンプル中のDNAトポイソメラーゼIのレベルがコントロールサンプルと比べて高ければ、そのテストサンプルが腫瘍状であることが示される。
【0007】
本発明の別の目的は、対象者の腫瘍を診断するための方法を提供することであり、その方法は、テストサンプル中のDNAトポイソメラーゼIのレベルを測定し、そのレベルを、コントロールサンプル中のDNAトポイソメラーゼIのレベルと比較することを含む。したがって、テストサンプル中のDNAトポイソメラーゼIのレベルがコントロールサンプル中のものと比較して高ければ、そのテストサンプルが腫瘍状であることが示される。
【0008】
本発明のさらに別の目的は、対象者のPC4の細胞レベルを低下させるかPC4の機能を阻害することによって癌を治療する、または対象者の癌の発病を阻害する方法を提供することである。本発明の一実施態様では、PC4タンパク質に対し有効量のアンタゴニストを含む製薬組成物を対象者に投与する。所定の実施態様では、PC4タンパク質に対するアンタゴニストは抗PC4抗体、PC4コーディング配列に基づくアンチセンス核酸分子、PC4遺伝子配列に基づくsiRNA分子、あるいは修飾された非機能性PC4ペプチドである。一実施態様では、その修飾された非機能性PC4ペプチドはF77P点突然変異を含む。別の実施態様では、修飾された非機能性PC4ペプチドはリン酸化PC4タンパク質またはそれらの適切なフラグメントもしくは類似体を含む。
【0009】
本発明のさらに別の目的は、癌阻害剤に関するスクリーニング方法を提供することである。本発明の一実施態様では、その方法は(1)適切なレポータ遺伝子に有効に(operatively)結合したPC4遺伝子のプロモータ配列を含む遺伝子構造物を提供し、(2)レポータ遺伝子の発現に適した条件下でその遺伝子構造物と候補化合物を接触させ、レポータ遺伝子の発現を阻害する候補化合物が癌阻害剤であるとすることにより達成される。本発明の別の実施態様では、その方法は(1)PC4依存型転写分析試料を提供し、(2)その分析試料に候補化合物を添加し、PC4転写を減少させる候補化合物が癌阻害剤であるとすることによって達成される。本発明のさらに別の実施態様では、その方法は、(1)PC4−タンパク質相互作用分析試料またはPC4−DNA相互作用分析試料を提供し、(2)その分析試料に候補化合物を添加し、PC4−タンパク質相互作用またはPC4−DNA相互作用を減少させる候補化合物が癌阻害剤であるとすることにより達成される。
【0010】
本発明のさらなる目的は、対象者の癌治療をモニタリングすることである。本発明の一実施態様では、その方法は、治療過程で複数回にわたりサンプルを採集し、そのサンプル中の転写正補因子4(PC4)タンパク質のレベルを測定し、治療過程でのサンプル中の転写補因子4(PC4)タンパク質のレベルを比較して、サンプル中の転写正補因子4(PC4)のレベルが低下すれば癌治療の成功とみなすことにより達成される。本発明の他の実施態様では、それらのサンプルはDNAトポイソメラーゼIタンパク質の発現に関して同時にまたは別個に検査され、それらのレベルが治療時間の経過に従って低下すれば、癌治療が成功している証拠となる。
【0011】
本発明のさらなる目的は、PC−4依存型腫瘍治療用の治療薬剤としての突然変異型PC4タンパク質の使用法を提供することである。
【0012】
本発明のさらに別の目的は、PC4の活性化ドメインに対応する短いペプチドの、癌阻害剤としての使用法を提供することである。
【0013】
本発明のさらに別の目的は、人為的(artificial)活性化ドメインの癌阻害剤としての使用法を提供することである。
【0014】
本発明のさらに別の目的は、PC4タンパク質に関連する試薬の腫瘍細胞への進入を容易にするための転移ドメイン(TLD)の使用法を提供することである。
【0015】
本発明のさらに別の目的は、PC4活性を阻害する化合物をスクリーニングするためのハイスループットシステム(HTS)を提供することである。
【0016】
本発明のさらに別の目的は、癌の治療法または癌の発病を阻害する方法を提供することであり、対象者に対し1種以上の癌阻害剤を投与することをさらに含む。
【0017】
上記およびその他の目的が、本発明において達成される。
【0018】
本発明は、転写補因子PC4の発現を計測する方法およびPC4の機能の発現を減少させる方法を提供することにより、癌発病の阻害、癌の診断および癌治療の分野における主要な制限を克服する。
【0019】
よって、本発明のより重要な特徴については、比較的一般的な観点からこれまで概説してきた。その目的は、以下に続くその詳細がよりよく理解されるということと、本発明の当該技術分野における貢献がよりよく評価されるということである。無論、本発明の追加的な特徴については、以下にさらに記載されることになる。いずれにせよ、これまで述べてきた一般的な記述も以後の詳細な記述も典型的かつ説明的であり、請求されている発明をさらに説明することを意図したものであることは理解されねばならない。
【0020】
この点に関して、本発明の少なくとも1つの実施態様について詳細に説明する前に、本発明が、以下の明細書や図面で詳細に述べられている構造体の詳細および構成要素の配置に限定されるものではないということが理解されねばならない。本発明は他の実施態様にも適用可能であり、様々な方法で実施および実行可能である。また、ここで採用されている語法および用語は説明目的であって、限定を意図したものとみなすべきではないということが理解されねばならない。
【0021】
よって、当業者にとっては、本発明の幾つかの目的を実施する目的で、本開示内容の根拠となる概念が他の構造体、方法、およびシステムの基礎を成すものとして容易に利用され得ることが理解可能であろう。したがって、本発明の意図および請求範囲を逸脱しない限り、同等の構造体も本発明に含まれるということが重要である。
【0022】
添付の図面は、本発明がより理解されやすいように提供されるものであり、本明細書に挿入され本明細書の一部を構成するものであって、本発明の幾つかの実施態様を例示し、明細書の記載と共に、本発明の原理を説明するのに役立つ。
【図面の簡単な説明】
【0023】
【図1A】図1A、1Bおよび1Cは、ヒトPC4の配列情報を提供する。図1Aは、ヒトPC4のcDNA配列とプロモータ領域を示す(ジェンバンクアソシエーション(GenBank Accession)No.NM_006713)。
【図1B】図1A、1Bおよび1Cは、ヒトPC4の配列情報を提供する。図1Bは、ヒトPC4のコーディング領域を示す。
【図1C】図1A、1Bおよび1Cは、ヒトPC4の配列情報を提供する。図1Cは、ヒトPC4のアミノ酸配列を示す。アミノ酸位置77での点突然変異(F:フェニルアラニン;下線)は、PC4ssDNA結合活性を消失させる。
【図2】図2は、PC4のN−末端での突然変異の解析を表しており、塩基性領域およびF77を含む。
【図3】図3A、3Bおよび3Cは、異なる分析試料におけるPC4突然変異の機能的解析を示す。図3Aは、様々な精製組換えPC4タンパク質(野生型WTおよび突然変異種mt)の標準化を示す。図3Bは、PC4のdsDNA結合活性に関する電気泳動移動度シフト分析(EMSA)の結果を示す。図3Cは、PC4によるインビトロの転写分析の結果を示すものであり、pG5HMがPC4依存型転写用鋳型で、pMLD53がPC4独立型鋳型である。
【図4】図4A、4B、4C、4D、4Eおよび4Fは、様々なPC4突然変異種のタンパク質アレイ解析の結果を図示するものである。図4Cは、PC4および突然変異種と転写因子TFIIAとの相互作用を示す。図4Eは、PC4および突然変異種と転写因子Sp1との相互作用を示す。図4Fは、PC4および突然変異種とssDNAとの相互作用を示す。図4Aと4Bは、サンプルのローディング量が等しいことを示しており、図4DはGal4への非特異的結合に関するコントロールである。
【図5】図5A、5Bおよび5Cは、PC4活性とアフリカツメガエル(Xenopus laevis)の変態との相関関係を図示しており、それによると、PC4はステージ56〜58の間に著しく活性化される。ゲルの個々のレーンは、オタマジャクシの発生の様々なステージを表す。図5Aと5Bは、それぞれステージ2〜58と56〜64を検査する別々の実験を表す。「O」は卵母細胞を表し、「E」は胚を表し、PC4−PはPC4のリン酸化(非活性)形態を表す。図5Cは、PC4活性化とアフリカツメガエルの分化との相関関係を示す。甲状腺ホルモンT3とT4、甲状腺ホルモンレセプタTRαとTRβ、およびPC4の効果についてのデータが示されている。
【図6】図6A、6Bおよび6Cは、PC4が細胞核に局在され、HeLa細胞にトランスフェクトされたときに染色体凝縮およびアポトーシスを引き起こすことを示す。図6Aは、コントロール(非トランスフェクト細胞)である。図6Bは、野生型PC4でトランスフェクトされた細胞を表す。図6Cは、PC4のセリンリッチ領域突然変異種でトランスフェクトされた細胞を表す。
【図7】図7A、7Bおよび7Cは、PC4mRNAが形質転換細胞系および乳癌細胞系においては検出可能であるが、初代NIH3T3細胞系および非悪性マウス組織ではそうではないことを示す。図7Aは、RNAサンプルの定量化および同等のローディング量を表す。図7Bは、様々な細胞系における別の転写コアクチベーターであるp52mRNAの発現を示す。図7Cは、様々な細胞系におけるPC4mRNAの発現を示す。
【図8】図8Aと8Bは、PC4のウエスタンブロット解析とトポイソメラーゼIのウエスタンブロット解析の結果を図示するものである。図8Bは、PC4タンパク質が多数のヒト腫瘍組織(T)において検出可能であるが、対応する正常な(N)ヒト組織では検出されないことを示す。図8Aより、PC4の活性化が、各種癌阻害薬について十分に研究されてきた標的であるDNAトポイソメラーゼIの活性化と相関関係があることが分かる。
【図9】図9Aと9Bは、ヒトの肺癌腫におけるPC4の免疫組織化学(IHC)解析を表す。図9Aは、PC4タンパク質が正常なヒトの肺組織においては検出不可能であることを示す。図9Bは、PC4タンパク質が、ヒトの肺癌腫組織の全ての腫瘍細胞に蓄積していることを示す。
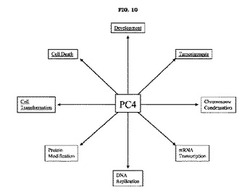
【図10】図10は、PC4の多種多様な機能を図示するものである。これらの機能は全て、癌の病因に関連しているかもしくはその原因となっているため、癌阻害剤の標的として適している。
【図11】図11は、癌阻害剤として使用される可能性のある指定ペプチドのアミノ酸配列を提示するものである。
【発明を実施するための形態】
【0024】
本発明の実施態様について以下に詳細に言及する。それらの例は、添付の図面に図示されている。
【0025】
発明者らは、アフリカツメガエル、哺乳動物細胞系およびヒト組織を含む様々な系を用いて、PC4が癌タンパク質として機能し、細胞分化、発生および腫瘍の病因で重要な役割を果たすという驚くようなことを発見した。具体的に述べるなら、肺癌、膀胱癌、結腸癌、乳癌、子宮体癌、甲状腺癌、および小腸癌を含む数多くの腫瘍組織において、PC4がタンパク質レベルで活性化されることが分かった。対照的に、対応する正常な組織(それ程急激な発生を経験していない)でのPC4タンパク質レベルは活性化されていない。mRNAレベルでのPC4の活性化は、腫瘍細胞系および他の形質転換細胞系で発見されているが、初代細胞系では発見されていない。
【0026】
腫瘍組織におけるPC4の活性化はさらに、DNAトポイソメラーゼIと相関関係にある。DNAトポイソメラーゼIは、DNAを弛緩させる酵素であり、NB−506、J−109,382、DB−67といった各種抗癌剤の標的である[ピルシュ(Pilch), B.ら、(2001)、セリンリッチおよびアルギニンリッチスプライシング因子リン酸化の特異的阻害、スプライソソームアセンブリー、および抗腫瘍薬NB−506によるスプライシング(Specific inhibition of serine- and arginine-rich splicing factors phosphorylation, spliceosome assembly, and splicing by the antitumor drug NB-506)。Cancer Res.61, 6876-6884;チェン(Chen), A.Y.ら、(2005)シラテカンDB−67は新規のDNAトポイソメラーゼI−ターゲッティング放射線感作物質である(Silatecan DB-67 is a novel DNA topoisomerase I-targeted radiation sensitizer)。Mol. Cancer Thera. 4, 317-324]。
【0027】
DNAトポイソメラーゼIのみならずc−myc、p53といった多くの癌遺伝子および腫瘍抑制遺伝子によってエンコーディングされるタンパク質が転写調節因子として機能することも知られており、それらの活性をPC4により高めることも可能である。
【0028】
上記のデータは、PC4が転写コアクチベーターとしての機能に加えて、細胞発生、分化、悪性形質転換、および癌の進行を刺激する癌タンパク質としても機能するという結論と一致する。実際、癌の病因におけるPC4の活性化は、DNAアレイ法を用いた他の研究によって、RNAレベルで発見されている[ダス(Das), C.ら、(2006)クロマチン−結合性タンパク質(chromatin-associated protein)である転写コアクチベーターPC4がクロマチン凝縮を誘起する(Transcripional coactivator PC4, a chromatin- associated protein, induces chromatin condensation)。Mol.Cell.Biol. 26 8303-8315][クレイヴィ(Kleivi), K.ら、(2007)、一次結腸直腸癌腫、肝臓転移、および癌腫症の遺伝子発現プロフィール(Gene expression profiles of primary colorectal carcinomas, liver metastases, and carcinomatoses)。Mol.Cancer.6, 1-16]。
【0029】
本発明は、様々なタイプのヒト腫瘍の腫瘍形成に重要な役割を果たすPC4が癌タンパク質であるという立証(establishment)に基づき、所定の実施態様において、対象者の腫瘍を診断する方法を提供するものであって、その方法は、対象者から適切な組織サンプルまたは液状サンプルが提供され、その中のバイオマーカとしてのPC4タンパク質のレベルを検出することを含む方法であって、コントロールサンプルと比べてPC4のレベルが高ければその検体が腫瘍状であることが示される。この方法がさらに、追加の証拠としてDNAトポイソメラーゼIといった他の関連するバイオマーカのレベルの検出を含んでいてもよい。
【0030】
本発明はさらに、対象者の腫瘍の存在を検出する方法を提供するものであり、その方法は、対象者から適切なサンプルが提供され、その中のバイオマーカとしてのDNAトポイソメラーゼIのレベルを検出するということを含む。その場合、コントロールサンプルと比べてDNAトポイソメラーゼIのレベルが高ければ、その検体が腫瘍状であることが示される。
【0031】
さらに、本発明は細胞PC4レベルを低下させるか、またはその機能を阻害することによって癌を治療する方法および組成物を提供する。所定の実施態様では、本発明は癌の治療法を提供する。その方法は、有効量の適切なPC4アンタゴニストを含む調剤組成物を、それを必要としている患者に投与することを含む。具体的な実施態様では、その治療法は、肺癌、膀胱癌、結腸癌、乳癌、子宮体癌、甲状腺癌、小腸癌、卵巣癌およびその他の悪性腫瘍の治療に用いられる。
【0032】
所定の実施態様では、適切なPC4アンタゴニストを含むその調剤組成物を、ヒト腫瘍の病因を阻害するために予防目的で用いてもよい。
【0033】
所定の実施態様では、本発明による適切な治療法または組成物は、修飾されたPC4ペプチドに基づくものであってもよい。DNAに結合すると同時に他のタンパク質と相互作用する能力を持つことから証明されるように、PC4が多機能タンパク質であることは周知である。修飾された非機能性PC4突然変異体またはそのフラグメントが、細胞中の既存の野生型または非修飾PC4タンパク質に対し負に優性であり得ることが認識されている。あるいは、その修飾された非機能性突然変異体、その類似体またはフラグメントが、野生型または非修飾タンパク質と競合することによって、天然タンパク質の機能を効果的に低下させ得る。例えば、F77P点突然変異種またはその同等物を含むPC4タンパク質またはペプチド(PC4のDNA結合活性を消失させることが知られている)を調剤目的で使用することができる。類似の機能を有するペプチド模倣薬化合物は、動物の免疫系またはタンパク質代謝機構による破壊を回避することができるため、非常に望ましい薬剤となり得る。また、リン酸化PC4は不活性であるため、非リン酸化PC4(活性形態)と競合することにより、治療目的で使用できる。
【0034】
本発明の適切なアンタゴニストは、抗体、アンチセンス核酸分子、および低分子干渉RNA分子を含む。
【0035】
(抗体)
一実施態様では、本発明は、PC4タンパク質またはDNAトポイソメラーゼI(「標的タンパク質」)の生物作用を阻害するための中和抗体を提供する。本発明に適した抗体は、ポリクローナル抗体であってもよい。その抗体がモノクローナル抗体であるのが好ましい。またその抗体がアイソフォーム特異性であってもよい。本発明のモノクローナル抗体またはその結合フラグメントは、Fabフラグメント、F(ab)2フラグメント、Fab’フラグメント、F(ab’)2フラグメント、Fdフラグメント、Fd’フラグメント、またはFvフラグメントであってもよい。ドメイン抗体(dAbs)(ホルト(Holt)ら、2003、バイオテクノロジーのトレンド(Trends in Biotechnology) 21:484-490参照)も、本発明の方法に適している。
【0036】
公知の抗原で抗体を製造する様々な方法が、当業者間で公知である(例えば、ハーローとレーン(Harlow and Lane)、1988、抗体(Antibodies): A laboratory Manual. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NYを参照;また、WO 01/25437を参照)。特に、適切な抗体は、細胞内免疫処理(すなわち、イントラボディ・テクノロジー(intrabody technology))による化学合成、または、好ましくは組換え発現技術によって製造してもよい。抗体製造方法がさらに、当該技術分野で公知のハイブリドーマテクノロジーを含んでいてもよい。
【0037】
本発明によれば、抗体またはその結合フラグメントは、標的タンパク質またはその抗原性フラグメントに特異的に結合可能なものを含み、その抗体がインビボで投与される場合にはその抗体によって認識されるエピトープを含むのが好ましい。抗体は、動物の宿主内で標的タンパク質由来の免疫原化成分での免疫処理によって誘発することが可能であり、あるいは、免疫性細胞のインビトロ免疫処理(感作)によって形成することが可能である。また抗体を、適当な細胞系が適当な抗体エンコーディングDNAで形質転換、トランスフェクト、感染、または形質導入した組換え系において製造することも可能である。あるいは、抗体を、精製した重鎖および軽鎖の生化学的再構成によって構成することもできる。
【0038】
抗体は、ヒト、またはヒト以外の動物、好ましくはマウス、モルモット、ウサギ、ヤギ、ヒツジおよびブタといった哺乳類、またはニワトリのような鳥類由来のものであってもよい。マウスのモノクローナル抗体および抗原結合フラグメントまたは抗原結合フラグメントの一部(portions)が好ましい。加えて、キメラ抗体およびハイブリッド抗体が本発明の範囲に含まれる。キメラ抗体を製造する技術は、例えば、モリソン(Morrison)ら、1984、Proc. Natl. Acad. Sci. USA, 81:6851-6855;ネオベルガー(Neuberger)ら、1984、Nature、312:604-608;および、タナカ(Tanaka)ら、1985、Nature、314:452-454に記載されている。ヒトの治療用としては、ヒト化抗体、またはより好ましくはヒトの抗体が用いられる。
【0039】
さらに、一本鎖抗体も本発明に適している(例えばヒューストン(Huston)、米国特許番号5,476,786および5,132,405;ヒューストンら、1988、Proc. Natl. Acad. Sci. USA, 85:5879-5883;ラドナー(Ladner)ら、米国特許出願4,946,778;バード(Bird)、1988、Science, 242:423-426、およびワード(Ward)ら、1989、Nature, 334:544-546を参照)。一本鎖抗体は、アミノ酸ブリッジを介してFv領域の重鎖および軽鎖免疫グロブリンフラグメントを結合することで形成され、最終的に一本鎖ポリペプチドになる。一価抗体も本発明の範囲に含まれる。
【0040】
抗体の送達用として多くの送達の径路が当業者間で知られている。例えば、抗体を関心部位に送達するのには直接注入が適切であり得る。抗体を膜中に持つリポゾームを使用して、標的遺伝子の発現または機能を阻害する必要のあるエリアにリポゾームを特異的に送達することも可能である。これらのリポゾームを、モノクローナル抗体のみならず上記のような他の治療薬を含むよう製造することも可能である。それらはその後、標的部位で放出されることになる(例えばウルフ(Wolff)ら、1984、Biochem. et Biophys. Acta, 802:259参照)。
【0041】
(アンチセンス核酸分子)
本発明の他の実施態様では、PC4遺伝子またはDNAトポイソメラーゼI遺伝子(「標的遺伝子」)の発現を阻害する目的で、アンチセンスオリゴヌクレオチドを用いることができる。細胞中のアンチセンスRNAの発現、好ましくは恒常的発現は、おそらくは翻訳の妨害またはスプライシングの阻害を通じて遺伝子の発現を阻害することが知られている。この点に関して、スプライシングを伴う干渉では、保存が少ないはずのイントロン配列の使用が可能になるので、結果的に特異性が増大し、ある種の遺伝子生成物の発現は阻害されるが他の種の相同体は阻害されないようになる。
【0042】
「アンチセンス成分」という用語は、DNA配列のみならずRNA配列にも対応しており、アンチセンスRNAが特異的に、mRNAの翻訳が阻害されるようにアンチセンスRNAとmRNAとの間に分子ハイブリダイゼーションを引き起こすように、特定のmRNA分子に対し十分な相補性を有している。そのようなハイブリダイゼーションがインビボ条件下で生じる可能性もある。このアンチセンス分子は標的遺伝子に対して、長さにして18〜30ヌクレオチド程度の十分な相補性を有するものでなければならない。それにより、その作用がスプライシング、転写または翻訳のレベルであるかどうかとは関係なく、アンチセンスRNAが標的遺伝子(またはmRNA)とハイブリダイズすることができ、標的遺伝子発現を阻害することができる。本発明のアンチセンス成分は、コーディング配列、3’もしくは5’非翻訳領域またはその他のイントロン配列を含む標的cDNAの幾つかの部分のいずれか、あるいは標的mRNAにハイブリダイズ可能なものであってもよい。当業者であれば、アンチセンス分子が公知のmRNA配列に基づいて容易に設計可能であることをすぐ理解するであろう。
【0043】
アンチセンスRNAは、レトロウィルスベクターおよびプラスミドを含むベクターを介した形質転換またはトランスフェクションによって細胞まで送達され、ベクター中に、プロモータを含め適切な調節配列を持つアンチセンスRNAをエンコーディングしているDNAが配置されているので、宿主細胞中でアンチセンスRNAの発現が生じる。一実施態様では、アンチセンス方向の標的cDNAフラグメントを含むベクターの安定したトランスフェクションおよび恒常的発現が得られる。あるいは、そのような発現が、組織または発生特異的プロモータの制御下にあってもよい。リポゾームにより送達を達成することもできる。
【0044】
インビボ治療法に関して、現在好ましいとされる方法は、発現ベクター内に構築されたアンチセンスcDNAフラグメントの安定トランスフェクションの代わりに、アンチセンスオリゴヌクレオチドを直接送達することである。サイズとしては長さが15〜30塩基で、コーディング配列、3’もしくは5’非翻訳領域または他のイントロン配列を含む標的cDNAの幾つかの部分のいずれか、あるいは標的mRNAとハイブリダイズ可能な配列を備えるアンチセンスオリゴヌクレオチドが好ましい。ターゲッティング用のアンチセンスオリゴヌクレオチドに関する配列として、最も強力なアンチセンス効果を持つものが選択されることが好ましい。アンチセンスオリゴヌクレオチド配列用の標的部位に影響を及ぼす要因には、オリゴヌクレオチドの長さ、結合親和性、および標的配列の接近可能性(accessibility)が含まれる。配列は、標的タンパク質の翻訳および標的に関連する表現型の阻害(例えば培養中の細胞における細胞増殖の阻害)を計測することによって、そのアンチセンス活性の効力に関してインビトロでスクリーニングされてもよい。通常、RNAのほとんどの領域(5’および3’非翻訳領域、AUG開始、コーディング領域、スプライスジャンクション、およびイントロン)は、アンチセンスオリゴヌクレオチドを用いてターゲッティング可能であることが知られている。
【0045】
好ましい標的アンチセンスオリゴヌクレオチドは、安定性があり、高いヌクレアーゼ耐性を持ち、非毒性の薬量で標的の組織部位への運搬を可能にする適度な薬物動態を備え、原形質膜を透過する(cross through)能力を有するこれらのオリゴヌクレオチドである。
【0046】
ホスホロチオエートアンチセンスオリゴヌクレオチドを用いてもよい。ヘテロ環またはその糖の修飾のみならずホスホジエステル結合の修飾により高い効果が得られる可能性がある。ホスホロチオエートは、ホスホジエステル結合を修飾させるのに用いられる。N3’−P5’アミド亜リン酸エステル結合は、オリゴヌクレオチドをヌクレアーゼに対し安定化させ、RNAとの結合を増加させるものとして記載されてきた。ペプチド核酸(PNA)結合は、リボースおよびホスホジエステルのバックボーンの完全な代替物(replacement)であり、ヌクレアーゼに対し安定であり、RNAへの結合親和性を向上させ、RNaseHによる切断を防ぐ。その塩基構造も、アンチセンス成分としてのその最適化を可能にする修飾の対象となる。ヘテロ環の修飾に関して、所定のヘテロ環の修飾は、RNAseH活性に干渉せずにアンチセンス効果を高めることが証明されている。そのような修飾の一例がC−5チアゾール修飾である。最後に、糖の修飾も考えられる。2’−O−プロピルおよび2’―メトキシエトキシリボース修飾は、細胞培養中およびインビボのヌクレア−ゼに対してオリゴヌクレオチドを安定させる。
【0047】
送達径路は、上記の基準に従って計測した場合に最適なアンチセンス効果をもたらすものになり得る。アンチセンスオリゴヌクレオチドを用いたインビトロ分析およびインビボ分析により、カチオン性リポゾームやレトロウィルスベクターにより媒介される送達および直接送達が有効であることが証明された。それ以外に考えられる送達モードは、標的細胞の細胞表面マーカーに対する抗体を用いてのターゲッティングである。標的またはそのレセプタに対する抗体をこの目的に利用できる。
(低分子干渉RNA分子)
さらなる実施態様では、標的遺伝子の発現が、低分子干渉RNA(siRNA)(RNAi、RNA干渉核酸としても知られている)によって阻害されていてもよい。siRNAは、二本鎖RNA分子で、通常は長さが21n.t.、標的遺伝子に対し相同的であって、標的遺伝子の活性に干渉する。
【0048】
siRNAテクノロジーは、真核細胞に生じ得る配列特異的転写後遺伝子抑制のプロセスに関連する。通常このプロセスは、特定の配列のmRNAの分解を伴うものであり、その分解は、上記の特定の配列と相同形である二本鎖RNA(dsRNA)によって誘発される。例えば、特定の一本鎖mRNA(ssmRNA)の配列に対応する長いdsRNAの発現は、そのメッセージを不安定にし、それによって、対応する遺伝子の発現に「干渉する」。したがって、選択されるいずれの遺伝子も、その遺伝子に関するmRNAの全てまたは本質的な部分に対応するdsRNAを導入することによって抑制され得る。長いdsRNAが発現するとき、それはまずリボヌクレアーゼIIIによって、長さにして塩基ペアが21〜22程度しかない、より短いdsRNAオリゴヌクレオチドになるよう処理される。したがって、比較的短い相同形dsRNAの導入または発現によりsiRNAを生じさせてもよい。実際、比較的短い相同形dsRNAを使用することで、以下に述べるような所定の効果が得られるとも思われる。
【0049】
哺乳動物細胞は、二本鎖RNA(dsRNA)の影響を受ける少なくとも2本の系路を持つ。上記のように、siRNA(配列特異性)系路では、まず開始dsRNAが複数の短い干渉(si)RNAに分解(break)される。siRNAは、各3’末端において2つのヌクレオチドが突出している(overhang)19ヌクレオチド程度のsiRNAを形成する約21個のヌクレオチドのセンス鎖およびアンチセンス鎖を持つ。短い干渉RNAは、特異的メッセンジャーRNAが分解のためターゲッティングされることを可能にする配列情報を提供すると考えられる。対照的に、非特異的系路は、長さにして約30個以上の塩基対であれば、いずれかの配列のdsRNAによって引き起こされる。
【0050】
非特異的効果は、dsRNAが2つの酵素すなわちPKRと2’,5’オリゴアデニル酸シンテターゼを活性化することから生じる。PKRは、活性形態では翻訳開始因子eIF2をリン酸化して、全てのタンパク質合成を遮断する。また、2’,5’オリゴアデニル酸シンテターゼ(2’,5’−AS)は、全てのmRNAをターゲッティングしている非特異的酵素であるRNase Lを活性化する分子を合成する。非特異的系路は、ストレスやウイルス性感染に対する宿主反応を表すこともあり、通常は、非特異的系路の影響が最小限度であるのが好ましい。重要なのは、非特異的系路を誘導するには長めのdsRNAが必要と思われることで、したがって、約30塩基対より短いdsRNAが、RNAiによる遺伝子抑制効果があるとして好まれる(ハンター(Hunter)ら、1975、J. Biol. Chem. 250:409-17;マンシェ(Manche)ら、1992、Mol. Cell. Biol. 12:5239-48;ミンクス(Minks)ら、1979、J. Biol. Chem. 254: 10180-3;およびエルバシール(Elbashir)ら、2001、Nature 411 :494-8参照)。siRNAは、HeLa細胞、NIH/3T3細胞、COS細胞、293細胞およびBHK−21細胞を含む様々なタイプの細胞において遺伝子発現を減少させる有効な手段であることが立証されており、通常は、アンチセンス技術を用いて達成されたものより低いレベルまで遺伝子の発現を減少させ、実際、発現を完全に無くすこともしばしば起こる(バス(Bass)、2001、Nature 411 :428-9を参照)。哺乳動物細胞では、siRNAが、アンチセンス実験で通常用いられる濃度より何桁も低い濃度で効果がある(エルバシールら、2001、Nature 411 :494-8参照)。
【0051】
RNAiを生じるために用いられる二本鎖オリゴヌクレオチドは、長さにして30塩基対未満であるのが好ましく,より好ましくは約25、24、23、22、21、20、19、18または17塩基対のリボ核酸を含む。任意で、dsRNAオリゴヌクレオチドが、3’突出末端を含んでもよい。典型的な2−ヌクレオチド3’突出は、いずれのタイプのリボヌクレオチド残基で構成されていてもよく、2’−デオキシチミジン残基で構成されていてもよい。これによりRNA合成のコストが抑えられ、また、細胞培養の培地およびトランスフェクトされた細胞内のsiRNAのヌクレアーゼ耐性も向上し得る(エルバシール(Elbashi)ら、2001、Nature 411 :494-8参照)。
【0052】
50、75、100または500以上にもなる塩基対のさらに長いdsRNAも、本発明の所定の実施態様で用いられる。RNAiを生じるためのdsRNAの典型的な濃度は、約0.05nM、0.1nM、0.5nM、1.0nM、1.5nM、25nMまたは100nMである。ただし、処理される細胞の性質、遺伝子標的およびその他、当業者にとって容易に認められる要因によっては、それ以外の濃度を用いてもよい。
【0053】
典型的なdsRNAは、化学的に合成してもよく、または適切な発現ベクターを用いてインビトロまたはインビボで製造してもよい。典型的な合成RNAには、当該技術分野で公知の方法を用いて化学的に合成された21個のヌクレオチドRNAが含まれる。合成オリゴヌクレオチドは、当該技術分野で公知の方法を用いて脱保護およびゲル精製されるのが好ましい(例えばエルバシールら、2001、Genes Dev. 15: 188-200を参照)。より長いRNAは、例えば当該技術分野で公知のT7RNAポリメラーゼプロモータのようなプロモータから転写されてもよい。単一RNA標的は、インビトロプロモータの下流で双方の可能な方位に設けられているものであり、標的の両方の鎖を転写して所望の標的配列のdsRNAオリゴヌクレオチドを生成する。上記RNA種はいずれも、標的核酸において表現される核酸配列の部分を含むよう設計されてもよい。
【0054】
オリゴヌクレオチドの設計に利用される特異的な配列は、標的の発現遺伝子メッセージ内に含まれるヌクレオチドのいずれの隣接配列であってもよい。当該技術分野で知られているプログラムとアルゴリズムを適切な標的配列を選択する目的で用いてもよい。それに加え、特定の一本鎖核酸配列の二次構造を予測するよう設計されたプログラムを利用し、またそれらの配列の選択が,折りたたまれたmRNAの露出一本鎖領域で生じやすいようにして、最良の配列を選択してもよい。適切なオリゴヌクレオチドを設計するための方法および組成物が,例えば、米国特許番号No. 6,251,588に記載されており、その内容は参照用としてここに挿入されている。
【0055】
mRNAは通常、リボヌクレオチドの配列中にタンパク質合成を指示する情報を含む直線分子であると考えられているが、ほとんどのmRNAが多数の二次および三次構造を含むことが証明されている。RNA中の二次構造エレメントは、主として同じRNA分子の異なる領域間でのワトソン・クリック型相互作用によって形成される。重要な二次構造エレメントには、分子内二本鎖領域、ヘアピンループ、二重鎖RNAのバルジおよび内部ループが含まれる。三次構造エレメントは、二次構造エレメントが互いに、または一本鎖領域と接触してより複雑な三次元の構造を作ったときに形成される。これまで数多くの研究者らが非常に多くのRNA二重構造の結合エネルギーを計測してきたし、また、RNAの二次構造を予測するのに使用可能な一連の規則を推測してきた(例えば、ジェーガー(Jaeger)ら、1989、Proc. Natl. Acad. Sci. USA 86:7706;およびターナー(Turner)ら、1988、Annu. Rev. Biophys. Biophys. Chem. 17: 167を参照)。それらの規則はRNA構造エレメントの同定,特に、siRNA、リボザイム、またはアンチセンステクノロジーを標的とするmRNAの好ましいセグメントを表し得る一本鎖RNA領域の同定に用いられる。したがって、mRNA標的の好ましいセグメントは、本発明の適切なリボザイムおよびハンマーヘッド型リボザイム(hammerheadribozyme)組成物のみならずsiRNA媒介dsRNAオリゴヌクレオチドの設計についても同定可能である(以下参照)。
【0056】
リポゾーム等の担体組成物を用いた異種標的遺伝子でのトランスフェクションによって、dsRNAオリゴヌクレオチドを細胞に導入してもよい。当該技術分野で知られているリポゾームとしては、例えば接着細胞系のメーカーによって記載されているようなリポフェクタミン(Lipofectamine)2000(ライフ・テクノロジーズ(Life Technologies))が挙げられる。ターゲティング内因性遺伝子についてのdsRNAオリゴヌクレオチドのトランスフェクションを、オリゴフェクタミン(Oligofectamine)(ライフ・テクノロジーズ)を用いて実施してもよい。hGFP−エンコーディングpAD3との同時トランスフェクション後に、哺乳動物細胞用の蛍光顕微鏡を用いてトランスフェクション効率をチェックしてもよい(ケーレンバック(Kehlenback)ら、1988、J. Cell Biol. 141 :863-74参照)。siRNAの有効性については、dsRNA導入後に,数多くの分析のいずれを用いて評価してもよい。それらの分析には、新しいタンパク質合成を抑制した後で内因性貯留(endogenous pool)の代謝回転に十分な時間をかけてから標的遺伝子生成物を認識する抗体を用いるウエスタンブロット解析、逆転写酵素ポリメラーゼ連鎖反応、および、存在する標的mRNAレベルを測定するためのノーザンブロット解析も含まれる。
【0057】
siRNAテクノロジーのさらなる組成物,方法および適用については、米国特許番号6,278,039、5,723,750および5,244,805に記載されており、それらは参照用としてここに挿入されている。
【0058】
さらなる実施態様における本発明は、PC4が癌タンパク質であり阻害用化合物の標的になり得るという上記発見に基づく、癌阻害剤に関するスクリーニング方法を提供するものである。本発明のスクリーニング方法は、例えば、ルシフェラーゼまたは緑色蛍光タンパク質遺伝子といった適切なレポータ遺伝子に結合したPC4プロモータ配列(例えばFIG.1A参照)を用いるプロモータ系スクリーニングである。当業者であれば、ここで例示されている典型的な配列以外にも、PC4遺伝子に対する多くの適切なプロモータ配列またはその他のシス作用転写因子(cis-acting transcriptional factors)が入手可能であり,かつ使用可能であることを理解するであろう。
【0059】
また、本発明のスクリーニング方法は、PC4依存型転写分析[例えば、ゲとレーダーに記載(1994)、クラスII遺伝子の転写活性化を媒介するヒトのコアクチベータ、PC4の精製、クローニングおよび特性評価(Purification, cloning and characterization of a human coactivator, PC4, that mediates transcriptional activation of class II genes)。Cell 78, 513-523参照]、またはタンパク質−タンパク質相互作用分析、またはタンパク質−DNA相互作用分析[例えば、ゲ(Ge), H. (2000) UPA, タンパク質−タンパク質、タンパク質−DNA、タンパク質−RNA、およびタンパク質−リガンド相互作用の定量検出用ユニバーサル・プロテイン・アレイシステム(a universal protein array system for quantitative detection of protein-protein, protein-DNA, protein-RNA and protein-ligand interactions)。Nucleic Acids Res. 28, e3参照]のような、タンパク質活性に基づく分析であってもよい
本発明の診断またはスクリーニング方法は、十分に確立され当業者間公知である、タンパク質または核酸に基づく多くの分析方法に基づくものであってもよい。抗PC4抗体および抗トポイソメラーゼI抗体は、公知であり市販されている。例えば、金のナノ粒子と共役している抗体をバイオアッセイワークス(BioassayWorks)(イジャムスヴィル(Ijamsville)、メリーランド)から入手して、PC4タンパク質またはトポイソメラーゼIのレベルを早急かつ定量的にモニタリングするのに用いることができる。同様に、RT−PCR(逆転写酵素ポリメラーゼ連鎖反応)分析を、RNAレベルでのPC4とトポイソメラーゼIの活性化をモニタリングするのに用いることができる。
【0060】
当業者であれば,本発明の「対象者(subject)」が、腫瘍が生じやすいヒトおよびヒト以外の動物を含むことを理解している。
【0061】
当業者であれば、本発明の「癌治療法」が、化学療法、放射線療法、免疫療法、および、それらの組み合わせを含むことを理解している。
【0062】
本発明の癌阻害剤は、単独で,もしくは、1つまたは複数の公知または非公知の癌阻害剤と組み合わせて、癌を阻害または治療するのに有効な量で、対象者に投与可能である。「有効量」とは、何らかの有害な副作用があっても利点がそれを上回る、対象者に害を及ぼさない量であると理解される。有効な投与量は、年齢、体重、および治療される対象者、投与のモードおよび径路、および、阻害または治療が求められる癌または腫瘍のタイプによって変更され得る。
【0063】
本発明の癌阻害剤の投与量および径路は、余分な実験を行わずとも、全ての基準(特定の種類の薬剤についてリストアップ済みのものを含む)を考慮し、またその対象者についてベストの判断を行使して、当業者が決定することが可能である。
【0064】
さらに、PC4依存型悪性腫瘍の治療用の医薬剤としての突然変異型PC4タンパク質の使用が意図されている。N−末端セリンリッチドメインがPC4の活性にとって非常に重要でありカゼインキナーゼIIリン酸化によって制御されていることは既に報告されている。N−末端領域の欠失によって、そのコアクチベーターの活性が完全に消失した。一連の点突然変異を発生させることによりPC4活性に必要な重要なアミノ酸類を、ここでマッピングおよび開示する。野生型PC4と共に7種の突然変異型PC4タンパク質が発現、精製され、それらの活性が、1)電気泳動移動度シフト分析、2)インビトロ転写分析、および3)タンパク質アレイ分析でテストされた。PC4のDNA結合活性および転写活性を消失させるF77(F77P)での単一アミノ酸変化に加え、N−末端塩基領域での2つの二重突然変異種(K23I/K29AおよびK35I/K41A)ならびに三重突然変異種(R27A/K28I/K29A)もまた、PC4活性を激減させる。よって、PC4突然変異体F77P、K2I/K29A、K35I/K41A、およびR27A/K28I/K29Aは、内因性野生型PC4と競合することによって、癌阻害試薬として用いることができ、PC4依存型悪性腫瘍に対する治療効果が得られた。
【0065】
さらに、PC4の活性化ドメインに対応する短いペプチドの、癌阻害剤としての使用も意図されている。一般的な転写コアクチベーターとして、一般的な転写因子(類)、アクチベーター、および鋳型DNAとの相互作用は全てPC4活性にとって必要である。PC4活性化ドメインアミノ酸16−30(DSDSEVDKKLKRKKQ)および26−40(KRKKQVAPEKPVKKQ)に対応する2つのペプチドが合成され、またPC4に対するそれらの阻害効果が、タンパク質−タンパク質相互作用およびインビトロ転写分析においてPC4とアクチベーターの相互作用と競合させることによりテストされてもよい。
【0066】
また、癌阻害剤としての人為的活性化ドメインの使用も意図されている。PC4の発癌性活性が、全部とはいかなくても大部分の癌遺伝子、成長因子、およびその他の腫瘍形成因子の発現を、それらの特異的なアクチベーターとの相互作用を通じて活性化させる転写コアクチベーターとして機能するため、内因性アクチベーターとPC4の結合活性をブロックすることにより、PC4のアクチベーター活性を消失させることができた。15個のアミノ酸を持つ両親媒性らせん(AH)ペプチドはテストされ、PC4との相互作用が強い活性化ドメインを模倣させる(mimic)ことができた。Gal4DNA結合ドメインとの融合により、PC4依存方式での劇的な転写活性化が生じた。AHペプチド(ELQELQELQALLQQQ)は、合成され、PC4と結合する他の内因性アクチベーターと競合させることによりPC4に対するその阻害効果についてテストされてもよい。
【0067】
また、腫瘍細胞に対するPC4タンパク質関連試薬の進入を容易にするための転移ドメイン(TLD)の使用も意図されている。転移ドメイン(TLD)は、12個のアミノ酸(PLSSIFSRIGDP)で構成された、分子量1288.47(pI=6.27)の短いペプチドである。このペプチドが、B型肝炎ウイルス感染および他のタンパク質の細胞透過性にとって重要であることが報告された(エスおよびヒルト(Oess and Hildt)2000;ステッケルら(Stoeckl et al.)、2006)。タンパク質関連癌阻害剤が核癌タンパク質PC4をターゲティングできるように、TLDは、組換え型モノクローナル抗体、PC4突然変異体タンパク質、PC4活性化ドメインに対応するペプチド、両親媒性らせんペプチドおよびその他、PC4活性を阻害できるタンパク質またはペプチド類と融合させられてもよい。HIVtatタンパク質のTLDといった他のタイプの転移ドメインもテストされ得る。
【0068】
PC4活性を阻害する化合物をスクリーニングするためのハイスループットシステム(HTS)も意図されている。蛍光共鳴エネルギー移動(FRET)テクノロジーは、タンパク質−タンパク質相互作用、タンパク質−DNA相互作用、およびタンパク質立体配座変化といった分子動力学を量化するハイスループットスクリーニング分析において有効なツールであった。ハイスループットFRET分析システムは、96ウェルまたは384ウェルのプレートフォーマットで開発されており、それによれば、蛍光標識された両親媒性らせん(AH)ドメインはエネルギードナーとして作用し、蛍光標識されたPC4タンパク質はエネルギーアクセプターとして作用する。2つの分子の相互作用によりドナーとアクセプターが近接している(1〜10nm)ところで一旦PC4−AH複合体が形成されると、AHドメインからPC4タンパク質への分子間FRETが原因で、PC4の発光(emission)が顕著になる。AHペプチドの励起とPC4発光は、蛍光プレートリーダーによりモニタリングされる。どの化合物の阻害効果も、読取り値の変化をモニタリングすることにより検出できる。これらの化合物は、PC4依存型悪性腫瘍用の潜在的な癌阻害剤候補としてさらに確認され、また開発され得る。2種類の化合物、すなわち1)低分子量合成分子,および2)天然化合物、がスクリーニングされることになろう。
【0069】
低分子量合成分子は、市販および組織体内(in-house)のコレクションを含む。登録済みの搬入化合物を96ウェルまたは384ウェルプレートに保存した後、目録データベースが設定され得る。反応プレートのウェルはそれぞれ、10〜50μlの(384ウェルプレートについては10μl、96ウェルプレートについては50μl)蛍光標識されたPC4およびAHを含む反応混合物中にテスト済みの化合物1mMを含む。プレートはそれぞれ陽性コントロール(10mMの標識されていないAH)のウェルを4つ、および陰性コントロール(蛍光標識されたAHドナーの代わりにH2O)のウェルを4つ含む。その後、OD535での発光が、プレートリーダー(モレキュラー・ダイナミックス(Molecular Dynamics))で計測される。予備の(preliminary)陽性分子について、インビトロタンパク質−タンパク質相互作用分析、転写分析、細胞系分析および、臨床試験前の動物実験を含む別々の分析を用いてさらに確認されてもよい。
【0070】
処方薬の大部分が天然化合物で構成される。市販の抗腫瘍剤および抗感染剤のうち50%を上回る分が、天然の生成物を原料としている。PC4活性を阻害可能な天然分子を同定する目的で、土壌微生物、海洋微生物、植物、およびその他のソースが、HTS PC4−AH FRET分析を用いてスクリーニングされることになり得る。同定された生の原料については、異なる分析システムでさらに精製、特性評価、および確認がなされてもよい。
【0071】
以下の実施例は、本発明を分かりやすくする目的で提示されるものに過ぎず、本発明の範囲を限定する意図で提示されるものではない。
【0072】
(実施例1)
[材料および方法]
<突然変異種生成>
特異的点突然変異種を含む二本鎖オリゴは、異なる点突然変異種を生じるためのバクテリア発現ベクターにおいてPC4の野生型領域に取って代わるものとして商業的に合成され使用されていた。各突然変異構造物は、配列解析によって確認され大腸菌中で発現した。バクテリア発現PC4タンパク質(野生型と突然変異体を含む)は、2段階の精製法、すなわち1)P11ホスホセルロースおよび2)ヘパリンセファロース精製法によって製造される。ブラッドフォード法を用いて精製済みのタンパク質の濃度を計測し、SDS―PAGEを用いてその純度を検査した。
【0073】
<電気泳動移動度シフト分析(EMSA)>
PC4タンパク質のds−DNA結合活性を測定する目的でEMSAが用いられ、このEMSAは、10ngの精製PC4タンパク質およびアデノウィルスの主要後期プロモータ領域(major late promoter region)由来の32P−標識64bpのdsDNAプローブを含む20μlの反応混合物で実施された。4℃で1時間インキュベートした後、反応混合物を8%ポリアクリルアミドゲル上で解析した。移動したPC4−dsDNA複合体を、オートラジオグラフィーを用いて可視化した。
【0074】
<インビトロ転写分析>
TFIIA、TFIIB、TFIID、TFIIF、TFIIHおよびRNAポリメラーゼIIを含む精製済みの一般的な転写因子で、インビトロ転写分析系を再構築した。それらはHeLa細胞または組換えソースから精製されたものである。この系は、PC4中で、アクチベーター依存式の方法で活性化可能である。転写因子に加え、その系はまた、1つのアクチベーター反応性鋳型、塩基性鋳型(アクチベーター独立型)および32P−CTPを含んでいた。30℃で1時間インキュベートした後、新たに合成されたRNAを抽出し、変性ポリアクリルアミドゲル上で解析して、オートラジオグラフィーを用いて可視化した。
【0075】
<タンパク質アレイ分析>
タンパク質アレイ分析は「ユニバーサル・プロテイン・アレイ(Universal Protein Array)方法」またはUPAと呼ばれる方法[ゲ(Ge), H. (2000) UPA, タンパク質−タンパク質、タンパク質−DNA、タンパク質−RNAおよび、タンパク質−リガンドの相互作用の定量測定用ユニバーサル・プロテイン・アレイシステム(a universal protein array system for quantitative detection of protein-protein, protein-DNA, protein-RNA and protein-ligand interactions) Nucleic Acids Res. 28, e3]に基づく。精製されたタンパク質を確認し、標準化を行いさらにニトロセルロースシート上に配列させた。各スポットはサイズにしたがって10〜100ngのタンパク質を含むよう直径1mmで配列された。アレイ上でPC4タンパク質と相互作用した標的のタンパク質は、転写因子TFIIA、Gal4、またはSp1に対する抗体等の特異的抗体によって検出された。タンパク質−DNA相互作用については、プローブDNAが32p−dCTPで標識化され、その結合DNAは、オートラジオグラフィーによってモニタリングされた。
【0076】
<アフリカツメガエル変態中のPC4発現の検査>
オタマジャクシの異なるステージから全タンパク質抽出物を準備し、SDS−PAGEを用いて解析した。タンパク質がニトロセルロース膜にトランスファーされた後、差別的に発現したPC4が、ヒトPC4に対するポリクローナル抗体を用いてウエスタンブロットにより検出され、ECL方法により可視化された。
【0077】
<PC4−トランスフェクトされたHeLa細胞の共焦点顕微鏡観察>
ヒトPC4の野生型(WT)またはセリンリッチ領域突然変異体(ΔS)を、哺乳動物発現ベクターpcDNA3.1にサブクローニングして、HeLaS細胞にトランスフェクトした。トランスフェクションから2日後、共焦点顕微鏡下で検体を観察した。
【0078】
<ノーザンブロット解析>
全ポリARNAを異なる細胞系から単離して、1%アガロースホルムアルデヒドゲル上で分離した。ニトロセルロース膜にトランスファーした後、32P−標識されたPC4cDNAと一緒にその膜をインキュベートすることにより、PC4mRNAを検出した。28Sおよび18SリボゾームのRNAが、EtBr染色によって可視化された。
【0079】
<腫瘍組織におけるPC4発現の検査>
米国国立衛生研究所のヒト組織ネットワークセンター(Center of Human Tissue Network)より、異なるヒト腫瘍組織およびそれらと対を成す正常な組織を入手した。全タンパク質が別々の組織から抽出された。PC4とDNAトポイソメラーゼIの発現レベルをウエスタンブロットにより検出した。この方法では、各組織からの合計50μgの全タンパク質を解析し、それぞれ抗PC4または抗トポIポリクローナル抗体と共にインキュベートした。免疫組織化学(IHC)解析用として、正常なヒト肺組織または肺の癌組織を含むスライドガラスを、国立衛生研究所より入手した。組織のスライドガラスをまずキシレンで2×15分処理してから、エタノールの濃度を5分おきに100%から70%まで減少させながらインキュベートした。95°で5分間処理し、H2OおよびIxPBSでゆすぎ、3%の粉ミルクを含むブロッキング緩衝液でブロッキングした後で、それらのスライドガラスを抗PC4ポリクローナル抗体(ブロッキング緩衝液中で1:1000)と共に、室温で1時間インキュベートした。余分な一次抗体を洗い流した後、スライドガラスを蛍光標識した二次抗体と共に30分間インキュベートした。スライドガラスをゆすいだ後、蛍光顕微鏡下でPC4抗原を検出した。
【0080】
(実施例2)
<DNA結合および転写の際のPC4突然変異の効果>
PC4のN−末端セリンリッチドメインは、PC4活性にとって非常に重要でありカゼインキナーゼIIリン酸化によって制御されることが知られている。実際、N−末端領域を欠失するとPC4コアクチベーターの活性が完全に消失することが知られている。発明者らは、一連の点突然変異種を発生させることによってPC4活性に必要な重要なアミノ酸をマッピングした(図2)。したがって、図2は、野生型PC4(PC4−wt)とPC4の5つの突然変異種を示す。特定の残基位置でのアミノ酸置換を、その突然変異種(すなわちmt)番号下の括弧内に示す。mt5に関しては、アミノ酸フェニルアラニンが、タンパク質−タンパク質またはタンパク質−DNA相互作用を含む分子間相互作用に関与していることが知られている。先のデータより、PC4のssDNA結合領域がアミノ酸残基77の付近に局在することが分かる。野生型PC4と共に7種の突然変異型PC4タンパク質が発現および精製され(図3A)、その活性について、1)電気泳動移動度シフト分析(EMSA、図3B)、2)インビトロ転写分析(図3C)、および3)タンパク質アレイ解析(図4)で検査された。PC4のDNA結合活性と転写活性を消失させるF77(F77P)での単一アミノ酸変化に加え、N−末端塩基領域での2つの二重突然変異種(K23I/K29AとK35I/K41A)および1つの三重突然変異種(R27A/K28I/K29A)も、PC4活性を激減させる。よって、PC4の突然変異体F77P、K2I/K29A、K35I/K41A、およびR27A/K28I/K29Aは、内因性野生型PC4との競合により癌阻害試薬として使用することができ、その結果、PC4依存型悪性腫瘍の治療効果があった。
【0081】
(実施例3)
<PC4をDNAおよびその他の転写因子に結合させる際のPC4突然変異の効果>
図4は、ポジション77でのアミノ酸フェニルアラニンが、PC4のssDNA結合活性にとって決定的であることを示す(図4Fのmt5を参照)。一方、このF77P点突然変異種(すなわちmt5)は、PC4と転写因子TFIIA(図4C参照)およびSp1(図4E参照)との相互作用を増強する。それ以外の突然変異種は、PC4がDNAおよびタンパク質であるSpIやTFIIAと相互作用する能力に対しほとんど、または全く影響しなかった。野生型PC4(wt)と個々の突然変異体(mt)が略同等に存在することが、ポンソーS染色(図4A)および、抗PC4抗体での検出(図4B)によって確認された。Gal4−(l−94)は、Gal4−Sp1融合タンパク質とのPC4の相互作用に対する陰性コントロールとして使用されている(図4E)。
【0082】
(実施例4)
<分化におけるPC4の役割>
図5A、5Bおよび5Cは、PC4活性化がアフリカツメガエルの変態に必要であることを示す。この結果は、オタマジャクシの発生のステージ56〜58の間にPC4が活性化されることを示す。これは、リン酸化PC4(すなわちPC4−P)(PC4の不活性形態)の発現が減少し非リン酸化PC4(すなわちPC4の活性化形態)の発現が増加することから証明される。癌の転移プロセスに類似して、変態には多くの成長因子、転写因子、分化プロセスに関与する核ホルモンレセプタの活性化が必要であるため、これらのデータがPC4と癌との関連性を裏付けるものとなる。アフリカツメガエルの変態は、オタマジャクシから成体への1種類の変化を経る(図5C参照)。数多くのホルモン(甲状腺ホルモンT3およびT4のような)が必要となるだけでなく、数多くの成長因子、核ホルモンレセプタ、および転写因子(甲状腺ホルモンレセプタTRαおよびTRβのような)が、細胞の成長および分化に必要である。PC4は、これらの因子を活性化させる上で重要な役割を果たすと考えられる。
【0083】
(実施例5)
<PC4がHeLa細胞中の染色体凝縮を引き起こす>
図6は、PC4が核内に局在され、HeLa細胞にトランスフェクトされるときに染色体凝縮とアポトーシスを引き起こすことを示す。野生型PC4の細胞へのトランスフェクションにより、HeLa細胞の染色体が凝縮されることが分かる(図6Aのコントロールを図6BのPC4と比較)。PC4のセリンリッチ領域突然変異種によるトランスフェクション(図6C)は、それ自体はもはやカゼインキナーゼIIによってリン酸化することは不可能であるが、染色体凝縮に加えて、核と細胞の形状が変化する(悪性腫瘍細胞に共通の特徴を表している)ことを示す。このデータは、癌が突然変異によって引き起こされ得ること、および突然変異がしばしば動原体領域に起こるという理論を裏付けるものである。これらのデータは、PC4が染色体に結合するのみならず、実際には動原体に結合することを示し、またそれによって、PC4の潜在的なメカニズム(すなわち、PC4は他のDNA修復酵素のDNAとの結合を妨げることにより癌遺伝子として機能する)を示唆する。
【0084】
(実施例6)
<形質転換された細胞系および腫瘍細胞系におけるPC4mRNAの発現>
図7は、PC4mRNAが全ての形質転換細胞系および乳癌細胞系において検出可能であるが、初代NIH3T3細胞系および非悪性マウス組織では検出不可能であることを示す。図7Aは、細胞系mRNAを用いてのノーザンブロットのレーンの略同等のローディング量を表す(18Sおよび28SrRNAについての染色により表示される)。図7Bは、陰性コントロール(ヒトp52mRNA)の結果を示す。図7Cは、PC4cDNAでハイブリダイゼーションがあることによって異なる細胞系においてPC4mRNAが発現することを示す。
【0085】
(実施例7)
<腫瘍組織におけるPC4タンパク質の発現増加>
図8は、多数のヒト腫瘍組織(T)におけるPC4タンパク質がウエスタンブロット解析によって検出可能であるが、それに対応する正常な(N)ヒト組織では検出不可能であることを示す(図8B)。加えて、PC4の活性化は、幾つもの癌阻害薬剤として十分研究された標的であるDNAトポイソメラーゼI(図8A)の活性化と相関関係がある。
【0086】
(実施例8)
<肺腫瘍でのPC4タンパク質の発現>
図9は、PC4タンパク質がヒトの肺癌組織の全ての腫瘍細胞に蓄積する(図9B)が、非悪性の肺組織の正常な細胞には蓄積しない(図9A)ことを示す。
【0087】
これまでに本発明の幾つかの実施態様を記載してきたが、上記の内容が単なる解説であって本発明を限定するものではなく、実施例によって提示されているに過ぎないことは当業者にとっては明らかである。数々の部分的変更およびその他の実施態様もこの分野の技術範囲に含まれ、本発明の範囲およびその同等物に含まれるとされる。本発明の変形は当業者にとって容易に理解可能であろうし、本発明はそれらの代替案を含むとされる。さらに、当業者であれば数多くの変更に容易に思い至るであろうから、本発明を、ここに記載されているような構造および操作に厳密に限定することは望ましくなく、したがって、適切な変更および同等物全てが、本発明の権利範囲に含まれるものとして依拠されることになり得る。
【配列表フリーテキスト】
【0088】
配列番号1 ヒトPC4のcDNA配列
配列番号2 ヒトPC4のコーディング領域
配列番号3 ヒトPC4のアミノ酸配列
配列番号4〜10 癌阻害剤として使用される可能性のある指定ペプチドのアミノ酸配列
【技術分野】
【0001】
(優先権主張)
本願は、2007年9月7日に提出された米国仮特許出願番号60/970,686の特典を主張する。
【0002】
本発明は、癌の発病阻害、癌診断および治療の方法および組成物に関する。具体的には、本発明は、悪性組織中の転写正補因子4(transcriptional positive cofactor)(PC4)の発現および制御に関する。
【背景技術】
【0003】
ヒトの転写正補因子4(PC4)(p14、p15、Subl相同体等としても知られる)は、N−末端付近にセリンリッチ領域を備えた127アミノ酸残基の一本鎖DNA結合タンパク質である。この補因子はクローニングされ、多くの配列特異的調節因子および細胞特異的調節因子と直接的に相互作用することにより多くの遺伝子の転写活性化を媒介する一般的な正補因子として同定されてきた[ゲ(Ge)およびレーダー(Roeder)、(1994)、クラスII遺伝子の転写活性化を媒介するヒトのコアクチベーターPC4の精製、クローニングおよび特性評価(Purification, cloning and characterization of a human coactivator, PC4, that mediates transcriptional activation of class II genes)。Cell78、513-523;クレッツシュマー(Kretzschmar) M.ら(1994)、ウィルス性即時転写調節因子と相同性を有する新規なクラスII遺伝子転写の媒介物質(A novel mediator of class II gene transcription with homology to viral immediate-early transcriptional regulators)。Cell78、525-534]。PC4によって媒介される調節因子は多数の核ホルモンレセプタ、腫瘍抑制遺伝子、癌タンパク質、ならびにその他、腫瘍形成およびその他のヒトの病気の病因にとって極めて重要な因子を含む。
【0004】
PC4の発現は腫瘍抑制タンパク質p53によって制御されている。p53は、転写レベルでPC4タンパク質自体と相互作用する。加えて、PC4は、細胞周期、アポトーシス、DNA修復、およびその他の細胞反応に関与する多数の遺伝子の転写を制御するp53の唯一のアクチベーターとして機能する[キショア(Kishore) A.H.ら、(2007)、p53は、自身のアクチベーター−転写コアクチベーターPC4を制御している(p53 regulates its own activator-transcriptional coactivator PC4: a new p53 responsive gene)。新p53応答性遺伝子(a new p53 responsive gene)。Biochem.J. BJ20070390;バナージー(Banerjee), Sら(2004)、一般的な転写コアクチベーターPC4はp53の機能を活性化する(General transcriptional coactivator PC4 activates p53 function)。Mol.Cell Bio. 24, 2052-2062]。PC4活性は、少なくともリン酸化およびアセチル化を含む翻訳後修飾によってさらに制御可能である。PC4のリン酸化は、ターゲティングされたアクチベーターと相互作用するという自身の活性を阻害し、自身のコアクチベーター機能を負の方向に制御する。質量分析法により、PC4のインビボの過剰リン酸化が主としてカゼインキナーゼIIによって媒介されN−末端セリンリッチ領域に限定されることが示唆されている[ゲ(Ge), Hら、(1994)、リン酸化がコアクチベーターPC4の機能を負の方向に制御する(Phosphorylation negatively regulates the function of coactivator)。Proc.Natl, Acad.Sci. USA91, 12691-12695]。PC4のアセチル化はp300によって媒介されリン酸化によって阻害される[クモール(Kumor), P.B.R.ら、(2001)、ヒト転写コアクチベーターPC4のp300−媒介アセチル化はリン酸化により阻害される(p300-mediated acetylation of human transcriptional coactivator PC4 is inhibited by phosphorylation)。J.Biol. Chem. 276, 16804-16809]。
【0005】
癌または腫瘍形成に関する調節遺伝子におけるPC4の役割は、これまでのところ明らかにされていない。高度な悪性腫瘍分子診断法が求められている。加えて、高度な腫瘍特異性を備え、かつ正常な細胞および組織に対する毒性が低い安全で効果的な癌阻害剤のみならず、癌阻害剤に関する高度なスクリーニング方法が求められている。
【発明の概要】
【課題を解決するための手段】
【0006】
したがって、本発明の目的の1つは、対象者から適切なサンプルを採集しPC4タンパク質のレベルを測定することにより対象者の腫瘍を診断する方法を提供することである。本発明の一実施態様では、テストサンプル中のPC4レベルがコントロールサンプルと比べて高いことが同定されれば、そのテストサンプルが腫瘍状であることが示される。別の実施態様では、テストサンプル中のPC4のレベルが高ければ、悪性腫瘍であることが示される。本発明の別の実施態様では、対象者の腫瘍を診断する方法は、そのテストサンプル中のDNAトポイソメラーゼIのレベルを測定することと、そのレベルをコントロールサンプル中のDNAトポイソメラーゼIのレベルと比較することを追加的に含む。したがって、テストサンプル中のDNAトポイソメラーゼIのレベルがコントロールサンプルと比べて高ければ、そのテストサンプルが腫瘍状であることが示される。
【0007】
本発明の別の目的は、対象者の腫瘍を診断するための方法を提供することであり、その方法は、テストサンプル中のDNAトポイソメラーゼIのレベルを測定し、そのレベルを、コントロールサンプル中のDNAトポイソメラーゼIのレベルと比較することを含む。したがって、テストサンプル中のDNAトポイソメラーゼIのレベルがコントロールサンプル中のものと比較して高ければ、そのテストサンプルが腫瘍状であることが示される。
【0008】
本発明のさらに別の目的は、対象者のPC4の細胞レベルを低下させるかPC4の機能を阻害することによって癌を治療する、または対象者の癌の発病を阻害する方法を提供することである。本発明の一実施態様では、PC4タンパク質に対し有効量のアンタゴニストを含む製薬組成物を対象者に投与する。所定の実施態様では、PC4タンパク質に対するアンタゴニストは抗PC4抗体、PC4コーディング配列に基づくアンチセンス核酸分子、PC4遺伝子配列に基づくsiRNA分子、あるいは修飾された非機能性PC4ペプチドである。一実施態様では、その修飾された非機能性PC4ペプチドはF77P点突然変異を含む。別の実施態様では、修飾された非機能性PC4ペプチドはリン酸化PC4タンパク質またはそれらの適切なフラグメントもしくは類似体を含む。
【0009】
本発明のさらに別の目的は、癌阻害剤に関するスクリーニング方法を提供することである。本発明の一実施態様では、その方法は(1)適切なレポータ遺伝子に有効に(operatively)結合したPC4遺伝子のプロモータ配列を含む遺伝子構造物を提供し、(2)レポータ遺伝子の発現に適した条件下でその遺伝子構造物と候補化合物を接触させ、レポータ遺伝子の発現を阻害する候補化合物が癌阻害剤であるとすることにより達成される。本発明の別の実施態様では、その方法は(1)PC4依存型転写分析試料を提供し、(2)その分析試料に候補化合物を添加し、PC4転写を減少させる候補化合物が癌阻害剤であるとすることによって達成される。本発明のさらに別の実施態様では、その方法は、(1)PC4−タンパク質相互作用分析試料またはPC4−DNA相互作用分析試料を提供し、(2)その分析試料に候補化合物を添加し、PC4−タンパク質相互作用またはPC4−DNA相互作用を減少させる候補化合物が癌阻害剤であるとすることにより達成される。
【0010】
本発明のさらなる目的は、対象者の癌治療をモニタリングすることである。本発明の一実施態様では、その方法は、治療過程で複数回にわたりサンプルを採集し、そのサンプル中の転写正補因子4(PC4)タンパク質のレベルを測定し、治療過程でのサンプル中の転写補因子4(PC4)タンパク質のレベルを比較して、サンプル中の転写正補因子4(PC4)のレベルが低下すれば癌治療の成功とみなすことにより達成される。本発明の他の実施態様では、それらのサンプルはDNAトポイソメラーゼIタンパク質の発現に関して同時にまたは別個に検査され、それらのレベルが治療時間の経過に従って低下すれば、癌治療が成功している証拠となる。
【0011】
本発明のさらなる目的は、PC−4依存型腫瘍治療用の治療薬剤としての突然変異型PC4タンパク質の使用法を提供することである。
【0012】
本発明のさらに別の目的は、PC4の活性化ドメインに対応する短いペプチドの、癌阻害剤としての使用法を提供することである。
【0013】
本発明のさらに別の目的は、人為的(artificial)活性化ドメインの癌阻害剤としての使用法を提供することである。
【0014】
本発明のさらに別の目的は、PC4タンパク質に関連する試薬の腫瘍細胞への進入を容易にするための転移ドメイン(TLD)の使用法を提供することである。
【0015】
本発明のさらに別の目的は、PC4活性を阻害する化合物をスクリーニングするためのハイスループットシステム(HTS)を提供することである。
【0016】
本発明のさらに別の目的は、癌の治療法または癌の発病を阻害する方法を提供することであり、対象者に対し1種以上の癌阻害剤を投与することをさらに含む。
【0017】
上記およびその他の目的が、本発明において達成される。
【0018】
本発明は、転写補因子PC4の発現を計測する方法およびPC4の機能の発現を減少させる方法を提供することにより、癌発病の阻害、癌の診断および癌治療の分野における主要な制限を克服する。
【0019】
よって、本発明のより重要な特徴については、比較的一般的な観点からこれまで概説してきた。その目的は、以下に続くその詳細がよりよく理解されるということと、本発明の当該技術分野における貢献がよりよく評価されるということである。無論、本発明の追加的な特徴については、以下にさらに記載されることになる。いずれにせよ、これまで述べてきた一般的な記述も以後の詳細な記述も典型的かつ説明的であり、請求されている発明をさらに説明することを意図したものであることは理解されねばならない。
【0020】
この点に関して、本発明の少なくとも1つの実施態様について詳細に説明する前に、本発明が、以下の明細書や図面で詳細に述べられている構造体の詳細および構成要素の配置に限定されるものではないということが理解されねばならない。本発明は他の実施態様にも適用可能であり、様々な方法で実施および実行可能である。また、ここで採用されている語法および用語は説明目的であって、限定を意図したものとみなすべきではないということが理解されねばならない。
【0021】
よって、当業者にとっては、本発明の幾つかの目的を実施する目的で、本開示内容の根拠となる概念が他の構造体、方法、およびシステムの基礎を成すものとして容易に利用され得ることが理解可能であろう。したがって、本発明の意図および請求範囲を逸脱しない限り、同等の構造体も本発明に含まれるということが重要である。
【0022】
添付の図面は、本発明がより理解されやすいように提供されるものであり、本明細書に挿入され本明細書の一部を構成するものであって、本発明の幾つかの実施態様を例示し、明細書の記載と共に、本発明の原理を説明するのに役立つ。
【図面の簡単な説明】
【0023】
【図1A】図1A、1Bおよび1Cは、ヒトPC4の配列情報を提供する。図1Aは、ヒトPC4のcDNA配列とプロモータ領域を示す(ジェンバンクアソシエーション(GenBank Accession)No.NM_006713)。
【図1B】図1A、1Bおよび1Cは、ヒトPC4の配列情報を提供する。図1Bは、ヒトPC4のコーディング領域を示す。
【図1C】図1A、1Bおよび1Cは、ヒトPC4の配列情報を提供する。図1Cは、ヒトPC4のアミノ酸配列を示す。アミノ酸位置77での点突然変異(F:フェニルアラニン;下線)は、PC4ssDNA結合活性を消失させる。
【図2】図2は、PC4のN−末端での突然変異の解析を表しており、塩基性領域およびF77を含む。
【図3】図3A、3Bおよび3Cは、異なる分析試料におけるPC4突然変異の機能的解析を示す。図3Aは、様々な精製組換えPC4タンパク質(野生型WTおよび突然変異種mt)の標準化を示す。図3Bは、PC4のdsDNA結合活性に関する電気泳動移動度シフト分析(EMSA)の結果を示す。図3Cは、PC4によるインビトロの転写分析の結果を示すものであり、pG5HMがPC4依存型転写用鋳型で、pMLD53がPC4独立型鋳型である。
【図4】図4A、4B、4C、4D、4Eおよび4Fは、様々なPC4突然変異種のタンパク質アレイ解析の結果を図示するものである。図4Cは、PC4および突然変異種と転写因子TFIIAとの相互作用を示す。図4Eは、PC4および突然変異種と転写因子Sp1との相互作用を示す。図4Fは、PC4および突然変異種とssDNAとの相互作用を示す。図4Aと4Bは、サンプルのローディング量が等しいことを示しており、図4DはGal4への非特異的結合に関するコントロールである。
【図5】図5A、5Bおよび5Cは、PC4活性とアフリカツメガエル(Xenopus laevis)の変態との相関関係を図示しており、それによると、PC4はステージ56〜58の間に著しく活性化される。ゲルの個々のレーンは、オタマジャクシの発生の様々なステージを表す。図5Aと5Bは、それぞれステージ2〜58と56〜64を検査する別々の実験を表す。「O」は卵母細胞を表し、「E」は胚を表し、PC4−PはPC4のリン酸化(非活性)形態を表す。図5Cは、PC4活性化とアフリカツメガエルの分化との相関関係を示す。甲状腺ホルモンT3とT4、甲状腺ホルモンレセプタTRαとTRβ、およびPC4の効果についてのデータが示されている。
【図6】図6A、6Bおよび6Cは、PC4が細胞核に局在され、HeLa細胞にトランスフェクトされたときに染色体凝縮およびアポトーシスを引き起こすことを示す。図6Aは、コントロール(非トランスフェクト細胞)である。図6Bは、野生型PC4でトランスフェクトされた細胞を表す。図6Cは、PC4のセリンリッチ領域突然変異種でトランスフェクトされた細胞を表す。
【図7】図7A、7Bおよび7Cは、PC4mRNAが形質転換細胞系および乳癌細胞系においては検出可能であるが、初代NIH3T3細胞系および非悪性マウス組織ではそうではないことを示す。図7Aは、RNAサンプルの定量化および同等のローディング量を表す。図7Bは、様々な細胞系における別の転写コアクチベーターであるp52mRNAの発現を示す。図7Cは、様々な細胞系におけるPC4mRNAの発現を示す。
【図8】図8Aと8Bは、PC4のウエスタンブロット解析とトポイソメラーゼIのウエスタンブロット解析の結果を図示するものである。図8Bは、PC4タンパク質が多数のヒト腫瘍組織(T)において検出可能であるが、対応する正常な(N)ヒト組織では検出されないことを示す。図8Aより、PC4の活性化が、各種癌阻害薬について十分に研究されてきた標的であるDNAトポイソメラーゼIの活性化と相関関係があることが分かる。
【図9】図9Aと9Bは、ヒトの肺癌腫におけるPC4の免疫組織化学(IHC)解析を表す。図9Aは、PC4タンパク質が正常なヒトの肺組織においては検出不可能であることを示す。図9Bは、PC4タンパク質が、ヒトの肺癌腫組織の全ての腫瘍細胞に蓄積していることを示す。
【図10】図10は、PC4の多種多様な機能を図示するものである。これらの機能は全て、癌の病因に関連しているかもしくはその原因となっているため、癌阻害剤の標的として適している。
【図11】図11は、癌阻害剤として使用される可能性のある指定ペプチドのアミノ酸配列を提示するものである。
【発明を実施するための形態】
【0024】
本発明の実施態様について以下に詳細に言及する。それらの例は、添付の図面に図示されている。
【0025】
発明者らは、アフリカツメガエル、哺乳動物細胞系およびヒト組織を含む様々な系を用いて、PC4が癌タンパク質として機能し、細胞分化、発生および腫瘍の病因で重要な役割を果たすという驚くようなことを発見した。具体的に述べるなら、肺癌、膀胱癌、結腸癌、乳癌、子宮体癌、甲状腺癌、および小腸癌を含む数多くの腫瘍組織において、PC4がタンパク質レベルで活性化されることが分かった。対照的に、対応する正常な組織(それ程急激な発生を経験していない)でのPC4タンパク質レベルは活性化されていない。mRNAレベルでのPC4の活性化は、腫瘍細胞系および他の形質転換細胞系で発見されているが、初代細胞系では発見されていない。
【0026】
腫瘍組織におけるPC4の活性化はさらに、DNAトポイソメラーゼIと相関関係にある。DNAトポイソメラーゼIは、DNAを弛緩させる酵素であり、NB−506、J−109,382、DB−67といった各種抗癌剤の標的である[ピルシュ(Pilch), B.ら、(2001)、セリンリッチおよびアルギニンリッチスプライシング因子リン酸化の特異的阻害、スプライソソームアセンブリー、および抗腫瘍薬NB−506によるスプライシング(Specific inhibition of serine- and arginine-rich splicing factors phosphorylation, spliceosome assembly, and splicing by the antitumor drug NB-506)。Cancer Res.61, 6876-6884;チェン(Chen), A.Y.ら、(2005)シラテカンDB−67は新規のDNAトポイソメラーゼI−ターゲッティング放射線感作物質である(Silatecan DB-67 is a novel DNA topoisomerase I-targeted radiation sensitizer)。Mol. Cancer Thera. 4, 317-324]。
【0027】
DNAトポイソメラーゼIのみならずc−myc、p53といった多くの癌遺伝子および腫瘍抑制遺伝子によってエンコーディングされるタンパク質が転写調節因子として機能することも知られており、それらの活性をPC4により高めることも可能である。
【0028】
上記のデータは、PC4が転写コアクチベーターとしての機能に加えて、細胞発生、分化、悪性形質転換、および癌の進行を刺激する癌タンパク質としても機能するという結論と一致する。実際、癌の病因におけるPC4の活性化は、DNAアレイ法を用いた他の研究によって、RNAレベルで発見されている[ダス(Das), C.ら、(2006)クロマチン−結合性タンパク質(chromatin-associated protein)である転写コアクチベーターPC4がクロマチン凝縮を誘起する(Transcripional coactivator PC4, a chromatin- associated protein, induces chromatin condensation)。Mol.Cell.Biol. 26 8303-8315][クレイヴィ(Kleivi), K.ら、(2007)、一次結腸直腸癌腫、肝臓転移、および癌腫症の遺伝子発現プロフィール(Gene expression profiles of primary colorectal carcinomas, liver metastases, and carcinomatoses)。Mol.Cancer.6, 1-16]。
【0029】
本発明は、様々なタイプのヒト腫瘍の腫瘍形成に重要な役割を果たすPC4が癌タンパク質であるという立証(establishment)に基づき、所定の実施態様において、対象者の腫瘍を診断する方法を提供するものであって、その方法は、対象者から適切な組織サンプルまたは液状サンプルが提供され、その中のバイオマーカとしてのPC4タンパク質のレベルを検出することを含む方法であって、コントロールサンプルと比べてPC4のレベルが高ければその検体が腫瘍状であることが示される。この方法がさらに、追加の証拠としてDNAトポイソメラーゼIといった他の関連するバイオマーカのレベルの検出を含んでいてもよい。
【0030】
本発明はさらに、対象者の腫瘍の存在を検出する方法を提供するものであり、その方法は、対象者から適切なサンプルが提供され、その中のバイオマーカとしてのDNAトポイソメラーゼIのレベルを検出するということを含む。その場合、コントロールサンプルと比べてDNAトポイソメラーゼIのレベルが高ければ、その検体が腫瘍状であることが示される。
【0031】
さらに、本発明は細胞PC4レベルを低下させるか、またはその機能を阻害することによって癌を治療する方法および組成物を提供する。所定の実施態様では、本発明は癌の治療法を提供する。その方法は、有効量の適切なPC4アンタゴニストを含む調剤組成物を、それを必要としている患者に投与することを含む。具体的な実施態様では、その治療法は、肺癌、膀胱癌、結腸癌、乳癌、子宮体癌、甲状腺癌、小腸癌、卵巣癌およびその他の悪性腫瘍の治療に用いられる。
【0032】
所定の実施態様では、適切なPC4アンタゴニストを含むその調剤組成物を、ヒト腫瘍の病因を阻害するために予防目的で用いてもよい。
【0033】
所定の実施態様では、本発明による適切な治療法または組成物は、修飾されたPC4ペプチドに基づくものであってもよい。DNAに結合すると同時に他のタンパク質と相互作用する能力を持つことから証明されるように、PC4が多機能タンパク質であることは周知である。修飾された非機能性PC4突然変異体またはそのフラグメントが、細胞中の既存の野生型または非修飾PC4タンパク質に対し負に優性であり得ることが認識されている。あるいは、その修飾された非機能性突然変異体、その類似体またはフラグメントが、野生型または非修飾タンパク質と競合することによって、天然タンパク質の機能を効果的に低下させ得る。例えば、F77P点突然変異種またはその同等物を含むPC4タンパク質またはペプチド(PC4のDNA結合活性を消失させることが知られている)を調剤目的で使用することができる。類似の機能を有するペプチド模倣薬化合物は、動物の免疫系またはタンパク質代謝機構による破壊を回避することができるため、非常に望ましい薬剤となり得る。また、リン酸化PC4は不活性であるため、非リン酸化PC4(活性形態)と競合することにより、治療目的で使用できる。
【0034】
本発明の適切なアンタゴニストは、抗体、アンチセンス核酸分子、および低分子干渉RNA分子を含む。
【0035】
(抗体)
一実施態様では、本発明は、PC4タンパク質またはDNAトポイソメラーゼI(「標的タンパク質」)の生物作用を阻害するための中和抗体を提供する。本発明に適した抗体は、ポリクローナル抗体であってもよい。その抗体がモノクローナル抗体であるのが好ましい。またその抗体がアイソフォーム特異性であってもよい。本発明のモノクローナル抗体またはその結合フラグメントは、Fabフラグメント、F(ab)2フラグメント、Fab’フラグメント、F(ab’)2フラグメント、Fdフラグメント、Fd’フラグメント、またはFvフラグメントであってもよい。ドメイン抗体(dAbs)(ホルト(Holt)ら、2003、バイオテクノロジーのトレンド(Trends in Biotechnology) 21:484-490参照)も、本発明の方法に適している。
【0036】
公知の抗原で抗体を製造する様々な方法が、当業者間で公知である(例えば、ハーローとレーン(Harlow and Lane)、1988、抗体(Antibodies): A laboratory Manual. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NYを参照;また、WO 01/25437を参照)。特に、適切な抗体は、細胞内免疫処理(すなわち、イントラボディ・テクノロジー(intrabody technology))による化学合成、または、好ましくは組換え発現技術によって製造してもよい。抗体製造方法がさらに、当該技術分野で公知のハイブリドーマテクノロジーを含んでいてもよい。
【0037】
本発明によれば、抗体またはその結合フラグメントは、標的タンパク質またはその抗原性フラグメントに特異的に結合可能なものを含み、その抗体がインビボで投与される場合にはその抗体によって認識されるエピトープを含むのが好ましい。抗体は、動物の宿主内で標的タンパク質由来の免疫原化成分での免疫処理によって誘発することが可能であり、あるいは、免疫性細胞のインビトロ免疫処理(感作)によって形成することが可能である。また抗体を、適当な細胞系が適当な抗体エンコーディングDNAで形質転換、トランスフェクト、感染、または形質導入した組換え系において製造することも可能である。あるいは、抗体を、精製した重鎖および軽鎖の生化学的再構成によって構成することもできる。
【0038】
抗体は、ヒト、またはヒト以外の動物、好ましくはマウス、モルモット、ウサギ、ヤギ、ヒツジおよびブタといった哺乳類、またはニワトリのような鳥類由来のものであってもよい。マウスのモノクローナル抗体および抗原結合フラグメントまたは抗原結合フラグメントの一部(portions)が好ましい。加えて、キメラ抗体およびハイブリッド抗体が本発明の範囲に含まれる。キメラ抗体を製造する技術は、例えば、モリソン(Morrison)ら、1984、Proc. Natl. Acad. Sci. USA, 81:6851-6855;ネオベルガー(Neuberger)ら、1984、Nature、312:604-608;および、タナカ(Tanaka)ら、1985、Nature、314:452-454に記載されている。ヒトの治療用としては、ヒト化抗体、またはより好ましくはヒトの抗体が用いられる。
【0039】
さらに、一本鎖抗体も本発明に適している(例えばヒューストン(Huston)、米国特許番号5,476,786および5,132,405;ヒューストンら、1988、Proc. Natl. Acad. Sci. USA, 85:5879-5883;ラドナー(Ladner)ら、米国特許出願4,946,778;バード(Bird)、1988、Science, 242:423-426、およびワード(Ward)ら、1989、Nature, 334:544-546を参照)。一本鎖抗体は、アミノ酸ブリッジを介してFv領域の重鎖および軽鎖免疫グロブリンフラグメントを結合することで形成され、最終的に一本鎖ポリペプチドになる。一価抗体も本発明の範囲に含まれる。
【0040】
抗体の送達用として多くの送達の径路が当業者間で知られている。例えば、抗体を関心部位に送達するのには直接注入が適切であり得る。抗体を膜中に持つリポゾームを使用して、標的遺伝子の発現または機能を阻害する必要のあるエリアにリポゾームを特異的に送達することも可能である。これらのリポゾームを、モノクローナル抗体のみならず上記のような他の治療薬を含むよう製造することも可能である。それらはその後、標的部位で放出されることになる(例えばウルフ(Wolff)ら、1984、Biochem. et Biophys. Acta, 802:259参照)。
【0041】
(アンチセンス核酸分子)
本発明の他の実施態様では、PC4遺伝子またはDNAトポイソメラーゼI遺伝子(「標的遺伝子」)の発現を阻害する目的で、アンチセンスオリゴヌクレオチドを用いることができる。細胞中のアンチセンスRNAの発現、好ましくは恒常的発現は、おそらくは翻訳の妨害またはスプライシングの阻害を通じて遺伝子の発現を阻害することが知られている。この点に関して、スプライシングを伴う干渉では、保存が少ないはずのイントロン配列の使用が可能になるので、結果的に特異性が増大し、ある種の遺伝子生成物の発現は阻害されるが他の種の相同体は阻害されないようになる。
【0042】
「アンチセンス成分」という用語は、DNA配列のみならずRNA配列にも対応しており、アンチセンスRNAが特異的に、mRNAの翻訳が阻害されるようにアンチセンスRNAとmRNAとの間に分子ハイブリダイゼーションを引き起こすように、特定のmRNA分子に対し十分な相補性を有している。そのようなハイブリダイゼーションがインビボ条件下で生じる可能性もある。このアンチセンス分子は標的遺伝子に対して、長さにして18〜30ヌクレオチド程度の十分な相補性を有するものでなければならない。それにより、その作用がスプライシング、転写または翻訳のレベルであるかどうかとは関係なく、アンチセンスRNAが標的遺伝子(またはmRNA)とハイブリダイズすることができ、標的遺伝子発現を阻害することができる。本発明のアンチセンス成分は、コーディング配列、3’もしくは5’非翻訳領域またはその他のイントロン配列を含む標的cDNAの幾つかの部分のいずれか、あるいは標的mRNAにハイブリダイズ可能なものであってもよい。当業者であれば、アンチセンス分子が公知のmRNA配列に基づいて容易に設計可能であることをすぐ理解するであろう。
【0043】
アンチセンスRNAは、レトロウィルスベクターおよびプラスミドを含むベクターを介した形質転換またはトランスフェクションによって細胞まで送達され、ベクター中に、プロモータを含め適切な調節配列を持つアンチセンスRNAをエンコーディングしているDNAが配置されているので、宿主細胞中でアンチセンスRNAの発現が生じる。一実施態様では、アンチセンス方向の標的cDNAフラグメントを含むベクターの安定したトランスフェクションおよび恒常的発現が得られる。あるいは、そのような発現が、組織または発生特異的プロモータの制御下にあってもよい。リポゾームにより送達を達成することもできる。
【0044】
インビボ治療法に関して、現在好ましいとされる方法は、発現ベクター内に構築されたアンチセンスcDNAフラグメントの安定トランスフェクションの代わりに、アンチセンスオリゴヌクレオチドを直接送達することである。サイズとしては長さが15〜30塩基で、コーディング配列、3’もしくは5’非翻訳領域または他のイントロン配列を含む標的cDNAの幾つかの部分のいずれか、あるいは標的mRNAとハイブリダイズ可能な配列を備えるアンチセンスオリゴヌクレオチドが好ましい。ターゲッティング用のアンチセンスオリゴヌクレオチドに関する配列として、最も強力なアンチセンス効果を持つものが選択されることが好ましい。アンチセンスオリゴヌクレオチド配列用の標的部位に影響を及ぼす要因には、オリゴヌクレオチドの長さ、結合親和性、および標的配列の接近可能性(accessibility)が含まれる。配列は、標的タンパク質の翻訳および標的に関連する表現型の阻害(例えば培養中の細胞における細胞増殖の阻害)を計測することによって、そのアンチセンス活性の効力に関してインビトロでスクリーニングされてもよい。通常、RNAのほとんどの領域(5’および3’非翻訳領域、AUG開始、コーディング領域、スプライスジャンクション、およびイントロン)は、アンチセンスオリゴヌクレオチドを用いてターゲッティング可能であることが知られている。
【0045】
好ましい標的アンチセンスオリゴヌクレオチドは、安定性があり、高いヌクレアーゼ耐性を持ち、非毒性の薬量で標的の組織部位への運搬を可能にする適度な薬物動態を備え、原形質膜を透過する(cross through)能力を有するこれらのオリゴヌクレオチドである。
【0046】
ホスホロチオエートアンチセンスオリゴヌクレオチドを用いてもよい。ヘテロ環またはその糖の修飾のみならずホスホジエステル結合の修飾により高い効果が得られる可能性がある。ホスホロチオエートは、ホスホジエステル結合を修飾させるのに用いられる。N3’−P5’アミド亜リン酸エステル結合は、オリゴヌクレオチドをヌクレアーゼに対し安定化させ、RNAとの結合を増加させるものとして記載されてきた。ペプチド核酸(PNA)結合は、リボースおよびホスホジエステルのバックボーンの完全な代替物(replacement)であり、ヌクレアーゼに対し安定であり、RNAへの結合親和性を向上させ、RNaseHによる切断を防ぐ。その塩基構造も、アンチセンス成分としてのその最適化を可能にする修飾の対象となる。ヘテロ環の修飾に関して、所定のヘテロ環の修飾は、RNAseH活性に干渉せずにアンチセンス効果を高めることが証明されている。そのような修飾の一例がC−5チアゾール修飾である。最後に、糖の修飾も考えられる。2’−O−プロピルおよび2’―メトキシエトキシリボース修飾は、細胞培養中およびインビボのヌクレア−ゼに対してオリゴヌクレオチドを安定させる。
【0047】
送達径路は、上記の基準に従って計測した場合に最適なアンチセンス効果をもたらすものになり得る。アンチセンスオリゴヌクレオチドを用いたインビトロ分析およびインビボ分析により、カチオン性リポゾームやレトロウィルスベクターにより媒介される送達および直接送達が有効であることが証明された。それ以外に考えられる送達モードは、標的細胞の細胞表面マーカーに対する抗体を用いてのターゲッティングである。標的またはそのレセプタに対する抗体をこの目的に利用できる。
(低分子干渉RNA分子)
さらなる実施態様では、標的遺伝子の発現が、低分子干渉RNA(siRNA)(RNAi、RNA干渉核酸としても知られている)によって阻害されていてもよい。siRNAは、二本鎖RNA分子で、通常は長さが21n.t.、標的遺伝子に対し相同的であって、標的遺伝子の活性に干渉する。
【0048】
siRNAテクノロジーは、真核細胞に生じ得る配列特異的転写後遺伝子抑制のプロセスに関連する。通常このプロセスは、特定の配列のmRNAの分解を伴うものであり、その分解は、上記の特定の配列と相同形である二本鎖RNA(dsRNA)によって誘発される。例えば、特定の一本鎖mRNA(ssmRNA)の配列に対応する長いdsRNAの発現は、そのメッセージを不安定にし、それによって、対応する遺伝子の発現に「干渉する」。したがって、選択されるいずれの遺伝子も、その遺伝子に関するmRNAの全てまたは本質的な部分に対応するdsRNAを導入することによって抑制され得る。長いdsRNAが発現するとき、それはまずリボヌクレアーゼIIIによって、長さにして塩基ペアが21〜22程度しかない、より短いdsRNAオリゴヌクレオチドになるよう処理される。したがって、比較的短い相同形dsRNAの導入または発現によりsiRNAを生じさせてもよい。実際、比較的短い相同形dsRNAを使用することで、以下に述べるような所定の効果が得られるとも思われる。
【0049】
哺乳動物細胞は、二本鎖RNA(dsRNA)の影響を受ける少なくとも2本の系路を持つ。上記のように、siRNA(配列特異性)系路では、まず開始dsRNAが複数の短い干渉(si)RNAに分解(break)される。siRNAは、各3’末端において2つのヌクレオチドが突出している(overhang)19ヌクレオチド程度のsiRNAを形成する約21個のヌクレオチドのセンス鎖およびアンチセンス鎖を持つ。短い干渉RNAは、特異的メッセンジャーRNAが分解のためターゲッティングされることを可能にする配列情報を提供すると考えられる。対照的に、非特異的系路は、長さにして約30個以上の塩基対であれば、いずれかの配列のdsRNAによって引き起こされる。
【0050】
非特異的効果は、dsRNAが2つの酵素すなわちPKRと2’,5’オリゴアデニル酸シンテターゼを活性化することから生じる。PKRは、活性形態では翻訳開始因子eIF2をリン酸化して、全てのタンパク質合成を遮断する。また、2’,5’オリゴアデニル酸シンテターゼ(2’,5’−AS)は、全てのmRNAをターゲッティングしている非特異的酵素であるRNase Lを活性化する分子を合成する。非特異的系路は、ストレスやウイルス性感染に対する宿主反応を表すこともあり、通常は、非特異的系路の影響が最小限度であるのが好ましい。重要なのは、非特異的系路を誘導するには長めのdsRNAが必要と思われることで、したがって、約30塩基対より短いdsRNAが、RNAiによる遺伝子抑制効果があるとして好まれる(ハンター(Hunter)ら、1975、J. Biol. Chem. 250:409-17;マンシェ(Manche)ら、1992、Mol. Cell. Biol. 12:5239-48;ミンクス(Minks)ら、1979、J. Biol. Chem. 254: 10180-3;およびエルバシール(Elbashir)ら、2001、Nature 411 :494-8参照)。siRNAは、HeLa細胞、NIH/3T3細胞、COS細胞、293細胞およびBHK−21細胞を含む様々なタイプの細胞において遺伝子発現を減少させる有効な手段であることが立証されており、通常は、アンチセンス技術を用いて達成されたものより低いレベルまで遺伝子の発現を減少させ、実際、発現を完全に無くすこともしばしば起こる(バス(Bass)、2001、Nature 411 :428-9を参照)。哺乳動物細胞では、siRNAが、アンチセンス実験で通常用いられる濃度より何桁も低い濃度で効果がある(エルバシールら、2001、Nature 411 :494-8参照)。
【0051】
RNAiを生じるために用いられる二本鎖オリゴヌクレオチドは、長さにして30塩基対未満であるのが好ましく,より好ましくは約25、24、23、22、21、20、19、18または17塩基対のリボ核酸を含む。任意で、dsRNAオリゴヌクレオチドが、3’突出末端を含んでもよい。典型的な2−ヌクレオチド3’突出は、いずれのタイプのリボヌクレオチド残基で構成されていてもよく、2’−デオキシチミジン残基で構成されていてもよい。これによりRNA合成のコストが抑えられ、また、細胞培養の培地およびトランスフェクトされた細胞内のsiRNAのヌクレアーゼ耐性も向上し得る(エルバシール(Elbashi)ら、2001、Nature 411 :494-8参照)。
【0052】
50、75、100または500以上にもなる塩基対のさらに長いdsRNAも、本発明の所定の実施態様で用いられる。RNAiを生じるためのdsRNAの典型的な濃度は、約0.05nM、0.1nM、0.5nM、1.0nM、1.5nM、25nMまたは100nMである。ただし、処理される細胞の性質、遺伝子標的およびその他、当業者にとって容易に認められる要因によっては、それ以外の濃度を用いてもよい。
【0053】
典型的なdsRNAは、化学的に合成してもよく、または適切な発現ベクターを用いてインビトロまたはインビボで製造してもよい。典型的な合成RNAには、当該技術分野で公知の方法を用いて化学的に合成された21個のヌクレオチドRNAが含まれる。合成オリゴヌクレオチドは、当該技術分野で公知の方法を用いて脱保護およびゲル精製されるのが好ましい(例えばエルバシールら、2001、Genes Dev. 15: 188-200を参照)。より長いRNAは、例えば当該技術分野で公知のT7RNAポリメラーゼプロモータのようなプロモータから転写されてもよい。単一RNA標的は、インビトロプロモータの下流で双方の可能な方位に設けられているものであり、標的の両方の鎖を転写して所望の標的配列のdsRNAオリゴヌクレオチドを生成する。上記RNA種はいずれも、標的核酸において表現される核酸配列の部分を含むよう設計されてもよい。
【0054】
オリゴヌクレオチドの設計に利用される特異的な配列は、標的の発現遺伝子メッセージ内に含まれるヌクレオチドのいずれの隣接配列であってもよい。当該技術分野で知られているプログラムとアルゴリズムを適切な標的配列を選択する目的で用いてもよい。それに加え、特定の一本鎖核酸配列の二次構造を予測するよう設計されたプログラムを利用し、またそれらの配列の選択が,折りたたまれたmRNAの露出一本鎖領域で生じやすいようにして、最良の配列を選択してもよい。適切なオリゴヌクレオチドを設計するための方法および組成物が,例えば、米国特許番号No. 6,251,588に記載されており、その内容は参照用としてここに挿入されている。
【0055】
mRNAは通常、リボヌクレオチドの配列中にタンパク質合成を指示する情報を含む直線分子であると考えられているが、ほとんどのmRNAが多数の二次および三次構造を含むことが証明されている。RNA中の二次構造エレメントは、主として同じRNA分子の異なる領域間でのワトソン・クリック型相互作用によって形成される。重要な二次構造エレメントには、分子内二本鎖領域、ヘアピンループ、二重鎖RNAのバルジおよび内部ループが含まれる。三次構造エレメントは、二次構造エレメントが互いに、または一本鎖領域と接触してより複雑な三次元の構造を作ったときに形成される。これまで数多くの研究者らが非常に多くのRNA二重構造の結合エネルギーを計測してきたし、また、RNAの二次構造を予測するのに使用可能な一連の規則を推測してきた(例えば、ジェーガー(Jaeger)ら、1989、Proc. Natl. Acad. Sci. USA 86:7706;およびターナー(Turner)ら、1988、Annu. Rev. Biophys. Biophys. Chem. 17: 167を参照)。それらの規則はRNA構造エレメントの同定,特に、siRNA、リボザイム、またはアンチセンステクノロジーを標的とするmRNAの好ましいセグメントを表し得る一本鎖RNA領域の同定に用いられる。したがって、mRNA標的の好ましいセグメントは、本発明の適切なリボザイムおよびハンマーヘッド型リボザイム(hammerheadribozyme)組成物のみならずsiRNA媒介dsRNAオリゴヌクレオチドの設計についても同定可能である(以下参照)。
【0056】
リポゾーム等の担体組成物を用いた異種標的遺伝子でのトランスフェクションによって、dsRNAオリゴヌクレオチドを細胞に導入してもよい。当該技術分野で知られているリポゾームとしては、例えば接着細胞系のメーカーによって記載されているようなリポフェクタミン(Lipofectamine)2000(ライフ・テクノロジーズ(Life Technologies))が挙げられる。ターゲティング内因性遺伝子についてのdsRNAオリゴヌクレオチドのトランスフェクションを、オリゴフェクタミン(Oligofectamine)(ライフ・テクノロジーズ)を用いて実施してもよい。hGFP−エンコーディングpAD3との同時トランスフェクション後に、哺乳動物細胞用の蛍光顕微鏡を用いてトランスフェクション効率をチェックしてもよい(ケーレンバック(Kehlenback)ら、1988、J. Cell Biol. 141 :863-74参照)。siRNAの有効性については、dsRNA導入後に,数多くの分析のいずれを用いて評価してもよい。それらの分析には、新しいタンパク質合成を抑制した後で内因性貯留(endogenous pool)の代謝回転に十分な時間をかけてから標的遺伝子生成物を認識する抗体を用いるウエスタンブロット解析、逆転写酵素ポリメラーゼ連鎖反応、および、存在する標的mRNAレベルを測定するためのノーザンブロット解析も含まれる。
【0057】
siRNAテクノロジーのさらなる組成物,方法および適用については、米国特許番号6,278,039、5,723,750および5,244,805に記載されており、それらは参照用としてここに挿入されている。
【0058】
さらなる実施態様における本発明は、PC4が癌タンパク質であり阻害用化合物の標的になり得るという上記発見に基づく、癌阻害剤に関するスクリーニング方法を提供するものである。本発明のスクリーニング方法は、例えば、ルシフェラーゼまたは緑色蛍光タンパク質遺伝子といった適切なレポータ遺伝子に結合したPC4プロモータ配列(例えばFIG.1A参照)を用いるプロモータ系スクリーニングである。当業者であれば、ここで例示されている典型的な配列以外にも、PC4遺伝子に対する多くの適切なプロモータ配列またはその他のシス作用転写因子(cis-acting transcriptional factors)が入手可能であり,かつ使用可能であることを理解するであろう。
【0059】
また、本発明のスクリーニング方法は、PC4依存型転写分析[例えば、ゲとレーダーに記載(1994)、クラスII遺伝子の転写活性化を媒介するヒトのコアクチベータ、PC4の精製、クローニングおよび特性評価(Purification, cloning and characterization of a human coactivator, PC4, that mediates transcriptional activation of class II genes)。Cell 78, 513-523参照]、またはタンパク質−タンパク質相互作用分析、またはタンパク質−DNA相互作用分析[例えば、ゲ(Ge), H. (2000) UPA, タンパク質−タンパク質、タンパク質−DNA、タンパク質−RNA、およびタンパク質−リガンド相互作用の定量検出用ユニバーサル・プロテイン・アレイシステム(a universal protein array system for quantitative detection of protein-protein, protein-DNA, protein-RNA and protein-ligand interactions)。Nucleic Acids Res. 28, e3参照]のような、タンパク質活性に基づく分析であってもよい
本発明の診断またはスクリーニング方法は、十分に確立され当業者間公知である、タンパク質または核酸に基づく多くの分析方法に基づくものであってもよい。抗PC4抗体および抗トポイソメラーゼI抗体は、公知であり市販されている。例えば、金のナノ粒子と共役している抗体をバイオアッセイワークス(BioassayWorks)(イジャムスヴィル(Ijamsville)、メリーランド)から入手して、PC4タンパク質またはトポイソメラーゼIのレベルを早急かつ定量的にモニタリングするのに用いることができる。同様に、RT−PCR(逆転写酵素ポリメラーゼ連鎖反応)分析を、RNAレベルでのPC4とトポイソメラーゼIの活性化をモニタリングするのに用いることができる。
【0060】
当業者であれば,本発明の「対象者(subject)」が、腫瘍が生じやすいヒトおよびヒト以外の動物を含むことを理解している。
【0061】
当業者であれば、本発明の「癌治療法」が、化学療法、放射線療法、免疫療法、および、それらの組み合わせを含むことを理解している。
【0062】
本発明の癌阻害剤は、単独で,もしくは、1つまたは複数の公知または非公知の癌阻害剤と組み合わせて、癌を阻害または治療するのに有効な量で、対象者に投与可能である。「有効量」とは、何らかの有害な副作用があっても利点がそれを上回る、対象者に害を及ぼさない量であると理解される。有効な投与量は、年齢、体重、および治療される対象者、投与のモードおよび径路、および、阻害または治療が求められる癌または腫瘍のタイプによって変更され得る。
【0063】
本発明の癌阻害剤の投与量および径路は、余分な実験を行わずとも、全ての基準(特定の種類の薬剤についてリストアップ済みのものを含む)を考慮し、またその対象者についてベストの判断を行使して、当業者が決定することが可能である。
【0064】
さらに、PC4依存型悪性腫瘍の治療用の医薬剤としての突然変異型PC4タンパク質の使用が意図されている。N−末端セリンリッチドメインがPC4の活性にとって非常に重要でありカゼインキナーゼIIリン酸化によって制御されていることは既に報告されている。N−末端領域の欠失によって、そのコアクチベーターの活性が完全に消失した。一連の点突然変異を発生させることによりPC4活性に必要な重要なアミノ酸類を、ここでマッピングおよび開示する。野生型PC4と共に7種の突然変異型PC4タンパク質が発現、精製され、それらの活性が、1)電気泳動移動度シフト分析、2)インビトロ転写分析、および3)タンパク質アレイ分析でテストされた。PC4のDNA結合活性および転写活性を消失させるF77(F77P)での単一アミノ酸変化に加え、N−末端塩基領域での2つの二重突然変異種(K23I/K29AおよびK35I/K41A)ならびに三重突然変異種(R27A/K28I/K29A)もまた、PC4活性を激減させる。よって、PC4突然変異体F77P、K2I/K29A、K35I/K41A、およびR27A/K28I/K29Aは、内因性野生型PC4と競合することによって、癌阻害試薬として用いることができ、PC4依存型悪性腫瘍に対する治療効果が得られた。
【0065】
さらに、PC4の活性化ドメインに対応する短いペプチドの、癌阻害剤としての使用も意図されている。一般的な転写コアクチベーターとして、一般的な転写因子(類)、アクチベーター、および鋳型DNAとの相互作用は全てPC4活性にとって必要である。PC4活性化ドメインアミノ酸16−30(DSDSEVDKKLKRKKQ)および26−40(KRKKQVAPEKPVKKQ)に対応する2つのペプチドが合成され、またPC4に対するそれらの阻害効果が、タンパク質−タンパク質相互作用およびインビトロ転写分析においてPC4とアクチベーターの相互作用と競合させることによりテストされてもよい。
【0066】
また、癌阻害剤としての人為的活性化ドメインの使用も意図されている。PC4の発癌性活性が、全部とはいかなくても大部分の癌遺伝子、成長因子、およびその他の腫瘍形成因子の発現を、それらの特異的なアクチベーターとの相互作用を通じて活性化させる転写コアクチベーターとして機能するため、内因性アクチベーターとPC4の結合活性をブロックすることにより、PC4のアクチベーター活性を消失させることができた。15個のアミノ酸を持つ両親媒性らせん(AH)ペプチドはテストされ、PC4との相互作用が強い活性化ドメインを模倣させる(mimic)ことができた。Gal4DNA結合ドメインとの融合により、PC4依存方式での劇的な転写活性化が生じた。AHペプチド(ELQELQELQALLQQQ)は、合成され、PC4と結合する他の内因性アクチベーターと競合させることによりPC4に対するその阻害効果についてテストされてもよい。
【0067】
また、腫瘍細胞に対するPC4タンパク質関連試薬の進入を容易にするための転移ドメイン(TLD)の使用も意図されている。転移ドメイン(TLD)は、12個のアミノ酸(PLSSIFSRIGDP)で構成された、分子量1288.47(pI=6.27)の短いペプチドである。このペプチドが、B型肝炎ウイルス感染および他のタンパク質の細胞透過性にとって重要であることが報告された(エスおよびヒルト(Oess and Hildt)2000;ステッケルら(Stoeckl et al.)、2006)。タンパク質関連癌阻害剤が核癌タンパク質PC4をターゲティングできるように、TLDは、組換え型モノクローナル抗体、PC4突然変異体タンパク質、PC4活性化ドメインに対応するペプチド、両親媒性らせんペプチドおよびその他、PC4活性を阻害できるタンパク質またはペプチド類と融合させられてもよい。HIVtatタンパク質のTLDといった他のタイプの転移ドメインもテストされ得る。
【0068】
PC4活性を阻害する化合物をスクリーニングするためのハイスループットシステム(HTS)も意図されている。蛍光共鳴エネルギー移動(FRET)テクノロジーは、タンパク質−タンパク質相互作用、タンパク質−DNA相互作用、およびタンパク質立体配座変化といった分子動力学を量化するハイスループットスクリーニング分析において有効なツールであった。ハイスループットFRET分析システムは、96ウェルまたは384ウェルのプレートフォーマットで開発されており、それによれば、蛍光標識された両親媒性らせん(AH)ドメインはエネルギードナーとして作用し、蛍光標識されたPC4タンパク質はエネルギーアクセプターとして作用する。2つの分子の相互作用によりドナーとアクセプターが近接している(1〜10nm)ところで一旦PC4−AH複合体が形成されると、AHドメインからPC4タンパク質への分子間FRETが原因で、PC4の発光(emission)が顕著になる。AHペプチドの励起とPC4発光は、蛍光プレートリーダーによりモニタリングされる。どの化合物の阻害効果も、読取り値の変化をモニタリングすることにより検出できる。これらの化合物は、PC4依存型悪性腫瘍用の潜在的な癌阻害剤候補としてさらに確認され、また開発され得る。2種類の化合物、すなわち1)低分子量合成分子,および2)天然化合物、がスクリーニングされることになろう。
【0069】
低分子量合成分子は、市販および組織体内(in-house)のコレクションを含む。登録済みの搬入化合物を96ウェルまたは384ウェルプレートに保存した後、目録データベースが設定され得る。反応プレートのウェルはそれぞれ、10〜50μlの(384ウェルプレートについては10μl、96ウェルプレートについては50μl)蛍光標識されたPC4およびAHを含む反応混合物中にテスト済みの化合物1mMを含む。プレートはそれぞれ陽性コントロール(10mMの標識されていないAH)のウェルを4つ、および陰性コントロール(蛍光標識されたAHドナーの代わりにH2O)のウェルを4つ含む。その後、OD535での発光が、プレートリーダー(モレキュラー・ダイナミックス(Molecular Dynamics))で計測される。予備の(preliminary)陽性分子について、インビトロタンパク質−タンパク質相互作用分析、転写分析、細胞系分析および、臨床試験前の動物実験を含む別々の分析を用いてさらに確認されてもよい。
【0070】
処方薬の大部分が天然化合物で構成される。市販の抗腫瘍剤および抗感染剤のうち50%を上回る分が、天然の生成物を原料としている。PC4活性を阻害可能な天然分子を同定する目的で、土壌微生物、海洋微生物、植物、およびその他のソースが、HTS PC4−AH FRET分析を用いてスクリーニングされることになり得る。同定された生の原料については、異なる分析システムでさらに精製、特性評価、および確認がなされてもよい。
【0071】
以下の実施例は、本発明を分かりやすくする目的で提示されるものに過ぎず、本発明の範囲を限定する意図で提示されるものではない。
【0072】
(実施例1)
[材料および方法]
<突然変異種生成>
特異的点突然変異種を含む二本鎖オリゴは、異なる点突然変異種を生じるためのバクテリア発現ベクターにおいてPC4の野生型領域に取って代わるものとして商業的に合成され使用されていた。各突然変異構造物は、配列解析によって確認され大腸菌中で発現した。バクテリア発現PC4タンパク質(野生型と突然変異体を含む)は、2段階の精製法、すなわち1)P11ホスホセルロースおよび2)ヘパリンセファロース精製法によって製造される。ブラッドフォード法を用いて精製済みのタンパク質の濃度を計測し、SDS―PAGEを用いてその純度を検査した。
【0073】
<電気泳動移動度シフト分析(EMSA)>
PC4タンパク質のds−DNA結合活性を測定する目的でEMSAが用いられ、このEMSAは、10ngの精製PC4タンパク質およびアデノウィルスの主要後期プロモータ領域(major late promoter region)由来の32P−標識64bpのdsDNAプローブを含む20μlの反応混合物で実施された。4℃で1時間インキュベートした後、反応混合物を8%ポリアクリルアミドゲル上で解析した。移動したPC4−dsDNA複合体を、オートラジオグラフィーを用いて可視化した。
【0074】
<インビトロ転写分析>
TFIIA、TFIIB、TFIID、TFIIF、TFIIHおよびRNAポリメラーゼIIを含む精製済みの一般的な転写因子で、インビトロ転写分析系を再構築した。それらはHeLa細胞または組換えソースから精製されたものである。この系は、PC4中で、アクチベーター依存式の方法で活性化可能である。転写因子に加え、その系はまた、1つのアクチベーター反応性鋳型、塩基性鋳型(アクチベーター独立型)および32P−CTPを含んでいた。30℃で1時間インキュベートした後、新たに合成されたRNAを抽出し、変性ポリアクリルアミドゲル上で解析して、オートラジオグラフィーを用いて可視化した。
【0075】
<タンパク質アレイ分析>
タンパク質アレイ分析は「ユニバーサル・プロテイン・アレイ(Universal Protein Array)方法」またはUPAと呼ばれる方法[ゲ(Ge), H. (2000) UPA, タンパク質−タンパク質、タンパク質−DNA、タンパク質−RNAおよび、タンパク質−リガンドの相互作用の定量測定用ユニバーサル・プロテイン・アレイシステム(a universal protein array system for quantitative detection of protein-protein, protein-DNA, protein-RNA and protein-ligand interactions) Nucleic Acids Res. 28, e3]に基づく。精製されたタンパク質を確認し、標準化を行いさらにニトロセルロースシート上に配列させた。各スポットはサイズにしたがって10〜100ngのタンパク質を含むよう直径1mmで配列された。アレイ上でPC4タンパク質と相互作用した標的のタンパク質は、転写因子TFIIA、Gal4、またはSp1に対する抗体等の特異的抗体によって検出された。タンパク質−DNA相互作用については、プローブDNAが32p−dCTPで標識化され、その結合DNAは、オートラジオグラフィーによってモニタリングされた。
【0076】
<アフリカツメガエル変態中のPC4発現の検査>
オタマジャクシの異なるステージから全タンパク質抽出物を準備し、SDS−PAGEを用いて解析した。タンパク質がニトロセルロース膜にトランスファーされた後、差別的に発現したPC4が、ヒトPC4に対するポリクローナル抗体を用いてウエスタンブロットにより検出され、ECL方法により可視化された。
【0077】
<PC4−トランスフェクトされたHeLa細胞の共焦点顕微鏡観察>
ヒトPC4の野生型(WT)またはセリンリッチ領域突然変異体(ΔS)を、哺乳動物発現ベクターpcDNA3.1にサブクローニングして、HeLaS細胞にトランスフェクトした。トランスフェクションから2日後、共焦点顕微鏡下で検体を観察した。
【0078】
<ノーザンブロット解析>
全ポリARNAを異なる細胞系から単離して、1%アガロースホルムアルデヒドゲル上で分離した。ニトロセルロース膜にトランスファーした後、32P−標識されたPC4cDNAと一緒にその膜をインキュベートすることにより、PC4mRNAを検出した。28Sおよび18SリボゾームのRNAが、EtBr染色によって可視化された。
【0079】
<腫瘍組織におけるPC4発現の検査>
米国国立衛生研究所のヒト組織ネットワークセンター(Center of Human Tissue Network)より、異なるヒト腫瘍組織およびそれらと対を成す正常な組織を入手した。全タンパク質が別々の組織から抽出された。PC4とDNAトポイソメラーゼIの発現レベルをウエスタンブロットにより検出した。この方法では、各組織からの合計50μgの全タンパク質を解析し、それぞれ抗PC4または抗トポIポリクローナル抗体と共にインキュベートした。免疫組織化学(IHC)解析用として、正常なヒト肺組織または肺の癌組織を含むスライドガラスを、国立衛生研究所より入手した。組織のスライドガラスをまずキシレンで2×15分処理してから、エタノールの濃度を5分おきに100%から70%まで減少させながらインキュベートした。95°で5分間処理し、H2OおよびIxPBSでゆすぎ、3%の粉ミルクを含むブロッキング緩衝液でブロッキングした後で、それらのスライドガラスを抗PC4ポリクローナル抗体(ブロッキング緩衝液中で1:1000)と共に、室温で1時間インキュベートした。余分な一次抗体を洗い流した後、スライドガラスを蛍光標識した二次抗体と共に30分間インキュベートした。スライドガラスをゆすいだ後、蛍光顕微鏡下でPC4抗原を検出した。
【0080】
(実施例2)
<DNA結合および転写の際のPC4突然変異の効果>
PC4のN−末端セリンリッチドメインは、PC4活性にとって非常に重要でありカゼインキナーゼIIリン酸化によって制御されることが知られている。実際、N−末端領域を欠失するとPC4コアクチベーターの活性が完全に消失することが知られている。発明者らは、一連の点突然変異種を発生させることによってPC4活性に必要な重要なアミノ酸をマッピングした(図2)。したがって、図2は、野生型PC4(PC4−wt)とPC4の5つの突然変異種を示す。特定の残基位置でのアミノ酸置換を、その突然変異種(すなわちmt)番号下の括弧内に示す。mt5に関しては、アミノ酸フェニルアラニンが、タンパク質−タンパク質またはタンパク質−DNA相互作用を含む分子間相互作用に関与していることが知られている。先のデータより、PC4のssDNA結合領域がアミノ酸残基77の付近に局在することが分かる。野生型PC4と共に7種の突然変異型PC4タンパク質が発現および精製され(図3A)、その活性について、1)電気泳動移動度シフト分析(EMSA、図3B)、2)インビトロ転写分析(図3C)、および3)タンパク質アレイ解析(図4)で検査された。PC4のDNA結合活性と転写活性を消失させるF77(F77P)での単一アミノ酸変化に加え、N−末端塩基領域での2つの二重突然変異種(K23I/K29AとK35I/K41A)および1つの三重突然変異種(R27A/K28I/K29A)も、PC4活性を激減させる。よって、PC4の突然変異体F77P、K2I/K29A、K35I/K41A、およびR27A/K28I/K29Aは、内因性野生型PC4との競合により癌阻害試薬として使用することができ、その結果、PC4依存型悪性腫瘍の治療効果があった。
【0081】
(実施例3)
<PC4をDNAおよびその他の転写因子に結合させる際のPC4突然変異の効果>
図4は、ポジション77でのアミノ酸フェニルアラニンが、PC4のssDNA結合活性にとって決定的であることを示す(図4Fのmt5を参照)。一方、このF77P点突然変異種(すなわちmt5)は、PC4と転写因子TFIIA(図4C参照)およびSp1(図4E参照)との相互作用を増強する。それ以外の突然変異種は、PC4がDNAおよびタンパク質であるSpIやTFIIAと相互作用する能力に対しほとんど、または全く影響しなかった。野生型PC4(wt)と個々の突然変異体(mt)が略同等に存在することが、ポンソーS染色(図4A)および、抗PC4抗体での検出(図4B)によって確認された。Gal4−(l−94)は、Gal4−Sp1融合タンパク質とのPC4の相互作用に対する陰性コントロールとして使用されている(図4E)。
【0082】
(実施例4)
<分化におけるPC4の役割>
図5A、5Bおよび5Cは、PC4活性化がアフリカツメガエルの変態に必要であることを示す。この結果は、オタマジャクシの発生のステージ56〜58の間にPC4が活性化されることを示す。これは、リン酸化PC4(すなわちPC4−P)(PC4の不活性形態)の発現が減少し非リン酸化PC4(すなわちPC4の活性化形態)の発現が増加することから証明される。癌の転移プロセスに類似して、変態には多くの成長因子、転写因子、分化プロセスに関与する核ホルモンレセプタの活性化が必要であるため、これらのデータがPC4と癌との関連性を裏付けるものとなる。アフリカツメガエルの変態は、オタマジャクシから成体への1種類の変化を経る(図5C参照)。数多くのホルモン(甲状腺ホルモンT3およびT4のような)が必要となるだけでなく、数多くの成長因子、核ホルモンレセプタ、および転写因子(甲状腺ホルモンレセプタTRαおよびTRβのような)が、細胞の成長および分化に必要である。PC4は、これらの因子を活性化させる上で重要な役割を果たすと考えられる。
【0083】
(実施例5)
<PC4がHeLa細胞中の染色体凝縮を引き起こす>
図6は、PC4が核内に局在され、HeLa細胞にトランスフェクトされるときに染色体凝縮とアポトーシスを引き起こすことを示す。野生型PC4の細胞へのトランスフェクションにより、HeLa細胞の染色体が凝縮されることが分かる(図6Aのコントロールを図6BのPC4と比較)。PC4のセリンリッチ領域突然変異種によるトランスフェクション(図6C)は、それ自体はもはやカゼインキナーゼIIによってリン酸化することは不可能であるが、染色体凝縮に加えて、核と細胞の形状が変化する(悪性腫瘍細胞に共通の特徴を表している)ことを示す。このデータは、癌が突然変異によって引き起こされ得ること、および突然変異がしばしば動原体領域に起こるという理論を裏付けるものである。これらのデータは、PC4が染色体に結合するのみならず、実際には動原体に結合することを示し、またそれによって、PC4の潜在的なメカニズム(すなわち、PC4は他のDNA修復酵素のDNAとの結合を妨げることにより癌遺伝子として機能する)を示唆する。
【0084】
(実施例6)
<形質転換された細胞系および腫瘍細胞系におけるPC4mRNAの発現>
図7は、PC4mRNAが全ての形質転換細胞系および乳癌細胞系において検出可能であるが、初代NIH3T3細胞系および非悪性マウス組織では検出不可能であることを示す。図7Aは、細胞系mRNAを用いてのノーザンブロットのレーンの略同等のローディング量を表す(18Sおよび28SrRNAについての染色により表示される)。図7Bは、陰性コントロール(ヒトp52mRNA)の結果を示す。図7Cは、PC4cDNAでハイブリダイゼーションがあることによって異なる細胞系においてPC4mRNAが発現することを示す。
【0085】
(実施例7)
<腫瘍組織におけるPC4タンパク質の発現増加>
図8は、多数のヒト腫瘍組織(T)におけるPC4タンパク質がウエスタンブロット解析によって検出可能であるが、それに対応する正常な(N)ヒト組織では検出不可能であることを示す(図8B)。加えて、PC4の活性化は、幾つもの癌阻害薬剤として十分研究された標的であるDNAトポイソメラーゼI(図8A)の活性化と相関関係がある。
【0086】
(実施例8)
<肺腫瘍でのPC4タンパク質の発現>
図9は、PC4タンパク質がヒトの肺癌組織の全ての腫瘍細胞に蓄積する(図9B)が、非悪性の肺組織の正常な細胞には蓄積しない(図9A)ことを示す。
【0087】
これまでに本発明の幾つかの実施態様を記載してきたが、上記の内容が単なる解説であって本発明を限定するものではなく、実施例によって提示されているに過ぎないことは当業者にとっては明らかである。数々の部分的変更およびその他の実施態様もこの分野の技術範囲に含まれ、本発明の範囲およびその同等物に含まれるとされる。本発明の変形は当業者にとって容易に理解可能であろうし、本発明はそれらの代替案を含むとされる。さらに、当業者であれば数多くの変更に容易に思い至るであろうから、本発明を、ここに記載されているような構造および操作に厳密に限定することは望ましくなく、したがって、適切な変更および同等物全てが、本発明の権利範囲に含まれるものとして依拠されることになり得る。
【配列表フリーテキスト】
【0088】
配列番号1 ヒトPC4のcDNA配列
配列番号2 ヒトPC4のコーディング領域
配列番号3 ヒトPC4のアミノ酸配列
配列番号4〜10 癌阻害剤として使用される可能性のある指定ペプチドのアミノ酸配列
【特許請求の範囲】
【請求項1】
対象者の腫瘍を診断する方法であり、前記方法は前記対象者からサンプルが提供され、転写正補因子4(PC4)タンパク質のレベルを測定することを含み、コントロールサンプルに比べPC4レベルが高ければ前記サンプルが腫瘍状であることが示される方法。
【請求項2】
前記腫瘍が悪性である請求項1に記載の方法。
【請求項3】
前記サンプルが、肺、膀胱、結腸、乳房、子宮内膜、甲状腺、小腸、および卵巣からなる群から選択される請求項1に記載の方法。
【請求項4】
さらに前記サンプル中のDNAトポイソメラーゼIのレベルを測定し、そのレベルをコントロール中のDNAトポイソメラーゼIのレベルと比較することを含み、コントロールサンプルに比べDNAトポイソメラーゼIのレベルが高ければ前記サンプルが腫瘍状であることが示される方法。
【請求項5】
対象者の腫瘍を診断する方法であり、前記方法は前記対象者からサンプルが提供され、前記サンプル中のDNAトポイソメラーゼIのレベルを測定することを含み、コントロールサンプルに比べDNAトポイソメラーゼIのレベルが高ければ前記サンプルが腫瘍状であることが示される方法。
【請求項6】
前記腫瘍が悪性である請求項5に記載の方法。
【請求項7】
対象者の癌治療をモニタリングする方法であり、前記方法は治療過程において複数回にわたり前記対象者からサンプルが提供され、前記サンプル中の転写正補因子4(PC4)タンパク質のレベルを測定し、治療過程において前記サンプル中の転写正補因子4(PC4)タンパク質のレベルを比較することを含み、サンプル中の転写正補因子4(PC4)タンパク質のレベルが低下していれば癌治療が成功していることが示される方法。
【請求項8】
前記サンプルが、肺、膀胱、結腸、乳房、子宮内膜、甲状腺、小腸、および卵巣からなる群から選択される請求項7に記載の方法。
【請求項9】
前記癌治療法が、化学療法、放射線療法、免疫療法、化学療法と放射線療法との組み合わせ、化学療法と免疫療法との組み合わせ、放射線療法と免疫療法との組み合わせ、および、化学療法と放射線療法と免疫療法との組み合わせからなる群から選択される請求項7に記載の方法。
【請求項10】
癌阻害剤に関するスクリーニング方法であり、前記方法は(a)レポータ遺伝子に有効に結合しているPC4遺伝子のプロモータ配列を含む遺伝子構造物を提供し、(b)レポータ遺伝子を発現させる条件下で候補化合物を前記遺伝子構造物と接触させることを含み、前記レポータ遺伝子の発現を阻害する候補が癌阻害剤である方法。
【請求項11】
請求項10の方法にしたがって同定される癌阻害剤。
【請求項12】
癌阻害剤に関するスクリーニング方法であり、前記方法は(a)PC4−依存型転写分析試料を提供し、(b)候補化合物を前記分析試料に添加することを含み、PC4の転写を減少させる候補が癌阻害剤である方法。
【請求項13】
請求項12の方法にしたがって同定される癌阻害剤。
【請求項14】
抗癌剤に関するスクリーニング方法であり、前記方法は(a)PC4−タンパク質相互作用分析試料またはPC4−DNA相互作用分析試料を提供し、(b)候補化合物を前記分析試料に添加することを含み、PC4−タンパク質相互作用またはPC4−DNA相互作用を減少させる候補が抗癌剤である方法。
【請求項15】
請求項14の方法にしたがって同定される抗癌剤。
【請求項1】
対象者の腫瘍を診断する方法であり、前記方法は前記対象者からサンプルが提供され、転写正補因子4(PC4)タンパク質のレベルを測定することを含み、コントロールサンプルに比べPC4レベルが高ければ前記サンプルが腫瘍状であることが示される方法。
【請求項2】
前記腫瘍が悪性である請求項1に記載の方法。
【請求項3】
前記サンプルが、肺、膀胱、結腸、乳房、子宮内膜、甲状腺、小腸、および卵巣からなる群から選択される請求項1に記載の方法。
【請求項4】
さらに前記サンプル中のDNAトポイソメラーゼIのレベルを測定し、そのレベルをコントロール中のDNAトポイソメラーゼIのレベルと比較することを含み、コントロールサンプルに比べDNAトポイソメラーゼIのレベルが高ければ前記サンプルが腫瘍状であることが示される方法。
【請求項5】
対象者の腫瘍を診断する方法であり、前記方法は前記対象者からサンプルが提供され、前記サンプル中のDNAトポイソメラーゼIのレベルを測定することを含み、コントロールサンプルに比べDNAトポイソメラーゼIのレベルが高ければ前記サンプルが腫瘍状であることが示される方法。
【請求項6】
前記腫瘍が悪性である請求項5に記載の方法。
【請求項7】
対象者の癌治療をモニタリングする方法であり、前記方法は治療過程において複数回にわたり前記対象者からサンプルが提供され、前記サンプル中の転写正補因子4(PC4)タンパク質のレベルを測定し、治療過程において前記サンプル中の転写正補因子4(PC4)タンパク質のレベルを比較することを含み、サンプル中の転写正補因子4(PC4)タンパク質のレベルが低下していれば癌治療が成功していることが示される方法。
【請求項8】
前記サンプルが、肺、膀胱、結腸、乳房、子宮内膜、甲状腺、小腸、および卵巣からなる群から選択される請求項7に記載の方法。
【請求項9】
前記癌治療法が、化学療法、放射線療法、免疫療法、化学療法と放射線療法との組み合わせ、化学療法と免疫療法との組み合わせ、放射線療法と免疫療法との組み合わせ、および、化学療法と放射線療法と免疫療法との組み合わせからなる群から選択される請求項7に記載の方法。
【請求項10】
癌阻害剤に関するスクリーニング方法であり、前記方法は(a)レポータ遺伝子に有効に結合しているPC4遺伝子のプロモータ配列を含む遺伝子構造物を提供し、(b)レポータ遺伝子を発現させる条件下で候補化合物を前記遺伝子構造物と接触させることを含み、前記レポータ遺伝子の発現を阻害する候補が癌阻害剤である方法。
【請求項11】
請求項10の方法にしたがって同定される癌阻害剤。
【請求項12】
癌阻害剤に関するスクリーニング方法であり、前記方法は(a)PC4−依存型転写分析試料を提供し、(b)候補化合物を前記分析試料に添加することを含み、PC4の転写を減少させる候補が癌阻害剤である方法。
【請求項13】
請求項12の方法にしたがって同定される癌阻害剤。
【請求項14】
抗癌剤に関するスクリーニング方法であり、前記方法は(a)PC4−タンパク質相互作用分析試料またはPC4−DNA相互作用分析試料を提供し、(b)候補化合物を前記分析試料に添加することを含み、PC4−タンパク質相互作用またはPC4−DNA相互作用を減少させる候補が抗癌剤である方法。
【請求項15】
請求項14の方法にしたがって同定される抗癌剤。
【図1A】


【図1B】


【図1C】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図1B】


【図1C】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公表番号】特表2011−510262(P2011−510262A)
【公表日】平成23年3月31日(2011.3.31)
【国際特許分類】
【出願番号】特願2010−523261(P2010−523261)
【出願日】平成20年9月5日(2008.9.5)
【国際出願番号】PCT/CN2008/072274
【国際公開番号】WO2009/033411
【国際公開日】平成21年3月19日(2009.3.19)
【出願人】(510062000)スージョウ アセントジーン シーオー.,エルティーディー. (1)
【Fターム(参考)】
【公表日】平成23年3月31日(2011.3.31)
【国際特許分類】
【出願日】平成20年9月5日(2008.9.5)
【国際出願番号】PCT/CN2008/072274
【国際公開番号】WO2009/033411
【国際公開日】平成21年3月19日(2009.3.19)
【出願人】(510062000)スージョウ アセントジーン シーオー.,エルティーディー. (1)
【Fターム(参考)】
[ Back to top ]

