癌を診断し処置するための組成物および方法
【課題】癌を特徴決定し、診断し、処置するための組成物および方法を提供する。
【解決手段】腫瘍細胞の成長を阻害するヒトFZD受容体の細胞外ドメインを含む可溶性FZD受容体、または、ヒトFZD受容体のリガンドと結合するヒトFZD受容体のFriドメインを含む可溶性受容体。前記ヒトFZD受容体の細胞外ドメインまたはヒトFZD受容体のFriドメインのいずれかを含む可溶性FZD受容体を、腫瘍成長を阻害するために有効な量で投与する工程を含む、癌を処置する方法。
【解決手段】腫瘍細胞の成長を阻害するヒトFZD受容体の細胞外ドメインを含む可溶性FZD受容体、または、ヒトFZD受容体のリガンドと結合するヒトFZD受容体のFriドメインを含む可溶性受容体。前記ヒトFZD受容体の細胞外ドメインまたはヒトFZD受容体のFriドメインのいずれかを含む可溶性FZD受容体を、腫瘍成長を阻害するために有効な量で投与する工程を含む、癌を処置する方法。
【発明の詳細な説明】
【技術分野】
【0001】
発明の分野
本発明は腫瘍学の分野に関し、癌を診断し処置するための新規な組成物および方法を提供する。特に本発明は、癌に対するアンタゴニスト、特に充実性腫瘍の研究、診断、および処置に役立つ受容体融合タンパク質を含む、癌幹細胞マーカーに対するアンタゴニストを提供する。
【背景技術】
【0002】
背景技術
癌は、先進諸国における主要な死因の1つであって、米国のみで年間500,000例以上の死をもたらす。米国では毎年100万人以上が癌と診断される。また通算して、3人中2人以上が一生のうちになんらかの形の癌を発病するであろうと推測される。200種より多くの様々な種類の癌が存在するが、それらのうちの4つ、すなわち乳房、肺、結腸直腸、および前立腺の癌が、全ての新患の半分以上を占める(Jernal et al., Cancer J. Clin. 53:5-26 (2003)(非特許文献1))。
【0003】
乳癌は、女性で最も一般的な癌であり、女性の推定12%が一生のうちに発病するリスクを有する。死亡率は、早期検出および処置の改善により減少したが、未だ乳癌は中年女性の主要な死因である。さらに、転移性乳癌は、依然として不治の病である。論文発表においては、ほとんどの転移性乳癌患者は1つまたは2つの臓器系が罹患しているだけであるが、その疾病が進行するとともに、通常複数の部位に併発するようになる。転移併発の最も一般的な部位は、皮膚および胸壁の軟組織における、ならびに腋窩および鎖骨上における、局所領域的再発である。遠隔転移の最も一般的な部位は、骨(遠隔転移の30〜40%)であり、続いて肺および肝臓である。また、新しく乳癌と診断された女性の約1〜5%しか診断時には遠隔転移を有しないが、局所的疾病を有する患者のおよそ50%が、5年以内に転移によって最終的に再発する。現在、遠隔転移が起こってからの生存期間の中央値は、約3年である。
【0004】
乳癌を診断し病期分類をする現在の方法には、American Joint Committee on CancerのAJCC Cancer Staging Manual, Philadelphia, PA, Lippincott-Raven Publishers, 5th ed. (1997), pp 171-180(非特許文献2)およびHarris, J. R, et al., eds., Breast Diseases, Philadelphia, Lippincott (1991) 中のHarris, J R.: "Staging of breast carcinoma" (非特許文献3)に述べられているような、腫瘍の大きさ、リンパ節中の腫瘍の存在、および遠隔転移の存在に基づく腫瘍−結節−転移(TNM)システムが含まれる。これらのパラメーターは、予後診断を与え、適切な治療を選択するために用いられる。腫瘍の形態的外観を評価することもできるが、同様の組織病理学的外観を有する腫瘍が有意な臨床的多様性を示す場合があるので、この方法は重大な限界を有する。最後に、細胞表面マーカーの分析を用いて、ある腫瘍の種類をサブクラスに分けることができる。例えば、乳癌の予後診断および処置において考慮される1つの因子は、エストロゲン受容体(ER)の存在であり、ER陽性の乳癌は通常は、タモキシフェンまたはアロマターゼ阻害剤などのホルモン療法剤に、ER陰性の腫瘍よりも容易に応答する。それでも、これらの分析は有用ではあるが、乳腫瘍の臨床的挙動を部分的に予測できるだけであり、乳癌には、現在の診断機器によって検出できず、また現在の療法によって処置できない多くの表現型多様性が存在する。
【0005】
前立腺癌は、先進諸国における男性の最も一般的な癌であって、米国での全新癌患者の概算33%を占め、2番目に多い死因である(Jemal et al., CA Cancer J. Clin. 53:5-26 (2003)(非特許文献4))。前立腺特異抗原(PSA)血液検査の導入以来、前立腺癌の早期発見が劇的に生存率を改善し、診断時に局所的および局部的段階の前立腺癌を有する患者の5年生存率は、100%に近づいている。それでも50%を上回る患者が、局所的に進行した疾病あるいは転移性の疾病を最終的に発病する(Muthuramalingam et al., Clin. Oncol. 16:505-516 (2004)(非特許文献5))。
【0006】
現在、根治的前立腺摘除および放射線療法により、大多数の局所的な前立腺腫瘍に対する治癒的処置が提供される。しかし治療の選択肢は、進行した症例の場合は極めて限定されている。転移性疾病については、単独の、または抗アンドロゲン剤と組み合わせた黄体形成ホルモン放出ホルモン(LHRH)アゴニストを用いるアンドロゲン除去が標準的処置である。しかし、最大限のアンドロゲン遮断にもかかわらず、大多数の進行性アンドロゲン非依存性疾病の場合は、疾病はほとんど必ず進行する。現在のところ、ホルモン無反応性前立腺癌のための一様に容認された処置は存在せず、一般に化学療法的治療法が用いられる(Muthuramalingam et al., Clin. Oncol. 16:505-516 (2004)(非特許文献5); Trojan et al., Anticancer Res. 25:551-561 (2005)(非特許文献6))。
【0007】
結腸直腸癌は3番目に一般的な癌であり、世界中の癌死の中で4番目に多い原因である(Weitz et al., 2005, Lancet 365:153-65(非特許文献7))。全結腸直腸癌のおよそ5〜10%が遺伝性であって、その主要な形の1つが家族性大腸腺腫性ポリポーシス(FAP)であり、これは罹患者の約80%が大腸腺腫性ポリポーシス(APC)遺伝子に生殖細胞系列突然変異を含む、常染色体優性疾患である。結腸直腸癌腫には、周辺への成長により局所的に、および、リンパ性、血行性、腹膜横断性、および神経周囲への伝播により他の場所へ侵入する傾向がある。リンパ外の併発の最も一般的な部位は肝臓であり、最も頻繁に冒される腹腔外の器官は肺である。他の血行性の伝播部位には、骨、腎臓、副腎および脳が含まれる。
【0008】
結腸直腸癌用の現在の病期分類システムは、腫瘍が腸壁を通過する浸透の程度、およびリンパ節併発の存在または非存在に基づいている。この病期分類システムは、3つの主なデュークス分類によって定義される:デュークスA疾病は、結腸または直腸の粘膜下組織層に限定され;デュークスB疾病は、固有筋層を通過して侵入し、結腸または直腸壁に浸透する可能性のある腫瘍を有し;そしてデュークスC疾病は、任意の程度の腸壁侵入および局部的リンパ節転移を含む。外科的切除術は初期段階結腸直腸癌に極めて有効であって、デュークスA患者では95%の治癒率を与え、デュークスB患者では、治癒率は75%に減少し、またデュークスC疾病中の陽性リンパ節の存在は、60%の5年以内の再発可能性を予測する。デュークスC患者の外科手術後の化学療法コースによる処置は再発率を40%〜50%に低下させるが、これは、これらの患者に対する現在の標準の治療である。
【0009】
肺癌は世界的に最も一般的な癌であり、米国では3番目に多く診断される癌であって、癌死の最も多い原因である(Spiro et al., Am. J. Respir. Crit. Care Med. 166: 1166-1196 (2002)(非特許文献8); Jemal et al., CA Cancer J. Clin. 53:5-26 (2003)(非特許文献9))。喫煙が、すべての肺癌のうち推定87%の原因と考えられ、このことにより、肺癌は最も効果的に予防可能な疾病となっている。肺癌は、小細胞肺癌(SCLC)および非小細胞肺癌(NSCLC)の2つの主要なタイプに分類され、これらがすべての肺癌の90%以上を占める。SCLCは、症例の15〜20%を占め、それが大きな中枢気道に由来すること、および細胞質がほとんどない小細胞のシートという組織学的組成によって特徴づけられる。SCLCはNSCLCより攻撃的であり、急速に成長し、早期に高頻度で転移する。NSCLCは、すべての症例の80〜85%を占め、組織学に基づいてさらに3つの主なサブクラスである腺癌腫、扁平上皮癌腫(類表皮癌腫)および大細胞未分化癌腫、に分類される。
【0010】
肺癌は、典型的にはその進行の後期に症状を現わし、したがって生存中央値は診断後わずか6〜12ヶ月であり、全体としての5年生存率はわずか5〜10%に過ぎない。手術は治癒の最良の機会を提供するが、肺癌患者のごく一部しかそれに適格ではなく、大多数は化学療法と放射線療法に頼っている。これらの療法の時期および用量強度を操作する試みにもかかわらず、生存率は、過去15年にわたってほとんど増加していない(Spiro et al., Am. J. Respir. Crit. Care Med. 166: 1166-1196 (2002)(非特許文献8))。
【0011】
癌は、正常組織の発生および維持を制御する機構の調節不全から起こり、次第に幹細胞が中心的な役割を果たすようになると考えられている(Beachy et al., Nature 432:324 (2004)(非特許文献10))。正常な動物の発生において、大部分または全ての組織の細胞は、幹細胞と呼ばれる正常な前駆体から生じる(Morrison et al., Cell 88:287-298 (1997)(非特許文献11); Morrison et al., Curr. Opin. Immunol. 9:216-221 (1997)(非特許文献12); Morrison et al., Annu. Rev. Cell. Dev. Biol. 11:35-71 (1995)(非特許文献13))。幹細胞は(1) 高い成長能を有し;(2) 非対称細胞分裂して、成長および/または発生能力の低下した1つまたは複数の種類の子孫を生成することができ;かつ(3) 自己再生または自己維持のための対称細胞分裂が可能な細胞である。幹細胞の分化による成人の細胞再生の最もよく知られている例は造血系であって、発生上未熟な前駆体(造血幹細胞および始原細胞)が、分子信号に応答して、様々な血液細胞型およびリンパ球細胞型を形成する。腸、乳管系および皮膚の細胞を含む他の細胞は、絶えず各組織中の少数の幹細胞から補充されており、最近の研究によって、脳を含む大部分の他の成人組織もまた幹細胞を含むことが示唆されている。
【0012】
充実性腫瘍は異種性の細胞集団からなる。例えば乳癌は、癌細胞、ならびに間充織(間質)細胞、炎症細胞および内皮細胞を含む正常細胞の混合物である。癌の古典的モデルでは、表現型の異なるすべての癌細胞集団が、増殖して新しい腫瘍を生じさせる能力を有すると考えられている。古典的モデルでは、腫瘍細胞の異質性は、環境要因ならびに癌細胞内で進行中の突然変異に起因し、腫瘍形成性細胞の様々な集団をもたらす。このモデルは、すべての腫瘍細胞の集団がある程度の腫瘍形成能力を有するであろうという発想に基づく(Pandis et al., Genes, Chromosomes & Cancer 12:122-129 (1998)(非特許文献14); Kuukasjrvi et al., Cancer Res. 57:1597-1604 (1997)(非特許文献15); Bonsing et al., Cancer 71:382-391 (1993)(非特許文献16); Bonsing et al., Genes Chromosomes & Cancer 82:173-183 (2000)(非特許文献17); Beerman H. et al., Cytometry. 12:147-154 (1991)(非特許文献18); Aubele M & Werner M, Analyt. Cell. Path. 19:53 (1999)(非特許文献19); Shen L et al., Cancer Res. 60:3884 (2000)(非特許文献20))。
【0013】
観察される充実性腫瘍細胞の異質性についての代替モデルは、充実性腫瘍が「充実性腫瘍幹細胞」(あるいは充実性腫瘍由来の「癌幹細胞」)に起因し、それが対称および非対称段階の細胞分裂による無秩序な発生を経るというものである。この幹細胞モデルでは、充実性腫瘍は、別々の限定された(恐らく希でさえある)細胞のサブセットを含み、それらは、広汎に成長しかつさらなる充実性腫瘍幹細胞(自己再生)および腫瘍形成能力を欠く充実性腫瘍の大多数の腫瘍細胞の両者を効率的に生じるという点で、正常「幹細胞」の特性を共有する。実際、長命の(long-lived)幹細胞集団内の突然変異が、腫瘍の成長および維持の基礎となっており、その存在が現在の治療的アプローチの失敗に寄与する、癌幹細胞の形成を開始し得る。
【0014】
癌の幹細胞的性質は、最初に血液癌、即ち急性骨髄白血病(AML)において明らかにされた(Lapidot et al., Nature 17:645-648 (1994)(非特許文献21))。より最近になって、悪性ヒト乳房腫瘍が同様に、免疫不全マウスにおける腫瘍形成能力に富む癌幹細胞の小さな別々の集団を含むことが実証された。ESA+、CD44+、CD24-/low、Lin-細胞集団は、分画されていない腫瘍細胞と比較して、腫瘍形成性細胞が50倍濃縮されていることが判明した(Al-Hajj et al., PNAS 100:3983-3988 (2003)(非特許文献22))。予測的に腫瘍形成性癌細胞を単離できることによって、これらの細胞の腫瘍形成能の基礎となる重大な生物学的経路の研究が可能になり、このことはしたがって癌患者のためのよりよい診断分析および治療法の開発を約束する。本発明の方向性は、この目的を目指している。
【先行技術文献】
【非特許文献】
【0015】
【非特許文献1】Jernal et al., Cancer J. Clin. 53:5-26 (2003)
【非特許文献2】American Joint Committee on Cancer中、AJCC Cancer Staging Manual, Philadelphia, PA, Lippincott-Raven Publishers, 5th ed. (1997), pp 171-180
【非特許文献3】Harris, J. R, et al., eds., Breast Diseases, Philadelphia, Lippincott (1991)中、Harris, J R.: "Staging of breast carcinoma"
【非特許文献4】Jemal et al., CA Cancer J. Clin. 53:5-26 (2003)
【非特許文献5】Muthuramalingam et al., Clin. Oncol. 16:505-516 (2004)
【非特許文献6】Trojan et al., Anticancer Res. 25:551-561 (2005)
【非特許文献7】Weitz et al., 2005, Lancet 365:153-65
【非特許文献8】Spiro et al., Am. J. Respir. Crit. Care Med. 166: 1166-1196 (2002)
【非特許文献9】Jemal et al., CA Cancer J. Clin. 53:5-26 (2003)
【非特許文献10】Beachy et al., Nature 432:324 (2004)
【非特許文献11】Morrison et al., Cell 88:287-298 (1997)
【非特許文献12】Morrison et al., Curr. Opin. Immunol. 9:216-221 (1997)
【非特許文献13】Morrison et al., Annu. Rev. Cell. Dev. Biol. 11:35-71 (1995)
【非特許文献14】Pandis et al., Genes, Chromosomes & Cancer 12:122-129 (1998)
【非特許文献15】Kuukasjrvi et al., Cancer Res. 57:1597-1604 (1997)
【非特許文献16】Bonsing et al., Cancer 71:382-391 (1993)
【非特許文献17】Bonsing et al., Genes Chromosomes & Cancer 82:173-183 (2000)
【非特許文献18】Beerman H. et al., Cytometry. 12:147-154 (1991)
【非特許文献19】Aubele M & Werner M, Analyt. Cell. Path. 19:53 (1999)
【非特許文献20】Shen L et al., Cancer Res. 60:3884 (2000)
【非特許文献21】Lapidot et al., Nature 17:645-648 (1994)
【非特許文献22】Al-Hajj et al., PNAS 100:3983-3988 (2003)
【発明の概要】
【0016】
発明の概要
ある態様では、本発明は、癌幹細胞マーカーを含む可溶性受容体を提供する。ある態様では、可溶性受容体は、癌幹細胞マーカーのリガンドと結合する癌幹細胞マーカーを含む。ある態様では、可溶性受容体は癌幹細胞マーカーを含み、腫瘍細胞の成長を阻害する。ある態様では、可溶性受容体は、ヒトFZD受容体のFriドメインを含む。ある態様では、可溶性受容体は、ヒトFZD受容体のリガンドと結合するヒトFZD受容体のFriドメインを含む。ある態様では、可溶性受容体は、ヒトFZD受容体のFriドメインを含み、腫瘍細胞の成長を阻害する。
【0017】
ある態様では、本発明は、癌幹細胞マーカーを含む可溶性受容体をコードする、単離された核酸分子を提供する。ある態様では、単離された核酸分子は、癌幹細胞マーカーのリガンドと結合する、癌幹細胞マーカーを含む可溶性受容体をコードする。ある態様では、単離された核酸分子は、腫瘍細胞の成長を阻害する、癌幹細胞マーカーを含む可溶性受容体をコードする。ある態様では、単離された核酸分子は、ヒトFZD受容体のFriドメインを含む可溶性受容体をコードする。ある態様では、単離された核酸分子は、ヒトFZD受容体のリガンドと結合する、ヒトFZD受容体のFriドメインを含む可溶性受容体をコードする。ある態様では、単離された核酸分子は、腫瘍細胞の成長を阻害する、ヒトFZD受容体のFriドメインを含む可溶性受容体をコードする。
【0018】
ある態様では、本発明は、腫瘍細胞成長を阻害するために有効な量の、癌幹細胞マーカーを含む可溶性受容体を投与する工程を含む、癌を処置する方法を提供する。ある態様では、癌を処置する方法は、腫瘍細胞成長を阻害するために有効な量の、癌幹細胞マーカーのリガンドと結合する癌幹細胞マーカーを含む可溶性受容体を投与する工程を含む。ある態様では、癌を処置する方法は、腫瘍細胞成長を阻害するために有効な量の、ヒトFZD受容体のFriドメインを含む可溶性受容体を投与する工程を含む。ある態様では、癌を処置する方法は、腫瘍細胞成長を阻害するために有効な量の、ヒトFZD受容体のリガンドと結合するヒトFZD受容体のFriドメインを含む可溶性受容体を投与する工程を含む。
【0019】
本発明の治療用組成物、例えばFzd受容体と結合する抗体またはFzd受容体のリガンドによる活性化を阻止する受容体融合タンパク質を用いて処置することができる充実性腫瘍の例には、繊維肉腫、粘液肉腫、脂肪肉腫、軟骨肉腫、骨原性肉腫、脊索腫、血管肉腫、内皮肉腫、リンパ管肉腫、リンパ管内皮肉腫、滑膜腫、中皮腫、ユーイング腫瘍、平滑筋肉腫、横紋筋肉腫、結腸癌腫、膵臓癌、乳癌、卵巣癌、前立腺癌、扁平上皮癌腫、基底細胞癌腫、腺癌腫、汗腺癌腫、脂腺癌腫、乳頭癌腫、乳頭腺癌腫、嚢胞腺癌腫、髄様癌腫、気管支原生癌腫、腎細胞癌腫、肝臓癌、胆管癌腫、絨毛膜癌腫、精上皮腫、胎児性癌腫、ヴィルムス腫瘍、子宮頸癌、精巣腫瘍、肺癌腫、小細胞肺癌腫、膀胱癌腫、上皮性癌腫、神経膠腫、星状細胞腫、髄芽細胞腫、頭蓋咽頭腫、脳室上衣腫、松果体腫、血管芽細胞腫、聴神経腫、乏突起膠腫、髄膜腫、メラノーマ、神経芽細胞腫、および網膜芽細胞腫などの、しかしそれらに限定されない肉腫および癌腫が非限定的に含まれる。本発明は、卵巣癌および乳癌などの肉腫および上皮癌に適用可能である。
【図面の簡単な説明】
【0020】
【図1】FZD.Fc可溶性受容体の半減期。精製されたFc融合タンパク質を、2匹のマウス各々に腹腔内投与し、投与後様々な時間に血液試料を得た。FZD4 Fri.Fc、FZD5 Fri.FcおよびFZD8 Fri.Fcタンパク質は、注入72時間後に血清中に依然として存在し、FZD5 Fri.FcおよびFZD8 Fri.Fcタンパク質は、注入96時間後まで血清中に存在する。対照的に、FZD5 ECD.Fcは、わずか24時間後には血清中に検出できない(上部)。
【図2】FZD Fc可溶性受容体はWnt3aシグナル伝達を阻害する。Wnt3aリガンドの存在下または非存在下で、FZD4 Fri.Fc、FZD5 ECD.Fc、FZD5 Fri.FcおよびFZD8 Fri.Fcを含む、増大濃度(2nM、5nM、および60nM)のFZD Fc融合タンパク質をL細胞とインキュベーションし、βカテニンの安定化をイムノブロッティングにより測定した。Wnt3aリガンドの非存在下では、βカテニンを検出することはできなかった(LCM)。Wnt3aの存在下でβカテニンは安定化され、この安定化は、FZD5、FZD8およびFZD4 Fc可溶性受容体タンパク質の量を増加させることにより阻止されたが、対照Fcタンパク質(対照Fc)では阻止されなかった。
【図3】FZD Fc可溶性受容体はWntシグナル伝達を阻害する。8×TCF-ルシフェラーゼレポーターにより安定にトランスフェクションされたHEK293細胞を、増加濃度のFZD:Fc可溶性受容体と、Wntl、Wnt2、Wnt3、Wnt3aおよびWnt7bを含む種々のWntリガンドの存在下で、インキュベーションした。ルシフェラーゼ活性の低下によって示されるように、FZD4 Fc、FZD5 FcおよびFZD8 Fc融合タンパク質は、5つのWntリガンドすべてによって媒介されるWntシグナル伝達を阻害した。
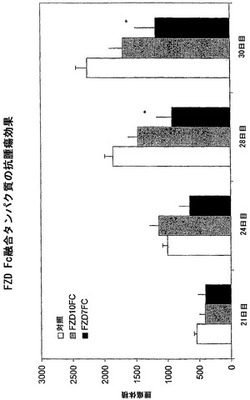
【図4】FZD Fc可溶性受容体タンパク質による腫瘍成長の減少。解離された結腸腫瘍細胞(動物当たり10,000の細胞;n=10)を皮下注射されたNOD/SCIDマウスを、2日後にFZD7 ECD.Fc可溶性受容体、FZD 10ECD.Fc可溶性受容体、または対照注入剤で処理した。総腫瘍体積を21、24、28および30日目について示す。FZD7 ECD.Fcによる腫瘍体積の減少が、28日目および30日目で統計的に有意であった(*)。
【図5】FZD8 Fri.Fc可溶性受容体タンパク質による、Wnt依存性腫瘍成長の防止。50,000個のMMTV WNT1腫瘍由来の細胞を注入されたNOD/SCIDマウス(n=10)を、翌日にFZD8 Fri.Fc可溶性受容体または対照としてPBSで処理した。腫瘍成長を、成長を検出するまで毎週モニターし、次に週に2度腫瘍成長を測定した。対照動物で観察された腫瘍成長(右バー)と比較して、FZD Fri.Fcで処理された動物中の腫瘍成長(左バー)は事実上消失した。
【図6】FZD8 Fri.Fc可溶性受容体タンパク質によるPE13異種移植片腫瘍成長の減少。50,000個のPE13乳房腫瘍細胞を注入されたNOD/SCIDマウス(n=10)を、翌日にFZD8 Fri.Fc可溶性受容体または対照としてPBSで処理した。腫瘍成長を、成長を検出するまで毎週モニターし、次に週に2度腫瘍成長を測定した。対照動物で観察された腫瘍成長(右バー)と比較して、FZD Fri.Fcで処理された動物中の腫瘍成長(左バー)は有意に減少した。
【図7】FZD Fri.Fc可溶性受容体タンパク質による、Wnt依存性腫瘍成長の処理。雌のrag-2/γ系ダブルノックアウトマウスに、50,000個のMMTV Wnt1乳房腫瘍由来の細胞を移植した。5mg/kgのFZD8 Fri.Fcによる処理が、腫瘍の成長を全腫瘍体積の経時的変化により決定したところ、PBSで処理されたマウス(白いバー)に比較して低下させた。10mg/kgおよび30mg/kgのFZD8 Fri.Fcによる処理は、株化前の腫瘍の大きさを縮小させるのにさらに有効であった。対照的に、FZD5 Fri.Fcは、成長にWnt1を必要とする株化乳房腫瘍に対する抗腫瘍効果を発揮しなかった。
【発明を実施するための形態】
【0021】
発明の詳細な説明
定義
本明細書では、用語「アンタゴニスト」を、本明細書に開示する癌幹細胞マーカーの発現または生物活性を部分的にまたは完全に遮断、阻害、あるいは中和する任意の分子を含むように用いるが、そのような生物活性は、腫瘍成長の阻害を非限定的に含む。用語「アンタゴニスト」は、FZD経路の生物活性を部分的にまたは完全に遮断、阻害、または中和する任意の分子を含む。適切なアンタゴニスト分子は、可溶性FZD受容体を含む天然のFZD受容体タンパク質の断片またはアミノ酸配列変異体を非限定的に含む。
【0022】
用語「単離された」および「精製された」とは、ある物質の天然の状態では通常その物質に付随する成分が実質的にまたは本質的に存在しない物質を指す。純度および均一性は、典型的にはポリアクリルアミドゲル電気泳動法または高速液体クロマトグラフィーなどの分析化学技術を用いて決定される。調製物中に存在する主な種であるタンパク質(例えば可溶性受容体)または核酸は、実質的に精製されている。特に単離された核酸とは、自然にはその遺伝子に隣接しかつその遺伝子によってコードされるタンパク質以外のタンパク質をコードするオープンリーディングフレームから、分離されている。単離された抗体は、他の非免疫グロブリンタンパク質および異なる抗原結合特異性を有する他の免疫グロブリンタンパク質から分離されている。これはさらに、核酸またはタンパク質が、少なくとも85%純粋であること、少なくとも95%純粋であること、そしていくつかの態様では少なくとも99%純粋であることを意味しうる。
【0023】
本明細書に用いられる用語「可溶性受容体」および「FZD可溶性受容体」とは、ヒトFZD受容体の第1の膜貫通ドメインに先行し、細胞から可溶性形態で分泌され得る、ヒトFZD受容体タンパク質のN末端細胞外断片を指す。N末端細胞外ドメイン(ECD)(本明細書で「FZD ECD」と呼ぶ)全体およびより小さな断片を含む、FZD可溶性受容体の両方が想定される。Friドメインを含むFZD可溶性受容体(本明細書で「FZD Fri」と呼ぶ)もまた開示される。FZD Fri可溶性受容体は、FZD ECD全体を含む可溶性受容体と比較して、変化した生物活性(例えば、増大したタンパク質半減期)を示すことができる。タンパク質の半減期は、ポリ(エチレングリコール)またはポリ(エチレンオキシド)(両方ともPEGと呼ぶ)との共有結合性修飾によってさらに増大させることができる。FZD可溶性受容体には、ヒトFc(例えば、IgG1、IgG2、IgG3、IgG4、IgA1、IgA2、IgD、IgE、IgMに由来するヒトFc);タンパク質タグ(例えば、myc、FLAG、GST);他の内在性タンパク質またはタンパク質断片;あるいは、FZD ECDまたはFriドメインと連結したタンパク質の間の任意のリンカー領域も含む任意の他の有用なタンパク質配列を非限定的に含む他の機能タンパク質および構造タンパク質にインフレームで融合された、FZD ECDまたはFriドメインが含まれる。ある態様では、FZD受容体のFriドメインがヒトIgG1 Fcに連結されている(本明細書で「FZD Fri.Fc」と呼ぶ)。FZD可溶性受容体には、さらにアミノ酸挿入、欠失、置換、および保存的変化などを有するタンパク質が含まれる。
【0024】
本明細書に用いられる、用語「癌」および「癌性」は、細胞集団が無秩序な細胞成長をすることを特徴とする哺乳動物の生理的症状を指すまたは説明する。癌の例には、癌腫、リンパ腫、芽細胞腫、肉腫、および白血病が非限定的に含まれる。そのような癌のより詳細な例には、扁平上皮癌、小細胞肺癌、非小細胞肺癌、肺の腺癌腫、肺扁平上皮癌腫、腹膜癌、肝細胞癌、胃腸癌、膵臓癌、膠芽腫、子宮頸癌、卵巣癌、肝臓癌、膀胱癌、肝臓癌、乳癌、結腸癌、結腸直腸癌、子宮内膜または子宮癌腫、唾液腺癌腫、腎臓癌、肝臓癌、前立腺癌、外陰部癌、甲状腺癌、肝癌腫、および様々な種類の頭頸部癌が含まれる。
【0025】
用語「増殖性障害」および「増殖性疾病」とは、癌などの異常細胞増殖に関連した障害を指す。
【0026】
本明細書に用いられる「腫瘍」および「新生物」とは、過度の細胞成長または増殖に起因する、良性(非癌性)病変または、前癌を含む悪性(癌性)病変のいずれかの、任意の組織の集塊を指す。
【0027】
本明細書に用いられる「転移」とは、癌が、新しい位置で同様の癌病変の発症を伴って、発生部位から他の身体の領域へと拡張または移行するプロセスを指す。「転移性の」または「転移する」細胞とは、近隣の細胞との粘着性接触を失い、疾病の原発部位から血流またはリンパ液によって移動して、近隣の身体構造へと侵入する細胞である。
【0028】
本明細書に用いられる用語「被検体」とは、特定の処置の受容者となるべき、ヒト、ヒト以外の霊長類、げっ歯動物などを非限定的に含む任意の動物(例えば哺乳動物)を指す。典型的には、ヒト被験体に関しては、「被験体」と「患者」という用語は本明細書において交換可能に用いられる。
【0029】
用語「癌幹細胞」、「腫瘍幹細胞」、または「充実性腫瘍幹細胞」は、本明細書で交換可能に用いられ:(1) 高い増殖能を有し;(2) 増殖または発生能力の低下した1つまたは複数種類の分化した後代細胞を生じるための非対称細胞分裂が可能であり;および (3) 自己再生または自己維持のための対称細胞分裂ができる、充実性腫瘍由来の細胞集団を指す。「癌幹細胞」、「腫瘍幹細胞」、または「充実性腫瘍幹細胞」のこれらの特性によって、これらの癌幹細胞は、腫瘍を形成できない大多数の腫瘍細胞と比較して、免疫不全マウスへの累代移植の際に触診可能な腫瘍を形成できる。充実性腫瘍から腫瘍細胞を得た後、この腫瘍細胞、即ち非腫瘍形成性細胞は、移植の際に限られた回数(例えば1または2回)腫瘍を形成することが出来るが、免疫不全マウスへの累代移植において触診可能な腫瘍を形成する能力を保持しないであろう。癌幹細胞は、無秩序な分化に対して自己再生を受け、突然変異が生じるにつれて経時的に変化することができる異常細胞型を有する腫瘍を形成する。本発明の充実性腫瘍幹細胞は、米国特許第6,004,528号によって提供される「癌幹細胞系統」とは異なる。上記特許では、「癌幹細胞系統」を、それ自体には殆ど突然変異がないが、細胞環境に生じる腫瘍形成性変化の結果として非対称細胞分裂ではなく対称細胞分裂を行う、ゆっくりと成長する始原細胞型であると定義する。したがってこの「癌幹細胞系統」仮説は、主に、比較的正常な幹細胞を蓄積させその後変異を受けてそれらを腫瘍細胞にするような異常な環境の結果、高度に突然変異し急速に増殖している腫瘍細胞が生じることを提唱する。米国特許第6,004,528号は、そのようなモデルを用いて癌の診断を促進できることを提唱する。充実性腫瘍幹細胞モデルは、「癌幹細胞系統」モデルと基本的に異なり、結果として「癌幹細胞系統」モデルによっては提供されない有用性を示す。第1に、充実性腫瘍幹細胞は、「突然変異を免れて」はいない。米国特許第6,004,528号によって記述された「突然変異を免れた癌幹細胞系統」は、前癌病変と考えることができ、その一方で、本発明によって記述される充実性腫瘍幹細胞は、それら自身が腫瘍形成の原因である突然変異を含む癌細胞である。即ち、本発明の充実性腫瘍幹細胞(「癌幹細胞」)は、米国特許第6,004,528号中の「癌幹細胞系統」とは区別される、高度に突然変異された細胞の中に含まれることになる。第2に、癌をもたらす遺伝子突然変異は、環境的なものだけではなく、大部分は充実性腫瘍幹細胞内部の内因性のものであり得る。単離された充実性腫瘍幹細胞は移植の際に追加の腫瘍を生じさせることができることが充実性腫瘍幹細胞モデルによって予測され(したがって転移が説明される)、その一方で「癌幹細胞系統」モデルによって、腫瘍形成性であるそれらの異常な環境のため、移植された「癌幹細胞系統」細胞は新しい腫瘍を生じさせることができないことが予測される。確かに、解離され、表現型によって単離されたヒト充実性腫瘍幹細胞を、依然として新しい腫瘍を形成する場所であるマウスに(正常な腫瘍環境とは非常に異なる環境の中へ)移植可能であることは、本発明を「癌幹細胞系統」モデルから区別する。第3に、充実性腫瘍幹細胞は、対称的におよび非対称的に分割する可能性があり、したがって対称細胞分裂は絶対の特性ではない。第4に、充実性腫瘍幹細胞は、多くの変数に依存して、急速にまたは緩慢に分裂することができ、したがって遅い増殖速度は決定的な特性ではない。
【0030】
用語「癌細胞」、「腫瘍細胞」、およびそれらの文法上の等価物は、腫瘍細胞集団の大部分を含む非腫瘍形成性細胞および、本明細書では癌幹細胞とも呼ぶ腫瘍形成性幹細胞の両方を含む、腫瘍に由来する細胞の全集団を指す。
【0031】
本明細書で用いられる「腫瘍形成性」とは、充実性腫瘍幹細胞が腫瘍を形成することを可能にする、自己再生(新たな腫瘍形成性癌幹細胞を生ずる)および他の全ての腫瘍細胞を生成するための増殖(分化し、したがって非腫瘍形成性の腫瘍細胞を生ずる)という特性を含む、充実性腫瘍幹細胞の機能的な性質を指す。累代移植で腫瘍を形成することができない大多数の腫瘍細胞と比較して、自己再生および他の全ての腫瘍細胞を生成するための増殖というこれらの特性によって、本発明の癌幹細胞は、免疫不全マウスへの累代移植の際に触診可能な腫瘍を形成することができる。腫瘍細胞、即ち非腫瘍形成性腫瘍細胞は、充実性腫瘍から腫瘍細胞を得た後、免疫不全マウスへの移植の際に、限られた回数(例えば1または2回)腫瘍を形成し得る。
【0032】
本明細書に用いられる用語「幹細胞癌マーカー」、「癌幹細胞マーカー」、「腫瘍幹細胞マーカー」、または「充実性腫瘍幹細胞マーカー」とは、単独または他の遺伝子と組み合わせたその発現レベルが、非腫瘍形成性細胞と比較して腫瘍形成性癌細胞の存在と相関関係にある、1つもしくは複数の遺伝子、またはその1つもしくは複数の遺伝子により発現されるタンパク質、ポリペプチド、あるいはペプチドを指す。相関関係は、遺伝子の発現の増加または減少(例えば、遺伝子によってコードされるmRNAまたはペプチドレベルの増加または減少)のいずれかに関連しうる。
【0033】
本明細書に用いられる用語「生検」および「生検組織」とは、試料が癌組織を含むかどうかを決定する目的で被検体から取り出される、組織または流体の試料を指す。いくつかの態様では、被検体が癌を有する疑いがあるので、生検組織または流体を得る。次に生検組織または流体を、癌の有無について検査する。
【0034】
本明細書で用いる「許容される薬学的担体」とは、抗体などの薬学的組成物の有効成分と組み合わせた時、例えば抗体がその生物活性を保持することを可能にする、任意の物質を指す。さらに、「許容される薬学的担体」は、レシピエントの免疫応答を引き起こさない。例として、リン酸緩衝食塩水、水、および様々な油/水乳剤などの、任意の標準的な薬学的担体が非限定的に挙げられる。エアロゾルまたは非経口投与のための希釈剤の例は、リン酸緩衝食塩水または生理(0.9%)食塩水である。
【0035】
用語「治療的有効量」とは、被検体もしくは哺乳動物の疾病または障害を「処置する」ために有効な、可溶性受容体または他の薬物の量を指す。癌の場合には、治療的有効量の薬物は、癌細胞の数を減少させ;腫瘍の大きさを縮小させ;辺縁の器官への癌細胞浸潤を阻害または停止させ;腫瘍転移を阻害または停止させ;腫瘍成長を阻害または停止させ;および/または癌に関連した1つまたは複数の症状をある程度軽減することができる。薬物が既存の癌細胞の成長を防止しおよび/または殺す範囲では、それを細胞成長抑制性および/または細胞毒性であると言うことができる。
【0036】
本明細書に用いる用語「腫瘍成長を阻害する」とは、腫瘍細胞成長を阻害することができる任意の機構を指す。ある態様では、腫瘍細胞の増殖を遅くすることにより腫瘍細胞成長を阻害する。ある態様では、腫瘍細胞の増殖を停止させることにより腫瘍細胞成長を阻害する。ある態様では、腫瘍細胞を殺すことにより腫瘍細胞成長を阻害する。ある態様では、腫瘍細胞のアポトーシスを引き起こすことにより腫瘍細胞成長を阻害する。ある態様では、腫瘍細胞から栄養を奪うことにより腫瘍細胞成長を阻害する。ある態様では、腫瘍細胞の移動を防止することにより腫瘍細胞成長を阻害する。ある態様では、腫瘍細胞の侵入を防止することにより腫瘍細胞成長を阻害する。
【0037】
本明細書に用いる「診断を提供する」または「診断情報」とは、患者が疾病または症状を有するかどうか判断する際に;および/または、疾病もしくは症状を表現型のカテゴリーに分類する際に、あるいは疾病もしくは症状の予後診断または処置(処置一般または任意の特定の処置のいずれか)に対する予想される応答に関して重要性を有する任意のカテゴリーに分類する際に役立つ、任意の情報を指す。同様に、診断とは、被検体が症状(腫瘍などの)を持つ可能性が高いかどうか、腫瘍の性質または分類、例えばリスクの高い腫瘍またはリスクの低い腫瘍に関する情報、予後に関する情報、および/または適切な処置を選択するのに役立つ情報を非限定的に含む、任意の種類の診断情報を提供することを指す。処置の選択には、特定の化学療法剤または手術もしくは放射線などの他の処置様式の選択、あるいは療法を保留するべきか提供するべきかに関する選択が含まれ得る。
【0038】
本明細書に用いる用語「予後診断を提供する」、「予後情報」または「予測情報」とは、被検体の将来の健康(例えば予期される罹患率または死亡率、癌に罹る可能性、および転移の危険性)に対する(例えば本発明の診断法によって決定される)癌の存在の影響に関する情報を提供することを指す。
【0039】
「処置する」、「処置」、「処置すること」、「軽減する」、および「軽減すること」などの用語は、1) 診断された病理的症状または障害を治癒し、遅らせ、症状を減少させ、かつ/またはそれらの進行を停止させる治療的方策、および 2) 標的とする病理的症状または障害の発生を予防するかまたは遅延させる予防もしくは防止処置の両方を指す。したがって、処置を必要とする人々には、既に障害を有する人々;障害を有しやすい人々;および障害が予防されるべき人々が含まれる。患者が、下記の1つまたは複数を示せば、本発明の方法による被検体の「処置」は成功である:癌細胞数の減少またはその完全な消失;腫瘍の大きさの減少;軟組織および骨の中への癌の展開を含む、辺縁器官への癌細胞浸潤の阻害または非存在;腫瘍転移の阻害または非存在;腫瘍成長の阻害または非存在;特定の癌に関連する1つまたは複数の症状の軽減;低下した罹患率および死亡率;および生活の質の改善。
【0040】
本明細書に用いられる用語「ポリヌクレオチド」および「核酸」とは、リン酸ジエステル結合によって連結された多数のヌクレオチドユニット(リボヌクレオチドまたはデオキシリボヌクレオチド、または関連する構造変異種)から構成されるポリマーを指し、DNAまたはRNAを非限定的に含む。この用語は、4アセチルシトシン、8-ヒドロキシ-N6-メチルアデノシン、アジリジニルシトシン、プソイドイソシトシン、5(カルボキシヒドロキシル-メチル)ウラシル、5-フルオロウラシル、5ブロモウラシル、5-カルボキシメチルアミノメチル2チオウラシル、5カルボキシメチル-アミノメチルウラシル、ジヒドロウラシル、イノシン、N6イソペンテニルアデニン、1メチルアデニン、1-メチルプソイド-ウラシル、1メチルグアニン、1メチルイノシン、2,2-ジメチル-グアニン、2メチルアデニン、2メチルグアニン、3-メチル-シトシン、5メチルシトシン、N6メチルアデニン、7メチルグアニン、5メチルアミノメチルウラシル、5-メトキシ-アミノ-メチル2チオウラシル、βDマンノシルキューオシン(queosine)、5'メトキシカルボニルメチルウラシル、5メトキシウラシル、2メチルチオN6イソペンテニルアデニン、ウラシル5オキシ酢酸メチルエステル、ウラシル5オキシ酢酸、オキシブトキソシン(oxybutoxosine)、プソイドウラシル、キューオシン、2チオシトシン、5-メチル-2チオウラシル、2-チオウラシル、4チオウラシル、5-メチルウラシル、N-ウラシル5オキシ酢酸メチルエステル、ウラシル5オキシ酢酸、プソイドウラシル、キューオシン、2-チオシトシン、および2,6ジアミノプリンを非限定的に含む、DNAおよびRNAの任意の公知の塩基類似体を含む配列を包含する。
【0041】
用語「遺伝子」とは、ポリペプチド、前駆体、またはRNA (例えばrRNA、tRNA)の産生に必要なコード配列を含む核酸(例えばDNA)分子を指す。ポリペプチドは、全長または断片の望ましい活性または機能特性(例えば酵素活性、リガンド結合、信号変換、免疫原性など)を保持する限り、全長のコード配列、またはコード配列の任意の部分によってコードされることができる。この用語はまた、構造遺伝子のコード領域、ならびにコード領域の5'および3'端の両方に隣接して位置する配列であって、いずれかの端において遺伝子が全長のmRNAの長さに対応するように約1kbまたはそれ以上の距離に及ぶものを包含する。コード領域の5'に位置し、mRNA上に存在する配列は、5'非翻訳配列と呼ばれる。コード領域の3'即ち下流に位置し、mRNA上に存在する配列は、3'非翻訳配列と呼ばれる。用語「遺伝子」は、遺伝子のcDNAおよびゲノム形式の両方を包含する。遺伝子のゲノム形式またはクローンは、「イントロン」または「介在領域」あるいは「介在配列」と名付けられた非コード配列によって中断されたコード領域を含む。イントロンは核RNA (hnRNA)へ転写される遺伝子の区画であり;イントロンは、エンハンサーなどの調節エレメントを含むことができる。イントロンは、核または一次転写産物から除去、即ち「スプライシング除去」され;したがって、イントロンはメッセンジャーRNA (mRNA)転写物中には存在しない。mRNAは翻訳中に機能して、合成途中のポリペプチド中のアミノ酸の配列即ち順序を指定する。イントロンを含むことに加えて、遺伝子のゲノム形式は、さらにRNA転写物上に存在する配列の5'および3'端の両方に位置する配列を含むことができる。これらの配列は、「隣接」配列または領域と呼ばれる(これらの隣接配列は、mRNA転写物上に存在する非翻訳配列の5'または3'に位置する)。5'隣接領域は、遺伝子の転写を制御するかまたはこれに影響を及ぼすプロモーターおよびエンハンサーなどの調節配列を含むことができる。3'隣接領域は、転写の終了、転写後の切断およびポリアデニル化を指示する配列を含むことができる。
【0042】
用語「組換え体」は、細胞、核酸、タンパク質またはベクターに関して用いられるとき、異種の核酸またはタンパク質の導入、天然の核酸またはタンパク質の改変によって、細胞、核酸、タンパク質またはベクターが修飾されたこと、または細胞がそのような修飾された細胞に由来することを示す。したがって、例えば組換え細胞は、天然(非組換え)型の細胞中に見出されない遺伝子を発現するか、あるいは、天然の遺伝子を過剰に発現し、そうでなければ異常に発現され、例えば、自然には起こらない断片またはスプライシング変異体として発現される。本明細書では用語「組換え核酸」とは、通常は核酸の操作によって、例えばポリメラーゼおよびエンドヌクレアーゼを用いて、本来はインビトロで形成される、天然には通常見出されない形式の核酸を意味する。このように、種々の配列の機能的連結が達成される。したがって、通常結合されないDNA分子のライゲーションによりインビトロで形成された、直鎖状の単離された核酸分子または発現ベクターは両方とも、本発明の目的のためには組換え体であるとみなされる。一旦組換え核酸分子が作製されて宿主細胞または生物体に導入されると、それは、非組換え的に、即ち、インビトロ操作ではなく宿主細胞のインビボの細胞機構を用いて複製するであろうことが理解される。しかし、一旦組換え的に産生されたそのような核酸は、その後非組換え的に複製されるとしても、本発明の目的に関しては依然として組換え体であるとみなされる。同様に、「組換えタンパク質」とは、組換え技術を用いて、すなわち、上に記載したような組換え核酸分子の発現を通じて作製されたタンパク質である。
【0043】
本明細書で用いる用語「異種遺伝子」とは、自身の自然環境にはない遺伝子を指す。例えば、異種遺伝子は、1つの種から別の種へ導入された遺伝子を含む。異種遺伝子とはまた、(例えば、突然変異、複数コピーでの添加、非天然調節配列への連結などの)何らかの形で改変されている、生物体にとって天然である遺伝子を含む。異種遺伝子配列が、染色体中で該遺伝子配列との結合を天然には認められないDNA配列に典型的には結合しているか、あるいは自然には認められない染色体部分(例えば通常は遺伝子が発現されない遺伝子座において発現した遺伝子)と結合しているという点で、異種遺伝子は内因性遺伝子と区別される。
【0044】
本明細書で用いる用語「ベクター」は、DNA画分を1つの細胞から別の細胞へ移植する核酸分子について用いられる。用語「媒体」は、「ベクター」と交換可能に用いられることがある。ベクターは、しばしばプラスミド、バクテリオファージ、あるいは植物または動物ウイルスに由来する。
【0045】
「ライゲーション」とは、2つの二重鎖核酸断片間にリン酸ジエステル結合を形成するプロセスを指す。別段の定めのない限り、公知の緩衝液および条件を用いて、ほぼ等モル量のライゲーションされるべきDNA断片0.5ugにつき10単位のT4DNAリガーゼ(「リガーゼ」)により、ライゲーションを遂行することができる。核酸のライゲーションは、2つのタンパク質をインフレームで互いに連結されて、単一のタンパク質、即ち融合タンパク質を生成する役割を果たすことができる。
【0046】
本明細書で用いる用語「遺伝子発現」とは、遺伝子中にコードされた遺伝情報を、遺伝子の「転写」を通じて(例えば、RNAポリメラーゼの酵素作用により)、RNA (例えば、mRNA、rRNA、tRNAまたはsnRNA)へ変換するプロセス、およびタンパク質をコードする遺伝子については、mRNAの「翻訳」によってタンパク質へ変換するプロセスを指す。遺伝子発現を、プロセス中の多くの段階で調節することができる。「アップレギュレーション」または「活性化」とは、遺伝子発現産物(例えばRNAまたはタンパク質)の産生を増大させる調節を指し、「ダウンレギュレーション」または「抑制」とは、産生を減少させる調節を指す。アップレギュレーションまたはダウンレギュレーションに関係する分子(例えば転写因子)は、それぞれしばしば「アクチベーター」および「リプレッサー」と呼ばれる。
【0047】
用語「ポリペプチド」、「ペプチド」、「タンパク質」および「タンパク質断片」は交換可能に本明細書で用いられ、アミノ酸残基のポリマーを指す。この用語は、天然のアミノ酸ポリマーおよび非天然のアミノ酸ポリマーはもとより、1つまたは複数のアミノ酸残基が対応する天然のアミノ酸の人工化学的模倣体である、アミノ酸ポリマーにも用いられる。
【0048】
用語「アミノ酸」とは、天然のおよび合成のアミノ酸、ならびに天然のアミノ酸と同様に機能するアミノ酸類似体およびアミノ酸模倣体を指す。天然のアミノ酸は、遺伝子コードによってコードされたアミノ酸、ならびに後で修飾されたアミノ酸、例えばヒドロキシプロリン、γ-カルボキシグルタミン酸、O-ホスホセリンである。アミノ酸類似体は、天然のアミノ酸と同じ基礎的化学構造、例えば水素、カルボキシル基、アミノ基、およびR基に結合されているα炭素を有する化合物、例えばホモセリン、ノルロイシン、メチオニンスルホキシド、メチオニンメチルスルホニウムを指す。そのような類似体は、修飾されたR基(例えばノルロイシン)または修飾されたペプチド骨格を有することができるが、天然のアミノ酸と同じ基礎的な化学構造を保持する。アミノ酸模倣体とは、アミノ酸の一般的な化学構造とは異なる構造を有するが、天然のアミノ酸と同様に機能する化学化合物を指す。
【0049】
「保存的修飾変異体」は、アミノ酸および核酸配列の両方に用いられる。「アミノ酸変異体」はアミノ酸配列を指す。特定の核酸配列について、保存的修飾変異体とは、同一のまたは本質的に同一のアミノ酸配列をコードする核酸を指し、あるいは、核酸がアミノ酸配列をコードしない場合には、本質的に同一の配列または関連した(例えば、自然に隣接する)配列を指す。遺伝子コードの縮退のために、多数の機能的に同一の核酸が大部分のタンパク質をコードする。例えば、コドンGCA、GCC、GCGおよびGCUはすべて、アミノ酸のアラニンをコードする。したがって、コドンがアラニンを指定するすべての位置で、コードされるポリペプチドを改変することなく、コドンを、前述した対応する別のコドンに改変することができる。そのような核酸変異は「サイレントな変異」であり、保存的に修飾された変異の一種である。あるポリペプチドをコードする本明細書の核酸配列のすべては、核酸のサイレントな変異も含めて記述している。特定の文脈において、核酸中の各コドン(通常メチオニンのただ1つのコドンであるAUG、および通常トリプトファンのただ1つのコドンであるTGGを除く)を修飾して機能的に同一の分子を産出することができることを、当業者は認識するであろう。従って、ポリペプチドをコードする核酸のサイレントな変異は、発現産物については、記載される配列中で潜在しているが、実際のプローブ配列ではそうではない。アミノ酸配列については、改変が化学的に類似したアミノ酸によるアミノ酸置換をもたらす場合を含め、コード配列中の単一のアミノ酸または数パーセントのアミノ酸を改変するか、追加するか、または欠失させる核酸、ペプチド、ポリペプチドまたはタンパク質配列への個々の置換、欠失または追加は「保存的に修飾された変異体」であることを、当業者は認識するであろう。機能的に類似のアミノ酸を提供する保存的置換表が、当技術分野において周知である。そのような保存的修飾変異体は、本発明の多型変異体、異種間同族体、および対立遺伝子に含まれ、それらを除外するものではない。典型的には、保存的置換には以下のものが含まれる:1) アラニン(A)、グリシン(G);2) アスパラギン酸(D)、グルタミン酸(E);3) アスパラギン(N)、グルタミン(Q);4) アルギニン(R)、リジン(K);5) イソロイシン(I)、ロイシン(L)、メチオニン(M)、バリン(V);6) フェニルアラニン(F)、チロシン(Y)、トリプトファン(W);7) セリン(S)、スレオニン(T);および 8) システイン(C)、メチオニン(M)(例えば Creighton, Proteins (1984)を参照のこと)。
【0050】
本明細書で用いる用語「エピトープタグを付けた」とは、「エピトープタグ」に融合された癌幹細胞マーカータンパク質、あるいはそのドメイン配列またはその部分を含むキメラポリペプチドを指す。エピトープタグポリペプチドは、抗体による認識用のエピトープを提供するためには十分であるが、癌幹細胞マーカータンパク質の活性を邪魔しない程度に十分に短いアミノ酸残基を含む。適当なエピトープタグは、一般に少なくとも6アミノ酸残基、通常約8〜約50アミノ酸残基、または約10〜約20アミノ酸残基を有する。一般に使用されるエピトープタグには、Fc、HA、His、およびFLAGタグが含まれる。
【0051】
本明細書で用いる「約」とは、表示した数のプラスマイナス10%を指す。例えば、「約10%」とは、9%〜11%の範囲を示す。
【0052】
発明の詳細な説明
本発明は、癌を研究し、診断し、特徴決定し、処置するための組成物および方法を提供する。特に本発明は、充実性腫瘍幹細胞マーカーに対するアンタゴニスト、およびこれらのアンタゴニストを用いてヒト患者中の腫瘍成長を阻害し、癌を処置する方法を提供する。アンタゴニストには、癌幹細胞マーカーを含む可溶性受容体タンパク質が含有される。ある態様では、本発明は、腫瘍細胞の成長を阻害するヒトFZD受容体のFriドメインを含む可溶性受容体を提供する。ある態様では、可溶性受容体は、ヒトFZD4のFriドメインを含む。ある態様では、可溶性受容体は、配列番号:8のアミノ酸配列を含むヒトFZD4のFriドメインを含む。ある態様では、可溶性受容体は、非FZD受容体タンパク質配列にインフレームで連結されたヒトFZD4のFriドメインを含む。ある態様では、可溶性受容体は、ヒトFcにインフレームで連結されたヒトFZD4のFriドメインを含む。ある態様では、可溶性受容体は、ヒトIgG1 Fcにインフレームで連結されたヒトFZD4のFriドメインを含む。ある態様では、可溶性受容体は、配列番号:4に示すアミノ酸配列を含むヒトIgG1Fcにインフレームで連結されたヒトFZD4のFriドメインを含む。
【0053】
ある態様では、可溶性受容体は、ヒトFZD5のFriドメインを含む。ある態様では、可溶性受容体は、配列番号:9のアミノ酸配列を含むヒトFZD5のFriドメインを含む。ある態様では、可溶性受容体は、非FZD受容体タンパク質配列にインフレームで連結された、ヒトFZD5のFriドメインを含む。ある態様では、可溶性受容体は、ヒトFcにインフレームで連結されたヒトFZD5のFriドメインを含む。ある態様では、可溶性受容体は、ヒトIgG1 Fcにインフレームで連結されたヒトFZD5のFriドメインを含む。ある態様では、可溶性受容体は、配列番号:4に示すアミノ酸配列を含むヒトのIgG1 Fcにインフレームで連結されたヒトFZD5のFriドメインを含む。
【0054】
ある態様では、可溶性受容体は、ヒトFZD8のFriドメインを含む。ある態様では、可溶性受容体は、配列番号:7のアミノ酸配列を含むヒトFZD8のFriドメインを含む。ある態様では、可溶性受容体は、非FZD受容体タンパク質配列にインフレームで連結された、ヒトFZD8のFriドメインを含む。ある態様では、可溶性受容体は、ヒトFcにインフレームで連結されたヒトFZD8のFriドメインを含む。 ある態様では、可溶性受容体は、ヒトIgG1 Fcにインフレームで連結されたヒトFZD8のFriドメインを含む。ある態様では、可溶性受容体は、配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcにインフレームで連結されたヒトFZD8のFriドメインを含む。
【0055】
ある態様では本発明は、配列番号:8に示すアミノ酸配列を含むヒトFZD4のFriドメインをコードする核酸配列および配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcをコードする核酸配列を含む可溶性受容体をコードする、単離された核酸を提供する。ある態様では、本発明は、配列番号:8に示すアミノ酸配列を含むヒトFZD4のFriドメインをコードする核酸配列および配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcをコードする核酸配列を含む、ベクターを提供する。ある態様では、ベクターは、ベクターで形質転換された宿主細胞によって認識される制御配列に機能的に連結される。ある態様では、本発明は、配列番号:8に示すアミノ酸配列を含むヒトFZD4のFriドメインをコードする核酸配列および配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcをコードする核酸配列を含むベクターを含む、単離された宿主細胞を提供する。
【0056】
ある態様では、本発明は、配列番号:9に示すアミノ酸配列を含むヒトFZD5のFriドメインをコードする核酸配列および配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcをコードする核酸配列を含む可溶性受容体をコードする、単離された核酸分子を提供する。ある態様では、本発明は、配列番号:9に示すアミノ酸配列を含むヒトFZD5のFriドメインをコードする核酸配列および配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcをコードする核酸配列を含む、ベクターを提供する。ある態様では、ベクターは、ベクターで形質転換された宿主細胞によって認識される制御配列に機能的に連結される。ある態様では、本発明は、配列番号:9に示すアミノ酸配列を含むヒトFZD5のFriドメインをンコードする核酸配列および配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcをコードする核酸配列を含むベクターを含む、単離された宿主細胞を提供する。
【0057】
ある態様では、本発明は、 配列番号:7に示すアミノ酸配列を含むヒトFZD8のFriドメインをコードする核酸配列;および 配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcをコードする核酸配列を含む可溶性受容体をコードする、単離された核酸分子を提供する。ある態様では、本発明は、配列番号:7に示すアミノ酸配列を含むヒトFZD8のFriドメインをコードする核酸配列および配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcをコードする核酸配列を含む、ベクターを提供する。ある態様では、ベクターは、ベクターで形質転換された宿主細胞によって認識される制御配列に機能的に連結される。ある態様では、本発明は、配列番号:7に示すアミノ酸配列を含むヒトFZD8のFriドメインをンコードする核酸配列および配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcをコードする核酸配列を含むベクターを含む、単離された宿主細胞を提供する。
【0058】
ある態様では、本発明は、可溶性受容体を含む薬学的組成物を提供する。ある態様では、薬学的組成物は、ヒトFZD受容体のFriドメインを含む可溶性受容体を含む。ある態様では、薬学的組成物は、ヒトFZD4受容体のFriドメインを含む可溶性受容体を含む。ある態様では、薬学的組成物は、ヒトFZD5受容体のFriドメインを含む可溶性受容体を含む。ある態様では、薬学的組成物は、ヒトFZD8受容体のFriドメインを含む可溶性受容体を含む。
【0059】
ある態様では、本発明は、腫瘍細胞の成長を阻害するために有効な量の、ヒトFZD受容体のFriドメインを含む可溶性受容体を投与する工程を含む、癌を処置する方法を提供する。ある態様では、癌を処置する方法は、腫瘍細胞の成長を阻害するために有効な量の、ヒトFZD4受容体のFriドメインを含む可溶性受容体を投与する工程を含む。ある態様では、癌を処置する方法は、腫瘍細胞の成長を阻害するために有効な量の、ヒトFZD5受容体のFriドメインを含む可溶性受容体を投与する工程を含む。ある態様では、癌を処置する方法は、腫瘍細胞の成長を阻害するために有効な量の、ヒトFZD8受容体のFriドメインを含む可溶性受容体を投与する工程を含む。
【0060】
ある態様では、癌を処置する方法は、腫瘍細胞の成長を阻害するために有効な量の、非FZD受容体タンパク質配列にインフレームで連結されたヒトFZD受容体のFriドメインを含む可溶性受容体を投与する工程を含む。ある態様では、癌を処置する方法は、腫瘍細胞の成長を阻害するために有効な量の、ヒトFcにインフレームで連結されたヒトFZD受容体のFriドメインを含む可溶性受容体を投与する工程を含む。ある態様では、癌を処置する方法は、腫瘍細胞の成長を阻害するために有効な量の、ヒトIgG1 Fcにインフレームで連結されたヒトFZD受容体のFriドメインを含む可溶性受容体を投与する工程を含む。ある態様では、癌を処置する方法は、腫瘍細胞の成長を阻害するために有効な量の、配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcにインフレームで連結されたヒトFZD受容体のFriドメインを含む可溶性受容体を投与する工程を含む。
【0061】
ある態様では、本発明は、放射線療法と組み合わせて、腫瘍細胞の成長を阻害するために有効な量の、ヒトFZD受容体のFriドメインを含む可溶性受容体を投与する工程を含む、癌を処置する方法を提供する。ある態様では、癌を処置する方法は、化学療法と組み合わせて、腫瘍細胞成長を阻害するために有効な量の、ヒトFZD受容体のFriドメインを含む可溶性受容体を投与する工程を含む。ある態様では、癌を処置する方法は、乳房腫瘍、結腸直腸腫瘍、肺腫瘍、膵臓腫瘍、前立腺腫瘍、または頭頸部腫瘍に由来する腫瘍細胞の腫瘍細胞成長を阻害するために有効な量の、ヒトFZD受容体のFriドメインを含む可溶性受容体を投与する工程を含む。
【0062】
幹細胞および充実性腫瘍幹細胞
一般的な癌は、短命な成熟細胞を補充する役割を担う成長細胞の部分集団を含む組織で発生する。そのような器官では、細胞成熟は階層化されており、ごくわずかな幹細胞が、より分化した細胞を生じること、および自己再生と呼ばれるプロセスを通じて幹細胞自身を永続させることの両方を行う(Akashi & Weissman, Developmental Biology of Hematopoiesis, Oxford Univ. Press, NY (2001); Spangrude et al., Science 247:58-61 (1988); Baum et al, PNAS 89:2804-2808 (1992); Morrison et al., PNAS 92: 10302-20306 (1995); Morrison et al., Immunity 5:207-216 (1996); Morrison et al., Annu. Rev. Cell Dev. Biol 11:35-71 (1995); Morrison et al, Dev. 124:1929-1939 (1997); Morrison & Weissman, Immunity 1:661 (1994); Morrison et al, Cell 88:287-298 (1997); Uchida et al., PNAS 97:14720-14725 (2000); Morrison et al., Cell 101:499-510 (2000))。ほとんどの組織が幹細胞を含む可能性があるが、希少であるので、その生物学的、分子的および生化学的特性を研究するためにわずか数種の組織においてしか、これらの細胞は厳密に同定および精製されていない。最も良く特徴決定された幹細胞は、造血幹細胞(HSC)と呼ばれる、造血系を生じさせる幹細胞である。骨髄破壊プロトコルに続いて血液リンパ系を再生するための骨髄移植に関するその大規模使用によって、癌治療におけるHSCの有用性は実証されている(Baum et al., Bone Marrow Transplantation, Blackwell Scientific Publications, Boston (1994))。癌が発生する組織、および特にそれらの組織中に存在する幹細胞の細胞生物学を理解することによって、癌生物学に対する新しい洞察力が提供されることが約束される。
【0063】
充実性腫瘍は、それらが生ずる組織と同様に、異種の細胞の集団から成る。これらの細胞の大多数が腫瘍形成能を欠くことが、充実性腫瘍の発生および維持もまた、増殖しかつさらなる腫瘍幹細胞(自己再生)および腫瘍形成能力を欠くより分化した腫瘍細胞の大多数(即ち非腫瘍形成性癌細胞)の両方を効率的に生じる能力を有する幹細胞小集団(即ち腫瘍形成性癌細胞)に依存していることを示唆した。癌幹細胞の概念はHSCの発見の直後にまず導入され、急性骨髄性白血病(AML)において実験的に確立された(Park et al., J. Natl. Cancer Inst. 46:411-422 (1971); Lapidot et al., Nature 367:645-648 (1994); Bonnet & Dick, Nat. Med. 3:730-737 (1997); Hope et al., Nat. Immunol. 5:738-743 (2004))。充実性腫瘍由来の幹細胞は、より最近、その細胞表面受容体発現の独特なパターンならびに培養中および異種移植片動物モデル中での自己再生および成長特性の評価に基づいて、単離された。分画されていない腫瘍細胞と比較して、50倍を上回る腫瘍形成能力を有するESA+CD44+CD24-/low系列集団が発見された(Al-Hajj et al., PNAS 100:3983-3988 (2003))。大量の非腫瘍形成性腫瘍細胞から腫瘍形成性癌幹細胞を単離できる能力が、マイクロアレイ分析を用いた癌幹細胞マーカーである非腫瘍形成性腫瘍細胞または正常な乳房上皮と比較して癌幹細胞中で差示的な発現を有する遺伝子の同定につながった。本発明は、これらの同定された癌幹細胞マーカーの知識を利用して、癌を研究し、特徴決定し、診断し、処置を行う。
【0064】
癌幹細胞マーカータンパク質
正常な幹細胞および癌幹細胞は共に、増殖能力および自己再生能力を共有するので、正常な幹細胞の発生を調節する多くの遺伝子が腫瘍形成に寄与することは驚くに当たらない(Reya et al., Nature 414:105-111 (2001) および Taipale & Beachy, Nature 411:349-354 (2001)に概説されている)。本発明は、Wntシグナル伝達経路を癌幹細胞の維持に関連付ける、例えばFZD4、FZD5およびFZD8を含むFzd受容体を、癌幹細胞のマーカーとしておよびこれらの腫瘍形成性細胞の除去によって癌を処置する標的として同定する。
【0065】
Wntシグナル伝達経路は、胚パターン形成、後胚期組織維持および幹細胞生物学のいくつかの重大な調節因子の1つである。より具体的には、Wntシグナル伝達は、幹細胞集団による自己再生を含む、細胞極性の生成および細胞運命指定に重要な役割を果たす。Wnt経路の未調節活性化は多数のヒト癌に関連するが、その場合、Wnt経路は、腫瘍細胞の発生運命を変更して、未分化の増殖状態にそれらを保持することができる。このように発癌は、幹細胞による正常な発生および組織修復を制御するホメオスタシス機構を奪うことによって、進行することができる(Reya & Clevers, Nature 434:843 (2005); Beachy et al., Nature 432:324 (2004)に概説されている)。
【0066】
Wntシグナル伝達経路は、ショウジョウバエ(Drosophila)の発生突然変異体であるwingless(wg)において、およびマウス癌原遺伝子int-1(現在はWnt1)から、最初に解明された(Nusse & Varmus, Cell 31:99-109 (1982); Van Ooyen & Nusse, Cell 39:233-240 (1984); Cabrera et al., Cell 50:659-663 (1987); Rijsewijk et al., Cell 50:649-657 (1987))。Wnt遺伝子は、脂質で修飾された分泌糖タンパク質をコードし、そのうち19種が哺乳動物中で同定されている。これらの分泌されたリガンドは、Frizzled (Fzd)受容体ファミリーメンバーと低密度リポタンパク質(LDL)受容体関連タンパク質5または6 (LPR5/6)からなる受容体複合体を活性化する。Fzd受容体は、Gタンパク質共役受容体(GPCR)スーパーファミリーの7回膜貫通ドメインタンパク質であって、高システインドメイン(CRD)またはFriドメインとして知られる、10個の保存されたシステインを有する大きな細胞外N末端リガンド結合ドメインを含む。10種のヒトFZD受容体(FZD1〜10)が存在する。異なるFzdCRDは、特異的なWntに対して異なる結合親和性を有しており(Wu & Nusse, J. Biol Chem. 277:41762- 41769 (2002))、Fzd受容体は、下記の標準β-カテニン経路を活性化するものと非標準経路を活性化するものに分類されている(Miller et al., Oncogene 18:7860-7872 (1999))。LRP5/6は、Fzdとリガンドの結合に寄与する、6つのYWTDアミノ酸反復によって隔てられた4つの細胞外EGF様ドメインを有する単一通過膜貫通型タンパク質である(Johnson et al., J. Bone Mineral Res 19:1749 (2004))。
【0067】
受容体結合により活性化された標準Wntシグナル伝達経路は、Fzd受容体と直接に相互作用する細胞質タンパク質Dishevelled (Dsh)によって仲介され、βカテニンの細胞質での安定化および蓄積をもたらす。Wntシグナルが存在しない場合は、βカテニンは、腫瘍抑制タンパク質である大腸腺腫様ポリポーシス(APC)およびオーキシンを含む細胞質の分解複合体に局在する。これらのタンパク質は、グリコーゲン合成酵素キナーゼ(GSK)-3βが、βカテニンに結合してリン酸化し、これをユビキチン/プロテアソーム経路を介した分解用に指定するための重大な足場として機能する。Dshの活性化が、GSK3βのリン酸化および分解複合体の解離をもたらす。蓄積された細胞質のβカテニンは次に核へ輸送され、そこでTcf/LefファミリーのDNA結合性タンパク質と相互作用して、転写を活性化する。
【0068】
標準シグナル伝達経路に加えて、Wntリガンドはさらにβカテニン非依存経路も活性化する(Veeman et al., Dev. Cell 5:367-377 (2003))。非標準Wntシグナル伝達は多数のプロセスに関係していることが示されているが、最も確実なのは、ショウジョウバエの平面細胞極性(PCP)経路と同様の機構による原腸胚形成運動に関連することである。非標準Wntシグナル伝達の他の有力な機構には、カルシウム流、JNK、ならびに低分子量Gタンパク質およびヘテロ三量体Gタンパク質の両方が含まれる。標準および非標準経路間でしばしば拮抗現象が観察されており、いくつかの証拠によって、非標準シグナル伝達が癌形成を抑制できることが示されている(Olson & Gibo, Exp. Cell Res. 241:134 (1998); Topol et al., J. Cell Biol. 162:899-908 (2003))。
【0069】
造血幹細胞(HSC)は、最もよく理解されている体内の幹細胞であり、Wntシグナル伝達は、それらの正常な維持および白血病性形質転換の両方に関係している(Reya & Clevers, 2005, Nature 434:843)。HSCは、成人の骨髄内の間質間隙に存在する僅かな数の細胞である。これらの細胞は、独自の遺伝子発現プロファイル、ならびにより分化した始原細胞を継続的に生みだして造血システム全体を再構成する能力の両方によって特徴づけられる。HSCおよびそれらの間質微環境の細胞の両方がWntリガンドを発現し、Wntレポーター活性化がインビボでHSC中に存在する。さらにβカテニンおよび精製されたWnt3Aの両方が、マウスのHSCの自己再生をインビトロにおいて促進し、造血システムを再構成するそれらの能力をインビボにおいて増強するが、一方で、Wnt5Aはインビトロにおけるヒト造血始原細胞の拡張およびNOD-SCID異種移植モデルにおける再成長を促進する(Reya et al., Nature 423:409-414 (2003); Willert et al., Nature 423:448-452 (2003); Van Den Berg et al, Blood 92:3189- 3202 (1998); Murdoch et al., PNAS 100:3422-3427 (2003))。
【0070】
Wntシグナル伝達が骨髄系統およびリンパ系統の両方の腫瘍形成性成長において役割を果たしていることがより最近見出された。例えば、慢性骨髄性白血病由来の顆粒球マクロファージ始原細胞(GMP)は、活性化されたWntシグナル伝達を示し、始原細胞の成長および再生はWntシグナル伝達に依存している(Jamieson et al., N. Engl J. Med. 351:657-667 (2004))。また、白血病ではWnt経路内に突然変異は存在しないようであるが、オートクリンおよび/またはパラクリンWntシグナル伝達は、癌性自己再生を保持することができる(Reya&Clevers, Nature 434:843(2005))。
【0071】
標準Wntシグナル経路は、さらに小腸および結腸中の幹細胞集団の維持に中心的な役割を果たし、この経路の不適切な活性化は結腸直腸癌において顕著な役割を果たす(Reya & Clevers, Nature 434:843 (2005))。腸の吸収上皮には絨毛および凹窩が並ぶ。幹細胞は凹窩に存在し、ゆっくり分割して、全ての分化細胞集団を生ずる急速に増殖する細胞を産生する。分化細胞集団は凹窩から上に移動して腸絨毛を占める。Wntシグナル伝達カスケードは、凹窩-絨毛軸に沿った細胞運命の制御に主要な役割を果たし、また幹細胞集団の維持にとって不可欠である。相同組換えによるTcf7/2の遺伝的喪失(Korinek et al., Nat. Genet. 19:379 (1998))、または分泌される強力なWntアンタゴニストであるDickkopf-1 (Dkkl) (Pinto et al., Genes Dev. 17:1709-1713 (2003); Kuhnert et al, PNAS 101:266-271 (2004))の過剰発現のいずれかによるWntシグナル伝達の混乱が、腸の幹細胞集団の消失をもたらす。
【0072】
結腸直腸癌は、最も一般的には、Wntシグナル伝達カスケードにおける突然変異の活性化によって開始される。全ての結腸直腸癌のおよそ5〜10%が遺伝的であり、その主要型の1つが家族性腺腫性ポリポーシス(FAP)であり、これは、その罹患者の約80%が大腸腺腫性ポリポーシス(APC)遺伝子中に生殖細胞系列突然変異を含む、常染色体優性疾患である。突然変異は、オーキシンおよびβカテニンを含む他のWnt経路の構成成分で同定されている。個々の腺腫は、第2の不活性化された対立遺伝子を含む上皮細胞のクローン成長物であり、多数のFAP腺腫が、癌遺伝子および/または腫瘍抑制遺伝子のさらなる突然変異によって必然的に腺癌腫の発症をもたらす。さらに、APCおよびβカテニン中の機能獲得型突然変異を含むWntシグナル伝達経路の活性化は、マウスモデル中の過形成発症および腫瘍成長を引き起こすことができる(Oshima et al., Cancer Res. 57:1644-1649 (1997); Harada et al., EMBO J. 18:5931-5942 (1999))。
【0073】
癌におけるWntシグナル伝達の役割は、マウスウイルスの近接挿入によって形質転換された乳腺腫瘍における癌遺伝子としてWnt1 (もとはint1)が同定されたことによって、最初に解明された(Nusse & Varrmus, Cell 31:99-109 (1982))。乳癌におけるWntシグナル伝達の役割を立証するさらなる証拠がそれ以来蓄積されてきた。例えば、乳腺中のβカテニンの遺伝子組換えによる過剰発現は、過形成および腺癌腫をもたらすが(Imbert et al., J. Cell Biol. 153:555-568 (2001); Michaelson & Leder, Oncogene 20:5093-5099 (2001))、Wntシグナル伝達の喪失は正常な乳腺の発達を妨害する(Tepera et al., J. Cell Sc. 116:1137-1149 (2003); Hatsell et al., J. Mammary Gland Biol. Neoplasia 8:145-158 (2003))。より最近、乳腺幹細胞がWntシグナル伝達によって活性化されることが示された(Liu et al, PNAS 101:4158 (2004))。ヒト乳癌では、50%以上の癌腫においてβカテニンの蓄積が活性化Wntシグナル伝達に関係しており、特異的な突然変異がまだ同定されていないにもかかわらず、Frizzled受容体発現のアップレギュレーションが観察されている(Brennan & Brown, J. Mammary Gland Neoplasia 9: 119-131 (2004); Malovanovic et al., Int. J. Oncol. 25:1337-1342 (2004))。
【0074】
FZD10、FZD8、FZD7、FZD4およびFZD5は、10種の同定されたヒトWnt受容体のうちの5つである。マウス胚では、Fzd10はWnt7aと共に、神経管、肢芽およびミュラー管中で発現され(Nunnally & Parr, Dev. Genes Evol. 214:144-148 (2004))、肢芽発生の間にWnt-7aの受容体として働くことができる(Kawakami et al., Dev. Growth Differ. 42:561-569 (2000))。Fzdl0は肺でWnt7bと共発現するが、細胞トランスフェクションの研究によって、Fzdl0/LRP5共受容体がWnt7bに応答して標準Wntシグナル伝達経路を活性化することが実証された(Wang et al., Mol. Cell Biol. 25:5022-5030 (2005))。FZDl0 mRNAは、頚部、胃および膠芽腫の細胞系統を含む多数の癌細胞系統で、ならびにおよそ40%の原発性胃癌、結腸癌および滑膜肉腫を含む原発性癌で、アップレギュレーションされる(Saitoh et al., Int. J. Oncol. 20:117-120 (2002); Terasaki et al, Int. J. Mol. Med. 9:107-112 (2002); Nagayama et al., Oncogene 1-12 (2005))。FZD8は、いくつかのヒト癌細胞系統、原発性胃癌、および腎癌腫中でアップレギュレーションされる(Saitoh et al., Int. J. Oncol. 18:991-996 (2001); Kirikoshi et al., Int. J. Oncol. 19:111-115 (2001); Janssens et al., Tumor Biol. 25:161-171 (2004))。FZD7は胃腸管の全体にわたって発現され、ヒト原発性胃癌の6つの症例のうちの1つにおいてアップレギュレーションされる(Kirikoshi et al., Int. J. Oncol 19:111-115 (2001))。結腸癌細胞系統によるFZD7外部ドメインの発現は、異種移植片モデル中の形態学的変化を引き起こし、腫瘍成長を減少させた(Vincan et al., Differentiation 73:142-153 (2005))。FZD5は、卵黄嚢および胎盤の血管形成に本質的な役割を果たし(Ishikawa et al., Dev. 128:25-33 (2001))、腎癌腫で、Wnt/βカテニンシグナル伝達の活性化と関連してアップレギュレーションされる(Janssens et al., Tumor Biology 25:161-171 (2004))。FZD4は、腸陰窩上皮細胞中で高度に発現され、正常組織と新生物組織とで異なる発現を示すいくつかの因子のうちの1つである(Gregorieff et al., Gastroenterology 129:626-638 (2005))。したがって、FZD4、5、7、8、および10を癌幹細胞のマーカーとして同定することによって、これらのタンパク質が癌治療の理想的な標的となる。
【0075】
診断用分析
本発明は癌幹細胞マーカーを発現させて、これを分析することにより、癌幹細胞マーカーの発現に関連した疾病を検出、特徴決定、診断、またはモニターすることができる。ある態様では、癌幹細胞マーカーの発現は、例えば癌幹細胞マーカーをコードするmRNAなどのポリヌクレオチド発現によって決定される。ポリヌクレオチドは、当業者に周知の多数の任意の手段により、検出および定量することができる。いくつかの態様では、癌幹細胞マーカーをコードするmRNAは、例えば患者の生検からの組織画分のインサイチューハイブリダイゼーションによって検出される。または、RNAを組織から単離し、例えばノーザンブロット、定量的RT-PCR、またはマイクロアレイによって検出することができる。例えば、全RNAを組織試料から抽出し、RT-PCRを用い、特異的にハイブリダイズして癌幹細胞マーカーを増幅するプライマーを用いて、癌幹細胞マーカーポリヌクレオチドの発現を検出することができる。
【0076】
ある態様では、癌幹細胞マーカーの発現を、対応するポリペプチドの検出により、決定することができる。当業者に周知の多くの任意の手段により、ポリペプチドを検出し定量することができる。いくつかの態様では、例えば電気泳動、キャピラリー電気泳動、高速液体クロマトグラフィー(HPLC)または薄層クロマトグラフィー(TLC)のような分析的生化学的方法を用いて、癌幹細胞マーカーポリペプチドを検出する。単離したポリペプチドを、標準の技術によって配列決定することもできる。いくつかの態様では、癌幹細胞マーカータンパク質を、タンパク質に対して生産された抗体により、例えば、組織片への免疫蛍光法または免疫組織化学を用いて検出する。または、癌幹細胞マーカーに対する抗体により、例えばELISA、FACS、ウエスタンブロット、免疫沈降法またはタンパク質マイクロアレイを用いて、発現を検出することができる。例えば、癌幹細胞を患者の生検から単離し、FACSを用いて、癌幹細胞マーカータンパク質の発現を、蛍光標識された抗体により検出することができる。別の方法では、インビボにおいて、標識された抗体を用いて癌幹細胞マーカーを発現する細胞を典型的な画像システム中で検出することができる。例えば、常磁性アイソトープで標識された抗体を、磁気共鳴イメージング(MRI)に用いることができる。
【0077】
本発明のいくつかの態様では、診断用分析は、例えば、免疫組織化学、インサイチューハイブリダイゼーションまたはRT-PCRを用いて、腫瘍細胞中の癌幹細胞マーカーの発現の有無を決定することを含む。他の態様では、診断用分析は、例えば定量的RT-PCRを用いて、癌幹細胞マーカーの発現レベルを決定することを含む。いくつかの態様では、診断用分析は、例えば正常な上皮などの対照組織と比較して、癌幹細胞マーカーの発現レベルを決定することをさらに含む。
【0078】
癌幹細胞マーカー発現の検出を用いて、次に予後診断を提供することができる。予後診断は、癌幹細胞マーカーが表示できる任意の公知の危険表現に基づくことができる。さらに、癌幹細胞マーカーの検出を用いて、例えば検出された癌幹細胞マーカーに対するアンタゴニストによる処置を含む、適切な治療法を選択することができる。いくつかの態様では、アンタゴニストは、癌幹細胞マーカータンパク質の細胞外ドメインへ特異的に結合する抗体である。
【0079】
癌幹細胞マーカーのアンタゴニスト
本発明の文脈においては、適切なアンタゴニストは、例えば以下の効果の1つまたは複数を有しうる薬剤である:癌幹細胞マーカーの発現の妨害;例えば癌幹細胞マーカーと、そのリガンド、受容体または共受容体との間の相互作用を立体的に阻害することによる、癌幹細胞シグナル伝達経路活性化の妨害;あるいは、癌幹細胞マーカーへの結合および、細胞死のトリガーまたは腫瘍細胞成長の阻害。
【0080】
ある態様では、本発明は、細胞外で作用して、癌幹細胞マーカーの機能に影響するかまたは阻害する、癌幹細胞マーカーに対するアンタゴニストを提供する。ある態様では、アンタゴニストは、癌幹細胞マーカータンパク質の細胞外ドメインへ結合する小分子である。他の態様では、癌幹細胞マーカーのアンタゴニストはタンパク質性である。いくつかの態様では、タンパク質性アンタゴニストは、天然の癌幹細胞マーカー受容体または結合パートナーの断片またはアミノ酸配列変異体である。いくつかの態様では、断片またはアミノ酸配列変異体は、癌幹細胞マーカー受容体に結合して、シグナル伝達リガンドの結合を増強するかまたは阻止することができる。他の態様では、天然の癌幹細胞マーカーもしくは結合パートナーの断片またはアミノ酸配列変異体は、癌幹細胞マーカーのシグナル伝達リガンドに結合して、シグナル伝達リガンドの結合を増強するか阻止することができる。いくつかの態様では、アンタゴニストは、可溶性癌幹細胞タンパク質受容体または可溶性受容体タンパク質である。癌幹細胞マーカーに対するアンタゴニストの細胞外結合は、癌幹細胞マーカーの内因性活性化(例えばキナーゼ活性)の阻害により、および/または、例えば癌幹細胞マーカーとそのリガンドとの、癌幹細胞マーカーとその受容体との、癌幹細胞マーカーとその共受容体との、または癌幹細胞マーカーと細胞外マトリックスとの相互作用を立体的に阻害することにより、癌幹細胞マーカータンパク質のシグナル伝達を阻害することができる。さらに、癌幹細胞マーカーに対するアンタゴニストの細胞外結合は、例えば癌幹細胞マーカータンパク質を内在化させることによって、および/または癌幹細胞マーカーが細胞表面を動き回ることを減少させることなどによって、癌幹細胞マーカーの細胞表面発現をダウンレギュレーションすることができる。
【0081】
ある態様では、癌幹細胞マーカーのアンタゴニストは、血管形成の阻害によって、細胞死を間接的に引き起こすことができる。血管形成は、既存の血管から新しい血管が生ずるプロセスであり、例えば胚発生の間の、創傷治癒の間の、および排卵に応答した正常な成長に必要な、基本のプロセスである。栄養源および酸素を供給するために、1〜2mm2より大きな充実性腫瘍の成長にも血管形成が必要であり、それがなければ腫瘍細胞は死ぬ。したがってある態様では、癌幹細胞マーカーのアンタゴニストは、例えば、内皮細胞、平滑筋細胞、または血管構築に必要な細胞外マトリックスの成分を含む癌幹細胞マーカーを発現する血管細胞を標的とする。いくつかの態様では、癌幹細胞マーカーのアンタゴニストは、血管細胞の補充、構築、維持、または生存に必要な成長因子シグナル伝達を阻害する。
【0082】
ポリヌクレオチド
本発明は、配列番号:1〜9を含むポリペプチドをコードする単離されたポリヌクレオチドに向けられたものである。本発明のポリヌクレオチドはRNAの形態でもDNAの形態でもよく、DNAは、cDNA、ゲノムDNA、および合成DNAを含むことができる。DNAは二重鎖または一本鎖でよく、一本鎖である場合は、コード鎖または非コード(アンチセンス)鎖でよい。したがって、用語「ポリペプチドをコードするポリヌクレオチド」は、ポリペプチドに対するコード配列のみを含むポリヌクレオチドだけでなく、追加のコード配列および/または非コード配列を含むポリヌクレオチドも包含する。
【0083】
本発明はさらに、上述のポリヌクレオチドの変異体に関し、これらは例えば、断片、類似体および誘導体をコードする。ポリヌクレオチドの変異体とは、該ポリヌクレオチドの天然の対立遺伝子変異体または該ポリヌクレオチドの非天然の変異体であり得る。上記に示したように、ポリヌクレオチドは、開示したポリペプチドのコード配列の天然の対立遺伝子変異体であるコード配列を有することができる。当技術分野で公知のように、対立遺伝子変異体とは、ポリヌクレオチド配列の別の形であって、1つまたは複数のヌクレオチドの置換、欠失、または追加を有し、コードされるポリペプチドの機能を実質的に改変しない。
【0084】
本発明にはまた、例えば細胞からのポリペプチドの輸送を制御するための分泌配列として機能するリーダー配列を含む宿主細胞由来のポリペプチドの例えば発現、分泌、タンパク質安定性を助けるポリヌクレオチドに成熟ポリペプチドのコード配列を同じリーディングフレームで融合できるポリヌクレオチドも含まれる。リーダー配列を有するポリペプチドは前駆体タンパク質であり、宿主細胞によって切断され、成熟型のポリペプチドを形成するためのリーダー配列を有する。ポリヌクレオチドはまた、成熟タンパク質に追加の5'アミノ酸残基が加わったものであるプロタンパク質もコードすることができる。プロ配列を有する成熟タンパク質はプロタンパク質であり、タンパク質の不活性型である。プロ配列が切断されると、活性成熟タンパク質が残る。したがって、例えば、本発明のポリヌクレオチドは、成熟タンパク質、またはプロ配列を有するタンパク質、あるいはプロ配列およびプレ配列(リーダー配列)の両方を有するタンパク質をコードすることができる。
【0085】
本発明のポリヌクレオチドはまた、マーカー配列にインフレームで融合されたコード配列を有することもでき、これにより、本発明のポリペプチドの精製が可能になる。細菌宿主の場合、マーカーに融合された成熟ポリペプチドの精製を提供するために、マーカー配列はpQE-9ベクターによって供給されるヘキサヒスチジンタグであることができる。または、例えば、哺乳動物宿主、例えばCOS-7細胞を用いる場合は、マーカー配列はヘマグルチニン(HA)タグでよい。HAタグは、インフルエンザヘマグルチニンタンパク質に由来するエピトープに対応する(Wilson, I., et al., Cell 37:767 (1984))。
【0086】
本発明のある態様には、開示された配列をコードするヌクレオチドに対して少なくとも90%同一の、95%同一の、およびいくつかの実施態様では、少なくとも96%、97%、98%、または99%同一のヌクレオチド配列を有するポリヌクレオチドを含む、単離された核酸分子が含まれる。
【0087】
ポリヌクレオチド変異体は、コード領域、非コード領域、または両方に、改変を含むことができる。いくつかの態様では、ポリヌクレオチド変異体は、サイレントな置換、付加、または欠失を生成するが、コードされたポリペプチドの特性または活性を変更しない改変を含む。いくつかの態様では、遺伝コードの縮退によるサイレントな置換により、ヌクレオチド変異体が生成される。ポリヌクレオチド変異体は、様々な理由のために、例えば、特定の宿主のためにコドン発現を最適化する(ヒトmRNA中のコドンを大腸菌(E. coli)のような細菌宿主に好まれるものへ変更する)ために、産生することができる。
【0088】
可溶性受容体ポリペプチド
本発明のポリペプチドは、組換えポリペプチド、天然のポリペプチド、または配列番号:1〜9の配列を有する合成ポリペプチドであり得る。本発明のいくつかのアミノ酸配列を、タンパク質の構造または機能に対する有意な影響なしに変化させることができることが、当技術分野において認められるであろう。そのような配列の相違が意図される場合は、タンパク質上には、活性を決定する重大な領域があるということを覚えておかなければならない。したがって、本発明はさらに、相当な活性を示すポリペプチドの変異、または本明細書で議論したタンパク質部分などのFZDタンパク質の領域を含むポリペプチドの変異を含む。そのような突然変異体には、欠失、挿入、逆位、繰り返し、および型の置換が含まれる。以下に示すように、どのアミノ酸変化が表現型でサイレントである可能性が高いかに関する手引きをBowie, et al., Science 247:1306-1310 (1990)の中に見出すことができる。
【0089】
したがって、本発明のポリペプチドの断片、誘導体または類似体は、以下のものであり得る:(i) アミノ酸残基の1つまたは複数が保存的または非保存的アミノ酸残基で置換されたものであり、ここで、そのような置換されたアミノ酸残基には、遺伝子コードによってコードされ得るものも、コードされ得ないものも含まれる;または (ii) アミノ酸残基の1つまたは複数が、置換された基を含むもの;または (iii) 成熟ポリペプチドが、ポリペプチドの半減期を増加させる化合物(例えばポリエチレングリコール)などの別の化合物と融合されているもの;または (iv) 成熟ポリペプチドに、追加のアミノ酸、例えばリーダー配列もしくは分泌配列、または成熟ポリペプチドの精製のために使用される配列、またはプロタンパク質配列が融合されているもの。そのような断片、誘導体、および類似体は、当業者にとって本明細書の教示の範囲内であると考えられる。
【0090】
特に興味深いのは、荷電アミノ酸と別の荷電アミノ酸との、および中性または負に荷電したアミノ酸との置換である。後者は、低い正荷電を有するタンパク質をもたらし、可溶性受容体タンパク質の特性を改善する。タンパク質の凝集は活性の喪失をもたらし、さらにこれは免疫原となる可能性があるために薬学的製剤調製の際には問題にもなり得るので、凝集の予防は極めて望ましい(Pinckard et al., Clin. Exp. Immunol. 2:331-340 (1967); Robbins et al., Diabetes 36:838-845 (1987); Cleland et al., Crit. Rev. Therapeutic Drug Carrier Systems 10:301-377 (1993))。
【0091】
示したように、通常は、変更とは、タンパク質の折り畳みや活性に大きく影響しない保存的アミノ酸置換などの些細な性質である(表1および2を参照のこと)。
【0092】
(表1)保存的アミノ酸置換

【0093】
(表2)アミノ酸置換

【0094】
当然ながら、当業者が行うアミノ酸置換の数は、上述の因子を含む多くの因子に依存する。概説すると、任意の所与の可溶性受容体ポリペプチドについて、置換の数は50、40、30、25、20、15、10、5、または3以下である。
【0095】
本発明のポリペプチドには、配列番号:1〜9のポリペプチド、ならびに、特定の場合には配列番号:1〜9のポリペプチドと少なくとも90%の類似性を有するポリペプチド、および特定の場合には、配列番号:1〜9のポリペプチドと少なくとも95%の類似性を有するポリペプチド;および特定の場合には、配列番号:1〜9のポリペプチドと少なくとも96%、97%、98%、または99%の類似性を有するポリペプチドが含まれる。当技術分野で公知のように、2つのポリペプチド間の「類似性」とは、1つのポリペプチドのアミノ酸配列およびその保存的アミノ酸置換物を第2のポリペプチドの配列と比較することにより決定される。
【0096】
ペプチド合成によって対応する全長ポリペプチドを産生するために、本発明のポリペプチドの断片または一部を使用することができる;したがって、断片を、全長ポリペプチドを産生するための中間体として使用することができる。本発明のポリヌクレオチドの断片または一部を用いて、本発明の全長ポリヌクレオチドを合成することができる。
【0097】
本発明のタンパク質の断片は、癌幹細胞マーカータンパク質または癌幹細胞タンパク質の結合パートナー(例えば受容体、共受容体、リガンドまたはコリガンド)に結合することができるタンパク質の一部または全体である。この断片は癌幹細胞マーカータンパク質、または癌幹細胞タンパク質の結合パートナー(例えば受容体、共受容体、リガンドまたはコリガンド)に対して高い親和性を有する。融合タンパク質のいくつかの断片は、免疫グロブリンの不変領域の少なくとも一部へ結合した、癌幹細胞マーカータンパク質または癌幹細胞タンパク質の結合パートナーの細胞外部分の少なくとも一部を含むタンパク質断片である。親和性は約10-11〜10-12Mの範囲であり得るが、親和性は、大きさの異なる断片に応じて10-7〜10-13Mの範囲で相当に変化することができる。いくつかの態様では、断片は、約10〜255アミノ酸長であり、免疫グロブリンの不変領域の少なくとも一部に連結された癌幹細胞マーカータンパク質リガンド結合部位を含む。
【0098】
ポリペプチドおよび類似体をさらに修飾して、通常はタンパク質の一部ではない追加の化学的部分を含むようにすることができる。それらの誘導体化された部分は、タンパク質の溶解度、生物学的半減期または吸収を改善することができる。その部分はまた、タンパク質等の任意の所望の副作用を低減させるかまたは除去することができる。それらの部分の概要は、Remington's Pharmaceutical Sciences, 20th ed., Mack Publishing Co., Easton, PA (2000)中に認められる。
【0099】
誘導体化に最も適した化学的部分には、水溶性ポリマーが含まれる。水溶性ポリマーは、それに付着しているタンパク質が生理的環境などの水性環境で沈殿しないので、望ましい。いくつかの態様では、ポリマーは、治療用の生成物または組成物の調製のために薬学的に許容されるであろう。当業者は、ポリマー/タンパク質抱合体を治療用に用いるかどうかの考察に基づいて、また用いるならば、所望の用量、循環時間、タンパク質分解に対する抵抗性および他の考察に基づいて、所望のポリマーを選択することができるであろう。誘導体化の有効性を、誘導体を所望の形式で投与することにより(即ち、浸透ポンプにより、または注射や注入により、あるいはさらに、経口、肺または他の送達経路用に調剤して)、およびその有効性を測定することにより確認することができる。適当な水溶性ポリマーには、ポリエチレングリコール(PEG)、エチレングリコール/プロピレングリコールコポリマー、カルボキシメチルセルロース、デキストラン、ポリビニルアルコール、ポリビニルピロリドン、ポリ1,3ジオキソラン、ポリ1,3,6トリオキサン、エチレン/無水マレイン酸コポリマー、ポリアミノ酸(ホモポリマーまたはランダムコポリマーのいずれか)、およびデキストランまたはポリ(n-ビニルピロリドン)ポリエチレングリコール、プロプロピレングリコールホモポリマー、プロリプロピレンオキシド/エチレンオキシドコポリマー、ポリオキシエチル化ポリオール(例えばグリセロール)、ポリビニルアルコール、およびそれらの混合物が非限定的に含まれる。ポリエチレングリコールプロピオンアルデヒドは、水中での安定性により、作製の際に有利であり得る。
【0100】
そのように付着されたポリマー分子の数は変化してもよく、また当業者は機能に対する影響を確認することができるであろう。モノ誘導体化することができ、あるいは、同一または異なる化学的部分(例えば、様々な重量のポリエチレングリコールなどのポリマー)によって、ジ、トリ、テトラ、またはある組合せの誘導体化をすることができる。ポリマー分子のタンパク質(あるいはペプチド)分子に対する比率は、反応混合液中のポリマー分子の濃度が変化するにつれて、変化するであろう。一般に、最適な比率(過剰な未反応タンパク質またはポリマーが存在しないという反応効率の観点から)は、望ましい誘導体化の程度(例えばモノ-、ジ、トリ-など)、選択されたポリマーの分子量、ポリマーが分岐しているか非分岐か、および反応条件などの要素によって決定されるであろう。
【0101】
タンパク質の機能的または抗原性ドメインに対する影響を考慮して、ポリエチレングリコール分子(あるいは他の化学的部分)を、タンパク質に付着させるべきである。当業者に利用可能な多くの付着方法がある。例えば、その開示(PEGのG-CSFとのカップリング)が参照により本明細書に組み入れられるEP 0 401 384を参照のこと。さらにMalik et al., Exp. Hematol 20:1028-1035 (1992)を参照のこと(塩化トレシル(tresyl chloride)を用いたGM-CSFのPEG化(pegylation)を報告している)。例えば、ポリエチレングリコールを、遊離アミノ基または遊離カルボキシル基などの反応基により、アミノ酸残基を介して共有結合的に結合させることができる。反応基は、活性化されたポリエチレングリコール分子を結合させることができる。遊離アミノ基を有するアミノ酸残基には、リジン残基およびN末端アミノ酸残基が含まれ得る。遊離カルボキシル基を有するものには、アスパラギン酸残基、グルタミン酸残基、およびC末端アミノ酸残基が含まれ得る。スルフヒドリル基もまた、ポリエチレングリコール分子を付着させるための反応基として用いることができる。治療目的のために、N末端またはリジン基における付着などの、アミノ基における付着を行なうことができる。受容体結合が望ましい場合は、受容体結合にとって重要な残基における付着を回避するべきである。
【0102】
アミノ末端が化学的に修飾されたタンパク質が特に望ましい場合がある。本組成物の例としてポリエチレングリコールを用い、様々なポリエチレングリコール分子(分子量、分岐などによる)、反応混合物中のポリエチレングリコール分子のタンパク質(あるいはペプチド)分子に対する比率、行なわれるべきPEG化反応の種類、および選択されたN末端がPEG化されたタンパク質を得る方法を選択することができる。N末端をPEG化された調製物を得る方法(即ち必要ならば、この部分を他のモノPEG化された(monopegylated)部分から分離する方法)は、PEG化されたタンパク質分子の集団から、N末端をPEG化された物質を精製することによるものであってよい。特定のタンパク質における誘導体化に利用可能な種々の種類の一級アミノ基(リジンに対するN末端)の異なる反応性を利用する還元的アルキル化により、選択的なN末端の化学的修飾を遂行することができる。適切な反応条件下で、カルボニル基を含むポリマーにより、N末端での実質的に選択的なタンパク質の誘導体化が達成される。例えば、リジン残基のεアミノ基とタンパク質のN末端残基のαアミノ基の間のpKa差を利用することが可能なpHで反応を行なうことにより、タンパク質を選択的にN末端でPEG化することができる。そのような選択的な誘導体化によって、タンパク質への水溶性ポリマーの付着が制御されるが、ポリマーとの抱合は、主にタンパク質のN末端で起り、リジン側鎖アミノ基などの他の反応基の有意な修飾は生じない。還元的アルキル化を用いると、水溶性ポリマーは上述の種類でよく、タンパク質にカップリングするための単一の反応性アルデヒドを有するべきである。単一の反応性アルデヒドを含むポリエチレングリコールプロピオンアルデヒドを用いることができる。
【0103】
PEG化を、任意の公知技術のPEG化反応によって行なうことができる。例えば、Focus on Growth Factors, 3(2): 4-10 (1992);EP 0 154 316、その開示は参照により本明細書に組み入れられる;EP 0 401 384;および本明細書に引用されたPEG化に関する他の出版物を参照のこと。反応性ポリエチレングリコール分子(あるいは類似の反応性水溶性ポリマー)とのアシル化反応またはアルキル化反応によって、PEG化を実施することができる。
【0104】
したがって、本発明にしたがって用いられる可溶性受容体ポリペプチドは、PEG基がアシル基またはアルキル基を介して付着されたPEG化可溶性受容体タンパク質または変異体を含むことができることが、意図されている。そのような生成物は、モノPEG化またはポリPEG化(poly pegylated)であってよい(例えば、26個の、典型的には25個のPEG基を含む)。一般にPEG基はアミノ酸のαまたはεのアミノ基でタンパク質に付着しているが、PEG基は、適当な反応条件下でPEG基に付着されるために十分に反応性であるタンパク質に付着された、任意のアミノ基に付着できることも意図されている。
【0105】
アシル化およびアルキル化の両方の手法で用いられるポリマー分子を、上述の水溶性ポリマーの中から選択することができる。選択されたポリマーを、アシル化用の活性エステルまたはアルキル化用のアルデヒドなどの単一の反応基を持つように修飾するべきであり、それによって、本方法で行われるように重合度を制御することができる。例示的な反応性PEGアルデヒドは、水に安定なポリエチレングリコールプロピオンアルデヒド、またはそのモノC1〜C10アルコキシまたはアリールオキシ誘導体である(米国特許第5,252,714号を参照のこと)。ポリマーは分岐していても分岐していなくてもよい。アシル化反応については、選択したポリマーは単一の反応性エステル基を有するべきである。本還元的アルキル化のために、選択されたポリマーは単一の反応性アルデヒド基を有するべきである。一般に、水溶性ポリマーは、天然のグリコシル残基からは選ばれないであろう。これらは通常哺乳動物組換え発現系によってより便利に作製されるからである。ポリマーは任意の分子量でよく、分岐していても分岐していなくてもよい。本明細書で使用するための1つの水溶性ポリマーはポリエチレングリコールである。本明細書で用いるポリエチレングリコールは、他のタンパク質を誘導体化するために用いられてきた、モノ(C1〜C10)アルコキシ-またはアリールオキシ-ポリエチレングリコールなどの、任意の形のPEGを包含するものとする。
【0106】
溶媒、反応時間、温度などの他の反応パラメーターおよび生成物の精製手段は、水溶性ポリマーによるタンパク質の誘導体化に関係する公表された情報(本明細書に引用された出版物を参照のこと)に基づいて、ケースバイケースで決定することができる。
【0107】
本明細書に記述された単離されたポリペプチドを、当技術分野で公知の任意の適切な方法により産生することができる。そのような方法は、直接タンパク質合成法から、単離されたポリペプチド配列をコードするDNA配列の構築、および適切な形質変換宿主中でのその配列の発現までの範囲にわたる。例えば、配列番号:1のポリペプチドをコードする標識されたDNA断片でヒトcDNAライブラリーをスクリーニングし、オートラジオグラフィーによって陽性クローンを同定することにより、cDNAを得ることができる。一連のプラーク精製およびハイブリダイゼーションを、従来方式を用いてさらに行なう。
【0108】
組換え法のいくつかの態様では、関心対象の野生型タンパク質をコードするDNA配列を単離または合成することにより、DNA配列を構築する。任意で、部位特異的突然変異誘発により配列を突然変異誘発し、その機能的類似体を提供することができる。Zoeller et al., Proc. Natl. Acad. Sci. USA 81:5662-5066 (1984) および米国特許第4,588,585号を参照のこと。関心対象のポリペプチドをコードするDNA配列を構築する別の方法は、オリゴヌクレオチド合成機を用いる化学合成によるものであろう。所望のポリペプチドのアミノ酸配列に基づき、関心対象の組換えポリペプチドを生成する宿主細胞中で好まれるコドンを選択して、そのようなオリゴヌクレオチドを設計することができる。
【0109】
標準的方法を適用して、関心対象の単離されたポリペプチドをコードする単離されたポリヌクレオチド配列を合成することができる。例えば、完全なアミノ酸配列を用いて、逆翻訳された遺伝子を構築することができる。さらに、特定の単離されたポリペプチドをコードするヌクレオチド配列を含むDNAオリゴマーを合成することができる。例えば、所望のポリペプチドの一部ずつをコードするいくつかの小さなオリゴヌクレオチドを合成し、次にライゲーションすることができる。個々のオリゴヌクレオチドは典型的には、相補的組み立てのために、5'または3'突出部を含む。
【0110】
(合成、部位特異的変異誘発、または別の方法により)組み立てられたら、特定の単離された関心対象のポリペプチドをコードする突然変異体DNA配列を発現ベクターに挿入し、所望の宿主中でのタンパク質発現に適した発現制御配列に機能的に連結させる。ヌクレオチド配列決定、制限酵素マッピング、および生物学的活性を持つポリペプチドの適当な宿主中での発現により、適切な組み立てを確認することができる。当技術分野において周知のように、トランスフェクションされた遺伝子の宿主中での高い発現レベルを得るためには、選ばれた発現宿主中で機能する転写および翻訳の発現制御配列に、遺伝子を機能的に連結しなければならない。
【0111】
組換え体発現ベクターを用いて、癌幹細胞マーカーポリペプチド融合体をコードするDNAを増幅および発現させることができる。組換え体発現ベクターとは、哺乳動物、微生物、ウイルスまたは昆虫の遺伝子に由来する適切な転写または翻訳の調節エレメントに機能的に連結された癌幹細胞マーカーポリペプチド融合体または生物学的に同等な類似体をコードする合成のまたはcDNA由来のDNA断片を有する、複製可能なDNA構築物である。転写ユニットは、一般に (1) 遺伝子発現において調節の役割を有する遺伝子エレメント、例えば転写プロモーターまたはエンハンサー、(2) mRNAへ転写されてタンパク質に翻訳される構造配列またはコード配列、および (3) 以下に詳述される適切な転写および翻訳の開始および終止配列の集合を含む。そのような調節エレメントは、転写を制御するオペレーター配列を含むことができる。複製開始点によって通常与えられる宿主中での複製能力、および、形質変換体の認識を容易にするための選択遺伝子を、さらに組込むことができる。DNA領域は、それらが互いに機能的に関連している場合には、機能的に連結されている。例えば、シグナルペプチド(分泌リーダー)のDNAは、ポリペプチドの分泌に関与する前駆物質として発現される場合には、ポリペプチド用のDNAに機能的に連結されている;プロモーターは、それが配列の転写を制御する場合は、コード配列に機能的に連結されている;またはリボソーム結合部位は、それが翻訳を許すような位置にある場合には、コード配列に機能的に連結されている。一般に、機能的に連結されているとは近接していることを意味し、分泌リーダーの場合には、近接していることおよびリーディングフレーム中にあることを意味する。酵母発現系で用いる目的の構造エレメントは、宿主細胞による翻訳されたタンパク質の細胞外の分泌を可能にするリーダー配列を含むことができる。または、組換えタンパク質がリーダー配列または輸送配列なしで発現される場合、それはN末端メチオニン残基を含むことができる。この残基を任意で次に、発現された組換え型タンパク質から切断し、最終生産物を提供することができる。
【0112】
発現制御配列および発現ベクターの選択は、宿主の選択に依存することになろう。種々様々の発現宿主/ベクターの組合せを使用することができる。真核生物宿主のための有用な発現ベクターには、例えば、SV40、ウシパピローマウイルス、アデノウイルス、およびサイトメガロウイルス由来の発現制御配列を含むベクターが含まれる。細菌の宿主のための有用な発現ベクターには、pCR1、pBR322、pMB9およびそれらの誘導体を含む、大腸菌(Esherichia coli)由来のプラスミドなどの公知の細菌のプラスミド、M13およびフィラメント状一本鎖DNAファージなどのより広い宿主範囲のプラスミドが含まれる。
【0113】
癌幹細胞マーカータンパク質の発現に適切な宿主細胞には、適切なプロモーターの制御下の、原核生物、酵母、昆虫または高等真核細胞が含まれる。原核生物には、グラム陰性またはグラム陽性生物、例えば大腸菌、桿菌(bacilli)が含まれる。高等真核細胞には、下記に述べる哺乳動物由来の確立された細胞系統が含まれる。無細胞系翻訳システムを使用することもできよう。細菌、真菌、酵母、および哺乳動物細胞の宿主での使用のための適切なクローニングおよび発現ベクターについてはPouwels et al., Cloning Vectors: A Laboratory Manual, Elsevier, N. Y. (1985)が記述しており、これに関連する開示は、参照により本明細書に組み入れられる。
【0114】
様々な哺乳動物または昆虫の細胞培養系も、組換えタンパク質を発現するために有利に使用される。組換えタンパク質は一般に正確に折り畳まれ、適切に修飾され、かつ完全に機能的であるので、哺乳動物細胞中の組換えタンパク質の発現を行なうことができる。適切な哺乳動物宿主細胞系統の例には、Gluzman, Cell 23:175 (1981)に記述されているサル腎細胞のCOS-7系統、ならびに、例えばL細胞、C127、3T3、チャイニーズハムスター卵巣(CHO)、HeLa、およびBHK細胞系統を含む、適切なベクターを発現することができる他の細胞系統が含まれる。哺乳動物発現ベクターは、複製開始点、発現されるべき遺伝子に連結された適切なプロモーターおよびエンハンサー、および他の5'または3'隣接非転写配列、および5'または3'非翻訳配列、例えば必要なリボソーム結合部位、ポリアデニル化部位、スプライシングドナーおよびアクセプター部位、および転写終結配列などを含むことができる。昆虫細胞における異種タンパク質産生用のバキュロウイルスシステムが、Luckow and Summers, Bio/Technology 6:47 (1988)によって概説されている。
【0115】
形質変換宿主によって産生されたタンパク質を、任意の適切な方法により精製することができる。そのような標準的方法には、クロマトグラフィー(例えばイオン交換、親和性、およびサイジングカラムクロマトグラフィー)、遠心分離、溶解度の差異、またはタンパク質精製のための任意の他の標準技術によるもの、が含まれる。ヘキサヒスチジン、マルトース結合ドメイン、インフルエンザコート配列、およびグルタチオン-S-トランスフェラーゼなどのアフィニティータグをタンパク質に付着させて適切なアフィニティカラムを通すことにより、容易な精製が可能になる。単離されたタンパク質を、タンパク質分解、核磁気共鳴、およびX線結晶学などの技術を用いて、物理的に特徴決定することができる。
【0116】
例えば、培地へ組換えタンパク質を分泌する系由来の上清を、市販のタンパク質濃縮フィルター、例えばアミコンまたはミリポアペリコン限外濾過ユニットを用いて、最初に濃縮することができる。濃縮工程の次に、濃縮物を適切な精製マトリックスに供することができる。または、陰イオン交換樹脂、例えば側鎖ジエチルアミノエチル(DEAE)基を有するマトリックスまたは基質を使用することができる。マトリックスは、アクリルアミド、アガロース、デキストラン、セルロース、またはタンパク質精製に一般に使用される他の種類であってよい。または、陽イオン交換工程を採用することもできる。適切な陽イオン交換体には、スルホプロピル基またはカルボキシメチル基を含む様々な不溶性マトリックスが含まれる。最後に、疎水性RP-HPLC材、例えば側鎖メチルまたは他の脂肪族基を有するシリカゲルを使用する、1つまたは複数の逆相高速液体クロマトグラフィー(RP-HPLC)の工程を利用して、癌幹細胞タンパク質-Fc組成物をさらに精製することができる。前記の精製工程のうちのいくつかまたはすべてを色々な組み合わせで使用して、均質な組換え型タンパク質を提供することができる。
【0117】
細菌培養物中に産生された組換えタンパク質を、通常は最初に細胞沈殿物から抽出し、その後、1つまたは複数の濃縮、塩析、水性イオン交換、またはサイズ排除クロマトグラフィーの工程を続けることにより、単離する。最終の精製工程用に、高速液体クロマトグラフィー(HPLC)を採用することができる。組換え型タンパク質の発現に使用した微生物細胞を、凍結融解の繰り返し、超音波処理、機械的破壊、または細胞溶解剤の使用を含む任意の便利な方法によって、破壊することができる。
【0118】
腫瘍細胞成長の阻害
本発明はまた、癌幹細胞マーカーを発現している腫瘍形成性細胞の成長を、本明細書に記述した癌幹細胞マーカーのアンタゴニストを用いて阻害する方法を提供する。ある態様では、癌幹細胞マーカーを発現している腫瘍形成性細胞の成長を阻害する方法は、細胞を癌幹細胞マーカーに対するアンタゴニストとインビトロで接触させる工程を含む。例えば、癌幹細胞マーカーを発現する不死化された細胞系統または癌細胞系統を、発現された癌幹細胞マーカーのアンタゴニストを加えた培地で培養して、細胞成長を阻害する。または、患者の試料、例えば組織生検、胸水または血液サンプルなどから腫瘍細胞および/または腫瘍幹細胞を単離し、癌幹細胞マーカーのアンタゴニストを加えた培地中で培養して、細胞成長を阻害する。ある態様では、アンタゴニストは、癌幹細胞マーカータンパク質または癌幹細胞マーカー結合タンパク質(例えば受容体、共受容体、リガンドまたはコリガンド)に特異的に結合する癌幹細胞マーカータンパク質融合体である。例えば、精製された癌幹細胞マーカータンパク質融合体を、単離された癌幹細胞の培地に加えて、細胞成長を阻害する。
【0119】
ある態様では、癌幹細胞マーカーを発現する腫瘍形成性細胞の成長を阻害する方法は、細胞と、癌幹細胞マーカーに対するアンタゴニストとをインビボで接触させる工程を含む。ある態様では、動物モデル中で、腫瘍形成性細胞と癌幹細胞マーカーに対するアンタゴニストとを接触させる工程を行う。例えば、癌幹細胞マーカーを発現している異種移植片を、腫瘍成長を阻害するために癌幹細胞マーカーに対するアンタゴニストを投与された免疫不全マウス(例えばNOD/SCIDマウス)中で、成長させる。または、例えば組織生検、胸水、または血液サンプルなどの患者の試料から癌幹細胞マーカーを発現する癌幹細胞を単離して、腫瘍成長を阻害するために癌幹細胞マーカーに対するアンタゴニストを投与された免疫不全マウスに注入する。いくつかの態様では、癌幹細胞マーカーのアンタゴニストを、動物中への腫瘍形成性細胞の導入と同時にまたは直後に投与して、腫瘍成長を防止する。いくつかの態様では、癌幹細胞マーカーのアンタゴニストを、腫瘍形成性細胞が所定の大きさに成長した後の治療薬として投与する。いくつかの態様では、アンタゴニストは、癌幹細胞マーカータンパク質または癌幹細胞マーカー結合タンパク質(例えば受容体、共受容体、リガンドまたはコリガンド)に特異的に結合する癌幹細胞マーカータンパク質融合体である。ある態様では、腫瘍形成性細胞と癌幹細胞へのアンタゴニストとを、癌と診察されたヒト患者中で接触させる工程を行う。
【0120】
薬学的組成物
本発明はさらに、癌幹細胞マーカーを標的とするアンタゴニスト(例えば抗体)を含む薬学的組成物を提供する。これらの薬学的組成物は、腫瘍細胞成長を阻害およびヒト患者中の癌の処置に用いられる。
【0121】
貯蔵および使用のために、本発明の精製アンタゴニスト(例えば抗体)を薬学的に許容される担体、賦形剤、および/または安定化剤と組み合わせることにより、無菌凍結乾燥粉末、水溶液その他として、製剤が調製される(Remington, The Science and Practice of Pharmacy, 20th Edition, Mack Publishing (2000))。適切な担体、賦形剤、または安定化剤は、リン酸、クエン酸、および他の有機酸などの無毒な緩衝剤;塩化ナトリウムなどの塩;アスコルビン酸およびメチオニンを含む酸化防止剤;保存剤(例えば、オクタデシルジメチルベンジルアンモニウムクロリド;ヘキサメトニウムクロリド;ベンザルコニウムクロリド;ベンゼトニウムクロリド;フェノール;ブチルまたはベンジルアルコール;メチルまたはプロピルパラベンなどのアルキルパラベン;カテコール;レゾルシノール;シクロヘキサノール;3-ペンタノール;およびm-クレゾール);低分子量ポリペプチド(約10個より少ないのアミノ酸残基などの);血清アルブミン、ゼラチンまたは免疫グロブリンなどのタンパク質;ポリビニルピロリドンなどの親水性ポリマー;グリシン、グルタミン、アスパラギン、ヒスチジン、アルギニンまたはリジンなどのアミノ酸;単糖類、二糖類、グルコース、マンノースまたはデキストリンなどの炭水化物;EDTAのようなキレート剤;ショ糖、マニトール、トレハロース、またはソルビトールなどの糖;ナトリウムなどの塩形成性対イオン;金属複合体(例えばZn-タンパク質複合体);および/またはTWEENまたはポリエチレングリコール(PEG)などの非イオン性界面活性剤を含む。
【0122】
本発明の薬学的組成物を、任意の数の方法で局所処置または全身処置のために投与することができる。投与は、(膣および直腸への送達を含む粘膜などへの)局所的投与、例えば経皮貼付剤、軟膏、ローション、クリーム、ゲル、液滴、坐剤、スプレー、液体および散剤など;肺内投与(例えば噴霧器によるものを含む、散剤またはエアロゾルの吸入または通気による;気管内、鼻腔内、表皮、および経皮的投与);経口的投与;または静脈内、動脈内、皮下、腹腔内または筋肉内の注射または注入を含む非経口的投与;あるいは頭蓋内(例えば、髄膜下または脳室内)投与でよい。
【0123】
治療製剤は単位剤形であってよい。そのような製剤には、経口、非経口、または直腸内投与のためのまたは吸入器による投与のための、錠剤、ピル、カプセル剤、散剤、果粒剤、水または非水性溶媒中の溶液または懸濁液、あるいは坐剤が含まれる。錠剤などの固形組成物では、主要な有効成分が薬学的担体と混合されている。従来の錠剤化成分には、本発明の化合物またはその無毒な薬学的に許容される塩の均一混合物を含む固体の予備処方組成物を形成するための、コーンスターチ、ラクトース、ショ糖、ソルビトール、タルク、ステアリン酸、ステアリン酸マグネシウム、リン酸二カルシウム、またはゴム、および他の希釈剤(例えば水)が含まれる。固体予備処方組成物を、次に上述の種類の単位剤形へ細分する。新規組成物の錠剤やピルなどをコーティングするか、そうでなければ調合して、持続作用の長所を与える剤形を提供することができる。例えば、錠剤またはピルは、外部成分によって覆われた内部組成物を含むことができる。さらに、分解に抵抗するよう働いて、内部成分がそのまま胃を通過するかまたはその放出が遅れることを可能にする腸溶層によって、2つの成分を分離することができる。そのような腸溶層またはコーティングのために様々な材料を用いることができるが、そのような材料には、多くのポリマー酸および、ポリマー酸と、セラック、セチルアルコールおよび酢酸セルロースのような物質との混合物が含まれる。
【0124】
薬学的製剤には、リポソームと複合体化された本発明のアンタゴニストが含まれる(Epstein, et al., Proc. Natl. Acad. Sci. USA 82:3688 (1985); Hwang, et al., Proc. Natl. Acad. Sci. USA 77:4030 (1980); ならびに米国特許第4,485,045号および第4,544,545号)。循環時間が増大したリポソームが、米国特許第5,013,556号に開示されている。リポソームを、ホスファチジルコリン、コレステロール、およびPEG誘導体化ホスファチジルエタノールアミン(PEG-PE)を含む脂質組成物を用いた逆相蒸発によって生成することができる。規定の孔径のフィルターを通してリポソームを押し出すことにより、所望の直径を有するリポソームを生成する。
【0125】
アンタゴニストをマイクロカプセル中に封入することもできる。そのようなマイクロカプセルは、例えばコアセルベーション技術によって、または界面重合法によって、例えばヒドロキシメチルセルロースまたはゼラチンのマイクロカプセルおよびポリ(メチルメタクリレート)マイクロカプセルが、コロイド状薬物送達システム(例えばリポソーム、アルブミンミクロスフェア、マイクロエマルジョン、ナノ粒子およびナノカプセル)中に、またはRemington, The Science and Practice of Pharmacy, 20th Ed. Mack Publishing (2000)に記述されているマクロエマルジョン中に、それぞれ調製される。
【0126】
さらに、徐放性製剤を調製することができる。徐放性製剤の適切な例には、抗体を含む固体疎水性ポリマーの半透性マトリックスが含まれ、そのマトリックスは、成形された物品(例えばフィルム、またはマイクロカプセル)の形をしている。徐放性マトリックスの例には、ポリエステル、ポリ(2-ヒドロキシエチル-メタクリレート)またはポリ(ビニルアルコール)などのヒドロゲル、ポリラクチド(米国特許第3,773,919)、L-グルタミン酸と7エチル-L-グルタメートのコポリマー、非分解性エチレン-酢酸ビニル、LUPRON DEPOT (登録商標)などの分解性乳酸-グリコール酸コポリマー(乳酸-グリコール酸コポリマーおよび酢酸ロイプロリドからなる注射可能なミクロスフェア)、ショ糖酢酸イソ酪酸エステル、およびポリD-(-)-3-ヒドロキシ酪酸が含まれる。
【0127】
アンタゴニストによる処置
本発明のアンタゴニストを用いて、癌幹細胞マーカーの発現および/またはそれに対する細胞の高い反応性によって特徴づけられる様々な症状を処置することができると考えられる。特に、癌幹細胞マーカーに対するアンタゴニスト(例えば抗体)を用いて、腎臓、肝臓、膀胱、乳房、胃、卵巣、結腸、直腸、前立腺、肺、外陰、甲状腺、頭および頸、脳(膠芽腫、星状細胞腫、髄芽細胞腫など)、血液およびリンパ液(白血病およびリンパ腫)の良性および悪性の腫瘍を非限定的に含む成長性障害を処置することが構想される。
【0128】
アンタゴニストを、公知の方法により、ヒト患者への適当な薬学的組成物として投与する。適当な投与法には、ボーラス注入としてのまたはある期間にわたる連続注入による静脈内投与が含まれ、また筋肉内、腹腔内、静脈内、脳脊髄内、皮下、関節内、滑液内、髄膜下、経口、局所的、または吸入による経路が非限定的に含まれる。
【0129】
ある態様では、処置に、本発明のアンタゴニストと、化学療法剤または複数の異なる化学療法剤の混合物との組み合わせ投与が含まれる。アンタゴニストによる処置を、化学療法剤の投与の前に、それと同時に、またはその後に行ってもよい。本発明が意図する化学療法には、ドキソルビシン、5-フルオロウラシル、シトシンアラビノシド(「Ara-C」)、シクロホスファミド、チオテパ、ブスルファン、サイトキシン、タキソール、メトトレキセート、シスプラチン、メルファラン、ビンブラスチンおよびカルボプラチンなどの、当技術分野において公知である、市販の化学物質または薬物が含まれる。組合せ投与には、単一の薬学的製剤によるまたは別々の製剤を用いた同時投与、あるいは、いずれかの順序であるが好ましくは全ての活性薬剤がそれらの生物活性を同時に発揮できるような期間内での、連続投与が含まれ得る。そのような化学療法剤の調製および投薬スケジュールを、メーカーの指示に従って、あるいは、熟練した施術者が経験的に決定して、用いることができる。そのような化学療法の調剤および投薬スケジュールは、Chemotherapy Service, M.C. Perry, ed., Williams & Wilkins, Baltimore, MD (1992) にも記載されている。
【0130】
ある態様では、処置には、本発明のアンタゴニストの放射線療法と組み合わせた投与が含まれる。アンタゴニストによる処置を、放射線療法の投与の前に、それと同時に、またはその後に行うことができる。そのような放射線療法の任意の適用スケジュールを、熟練した施術者が決定して用いることができる。
【0131】
ある態様では、処置は、本発明のアンタゴニストと、EGFR、HER2、およびVEGFに結合する抗体を非限定的に含む追加の腫瘍関連抗原に対する抗体との組み合わせ投与を含むことができる。さらに処置は、1つまたは複数のサイトカインの投与を含むことができ、癌細胞の外科的除去、または処置する医師によって必要と認められる任意の他の療法を一緒に行うことができる。
【0132】
疾病の処置については、本発明のアンタゴニストの適当な用量は、処置するべき疾病の種類、疾病の重症度および経過、疾病の反応性、治療または防止のどちらの目的でアンタゴニストを投与するのか、以前の療法、患者の病歴など、治療医の裁量におけるすべてによって決まる。一度に、または数日〜数か月の間継続する一連の処置に亘って、または治癒が達成されるか疾病状態の低減が達成されるまで(例えば腫瘍の大きさの減少)、アンタゴニストを投与することができる。患者の体内の薬物蓄積の測定値から最適な投薬スケジュールを計算することができるが、これは個々のアンタゴニストの相対的な効能に応じて変動しうる。投与する医師は、最適な用量、投薬方法、および反復回数を容易に決定することができる。一般に用量は、体重1kg当たり0.01μg〜100mgであり、1日、1週間、1か月、または1年に1回または複数回与えることができる。治療する医師は、体液または組織中の薬物の測定された滞留時間および濃度に基づいて、投薬のための反復回数を推定することができる。
【0133】
キット
さらに他の態様では、本発明は、本明細書に記述された方法を実施するために用いることができるキットを提供する。ある態様では、キットは、1つまたは複数の容器中に、精製された癌幹細胞マーカー可溶性受容体を含む。いくつかの態様では、キットは、すべての対照、分析を行なうための説明書、および結果の分析および呈示に必要な任意のソフトウェアを含めて、検出分析を行なうために必要および/または十分な構成要素のすべてを含む。ある態様では、本発明は、試薬が別々の容器に含まれている区画(compartment)キットを提供する。そのような容器は、試薬を1つの区画から別の区画へ効率的に移すことを可能にし、その結果、試料および試薬は相互に汚染されず、また各容器の薬剤または溶液を定量的な方法で1つの区画から別の区画へ加えることができる。そのような容器には、試験サンプルを受取る容器、本方法で使用する可溶性受容体を含む容器、洗浄剤(リン酸緩衝食塩水、トリス緩衝液など)を含む容器、および結合した抗体またはプローブを検出するために用いる試薬を含む容器が含まれることになろう。当業者は、本発明の開示されたポリヌクレオチド、ポリペプチドおよび抗体を、当技術分野において周知であって確立したキット形式の1つに容易に組み入れることができることを、容易に認識するであろう。
【実施例】
【0134】
実施例
実施例1
FZD Fc可溶性受容体タンパク質の産生およびインビボでの半減期の決定
ヒトFZD受容体のN末端細胞外ドメイン(ECD)の可溶型は、Wntリガンドを結合し、Wnt経路シグナル伝達のアンタゴニストとして働く(He et al.,(1997) Science 275:1652-54; Tanaka et al., (1998) Proc. Natl. Acad. Sci. 95:10164-69; Holmen et al., (2002) JBC 277:34727-35; Vincan et al., (2005) Differentiation 73:142-53)。昆虫細胞およびHEK293細胞中での発現用のベクター中で、FZD10、FZD7、FZD5、FZD4またはFZD8の、1) ECDまたは 2) Friドメインを、ヒトB細胞ライブラリーから単離されたヒトIgG1 Fc (配列番号:4) に、インフレームでライゲーションすることにより、可溶性FZD受容体を生成した。標準の組換えDNA技術を用いて、FZD10のおよそ21から227までのアミノ酸(FZD10 ECD.Fc);FZD7のおよそ32から255までのアミノ酸(FZD7 ECD.Fc);FZD5のおよそ27から233までのアミノ酸(FZD5 ECD.Fc);およびFZD4のおよそ37から224までのアミノ酸(FZD4 ECD.Fc)を含む、FZD受容体ECD、ならびにFZD10のおよそ21から154までのアミノ酸(FZD10 Fri.Fc);FZD7のおよそ32から171までのアミノ酸(FZD7 Fri.Fc);FZD5のおよそ27から157までのアミノ酸(FZD5 Fri.Fc);FZD4のおよそ37から170までのアミノ酸(FZD4 Fri.Fc);およびFZD8のおよそ28から158までのアミノ酸(FZD8 Fri.Fc)を含むFZD受容体Friドメインをコードするポリヌクレオチドを単離した。可溶性受容体タンパク質を、プロテインAカラムで精製した。
【0135】
可溶性FZD受容体の半減期を決定するために、インビボの実験を行なった。具体的には、200ugの精製されたFZD4 Fri.Fc、FZD8 Fri.Fc、FZD5 Fri.Fc、およびFZD5 ECD.Fcをマウス(n=3)に腹腔内投与し、示した時点(図1)で血液試料を得た。プロテインAアガロースビーズ上に保持された血清タンパク質をSDS-PAGEゲルで分離し、ニトロセルロース膜に移し、HRPに抱合されたヤギ抗ヒトIgG Fc断片で検査して、hFc融合タンパク質を検出した。FZD4 Fri.Fc、FZD5 Fri.FcおよびFZD8 Fri.Fcタンパク質はすべて、注入72時間後に血清中に存在し、また、FZD5 Fri.FcおよびFZD8 Fri.Fcは注入96時間後に血清中に存在する(図1)。対照的に、FZD5 ECD.Fcは24時間後には検出できない(図1)。
【0136】
実施例2
FZD Fc可溶性受容体タンパク質を評価するためのインビトロ分析
この実施例は、細胞増殖および経路活性化に対するFZD Fc受容体の活性を試験するためのインビトロ分析の方法について記述する。
【0137】
増殖分析
種々の癌細胞系統によるFZD受容体の発現を、Taqman分析を用いて定量する。FZD受容体を発現することが確認された細胞系統を、96ウエル組織培養マイクロプレートに、ウエル当たり細胞104個の密度でプレートし、24時間増殖させた。続いて、細胞を、さらに12時間、2%のFCSを含む新鮮なDMEM中で培養し、その時点で、可溶性FZD Fc受容体タンパク質および対照タンパク質を10umol/LのBrdUの存在下で培養液に加える。BrdUでラベルした後に、培地を除去し、細胞をエタノール中で30分間室温で固定し、ペルオキシダーゼを抱合したモロクローナル抗BrdU抗体(クローンBMG 6H8、Fab断片)と90分間反応させる。テトラメチルベンジジンを含む溶液中で基質を発色させ、15分間後に、1mol/LのH2SO4 25ulによって止めた。発色反応を、自動ELISAプレートリーダー(UV Microplate Reader; Bio-Rad Laboratories, Richmond, CA)で450nmフィルターを用いて測定した。全ての実験を3重に行なった。FZD Fc可溶性受容体タンパク質の細胞成長を阻害する能力を比較して決定した。
【0138】
経路活性化分析
可溶性FZD Fc受容体タンパク質がWntシグナル伝達経路の活性化を妨害する能力を、インビトロで決定する。1つの態様では、抗生物質および10% FCSを補ったDMEM中で培養したHEK293細胞を以下で共トランスフェクションした:1) Wntシグナル伝達経路を活性化するためのWnt7bおよびFZD10発現ベクター;2) 標準Wntシグナル伝達レベルを測定するための、ホタルルシフェラーゼレポーター遺伝子の上流にTCF結合ドメインの3コピーを含む野生型または突然変異型のTCF/Lucレポーターベクター(Gazit et al., 1999, Oncogene 18:5959-66);および 3) トランスフェクション効率の内部対照としてのウミシイタケ(Renilla)ルシフェラーゼレポーター(Promega; Madison, WI)。次に、FZD Fcタンパク質を細胞培養培地に加えた。トランスフェクションの48時間後に、デュアルルシフェラーゼ分析キット(Promega; Madison, WI)を用いてルシフェラーゼレベルを測定し、ホタルルシフェラーゼ活性をウミシイタケルシフェラーゼ活性で規格化した。独立した3つの実験を3重に行った。可溶性FZD10 Fcタンパク質がWnt経路活性化を阻害する能力が、このようにして決定される。
【0139】
いくつかの態様では、Wnt3aリガンドの存在下または非存在下で、増加量のFZD Fc融合タンパク質をL細胞とインキュベーションし、Wnt3aによって誘起されるβカテニンの安定化をイムノブロッティングにより測定した。Wnt3aの存在下でのみβカテニンが検知でき、また、この安定化は、FZD5 ECD.Fc、FZD8 Fri.FcおよびFZD4 Fri.Fc可溶性受容体タンパク質の量の増加に伴って阻止された(図2)。これはFZD Fc可溶性受容体タンパク質が、Wnt3aリガンドによって活性化されたWnt経路シグナル伝達に拮抗することを実証する。
【0140】
次に、FZD:Fc融合タンパク質が種々のWntリガンドによるシグナル伝達に拮抗する能力を測定した。8×TCF-ルシフェラーゼレポーターで安定してトランスフェクションされたHEK293細胞を、Wnt1、Wnt2、Wnt3、Wnt3aおよびWnt7bを含む種々のWntリガンドの存在下で、増加量のFZD Fri.Fc可溶性受容体とインキュベーションした。FZD4 Fri.Fc、FZD5 Fri.Fc、およびFZD8 Fri.Fc融合タンパク質が、5つのWntリガンドすべてによって媒介されるWntシグナル伝達を阻害した(図3)。
【0141】
実施例3
FZD Fc可溶性受容体タンパク質を用いる、腫瘍成長のインビボでの防止
この実施例は、異種移植片モデル中の腫瘍成長を防止するためのFZD Fc可溶性受容体の使用について記述する。
【0142】
マウス中で異種移植片として継代された患者試料(充実性腫瘍生検または胸水)由来の腫瘍細胞を、実験動物への再継代のために、詳細に上述したようにして調製した。次に、解離された腫瘍細胞(1動物当たり<10,000個の細胞;n=10)を、NOD/SCIDマウスの乳腺脂肪組織へ皮下注射して、腫瘍成長を誘発した。
【0143】
ある態様では、実験動物への注入の前に、解離された腫瘍細胞を、細胞表面マーカーに基づいて腫瘍形成性および非腫瘍形成性の細胞へ先ず選別する。具体的には、上述のように解離された腫瘍細胞を、2%加熱不活性化子ウシ血清(HICS)を含むHepes緩衝生理食塩水(HBSS)で2回洗浄し、100ul当たり106細胞となるよう再懸濁した。抗体を加えて、細胞を20分間氷上でインキュベーションし、その後HBSS/2% HICSで2回洗浄した。抗体には、抗ESA (Biomeda, Foster City, CA)、抗CD44、抗CD24、および細胞系統マーカーに対する抗CD2、抗CD3、抗CD10、抗CD16、抗CD18、抗CD31、抗CD64、および抗CD140b (まとめてLinと呼ばれる;PharMingen, San Jose, CA)が含まれる。これらのマーカーを発現する細胞を陽性選択または陰性選択するために、抗体を蛍光色素に直接抱合した。H2Kd+細胞を除く選択を行うことによりマウス細胞を除去し、また死細胞検出試薬7AADを用いることにより死細胞を除去した。フローサイトメトリーを、FACS Vantage (Becton Dickinson, Franklin Lakes, NJ)上で行なう。細胞の集塊を除去するために側方散乱および前方散乱プロファイルを用いた。単離されたESA+、CD44+、CD24-/low、Lin-腫瘍形成性細胞を、次に乳房腫瘍のためにはNOD/SCIDマウスの乳腺脂肪組織へ、または非乳房腫瘍のためには横腹へ皮下注射して、腫瘍成長を誘発した。
【0144】
ある態様では、腫瘍細胞注入の2日後に、動物を、FZD7 ECD.Fc可溶性受容体、FZD10 ECD.Fc可溶性受容体、またはFZD5 ECD.Fc可溶性受容体で処理した。各試験注入動物は、10mg/kgのFZD7 ECD.Fc、FZD5 ECD.Fc、またはFZD10 ECD.Fcタンパク質を、毎週2〜3回腹腔内へ(i.p.)、合計4週間投与された。対照注入動物は、毎週2回、合計4週間注入された。腫瘍の大きさを、21日目、24日目、28日目、および30日目に評価した。可溶性FZD10 ECD.FcおよびFZD7 ECD.Fcの両方による処理は、対照処理された動物と比較して、全腫瘍体積を縮小させた(図4)。FZD7 ECD.Fcによる腫瘍体積の縮小は、28日目および30日目で統計的に有意であった(図4)。
【0145】
次に、腫瘍中の癌幹細胞の存在に対するFZD Fc可溶性受容体処理の効果を評価する。FZD Fcおよび対照で処理したマウスから得た腫瘍試料を、殺菌した刃を用いて小片に切断し、完全に刻み、酵素消化および機械的破壊によって単細胞浮遊液を得た。詳細に上述したESA+、CD44+、CD24-/low、Lin表面細胞マーカーの発現に基づいて、次に解離された腫瘍細胞を、FACS分析により、腫瘍形成性癌幹細胞の存在について解析した。
【0146】
FZD Fc処理に続いて、ESA+、CD44+、CD24-/low、Lin-の発現に基づいて単離された細胞の腫瘍形成能を評価することができる。FZD Fc処理マウスおよび対照処理マウス由来の、5,000、1,000、500および100個の単離されたESA+、CD44+、CD24-/low、Lin-癌幹細胞を、NOD/SCIDマウスの乳腺脂肪組織へ再皮下注入する。一貫した腫瘍形成に必要な注入細胞数に基づく癌幹細胞の腫瘍形成能を、このように決定する。
【0147】
ある態様では、5〜7週齢の雌rag-2/γ系ダブルノックアウトマウスに、マウス乳腺腫瘍ウイルス(MMTV)-WNT1腫瘍由来の50,000個の細胞を、右上乳腺脂肪組織中へ注入した。遺伝子組換え(MMTV)−Wnt1マウスは、過形成、浸潤性腺管癌腫、および遠隔転移を含む乳房腫瘍形成の個別の段階を示すので、したがってこの乳癌マウスモデルは、腫瘍形成および成長におけるWntの役割を解析するための有用な手段を提供する(Nusse and Varmus (1982) Cell 31:99-109)。これらのマウスからの腫瘍を解離させ、解離された腫瘍細胞を腫瘍を成長させる目的に用いた。乳腺脂肪組織に腫瘍細胞を移植されたマウスを、毎週5回、200ulのPBS (n=10)またはPBSで薄めたFZD8 Fri.Fc可溶性受容体(10mg/kg)で処理した。腫瘍が触診可能になったら、毎週2回腫瘍の大きさを測定した。可溶性受容体FZD8 Fri.Fcによる処理は、PBSによる対照処理と比較して、劇的に腫瘍成長を減少させた(図5)。
【0148】
FZD可溶性受容体の腫瘍成長阻害能力を再び試験するために、50,000個のPE13乳房腫瘍細胞をNOD/SCIDマウスに注入した。細胞注入の1日後に、200ulのPBSで薄められたFZD8 Fri.Fc可溶性受容体を10mg/kgで腹腔内に注入するかまたは200ulのPBSを注入し、毎週5回(実験群当たりn=10)処理を続けた。腫瘍成長を検出するまで毎週モニターし、次に毎週2回腫瘍成長を測定した。FZD8 Fri.Fcによる動物の処理により、乳房腫瘍細胞成長は、PBS注入対照と比較して有意に減少した(図6)。
【0149】
実施例4
FZD Fc可溶性受容体タンパク質を用いる、腫瘍成長のインビボでの処理
この実施例は、異種移植片モデルの腫瘍を処理するための、FZD Fc可溶性受容体の使用について記述する。
【0150】
ある態様では、マトリゲル中のMMTV Wnt1乳房腫瘍由来の50,000個の細胞を、5〜7週齢の雌 rag-2/γ系ダブルノックアウトマウスの皮下へ移植した。19日目に、腫瘍を有するマウスを65mm3の平均腫瘍体積を有するグループに無作為に割り当て、26日目に、FZD8 Fri.FcまたはFZD5 Fri.Fc融合タンパク質による処理を開始した。具体的には、毎週5回、FZD8 Fri.Fc融合タンパク質を、増大濃度で(5mg/kg、10mg/kg、および30mg/kg)投与し、FZD5 Fri.Fcを10mg/kg投与した。対照動物をPBSで処理した。
【0151】
FZD8 Fri.Fc融合タンパク質の用量依存性の抗腫瘍活性が観察された(図7)。最低用量-5mg/kg-のFZD8 Fri.Fcは、PBSで処理したマウスと比較して腫瘍の成長を低下させたが、10mg/kgおよび30mg/kgのFZD8 Fri.Fc処理の措置は、株化前の腫瘍の大きさを低下させるためにより著しく有効であった。対照的に、FZD5 Fri.Fcは、成長にWnt1が必要な株化乳房腫瘍に対しては、抗腫瘍効果を発揮しなかった。
【0152】
実施例5
FZD Fc可溶性受容体タンパク質を用いる、腫瘍のインビボでの処理
この実施例は、異種移植片モデル中の癌を処理するためのFZD Fc可溶性受容体の使用について記述する。
【0153】
マウス中で異種移植片として継代されてきた患者の試料(充実性腫瘍生検または胸水)からの腫瘍細胞を、実験動物へ再継代するために調製する。腫瘍組織を取出し、殺菌された刃を用いて小片へ切断し、完全に刻み、酵素消化および機械的な破壊によって、単細胞懸濁液を得る。次に解離された腫瘍細胞を、乳房腫瘍についてはNOD/SCIDマウスの乳腺脂肪組織へ、また非乳房腫瘍については横腹へ皮下注射して、腫瘍成長を誘発した。または、ESA+、CD44+、CD24-/low、Lin-腫瘍形成性腫瘍細胞を詳細に上述したように単離して、注入した。
【0154】
腫瘍細胞注入に続いて、動物を腫瘍成長についてモニターする。腫瘍がおよそ150〜200mmの平均の大きさに達したら、FZD Fcタンパク質処理を開始する。各動物は、毎週2回〜5回で合計6週間、10mg/kgのFZD Fcまたは対照タンパク質を、腹腔内に投与される。腫瘍の大きさを、この6週間の間、毎週2回評価する。対照の抗体と比較して、さらなる腫瘍成長を防止するかまたは腫瘍の大きさを縮小するFZD Fcの能力を、このようにして決定する。
【0155】
実施例6
FZD Fc可溶性受容体タンパク質を用いるヒト癌の処置
この実施例は、FZD受容体発現が検出されている癌幹細胞および/または腫瘍細胞を含む腫瘍を標的とする、FZD Fc可溶性受容体を用いて癌を処置するための方法について記述する。
【0156】
癌幹細胞マーカー発現の存在を、最初に腫瘍生検から決定することができる。癌と診察された患者の生検から、腫瘍細胞を無菌条件下で取出す。1つの態様では、組織生検を、液体窒素中で新鮮凍結して、O.C.T.に包埋し、クリオスタットで10um切片に切断してスライドガラスに載せる。または、組織生検をホルマリン固定し、パラフィン包埋し、ミクロトームで10umの切片に切断してスライドガラスに載せる。切片をFZD受容体に対する抗体とインキュベーションして、タンパク質発現を検出する。追加して、癌幹細胞の存在を決定することができる。組織生検試料を、殺菌した刃を用いて小片に切断し、完全に刻み、細胞を酵素消化および機械的破壊に供して、単細胞懸濁液を得る。次に、癌幹細胞を検出するために、解離された腫瘍細胞を、抗ESA、抗CD44、抗CD24、抗Lin、および抗FZD抗体とインキュベーションして、ESA+、CD44+、CD24-/low、Lin-、FZD+腫瘍幹細胞の存在を、詳細に上述したように、フローサイトメトリーによって決定する。
【0157】
腫瘍が癌幹細胞を有すると診断された癌患者を、FZD:Fc可溶性受容体で処置する。上述のように生成したヒトFZD Fc融合タンパク質を精製し、PBS中の適当な薬学的担体と共に注入用に製剤する。患者をFZD Fcによって、好ましくは週に1回少なくとも10週間、しかしより好ましくは週に1回少なくとも約14週間、処置する。FZD Fcの各投与は、薬学的に有効な約2〜約100mg/mlまたは約5〜約40mg/mlの用量であるべきである。標準の放射線療法措置、またはオキサリプラチン、フルオロウラシル、ロイコボリンまたはストレプトゾシンなどの1つまたは複数の化学療法剤を用いる化学療法措置の前に、それと同時に、またはその後に、FZD Fcを投与することができる。患者をモニターし、例えば腫瘍退縮、新しい腫瘍発生の減少、腫瘍抗原の発現低下、癌幹細胞の数の減少、または疾病予後を評価する他の手段に基づいて、そのような処置が、抗腫瘍応答に帰着したかどうかを決定する。
【0158】
上記の明細書中に言及した出版物および特許は、参照によりすべて本明細書に組み入れられる。本発明の範囲および精神から外れることなく、記載された本発明の方法およびシステムの様々な修飾および変形が可能なことは、当業者には明白であろう。本発明を特定の態様に関連して記述したが、権利請求する本発明はそのような特定の態様に不当に限定されるべきでないことは当然である。確かに、本発明を実施するための記述された様式の、当業者にとって明白な様々な修飾は、添付の特許請求の範囲内であると考える。
【技術分野】
【0001】
発明の分野
本発明は腫瘍学の分野に関し、癌を診断し処置するための新規な組成物および方法を提供する。特に本発明は、癌に対するアンタゴニスト、特に充実性腫瘍の研究、診断、および処置に役立つ受容体融合タンパク質を含む、癌幹細胞マーカーに対するアンタゴニストを提供する。
【背景技術】
【0002】
背景技術
癌は、先進諸国における主要な死因の1つであって、米国のみで年間500,000例以上の死をもたらす。米国では毎年100万人以上が癌と診断される。また通算して、3人中2人以上が一生のうちになんらかの形の癌を発病するであろうと推測される。200種より多くの様々な種類の癌が存在するが、それらのうちの4つ、すなわち乳房、肺、結腸直腸、および前立腺の癌が、全ての新患の半分以上を占める(Jernal et al., Cancer J. Clin. 53:5-26 (2003)(非特許文献1))。
【0003】
乳癌は、女性で最も一般的な癌であり、女性の推定12%が一生のうちに発病するリスクを有する。死亡率は、早期検出および処置の改善により減少したが、未だ乳癌は中年女性の主要な死因である。さらに、転移性乳癌は、依然として不治の病である。論文発表においては、ほとんどの転移性乳癌患者は1つまたは2つの臓器系が罹患しているだけであるが、その疾病が進行するとともに、通常複数の部位に併発するようになる。転移併発の最も一般的な部位は、皮膚および胸壁の軟組織における、ならびに腋窩および鎖骨上における、局所領域的再発である。遠隔転移の最も一般的な部位は、骨(遠隔転移の30〜40%)であり、続いて肺および肝臓である。また、新しく乳癌と診断された女性の約1〜5%しか診断時には遠隔転移を有しないが、局所的疾病を有する患者のおよそ50%が、5年以内に転移によって最終的に再発する。現在、遠隔転移が起こってからの生存期間の中央値は、約3年である。
【0004】
乳癌を診断し病期分類をする現在の方法には、American Joint Committee on CancerのAJCC Cancer Staging Manual, Philadelphia, PA, Lippincott-Raven Publishers, 5th ed. (1997), pp 171-180(非特許文献2)およびHarris, J. R, et al., eds., Breast Diseases, Philadelphia, Lippincott (1991) 中のHarris, J R.: "Staging of breast carcinoma" (非特許文献3)に述べられているような、腫瘍の大きさ、リンパ節中の腫瘍の存在、および遠隔転移の存在に基づく腫瘍−結節−転移(TNM)システムが含まれる。これらのパラメーターは、予後診断を与え、適切な治療を選択するために用いられる。腫瘍の形態的外観を評価することもできるが、同様の組織病理学的外観を有する腫瘍が有意な臨床的多様性を示す場合があるので、この方法は重大な限界を有する。最後に、細胞表面マーカーの分析を用いて、ある腫瘍の種類をサブクラスに分けることができる。例えば、乳癌の予後診断および処置において考慮される1つの因子は、エストロゲン受容体(ER)の存在であり、ER陽性の乳癌は通常は、タモキシフェンまたはアロマターゼ阻害剤などのホルモン療法剤に、ER陰性の腫瘍よりも容易に応答する。それでも、これらの分析は有用ではあるが、乳腫瘍の臨床的挙動を部分的に予測できるだけであり、乳癌には、現在の診断機器によって検出できず、また現在の療法によって処置できない多くの表現型多様性が存在する。
【0005】
前立腺癌は、先進諸国における男性の最も一般的な癌であって、米国での全新癌患者の概算33%を占め、2番目に多い死因である(Jemal et al., CA Cancer J. Clin. 53:5-26 (2003)(非特許文献4))。前立腺特異抗原(PSA)血液検査の導入以来、前立腺癌の早期発見が劇的に生存率を改善し、診断時に局所的および局部的段階の前立腺癌を有する患者の5年生存率は、100%に近づいている。それでも50%を上回る患者が、局所的に進行した疾病あるいは転移性の疾病を最終的に発病する(Muthuramalingam et al., Clin. Oncol. 16:505-516 (2004)(非特許文献5))。
【0006】
現在、根治的前立腺摘除および放射線療法により、大多数の局所的な前立腺腫瘍に対する治癒的処置が提供される。しかし治療の選択肢は、進行した症例の場合は極めて限定されている。転移性疾病については、単独の、または抗アンドロゲン剤と組み合わせた黄体形成ホルモン放出ホルモン(LHRH)アゴニストを用いるアンドロゲン除去が標準的処置である。しかし、最大限のアンドロゲン遮断にもかかわらず、大多数の進行性アンドロゲン非依存性疾病の場合は、疾病はほとんど必ず進行する。現在のところ、ホルモン無反応性前立腺癌のための一様に容認された処置は存在せず、一般に化学療法的治療法が用いられる(Muthuramalingam et al., Clin. Oncol. 16:505-516 (2004)(非特許文献5); Trojan et al., Anticancer Res. 25:551-561 (2005)(非特許文献6))。
【0007】
結腸直腸癌は3番目に一般的な癌であり、世界中の癌死の中で4番目に多い原因である(Weitz et al., 2005, Lancet 365:153-65(非特許文献7))。全結腸直腸癌のおよそ5〜10%が遺伝性であって、その主要な形の1つが家族性大腸腺腫性ポリポーシス(FAP)であり、これは罹患者の約80%が大腸腺腫性ポリポーシス(APC)遺伝子に生殖細胞系列突然変異を含む、常染色体優性疾患である。結腸直腸癌腫には、周辺への成長により局所的に、および、リンパ性、血行性、腹膜横断性、および神経周囲への伝播により他の場所へ侵入する傾向がある。リンパ外の併発の最も一般的な部位は肝臓であり、最も頻繁に冒される腹腔外の器官は肺である。他の血行性の伝播部位には、骨、腎臓、副腎および脳が含まれる。
【0008】
結腸直腸癌用の現在の病期分類システムは、腫瘍が腸壁を通過する浸透の程度、およびリンパ節併発の存在または非存在に基づいている。この病期分類システムは、3つの主なデュークス分類によって定義される:デュークスA疾病は、結腸または直腸の粘膜下組織層に限定され;デュークスB疾病は、固有筋層を通過して侵入し、結腸または直腸壁に浸透する可能性のある腫瘍を有し;そしてデュークスC疾病は、任意の程度の腸壁侵入および局部的リンパ節転移を含む。外科的切除術は初期段階結腸直腸癌に極めて有効であって、デュークスA患者では95%の治癒率を与え、デュークスB患者では、治癒率は75%に減少し、またデュークスC疾病中の陽性リンパ節の存在は、60%の5年以内の再発可能性を予測する。デュークスC患者の外科手術後の化学療法コースによる処置は再発率を40%〜50%に低下させるが、これは、これらの患者に対する現在の標準の治療である。
【0009】
肺癌は世界的に最も一般的な癌であり、米国では3番目に多く診断される癌であって、癌死の最も多い原因である(Spiro et al., Am. J. Respir. Crit. Care Med. 166: 1166-1196 (2002)(非特許文献8); Jemal et al., CA Cancer J. Clin. 53:5-26 (2003)(非特許文献9))。喫煙が、すべての肺癌のうち推定87%の原因と考えられ、このことにより、肺癌は最も効果的に予防可能な疾病となっている。肺癌は、小細胞肺癌(SCLC)および非小細胞肺癌(NSCLC)の2つの主要なタイプに分類され、これらがすべての肺癌の90%以上を占める。SCLCは、症例の15〜20%を占め、それが大きな中枢気道に由来すること、および細胞質がほとんどない小細胞のシートという組織学的組成によって特徴づけられる。SCLCはNSCLCより攻撃的であり、急速に成長し、早期に高頻度で転移する。NSCLCは、すべての症例の80〜85%を占め、組織学に基づいてさらに3つの主なサブクラスである腺癌腫、扁平上皮癌腫(類表皮癌腫)および大細胞未分化癌腫、に分類される。
【0010】
肺癌は、典型的にはその進行の後期に症状を現わし、したがって生存中央値は診断後わずか6〜12ヶ月であり、全体としての5年生存率はわずか5〜10%に過ぎない。手術は治癒の最良の機会を提供するが、肺癌患者のごく一部しかそれに適格ではなく、大多数は化学療法と放射線療法に頼っている。これらの療法の時期および用量強度を操作する試みにもかかわらず、生存率は、過去15年にわたってほとんど増加していない(Spiro et al., Am. J. Respir. Crit. Care Med. 166: 1166-1196 (2002)(非特許文献8))。
【0011】
癌は、正常組織の発生および維持を制御する機構の調節不全から起こり、次第に幹細胞が中心的な役割を果たすようになると考えられている(Beachy et al., Nature 432:324 (2004)(非特許文献10))。正常な動物の発生において、大部分または全ての組織の細胞は、幹細胞と呼ばれる正常な前駆体から生じる(Morrison et al., Cell 88:287-298 (1997)(非特許文献11); Morrison et al., Curr. Opin. Immunol. 9:216-221 (1997)(非特許文献12); Morrison et al., Annu. Rev. Cell. Dev. Biol. 11:35-71 (1995)(非特許文献13))。幹細胞は(1) 高い成長能を有し;(2) 非対称細胞分裂して、成長および/または発生能力の低下した1つまたは複数の種類の子孫を生成することができ;かつ(3) 自己再生または自己維持のための対称細胞分裂が可能な細胞である。幹細胞の分化による成人の細胞再生の最もよく知られている例は造血系であって、発生上未熟な前駆体(造血幹細胞および始原細胞)が、分子信号に応答して、様々な血液細胞型およびリンパ球細胞型を形成する。腸、乳管系および皮膚の細胞を含む他の細胞は、絶えず各組織中の少数の幹細胞から補充されており、最近の研究によって、脳を含む大部分の他の成人組織もまた幹細胞を含むことが示唆されている。
【0012】
充実性腫瘍は異種性の細胞集団からなる。例えば乳癌は、癌細胞、ならびに間充織(間質)細胞、炎症細胞および内皮細胞を含む正常細胞の混合物である。癌の古典的モデルでは、表現型の異なるすべての癌細胞集団が、増殖して新しい腫瘍を生じさせる能力を有すると考えられている。古典的モデルでは、腫瘍細胞の異質性は、環境要因ならびに癌細胞内で進行中の突然変異に起因し、腫瘍形成性細胞の様々な集団をもたらす。このモデルは、すべての腫瘍細胞の集団がある程度の腫瘍形成能力を有するであろうという発想に基づく(Pandis et al., Genes, Chromosomes & Cancer 12:122-129 (1998)(非特許文献14); Kuukasjrvi et al., Cancer Res. 57:1597-1604 (1997)(非特許文献15); Bonsing et al., Cancer 71:382-391 (1993)(非特許文献16); Bonsing et al., Genes Chromosomes & Cancer 82:173-183 (2000)(非特許文献17); Beerman H. et al., Cytometry. 12:147-154 (1991)(非特許文献18); Aubele M & Werner M, Analyt. Cell. Path. 19:53 (1999)(非特許文献19); Shen L et al., Cancer Res. 60:3884 (2000)(非特許文献20))。
【0013】
観察される充実性腫瘍細胞の異質性についての代替モデルは、充実性腫瘍が「充実性腫瘍幹細胞」(あるいは充実性腫瘍由来の「癌幹細胞」)に起因し、それが対称および非対称段階の細胞分裂による無秩序な発生を経るというものである。この幹細胞モデルでは、充実性腫瘍は、別々の限定された(恐らく希でさえある)細胞のサブセットを含み、それらは、広汎に成長しかつさらなる充実性腫瘍幹細胞(自己再生)および腫瘍形成能力を欠く充実性腫瘍の大多数の腫瘍細胞の両者を効率的に生じるという点で、正常「幹細胞」の特性を共有する。実際、長命の(long-lived)幹細胞集団内の突然変異が、腫瘍の成長および維持の基礎となっており、その存在が現在の治療的アプローチの失敗に寄与する、癌幹細胞の形成を開始し得る。
【0014】
癌の幹細胞的性質は、最初に血液癌、即ち急性骨髄白血病(AML)において明らかにされた(Lapidot et al., Nature 17:645-648 (1994)(非特許文献21))。より最近になって、悪性ヒト乳房腫瘍が同様に、免疫不全マウスにおける腫瘍形成能力に富む癌幹細胞の小さな別々の集団を含むことが実証された。ESA+、CD44+、CD24-/low、Lin-細胞集団は、分画されていない腫瘍細胞と比較して、腫瘍形成性細胞が50倍濃縮されていることが判明した(Al-Hajj et al., PNAS 100:3983-3988 (2003)(非特許文献22))。予測的に腫瘍形成性癌細胞を単離できることによって、これらの細胞の腫瘍形成能の基礎となる重大な生物学的経路の研究が可能になり、このことはしたがって癌患者のためのよりよい診断分析および治療法の開発を約束する。本発明の方向性は、この目的を目指している。
【先行技術文献】
【非特許文献】
【0015】
【非特許文献1】Jernal et al., Cancer J. Clin. 53:5-26 (2003)
【非特許文献2】American Joint Committee on Cancer中、AJCC Cancer Staging Manual, Philadelphia, PA, Lippincott-Raven Publishers, 5th ed. (1997), pp 171-180
【非特許文献3】Harris, J. R, et al., eds., Breast Diseases, Philadelphia, Lippincott (1991)中、Harris, J R.: "Staging of breast carcinoma"
【非特許文献4】Jemal et al., CA Cancer J. Clin. 53:5-26 (2003)
【非特許文献5】Muthuramalingam et al., Clin. Oncol. 16:505-516 (2004)
【非特許文献6】Trojan et al., Anticancer Res. 25:551-561 (2005)
【非特許文献7】Weitz et al., 2005, Lancet 365:153-65
【非特許文献8】Spiro et al., Am. J. Respir. Crit. Care Med. 166: 1166-1196 (2002)
【非特許文献9】Jemal et al., CA Cancer J. Clin. 53:5-26 (2003)
【非特許文献10】Beachy et al., Nature 432:324 (2004)
【非特許文献11】Morrison et al., Cell 88:287-298 (1997)
【非特許文献12】Morrison et al., Curr. Opin. Immunol. 9:216-221 (1997)
【非特許文献13】Morrison et al., Annu. Rev. Cell. Dev. Biol. 11:35-71 (1995)
【非特許文献14】Pandis et al., Genes, Chromosomes & Cancer 12:122-129 (1998)
【非特許文献15】Kuukasjrvi et al., Cancer Res. 57:1597-1604 (1997)
【非特許文献16】Bonsing et al., Cancer 71:382-391 (1993)
【非特許文献17】Bonsing et al., Genes Chromosomes & Cancer 82:173-183 (2000)
【非特許文献18】Beerman H. et al., Cytometry. 12:147-154 (1991)
【非特許文献19】Aubele M & Werner M, Analyt. Cell. Path. 19:53 (1999)
【非特許文献20】Shen L et al., Cancer Res. 60:3884 (2000)
【非特許文献21】Lapidot et al., Nature 17:645-648 (1994)
【非特許文献22】Al-Hajj et al., PNAS 100:3983-3988 (2003)
【発明の概要】
【0016】
発明の概要
ある態様では、本発明は、癌幹細胞マーカーを含む可溶性受容体を提供する。ある態様では、可溶性受容体は、癌幹細胞マーカーのリガンドと結合する癌幹細胞マーカーを含む。ある態様では、可溶性受容体は癌幹細胞マーカーを含み、腫瘍細胞の成長を阻害する。ある態様では、可溶性受容体は、ヒトFZD受容体のFriドメインを含む。ある態様では、可溶性受容体は、ヒトFZD受容体のリガンドと結合するヒトFZD受容体のFriドメインを含む。ある態様では、可溶性受容体は、ヒトFZD受容体のFriドメインを含み、腫瘍細胞の成長を阻害する。
【0017】
ある態様では、本発明は、癌幹細胞マーカーを含む可溶性受容体をコードする、単離された核酸分子を提供する。ある態様では、単離された核酸分子は、癌幹細胞マーカーのリガンドと結合する、癌幹細胞マーカーを含む可溶性受容体をコードする。ある態様では、単離された核酸分子は、腫瘍細胞の成長を阻害する、癌幹細胞マーカーを含む可溶性受容体をコードする。ある態様では、単離された核酸分子は、ヒトFZD受容体のFriドメインを含む可溶性受容体をコードする。ある態様では、単離された核酸分子は、ヒトFZD受容体のリガンドと結合する、ヒトFZD受容体のFriドメインを含む可溶性受容体をコードする。ある態様では、単離された核酸分子は、腫瘍細胞の成長を阻害する、ヒトFZD受容体のFriドメインを含む可溶性受容体をコードする。
【0018】
ある態様では、本発明は、腫瘍細胞成長を阻害するために有効な量の、癌幹細胞マーカーを含む可溶性受容体を投与する工程を含む、癌を処置する方法を提供する。ある態様では、癌を処置する方法は、腫瘍細胞成長を阻害するために有効な量の、癌幹細胞マーカーのリガンドと結合する癌幹細胞マーカーを含む可溶性受容体を投与する工程を含む。ある態様では、癌を処置する方法は、腫瘍細胞成長を阻害するために有効な量の、ヒトFZD受容体のFriドメインを含む可溶性受容体を投与する工程を含む。ある態様では、癌を処置する方法は、腫瘍細胞成長を阻害するために有効な量の、ヒトFZD受容体のリガンドと結合するヒトFZD受容体のFriドメインを含む可溶性受容体を投与する工程を含む。
【0019】
本発明の治療用組成物、例えばFzd受容体と結合する抗体またはFzd受容体のリガンドによる活性化を阻止する受容体融合タンパク質を用いて処置することができる充実性腫瘍の例には、繊維肉腫、粘液肉腫、脂肪肉腫、軟骨肉腫、骨原性肉腫、脊索腫、血管肉腫、内皮肉腫、リンパ管肉腫、リンパ管内皮肉腫、滑膜腫、中皮腫、ユーイング腫瘍、平滑筋肉腫、横紋筋肉腫、結腸癌腫、膵臓癌、乳癌、卵巣癌、前立腺癌、扁平上皮癌腫、基底細胞癌腫、腺癌腫、汗腺癌腫、脂腺癌腫、乳頭癌腫、乳頭腺癌腫、嚢胞腺癌腫、髄様癌腫、気管支原生癌腫、腎細胞癌腫、肝臓癌、胆管癌腫、絨毛膜癌腫、精上皮腫、胎児性癌腫、ヴィルムス腫瘍、子宮頸癌、精巣腫瘍、肺癌腫、小細胞肺癌腫、膀胱癌腫、上皮性癌腫、神経膠腫、星状細胞腫、髄芽細胞腫、頭蓋咽頭腫、脳室上衣腫、松果体腫、血管芽細胞腫、聴神経腫、乏突起膠腫、髄膜腫、メラノーマ、神経芽細胞腫、および網膜芽細胞腫などの、しかしそれらに限定されない肉腫および癌腫が非限定的に含まれる。本発明は、卵巣癌および乳癌などの肉腫および上皮癌に適用可能である。
【図面の簡単な説明】
【0020】
【図1】FZD.Fc可溶性受容体の半減期。精製されたFc融合タンパク質を、2匹のマウス各々に腹腔内投与し、投与後様々な時間に血液試料を得た。FZD4 Fri.Fc、FZD5 Fri.FcおよびFZD8 Fri.Fcタンパク質は、注入72時間後に血清中に依然として存在し、FZD5 Fri.FcおよびFZD8 Fri.Fcタンパク質は、注入96時間後まで血清中に存在する。対照的に、FZD5 ECD.Fcは、わずか24時間後には血清中に検出できない(上部)。
【図2】FZD Fc可溶性受容体はWnt3aシグナル伝達を阻害する。Wnt3aリガンドの存在下または非存在下で、FZD4 Fri.Fc、FZD5 ECD.Fc、FZD5 Fri.FcおよびFZD8 Fri.Fcを含む、増大濃度(2nM、5nM、および60nM)のFZD Fc融合タンパク質をL細胞とインキュベーションし、βカテニンの安定化をイムノブロッティングにより測定した。Wnt3aリガンドの非存在下では、βカテニンを検出することはできなかった(LCM)。Wnt3aの存在下でβカテニンは安定化され、この安定化は、FZD5、FZD8およびFZD4 Fc可溶性受容体タンパク質の量を増加させることにより阻止されたが、対照Fcタンパク質(対照Fc)では阻止されなかった。
【図3】FZD Fc可溶性受容体はWntシグナル伝達を阻害する。8×TCF-ルシフェラーゼレポーターにより安定にトランスフェクションされたHEK293細胞を、増加濃度のFZD:Fc可溶性受容体と、Wntl、Wnt2、Wnt3、Wnt3aおよびWnt7bを含む種々のWntリガンドの存在下で、インキュベーションした。ルシフェラーゼ活性の低下によって示されるように、FZD4 Fc、FZD5 FcおよびFZD8 Fc融合タンパク質は、5つのWntリガンドすべてによって媒介されるWntシグナル伝達を阻害した。
【図4】FZD Fc可溶性受容体タンパク質による腫瘍成長の減少。解離された結腸腫瘍細胞(動物当たり10,000の細胞;n=10)を皮下注射されたNOD/SCIDマウスを、2日後にFZD7 ECD.Fc可溶性受容体、FZD 10ECD.Fc可溶性受容体、または対照注入剤で処理した。総腫瘍体積を21、24、28および30日目について示す。FZD7 ECD.Fcによる腫瘍体積の減少が、28日目および30日目で統計的に有意であった(*)。
【図5】FZD8 Fri.Fc可溶性受容体タンパク質による、Wnt依存性腫瘍成長の防止。50,000個のMMTV WNT1腫瘍由来の細胞を注入されたNOD/SCIDマウス(n=10)を、翌日にFZD8 Fri.Fc可溶性受容体または対照としてPBSで処理した。腫瘍成長を、成長を検出するまで毎週モニターし、次に週に2度腫瘍成長を測定した。対照動物で観察された腫瘍成長(右バー)と比較して、FZD Fri.Fcで処理された動物中の腫瘍成長(左バー)は事実上消失した。
【図6】FZD8 Fri.Fc可溶性受容体タンパク質によるPE13異種移植片腫瘍成長の減少。50,000個のPE13乳房腫瘍細胞を注入されたNOD/SCIDマウス(n=10)を、翌日にFZD8 Fri.Fc可溶性受容体または対照としてPBSで処理した。腫瘍成長を、成長を検出するまで毎週モニターし、次に週に2度腫瘍成長を測定した。対照動物で観察された腫瘍成長(右バー)と比較して、FZD Fri.Fcで処理された動物中の腫瘍成長(左バー)は有意に減少した。
【図7】FZD Fri.Fc可溶性受容体タンパク質による、Wnt依存性腫瘍成長の処理。雌のrag-2/γ系ダブルノックアウトマウスに、50,000個のMMTV Wnt1乳房腫瘍由来の細胞を移植した。5mg/kgのFZD8 Fri.Fcによる処理が、腫瘍の成長を全腫瘍体積の経時的変化により決定したところ、PBSで処理されたマウス(白いバー)に比較して低下させた。10mg/kgおよび30mg/kgのFZD8 Fri.Fcによる処理は、株化前の腫瘍の大きさを縮小させるのにさらに有効であった。対照的に、FZD5 Fri.Fcは、成長にWnt1を必要とする株化乳房腫瘍に対する抗腫瘍効果を発揮しなかった。
【発明を実施するための形態】
【0021】
発明の詳細な説明
定義
本明細書では、用語「アンタゴニスト」を、本明細書に開示する癌幹細胞マーカーの発現または生物活性を部分的にまたは完全に遮断、阻害、あるいは中和する任意の分子を含むように用いるが、そのような生物活性は、腫瘍成長の阻害を非限定的に含む。用語「アンタゴニスト」は、FZD経路の生物活性を部分的にまたは完全に遮断、阻害、または中和する任意の分子を含む。適切なアンタゴニスト分子は、可溶性FZD受容体を含む天然のFZD受容体タンパク質の断片またはアミノ酸配列変異体を非限定的に含む。
【0022】
用語「単離された」および「精製された」とは、ある物質の天然の状態では通常その物質に付随する成分が実質的にまたは本質的に存在しない物質を指す。純度および均一性は、典型的にはポリアクリルアミドゲル電気泳動法または高速液体クロマトグラフィーなどの分析化学技術を用いて決定される。調製物中に存在する主な種であるタンパク質(例えば可溶性受容体)または核酸は、実質的に精製されている。特に単離された核酸とは、自然にはその遺伝子に隣接しかつその遺伝子によってコードされるタンパク質以外のタンパク質をコードするオープンリーディングフレームから、分離されている。単離された抗体は、他の非免疫グロブリンタンパク質および異なる抗原結合特異性を有する他の免疫グロブリンタンパク質から分離されている。これはさらに、核酸またはタンパク質が、少なくとも85%純粋であること、少なくとも95%純粋であること、そしていくつかの態様では少なくとも99%純粋であることを意味しうる。
【0023】
本明細書に用いられる用語「可溶性受容体」および「FZD可溶性受容体」とは、ヒトFZD受容体の第1の膜貫通ドメインに先行し、細胞から可溶性形態で分泌され得る、ヒトFZD受容体タンパク質のN末端細胞外断片を指す。N末端細胞外ドメイン(ECD)(本明細書で「FZD ECD」と呼ぶ)全体およびより小さな断片を含む、FZD可溶性受容体の両方が想定される。Friドメインを含むFZD可溶性受容体(本明細書で「FZD Fri」と呼ぶ)もまた開示される。FZD Fri可溶性受容体は、FZD ECD全体を含む可溶性受容体と比較して、変化した生物活性(例えば、増大したタンパク質半減期)を示すことができる。タンパク質の半減期は、ポリ(エチレングリコール)またはポリ(エチレンオキシド)(両方ともPEGと呼ぶ)との共有結合性修飾によってさらに増大させることができる。FZD可溶性受容体には、ヒトFc(例えば、IgG1、IgG2、IgG3、IgG4、IgA1、IgA2、IgD、IgE、IgMに由来するヒトFc);タンパク質タグ(例えば、myc、FLAG、GST);他の内在性タンパク質またはタンパク質断片;あるいは、FZD ECDまたはFriドメインと連結したタンパク質の間の任意のリンカー領域も含む任意の他の有用なタンパク質配列を非限定的に含む他の機能タンパク質および構造タンパク質にインフレームで融合された、FZD ECDまたはFriドメインが含まれる。ある態様では、FZD受容体のFriドメインがヒトIgG1 Fcに連結されている(本明細書で「FZD Fri.Fc」と呼ぶ)。FZD可溶性受容体には、さらにアミノ酸挿入、欠失、置換、および保存的変化などを有するタンパク質が含まれる。
【0024】
本明細書に用いられる、用語「癌」および「癌性」は、細胞集団が無秩序な細胞成長をすることを特徴とする哺乳動物の生理的症状を指すまたは説明する。癌の例には、癌腫、リンパ腫、芽細胞腫、肉腫、および白血病が非限定的に含まれる。そのような癌のより詳細な例には、扁平上皮癌、小細胞肺癌、非小細胞肺癌、肺の腺癌腫、肺扁平上皮癌腫、腹膜癌、肝細胞癌、胃腸癌、膵臓癌、膠芽腫、子宮頸癌、卵巣癌、肝臓癌、膀胱癌、肝臓癌、乳癌、結腸癌、結腸直腸癌、子宮内膜または子宮癌腫、唾液腺癌腫、腎臓癌、肝臓癌、前立腺癌、外陰部癌、甲状腺癌、肝癌腫、および様々な種類の頭頸部癌が含まれる。
【0025】
用語「増殖性障害」および「増殖性疾病」とは、癌などの異常細胞増殖に関連した障害を指す。
【0026】
本明細書に用いられる「腫瘍」および「新生物」とは、過度の細胞成長または増殖に起因する、良性(非癌性)病変または、前癌を含む悪性(癌性)病変のいずれかの、任意の組織の集塊を指す。
【0027】
本明細書に用いられる「転移」とは、癌が、新しい位置で同様の癌病変の発症を伴って、発生部位から他の身体の領域へと拡張または移行するプロセスを指す。「転移性の」または「転移する」細胞とは、近隣の細胞との粘着性接触を失い、疾病の原発部位から血流またはリンパ液によって移動して、近隣の身体構造へと侵入する細胞である。
【0028】
本明細書に用いられる用語「被検体」とは、特定の処置の受容者となるべき、ヒト、ヒト以外の霊長類、げっ歯動物などを非限定的に含む任意の動物(例えば哺乳動物)を指す。典型的には、ヒト被験体に関しては、「被験体」と「患者」という用語は本明細書において交換可能に用いられる。
【0029】
用語「癌幹細胞」、「腫瘍幹細胞」、または「充実性腫瘍幹細胞」は、本明細書で交換可能に用いられ:(1) 高い増殖能を有し;(2) 増殖または発生能力の低下した1つまたは複数種類の分化した後代細胞を生じるための非対称細胞分裂が可能であり;および (3) 自己再生または自己維持のための対称細胞分裂ができる、充実性腫瘍由来の細胞集団を指す。「癌幹細胞」、「腫瘍幹細胞」、または「充実性腫瘍幹細胞」のこれらの特性によって、これらの癌幹細胞は、腫瘍を形成できない大多数の腫瘍細胞と比較して、免疫不全マウスへの累代移植の際に触診可能な腫瘍を形成できる。充実性腫瘍から腫瘍細胞を得た後、この腫瘍細胞、即ち非腫瘍形成性細胞は、移植の際に限られた回数(例えば1または2回)腫瘍を形成することが出来るが、免疫不全マウスへの累代移植において触診可能な腫瘍を形成する能力を保持しないであろう。癌幹細胞は、無秩序な分化に対して自己再生を受け、突然変異が生じるにつれて経時的に変化することができる異常細胞型を有する腫瘍を形成する。本発明の充実性腫瘍幹細胞は、米国特許第6,004,528号によって提供される「癌幹細胞系統」とは異なる。上記特許では、「癌幹細胞系統」を、それ自体には殆ど突然変異がないが、細胞環境に生じる腫瘍形成性変化の結果として非対称細胞分裂ではなく対称細胞分裂を行う、ゆっくりと成長する始原細胞型であると定義する。したがってこの「癌幹細胞系統」仮説は、主に、比較的正常な幹細胞を蓄積させその後変異を受けてそれらを腫瘍細胞にするような異常な環境の結果、高度に突然変異し急速に増殖している腫瘍細胞が生じることを提唱する。米国特許第6,004,528号は、そのようなモデルを用いて癌の診断を促進できることを提唱する。充実性腫瘍幹細胞モデルは、「癌幹細胞系統」モデルと基本的に異なり、結果として「癌幹細胞系統」モデルによっては提供されない有用性を示す。第1に、充実性腫瘍幹細胞は、「突然変異を免れて」はいない。米国特許第6,004,528号によって記述された「突然変異を免れた癌幹細胞系統」は、前癌病変と考えることができ、その一方で、本発明によって記述される充実性腫瘍幹細胞は、それら自身が腫瘍形成の原因である突然変異を含む癌細胞である。即ち、本発明の充実性腫瘍幹細胞(「癌幹細胞」)は、米国特許第6,004,528号中の「癌幹細胞系統」とは区別される、高度に突然変異された細胞の中に含まれることになる。第2に、癌をもたらす遺伝子突然変異は、環境的なものだけではなく、大部分は充実性腫瘍幹細胞内部の内因性のものであり得る。単離された充実性腫瘍幹細胞は移植の際に追加の腫瘍を生じさせることができることが充実性腫瘍幹細胞モデルによって予測され(したがって転移が説明される)、その一方で「癌幹細胞系統」モデルによって、腫瘍形成性であるそれらの異常な環境のため、移植された「癌幹細胞系統」細胞は新しい腫瘍を生じさせることができないことが予測される。確かに、解離され、表現型によって単離されたヒト充実性腫瘍幹細胞を、依然として新しい腫瘍を形成する場所であるマウスに(正常な腫瘍環境とは非常に異なる環境の中へ)移植可能であることは、本発明を「癌幹細胞系統」モデルから区別する。第3に、充実性腫瘍幹細胞は、対称的におよび非対称的に分割する可能性があり、したがって対称細胞分裂は絶対の特性ではない。第4に、充実性腫瘍幹細胞は、多くの変数に依存して、急速にまたは緩慢に分裂することができ、したがって遅い増殖速度は決定的な特性ではない。
【0030】
用語「癌細胞」、「腫瘍細胞」、およびそれらの文法上の等価物は、腫瘍細胞集団の大部分を含む非腫瘍形成性細胞および、本明細書では癌幹細胞とも呼ぶ腫瘍形成性幹細胞の両方を含む、腫瘍に由来する細胞の全集団を指す。
【0031】
本明細書で用いられる「腫瘍形成性」とは、充実性腫瘍幹細胞が腫瘍を形成することを可能にする、自己再生(新たな腫瘍形成性癌幹細胞を生ずる)および他の全ての腫瘍細胞を生成するための増殖(分化し、したがって非腫瘍形成性の腫瘍細胞を生ずる)という特性を含む、充実性腫瘍幹細胞の機能的な性質を指す。累代移植で腫瘍を形成することができない大多数の腫瘍細胞と比較して、自己再生および他の全ての腫瘍細胞を生成するための増殖というこれらの特性によって、本発明の癌幹細胞は、免疫不全マウスへの累代移植の際に触診可能な腫瘍を形成することができる。腫瘍細胞、即ち非腫瘍形成性腫瘍細胞は、充実性腫瘍から腫瘍細胞を得た後、免疫不全マウスへの移植の際に、限られた回数(例えば1または2回)腫瘍を形成し得る。
【0032】
本明細書に用いられる用語「幹細胞癌マーカー」、「癌幹細胞マーカー」、「腫瘍幹細胞マーカー」、または「充実性腫瘍幹細胞マーカー」とは、単独または他の遺伝子と組み合わせたその発現レベルが、非腫瘍形成性細胞と比較して腫瘍形成性癌細胞の存在と相関関係にある、1つもしくは複数の遺伝子、またはその1つもしくは複数の遺伝子により発現されるタンパク質、ポリペプチド、あるいはペプチドを指す。相関関係は、遺伝子の発現の増加または減少(例えば、遺伝子によってコードされるmRNAまたはペプチドレベルの増加または減少)のいずれかに関連しうる。
【0033】
本明細書に用いられる用語「生検」および「生検組織」とは、試料が癌組織を含むかどうかを決定する目的で被検体から取り出される、組織または流体の試料を指す。いくつかの態様では、被検体が癌を有する疑いがあるので、生検組織または流体を得る。次に生検組織または流体を、癌の有無について検査する。
【0034】
本明細書で用いる「許容される薬学的担体」とは、抗体などの薬学的組成物の有効成分と組み合わせた時、例えば抗体がその生物活性を保持することを可能にする、任意の物質を指す。さらに、「許容される薬学的担体」は、レシピエントの免疫応答を引き起こさない。例として、リン酸緩衝食塩水、水、および様々な油/水乳剤などの、任意の標準的な薬学的担体が非限定的に挙げられる。エアロゾルまたは非経口投与のための希釈剤の例は、リン酸緩衝食塩水または生理(0.9%)食塩水である。
【0035】
用語「治療的有効量」とは、被検体もしくは哺乳動物の疾病または障害を「処置する」ために有効な、可溶性受容体または他の薬物の量を指す。癌の場合には、治療的有効量の薬物は、癌細胞の数を減少させ;腫瘍の大きさを縮小させ;辺縁の器官への癌細胞浸潤を阻害または停止させ;腫瘍転移を阻害または停止させ;腫瘍成長を阻害または停止させ;および/または癌に関連した1つまたは複数の症状をある程度軽減することができる。薬物が既存の癌細胞の成長を防止しおよび/または殺す範囲では、それを細胞成長抑制性および/または細胞毒性であると言うことができる。
【0036】
本明細書に用いる用語「腫瘍成長を阻害する」とは、腫瘍細胞成長を阻害することができる任意の機構を指す。ある態様では、腫瘍細胞の増殖を遅くすることにより腫瘍細胞成長を阻害する。ある態様では、腫瘍細胞の増殖を停止させることにより腫瘍細胞成長を阻害する。ある態様では、腫瘍細胞を殺すことにより腫瘍細胞成長を阻害する。ある態様では、腫瘍細胞のアポトーシスを引き起こすことにより腫瘍細胞成長を阻害する。ある態様では、腫瘍細胞から栄養を奪うことにより腫瘍細胞成長を阻害する。ある態様では、腫瘍細胞の移動を防止することにより腫瘍細胞成長を阻害する。ある態様では、腫瘍細胞の侵入を防止することにより腫瘍細胞成長を阻害する。
【0037】
本明細書に用いる「診断を提供する」または「診断情報」とは、患者が疾病または症状を有するかどうか判断する際に;および/または、疾病もしくは症状を表現型のカテゴリーに分類する際に、あるいは疾病もしくは症状の予後診断または処置(処置一般または任意の特定の処置のいずれか)に対する予想される応答に関して重要性を有する任意のカテゴリーに分類する際に役立つ、任意の情報を指す。同様に、診断とは、被検体が症状(腫瘍などの)を持つ可能性が高いかどうか、腫瘍の性質または分類、例えばリスクの高い腫瘍またはリスクの低い腫瘍に関する情報、予後に関する情報、および/または適切な処置を選択するのに役立つ情報を非限定的に含む、任意の種類の診断情報を提供することを指す。処置の選択には、特定の化学療法剤または手術もしくは放射線などの他の処置様式の選択、あるいは療法を保留するべきか提供するべきかに関する選択が含まれ得る。
【0038】
本明細書に用いる用語「予後診断を提供する」、「予後情報」または「予測情報」とは、被検体の将来の健康(例えば予期される罹患率または死亡率、癌に罹る可能性、および転移の危険性)に対する(例えば本発明の診断法によって決定される)癌の存在の影響に関する情報を提供することを指す。
【0039】
「処置する」、「処置」、「処置すること」、「軽減する」、および「軽減すること」などの用語は、1) 診断された病理的症状または障害を治癒し、遅らせ、症状を減少させ、かつ/またはそれらの進行を停止させる治療的方策、および 2) 標的とする病理的症状または障害の発生を予防するかまたは遅延させる予防もしくは防止処置の両方を指す。したがって、処置を必要とする人々には、既に障害を有する人々;障害を有しやすい人々;および障害が予防されるべき人々が含まれる。患者が、下記の1つまたは複数を示せば、本発明の方法による被検体の「処置」は成功である:癌細胞数の減少またはその完全な消失;腫瘍の大きさの減少;軟組織および骨の中への癌の展開を含む、辺縁器官への癌細胞浸潤の阻害または非存在;腫瘍転移の阻害または非存在;腫瘍成長の阻害または非存在;特定の癌に関連する1つまたは複数の症状の軽減;低下した罹患率および死亡率;および生活の質の改善。
【0040】
本明細書に用いられる用語「ポリヌクレオチド」および「核酸」とは、リン酸ジエステル結合によって連結された多数のヌクレオチドユニット(リボヌクレオチドまたはデオキシリボヌクレオチド、または関連する構造変異種)から構成されるポリマーを指し、DNAまたはRNAを非限定的に含む。この用語は、4アセチルシトシン、8-ヒドロキシ-N6-メチルアデノシン、アジリジニルシトシン、プソイドイソシトシン、5(カルボキシヒドロキシル-メチル)ウラシル、5-フルオロウラシル、5ブロモウラシル、5-カルボキシメチルアミノメチル2チオウラシル、5カルボキシメチル-アミノメチルウラシル、ジヒドロウラシル、イノシン、N6イソペンテニルアデニン、1メチルアデニン、1-メチルプソイド-ウラシル、1メチルグアニン、1メチルイノシン、2,2-ジメチル-グアニン、2メチルアデニン、2メチルグアニン、3-メチル-シトシン、5メチルシトシン、N6メチルアデニン、7メチルグアニン、5メチルアミノメチルウラシル、5-メトキシ-アミノ-メチル2チオウラシル、βDマンノシルキューオシン(queosine)、5'メトキシカルボニルメチルウラシル、5メトキシウラシル、2メチルチオN6イソペンテニルアデニン、ウラシル5オキシ酢酸メチルエステル、ウラシル5オキシ酢酸、オキシブトキソシン(oxybutoxosine)、プソイドウラシル、キューオシン、2チオシトシン、5-メチル-2チオウラシル、2-チオウラシル、4チオウラシル、5-メチルウラシル、N-ウラシル5オキシ酢酸メチルエステル、ウラシル5オキシ酢酸、プソイドウラシル、キューオシン、2-チオシトシン、および2,6ジアミノプリンを非限定的に含む、DNAおよびRNAの任意の公知の塩基類似体を含む配列を包含する。
【0041】
用語「遺伝子」とは、ポリペプチド、前駆体、またはRNA (例えばrRNA、tRNA)の産生に必要なコード配列を含む核酸(例えばDNA)分子を指す。ポリペプチドは、全長または断片の望ましい活性または機能特性(例えば酵素活性、リガンド結合、信号変換、免疫原性など)を保持する限り、全長のコード配列、またはコード配列の任意の部分によってコードされることができる。この用語はまた、構造遺伝子のコード領域、ならびにコード領域の5'および3'端の両方に隣接して位置する配列であって、いずれかの端において遺伝子が全長のmRNAの長さに対応するように約1kbまたはそれ以上の距離に及ぶものを包含する。コード領域の5'に位置し、mRNA上に存在する配列は、5'非翻訳配列と呼ばれる。コード領域の3'即ち下流に位置し、mRNA上に存在する配列は、3'非翻訳配列と呼ばれる。用語「遺伝子」は、遺伝子のcDNAおよびゲノム形式の両方を包含する。遺伝子のゲノム形式またはクローンは、「イントロン」または「介在領域」あるいは「介在配列」と名付けられた非コード配列によって中断されたコード領域を含む。イントロンは核RNA (hnRNA)へ転写される遺伝子の区画であり;イントロンは、エンハンサーなどの調節エレメントを含むことができる。イントロンは、核または一次転写産物から除去、即ち「スプライシング除去」され;したがって、イントロンはメッセンジャーRNA (mRNA)転写物中には存在しない。mRNAは翻訳中に機能して、合成途中のポリペプチド中のアミノ酸の配列即ち順序を指定する。イントロンを含むことに加えて、遺伝子のゲノム形式は、さらにRNA転写物上に存在する配列の5'および3'端の両方に位置する配列を含むことができる。これらの配列は、「隣接」配列または領域と呼ばれる(これらの隣接配列は、mRNA転写物上に存在する非翻訳配列の5'または3'に位置する)。5'隣接領域は、遺伝子の転写を制御するかまたはこれに影響を及ぼすプロモーターおよびエンハンサーなどの調節配列を含むことができる。3'隣接領域は、転写の終了、転写後の切断およびポリアデニル化を指示する配列を含むことができる。
【0042】
用語「組換え体」は、細胞、核酸、タンパク質またはベクターに関して用いられるとき、異種の核酸またはタンパク質の導入、天然の核酸またはタンパク質の改変によって、細胞、核酸、タンパク質またはベクターが修飾されたこと、または細胞がそのような修飾された細胞に由来することを示す。したがって、例えば組換え細胞は、天然(非組換え)型の細胞中に見出されない遺伝子を発現するか、あるいは、天然の遺伝子を過剰に発現し、そうでなければ異常に発現され、例えば、自然には起こらない断片またはスプライシング変異体として発現される。本明細書では用語「組換え核酸」とは、通常は核酸の操作によって、例えばポリメラーゼおよびエンドヌクレアーゼを用いて、本来はインビトロで形成される、天然には通常見出されない形式の核酸を意味する。このように、種々の配列の機能的連結が達成される。したがって、通常結合されないDNA分子のライゲーションによりインビトロで形成された、直鎖状の単離された核酸分子または発現ベクターは両方とも、本発明の目的のためには組換え体であるとみなされる。一旦組換え核酸分子が作製されて宿主細胞または生物体に導入されると、それは、非組換え的に、即ち、インビトロ操作ではなく宿主細胞のインビボの細胞機構を用いて複製するであろうことが理解される。しかし、一旦組換え的に産生されたそのような核酸は、その後非組換え的に複製されるとしても、本発明の目的に関しては依然として組換え体であるとみなされる。同様に、「組換えタンパク質」とは、組換え技術を用いて、すなわち、上に記載したような組換え核酸分子の発現を通じて作製されたタンパク質である。
【0043】
本明細書で用いる用語「異種遺伝子」とは、自身の自然環境にはない遺伝子を指す。例えば、異種遺伝子は、1つの種から別の種へ導入された遺伝子を含む。異種遺伝子とはまた、(例えば、突然変異、複数コピーでの添加、非天然調節配列への連結などの)何らかの形で改変されている、生物体にとって天然である遺伝子を含む。異種遺伝子配列が、染色体中で該遺伝子配列との結合を天然には認められないDNA配列に典型的には結合しているか、あるいは自然には認められない染色体部分(例えば通常は遺伝子が発現されない遺伝子座において発現した遺伝子)と結合しているという点で、異種遺伝子は内因性遺伝子と区別される。
【0044】
本明細書で用いる用語「ベクター」は、DNA画分を1つの細胞から別の細胞へ移植する核酸分子について用いられる。用語「媒体」は、「ベクター」と交換可能に用いられることがある。ベクターは、しばしばプラスミド、バクテリオファージ、あるいは植物または動物ウイルスに由来する。
【0045】
「ライゲーション」とは、2つの二重鎖核酸断片間にリン酸ジエステル結合を形成するプロセスを指す。別段の定めのない限り、公知の緩衝液および条件を用いて、ほぼ等モル量のライゲーションされるべきDNA断片0.5ugにつき10単位のT4DNAリガーゼ(「リガーゼ」)により、ライゲーションを遂行することができる。核酸のライゲーションは、2つのタンパク質をインフレームで互いに連結されて、単一のタンパク質、即ち融合タンパク質を生成する役割を果たすことができる。
【0046】
本明細書で用いる用語「遺伝子発現」とは、遺伝子中にコードされた遺伝情報を、遺伝子の「転写」を通じて(例えば、RNAポリメラーゼの酵素作用により)、RNA (例えば、mRNA、rRNA、tRNAまたはsnRNA)へ変換するプロセス、およびタンパク質をコードする遺伝子については、mRNAの「翻訳」によってタンパク質へ変換するプロセスを指す。遺伝子発現を、プロセス中の多くの段階で調節することができる。「アップレギュレーション」または「活性化」とは、遺伝子発現産物(例えばRNAまたはタンパク質)の産生を増大させる調節を指し、「ダウンレギュレーション」または「抑制」とは、産生を減少させる調節を指す。アップレギュレーションまたはダウンレギュレーションに関係する分子(例えば転写因子)は、それぞれしばしば「アクチベーター」および「リプレッサー」と呼ばれる。
【0047】
用語「ポリペプチド」、「ペプチド」、「タンパク質」および「タンパク質断片」は交換可能に本明細書で用いられ、アミノ酸残基のポリマーを指す。この用語は、天然のアミノ酸ポリマーおよび非天然のアミノ酸ポリマーはもとより、1つまたは複数のアミノ酸残基が対応する天然のアミノ酸の人工化学的模倣体である、アミノ酸ポリマーにも用いられる。
【0048】
用語「アミノ酸」とは、天然のおよび合成のアミノ酸、ならびに天然のアミノ酸と同様に機能するアミノ酸類似体およびアミノ酸模倣体を指す。天然のアミノ酸は、遺伝子コードによってコードされたアミノ酸、ならびに後で修飾されたアミノ酸、例えばヒドロキシプロリン、γ-カルボキシグルタミン酸、O-ホスホセリンである。アミノ酸類似体は、天然のアミノ酸と同じ基礎的化学構造、例えば水素、カルボキシル基、アミノ基、およびR基に結合されているα炭素を有する化合物、例えばホモセリン、ノルロイシン、メチオニンスルホキシド、メチオニンメチルスルホニウムを指す。そのような類似体は、修飾されたR基(例えばノルロイシン)または修飾されたペプチド骨格を有することができるが、天然のアミノ酸と同じ基礎的な化学構造を保持する。アミノ酸模倣体とは、アミノ酸の一般的な化学構造とは異なる構造を有するが、天然のアミノ酸と同様に機能する化学化合物を指す。
【0049】
「保存的修飾変異体」は、アミノ酸および核酸配列の両方に用いられる。「アミノ酸変異体」はアミノ酸配列を指す。特定の核酸配列について、保存的修飾変異体とは、同一のまたは本質的に同一のアミノ酸配列をコードする核酸を指し、あるいは、核酸がアミノ酸配列をコードしない場合には、本質的に同一の配列または関連した(例えば、自然に隣接する)配列を指す。遺伝子コードの縮退のために、多数の機能的に同一の核酸が大部分のタンパク質をコードする。例えば、コドンGCA、GCC、GCGおよびGCUはすべて、アミノ酸のアラニンをコードする。したがって、コドンがアラニンを指定するすべての位置で、コードされるポリペプチドを改変することなく、コドンを、前述した対応する別のコドンに改変することができる。そのような核酸変異は「サイレントな変異」であり、保存的に修飾された変異の一種である。あるポリペプチドをコードする本明細書の核酸配列のすべては、核酸のサイレントな変異も含めて記述している。特定の文脈において、核酸中の各コドン(通常メチオニンのただ1つのコドンであるAUG、および通常トリプトファンのただ1つのコドンであるTGGを除く)を修飾して機能的に同一の分子を産出することができることを、当業者は認識するであろう。従って、ポリペプチドをコードする核酸のサイレントな変異は、発現産物については、記載される配列中で潜在しているが、実際のプローブ配列ではそうではない。アミノ酸配列については、改変が化学的に類似したアミノ酸によるアミノ酸置換をもたらす場合を含め、コード配列中の単一のアミノ酸または数パーセントのアミノ酸を改変するか、追加するか、または欠失させる核酸、ペプチド、ポリペプチドまたはタンパク質配列への個々の置換、欠失または追加は「保存的に修飾された変異体」であることを、当業者は認識するであろう。機能的に類似のアミノ酸を提供する保存的置換表が、当技術分野において周知である。そのような保存的修飾変異体は、本発明の多型変異体、異種間同族体、および対立遺伝子に含まれ、それらを除外するものではない。典型的には、保存的置換には以下のものが含まれる:1) アラニン(A)、グリシン(G);2) アスパラギン酸(D)、グルタミン酸(E);3) アスパラギン(N)、グルタミン(Q);4) アルギニン(R)、リジン(K);5) イソロイシン(I)、ロイシン(L)、メチオニン(M)、バリン(V);6) フェニルアラニン(F)、チロシン(Y)、トリプトファン(W);7) セリン(S)、スレオニン(T);および 8) システイン(C)、メチオニン(M)(例えば Creighton, Proteins (1984)を参照のこと)。
【0050】
本明細書で用いる用語「エピトープタグを付けた」とは、「エピトープタグ」に融合された癌幹細胞マーカータンパク質、あるいはそのドメイン配列またはその部分を含むキメラポリペプチドを指す。エピトープタグポリペプチドは、抗体による認識用のエピトープを提供するためには十分であるが、癌幹細胞マーカータンパク質の活性を邪魔しない程度に十分に短いアミノ酸残基を含む。適当なエピトープタグは、一般に少なくとも6アミノ酸残基、通常約8〜約50アミノ酸残基、または約10〜約20アミノ酸残基を有する。一般に使用されるエピトープタグには、Fc、HA、His、およびFLAGタグが含まれる。
【0051】
本明細書で用いる「約」とは、表示した数のプラスマイナス10%を指す。例えば、「約10%」とは、9%〜11%の範囲を示す。
【0052】
発明の詳細な説明
本発明は、癌を研究し、診断し、特徴決定し、処置するための組成物および方法を提供する。特に本発明は、充実性腫瘍幹細胞マーカーに対するアンタゴニスト、およびこれらのアンタゴニストを用いてヒト患者中の腫瘍成長を阻害し、癌を処置する方法を提供する。アンタゴニストには、癌幹細胞マーカーを含む可溶性受容体タンパク質が含有される。ある態様では、本発明は、腫瘍細胞の成長を阻害するヒトFZD受容体のFriドメインを含む可溶性受容体を提供する。ある態様では、可溶性受容体は、ヒトFZD4のFriドメインを含む。ある態様では、可溶性受容体は、配列番号:8のアミノ酸配列を含むヒトFZD4のFriドメインを含む。ある態様では、可溶性受容体は、非FZD受容体タンパク質配列にインフレームで連結されたヒトFZD4のFriドメインを含む。ある態様では、可溶性受容体は、ヒトFcにインフレームで連結されたヒトFZD4のFriドメインを含む。ある態様では、可溶性受容体は、ヒトIgG1 Fcにインフレームで連結されたヒトFZD4のFriドメインを含む。ある態様では、可溶性受容体は、配列番号:4に示すアミノ酸配列を含むヒトIgG1Fcにインフレームで連結されたヒトFZD4のFriドメインを含む。
【0053】
ある態様では、可溶性受容体は、ヒトFZD5のFriドメインを含む。ある態様では、可溶性受容体は、配列番号:9のアミノ酸配列を含むヒトFZD5のFriドメインを含む。ある態様では、可溶性受容体は、非FZD受容体タンパク質配列にインフレームで連結された、ヒトFZD5のFriドメインを含む。ある態様では、可溶性受容体は、ヒトFcにインフレームで連結されたヒトFZD5のFriドメインを含む。ある態様では、可溶性受容体は、ヒトIgG1 Fcにインフレームで連結されたヒトFZD5のFriドメインを含む。ある態様では、可溶性受容体は、配列番号:4に示すアミノ酸配列を含むヒトのIgG1 Fcにインフレームで連結されたヒトFZD5のFriドメインを含む。
【0054】
ある態様では、可溶性受容体は、ヒトFZD8のFriドメインを含む。ある態様では、可溶性受容体は、配列番号:7のアミノ酸配列を含むヒトFZD8のFriドメインを含む。ある態様では、可溶性受容体は、非FZD受容体タンパク質配列にインフレームで連結された、ヒトFZD8のFriドメインを含む。ある態様では、可溶性受容体は、ヒトFcにインフレームで連結されたヒトFZD8のFriドメインを含む。 ある態様では、可溶性受容体は、ヒトIgG1 Fcにインフレームで連結されたヒトFZD8のFriドメインを含む。ある態様では、可溶性受容体は、配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcにインフレームで連結されたヒトFZD8のFriドメインを含む。
【0055】
ある態様では本発明は、配列番号:8に示すアミノ酸配列を含むヒトFZD4のFriドメインをコードする核酸配列および配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcをコードする核酸配列を含む可溶性受容体をコードする、単離された核酸を提供する。ある態様では、本発明は、配列番号:8に示すアミノ酸配列を含むヒトFZD4のFriドメインをコードする核酸配列および配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcをコードする核酸配列を含む、ベクターを提供する。ある態様では、ベクターは、ベクターで形質転換された宿主細胞によって認識される制御配列に機能的に連結される。ある態様では、本発明は、配列番号:8に示すアミノ酸配列を含むヒトFZD4のFriドメインをコードする核酸配列および配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcをコードする核酸配列を含むベクターを含む、単離された宿主細胞を提供する。
【0056】
ある態様では、本発明は、配列番号:9に示すアミノ酸配列を含むヒトFZD5のFriドメインをコードする核酸配列および配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcをコードする核酸配列を含む可溶性受容体をコードする、単離された核酸分子を提供する。ある態様では、本発明は、配列番号:9に示すアミノ酸配列を含むヒトFZD5のFriドメインをコードする核酸配列および配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcをコードする核酸配列を含む、ベクターを提供する。ある態様では、ベクターは、ベクターで形質転換された宿主細胞によって認識される制御配列に機能的に連結される。ある態様では、本発明は、配列番号:9に示すアミノ酸配列を含むヒトFZD5のFriドメインをンコードする核酸配列および配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcをコードする核酸配列を含むベクターを含む、単離された宿主細胞を提供する。
【0057】
ある態様では、本発明は、 配列番号:7に示すアミノ酸配列を含むヒトFZD8のFriドメインをコードする核酸配列;および 配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcをコードする核酸配列を含む可溶性受容体をコードする、単離された核酸分子を提供する。ある態様では、本発明は、配列番号:7に示すアミノ酸配列を含むヒトFZD8のFriドメインをコードする核酸配列および配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcをコードする核酸配列を含む、ベクターを提供する。ある態様では、ベクターは、ベクターで形質転換された宿主細胞によって認識される制御配列に機能的に連結される。ある態様では、本発明は、配列番号:7に示すアミノ酸配列を含むヒトFZD8のFriドメインをンコードする核酸配列および配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcをコードする核酸配列を含むベクターを含む、単離された宿主細胞を提供する。
【0058】
ある態様では、本発明は、可溶性受容体を含む薬学的組成物を提供する。ある態様では、薬学的組成物は、ヒトFZD受容体のFriドメインを含む可溶性受容体を含む。ある態様では、薬学的組成物は、ヒトFZD4受容体のFriドメインを含む可溶性受容体を含む。ある態様では、薬学的組成物は、ヒトFZD5受容体のFriドメインを含む可溶性受容体を含む。ある態様では、薬学的組成物は、ヒトFZD8受容体のFriドメインを含む可溶性受容体を含む。
【0059】
ある態様では、本発明は、腫瘍細胞の成長を阻害するために有効な量の、ヒトFZD受容体のFriドメインを含む可溶性受容体を投与する工程を含む、癌を処置する方法を提供する。ある態様では、癌を処置する方法は、腫瘍細胞の成長を阻害するために有効な量の、ヒトFZD4受容体のFriドメインを含む可溶性受容体を投与する工程を含む。ある態様では、癌を処置する方法は、腫瘍細胞の成長を阻害するために有効な量の、ヒトFZD5受容体のFriドメインを含む可溶性受容体を投与する工程を含む。ある態様では、癌を処置する方法は、腫瘍細胞の成長を阻害するために有効な量の、ヒトFZD8受容体のFriドメインを含む可溶性受容体を投与する工程を含む。
【0060】
ある態様では、癌を処置する方法は、腫瘍細胞の成長を阻害するために有効な量の、非FZD受容体タンパク質配列にインフレームで連結されたヒトFZD受容体のFriドメインを含む可溶性受容体を投与する工程を含む。ある態様では、癌を処置する方法は、腫瘍細胞の成長を阻害するために有効な量の、ヒトFcにインフレームで連結されたヒトFZD受容体のFriドメインを含む可溶性受容体を投与する工程を含む。ある態様では、癌を処置する方法は、腫瘍細胞の成長を阻害するために有効な量の、ヒトIgG1 Fcにインフレームで連結されたヒトFZD受容体のFriドメインを含む可溶性受容体を投与する工程を含む。ある態様では、癌を処置する方法は、腫瘍細胞の成長を阻害するために有効な量の、配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcにインフレームで連結されたヒトFZD受容体のFriドメインを含む可溶性受容体を投与する工程を含む。
【0061】
ある態様では、本発明は、放射線療法と組み合わせて、腫瘍細胞の成長を阻害するために有効な量の、ヒトFZD受容体のFriドメインを含む可溶性受容体を投与する工程を含む、癌を処置する方法を提供する。ある態様では、癌を処置する方法は、化学療法と組み合わせて、腫瘍細胞成長を阻害するために有効な量の、ヒトFZD受容体のFriドメインを含む可溶性受容体を投与する工程を含む。ある態様では、癌を処置する方法は、乳房腫瘍、結腸直腸腫瘍、肺腫瘍、膵臓腫瘍、前立腺腫瘍、または頭頸部腫瘍に由来する腫瘍細胞の腫瘍細胞成長を阻害するために有効な量の、ヒトFZD受容体のFriドメインを含む可溶性受容体を投与する工程を含む。
【0062】
幹細胞および充実性腫瘍幹細胞
一般的な癌は、短命な成熟細胞を補充する役割を担う成長細胞の部分集団を含む組織で発生する。そのような器官では、細胞成熟は階層化されており、ごくわずかな幹細胞が、より分化した細胞を生じること、および自己再生と呼ばれるプロセスを通じて幹細胞自身を永続させることの両方を行う(Akashi & Weissman, Developmental Biology of Hematopoiesis, Oxford Univ. Press, NY (2001); Spangrude et al., Science 247:58-61 (1988); Baum et al, PNAS 89:2804-2808 (1992); Morrison et al., PNAS 92: 10302-20306 (1995); Morrison et al., Immunity 5:207-216 (1996); Morrison et al., Annu. Rev. Cell Dev. Biol 11:35-71 (1995); Morrison et al, Dev. 124:1929-1939 (1997); Morrison & Weissman, Immunity 1:661 (1994); Morrison et al, Cell 88:287-298 (1997); Uchida et al., PNAS 97:14720-14725 (2000); Morrison et al., Cell 101:499-510 (2000))。ほとんどの組織が幹細胞を含む可能性があるが、希少であるので、その生物学的、分子的および生化学的特性を研究するためにわずか数種の組織においてしか、これらの細胞は厳密に同定および精製されていない。最も良く特徴決定された幹細胞は、造血幹細胞(HSC)と呼ばれる、造血系を生じさせる幹細胞である。骨髄破壊プロトコルに続いて血液リンパ系を再生するための骨髄移植に関するその大規模使用によって、癌治療におけるHSCの有用性は実証されている(Baum et al., Bone Marrow Transplantation, Blackwell Scientific Publications, Boston (1994))。癌が発生する組織、および特にそれらの組織中に存在する幹細胞の細胞生物学を理解することによって、癌生物学に対する新しい洞察力が提供されることが約束される。
【0063】
充実性腫瘍は、それらが生ずる組織と同様に、異種の細胞の集団から成る。これらの細胞の大多数が腫瘍形成能を欠くことが、充実性腫瘍の発生および維持もまた、増殖しかつさらなる腫瘍幹細胞(自己再生)および腫瘍形成能力を欠くより分化した腫瘍細胞の大多数(即ち非腫瘍形成性癌細胞)の両方を効率的に生じる能力を有する幹細胞小集団(即ち腫瘍形成性癌細胞)に依存していることを示唆した。癌幹細胞の概念はHSCの発見の直後にまず導入され、急性骨髄性白血病(AML)において実験的に確立された(Park et al., J. Natl. Cancer Inst. 46:411-422 (1971); Lapidot et al., Nature 367:645-648 (1994); Bonnet & Dick, Nat. Med. 3:730-737 (1997); Hope et al., Nat. Immunol. 5:738-743 (2004))。充実性腫瘍由来の幹細胞は、より最近、その細胞表面受容体発現の独特なパターンならびに培養中および異種移植片動物モデル中での自己再生および成長特性の評価に基づいて、単離された。分画されていない腫瘍細胞と比較して、50倍を上回る腫瘍形成能力を有するESA+CD44+CD24-/low系列集団が発見された(Al-Hajj et al., PNAS 100:3983-3988 (2003))。大量の非腫瘍形成性腫瘍細胞から腫瘍形成性癌幹細胞を単離できる能力が、マイクロアレイ分析を用いた癌幹細胞マーカーである非腫瘍形成性腫瘍細胞または正常な乳房上皮と比較して癌幹細胞中で差示的な発現を有する遺伝子の同定につながった。本発明は、これらの同定された癌幹細胞マーカーの知識を利用して、癌を研究し、特徴決定し、診断し、処置を行う。
【0064】
癌幹細胞マーカータンパク質
正常な幹細胞および癌幹細胞は共に、増殖能力および自己再生能力を共有するので、正常な幹細胞の発生を調節する多くの遺伝子が腫瘍形成に寄与することは驚くに当たらない(Reya et al., Nature 414:105-111 (2001) および Taipale & Beachy, Nature 411:349-354 (2001)に概説されている)。本発明は、Wntシグナル伝達経路を癌幹細胞の維持に関連付ける、例えばFZD4、FZD5およびFZD8を含むFzd受容体を、癌幹細胞のマーカーとしておよびこれらの腫瘍形成性細胞の除去によって癌を処置する標的として同定する。
【0065】
Wntシグナル伝達経路は、胚パターン形成、後胚期組織維持および幹細胞生物学のいくつかの重大な調節因子の1つである。より具体的には、Wntシグナル伝達は、幹細胞集団による自己再生を含む、細胞極性の生成および細胞運命指定に重要な役割を果たす。Wnt経路の未調節活性化は多数のヒト癌に関連するが、その場合、Wnt経路は、腫瘍細胞の発生運命を変更して、未分化の増殖状態にそれらを保持することができる。このように発癌は、幹細胞による正常な発生および組織修復を制御するホメオスタシス機構を奪うことによって、進行することができる(Reya & Clevers, Nature 434:843 (2005); Beachy et al., Nature 432:324 (2004)に概説されている)。
【0066】
Wntシグナル伝達経路は、ショウジョウバエ(Drosophila)の発生突然変異体であるwingless(wg)において、およびマウス癌原遺伝子int-1(現在はWnt1)から、最初に解明された(Nusse & Varmus, Cell 31:99-109 (1982); Van Ooyen & Nusse, Cell 39:233-240 (1984); Cabrera et al., Cell 50:659-663 (1987); Rijsewijk et al., Cell 50:649-657 (1987))。Wnt遺伝子は、脂質で修飾された分泌糖タンパク質をコードし、そのうち19種が哺乳動物中で同定されている。これらの分泌されたリガンドは、Frizzled (Fzd)受容体ファミリーメンバーと低密度リポタンパク質(LDL)受容体関連タンパク質5または6 (LPR5/6)からなる受容体複合体を活性化する。Fzd受容体は、Gタンパク質共役受容体(GPCR)スーパーファミリーの7回膜貫通ドメインタンパク質であって、高システインドメイン(CRD)またはFriドメインとして知られる、10個の保存されたシステインを有する大きな細胞外N末端リガンド結合ドメインを含む。10種のヒトFZD受容体(FZD1〜10)が存在する。異なるFzdCRDは、特異的なWntに対して異なる結合親和性を有しており(Wu & Nusse, J. Biol Chem. 277:41762- 41769 (2002))、Fzd受容体は、下記の標準β-カテニン経路を活性化するものと非標準経路を活性化するものに分類されている(Miller et al., Oncogene 18:7860-7872 (1999))。LRP5/6は、Fzdとリガンドの結合に寄与する、6つのYWTDアミノ酸反復によって隔てられた4つの細胞外EGF様ドメインを有する単一通過膜貫通型タンパク質である(Johnson et al., J. Bone Mineral Res 19:1749 (2004))。
【0067】
受容体結合により活性化された標準Wntシグナル伝達経路は、Fzd受容体と直接に相互作用する細胞質タンパク質Dishevelled (Dsh)によって仲介され、βカテニンの細胞質での安定化および蓄積をもたらす。Wntシグナルが存在しない場合は、βカテニンは、腫瘍抑制タンパク質である大腸腺腫様ポリポーシス(APC)およびオーキシンを含む細胞質の分解複合体に局在する。これらのタンパク質は、グリコーゲン合成酵素キナーゼ(GSK)-3βが、βカテニンに結合してリン酸化し、これをユビキチン/プロテアソーム経路を介した分解用に指定するための重大な足場として機能する。Dshの活性化が、GSK3βのリン酸化および分解複合体の解離をもたらす。蓄積された細胞質のβカテニンは次に核へ輸送され、そこでTcf/LefファミリーのDNA結合性タンパク質と相互作用して、転写を活性化する。
【0068】
標準シグナル伝達経路に加えて、Wntリガンドはさらにβカテニン非依存経路も活性化する(Veeman et al., Dev. Cell 5:367-377 (2003))。非標準Wntシグナル伝達は多数のプロセスに関係していることが示されているが、最も確実なのは、ショウジョウバエの平面細胞極性(PCP)経路と同様の機構による原腸胚形成運動に関連することである。非標準Wntシグナル伝達の他の有力な機構には、カルシウム流、JNK、ならびに低分子量Gタンパク質およびヘテロ三量体Gタンパク質の両方が含まれる。標準および非標準経路間でしばしば拮抗現象が観察されており、いくつかの証拠によって、非標準シグナル伝達が癌形成を抑制できることが示されている(Olson & Gibo, Exp. Cell Res. 241:134 (1998); Topol et al., J. Cell Biol. 162:899-908 (2003))。
【0069】
造血幹細胞(HSC)は、最もよく理解されている体内の幹細胞であり、Wntシグナル伝達は、それらの正常な維持および白血病性形質転換の両方に関係している(Reya & Clevers, 2005, Nature 434:843)。HSCは、成人の骨髄内の間質間隙に存在する僅かな数の細胞である。これらの細胞は、独自の遺伝子発現プロファイル、ならびにより分化した始原細胞を継続的に生みだして造血システム全体を再構成する能力の両方によって特徴づけられる。HSCおよびそれらの間質微環境の細胞の両方がWntリガンドを発現し、Wntレポーター活性化がインビボでHSC中に存在する。さらにβカテニンおよび精製されたWnt3Aの両方が、マウスのHSCの自己再生をインビトロにおいて促進し、造血システムを再構成するそれらの能力をインビボにおいて増強するが、一方で、Wnt5Aはインビトロにおけるヒト造血始原細胞の拡張およびNOD-SCID異種移植モデルにおける再成長を促進する(Reya et al., Nature 423:409-414 (2003); Willert et al., Nature 423:448-452 (2003); Van Den Berg et al, Blood 92:3189- 3202 (1998); Murdoch et al., PNAS 100:3422-3427 (2003))。
【0070】
Wntシグナル伝達が骨髄系統およびリンパ系統の両方の腫瘍形成性成長において役割を果たしていることがより最近見出された。例えば、慢性骨髄性白血病由来の顆粒球マクロファージ始原細胞(GMP)は、活性化されたWntシグナル伝達を示し、始原細胞の成長および再生はWntシグナル伝達に依存している(Jamieson et al., N. Engl J. Med. 351:657-667 (2004))。また、白血病ではWnt経路内に突然変異は存在しないようであるが、オートクリンおよび/またはパラクリンWntシグナル伝達は、癌性自己再生を保持することができる(Reya&Clevers, Nature 434:843(2005))。
【0071】
標準Wntシグナル経路は、さらに小腸および結腸中の幹細胞集団の維持に中心的な役割を果たし、この経路の不適切な活性化は結腸直腸癌において顕著な役割を果たす(Reya & Clevers, Nature 434:843 (2005))。腸の吸収上皮には絨毛および凹窩が並ぶ。幹細胞は凹窩に存在し、ゆっくり分割して、全ての分化細胞集団を生ずる急速に増殖する細胞を産生する。分化細胞集団は凹窩から上に移動して腸絨毛を占める。Wntシグナル伝達カスケードは、凹窩-絨毛軸に沿った細胞運命の制御に主要な役割を果たし、また幹細胞集団の維持にとって不可欠である。相同組換えによるTcf7/2の遺伝的喪失(Korinek et al., Nat. Genet. 19:379 (1998))、または分泌される強力なWntアンタゴニストであるDickkopf-1 (Dkkl) (Pinto et al., Genes Dev. 17:1709-1713 (2003); Kuhnert et al, PNAS 101:266-271 (2004))の過剰発現のいずれかによるWntシグナル伝達の混乱が、腸の幹細胞集団の消失をもたらす。
【0072】
結腸直腸癌は、最も一般的には、Wntシグナル伝達カスケードにおける突然変異の活性化によって開始される。全ての結腸直腸癌のおよそ5〜10%が遺伝的であり、その主要型の1つが家族性腺腫性ポリポーシス(FAP)であり、これは、その罹患者の約80%が大腸腺腫性ポリポーシス(APC)遺伝子中に生殖細胞系列突然変異を含む、常染色体優性疾患である。突然変異は、オーキシンおよびβカテニンを含む他のWnt経路の構成成分で同定されている。個々の腺腫は、第2の不活性化された対立遺伝子を含む上皮細胞のクローン成長物であり、多数のFAP腺腫が、癌遺伝子および/または腫瘍抑制遺伝子のさらなる突然変異によって必然的に腺癌腫の発症をもたらす。さらに、APCおよびβカテニン中の機能獲得型突然変異を含むWntシグナル伝達経路の活性化は、マウスモデル中の過形成発症および腫瘍成長を引き起こすことができる(Oshima et al., Cancer Res. 57:1644-1649 (1997); Harada et al., EMBO J. 18:5931-5942 (1999))。
【0073】
癌におけるWntシグナル伝達の役割は、マウスウイルスの近接挿入によって形質転換された乳腺腫瘍における癌遺伝子としてWnt1 (もとはint1)が同定されたことによって、最初に解明された(Nusse & Varrmus, Cell 31:99-109 (1982))。乳癌におけるWntシグナル伝達の役割を立証するさらなる証拠がそれ以来蓄積されてきた。例えば、乳腺中のβカテニンの遺伝子組換えによる過剰発現は、過形成および腺癌腫をもたらすが(Imbert et al., J. Cell Biol. 153:555-568 (2001); Michaelson & Leder, Oncogene 20:5093-5099 (2001))、Wntシグナル伝達の喪失は正常な乳腺の発達を妨害する(Tepera et al., J. Cell Sc. 116:1137-1149 (2003); Hatsell et al., J. Mammary Gland Biol. Neoplasia 8:145-158 (2003))。より最近、乳腺幹細胞がWntシグナル伝達によって活性化されることが示された(Liu et al, PNAS 101:4158 (2004))。ヒト乳癌では、50%以上の癌腫においてβカテニンの蓄積が活性化Wntシグナル伝達に関係しており、特異的な突然変異がまだ同定されていないにもかかわらず、Frizzled受容体発現のアップレギュレーションが観察されている(Brennan & Brown, J. Mammary Gland Neoplasia 9: 119-131 (2004); Malovanovic et al., Int. J. Oncol. 25:1337-1342 (2004))。
【0074】
FZD10、FZD8、FZD7、FZD4およびFZD5は、10種の同定されたヒトWnt受容体のうちの5つである。マウス胚では、Fzd10はWnt7aと共に、神経管、肢芽およびミュラー管中で発現され(Nunnally & Parr, Dev. Genes Evol. 214:144-148 (2004))、肢芽発生の間にWnt-7aの受容体として働くことができる(Kawakami et al., Dev. Growth Differ. 42:561-569 (2000))。Fzdl0は肺でWnt7bと共発現するが、細胞トランスフェクションの研究によって、Fzdl0/LRP5共受容体がWnt7bに応答して標準Wntシグナル伝達経路を活性化することが実証された(Wang et al., Mol. Cell Biol. 25:5022-5030 (2005))。FZDl0 mRNAは、頚部、胃および膠芽腫の細胞系統を含む多数の癌細胞系統で、ならびにおよそ40%の原発性胃癌、結腸癌および滑膜肉腫を含む原発性癌で、アップレギュレーションされる(Saitoh et al., Int. J. Oncol. 20:117-120 (2002); Terasaki et al, Int. J. Mol. Med. 9:107-112 (2002); Nagayama et al., Oncogene 1-12 (2005))。FZD8は、いくつかのヒト癌細胞系統、原発性胃癌、および腎癌腫中でアップレギュレーションされる(Saitoh et al., Int. J. Oncol. 18:991-996 (2001); Kirikoshi et al., Int. J. Oncol. 19:111-115 (2001); Janssens et al., Tumor Biol. 25:161-171 (2004))。FZD7は胃腸管の全体にわたって発現され、ヒト原発性胃癌の6つの症例のうちの1つにおいてアップレギュレーションされる(Kirikoshi et al., Int. J. Oncol 19:111-115 (2001))。結腸癌細胞系統によるFZD7外部ドメインの発現は、異種移植片モデル中の形態学的変化を引き起こし、腫瘍成長を減少させた(Vincan et al., Differentiation 73:142-153 (2005))。FZD5は、卵黄嚢および胎盤の血管形成に本質的な役割を果たし(Ishikawa et al., Dev. 128:25-33 (2001))、腎癌腫で、Wnt/βカテニンシグナル伝達の活性化と関連してアップレギュレーションされる(Janssens et al., Tumor Biology 25:161-171 (2004))。FZD4は、腸陰窩上皮細胞中で高度に発現され、正常組織と新生物組織とで異なる発現を示すいくつかの因子のうちの1つである(Gregorieff et al., Gastroenterology 129:626-638 (2005))。したがって、FZD4、5、7、8、および10を癌幹細胞のマーカーとして同定することによって、これらのタンパク質が癌治療の理想的な標的となる。
【0075】
診断用分析
本発明は癌幹細胞マーカーを発現させて、これを分析することにより、癌幹細胞マーカーの発現に関連した疾病を検出、特徴決定、診断、またはモニターすることができる。ある態様では、癌幹細胞マーカーの発現は、例えば癌幹細胞マーカーをコードするmRNAなどのポリヌクレオチド発現によって決定される。ポリヌクレオチドは、当業者に周知の多数の任意の手段により、検出および定量することができる。いくつかの態様では、癌幹細胞マーカーをコードするmRNAは、例えば患者の生検からの組織画分のインサイチューハイブリダイゼーションによって検出される。または、RNAを組織から単離し、例えばノーザンブロット、定量的RT-PCR、またはマイクロアレイによって検出することができる。例えば、全RNAを組織試料から抽出し、RT-PCRを用い、特異的にハイブリダイズして癌幹細胞マーカーを増幅するプライマーを用いて、癌幹細胞マーカーポリヌクレオチドの発現を検出することができる。
【0076】
ある態様では、癌幹細胞マーカーの発現を、対応するポリペプチドの検出により、決定することができる。当業者に周知の多くの任意の手段により、ポリペプチドを検出し定量することができる。いくつかの態様では、例えば電気泳動、キャピラリー電気泳動、高速液体クロマトグラフィー(HPLC)または薄層クロマトグラフィー(TLC)のような分析的生化学的方法を用いて、癌幹細胞マーカーポリペプチドを検出する。単離したポリペプチドを、標準の技術によって配列決定することもできる。いくつかの態様では、癌幹細胞マーカータンパク質を、タンパク質に対して生産された抗体により、例えば、組織片への免疫蛍光法または免疫組織化学を用いて検出する。または、癌幹細胞マーカーに対する抗体により、例えばELISA、FACS、ウエスタンブロット、免疫沈降法またはタンパク質マイクロアレイを用いて、発現を検出することができる。例えば、癌幹細胞を患者の生検から単離し、FACSを用いて、癌幹細胞マーカータンパク質の発現を、蛍光標識された抗体により検出することができる。別の方法では、インビボにおいて、標識された抗体を用いて癌幹細胞マーカーを発現する細胞を典型的な画像システム中で検出することができる。例えば、常磁性アイソトープで標識された抗体を、磁気共鳴イメージング(MRI)に用いることができる。
【0077】
本発明のいくつかの態様では、診断用分析は、例えば、免疫組織化学、インサイチューハイブリダイゼーションまたはRT-PCRを用いて、腫瘍細胞中の癌幹細胞マーカーの発現の有無を決定することを含む。他の態様では、診断用分析は、例えば定量的RT-PCRを用いて、癌幹細胞マーカーの発現レベルを決定することを含む。いくつかの態様では、診断用分析は、例えば正常な上皮などの対照組織と比較して、癌幹細胞マーカーの発現レベルを決定することをさらに含む。
【0078】
癌幹細胞マーカー発現の検出を用いて、次に予後診断を提供することができる。予後診断は、癌幹細胞マーカーが表示できる任意の公知の危険表現に基づくことができる。さらに、癌幹細胞マーカーの検出を用いて、例えば検出された癌幹細胞マーカーに対するアンタゴニストによる処置を含む、適切な治療法を選択することができる。いくつかの態様では、アンタゴニストは、癌幹細胞マーカータンパク質の細胞外ドメインへ特異的に結合する抗体である。
【0079】
癌幹細胞マーカーのアンタゴニスト
本発明の文脈においては、適切なアンタゴニストは、例えば以下の効果の1つまたは複数を有しうる薬剤である:癌幹細胞マーカーの発現の妨害;例えば癌幹細胞マーカーと、そのリガンド、受容体または共受容体との間の相互作用を立体的に阻害することによる、癌幹細胞シグナル伝達経路活性化の妨害;あるいは、癌幹細胞マーカーへの結合および、細胞死のトリガーまたは腫瘍細胞成長の阻害。
【0080】
ある態様では、本発明は、細胞外で作用して、癌幹細胞マーカーの機能に影響するかまたは阻害する、癌幹細胞マーカーに対するアンタゴニストを提供する。ある態様では、アンタゴニストは、癌幹細胞マーカータンパク質の細胞外ドメインへ結合する小分子である。他の態様では、癌幹細胞マーカーのアンタゴニストはタンパク質性である。いくつかの態様では、タンパク質性アンタゴニストは、天然の癌幹細胞マーカー受容体または結合パートナーの断片またはアミノ酸配列変異体である。いくつかの態様では、断片またはアミノ酸配列変異体は、癌幹細胞マーカー受容体に結合して、シグナル伝達リガンドの結合を増強するかまたは阻止することができる。他の態様では、天然の癌幹細胞マーカーもしくは結合パートナーの断片またはアミノ酸配列変異体は、癌幹細胞マーカーのシグナル伝達リガンドに結合して、シグナル伝達リガンドの結合を増強するか阻止することができる。いくつかの態様では、アンタゴニストは、可溶性癌幹細胞タンパク質受容体または可溶性受容体タンパク質である。癌幹細胞マーカーに対するアンタゴニストの細胞外結合は、癌幹細胞マーカーの内因性活性化(例えばキナーゼ活性)の阻害により、および/または、例えば癌幹細胞マーカーとそのリガンドとの、癌幹細胞マーカーとその受容体との、癌幹細胞マーカーとその共受容体との、または癌幹細胞マーカーと細胞外マトリックスとの相互作用を立体的に阻害することにより、癌幹細胞マーカータンパク質のシグナル伝達を阻害することができる。さらに、癌幹細胞マーカーに対するアンタゴニストの細胞外結合は、例えば癌幹細胞マーカータンパク質を内在化させることによって、および/または癌幹細胞マーカーが細胞表面を動き回ることを減少させることなどによって、癌幹細胞マーカーの細胞表面発現をダウンレギュレーションすることができる。
【0081】
ある態様では、癌幹細胞マーカーのアンタゴニストは、血管形成の阻害によって、細胞死を間接的に引き起こすことができる。血管形成は、既存の血管から新しい血管が生ずるプロセスであり、例えば胚発生の間の、創傷治癒の間の、および排卵に応答した正常な成長に必要な、基本のプロセスである。栄養源および酸素を供給するために、1〜2mm2より大きな充実性腫瘍の成長にも血管形成が必要であり、それがなければ腫瘍細胞は死ぬ。したがってある態様では、癌幹細胞マーカーのアンタゴニストは、例えば、内皮細胞、平滑筋細胞、または血管構築に必要な細胞外マトリックスの成分を含む癌幹細胞マーカーを発現する血管細胞を標的とする。いくつかの態様では、癌幹細胞マーカーのアンタゴニストは、血管細胞の補充、構築、維持、または生存に必要な成長因子シグナル伝達を阻害する。
【0082】
ポリヌクレオチド
本発明は、配列番号:1〜9を含むポリペプチドをコードする単離されたポリヌクレオチドに向けられたものである。本発明のポリヌクレオチドはRNAの形態でもDNAの形態でもよく、DNAは、cDNA、ゲノムDNA、および合成DNAを含むことができる。DNAは二重鎖または一本鎖でよく、一本鎖である場合は、コード鎖または非コード(アンチセンス)鎖でよい。したがって、用語「ポリペプチドをコードするポリヌクレオチド」は、ポリペプチドに対するコード配列のみを含むポリヌクレオチドだけでなく、追加のコード配列および/または非コード配列を含むポリヌクレオチドも包含する。
【0083】
本発明はさらに、上述のポリヌクレオチドの変異体に関し、これらは例えば、断片、類似体および誘導体をコードする。ポリヌクレオチドの変異体とは、該ポリヌクレオチドの天然の対立遺伝子変異体または該ポリヌクレオチドの非天然の変異体であり得る。上記に示したように、ポリヌクレオチドは、開示したポリペプチドのコード配列の天然の対立遺伝子変異体であるコード配列を有することができる。当技術分野で公知のように、対立遺伝子変異体とは、ポリヌクレオチド配列の別の形であって、1つまたは複数のヌクレオチドの置換、欠失、または追加を有し、コードされるポリペプチドの機能を実質的に改変しない。
【0084】
本発明にはまた、例えば細胞からのポリペプチドの輸送を制御するための分泌配列として機能するリーダー配列を含む宿主細胞由来のポリペプチドの例えば発現、分泌、タンパク質安定性を助けるポリヌクレオチドに成熟ポリペプチドのコード配列を同じリーディングフレームで融合できるポリヌクレオチドも含まれる。リーダー配列を有するポリペプチドは前駆体タンパク質であり、宿主細胞によって切断され、成熟型のポリペプチドを形成するためのリーダー配列を有する。ポリヌクレオチドはまた、成熟タンパク質に追加の5'アミノ酸残基が加わったものであるプロタンパク質もコードすることができる。プロ配列を有する成熟タンパク質はプロタンパク質であり、タンパク質の不活性型である。プロ配列が切断されると、活性成熟タンパク質が残る。したがって、例えば、本発明のポリヌクレオチドは、成熟タンパク質、またはプロ配列を有するタンパク質、あるいはプロ配列およびプレ配列(リーダー配列)の両方を有するタンパク質をコードすることができる。
【0085】
本発明のポリヌクレオチドはまた、マーカー配列にインフレームで融合されたコード配列を有することもでき、これにより、本発明のポリペプチドの精製が可能になる。細菌宿主の場合、マーカーに融合された成熟ポリペプチドの精製を提供するために、マーカー配列はpQE-9ベクターによって供給されるヘキサヒスチジンタグであることができる。または、例えば、哺乳動物宿主、例えばCOS-7細胞を用いる場合は、マーカー配列はヘマグルチニン(HA)タグでよい。HAタグは、インフルエンザヘマグルチニンタンパク質に由来するエピトープに対応する(Wilson, I., et al., Cell 37:767 (1984))。
【0086】
本発明のある態様には、開示された配列をコードするヌクレオチドに対して少なくとも90%同一の、95%同一の、およびいくつかの実施態様では、少なくとも96%、97%、98%、または99%同一のヌクレオチド配列を有するポリヌクレオチドを含む、単離された核酸分子が含まれる。
【0087】
ポリヌクレオチド変異体は、コード領域、非コード領域、または両方に、改変を含むことができる。いくつかの態様では、ポリヌクレオチド変異体は、サイレントな置換、付加、または欠失を生成するが、コードされたポリペプチドの特性または活性を変更しない改変を含む。いくつかの態様では、遺伝コードの縮退によるサイレントな置換により、ヌクレオチド変異体が生成される。ポリヌクレオチド変異体は、様々な理由のために、例えば、特定の宿主のためにコドン発現を最適化する(ヒトmRNA中のコドンを大腸菌(E. coli)のような細菌宿主に好まれるものへ変更する)ために、産生することができる。
【0088】
可溶性受容体ポリペプチド
本発明のポリペプチドは、組換えポリペプチド、天然のポリペプチド、または配列番号:1〜9の配列を有する合成ポリペプチドであり得る。本発明のいくつかのアミノ酸配列を、タンパク質の構造または機能に対する有意な影響なしに変化させることができることが、当技術分野において認められるであろう。そのような配列の相違が意図される場合は、タンパク質上には、活性を決定する重大な領域があるということを覚えておかなければならない。したがって、本発明はさらに、相当な活性を示すポリペプチドの変異、または本明細書で議論したタンパク質部分などのFZDタンパク質の領域を含むポリペプチドの変異を含む。そのような突然変異体には、欠失、挿入、逆位、繰り返し、および型の置換が含まれる。以下に示すように、どのアミノ酸変化が表現型でサイレントである可能性が高いかに関する手引きをBowie, et al., Science 247:1306-1310 (1990)の中に見出すことができる。
【0089】
したがって、本発明のポリペプチドの断片、誘導体または類似体は、以下のものであり得る:(i) アミノ酸残基の1つまたは複数が保存的または非保存的アミノ酸残基で置換されたものであり、ここで、そのような置換されたアミノ酸残基には、遺伝子コードによってコードされ得るものも、コードされ得ないものも含まれる;または (ii) アミノ酸残基の1つまたは複数が、置換された基を含むもの;または (iii) 成熟ポリペプチドが、ポリペプチドの半減期を増加させる化合物(例えばポリエチレングリコール)などの別の化合物と融合されているもの;または (iv) 成熟ポリペプチドに、追加のアミノ酸、例えばリーダー配列もしくは分泌配列、または成熟ポリペプチドの精製のために使用される配列、またはプロタンパク質配列が融合されているもの。そのような断片、誘導体、および類似体は、当業者にとって本明細書の教示の範囲内であると考えられる。
【0090】
特に興味深いのは、荷電アミノ酸と別の荷電アミノ酸との、および中性または負に荷電したアミノ酸との置換である。後者は、低い正荷電を有するタンパク質をもたらし、可溶性受容体タンパク質の特性を改善する。タンパク質の凝集は活性の喪失をもたらし、さらにこれは免疫原となる可能性があるために薬学的製剤調製の際には問題にもなり得るので、凝集の予防は極めて望ましい(Pinckard et al., Clin. Exp. Immunol. 2:331-340 (1967); Robbins et al., Diabetes 36:838-845 (1987); Cleland et al., Crit. Rev. Therapeutic Drug Carrier Systems 10:301-377 (1993))。
【0091】
示したように、通常は、変更とは、タンパク質の折り畳みや活性に大きく影響しない保存的アミノ酸置換などの些細な性質である(表1および2を参照のこと)。
【0092】
(表1)保存的アミノ酸置換

【0093】
(表2)アミノ酸置換

【0094】
当然ながら、当業者が行うアミノ酸置換の数は、上述の因子を含む多くの因子に依存する。概説すると、任意の所与の可溶性受容体ポリペプチドについて、置換の数は50、40、30、25、20、15、10、5、または3以下である。
【0095】
本発明のポリペプチドには、配列番号:1〜9のポリペプチド、ならびに、特定の場合には配列番号:1〜9のポリペプチドと少なくとも90%の類似性を有するポリペプチド、および特定の場合には、配列番号:1〜9のポリペプチドと少なくとも95%の類似性を有するポリペプチド;および特定の場合には、配列番号:1〜9のポリペプチドと少なくとも96%、97%、98%、または99%の類似性を有するポリペプチドが含まれる。当技術分野で公知のように、2つのポリペプチド間の「類似性」とは、1つのポリペプチドのアミノ酸配列およびその保存的アミノ酸置換物を第2のポリペプチドの配列と比較することにより決定される。
【0096】
ペプチド合成によって対応する全長ポリペプチドを産生するために、本発明のポリペプチドの断片または一部を使用することができる;したがって、断片を、全長ポリペプチドを産生するための中間体として使用することができる。本発明のポリヌクレオチドの断片または一部を用いて、本発明の全長ポリヌクレオチドを合成することができる。
【0097】
本発明のタンパク質の断片は、癌幹細胞マーカータンパク質または癌幹細胞タンパク質の結合パートナー(例えば受容体、共受容体、リガンドまたはコリガンド)に結合することができるタンパク質の一部または全体である。この断片は癌幹細胞マーカータンパク質、または癌幹細胞タンパク質の結合パートナー(例えば受容体、共受容体、リガンドまたはコリガンド)に対して高い親和性を有する。融合タンパク質のいくつかの断片は、免疫グロブリンの不変領域の少なくとも一部へ結合した、癌幹細胞マーカータンパク質または癌幹細胞タンパク質の結合パートナーの細胞外部分の少なくとも一部を含むタンパク質断片である。親和性は約10-11〜10-12Mの範囲であり得るが、親和性は、大きさの異なる断片に応じて10-7〜10-13Mの範囲で相当に変化することができる。いくつかの態様では、断片は、約10〜255アミノ酸長であり、免疫グロブリンの不変領域の少なくとも一部に連結された癌幹細胞マーカータンパク質リガンド結合部位を含む。
【0098】
ポリペプチドおよび類似体をさらに修飾して、通常はタンパク質の一部ではない追加の化学的部分を含むようにすることができる。それらの誘導体化された部分は、タンパク質の溶解度、生物学的半減期または吸収を改善することができる。その部分はまた、タンパク質等の任意の所望の副作用を低減させるかまたは除去することができる。それらの部分の概要は、Remington's Pharmaceutical Sciences, 20th ed., Mack Publishing Co., Easton, PA (2000)中に認められる。
【0099】
誘導体化に最も適した化学的部分には、水溶性ポリマーが含まれる。水溶性ポリマーは、それに付着しているタンパク質が生理的環境などの水性環境で沈殿しないので、望ましい。いくつかの態様では、ポリマーは、治療用の生成物または組成物の調製のために薬学的に許容されるであろう。当業者は、ポリマー/タンパク質抱合体を治療用に用いるかどうかの考察に基づいて、また用いるならば、所望の用量、循環時間、タンパク質分解に対する抵抗性および他の考察に基づいて、所望のポリマーを選択することができるであろう。誘導体化の有効性を、誘導体を所望の形式で投与することにより(即ち、浸透ポンプにより、または注射や注入により、あるいはさらに、経口、肺または他の送達経路用に調剤して)、およびその有効性を測定することにより確認することができる。適当な水溶性ポリマーには、ポリエチレングリコール(PEG)、エチレングリコール/プロピレングリコールコポリマー、カルボキシメチルセルロース、デキストラン、ポリビニルアルコール、ポリビニルピロリドン、ポリ1,3ジオキソラン、ポリ1,3,6トリオキサン、エチレン/無水マレイン酸コポリマー、ポリアミノ酸(ホモポリマーまたはランダムコポリマーのいずれか)、およびデキストランまたはポリ(n-ビニルピロリドン)ポリエチレングリコール、プロプロピレングリコールホモポリマー、プロリプロピレンオキシド/エチレンオキシドコポリマー、ポリオキシエチル化ポリオール(例えばグリセロール)、ポリビニルアルコール、およびそれらの混合物が非限定的に含まれる。ポリエチレングリコールプロピオンアルデヒドは、水中での安定性により、作製の際に有利であり得る。
【0100】
そのように付着されたポリマー分子の数は変化してもよく、また当業者は機能に対する影響を確認することができるであろう。モノ誘導体化することができ、あるいは、同一または異なる化学的部分(例えば、様々な重量のポリエチレングリコールなどのポリマー)によって、ジ、トリ、テトラ、またはある組合せの誘導体化をすることができる。ポリマー分子のタンパク質(あるいはペプチド)分子に対する比率は、反応混合液中のポリマー分子の濃度が変化するにつれて、変化するであろう。一般に、最適な比率(過剰な未反応タンパク質またはポリマーが存在しないという反応効率の観点から)は、望ましい誘導体化の程度(例えばモノ-、ジ、トリ-など)、選択されたポリマーの分子量、ポリマーが分岐しているか非分岐か、および反応条件などの要素によって決定されるであろう。
【0101】
タンパク質の機能的または抗原性ドメインに対する影響を考慮して、ポリエチレングリコール分子(あるいは他の化学的部分)を、タンパク質に付着させるべきである。当業者に利用可能な多くの付着方法がある。例えば、その開示(PEGのG-CSFとのカップリング)が参照により本明細書に組み入れられるEP 0 401 384を参照のこと。さらにMalik et al., Exp. Hematol 20:1028-1035 (1992)を参照のこと(塩化トレシル(tresyl chloride)を用いたGM-CSFのPEG化(pegylation)を報告している)。例えば、ポリエチレングリコールを、遊離アミノ基または遊離カルボキシル基などの反応基により、アミノ酸残基を介して共有結合的に結合させることができる。反応基は、活性化されたポリエチレングリコール分子を結合させることができる。遊離アミノ基を有するアミノ酸残基には、リジン残基およびN末端アミノ酸残基が含まれ得る。遊離カルボキシル基を有するものには、アスパラギン酸残基、グルタミン酸残基、およびC末端アミノ酸残基が含まれ得る。スルフヒドリル基もまた、ポリエチレングリコール分子を付着させるための反応基として用いることができる。治療目的のために、N末端またはリジン基における付着などの、アミノ基における付着を行なうことができる。受容体結合が望ましい場合は、受容体結合にとって重要な残基における付着を回避するべきである。
【0102】
アミノ末端が化学的に修飾されたタンパク質が特に望ましい場合がある。本組成物の例としてポリエチレングリコールを用い、様々なポリエチレングリコール分子(分子量、分岐などによる)、反応混合物中のポリエチレングリコール分子のタンパク質(あるいはペプチド)分子に対する比率、行なわれるべきPEG化反応の種類、および選択されたN末端がPEG化されたタンパク質を得る方法を選択することができる。N末端をPEG化された調製物を得る方法(即ち必要ならば、この部分を他のモノPEG化された(monopegylated)部分から分離する方法)は、PEG化されたタンパク質分子の集団から、N末端をPEG化された物質を精製することによるものであってよい。特定のタンパク質における誘導体化に利用可能な種々の種類の一級アミノ基(リジンに対するN末端)の異なる反応性を利用する還元的アルキル化により、選択的なN末端の化学的修飾を遂行することができる。適切な反応条件下で、カルボニル基を含むポリマーにより、N末端での実質的に選択的なタンパク質の誘導体化が達成される。例えば、リジン残基のεアミノ基とタンパク質のN末端残基のαアミノ基の間のpKa差を利用することが可能なpHで反応を行なうことにより、タンパク質を選択的にN末端でPEG化することができる。そのような選択的な誘導体化によって、タンパク質への水溶性ポリマーの付着が制御されるが、ポリマーとの抱合は、主にタンパク質のN末端で起り、リジン側鎖アミノ基などの他の反応基の有意な修飾は生じない。還元的アルキル化を用いると、水溶性ポリマーは上述の種類でよく、タンパク質にカップリングするための単一の反応性アルデヒドを有するべきである。単一の反応性アルデヒドを含むポリエチレングリコールプロピオンアルデヒドを用いることができる。
【0103】
PEG化を、任意の公知技術のPEG化反応によって行なうことができる。例えば、Focus on Growth Factors, 3(2): 4-10 (1992);EP 0 154 316、その開示は参照により本明細書に組み入れられる;EP 0 401 384;および本明細書に引用されたPEG化に関する他の出版物を参照のこと。反応性ポリエチレングリコール分子(あるいは類似の反応性水溶性ポリマー)とのアシル化反応またはアルキル化反応によって、PEG化を実施することができる。
【0104】
したがって、本発明にしたがって用いられる可溶性受容体ポリペプチドは、PEG基がアシル基またはアルキル基を介して付着されたPEG化可溶性受容体タンパク質または変異体を含むことができることが、意図されている。そのような生成物は、モノPEG化またはポリPEG化(poly pegylated)であってよい(例えば、26個の、典型的には25個のPEG基を含む)。一般にPEG基はアミノ酸のαまたはεのアミノ基でタンパク質に付着しているが、PEG基は、適当な反応条件下でPEG基に付着されるために十分に反応性であるタンパク質に付着された、任意のアミノ基に付着できることも意図されている。
【0105】
アシル化およびアルキル化の両方の手法で用いられるポリマー分子を、上述の水溶性ポリマーの中から選択することができる。選択されたポリマーを、アシル化用の活性エステルまたはアルキル化用のアルデヒドなどの単一の反応基を持つように修飾するべきであり、それによって、本方法で行われるように重合度を制御することができる。例示的な反応性PEGアルデヒドは、水に安定なポリエチレングリコールプロピオンアルデヒド、またはそのモノC1〜C10アルコキシまたはアリールオキシ誘導体である(米国特許第5,252,714号を参照のこと)。ポリマーは分岐していても分岐していなくてもよい。アシル化反応については、選択したポリマーは単一の反応性エステル基を有するべきである。本還元的アルキル化のために、選択されたポリマーは単一の反応性アルデヒド基を有するべきである。一般に、水溶性ポリマーは、天然のグリコシル残基からは選ばれないであろう。これらは通常哺乳動物組換え発現系によってより便利に作製されるからである。ポリマーは任意の分子量でよく、分岐していても分岐していなくてもよい。本明細書で使用するための1つの水溶性ポリマーはポリエチレングリコールである。本明細書で用いるポリエチレングリコールは、他のタンパク質を誘導体化するために用いられてきた、モノ(C1〜C10)アルコキシ-またはアリールオキシ-ポリエチレングリコールなどの、任意の形のPEGを包含するものとする。
【0106】
溶媒、反応時間、温度などの他の反応パラメーターおよび生成物の精製手段は、水溶性ポリマーによるタンパク質の誘導体化に関係する公表された情報(本明細書に引用された出版物を参照のこと)に基づいて、ケースバイケースで決定することができる。
【0107】
本明細書に記述された単離されたポリペプチドを、当技術分野で公知の任意の適切な方法により産生することができる。そのような方法は、直接タンパク質合成法から、単離されたポリペプチド配列をコードするDNA配列の構築、および適切な形質変換宿主中でのその配列の発現までの範囲にわたる。例えば、配列番号:1のポリペプチドをコードする標識されたDNA断片でヒトcDNAライブラリーをスクリーニングし、オートラジオグラフィーによって陽性クローンを同定することにより、cDNAを得ることができる。一連のプラーク精製およびハイブリダイゼーションを、従来方式を用いてさらに行なう。
【0108】
組換え法のいくつかの態様では、関心対象の野生型タンパク質をコードするDNA配列を単離または合成することにより、DNA配列を構築する。任意で、部位特異的突然変異誘発により配列を突然変異誘発し、その機能的類似体を提供することができる。Zoeller et al., Proc. Natl. Acad. Sci. USA 81:5662-5066 (1984) および米国特許第4,588,585号を参照のこと。関心対象のポリペプチドをコードするDNA配列を構築する別の方法は、オリゴヌクレオチド合成機を用いる化学合成によるものであろう。所望のポリペプチドのアミノ酸配列に基づき、関心対象の組換えポリペプチドを生成する宿主細胞中で好まれるコドンを選択して、そのようなオリゴヌクレオチドを設計することができる。
【0109】
標準的方法を適用して、関心対象の単離されたポリペプチドをコードする単離されたポリヌクレオチド配列を合成することができる。例えば、完全なアミノ酸配列を用いて、逆翻訳された遺伝子を構築することができる。さらに、特定の単離されたポリペプチドをコードするヌクレオチド配列を含むDNAオリゴマーを合成することができる。例えば、所望のポリペプチドの一部ずつをコードするいくつかの小さなオリゴヌクレオチドを合成し、次にライゲーションすることができる。個々のオリゴヌクレオチドは典型的には、相補的組み立てのために、5'または3'突出部を含む。
【0110】
(合成、部位特異的変異誘発、または別の方法により)組み立てられたら、特定の単離された関心対象のポリペプチドをコードする突然変異体DNA配列を発現ベクターに挿入し、所望の宿主中でのタンパク質発現に適した発現制御配列に機能的に連結させる。ヌクレオチド配列決定、制限酵素マッピング、および生物学的活性を持つポリペプチドの適当な宿主中での発現により、適切な組み立てを確認することができる。当技術分野において周知のように、トランスフェクションされた遺伝子の宿主中での高い発現レベルを得るためには、選ばれた発現宿主中で機能する転写および翻訳の発現制御配列に、遺伝子を機能的に連結しなければならない。
【0111】
組換え体発現ベクターを用いて、癌幹細胞マーカーポリペプチド融合体をコードするDNAを増幅および発現させることができる。組換え体発現ベクターとは、哺乳動物、微生物、ウイルスまたは昆虫の遺伝子に由来する適切な転写または翻訳の調節エレメントに機能的に連結された癌幹細胞マーカーポリペプチド融合体または生物学的に同等な類似体をコードする合成のまたはcDNA由来のDNA断片を有する、複製可能なDNA構築物である。転写ユニットは、一般に (1) 遺伝子発現において調節の役割を有する遺伝子エレメント、例えば転写プロモーターまたはエンハンサー、(2) mRNAへ転写されてタンパク質に翻訳される構造配列またはコード配列、および (3) 以下に詳述される適切な転写および翻訳の開始および終止配列の集合を含む。そのような調節エレメントは、転写を制御するオペレーター配列を含むことができる。複製開始点によって通常与えられる宿主中での複製能力、および、形質変換体の認識を容易にするための選択遺伝子を、さらに組込むことができる。DNA領域は、それらが互いに機能的に関連している場合には、機能的に連結されている。例えば、シグナルペプチド(分泌リーダー)のDNAは、ポリペプチドの分泌に関与する前駆物質として発現される場合には、ポリペプチド用のDNAに機能的に連結されている;プロモーターは、それが配列の転写を制御する場合は、コード配列に機能的に連結されている;またはリボソーム結合部位は、それが翻訳を許すような位置にある場合には、コード配列に機能的に連結されている。一般に、機能的に連結されているとは近接していることを意味し、分泌リーダーの場合には、近接していることおよびリーディングフレーム中にあることを意味する。酵母発現系で用いる目的の構造エレメントは、宿主細胞による翻訳されたタンパク質の細胞外の分泌を可能にするリーダー配列を含むことができる。または、組換えタンパク質がリーダー配列または輸送配列なしで発現される場合、それはN末端メチオニン残基を含むことができる。この残基を任意で次に、発現された組換え型タンパク質から切断し、最終生産物を提供することができる。
【0112】
発現制御配列および発現ベクターの選択は、宿主の選択に依存することになろう。種々様々の発現宿主/ベクターの組合せを使用することができる。真核生物宿主のための有用な発現ベクターには、例えば、SV40、ウシパピローマウイルス、アデノウイルス、およびサイトメガロウイルス由来の発現制御配列を含むベクターが含まれる。細菌の宿主のための有用な発現ベクターには、pCR1、pBR322、pMB9およびそれらの誘導体を含む、大腸菌(Esherichia coli)由来のプラスミドなどの公知の細菌のプラスミド、M13およびフィラメント状一本鎖DNAファージなどのより広い宿主範囲のプラスミドが含まれる。
【0113】
癌幹細胞マーカータンパク質の発現に適切な宿主細胞には、適切なプロモーターの制御下の、原核生物、酵母、昆虫または高等真核細胞が含まれる。原核生物には、グラム陰性またはグラム陽性生物、例えば大腸菌、桿菌(bacilli)が含まれる。高等真核細胞には、下記に述べる哺乳動物由来の確立された細胞系統が含まれる。無細胞系翻訳システムを使用することもできよう。細菌、真菌、酵母、および哺乳動物細胞の宿主での使用のための適切なクローニングおよび発現ベクターについてはPouwels et al., Cloning Vectors: A Laboratory Manual, Elsevier, N. Y. (1985)が記述しており、これに関連する開示は、参照により本明細書に組み入れられる。
【0114】
様々な哺乳動物または昆虫の細胞培養系も、組換えタンパク質を発現するために有利に使用される。組換えタンパク質は一般に正確に折り畳まれ、適切に修飾され、かつ完全に機能的であるので、哺乳動物細胞中の組換えタンパク質の発現を行なうことができる。適切な哺乳動物宿主細胞系統の例には、Gluzman, Cell 23:175 (1981)に記述されているサル腎細胞のCOS-7系統、ならびに、例えばL細胞、C127、3T3、チャイニーズハムスター卵巣(CHO)、HeLa、およびBHK細胞系統を含む、適切なベクターを発現することができる他の細胞系統が含まれる。哺乳動物発現ベクターは、複製開始点、発現されるべき遺伝子に連結された適切なプロモーターおよびエンハンサー、および他の5'または3'隣接非転写配列、および5'または3'非翻訳配列、例えば必要なリボソーム結合部位、ポリアデニル化部位、スプライシングドナーおよびアクセプター部位、および転写終結配列などを含むことができる。昆虫細胞における異種タンパク質産生用のバキュロウイルスシステムが、Luckow and Summers, Bio/Technology 6:47 (1988)によって概説されている。
【0115】
形質変換宿主によって産生されたタンパク質を、任意の適切な方法により精製することができる。そのような標準的方法には、クロマトグラフィー(例えばイオン交換、親和性、およびサイジングカラムクロマトグラフィー)、遠心分離、溶解度の差異、またはタンパク質精製のための任意の他の標準技術によるもの、が含まれる。ヘキサヒスチジン、マルトース結合ドメイン、インフルエンザコート配列、およびグルタチオン-S-トランスフェラーゼなどのアフィニティータグをタンパク質に付着させて適切なアフィニティカラムを通すことにより、容易な精製が可能になる。単離されたタンパク質を、タンパク質分解、核磁気共鳴、およびX線結晶学などの技術を用いて、物理的に特徴決定することができる。
【0116】
例えば、培地へ組換えタンパク質を分泌する系由来の上清を、市販のタンパク質濃縮フィルター、例えばアミコンまたはミリポアペリコン限外濾過ユニットを用いて、最初に濃縮することができる。濃縮工程の次に、濃縮物を適切な精製マトリックスに供することができる。または、陰イオン交換樹脂、例えば側鎖ジエチルアミノエチル(DEAE)基を有するマトリックスまたは基質を使用することができる。マトリックスは、アクリルアミド、アガロース、デキストラン、セルロース、またはタンパク質精製に一般に使用される他の種類であってよい。または、陽イオン交換工程を採用することもできる。適切な陽イオン交換体には、スルホプロピル基またはカルボキシメチル基を含む様々な不溶性マトリックスが含まれる。最後に、疎水性RP-HPLC材、例えば側鎖メチルまたは他の脂肪族基を有するシリカゲルを使用する、1つまたは複数の逆相高速液体クロマトグラフィー(RP-HPLC)の工程を利用して、癌幹細胞タンパク質-Fc組成物をさらに精製することができる。前記の精製工程のうちのいくつかまたはすべてを色々な組み合わせで使用して、均質な組換え型タンパク質を提供することができる。
【0117】
細菌培養物中に産生された組換えタンパク質を、通常は最初に細胞沈殿物から抽出し、その後、1つまたは複数の濃縮、塩析、水性イオン交換、またはサイズ排除クロマトグラフィーの工程を続けることにより、単離する。最終の精製工程用に、高速液体クロマトグラフィー(HPLC)を採用することができる。組換え型タンパク質の発現に使用した微生物細胞を、凍結融解の繰り返し、超音波処理、機械的破壊、または細胞溶解剤の使用を含む任意の便利な方法によって、破壊することができる。
【0118】
腫瘍細胞成長の阻害
本発明はまた、癌幹細胞マーカーを発現している腫瘍形成性細胞の成長を、本明細書に記述した癌幹細胞マーカーのアンタゴニストを用いて阻害する方法を提供する。ある態様では、癌幹細胞マーカーを発現している腫瘍形成性細胞の成長を阻害する方法は、細胞を癌幹細胞マーカーに対するアンタゴニストとインビトロで接触させる工程を含む。例えば、癌幹細胞マーカーを発現する不死化された細胞系統または癌細胞系統を、発現された癌幹細胞マーカーのアンタゴニストを加えた培地で培養して、細胞成長を阻害する。または、患者の試料、例えば組織生検、胸水または血液サンプルなどから腫瘍細胞および/または腫瘍幹細胞を単離し、癌幹細胞マーカーのアンタゴニストを加えた培地中で培養して、細胞成長を阻害する。ある態様では、アンタゴニストは、癌幹細胞マーカータンパク質または癌幹細胞マーカー結合タンパク質(例えば受容体、共受容体、リガンドまたはコリガンド)に特異的に結合する癌幹細胞マーカータンパク質融合体である。例えば、精製された癌幹細胞マーカータンパク質融合体を、単離された癌幹細胞の培地に加えて、細胞成長を阻害する。
【0119】
ある態様では、癌幹細胞マーカーを発現する腫瘍形成性細胞の成長を阻害する方法は、細胞と、癌幹細胞マーカーに対するアンタゴニストとをインビボで接触させる工程を含む。ある態様では、動物モデル中で、腫瘍形成性細胞と癌幹細胞マーカーに対するアンタゴニストとを接触させる工程を行う。例えば、癌幹細胞マーカーを発現している異種移植片を、腫瘍成長を阻害するために癌幹細胞マーカーに対するアンタゴニストを投与された免疫不全マウス(例えばNOD/SCIDマウス)中で、成長させる。または、例えば組織生検、胸水、または血液サンプルなどの患者の試料から癌幹細胞マーカーを発現する癌幹細胞を単離して、腫瘍成長を阻害するために癌幹細胞マーカーに対するアンタゴニストを投与された免疫不全マウスに注入する。いくつかの態様では、癌幹細胞マーカーのアンタゴニストを、動物中への腫瘍形成性細胞の導入と同時にまたは直後に投与して、腫瘍成長を防止する。いくつかの態様では、癌幹細胞マーカーのアンタゴニストを、腫瘍形成性細胞が所定の大きさに成長した後の治療薬として投与する。いくつかの態様では、アンタゴニストは、癌幹細胞マーカータンパク質または癌幹細胞マーカー結合タンパク質(例えば受容体、共受容体、リガンドまたはコリガンド)に特異的に結合する癌幹細胞マーカータンパク質融合体である。ある態様では、腫瘍形成性細胞と癌幹細胞へのアンタゴニストとを、癌と診察されたヒト患者中で接触させる工程を行う。
【0120】
薬学的組成物
本発明はさらに、癌幹細胞マーカーを標的とするアンタゴニスト(例えば抗体)を含む薬学的組成物を提供する。これらの薬学的組成物は、腫瘍細胞成長を阻害およびヒト患者中の癌の処置に用いられる。
【0121】
貯蔵および使用のために、本発明の精製アンタゴニスト(例えば抗体)を薬学的に許容される担体、賦形剤、および/または安定化剤と組み合わせることにより、無菌凍結乾燥粉末、水溶液その他として、製剤が調製される(Remington, The Science and Practice of Pharmacy, 20th Edition, Mack Publishing (2000))。適切な担体、賦形剤、または安定化剤は、リン酸、クエン酸、および他の有機酸などの無毒な緩衝剤;塩化ナトリウムなどの塩;アスコルビン酸およびメチオニンを含む酸化防止剤;保存剤(例えば、オクタデシルジメチルベンジルアンモニウムクロリド;ヘキサメトニウムクロリド;ベンザルコニウムクロリド;ベンゼトニウムクロリド;フェノール;ブチルまたはベンジルアルコール;メチルまたはプロピルパラベンなどのアルキルパラベン;カテコール;レゾルシノール;シクロヘキサノール;3-ペンタノール;およびm-クレゾール);低分子量ポリペプチド(約10個より少ないのアミノ酸残基などの);血清アルブミン、ゼラチンまたは免疫グロブリンなどのタンパク質;ポリビニルピロリドンなどの親水性ポリマー;グリシン、グルタミン、アスパラギン、ヒスチジン、アルギニンまたはリジンなどのアミノ酸;単糖類、二糖類、グルコース、マンノースまたはデキストリンなどの炭水化物;EDTAのようなキレート剤;ショ糖、マニトール、トレハロース、またはソルビトールなどの糖;ナトリウムなどの塩形成性対イオン;金属複合体(例えばZn-タンパク質複合体);および/またはTWEENまたはポリエチレングリコール(PEG)などの非イオン性界面活性剤を含む。
【0122】
本発明の薬学的組成物を、任意の数の方法で局所処置または全身処置のために投与することができる。投与は、(膣および直腸への送達を含む粘膜などへの)局所的投与、例えば経皮貼付剤、軟膏、ローション、クリーム、ゲル、液滴、坐剤、スプレー、液体および散剤など;肺内投与(例えば噴霧器によるものを含む、散剤またはエアロゾルの吸入または通気による;気管内、鼻腔内、表皮、および経皮的投与);経口的投与;または静脈内、動脈内、皮下、腹腔内または筋肉内の注射または注入を含む非経口的投与;あるいは頭蓋内(例えば、髄膜下または脳室内)投与でよい。
【0123】
治療製剤は単位剤形であってよい。そのような製剤には、経口、非経口、または直腸内投与のためのまたは吸入器による投与のための、錠剤、ピル、カプセル剤、散剤、果粒剤、水または非水性溶媒中の溶液または懸濁液、あるいは坐剤が含まれる。錠剤などの固形組成物では、主要な有効成分が薬学的担体と混合されている。従来の錠剤化成分には、本発明の化合物またはその無毒な薬学的に許容される塩の均一混合物を含む固体の予備処方組成物を形成するための、コーンスターチ、ラクトース、ショ糖、ソルビトール、タルク、ステアリン酸、ステアリン酸マグネシウム、リン酸二カルシウム、またはゴム、および他の希釈剤(例えば水)が含まれる。固体予備処方組成物を、次に上述の種類の単位剤形へ細分する。新規組成物の錠剤やピルなどをコーティングするか、そうでなければ調合して、持続作用の長所を与える剤形を提供することができる。例えば、錠剤またはピルは、外部成分によって覆われた内部組成物を含むことができる。さらに、分解に抵抗するよう働いて、内部成分がそのまま胃を通過するかまたはその放出が遅れることを可能にする腸溶層によって、2つの成分を分離することができる。そのような腸溶層またはコーティングのために様々な材料を用いることができるが、そのような材料には、多くのポリマー酸および、ポリマー酸と、セラック、セチルアルコールおよび酢酸セルロースのような物質との混合物が含まれる。
【0124】
薬学的製剤には、リポソームと複合体化された本発明のアンタゴニストが含まれる(Epstein, et al., Proc. Natl. Acad. Sci. USA 82:3688 (1985); Hwang, et al., Proc. Natl. Acad. Sci. USA 77:4030 (1980); ならびに米国特許第4,485,045号および第4,544,545号)。循環時間が増大したリポソームが、米国特許第5,013,556号に開示されている。リポソームを、ホスファチジルコリン、コレステロール、およびPEG誘導体化ホスファチジルエタノールアミン(PEG-PE)を含む脂質組成物を用いた逆相蒸発によって生成することができる。規定の孔径のフィルターを通してリポソームを押し出すことにより、所望の直径を有するリポソームを生成する。
【0125】
アンタゴニストをマイクロカプセル中に封入することもできる。そのようなマイクロカプセルは、例えばコアセルベーション技術によって、または界面重合法によって、例えばヒドロキシメチルセルロースまたはゼラチンのマイクロカプセルおよびポリ(メチルメタクリレート)マイクロカプセルが、コロイド状薬物送達システム(例えばリポソーム、アルブミンミクロスフェア、マイクロエマルジョン、ナノ粒子およびナノカプセル)中に、またはRemington, The Science and Practice of Pharmacy, 20th Ed. Mack Publishing (2000)に記述されているマクロエマルジョン中に、それぞれ調製される。
【0126】
さらに、徐放性製剤を調製することができる。徐放性製剤の適切な例には、抗体を含む固体疎水性ポリマーの半透性マトリックスが含まれ、そのマトリックスは、成形された物品(例えばフィルム、またはマイクロカプセル)の形をしている。徐放性マトリックスの例には、ポリエステル、ポリ(2-ヒドロキシエチル-メタクリレート)またはポリ(ビニルアルコール)などのヒドロゲル、ポリラクチド(米国特許第3,773,919)、L-グルタミン酸と7エチル-L-グルタメートのコポリマー、非分解性エチレン-酢酸ビニル、LUPRON DEPOT (登録商標)などの分解性乳酸-グリコール酸コポリマー(乳酸-グリコール酸コポリマーおよび酢酸ロイプロリドからなる注射可能なミクロスフェア)、ショ糖酢酸イソ酪酸エステル、およびポリD-(-)-3-ヒドロキシ酪酸が含まれる。
【0127】
アンタゴニストによる処置
本発明のアンタゴニストを用いて、癌幹細胞マーカーの発現および/またはそれに対する細胞の高い反応性によって特徴づけられる様々な症状を処置することができると考えられる。特に、癌幹細胞マーカーに対するアンタゴニスト(例えば抗体)を用いて、腎臓、肝臓、膀胱、乳房、胃、卵巣、結腸、直腸、前立腺、肺、外陰、甲状腺、頭および頸、脳(膠芽腫、星状細胞腫、髄芽細胞腫など)、血液およびリンパ液(白血病およびリンパ腫)の良性および悪性の腫瘍を非限定的に含む成長性障害を処置することが構想される。
【0128】
アンタゴニストを、公知の方法により、ヒト患者への適当な薬学的組成物として投与する。適当な投与法には、ボーラス注入としてのまたはある期間にわたる連続注入による静脈内投与が含まれ、また筋肉内、腹腔内、静脈内、脳脊髄内、皮下、関節内、滑液内、髄膜下、経口、局所的、または吸入による経路が非限定的に含まれる。
【0129】
ある態様では、処置に、本発明のアンタゴニストと、化学療法剤または複数の異なる化学療法剤の混合物との組み合わせ投与が含まれる。アンタゴニストによる処置を、化学療法剤の投与の前に、それと同時に、またはその後に行ってもよい。本発明が意図する化学療法には、ドキソルビシン、5-フルオロウラシル、シトシンアラビノシド(「Ara-C」)、シクロホスファミド、チオテパ、ブスルファン、サイトキシン、タキソール、メトトレキセート、シスプラチン、メルファラン、ビンブラスチンおよびカルボプラチンなどの、当技術分野において公知である、市販の化学物質または薬物が含まれる。組合せ投与には、単一の薬学的製剤によるまたは別々の製剤を用いた同時投与、あるいは、いずれかの順序であるが好ましくは全ての活性薬剤がそれらの生物活性を同時に発揮できるような期間内での、連続投与が含まれ得る。そのような化学療法剤の調製および投薬スケジュールを、メーカーの指示に従って、あるいは、熟練した施術者が経験的に決定して、用いることができる。そのような化学療法の調剤および投薬スケジュールは、Chemotherapy Service, M.C. Perry, ed., Williams & Wilkins, Baltimore, MD (1992) にも記載されている。
【0130】
ある態様では、処置には、本発明のアンタゴニストの放射線療法と組み合わせた投与が含まれる。アンタゴニストによる処置を、放射線療法の投与の前に、それと同時に、またはその後に行うことができる。そのような放射線療法の任意の適用スケジュールを、熟練した施術者が決定して用いることができる。
【0131】
ある態様では、処置は、本発明のアンタゴニストと、EGFR、HER2、およびVEGFに結合する抗体を非限定的に含む追加の腫瘍関連抗原に対する抗体との組み合わせ投与を含むことができる。さらに処置は、1つまたは複数のサイトカインの投与を含むことができ、癌細胞の外科的除去、または処置する医師によって必要と認められる任意の他の療法を一緒に行うことができる。
【0132】
疾病の処置については、本発明のアンタゴニストの適当な用量は、処置するべき疾病の種類、疾病の重症度および経過、疾病の反応性、治療または防止のどちらの目的でアンタゴニストを投与するのか、以前の療法、患者の病歴など、治療医の裁量におけるすべてによって決まる。一度に、または数日〜数か月の間継続する一連の処置に亘って、または治癒が達成されるか疾病状態の低減が達成されるまで(例えば腫瘍の大きさの減少)、アンタゴニストを投与することができる。患者の体内の薬物蓄積の測定値から最適な投薬スケジュールを計算することができるが、これは個々のアンタゴニストの相対的な効能に応じて変動しうる。投与する医師は、最適な用量、投薬方法、および反復回数を容易に決定することができる。一般に用量は、体重1kg当たり0.01μg〜100mgであり、1日、1週間、1か月、または1年に1回または複数回与えることができる。治療する医師は、体液または組織中の薬物の測定された滞留時間および濃度に基づいて、投薬のための反復回数を推定することができる。
【0133】
キット
さらに他の態様では、本発明は、本明細書に記述された方法を実施するために用いることができるキットを提供する。ある態様では、キットは、1つまたは複数の容器中に、精製された癌幹細胞マーカー可溶性受容体を含む。いくつかの態様では、キットは、すべての対照、分析を行なうための説明書、および結果の分析および呈示に必要な任意のソフトウェアを含めて、検出分析を行なうために必要および/または十分な構成要素のすべてを含む。ある態様では、本発明は、試薬が別々の容器に含まれている区画(compartment)キットを提供する。そのような容器は、試薬を1つの区画から別の区画へ効率的に移すことを可能にし、その結果、試料および試薬は相互に汚染されず、また各容器の薬剤または溶液を定量的な方法で1つの区画から別の区画へ加えることができる。そのような容器には、試験サンプルを受取る容器、本方法で使用する可溶性受容体を含む容器、洗浄剤(リン酸緩衝食塩水、トリス緩衝液など)を含む容器、および結合した抗体またはプローブを検出するために用いる試薬を含む容器が含まれることになろう。当業者は、本発明の開示されたポリヌクレオチド、ポリペプチドおよび抗体を、当技術分野において周知であって確立したキット形式の1つに容易に組み入れることができることを、容易に認識するであろう。
【実施例】
【0134】
実施例
実施例1
FZD Fc可溶性受容体タンパク質の産生およびインビボでの半減期の決定
ヒトFZD受容体のN末端細胞外ドメイン(ECD)の可溶型は、Wntリガンドを結合し、Wnt経路シグナル伝達のアンタゴニストとして働く(He et al.,(1997) Science 275:1652-54; Tanaka et al., (1998) Proc. Natl. Acad. Sci. 95:10164-69; Holmen et al., (2002) JBC 277:34727-35; Vincan et al., (2005) Differentiation 73:142-53)。昆虫細胞およびHEK293細胞中での発現用のベクター中で、FZD10、FZD7、FZD5、FZD4またはFZD8の、1) ECDまたは 2) Friドメインを、ヒトB細胞ライブラリーから単離されたヒトIgG1 Fc (配列番号:4) に、インフレームでライゲーションすることにより、可溶性FZD受容体を生成した。標準の組換えDNA技術を用いて、FZD10のおよそ21から227までのアミノ酸(FZD10 ECD.Fc);FZD7のおよそ32から255までのアミノ酸(FZD7 ECD.Fc);FZD5のおよそ27から233までのアミノ酸(FZD5 ECD.Fc);およびFZD4のおよそ37から224までのアミノ酸(FZD4 ECD.Fc)を含む、FZD受容体ECD、ならびにFZD10のおよそ21から154までのアミノ酸(FZD10 Fri.Fc);FZD7のおよそ32から171までのアミノ酸(FZD7 Fri.Fc);FZD5のおよそ27から157までのアミノ酸(FZD5 Fri.Fc);FZD4のおよそ37から170までのアミノ酸(FZD4 Fri.Fc);およびFZD8のおよそ28から158までのアミノ酸(FZD8 Fri.Fc)を含むFZD受容体Friドメインをコードするポリヌクレオチドを単離した。可溶性受容体タンパク質を、プロテインAカラムで精製した。
【0135】
可溶性FZD受容体の半減期を決定するために、インビボの実験を行なった。具体的には、200ugの精製されたFZD4 Fri.Fc、FZD8 Fri.Fc、FZD5 Fri.Fc、およびFZD5 ECD.Fcをマウス(n=3)に腹腔内投与し、示した時点(図1)で血液試料を得た。プロテインAアガロースビーズ上に保持された血清タンパク質をSDS-PAGEゲルで分離し、ニトロセルロース膜に移し、HRPに抱合されたヤギ抗ヒトIgG Fc断片で検査して、hFc融合タンパク質を検出した。FZD4 Fri.Fc、FZD5 Fri.FcおよびFZD8 Fri.Fcタンパク質はすべて、注入72時間後に血清中に存在し、また、FZD5 Fri.FcおよびFZD8 Fri.Fcは注入96時間後に血清中に存在する(図1)。対照的に、FZD5 ECD.Fcは24時間後には検出できない(図1)。
【0136】
実施例2
FZD Fc可溶性受容体タンパク質を評価するためのインビトロ分析
この実施例は、細胞増殖および経路活性化に対するFZD Fc受容体の活性を試験するためのインビトロ分析の方法について記述する。
【0137】
増殖分析
種々の癌細胞系統によるFZD受容体の発現を、Taqman分析を用いて定量する。FZD受容体を発現することが確認された細胞系統を、96ウエル組織培養マイクロプレートに、ウエル当たり細胞104個の密度でプレートし、24時間増殖させた。続いて、細胞を、さらに12時間、2%のFCSを含む新鮮なDMEM中で培養し、その時点で、可溶性FZD Fc受容体タンパク質および対照タンパク質を10umol/LのBrdUの存在下で培養液に加える。BrdUでラベルした後に、培地を除去し、細胞をエタノール中で30分間室温で固定し、ペルオキシダーゼを抱合したモロクローナル抗BrdU抗体(クローンBMG 6H8、Fab断片)と90分間反応させる。テトラメチルベンジジンを含む溶液中で基質を発色させ、15分間後に、1mol/LのH2SO4 25ulによって止めた。発色反応を、自動ELISAプレートリーダー(UV Microplate Reader; Bio-Rad Laboratories, Richmond, CA)で450nmフィルターを用いて測定した。全ての実験を3重に行なった。FZD Fc可溶性受容体タンパク質の細胞成長を阻害する能力を比較して決定した。
【0138】
経路活性化分析
可溶性FZD Fc受容体タンパク質がWntシグナル伝達経路の活性化を妨害する能力を、インビトロで決定する。1つの態様では、抗生物質および10% FCSを補ったDMEM中で培養したHEK293細胞を以下で共トランスフェクションした:1) Wntシグナル伝達経路を活性化するためのWnt7bおよびFZD10発現ベクター;2) 標準Wntシグナル伝達レベルを測定するための、ホタルルシフェラーゼレポーター遺伝子の上流にTCF結合ドメインの3コピーを含む野生型または突然変異型のTCF/Lucレポーターベクター(Gazit et al., 1999, Oncogene 18:5959-66);および 3) トランスフェクション効率の内部対照としてのウミシイタケ(Renilla)ルシフェラーゼレポーター(Promega; Madison, WI)。次に、FZD Fcタンパク質を細胞培養培地に加えた。トランスフェクションの48時間後に、デュアルルシフェラーゼ分析キット(Promega; Madison, WI)を用いてルシフェラーゼレベルを測定し、ホタルルシフェラーゼ活性をウミシイタケルシフェラーゼ活性で規格化した。独立した3つの実験を3重に行った。可溶性FZD10 Fcタンパク質がWnt経路活性化を阻害する能力が、このようにして決定される。
【0139】
いくつかの態様では、Wnt3aリガンドの存在下または非存在下で、増加量のFZD Fc融合タンパク質をL細胞とインキュベーションし、Wnt3aによって誘起されるβカテニンの安定化をイムノブロッティングにより測定した。Wnt3aの存在下でのみβカテニンが検知でき、また、この安定化は、FZD5 ECD.Fc、FZD8 Fri.FcおよびFZD4 Fri.Fc可溶性受容体タンパク質の量の増加に伴って阻止された(図2)。これはFZD Fc可溶性受容体タンパク質が、Wnt3aリガンドによって活性化されたWnt経路シグナル伝達に拮抗することを実証する。
【0140】
次に、FZD:Fc融合タンパク質が種々のWntリガンドによるシグナル伝達に拮抗する能力を測定した。8×TCF-ルシフェラーゼレポーターで安定してトランスフェクションされたHEK293細胞を、Wnt1、Wnt2、Wnt3、Wnt3aおよびWnt7bを含む種々のWntリガンドの存在下で、増加量のFZD Fri.Fc可溶性受容体とインキュベーションした。FZD4 Fri.Fc、FZD5 Fri.Fc、およびFZD8 Fri.Fc融合タンパク質が、5つのWntリガンドすべてによって媒介されるWntシグナル伝達を阻害した(図3)。
【0141】
実施例3
FZD Fc可溶性受容体タンパク質を用いる、腫瘍成長のインビボでの防止
この実施例は、異種移植片モデル中の腫瘍成長を防止するためのFZD Fc可溶性受容体の使用について記述する。
【0142】
マウス中で異種移植片として継代された患者試料(充実性腫瘍生検または胸水)由来の腫瘍細胞を、実験動物への再継代のために、詳細に上述したようにして調製した。次に、解離された腫瘍細胞(1動物当たり<10,000個の細胞;n=10)を、NOD/SCIDマウスの乳腺脂肪組織へ皮下注射して、腫瘍成長を誘発した。
【0143】
ある態様では、実験動物への注入の前に、解離された腫瘍細胞を、細胞表面マーカーに基づいて腫瘍形成性および非腫瘍形成性の細胞へ先ず選別する。具体的には、上述のように解離された腫瘍細胞を、2%加熱不活性化子ウシ血清(HICS)を含むHepes緩衝生理食塩水(HBSS)で2回洗浄し、100ul当たり106細胞となるよう再懸濁した。抗体を加えて、細胞を20分間氷上でインキュベーションし、その後HBSS/2% HICSで2回洗浄した。抗体には、抗ESA (Biomeda, Foster City, CA)、抗CD44、抗CD24、および細胞系統マーカーに対する抗CD2、抗CD3、抗CD10、抗CD16、抗CD18、抗CD31、抗CD64、および抗CD140b (まとめてLinと呼ばれる;PharMingen, San Jose, CA)が含まれる。これらのマーカーを発現する細胞を陽性選択または陰性選択するために、抗体を蛍光色素に直接抱合した。H2Kd+細胞を除く選択を行うことによりマウス細胞を除去し、また死細胞検出試薬7AADを用いることにより死細胞を除去した。フローサイトメトリーを、FACS Vantage (Becton Dickinson, Franklin Lakes, NJ)上で行なう。細胞の集塊を除去するために側方散乱および前方散乱プロファイルを用いた。単離されたESA+、CD44+、CD24-/low、Lin-腫瘍形成性細胞を、次に乳房腫瘍のためにはNOD/SCIDマウスの乳腺脂肪組織へ、または非乳房腫瘍のためには横腹へ皮下注射して、腫瘍成長を誘発した。
【0144】
ある態様では、腫瘍細胞注入の2日後に、動物を、FZD7 ECD.Fc可溶性受容体、FZD10 ECD.Fc可溶性受容体、またはFZD5 ECD.Fc可溶性受容体で処理した。各試験注入動物は、10mg/kgのFZD7 ECD.Fc、FZD5 ECD.Fc、またはFZD10 ECD.Fcタンパク質を、毎週2〜3回腹腔内へ(i.p.)、合計4週間投与された。対照注入動物は、毎週2回、合計4週間注入された。腫瘍の大きさを、21日目、24日目、28日目、および30日目に評価した。可溶性FZD10 ECD.FcおよびFZD7 ECD.Fcの両方による処理は、対照処理された動物と比較して、全腫瘍体積を縮小させた(図4)。FZD7 ECD.Fcによる腫瘍体積の縮小は、28日目および30日目で統計的に有意であった(図4)。
【0145】
次に、腫瘍中の癌幹細胞の存在に対するFZD Fc可溶性受容体処理の効果を評価する。FZD Fcおよび対照で処理したマウスから得た腫瘍試料を、殺菌した刃を用いて小片に切断し、完全に刻み、酵素消化および機械的破壊によって単細胞浮遊液を得た。詳細に上述したESA+、CD44+、CD24-/low、Lin表面細胞マーカーの発現に基づいて、次に解離された腫瘍細胞を、FACS分析により、腫瘍形成性癌幹細胞の存在について解析した。
【0146】
FZD Fc処理に続いて、ESA+、CD44+、CD24-/low、Lin-の発現に基づいて単離された細胞の腫瘍形成能を評価することができる。FZD Fc処理マウスおよび対照処理マウス由来の、5,000、1,000、500および100個の単離されたESA+、CD44+、CD24-/low、Lin-癌幹細胞を、NOD/SCIDマウスの乳腺脂肪組織へ再皮下注入する。一貫した腫瘍形成に必要な注入細胞数に基づく癌幹細胞の腫瘍形成能を、このように決定する。
【0147】
ある態様では、5〜7週齢の雌rag-2/γ系ダブルノックアウトマウスに、マウス乳腺腫瘍ウイルス(MMTV)-WNT1腫瘍由来の50,000個の細胞を、右上乳腺脂肪組織中へ注入した。遺伝子組換え(MMTV)−Wnt1マウスは、過形成、浸潤性腺管癌腫、および遠隔転移を含む乳房腫瘍形成の個別の段階を示すので、したがってこの乳癌マウスモデルは、腫瘍形成および成長におけるWntの役割を解析するための有用な手段を提供する(Nusse and Varmus (1982) Cell 31:99-109)。これらのマウスからの腫瘍を解離させ、解離された腫瘍細胞を腫瘍を成長させる目的に用いた。乳腺脂肪組織に腫瘍細胞を移植されたマウスを、毎週5回、200ulのPBS (n=10)またはPBSで薄めたFZD8 Fri.Fc可溶性受容体(10mg/kg)で処理した。腫瘍が触診可能になったら、毎週2回腫瘍の大きさを測定した。可溶性受容体FZD8 Fri.Fcによる処理は、PBSによる対照処理と比較して、劇的に腫瘍成長を減少させた(図5)。
【0148】
FZD可溶性受容体の腫瘍成長阻害能力を再び試験するために、50,000個のPE13乳房腫瘍細胞をNOD/SCIDマウスに注入した。細胞注入の1日後に、200ulのPBSで薄められたFZD8 Fri.Fc可溶性受容体を10mg/kgで腹腔内に注入するかまたは200ulのPBSを注入し、毎週5回(実験群当たりn=10)処理を続けた。腫瘍成長を検出するまで毎週モニターし、次に毎週2回腫瘍成長を測定した。FZD8 Fri.Fcによる動物の処理により、乳房腫瘍細胞成長は、PBS注入対照と比較して有意に減少した(図6)。
【0149】
実施例4
FZD Fc可溶性受容体タンパク質を用いる、腫瘍成長のインビボでの処理
この実施例は、異種移植片モデルの腫瘍を処理するための、FZD Fc可溶性受容体の使用について記述する。
【0150】
ある態様では、マトリゲル中のMMTV Wnt1乳房腫瘍由来の50,000個の細胞を、5〜7週齢の雌 rag-2/γ系ダブルノックアウトマウスの皮下へ移植した。19日目に、腫瘍を有するマウスを65mm3の平均腫瘍体積を有するグループに無作為に割り当て、26日目に、FZD8 Fri.FcまたはFZD5 Fri.Fc融合タンパク質による処理を開始した。具体的には、毎週5回、FZD8 Fri.Fc融合タンパク質を、増大濃度で(5mg/kg、10mg/kg、および30mg/kg)投与し、FZD5 Fri.Fcを10mg/kg投与した。対照動物をPBSで処理した。
【0151】
FZD8 Fri.Fc融合タンパク質の用量依存性の抗腫瘍活性が観察された(図7)。最低用量-5mg/kg-のFZD8 Fri.Fcは、PBSで処理したマウスと比較して腫瘍の成長を低下させたが、10mg/kgおよび30mg/kgのFZD8 Fri.Fc処理の措置は、株化前の腫瘍の大きさを低下させるためにより著しく有効であった。対照的に、FZD5 Fri.Fcは、成長にWnt1が必要な株化乳房腫瘍に対しては、抗腫瘍効果を発揮しなかった。
【0152】
実施例5
FZD Fc可溶性受容体タンパク質を用いる、腫瘍のインビボでの処理
この実施例は、異種移植片モデル中の癌を処理するためのFZD Fc可溶性受容体の使用について記述する。
【0153】
マウス中で異種移植片として継代されてきた患者の試料(充実性腫瘍生検または胸水)からの腫瘍細胞を、実験動物へ再継代するために調製する。腫瘍組織を取出し、殺菌された刃を用いて小片へ切断し、完全に刻み、酵素消化および機械的な破壊によって、単細胞懸濁液を得る。次に解離された腫瘍細胞を、乳房腫瘍についてはNOD/SCIDマウスの乳腺脂肪組織へ、また非乳房腫瘍については横腹へ皮下注射して、腫瘍成長を誘発した。または、ESA+、CD44+、CD24-/low、Lin-腫瘍形成性腫瘍細胞を詳細に上述したように単離して、注入した。
【0154】
腫瘍細胞注入に続いて、動物を腫瘍成長についてモニターする。腫瘍がおよそ150〜200mmの平均の大きさに達したら、FZD Fcタンパク質処理を開始する。各動物は、毎週2回〜5回で合計6週間、10mg/kgのFZD Fcまたは対照タンパク質を、腹腔内に投与される。腫瘍の大きさを、この6週間の間、毎週2回評価する。対照の抗体と比較して、さらなる腫瘍成長を防止するかまたは腫瘍の大きさを縮小するFZD Fcの能力を、このようにして決定する。
【0155】
実施例6
FZD Fc可溶性受容体タンパク質を用いるヒト癌の処置
この実施例は、FZD受容体発現が検出されている癌幹細胞および/または腫瘍細胞を含む腫瘍を標的とする、FZD Fc可溶性受容体を用いて癌を処置するための方法について記述する。
【0156】
癌幹細胞マーカー発現の存在を、最初に腫瘍生検から決定することができる。癌と診察された患者の生検から、腫瘍細胞を無菌条件下で取出す。1つの態様では、組織生検を、液体窒素中で新鮮凍結して、O.C.T.に包埋し、クリオスタットで10um切片に切断してスライドガラスに載せる。または、組織生検をホルマリン固定し、パラフィン包埋し、ミクロトームで10umの切片に切断してスライドガラスに載せる。切片をFZD受容体に対する抗体とインキュベーションして、タンパク質発現を検出する。追加して、癌幹細胞の存在を決定することができる。組織生検試料を、殺菌した刃を用いて小片に切断し、完全に刻み、細胞を酵素消化および機械的破壊に供して、単細胞懸濁液を得る。次に、癌幹細胞を検出するために、解離された腫瘍細胞を、抗ESA、抗CD44、抗CD24、抗Lin、および抗FZD抗体とインキュベーションして、ESA+、CD44+、CD24-/low、Lin-、FZD+腫瘍幹細胞の存在を、詳細に上述したように、フローサイトメトリーによって決定する。
【0157】
腫瘍が癌幹細胞を有すると診断された癌患者を、FZD:Fc可溶性受容体で処置する。上述のように生成したヒトFZD Fc融合タンパク質を精製し、PBS中の適当な薬学的担体と共に注入用に製剤する。患者をFZD Fcによって、好ましくは週に1回少なくとも10週間、しかしより好ましくは週に1回少なくとも約14週間、処置する。FZD Fcの各投与は、薬学的に有効な約2〜約100mg/mlまたは約5〜約40mg/mlの用量であるべきである。標準の放射線療法措置、またはオキサリプラチン、フルオロウラシル、ロイコボリンまたはストレプトゾシンなどの1つまたは複数の化学療法剤を用いる化学療法措置の前に、それと同時に、またはその後に、FZD Fcを投与することができる。患者をモニターし、例えば腫瘍退縮、新しい腫瘍発生の減少、腫瘍抗原の発現低下、癌幹細胞の数の減少、または疾病予後を評価する他の手段に基づいて、そのような処置が、抗腫瘍応答に帰着したかどうかを決定する。
【0158】
上記の明細書中に言及した出版物および特許は、参照によりすべて本明細書に組み入れられる。本発明の範囲および精神から外れることなく、記載された本発明の方法およびシステムの様々な修飾および変形が可能なことは、当業者には明白であろう。本発明を特定の態様に関連して記述したが、権利請求する本発明はそのような特定の態様に不当に限定されるべきでないことは当然である。確かに、本発明を実施するための記述された様式の、当業者にとって明白な様々な修飾は、添付の特許請求の範囲内であると考える。
【特許請求の範囲】
【請求項1】
腫瘍細胞の成長を阻害するヒトFZD受容体のFriドメインを含む、可溶性受容体。
【請求項2】
ヒトFZD受容体のFriドメインがヒトFZD4のFriドメインを含む、請求項1記載の可溶性受容体。
【請求項3】
ヒトFZD4のFriドメインが、配列番号:8に示すアミノ酸配列を含む、請求項2記載の可溶性受容体。
【請求項4】
ヒトFZD4のFriドメインが、非FZD受容体タンパク質配列にインフレームで連結されている、請求項2記載の可溶性受容体。
【請求項5】
非FZD受容体タンパク質がヒトFcである、請求項4記載の可溶性受容体。
【請求項6】
ヒトFcが、配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcである、請求項5記載の可溶性受容体。
【請求項7】
配列番号:8に示すアミノ酸配列を含むヒトFZD4のFriドメインをコードする核酸配列;および配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcをコードする核酸配列を含む、可溶性受容体をコードする単離された核酸分子。
【請求項8】
請求項7記載の核酸分子を含むベクター。
【請求項9】
核酸分子が、ベクターで形質転換された宿主細胞によって認識される制御配列に機能的に連結されている、請求項8記載のベクター。
【請求項10】
請求項9記載のベクターを含む、単離された宿主細胞。
【請求項11】
ヒトFZD受容体のFriドメインがヒトFZD5のFriドメインを含む、請求項1記載の可溶性受容体。
【請求項12】
ヒトFZD5のFriドメインが、配列番号:9に示すアミノ酸配列を含む、請求項11記載の可溶性受容体。
【請求項13】
ヒトFZD5のFriドメインが非FZD受容体タンパク質配列にインフレームで連結されている、請求項11記載の可溶性受容体。
【請求項14】
非FZD受容体タンパク質がヒトFcである、請求項13記載の可溶性受容体。
【請求項15】
ヒトFcが、配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcである、請求項14記載の可溶性受容体。
【請求項16】
配列番号:9に示すアミノ酸配列を含むFZD5のFriドメインをコードする核酸配列;および配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcをコードする核酸配列を含む、可溶性FZD受容体をコードする単離された核酸分子。
【請求項17】
請求項16記載の核酸分子を含むベクター。
【請求項18】
核酸分子が、ベクターで形質転換された宿主細胞によって認識される制御配列に機能的に連結されている、請求項17記載のベクター。
【請求項19】
請求項18記載のベクターを含む、単離された宿主細胞。
【請求項20】
ヒトFZD受容体のFriドメインがヒトFZD8のFriドメインを含む、請求項1記載の可溶性受容体。
【請求項21】
ヒトFZD8のFriドメインが配列番号:7に示すアミノ酸配列を含む、請求項20記載の可溶性受容体。
【請求項22】
ヒトFZD8のFriドメインが非FZD受容体タンパク質配列にインフレームで連結されている、請求項20記載の可溶性FZD受容体。
【請求項23】
非FZD受容体タンパク質がヒトFcである、請求項22記載の可溶性受容体。
【請求項24】
ヒトFcが、配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcである、請求項23記載の可溶性受容体。
【請求項25】
配列番号:7に示すアミノ酸配列を含むFZD8のFriドメインをコードする核酸配列;および配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcをコードする核酸配列を含む、可溶性FZD受容体をコードする単離された核酸分子。
【請求項26】
請求項25記載の核酸分子を含むベクター。
【請求項27】
核酸分子が、ベクターで形質転換された宿主細胞によって認識される制御配列に機能的に連結されている、請求項26記載のベクター。
【請求項28】
請求項27記載のベクターを含む、単離された宿主細胞。
【請求項29】
請求項1記載の可溶性受容体を含む薬学的組成物。
【請求項30】
腫瘍細胞成長を阻害するのに有効な量のヒトFZD受容体のFriドメインを含む可溶性受容体を被検体に投与する工程を含む、それを必要とする被検体において癌を処置する方法。
【請求項31】
ヒトFZD受容体のFriドメインが、ヒトFZD4、FZD5、およびFZD8からなる群より選択されるFriドメインを含む、請求項30記載の方法。
【請求項32】
Friドメインが非FZD受容体タンパク質配列にインフレームで連結されている、請求項31記載の方法。
【請求項33】
非FZD受容体タンパク質がヒトFcである、請求項32記載の方法。
【請求項34】
ヒトFcが、配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcである、請求項33記載の方法。
【請求項35】
可溶性受容体を放射線療法と共に投与する、請求項30記載の方法。
【請求項36】
可溶性受容体を化学療法と共に投与する、請求項30記載の方法。
【請求項37】
腫瘍細胞が、乳房腫瘍、結腸直腸腫瘍、肺腫瘍、膵臓腫瘍、前立腺腫瘍、または頭頸部腫瘍に由来する、請求項30記載の方法。
【請求項38】
配列番号:7、8、および9からなる群より選択されるアミノ酸配列をコードするポリヌクレオチド配列から本質的に成る、単離された核酸分子。
【請求項39】
配列番号:7、8、および9からなる群より選択されるアミノ酸配列をコードするポリヌクレオチド配列に対して少なくとも95%の配列同一性を有するポリヌクレオチド配列から本質的に成る、単離された核酸分子。
【請求項40】
配列番号:7、8、および9からなる群より選択されるアミノ酸配列に対して少なくとも95%の配列同一性を有するアミノ酸配列を含む、単離されたポリペプチド。
【請求項41】
請求項1記載の可溶性受容体を含むキット。
【請求項1】
腫瘍細胞の成長を阻害するヒトFZD受容体のFriドメインを含む、可溶性受容体。
【請求項2】
ヒトFZD受容体のFriドメインがヒトFZD4のFriドメインを含む、請求項1記載の可溶性受容体。
【請求項3】
ヒトFZD4のFriドメインが、配列番号:8に示すアミノ酸配列を含む、請求項2記載の可溶性受容体。
【請求項4】
ヒトFZD4のFriドメインが、非FZD受容体タンパク質配列にインフレームで連結されている、請求項2記載の可溶性受容体。
【請求項5】
非FZD受容体タンパク質がヒトFcである、請求項4記載の可溶性受容体。
【請求項6】
ヒトFcが、配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcである、請求項5記載の可溶性受容体。
【請求項7】
配列番号:8に示すアミノ酸配列を含むヒトFZD4のFriドメインをコードする核酸配列;および配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcをコードする核酸配列を含む、可溶性受容体をコードする単離された核酸分子。
【請求項8】
請求項7記載の核酸分子を含むベクター。
【請求項9】
核酸分子が、ベクターで形質転換された宿主細胞によって認識される制御配列に機能的に連結されている、請求項8記載のベクター。
【請求項10】
請求項9記載のベクターを含む、単離された宿主細胞。
【請求項11】
ヒトFZD受容体のFriドメインがヒトFZD5のFriドメインを含む、請求項1記載の可溶性受容体。
【請求項12】
ヒトFZD5のFriドメインが、配列番号:9に示すアミノ酸配列を含む、請求項11記載の可溶性受容体。
【請求項13】
ヒトFZD5のFriドメインが非FZD受容体タンパク質配列にインフレームで連結されている、請求項11記載の可溶性受容体。
【請求項14】
非FZD受容体タンパク質がヒトFcである、請求項13記載の可溶性受容体。
【請求項15】
ヒトFcが、配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcである、請求項14記載の可溶性受容体。
【請求項16】
配列番号:9に示すアミノ酸配列を含むFZD5のFriドメインをコードする核酸配列;および配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcをコードする核酸配列を含む、可溶性FZD受容体をコードする単離された核酸分子。
【請求項17】
請求項16記載の核酸分子を含むベクター。
【請求項18】
核酸分子が、ベクターで形質転換された宿主細胞によって認識される制御配列に機能的に連結されている、請求項17記載のベクター。
【請求項19】
請求項18記載のベクターを含む、単離された宿主細胞。
【請求項20】
ヒトFZD受容体のFriドメインがヒトFZD8のFriドメインを含む、請求項1記載の可溶性受容体。
【請求項21】
ヒトFZD8のFriドメインが配列番号:7に示すアミノ酸配列を含む、請求項20記載の可溶性受容体。
【請求項22】
ヒトFZD8のFriドメインが非FZD受容体タンパク質配列にインフレームで連結されている、請求項20記載の可溶性FZD受容体。
【請求項23】
非FZD受容体タンパク質がヒトFcである、請求項22記載の可溶性受容体。
【請求項24】
ヒトFcが、配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcである、請求項23記載の可溶性受容体。
【請求項25】
配列番号:7に示すアミノ酸配列を含むFZD8のFriドメインをコードする核酸配列;および配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcをコードする核酸配列を含む、可溶性FZD受容体をコードする単離された核酸分子。
【請求項26】
請求項25記載の核酸分子を含むベクター。
【請求項27】
核酸分子が、ベクターで形質転換された宿主細胞によって認識される制御配列に機能的に連結されている、請求項26記載のベクター。
【請求項28】
請求項27記載のベクターを含む、単離された宿主細胞。
【請求項29】
請求項1記載の可溶性受容体を含む薬学的組成物。
【請求項30】
腫瘍細胞成長を阻害するのに有効な量のヒトFZD受容体のFriドメインを含む可溶性受容体を被検体に投与する工程を含む、それを必要とする被検体において癌を処置する方法。
【請求項31】
ヒトFZD受容体のFriドメインが、ヒトFZD4、FZD5、およびFZD8からなる群より選択されるFriドメインを含む、請求項30記載の方法。
【請求項32】
Friドメインが非FZD受容体タンパク質配列にインフレームで連結されている、請求項31記載の方法。
【請求項33】
非FZD受容体タンパク質がヒトFcである、請求項32記載の方法。
【請求項34】
ヒトFcが、配列番号:4に示すアミノ酸配列を含むヒトIgG1 Fcである、請求項33記載の方法。
【請求項35】
可溶性受容体を放射線療法と共に投与する、請求項30記載の方法。
【請求項36】
可溶性受容体を化学療法と共に投与する、請求項30記載の方法。
【請求項37】
腫瘍細胞が、乳房腫瘍、結腸直腸腫瘍、肺腫瘍、膵臓腫瘍、前立腺腫瘍、または頭頸部腫瘍に由来する、請求項30記載の方法。
【請求項38】
配列番号:7、8、および9からなる群より選択されるアミノ酸配列をコードするポリヌクレオチド配列から本質的に成る、単離された核酸分子。
【請求項39】
配列番号:7、8、および9からなる群より選択されるアミノ酸配列をコードするポリヌクレオチド配列に対して少なくとも95%の配列同一性を有するポリヌクレオチド配列から本質的に成る、単離された核酸分子。
【請求項40】
配列番号:7、8、および9からなる群より選択されるアミノ酸配列に対して少なくとも95%の配列同一性を有するアミノ酸配列を含む、単離されたポリペプチド。
【請求項41】
請求項1記載の可溶性受容体を含むキット。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公開番号】特開2013−39127(P2013−39127A)
【公開日】平成25年2月28日(2013.2.28)
【国際特許分類】
【出願番号】特願2012−183807(P2012−183807)
【出願日】平成24年8月23日(2012.8.23)
【分割の表示】特願2008−539171(P2008−539171)の分割
【原出願日】平成18年10月31日(2006.10.31)
【出願人】(308031072)オンコメッド ファーマシューティカルズ インコーポレイテッド (16)
【Fターム(参考)】
【公開日】平成25年2月28日(2013.2.28)
【国際特許分類】
【出願日】平成24年8月23日(2012.8.23)
【分割の表示】特願2008−539171(P2008−539171)の分割
【原出願日】平成18年10月31日(2006.10.31)
【出願人】(308031072)オンコメッド ファーマシューティカルズ インコーポレイテッド (16)
【Fターム(参考)】
[ Back to top ]

