癌患者の術後の予後又は転移可能性を予測するための組成物及び方法
【課題】癌転移関連遺伝子と癌患者の予後又は転移可能性との関係を解明し、予後の予測に利用する。
【解決手段】癌患者の術後の予後又は転移可能性をインビトロで予測する方法であって、患者由来の生物学的検体中の癌転移関連遺伝子マーカーの少なくとも1つの発現レベル又はその転写若しくは翻訳産物レベルを、マーカーに対応するプローブを用いて測定し、術後の予後がより良い又は転移可能性がより低い患者群と術後の予後がより悪い又は転移可能性がより高い患者群との間の相対的な該レベルの差を指標にして、術後の予後又は転移可能性を判定することを含む方法、並びにそのプローブを含む術後の予後又は転移可能性の予測用組成物。
【解決手段】癌患者の術後の予後又は転移可能性をインビトロで予測する方法であって、患者由来の生物学的検体中の癌転移関連遺伝子マーカーの少なくとも1つの発現レベル又はその転写若しくは翻訳産物レベルを、マーカーに対応するプローブを用いて測定し、術後の予後がより良い又は転移可能性がより低い患者群と術後の予後がより悪い又は転移可能性がより高い患者群との間の相対的な該レベルの差を指標にして、術後の予後又は転移可能性を判定することを含む方法、並びにそのプローブを含む術後の予後又は転移可能性の予測用組成物。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物又は方法に関する。
【0002】
本発明はまた、培養癌細胞を用いて癌転移抑制剤をスクリーニングするための方法に関する。
【背景技術】
【0003】
癌は、遺伝子と環境因子が複雑に絡んだ多因子疾患である。化学療法、放射線療法、外科療法、免疫療法などの種々の治療法が実施されているが、癌の発症メカニズムの複雑さゆえに、中期及び末期癌の治療や癌転移の抑制については必ずしも十分な効果が達成されているとはいえない。
【0004】
一方、癌の早期発見と早期治療によって多くの癌患者が完治又は延命していることも事実である。癌の診断には、例えば細胞診、組織診、内視鏡、画像診断、癌マーカーによる生化学的診断などの方法が採用されており、特に早期癌の検出のために多方面からの研究が活発に行われている。
【0005】
癌の治療や再発を妨げる大きな原因の1つが、癌の転移である。癌の運動能と浸潤能のために癌は原発巣から別の組織に遠隔転移し増殖する。この転移メカニズムの全体像は、ほとんど解明されていない。癌が悪性化するにつれて、また癌の摘出に際して、癌は転移し易くなり、その結果癌の再発が起こるため、癌の転移を防ぐことが、癌の早期診断法や有効な治療法の開発とともに、医療現場で重要な課題となっている。
【0006】
現在、いくつかの癌転移関連遺伝子が報告されているが、そのほとんどはディファレンシャル・ディスプレー法によって発見されている。この方法は発現パターンの差異に基づいて目的遺伝子を検出するものであるが、この方法によって見出された遺伝子の多くは、多くの組織や細胞中で共通して一定量発現する遺伝子、いわゆるハウスキーピング遺伝子である。本質的に癌転移に関わる遺伝子を特定することができるならば、癌転移を抑制する薬剤の開発に繋がることが期待される。
【0007】
癌転移抑制剤として、例えばヒトVEGF受容体Flt−1を介する情報伝達を阻害する物質(特許文献1)、細胞接着阻害活性を有するペプチド(特許文献2)、プリンレセプター作働機能を有するプリン系化合物(特許文献3)などが知られている。また、癌の転移に関わる遺伝子の研究から、マトリックス分解酵素や血管内皮増殖因子とその受容体などが転移に関わることが示唆されている。例えば癌転移関連遺伝子として、マウス細胞株から発見された癌転移関連遺伝子が報告されている(特許文献4)。
【0008】
近年、mRNAを標的とした遺伝子抑制技術の癌治療への応用が試みられようとしている。そのような遺伝子抑制技術には、例えばアンチセンス法、リボザイム、RNA干渉(RNAi)などが含まれる(非特許文献1)。特に、RNAiは特異性が高いため、その医療への応用のための基礎研究が急速に進行しており、その標的としてウイルス性疾患、癌、遺伝性疾患などに注目が集まっている(非特許文献2)。
【0009】
【特許文献1】特開2003−261460
【特許文献2】特開平09−143076号公報
【特許文献3】特開平7−082156号公報
【特許文献4】再表98/045431
【非特許文献1】関大輔ら,実験医学22巻14号(増刊),89〜98頁,2004年,羊土社
【非特許文献2】実験医学22巻4号「RNAiのサイエンス」,2004年,羊土社
【発明の開示】
【発明が解決しようとする課題】
【0010】
これまでに、ある特定の遺伝子又はポリペプチドが癌の転移に関連している可能性が提案されてきたが、実験室レベルでは転移に関連していても他の系では転移との関連が確認できなかった、或いは阻害剤を開発して臨床応用しても十分な効果が得られなかった、という多くの事象が存在した。
【0011】
このような状況において、本発明者らは、転移が単一遺伝子によって起こるものではなく、複数の遺伝子群の協調的な相互作用によって起きることに着目し、癌転移関連遺伝子マーカーの同定、並びに該遺伝子マーカーと癌患者の術後の予後又は転移可能性との関係について検討した。
【0012】
本発明の目的は、癌転移関連遺伝子群をマーカーとして癌患者の術後の予後又は転移可能性をインビトロで予測する方法及び組成物を提供することである。
【0013】
本発明の別の目的は、癌転移関連遺伝子又はその転写産物の阻害又は抑制について、癌転移抑制剤をスクリーニングする方法を提供することである。
【課題を解決するための手段】
【0014】
本発明者らが開発した高転移性ヒト肺癌細胞株とその低転移性親株との間で、網羅的遺伝子発現解析を行い、転移性獲得に関わると考えられる両者の間で発現差を示す遺伝子群を同定し、さらに、ヒト癌患者において転移・再発に関わる可能性を、複数の癌腫について異なるマイクロアレイプラットフォームを用いて採取された網羅的遺伝子発現データを用いて検討した。その結果、複数の癌腫において、同定した遺伝子群の発現プロファイルによって癌患者群が2群間に大別され、かつ、その2群間に外科手術後の生存期間(又は、予後)に有意な差異の存在を示すことが判明した。
【0015】
発明の概要
本発明は、要約すると、次のような特徴を有する。
(1)癌患者の術後の予後又は転移可能性をインビトロで予測する方法であって、該患者由来の生物学的検体中の、配列番号1〜45に示される塩基配列又はその変異配列を含む癌転移関連遺伝子マーカーの少なくとも1つの発現レベル又はその転写若しくは翻訳産物レベルを、該マーカーに対応するプローブを用いて測定し、術後の予後がより良い又は転移可能性がより低い患者群と術後の予後がより悪い又は転移可能性がより高い患者群との間の相対的な該レベルの差を指標にして、術後の予後又は転移可能性を判定することを含む、上記方法。
(2)前記癌転移関連遺伝子マーカーが、配列番号28〜45に示される塩基配列又はその変異配列からなるとき、前記患者は、術後の予後がより良い又は転移可能性がより低い患者として識別される、上記(1)に記載の方法。
(3)前記癌転移関連遺伝子マーカーが、配列番号1〜27に示される塩基配列又はその変異配列からなるとき、前記患者は、術後の予後がより悪い又は転移可能性がより高い患者として識別される、上記(1)に記載の方法。
(4)前記プローブが、配列番号1〜45に示される塩基配列からなるポリヌクレオチド、それに相補的なポリヌクレオチド、それらの変異体、それらにストリンジェントな条件下でハイブリダイズするポリヌクレオチド、或いは15以上の連続した塩基を含むそれらの断片からなる群から選択される、上記(1)〜(3)のいずれかに記載の方法。
(5)前記プローブが、配列番号1〜45に示される塩基配列からなるポリヌクレオチド又はその変異体によってコードされるポリペプチドからなる群から選択されるポリペプチド又はその断片に対する抗体又はその断片である、上記(1)〜(3)のいずれかに記載の方法。
【0016】
(6)前記抗体が、ポリクローナル抗体、モノクローナル抗体又はペプチド抗体である、上記(5)に記載の方法。
(7)前記癌が固形癌である、上記(1)〜(6)のいずれかに記載の方法。
(8)前記固形癌が肺癌又は乳癌である、上記(7)に記載の方法。
(9)配列番号1〜45に示される塩基配列からなるポリヌクレオチド、それに相補的なポリヌクレオチド、それらの変異体、それらにストリンジェントな条件下でハイブリダイズするポリヌクレオチド、或いは15以上の連続した塩基を含むそれらの断片からなる群から選択される少なくとも1つのプローブを含む、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物。
(10)配列番号28〜45に示される塩基配列からなるポリヌクレオチド、それに相補的なポリヌクレオチド、それらの変異体、それらにストリンジェントな条件下でハイブリダイズするポリヌクレオチド、或いは15以上の連続した塩基を含むそれらの断片からなる群から選択される少なくとも1つのプローブを含む、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物。
【0017】
(11)配列番号1〜27に示される塩基配列からなるポリヌクレオチド、それに相補的なポリヌクレオチド、それらの変異体、それらにストリンジェントな条件下でハイブリダイズするポリヌクレオチド、或いは15以上の連続した塩基を含むそれらの断片からなる群から選択される少なくとも1つのプローブを含む、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物。
(12)配列番号1〜45に示される塩基配列からなるポリヌクレオチド又はその変異体によってコードされるポリペプチドからなる群から選択されるポリペプチド又はその断片に対する抗体又はその断片からなる群から選択される少なくとも1つのプローブを含む、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物。
(13)配列番号28〜45に示される塩基配列からなるポリヌクレオチド又はその変異体によってコードされるポリペプチドからなる群から選択されるポリペプチド又はその断片に対する抗体又はその断片からなる群から選択される少なくとも1つのプローブを含む、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物。
(14)配列番号1〜27に示される塩基配列からなるポリヌクレオチド又はその変異体によってコードされるポリペプチドからなる群から選択されるポリペプチド又はその断片に対する抗体又はその断片からなる群から選択される少なくとも1つのプローブを含む、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物。
(15)前記プローブがキットの形態で含まれる、上記(9)〜(14)のいずれかに記載の組成物。
【0018】
(16)前記プローブがマイクロアレイの形態で含まれる、上記(9)〜(11)のいずれかに記載の組成物。
(17)培養癌細胞を用いて、配列番号1〜27のいずれかの塩基配列を含む癌転移関連遺伝子又はその転写産物の阻害又は抑制について、或いはヒト培養癌細胞の運動能及び/又は浸潤能の阻害又は抑制について、候補薬剤をスクリーニングすることを含む、癌転移抑制剤のスクリーニング方法。
(18)培養癌細胞を準備し、該細胞を候補薬剤の存在下で培養し、前記癌転移関連遺伝子又はその転写産物の発現の阻害又は抑制について、或いは培養癌細胞の運動能及び/又は浸潤能の阻害又は抑制について、候補薬剤をスクリーニングすることを含む、上記(17)に記載の方法。
【発明の効果】
【0019】
本発明者らは、今回、同定された45種類の癌転移関連遺伝子マーカーが、複数の癌腫において癌患者の術後の予後又は転移可能性を判定しうる上で非常に有用であることを見出した。これらのマーカーを指標とすることによって、癌患者の術後予後及び癌転移の可能性を予測することができるため、患者に対する治療計画の策定、癌に対する治療成績の向上、並びに転移癌による再発の防止と予後の管理のために大いに役立つことが期待できる。さらにまた、培養癌細胞において、上記マーカーを指標として、その発現を調節する薬剤をスクリーニングすることも可能になり、これによって、癌転移を抑制又は防止する薬剤の開発に導くことができる。
【発明を実施するための最良の形態】
【0020】
定義
本明細書中で使用する用語は、以下の意味を含む。
本明細書で使用する「術後予後」は、癌の手術後の患者の予後を、代表的には術後5年時点での生存率で判定することを意味する。予後は、癌の転移と深く関係しており、「予後が悪い」とは、癌の浸潤性、転移性又は進行度が高いことを意味し、一方、「予後が良い」とは、そのような浸潤性、転移性又は進行度が低いことを意味する。
【0021】
本明細書で使用する「転移(metastasis)」は、癌細胞が、その運動能と浸潤能によって、原発巣から遠隔部位の組織に移動し、そこで増殖し新生物を形成する一連の過程をいう。転移は、癌の再発を引き起すため、癌治療の大きな障害となっている。血管又はリンパ管内に浸潤した癌細胞は、種々の組織に居留して多発的に癌疾患を起こすことも知られている。本発明では、本発明の癌転移関連遺伝子マーカーが関わる限りいずれの転移も対象となるが、例えばリンパ節転移も対象としうる。
【0022】
本明細書で使用する「患者」は、ヒト、イヌ、ネコを含む哺乳動物を指し、好ましい哺乳動物はヒトである。
【0023】
本明細書で使用する「生物学的検体」は、哺乳動物(好ましくはヒト)から採取された組織、細胞又は体液を指し、好ましくは癌の組織又は細胞である。本発明においては、癌組織又は細胞において、術後の予後がより良い又は転移可能性がより低い患者群由来のものと、術後の予後がより悪い又は転移可能性がより高い患者群由来のものとの間で、本発明に関わる遺伝子マーカーの発現レベルに相対的な差異が認められる癌であればいずれの癌も対象となりうる。癌には、例えば、肺癌、乳癌、大腸癌、前立腺癌、胃癌、食道癌、肝臓癌、膵臓癌、腎臓癌、子宮体部・頚部癌、卵巣癌、膀胱癌、脳腫瘍、甲状腺癌、リンパ腫、精巣癌、骨肉腫、皮膚癌、黒色腫、血液癌(特に白血病)などが含まれるが、これらに限定されない。
【0024】
本明細書で使用する「癌転移関連遺伝子マーカー」は、高転移性癌細胞株と低転移性癌細胞株との間で、発現レベルに差異のある遺伝子を同定することによって今回見出されたマーカーであり、本発明方法におけるような癌患者の術後予後又は転移可能性の判定等に使用することがきる。
【0025】
本明細書で使用する「変異体」は、例えば突然変異、多型性、選択的スプライシングなどの生物学的事象、遺伝暗号の縮重などに起因して生じる変異体、生物種間のホモログなどを包含する。変異体には、本発明に関わる配列番号1〜45によって示される塩基配列を含む遺伝子、或いは該遺伝子によってコードされるポリペプチド、の配列上に1若しくは複数、好ましくは1若しくは数個、の置換、欠失、付加、挿入などの変異を有する変異体、該配列又はその部分配列と80%以上、85%以上、90%以上、95%以上、98%以上の同一性を有する配列からなる変異体、などが含まれる。ここで、「数個」とは、通常、10個以下の整数を意味する。また、同一性(%)は、ギャップを導入した公知のBLASTやFASTAプラグラムを用いて決定することができる(S. F. Altschulら, J. Mol. Bio. 215:403−410,1990)。一般に、全塩基数に対する一致した塩基数の百分率として同一性(%)を算出できる。
【0026】
本明細書で使用する「ストリンジェントな条件」は、以下のものに限定されないが、少なくとも80%、好ましくは少なくとも95%の同一性を有するヌクレオチド配列が互いにハイブリダイズするようなハイブリダイゼーション及び洗浄条件を意味し、例えばマイクロアレイ解析におけるハイブリダイゼーション及び洗浄条件は、1M塩化ナトリウム/0.5%(W/V)サルコシル/30%ホルムアミド中、60℃、17時間のハイブリダイゼーション、その後、6×SSC/0.005%(W/V)トライトンX−102溶液中、室温、10分間で一回、さらに、0.1×SSC/0.005%(W/V)トライトンX−102溶液中で0〜4℃に保ちながら5分間で一回の洗浄の条件である。ここで、1×SSCは150mM塩化ナトリウムと15mMクエン酸ナトリウム水溶液(pH7.2)である。ハイブリダイゼーションについては、F.M. Ausbelら, Short Protocols in Molecular Biology(3版)A Compendium of Method s from Current Protocols in Molecular Biology, 1995年, John Wiley & Sons, Inc.(米国)に記載されている。
【0027】
詳細な説明
以下において、本発明をさらに詳細に説明する。
1.癌転移関連遺伝子マーカー
本発明のヒト癌転移関連遺伝子マーカーは、次のようにして見出された。
公知の転移性肺癌細胞株NCI−H460(American Type Culture Collection)(親株)をマウスに皮下移植して肺転移を起こさせたのち、肺転移巣からの細胞の継代培養と、転移能に基づくマウスを用いたインビボ選択とによって、高転移癌細胞株LNM35を単離した(図1参照)。一方、NCI−H460細胞から限界希釈法又は脱メチル化剤での処理などによって、さらに低転移性の癌細胞株を得ることができる。LNM35株は、培養細胞又はマウス移植試験において、運動能、浸潤能、リンパ節転移及び肺転移のいずれにおいても、親株又は低転移癌細胞株と比べて非常に高値を示した(図2参照)。
【0028】
高転移癌細胞株LNM35と、親株又は低転移癌細胞株との間で、ジーンフィルターマイクロアレイ(gene filter microarray; Research Genetics社)による遺伝子発現差を調べることによって、配列番号1〜45の塩基配列を含むヒト癌転移関連遺伝子を見出した。データバンク検索の結果、これらの遺伝子は、表1に示すように、Unigene又はGenBankに登録されているが、癌転移との関連性については知られていない。表1及び表2はそれぞれ、高転移性のLNM35株で発現が高い遺伝子マーカー及び発現が低い遺伝子マーカーの配列番号、GenBank受託番号(Accession number)、UniGene ID、遺伝子名(Gene symbol, Gene name)を示す。
【0029】
【表1】

【0030】
【表2】

【0031】
上記のように同定された癌転移関連マーカーは、肺癌だけでなく、乳癌などの固形癌においてもマーカーとなりうる。これまで報告されたマーカーは特定の癌に特異的であったが、本発明のマーカーは種々の癌に共通のマーカーである点で驚くべきことであった。
【0032】
このために、本発明方法の対象となる患者の癌には、例えば、肺癌、乳癌、大腸癌、前立腺癌、胃癌、食道癌、肝臓癌、膵臓癌、腎臓癌、子宮体部・頚部癌、卵巣癌、膀胱癌、脳腫瘍、甲状腺癌、リンパ腫、精巣癌、骨肉腫、皮膚癌、黒色腫などの固形癌が含まれる。さらに可能な癌として、血液癌(特に白血病)なども挙げられる。
【0033】
本発明において、癌転移関連遺伝子マーカーには、配列番号1〜45に示される塩基配列を含む遺伝子だけでなく、その変異体遺伝子も含まれる。通常、そのような変異体は、生体内で例えば突然変異、多型性、選択的スプライシングなどの生物学的事象の結果とし生じた変異体を含む。実際には、該遺伝子マーカーは、転写産物又は翻訳産物として核酸レベル又はタンパク質レベルで検出される。
【0034】
転写産物の場合、それはmRNA、cRNA又はcDNAとして検出される。細胞又は組織からフェノール/クロロホルム法などの方法で全RNAを抽出し、オリゴdTセルロースカラム法によってポリA(+)RNA又はmRNAを調製し、必要により、さらにmRNAからcDNA、cRNAを合成する。
【0035】
翻訳産物の場合、それは上記遺伝子又はその変異体によってコードされるタンパク質又はその断片として検出される。
【0036】
本発明に関わる上記癌関連遺伝子マーカーは、その発現パターンによって、外科手術後の癌患者の予後又は転移可能性の程度に対応して2群に大別される(図3〜図5参照)。
【0037】
具体的には、癌転移関連遺伝子マーカーが、配列番号28〜45に示される塩基配列又はその変異配列からなるとき、患者は、術後の予後がより良い又は転移可能性がより低い患者として識別される。一方、癌転移関連遺伝子マーカーが、配列番号1〜27に示される塩基配列又はその変異配列からなるとき、患者は、術後の予後がより悪い又は転移可能性がより高い患者として識別される。
【0038】
2.予後又は転移可能性を予測するための組成物
本発明は、上記のとおり、癌患者の術後の予後又は転移可能性をインビトロで予測する方法を提供し、この方法は、該患者由来の生物学的検体中の、配列番号1〜45に示される塩基配列又はその変異配列を含む癌転移関連遺伝子マーカーの少なくとも1つの発現レベル又はその転写若しくは翻訳産物レベルを、該マーカーに対応するプローブを用いて測定し、正常又は非癌の対照検体に対する有意なレベル差を指標にして、術後の予後又は転移可能性を予測することを含む。
【0039】
本発明で使用されるプローブは、上記マーカーを検出可能なものであれば特に制限されないが、通常は、ポリヌクレオチド又は抗体である。したがって、このようなポリヌクレオチド又は抗体を含む組成物は、癌患者の術後の予後又は転移可能性を予測するために使用されうる。
【0040】
2.1 ポリヌクレオチドプローブ
具体的には、本発明に関わるポリヌクレオチドプローブは、(i)配列番号1〜45に示される塩基配列からなるポリヌクレオチド、(ii)(i)のポリヌクレオチドに相補的なポリヌクレオチド、(iii)(i)及び(ii)のポリヌクレオチドの変異体、(iv)(i)又は(ii)のポリヌクレオチド或いは(iii)の変異体にストリンジェントな条件下でハイブリダイズするポリヌクレオチド、並びに(v)前記ポリヌクレオチド又は変異体の15以上の連続した塩基を含む断片からなる群から選択される少なくとも1個、好ましくは少なくとも2個、さらに好ましくは3〜45個、例えば4〜45個、5〜45個のプローブを含む。
【0041】
本発明に関わる癌転移関連遺伝子マーカーは、癌患者の予後の状態(生存者の割合)に応じて、次のように2つの群に分けることができる。
【0042】
すなわち、グループ1は、癌患者の術後予後がより悪い場合であり、この群に関与するマーカーは、配列番号1〜27の遺伝子群であり、一方、グループ2は、癌患者の術後予後がより良い場合であり、この群に関与するマーカーは、配列番号28〜45の遺伝子群である。
【0043】
本明細書中で使用する「予後が良い」とは、癌の浸潤性、転移性又は進行度が高いことを意味し、このように判定される癌患者の5年生存者の割合は約70%以上であるのに対して、「予後が悪い」とは、癌の浸潤性、転移性又は進行度が低いことを意味し、癌患者の5年生存者の割合は約50%以下である。
【0044】
本発明においては、それぞれの群に属する遺伝子マーカーのうち少なくとも1個、好ましくは少なくとも2個、さらに好ましくは3個〜全部、例えば4個〜全部、5個〜全部のマーカーについて、対応するプローブを用いて検査する。
グループ1に属するマーカーを検査するためのプローブには、配列番号1〜27に示される塩基配列からなるポリヌクレオチド、それに相補的なポリヌクレオチド、それらの変異体、それらにストリンジェントな条件下でハイブリダイズするポリヌクレオチド、或いは15以上の連続した塩基を含むそれらの断片からなる群から選択されるプローブが含まれる。
【0045】
一方、グループ2に属するマーカーを検査するためのプローブには、配列番号28〜45に示される塩基配列からなるポリヌクレオチド、それに相補的なポリヌクレオチド、それらの変異体、それらにストリンジェントな条件下でハイブリダイズするポリヌクレオチド、或いは15以上の連続した塩基を含むそれらの断片からなる群から選択されるプローブが含まれる。
【0046】
このように、本発明には、これらのグループ1及びグループ2に関わる各プローブ群を含む組成物も包含される。
【0047】
本発明において、プローブとしての変異体は、上記定義のとおり、配列番号1〜45によって示される塩基配列に1若しくは複数、好ましくは1若しくは数個、の置換、欠失、付加、挿入などの変異を有する変異体、該配列と通常80%以上、85%以上、好ましくは90%以上、さらに好ましくは95%以上、98%以上の同一性を有する配列からなる変異体などを含む。
【0048】
さらに、本発明において、ストリンジェントな条件下でハイブリダイズするポリヌクレオチドは、上記定義のようなハイブリダイゼーション条件下で、上記(i)から(iii)のポリヌクレオチド又は変異体にハイブリダイズすることが可能なものであれば、特に制限されないものとする。患者の個体によっては、突然変異、多型性、選択的スプライシングなどの生物学的事象により配列番号1〜45によって示される塩基配列が変化した遺伝子をもつこともありえるために、そのようなポリヌクレオチドは、該遺伝子の検出を可能にする。
【0049】
さらにまた、本発明において、ポリヌクレオチドの断片は、15塩基数〜全塩基数未満のサイズを有する。断片は、この範囲の任意の塩基数、例えば20塩基以上、30塩基以上、50塩基以上、70塩基以上、100塩基以上、150塩基以上、200塩基以上、250塩基以上などの塩基数である。
【0050】
本発明で使用されるポリヌクレオチドプローブは、慣用の化学的DNA合成技術や遺伝子組換え技術によって合成されうる。
【0051】
ポリヌクレオチドが約100塩基以下のDNA分子であれば、ホスホアミダイト法を利用するDNA自動合成装置(例えばApplied Biosystems、米国)を用いて合成することができる。
【0052】
或いは、上記ポリヌクレオチドは、cDNAクローニングによって作製することができる。対象の癌組織から全RNAを取得し、オリゴdTセルロースカラム処理によってポリA(+)RNAを得たのち、逆転写酵素−ポリメラーゼ連鎖反応(RT−PCR)法によってcDNAライブラリーを作製し、このライブラリーから、GenBankやUniGeneなどのデータバンクに登録された配列(表1及び表2)に基づいて予め作製したプローブ(15以上、好ましくは30以上、より好ましくは、50〜100又はそれ以上の塩基長)とのハイブリダイゼーションによりcDNAクローンを得ることができる。取得したクローンは、例えば市販されるような発現ベクターに組み込んだのち大腸菌、枯草菌などの適当な宿主細胞に導入し、宿主細胞を増殖することによって、或いはデータバンクに登録された配列に基づいて予め作製したプライマー(通常15〜30塩基、好ましくは17〜25塩基長)を使用し、かつ前記cDNAクローンを鋳型とするポリメラーゼ連鎖反応(PCR)によって、増幅することができる。cDNAクローニング及びPCR法の具体的手順や試薬等については、市販のキット、装置、試薬を使用することができるし、また、例えばSambrook Jら, Molecular Cloning A Laboratory Manual,1989年, Cold Spring Harbor Laboratory Press(米国);F.M. Ausbelら, Short Protocols in Molecular Biology(3版)A Compendium of Method s from Current Protocols in Molecular Biology, 1995年, John Wiley & Sons, Inc.(米国)などに教示されている。
【0053】
2.2 抗体プローブ
本発明においては、抗体をプローブとして用いてもよい。抗体としては、次のものが挙げられる。
(i)配列番号1〜45に示される塩基配列からなるポリヌクレオチド又はその変異体によってコードされるポリペプチドからなる群から選択されるポリペプチド又はその断片に対する抗体又はその断片、
(ii)配列番号1〜27に示される塩基配列からなるポリヌクレオチド又はその変異体によってコードされるポリペプチドからなる群から選択されるポリペプチド又はその断片に対する抗体又はその断片、並びに、
(iii)配列番号28〜45に示される塩基配列からなるポリヌクレオチド又はその変異体によってコードされるポリペプチドからなる群から選択されるポリペプチド又はその断片に対する抗体又はその断片。
【0054】
したがって、本発明は、上記の(i)、(ii)及び(iii)に記載の抗体又はその断片、好ましくは(ii)及び(iii)の各々から選択される少なくとも1個、好ましくは少なくとも2個、さらに好ましくは3個〜全部、例えば4個〜全部、5個〜全部の抗体又はその断片、を含む組成物も包含する。
【0055】
本発明で使用される抗体は、ポリクローナル抗体、モノクローナル抗体、抗ペプチド抗体などを含む。また、抗体の断片には、Fab、(Fab')2、Fc、Fc'、Fd、Fvなどが含まれる。これらの抗体断片は、例えばパパイン、ペプシンなどのプロテアーゼによる抗体の限定分解によって得ることができる。
【0056】
各遺伝子に対応するポリペプチド又はその断片を、タンパク質合成又は遺伝子組換え技術を用いて合成し、その結果得られたポリペプチド又はその断片を抗原としてウサギ、マウス、ラット、ウマ、ウシ、ヤギ、ヒツジなどの動物を免疫し、それらの抗原に対する抗体を産生し、精製する。
【0057】
ポリクローナル抗体は、前記動物を10〜300μg程度の抗原で皮下に免疫し、さらに約2週間後に追加免疫し、初回免疫から約3週間〜1か月後に採血し、抗血清から目的のポリクローナル抗体を含むIgG成分を硫安分画、イオン交換クロマトグラフィーを使用して分離することを含む方法によって作製することができる。特異性を高めるために、得られたIgGを、目的タンパク質をセルロース又はアガロースなどの担体に結合して作製されたカラムに結合させたのち、高塩濃度のバッファーで溶出し、透析や限外ろ過などの方法で脱塩して、特異的ポリクローナル抗体を得ることができる。抗体価は、通常の免疫測定法、例えば酵素免疫測定法(EIA、ELISA)、放射性免疫測定法(RIA)、蛍光抗体法などによって測定することができる。
【0058】
モノクローナル抗体は、例えば以下の一般的方法によって作製することができる。
標的ポリペプチド又はその断片を、ポリクローナル抗体の作製と同様にマウス又はラット(例えばBalb/cマウス)の皮下に投与し、1〜4週間間隔で、約2〜4回追加免疫を行う。抗体価が頭打ちになったとき、抗原を静脈内または腹腔内に注射し、最終免疫とする。2〜5日後、抗体産生細胞(例えば脾臓細胞又はリンパ節細胞)を採取する。次いで、抗体産生細胞を骨髄腫細胞株(好ましくはヒポキサンチン・グアニン・ホスホリボシル・トランスフェラーゼ(HGPRT)欠損細胞株)に融合させてハイブリドーマ細胞を生成し、HAT(ヒポキサンチン、アミノプテリン、チミン)選択を行う。細胞融合は、血清を含まないDMEM、RPMI−1640培地などの動物細胞培養用培地中で、抗体産生細胞と骨髄腫細胞株とを約1:1〜 20:1の割合で混合し、ポリエチレングリコールなどの細胞融合促進剤の存在下で実施する。目的の抗体かどうかの確認は、上記の免疫測定法によって行うことができる。さらに、ハイブリドーマの増殖のために、マウスの腹腔内にハイブリドーマを約1,000万個投与し、ハイブリドーマを増殖させたのち、1〜2週間後に腹水を採取する。抗体の精製は、硫安分画、イオン交換クロマトグラフィー、アフィニティクロマトグラフィー、ゲルクロマトグラフィーなどの方法を適宜組み合わせて行うことができる。
【0059】
抗ペプチド抗体は、タンパク質の表面上のリニアーなペプチドに対する抗体であり、免疫学的特異性を高めることができる。そのようなペプチドは、例えばKyte−Doolittleらの親水性−疎水性領域の推定法、Eminiらによるタンパク質分子上の特定ペプチド部位の表面に位置する確率、ポリペプチド鎖の折れ曲がり程度、例えばChou−Fasmanらなどのαヘリックス、βシート、ターンを表示するタンパク質の二次構造予測、等を単独で又は組み合わせて使用して推定しうる。次いで、推定されたペプチドは、ペプチド合成機を用いて合成することができる。
【0060】
ここで、標的ポリペプチド(上記表1及び表2に示される遺伝子によってコードされる)の合成は、cDNAクローンを発現ベクターに組み込み、該ベクターによって形質転換又はトランスフェクションされた原核又は真核宿主細胞を培養することによって該細胞又は培養上清から得ることができる。発現ベクターは市販のものを使用することができる。宿主細胞は、細菌などの原核細胞(例えば大腸菌、枯草菌、シュウドモナス属細菌など)、酵母(例えばサッカロマイセス属、ピチア属など)、昆虫細胞(例えばSf細胞)、哺乳動物細胞(例えばCHO、COS、BHK、HEK293など)などを含む。また、ベクターは、プラスミド、コスミド、ファージなどからなり、標的ポリペプチドをコードするDNA、プロモーター、必要ならエンハンサー、ポリアデニル化シグナル、リボソーム結合部位、複製開始点、ターミネーター、選択マーカーなどを含むことができる。ポリペプチドの精製を容易にするために、標識ペプチド、例えば6〜10残基のヒスチジンタグ、FLAG、GFPポリペプチドなどをコードするDNA配列を含有させることもできる。遺伝子組換え技術については、Sambrookら(上記)、Ausbelら(上記)に記載されており、それらに記載の技術を本発明のために使用することができる。
【0061】
上記のようにして得られた標的ポリペプチドは、ゲルろ過、イオン交換クロマトグラフィー、アフィニティクロマトグラフィー、疎水性クロマトグラフィー、等電点電気泳動、電気泳動、限外ろ過、塩析、透析などを適宜組み合わせて精製することができる。
【0062】
標的ポリペプチド又はその断片の配列は、上記表1及び表2に記載されるGenBank又はUniGene登録番号に基づいてNCBI HomePageにアクセスすることによって入手可能である。
【0063】
本発明の実施形態により、前記組成物は、キット又はマイクロアレイの形態であってもよく、すなわち、前記プローブは、キット又はマイクロアレイの形態で含まれる。
【0064】
キットの場合、2つのグループの各遺伝子マーカー(表1及び表2)の1又は2以上から全数のマーカーを検出することが可能なポリヌクレオチド又は抗体を、個別に又は2以上を組み合わせて適当な容器に包装することができる。
【0065】
抗体は、上記の方法で作製されるようなポリクローナル抗体、モノクローナル抗体、抗ペプチド抗体などであるが、それらに限定されないものとする。抗体の種類は、いずれのタイプ、クラス、サブクラスでもよく、例えばIgG、IgM、IgE、IgD、IgA、IgG1、IgG2、IgG3、IgG4、IgA1、IgA2などを含む。また、抗体の断片は、Fab、(Fab')2、Fc、Fd、Fvなどを含む。
【0066】
キットにはさらに、ハイブリダイゼーションを行うための試薬類、例えばバッファー、逆転写酵素、標識二次抗体などを含有させてもよい。
【0067】
マイクロアレイの場合、アレイは、DNAマイクロアレイ(DNAチップともいう)、組織アレイ又はタンパク質マイクロアレイである。
【0068】
これらのマイクロアレイにはそれぞれ、プローブとしての上記のポリヌクレオチド或いは上記の抗体又はその断片が結合される。すなわち、アレイの表面に、上記遺伝子マーカー又は転写若しくは翻訳産物を検出することができる、遺伝子マーカー又はその変異体とハイブリダイズすることが可能なポリヌクレオチド、或いはそれらの遺伝子によってコードされるポリペプチド、又はその変異体若しくは誘導体と特異的に結合反応することができる抗体又はその断片が、プローブとして結合される。
【0069】
アレイの基板としては、ガラス又は樹脂(ポリマー)が通常使用され、その表面に例えばポリL−リジン、シラン又は高密度化アミノ基が導入される。また、基板上へのポリヌクレオチド又は抗体の結合は、スポット法又はインクジェット法によって行われる。
【0070】
変異体は、上記遺伝子又はポリペプチドの完全又は部分配列と、ヌクレオチド又はアミノ酸レベルで通常80%以上、85%以上、好ましくは90%以上、さらに好ましくは95%以上、98%以上の同一性を有するものである。
【0071】
ポリペプチドの誘導体は、例えば、グリコシル化、リン酸化、硫酸化、アルキル化、アシル化などの化学修飾誘導体を含む。
【0072】
3.予後又は転移可能性を予測する方法
本発明の方法は、癌患者の術後の予後又は転移可能性をインビトロで予測する方法であって、該患者由来の生物学的検体中の、配列番号1〜45に示される塩基配列又はその変異配列を含む癌転移関連遺伝子マーカーの少なくとも1つの発現レベル又はその転写若しくは翻訳産物レベルを、該マーカーに対応するプローブを用いて測定し、術後の予後がより良い又は転移可能性がより低い患者群と術後の予後がより悪い又は転移可能性がより高い患者群との間の相対的な該レベルの差を指標にして、術後の予後又は転移可能性を判定することを含む。
【0073】
ここで、発現レベルは、生物学的検体中の上記遺伝子の発現について、転写又は翻訳産物レベルで、術後の予後がより良い又は転移可能性がより低い患者群からの検体と、術後の予後がより悪い又は転移可能性がより高い患者群からの検体との間で該遺伝子の発現を比較したときの該遺伝子の発現の差異を意味する。
【0074】
発現レベルの差を示す上記遺伝子を同定することによって、癌患者の術後の予後又は転移可能性をインビトロで予測することができる。
【0075】
本発明によれば、遺伝子の発現レベルの差は、マーカーとしての該遺伝子又はそれに対応するポリペプチドの存在又は量を測定することによって行うことができる。したがって、単に2つの群に分類される各マーカーの存在を測定するだけで、癌患者の術後の予後又は転移可能性をインビトロで予測することができる。
【0076】
生物学的検体は、癌患者の組織又細胞を含み、手術によって切除された癌組織、生検によって得られた組織又は細胞などである。
以下に、これらの2つの異なる方法について具体的に説明する。
【0077】
3.1 ポリヌクレオチドによる方法
本発明に関わる45個の遺伝子マーカーを検出するために、それらの各マーカーとハイブリダイズする上記ポリヌクレオチドを使用する。検出すべき遺伝子の数は、グループ毎に1又は2以上であり、好ましくは2以上、より好ましくは3から全数、例えば4から全数、5以上から全数である。検出すべき遺伝子の数が多いほど、予測の確度が向上する。
【0078】
ハイブリダイゼーションは、マイクロアレイ法、ブロット法、例えばノーザンもしくはサザンブロット、ノーザンもしくはサザンハイブリダイゼーション法、in situeハイブリダイゼーション法、定量RT−PCR法などの方法で実施することができる。好ましいハイブリダイゼーション法は、マイクロアレイ、定量RT−PCR又はブロット法である。また、好ましいマイクロアレイの例は、DNAマイクロアレイ及びタンパク質マイクロアレイである。
【0079】
DNAマイクロアレイ法では、上記の2つのグループの各遺伝子群(1〜全数)とハイブリダイズする核酸プローブを基板に結合したDNAマイクロアレイを作製し使用する。
【0080】
DNAマイクロアレイは、核酸プローブを固相化できるものであればいずれの種類の基板も使用できる。固相には、例えばガラス、ポリマーなどが含まれ、さらに核酸を共有結合するための反応性基を含むスペーサーやクロスリンカーを導入することができる。このようなチップは市販されているため、それらを使用することが望ましい。
【0081】
核酸プローブの固相化は、特に制限はないが、一般的な方法、例えばスポッター又はアレイヤーと呼ばれる高密度分注機を用いてDNAをスポットする方法、ノズルから液滴を噴射するインクジェット方式などの方法を用いて実施することができる。
【0082】
生物学的検体中のDNA又はRNA、それから誘導されたcDNA、cRNAなどの核酸を、Cy染料(Cr3又はCy5)などの蛍光物質で標識した核酸を、DNAマイクロアレイ上のプローブとハイブリダイズさせる。レーザースキャンによる読み取り装置を用いて蛍光強度を読み取り、コンピュータでデータを解析する。
【0083】
ブロット法では、本発明の核酸プローブを放射性同位元素(例えば、32P及び35S)や蛍光物質(ローダミン誘導体、Cy染料など)などで標識したのち、ナイロンなどのポリマーメンブレンに転写した生物学的試料中のDNA又はRNA、それから誘導されたcDNA、cRNAなどの核酸との間でハイブリダイゼーションを行う。シグナルを、放射線検出器又は蛍光検出器を用いて検出し、その強度を測定する。
【0084】
定量RT―PCR法では、生物学的検体中のRNAから作製したcDNAを鋳型として標的の各遺伝子の領域が増幅できるように、プライマーをcDNAとアニーリングさせPCRを行い、得られた二本鎖DNAを検出する。プライマーを予め放射性同位元素や蛍光物質で標識しておくか、或いは、PCR産物をアガロースゲルで電気泳動し、エチジウムブロマイドなどで二本鎖DNAを染色するなどの方法で、標的遺伝子を検出、定量することができる。
【0085】
PCR条件は、例えば変性:92〜94℃で30〜60秒;アニーリング:50〜55℃で30〜60秒;伸長:68〜72℃で30〜60秒を1サイクルとして30〜40サイクルの反応を含む。逆転写酵素は、市販の酵素、例えばSuperScript(登録商標)III(Invitrogen、米国)、AMV Reverse Transcriptase (Promega、米国)、M−MLV(RNaseH−)(宝酒造、京都)などを使用することができる。
【0086】
本発明において、ハイブリダイゼーションは、DNA−DNAハイブリダイゼーション、DNA−RNAハイブリダイゼーション、RNA−RNAハイブリダイゼーションのいずれでもよい。
【0087】
ハイブリダイゼーションは、通常、ストリンジェントな条件下で行われる。このような条件は、例えば、1M塩化ナトリウム/0.5%(W/V)サルコシル/30%ホルムアミド中、60℃、17時間のハイブリダイゼーション、その後、6×SSC/0.005%(W/V)トライトンX−102溶液中、室温、10分間で一回、さらに、0.1×SSC/0.005%(W/V)トライトンX−102溶液中で0〜4℃に保ちながら5分間で一回の洗浄を含む。或いは、別のハイブリダイゼーション条件は、例えば、約45〜50℃で2〜6×SSC中でのハイブリダイゼーションと、それに続く、約50〜65℃での0.2〜2×SSC/0.1〜1%SDSによる洗浄;或いは、60〜65℃で6×SSC、Denhardt溶液、0.2%SDS中でのハイブリダイゼーションののち、60〜65℃での0.2×SSC、0.1%SDSによる洗浄を含む。ハイブリダイゼーションの条件及び方法については、例えば、Ausubelら, Curent Protocols in Molecular Biology, 1989, John Wiley and Sons, US)を参照することができる。
【0088】
3.2 抗体による方法
上記遺伝子の発現レベルの代替的測定法は、免疫学的方法である。
上記のように作製された抗体を、生物学的検体中の標的ポリペプチド又はその断片の検出のために使用することができる。
【0089】
多数の抗体をマイクロアレイ基板上に結合したタンパク質マイクロアレイを作製することによって、或いは、多数の抗体をPVDF膜などのフィルター上にドット状にスポットすることによって、一度に多数の標的ポリペプチドを検出又は定量することが可能になる。或いは、慣用の免疫学的測定法、例えば酵素免疫測定法(ELISA、EIA)、蛍光抗体法、放射性免疫測定法(RIA)、発光免疫測定法、免疫比濁法、ラテックス凝集反応、ラテックス比濁法、赤血球凝集反応、粒子凝集反応またはウェスタンブロット法などによって、生物学的試料中の標的ポリペプチド又はその断片を検出又は定量することができる。
【0090】
固相上で反応を行うときには、固相担体として、ポリスチレン、ポリカーボネート、ポリエチレンなどのポリマーの膜(フィルター)、プレート、チューブ、ストリップなど、ラテックス、磁性体などの粒子、などが含まれる。固相化は、物理的に或いは化学的に行うことができる。化学的結合のためには、例えばマレイル化試薬、臭化シアンなどの試薬で固相を処理し、タンパク質のアミノ基などと反応する官能基を固相に導入することができる。
【0091】
標的の検出のために、抗体を標識してもよいし、或いは標識二次抗体を使用してもよい。標識としては、西洋ワサビペルオキシダーゼ、アルカリホスファターゼなどの酵素、フルオレセイン、ローダミン、それらの誘導体などの蛍光物質、ルシフェラーゼ系、ルミノール系などの発光物質、32P、125I、35Sなどの放射性同位元素などが含まれる。標識化は、例えばグルタルアルデヒド法、マレイミド法、ピリジルジスルフィド法、クロラミンT法、ボルトンハンター法などを含む。
【0092】
4.癌転移抑制剤のスクリーニング
本発明はさらに、培養癌細胞を用いて、配列番号1〜27のいずれかの塩基配列を含む癌転移関連遺伝子又はその転写産物の阻害又は抑制について、或いは培養癌細胞の運動能及び/又は浸潤能の阻害又は抑制について、候補薬剤をスクリーニングすることを含む、癌転移抑制剤のスクリーニング方法を提供する。
【0093】
具体的には、この方法は、培養癌細胞を準備し、該細胞を候補薬剤の存在下で培養し、前記癌転移関連遺伝子又はその転写産物の発現の阻害又は抑制について、或いは培養癌細胞の運動能及び/又は浸潤能の阻害又は抑制について、候補薬剤をスクリーニングすることを含む。
【0094】
ヒト培養癌細胞、好ましくはヒト培養転移性癌細胞、の細胞株は、癌の種類によって特に制限されないものとし、例えば公知の転移性ヒト癌細胞株である、MeWo;悪性黒色腫細胞株、MDA−MB−435;乳癌細胞株、LNCaP又はPC−3;高転移性ヒト肺癌細胞株、LNM35;前立腺癌細胞株などが含まれ、本発明において使用できる。
【0095】
本発明において、前記ヒト癌転移関連遺伝子又はその転写産物の発現の阻害又は抑制の程度は、候補薬剤を添加しない対照との比較実験によって判定できる。発現レベルは、癌細胞株から周知の方法(例えばフェノール/クロロホルム抽出及びエタノール沈殿、オリゴdTセルロースカラムクロマトグラフィーなど)で得た全RNA又はmRNA又はポリA(+)RNAについて、或いは逆転写酵素−PCR(RT−PCR)法によってRNAから合成されたcDNAについて、蛍光又は放射性標識したプローブを用いるハイブリダイゼーション法(例えばノーザンハイブリダイゼーション、サザンハイブリダイゼーション、DNAマイクロアレイ、組織マイクロアレイなど)によって決定することができる。或いは、発現レベルは、上記ヒト癌転移関連遺伝子によってコードされるポリペプチドの細胞内レベルを、該ポリペプチドに対する抗体又はその断片を用いる免疫測定法、ウエスタンハイブリダイゼーションなどによって測定することによって間接的に決定することができる。
【0096】
前記プローブは、配列番号1〜45の塩基配列又はそれと相補的な配列、或いはその連続する例えば約20以上、約30以上、50以上、70以上、100以上、150以上、200以上、250以上のヌクレオチドからなる配列、を有するDNAである。プローブは、蛍光又は放射性標識を結合した標識プローブとするのが好ましい。蛍光性標識には、例えばフルオレサミン、ローダミン、それらの誘導体、Cy3、Cy5などが含まれる、放射性標識には、例えば放射性リン又はイオウ原子が含まれる。
【0097】
免疫測定法は、抗原−抗体反応を利用する分析法であり、例えば酵素結合抗体法(例えばELISA)、蛍光抗体法、固相法、均一法、サンドイッチ法などを適宜組み合わせた方法によって行うことができる。これらの方法は、当業界で周知であり、その慣用技術を本発明で使用できる。
【0098】
ヒト培養(転移性)癌細胞において、前記ヒト癌転移関連遺伝子又は対応するmRNAの発現が、候補薬剤の存在によって、候補薬剤無添加の対照と比べて、有意に阻害又は抑制される場合、該候補薬剤は癌転移抑制剤として同定しうる。
【0099】
候補薬剤のスクリーニングはまた、ヒト培養癌細胞、好ましくは転移性癌細胞、の運動能及び/又は浸潤能の阻害又は抑制を調べることによっても見出すことができる。
【0100】
癌細胞のインビトロにおける運動能アッセイあるいは浸潤能アッセイは、例えばトランスウェルチャンバー培養システムを用いて行うことができる。運動能アッセイにおいては、例えば24ウェル細胞培養プレートに径8ミクロンの小孔を有するテレフタル酸ポリエチレン膜を有するインサート(ベクトンディキンソン社製)を挿入し、インサート内部の無血清細胞培地に転移性癌細胞株を接種し、24時間培養した後、小孔を通過し膜下層に移動した細胞数をカウントすることによって行うことができる(Kozaki Kら, Cancer Research 60:2535−40,2000)。浸潤能アッセイでは、同様のシステムを使用するが、細胞を接種する以前に膜上部をマトリゲルによって覆っておくことにより、計測することができる(Kozaki Kら,Cancer Research 60:2535−40,2000)。
【0101】
上記のアッセイにおいて、無血清細胞培地に候補薬剤を添加しておくことにより、転移性癌細胞の運動能及び/又は浸潤能を阻害又は抑制する候補物質が、癌転移抑制剤として同定しうる。
【0102】
候補薬剤は、小分子、ペプチド、ポリペプチド、タンパク質、ヌクレオシド、オリゴヌクレオチド、ポリヌクレオチド、核酸(DNA又はRNA)などを含むが、これらに限定されない。
【0103】
候補薬剤としてのポリペプチド又はタンパク質には、例えば配列番号1〜27に示される塩基配列又はその変異配列によってコードされるポリペプチド又はタンパク質に対する抗体又はその断片が含まれる。また、核酸には、配列番号1〜27に示される塩基配列又はその変異配列に対応するmRNAを切断することが可能なリボザイム、siRNA(small interfering RNA)などが含まれる。
【0104】
siRNAの配列を選択するために、例えば標的mRNAの標的サイトの選択のための公知の知識、例えば、(a)GC含量が約30〜約70%、好ましくは約50%である、(b)すべてのヌクレオチドが均等であり、またGが連続していない、(c)アンチセンス鎖の5'末端のヌクレオチドがA、Uである、などの基準を使用することができる(D.M. Dykxhoornら,Nature Rev. Mol. Cell Biol. (2003),77:7174−7181;A. Khvorovaら,Cell (2003),115:209−216)。
【0105】
また、候補薬剤としてのリボザイムは、触媒活性をもつRNAであり、本発明に関わる標的ヒト癌転移関連遺伝子に対応するmRNAを切断する活性を有している。この切断によって該遺伝子の発現が阻害又は抑制される。リボザイムの切断可能な標的配列は、一般にはNUX(N=A,G,C,U;X=A,C,U)、例えばGUCトリプレットを含む配列であることが知られている。本発明における標的ヒト癌転移関連遺伝子の配列番号1〜27の塩基配列によってコードされる対応のmRNA配列には、上記の候補トリプレットが存在しているため、候補トリプレットを含む切断すべきmRNA配列部分に相補的な配列を含むリボザイムは、標的mRNAの切断のために使用することができる。このようなリボザイムには、ハンマーヘッド型リボザイムが含まれる。ハンマーヘッド型リボザイムは、センサー部位を構成するヌクレオチド配列、センサー部位にRNAが結合したときのみ安定にMg2+イオンを捕捉する空洞を形成しうる領域を含むヌクレオチド配列、及び標的RNAの切断部位周辺の配列に相補的である領域を含むヌクレオチド配列を含むことができる。
【0106】
本発明を以下の実施例によってさらに具体的に説明するが、本発明はそれらの実施例によって制限されないものとする。
【実施例1】
【0107】
(高転移ヒト肺癌細胞株(LNM35)の樹立)
NCI−H460細胞(American Type Culture Collectionから入手)(親株)1×107細胞/100μl(RPMI 1640細胞培地)を、SCIDマウス(静岡実験動物研究所より購入)に皮下移植した。移植して45日後に、癌細胞の肺転移を確認し、さらに肺転移巣からの癌細胞を別のマウスの皮下に移植し、肺転移巣からの癌細胞を、培養培地(10%ウシ血清添加RPMI 1640)中で初代培養を行った。この細胞を、別のマウスの皮下に移植し、同様に、肺転移巣からの癌細胞を培養した。さらに、2度のin vivo selection後の細胞をマウスの皮下に移植し、腋窩リンパ節からの癌細胞を培養培地(10%ウシ血清添加RPMI 1640)中で初代培養を行った。引き続いて96ウェルプレートを用いた限界希釈法により、クローニングを行い、高転移株のNCI−H460−LNM35を得た(図1)。
【0108】
これとは別に、親株であるNCI−H460細胞から限界希釈法により低転移株(N15)を得ることができた。さらまた、LNM35株を、上記と同じ培養培地中、脱メチル化剤(5−アザ−2'−デオキシシチジン)(1μMで24時間)で処理することにより、低転移株(L2D2及びL2D3A)を得ることができた。
【0109】
上記の手順で得たLNM35株及び親株について、細胞の運動能アッセイ及び浸潤能アッセイによる転移能、並びにマウスへの皮下移植による腋窩のリンパ節及び肺への転移能の強さを調べた。
【0110】
運動能アッセイは、8μmの微小孔をもつフィルターのトランスウェルチャンバーを用いて、24時間の培養後に、フィルター裏側へ移動した細胞数をカウントする手順で行った。
【0111】
浸潤能アッセイは、8μmの微小孔をもつフィルターにマトリゲルをコートしたトランスウェルチャンバーを用いて、24時間の培養後に、フィルター裏側へ移動した細胞数をカウントする手順で行った。
リンパ節及び肺への転移はそれぞれ、重量及び腫瘤の数によって判定した。
【0112】
その結果、図2に示すように、LNM35株は、運動能、浸潤能がともに最も高値を示し、またリンパ節及び肺への転移も高値を示したことから、高転移癌細胞株であることを確認した。一方、親株はいずれも、非常に低い運動能、浸潤能、リンパ節転移、肺転移を示したことから、低転移癌細胞株であることを確認した。
【実施例2】
【0113】
(新規の癌転移関連遺伝子の検出)
GeneFilter Human Microarrays Release IとRelease II(登録商標)マイクロアレイ(Invitrogen社製)を用いて、高転移性株LNM35株と親株N15株との間で遺伝子発現差を示す特定の遺伝子の検出について検討した。
【0114】
具体的に、このマイクロアレイでは、5μgの全RNAを鋳型とし、オリゴ-dTプライマーとSuperScriptII逆転写酵素を用いて、100μCiの[33P]dCTP存在下で逆転写し、Invitrogen社製のcDNAマイクロアレイ(GeneFilter Human Microarrays Release IとRelease II)とハイブリダイズさせた。2M of urea, 0.1 % of SDS, 50mM of Na phosphate buffer (pH 7.0), 150mM of NaCl, 1mM of MgCl2と0.2% AlkPhos DIRECT blocking reagent (Amersham Bioscience社製)による洗浄を行った後、マイクロアレイをイメージングプレート(富士写真フィルム社製)と2時間接触させ、BAS5000(富士写真フィルム社製)を用いてイメージングプレートをスキャンする事で、8,644個の遺伝子に相当する全11,168スポットの発現プロファイルを2回取得した。
【0115】
(バイオインフォマティクス解析)
LNM35とN15それぞれ2回、計4回の発現プロファイルに於いて、発現量(スキャンしたスポットの値)が0.1以下のスポットについては、検出限界のため、解析対象から除外した。
【0116】
非線形補正手法であるlowess手法を用いて、4回の発現プロファイルをnormalizeした後、LNM35とN15のそれぞれについて、平均値を求めた。
【0117】
LNM35とN15の発現プロファイルを比較し、2SD(標準偏差の2倍)以上発現差があるスポットを抽出した。
【0118】
さらに、抽出したスポットを対象に、LNM35で発現が亢進しているスポットでは、LNM35の2回の発現プロファイルの発現値が共に1.0より大きい、またN15で発現が亢進しているスポットでは、N15の2回の発現プロファイルの発現値が共に1.0より大きい、という条件に合致するスポットを検索したところ、45個の遺伝子に相当するスポットが抽出された。
【実施例3】
【0119】
(患者症例)
50の肺癌患者症例を、愛知県がんセンターの胸部外科(名古屋)で治癒的切除術を行い成功した患者のファイルから得た。すべての腫瘍標本をOCT化合物に包埋し、正規の検討部門からの必要な承認と患者からのインフォームドコンセントの書面を得たあとで−80℃に保存した。
【0120】
(発現プロファイルの取得)
腫瘍標本の凍結組織から、約7μm厚に約50切片を削りだした。10切片毎にギムザ染色し、病理医の指導のもと、腫瘍組織が大半を占める領域からRNeasyキット(Qiagen社、米国)を用いて全RNAを抽出した。オリゴ-dTプライマーとSuperScriptII逆転写酵素を用いて、100μCiの[33P]dCTP存在下で約5μgの全RNAを逆転写した。Invitrogen社製のcDNAマイクロアレイ(GeneFilter Human Microarrays Release IとRelease II)とハイブリダイズさせた後、マイクロアレイをイメージングプレート(富士フィルム社製)と2時間接触させ、BAS5000(富士フィルム社製)を用いてイメージングプレートをスキャンすることで、8,644個の遺伝子に相当する全11,168スポットの発現プロファイルを2回取得した。
【0121】
(バイオインフォマティクス解析)
rank-invariant手法をもちいて取得した発現プロファイルを補正した後、2回の平均値から発現値を求めた。
【0122】
(45個の転移関連遺伝子の発現パターンと再発・死亡の関係)
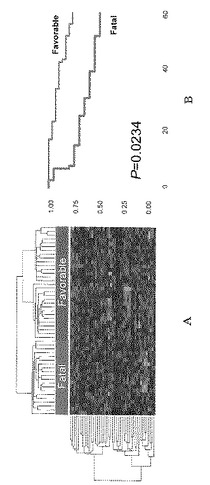
LNM35とN15の比較から抽出した45遺伝子の類似性をもとに、愛知県がんセンターで肺癌の手術を受けた50症例の肺癌患者のデータをクラスター解析した(図3A)。
【0123】
図中に赤色もしくは緑色で示されたドットは、個々の症例における各遺伝子の発現状態を示している。赤色はその遺伝子の発現が他の症例と比較して相対的に高いことを示しており、緑色はその遺伝子の発現が相対的に低いことを示している。また、図中の樹形図は類似性を示しており、類似度が高ければ樹形図の結びつきを示す枝は短く、類似度が低ければ樹形図の結びつきを示す枝は長くなる。類似度が高い症例から順に結び付け、最終的には1つの樹形図としてまとめられている。
【0124】
50症例の肺癌検体について、クラスタリング解析を行ったところ、左右2つの大群に分類された。左側の一群は発現が高い(赤いドットの)遺伝子の多くが、LNM35で発現が亢進している遺伝子であった。一方、右側の一群では、発現が高い遺伝子の多くが、LNM35で発現が抑制されている遺伝子であった。ここで、左側の一群をFatal群、右側の一群をFavorable群として、この2群の予後についてカプランマイヤー生存率解析を行ったところ、有意差をもって(P=0.0234)予後の差が検出された(図3B)。この結果、LNM35で発現が亢進している遺伝子群の発現が相対的に高い群(Fatal群)の予後は悪く、LNM35で発現が抑制されている遺伝子群の発現が相対的に高い群(Favorable群)の予後は良い、ということがヒト肺癌症例のデータを用いて、確認することができた。
【0125】
Harvard大で取得された62症例の肺癌患者のデータを用いて、クラスター解析した結果を図4Aに示した。
【0126】
他施設で得られたデータを解析し、図3と同様の結果が得られるか検討した。Harvard大のデータは我々のデータ取得手法とは異なる為、45個の遺伝子中、38個の遺伝子に関する発現情報のみ得る事が出来た。この38個の遺伝子の発現情報を用いて、図3と同様の解析を行った。
【0127】
62症例の肺癌検体について、クラスタリング解析を行った所、左右2つの大群に分類された。右側の一群は発現が高い(赤いドットの)遺伝子の多くが、LNM35で発現が亢進している遺伝子であった。一方、左側の一群では、発現が高い遺伝子の多くが、LNM35で発現が抑制されている遺伝子であった。ここで、右側の一群をFatal群、左側の一群をFavorable群として、この2群の予後についてカプランマイヤー生存率解析を行ったところ、有意差をもって(P=0.0385)予後の差が検出された(図4B)。この結果、LNM35で発現が亢進している遺伝子群の発現が相対的に高い群(Fatal群)の予後は悪く、LNM35で発現が抑制されている遺伝子群の発現が相対的に高い群(Favorable群)の予後は良い、ということがハーバード大で取得されたヒト肺癌症例のデータを用いても、確認することができた。
【0128】
オランダ国立癌研究所で取得された79症例の乳癌患者のデータを用いて、クラスター解析した結果を図5Aに示した。
【0129】
他施設で得られたデータを解析し、肺癌以外の固形癌で、図3と同様の結果が得られるか検討した。オランダ国立癌研究所のデータは我々のデータ取得手法とは異なる為、45個の遺伝子中、37個の遺伝子に関する発現情報のみ得ることが出来た。この37個の遺伝子の発現情報を用いて、図3と同様の解析を行った。
【0130】
79症例の乳癌検体について、クラスタリング解析を行った所、左右2つの大群に分類された。左側の一群は発現が高い(赤いドットの)遺伝子の多くが、LNM35で発現が亢進している遺伝子であった。一方、右側の一群では、発現が高い遺伝子の多くが、LNM35で発現が抑制されている遺伝子であった。ここで、左側の一群をFatal群、右側の一群をFavorable群として、この2群の予後についてカプランマイヤー生存率解析を行ったところ、有意差をもって(P=0.0032)予後の差が検出された(図5B)。この結果、LNM35で発現が亢進している遺伝子群の発現が相対的に高い群(Fatal群)の予後は悪く、LNM35で発現が抑制されている遺伝子群の発現が相対的に高い群(Favorable群)の予後は良い、ということがオランダ国立癌研究所で取得されたヒト乳癌症例のデータを用いても、確認することができた。
【0131】
(Cox比例ハザードモデルによる多変量解析)
LNM35とN15の比較から抽出した45遺伝子による予後指標の検討を行った(図6)。
【0132】
45遺伝子による術後予後の指標が、術後の予後因子として有効であるかどうかについて、COXの比例ハザードモデルによる、年齢(63歳以上/63歳未満)、性別(男性/女性)、喫煙歴(喫煙歴なし/あり)、組織型(扁平上皮癌/非扁平上皮癌)、病期(pSTAGE)、転移シグネチャー(Favorable/Fatal)の6つの項目を用いた多変量解析により検討を行った。その結果、病期と45遺伝子による転移シグネチャーの2項目のみが、術後予後因子として有効であるということが統計学的有意差をもって示された(病期:P=0.014、45遺伝子による転移シグネチャー:P=0.039)。なお、図中、Hazard ratioはハザード比、95%CIは95%信頼区間、P valueは危険率をそれぞれ示す。
【0133】
(術後予後が良い又は悪い癌の識別例)
術後予後が良い又は悪い癌を分類するために、シグナル−ノイズ関数(signal−to−noise metrics、Golubら、Science,Vol.286,pp531 to537,1999)を用いた。癌症例群を、術後予後が良い癌の場合class1、術後予後が悪い癌の場合class2とそれぞれ規定した場合、シグナル−ノイズ統計値である重みSは次式によって計算される。
S=(μclass1−μclass2/σclass1+σclass2)
【0134】
ここで、各遺伝子について、μclass1はclass1の全発現強度データの平均値を示し、μclass2はclass2の全発現強度データの平均値を示し、σclass1はclass1の全発現強度データの標準偏差を示し、σclass2はclass2の全発現強度データの標準偏差を示す。
【0135】
次に、遺伝子xに関する重み付き投票を、下記のWeighted−Voting の計算式を用いて計算する。
Vx=S(Gx−bx)
【0136】
ここで、VXは、遺伝子xに関する重み付き投票を示し、Sは上記式によって算出される重みを示し、GXは、遺伝子xの発現強度(又は発現レベル)を示し、bXは、
bX=(μ1+μ2)/2
(ここで、μ1及びμ2は、それぞれclass1、class2の各平均値の平均を示す。)によって示され、2つの群の中心(すなわち、重心)を示す。
【0137】
重心からのずれに応じて重みを加算していく手法により、各群のVXの総和が0より大きいとき、癌はclass1に分類され、VXの総和が0より小さいとき、癌はclass2に分類される、とすることができる。
【0138】
例えば、class1に属するsample1,2,3,4及び5と、class2に属するsample6,7,8,9及び10について、遺伝子(Gene)A,B,C(以上、術後予後が良いと特徴付けられる遺伝子)、遺伝子(Gene)X,Y,Z(以上、術後予後が悪いと特徴付けられる遺伝子)の発現強度(又は発現レベル)を測定し、各群の5つのサンプルの各遺伝子の発現強度の平均値(μ)と標準偏差(σ)を算出し、さらに、上記の式から、重み(S)と重心(bX)を計算する。
【0139】
型分類すべきsample Aとsample Bについて、各遺伝子の発現強度(又は発現レベル)を測定し、上記式から重み(S)、Gx−bxを計算して各VXを求め、さらに6つの遺伝子のVXの総和を求める。
【0140】
その結果、sampleAは、VXの総和が0より大きいため、class1と識別される。また、sampleBは、VXの総和が0より小さいため、class2と識別される。
【産業上の利用可能性】
【0141】
本発明により、癌患者における癌転移の可能性と予後の予測ができるため、癌の治療計画と予後の管理に多大な貢献をもたらすことができる。
【図面の簡単な説明】
【0142】
【図1】ヒト高転移肺癌細胞株LNM35の樹立手順を示す。
【図2】LNM35株とその親株との間の、培養細胞での運動能及び浸潤能、並びに、マウス移植後のリンパ節転移及び肺転移の割合の比較を示す。
【図3】愛知がんセンターの肺癌50症例データに適用したとき、肺癌患者が、45個の転移関連遺伝子の発現パターンと術後の生存者の割合との相関関係から、2つのグループに大別されることを示す。図3Aは階層的クラスタリング解析の結果を示す。図3Bはカプランマイヤー生存率解析の結果を示す(横軸:月数)。
【図4】ハーバード大学の肺癌62症例データ(Bhattacharjee Aら,Proc Natl Acad Sci USA 98:13790−95,2001)に適用したとき、肺癌患者が、45個の転移関連遺伝子の発現パターンと術後の生存者の割合との相関関係について、2つのグループに大別されることを示す。図4Aは階層的クラスタリング解析の結果を示す。図4Bはカプランマイヤー生存率解析の結果を示す(横軸:月数)。
【図5】オランダ国立癌研究所の乳癌79症例データ(van'tVeer LJら,Nature 415:530−6,2002)に適用したとき、乳癌患者が、45個の転移関連遺伝子の発現パターンと術後の生存者の割合との相関関係について、2つのグループに大別されることを示す。図5Aは階層的クラスタリング解析の結果を示す。図5Bはカプランマイヤー生存率解析の結果を示す(横軸:月数)。
【図6】術後5年生存の危険率に関する」Cox比例ハザードモデルによる多変量解析により決定された病期と独立した再発・死亡の予測因子を示す。
【技術分野】
【0001】
本発明は、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物又は方法に関する。
【0002】
本発明はまた、培養癌細胞を用いて癌転移抑制剤をスクリーニングするための方法に関する。
【背景技術】
【0003】
癌は、遺伝子と環境因子が複雑に絡んだ多因子疾患である。化学療法、放射線療法、外科療法、免疫療法などの種々の治療法が実施されているが、癌の発症メカニズムの複雑さゆえに、中期及び末期癌の治療や癌転移の抑制については必ずしも十分な効果が達成されているとはいえない。
【0004】
一方、癌の早期発見と早期治療によって多くの癌患者が完治又は延命していることも事実である。癌の診断には、例えば細胞診、組織診、内視鏡、画像診断、癌マーカーによる生化学的診断などの方法が採用されており、特に早期癌の検出のために多方面からの研究が活発に行われている。
【0005】
癌の治療や再発を妨げる大きな原因の1つが、癌の転移である。癌の運動能と浸潤能のために癌は原発巣から別の組織に遠隔転移し増殖する。この転移メカニズムの全体像は、ほとんど解明されていない。癌が悪性化するにつれて、また癌の摘出に際して、癌は転移し易くなり、その結果癌の再発が起こるため、癌の転移を防ぐことが、癌の早期診断法や有効な治療法の開発とともに、医療現場で重要な課題となっている。
【0006】
現在、いくつかの癌転移関連遺伝子が報告されているが、そのほとんどはディファレンシャル・ディスプレー法によって発見されている。この方法は発現パターンの差異に基づいて目的遺伝子を検出するものであるが、この方法によって見出された遺伝子の多くは、多くの組織や細胞中で共通して一定量発現する遺伝子、いわゆるハウスキーピング遺伝子である。本質的に癌転移に関わる遺伝子を特定することができるならば、癌転移を抑制する薬剤の開発に繋がることが期待される。
【0007】
癌転移抑制剤として、例えばヒトVEGF受容体Flt−1を介する情報伝達を阻害する物質(特許文献1)、細胞接着阻害活性を有するペプチド(特許文献2)、プリンレセプター作働機能を有するプリン系化合物(特許文献3)などが知られている。また、癌の転移に関わる遺伝子の研究から、マトリックス分解酵素や血管内皮増殖因子とその受容体などが転移に関わることが示唆されている。例えば癌転移関連遺伝子として、マウス細胞株から発見された癌転移関連遺伝子が報告されている(特許文献4)。
【0008】
近年、mRNAを標的とした遺伝子抑制技術の癌治療への応用が試みられようとしている。そのような遺伝子抑制技術には、例えばアンチセンス法、リボザイム、RNA干渉(RNAi)などが含まれる(非特許文献1)。特に、RNAiは特異性が高いため、その医療への応用のための基礎研究が急速に進行しており、その標的としてウイルス性疾患、癌、遺伝性疾患などに注目が集まっている(非特許文献2)。
【0009】
【特許文献1】特開2003−261460
【特許文献2】特開平09−143076号公報
【特許文献3】特開平7−082156号公報
【特許文献4】再表98/045431
【非特許文献1】関大輔ら,実験医学22巻14号(増刊),89〜98頁,2004年,羊土社
【非特許文献2】実験医学22巻4号「RNAiのサイエンス」,2004年,羊土社
【発明の開示】
【発明が解決しようとする課題】
【0010】
これまでに、ある特定の遺伝子又はポリペプチドが癌の転移に関連している可能性が提案されてきたが、実験室レベルでは転移に関連していても他の系では転移との関連が確認できなかった、或いは阻害剤を開発して臨床応用しても十分な効果が得られなかった、という多くの事象が存在した。
【0011】
このような状況において、本発明者らは、転移が単一遺伝子によって起こるものではなく、複数の遺伝子群の協調的な相互作用によって起きることに着目し、癌転移関連遺伝子マーカーの同定、並びに該遺伝子マーカーと癌患者の術後の予後又は転移可能性との関係について検討した。
【0012】
本発明の目的は、癌転移関連遺伝子群をマーカーとして癌患者の術後の予後又は転移可能性をインビトロで予測する方法及び組成物を提供することである。
【0013】
本発明の別の目的は、癌転移関連遺伝子又はその転写産物の阻害又は抑制について、癌転移抑制剤をスクリーニングする方法を提供することである。
【課題を解決するための手段】
【0014】
本発明者らが開発した高転移性ヒト肺癌細胞株とその低転移性親株との間で、網羅的遺伝子発現解析を行い、転移性獲得に関わると考えられる両者の間で発現差を示す遺伝子群を同定し、さらに、ヒト癌患者において転移・再発に関わる可能性を、複数の癌腫について異なるマイクロアレイプラットフォームを用いて採取された網羅的遺伝子発現データを用いて検討した。その結果、複数の癌腫において、同定した遺伝子群の発現プロファイルによって癌患者群が2群間に大別され、かつ、その2群間に外科手術後の生存期間(又は、予後)に有意な差異の存在を示すことが判明した。
【0015】
発明の概要
本発明は、要約すると、次のような特徴を有する。
(1)癌患者の術後の予後又は転移可能性をインビトロで予測する方法であって、該患者由来の生物学的検体中の、配列番号1〜45に示される塩基配列又はその変異配列を含む癌転移関連遺伝子マーカーの少なくとも1つの発現レベル又はその転写若しくは翻訳産物レベルを、該マーカーに対応するプローブを用いて測定し、術後の予後がより良い又は転移可能性がより低い患者群と術後の予後がより悪い又は転移可能性がより高い患者群との間の相対的な該レベルの差を指標にして、術後の予後又は転移可能性を判定することを含む、上記方法。
(2)前記癌転移関連遺伝子マーカーが、配列番号28〜45に示される塩基配列又はその変異配列からなるとき、前記患者は、術後の予後がより良い又は転移可能性がより低い患者として識別される、上記(1)に記載の方法。
(3)前記癌転移関連遺伝子マーカーが、配列番号1〜27に示される塩基配列又はその変異配列からなるとき、前記患者は、術後の予後がより悪い又は転移可能性がより高い患者として識別される、上記(1)に記載の方法。
(4)前記プローブが、配列番号1〜45に示される塩基配列からなるポリヌクレオチド、それに相補的なポリヌクレオチド、それらの変異体、それらにストリンジェントな条件下でハイブリダイズするポリヌクレオチド、或いは15以上の連続した塩基を含むそれらの断片からなる群から選択される、上記(1)〜(3)のいずれかに記載の方法。
(5)前記プローブが、配列番号1〜45に示される塩基配列からなるポリヌクレオチド又はその変異体によってコードされるポリペプチドからなる群から選択されるポリペプチド又はその断片に対する抗体又はその断片である、上記(1)〜(3)のいずれかに記載の方法。
【0016】
(6)前記抗体が、ポリクローナル抗体、モノクローナル抗体又はペプチド抗体である、上記(5)に記載の方法。
(7)前記癌が固形癌である、上記(1)〜(6)のいずれかに記載の方法。
(8)前記固形癌が肺癌又は乳癌である、上記(7)に記載の方法。
(9)配列番号1〜45に示される塩基配列からなるポリヌクレオチド、それに相補的なポリヌクレオチド、それらの変異体、それらにストリンジェントな条件下でハイブリダイズするポリヌクレオチド、或いは15以上の連続した塩基を含むそれらの断片からなる群から選択される少なくとも1つのプローブを含む、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物。
(10)配列番号28〜45に示される塩基配列からなるポリヌクレオチド、それに相補的なポリヌクレオチド、それらの変異体、それらにストリンジェントな条件下でハイブリダイズするポリヌクレオチド、或いは15以上の連続した塩基を含むそれらの断片からなる群から選択される少なくとも1つのプローブを含む、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物。
【0017】
(11)配列番号1〜27に示される塩基配列からなるポリヌクレオチド、それに相補的なポリヌクレオチド、それらの変異体、それらにストリンジェントな条件下でハイブリダイズするポリヌクレオチド、或いは15以上の連続した塩基を含むそれらの断片からなる群から選択される少なくとも1つのプローブを含む、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物。
(12)配列番号1〜45に示される塩基配列からなるポリヌクレオチド又はその変異体によってコードされるポリペプチドからなる群から選択されるポリペプチド又はその断片に対する抗体又はその断片からなる群から選択される少なくとも1つのプローブを含む、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物。
(13)配列番号28〜45に示される塩基配列からなるポリヌクレオチド又はその変異体によってコードされるポリペプチドからなる群から選択されるポリペプチド又はその断片に対する抗体又はその断片からなる群から選択される少なくとも1つのプローブを含む、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物。
(14)配列番号1〜27に示される塩基配列からなるポリヌクレオチド又はその変異体によってコードされるポリペプチドからなる群から選択されるポリペプチド又はその断片に対する抗体又はその断片からなる群から選択される少なくとも1つのプローブを含む、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物。
(15)前記プローブがキットの形態で含まれる、上記(9)〜(14)のいずれかに記載の組成物。
【0018】
(16)前記プローブがマイクロアレイの形態で含まれる、上記(9)〜(11)のいずれかに記載の組成物。
(17)培養癌細胞を用いて、配列番号1〜27のいずれかの塩基配列を含む癌転移関連遺伝子又はその転写産物の阻害又は抑制について、或いはヒト培養癌細胞の運動能及び/又は浸潤能の阻害又は抑制について、候補薬剤をスクリーニングすることを含む、癌転移抑制剤のスクリーニング方法。
(18)培養癌細胞を準備し、該細胞を候補薬剤の存在下で培養し、前記癌転移関連遺伝子又はその転写産物の発現の阻害又は抑制について、或いは培養癌細胞の運動能及び/又は浸潤能の阻害又は抑制について、候補薬剤をスクリーニングすることを含む、上記(17)に記載の方法。
【発明の効果】
【0019】
本発明者らは、今回、同定された45種類の癌転移関連遺伝子マーカーが、複数の癌腫において癌患者の術後の予後又は転移可能性を判定しうる上で非常に有用であることを見出した。これらのマーカーを指標とすることによって、癌患者の術後予後及び癌転移の可能性を予測することができるため、患者に対する治療計画の策定、癌に対する治療成績の向上、並びに転移癌による再発の防止と予後の管理のために大いに役立つことが期待できる。さらにまた、培養癌細胞において、上記マーカーを指標として、その発現を調節する薬剤をスクリーニングすることも可能になり、これによって、癌転移を抑制又は防止する薬剤の開発に導くことができる。
【発明を実施するための最良の形態】
【0020】
定義
本明細書中で使用する用語は、以下の意味を含む。
本明細書で使用する「術後予後」は、癌の手術後の患者の予後を、代表的には術後5年時点での生存率で判定することを意味する。予後は、癌の転移と深く関係しており、「予後が悪い」とは、癌の浸潤性、転移性又は進行度が高いことを意味し、一方、「予後が良い」とは、そのような浸潤性、転移性又は進行度が低いことを意味する。
【0021】
本明細書で使用する「転移(metastasis)」は、癌細胞が、その運動能と浸潤能によって、原発巣から遠隔部位の組織に移動し、そこで増殖し新生物を形成する一連の過程をいう。転移は、癌の再発を引き起すため、癌治療の大きな障害となっている。血管又はリンパ管内に浸潤した癌細胞は、種々の組織に居留して多発的に癌疾患を起こすことも知られている。本発明では、本発明の癌転移関連遺伝子マーカーが関わる限りいずれの転移も対象となるが、例えばリンパ節転移も対象としうる。
【0022】
本明細書で使用する「患者」は、ヒト、イヌ、ネコを含む哺乳動物を指し、好ましい哺乳動物はヒトである。
【0023】
本明細書で使用する「生物学的検体」は、哺乳動物(好ましくはヒト)から採取された組織、細胞又は体液を指し、好ましくは癌の組織又は細胞である。本発明においては、癌組織又は細胞において、術後の予後がより良い又は転移可能性がより低い患者群由来のものと、術後の予後がより悪い又は転移可能性がより高い患者群由来のものとの間で、本発明に関わる遺伝子マーカーの発現レベルに相対的な差異が認められる癌であればいずれの癌も対象となりうる。癌には、例えば、肺癌、乳癌、大腸癌、前立腺癌、胃癌、食道癌、肝臓癌、膵臓癌、腎臓癌、子宮体部・頚部癌、卵巣癌、膀胱癌、脳腫瘍、甲状腺癌、リンパ腫、精巣癌、骨肉腫、皮膚癌、黒色腫、血液癌(特に白血病)などが含まれるが、これらに限定されない。
【0024】
本明細書で使用する「癌転移関連遺伝子マーカー」は、高転移性癌細胞株と低転移性癌細胞株との間で、発現レベルに差異のある遺伝子を同定することによって今回見出されたマーカーであり、本発明方法におけるような癌患者の術後予後又は転移可能性の判定等に使用することがきる。
【0025】
本明細書で使用する「変異体」は、例えば突然変異、多型性、選択的スプライシングなどの生物学的事象、遺伝暗号の縮重などに起因して生じる変異体、生物種間のホモログなどを包含する。変異体には、本発明に関わる配列番号1〜45によって示される塩基配列を含む遺伝子、或いは該遺伝子によってコードされるポリペプチド、の配列上に1若しくは複数、好ましくは1若しくは数個、の置換、欠失、付加、挿入などの変異を有する変異体、該配列又はその部分配列と80%以上、85%以上、90%以上、95%以上、98%以上の同一性を有する配列からなる変異体、などが含まれる。ここで、「数個」とは、通常、10個以下の整数を意味する。また、同一性(%)は、ギャップを導入した公知のBLASTやFASTAプラグラムを用いて決定することができる(S. F. Altschulら, J. Mol. Bio. 215:403−410,1990)。一般に、全塩基数に対する一致した塩基数の百分率として同一性(%)を算出できる。
【0026】
本明細書で使用する「ストリンジェントな条件」は、以下のものに限定されないが、少なくとも80%、好ましくは少なくとも95%の同一性を有するヌクレオチド配列が互いにハイブリダイズするようなハイブリダイゼーション及び洗浄条件を意味し、例えばマイクロアレイ解析におけるハイブリダイゼーション及び洗浄条件は、1M塩化ナトリウム/0.5%(W/V)サルコシル/30%ホルムアミド中、60℃、17時間のハイブリダイゼーション、その後、6×SSC/0.005%(W/V)トライトンX−102溶液中、室温、10分間で一回、さらに、0.1×SSC/0.005%(W/V)トライトンX−102溶液中で0〜4℃に保ちながら5分間で一回の洗浄の条件である。ここで、1×SSCは150mM塩化ナトリウムと15mMクエン酸ナトリウム水溶液(pH7.2)である。ハイブリダイゼーションについては、F.M. Ausbelら, Short Protocols in Molecular Biology(3版)A Compendium of Method s from Current Protocols in Molecular Biology, 1995年, John Wiley & Sons, Inc.(米国)に記載されている。
【0027】
詳細な説明
以下において、本発明をさらに詳細に説明する。
1.癌転移関連遺伝子マーカー
本発明のヒト癌転移関連遺伝子マーカーは、次のようにして見出された。
公知の転移性肺癌細胞株NCI−H460(American Type Culture Collection)(親株)をマウスに皮下移植して肺転移を起こさせたのち、肺転移巣からの細胞の継代培養と、転移能に基づくマウスを用いたインビボ選択とによって、高転移癌細胞株LNM35を単離した(図1参照)。一方、NCI−H460細胞から限界希釈法又は脱メチル化剤での処理などによって、さらに低転移性の癌細胞株を得ることができる。LNM35株は、培養細胞又はマウス移植試験において、運動能、浸潤能、リンパ節転移及び肺転移のいずれにおいても、親株又は低転移癌細胞株と比べて非常に高値を示した(図2参照)。
【0028】
高転移癌細胞株LNM35と、親株又は低転移癌細胞株との間で、ジーンフィルターマイクロアレイ(gene filter microarray; Research Genetics社)による遺伝子発現差を調べることによって、配列番号1〜45の塩基配列を含むヒト癌転移関連遺伝子を見出した。データバンク検索の結果、これらの遺伝子は、表1に示すように、Unigene又はGenBankに登録されているが、癌転移との関連性については知られていない。表1及び表2はそれぞれ、高転移性のLNM35株で発現が高い遺伝子マーカー及び発現が低い遺伝子マーカーの配列番号、GenBank受託番号(Accession number)、UniGene ID、遺伝子名(Gene symbol, Gene name)を示す。
【0029】
【表1】

【0030】
【表2】

【0031】
上記のように同定された癌転移関連マーカーは、肺癌だけでなく、乳癌などの固形癌においてもマーカーとなりうる。これまで報告されたマーカーは特定の癌に特異的であったが、本発明のマーカーは種々の癌に共通のマーカーである点で驚くべきことであった。
【0032】
このために、本発明方法の対象となる患者の癌には、例えば、肺癌、乳癌、大腸癌、前立腺癌、胃癌、食道癌、肝臓癌、膵臓癌、腎臓癌、子宮体部・頚部癌、卵巣癌、膀胱癌、脳腫瘍、甲状腺癌、リンパ腫、精巣癌、骨肉腫、皮膚癌、黒色腫などの固形癌が含まれる。さらに可能な癌として、血液癌(特に白血病)なども挙げられる。
【0033】
本発明において、癌転移関連遺伝子マーカーには、配列番号1〜45に示される塩基配列を含む遺伝子だけでなく、その変異体遺伝子も含まれる。通常、そのような変異体は、生体内で例えば突然変異、多型性、選択的スプライシングなどの生物学的事象の結果とし生じた変異体を含む。実際には、該遺伝子マーカーは、転写産物又は翻訳産物として核酸レベル又はタンパク質レベルで検出される。
【0034】
転写産物の場合、それはmRNA、cRNA又はcDNAとして検出される。細胞又は組織からフェノール/クロロホルム法などの方法で全RNAを抽出し、オリゴdTセルロースカラム法によってポリA(+)RNA又はmRNAを調製し、必要により、さらにmRNAからcDNA、cRNAを合成する。
【0035】
翻訳産物の場合、それは上記遺伝子又はその変異体によってコードされるタンパク質又はその断片として検出される。
【0036】
本発明に関わる上記癌関連遺伝子マーカーは、その発現パターンによって、外科手術後の癌患者の予後又は転移可能性の程度に対応して2群に大別される(図3〜図5参照)。
【0037】
具体的には、癌転移関連遺伝子マーカーが、配列番号28〜45に示される塩基配列又はその変異配列からなるとき、患者は、術後の予後がより良い又は転移可能性がより低い患者として識別される。一方、癌転移関連遺伝子マーカーが、配列番号1〜27に示される塩基配列又はその変異配列からなるとき、患者は、術後の予後がより悪い又は転移可能性がより高い患者として識別される。
【0038】
2.予後又は転移可能性を予測するための組成物
本発明は、上記のとおり、癌患者の術後の予後又は転移可能性をインビトロで予測する方法を提供し、この方法は、該患者由来の生物学的検体中の、配列番号1〜45に示される塩基配列又はその変異配列を含む癌転移関連遺伝子マーカーの少なくとも1つの発現レベル又はその転写若しくは翻訳産物レベルを、該マーカーに対応するプローブを用いて測定し、正常又は非癌の対照検体に対する有意なレベル差を指標にして、術後の予後又は転移可能性を予測することを含む。
【0039】
本発明で使用されるプローブは、上記マーカーを検出可能なものであれば特に制限されないが、通常は、ポリヌクレオチド又は抗体である。したがって、このようなポリヌクレオチド又は抗体を含む組成物は、癌患者の術後の予後又は転移可能性を予測するために使用されうる。
【0040】
2.1 ポリヌクレオチドプローブ
具体的には、本発明に関わるポリヌクレオチドプローブは、(i)配列番号1〜45に示される塩基配列からなるポリヌクレオチド、(ii)(i)のポリヌクレオチドに相補的なポリヌクレオチド、(iii)(i)及び(ii)のポリヌクレオチドの変異体、(iv)(i)又は(ii)のポリヌクレオチド或いは(iii)の変異体にストリンジェントな条件下でハイブリダイズするポリヌクレオチド、並びに(v)前記ポリヌクレオチド又は変異体の15以上の連続した塩基を含む断片からなる群から選択される少なくとも1個、好ましくは少なくとも2個、さらに好ましくは3〜45個、例えば4〜45個、5〜45個のプローブを含む。
【0041】
本発明に関わる癌転移関連遺伝子マーカーは、癌患者の予後の状態(生存者の割合)に応じて、次のように2つの群に分けることができる。
【0042】
すなわち、グループ1は、癌患者の術後予後がより悪い場合であり、この群に関与するマーカーは、配列番号1〜27の遺伝子群であり、一方、グループ2は、癌患者の術後予後がより良い場合であり、この群に関与するマーカーは、配列番号28〜45の遺伝子群である。
【0043】
本明細書中で使用する「予後が良い」とは、癌の浸潤性、転移性又は進行度が高いことを意味し、このように判定される癌患者の5年生存者の割合は約70%以上であるのに対して、「予後が悪い」とは、癌の浸潤性、転移性又は進行度が低いことを意味し、癌患者の5年生存者の割合は約50%以下である。
【0044】
本発明においては、それぞれの群に属する遺伝子マーカーのうち少なくとも1個、好ましくは少なくとも2個、さらに好ましくは3個〜全部、例えば4個〜全部、5個〜全部のマーカーについて、対応するプローブを用いて検査する。
グループ1に属するマーカーを検査するためのプローブには、配列番号1〜27に示される塩基配列からなるポリヌクレオチド、それに相補的なポリヌクレオチド、それらの変異体、それらにストリンジェントな条件下でハイブリダイズするポリヌクレオチド、或いは15以上の連続した塩基を含むそれらの断片からなる群から選択されるプローブが含まれる。
【0045】
一方、グループ2に属するマーカーを検査するためのプローブには、配列番号28〜45に示される塩基配列からなるポリヌクレオチド、それに相補的なポリヌクレオチド、それらの変異体、それらにストリンジェントな条件下でハイブリダイズするポリヌクレオチド、或いは15以上の連続した塩基を含むそれらの断片からなる群から選択されるプローブが含まれる。
【0046】
このように、本発明には、これらのグループ1及びグループ2に関わる各プローブ群を含む組成物も包含される。
【0047】
本発明において、プローブとしての変異体は、上記定義のとおり、配列番号1〜45によって示される塩基配列に1若しくは複数、好ましくは1若しくは数個、の置換、欠失、付加、挿入などの変異を有する変異体、該配列と通常80%以上、85%以上、好ましくは90%以上、さらに好ましくは95%以上、98%以上の同一性を有する配列からなる変異体などを含む。
【0048】
さらに、本発明において、ストリンジェントな条件下でハイブリダイズするポリヌクレオチドは、上記定義のようなハイブリダイゼーション条件下で、上記(i)から(iii)のポリヌクレオチド又は変異体にハイブリダイズすることが可能なものであれば、特に制限されないものとする。患者の個体によっては、突然変異、多型性、選択的スプライシングなどの生物学的事象により配列番号1〜45によって示される塩基配列が変化した遺伝子をもつこともありえるために、そのようなポリヌクレオチドは、該遺伝子の検出を可能にする。
【0049】
さらにまた、本発明において、ポリヌクレオチドの断片は、15塩基数〜全塩基数未満のサイズを有する。断片は、この範囲の任意の塩基数、例えば20塩基以上、30塩基以上、50塩基以上、70塩基以上、100塩基以上、150塩基以上、200塩基以上、250塩基以上などの塩基数である。
【0050】
本発明で使用されるポリヌクレオチドプローブは、慣用の化学的DNA合成技術や遺伝子組換え技術によって合成されうる。
【0051】
ポリヌクレオチドが約100塩基以下のDNA分子であれば、ホスホアミダイト法を利用するDNA自動合成装置(例えばApplied Biosystems、米国)を用いて合成することができる。
【0052】
或いは、上記ポリヌクレオチドは、cDNAクローニングによって作製することができる。対象の癌組織から全RNAを取得し、オリゴdTセルロースカラム処理によってポリA(+)RNAを得たのち、逆転写酵素−ポリメラーゼ連鎖反応(RT−PCR)法によってcDNAライブラリーを作製し、このライブラリーから、GenBankやUniGeneなどのデータバンクに登録された配列(表1及び表2)に基づいて予め作製したプローブ(15以上、好ましくは30以上、より好ましくは、50〜100又はそれ以上の塩基長)とのハイブリダイゼーションによりcDNAクローンを得ることができる。取得したクローンは、例えば市販されるような発現ベクターに組み込んだのち大腸菌、枯草菌などの適当な宿主細胞に導入し、宿主細胞を増殖することによって、或いはデータバンクに登録された配列に基づいて予め作製したプライマー(通常15〜30塩基、好ましくは17〜25塩基長)を使用し、かつ前記cDNAクローンを鋳型とするポリメラーゼ連鎖反応(PCR)によって、増幅することができる。cDNAクローニング及びPCR法の具体的手順や試薬等については、市販のキット、装置、試薬を使用することができるし、また、例えばSambrook Jら, Molecular Cloning A Laboratory Manual,1989年, Cold Spring Harbor Laboratory Press(米国);F.M. Ausbelら, Short Protocols in Molecular Biology(3版)A Compendium of Method s from Current Protocols in Molecular Biology, 1995年, John Wiley & Sons, Inc.(米国)などに教示されている。
【0053】
2.2 抗体プローブ
本発明においては、抗体をプローブとして用いてもよい。抗体としては、次のものが挙げられる。
(i)配列番号1〜45に示される塩基配列からなるポリヌクレオチド又はその変異体によってコードされるポリペプチドからなる群から選択されるポリペプチド又はその断片に対する抗体又はその断片、
(ii)配列番号1〜27に示される塩基配列からなるポリヌクレオチド又はその変異体によってコードされるポリペプチドからなる群から選択されるポリペプチド又はその断片に対する抗体又はその断片、並びに、
(iii)配列番号28〜45に示される塩基配列からなるポリヌクレオチド又はその変異体によってコードされるポリペプチドからなる群から選択されるポリペプチド又はその断片に対する抗体又はその断片。
【0054】
したがって、本発明は、上記の(i)、(ii)及び(iii)に記載の抗体又はその断片、好ましくは(ii)及び(iii)の各々から選択される少なくとも1個、好ましくは少なくとも2個、さらに好ましくは3個〜全部、例えば4個〜全部、5個〜全部の抗体又はその断片、を含む組成物も包含する。
【0055】
本発明で使用される抗体は、ポリクローナル抗体、モノクローナル抗体、抗ペプチド抗体などを含む。また、抗体の断片には、Fab、(Fab')2、Fc、Fc'、Fd、Fvなどが含まれる。これらの抗体断片は、例えばパパイン、ペプシンなどのプロテアーゼによる抗体の限定分解によって得ることができる。
【0056】
各遺伝子に対応するポリペプチド又はその断片を、タンパク質合成又は遺伝子組換え技術を用いて合成し、その結果得られたポリペプチド又はその断片を抗原としてウサギ、マウス、ラット、ウマ、ウシ、ヤギ、ヒツジなどの動物を免疫し、それらの抗原に対する抗体を産生し、精製する。
【0057】
ポリクローナル抗体は、前記動物を10〜300μg程度の抗原で皮下に免疫し、さらに約2週間後に追加免疫し、初回免疫から約3週間〜1か月後に採血し、抗血清から目的のポリクローナル抗体を含むIgG成分を硫安分画、イオン交換クロマトグラフィーを使用して分離することを含む方法によって作製することができる。特異性を高めるために、得られたIgGを、目的タンパク質をセルロース又はアガロースなどの担体に結合して作製されたカラムに結合させたのち、高塩濃度のバッファーで溶出し、透析や限外ろ過などの方法で脱塩して、特異的ポリクローナル抗体を得ることができる。抗体価は、通常の免疫測定法、例えば酵素免疫測定法(EIA、ELISA)、放射性免疫測定法(RIA)、蛍光抗体法などによって測定することができる。
【0058】
モノクローナル抗体は、例えば以下の一般的方法によって作製することができる。
標的ポリペプチド又はその断片を、ポリクローナル抗体の作製と同様にマウス又はラット(例えばBalb/cマウス)の皮下に投与し、1〜4週間間隔で、約2〜4回追加免疫を行う。抗体価が頭打ちになったとき、抗原を静脈内または腹腔内に注射し、最終免疫とする。2〜5日後、抗体産生細胞(例えば脾臓細胞又はリンパ節細胞)を採取する。次いで、抗体産生細胞を骨髄腫細胞株(好ましくはヒポキサンチン・グアニン・ホスホリボシル・トランスフェラーゼ(HGPRT)欠損細胞株)に融合させてハイブリドーマ細胞を生成し、HAT(ヒポキサンチン、アミノプテリン、チミン)選択を行う。細胞融合は、血清を含まないDMEM、RPMI−1640培地などの動物細胞培養用培地中で、抗体産生細胞と骨髄腫細胞株とを約1:1〜 20:1の割合で混合し、ポリエチレングリコールなどの細胞融合促進剤の存在下で実施する。目的の抗体かどうかの確認は、上記の免疫測定法によって行うことができる。さらに、ハイブリドーマの増殖のために、マウスの腹腔内にハイブリドーマを約1,000万個投与し、ハイブリドーマを増殖させたのち、1〜2週間後に腹水を採取する。抗体の精製は、硫安分画、イオン交換クロマトグラフィー、アフィニティクロマトグラフィー、ゲルクロマトグラフィーなどの方法を適宜組み合わせて行うことができる。
【0059】
抗ペプチド抗体は、タンパク質の表面上のリニアーなペプチドに対する抗体であり、免疫学的特異性を高めることができる。そのようなペプチドは、例えばKyte−Doolittleらの親水性−疎水性領域の推定法、Eminiらによるタンパク質分子上の特定ペプチド部位の表面に位置する確率、ポリペプチド鎖の折れ曲がり程度、例えばChou−Fasmanらなどのαヘリックス、βシート、ターンを表示するタンパク質の二次構造予測、等を単独で又は組み合わせて使用して推定しうる。次いで、推定されたペプチドは、ペプチド合成機を用いて合成することができる。
【0060】
ここで、標的ポリペプチド(上記表1及び表2に示される遺伝子によってコードされる)の合成は、cDNAクローンを発現ベクターに組み込み、該ベクターによって形質転換又はトランスフェクションされた原核又は真核宿主細胞を培養することによって該細胞又は培養上清から得ることができる。発現ベクターは市販のものを使用することができる。宿主細胞は、細菌などの原核細胞(例えば大腸菌、枯草菌、シュウドモナス属細菌など)、酵母(例えばサッカロマイセス属、ピチア属など)、昆虫細胞(例えばSf細胞)、哺乳動物細胞(例えばCHO、COS、BHK、HEK293など)などを含む。また、ベクターは、プラスミド、コスミド、ファージなどからなり、標的ポリペプチドをコードするDNA、プロモーター、必要ならエンハンサー、ポリアデニル化シグナル、リボソーム結合部位、複製開始点、ターミネーター、選択マーカーなどを含むことができる。ポリペプチドの精製を容易にするために、標識ペプチド、例えば6〜10残基のヒスチジンタグ、FLAG、GFPポリペプチドなどをコードするDNA配列を含有させることもできる。遺伝子組換え技術については、Sambrookら(上記)、Ausbelら(上記)に記載されており、それらに記載の技術を本発明のために使用することができる。
【0061】
上記のようにして得られた標的ポリペプチドは、ゲルろ過、イオン交換クロマトグラフィー、アフィニティクロマトグラフィー、疎水性クロマトグラフィー、等電点電気泳動、電気泳動、限外ろ過、塩析、透析などを適宜組み合わせて精製することができる。
【0062】
標的ポリペプチド又はその断片の配列は、上記表1及び表2に記載されるGenBank又はUniGene登録番号に基づいてNCBI HomePageにアクセスすることによって入手可能である。
【0063】
本発明の実施形態により、前記組成物は、キット又はマイクロアレイの形態であってもよく、すなわち、前記プローブは、キット又はマイクロアレイの形態で含まれる。
【0064】
キットの場合、2つのグループの各遺伝子マーカー(表1及び表2)の1又は2以上から全数のマーカーを検出することが可能なポリヌクレオチド又は抗体を、個別に又は2以上を組み合わせて適当な容器に包装することができる。
【0065】
抗体は、上記の方法で作製されるようなポリクローナル抗体、モノクローナル抗体、抗ペプチド抗体などであるが、それらに限定されないものとする。抗体の種類は、いずれのタイプ、クラス、サブクラスでもよく、例えばIgG、IgM、IgE、IgD、IgA、IgG1、IgG2、IgG3、IgG4、IgA1、IgA2などを含む。また、抗体の断片は、Fab、(Fab')2、Fc、Fd、Fvなどを含む。
【0066】
キットにはさらに、ハイブリダイゼーションを行うための試薬類、例えばバッファー、逆転写酵素、標識二次抗体などを含有させてもよい。
【0067】
マイクロアレイの場合、アレイは、DNAマイクロアレイ(DNAチップともいう)、組織アレイ又はタンパク質マイクロアレイである。
【0068】
これらのマイクロアレイにはそれぞれ、プローブとしての上記のポリヌクレオチド或いは上記の抗体又はその断片が結合される。すなわち、アレイの表面に、上記遺伝子マーカー又は転写若しくは翻訳産物を検出することができる、遺伝子マーカー又はその変異体とハイブリダイズすることが可能なポリヌクレオチド、或いはそれらの遺伝子によってコードされるポリペプチド、又はその変異体若しくは誘導体と特異的に結合反応することができる抗体又はその断片が、プローブとして結合される。
【0069】
アレイの基板としては、ガラス又は樹脂(ポリマー)が通常使用され、その表面に例えばポリL−リジン、シラン又は高密度化アミノ基が導入される。また、基板上へのポリヌクレオチド又は抗体の結合は、スポット法又はインクジェット法によって行われる。
【0070】
変異体は、上記遺伝子又はポリペプチドの完全又は部分配列と、ヌクレオチド又はアミノ酸レベルで通常80%以上、85%以上、好ましくは90%以上、さらに好ましくは95%以上、98%以上の同一性を有するものである。
【0071】
ポリペプチドの誘導体は、例えば、グリコシル化、リン酸化、硫酸化、アルキル化、アシル化などの化学修飾誘導体を含む。
【0072】
3.予後又は転移可能性を予測する方法
本発明の方法は、癌患者の術後の予後又は転移可能性をインビトロで予測する方法であって、該患者由来の生物学的検体中の、配列番号1〜45に示される塩基配列又はその変異配列を含む癌転移関連遺伝子マーカーの少なくとも1つの発現レベル又はその転写若しくは翻訳産物レベルを、該マーカーに対応するプローブを用いて測定し、術後の予後がより良い又は転移可能性がより低い患者群と術後の予後がより悪い又は転移可能性がより高い患者群との間の相対的な該レベルの差を指標にして、術後の予後又は転移可能性を判定することを含む。
【0073】
ここで、発現レベルは、生物学的検体中の上記遺伝子の発現について、転写又は翻訳産物レベルで、術後の予後がより良い又は転移可能性がより低い患者群からの検体と、術後の予後がより悪い又は転移可能性がより高い患者群からの検体との間で該遺伝子の発現を比較したときの該遺伝子の発現の差異を意味する。
【0074】
発現レベルの差を示す上記遺伝子を同定することによって、癌患者の術後の予後又は転移可能性をインビトロで予測することができる。
【0075】
本発明によれば、遺伝子の発現レベルの差は、マーカーとしての該遺伝子又はそれに対応するポリペプチドの存在又は量を測定することによって行うことができる。したがって、単に2つの群に分類される各マーカーの存在を測定するだけで、癌患者の術後の予後又は転移可能性をインビトロで予測することができる。
【0076】
生物学的検体は、癌患者の組織又細胞を含み、手術によって切除された癌組織、生検によって得られた組織又は細胞などである。
以下に、これらの2つの異なる方法について具体的に説明する。
【0077】
3.1 ポリヌクレオチドによる方法
本発明に関わる45個の遺伝子マーカーを検出するために、それらの各マーカーとハイブリダイズする上記ポリヌクレオチドを使用する。検出すべき遺伝子の数は、グループ毎に1又は2以上であり、好ましくは2以上、より好ましくは3から全数、例えば4から全数、5以上から全数である。検出すべき遺伝子の数が多いほど、予測の確度が向上する。
【0078】
ハイブリダイゼーションは、マイクロアレイ法、ブロット法、例えばノーザンもしくはサザンブロット、ノーザンもしくはサザンハイブリダイゼーション法、in situeハイブリダイゼーション法、定量RT−PCR法などの方法で実施することができる。好ましいハイブリダイゼーション法は、マイクロアレイ、定量RT−PCR又はブロット法である。また、好ましいマイクロアレイの例は、DNAマイクロアレイ及びタンパク質マイクロアレイである。
【0079】
DNAマイクロアレイ法では、上記の2つのグループの各遺伝子群(1〜全数)とハイブリダイズする核酸プローブを基板に結合したDNAマイクロアレイを作製し使用する。
【0080】
DNAマイクロアレイは、核酸プローブを固相化できるものであればいずれの種類の基板も使用できる。固相には、例えばガラス、ポリマーなどが含まれ、さらに核酸を共有結合するための反応性基を含むスペーサーやクロスリンカーを導入することができる。このようなチップは市販されているため、それらを使用することが望ましい。
【0081】
核酸プローブの固相化は、特に制限はないが、一般的な方法、例えばスポッター又はアレイヤーと呼ばれる高密度分注機を用いてDNAをスポットする方法、ノズルから液滴を噴射するインクジェット方式などの方法を用いて実施することができる。
【0082】
生物学的検体中のDNA又はRNA、それから誘導されたcDNA、cRNAなどの核酸を、Cy染料(Cr3又はCy5)などの蛍光物質で標識した核酸を、DNAマイクロアレイ上のプローブとハイブリダイズさせる。レーザースキャンによる読み取り装置を用いて蛍光強度を読み取り、コンピュータでデータを解析する。
【0083】
ブロット法では、本発明の核酸プローブを放射性同位元素(例えば、32P及び35S)や蛍光物質(ローダミン誘導体、Cy染料など)などで標識したのち、ナイロンなどのポリマーメンブレンに転写した生物学的試料中のDNA又はRNA、それから誘導されたcDNA、cRNAなどの核酸との間でハイブリダイゼーションを行う。シグナルを、放射線検出器又は蛍光検出器を用いて検出し、その強度を測定する。
【0084】
定量RT―PCR法では、生物学的検体中のRNAから作製したcDNAを鋳型として標的の各遺伝子の領域が増幅できるように、プライマーをcDNAとアニーリングさせPCRを行い、得られた二本鎖DNAを検出する。プライマーを予め放射性同位元素や蛍光物質で標識しておくか、或いは、PCR産物をアガロースゲルで電気泳動し、エチジウムブロマイドなどで二本鎖DNAを染色するなどの方法で、標的遺伝子を検出、定量することができる。
【0085】
PCR条件は、例えば変性:92〜94℃で30〜60秒;アニーリング:50〜55℃で30〜60秒;伸長:68〜72℃で30〜60秒を1サイクルとして30〜40サイクルの反応を含む。逆転写酵素は、市販の酵素、例えばSuperScript(登録商標)III(Invitrogen、米国)、AMV Reverse Transcriptase (Promega、米国)、M−MLV(RNaseH−)(宝酒造、京都)などを使用することができる。
【0086】
本発明において、ハイブリダイゼーションは、DNA−DNAハイブリダイゼーション、DNA−RNAハイブリダイゼーション、RNA−RNAハイブリダイゼーションのいずれでもよい。
【0087】
ハイブリダイゼーションは、通常、ストリンジェントな条件下で行われる。このような条件は、例えば、1M塩化ナトリウム/0.5%(W/V)サルコシル/30%ホルムアミド中、60℃、17時間のハイブリダイゼーション、その後、6×SSC/0.005%(W/V)トライトンX−102溶液中、室温、10分間で一回、さらに、0.1×SSC/0.005%(W/V)トライトンX−102溶液中で0〜4℃に保ちながら5分間で一回の洗浄を含む。或いは、別のハイブリダイゼーション条件は、例えば、約45〜50℃で2〜6×SSC中でのハイブリダイゼーションと、それに続く、約50〜65℃での0.2〜2×SSC/0.1〜1%SDSによる洗浄;或いは、60〜65℃で6×SSC、Denhardt溶液、0.2%SDS中でのハイブリダイゼーションののち、60〜65℃での0.2×SSC、0.1%SDSによる洗浄を含む。ハイブリダイゼーションの条件及び方法については、例えば、Ausubelら, Curent Protocols in Molecular Biology, 1989, John Wiley and Sons, US)を参照することができる。
【0088】
3.2 抗体による方法
上記遺伝子の発現レベルの代替的測定法は、免疫学的方法である。
上記のように作製された抗体を、生物学的検体中の標的ポリペプチド又はその断片の検出のために使用することができる。
【0089】
多数の抗体をマイクロアレイ基板上に結合したタンパク質マイクロアレイを作製することによって、或いは、多数の抗体をPVDF膜などのフィルター上にドット状にスポットすることによって、一度に多数の標的ポリペプチドを検出又は定量することが可能になる。或いは、慣用の免疫学的測定法、例えば酵素免疫測定法(ELISA、EIA)、蛍光抗体法、放射性免疫測定法(RIA)、発光免疫測定法、免疫比濁法、ラテックス凝集反応、ラテックス比濁法、赤血球凝集反応、粒子凝集反応またはウェスタンブロット法などによって、生物学的試料中の標的ポリペプチド又はその断片を検出又は定量することができる。
【0090】
固相上で反応を行うときには、固相担体として、ポリスチレン、ポリカーボネート、ポリエチレンなどのポリマーの膜(フィルター)、プレート、チューブ、ストリップなど、ラテックス、磁性体などの粒子、などが含まれる。固相化は、物理的に或いは化学的に行うことができる。化学的結合のためには、例えばマレイル化試薬、臭化シアンなどの試薬で固相を処理し、タンパク質のアミノ基などと反応する官能基を固相に導入することができる。
【0091】
標的の検出のために、抗体を標識してもよいし、或いは標識二次抗体を使用してもよい。標識としては、西洋ワサビペルオキシダーゼ、アルカリホスファターゼなどの酵素、フルオレセイン、ローダミン、それらの誘導体などの蛍光物質、ルシフェラーゼ系、ルミノール系などの発光物質、32P、125I、35Sなどの放射性同位元素などが含まれる。標識化は、例えばグルタルアルデヒド法、マレイミド法、ピリジルジスルフィド法、クロラミンT法、ボルトンハンター法などを含む。
【0092】
4.癌転移抑制剤のスクリーニング
本発明はさらに、培養癌細胞を用いて、配列番号1〜27のいずれかの塩基配列を含む癌転移関連遺伝子又はその転写産物の阻害又は抑制について、或いは培養癌細胞の運動能及び/又は浸潤能の阻害又は抑制について、候補薬剤をスクリーニングすることを含む、癌転移抑制剤のスクリーニング方法を提供する。
【0093】
具体的には、この方法は、培養癌細胞を準備し、該細胞を候補薬剤の存在下で培養し、前記癌転移関連遺伝子又はその転写産物の発現の阻害又は抑制について、或いは培養癌細胞の運動能及び/又は浸潤能の阻害又は抑制について、候補薬剤をスクリーニングすることを含む。
【0094】
ヒト培養癌細胞、好ましくはヒト培養転移性癌細胞、の細胞株は、癌の種類によって特に制限されないものとし、例えば公知の転移性ヒト癌細胞株である、MeWo;悪性黒色腫細胞株、MDA−MB−435;乳癌細胞株、LNCaP又はPC−3;高転移性ヒト肺癌細胞株、LNM35;前立腺癌細胞株などが含まれ、本発明において使用できる。
【0095】
本発明において、前記ヒト癌転移関連遺伝子又はその転写産物の発現の阻害又は抑制の程度は、候補薬剤を添加しない対照との比較実験によって判定できる。発現レベルは、癌細胞株から周知の方法(例えばフェノール/クロロホルム抽出及びエタノール沈殿、オリゴdTセルロースカラムクロマトグラフィーなど)で得た全RNA又はmRNA又はポリA(+)RNAについて、或いは逆転写酵素−PCR(RT−PCR)法によってRNAから合成されたcDNAについて、蛍光又は放射性標識したプローブを用いるハイブリダイゼーション法(例えばノーザンハイブリダイゼーション、サザンハイブリダイゼーション、DNAマイクロアレイ、組織マイクロアレイなど)によって決定することができる。或いは、発現レベルは、上記ヒト癌転移関連遺伝子によってコードされるポリペプチドの細胞内レベルを、該ポリペプチドに対する抗体又はその断片を用いる免疫測定法、ウエスタンハイブリダイゼーションなどによって測定することによって間接的に決定することができる。
【0096】
前記プローブは、配列番号1〜45の塩基配列又はそれと相補的な配列、或いはその連続する例えば約20以上、約30以上、50以上、70以上、100以上、150以上、200以上、250以上のヌクレオチドからなる配列、を有するDNAである。プローブは、蛍光又は放射性標識を結合した標識プローブとするのが好ましい。蛍光性標識には、例えばフルオレサミン、ローダミン、それらの誘導体、Cy3、Cy5などが含まれる、放射性標識には、例えば放射性リン又はイオウ原子が含まれる。
【0097】
免疫測定法は、抗原−抗体反応を利用する分析法であり、例えば酵素結合抗体法(例えばELISA)、蛍光抗体法、固相法、均一法、サンドイッチ法などを適宜組み合わせた方法によって行うことができる。これらの方法は、当業界で周知であり、その慣用技術を本発明で使用できる。
【0098】
ヒト培養(転移性)癌細胞において、前記ヒト癌転移関連遺伝子又は対応するmRNAの発現が、候補薬剤の存在によって、候補薬剤無添加の対照と比べて、有意に阻害又は抑制される場合、該候補薬剤は癌転移抑制剤として同定しうる。
【0099】
候補薬剤のスクリーニングはまた、ヒト培養癌細胞、好ましくは転移性癌細胞、の運動能及び/又は浸潤能の阻害又は抑制を調べることによっても見出すことができる。
【0100】
癌細胞のインビトロにおける運動能アッセイあるいは浸潤能アッセイは、例えばトランスウェルチャンバー培養システムを用いて行うことができる。運動能アッセイにおいては、例えば24ウェル細胞培養プレートに径8ミクロンの小孔を有するテレフタル酸ポリエチレン膜を有するインサート(ベクトンディキンソン社製)を挿入し、インサート内部の無血清細胞培地に転移性癌細胞株を接種し、24時間培養した後、小孔を通過し膜下層に移動した細胞数をカウントすることによって行うことができる(Kozaki Kら, Cancer Research 60:2535−40,2000)。浸潤能アッセイでは、同様のシステムを使用するが、細胞を接種する以前に膜上部をマトリゲルによって覆っておくことにより、計測することができる(Kozaki Kら,Cancer Research 60:2535−40,2000)。
【0101】
上記のアッセイにおいて、無血清細胞培地に候補薬剤を添加しておくことにより、転移性癌細胞の運動能及び/又は浸潤能を阻害又は抑制する候補物質が、癌転移抑制剤として同定しうる。
【0102】
候補薬剤は、小分子、ペプチド、ポリペプチド、タンパク質、ヌクレオシド、オリゴヌクレオチド、ポリヌクレオチド、核酸(DNA又はRNA)などを含むが、これらに限定されない。
【0103】
候補薬剤としてのポリペプチド又はタンパク質には、例えば配列番号1〜27に示される塩基配列又はその変異配列によってコードされるポリペプチド又はタンパク質に対する抗体又はその断片が含まれる。また、核酸には、配列番号1〜27に示される塩基配列又はその変異配列に対応するmRNAを切断することが可能なリボザイム、siRNA(small interfering RNA)などが含まれる。
【0104】
siRNAの配列を選択するために、例えば標的mRNAの標的サイトの選択のための公知の知識、例えば、(a)GC含量が約30〜約70%、好ましくは約50%である、(b)すべてのヌクレオチドが均等であり、またGが連続していない、(c)アンチセンス鎖の5'末端のヌクレオチドがA、Uである、などの基準を使用することができる(D.M. Dykxhoornら,Nature Rev. Mol. Cell Biol. (2003),77:7174−7181;A. Khvorovaら,Cell (2003),115:209−216)。
【0105】
また、候補薬剤としてのリボザイムは、触媒活性をもつRNAであり、本発明に関わる標的ヒト癌転移関連遺伝子に対応するmRNAを切断する活性を有している。この切断によって該遺伝子の発現が阻害又は抑制される。リボザイムの切断可能な標的配列は、一般にはNUX(N=A,G,C,U;X=A,C,U)、例えばGUCトリプレットを含む配列であることが知られている。本発明における標的ヒト癌転移関連遺伝子の配列番号1〜27の塩基配列によってコードされる対応のmRNA配列には、上記の候補トリプレットが存在しているため、候補トリプレットを含む切断すべきmRNA配列部分に相補的な配列を含むリボザイムは、標的mRNAの切断のために使用することができる。このようなリボザイムには、ハンマーヘッド型リボザイムが含まれる。ハンマーヘッド型リボザイムは、センサー部位を構成するヌクレオチド配列、センサー部位にRNAが結合したときのみ安定にMg2+イオンを捕捉する空洞を形成しうる領域を含むヌクレオチド配列、及び標的RNAの切断部位周辺の配列に相補的である領域を含むヌクレオチド配列を含むことができる。
【0106】
本発明を以下の実施例によってさらに具体的に説明するが、本発明はそれらの実施例によって制限されないものとする。
【実施例1】
【0107】
(高転移ヒト肺癌細胞株(LNM35)の樹立)
NCI−H460細胞(American Type Culture Collectionから入手)(親株)1×107細胞/100μl(RPMI 1640細胞培地)を、SCIDマウス(静岡実験動物研究所より購入)に皮下移植した。移植して45日後に、癌細胞の肺転移を確認し、さらに肺転移巣からの癌細胞を別のマウスの皮下に移植し、肺転移巣からの癌細胞を、培養培地(10%ウシ血清添加RPMI 1640)中で初代培養を行った。この細胞を、別のマウスの皮下に移植し、同様に、肺転移巣からの癌細胞を培養した。さらに、2度のin vivo selection後の細胞をマウスの皮下に移植し、腋窩リンパ節からの癌細胞を培養培地(10%ウシ血清添加RPMI 1640)中で初代培養を行った。引き続いて96ウェルプレートを用いた限界希釈法により、クローニングを行い、高転移株のNCI−H460−LNM35を得た(図1)。
【0108】
これとは別に、親株であるNCI−H460細胞から限界希釈法により低転移株(N15)を得ることができた。さらまた、LNM35株を、上記と同じ培養培地中、脱メチル化剤(5−アザ−2'−デオキシシチジン)(1μMで24時間)で処理することにより、低転移株(L2D2及びL2D3A)を得ることができた。
【0109】
上記の手順で得たLNM35株及び親株について、細胞の運動能アッセイ及び浸潤能アッセイによる転移能、並びにマウスへの皮下移植による腋窩のリンパ節及び肺への転移能の強さを調べた。
【0110】
運動能アッセイは、8μmの微小孔をもつフィルターのトランスウェルチャンバーを用いて、24時間の培養後に、フィルター裏側へ移動した細胞数をカウントする手順で行った。
【0111】
浸潤能アッセイは、8μmの微小孔をもつフィルターにマトリゲルをコートしたトランスウェルチャンバーを用いて、24時間の培養後に、フィルター裏側へ移動した細胞数をカウントする手順で行った。
リンパ節及び肺への転移はそれぞれ、重量及び腫瘤の数によって判定した。
【0112】
その結果、図2に示すように、LNM35株は、運動能、浸潤能がともに最も高値を示し、またリンパ節及び肺への転移も高値を示したことから、高転移癌細胞株であることを確認した。一方、親株はいずれも、非常に低い運動能、浸潤能、リンパ節転移、肺転移を示したことから、低転移癌細胞株であることを確認した。
【実施例2】
【0113】
(新規の癌転移関連遺伝子の検出)
GeneFilter Human Microarrays Release IとRelease II(登録商標)マイクロアレイ(Invitrogen社製)を用いて、高転移性株LNM35株と親株N15株との間で遺伝子発現差を示す特定の遺伝子の検出について検討した。
【0114】
具体的に、このマイクロアレイでは、5μgの全RNAを鋳型とし、オリゴ-dTプライマーとSuperScriptII逆転写酵素を用いて、100μCiの[33P]dCTP存在下で逆転写し、Invitrogen社製のcDNAマイクロアレイ(GeneFilter Human Microarrays Release IとRelease II)とハイブリダイズさせた。2M of urea, 0.1 % of SDS, 50mM of Na phosphate buffer (pH 7.0), 150mM of NaCl, 1mM of MgCl2と0.2% AlkPhos DIRECT blocking reagent (Amersham Bioscience社製)による洗浄を行った後、マイクロアレイをイメージングプレート(富士写真フィルム社製)と2時間接触させ、BAS5000(富士写真フィルム社製)を用いてイメージングプレートをスキャンする事で、8,644個の遺伝子に相当する全11,168スポットの発現プロファイルを2回取得した。
【0115】
(バイオインフォマティクス解析)
LNM35とN15それぞれ2回、計4回の発現プロファイルに於いて、発現量(スキャンしたスポットの値)が0.1以下のスポットについては、検出限界のため、解析対象から除外した。
【0116】
非線形補正手法であるlowess手法を用いて、4回の発現プロファイルをnormalizeした後、LNM35とN15のそれぞれについて、平均値を求めた。
【0117】
LNM35とN15の発現プロファイルを比較し、2SD(標準偏差の2倍)以上発現差があるスポットを抽出した。
【0118】
さらに、抽出したスポットを対象に、LNM35で発現が亢進しているスポットでは、LNM35の2回の発現プロファイルの発現値が共に1.0より大きい、またN15で発現が亢進しているスポットでは、N15の2回の発現プロファイルの発現値が共に1.0より大きい、という条件に合致するスポットを検索したところ、45個の遺伝子に相当するスポットが抽出された。
【実施例3】
【0119】
(患者症例)
50の肺癌患者症例を、愛知県がんセンターの胸部外科(名古屋)で治癒的切除術を行い成功した患者のファイルから得た。すべての腫瘍標本をOCT化合物に包埋し、正規の検討部門からの必要な承認と患者からのインフォームドコンセントの書面を得たあとで−80℃に保存した。
【0120】
(発現プロファイルの取得)
腫瘍標本の凍結組織から、約7μm厚に約50切片を削りだした。10切片毎にギムザ染色し、病理医の指導のもと、腫瘍組織が大半を占める領域からRNeasyキット(Qiagen社、米国)を用いて全RNAを抽出した。オリゴ-dTプライマーとSuperScriptII逆転写酵素を用いて、100μCiの[33P]dCTP存在下で約5μgの全RNAを逆転写した。Invitrogen社製のcDNAマイクロアレイ(GeneFilter Human Microarrays Release IとRelease II)とハイブリダイズさせた後、マイクロアレイをイメージングプレート(富士フィルム社製)と2時間接触させ、BAS5000(富士フィルム社製)を用いてイメージングプレートをスキャンすることで、8,644個の遺伝子に相当する全11,168スポットの発現プロファイルを2回取得した。
【0121】
(バイオインフォマティクス解析)
rank-invariant手法をもちいて取得した発現プロファイルを補正した後、2回の平均値から発現値を求めた。
【0122】
(45個の転移関連遺伝子の発現パターンと再発・死亡の関係)
LNM35とN15の比較から抽出した45遺伝子の類似性をもとに、愛知県がんセンターで肺癌の手術を受けた50症例の肺癌患者のデータをクラスター解析した(図3A)。
【0123】
図中に赤色もしくは緑色で示されたドットは、個々の症例における各遺伝子の発現状態を示している。赤色はその遺伝子の発現が他の症例と比較して相対的に高いことを示しており、緑色はその遺伝子の発現が相対的に低いことを示している。また、図中の樹形図は類似性を示しており、類似度が高ければ樹形図の結びつきを示す枝は短く、類似度が低ければ樹形図の結びつきを示す枝は長くなる。類似度が高い症例から順に結び付け、最終的には1つの樹形図としてまとめられている。
【0124】
50症例の肺癌検体について、クラスタリング解析を行ったところ、左右2つの大群に分類された。左側の一群は発現が高い(赤いドットの)遺伝子の多くが、LNM35で発現が亢進している遺伝子であった。一方、右側の一群では、発現が高い遺伝子の多くが、LNM35で発現が抑制されている遺伝子であった。ここで、左側の一群をFatal群、右側の一群をFavorable群として、この2群の予後についてカプランマイヤー生存率解析を行ったところ、有意差をもって(P=0.0234)予後の差が検出された(図3B)。この結果、LNM35で発現が亢進している遺伝子群の発現が相対的に高い群(Fatal群)の予後は悪く、LNM35で発現が抑制されている遺伝子群の発現が相対的に高い群(Favorable群)の予後は良い、ということがヒト肺癌症例のデータを用いて、確認することができた。
【0125】
Harvard大で取得された62症例の肺癌患者のデータを用いて、クラスター解析した結果を図4Aに示した。
【0126】
他施設で得られたデータを解析し、図3と同様の結果が得られるか検討した。Harvard大のデータは我々のデータ取得手法とは異なる為、45個の遺伝子中、38個の遺伝子に関する発現情報のみ得る事が出来た。この38個の遺伝子の発現情報を用いて、図3と同様の解析を行った。
【0127】
62症例の肺癌検体について、クラスタリング解析を行った所、左右2つの大群に分類された。右側の一群は発現が高い(赤いドットの)遺伝子の多くが、LNM35で発現が亢進している遺伝子であった。一方、左側の一群では、発現が高い遺伝子の多くが、LNM35で発現が抑制されている遺伝子であった。ここで、右側の一群をFatal群、左側の一群をFavorable群として、この2群の予後についてカプランマイヤー生存率解析を行ったところ、有意差をもって(P=0.0385)予後の差が検出された(図4B)。この結果、LNM35で発現が亢進している遺伝子群の発現が相対的に高い群(Fatal群)の予後は悪く、LNM35で発現が抑制されている遺伝子群の発現が相対的に高い群(Favorable群)の予後は良い、ということがハーバード大で取得されたヒト肺癌症例のデータを用いても、確認することができた。
【0128】
オランダ国立癌研究所で取得された79症例の乳癌患者のデータを用いて、クラスター解析した結果を図5Aに示した。
【0129】
他施設で得られたデータを解析し、肺癌以外の固形癌で、図3と同様の結果が得られるか検討した。オランダ国立癌研究所のデータは我々のデータ取得手法とは異なる為、45個の遺伝子中、37個の遺伝子に関する発現情報のみ得ることが出来た。この37個の遺伝子の発現情報を用いて、図3と同様の解析を行った。
【0130】
79症例の乳癌検体について、クラスタリング解析を行った所、左右2つの大群に分類された。左側の一群は発現が高い(赤いドットの)遺伝子の多くが、LNM35で発現が亢進している遺伝子であった。一方、右側の一群では、発現が高い遺伝子の多くが、LNM35で発現が抑制されている遺伝子であった。ここで、左側の一群をFatal群、右側の一群をFavorable群として、この2群の予後についてカプランマイヤー生存率解析を行ったところ、有意差をもって(P=0.0032)予後の差が検出された(図5B)。この結果、LNM35で発現が亢進している遺伝子群の発現が相対的に高い群(Fatal群)の予後は悪く、LNM35で発現が抑制されている遺伝子群の発現が相対的に高い群(Favorable群)の予後は良い、ということがオランダ国立癌研究所で取得されたヒト乳癌症例のデータを用いても、確認することができた。
【0131】
(Cox比例ハザードモデルによる多変量解析)
LNM35とN15の比較から抽出した45遺伝子による予後指標の検討を行った(図6)。
【0132】
45遺伝子による術後予後の指標が、術後の予後因子として有効であるかどうかについて、COXの比例ハザードモデルによる、年齢(63歳以上/63歳未満)、性別(男性/女性)、喫煙歴(喫煙歴なし/あり)、組織型(扁平上皮癌/非扁平上皮癌)、病期(pSTAGE)、転移シグネチャー(Favorable/Fatal)の6つの項目を用いた多変量解析により検討を行った。その結果、病期と45遺伝子による転移シグネチャーの2項目のみが、術後予後因子として有効であるということが統計学的有意差をもって示された(病期:P=0.014、45遺伝子による転移シグネチャー:P=0.039)。なお、図中、Hazard ratioはハザード比、95%CIは95%信頼区間、P valueは危険率をそれぞれ示す。
【0133】
(術後予後が良い又は悪い癌の識別例)
術後予後が良い又は悪い癌を分類するために、シグナル−ノイズ関数(signal−to−noise metrics、Golubら、Science,Vol.286,pp531 to537,1999)を用いた。癌症例群を、術後予後が良い癌の場合class1、術後予後が悪い癌の場合class2とそれぞれ規定した場合、シグナル−ノイズ統計値である重みSは次式によって計算される。
S=(μclass1−μclass2/σclass1+σclass2)
【0134】
ここで、各遺伝子について、μclass1はclass1の全発現強度データの平均値を示し、μclass2はclass2の全発現強度データの平均値を示し、σclass1はclass1の全発現強度データの標準偏差を示し、σclass2はclass2の全発現強度データの標準偏差を示す。
【0135】
次に、遺伝子xに関する重み付き投票を、下記のWeighted−Voting の計算式を用いて計算する。
Vx=S(Gx−bx)
【0136】
ここで、VXは、遺伝子xに関する重み付き投票を示し、Sは上記式によって算出される重みを示し、GXは、遺伝子xの発現強度(又は発現レベル)を示し、bXは、
bX=(μ1+μ2)/2
(ここで、μ1及びμ2は、それぞれclass1、class2の各平均値の平均を示す。)によって示され、2つの群の中心(すなわち、重心)を示す。
【0137】
重心からのずれに応じて重みを加算していく手法により、各群のVXの総和が0より大きいとき、癌はclass1に分類され、VXの総和が0より小さいとき、癌はclass2に分類される、とすることができる。
【0138】
例えば、class1に属するsample1,2,3,4及び5と、class2に属するsample6,7,8,9及び10について、遺伝子(Gene)A,B,C(以上、術後予後が良いと特徴付けられる遺伝子)、遺伝子(Gene)X,Y,Z(以上、術後予後が悪いと特徴付けられる遺伝子)の発現強度(又は発現レベル)を測定し、各群の5つのサンプルの各遺伝子の発現強度の平均値(μ)と標準偏差(σ)を算出し、さらに、上記の式から、重み(S)と重心(bX)を計算する。
【0139】
型分類すべきsample Aとsample Bについて、各遺伝子の発現強度(又は発現レベル)を測定し、上記式から重み(S)、Gx−bxを計算して各VXを求め、さらに6つの遺伝子のVXの総和を求める。
【0140】
その結果、sampleAは、VXの総和が0より大きいため、class1と識別される。また、sampleBは、VXの総和が0より小さいため、class2と識別される。
【産業上の利用可能性】
【0141】
本発明により、癌患者における癌転移の可能性と予後の予測ができるため、癌の治療計画と予後の管理に多大な貢献をもたらすことができる。
【図面の簡単な説明】
【0142】
【図1】ヒト高転移肺癌細胞株LNM35の樹立手順を示す。
【図2】LNM35株とその親株との間の、培養細胞での運動能及び浸潤能、並びに、マウス移植後のリンパ節転移及び肺転移の割合の比較を示す。
【図3】愛知がんセンターの肺癌50症例データに適用したとき、肺癌患者が、45個の転移関連遺伝子の発現パターンと術後の生存者の割合との相関関係から、2つのグループに大別されることを示す。図3Aは階層的クラスタリング解析の結果を示す。図3Bはカプランマイヤー生存率解析の結果を示す(横軸:月数)。
【図4】ハーバード大学の肺癌62症例データ(Bhattacharjee Aら,Proc Natl Acad Sci USA 98:13790−95,2001)に適用したとき、肺癌患者が、45個の転移関連遺伝子の発現パターンと術後の生存者の割合との相関関係について、2つのグループに大別されることを示す。図4Aは階層的クラスタリング解析の結果を示す。図4Bはカプランマイヤー生存率解析の結果を示す(横軸:月数)。
【図5】オランダ国立癌研究所の乳癌79症例データ(van'tVeer LJら,Nature 415:530−6,2002)に適用したとき、乳癌患者が、45個の転移関連遺伝子の発現パターンと術後の生存者の割合との相関関係について、2つのグループに大別されることを示す。図5Aは階層的クラスタリング解析の結果を示す。図5Bはカプランマイヤー生存率解析の結果を示す(横軸:月数)。
【図6】術後5年生存の危険率に関する」Cox比例ハザードモデルによる多変量解析により決定された病期と独立した再発・死亡の予測因子を示す。
【特許請求の範囲】
【請求項1】
癌患者の術後の予後又は転移可能性をインビトロで予測する方法であって、該患者由来の生物学的検体中の、配列番号1〜45に示される塩基配列又はその変異配列を含む癌転移関連遺伝子マーカーの少なくとも1つの発現レベル又はその転写若しくは翻訳産物レベルを、該マーカーに対応するプローブを用いて測定し、術後の予後がより良い又は転移可能性がより低い患者群と術後の予後がより悪い又は転移可能性がより高い患者群との間の相対的な該レベルの差を指標にして、術後の予後又は転移可能性を判定することを含む、上記方法。
【請求項2】
前記癌転移関連遺伝子マーカーが、配列番号28〜45に示される塩基配列又はその変異配列からなるとき、前記患者は、術後の予後がより良い又は転移可能性がより低い患者として識別される、請求項1に記載の方法。
【請求項3】
前記癌転移関連遺伝子マーカーが、配列番号1〜27に示される塩基配列又はその変異配列からなるとき、前記患者は、術後の予後がより悪い又は転移可能性がより高い患者として識別される、請求項1に記載の方法。
【請求項4】
前記プローブが、配列番号1〜45に示される塩基配列からなるポリヌクレオチド、それに相補的なポリヌクレオチド、それらの変異体、それらにストリンジェントな条件下でハイブリダイズするポリヌクレオチド、或いは15以上の連続した塩基を含むそれらの断片からなる群から選択される、請求項1〜3のいずれか1項に記載の方法。
【請求項5】
前記プローブが、配列番号1〜45に示される塩基配列からなるポリヌクレオチド又はその変異体によってコードされるポリペプチドからなる群から選択されるポリペプチド又はその断片に対する抗体又はその断片である、請求項1〜3のいずれか1項に記載の方法。
【請求項6】
前記抗体が、ポリクローナル抗体、モノクローナル抗体又は抗ペプチド抗体である、請求項5に記載の方法。
【請求項7】
前記癌が固形癌である、請求項1〜6のいずれか1項に記載の方法。
【請求項8】
前記固形癌が肺癌又は乳癌である、請求項7に記載の方法。
【請求項9】
配列番号1〜45に示される塩基配列からなるポリヌクレオチド、それに相補的なポリヌクレオチド、それらの変異体、それらにストリンジェントな条件下でハイブリダイズするポリヌクレオチド、或いは15以上の連続した塩基を含むそれらの断片からなる群から選択される少なくとも1つのプローブを含む、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物。
【請求項10】
配列番号28〜45に示される塩基配列からなるポリヌクレオチド、それに相補的なポリヌクレオチド、それらの変異体、それらにストリンジェントな条件下でハイブリダイズするポリヌクレオチド、或いは15以上の連続した塩基を含むそれらの断片からなる群から選択される少なくとも1つのプローブを含む、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物。
【請求項11】
配列番号1〜27に示される塩基配列からなるポリヌクレオチド、それに相補的なポリヌクレオチド、それらの変異体、それらにストリンジェントな条件下でハイブリダイズするポリヌクレオチド、或いは15以上の連続した塩基を含むそれらの断片からなる群から選択される少なくとも1つのプローブを含む、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物。
【請求項12】
配列番号1〜45に示される塩基配列からなるポリヌクレオチド又はその変異体によってコードされるポリペプチドからなる群から選択されるポリペプチド又はその断片に対する抗体又はその断片からなる群から選択される少なくとも1つのプローブを含む、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物。
【請求項13】
配列番号28〜45に示される塩基配列からなるポリヌクレオチド又はその変異体によってコードされるポリペプチドからなる群から選択されるポリペプチド又はその断片に対する抗体又はその断片からなる群から選択される少なくとも1つのプローブを含む、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物。
【請求項14】
配列番号1〜27に示される塩基配列からなるポリヌクレオチド又はその変異体によってコードされるポリペプチドからなる群から選択されるポリペプチド又はその断片に対する抗体又はその断片からなる群から選択される少なくとも1つのプローブを含む、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物。
【請求項15】
前記プローブがキットの形態で含まれる、請求項9〜14のいずれか1項に記載の組成物。
【請求項16】
前記プローブがマイクロアレイの形態で含まれる、請求項9〜11のいずれか1項に記載の組成物。
【請求項17】
培養癌細胞を用いて、配列番号1〜27のいずれかの塩基配列を含む癌転移関連遺伝子又はその転写産物の阻害又は抑制について、或いは培養癌細胞の運動能及び/又は浸潤能の阻害又は抑制について、候補薬剤をスクリーニングすることを含む、癌転移抑制剤のスクリーニング方法。
【請求項18】
培養癌細胞を準備し、該細胞を候補薬剤の存在下で培養し、前記癌転移関連遺伝子又はその転写産物の発現の阻害又は抑制について、或いは培養癌細胞の運動能及び/又は浸潤能の阻害又は抑制について、候補薬剤をスクリーニングすることを含む、請求項17に記載の方法。
【請求項1】
癌患者の術後の予後又は転移可能性をインビトロで予測する方法であって、該患者由来の生物学的検体中の、配列番号1〜45に示される塩基配列又はその変異配列を含む癌転移関連遺伝子マーカーの少なくとも1つの発現レベル又はその転写若しくは翻訳産物レベルを、該マーカーに対応するプローブを用いて測定し、術後の予後がより良い又は転移可能性がより低い患者群と術後の予後がより悪い又は転移可能性がより高い患者群との間の相対的な該レベルの差を指標にして、術後の予後又は転移可能性を判定することを含む、上記方法。
【請求項2】
前記癌転移関連遺伝子マーカーが、配列番号28〜45に示される塩基配列又はその変異配列からなるとき、前記患者は、術後の予後がより良い又は転移可能性がより低い患者として識別される、請求項1に記載の方法。
【請求項3】
前記癌転移関連遺伝子マーカーが、配列番号1〜27に示される塩基配列又はその変異配列からなるとき、前記患者は、術後の予後がより悪い又は転移可能性がより高い患者として識別される、請求項1に記載の方法。
【請求項4】
前記プローブが、配列番号1〜45に示される塩基配列からなるポリヌクレオチド、それに相補的なポリヌクレオチド、それらの変異体、それらにストリンジェントな条件下でハイブリダイズするポリヌクレオチド、或いは15以上の連続した塩基を含むそれらの断片からなる群から選択される、請求項1〜3のいずれか1項に記載の方法。
【請求項5】
前記プローブが、配列番号1〜45に示される塩基配列からなるポリヌクレオチド又はその変異体によってコードされるポリペプチドからなる群から選択されるポリペプチド又はその断片に対する抗体又はその断片である、請求項1〜3のいずれか1項に記載の方法。
【請求項6】
前記抗体が、ポリクローナル抗体、モノクローナル抗体又は抗ペプチド抗体である、請求項5に記載の方法。
【請求項7】
前記癌が固形癌である、請求項1〜6のいずれか1項に記載の方法。
【請求項8】
前記固形癌が肺癌又は乳癌である、請求項7に記載の方法。
【請求項9】
配列番号1〜45に示される塩基配列からなるポリヌクレオチド、それに相補的なポリヌクレオチド、それらの変異体、それらにストリンジェントな条件下でハイブリダイズするポリヌクレオチド、或いは15以上の連続した塩基を含むそれらの断片からなる群から選択される少なくとも1つのプローブを含む、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物。
【請求項10】
配列番号28〜45に示される塩基配列からなるポリヌクレオチド、それに相補的なポリヌクレオチド、それらの変異体、それらにストリンジェントな条件下でハイブリダイズするポリヌクレオチド、或いは15以上の連続した塩基を含むそれらの断片からなる群から選択される少なくとも1つのプローブを含む、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物。
【請求項11】
配列番号1〜27に示される塩基配列からなるポリヌクレオチド、それに相補的なポリヌクレオチド、それらの変異体、それらにストリンジェントな条件下でハイブリダイズするポリヌクレオチド、或いは15以上の連続した塩基を含むそれらの断片からなる群から選択される少なくとも1つのプローブを含む、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物。
【請求項12】
配列番号1〜45に示される塩基配列からなるポリヌクレオチド又はその変異体によってコードされるポリペプチドからなる群から選択されるポリペプチド又はその断片に対する抗体又はその断片からなる群から選択される少なくとも1つのプローブを含む、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物。
【請求項13】
配列番号28〜45に示される塩基配列からなるポリヌクレオチド又はその変異体によってコードされるポリペプチドからなる群から選択されるポリペプチド又はその断片に対する抗体又はその断片からなる群から選択される少なくとも1つのプローブを含む、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物。
【請求項14】
配列番号1〜27に示される塩基配列からなるポリヌクレオチド又はその変異体によってコードされるポリペプチドからなる群から選択されるポリペプチド又はその断片に対する抗体又はその断片からなる群から選択される少なくとも1つのプローブを含む、癌患者の術後の予後又は転移可能性をインビトロで予測するための組成物。
【請求項15】
前記プローブがキットの形態で含まれる、請求項9〜14のいずれか1項に記載の組成物。
【請求項16】
前記プローブがマイクロアレイの形態で含まれる、請求項9〜11のいずれか1項に記載の組成物。
【請求項17】
培養癌細胞を用いて、配列番号1〜27のいずれかの塩基配列を含む癌転移関連遺伝子又はその転写産物の阻害又は抑制について、或いは培養癌細胞の運動能及び/又は浸潤能の阻害又は抑制について、候補薬剤をスクリーニングすることを含む、癌転移抑制剤のスクリーニング方法。
【請求項18】
培養癌細胞を準備し、該細胞を候補薬剤の存在下で培養し、前記癌転移関連遺伝子又はその転写産物の発現の阻害又は抑制について、或いは培養癌細胞の運動能及び/又は浸潤能の阻害又は抑制について、候補薬剤をスクリーニングすることを含む、請求項17に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2007−175023(P2007−175023A)
【公開日】平成19年7月12日(2007.7.12)
【国際特許分類】
【出願番号】特願2005−379867(P2005−379867)
【出願日】平成17年12月28日(2005.12.28)
【出願人】(504139662)国立大学法人名古屋大学 (996)
【Fターム(参考)】
【公開日】平成19年7月12日(2007.7.12)
【国際特許分類】
【出願日】平成17年12月28日(2005.12.28)
【出願人】(504139662)国立大学法人名古屋大学 (996)
【Fターム(参考)】
[ Back to top ]

