癌治療のために単独で用いるまたは化学療法薬と併用するヒストンデアセチラーゼ(HDAC)阻害剤
【課題】癌の治療法の提供。
【解決手段】血液の癌(たとえば、多発性骨髄腫、白血病、リンパ腫)の治療法では、治療上有効な量のヒストンデアセチラーゼ阻害剤、たとえばヒストンデアセチラーゼ(HDAC)阻害剤PXD-101を投与することを含む。また、癌(直腸癌、結腸癌、卵巣癌等の固形腫瘍癌;多発性骨髄腫、白血病、リンパ腫等の血液の癌)を治療する方法に関し、第1の量のPXD-101等のHDAC阻害剤、および第2の量の他の化学療法薬、たとえばVEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、またはメルファランから選択される他の化学療法薬を、投与することを含み、この第1の量および第2の量を合わせた量が治療上有効な量となる。
【解決手段】血液の癌(たとえば、多発性骨髄腫、白血病、リンパ腫)の治療法では、治療上有効な量のヒストンデアセチラーゼ阻害剤、たとえばヒストンデアセチラーゼ(HDAC)阻害剤PXD-101を投与することを含む。また、癌(直腸癌、結腸癌、卵巣癌等の固形腫瘍癌;多発性骨髄腫、白血病、リンパ腫等の血液の癌)を治療する方法に関し、第1の量のPXD-101等のHDAC阻害剤、および第2の量の他の化学療法薬、たとえばVEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、またはメルファランから選択される他の化学療法薬を、投与することを含み、この第1の量および第2の量を合わせた量が治療上有効な量となる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は癌の治療法に関する。ある観点から見ると、本発明は、癌(たとえば、固形腫瘍癌、その例としては直腸癌、結腸癌、卵巣癌;血液の癌、たとえば、多発性骨髄腫、白血病、リンパ腫)を治療する方法に関するものであって、その方法は、第1の量のヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤、および第2の量の他の化学療法薬、たとえばVEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、またはメルファランから選択される他の化学療法薬を、それを必要とする患者に投与することを含んでなり、この第1の量および第2の量が合わさって治療上有効な量となる。もう一つの観点から言えば、本発明は血液の癌(たとえば、多発性骨髄腫、白血病、リンパ腫)の治療法に関するものであり、その方法は、治療上有効な量のヒストンデアセチラーゼ阻害剤、たとえば、本明細書に記載のヒストンデアセチラーゼ(HDAC)阻害剤、たとえばPXD-101を、それを必要とする患者に投与することを含んでなる。
【背景技術】
【0002】
本発明、ならびに本発明に関わる最新技術をより完全に記載し、開示するために、いくつかの特許および出版物が本明細書に引用される。こうした参考文献はそれぞれ、個々の参考文献が具体的に、個別に、参照により組み入れられると示される範囲で、参照としてその全体を本明細書に含めるものとする。
【0003】
本明細書を通じ、特許請求の範囲を含めて、文脈上他の意味に解するべき場合を除き、「含む」または「含んでなる」という語は、提示された整数もしくはステップ、または整数群もしくはステップ群を包含するが、その他の整数もしくはステップ、または整数群もしくはステップ群を除外するものではないと理解されるべきである。
【0004】
本明細書で使用される場合、単数の表現は、文脈上あきらかにそうでないと指示されない限り、単数および複数の指示物を包含する。したがって、たとえば、「活性物質」および「薬理活性物質」に対する言及は、単一の活性物質、ならびに2種以上の異なる活性物質の組み合わせを包含し、「担体」への言及は、単一の担体のみならず、2種以上の担体の混合物も包含するが、それ以外も同様である。
【0005】
値域は、本明細書では、多くの場合、「約を冠したある特定の値から」および/または「約を冠した別の特定の値まで」として表現される。このように値域が表現される場合、「ある特定の値から」および/または「他の特定の値まで」は、別の実施形態に含まれる。同様に、先行して「約」を使用することによって、値が概数として表現されるとき、当然のことながら、特定の値は別の実施形態を構成する。
【0006】
多発性骨髄腫
多発性骨髄腫は、散在する形質細胞の悪性腫瘍であり、米国では毎年およそ14,600人が新たに罹患する。おもに中高年を襲う、このまれな血液疾患の原因は、遺伝的素因および環境的要因の関与はあるが、ほとんど不明である。発症時から、クローン性増殖に起因する悪性の形質細胞が骨髄に蓄積し、異常に高いレベルの免疫グロブリンを産生する。多発性骨髄腫は、初期にはまったく症状がないことがあるため、早期に診断することが困難である。特に、肋骨または脊椎の圧迫骨折に続いて起こる骨の痛みが、もっともよく見られる症状である。
【0007】
デキサメタゾンは、この疾患の一次治療によく使用されるレジメンである。つい最近、ビンクリスチン、ドキソルビシン、およびデキサメタゾンの併用(VAD)が、多発性骨髄腫を治療するために用いられるようになった。しかしながら、効果的な維持療法はない。デキサメタゾン治療の奏効率は約25-35%である。
【0008】
多くの患者において、自家幹細胞移植(ASCT)によってサポートされる高用量化学療法は、最初の診断から12か月以内に治療を行えば、無再発生存期間を延ばすことができる。しかしながら、高用量化学療法および自家末梢幹細胞移植を受けた患者のほぼすべてが、結局再発する。
【0009】
リンパ腫
長年にわたる新しい治療法の開発研究にもかかわらず、リンパ系の癌、すなわちリンパ腫は、相変わらず非常によく見られる。たとえば、米国では毎年60,000人以上が、リンパ腫と診断されるが、これには55,000例以上の非ホジキンリンパ腫(NHL)が含まれており、その数は着実に増加しつつある。それに加えて、こうした疾患に罹患した人の予後は芳しくないことが多く、リンパ腫患者の生存率は依然として低いままである。こうした疾患を治療する新しい方法が必要であることは明白である
リンパ腫の従来の治療法は一般に、リンパ腫のタイプ、ならびに患者の病歴によって決まるが、多くのリンパ腫の一次治療には、典型的には化学療法が含まれる。この化学療法は、化合物の「カクテル」、たとえばCHOPの処方の投与を必要とすることが多いが、これにはシクロホスファミド、ドキソルビシン、ビンクリスチンおよびプレドニゾンが含まれる。さらに一部の癌一次治療には、他の方式の癌治療、たとえば放射線療法も含まれる。
【0010】
多くの場合、患者は、初めは、こうした一次治療に反応するが、その後再発する、すなわち腫瘍が再び出現し、もしくは再び増殖しはじめる。こうした1回の再発後、患者はさらに、たとえばCHOPもしくは他の処方で、化学療法を受けることが多いが、場合によっては、患者は骨髄移植のような他の手段による治療を受ける。この場合もやはり、多くの場合、患者はこうした追加治療に初めは反応するが、その後また別の再発をする。一般に、患者の再発が多いほど、最良のその後の治療について、技術的に、合意が得られにくい。他に、患者が、初めから治療にまったく反応することができない例もあり、この患者はしたがって、難治性の癌であると言われる。こうした場合にも同様に、その後の最適な治療について、合意はほとんど得られない。
【0011】
白血病
白血病は、骨髄および血液の悪性の癌である。これは、血液細胞の制御されない増殖を特徴とする。よく見られるタイプの白血病は4つに分類される:急性もしくは慢性骨髄性白血病、これは骨髄の骨髄系要素(白血球、赤血球、巨核球)に関わる、ならびに急性もしくは慢性リンパ球性白血病、これはリンパ系の細胞に関わる。
【0012】
急性白血病は、結果として、骨髄および血液中に未熟で機能しない細胞(芽球)の多大な蓄積をもたらす、急速に進行する疾患である。骨髄は多くの場合、もはや正常な赤血球および白血球ならびに血小板を十分に産生することができない。貧血、赤血球の欠乏が、ほとんどすべての白血病患者に発生する。正常な白血球の不足は、身体が感染症と戦う能力を損なう。血小板の不足は、結果として、挫傷形成および出血傾向をもたらす。これに対して、慢性白血病は、もっとゆっくり進行して、無秩序な増殖をもたらし、それによって成熟(分化)細胞の著しい過剰増殖に至る。一般に、急性白血病は、慢性型とは異なり、腫瘍クローンの除去によって治癒する可能性がある。
【0013】
米国では今年、28,700件の白血病の新規症例が発生することが見込まれる;急性白血病と慢性型はほぼ同数である。大半の症例は高齢者での発生である。実際、白血病の全症例の半分以上が、60歳より高齢の人に発生している。成人にもっともよく見られる白血病は、急性骨髄性白血病(AML)(毎年9,400人の新患が見込まれる)、慢性リンパ球性白血病(CLL)(本年の新患は約7.300人)、および慢性骨髄性白血病(CML)である。小児にもっともよく見られるタイプの白血病は、急性リンパ球性白血病(ALL)である。
【0014】
白血病の標準治療は通常、化学療法、および/または骨髄移植、および/または放射線治療を要する。
【0015】
白血病の化学療法は通常、2つ以上の抗癌剤の併用を要する。およそ40の異なる薬物が現在、白血病治療に使用されている。一般的な組み合わせの一部として、ドキソルビシンもしくはダウノルビシンもしくはミトキサントロンもしくはチオグアニンのいずれかとシタラビンの組み合わせ、メトトレキサートとメルカプトプリン、エトポシドとミトキサントロン、ビンクリスチンとアスパラギナーゼ、ダウノルビシンおよびプレドニゾン、ビンクリスチンとシクロホスファミド、シタラビンおよびプレドニゾン、ビンクリスチンおよびプレドニゾンとともにシクロホスファミドの組み合わせ、シタラビンおよびチオグアニンとダウノルビシンの組み合わせ、ならびにビンクリスチンおよびプレドニゾンとダウノルビシンの組み合わせが挙げられる。
【0016】
骨髄移植の主な2つのタイプは、自家(患者自身の骨髄を使用する)および同種(適合するドナーの骨髄を使用する)である。
【0017】
放射線治療は、高エネルギー放射線の使用を必要とするが、通常、骨髄移植の前にすべての白血病細胞を死滅させるために行われる。
【0018】
白血病の治療はたいへん複雑である。白血病の患者においては、ある一連の治療後の患者であっても、寛解に非常に多くの臨床的多様性が見られる。治療に抵抗性を示す患者は、抵抗性が生じる時期を問わず、生存期間が非常に短い。現行の治療プログラムによる予後の改善にもかかわらず、あらゆるタイプの白血病治療のための新規薬剤を発見する必要性は依然として存在する。
【0019】
したがって、多発性骨髄腫の治療を改善する差し迫った必要性がある。具体的には、多発性骨髄腫の治療において、一次治療としても、再発患者の治療目的としても、奏効率の向上、および/または再発率の低下を可能にする、効果的な単剤および併用療法を発見する必要がある。
【発明の概要】
【0020】
発明の概要
癌治療における併用療法
本発明は、一つには、PXD-101のようなヒストンデアセチラーゼ(HDAC)阻害剤を、他の化学療法薬とともに癌の治療に使用すると相乗効果がある、という発見に基づくものである。
【0021】
したがって、本発明のある態様は、第1の量のヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤、ならびに第2の量の他の化学療法薬、たとえばVEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファランから選択される他の化学療法薬を、それを必要とする患者に投与することを含んでなる、癌を治療する方法であり、この第1の量および第2の量を合わせたものが、治療上有効な量となる。
【0022】
本発明のもう一つの態様は、癌を治療する方法に使用するためのヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤であり、前記治療は、(i)前記ヒストンデアセチラーゼ阻害剤、ならびに(ii)他の化学療法薬、たとえばVEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファランから選択される他の化学療法薬、による治療を含んでなる。
【0023】
本発明のまた別の態様は、癌を治療するための薬剤の製造において、ヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤を使用することであり、前記治療は、(i)前記ヒストンデアセチラーゼ阻害剤、ならびに(ii)他の化学療法薬、たとえばVEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファランから選択される他の化学療法薬、による治療を含んでなる。
【0024】
ある実施形態において、癌は固形腫瘍癌、たとえば直腸癌、結腸癌、卵巣癌である。ある実施形態において、癌は血液の癌である。ある実施形態において、血液の癌は、多発性骨髄腫、リンパ腫、または白血病である。ある実施形態において、血液の癌は多発性骨髄腫である。ある実施形態において、血液の癌は、リンパ腫、たとえば非ホジキンリンパ腫(NHL)である。ある実施形態において、血液の癌は、白血病、たとえば、骨髄性白血病、リンパ球性白血病であり、その例としては、急性骨髄性白血病(AML)、慢性骨髄性白血病(CML)、急性リンパ球性白血病(ALL)、慢性リンパ球性白血病(CLL)である。
【0025】
本発明のもう一つの態様は、腫瘍細胞(たとえば、骨髄腫細胞、形質細胞腫細胞、もしくは形質細胞白血病細胞といった、血液の癌に特徴的な腫瘍細胞)の最終分化、細胞増殖停止、および/またはアポトーシスを選択的に誘導する、もしくは前記腫瘍細胞の生存能を低下させる方法(たとえば、in vitro法、in vivo法)であって、その方法は、第1の量のヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤、ならびに第2の量の他の化学療法薬、たとえばVEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファランから選択される他の化学療法薬を、腫瘍細胞と接触させることを含んでなり、この第1の量および第2の量を合わせたものが、有効な量となる。
【0026】
本発明のもう一つの態様は、腫瘍細胞(たとえば、骨髄腫細胞、形質細胞腫細胞、もしくは形質細胞白血病細胞といった、血液の癌に特徴的な腫瘍細胞)の細胞増殖を防止、阻害(完全に、もしくは部分的に)、または停止する方法(たとえば、in vitro法、in vivo法)であって、その方法は、第1の量のヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤、ならびに第2の量の他の化学療法薬、たとえばVEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファランから選択される他の化学療法薬を、腫瘍細胞と接触させることを含んでなり、この第1の量および第2の量を合わせたものが、有効な量となる。
【0027】
血液の癌の治療
本発明は、一つには、血液の癌(たとえば、多発性骨髄腫、白血病、リンパ腫)に対する治療上有効な処置を提供するために、PXD-101のようなヒストンデアセチラーゼ(HDAC)阻害剤を使用することができるという発見に基づく。具体的には、PXD-101は、血液の癌細胞において、細胞の増殖、遊走を阻害し、生存能を低下させ、および/またはアポトーシスを誘導することが明らかになった。
【0028】
したがって、本発明のある態様は、治療上有効な量のヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤を、必要な患者に投与することを含んでなる、血液の癌を治療する方法である。
【0029】
本発明のもう一つの態様は、血液の癌の治療法に用いる、ヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤である。
【0030】
本発明のまた別の態様は、血液の癌の治療のための薬剤の製造における、ヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤の使用である。
【0031】
ある実施形態において、血液の癌は、多発性骨髄腫、リンパ腫、または白血病である。ある実施形態において、血液の癌は多発性骨髄腫である。ある実施形態において、血液の癌は、リンパ腫、たとえば非ホジキンリンパ腫(NHL)である。ある実施形態において、血液の癌は、白血病、たとえば、骨髄性白血病、リンパ球性白血病であり、その例としては、急性骨髄性白血病(AML)、慢性骨髄性白血病(CML)、急性リンパ球性白血病(ALL)、慢性リンパ球性白血病(CLL)である。
【0032】
本発明のもう一つの態様は、たとえば、骨髄腫細胞、形質細胞腫細胞、もしくは形質細胞白血病細胞といった、血液の癌に特徴的な腫瘍細胞の最終分化、細胞増殖停止、および/またはアポトーシスを選択的に誘導する、もしくはその生存能を低下させる方法(たとえば、in vitro法、in vivo法)であって、その方法は、有効量のヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤と腫瘍細胞を接触させることを含んでなる。
【0033】
本発明のもう一つの態様は、たとえば、骨髄腫細胞、形質細胞腫細胞、もしくは形質細胞白血病細胞といった、血液の癌に特徴的な腫瘍細胞の細胞増殖を防止、阻害(完全に、もしくは部分的に)、または停止する方法(たとえば、in vitro法、in vivo法)であって、その方法は、有効量のヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤と、腫瘍細胞とを接触させることを含んでなる。
【図面の簡単な説明】
【0034】
【図1】骨髄腫細胞株(すなわちU266)に対するPXD-101およびデキサメタゾンの効果に関する併用試験の結果を示すグラフである(実施例2を参照されたい)。
【図2】PXD-101、ボルテゾミブ(Velcade(登録商標))、もしくはその両方による治療について、多発性骨髄腫細胞株(U266)の生存率を示す棒グラフである(実施例3を参照されたい)。
【図3】SAHA、ボルテゾミブ(Velcade(登録商標))もしくはその両方による治療について、多発性骨髄腫細胞株(U266)の生存率を示す棒グラフである(実施例3を参照されたい)。
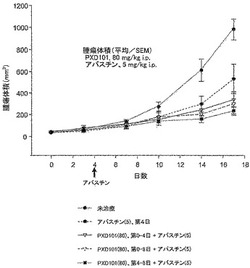
【図4】卵巣腫瘍細胞株A2780のマウス異種移植片におけるPXD-101のアバスチン(登録商標)とのin vivo相乗作用を示す(実施例7を参照されたい)。
【図5】結腸癌細胞株SU-DHL-4において、PXD-101とリツキシマブとの相乗作用を示すグラフである。PXD-101とリツキシマブとの相乗作用は、リンパ腫細胞株RamosおよびRajiにも見られた(実施例2を参照されたい)。
【発明を実施するための形態】
【0035】
発明の詳細な説明
制限するつもりではなく、開示内容を明確にするためにのみ、本発明の詳細な説明は、下記の小項目に分けられる:
I. ヒストンデアセチラーゼおよびヒストンデアセチラーゼ阻害剤
II. 化学療法薬
III. 治療上の使用
IV. 投与法および投与量
V. 医薬組成物
【0036】
I. ヒストンデアセチラーゼおよびヒストンデアセチラーゼ阻害剤
ヒストンデアセチラーゼは、ヒストンおよび非ヒストンタンパク質(p53、チューブリン、および各種の転写因子)の可逆的なアセチル化に関与する。哺乳類HDACは、既知の酵母因子との類似性に基づいて、3クラスに分類されている。クラスI HDAC(HDAC1、2、3および8)は、酵母RPD3タンパク質との類似性を有し、核内にあり、転写コレプレッサーと結合した複合体として見出される。クラスII HDAC(HDAC4、5、6、7および9)は、酵母HDA1タンパク質と類似しており、核にも細胞質内にも局在する。クラスIII HDACは、酵母SIR2タンパク質に類縁性のあるNAD依存性酵素からなる構造的に遠いクラスを形成する。
【0037】
HDAC活性の阻害を示す化合物は、5つの構造的に多様なクラスに分類される:(1)ヒドロキサム酸;(2)環状テトラペプチド;(3)脂肪族酸;(4)ベンズアミド;および(5)求電子性ケトン。
【0038】
ヒドロキサム酸は、最初に同定されたHDAC阻害剤の一つであり、こうした物質は、HDAC阻害剤のモデルファーマコフォアを明らかにするのに役立った。こうした物質のリンカードメインは、直鎖もしくは環状構造からなり、飽和もしくは不飽和のいずれかであって、表面認識ドメインは、一般に、疎水基であり、もっとも多くの場合芳香族である。第I相および第II相臨床試験が、PXD-101を含めて、いくつかのヒドロキサム酸を基本とするHDAC阻害剤について、現在、進行中である。
【0039】
PXD-101は、低いマイクロモル数でさまざまな腫瘍細胞株の増殖を阻止し(IC50 0.08-2.43 μM)、HDAC酵素活性を阻害する(IC50 9-110 nM)、非常に強力なHDAC阻害剤である。異種移植モデルにおいて、PXD-101は、腫瘍増殖を鈍化させる。それに加えて、PXD-101は、増殖の速い細胞において、細胞周期停止およびアポトーシスを引き起こす。
【0040】
ヒドロキサム酸を基本とするHDAC阻害剤は、本発明で使用するのに特に好適である。
【0041】
ある実施形態において、本発明で使用されるHDAC阻害剤は、下記の式の化合物、ならびに製薬上許容されるそれらの塩および溶媒和物から選択される:
【化1】

【0042】
[式中、
A は、非置換フェニル基であり、
Q1 は、共有結合、C1-7アルキレン基、またはC2-7アルケニレン基であり、
J は
【化2】

【0043】
であり、
R1 は、水素、C1-7アルキル、C3-20ヘテロシクリル、C5-20アリール、またはC5-20アリール-C1-7アルキルであり、
Q2 は
【化3】

【0044】
または
【化4】

【0045】
である]。
【0046】
ある実施形態において、Q1 は共有結合、C1-4アルキレン基、またはC2-4アルケニレン基である。
【0047】
ある実施形態において、Q1 は共有結合である。
【0048】
ある実施形態において、Q1 はC1-7アルキレン基である。
【0049】
ある実施形態において、Q1 is -CH2-、-C(CH3)-、-CH2CH2-、-CH2CH(CH3)-、-CH2CH(CH2CH3)-、-CH2CH2CH2-、または-CH2CH2CH2CH2-である。
【0050】
ある実施形態において、Q1 はC2-7アルケニレン基である。
【0051】
ある実施形態において、Q1 は-CH=CH-または-CH=CH-CH2-である。
【0052】
ある実施形態において、R1 は水素、またはC1-7アルキルである。
【0053】
ある実施形態において、R1 は水素、またはC1-3アルキルである。
【0054】
ある実施形態において、R1 は水素、-Me、-Et、-nPr、-iPr、-nBu、-iBu、-sBu、またはtBuである。
【0055】
ある実施形態において、R1 は水素、-Me、または-Etである。
【0056】
ある実施形態において、R1 は水素である。
【0057】
ある実施形態において、Q2 は下記のとおりである:
【化5】

【0058】
ある実施形態において、Q2 は下記のとおりである:
【化6】

【0059】
上記実施形態のすべての適合する組み合わせは、それぞれの特定の組み合わせが、個々に、しかも明示的に、列挙されているかのように、本明細書で開示される。
【0060】
ある実施形態において、本発明で使用されるHDAC阻害剤は、下記の式の化合物、ならびに製薬上許容されるそれらの塩もしくは溶媒和物から選択される:
【化7】



【0061】
ある実施形態において、本発明で使用されるHDAC阻害剤は、下記の式の化合物(PXD-101としても知られている)、ならびに製薬上許容されるその塩および溶媒和物から選択される:
【化8】

【0062】
本発明で使用するのに適した他のHDAC阻害剤としては、U.S.S.N. 10,381,790; 10/381,794; 10/381,791に記載の化合物があるが、これらは参照としてその全体を本明細書に含めるものとする。
【0063】
立体異性体:
上記化合物の立体異性体は、本発明の範囲に含まれる。多くの有機化合物は、平面偏光面を回転させることができる、光学活性体として存在する。光学活性化合物を説明する際には、接頭辞DおよびL、またはRおよびSを用いて、その分子の不斉中心(1つもしくは複数)に関する絶対立体配置を示す。接頭辞dおよびl、または(+)および(-)は、化合物による平面偏光の回転の様相を示すために用いられ、(-)もしくはlは、その化合物が左旋性であることを意味する。(+)もしくはdが前に付いた化合物は、右旋性である。所与の化学構造に関して、こうした化合物は立体異性体と呼ばれるが、これらは互いに重ね合わせることができない鏡像であること以外は、同一である。特定の立体異性体は、エナンチオマーとも称され、このような異性体の混合物はエナンチオマー混合物と呼ばれることが多い。エナンチオマーの50:50混合物は、ラセミ混合物と呼ばれる。本明細書に記載の化合物の多くは、1つもしくは複数の不斉中心を有するので、異なるエナンチオマー型として存在する可能性がある。必要に応じて、不斉炭素は星印(*)で示される。本発明の化学式において、不斉炭素への結合を直線として表示する場合、当然のことながら、その不斉炭素の(R)および(S)立体配置はともにこの化学式に包含され、したがってエナンチオマーもその混合物もこれに含まれる。当技術分野で使用されるように、不斉炭素について絶対配置を指定することが求められる場合、不斉炭素への結合のうち1つは楔形で表示され(平面より上にある原子への結合)、もう1つは、一連の短い平行線、もしくは短い平行線からなる楔形として表示することができる(平面より下にある原子への結合)。Cahn-Inglod-Prelogシステムを用いて、不斉炭素の(R)および(S)立体配置を割り当てることができる。
【0064】
本発明で使用されるHDAC阻害剤が1つの不斉中心を有する場合、その化合物は2つのエナンチオマーとして存在しており、この場合、その化合物への言及は本明細書では2つのエナンチオマーの双方に関わるものであり、エナンチオマーの混合物、たとえばラセミ混合物と呼ばれる特殊な50:50混合物にも関するものである。エナンチオマーは、当業者に公知の方法で分離することができるが、その方法は、たとえば、結晶化などによって分離可能なジアステレオ異性体の塩を形成すること(たとえば、CRC Handbook of Optical Resolutions via Diastereomeric Salt Formation by David Kozma (CRC Press, 2001)を参照);たとえば結晶化、気-液または液体クロマトグラフィーにより分離することができるジアステレオ異性体誘導体もしくは複合体を形成すること;エナンチオマー特異的試薬を用いた一方のエナンチオマーの選択的反応、たとえば、酵素によるエステル化;または、キラル環境における気-液もしくは液体クロマトグラフィー、たとえば、キラル担体(たとえば、結合したキラルリガンドを有するシリカ)での前記クロマトグラフィー、もしくはキラル溶媒存在下での前記クロマトグラフィー、による。当然のことながら、上記の分離法の一つによって望ましいエナンチオマーが別の化学物質に変換される場合には、望ましいエナンチオマーを遊離するために、追加のステップが必要である。あるいはまた、光学活性試薬、基質、触媒、もしくは溶媒を用いた不斉合成によって、または不斉転換により一方のエナンチオマーを他方に変換することによって、特定のエナンチオマーを合成することができる。
【0065】
不斉炭素における特定の絶対立体配置の指定は、化合物の指定された型のエナンチオマーが、鏡像体過剰(ee)の状態であること、すなわち言い換えると、実質的に他方のエナンチオマーがないことを意味するものと理解される。たとえば、"R"型の化合物には、実質的にその化合物の"S"型はなく、したがって、"R"型の鏡像体過剰状態である。逆に、"S"型の化合物には、実質的にその化合物の"R"型はなく、したがって"S"型の鏡像体過剰の状態である。鏡像体過剰は、本明細書で使用される場合、特定のエナンチオマーが50%を越えて存在することである。たとえば、鏡像体過剰は、約60%以上、たとえば約70%以上、たとえば約80%以上、たとえば約90%以上とすることができる。特定の実施形態において、一定の絶対立体配置が指定される場合、記載の化合物の鏡像体過剰率は少なくとも約90%である。さらに特定した実施形態において、化合物の鏡像体過剰率は、少なくとも約95%、たとえば少なくとも約97.5%、たとえば少なくとも約99%鏡像体過剰である。
【0066】
本発明で使用されるHDAC阻害剤が2つ以上の不斉炭素を有する場合、3つ以上の光学異性体があって、ジアステレオ異性体として存在する可能性があるが、このような場合、本明細書でのこうした化合物への言及は、その化合物のそれぞれのジアステレオ異性体、およびそれらの混合物に関わる。たとえば、2つの不斉炭素がある場合、化合物は最大4つの光学異性体を有する可能性があり、2対のエナンチオマー((S,S)/(R,R)および(R,S)/(S,R))を有する可能性がある。エナンチオマー対(たとえば、(S,S)/(R,R))は、互いに鏡像の立体異性体である。鏡像でない立体異性体(たとえば、(S,S)および(R,S))がジアステレオマーである。ジアステレオ異性体対は、当業者に知られている方法、たとえば、クロマトグラフィーもしくは結晶化によって分離することができ、個々のエナンチオマーはそれぞれの対の中で上記のように分離することができる。
【0067】
塩および溶媒和物:
本明細書に記載の活性化合物は、上記のように、そうした化合物の製薬上許容される塩の形で調製することができる。製薬上許容される塩は、親化合物の望ましい生物活性を維持しているが望ましくない毒性効果を与えない塩である。製薬上許容される塩の例は、Bergeら、1977, "Pharmaceutically Acceptable Salts," J. Pharm. Sci., Vol. 66, pp. 1-19において検討されている。記載の活性化合物は、上記のように、溶媒和物の形で調製することができる。「溶媒和物」という用語は、本明細書では、溶質(たとえば、活性化合物、活性化合物の塩)と溶媒の複合体を指す従来の意味で用いられる。溶媒が水である場合、溶媒和物は、簡便に、水和物、たとえば、0.5水和物、一水和物、二水和物、三水和物、などと呼ぶことができる。
【0068】
プロドラッグ:
本明細書に記載のHDAC阻害剤のプロドラッグも、本発明における使用に適している。どのような化合物のプロドラッグも、周知の薬理学的手法を用いて作製することができる。
【0069】
異性体、ホモログ、およびアナログ:
本明細書に記載のHDAC阻害剤の異性体、ホモログおよびアナログも、本発明における使用に適している。これに関連して、ホモログは、上記化合物への、相当な構造的類似性を有する分子である;アナログは、構造的類似性に関わらず、相当の生物学的類似性を有する分子である;また、異性体は、同じ分子式を有するが構造の異なる化合物である(たとえば、メタ、パラ、またはオルト配置)。
【0070】
II. 化学療法薬
本発明での使用に適したもう一方の化学療法薬(すなわち、HDAC阻害剤と併せて使用される、もう一つの化学療法薬)としては、他の抗腫瘍性物質があるが、たとえばこれらは下記から選択される:
有糸分裂阻害剤、たとえば、ビンブラスチン;
アルキル化剤、たとえば、シスプラチン、カルボプラチン、およびシクロホスファミド;
微小管重合阻害剤、たとえば、パクリタキセル、または他のタキサン類;
代謝拮抗薬、たとえば、5-フルオロウラシル、カペシタビン、シトシンアラビノシド、およびヒドロキシ尿素、または、たとえば、インターカレートする抗生物質、たとえば、アドリアマイシンおよびブレオマイシン;
免疫調節薬、たとえば、レナリドマイド(CC-5013 /Revlimid(商標名));
免疫賦活薬、たとえば、トラスツズマブ;
DNA合成阻害薬、たとえば、ゲムシタビン;
酵素、たとえば、アスパラギナーゼ;
トポイソメラーゼ阻害剤、たとえば、エトポシド;
プロテアソーム阻害剤、たとえば、ボルテゾミブ;
生物学的応答調節物質、たとえば、インターフェロン;
コルチコステロイド、たとえば、デキサメタゾン、および抗ホルモン、たとえば、タモキシフェンのような抗エストロゲン、ならびに(4'-シアノ-3-(4-フルオロフェニルスルホニル)-2-ヒドロキシ-2-メチル-3'-(トリフルオロメチル)-プロピオンアニリドといった抗アンドロゲン;
抗生物質、たとえば、アバスチン(登録商標)およびリツキシマブ;
または、たとえば、DeVita, V. T., Jr., Hellmann, S., Rosenberg, S. A.; In: Cancer: Principles & Practice of Oncology, 5.sup.th ed., Lippincott-Raven Publishers (1997)に記載の、他の治療薬および治療原理。
【0071】
アバスチン(登録商標)は、血管内皮細胞増殖因子(VEGF)に対する組換えヒト化抗体である。アバスチン(登録商標)は、腫瘍血管新生(腫瘍に向けて新しい血管を形成すること)において重要な役割を果たすタンパク質VEGFに結合し、これを阻害するようにデザインされている。VEGFに対する他の治療用抗体が当技術分野において知られており、ラニビツマブ(ranibizumab)、米国特許第6,342,219号に記載の2C3およびアナログ、ならびに特許出願EP 0 787 742およびWO 2006/012688に記載のVEGF抗体などがある。
【0072】
リツキシマブは、B細胞を含めたいくつかの細胞型の表面に見られる、CD20に対するモノクローナル抗体である。したがって、リツキシマブはB細胞リンパ腫の治療に適用されるが、B細胞リンパ腫においてこの抗体はB細胞に付着し、B細胞は免疫系の細胞によって除去される。CD20に対する他の抗体も当技術分野において知られており、トシツモマブ(Bexxar(登録商標))、イブリツモマブ、オクレリツマブ(ocrelizumab)、オファツムマブ(ofatumumab)、GA-101、SGU-35、TRU-015、Lymphomun、CD20 ValidTarget抗体、ならびに特許出願WO 2005/00090およびWO 2006/064121に記載の抗体などがある。
【0073】
適当な抗体、たとえば、VEGFに対する抗体、CD20に対する抗体、を調製し同定する方法は、当業者によく知られている。
【0074】
ある実施形態において、もう一方の化学療法薬は下記から選択される:VEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファラン(L-PAMおよびPAMとしても知られている)。
【0075】
ある実施形態において、もう一方の化学療法薬は下記から選択される:VEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、およびサリドマイド。
【0076】
ある実施形態において、もう一方の化学療法薬は下記から選択される:VEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、およびリツキシマブ。
【0077】
ある実施形態において、もう一方の化学療法薬は下記から選択される:VEGFに対する抗体、およびアバスチン(登録商標)。
【0078】
ある実施形態において、もう一方の化学療法薬は下記から選択される:CD20に対する抗体、およびリツキシマブ。
【0079】
ある実施形態において、もう一方の化学療法薬は、VEGFに対する抗体である。
【0080】
ある実施形態において、もう一方の化学療法薬は、アバスチン(登録商標)である。
【0081】
ある実施形態において、もう一方の化学療法薬は、CD20に対する抗体である。
【0082】
ある実施形態において、もう一方の化学療法薬は、リツキシマブである。
【0083】
ある実施形態において、もう一方の化学療法薬は、ボルテゾミブである。
【0084】
ある実施形態において、もう一方の化学療法薬は、サリドマイドである。
【0085】
ある実施形態において、もう一方の化学療法薬は、デキサメタゾンである。
【0086】
ある実施形態において、もう一方の化学療法薬は、ビンクリスチンである。
【0087】
ある実施形態において、もう一方の化学療法薬は、ドキソルビシンである。
【0088】
ある実施形態において、もう一方の化学療法薬は、メルファランである。
【0089】
もちろん、本明細書に記載の併用療法は、HDAC阻害剤(たとえば、PXD-101)、および少なくとも1つの他の化学療法薬の使用を必要とするが、こうした併用法は、追加の化学療法薬を用いてもよく、これは、たとえば、本明細書に記載の追加の化学療法薬であり、たとえば下記から選択される1つもしくは複数の化学療法薬である:VEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファラン。
【0090】
たとえば、ある実施形態において、併用療法は、HDAC阻害剤(たとえば、PXD-101)、ならびにデキサメタゾン、ボルテゾミブ、およびドキソルビシンを使用する。
【0091】
たとえば、ある実施形態において、併用療法は、HDAC阻害剤(たとえば、PXD-101)、ならびにデキサメタゾン、およびサリドマイドを使用する。
【0092】
III. 治療上の使用
本発明は、癌の治療法に関する。
【0093】
本明細書で使用される場合、「癌」という用語は、腫瘍、新生物、癌腫、肉腫、白血病、リンパ腫などを指す。たとえば、癌は、白血病およびリンパ腫、たとえば皮膚T細胞リンパ腫(CTCL)、非皮膚末梢性T細胞リンパ腫、ヒトTリンパ球向性ウイルス(HTLV)の関与するリンパ腫、たとえば、成人T細胞白血病/リンパ腫(ATLL)、急性リンパ球性白血病、急性非リンパ球性白血病、慢性リンパ球性白血病、慢性骨髄性白血病、ホジキン病、非ホジキンリンパ腫、および多発性骨髄腫、小児固形腫瘍、たとえば、脳腫瘍、神経芽細胞腫、 網膜芽細胞腫、ウィルムス腫瘍、骨腫瘍、および軟部肉腫、成人の一般的な固形腫瘍、たとえば、頭頸部癌(たとえば、口腔、喉頭、食道)、泌尿生殖器癌(たとえば、前立腺、膀胱、腎臓、子宮、卵巣、睾丸、直腸、および結腸)、肺癌、乳癌、膵臓癌、黒色腫およびその他の皮膚癌、胃癌、脳腫瘍、肝臓癌、甲状腺癌、および胸腺癌(上皮縦隔胸腺腫など)を含むがそれらに限定されない。
【0094】
ある実施形態において、治療される癌は、固形腫瘍癌である。
【0095】
ある実施形態において、治療される癌は、直腸癌または結腸癌である。
【0096】
ある実施形態において、治療される癌は、結腸癌である。
【0097】
ある実施形態において、治療される癌は、卵巣癌である。
【0098】
ある実施形態において、治療される癌は、血液の癌である。
【0099】
ある実施形態において、治療される癌は、多発性骨髄腫、リンパ腫、もしくは白血病である。
【0100】
ある実施形態において、治療される癌は、多発性骨髄腫である。
【0101】
ある実施形態において、治療される癌は、リンパ腫である。
【0102】
ある実施形態において、治療される癌は、非ホジキンリンパ腫(NHL)である。
【0103】
ある実施形態において、治療される癌は、白血病である。
【0104】
ある実施形態において、治療される癌は、骨髄性白血病である。
【0105】
ある実施形態において、治療される癌は、リンパ球性白血病である。
【0106】
ある実施形態において、治療される癌は、急性骨髄性白血病(AML)である。
【0107】
ある実施形態において、治療される癌は、慢性骨髄性白血病(CML)である。
【0108】
ある実施形態において、治療される癌は、急性リンパ球性白血病(ALL)である。
【0109】
ある実施形態において、治療される癌は、慢性リンパ球性白血病(CLL)である。
【0110】
「癌の治療」および「癌治療」という表現は、本明細書で使用される場合、哺乳類、たとえばヒトにおいて、部分的に、もしくは完全に、癌転移を含めた癌の進行を抑え、遅らせ、もしくは妨げること;癌転移を含めた癌の再発を抑え、遅らせ、もしくは妨げること;または、癌の発病もしくは発生を予防すること(化学予防)を指す。
【0111】
「被験体」および「患者」という用語は、本明細書で使用される場合、治療を受けるもの、つまりレシピエントを指す。哺乳類および非哺乳類被験体が含まれる。ある実施形態において、被験体は哺乳類、たとえばヒト、イヌ、マウス、ネコ、ウシ、ヒツジ、ブタ、またはヤギである。ある好ましい実施形態において、被験体はヒトである。
【0112】
2つの活性薬剤(たとえば、HDAC阻害剤(たとえば、PXD-101)、および本明細書に記載の他の化学療法薬)に言及する、本明細書に記載の治療法との関連において、「治療上有効な量」という表現は、併用療法において第1および第2の薬剤を合わせた量を意味するものとする。この併用薬を合わせた量は、望ましい生物学的応答、たとえば、哺乳類、たとえばヒトにおいて、部分的に、もしくは完全に、癌転移を含めた癌の進行を抑え、遅らせ、もしくは妨げること;癌転移を含めた癌の再発を抑え、遅らせ、もしくは妨げること;または、癌の発病もしくは発生を予防すること(化学予防)を達成することができる。
【0113】
1つの活性薬剤(たとえば、HDAC阻害剤(たとえば、PXD-101))に言及する、本明細書に記載の治療法との関連において、「治療上有効な量」という表現は、治療で使用されるその薬剤の量を意味するものとする。その量は、望ましい生物学的応答、たとえば、哺乳類、たとえばヒトにおいて、部分的もしくは完全に、癌転移を含めた癌の進行を抑え、遅らせ、もしくは妨げること;癌転移を含めた癌の再発を抑え、遅らせ、もしくは妨げること;または、癌の発病もしくは発生を予防すること(化学予防)を達成することができる。
【0114】
HDAC阻害剤治療
上記のように、本発明の一態様は、治療上有効な量のヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤を、治療の必要な患者に投与することを含んでなる、血液の癌を治療する方法である。
【0115】
本発明のもう一つの態様は、血液の癌を治療する方法に用いるための、ヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤である。
【0116】
本発明の別の態様は、血液の癌を治療する薬剤の製造における、ヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤の使用である。
【0117】
併用療法
上記のように、本発明の一態様は、第1の量のヒストンデアセチラーゼ阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤、ならびに第2の量のその他の化学療法薬、たとえば、VEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファランから選択される他の化学療法薬を、治療の必要な患者に投与することを含んでなる、癌を治療する方法であって、この第1および第2の量を合わせるとそれが治療上有効な量となる、前記方法である。
【0118】
本発明のもう一つの態様は、癌を治療する方法に用いるための、ヒストンデアセチラーゼ阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤であって、ここで前記治療は、(i)前記ヒストンデアセチラーゼ阻害剤、および(ii)その他の化学療法薬、たとえば、VEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファランから選択される他の化学療法薬による治療を含んでなる。
【0119】
本発明の別の態様は、癌を治療する薬剤の製造における、ヒストンデアセチラーゼ阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤の使用であって、ここで前記治療は、(i)前記ヒストンデアセチラーゼ阻害剤、および(ii)その他の化学療法薬、たとえば、VEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファランから選択される他の化学療法薬による治療を含んでなる。
【0120】
ある実施形態において、併用療法は相乗的な効果をもたらし、たとえば、HDAC阻害剤(例、PXD-101)および他の化学療法薬は、たとえば、多発性骨髄腫の腫瘍細胞のような癌細胞の増殖阻害において、相乗的に作用する。
【0121】
治療手順(たとえば、PXD-101のようなヒストンデアセチラーゼ阻害剤による治療;他の化学療法薬による治療)は、任意の順序で逐次行うことができるが、同時に行ってもよく、またはそれらを組み合わせて行うこともできる。
【0122】
たとえば、ある実施形態において、第1の治療手順(すなわち、HDAC阻害剤の投与)は、第2の治療手順(すなわち、他の化学療法薬の投与)に先だって行うことができるが、第2の治療手順の後に行ってもよく、第2の治療手順と同時に、またはこれらを組み合わせて行うこともできる。
【0123】
たとえば、第1の量のヒストンデアセチラーゼ阻害剤を投与するステップ、および第2の量の他の化学療法薬を投与するステップは、任意の順序で逐次行う、同時に行う、またはそれらを組み合わせて行うことができる。
【0124】
たとえば、ある実施形態において、第1の量のヒストンデアセチラーゼ阻害剤を投与するステップは、第2の量の他の化学療法薬を投与するステップの前に行われる。
【0125】
たとえば、ある実施形態において、第1の量のヒストンデアセチラーゼ阻害剤を投与するステップは、第2の量の他の化学療法薬を投与するステップ後に行われる。
【0126】
たとえば、ある実施形態において、第1の量のヒストンデアセチラーゼ阻害剤を投与するステップ、および第2の量の他の化学療法薬を投与するステップは同時に行われる。
【0127】
たとえば、全治療期間はHDAC阻害剤に対して決定することができる。他の化学療法薬は、HDAC阻害剤による治療をはじめる前に、またはHDAC阻害剤による治療後に、投与することができる。さらに、他の化学療法薬は、HDAC阻害剤投与期間中に投与することができるが、HDAC阻害剤治療の全期間を越えて行う必要はない。
【0128】
本明細書に記載の驚くべき予想外の結果の1つは、PXD-101およびアバスチン(登録商標)が、卵巣腫瘍細胞の増殖阻害において相乗的に作用しうることである。
【0129】
したがって、ある実施形態において、本発明は、第1の量のPXD-101、および第2の量のアバスチン(登録商標)(この第1および第2の量を合わせると治療上有効な量となる)を、治療の必要な患者に投与することを含んでなる、癌(たとえば、固形腫瘍癌、その例として卵巣癌)を治療する方法に関する。
【0130】
もう一つの、本明細書に記載の驚くべき予想外の結果は、PXD-101およびリツキシマブが、結腸腫瘍細胞およびリンパ腫細胞の増殖阻害において相乗的に作用しうることである。
【0131】
したがって、ある実施形態において、本発明は、第1の量のPXD-101、および第2の量のリツキシマブ(この第1および第2の量を合わせると治療上有効な量となる)を、治療の必要な患者に投与することを含んでなる、癌(たとえば、血液の癌、その例として多発性骨髄腫)を治療する方法に関する。
【0132】
したがって、ある実施形態において、本発明は、第1の量のPXD-101、および第2の量のリツキシマブ(この第1および第2の量を合わせると治療上有効な量となる)を、治療の必要な患者に投与することを含んでなる、癌(たとえば、固形腫瘍癌、その例として結腸癌)を治療する方法に関する。
【0133】
もう一つの、本明細書に記載の驚くべき予想外の結果は、PXD-101およびデキサメタゾンが、多発性骨髄腫腫瘍細胞の増殖阻害において相乗的に作用しうることである。
【0134】
したがって、ある実施形態において、本発明は、第1の量のPXD-101、および第2の量のデキサメタゾン(この第1および第2の量を合わせると治療上有効な量となる)を、治療の必要な患者に投与することを含んでなる、癌(たとえば、血液の癌、その例として多発性骨髄腫)を治療する方法に関する。
【0135】
ある実施形態において、PXD-101は、デキサメタゾンの投与に先だって、数日間被験体に投与される。別の実施形態において、併用療法は21日サイクルとし、PXD-101は24時間ごとに5日間投与され、次にデキサメタゾンおよびPXD-101が第2〜5日、および第10〜13日に投与される。
【0136】
もう一つの、本明細書に記載の驚くべき予想外の結果は、PXD-101およびボルテゾミブが、多発性骨髄腫腫瘍細胞の増殖阻害において相加的様式で作用しうることである。
【0137】
したがって、ある実施形態において、本発明は、第1の量のPXD-101、および第2の量のボルテゾミブ(この第1および第2の量を合わせると治療上有効な量となる)を、治療の必要な患者に投与することを含んでなる、癌(たとえば、血液の癌、その例として、多発性骨髄腫)を治療する方法に関する。
【0138】
ある実施形態において、PXD-101およびボルテゾミブは、少なくとも第1日に同時に投与される。別の実施形態において、PXD-101は、ボルテゾミブの前に投与される。もう一つの実施形態において、PXD-101およびボルテゾミブは、21日サイクルで投与され、たとえば、その場合、PXD-101は24時間ごとに、最初の5日間、およびその後第16〜21日に再度、投与され、ボルテゾミブは第1、4、8および11日に投与される。
【0139】
上記併用療法は、個々の治療法に伴う毒性の差から見て、治療上の利点をもたらすことができる。より具体的には、HDAC阻害剤による治療が、血液毒性をもたらす可能性があるのに対して、化学療法による治療は、当該組織部位に隣接する組織に対して毒性を示すことがある。このように、毒性に差があることで、患者の病的状態を強めることなく、それぞれの治療を好ましくは、より低い薬用量で行うことが可能となる。
【0140】
細胞増殖などの阻害
上記のように、本発明のある態様は、骨髄腫細胞、形質細胞腫細胞、もしくは形質細胞白血病細胞といった、血液の癌に特徴的な腫瘍細胞の、最終分化、細胞増殖停止および/またはアポトーシスを選択的に誘導し、生存能を低下させる方法(たとえば、in vitro法、in vivo法)であって、その方法は、腫瘍細胞を、有効量のHDAC阻害剤、たとえば、PXD-101といった、本明細書に記載のヒストンデアセチラーゼ阻害剤と接触させることを含んでなる。
【0141】
本発明のもう1つの態様は、骨髄腫細胞、形質細胞腫細胞、もしくは形質細胞白血病細胞といった、血液の癌に特徴的な腫瘍細胞の細胞増殖を防止、阻害(完全に、もしくは部分的に)、または停止する方法(たとえば、in vitro法、in vivo法)であって、その方法は、有効量のHDAC阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤と、腫瘍細胞を接触させることを含んでなる。
【0142】
本発明のもう1つの態様は、骨髄腫細胞、形質細胞腫細胞、もしくは形質細胞白血病細胞といった、血液の癌に特徴的な腫瘍細胞の、最終分化、細胞増殖停止および/またはアポトーシスを選択的に誘導し、生存能を低下させる方法(たとえば、in vitro法、in vivo法)であって、その方法は、第1の量のHDAC阻害剤、たとえば、PXD-101といった、本明細書に記載のヒストンデアセチラーゼ阻害剤、および第2の量の他の化学療法薬、たとえばVEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファランから選択される他の化学療法薬を、腫瘍細胞と接触させることを含んでなり、第1の量および第2の量を合わせたものが、有効な量となる。
【0143】
本発明のもう1つの態様は、腫瘍細胞、たとえば、骨髄腫細胞、形質細胞腫細胞、もしくは形質細胞白血病細胞といった、血液の癌に特徴的な腫瘍細胞の細胞増殖を防止、阻害(完全に、もしくは部分的に)、または停止する方法(たとえば、in vitro法、in vivo法)であって、その方法は、第1の量のHDAC阻害剤、たとえば、PXD-101といった、本明細書に記載のヒストンデアセチラーゼ阻害剤、および第2の量の他の化学療法薬、たとえばVEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファランから選択される他の化学療法薬を、腫瘍細胞と接触させることを含んでなり、第1の量および第2の量を合わせたものが、有効な量となる。
【0144】
ある実施形態において、HDAC阻害剤の量は、約1 pMから約50 μMまで、たとえば、約1 pMから約5 μMまで、たとえば、約1 pMから約500 nMまで、たとえば、約1 pMから約50 nMまで、たとえば、約1 pMから約500 pMまでの、接触濃度である。ある実施形態において、接触濃度は約5.0 μM未満である。ある実施形態において、接触濃度は約500 nMである。ある実施形態において、接触濃度は約130 nMである。ある実施形態において、接触濃度は約100 nMである。
【0145】
ある実施形態において、前記方法はin vitroで実施される。
【0146】
ある実施形態において、前記方法はin vivoで実施される。
【0147】
ある実施形態において、腫瘍細胞は骨髄腫細胞である。
【0148】
ある実施形態において、腫瘍細胞は形質細胞腫細胞である。
【0149】
ある実施形態において、腫瘍細胞は形質細胞白血病細胞である。
【0150】
ある実施形態において、腫瘍細胞はトランスジェニック細胞である。
【0151】
ある実施形態において、腫瘍細胞は、哺乳類、たとえばヒトといった、被験体(たとえば、生きている被験体)に存在する(またはその一部である)。
【0152】
IV. 投与法および用量
上記のように、本発明のある態様は、治療上有効な量のヒストンデアセチラーゼ阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤を、治療の必要な患者に投与することを含んでなる、血液の癌の治療法に関する。
【0153】
上記のように、本発明のある態様は、第1の量のヒストンデアセチラーゼ阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤、ならびに第2の量の他の化学療法薬、たとえば、VEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファランから選択される他の化学療法薬を、治療の必要な患者に投与することを含んでなる、癌を治療する方法に関するが、この第1および第2の量は合わせて治療上有効な量となる。
【0154】
他の化学療法薬(単数)(もしくは、2つ以上使用される場合、複数の化学療法薬)は、当業者によく知られている従来の方法およびプロトコルで投与することができる。たとえば、アバスチン(登録商標)の典型的な用量は、5-15 mg/kgであり、リツキシマブの典型的な用量は、10-500 mg/m2である。
【0155】
HDAC阻害剤は、経口剤形、たとえば、いずれも製薬技術分野の当業者によく知られている、錠剤、カプセル剤(これらはそれぞれ持続放出製剤を含む)、丸剤、粉剤、顆粒剤、エリキシル剤、チンキ剤、懸濁液剤、シロップ剤、および乳剤として投与することができる。また、HDAC阻害剤は、製薬技術分野の当業者によく知られている、静脈内(ボーラスもしくは輸液)、腹腔内、皮下、もしくは筋肉内投与剤形で投与することができる。
【0156】
HDAC阻害剤は、活性成分の持続放出を可能にするような方式で製剤化された、デポー注射剤もしくはインプラント製剤として投与することができる。活性成分は小球形または小円柱形に圧縮され、皮下もしくは筋肉内に、デポー注射剤もしくはインプラントとして埋め込まれる。インプラントは、生分解性ポリマーもしくは合成シリコーン、たとえば、Silastic、シリコーンゴム、またはDow-Corning社製の他のポリマーといった、不活性材料を用いることができる。
【0157】
HDAC阻害剤はまた、小単層ベシクル、大単層ベシクル、および多重膜ベシクルといった、リポソームデリバリーシステムの形で投与することができる。リポソームは、コレステロール、ステアリルアミン、もしくはホスファチジルコリンといった、さまざまなリン脂質から作製することができる。
【0158】
HDAC阻害剤はまた、当該化合物分子が結合される個別の担体として、モノクローナル抗体を使用することによって、送達することもできる。
【0159】
HDAC阻害剤はまた、標的指向性薬物担体として可溶性ポリマーを用いて、調製することができる。こうしたポリマーとして、ポリビニルピロリドン、ピランコポリマー、ポリヒドロキシ-プロピル-メタクリルアミド-フェノール、ポリヒドロキシエチル-アスパルトアミド-フェノール、またはパルミトイル残基で置換されたポリエチレンオキシド-ポリリジンを挙げることができる。
【0160】
さらに、HDAC阻害剤は、薬物の放出制御を実現するのに有用な生分解性ポリマー、たとえば、ポリ乳酸、ポリグリコール酸、ポリ乳酸とポリグリコール酸のコポリマー、ポリεカプロラクトン、ポリヒドロキシ酪酸、ポリオルトエステル、ポリアセタール、ポリジヒドロピラン、ポリシアノアクリレート、ならびにハイドロゲルの架橋したもしくは両親媒性のブロックコポリマーを用いて調製することができる。
【0161】
HDAC阻害剤を用いる投与計画は、生物種、年齢、体重、性別、ならびに治療すべき癌のタイプ;治療すべき癌の重症度(すなわち、病期);投与経路;被験体の腎機能および肝機能;および使用される個別の化合物もしくはその塩、などのさまざまな要因によって、選択することができる。通常の熟練した医師もしくは獣医師であれば、たとえば病気の進行を妨げ、(完全に、もしくは部分的に)阻害し、または停止させるといった、治療に必要な薬物の有効量を、容易に決定して処方することができる。
【0162】
HDAC阻害剤の経口投与量は、目的とする癌を治療するために、単独で、または併用療法の一部として使用する場合、1日当たり約2〜約2000mg、たとえば、1日当たり約20〜約2000mg、たとえば、1日当たり約200〜約2000mgの範囲とすることができる。たとえば、経口投与量は、1日当たり約2、約20、約200、約400、約800、約1200、約1600、または約2000mgとすることができる。1日当たりの総量は、単回投与で与えることができるが、1日当たり2回、3回もしくは4回といった複数回投与で与えることもできる。
【0163】
たとえば、被験体は、約2〜約2000mg/日、たとえば、約20〜約2000mg/日、たとえば、約200〜約2000mg/日、たとえば、約400〜約1200mg/日の範囲で投与を受けることができる。したがって、1日1回投与用に適切に調製された薬剤は、約2〜約2000mg、たとえば、約20〜約2000mg、たとえば、約200〜約2000mg、たとえば、約400〜約1200mgを含有すると考えられる。HDAC阻害剤は、1日に1回の投与で、もしくは2、3、もしくは4回に分けた用量で投与することができる。したがって、1日2回投与用に適切に調製された薬剤は、必要とされる1日量の半分を含有することになる。
【0164】
静脈内もしくは皮下に、被験体は、1日当たり約3〜1500 mg/m2、たとえば1日当たり約3、30、60、90、180、300、600、900、1000、1200、もしくは1500 mg/m2を送達するのに十分な量の、HDAC阻害剤(たとえば、PXD-101)を受け入れるであろう。上記の量は、いくつかの適当な方法で、たとえば、大容量の低濃度HDAC阻害剤を、長時間にわたって、もしくは1日数回、投与される。上記の量は、1日以上の連続した日数、断続的な日数、または1週間(7日間)ごとにそれらを組み合わせて、投与することができる。あるいはまた、小容量の高濃度HDAC阻害剤を、短期間にわたって、たとえば、1日1回、1日以上の日数にわたって、連続して、間をおいて、または1週間(7日間)ごとにそれらを組み合わせて、投与することができる。たとえば、1日当たり300 mg/m2の用量を、5日連続で治療当たり総計1500 mg/m2投与することができる。別の投与計画では、連続日数はやはり5日であるが、治療は2ないし3週間続き、治療全体で、総計3000 mg/m2 および4500 mg/m2投与することができる。
【0165】
典型的には、約1.0 mg/mLから約10 mg/mLまで、たとえば、2.0 mg/mL、3.0 mg/mL、4.0 mg/mL、5.0 mg/mL、6.0 mg/mL、7.0 mg/mL、8.0 mg/mL、9.0 mg/mL、もしくは10 mg/mLの濃度のHDAC阻害剤を含有する静注製剤を調製し、上記の投与量を達成できる量として投与することができる。ある例において、1日の全投与量が約300から1200 mg/m2の間となるように、十分な容量の静注製剤を1日で被験体に投与することができる。
【0166】
好ましい実施形態において、900 mg/m2のPXD-101を少なくとも5日間連続して、24時間ごとに静脈内投与することができる。
【0167】
ある実施形態において、PXD-101は、1日総投与量として1500 mg/m2まで投与される。ある実施形態において、PXD-101は、1日総投与量として900 mg/m2を、たとえば、1日1回、連続して(毎日)、もしくは間欠的に、静脈内投与される。ある実施形態において、PXD-101は、1日総投与量として1000 mg/m2を、たとえば、1日1回、連続して(毎日)、もしくは間欠的に、静脈内投与される。ある実施形態において、PXD-101は3週間毎に第1日から第5日まで毎日投与される。
【0168】
HDAC阻害剤の静脈内投与のために許容されるpH範囲において、妥当な緩衝能を有するグルクロン酸、L-乳酸、酢酸、クエン酸、もしくは製薬上許容される酸/共役塩基をバッファーとして使用することができる。酸または塩基、たとえば、塩酸または水酸化ナトリウムのいずれかによって望ましいpH範囲に調整されたクエン酸ナトリウム溶液も使用することができる。典型的には、静注製剤のpH範囲は、約5から約12までの範囲内とすることができる。静注製剤に好ましいpH範囲は、HDAC阻害剤がヒドロキサム酸部分を有する場合(たとえば、PXD-101のように)、約9から約12までとすることができる。適当な添加剤を選択する際には、HDAC阻害剤の溶解性および化学的適合性を考慮すべきである。
【0169】
好ましくは、約5から約12までのpHで、当技術分野で周知の方法に従って調製された皮下投与製剤は、適当なバッファーおよび等張化剤も含有する。こうした製剤は、毎日1回ないし複数回の皮下投与で、たとえば、毎日1、2もしくは3回で、HDAC阻害剤の1日投与量を送達するように製剤化することができる。適当な製剤のバッファーおよびpHは、投与すべきHDAC阻害剤の溶解性に応じて、当業者により容易に選択される。酸または塩基、たとえば、塩酸または水酸化ナトリウムのいずれかによって望ましいpH範囲に調整された塩化ナトリウム溶液も、皮下投与製剤に使用することができる。典型的には、皮下投与製剤のpH範囲は、約5から約12の範囲内とすることができる。皮下投与製剤に好ましいpH範囲は、HDAC阻害剤がヒドロキサム酸部分を有する場合(たとえば、PXD-101のように)、約9から約12までである。適当な添加剤を選択する際には、HDAC阻害剤の溶解性および化学的適合性を考慮すべきである。
【0170】
HDAC阻害剤はまた、適当な経鼻投与媒体の局所使用によって、または経皮経路によって、当業者によく知られているそうした形の経皮パッチを用いて、経鼻投与の形で投与することができる。経皮デリバリーシステムの形で投与するため、投与は、投与計画の全体にわたって、おそらく、間欠的ではなく連続的となる。
【0171】
V. 医薬組成物
HDAC阻害剤は、目的とする投与形態、すなわち、経口錠剤、カプセル剤、エリキシル剤、シロップ剤などについて適切に選択され、従来の製薬上の慣例と矛盾しない、適当な医薬用希釈剤、賦形剤、もしくは担体(ここでは、集合的に「担体」材料と呼ぶ)と混合した活性成分として投与することができる。
【0172】
たとえば、ある実施形態において、医薬組成物は、HDAC阻害剤PXD-101を、L-アルギニンとともに溶液中に含んでなる。この組成物を調製するために、10g量のL-アルギニンを、約70 mLの注射用水(Water-For-Injections BP)を入れた容器に加えた。この混合物を、アルギニンが溶解するまでマグネティックスターラーで撹拌した。5g量のPXD-101を加え、PXD-101が溶解するまで、混合物を25℃にて撹拌した。その溶液を、最終容量が100 mLとなるまで注射用水で希釈した。その結果得られた溶液は、pHが9.2〜9.4であり、浸透圧は約430 mOSmol/kgであった。この溶液は、適当な0.2μm無菌濾過(たとえばPVDF)膜を通して濾過した。濾過した溶液をバイアルもしくはアンプルに入れ、加熱により、または適当なストッパーおよびキャップにより、密封した。溶液は室温で、またはより好ましくは、薬物の分解を少なくするために冷蔵(たとえば、2〜8℃)で保存した。
【0173】
ある実施形態において、HDAC阻害剤(たとえば、PXD-101)は、経口投与することができる。経口投与は、錠剤もしくはカプセル剤の形をとることができる。HDAC阻害剤は、毒性がなく、製薬上許容される、不活性な経口担体、たとえば、乳糖、デンプン、ショ糖、ブドウ糖、メチルセルロース、結晶セルロース、クロスカルメロースナトリウム、ステアリン酸マグネシウム、リン酸二カルシウム、硫酸カルシウム、マンニトール、ソルビトールなど、またはそれらの組み合わせと、混合する。液体状での経口投与のためには、HDAC阻害剤は、毒性がなく、製薬上許容される、不活性な任意の経口担体、たとえば、エタノール、グリセロール、水などと混合する。さらに、望ましい場合、もしくは必要である場合には、適当な結合剤、滑沢剤、崩壊剤、および着色剤もこの混合物に組み入れることができる。適当な結合剤には、デンプン、ゼラチン、天然の糖、たとえば、ブドウ糖もしくはβ乳糖、コーンシロップ、天然および合成ガム、たとえば、アカシア、トラガカントもしくはアルギン酸ナトリウム、カルボキシメチルセルロース、結晶セルロース、クロスカルメロースナトリウム、ポリエチレングリコール、ワックスなどがある。上記剤形への使用に適した滑沢剤には、オレイン酸アトリウム、ステアリン酸ナトリウム、ステアリン酸マグネシウム、安息香酸ナトリウム、酢酸ナトリウム、塩化ナトリウムなどがある。上記剤形への使用に適した崩壊剤としては、デンプン、メチルセルロース、寒天、ベントナイト、キサンタンガムなどが挙げられる。
【0174】
本明細書に記載され、本発明の方法での使用に適した、HDAC阻害剤の製薬上許容される適切な塩は、毒性のない通常の塩であって、これには、無機塩基との塩、たとえば、アルカリ金属塩(例、リチウム塩、ナトリウム塩、カリウム塩など)、アルカリ土類金属塩(例、カルシウム塩、マグネシウム塩など)、アンモニウム塩;有機塩基との塩、たとえば、有機アミン塩(例、トリエチルアミン塩、ピリジン塩、ピコリン塩、エタノールアミン塩、トリエタノールアミン塩、ジシクロヘキシルアミン塩、N,N'-ジベンジルエチレンジアミン塩など)など;無機酸付加塩(例、塩酸塩、臭化水素酸塩、硫酸塩、リン酸塩など);有機カルボン酸もしくはスルホン酸付加塩(例、ギ酸塩、酢酸塩、トリフルオロ酢酸塩、マレイン酸塩、酒石酸塩、メタンスルホン酸塩、ベンゼンスルホン酸塩、p-トルエンスルホン酸塩など);塩基性もしくは酸性アミノ酸との塩(例、アルギニン、アスパラギン酸、グルタミン酸など)などといった、塩基との塩または酸付加塩を含めることができる。
【0175】
キット
本発明のある態様は:
(a) ヒストンデアセチラーゼ(HDAC)阻害剤、たとえばPXD-101(好ましくは製薬上許容される製剤の成分として、好ましくは、適当な容器に入れて、および/または適切に包装して提供される);ならびに、
(b) 別の化学療法薬(好ましくは製薬上許容される製剤の成分として、好ましくは、適当な容器に入れて、および/または適切に包装して提供される);
を含んでなる、キットもしくはキット・オブ・パーツ(kit-of-parts)に関するが、
前記キットもしくはキット・オブ・パーツは癌の治療法で使用することに適している。
【0176】
ある実施形態において、キットもしくはキット・オブ・パーツはさらに、指示、たとえば使用説明書、その例として、たとえば2つの薬物の投与のための指示を含んでなる。ある実施形態において、使用説明書は、薬物の併用が適切な治療となる適応症(たとえば、癌、癌のタイプ)のリストを含む。
【0177】
ある実施形態において、キットもしくはキット・オブ・パーツはさらに、組み立てて使用(たとえば、投与)するための、適当な試薬(たとえば、バッファー、溶媒)、および器具(たとえば、チューブ、シリンジ)を含んでなる。
【0178】
下記の実施例は、本発明の好ましい実施形態を、より完全に説明するものである。しかしながら、それらは、けっして、本明細書に記載の本発明の広汎な範囲を限定するものと解釈されるべきではない。
【実施例】
【0179】
癌細胞の増殖に対するHDAC阻害剤の、単独での効果、もしくは化学療法薬との併用での効果を測定するために、さまざまなヒト多発性骨髄腫細胞株をin vitroで増殖させて、HDAC阻害剤(すなわちPXD-101)のみとともに、または下記の化学療法薬と組み合わせたHDAC阻害剤とともに、インキュベートした。それに加えて、PXD-101は、単独で、またはデキサメタゾンもしくはボルテゾミブと併用して、多発性骨髄腫治療のための臨床試験に使用される。アバスチン(登録商標)(CD20に対する抗体)もしくはリツキシマブ(VEGFに対する抗体)とPXD-101の併用を採用した追加試験も実施した。
【0180】
実施例1
PXD-101のin vitroでの抗増殖活性
さまざまなヒト多発性骨髄腫細胞株に対するHDAC阻害剤の効果をin vitroで検討し、多発性骨髄腫の治療におけるHDAC阻害剤(すなわちPXD-101)の臨床的使用の可能性を判断した。
【0181】
CellTiter-Gloアッセイを用いて、in vitroで、多発性骨髄腫細胞の細胞増殖もしくは生存能に対するPXD-101の影響を評価した(表1を参照されたい)。たとえば、6種類の多発性骨髄腫細胞株(RPMI-8226、U266、EJM、LP-1、OPM-2およびKMS-12-BM)を実験に使用した。細胞を培養し、一定期間、PXD-101のみと接触させ、もしくは化学療法薬とともにPXD-101と接触させて、その後、生細胞数を、Promega社製CellTiter-Glo試薬(Madison, WI; カタログ番号G7572)を用いて以下のように算定した。
【0182】
細胞を、培地90μL中3,000個/ウェルとして96ウェルプレートにまいた。翌日、さまざまな濃度のPXD-101を、単独で、もしくは化学療法薬とともに、10μL/ウェルとして添加し、その後、細胞を37℃にて72時間インキュベートした。場合によっては、細胞は、PXD-101添加前に6時間、化学療法薬で前処理した。その後、50μL/ウェルのCellTiter-Glo試薬を加え、細胞を2分間振盪した後、さらに10分間室温でインキュベートした。インキュベーション時間後、ルミネセンス(光)をルミノメーターで測定した。
【0183】
CellTiter-Gloアッセイは、存在するATP量を測定するものであって、それは言い換えると、細胞数および生存能に比例する。CellTiter-Glo試薬は、基質(ルシフェリン)存在下で、光を放出するATP依存性反応を触媒する酵素(ルシフェラーゼ)を利用する。生細胞数の増大は、結果として全体的なATPレベルの増加をもたらし、それが次に、放射光の増加に反映される。ある薬物が細胞の増殖もしくは生存能を阻害するならば、これは、未処理対照培養物と比較して、放射光の減少に反映されることになる。
【0184】
活性パーセント(活性%)は、それぞれのテスト化合物について下記のように算出される:
活性% = { (Sc-B) / (S°-B) } x 100
式中、Scは、テスト化合物の存在下で測定されたシグナルを表し、S°は、テスト化合物の非存在下で測定されたシグナルを表し、Bは培地のみを入れたブランクウェルで測定されたバックグラウンドシグナルを示す。IC50は、未処理対照培養物の50%活性を達成する薬物濃度に相当する。IC50値は、ソフトウェアパッケージPrism 3.0 (GraphPad Software社, San Diego, Calif.)を用いて可変勾配オプションで算出した。
【0185】
本実施例では、6種の別個の多発性骨髄腫細胞株、3種の形質細胞白血病細胞株、および1種の形質細胞腫に対するPXD-101の効果を報告する。細胞を、in vitroでPXD-101とともに72時間インキュベートし、その生存能をCellTiter-Gloアッセイによって測定した。PXD-101はこのアッセイで、生細胞数を大きく減少させた。PXD-101のIC50は、0.028から0.196μMの範囲であり、10細胞株で測定された平均IC50は0.097μMであった。
【0186】
下記の表は、さまざまな多発性骨髄腫細胞株、ならびにさまざまな形質細胞白血病細胞株および形質細胞腫細胞株におけるPXD-101のIC50濃度をまとめたものである。
【表1】

【0187】
したがって、この試験から、多発性骨髄腫、形質細胞白血病、および形質細胞腫の治療を目的とする臨床試験に使用するための、PXD-101の有効治療濃度が確認される。
【0188】
実施例2
併用試験
標準的な化学療法薬と併用したHDAC阻害剤の効果をin vitroで検討し、さまざまな化学療法薬(すなわち、ビンクリスチン、ドキソルビシン、メルファラン、デキサメタゾン)と併用した場合の、HDAC阻害剤(すなわちPXD-101)の臨床的使用の可能性を判断した。
【0189】
Wst-1増殖アッセイを用いて、薬物併用の抗増殖効果を評価した。この実験に使用した細胞株を表2に示す。4種の黒色腫細胞株(たとえば、JJN3、LP-1、RPMI-8226、U266)を併用試験に使用した。市販のプログラムCalcuSynを用いて、併用効果が相乗的であるか、拮抗的であるか、または相加的であるかを判断した。
【0190】
細胞を培養し、PXD-101のみと接触させ、もしくは化学療法薬とともにPXD-101と接触させて、一定期間インキュベートした後、下記のBoehringer Mannheim社製 Cell Proliferation Reagent WST-1(カタログ番号1 644 807)を用いて、生細胞数を評価した。
【0191】
細胞を、培地100μL中3,000個/ウェルとして96ウェルプレートにまいた。翌日、さまざまな濃度のPXD-101を、単独で、もしくは化学療法薬とともに添加し、細胞を37℃にて48時間インキュベートした。その後、10μL/ウェルのWst-1試薬を加え、細胞を1時間、再インキュベートした。インキュベーション時間後、吸光度を測定した。
【0192】
Wst-1は、細胞の酵素によって切断されてホルマザン色素となる、テトラゾリウム塩である。生細胞数の増大は、結果として、サンプルにおいて、ミトコンドリア脱水素酵素の全活性を増加させる。酵素活性のこうした増加は、生成されるホルマザン色素量の増加につながり、それはそのまま、培養物中の代謝活性細胞の数と相関する。生成したホルマザン色素は、走査型マルチウェル分光光度計で、450nmの波長で、色素溶液の吸光度を測定する(基準波長690 nm)ことによって定量する。
【0193】
生細胞数の減少の活性パーセント(活性%)は、それぞれのテスト化合物について下記のように算出される:
活性% = { (Sc-B) / (S°-B) } x 100
式中、Scは、テスト化合物の存在下で測定されたシグナルを表し、S°は、テスト化合物の非存在下で測定されたシグナルを表し、Bは培地のみを入れたブランクウェルで測定されたバックグラウンドシグナルを示す。IC50は、50%活性を達成する濃度に相当する。IC50値は、ソフトウェアパッケージPrism 3.0 (GraphPad Software社, San Diego, Calif.)を用いて、最高値を100、最低値を0に設定して算出した。
【0194】
濃度を次第に高めたテスト化合物の存在下で細胞生存能を測定することによって、化合物の細胞毒性および細胞増殖に対する効果をともに評価する。
【0195】
結果は、Biosoft社製 CalcuSynプログラムによる併用指数(Combination Index: CI)法を用いて、さらに解析した。1未満のCI値は相乗作用を示し、1は相加作用を示し、1より大きい値は拮抗作用を示す。
【0196】
CalcuSynプログラムを用いて、CIはアイソボログラムの式:CI = (D)1/(Dx)1 + (D)2/(Dx)2により算定される。薬物1 (D)1および薬物2 (D)2は併用でX%阻害し、(Dx)1および(Dx)2は、同様にX%阻害する薬物1および薬物2単独での用量である。それぞれの化合物について、Wst-1アッセイで決定された各用量での増殖%の値を使用する。0.3未満のCI値はきわめて相乗的であり、0.3〜0.7は相乗的、0.7〜1は相加的、1を超える値は拮抗的である。さまざまな阻害パーセント濃度でCI値を比較する。
【0197】
PXD-101 + デキサメタゾン
JJN3、LP-1、RPMI-8226、およびU266腫瘍細胞株に化学療法薬デキサメタゾンを添加するのと同時に、その24時間後に、またはその24時間前に、PXD-101を添加すること(たとえば、48時間共インキュベーション)の抗増殖効果を、やはり上記の方法によって調べた(例えば、図1を参照されたい)。
【0198】
細胞がデキサメタゾンと併用したPXD-101によって同時に(すなわち、48時間の共インキュベーションで)処理される、または24時間 PXD-101その後48時間 PXD-101 + DEXで処理される、または24時間DEXその後48時間 PXD-101 + DEXで処理されるとき、LP-1およびU266腫瘍細胞株では、ある範囲の濃度にわたって相乗効果が得られた(表2を参照されたい)。U266細胞株では、PXD-101を24時間投与したのち48時間 PXD-101 + DEXとしたときに、またLP1細胞株では、DEXを24時間投与したのちPXD-101およびDEXを48時間共インキュベーションしたときに、ある範囲の濃度および条件にわたって、強い相乗性(CI<0.3)が観察された(表2を参照されたい)。
【0199】
PXD-101 + ドキソルビシン
黒色腫細胞株(たとえば、JJN3、LP-1、RPMI-8226、U266)をPXD-101およびドキソルビシンで処理した。上記のように、黒色腫細胞株に対するこれらの化合物の併用効果は、アイソボログラムをプロットし、併用指数を算出することによって測定した。
【0200】
PXD-101およびドキソルビシンを、ある濃度範囲にわたって48時間共インキュベートしたとき、この組み合わせで、相加的から相乗的な効果が観察された(表2を参照されたい)。
【0201】
この実施例は、標準的な化学療法薬と併用するPXD-101の効果を報告するものである。U266細胞株を、DEXの投与に先だってPXD-101と24時間インキュベートした場合、ならびにLP1細胞を、PXD-101の投与に先だってDEXと24時間インキュベートした場合、一定の範囲の濃度および条件にわたって、PXD-101とDEXとの間に強い相乗作用が存在する(表2を参照されたい)。
【0202】
PXD-101とドキソルビシンとの併用は、それらの化合物をある範囲の濃度および条件にわたって共インキュベートしたとき、黒色腫細胞株に対して、相加的から相乗的な効果をもたらした(表2を参照されたい)。
【0203】
下記の表は、4種の黒色腫細胞株について、3通りの異なるインキュベーション計画を用いて、PXD-101および4種の化学療法薬(すなわち、ビンクリスチン、ドキソルビシン、メルファラン、デキサメタゾン)により併用処理した結果得られた、併用指数(CI)をまとめたものである。
【表2】

【0204】
PXD-101 + リツキシマブ
結腸癌細胞株SU-DHL-4およびB細胞リンパ腫細胞株RajiおよびRAMOSをPXD-101およびリツキシマブで処理した。上記のように、黒色腫細胞株に対するこうした化合物の併用効果は、アイソボログラムをプロットして併用指数を計算することによって測定された。PXD-101およびリツキシマブを、ある範囲の濃度にわたって48時間、共インキュベートしたとき、相加的から相乗的な効果がこの併用について観察された(図5を参照されたい)。
【0205】
したがって、上記の併用試験は、PXD-101の臨床試験に使用するための、治療に有効な組み合わせを特定する。
【0206】
実施例3
in vitroでボルテゾミブと併用したPXD-101の抗増殖活性
化学療法薬ボルテゾミブと併用したHDAC阻害剤の効果をin vitroで調べ、併用化学療法におけるHDAC阻害剤(すなわち、PXD-101もしくはSAHA)の臨床的使用の可能性を判断した。
【0207】
CellTiter-Glo細胞生存能アッセイ(上記)を用いて、ボルテゾミブと併用したPXD-101の抗増殖効果を評価した(図2)。比較のために、ボルテゾミブと併用したSAHAの抗増殖効果も測定した(図3)。併用試験には多発性骨髄腫細胞株U266を使用した。U266細胞を1 nMのボルテゾミブで6時間処理した後、1 nMのボルテゾミブと130 nMのPXD-101を併用して72時間、共処理した(図2)。同様に、U266細胞を、1 nMのボルテゾミブで6時間処理した後、1 nMのボルテゾミブと130 nMのSAHAを併用して72時間、共処理した(図3)。対照実験では、PXD-101、SAHAもしくはボルテゾミブのいずれかを除いた。
【0208】
U266をボルテゾミブで前処理し、その後ボルテゾミブおよびPXD-101で上記のように共処理したとき、増殖に対する効果は、いずれか一方の薬物で処理するより大きかった(図2)。ボルテゾミブおよびPXD-101による共処理は、結果として少なくとも相加的効果をもたらした。
【0209】
U266をボルテゾミブで前処理し、その後ボルテゾミブおよびSAHAで上記のように共処理したとき(図2)、増殖に対する効果は、ボルテゾミブ/PXD-101の併用による処理より小さかった(図3)。その上、U266細胞をPXD-101単独で処理したとき、増殖に対する効果(図2)は、U266細胞をSAHA単独で処理した場合より大きかった(図3)。したがって、ボルテゾミブと併用したPXD-101は、ボルテゾミブと併用したSAHAより強く増殖を阻害した。さらに、PXD-101は単独で、SAHA単独より強く増殖を阻害した。
【0210】
したがって、実施例3に記載の試験は、臨床試験で使用するための、PXD-101およびボルテゾミブの治療上有効な濃度および組み合わせを明らかにする。
【0211】
実施例4
臨床試験:PXD-101単剤療法、およびPXD-101 + DEX併用療法
主目的
この試験の主目的は、進行した黒色腫の患者において、PXD-101治療の有効性を評価することであり、Bladeら(Br. J. Haematol., 1998, vol. 102, pp. 1115-1123)の奏効基準を用いて、奏効率によって判定される。
【0212】
副次的な目的
この試験の副次的な目的は、PXD-101単剤治療後の、奏効までの時間、奏効持続時間、無増悪期間、次回治療までの期間、および生存期間を調べること;ならびにPXD-101単剤治療後の安全性を調べることである。
【0213】
2サイクルのPXD-101単剤治療後にCR、PRもしくはMRに達しない患者に関する目的(パートB):
この点に関する目的としては、下記が挙げられる:デキサメタゾンおよびPXD-101の併用の有効性(奏効率、奏効持続時間、無増悪期間および生存期間)ならびに安全性を評価することによって、化学療法の感受性を高めるPXD-101の効果を調べること;単剤療法およびデキサメタゾン併用による静脈内投与後、第1日および第4日のPXD-101に関する薬物動態パラメーターを決定すること;第1日および第4日の血液単核球において、および可能であれば腫瘍生検標本(骨髄)において、PXD-101の薬力学的効果を調べること。
【0214】
治験デザイン
PXD-101単剤療法の有効性を評価するための非盲検、非無作為化、多施設第II相治験、ならびにノンレスポンダー(効果のなかった患者)においてデキサメタゾンと併用したPXD-101の有効性および安全性の評価。約50人の評価可能な患者が含まれる。
【0215】
患者の主な選択基準
2つの事前の治療に失敗した患者の中で、多発性骨髄腫の確定診断を受けた18歳以上の患者(下記の診断基準を参照されたい)。
【0216】
多発性骨髄腫の診断基準
A. 血清中のモノクローナル免疫グロブリン(M成分)について、IgG型のM成分>30 g/L、IgA型M成分>20 g/L、IgD型もしくはIgE型M成分は任意の濃度、および/または尿中のk型もしくはl型のM成分排泄>1g/24時間。
【0217】
B. 上記A項で示したより低い濃度の血清および/または尿中のM成分。
【0218】
C. 骨髄吸引物中10%以上の形質細胞、または骨髄もしくは軟部組織腫瘍由来の生検標本における形質細胞増加
D. 溶骨性骨病変
多発性骨髄腫の診断は、以下の組み合わせのうち1つを要する:A+C、A+D、またはB+C+D。
【0219】
評価可能な疾患(上記)
適切な骨髄および肝機能。総ビリルビン<1.5 x正常値の上限。AST (SGOT)、ALT (SGPT)<2.5 x正常値の上限。一般健康状態(Performance status: PS)<2(ECOGスケール)。推定余命が3か月より長い。生殖能力を有する女性患者は、治験登録前の最後の7日以内の血清妊娠検査が陰性であるものとし、治験中および治験後60日間、安全な避妊薬を使用する。男性治験参加者に対する妊娠可能な女性パートナーも、同様に避妊薬を使用しなければならない。
【0220】
PXD-101製剤
PXD-101注射剤(50 mg/mL)には、pH 9.0〜9.9のWater-for-Irrigation (Ph. Eur.:ヨーロッパ薬局方)に溶解した50 mg/mLのPXD-101および100 mg/mLのL-アルギニン(Ph. Eur.)の透明な黄色の無菌溶液10 mLが入っている。この製剤は、注入前に9.9%生理食塩水、または5%ブドウ糖液で希釈する必要がある。
【0221】
PXD-101の調製および投与
個別の投与量は体表面積に基づく。計算された用量をPXD-101バイアルから取り出し、輸液用等張ブドウ糖液の250 mLバッグに加え、30分かけて静脈内に注入する。割り当てられたスケジュールにしたがって、治療は1日1回行われることになる。
【0222】
デキサメタゾンの送達、調製および投与
デキサメタゾンの標準用量40 mg/日は、8 mgを5錠として経口投与することになっている。PXD-101をも静脈内(IV)投与する治療日には、デキサメタゾンをPXD-101投与の2時間後に投与する。
【0223】
治療の用量およびスケジュール - 初期試験パートA
PXD-101を、第1サイクルにおいて、900 mg/m2/日の30分間の静脈内(IV)注入として投与する。治療を5日間連続して24時間(±2時間)おきに行った後、2週間観察する。これがサイクル1である。
【0224】
サイクル2は、第22日(試験第22日)に、PXD-101による治療の2回目の5日サイクルで開始し、その後2週間の観察とする。試験第6週(サイクル2、第15〜21日)の間に、患者は、奏効を判断するための評価試験を受ける。奏効性は、試験第43日に、前週からの試験結果に基づいてCR、PR、MR、SD、PDとして評価指定を受け、治療を次のように継続する:
すべての患者は最低限として2サイクルのPXD-101単剤療法を受ける。2サイクル終了時点で、患者は奏効について評価を受ける。試験第43日に決定された患者の奏効性に基づいて、治療は試験パートAを続け、もしくは次のように試験パートBとして続行する:
CR(完全奏効)、PR(部分奏効)、もしくはMR(やや有効)の患者は、増悪まで、または最初の2サイクルを含めて最大8サイクルを受けるまで、試験パートAのPXD-101単剤療法を続ける。奏効性がNC/SD(不変/安定)、PD(進行(増悪))の患者は、試験パートB、PXD-101 + デキサメタゾンを、次項のように開始する。
【0225】
治療の用量およびスケジュール - 試験パートB
2サイクルのPXD-101単剤療法後、2回目の治療サイクル後の評価として奏効性がSDもしくはPDの患者は、サイクル1および2で注入されたPXD-101と併用して、第2〜5日および第10〜13日に毎日経口でデキサメタゾン40 mgを加えた治療を続行する。試験パートBの患者は最低2サイクルの併用療法を受ける。この併用に反応する患者は、増悪するまで、または最初の2サイクルを含めて全部で8サイクルを終えるまで、治療を続けることができる。
【0226】
実施例5
臨床試験:PXD-101とボルテゾミブとの併用療法
この試験の主たる目的は:(i) ボルテゾミブと併用して投与されるPXD-101の最大耐容量(MTD)および用量制限毒性(DLT)を測定すること;(ii)今後の併用による第II相プロトコルのために推奨される各薬物の用量を確立すること;(iii) 再発/難治性多発性骨髄腫の患者においてPXD-101 + ボルテゾミブ併用の抗腫瘍活性を調べること、とした。
【0227】
副次的な目的は:(i) ボルテゾミブの存在下および非存在下でのPXD-101の薬力学(ヒストンアセチル化)の比較;(ii) PXD-101の存在下および非存在下でのボルテゾミブの薬力学(プロテアソーム阻害)の測定;ならびに(iii)ボルテゾミブと併用して投与したときのPXD-101の薬物動態の測定、とした。
【0228】
この治験は、安全性を確認し、かつ抗腫瘍活性、薬物動態、および薬力学を評価するためにMTDまで増量した投与群を含む、少なくとも2つの以前の治療に失敗した再発/難治性多発性骨髄腫の患者、ならびに同じ多発性骨髄腫患者集団における、非盲検、多施設、用量漸増、安全性、薬物動態、および薬力学試験である。
【0229】
全部で45人までの患者が試験登録に参加し、約30人を用量漸増群、最大15人をMTDまで増量した投与群とする。患者は、21日サイクルで、第1〜5日に毎日静脈内に(IV)PXD-101による治療(30分輸液)を受け、第1、4、8および11日に静脈内に(IV)ボルテゾミブによる治療(3〜5秒注入)を受ける。PXD-101の輸液はボルテゾミブ投与の約1時間後に開始する。用量漸増は、PXD-101 300〜900 mg/m2およびのボルテゾミブ0.7〜1.6 mg/m2の範囲で、併用のMTDが確立されるまで、一連のコホートで行う。
【0230】
PXD-101およびボルテゾミブの併用のMTDが確立されたならば、再発/難治性多発性骨髄腫の患者で追加の最大15人を、安全性、PKおよびPDを確認し、抗腫瘍活性を評価するために、併用MTDに登録する。こうして、漸増群の3〜6人を含めて約20人の患者にMTD量で投与する。MTD増量群では、用量スケジュールを用量漸増群の場合と同じにする。
【0231】
薬物動態および薬力学分析はサイクル1で実施する。PXD-101については、PKおよびPDは、第3および4日(ボルテゾミブ投与のない日とある日)に分析し、ボルテゾミブについては、PD分析は第4および第8日(PXD-101投与のある日とない日)とする。PXD-101の薬力学的評価は、末梢血液細胞におけるヒストンアセチル化の測定によりなされるが、ボルテゾミブについては、20Sプロテアソームの阻害を測定する。抗腫瘍活性は、すべての患者で、2サイクル後、およびその後の各サイクル後に、Blade判定基準(Blade 1998)によって評価する。この試験に参加したすべての患者は、8サイクルに至るまでの間、Bladeの判定基準により増悪と評価されるまで、または有意な治療関連毒性が現れるまで、2つの薬物の投与を受ける。
【0232】
下記の患者選択基準を用いた:18歳以上の、多発性骨髄腫の確定診断(International Myeloma Working Group [IMWG, 2003]に記載の基準)を受けた患者。以前に少なくとも2つの多発性骨髄腫の治療を受け、その後再発、もしくはその治療に失敗。カルノフスキー(Karnofsky)パフォーマンス>70%。推定余命3か月以上。許容される肝機能(ビリルビン<正常値の上限(ULN)の1.5倍;AST (SGOT)、ALT (SGPT)およびアルカリホスファターゼ<ULNの2.5倍)。許容される血液の状態(ANC>1500細胞/mm3; 血小板数>100,000 (plt/mm3); ヘモグロビン>9 g/dL)。血清カリウムは正常範囲内。子供ができる可能性のある男女については、試験期間中、有効な避妊法を使用。
【0233】
実施例6
ヒトにおける腫瘍縮小の証明
PXD-101の第I相非盲検、用量漸増、安全性、薬物動態(PK)、および薬力学(PD)試験は、進行癌の患者で行った。
【0234】
PXD-101を、3週間ごとに5日間毎日30分の静脈内(IV)輸液として投与した。患者のある1群では、PXD-101を、コース2もしくは3において、第1日だけ、1回、2回もしくは3回経口投与した。末梢血単核細胞(PBMNC)から抽出されたヒストンのアセチル化は、ウェスタンブロット法により測定した。静脈内および経口PXD-101のPK/PD特性を評価した。
【0235】
この試験の結果は、下記のとおりである:34人の患者(年齢の中央値58歳、範囲28〜74歳;男性19人、いずれもECOG PS<2)を、合計103サイクルのPXD-101(中央値2;範囲1〜13)により、6通りの用量レベルで治療した:150 mg/m2 (4人)、300 mg/m2 (4人)、600 mg/m2 (6人)、900 mg/m2 (3人)、1000 mg/m2 (12人)、および1200 mg/m2 (5人)。用量制限毒性は、3人の患者で報告された: 600 mg/m2でG3の疲労(1人)、1200 mg/m2で短時間の心房細動(1人)、ならびに1200 mg/m2 でG3の下痢および嗜眠(1人)。もっとも報告の多い他の有害事象(いずれもグレード1/2)は、疲労、嘔気、嘔吐、便秘、下痢、および注射部位の反応などであった。
【0236】
PXD-101のPKは用量に比例した。終末相の消失半減期は、t1/2 が1.8時間の患者1人を除いて、30〜60分の範囲であった。繰り返しIV投与で薬物の蓄積は起こらなかった。注入終了時にCmax (範囲6.5〜55.8 μg/ml)に達し、ヒストンH4高アセチル化と同様に、後者は用量依存的に4〜24時間持続した。平均単回投与経口バイオアベイラビリティは33%であった。5人の患者における1日のb.i.d(1日2回)(1000 mg/m2)経口投与について、Cmaxは1.1〜2.9μg/mL、t1/2 は1.5〜2.0時間であって、平均経口バイオアベイラビリティは42.8%であり、SDは12.5%であった。1000 mg/m2のPXD-101の経口投与は、ベースラインから40〜50%高いヒストンアセチル化を5〜10時間維持した。2人の患者における1日のt.i.d(1日3回)(1000 mg/m2)経口投与について、Cmax は1.3〜1.8μg/mL、t1/2 は2.0〜2.6時間であり、経口バイオアベイラビリティは28%および70%であった。12時間の投与間隔で蓄積は生じなかったが、8時間の投与間隔では蓄積傾向が生じた。患者が5日間1日1回経口投与(1000 mg/m2)を受ける状態で、集積が現在続いている。
【0237】
上皮性縦隔胸腺腫の患者は、縦隔疾患が70%縮小し、1年以上にわたってこの治験を受けた。転移性胞巣状肉腫の患者では、好ましい転帰も認められた。
【0238】
したがって、上記に照らして、HDAC阻害剤PXD-101は、MTD 1000 mg/m2で、1日1回5日間30分の静脈内(IV)注入によって、良好な耐容性を示すと結論した。PXD-101は、経口バイオアベイラビリティを示し、1日に1回、2回または3回の服用によって投与されるとき、良好な耐容性を示す。
【0239】
実施例7
アバスチン(登録商標)およびPXD-101
この試験の目的は、A2780卵巣癌皮下異種移植モデルにおいて、アバスチン(登録商標)の腫瘍増殖阻害効果を調べることとした。マウスを第4日にアバスチン(登録商標)(5 mg/kg)で処置した。アバスチン(登録商標)と併用したPXD-101の化学増感効果も調べた。アバスチン(登録商標)は、マウスのA2780異種移植片において、有意な増殖阻害を引き起こした。図5は、第0-8、0-4もしくは4-8日に与えられたPXD-101がアバスチン(登録商標)との相乗作用を示したことを明らかにし、有意な化学増感効果を示す。
【0240】
当業者は、ただ通常の実験を用いるだけで、本明細書に記載の、本発明の特定の実施形態に相当する多くの均等物を認識し、または確認することができる。こうした均等物は、特許請求の範囲に含まれるものとする。
【0241】
したがって、本発明の好ましい実施形態を図および記述で説明したが、当然のことながら、本発明は変更および修正可能であって、記述された用語そのものに限定されるべきではない。本発明者らは、本発明をさまざまな用途および条件に適合させるために行うことができる、そうした変更および改変を利用することを希望する。こういった改変および変更には、たとえば、哺乳類に本発明の治療薬を投与するための別の医薬組成物;投与されるべき組成物中の治療薬量が異なること;異なる時間および方法で本発明の治療薬を投与すること;ならびに、異なる材料が投薬に含まれること、たとえば、本明細書に具体的に記載した治療薬の望ましい効用と同一の、同様の、もしくは異なる目的での、異なる治療薬の併用、または本発明の治療薬と他の生物活性化合物の併用など、を含めることができる。こうした変更および改変には、本明細書に記載の治療薬の化学構造の変更(こうした変更は、治療薬の望ましい能力は変えないように、しかし投与される医薬組成物中もしくは体内での治療薬の溶解性、治療薬の身体への吸収、貯蔵有効期間の間または体内で治療薬の生物学的作用が望ましい効果をもたらす時までの間の治療薬の保護を変化させるように、薬剤を改変する)、ならびに同様の変更も含まれるものとする。したがって、こうした変更および改変は、均等物の全範囲に適正に含まれるものとし、したがって特許請求の範囲内に含まれるものとする。
【0242】
したがって、本発明、ならびにそれを実施および使用する方法およびプロセスは、本発明の属する分野、もしくは本発明のもっとも密接に関係する分野のいかなる当業者も、それを実施および使用することができるよう、完全、明快、簡潔および正確な表現で記載した。
【技術分野】
【0001】
本発明は癌の治療法に関する。ある観点から見ると、本発明は、癌(たとえば、固形腫瘍癌、その例としては直腸癌、結腸癌、卵巣癌;血液の癌、たとえば、多発性骨髄腫、白血病、リンパ腫)を治療する方法に関するものであって、その方法は、第1の量のヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤、および第2の量の他の化学療法薬、たとえばVEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、またはメルファランから選択される他の化学療法薬を、それを必要とする患者に投与することを含んでなり、この第1の量および第2の量が合わさって治療上有効な量となる。もう一つの観点から言えば、本発明は血液の癌(たとえば、多発性骨髄腫、白血病、リンパ腫)の治療法に関するものであり、その方法は、治療上有効な量のヒストンデアセチラーゼ阻害剤、たとえば、本明細書に記載のヒストンデアセチラーゼ(HDAC)阻害剤、たとえばPXD-101を、それを必要とする患者に投与することを含んでなる。
【背景技術】
【0002】
本発明、ならびに本発明に関わる最新技術をより完全に記載し、開示するために、いくつかの特許および出版物が本明細書に引用される。こうした参考文献はそれぞれ、個々の参考文献が具体的に、個別に、参照により組み入れられると示される範囲で、参照としてその全体を本明細書に含めるものとする。
【0003】
本明細書を通じ、特許請求の範囲を含めて、文脈上他の意味に解するべき場合を除き、「含む」または「含んでなる」という語は、提示された整数もしくはステップ、または整数群もしくはステップ群を包含するが、その他の整数もしくはステップ、または整数群もしくはステップ群を除外するものではないと理解されるべきである。
【0004】
本明細書で使用される場合、単数の表現は、文脈上あきらかにそうでないと指示されない限り、単数および複数の指示物を包含する。したがって、たとえば、「活性物質」および「薬理活性物質」に対する言及は、単一の活性物質、ならびに2種以上の異なる活性物質の組み合わせを包含し、「担体」への言及は、単一の担体のみならず、2種以上の担体の混合物も包含するが、それ以外も同様である。
【0005】
値域は、本明細書では、多くの場合、「約を冠したある特定の値から」および/または「約を冠した別の特定の値まで」として表現される。このように値域が表現される場合、「ある特定の値から」および/または「他の特定の値まで」は、別の実施形態に含まれる。同様に、先行して「約」を使用することによって、値が概数として表現されるとき、当然のことながら、特定の値は別の実施形態を構成する。
【0006】
多発性骨髄腫
多発性骨髄腫は、散在する形質細胞の悪性腫瘍であり、米国では毎年およそ14,600人が新たに罹患する。おもに中高年を襲う、このまれな血液疾患の原因は、遺伝的素因および環境的要因の関与はあるが、ほとんど不明である。発症時から、クローン性増殖に起因する悪性の形質細胞が骨髄に蓄積し、異常に高いレベルの免疫グロブリンを産生する。多発性骨髄腫は、初期にはまったく症状がないことがあるため、早期に診断することが困難である。特に、肋骨または脊椎の圧迫骨折に続いて起こる骨の痛みが、もっともよく見られる症状である。
【0007】
デキサメタゾンは、この疾患の一次治療によく使用されるレジメンである。つい最近、ビンクリスチン、ドキソルビシン、およびデキサメタゾンの併用(VAD)が、多発性骨髄腫を治療するために用いられるようになった。しかしながら、効果的な維持療法はない。デキサメタゾン治療の奏効率は約25-35%である。
【0008】
多くの患者において、自家幹細胞移植(ASCT)によってサポートされる高用量化学療法は、最初の診断から12か月以内に治療を行えば、無再発生存期間を延ばすことができる。しかしながら、高用量化学療法および自家末梢幹細胞移植を受けた患者のほぼすべてが、結局再発する。
【0009】
リンパ腫
長年にわたる新しい治療法の開発研究にもかかわらず、リンパ系の癌、すなわちリンパ腫は、相変わらず非常によく見られる。たとえば、米国では毎年60,000人以上が、リンパ腫と診断されるが、これには55,000例以上の非ホジキンリンパ腫(NHL)が含まれており、その数は着実に増加しつつある。それに加えて、こうした疾患に罹患した人の予後は芳しくないことが多く、リンパ腫患者の生存率は依然として低いままである。こうした疾患を治療する新しい方法が必要であることは明白である
リンパ腫の従来の治療法は一般に、リンパ腫のタイプ、ならびに患者の病歴によって決まるが、多くのリンパ腫の一次治療には、典型的には化学療法が含まれる。この化学療法は、化合物の「カクテル」、たとえばCHOPの処方の投与を必要とすることが多いが、これにはシクロホスファミド、ドキソルビシン、ビンクリスチンおよびプレドニゾンが含まれる。さらに一部の癌一次治療には、他の方式の癌治療、たとえば放射線療法も含まれる。
【0010】
多くの場合、患者は、初めは、こうした一次治療に反応するが、その後再発する、すなわち腫瘍が再び出現し、もしくは再び増殖しはじめる。こうした1回の再発後、患者はさらに、たとえばCHOPもしくは他の処方で、化学療法を受けることが多いが、場合によっては、患者は骨髄移植のような他の手段による治療を受ける。この場合もやはり、多くの場合、患者はこうした追加治療に初めは反応するが、その後また別の再発をする。一般に、患者の再発が多いほど、最良のその後の治療について、技術的に、合意が得られにくい。他に、患者が、初めから治療にまったく反応することができない例もあり、この患者はしたがって、難治性の癌であると言われる。こうした場合にも同様に、その後の最適な治療について、合意はほとんど得られない。
【0011】
白血病
白血病は、骨髄および血液の悪性の癌である。これは、血液細胞の制御されない増殖を特徴とする。よく見られるタイプの白血病は4つに分類される:急性もしくは慢性骨髄性白血病、これは骨髄の骨髄系要素(白血球、赤血球、巨核球)に関わる、ならびに急性もしくは慢性リンパ球性白血病、これはリンパ系の細胞に関わる。
【0012】
急性白血病は、結果として、骨髄および血液中に未熟で機能しない細胞(芽球)の多大な蓄積をもたらす、急速に進行する疾患である。骨髄は多くの場合、もはや正常な赤血球および白血球ならびに血小板を十分に産生することができない。貧血、赤血球の欠乏が、ほとんどすべての白血病患者に発生する。正常な白血球の不足は、身体が感染症と戦う能力を損なう。血小板の不足は、結果として、挫傷形成および出血傾向をもたらす。これに対して、慢性白血病は、もっとゆっくり進行して、無秩序な増殖をもたらし、それによって成熟(分化)細胞の著しい過剰増殖に至る。一般に、急性白血病は、慢性型とは異なり、腫瘍クローンの除去によって治癒する可能性がある。
【0013】
米国では今年、28,700件の白血病の新規症例が発生することが見込まれる;急性白血病と慢性型はほぼ同数である。大半の症例は高齢者での発生である。実際、白血病の全症例の半分以上が、60歳より高齢の人に発生している。成人にもっともよく見られる白血病は、急性骨髄性白血病(AML)(毎年9,400人の新患が見込まれる)、慢性リンパ球性白血病(CLL)(本年の新患は約7.300人)、および慢性骨髄性白血病(CML)である。小児にもっともよく見られるタイプの白血病は、急性リンパ球性白血病(ALL)である。
【0014】
白血病の標準治療は通常、化学療法、および/または骨髄移植、および/または放射線治療を要する。
【0015】
白血病の化学療法は通常、2つ以上の抗癌剤の併用を要する。およそ40の異なる薬物が現在、白血病治療に使用されている。一般的な組み合わせの一部として、ドキソルビシンもしくはダウノルビシンもしくはミトキサントロンもしくはチオグアニンのいずれかとシタラビンの組み合わせ、メトトレキサートとメルカプトプリン、エトポシドとミトキサントロン、ビンクリスチンとアスパラギナーゼ、ダウノルビシンおよびプレドニゾン、ビンクリスチンとシクロホスファミド、シタラビンおよびプレドニゾン、ビンクリスチンおよびプレドニゾンとともにシクロホスファミドの組み合わせ、シタラビンおよびチオグアニンとダウノルビシンの組み合わせ、ならびにビンクリスチンおよびプレドニゾンとダウノルビシンの組み合わせが挙げられる。
【0016】
骨髄移植の主な2つのタイプは、自家(患者自身の骨髄を使用する)および同種(適合するドナーの骨髄を使用する)である。
【0017】
放射線治療は、高エネルギー放射線の使用を必要とするが、通常、骨髄移植の前にすべての白血病細胞を死滅させるために行われる。
【0018】
白血病の治療はたいへん複雑である。白血病の患者においては、ある一連の治療後の患者であっても、寛解に非常に多くの臨床的多様性が見られる。治療に抵抗性を示す患者は、抵抗性が生じる時期を問わず、生存期間が非常に短い。現行の治療プログラムによる予後の改善にもかかわらず、あらゆるタイプの白血病治療のための新規薬剤を発見する必要性は依然として存在する。
【0019】
したがって、多発性骨髄腫の治療を改善する差し迫った必要性がある。具体的には、多発性骨髄腫の治療において、一次治療としても、再発患者の治療目的としても、奏効率の向上、および/または再発率の低下を可能にする、効果的な単剤および併用療法を発見する必要がある。
【発明の概要】
【0020】
発明の概要
癌治療における併用療法
本発明は、一つには、PXD-101のようなヒストンデアセチラーゼ(HDAC)阻害剤を、他の化学療法薬とともに癌の治療に使用すると相乗効果がある、という発見に基づくものである。
【0021】
したがって、本発明のある態様は、第1の量のヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤、ならびに第2の量の他の化学療法薬、たとえばVEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファランから選択される他の化学療法薬を、それを必要とする患者に投与することを含んでなる、癌を治療する方法であり、この第1の量および第2の量を合わせたものが、治療上有効な量となる。
【0022】
本発明のもう一つの態様は、癌を治療する方法に使用するためのヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤であり、前記治療は、(i)前記ヒストンデアセチラーゼ阻害剤、ならびに(ii)他の化学療法薬、たとえばVEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファランから選択される他の化学療法薬、による治療を含んでなる。
【0023】
本発明のまた別の態様は、癌を治療するための薬剤の製造において、ヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤を使用することであり、前記治療は、(i)前記ヒストンデアセチラーゼ阻害剤、ならびに(ii)他の化学療法薬、たとえばVEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファランから選択される他の化学療法薬、による治療を含んでなる。
【0024】
ある実施形態において、癌は固形腫瘍癌、たとえば直腸癌、結腸癌、卵巣癌である。ある実施形態において、癌は血液の癌である。ある実施形態において、血液の癌は、多発性骨髄腫、リンパ腫、または白血病である。ある実施形態において、血液の癌は多発性骨髄腫である。ある実施形態において、血液の癌は、リンパ腫、たとえば非ホジキンリンパ腫(NHL)である。ある実施形態において、血液の癌は、白血病、たとえば、骨髄性白血病、リンパ球性白血病であり、その例としては、急性骨髄性白血病(AML)、慢性骨髄性白血病(CML)、急性リンパ球性白血病(ALL)、慢性リンパ球性白血病(CLL)である。
【0025】
本発明のもう一つの態様は、腫瘍細胞(たとえば、骨髄腫細胞、形質細胞腫細胞、もしくは形質細胞白血病細胞といった、血液の癌に特徴的な腫瘍細胞)の最終分化、細胞増殖停止、および/またはアポトーシスを選択的に誘導する、もしくは前記腫瘍細胞の生存能を低下させる方法(たとえば、in vitro法、in vivo法)であって、その方法は、第1の量のヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤、ならびに第2の量の他の化学療法薬、たとえばVEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファランから選択される他の化学療法薬を、腫瘍細胞と接触させることを含んでなり、この第1の量および第2の量を合わせたものが、有効な量となる。
【0026】
本発明のもう一つの態様は、腫瘍細胞(たとえば、骨髄腫細胞、形質細胞腫細胞、もしくは形質細胞白血病細胞といった、血液の癌に特徴的な腫瘍細胞)の細胞増殖を防止、阻害(完全に、もしくは部分的に)、または停止する方法(たとえば、in vitro法、in vivo法)であって、その方法は、第1の量のヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤、ならびに第2の量の他の化学療法薬、たとえばVEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファランから選択される他の化学療法薬を、腫瘍細胞と接触させることを含んでなり、この第1の量および第2の量を合わせたものが、有効な量となる。
【0027】
血液の癌の治療
本発明は、一つには、血液の癌(たとえば、多発性骨髄腫、白血病、リンパ腫)に対する治療上有効な処置を提供するために、PXD-101のようなヒストンデアセチラーゼ(HDAC)阻害剤を使用することができるという発見に基づく。具体的には、PXD-101は、血液の癌細胞において、細胞の増殖、遊走を阻害し、生存能を低下させ、および/またはアポトーシスを誘導することが明らかになった。
【0028】
したがって、本発明のある態様は、治療上有効な量のヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤を、必要な患者に投与することを含んでなる、血液の癌を治療する方法である。
【0029】
本発明のもう一つの態様は、血液の癌の治療法に用いる、ヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤である。
【0030】
本発明のまた別の態様は、血液の癌の治療のための薬剤の製造における、ヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤の使用である。
【0031】
ある実施形態において、血液の癌は、多発性骨髄腫、リンパ腫、または白血病である。ある実施形態において、血液の癌は多発性骨髄腫である。ある実施形態において、血液の癌は、リンパ腫、たとえば非ホジキンリンパ腫(NHL)である。ある実施形態において、血液の癌は、白血病、たとえば、骨髄性白血病、リンパ球性白血病であり、その例としては、急性骨髄性白血病(AML)、慢性骨髄性白血病(CML)、急性リンパ球性白血病(ALL)、慢性リンパ球性白血病(CLL)である。
【0032】
本発明のもう一つの態様は、たとえば、骨髄腫細胞、形質細胞腫細胞、もしくは形質細胞白血病細胞といった、血液の癌に特徴的な腫瘍細胞の最終分化、細胞増殖停止、および/またはアポトーシスを選択的に誘導する、もしくはその生存能を低下させる方法(たとえば、in vitro法、in vivo法)であって、その方法は、有効量のヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤と腫瘍細胞を接触させることを含んでなる。
【0033】
本発明のもう一つの態様は、たとえば、骨髄腫細胞、形質細胞腫細胞、もしくは形質細胞白血病細胞といった、血液の癌に特徴的な腫瘍細胞の細胞増殖を防止、阻害(完全に、もしくは部分的に)、または停止する方法(たとえば、in vitro法、in vivo法)であって、その方法は、有効量のヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤と、腫瘍細胞とを接触させることを含んでなる。
【図面の簡単な説明】
【0034】
【図1】骨髄腫細胞株(すなわちU266)に対するPXD-101およびデキサメタゾンの効果に関する併用試験の結果を示すグラフである(実施例2を参照されたい)。
【図2】PXD-101、ボルテゾミブ(Velcade(登録商標))、もしくはその両方による治療について、多発性骨髄腫細胞株(U266)の生存率を示す棒グラフである(実施例3を参照されたい)。
【図3】SAHA、ボルテゾミブ(Velcade(登録商標))もしくはその両方による治療について、多発性骨髄腫細胞株(U266)の生存率を示す棒グラフである(実施例3を参照されたい)。
【図4】卵巣腫瘍細胞株A2780のマウス異種移植片におけるPXD-101のアバスチン(登録商標)とのin vivo相乗作用を示す(実施例7を参照されたい)。
【図5】結腸癌細胞株SU-DHL-4において、PXD-101とリツキシマブとの相乗作用を示すグラフである。PXD-101とリツキシマブとの相乗作用は、リンパ腫細胞株RamosおよびRajiにも見られた(実施例2を参照されたい)。
【発明を実施するための形態】
【0035】
発明の詳細な説明
制限するつもりではなく、開示内容を明確にするためにのみ、本発明の詳細な説明は、下記の小項目に分けられる:
I. ヒストンデアセチラーゼおよびヒストンデアセチラーゼ阻害剤
II. 化学療法薬
III. 治療上の使用
IV. 投与法および投与量
V. 医薬組成物
【0036】
I. ヒストンデアセチラーゼおよびヒストンデアセチラーゼ阻害剤
ヒストンデアセチラーゼは、ヒストンおよび非ヒストンタンパク質(p53、チューブリン、および各種の転写因子)の可逆的なアセチル化に関与する。哺乳類HDACは、既知の酵母因子との類似性に基づいて、3クラスに分類されている。クラスI HDAC(HDAC1、2、3および8)は、酵母RPD3タンパク質との類似性を有し、核内にあり、転写コレプレッサーと結合した複合体として見出される。クラスII HDAC(HDAC4、5、6、7および9)は、酵母HDA1タンパク質と類似しており、核にも細胞質内にも局在する。クラスIII HDACは、酵母SIR2タンパク質に類縁性のあるNAD依存性酵素からなる構造的に遠いクラスを形成する。
【0037】
HDAC活性の阻害を示す化合物は、5つの構造的に多様なクラスに分類される:(1)ヒドロキサム酸;(2)環状テトラペプチド;(3)脂肪族酸;(4)ベンズアミド;および(5)求電子性ケトン。
【0038】
ヒドロキサム酸は、最初に同定されたHDAC阻害剤の一つであり、こうした物質は、HDAC阻害剤のモデルファーマコフォアを明らかにするのに役立った。こうした物質のリンカードメインは、直鎖もしくは環状構造からなり、飽和もしくは不飽和のいずれかであって、表面認識ドメインは、一般に、疎水基であり、もっとも多くの場合芳香族である。第I相および第II相臨床試験が、PXD-101を含めて、いくつかのヒドロキサム酸を基本とするHDAC阻害剤について、現在、進行中である。
【0039】
PXD-101は、低いマイクロモル数でさまざまな腫瘍細胞株の増殖を阻止し(IC50 0.08-2.43 μM)、HDAC酵素活性を阻害する(IC50 9-110 nM)、非常に強力なHDAC阻害剤である。異種移植モデルにおいて、PXD-101は、腫瘍増殖を鈍化させる。それに加えて、PXD-101は、増殖の速い細胞において、細胞周期停止およびアポトーシスを引き起こす。
【0040】
ヒドロキサム酸を基本とするHDAC阻害剤は、本発明で使用するのに特に好適である。
【0041】
ある実施形態において、本発明で使用されるHDAC阻害剤は、下記の式の化合物、ならびに製薬上許容されるそれらの塩および溶媒和物から選択される:
【化1】

【0042】
[式中、
A は、非置換フェニル基であり、
Q1 は、共有結合、C1-7アルキレン基、またはC2-7アルケニレン基であり、
J は
【化2】

【0043】
であり、
R1 は、水素、C1-7アルキル、C3-20ヘテロシクリル、C5-20アリール、またはC5-20アリール-C1-7アルキルであり、
Q2 は
【化3】

【0044】
または
【化4】

【0045】
である]。
【0046】
ある実施形態において、Q1 は共有結合、C1-4アルキレン基、またはC2-4アルケニレン基である。
【0047】
ある実施形態において、Q1 は共有結合である。
【0048】
ある実施形態において、Q1 はC1-7アルキレン基である。
【0049】
ある実施形態において、Q1 is -CH2-、-C(CH3)-、-CH2CH2-、-CH2CH(CH3)-、-CH2CH(CH2CH3)-、-CH2CH2CH2-、または-CH2CH2CH2CH2-である。
【0050】
ある実施形態において、Q1 はC2-7アルケニレン基である。
【0051】
ある実施形態において、Q1 は-CH=CH-または-CH=CH-CH2-である。
【0052】
ある実施形態において、R1 は水素、またはC1-7アルキルである。
【0053】
ある実施形態において、R1 は水素、またはC1-3アルキルである。
【0054】
ある実施形態において、R1 は水素、-Me、-Et、-nPr、-iPr、-nBu、-iBu、-sBu、またはtBuである。
【0055】
ある実施形態において、R1 は水素、-Me、または-Etである。
【0056】
ある実施形態において、R1 は水素である。
【0057】
ある実施形態において、Q2 は下記のとおりである:
【化5】

【0058】
ある実施形態において、Q2 は下記のとおりである:
【化6】

【0059】
上記実施形態のすべての適合する組み合わせは、それぞれの特定の組み合わせが、個々に、しかも明示的に、列挙されているかのように、本明細書で開示される。
【0060】
ある実施形態において、本発明で使用されるHDAC阻害剤は、下記の式の化合物、ならびに製薬上許容されるそれらの塩もしくは溶媒和物から選択される:
【化7】



【0061】
ある実施形態において、本発明で使用されるHDAC阻害剤は、下記の式の化合物(PXD-101としても知られている)、ならびに製薬上許容されるその塩および溶媒和物から選択される:
【化8】

【0062】
本発明で使用するのに適した他のHDAC阻害剤としては、U.S.S.N. 10,381,790; 10/381,794; 10/381,791に記載の化合物があるが、これらは参照としてその全体を本明細書に含めるものとする。
【0063】
立体異性体:
上記化合物の立体異性体は、本発明の範囲に含まれる。多くの有機化合物は、平面偏光面を回転させることができる、光学活性体として存在する。光学活性化合物を説明する際には、接頭辞DおよびL、またはRおよびSを用いて、その分子の不斉中心(1つもしくは複数)に関する絶対立体配置を示す。接頭辞dおよびl、または(+)および(-)は、化合物による平面偏光の回転の様相を示すために用いられ、(-)もしくはlは、その化合物が左旋性であることを意味する。(+)もしくはdが前に付いた化合物は、右旋性である。所与の化学構造に関して、こうした化合物は立体異性体と呼ばれるが、これらは互いに重ね合わせることができない鏡像であること以外は、同一である。特定の立体異性体は、エナンチオマーとも称され、このような異性体の混合物はエナンチオマー混合物と呼ばれることが多い。エナンチオマーの50:50混合物は、ラセミ混合物と呼ばれる。本明細書に記載の化合物の多くは、1つもしくは複数の不斉中心を有するので、異なるエナンチオマー型として存在する可能性がある。必要に応じて、不斉炭素は星印(*)で示される。本発明の化学式において、不斉炭素への結合を直線として表示する場合、当然のことながら、その不斉炭素の(R)および(S)立体配置はともにこの化学式に包含され、したがってエナンチオマーもその混合物もこれに含まれる。当技術分野で使用されるように、不斉炭素について絶対配置を指定することが求められる場合、不斉炭素への結合のうち1つは楔形で表示され(平面より上にある原子への結合)、もう1つは、一連の短い平行線、もしくは短い平行線からなる楔形として表示することができる(平面より下にある原子への結合)。Cahn-Inglod-Prelogシステムを用いて、不斉炭素の(R)および(S)立体配置を割り当てることができる。
【0064】
本発明で使用されるHDAC阻害剤が1つの不斉中心を有する場合、その化合物は2つのエナンチオマーとして存在しており、この場合、その化合物への言及は本明細書では2つのエナンチオマーの双方に関わるものであり、エナンチオマーの混合物、たとえばラセミ混合物と呼ばれる特殊な50:50混合物にも関するものである。エナンチオマーは、当業者に公知の方法で分離することができるが、その方法は、たとえば、結晶化などによって分離可能なジアステレオ異性体の塩を形成すること(たとえば、CRC Handbook of Optical Resolutions via Diastereomeric Salt Formation by David Kozma (CRC Press, 2001)を参照);たとえば結晶化、気-液または液体クロマトグラフィーにより分離することができるジアステレオ異性体誘導体もしくは複合体を形成すること;エナンチオマー特異的試薬を用いた一方のエナンチオマーの選択的反応、たとえば、酵素によるエステル化;または、キラル環境における気-液もしくは液体クロマトグラフィー、たとえば、キラル担体(たとえば、結合したキラルリガンドを有するシリカ)での前記クロマトグラフィー、もしくはキラル溶媒存在下での前記クロマトグラフィー、による。当然のことながら、上記の分離法の一つによって望ましいエナンチオマーが別の化学物質に変換される場合には、望ましいエナンチオマーを遊離するために、追加のステップが必要である。あるいはまた、光学活性試薬、基質、触媒、もしくは溶媒を用いた不斉合成によって、または不斉転換により一方のエナンチオマーを他方に変換することによって、特定のエナンチオマーを合成することができる。
【0065】
不斉炭素における特定の絶対立体配置の指定は、化合物の指定された型のエナンチオマーが、鏡像体過剰(ee)の状態であること、すなわち言い換えると、実質的に他方のエナンチオマーがないことを意味するものと理解される。たとえば、"R"型の化合物には、実質的にその化合物の"S"型はなく、したがって、"R"型の鏡像体過剰状態である。逆に、"S"型の化合物には、実質的にその化合物の"R"型はなく、したがって"S"型の鏡像体過剰の状態である。鏡像体過剰は、本明細書で使用される場合、特定のエナンチオマーが50%を越えて存在することである。たとえば、鏡像体過剰は、約60%以上、たとえば約70%以上、たとえば約80%以上、たとえば約90%以上とすることができる。特定の実施形態において、一定の絶対立体配置が指定される場合、記載の化合物の鏡像体過剰率は少なくとも約90%である。さらに特定した実施形態において、化合物の鏡像体過剰率は、少なくとも約95%、たとえば少なくとも約97.5%、たとえば少なくとも約99%鏡像体過剰である。
【0066】
本発明で使用されるHDAC阻害剤が2つ以上の不斉炭素を有する場合、3つ以上の光学異性体があって、ジアステレオ異性体として存在する可能性があるが、このような場合、本明細書でのこうした化合物への言及は、その化合物のそれぞれのジアステレオ異性体、およびそれらの混合物に関わる。たとえば、2つの不斉炭素がある場合、化合物は最大4つの光学異性体を有する可能性があり、2対のエナンチオマー((S,S)/(R,R)および(R,S)/(S,R))を有する可能性がある。エナンチオマー対(たとえば、(S,S)/(R,R))は、互いに鏡像の立体異性体である。鏡像でない立体異性体(たとえば、(S,S)および(R,S))がジアステレオマーである。ジアステレオ異性体対は、当業者に知られている方法、たとえば、クロマトグラフィーもしくは結晶化によって分離することができ、個々のエナンチオマーはそれぞれの対の中で上記のように分離することができる。
【0067】
塩および溶媒和物:
本明細書に記載の活性化合物は、上記のように、そうした化合物の製薬上許容される塩の形で調製することができる。製薬上許容される塩は、親化合物の望ましい生物活性を維持しているが望ましくない毒性効果を与えない塩である。製薬上許容される塩の例は、Bergeら、1977, "Pharmaceutically Acceptable Salts," J. Pharm. Sci., Vol. 66, pp. 1-19において検討されている。記載の活性化合物は、上記のように、溶媒和物の形で調製することができる。「溶媒和物」という用語は、本明細書では、溶質(たとえば、活性化合物、活性化合物の塩)と溶媒の複合体を指す従来の意味で用いられる。溶媒が水である場合、溶媒和物は、簡便に、水和物、たとえば、0.5水和物、一水和物、二水和物、三水和物、などと呼ぶことができる。
【0068】
プロドラッグ:
本明細書に記載のHDAC阻害剤のプロドラッグも、本発明における使用に適している。どのような化合物のプロドラッグも、周知の薬理学的手法を用いて作製することができる。
【0069】
異性体、ホモログ、およびアナログ:
本明細書に記載のHDAC阻害剤の異性体、ホモログおよびアナログも、本発明における使用に適している。これに関連して、ホモログは、上記化合物への、相当な構造的類似性を有する分子である;アナログは、構造的類似性に関わらず、相当の生物学的類似性を有する分子である;また、異性体は、同じ分子式を有するが構造の異なる化合物である(たとえば、メタ、パラ、またはオルト配置)。
【0070】
II. 化学療法薬
本発明での使用に適したもう一方の化学療法薬(すなわち、HDAC阻害剤と併せて使用される、もう一つの化学療法薬)としては、他の抗腫瘍性物質があるが、たとえばこれらは下記から選択される:
有糸分裂阻害剤、たとえば、ビンブラスチン;
アルキル化剤、たとえば、シスプラチン、カルボプラチン、およびシクロホスファミド;
微小管重合阻害剤、たとえば、パクリタキセル、または他のタキサン類;
代謝拮抗薬、たとえば、5-フルオロウラシル、カペシタビン、シトシンアラビノシド、およびヒドロキシ尿素、または、たとえば、インターカレートする抗生物質、たとえば、アドリアマイシンおよびブレオマイシン;
免疫調節薬、たとえば、レナリドマイド(CC-5013 /Revlimid(商標名));
免疫賦活薬、たとえば、トラスツズマブ;
DNA合成阻害薬、たとえば、ゲムシタビン;
酵素、たとえば、アスパラギナーゼ;
トポイソメラーゼ阻害剤、たとえば、エトポシド;
プロテアソーム阻害剤、たとえば、ボルテゾミブ;
生物学的応答調節物質、たとえば、インターフェロン;
コルチコステロイド、たとえば、デキサメタゾン、および抗ホルモン、たとえば、タモキシフェンのような抗エストロゲン、ならびに(4'-シアノ-3-(4-フルオロフェニルスルホニル)-2-ヒドロキシ-2-メチル-3'-(トリフルオロメチル)-プロピオンアニリドといった抗アンドロゲン;
抗生物質、たとえば、アバスチン(登録商標)およびリツキシマブ;
または、たとえば、DeVita, V. T., Jr., Hellmann, S., Rosenberg, S. A.; In: Cancer: Principles & Practice of Oncology, 5.sup.th ed., Lippincott-Raven Publishers (1997)に記載の、他の治療薬および治療原理。
【0071】
アバスチン(登録商標)は、血管内皮細胞増殖因子(VEGF)に対する組換えヒト化抗体である。アバスチン(登録商標)は、腫瘍血管新生(腫瘍に向けて新しい血管を形成すること)において重要な役割を果たすタンパク質VEGFに結合し、これを阻害するようにデザインされている。VEGFに対する他の治療用抗体が当技術分野において知られており、ラニビツマブ(ranibizumab)、米国特許第6,342,219号に記載の2C3およびアナログ、ならびに特許出願EP 0 787 742およびWO 2006/012688に記載のVEGF抗体などがある。
【0072】
リツキシマブは、B細胞を含めたいくつかの細胞型の表面に見られる、CD20に対するモノクローナル抗体である。したがって、リツキシマブはB細胞リンパ腫の治療に適用されるが、B細胞リンパ腫においてこの抗体はB細胞に付着し、B細胞は免疫系の細胞によって除去される。CD20に対する他の抗体も当技術分野において知られており、トシツモマブ(Bexxar(登録商標))、イブリツモマブ、オクレリツマブ(ocrelizumab)、オファツムマブ(ofatumumab)、GA-101、SGU-35、TRU-015、Lymphomun、CD20 ValidTarget抗体、ならびに特許出願WO 2005/00090およびWO 2006/064121に記載の抗体などがある。
【0073】
適当な抗体、たとえば、VEGFに対する抗体、CD20に対する抗体、を調製し同定する方法は、当業者によく知られている。
【0074】
ある実施形態において、もう一方の化学療法薬は下記から選択される:VEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファラン(L-PAMおよびPAMとしても知られている)。
【0075】
ある実施形態において、もう一方の化学療法薬は下記から選択される:VEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、およびサリドマイド。
【0076】
ある実施形態において、もう一方の化学療法薬は下記から選択される:VEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、およびリツキシマブ。
【0077】
ある実施形態において、もう一方の化学療法薬は下記から選択される:VEGFに対する抗体、およびアバスチン(登録商標)。
【0078】
ある実施形態において、もう一方の化学療法薬は下記から選択される:CD20に対する抗体、およびリツキシマブ。
【0079】
ある実施形態において、もう一方の化学療法薬は、VEGFに対する抗体である。
【0080】
ある実施形態において、もう一方の化学療法薬は、アバスチン(登録商標)である。
【0081】
ある実施形態において、もう一方の化学療法薬は、CD20に対する抗体である。
【0082】
ある実施形態において、もう一方の化学療法薬は、リツキシマブである。
【0083】
ある実施形態において、もう一方の化学療法薬は、ボルテゾミブである。
【0084】
ある実施形態において、もう一方の化学療法薬は、サリドマイドである。
【0085】
ある実施形態において、もう一方の化学療法薬は、デキサメタゾンである。
【0086】
ある実施形態において、もう一方の化学療法薬は、ビンクリスチンである。
【0087】
ある実施形態において、もう一方の化学療法薬は、ドキソルビシンである。
【0088】
ある実施形態において、もう一方の化学療法薬は、メルファランである。
【0089】
もちろん、本明細書に記載の併用療法は、HDAC阻害剤(たとえば、PXD-101)、および少なくとも1つの他の化学療法薬の使用を必要とするが、こうした併用法は、追加の化学療法薬を用いてもよく、これは、たとえば、本明細書に記載の追加の化学療法薬であり、たとえば下記から選択される1つもしくは複数の化学療法薬である:VEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファラン。
【0090】
たとえば、ある実施形態において、併用療法は、HDAC阻害剤(たとえば、PXD-101)、ならびにデキサメタゾン、ボルテゾミブ、およびドキソルビシンを使用する。
【0091】
たとえば、ある実施形態において、併用療法は、HDAC阻害剤(たとえば、PXD-101)、ならびにデキサメタゾン、およびサリドマイドを使用する。
【0092】
III. 治療上の使用
本発明は、癌の治療法に関する。
【0093】
本明細書で使用される場合、「癌」という用語は、腫瘍、新生物、癌腫、肉腫、白血病、リンパ腫などを指す。たとえば、癌は、白血病およびリンパ腫、たとえば皮膚T細胞リンパ腫(CTCL)、非皮膚末梢性T細胞リンパ腫、ヒトTリンパ球向性ウイルス(HTLV)の関与するリンパ腫、たとえば、成人T細胞白血病/リンパ腫(ATLL)、急性リンパ球性白血病、急性非リンパ球性白血病、慢性リンパ球性白血病、慢性骨髄性白血病、ホジキン病、非ホジキンリンパ腫、および多発性骨髄腫、小児固形腫瘍、たとえば、脳腫瘍、神経芽細胞腫、 網膜芽細胞腫、ウィルムス腫瘍、骨腫瘍、および軟部肉腫、成人の一般的な固形腫瘍、たとえば、頭頸部癌(たとえば、口腔、喉頭、食道)、泌尿生殖器癌(たとえば、前立腺、膀胱、腎臓、子宮、卵巣、睾丸、直腸、および結腸)、肺癌、乳癌、膵臓癌、黒色腫およびその他の皮膚癌、胃癌、脳腫瘍、肝臓癌、甲状腺癌、および胸腺癌(上皮縦隔胸腺腫など)を含むがそれらに限定されない。
【0094】
ある実施形態において、治療される癌は、固形腫瘍癌である。
【0095】
ある実施形態において、治療される癌は、直腸癌または結腸癌である。
【0096】
ある実施形態において、治療される癌は、結腸癌である。
【0097】
ある実施形態において、治療される癌は、卵巣癌である。
【0098】
ある実施形態において、治療される癌は、血液の癌である。
【0099】
ある実施形態において、治療される癌は、多発性骨髄腫、リンパ腫、もしくは白血病である。
【0100】
ある実施形態において、治療される癌は、多発性骨髄腫である。
【0101】
ある実施形態において、治療される癌は、リンパ腫である。
【0102】
ある実施形態において、治療される癌は、非ホジキンリンパ腫(NHL)である。
【0103】
ある実施形態において、治療される癌は、白血病である。
【0104】
ある実施形態において、治療される癌は、骨髄性白血病である。
【0105】
ある実施形態において、治療される癌は、リンパ球性白血病である。
【0106】
ある実施形態において、治療される癌は、急性骨髄性白血病(AML)である。
【0107】
ある実施形態において、治療される癌は、慢性骨髄性白血病(CML)である。
【0108】
ある実施形態において、治療される癌は、急性リンパ球性白血病(ALL)である。
【0109】
ある実施形態において、治療される癌は、慢性リンパ球性白血病(CLL)である。
【0110】
「癌の治療」および「癌治療」という表現は、本明細書で使用される場合、哺乳類、たとえばヒトにおいて、部分的に、もしくは完全に、癌転移を含めた癌の進行を抑え、遅らせ、もしくは妨げること;癌転移を含めた癌の再発を抑え、遅らせ、もしくは妨げること;または、癌の発病もしくは発生を予防すること(化学予防)を指す。
【0111】
「被験体」および「患者」という用語は、本明細書で使用される場合、治療を受けるもの、つまりレシピエントを指す。哺乳類および非哺乳類被験体が含まれる。ある実施形態において、被験体は哺乳類、たとえばヒト、イヌ、マウス、ネコ、ウシ、ヒツジ、ブタ、またはヤギである。ある好ましい実施形態において、被験体はヒトである。
【0112】
2つの活性薬剤(たとえば、HDAC阻害剤(たとえば、PXD-101)、および本明細書に記載の他の化学療法薬)に言及する、本明細書に記載の治療法との関連において、「治療上有効な量」という表現は、併用療法において第1および第2の薬剤を合わせた量を意味するものとする。この併用薬を合わせた量は、望ましい生物学的応答、たとえば、哺乳類、たとえばヒトにおいて、部分的に、もしくは完全に、癌転移を含めた癌の進行を抑え、遅らせ、もしくは妨げること;癌転移を含めた癌の再発を抑え、遅らせ、もしくは妨げること;または、癌の発病もしくは発生を予防すること(化学予防)を達成することができる。
【0113】
1つの活性薬剤(たとえば、HDAC阻害剤(たとえば、PXD-101))に言及する、本明細書に記載の治療法との関連において、「治療上有効な量」という表現は、治療で使用されるその薬剤の量を意味するものとする。その量は、望ましい生物学的応答、たとえば、哺乳類、たとえばヒトにおいて、部分的もしくは完全に、癌転移を含めた癌の進行を抑え、遅らせ、もしくは妨げること;癌転移を含めた癌の再発を抑え、遅らせ、もしくは妨げること;または、癌の発病もしくは発生を予防すること(化学予防)を達成することができる。
【0114】
HDAC阻害剤治療
上記のように、本発明の一態様は、治療上有効な量のヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤を、治療の必要な患者に投与することを含んでなる、血液の癌を治療する方法である。
【0115】
本発明のもう一つの態様は、血液の癌を治療する方法に用いるための、ヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤である。
【0116】
本発明の別の態様は、血液の癌を治療する薬剤の製造における、ヒストンデアセチラーゼ(HDAC)阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤の使用である。
【0117】
併用療法
上記のように、本発明の一態様は、第1の量のヒストンデアセチラーゼ阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤、ならびに第2の量のその他の化学療法薬、たとえば、VEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファランから選択される他の化学療法薬を、治療の必要な患者に投与することを含んでなる、癌を治療する方法であって、この第1および第2の量を合わせるとそれが治療上有効な量となる、前記方法である。
【0118】
本発明のもう一つの態様は、癌を治療する方法に用いるための、ヒストンデアセチラーゼ阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤であって、ここで前記治療は、(i)前記ヒストンデアセチラーゼ阻害剤、および(ii)その他の化学療法薬、たとえば、VEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファランから選択される他の化学療法薬による治療を含んでなる。
【0119】
本発明の別の態様は、癌を治療する薬剤の製造における、ヒストンデアセチラーゼ阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤の使用であって、ここで前記治療は、(i)前記ヒストンデアセチラーゼ阻害剤、および(ii)その他の化学療法薬、たとえば、VEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファランから選択される他の化学療法薬による治療を含んでなる。
【0120】
ある実施形態において、併用療法は相乗的な効果をもたらし、たとえば、HDAC阻害剤(例、PXD-101)および他の化学療法薬は、たとえば、多発性骨髄腫の腫瘍細胞のような癌細胞の増殖阻害において、相乗的に作用する。
【0121】
治療手順(たとえば、PXD-101のようなヒストンデアセチラーゼ阻害剤による治療;他の化学療法薬による治療)は、任意の順序で逐次行うことができるが、同時に行ってもよく、またはそれらを組み合わせて行うこともできる。
【0122】
たとえば、ある実施形態において、第1の治療手順(すなわち、HDAC阻害剤の投与)は、第2の治療手順(すなわち、他の化学療法薬の投与)に先だって行うことができるが、第2の治療手順の後に行ってもよく、第2の治療手順と同時に、またはこれらを組み合わせて行うこともできる。
【0123】
たとえば、第1の量のヒストンデアセチラーゼ阻害剤を投与するステップ、および第2の量の他の化学療法薬を投与するステップは、任意の順序で逐次行う、同時に行う、またはそれらを組み合わせて行うことができる。
【0124】
たとえば、ある実施形態において、第1の量のヒストンデアセチラーゼ阻害剤を投与するステップは、第2の量の他の化学療法薬を投与するステップの前に行われる。
【0125】
たとえば、ある実施形態において、第1の量のヒストンデアセチラーゼ阻害剤を投与するステップは、第2の量の他の化学療法薬を投与するステップ後に行われる。
【0126】
たとえば、ある実施形態において、第1の量のヒストンデアセチラーゼ阻害剤を投与するステップ、および第2の量の他の化学療法薬を投与するステップは同時に行われる。
【0127】
たとえば、全治療期間はHDAC阻害剤に対して決定することができる。他の化学療法薬は、HDAC阻害剤による治療をはじめる前に、またはHDAC阻害剤による治療後に、投与することができる。さらに、他の化学療法薬は、HDAC阻害剤投与期間中に投与することができるが、HDAC阻害剤治療の全期間を越えて行う必要はない。
【0128】
本明細書に記載の驚くべき予想外の結果の1つは、PXD-101およびアバスチン(登録商標)が、卵巣腫瘍細胞の増殖阻害において相乗的に作用しうることである。
【0129】
したがって、ある実施形態において、本発明は、第1の量のPXD-101、および第2の量のアバスチン(登録商標)(この第1および第2の量を合わせると治療上有効な量となる)を、治療の必要な患者に投与することを含んでなる、癌(たとえば、固形腫瘍癌、その例として卵巣癌)を治療する方法に関する。
【0130】
もう一つの、本明細書に記載の驚くべき予想外の結果は、PXD-101およびリツキシマブが、結腸腫瘍細胞およびリンパ腫細胞の増殖阻害において相乗的に作用しうることである。
【0131】
したがって、ある実施形態において、本発明は、第1の量のPXD-101、および第2の量のリツキシマブ(この第1および第2の量を合わせると治療上有効な量となる)を、治療の必要な患者に投与することを含んでなる、癌(たとえば、血液の癌、その例として多発性骨髄腫)を治療する方法に関する。
【0132】
したがって、ある実施形態において、本発明は、第1の量のPXD-101、および第2の量のリツキシマブ(この第1および第2の量を合わせると治療上有効な量となる)を、治療の必要な患者に投与することを含んでなる、癌(たとえば、固形腫瘍癌、その例として結腸癌)を治療する方法に関する。
【0133】
もう一つの、本明細書に記載の驚くべき予想外の結果は、PXD-101およびデキサメタゾンが、多発性骨髄腫腫瘍細胞の増殖阻害において相乗的に作用しうることである。
【0134】
したがって、ある実施形態において、本発明は、第1の量のPXD-101、および第2の量のデキサメタゾン(この第1および第2の量を合わせると治療上有効な量となる)を、治療の必要な患者に投与することを含んでなる、癌(たとえば、血液の癌、その例として多発性骨髄腫)を治療する方法に関する。
【0135】
ある実施形態において、PXD-101は、デキサメタゾンの投与に先だって、数日間被験体に投与される。別の実施形態において、併用療法は21日サイクルとし、PXD-101は24時間ごとに5日間投与され、次にデキサメタゾンおよびPXD-101が第2〜5日、および第10〜13日に投与される。
【0136】
もう一つの、本明細書に記載の驚くべき予想外の結果は、PXD-101およびボルテゾミブが、多発性骨髄腫腫瘍細胞の増殖阻害において相加的様式で作用しうることである。
【0137】
したがって、ある実施形態において、本発明は、第1の量のPXD-101、および第2の量のボルテゾミブ(この第1および第2の量を合わせると治療上有効な量となる)を、治療の必要な患者に投与することを含んでなる、癌(たとえば、血液の癌、その例として、多発性骨髄腫)を治療する方法に関する。
【0138】
ある実施形態において、PXD-101およびボルテゾミブは、少なくとも第1日に同時に投与される。別の実施形態において、PXD-101は、ボルテゾミブの前に投与される。もう一つの実施形態において、PXD-101およびボルテゾミブは、21日サイクルで投与され、たとえば、その場合、PXD-101は24時間ごとに、最初の5日間、およびその後第16〜21日に再度、投与され、ボルテゾミブは第1、4、8および11日に投与される。
【0139】
上記併用療法は、個々の治療法に伴う毒性の差から見て、治療上の利点をもたらすことができる。より具体的には、HDAC阻害剤による治療が、血液毒性をもたらす可能性があるのに対して、化学療法による治療は、当該組織部位に隣接する組織に対して毒性を示すことがある。このように、毒性に差があることで、患者の病的状態を強めることなく、それぞれの治療を好ましくは、より低い薬用量で行うことが可能となる。
【0140】
細胞増殖などの阻害
上記のように、本発明のある態様は、骨髄腫細胞、形質細胞腫細胞、もしくは形質細胞白血病細胞といった、血液の癌に特徴的な腫瘍細胞の、最終分化、細胞増殖停止および/またはアポトーシスを選択的に誘導し、生存能を低下させる方法(たとえば、in vitro法、in vivo法)であって、その方法は、腫瘍細胞を、有効量のHDAC阻害剤、たとえば、PXD-101といった、本明細書に記載のヒストンデアセチラーゼ阻害剤と接触させることを含んでなる。
【0141】
本発明のもう1つの態様は、骨髄腫細胞、形質細胞腫細胞、もしくは形質細胞白血病細胞といった、血液の癌に特徴的な腫瘍細胞の細胞増殖を防止、阻害(完全に、もしくは部分的に)、または停止する方法(たとえば、in vitro法、in vivo法)であって、その方法は、有効量のHDAC阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤と、腫瘍細胞を接触させることを含んでなる。
【0142】
本発明のもう1つの態様は、骨髄腫細胞、形質細胞腫細胞、もしくは形質細胞白血病細胞といった、血液の癌に特徴的な腫瘍細胞の、最終分化、細胞増殖停止および/またはアポトーシスを選択的に誘導し、生存能を低下させる方法(たとえば、in vitro法、in vivo法)であって、その方法は、第1の量のHDAC阻害剤、たとえば、PXD-101といった、本明細書に記載のヒストンデアセチラーゼ阻害剤、および第2の量の他の化学療法薬、たとえばVEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファランから選択される他の化学療法薬を、腫瘍細胞と接触させることを含んでなり、第1の量および第2の量を合わせたものが、有効な量となる。
【0143】
本発明のもう1つの態様は、腫瘍細胞、たとえば、骨髄腫細胞、形質細胞腫細胞、もしくは形質細胞白血病細胞といった、血液の癌に特徴的な腫瘍細胞の細胞増殖を防止、阻害(完全に、もしくは部分的に)、または停止する方法(たとえば、in vitro法、in vivo法)であって、その方法は、第1の量のHDAC阻害剤、たとえば、PXD-101といった、本明細書に記載のヒストンデアセチラーゼ阻害剤、および第2の量の他の化学療法薬、たとえばVEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファランから選択される他の化学療法薬を、腫瘍細胞と接触させることを含んでなり、第1の量および第2の量を合わせたものが、有効な量となる。
【0144】
ある実施形態において、HDAC阻害剤の量は、約1 pMから約50 μMまで、たとえば、約1 pMから約5 μMまで、たとえば、約1 pMから約500 nMまで、たとえば、約1 pMから約50 nMまで、たとえば、約1 pMから約500 pMまでの、接触濃度である。ある実施形態において、接触濃度は約5.0 μM未満である。ある実施形態において、接触濃度は約500 nMである。ある実施形態において、接触濃度は約130 nMである。ある実施形態において、接触濃度は約100 nMである。
【0145】
ある実施形態において、前記方法はin vitroで実施される。
【0146】
ある実施形態において、前記方法はin vivoで実施される。
【0147】
ある実施形態において、腫瘍細胞は骨髄腫細胞である。
【0148】
ある実施形態において、腫瘍細胞は形質細胞腫細胞である。
【0149】
ある実施形態において、腫瘍細胞は形質細胞白血病細胞である。
【0150】
ある実施形態において、腫瘍細胞はトランスジェニック細胞である。
【0151】
ある実施形態において、腫瘍細胞は、哺乳類、たとえばヒトといった、被験体(たとえば、生きている被験体)に存在する(またはその一部である)。
【0152】
IV. 投与法および用量
上記のように、本発明のある態様は、治療上有効な量のヒストンデアセチラーゼ阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤を、治療の必要な患者に投与することを含んでなる、血液の癌の治療法に関する。
【0153】
上記のように、本発明のある態様は、第1の量のヒストンデアセチラーゼ阻害剤、たとえば、PXD-101のような本明細書に記載のヒストンデアセチラーゼ阻害剤、ならびに第2の量の他の化学療法薬、たとえば、VEGFに対する抗体、アバスチン(登録商標)、CD20に対する抗体、リツキシマブ、ボルテゾミブ、サリドマイド、デキサメタゾン、ビンクリスチン、ドキソルビシン、およびメルファランから選択される他の化学療法薬を、治療の必要な患者に投与することを含んでなる、癌を治療する方法に関するが、この第1および第2の量は合わせて治療上有効な量となる。
【0154】
他の化学療法薬(単数)(もしくは、2つ以上使用される場合、複数の化学療法薬)は、当業者によく知られている従来の方法およびプロトコルで投与することができる。たとえば、アバスチン(登録商標)の典型的な用量は、5-15 mg/kgであり、リツキシマブの典型的な用量は、10-500 mg/m2である。
【0155】
HDAC阻害剤は、経口剤形、たとえば、いずれも製薬技術分野の当業者によく知られている、錠剤、カプセル剤(これらはそれぞれ持続放出製剤を含む)、丸剤、粉剤、顆粒剤、エリキシル剤、チンキ剤、懸濁液剤、シロップ剤、および乳剤として投与することができる。また、HDAC阻害剤は、製薬技術分野の当業者によく知られている、静脈内(ボーラスもしくは輸液)、腹腔内、皮下、もしくは筋肉内投与剤形で投与することができる。
【0156】
HDAC阻害剤は、活性成分の持続放出を可能にするような方式で製剤化された、デポー注射剤もしくはインプラント製剤として投与することができる。活性成分は小球形または小円柱形に圧縮され、皮下もしくは筋肉内に、デポー注射剤もしくはインプラントとして埋め込まれる。インプラントは、生分解性ポリマーもしくは合成シリコーン、たとえば、Silastic、シリコーンゴム、またはDow-Corning社製の他のポリマーといった、不活性材料を用いることができる。
【0157】
HDAC阻害剤はまた、小単層ベシクル、大単層ベシクル、および多重膜ベシクルといった、リポソームデリバリーシステムの形で投与することができる。リポソームは、コレステロール、ステアリルアミン、もしくはホスファチジルコリンといった、さまざまなリン脂質から作製することができる。
【0158】
HDAC阻害剤はまた、当該化合物分子が結合される個別の担体として、モノクローナル抗体を使用することによって、送達することもできる。
【0159】
HDAC阻害剤はまた、標的指向性薬物担体として可溶性ポリマーを用いて、調製することができる。こうしたポリマーとして、ポリビニルピロリドン、ピランコポリマー、ポリヒドロキシ-プロピル-メタクリルアミド-フェノール、ポリヒドロキシエチル-アスパルトアミド-フェノール、またはパルミトイル残基で置換されたポリエチレンオキシド-ポリリジンを挙げることができる。
【0160】
さらに、HDAC阻害剤は、薬物の放出制御を実現するのに有用な生分解性ポリマー、たとえば、ポリ乳酸、ポリグリコール酸、ポリ乳酸とポリグリコール酸のコポリマー、ポリεカプロラクトン、ポリヒドロキシ酪酸、ポリオルトエステル、ポリアセタール、ポリジヒドロピラン、ポリシアノアクリレート、ならびにハイドロゲルの架橋したもしくは両親媒性のブロックコポリマーを用いて調製することができる。
【0161】
HDAC阻害剤を用いる投与計画は、生物種、年齢、体重、性別、ならびに治療すべき癌のタイプ;治療すべき癌の重症度(すなわち、病期);投与経路;被験体の腎機能および肝機能;および使用される個別の化合物もしくはその塩、などのさまざまな要因によって、選択することができる。通常の熟練した医師もしくは獣医師であれば、たとえば病気の進行を妨げ、(完全に、もしくは部分的に)阻害し、または停止させるといった、治療に必要な薬物の有効量を、容易に決定して処方することができる。
【0162】
HDAC阻害剤の経口投与量は、目的とする癌を治療するために、単独で、または併用療法の一部として使用する場合、1日当たり約2〜約2000mg、たとえば、1日当たり約20〜約2000mg、たとえば、1日当たり約200〜約2000mgの範囲とすることができる。たとえば、経口投与量は、1日当たり約2、約20、約200、約400、約800、約1200、約1600、または約2000mgとすることができる。1日当たりの総量は、単回投与で与えることができるが、1日当たり2回、3回もしくは4回といった複数回投与で与えることもできる。
【0163】
たとえば、被験体は、約2〜約2000mg/日、たとえば、約20〜約2000mg/日、たとえば、約200〜約2000mg/日、たとえば、約400〜約1200mg/日の範囲で投与を受けることができる。したがって、1日1回投与用に適切に調製された薬剤は、約2〜約2000mg、たとえば、約20〜約2000mg、たとえば、約200〜約2000mg、たとえば、約400〜約1200mgを含有すると考えられる。HDAC阻害剤は、1日に1回の投与で、もしくは2、3、もしくは4回に分けた用量で投与することができる。したがって、1日2回投与用に適切に調製された薬剤は、必要とされる1日量の半分を含有することになる。
【0164】
静脈内もしくは皮下に、被験体は、1日当たり約3〜1500 mg/m2、たとえば1日当たり約3、30、60、90、180、300、600、900、1000、1200、もしくは1500 mg/m2を送達するのに十分な量の、HDAC阻害剤(たとえば、PXD-101)を受け入れるであろう。上記の量は、いくつかの適当な方法で、たとえば、大容量の低濃度HDAC阻害剤を、長時間にわたって、もしくは1日数回、投与される。上記の量は、1日以上の連続した日数、断続的な日数、または1週間(7日間)ごとにそれらを組み合わせて、投与することができる。あるいはまた、小容量の高濃度HDAC阻害剤を、短期間にわたって、たとえば、1日1回、1日以上の日数にわたって、連続して、間をおいて、または1週間(7日間)ごとにそれらを組み合わせて、投与することができる。たとえば、1日当たり300 mg/m2の用量を、5日連続で治療当たり総計1500 mg/m2投与することができる。別の投与計画では、連続日数はやはり5日であるが、治療は2ないし3週間続き、治療全体で、総計3000 mg/m2 および4500 mg/m2投与することができる。
【0165】
典型的には、約1.0 mg/mLから約10 mg/mLまで、たとえば、2.0 mg/mL、3.0 mg/mL、4.0 mg/mL、5.0 mg/mL、6.0 mg/mL、7.0 mg/mL、8.0 mg/mL、9.0 mg/mL、もしくは10 mg/mLの濃度のHDAC阻害剤を含有する静注製剤を調製し、上記の投与量を達成できる量として投与することができる。ある例において、1日の全投与量が約300から1200 mg/m2の間となるように、十分な容量の静注製剤を1日で被験体に投与することができる。
【0166】
好ましい実施形態において、900 mg/m2のPXD-101を少なくとも5日間連続して、24時間ごとに静脈内投与することができる。
【0167】
ある実施形態において、PXD-101は、1日総投与量として1500 mg/m2まで投与される。ある実施形態において、PXD-101は、1日総投与量として900 mg/m2を、たとえば、1日1回、連続して(毎日)、もしくは間欠的に、静脈内投与される。ある実施形態において、PXD-101は、1日総投与量として1000 mg/m2を、たとえば、1日1回、連続して(毎日)、もしくは間欠的に、静脈内投与される。ある実施形態において、PXD-101は3週間毎に第1日から第5日まで毎日投与される。
【0168】
HDAC阻害剤の静脈内投与のために許容されるpH範囲において、妥当な緩衝能を有するグルクロン酸、L-乳酸、酢酸、クエン酸、もしくは製薬上許容される酸/共役塩基をバッファーとして使用することができる。酸または塩基、たとえば、塩酸または水酸化ナトリウムのいずれかによって望ましいpH範囲に調整されたクエン酸ナトリウム溶液も使用することができる。典型的には、静注製剤のpH範囲は、約5から約12までの範囲内とすることができる。静注製剤に好ましいpH範囲は、HDAC阻害剤がヒドロキサム酸部分を有する場合(たとえば、PXD-101のように)、約9から約12までとすることができる。適当な添加剤を選択する際には、HDAC阻害剤の溶解性および化学的適合性を考慮すべきである。
【0169】
好ましくは、約5から約12までのpHで、当技術分野で周知の方法に従って調製された皮下投与製剤は、適当なバッファーおよび等張化剤も含有する。こうした製剤は、毎日1回ないし複数回の皮下投与で、たとえば、毎日1、2もしくは3回で、HDAC阻害剤の1日投与量を送達するように製剤化することができる。適当な製剤のバッファーおよびpHは、投与すべきHDAC阻害剤の溶解性に応じて、当業者により容易に選択される。酸または塩基、たとえば、塩酸または水酸化ナトリウムのいずれかによって望ましいpH範囲に調整された塩化ナトリウム溶液も、皮下投与製剤に使用することができる。典型的には、皮下投与製剤のpH範囲は、約5から約12の範囲内とすることができる。皮下投与製剤に好ましいpH範囲は、HDAC阻害剤がヒドロキサム酸部分を有する場合(たとえば、PXD-101のように)、約9から約12までである。適当な添加剤を選択する際には、HDAC阻害剤の溶解性および化学的適合性を考慮すべきである。
【0170】
HDAC阻害剤はまた、適当な経鼻投与媒体の局所使用によって、または経皮経路によって、当業者によく知られているそうした形の経皮パッチを用いて、経鼻投与の形で投与することができる。経皮デリバリーシステムの形で投与するため、投与は、投与計画の全体にわたって、おそらく、間欠的ではなく連続的となる。
【0171】
V. 医薬組成物
HDAC阻害剤は、目的とする投与形態、すなわち、経口錠剤、カプセル剤、エリキシル剤、シロップ剤などについて適切に選択され、従来の製薬上の慣例と矛盾しない、適当な医薬用希釈剤、賦形剤、もしくは担体(ここでは、集合的に「担体」材料と呼ぶ)と混合した活性成分として投与することができる。
【0172】
たとえば、ある実施形態において、医薬組成物は、HDAC阻害剤PXD-101を、L-アルギニンとともに溶液中に含んでなる。この組成物を調製するために、10g量のL-アルギニンを、約70 mLの注射用水(Water-For-Injections BP)を入れた容器に加えた。この混合物を、アルギニンが溶解するまでマグネティックスターラーで撹拌した。5g量のPXD-101を加え、PXD-101が溶解するまで、混合物を25℃にて撹拌した。その溶液を、最終容量が100 mLとなるまで注射用水で希釈した。その結果得られた溶液は、pHが9.2〜9.4であり、浸透圧は約430 mOSmol/kgであった。この溶液は、適当な0.2μm無菌濾過(たとえばPVDF)膜を通して濾過した。濾過した溶液をバイアルもしくはアンプルに入れ、加熱により、または適当なストッパーおよびキャップにより、密封した。溶液は室温で、またはより好ましくは、薬物の分解を少なくするために冷蔵(たとえば、2〜8℃)で保存した。
【0173】
ある実施形態において、HDAC阻害剤(たとえば、PXD-101)は、経口投与することができる。経口投与は、錠剤もしくはカプセル剤の形をとることができる。HDAC阻害剤は、毒性がなく、製薬上許容される、不活性な経口担体、たとえば、乳糖、デンプン、ショ糖、ブドウ糖、メチルセルロース、結晶セルロース、クロスカルメロースナトリウム、ステアリン酸マグネシウム、リン酸二カルシウム、硫酸カルシウム、マンニトール、ソルビトールなど、またはそれらの組み合わせと、混合する。液体状での経口投与のためには、HDAC阻害剤は、毒性がなく、製薬上許容される、不活性な任意の経口担体、たとえば、エタノール、グリセロール、水などと混合する。さらに、望ましい場合、もしくは必要である場合には、適当な結合剤、滑沢剤、崩壊剤、および着色剤もこの混合物に組み入れることができる。適当な結合剤には、デンプン、ゼラチン、天然の糖、たとえば、ブドウ糖もしくはβ乳糖、コーンシロップ、天然および合成ガム、たとえば、アカシア、トラガカントもしくはアルギン酸ナトリウム、カルボキシメチルセルロース、結晶セルロース、クロスカルメロースナトリウム、ポリエチレングリコール、ワックスなどがある。上記剤形への使用に適した滑沢剤には、オレイン酸アトリウム、ステアリン酸ナトリウム、ステアリン酸マグネシウム、安息香酸ナトリウム、酢酸ナトリウム、塩化ナトリウムなどがある。上記剤形への使用に適した崩壊剤としては、デンプン、メチルセルロース、寒天、ベントナイト、キサンタンガムなどが挙げられる。
【0174】
本明細書に記載され、本発明の方法での使用に適した、HDAC阻害剤の製薬上許容される適切な塩は、毒性のない通常の塩であって、これには、無機塩基との塩、たとえば、アルカリ金属塩(例、リチウム塩、ナトリウム塩、カリウム塩など)、アルカリ土類金属塩(例、カルシウム塩、マグネシウム塩など)、アンモニウム塩;有機塩基との塩、たとえば、有機アミン塩(例、トリエチルアミン塩、ピリジン塩、ピコリン塩、エタノールアミン塩、トリエタノールアミン塩、ジシクロヘキシルアミン塩、N,N'-ジベンジルエチレンジアミン塩など)など;無機酸付加塩(例、塩酸塩、臭化水素酸塩、硫酸塩、リン酸塩など);有機カルボン酸もしくはスルホン酸付加塩(例、ギ酸塩、酢酸塩、トリフルオロ酢酸塩、マレイン酸塩、酒石酸塩、メタンスルホン酸塩、ベンゼンスルホン酸塩、p-トルエンスルホン酸塩など);塩基性もしくは酸性アミノ酸との塩(例、アルギニン、アスパラギン酸、グルタミン酸など)などといった、塩基との塩または酸付加塩を含めることができる。
【0175】
キット
本発明のある態様は:
(a) ヒストンデアセチラーゼ(HDAC)阻害剤、たとえばPXD-101(好ましくは製薬上許容される製剤の成分として、好ましくは、適当な容器に入れて、および/または適切に包装して提供される);ならびに、
(b) 別の化学療法薬(好ましくは製薬上許容される製剤の成分として、好ましくは、適当な容器に入れて、および/または適切に包装して提供される);
を含んでなる、キットもしくはキット・オブ・パーツ(kit-of-parts)に関するが、
前記キットもしくはキット・オブ・パーツは癌の治療法で使用することに適している。
【0176】
ある実施形態において、キットもしくはキット・オブ・パーツはさらに、指示、たとえば使用説明書、その例として、たとえば2つの薬物の投与のための指示を含んでなる。ある実施形態において、使用説明書は、薬物の併用が適切な治療となる適応症(たとえば、癌、癌のタイプ)のリストを含む。
【0177】
ある実施形態において、キットもしくはキット・オブ・パーツはさらに、組み立てて使用(たとえば、投与)するための、適当な試薬(たとえば、バッファー、溶媒)、および器具(たとえば、チューブ、シリンジ)を含んでなる。
【0178】
下記の実施例は、本発明の好ましい実施形態を、より完全に説明するものである。しかしながら、それらは、けっして、本明細書に記載の本発明の広汎な範囲を限定するものと解釈されるべきではない。
【実施例】
【0179】
癌細胞の増殖に対するHDAC阻害剤の、単独での効果、もしくは化学療法薬との併用での効果を測定するために、さまざまなヒト多発性骨髄腫細胞株をin vitroで増殖させて、HDAC阻害剤(すなわちPXD-101)のみとともに、または下記の化学療法薬と組み合わせたHDAC阻害剤とともに、インキュベートした。それに加えて、PXD-101は、単独で、またはデキサメタゾンもしくはボルテゾミブと併用して、多発性骨髄腫治療のための臨床試験に使用される。アバスチン(登録商標)(CD20に対する抗体)もしくはリツキシマブ(VEGFに対する抗体)とPXD-101の併用を採用した追加試験も実施した。
【0180】
実施例1
PXD-101のin vitroでの抗増殖活性
さまざまなヒト多発性骨髄腫細胞株に対するHDAC阻害剤の効果をin vitroで検討し、多発性骨髄腫の治療におけるHDAC阻害剤(すなわちPXD-101)の臨床的使用の可能性を判断した。
【0181】
CellTiter-Gloアッセイを用いて、in vitroで、多発性骨髄腫細胞の細胞増殖もしくは生存能に対するPXD-101の影響を評価した(表1を参照されたい)。たとえば、6種類の多発性骨髄腫細胞株(RPMI-8226、U266、EJM、LP-1、OPM-2およびKMS-12-BM)を実験に使用した。細胞を培養し、一定期間、PXD-101のみと接触させ、もしくは化学療法薬とともにPXD-101と接触させて、その後、生細胞数を、Promega社製CellTiter-Glo試薬(Madison, WI; カタログ番号G7572)を用いて以下のように算定した。
【0182】
細胞を、培地90μL中3,000個/ウェルとして96ウェルプレートにまいた。翌日、さまざまな濃度のPXD-101を、単独で、もしくは化学療法薬とともに、10μL/ウェルとして添加し、その後、細胞を37℃にて72時間インキュベートした。場合によっては、細胞は、PXD-101添加前に6時間、化学療法薬で前処理した。その後、50μL/ウェルのCellTiter-Glo試薬を加え、細胞を2分間振盪した後、さらに10分間室温でインキュベートした。インキュベーション時間後、ルミネセンス(光)をルミノメーターで測定した。
【0183】
CellTiter-Gloアッセイは、存在するATP量を測定するものであって、それは言い換えると、細胞数および生存能に比例する。CellTiter-Glo試薬は、基質(ルシフェリン)存在下で、光を放出するATP依存性反応を触媒する酵素(ルシフェラーゼ)を利用する。生細胞数の増大は、結果として全体的なATPレベルの増加をもたらし、それが次に、放射光の増加に反映される。ある薬物が細胞の増殖もしくは生存能を阻害するならば、これは、未処理対照培養物と比較して、放射光の減少に反映されることになる。
【0184】
活性パーセント(活性%)は、それぞれのテスト化合物について下記のように算出される:
活性% = { (Sc-B) / (S°-B) } x 100
式中、Scは、テスト化合物の存在下で測定されたシグナルを表し、S°は、テスト化合物の非存在下で測定されたシグナルを表し、Bは培地のみを入れたブランクウェルで測定されたバックグラウンドシグナルを示す。IC50は、未処理対照培養物の50%活性を達成する薬物濃度に相当する。IC50値は、ソフトウェアパッケージPrism 3.0 (GraphPad Software社, San Diego, Calif.)を用いて可変勾配オプションで算出した。
【0185】
本実施例では、6種の別個の多発性骨髄腫細胞株、3種の形質細胞白血病細胞株、および1種の形質細胞腫に対するPXD-101の効果を報告する。細胞を、in vitroでPXD-101とともに72時間インキュベートし、その生存能をCellTiter-Gloアッセイによって測定した。PXD-101はこのアッセイで、生細胞数を大きく減少させた。PXD-101のIC50は、0.028から0.196μMの範囲であり、10細胞株で測定された平均IC50は0.097μMであった。
【0186】
下記の表は、さまざまな多発性骨髄腫細胞株、ならびにさまざまな形質細胞白血病細胞株および形質細胞腫細胞株におけるPXD-101のIC50濃度をまとめたものである。
【表1】

【0187】
したがって、この試験から、多発性骨髄腫、形質細胞白血病、および形質細胞腫の治療を目的とする臨床試験に使用するための、PXD-101の有効治療濃度が確認される。
【0188】
実施例2
併用試験
標準的な化学療法薬と併用したHDAC阻害剤の効果をin vitroで検討し、さまざまな化学療法薬(すなわち、ビンクリスチン、ドキソルビシン、メルファラン、デキサメタゾン)と併用した場合の、HDAC阻害剤(すなわちPXD-101)の臨床的使用の可能性を判断した。
【0189】
Wst-1増殖アッセイを用いて、薬物併用の抗増殖効果を評価した。この実験に使用した細胞株を表2に示す。4種の黒色腫細胞株(たとえば、JJN3、LP-1、RPMI-8226、U266)を併用試験に使用した。市販のプログラムCalcuSynを用いて、併用効果が相乗的であるか、拮抗的であるか、または相加的であるかを判断した。
【0190】
細胞を培養し、PXD-101のみと接触させ、もしくは化学療法薬とともにPXD-101と接触させて、一定期間インキュベートした後、下記のBoehringer Mannheim社製 Cell Proliferation Reagent WST-1(カタログ番号1 644 807)を用いて、生細胞数を評価した。
【0191】
細胞を、培地100μL中3,000個/ウェルとして96ウェルプレートにまいた。翌日、さまざまな濃度のPXD-101を、単独で、もしくは化学療法薬とともに添加し、細胞を37℃にて48時間インキュベートした。その後、10μL/ウェルのWst-1試薬を加え、細胞を1時間、再インキュベートした。インキュベーション時間後、吸光度を測定した。
【0192】
Wst-1は、細胞の酵素によって切断されてホルマザン色素となる、テトラゾリウム塩である。生細胞数の増大は、結果として、サンプルにおいて、ミトコンドリア脱水素酵素の全活性を増加させる。酵素活性のこうした増加は、生成されるホルマザン色素量の増加につながり、それはそのまま、培養物中の代謝活性細胞の数と相関する。生成したホルマザン色素は、走査型マルチウェル分光光度計で、450nmの波長で、色素溶液の吸光度を測定する(基準波長690 nm)ことによって定量する。
【0193】
生細胞数の減少の活性パーセント(活性%)は、それぞれのテスト化合物について下記のように算出される:
活性% = { (Sc-B) / (S°-B) } x 100
式中、Scは、テスト化合物の存在下で測定されたシグナルを表し、S°は、テスト化合物の非存在下で測定されたシグナルを表し、Bは培地のみを入れたブランクウェルで測定されたバックグラウンドシグナルを示す。IC50は、50%活性を達成する濃度に相当する。IC50値は、ソフトウェアパッケージPrism 3.0 (GraphPad Software社, San Diego, Calif.)を用いて、最高値を100、最低値を0に設定して算出した。
【0194】
濃度を次第に高めたテスト化合物の存在下で細胞生存能を測定することによって、化合物の細胞毒性および細胞増殖に対する効果をともに評価する。
【0195】
結果は、Biosoft社製 CalcuSynプログラムによる併用指数(Combination Index: CI)法を用いて、さらに解析した。1未満のCI値は相乗作用を示し、1は相加作用を示し、1より大きい値は拮抗作用を示す。
【0196】
CalcuSynプログラムを用いて、CIはアイソボログラムの式:CI = (D)1/(Dx)1 + (D)2/(Dx)2により算定される。薬物1 (D)1および薬物2 (D)2は併用でX%阻害し、(Dx)1および(Dx)2は、同様にX%阻害する薬物1および薬物2単独での用量である。それぞれの化合物について、Wst-1アッセイで決定された各用量での増殖%の値を使用する。0.3未満のCI値はきわめて相乗的であり、0.3〜0.7は相乗的、0.7〜1は相加的、1を超える値は拮抗的である。さまざまな阻害パーセント濃度でCI値を比較する。
【0197】
PXD-101 + デキサメタゾン
JJN3、LP-1、RPMI-8226、およびU266腫瘍細胞株に化学療法薬デキサメタゾンを添加するのと同時に、その24時間後に、またはその24時間前に、PXD-101を添加すること(たとえば、48時間共インキュベーション)の抗増殖効果を、やはり上記の方法によって調べた(例えば、図1を参照されたい)。
【0198】
細胞がデキサメタゾンと併用したPXD-101によって同時に(すなわち、48時間の共インキュベーションで)処理される、または24時間 PXD-101その後48時間 PXD-101 + DEXで処理される、または24時間DEXその後48時間 PXD-101 + DEXで処理されるとき、LP-1およびU266腫瘍細胞株では、ある範囲の濃度にわたって相乗効果が得られた(表2を参照されたい)。U266細胞株では、PXD-101を24時間投与したのち48時間 PXD-101 + DEXとしたときに、またLP1細胞株では、DEXを24時間投与したのちPXD-101およびDEXを48時間共インキュベーションしたときに、ある範囲の濃度および条件にわたって、強い相乗性(CI<0.3)が観察された(表2を参照されたい)。
【0199】
PXD-101 + ドキソルビシン
黒色腫細胞株(たとえば、JJN3、LP-1、RPMI-8226、U266)をPXD-101およびドキソルビシンで処理した。上記のように、黒色腫細胞株に対するこれらの化合物の併用効果は、アイソボログラムをプロットし、併用指数を算出することによって測定した。
【0200】
PXD-101およびドキソルビシンを、ある濃度範囲にわたって48時間共インキュベートしたとき、この組み合わせで、相加的から相乗的な効果が観察された(表2を参照されたい)。
【0201】
この実施例は、標準的な化学療法薬と併用するPXD-101の効果を報告するものである。U266細胞株を、DEXの投与に先だってPXD-101と24時間インキュベートした場合、ならびにLP1細胞を、PXD-101の投与に先だってDEXと24時間インキュベートした場合、一定の範囲の濃度および条件にわたって、PXD-101とDEXとの間に強い相乗作用が存在する(表2を参照されたい)。
【0202】
PXD-101とドキソルビシンとの併用は、それらの化合物をある範囲の濃度および条件にわたって共インキュベートしたとき、黒色腫細胞株に対して、相加的から相乗的な効果をもたらした(表2を参照されたい)。
【0203】
下記の表は、4種の黒色腫細胞株について、3通りの異なるインキュベーション計画を用いて、PXD-101および4種の化学療法薬(すなわち、ビンクリスチン、ドキソルビシン、メルファラン、デキサメタゾン)により併用処理した結果得られた、併用指数(CI)をまとめたものである。
【表2】

【0204】
PXD-101 + リツキシマブ
結腸癌細胞株SU-DHL-4およびB細胞リンパ腫細胞株RajiおよびRAMOSをPXD-101およびリツキシマブで処理した。上記のように、黒色腫細胞株に対するこうした化合物の併用効果は、アイソボログラムをプロットして併用指数を計算することによって測定された。PXD-101およびリツキシマブを、ある範囲の濃度にわたって48時間、共インキュベートしたとき、相加的から相乗的な効果がこの併用について観察された(図5を参照されたい)。
【0205】
したがって、上記の併用試験は、PXD-101の臨床試験に使用するための、治療に有効な組み合わせを特定する。
【0206】
実施例3
in vitroでボルテゾミブと併用したPXD-101の抗増殖活性
化学療法薬ボルテゾミブと併用したHDAC阻害剤の効果をin vitroで調べ、併用化学療法におけるHDAC阻害剤(すなわち、PXD-101もしくはSAHA)の臨床的使用の可能性を判断した。
【0207】
CellTiter-Glo細胞生存能アッセイ(上記)を用いて、ボルテゾミブと併用したPXD-101の抗増殖効果を評価した(図2)。比較のために、ボルテゾミブと併用したSAHAの抗増殖効果も測定した(図3)。併用試験には多発性骨髄腫細胞株U266を使用した。U266細胞を1 nMのボルテゾミブで6時間処理した後、1 nMのボルテゾミブと130 nMのPXD-101を併用して72時間、共処理した(図2)。同様に、U266細胞を、1 nMのボルテゾミブで6時間処理した後、1 nMのボルテゾミブと130 nMのSAHAを併用して72時間、共処理した(図3)。対照実験では、PXD-101、SAHAもしくはボルテゾミブのいずれかを除いた。
【0208】
U266をボルテゾミブで前処理し、その後ボルテゾミブおよびPXD-101で上記のように共処理したとき、増殖に対する効果は、いずれか一方の薬物で処理するより大きかった(図2)。ボルテゾミブおよびPXD-101による共処理は、結果として少なくとも相加的効果をもたらした。
【0209】
U266をボルテゾミブで前処理し、その後ボルテゾミブおよびSAHAで上記のように共処理したとき(図2)、増殖に対する効果は、ボルテゾミブ/PXD-101の併用による処理より小さかった(図3)。その上、U266細胞をPXD-101単独で処理したとき、増殖に対する効果(図2)は、U266細胞をSAHA単独で処理した場合より大きかった(図3)。したがって、ボルテゾミブと併用したPXD-101は、ボルテゾミブと併用したSAHAより強く増殖を阻害した。さらに、PXD-101は単独で、SAHA単独より強く増殖を阻害した。
【0210】
したがって、実施例3に記載の試験は、臨床試験で使用するための、PXD-101およびボルテゾミブの治療上有効な濃度および組み合わせを明らかにする。
【0211】
実施例4
臨床試験:PXD-101単剤療法、およびPXD-101 + DEX併用療法
主目的
この試験の主目的は、進行した黒色腫の患者において、PXD-101治療の有効性を評価することであり、Bladeら(Br. J. Haematol., 1998, vol. 102, pp. 1115-1123)の奏効基準を用いて、奏効率によって判定される。
【0212】
副次的な目的
この試験の副次的な目的は、PXD-101単剤治療後の、奏効までの時間、奏効持続時間、無増悪期間、次回治療までの期間、および生存期間を調べること;ならびにPXD-101単剤治療後の安全性を調べることである。
【0213】
2サイクルのPXD-101単剤治療後にCR、PRもしくはMRに達しない患者に関する目的(パートB):
この点に関する目的としては、下記が挙げられる:デキサメタゾンおよびPXD-101の併用の有効性(奏効率、奏効持続時間、無増悪期間および生存期間)ならびに安全性を評価することによって、化学療法の感受性を高めるPXD-101の効果を調べること;単剤療法およびデキサメタゾン併用による静脈内投与後、第1日および第4日のPXD-101に関する薬物動態パラメーターを決定すること;第1日および第4日の血液単核球において、および可能であれば腫瘍生検標本(骨髄)において、PXD-101の薬力学的効果を調べること。
【0214】
治験デザイン
PXD-101単剤療法の有効性を評価するための非盲検、非無作為化、多施設第II相治験、ならびにノンレスポンダー(効果のなかった患者)においてデキサメタゾンと併用したPXD-101の有効性および安全性の評価。約50人の評価可能な患者が含まれる。
【0215】
患者の主な選択基準
2つの事前の治療に失敗した患者の中で、多発性骨髄腫の確定診断を受けた18歳以上の患者(下記の診断基準を参照されたい)。
【0216】
多発性骨髄腫の診断基準
A. 血清中のモノクローナル免疫グロブリン(M成分)について、IgG型のM成分>30 g/L、IgA型M成分>20 g/L、IgD型もしくはIgE型M成分は任意の濃度、および/または尿中のk型もしくはl型のM成分排泄>1g/24時間。
【0217】
B. 上記A項で示したより低い濃度の血清および/または尿中のM成分。
【0218】
C. 骨髄吸引物中10%以上の形質細胞、または骨髄もしくは軟部組織腫瘍由来の生検標本における形質細胞増加
D. 溶骨性骨病変
多発性骨髄腫の診断は、以下の組み合わせのうち1つを要する:A+C、A+D、またはB+C+D。
【0219】
評価可能な疾患(上記)
適切な骨髄および肝機能。総ビリルビン<1.5 x正常値の上限。AST (SGOT)、ALT (SGPT)<2.5 x正常値の上限。一般健康状態(Performance status: PS)<2(ECOGスケール)。推定余命が3か月より長い。生殖能力を有する女性患者は、治験登録前の最後の7日以内の血清妊娠検査が陰性であるものとし、治験中および治験後60日間、安全な避妊薬を使用する。男性治験参加者に対する妊娠可能な女性パートナーも、同様に避妊薬を使用しなければならない。
【0220】
PXD-101製剤
PXD-101注射剤(50 mg/mL)には、pH 9.0〜9.9のWater-for-Irrigation (Ph. Eur.:ヨーロッパ薬局方)に溶解した50 mg/mLのPXD-101および100 mg/mLのL-アルギニン(Ph. Eur.)の透明な黄色の無菌溶液10 mLが入っている。この製剤は、注入前に9.9%生理食塩水、または5%ブドウ糖液で希釈する必要がある。
【0221】
PXD-101の調製および投与
個別の投与量は体表面積に基づく。計算された用量をPXD-101バイアルから取り出し、輸液用等張ブドウ糖液の250 mLバッグに加え、30分かけて静脈内に注入する。割り当てられたスケジュールにしたがって、治療は1日1回行われることになる。
【0222】
デキサメタゾンの送達、調製および投与
デキサメタゾンの標準用量40 mg/日は、8 mgを5錠として経口投与することになっている。PXD-101をも静脈内(IV)投与する治療日には、デキサメタゾンをPXD-101投与の2時間後に投与する。
【0223】
治療の用量およびスケジュール - 初期試験パートA
PXD-101を、第1サイクルにおいて、900 mg/m2/日の30分間の静脈内(IV)注入として投与する。治療を5日間連続して24時間(±2時間)おきに行った後、2週間観察する。これがサイクル1である。
【0224】
サイクル2は、第22日(試験第22日)に、PXD-101による治療の2回目の5日サイクルで開始し、その後2週間の観察とする。試験第6週(サイクル2、第15〜21日)の間に、患者は、奏効を判断するための評価試験を受ける。奏効性は、試験第43日に、前週からの試験結果に基づいてCR、PR、MR、SD、PDとして評価指定を受け、治療を次のように継続する:
すべての患者は最低限として2サイクルのPXD-101単剤療法を受ける。2サイクル終了時点で、患者は奏効について評価を受ける。試験第43日に決定された患者の奏効性に基づいて、治療は試験パートAを続け、もしくは次のように試験パートBとして続行する:
CR(完全奏効)、PR(部分奏効)、もしくはMR(やや有効)の患者は、増悪まで、または最初の2サイクルを含めて最大8サイクルを受けるまで、試験パートAのPXD-101単剤療法を続ける。奏効性がNC/SD(不変/安定)、PD(進行(増悪))の患者は、試験パートB、PXD-101 + デキサメタゾンを、次項のように開始する。
【0225】
治療の用量およびスケジュール - 試験パートB
2サイクルのPXD-101単剤療法後、2回目の治療サイクル後の評価として奏効性がSDもしくはPDの患者は、サイクル1および2で注入されたPXD-101と併用して、第2〜5日および第10〜13日に毎日経口でデキサメタゾン40 mgを加えた治療を続行する。試験パートBの患者は最低2サイクルの併用療法を受ける。この併用に反応する患者は、増悪するまで、または最初の2サイクルを含めて全部で8サイクルを終えるまで、治療を続けることができる。
【0226】
実施例5
臨床試験:PXD-101とボルテゾミブとの併用療法
この試験の主たる目的は:(i) ボルテゾミブと併用して投与されるPXD-101の最大耐容量(MTD)および用量制限毒性(DLT)を測定すること;(ii)今後の併用による第II相プロトコルのために推奨される各薬物の用量を確立すること;(iii) 再発/難治性多発性骨髄腫の患者においてPXD-101 + ボルテゾミブ併用の抗腫瘍活性を調べること、とした。
【0227】
副次的な目的は:(i) ボルテゾミブの存在下および非存在下でのPXD-101の薬力学(ヒストンアセチル化)の比較;(ii) PXD-101の存在下および非存在下でのボルテゾミブの薬力学(プロテアソーム阻害)の測定;ならびに(iii)ボルテゾミブと併用して投与したときのPXD-101の薬物動態の測定、とした。
【0228】
この治験は、安全性を確認し、かつ抗腫瘍活性、薬物動態、および薬力学を評価するためにMTDまで増量した投与群を含む、少なくとも2つの以前の治療に失敗した再発/難治性多発性骨髄腫の患者、ならびに同じ多発性骨髄腫患者集団における、非盲検、多施設、用量漸増、安全性、薬物動態、および薬力学試験である。
【0229】
全部で45人までの患者が試験登録に参加し、約30人を用量漸増群、最大15人をMTDまで増量した投与群とする。患者は、21日サイクルで、第1〜5日に毎日静脈内に(IV)PXD-101による治療(30分輸液)を受け、第1、4、8および11日に静脈内に(IV)ボルテゾミブによる治療(3〜5秒注入)を受ける。PXD-101の輸液はボルテゾミブ投与の約1時間後に開始する。用量漸増は、PXD-101 300〜900 mg/m2およびのボルテゾミブ0.7〜1.6 mg/m2の範囲で、併用のMTDが確立されるまで、一連のコホートで行う。
【0230】
PXD-101およびボルテゾミブの併用のMTDが確立されたならば、再発/難治性多発性骨髄腫の患者で追加の最大15人を、安全性、PKおよびPDを確認し、抗腫瘍活性を評価するために、併用MTDに登録する。こうして、漸増群の3〜6人を含めて約20人の患者にMTD量で投与する。MTD増量群では、用量スケジュールを用量漸増群の場合と同じにする。
【0231】
薬物動態および薬力学分析はサイクル1で実施する。PXD-101については、PKおよびPDは、第3および4日(ボルテゾミブ投与のない日とある日)に分析し、ボルテゾミブについては、PD分析は第4および第8日(PXD-101投与のある日とない日)とする。PXD-101の薬力学的評価は、末梢血液細胞におけるヒストンアセチル化の測定によりなされるが、ボルテゾミブについては、20Sプロテアソームの阻害を測定する。抗腫瘍活性は、すべての患者で、2サイクル後、およびその後の各サイクル後に、Blade判定基準(Blade 1998)によって評価する。この試験に参加したすべての患者は、8サイクルに至るまでの間、Bladeの判定基準により増悪と評価されるまで、または有意な治療関連毒性が現れるまで、2つの薬物の投与を受ける。
【0232】
下記の患者選択基準を用いた:18歳以上の、多発性骨髄腫の確定診断(International Myeloma Working Group [IMWG, 2003]に記載の基準)を受けた患者。以前に少なくとも2つの多発性骨髄腫の治療を受け、その後再発、もしくはその治療に失敗。カルノフスキー(Karnofsky)パフォーマンス>70%。推定余命3か月以上。許容される肝機能(ビリルビン<正常値の上限(ULN)の1.5倍;AST (SGOT)、ALT (SGPT)およびアルカリホスファターゼ<ULNの2.5倍)。許容される血液の状態(ANC>1500細胞/mm3; 血小板数>100,000 (plt/mm3); ヘモグロビン>9 g/dL)。血清カリウムは正常範囲内。子供ができる可能性のある男女については、試験期間中、有効な避妊法を使用。
【0233】
実施例6
ヒトにおける腫瘍縮小の証明
PXD-101の第I相非盲検、用量漸増、安全性、薬物動態(PK)、および薬力学(PD)試験は、進行癌の患者で行った。
【0234】
PXD-101を、3週間ごとに5日間毎日30分の静脈内(IV)輸液として投与した。患者のある1群では、PXD-101を、コース2もしくは3において、第1日だけ、1回、2回もしくは3回経口投与した。末梢血単核細胞(PBMNC)から抽出されたヒストンのアセチル化は、ウェスタンブロット法により測定した。静脈内および経口PXD-101のPK/PD特性を評価した。
【0235】
この試験の結果は、下記のとおりである:34人の患者(年齢の中央値58歳、範囲28〜74歳;男性19人、いずれもECOG PS<2)を、合計103サイクルのPXD-101(中央値2;範囲1〜13)により、6通りの用量レベルで治療した:150 mg/m2 (4人)、300 mg/m2 (4人)、600 mg/m2 (6人)、900 mg/m2 (3人)、1000 mg/m2 (12人)、および1200 mg/m2 (5人)。用量制限毒性は、3人の患者で報告された: 600 mg/m2でG3の疲労(1人)、1200 mg/m2で短時間の心房細動(1人)、ならびに1200 mg/m2 でG3の下痢および嗜眠(1人)。もっとも報告の多い他の有害事象(いずれもグレード1/2)は、疲労、嘔気、嘔吐、便秘、下痢、および注射部位の反応などであった。
【0236】
PXD-101のPKは用量に比例した。終末相の消失半減期は、t1/2 が1.8時間の患者1人を除いて、30〜60分の範囲であった。繰り返しIV投与で薬物の蓄積は起こらなかった。注入終了時にCmax (範囲6.5〜55.8 μg/ml)に達し、ヒストンH4高アセチル化と同様に、後者は用量依存的に4〜24時間持続した。平均単回投与経口バイオアベイラビリティは33%であった。5人の患者における1日のb.i.d(1日2回)(1000 mg/m2)経口投与について、Cmaxは1.1〜2.9μg/mL、t1/2 は1.5〜2.0時間であって、平均経口バイオアベイラビリティは42.8%であり、SDは12.5%であった。1000 mg/m2のPXD-101の経口投与は、ベースラインから40〜50%高いヒストンアセチル化を5〜10時間維持した。2人の患者における1日のt.i.d(1日3回)(1000 mg/m2)経口投与について、Cmax は1.3〜1.8μg/mL、t1/2 は2.0〜2.6時間であり、経口バイオアベイラビリティは28%および70%であった。12時間の投与間隔で蓄積は生じなかったが、8時間の投与間隔では蓄積傾向が生じた。患者が5日間1日1回経口投与(1000 mg/m2)を受ける状態で、集積が現在続いている。
【0237】
上皮性縦隔胸腺腫の患者は、縦隔疾患が70%縮小し、1年以上にわたってこの治験を受けた。転移性胞巣状肉腫の患者では、好ましい転帰も認められた。
【0238】
したがって、上記に照らして、HDAC阻害剤PXD-101は、MTD 1000 mg/m2で、1日1回5日間30分の静脈内(IV)注入によって、良好な耐容性を示すと結論した。PXD-101は、経口バイオアベイラビリティを示し、1日に1回、2回または3回の服用によって投与されるとき、良好な耐容性を示す。
【0239】
実施例7
アバスチン(登録商標)およびPXD-101
この試験の目的は、A2780卵巣癌皮下異種移植モデルにおいて、アバスチン(登録商標)の腫瘍増殖阻害効果を調べることとした。マウスを第4日にアバスチン(登録商標)(5 mg/kg)で処置した。アバスチン(登録商標)と併用したPXD-101の化学増感効果も調べた。アバスチン(登録商標)は、マウスのA2780異種移植片において、有意な増殖阻害を引き起こした。図5は、第0-8、0-4もしくは4-8日に与えられたPXD-101がアバスチン(登録商標)との相乗作用を示したことを明らかにし、有意な化学増感効果を示す。
【0240】
当業者は、ただ通常の実験を用いるだけで、本明細書に記載の、本発明の特定の実施形態に相当する多くの均等物を認識し、または確認することができる。こうした均等物は、特許請求の範囲に含まれるものとする。
【0241】
したがって、本発明の好ましい実施形態を図および記述で説明したが、当然のことながら、本発明は変更および修正可能であって、記述された用語そのものに限定されるべきではない。本発明者らは、本発明をさまざまな用途および条件に適合させるために行うことができる、そうした変更および改変を利用することを希望する。こういった改変および変更には、たとえば、哺乳類に本発明の治療薬を投与するための別の医薬組成物;投与されるべき組成物中の治療薬量が異なること;異なる時間および方法で本発明の治療薬を投与すること;ならびに、異なる材料が投薬に含まれること、たとえば、本明細書に具体的に記載した治療薬の望ましい効用と同一の、同様の、もしくは異なる目的での、異なる治療薬の併用、または本発明の治療薬と他の生物活性化合物の併用など、を含めることができる。こうした変更および改変には、本明細書に記載の治療薬の化学構造の変更(こうした変更は、治療薬の望ましい能力は変えないように、しかし投与される医薬組成物中もしくは体内での治療薬の溶解性、治療薬の身体への吸収、貯蔵有効期間の間または体内で治療薬の生物学的作用が望ましい効果をもたらす時までの間の治療薬の保護を変化させるように、薬剤を改変する)、ならびに同様の変更も含まれるものとする。したがって、こうした変更および改変は、均等物の全範囲に適正に含まれるものとし、したがって特許請求の範囲内に含まれるものとする。
【0242】
したがって、本発明、ならびにそれを実施および使用する方法およびプロセスは、本発明の属する分野、もしくは本発明のもっとも密接に関係する分野のいかなる当業者も、それを実施および使用することができるよう、完全、明快、簡潔および正確な表現で記載した。
【特許請求の範囲】
【請求項1】
癌の治療に使用するための、ヒストンデアセチラーゼ阻害剤を含む医薬組成物であって、
癌がリンパ腫または白血病であり、
ヒストンデアセチラーゼ阻害剤が、下記の式の化合物:
【化1】

またはその製薬上許容される塩もしくは溶媒和物である、前記医薬組成物。
【請求項2】
ヒストンデアセチラーゼ阻害剤が、下記の化合物:
【化2】

である、請求項1に記載の医薬組成物。
【請求項3】
癌がリンパ腫である、請求項1または2に記載の医薬組成物。
【請求項4】
癌が非ホジキンリンパ腫(NHL)である、請求項1または2に記載の医薬組成物。
【請求項5】
癌が白血病である、請求項1または2に記載の医薬組成物。
【請求項6】
癌が骨髄性白血病である、請求項1または2に記載の医薬組成物。
【請求項7】
癌が急性骨髄性白血病(AML)または慢性骨髄性白血病(CML)である、請求項1または2に記載の医薬組成物。
【請求項8】
癌がリンパ球性白血病である、請求項1または2に記載の医薬組成物。
【請求項9】
癌が急性リンパ球性白血病(ALL)または慢性リンパ球性白血病(CLL)である、請求項1または2に記載の医薬組成物。
【請求項10】
癌を治療するための薬剤の製造におけるヒストンデアセチラーゼ阻害剤の使用であって、
癌がリンパ腫または白血病であり、
ヒストンデアセチラーゼ阻害剤が、下記の式の化合物:
【化3】

またはその製薬上許容される塩もしくは溶媒和物である、前記使用。
【請求項11】
ヒストンデアセチラーゼ阻害剤が、下記の式の化合物:
【化4】

である、請求項10に記載の使用。
【請求項12】
癌がリンパ腫である、請求項10または11に記載の使用。
【請求項13】
癌が非ホジキンリンパ腫(NHL)である、請求項10または11に記載の使用。
【請求項14】
癌が白血病である、請求項10または11に記載の使用。
【請求項15】
癌が骨髄性白血病である、請求項10または11に記載の使用。
【請求項16】
癌が急性骨髄性白血病(AML)または慢性骨髄性白血病(CML)である、請求項10または11に記載の使用。
【請求項17】
癌がリンパ球性白血病である、請求項10または11に記載の使用。
【請求項18】
癌が急性リンパ球性白血病(ALL)または慢性リンパ球性白血病(CLL)である、請求項10または11に記載の使用。
【請求項1】
癌の治療に使用するための、ヒストンデアセチラーゼ阻害剤を含む医薬組成物であって、
癌がリンパ腫または白血病であり、
ヒストンデアセチラーゼ阻害剤が、下記の式の化合物:
【化1】

またはその製薬上許容される塩もしくは溶媒和物である、前記医薬組成物。
【請求項2】
ヒストンデアセチラーゼ阻害剤が、下記の化合物:
【化2】

である、請求項1に記載の医薬組成物。
【請求項3】
癌がリンパ腫である、請求項1または2に記載の医薬組成物。
【請求項4】
癌が非ホジキンリンパ腫(NHL)である、請求項1または2に記載の医薬組成物。
【請求項5】
癌が白血病である、請求項1または2に記載の医薬組成物。
【請求項6】
癌が骨髄性白血病である、請求項1または2に記載の医薬組成物。
【請求項7】
癌が急性骨髄性白血病(AML)または慢性骨髄性白血病(CML)である、請求項1または2に記載の医薬組成物。
【請求項8】
癌がリンパ球性白血病である、請求項1または2に記載の医薬組成物。
【請求項9】
癌が急性リンパ球性白血病(ALL)または慢性リンパ球性白血病(CLL)である、請求項1または2に記載の医薬組成物。
【請求項10】
癌を治療するための薬剤の製造におけるヒストンデアセチラーゼ阻害剤の使用であって、
癌がリンパ腫または白血病であり、
ヒストンデアセチラーゼ阻害剤が、下記の式の化合物:
【化3】

またはその製薬上許容される塩もしくは溶媒和物である、前記使用。
【請求項11】
ヒストンデアセチラーゼ阻害剤が、下記の式の化合物:
【化4】

である、請求項10に記載の使用。
【請求項12】
癌がリンパ腫である、請求項10または11に記載の使用。
【請求項13】
癌が非ホジキンリンパ腫(NHL)である、請求項10または11に記載の使用。
【請求項14】
癌が白血病である、請求項10または11に記載の使用。
【請求項15】
癌が骨髄性白血病である、請求項10または11に記載の使用。
【請求項16】
癌が急性骨髄性白血病(AML)または慢性骨髄性白血病(CML)である、請求項10または11に記載の使用。
【請求項17】
癌がリンパ球性白血病である、請求項10または11に記載の使用。
【請求項18】
癌が急性リンパ球性白血病(ALL)または慢性リンパ球性白血病(CLL)である、請求項10または11に記載の使用。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2013−49706(P2013−49706A)
【公開日】平成25年3月14日(2013.3.14)
【国際特許分類】
【出願番号】特願2012−250868(P2012−250868)
【出願日】平成24年11月15日(2012.11.15)
【分割の表示】特願2008−539501(P2008−539501)の分割
【原出願日】平成18年11月10日(2006.11.10)
【出願人】(504367645)トポターゲット ユーケー リミテッド (12)
【Fターム(参考)】
【公開日】平成25年3月14日(2013.3.14)
【国際特許分類】
【出願日】平成24年11月15日(2012.11.15)
【分割の表示】特願2008−539501(P2008−539501)の分割
【原出願日】平成18年11月10日(2006.11.10)
【出願人】(504367645)トポターゲット ユーケー リミテッド (12)
【Fターム(参考)】
[ Back to top ]

