癌治療システム
【課題】癌細胞を高い選択性をもって破壊する。
【解決手段】薬剤投与手段10は、患者A、B、Cに対して特定の同位体を含む薬剤11を、例えば注射等によって投与する。次に、薬剤11が患部に蓄積した患者A、B、Cにおける各患部A1、B1、C1に、ガンマ線照射手段20から発したガンマ線21が照射される。ここで投与される薬剤11には、ガンマ線21を吸収することによって重粒子を発生する同位体が含まれる。ガンマ線照射手段20として、特にレーザーコンプトンガンマ線源が特に好ましく用いられる。
【解決手段】薬剤投与手段10は、患者A、B、Cに対して特定の同位体を含む薬剤11を、例えば注射等によって投与する。次に、薬剤11が患部に蓄積した患者A、B、Cにおける各患部A1、B1、C1に、ガンマ線照射手段20から発したガンマ線21が照射される。ここで投与される薬剤11には、ガンマ線21を吸収することによって重粒子を発生する同位体が含まれる。ガンマ線照射手段20として、特にレーザーコンプトンガンマ線源が特に好ましく用いられる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、放射線を用いた癌の治療を行う癌治療システムに関する。
【背景技術】
【0002】
癌の治療方法として、放射線を用いて癌細胞を破壊するという方法が知られている。こうした治療方法としては、例えば加速器でイオンとして加速された粒子線(陽子線、炭素線や重粒子線)を患部に照射するという方法が用いられている。この治療方法においては、健康な細胞に対しても粒子線は悪影響を与えるため、患部(癌のある部位)に集中的に粒子線が照射されるように、ビームの位置やエネルギーが設定される。しかしながら、患部に対して選択的に粒子線を照射することは実際には困難である。
【0003】
この点を改善した治療方法として、ホウ素中性子捕捉療法(BNCT:Boron Neutron Capture Therapy)が知られている。BNCTは、例えば非特許文献1に記載されている。BNCTにおいては、まず、体内の癌細胞に集まりやすいホウ素(10B)化合物を患者に投与する。その後、患部に中性子線を照射する。10Bは中性子の吸収断面積が大きいため、この中性子によって10B(n、α)7Li反応が生ずる。すなわち、中性子ビームの照射によってα粒子とLi原子核が生成される。このα粒子とLi原子核が前記の粒子線(重粒子線)として機能する。すなわち、10Bと中性子との間の反応によって生じたα粒子やLi原子核によって癌細胞が破壊される。中性子線は、例えば原子炉から発生したものを用いることができる。また、原子炉から発せられる中性子線は制御が容易でないために、この中性子線を生成するのに適した加速器が特許文献1、2に記載されている。すなわち、こうした加速器を用いて中性子線の制御をより容易に行うことができる。
【0004】
この治療方法においては、(1)10Bが癌細胞近傍に集まりやすいこと、(2)体内におけるα粒子やLi原子核の飛程は短いこと、のために、特に患部に集中的にα粒子やLi原子核を照射することができる。すなわち、高い選択性をもって癌細胞にこれらの粒子を照射することができる。また、この治療方法においては、癌細胞に直接影響を及ぼすのは照射した中性子線ではなく、核反応によって生成されたα粒子やLi原子核である。粒子線で癌細胞を破壊するに際しては、軽い粒子よりも重い粒子の方がより大きなエネルギーを癌細胞に吸収させることが可能であり、癌細胞における2重螺旋構造のDNAを2本とも破壊できる確率が高い。このため、陽子線等を用いた場合と比べて、癌細胞を破壊する効果が大きい。
【0005】
すなわち、BNCTを用いて、正常な細胞との間の高い選択性をもって、体内の癌細胞を破壊することができる。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2007−95553号公報
【特許文献2】特開2010−287419号公報
【非特許文献】
【0007】
【非特許文献1】独立行政法人日本原子力研究開発機構HP、平成18年6月26日、資料2、[2011年7月22日検索]、インターネット(URL:http://www.jaea.go.jp/02/press2006/p06062601/t2.pdf)
【発明の概要】
【発明が解決しようとする課題】
【0008】
しかしながら、陽子線等の粒子線は一般には電荷をもったイオンの形でビームとして生成され、このビームを電磁気的に制御することが容易であるのに対し、中性子は電荷をもたないために、陽子線等と比べると、ビームの制御が極めて困難である。一方、BNCTで破壊すべき癌細胞のある箇所(悪性腫瘍)の大きさは数mm程度である場合が多い。このため、上記のBNCTにおいては、中性子ビームを充分小さなビーム径で患部に選択的に照射することは困難である。一方、中性子線は健康な細胞に対して悪影響を与える。このため、やはりBNCTによっても、癌細胞を高い選択性で破壊することは困難であった。
【0009】
すなわち、癌細胞を高い選択性で破壊することのできる癌治療システムを得ることは困難であった。
【0010】
本発明は、かかる問題点に鑑みてなされたものであり、上記問題点を解決する発明を提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明は、上記課題を解決すべく、以下に掲げる構成とした。
本発明の癌治療システムは、ガンマ線を吸収することによって重粒子を生成する核種を含み、かつ癌細胞が存在する箇所に蓄積される薬剤を、患者に投与する薬剤投与手段と、前記薬剤が投与された患者に対してガンマ線のビームを照射するガンマ線照射手段と、を具備することを特徴とする。
本発明の癌治療システムにおいて、前記ガンマ線照射手段はレーザーコンプトンガンマ線源であることを特徴とする。
本発明の癌治療システムは、前記レーザーコンプトンガンマ線源において、閉軌道を周回する電子が用いられ、前記閉軌道における複数の箇所から前記ガンマ線が取り出される構成とされたことを特徴とする。
本発明の癌治療システムは、前記レーザーコンプトンガンマ線源において、開軌道を進行する電子が用いられ、前記開軌道における複数の箇所から前記ガンマ線が取り出される構成とされたことを特徴とする。
本発明の癌治療システムにおいて、前記核種には、少なくとも19F、17O、18Oのいずれかが含まれることを特徴とする。
本発明の癌治療システムにおいて、前記薬剤はFDG(フルオロデオキシグルコース)を主成分とすることを特徴とする。
本発明の癌治療システムにおいて、前記薬剤に18Fが添加されたことを特徴とする。
【発明の効果】
【0012】
本発明は以上のように構成されているので、癌細胞を高い選択性をもって破壊することができる。
【図面の簡単な説明】
【0013】
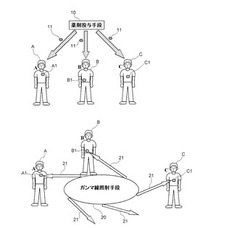
【図1】本発明の実施の形態に係る癌治療システムの構成の概要を示す図である。
【図2】本発明の実施の形態に係る癌治療システムにおいて患者に投与される核種がガンマ線を吸収する反応の状況を示す図である。
【図3】体内において19Fがガンマ線を吸収した際の状況を模式的に示す図である。
【図4】レーザーコンプトンガンマ線源の構成の一例を示す図である。
【図5】レーザーコンプトンガンマ線源におけるガンマ線発生部の詳細を示す構成図である。
【図6】本発明の実施の形態に係る癌治療システムによる体内のエネルギー吸収密度を、粒子線照射、X線照射と比較した結果を模式的に示す図である。
【発明を実施するための形態】
【0014】
以下、本発明の実施の形態に係る癌治療システムについて説明する。図1は、この癌治療システムの構成を示す図である。この癌治療システムにおいては、薬剤投与手段10と、ガンマ線照射手段20が用いられる。
【0015】
図1では、3人の患者A、B、Cに対して癌の治療が行われる例について記載している。患者A、B、Cにおいては癌細胞のある患部A1、B1、C1はそれぞれ異なる部位となっている。図1上側に示されるように、薬剤投与手段10は、患者A、B、Cに対して特定の同位体を含む薬剤11を、例えば注射等によって投与する。薬剤11としては、患者A、B、Cの体内における患部A1、B1、C1に集まりやすいものが用いられる。このため、投与後にはそれぞれの患部A1、B1、C1に薬剤11が蓄積される。この点については前記のBNCTと同様である。薬剤11の具体的内容については後述する。
【0016】
次に、図1下側に示されるように、薬剤11が患部に蓄積した患者A、B、Cにおける各患部A1、B1、C1に、ガンマ線照射手段20から発したガンマ線21が照射される。ここで、単一のガンマ線照射手段20から同時に複数の方向に対してガンマ線21を照射することが可能である。このため、この照射を患者A、B、Cに対して同時に行うことができる。ガンマ線照射手段20の詳細については後述する。
【0017】
まず、ここで投与される薬剤11について説明する。ここで投与される薬剤11には、ガンマ線21を吸収することによって重粒子を発生する同位体が含まれる。ここでいう重粒子とは、陽子と同等以上の重さをもつ粒子であり、具体的には、陽子、中性子、α粒子や、各種の原子核を意味する。また、人体を構成する主な元素としては、H、O、C、N、Ca等があるが、これらに属しない元素の同位体がこの同位体として好ましい。例えばこの同位体としては、ガンマ線21を吸収することによってα粒子と15N原子核を放出する19Fが有効である。
【0018】
19Fを含み、患部に蓄積されやすい薬剤11としては、具体的には、19Fを添加したFDG(フルオロデオキシグルコース)を用いることができる。FDGは、PET(ポジトロン断層法)による診断を行う際に投与される薬剤であり、ブドウ糖におけるグルコースの水酸基の一つを陽電子(ポジトロン)を放射する核種で置換したものである。通常はこの核種としては18Fが特に好ましく用いられる。PETにおいては、18Fが添加されたFDGが患部(癌細胞のある部位)に蓄積され、18Fから発せられる陽電子と電子との対消滅によって発生したガンマ線を検出することによって癌細胞の分布を測定する。ここで用いる薬剤11としては、このFDGにおける18Fを19Fで置換したものを好ましく用いることができる。18Fと19Fは化学的性質が同等であるため、この置換は容易である。
【0019】
19F原子核は、例えば6088keVのエネルギーのガンマ線21を共鳴吸収することによって励起状態になる。その後、α粒子(4He原子核)と15N原子核に壊変する。この核反応におけるエネルギー準位の関係を図2左側に、これに対応したガンマ線21のスペクトルを模式的に図2右側に示す。すなわち、スペクトルのピークがこの励起エネルギーと等しい準単色のガンマ線21を照射することによって、この核反応を選択的に発生させることが可能である。
【0020】
図3に模式的に示されるように、19F原子核100がこのエネルギーのガンマ線21を吸収した場合には、α粒子101と15N原子核102が生成される。α粒子101や15N原子核102は、近傍の癌細胞200における細胞核201中のDNA202を破壊する。重粒子であるα粒子101や15N原子核は、単位体積当たりに与えるエネルギーが大きく、DNA202の2重螺旋構造を2本とも破壊する確率が高い。より大きな15N原子核においては、特にこの効果が大きい。すなわち、BNCTと同様に、癌細胞200を破壊することができる。この際、(1)FDG(19F)が癌細胞近傍に集まりやすいこと、(2)体内におけるα粒子101や15N原子核102の飛程は短いこと、のために、特に癌細胞を効率的に破壊することができる点もBNCTと同様である。
【0021】
しかしながら、ここでは、BNCTにおいて中性子ビームが用いられた代わりに、ガンマ線を用いる点が異なる。ガンマ線を用いることの利点は、特定の領域に対して局所的に照射することが容易であることと、身体の深部に照射可能であること、単一の照射装置(ガンマ線照射手段20)を用いて同時に多数の患者に対して照射が可能であること、である。以下に、ガンマ線照射手段20の具体的構成について説明する。
【0022】
ガンマ線照射手段20としては、薬剤11に含まれる同位体原子核の共鳴吸収エネルギーに対応した単色あるいは準単色のガンマ線21を発することができるものが用いられる。このようなガンマ線照射手段20として、特にレーザーコンプトンガンマ線源が特に好ましく用いられる。
【0023】
図4は、レーザーコンプトンガンマ線源50の構成を示す図である。このレーザーコンプトンガンマ線源50においては、高エネルギー電子が閉軌道を周回し、照射されたレーザー光(可視光等)にこの高エネルギー電子からエネルギーが移動することにより、レーザー光が高エネルギー化し、ガンマ線となる。レーザー光は単色であるが、このガンマ線は、電子のエネルギーに応じてそのエネルギーが決まる準単色となる。このため、電子のエネルギーを調整することにより、ガンマ線のエネルギーを調整することが可能である。この構成は、例えば特開2003−232892号公報等に記載されたものと同様である。
【0024】
図4において、入射器51から入射した比較的低エネルギーの電子線は、入射偏向磁石(図示せず)によって偏向され、所定の電子軌道上に投入される。電子軌道には、複数の偏向磁石52が設けられることによって、電子が所定の電子軌道(閉軌道)を形成するように設定される。この構成では、電子軌道が8箇所の偏向磁石52で曲げられる設定とされている。また、偏向磁石52の間で軌道が直線となる箇所には、高周波(RF)加速空洞53が設けられ、高周波加速空洞53中の高周波電界で電子が加速され、電子が高エネルギー化される、あるいは、ガンマ線や放射光の発振に伴って電子が失うエネルギーが補給される。この際、高周波加速空洞53で用いられる高周波は、電子の軌道が保たれるように設定される。なお、運転終了時にこの高エネルギー電子を消滅させるために、電子が上記の閉軌道を外れてビームダンプ54で吸収される設定とされる。この構成は、電子シンクロトロンや、放射光を発生させるための電子蓄積リング、エネルギー回収型リニアックにおいても同様である。
【0025】
このレーザーコンプトンガンマ線源50においては、電子が偏向する箇所あるいは直線部に対応して6箇所にガンマ線発生部60が設置されている。図5は、このガンマ線発生部60の構成をより詳細に示す構成図であり、特に図4中の左上の破線で囲まれたガンマ線発生部60の構成を示している。前記の通り、高エネルギーの電子ビーム70は、図5中の黒矢印で示す方向に進行し、偏向磁石52でその向きが変わる。一方、レーザー光源80が設けられ、可視光であるレーザー光81が発せされる。レーザー光81は反射鏡82で反射され、電子ビーム70の直線軌道上の衝突点Pで電子ビーム70と正面衝突する設定とされる。
【0026】
レーザー光81は、この衝突の際の(逆)コンプトン効果によって、高エネルギーの電子からエネルギーを受け取り、高エネルギー化する。これによって、ガンマ線21が電子ビーム70の直線軌道に沿った方向に発せられる。このガンマ線21は、偏向磁石52や反射鏡82を透過して取り出される。なお、電子ビーム70における電子はこの衝突によってエネルギーを失うが、この分のエネルギーは高周波加速空洞53によって補給される。
【0027】
このガンマ線発生部60は、偏向磁石52あるいは直線部分に対応して設けられる。このため、図4の構成では、ガンマ線21が発せられる方向が異なる6箇所にガンマ線発生部60が設けられている。すなわち、単一のレーザーコンプトンガンマ線源50から、独立した6つのガンマ線21を取り出すことが可能である。このため、ガンマ線源(レーザーコンプトンガンマ線源50)やその維持管理が高コストであっても、治療に要するコストを低減することが可能である。この効果は、ガンマ線発生部60を多く設けるほど顕著である。
【0028】
また、このように高エネルギー電子を発生させてこれをレーザー光と衝突させてレーザーコンプトンガンマ線を発生させることのできる加速器であれば、電子が閉軌道を構成する加速器でなくとも同様である。例えば、電子が開軌道を構成するリニアックにおいても、同様にレーザーコンプトンガンマ線を発生させることができ、複数のガンマ線発生部を設けることができる。
【0029】
また、電子ビーム70とレーザー光81とを正面衝突させる場合にはガンマ線31は電子ビーム70の進行方向をピークとした鋭い指向性をもつ。また、そのスペクトルには発散角依存性があるが、準単色とみなせる程度の狭いエネルギー帯域をもつ。また、電子ビーム70とレーザー光81との衝突を、正面衝突からわずかにずらせた設定とすることも可能であり、この場合においても、やはり準単色のスペクトルを得ることができる。このピークのエネルギーは電子のエネルギーを調整することによって設定が可能であり、図2右側に示されるように、原子核の共鳴エネルギーにそのピークを合わせることが可能である。
【0030】
また、中性子線と異なり、発せられるガンマ線21の指向性は強いため、これを2次元面内の特定の領域に照射することは容易であり、これを患部に局所的に照射することも容易である。このためには、ガンマ線発生部60の位置やガンマ線21が発せられる方向を固定した状態で、患者A、B、Cの位置を正確に制御することが好ましい。また、ガンマ線21のオンオフの制御は、レーザー光81、電子ビーム70のオンオフによって容易になされる。このため、従来のBNCTと比べて、癌細胞以外の正常な細胞に対する悪影響をより低減することができる。
【0031】
従来より、癌治療方法として、ガンマ線やX線、粒子線の照射が行われている。これらの場合には、癌細胞を破壊するための尺度として、単位体積当たりの吸収エネルギーをとることができる。すなわち、癌細胞が存在する箇所において、この吸収エネルギーが大きいほど治療の効果が大きい。逆に、癌細胞が存在しない箇所においてはこの吸収エネルギーを小さくすることが好ましい。図6は、体の表面からのこの吸収エネルギーの分布を模式的に示した図である。ここで、点線は高エネルギー粒子線、破線はX線や低エネルギーガンマ線、実線は上記の癌治療システムによる場合をそれぞれ示す。
【0032】
通常の高エネルギー粒子線(点線)では、粒子が最終的に留まる領域はある一定の深さとなる。このため、吸収エネルギーの分布も、これに対応し、ある深さでピークをもつ分布となる。ただし、このピーク深さに達する前における吸収エネルギーも無視できず、ピークの値の1/2〜1/3程度である。このため、正常な細胞に対して与える悪影響が無視できない。
【0033】
また、単純にX線や低エネルギーガンマ線を照射した場合(破線)には、表面付近での吸収エネルギーが大きく、体内に進むにつれて吸収エネルギーは小さくなる。
【0034】
これに対して、上記の癌治療システムにおいては、まず、薬剤11に含まれる核種は患部以外に極微量しか存在しないと考えることができるため、患部が存在するまでの深さにおけるガンマ線21の吸収は小さい。しかしながら、ガンマ線21が患部に達した場合には、薬剤11に含まれる核種(19F)に吸収され、α粒子101、15N原子核102が発生し、これらが患部近辺で吸収される。このため、上記の癌治療システムを用いた場合には、吸収エネルギーは体内の患部において特に高くなった鋭い分布をもつ。すなわち、上記の癌治療システムを用いた場合には、体内における深さ方向においても、患部に対する高い選択性をもってエネルギーを与えることができる。また、このエネルギーはガンマ線21のエネルギーに対応するが、このエネルギーは電子ビーム70ないしレーザー光81によって調整することが可能である。
【0035】
また、従来のBNCTにおいては、体内に多く存在する14Nが中性子と反応して、14Cが形成されることがある。14Cは長寿命の放射性同位元素であり、体内被曝の原因となる。上記の癌治療システムにおいては、14Cは生成されない。すなわち、この観点からも、BNCTと比べて癌細胞以外に対する悪影響を低減することができる。
【0036】
また、前記の通り、薬剤11としては、19Fが添加されたFDGが好ましく用いられる。一方、陽電子放出核種である18Fが添加されたFDGはPET診断の際に広く用いられており、18Fから放出された陽電子を調べることにより、癌細胞のある部位を検出することができる。18Fも19Fもフッ素の同位体であり同様の化学的性質をもつため、これらが同時に添加されたFDGを用いることも可能である。この場合には、PET診断を行って癌の存在を確認した直後に、上記の癌治療システムによって癌細胞を破壊することも可能である。
【0037】
なお、上記の例では、19Fを添加したFDGを薬剤11として患者に投与した場合について記載したが、19Fの代わりに、他の核種を用いることも可能である。こうした核種としては、共鳴エネルギーをもつガンマ線を吸収することによって励起され、その後に重粒子を放出する核反応を起こす原子核をもつものが好ましい。この際、励起状態とされてから重粒子を放出するまでの時間はフェムト秒からナノ秒程度の短時間である。このため、実質的にはガンマ線を照射した直後に重粒子が発せられる。
【0038】
重粒子は患部の近傍のみで発生することが好ましいため、この核種としては、人体における存在比率が小さいものが好ましい。具体的には、6Li、7Li、9Be、10B、11B、15N、17O、18O等を用いることができる。ここで、酸素は人体に極めて多く存在しているが、17O、18Oの天然の同位体存在比はそれぞれ0.038%、0.205%と小さい。このため、17O、18Oを例えば100倍程度に濃縮した薬剤11を用いることができる。現在、18OはPETにも用いられるため、100%近くの濃度の材料を安価に得ることが可能であり、17Oについても安価に得ることが可能である。また、17O、18Oの化学的性質は通常の酸素と同様であるため、人体に対する悪影響も少ない。
【0039】
表1は、こうした核種の共鳴エネルギー(励起エネルギー)E、スピン及びパリティ、この励起における遷移の種類、ΓT(励起状態から重粒子を放出する確率:エネルギーの次元で表示)、Γγ0(励起状態から1本のガンマ線を放出して基底状態に戻る確率:エネルギーの次元で表示)、ΓT/E、生成される核種(粒子)、を示したものである。ここで、Eは照射すべきガンマ線の(ピーク)エネルギーに相当する。また、ΓT>>Γγ0であることが、重粒子を効率的に発生する観点からは好ましい。また、E±ΓTの範囲内のエネルギーのガンマ線によって共鳴吸収が起きやすくなる。従って、ΓT/Eが大きいほど反応自体は起きやすくなるという観点では好ましいが、他の核種や他の準位との選択性は悪くなるため、患部以外で重粒子やガンマ線が発生する原因となる場合がある。このため、ΓT/Eの上限は10%程度とすることが好ましい。ガンマ線21のエネルギーは使用する核種に応じて設定するが、この設定はレーザーコンプトンガンマ線源50における電子ビーム70のエネルギーや、レーザー光81の波長の調整によりなされる。
【0040】
【表1】

【0041】
また、患部に蓄積されやすい薬剤11の主成分となる物質として、FDG以外にも、核種に応じて適宜設定が可能である。例えば、ホウ素の同位体である10B、11Bを用いる場合には、BNCTにも用いられるBSH(Na2B12H11SH)を用いることができる。また、BPA(パラボロフェニルアラニン)も同様に用いることができる。これらの物質におけるホウ素として10B、11Bを用いることにより、上記のFDGと同様の効果を奏することは明らかである。その他、薬剤11の主成分としては、人体に投与が可能でありかつ患部に蓄積されやすい物質を適宜選択して用いることができる。
【0042】
また、上記の例では、ガンマ線発生手段として、レーザーコンプトンガンマ線源を用いた場合について記載したが、単色あるいは準単色のガンマ線を発することができるガンマ線源であれば、同様に用いることができる。例として、粒子や中性子の捕獲ガンマ線や、制動放射ガンマ線を発するガンマ線源も用いることができる。
【符号の説明】
【0043】
10 薬剤投与手段
11 薬剤
20 ガンマ線照射手段
21 ガンマ線
50 レーザーコンプトンガンマ線源
51 入射器
52 偏向磁石
53 高周波(RF)加速空洞
54 ビームダンプ
60 ガンマ線発生部
70 電子ビーム
80 レーザー光源
81 レーザー光
82 反射鏡
100 19F原子核
101 α粒子
102 15N原子核
200 癌細胞
201 細胞核
202 DNA
A、B、C 患者
A1、B1、C1 患部
P 衝突点
【技術分野】
【0001】
本発明は、放射線を用いた癌の治療を行う癌治療システムに関する。
【背景技術】
【0002】
癌の治療方法として、放射線を用いて癌細胞を破壊するという方法が知られている。こうした治療方法としては、例えば加速器でイオンとして加速された粒子線(陽子線、炭素線や重粒子線)を患部に照射するという方法が用いられている。この治療方法においては、健康な細胞に対しても粒子線は悪影響を与えるため、患部(癌のある部位)に集中的に粒子線が照射されるように、ビームの位置やエネルギーが設定される。しかしながら、患部に対して選択的に粒子線を照射することは実際には困難である。
【0003】
この点を改善した治療方法として、ホウ素中性子捕捉療法(BNCT:Boron Neutron Capture Therapy)が知られている。BNCTは、例えば非特許文献1に記載されている。BNCTにおいては、まず、体内の癌細胞に集まりやすいホウ素(10B)化合物を患者に投与する。その後、患部に中性子線を照射する。10Bは中性子の吸収断面積が大きいため、この中性子によって10B(n、α)7Li反応が生ずる。すなわち、中性子ビームの照射によってα粒子とLi原子核が生成される。このα粒子とLi原子核が前記の粒子線(重粒子線)として機能する。すなわち、10Bと中性子との間の反応によって生じたα粒子やLi原子核によって癌細胞が破壊される。中性子線は、例えば原子炉から発生したものを用いることができる。また、原子炉から発せられる中性子線は制御が容易でないために、この中性子線を生成するのに適した加速器が特許文献1、2に記載されている。すなわち、こうした加速器を用いて中性子線の制御をより容易に行うことができる。
【0004】
この治療方法においては、(1)10Bが癌細胞近傍に集まりやすいこと、(2)体内におけるα粒子やLi原子核の飛程は短いこと、のために、特に患部に集中的にα粒子やLi原子核を照射することができる。すなわち、高い選択性をもって癌細胞にこれらの粒子を照射することができる。また、この治療方法においては、癌細胞に直接影響を及ぼすのは照射した中性子線ではなく、核反応によって生成されたα粒子やLi原子核である。粒子線で癌細胞を破壊するに際しては、軽い粒子よりも重い粒子の方がより大きなエネルギーを癌細胞に吸収させることが可能であり、癌細胞における2重螺旋構造のDNAを2本とも破壊できる確率が高い。このため、陽子線等を用いた場合と比べて、癌細胞を破壊する効果が大きい。
【0005】
すなわち、BNCTを用いて、正常な細胞との間の高い選択性をもって、体内の癌細胞を破壊することができる。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2007−95553号公報
【特許文献2】特開2010−287419号公報
【非特許文献】
【0007】
【非特許文献1】独立行政法人日本原子力研究開発機構HP、平成18年6月26日、資料2、[2011年7月22日検索]、インターネット(URL:http://www.jaea.go.jp/02/press2006/p06062601/t2.pdf)
【発明の概要】
【発明が解決しようとする課題】
【0008】
しかしながら、陽子線等の粒子線は一般には電荷をもったイオンの形でビームとして生成され、このビームを電磁気的に制御することが容易であるのに対し、中性子は電荷をもたないために、陽子線等と比べると、ビームの制御が極めて困難である。一方、BNCTで破壊すべき癌細胞のある箇所(悪性腫瘍)の大きさは数mm程度である場合が多い。このため、上記のBNCTにおいては、中性子ビームを充分小さなビーム径で患部に選択的に照射することは困難である。一方、中性子線は健康な細胞に対して悪影響を与える。このため、やはりBNCTによっても、癌細胞を高い選択性で破壊することは困難であった。
【0009】
すなわち、癌細胞を高い選択性で破壊することのできる癌治療システムを得ることは困難であった。
【0010】
本発明は、かかる問題点に鑑みてなされたものであり、上記問題点を解決する発明を提供することを目的とする。
【課題を解決するための手段】
【0011】
本発明は、上記課題を解決すべく、以下に掲げる構成とした。
本発明の癌治療システムは、ガンマ線を吸収することによって重粒子を生成する核種を含み、かつ癌細胞が存在する箇所に蓄積される薬剤を、患者に投与する薬剤投与手段と、前記薬剤が投与された患者に対してガンマ線のビームを照射するガンマ線照射手段と、を具備することを特徴とする。
本発明の癌治療システムにおいて、前記ガンマ線照射手段はレーザーコンプトンガンマ線源であることを特徴とする。
本発明の癌治療システムは、前記レーザーコンプトンガンマ線源において、閉軌道を周回する電子が用いられ、前記閉軌道における複数の箇所から前記ガンマ線が取り出される構成とされたことを特徴とする。
本発明の癌治療システムは、前記レーザーコンプトンガンマ線源において、開軌道を進行する電子が用いられ、前記開軌道における複数の箇所から前記ガンマ線が取り出される構成とされたことを特徴とする。
本発明の癌治療システムにおいて、前記核種には、少なくとも19F、17O、18Oのいずれかが含まれることを特徴とする。
本発明の癌治療システムにおいて、前記薬剤はFDG(フルオロデオキシグルコース)を主成分とすることを特徴とする。
本発明の癌治療システムにおいて、前記薬剤に18Fが添加されたことを特徴とする。
【発明の効果】
【0012】
本発明は以上のように構成されているので、癌細胞を高い選択性をもって破壊することができる。
【図面の簡単な説明】
【0013】
【図1】本発明の実施の形態に係る癌治療システムの構成の概要を示す図である。
【図2】本発明の実施の形態に係る癌治療システムにおいて患者に投与される核種がガンマ線を吸収する反応の状況を示す図である。
【図3】体内において19Fがガンマ線を吸収した際の状況を模式的に示す図である。
【図4】レーザーコンプトンガンマ線源の構成の一例を示す図である。
【図5】レーザーコンプトンガンマ線源におけるガンマ線発生部の詳細を示す構成図である。
【図6】本発明の実施の形態に係る癌治療システムによる体内のエネルギー吸収密度を、粒子線照射、X線照射と比較した結果を模式的に示す図である。
【発明を実施するための形態】
【0014】
以下、本発明の実施の形態に係る癌治療システムについて説明する。図1は、この癌治療システムの構成を示す図である。この癌治療システムにおいては、薬剤投与手段10と、ガンマ線照射手段20が用いられる。
【0015】
図1では、3人の患者A、B、Cに対して癌の治療が行われる例について記載している。患者A、B、Cにおいては癌細胞のある患部A1、B1、C1はそれぞれ異なる部位となっている。図1上側に示されるように、薬剤投与手段10は、患者A、B、Cに対して特定の同位体を含む薬剤11を、例えば注射等によって投与する。薬剤11としては、患者A、B、Cの体内における患部A1、B1、C1に集まりやすいものが用いられる。このため、投与後にはそれぞれの患部A1、B1、C1に薬剤11が蓄積される。この点については前記のBNCTと同様である。薬剤11の具体的内容については後述する。
【0016】
次に、図1下側に示されるように、薬剤11が患部に蓄積した患者A、B、Cにおける各患部A1、B1、C1に、ガンマ線照射手段20から発したガンマ線21が照射される。ここで、単一のガンマ線照射手段20から同時に複数の方向に対してガンマ線21を照射することが可能である。このため、この照射を患者A、B、Cに対して同時に行うことができる。ガンマ線照射手段20の詳細については後述する。
【0017】
まず、ここで投与される薬剤11について説明する。ここで投与される薬剤11には、ガンマ線21を吸収することによって重粒子を発生する同位体が含まれる。ここでいう重粒子とは、陽子と同等以上の重さをもつ粒子であり、具体的には、陽子、中性子、α粒子や、各種の原子核を意味する。また、人体を構成する主な元素としては、H、O、C、N、Ca等があるが、これらに属しない元素の同位体がこの同位体として好ましい。例えばこの同位体としては、ガンマ線21を吸収することによってα粒子と15N原子核を放出する19Fが有効である。
【0018】
19Fを含み、患部に蓄積されやすい薬剤11としては、具体的には、19Fを添加したFDG(フルオロデオキシグルコース)を用いることができる。FDGは、PET(ポジトロン断層法)による診断を行う際に投与される薬剤であり、ブドウ糖におけるグルコースの水酸基の一つを陽電子(ポジトロン)を放射する核種で置換したものである。通常はこの核種としては18Fが特に好ましく用いられる。PETにおいては、18Fが添加されたFDGが患部(癌細胞のある部位)に蓄積され、18Fから発せられる陽電子と電子との対消滅によって発生したガンマ線を検出することによって癌細胞の分布を測定する。ここで用いる薬剤11としては、このFDGにおける18Fを19Fで置換したものを好ましく用いることができる。18Fと19Fは化学的性質が同等であるため、この置換は容易である。
【0019】
19F原子核は、例えば6088keVのエネルギーのガンマ線21を共鳴吸収することによって励起状態になる。その後、α粒子(4He原子核)と15N原子核に壊変する。この核反応におけるエネルギー準位の関係を図2左側に、これに対応したガンマ線21のスペクトルを模式的に図2右側に示す。すなわち、スペクトルのピークがこの励起エネルギーと等しい準単色のガンマ線21を照射することによって、この核反応を選択的に発生させることが可能である。
【0020】
図3に模式的に示されるように、19F原子核100がこのエネルギーのガンマ線21を吸収した場合には、α粒子101と15N原子核102が生成される。α粒子101や15N原子核102は、近傍の癌細胞200における細胞核201中のDNA202を破壊する。重粒子であるα粒子101や15N原子核は、単位体積当たりに与えるエネルギーが大きく、DNA202の2重螺旋構造を2本とも破壊する確率が高い。より大きな15N原子核においては、特にこの効果が大きい。すなわち、BNCTと同様に、癌細胞200を破壊することができる。この際、(1)FDG(19F)が癌細胞近傍に集まりやすいこと、(2)体内におけるα粒子101や15N原子核102の飛程は短いこと、のために、特に癌細胞を効率的に破壊することができる点もBNCTと同様である。
【0021】
しかしながら、ここでは、BNCTにおいて中性子ビームが用いられた代わりに、ガンマ線を用いる点が異なる。ガンマ線を用いることの利点は、特定の領域に対して局所的に照射することが容易であることと、身体の深部に照射可能であること、単一の照射装置(ガンマ線照射手段20)を用いて同時に多数の患者に対して照射が可能であること、である。以下に、ガンマ線照射手段20の具体的構成について説明する。
【0022】
ガンマ線照射手段20としては、薬剤11に含まれる同位体原子核の共鳴吸収エネルギーに対応した単色あるいは準単色のガンマ線21を発することができるものが用いられる。このようなガンマ線照射手段20として、特にレーザーコンプトンガンマ線源が特に好ましく用いられる。
【0023】
図4は、レーザーコンプトンガンマ線源50の構成を示す図である。このレーザーコンプトンガンマ線源50においては、高エネルギー電子が閉軌道を周回し、照射されたレーザー光(可視光等)にこの高エネルギー電子からエネルギーが移動することにより、レーザー光が高エネルギー化し、ガンマ線となる。レーザー光は単色であるが、このガンマ線は、電子のエネルギーに応じてそのエネルギーが決まる準単色となる。このため、電子のエネルギーを調整することにより、ガンマ線のエネルギーを調整することが可能である。この構成は、例えば特開2003−232892号公報等に記載されたものと同様である。
【0024】
図4において、入射器51から入射した比較的低エネルギーの電子線は、入射偏向磁石(図示せず)によって偏向され、所定の電子軌道上に投入される。電子軌道には、複数の偏向磁石52が設けられることによって、電子が所定の電子軌道(閉軌道)を形成するように設定される。この構成では、電子軌道が8箇所の偏向磁石52で曲げられる設定とされている。また、偏向磁石52の間で軌道が直線となる箇所には、高周波(RF)加速空洞53が設けられ、高周波加速空洞53中の高周波電界で電子が加速され、電子が高エネルギー化される、あるいは、ガンマ線や放射光の発振に伴って電子が失うエネルギーが補給される。この際、高周波加速空洞53で用いられる高周波は、電子の軌道が保たれるように設定される。なお、運転終了時にこの高エネルギー電子を消滅させるために、電子が上記の閉軌道を外れてビームダンプ54で吸収される設定とされる。この構成は、電子シンクロトロンや、放射光を発生させるための電子蓄積リング、エネルギー回収型リニアックにおいても同様である。
【0025】
このレーザーコンプトンガンマ線源50においては、電子が偏向する箇所あるいは直線部に対応して6箇所にガンマ線発生部60が設置されている。図5は、このガンマ線発生部60の構成をより詳細に示す構成図であり、特に図4中の左上の破線で囲まれたガンマ線発生部60の構成を示している。前記の通り、高エネルギーの電子ビーム70は、図5中の黒矢印で示す方向に進行し、偏向磁石52でその向きが変わる。一方、レーザー光源80が設けられ、可視光であるレーザー光81が発せされる。レーザー光81は反射鏡82で反射され、電子ビーム70の直線軌道上の衝突点Pで電子ビーム70と正面衝突する設定とされる。
【0026】
レーザー光81は、この衝突の際の(逆)コンプトン効果によって、高エネルギーの電子からエネルギーを受け取り、高エネルギー化する。これによって、ガンマ線21が電子ビーム70の直線軌道に沿った方向に発せられる。このガンマ線21は、偏向磁石52や反射鏡82を透過して取り出される。なお、電子ビーム70における電子はこの衝突によってエネルギーを失うが、この分のエネルギーは高周波加速空洞53によって補給される。
【0027】
このガンマ線発生部60は、偏向磁石52あるいは直線部分に対応して設けられる。このため、図4の構成では、ガンマ線21が発せられる方向が異なる6箇所にガンマ線発生部60が設けられている。すなわち、単一のレーザーコンプトンガンマ線源50から、独立した6つのガンマ線21を取り出すことが可能である。このため、ガンマ線源(レーザーコンプトンガンマ線源50)やその維持管理が高コストであっても、治療に要するコストを低減することが可能である。この効果は、ガンマ線発生部60を多く設けるほど顕著である。
【0028】
また、このように高エネルギー電子を発生させてこれをレーザー光と衝突させてレーザーコンプトンガンマ線を発生させることのできる加速器であれば、電子が閉軌道を構成する加速器でなくとも同様である。例えば、電子が開軌道を構成するリニアックにおいても、同様にレーザーコンプトンガンマ線を発生させることができ、複数のガンマ線発生部を設けることができる。
【0029】
また、電子ビーム70とレーザー光81とを正面衝突させる場合にはガンマ線31は電子ビーム70の進行方向をピークとした鋭い指向性をもつ。また、そのスペクトルには発散角依存性があるが、準単色とみなせる程度の狭いエネルギー帯域をもつ。また、電子ビーム70とレーザー光81との衝突を、正面衝突からわずかにずらせた設定とすることも可能であり、この場合においても、やはり準単色のスペクトルを得ることができる。このピークのエネルギーは電子のエネルギーを調整することによって設定が可能であり、図2右側に示されるように、原子核の共鳴エネルギーにそのピークを合わせることが可能である。
【0030】
また、中性子線と異なり、発せられるガンマ線21の指向性は強いため、これを2次元面内の特定の領域に照射することは容易であり、これを患部に局所的に照射することも容易である。このためには、ガンマ線発生部60の位置やガンマ線21が発せられる方向を固定した状態で、患者A、B、Cの位置を正確に制御することが好ましい。また、ガンマ線21のオンオフの制御は、レーザー光81、電子ビーム70のオンオフによって容易になされる。このため、従来のBNCTと比べて、癌細胞以外の正常な細胞に対する悪影響をより低減することができる。
【0031】
従来より、癌治療方法として、ガンマ線やX線、粒子線の照射が行われている。これらの場合には、癌細胞を破壊するための尺度として、単位体積当たりの吸収エネルギーをとることができる。すなわち、癌細胞が存在する箇所において、この吸収エネルギーが大きいほど治療の効果が大きい。逆に、癌細胞が存在しない箇所においてはこの吸収エネルギーを小さくすることが好ましい。図6は、体の表面からのこの吸収エネルギーの分布を模式的に示した図である。ここで、点線は高エネルギー粒子線、破線はX線や低エネルギーガンマ線、実線は上記の癌治療システムによる場合をそれぞれ示す。
【0032】
通常の高エネルギー粒子線(点線)では、粒子が最終的に留まる領域はある一定の深さとなる。このため、吸収エネルギーの分布も、これに対応し、ある深さでピークをもつ分布となる。ただし、このピーク深さに達する前における吸収エネルギーも無視できず、ピークの値の1/2〜1/3程度である。このため、正常な細胞に対して与える悪影響が無視できない。
【0033】
また、単純にX線や低エネルギーガンマ線を照射した場合(破線)には、表面付近での吸収エネルギーが大きく、体内に進むにつれて吸収エネルギーは小さくなる。
【0034】
これに対して、上記の癌治療システムにおいては、まず、薬剤11に含まれる核種は患部以外に極微量しか存在しないと考えることができるため、患部が存在するまでの深さにおけるガンマ線21の吸収は小さい。しかしながら、ガンマ線21が患部に達した場合には、薬剤11に含まれる核種(19F)に吸収され、α粒子101、15N原子核102が発生し、これらが患部近辺で吸収される。このため、上記の癌治療システムを用いた場合には、吸収エネルギーは体内の患部において特に高くなった鋭い分布をもつ。すなわち、上記の癌治療システムを用いた場合には、体内における深さ方向においても、患部に対する高い選択性をもってエネルギーを与えることができる。また、このエネルギーはガンマ線21のエネルギーに対応するが、このエネルギーは電子ビーム70ないしレーザー光81によって調整することが可能である。
【0035】
また、従来のBNCTにおいては、体内に多く存在する14Nが中性子と反応して、14Cが形成されることがある。14Cは長寿命の放射性同位元素であり、体内被曝の原因となる。上記の癌治療システムにおいては、14Cは生成されない。すなわち、この観点からも、BNCTと比べて癌細胞以外に対する悪影響を低減することができる。
【0036】
また、前記の通り、薬剤11としては、19Fが添加されたFDGが好ましく用いられる。一方、陽電子放出核種である18Fが添加されたFDGはPET診断の際に広く用いられており、18Fから放出された陽電子を調べることにより、癌細胞のある部位を検出することができる。18Fも19Fもフッ素の同位体であり同様の化学的性質をもつため、これらが同時に添加されたFDGを用いることも可能である。この場合には、PET診断を行って癌の存在を確認した直後に、上記の癌治療システムによって癌細胞を破壊することも可能である。
【0037】
なお、上記の例では、19Fを添加したFDGを薬剤11として患者に投与した場合について記載したが、19Fの代わりに、他の核種を用いることも可能である。こうした核種としては、共鳴エネルギーをもつガンマ線を吸収することによって励起され、その後に重粒子を放出する核反応を起こす原子核をもつものが好ましい。この際、励起状態とされてから重粒子を放出するまでの時間はフェムト秒からナノ秒程度の短時間である。このため、実質的にはガンマ線を照射した直後に重粒子が発せられる。
【0038】
重粒子は患部の近傍のみで発生することが好ましいため、この核種としては、人体における存在比率が小さいものが好ましい。具体的には、6Li、7Li、9Be、10B、11B、15N、17O、18O等を用いることができる。ここで、酸素は人体に極めて多く存在しているが、17O、18Oの天然の同位体存在比はそれぞれ0.038%、0.205%と小さい。このため、17O、18Oを例えば100倍程度に濃縮した薬剤11を用いることができる。現在、18OはPETにも用いられるため、100%近くの濃度の材料を安価に得ることが可能であり、17Oについても安価に得ることが可能である。また、17O、18Oの化学的性質は通常の酸素と同様であるため、人体に対する悪影響も少ない。
【0039】
表1は、こうした核種の共鳴エネルギー(励起エネルギー)E、スピン及びパリティ、この励起における遷移の種類、ΓT(励起状態から重粒子を放出する確率:エネルギーの次元で表示)、Γγ0(励起状態から1本のガンマ線を放出して基底状態に戻る確率:エネルギーの次元で表示)、ΓT/E、生成される核種(粒子)、を示したものである。ここで、Eは照射すべきガンマ線の(ピーク)エネルギーに相当する。また、ΓT>>Γγ0であることが、重粒子を効率的に発生する観点からは好ましい。また、E±ΓTの範囲内のエネルギーのガンマ線によって共鳴吸収が起きやすくなる。従って、ΓT/Eが大きいほど反応自体は起きやすくなるという観点では好ましいが、他の核種や他の準位との選択性は悪くなるため、患部以外で重粒子やガンマ線が発生する原因となる場合がある。このため、ΓT/Eの上限は10%程度とすることが好ましい。ガンマ線21のエネルギーは使用する核種に応じて設定するが、この設定はレーザーコンプトンガンマ線源50における電子ビーム70のエネルギーや、レーザー光81の波長の調整によりなされる。
【0040】
【表1】

【0041】
また、患部に蓄積されやすい薬剤11の主成分となる物質として、FDG以外にも、核種に応じて適宜設定が可能である。例えば、ホウ素の同位体である10B、11Bを用いる場合には、BNCTにも用いられるBSH(Na2B12H11SH)を用いることができる。また、BPA(パラボロフェニルアラニン)も同様に用いることができる。これらの物質におけるホウ素として10B、11Bを用いることにより、上記のFDGと同様の効果を奏することは明らかである。その他、薬剤11の主成分としては、人体に投与が可能でありかつ患部に蓄積されやすい物質を適宜選択して用いることができる。
【0042】
また、上記の例では、ガンマ線発生手段として、レーザーコンプトンガンマ線源を用いた場合について記載したが、単色あるいは準単色のガンマ線を発することができるガンマ線源であれば、同様に用いることができる。例として、粒子や中性子の捕獲ガンマ線や、制動放射ガンマ線を発するガンマ線源も用いることができる。
【符号の説明】
【0043】
10 薬剤投与手段
11 薬剤
20 ガンマ線照射手段
21 ガンマ線
50 レーザーコンプトンガンマ線源
51 入射器
52 偏向磁石
53 高周波(RF)加速空洞
54 ビームダンプ
60 ガンマ線発生部
70 電子ビーム
80 レーザー光源
81 レーザー光
82 反射鏡
100 19F原子核
101 α粒子
102 15N原子核
200 癌細胞
201 細胞核
202 DNA
A、B、C 患者
A1、B1、C1 患部
P 衝突点
【特許請求の範囲】
【請求項1】
ガンマ線を吸収することによって重粒子を生成する核種を含み、かつ癌細胞が存在する箇所に蓄積される薬剤を、患者に投与する薬剤投与手段と、
前記薬剤が投与された患者に対してガンマ線のビームを照射するガンマ線照射手段と、を具備することを特徴とする癌治療システム。
【請求項2】
前記ガンマ線照射手段はレーザーコンプトンガンマ線源であることを特徴とする請求項1に記載の癌治療システム。
【請求項3】
前記レーザーコンプトンガンマ線源において、閉軌道を周回する電子が用いられ、前記閉軌道における複数の箇所から前記ガンマ線が取り出される構成とされたことを特徴とする請求項2に記載の癌治療システム。
【請求項4】
前記レーザーコンプトンガンマ線源において、開軌道を進行する電子が用いられ、前記開軌道における複数の箇所から前記ガンマ線が取り出される構成とされたことを特徴とする請求項2に記載の癌治療システム。
【請求項5】
前記核種には、少なくとも19F、17O、18Oのいずれかが含まれることを特徴とする請求項1から請求項4までのいずれか1項に記載の癌治療システム。
【請求項6】
前記薬剤はFDG(フルオロデオキシグルコース)を主成分とすることを特徴とする請求項5に記載の癌治療システム。
【請求項7】
前記薬剤に18Fが添加されたことを特徴とする請求項6に記載の癌治療システム。
【請求項1】
ガンマ線を吸収することによって重粒子を生成する核種を含み、かつ癌細胞が存在する箇所に蓄積される薬剤を、患者に投与する薬剤投与手段と、
前記薬剤が投与された患者に対してガンマ線のビームを照射するガンマ線照射手段と、を具備することを特徴とする癌治療システム。
【請求項2】
前記ガンマ線照射手段はレーザーコンプトンガンマ線源であることを特徴とする請求項1に記載の癌治療システム。
【請求項3】
前記レーザーコンプトンガンマ線源において、閉軌道を周回する電子が用いられ、前記閉軌道における複数の箇所から前記ガンマ線が取り出される構成とされたことを特徴とする請求項2に記載の癌治療システム。
【請求項4】
前記レーザーコンプトンガンマ線源において、開軌道を進行する電子が用いられ、前記開軌道における複数の箇所から前記ガンマ線が取り出される構成とされたことを特徴とする請求項2に記載の癌治療システム。
【請求項5】
前記核種には、少なくとも19F、17O、18Oのいずれかが含まれることを特徴とする請求項1から請求項4までのいずれか1項に記載の癌治療システム。
【請求項6】
前記薬剤はFDG(フルオロデオキシグルコース)を主成分とすることを特徴とする請求項5に記載の癌治療システム。
【請求項7】
前記薬剤に18Fが添加されたことを特徴とする請求項6に記載の癌治療システム。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】




【図2】


【図3】


【図4】


【図5】


【図6】


【公開番号】特開2013−31600(P2013−31600A)
【公開日】平成25年2月14日(2013.2.14)
【国際特許分類】
【出願番号】特願2011−169892(P2011−169892)
【出願日】平成23年8月3日(2011.8.3)
【出願人】(505374783)独立行政法人日本原子力研究開発機構 (727)
【Fターム(参考)】
【公開日】平成25年2月14日(2013.2.14)
【国際特許分類】
【出願日】平成23年8月3日(2011.8.3)
【出願人】(505374783)独立行政法人日本原子力研究開発機構 (727)
【Fターム(参考)】
[ Back to top ]

