癌治療剤
【課題】 新たな治療メカニズムによる癌治療剤を提供する。
【解決手段】 本発明の癌治療剤は、癌を治療するための癌治療剤であって、コリントランスポーターによるコリン取り込みを阻害する物質、および前記コリントランスポーターの発現を阻害する物質の少なくとも一方を含むことを特徴とする。前記コリン取り込みを阻害物質は、コリンとの競合的拮抗作用によりコリン取り込みを阻害する物質が好ましく、この場合、有機カチオン系化合物がより好ましい。前記コリントランスポーターの発現阻害物質は、RNA干渉により前記コリントランスポーターのmRNAの発現を阻害するsiRNAが好ましい。前記コリントランスポーターは、例えば、CTL1、CTL2、CTL3、CTL4、CTL5等があげられる。
【解決手段】 本発明の癌治療剤は、癌を治療するための癌治療剤であって、コリントランスポーターによるコリン取り込みを阻害する物質、および前記コリントランスポーターの発現を阻害する物質の少なくとも一方を含むことを特徴とする。前記コリン取り込みを阻害物質は、コリンとの競合的拮抗作用によりコリン取り込みを阻害する物質が好ましく、この場合、有機カチオン系化合物がより好ましい。前記コリントランスポーターの発現阻害物質は、RNA干渉により前記コリントランスポーターのmRNAの発現を阻害するsiRNAが好ましい。前記コリントランスポーターは、例えば、CTL1、CTL2、CTL3、CTL4、CTL5等があげられる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、癌治療剤に関する。
【背景技術】
【0002】
従来から、癌を治療する癌治療剤として、アルキル化剤、代謝拮抗剤、抗癌性抗生物質、植物アルカロイド等が、臨床において使用されている。さらに、近年では、腫瘍細胞の増殖、浸潤、転移に関わる分子を標的とする治療メカニズムの分子標的薬等も開発されている。このような分子標的薬として、例えば、血管新生に関わると考えられるヒトアンジオポエチン様因子2(ANGPTL2)の機能を阻害する物質を含む癌治療剤が提案されている(特許文献1)。
【0003】
癌治療においては、癌の発生部位やその進行度合い等により癌治療剤の効果が左右される場合があり、また、既存の癌治療剤に対する耐性が生じることで、その効果が低下する場合もある。このため、常に、新たな治療メカニズムによる癌治療剤が求められている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2011−93896号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
そこで、本発明は、新たな治療メカニズムによる癌治療剤を提供することを目的とする。
【課題を解決するための手段】
【0006】
前記目的を達成するために、本発明の癌治療剤は、
癌を治療するための癌治療剤であって、
コリントランスポーターによるコリン取り込みを阻害する物質、および前記コリントランスポーターの発現を阻害する物質の少なくとも一方を含むことを特徴とする。
【発明の効果】
【0007】
本発明によれば、新たな治療メカニズムによる癌治療剤を提供できる。
【図面の簡単な説明】
【0008】
【図1】図1は、参考例1における、各種ヒト癌細胞でのコリントランスポーターのmRNAの発現量の測定結果を示すグラフである。
【図2】図2は、参考例2における、ヒト乳癌細胞およびヒト正常乳腺上皮細胞でのコリントランスポーターのmRNAの発現量の測定結果を示すグラフである。
【図3】図3は、参考例3における、ヒト乳癌組織切片でのCTL2タンパク質の発現の確認結果を示す写真である。
【図4】図4は、参考例4における、ヒト乳癌細胞およびヒト正常乳腺上皮細胞でのコリン取り込み作用の確認結果を示すグラフである。
【図5】図5は、実施例1における、細胞生存率およびカスパーゼ3/7活性の測定結果を示すグラフである。
【図6】図6は、実施例2における、CTL1 mRNAの発現量、コリン取り込み、細胞生存率およびカスパーゼ3/7の活性の測定結果を示すグラフである。
【図7】図7は、実施例3で使用した有機カチオン系化合物の、コリン取り込み阻害作用と細胞死誘導作用との相関関係を示すグラフである。
【発明を実施するための形態】
【0009】
1.癌治療剤
本発明の癌治療剤は、前述のように、癌を治療するための癌治療剤であって、コリントランスポーターによるコリン取り込みを阻害する物質(以下、「コリン取り込み阻害物質」ともいう。)、および前記コリントランスポーターの発現を阻害する物質(以下、「コリントランスポーター発現阻害物質」ともいう。)の少なくとも一方を含むことを特徴とする。すなわち、本発明の癌治療剤は、前記コリン取り込み阻害物質を含むか、前記コリントランスポーター発現阻害物質を含むか、前記コリン取り込み阻害物質および前記コリントランスポーター発現阻害物質の両方を含む。
【0010】
本発明において、前記コリントランスポーターは、choline transporter−like protein(CTL)であり、そのファミリーとして、CTL1、CTL2、CTL3、CTL4、CTL5等があげられる。
【0011】
前記各CTL遺伝子のmRNA配列、および各CTLタンパク質のアミノ酸配列は、例えば、下記のようにデータベースに登録されている。このため、当業者であれば、CTLタンパク質およびそれをコードする遺伝子等を容易に取得できる。
(1)CTL1
mRNA配列:GeneBank、アクセッションNo.NM_080546.3
アミノ酸配列:GenPept、アクセッションNo.NP_536856.2
(2)CTL2
mRNA配列:GeneBank、アクセッションNo.NM_020428.3
アミノ酸配列:GenPept、アクセッションNo.NP_065161.3
(3)CTL3
mRNA配列:GeneBank、アクセッションNo.NM_152369.3
アミノ酸配列:GenPept、アクセッションNo.NP_689582.2
(4)CTL4
mRNA配列:GeneBank、アクセッションNo.NM_025257.2
アミノ酸配列:GenPept、アクセッションNo.NP_079533.2
(5)CTL5
mRNA配列:GeneBank、アクセッションNo.NM_152697.4
アミノ酸配列:GenPept、アクセッションNo.NP_689910.2
【0012】
1−1.治療メカニズム
本発明の癌治療剤は、前述のように、新たな治療メカニズムにより癌を治療する癌治療剤である。すなわち、本発明の癌治療剤が癌を治療するメカニズムは、前記コリン取り込み阻害物質による、前記コリントランスポーターによるコリン取り込みの阻害もしくは前記コリントランスポーター発現阻害物質による、前記コリントランスポーターの発現の阻害、またはこれらの両方である。コリンは、全ての動物細胞にとって重要な必須栄養素であり、細胞膜の構成成分であるリン脂質の合成に利用されている。コリンは腫瘍細胞への集積性が高いことが知られており、この知見を利用して、11C−コリンまたは18F−コリンによるPET/CTを使用した癌の画像診断が報告されている(例えば、DeGrado et al. The Journal of Nuclear Medicine Vol.42 No.12 December 2001 p1805−1814、およびHara The Journal of Nuclear Medicine Vol.42 No.12 December 2001 p1815−1817)。これらの知見から、腫瘍細胞は、積極的にコリンを取り込み、増殖に利用していると、本発明者等は推察した。しかしながら、細胞外からコリンを取り込むために、腫瘍細胞に発現するコリントランスポーターの分子的実体は明らかではなかった。そこで、本発明者等は、鋭意研究の結果、大腸癌、乳癌、前立腺癌、肺癌、神経芽腫、グリオーマ、白血病等の癌細胞へのコリンの取り込みが、CTLを介して行われることを見出した。この知見に基づき、本発明者等は、さらに研究を重ねた結果、前記コリン取り込み阻害物質および前記コリントランスポーター発現阻害物質が、前記CTLを標的分子とする治療メカニズムにより、癌を治療できることを見出し、本発明に至った。本発明者等は、前記両物質による癌治療のメカニズムを解明すべく、さらに研究を行った。その結果、前記両物質による癌治療の効果は、前記CTLによるコリン取り込み作用を阻害することにより、腫瘍細胞においてアポトーシスを誘導し、細胞死を引き起こさせることによることを見出した。このような癌の治療メカニズムは、これまで全く知られていなかった新たな治療メカニズムである。
【0013】
1−2.コリン取り込み阻害物質
前記コリン取り込み阻害物質は、前記CTLによるコリン取り込みを阻害する物質であり、その阻害機能は、例えば、コリンとの競合的拮抗作用、前記CTLの機能部位の阻害作用等があげられる。前記コリン取り込み阻害物質は、例えば、一種類の阻害機能のコリン取り込み阻害物質を単独で使用してもよいし、二種類以上の阻害機能のコリン取り込み阻害物質を併用してもよい。
【0014】
前記コリンとの競合的拮抗作用によりコリン取り込みを阻害する物質は、例えば、有機カチオン系化合物があげられる。前記有機カチオン系化合物は、例えば、有機第四級アンモニウム塩の化合物があげられ、具体的には、抗うつ剤等の医薬品として使用されるものがあげられる。より具体的には、例えば、ヘミコリニウム−3、キニーネ、キニジン、デシプラミン、イミプラミン、クロミプラミン、ジフェンヒドラミン、クロニジン、フルボキサミン、パロキセチン、ミルナシプラン、ベンラファキシン、レボキセチン、シタロプラム、フルオキセチン、シメチジン、プロカインアミド、ジソピラミド、クロルフェニラミン、アミロライド、アトロピン、モルヒネ、メトホルミン、アマンタジン等があげられる。これらの化合物は、例えば、一種類を単独で使用してもよいし、二種類以上を併用してもよい。これらの化合物は、例えば、市販品を使用できる。
【0015】
前記コリン取り込み阻害物質は、例えば、前記CTLに特異的に結合することで、前記CTLの機能を阻害する物質があげられる。前記物質は、例えば、抗体、アプタマー等があげられる。前記抗体は、例えば、免疫グロブリン(Ig)、抗体フラグメント、キメラ抗体等があげられる。前記免疫グロブリンは、例えば、IgG、IgA、IgM、IgE、IgD等があげられる。前記抗体フラグメントは、例えば、Fab、Fab’、F(ab’)2等があげられる。前記キメラ抗体は、例えば、ヒト化抗体等があげられる。前記抗体は、例えば、マウス、ウサギ、ウシ、ブタ、ウマ、ヒツジ、ヤギ等の哺乳動物、ニワトリ等の鳥類、ヒト等の動物種由来のものでもよく、特に制限されない。前記抗体は、例えば、前記動物種由来の血清から、従来公知の方法により調製してもよいし、市販の抗体を使用してもよい。前記抗体は、例えば、ポリクローナル抗体およびモノクローナル抗体のいずれでもよい。
【0016】
1−3.コリントランスポーター発現阻害物質
前記コリントランスポーター発現阻害物質は、前記CTLの発現を阻害することにより、結果として、前記CTLによるコリン取り込みを阻害する。前記CTLの発現阻害は、例えば、前記CTLのmRNAの発現阻害により行える。前記CTLのmRNAの発現阻害は、例えば、RNA干渉による前記CTLのmRNAの発現阻害により行える。RNA干渉による前記CTLのmRNAの発現を阻害する物質は、例えば、siRNAがあげられる。
【0017】
前記si(small interfering)RNAは、両鎖の3’末端が2塩基突出した20〜25塩基対の二本鎖RNAであり、RNA干渉(RNAi)経路で相補的な配列を有するRNAの特異的な切断を誘導する。前記siRNAの配列と切断されるmRNAの対象部位の配列とは、同一性が100%であることが最も好ましい。ただし、必ずしも同一性が100%である必要はなく、前記同一性は、例えば、前記siRNAが、前記相補的な配列を有するRNAを切断する機能を有する範囲であればよい。前記siRNAは、目的とするCTLの配列に対し、従来公知の方法により設計できる。前記siRNAは、例えば、従来公知の導入剤により、癌細胞に導入される。前記導入剤は、例えば、ウイルスベクター、リポフェクタミン等があげられる。前記ウイルスベクターは、例えば、従来公知のものを使用できる。前記導入剤は、例えば、市販の導入剤を使用してもよい。
【0018】
CTL1のmRNAの発現を阻害するsiRNAは、例えば、下記(1)〜(3)のsiRNAがあげられる。下記(1)〜(3)のsiRNAは、それぞれ、前記CTL1遺伝子の異なるコード領域を対して設計されたものである。各siRNAについて、二本鎖の配列をそれぞれ示す。
(1)HSS118777
AAAUUCACUGAUCCAAAUCAGGCCC(配列番号1)
GGGCCUGAUUUGGAUCAGUGAAUUU(配列番号2)
(2)HSS118778
UUACCAGCUUCUUUCAUUGCUUUCC(配列番号3)
GGAAAGCAAUGAAAGAAGCUGGUAA(配列番号4)
(3)HSS118779
UUAAGAUCCACACAAGUACUCUUGA(配列番号5)
UCAAGAGUACUUGUGUGGAUCUUAA(配列番号6)
【0019】
前記RNA干渉による前記CTLのmRNAの発現を阻害する物質は、siRNAの他に、例えば、shRNAがあげられる。前記sh(small hairpin)RNAは、一本鎖RNAで部分的に回文状の塩基配列を含むことにより、分子内で二本鎖構造をとり、ヘアピンのような構造となる約20塩基対以上の分子である。前記shRNAも、前記siRNAと同様に、RNA干渉(RNAi)経路で相補的な配列を有するRNAの特異的な切断を誘導する。
【0020】
前記RNA干渉による前記CTLのmRNAの発現を阻害する物質は、例えば、前記siRNAまたは前記shRNAをコードする核酸配列を含む発現ベクターでもよい。前記発現ベクターは、ベクターの基本骨格に、前記siRNAまたは前記shRNAをコードする核酸を挿入することで構築できる。前記発現ベクターを構築するためのベクターの基本骨格は、特に制限されず、例えば、従来公知のものを使用できる。
【0021】
1−4.治療対象
本発明の癌治療剤が治療対象とする癌は、特に制限されず、例えば、大腸癌、乳癌、前立腺癌、肺癌、神経芽種、グリオーマ、白血病、肝臓癌、咽頭癌、胃癌、膵臓癌、胆嚢癌、食道癌、腎臓癌、子宮頸癌、子宮体癌、卵巣癌、口腔癌、舌癌、皮膚癌、骨肉腫、悪性リンパ腫、甲状腺癌、脳腫瘍等があげられる。本発明の癌治療剤は、前述のように、癌細胞で高発現するCTLの機能阻害により癌治療効果を奏するため、例えば、特定の癌種に限定されず、幅広い癌腫の治療に使用できる。前記治療は、例えば、前記癌の縮小(癌細胞の減少)、前記癌の増殖抑制、前記癌の転移抑制等を含む。また、本発明の癌治療剤の治療対象は、前記コリントランスポーター遺伝子を有する生物があげられ、具体的には、例えば、ヒト、ヒトを除く非ヒト動物があげられ、前記非ヒト動物は、例えば、ヒトを除く非ヒト哺乳類、鳥類、魚類等があげられる。
【0022】
1−5.投与方法、投与量、剤形
本発明の癌治療剤の投与方法は、特に制限されず、例えば、経口投与でもよいし、非経口投与でもよい。前記非経口投与は、例えば、静脈注射、筋肉注射、皮下投与、直腸投与、経皮投与、腹腔内投与、局所投与等があげられる。本発明の癌治療剤の投与量は、特に制限されず、例えば、選択する物質、動物種、年齢等に応じて適宜設定できる。本発明の癌治療剤をヒト成人に投与する場合、前記有機カチオン系化合物の1日あたりの投与量は、例えば、10〜500mg/kgであり、前記siRNAおよび前記抗体の1日あたりの投与量は、例えば、癌治療において分子標的剤として使用される、他のsiRNAおよび抗体と同様に、従来公知の範囲である。
【0023】
本発明の癌治療剤の剤型は、特に制限されず、例えば、用途に応じて適宜決定できる。本発明の癌治療剤を非経口投与する場合、前記剤型は、例えば、注射用製剤、点滴製剤等の非経口製剤があげられる。本発明の癌治療剤を経口投与する場合、前記剤型は、例えば、固体状または液体状の経口製剤があげられ、具体的には、例えば、錠剤、被覆錠剤、カプセル剤、丸剤、散剤、細粒剤、顆粒剤、カプセル剤、トローチ剤、液剤等があげられる。
【0024】
1−6.添加剤等
本発明の癌治療剤は、例えば、前記コリン取り込み阻害物質および前記コリントランスポーター発現阻害物質の他に、その剤型に応じて、添加剤を含んでもよい。前記添加剤は、薬学上許容される添加剤であることが好ましく、前記コリン取り込み阻害物質および前記コリントランスポーター発現阻害物質の癌治療作用に、実質的に影響を与えないものが使用できる。前記添加剤は、例えば、賦形剤、結合剤、滑沢剤、崩壊剤、吸収促進剤、乳化剤、安定化剤、防腐剤等があげられ、例えば、従来公知のものが使用できる。本発明の癌治療剤は、従来公知の製剤化技術等により製剤化可能である。
【0025】
本発明の癌治療剤は、例えば、他の癌治療剤を含んでもよい。他の癌治療剤を併用することにより、本発明の癌治療剤の癌治療効果をさらに向上できる。前記他の癌治療剤は、特に制限されず、例えば、従来から臨床で使用されている、アルキル化剤、代謝拮抗剤、抗癌性抗生物質、植物アルカロイド等、または前記CTLとは異なる遺伝子を標的とする分子標的剤等があげられる。前記他の癌治療剤は、本発明の癌治療剤に、例えば、一種類のみ含まれてもよいし、二種類以上が含まれてもよい。また、本発明の癌治療剤は、例えば、前記コリン取り込み阻害物質および前記コリントランスポーター発現阻害物質と、前記他の癌治療剤とが、それぞれ、別々に準備されたキットの形態でもよい。
【0026】
2.治療方法
本発明の癌治療方法は、癌患者に、前記本発明の癌治療剤を投与する工程を含むことを特徴とする。本発明の癌治療方法は、前記本発明の癌治療剤を投与することが特徴であって、その他の工程は、特に制限されない。本発明の癌治療方法は、前記本発明の癌治療剤の記載を引用できる。
【実施例】
【0027】
つぎに、本発明の実施例について、説明する。本発明は、以下の実施例に限定されるものではない。
【0028】
(ヒト癌細胞)
ヒト癌細胞は、下記(1)〜(9)の9種類を使用した。
(1)小細胞肺癌細胞(NCI−H69、入手元:American Type CultureCollection(ATCC))
(2)前立腺癌細胞(LNCaP、入手元:RIKEN BioResource Center)
(3)前立腺癌細胞(PC−3、入手元:RIKEN BioResource Center)
(4)乳癌細胞(MCF−7、入手元:ATCC)
(5)骨髄性白血病細胞(HL−60、入手元:ATCC)
(6)神経芽細胞種(SH−SY5Y、入手元:DS Pharma Biomedical Co., Ltd.)
(7)神経芽細胞種(LA−N−2、入手元:RIKEN BioResource Center)
(8)白血病T細胞(Jurkat、入手元:ATCC)
(9)大腸癌細胞(HT−29、入手元:ATCC)
【0029】
(ヒト正常乳腺上皮細胞)
ヒト正常乳腺上皮細胞は、MCF−10A細胞(入手元:ATCC)を使用した。
【0030】
(ヒト乳癌組織切片)
ヒト乳癌組織切片は、ジェノスタッフ株式会社から入手した。
【0031】
(有機カチオン系化合物)
有機カチオン系化合物は、下記(1)〜(15)の15種類を使用した。
(1)ヘミコリニウム−3(HC−3、入手元:SIGMA−Ardlich社)
(2)キニーネ(入手元:SIGMA−Ardlich社)
(3)キニジン(入手元:SIGMA−Ardlich社)
(4)デシプラミン(入手元:SIGMA−Ardlich社)
(5)イミプラミン(入手元:SIGMA−Ardlich社)
(6)クロミプラミン(入手元:SIGMA−Ardlich社)
(7)ジフェンヒドラミン(入手元:SIGMA−Ardlich社)
(8)クロニジン(入手元:SIGMA−Ardlich社)
(9)フルボキサミン(入手元:株式会社明治製菓)
(10)パロキセチン(入手元:SIGMA−Ardlich社)
(11)ミルナシプラン(入手元:旭化成株式会社)
(12)ベンラファキシン(入手元:Wyeth−Ayrest Research社)
(13)レボキセチン(入手元:Toronto Research Chemicals社)
(14)シタロプラム(入手元:Toronto Research Chemicals社)
(15)フルオキセチン(入手元:Toronto Research Chemicals社)
【0032】
(siRNA)
Stealth Select RNAi(登録商標)のsiRNAおよびStealth RNAi(登録商標)のsiRNAネガティブコントロールを、Invitrogen Life Technologies Inc.社(Carlsbad、CA)で、商業的に合成した。3種類のStealth RNAi二本鎖(Oligo ID:HSS118777、HSS118778およびHSS118779)を、ヒトCTL1mRNA配列(GeneBank accession no. NM_080546.3)の異なるコード領域に対して設計した。前記3種類のStealth RNAi二本鎖の各鎖の配列を、下記(1)〜(3)に示す。
(1)HSS118777
AAAUUCACUGAUCCAAAUCAGGCCC(配列番号1)
GGGCCUGAUUUGGAUCAGUGAAUUU(配列番号2)
(2)HSS118778
UUACCAGCUUCUUUCAUUGCUUUCC(配列番号3)
GGAAAGCAAUGAAAGAAGCUGGUAA(配列番号4)
(3)HSS118779
UUAAGAUCCACACAAGUACUCUUGA(配列番号5)
UCAAGAGUACUUGUGUGGAUCUUAA(配列番号6)
【0033】
(mRNA発現量の定量)
(1)トータルRNAの抽出
前記ヒト癌細胞を、滅菌したダルベッコリン酸緩衝生理食塩水(D−PBS、WAKO)で洗浄し、QIAshredderおよびRNeasy Mini Kit(QIAGEN、Valencia、CA)を使用して、前記ヒト癌細胞からトータルRNAを、抽出した。
【0034】
(2)プライマーおよびプローブ
対象とするmRNA(CHT1およびCTL1〜5)、およびハウスキーピング遺伝子(グリセルアルデヒド3リン酸脱水素酵素(GAPDH))に対する、一対のプライマーおよびTaqManプローブは、ヒトmRNA配列に基づいて設計された、市販品を使用した。前記設計には、TaqMan Gene Expression Assays(Applied Biosystems)を使用した。
(TaqManプローブ)
CHT1用プローブ (アッセイID:Hs00222367_m1)
CTL1用プローブ (アッセイID:Hs00939357_m1)
CTL2用プローブ (アッセイID:Hs01105938_m1)
CTL3用プローブ (アッセイID:Hs01118290_m1)
CTL4用プローブ (アッセイID:Hs01046784_m1)
CTL5用プローブ (アッセイID:Hs01120485_m1)
GAPDH用プローブ(アッセイID:Hs99999905_m1)
【0035】
(3)リアルタイムPCR
1ステップリアルタイムPCRのために、5μLのトータルRNA(10ng)を、TaqMan RNA−to−CT(登録商標) 1−Step Kitを使用して、15μLのmaster mixtureに添加した。前記master mixtureには、最終的に、TaqMan RT Enzyme Mixture、TaqMan RT−PCR MixtureおよびTaqMan(登録商標) Gene Expression Assayが含まれる。リアルタイムPCRのサイクル条件は、下記のとおりとした。
(サイクル条件)
cDNA合成:48℃・15分
RT(逆転写酵素)の不活性化およびTaqポリメラーゼの活性化:95℃・10分
増幅:95℃・15秒および60℃・1分を1サイクルとし、40サイクル
【0036】
リアルタイムPCRデータを、Applied Biosystems StepOne Plus(登録商標) Real−Time PCR systemで分析した。前記ヒト癌細胞における対象遺伝子の相対的mRNA発現レベルを、比較Ct法により算出した。各対象のPCRについて、GAPDHと比較した前記mRNA発現レベルは、下記式により算出できる。
相対的mRNA発現(%)=2−(Ct target−Ct GAPDH)×100
【0037】
(細胞生存率)
前記ヒト癌細胞の細胞数を、ATPLite(登録商標)(PerkinElmer Life and Analytical Sciences、Boston、MA)で測定した。luminescence ATP detection assay systemを、製造元の説明書の記載に従って行い、発光を、2030 ARVO X5 Multilabel Reader(PerkinElmer、Waltham、MA)で測定した。
【0038】
(カスパーゼ3および7活性の定量)
カスパーゼ3および7の活性の測定のために、Caspase−Glo(登録商標) 3/7 Assay(Promega、Mannheim、Germany)を、製造元の説明書に従って行った。このキットは、カスパーゼ3および7による発光基質のDEVD配列の切断に基づき、発光シグナルを発する。具体的には、前記ヒト癌細胞に、Caspase−Glo 3/7 reagent(Promega Corporation, Madison. WI)を添加し、発光を、2030 ARVO X5 Multilabel Reader(PerkinElmer、Waltham、MA)で測定した。
【0039】
(コリン取り込み)
まず、前記ヒト癌細胞を、下記組成の取り込みバッファーで2回洗浄した。
取り込みバッファー(pH7.4)
125mmol/L NaCl
4.8mmol/L KCl
1.2mmol/L CaCl2
1.2mmol/L KH2PO4
5.6mmol/L グルコース
1.2mmol/L MgSO4
25mmol/L HEPES
【0040】
つぎに、取り込みを、[3H]コリン[(比放射能:3182GBq/mmol)、PerkinElmer Life Sciences, Inc.(Boston, MA)から入手]を含む取り込みバッファーの添加により開始した。所定時間インキュベーション後、氷冷した取り込みバッファーで急速に所定回数洗浄した。ついで、洗浄後の前記ヒト癌細胞を、0.1mol/L NaOHおよびTriton X−100に溶解し、アリコートを、液体シンチレーション計数法用に採取した。放射能を、液体シンチレーションカウンター(Tri−Carb(登録商標) 2100 TR、Packard Instrument Company、Meriden、CT)で測定した。[3H]コリンの特異的取り込みを、前記アリコートに含まれるタンパク質1mgあたりにおける、30mmol/Lの標識化していないコリンの存在下および非存在下における、全[3H]コリン取り込みの差として算出した。前記アリコートに含まれるタンパク質の濃度は、DC Protein Assay Kit(Bio−Rad Laboratories、Hercules、CA、USA)を使用して決定した。
【0041】
[参考例1]
本参考例では、各種ヒト癌細胞におけるコリントランスポーターのmRNA発現を確認した。
【0042】
前記9種類全てのヒト癌細胞を使用した。前記ヒト癌細胞から、トータルRNAを抽出し、リアルタイムPCRにより、コリントランスポーターのmRNAの発現量を測定した。
【0043】
図1に、コリントランスポーターのmRNAの発現量の測定結果を示す。図1の各グラフにおいて、横軸は、各種コリントランスポーターを示し、縦軸は、相対的mRNA発現(%)を示し、GAPDHのmRNAの発現量を100%とする相対値で示す。
【0044】
図1に示すように、choline transpoter−like proteins(CTL1〜5)が、検討した全てのヒト癌細胞において、高発現していることが確認された。また、前記CTL1〜5の発現パターンは、各種ヒト癌細胞において、様々であることが確認された。一方、高親和性コリントランスポーターであるCHT1は、アセチルコリン神経系の神経芽細胞腫(LA−N−2)以外のヒト癌細胞では、発現が確認できなかった。これらの結果から、前記各種ヒト癌細胞におけるコリン取り込みは、CTL1〜5を介して行われることが明らかである。
【0045】
[参考例2]
本参考例では、ヒト乳癌細胞およびヒト正常乳腺上皮細胞におけるコリントランスポーターのmRNA発現を確認した。
【0046】
前記ヒト乳癌細胞は、MCF−7細胞を使用し、前記ヒト正常乳腺上皮細胞は、MCF−10Aを使用した。まず、前記両細胞を、RPMI1640培地(Gibco BRL、Carlsbad、CA)で増殖させた。前記RPMI1640培地は、コーティングしていないフラスコ(BD Biosciences、Bedford、MA)で、10% ウシ胎児血清(Gibco BRL)および20mg/L カナマイシン(Gibco BRL)を添加したものを使用した。増殖させた前記両細胞から、トータルRNAを抽出し、リアルタイムPCRにより、コリントランスポーターのmRNAの発現量を測定した。
【0047】
図2に、コリントランスポーターのmRNAの発現量の測定結果を示す。図2において、横軸は、各種コリントランスポーターを示し、縦軸は、相対的mRNA発現(%)を示し、GAPDHのmRNAの発現量を100%とする相対値で示す。黒のバーは、MCF−7細胞の結果、白のバーは、MCF−10A細胞の結果を示す。
【0048】
図2に示すように、MCF−7細胞とMCF−10A細胞とでは、コリントランスポーターのmRNAの発現量および発現パターンが異なっていた。具体的には、ヒト乳癌細胞であるMCF−7細胞では、ヒト正常乳腺上皮細胞であるMCF−10A細胞と比較して、CTL1のmRNAの発現量が約5倍、CTL2のmRNAの発現量が約20倍亢進していた。また、CTL4のmRNAは、ヒト乳癌細胞であるMCF−7細胞でのみ特異的に発現していた。
【0049】
[参考例3]
本参考例では、ヒト乳癌組織切片について、免疫組織化学的検査を行うことで、前記ヒト乳癌組織におけるCTL2タンパク質の発現を確認した。
【0050】
前記ヒト乳癌組織切片を、脱パラフィンし、PBSを使用して再度水和し、サンプルを調製した。このサンプルを、0.1%トリプシン中に置き、37℃で25分間振とうした。ついで、下記工程1〜7をこの順序で行い、CTL2タンパク質の発現を確認した。
(工程)
1.前記サンプルを、3%H2O2を含む1×PBS中で、室温で10分間インキュベートする。インキュベート後の前記サンプルを再度洗浄する。
2.洗浄後の前記サンプルを、ブロッキング液(DAKO Protein Block)中で、10分間インキュベートする。
3.ブロッキング後の前記サンプルに、一次抗体(10μg/mL、抗CTL2抗体および正常マウスIgG1抗体、ブロッキング液で希釈)を添加し、前記サンプルを、4℃で一昼夜インキュベートする。インキュベート後の前記サンプルを、1×PBSで洗浄する。
4.洗浄後の前記サンプルを、二次抗体(1:500、マウスIgビオチン(DAKO:E0433))と、30分間インキュベートする。インキュベート後の前記サンプルを、PBSで洗浄する。
5.CTL2タンパク質を、ABC法によりDAB/H2O2染色を行うことで検出する。具体的には、VECTASTAIN ABC kitを使用し、基質溶液(DAB/H2O2染色)を適用する。前記基質溶液の適用後の前記サンプルを、水道水で徹底的に洗浄する。
6.洗浄後の前記サンプルを、マイヤーヘマトキシリン中で対比染色する。
7.染色後の前記サンプルを脱水し、脱水後の前記サンプルを、松浪硝子工業株式会社製の商品名「APSコートスライドグラス」にマウントし、蛍光顕微鏡(株式会社キーエンス製の商品名「BZ−8000」)で観察する。
【0051】
図3に、CTL2タンパク質の発現の確認結果を示す。図3において、左側の写真が、1次抗体として正常マウスIgG1抗体を使用した結果(コントロール)、右側の写真が、1次抗体として抗CTL2抗体を使用した結果を示す。倍率は、200倍とした。
【0052】
図3に示すように、1次抗体として抗CTL2抗体を使用した場合にのみ、前記ヒト乳癌組織において、陽性の染色像が確認された。この結果から、ヒト乳癌組織におけるCTL2タンパク質の発現が確認された。
【0053】
[参考例4]
本参考例では、ヒト乳癌細胞とヒト正常乳腺上皮細胞におけるコリン取り込み作用を確認した。
【0054】
前記ヒト乳癌細胞は、MCF−7細胞を使用し、前記ヒト正常乳腺上皮細胞は、MCF−10Aを使用した。コリン取り込みを、60分間での濃度10μmol/Lの[3H]コリン取り込みのタイムコースで試験した。具体的には、まず、前記両細胞を、RPMI1640培地(Gibco BRL、Carlsbad、CA)中で、24穴プレートに、細胞密度80%で増殖させた。前記RPMI1640培地は、24穴プレート(BD Biosciences、Bedford、MA)で、10% ウシ胎児血清(Gibco BRL)および20mg/L カナマイシン(Gibco BRL)を添加したものを使用した。前記増殖後、前記24穴プレートから、前記培地を除去し、前記両細胞について、コリン取り込みを測定した。前記コリン取り込みでは、前記氷冷した取り込みバッファーで、前記細胞を2回洗浄し、前記タイムコースは、[3H]コリンの添加から、5、10、20、30、45および60分とした。
【0055】
図4に、コリン取り込み作用の確認結果を示す。図4において、横軸は、コリン添加からの経過時間(分)を示し、縦軸は、タンパク質1mgあたりの[3H]コリンの取り込み量(pmol/mg protein)を示す。黒丸は、MCF−7細胞の結果、白丸は、MCF−10A細胞の結果を示す。
【0056】
図4に示すように、ヒト乳癌細胞であるMCF−7細胞では、ヒト正常乳腺上皮細胞であるMCF−10A細胞と比較して、[3H]コリンの取り込み量が約2倍に増大していた。この結果から、ヒト乳癌細胞は、ヒト正常乳腺上皮細胞と比較して、コリンを大量に取り込んでいることが明らかである。
【0057】
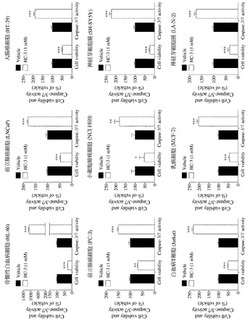
[実施例1]
本実施例では、各種ヒト癌細胞に対するコリン取り込み阻害物質HC−3の、細胞生存率およびカスパーゼ3/7活性に及ぼす影響を確認した。
【0058】
前記9種類全てのヒト癌細胞を使用した。まず、前記各細胞を、細胞密度60〜70%で、24穴プレートに播種した。これに、HC−3を濃度1mmol/Lで、2日間毎日添加し、各ウェルの液量を、1.0mLとした。HC−3の最初の添加から3日後に、前記各細胞について、細胞生存率およびカスパーゼ3/7の活性を測定した。コントロールは、HC−3に代えて、生理食塩水を添加し、同様にして細胞生存率およびカスパーゼ3/7の活性を測定した。
【0059】
図5に、細胞生存率およびカスパーゼ3/7活性の測定結果を示す。図5の各グラフにおいて、白のバーは、HC−3添加(1mmol/L)の結果、黒のバーは、コントロール(Vehicle)の結果を示す。また、各グラフにおける左側の白のバーおよび黒のバーのセットは、細胞生存率の測定結果を示し、各グラフにおける右側の白のバーおよび黒のバーのセットは、カスパーゼ3/7活性の測定結果を示す。細胞生存率およびカスパーゼ3/7活性は、コントロールでの測定結果を100%とし、前記各種ヒト癌細胞における測定結果を、相対値(%)で示す。
【0060】
図5に示すように、検討した全てのヒト癌細胞において、コリン取り込み阻害物質であるHC−3の添加により、有意な細胞生存率の低下、および有意なカスパーゼ3/7活性の増大が確認された。これらの結果から、HC−3によるコリン取り込み阻害により、前記ヒト癌細胞において、アポトーシスが誘導され、細胞死が引き起こされていることが確認された。したがって、癌細胞におけるコリン取り込み作用を担っているコリントランスポーターが、癌治療の標的分子であることが明らかとなった。そして、前記参考例1に示すように、ヒト癌細胞において発現しているコリントランスポーターがCTL1〜5であることが明らかとなっている。以上を踏まえると、癌細胞において発現するCTL1〜5の機能を阻害する作用は、アポトーシスによる細胞死をもたらすことになり、前記コリントランスポーターによるコリン取り込みを阻害する物質は、新たな治療メカニズムによる癌治療剤として、癌治療に有用といえる。
【0061】
[実施例2]
本実施例では、小細胞肺癌細胞に対するRNA干渉法でのCTL1 mRNA発現抑制による、細胞生存率およびカスパーゼ3/7活性への影響を確認した。
【0062】
小細胞肺癌細胞は、NCI−H69細胞を使用した。前記細胞を、培養密度50〜60%で、ポリ−D−リジンでコーティングした24穴組織培養プレートに播種した。前記培養後、培地を除去し、前記細胞を、Opti−MEM I reduced serum medium(Invitrogen Life Technologies Inc.)で、1回洗浄した。洗浄後の前記細胞を、Opti−MEM I reduced serum medium中で、Optifect(ウェルあたり3μL、Invitrogen Life Technologies Inc.)を使用し、前記3種類のCTL1 siRNAの混合物(各50nmol/L)によりトランスファーした。前記CTL1 siRNA混合物を、2日毎に3回添加した。そして、初回のトランスフェクションから7日後に、前記細胞について、CTL1 mRNAの発現量、コリン取り込み、細胞生存率およびカスパーゼ3/7の活性を測定した。コリン取り込みでは、10分間のインキュベーション後、前記氷冷した取り込みバッファーで、前記細胞を3回洗浄した。コントロールは、前記CTL1 siRNA混合物に代えて、siRNAネガティブコントロールを添加し、同様にしてCTL1 mRNAの発現量、コリン取り込み、細胞生存率およびカスパーゼ3/7の活性を測定した。
【0063】
図6に、CTL1 mRNAの発現量、コリン取り込み、細胞生存率およびカスパーゼ3/7の活性の測定結果を示す。図6において、(a)はCTL1 mRNAの発現量の測定結果、(b)はコリン取り込みの測定結果、(c)は細胞生存率の測定結果、(d)はカスパーゼ3/7の活性の測定結果を示す。CTL1 mRNAの発現量は、GAPDHのmRNAの発現量を100%とする相対値(%、相対的mRNA発現(%))で示す。コリン取り込み、細胞生存率およびカスパーゼ3/7の活性は、それぞれ、コントロールでの測定結果を100%として、NCI−H69細胞における測定結果を、相対値(%)で示す。
【0064】
図6に示すように、前記CTL1 siRNAのトランスフェクションにより、CTL1 mRNAの発現は、約50%抑制された(図6(a))。また、コリン取り込み作用および細胞生存率は、有意に抑制された(図6(b)および図6(c))。そして、カスパーゼ3/7活性は、増大された(図6(d))。これらの結果から、CTL1 mRNAの発現を、siRNAにより特異的に抑制することで、コリン取り込みの抑制と、アポトーシス誘導とによる細胞死が引き起こされることが確認された。したがって、小細胞肺癌細胞におけるCTL1分子を介するコリン取り込み作用は、癌細胞の生存に重要な役割を担っており、CTL1分子は、癌治療の標的分子であることが明らかである。そして、RNA干渉により前記コリントランスポーターのmRNAの発現を阻害する物質は、新たな治療メカニズムによる癌治療剤として、癌治療に有用といえる。
【0065】
[実施例3]
本実施例では、各種ヒト癌細胞に対する有機カチオン系化合物の、コリン取り込み阻害作用および細胞死誘導作用を評価した。
【0066】
(1)コリン取り込み阻害作用の評価
前記9種類全てのヒト癌細胞を使用した。まず、前記各細胞を、10% ウシ胎児血清含有RPMI1640培地中で、24穴プレートに、細胞密度80%で増殖させた。一方、HC−3を除く14種類の有機カチオン系化合物を、最終濃度100μmol/Lとなるように、生理食塩水に溶解した。前記有機カチオン系化合物の溶液を、前記[3H]コリンを含む取り込みバッファーに添加した。この[3H]コリンを含む取り込みバッファーを使用して、コリン取り込みを測定した。コリン取り込みでは、10分間のインキュベーション後、前記氷冷した取り込みバッファーで、前記細胞を2回洗浄した。コントロールは、前記有機カチオン系化合物の溶液に代えて、生理食塩水を添加し、コリン取り込みを測定した。
【0067】
(2)細胞死誘導作用の評価
前記9種類全てのヒト癌細胞を使用した。まず、前記各細胞を、Opti−MEM I reduced serum medium(Invitrogen Life Technologies Inc.)中で、24穴プレートに、細胞密度80%で増殖させた。前記有機カチオン系化合物の溶液を、前記培地に添加し、前記添加から24時間後に、細胞生存率を測定した。コントロールは、前記有機カチオン系化合物の溶液に代えて、生理食塩水を添加し、同様にして細胞生存率を測定した。
【0068】
表1に、コリン取り込みの測定結果を示し、表2に、細胞生存率の測定結果を示す。コリン取り込みおよび細胞生存率は、コントロールでの測定結果を100%として、前記各種ヒト癌細胞における測定結果を、相対値(%)で示す。
【0069】
【表1】

【0070】
【表2】

【0071】
前記表1に示すように、本実施例で使用した有機カチオン系化合物は、検討した全てのヒト癌細胞へのコリン取り込みを阻害することが確認された。特に、抗うつ薬として使用される、デシプラミン、イミプラミン、クロミプラミン、フルボキサミン、パロキセチンおよびフルオキセチンは、強力なコリン取り込み阻害活性を示した。また、前記表2に示すように、本実施例で使用した有機カチオン系化合物は、各種ヒト癌細胞の細胞生存率を低下させ、細胞死を誘導することが確認された。そして、本実施例で使用した有機カチオン系化合物の、コリン取り込み阻害作用と細胞死誘導作用との間には、図7に示すように、有意な相関関係(R=0.7672、P<0.0001)が確認された。
【産業上の利用可能性】
【0072】
以上のように、本発明によれば、新たな治療メカニズムによる癌治療剤を提供できる。本発明の癌治療剤は、癌細胞で高発現するCTLの機能阻害により癌治療効果を奏するため、例えば、特定の癌種に限定されず、幅広い癌腫の治療に使用できる。このため、本発明の癌治療剤は、癌治療に極めて有用である。
【技術分野】
【0001】
本発明は、癌治療剤に関する。
【背景技術】
【0002】
従来から、癌を治療する癌治療剤として、アルキル化剤、代謝拮抗剤、抗癌性抗生物質、植物アルカロイド等が、臨床において使用されている。さらに、近年では、腫瘍細胞の増殖、浸潤、転移に関わる分子を標的とする治療メカニズムの分子標的薬等も開発されている。このような分子標的薬として、例えば、血管新生に関わると考えられるヒトアンジオポエチン様因子2(ANGPTL2)の機能を阻害する物質を含む癌治療剤が提案されている(特許文献1)。
【0003】
癌治療においては、癌の発生部位やその進行度合い等により癌治療剤の効果が左右される場合があり、また、既存の癌治療剤に対する耐性が生じることで、その効果が低下する場合もある。このため、常に、新たな治療メカニズムによる癌治療剤が求められている。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開2011−93896号公報
【発明の概要】
【発明が解決しようとする課題】
【0005】
そこで、本発明は、新たな治療メカニズムによる癌治療剤を提供することを目的とする。
【課題を解決するための手段】
【0006】
前記目的を達成するために、本発明の癌治療剤は、
癌を治療するための癌治療剤であって、
コリントランスポーターによるコリン取り込みを阻害する物質、および前記コリントランスポーターの発現を阻害する物質の少なくとも一方を含むことを特徴とする。
【発明の効果】
【0007】
本発明によれば、新たな治療メカニズムによる癌治療剤を提供できる。
【図面の簡単な説明】
【0008】
【図1】図1は、参考例1における、各種ヒト癌細胞でのコリントランスポーターのmRNAの発現量の測定結果を示すグラフである。
【図2】図2は、参考例2における、ヒト乳癌細胞およびヒト正常乳腺上皮細胞でのコリントランスポーターのmRNAの発現量の測定結果を示すグラフである。
【図3】図3は、参考例3における、ヒト乳癌組織切片でのCTL2タンパク質の発現の確認結果を示す写真である。
【図4】図4は、参考例4における、ヒト乳癌細胞およびヒト正常乳腺上皮細胞でのコリン取り込み作用の確認結果を示すグラフである。
【図5】図5は、実施例1における、細胞生存率およびカスパーゼ3/7活性の測定結果を示すグラフである。
【図6】図6は、実施例2における、CTL1 mRNAの発現量、コリン取り込み、細胞生存率およびカスパーゼ3/7の活性の測定結果を示すグラフである。
【図7】図7は、実施例3で使用した有機カチオン系化合物の、コリン取り込み阻害作用と細胞死誘導作用との相関関係を示すグラフである。
【発明を実施するための形態】
【0009】
1.癌治療剤
本発明の癌治療剤は、前述のように、癌を治療するための癌治療剤であって、コリントランスポーターによるコリン取り込みを阻害する物質(以下、「コリン取り込み阻害物質」ともいう。)、および前記コリントランスポーターの発現を阻害する物質(以下、「コリントランスポーター発現阻害物質」ともいう。)の少なくとも一方を含むことを特徴とする。すなわち、本発明の癌治療剤は、前記コリン取り込み阻害物質を含むか、前記コリントランスポーター発現阻害物質を含むか、前記コリン取り込み阻害物質および前記コリントランスポーター発現阻害物質の両方を含む。
【0010】
本発明において、前記コリントランスポーターは、choline transporter−like protein(CTL)であり、そのファミリーとして、CTL1、CTL2、CTL3、CTL4、CTL5等があげられる。
【0011】
前記各CTL遺伝子のmRNA配列、および各CTLタンパク質のアミノ酸配列は、例えば、下記のようにデータベースに登録されている。このため、当業者であれば、CTLタンパク質およびそれをコードする遺伝子等を容易に取得できる。
(1)CTL1
mRNA配列:GeneBank、アクセッションNo.NM_080546.3
アミノ酸配列:GenPept、アクセッションNo.NP_536856.2
(2)CTL2
mRNA配列:GeneBank、アクセッションNo.NM_020428.3
アミノ酸配列:GenPept、アクセッションNo.NP_065161.3
(3)CTL3
mRNA配列:GeneBank、アクセッションNo.NM_152369.3
アミノ酸配列:GenPept、アクセッションNo.NP_689582.2
(4)CTL4
mRNA配列:GeneBank、アクセッションNo.NM_025257.2
アミノ酸配列:GenPept、アクセッションNo.NP_079533.2
(5)CTL5
mRNA配列:GeneBank、アクセッションNo.NM_152697.4
アミノ酸配列:GenPept、アクセッションNo.NP_689910.2
【0012】
1−1.治療メカニズム
本発明の癌治療剤は、前述のように、新たな治療メカニズムにより癌を治療する癌治療剤である。すなわち、本発明の癌治療剤が癌を治療するメカニズムは、前記コリン取り込み阻害物質による、前記コリントランスポーターによるコリン取り込みの阻害もしくは前記コリントランスポーター発現阻害物質による、前記コリントランスポーターの発現の阻害、またはこれらの両方である。コリンは、全ての動物細胞にとって重要な必須栄養素であり、細胞膜の構成成分であるリン脂質の合成に利用されている。コリンは腫瘍細胞への集積性が高いことが知られており、この知見を利用して、11C−コリンまたは18F−コリンによるPET/CTを使用した癌の画像診断が報告されている(例えば、DeGrado et al. The Journal of Nuclear Medicine Vol.42 No.12 December 2001 p1805−1814、およびHara The Journal of Nuclear Medicine Vol.42 No.12 December 2001 p1815−1817)。これらの知見から、腫瘍細胞は、積極的にコリンを取り込み、増殖に利用していると、本発明者等は推察した。しかしながら、細胞外からコリンを取り込むために、腫瘍細胞に発現するコリントランスポーターの分子的実体は明らかではなかった。そこで、本発明者等は、鋭意研究の結果、大腸癌、乳癌、前立腺癌、肺癌、神経芽腫、グリオーマ、白血病等の癌細胞へのコリンの取り込みが、CTLを介して行われることを見出した。この知見に基づき、本発明者等は、さらに研究を重ねた結果、前記コリン取り込み阻害物質および前記コリントランスポーター発現阻害物質が、前記CTLを標的分子とする治療メカニズムにより、癌を治療できることを見出し、本発明に至った。本発明者等は、前記両物質による癌治療のメカニズムを解明すべく、さらに研究を行った。その結果、前記両物質による癌治療の効果は、前記CTLによるコリン取り込み作用を阻害することにより、腫瘍細胞においてアポトーシスを誘導し、細胞死を引き起こさせることによることを見出した。このような癌の治療メカニズムは、これまで全く知られていなかった新たな治療メカニズムである。
【0013】
1−2.コリン取り込み阻害物質
前記コリン取り込み阻害物質は、前記CTLによるコリン取り込みを阻害する物質であり、その阻害機能は、例えば、コリンとの競合的拮抗作用、前記CTLの機能部位の阻害作用等があげられる。前記コリン取り込み阻害物質は、例えば、一種類の阻害機能のコリン取り込み阻害物質を単独で使用してもよいし、二種類以上の阻害機能のコリン取り込み阻害物質を併用してもよい。
【0014】
前記コリンとの競合的拮抗作用によりコリン取り込みを阻害する物質は、例えば、有機カチオン系化合物があげられる。前記有機カチオン系化合物は、例えば、有機第四級アンモニウム塩の化合物があげられ、具体的には、抗うつ剤等の医薬品として使用されるものがあげられる。より具体的には、例えば、ヘミコリニウム−3、キニーネ、キニジン、デシプラミン、イミプラミン、クロミプラミン、ジフェンヒドラミン、クロニジン、フルボキサミン、パロキセチン、ミルナシプラン、ベンラファキシン、レボキセチン、シタロプラム、フルオキセチン、シメチジン、プロカインアミド、ジソピラミド、クロルフェニラミン、アミロライド、アトロピン、モルヒネ、メトホルミン、アマンタジン等があげられる。これらの化合物は、例えば、一種類を単独で使用してもよいし、二種類以上を併用してもよい。これらの化合物は、例えば、市販品を使用できる。
【0015】
前記コリン取り込み阻害物質は、例えば、前記CTLに特異的に結合することで、前記CTLの機能を阻害する物質があげられる。前記物質は、例えば、抗体、アプタマー等があげられる。前記抗体は、例えば、免疫グロブリン(Ig)、抗体フラグメント、キメラ抗体等があげられる。前記免疫グロブリンは、例えば、IgG、IgA、IgM、IgE、IgD等があげられる。前記抗体フラグメントは、例えば、Fab、Fab’、F(ab’)2等があげられる。前記キメラ抗体は、例えば、ヒト化抗体等があげられる。前記抗体は、例えば、マウス、ウサギ、ウシ、ブタ、ウマ、ヒツジ、ヤギ等の哺乳動物、ニワトリ等の鳥類、ヒト等の動物種由来のものでもよく、特に制限されない。前記抗体は、例えば、前記動物種由来の血清から、従来公知の方法により調製してもよいし、市販の抗体を使用してもよい。前記抗体は、例えば、ポリクローナル抗体およびモノクローナル抗体のいずれでもよい。
【0016】
1−3.コリントランスポーター発現阻害物質
前記コリントランスポーター発現阻害物質は、前記CTLの発現を阻害することにより、結果として、前記CTLによるコリン取り込みを阻害する。前記CTLの発現阻害は、例えば、前記CTLのmRNAの発現阻害により行える。前記CTLのmRNAの発現阻害は、例えば、RNA干渉による前記CTLのmRNAの発現阻害により行える。RNA干渉による前記CTLのmRNAの発現を阻害する物質は、例えば、siRNAがあげられる。
【0017】
前記si(small interfering)RNAは、両鎖の3’末端が2塩基突出した20〜25塩基対の二本鎖RNAであり、RNA干渉(RNAi)経路で相補的な配列を有するRNAの特異的な切断を誘導する。前記siRNAの配列と切断されるmRNAの対象部位の配列とは、同一性が100%であることが最も好ましい。ただし、必ずしも同一性が100%である必要はなく、前記同一性は、例えば、前記siRNAが、前記相補的な配列を有するRNAを切断する機能を有する範囲であればよい。前記siRNAは、目的とするCTLの配列に対し、従来公知の方法により設計できる。前記siRNAは、例えば、従来公知の導入剤により、癌細胞に導入される。前記導入剤は、例えば、ウイルスベクター、リポフェクタミン等があげられる。前記ウイルスベクターは、例えば、従来公知のものを使用できる。前記導入剤は、例えば、市販の導入剤を使用してもよい。
【0018】
CTL1のmRNAの発現を阻害するsiRNAは、例えば、下記(1)〜(3)のsiRNAがあげられる。下記(1)〜(3)のsiRNAは、それぞれ、前記CTL1遺伝子の異なるコード領域を対して設計されたものである。各siRNAについて、二本鎖の配列をそれぞれ示す。
(1)HSS118777
AAAUUCACUGAUCCAAAUCAGGCCC(配列番号1)
GGGCCUGAUUUGGAUCAGUGAAUUU(配列番号2)
(2)HSS118778
UUACCAGCUUCUUUCAUUGCUUUCC(配列番号3)
GGAAAGCAAUGAAAGAAGCUGGUAA(配列番号4)
(3)HSS118779
UUAAGAUCCACACAAGUACUCUUGA(配列番号5)
UCAAGAGUACUUGUGUGGAUCUUAA(配列番号6)
【0019】
前記RNA干渉による前記CTLのmRNAの発現を阻害する物質は、siRNAの他に、例えば、shRNAがあげられる。前記sh(small hairpin)RNAは、一本鎖RNAで部分的に回文状の塩基配列を含むことにより、分子内で二本鎖構造をとり、ヘアピンのような構造となる約20塩基対以上の分子である。前記shRNAも、前記siRNAと同様に、RNA干渉(RNAi)経路で相補的な配列を有するRNAの特異的な切断を誘導する。
【0020】
前記RNA干渉による前記CTLのmRNAの発現を阻害する物質は、例えば、前記siRNAまたは前記shRNAをコードする核酸配列を含む発現ベクターでもよい。前記発現ベクターは、ベクターの基本骨格に、前記siRNAまたは前記shRNAをコードする核酸を挿入することで構築できる。前記発現ベクターを構築するためのベクターの基本骨格は、特に制限されず、例えば、従来公知のものを使用できる。
【0021】
1−4.治療対象
本発明の癌治療剤が治療対象とする癌は、特に制限されず、例えば、大腸癌、乳癌、前立腺癌、肺癌、神経芽種、グリオーマ、白血病、肝臓癌、咽頭癌、胃癌、膵臓癌、胆嚢癌、食道癌、腎臓癌、子宮頸癌、子宮体癌、卵巣癌、口腔癌、舌癌、皮膚癌、骨肉腫、悪性リンパ腫、甲状腺癌、脳腫瘍等があげられる。本発明の癌治療剤は、前述のように、癌細胞で高発現するCTLの機能阻害により癌治療効果を奏するため、例えば、特定の癌種に限定されず、幅広い癌腫の治療に使用できる。前記治療は、例えば、前記癌の縮小(癌細胞の減少)、前記癌の増殖抑制、前記癌の転移抑制等を含む。また、本発明の癌治療剤の治療対象は、前記コリントランスポーター遺伝子を有する生物があげられ、具体的には、例えば、ヒト、ヒトを除く非ヒト動物があげられ、前記非ヒト動物は、例えば、ヒトを除く非ヒト哺乳類、鳥類、魚類等があげられる。
【0022】
1−5.投与方法、投与量、剤形
本発明の癌治療剤の投与方法は、特に制限されず、例えば、経口投与でもよいし、非経口投与でもよい。前記非経口投与は、例えば、静脈注射、筋肉注射、皮下投与、直腸投与、経皮投与、腹腔内投与、局所投与等があげられる。本発明の癌治療剤の投与量は、特に制限されず、例えば、選択する物質、動物種、年齢等に応じて適宜設定できる。本発明の癌治療剤をヒト成人に投与する場合、前記有機カチオン系化合物の1日あたりの投与量は、例えば、10〜500mg/kgであり、前記siRNAおよび前記抗体の1日あたりの投与量は、例えば、癌治療において分子標的剤として使用される、他のsiRNAおよび抗体と同様に、従来公知の範囲である。
【0023】
本発明の癌治療剤の剤型は、特に制限されず、例えば、用途に応じて適宜決定できる。本発明の癌治療剤を非経口投与する場合、前記剤型は、例えば、注射用製剤、点滴製剤等の非経口製剤があげられる。本発明の癌治療剤を経口投与する場合、前記剤型は、例えば、固体状または液体状の経口製剤があげられ、具体的には、例えば、錠剤、被覆錠剤、カプセル剤、丸剤、散剤、細粒剤、顆粒剤、カプセル剤、トローチ剤、液剤等があげられる。
【0024】
1−6.添加剤等
本発明の癌治療剤は、例えば、前記コリン取り込み阻害物質および前記コリントランスポーター発現阻害物質の他に、その剤型に応じて、添加剤を含んでもよい。前記添加剤は、薬学上許容される添加剤であることが好ましく、前記コリン取り込み阻害物質および前記コリントランスポーター発現阻害物質の癌治療作用に、実質的に影響を与えないものが使用できる。前記添加剤は、例えば、賦形剤、結合剤、滑沢剤、崩壊剤、吸収促進剤、乳化剤、安定化剤、防腐剤等があげられ、例えば、従来公知のものが使用できる。本発明の癌治療剤は、従来公知の製剤化技術等により製剤化可能である。
【0025】
本発明の癌治療剤は、例えば、他の癌治療剤を含んでもよい。他の癌治療剤を併用することにより、本発明の癌治療剤の癌治療効果をさらに向上できる。前記他の癌治療剤は、特に制限されず、例えば、従来から臨床で使用されている、アルキル化剤、代謝拮抗剤、抗癌性抗生物質、植物アルカロイド等、または前記CTLとは異なる遺伝子を標的とする分子標的剤等があげられる。前記他の癌治療剤は、本発明の癌治療剤に、例えば、一種類のみ含まれてもよいし、二種類以上が含まれてもよい。また、本発明の癌治療剤は、例えば、前記コリン取り込み阻害物質および前記コリントランスポーター発現阻害物質と、前記他の癌治療剤とが、それぞれ、別々に準備されたキットの形態でもよい。
【0026】
2.治療方法
本発明の癌治療方法は、癌患者に、前記本発明の癌治療剤を投与する工程を含むことを特徴とする。本発明の癌治療方法は、前記本発明の癌治療剤を投与することが特徴であって、その他の工程は、特に制限されない。本発明の癌治療方法は、前記本発明の癌治療剤の記載を引用できる。
【実施例】
【0027】
つぎに、本発明の実施例について、説明する。本発明は、以下の実施例に限定されるものではない。
【0028】
(ヒト癌細胞)
ヒト癌細胞は、下記(1)〜(9)の9種類を使用した。
(1)小細胞肺癌細胞(NCI−H69、入手元:American Type CultureCollection(ATCC))
(2)前立腺癌細胞(LNCaP、入手元:RIKEN BioResource Center)
(3)前立腺癌細胞(PC−3、入手元:RIKEN BioResource Center)
(4)乳癌細胞(MCF−7、入手元:ATCC)
(5)骨髄性白血病細胞(HL−60、入手元:ATCC)
(6)神経芽細胞種(SH−SY5Y、入手元:DS Pharma Biomedical Co., Ltd.)
(7)神経芽細胞種(LA−N−2、入手元:RIKEN BioResource Center)
(8)白血病T細胞(Jurkat、入手元:ATCC)
(9)大腸癌細胞(HT−29、入手元:ATCC)
【0029】
(ヒト正常乳腺上皮細胞)
ヒト正常乳腺上皮細胞は、MCF−10A細胞(入手元:ATCC)を使用した。
【0030】
(ヒト乳癌組織切片)
ヒト乳癌組織切片は、ジェノスタッフ株式会社から入手した。
【0031】
(有機カチオン系化合物)
有機カチオン系化合物は、下記(1)〜(15)の15種類を使用した。
(1)ヘミコリニウム−3(HC−3、入手元:SIGMA−Ardlich社)
(2)キニーネ(入手元:SIGMA−Ardlich社)
(3)キニジン(入手元:SIGMA−Ardlich社)
(4)デシプラミン(入手元:SIGMA−Ardlich社)
(5)イミプラミン(入手元:SIGMA−Ardlich社)
(6)クロミプラミン(入手元:SIGMA−Ardlich社)
(7)ジフェンヒドラミン(入手元:SIGMA−Ardlich社)
(8)クロニジン(入手元:SIGMA−Ardlich社)
(9)フルボキサミン(入手元:株式会社明治製菓)
(10)パロキセチン(入手元:SIGMA−Ardlich社)
(11)ミルナシプラン(入手元:旭化成株式会社)
(12)ベンラファキシン(入手元:Wyeth−Ayrest Research社)
(13)レボキセチン(入手元:Toronto Research Chemicals社)
(14)シタロプラム(入手元:Toronto Research Chemicals社)
(15)フルオキセチン(入手元:Toronto Research Chemicals社)
【0032】
(siRNA)
Stealth Select RNAi(登録商標)のsiRNAおよびStealth RNAi(登録商標)のsiRNAネガティブコントロールを、Invitrogen Life Technologies Inc.社(Carlsbad、CA)で、商業的に合成した。3種類のStealth RNAi二本鎖(Oligo ID:HSS118777、HSS118778およびHSS118779)を、ヒトCTL1mRNA配列(GeneBank accession no. NM_080546.3)の異なるコード領域に対して設計した。前記3種類のStealth RNAi二本鎖の各鎖の配列を、下記(1)〜(3)に示す。
(1)HSS118777
AAAUUCACUGAUCCAAAUCAGGCCC(配列番号1)
GGGCCUGAUUUGGAUCAGUGAAUUU(配列番号2)
(2)HSS118778
UUACCAGCUUCUUUCAUUGCUUUCC(配列番号3)
GGAAAGCAAUGAAAGAAGCUGGUAA(配列番号4)
(3)HSS118779
UUAAGAUCCACACAAGUACUCUUGA(配列番号5)
UCAAGAGUACUUGUGUGGAUCUUAA(配列番号6)
【0033】
(mRNA発現量の定量)
(1)トータルRNAの抽出
前記ヒト癌細胞を、滅菌したダルベッコリン酸緩衝生理食塩水(D−PBS、WAKO)で洗浄し、QIAshredderおよびRNeasy Mini Kit(QIAGEN、Valencia、CA)を使用して、前記ヒト癌細胞からトータルRNAを、抽出した。
【0034】
(2)プライマーおよびプローブ
対象とするmRNA(CHT1およびCTL1〜5)、およびハウスキーピング遺伝子(グリセルアルデヒド3リン酸脱水素酵素(GAPDH))に対する、一対のプライマーおよびTaqManプローブは、ヒトmRNA配列に基づいて設計された、市販品を使用した。前記設計には、TaqMan Gene Expression Assays(Applied Biosystems)を使用した。
(TaqManプローブ)
CHT1用プローブ (アッセイID:Hs00222367_m1)
CTL1用プローブ (アッセイID:Hs00939357_m1)
CTL2用プローブ (アッセイID:Hs01105938_m1)
CTL3用プローブ (アッセイID:Hs01118290_m1)
CTL4用プローブ (アッセイID:Hs01046784_m1)
CTL5用プローブ (アッセイID:Hs01120485_m1)
GAPDH用プローブ(アッセイID:Hs99999905_m1)
【0035】
(3)リアルタイムPCR
1ステップリアルタイムPCRのために、5μLのトータルRNA(10ng)を、TaqMan RNA−to−CT(登録商標) 1−Step Kitを使用して、15μLのmaster mixtureに添加した。前記master mixtureには、最終的に、TaqMan RT Enzyme Mixture、TaqMan RT−PCR MixtureおよびTaqMan(登録商標) Gene Expression Assayが含まれる。リアルタイムPCRのサイクル条件は、下記のとおりとした。
(サイクル条件)
cDNA合成:48℃・15分
RT(逆転写酵素)の不活性化およびTaqポリメラーゼの活性化:95℃・10分
増幅:95℃・15秒および60℃・1分を1サイクルとし、40サイクル
【0036】
リアルタイムPCRデータを、Applied Biosystems StepOne Plus(登録商標) Real−Time PCR systemで分析した。前記ヒト癌細胞における対象遺伝子の相対的mRNA発現レベルを、比較Ct法により算出した。各対象のPCRについて、GAPDHと比較した前記mRNA発現レベルは、下記式により算出できる。
相対的mRNA発現(%)=2−(Ct target−Ct GAPDH)×100
【0037】
(細胞生存率)
前記ヒト癌細胞の細胞数を、ATPLite(登録商標)(PerkinElmer Life and Analytical Sciences、Boston、MA)で測定した。luminescence ATP detection assay systemを、製造元の説明書の記載に従って行い、発光を、2030 ARVO X5 Multilabel Reader(PerkinElmer、Waltham、MA)で測定した。
【0038】
(カスパーゼ3および7活性の定量)
カスパーゼ3および7の活性の測定のために、Caspase−Glo(登録商標) 3/7 Assay(Promega、Mannheim、Germany)を、製造元の説明書に従って行った。このキットは、カスパーゼ3および7による発光基質のDEVD配列の切断に基づき、発光シグナルを発する。具体的には、前記ヒト癌細胞に、Caspase−Glo 3/7 reagent(Promega Corporation, Madison. WI)を添加し、発光を、2030 ARVO X5 Multilabel Reader(PerkinElmer、Waltham、MA)で測定した。
【0039】
(コリン取り込み)
まず、前記ヒト癌細胞を、下記組成の取り込みバッファーで2回洗浄した。
取り込みバッファー(pH7.4)
125mmol/L NaCl
4.8mmol/L KCl
1.2mmol/L CaCl2
1.2mmol/L KH2PO4
5.6mmol/L グルコース
1.2mmol/L MgSO4
25mmol/L HEPES
【0040】
つぎに、取り込みを、[3H]コリン[(比放射能:3182GBq/mmol)、PerkinElmer Life Sciences, Inc.(Boston, MA)から入手]を含む取り込みバッファーの添加により開始した。所定時間インキュベーション後、氷冷した取り込みバッファーで急速に所定回数洗浄した。ついで、洗浄後の前記ヒト癌細胞を、0.1mol/L NaOHおよびTriton X−100に溶解し、アリコートを、液体シンチレーション計数法用に採取した。放射能を、液体シンチレーションカウンター(Tri−Carb(登録商標) 2100 TR、Packard Instrument Company、Meriden、CT)で測定した。[3H]コリンの特異的取り込みを、前記アリコートに含まれるタンパク質1mgあたりにおける、30mmol/Lの標識化していないコリンの存在下および非存在下における、全[3H]コリン取り込みの差として算出した。前記アリコートに含まれるタンパク質の濃度は、DC Protein Assay Kit(Bio−Rad Laboratories、Hercules、CA、USA)を使用して決定した。
【0041】
[参考例1]
本参考例では、各種ヒト癌細胞におけるコリントランスポーターのmRNA発現を確認した。
【0042】
前記9種類全てのヒト癌細胞を使用した。前記ヒト癌細胞から、トータルRNAを抽出し、リアルタイムPCRにより、コリントランスポーターのmRNAの発現量を測定した。
【0043】
図1に、コリントランスポーターのmRNAの発現量の測定結果を示す。図1の各グラフにおいて、横軸は、各種コリントランスポーターを示し、縦軸は、相対的mRNA発現(%)を示し、GAPDHのmRNAの発現量を100%とする相対値で示す。
【0044】
図1に示すように、choline transpoter−like proteins(CTL1〜5)が、検討した全てのヒト癌細胞において、高発現していることが確認された。また、前記CTL1〜5の発現パターンは、各種ヒト癌細胞において、様々であることが確認された。一方、高親和性コリントランスポーターであるCHT1は、アセチルコリン神経系の神経芽細胞腫(LA−N−2)以外のヒト癌細胞では、発現が確認できなかった。これらの結果から、前記各種ヒト癌細胞におけるコリン取り込みは、CTL1〜5を介して行われることが明らかである。
【0045】
[参考例2]
本参考例では、ヒト乳癌細胞およびヒト正常乳腺上皮細胞におけるコリントランスポーターのmRNA発現を確認した。
【0046】
前記ヒト乳癌細胞は、MCF−7細胞を使用し、前記ヒト正常乳腺上皮細胞は、MCF−10Aを使用した。まず、前記両細胞を、RPMI1640培地(Gibco BRL、Carlsbad、CA)で増殖させた。前記RPMI1640培地は、コーティングしていないフラスコ(BD Biosciences、Bedford、MA)で、10% ウシ胎児血清(Gibco BRL)および20mg/L カナマイシン(Gibco BRL)を添加したものを使用した。増殖させた前記両細胞から、トータルRNAを抽出し、リアルタイムPCRにより、コリントランスポーターのmRNAの発現量を測定した。
【0047】
図2に、コリントランスポーターのmRNAの発現量の測定結果を示す。図2において、横軸は、各種コリントランスポーターを示し、縦軸は、相対的mRNA発現(%)を示し、GAPDHのmRNAの発現量を100%とする相対値で示す。黒のバーは、MCF−7細胞の結果、白のバーは、MCF−10A細胞の結果を示す。
【0048】
図2に示すように、MCF−7細胞とMCF−10A細胞とでは、コリントランスポーターのmRNAの発現量および発現パターンが異なっていた。具体的には、ヒト乳癌細胞であるMCF−7細胞では、ヒト正常乳腺上皮細胞であるMCF−10A細胞と比較して、CTL1のmRNAの発現量が約5倍、CTL2のmRNAの発現量が約20倍亢進していた。また、CTL4のmRNAは、ヒト乳癌細胞であるMCF−7細胞でのみ特異的に発現していた。
【0049】
[参考例3]
本参考例では、ヒト乳癌組織切片について、免疫組織化学的検査を行うことで、前記ヒト乳癌組織におけるCTL2タンパク質の発現を確認した。
【0050】
前記ヒト乳癌組織切片を、脱パラフィンし、PBSを使用して再度水和し、サンプルを調製した。このサンプルを、0.1%トリプシン中に置き、37℃で25分間振とうした。ついで、下記工程1〜7をこの順序で行い、CTL2タンパク質の発現を確認した。
(工程)
1.前記サンプルを、3%H2O2を含む1×PBS中で、室温で10分間インキュベートする。インキュベート後の前記サンプルを再度洗浄する。
2.洗浄後の前記サンプルを、ブロッキング液(DAKO Protein Block)中で、10分間インキュベートする。
3.ブロッキング後の前記サンプルに、一次抗体(10μg/mL、抗CTL2抗体および正常マウスIgG1抗体、ブロッキング液で希釈)を添加し、前記サンプルを、4℃で一昼夜インキュベートする。インキュベート後の前記サンプルを、1×PBSで洗浄する。
4.洗浄後の前記サンプルを、二次抗体(1:500、マウスIgビオチン(DAKO:E0433))と、30分間インキュベートする。インキュベート後の前記サンプルを、PBSで洗浄する。
5.CTL2タンパク質を、ABC法によりDAB/H2O2染色を行うことで検出する。具体的には、VECTASTAIN ABC kitを使用し、基質溶液(DAB/H2O2染色)を適用する。前記基質溶液の適用後の前記サンプルを、水道水で徹底的に洗浄する。
6.洗浄後の前記サンプルを、マイヤーヘマトキシリン中で対比染色する。
7.染色後の前記サンプルを脱水し、脱水後の前記サンプルを、松浪硝子工業株式会社製の商品名「APSコートスライドグラス」にマウントし、蛍光顕微鏡(株式会社キーエンス製の商品名「BZ−8000」)で観察する。
【0051】
図3に、CTL2タンパク質の発現の確認結果を示す。図3において、左側の写真が、1次抗体として正常マウスIgG1抗体を使用した結果(コントロール)、右側の写真が、1次抗体として抗CTL2抗体を使用した結果を示す。倍率は、200倍とした。
【0052】
図3に示すように、1次抗体として抗CTL2抗体を使用した場合にのみ、前記ヒト乳癌組織において、陽性の染色像が確認された。この結果から、ヒト乳癌組織におけるCTL2タンパク質の発現が確認された。
【0053】
[参考例4]
本参考例では、ヒト乳癌細胞とヒト正常乳腺上皮細胞におけるコリン取り込み作用を確認した。
【0054】
前記ヒト乳癌細胞は、MCF−7細胞を使用し、前記ヒト正常乳腺上皮細胞は、MCF−10Aを使用した。コリン取り込みを、60分間での濃度10μmol/Lの[3H]コリン取り込みのタイムコースで試験した。具体的には、まず、前記両細胞を、RPMI1640培地(Gibco BRL、Carlsbad、CA)中で、24穴プレートに、細胞密度80%で増殖させた。前記RPMI1640培地は、24穴プレート(BD Biosciences、Bedford、MA)で、10% ウシ胎児血清(Gibco BRL)および20mg/L カナマイシン(Gibco BRL)を添加したものを使用した。前記増殖後、前記24穴プレートから、前記培地を除去し、前記両細胞について、コリン取り込みを測定した。前記コリン取り込みでは、前記氷冷した取り込みバッファーで、前記細胞を2回洗浄し、前記タイムコースは、[3H]コリンの添加から、5、10、20、30、45および60分とした。
【0055】
図4に、コリン取り込み作用の確認結果を示す。図4において、横軸は、コリン添加からの経過時間(分)を示し、縦軸は、タンパク質1mgあたりの[3H]コリンの取り込み量(pmol/mg protein)を示す。黒丸は、MCF−7細胞の結果、白丸は、MCF−10A細胞の結果を示す。
【0056】
図4に示すように、ヒト乳癌細胞であるMCF−7細胞では、ヒト正常乳腺上皮細胞であるMCF−10A細胞と比較して、[3H]コリンの取り込み量が約2倍に増大していた。この結果から、ヒト乳癌細胞は、ヒト正常乳腺上皮細胞と比較して、コリンを大量に取り込んでいることが明らかである。
【0057】
[実施例1]
本実施例では、各種ヒト癌細胞に対するコリン取り込み阻害物質HC−3の、細胞生存率およびカスパーゼ3/7活性に及ぼす影響を確認した。
【0058】
前記9種類全てのヒト癌細胞を使用した。まず、前記各細胞を、細胞密度60〜70%で、24穴プレートに播種した。これに、HC−3を濃度1mmol/Lで、2日間毎日添加し、各ウェルの液量を、1.0mLとした。HC−3の最初の添加から3日後に、前記各細胞について、細胞生存率およびカスパーゼ3/7の活性を測定した。コントロールは、HC−3に代えて、生理食塩水を添加し、同様にして細胞生存率およびカスパーゼ3/7の活性を測定した。
【0059】
図5に、細胞生存率およびカスパーゼ3/7活性の測定結果を示す。図5の各グラフにおいて、白のバーは、HC−3添加(1mmol/L)の結果、黒のバーは、コントロール(Vehicle)の結果を示す。また、各グラフにおける左側の白のバーおよび黒のバーのセットは、細胞生存率の測定結果を示し、各グラフにおける右側の白のバーおよび黒のバーのセットは、カスパーゼ3/7活性の測定結果を示す。細胞生存率およびカスパーゼ3/7活性は、コントロールでの測定結果を100%とし、前記各種ヒト癌細胞における測定結果を、相対値(%)で示す。
【0060】
図5に示すように、検討した全てのヒト癌細胞において、コリン取り込み阻害物質であるHC−3の添加により、有意な細胞生存率の低下、および有意なカスパーゼ3/7活性の増大が確認された。これらの結果から、HC−3によるコリン取り込み阻害により、前記ヒト癌細胞において、アポトーシスが誘導され、細胞死が引き起こされていることが確認された。したがって、癌細胞におけるコリン取り込み作用を担っているコリントランスポーターが、癌治療の標的分子であることが明らかとなった。そして、前記参考例1に示すように、ヒト癌細胞において発現しているコリントランスポーターがCTL1〜5であることが明らかとなっている。以上を踏まえると、癌細胞において発現するCTL1〜5の機能を阻害する作用は、アポトーシスによる細胞死をもたらすことになり、前記コリントランスポーターによるコリン取り込みを阻害する物質は、新たな治療メカニズムによる癌治療剤として、癌治療に有用といえる。
【0061】
[実施例2]
本実施例では、小細胞肺癌細胞に対するRNA干渉法でのCTL1 mRNA発現抑制による、細胞生存率およびカスパーゼ3/7活性への影響を確認した。
【0062】
小細胞肺癌細胞は、NCI−H69細胞を使用した。前記細胞を、培養密度50〜60%で、ポリ−D−リジンでコーティングした24穴組織培養プレートに播種した。前記培養後、培地を除去し、前記細胞を、Opti−MEM I reduced serum medium(Invitrogen Life Technologies Inc.)で、1回洗浄した。洗浄後の前記細胞を、Opti−MEM I reduced serum medium中で、Optifect(ウェルあたり3μL、Invitrogen Life Technologies Inc.)を使用し、前記3種類のCTL1 siRNAの混合物(各50nmol/L)によりトランスファーした。前記CTL1 siRNA混合物を、2日毎に3回添加した。そして、初回のトランスフェクションから7日後に、前記細胞について、CTL1 mRNAの発現量、コリン取り込み、細胞生存率およびカスパーゼ3/7の活性を測定した。コリン取り込みでは、10分間のインキュベーション後、前記氷冷した取り込みバッファーで、前記細胞を3回洗浄した。コントロールは、前記CTL1 siRNA混合物に代えて、siRNAネガティブコントロールを添加し、同様にしてCTL1 mRNAの発現量、コリン取り込み、細胞生存率およびカスパーゼ3/7の活性を測定した。
【0063】
図6に、CTL1 mRNAの発現量、コリン取り込み、細胞生存率およびカスパーゼ3/7の活性の測定結果を示す。図6において、(a)はCTL1 mRNAの発現量の測定結果、(b)はコリン取り込みの測定結果、(c)は細胞生存率の測定結果、(d)はカスパーゼ3/7の活性の測定結果を示す。CTL1 mRNAの発現量は、GAPDHのmRNAの発現量を100%とする相対値(%、相対的mRNA発現(%))で示す。コリン取り込み、細胞生存率およびカスパーゼ3/7の活性は、それぞれ、コントロールでの測定結果を100%として、NCI−H69細胞における測定結果を、相対値(%)で示す。
【0064】
図6に示すように、前記CTL1 siRNAのトランスフェクションにより、CTL1 mRNAの発現は、約50%抑制された(図6(a))。また、コリン取り込み作用および細胞生存率は、有意に抑制された(図6(b)および図6(c))。そして、カスパーゼ3/7活性は、増大された(図6(d))。これらの結果から、CTL1 mRNAの発現を、siRNAにより特異的に抑制することで、コリン取り込みの抑制と、アポトーシス誘導とによる細胞死が引き起こされることが確認された。したがって、小細胞肺癌細胞におけるCTL1分子を介するコリン取り込み作用は、癌細胞の生存に重要な役割を担っており、CTL1分子は、癌治療の標的分子であることが明らかである。そして、RNA干渉により前記コリントランスポーターのmRNAの発現を阻害する物質は、新たな治療メカニズムによる癌治療剤として、癌治療に有用といえる。
【0065】
[実施例3]
本実施例では、各種ヒト癌細胞に対する有機カチオン系化合物の、コリン取り込み阻害作用および細胞死誘導作用を評価した。
【0066】
(1)コリン取り込み阻害作用の評価
前記9種類全てのヒト癌細胞を使用した。まず、前記各細胞を、10% ウシ胎児血清含有RPMI1640培地中で、24穴プレートに、細胞密度80%で増殖させた。一方、HC−3を除く14種類の有機カチオン系化合物を、最終濃度100μmol/Lとなるように、生理食塩水に溶解した。前記有機カチオン系化合物の溶液を、前記[3H]コリンを含む取り込みバッファーに添加した。この[3H]コリンを含む取り込みバッファーを使用して、コリン取り込みを測定した。コリン取り込みでは、10分間のインキュベーション後、前記氷冷した取り込みバッファーで、前記細胞を2回洗浄した。コントロールは、前記有機カチオン系化合物の溶液に代えて、生理食塩水を添加し、コリン取り込みを測定した。
【0067】
(2)細胞死誘導作用の評価
前記9種類全てのヒト癌細胞を使用した。まず、前記各細胞を、Opti−MEM I reduced serum medium(Invitrogen Life Technologies Inc.)中で、24穴プレートに、細胞密度80%で増殖させた。前記有機カチオン系化合物の溶液を、前記培地に添加し、前記添加から24時間後に、細胞生存率を測定した。コントロールは、前記有機カチオン系化合物の溶液に代えて、生理食塩水を添加し、同様にして細胞生存率を測定した。
【0068】
表1に、コリン取り込みの測定結果を示し、表2に、細胞生存率の測定結果を示す。コリン取り込みおよび細胞生存率は、コントロールでの測定結果を100%として、前記各種ヒト癌細胞における測定結果を、相対値(%)で示す。
【0069】
【表1】

【0070】
【表2】

【0071】
前記表1に示すように、本実施例で使用した有機カチオン系化合物は、検討した全てのヒト癌細胞へのコリン取り込みを阻害することが確認された。特に、抗うつ薬として使用される、デシプラミン、イミプラミン、クロミプラミン、フルボキサミン、パロキセチンおよびフルオキセチンは、強力なコリン取り込み阻害活性を示した。また、前記表2に示すように、本実施例で使用した有機カチオン系化合物は、各種ヒト癌細胞の細胞生存率を低下させ、細胞死を誘導することが確認された。そして、本実施例で使用した有機カチオン系化合物の、コリン取り込み阻害作用と細胞死誘導作用との間には、図7に示すように、有意な相関関係(R=0.7672、P<0.0001)が確認された。
【産業上の利用可能性】
【0072】
以上のように、本発明によれば、新たな治療メカニズムによる癌治療剤を提供できる。本発明の癌治療剤は、癌細胞で高発現するCTLの機能阻害により癌治療効果を奏するため、例えば、特定の癌種に限定されず、幅広い癌腫の治療に使用できる。このため、本発明の癌治療剤は、癌治療に極めて有用である。
【特許請求の範囲】
【請求項1】
癌を治療するための癌治療剤であって、
コリントランスポーターによるコリン取り込みを阻害する物質、および前記コリントランスポーターの発現を阻害する物質の少なくとも一方を含むことを特徴とする、癌治療剤。
【請求項2】
前記コリン取り込みを阻害する物質が、コリンとの競合的拮抗作用によりコリン取り込みを阻害する物質を含む、請求項1記載の癌治療剤。
【請求項3】
前記コリンとの競合的拮抗作用によりコリン取り込みを阻害する物質が、有機カチオン系化合物を含む、請求項2記載の癌治療剤。
【請求項4】
前記有機カチオン系化合物が、ヘミコリニウム−3、キニーネ、キニジン、デシプラミン、イミプラミン、クロミプラミン、ジフェンヒドラミン、クロニジン、フルボキサミン、パロキセチン、ミルナシプラン、ベンラファキシン、レボキセチン、シタロプラム、フルオキセチン、シメチジン、プロカインアミド、ジソピラミド、クロルフェニラミン、アミロライド、アトロピン、モルヒネ、メトホルミンおよびアマンタジンからなる群から選択される少なくとも一つを含む、請求項3記載の癌治療剤。
【請求項5】
前記コリントランスポーターの発現を阻害する物質が、RNA干渉により前記コリントランスポーターのmRNAの発現を阻害するsiRNAを含む、請求項1から4のいずれか一項に記載の癌治療剤。
【請求項6】
前記コリントランスポーターが、CTL1、CTL2、CTL3、CTL4およびCTL5からなる群から選択される少なくとも一つを含む、請求項1から5のいずれか一項に記載の癌治療剤。
【請求項7】
前記癌が、大腸癌、乳癌、前立腺癌、肺癌、神経芽種、グリオーマ、白血病、肝臓癌、咽頭癌、胃癌、膵臓癌、胆嚢癌、食道癌、腎臓癌、子宮頸癌、子宮体癌、卵巣癌、口腔癌、舌癌、皮膚癌、骨肉腫、悪性リンパ腫、甲状腺癌および脳腫瘍からなる群から選択される少なくとも一つを含む、請求項1から6のいずれか一項に記載の癌治療剤。
【請求項1】
癌を治療するための癌治療剤であって、
コリントランスポーターによるコリン取り込みを阻害する物質、および前記コリントランスポーターの発現を阻害する物質の少なくとも一方を含むことを特徴とする、癌治療剤。
【請求項2】
前記コリン取り込みを阻害する物質が、コリンとの競合的拮抗作用によりコリン取り込みを阻害する物質を含む、請求項1記載の癌治療剤。
【請求項3】
前記コリンとの競合的拮抗作用によりコリン取り込みを阻害する物質が、有機カチオン系化合物を含む、請求項2記載の癌治療剤。
【請求項4】
前記有機カチオン系化合物が、ヘミコリニウム−3、キニーネ、キニジン、デシプラミン、イミプラミン、クロミプラミン、ジフェンヒドラミン、クロニジン、フルボキサミン、パロキセチン、ミルナシプラン、ベンラファキシン、レボキセチン、シタロプラム、フルオキセチン、シメチジン、プロカインアミド、ジソピラミド、クロルフェニラミン、アミロライド、アトロピン、モルヒネ、メトホルミンおよびアマンタジンからなる群から選択される少なくとも一つを含む、請求項3記載の癌治療剤。
【請求項5】
前記コリントランスポーターの発現を阻害する物質が、RNA干渉により前記コリントランスポーターのmRNAの発現を阻害するsiRNAを含む、請求項1から4のいずれか一項に記載の癌治療剤。
【請求項6】
前記コリントランスポーターが、CTL1、CTL2、CTL3、CTL4およびCTL5からなる群から選択される少なくとも一つを含む、請求項1から5のいずれか一項に記載の癌治療剤。
【請求項7】
前記癌が、大腸癌、乳癌、前立腺癌、肺癌、神経芽種、グリオーマ、白血病、肝臓癌、咽頭癌、胃癌、膵臓癌、胆嚢癌、食道癌、腎臓癌、子宮頸癌、子宮体癌、卵巣癌、口腔癌、舌癌、皮膚癌、骨肉腫、悪性リンパ腫、甲状腺癌および脳腫瘍からなる群から選択される少なくとも一つを含む、請求項1から6のいずれか一項に記載の癌治療剤。
【図1】


【図2】


【図4】


【図5】


【図6】


【図7】


【図3】




【図2】


【図4】


【図5】


【図6】


【図7】


【図3】


【公開番号】特開2013−49646(P2013−49646A)
【公開日】平成25年3月14日(2013.3.14)
【国際特許分類】
【出願番号】特願2011−188053(P2011−188053)
【出願日】平成23年8月30日(2011.8.30)
【出願人】(505457994)学校法人東京医科大学 (6)
【Fターム(参考)】
【公開日】平成25年3月14日(2013.3.14)
【国際特許分類】
【出願日】平成23年8月30日(2011.8.30)
【出願人】(505457994)学校法人東京医科大学 (6)
【Fターム(参考)】
[ Back to top ]

