癌罹病の検定に使用するデータの収集方法
【課題】リンパ球に結合したヘマトポルフィリン誘導体量を測定する技術を含む信頼性のより高い癌罹病検定用データの収集方法を提供する。
【解決手段】癌罹病の検定に使用するデータを収集する方法であって、被検者から採取したリンパ球に結合したポルフィリン系化合物を定量することにより第一のデータを得る工程と、被検者から採取した前記リンパ球に含まれるCD4抗原をもつT細胞(CD4+T細胞)とCD8抗原をもつT細胞(CD8+T細胞)を定量し、CD4+T細胞に対するCD8+T細胞の比(CD4+T細胞/CD8+T細胞)を算出することにより第二のデータを得る工程とを含み、第一のデータであるポルフィリン系化合物量と、第二のデータであるCD4+T細胞/CD8+T細胞の値の少なくとも一方が、各々に設定された所定値以上である場合に、被検者が癌を罹患している可能性が高いと判断する検定を特徴とするデータの収集方法。
【解決手段】癌罹病の検定に使用するデータを収集する方法であって、被検者から採取したリンパ球に結合したポルフィリン系化合物を定量することにより第一のデータを得る工程と、被検者から採取した前記リンパ球に含まれるCD4抗原をもつT細胞(CD4+T細胞)とCD8抗原をもつT細胞(CD8+T細胞)を定量し、CD4+T細胞に対するCD8+T細胞の比(CD4+T細胞/CD8+T細胞)を算出することにより第二のデータを得る工程とを含み、第一のデータであるポルフィリン系化合物量と、第二のデータであるCD4+T細胞/CD8+T細胞の値の少なくとも一方が、各々に設定された所定値以上である場合に、被検者が癌を罹患している可能性が高いと判断する検定を特徴とするデータの収集方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、癌罹病の簡便な体外診断に使用可能な癌罹病検定用データの収集方法に関するものであり、詳しくは、被検者から採取したリンパ球から得られる2種類のデータの組合せにより、被検者が癌を罹患している可能性を判断する検定に使用する信頼性の高いデータの収集方法に関するものである。
【背景技術】
【0002】
癌の診断・治療方法として、光感受性物質であるヘマトポルフィリン誘導体(hematoporphyrin derivative : HPD)の腫瘍に対する親和性及び蓄積性を応用した技術の研究・開発が進められてきた。具体的には、HPDを体内に投与し、長時間かけて腫瘍に蓄積させた後、光照射により励起三重項状態を経て誘起される活性酸素による酸化反応によって癌細胞を破壊する研究や(例えば、非特許文献1を参照)、HPD染色した癌細胞が蛍光を発することから、癌組織の有無を判定する体内診断に応用することが行われている(例えば、非特許文献2を参照)。しかしながら、これらはいずれも生体内測定であり、腫瘍に蓄積するまでに3日程度かかり、多くの手間がかかる上、患者の苦痛を伴うものであった。また、活性酸素による癌細胞の破壊においては、活性酸素の過剰な生成により皮膚や目に対して様々な副作用を引き起こすという問題点も指摘されていた(例えば、非特許文献3、4を参照)。
【0003】
一方、非侵襲の癌の体外診断技術として、例えば特許文献1には、HPDが生体外に取り出した癌細胞やリンパ球によっても摂取されることに着目し、電子スピン共鳴(ESR)装置を用いて癌診断への応用を図った技術が開示されている。しかし、かかる技術は、細胞分離法が確立されておらず、またHPD染色などの前処理が煩雑であったこと、また細胞の管理、保存技術が確立されていなかったこと、更にESR装置を用いた観測では、HPDの選択的な測定をしていたものではなく、光励起によりHPDが生成する各種活性酸素により生成したリンパ球表面酸化物量を見ていたにすぎない。故に診断判定のためのESRスペクトルの解釈が難しい、などの理由により実用化に至っていない。
【0004】
かかる背景技術に鑑み、簡便且つ実用的な非侵襲の癌の体外診断技術として、特許文献2には、HPDが癌患者由来のリンパ球に選択的に結合する性質を利用し、リンパ球に結合したHPD量を直接的に測定する技術を含む癌罹病検定用データの収集方法が開示されている。癌の早期発見のために、かかるデータ収集技術を利用したより信頼性の高い癌の診断システムの確立が所望されている。
【特許文献1】特開昭60−135765号公報
【特許文献2】特開2007−178237号公報
【非特許文献1】Poto, L. & Berki.T. Investigation on the free radical producing effect of hematoporphyrin: a spin trapping study. Acta Physiol. Hung. 74, 285- (1989).
【非特許文献2】Dougherty, T.J.等、Photodynamic Therapy. J. Natl. Cancer Inst., 90, 889-905 (1998).
【非特許文献3】He, D., Soter, N.A., & Lim.H.W. The late phase of hematoporphyrin derivative-induced phototoxicity in mice: Release of hisitamine and histogic changes. Photochem. Photobiol., 50, 91- (1989).
【非特許文献4】Hawkins, C.W. Bickkers, D.R.Mukhter, H. & Elemets, C.A. Cutaneour Photosensitization: murine ear swelling as a marker of acute response. J. Invest. Dermatol. 86, 638- (1986).
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、かかる背景技術に鑑み、癌罹病の簡便な体外診断に使用し得る、信頼性の高い癌罹病検定用データの収集方法を提供することを目的とする。
【課題を解決するための手段】
【0006】
本発明者等は、リンパ球に含まれるCD4抗原をもつT細胞とCD8抗原をもつT細胞に着目し、上記課題を解決すべく鋭意研究した結果、リンパ球に結合したHPDを定量することにより得られるデータと組合せて使用することにより、信頼性の高い癌罹病の体外診断を可能とする新たなデータの収集技術を見出し、本発明を完成するに至った。
【0007】
すなわち、被検者が癌を罹患している可能性を判断する検定に使用されるデータとして、被検者から採取したリンパ球に結合したポルフィリン系化合物を定量することにより得られる第一のデータと、同じリンパ球に含まれるCD4抗原をもつT細胞(CD4+T細胞)とCD8抗原をもつT細胞(CD8+T細胞)を定量し、CD4+T細胞に対するCD8+T細胞の比(CD4+T細胞/CD8+T細胞)を算出することにより得られる第二のデータとを組合せて判断することにより、より信頼性の高い判断が可能となることを見出した。
【0008】
すなわち、本発明により、
癌罹病の検定に使用するデータを収集する方法であって、
被検者から採取したリンパ球に結合したポルフィリン系化合物を定量することにより第一のデータを得る工程と、被検者から採取した前記リンパ球に含まれるCD4抗原をもつT細胞(CD4+T細胞)とCD8抗原をもつT細胞(CD8+T細胞)を定量し、CD4+T細胞に対するCD8+T細胞の比(CD4+T細胞/CD8+T細胞)を算出することにより第二のデータを得る工程とを含み、
第一のデータであるポルフィリン系化合物量と、第二のデータであるCD4+T細胞/CD8+T細胞の値の少なくとも一方が、各々に設定された所定値以上である場合に、被検者が癌を罹患している可能性が高いと判断する検定において使用されることを特徴とする、癌罹病の検定に使用するデータの収集方法が提供される。
【0009】
本発明の一態様において、第一のデータ取得工程におけるポルフィリン系化合物の前記定量は、
(a) 被検者から採取したリンパ球にポルフィリン系化合物を加える工程と、
(b) 工程(a)で得られた混合物に特定波長の光を照射してリンパ球に結合したポルフィリン系化合物を励起し、化学反応を起こすことにより発光を生じさせる工程と、
(c) 工程(b)で発生した発光量を測定する工程と、
を含む手段により行われる。
【0010】
また、本発明の他の態様において、第二のデータ取得工程におけるCD4抗原をもつT細胞(CD4+T細胞)とCD8抗原をもつT細胞(CD8+T細胞)の定量は、フローサイトメトリー又は免疫蛍光法により測定される。
また、本発明の他の態様において、前記ポルフィリン系化合物は、ヘマトポルフィリン及び/又はその誘導体である。
また、本発明の他の態様において、前記工程(b)においてポルフィリン系化合物が結合するリンパ球はB細胞リンパ球である。
【0011】
また、本発明の他の態様において、前記工程(b)において生じる発光は、一重項酸素由来のものである。
【発明の効果】
【0012】
本発明により、患者の身体的・経済的な負担を増大させることなく、癌罹病の簡便な体外診断に使用可能な、信頼性の高いデータの収集方法が提供された。これにより癌の早期発見が更に促進され、また術後の経過診断及び癌再発防止のための治療にも有効に利用することができる。
【発明を実施するための最良の形態】
【0013】
以下、本発明を詳細に説明する。
本発明に係る癌罹病検定用データの収集方法は、上述したように、被検者から採取したリンパ球に結合したポルフィリン系化合物を定量することにより第一のデータを得る工程と、被検者から採取した前記リンパ球に含まれるCD4抗原をもつT細胞(以下、「CD4+T細胞」ともいう。)とCD8抗原をもつT細胞(以下、「CD8+T細胞」ともいう。)を定量し、CD4+T細胞に対するCD8+T細胞の比(CD4+T細胞/CD8+T細胞)を算出することにより第二のデータを得る工程とを含み、第一のデータと第二のデータとの組合せにおいて、癌罹病の検定に使用されることを特徴とする。すなわち、第一のデータであるポルフィリン系化合物量と、第二のデータであるCD4+T細胞/CD8+T細胞の値の少なくとも一方が、各々に設定された所定値以上である場合に、被検者が癌を罹患している可能性が高いと判断する検定において使用される。
【0014】
第一のデータ取得工程におけるポルフィリン系化合物の定量は、ポルフィリン系化合物が健常人由来のリンパ球よりも、罹癌者由来のリンパ球により選択的に取り込まれるという特異的な性質を利用したものであり、本発明においては罹癌者由来のリンパ球とかかる特異的結合を示すすべてのポルフィリン系化合物が用いられ得る。具体的には、ポルフィリン系化合物にはヘマトポルフィリン、及び、その重合体やアセチル化体などの誘導体が含まれる。
【0015】
ポルフィリン系化合物の定量は、一態様において、被検者から採取したリンパ球にポルフィリン系化合物を加える工程と、前記工程で得られた混合物に特定波長の光を照射してポルフィリン系化合物を励起させ、化学反応を起こすことで発光を生じさせる工程と、前記工程で発生した発光量を測定する工程とを含む手段により行われ得る。すなわち、ポルフィリン系化合物に特定波長の光を照射することにより発生するポルフィリン系化合物由来の一重項酸素を化学発光計測器で測定することにより、リンパ球に結合したポルフィリン系化合物を直接的に定量するものである。ヘマトポルフィリン系化合物は、その殆どがB細胞リンパ球に取り込まれることがわかっている。したがって、本発明のデータの収集方法は、ヘマトポルフィリン系化合物が結合するリンパ球B細胞と、CD4抗原及びCD8抗原を含むリンパ球T細胞における相互のデータを利用することにより、癌罹病の簡便な体外診断の精度を上げたものということができる。
【0016】
次に、第二のデータ取得工程について説明する。
第二のデータ収集工程では、被検者から採取したリンパ球に含まれるCD4+T細胞とCD8+T細胞が定量され、CD4+T細胞に対するCD8+T細胞の比(CD4+T細胞/CD8+T細胞(以下において、「CD4/CD8」と表記する。))が算出される。リンパ球の中でもT細胞は細胞性免疫に関与し、ウイルス感染細胞を殺したり、他の白血球の活性を調整したりする働きをもっている。T細胞を特異的に結合するCD4及びCD8を用いた研究により、罹癌者と健常人とではCD4とCD8に結合される細胞の割合が異なるという報告があるが、本発明者等による鋭意研究の結果、上述したポルフィリン系化合物量に関わる第一のデータと組み合わせて癌罹病の検定用データとして用いることにより、信頼性がより高まることが見出された。
【0017】
そして、第一のデータ取得工程において得られるポルフィリン系化合物量と、第二のデータ取得工程において得られるCD4/CD8の値は、以下のように利用される。すなわち、被検者における少なくとも一方の値が、第一及び第二のデータ各々に設定された所定値以上である場合に、被検者が癌を罹患している可能性が高いと判断される。第一のデータであるポルフィリン系化合物量および第二のデータであるCD4/CD8値に設定される各所定値は、一義的に決定されるものではなく、例えば母集団となる検体の測定データの数などに応じて適宜決定される。
【0018】
一態様において、母集団として十分な数(例えば数千程度)の検体の測定データがある場合には、ポルフィリン系化合物量及びCD4/CD8値に関する健常人のデータの平均値(m)と偏差値(SD)を用いて所定値を設定することができる。その一例として、健常人のデータの平均値(m)+3SDなどが挙げられる。
【0019】
また、他の態様において、所定の母集団におけるポルフィリン系化合物量およびCD4/CD8値の各々の中央値を所定値として用いることもできる。ここで、中央値とは、測定母数における、ポルフィリン系化合物量、及びCD4/CD8値の各々が中間の順番に当る人のポルフィリン系化合物量、CD4/CD8値をいい、例えば、母数が7人の場合は4番目のポルフィリン系化合物量又はCD4/CD8値を有する人のポルフィリン系化合物量又はCD4/CD8値をいう。
【0020】
また、所定の母集団としては、健常人から構成される母集団のみならず、罹癌者を含む母集団であってもよく、後掲の実施例では、術前の癌患者19人から構成される母集団が用いられている。
【0021】
本発明において第一のデータを収集するために使用し得る装置は、特定波長の光照射手段と、低雑音で高感度に発光スペクトルを観測できる微弱発光測定手段とを具備することが必要である。図1は、本発明の癌罹病検定用装置の一態様を示すものであり、試料セル1と、試料セルを収容する試料室2と、試料セル1に収容されるべき試料に光を照射するための光照射手段10と、試料から発生する発光強度を測定する発光測定手段11と、前記発光測定手段11との間に設けられた光学フィルター12と、前記試料室の下方に設けられた加熱手段13とを具備し、更に前記試料室2は、該試料室内の雰囲気をガス雰囲気に置換するためのガス入口3及びガス出口4を備えている。
【0022】
前記光学フィルター12は、分光機構の一例であり、HPDに特異的な発光を測定するために600nm以上の光を通す光学フィルターが用いられる。また、分光機構の他の例としては、600nm以上の光を通す分光器又は受光素子が挙げられ、分光器としては例えばグレーティングなどが好適に用いられる。
【0023】
また、前記試料セル1及び/又は試料室2は、照射される光により励起される物質を含まない材料、すなわち、高純度物質から形成されていることが好ましく、例えば、SiO2、高純度ガラス、高純度石英ガラス、ステンレス、Si、SiCなどが具体例として挙げられる。
【0024】
また、光照射手段10としてレーザー光源が使用され得、レーザー光の波長は、HPD由来の発光を誘発すべく、300nm〜450nmであることが好ましく、330nm〜420nmがより好ましい。更に、レーザー光の照射出力が高すぎると大量の活性酸素が生成し、細胞死を招いて自己発光を誘起するおそれがある。このため、照射出力の調整が必要であり、その上限は平均出力10mW以下とすることが好ましい。なお、レーザーは直線光であるため、拡散レンズ(非球面)を通すことにより、光を拡散させ照射面積を大きくすることもできる。また、パルスレーザーでも前記条件を満たすものであれば本発明において好適に使用することができる。パルスレーザーの場合、送信と受信との同期をとる周期増幅方式を受光源にも適用でき、ノイズ軽減に役立てることができる。
【0025】
本発明の癌罹病検定用装置における、特に光照射手段と、分光機構と、発光強度測定手段とにより構成される態様について、図1とは異なる他の態様を、模式的に示した図を参照しながら以下に説明する。
【0026】
図2は、特定波長の光を通す光学フィルターを用いた装置の一態様であり、光学フィルター112により、光照射手段100から照射された光が反射される一方、600nm以上の光を通すことにより、ヘマトポルフェリン及び/又はその誘導体由来の励起発光の発光量が発光強度測定手段111により測定される。
【0027】
図3は、特定波長の光を通す分光器としてグレーティングを用いた装置の一態様であり、光照射手段200から照射された光を受けて試料から発生した励起発光から、グレーティング212により600nm以上の光が取り出されることにより、ヘマトポルフェリン及び/又はその誘導体由来の励起発光の発光量が発光強度測定手段211により測定される。
【0028】
また、図4に示すような構成(多検体測定装置)とすることにより、複数の試料を連続的に測定することができる。すなわち、試料室(図示せず)内に設けられた移動手段350(例えば、ターンテーブル)の上に、複数の試料セル301を載荷する。ターンテーブルの場合、試料セル301は図4に示すように円状に配置する。このような構成を採用した場合、移動手段350を移動(回転)させることにより試料302を発光強度測定手段311の下へ移動し、光照射手段300が光を試料302に照射しながら、600nm以上の光を通す分光機構312を介した試料からの励起発光を測定することにより、ヘマトポルフィリン及び/又はその誘導体由来の励起発光の発光量が測定される。このような操作を繰り返すことにより、複数の試料を連続的に測定することができる。ここで、移動手段350及び試料セル301は照射光が当たっても光りにくい素材のものが用いられる。また、このような移動手段350を用いることなく試料室内に置かれた複数の試料について一度に測定することも、照射が均一になるよう複数の光照射手段を用いる、CCDカメラのような受光素子を利用した発光強度測定、など工夫次第で可能である。
【0029】
本発明において第二のデータを収集するために使用し得る手段・装置としては、CD4+T細胞とCD8+T細胞の定量が可能な公知の手段・装置を用いることができる。一態様として、フローサイトメトリー(FCM)を利用することができる。フローサイトメトリーにより、蛍光色素を抗体分子に標識することで、目的とする細胞を測定することが可能であり、染色を行うことでリンパ球の中でもT細胞を特異的に測定することができる。他の態様として、フローサイトメトリー以外に免疫蛍光法により測定することもできる。
【実施例】
【0030】
(1)検体
本実施例で用いた検体は、乳がん手術前後の検体を含む以下の通りである。
【表1】

【0031】
(2)血液分離
被検者から採取した血液14mlに対するリンパ球の分離は、LYMPHOPREP Tube(第一化学薬品株式会社製)を用いて以下の手順に従い行った。
【0032】
1.血液をチューブに入れ、血液と等量のPBSを加え転倒混和する。
【0033】
2.1100gで10分間遠心する。
【0034】
3.新しいチューブに単核球層を回収し、10mlとなるようにPBSを加え懸濁する。
【0035】
4.250gで10分間遠心する。
【0036】
5.上清を捨て、沈殿物にPBSを10ml加え、懸濁する。
【0037】
6.250gで10分間遠心する。
【0038】
7.上清を捨て、沈殿物にPBSを1ml加える。
【0039】
8.チュルク氏液45μlと、細胞懸濁液5μlとあわせる。
【0040】
9.リンパ球を数え、1×106cells/mlとなるようにハンクス液で調整する。
【表2】

【0041】
(3)HPD染色
HPD染色は、以下の手順に従い行った。
【0042】
1.1×106cells/mlのリンパ球液3mlに対し、5mg/mlのHPDを150μl添加する。
【0043】
2.37℃で10分間温める。
【0044】
3.420gで10分間遠心する。
【0045】
4.上清を捨て、PBSを5ml加え懸濁する。
【0046】
5.420gで10分間遠心する。
【0047】
6.沈殿物にPBS1mlを加える。
【0048】
7.チュルク氏液45μlと、細胞懸濁液5μlとあわせる。
【0049】
8.リンパ球を数え、1×106cells/mlとなるようにハンクス液で調整する。
【0050】
(4)化学発光量の測定
化学発光検出(Chemiluminescence detection: CL-detection)は、室温において、励起発光計測装置としてCLA−FS3(東北電子産業株式会社製)を用い、以下の条件及び手順に従い行った。
【0051】
励起発光計測装置:CLアナライザー CLA−FS3(東北電子産業株式会社製)
レーザー:405nmLD、2.6mW
フィルター:Neutral−Density(ND)フィルター10−3+500high pass (HP)フィルター+600HPフィルター、又はNDフィルター10−3+500HPフィルター+620HPフィルター、gain:100
1.HPD染色したリンパ球液又はHPD染色しないリンパ球液60μl(1×106cells/ml)を石英丸溝試料管に入れる。
【0052】
2.レーザーを照射しながら発光を測定する。
【0053】
3.HPD染色したリンパ球の発光強度からHPD染色しないリンパ球の発光強度を引いた値を発光量とする。それぞれの測定は2回行い、平均値を使用する。
【0054】
(5)CD4−FITC/CD8−PE標識抗体を用いたT細胞の染色
標識抗体としてDual Color Kit「イムノテック」CD4/CD8(ベックマン・コールター株式会社製)を用い、以下の手順に従いT細胞を染色しFCM測定試料を作成した。
【0055】
なお、CD4−FITCはインデューサー/ヘルパーT細胞で発現するCD4抗原を認識し、CD8−PEはサプレッサー/細胞障害性T細胞で発現するCD8抗原を認識する。
【0056】
1.105〜106cells/mlに調整したリンパ球液100μlに対し、CD4−FITC/CD8−PE標識抗体を20μl添加する。
【0057】
2.氷上で30分間置く。
【0058】
3.PBS(0.1M PB、0.9%NaCl)を2ml添加し、懸濁する。
【0059】
4.201gで15分間遠心する。
【0060】
5.上清を捨て、PBSを2ml添加する。
【0061】
6.201gで15分間遠心する。
【0062】
7.上清を捨て、PBSを0.5ml添加し、FCM測定試料とする。
【0063】
(6)FCMによる測定
CD4+T細胞とCD8+T細胞の定量は、以下の装置及び手順に従い行った。
【0064】
フローサイトメーター:Cytomics FC500(ベックマン・コールター株式会社製)
レーザー:Ar 488nm
検出器:FL1(FITC、525nm)、FL2(PE、575nm)
1.CD4−FITC/CD8−PE標識抗体で染色したリンパ球500μlを試料管に入れ、測定を行う。
【0065】
2.FL1で検出されたCD4+T細胞の値をFL2で検出されたCD8+T細胞の値で割ることにより、CD4/CD8を計算する。測定は2回行い、平均値をデータとして用いる。(但し、細胞が少なかった試料については1回のみの測定データを使用している。)
(7)結果
(7−1)CD4/CD8とCL強度の測定値
CD4/CD8とCL強度の測定値を表3−1〜3−3に示す。
【表3−1】

【0066】
【表3−2】

【0067】
【表3−3】

(7−2)CD4/CD8値とCL強度の相関関係
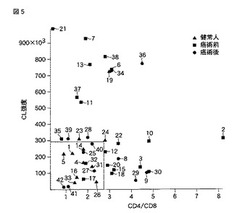
CD4/CD8値とCL強度の相関関係をグラフにしたものを図5に示す。グラフ中の囲み線は、術前罹癌者19人中のCL強度、及びCD4/CD8値の中央値を示す。CL強度、CD4/CD8値の中央値は、CL強度:293086(検体No.10)、CD4/CD8値:2.8(検体No.12)であった。図5から、術前の罹癌者におけるCL強度及びCD4/CD8値の各中央値をしきい値とすることにより、被検者が癌を罹患しているか否かの診断が高い確率で可能であることがわかる。
【表4】

【0068】
表4に示す相関グラフの結果から、術前の罹癌者では中央値領域外に89.5%、領域内に10.5%の確率で存在することから、9割程度の確率で癌を発見することが可能であることが示された。
【図面の簡単な説明】
【0069】
【図1】本発明において第一のデータ取得に好適な装置の一態様を模式的に示す図。
【図2】本発明において第一のデータ取得に好適な装置の他の態様を模式的に示す図。
【図3】本発明において第一のデータ取得に好適な装置の他の態様を模式的に示す図。
【図4】本発明において第一のデータ取得に好適な装置の他の態様を模式的に示す図。
【図5】CD4/CD8値とCL強度の相関関係を示すグラフ。
【技術分野】
【0001】
本発明は、癌罹病の簡便な体外診断に使用可能な癌罹病検定用データの収集方法に関するものであり、詳しくは、被検者から採取したリンパ球から得られる2種類のデータの組合せにより、被検者が癌を罹患している可能性を判断する検定に使用する信頼性の高いデータの収集方法に関するものである。
【背景技術】
【0002】
癌の診断・治療方法として、光感受性物質であるヘマトポルフィリン誘導体(hematoporphyrin derivative : HPD)の腫瘍に対する親和性及び蓄積性を応用した技術の研究・開発が進められてきた。具体的には、HPDを体内に投与し、長時間かけて腫瘍に蓄積させた後、光照射により励起三重項状態を経て誘起される活性酸素による酸化反応によって癌細胞を破壊する研究や(例えば、非特許文献1を参照)、HPD染色した癌細胞が蛍光を発することから、癌組織の有無を判定する体内診断に応用することが行われている(例えば、非特許文献2を参照)。しかしながら、これらはいずれも生体内測定であり、腫瘍に蓄積するまでに3日程度かかり、多くの手間がかかる上、患者の苦痛を伴うものであった。また、活性酸素による癌細胞の破壊においては、活性酸素の過剰な生成により皮膚や目に対して様々な副作用を引き起こすという問題点も指摘されていた(例えば、非特許文献3、4を参照)。
【0003】
一方、非侵襲の癌の体外診断技術として、例えば特許文献1には、HPDが生体外に取り出した癌細胞やリンパ球によっても摂取されることに着目し、電子スピン共鳴(ESR)装置を用いて癌診断への応用を図った技術が開示されている。しかし、かかる技術は、細胞分離法が確立されておらず、またHPD染色などの前処理が煩雑であったこと、また細胞の管理、保存技術が確立されていなかったこと、更にESR装置を用いた観測では、HPDの選択的な測定をしていたものではなく、光励起によりHPDが生成する各種活性酸素により生成したリンパ球表面酸化物量を見ていたにすぎない。故に診断判定のためのESRスペクトルの解釈が難しい、などの理由により実用化に至っていない。
【0004】
かかる背景技術に鑑み、簡便且つ実用的な非侵襲の癌の体外診断技術として、特許文献2には、HPDが癌患者由来のリンパ球に選択的に結合する性質を利用し、リンパ球に結合したHPD量を直接的に測定する技術を含む癌罹病検定用データの収集方法が開示されている。癌の早期発見のために、かかるデータ収集技術を利用したより信頼性の高い癌の診断システムの確立が所望されている。
【特許文献1】特開昭60−135765号公報
【特許文献2】特開2007−178237号公報
【非特許文献1】Poto, L. & Berki.T. Investigation on the free radical producing effect of hematoporphyrin: a spin trapping study. Acta Physiol. Hung. 74, 285- (1989).
【非特許文献2】Dougherty, T.J.等、Photodynamic Therapy. J. Natl. Cancer Inst., 90, 889-905 (1998).
【非特許文献3】He, D., Soter, N.A., & Lim.H.W. The late phase of hematoporphyrin derivative-induced phototoxicity in mice: Release of hisitamine and histogic changes. Photochem. Photobiol., 50, 91- (1989).
【非特許文献4】Hawkins, C.W. Bickkers, D.R.Mukhter, H. & Elemets, C.A. Cutaneour Photosensitization: murine ear swelling as a marker of acute response. J. Invest. Dermatol. 86, 638- (1986).
【発明の開示】
【発明が解決しようとする課題】
【0005】
本発明は、かかる背景技術に鑑み、癌罹病の簡便な体外診断に使用し得る、信頼性の高い癌罹病検定用データの収集方法を提供することを目的とする。
【課題を解決するための手段】
【0006】
本発明者等は、リンパ球に含まれるCD4抗原をもつT細胞とCD8抗原をもつT細胞に着目し、上記課題を解決すべく鋭意研究した結果、リンパ球に結合したHPDを定量することにより得られるデータと組合せて使用することにより、信頼性の高い癌罹病の体外診断を可能とする新たなデータの収集技術を見出し、本発明を完成するに至った。
【0007】
すなわち、被検者が癌を罹患している可能性を判断する検定に使用されるデータとして、被検者から採取したリンパ球に結合したポルフィリン系化合物を定量することにより得られる第一のデータと、同じリンパ球に含まれるCD4抗原をもつT細胞(CD4+T細胞)とCD8抗原をもつT細胞(CD8+T細胞)を定量し、CD4+T細胞に対するCD8+T細胞の比(CD4+T細胞/CD8+T細胞)を算出することにより得られる第二のデータとを組合せて判断することにより、より信頼性の高い判断が可能となることを見出した。
【0008】
すなわち、本発明により、
癌罹病の検定に使用するデータを収集する方法であって、
被検者から採取したリンパ球に結合したポルフィリン系化合物を定量することにより第一のデータを得る工程と、被検者から採取した前記リンパ球に含まれるCD4抗原をもつT細胞(CD4+T細胞)とCD8抗原をもつT細胞(CD8+T細胞)を定量し、CD4+T細胞に対するCD8+T細胞の比(CD4+T細胞/CD8+T細胞)を算出することにより第二のデータを得る工程とを含み、
第一のデータであるポルフィリン系化合物量と、第二のデータであるCD4+T細胞/CD8+T細胞の値の少なくとも一方が、各々に設定された所定値以上である場合に、被検者が癌を罹患している可能性が高いと判断する検定において使用されることを特徴とする、癌罹病の検定に使用するデータの収集方法が提供される。
【0009】
本発明の一態様において、第一のデータ取得工程におけるポルフィリン系化合物の前記定量は、
(a) 被検者から採取したリンパ球にポルフィリン系化合物を加える工程と、
(b) 工程(a)で得られた混合物に特定波長の光を照射してリンパ球に結合したポルフィリン系化合物を励起し、化学反応を起こすことにより発光を生じさせる工程と、
(c) 工程(b)で発生した発光量を測定する工程と、
を含む手段により行われる。
【0010】
また、本発明の他の態様において、第二のデータ取得工程におけるCD4抗原をもつT細胞(CD4+T細胞)とCD8抗原をもつT細胞(CD8+T細胞)の定量は、フローサイトメトリー又は免疫蛍光法により測定される。
また、本発明の他の態様において、前記ポルフィリン系化合物は、ヘマトポルフィリン及び/又はその誘導体である。
また、本発明の他の態様において、前記工程(b)においてポルフィリン系化合物が結合するリンパ球はB細胞リンパ球である。
【0011】
また、本発明の他の態様において、前記工程(b)において生じる発光は、一重項酸素由来のものである。
【発明の効果】
【0012】
本発明により、患者の身体的・経済的な負担を増大させることなく、癌罹病の簡便な体外診断に使用可能な、信頼性の高いデータの収集方法が提供された。これにより癌の早期発見が更に促進され、また術後の経過診断及び癌再発防止のための治療にも有効に利用することができる。
【発明を実施するための最良の形態】
【0013】
以下、本発明を詳細に説明する。
本発明に係る癌罹病検定用データの収集方法は、上述したように、被検者から採取したリンパ球に結合したポルフィリン系化合物を定量することにより第一のデータを得る工程と、被検者から採取した前記リンパ球に含まれるCD4抗原をもつT細胞(以下、「CD4+T細胞」ともいう。)とCD8抗原をもつT細胞(以下、「CD8+T細胞」ともいう。)を定量し、CD4+T細胞に対するCD8+T細胞の比(CD4+T細胞/CD8+T細胞)を算出することにより第二のデータを得る工程とを含み、第一のデータと第二のデータとの組合せにおいて、癌罹病の検定に使用されることを特徴とする。すなわち、第一のデータであるポルフィリン系化合物量と、第二のデータであるCD4+T細胞/CD8+T細胞の値の少なくとも一方が、各々に設定された所定値以上である場合に、被検者が癌を罹患している可能性が高いと判断する検定において使用される。
【0014】
第一のデータ取得工程におけるポルフィリン系化合物の定量は、ポルフィリン系化合物が健常人由来のリンパ球よりも、罹癌者由来のリンパ球により選択的に取り込まれるという特異的な性質を利用したものであり、本発明においては罹癌者由来のリンパ球とかかる特異的結合を示すすべてのポルフィリン系化合物が用いられ得る。具体的には、ポルフィリン系化合物にはヘマトポルフィリン、及び、その重合体やアセチル化体などの誘導体が含まれる。
【0015】
ポルフィリン系化合物の定量は、一態様において、被検者から採取したリンパ球にポルフィリン系化合物を加える工程と、前記工程で得られた混合物に特定波長の光を照射してポルフィリン系化合物を励起させ、化学反応を起こすことで発光を生じさせる工程と、前記工程で発生した発光量を測定する工程とを含む手段により行われ得る。すなわち、ポルフィリン系化合物に特定波長の光を照射することにより発生するポルフィリン系化合物由来の一重項酸素を化学発光計測器で測定することにより、リンパ球に結合したポルフィリン系化合物を直接的に定量するものである。ヘマトポルフィリン系化合物は、その殆どがB細胞リンパ球に取り込まれることがわかっている。したがって、本発明のデータの収集方法は、ヘマトポルフィリン系化合物が結合するリンパ球B細胞と、CD4抗原及びCD8抗原を含むリンパ球T細胞における相互のデータを利用することにより、癌罹病の簡便な体外診断の精度を上げたものということができる。
【0016】
次に、第二のデータ取得工程について説明する。
第二のデータ収集工程では、被検者から採取したリンパ球に含まれるCD4+T細胞とCD8+T細胞が定量され、CD4+T細胞に対するCD8+T細胞の比(CD4+T細胞/CD8+T細胞(以下において、「CD4/CD8」と表記する。))が算出される。リンパ球の中でもT細胞は細胞性免疫に関与し、ウイルス感染細胞を殺したり、他の白血球の活性を調整したりする働きをもっている。T細胞を特異的に結合するCD4及びCD8を用いた研究により、罹癌者と健常人とではCD4とCD8に結合される細胞の割合が異なるという報告があるが、本発明者等による鋭意研究の結果、上述したポルフィリン系化合物量に関わる第一のデータと組み合わせて癌罹病の検定用データとして用いることにより、信頼性がより高まることが見出された。
【0017】
そして、第一のデータ取得工程において得られるポルフィリン系化合物量と、第二のデータ取得工程において得られるCD4/CD8の値は、以下のように利用される。すなわち、被検者における少なくとも一方の値が、第一及び第二のデータ各々に設定された所定値以上である場合に、被検者が癌を罹患している可能性が高いと判断される。第一のデータであるポルフィリン系化合物量および第二のデータであるCD4/CD8値に設定される各所定値は、一義的に決定されるものではなく、例えば母集団となる検体の測定データの数などに応じて適宜決定される。
【0018】
一態様において、母集団として十分な数(例えば数千程度)の検体の測定データがある場合には、ポルフィリン系化合物量及びCD4/CD8値に関する健常人のデータの平均値(m)と偏差値(SD)を用いて所定値を設定することができる。その一例として、健常人のデータの平均値(m)+3SDなどが挙げられる。
【0019】
また、他の態様において、所定の母集団におけるポルフィリン系化合物量およびCD4/CD8値の各々の中央値を所定値として用いることもできる。ここで、中央値とは、測定母数における、ポルフィリン系化合物量、及びCD4/CD8値の各々が中間の順番に当る人のポルフィリン系化合物量、CD4/CD8値をいい、例えば、母数が7人の場合は4番目のポルフィリン系化合物量又はCD4/CD8値を有する人のポルフィリン系化合物量又はCD4/CD8値をいう。
【0020】
また、所定の母集団としては、健常人から構成される母集団のみならず、罹癌者を含む母集団であってもよく、後掲の実施例では、術前の癌患者19人から構成される母集団が用いられている。
【0021】
本発明において第一のデータを収集するために使用し得る装置は、特定波長の光照射手段と、低雑音で高感度に発光スペクトルを観測できる微弱発光測定手段とを具備することが必要である。図1は、本発明の癌罹病検定用装置の一態様を示すものであり、試料セル1と、試料セルを収容する試料室2と、試料セル1に収容されるべき試料に光を照射するための光照射手段10と、試料から発生する発光強度を測定する発光測定手段11と、前記発光測定手段11との間に設けられた光学フィルター12と、前記試料室の下方に設けられた加熱手段13とを具備し、更に前記試料室2は、該試料室内の雰囲気をガス雰囲気に置換するためのガス入口3及びガス出口4を備えている。
【0022】
前記光学フィルター12は、分光機構の一例であり、HPDに特異的な発光を測定するために600nm以上の光を通す光学フィルターが用いられる。また、分光機構の他の例としては、600nm以上の光を通す分光器又は受光素子が挙げられ、分光器としては例えばグレーティングなどが好適に用いられる。
【0023】
また、前記試料セル1及び/又は試料室2は、照射される光により励起される物質を含まない材料、すなわち、高純度物質から形成されていることが好ましく、例えば、SiO2、高純度ガラス、高純度石英ガラス、ステンレス、Si、SiCなどが具体例として挙げられる。
【0024】
また、光照射手段10としてレーザー光源が使用され得、レーザー光の波長は、HPD由来の発光を誘発すべく、300nm〜450nmであることが好ましく、330nm〜420nmがより好ましい。更に、レーザー光の照射出力が高すぎると大量の活性酸素が生成し、細胞死を招いて自己発光を誘起するおそれがある。このため、照射出力の調整が必要であり、その上限は平均出力10mW以下とすることが好ましい。なお、レーザーは直線光であるため、拡散レンズ(非球面)を通すことにより、光を拡散させ照射面積を大きくすることもできる。また、パルスレーザーでも前記条件を満たすものであれば本発明において好適に使用することができる。パルスレーザーの場合、送信と受信との同期をとる周期増幅方式を受光源にも適用でき、ノイズ軽減に役立てることができる。
【0025】
本発明の癌罹病検定用装置における、特に光照射手段と、分光機構と、発光強度測定手段とにより構成される態様について、図1とは異なる他の態様を、模式的に示した図を参照しながら以下に説明する。
【0026】
図2は、特定波長の光を通す光学フィルターを用いた装置の一態様であり、光学フィルター112により、光照射手段100から照射された光が反射される一方、600nm以上の光を通すことにより、ヘマトポルフェリン及び/又はその誘導体由来の励起発光の発光量が発光強度測定手段111により測定される。
【0027】
図3は、特定波長の光を通す分光器としてグレーティングを用いた装置の一態様であり、光照射手段200から照射された光を受けて試料から発生した励起発光から、グレーティング212により600nm以上の光が取り出されることにより、ヘマトポルフェリン及び/又はその誘導体由来の励起発光の発光量が発光強度測定手段211により測定される。
【0028】
また、図4に示すような構成(多検体測定装置)とすることにより、複数の試料を連続的に測定することができる。すなわち、試料室(図示せず)内に設けられた移動手段350(例えば、ターンテーブル)の上に、複数の試料セル301を載荷する。ターンテーブルの場合、試料セル301は図4に示すように円状に配置する。このような構成を採用した場合、移動手段350を移動(回転)させることにより試料302を発光強度測定手段311の下へ移動し、光照射手段300が光を試料302に照射しながら、600nm以上の光を通す分光機構312を介した試料からの励起発光を測定することにより、ヘマトポルフィリン及び/又はその誘導体由来の励起発光の発光量が測定される。このような操作を繰り返すことにより、複数の試料を連続的に測定することができる。ここで、移動手段350及び試料セル301は照射光が当たっても光りにくい素材のものが用いられる。また、このような移動手段350を用いることなく試料室内に置かれた複数の試料について一度に測定することも、照射が均一になるよう複数の光照射手段を用いる、CCDカメラのような受光素子を利用した発光強度測定、など工夫次第で可能である。
【0029】
本発明において第二のデータを収集するために使用し得る手段・装置としては、CD4+T細胞とCD8+T細胞の定量が可能な公知の手段・装置を用いることができる。一態様として、フローサイトメトリー(FCM)を利用することができる。フローサイトメトリーにより、蛍光色素を抗体分子に標識することで、目的とする細胞を測定することが可能であり、染色を行うことでリンパ球の中でもT細胞を特異的に測定することができる。他の態様として、フローサイトメトリー以外に免疫蛍光法により測定することもできる。
【実施例】
【0030】
(1)検体
本実施例で用いた検体は、乳がん手術前後の検体を含む以下の通りである。
【表1】

【0031】
(2)血液分離
被検者から採取した血液14mlに対するリンパ球の分離は、LYMPHOPREP Tube(第一化学薬品株式会社製)を用いて以下の手順に従い行った。
【0032】
1.血液をチューブに入れ、血液と等量のPBSを加え転倒混和する。
【0033】
2.1100gで10分間遠心する。
【0034】
3.新しいチューブに単核球層を回収し、10mlとなるようにPBSを加え懸濁する。
【0035】
4.250gで10分間遠心する。
【0036】
5.上清を捨て、沈殿物にPBSを10ml加え、懸濁する。
【0037】
6.250gで10分間遠心する。
【0038】
7.上清を捨て、沈殿物にPBSを1ml加える。
【0039】
8.チュルク氏液45μlと、細胞懸濁液5μlとあわせる。
【0040】
9.リンパ球を数え、1×106cells/mlとなるようにハンクス液で調整する。
【表2】

【0041】
(3)HPD染色
HPD染色は、以下の手順に従い行った。
【0042】
1.1×106cells/mlのリンパ球液3mlに対し、5mg/mlのHPDを150μl添加する。
【0043】
2.37℃で10分間温める。
【0044】
3.420gで10分間遠心する。
【0045】
4.上清を捨て、PBSを5ml加え懸濁する。
【0046】
5.420gで10分間遠心する。
【0047】
6.沈殿物にPBS1mlを加える。
【0048】
7.チュルク氏液45μlと、細胞懸濁液5μlとあわせる。
【0049】
8.リンパ球を数え、1×106cells/mlとなるようにハンクス液で調整する。
【0050】
(4)化学発光量の測定
化学発光検出(Chemiluminescence detection: CL-detection)は、室温において、励起発光計測装置としてCLA−FS3(東北電子産業株式会社製)を用い、以下の条件及び手順に従い行った。
【0051】
励起発光計測装置:CLアナライザー CLA−FS3(東北電子産業株式会社製)
レーザー:405nmLD、2.6mW
フィルター:Neutral−Density(ND)フィルター10−3+500high pass (HP)フィルター+600HPフィルター、又はNDフィルター10−3+500HPフィルター+620HPフィルター、gain:100
1.HPD染色したリンパ球液又はHPD染色しないリンパ球液60μl(1×106cells/ml)を石英丸溝試料管に入れる。
【0052】
2.レーザーを照射しながら発光を測定する。
【0053】
3.HPD染色したリンパ球の発光強度からHPD染色しないリンパ球の発光強度を引いた値を発光量とする。それぞれの測定は2回行い、平均値を使用する。
【0054】
(5)CD4−FITC/CD8−PE標識抗体を用いたT細胞の染色
標識抗体としてDual Color Kit「イムノテック」CD4/CD8(ベックマン・コールター株式会社製)を用い、以下の手順に従いT細胞を染色しFCM測定試料を作成した。
【0055】
なお、CD4−FITCはインデューサー/ヘルパーT細胞で発現するCD4抗原を認識し、CD8−PEはサプレッサー/細胞障害性T細胞で発現するCD8抗原を認識する。
【0056】
1.105〜106cells/mlに調整したリンパ球液100μlに対し、CD4−FITC/CD8−PE標識抗体を20μl添加する。
【0057】
2.氷上で30分間置く。
【0058】
3.PBS(0.1M PB、0.9%NaCl)を2ml添加し、懸濁する。
【0059】
4.201gで15分間遠心する。
【0060】
5.上清を捨て、PBSを2ml添加する。
【0061】
6.201gで15分間遠心する。
【0062】
7.上清を捨て、PBSを0.5ml添加し、FCM測定試料とする。
【0063】
(6)FCMによる測定
CD4+T細胞とCD8+T細胞の定量は、以下の装置及び手順に従い行った。
【0064】
フローサイトメーター:Cytomics FC500(ベックマン・コールター株式会社製)
レーザー:Ar 488nm
検出器:FL1(FITC、525nm)、FL2(PE、575nm)
1.CD4−FITC/CD8−PE標識抗体で染色したリンパ球500μlを試料管に入れ、測定を行う。
【0065】
2.FL1で検出されたCD4+T細胞の値をFL2で検出されたCD8+T細胞の値で割ることにより、CD4/CD8を計算する。測定は2回行い、平均値をデータとして用いる。(但し、細胞が少なかった試料については1回のみの測定データを使用している。)
(7)結果
(7−1)CD4/CD8とCL強度の測定値
CD4/CD8とCL強度の測定値を表3−1〜3−3に示す。
【表3−1】

【0066】
【表3−2】

【0067】
【表3−3】

(7−2)CD4/CD8値とCL強度の相関関係
CD4/CD8値とCL強度の相関関係をグラフにしたものを図5に示す。グラフ中の囲み線は、術前罹癌者19人中のCL強度、及びCD4/CD8値の中央値を示す。CL強度、CD4/CD8値の中央値は、CL強度:293086(検体No.10)、CD4/CD8値:2.8(検体No.12)であった。図5から、術前の罹癌者におけるCL強度及びCD4/CD8値の各中央値をしきい値とすることにより、被検者が癌を罹患しているか否かの診断が高い確率で可能であることがわかる。
【表4】

【0068】
表4に示す相関グラフの結果から、術前の罹癌者では中央値領域外に89.5%、領域内に10.5%の確率で存在することから、9割程度の確率で癌を発見することが可能であることが示された。
【図面の簡単な説明】
【0069】
【図1】本発明において第一のデータ取得に好適な装置の一態様を模式的に示す図。
【図2】本発明において第一のデータ取得に好適な装置の他の態様を模式的に示す図。
【図3】本発明において第一のデータ取得に好適な装置の他の態様を模式的に示す図。
【図4】本発明において第一のデータ取得に好適な装置の他の態様を模式的に示す図。
【図5】CD4/CD8値とCL強度の相関関係を示すグラフ。
【特許請求の範囲】
【請求項1】
癌罹病の検定に使用するデータを収集する方法であって、被検者から採取したリンパ球に結合したポルフィリン系化合物を定量することにより第一のデータを得る工程と、被検者から採取した前記リンパ球に含まれるCD4抗原をもつT細胞(CD4+T細胞)とCD8抗原をもつT細胞(CD8+T細胞)を定量し、CD4+T細胞に対するCD8+T細胞の比(CD4+T細胞/CD8+T細胞)を算出することにより第二のデータを得る工程とを含み、
第一のデータであるポルフィリン系化合物量と、第二のデータであるCD4+T細胞/CD8+T細胞の値の少なくとも一方が、各々に設定された所定値以上である場合に、被検者が癌を罹患している可能性が高いと判断する検定において使用されることを特徴とする、癌罹病の検定に使用するデータの収集方法。
【請求項2】
第一のデータ取得工程におけるポルフィリン系化合物の前記定量が、
(a) 被検者から採取したリンパ球にポルフィリン系化合物を加える工程と、
(b) 工程(a)で得られた混合物に特定波長の光を照射してリンパ球に結合したポルフィリン系化合物を励起し、化学反応を起こすことにより発光を生じさせる工程と、
(c) 工程(b)で発生した発光量を測定する工程と、
を含む手段により行われることを特徴とする、請求項1に記載の癌罹病の検定に使用するデータの収集方法。
【請求項3】
第二のデータ取得工程におけるCD4抗原をもつT細胞(CD4+T細胞)とCD8抗原をもつT細胞(CD8+T細胞)の定量が、フローサイトメトリー又は免疫蛍光法により測定される、請求項1又は2に記載の癌罹病の検定に使用するデータの収集方法。
【請求項4】
前記ポルフィリン系化合物が、ヘマトポルフィリン及び/又はその誘導体であることを特徴とする、請求項1乃至3のいずれか1項に記載の癌罹病の検定に使用するデータの収集方法。
【請求項5】
前記工程(b)においてポルフィリン系化合物が結合するリンパ球がB細胞リンパ球である、請求項2乃至4のいずれか1項に記載のデータ取得方法。
【請求項6】
前記工程(b)において生じる発光が、一重項酸素由来のものであることを特徴とする、請求項2乃至5のいずれか1項に記載の癌罹病の検定に使用するデータの収集方法。
【請求項1】
癌罹病の検定に使用するデータを収集する方法であって、被検者から採取したリンパ球に結合したポルフィリン系化合物を定量することにより第一のデータを得る工程と、被検者から採取した前記リンパ球に含まれるCD4抗原をもつT細胞(CD4+T細胞)とCD8抗原をもつT細胞(CD8+T細胞)を定量し、CD4+T細胞に対するCD8+T細胞の比(CD4+T細胞/CD8+T細胞)を算出することにより第二のデータを得る工程とを含み、
第一のデータであるポルフィリン系化合物量と、第二のデータであるCD4+T細胞/CD8+T細胞の値の少なくとも一方が、各々に設定された所定値以上である場合に、被検者が癌を罹患している可能性が高いと判断する検定において使用されることを特徴とする、癌罹病の検定に使用するデータの収集方法。
【請求項2】
第一のデータ取得工程におけるポルフィリン系化合物の前記定量が、
(a) 被検者から採取したリンパ球にポルフィリン系化合物を加える工程と、
(b) 工程(a)で得られた混合物に特定波長の光を照射してリンパ球に結合したポルフィリン系化合物を励起し、化学反応を起こすことにより発光を生じさせる工程と、
(c) 工程(b)で発生した発光量を測定する工程と、
を含む手段により行われることを特徴とする、請求項1に記載の癌罹病の検定に使用するデータの収集方法。
【請求項3】
第二のデータ取得工程におけるCD4抗原をもつT細胞(CD4+T細胞)とCD8抗原をもつT細胞(CD8+T細胞)の定量が、フローサイトメトリー又は免疫蛍光法により測定される、請求項1又は2に記載の癌罹病の検定に使用するデータの収集方法。
【請求項4】
前記ポルフィリン系化合物が、ヘマトポルフィリン及び/又はその誘導体であることを特徴とする、請求項1乃至3のいずれか1項に記載の癌罹病の検定に使用するデータの収集方法。
【請求項5】
前記工程(b)においてポルフィリン系化合物が結合するリンパ球がB細胞リンパ球である、請求項2乃至4のいずれか1項に記載のデータ取得方法。
【請求項6】
前記工程(b)において生じる発光が、一重項酸素由来のものであることを特徴とする、請求項2乃至5のいずれか1項に記載の癌罹病の検定に使用するデータの収集方法。
【図1】


【図2】


【図3】


【図4】


【図5】




【図2】


【図3】


【図4】


【図5】


【公開番号】特開2010−54305(P2010−54305A)
【公開日】平成22年3月11日(2010.3.11)
【国際特許分類】
【出願番号】特願2008−218687(P2008−218687)
【出願日】平成20年8月27日(2008.8.27)
【出願人】(000222026)東北電子産業株式会社 (11)
【出願人】(504157024)国立大学法人東北大学 (2,297)
【Fターム(参考)】
【公開日】平成22年3月11日(2010.3.11)
【国際特許分類】
【出願日】平成20年8月27日(2008.8.27)
【出願人】(000222026)東北電子産業株式会社 (11)
【出願人】(504157024)国立大学法人東北大学 (2,297)
【Fターム(参考)】
[ Back to top ]

