発がんプロモーション活性の評価方法
【課題】 天然物質や化学物質などの発がんについての危険性や安全性の検定などに際して有用な、発がんプロモーション活性の評価方法を提供すること。
【解決手段】 哺乳類動物(ヒトを除く)に発がん物質を6〜10週間投与した後、被験物質を1〜3週間投与し、肝臓に発生した胎盤型グルタチオン−S−トランスフェラーゼ陽性細胞巣および/またはγ−グルタミルトランスペプチダーゼ陽性細胞巣の面積が大きいほど発がんプロモーション活性が高いと判断することを特徴とする。
【解決手段】 哺乳類動物(ヒトを除く)に発がん物質を6〜10週間投与した後、被験物質を1〜3週間投与し、肝臓に発生した胎盤型グルタチオン−S−トランスフェラーゼ陽性細胞巣および/またはγ−グルタミルトランスペプチダーゼ陽性細胞巣の面積が大きいほど発がんプロモーション活性が高いと判断することを特徴とする。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、天然物質や化学物質などの発がんについての危険性や安全性の検定などに際して有用な、発がんプロモーション活性の評価方法に関する。
【背景技術】
【0002】
がんは依然として日本における主要な死亡原因の1つであり、近年、食品添加物などに利用されている天然物質や化学物質などの発がんについての危険性や安全性への関心がますます高まっている。がんの発生過程は、イニシエーションとプロモーションの2段階からなるとされているが、現在、発がんプロモーション活性の評価方法としては、試験開始時に発がん物質であるN,N’−ジエチルニトロソアミン(DEN)を発がんイニシエーターとしてラットの腹腔内に投与し、2週間標準食(MF飼料など)を摂取させた後、被験物質添加食に切り替え、試験開始から3週間後に2/3の部分肝切除を行い、試験開始から8週間後に肝臓に発生した胎盤型グルタチオン−S−トランスフェラーゼ(GST−P)陽性細胞巣の面積を測定する方法が標準的に採用されている(非特許文献1)。しかしながら、この方法は、ラットに対して部分肝切除を行う必要があるので手間がかかることから、より簡便に発がんプロモーション活性の評価を行うことができる方法が望まれている。
【先行技術文献】
【非特許文献】
【0003】
【非特許文献1】Ito N.et al.,Cancer Science,2003;94:3−9
【発明の概要】
【発明が解決しようとする課題】
【0004】
そこで本発明は、従来の方法に比較してより簡便に行うことができる発がんプロモーション活性の評価方法を提供することを目的とする。
【課題を解決するための手段】
【0005】
本発明者は上記の点に鑑みて鋭意研究を重ねた結果、発がんイニシエーションのための発がん物質と被験物質の投与スケジュールを巧みに組み合わせることにより、ラットに対して部分肝切除を行うことなく、発がんプロモーション活性の評価を行うことができることを知見した。
【0006】
上記の知見に基づいてなされた本発明の被験物質の発がんプロモーション活性を評価する方法は、請求項1記載の通り、哺乳類動物(ヒトを除く)に発がん物質を6〜10週間投与した後、被験物質を1〜3週間投与し、肝臓に発生したGST−P陽性細胞巣および/またはGGT(γ−グルタミルトランスペプチダーゼ)陽性細胞巣の面積が大きいほど発がんプロモーション活性が高いと判断することを特徴とする。
また、請求項2記載の方法は、請求項1記載の方法において、発がん物質として3’−メチル−4−ジメチルアミノアゾベンゼン、4−ジメチルアミノアゾベンゼン、o−アミノアゾトルエンから選択される少なくとも1つを投与することを特徴とする。
【発明の効果】
【0007】
本発明によれば、従来の方法に比較してより簡便に行うことができる発がんプロモーション活性の評価方法を提供することができる。
【図面の簡単な説明】
【0008】
【図1】実施例における各種の被験物質の発がんプロモーション活性を示す画像である。
【発明を実施するための形態】
【0009】
本発明の被験物質の発がんプロモーションに対する活性を評価する方法は、哺乳類動物(ヒトを除く)に発がん物質を6〜10週間投与した後、被験物質を1〜3週間投与し、肝臓に発生したGST−P陽性細胞巣および/またはGGT陽性細胞巣の面積が大きいほど発がんプロモーション活性が高いと判断することを特徴とするものである。
【0010】
本発明において利用することができる哺乳類動物(ヒトを除く)としては、ラットやマウスなどの齧歯類を例示することができる。
【0011】
哺乳類動物(ヒトを除く)への発がん物質と被験物質の投与は、経口から行うことが可能であり、例えば基礎食と共に自由摂取させたり、それ自体を食餌として自由摂取させることで行えばよい。基礎食への発がん物質や被験物質の添加量は、例えば0.01〜0.5%とすることが望ましい。
【0012】
発がん物質としては、3’−メチル−4−ジメチルアミノアゾベンゼン(3’−Me−DAB)の他、4−ジメチルアミノアゾベンゼン(DAB)やo−アミノアゾトルエンを好適に用いることができる。これらの発がん物質は、悪性度の低い前がん細胞群を誘発することから、被験物質の発がんプロモーション活性の評価を行いやすい点において望ましい。
【0013】
GST−P陽性細胞巣の面積は、例えば抗GST−P抗体を用いた自体公知の免疫組織化学的染色法によって細胞に存在するGST−Pを染色することで、また、GGT陽性細胞巣の面積は、例えば基質としてγ−グルタミル−4−メトキシ−2−ナフチルアミド(GMNA)を用いた自体公知の活性染色法によって細胞に存在するGGTを染色することで、それぞれ測定することができるが、本発明者が開発した特開2007−181444号公報に記載の以下の方法によれば、GST−P陽性細胞巣の面積とGGT陽性細胞巣の面積の測定を同時にかつ高精度に行うことができる。
【0014】
(1)哺乳類動物(ヒトを除く)の体内から肝臓を摘出して2〜6mm厚にスライスしてからアセトン固定する工程。
(2)アセトン固定した肝臓切片から20〜30μm厚の切片を連続的に複数枚調製する工程。
(3)調製した連続切片の1枚の面に対して抗GST−P抗体を用いて免疫組織化学的染色を行うとともに、このようにして免疫組織化学的染色を行った面と鏡面関係にある連続切片のもう1枚の面に対してGGTの活性染色を基質溶液中で行う工程。
(4)染色を行った2枚の連続切片の鏡像面をタングステンランプよりも熱発生量が少ない光源を用いた照明下でデジタル顕微鏡撮影する工程。
(5)得られた鏡像面のデジタル画像でGST−P陽性細胞巣が存在するポイントからその面積を測定するとともに、GST−P陽性細胞巣が存在するポイントとGGT陽性細胞巣が存在するポイントを比較し、共通するポイントからGGT陽性細胞巣の面積を測定する工程。
【0015】
被験物質の発がんプロモーション活性は、肝臓に発生したGST−P陽性細胞巣やGGT陽性細胞巣の面積が大きいほどが高い、即ち、発がんについての危険性が高いと判断することができるが(逆に言えば当該面積が小さいほど発がんについての安全性が高いと判断することができる)、発がん物質と被験物質の合計投与期間の全期間にわたって発がん物質を投与するプロトコルをコントロールとして採用し、コントロールにおける肝臓に発生したGST−P陽性細胞巣やGGT陽性細胞巣の面積と比較することで、より正確にその判断を行うことができる。GST−P陽性細胞巣の面積の増大はがん化する細胞の増殖能の目安となる。また、GGTは前がん細胞やがん細胞のマーカー酵素であるので、GGT陽性細胞巣の面積の増大は正常細胞からがん細胞への形質転換および/または悪性化の目安となる。従って、例えば、GST−P陽性細胞巣の面積はコントロールと同程度でも、GGT陽性細胞巣の面積がコントロールよりも大きければ、発がんプロモーション活性は高いと判断することができる。
【実施例】
【0016】
以下、本発明を実施例によって詳細に説明するが、本発明は以下の記載に限定して解釈されるものではない。
【0017】
実施例1:
(実験方法)
5週齢のSDラット雄(日本国Clea社より購入)に、発がんイニシエーターとして発がん物質である3’−Me−DABを0.05%添加した基礎食(MF飼料、以下同じ)を8週間自由摂取させた後、被験物質を添加した基礎食または被験物質自体を食餌として2週間自由摂取させた。試験開始から10週間後にラットの体内から肝臓を摘出し、3〜5mm厚にカミソリ刃を用いてスライスし、得られた肝臓切片を冷アセトン液(100%)に浸漬して固定化し、8℃で冷蔵庫保存した。2日後にアセトン液を交換し、さらに2日後に70%アセトン/30%水の混合液に交換し、8℃で冷蔵庫保存した。
次に、アセトン固定した肝臓切片から25μm厚の切片をマイクロスライサー(Vibratome 1500:米国Vibratome社)を用いて連続的に4枚調製した。
次に、連続切片の1枚の面に対する抗GST−P抗体を用いた免疫組織化学的染色を、Carcinogenesis 2002;23:1193−8に記載の方法に従って、1次抗体としてウサギ抗GST−Pポリクローナル抗体(日本国Medical and Biological Laboratories社)、2次抗体としてペルオキシダーゼを結合させたヤギ抗ウサギIgGポリクローナル抗体(Envision,labeled polymer,HRP,antirabbit:日本国Dako社)、ペルオキシダーゼの基質として3,3’−ジアミノベンジジンを用いて行った。なお、切片の洗浄操作は、先端口径5mmのゴムキャップを付けた広口ピペットで切片を吸い上げて洗浄液(リン酸緩衝液)に連続的に移し替えるという手法を採用し、能率的に行った。また、抗GST−P抗体を用いた免疫組織化学的染色を行った面と鏡面関係にある連続切片のもう1枚の面に対するGGTの活性染色を、J.Histochem.Cytochem.1969;17:517−26に記載の方法に従って、22mMのTris−HCl溶液にGMNA、グリシルグリシン、NaCl、4’−アミノ−2’,5’−ジエトキシベンズアニリドのジアゾニウム塩をそれぞれの濃度が0.57mM、3.3mM、93mM、0.52mMになるように添加して調製した基質溶液(pH7.6)に切片を浸漬し、時折溶液をかき混ぜながら15〜20分間室温にて反応を行った後、切片を0.1M硫酸銅水溶液に2分間浸漬することでアゾ染色カップリング反応を完結させてから食塩水で洗浄して行った(洗浄操作は上述した手法を採用)。
次に、光源に白色LEDを搭載したデジタル顕微鏡撮影装置として日本国Nikon社のCOOL SCOPEを用い、スライドガラス上に載置した染色標本の鏡像面のデジタル撮影を行った。
最後に、得られた鏡像面のデジタル画像のうちのGGT染色標本の画像を左右反転させ、GST−P陽性細胞巣が存在するポイントとGGT陽性細胞巣が存在するポイントの比較を行い、Carcinogenesis 2002;23:1193−8に記載の方法に従ってデータ解析を行った。
【0018】
(実験結果)
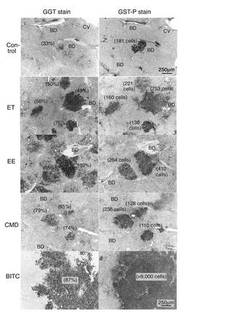
GST−P染色標本とGGT染色標本の鏡像面の2箇所の拡大画像を図1に示す(右:GST−P染色標本,左:GGT染色標本)。なお、図1において、Controlは3’−Me−DABを0.05%添加した基礎食を10週間自由摂取させたコントロールの結果(非特異的染色)、ETは被験物質としてD,L−メチオニンを0.25%添加した基礎食を投与した結果、EEは同、17α−エチニルエストラジオールを0.02%添加した基礎食を投与した結果、CMDは同、コリン−メチオニン欠乏食を食餌として基礎食の代わりに投与した結果、BITCは同、ベンジルイソチオシアネートを0.25%添加した基礎食を投与した結果である。図1から明らかなように、ベンジルイソチオシアネートを投与した場合、コントロールに比較してGST−P陽性細胞巣の面積が非常に大きく(図1に示した細胞巣は9000個を超える細胞から構成されている)、また、そのうちの87%がGGT陽性であることから(GGT陽性細胞巣)、ベンジルイソチオシアネートの発がんプロモーション活性は非常に高いことがわかった。同様に、D,L−メチオニンと17α−エチニルエストラジオールについても、発がんプロモーション活性が高いことがわかった。
【産業上の利用可能性】
【0019】
本発明は、従来の方法に比較してより簡便に行うことができる発がんプロモーション活性の評価方法を提供することができる点において産業上の利用可能性を有する。
【技術分野】
【0001】
本発明は、天然物質や化学物質などの発がんについての危険性や安全性の検定などに際して有用な、発がんプロモーション活性の評価方法に関する。
【背景技術】
【0002】
がんは依然として日本における主要な死亡原因の1つであり、近年、食品添加物などに利用されている天然物質や化学物質などの発がんについての危険性や安全性への関心がますます高まっている。がんの発生過程は、イニシエーションとプロモーションの2段階からなるとされているが、現在、発がんプロモーション活性の評価方法としては、試験開始時に発がん物質であるN,N’−ジエチルニトロソアミン(DEN)を発がんイニシエーターとしてラットの腹腔内に投与し、2週間標準食(MF飼料など)を摂取させた後、被験物質添加食に切り替え、試験開始から3週間後に2/3の部分肝切除を行い、試験開始から8週間後に肝臓に発生した胎盤型グルタチオン−S−トランスフェラーゼ(GST−P)陽性細胞巣の面積を測定する方法が標準的に採用されている(非特許文献1)。しかしながら、この方法は、ラットに対して部分肝切除を行う必要があるので手間がかかることから、より簡便に発がんプロモーション活性の評価を行うことができる方法が望まれている。
【先行技術文献】
【非特許文献】
【0003】
【非特許文献1】Ito N.et al.,Cancer Science,2003;94:3−9
【発明の概要】
【発明が解決しようとする課題】
【0004】
そこで本発明は、従来の方法に比較してより簡便に行うことができる発がんプロモーション活性の評価方法を提供することを目的とする。
【課題を解決するための手段】
【0005】
本発明者は上記の点に鑑みて鋭意研究を重ねた結果、発がんイニシエーションのための発がん物質と被験物質の投与スケジュールを巧みに組み合わせることにより、ラットに対して部分肝切除を行うことなく、発がんプロモーション活性の評価を行うことができることを知見した。
【0006】
上記の知見に基づいてなされた本発明の被験物質の発がんプロモーション活性を評価する方法は、請求項1記載の通り、哺乳類動物(ヒトを除く)に発がん物質を6〜10週間投与した後、被験物質を1〜3週間投与し、肝臓に発生したGST−P陽性細胞巣および/またはGGT(γ−グルタミルトランスペプチダーゼ)陽性細胞巣の面積が大きいほど発がんプロモーション活性が高いと判断することを特徴とする。
また、請求項2記載の方法は、請求項1記載の方法において、発がん物質として3’−メチル−4−ジメチルアミノアゾベンゼン、4−ジメチルアミノアゾベンゼン、o−アミノアゾトルエンから選択される少なくとも1つを投与することを特徴とする。
【発明の効果】
【0007】
本発明によれば、従来の方法に比較してより簡便に行うことができる発がんプロモーション活性の評価方法を提供することができる。
【図面の簡単な説明】
【0008】
【図1】実施例における各種の被験物質の発がんプロモーション活性を示す画像である。
【発明を実施するための形態】
【0009】
本発明の被験物質の発がんプロモーションに対する活性を評価する方法は、哺乳類動物(ヒトを除く)に発がん物質を6〜10週間投与した後、被験物質を1〜3週間投与し、肝臓に発生したGST−P陽性細胞巣および/またはGGT陽性細胞巣の面積が大きいほど発がんプロモーション活性が高いと判断することを特徴とするものである。
【0010】
本発明において利用することができる哺乳類動物(ヒトを除く)としては、ラットやマウスなどの齧歯類を例示することができる。
【0011】
哺乳類動物(ヒトを除く)への発がん物質と被験物質の投与は、経口から行うことが可能であり、例えば基礎食と共に自由摂取させたり、それ自体を食餌として自由摂取させることで行えばよい。基礎食への発がん物質や被験物質の添加量は、例えば0.01〜0.5%とすることが望ましい。
【0012】
発がん物質としては、3’−メチル−4−ジメチルアミノアゾベンゼン(3’−Me−DAB)の他、4−ジメチルアミノアゾベンゼン(DAB)やo−アミノアゾトルエンを好適に用いることができる。これらの発がん物質は、悪性度の低い前がん細胞群を誘発することから、被験物質の発がんプロモーション活性の評価を行いやすい点において望ましい。
【0013】
GST−P陽性細胞巣の面積は、例えば抗GST−P抗体を用いた自体公知の免疫組織化学的染色法によって細胞に存在するGST−Pを染色することで、また、GGT陽性細胞巣の面積は、例えば基質としてγ−グルタミル−4−メトキシ−2−ナフチルアミド(GMNA)を用いた自体公知の活性染色法によって細胞に存在するGGTを染色することで、それぞれ測定することができるが、本発明者が開発した特開2007−181444号公報に記載の以下の方法によれば、GST−P陽性細胞巣の面積とGGT陽性細胞巣の面積の測定を同時にかつ高精度に行うことができる。
【0014】
(1)哺乳類動物(ヒトを除く)の体内から肝臓を摘出して2〜6mm厚にスライスしてからアセトン固定する工程。
(2)アセトン固定した肝臓切片から20〜30μm厚の切片を連続的に複数枚調製する工程。
(3)調製した連続切片の1枚の面に対して抗GST−P抗体を用いて免疫組織化学的染色を行うとともに、このようにして免疫組織化学的染色を行った面と鏡面関係にある連続切片のもう1枚の面に対してGGTの活性染色を基質溶液中で行う工程。
(4)染色を行った2枚の連続切片の鏡像面をタングステンランプよりも熱発生量が少ない光源を用いた照明下でデジタル顕微鏡撮影する工程。
(5)得られた鏡像面のデジタル画像でGST−P陽性細胞巣が存在するポイントからその面積を測定するとともに、GST−P陽性細胞巣が存在するポイントとGGT陽性細胞巣が存在するポイントを比較し、共通するポイントからGGT陽性細胞巣の面積を測定する工程。
【0015】
被験物質の発がんプロモーション活性は、肝臓に発生したGST−P陽性細胞巣やGGT陽性細胞巣の面積が大きいほどが高い、即ち、発がんについての危険性が高いと判断することができるが(逆に言えば当該面積が小さいほど発がんについての安全性が高いと判断することができる)、発がん物質と被験物質の合計投与期間の全期間にわたって発がん物質を投与するプロトコルをコントロールとして採用し、コントロールにおける肝臓に発生したGST−P陽性細胞巣やGGT陽性細胞巣の面積と比較することで、より正確にその判断を行うことができる。GST−P陽性細胞巣の面積の増大はがん化する細胞の増殖能の目安となる。また、GGTは前がん細胞やがん細胞のマーカー酵素であるので、GGT陽性細胞巣の面積の増大は正常細胞からがん細胞への形質転換および/または悪性化の目安となる。従って、例えば、GST−P陽性細胞巣の面積はコントロールと同程度でも、GGT陽性細胞巣の面積がコントロールよりも大きければ、発がんプロモーション活性は高いと判断することができる。
【実施例】
【0016】
以下、本発明を実施例によって詳細に説明するが、本発明は以下の記載に限定して解釈されるものではない。
【0017】
実施例1:
(実験方法)
5週齢のSDラット雄(日本国Clea社より購入)に、発がんイニシエーターとして発がん物質である3’−Me−DABを0.05%添加した基礎食(MF飼料、以下同じ)を8週間自由摂取させた後、被験物質を添加した基礎食または被験物質自体を食餌として2週間自由摂取させた。試験開始から10週間後にラットの体内から肝臓を摘出し、3〜5mm厚にカミソリ刃を用いてスライスし、得られた肝臓切片を冷アセトン液(100%)に浸漬して固定化し、8℃で冷蔵庫保存した。2日後にアセトン液を交換し、さらに2日後に70%アセトン/30%水の混合液に交換し、8℃で冷蔵庫保存した。
次に、アセトン固定した肝臓切片から25μm厚の切片をマイクロスライサー(Vibratome 1500:米国Vibratome社)を用いて連続的に4枚調製した。
次に、連続切片の1枚の面に対する抗GST−P抗体を用いた免疫組織化学的染色を、Carcinogenesis 2002;23:1193−8に記載の方法に従って、1次抗体としてウサギ抗GST−Pポリクローナル抗体(日本国Medical and Biological Laboratories社)、2次抗体としてペルオキシダーゼを結合させたヤギ抗ウサギIgGポリクローナル抗体(Envision,labeled polymer,HRP,antirabbit:日本国Dako社)、ペルオキシダーゼの基質として3,3’−ジアミノベンジジンを用いて行った。なお、切片の洗浄操作は、先端口径5mmのゴムキャップを付けた広口ピペットで切片を吸い上げて洗浄液(リン酸緩衝液)に連続的に移し替えるという手法を採用し、能率的に行った。また、抗GST−P抗体を用いた免疫組織化学的染色を行った面と鏡面関係にある連続切片のもう1枚の面に対するGGTの活性染色を、J.Histochem.Cytochem.1969;17:517−26に記載の方法に従って、22mMのTris−HCl溶液にGMNA、グリシルグリシン、NaCl、4’−アミノ−2’,5’−ジエトキシベンズアニリドのジアゾニウム塩をそれぞれの濃度が0.57mM、3.3mM、93mM、0.52mMになるように添加して調製した基質溶液(pH7.6)に切片を浸漬し、時折溶液をかき混ぜながら15〜20分間室温にて反応を行った後、切片を0.1M硫酸銅水溶液に2分間浸漬することでアゾ染色カップリング反応を完結させてから食塩水で洗浄して行った(洗浄操作は上述した手法を採用)。
次に、光源に白色LEDを搭載したデジタル顕微鏡撮影装置として日本国Nikon社のCOOL SCOPEを用い、スライドガラス上に載置した染色標本の鏡像面のデジタル撮影を行った。
最後に、得られた鏡像面のデジタル画像のうちのGGT染色標本の画像を左右反転させ、GST−P陽性細胞巣が存在するポイントとGGT陽性細胞巣が存在するポイントの比較を行い、Carcinogenesis 2002;23:1193−8に記載の方法に従ってデータ解析を行った。
【0018】
(実験結果)
GST−P染色標本とGGT染色標本の鏡像面の2箇所の拡大画像を図1に示す(右:GST−P染色標本,左:GGT染色標本)。なお、図1において、Controlは3’−Me−DABを0.05%添加した基礎食を10週間自由摂取させたコントロールの結果(非特異的染色)、ETは被験物質としてD,L−メチオニンを0.25%添加した基礎食を投与した結果、EEは同、17α−エチニルエストラジオールを0.02%添加した基礎食を投与した結果、CMDは同、コリン−メチオニン欠乏食を食餌として基礎食の代わりに投与した結果、BITCは同、ベンジルイソチオシアネートを0.25%添加した基礎食を投与した結果である。図1から明らかなように、ベンジルイソチオシアネートを投与した場合、コントロールに比較してGST−P陽性細胞巣の面積が非常に大きく(図1に示した細胞巣は9000個を超える細胞から構成されている)、また、そのうちの87%がGGT陽性であることから(GGT陽性細胞巣)、ベンジルイソチオシアネートの発がんプロモーション活性は非常に高いことがわかった。同様に、D,L−メチオニンと17α−エチニルエストラジオールについても、発がんプロモーション活性が高いことがわかった。
【産業上の利用可能性】
【0019】
本発明は、従来の方法に比較してより簡便に行うことができる発がんプロモーション活性の評価方法を提供することができる点において産業上の利用可能性を有する。
【特許請求の範囲】
【請求項1】
被験物質の発がんプロモーション活性を評価する方法であって、哺乳類動物(ヒトを除く)に発がん物質を6〜10週間投与した後、被験物質を1〜3週間投与し、肝臓に発生した胎盤型グルタチオン−S−トランスフェラーゼ陽性細胞巣および/またはγ−グルタミルトランスペプチダーゼ陽性細胞巣の面積が大きいほど発がんプロモーション活性が高いと判断する方法。
【請求項2】
発がん物質として3’−メチル−4−ジメチルアミノアゾベンゼン、4−ジメチルアミノアゾベンゼン、o−アミノアゾトルエンから選択される少なくとも1つを投与する請求項1記載の方法。
【請求項1】
被験物質の発がんプロモーション活性を評価する方法であって、哺乳類動物(ヒトを除く)に発がん物質を6〜10週間投与した後、被験物質を1〜3週間投与し、肝臓に発生した胎盤型グルタチオン−S−トランスフェラーゼ陽性細胞巣および/またはγ−グルタミルトランスペプチダーゼ陽性細胞巣の面積が大きいほど発がんプロモーション活性が高いと判断する方法。
【請求項2】
発がん物質として3’−メチル−4−ジメチルアミノアゾベンゼン、4−ジメチルアミノアゾベンゼン、o−アミノアゾトルエンから選択される少なくとも1つを投与する請求項1記載の方法。
【図1】




【公開番号】特開2010−249633(P2010−249633A)
【公開日】平成22年11月4日(2010.11.4)
【国際特許分類】
【出願番号】特願2009−98834(P2009−98834)
【出願日】平成21年4月15日(2009.4.15)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り (1)平成20年10月15日 第28回日本分子腫瘍マーカー研究会事務局が発行する「第28回日本分子腫瘍マーカー研究会プログラム・講演抄録」に発表 (2)平成20年12月12日 独立行政法人科学技術振興機構が発行する「弘前大学新技術説明会資料集」に発表 (3)平成20年12月12日 国立大学法人弘前大学と独立行政法人科学技術振興機構が主催する「弘前大学新技術説明会」において文書をもって発表
【出願人】(504229284)国立大学法人弘前大学 (162)
【Fターム(参考)】
【公開日】平成22年11月4日(2010.11.4)
【国際特許分類】
【出願日】平成21年4月15日(2009.4.15)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り (1)平成20年10月15日 第28回日本分子腫瘍マーカー研究会事務局が発行する「第28回日本分子腫瘍マーカー研究会プログラム・講演抄録」に発表 (2)平成20年12月12日 独立行政法人科学技術振興機構が発行する「弘前大学新技術説明会資料集」に発表 (3)平成20年12月12日 国立大学法人弘前大学と独立行政法人科学技術振興機構が主催する「弘前大学新技術説明会」において文書をもって発表
【出願人】(504229284)国立大学法人弘前大学 (162)
【Fターム(参考)】
[ Back to top ]

