発光観察方法および発光観察システム
【課題】本発明の目的は、透過光や励起光の影響を受けない、より定量性の高い発光画像観察を可能にした発光観察方法および発光観察システムを提供することにある。
【解決手段】本発明は、本発明は、発光タンパク質を発現する遺伝子を導入した生物試料に対し、明視野観察用の照明光および/または蛍光観察用の励起光を照射する、明視野観察および/または蛍光観察ステップと、前記明視野観察および/または蛍光観察ステップ後、発光強度を経時的に検出し、得られた発光強度に基づいて、前記照明光および/または励起光由来のノイズを排除するためのインターバルを設定するとともに設定したインターバル条件に基づいて制御する、インターバル制御ステップと、前記インターバル終了後、発光画像を撮像する、発光画像撮像ステップと、を含む、発光観察方法を提供する。
【解決手段】本発明は、本発明は、発光タンパク質を発現する遺伝子を導入した生物試料に対し、明視野観察用の照明光および/または蛍光観察用の励起光を照射する、明視野観察および/または蛍光観察ステップと、前記明視野観察および/または蛍光観察ステップ後、発光強度を経時的に検出し、得られた発光強度に基づいて、前記照明光および/または励起光由来のノイズを排除するためのインターバルを設定するとともに設定したインターバル条件に基づいて制御する、インターバル制御ステップと、前記インターバル終了後、発光画像を撮像する、発光画像撮像ステップと、を含む、発光観察方法を提供する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、明視野観察用の照明光および/または蛍光観察用の励起光を照射しながら生物試料からの発光観察も併行して行う、発光観察方法および発光観察システムに関する。
【背景技術】
【0002】
生物発光を利用した標的遺伝子のイメージング(発光イメージング)は、生物試料中の遺伝子発現のダイナミズムを非侵襲的に観察することができるため、極めて有用な観察手法として広く用いられている。発光イメージングには、種々の発光材料が利用されているが、代表的なものとして、例えば、ホタル、ウミシイタケなど、各種生物に由来するルシフェラーゼ遺伝子が挙げられる。ルシフェラーゼは、発光基質であるルシフェリンを酸化し、発光を誘導する。
【0003】
例えば、標的遺伝子のプロモーターにルシフェラーゼ遺伝子を融合したベクターを生物試料に導入することによって、標的遺伝子とともにルシフェラーゼ遺伝子が共発現するので、生物試料における標的遺伝子の発現を視覚的に捉えることができる。
【0004】
また、標的遺伝子の発現量はルシフェラーゼ遺伝子の発現量と同調しているので、ルシフェラーゼによる発光量を測定することによって、標的遺伝子の発現量を算出することができる。例えば、異なる細胞、あるいは異なる組織部位での発光量を測定することによって、各細胞の応答性の相違、あるいは各組織部位での標的遺伝子の発現量の相違を、比較・検討することができる。
【0005】
さらにまた、定量性に優れた発光イメージングに明視野観察や蛍光観察を併用することによって、細胞の形態と遺伝子発現の様子を捉えるとともに、細胞内局在性や分子動態など、様々な細胞内現象を複合的に観察・評価することができる(特許文献1)。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】国際公開第2006/106882号パンフレット
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら従来手法では、明視野観察時の透過光や、蛍光観察時の励起光が高感度CCDカメラの検出部に蓄積されることで、発光観察時のノイズとして検出されてしまうことがあった。従って、本発明の目的は、透過光や励起光の影響を受けない、より定量性の高い発光画像観察を可能にした発光観察方法および発光観察システムを提供することにある。
【課題を解決するための手段】
【0008】
明視野観察用の照明光および/または蛍光観察用の励起光を照射した後に行った発光観察時の高感度CCDカメラのバックグラウンドノイズは、一定の関数曲線(以下、減光関数ともいう)を描きながら減衰していく。本発明者は、鋭意研究の結果、この減光関数に基づいて前記照明光および/または励起光のノイズを排除するためのインターバルを制御することによって、恒常的に高精度な発光画像を得ることに成功した。
【0009】
即ち、本発明は、発光タンパク質を発現する遺伝子を導入した生物試料に対し、明視野観察用の照明光および/または蛍光観察用の励起光を照射する、明視野観察および/または蛍光観察ステップと、前記明視野観察および/または蛍光観察ステップ後、発光強度を経時的に検出し、得られた発光強度に基づいて、前記照明光および/または励起光由来のノイズを排除するためのインターバルを設定するとともに設定したインターバル条件に基づいて制御する、インターバル制御ステップと、前記インターバル終了後、発光画像を撮像する、発光画像撮像ステップと、を含む、発光観察方法を提供する。
【0010】
また、本発明は、明視野観察用の照明光および/または蛍光観察用の励起光を照射する、光照射手段と、前記照明光および/または励起光のノイズを排除するためのインターバルを設定するとともに設定したインターバル条件に基づいた制御を実行する、インターバル制御手段と、前記インターバル制御手段による制御の下で発光画像を撮像する、発光画像撮像手段と、を備える、発光観察システムを提供する。
【発明の効果】
【0011】
本発明の発光観察方法および発光観察システムによって、透過光や励起光の影響を受けない、より定量性の高い発光画像観察を可能にした発光観察方法および発光観察システムを提供することができる。
【図面の簡単な説明】
【0012】
【図1】第1の実施形態における発光観察方法のフローチャート
【図2】第1の実施形態における発光観察方法のタイムフロー
【図3】第1の実施形態におけるインターバルを算出するために用いる減光関数のグラフ
【図4】第1の実施形態において使用する倒立型の発光観察システム100の模式図
【発明を実施するための形態】
【0013】
以下、図面を用いて本発明の実施形態について説明する。なお、以下に示す各実施形態は、本発明の構成を詳細に説明するために例示的に示したものに過ぎない。従って、本発明は、以下の各実施形態に記載された説明に基づいて限定解釈されるべきではない。本発明の範囲には、特許請求の範囲に記載された発明の範囲内にある限り、以下の各実施形態の種々の変形、改良形態を含む全ての実施形態が含まれる。
【0014】
1.発光観察方法
<第1の実施形態>
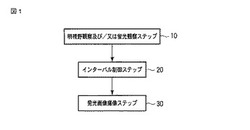
図1
図1は、第1の実施形態における発光観察方法のフローチャートである。
【0015】
(1)明視野観察および/または蛍光観察ステップ
先ず、発光タンパク質を発現する遺伝子を導入した生物試料に対し、明視野観察用の照明光および/または蛍光観察用の励起光を照射して明視野観察および/または蛍光観察を行う(10)。
【0016】
第1の実施形態に用いる「生物試料」は、特に制限されることなく、例えば、動物(ヒトを除く)、植物、菌類、真核単細胞生物、および原核生物からなる群から選択された生物体など、任意の生物種を選択することができる。また、生物試料は、生物個体から取り出した各種の器官もしくはその組織片であってもよく、あるいは前記組織片から取り出した細胞であってもよい。
【0017】
第1の実施形態に用いる「発光タンパク質を発現する遺伝子」には、任意の発光基質を添加することによって発光を誘導可能な発光タンパク質を発現する遺伝子(以下、発光タンパク質遺伝子ともいう)が含まれる。代表的なものとして、例えば、ホタル、ウミシイタケなど、各種生物に由来するルシフェラーゼ遺伝子が挙げられる。ルシフェラーゼは、発光基質であるルシフェリンをオキシルシフェリンに酸化し、その際に530nm付近の黄色の発光を誘導する。その他の例として、例えば、オワンクラゲに由来する青色蛍光蛋白質であるエクオリン(aequorin)遺伝子が知られている。エクオリンは、発光基質であるセレンテラジン(coelenterazine)を酸化し、青色発光を誘導する。また、エクオリン類似発光タンパク質であるオベリンは、特に、カルシウムイメージングに適した発光タンパク質である。オベリン(obeline)は、アポオベリン(カルシウム結合タンパク質)とセレンテラジン(発光基質)との複合タンパク質であり、これにカルシウムが結合すると、490nm付近の青色の光を発する。
【0018】
前記発光タンパク質遺伝子は、観察対象となる標的遺伝子のイメージングに用いているため、両遺伝子は連動して発現する必要がある。具体的には、発光タンパク質遺伝子を標的遺伝子のプロモーターに融合するように配置する。標的遺伝子のプロモーターに発光タンパク質遺伝子を融合したベクターを生物試料に導入することによって、標的遺伝子とともに発光タンパク質遺伝子が共発現するので、生物試料における標的遺伝子の発現を発光タンパク質を通して視覚的に捉えることができる。
【0019】
前記発光タンパク質遺伝子は、当業者に既知の任意の遺伝子組換え技術によって生物試料内に導入することができる。例えば、プラスミドなどの発現ベクターに発光タンパク質遺伝子を組み込み、該発現ベクターを、リン酸カルシウム法、リポフェクション法、パーティクルガン法、エレクトロポーレーション法、マイクロインジェクション法などを用いて生物試料内に導入してもよい。また、アデノウイルスやレトロウイルスベクターの感染力を利用して、発光タンパク質遺伝子を生物試料内に導入してもよい。さらにまた、発光タンパク質遺伝子を発現するトランスジェニック生物を作製してもよい。
【0020】
前記発光タンパク質遺伝子を導入した生物試料では、標的遺伝子の発現とともに発光タンパク質遺伝子が共発現するため、発光タンパク質の発光を検出することによって、標的遺伝子の観察・評価を行うことができる。
【0021】
「明視野観察用の照明光」とは、光学顕微鏡における通常の観察に用いられる照明光であり、細胞の形態や遺伝子発現の様子など、各種の一般的な観察をすることができる。
【0022】
「蛍光観察用の励起光」とは、蛍光顕微鏡における通常の観察に用いられる励起光である。発光観察と同様、標的遺伝子に隣接して蛍光タンパク質遺伝子を配置したベクターを生物試料に導入する。該ベクターを導入した生物試料は、標的遺伝子とともに蛍光タンパク質遺伝子を共発現するため、該標的遺伝子とともに発現した蛍光タンパク質を励起する特定波長の励起光を照射することによって、標的タンパク質の細胞内局在性や分子動態など、様々な細胞内現象を複合的に観察・評価することができる。代表的蛍光タンパク質としては、緑色蛍光蛋白質(GFP; Green Fluorescent Protein)などが挙げられる。かかる生物活性を有する蛍光タンパク質を発現させる方法以外に、生物活性を持たない種々の蛍光色素を生物試料の所望の部位または領域に対して標識するようにしてもよく、特異親和性を有する抗体等と結合させた、いわゆる蛍光プローブを用いることで特異的な標識を行うようにしてもよい。但し、生物発光エネルギー転移(BRET)による蛍光は、励起光照射を用いない蛍光であるため、本発明では発光(とくに生物発光)に含めることとし、蛍光観察画像としては扱わない。
【0023】
蛍光観察は高感度な検出が可能である点、有力な観察手法であるが、生物試料に強い励起光を照射するため、生物試料の損傷が大きい。一般に、蛍光観察は24時間程度の観察に使われることが多い。これに対して、発光観察は発光タンパク質遺伝子の発現と、発光用の酵素が反応することによる発光に基づく自己発光を検出するため、生物試料に物理的ダメージを与えることがない。一般に、発光観察は数日〜数週間程度にわたる長期間の観察が可能となる。したがって、生物試料を長時間にわたって経時的に観察する場合、発光観察による経過観察を基本とし、この観察結果に応じて適宜、蛍光観察に切り換えるといった観察手法が有力である。
【0024】
(2)インターバル制御ステップ
続いて、前記明視野観察および/または蛍光観察ステップ後、発光強度を経時的に検出し、得られた発光強度に基づいて、前記照明光および/または励起光のノイズを排除するためのインターバルを制御する(20)。
【0025】
「インターバル」とは、明視野観察および/または蛍光観察後、発光観察に至るまでの時間を意味する。上述したように、発光観察は、物理的ストレスを加えることなく非侵襲的に観察を行うことができるため、特に、長時間にわたる経時観察に適しているが、得られる発光量が微弱であるため、相対的に照明光や励起光のノイズの影響を受けやすい。したがって、結像光学系と撮像系(例えば、CCDカメラ、CMOSカメラ等)で構成される発光画像撮像手段で検出される発光強度から照明光および/または励起光のノイズが排除されるまで、インターバルを設け、インターバル経過後に発光観察を開始することによって、照明光や励起光のノイズの影響が排除された、高精度な発光観察が実現される。
【0026】
図2
図2は、第1の実施形態における発光観察方法のタイムフローである。
【0027】
図2では、一例として、明視野観察および蛍光観察の後、所定のインターバル経過後に発光観察を行い、以後、同様の観察順序を繰り返す観察手法を表わしている。より具体的には、明視野/蛍光観察1の後、所定のインターバルI1を設ける。インターバルI1は、明視野/蛍光観察1に用いた照明光および励起光のノイズを排除するために必要な時間である。そして、インターバルI1の経過後、発光観察1を行う(第1の観察サイクルS1)。以後同様に、明視野/蛍光観察2の後、所定のインターバルI2を設ける。インターバルI2の経過後、発光観察2を行う(第2の観察サイクルS2)。発光観察2の後、同様に、明視野/蛍光観察3を行い、第3の観察サイクルS3に入る。各観察サイクルは連続的に行ってもよいし(図中、T=0)、あるいは任意の時間間隔を空けて断続的に行ってもよい(図中、T=k(kは任意の時間))。
【0028】
インターバルは、明視野観察および/または蛍光観察(以下、明視野観察等ともいう)の時間や方法(光量、各観察の組み合わせなど)によって変化するため、各観察態様ごとに最適なインターバルを算出する。インターバルの算出方法は、減光関数に基づいて行う。ここで「減光関数」とは、発光強度を経時的に測定したときに現れる一定の関数曲線を意味する。この減光関数に基づいてインターバルを制御することによって、ノイズの影響が排除された高精度な発光観察を行うために必要な最短のインターバルを恒常的に算出することができる。
【0029】
図3
図3は、第1の実施形態におけるインターバルを算出するために用いる減光関数を表わすグラフである。
【0030】
図3は、明視野観察および/または蛍光観察後のインターバルの間に検出された発光強度を表わしている。撮像には蛍光観察と明視野観察が可能な発光観察顕微鏡LV200 (Olympus)を使用し、画像データから全観察視野の発光強度の平均値を算出し、これをデータとして採用した。縦軸の発光強度は、16ビット画像を数値化した数値データをプロットしたものであり、最大値が64400となる相対値である。
【0031】
観察対象としては、HeLa細胞を使用した。先ず、DMEM培地(10%FCS溶液入り)内の35mmガラスボトムディッシュでHeLa細胞を一晩培養後、蛍光タンパク質GFP(Green Fluorescent Protein)遺伝子を一過性発現させた。さらに一晩培養し、培地をフェノールレッド抜きのDMEM溶液に置き換えて、D-ルシフェリン溶液(プロメガ製、終濃度100μM)を加えた。その後、発光イメージングシステムLV200(オリンパス)を使用して観察を行った。
【0032】
なお、本検討では、発光観察時の蛍光ノイズとバックグラウンドレベル(BGレベル)の測定を目的としたため、ルシフェラーゼ遺伝子は導入していないが、ルシフェラーゼ遺伝子を導入した場合であっても、同様の減光関数曲線が得られる。このとき得られる減光関数曲線を構成する経時毎の各データ値には、観察視野内の生物試料が発するルシフェラーゼ発光量の平均値が加算されているが、図3の縦軸の発光強度は相対値であるので、得られる結果に相違はない。以下、説明の便宜上、図3の減光関数を構成する経時毎の各データ値には、生物試料の発光強度が含まれていると仮定して説明する。
【0033】
照明光および/または励起光の遮断後(以下、光遮断後ともいう)(0分)、露出時間1分の発光連続測定を行い、検出された発光強度をプロットした。図3に示したように、検出された発光強度は、光遮断直後は急激に低下し、時間経過とともに減少幅が小さくなる。光遮断直後では、照明光や励起光のノイズが強く残存しているため、検出される発光強度は、実際に生物試料から放出された発光量よりも高く検出される。時間経過とともに、ノイズが低下し、検出される発光強度の総量が、実際に生物試料から放出される発光量に近似してくる。
【0034】
第1の実施形態において、インターバルは、前記発光強度が所定の閾値以下に達したときに終了する。所定の閾値は、照明光や励起光を照射しない状態でのバックグラウンドレベル(BGレベル)以上の任意の値に設定することができる。
【0035】
ここで、BGレベルとは、暗電流などによるカメラ側のCCDチップのノイズであることが考えられる。BGレベルは、例えば、生物試料が細胞である場合、観察領域を格子状に複数領域に分割し、各領域ごとに光量を検出した後、最も低い光量を同定することによって行われる。このとき、最も低い光量を示す領域は細胞が存在しない領域(無細胞領域)であると推定することができるので、この光量をBGレベルとして設定することができる。その他、あらかじめ数値化する領域を指定してBGレベルを測定することも有効である。このとき、数値化する領域は、無細胞領域であり、明視野観察によってあらかじめ指定することができる。
【0036】
前記所定の閾値は、観察系や所望の観察精度など、測定者が定める諸般の測定条件等を考慮しながら決定することができる。具体例として、図3の発光強度において前記BGレベルが1900程度であったとき、所定の閾値を、例えば2100に設定することができる。そして、明視野観察および/または蛍光観察後、インターバル継続中に数点データ測定を行い、全観察視野の発光強度の平均値が、前記閾値2100以下に達したとき、インターバルを終了して発光観察を開始する(図3では、10分後)。このとき付与されたインターバルは、照明光や励起光のノイズを排除するために必要な最短の時間である。BGレベルは一定なので、この時点で発光観察に移行した場合、検出された発光強度からBGレベルを差し引くことによって生物試料由来の発光量を正確に検出することができる。
【0037】
他の実施形態において、インターバルは、前記発光強度の減光率が所定の閾値以下に達したときに終了する。ここで、「減光率」とは、単位時間当たりの発光強度の減少の割合を意味する。例えば、図3の露出時間1分の発光連続測定において、光遮断1分後の発光強度は約3200であり、光遮断2分後の発光強度は約2600であり、このときの減光率は、{(3200−2600)/3200}×100=18.75(%)となる。例えば、減光率の閾値を5%に設定し、インターバルの間に数点データ測定を行い、経時毎の各数値データ間の減光率が5%以下に達したとき、発光観察を開始する。このとき付与されたインターバルは、第1の実施形態と同様、高精度な発光観察に必要な最短の待ち時間であり、該インターバルの制御方法によって、ノイズの影響を常に一定の割合で排除することができる。
【0038】
最適な減光率の閾値は、これに限定されるわけではないが、例えば、20%、15%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、0.1%、0.05%、および0.01%から適宜選択される。
【0039】
なお、インターバル中の測定は、必ずしも明視野/蛍光観察直後から行う必要はない。例えば、事前の実験において最低5分程度は減光が進行することが分っている場合、明視野/蛍光観察から5分経過後に測定を開始してもよい。また、生物試料の撮像は、インターバル終了後に開始してもよいし、あるいはインターバルおよび発光観察の露出時間を同一とし、観察後に適した画像を選択してもよい。
【0040】
第1の実施形態において、インターバルは、実際の観察における各インターバル毎に制御してもよい。例えば、図2におけるインターバル1の間に露出時間1分の発光連続測定を行い、得られた減光関数に基づいてインターバル終了時点を決定する。同様に、インターバル2の間に露出時間1分の発光連続測定を行い、得られた減光関数に基づいてインターバル終了時点を決定する。このとき、インターバル1および2は、それぞれ独立して制御されている。上記インターバル制御方法によれば、各観察サイクルの明視野・蛍光観察方法(時間、光量など)が異なる場合であっても、常に最適なインターバルを提供することができる。
【0041】
他の実施形態において、インターバルは、予め設定された所定のインターバルで制御されてもよい。例えば、前記発光観察を行う観察系と同一または類似の観察系において、事前に最適なインターバルを決定し、実際の観察における各インターバルは、この予め設定された所定のインターバルで統一して制御する。この場合、各観察サイクル毎にインターバルを決定するための発光連続測定を行う必要がなくなるので、簡易なインターバルの制御が実現される。特に、各観察サイクルの明視野・蛍光観察方法(時間、光量など)が同一条件である場合、上記インターバル制御方法は有効である。
【0042】
またさらに他の実施態様において、インターバルは、所定のインターバルで撮像された発光画像に対して、上記BGレベル以下(または未満)となった時刻に相当する撮像データ分を差し引いたり、発光画像形成に必要な蓄積時間相当の撮像データ領域を全体的にズラすようにして、ノイズの無い発光画像を生成するように制御するのも有効である。
【0043】
その他、初回の観察サイクルのみインターバルを決定し、2回目以降の観察サイクルでは初回に決定したインターバルで統一制御してもよい。この場合、事前にインターバルを決定する必要がなく、かつ観察サイクル毎にインターバルを決定する必要もないので、極めて簡易なインターバルの制御が実現される。
【0044】
(3)発光画像撮像ステップ
前記インターバル終了後、発光画像を撮像する(30)。
【0045】
上述したように、設定されたインターバル経過後には、照明光や励起光のノイズが排除されているため、生物試料自体が発する発光のみを正確に検出することができる。生物発光は微弱な光のため、暗視野において観察を行う。その他、発光観察の手法は、出願時に公知の任意の観察手法を適用することができる。
【0046】
なお、生物発光を観察するためには、発光基質を別途添加する必要がある。例えば、ルシフェラーゼ発光を検出する場合、生物試料には、発光基質であるルシフェリンを導入する。また、エクオリンやオベリン発光を検出する場合、生物試料には、セレンテラジンを導入する。ルシフェリンやセレンテラジン(以下、ルシフェリン等ともいう)を導入する方法としては、例えば、ルシフェリン等溶液を観察対象部位に直接噴霧する方法や、ルシフェリン等を培養液など、生物試料を保持する溶液に添加する方法などがある。
【0047】
図2に示したように、発光観察の終了によって、その観察サイクルは終了する。続けて次の観察サイクルに移行してもよいし、あるいは全観察を終了してもよい。次の観察サイクルに移行する場合、前記発光観察後、直ちに移行してもよいし、任意の時間経過後に移行してもよい。
【0048】
2.発光観察システム
図4
図4は、第1の実施形態において使用する倒立型の発光観察システム100の模式図である。
【0049】
図4の発光観察システム100は、明視野観察用の照明光および/または蛍光観察用の励起光を照射する、光照射手段110と、前記照明光および/または励起光のノイズを排除するためのインターバルを制御する、インターバル制御手段130と、発光画像を撮像する、発光画像撮像手段120と、を備えている。
【0050】
光照射手段110には、明視野観察用の照明光および/または蛍光観察用の励起光を照射可能な任意の光照射手段を用いることができる。図4には、例示的に、明視野観察および蛍光観察が可能な光照射手段110を示した。
【0051】
先ず、光照射手段110は、明視野観察用の照明手段として、光源106、シャッター107、およびダイクロイックミラー108を備える。光源106は、明視野観察用の照明であり、光源106から照射された照明光は、シャッター107を通過してダイクロイックミラー108に至り、該ダイクロイックミラーに反射して生物試料Aに照射される。シャッター107は、照明光を遮断することによって、生物試料Aへの照明光の照射のオン/オフを制御する。
【0052】
次に、光照射手段110は、蛍光観察用の励起手段として、光源101、励起用分光フィルター102、光ファイバー103、コンデンサーレンズ104、およびシャッター105を備える。光源101は、励起光を照射するためのものであり、具体的には、キセノンランプ、ハロゲン等のランプ、レーザー、LEDなどである。
【0053】
光源101から発せられた励起光は、励起用分光フィルター102を通して波長領域の異なる複数の励起光に分離され、分離された各励起光は、光ファイバー103およびコンデンサーレンズ104を通して生物試料Aに照射される。コンデンサーレンズ104は、生物試料Aを均等に照明するために用いるレンズであり、光ファイバー103によって導かれた各励起光を集光する。また、シャッター105は、光ファイバー103から照射される励起光を遮断することによって、生物試料Aへの励起光の照射のオン/オフを制御する。
【0054】
なお、生物試料Aは、例えば、サンプル用容器50に収納された状態で観察される。サンプル用容器50には、これに限定されるわけではないが、例えば、シャーレ、スライドガラス、マイクロプレート、ゲル支持体、微粒子担体などが含まれる。また、サンプル用容器50は、観察用ステージ60に配置される。また、生物試料Aは、それ自身が小動物等の生体内に設けられた観察部位であってもよい(in vivoイメージングまたは内視鏡等を参照)。その場合、上方から観察する正立型であってもよい。
【0055】
生物試料Aに照射された照明光は、下方に配置されたCCDカメラ113で検出され、明視野観察画像が取得される。また、生物試料Aに照射された励起光によって、生物試料A中に予め導入された蛍光物質が励起されて蛍光を発する。生物試料Aから放出された蛍光は、下方に配置されたCCDカメラ113で検出され、蛍光観察画像が取得される。
【0056】
続いて、インターバル制御手段130には、前記照明光および/または励起光のノイズを排除するためのインターバルを制御可能な任意のインターバル制御手段を用いることができる。一般的には、諸般の画像処理用のソフトウェアを用いたパーソナルコンピュータによる制御が有効である。パーソナルコンピュータは、CCDカメラ113によって撮像された明視野および/または蛍光観察画像情報に基づいて減光関数を抽出し、該減光関数から最適なインターバルを決定する。その他、CCDカメラ113とは別に、光電子増倍管(Photomultiplier; PMT)を新たに用意し、該PMTを用いて前記照明光や励起光のノイズを検出してもよい。
【0057】
インターバルの制御は、上述したように、各インターバル毎に行ってもよいし、同一または類似の観察系において事前にインターバルを決定し、該インターバルで一律に制御してもよい。また、初回のインターバルのみ決定し、該インターバルで2回目以降を一律に制御してもよい。さらにまた、減光関数を構成する発光強度の測定は、任意の時間間隔で行うことができる。照明光や励起光のノイズが無視できるレベルに達するまでインターバルを設けることで、微弱な発光検出をS/N比(Signal to Noise ratio)良く検出することができる。
【0058】
最後に、発光画像撮像手段120には、発光画像を撮像可能な任意の撮像手段を用いることができる。その具体的構成としては、例えば、前記発光画像撮像手段120は、対物レンズ111、結像レンズ112、およびCCDカメラ113により構成される。対物レンズ111は、「(開口数/倍率)2の値が0.01以上」という条件を満たすものであることが好ましい。生物試料Aから放出された発光は、対物レンズ111および結像レンズ112を通過してCCDカメラ113によって検出され、発光観察画像が取得される。
【0059】
撮像手段として使用するCCDカメラ113は、明視野観察画像および蛍光観察画像を取得したカメラである。したがって、照明光や励起光の遮断後、CCDカメラ113には照明光や励起光のノイズが残存するため、正確な発光観察を行うことができない。しかしながら、本発明の発光観察システム100では、インターバル制御手段130によって最適なインターバルが設定され、該インターバル経過後に発光観察が行われるため、CCDカメラに残存した照明光や励起光のノイズが排除され、正確な発光観察を行うことができる。
【符号の説明】
【0060】
10・・・明視野観察及び/又は蛍光観察ステップ、20・・・インターバル制御ステップ、30・・・発光画像撮像ステップ、50・・・サンプル用容器、60・・・観察用ステージ、100・・・発光観察システム、101、106・・・光源、102・・・励起用分光フィルター、103・・・光ファイバー、104・・・コンデンサーレンズ、105、107・・・シャッター、108・・・ダイクロイックミラー、110・・・光照射手段、111・・・対物レンズ、112・・・結像レンズ、113・・・CCDカメラ、120・・・発光画像撮像手段、130・・・インターバル制御手段、A・・・生物試料
【技術分野】
【0001】
本発明は、明視野観察用の照明光および/または蛍光観察用の励起光を照射しながら生物試料からの発光観察も併行して行う、発光観察方法および発光観察システムに関する。
【背景技術】
【0002】
生物発光を利用した標的遺伝子のイメージング(発光イメージング)は、生物試料中の遺伝子発現のダイナミズムを非侵襲的に観察することができるため、極めて有用な観察手法として広く用いられている。発光イメージングには、種々の発光材料が利用されているが、代表的なものとして、例えば、ホタル、ウミシイタケなど、各種生物に由来するルシフェラーゼ遺伝子が挙げられる。ルシフェラーゼは、発光基質であるルシフェリンを酸化し、発光を誘導する。
【0003】
例えば、標的遺伝子のプロモーターにルシフェラーゼ遺伝子を融合したベクターを生物試料に導入することによって、標的遺伝子とともにルシフェラーゼ遺伝子が共発現するので、生物試料における標的遺伝子の発現を視覚的に捉えることができる。
【0004】
また、標的遺伝子の発現量はルシフェラーゼ遺伝子の発現量と同調しているので、ルシフェラーゼによる発光量を測定することによって、標的遺伝子の発現量を算出することができる。例えば、異なる細胞、あるいは異なる組織部位での発光量を測定することによって、各細胞の応答性の相違、あるいは各組織部位での標的遺伝子の発現量の相違を、比較・検討することができる。
【0005】
さらにまた、定量性に優れた発光イメージングに明視野観察や蛍光観察を併用することによって、細胞の形態と遺伝子発現の様子を捉えるとともに、細胞内局在性や分子動態など、様々な細胞内現象を複合的に観察・評価することができる(特許文献1)。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】国際公開第2006/106882号パンフレット
【発明の概要】
【発明が解決しようとする課題】
【0007】
しかしながら従来手法では、明視野観察時の透過光や、蛍光観察時の励起光が高感度CCDカメラの検出部に蓄積されることで、発光観察時のノイズとして検出されてしまうことがあった。従って、本発明の目的は、透過光や励起光の影響を受けない、より定量性の高い発光画像観察を可能にした発光観察方法および発光観察システムを提供することにある。
【課題を解決するための手段】
【0008】
明視野観察用の照明光および/または蛍光観察用の励起光を照射した後に行った発光観察時の高感度CCDカメラのバックグラウンドノイズは、一定の関数曲線(以下、減光関数ともいう)を描きながら減衰していく。本発明者は、鋭意研究の結果、この減光関数に基づいて前記照明光および/または励起光のノイズを排除するためのインターバルを制御することによって、恒常的に高精度な発光画像を得ることに成功した。
【0009】
即ち、本発明は、発光タンパク質を発現する遺伝子を導入した生物試料に対し、明視野観察用の照明光および/または蛍光観察用の励起光を照射する、明視野観察および/または蛍光観察ステップと、前記明視野観察および/または蛍光観察ステップ後、発光強度を経時的に検出し、得られた発光強度に基づいて、前記照明光および/または励起光由来のノイズを排除するためのインターバルを設定するとともに設定したインターバル条件に基づいて制御する、インターバル制御ステップと、前記インターバル終了後、発光画像を撮像する、発光画像撮像ステップと、を含む、発光観察方法を提供する。
【0010】
また、本発明は、明視野観察用の照明光および/または蛍光観察用の励起光を照射する、光照射手段と、前記照明光および/または励起光のノイズを排除するためのインターバルを設定するとともに設定したインターバル条件に基づいた制御を実行する、インターバル制御手段と、前記インターバル制御手段による制御の下で発光画像を撮像する、発光画像撮像手段と、を備える、発光観察システムを提供する。
【発明の効果】
【0011】
本発明の発光観察方法および発光観察システムによって、透過光や励起光の影響を受けない、より定量性の高い発光画像観察を可能にした発光観察方法および発光観察システムを提供することができる。
【図面の簡単な説明】
【0012】
【図1】第1の実施形態における発光観察方法のフローチャート
【図2】第1の実施形態における発光観察方法のタイムフロー
【図3】第1の実施形態におけるインターバルを算出するために用いる減光関数のグラフ
【図4】第1の実施形態において使用する倒立型の発光観察システム100の模式図
【発明を実施するための形態】
【0013】
以下、図面を用いて本発明の実施形態について説明する。なお、以下に示す各実施形態は、本発明の構成を詳細に説明するために例示的に示したものに過ぎない。従って、本発明は、以下の各実施形態に記載された説明に基づいて限定解釈されるべきではない。本発明の範囲には、特許請求の範囲に記載された発明の範囲内にある限り、以下の各実施形態の種々の変形、改良形態を含む全ての実施形態が含まれる。
【0014】
1.発光観察方法
<第1の実施形態>
図1
図1は、第1の実施形態における発光観察方法のフローチャートである。
【0015】
(1)明視野観察および/または蛍光観察ステップ
先ず、発光タンパク質を発現する遺伝子を導入した生物試料に対し、明視野観察用の照明光および/または蛍光観察用の励起光を照射して明視野観察および/または蛍光観察を行う(10)。
【0016】
第1の実施形態に用いる「生物試料」は、特に制限されることなく、例えば、動物(ヒトを除く)、植物、菌類、真核単細胞生物、および原核生物からなる群から選択された生物体など、任意の生物種を選択することができる。また、生物試料は、生物個体から取り出した各種の器官もしくはその組織片であってもよく、あるいは前記組織片から取り出した細胞であってもよい。
【0017】
第1の実施形態に用いる「発光タンパク質を発現する遺伝子」には、任意の発光基質を添加することによって発光を誘導可能な発光タンパク質を発現する遺伝子(以下、発光タンパク質遺伝子ともいう)が含まれる。代表的なものとして、例えば、ホタル、ウミシイタケなど、各種生物に由来するルシフェラーゼ遺伝子が挙げられる。ルシフェラーゼは、発光基質であるルシフェリンをオキシルシフェリンに酸化し、その際に530nm付近の黄色の発光を誘導する。その他の例として、例えば、オワンクラゲに由来する青色蛍光蛋白質であるエクオリン(aequorin)遺伝子が知られている。エクオリンは、発光基質であるセレンテラジン(coelenterazine)を酸化し、青色発光を誘導する。また、エクオリン類似発光タンパク質であるオベリンは、特に、カルシウムイメージングに適した発光タンパク質である。オベリン(obeline)は、アポオベリン(カルシウム結合タンパク質)とセレンテラジン(発光基質)との複合タンパク質であり、これにカルシウムが結合すると、490nm付近の青色の光を発する。
【0018】
前記発光タンパク質遺伝子は、観察対象となる標的遺伝子のイメージングに用いているため、両遺伝子は連動して発現する必要がある。具体的には、発光タンパク質遺伝子を標的遺伝子のプロモーターに融合するように配置する。標的遺伝子のプロモーターに発光タンパク質遺伝子を融合したベクターを生物試料に導入することによって、標的遺伝子とともに発光タンパク質遺伝子が共発現するので、生物試料における標的遺伝子の発現を発光タンパク質を通して視覚的に捉えることができる。
【0019】
前記発光タンパク質遺伝子は、当業者に既知の任意の遺伝子組換え技術によって生物試料内に導入することができる。例えば、プラスミドなどの発現ベクターに発光タンパク質遺伝子を組み込み、該発現ベクターを、リン酸カルシウム法、リポフェクション法、パーティクルガン法、エレクトロポーレーション法、マイクロインジェクション法などを用いて生物試料内に導入してもよい。また、アデノウイルスやレトロウイルスベクターの感染力を利用して、発光タンパク質遺伝子を生物試料内に導入してもよい。さらにまた、発光タンパク質遺伝子を発現するトランスジェニック生物を作製してもよい。
【0020】
前記発光タンパク質遺伝子を導入した生物試料では、標的遺伝子の発現とともに発光タンパク質遺伝子が共発現するため、発光タンパク質の発光を検出することによって、標的遺伝子の観察・評価を行うことができる。
【0021】
「明視野観察用の照明光」とは、光学顕微鏡における通常の観察に用いられる照明光であり、細胞の形態や遺伝子発現の様子など、各種の一般的な観察をすることができる。
【0022】
「蛍光観察用の励起光」とは、蛍光顕微鏡における通常の観察に用いられる励起光である。発光観察と同様、標的遺伝子に隣接して蛍光タンパク質遺伝子を配置したベクターを生物試料に導入する。該ベクターを導入した生物試料は、標的遺伝子とともに蛍光タンパク質遺伝子を共発現するため、該標的遺伝子とともに発現した蛍光タンパク質を励起する特定波長の励起光を照射することによって、標的タンパク質の細胞内局在性や分子動態など、様々な細胞内現象を複合的に観察・評価することができる。代表的蛍光タンパク質としては、緑色蛍光蛋白質(GFP; Green Fluorescent Protein)などが挙げられる。かかる生物活性を有する蛍光タンパク質を発現させる方法以外に、生物活性を持たない種々の蛍光色素を生物試料の所望の部位または領域に対して標識するようにしてもよく、特異親和性を有する抗体等と結合させた、いわゆる蛍光プローブを用いることで特異的な標識を行うようにしてもよい。但し、生物発光エネルギー転移(BRET)による蛍光は、励起光照射を用いない蛍光であるため、本発明では発光(とくに生物発光)に含めることとし、蛍光観察画像としては扱わない。
【0023】
蛍光観察は高感度な検出が可能である点、有力な観察手法であるが、生物試料に強い励起光を照射するため、生物試料の損傷が大きい。一般に、蛍光観察は24時間程度の観察に使われることが多い。これに対して、発光観察は発光タンパク質遺伝子の発現と、発光用の酵素が反応することによる発光に基づく自己発光を検出するため、生物試料に物理的ダメージを与えることがない。一般に、発光観察は数日〜数週間程度にわたる長期間の観察が可能となる。したがって、生物試料を長時間にわたって経時的に観察する場合、発光観察による経過観察を基本とし、この観察結果に応じて適宜、蛍光観察に切り換えるといった観察手法が有力である。
【0024】
(2)インターバル制御ステップ
続いて、前記明視野観察および/または蛍光観察ステップ後、発光強度を経時的に検出し、得られた発光強度に基づいて、前記照明光および/または励起光のノイズを排除するためのインターバルを制御する(20)。
【0025】
「インターバル」とは、明視野観察および/または蛍光観察後、発光観察に至るまでの時間を意味する。上述したように、発光観察は、物理的ストレスを加えることなく非侵襲的に観察を行うことができるため、特に、長時間にわたる経時観察に適しているが、得られる発光量が微弱であるため、相対的に照明光や励起光のノイズの影響を受けやすい。したがって、結像光学系と撮像系(例えば、CCDカメラ、CMOSカメラ等)で構成される発光画像撮像手段で検出される発光強度から照明光および/または励起光のノイズが排除されるまで、インターバルを設け、インターバル経過後に発光観察を開始することによって、照明光や励起光のノイズの影響が排除された、高精度な発光観察が実現される。
【0026】
図2
図2は、第1の実施形態における発光観察方法のタイムフローである。
【0027】
図2では、一例として、明視野観察および蛍光観察の後、所定のインターバル経過後に発光観察を行い、以後、同様の観察順序を繰り返す観察手法を表わしている。より具体的には、明視野/蛍光観察1の後、所定のインターバルI1を設ける。インターバルI1は、明視野/蛍光観察1に用いた照明光および励起光のノイズを排除するために必要な時間である。そして、インターバルI1の経過後、発光観察1を行う(第1の観察サイクルS1)。以後同様に、明視野/蛍光観察2の後、所定のインターバルI2を設ける。インターバルI2の経過後、発光観察2を行う(第2の観察サイクルS2)。発光観察2の後、同様に、明視野/蛍光観察3を行い、第3の観察サイクルS3に入る。各観察サイクルは連続的に行ってもよいし(図中、T=0)、あるいは任意の時間間隔を空けて断続的に行ってもよい(図中、T=k(kは任意の時間))。
【0028】
インターバルは、明視野観察および/または蛍光観察(以下、明視野観察等ともいう)の時間や方法(光量、各観察の組み合わせなど)によって変化するため、各観察態様ごとに最適なインターバルを算出する。インターバルの算出方法は、減光関数に基づいて行う。ここで「減光関数」とは、発光強度を経時的に測定したときに現れる一定の関数曲線を意味する。この減光関数に基づいてインターバルを制御することによって、ノイズの影響が排除された高精度な発光観察を行うために必要な最短のインターバルを恒常的に算出することができる。
【0029】
図3
図3は、第1の実施形態におけるインターバルを算出するために用いる減光関数を表わすグラフである。
【0030】
図3は、明視野観察および/または蛍光観察後のインターバルの間に検出された発光強度を表わしている。撮像には蛍光観察と明視野観察が可能な発光観察顕微鏡LV200 (Olympus)を使用し、画像データから全観察視野の発光強度の平均値を算出し、これをデータとして採用した。縦軸の発光強度は、16ビット画像を数値化した数値データをプロットしたものであり、最大値が64400となる相対値である。
【0031】
観察対象としては、HeLa細胞を使用した。先ず、DMEM培地(10%FCS溶液入り)内の35mmガラスボトムディッシュでHeLa細胞を一晩培養後、蛍光タンパク質GFP(Green Fluorescent Protein)遺伝子を一過性発現させた。さらに一晩培養し、培地をフェノールレッド抜きのDMEM溶液に置き換えて、D-ルシフェリン溶液(プロメガ製、終濃度100μM)を加えた。その後、発光イメージングシステムLV200(オリンパス)を使用して観察を行った。
【0032】
なお、本検討では、発光観察時の蛍光ノイズとバックグラウンドレベル(BGレベル)の測定を目的としたため、ルシフェラーゼ遺伝子は導入していないが、ルシフェラーゼ遺伝子を導入した場合であっても、同様の減光関数曲線が得られる。このとき得られる減光関数曲線を構成する経時毎の各データ値には、観察視野内の生物試料が発するルシフェラーゼ発光量の平均値が加算されているが、図3の縦軸の発光強度は相対値であるので、得られる結果に相違はない。以下、説明の便宜上、図3の減光関数を構成する経時毎の各データ値には、生物試料の発光強度が含まれていると仮定して説明する。
【0033】
照明光および/または励起光の遮断後(以下、光遮断後ともいう)(0分)、露出時間1分の発光連続測定を行い、検出された発光強度をプロットした。図3に示したように、検出された発光強度は、光遮断直後は急激に低下し、時間経過とともに減少幅が小さくなる。光遮断直後では、照明光や励起光のノイズが強く残存しているため、検出される発光強度は、実際に生物試料から放出された発光量よりも高く検出される。時間経過とともに、ノイズが低下し、検出される発光強度の総量が、実際に生物試料から放出される発光量に近似してくる。
【0034】
第1の実施形態において、インターバルは、前記発光強度が所定の閾値以下に達したときに終了する。所定の閾値は、照明光や励起光を照射しない状態でのバックグラウンドレベル(BGレベル)以上の任意の値に設定することができる。
【0035】
ここで、BGレベルとは、暗電流などによるカメラ側のCCDチップのノイズであることが考えられる。BGレベルは、例えば、生物試料が細胞である場合、観察領域を格子状に複数領域に分割し、各領域ごとに光量を検出した後、最も低い光量を同定することによって行われる。このとき、最も低い光量を示す領域は細胞が存在しない領域(無細胞領域)であると推定することができるので、この光量をBGレベルとして設定することができる。その他、あらかじめ数値化する領域を指定してBGレベルを測定することも有効である。このとき、数値化する領域は、無細胞領域であり、明視野観察によってあらかじめ指定することができる。
【0036】
前記所定の閾値は、観察系や所望の観察精度など、測定者が定める諸般の測定条件等を考慮しながら決定することができる。具体例として、図3の発光強度において前記BGレベルが1900程度であったとき、所定の閾値を、例えば2100に設定することができる。そして、明視野観察および/または蛍光観察後、インターバル継続中に数点データ測定を行い、全観察視野の発光強度の平均値が、前記閾値2100以下に達したとき、インターバルを終了して発光観察を開始する(図3では、10分後)。このとき付与されたインターバルは、照明光や励起光のノイズを排除するために必要な最短の時間である。BGレベルは一定なので、この時点で発光観察に移行した場合、検出された発光強度からBGレベルを差し引くことによって生物試料由来の発光量を正確に検出することができる。
【0037】
他の実施形態において、インターバルは、前記発光強度の減光率が所定の閾値以下に達したときに終了する。ここで、「減光率」とは、単位時間当たりの発光強度の減少の割合を意味する。例えば、図3の露出時間1分の発光連続測定において、光遮断1分後の発光強度は約3200であり、光遮断2分後の発光強度は約2600であり、このときの減光率は、{(3200−2600)/3200}×100=18.75(%)となる。例えば、減光率の閾値を5%に設定し、インターバルの間に数点データ測定を行い、経時毎の各数値データ間の減光率が5%以下に達したとき、発光観察を開始する。このとき付与されたインターバルは、第1の実施形態と同様、高精度な発光観察に必要な最短の待ち時間であり、該インターバルの制御方法によって、ノイズの影響を常に一定の割合で排除することができる。
【0038】
最適な減光率の閾値は、これに限定されるわけではないが、例えば、20%、15%、10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、0.1%、0.05%、および0.01%から適宜選択される。
【0039】
なお、インターバル中の測定は、必ずしも明視野/蛍光観察直後から行う必要はない。例えば、事前の実験において最低5分程度は減光が進行することが分っている場合、明視野/蛍光観察から5分経過後に測定を開始してもよい。また、生物試料の撮像は、インターバル終了後に開始してもよいし、あるいはインターバルおよび発光観察の露出時間を同一とし、観察後に適した画像を選択してもよい。
【0040】
第1の実施形態において、インターバルは、実際の観察における各インターバル毎に制御してもよい。例えば、図2におけるインターバル1の間に露出時間1分の発光連続測定を行い、得られた減光関数に基づいてインターバル終了時点を決定する。同様に、インターバル2の間に露出時間1分の発光連続測定を行い、得られた減光関数に基づいてインターバル終了時点を決定する。このとき、インターバル1および2は、それぞれ独立して制御されている。上記インターバル制御方法によれば、各観察サイクルの明視野・蛍光観察方法(時間、光量など)が異なる場合であっても、常に最適なインターバルを提供することができる。
【0041】
他の実施形態において、インターバルは、予め設定された所定のインターバルで制御されてもよい。例えば、前記発光観察を行う観察系と同一または類似の観察系において、事前に最適なインターバルを決定し、実際の観察における各インターバルは、この予め設定された所定のインターバルで統一して制御する。この場合、各観察サイクル毎にインターバルを決定するための発光連続測定を行う必要がなくなるので、簡易なインターバルの制御が実現される。特に、各観察サイクルの明視野・蛍光観察方法(時間、光量など)が同一条件である場合、上記インターバル制御方法は有効である。
【0042】
またさらに他の実施態様において、インターバルは、所定のインターバルで撮像された発光画像に対して、上記BGレベル以下(または未満)となった時刻に相当する撮像データ分を差し引いたり、発光画像形成に必要な蓄積時間相当の撮像データ領域を全体的にズラすようにして、ノイズの無い発光画像を生成するように制御するのも有効である。
【0043】
その他、初回の観察サイクルのみインターバルを決定し、2回目以降の観察サイクルでは初回に決定したインターバルで統一制御してもよい。この場合、事前にインターバルを決定する必要がなく、かつ観察サイクル毎にインターバルを決定する必要もないので、極めて簡易なインターバルの制御が実現される。
【0044】
(3)発光画像撮像ステップ
前記インターバル終了後、発光画像を撮像する(30)。
【0045】
上述したように、設定されたインターバル経過後には、照明光や励起光のノイズが排除されているため、生物試料自体が発する発光のみを正確に検出することができる。生物発光は微弱な光のため、暗視野において観察を行う。その他、発光観察の手法は、出願時に公知の任意の観察手法を適用することができる。
【0046】
なお、生物発光を観察するためには、発光基質を別途添加する必要がある。例えば、ルシフェラーゼ発光を検出する場合、生物試料には、発光基質であるルシフェリンを導入する。また、エクオリンやオベリン発光を検出する場合、生物試料には、セレンテラジンを導入する。ルシフェリンやセレンテラジン(以下、ルシフェリン等ともいう)を導入する方法としては、例えば、ルシフェリン等溶液を観察対象部位に直接噴霧する方法や、ルシフェリン等を培養液など、生物試料を保持する溶液に添加する方法などがある。
【0047】
図2に示したように、発光観察の終了によって、その観察サイクルは終了する。続けて次の観察サイクルに移行してもよいし、あるいは全観察を終了してもよい。次の観察サイクルに移行する場合、前記発光観察後、直ちに移行してもよいし、任意の時間経過後に移行してもよい。
【0048】
2.発光観察システム
図4
図4は、第1の実施形態において使用する倒立型の発光観察システム100の模式図である。
【0049】
図4の発光観察システム100は、明視野観察用の照明光および/または蛍光観察用の励起光を照射する、光照射手段110と、前記照明光および/または励起光のノイズを排除するためのインターバルを制御する、インターバル制御手段130と、発光画像を撮像する、発光画像撮像手段120と、を備えている。
【0050】
光照射手段110には、明視野観察用の照明光および/または蛍光観察用の励起光を照射可能な任意の光照射手段を用いることができる。図4には、例示的に、明視野観察および蛍光観察が可能な光照射手段110を示した。
【0051】
先ず、光照射手段110は、明視野観察用の照明手段として、光源106、シャッター107、およびダイクロイックミラー108を備える。光源106は、明視野観察用の照明であり、光源106から照射された照明光は、シャッター107を通過してダイクロイックミラー108に至り、該ダイクロイックミラーに反射して生物試料Aに照射される。シャッター107は、照明光を遮断することによって、生物試料Aへの照明光の照射のオン/オフを制御する。
【0052】
次に、光照射手段110は、蛍光観察用の励起手段として、光源101、励起用分光フィルター102、光ファイバー103、コンデンサーレンズ104、およびシャッター105を備える。光源101は、励起光を照射するためのものであり、具体的には、キセノンランプ、ハロゲン等のランプ、レーザー、LEDなどである。
【0053】
光源101から発せられた励起光は、励起用分光フィルター102を通して波長領域の異なる複数の励起光に分離され、分離された各励起光は、光ファイバー103およびコンデンサーレンズ104を通して生物試料Aに照射される。コンデンサーレンズ104は、生物試料Aを均等に照明するために用いるレンズであり、光ファイバー103によって導かれた各励起光を集光する。また、シャッター105は、光ファイバー103から照射される励起光を遮断することによって、生物試料Aへの励起光の照射のオン/オフを制御する。
【0054】
なお、生物試料Aは、例えば、サンプル用容器50に収納された状態で観察される。サンプル用容器50には、これに限定されるわけではないが、例えば、シャーレ、スライドガラス、マイクロプレート、ゲル支持体、微粒子担体などが含まれる。また、サンプル用容器50は、観察用ステージ60に配置される。また、生物試料Aは、それ自身が小動物等の生体内に設けられた観察部位であってもよい(in vivoイメージングまたは内視鏡等を参照)。その場合、上方から観察する正立型であってもよい。
【0055】
生物試料Aに照射された照明光は、下方に配置されたCCDカメラ113で検出され、明視野観察画像が取得される。また、生物試料Aに照射された励起光によって、生物試料A中に予め導入された蛍光物質が励起されて蛍光を発する。生物試料Aから放出された蛍光は、下方に配置されたCCDカメラ113で検出され、蛍光観察画像が取得される。
【0056】
続いて、インターバル制御手段130には、前記照明光および/または励起光のノイズを排除するためのインターバルを制御可能な任意のインターバル制御手段を用いることができる。一般的には、諸般の画像処理用のソフトウェアを用いたパーソナルコンピュータによる制御が有効である。パーソナルコンピュータは、CCDカメラ113によって撮像された明視野および/または蛍光観察画像情報に基づいて減光関数を抽出し、該減光関数から最適なインターバルを決定する。その他、CCDカメラ113とは別に、光電子増倍管(Photomultiplier; PMT)を新たに用意し、該PMTを用いて前記照明光や励起光のノイズを検出してもよい。
【0057】
インターバルの制御は、上述したように、各インターバル毎に行ってもよいし、同一または類似の観察系において事前にインターバルを決定し、該インターバルで一律に制御してもよい。また、初回のインターバルのみ決定し、該インターバルで2回目以降を一律に制御してもよい。さらにまた、減光関数を構成する発光強度の測定は、任意の時間間隔で行うことができる。照明光や励起光のノイズが無視できるレベルに達するまでインターバルを設けることで、微弱な発光検出をS/N比(Signal to Noise ratio)良く検出することができる。
【0058】
最後に、発光画像撮像手段120には、発光画像を撮像可能な任意の撮像手段を用いることができる。その具体的構成としては、例えば、前記発光画像撮像手段120は、対物レンズ111、結像レンズ112、およびCCDカメラ113により構成される。対物レンズ111は、「(開口数/倍率)2の値が0.01以上」という条件を満たすものであることが好ましい。生物試料Aから放出された発光は、対物レンズ111および結像レンズ112を通過してCCDカメラ113によって検出され、発光観察画像が取得される。
【0059】
撮像手段として使用するCCDカメラ113は、明視野観察画像および蛍光観察画像を取得したカメラである。したがって、照明光や励起光の遮断後、CCDカメラ113には照明光や励起光のノイズが残存するため、正確な発光観察を行うことができない。しかしながら、本発明の発光観察システム100では、インターバル制御手段130によって最適なインターバルが設定され、該インターバル経過後に発光観察が行われるため、CCDカメラに残存した照明光や励起光のノイズが排除され、正確な発光観察を行うことができる。
【符号の説明】
【0060】
10・・・明視野観察及び/又は蛍光観察ステップ、20・・・インターバル制御ステップ、30・・・発光画像撮像ステップ、50・・・サンプル用容器、60・・・観察用ステージ、100・・・発光観察システム、101、106・・・光源、102・・・励起用分光フィルター、103・・・光ファイバー、104・・・コンデンサーレンズ、105、107・・・シャッター、108・・・ダイクロイックミラー、110・・・光照射手段、111・・・対物レンズ、112・・・結像レンズ、113・・・CCDカメラ、120・・・発光画像撮像手段、130・・・インターバル制御手段、A・・・生物試料
【特許請求の範囲】
【請求項1】
発光タンパク質を発現する遺伝子を導入した生物試料に対し、明視野観察用の照明光および/または蛍光観察用の励起光を照射する、明視野観察および/または蛍光観察ステップと、
前記明視野観察および/または蛍光観察ステップ後、発光強度を経時的に検出し、得られた発光強度に基づいて、前記照明光および/または励起光由来のノイズを排除するためのインターバルを設定するとともに設定したインターバル条件に基づいて制御する、インターバル制御ステップと、
前記インターバル終了後、発光画像を撮像する、発光画像撮像ステップと、
を含む、発光観察方法。
【請求項2】
前記インターバル制御ステップが、前記発光強度が所定の閾値以下に達したときに前記インターバルを終了させる、請求項1に記載の発光観察方法。
【請求項3】
前記インターバル制御ステップが、前記発光強度の減光率が所定の閾値以下に達したときに前記インターバルを終了させる、請求項1に記載の発光観察方法。
【請求項4】
前記インターバル制御ステップが、前記発光観察を行う観察系と同一または類似の観察系において決定される、所定のインターバル条件を予め設定する、請求項1に記載の発光観察方法。
【請求項5】
前記インターバル制御ステップが、撮像後の画像データに対し、設定したインターバル条件に相当する画像データを抽出し、抽出した画像データに基づき発光画像を生成する、請求項1または4に記載の発光観察方法。
【請求項6】
明視野観察用の照明光および/または蛍光観察用の励起光を照射する、光照射手段と、
前記照明光および/または励起光のノイズを排除するためのインターバルを設定するとともに設定したインターバル条件に基づいた制御を実行する、インターバル制御手段と、
前記インターバル制御手段による制御の下で発光画像を撮像する、発光画像撮像手段と、
を備える、発光観察システム。
【請求項7】
明視野観察用の照明光および/または蛍光観察用の励起光を照射する、光照射手段と、
前記照明光および/または励起光由来のノイズを排除するためのインターバルを設定するとともに設定したインターバル条件に基づいた制御を実行する、インターバル制御手段と、
発光画像を撮像する、発光画像撮像手段と、
前記インターバル制御手段による制御の下で撮像された発光画像を画像処理する画像処理手段と、
を備える、発光観察システム。
【請求項1】
発光タンパク質を発現する遺伝子を導入した生物試料に対し、明視野観察用の照明光および/または蛍光観察用の励起光を照射する、明視野観察および/または蛍光観察ステップと、
前記明視野観察および/または蛍光観察ステップ後、発光強度を経時的に検出し、得られた発光強度に基づいて、前記照明光および/または励起光由来のノイズを排除するためのインターバルを設定するとともに設定したインターバル条件に基づいて制御する、インターバル制御ステップと、
前記インターバル終了後、発光画像を撮像する、発光画像撮像ステップと、
を含む、発光観察方法。
【請求項2】
前記インターバル制御ステップが、前記発光強度が所定の閾値以下に達したときに前記インターバルを終了させる、請求項1に記載の発光観察方法。
【請求項3】
前記インターバル制御ステップが、前記発光強度の減光率が所定の閾値以下に達したときに前記インターバルを終了させる、請求項1に記載の発光観察方法。
【請求項4】
前記インターバル制御ステップが、前記発光観察を行う観察系と同一または類似の観察系において決定される、所定のインターバル条件を予め設定する、請求項1に記載の発光観察方法。
【請求項5】
前記インターバル制御ステップが、撮像後の画像データに対し、設定したインターバル条件に相当する画像データを抽出し、抽出した画像データに基づき発光画像を生成する、請求項1または4に記載の発光観察方法。
【請求項6】
明視野観察用の照明光および/または蛍光観察用の励起光を照射する、光照射手段と、
前記照明光および/または励起光のノイズを排除するためのインターバルを設定するとともに設定したインターバル条件に基づいた制御を実行する、インターバル制御手段と、
前記インターバル制御手段による制御の下で発光画像を撮像する、発光画像撮像手段と、
を備える、発光観察システム。
【請求項7】
明視野観察用の照明光および/または蛍光観察用の励起光を照射する、光照射手段と、
前記照明光および/または励起光由来のノイズを排除するためのインターバルを設定するとともに設定したインターバル条件に基づいた制御を実行する、インターバル制御手段と、
発光画像を撮像する、発光画像撮像手段と、
前記インターバル制御手段による制御の下で撮像された発光画像を画像処理する画像処理手段と、
を備える、発光観察システム。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2010−220531(P2010−220531A)
【公開日】平成22年10月7日(2010.10.7)
【国際特許分類】
【出願番号】特願2009−70740(P2009−70740)
【出願日】平成21年3月23日(2009.3.23)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
【公開日】平成22年10月7日(2010.10.7)
【国際特許分類】
【出願日】平成21年3月23日(2009.3.23)
【出願人】(000000376)オリンパス株式会社 (11,466)
【Fターム(参考)】
[ Back to top ]

