発酵法による乳酸の製法
【課題】安価な培地を用いて、糖質を、残存させることなく効率良く乳酸に転換させることができる方法を提供する。
【解決手段】乳酸生産能を有する微生物を、窒素源と炭素源とを含む培地で培養する工程と、生産された乳酸を回収する工程とを含む乳酸の製造方法であり、培養開始時の培地には、窒素源として魚由来窒素源のみ添加し、乳酸生産速度が低下又は実質的に停止した時点で、それ以外の窒素源を添加する方法。
【解決手段】乳酸生産能を有する微生物を、窒素源と炭素源とを含む培地で培養する工程と、生産された乳酸を回収する工程とを含む乳酸の製造方法であり、培養開始時の培地には、窒素源として魚由来窒素源のみ添加し、乳酸生産速度が低下又は実質的に停止した時点で、それ以外の窒素源を添加する方法。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は代替プラスチックとして注目されている乳酸ポリマーの原料として有用な高純度乳酸を微生物利用(発酵法)により工業的に製造する方法に関する。
【背景技術】
【0002】
ラセミ体乳酸は化学的な方法で生産されているが、光学活性の乳酸は発酵法により生産される場合がほとんどである。
乳酸を産生する微生物としては、Lactobacillus delbrueckiiなどの乳酸菌が古くから知られている(特許文献1、非特許文献1)。乳酸菌は、比較的高温での発酵が可能であり、グルコースから理論値に近い乳酸を生産することが知られている。しかし、乳酸菌を用いた工業的な乳酸の生産条件については、余り研究されていない。
また、乳酸は、プラスチックの代替物となりうる乳酸ポリマーの原料として生産するのであるから、工業的に安価に生産することが求められる。しかし、従来、乳酸生産菌を用いて高光学純度の乳酸の生産を行うためには、乳酸原料としてグルコースのような糖質、酵母エキスやペプトンのような窒素源、Tween80などの脂肪酸、及びビタミンなどを含む培養液を用いる必要があった。酵母エキス、ペプトン、ビタミンなどは高価であるため、得られる乳酸も高価なものになってしまう。さらに糖質も、グルコースより安価なデンプンを利用することが望ましい。
【0003】
また、乳酸を産生する微生物の生育には比較的高い栄養価の培地を必要とするため、発酵後の培養液には培地成分が高濃度に含まれる。従って、発酵後の培養液から乳酸を精製するために多段階の化学的手法を要する。特に、乳酸の主原料である糖質が培養液に残存すると、乳酸をエステル化に供するときに、乳酸のカルボキシル基と糖質のヒドロキシル基との間で副反応が起こり、目的とする乳酸エステルの収率が低下する。また、糖質が残存する培養液を濃縮すると、高濃度の糖質のために濃縮液の粘度が高くなり、濃縮培養液のその後の扱いが困難になる。従って、発酵後の培養液から残存した糖質を除去する必要があり、煩雑でコスト高な方法になる。
なお、鯖の肉の加水分解物が乳酸菌の生育促進や乳製品のカードテンションを低下させることが報告されているが、魚肉乾燥物の加水分解物で効果のあった乳酸菌はStreptcoccus thermophilus, Streptcoccus lactis, Streptococcus cremoris, Lactobacillus helveticusの4種の菌株である(非特許文献2)。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開昭62−44188号公報
【非特許文献】
【0005】
【非特許文献1】K. Hofvendahl, Enzyme and Microbial Technology, 26, 87-107 (2000)
【非特許文献2】H. Yuguchi, Japanese Journal of Dairy and Food Science, 33,81-91 (1984)
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は、安価な培地を用いて、糖質を、残存させることなく効率良く乳酸に転換させることができる方法を提供することを課題とする。
【課題を解決するための手段】
【0007】
本発明者らは、上記課題を解決するために研究を重ね、以下の知見を得た。即ち、乳酸生産能を有する微生物を窒素源と炭素源とを含む培地で培養するに当たり、培養開始時の培地に含まれる窒素源は魚由来窒素源のみとし、乳酸生産速度が低下、実質的に停止、又は停止した時点で、それ以外の窒素源を添加すれば、魚由来の安価な窒素源を使用しながら、糖質を、残存させることなく効率良く乳酸に転換させることができる
本発明は、上記知見に基づき、さらに研究を重ねて完成されたものであり、以下の乳酸の製造方法を提供することを課題とする。
【0008】
項1. 乳酸生産能を有する微生物を、窒素源と炭素源とを含む培地で培養する工程と、生産された乳酸を回収する工程とを含む乳酸の製造方法であり、培養開始時の培地には、窒素源として魚由来窒素源のみ添加し、乳酸生産速度が低下又は実質的に停止した時点で、それ以外の窒素源を添加する方法。
項2. 培養工程終了時の、培地中の残糖濃度が10mg/ml以下である、項1に記載の方法。
項3. 魚由来窒素源がフィッシュミールである項1又は2に記載の方法。
項4. 培養開始時の培地中の魚由来窒素源の濃度が、乾燥重量に換算して、1〜7w/v%である項1〜3のいずれかに記載の方法。
項5. 魚由来窒素源以外の窒素源の培地中濃度が、乾燥重量に換算して、0.01〜4w/v%になるように後添加する項1〜4のいずれかに記載の方法。
項6. 炭素源が糖質を含み、培養開始時の培地中の糖質濃度が10〜120mg/mlである項1〜5のいずれかに記載の方法。
項7. 炭素源が糖質を含み、糖質が、グルコース、スクロース、及び廃糖蜜からなる群より選ばれる少なくとも1種である項1〜6のいずれかに記載の方法。
項8. 乳酸生産能を有する微生物がLactobacillus属に属する乳酸菌である項1〜7の何れかに記載の方法。
項9. 乳酸生産能を有する微生物がLactobacillus delbrueckiiである項1〜7の何れかに記載の方法。
項10. 乳酸がD-乳酸である項1〜9の何れかに記載の方法。
【発明の効果】
【0009】
本発明方法によれば、魚由来窒素源を含む安価な培地を用いながら、糖質の乳酸への転換率を非常に高くすることができる。従って、本発明方法により得られる培養液は、糖質濃度が極めて低くなり、培養後の培養液から糖質を除去する手間を省くことができる。発酵後の乳酸を含む培養液は、そのまま次工程、例えばエステル化工程に供される場合があるが、本発明方法により得られる培養液を用いる場合は、乳酸と残存糖質との副反応が抑制されて、乳酸が副反応に消費されることなく、また、不純物となる副生成物の生成を抑制できるため、これを簡単に除去でき、これらの結果、乳酸エステルの回収率が高くなる。また、発酵後の乳酸を含む培養液は、乳酸を濃縮の上、次工程に供される場合が多いが、培養液の残存糖質濃度が低いため、濃縮しても培養液の粘度が高くなり過ぎることがなく、扱いが容易である。
また、本発明方法によれば、高光学純度の乳酸(特に、D-乳酸)が得られる。
さらに、本発明方法によれば、乳酸濃度の高い培養液が得られる。即ち、培地中の原料糖質濃度を高くすることができ、その結果、培養後に、高乳酸濃度の培養液を得ることができる。
本発明方法は、特にD−乳酸の製造に適している。
【図面の簡単な説明】
【0010】
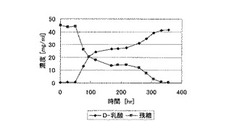
【図1】実施例5において、魚由来窒素源にそれ以外の窒素源を後添加した場合の、D-乳酸濃度の推移を示す図である。
【図2】実施例6において、魚由来窒素源にそれ以外の窒素源を後添加した場合の、D-乳酸濃度の推移を示す図である。
【図3】実施例7において、魚由来窒素源にそれ以外の窒素源を後添加した場合の、D-乳酸濃度の推移を示す図である。
【発明を実施するための形態】
【0011】
以下、本発明を詳細に説明する。
培地中の窒素源
<魚由来窒素源>
魚由来窒素源としては、魚肉;魚の骨、皮、目玉、内臓のような「あら」(魚の魚肉以外の部分);及び魚の全体;並びにそれらの乾燥物などが挙げられる。中でも、フィッシュミール(魚粉)が好ましい。フィッシュミールは、魚を丸ごと乾燥し、粉砕したものである。魚の種類は特に限定されないが、大量に入手できるイワシ、カツオ、サメ、タラ、ニシン、メンハーデンなどを使用すればよい。
魚由来窒素源は、例えば粉砕してそのまま培地に添加してもよいが、乳酸生産菌の乳酸発酵性能が高くなる点で、タンパク質分解酵素で処理したものを用いることが好ましい。タンパク質分解酵素処理物は、魚肉、あら、魚の全体、及びそれらの乾燥物などを、プロテアーゼで例えば約30〜80℃で数時間処理することにより得ることができる。
魚由来窒素源としては、中でも、乳酸生産菌の発酵性能が高くなり、また低価格である点で、フィッシュミールのタンパク質分解酵素処理物が好ましい。タンパク質分解酵素は、公知の酵素を制限なく使用できる。また、アルカリ性プロテアーゼ、酸性プロテアーゼ、中性プロテアーゼの何れでもよく、由来生物種も制限されない。
魚由来窒素源は1種を単独で、又は2種以上を組み合わせて使用できる。
【0012】
<その他の窒素源>
魚由来以外の、即ちその他の窒素源としては、微生物の培養に用いられる公知の窒素源を制限なく使用できる。魚由来以外の窒素源には、非魚動物由来窒素源、微生物由来、及び植物由来窒素源が含まれる。このような窒素源として、例えば、酵母エキス、ペプトン(魚由来ペプトンを除く。非魚動物由来ペプトン、植物由来ペプトンを含む。)、ポリペプトン(魚由来ポリペプトンを除く。牛乳カゼイン由来ポリペプトンのような非魚動物由来ポリペプトン、大豆やエンドウ豆由来ポリペプトンのような植物由来ポリペプトンを含む。)、ビール酵母、肉エキス、大豆加水分解物、エンドウ豆加水分解物、麦加水分解物、カゼイン分解物、カザミノ酸、油粕のようなペプチド又はアミノ酸類;アンモニア、硝酸塩のような無機体窒素類;尿素などが挙げられる。中でも、乳酸生産菌の発酵性能が高くなる点で、ペプチド又はアミノ酸類が好ましく、酵母エキス、非魚動物又は植物由来のポリペプトンがより好ましく、ビール酵母エキス(中でも、日本製薬株式会社製、酵母エキスイーストD3)、酵母エキス(中でも、KERRY社製、HY−yest、又はアサヒフードアンドヘルスケア株式会社製、ミーストN)、大豆由来ポリペプトン(中でも、日本製薬株式会社製、ポリペプトンN)、カゼイン由来ポリペプトン(中でも、日本製薬株式会社製、ポリペプトン、又はDMVinternational社製、ペプトンCE90M)が特に好ましい。
その他の窒素源は1種を単独で、又は2種以上を組み合わせて使用できる。
【0013】
<窒素源の比率>
培養開始時の培地中の魚由来窒素源の濃度は、乾燥重量に換算して、約1〜7w/v%が好ましく、約2〜6w/v%がより好ましく、約3〜5w/v%がさらにより好ましい。上記範囲であれば、高光学純度の乳酸(特に、D-乳酸)が得られる。また、魚由来窒素源が多すぎて攪拌し難くなるということがない。
また、培地に後添加する、その他の窒素源の培地中の濃度は、乾燥重量に換算して、約0.01〜4w/v%が好ましく、約0.05〜3w/v%がより好ましく、約0.1〜2w/v%がさらにより好ましい。上記範囲であれば、安価な魚由来窒素源を用いてコストを抑えながら、高光学純度の乳酸(特に、D-乳酸)が得られ、培地中の糖質を効率よく乳酸に転換させることができる。
また、種菌は、どのような窒素源を用いた培地で培養したものであってもよい。種菌も魚由来窒素源を含む培地を用いてもよい。
【0014】
その他の窒素源を添加するタイミングは、培養途中で、乳酸生産速度が低下、実質的に停止し、又は停止した時点とすればよい。乳酸生産速度が低下又は実質的に停止した時点とは、乳酸生産速度が、例えば0.5mg/ml/hr以下、好ましくは0.3mg/ml/hr以下、より好ましくは0.1mg/ml/hr以下となった時点である。
魚由来窒素源だけでは、培地中の糖質の全ては乳酸に変換されず、培地中に糖質が残存しているのに乳酸生産が遅滞又は停止してしまう傾向にあるが、その他の窒素源を添加することにより、乳酸発酵を再開させることができる。
その他の窒素源を後添加する方法には、当該その他窒素源のみ後添加する方法、当該その他窒素源と炭素源とを後添加する方法、当該その他窒素源と窒素源以外の必要成分を含む培地とを後添加する方法、当該窒素源と魚由来窒素源と窒素源以外の必要成分を含む培地とを後添加する方法などが含まれる。
【0015】
培地中の炭素源
炭素源としては、使用する乳酸生産菌が乳酸発酵できる糖質を用いればよい。糖質としては、グルコース、フルクトースのような単糖類;シュークロース、マルトース、トレハロースのような二糖類;デンプン、セルロース、ヘミセルロース、キシランのような多糖類などが挙げられる。糖質としてデンプン、セルロース、ヘミセルロース、キシランなどの多糖類を用いる場合は、アミラーゼ、セルラーゼ、ヘミセルラーゼ、エンドキシラナーゼ、キシロシダーゼのような、当該多糖類を分解する酵素で予め処理したものを用いたり、又は多糖類とともに多糖類分解酵素を培地に添加することにより多糖類の分解と並行して乳酸発酵を行うことが好ましく、これにより、効果的に乳酸を産生させることができる。また、これらの糖類を含有する甘藷糖蜜、サトウキビ廃糖蜜のような廃糖蜜なども使用できる。
中でも、乳酸生産菌の発酵性能が高くなる点で、単糖類、二糖類がより好ましく、グルコース、スクロースがさらにより好ましい。また、乳酸の生産性が高くなる点で、サトウキビ廃糖蜜も好ましい。
【0016】
糖質に加えて、酢酸、フマル酸のような有機酸;エタノールのような一価アルコール類;グリセリンのような多価アルコールなども炭素源として用いることができる。
糖質を含む炭素源は、1種を単独で、又は2種以上を組合わせて使用できる。
培養開始時の培地中の糖質濃度は、約10〜120mg/mlが好ましく、約30〜100mg/mlがより好ましく、約40〜80mg/mlがさらに好ましい。上記範囲であれば、効率よく乳酸を生産できるとともに、残存糖質量が抑えられる。
炭素源、及び窒素源は、それぞれ、蒸気殺菌、ろ過殺菌、瞬間殺菌など一般的な殺菌方法で殺菌しておき、培地に添加すればよい。
【0017】
培地のその他の成分
培地は、乳酸発酵用の培地に通常添加される、リン酸塩、硫酸マグネシウムのようなマグネシウム塩、カルシウム塩、鉄塩、マンガン塩のような無機塩類;ビタミン類;ポリソルベートのような脂肪酸などを含んでいてよい。
【0018】
乳酸生産菌
乳酸生産菌、特にD-乳酸を生産できる菌としては、ホモ発酵を行う、Lactobacillus delbrueckii subsp. lactis IAM 12476、Lactobacillus delbrueckii IFO 3534等の菌株が挙げられる。中でも、発酵性能の点で乳酸の工業生産に適しているため、Lactobacillus delbrueckii IFO 3534が好ましい。その他、ヘテロ発酵を行う乳酸菌株として、Leuconostoc pseudomesenteroides JCM 9696等も用いることができる。
IFO番号が付された微生物は、独立行政法人製品評価技術基盤機構バイオテクノロジー本部生物遺伝資源部門(NBRC)から入手できる。IAM番号およびJCM番号の付された微生物は、独立行政法人理化学研究所バイオリソースセンター微生物材料開発室(RIKEN BRC−JCM)より入手できる。
【0019】
培養条件
乳酸発酵の温度は、使用する乳酸生産菌が生育する温度であればよく、例えば約0〜60℃が好ましく、約30〜50℃がより好ましく、約35〜45℃がさらにより好ましい。
発酵中は、乳酸の生成に伴って培地pHが低下する。培地pHが下がりすぎると菌の生育を阻害するため、炭酸カルシウム、水酸化ナトリウム、アンモニアなどのアルカリでpHを調整すればよい。中でも、水酸化ナトリウム、アンモニアが好ましい。これは乳酸ナトリウム、乳酸アンモニウムは常温で液状であるため、培養後に、菌体などの不溶性成分と分離し易いからである。また水酸化ナトリウムなどの液状の中和剤を用いれば、中和剤の必要添加量と乳酸の生成量が相関することから、中和剤の添加量から発酵の進行度合いを簡単に知ることができる。さらに水酸化ナトリウムは安価であり、工業生産に有利である。発酵液のpHは、使用菌株によって異なるが、約4〜7に調整することが好ましく、約5〜6.5に調整することがより好ましい。
培養開始時又はその後に培地中に予め炭酸カルシウムを約0.1〜1w/v%添加しておき、pHの低下に伴い、さらに異種のアルカリを用いて上記範囲にpH調整することも好ましい。これにより、乳酸生産速度が一層高くなり、効率よく乳酸を製造できる。
【0020】
培養は、回分培養、半回分培養、連続培養の何れであってもよい。中でも、残存糖質量を低減できる点で回分培養が好ましい。また、糖質のみ培養中に追加する半回分培養、連続培養であってもよい。
培養時間は、使用菌株、培地成分、特に糖質の量などにより異なるが、回分培養の場合、約1〜20日間が好ましく、約2〜17日間がより好ましく、約3〜10日間がさらに好ましい。連続培養、半回分培養を行う場合はこれに限定されない。
本発明方法により、最終的に培地中の残糖濃度を、通常10mg/ml以下、好ましくは5mg/ml以下、より好ましくは3mg/ml以下、さらに好ましくは1mg/ml以下にすることができる。また、条件を選択することにより、残存する糖質の全て、又は殆ど全てを乳酸に転換することができる。
【0021】
乳酸の回収
培養後の培養液から菌体を除去することにより、乳酸を、乳酸又は乳酸アルカリ塩の形態で回収することができる。また、pH調整用のアルカリとして、炭酸カルシウムを使用する場合は乳酸カルシウムが生じるが、乳酸カルシウムは水に不溶性であるため、培養液を例えば硫酸で酸性(pH3.5以下)にし、カルシウムを硫酸カルシウムとして析出させ、菌体と共に除去すればよい。さらに、菌体などの不溶性成分を除去した後、エタノール、又はメタノールで乳酸エステルを生成させ、有機溶媒中に回収することもできる。
【実施例】
【0022】
以下、本発明を実施例を挙げてより具体的に説明する。
分析方法
(1)乳酸の定量および光学純度の測定
乳酸の定量用試料は、乳酸カルシウムの溶解度を考慮し、試料希釈液0.2mlにエタノール0.8mlを加え生じる沈殿物を遠心分離(15.000rpm、5min)して除去し、上清を水で適宜希釈することにより調製した。この試料をHPLC(キラルカラム)で分析した。HPLC条件は下記の通りである。
カラム:Sumichiral OAキラルカラム(Column, Sumichiral OA-5000
(4.6mm ID×15cm)
温度:室温
移動相:2mM Cooper(II)sulfate-5H2O(249.69) 水-イソプロパノール混液(98:2)溶液
溶出率:1.0ml/min
検出:UV at 254nm
鏡像異性体過剰率ee(Enantiomeric excess)は、以下の式により計算した。
ee (%) =([D-体]-[L-体])/([D-体]+[L-体])×100
(2)糖の定量
糖はフェノール硫酸法で定量した。グルコースは、グルコース定量キット(グルコースCIIテストワコー、和光純薬)を用いて定量した。
【0023】
実施例1(各乳酸菌による通常培地中でのD−乳酸の生産率の比較)
200ml容の三角フラスコに1%ペプトン、1%酵母エキス、0.4%リン酸水素二カリウムからなる培地100mlを調製し、1N NaOHでpH6.8に調整後、121℃、15分オートクレーブした。別にオートクレーブした50%グルコース溶液を終濃度50mg/mlになるように無菌的に加えて種培養用培地とした。中和剤としてCaCO3を4g添加してPYG培地とした。これに、保存用寒天培地から各菌株を白金耳で植菌し、ロータリーシェイカーにて40℃で72時間培養した。この種培養液の10mlを種培養用培地と同様に調製した本培養用培地に加え、種培養と同条件で48時間培養した。以下の表1に、試験した菌種とD−乳酸の生成濃度、光学純度を示す。
【0024】
【表1】

菌種1:Lactobacillus delbrueckii subsp. lactis IAM 12476
菌種2:Lactobacillus delbrueckii IFO 3534
菌種3:Leuconostoc pseudomesenteroides JCM 9696 (ヘテロ発酵)
【0025】
実施例2(魚粉末の種類の検討)
窒素源として各種魚粉末を用いてD-乳酸を生産し、得られる乳酸濃度と、D-乳酸の光学純度を比較した。即ち、200ml容の三角フラスコに各種魚粉末4g、0.4%K2HPO4(pH7.2)50ml、オリエンターゼ22BF(エイチビーアイ社製アルカリプロテアーゼ)200mgを加えて、60℃で3時間反応させた。反応後、終濃度4%になるようにCaCO3を加えて、85mlになるよう水でメスアップし、121℃で15分間オートクレーブし、別にオートクレーブした50%(w/v)グルコース溶液10ml(培地中のグルコースの仕込み濃度50mg/ml)を加え、魚粉末培地とした。これらの培地に実施例1と同様に調製したLactobacillus delbrueckii IFO 3534株の種培養液を10ml加え、40℃、72時間培養した。結果を以下の表2に示す。
【0026】
【表2】

【0027】
実施例3(各乳酸菌による魚粉末蛋白分解酵素処理物含有培地中でのD−乳酸の生産率の比較)
200ml容の三角フラスコにカツオ魚粉末(粉砕した試料)4g、0.4%K2HPO4(pH7.2)50ml、オリエンターゼ90N(エイチビーアイ社製中性プロテアーゼ)80mgを加えて、50℃で3時間反応させた。反応後、終濃度4%になるようにCaCO3加えて、85mlになるよう水でメスアップし、121℃で15分間オートクレーブし、別にオートクレーブした50%(w/v)グルコース溶液10mlを加え(培地中のグルコースの仕込み濃度50mg/ml)カツオ魚粉末蛋白分解酵素処理物含有培地(フィッシュミール培地)とした。これらの培地に実施例1と同様に調製した各種菌株の種培養液を15ml加え、Lactobacillus delbrueckii IFO 3534は40℃で48時間培養した。結果を以下の表3に示す。各種菌株とも、カツオ魚粉末蛋白分解酵素処理物含有培地を用いてD−乳酸を生成することができた。
【0028】
【表3】

菌種1:Lactobacillus delbrueckii subsp. lactis IAM 12476
菌種2:Lactobacillus delbrueckii IFO 3534
菌種3:Leuconostoc pseudomesenteroides JCM 9696 (ヘテロ発酵)
【0029】
実施例4(魚由来窒素源とそれ以外の窒素源との併用)
培地中のグルコースの仕込み濃度を120mg/mlにした以外は、実施例2と同様にして、200ml容の三角フラスコに魚粉末蛋白分解酵素分解物含有培地(ニシンフィッシュミール培地)100mlを調製し、Lactobacillus delbrueckii IFO 3534株を培養した。但し、培養時間は48時間とした。
培養48時間後の培養液にポリペプトンN(日本製薬株式会社製)およびHY−yest(KERRY社製)を各1%ずつ添加し、さらに120時間培養を継続した(合計168時間)。培地中の魚粉末蛋白分解酵素分解物の濃度は4%であり、ポリペプトンNおよびHY−yestの合計濃度は2%である。
以下の表4に、魚粉末蛋白分解酵素分解物含有培地を用いて48時間培養した場合、及びさらにポリペプトンNおよびHY−yestを添加して合計168時間培養した場合の、培養後の培地の濁度、D-乳酸濃度、グルコース濃度、D-乳酸の光学純度を示す。表4から、ポリペプトンNおよびHY−yestをフィッシュミール培地に加えることにより、グルコースのほぼ全量を消費することができ、高濃度のD-乳酸が得られることが分かる。
【0030】
【表4】

【0031】
実施例5(魚由来窒素源とそれ以外の窒素源との併用)
ミツワ製50L容のジャーファーメンターにカツオ魚粉末(丸石株式会社製)1.2kg、0.4%K2HPO4(pH7.2)15LオリエンターゼN(エイチビーアイ社製中性プロテアーゼ)24gを加えて、50℃で3時間(回転数100rpm)反応させた。反応後、27Lになるように水でメスアップし、121℃で30分間蒸気滅菌し、別途オートクレーブ滅菌した50%グルコース溶液3L(培地中のグルコースの仕込み濃度50mg/ml)を加えてカツオ培地とした。
【0032】
このカツオ培地に実施例1と同様に調製したLactobacillus delbrueckii IFO 3534株の種培養液を300ml加えて培養を行った。培養条件は攪拌回転数80rpm、培養温度40℃、通気は5%vvm量を気相のみに行い、25%NaOH水溶液を用いてpH6.0に制御した。培養開始170時間で、D−乳酸の生産が停止したため(D-乳酸生産速度が約0mg/ml/hr)、ポリペプトン(日本製薬株式会社製)と酵母エキスイーストD3(日本製薬株式会社製)を各0.1%ずつ添加した。培地中の魚粉末蛋白分解酵素分解物の濃度は4%であり、ポリペプトンと酵母エキスイーストD3の合計濃度は0.2%である。
培養液中のD-乳酸濃度を経時的に測定した結果を以下の表5、及び図1に示す。表5、及び図1から明らかなように、一旦停止したD-乳酸の発酵が、ポリペプトン、及び酵母エキスイーストD3の添加により再開された。また、培地中の糖質を実質的に全て消費してD-乳酸に転換させることができた。
【0033】
【表5】

【0034】
実施例6(魚由来窒素源とそれ以外の窒素源との併用(工業スケールでの検討;2000L))
小松川化工機製3000L容のジャーファーメンターにカツオ魚粉末(丸石株式会社製)80Kg、K2HPO4 4kg、オリエンターゼ 90N(エイチビーアイ社製中性プロテアーゼ)1.6kgを加えて、50℃で3時間反応させた。反応後、1000Lになるように水でメスアップし、121℃で30分間蒸気滅菌し、別途滅菌した25%グルコース溶液400Lを加えて(培地中のグルコースの仕込み濃度50mg/ml)カツオ培地とした。カツオ培地に実施例1と同様に調製したLactobacillus delbrueckii IFO 3534株の種培養液を20L加えて培養を行った。培養条件は攪拌回転数65rpm、培養温度40℃、通気は5%vvm量を気相のみに行い、25%NaOH水溶液を用いてpH6.0に制御した。培養開始230時間でD−乳酸の生産が停止したため(D-乳酸生産速度が約0mg/ml/hr)、ポリペプトン(日本製薬株式会社製)と酵母エキスイーストD3(日本製薬株式会社製)を各0.1%ずつ添加した。培地中の魚粉末蛋白分解酵素分解物の濃度は4%であり、ポリペプトンと酵母エキスイーストD3の合計濃度は0.2%である。
培養液中のD-乳酸濃度を経時的に測定した結果を以下の表6、及び図2に示す。表6、及び図2から明らかなように、一旦停止したD-乳酸の発酵が、ポリペプトン、及び酵母エキスイーストD3の添加により再開された。また、培地中の糖質を全て消費してD-乳酸に転換させることができた。
【0035】
【表6】

【0036】
実施例7(魚由来窒素源とそれ以外の窒素源との併用(工業スケールでの検討;3,000L))
5000L容の培養槽にニシンフィッシュミール粉末(エクアドル産)120kg、K2HPO46kg、オリエンターゼ22BF(エイチビーアイ社製アルカリ性プロテアーゼ)6kgを加えて、60℃で3時間反応させた。反応後、2000Lになるように水でメスアップし、121℃で30分間蒸気滅菌し、別途滅菌した150mg/mlグルコース溶液1000Lを加えて(培地中のグルコースの仕込み濃度50mg/ml)魚粉培地とした。魚粉培地に実施例1と同様に調製したLactobacillus delbrueckii IFO 3534株の種培養液を30L加えて培養を行った。培養条件は攪拌回転数80rpm、培養温度40℃、通気は5%vvm量を気相のみに行い、25%NaOH水溶液を用いてpH6.0に制御した。培養開始48時間で、D-乳酸の生産速度が低下したため(D-乳酸生産速度が約0.1mg/ml/hr以下)、カゼインペプトン(CE90M)(DMVinternational社製)と酵母エキス(ミーストN)(アサヒフードアンドヘルスケア株式会社製)を各0.1%添加した。培地中の魚粉末蛋白分解酵素分解物の濃度は4%であり、カゼインペプトン(CE90M)と酵母エキス(ミーストN)の合計濃度は0.2%である。
培養液中のD-乳酸濃度を経時的に測定した結果を以下の表7及び図3に示す。表7及び図3から明らかなように、一旦遅滞したD-乳酸の発酵が、カゼインペプトン(CE90M)及び酵母エキス(ミーストN)の添加により再開された。また、培地中の糖質を全て消費してD-乳酸に転換させて、高濃度のD−乳酸液が得られた。また、非常に光学純度が高いD-乳酸が得られた。
【0037】
【表7】

【0038】
比較例1(魚由来窒素源のみを用いた発酵(2000L))
小松川化工機製3000L容のジャーファーメンターにニシンフィッシュミール粉末(エクアドル産)80Kg、K2HPO4 4kg、オリエンターゼ22BF(エイチビーアイ社製アルカリプロテアーゼ)4kg、水1000Lを加えて、60℃で3時間反応させた。反応後、合計1600Lになるように水でメスアップし、121℃で30分間蒸気滅菌し、別途滅菌した25%グルコース溶液400Lを加えて(培地中のグルコースの仕込み濃度50mg/ml)フィッシュミール培地とした。フィッシュミール培地に実施例1と同様に調製したLactobacillus delbrueckii IFO 3534株の種培養液を20L加えて培養を行った。培養条件は攪拌回転数65rpm、培養温度40℃、通気は5%vvm量を気相のみに行い、25%NaOH水溶液を用いてpH6.0に制御した。培養開始110時間でD−乳酸の生産が停止したため発酵を終了した。培養液をジャーファーメンターからタンクへと移液し、72時間静置した。
培養液中のD-乳酸濃度を経時的に測定した結果を以下の表8に示す。表8から明らかなように、生成したD-乳酸の光学純度およびD−乳酸の濃度が、発酵終了時(110時間)から静置後(182時間)にかけて顕著に低下した。
【0039】
【表8】

【産業上の利用可能性】
【0040】
本発明方法によれば、ポリ乳酸原料となる乳酸、特にD-乳酸を安価に効率よく生産できるため、ポリ乳酸を低コストで工業生産できるようになった。
【技術分野】
【0001】
本発明は代替プラスチックとして注目されている乳酸ポリマーの原料として有用な高純度乳酸を微生物利用(発酵法)により工業的に製造する方法に関する。
【背景技術】
【0002】
ラセミ体乳酸は化学的な方法で生産されているが、光学活性の乳酸は発酵法により生産される場合がほとんどである。
乳酸を産生する微生物としては、Lactobacillus delbrueckiiなどの乳酸菌が古くから知られている(特許文献1、非特許文献1)。乳酸菌は、比較的高温での発酵が可能であり、グルコースから理論値に近い乳酸を生産することが知られている。しかし、乳酸菌を用いた工業的な乳酸の生産条件については、余り研究されていない。
また、乳酸は、プラスチックの代替物となりうる乳酸ポリマーの原料として生産するのであるから、工業的に安価に生産することが求められる。しかし、従来、乳酸生産菌を用いて高光学純度の乳酸の生産を行うためには、乳酸原料としてグルコースのような糖質、酵母エキスやペプトンのような窒素源、Tween80などの脂肪酸、及びビタミンなどを含む培養液を用いる必要があった。酵母エキス、ペプトン、ビタミンなどは高価であるため、得られる乳酸も高価なものになってしまう。さらに糖質も、グルコースより安価なデンプンを利用することが望ましい。
【0003】
また、乳酸を産生する微生物の生育には比較的高い栄養価の培地を必要とするため、発酵後の培養液には培地成分が高濃度に含まれる。従って、発酵後の培養液から乳酸を精製するために多段階の化学的手法を要する。特に、乳酸の主原料である糖質が培養液に残存すると、乳酸をエステル化に供するときに、乳酸のカルボキシル基と糖質のヒドロキシル基との間で副反応が起こり、目的とする乳酸エステルの収率が低下する。また、糖質が残存する培養液を濃縮すると、高濃度の糖質のために濃縮液の粘度が高くなり、濃縮培養液のその後の扱いが困難になる。従って、発酵後の培養液から残存した糖質を除去する必要があり、煩雑でコスト高な方法になる。
なお、鯖の肉の加水分解物が乳酸菌の生育促進や乳製品のカードテンションを低下させることが報告されているが、魚肉乾燥物の加水分解物で効果のあった乳酸菌はStreptcoccus thermophilus, Streptcoccus lactis, Streptococcus cremoris, Lactobacillus helveticusの4種の菌株である(非特許文献2)。
【先行技術文献】
【特許文献】
【0004】
【特許文献1】特開昭62−44188号公報
【非特許文献】
【0005】
【非特許文献1】K. Hofvendahl, Enzyme and Microbial Technology, 26, 87-107 (2000)
【非特許文献2】H. Yuguchi, Japanese Journal of Dairy and Food Science, 33,81-91 (1984)
【発明の概要】
【発明が解決しようとする課題】
【0006】
本発明は、安価な培地を用いて、糖質を、残存させることなく効率良く乳酸に転換させることができる方法を提供することを課題とする。
【課題を解決するための手段】
【0007】
本発明者らは、上記課題を解決するために研究を重ね、以下の知見を得た。即ち、乳酸生産能を有する微生物を窒素源と炭素源とを含む培地で培養するに当たり、培養開始時の培地に含まれる窒素源は魚由来窒素源のみとし、乳酸生産速度が低下、実質的に停止、又は停止した時点で、それ以外の窒素源を添加すれば、魚由来の安価な窒素源を使用しながら、糖質を、残存させることなく効率良く乳酸に転換させることができる
本発明は、上記知見に基づき、さらに研究を重ねて完成されたものであり、以下の乳酸の製造方法を提供することを課題とする。
【0008】
項1. 乳酸生産能を有する微生物を、窒素源と炭素源とを含む培地で培養する工程と、生産された乳酸を回収する工程とを含む乳酸の製造方法であり、培養開始時の培地には、窒素源として魚由来窒素源のみ添加し、乳酸生産速度が低下又は実質的に停止した時点で、それ以外の窒素源を添加する方法。
項2. 培養工程終了時の、培地中の残糖濃度が10mg/ml以下である、項1に記載の方法。
項3. 魚由来窒素源がフィッシュミールである項1又は2に記載の方法。
項4. 培養開始時の培地中の魚由来窒素源の濃度が、乾燥重量に換算して、1〜7w/v%である項1〜3のいずれかに記載の方法。
項5. 魚由来窒素源以外の窒素源の培地中濃度が、乾燥重量に換算して、0.01〜4w/v%になるように後添加する項1〜4のいずれかに記載の方法。
項6. 炭素源が糖質を含み、培養開始時の培地中の糖質濃度が10〜120mg/mlである項1〜5のいずれかに記載の方法。
項7. 炭素源が糖質を含み、糖質が、グルコース、スクロース、及び廃糖蜜からなる群より選ばれる少なくとも1種である項1〜6のいずれかに記載の方法。
項8. 乳酸生産能を有する微生物がLactobacillus属に属する乳酸菌である項1〜7の何れかに記載の方法。
項9. 乳酸生産能を有する微生物がLactobacillus delbrueckiiである項1〜7の何れかに記載の方法。
項10. 乳酸がD-乳酸である項1〜9の何れかに記載の方法。
【発明の効果】
【0009】
本発明方法によれば、魚由来窒素源を含む安価な培地を用いながら、糖質の乳酸への転換率を非常に高くすることができる。従って、本発明方法により得られる培養液は、糖質濃度が極めて低くなり、培養後の培養液から糖質を除去する手間を省くことができる。発酵後の乳酸を含む培養液は、そのまま次工程、例えばエステル化工程に供される場合があるが、本発明方法により得られる培養液を用いる場合は、乳酸と残存糖質との副反応が抑制されて、乳酸が副反応に消費されることなく、また、不純物となる副生成物の生成を抑制できるため、これを簡単に除去でき、これらの結果、乳酸エステルの回収率が高くなる。また、発酵後の乳酸を含む培養液は、乳酸を濃縮の上、次工程に供される場合が多いが、培養液の残存糖質濃度が低いため、濃縮しても培養液の粘度が高くなり過ぎることがなく、扱いが容易である。
また、本発明方法によれば、高光学純度の乳酸(特に、D-乳酸)が得られる。
さらに、本発明方法によれば、乳酸濃度の高い培養液が得られる。即ち、培地中の原料糖質濃度を高くすることができ、その結果、培養後に、高乳酸濃度の培養液を得ることができる。
本発明方法は、特にD−乳酸の製造に適している。
【図面の簡単な説明】
【0010】
【図1】実施例5において、魚由来窒素源にそれ以外の窒素源を後添加した場合の、D-乳酸濃度の推移を示す図である。
【図2】実施例6において、魚由来窒素源にそれ以外の窒素源を後添加した場合の、D-乳酸濃度の推移を示す図である。
【図3】実施例7において、魚由来窒素源にそれ以外の窒素源を後添加した場合の、D-乳酸濃度の推移を示す図である。
【発明を実施するための形態】
【0011】
以下、本発明を詳細に説明する。
培地中の窒素源
<魚由来窒素源>
魚由来窒素源としては、魚肉;魚の骨、皮、目玉、内臓のような「あら」(魚の魚肉以外の部分);及び魚の全体;並びにそれらの乾燥物などが挙げられる。中でも、フィッシュミール(魚粉)が好ましい。フィッシュミールは、魚を丸ごと乾燥し、粉砕したものである。魚の種類は特に限定されないが、大量に入手できるイワシ、カツオ、サメ、タラ、ニシン、メンハーデンなどを使用すればよい。
魚由来窒素源は、例えば粉砕してそのまま培地に添加してもよいが、乳酸生産菌の乳酸発酵性能が高くなる点で、タンパク質分解酵素で処理したものを用いることが好ましい。タンパク質分解酵素処理物は、魚肉、あら、魚の全体、及びそれらの乾燥物などを、プロテアーゼで例えば約30〜80℃で数時間処理することにより得ることができる。
魚由来窒素源としては、中でも、乳酸生産菌の発酵性能が高くなり、また低価格である点で、フィッシュミールのタンパク質分解酵素処理物が好ましい。タンパク質分解酵素は、公知の酵素を制限なく使用できる。また、アルカリ性プロテアーゼ、酸性プロテアーゼ、中性プロテアーゼの何れでもよく、由来生物種も制限されない。
魚由来窒素源は1種を単独で、又は2種以上を組み合わせて使用できる。
【0012】
<その他の窒素源>
魚由来以外の、即ちその他の窒素源としては、微生物の培養に用いられる公知の窒素源を制限なく使用できる。魚由来以外の窒素源には、非魚動物由来窒素源、微生物由来、及び植物由来窒素源が含まれる。このような窒素源として、例えば、酵母エキス、ペプトン(魚由来ペプトンを除く。非魚動物由来ペプトン、植物由来ペプトンを含む。)、ポリペプトン(魚由来ポリペプトンを除く。牛乳カゼイン由来ポリペプトンのような非魚動物由来ポリペプトン、大豆やエンドウ豆由来ポリペプトンのような植物由来ポリペプトンを含む。)、ビール酵母、肉エキス、大豆加水分解物、エンドウ豆加水分解物、麦加水分解物、カゼイン分解物、カザミノ酸、油粕のようなペプチド又はアミノ酸類;アンモニア、硝酸塩のような無機体窒素類;尿素などが挙げられる。中でも、乳酸生産菌の発酵性能が高くなる点で、ペプチド又はアミノ酸類が好ましく、酵母エキス、非魚動物又は植物由来のポリペプトンがより好ましく、ビール酵母エキス(中でも、日本製薬株式会社製、酵母エキスイーストD3)、酵母エキス(中でも、KERRY社製、HY−yest、又はアサヒフードアンドヘルスケア株式会社製、ミーストN)、大豆由来ポリペプトン(中でも、日本製薬株式会社製、ポリペプトンN)、カゼイン由来ポリペプトン(中でも、日本製薬株式会社製、ポリペプトン、又はDMVinternational社製、ペプトンCE90M)が特に好ましい。
その他の窒素源は1種を単独で、又は2種以上を組み合わせて使用できる。
【0013】
<窒素源の比率>
培養開始時の培地中の魚由来窒素源の濃度は、乾燥重量に換算して、約1〜7w/v%が好ましく、約2〜6w/v%がより好ましく、約3〜5w/v%がさらにより好ましい。上記範囲であれば、高光学純度の乳酸(特に、D-乳酸)が得られる。また、魚由来窒素源が多すぎて攪拌し難くなるということがない。
また、培地に後添加する、その他の窒素源の培地中の濃度は、乾燥重量に換算して、約0.01〜4w/v%が好ましく、約0.05〜3w/v%がより好ましく、約0.1〜2w/v%がさらにより好ましい。上記範囲であれば、安価な魚由来窒素源を用いてコストを抑えながら、高光学純度の乳酸(特に、D-乳酸)が得られ、培地中の糖質を効率よく乳酸に転換させることができる。
また、種菌は、どのような窒素源を用いた培地で培養したものであってもよい。種菌も魚由来窒素源を含む培地を用いてもよい。
【0014】
その他の窒素源を添加するタイミングは、培養途中で、乳酸生産速度が低下、実質的に停止し、又は停止した時点とすればよい。乳酸生産速度が低下又は実質的に停止した時点とは、乳酸生産速度が、例えば0.5mg/ml/hr以下、好ましくは0.3mg/ml/hr以下、より好ましくは0.1mg/ml/hr以下となった時点である。
魚由来窒素源だけでは、培地中の糖質の全ては乳酸に変換されず、培地中に糖質が残存しているのに乳酸生産が遅滞又は停止してしまう傾向にあるが、その他の窒素源を添加することにより、乳酸発酵を再開させることができる。
その他の窒素源を後添加する方法には、当該その他窒素源のみ後添加する方法、当該その他窒素源と炭素源とを後添加する方法、当該その他窒素源と窒素源以外の必要成分を含む培地とを後添加する方法、当該窒素源と魚由来窒素源と窒素源以外の必要成分を含む培地とを後添加する方法などが含まれる。
【0015】
培地中の炭素源
炭素源としては、使用する乳酸生産菌が乳酸発酵できる糖質を用いればよい。糖質としては、グルコース、フルクトースのような単糖類;シュークロース、マルトース、トレハロースのような二糖類;デンプン、セルロース、ヘミセルロース、キシランのような多糖類などが挙げられる。糖質としてデンプン、セルロース、ヘミセルロース、キシランなどの多糖類を用いる場合は、アミラーゼ、セルラーゼ、ヘミセルラーゼ、エンドキシラナーゼ、キシロシダーゼのような、当該多糖類を分解する酵素で予め処理したものを用いたり、又は多糖類とともに多糖類分解酵素を培地に添加することにより多糖類の分解と並行して乳酸発酵を行うことが好ましく、これにより、効果的に乳酸を産生させることができる。また、これらの糖類を含有する甘藷糖蜜、サトウキビ廃糖蜜のような廃糖蜜なども使用できる。
中でも、乳酸生産菌の発酵性能が高くなる点で、単糖類、二糖類がより好ましく、グルコース、スクロースがさらにより好ましい。また、乳酸の生産性が高くなる点で、サトウキビ廃糖蜜も好ましい。
【0016】
糖質に加えて、酢酸、フマル酸のような有機酸;エタノールのような一価アルコール類;グリセリンのような多価アルコールなども炭素源として用いることができる。
糖質を含む炭素源は、1種を単独で、又は2種以上を組合わせて使用できる。
培養開始時の培地中の糖質濃度は、約10〜120mg/mlが好ましく、約30〜100mg/mlがより好ましく、約40〜80mg/mlがさらに好ましい。上記範囲であれば、効率よく乳酸を生産できるとともに、残存糖質量が抑えられる。
炭素源、及び窒素源は、それぞれ、蒸気殺菌、ろ過殺菌、瞬間殺菌など一般的な殺菌方法で殺菌しておき、培地に添加すればよい。
【0017】
培地のその他の成分
培地は、乳酸発酵用の培地に通常添加される、リン酸塩、硫酸マグネシウムのようなマグネシウム塩、カルシウム塩、鉄塩、マンガン塩のような無機塩類;ビタミン類;ポリソルベートのような脂肪酸などを含んでいてよい。
【0018】
乳酸生産菌
乳酸生産菌、特にD-乳酸を生産できる菌としては、ホモ発酵を行う、Lactobacillus delbrueckii subsp. lactis IAM 12476、Lactobacillus delbrueckii IFO 3534等の菌株が挙げられる。中でも、発酵性能の点で乳酸の工業生産に適しているため、Lactobacillus delbrueckii IFO 3534が好ましい。その他、ヘテロ発酵を行う乳酸菌株として、Leuconostoc pseudomesenteroides JCM 9696等も用いることができる。
IFO番号が付された微生物は、独立行政法人製品評価技術基盤機構バイオテクノロジー本部生物遺伝資源部門(NBRC)から入手できる。IAM番号およびJCM番号の付された微生物は、独立行政法人理化学研究所バイオリソースセンター微生物材料開発室(RIKEN BRC−JCM)より入手できる。
【0019】
培養条件
乳酸発酵の温度は、使用する乳酸生産菌が生育する温度であればよく、例えば約0〜60℃が好ましく、約30〜50℃がより好ましく、約35〜45℃がさらにより好ましい。
発酵中は、乳酸の生成に伴って培地pHが低下する。培地pHが下がりすぎると菌の生育を阻害するため、炭酸カルシウム、水酸化ナトリウム、アンモニアなどのアルカリでpHを調整すればよい。中でも、水酸化ナトリウム、アンモニアが好ましい。これは乳酸ナトリウム、乳酸アンモニウムは常温で液状であるため、培養後に、菌体などの不溶性成分と分離し易いからである。また水酸化ナトリウムなどの液状の中和剤を用いれば、中和剤の必要添加量と乳酸の生成量が相関することから、中和剤の添加量から発酵の進行度合いを簡単に知ることができる。さらに水酸化ナトリウムは安価であり、工業生産に有利である。発酵液のpHは、使用菌株によって異なるが、約4〜7に調整することが好ましく、約5〜6.5に調整することがより好ましい。
培養開始時又はその後に培地中に予め炭酸カルシウムを約0.1〜1w/v%添加しておき、pHの低下に伴い、さらに異種のアルカリを用いて上記範囲にpH調整することも好ましい。これにより、乳酸生産速度が一層高くなり、効率よく乳酸を製造できる。
【0020】
培養は、回分培養、半回分培養、連続培養の何れであってもよい。中でも、残存糖質量を低減できる点で回分培養が好ましい。また、糖質のみ培養中に追加する半回分培養、連続培養であってもよい。
培養時間は、使用菌株、培地成分、特に糖質の量などにより異なるが、回分培養の場合、約1〜20日間が好ましく、約2〜17日間がより好ましく、約3〜10日間がさらに好ましい。連続培養、半回分培養を行う場合はこれに限定されない。
本発明方法により、最終的に培地中の残糖濃度を、通常10mg/ml以下、好ましくは5mg/ml以下、より好ましくは3mg/ml以下、さらに好ましくは1mg/ml以下にすることができる。また、条件を選択することにより、残存する糖質の全て、又は殆ど全てを乳酸に転換することができる。
【0021】
乳酸の回収
培養後の培養液から菌体を除去することにより、乳酸を、乳酸又は乳酸アルカリ塩の形態で回収することができる。また、pH調整用のアルカリとして、炭酸カルシウムを使用する場合は乳酸カルシウムが生じるが、乳酸カルシウムは水に不溶性であるため、培養液を例えば硫酸で酸性(pH3.5以下)にし、カルシウムを硫酸カルシウムとして析出させ、菌体と共に除去すればよい。さらに、菌体などの不溶性成分を除去した後、エタノール、又はメタノールで乳酸エステルを生成させ、有機溶媒中に回収することもできる。
【実施例】
【0022】
以下、本発明を実施例を挙げてより具体的に説明する。
分析方法
(1)乳酸の定量および光学純度の測定
乳酸の定量用試料は、乳酸カルシウムの溶解度を考慮し、試料希釈液0.2mlにエタノール0.8mlを加え生じる沈殿物を遠心分離(15.000rpm、5min)して除去し、上清を水で適宜希釈することにより調製した。この試料をHPLC(キラルカラム)で分析した。HPLC条件は下記の通りである。
カラム:Sumichiral OAキラルカラム(Column, Sumichiral OA-5000
(4.6mm ID×15cm)
温度:室温
移動相:2mM Cooper(II)sulfate-5H2O(249.69) 水-イソプロパノール混液(98:2)溶液
溶出率:1.0ml/min
検出:UV at 254nm
鏡像異性体過剰率ee(Enantiomeric excess)は、以下の式により計算した。
ee (%) =([D-体]-[L-体])/([D-体]+[L-体])×100
(2)糖の定量
糖はフェノール硫酸法で定量した。グルコースは、グルコース定量キット(グルコースCIIテストワコー、和光純薬)を用いて定量した。
【0023】
実施例1(各乳酸菌による通常培地中でのD−乳酸の生産率の比較)
200ml容の三角フラスコに1%ペプトン、1%酵母エキス、0.4%リン酸水素二カリウムからなる培地100mlを調製し、1N NaOHでpH6.8に調整後、121℃、15分オートクレーブした。別にオートクレーブした50%グルコース溶液を終濃度50mg/mlになるように無菌的に加えて種培養用培地とした。中和剤としてCaCO3を4g添加してPYG培地とした。これに、保存用寒天培地から各菌株を白金耳で植菌し、ロータリーシェイカーにて40℃で72時間培養した。この種培養液の10mlを種培養用培地と同様に調製した本培養用培地に加え、種培養と同条件で48時間培養した。以下の表1に、試験した菌種とD−乳酸の生成濃度、光学純度を示す。
【0024】
【表1】

菌種1:Lactobacillus delbrueckii subsp. lactis IAM 12476
菌種2:Lactobacillus delbrueckii IFO 3534
菌種3:Leuconostoc pseudomesenteroides JCM 9696 (ヘテロ発酵)
【0025】
実施例2(魚粉末の種類の検討)
窒素源として各種魚粉末を用いてD-乳酸を生産し、得られる乳酸濃度と、D-乳酸の光学純度を比較した。即ち、200ml容の三角フラスコに各種魚粉末4g、0.4%K2HPO4(pH7.2)50ml、オリエンターゼ22BF(エイチビーアイ社製アルカリプロテアーゼ)200mgを加えて、60℃で3時間反応させた。反応後、終濃度4%になるようにCaCO3を加えて、85mlになるよう水でメスアップし、121℃で15分間オートクレーブし、別にオートクレーブした50%(w/v)グルコース溶液10ml(培地中のグルコースの仕込み濃度50mg/ml)を加え、魚粉末培地とした。これらの培地に実施例1と同様に調製したLactobacillus delbrueckii IFO 3534株の種培養液を10ml加え、40℃、72時間培養した。結果を以下の表2に示す。
【0026】
【表2】

【0027】
実施例3(各乳酸菌による魚粉末蛋白分解酵素処理物含有培地中でのD−乳酸の生産率の比較)
200ml容の三角フラスコにカツオ魚粉末(粉砕した試料)4g、0.4%K2HPO4(pH7.2)50ml、オリエンターゼ90N(エイチビーアイ社製中性プロテアーゼ)80mgを加えて、50℃で3時間反応させた。反応後、終濃度4%になるようにCaCO3加えて、85mlになるよう水でメスアップし、121℃で15分間オートクレーブし、別にオートクレーブした50%(w/v)グルコース溶液10mlを加え(培地中のグルコースの仕込み濃度50mg/ml)カツオ魚粉末蛋白分解酵素処理物含有培地(フィッシュミール培地)とした。これらの培地に実施例1と同様に調製した各種菌株の種培養液を15ml加え、Lactobacillus delbrueckii IFO 3534は40℃で48時間培養した。結果を以下の表3に示す。各種菌株とも、カツオ魚粉末蛋白分解酵素処理物含有培地を用いてD−乳酸を生成することができた。
【0028】
【表3】

菌種1:Lactobacillus delbrueckii subsp. lactis IAM 12476
菌種2:Lactobacillus delbrueckii IFO 3534
菌種3:Leuconostoc pseudomesenteroides JCM 9696 (ヘテロ発酵)
【0029】
実施例4(魚由来窒素源とそれ以外の窒素源との併用)
培地中のグルコースの仕込み濃度を120mg/mlにした以外は、実施例2と同様にして、200ml容の三角フラスコに魚粉末蛋白分解酵素分解物含有培地(ニシンフィッシュミール培地)100mlを調製し、Lactobacillus delbrueckii IFO 3534株を培養した。但し、培養時間は48時間とした。
培養48時間後の培養液にポリペプトンN(日本製薬株式会社製)およびHY−yest(KERRY社製)を各1%ずつ添加し、さらに120時間培養を継続した(合計168時間)。培地中の魚粉末蛋白分解酵素分解物の濃度は4%であり、ポリペプトンNおよびHY−yestの合計濃度は2%である。
以下の表4に、魚粉末蛋白分解酵素分解物含有培地を用いて48時間培養した場合、及びさらにポリペプトンNおよびHY−yestを添加して合計168時間培養した場合の、培養後の培地の濁度、D-乳酸濃度、グルコース濃度、D-乳酸の光学純度を示す。表4から、ポリペプトンNおよびHY−yestをフィッシュミール培地に加えることにより、グルコースのほぼ全量を消費することができ、高濃度のD-乳酸が得られることが分かる。
【0030】
【表4】

【0031】
実施例5(魚由来窒素源とそれ以外の窒素源との併用)
ミツワ製50L容のジャーファーメンターにカツオ魚粉末(丸石株式会社製)1.2kg、0.4%K2HPO4(pH7.2)15LオリエンターゼN(エイチビーアイ社製中性プロテアーゼ)24gを加えて、50℃で3時間(回転数100rpm)反応させた。反応後、27Lになるように水でメスアップし、121℃で30分間蒸気滅菌し、別途オートクレーブ滅菌した50%グルコース溶液3L(培地中のグルコースの仕込み濃度50mg/ml)を加えてカツオ培地とした。
【0032】
このカツオ培地に実施例1と同様に調製したLactobacillus delbrueckii IFO 3534株の種培養液を300ml加えて培養を行った。培養条件は攪拌回転数80rpm、培養温度40℃、通気は5%vvm量を気相のみに行い、25%NaOH水溶液を用いてpH6.0に制御した。培養開始170時間で、D−乳酸の生産が停止したため(D-乳酸生産速度が約0mg/ml/hr)、ポリペプトン(日本製薬株式会社製)と酵母エキスイーストD3(日本製薬株式会社製)を各0.1%ずつ添加した。培地中の魚粉末蛋白分解酵素分解物の濃度は4%であり、ポリペプトンと酵母エキスイーストD3の合計濃度は0.2%である。
培養液中のD-乳酸濃度を経時的に測定した結果を以下の表5、及び図1に示す。表5、及び図1から明らかなように、一旦停止したD-乳酸の発酵が、ポリペプトン、及び酵母エキスイーストD3の添加により再開された。また、培地中の糖質を実質的に全て消費してD-乳酸に転換させることができた。
【0033】
【表5】

【0034】
実施例6(魚由来窒素源とそれ以外の窒素源との併用(工業スケールでの検討;2000L))
小松川化工機製3000L容のジャーファーメンターにカツオ魚粉末(丸石株式会社製)80Kg、K2HPO4 4kg、オリエンターゼ 90N(エイチビーアイ社製中性プロテアーゼ)1.6kgを加えて、50℃で3時間反応させた。反応後、1000Lになるように水でメスアップし、121℃で30分間蒸気滅菌し、別途滅菌した25%グルコース溶液400Lを加えて(培地中のグルコースの仕込み濃度50mg/ml)カツオ培地とした。カツオ培地に実施例1と同様に調製したLactobacillus delbrueckii IFO 3534株の種培養液を20L加えて培養を行った。培養条件は攪拌回転数65rpm、培養温度40℃、通気は5%vvm量を気相のみに行い、25%NaOH水溶液を用いてpH6.0に制御した。培養開始230時間でD−乳酸の生産が停止したため(D-乳酸生産速度が約0mg/ml/hr)、ポリペプトン(日本製薬株式会社製)と酵母エキスイーストD3(日本製薬株式会社製)を各0.1%ずつ添加した。培地中の魚粉末蛋白分解酵素分解物の濃度は4%であり、ポリペプトンと酵母エキスイーストD3の合計濃度は0.2%である。
培養液中のD-乳酸濃度を経時的に測定した結果を以下の表6、及び図2に示す。表6、及び図2から明らかなように、一旦停止したD-乳酸の発酵が、ポリペプトン、及び酵母エキスイーストD3の添加により再開された。また、培地中の糖質を全て消費してD-乳酸に転換させることができた。
【0035】
【表6】

【0036】
実施例7(魚由来窒素源とそれ以外の窒素源との併用(工業スケールでの検討;3,000L))
5000L容の培養槽にニシンフィッシュミール粉末(エクアドル産)120kg、K2HPO46kg、オリエンターゼ22BF(エイチビーアイ社製アルカリ性プロテアーゼ)6kgを加えて、60℃で3時間反応させた。反応後、2000Lになるように水でメスアップし、121℃で30分間蒸気滅菌し、別途滅菌した150mg/mlグルコース溶液1000Lを加えて(培地中のグルコースの仕込み濃度50mg/ml)魚粉培地とした。魚粉培地に実施例1と同様に調製したLactobacillus delbrueckii IFO 3534株の種培養液を30L加えて培養を行った。培養条件は攪拌回転数80rpm、培養温度40℃、通気は5%vvm量を気相のみに行い、25%NaOH水溶液を用いてpH6.0に制御した。培養開始48時間で、D-乳酸の生産速度が低下したため(D-乳酸生産速度が約0.1mg/ml/hr以下)、カゼインペプトン(CE90M)(DMVinternational社製)と酵母エキス(ミーストN)(アサヒフードアンドヘルスケア株式会社製)を各0.1%添加した。培地中の魚粉末蛋白分解酵素分解物の濃度は4%であり、カゼインペプトン(CE90M)と酵母エキス(ミーストN)の合計濃度は0.2%である。
培養液中のD-乳酸濃度を経時的に測定した結果を以下の表7及び図3に示す。表7及び図3から明らかなように、一旦遅滞したD-乳酸の発酵が、カゼインペプトン(CE90M)及び酵母エキス(ミーストN)の添加により再開された。また、培地中の糖質を全て消費してD-乳酸に転換させて、高濃度のD−乳酸液が得られた。また、非常に光学純度が高いD-乳酸が得られた。
【0037】
【表7】

【0038】
比較例1(魚由来窒素源のみを用いた発酵(2000L))
小松川化工機製3000L容のジャーファーメンターにニシンフィッシュミール粉末(エクアドル産)80Kg、K2HPO4 4kg、オリエンターゼ22BF(エイチビーアイ社製アルカリプロテアーゼ)4kg、水1000Lを加えて、60℃で3時間反応させた。反応後、合計1600Lになるように水でメスアップし、121℃で30分間蒸気滅菌し、別途滅菌した25%グルコース溶液400Lを加えて(培地中のグルコースの仕込み濃度50mg/ml)フィッシュミール培地とした。フィッシュミール培地に実施例1と同様に調製したLactobacillus delbrueckii IFO 3534株の種培養液を20L加えて培養を行った。培養条件は攪拌回転数65rpm、培養温度40℃、通気は5%vvm量を気相のみに行い、25%NaOH水溶液を用いてpH6.0に制御した。培養開始110時間でD−乳酸の生産が停止したため発酵を終了した。培養液をジャーファーメンターからタンクへと移液し、72時間静置した。
培養液中のD-乳酸濃度を経時的に測定した結果を以下の表8に示す。表8から明らかなように、生成したD-乳酸の光学純度およびD−乳酸の濃度が、発酵終了時(110時間)から静置後(182時間)にかけて顕著に低下した。
【0039】
【表8】

【産業上の利用可能性】
【0040】
本発明方法によれば、ポリ乳酸原料となる乳酸、特にD-乳酸を安価に効率よく生産できるため、ポリ乳酸を低コストで工業生産できるようになった。
【特許請求の範囲】
【請求項1】
乳酸生産能を有する微生物を、窒素源と炭素源とを含む培地で培養する工程と、生産された乳酸を回収する工程とを含む乳酸の製造方法であり、培養開始時の培地には、窒素源として魚由来窒素源のみ添加し、乳酸生産速度が低下又は実質的に停止した時点で、それ以外の窒素源を添加する方法。
【請求項2】
培養工程終了時の、培地中の残糖濃度が10mg/ml以下である、請求項1に記載の方法。
【請求項3】
魚由来窒素源がフィッシュミールである請求項1又は2に記載の方法。
【請求項4】
培養開始時の培地中の魚由来窒素源の濃度が、乾燥重量に換算して、1〜7w/v%である請求項1〜3のいずれかに記載の方法。
【請求項5】
魚由来窒素源以外の窒素源の培地中濃度が、乾燥重量に換算して、0.01〜4w/v%になるように後添加する請求項1〜4のいずれかに記載の方法。
【請求項6】
炭素源が糖質を含み、培養開始時の培地中の糖質濃度が10〜120mg/mlである請求項1〜5のいずれかに記載の方法。
【請求項7】
炭素源が糖質を含み、糖質が、グルコース、スクロース、及び廃糖蜜からなる群より選ばれる少なくとも1種である請求項1〜6のいずれかに記載の方法。
【請求項8】
乳酸生産能を有する微生物がLactobacillus属に属する乳酸菌である請求項1〜7の何れかに記載の方法。
【請求項9】
乳酸生産能を有する微生物がLactobacillus delbrueckiiである請求項1〜7の何れかに記載の方法。
【請求項10】
乳酸がD-乳酸である請求項1〜9の何れかに記載の方法。
【請求項1】
乳酸生産能を有する微生物を、窒素源と炭素源とを含む培地で培養する工程と、生産された乳酸を回収する工程とを含む乳酸の製造方法であり、培養開始時の培地には、窒素源として魚由来窒素源のみ添加し、乳酸生産速度が低下又は実質的に停止した時点で、それ以外の窒素源を添加する方法。
【請求項2】
培養工程終了時の、培地中の残糖濃度が10mg/ml以下である、請求項1に記載の方法。
【請求項3】
魚由来窒素源がフィッシュミールである請求項1又は2に記載の方法。
【請求項4】
培養開始時の培地中の魚由来窒素源の濃度が、乾燥重量に換算して、1〜7w/v%である請求項1〜3のいずれかに記載の方法。
【請求項5】
魚由来窒素源以外の窒素源の培地中濃度が、乾燥重量に換算して、0.01〜4w/v%になるように後添加する請求項1〜4のいずれかに記載の方法。
【請求項6】
炭素源が糖質を含み、培養開始時の培地中の糖質濃度が10〜120mg/mlである請求項1〜5のいずれかに記載の方法。
【請求項7】
炭素源が糖質を含み、糖質が、グルコース、スクロース、及び廃糖蜜からなる群より選ばれる少なくとも1種である請求項1〜6のいずれかに記載の方法。
【請求項8】
乳酸生産能を有する微生物がLactobacillus属に属する乳酸菌である請求項1〜7の何れかに記載の方法。
【請求項9】
乳酸生産能を有する微生物がLactobacillus delbrueckiiである請求項1〜7の何れかに記載の方法。
【請求項10】
乳酸がD-乳酸である請求項1〜9の何れかに記載の方法。
【図1】


【図2】


【図3】




【図2】


【図3】


【公開番号】特開2010−273605(P2010−273605A)
【公開日】平成22年12月9日(2010.12.9)
【国際特許分類】
【出願番号】特願2009−129703(P2009−129703)
【出願日】平成21年5月28日(2009.5.28)
【出願人】(000108993)ダイソー株式会社 (229)
【Fターム(参考)】
【公開日】平成22年12月9日(2010.12.9)
【国際特許分類】
【出願日】平成21年5月28日(2009.5.28)
【出願人】(000108993)ダイソー株式会社 (229)
【Fターム(参考)】
[ Back to top ]

