発酵食品生産物中のフレーバー産生を改善する方法。
本発明は、発酵食品生産物におけるフレーバー産生を改善する方法、S.テルモフィルス、ここにおいて、グルタミン酸デヒドロゲナーゼが不活性化されている、並びに、前記株を含む食品生産物を記載する。更に、本発明は、改善されたフレーバー産生を有するS.テルモフィルスを同定する方法、および発酵食品生産物におけるフレーバー産生を改善するためのその使用を記載する。
【発明の詳細な説明】
【発明の分野】
【0001】
本発明は、微生物学および微生物学発酵を使用する食品生産の分野に関し、そこにおいてストレプトコッカス・テルモフィルス(Streptococcus thermophilus)が使用され、それは食品生産物中のフレーバー産生を改善する。
【背景】
【0002】
ストレプトコッカス・テルモフィルスは、食品産業のための重要な乳酸菌(LAB)である。それは、高い調理温度を使用するイタリアおよびスイスチーズの産生のために使用され、ヨーグルトの生産のためにラクトバシルス・デルブルエキイ亜種ブルガリクス(Lactobacillus delbrueckii subsp. bulgaricus)との共培養において使用される。
【0003】
更に、S.テルモフィルスは、多様な量のフレーバーを生産できる。しかしながら、それは、その急速な酸性化能のために頻繁に使用される。これは、大部分のアミノ酸生合成および変換経路の存在を示す。しかしながら、ストレプトコッカス(S.)・テルモフィルスLMG18311は、ゲノムに基づいて完全なペントースリン酸経路を有さないことが予測される。ペントースリン酸経路は、還元的生合成において使用するためのNADPHの供給源として全ての生物の要求を満たす。大部分のLABは、完全なペントースリン酸経路を有する。全ての生命体はNADPHを必要とすることから、S.テルモフィルスは、NADPHを合成するために代替経路を必要とする。
【0004】
S.テルモフィルスの入手可能なゲノムスケールモデル(Pastinkら、Appl.Environm.Microbiol.2009,vol.75,no.11:3627−3633)に基づくと、グルタミン酸デヒドロゲナーゼは、NADPH生成のための最も適した経路であるように予測された。一般に、グルタミン酸デヒドロゲナーゼ(GDH)活性を提示する株は、グルタメートからα−ケトグルタレートを作り出すことが可能であり、そのために、Gluを含む反応培地中でアミノ酸を分解することが可能である。
【発明の概要】
【0005】
S.テルモフィルスのゲノムスケールモデルは、ペントースリン酸経路の酸化部分の不在と、代替的なNADPHを生ずる代謝経路の必要性を示した。代謝モデルは、アミノ酸代謝、特に、グルタミン酸デヒドロゲナーゼがこのNADPHを提供するであろうことを示す。
【0006】
従って、本発明は、何れの経路がNADPH生成のためにS.テルモフィルスにより使用されるのかを発見することを目指す。S.テルモフィルスの入手可能なゲノムスケールモデルが使用され、モデルは、最初にグルタミン酸デヒドロゲナーゼが最も適した経路であると予測する。本発明者らは、この遺伝子のノックアウトを構築し、得られた変異体を、増殖実験、発酵挙動により、転写レベルについて分析した。
【0007】
S.テルモフィルスにおけるGDHの崩壊がアミノ酸代謝作用のより高い活性を導くことが発見され、増加したアンモニア産生により示された。これは、GDH、a−ケトグルタレートの産生がアミノ酸代謝作用における必須因子であると考えられることから極めて驚くべきことであった。彼らはまた、不活性なGDHSを有するテルモフィルスが、活性なGDHを有する同じS.テルモフィルスと比較して改善されたフレーバープロファイルを有することを発見した。
【0008】
本発明の目的は、改善されたフレーバーの生産能力を有するS.テルモフィルスを提供することである。S.テルモフィルスによる更なるアミノ酸利用はまた、ヨーグルト中での共培養におけるより少数のラクトバシルス・ブルガリクス(Lactobacillus bulgaricus)をもたらすだろう。L.ブルガリクスは、ヨーグルト発酵の終点での強い酸性化に関与することから、これはヨーグルトにおけるより少ないポスト酸性化を引き起こし、それ自体は、ヨーグルトのより穏やかな味を引き起こす。
【0009】
従って、第1の態様において、本発明は、発酵ブロス中のフレーバー産生を増大する方法であって、S.テルモフィルス株を使用する発酵媒体を発酵する工程を具備し、そこにおいてグルタミン酸デヒドロゲナーゼが不活性化されている方法に関する。
【0010】
更なる態様において、本発明は、S.テルモフィルス株であって、そこにおいてグルタミン酸デヒドロゲナーゼが不活性化されている株に関する。
【0011】
更なるもう1つの態様において、本発明は、S.テルモフィルス株を含む発酵ブロスであって、そこにおいて、グルタミン酸デヒドロゲナーゼが不活性化されている発酵ブロスを提供する。
【0012】
本発明は更に、S.テルモフィルス株を含む食品生産物であって、そこにおいてグルタミン酸デヒドロゲナーゼが不活性化されているS.テルモフィルス株を含む食品生産物、またはそこにおいてグルタミン酸デヒドロゲナーゼが不活性化されているS.テルモフィルス株を含む発酵ブロスに関する。
【0013】
本発明はまた、増大されたフレーバー産生を有するS.テルモフィルス株を同定する方法であって、S.テルモフィルス株におけるGDH−活性をスクリーニングする工程を具備する方法に関する。
【0014】
もう1つの態様において、本発明は、S.テルモフィルス株の使用であって、そこにおいてグルタミン酸デヒドロゲナーゼが不活性化されており、発酵食品生産物、特にヨーグルトまたはチーズ中のフレーバー産生を改善するための使用に関する。
【0015】
最後の態様において、本発明は、S.テルモフィルス株の使用であって、そこにおいてグルタミン酸デヒドロゲナーゼが不活性化されており、GDHが活性なS.テルモフィルス株を使用して製造されたヨーグルトに比較して、ヨーグルトにおいて減少されたCFUのL.ブルガリクスを得るための使用に関する。
【図面の簡単な説明】
【0016】
本発明は、以下の図面について、以下でより詳細に説明されるであろう。
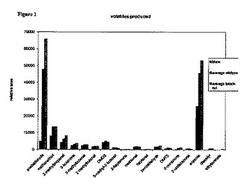
【図1】図1は、発酵サンプルのヘッドスペースのGC−MS分析を示す。S.テルモフィルスはCDM上で増殖された;サンプルは、指数増殖期の終わりに得られた(OD600〜1.3)。
【発明の詳細な説明】
【0017】
本発明は、発酵ブロスにおいて、特にS.テルモフィルスにより産生される、フレーバー産生を増大するための方法であって、S.テルモフィルス株を使用して発酵媒体を発酵する工程を具備し、そこにおいて、グルタミン酸デヒドロゲナーゼが不活性化されている方法に関する。
【0018】
本発明の方法は、a)発酵媒体を準備すること;b)発酵媒体を少なくともS.テルモフィルス株、ここにおいてグルタミン酸デヒドロゲナーゼが不活性化されている株を播種すること;c)発酵ブロスを得るために発酵を可能にすること;および任意にd)食品生産物の製造のために発酵ブロスの全てまたは一部分を使用すること;の工程を具備してよい。
【0019】
発酵ブロスは、それ自体フレーバー提供媒体として供給されてもよく、または産生されたフレーバー化合物が発酵ブロスから単離されてもよく、続いて食品生産物、飼料生産物などの製造において使用されてもよい。
【0020】
ここで使用されるとき用語「フレーバー産生の増大」は、食品生産物に対してフレーバーを提供するために重要な増大された量の少なくとも1つの化合物の産生をいう。不活性化グルタミン酸デヒドロゲナーゼを含む(以下、「GDH−不活性」ともよぶ)S.テルモフィルス株についてのフレーバー産生における改善は、グルタミン酸デヒドロゲナーゼが有意なグルタミン酸デヒドロゲナーゼ活性を有する(GDH−活性)同じS.テルモフィルス株と比較して規定されるだろう。ここで使用されるとき、GDH−不活性株は、グルタミン酸デヒドロゲナーゼが有意なグルタミン酸デヒドロゲナーゼ活性(GDH−活性)を有する同じS.テルモフィルス株(「親」株)に比較して、多くても約10%、例えば、約8%、約7%、約6%、約5%、約4%、約3%、好ましくは約2%および更にまた好ましくは約1%の残余のGDH活性を有するだろう。用語「グルタミン酸デヒドロゲナーゼが有意なグルタミン酸デヒドロゲナーゼ活性(GDH−活性)を有する同じS.テルモフィルス株(「親」株)」は、GDH−不活性S.テルモフィルス株が由来する株を示すために使用される。
【0021】
GDH−不活性株におけるフレーバー産生は、株が、フレーバー産生のために重要な少なくとも1つよりも多くの化合物の少なくとも約5%、好ましくは少なくとも約10%または約15%が産生されるときに、増大されるまたは改善されるだろう。フレーバー産生のために重要な化合物は、これらに限定するものではないが、アセトアルデヒド、メタンチオール、2−メチルプロパナール、2−ブタノン、3−メチルブタナール、2−メチルブタナール、ジメチルジスルフィド(DMDS)、3−メチル−2−ブテナール、2−ヘプタノン、メチオナール、ヘプタナール、ベンズアルデヒド、ジメチルトリスルフィド(DMTS)、2−ノナノン、2−ウンデカノン、アセトン、ジアセチル、およびエチルアセテートを含む。好ましくは、GDH−不活性株は、アセトアルデヒドおよび2−メチルプロパナールの少なくとも1つの増大された量またはアセトアルデヒドおよび2−メチルプロパナールの両方の増大された量を産生する。
【0022】
不活性化グルタミン酸デヒドロゲナーゼを含むS.テルモフィルス株は、ここにおいてまた、GDH−不活性株とも称される。株は、好ましくは組み換えDNA技術により作られた組み換え株である。グルタミン酸デヒドロゲナーゼは;gdhA遺伝子の欠失、挿入または変異;弱いプロモータでのgdhAプロモータの置換;アンチセンスDNAまたはRNA;およびsiRNA;の1つまたは1つ以上により不活性化されてよい。GDH−不活性株は、本質的に非機能的なGDHを含む。ここで使用されるとき、用語「本質的に非機能的なGDH」は、GDH活性が、極僅かであり、増殖のために十分なNADPHをS.テルモフィルス株に対して提供するために不十分であることを意味する。
【0023】
アミノ酸配列は、本質的に非機能的なGDHを産生するために変更されてよい。この目的のために、アミノ酸残基は、不活性GDHを得るために、欠失、挿入または変異されてもよい。アミノ酸配列の変異は、所望の位置で天然に存在するアミノ酸をもう1つのアミノ酸に変更することと理解される。部位特異的な変異生成が、例えば、GDHの触媒部位におけるアミノ酸残基を変更するために適用されてもよく、そのアミノ酸残基は、基質の結合または共同因子の結合のために重要であり、そのアミノ酸残基は、GDHの正確な折り畳みのためにまたはGDHの構造上重要なドメインである。アミノ酸配列は、部位特異的な変異生成を使用して変異されてもよく、または代替的に、ランダム変異生成を使用して、例えば、UV照射、化学的変異生成法またはランダムPCR法を使用して変異されてもよい。或いは、gdhA遺伝子が、公知のノックアウト技術を使用して、部分的または完全に欠失または不活性化されてもよい。もう1つの代替法は、ghdAプロモータを弱いまたは不活性なプロモータで置換して、GDHの発現の欠如をもたらすことである。当業者は、どのようにgdhAプロモータをもう1つのプロモータで置換するのかが分かる。
【0024】
当業者が、活性GDHタンパク質の発現が生じないために、gdhA遺伝子(グルタミン酸デヒドロゲナーゼをコードする)の適切な修飾を導入するための適切な戦略を選択することは通常業務である。例えば、インビトロで変異生成のための方法は、サンブロックらの文献に記載される(Sambrookら、Molecular cloning、A laboratory Manual、2nd ed.、Cold Spring Harbor Laboratory Press、Cold Spring Harbor、New York、USA、1989)。対応する方法もまたキットの形態で商業的に入手することが可能である(例えば、Quikchange site−directed mutagenesis kit by Stratagene、La Jolla、USA)。GDH−欠失は、例えば、遺伝子置換技術により達成されてよく、これは当業者に周知である。
【0025】
S.テルモフィルス株CNRZ1066、LMG18311およびLMD−9からのグルタミン酸デヒドロゲナーゼのアミノ酸配列は、公のデータベースから知られる(例えば、http://blast.ncbi.nlm.nih.gov/を参照されたい)。それらは等しい。GDHアミノ酸配列は、450のアミノ酸からなる。GDHタンパク質は、ストレプトコッカス種の間で高度に保存される(大部分のストレプトコッカス株で75%よりも高い同一性)。
【0026】
gdhA遺伝子はまた、アンチセンスDNAまたは(m)RNAまたはRNAi、好ましくはsiRNAを使用してサイレンシング(または「スイッチオフ」)されてもよい。用語、遺伝子サイレンシングは、一般に、遺伝子組み換え以外の機序により遺伝子をスイッチオフすることを表すために使用される。即ち、正常な環境下で発現されるだろう遺伝子は、細胞内の機構によりスイッチオフされる。当業者は、どのように本発明に対して遺伝子サイレンシングを適用するのか、およびどうように適切な遺伝子サイレンシング構築物を選択および製造するのかが分かる。
【0027】
本発明者らは、例の節で下文に示すように、全体のgdhA遺伝子をノックアウト(または欠失)することを選択している。
【0028】
発酵媒体は、それがS.テルモフィルスによる発酵を可能にする何れかの水性培地であってよい。「発酵」または「発酵培養」は、通常(必然的にではないが)嫌気性条件下で、炭水化物をアルコールおよび/または酸に変換する細菌の増殖のために使用される増殖培養をいう。「発酵媒体」は、発酵培養を設置するために使用される増殖媒体をいい、他方「発酵ブロス」は、一般に、発酵した媒体(即ち、発酵中および/または発酵後)を指すために使用される。しかしながら、両方の用語は、ここにおいて交換可能に使用されてもよく、意味は文脈から明らかだろう。発酵媒体は、糖源およびタンパク質源を含む何れかの発酵媒体であってよい。糖源は、使用されるS.テルモフィルス株により発酵される何れかの糖であってよく、これらに限定するものではないが、ラクトース、スクロース、デキストロース、グルコースなどを含む。タンパク質源は、何れかのタンパク質源であってよく、これらに限定するものではないが、乳タンパク質、植物タンパク質、魚タンパク質、肉タンパク質などを含む。特に、発酵食品生産物の生産のためには、タンパク質源が乳タンパク質および植物タンパク質から選択されることが好ましい。
【0029】
発酵ブロスは、何れかの発酵ブロスであってよいが、発酵食品生産物であってもよく、即ち、それ自身ヒトおよび/または動物の消費に適切な液体、半固体および/または固体の食品生産物(栄養組成物)であってもよい。
【0030】
S.テルモフィルスは、通常、乳タンパク質を含む乳型主成分の発酵媒体、例えば、乳を発酵することによるヨーグルトおよびチーズの製造において使用される。それはまた、通常、0.5〜10%(w/w)の大豆タンパク質、例えば、豆乳を含む大豆型主成分の発酵媒体を使用する大豆ヨーグルトの製造において使用される。S.テルモフィルスは更に、炭素およびエネルギーの供給源、例えば、炭水化物、例えば、糖、例えば、ラクトースを必要とする。好ましくは、乳型主成分の媒体(「乳基質」とも称する)は、天然または再構成された乳、スキムミルクまたは他のもの、または乳に基づく媒体または乳製品起源の生産物に基づく媒体である。
【0031】
この乳基質または大豆型主成分の媒体は、乳デザートの製造のために一般に使用されるアイテム、固体アイテム、例えば、果物、チョコレートチップまたはシリアル、例えば、更にまた甘味製品または液体チョコレートを含んでよい。
【0032】
有利に、本発明の株は、全ての種類の発酵乳および/または大豆製品の製造において使用される。
【0033】
従って、本発明は、発酵酪農製品の製造のためのプロセスに関し、そこにおいて乳基質は、本発明の少なくとも1つのS.テルモフィルス株で発酵される。
【0034】
或いは、本発明はまた、発酵された大豆製品の製造のためのプロセスに関し、そこにおいて、0.5〜10%(w/w)の大豆タンパク質、例えば、豆乳を含む大豆型主成分発酵媒体は、本発明の少なくとも1つのS.テルモフィルス株で発酵される。
【0035】
それはまた、このプロセスにおいて、本発明のS.テルモフィルス株と1つまたは1つ以上の更なる細菌株、特に、他の乳酸菌との組み合わせの使用のために提供することが可能である。「乳酸菌」(LAB)は、乳酸または他の有機酸(例えば、プロピオン酸)を発酵の最終産物として産生する細菌をいい、例えば、しかしながらこれらに限定するものではないが、ラクトバシルス(Lactobacillus)、ストレプトコッカス(Streptococcus)、ラクトコッカス(Lactococcus)、オイノコッカス(Oenococcus)、ロイコノストック(Leuconostoc)、ペジオコッカス(Pediococcus)、カルノバクテリウム(Carnobacterium)、プロピオニバクテリウム(Propionibacterium)、エンテロコッカス(Enterococcus)およびビフィドバクテリウム(Bifidobacterium)などの属の細菌である。
【0036】
好ましくは1つまたは1つ以上の更なる細菌株は、ラクトバシルス・ブルガリクス(Lactobacillus bulgaricus)、ラクトバシルス・アシドフィルス(Lactobacillus acidophilus)、ラクトバシルス・カゼイ(Lactobacillus casei)および/またはビフィドバクテリウム(Bifidobacterium)から選択される。
【0037】
本発明はまた、S.テルモフィルス株に関し、そこにおいて、グルタミン酸デヒドロゲナーゼが不活性化されている株に関する。前記株は、グルタミン酸デヒドロゲナーゼの完全に機能的なコピーを含まない。それは組み換え株または天然の株(非gmoおよび非変異体)であってよい。好ましくは、それは組み換え株である。テルモフィルス株は、好ましくは食品等級である。「食品等級」は、例えば、US食品医薬品局(FDA)などの関連行政当局によりヒトおよび/または動物消費のために安全と評価されていることをいう。株は、上述のとおりに製造されてよい。実施形態において、株はS.テルモフィルス株CBS125184であり、それはブタペスト条約の規則下にCentraalbureau voor Schimmelculturesに寄託されている(2009年9月3日に受託)。
【0038】
更に、本発明は、S.テルモフィルス株を含む発酵ブロスについて提供し、そこにおいて、グルタミン酸デヒドロゲナーゼは不活性化されている。発酵ブロスは、それ自身発酵食品生産物、例えば、ヨーグルトまたはチーズであってもよく、または発酵ブロスは、食品生産物の製造において使用されてもよい。「食品」または「食品生産物」は、ヒトおよび/または動物の消費のために適切な液体、半固体および/または固体の食品生産物(栄養組成物)をいう。食品または食品生産物は、それ自身発酵(「発酵食品生産物」)されていてもよく、例えば、ヨーグルト、チーズ、ケフィアなどであってよく、または本発明の方法を使用して製造された発酵食品生産物または発酵ブロスを含んでもよい。
【0039】
例えば、発酵ブロスは、他の食品生産物、例えば、液体食品(例えば、飲料、スープ、ヨーグルトまたはヨーグルトに基づく飲料、乳シェイク、清涼飲料、果実飲料、発酵酪農製品、食事代替物、発酵果実および/またはジュース製品など)または固体食品/飼料(食餌、食餌代替物、スナック、例えば、キャンディバー、動物飼料、発酵酪農製品、発酵食品または飼料生産物、アイス製品、凍結乾燥食品添加物、チーズなど)または半固体食品(デザートなど)において使用されてもよい。発酵ブロスは、単に食品生産物に対して添加されてもよく、またはそのような食品生産物の生産プロセスの間に使用されてもよい。
【0040】
或いは、発酵ブロスは、濃縮されてもよく、希釈されてもよく、または食品組成物を製造するために使用される前に前処理されてもよい。前処理は、濾過および/または遠心分離、滅菌、凍結乾燥、凍結などを含む。発酵ブロスそれ自身/または前処理発酵ブロスは、基本的に上記の方法の一次生産物である。これらの一次生産物は、例えば、発酵食品生産物の場合においてそれ自身使用されてもよく、食品生産物材料として使用されてもよく、即ち、最終食品生産物を製造するときに、適切な量の一次生産物が材料として使用されてもよい。本発明に従う食品組成物は、適切な量の一次生産物(発酵ブロス、例えば、それ自身または前処理物)を含む、または適切な量の一次生産物からなる。
【0041】
食品生産物または発酵ブロスは、好ましくはそれ自身発酵食品生産物であり、それは、これらに限定するものではないが、発酵酪農食品産生物、例えば、ヨーグルト、チーズ、ケフィア、バターミルク、サワークリーム、大豆ヨーグルトなどを含む。そのような食品生産物は、更に酪農デザートの製造のための一般的な材料、例えば、果実、チョコレートチップまたはシリアル、例えば、また更に甘味製品、液体チョコレートなどを含んでもよい。食品生産物は、更に例えば、乳化剤、ゲル化剤、安定剤、甘味料などの一般的な食品材料を含んでもよい。当業者は、本発明の(発酵された)食品生産物を使用してどのように食品生産物を製造するかが分かる。
【0042】
有利な実施形態において、発酵食品生産物は、ヨーグルトまたはチーズから選択される。ヨーグルトの製造のために、乳基質は、少なくとも本発明のS.テルモフィルス株およびラクトバシルス・デルブルエキイ亜種ブルガリクス(Lactobacillus delbrueckii subsp. bulgaricus)を使用して発酵される。他の細菌、例えば、LABが、例えば、ヨーグルトプロバイオティック特性を提供するために添加されてもよい。チーズの製造のために、乳基質は、少なくとも本発明に従うS.テルモフィルス株、および好ましくは、チーズ製造のための開始培養、例えば、一般的に使用される開始培養、任意に付加培養を使用して発酵される。本発明のS.テルモフィルス株はまた、チーズ開始培養の一部分であってもよい。
【0043】
本発明はまた、改善された(増大された)フレーバー産生を有するS.テルモフィルス株を同定する方法であって、S.テルモフィルス株におけるGDH−活性をスクリーニングする工程を具備する方法を提供する。更なる工程は、1つまたは1つ以上のGDH−不活性株の選択、またはGDH−不活性株を同定することであってよい。改善されたフレーバー産生を有するそのような株は、上述のような発酵ブロス、食品生産物または発酵食品生産物の製造において有利に使用される。GDH−活性をスクリーニングする方法は、当該技術分野において周知の方法を使用して行われてよく、例えば、以下の例に記載される方法を使用してよい。
【0044】
また、本発明は、S.テルモフィルス株の使用に関し、そこにおいてグルタミン酸デヒドロゲナーゼは不活性化されており、発酵食品生産物、特に、ヨーグルトまたはチーズにおけるフレーバー産生を改善するための使用に関する。
【0045】
アセトアルデヒドは、同様なGDH−活性な株と比べてGDH−不活性株において過剰に産生され、ヨーグルトにその特有のフレーバーを与える。2−メチルプロパナールは、ナッツフレーバーを与え、それは、特にある種類のチーズ、例えば、チェダーチーズに望ましい。
【0046】
最後に、本発明は、S.テルモフィルス株の使用に関し、そこにおいてグルタミン酸デヒドロゲナーゼが不活性化されており、GDHが活性なS.テルモフィルス株を使用して製造されたヨーグルトに比較して、ヨーグルトにおいてL.ブルガリクスの減少されたCFUを得るための使用に関する。2つの株は、フレーバー産生の公正な比較を可能にするために、好ましくは同様または同一の条件下において発酵される。用語「コロニー形成単位(CFU)」は、生存可能な細菌または真菌数の測定単位である。
【0047】
本書において、およびその特許請求の範囲において、動詞「含む(comprise)」およびその活用は、その非限定的な意味において使用され、その後に続く事項が含まれることを意味するが、しかしながら特に言及されない事項が排除されるものではない。加えて、動詞「なる(consist)」は、「本質的になる(consist essentially)」により置換されてよく、本発明の組成が、特に特定されたものとは異なる更なる成分(単数または複数)を含んでもよいことを意味し、更なる成分(単数または複数)は、本発明の特有の特徴を変更するものではない。
【0048】
数値に関して使用されるとき、用語「約(approximately)」または「約(about)」(約10(approximately 10)、約10(about 10))は、好ましくは値が問題の値である10に±1%の範囲の値であってよいことを意味する。
【0049】
加えて、不定冠詞「1つの(a)」または「1つの(an)」による成分への言及は、文脈が1つおよび1つのみの成分が存在することを明確に要求する場合を除いて、1つよりも多くの成分が存在する可能性を排除するものではない。不定冠詞「1つの(a)」または「1つの(an)」は、従って、通常「少なくとも1つ」を意味する。
【0050】
本明細書において引用された全ての参考特許および文献は、引用することによりその全体がここに組み込まれる。
【0051】
上記の記載および図面は本発明の幾つかの実施形態を説明するために含まれるものであり、本発明の範囲を制限するものではないことは明白だろう。本開示から始まり、多くの更なる実施形態が、当業者には明らかであり、それらは保護および本発明の本質の範囲内にあり、それらは、先行技術および本特許の開示の明らかな組み合わせである。
【例】
【0052】
[材料および方法]
細菌株、媒体および増殖条件
本検討において使用された株は、ストレプトコッカス(S.)テルモフィルスLMG18311、ラクトコッカス・ラクチス(Lactococcus (L.) lactis)MG1363およびラクトバシルス(Lb.)プランタルムWCFS1であった。細胞は嫌気的に増殖した。L.ラクチスおよびS.テルモフィルスはグルコース(GM17)が補われたM17ブロス(Difco、Detroit、MI、USA)中で、30℃と42℃のそれぞれで、1%(重量/体積)の最終濃度まで増殖された。S.テルモフィルスΔgdhAは、クロラムフェニコール(10μg/mL)の存在において増殖した。Lb.プランタルムは、グルコースが補われたマン・ロゴサ・シャープ(Mann Rogosa Sharpe、MRS)ブロス(Merck、Whitehouse Station、NY、USA)中で、37℃で最終濃度が1%(重量/体積)まで増殖された。エシェリキア・コリDH5α(27)を1つの酵素アッセイのために使用し、TYB培地(Difco)において37℃で好気的に培養された。
【0053】
発酵実験のために、細胞は既知組成培地(CDM)において増殖された。
【0054】
グルタミン酸デヒドロゲナーゼ(gdhA)活性
Lb.プランタルム、L.ラクチスMG1363およびS.テルモフィルス(野生型およびgdhAノックアウトの両方)の培養物は、OD600〜1まで増殖させた。培養物を遠心し、50mMのβ−グリセロフォスフェート(pH7)中で2回洗浄した(4℃、5000rpm、15分間)。2回目の洗浄工程の後に、ペレットをOD600〜200/mLにまで同じ緩衝液中で濃縮した。ビート−ビーティングにより細胞崩壊(4×30秒、スピード4.0、Fastprep FP120)の後に、遠心分離により、細胞崩壊堆積物を除いた(13000rpm、10分間、4℃、Eppendorf Centrifuge 5417R)。gdhAアッセイは、バックグラウンドノイズに対して敏感であるために、細胞非含有抽出物をスライド−ア−ライザー(slide−a−lizer、Pierce、Rokcford、IL、USA)で精製し、50mMのβ−グリセロフォスフェート(pH7)中、4℃で、一晩、透析した。細胞非含有抽出物をスライド−ア−ライザーからシリンジを使用して除去し、直ちに酵素活性の測定のために使用した。
【0055】
gdhA活性は、比色分析グルタメートアッセイで分析した(Boehringer、Mannheim、Germany、Cat.No.10139092035)。反応混合物を37℃でインキュベートし、50mMのリン酸カリウム/TEA緩衝液pH9(溶液1、キット)、1.76U/mLのジアフォラーゼ+NAD(溶液2、キット)、2mMのINT(溶液3、キット)、100mMのグルタメート、13.8mMのNADP+またはNAD+および細胞非含有抽出物を含む。NADPHの形成の後に、492nmでの吸光度の増加をモニタリングすることにより分光光度法を行った。
【0056】
グルコース−6−リン酸デヒドロゲナーゼ(G6PDH)活性
Lb.プランタルム(陽性対照)およびS.テルモフィルスの培養物をOD600〜1まで増殖した。培養物を遠心し、55mMトリス/HCl緩衝液(pH7.8)中のメガヒュージ1.0R(Megafuge 1.0R(Heraeus Instruments、Germany)中で洗浄した(5000rpm、15分間、4℃)。2回目の洗浄工程の後、ペレットを1mLの55mMトリス/HCl緩衝液(pH7.8)中で濃縮し、ビート−ビーティング(4×30秒間、スピード4.0、Fastprep FP120)および遠心(13000rpm、10分間、4℃、Eppendorf Centrifuge 5417R)を行った。G6PDH活性は、ホンジョウ(Honjohら、2003、Biosci.Biotechnol.Biochem.67:1888−1896)による記載の通りに分析した。反応混合物を25℃でインキュベートし、55mMトリス/HCl緩衝液(pH7.8)、3.3mMのMgCl2、0.2mMのNADP+および3.3mMのグルコース−6−ホスフェートおよび細胞非含有抽出物を含んだ。NADPHまたはNADHの形成の後、340nmでの吸光度の増加をモニタリングすることにより分光光度法を行った。
【0057】
イソクエン酸デヒドロゲナーゼ(ICDH)活性
E.コリDH5α(陽性対照として使用)およびS.テルモフィルス(野生型およびgdhA変異体)の培養物をOD600〜1まで増殖した。細胞を遠心分離(5000rpm、15分間、4℃)により採取し、35mMトリス/HCL緩衝液(pH7.5)中で2回洗浄した。細胞ペレットを1mLの35mMトリス/HCL緩衝液(pH7.5)中で濃縮し、ビート−ビーティング(4×30秒間、スピード4.0、Fastprep FP120)した。ICDH活性は、クビトコビッチらによる記載の通りに分析した(Cvitkovitchら、1997.J.Bacteriol.179:650−655)。反応混合物を37℃でインキュベートし、35mMトリス/HCl緩衝液(pH7.5)、5mMのイソシトレート、3.5mMのMgCl2またはMnCl2、0.35mMのNADP+および細胞非含有抽出物を含んだ。NADPHの形成の後に、340nmでの吸光度の増大のモニタリングにより分光光度法を行った。
【0058】
S.テルモフィルスのためのgdhAノックアウト構築
分子クローニング技術を標準的な実験室手順に従い行った。野生型株S.テルモフィルスLMG18311を、ブロンキビストらの記載の通りのオーバーラッピングPCR産物の自然変換を使用する機能的なgdhA遺伝子(ΔgdhA)を欠く変異体の構築のために使用した(Blomqvistら、2006.Appl.Environ.Microbiol.72:6751−6756)。
【0059】
Lb.プランタルムのためのgdhA/glnAノックアウトの構築
Lb.プランタルムにおいて、gdhAおよびglnA(グルタミンシンテターゼ)の両方のダブルノックアウトを以前に記載された戦略に従い構築した(Goffinら、2006.Appl.Environ.Microbiol.72:7933−7940)。両方の遺伝子は、遺伝子約600bpの内部フラグメントの挿入を有する自殺プラスミド(pGIM008およびpJDC9)を使用する単一交差により不活性化された。エリストマイシンおよびクロラムフェニコールの付加が、挿入の安定性を保証する。この変異体は、S.テルモフィルスgdhA変異体と機能的に同じである。
【0060】
バッチ培養
発酵は、1Lのバイオリアクター(Applikon Biotechnology BV、The Netherlands)内でデュプリケートで行った。発酵は、Bio Controller ADI 1010およびBio Console ADI 1025により制御された(Applikon Biotechnology BV、The Netherlands)。S.テルモフィルス野生型およびΔgdhAをCDM中で一晩培養し、1000mLのpH制御CDMの接種材料として使用し、培地は、1%で接種された。gdhAノックアウトのための培地は、クロラムフェニコール(10μg/mL)を補われた。株は、増殖の間、42℃で増殖され、pHは、2.5MのNaOHの添加によりpH=6.5で一定に維持された。
【0061】
Lb.プランタルム野生型およびΔgdhAは、CDM中で一晩培養され、1000mLのpH制御CDMの接種材料として使用され、培地は1%で接種された。gdhAノックアウトのための培地は、クロラムフェニコール(10μg/mL)およびエリストマイシン(10μg/mL)を補われた。株は、増殖中、37℃で増殖され、pHは、2.5MのNaOHの添加によりpH=5.5で一定に維持された。
【0062】
培養物は100rpmの一定の速度で攪拌された。増殖の後、30分毎に600nmで細胞密度を測定された。HPLCおよびRNA単離のためのサンプル(2×25mL)は指数増殖期の終わりに得た。GC−MS分析のためのサンプル(3mL)は、中間指数増殖期および静止期で得た。
【0063】
ゲノムスケールでのmRNA転写レベルの分析
RNA単離
幾つかの改変を伴って他に記載されたようにRNAを単離した(Sperandioら、2005.J.Bacteriol.187:3762−3778.)。中間指数増殖期で、各発酵槽からの25mLの培養物(制限培地および完全培地の両方についてデュプリケートのサンプル)を14000rpmで2分間に亘る室温での遠心により直ちにペレット化した(Herolab、Unicen MR、Germany)。ペレットを液体窒素中で急速に凍結し、−80℃で更なる使用まで保存した。凍結ペレットを400μLのTEに再懸濁し、500μLのフェノール−クロロホルム(5:1)、15μLの20%ドデシル硫酸ナトリウム、30μLの3M酢酸ナトリウム、pH4.8および0.6gジルコニウムガラスビーズを含むネジ蓋付きチューブに移した。細胞をファストプレップ(Fastprep、Savant、FP120)中で、40秒間、5.0で破壊し、混合物をビーズを除去するために遠心した(13000rpm、20分間、4℃)。次に、500μLの冷クロロホルムを上清に添加し、続いて、遠心分離工程(13000rpm、10分間、4℃)を行った。遠心分離の後、DNAseI処理を我々は30分、37℃に変更したことを除いて、製造者のプロトコールに続き、0.5mLの水相をハイ・ピュア・RNA・単離キット(High Pure RNA Isolation kit、Roche Diagnostics、Mannheim、Germany)を使用するRNA抽出のために使用した。RNAは、60μLの溶出緩衝液(キット中に提供される)において溶出され、サンプルは−80℃で保存した。
【0064】
RNAの濃度をND−1000分光光度計(NanoDrop Technologies、Inc.、USA)で検査し、質を2100バイオアナライザー(2100 Bioanalyzer、Agilent Technologies、Santa Clara、CA、USA)により試験した。23S/16S比が1.6よりも高いサンプルだけは、標識化のために使用した。
【0065】
cDNA合成および標識
5μgRNAからの第1の鎖cDNA合成を以前記載されたように行った(Saulnierら、2007.Appl Environ Microbiol 73:1753−1765;Serranoら、2007.Microb.Cell Fact.6:29)。合成されたcDNAを精製し、シアニン3およびシアニン5で全てのサンプルについて標識した。標識されたcDNAの質およびその濃度をND−1000分光光度計(NanoDrop Technologies、Inc.、USA)で測定した。
【0066】
ハイブリダイゼーション
ラベルされたcDNA(サンプル当たり0.3μg)のハイブリダイゼーションを以前記載されたように行った(Saulnierら、2007.Appl Environ Microbiol 73:1753−1765;Serranoら、2007.Microb.Cell Fact.6:29)。サンプルは、特注設計のアジレント・テクノロジー・オリゴ・マイクロアレイ(Agilent Technologies oligo microarrays)上でアジレント・60マー・オリゴ・マイクロアレイ・プロセッシング・プロトコール・バージョン4.1(Agilent 60−mer oligo microarray processing protocol version 4.1)を使用してハイブリダイズした(Saulnierら、2007.Appl Environ Microbiol 73:1753−1765)。
【0067】
スキャニングおよびデータ解析
スライドをスキャン・アレイ・エクスプレス・スキャナー(ScanArray Express scanner)により解像度5μmでスキャンした。データ解析および処理は他に記載されたように行った(Saulnierら、2007.Appl Environ Microbiol 73:1753−1765;Serranoら、2007.Microb.Cell Fact.6:29)。折り畳み変化は2Mとして規定する、ここでM=2log(cy5強度/cy3強度)(Serranoら、2007.Microb.Cell Fact.6:29)。有意に調節された遺伝子は、その平均p値が5%未満であり、そのM値が1.5に等しいか、または1.5よりも高い遺伝子として規定された。
【0068】
スキャン強度、正規化、スケーリング、サイバーT(Cyber−T)および偽発見率(False Discovery Rate、FDR)の選択は、他で記載されたように行った(Blomら、2008.BMC Genomics.9:495)。単一遺伝子fdr基準を通過しないマイクロアレイデータにおけるより微細な差次的発現を表すために、それらが以下の基準に従う場合に、マルチプル遺伝子のFDRの相乗平均(geometric mean)を算出した:(i)遺伝子が同じオペロンの一部分である、(ii)それらが同様の差次的発現を示す(例えば、gdhA変異体において発現された全ての合計)(iii)それらが後の代謝的変換に関与する(ひいては同じ代謝経路の一部分)。
【0069】
これらの基準により、我々は、共発現された遺伝子からなる2つの異なる経路を発見し、それは、各経路についてオペロンにおいて組織化された(シトレート経路およびコンピテント遺伝子)
比較ゲノミクス
ERGOインフォマティクス・スウィート(The ERGO bioinformatics suite、http://ergo.integratedgenomics.com/ERGO/)を使用して、ゲノムレベルで、S.テルモフィルスと他のシーケンシングされたLABとを比較した。特に、ペントースリン酸経路の存在を試験し、入手可能な53のLABゲノムの間で比較した。
【0070】
アンモニア測定
発酵サンプルの上清中のアンモニア濃度を、アンモニアキット(R−biopharm AG、Darmstadt、Germany)によるUV法を使用して測定した。
【0071】
タンパク質濃度
細胞非含有抽出物中のタンパク質濃度をビシンコニン酸タンパク質アッセイ試薬(Pierce、Rockford、Il.USA)を使用して測定した。
【0072】
代謝分析
サンプル中の揮発性成分を同定するために、パージ・アンド・トラップ・サーマル・デソルプション・コールド・トラップ・ガスクロマトグラフィを以前に記載された通りに使用した(Engels.1997.PhD thesis Wageningen University;Smitら、2004.Appl.Microbiol.Biotechnol.64:396−402)。ヘッドスペースサンプルを、フィジョン・MFA814・コールド・トラップ(Fisons MFA815 cold trap、CE Instruments,Milan,Italy)において濃縮し、続いて、CIP−SIL5CBロウ・ブリード・カラム(CIP−SIL 5 CB low−bleed column、Chrompack、Middelburg、The Netherlands)を備えたGC−8000トップ・ガス・カラムクロマトグラフィ(GC−8000 top gas chromatograph、CE Instruments)上で分離し、更に、フレームイオン化検出器により検出した。
【0073】
発酵サンプルの錠生中に存在する細胞外代謝産物を他で記載されるように測定した(Starrenburg and Hugenholtz.1991.Appl.Environ.Microbiol.57:3535−3540)
[結果]
NADPH生成の予測およびgdhAノックアウトの構築
導入部において記載されたとおり、我々は以前に開発されたS.テルモフィルスのゲノムスケールモデル(Pastinkら、2009.Appl.Environ.Microbiol.75:3627−3633)を使用して、NADPH発生経路について探索した。S.テルモフィルスは、完全なペントースリン酸経路を有さず、この経路を介してNADPHは生ずることができないと予測される。モデルは、イソクエン酸デヒドロゲナーゼまたはグルタミン酸デヒドロゲナーゼが有力なNADPH生成酵素であるかもしれないことを予測した。これらの酵素がコードする経路は、α−ケトグルタレートを介して関連しており、これは重要な生体化合物である。モデルの予測は、酵素活性をアッセイすることにより実験的に試験された。また、予測されたPPPの不在は、PPPの第1の酵素、グルコース−6−リン酸デヒドロゲナーゼの活性を測定することにより検証した。
【0074】
Lb.プランタルムおよびS.テルモフィルスの細胞非含有抽出物をG6PDH活性のために分析した。この株が完全なペントースリン酸経路を有することが公知であることから、Lb.プランタルムを陽性対照として使用した。酵素アッセイは、Lb.プランタルムがG6PDH活性を有し、S.テルモフィルスがG6PDH活性を有さないことを実際に示した(表1)。
【0075】
Lb.プランタルム、L.ラクチスおよびS.テルモフィルス野生型およびΔgdhAの細胞非含有抽出物をGDH活性について分析した。L.ラクチスは、陰性対照として使用した。Lb.プランタルムおよび野生型S.テルモフィルスはGDH活性を有する(表1)。予期された通り、gdhAノックアウトは、GDH活性を有さない。
【表1】

【0076】
S.テルモフィルス野生型およびΔgdhAおよびE.コリDH5αの細胞非含有抽出物をイソクエン酸デヒドロゲナーゼ活性について分析した。E.コリは、陽性対照として使用し、ICDH活性を実際に有する。E.コリのICDHは、TCA回路における重要な調整酵素であり、そのためにこの酵素の高い活性が観察される。ICDH活性は、野生型のS.テルモフィルスについては観察されず、それに対してgdhA変異体はICDH活性を有する(表1)。
【0077】
この知見と、S.テルモフィルスの野生型がグルタメートを利用できるという観察(Tanousら、2002.Antonie Van Leeuwenhoek.82:271−278)に基づいて、グルタミン酸デヒドロゲナーゼ変異体が、ブロンキビストら(前掲)により記載されたようなオーバーラップPCR産物の自然変換を使用する構築された。gdhAのオープンリーディングフレームが、クロラムフェニコール抵抗性を与えるP32−catカセットにより交換された。この検討において使用されたプライマーは表2に掲載され、全てのPCR反応は、フージョンポリメラーゼ(Fhusion polymerase、New England Biolabs Inc、Ipswich、MA、USA)を用いて行われた。
【表2】

【0078】
gdhAの上流および下流の組み換えフラグメント(1.5kb)をPCRによりUpDelgdhA1/UpDelgdhA2およびDnDelgdhA1/DnDelgdhA1プライマー対を使用してそれぞれ増幅した。pNZ5320からのP32−catカセット(pNZ5318の派生物、lp291フラグメントの除去)(Lambertら、2007.Appl.Environ.Microbiol.73:1126−1135)を、UpcatおよびDncatプライマーを用いるPCRにより増幅した。3つのオーバーラップPCR産物を等モル濃度で混合し、プライマーUpDelgdhA1/DnDelgdhA2を使用するPCRにより結合し、次にPCR混合物を自然変換のために使用した。変異体の遺伝子型は、組み換え領域の上流および下流に配置されたプライマーでのPCRにより確認された。対照として、我々はペントースリン酸経路陽性のLAB、Lb.プランタルムを使用し、それについて、同様のgdhA変異体を構築した。この変異体の構築のために使用されたプライマーを表3に掲載する。
【表3】

【0079】
代謝反応
発酵サンプルをHPLC上で分析した(表4)。野生型は、ホモ乳酸増殖を示し、これは以前に観察および記載された通りであった(Holsら、2005.FEMS Microbiol.Rev.29:435−463)。gdhA変異体はまた、主にラクテートを生成し、少量のホルメートを生成し、それはシトレートを消費する。同じ増殖率で、野生型よりも少ないグルコースが変異体により消費され、これはより効率的な増殖を示しうる。
【表4】

【0080】
揮発性物質のプロファイルは2つの株で同様である;しかしながら、gdhA変異体は、野生型よりも多くのアセトアルデヒド、アセトンおよび2−メチルプロパナールを産生する。
【0081】
gdhAはまた、より多くのトレオニンを消費し、これはトレオニンアルドラーゼによるトレオニン変換からのアセトアルデヒド産生を指し示しうる。また、gdhA変異体は、野生型よりも多くのプロパノンを産生し、プロパノンは、解糖の一部分として形成されうる。幾つかのアルデヒド、例えば、2−メチルプロパナールおよび3−メチルブタナールがgdhA変異体からのサンプル中で高い濃度で見られる。これらのアルデヒドは、バリンおよびロイシン代謝の間にそれぞれ産生され、HPLCデータは、野生型に比較して変異体により分岐アミノ酸の高い消費を実際に示す。
【0082】
同じサンプルにおけるアミノ酸のHPLC分析は(表5)、野生型よりもgdhA変異体によって、全てのアミノ酸がより多く消費されることを示す。
【表5】

【0083】
加えて、変異体はまた、野生型に比べて高いアンモニア産生(3倍に匹敵する)を示し(表6)、これは、高いアミノ酸消費と十分に一致する。これは恐らく、アミノ酸分解を示す。
【表6】

【0084】
Lb.プランタルムの場合において、発酵サンプルは、S.テルモフィルスのために使用されたものと同じ手続きに続き分析された(表4)。gdh/glnA変異体および野生型は主な代謝に相違を示さない;ラクテート、ホルメートおよびアセテートが同様の量で産生される。更に、アミノ酸測定は、アスパルテートを除いて、変異体による異なるアミノ酸の同様な利用を示す(表5)。野生型およびgdhA/glnA変異体の揮発性物質プロファイルはほぼ等しい(データは示さず)。
【0085】
トランスクリプトーム分析
遺伝子発現におけるghdA遺伝子の不在の影響をマイクロアレイで検討した。差次的な制御のために、我々は、以下の基準を満たす遺伝子のみを選択した(i)比率≧1.25および(ii)FDR値<0.05。これらの基準により、我々は142遺伝子が差次的に発現することを発見した(表S1)。理論的に、グルタミン酸デヒドロゲナーゼは、gdhA変異体において激しく下方制御される。ΔgdhAは、NADPHを産生するための代替的な経路を必要とする;近年開発されたシンフェニーモデル(Pastinkら、2009.Appl.Environ.Microbiol.75:3627−3633)からの予測は、イソクエン酸デヒドロゲナーゼであった。アレイデータは、シトレート代謝(相乗平均FDR<0.05、平均比率≧1.25);メチルクエン酸シンターゼ、アコニテートシンターゼおよびイソクエン酸デヒドロゲナーゼの上方制御を示した。この上方制御はまた、シトレート(HPLC分析)の消費および高いICDH活性に一致し、NADPHのためのイソクエン酸デヒドロゲナーゼの重要性が示されうる。更に、アミノ酸代謝の同じ部分は、gdhA変異体において影響される;幾つかのアミノ酸トランスポーターが変異体において上方制御され、分岐鎖アミノ酸エクスポーターが下方制御される。ヒスチジンアンモニアリアーゼが下方制御され、この酵素は、窒素代謝の一部分である。ホスホセリンアミノトランスフェラーゼは、gdhA変異体において極めて上方制御される;この酵素は、O−ホスホ−L−セリンおよび2−オキソグルタレートからのグルタメートおよびホスホノオキシピルベートの形成を触媒する。
【0086】
コンピテンスに関与する共発現遺伝子(相乗平均<0.05;平均比率≧1.25)は、野生型に比べて変異体において下方制御された。
【0087】
比較ゲノミクス
ERGOバイオインフォマティクススウィートを使用して、入手可能なシーケンシングされたLABをペントースリン酸経路の不在において比較した。S.テルモフィルスだけが不完全なPPPを有するLABではない。実際に、少数のS.スイス(S.suis)およびS.ニューモニア(S.pneumonia)株を除外する殆ど全てのストレプトコッカスは、S.テルモフィルスPPPにおける132gdhA変異の酸化部分を欠く。全てのストレプトコッカスは、同様の共通する祖先を共有するが、この先祖は、異なる分岐において分かれる。大部分のストレプトコッカスにおけるPPP遺伝子の遺伝子喪失の事象は、恐らく並行して、機能的な理由のために生じた。S.テルモフィルスは、その速い増殖について知られており、異なるストレプトコッカスの間での遺伝子喪失の事象は、珍しいとも思われず、増殖遅延をもたらすものでもない。
【発明の分野】
【0001】
本発明は、微生物学および微生物学発酵を使用する食品生産の分野に関し、そこにおいてストレプトコッカス・テルモフィルス(Streptococcus thermophilus)が使用され、それは食品生産物中のフレーバー産生を改善する。
【背景】
【0002】
ストレプトコッカス・テルモフィルスは、食品産業のための重要な乳酸菌(LAB)である。それは、高い調理温度を使用するイタリアおよびスイスチーズの産生のために使用され、ヨーグルトの生産のためにラクトバシルス・デルブルエキイ亜種ブルガリクス(Lactobacillus delbrueckii subsp. bulgaricus)との共培養において使用される。
【0003】
更に、S.テルモフィルスは、多様な量のフレーバーを生産できる。しかしながら、それは、その急速な酸性化能のために頻繁に使用される。これは、大部分のアミノ酸生合成および変換経路の存在を示す。しかしながら、ストレプトコッカス(S.)・テルモフィルスLMG18311は、ゲノムに基づいて完全なペントースリン酸経路を有さないことが予測される。ペントースリン酸経路は、還元的生合成において使用するためのNADPHの供給源として全ての生物の要求を満たす。大部分のLABは、完全なペントースリン酸経路を有する。全ての生命体はNADPHを必要とすることから、S.テルモフィルスは、NADPHを合成するために代替経路を必要とする。
【0004】
S.テルモフィルスの入手可能なゲノムスケールモデル(Pastinkら、Appl.Environm.Microbiol.2009,vol.75,no.11:3627−3633)に基づくと、グルタミン酸デヒドロゲナーゼは、NADPH生成のための最も適した経路であるように予測された。一般に、グルタミン酸デヒドロゲナーゼ(GDH)活性を提示する株は、グルタメートからα−ケトグルタレートを作り出すことが可能であり、そのために、Gluを含む反応培地中でアミノ酸を分解することが可能である。
【発明の概要】
【0005】
S.テルモフィルスのゲノムスケールモデルは、ペントースリン酸経路の酸化部分の不在と、代替的なNADPHを生ずる代謝経路の必要性を示した。代謝モデルは、アミノ酸代謝、特に、グルタミン酸デヒドロゲナーゼがこのNADPHを提供するであろうことを示す。
【0006】
従って、本発明は、何れの経路がNADPH生成のためにS.テルモフィルスにより使用されるのかを発見することを目指す。S.テルモフィルスの入手可能なゲノムスケールモデルが使用され、モデルは、最初にグルタミン酸デヒドロゲナーゼが最も適した経路であると予測する。本発明者らは、この遺伝子のノックアウトを構築し、得られた変異体を、増殖実験、発酵挙動により、転写レベルについて分析した。
【0007】
S.テルモフィルスにおけるGDHの崩壊がアミノ酸代謝作用のより高い活性を導くことが発見され、増加したアンモニア産生により示された。これは、GDH、a−ケトグルタレートの産生がアミノ酸代謝作用における必須因子であると考えられることから極めて驚くべきことであった。彼らはまた、不活性なGDHSを有するテルモフィルスが、活性なGDHを有する同じS.テルモフィルスと比較して改善されたフレーバープロファイルを有することを発見した。
【0008】
本発明の目的は、改善されたフレーバーの生産能力を有するS.テルモフィルスを提供することである。S.テルモフィルスによる更なるアミノ酸利用はまた、ヨーグルト中での共培養におけるより少数のラクトバシルス・ブルガリクス(Lactobacillus bulgaricus)をもたらすだろう。L.ブルガリクスは、ヨーグルト発酵の終点での強い酸性化に関与することから、これはヨーグルトにおけるより少ないポスト酸性化を引き起こし、それ自体は、ヨーグルトのより穏やかな味を引き起こす。
【0009】
従って、第1の態様において、本発明は、発酵ブロス中のフレーバー産生を増大する方法であって、S.テルモフィルス株を使用する発酵媒体を発酵する工程を具備し、そこにおいてグルタミン酸デヒドロゲナーゼが不活性化されている方法に関する。
【0010】
更なる態様において、本発明は、S.テルモフィルス株であって、そこにおいてグルタミン酸デヒドロゲナーゼが不活性化されている株に関する。
【0011】
更なるもう1つの態様において、本発明は、S.テルモフィルス株を含む発酵ブロスであって、そこにおいて、グルタミン酸デヒドロゲナーゼが不活性化されている発酵ブロスを提供する。
【0012】
本発明は更に、S.テルモフィルス株を含む食品生産物であって、そこにおいてグルタミン酸デヒドロゲナーゼが不活性化されているS.テルモフィルス株を含む食品生産物、またはそこにおいてグルタミン酸デヒドロゲナーゼが不活性化されているS.テルモフィルス株を含む発酵ブロスに関する。
【0013】
本発明はまた、増大されたフレーバー産生を有するS.テルモフィルス株を同定する方法であって、S.テルモフィルス株におけるGDH−活性をスクリーニングする工程を具備する方法に関する。
【0014】
もう1つの態様において、本発明は、S.テルモフィルス株の使用であって、そこにおいてグルタミン酸デヒドロゲナーゼが不活性化されており、発酵食品生産物、特にヨーグルトまたはチーズ中のフレーバー産生を改善するための使用に関する。
【0015】
最後の態様において、本発明は、S.テルモフィルス株の使用であって、そこにおいてグルタミン酸デヒドロゲナーゼが不活性化されており、GDHが活性なS.テルモフィルス株を使用して製造されたヨーグルトに比較して、ヨーグルトにおいて減少されたCFUのL.ブルガリクスを得るための使用に関する。
【図面の簡単な説明】
【0016】
本発明は、以下の図面について、以下でより詳細に説明されるであろう。
【図1】図1は、発酵サンプルのヘッドスペースのGC−MS分析を示す。S.テルモフィルスはCDM上で増殖された;サンプルは、指数増殖期の終わりに得られた(OD600〜1.3)。
【発明の詳細な説明】
【0017】
本発明は、発酵ブロスにおいて、特にS.テルモフィルスにより産生される、フレーバー産生を増大するための方法であって、S.テルモフィルス株を使用して発酵媒体を発酵する工程を具備し、そこにおいて、グルタミン酸デヒドロゲナーゼが不活性化されている方法に関する。
【0018】
本発明の方法は、a)発酵媒体を準備すること;b)発酵媒体を少なくともS.テルモフィルス株、ここにおいてグルタミン酸デヒドロゲナーゼが不活性化されている株を播種すること;c)発酵ブロスを得るために発酵を可能にすること;および任意にd)食品生産物の製造のために発酵ブロスの全てまたは一部分を使用すること;の工程を具備してよい。
【0019】
発酵ブロスは、それ自体フレーバー提供媒体として供給されてもよく、または産生されたフレーバー化合物が発酵ブロスから単離されてもよく、続いて食品生産物、飼料生産物などの製造において使用されてもよい。
【0020】
ここで使用されるとき用語「フレーバー産生の増大」は、食品生産物に対してフレーバーを提供するために重要な増大された量の少なくとも1つの化合物の産生をいう。不活性化グルタミン酸デヒドロゲナーゼを含む(以下、「GDH−不活性」ともよぶ)S.テルモフィルス株についてのフレーバー産生における改善は、グルタミン酸デヒドロゲナーゼが有意なグルタミン酸デヒドロゲナーゼ活性を有する(GDH−活性)同じS.テルモフィルス株と比較して規定されるだろう。ここで使用されるとき、GDH−不活性株は、グルタミン酸デヒドロゲナーゼが有意なグルタミン酸デヒドロゲナーゼ活性(GDH−活性)を有する同じS.テルモフィルス株(「親」株)に比較して、多くても約10%、例えば、約8%、約7%、約6%、約5%、約4%、約3%、好ましくは約2%および更にまた好ましくは約1%の残余のGDH活性を有するだろう。用語「グルタミン酸デヒドロゲナーゼが有意なグルタミン酸デヒドロゲナーゼ活性(GDH−活性)を有する同じS.テルモフィルス株(「親」株)」は、GDH−不活性S.テルモフィルス株が由来する株を示すために使用される。
【0021】
GDH−不活性株におけるフレーバー産生は、株が、フレーバー産生のために重要な少なくとも1つよりも多くの化合物の少なくとも約5%、好ましくは少なくとも約10%または約15%が産生されるときに、増大されるまたは改善されるだろう。フレーバー産生のために重要な化合物は、これらに限定するものではないが、アセトアルデヒド、メタンチオール、2−メチルプロパナール、2−ブタノン、3−メチルブタナール、2−メチルブタナール、ジメチルジスルフィド(DMDS)、3−メチル−2−ブテナール、2−ヘプタノン、メチオナール、ヘプタナール、ベンズアルデヒド、ジメチルトリスルフィド(DMTS)、2−ノナノン、2−ウンデカノン、アセトン、ジアセチル、およびエチルアセテートを含む。好ましくは、GDH−不活性株は、アセトアルデヒドおよび2−メチルプロパナールの少なくとも1つの増大された量またはアセトアルデヒドおよび2−メチルプロパナールの両方の増大された量を産生する。
【0022】
不活性化グルタミン酸デヒドロゲナーゼを含むS.テルモフィルス株は、ここにおいてまた、GDH−不活性株とも称される。株は、好ましくは組み換えDNA技術により作られた組み換え株である。グルタミン酸デヒドロゲナーゼは;gdhA遺伝子の欠失、挿入または変異;弱いプロモータでのgdhAプロモータの置換;アンチセンスDNAまたはRNA;およびsiRNA;の1つまたは1つ以上により不活性化されてよい。GDH−不活性株は、本質的に非機能的なGDHを含む。ここで使用されるとき、用語「本質的に非機能的なGDH」は、GDH活性が、極僅かであり、増殖のために十分なNADPHをS.テルモフィルス株に対して提供するために不十分であることを意味する。
【0023】
アミノ酸配列は、本質的に非機能的なGDHを産生するために変更されてよい。この目的のために、アミノ酸残基は、不活性GDHを得るために、欠失、挿入または変異されてもよい。アミノ酸配列の変異は、所望の位置で天然に存在するアミノ酸をもう1つのアミノ酸に変更することと理解される。部位特異的な変異生成が、例えば、GDHの触媒部位におけるアミノ酸残基を変更するために適用されてもよく、そのアミノ酸残基は、基質の結合または共同因子の結合のために重要であり、そのアミノ酸残基は、GDHの正確な折り畳みのためにまたはGDHの構造上重要なドメインである。アミノ酸配列は、部位特異的な変異生成を使用して変異されてもよく、または代替的に、ランダム変異生成を使用して、例えば、UV照射、化学的変異生成法またはランダムPCR法を使用して変異されてもよい。或いは、gdhA遺伝子が、公知のノックアウト技術を使用して、部分的または完全に欠失または不活性化されてもよい。もう1つの代替法は、ghdAプロモータを弱いまたは不活性なプロモータで置換して、GDHの発現の欠如をもたらすことである。当業者は、どのようにgdhAプロモータをもう1つのプロモータで置換するのかが分かる。
【0024】
当業者が、活性GDHタンパク質の発現が生じないために、gdhA遺伝子(グルタミン酸デヒドロゲナーゼをコードする)の適切な修飾を導入するための適切な戦略を選択することは通常業務である。例えば、インビトロで変異生成のための方法は、サンブロックらの文献に記載される(Sambrookら、Molecular cloning、A laboratory Manual、2nd ed.、Cold Spring Harbor Laboratory Press、Cold Spring Harbor、New York、USA、1989)。対応する方法もまたキットの形態で商業的に入手することが可能である(例えば、Quikchange site−directed mutagenesis kit by Stratagene、La Jolla、USA)。GDH−欠失は、例えば、遺伝子置換技術により達成されてよく、これは当業者に周知である。
【0025】
S.テルモフィルス株CNRZ1066、LMG18311およびLMD−9からのグルタミン酸デヒドロゲナーゼのアミノ酸配列は、公のデータベースから知られる(例えば、http://blast.ncbi.nlm.nih.gov/を参照されたい)。それらは等しい。GDHアミノ酸配列は、450のアミノ酸からなる。GDHタンパク質は、ストレプトコッカス種の間で高度に保存される(大部分のストレプトコッカス株で75%よりも高い同一性)。
【0026】
gdhA遺伝子はまた、アンチセンスDNAまたは(m)RNAまたはRNAi、好ましくはsiRNAを使用してサイレンシング(または「スイッチオフ」)されてもよい。用語、遺伝子サイレンシングは、一般に、遺伝子組み換え以外の機序により遺伝子をスイッチオフすることを表すために使用される。即ち、正常な環境下で発現されるだろう遺伝子は、細胞内の機構によりスイッチオフされる。当業者は、どのように本発明に対して遺伝子サイレンシングを適用するのか、およびどうように適切な遺伝子サイレンシング構築物を選択および製造するのかが分かる。
【0027】
本発明者らは、例の節で下文に示すように、全体のgdhA遺伝子をノックアウト(または欠失)することを選択している。
【0028】
発酵媒体は、それがS.テルモフィルスによる発酵を可能にする何れかの水性培地であってよい。「発酵」または「発酵培養」は、通常(必然的にではないが)嫌気性条件下で、炭水化物をアルコールおよび/または酸に変換する細菌の増殖のために使用される増殖培養をいう。「発酵媒体」は、発酵培養を設置するために使用される増殖媒体をいい、他方「発酵ブロス」は、一般に、発酵した媒体(即ち、発酵中および/または発酵後)を指すために使用される。しかしながら、両方の用語は、ここにおいて交換可能に使用されてもよく、意味は文脈から明らかだろう。発酵媒体は、糖源およびタンパク質源を含む何れかの発酵媒体であってよい。糖源は、使用されるS.テルモフィルス株により発酵される何れかの糖であってよく、これらに限定するものではないが、ラクトース、スクロース、デキストロース、グルコースなどを含む。タンパク質源は、何れかのタンパク質源であってよく、これらに限定するものではないが、乳タンパク質、植物タンパク質、魚タンパク質、肉タンパク質などを含む。特に、発酵食品生産物の生産のためには、タンパク質源が乳タンパク質および植物タンパク質から選択されることが好ましい。
【0029】
発酵ブロスは、何れかの発酵ブロスであってよいが、発酵食品生産物であってもよく、即ち、それ自身ヒトおよび/または動物の消費に適切な液体、半固体および/または固体の食品生産物(栄養組成物)であってもよい。
【0030】
S.テルモフィルスは、通常、乳タンパク質を含む乳型主成分の発酵媒体、例えば、乳を発酵することによるヨーグルトおよびチーズの製造において使用される。それはまた、通常、0.5〜10%(w/w)の大豆タンパク質、例えば、豆乳を含む大豆型主成分の発酵媒体を使用する大豆ヨーグルトの製造において使用される。S.テルモフィルスは更に、炭素およびエネルギーの供給源、例えば、炭水化物、例えば、糖、例えば、ラクトースを必要とする。好ましくは、乳型主成分の媒体(「乳基質」とも称する)は、天然または再構成された乳、スキムミルクまたは他のもの、または乳に基づく媒体または乳製品起源の生産物に基づく媒体である。
【0031】
この乳基質または大豆型主成分の媒体は、乳デザートの製造のために一般に使用されるアイテム、固体アイテム、例えば、果物、チョコレートチップまたはシリアル、例えば、更にまた甘味製品または液体チョコレートを含んでよい。
【0032】
有利に、本発明の株は、全ての種類の発酵乳および/または大豆製品の製造において使用される。
【0033】
従って、本発明は、発酵酪農製品の製造のためのプロセスに関し、そこにおいて乳基質は、本発明の少なくとも1つのS.テルモフィルス株で発酵される。
【0034】
或いは、本発明はまた、発酵された大豆製品の製造のためのプロセスに関し、そこにおいて、0.5〜10%(w/w)の大豆タンパク質、例えば、豆乳を含む大豆型主成分発酵媒体は、本発明の少なくとも1つのS.テルモフィルス株で発酵される。
【0035】
それはまた、このプロセスにおいて、本発明のS.テルモフィルス株と1つまたは1つ以上の更なる細菌株、特に、他の乳酸菌との組み合わせの使用のために提供することが可能である。「乳酸菌」(LAB)は、乳酸または他の有機酸(例えば、プロピオン酸)を発酵の最終産物として産生する細菌をいい、例えば、しかしながらこれらに限定するものではないが、ラクトバシルス(Lactobacillus)、ストレプトコッカス(Streptococcus)、ラクトコッカス(Lactococcus)、オイノコッカス(Oenococcus)、ロイコノストック(Leuconostoc)、ペジオコッカス(Pediococcus)、カルノバクテリウム(Carnobacterium)、プロピオニバクテリウム(Propionibacterium)、エンテロコッカス(Enterococcus)およびビフィドバクテリウム(Bifidobacterium)などの属の細菌である。
【0036】
好ましくは1つまたは1つ以上の更なる細菌株は、ラクトバシルス・ブルガリクス(Lactobacillus bulgaricus)、ラクトバシルス・アシドフィルス(Lactobacillus acidophilus)、ラクトバシルス・カゼイ(Lactobacillus casei)および/またはビフィドバクテリウム(Bifidobacterium)から選択される。
【0037】
本発明はまた、S.テルモフィルス株に関し、そこにおいて、グルタミン酸デヒドロゲナーゼが不活性化されている株に関する。前記株は、グルタミン酸デヒドロゲナーゼの完全に機能的なコピーを含まない。それは組み換え株または天然の株(非gmoおよび非変異体)であってよい。好ましくは、それは組み換え株である。テルモフィルス株は、好ましくは食品等級である。「食品等級」は、例えば、US食品医薬品局(FDA)などの関連行政当局によりヒトおよび/または動物消費のために安全と評価されていることをいう。株は、上述のとおりに製造されてよい。実施形態において、株はS.テルモフィルス株CBS125184であり、それはブタペスト条約の規則下にCentraalbureau voor Schimmelculturesに寄託されている(2009年9月3日に受託)。
【0038】
更に、本発明は、S.テルモフィルス株を含む発酵ブロスについて提供し、そこにおいて、グルタミン酸デヒドロゲナーゼは不活性化されている。発酵ブロスは、それ自身発酵食品生産物、例えば、ヨーグルトまたはチーズであってもよく、または発酵ブロスは、食品生産物の製造において使用されてもよい。「食品」または「食品生産物」は、ヒトおよび/または動物の消費のために適切な液体、半固体および/または固体の食品生産物(栄養組成物)をいう。食品または食品生産物は、それ自身発酵(「発酵食品生産物」)されていてもよく、例えば、ヨーグルト、チーズ、ケフィアなどであってよく、または本発明の方法を使用して製造された発酵食品生産物または発酵ブロスを含んでもよい。
【0039】
例えば、発酵ブロスは、他の食品生産物、例えば、液体食品(例えば、飲料、スープ、ヨーグルトまたはヨーグルトに基づく飲料、乳シェイク、清涼飲料、果実飲料、発酵酪農製品、食事代替物、発酵果実および/またはジュース製品など)または固体食品/飼料(食餌、食餌代替物、スナック、例えば、キャンディバー、動物飼料、発酵酪農製品、発酵食品または飼料生産物、アイス製品、凍結乾燥食品添加物、チーズなど)または半固体食品(デザートなど)において使用されてもよい。発酵ブロスは、単に食品生産物に対して添加されてもよく、またはそのような食品生産物の生産プロセスの間に使用されてもよい。
【0040】
或いは、発酵ブロスは、濃縮されてもよく、希釈されてもよく、または食品組成物を製造するために使用される前に前処理されてもよい。前処理は、濾過および/または遠心分離、滅菌、凍結乾燥、凍結などを含む。発酵ブロスそれ自身/または前処理発酵ブロスは、基本的に上記の方法の一次生産物である。これらの一次生産物は、例えば、発酵食品生産物の場合においてそれ自身使用されてもよく、食品生産物材料として使用されてもよく、即ち、最終食品生産物を製造するときに、適切な量の一次生産物が材料として使用されてもよい。本発明に従う食品組成物は、適切な量の一次生産物(発酵ブロス、例えば、それ自身または前処理物)を含む、または適切な量の一次生産物からなる。
【0041】
食品生産物または発酵ブロスは、好ましくはそれ自身発酵食品生産物であり、それは、これらに限定するものではないが、発酵酪農食品産生物、例えば、ヨーグルト、チーズ、ケフィア、バターミルク、サワークリーム、大豆ヨーグルトなどを含む。そのような食品生産物は、更に酪農デザートの製造のための一般的な材料、例えば、果実、チョコレートチップまたはシリアル、例えば、また更に甘味製品、液体チョコレートなどを含んでもよい。食品生産物は、更に例えば、乳化剤、ゲル化剤、安定剤、甘味料などの一般的な食品材料を含んでもよい。当業者は、本発明の(発酵された)食品生産物を使用してどのように食品生産物を製造するかが分かる。
【0042】
有利な実施形態において、発酵食品生産物は、ヨーグルトまたはチーズから選択される。ヨーグルトの製造のために、乳基質は、少なくとも本発明のS.テルモフィルス株およびラクトバシルス・デルブルエキイ亜種ブルガリクス(Lactobacillus delbrueckii subsp. bulgaricus)を使用して発酵される。他の細菌、例えば、LABが、例えば、ヨーグルトプロバイオティック特性を提供するために添加されてもよい。チーズの製造のために、乳基質は、少なくとも本発明に従うS.テルモフィルス株、および好ましくは、チーズ製造のための開始培養、例えば、一般的に使用される開始培養、任意に付加培養を使用して発酵される。本発明のS.テルモフィルス株はまた、チーズ開始培養の一部分であってもよい。
【0043】
本発明はまた、改善された(増大された)フレーバー産生を有するS.テルモフィルス株を同定する方法であって、S.テルモフィルス株におけるGDH−活性をスクリーニングする工程を具備する方法を提供する。更なる工程は、1つまたは1つ以上のGDH−不活性株の選択、またはGDH−不活性株を同定することであってよい。改善されたフレーバー産生を有するそのような株は、上述のような発酵ブロス、食品生産物または発酵食品生産物の製造において有利に使用される。GDH−活性をスクリーニングする方法は、当該技術分野において周知の方法を使用して行われてよく、例えば、以下の例に記載される方法を使用してよい。
【0044】
また、本発明は、S.テルモフィルス株の使用に関し、そこにおいてグルタミン酸デヒドロゲナーゼは不活性化されており、発酵食品生産物、特に、ヨーグルトまたはチーズにおけるフレーバー産生を改善するための使用に関する。
【0045】
アセトアルデヒドは、同様なGDH−活性な株と比べてGDH−不活性株において過剰に産生され、ヨーグルトにその特有のフレーバーを与える。2−メチルプロパナールは、ナッツフレーバーを与え、それは、特にある種類のチーズ、例えば、チェダーチーズに望ましい。
【0046】
最後に、本発明は、S.テルモフィルス株の使用に関し、そこにおいてグルタミン酸デヒドロゲナーゼが不活性化されており、GDHが活性なS.テルモフィルス株を使用して製造されたヨーグルトに比較して、ヨーグルトにおいてL.ブルガリクスの減少されたCFUを得るための使用に関する。2つの株は、フレーバー産生の公正な比較を可能にするために、好ましくは同様または同一の条件下において発酵される。用語「コロニー形成単位(CFU)」は、生存可能な細菌または真菌数の測定単位である。
【0047】
本書において、およびその特許請求の範囲において、動詞「含む(comprise)」およびその活用は、その非限定的な意味において使用され、その後に続く事項が含まれることを意味するが、しかしながら特に言及されない事項が排除されるものではない。加えて、動詞「なる(consist)」は、「本質的になる(consist essentially)」により置換されてよく、本発明の組成が、特に特定されたものとは異なる更なる成分(単数または複数)を含んでもよいことを意味し、更なる成分(単数または複数)は、本発明の特有の特徴を変更するものではない。
【0048】
数値に関して使用されるとき、用語「約(approximately)」または「約(about)」(約10(approximately 10)、約10(about 10))は、好ましくは値が問題の値である10に±1%の範囲の値であってよいことを意味する。
【0049】
加えて、不定冠詞「1つの(a)」または「1つの(an)」による成分への言及は、文脈が1つおよび1つのみの成分が存在することを明確に要求する場合を除いて、1つよりも多くの成分が存在する可能性を排除するものではない。不定冠詞「1つの(a)」または「1つの(an)」は、従って、通常「少なくとも1つ」を意味する。
【0050】
本明細書において引用された全ての参考特許および文献は、引用することによりその全体がここに組み込まれる。
【0051】
上記の記載および図面は本発明の幾つかの実施形態を説明するために含まれるものであり、本発明の範囲を制限するものではないことは明白だろう。本開示から始まり、多くの更なる実施形態が、当業者には明らかであり、それらは保護および本発明の本質の範囲内にあり、それらは、先行技術および本特許の開示の明らかな組み合わせである。
【例】
【0052】
[材料および方法]
細菌株、媒体および増殖条件
本検討において使用された株は、ストレプトコッカス(S.)テルモフィルスLMG18311、ラクトコッカス・ラクチス(Lactococcus (L.) lactis)MG1363およびラクトバシルス(Lb.)プランタルムWCFS1であった。細胞は嫌気的に増殖した。L.ラクチスおよびS.テルモフィルスはグルコース(GM17)が補われたM17ブロス(Difco、Detroit、MI、USA)中で、30℃と42℃のそれぞれで、1%(重量/体積)の最終濃度まで増殖された。S.テルモフィルスΔgdhAは、クロラムフェニコール(10μg/mL)の存在において増殖した。Lb.プランタルムは、グルコースが補われたマン・ロゴサ・シャープ(Mann Rogosa Sharpe、MRS)ブロス(Merck、Whitehouse Station、NY、USA)中で、37℃で最終濃度が1%(重量/体積)まで増殖された。エシェリキア・コリDH5α(27)を1つの酵素アッセイのために使用し、TYB培地(Difco)において37℃で好気的に培養された。
【0053】
発酵実験のために、細胞は既知組成培地(CDM)において増殖された。
【0054】
グルタミン酸デヒドロゲナーゼ(gdhA)活性
Lb.プランタルム、L.ラクチスMG1363およびS.テルモフィルス(野生型およびgdhAノックアウトの両方)の培養物は、OD600〜1まで増殖させた。培養物を遠心し、50mMのβ−グリセロフォスフェート(pH7)中で2回洗浄した(4℃、5000rpm、15分間)。2回目の洗浄工程の後に、ペレットをOD600〜200/mLにまで同じ緩衝液中で濃縮した。ビート−ビーティングにより細胞崩壊(4×30秒、スピード4.0、Fastprep FP120)の後に、遠心分離により、細胞崩壊堆積物を除いた(13000rpm、10分間、4℃、Eppendorf Centrifuge 5417R)。gdhAアッセイは、バックグラウンドノイズに対して敏感であるために、細胞非含有抽出物をスライド−ア−ライザー(slide−a−lizer、Pierce、Rokcford、IL、USA)で精製し、50mMのβ−グリセロフォスフェート(pH7)中、4℃で、一晩、透析した。細胞非含有抽出物をスライド−ア−ライザーからシリンジを使用して除去し、直ちに酵素活性の測定のために使用した。
【0055】
gdhA活性は、比色分析グルタメートアッセイで分析した(Boehringer、Mannheim、Germany、Cat.No.10139092035)。反応混合物を37℃でインキュベートし、50mMのリン酸カリウム/TEA緩衝液pH9(溶液1、キット)、1.76U/mLのジアフォラーゼ+NAD(溶液2、キット)、2mMのINT(溶液3、キット)、100mMのグルタメート、13.8mMのNADP+またはNAD+および細胞非含有抽出物を含む。NADPHの形成の後に、492nmでの吸光度の増加をモニタリングすることにより分光光度法を行った。
【0056】
グルコース−6−リン酸デヒドロゲナーゼ(G6PDH)活性
Lb.プランタルム(陽性対照)およびS.テルモフィルスの培養物をOD600〜1まで増殖した。培養物を遠心し、55mMトリス/HCl緩衝液(pH7.8)中のメガヒュージ1.0R(Megafuge 1.0R(Heraeus Instruments、Germany)中で洗浄した(5000rpm、15分間、4℃)。2回目の洗浄工程の後、ペレットを1mLの55mMトリス/HCl緩衝液(pH7.8)中で濃縮し、ビート−ビーティング(4×30秒間、スピード4.0、Fastprep FP120)および遠心(13000rpm、10分間、4℃、Eppendorf Centrifuge 5417R)を行った。G6PDH活性は、ホンジョウ(Honjohら、2003、Biosci.Biotechnol.Biochem.67:1888−1896)による記載の通りに分析した。反応混合物を25℃でインキュベートし、55mMトリス/HCl緩衝液(pH7.8)、3.3mMのMgCl2、0.2mMのNADP+および3.3mMのグルコース−6−ホスフェートおよび細胞非含有抽出物を含んだ。NADPHまたはNADHの形成の後、340nmでの吸光度の増加をモニタリングすることにより分光光度法を行った。
【0057】
イソクエン酸デヒドロゲナーゼ(ICDH)活性
E.コリDH5α(陽性対照として使用)およびS.テルモフィルス(野生型およびgdhA変異体)の培養物をOD600〜1まで増殖した。細胞を遠心分離(5000rpm、15分間、4℃)により採取し、35mMトリス/HCL緩衝液(pH7.5)中で2回洗浄した。細胞ペレットを1mLの35mMトリス/HCL緩衝液(pH7.5)中で濃縮し、ビート−ビーティング(4×30秒間、スピード4.0、Fastprep FP120)した。ICDH活性は、クビトコビッチらによる記載の通りに分析した(Cvitkovitchら、1997.J.Bacteriol.179:650−655)。反応混合物を37℃でインキュベートし、35mMトリス/HCl緩衝液(pH7.5)、5mMのイソシトレート、3.5mMのMgCl2またはMnCl2、0.35mMのNADP+および細胞非含有抽出物を含んだ。NADPHの形成の後に、340nmでの吸光度の増大のモニタリングにより分光光度法を行った。
【0058】
S.テルモフィルスのためのgdhAノックアウト構築
分子クローニング技術を標準的な実験室手順に従い行った。野生型株S.テルモフィルスLMG18311を、ブロンキビストらの記載の通りのオーバーラッピングPCR産物の自然変換を使用する機能的なgdhA遺伝子(ΔgdhA)を欠く変異体の構築のために使用した(Blomqvistら、2006.Appl.Environ.Microbiol.72:6751−6756)。
【0059】
Lb.プランタルムのためのgdhA/glnAノックアウトの構築
Lb.プランタルムにおいて、gdhAおよびglnA(グルタミンシンテターゼ)の両方のダブルノックアウトを以前に記載された戦略に従い構築した(Goffinら、2006.Appl.Environ.Microbiol.72:7933−7940)。両方の遺伝子は、遺伝子約600bpの内部フラグメントの挿入を有する自殺プラスミド(pGIM008およびpJDC9)を使用する単一交差により不活性化された。エリストマイシンおよびクロラムフェニコールの付加が、挿入の安定性を保証する。この変異体は、S.テルモフィルスgdhA変異体と機能的に同じである。
【0060】
バッチ培養
発酵は、1Lのバイオリアクター(Applikon Biotechnology BV、The Netherlands)内でデュプリケートで行った。発酵は、Bio Controller ADI 1010およびBio Console ADI 1025により制御された(Applikon Biotechnology BV、The Netherlands)。S.テルモフィルス野生型およびΔgdhAをCDM中で一晩培養し、1000mLのpH制御CDMの接種材料として使用し、培地は、1%で接種された。gdhAノックアウトのための培地は、クロラムフェニコール(10μg/mL)を補われた。株は、増殖の間、42℃で増殖され、pHは、2.5MのNaOHの添加によりpH=6.5で一定に維持された。
【0061】
Lb.プランタルム野生型およびΔgdhAは、CDM中で一晩培養され、1000mLのpH制御CDMの接種材料として使用され、培地は1%で接種された。gdhAノックアウトのための培地は、クロラムフェニコール(10μg/mL)およびエリストマイシン(10μg/mL)を補われた。株は、増殖中、37℃で増殖され、pHは、2.5MのNaOHの添加によりpH=5.5で一定に維持された。
【0062】
培養物は100rpmの一定の速度で攪拌された。増殖の後、30分毎に600nmで細胞密度を測定された。HPLCおよびRNA単離のためのサンプル(2×25mL)は指数増殖期の終わりに得た。GC−MS分析のためのサンプル(3mL)は、中間指数増殖期および静止期で得た。
【0063】
ゲノムスケールでのmRNA転写レベルの分析
RNA単離
幾つかの改変を伴って他に記載されたようにRNAを単離した(Sperandioら、2005.J.Bacteriol.187:3762−3778.)。中間指数増殖期で、各発酵槽からの25mLの培養物(制限培地および完全培地の両方についてデュプリケートのサンプル)を14000rpmで2分間に亘る室温での遠心により直ちにペレット化した(Herolab、Unicen MR、Germany)。ペレットを液体窒素中で急速に凍結し、−80℃で更なる使用まで保存した。凍結ペレットを400μLのTEに再懸濁し、500μLのフェノール−クロロホルム(5:1)、15μLの20%ドデシル硫酸ナトリウム、30μLの3M酢酸ナトリウム、pH4.8および0.6gジルコニウムガラスビーズを含むネジ蓋付きチューブに移した。細胞をファストプレップ(Fastprep、Savant、FP120)中で、40秒間、5.0で破壊し、混合物をビーズを除去するために遠心した(13000rpm、20分間、4℃)。次に、500μLの冷クロロホルムを上清に添加し、続いて、遠心分離工程(13000rpm、10分間、4℃)を行った。遠心分離の後、DNAseI処理を我々は30分、37℃に変更したことを除いて、製造者のプロトコールに続き、0.5mLの水相をハイ・ピュア・RNA・単離キット(High Pure RNA Isolation kit、Roche Diagnostics、Mannheim、Germany)を使用するRNA抽出のために使用した。RNAは、60μLの溶出緩衝液(キット中に提供される)において溶出され、サンプルは−80℃で保存した。
【0064】
RNAの濃度をND−1000分光光度計(NanoDrop Technologies、Inc.、USA)で検査し、質を2100バイオアナライザー(2100 Bioanalyzer、Agilent Technologies、Santa Clara、CA、USA)により試験した。23S/16S比が1.6よりも高いサンプルだけは、標識化のために使用した。
【0065】
cDNA合成および標識
5μgRNAからの第1の鎖cDNA合成を以前記載されたように行った(Saulnierら、2007.Appl Environ Microbiol 73:1753−1765;Serranoら、2007.Microb.Cell Fact.6:29)。合成されたcDNAを精製し、シアニン3およびシアニン5で全てのサンプルについて標識した。標識されたcDNAの質およびその濃度をND−1000分光光度計(NanoDrop Technologies、Inc.、USA)で測定した。
【0066】
ハイブリダイゼーション
ラベルされたcDNA(サンプル当たり0.3μg)のハイブリダイゼーションを以前記載されたように行った(Saulnierら、2007.Appl Environ Microbiol 73:1753−1765;Serranoら、2007.Microb.Cell Fact.6:29)。サンプルは、特注設計のアジレント・テクノロジー・オリゴ・マイクロアレイ(Agilent Technologies oligo microarrays)上でアジレント・60マー・オリゴ・マイクロアレイ・プロセッシング・プロトコール・バージョン4.1(Agilent 60−mer oligo microarray processing protocol version 4.1)を使用してハイブリダイズした(Saulnierら、2007.Appl Environ Microbiol 73:1753−1765)。
【0067】
スキャニングおよびデータ解析
スライドをスキャン・アレイ・エクスプレス・スキャナー(ScanArray Express scanner)により解像度5μmでスキャンした。データ解析および処理は他に記載されたように行った(Saulnierら、2007.Appl Environ Microbiol 73:1753−1765;Serranoら、2007.Microb.Cell Fact.6:29)。折り畳み変化は2Mとして規定する、ここでM=2log(cy5強度/cy3強度)(Serranoら、2007.Microb.Cell Fact.6:29)。有意に調節された遺伝子は、その平均p値が5%未満であり、そのM値が1.5に等しいか、または1.5よりも高い遺伝子として規定された。
【0068】
スキャン強度、正規化、スケーリング、サイバーT(Cyber−T)および偽発見率(False Discovery Rate、FDR)の選択は、他で記載されたように行った(Blomら、2008.BMC Genomics.9:495)。単一遺伝子fdr基準を通過しないマイクロアレイデータにおけるより微細な差次的発現を表すために、それらが以下の基準に従う場合に、マルチプル遺伝子のFDRの相乗平均(geometric mean)を算出した:(i)遺伝子が同じオペロンの一部分である、(ii)それらが同様の差次的発現を示す(例えば、gdhA変異体において発現された全ての合計)(iii)それらが後の代謝的変換に関与する(ひいては同じ代謝経路の一部分)。
【0069】
これらの基準により、我々は、共発現された遺伝子からなる2つの異なる経路を発見し、それは、各経路についてオペロンにおいて組織化された(シトレート経路およびコンピテント遺伝子)
比較ゲノミクス
ERGOインフォマティクス・スウィート(The ERGO bioinformatics suite、http://ergo.integratedgenomics.com/ERGO/)を使用して、ゲノムレベルで、S.テルモフィルスと他のシーケンシングされたLABとを比較した。特に、ペントースリン酸経路の存在を試験し、入手可能な53のLABゲノムの間で比較した。
【0070】
アンモニア測定
発酵サンプルの上清中のアンモニア濃度を、アンモニアキット(R−biopharm AG、Darmstadt、Germany)によるUV法を使用して測定した。
【0071】
タンパク質濃度
細胞非含有抽出物中のタンパク質濃度をビシンコニン酸タンパク質アッセイ試薬(Pierce、Rockford、Il.USA)を使用して測定した。
【0072】
代謝分析
サンプル中の揮発性成分を同定するために、パージ・アンド・トラップ・サーマル・デソルプション・コールド・トラップ・ガスクロマトグラフィを以前に記載された通りに使用した(Engels.1997.PhD thesis Wageningen University;Smitら、2004.Appl.Microbiol.Biotechnol.64:396−402)。ヘッドスペースサンプルを、フィジョン・MFA814・コールド・トラップ(Fisons MFA815 cold trap、CE Instruments,Milan,Italy)において濃縮し、続いて、CIP−SIL5CBロウ・ブリード・カラム(CIP−SIL 5 CB low−bleed column、Chrompack、Middelburg、The Netherlands)を備えたGC−8000トップ・ガス・カラムクロマトグラフィ(GC−8000 top gas chromatograph、CE Instruments)上で分離し、更に、フレームイオン化検出器により検出した。
【0073】
発酵サンプルの錠生中に存在する細胞外代謝産物を他で記載されるように測定した(Starrenburg and Hugenholtz.1991.Appl.Environ.Microbiol.57:3535−3540)
[結果]
NADPH生成の予測およびgdhAノックアウトの構築
導入部において記載されたとおり、我々は以前に開発されたS.テルモフィルスのゲノムスケールモデル(Pastinkら、2009.Appl.Environ.Microbiol.75:3627−3633)を使用して、NADPH発生経路について探索した。S.テルモフィルスは、完全なペントースリン酸経路を有さず、この経路を介してNADPHは生ずることができないと予測される。モデルは、イソクエン酸デヒドロゲナーゼまたはグルタミン酸デヒドロゲナーゼが有力なNADPH生成酵素であるかもしれないことを予測した。これらの酵素がコードする経路は、α−ケトグルタレートを介して関連しており、これは重要な生体化合物である。モデルの予測は、酵素活性をアッセイすることにより実験的に試験された。また、予測されたPPPの不在は、PPPの第1の酵素、グルコース−6−リン酸デヒドロゲナーゼの活性を測定することにより検証した。
【0074】
Lb.プランタルムおよびS.テルモフィルスの細胞非含有抽出物をG6PDH活性のために分析した。この株が完全なペントースリン酸経路を有することが公知であることから、Lb.プランタルムを陽性対照として使用した。酵素アッセイは、Lb.プランタルムがG6PDH活性を有し、S.テルモフィルスがG6PDH活性を有さないことを実際に示した(表1)。
【0075】
Lb.プランタルム、L.ラクチスおよびS.テルモフィルス野生型およびΔgdhAの細胞非含有抽出物をGDH活性について分析した。L.ラクチスは、陰性対照として使用した。Lb.プランタルムおよび野生型S.テルモフィルスはGDH活性を有する(表1)。予期された通り、gdhAノックアウトは、GDH活性を有さない。
【表1】

【0076】
S.テルモフィルス野生型およびΔgdhAおよびE.コリDH5αの細胞非含有抽出物をイソクエン酸デヒドロゲナーゼ活性について分析した。E.コリは、陽性対照として使用し、ICDH活性を実際に有する。E.コリのICDHは、TCA回路における重要な調整酵素であり、そのためにこの酵素の高い活性が観察される。ICDH活性は、野生型のS.テルモフィルスについては観察されず、それに対してgdhA変異体はICDH活性を有する(表1)。
【0077】
この知見と、S.テルモフィルスの野生型がグルタメートを利用できるという観察(Tanousら、2002.Antonie Van Leeuwenhoek.82:271−278)に基づいて、グルタミン酸デヒドロゲナーゼ変異体が、ブロンキビストら(前掲)により記載されたようなオーバーラップPCR産物の自然変換を使用する構築された。gdhAのオープンリーディングフレームが、クロラムフェニコール抵抗性を与えるP32−catカセットにより交換された。この検討において使用されたプライマーは表2に掲載され、全てのPCR反応は、フージョンポリメラーゼ(Fhusion polymerase、New England Biolabs Inc、Ipswich、MA、USA)を用いて行われた。
【表2】

【0078】
gdhAの上流および下流の組み換えフラグメント(1.5kb)をPCRによりUpDelgdhA1/UpDelgdhA2およびDnDelgdhA1/DnDelgdhA1プライマー対を使用してそれぞれ増幅した。pNZ5320からのP32−catカセット(pNZ5318の派生物、lp291フラグメントの除去)(Lambertら、2007.Appl.Environ.Microbiol.73:1126−1135)を、UpcatおよびDncatプライマーを用いるPCRにより増幅した。3つのオーバーラップPCR産物を等モル濃度で混合し、プライマーUpDelgdhA1/DnDelgdhA2を使用するPCRにより結合し、次にPCR混合物を自然変換のために使用した。変異体の遺伝子型は、組み換え領域の上流および下流に配置されたプライマーでのPCRにより確認された。対照として、我々はペントースリン酸経路陽性のLAB、Lb.プランタルムを使用し、それについて、同様のgdhA変異体を構築した。この変異体の構築のために使用されたプライマーを表3に掲載する。
【表3】

【0079】
代謝反応
発酵サンプルをHPLC上で分析した(表4)。野生型は、ホモ乳酸増殖を示し、これは以前に観察および記載された通りであった(Holsら、2005.FEMS Microbiol.Rev.29:435−463)。gdhA変異体はまた、主にラクテートを生成し、少量のホルメートを生成し、それはシトレートを消費する。同じ増殖率で、野生型よりも少ないグルコースが変異体により消費され、これはより効率的な増殖を示しうる。
【表4】

【0080】
揮発性物質のプロファイルは2つの株で同様である;しかしながら、gdhA変異体は、野生型よりも多くのアセトアルデヒド、アセトンおよび2−メチルプロパナールを産生する。
【0081】
gdhAはまた、より多くのトレオニンを消費し、これはトレオニンアルドラーゼによるトレオニン変換からのアセトアルデヒド産生を指し示しうる。また、gdhA変異体は、野生型よりも多くのプロパノンを産生し、プロパノンは、解糖の一部分として形成されうる。幾つかのアルデヒド、例えば、2−メチルプロパナールおよび3−メチルブタナールがgdhA変異体からのサンプル中で高い濃度で見られる。これらのアルデヒドは、バリンおよびロイシン代謝の間にそれぞれ産生され、HPLCデータは、野生型に比較して変異体により分岐アミノ酸の高い消費を実際に示す。
【0082】
同じサンプルにおけるアミノ酸のHPLC分析は(表5)、野生型よりもgdhA変異体によって、全てのアミノ酸がより多く消費されることを示す。
【表5】

【0083】
加えて、変異体はまた、野生型に比べて高いアンモニア産生(3倍に匹敵する)を示し(表6)、これは、高いアミノ酸消費と十分に一致する。これは恐らく、アミノ酸分解を示す。
【表6】

【0084】
Lb.プランタルムの場合において、発酵サンプルは、S.テルモフィルスのために使用されたものと同じ手続きに続き分析された(表4)。gdh/glnA変異体および野生型は主な代謝に相違を示さない;ラクテート、ホルメートおよびアセテートが同様の量で産生される。更に、アミノ酸測定は、アスパルテートを除いて、変異体による異なるアミノ酸の同様な利用を示す(表5)。野生型およびgdhA/glnA変異体の揮発性物質プロファイルはほぼ等しい(データは示さず)。
【0085】
トランスクリプトーム分析
遺伝子発現におけるghdA遺伝子の不在の影響をマイクロアレイで検討した。差次的な制御のために、我々は、以下の基準を満たす遺伝子のみを選択した(i)比率≧1.25および(ii)FDR値<0.05。これらの基準により、我々は142遺伝子が差次的に発現することを発見した(表S1)。理論的に、グルタミン酸デヒドロゲナーゼは、gdhA変異体において激しく下方制御される。ΔgdhAは、NADPHを産生するための代替的な経路を必要とする;近年開発されたシンフェニーモデル(Pastinkら、2009.Appl.Environ.Microbiol.75:3627−3633)からの予測は、イソクエン酸デヒドロゲナーゼであった。アレイデータは、シトレート代謝(相乗平均FDR<0.05、平均比率≧1.25);メチルクエン酸シンターゼ、アコニテートシンターゼおよびイソクエン酸デヒドロゲナーゼの上方制御を示した。この上方制御はまた、シトレート(HPLC分析)の消費および高いICDH活性に一致し、NADPHのためのイソクエン酸デヒドロゲナーゼの重要性が示されうる。更に、アミノ酸代謝の同じ部分は、gdhA変異体において影響される;幾つかのアミノ酸トランスポーターが変異体において上方制御され、分岐鎖アミノ酸エクスポーターが下方制御される。ヒスチジンアンモニアリアーゼが下方制御され、この酵素は、窒素代謝の一部分である。ホスホセリンアミノトランスフェラーゼは、gdhA変異体において極めて上方制御される;この酵素は、O−ホスホ−L−セリンおよび2−オキソグルタレートからのグルタメートおよびホスホノオキシピルベートの形成を触媒する。
【0086】
コンピテンスに関与する共発現遺伝子(相乗平均<0.05;平均比率≧1.25)は、野生型に比べて変異体において下方制御された。
【0087】
比較ゲノミクス
ERGOバイオインフォマティクススウィートを使用して、入手可能なシーケンシングされたLABをペントースリン酸経路の不在において比較した。S.テルモフィルスだけが不完全なPPPを有するLABではない。実際に、少数のS.スイス(S.suis)およびS.ニューモニア(S.pneumonia)株を除外する殆ど全てのストレプトコッカスは、S.テルモフィルスPPPにおける132gdhA変異の酸化部分を欠く。全てのストレプトコッカスは、同様の共通する祖先を共有するが、この先祖は、異なる分岐において分かれる。大部分のストレプトコッカスにおけるPPP遺伝子の遺伝子喪失の事象は、恐らく並行して、機能的な理由のために生じた。S.テルモフィルスは、その速い増殖について知られており、異なるストレプトコッカスの間での遺伝子喪失の事象は、珍しいとも思われず、増殖遅延をもたらすものでもない。
【特許請求の範囲】
【請求項1】
発酵ブロス中のフレーバー産生を増大する方法であって、S.テルモフィルス株を使用して発酵媒体を発酵する工程を具備し、ここにおいて、グルタミン酸デヒドロゲナーゼが不活性されている方法。
【請求項2】
請求項1に記載の方法であって、以下の1つまたは1つ以上によりグルタミン酸デヒドロゲナーゼが不活性化される方法:
− gdhA遺伝子の欠失、挿入または変異;
− gdhA遺伝子プロモータを弱いプロモータで置換すること;
− アンチセンスDNAまたはRNA;および
− siRNA。
【請求項3】
請求項1または2の何れか1項に記載の方法であって、発酵ブロスが食品産生物である方法。
【請求項4】
請求項1〜3の何れか1項に記載の方法であって、発酵ブロスが発酵食品生産物である方法。
【請求項5】
グルタミン酸デヒドロゲナーゼが不活性化されているS.テルモフィルス株。
【請求項6】
請求項5に記載の株であって、食品等級である株。
【請求項7】
S.テルモフィルス株CBS125184。
【請求項8】
請求項5〜7の何れか1項に記載のS.テルモフィルスを含む発酵ブロス。
【請求項9】
請求項8に記載の発酵ブロスであって、発酵食品生産物である発酵ブロス。
【請求項10】
請求項9に記載の発酵ブロスであって、発酵食品生産物がヨーグルトおよびチーズから選択される発酵ブロス。
【請求項11】
請求項5〜7の何れか1項に記載のS.テルモフィルスまたは請求項8または9に記載の発酵ブロスを含む食品生産物。
【請求項12】
改善されたフレーバー産生を有するS.テルモフィルス株を同定する方法であって、S.テルモフィルス株におけるGDH−活性をスクリーニングする工程を具備する方法。
【請求項13】
S.テルモフィルス株の使用であって、そこにおいてグルタミン酸デヒドロゲナーゼが不活性化されており、発酵食品生産物、特にヨーグルトまたはチーズにおけるフレーバー産生を改善するための使用。
【請求項14】
S.テルモフィルス株の使用であって、そこにおいてグルタミン酸デヒドロゲナーゼが不活性化されており、GDHが活性なS.テルモフィルス株を使用して製造されたヨーグルトに比較して、ヨーグルトにおいてL.ブルガリクスの減少されたコロニー形成単位を得るための使用。
【請求項1】
発酵ブロス中のフレーバー産生を増大する方法であって、S.テルモフィルス株を使用して発酵媒体を発酵する工程を具備し、ここにおいて、グルタミン酸デヒドロゲナーゼが不活性されている方法。
【請求項2】
請求項1に記載の方法であって、以下の1つまたは1つ以上によりグルタミン酸デヒドロゲナーゼが不活性化される方法:
− gdhA遺伝子の欠失、挿入または変異;
− gdhA遺伝子プロモータを弱いプロモータで置換すること;
− アンチセンスDNAまたはRNA;および
− siRNA。
【請求項3】
請求項1または2の何れか1項に記載の方法であって、発酵ブロスが食品産生物である方法。
【請求項4】
請求項1〜3の何れか1項に記載の方法であって、発酵ブロスが発酵食品生産物である方法。
【請求項5】
グルタミン酸デヒドロゲナーゼが不活性化されているS.テルモフィルス株。
【請求項6】
請求項5に記載の株であって、食品等級である株。
【請求項7】
S.テルモフィルス株CBS125184。
【請求項8】
請求項5〜7の何れか1項に記載のS.テルモフィルスを含む発酵ブロス。
【請求項9】
請求項8に記載の発酵ブロスであって、発酵食品生産物である発酵ブロス。
【請求項10】
請求項9に記載の発酵ブロスであって、発酵食品生産物がヨーグルトおよびチーズから選択される発酵ブロス。
【請求項11】
請求項5〜7の何れか1項に記載のS.テルモフィルスまたは請求項8または9に記載の発酵ブロスを含む食品生産物。
【請求項12】
改善されたフレーバー産生を有するS.テルモフィルス株を同定する方法であって、S.テルモフィルス株におけるGDH−活性をスクリーニングする工程を具備する方法。
【請求項13】
S.テルモフィルス株の使用であって、そこにおいてグルタミン酸デヒドロゲナーゼが不活性化されており、発酵食品生産物、特にヨーグルトまたはチーズにおけるフレーバー産生を改善するための使用。
【請求項14】
S.テルモフィルス株の使用であって、そこにおいてグルタミン酸デヒドロゲナーゼが不活性化されており、GDHが活性なS.テルモフィルス株を使用して製造されたヨーグルトに比較して、ヨーグルトにおいてL.ブルガリクスの減少されたコロニー形成単位を得るための使用。
【図1】




【公表番号】特表2013−503652(P2013−503652A)
【公表日】平成25年2月4日(2013.2.4)
【国際特許分類】
【出願番号】特願2012−528766(P2012−528766)
【出願日】平成22年9月8日(2010.9.8)
【国際出願番号】PCT/NL2010/050568
【国際公開番号】WO2011/031141
【国際公開日】平成23年3月17日(2011.3.17)
【出願人】(512059844)プラク・バイオケム・ビー.ブイ. (1)
【氏名又は名称原語表記】Purac Biochem B.V.
【住所又は居所原語表記】Arkelsedijk 46, NL−4206 AC GORINCHEM, the Netherlands
【Fターム(参考)】
【公表日】平成25年2月4日(2013.2.4)
【国際特許分類】
【出願日】平成22年9月8日(2010.9.8)
【国際出願番号】PCT/NL2010/050568
【国際公開番号】WO2011/031141
【国際公開日】平成23年3月17日(2011.3.17)
【出願人】(512059844)プラク・バイオケム・ビー.ブイ. (1)
【氏名又は名称原語表記】Purac Biochem B.V.
【住所又は居所原語表記】Arkelsedijk 46, NL−4206 AC GORINCHEM, the Netherlands
【Fターム(参考)】
[ Back to top ]

