発酵飼料およびその製造方法
【課題】食品残渣を原料とする発酵飼料であって、腐敗を抑制して保存性を向上できると共に、動物に給与されたときに動物の免疫機能を強化して動物の体調を顕著に改善できる発酵飼料およびその製造方法を提供する。
【解決手段】水分を含有する食品残渣を含む原料を乳酸菌で発酵させて得られる発酵飼料において、前記乳酸菌の生菌数濃度が飽和した状態とする。また、水分を含有する食品残渣を含む原料を乳酸菌と混合し、嫌気性条件下で発酵させる発酵飼料の製造方法において、前記原料の発酵を、乳酸菌の生菌数濃度が極大値となる時点以降まで継続する。
【解決手段】水分を含有する食品残渣を含む原料を乳酸菌で発酵させて得られる発酵飼料において、前記乳酸菌の生菌数濃度が飽和した状態とする。また、水分を含有する食品残渣を含む原料を乳酸菌と混合し、嫌気性条件下で発酵させる発酵飼料の製造方法において、前記原料の発酵を、乳酸菌の生菌数濃度が極大値となる時点以降まで継続する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、豆腐粕(豆腐を製造する過程で豆乳を搾った後に残る粕)などの食品残渣を含む原料を乳酸菌で発酵させる発酵飼料の製造方法およびそれによって得られる発酵飼料に関するものである。
【背景技術】
【0002】
現在、豆腐粕などの食品製造副産物が食品工場から大量に排出されている。しかしながら、近年、我が国においては、食品リサイクル法が強化されたことにより、食品工場で廃棄される食品製造副産物の減量化が義務づけられている。そのため、食品工場では、廃棄する食品製造副産物を乾燥などの処理によって減量化することが必要となっており、その処理に係るコストは膨大な額にのぼる。
【0003】
そこで、従来より、食品製造副産物を肥料、飼料などに再利用することが行われている。例えば、豆腐粕は、豊富に栄養成分を含むことから、家畜飼料原料、キノコ培地などへの再利用が進められている。
【0004】
しかしながら、食品製造副産物は水分含量(水分含有率)が高いために腐敗しやすいものが多く、特に豆腐粕は水分含量がより高く腐敗しやすいため、食品製造副産物自体を肥料、飼料などとして再利用するためには、乾燥を行うことが必要である。近年、食品製造副産物の乾燥は、食品製造工場内で行われることが多くなってきている。例えば、近年の豆腐業界の再編の加速化に伴い、豆腐製造業者の規模が拡大され、豆腐製造工場内に豆腐粕の乾燥施設を設置する豆腐製造業者が多くなってきている。我が国においては、乾燥施設の燃料として用いる重油などの化石燃料を海外に依存しており、乾燥施設の運転コストが高いため、食品製造工場内で食品製造副産物の乾燥を行うことは、食品製造業者の負担コストの増大につながると予想される。そのため、安価な食品製造副産物の再利用方法が強く求められている。
【0005】
そこで、従来より、食品製造副産物などの食品残渣を発酵させて飼料として再利用することが行われている。例えば、特許文献1には、米糠と水と糖類とを含有する培地で、ラクトバチルス菌群、サッカロミセス菌群、ピチア菌群、バチルス菌群を含む4種類の菌群を培養して得られた培養液を大豆粕に含有させて調製した動物・家畜用飼料が記載されている。
【0006】
食品残渣を発酵させて飼料として利用することにより、化石燃料を必要とせず安価に食品残渣飼料の保存性を高めることができる。また、食品残渣を発酵させて得られた発酵飼料は、有用微生物の効果により、家畜の体調の改善が期待できるといわれている。
【0007】
また、食品を発酵させて得られた飼料も種々提案されている。例えば、特許文献2には、脱脂粉乳とスクロースとを水に溶解し、ラクトバチルス・ブレビスのスターターを添加し培養して乳酸菌発酵物を得た後、乳酸菌発酵物に脱脂粉乳やトウモロコシデンプンなどを混合することによって得られる動物飼料が記載されている。また、特許文献3には、アスパラガスから得られる組成物を含有する培地に、乳酸菌を接種し、培養して得られる発酵物を含有する飼料が記載されている。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2009−209057号公報
【特許文献2】特開2007−308419号公報
【特許文献3】特開2007−308404号公報
【発明の概要】
【発明が解決しようとする課題】
【0009】
しかしながら、食品残渣などを発酵させて得られた従来の発酵飼料は、家畜の体調を顕著に改善できることが科学的に証明されていないため、通常の飼料と比較して給与方法に手間がかかることなどから敬遠されて、広く普及するには至っていない。
【0010】
一方、畜産分野では、世界的な穀物不足の影響を受けて、飼料費の高騰対策や自給率向上の観点から、食品残渣を飼料に再利用することが、以前にも増して強く望まれている。また、畜産経営の大規模化による家畜の過密飼育のストレスにより、家畜の感染症による損失が増加し、生産性が低下していることが問題になっている。これらは、低価格で低品質の飼料の使用と家畜の抗病性の低下(免疫機能の低下)とが主原因とみられている。
【0011】
本発明は、上記従来の課題に鑑みなされたものであり、その目的は、食品残渣を原料とする発酵飼料であって、腐敗を抑制して保存性を向上できると共に、動物に給与されたときに動物の免疫機能を強化して動物の体調を顕著に改善できる発酵飼料およびその製造方法を提供することにある。
【課題を解決するための手段】
【0012】
本願発明者らは、上記課題を解決すべく鋭意検討した結果、水分を含有する食品残渣を含む原料を乳酸菌で発酵させて、前記乳酸菌の生菌数濃度を飽和させることにより得られる発酵飼料が、腐敗を抑制して保存性を向上できると共に、動物に給与されたときに動物の免疫機能を強化して(例えば腸管免疫グロブリンAの濃度を向上させて)、動物の体調を顕著に改善できることを見出し、本発明を完成するに至った。
【0013】
すなわち、本発明に係る発酵飼料は、前記課題を解決するために、水分を含有する食品残渣を含む原料を乳酸菌で発酵させて得られる発酵飼料であって、前記乳酸菌の生菌数濃度(単位質量あたりの生菌数または単位体積あたりの生菌数)が飽和した状態となっていることを特徴としている。
【0014】
前記構成の発酵飼料は、乳酸菌の生菌数濃度が飽和した状態となっているので、乳酸発酵が高度に進行して、乳酸菌が極大値の生菌数濃度まで増殖した状態、あるいは、その状態からさらに発酵が進行した状態となっている。そのため、前記構成の発酵飼料は、乳酸菌の総菌数(生菌数と死菌数とを合わせたもの)の濃度が高いので、乳酸菌の細胞壁に由来する水溶性β−1,3−グルカンを高濃度に含んでいる。これにより、前記構成の発酵飼料は、動物に給与されたときに、動物の免疫機能を強化して(例えば腸管免疫グロブリンAの濃度を向上させて)、動物の体調を顕著に改善することができる。
【0015】
また、前記構成の発酵飼料は、乳酸菌の生菌数濃度が飽和した状態となっているため、乳酸菌の生菌数濃度(密度)が高くなっている。これにより、動物の腸内における乳酸菌の濃度を高めることができ、また、増殖した乳酸菌が乳酸などの有機酸を産生することによって動物の腸内における乳酸などの有機酸の濃度も高めることができる。これらにより、動物の腸内における大腸菌などの悪玉菌の数を減少させることができ、動物の腸内環境を改善できる。
【0016】
さらに、前記構成の発酵飼料は、乳酸菌の生菌数濃度が飽和した状態となっており、乳酸発酵が高度に進行した状態であるため、原料が乳酸菌で発酵することによって生成する乳酸などの有機酸を高濃度に含んでいる。前記構成の発酵飼料は、乳酸菌の生菌数濃度が高く、かつ乳酸などの有機酸の濃度が高いことにより、腐敗菌の増殖、すなわち飼料の腐敗を抑制することができるので、保存性が向上する。
【0017】
なお、本明細書において、「乳酸菌の生菌数濃度が飽和した状態」とは、乳酸菌の生菌数濃度の増加(乳酸菌の増殖)が止まった状態あるいはほぼ止まった状態を指し、具体的には、発酵飼料を嫌気性条件下、24℃で1日間保持したときにおける生菌数濃度の増加率の測定値が2倍未満である状態を指すものとする。「乳酸菌の生菌数濃度が飽和した状態」では、基本的には、乳酸菌の生菌数濃度が徐々に低下していくはずであるが、生菌数濃度の測定は一般に手作業で行われるために、生菌数濃度の測定値には最大1.5倍程度の誤差が生じることが確認されている。前記の「生菌数濃度の増加率の測定値が2倍未満」という数値の上限の規定は、この誤差を考慮して導出されたものである。
【0018】
また、本発明に係る発酵飼料の製造方法は、前記課題を解決するために、水分を含有する食品製造副産物を含む原料を乳酸菌で発酵させる発酵飼料の製造方法であって、前記原料の発酵を、乳酸菌の生菌数濃度が極大値となる時点以降まで継続することを特徴としている。
【0019】
前記方法によれば、前記原料の発酵を、乳酸菌の生菌数濃度が極大値となる時点以降まで継続することから、本発明に係る前記乳酸菌の生菌数濃度が飽和した状態の発酵飼料を容易に得ることができる。したがって、前記方法は、腐敗を抑制して保存性を向上できると共に、動物に給与されたときに動物の免疫機能を強化して動物の体調を顕著に改善できる発酵飼料を容易に製造することができる。
【発明の効果】
【0020】
以上のように、本発明によれば、食品残渣を原料とする発酵飼料であって、腐敗を抑制して保存性を向上できると共に、動物に給与されたときに動物の免疫機能を強化して動物の体調を顕著に改善できる発酵飼料およびその製造方法を提供することができる。
【図面の簡単な説明】
【0021】
【図1】本発明の実施例に係る発酵飼料において豆腐粕に対するグルコースの添加量を変化させたときの、発酵飼料の単位質量あたりに含まれる乳酸菌の生菌数(生菌数濃度)の変化を示すグラフである。
【図2】本発明の実施例に係る発酵飼料のpHの経時変化を示すグラフである。
【図3】本発明の実施例に係る発酵飼料中の大腸菌群数の経時変化を示すグラフである。
【図4】本発明の実施例に係る発酵飼料中の乳酸濃度および酢酸濃度の経時変化を示すグラフである。
【図5】本発明の実施例に係る発酵飼料の単位質量あたりに含まれる乳酸菌の生菌数(生菌数濃度)の経時変化を示すグラフである。
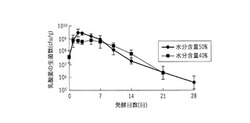
【図6】本発明の実施例に係る発酵飼料において豆腐粕の水分含量を変化させたときの、発酵飼料の単位質量あたりに含まれる乳酸菌の生菌数(生菌数濃度)の変化を示すグラフである。
【図7】本発明の実施例に係る発酵飼料の給与前、1ヶ月間給与後、および4ヶ月間給与後のそれぞれにおける牧場Aおよび牧場Bの泌乳牛の血液中に含まれる総蛋白質の濃度を示すグラフである。
【図8】本発明の実施例に係る発酵飼料の給与前、1ヶ月間給与後、および4ヶ月間給与後のそれぞれにおける牧場Aおよび牧場Bの泌乳牛の血中尿素態窒素(BUN)の濃度を示すグラフである。
【図9】本発明の実施例に係る発酵飼料の給与前、1ヶ月間給与後、および4ヶ月間給与後のそれぞれにおける牧場Aおよび牧場Bの泌乳牛の血液中に含まれるアルブミンの濃度を示すグラフである。
【図10】本発明の実施例に係る発酵飼料の給与前、1ヶ月間給与後、および4ヶ月間給与後のそれぞれにおける牧場Aおよび牧場Bの泌乳牛の血液中に含まれるグルタミン酸オキサロ酢酸トランスアミナーゼ(GOT)の活性値を示すグラフである。
【図11】本発明の実施例に係る発酵飼料の給与前、1ヶ月間給与後、および4ヶ月間給与後のそれぞれにおける牧場Aおよび牧場Bの泌乳牛の血液中に含まれるグルタミルトランスフェラーゼ(γ−GTP)の活性値を示すグラフである。
【図12】本発明の実施例に係る発酵飼料の給与前、1ヶ月間給与後、および4ヶ月間給与後のそれぞれにおける牧場Aおよび牧場Bの泌乳牛のふんの臭気強度(官能評価)を示すグラフである。
【図13】本発明の実施例に係る発酵飼料の給与前、1ヶ月間給与後、および4ヶ月間給与後のそれぞれにおける泌乳牛のふん中におけるLactobacillus属と推定される細菌(乳酸菌)の全細菌に占める割合を示すグラフである。
【図14】本発明の実施例および比較例に係る0週間発酵、1週間発酵、2週間発酵の発酵飼料の給与後および給与前におけるマウスの小腸パイエル板の平均面積を示すグラフである。
【図15】本発明の実施例および比較例に係る0週間発酵、1週間発酵、2週間発酵の発酵飼料の給与後および給与前におけるマウスの小腸パイエル板の総面積を示すグラフである。
【図16】本発明の実施例に係る2週間発酵、3週間発酵、4週間発酵の発酵飼料の給与後および給与前におけるマウスのIFN−γの血中濃度を示すグラフである。
【図17】本発明の実施例に係る2週間発酵、3週間発酵、4週間発酵の発酵飼料の給与後および給与前におけるマウスのTNF(腫瘍壊死因子)−γの血中濃度を示すグラフである。
【図18】本発明の実施例に係る2週間発酵、3週間発酵、4週間発酵の発酵飼料の給与後および給与前におけるマウスの小腸パイエル板の総面積を示すグラフである。
【図19】本発明の実施例に係る2週間発酵、3週間発酵、4週間発酵の発酵飼料の給与後および給与前におけるマウスのふん中の免疫グロブリンA(IgA)濃度を示すグラフである。
【図20】本発明の実施例に係る発酵飼料の給与前および1ヶ月給与後における牧場Cおよび牧場Dの泌乳牛のふん中の免疫グロブリンA濃度を示すグラフである。
【図21】本発明の実施例に係る発酵飼料の給与期間を含む約10ヶ月間およびその1年前のほぼ同時期における牧場Cの泌乳牛の乳中体細胞数の変化を示すグラフである。
【図22】本発明の実施例に係る発酵飼料の給与期間を含む約10ヶ月間およびその1年前のほぼ同時期における牧場Dの泌乳牛の乳中体細胞数の変化を示すグラフである。
【発明を実施するための形態】
【0022】
以下、本発明について詳細に説明する。
【0023】
本発明に係る発酵飼料は、水分を含有する食品残渣を含む原料を乳酸菌で発酵させて得られる発酵飼料であって、前記乳酸菌の生菌数濃度が飽和した状態となっている発酵飼料である。本発明に係る発酵飼料は、前記原料を乳酸菌と混合し、嫌気性条件下で発酵させる製造方法であって、前記原料の発酵を、乳酸菌の生菌数濃度が極大値となる時点以降まで継続する製造方法により、容易に製造できる。
【0024】
前記食品残渣としては、特に限定されるものではないが、糖質を豊富に含むために乳酸菌の増殖に適していることから、植物性の食品残渣が好ましい。前記植物性の食品残渣としては、植物性の食品製造副産物(食品を加工して加工食品を製造する過程で得られる副産物)、植物性の調理残渣、植物性の余剰食品などが挙げられる。前記食品製造副産物としては、豆腐粕、餡子粕(小豆餡粕など)、茶粕(緑茶粕、麦茶粕など)、ビール粕、焼酎粕、酒粕、醤油粕、ジュース粕、サトウキビ搾り粕(バガス)などの粕類;小麦ふすま、米糠、大麦糠などの槽糠類;パン屑、菓子屑、乾麺屑などの食品加工屑などが挙げられる。前記調理残渣としては、野菜屑、果物屑、パン屑などが挙げられる。前記余剰食品としては、売れ残りのパン、売れ残りの菓子、売れ残りの乾麺などが挙げられる。
【0025】
前記食品残渣は、粕類を含んでいることが好ましく、豆腐粕を含んでいることがより好ましい。豆腐粕は、豆腐製造工場から一定して大量に排出され、安価であり、かつ栄養価が高いので、豆腐粕を食品残渣として用いた場合、安価で、安定的な生産が可能で、かつ栄養価が高い発酵飼料を実現できる。また、本発明は、特に豆腐粕を含む飼料の保存性を改良して、取り扱いが容易な発酵飼料を実現できる。
【0026】
前記原料は、食品残渣として粕類のみを含んでいることがさらに好ましく、食品残渣として豆腐粕のみを含んでいることがより一層好ましい。本願出願人は、平成20年度(平成20年4月〜平成21年3月)に、豆腐粕を主原料とし、この主原料と野菜屑などの副原料とを混合したものを乳酸発酵して得られる乳酸発酵飼料を開発した。しかしながら、この乳酸発酵飼料は、小麦ふすまなどの槽糠類、野菜屑などのような、排出が一定せず、安価でない食品残渣が副原料として必要である。そのため、この乳酸発酵飼料は、安価でなく、安定的に生産することが難しく、また、飼料製造場所が副原料の集荷・保管がし易い場所に制約される。これに対し、本発明の好ましい形態に係る発酵飼料は、前述したように、小麦ふすまなどの槽糠類、野菜屑などの食品残渣を含まず、豆腐粕のみを食品残渣として含む原料を乳酸発酵して得られるものである。これにより、安価で、安定的な生産が可能で、かつ栄養価が高い発酵飼料を実現でき、また、飼料製造場所の制約を解消できる。
【0027】
また、前記原料は、豆腐粕を98質量%以上含むことが好ましい。これにより、原料を構成する豆腐粕以外の成分の使用量を削減できるので、安価な発酵飼料を実現できる。
【0028】
本発明の発酵飼料の製造方法では、前記食品残渣をそのまま原料として用いて発酵を行ってもよいが、前記食品残渣の水分含量を調整した後、前記原料の発酵を行うことがより好ましい。前記食品残渣の水分含量は、前記食品残渣の水分含量は、前記食品残渣が液状となるような比較的高い水分含量であってもよく、前記食品残渣が半固形状となるような比較的低い水分含量であってもよい。前記食品残渣の水分含量は、40質量%を超え50質量%以下となるように調整することがより好ましく、48質量%以上50質量%以下となるように調整することがさらに好ましい。発酵時の食品残渣の水分含量を40質量%超とすることで、発酵飼料中における乳酸菌の生菌数濃度を、例えば1×108.9cfu/g(cfuは、コロニー形成単位(colony forming unit)を表す)以上といった高い濃度にまで高めることができるので、発酵飼料の保存性をさらに向上させると共に、動物に給与されたときに動物の体調をさらに改善することができる。また、発酵時の食品残渣の水分含量を48質量%以上とすることで、発酵飼料中における乳酸菌の生菌数濃度を、例えば1×109cfu/g以上といった高い濃度にまで高めることができるので、発酵飼料の保存性をさらに向上させると共に、動物に給与されたときに動物の体調をさらに改善することができる。また、発酵時の食品残渣の水分含量を50質量%以下とすることで、発酵飼料の搬送コストを抑制することができる。なお、発酵時の食品残渣の水分含量が、50質量%を超える割合、例えば90質量%であっても、発酵飼料中における乳酸菌の生菌数濃度を、例えば1×109cfu/g以上といった高い濃度にまで高めることは可能である。
【0029】
前記食品残渣の水分含量を調整する方法としては、前記食品残渣を乾燥させた後、乾燥された前記食品残渣に水を加える方法(以下「加水法」と呼ぶ);目標の水分含量よりも低い水分含量を有する食品残渣に水を加える方法;前記食品残渣を乾燥させた後、乾燥された前記食品残渣と、目標の水分含量よりも高い水分含量を有する未乾燥の食品残渣とを混合する方法(以下「混合法」と呼ぶ);目標の水分含量よりも高い水分含量を有する食品残渣を乾燥させる乾燥処理を実施し、食品残渣が適当な水分含量になった時点で乾燥処理を止める方法(以下「乾燥法」と呼ぶ)などが挙げられる。前記食品残渣の水分含量を調整する方法は、発酵飼料の製造場所などに応じて適宜選択可能である。例えば、発酵飼料の製造場所が食品残渣の排出元から離れた場所である場合には、前記食品残渣の水分含量を調整する方法として加水法を選択するとよい。これにより、食品残渣の搬送コストを削減できる。これら方法のうち、加水法は、単に水を適量加えるだけで食品残渣の水分含量を容易に調整することができるので、生産性を向上させて効率的に発酵飼料を製造することができるという利点がある。また、乾燥法は、乾燥に係るコストを削減でき、省エネリサイクル技術を実現できるという利点がある。各方法における乾燥の方法としては、食品残渣を熱風で乾燥する方法(熱風乾燥)が好ましい。これにより、食品残渣を熱風で効率的に乾燥させて乾燥食品残渣を準備できるので、発酵飼料を効率的に製造することができる。
【0030】
前記原料、特に食品残渣として豆腐粕のみを含む原料は、糖類を含んでいることが好ましい。これにより、糖類が発酵補助剤として機能して食品残渣の発酵を促し、発酵飼料中における乳酸菌の生菌数濃度、水溶性β−1,3−グルカンの濃度、および乳酸の濃度を高めることができる。したがって、発酵飼料の保存性をさらに向上させると共に、動物に給与されたときに動物の体調をさらに改善することができる。前記糖類としては、グルコース(ブドウ糖)、フルクトース(果糖)などの単糖類、スクロース(ショ糖)などの二糖類;澱粉などの多糖類を用いることができる。前記糖類としては、安価であることから、グルコースが好ましい。
【0031】
前記原料中における糖類の含有量は、0.5質量%以上であることが好ましく、1質量%以上であることがより好ましく、2質量%以上であることがさらに好ましい。これにより、発酵飼料中における乳酸菌の生菌数濃度、水溶性β−1,3−グルカンの濃度、および乳酸の濃度をさらに高めることができるので、発酵飼料の保存性をさらに向上させると共に、動物に給与されたときに動物の体調をさらに改善することができる。また、前記原料中における糖類の含有量は、2質量%以下であることが好ましい。これにより、発酵飼料の製造コストを低く抑えることができる。
【0032】
前記乳酸菌としては、ラクトバチルス属(Lactobacillus)、ストレプトコッカス属(Staphylococcus)、ラクトコッカス属(Lactococcus)、ロイコノストック属(Leuconostoc)属、ビフィドバクテリウム属(Bifidobacterium)、エンテロコッカス属(Enterococcus)、ペディオコッカス属(Pediococcus)などを使用することができる。ラクトバチルス属としては、ラクトバチルス・プランタラム(Lactobacillus plantarum)、ラクトバチルス・カゼイ、ラクトバチルス・ヘルベティカス、ラクトバチルス・ブルガリカス、ラクトバチルス・ガッセリ、ラクトバチルス・アシドフィルス、ラクトバチルス・ラクチス、ラクトバチルス・サリバリウス、ラクトバチルス・ガリナルム(Lactobacillus gallinarum)、ラクトバチルス・アミロボラス、ラクトバチルス・ブレビス、ラクトバチルス・ファーメンタム、ラクトバチルス・マリ、ラクトバチルス・デルブルッキィ、ラクトバチルス・サンフランシスエンシス、ラクトバチルス・パネックス、ラクトバチルス・コモエンシス、ラクトバチルス・イタリカス、ラクトバチルス・ライキマニ、ラクトバチルス・カルバタス、ラクトバチルス・ヒルガルディ、ラクトバチルス・ルテリ、ラクトバチルス・パストリアヌス、ラクトバチルス・ブクネリ、ラクトバチルス・セロビオサス、ラクトバチルス・フルクティボランスなどを使用することができる。ストレプトコッカス属としては、ストレプトコッカス・サーモフィルス、ストレプトコッカス・ラクチス、ストレプトコッカス・ジアセチルラクチスなどを使用することができる。ラクトコッカス属としては、ラクトコッカス・ラクチス・ラクチス、ラクトコッカス・ラクチス・クレモリスなどを使用することができる。ロイコノストック属としては、ロイコノストック・メセンテロイデス・クレモリス、ロイコノストック・ラクチスなどを使用することができる。ビフィドバクテリウム属としては、ビフィドバクテリウム・ビフィダム、ビフィドバクテリウム・ロンガム、ビフィドバクテリウム・インファンティス、ビフィドバクテリウム・ブレーベ、ビフィドバクテリウム・アドレセンティス、ビフィドバクテリウム・アンギュラータム、ビフィドバクテリウム・カテニュラータム、ビフィドバクテリウム・シュードカテニュラータム、ビフィドバクテリウム・デンティウム、ビフィドバクテリウム・グロボズム、ビフィドバクテリウム・シュードロンガム、ビフィドバクテリウム・クニキュリ、ビフィドバクテリウム・コエリナム、ビフィドバクテリウム・アニマリス、ビフィドバクテリウム・サーモフィラム、ビフィドバクテリウム・ボウム、ビフィドバクテリウム・マグナム、ビフィドバクテリウム・アステロイデス、ビフィドバクテリウム・インディカム、ビフィドバクテリウム・ガリカム、ビフィドバクテリウム・ラクチス、ビフィドバクテリウム・イノピナータム、ビフィドバクテリウム・デンティコレンス、ビフィドバクテリウム・プローラム、ビフィドバクテリウム・スイス、ビフィドバクテリウム・ガリナラム、ビフィドバクテリウム・ルミナンティウム、ビフィドバクテリウム・メリシカム、ビフィドバクテリウム・サーキュラーレ、ビフィドバクテリウム・ミニマム、ビフィドバクテリウム・サブチル、ビフィドバクテリウム・コリネフォルメなどを使用することができる。エンテロコッカス属としては、エンテロコッカス・フェカリス、エンテロコッカス・フェシウム(Enterococcus faecium)、エンテロコッカス・サリバリウス、エンテロコッカス・ミティスなどを使用することができる。ペディオコッカス属としては、ペディオコッカス・アシディラクティシ、ペディオコッカス・ペントサセウスなどを使用することができる。
【0033】
前記乳酸菌としては、ラクトバチルス・プランタラムが、安価であり、また、牛に給与されたときに牛の体調を顕著に改善できるので、特に発酵飼料が牛用である場合に、好ましい。また、前記乳酸菌としては、複数種類の菌株を用いてもよく、単一種類の菌株を用いてもよいが、単一種類の菌株、特にラクトバチルス・プランタラムを用いることがより好ましい。前述した本願出願人が平成20年度(平成20年4月〜平成21年3月)に開発した乳酸発酵飼料では、有限会社岡山県ヘルスアンドセーフティ製の乳酸菌3種(ラクトバチルス・プランタラム、ラクトバチルス・ガリナルム、およびエンテロコッカス・フェシウム)混合液を購入したものを直接、原料に添加していた。これに対し、乳酸菌として、汎用の乳酸菌であるラクトバチルス・プランタラムを用いた場合、安価な発酵飼料を実現できる。
【0034】
前記原料に対して乳酸菌を添加する方法としては、特に限定されるものでなく、乳酸菌を予備発酵培養してスターター(飼料発酵種菌)を調製した後、スターターを原料に添加する方法、乳酸菌を直接原料に添加する方法などが挙げられるが、前者の方法が好ましい。スターターを用いる添加方法は、特に乳酸菌として単一種類の菌株のみを用いる場合に、発酵飼料中における乳酸菌の生菌数濃度をより高めることができる。したがって、乳酸菌として単一種類の乳酸菌のみを、スターターを用いる添加方法によって原料に添加した場合、安価で、かつ乳酸菌の生菌数濃度が高い発酵飼料を実現できる。予備発酵培養する際に用いる培地としては、例えばスキムミルク水溶液を好適に用いることができる。
【0035】
前記原料の発酵は、14〜28日間かけて行うことが好ましく、21〜28日間かけて行うことがより好ましく、約21日間かけて行うことが最も好ましい。発酵期間を14日間以上とすることにより、発酵飼料中における乳酸菌の総菌数の濃度がさらに高くなるので、発酵飼料中における水溶性β−1,3−グルカンの濃度がさらに高くなる。その結果、発酵飼料を動物に給与したときに、動物の免疫機能をさらに強化して、動物の体調をさらに改善することができる。また、発酵期間を28日間以下とすることにより、発酵飼料の製造を効率化することができると共に、カビの発生を防止することができる。
【0036】
前記原料の発酵を行う温度は、乳酸菌の種類などによって適宜選択すればよいが、20〜30℃の範囲内であることが好ましい。これにより、発酵飼料中における乳酸菌の生菌数濃度をさらに高めることができるので、発酵飼料の保存性をさらに向上させると共に、動物に給与されたときに動物の体調をさらに改善することができる。
【0037】
前記原料の発酵を嫌気性条件下で行う方法としては、特に限定されるものではないが、酸素を遮断可能な容器に前記原料を密封して発酵させる方法が簡便である。酸素を遮断可能な容器としては、各種高分子フィルムで構成された袋などを用いることができるが、酸素バリア性の高いフィルム、例えばナイロン・ポリエチレンフィルム(ナイロンフィルムとポリエチレンフィルムとを積層した積層フィルム)で構成された袋が好ましい。これにより、発酵飼料にカビが発生することを防止できる。
【0038】
本発明に係る発酵飼料は、水溶性β−1,3−グルカンを40pg/g以上の濃度で含むことが好ましい。これにより、前記発酵飼料は、動物に給与されたときに、動物の免疫系をさらに活性化することができ、例えば、腸管免疫グロブリンAの濃度を上昇させたり、腸管免疫グロブリンAの産生を担っている小腸上皮に存在するパウエル板の面積を増大させたりすることができる。その結果、動物の感染に対する抗炎症作用が強まり、例えば動物の血中IFN−γ濃度および血中TNF−α濃度が低下する。したがって、動物の体調が改善され、例えば乳牛の乳中体細胞数が減少する。
【0039】
また、本発明に係る発酵飼料は、乳酸を200mM以上の濃度で含むことが好ましい。これにより、前記発酵飼料は、腐敗菌の増殖をさらに抑制することができるので、飼料の保存性をさらに向上させることができる。
【0040】
また、本発明に係る発酵飼料は、乳酸菌の生菌数濃度が3×105cfu/g(=105.48cfu/g)以上であることが好ましい。これにより、発酵飼料の保存性をさらに向上させると共に、動物に給与されたときに動物の腸内環境をさらに改善することができる。
【0041】
また、本発明に係る発酵飼料は、水分を含む状態であってもよく、乾燥した状態であってもよい。本発明に係る発酵飼料を乾燥した状態とする場合には、発酵後に風乾などの方法によって乾燥すればよい。また、本発明に係る発酵飼料は、単独で動物に給与してもよく、他の飼料と混合して動物に給与してもよい。
【0042】
また、本発明の発酵飼料は、反芻動物である牛に対する給与およびマウスに対する給与において効果が確認されているが、豚、鶏などのような牛以外の種類の家畜、最近ストレスなどが問題になっている犬、猫、愛玩鳥などのペットなどの他の動物に給与した場合にも、同様の効果が期待できる。
【実施例】
【0043】
以下、実施例および比較例に基づいて本発明をより詳細に説明するが、本発明はこれらに限定されるものではない。なお、以下の説明中および図面中において、「%」は質量%を表し、「部」は質量部を表す。
【0044】
〔スターターの調製例1〕
市販のスキムミルク粉末を10%水溶液としたもの100部をオートクレーブ滅菌(高圧蒸気滅菌)し、滅菌後のスキムミルクに実験用LBS培地を2部加えて混合し、液体培地とした。この液体培地に乳酸菌ラクトバチルス・プランタラムを植菌し、24℃で48時間培養した。これにより、液体培地1gあたりに含まれる乳酸菌の生菌数(生菌数濃度)は、コロニーカウント法(MRS寒天培地を使用)による測定値が1×109cfu/g以上(約1.3×109cfu/g)となった。以下の実施例および比較例では、この培養後の液体培地を発酵飼料用スターターとして使用する。
【0045】
〔スターターの調製例2〕
豆腐製造工場で豆乳から豆腐を作る際に排出された液(豆腐ホエー)100部をオートクレーブ滅菌し、実験用LBS培地を2部加えて混合し、液体培地とした。この液体培地に乳酸菌ラクトバチルス・プランタラムを植菌し、24℃で48時間培養した。これにより、液体培地1gあたりに含まれる乳酸菌の生菌数(生菌数濃度)は、コロニーカウント法(MRS寒天培地を使用)による測定値が1×109cfu/g以上(約1.2×109cfu/g)となった。この培養後の液体培地も、発酵飼料用スターターとして使用することができる。
【0046】
〔実施例1〕
まず、豆腐製造工場から排出された豆腐粕(食品残渣)を熱風乾燥機で熱風乾燥し、乾燥豆腐粕を得た。乾燥豆腐粕の水分含量を定法に基づき測定した。すなわち、乾燥豆腐粕を容器中で135℃で2時間かけて乾燥した前後の重量を精密天秤で秤量し、これらの重量から乾燥豆腐粕の水分含量を算出した。その結果、乾燥豆腐粕の水分含量は約12%であった。次に、乾燥豆腐粕に対し、水道水を加えることによって豆腐粕の水分含量を50%に調整した。水分含量の調整は、以下のようにして行った。まず、乾燥豆腐粕と水道水との混合比を幾つか試し、乾燥豆腐粕の水分含量を測定したのと同様の方法によって混合後の豆腐粕の水分含量を測定し、測定結果に基づいて豆腐粕の水分含量が50%になる場合の混合比を決定した。この例では、豆腐粕の水分含量が50%になる乾燥豆腐粕と水道水の混合比(質量比)は、4:3に決定された。そして、乾燥豆腐粕(水分含量約12%)粉末と水道水とを4:3の混合比で混合することによって、豆腐粕の水分含量を50%に調整した。なお、この方法は、水分含量を毎回実測しないので、気温・湿度・調製作業時間などによって、水分含量に若干の誤差が生じる可能性があるが、実用上は問題ないものと考えられる。
【0047】
次に、水分含量が50%に調整された豆腐粕100部に対し、グルコース2部と、「スターターの調製例1」で得られた発酵飼料用スターター1部とを添加して、ナイロン・ポリエチレンフィルムで構成された袋中に密封し、24℃で3日間かけて発酵させた。これにより、発酵飼料が得られた。発酵飼料1gあたりに含まれる乳酸菌の生菌数(生菌数濃度)は、コロニーカウント法(MRS寒天培地を使用)による測定値が1×109cfu/g以上であった。
【0048】
なお、実施例1では、豆腐製造工場から排出された豆腐粕を乾燥させて乾燥豆腐粕を得た後、乾燥豆腐粕に水を添加する方法で豆腐粕の水分含量の調整を行っていた。
【0049】
しかしながら、豆腐製造工場から排出された豆腐粕を攪拌しながら135℃で乾燥させる乾燥工程を適当な水分含量になった時点で止める方法(乾燥法)で豆腐粕の水分含量を50%に調整しても、実施例1と同様の乳酸菌の生菌数濃度を実現することができた。この場合、まず、乾燥中の豆腐粕の水分含量を経時的に測定して、豆腐粕の水分含量が50%になる乾燥時間を決定した。豆腐粕の水分含量の経時的な測定は、乾燥豆腐粕の水分含量を測定したのと同様の方法によって行った。この例では、豆腐粕の水分含量が50%になる乾燥時間は、約5時間に決定された。そこで、豆腐製造工場から排出された豆腐粕を攪拌しながら135℃で約5時間乾燥する方法によって、豆腐粕の水分含量を50%に調整した。なお、この方法も、水分含量を毎回実測しないので、気温・湿度・調製作業時間などによって水分含量に若干の誤差が生じる可能性があるが、実用上は問題ないものと考えられる。
【0050】
また、乾燥豆腐粕と豆腐製造工場で排出された豆腐粕とを混合する方法(混合法)で豆腐粕の水分含量を50%に調整しても、実施例1と同様の乳酸菌の生菌数濃度を実現することができた。
【0051】
〔実施例2〕
グルコースの添加量を、水分調整後の豆腐粕100部に対して0.5部および1部にそれぞれ変更する以外は、実施例1と同様にして発酵飼料を調製した。
【0052】
〔実施例3〕
グルコースを添加しないことを除いて実施例1と同様にして発酵飼料を調製した。
【0053】
実施例1〜3で得られた発酵飼料1gあたりに含まれる乳酸菌の生菌数(生菌数濃度)をコロニーカウント法(MRS寒天培地を使用)によって測定した。測定結果を図1にまとめて示す。図1において、各プロットは複数回の測定値の平均値を示し、エラーバーは平均値±標準偏差の範囲を示す。
【0054】
図1から分かるように、グルコースの添加量を水分調整後の豆腐粕100部に対して0〜2部の間で変化させた場合、グルコースの添加量の増加に比例して発酵飼料1gあたりに含まれる乳酸菌の生菌数(生菌数濃度)が高くなった。なお、グルコースの添加量を水分調整後の豆腐粕100部に対して最大2部とした(原料中における豆腐粕の含有率を98%以下とした)のは、発酵飼料の製造コストを低く抑えるためである。
【0055】
〔実施例4〕
発酵期間(発酵日数)を2日間に変更する以外は実施例1と同様にして発酵飼料を調製した。
【0056】
〔実施例5〕
発酵期間を5日間に変更する以外は実施例1と同様にして発酵飼料を調製した。
【0057】
〔実施例6〕
発酵期間を7日間(1週間)に変更する以外は実施例1と同様にして発酵飼料を調製した。
【0058】
〔実施例7〕
発酵期間を10日間に変更する以外は実施例1と同様にして発酵飼料を調製した。
【0059】
〔実施例8〕
発酵期間を14日間(2週間)に変更する以外は実施例1と同様にして発酵飼料を調製した。
【0060】
〔実施例9〕
発酵期間を21日間(3週間)に変更する以外は実施例1と同様にして発酵飼料を調製した。実施例1と比較して、発酵期間を延長したことで、乳酸菌の生菌・死菌を合わせた総菌数が高まり、生理活性のある水溶性β−1,3−グルカンを多量に含む発酵飼料が得られた。
【0061】
〔比較例1〕
発酵期間を1日間に変更する以外は実施例1と同様にして、比較用の発酵飼料を調製した。
【0062】
〔比較例2〕
発酵期間を0日間に変更する以外は実施例1と同様にして、比較用の発酵飼料を調製した。
【0063】
実施例9(発酵期間21日間)で得られた発酵飼料を、37℃で60分間かけて蒸留水により抽出し、ビージースター(登録商標)Aキット(和光純薬工業株式会社製)により発酵飼料中の水溶性β−1,3−グルカンの濃度を測定した。その結果、実施例9で得られた発酵飼料中における水溶性β−1,3−グルカンの濃度は、40〜100pg/gであった。発酵前の豆腐粕中における水溶性β−1,3−グルカンの濃度を同様の方法で測定したところ、水溶性β−1,3−グルカンは検出されなかった。
【0064】
また、実施例1、実施例4〜9、比較例1、および比較例2で得られた発酵飼料のpHを、pHメーターによって測定した。測定結果を図2にまとめて示す。図2において、各プロットは複数回の測定値の平均値を示し、エラーバーは平均値±標準偏差の範囲を示す。図2から分かるように、発酵期間が3日以上である場合、発酵飼料のpHは4.0まで低下した。
【0065】
また、汚染の指標として実施例1、実施例4〜8、比較例1、および比較例2で得られた発酵飼料中の大腸菌群数(汚染の指標)を、コロニーカウント法(MRS寒天培地を使用)により測定した。大腸菌群数の測定結果を図3にまとめて示す。図3において、縦軸は対数目盛であり、各プロットは複数回の測定値の平均値を示し、エラーバーは平均値±標準偏差の範囲を示す。図3から分かるように、発酵期間が5日以上の場合に、発酵飼料中から大腸菌群が検出されなくなり、汚染のない発酵飼料が得られることが確認された。
【0066】
また、実施例1、実施例5〜8、比較例1、および比較例2で得られた発酵飼料中の乳酸(有機酸)濃度および酢酸(有機酸)濃度を高速液体クロマトグラフィーによって測定した。乳酸および酢酸の濃度の測定結果を図4にまとめて示す。図4において、各プロットは複数回の測定値の平均値を示し、エラーバーは平均値±標準偏差の範囲を示す。図4から分かるように、発酵期間が3日以上である場合、発酵飼料中の乳酸の濃度は200mM以上となった。
【0067】
〔実施例10〕
発酵期間を28日間(4週間)に変更する以外は実施例1と同様にして発酵飼料を調製した。
【0068】
〔実施例11〕
水道水の添加による豆腐粕の水分調整を水分含量が40%となるように行う以外は、実施例1、実施例4〜9、および比較例1と同様にして発酵飼料を調製した。
【0069】
〔比較例3〕
水道水の添加による豆腐粕の水分調整を水分含量が40%となるように行う以外は、比較例2と同様にして発酵飼料を調製した。
【0070】
実施例1、実施例4〜11、および比較例1〜3で得られた発酵飼料1gあたりに含まれる乳酸菌の生菌数(生菌数濃度)を、MRS培地を寒天培地を用いたコロニーカウント法(MRS寒天培地を使用)によって測定した。測定結果を表1および図5にまとめて示す。図5において、縦軸は対数目盛であり、各プロットは複数回の測定値の平均値を示し、エラーバーは平均値±標準偏差の範囲を示す。
【0071】
【表1】

【0072】
表1および図5から分かるように、豆腐粕の水分含量が50%である場合(実施例1、実施例4〜10、比較例1、および比較例2)、発酵飼料1gあたりに含まれる乳酸菌の生菌数(生菌数濃度)は、発酵開始から2日後に極大値に到達して、飽和状態となった。また、表1および図5から分かるように、豆腐粕の水分含量が50%である場合(実施例1、実施例4〜10、比較例1、および比較例2)、約1×109cfu/g以上の生菌数濃度を、発酵開始から2日後から発酵開始から7日後まで維持することができた。
【0073】
また、表1および図5から分かるように、豆腐粕の水分含量が40%である場合(実施例11および比較例3)、発酵飼料1gあたりに含まれる乳酸菌の生菌数(生菌数濃度)は、発酵開始から1日後に極大値に到達して、飽和状態となった。
【0074】
また、表1および図5から分かるように、豆腐粕に糖類(この例ではグルコース)を添加しただけで、豆腐粕の水分含量が40%である場合(実施例11)にも、乳酸菌を高濃度に増殖させることが可能であった。しかしながら、豆腐粕の水分含量が40%である場合(実施例11)、豆腐粕の水分含量が50%である場合(実施例1および実施例4〜10)と比較すると、発酵飼料1gあたりに含まれる乳酸菌の生菌数(生菌数濃度)がやや低くなった。
【0075】
〔実施例12〕
乾燥豆腐粕に対して蒸留水を添加して、豆腐粕の水分含量が30%、35%、40%、45%、48%、および50%のそれぞれとなるように水分調整を行う以外は、実施例1と同様にして発酵飼料を調製した。
【0076】
実施例12で得られた発酵飼料1gあたりに含まれる乳酸菌の生菌数(生菌数濃度)を測定した。測定結果を表2および図6にまとめて示す。また、豆腐粕の水分含量が20%の場合については、乳酸菌の生菌数濃度は、実測していないが、表2に示すように105cfu/g以下になるものと推定される。図6では、豆腐粕の水分含量が20%の場合に乳酸菌の生菌数濃度が104cfu/gになるものと仮定して、豆腐粕の水分含量が20%の場合をプロットしている。図6において、縦軸は対数目盛であり、各カラムは、複数回の測定値の平均値を示し、エラーバーは、平均値から平均値+標準偏差までの範囲を示す。
【0077】
【表2】

【0078】
〔安全性試験〕
実施例6の発酵飼料(発酵期間1週間)および実施例9の発酵飼料(発酵期間3週間)を28℃で3ヶ月保存したところ、カビは目視によって検出されなかった。
【0079】
また、実施例6の発酵飼料および実施例9の発酵飼料について、アフラトキシンB1の測定を60日間にわたって行ったところ、60日間経過後もアフラトキシンB1が検出されなかった。したがって、実施例6の発酵飼料および実施例9の発酵飼料は、有害なカビ毒を生成しないことが確認された。
【0080】
また、実施例6の発酵飼料を鶏ヒナに給与して、飼料安全法で規定された鶏ヒナ安全性試験を行ったところ、鶏ヒナは正常な発育を示した。したがって、実施例1の発酵飼料は、飼料安全法上の安全性基準をクリアし、順調に鶏ヒナの生育を支持する安全な飼料であることが確認された。
【0081】
また、実施例6の発酵飼料および実施例9の発酵飼料を泌乳牛3頭に1日1kg、3週間給与する小規模投与試験を行い、泌乳牛の血液生化学検査および乳質検査を行った。その結果、発酵飼料が給与された泌乳牛3頭と、通常の飼料が給与された対照区の3頭との間で、血液生化学検査および乳質検査の結果に差異が見られなかった。したがって、実施例6の発酵飼料および実施例9の発酵飼料が、泌乳牛の肝機能、生理作用、乳生産性などに悪影響を与えない安全な飼料であることが確認された。
【0082】
〔乳牛への給与実証1〕
酪農家2戸の牧場A(30頭)および牧場B(20頭)で、泌乳牛(泌乳中の乳牛)に対して、各牧場で通常使用されている通常の飼料に加えて、実施例1および実施例4〜6で得られた2〜7日間発酵させた発酵飼料を4ヶ月間給与し、泌乳牛の乳質、血液成分、ふん臭気、およびふん中細菌などに及ぼす影響を検討した。発酵飼料は、通常の飼料の給与量に関わらず、泌乳牛1頭につき1日あたり1kg給与した。
【0083】
なお、牧場Aで通常使用されている通常の飼料は、乾草(イタリアンライグラス、オーツ)9〜10kg、ふすま1kg、配合ペレット飼料10kg、およびビタミンA・D・E剤(処方量)で構成されており、その給与量は泌乳牛の乳量に応じて配合ペレット飼料が増減される。また、牧場Bで通常使用されている通常の飼料は、乾草(イタリアンライグラス、オーツ)8kg、ヘイキューブ3kg、および自家配合乾燥飼料(ふすま、大麦、トウモロコシ、脱脂大豆、圧ペン大豆、綿実粕、炭酸カルシウム、塩等)15kgで構成されており、その給与量は泌乳牛の乳量に応じて自家配合乾燥飼料が増減される。
【0084】
発酵飼料給与前後の泌乳牛について乳質検査を行った。具体的には、発酵飼料の4ヶ月間給与の前後における牧場Aの泌乳牛30頭および牧場Bの泌乳牛20頭から搾乳した生乳の合乳(バルクーラー貯蔵乳)について、乳脂肪、乳タンパク質、無脂乳固形分などの成分の濃度と、乳牛が飼料から摂取したエネルギーと蛋白質とのバランスを示す指標である乳中尿素態窒素(MUN)の濃度とを測定した。その結果、乳脂肪、乳タンパク質、無脂乳固形分などの成分の濃度には、問題がみられなかった。また、乳中尿素態窒素(MUN)の濃度は、正常値を維持できた。したがって、実施例1および実施例4〜6の発酵飼料は、乳牛が摂取するエネルギーと蛋白質とのバランスに問題がないことが分かった。
【0085】
また、発酵飼料給与前後の泌乳牛について血液生化学検査を行った。
【0086】
具体的には、発酵飼料を給与する前および発酵飼料を1ヶ月間または4ヶ月間給与した後における牧場Aおよび牧場Bの泌乳牛群の中の8〜10頭ずつから血液を採取し、血液中における総蛋白質、血中尿素態窒素(BUN)、およびアルブミンの濃度と、グルタミン酸オキサロ酢酸トランスアミナーゼ(GOT)およびグルタミルトランスフェラーゼ(γ−GTP)の活性値とを測定した。測定結果を図7〜11に示す。図7〜11において、各カラムは、8〜10頭の泌乳牛の平均値を示し、エラーバーは、平均値から平均値+標準偏差までの範囲を示す。また、図7〜11において、網掛けの範囲は、縦軸の数値の適正範囲(一般に適正値とされる値の範囲)を示し、「*」は、発酵飼料を給与する前の濃度に対して有意に高い濃度となった場合(スチューデントのt検定(student t-test)において有意確率pがp<0.05である場合)を示している。
【0087】
発酵飼料の給与に従って、泌乳牛の蛋白質の摂取量を反映する血液中の総蛋白質、血中尿素態窒素(BUN)、およびアルブミンの濃度が上昇した(図7〜9参照)。特に、泌乳牛の血液中における血中尿素態窒素(BUN)およびアルブミンの濃度は、発酵飼料の給与前には適正範囲の下限値よりやや低かったが、発酵飼料の給与後には適正範囲に収まった(図8および図9参照)。このことから、実施例1および実施例4〜6の発酵飼料が、高蛋白質を効率よく乳牛に摂取させられる良質な飼料であることが確認された。また、肝機能の指標(肝機能が悪化すると上昇する)となる酵素GOTおよびγ-GTPの活性値は、4ヶ月間の試験期間を通して適正範囲内であった(図10および図11参照)。したがって、大量の乳酸菌を含む発酵飼料を給与したことによる肝臓の負担はみられず、4ヶ月間の試験期間を通して代謝を正常に維持できたことが確認された。
【0088】
また、発酵飼料を給与する前および発酵飼料を1ヶ月間または4ヶ月間給与した後における牧場Aおよび牧場Bの泌乳牛群の中の8〜10頭ずつから採取した血液中における総コレステロール、グルコース、遊離脂肪酸、カルシウム、およびリンの濃度を測定した。その結果、泌乳牛の血液中における総コレステロール、グルコース、遊離脂肪酸、カルシウム、リンの濃度は、4ヶ月間にわたって正常値に維持されていた。
【0089】
また、発酵飼料給与前後の泌乳牛についてふん臭気の官能検査を行った。具体的には、発酵飼料を給与する前および発酵飼料を1ヶ月間または4ヶ月間給与した後における牧場Aおよび牧場Bの泌乳牛群の中の8〜10頭ずつからふんを採取し、ふんの臭気強度を1〜5の5段階評価の官能試験によって測定した。測定結果を図12に示す。図12において、各カラムは、8〜10頭の泌乳牛の平均値を示し、エラーバーは、平均値から平均値+標準偏差までの範囲を示す。また、図12において、「*」は、発酵飼料を給与する前の濃度に対して有意に高い濃度となった場合(スチューデントのt検定において有意確率pがp<0.05である場合)を示している。図12から分かるように、これまで発酵飼料を給与していなかった牧場Aでは、泌乳牛のふん臭気が、発酵飼料の給与に従って減少し、4ヶ月給与後に給与前と比較して有意に低い値となった。したがって、実施例1および実施例4〜6の発酵飼料を泌乳牛に給与することによって、泌乳牛の腸内環境を改善して泌乳牛のふん臭気を改善できることが分かった。
【0090】
また、発酵飼料給与前後の泌乳牛について、ふん中の全細菌に占める乳酸菌の割合を求めた。具体的には、発酵飼料を給与する前および発酵飼料を1ヶ月間または4ヶ月間給与した後における牧場Aの泌乳牛群の中の8〜10頭から採取したふんについて、末端制限酵素断片長多型(t−RFLP;terminal Restriction Fragment Length Polymorphism)解析によって、ふん中における細菌の種類別存在比を求めた。発酵飼料を給与する前および発酵飼料を1ヶ月間または4ヶ月間給与した後における泌乳牛のふん中におけるLactobacillus属と推定される細菌の全細菌に占める割合を図13に示す。図13において、各カラムは、8〜10頭の泌乳牛の平均値を示し、エラーバーは、平均値から平均値+標準偏差までの範囲を示す。図13から分かるように、ふん中におけるLactobacillus属と推定される細菌の全細菌に占める割合が、発酵飼料の給与に従って増加する傾向がみられた。
【0091】
〔マウスへの給与試験1〕
実施例6、実施例8、および比較例2に従い、豆腐粕を含む原料を、0週間、1週間、および2週間発酵させて発酵飼料を調製し、発酵飼料を風乾した。マウスの通常飼料100部に各発酵飼料2部を添加した飼料を、2週間、マウス5匹に給与してマウス5匹を飼育した。なお、マウスの通常飼料としては、繁殖用、育成用、生体維持用などの用途に応じて、それぞれ必要な栄養成分を強化した配合飼料を使用した。マウスの通常飼料としては、一例として、生体維持用の配合飼料「AIN−93」を用いた。配合飼料「AIN−93」は、カゼイン14.0%、L−シスチン0.18%、コーンスターチ46.57%、α−コーンスターチ15.5%、スクロース10.0%、大豆油4.0%、セルロースパウダー5.0%、AIN−93Mミネラル混合3.5%、AIN−93ビタミン混合1.0%、および重酒石酸コリン0.25%で構成されている。
【0092】
発酵飼料の給与後、大腸菌から抽出したリポ多糖(LPS)をマウスに皮下注射して全身性の炎症を誘発させる処置を実施し、マウスの小腸をサンプリングして、マウスの感染や炎症に対する抵抗力(免疫力)を観察した。すなわち、マウスの免疫力の指標として、腸管免疫グログリン(IgA)産生を担っている小腸上皮に存在するパイエル板の状態(面積)の測定(組織学的検査)を行った。発酵飼料を給与する前、実施例6の発酵飼料(1週間発酵)を給与した後、実施例8の発酵飼料(2週間発酵)を給与した後、および比較例2の発酵飼料(未発酵)を給与した後におけるマウスの小腸パイエル板の平均面積(全小腸パイエル板の面積の平均)および総面積(全小腸パイエル板の面積の合計)を図14および図15に示す。図14および図15において、エラーバーは、平均値から平均値+標準偏差までの範囲を示し、「*」は、発酵飼料を給与する前の濃度(対照)に対して有意に大きい面積となった場合(スチューデントのt検定において有意確率pがp<0.05である場合)を示している。図14および図15から分かるように、発酵が進んだ発酵飼料を食べたマウスほど、小腸パイエル板の平均面積が増加し、小腸パイエル板の総面積も増加した。このことから、マウスは、実施例6および8の発酵飼料を食べたことにより、免疫機能が活性化され、リンパ組織の発達が起こったことが示唆された。
【0093】
〔マウスへの給与試験2〕
発酵飼料の発酵期間を変更することにより、さらに強い免疫増強効果が得られるかを検証した。すなわち、実施例8〜10に従って発酵期間がそれぞれ2週間、3週間、および4週間である発酵飼料の風乾物2部を調製し、「マウスへの給与試験1」と同様にして、マウスの通常飼料100部に添加して、2週間、マウス5匹に給与し、血液生化学検査、組織学的検査、およびふん便検査を行った。
【0094】
血液生化学検査では、発酵飼料を給与する前、実施例8の発酵飼料(2週間発酵)を給与した後、実施例9の発酵飼料(3週間発酵)を給与した後、および実施例10の発酵飼料(4週間発酵)を給与した後におけるマウスのIFN−γの血中濃度を測定した。測定結果を図16に示す。図16において、各カラムは、5匹のマウスの平均値を示し、エラーバーは、平均値から平均値+標準偏差までの範囲を示す。また、図16において、「*」は、発酵飼料を給与する前の濃度に対して有意に高い濃度となった場合(スチューデントのt検定において有意確率pがp<0.05である場合)を示している。マウスの血中のIFN-γ濃度は、2週間発酵の発酵飼料または4週間発酵の発酵飼料を給与した場合に、有意に低下した。したがって、実施例8および10の発酵飼料の給与により、マウスの感染に対する抵抗力(免疫力)が高まったことが示唆された。
【0095】
血液生化学検査においては、さらに、免疫機能に関係している血中の炎症性サイトカインであるマウスのTNF−αの血中濃度を測定した。すなわち、発酵飼料を給与する前におけるマウスのTNF−αの血中濃度(対照)と、実施例8の発酵飼料(2週間発酵)の風乾物を給与した後、実施例9の発酵飼料(3週間発酵)の風乾物を給与した後、および実施例10の発酵飼料(4週間発酵)の風乾物を給与した後におけるマウスのTNF−αの血中濃度とを測定した。測定結果を図17に示す。図17において、各カラムは、5匹のマウスの平均値を示し、エラーバーは、平均値から平均値+標準偏差までの範囲を示す。マウスのTNF-αの血中濃度は、2〜4週間発酵の発酵飼料間で比較すると、発酵が進んだものほど低い値を示す傾向がみられた(2週間発酵の発酵飼料を用いた場合と3週間発酵の発酵飼料を用いた場合との間でのスチューデントのt検定において、有意確率pが0.09であった)。したがって、発酵が進んだ発酵飼料を給与した場合ほど、抗炎症作用が強くなり、マウスの免疫機能が強化されることが示唆された。
【0096】
組織学的検査では、発酵飼料を給与する前におけるマウスの小腸パイエル板の総面積(対照)と、実施例8の発酵飼料(2週間発酵)を給与した後、実施例9の発酵飼料(3週間発酵)を給与した後、および実施例10の発酵飼料(4週間発酵)を給与した後におけるマウスの小腸パイエル板の総面積とを測定した。測定結果を図18に示す。図18から分かるように、マウスの小腸上皮のパイエル板は、発酵の進んだ発酵飼料が給与された場合ほど、総面積が大きくなり、パイエル板が発達する傾向がみられた。したがって、発酵が進んだ発酵飼料を給与した場合ほど、マウスの免疫機能が強化されることが示唆された。
【0097】
ふん便検査では、発酵飼料を給与する前におけるマウスのふん中の免疫グロブリンA濃度(対照)と、実施例8の発酵飼料(2週間発酵)を給与した後、実施例9の発酵飼料(3週間発酵)を給与した後、および実施例10の発酵飼料(4週間発酵)を給与した後におけるマウスのふん中の免疫グロブリンA濃度とを測定した。測定結果を図19に示す。図19において、各カラムは、5匹のマウスの平均値を示し、エラーバーは、平均値から平均値+標準偏差までの範囲を示す。図19から分かるように、マウスのふん中の免疫グロブリンA濃度は、3週間発酵の発酵飼料の給与によって給与前と比較して有意に高くなった。したがって、3週間発酵の発酵飼料の給与により、マウスの腸管の免疫細胞が活性化されたことが示唆された。
【0098】
これらの試験結果と、豆腐工場での保管のためのスペース確保にかかるコストと、カビ防除(次項参照)とを考慮すれば、豆腐粕を含む原料の発酵期間は、3週間であることが最も好ましいと考えられる。
【0099】
〔発酵飼料保存用袋の選定〕
実施例の発酵飼料をポリエチレン(PE)製の袋に封入したところ、夏季に調製した発酵飼料は、発酵期間が約2週間に達した時点から袋の口付近にカビが発生した。袋の中に脱酸素剤(エージレス(登録商標))を同封しても改善しなかった。
【0100】
次に、酸素の通りにくいナイロン・ポリエチレン(NYPE)フィルムで構成された袋3つに実施例の発酵飼料を封入した後、28℃で保存したところ、4ヶ月保存後、3袋全てでカビは発生しなかった。同様に、PE製の袋3つに実施例の発酵飼料を封入した後、28℃で保存したところ、約2週間後に3袋中2袋で夏季に発生したのと同様のカビが発生した。これらの結果、発酵飼料保存用袋として、ナイロン・ポリエチレンフィルムで構成された袋が適していることが分かった。
【0101】
〔乳牛への給与実証2〕
3週間発酵させた発酵飼料について、乳牛への給与試験を行った。具体的には、「乳牛への給与実証1」における酪農家2戸とは異なる酪農家2戸の牧場Cおよび牧場Dで、8〜10頭ずつの泌乳牛に対して、各牧場で通常使用されている濃厚飼料に加えて、実施例9で得られた3週間発酵させた発酵飼料を約6ヶ月間(牧場C)または約3ヶ月間(牧場D)、給与した。発酵飼料は、濃厚飼料の給与量に関わらず、泌乳牛1頭につき1日あたり1kg給与した。発酵飼料の給与期間中は、通常給与している濃厚飼料の量を調整して、泌乳牛のエネルギー・粗蛋白質の摂取量が発酵飼料の給与前と変わらないようにした。なお、牧場Cで通常使用されている通常の飼料は、乾草(チモシー、オーツ、クレイングラス)7〜8kg、植物系濃厚飼料(ビートパルプおよびアルファルファ)5〜6kg、および配合ペレット飼料7〜13kgで構成されており、その給与量は泌乳牛の乳量に応じて増減される。また、牧場Dで通常使用されている通常の飼料は、乾草(イタリアンライグラス、オーツ、およびクレイングラス)7kg、アルファルファ1kg、配合ペレット飼料10〜18kg、および自家配合乾燥飼料(小麦ふすま、大麦、トウモロコシ、大豆、ミカンジュース粕、炭酸カルシウム、食塩、重曹、ナイアシン、およびビタミンA・D・E剤)3kgで構成されており、その給与量は泌乳牛の乳量に応じて増減される。
【0102】
免疫機能への影響の評価については、泌乳牛が発酵飼料を食べるとことにより小腸での免疫グログリン(IgA)産生が増加しているかどうかを判定するために、泌乳牛から排出されたふん中のIgAの含量と、牛の体調診断の一つである乳汁中の体細胞数(乳中体細胞数)とを調べた。
【0103】
すなわち、まず、発酵飼料の給与前および1ヶ月給与後における牧場Cおよび牧場Dの泌乳牛8〜10頭から排出されたふん中の免疫グロブリンA(IgA)濃度の測定(ふん便検査)を行った。測定結果を図20に示す。図20において、各カラムは、泌乳牛8〜10頭の平均値を示し、エラーバーは、平均値から平均値+標準偏差までの範囲を示す。また、図20において、「*」は、発酵飼料を給与する前の濃度に対して有意に高い濃度となった場合(スチューデントのt検定において有意確率pがp<0.05である場合)を示している。図20から分かるように、発酵飼料を泌乳牛に1ヶ月給与することで、泌乳牛のふん中の免疫グロブリンA(IgA)が、1つの牧場Dでは有意に増加し、もう1つの牧場Cでも増加する傾向が見られた。したがって、実施例9の発酵飼料が牛の免疫機能を強化できることが分かった。
【0104】
また、発酵飼料の給与を行っている期間を含む約10ヶ月間において、1ヶ月に3回の割合で定期的に、牧場Cおよび牧場Dの泌乳牛から搾乳された生乳(バルク乳)の乳中体細胞数の測定(乳汁検査)を行った。また、これら測定期間の1年前のほぼ同時期においても、1ヶ月に3回の割合で定期的に、牧場Cおよび牧場Dの泌乳牛から搾乳された生乳の乳中体細胞数を測定した。これらの測定結果を図21および図22に示す。図21から分かるように、1つの牧場Cでは、発酵飼料を約6ヶ月間給与し、給与開始後約1ヶ月で、泌乳牛の乳中体細胞数が減少した。また、この牧場Cでは、発酵飼料の約1ヵ月給与後に、泌乳牛の乳中体細胞数が、50〜70万/mlのレベルから30〜40万/mlのレベルに低下した。また、この牧場Cでは、発酵飼料の給与中は、泌乳牛の乳中体細胞数が30〜40万/mlのレベルまで低下した状態を、最も気温の低下する12〜1月を含めて維持することができた。また、牧場Dでは、発酵飼料を約3ヶ月間給与し、給与前後で泌乳牛の乳中体細胞数に有意な変化は見られなかったものの、発酵飼料の給与中は、前年にみられた冬季(12月)の泌乳牛の体調不良による乳中体細胞数の増加が起こらなかった。これらの結果から、実施例9の発酵飼料が牛の体調を改善できることが分かった。
【0105】
また、実施例9の発酵飼料を6ヶ月間にわたって泌乳牛に給与し、「乳牛への給与実証1」と同様にして血液生化学検査を行ったところ、給与期間中の6ヶ月間にわたって血液生化学検査の測定値は正常値に維持された。
【産業上の利用可能性】
【0106】
本発明は、現在大量に廃棄されている豆腐粕を初めとする種々の食品残渣を用いて飼料を製造することができるリサイクル技術であるので、豆腐製造業を初めとする食品産業に広く利用することができる。また、本発明の発酵飼料は、牛、豚、鶏などの家畜;犬、猫、愛玩鳥などのペットなどの動物用の飼料として利用できるので、畜産用飼料、ペット用飼料などの飼料を製造する飼料製造業に利用することができる。
【技術分野】
【0001】
本発明は、豆腐粕(豆腐を製造する過程で豆乳を搾った後に残る粕)などの食品残渣を含む原料を乳酸菌で発酵させる発酵飼料の製造方法およびそれによって得られる発酵飼料に関するものである。
【背景技術】
【0002】
現在、豆腐粕などの食品製造副産物が食品工場から大量に排出されている。しかしながら、近年、我が国においては、食品リサイクル法が強化されたことにより、食品工場で廃棄される食品製造副産物の減量化が義務づけられている。そのため、食品工場では、廃棄する食品製造副産物を乾燥などの処理によって減量化することが必要となっており、その処理に係るコストは膨大な額にのぼる。
【0003】
そこで、従来より、食品製造副産物を肥料、飼料などに再利用することが行われている。例えば、豆腐粕は、豊富に栄養成分を含むことから、家畜飼料原料、キノコ培地などへの再利用が進められている。
【0004】
しかしながら、食品製造副産物は水分含量(水分含有率)が高いために腐敗しやすいものが多く、特に豆腐粕は水分含量がより高く腐敗しやすいため、食品製造副産物自体を肥料、飼料などとして再利用するためには、乾燥を行うことが必要である。近年、食品製造副産物の乾燥は、食品製造工場内で行われることが多くなってきている。例えば、近年の豆腐業界の再編の加速化に伴い、豆腐製造業者の規模が拡大され、豆腐製造工場内に豆腐粕の乾燥施設を設置する豆腐製造業者が多くなってきている。我が国においては、乾燥施設の燃料として用いる重油などの化石燃料を海外に依存しており、乾燥施設の運転コストが高いため、食品製造工場内で食品製造副産物の乾燥を行うことは、食品製造業者の負担コストの増大につながると予想される。そのため、安価な食品製造副産物の再利用方法が強く求められている。
【0005】
そこで、従来より、食品製造副産物などの食品残渣を発酵させて飼料として再利用することが行われている。例えば、特許文献1には、米糠と水と糖類とを含有する培地で、ラクトバチルス菌群、サッカロミセス菌群、ピチア菌群、バチルス菌群を含む4種類の菌群を培養して得られた培養液を大豆粕に含有させて調製した動物・家畜用飼料が記載されている。
【0006】
食品残渣を発酵させて飼料として利用することにより、化石燃料を必要とせず安価に食品残渣飼料の保存性を高めることができる。また、食品残渣を発酵させて得られた発酵飼料は、有用微生物の効果により、家畜の体調の改善が期待できるといわれている。
【0007】
また、食品を発酵させて得られた飼料も種々提案されている。例えば、特許文献2には、脱脂粉乳とスクロースとを水に溶解し、ラクトバチルス・ブレビスのスターターを添加し培養して乳酸菌発酵物を得た後、乳酸菌発酵物に脱脂粉乳やトウモロコシデンプンなどを混合することによって得られる動物飼料が記載されている。また、特許文献3には、アスパラガスから得られる組成物を含有する培地に、乳酸菌を接種し、培養して得られる発酵物を含有する飼料が記載されている。
【先行技術文献】
【特許文献】
【0008】
【特許文献1】特開2009−209057号公報
【特許文献2】特開2007−308419号公報
【特許文献3】特開2007−308404号公報
【発明の概要】
【発明が解決しようとする課題】
【0009】
しかしながら、食品残渣などを発酵させて得られた従来の発酵飼料は、家畜の体調を顕著に改善できることが科学的に証明されていないため、通常の飼料と比較して給与方法に手間がかかることなどから敬遠されて、広く普及するには至っていない。
【0010】
一方、畜産分野では、世界的な穀物不足の影響を受けて、飼料費の高騰対策や自給率向上の観点から、食品残渣を飼料に再利用することが、以前にも増して強く望まれている。また、畜産経営の大規模化による家畜の過密飼育のストレスにより、家畜の感染症による損失が増加し、生産性が低下していることが問題になっている。これらは、低価格で低品質の飼料の使用と家畜の抗病性の低下(免疫機能の低下)とが主原因とみられている。
【0011】
本発明は、上記従来の課題に鑑みなされたものであり、その目的は、食品残渣を原料とする発酵飼料であって、腐敗を抑制して保存性を向上できると共に、動物に給与されたときに動物の免疫機能を強化して動物の体調を顕著に改善できる発酵飼料およびその製造方法を提供することにある。
【課題を解決するための手段】
【0012】
本願発明者らは、上記課題を解決すべく鋭意検討した結果、水分を含有する食品残渣を含む原料を乳酸菌で発酵させて、前記乳酸菌の生菌数濃度を飽和させることにより得られる発酵飼料が、腐敗を抑制して保存性を向上できると共に、動物に給与されたときに動物の免疫機能を強化して(例えば腸管免疫グロブリンAの濃度を向上させて)、動物の体調を顕著に改善できることを見出し、本発明を完成するに至った。
【0013】
すなわち、本発明に係る発酵飼料は、前記課題を解決するために、水分を含有する食品残渣を含む原料を乳酸菌で発酵させて得られる発酵飼料であって、前記乳酸菌の生菌数濃度(単位質量あたりの生菌数または単位体積あたりの生菌数)が飽和した状態となっていることを特徴としている。
【0014】
前記構成の発酵飼料は、乳酸菌の生菌数濃度が飽和した状態となっているので、乳酸発酵が高度に進行して、乳酸菌が極大値の生菌数濃度まで増殖した状態、あるいは、その状態からさらに発酵が進行した状態となっている。そのため、前記構成の発酵飼料は、乳酸菌の総菌数(生菌数と死菌数とを合わせたもの)の濃度が高いので、乳酸菌の細胞壁に由来する水溶性β−1,3−グルカンを高濃度に含んでいる。これにより、前記構成の発酵飼料は、動物に給与されたときに、動物の免疫機能を強化して(例えば腸管免疫グロブリンAの濃度を向上させて)、動物の体調を顕著に改善することができる。
【0015】
また、前記構成の発酵飼料は、乳酸菌の生菌数濃度が飽和した状態となっているため、乳酸菌の生菌数濃度(密度)が高くなっている。これにより、動物の腸内における乳酸菌の濃度を高めることができ、また、増殖した乳酸菌が乳酸などの有機酸を産生することによって動物の腸内における乳酸などの有機酸の濃度も高めることができる。これらにより、動物の腸内における大腸菌などの悪玉菌の数を減少させることができ、動物の腸内環境を改善できる。
【0016】
さらに、前記構成の発酵飼料は、乳酸菌の生菌数濃度が飽和した状態となっており、乳酸発酵が高度に進行した状態であるため、原料が乳酸菌で発酵することによって生成する乳酸などの有機酸を高濃度に含んでいる。前記構成の発酵飼料は、乳酸菌の生菌数濃度が高く、かつ乳酸などの有機酸の濃度が高いことにより、腐敗菌の増殖、すなわち飼料の腐敗を抑制することができるので、保存性が向上する。
【0017】
なお、本明細書において、「乳酸菌の生菌数濃度が飽和した状態」とは、乳酸菌の生菌数濃度の増加(乳酸菌の増殖)が止まった状態あるいはほぼ止まった状態を指し、具体的には、発酵飼料を嫌気性条件下、24℃で1日間保持したときにおける生菌数濃度の増加率の測定値が2倍未満である状態を指すものとする。「乳酸菌の生菌数濃度が飽和した状態」では、基本的には、乳酸菌の生菌数濃度が徐々に低下していくはずであるが、生菌数濃度の測定は一般に手作業で行われるために、生菌数濃度の測定値には最大1.5倍程度の誤差が生じることが確認されている。前記の「生菌数濃度の増加率の測定値が2倍未満」という数値の上限の規定は、この誤差を考慮して導出されたものである。
【0018】
また、本発明に係る発酵飼料の製造方法は、前記課題を解決するために、水分を含有する食品製造副産物を含む原料を乳酸菌で発酵させる発酵飼料の製造方法であって、前記原料の発酵を、乳酸菌の生菌数濃度が極大値となる時点以降まで継続することを特徴としている。
【0019】
前記方法によれば、前記原料の発酵を、乳酸菌の生菌数濃度が極大値となる時点以降まで継続することから、本発明に係る前記乳酸菌の生菌数濃度が飽和した状態の発酵飼料を容易に得ることができる。したがって、前記方法は、腐敗を抑制して保存性を向上できると共に、動物に給与されたときに動物の免疫機能を強化して動物の体調を顕著に改善できる発酵飼料を容易に製造することができる。
【発明の効果】
【0020】
以上のように、本発明によれば、食品残渣を原料とする発酵飼料であって、腐敗を抑制して保存性を向上できると共に、動物に給与されたときに動物の免疫機能を強化して動物の体調を顕著に改善できる発酵飼料およびその製造方法を提供することができる。
【図面の簡単な説明】
【0021】
【図1】本発明の実施例に係る発酵飼料において豆腐粕に対するグルコースの添加量を変化させたときの、発酵飼料の単位質量あたりに含まれる乳酸菌の生菌数(生菌数濃度)の変化を示すグラフである。
【図2】本発明の実施例に係る発酵飼料のpHの経時変化を示すグラフである。
【図3】本発明の実施例に係る発酵飼料中の大腸菌群数の経時変化を示すグラフである。
【図4】本発明の実施例に係る発酵飼料中の乳酸濃度および酢酸濃度の経時変化を示すグラフである。
【図5】本発明の実施例に係る発酵飼料の単位質量あたりに含まれる乳酸菌の生菌数(生菌数濃度)の経時変化を示すグラフである。
【図6】本発明の実施例に係る発酵飼料において豆腐粕の水分含量を変化させたときの、発酵飼料の単位質量あたりに含まれる乳酸菌の生菌数(生菌数濃度)の変化を示すグラフである。
【図7】本発明の実施例に係る発酵飼料の給与前、1ヶ月間給与後、および4ヶ月間給与後のそれぞれにおける牧場Aおよび牧場Bの泌乳牛の血液中に含まれる総蛋白質の濃度を示すグラフである。
【図8】本発明の実施例に係る発酵飼料の給与前、1ヶ月間給与後、および4ヶ月間給与後のそれぞれにおける牧場Aおよび牧場Bの泌乳牛の血中尿素態窒素(BUN)の濃度を示すグラフである。
【図9】本発明の実施例に係る発酵飼料の給与前、1ヶ月間給与後、および4ヶ月間給与後のそれぞれにおける牧場Aおよび牧場Bの泌乳牛の血液中に含まれるアルブミンの濃度を示すグラフである。
【図10】本発明の実施例に係る発酵飼料の給与前、1ヶ月間給与後、および4ヶ月間給与後のそれぞれにおける牧場Aおよび牧場Bの泌乳牛の血液中に含まれるグルタミン酸オキサロ酢酸トランスアミナーゼ(GOT)の活性値を示すグラフである。
【図11】本発明の実施例に係る発酵飼料の給与前、1ヶ月間給与後、および4ヶ月間給与後のそれぞれにおける牧場Aおよび牧場Bの泌乳牛の血液中に含まれるグルタミルトランスフェラーゼ(γ−GTP)の活性値を示すグラフである。
【図12】本発明の実施例に係る発酵飼料の給与前、1ヶ月間給与後、および4ヶ月間給与後のそれぞれにおける牧場Aおよび牧場Bの泌乳牛のふんの臭気強度(官能評価)を示すグラフである。
【図13】本発明の実施例に係る発酵飼料の給与前、1ヶ月間給与後、および4ヶ月間給与後のそれぞれにおける泌乳牛のふん中におけるLactobacillus属と推定される細菌(乳酸菌)の全細菌に占める割合を示すグラフである。
【図14】本発明の実施例および比較例に係る0週間発酵、1週間発酵、2週間発酵の発酵飼料の給与後および給与前におけるマウスの小腸パイエル板の平均面積を示すグラフである。
【図15】本発明の実施例および比較例に係る0週間発酵、1週間発酵、2週間発酵の発酵飼料の給与後および給与前におけるマウスの小腸パイエル板の総面積を示すグラフである。
【図16】本発明の実施例に係る2週間発酵、3週間発酵、4週間発酵の発酵飼料の給与後および給与前におけるマウスのIFN−γの血中濃度を示すグラフである。
【図17】本発明の実施例に係る2週間発酵、3週間発酵、4週間発酵の発酵飼料の給与後および給与前におけるマウスのTNF(腫瘍壊死因子)−γの血中濃度を示すグラフである。
【図18】本発明の実施例に係る2週間発酵、3週間発酵、4週間発酵の発酵飼料の給与後および給与前におけるマウスの小腸パイエル板の総面積を示すグラフである。
【図19】本発明の実施例に係る2週間発酵、3週間発酵、4週間発酵の発酵飼料の給与後および給与前におけるマウスのふん中の免疫グロブリンA(IgA)濃度を示すグラフである。
【図20】本発明の実施例に係る発酵飼料の給与前および1ヶ月給与後における牧場Cおよび牧場Dの泌乳牛のふん中の免疫グロブリンA濃度を示すグラフである。
【図21】本発明の実施例に係る発酵飼料の給与期間を含む約10ヶ月間およびその1年前のほぼ同時期における牧場Cの泌乳牛の乳中体細胞数の変化を示すグラフである。
【図22】本発明の実施例に係る発酵飼料の給与期間を含む約10ヶ月間およびその1年前のほぼ同時期における牧場Dの泌乳牛の乳中体細胞数の変化を示すグラフである。
【発明を実施するための形態】
【0022】
以下、本発明について詳細に説明する。
【0023】
本発明に係る発酵飼料は、水分を含有する食品残渣を含む原料を乳酸菌で発酵させて得られる発酵飼料であって、前記乳酸菌の生菌数濃度が飽和した状態となっている発酵飼料である。本発明に係る発酵飼料は、前記原料を乳酸菌と混合し、嫌気性条件下で発酵させる製造方法であって、前記原料の発酵を、乳酸菌の生菌数濃度が極大値となる時点以降まで継続する製造方法により、容易に製造できる。
【0024】
前記食品残渣としては、特に限定されるものではないが、糖質を豊富に含むために乳酸菌の増殖に適していることから、植物性の食品残渣が好ましい。前記植物性の食品残渣としては、植物性の食品製造副産物(食品を加工して加工食品を製造する過程で得られる副産物)、植物性の調理残渣、植物性の余剰食品などが挙げられる。前記食品製造副産物としては、豆腐粕、餡子粕(小豆餡粕など)、茶粕(緑茶粕、麦茶粕など)、ビール粕、焼酎粕、酒粕、醤油粕、ジュース粕、サトウキビ搾り粕(バガス)などの粕類;小麦ふすま、米糠、大麦糠などの槽糠類;パン屑、菓子屑、乾麺屑などの食品加工屑などが挙げられる。前記調理残渣としては、野菜屑、果物屑、パン屑などが挙げられる。前記余剰食品としては、売れ残りのパン、売れ残りの菓子、売れ残りの乾麺などが挙げられる。
【0025】
前記食品残渣は、粕類を含んでいることが好ましく、豆腐粕を含んでいることがより好ましい。豆腐粕は、豆腐製造工場から一定して大量に排出され、安価であり、かつ栄養価が高いので、豆腐粕を食品残渣として用いた場合、安価で、安定的な生産が可能で、かつ栄養価が高い発酵飼料を実現できる。また、本発明は、特に豆腐粕を含む飼料の保存性を改良して、取り扱いが容易な発酵飼料を実現できる。
【0026】
前記原料は、食品残渣として粕類のみを含んでいることがさらに好ましく、食品残渣として豆腐粕のみを含んでいることがより一層好ましい。本願出願人は、平成20年度(平成20年4月〜平成21年3月)に、豆腐粕を主原料とし、この主原料と野菜屑などの副原料とを混合したものを乳酸発酵して得られる乳酸発酵飼料を開発した。しかしながら、この乳酸発酵飼料は、小麦ふすまなどの槽糠類、野菜屑などのような、排出が一定せず、安価でない食品残渣が副原料として必要である。そのため、この乳酸発酵飼料は、安価でなく、安定的に生産することが難しく、また、飼料製造場所が副原料の集荷・保管がし易い場所に制約される。これに対し、本発明の好ましい形態に係る発酵飼料は、前述したように、小麦ふすまなどの槽糠類、野菜屑などの食品残渣を含まず、豆腐粕のみを食品残渣として含む原料を乳酸発酵して得られるものである。これにより、安価で、安定的な生産が可能で、かつ栄養価が高い発酵飼料を実現でき、また、飼料製造場所の制約を解消できる。
【0027】
また、前記原料は、豆腐粕を98質量%以上含むことが好ましい。これにより、原料を構成する豆腐粕以外の成分の使用量を削減できるので、安価な発酵飼料を実現できる。
【0028】
本発明の発酵飼料の製造方法では、前記食品残渣をそのまま原料として用いて発酵を行ってもよいが、前記食品残渣の水分含量を調整した後、前記原料の発酵を行うことがより好ましい。前記食品残渣の水分含量は、前記食品残渣の水分含量は、前記食品残渣が液状となるような比較的高い水分含量であってもよく、前記食品残渣が半固形状となるような比較的低い水分含量であってもよい。前記食品残渣の水分含量は、40質量%を超え50質量%以下となるように調整することがより好ましく、48質量%以上50質量%以下となるように調整することがさらに好ましい。発酵時の食品残渣の水分含量を40質量%超とすることで、発酵飼料中における乳酸菌の生菌数濃度を、例えば1×108.9cfu/g(cfuは、コロニー形成単位(colony forming unit)を表す)以上といった高い濃度にまで高めることができるので、発酵飼料の保存性をさらに向上させると共に、動物に給与されたときに動物の体調をさらに改善することができる。また、発酵時の食品残渣の水分含量を48質量%以上とすることで、発酵飼料中における乳酸菌の生菌数濃度を、例えば1×109cfu/g以上といった高い濃度にまで高めることができるので、発酵飼料の保存性をさらに向上させると共に、動物に給与されたときに動物の体調をさらに改善することができる。また、発酵時の食品残渣の水分含量を50質量%以下とすることで、発酵飼料の搬送コストを抑制することができる。なお、発酵時の食品残渣の水分含量が、50質量%を超える割合、例えば90質量%であっても、発酵飼料中における乳酸菌の生菌数濃度を、例えば1×109cfu/g以上といった高い濃度にまで高めることは可能である。
【0029】
前記食品残渣の水分含量を調整する方法としては、前記食品残渣を乾燥させた後、乾燥された前記食品残渣に水を加える方法(以下「加水法」と呼ぶ);目標の水分含量よりも低い水分含量を有する食品残渣に水を加える方法;前記食品残渣を乾燥させた後、乾燥された前記食品残渣と、目標の水分含量よりも高い水分含量を有する未乾燥の食品残渣とを混合する方法(以下「混合法」と呼ぶ);目標の水分含量よりも高い水分含量を有する食品残渣を乾燥させる乾燥処理を実施し、食品残渣が適当な水分含量になった時点で乾燥処理を止める方法(以下「乾燥法」と呼ぶ)などが挙げられる。前記食品残渣の水分含量を調整する方法は、発酵飼料の製造場所などに応じて適宜選択可能である。例えば、発酵飼料の製造場所が食品残渣の排出元から離れた場所である場合には、前記食品残渣の水分含量を調整する方法として加水法を選択するとよい。これにより、食品残渣の搬送コストを削減できる。これら方法のうち、加水法は、単に水を適量加えるだけで食品残渣の水分含量を容易に調整することができるので、生産性を向上させて効率的に発酵飼料を製造することができるという利点がある。また、乾燥法は、乾燥に係るコストを削減でき、省エネリサイクル技術を実現できるという利点がある。各方法における乾燥の方法としては、食品残渣を熱風で乾燥する方法(熱風乾燥)が好ましい。これにより、食品残渣を熱風で効率的に乾燥させて乾燥食品残渣を準備できるので、発酵飼料を効率的に製造することができる。
【0030】
前記原料、特に食品残渣として豆腐粕のみを含む原料は、糖類を含んでいることが好ましい。これにより、糖類が発酵補助剤として機能して食品残渣の発酵を促し、発酵飼料中における乳酸菌の生菌数濃度、水溶性β−1,3−グルカンの濃度、および乳酸の濃度を高めることができる。したがって、発酵飼料の保存性をさらに向上させると共に、動物に給与されたときに動物の体調をさらに改善することができる。前記糖類としては、グルコース(ブドウ糖)、フルクトース(果糖)などの単糖類、スクロース(ショ糖)などの二糖類;澱粉などの多糖類を用いることができる。前記糖類としては、安価であることから、グルコースが好ましい。
【0031】
前記原料中における糖類の含有量は、0.5質量%以上であることが好ましく、1質量%以上であることがより好ましく、2質量%以上であることがさらに好ましい。これにより、発酵飼料中における乳酸菌の生菌数濃度、水溶性β−1,3−グルカンの濃度、および乳酸の濃度をさらに高めることができるので、発酵飼料の保存性をさらに向上させると共に、動物に給与されたときに動物の体調をさらに改善することができる。また、前記原料中における糖類の含有量は、2質量%以下であることが好ましい。これにより、発酵飼料の製造コストを低く抑えることができる。
【0032】
前記乳酸菌としては、ラクトバチルス属(Lactobacillus)、ストレプトコッカス属(Staphylococcus)、ラクトコッカス属(Lactococcus)、ロイコノストック属(Leuconostoc)属、ビフィドバクテリウム属(Bifidobacterium)、エンテロコッカス属(Enterococcus)、ペディオコッカス属(Pediococcus)などを使用することができる。ラクトバチルス属としては、ラクトバチルス・プランタラム(Lactobacillus plantarum)、ラクトバチルス・カゼイ、ラクトバチルス・ヘルベティカス、ラクトバチルス・ブルガリカス、ラクトバチルス・ガッセリ、ラクトバチルス・アシドフィルス、ラクトバチルス・ラクチス、ラクトバチルス・サリバリウス、ラクトバチルス・ガリナルム(Lactobacillus gallinarum)、ラクトバチルス・アミロボラス、ラクトバチルス・ブレビス、ラクトバチルス・ファーメンタム、ラクトバチルス・マリ、ラクトバチルス・デルブルッキィ、ラクトバチルス・サンフランシスエンシス、ラクトバチルス・パネックス、ラクトバチルス・コモエンシス、ラクトバチルス・イタリカス、ラクトバチルス・ライキマニ、ラクトバチルス・カルバタス、ラクトバチルス・ヒルガルディ、ラクトバチルス・ルテリ、ラクトバチルス・パストリアヌス、ラクトバチルス・ブクネリ、ラクトバチルス・セロビオサス、ラクトバチルス・フルクティボランスなどを使用することができる。ストレプトコッカス属としては、ストレプトコッカス・サーモフィルス、ストレプトコッカス・ラクチス、ストレプトコッカス・ジアセチルラクチスなどを使用することができる。ラクトコッカス属としては、ラクトコッカス・ラクチス・ラクチス、ラクトコッカス・ラクチス・クレモリスなどを使用することができる。ロイコノストック属としては、ロイコノストック・メセンテロイデス・クレモリス、ロイコノストック・ラクチスなどを使用することができる。ビフィドバクテリウム属としては、ビフィドバクテリウム・ビフィダム、ビフィドバクテリウム・ロンガム、ビフィドバクテリウム・インファンティス、ビフィドバクテリウム・ブレーベ、ビフィドバクテリウム・アドレセンティス、ビフィドバクテリウム・アンギュラータム、ビフィドバクテリウム・カテニュラータム、ビフィドバクテリウム・シュードカテニュラータム、ビフィドバクテリウム・デンティウム、ビフィドバクテリウム・グロボズム、ビフィドバクテリウム・シュードロンガム、ビフィドバクテリウム・クニキュリ、ビフィドバクテリウム・コエリナム、ビフィドバクテリウム・アニマリス、ビフィドバクテリウム・サーモフィラム、ビフィドバクテリウム・ボウム、ビフィドバクテリウム・マグナム、ビフィドバクテリウム・アステロイデス、ビフィドバクテリウム・インディカム、ビフィドバクテリウム・ガリカム、ビフィドバクテリウム・ラクチス、ビフィドバクテリウム・イノピナータム、ビフィドバクテリウム・デンティコレンス、ビフィドバクテリウム・プローラム、ビフィドバクテリウム・スイス、ビフィドバクテリウム・ガリナラム、ビフィドバクテリウム・ルミナンティウム、ビフィドバクテリウム・メリシカム、ビフィドバクテリウム・サーキュラーレ、ビフィドバクテリウム・ミニマム、ビフィドバクテリウム・サブチル、ビフィドバクテリウム・コリネフォルメなどを使用することができる。エンテロコッカス属としては、エンテロコッカス・フェカリス、エンテロコッカス・フェシウム(Enterococcus faecium)、エンテロコッカス・サリバリウス、エンテロコッカス・ミティスなどを使用することができる。ペディオコッカス属としては、ペディオコッカス・アシディラクティシ、ペディオコッカス・ペントサセウスなどを使用することができる。
【0033】
前記乳酸菌としては、ラクトバチルス・プランタラムが、安価であり、また、牛に給与されたときに牛の体調を顕著に改善できるので、特に発酵飼料が牛用である場合に、好ましい。また、前記乳酸菌としては、複数種類の菌株を用いてもよく、単一種類の菌株を用いてもよいが、単一種類の菌株、特にラクトバチルス・プランタラムを用いることがより好ましい。前述した本願出願人が平成20年度(平成20年4月〜平成21年3月)に開発した乳酸発酵飼料では、有限会社岡山県ヘルスアンドセーフティ製の乳酸菌3種(ラクトバチルス・プランタラム、ラクトバチルス・ガリナルム、およびエンテロコッカス・フェシウム)混合液を購入したものを直接、原料に添加していた。これに対し、乳酸菌として、汎用の乳酸菌であるラクトバチルス・プランタラムを用いた場合、安価な発酵飼料を実現できる。
【0034】
前記原料に対して乳酸菌を添加する方法としては、特に限定されるものでなく、乳酸菌を予備発酵培養してスターター(飼料発酵種菌)を調製した後、スターターを原料に添加する方法、乳酸菌を直接原料に添加する方法などが挙げられるが、前者の方法が好ましい。スターターを用いる添加方法は、特に乳酸菌として単一種類の菌株のみを用いる場合に、発酵飼料中における乳酸菌の生菌数濃度をより高めることができる。したがって、乳酸菌として単一種類の乳酸菌のみを、スターターを用いる添加方法によって原料に添加した場合、安価で、かつ乳酸菌の生菌数濃度が高い発酵飼料を実現できる。予備発酵培養する際に用いる培地としては、例えばスキムミルク水溶液を好適に用いることができる。
【0035】
前記原料の発酵は、14〜28日間かけて行うことが好ましく、21〜28日間かけて行うことがより好ましく、約21日間かけて行うことが最も好ましい。発酵期間を14日間以上とすることにより、発酵飼料中における乳酸菌の総菌数の濃度がさらに高くなるので、発酵飼料中における水溶性β−1,3−グルカンの濃度がさらに高くなる。その結果、発酵飼料を動物に給与したときに、動物の免疫機能をさらに強化して、動物の体調をさらに改善することができる。また、発酵期間を28日間以下とすることにより、発酵飼料の製造を効率化することができると共に、カビの発生を防止することができる。
【0036】
前記原料の発酵を行う温度は、乳酸菌の種類などによって適宜選択すればよいが、20〜30℃の範囲内であることが好ましい。これにより、発酵飼料中における乳酸菌の生菌数濃度をさらに高めることができるので、発酵飼料の保存性をさらに向上させると共に、動物に給与されたときに動物の体調をさらに改善することができる。
【0037】
前記原料の発酵を嫌気性条件下で行う方法としては、特に限定されるものではないが、酸素を遮断可能な容器に前記原料を密封して発酵させる方法が簡便である。酸素を遮断可能な容器としては、各種高分子フィルムで構成された袋などを用いることができるが、酸素バリア性の高いフィルム、例えばナイロン・ポリエチレンフィルム(ナイロンフィルムとポリエチレンフィルムとを積層した積層フィルム)で構成された袋が好ましい。これにより、発酵飼料にカビが発生することを防止できる。
【0038】
本発明に係る発酵飼料は、水溶性β−1,3−グルカンを40pg/g以上の濃度で含むことが好ましい。これにより、前記発酵飼料は、動物に給与されたときに、動物の免疫系をさらに活性化することができ、例えば、腸管免疫グロブリンAの濃度を上昇させたり、腸管免疫グロブリンAの産生を担っている小腸上皮に存在するパウエル板の面積を増大させたりすることができる。その結果、動物の感染に対する抗炎症作用が強まり、例えば動物の血中IFN−γ濃度および血中TNF−α濃度が低下する。したがって、動物の体調が改善され、例えば乳牛の乳中体細胞数が減少する。
【0039】
また、本発明に係る発酵飼料は、乳酸を200mM以上の濃度で含むことが好ましい。これにより、前記発酵飼料は、腐敗菌の増殖をさらに抑制することができるので、飼料の保存性をさらに向上させることができる。
【0040】
また、本発明に係る発酵飼料は、乳酸菌の生菌数濃度が3×105cfu/g(=105.48cfu/g)以上であることが好ましい。これにより、発酵飼料の保存性をさらに向上させると共に、動物に給与されたときに動物の腸内環境をさらに改善することができる。
【0041】
また、本発明に係る発酵飼料は、水分を含む状態であってもよく、乾燥した状態であってもよい。本発明に係る発酵飼料を乾燥した状態とする場合には、発酵後に風乾などの方法によって乾燥すればよい。また、本発明に係る発酵飼料は、単独で動物に給与してもよく、他の飼料と混合して動物に給与してもよい。
【0042】
また、本発明の発酵飼料は、反芻動物である牛に対する給与およびマウスに対する給与において効果が確認されているが、豚、鶏などのような牛以外の種類の家畜、最近ストレスなどが問題になっている犬、猫、愛玩鳥などのペットなどの他の動物に給与した場合にも、同様の効果が期待できる。
【実施例】
【0043】
以下、実施例および比較例に基づいて本発明をより詳細に説明するが、本発明はこれらに限定されるものではない。なお、以下の説明中および図面中において、「%」は質量%を表し、「部」は質量部を表す。
【0044】
〔スターターの調製例1〕
市販のスキムミルク粉末を10%水溶液としたもの100部をオートクレーブ滅菌(高圧蒸気滅菌)し、滅菌後のスキムミルクに実験用LBS培地を2部加えて混合し、液体培地とした。この液体培地に乳酸菌ラクトバチルス・プランタラムを植菌し、24℃で48時間培養した。これにより、液体培地1gあたりに含まれる乳酸菌の生菌数(生菌数濃度)は、コロニーカウント法(MRS寒天培地を使用)による測定値が1×109cfu/g以上(約1.3×109cfu/g)となった。以下の実施例および比較例では、この培養後の液体培地を発酵飼料用スターターとして使用する。
【0045】
〔スターターの調製例2〕
豆腐製造工場で豆乳から豆腐を作る際に排出された液(豆腐ホエー)100部をオートクレーブ滅菌し、実験用LBS培地を2部加えて混合し、液体培地とした。この液体培地に乳酸菌ラクトバチルス・プランタラムを植菌し、24℃で48時間培養した。これにより、液体培地1gあたりに含まれる乳酸菌の生菌数(生菌数濃度)は、コロニーカウント法(MRS寒天培地を使用)による測定値が1×109cfu/g以上(約1.2×109cfu/g)となった。この培養後の液体培地も、発酵飼料用スターターとして使用することができる。
【0046】
〔実施例1〕
まず、豆腐製造工場から排出された豆腐粕(食品残渣)を熱風乾燥機で熱風乾燥し、乾燥豆腐粕を得た。乾燥豆腐粕の水分含量を定法に基づき測定した。すなわち、乾燥豆腐粕を容器中で135℃で2時間かけて乾燥した前後の重量を精密天秤で秤量し、これらの重量から乾燥豆腐粕の水分含量を算出した。その結果、乾燥豆腐粕の水分含量は約12%であった。次に、乾燥豆腐粕に対し、水道水を加えることによって豆腐粕の水分含量を50%に調整した。水分含量の調整は、以下のようにして行った。まず、乾燥豆腐粕と水道水との混合比を幾つか試し、乾燥豆腐粕の水分含量を測定したのと同様の方法によって混合後の豆腐粕の水分含量を測定し、測定結果に基づいて豆腐粕の水分含量が50%になる場合の混合比を決定した。この例では、豆腐粕の水分含量が50%になる乾燥豆腐粕と水道水の混合比(質量比)は、4:3に決定された。そして、乾燥豆腐粕(水分含量約12%)粉末と水道水とを4:3の混合比で混合することによって、豆腐粕の水分含量を50%に調整した。なお、この方法は、水分含量を毎回実測しないので、気温・湿度・調製作業時間などによって、水分含量に若干の誤差が生じる可能性があるが、実用上は問題ないものと考えられる。
【0047】
次に、水分含量が50%に調整された豆腐粕100部に対し、グルコース2部と、「スターターの調製例1」で得られた発酵飼料用スターター1部とを添加して、ナイロン・ポリエチレンフィルムで構成された袋中に密封し、24℃で3日間かけて発酵させた。これにより、発酵飼料が得られた。発酵飼料1gあたりに含まれる乳酸菌の生菌数(生菌数濃度)は、コロニーカウント法(MRS寒天培地を使用)による測定値が1×109cfu/g以上であった。
【0048】
なお、実施例1では、豆腐製造工場から排出された豆腐粕を乾燥させて乾燥豆腐粕を得た後、乾燥豆腐粕に水を添加する方法で豆腐粕の水分含量の調整を行っていた。
【0049】
しかしながら、豆腐製造工場から排出された豆腐粕を攪拌しながら135℃で乾燥させる乾燥工程を適当な水分含量になった時点で止める方法(乾燥法)で豆腐粕の水分含量を50%に調整しても、実施例1と同様の乳酸菌の生菌数濃度を実現することができた。この場合、まず、乾燥中の豆腐粕の水分含量を経時的に測定して、豆腐粕の水分含量が50%になる乾燥時間を決定した。豆腐粕の水分含量の経時的な測定は、乾燥豆腐粕の水分含量を測定したのと同様の方法によって行った。この例では、豆腐粕の水分含量が50%になる乾燥時間は、約5時間に決定された。そこで、豆腐製造工場から排出された豆腐粕を攪拌しながら135℃で約5時間乾燥する方法によって、豆腐粕の水分含量を50%に調整した。なお、この方法も、水分含量を毎回実測しないので、気温・湿度・調製作業時間などによって水分含量に若干の誤差が生じる可能性があるが、実用上は問題ないものと考えられる。
【0050】
また、乾燥豆腐粕と豆腐製造工場で排出された豆腐粕とを混合する方法(混合法)で豆腐粕の水分含量を50%に調整しても、実施例1と同様の乳酸菌の生菌数濃度を実現することができた。
【0051】
〔実施例2〕
グルコースの添加量を、水分調整後の豆腐粕100部に対して0.5部および1部にそれぞれ変更する以外は、実施例1と同様にして発酵飼料を調製した。
【0052】
〔実施例3〕
グルコースを添加しないことを除いて実施例1と同様にして発酵飼料を調製した。
【0053】
実施例1〜3で得られた発酵飼料1gあたりに含まれる乳酸菌の生菌数(生菌数濃度)をコロニーカウント法(MRS寒天培地を使用)によって測定した。測定結果を図1にまとめて示す。図1において、各プロットは複数回の測定値の平均値を示し、エラーバーは平均値±標準偏差の範囲を示す。
【0054】
図1から分かるように、グルコースの添加量を水分調整後の豆腐粕100部に対して0〜2部の間で変化させた場合、グルコースの添加量の増加に比例して発酵飼料1gあたりに含まれる乳酸菌の生菌数(生菌数濃度)が高くなった。なお、グルコースの添加量を水分調整後の豆腐粕100部に対して最大2部とした(原料中における豆腐粕の含有率を98%以下とした)のは、発酵飼料の製造コストを低く抑えるためである。
【0055】
〔実施例4〕
発酵期間(発酵日数)を2日間に変更する以外は実施例1と同様にして発酵飼料を調製した。
【0056】
〔実施例5〕
発酵期間を5日間に変更する以外は実施例1と同様にして発酵飼料を調製した。
【0057】
〔実施例6〕
発酵期間を7日間(1週間)に変更する以外は実施例1と同様にして発酵飼料を調製した。
【0058】
〔実施例7〕
発酵期間を10日間に変更する以外は実施例1と同様にして発酵飼料を調製した。
【0059】
〔実施例8〕
発酵期間を14日間(2週間)に変更する以外は実施例1と同様にして発酵飼料を調製した。
【0060】
〔実施例9〕
発酵期間を21日間(3週間)に変更する以外は実施例1と同様にして発酵飼料を調製した。実施例1と比較して、発酵期間を延長したことで、乳酸菌の生菌・死菌を合わせた総菌数が高まり、生理活性のある水溶性β−1,3−グルカンを多量に含む発酵飼料が得られた。
【0061】
〔比較例1〕
発酵期間を1日間に変更する以外は実施例1と同様にして、比較用の発酵飼料を調製した。
【0062】
〔比較例2〕
発酵期間を0日間に変更する以外は実施例1と同様にして、比較用の発酵飼料を調製した。
【0063】
実施例9(発酵期間21日間)で得られた発酵飼料を、37℃で60分間かけて蒸留水により抽出し、ビージースター(登録商標)Aキット(和光純薬工業株式会社製)により発酵飼料中の水溶性β−1,3−グルカンの濃度を測定した。その結果、実施例9で得られた発酵飼料中における水溶性β−1,3−グルカンの濃度は、40〜100pg/gであった。発酵前の豆腐粕中における水溶性β−1,3−グルカンの濃度を同様の方法で測定したところ、水溶性β−1,3−グルカンは検出されなかった。
【0064】
また、実施例1、実施例4〜9、比較例1、および比較例2で得られた発酵飼料のpHを、pHメーターによって測定した。測定結果を図2にまとめて示す。図2において、各プロットは複数回の測定値の平均値を示し、エラーバーは平均値±標準偏差の範囲を示す。図2から分かるように、発酵期間が3日以上である場合、発酵飼料のpHは4.0まで低下した。
【0065】
また、汚染の指標として実施例1、実施例4〜8、比較例1、および比較例2で得られた発酵飼料中の大腸菌群数(汚染の指標)を、コロニーカウント法(MRS寒天培地を使用)により測定した。大腸菌群数の測定結果を図3にまとめて示す。図3において、縦軸は対数目盛であり、各プロットは複数回の測定値の平均値を示し、エラーバーは平均値±標準偏差の範囲を示す。図3から分かるように、発酵期間が5日以上の場合に、発酵飼料中から大腸菌群が検出されなくなり、汚染のない発酵飼料が得られることが確認された。
【0066】
また、実施例1、実施例5〜8、比較例1、および比較例2で得られた発酵飼料中の乳酸(有機酸)濃度および酢酸(有機酸)濃度を高速液体クロマトグラフィーによって測定した。乳酸および酢酸の濃度の測定結果を図4にまとめて示す。図4において、各プロットは複数回の測定値の平均値を示し、エラーバーは平均値±標準偏差の範囲を示す。図4から分かるように、発酵期間が3日以上である場合、発酵飼料中の乳酸の濃度は200mM以上となった。
【0067】
〔実施例10〕
発酵期間を28日間(4週間)に変更する以外は実施例1と同様にして発酵飼料を調製した。
【0068】
〔実施例11〕
水道水の添加による豆腐粕の水分調整を水分含量が40%となるように行う以外は、実施例1、実施例4〜9、および比較例1と同様にして発酵飼料を調製した。
【0069】
〔比較例3〕
水道水の添加による豆腐粕の水分調整を水分含量が40%となるように行う以外は、比較例2と同様にして発酵飼料を調製した。
【0070】
実施例1、実施例4〜11、および比較例1〜3で得られた発酵飼料1gあたりに含まれる乳酸菌の生菌数(生菌数濃度)を、MRS培地を寒天培地を用いたコロニーカウント法(MRS寒天培地を使用)によって測定した。測定結果を表1および図5にまとめて示す。図5において、縦軸は対数目盛であり、各プロットは複数回の測定値の平均値を示し、エラーバーは平均値±標準偏差の範囲を示す。
【0071】
【表1】

【0072】
表1および図5から分かるように、豆腐粕の水分含量が50%である場合(実施例1、実施例4〜10、比較例1、および比較例2)、発酵飼料1gあたりに含まれる乳酸菌の生菌数(生菌数濃度)は、発酵開始から2日後に極大値に到達して、飽和状態となった。また、表1および図5から分かるように、豆腐粕の水分含量が50%である場合(実施例1、実施例4〜10、比較例1、および比較例2)、約1×109cfu/g以上の生菌数濃度を、発酵開始から2日後から発酵開始から7日後まで維持することができた。
【0073】
また、表1および図5から分かるように、豆腐粕の水分含量が40%である場合(実施例11および比較例3)、発酵飼料1gあたりに含まれる乳酸菌の生菌数(生菌数濃度)は、発酵開始から1日後に極大値に到達して、飽和状態となった。
【0074】
また、表1および図5から分かるように、豆腐粕に糖類(この例ではグルコース)を添加しただけで、豆腐粕の水分含量が40%である場合(実施例11)にも、乳酸菌を高濃度に増殖させることが可能であった。しかしながら、豆腐粕の水分含量が40%である場合(実施例11)、豆腐粕の水分含量が50%である場合(実施例1および実施例4〜10)と比較すると、発酵飼料1gあたりに含まれる乳酸菌の生菌数(生菌数濃度)がやや低くなった。
【0075】
〔実施例12〕
乾燥豆腐粕に対して蒸留水を添加して、豆腐粕の水分含量が30%、35%、40%、45%、48%、および50%のそれぞれとなるように水分調整を行う以外は、実施例1と同様にして発酵飼料を調製した。
【0076】
実施例12で得られた発酵飼料1gあたりに含まれる乳酸菌の生菌数(生菌数濃度)を測定した。測定結果を表2および図6にまとめて示す。また、豆腐粕の水分含量が20%の場合については、乳酸菌の生菌数濃度は、実測していないが、表2に示すように105cfu/g以下になるものと推定される。図6では、豆腐粕の水分含量が20%の場合に乳酸菌の生菌数濃度が104cfu/gになるものと仮定して、豆腐粕の水分含量が20%の場合をプロットしている。図6において、縦軸は対数目盛であり、各カラムは、複数回の測定値の平均値を示し、エラーバーは、平均値から平均値+標準偏差までの範囲を示す。
【0077】
【表2】

【0078】
〔安全性試験〕
実施例6の発酵飼料(発酵期間1週間)および実施例9の発酵飼料(発酵期間3週間)を28℃で3ヶ月保存したところ、カビは目視によって検出されなかった。
【0079】
また、実施例6の発酵飼料および実施例9の発酵飼料について、アフラトキシンB1の測定を60日間にわたって行ったところ、60日間経過後もアフラトキシンB1が検出されなかった。したがって、実施例6の発酵飼料および実施例9の発酵飼料は、有害なカビ毒を生成しないことが確認された。
【0080】
また、実施例6の発酵飼料を鶏ヒナに給与して、飼料安全法で規定された鶏ヒナ安全性試験を行ったところ、鶏ヒナは正常な発育を示した。したがって、実施例1の発酵飼料は、飼料安全法上の安全性基準をクリアし、順調に鶏ヒナの生育を支持する安全な飼料であることが確認された。
【0081】
また、実施例6の発酵飼料および実施例9の発酵飼料を泌乳牛3頭に1日1kg、3週間給与する小規模投与試験を行い、泌乳牛の血液生化学検査および乳質検査を行った。その結果、発酵飼料が給与された泌乳牛3頭と、通常の飼料が給与された対照区の3頭との間で、血液生化学検査および乳質検査の結果に差異が見られなかった。したがって、実施例6の発酵飼料および実施例9の発酵飼料が、泌乳牛の肝機能、生理作用、乳生産性などに悪影響を与えない安全な飼料であることが確認された。
【0082】
〔乳牛への給与実証1〕
酪農家2戸の牧場A(30頭)および牧場B(20頭)で、泌乳牛(泌乳中の乳牛)に対して、各牧場で通常使用されている通常の飼料に加えて、実施例1および実施例4〜6で得られた2〜7日間発酵させた発酵飼料を4ヶ月間給与し、泌乳牛の乳質、血液成分、ふん臭気、およびふん中細菌などに及ぼす影響を検討した。発酵飼料は、通常の飼料の給与量に関わらず、泌乳牛1頭につき1日あたり1kg給与した。
【0083】
なお、牧場Aで通常使用されている通常の飼料は、乾草(イタリアンライグラス、オーツ)9〜10kg、ふすま1kg、配合ペレット飼料10kg、およびビタミンA・D・E剤(処方量)で構成されており、その給与量は泌乳牛の乳量に応じて配合ペレット飼料が増減される。また、牧場Bで通常使用されている通常の飼料は、乾草(イタリアンライグラス、オーツ)8kg、ヘイキューブ3kg、および自家配合乾燥飼料(ふすま、大麦、トウモロコシ、脱脂大豆、圧ペン大豆、綿実粕、炭酸カルシウム、塩等)15kgで構成されており、その給与量は泌乳牛の乳量に応じて自家配合乾燥飼料が増減される。
【0084】
発酵飼料給与前後の泌乳牛について乳質検査を行った。具体的には、発酵飼料の4ヶ月間給与の前後における牧場Aの泌乳牛30頭および牧場Bの泌乳牛20頭から搾乳した生乳の合乳(バルクーラー貯蔵乳)について、乳脂肪、乳タンパク質、無脂乳固形分などの成分の濃度と、乳牛が飼料から摂取したエネルギーと蛋白質とのバランスを示す指標である乳中尿素態窒素(MUN)の濃度とを測定した。その結果、乳脂肪、乳タンパク質、無脂乳固形分などの成分の濃度には、問題がみられなかった。また、乳中尿素態窒素(MUN)の濃度は、正常値を維持できた。したがって、実施例1および実施例4〜6の発酵飼料は、乳牛が摂取するエネルギーと蛋白質とのバランスに問題がないことが分かった。
【0085】
また、発酵飼料給与前後の泌乳牛について血液生化学検査を行った。
【0086】
具体的には、発酵飼料を給与する前および発酵飼料を1ヶ月間または4ヶ月間給与した後における牧場Aおよび牧場Bの泌乳牛群の中の8〜10頭ずつから血液を採取し、血液中における総蛋白質、血中尿素態窒素(BUN)、およびアルブミンの濃度と、グルタミン酸オキサロ酢酸トランスアミナーゼ(GOT)およびグルタミルトランスフェラーゼ(γ−GTP)の活性値とを測定した。測定結果を図7〜11に示す。図7〜11において、各カラムは、8〜10頭の泌乳牛の平均値を示し、エラーバーは、平均値から平均値+標準偏差までの範囲を示す。また、図7〜11において、網掛けの範囲は、縦軸の数値の適正範囲(一般に適正値とされる値の範囲)を示し、「*」は、発酵飼料を給与する前の濃度に対して有意に高い濃度となった場合(スチューデントのt検定(student t-test)において有意確率pがp<0.05である場合)を示している。
【0087】
発酵飼料の給与に従って、泌乳牛の蛋白質の摂取量を反映する血液中の総蛋白質、血中尿素態窒素(BUN)、およびアルブミンの濃度が上昇した(図7〜9参照)。特に、泌乳牛の血液中における血中尿素態窒素(BUN)およびアルブミンの濃度は、発酵飼料の給与前には適正範囲の下限値よりやや低かったが、発酵飼料の給与後には適正範囲に収まった(図8および図9参照)。このことから、実施例1および実施例4〜6の発酵飼料が、高蛋白質を効率よく乳牛に摂取させられる良質な飼料であることが確認された。また、肝機能の指標(肝機能が悪化すると上昇する)となる酵素GOTおよびγ-GTPの活性値は、4ヶ月間の試験期間を通して適正範囲内であった(図10および図11参照)。したがって、大量の乳酸菌を含む発酵飼料を給与したことによる肝臓の負担はみられず、4ヶ月間の試験期間を通して代謝を正常に維持できたことが確認された。
【0088】
また、発酵飼料を給与する前および発酵飼料を1ヶ月間または4ヶ月間給与した後における牧場Aおよび牧場Bの泌乳牛群の中の8〜10頭ずつから採取した血液中における総コレステロール、グルコース、遊離脂肪酸、カルシウム、およびリンの濃度を測定した。その結果、泌乳牛の血液中における総コレステロール、グルコース、遊離脂肪酸、カルシウム、リンの濃度は、4ヶ月間にわたって正常値に維持されていた。
【0089】
また、発酵飼料給与前後の泌乳牛についてふん臭気の官能検査を行った。具体的には、発酵飼料を給与する前および発酵飼料を1ヶ月間または4ヶ月間給与した後における牧場Aおよび牧場Bの泌乳牛群の中の8〜10頭ずつからふんを採取し、ふんの臭気強度を1〜5の5段階評価の官能試験によって測定した。測定結果を図12に示す。図12において、各カラムは、8〜10頭の泌乳牛の平均値を示し、エラーバーは、平均値から平均値+標準偏差までの範囲を示す。また、図12において、「*」は、発酵飼料を給与する前の濃度に対して有意に高い濃度となった場合(スチューデントのt検定において有意確率pがp<0.05である場合)を示している。図12から分かるように、これまで発酵飼料を給与していなかった牧場Aでは、泌乳牛のふん臭気が、発酵飼料の給与に従って減少し、4ヶ月給与後に給与前と比較して有意に低い値となった。したがって、実施例1および実施例4〜6の発酵飼料を泌乳牛に給与することによって、泌乳牛の腸内環境を改善して泌乳牛のふん臭気を改善できることが分かった。
【0090】
また、発酵飼料給与前後の泌乳牛について、ふん中の全細菌に占める乳酸菌の割合を求めた。具体的には、発酵飼料を給与する前および発酵飼料を1ヶ月間または4ヶ月間給与した後における牧場Aの泌乳牛群の中の8〜10頭から採取したふんについて、末端制限酵素断片長多型(t−RFLP;terminal Restriction Fragment Length Polymorphism)解析によって、ふん中における細菌の種類別存在比を求めた。発酵飼料を給与する前および発酵飼料を1ヶ月間または4ヶ月間給与した後における泌乳牛のふん中におけるLactobacillus属と推定される細菌の全細菌に占める割合を図13に示す。図13において、各カラムは、8〜10頭の泌乳牛の平均値を示し、エラーバーは、平均値から平均値+標準偏差までの範囲を示す。図13から分かるように、ふん中におけるLactobacillus属と推定される細菌の全細菌に占める割合が、発酵飼料の給与に従って増加する傾向がみられた。
【0091】
〔マウスへの給与試験1〕
実施例6、実施例8、および比較例2に従い、豆腐粕を含む原料を、0週間、1週間、および2週間発酵させて発酵飼料を調製し、発酵飼料を風乾した。マウスの通常飼料100部に各発酵飼料2部を添加した飼料を、2週間、マウス5匹に給与してマウス5匹を飼育した。なお、マウスの通常飼料としては、繁殖用、育成用、生体維持用などの用途に応じて、それぞれ必要な栄養成分を強化した配合飼料を使用した。マウスの通常飼料としては、一例として、生体維持用の配合飼料「AIN−93」を用いた。配合飼料「AIN−93」は、カゼイン14.0%、L−シスチン0.18%、コーンスターチ46.57%、α−コーンスターチ15.5%、スクロース10.0%、大豆油4.0%、セルロースパウダー5.0%、AIN−93Mミネラル混合3.5%、AIN−93ビタミン混合1.0%、および重酒石酸コリン0.25%で構成されている。
【0092】
発酵飼料の給与後、大腸菌から抽出したリポ多糖(LPS)をマウスに皮下注射して全身性の炎症を誘発させる処置を実施し、マウスの小腸をサンプリングして、マウスの感染や炎症に対する抵抗力(免疫力)を観察した。すなわち、マウスの免疫力の指標として、腸管免疫グログリン(IgA)産生を担っている小腸上皮に存在するパイエル板の状態(面積)の測定(組織学的検査)を行った。発酵飼料を給与する前、実施例6の発酵飼料(1週間発酵)を給与した後、実施例8の発酵飼料(2週間発酵)を給与した後、および比較例2の発酵飼料(未発酵)を給与した後におけるマウスの小腸パイエル板の平均面積(全小腸パイエル板の面積の平均)および総面積(全小腸パイエル板の面積の合計)を図14および図15に示す。図14および図15において、エラーバーは、平均値から平均値+標準偏差までの範囲を示し、「*」は、発酵飼料を給与する前の濃度(対照)に対して有意に大きい面積となった場合(スチューデントのt検定において有意確率pがp<0.05である場合)を示している。図14および図15から分かるように、発酵が進んだ発酵飼料を食べたマウスほど、小腸パイエル板の平均面積が増加し、小腸パイエル板の総面積も増加した。このことから、マウスは、実施例6および8の発酵飼料を食べたことにより、免疫機能が活性化され、リンパ組織の発達が起こったことが示唆された。
【0093】
〔マウスへの給与試験2〕
発酵飼料の発酵期間を変更することにより、さらに強い免疫増強効果が得られるかを検証した。すなわち、実施例8〜10に従って発酵期間がそれぞれ2週間、3週間、および4週間である発酵飼料の風乾物2部を調製し、「マウスへの給与試験1」と同様にして、マウスの通常飼料100部に添加して、2週間、マウス5匹に給与し、血液生化学検査、組織学的検査、およびふん便検査を行った。
【0094】
血液生化学検査では、発酵飼料を給与する前、実施例8の発酵飼料(2週間発酵)を給与した後、実施例9の発酵飼料(3週間発酵)を給与した後、および実施例10の発酵飼料(4週間発酵)を給与した後におけるマウスのIFN−γの血中濃度を測定した。測定結果を図16に示す。図16において、各カラムは、5匹のマウスの平均値を示し、エラーバーは、平均値から平均値+標準偏差までの範囲を示す。また、図16において、「*」は、発酵飼料を給与する前の濃度に対して有意に高い濃度となった場合(スチューデントのt検定において有意確率pがp<0.05である場合)を示している。マウスの血中のIFN-γ濃度は、2週間発酵の発酵飼料または4週間発酵の発酵飼料を給与した場合に、有意に低下した。したがって、実施例8および10の発酵飼料の給与により、マウスの感染に対する抵抗力(免疫力)が高まったことが示唆された。
【0095】
血液生化学検査においては、さらに、免疫機能に関係している血中の炎症性サイトカインであるマウスのTNF−αの血中濃度を測定した。すなわち、発酵飼料を給与する前におけるマウスのTNF−αの血中濃度(対照)と、実施例8の発酵飼料(2週間発酵)の風乾物を給与した後、実施例9の発酵飼料(3週間発酵)の風乾物を給与した後、および実施例10の発酵飼料(4週間発酵)の風乾物を給与した後におけるマウスのTNF−αの血中濃度とを測定した。測定結果を図17に示す。図17において、各カラムは、5匹のマウスの平均値を示し、エラーバーは、平均値から平均値+標準偏差までの範囲を示す。マウスのTNF-αの血中濃度は、2〜4週間発酵の発酵飼料間で比較すると、発酵が進んだものほど低い値を示す傾向がみられた(2週間発酵の発酵飼料を用いた場合と3週間発酵の発酵飼料を用いた場合との間でのスチューデントのt検定において、有意確率pが0.09であった)。したがって、発酵が進んだ発酵飼料を給与した場合ほど、抗炎症作用が強くなり、マウスの免疫機能が強化されることが示唆された。
【0096】
組織学的検査では、発酵飼料を給与する前におけるマウスの小腸パイエル板の総面積(対照)と、実施例8の発酵飼料(2週間発酵)を給与した後、実施例9の発酵飼料(3週間発酵)を給与した後、および実施例10の発酵飼料(4週間発酵)を給与した後におけるマウスの小腸パイエル板の総面積とを測定した。測定結果を図18に示す。図18から分かるように、マウスの小腸上皮のパイエル板は、発酵の進んだ発酵飼料が給与された場合ほど、総面積が大きくなり、パイエル板が発達する傾向がみられた。したがって、発酵が進んだ発酵飼料を給与した場合ほど、マウスの免疫機能が強化されることが示唆された。
【0097】
ふん便検査では、発酵飼料を給与する前におけるマウスのふん中の免疫グロブリンA濃度(対照)と、実施例8の発酵飼料(2週間発酵)を給与した後、実施例9の発酵飼料(3週間発酵)を給与した後、および実施例10の発酵飼料(4週間発酵)を給与した後におけるマウスのふん中の免疫グロブリンA濃度とを測定した。測定結果を図19に示す。図19において、各カラムは、5匹のマウスの平均値を示し、エラーバーは、平均値から平均値+標準偏差までの範囲を示す。図19から分かるように、マウスのふん中の免疫グロブリンA濃度は、3週間発酵の発酵飼料の給与によって給与前と比較して有意に高くなった。したがって、3週間発酵の発酵飼料の給与により、マウスの腸管の免疫細胞が活性化されたことが示唆された。
【0098】
これらの試験結果と、豆腐工場での保管のためのスペース確保にかかるコストと、カビ防除(次項参照)とを考慮すれば、豆腐粕を含む原料の発酵期間は、3週間であることが最も好ましいと考えられる。
【0099】
〔発酵飼料保存用袋の選定〕
実施例の発酵飼料をポリエチレン(PE)製の袋に封入したところ、夏季に調製した発酵飼料は、発酵期間が約2週間に達した時点から袋の口付近にカビが発生した。袋の中に脱酸素剤(エージレス(登録商標))を同封しても改善しなかった。
【0100】
次に、酸素の通りにくいナイロン・ポリエチレン(NYPE)フィルムで構成された袋3つに実施例の発酵飼料を封入した後、28℃で保存したところ、4ヶ月保存後、3袋全てでカビは発生しなかった。同様に、PE製の袋3つに実施例の発酵飼料を封入した後、28℃で保存したところ、約2週間後に3袋中2袋で夏季に発生したのと同様のカビが発生した。これらの結果、発酵飼料保存用袋として、ナイロン・ポリエチレンフィルムで構成された袋が適していることが分かった。
【0101】
〔乳牛への給与実証2〕
3週間発酵させた発酵飼料について、乳牛への給与試験を行った。具体的には、「乳牛への給与実証1」における酪農家2戸とは異なる酪農家2戸の牧場Cおよび牧場Dで、8〜10頭ずつの泌乳牛に対して、各牧場で通常使用されている濃厚飼料に加えて、実施例9で得られた3週間発酵させた発酵飼料を約6ヶ月間(牧場C)または約3ヶ月間(牧場D)、給与した。発酵飼料は、濃厚飼料の給与量に関わらず、泌乳牛1頭につき1日あたり1kg給与した。発酵飼料の給与期間中は、通常給与している濃厚飼料の量を調整して、泌乳牛のエネルギー・粗蛋白質の摂取量が発酵飼料の給与前と変わらないようにした。なお、牧場Cで通常使用されている通常の飼料は、乾草(チモシー、オーツ、クレイングラス)7〜8kg、植物系濃厚飼料(ビートパルプおよびアルファルファ)5〜6kg、および配合ペレット飼料7〜13kgで構成されており、その給与量は泌乳牛の乳量に応じて増減される。また、牧場Dで通常使用されている通常の飼料は、乾草(イタリアンライグラス、オーツ、およびクレイングラス)7kg、アルファルファ1kg、配合ペレット飼料10〜18kg、および自家配合乾燥飼料(小麦ふすま、大麦、トウモロコシ、大豆、ミカンジュース粕、炭酸カルシウム、食塩、重曹、ナイアシン、およびビタミンA・D・E剤)3kgで構成されており、その給与量は泌乳牛の乳量に応じて増減される。
【0102】
免疫機能への影響の評価については、泌乳牛が発酵飼料を食べるとことにより小腸での免疫グログリン(IgA)産生が増加しているかどうかを判定するために、泌乳牛から排出されたふん中のIgAの含量と、牛の体調診断の一つである乳汁中の体細胞数(乳中体細胞数)とを調べた。
【0103】
すなわち、まず、発酵飼料の給与前および1ヶ月給与後における牧場Cおよび牧場Dの泌乳牛8〜10頭から排出されたふん中の免疫グロブリンA(IgA)濃度の測定(ふん便検査)を行った。測定結果を図20に示す。図20において、各カラムは、泌乳牛8〜10頭の平均値を示し、エラーバーは、平均値から平均値+標準偏差までの範囲を示す。また、図20において、「*」は、発酵飼料を給与する前の濃度に対して有意に高い濃度となった場合(スチューデントのt検定において有意確率pがp<0.05である場合)を示している。図20から分かるように、発酵飼料を泌乳牛に1ヶ月給与することで、泌乳牛のふん中の免疫グロブリンA(IgA)が、1つの牧場Dでは有意に増加し、もう1つの牧場Cでも増加する傾向が見られた。したがって、実施例9の発酵飼料が牛の免疫機能を強化できることが分かった。
【0104】
また、発酵飼料の給与を行っている期間を含む約10ヶ月間において、1ヶ月に3回の割合で定期的に、牧場Cおよび牧場Dの泌乳牛から搾乳された生乳(バルク乳)の乳中体細胞数の測定(乳汁検査)を行った。また、これら測定期間の1年前のほぼ同時期においても、1ヶ月に3回の割合で定期的に、牧場Cおよび牧場Dの泌乳牛から搾乳された生乳の乳中体細胞数を測定した。これらの測定結果を図21および図22に示す。図21から分かるように、1つの牧場Cでは、発酵飼料を約6ヶ月間給与し、給与開始後約1ヶ月で、泌乳牛の乳中体細胞数が減少した。また、この牧場Cでは、発酵飼料の約1ヵ月給与後に、泌乳牛の乳中体細胞数が、50〜70万/mlのレベルから30〜40万/mlのレベルに低下した。また、この牧場Cでは、発酵飼料の給与中は、泌乳牛の乳中体細胞数が30〜40万/mlのレベルまで低下した状態を、最も気温の低下する12〜1月を含めて維持することができた。また、牧場Dでは、発酵飼料を約3ヶ月間給与し、給与前後で泌乳牛の乳中体細胞数に有意な変化は見られなかったものの、発酵飼料の給与中は、前年にみられた冬季(12月)の泌乳牛の体調不良による乳中体細胞数の増加が起こらなかった。これらの結果から、実施例9の発酵飼料が牛の体調を改善できることが分かった。
【0105】
また、実施例9の発酵飼料を6ヶ月間にわたって泌乳牛に給与し、「乳牛への給与実証1」と同様にして血液生化学検査を行ったところ、給与期間中の6ヶ月間にわたって血液生化学検査の測定値は正常値に維持された。
【産業上の利用可能性】
【0106】
本発明は、現在大量に廃棄されている豆腐粕を初めとする種々の食品残渣を用いて飼料を製造することができるリサイクル技術であるので、豆腐製造業を初めとする食品産業に広く利用することができる。また、本発明の発酵飼料は、牛、豚、鶏などの家畜;犬、猫、愛玩鳥などのペットなどの動物用の飼料として利用できるので、畜産用飼料、ペット用飼料などの飼料を製造する飼料製造業に利用することができる。
【特許請求の範囲】
【請求項1】
水分を含有する食品残渣を含む原料を乳酸菌で発酵させて得られる発酵飼料であって、
前記乳酸菌の生菌数濃度が飽和した状態となっていることを特徴とする発酵飼料。
【請求項2】
請求項1記載の発酵飼料であって、
水溶性β−1,3−グルカンを40pg/g以上の濃度で含むことを特徴とする発酵飼料。
【請求項3】
請求項1または2に記載の発酵飼料であって、
乳酸を200mM以上の濃度で含むことを特徴とする発酵飼料。
【請求項4】
請求項1〜3のいずれか1項に記載の発酵飼料であって、
前記乳酸菌の生菌数濃度は、3×105cfu/g以上であることを特徴とする発酵飼料。
【請求項5】
請求項1〜4のいずれか1項に記載の発酵飼料であって、
前記食品残渣は、豆腐粕を含むことを特徴とする発酵飼料。
【請求項6】
水分を含有する食品残渣を含む原料を乳酸菌と混合し、嫌気性条件下で発酵させる発酵飼料の製造方法であって、
前記原料の発酵を、乳酸菌の生菌数濃度が極大値となる時点以降まで継続することを特徴とする発酵飼料の製造方法。
【請求項7】
請求項6記載の発酵飼料の製造方法であって、
前記食品残渣の水分含量を40質量%を超え50質量%以下となるように調整した後、前記原料の発酵を行うことを特徴とする発酵飼料の製造方法。
【請求項8】
請求項6または7に記載の発酵飼料の製造方法であって、
前記原料は、糖類をさらに含むことを特徴とする発酵飼料の製造方法。
【請求項9】
請求項6〜8のいずれか1項に記載の発酵飼料の製造方法であって、
前記原料の発酵を14〜28日間かけて行うことを特徴とする発酵飼料の製造方法。
【請求項10】
請求項6〜9のいずれか1項に記載の発酵飼料の製造方法であって、
前記食品残渣を含む原料を乳酸菌と混合する前に、前記食品残渣の水分含量を調整する工程を含み、
前記水分含量を調整する工程では、前記食品残渣を乾燥させた後、乾燥された前記食品残渣に水を加えることを特徴とする発酵飼料の製造方法。
【請求項11】
請求項6〜10のいずれか1項に記載の発酵飼料の製造方法であって、
前記食品残渣は、豆腐粕を含むことを特徴とする発酵飼料の製造方法。
【請求項1】
水分を含有する食品残渣を含む原料を乳酸菌で発酵させて得られる発酵飼料であって、
前記乳酸菌の生菌数濃度が飽和した状態となっていることを特徴とする発酵飼料。
【請求項2】
請求項1記載の発酵飼料であって、
水溶性β−1,3−グルカンを40pg/g以上の濃度で含むことを特徴とする発酵飼料。
【請求項3】
請求項1または2に記載の発酵飼料であって、
乳酸を200mM以上の濃度で含むことを特徴とする発酵飼料。
【請求項4】
請求項1〜3のいずれか1項に記載の発酵飼料であって、
前記乳酸菌の生菌数濃度は、3×105cfu/g以上であることを特徴とする発酵飼料。
【請求項5】
請求項1〜4のいずれか1項に記載の発酵飼料であって、
前記食品残渣は、豆腐粕を含むことを特徴とする発酵飼料。
【請求項6】
水分を含有する食品残渣を含む原料を乳酸菌と混合し、嫌気性条件下で発酵させる発酵飼料の製造方法であって、
前記原料の発酵を、乳酸菌の生菌数濃度が極大値となる時点以降まで継続することを特徴とする発酵飼料の製造方法。
【請求項7】
請求項6記載の発酵飼料の製造方法であって、
前記食品残渣の水分含量を40質量%を超え50質量%以下となるように調整した後、前記原料の発酵を行うことを特徴とする発酵飼料の製造方法。
【請求項8】
請求項6または7に記載の発酵飼料の製造方法であって、
前記原料は、糖類をさらに含むことを特徴とする発酵飼料の製造方法。
【請求項9】
請求項6〜8のいずれか1項に記載の発酵飼料の製造方法であって、
前記原料の発酵を14〜28日間かけて行うことを特徴とする発酵飼料の製造方法。
【請求項10】
請求項6〜9のいずれか1項に記載の発酵飼料の製造方法であって、
前記食品残渣を含む原料を乳酸菌と混合する前に、前記食品残渣の水分含量を調整する工程を含み、
前記水分含量を調整する工程では、前記食品残渣を乾燥させた後、乾燥された前記食品残渣に水を加えることを特徴とする発酵飼料の製造方法。
【請求項11】
請求項6〜10のいずれか1項に記載の発酵飼料の製造方法であって、
前記食品残渣は、豆腐粕を含むことを特徴とする発酵飼料の製造方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【図15】


【図16】


【図17】


【図18】


【図19】


【図20】


【図21】


【図22】


【公開番号】特開2012−228218(P2012−228218A)
【公開日】平成24年11月22日(2012.11.22)
【国際特許分類】
【出願番号】特願2011−99419(P2011−99419)
【出願日】平成23年4月27日(2011.4.27)
【出願人】(000205627)大阪府 (238)
【出願人】(301064231)株式会社向井食品 (2)
【Fターム(参考)】
【公開日】平成24年11月22日(2012.11.22)
【国際特許分類】
【出願日】平成23年4月27日(2011.4.27)
【出願人】(000205627)大阪府 (238)
【出願人】(301064231)株式会社向井食品 (2)
【Fターム(参考)】
[ Back to top ]

