白血病の検出方法及びそのための試薬
【課題】くすぶり型のATLをも容易に検出することができる、ATLの検出方法及びそのための試薬を提供すること並びにATL以外の白血病をも容易に検出することができる、白血病の検出方法及びそのための試薬を提供すること。
【解決手段】生体から分離した白血球細胞表面上のSF−25抗原を測定することを含む白血病の検出方法を提供した。
【効果】白血球細胞上のSF−25抗原を癌マーカーとして用いることにより、発症後のATLのみならず、くすぶり型のATLをも検出することができる。また、白血球細胞上のSF−25抗原を癌マーカーとして用いることにより、B細胞性慢性リンパ性白血病、急性リンパ性白血病及び急性骨髄性白血病のような、ATL以外の白血病をも検出することができる。
【解決手段】生体から分離した白血球細胞表面上のSF−25抗原を測定することを含む白血病の検出方法を提供した。
【効果】白血球細胞上のSF−25抗原を癌マーカーとして用いることにより、発症後のATLのみならず、くすぶり型のATLをも検出することができる。また、白血球細胞上のSF−25抗原を癌マーカーとして用いることにより、B細胞性慢性リンパ性白血病、急性リンパ性白血病及び急性骨髄性白血病のような、ATL以外の白血病をも検出することができる。
【発明の詳細な説明】
【0001】
【発明の属する技術分野】
本発明は、成人T細胞白血病、B細胞性慢性リンパ性白血病、急性リンパ性白血病又は急性骨髄性白血病等の白血病の検出方法及び臨床上発症していない白血病(例えば、くすぶり型成人T細胞白血病)の検出方法及びそのための試薬に関する。
【0002】
【従来の技術】
成人T細胞白血病(adult T−cell luekemia, 以下、「ATL」ということがある)は、ヒトT細胞白血病ウイルス−I(human T−cell leukemia virus−I, HTLV−I)により、T細胞が癌化する白血病であり、皮膚病変、肝脾腫大、リンパ節腫脹が高率で起きる。HTLV−Iに感染しても、発病する者は約2000人に1人と少なく、ほとんど全ての感染者(キャリア)は、ATLを発病することなく生涯を終える。しかし、一旦発病すれば、治療法はなく、ほとんどの患者は発病から1年以内に死亡する。従来、ATLの診断は、臨床症状並びに白血球の検鏡及び抗体検査等の結果を総合的に考慮して行われている。
【0003】
キャリアが発症する場合、「くすぶり型」(smoldering type)を経由して完全な発症に至る。くすぶり型では、癌化したT細胞は極僅かであり、T細胞のほとんどは正常であるため、この段階で治療を行えば、発症を防ぐことが可能である。したがって、くすぶり型を検出することができれば、ATLの発症を防止することができ、医療上、極めて有利である。
【0004】
【発明が解決しようとする課題】
しかしながら、くすぶり型では、未だ臨床的には発症していないので、臨床症状に基づく診断はもちろんできない。また、抗体検査では、キャリアか否かは区別できるが、キャリアとくすぶり型の区別はできない。さらに、くすぶり型では、ほとんどのT細胞は正常細胞であり、癌化しているのは極少数であるから、検鏡によって癌化した極少数のT細胞を見つけ出すことはなかなか困難である。このように、くすぶり型を容易に検出できる診断方法は現在までに知られていない。
【0005】
したがって、本発明の目的は、くすぶり型のATLをも容易に検出することができる、ATLの検出方法及びそのための試薬を提供することである。さらにまた、本発明の目的は、ATL以外の白血病をも容易に検出することができる、白血病の検出方法及びそのための試薬を提供することである。
【0006】
【課題を解決するための手段】
本願発明者は、鋭意研究の結果、白血球細胞上のSF−25抗原を癌マーカーとして用いることにより、発症後のATLのみならず、くすぶり型のATLをも検出することができることを見出し、本発明を完成した。また、本願発明者らは、白血球細胞上のSF−25抗原を癌マーカーとして用いることにより、B細胞性慢性リンパ性白血病、急性リンパ性白血病及び急性骨髄性白血病のような、ATL以外の白血病をも検出することができることを見出し、本発明を完成した。
【0007】
すなわち、本発明は、生体から分離した白血球細胞表面上のSF−25抗原を測定することを含む白血病の検出方法を提供する。また、本発明は、SF−25抗原と抗原抗体反応する抗体又はその抗原結合性断片を含む、白血病診断用試薬を提供する。
【0008】
【発明の実施の形態】
上記の通り、本発明の白血病の検出方法は、生体から分離した白血球細胞表面上のSF−25抗原を測定することを含む。SF−25抗原は、1987年に発見された分子量約125 kDaの公知の糖タンパク抗原である(WO89/05307, 欧州特許第0 397 700号、米国特許第5,212,085号、Takahashi H, Wilson B, Ozturk M, Motte P, Strauss W, Isselbacher KJ and Wands JR. In vivo localization of colon adenocarcinoma by monoclonal antibody binding to a highly expressed cell surface antigen. Cancer Research 1988; 48: 6573−6579. 、Wilson B, Ozturk M, Takahashi H, Motte P, Kew M, Isselbacher KJ and Wands JR. Cell surface changes associated with transformation of human hepatocytes to the malignant phenotype. Proc. Natl. Acad. Sci. USA 1988; 85: 3140−3144.、TakahashiH, Carlson R, Ozturk M, Sun S, Motte P, Strauss W, Isselbacher KJ and Wands JR, Shouval D. Radioimmunolocalization of hepatic and pulmonary metastasis of human colon adenocarcinoma. Gastroenterology 1989; 96: 1317−1329.、Hurwitz E, Stancovski I, Wilcheck M, Shouval D, Takahashi H, WandsJR, Sela M. A conjugate of 5−Fluorourodine−poly(L−lysine) and an antibody reactive with human colon carcinoma. Bioconjugate Chemistry 1990; 1: 285−290.、Wands JR, Takahashi H. Studies on cell surface changes associated with transformation of human hepatocytes to the malignant phenotype and their role as potential immunotargeting sites. In Frontiers of Mucosal Immunology. Volume 2. Eds by Tsuchiya M. 1991 pp. 295−298. Hurwitz E,Adler R, Shouval D, Takahashi H, Wands JR, Sela M. Immunotargeting of daunomycin to localized and metastatic human colon adenocarcinoma in athymic mice. Cancer Immunology Immunotherapy 1992; 35: 186−192.、Takahashi H, Nakada T, Puisieux I. Inhibition of human colon cancer growth by antibody−directed human LAK cells in SCID mice. Science 1993; 259: 1460−1463.、Takahashi H, Nakada T, Nakaki M, Wands JR. Inhibition of hepatic metastases of human colon cancer in nude mice by a chimeric SF−25 monoclonal antibody. Gastroenterology 1995; 108: 172−182.)。SF−25抗原は、ヒト結腸腺腫細胞株(例えば、LS 180 (ATCC No. CL0187), COLO 320 (ATCC No. CCL−220.1), WiDr (ATCC No. CCL−218), Caco−2 (HTB−37)や、ヒト肝臓癌細胞株(例えばFOCUS (Lun H. et al., in Vitro 20; 493−504(1984))の表面上に発現していることが知られている。また、抗SF−25モノクローナル抗体も公知であり(WO89/05307, 欧州特許第0 397 700号、米国特許第5,212,085号)、抗SF−25モノクローナル抗体を産生するハイブリドーマがATCCに寄託されている(ATCC No. HB9599)。
【0009】
上記の通り、SF−25抗原は、ヒト結腸腺腫細胞及びヒト肝臓癌細胞上に発現される癌関連抗原であることは知られているが、ATL患者の単核球上に発現することはこれまでに知られておらず、また、白血病との関連もはっきりしていなかった。下記実施例に具体的に記載するように、本願発明者らは、急性及び慢性ATL患者並びにくすぶり型のATL患者の単核球表面上にSF−25抗原が発現され、健常者及びHTLV−1の健常キャリアの単球上にはSF−25抗原がほとんど全く発現されていないことを見出し、これを利用してATL、とりわけ、くすぶり型のATLを検出できることを見出した。さらに、下記実施例に具体的に記載するように、インバースPCRにより、HTLV−1がプロウイルス化(ヒトの染色体DNA中に、ウイルスDNAが組み込まれること)することによりSF−25抗原が単核球表面上に出現することを確認し、これにより、本発明の方法で、急性及び慢性ATL並びにくすぶり型ATLが検出できることが確認された。
【0010】
本発明の方法では、生体から分離された白血球細胞表面上のSF−25抗原を検出する。白血球細胞としては、特に限定されず、単核球や多核球を挙げることができる。血液から白血球細胞を分離する方法は周知であり、下記実施例にも単核球の分離方法が記載されている。
【0011】
白血球細胞表面上のSF−25抗原の検出は、白血球細胞と抗SF−25抗体又はその抗原結合性断片との抗原抗体反応を利用して、周知の免疫学的方法により行うことができる。抗SF−25抗体は、モノクローナル抗体であることが好ましい。上記の通り、抗SF−25モノクローナル抗体は公知であり、寄託もされている。寄託されている、ハイブリドーマATCC No. HB9599により産生されるモノクローナル抗体は、上記したヒト肝臓癌細胞株FOCUSを免疫原としてマウスに免疫し、常法によりモノクローナル抗体を産生するハイブリドーマを作製し、得られたモノクローナル抗体のうち、上記した各種ヒト結腸腺腫細胞株と抗原抗体反応するモノクローナル抗体を選択することにより得られた。本発明の方法には、この寄託された抗SF−25モノクローナル抗体を用いることもできるし、同様な方法で作製される他のモノクローナル抗体を用いることもできる。なお、ATCC No. HB9599を記載しているWO89/05307, 欧州特許第0 397 700号及び米国特許第5,212,085号の実施例に具体的に記載されているように、上記の方法により、抗SF−25モノクローナル抗体を産生するハイブリドーマは、ATCC No. HB9599以外にも1回の作製操作で多数得られているから、抗SF−25モノクローナル抗体は、公知の方法により容易に作製可能なものであり、したがって、本発明の方法に用いられるモノクローナル抗体は、寄託されたハイブリドーマが産生するものに限定されるものでは全くない。また、上記したSF−25抗原を発現していることが知られているヒト結腸腺腫細胞株やヒト肝臓癌細胞株を免疫原として動物を免疫し、常法によりモノクローナル抗体を作製し、正常ヒト白血球細胞と抗原抗体反応しないモノクローナル抗体を選択することによっても容易に得ることができる。また、抗体自体のみならず、FabフラグメントやF(ab’)2フラグメントのような、抗原との結合性を有する断片も用いることができる。
【0012】
抗SF−25抗体を用いて、SF−25抗原を発現している白血球細胞を検出すること、さらには、白血球細胞のうち、その表面上にSF−25抗原を発現する細胞の割合を測定することは、周知のフローサイトメトリーにより容易に行うことができる。フローサイトメトリーでは、蛍光標識した抗体を細胞と接触させ、抗原抗体反応により細胞に蛍光標識抗体が結合した細胞数を計数することができ、ひいては、抗体と結合した細胞の割合を算出することができる。フローサイトメトリーの装置及び必要な試薬類は市販されており、当業者が容易に実施することが可能である。
【0013】
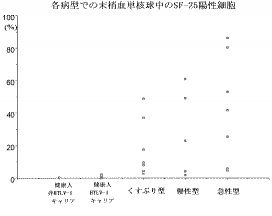
下記実施例に具体的に記載するように、SF−25抗原を発現している単核球の割合は、平均して、急性ATL患者で約43%、慢性ATL患者で約28%、くすぶり型ATL患者で約15%であったが、健常人では約0.4%、健常キャリアで約0.6%であり、健常人+健常キャリアの群と、急性+慢性+くすぶり型の群とは明瞭に区別することができる。すなわち、健常人の値と比較して、有意に高ければATL(くすぶり型を含む)であると診断できる。また、下記実施例に具体的に記載するように、インバースPCRにより、HTLV−1がプロウイルス化することによりSF−25抗原が単核球表面上に出現することを確認し、これにより、本発明の方法で、ATL及びくすぶり型ATLが検出できることが確認された。
【0014】
本発明の方法は、急性及び慢性ATLのみならず、くすぶり型ATLをも検出することができるという、医療上、非常に重要な特徴を有する。なお、くすぶり型ATLを検出できるということは、本発明の方法の重要な特徴であるが、本発明の方法によって、急性及び慢性ATLの診断も行えるので、本発明の方法は、急性及び慢性ATLの診断にも用いることができることは言うまでもない。
【0015】
さらに、下記実施例に具体的に記載するように、SF−25抗原は、ATL以外の他の白血病であるB細胞性慢性リンパ性白血病、急性リンパ性白血病及び急性骨髄性白血病の患者の単核球上にも存在することが明らかになった。したがって、上記した白血球細胞上のSF−25抗原の検出は、ATLのみならず、他の白血病の検出にも適用することができることが明らかになった。
【0016】
なお、白血球細胞上のSF−25抗原の検出のみでは、白血病がATL、B細胞性慢性リンパ性白血病、急性リンパ性白血病及び急性骨髄性白血病のいずれであるのかを識別することはできない。これらの識別は、公知の血液学的検査や、遺伝子検査(例えばATLの場合には、下記実施例に具体的に記載するインバースPCR等)により行うことができる。
【0017】
【実施例】
以下、本発明を実施例に基づきより具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【0018】
実施例1 ATLの検出
1. 試料の調製
急性ATL患者7名、慢性ATL患者5名、くすぶり型ATL患者9名、健常ATLキャリア42名及び健常人(HTLV−1非感染者)8名の末梢血から単核球を分離した。単核球の分離は、具体的に次のようにして行った。Lymphaprep(商品名) (Axis−Sheld PoC AS, Oslo, Norway)5mlを遠心管にとり、前記対象からえられたヘパリン加静脈血5mlを静かに重層する。その後400g、30分遠心し血漿と分離液の中間に帯上に浮遊する単核球を毛細管ピペットで回収した。回収した単核球をリン酸バッファー生理食塩水(PBS)を用いて3回遠心洗浄し、以下の実験に用いた。
【0019】
2. フローサイトメトリー
マウス抗SF−25モノクローナル抗体(ATCC No. HB9599により産生)を常法により、周知の蛍光標識であるフルオレッセインイソチオシアネート(FITC)で標識し、得られた蛍光標識抗SF−25モノクローナル抗体を用い、上記1で分離した単核球についてフローサイトメトリーを行った。フローサイトメトリーは、具体的に次のようにして行った。PBS中に5x106/mlとなるよう調整した単核球浮遊液から、0.1mlずつ2本の小試験管に分注し、1本には希釈した蛍光標識抗SF−25モノクローナル抗体を10μl加え、他の1本には同様にFITC標識マウスIgG1を10μl加えた。10分ごとに静かに混和させながら、4℃30分間反応させた。反応終了後PBSを加え、2回遠心洗浄後フローサイトメーター(EPICS XL(商品名)、Coulter, Miami, Florida, U.S.A.)にアプライし、FITC標識マウスIgG1をコントロールとして約1万個の細胞をカウントし陽性細胞の比率を求めた。
【0020】
上記フローサイトメトリーにより、全単核球中の、SF−25抗原を発現している単核球の割合を計測した。結果を下記表1及び図1に示す。
【0021】
【表1】
表1

【0022】
表1及び図1から明らかなように、本発明の方法により、健常人+健常キャリアの群と、急性+慢性+くすぶり型の群とは明瞭に区別することが可能である。とりわけ、くすぶり型であっても、健常HTLV−Iキャリアとは明瞭に区別できることがわかる。
【0023】
3. インバースPCR及びサザンブロット
次に、SF−25抗原を発現している単核球の染色体DNAに、HTLV−I遺伝子がプロウイルス化して挿入されているか否かをインバースPCR及びサザンブロットにより調べた。これらは、具体的に次のようにして行った。
【0024】
インバースPCRの方法:
くすぶり型ATL患者の末梢血から上記のようにして分離した単核球107をリン酸緩衝生食水(pH 7.2、0.5%牛血清アルブミンおよび2mM EDTAを含むー以下バッファー)60μlに浮遊させた。次に、FITC標識したマウス抗SF−25モノクローナル抗体(ATCC No. HB9599により産生)溶液(濃度0.1%)10μlを加え4oC5分間反応させ、2回洗浄し未吸着の抗体を除去した。この細胞に90μlのバッファ−を加え再浮遊させ、10μlの Anti−FITC マイクロ磁性ビ−ズ(Miltenyi Biotec GmbH, Bergish Gladbach, Germany 粒子直径50nm)を加え、6oC15分間標識し、SF−25抗原を表面に有する単核球を磁性ビーズと結合させた。未吸着の磁性ビーズを除去するため細胞を2回洗浄後、500μlのバッファーに再浮遊させた。マックスミディセット(Miltenyi Biotec GmbH, Bergish Gladbach, Germany) を用いて、この細胞をMACS分離ポジティブセレクションMSカラム(Miltenyi Biotec GmbH, Bergish Gladbach, Germany) (一度バッファー500μlで洗浄したもの)にアプライし、磁力により磁性ビーズで標識された細胞(SF−25抗原陽性細胞)と磁性ビーズで標識されなかった細胞(SF−25抗原陰性細胞)を分画し、以下の実験で検体として用いた。
【0025】
Takemoto Sらによる報告(Blood Vol 84 No9 3080−3085, 1994)に基づき以下のように行った。DNAzol(Molecular Research Center, Inc., Montgomery Rd., Cincinnati, Ohio.)を用いて各検体より染色体DNAを抽出し、このDNAをSau3AIを用いて切断し、T4 DNA ligaseをもちいてセルフライゲーションを行った。この方法により、HTLV−1 5’LTR及びgag sequnceからなるものと、HTLV−1 3’−LTRと染色体DNAからなるものとができる。HTLV−1の5’ proviral DNAからなるものを除く目的で、Sac IIで加熱処理した。このDNAをテンプレートとしてprimer 1 ; primer 1: 5’−aagccggcagtcagtcgtga−3’(HTLV−I 塩基配列の8946−8927)、 primer 2: 5’−aagtaccggcaactctgctg−3’ (HTLV−I 塩基配列の8958−8977)で第一段階のPCRを行い、次いでnested primerとして 3: 5’−gaaagggaaaggggtggaac−3’ (HTLV−I 塩基配列の8924−8905) primer 4: 5’−ccagcgacagcccattctat−3’.(HTLV−I 塩基配列の8986−9005) で第二段階のnested PCRを行った。各PCRはThermal Cycler を用いて94℃20秒、55℃20秒、72℃30秒のサイクルを第一段階は50回、第二段階は35回行った。このPCR産物 5mlをとり2% アガロースゲル電気泳動を行い、エチジウムブロマイドで染色後、バンドを確認しHTLV−Iのクローナルな組み込みの有無をみた。
【0026】
サザンブロット:
上記の泳動産物を、ナイロンメンブランフィルタ−にトランスファーし、オリゴヌクレチド(5’−ctccaggagagaaatttagtacac−3’ HTLV−I塩基配列の9012−9035)をプローブとしてHTLV−Iの組み込みを確認した。Takemotoらによる報告によると、この方法により染色体遺伝子を含むHTLV−1の3’LTRのU5領域が増幅されると考えられる。ATL患者におけるHTLV−1遺伝子の組み込みは各症例間でランダムであるが、1人の患者ATL細胞におけるHTLV−1遺伝子の組み込みはモノクローナルであり、染色体DNAを含むHTLV−1の3’LTRのU5領域を増幅することで、モノクローナルな増殖であるか否かを決定できる。事実彼らは染色体DNAを含むHTLV−1の3’LTRのU5領域のDNA sequence行うことによりそのことを確認している。
【0027】
その結果、SF−25抗原陽性単核球では、HTLV−Iプロウイルス化DNAが、モノクローナルに組み込まれており、SF−25抗原陰性細胞では、HTLV−Iのプロウイルス化は検出されなかった。このことから、本発明の方法により、急性、慢性及びくすぶり型ATLが検出できることが確認された。
【0028】
実施例2 B細胞性慢性リンパ性白血病、急性リンパ性白血病及び急性骨髄性白血病の検出
実施例1と同様な方法により、B細胞性慢性リンパ性白血病患者12名、急性リンパ性白血病患者10名及び急性骨髄性白血病患者12名の末梢血中の単核球について、SF−25抗原を発現している単核球の割合を測定した。結果を下記表2に示す。
【0029】
【表2】
表2

【0030】
上記のとおり、健常人中のSF−25抗原発現単核球の割合(%)は0.4%であるから、SF−25抗原をマーカーとしてB細胞性慢性リンパ性白血病、急性リンパ性白血病及び急性骨髄性白血病の検出も可能であることが明らかになった。
【0031】
【発明の効果】
本発明により、くすぶり型ATLを包含するATLを、容易に高感度に検出することができる方法が初めて提供された。本発明によれば、末梢血中の単核球を用いて、容易にくすぶり型ATLを包含するATLを検出することができる。くすぶり型ATLは治療可能であるので、くすぶり型ATLを容易に高感度に検出できることは、医療上、非常に有利である。
【0032】
【配列表】

【0033】

【0034】

【0035】

【0036】

【0037】

【図面の簡単な説明】
【図1】本発明の実施例において、急性ATL患者、慢性ATL患者、くすぶり型ATL患者、健常ATLキャリア及び健常人(HTLV−1非感染者)の末梢血中の単核球を被検試料とし、抗SF−25モノクローナル抗体を用いたフローサイトメトリーにより測定した、全単核球中のSF−25抗原陽性単核球の割合を示す図である。
【0001】
【発明の属する技術分野】
本発明は、成人T細胞白血病、B細胞性慢性リンパ性白血病、急性リンパ性白血病又は急性骨髄性白血病等の白血病の検出方法及び臨床上発症していない白血病(例えば、くすぶり型成人T細胞白血病)の検出方法及びそのための試薬に関する。
【0002】
【従来の技術】
成人T細胞白血病(adult T−cell luekemia, 以下、「ATL」ということがある)は、ヒトT細胞白血病ウイルス−I(human T−cell leukemia virus−I, HTLV−I)により、T細胞が癌化する白血病であり、皮膚病変、肝脾腫大、リンパ節腫脹が高率で起きる。HTLV−Iに感染しても、発病する者は約2000人に1人と少なく、ほとんど全ての感染者(キャリア)は、ATLを発病することなく生涯を終える。しかし、一旦発病すれば、治療法はなく、ほとんどの患者は発病から1年以内に死亡する。従来、ATLの診断は、臨床症状並びに白血球の検鏡及び抗体検査等の結果を総合的に考慮して行われている。
【0003】
キャリアが発症する場合、「くすぶり型」(smoldering type)を経由して完全な発症に至る。くすぶり型では、癌化したT細胞は極僅かであり、T細胞のほとんどは正常であるため、この段階で治療を行えば、発症を防ぐことが可能である。したがって、くすぶり型を検出することができれば、ATLの発症を防止することができ、医療上、極めて有利である。
【0004】
【発明が解決しようとする課題】
しかしながら、くすぶり型では、未だ臨床的には発症していないので、臨床症状に基づく診断はもちろんできない。また、抗体検査では、キャリアか否かは区別できるが、キャリアとくすぶり型の区別はできない。さらに、くすぶり型では、ほとんどのT細胞は正常細胞であり、癌化しているのは極少数であるから、検鏡によって癌化した極少数のT細胞を見つけ出すことはなかなか困難である。このように、くすぶり型を容易に検出できる診断方法は現在までに知られていない。
【0005】
したがって、本発明の目的は、くすぶり型のATLをも容易に検出することができる、ATLの検出方法及びそのための試薬を提供することである。さらにまた、本発明の目的は、ATL以外の白血病をも容易に検出することができる、白血病の検出方法及びそのための試薬を提供することである。
【0006】
【課題を解決するための手段】
本願発明者は、鋭意研究の結果、白血球細胞上のSF−25抗原を癌マーカーとして用いることにより、発症後のATLのみならず、くすぶり型のATLをも検出することができることを見出し、本発明を完成した。また、本願発明者らは、白血球細胞上のSF−25抗原を癌マーカーとして用いることにより、B細胞性慢性リンパ性白血病、急性リンパ性白血病及び急性骨髄性白血病のような、ATL以外の白血病をも検出することができることを見出し、本発明を完成した。
【0007】
すなわち、本発明は、生体から分離した白血球細胞表面上のSF−25抗原を測定することを含む白血病の検出方法を提供する。また、本発明は、SF−25抗原と抗原抗体反応する抗体又はその抗原結合性断片を含む、白血病診断用試薬を提供する。
【0008】
【発明の実施の形態】
上記の通り、本発明の白血病の検出方法は、生体から分離した白血球細胞表面上のSF−25抗原を測定することを含む。SF−25抗原は、1987年に発見された分子量約125 kDaの公知の糖タンパク抗原である(WO89/05307, 欧州特許第0 397 700号、米国特許第5,212,085号、Takahashi H, Wilson B, Ozturk M, Motte P, Strauss W, Isselbacher KJ and Wands JR. In vivo localization of colon adenocarcinoma by monoclonal antibody binding to a highly expressed cell surface antigen. Cancer Research 1988; 48: 6573−6579. 、Wilson B, Ozturk M, Takahashi H, Motte P, Kew M, Isselbacher KJ and Wands JR. Cell surface changes associated with transformation of human hepatocytes to the malignant phenotype. Proc. Natl. Acad. Sci. USA 1988; 85: 3140−3144.、TakahashiH, Carlson R, Ozturk M, Sun S, Motte P, Strauss W, Isselbacher KJ and Wands JR, Shouval D. Radioimmunolocalization of hepatic and pulmonary metastasis of human colon adenocarcinoma. Gastroenterology 1989; 96: 1317−1329.、Hurwitz E, Stancovski I, Wilcheck M, Shouval D, Takahashi H, WandsJR, Sela M. A conjugate of 5−Fluorourodine−poly(L−lysine) and an antibody reactive with human colon carcinoma. Bioconjugate Chemistry 1990; 1: 285−290.、Wands JR, Takahashi H. Studies on cell surface changes associated with transformation of human hepatocytes to the malignant phenotype and their role as potential immunotargeting sites. In Frontiers of Mucosal Immunology. Volume 2. Eds by Tsuchiya M. 1991 pp. 295−298. Hurwitz E,Adler R, Shouval D, Takahashi H, Wands JR, Sela M. Immunotargeting of daunomycin to localized and metastatic human colon adenocarcinoma in athymic mice. Cancer Immunology Immunotherapy 1992; 35: 186−192.、Takahashi H, Nakada T, Puisieux I. Inhibition of human colon cancer growth by antibody−directed human LAK cells in SCID mice. Science 1993; 259: 1460−1463.、Takahashi H, Nakada T, Nakaki M, Wands JR. Inhibition of hepatic metastases of human colon cancer in nude mice by a chimeric SF−25 monoclonal antibody. Gastroenterology 1995; 108: 172−182.)。SF−25抗原は、ヒト結腸腺腫細胞株(例えば、LS 180 (ATCC No. CL0187), COLO 320 (ATCC No. CCL−220.1), WiDr (ATCC No. CCL−218), Caco−2 (HTB−37)や、ヒト肝臓癌細胞株(例えばFOCUS (Lun H. et al., in Vitro 20; 493−504(1984))の表面上に発現していることが知られている。また、抗SF−25モノクローナル抗体も公知であり(WO89/05307, 欧州特許第0 397 700号、米国特許第5,212,085号)、抗SF−25モノクローナル抗体を産生するハイブリドーマがATCCに寄託されている(ATCC No. HB9599)。
【0009】
上記の通り、SF−25抗原は、ヒト結腸腺腫細胞及びヒト肝臓癌細胞上に発現される癌関連抗原であることは知られているが、ATL患者の単核球上に発現することはこれまでに知られておらず、また、白血病との関連もはっきりしていなかった。下記実施例に具体的に記載するように、本願発明者らは、急性及び慢性ATL患者並びにくすぶり型のATL患者の単核球表面上にSF−25抗原が発現され、健常者及びHTLV−1の健常キャリアの単球上にはSF−25抗原がほとんど全く発現されていないことを見出し、これを利用してATL、とりわけ、くすぶり型のATLを検出できることを見出した。さらに、下記実施例に具体的に記載するように、インバースPCRにより、HTLV−1がプロウイルス化(ヒトの染色体DNA中に、ウイルスDNAが組み込まれること)することによりSF−25抗原が単核球表面上に出現することを確認し、これにより、本発明の方法で、急性及び慢性ATL並びにくすぶり型ATLが検出できることが確認された。
【0010】
本発明の方法では、生体から分離された白血球細胞表面上のSF−25抗原を検出する。白血球細胞としては、特に限定されず、単核球や多核球を挙げることができる。血液から白血球細胞を分離する方法は周知であり、下記実施例にも単核球の分離方法が記載されている。
【0011】
白血球細胞表面上のSF−25抗原の検出は、白血球細胞と抗SF−25抗体又はその抗原結合性断片との抗原抗体反応を利用して、周知の免疫学的方法により行うことができる。抗SF−25抗体は、モノクローナル抗体であることが好ましい。上記の通り、抗SF−25モノクローナル抗体は公知であり、寄託もされている。寄託されている、ハイブリドーマATCC No. HB9599により産生されるモノクローナル抗体は、上記したヒト肝臓癌細胞株FOCUSを免疫原としてマウスに免疫し、常法によりモノクローナル抗体を産生するハイブリドーマを作製し、得られたモノクローナル抗体のうち、上記した各種ヒト結腸腺腫細胞株と抗原抗体反応するモノクローナル抗体を選択することにより得られた。本発明の方法には、この寄託された抗SF−25モノクローナル抗体を用いることもできるし、同様な方法で作製される他のモノクローナル抗体を用いることもできる。なお、ATCC No. HB9599を記載しているWO89/05307, 欧州特許第0 397 700号及び米国特許第5,212,085号の実施例に具体的に記載されているように、上記の方法により、抗SF−25モノクローナル抗体を産生するハイブリドーマは、ATCC No. HB9599以外にも1回の作製操作で多数得られているから、抗SF−25モノクローナル抗体は、公知の方法により容易に作製可能なものであり、したがって、本発明の方法に用いられるモノクローナル抗体は、寄託されたハイブリドーマが産生するものに限定されるものでは全くない。また、上記したSF−25抗原を発現していることが知られているヒト結腸腺腫細胞株やヒト肝臓癌細胞株を免疫原として動物を免疫し、常法によりモノクローナル抗体を作製し、正常ヒト白血球細胞と抗原抗体反応しないモノクローナル抗体を選択することによっても容易に得ることができる。また、抗体自体のみならず、FabフラグメントやF(ab’)2フラグメントのような、抗原との結合性を有する断片も用いることができる。
【0012】
抗SF−25抗体を用いて、SF−25抗原を発現している白血球細胞を検出すること、さらには、白血球細胞のうち、その表面上にSF−25抗原を発現する細胞の割合を測定することは、周知のフローサイトメトリーにより容易に行うことができる。フローサイトメトリーでは、蛍光標識した抗体を細胞と接触させ、抗原抗体反応により細胞に蛍光標識抗体が結合した細胞数を計数することができ、ひいては、抗体と結合した細胞の割合を算出することができる。フローサイトメトリーの装置及び必要な試薬類は市販されており、当業者が容易に実施することが可能である。
【0013】
下記実施例に具体的に記載するように、SF−25抗原を発現している単核球の割合は、平均して、急性ATL患者で約43%、慢性ATL患者で約28%、くすぶり型ATL患者で約15%であったが、健常人では約0.4%、健常キャリアで約0.6%であり、健常人+健常キャリアの群と、急性+慢性+くすぶり型の群とは明瞭に区別することができる。すなわち、健常人の値と比較して、有意に高ければATL(くすぶり型を含む)であると診断できる。また、下記実施例に具体的に記載するように、インバースPCRにより、HTLV−1がプロウイルス化することによりSF−25抗原が単核球表面上に出現することを確認し、これにより、本発明の方法で、ATL及びくすぶり型ATLが検出できることが確認された。
【0014】
本発明の方法は、急性及び慢性ATLのみならず、くすぶり型ATLをも検出することができるという、医療上、非常に重要な特徴を有する。なお、くすぶり型ATLを検出できるということは、本発明の方法の重要な特徴であるが、本発明の方法によって、急性及び慢性ATLの診断も行えるので、本発明の方法は、急性及び慢性ATLの診断にも用いることができることは言うまでもない。
【0015】
さらに、下記実施例に具体的に記載するように、SF−25抗原は、ATL以外の他の白血病であるB細胞性慢性リンパ性白血病、急性リンパ性白血病及び急性骨髄性白血病の患者の単核球上にも存在することが明らかになった。したがって、上記した白血球細胞上のSF−25抗原の検出は、ATLのみならず、他の白血病の検出にも適用することができることが明らかになった。
【0016】
なお、白血球細胞上のSF−25抗原の検出のみでは、白血病がATL、B細胞性慢性リンパ性白血病、急性リンパ性白血病及び急性骨髄性白血病のいずれであるのかを識別することはできない。これらの識別は、公知の血液学的検査や、遺伝子検査(例えばATLの場合には、下記実施例に具体的に記載するインバースPCR等)により行うことができる。
【0017】
【実施例】
以下、本発明を実施例に基づきより具体的に説明する。もっとも、本発明は下記実施例に限定されるものではない。
【0018】
実施例1 ATLの検出
1. 試料の調製
急性ATL患者7名、慢性ATL患者5名、くすぶり型ATL患者9名、健常ATLキャリア42名及び健常人(HTLV−1非感染者)8名の末梢血から単核球を分離した。単核球の分離は、具体的に次のようにして行った。Lymphaprep(商品名) (Axis−Sheld PoC AS, Oslo, Norway)5mlを遠心管にとり、前記対象からえられたヘパリン加静脈血5mlを静かに重層する。その後400g、30分遠心し血漿と分離液の中間に帯上に浮遊する単核球を毛細管ピペットで回収した。回収した単核球をリン酸バッファー生理食塩水(PBS)を用いて3回遠心洗浄し、以下の実験に用いた。
【0019】
2. フローサイトメトリー
マウス抗SF−25モノクローナル抗体(ATCC No. HB9599により産生)を常法により、周知の蛍光標識であるフルオレッセインイソチオシアネート(FITC)で標識し、得られた蛍光標識抗SF−25モノクローナル抗体を用い、上記1で分離した単核球についてフローサイトメトリーを行った。フローサイトメトリーは、具体的に次のようにして行った。PBS中に5x106/mlとなるよう調整した単核球浮遊液から、0.1mlずつ2本の小試験管に分注し、1本には希釈した蛍光標識抗SF−25モノクローナル抗体を10μl加え、他の1本には同様にFITC標識マウスIgG1を10μl加えた。10分ごとに静かに混和させながら、4℃30分間反応させた。反応終了後PBSを加え、2回遠心洗浄後フローサイトメーター(EPICS XL(商品名)、Coulter, Miami, Florida, U.S.A.)にアプライし、FITC標識マウスIgG1をコントロールとして約1万個の細胞をカウントし陽性細胞の比率を求めた。
【0020】
上記フローサイトメトリーにより、全単核球中の、SF−25抗原を発現している単核球の割合を計測した。結果を下記表1及び図1に示す。
【0021】
【表1】
表1

【0022】
表1及び図1から明らかなように、本発明の方法により、健常人+健常キャリアの群と、急性+慢性+くすぶり型の群とは明瞭に区別することが可能である。とりわけ、くすぶり型であっても、健常HTLV−Iキャリアとは明瞭に区別できることがわかる。
【0023】
3. インバースPCR及びサザンブロット
次に、SF−25抗原を発現している単核球の染色体DNAに、HTLV−I遺伝子がプロウイルス化して挿入されているか否かをインバースPCR及びサザンブロットにより調べた。これらは、具体的に次のようにして行った。
【0024】
インバースPCRの方法:
くすぶり型ATL患者の末梢血から上記のようにして分離した単核球107をリン酸緩衝生食水(pH 7.2、0.5%牛血清アルブミンおよび2mM EDTAを含むー以下バッファー)60μlに浮遊させた。次に、FITC標識したマウス抗SF−25モノクローナル抗体(ATCC No. HB9599により産生)溶液(濃度0.1%)10μlを加え4oC5分間反応させ、2回洗浄し未吸着の抗体を除去した。この細胞に90μlのバッファ−を加え再浮遊させ、10μlの Anti−FITC マイクロ磁性ビ−ズ(Miltenyi Biotec GmbH, Bergish Gladbach, Germany 粒子直径50nm)を加え、6oC15分間標識し、SF−25抗原を表面に有する単核球を磁性ビーズと結合させた。未吸着の磁性ビーズを除去するため細胞を2回洗浄後、500μlのバッファーに再浮遊させた。マックスミディセット(Miltenyi Biotec GmbH, Bergish Gladbach, Germany) を用いて、この細胞をMACS分離ポジティブセレクションMSカラム(Miltenyi Biotec GmbH, Bergish Gladbach, Germany) (一度バッファー500μlで洗浄したもの)にアプライし、磁力により磁性ビーズで標識された細胞(SF−25抗原陽性細胞)と磁性ビーズで標識されなかった細胞(SF−25抗原陰性細胞)を分画し、以下の実験で検体として用いた。
【0025】
Takemoto Sらによる報告(Blood Vol 84 No9 3080−3085, 1994)に基づき以下のように行った。DNAzol(Molecular Research Center, Inc., Montgomery Rd., Cincinnati, Ohio.)を用いて各検体より染色体DNAを抽出し、このDNAをSau3AIを用いて切断し、T4 DNA ligaseをもちいてセルフライゲーションを行った。この方法により、HTLV−1 5’LTR及びgag sequnceからなるものと、HTLV−1 3’−LTRと染色体DNAからなるものとができる。HTLV−1の5’ proviral DNAからなるものを除く目的で、Sac IIで加熱処理した。このDNAをテンプレートとしてprimer 1 ; primer 1: 5’−aagccggcagtcagtcgtga−3’(HTLV−I 塩基配列の8946−8927)、 primer 2: 5’−aagtaccggcaactctgctg−3’ (HTLV−I 塩基配列の8958−8977)で第一段階のPCRを行い、次いでnested primerとして 3: 5’−gaaagggaaaggggtggaac−3’ (HTLV−I 塩基配列の8924−8905) primer 4: 5’−ccagcgacagcccattctat−3’.(HTLV−I 塩基配列の8986−9005) で第二段階のnested PCRを行った。各PCRはThermal Cycler を用いて94℃20秒、55℃20秒、72℃30秒のサイクルを第一段階は50回、第二段階は35回行った。このPCR産物 5mlをとり2% アガロースゲル電気泳動を行い、エチジウムブロマイドで染色後、バンドを確認しHTLV−Iのクローナルな組み込みの有無をみた。
【0026】
サザンブロット:
上記の泳動産物を、ナイロンメンブランフィルタ−にトランスファーし、オリゴヌクレチド(5’−ctccaggagagaaatttagtacac−3’ HTLV−I塩基配列の9012−9035)をプローブとしてHTLV−Iの組み込みを確認した。Takemotoらによる報告によると、この方法により染色体遺伝子を含むHTLV−1の3’LTRのU5領域が増幅されると考えられる。ATL患者におけるHTLV−1遺伝子の組み込みは各症例間でランダムであるが、1人の患者ATL細胞におけるHTLV−1遺伝子の組み込みはモノクローナルであり、染色体DNAを含むHTLV−1の3’LTRのU5領域を増幅することで、モノクローナルな増殖であるか否かを決定できる。事実彼らは染色体DNAを含むHTLV−1の3’LTRのU5領域のDNA sequence行うことによりそのことを確認している。
【0027】
その結果、SF−25抗原陽性単核球では、HTLV−Iプロウイルス化DNAが、モノクローナルに組み込まれており、SF−25抗原陰性細胞では、HTLV−Iのプロウイルス化は検出されなかった。このことから、本発明の方法により、急性、慢性及びくすぶり型ATLが検出できることが確認された。
【0028】
実施例2 B細胞性慢性リンパ性白血病、急性リンパ性白血病及び急性骨髄性白血病の検出
実施例1と同様な方法により、B細胞性慢性リンパ性白血病患者12名、急性リンパ性白血病患者10名及び急性骨髄性白血病患者12名の末梢血中の単核球について、SF−25抗原を発現している単核球の割合を測定した。結果を下記表2に示す。
【0029】
【表2】
表2

【0030】
上記のとおり、健常人中のSF−25抗原発現単核球の割合(%)は0.4%であるから、SF−25抗原をマーカーとしてB細胞性慢性リンパ性白血病、急性リンパ性白血病及び急性骨髄性白血病の検出も可能であることが明らかになった。
【0031】
【発明の効果】
本発明により、くすぶり型ATLを包含するATLを、容易に高感度に検出することができる方法が初めて提供された。本発明によれば、末梢血中の単核球を用いて、容易にくすぶり型ATLを包含するATLを検出することができる。くすぶり型ATLは治療可能であるので、くすぶり型ATLを容易に高感度に検出できることは、医療上、非常に有利である。
【0032】
【配列表】

【0033】

【0034】

【0035】

【0036】

【0037】

【図面の簡単な説明】
【図1】本発明の実施例において、急性ATL患者、慢性ATL患者、くすぶり型ATL患者、健常ATLキャリア及び健常人(HTLV−1非感染者)の末梢血中の単核球を被検試料とし、抗SF−25モノクローナル抗体を用いたフローサイトメトリーにより測定した、全単核球中のSF−25抗原陽性単核球の割合を示す図である。
【特許請求の範囲】
【請求項1】
生体から分離した白血球細胞表面上のSF−25抗原を測定することを含む白血病の検出方法。
【請求項2】
白血球細胞のうち、その表面上にSF−25抗原を発現する細胞の割合を測定することを含む請求項1記載の方法。
【請求項3】
白血球細胞が単核球である請求項1又は2記載の方法。
【請求項4】
SF−25抗原と抗原抗体反応する抗体又はその抗原結合性断片と、白血球細胞上のSF−25抗原との抗原抗体反応を利用して行う請求項1ないし3のいずれか1項に記載の方法。
【請求項5】
前記抗体又はその抗原結合性断片が蛍光標識されており、フローサイトメトリーにより行う請求項4記載の方法。
【請求項6】
前記抗体がモノクローナル抗体である請求項4又は5記載の方法。
【請求項7】
前記白血病が成人T細胞白血病、B細胞性慢性リンパ性白血病、急性リンパ性白血病又は急性骨髄性白血病である請求項1ないし6のいずれか1項に記載の方法。
【請求項8】
前記白血病が成人T細胞白血病である請求項7記載の方法。
【請求項9】
くすぶり型を検出する請求項8記載の方法。
【請求項10】
SF−25抗原と抗原抗体反応する抗体又はその抗原結合性断片を含む、白血病診断用試薬。
【請求項11】
前記抗体が蛍光標識されている請求項10記載の試薬。
【請求項12】
前記抗体がモノクローナル抗体である請求項10又は11記載の試薬。
【請求項13】
成人T細胞白血病、B細胞性慢性リンパ性白血病、急性リンパ性白血病又は急性骨髄性白血病診断用試薬である請求項10ないし12記載の試薬。
【請求項14】
成人T細胞白血病診断用試薬である請求項13記載の試薬。
【請求項1】
生体から分離した白血球細胞表面上のSF−25抗原を測定することを含む白血病の検出方法。
【請求項2】
白血球細胞のうち、その表面上にSF−25抗原を発現する細胞の割合を測定することを含む請求項1記載の方法。
【請求項3】
白血球細胞が単核球である請求項1又は2記載の方法。
【請求項4】
SF−25抗原と抗原抗体反応する抗体又はその抗原結合性断片と、白血球細胞上のSF−25抗原との抗原抗体反応を利用して行う請求項1ないし3のいずれか1項に記載の方法。
【請求項5】
前記抗体又はその抗原結合性断片が蛍光標識されており、フローサイトメトリーにより行う請求項4記載の方法。
【請求項6】
前記抗体がモノクローナル抗体である請求項4又は5記載の方法。
【請求項7】
前記白血病が成人T細胞白血病、B細胞性慢性リンパ性白血病、急性リンパ性白血病又は急性骨髄性白血病である請求項1ないし6のいずれか1項に記載の方法。
【請求項8】
前記白血病が成人T細胞白血病である請求項7記載の方法。
【請求項9】
くすぶり型を検出する請求項8記載の方法。
【請求項10】
SF−25抗原と抗原抗体反応する抗体又はその抗原結合性断片を含む、白血病診断用試薬。
【請求項11】
前記抗体が蛍光標識されている請求項10記載の試薬。
【請求項12】
前記抗体がモノクローナル抗体である請求項10又は11記載の試薬。
【請求項13】
成人T細胞白血病、B細胞性慢性リンパ性白血病、急性リンパ性白血病又は急性骨髄性白血病診断用試薬である請求項10ないし12記載の試薬。
【請求項14】
成人T細胞白血病診断用試薬である請求項13記載の試薬。
【図1】




【公開番号】特開2004−163121(P2004−163121A)
【公開日】平成16年6月10日(2004.6.10)
【国際特許分類】
【出願番号】特願2002−326045(P2002−326045)
【出願日】平成14年11月8日(2002.11.8)
【出願人】(390037006)株式会社エスアールエル (29)
【Fターム(参考)】
【公開日】平成16年6月10日(2004.6.10)
【国際特許分類】
【出願日】平成14年11月8日(2002.11.8)
【出願人】(390037006)株式会社エスアールエル (29)
【Fターム(参考)】
[ Back to top ]

