白金コアシェル触媒、その製造方法及びそれを用いた燃料電池
【課題】白金コアシェル触媒において、シェルである白金がコアに固溶することを抑制し、白金コアシェル触媒の耐久性を向上させることを課題とする。
【解決手段】金及び白金を含有するコアと、当該コアの外層に形成された白金のシェルとを有する、燃料電池用の白金コアシェル触媒とする。AuPtコアの粒径は1〜5nmであることが好ましい。また、本発明のAuPtコアは、炭素質材料からなる坦体に担持されていることが好ましい。
【解決手段】金及び白金を含有するコアと、当該コアの外層に形成された白金のシェルとを有する、燃料電池用の白金コアシェル触媒とする。AuPtコアの粒径は1〜5nmであることが好ましい。また、本発明のAuPtコアは、炭素質材料からなる坦体に担持されていることが好ましい。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、燃料電池において酸素還元反応の触媒として用いるのに適した、白金コアシェル触媒とその製造方法、及び当該触媒を用いた燃料電池に関する。
【背景技術】
【0002】
固体高分子形燃料電池(PEFC)は、アノード側で水素の酸化反応を、カソード側で酸素の還元反応を起こすことにより、水のみを生成するクリーンエネルギーデバイスとして知られており、PEFCのカソード側の触媒としては、カーボンブラック担体に白金微粒子を高分散担持させた白金担持カーボン触媒(Pt/C触媒)が知られている。Pt/C触媒は、触媒活性が高く、電気伝導性が高いという利点を有し、また、貴金属であるため、周辺環境の状態や周辺環境に存在する物質により腐食や被毒を受けにくいという利点を有する。
しかし、白金は価格が高く、資源量も少ないことから、白金の利用効率や耐久性を向上させて、白金の使用量を低減することが求められている。
【0003】
そこで、異種金属上に白金を被覆してなる白金コアシェル触媒が注目されている。白金コアシェル触媒は、白金原子層(シェル)で被覆された異種金属微粒子(コア金属)が担体に高分散担持された構成を有する。このような構成とすれば、白金量を少なくしつつ、触媒の表面積の増大を図ることができるため、白金の質量当たりの活性を向上させ、使用する白金量の低減を図ることができる。
【0004】
白金(Pt)シェルに対するコア金属の一つとして、金(Au)が知られている。金は貴金属であり、白金よりもイオン化傾向が小さく、酸化に対して安定であり、また白金よりもはるかに資源量が多いことから、コア金属の一つとして期待されている。
例えば、特開2010−92725号公報(特許文献1)には、コア粒子を1〜10nmのAuまたはその合金で構成し、コアの表面に厚さが2nm以下のPtまたはその合金のシェル層を形成した触媒が開示されている。当該文献にはまた、Au(コア)の格子定数がPt(シェル)の格子定数よりも大きいために、当該発明の白金コアシェル触媒は耐久性が高いと考えられるとの記載があり、さらに、Auコアに他種の金属を添加する場合には、コアの格子定数がシェルの格子定数よりも大きくなるように添加元素の種類および添加量を選択することが好ましいとの開示がある。
【0005】
しかしながらこのような白金コアシェル触媒を実用に供するためには、耐久性が未だ充分ではなかった。なかでも、Auコアを用いる白金コアシェル触媒では、PtとAuとが互いに固溶する性質を有するため、電位サイクルを繰り返すに従ってシェルのPt原子が徐々にAuコアに固溶し、触媒表面のPt原子がAuコア内に埋没して触媒活性が低下するという問題があった。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2010−92725号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
したがって本発明は、白金コアシェル触媒において、シェルである白金がコアに固溶埋没することを抑制し、白金コアシェル触媒の耐久性を向上させることを課題とする。
【課題を解決するための手段】
【0008】
本発明者らは前記課題を解決するために検討を繰り返す中で、コア材料として化学的に安定な金を使用し、さらに、金コア内に予め白金を添加しておくことで、シェルの白金原子の金コアへの固溶を抑制することが可能となり、白金シェルの耐久性が向上することを見出し、本発明を完成した。
【0009】
すなわち、本発明は、金及び白金を含有するコアと、当該コアの外層に形成された白金のシェルとを有する、燃料電池用の白金コアシェル触媒に関する。
本発明の白金コアシェル触媒は、白金シェルが金及び白金を含有する金属微粒子(コア)の外層として形成されているので、白金の利用効率は100%と高く、触媒質量当たりの活性(質量活性)を向上させることができる。また、本発明では、コアである金属微粒子が、金及び白金を含有しているため、シェルの白金原子がコアへ固溶することが抑制され、シェル中の白金原子の固溶埋没を抑制することができる。すなわち、本発明の白金コアシェル触媒では、高い白金利用効率に基づく高い質量活性と、白金シェルがコア内に固溶することを抑止した構造に基づく高い耐久性を同時に提供することができる。
【0010】
本発明の白金コアシェル触媒は、コアの粒径が1〜10nm、より好ましくは1〜5nmである。コアの粒径を1〜5nmとすれば、表面積の大きな触媒が得られ、白金コアシェル触媒の触媒活性を向上させることができ、また、コア表面に設けるシェル層形成に必要なPt原子数が減少し、高価な白金の使用量を一層低減させることができる。さらに、コア粒径が小さければ、コアに固溶しうる白金量が減少するため、コア内への白金固溶量が減少し、白金コアシェル触媒の耐久性を高めることができる。したがって、コア粒子径を減少させることは、触媒性能、コスト面および耐久性の面で有利である。
【0011】
本発明の白金コアシェル触媒は、炭素質材料からなる担体に担持されていることが好ましい。また、炭素質材料担体の酸化劣化の観点から、耐酸化性の高い酸化錫(SnOx)や酸化チタン(TiOx)などの金属酸化物担体、あるいはこれらの金属酸化物と炭素質材料を混合した担体を使用してもよい。また、本発明の白金コアシェル触媒は、燃料電池における酸化還元反応の触媒として好適に利用することができる。
【0012】
また、本発明は、(1)金含有化合物、白金含有化合物、還元剤及び微粒子化剤を含む混合物を撹拌混合し、金及び白金を含有するコアを得るステップと、(2)前記(1)で得たコアを炭素質材料からなる担体に担持させるステップと、(3)前記(1)で得たコアの表面に白金原子を担持させて白金シェルを形成するステップと、を含むことを特徴とする燃料電池用の白金コアシェル触媒の製造方法に関する。
本発明の方法によれば、金及び白金を含有する金属微粒子であるコアを得ることができ、当該コアの表面に白金シェル層を有し、炭素質材料に担持された白金コアシェル触媒を得ることができる。
【0013】
本発明の方法は、前記(1)と(2)とを同時に行うことができる。すなわち、金化合物、白金化合物、還元剤及び微粒子化剤の混合物にさらに炭素質材料からなる担体を混合して撹拌する方法によって、炭素質材料に担持された金・白金含有コア(以下、AuPtコアと記載する)を得ることができる。
【0014】
また、本発明の方法は、前記(1)と(2)とを逐次的に行うことができる。すなわち、まず、ステップ(1)によってAuPtコアを形成し、必要に応じて分離・洗浄等を行った後に、当該コアを炭素質材料に担持させることもできる。
上記の各方法で製造された白金コアシェル触媒は、燃料電池における酸化還元反応の触媒として好適に利用することができる。
【発明の効果】
【0015】
本発明の白金コアシェル触媒は耐久性が高く、触媒活性を長期間に渡って維持することが可能である。また、本発明の方法によれば、耐久性に優れた白金コアシェル触媒を、特別な設備等を用いることなく効率的に製造することができる。本発明の白金コアシェル触媒は燃料電池の触媒として用いることができるため、燃料電池のコストの飛躍的低減が可能となる。
【図面の簡単な説明】
【0016】
【図1】(a)は従来品であるカーボン担持金微粒子の透過型電子顕微鏡(TEM)写真である。(b)及び(c)は本発明のカーボン担持AuPtコア微粒子の透過型電子顕微鏡(TEM)写真である。
【図2】酸素還元活性(ORR活性)評価に使用した回転リングディスク電極を模式的に示す図である。
【図3】(a)は実施例2及び比較例2のサイクリックボルタモグラムを示す図である。(b)は実施例2及び比較例2の対流ボルタモグラムを示す図である。
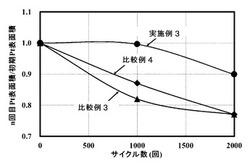
【図4】実施例3、比較例3及び比較例4の電位サイクル試験結果を示す図である。
【発明を実施するための形態】
【0017】
本発明の白金コアシェル触媒のコアは金及び白金を含有することを特徴とし、金と白金の割合は特に制限されないが、例えばモル比において20:1〜3:1とすることができ、15:1〜5:1とすることが好ましい。常温付近のバルク金属では、白金の金への固溶限界は約17原子%であることから、作製するコア微粒子を安定化させるため、白金含有割合を固溶限界以下にすることが好ましい。
本発明のAuPtコアは、金及び白金以外にも、本発明の効果に影響を与えない範囲で他種金属を含んでいてもよい。また、製造の過程で使用される添加剤(還元剤、微粒子化剤等)の残渣或いは一部を含んでいてもよい。
【0018】
AuPtコアの大きさは、粒径が1〜10nmであることが好ましく、1〜5nmであることがさらに好ましい。粒径を1nmより大きくすることで、安定的にコアを製造し、さらに表面に白金シェルを形成した白金コアシェル触媒を得ることが可能であり、粒径を10nm以下とすることで、触媒の表面積を大きくして、触媒の酸素還元の反応性を向上させることができる。コアの粒径を5nm以下とすると特に、大きな表面積を得ることができ、白金シェル形成に必要な白金原子数が減少し、また、コアに固溶する白金量を低減することが可能であり、触媒活性、コスト及び耐久性で有利な白金コアシェル触媒を得ることができる。
なお、本明細書中でAuPtコアの粒径とは、透過型電子顕微鏡(TEM)画像から算出した粒径、或いは、X線回折にシェラー式を適用して算出した値を意味している。
【0019】
本発明の白金コアシェル触媒は、前記AuPtコアの外層に白金原子のシェルが形成されている。かかるシェルは主成分が白金原子であるが、白金原子以外にも、所望の触媒活性を満たす範囲で、他の原子及び/又は分子を含有していてもよい。例えば、金、銀、ルテニウム等の貴金属、製造過程で添加される白金化合物や有機化合物の残渣等が含まれていてもよい。
白金シェルの平均的厚みは、白金原子の単原子層〜二原子層であることが好ましい。酸素還元触媒としての活性を有する白金原子は、シェルの最外層(最表面)に位置する白金原子のみであるので、シェル層の厚みを増すことには特段の利点がない。
【0020】
本発明の白金コアシェル触媒は、炭素質材料からなる担体の表面に分散されて担持されていることが好ましく、このような炭素質材料としてはカーボンブラック、ケッチェンブラック、アセチレンブラック、カーボンナノチューブ等が挙げられる。また、炭素質材料担体の酸化劣化の観点から、耐酸化性の高い酸化錫(SnOx)や酸化チタン(TiOx)などの金属酸化物担体を使用してもよく、炭素質材料担体と金属酸化物担体とを混合して使用してもよい。担体は、粒径が10nm〜1mm程度、比表面積が10〜1000m2/g程度であることが好ましい。白金コアシェル触媒は、主に静電的相互作用によって担体の表面に担持されていると考えられるが、より強固に担持させて担体表面からの触媒の脱落を低減するためには、白金コアシェル触媒と担体との間に化学的結合を形成して担持してもよい。
【0021】
本発明の白金コアシェル触媒は、(1)金化合物、白金化合物、還元剤及び微粒子化剤を含む混合物を撹拌混合し、金及び白金を含有するコアを得るステップと、(2)前記(1)で得たコアを炭素質材料からなる担体に担持させるステップと、(3)前記(1)で得たコアの表面に白金原子を担持させて白金シェルを形成するステップとを含む製造方法で製造することができる。
金化合物及び白金化合物としては、例えば、金と白金の塩化物錯体を好ましく用いることができ、具体的には、四塩化金酸(HAuCl4)、塩化白金酸塩(K2PtCl4、K2PtBr4)を用いることができる。また、Pt(NH3)2(NO2)2等の錯体化合物を使用してもよい。これらはさらに塩になっていてもよく、水和物になっていてもよい。
【0022】
前記の金化合物及び白金化合物を還元して金属微粒子を形成するための還元剤としては、クエン酸、アスコルビン酸、コハク酸、リンゴ酸、酒石酸、マレイン酸、ニトリロ三酢酸等の有機酸、水素化ホウ素ナトリウム、水素化リチウムアルミニウム、ヨウ化水素、水素ガス等の水素化合物を用いることができ、有機酸としてはクエン酸又はアスコルビン酸、水素化合物では水酸化ホウ素ナトリウムを用いることが好ましい。これらの還元剤は1種のみを用いてもよく、2種以上を組み合わせて使用することもできる。
【0023】
微粒子化剤としては、コア微粒子を形成する金及び白金に配位可能であり、かつ、酸/塩基洗浄、又は加熱等によって微粒子の表面から脱離しうる化合物を使用することが好ましい。例えば、タンニン酸等の有機酸、アルキルアミン等の窒素原子を有する化合物、アルカンジオール等の酸素含有化合物、アルキルチオール等の硫黄原子を有する化合物等を用いることができ、AuPtコアを得るためには、タンニン酸や、炭素数が6〜22程度のアルキル鎖を有するアルキルチオール、例えば、ドデカンチオール(C12H25SH)を好ましく用いることができる。
前記の還元剤と微粒子化剤は、同一の物質が両方の機能を有する場合もあり、同一物質で併用可能である場合もある。
【0024】
前記の金化合物、白金化合物、還元剤及び微粒子化剤を含む混合物には、必要に応じてさらに別の物質を含んでいてもよく、例えば、溶媒、相間移動剤等を含んでいてもよい。
【0025】
ステップ(1)の反応温度及び反応時間は、金属ナノ粒子の製造において常用される範囲から適宜選択することが可能であり、例えば、0〜80℃において、10秒〜10時間の反応時間とすることができる。反応温度は、撹拌開始から終了まで同一温度としてもよく、所望に応じて、例えば、得られるコア粒径を制御することを目的として、急冷、徐冷等、温度を変化させてもよい。
【0026】
ステップ(2)として、前記(1)で得たコアを炭素質材料からなる担体に担持させる工程がある。ステップ(1)及び(2)を同時に行う場合、金化合物、白金化合物等を含む混合物にさらに担体を混合し、撹拌することにより行うことができる。ステップ(2)をステップ(1)の後に逐次的に行う場合、ステップ(1)で得た反応混合物から、AuPtコアを分離、精製、洗浄等によって取り出し、担体に担持させることができる。
【0027】
また本発明の製造方法は、ステップ(3)として、ステップ(1)で得たコアの表面に白金原子を担持させて白金シェルを形成するステップを含む。かかるステップは公知の方法で行うことができる。例えば、WO2011/115012号に開示されているように、還元剤の不存在下で二価白金イオンを含む溶液にAuPtコアを浸漬し、AuPtコア粒子の外層に白金を析出させてもよい。或いは、アンダーポテンシャル析出法(UPD法)を用いて、AuPtコア粒子を銅の単原子膜で被覆した後に、銅原子と白金原子を置換させて、白金シェルを形成することもできる。
また、本発明の製造方法には、前述のステップの他、必要に応じて分離、精製、洗浄工程等を含むことができる。
【0028】
以下、実施例を用いて本発明をより具体的に説明するが、本発明は実施例に限定されるものではない。
【実施例】
【0029】
[作製例1]AuPtコアの作製1
(i)AuPtコア(Au:Pt=90:10)担持カーボン担体の合成
アルゴンガス通気下で60℃に調整した、水250mLにクエン酸3ナトリウム12.5g及びタンニン酸1.25gを含む溶液に、カーボン担体(Ketjen black EC 300 J, 比表面積800 m2/g)34mg、及び、水250mL中に四塩化金酸0.1125mmol及び六塩化白金酸0.0125mmolを含み、アルゴンガス通気下で60℃に調整した溶液を混合し、1分間撹拌した。続いて5℃に急冷して30分間撹拌後、さらに10分間撹拌した。その後、5N塩酸を添加してpH=4.5に調整し、続いて10分間撹拌し、未洗浄のカーボン担持AuPtコア(Au:Pt=90:10。以下、Au90Pt10/Cと記載する)を得た。
(ii)Au90Pt10/Cの洗浄
水250mLに(i)のAu90Pt10/Cを約45mg添加し、アンモニア水でpH=11に調整し、30分間超音波処理を行った後、濾別により分離した。この操作を5回繰り返した。
さらに、水250mLにアルカリ洗浄後のAu90Pt10/Cを添加し、30分間超音波処理を行った後、濾別により分離した。この操作を3回繰り返した。
その後、60℃で乾燥し、洗浄したAu90Pt10/Cを得た。
(iii)分析
得られたAu90Pt10/Cを透過型電子顕微鏡(TEM)で観察したところ、カーボン担体に担持された微粒子が確認された。得られたTEM画像中の500個のAu90Pt10コアの直径を測定して粒度分布を得、粒度分布よりAuPtコアの平均粒径を算出したところ、平均粒径は2.0nmであった。
【0030】
[作製例2]AuPtコアの作製2
(i)AuPtコア(Au:Pt=90:10)の合成
分液漏斗に、四塩化金酸及び六塩化白金酸を9:1(モル比)で含む水溶液、及び、相間移動剤であるテトラオクチルアンモニウムブロマイドのトルエン溶液を仕込んで振盪撹拌後、水層を除去し、油層を得た。続いて油層をビーカーに移し、ドデカンチオールを添加して室温で10分間撹拌した。続いて水素化ホウ素ナトリウム水溶液を添加し、室温で3時間撹拌した。この反応液を分液漏斗で振盪撹拌・分離し、水層を除去し、油層を得た。溶媒(トルエン)をエバポレータで留去し、未洗浄のAu90Pt10コアを得た。
(ii)Au90Pt10コアの洗浄
(i)で得たAu90Pt10コアをn−ヘキサンに再分散し、超音波を30分間照射した。その後、エタノールを添加してAu90Pt10コアを沈殿させ、遠心分離後、上澄みを除去した。この操作を4回繰り返し、Au90Pt10コアを洗浄した。最終的に、Au90Pt10コアをn−ヘキサンに分散させた。
(iii)カーボン担体への担持
n−ヘキサンにカーボン担体であるケッチェンブラックEC300Jを超音波分散させた。この分散液とn−ヘキサンに分散させたAu90Pt10コアを混合し、超音波を30分間照射した。その後、一昼夜、常温で撹拌することにより、カーボン担持Au90Pt10コア(Au90Pt10/C)を得た。
(iv)分析
得られたAu90Pt10/Cを透過型電子顕微鏡(TEM)で観察したところ、カーボン担体に担持された微粒子が確認された。得られたTEM画像中の500個のAu90Pt10コアの直径を測定して粒度分布を得、粒度分布よりAuPtコアの平均粒径を算出したところ、平均粒径は1.6nmであった。なお、このAu90Pt10コア粒子表面には、微粒子化剤であるドデカンチオールが吸着している。この微粒子化剤を除去し、Au90Pt10コア表面を活性化する方法としては、例えば、酸素を含んだアルゴンガス雰囲気下、300℃で1時間熱処理し、その後、水素ガスを含んだアルゴンガス雰囲気下、400〜500℃で2時間熱処理を行う。
【0031】
図1(a)に従来品(参考例)であるカーボン担持金微粒子(Au/C、平均粒径5.0nm)のTEM写真、(b)、(c)に作製例1及び2のAu90Pt10/CのTEM写真を示す。従来品と比較して、作製例のAu90Pt10コアは、粒径が小さく、その粒子径分布が狭いことがわかる。また、微粒子同士の凝集が少なく、高分散にカーボン担体上に担持されていることがわかる。
【0032】
[実施例1]白金コアシェル触媒及び試験電極の作製
作製例1で得たAu90Pt10/Cを100mg、1mMの四塩化白金酸カリウムを含む水溶液1000mLに超音波分散後、アルゴン雰囲気下、30℃で24時間撹拌してコア表面に白金層を形成し、白金コアシェル触媒を得た。
また、この白金コアシェル触媒のn−ヘキサノール懸濁液を調製し、回転リングディスク電極のグラッシーカーボンディスク(直径6mm)上に、AuPtコアが14.1μg/cm2となるよう塗布担持し、試験電極を作製した。図2に回転リングディスク電極の構造を示す。ディスク部分に触媒を塗布担持させ、作用電極を回転させることにより電解液中に一定の対流を発生させ、物質移動を制御した。
【0033】
[比較例1]
比較例として、作製例1で得たAu90Pt10コア担持カーボン担体に、白金シェルを形成せずに、実施例1と同様に試験電極を作製した。
【0034】
[実施例2]電極の評価
実施例1で得た試験電極について、白金コアシェル触媒の白金表面積と白金被覆率を評価するため、アルゴンガス飽和した0.1Mの過塩素酸水溶液中で、RHE(可逆水素電極)に対して、0.05-1.7Vの電位幅でサイクリックボルタンメトリーを行った。走査電位速度は50mV/s、温度は25℃とした。
次いで、酸素で飽和した25℃の0.1M過塩素酸中で、回転リングディスク電極を1600rpm(回転/分)の速度で回転させ、10mV/sの走査速度で、RHEに対して0.05-1.0Vの電位幅で対流ボルタンメトリーを行い、酸素還元電流を測定して酸素還元反応活性(ORR活性)を評価した。
【0035】
[比較例2]
比較例1の試験電極について、実施例1と同様に試験を行った。
【0036】
図3(a)に実施例2及び比較例2のサイクリックボルタモグラムを示す。AuPtコア上にPtシェルを設けた場合(実施例2)、白金に特徴的な水素脱着波が0.05-0.4V付近に観察され、また0.8-1.2V付近に白金酸化物被膜形成/還元ピークが確認された。さらに、比較例2で見られた1.2V付近の金に特徴的な酸化物被膜/還元ピークが、実施例2では大きく減少した。この酸化物被膜/還元ピークの減少率から算出した白金の被覆率は75.7%であった。
図3(b)に実施例2及び比較例2のORR対流ボルタモグラムを示す。比較例2においても、酸素還元電流の立ち上がりが0.8V付近に見られる。そのORR活性は低いが、比較例2の表面に白金が存在することを示している。一方、実施例2では、1.0V付近から酸素還元電流が立ち上がり、白金シェル層の形成によってORR活性が向上していることがわかる。
また、中間生成物である過酸化水素の生成量は白金シェル層の形成によって大きく減少した。実施例2のORR表面積比活性(0.9Vにおける)は、従来の白金触媒と比較して約2.5倍に向上した。
【0037】
[実施例3]電極の耐久性評価
実施例1で得た試験電極について、アルゴンガス飽和した、60℃の0.1Mの過塩素酸水溶液中で、RHE(可逆水素電極)に対して0.6-1.0Vの電位幅、矩形波(3s/3s)で電位サイクル試験を行い、白金コアシェル触媒の耐久性を評価した。
【0038】
[比較例3、4]
従来品であるカーボン担持白金触媒(Pt/C、白金平均粒径:2.8nm、カーボン担体:Ketjen black EC 300 J、白金担持率:46.8%)(比較例3)、及び、コアが金のみで構成された白金コアシェル触媒(Pt/Au/C、金平均粒径:5nm)(比較例4)について、実施例3と同様のサイクル試験を行った。
【0039】
図4に、実施例3及び比較例3、4の、耐久性試験に伴う電気化学的表面積の変化を示す。グラフ中、横軸は電位サイクル回数を示し、縦軸はサイクル試験前の白金表面積を1とした白金表面積の値(割合)を示している。実施例3(●)では、比較例3(▲)、比較例4(◆)と比べ、電位サイクル試験回数の増加に伴う白金表面積の減少が小さく、耐久性に優れていることがわかる。特に、サイクル1000回時点では、比較例3、4では白金表面積がサイクル試験前の9割を下回っているのに対し、実施例3ではサイクル試験前の白金表面積がほぼ維持されている。実施例3では、予め金に白金を含ませたAuPtコアを用いているため、白金シェル原子のコアへの固溶が抑制された結果、耐久性が向上したと考えられる。
【技術分野】
【0001】
本発明は、燃料電池において酸素還元反応の触媒として用いるのに適した、白金コアシェル触媒とその製造方法、及び当該触媒を用いた燃料電池に関する。
【背景技術】
【0002】
固体高分子形燃料電池(PEFC)は、アノード側で水素の酸化反応を、カソード側で酸素の還元反応を起こすことにより、水のみを生成するクリーンエネルギーデバイスとして知られており、PEFCのカソード側の触媒としては、カーボンブラック担体に白金微粒子を高分散担持させた白金担持カーボン触媒(Pt/C触媒)が知られている。Pt/C触媒は、触媒活性が高く、電気伝導性が高いという利点を有し、また、貴金属であるため、周辺環境の状態や周辺環境に存在する物質により腐食や被毒を受けにくいという利点を有する。
しかし、白金は価格が高く、資源量も少ないことから、白金の利用効率や耐久性を向上させて、白金の使用量を低減することが求められている。
【0003】
そこで、異種金属上に白金を被覆してなる白金コアシェル触媒が注目されている。白金コアシェル触媒は、白金原子層(シェル)で被覆された異種金属微粒子(コア金属)が担体に高分散担持された構成を有する。このような構成とすれば、白金量を少なくしつつ、触媒の表面積の増大を図ることができるため、白金の質量当たりの活性を向上させ、使用する白金量の低減を図ることができる。
【0004】
白金(Pt)シェルに対するコア金属の一つとして、金(Au)が知られている。金は貴金属であり、白金よりもイオン化傾向が小さく、酸化に対して安定であり、また白金よりもはるかに資源量が多いことから、コア金属の一つとして期待されている。
例えば、特開2010−92725号公報(特許文献1)には、コア粒子を1〜10nmのAuまたはその合金で構成し、コアの表面に厚さが2nm以下のPtまたはその合金のシェル層を形成した触媒が開示されている。当該文献にはまた、Au(コア)の格子定数がPt(シェル)の格子定数よりも大きいために、当該発明の白金コアシェル触媒は耐久性が高いと考えられるとの記載があり、さらに、Auコアに他種の金属を添加する場合には、コアの格子定数がシェルの格子定数よりも大きくなるように添加元素の種類および添加量を選択することが好ましいとの開示がある。
【0005】
しかしながらこのような白金コアシェル触媒を実用に供するためには、耐久性が未だ充分ではなかった。なかでも、Auコアを用いる白金コアシェル触媒では、PtとAuとが互いに固溶する性質を有するため、電位サイクルを繰り返すに従ってシェルのPt原子が徐々にAuコアに固溶し、触媒表面のPt原子がAuコア内に埋没して触媒活性が低下するという問題があった。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2010−92725号公報
【発明の概要】
【発明が解決しようとする課題】
【0007】
したがって本発明は、白金コアシェル触媒において、シェルである白金がコアに固溶埋没することを抑制し、白金コアシェル触媒の耐久性を向上させることを課題とする。
【課題を解決するための手段】
【0008】
本発明者らは前記課題を解決するために検討を繰り返す中で、コア材料として化学的に安定な金を使用し、さらに、金コア内に予め白金を添加しておくことで、シェルの白金原子の金コアへの固溶を抑制することが可能となり、白金シェルの耐久性が向上することを見出し、本発明を完成した。
【0009】
すなわち、本発明は、金及び白金を含有するコアと、当該コアの外層に形成された白金のシェルとを有する、燃料電池用の白金コアシェル触媒に関する。
本発明の白金コアシェル触媒は、白金シェルが金及び白金を含有する金属微粒子(コア)の外層として形成されているので、白金の利用効率は100%と高く、触媒質量当たりの活性(質量活性)を向上させることができる。また、本発明では、コアである金属微粒子が、金及び白金を含有しているため、シェルの白金原子がコアへ固溶することが抑制され、シェル中の白金原子の固溶埋没を抑制することができる。すなわち、本発明の白金コアシェル触媒では、高い白金利用効率に基づく高い質量活性と、白金シェルがコア内に固溶することを抑止した構造に基づく高い耐久性を同時に提供することができる。
【0010】
本発明の白金コアシェル触媒は、コアの粒径が1〜10nm、より好ましくは1〜5nmである。コアの粒径を1〜5nmとすれば、表面積の大きな触媒が得られ、白金コアシェル触媒の触媒活性を向上させることができ、また、コア表面に設けるシェル層形成に必要なPt原子数が減少し、高価な白金の使用量を一層低減させることができる。さらに、コア粒径が小さければ、コアに固溶しうる白金量が減少するため、コア内への白金固溶量が減少し、白金コアシェル触媒の耐久性を高めることができる。したがって、コア粒子径を減少させることは、触媒性能、コスト面および耐久性の面で有利である。
【0011】
本発明の白金コアシェル触媒は、炭素質材料からなる担体に担持されていることが好ましい。また、炭素質材料担体の酸化劣化の観点から、耐酸化性の高い酸化錫(SnOx)や酸化チタン(TiOx)などの金属酸化物担体、あるいはこれらの金属酸化物と炭素質材料を混合した担体を使用してもよい。また、本発明の白金コアシェル触媒は、燃料電池における酸化還元反応の触媒として好適に利用することができる。
【0012】
また、本発明は、(1)金含有化合物、白金含有化合物、還元剤及び微粒子化剤を含む混合物を撹拌混合し、金及び白金を含有するコアを得るステップと、(2)前記(1)で得たコアを炭素質材料からなる担体に担持させるステップと、(3)前記(1)で得たコアの表面に白金原子を担持させて白金シェルを形成するステップと、を含むことを特徴とする燃料電池用の白金コアシェル触媒の製造方法に関する。
本発明の方法によれば、金及び白金を含有する金属微粒子であるコアを得ることができ、当該コアの表面に白金シェル層を有し、炭素質材料に担持された白金コアシェル触媒を得ることができる。
【0013】
本発明の方法は、前記(1)と(2)とを同時に行うことができる。すなわち、金化合物、白金化合物、還元剤及び微粒子化剤の混合物にさらに炭素質材料からなる担体を混合して撹拌する方法によって、炭素質材料に担持された金・白金含有コア(以下、AuPtコアと記載する)を得ることができる。
【0014】
また、本発明の方法は、前記(1)と(2)とを逐次的に行うことができる。すなわち、まず、ステップ(1)によってAuPtコアを形成し、必要に応じて分離・洗浄等を行った後に、当該コアを炭素質材料に担持させることもできる。
上記の各方法で製造された白金コアシェル触媒は、燃料電池における酸化還元反応の触媒として好適に利用することができる。
【発明の効果】
【0015】
本発明の白金コアシェル触媒は耐久性が高く、触媒活性を長期間に渡って維持することが可能である。また、本発明の方法によれば、耐久性に優れた白金コアシェル触媒を、特別な設備等を用いることなく効率的に製造することができる。本発明の白金コアシェル触媒は燃料電池の触媒として用いることができるため、燃料電池のコストの飛躍的低減が可能となる。
【図面の簡単な説明】
【0016】
【図1】(a)は従来品であるカーボン担持金微粒子の透過型電子顕微鏡(TEM)写真である。(b)及び(c)は本発明のカーボン担持AuPtコア微粒子の透過型電子顕微鏡(TEM)写真である。
【図2】酸素還元活性(ORR活性)評価に使用した回転リングディスク電極を模式的に示す図である。
【図3】(a)は実施例2及び比較例2のサイクリックボルタモグラムを示す図である。(b)は実施例2及び比較例2の対流ボルタモグラムを示す図である。
【図4】実施例3、比較例3及び比較例4の電位サイクル試験結果を示す図である。
【発明を実施するための形態】
【0017】
本発明の白金コアシェル触媒のコアは金及び白金を含有することを特徴とし、金と白金の割合は特に制限されないが、例えばモル比において20:1〜3:1とすることができ、15:1〜5:1とすることが好ましい。常温付近のバルク金属では、白金の金への固溶限界は約17原子%であることから、作製するコア微粒子を安定化させるため、白金含有割合を固溶限界以下にすることが好ましい。
本発明のAuPtコアは、金及び白金以外にも、本発明の効果に影響を与えない範囲で他種金属を含んでいてもよい。また、製造の過程で使用される添加剤(還元剤、微粒子化剤等)の残渣或いは一部を含んでいてもよい。
【0018】
AuPtコアの大きさは、粒径が1〜10nmであることが好ましく、1〜5nmであることがさらに好ましい。粒径を1nmより大きくすることで、安定的にコアを製造し、さらに表面に白金シェルを形成した白金コアシェル触媒を得ることが可能であり、粒径を10nm以下とすることで、触媒の表面積を大きくして、触媒の酸素還元の反応性を向上させることができる。コアの粒径を5nm以下とすると特に、大きな表面積を得ることができ、白金シェル形成に必要な白金原子数が減少し、また、コアに固溶する白金量を低減することが可能であり、触媒活性、コスト及び耐久性で有利な白金コアシェル触媒を得ることができる。
なお、本明細書中でAuPtコアの粒径とは、透過型電子顕微鏡(TEM)画像から算出した粒径、或いは、X線回折にシェラー式を適用して算出した値を意味している。
【0019】
本発明の白金コアシェル触媒は、前記AuPtコアの外層に白金原子のシェルが形成されている。かかるシェルは主成分が白金原子であるが、白金原子以外にも、所望の触媒活性を満たす範囲で、他の原子及び/又は分子を含有していてもよい。例えば、金、銀、ルテニウム等の貴金属、製造過程で添加される白金化合物や有機化合物の残渣等が含まれていてもよい。
白金シェルの平均的厚みは、白金原子の単原子層〜二原子層であることが好ましい。酸素還元触媒としての活性を有する白金原子は、シェルの最外層(最表面)に位置する白金原子のみであるので、シェル層の厚みを増すことには特段の利点がない。
【0020】
本発明の白金コアシェル触媒は、炭素質材料からなる担体の表面に分散されて担持されていることが好ましく、このような炭素質材料としてはカーボンブラック、ケッチェンブラック、アセチレンブラック、カーボンナノチューブ等が挙げられる。また、炭素質材料担体の酸化劣化の観点から、耐酸化性の高い酸化錫(SnOx)や酸化チタン(TiOx)などの金属酸化物担体を使用してもよく、炭素質材料担体と金属酸化物担体とを混合して使用してもよい。担体は、粒径が10nm〜1mm程度、比表面積が10〜1000m2/g程度であることが好ましい。白金コアシェル触媒は、主に静電的相互作用によって担体の表面に担持されていると考えられるが、より強固に担持させて担体表面からの触媒の脱落を低減するためには、白金コアシェル触媒と担体との間に化学的結合を形成して担持してもよい。
【0021】
本発明の白金コアシェル触媒は、(1)金化合物、白金化合物、還元剤及び微粒子化剤を含む混合物を撹拌混合し、金及び白金を含有するコアを得るステップと、(2)前記(1)で得たコアを炭素質材料からなる担体に担持させるステップと、(3)前記(1)で得たコアの表面に白金原子を担持させて白金シェルを形成するステップとを含む製造方法で製造することができる。
金化合物及び白金化合物としては、例えば、金と白金の塩化物錯体を好ましく用いることができ、具体的には、四塩化金酸(HAuCl4)、塩化白金酸塩(K2PtCl4、K2PtBr4)を用いることができる。また、Pt(NH3)2(NO2)2等の錯体化合物を使用してもよい。これらはさらに塩になっていてもよく、水和物になっていてもよい。
【0022】
前記の金化合物及び白金化合物を還元して金属微粒子を形成するための還元剤としては、クエン酸、アスコルビン酸、コハク酸、リンゴ酸、酒石酸、マレイン酸、ニトリロ三酢酸等の有機酸、水素化ホウ素ナトリウム、水素化リチウムアルミニウム、ヨウ化水素、水素ガス等の水素化合物を用いることができ、有機酸としてはクエン酸又はアスコルビン酸、水素化合物では水酸化ホウ素ナトリウムを用いることが好ましい。これらの還元剤は1種のみを用いてもよく、2種以上を組み合わせて使用することもできる。
【0023】
微粒子化剤としては、コア微粒子を形成する金及び白金に配位可能であり、かつ、酸/塩基洗浄、又は加熱等によって微粒子の表面から脱離しうる化合物を使用することが好ましい。例えば、タンニン酸等の有機酸、アルキルアミン等の窒素原子を有する化合物、アルカンジオール等の酸素含有化合物、アルキルチオール等の硫黄原子を有する化合物等を用いることができ、AuPtコアを得るためには、タンニン酸や、炭素数が6〜22程度のアルキル鎖を有するアルキルチオール、例えば、ドデカンチオール(C12H25SH)を好ましく用いることができる。
前記の還元剤と微粒子化剤は、同一の物質が両方の機能を有する場合もあり、同一物質で併用可能である場合もある。
【0024】
前記の金化合物、白金化合物、還元剤及び微粒子化剤を含む混合物には、必要に応じてさらに別の物質を含んでいてもよく、例えば、溶媒、相間移動剤等を含んでいてもよい。
【0025】
ステップ(1)の反応温度及び反応時間は、金属ナノ粒子の製造において常用される範囲から適宜選択することが可能であり、例えば、0〜80℃において、10秒〜10時間の反応時間とすることができる。反応温度は、撹拌開始から終了まで同一温度としてもよく、所望に応じて、例えば、得られるコア粒径を制御することを目的として、急冷、徐冷等、温度を変化させてもよい。
【0026】
ステップ(2)として、前記(1)で得たコアを炭素質材料からなる担体に担持させる工程がある。ステップ(1)及び(2)を同時に行う場合、金化合物、白金化合物等を含む混合物にさらに担体を混合し、撹拌することにより行うことができる。ステップ(2)をステップ(1)の後に逐次的に行う場合、ステップ(1)で得た反応混合物から、AuPtコアを分離、精製、洗浄等によって取り出し、担体に担持させることができる。
【0027】
また本発明の製造方法は、ステップ(3)として、ステップ(1)で得たコアの表面に白金原子を担持させて白金シェルを形成するステップを含む。かかるステップは公知の方法で行うことができる。例えば、WO2011/115012号に開示されているように、還元剤の不存在下で二価白金イオンを含む溶液にAuPtコアを浸漬し、AuPtコア粒子の外層に白金を析出させてもよい。或いは、アンダーポテンシャル析出法(UPD法)を用いて、AuPtコア粒子を銅の単原子膜で被覆した後に、銅原子と白金原子を置換させて、白金シェルを形成することもできる。
また、本発明の製造方法には、前述のステップの他、必要に応じて分離、精製、洗浄工程等を含むことができる。
【0028】
以下、実施例を用いて本発明をより具体的に説明するが、本発明は実施例に限定されるものではない。
【実施例】
【0029】
[作製例1]AuPtコアの作製1
(i)AuPtコア(Au:Pt=90:10)担持カーボン担体の合成
アルゴンガス通気下で60℃に調整した、水250mLにクエン酸3ナトリウム12.5g及びタンニン酸1.25gを含む溶液に、カーボン担体(Ketjen black EC 300 J, 比表面積800 m2/g)34mg、及び、水250mL中に四塩化金酸0.1125mmol及び六塩化白金酸0.0125mmolを含み、アルゴンガス通気下で60℃に調整した溶液を混合し、1分間撹拌した。続いて5℃に急冷して30分間撹拌後、さらに10分間撹拌した。その後、5N塩酸を添加してpH=4.5に調整し、続いて10分間撹拌し、未洗浄のカーボン担持AuPtコア(Au:Pt=90:10。以下、Au90Pt10/Cと記載する)を得た。
(ii)Au90Pt10/Cの洗浄
水250mLに(i)のAu90Pt10/Cを約45mg添加し、アンモニア水でpH=11に調整し、30分間超音波処理を行った後、濾別により分離した。この操作を5回繰り返した。
さらに、水250mLにアルカリ洗浄後のAu90Pt10/Cを添加し、30分間超音波処理を行った後、濾別により分離した。この操作を3回繰り返した。
その後、60℃で乾燥し、洗浄したAu90Pt10/Cを得た。
(iii)分析
得られたAu90Pt10/Cを透過型電子顕微鏡(TEM)で観察したところ、カーボン担体に担持された微粒子が確認された。得られたTEM画像中の500個のAu90Pt10コアの直径を測定して粒度分布を得、粒度分布よりAuPtコアの平均粒径を算出したところ、平均粒径は2.0nmであった。
【0030】
[作製例2]AuPtコアの作製2
(i)AuPtコア(Au:Pt=90:10)の合成
分液漏斗に、四塩化金酸及び六塩化白金酸を9:1(モル比)で含む水溶液、及び、相間移動剤であるテトラオクチルアンモニウムブロマイドのトルエン溶液を仕込んで振盪撹拌後、水層を除去し、油層を得た。続いて油層をビーカーに移し、ドデカンチオールを添加して室温で10分間撹拌した。続いて水素化ホウ素ナトリウム水溶液を添加し、室温で3時間撹拌した。この反応液を分液漏斗で振盪撹拌・分離し、水層を除去し、油層を得た。溶媒(トルエン)をエバポレータで留去し、未洗浄のAu90Pt10コアを得た。
(ii)Au90Pt10コアの洗浄
(i)で得たAu90Pt10コアをn−ヘキサンに再分散し、超音波を30分間照射した。その後、エタノールを添加してAu90Pt10コアを沈殿させ、遠心分離後、上澄みを除去した。この操作を4回繰り返し、Au90Pt10コアを洗浄した。最終的に、Au90Pt10コアをn−ヘキサンに分散させた。
(iii)カーボン担体への担持
n−ヘキサンにカーボン担体であるケッチェンブラックEC300Jを超音波分散させた。この分散液とn−ヘキサンに分散させたAu90Pt10コアを混合し、超音波を30分間照射した。その後、一昼夜、常温で撹拌することにより、カーボン担持Au90Pt10コア(Au90Pt10/C)を得た。
(iv)分析
得られたAu90Pt10/Cを透過型電子顕微鏡(TEM)で観察したところ、カーボン担体に担持された微粒子が確認された。得られたTEM画像中の500個のAu90Pt10コアの直径を測定して粒度分布を得、粒度分布よりAuPtコアの平均粒径を算出したところ、平均粒径は1.6nmであった。なお、このAu90Pt10コア粒子表面には、微粒子化剤であるドデカンチオールが吸着している。この微粒子化剤を除去し、Au90Pt10コア表面を活性化する方法としては、例えば、酸素を含んだアルゴンガス雰囲気下、300℃で1時間熱処理し、その後、水素ガスを含んだアルゴンガス雰囲気下、400〜500℃で2時間熱処理を行う。
【0031】
図1(a)に従来品(参考例)であるカーボン担持金微粒子(Au/C、平均粒径5.0nm)のTEM写真、(b)、(c)に作製例1及び2のAu90Pt10/CのTEM写真を示す。従来品と比較して、作製例のAu90Pt10コアは、粒径が小さく、その粒子径分布が狭いことがわかる。また、微粒子同士の凝集が少なく、高分散にカーボン担体上に担持されていることがわかる。
【0032】
[実施例1]白金コアシェル触媒及び試験電極の作製
作製例1で得たAu90Pt10/Cを100mg、1mMの四塩化白金酸カリウムを含む水溶液1000mLに超音波分散後、アルゴン雰囲気下、30℃で24時間撹拌してコア表面に白金層を形成し、白金コアシェル触媒を得た。
また、この白金コアシェル触媒のn−ヘキサノール懸濁液を調製し、回転リングディスク電極のグラッシーカーボンディスク(直径6mm)上に、AuPtコアが14.1μg/cm2となるよう塗布担持し、試験電極を作製した。図2に回転リングディスク電極の構造を示す。ディスク部分に触媒を塗布担持させ、作用電極を回転させることにより電解液中に一定の対流を発生させ、物質移動を制御した。
【0033】
[比較例1]
比較例として、作製例1で得たAu90Pt10コア担持カーボン担体に、白金シェルを形成せずに、実施例1と同様に試験電極を作製した。
【0034】
[実施例2]電極の評価
実施例1で得た試験電極について、白金コアシェル触媒の白金表面積と白金被覆率を評価するため、アルゴンガス飽和した0.1Mの過塩素酸水溶液中で、RHE(可逆水素電極)に対して、0.05-1.7Vの電位幅でサイクリックボルタンメトリーを行った。走査電位速度は50mV/s、温度は25℃とした。
次いで、酸素で飽和した25℃の0.1M過塩素酸中で、回転リングディスク電極を1600rpm(回転/分)の速度で回転させ、10mV/sの走査速度で、RHEに対して0.05-1.0Vの電位幅で対流ボルタンメトリーを行い、酸素還元電流を測定して酸素還元反応活性(ORR活性)を評価した。
【0035】
[比較例2]
比較例1の試験電極について、実施例1と同様に試験を行った。
【0036】
図3(a)に実施例2及び比較例2のサイクリックボルタモグラムを示す。AuPtコア上にPtシェルを設けた場合(実施例2)、白金に特徴的な水素脱着波が0.05-0.4V付近に観察され、また0.8-1.2V付近に白金酸化物被膜形成/還元ピークが確認された。さらに、比較例2で見られた1.2V付近の金に特徴的な酸化物被膜/還元ピークが、実施例2では大きく減少した。この酸化物被膜/還元ピークの減少率から算出した白金の被覆率は75.7%であった。
図3(b)に実施例2及び比較例2のORR対流ボルタモグラムを示す。比較例2においても、酸素還元電流の立ち上がりが0.8V付近に見られる。そのORR活性は低いが、比較例2の表面に白金が存在することを示している。一方、実施例2では、1.0V付近から酸素還元電流が立ち上がり、白金シェル層の形成によってORR活性が向上していることがわかる。
また、中間生成物である過酸化水素の生成量は白金シェル層の形成によって大きく減少した。実施例2のORR表面積比活性(0.9Vにおける)は、従来の白金触媒と比較して約2.5倍に向上した。
【0037】
[実施例3]電極の耐久性評価
実施例1で得た試験電極について、アルゴンガス飽和した、60℃の0.1Mの過塩素酸水溶液中で、RHE(可逆水素電極)に対して0.6-1.0Vの電位幅、矩形波(3s/3s)で電位サイクル試験を行い、白金コアシェル触媒の耐久性を評価した。
【0038】
[比較例3、4]
従来品であるカーボン担持白金触媒(Pt/C、白金平均粒径:2.8nm、カーボン担体:Ketjen black EC 300 J、白金担持率:46.8%)(比較例3)、及び、コアが金のみで構成された白金コアシェル触媒(Pt/Au/C、金平均粒径:5nm)(比較例4)について、実施例3と同様のサイクル試験を行った。
【0039】
図4に、実施例3及び比較例3、4の、耐久性試験に伴う電気化学的表面積の変化を示す。グラフ中、横軸は電位サイクル回数を示し、縦軸はサイクル試験前の白金表面積を1とした白金表面積の値(割合)を示している。実施例3(●)では、比較例3(▲)、比較例4(◆)と比べ、電位サイクル試験回数の増加に伴う白金表面積の減少が小さく、耐久性に優れていることがわかる。特に、サイクル1000回時点では、比較例3、4では白金表面積がサイクル試験前の9割を下回っているのに対し、実施例3ではサイクル試験前の白金表面積がほぼ維持されている。実施例3では、予め金に白金を含ませたAuPtコアを用いているため、白金シェル原子のコアへの固溶が抑制された結果、耐久性が向上したと考えられる。
【特許請求の範囲】
【請求項1】
金及び白金を含有するコアと、当該コアの外層に形成された白金のシェルとを有する、燃料電池用の白金コアシェル触媒。
【請求項2】
前記コアの粒径が1〜10nmであることを特徴とする、請求項1に記載の触媒。
【請求項3】
前記コアの粒径が1〜5nmであることを特徴とする、請求項1に記載の触媒。
【請求項4】
前記触媒が、炭素質材料からなる坦体に担持されていることを特徴とする、請求項1〜3のいずれかに記載の触媒。
【請求項5】
請求項1〜4のいずれか1項に記載の触媒を用いた、白金コアシェル触媒を酸素還元反応の触媒として利用する燃料電池。
【請求項6】
(1)金含有化合物、白金含有化合物、還元剤及び微粒子化剤を含む混合物を撹拌混合し、金及び白金を含有するコアを得るステップと、
(2)前記(1)で得たコアを炭素質材料からなる担体に担持させるステップと、
(3)前記(1)で得たコアの表面に白金原子を担持させて白金シェルを形成するステップと、
を含むことを特徴とする、燃料電池用の白金コアシェル触媒の製造方法。
【請求項7】
前記ステップ(1)及び(2)を、同時に行うことを特徴とする、請求項6に記載の製造方法。
【請求項8】
前記ステップ(1)及び(2)を、逐次的に行うことを特徴とする、請求項6に記載の製造方法。
【請求項9】
請求項6〜8のいずれか1項に記載の方法によって製造された白金コアシェル触媒を酸素還元反応の触媒として利用する燃料電池。
【請求項1】
金及び白金を含有するコアと、当該コアの外層に形成された白金のシェルとを有する、燃料電池用の白金コアシェル触媒。
【請求項2】
前記コアの粒径が1〜10nmであることを特徴とする、請求項1に記載の触媒。
【請求項3】
前記コアの粒径が1〜5nmであることを特徴とする、請求項1に記載の触媒。
【請求項4】
前記触媒が、炭素質材料からなる坦体に担持されていることを特徴とする、請求項1〜3のいずれかに記載の触媒。
【請求項5】
請求項1〜4のいずれか1項に記載の触媒を用いた、白金コアシェル触媒を酸素還元反応の触媒として利用する燃料電池。
【請求項6】
(1)金含有化合物、白金含有化合物、還元剤及び微粒子化剤を含む混合物を撹拌混合し、金及び白金を含有するコアを得るステップと、
(2)前記(1)で得たコアを炭素質材料からなる担体に担持させるステップと、
(3)前記(1)で得たコアの表面に白金原子を担持させて白金シェルを形成するステップと、
を含むことを特徴とする、燃料電池用の白金コアシェル触媒の製造方法。
【請求項7】
前記ステップ(1)及び(2)を、同時に行うことを特徴とする、請求項6に記載の製造方法。
【請求項8】
前記ステップ(1)及び(2)を、逐次的に行うことを特徴とする、請求項6に記載の製造方法。
【請求項9】
請求項6〜8のいずれか1項に記載の方法によって製造された白金コアシェル触媒を酸素還元反応の触媒として利用する燃料電池。
【図4】


【図1】


【図2】


【図3】




【図1】


【図2】


【図3】


【公開番号】特開2013−89287(P2013−89287A)
【公開日】平成25年5月13日(2013.5.13)
【国際特許分類】
【出願番号】特願2011−225503(P2011−225503)
【出願日】平成23年10月13日(2011.10.13)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成23年度、独立行政法人新エネルギー・産業技術総合開発機構「固体高分子形燃料電池実用化推進技術開発/基盤技術開発/低白金化技術」に係る委託研究、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(503027931)学校法人同志社 (346)
【Fターム(参考)】
【公開日】平成25年5月13日(2013.5.13)
【国際特許分類】
【出願日】平成23年10月13日(2011.10.13)
【国等の委託研究の成果に係る記載事項】(出願人による申告)平成23年度、独立行政法人新エネルギー・産業技術総合開発機構「固体高分子形燃料電池実用化推進技術開発/基盤技術開発/低白金化技術」に係る委託研究、産業技術力強化法第19条の適用を受ける特許出願
【出願人】(503027931)学校法人同志社 (346)
【Fターム(参考)】
[ Back to top ]

