皮脂産生抑制剤
【課題】
本発明の目的は、少量で効果を発揮し、長期間使用しても安全上問題のない皮脂産生抑制剤、該皮脂産生抑制剤を含有する化粧品、飲食品、医薬品、サプリメント、ペットフード等を提供することにある。
【解決手段】
温州みかん等に含まれるカロテノイド及び/又はその誘導体、特にクリプトキサンチン及び/又はその誘導体を含有することにより、少量で効果を発揮し、長期間使用しても問題ない皮脂産生抑制剤、該皮脂産生抑制剤を含有する化粧品、飲食品、医薬品、サプリメント、ペットフードである。
本発明の目的は、少量で効果を発揮し、長期間使用しても安全上問題のない皮脂産生抑制剤、該皮脂産生抑制剤を含有する化粧品、飲食品、医薬品、サプリメント、ペットフード等を提供することにある。
【解決手段】
温州みかん等に含まれるカロテノイド及び/又はその誘導体、特にクリプトキサンチン及び/又はその誘導体を含有することにより、少量で効果を発揮し、長期間使用しても問題ない皮脂産生抑制剤、該皮脂産生抑制剤を含有する化粧品、飲食品、医薬品、サプリメント、ペットフードである。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、皮脂の産生を抑制する皮脂産生抑制剤、該剤を含有する化粧品、飲食品、医薬品、飼料、ペットフードに関する。
【背景技術】
【0002】
皮膚の付属器官である皮脂腺より分泌された皮脂は、表皮に脂肪膜を形成することで外界物質に対する緩衝機能、殺菌機能、内因性物質の排泄作用などの生理的に重要な機能を担っている(例えば、非特許文献1、2参照)。そのため、皮脂線の機能異常、すなわち皮脂の過剰分泌および分泌低下は、それぞれ尋常性ざ瘡、脂漏性皮疹、乾皮症(乾燥肌)といった皮膚疾患の発症に密接に関連している。なかでも、皮脂分泌亢進に起因したざ瘡は、主として顔面に発症することから思春期のみならず成人の男女においても精神的ストレスを伴う皮膚疾患であり、患者のQuality of lifeを低下させる(例えば、非特許文献1〜4参照)。
【0003】
皮脂の産生・分泌には、男性ホルモンである5α−ジヒドロテストステロンやインスリンなどが関与することが報告されている(例えば、非特許文献5〜8参照)。また、リン酸化タンパク質の一つであり、細胞内脂肪滴の形成のみならず脂質合成・分解調節にも関与するペリリピンが、ハムスター皮脂腺において発現していることが報告されている(例えば、非特許文献9、10参照)。
【0004】
ざ瘡は毛胞閉塞および皮脂貯留によって面皰が生じる非炎症性ざ瘡と、偏性嫌気性グラム陽性桿菌であるPropionibacteriumacne(P. acne)の増殖およびそれに対する免疫応答に起因した炎症反応を伴う炎症性ざ瘡に分類される(例えば、非特許文献11、12参照)。両者は病理的に異なることから、ざ瘡治の二面性を踏まえた医療戦略が必須であると考えられる(例えば、非特許文献13参照)。非炎症性ざ瘡には表皮角化異常の改善のためレチノイン酸製剤である13−cis Retinoic acid(イソトレチノイン、以下「13cisRA」と略す)が、炎症性ざ瘡にはP.acneを標的とした経口抗菌剤が処方されている(例えば、非特許文献14参照)。また13cisRAは、ざ瘡の根本的な原因である皮脂産生の異常な亢進も直接的に抑制できるが(例えば、非特許文献15〜17参照)、その催奇形性の問題から長期間の薬剤使用は制限されている(例えば、非特許文献14参照)。したがって、皮脂産生を直接的に抑制することができる、安全かつ有効な医薬品の開発が望まれているのが現状である。
【0005】
これら状況を鑑み、天然の生薬等からの抽出物を用いた抑制剤(例えば、特許文献1、2参照)など、複数の皮脂産生抑制剤が存在する。
【0006】
しかしながら、上記のような公知の皮脂産生抑制剤はその安全性などに問題があり、また満足のいく効果が得られるものがなかった。これらの現状から、少量で安全に長期間使用しても問題のない皮脂産生抑制効果のある商品が求められていた。
【0007】
カロテノイドは、中央部に共役二重結合とメチル基の側差を持つ化合物であり、炭化水素のみで構成されているカロテンと酸素原子を含むキサントフィルに分類される。カロテンは、分子鎖の両端に環状の炭化水素を有するα−カロテン、β−カロテンと、分子鎖の両端に環状の炭化水素を有しないリコペンにも分類される。これらカロテノイドは、共役二重結合鎖や環状の炭化水素に付加される側鎖などによって多くの種類が存在し、構造が決定したカロテノイドは750種以上存在する。動物はカロテノイドを合成する作用が無く、植物や一部の微生物がカロテノイドの合成を可能としている。
【0008】
カロテノイドのうち、α−カロテン、β−カロテン、ルテイン/ゼアキサンチン、リコペン、クリプトキサンチンは、特に血中への移行性が高いカロテノイドとして知られており、臓器などにも蓄積することが知られている。また疫学研究などから心臓血管疾患などの発生と負の相関を持ち(例えば、非特許文献18参照)、黄斑変性の予防(例えば、非特許文献19参照)などの効果があると報告されている。
【0009】
しかしながら、カロテノイド及び/又はその誘導体が、脂腺に作用し、皮脂の産生を抑制することは知られていなかった。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開2003−212789号公報
【特許文献2】特開2005−206588号公報
【非特許文献】
【0011】
【非特許文献1】標準皮膚科学(瀧川雅浩,富田靖,橋本隆編) (2007) 医学書院, 25-27, 339-341.
【非特許文献2】Thiboutot, D. (2004) J. Invest. Dermatol. 123, 1-12
【非特許文献3】Farrar, M. D. and Ingham, E. (2004) Clin. Dermatol. 22, 380-384.
【非特許文献4】Zouboulis, C. C., Eady, A., Philpott, M., Goldsmith, L. A., Orfanos, C., Cunliffe, W. C., and Rossenfield, R. (2005) Exp. Dermatol. 14, 143-152.
【非特許文献5】Plewig, G. and Luderschmidt, C. (1977) J. Invest. Dermatol. 68, 171-176.
【非特許文献6】Akamatsu, H., Zouboulis, C. C., and Orfanos, C. E. (1992) J. Invest. Dermatol. 99, 509-511.
【非特許文献7】Deplewski, D. and Rosenfield, R. L. (1999) Endocrinology 140, 4089-4094.
【非特許文献8】Sato, T., Imai, N., Akimoto, N., Sakiguchi, T., Kitamura, K., and Ito, A. (2001) J. Invest. Dermatol. 117, 965-970.
【非特許文献9】Akimoto,N.,Sato,T.,Iwata,C.,Koshizuka,M.,Shibata,F.,Nagai,A., Sumida,M.,and Ito,A. (2005) J. Invest. Dermatol. 124, 1127-1133.
【非特許文献10】Kimmel, A. R., Brasaemle, D. L., McAndrews-Hill, M., Sztalryd, C., and Londos, C. (2010) J. Lipid Res. 51, 468-471.
【非特許文献11】Bojar, R. A. and Holland, K. T. (2004) Clin. Dermatol. 22, 357-379.
【非特許文献12】Pawin, H., Beylot, C., Chivot, M., Poli, F., Revuz, J., and Dreno, B. (2004) Eur. J. Dermatol. 14, 4-12.
【非特許文献13】皮膚科診療プラクティス18ニキビ治療の技法 (吉川福美,宮地良樹,瀧川雅浩編) (2005) 文光堂,48-52. 171-175.
【非特許文献14】Thiboutot, D., Gollnick, H., Bettoli, V., Dreno, B., Kang, S., Leyden, J. J., Shalita, A. R., Lozada, V. T., Berson, D., Finlay, A., Goh, C. L., Herane, M. I., Kaminsky, A., Kubba, R., Layton, A., Miyachi, Y., Perez, M., Martin, J. P., Ramos-E-Silva, M., See, J. A., Shear, N., Wolf, J. Jr. (2009) J. Am. Acad. Dermatol. 60, S1-S50.
【非特許文献15】Tsukada, M., Schroder, M., Roos, T. C., Chandraratna, R. A., Reichert, U., Merk, H. F., Orfanos, C. E., and Zouboulis, C. C. (2000) J. Invest. Dermatol. 115, 321-327.
【非特許文献16】Zouboulis, C. C. (2006) J. Invest. Dermatol. 126, 2154-2156.
【非特許文献17】Sato, T., Takahashi, A., Kojima, M., Akimoto, N., Yano, M., and Ito, A. (2007) J. Invest. Dermatol. 127, 2740-2748.
【非特許文献18】治療 Vol.84 果物と生活習慣病(杉浦 実)(2002)No.4 142−144
【非特許文献19】D Max Snodderly (1995) Am J Clin Nutr. 62,1448S−61S
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明の目的は、上記の問題を解決し、少量で効果を発揮し、長期間使用しても安全上問題のない皮脂産生抑制剤、該皮脂産生抑制剤を含有する化粧品、飲食品、医薬品、飼料、ペットフード等を提供することにある。
【課題を解決するための手段】
【0013】
本発明者らは、上記課題を解決するために鋭意検討した結果、意外にもカロテノイド及び/又はその誘導体、特にクリプトキサンチン及び/又はその誘導体に皮脂産生抑制効果を見出し、本発明に到達した。
【0014】
すなわち本発明は下記の通りである。
(1)カロテノイド及び/又はその誘導体を含有することを特徴とする皮脂産生抑制剤。
(2)カロテノイド及び/又はその誘導体が、クリプトキサンチン及び/又はその誘導体であることを特徴とする皮脂産生抑制剤。
(3)クリプトキサンチン及び/又はその誘導体が、かんきつ類由来であることを特徴とする(2)記載の皮脂産生抑制剤。
(4)かんきつ類が、温州みかんであることを特徴とする(3)記載の皮脂産生抑制剤。
【図面の簡単な説明】
【0015】
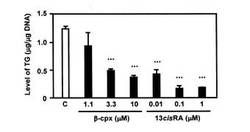
【図1】インスリン非誘導性のハムスター脂腺細胞のトリアシルグリセロール(TG)産生に対するβ-cryptoxanthin及び13cisRAによる抑制効果を比較したグラフである。
【図2】インスリン誘導性のハムスター脂腺細胞のトリアシルグリセロール(TG)産生に対するβ-cryptoxanthinおよび13cisRAによる抑制効果を比較したグラフである。
【図3】インスリン誘導性のハムスター脂腺細胞のトリアシルグリセロール(TG)産生に対するβ-cryptoxanthinおよび13cisRAによる経時的な抑制効果を比較したグラフである。
【図4】インスリン非誘導性(〔A〕)又はインスリン誘導性(〔B〕)のハムスター脂腺細胞のトリアシルグリセロール(TG)産生におけるβ-cryptoxanthinおよび13cisRAによる細胞内脂肪滴形成抑制効果を比較したグラフである。
【発明を実施するための形態】
【0016】
以下、本発明を詳細に説明する。
【0017】
本発明におけるカロテノイドは、特に限定されないが、αークリプトキサンチン、β−クリプトキサンチン、イソクリプトキサンチン、アクチノエリスロール、アスタキサンチン、アスタシン、アドニキサンチン、フェニコキサンチン、β−アポ−8´−カロテナール、β−アポ−8´−カロテノール、アロキサンチン、アンテラキサンチン、イソアゲラキサンチン、イソゼアサキンチン、イソレニエラテン、β−イソレニエラテン、イドキサンチン、エキネノン、3´−エピルテイン、エリスロキサンチン硫酸、オケノン、オシラキサンチン、カプサンチン、カブソルビン、カロキサンチン、α−カロテン、β−カロテン、β−カロテノン、δ−カロテン、ε−カロテン、ε,ε−カロテン−3.3´−ジオール、η−カロテン、ζ−カロテン、カンタキサンチン、ギロキサンチン、グアラキサンチン、クリスタキサンチン、クロコキサンチン、クロセチン、クロロキサンチン、クロロバクテン、ケトミクソコキサンチン、ケトミクソール・フコシド、ゲリオデスキサンチン、ザイノキサンチン、サーモゼアキサンチン、ジアジノキサンチン、ジアトキサンチン、ジアポニューロスポレン、ジアポフィトエン、4.4´−ジアポリコペンジアール、2,2´−ジケトスピリロキサンチン、3,4−デヒドロロドピン、デヒドロリコペン、シトラナキサンチン、シトラナキサンチン、シフォナキサンチン、スタフィロキサンチン、スピロキサンチン、スフェロイデノン、スフェノイデン、ゼアキサンチン、タラキサンチン、ツナキサンチン、デオキシフレキシキサンチン、デカプレノキサンチン、テチアテン、デメチルスフェロイデン、パピリオエリトリン、トリケントリオロジン、トルラロジン、トルレン、ニューロスポラキサンチン、ニューロスポレン、ネオキサンチン、ノストキサンチン、バクテリオルビキサンチン、バクテリオルベリン、バスタキサンチン、パピリオエリトリノン、パピリオエリトリン、パラシロキサンチン、ハラシンチアキサンチン、ビオラキサンチン、フィザリエン、フィトエン、フィトフルエン、フィリプシアキサンチン、フェニコキサンチン、フコキサンチン、プラシノキサンチン、フラブキサンチン、フリチュラキサンチン、プレクタニアキサンチン、ヘテロキサンチン、ペリジニン、ヘレニエン、ボーケリアキサンチン、ミクソキサンチン、ミチロキサンチン、ムタトキサンチン、ムタトクローム、メソ・ゼアキサンチン、モナドキサンチン、ラクツーカキサンチン、リコペン、ルテイン、ルビキサンチン、ロドキサンチン、ロドピナール、ロドピノール、ロドビブリン、ロドピン、ロロキサンチンなどが挙げられる。
【0018】
本発明におけるカロテノイドの誘導体としては、特に限定されないが、前記カロテノイドの脂肪酸エステル体、硫酸エステル体、水酸基付加体、脱水酸基体、配糖体などが挙げられる。
【0019】
脂肪酸エステル体としては、その脂肪酸がラウリン酸(C12)、ミリスチン酸(C14)、パルミチン酸(C16)、ステアリン酸(C18)などの脂肪酸エステルが挙げられる。
【0020】
上記カロテノイド及び/又はその誘導体のなかでも、皮脂産生抑制効果の観点から、経口摂取する場合は、β−クリプトキサンチン、α−カロテン、β−カロテン、リコペン、ルテイン/ゼアキサンチン、及び/又はそれら誘導体が好ましく、β−クリプトキサンチン及び/又はその誘導体が特に好ましい。
【0021】
経皮吸収する場合は、皮脂産生抑制効果の観点から、β−クリプトキサンチン及び/またはその誘導体、アスタキサンチン及び/又はその誘導体、フコキサンチン及び/又はその誘導体などが好ましく、β−クリプトキサンチン及び/又はその誘導体が特に好ましい。
【0022】
本発明の皮脂産生抑制剤は、皮脂産生抑制効果の観点から、総カロテノイドに対する8種のカロテノイド(β−クリプトキサンチン、α−カロテン、β−カロテン、リコペン、ルテイン/ゼアキサンチン、アスタキサンチン、フコキサンチン)及び/又はそれら誘導体のカロテノイドの合計割合が50質量%以上であることが好ましく、70質量%以上がより好ましく、90質量%以上がいっそう好ましい。
【0023】
本発明の皮脂産生抑制剤の剤型は、固形状、半固形状、液状等のいずれであってもよく、配合される製品の形態に応じて適宜設定される。本発明の皮脂産生抑制剤が配合される製品には、その形態等に応じて、本発明の効果を損なわない範囲内で、水、油脂類、ロウ類、炭化水素類、脂肪酸類、高級アルコール類、エステル類、植物抽出エキス類、水溶性高分子、界面活性剤、金属石鹸、アルコール、多価アルコール、pH調整剤、酸化防止剤、紫外線吸収剤、防腐剤、香料、粉体、増粘剤、色素、キレート剤等の添加剤を含有してもよい。また、本発明の皮脂産生抑制剤が配合される製品には、その形態や用途等に応じて、本発明の効果を損なわない範囲で、機能性成分を含有してもよい。機能性成分としては、例えば、ビタミンC、コラーゲン、スクワラン、ナイアシン、ナイアシンアミド、ヒアルロン酸、プラセンタエキス、ソルビトール、キチン、キトサン、各種植物抽出物等が挙げられる。これらの配合量については、本発明の効果を損なわない限り限定されない。
【0024】
本発明における皮脂産生抑制剤は、カロテノイドとして成人1日あたりの摂取量が0.01〜100gとなるように摂取することが好ましく、さらに0.1〜50gが好ましく、0.1〜30gが一層好ましい。なお、成人1日あたりの摂取量が0.01g未満であると、皮脂産生抑制効果が低くなる場合がある。一方、成人1日あたりの摂取量が100gを超えると、得られる皮脂産生抑制効果に対して原料コストが高くなり好ましくない。
【0025】
本発明における皮脂産生抑制剤は、経口、経腸、径粘膜、注射等の任意の投与形態で使用できるので、化粧品、飲食品、医薬品、ペットフード、飼料等の製品に配合して使用される。
【0026】
本発明の皮脂産生抑制剤を化粧品に使用する場合、本発明の皮脂産生抑制剤を香粧学的に許容される基材や添加成分と組み合わせて所望の形態に調製して、皮脂産生抑制用の化粧品として提供される。このような化粧品の形態としては、特に制限されないが、具体的には、乳液、クリーム、化粧水(ローション)、パック、美容液、洗浄剤、メーキャップ化粧料等が挙げられる。
【0027】
また、本発明の皮脂産生抑制剤を飲食品に使用する場合、本発明の皮脂産生抑制剤を単独で又は他の食品素材や添加成分と組み合わせて所望の形態に調製して、皮脂産生抑制用の飲食品として提供される。このような飲食品としては、一般の飲食品の他、特定保健用食品、栄養補助食品、機能性食品、病者用食品等が挙げられる。これらの飲食品の形態として、特に制限されないが、具体的には、パン類、麺類等の主菜;チーズ、ハム、ウィンナー、魚介加工品等の副菜;果汁飲料、炭酸飲料、乳飲料等の飲料;クッキー、ケーキ、ゼリー、プリン、キャンディー、ヨーグルト等の嗜好品;錠剤、顆粒、粉剤、カプセル、ソフトカプセル、栄養ドリンク等のサプリメント等が例示される。なお、病者用食品については、皮脂産生抑制により症状の改善が見込まれる疾患の患者用の食事として使用することができる。
【0028】
更に、本発明の皮脂産生抑制剤を飲食品に使用する場合、本発明の皮脂産生抑制剤を単独で又は他の成分と組み合わせて、皮脂産生抑制用の食品添加剤として提供することもできる。
【0029】
また、本発明の皮脂産生抑制剤を医薬品に使用する場合、本発明の皮脂産生抑制剤を単独で、又は他の薬理活性成分、薬学的に許容される基材や添加成分等と組み合わせて所望の形態に調製して、皮脂産生抑制用の医薬品として提供される。このような医薬品の形態としては、特に制限されないが、具体的には、錠剤、顆粒剤、粉剤、カプセル剤、ソフトカプセル剤、シロップ剤等の経口投与製剤;外用剤、吸入剤、坐剤等の経皮又は経粘膜投与製剤;注射剤等が挙げられる。
【0030】
また、本発明の皮脂産生抑制剤を飼料又はペットフードに使用する場合、本発明の皮脂産生抑制剤を単独で又は他の飼料成分と組み合わせて所望の形態に調製して、皮脂産生抑制用の飼料又はペットフードとして提供される。該飼料又はペットフードに使用される飼料成分としては、例えば、トウモロコシ、小麦、大麦、ライ麦等の穀類;ふすま、米ぬか等のぬか類;コーングルテンミール、コーンジャムミール等の粕類;脱脂粉乳、ホエー、魚粉、骨粉等の動物性飼料類;ビール酵母等の酵母類;リン酸カルシウム、炭酸カルシウム等のカルシウム類;ビタミン類;油脂類;アミノ酸類;糖類等が挙げられる。
【0031】
本発明の皮脂産生抑制剤を化粧品、飲食品、医薬品、飼料およびペットフードとして使用する場合の皮脂産生抑制剤の投与又は摂取量については、該剤の投与形態、投与対象者の年齢、期待される効果等に応じて、皮脂産生抑制に有効な量を適宜設定すればよい。例えば、カロテノイドとして成人1日あたりの投与又は摂取量を、通常0.01〜100g程度、好ましくは0.1〜50g程度、更に好ましくは0.1〜30g程度に設定すればよい。このような投与又は摂取量を充足することにより、生体内で皮脂産生抑制効果を有効に奏させることができる。
【0032】
本発明の皮脂産生抑制剤、それを配合した化粧品、飲食物、医薬品、飼料およびペットフードには、本発明の効果を損なわない範囲で、必要に応じて、種々の機能性成分を配合することが出来る。機能性成分としては、例えば、他の皮脂産生抑制剤でも良いし、ビタミンC、コラーゲン、スクワラン、ナイアシン、ナイアシンアミド、ヒアルロン酸、プラセンタエキス、ソルビトール、キチン、キトサンや、その他にも種々の植物抽出物等が挙げられる。これらの配合量については、本発明の効果を損なわない限り限定されない。
【0033】
本発明の皮脂産生抑制剤の製造方法について、以下に例を挙げて説明する。
【0034】
本発明のカロテノイド及び/又はその誘導体は、動植物又は細菌から、溶媒などを用いて抽出する方法により得ることができる。さらに、上記カロテノイド抽出物は、常法により濃縮乾固させて濃縮することが好ましい。
【0035】
動植物由来のカロテノイドを得る場合に、用いる動植物は特に限定されないが、玄米、とうもろこし等の穀類、さつまいも、さといも、やまいも等のいも類とその加工物、あずき、いんげんまめ、えんどうまめ、ささげ、そらまめ、だいず、ひよこまめ、べにばないんげん、らいまめ、りょくとう、レンズまめ等の豆類、アーモンド、あさ、えごま、カシューナッツ、かや、銀杏、栗、くるみ、ココナッツ、ゴマ、しい、すいか、とち、はす、ひし、ピスタチオ、ひまわり、ブラジルナッツ、ヘーゼルナッツ、マカダミアナッツ、まつ、落花生等の種実類、アーティチョーク、あさつき、明日葉、アスパラガス、うど、おおさかしろな、丘ひじき、おくら、カブ、かぼちゃ、からしな、カリフラワー、かんぴょう、菊、キャベツ、きゅうり、ぎょうじゃにんにく、京菜、キノコ類、キンサイ、クレソン、くわい、ケール、コールラビ、こごみ、ごぼう、小松菜、ザーサイ、さんとうさい、ししとうがらし、しそ、じゅうろくささげ、春菊、じゅんさい、しょうが、しろうり、ずいき、すぐきな、ズッキーニ、せり、セロリー、ぜんまい、タアサイ、だいこん類、たいさい、高菜、タケノコ、たまねぎ類、たらのめ、チコリー、チンゲンサイ、つうし、つるな、つるむらさき、つわぶき、唐辛子、冬瓜、トマト類、トレビス、とんぶり、ながさきはくさい、なす類、なずな、にがうり、にら、ニンジン、にんにく、ねぎ、野沢菜、のびる、白菜類、パクチョイ、バジル、パセリ、はつかだいこん、はやとうり、ビート、ピーマン類、ひのな、ひろしまな、ふき類、ふだんそう、ブロッコリー、ほうれん草、ホースラディッシュ、まこも、みずかけな、三つ葉、みょうが、むかご、めたで、もやし類、モロヘイヤ、やまごぼう、ゆりね、ようさい、よめな、よもぎ、落花生、らっきょう、リーキ、ルバーブ、レタス類、れんこん、わけぎ、わさび、わらび等の野菜類、アセロラ、アボカド、杏、イチゴ、イチジク、いよかん、梅、温州みかん、オリーブ、オレンジ、オロブランコ、柿、かぼす、かりん、キウイフルーツ、キワノ、キンカン、グァバ、グズベリー、ぐみ、グレープフルーツ、ごれんし、サクランボ、さんぼうかん、シイクワシャ―、すいか、すだち、すもも、だいだい、タンゴール、ダンゼロ、チェリモヤ、ドリアン、夏みかん、なつめ、なつめやし、パインアップル、ハスカップ、はっさく、パッションフルーツ、バナナ、パパイア、ひゅうがなつ、びわ、ぶどう、ブルーベリー、ぶんたん、ホワイトサポテ、ポンカン、まくわうり、マルメロ、マンゴー、メロン、もも、やまもも、ゆず、ラズベリー、りんご、レモン等の果実類、あおさ、あおのり、あまのり、あらめ、いわのり、えごのり、おごのり、かわのり、くびれつた、昆布類、すいぜんじのり、天草、とさかのり、ひじき、ひとえぐさ、ふのり、まつも、むかでのり、もずく類、わかめ類等の海藻類、いかなご、いわな、うなぎ、キャビア、こち、さけ・ます類、ししゃも、たら類、どじょう、はぜ、ぼら、まぐろ、わかさぎ等の魚類、あげまき、あさり、あわび、いあたやがい、牡蠣、さざえ、しじみ、たにし、つぶ、とこぶし、トップシェル、ばいがい、ばかがい、ハマグリ類、帆立貝、ほっきがい、もがい等の貝類、えび類やかに類のような甲殻類、いか類やたこ類のような頭足類、その他うに、おきあみ、くらげ、しゃこ、なまこ、ほや等、いのしし、いのぶた、うさぎ、牛、馬、鯨、鹿、豚、めんよう、ヤギ、あいがも、鳥肉類等の肉類、うこっけい卵、うずら卵、鶏卵、ピータン等の卵類、牛乳などの乳類や加工品などが挙げられる。
【0036】
上記動植物の中でも、かんきつ類由来のものが好ましい。本発明におけるかんきつ類とは、ミカン科などに属する植物を挙げることができる。より具体的には、温州みかん、イヨカン、夏みかん、オレンジ、カボス、カワバタ、キシュウミカン、清見、キンカン、グレープフルーツ、ゲッキツ、三宝柑、シイクワサー、ジャバラ、スウィーティー、スダチ、ダイダイ、タチバナ、デコポン、ナツダイダイ、ハッサク、ネーブルオレンジ、バレンシアオレンジ、晩白柚、ヒュウガナツ、ブンタン、ポンカン、マンダリンオレンジ、ヤツシロ、ユズ、ライム、レモン、カラタチ(これらと同等又は類似の品種のものも含む)などが挙げられる。その中でも温州みかんがクリプトキサンチン及び/又はその誘導体の含有率が高く望ましい。
【0037】
微生物由来のカロテノイドを得る場合に、用いる微生物は特に限定されないが、カロテノイド産生能力を有するデュナリエラ、ヘマトコッカス等の藻類、ファフィア属、ロドトルーラ属等の酵母等から選択される微生物が挙げられる。これらの中でも、カロテノイド産生能力の観点から、Paracoccus属、Sphingomonas属、Brevundimonas属またはErythrobacter属に属する細菌が好ましく、Paracoccus属に属する細菌がより好ましい。
【0038】
Paracoccus属に属する細菌の中では、Paracoccus carotinifaciens、Paracoccus marcusii、ParacoccushaeundaensisおよびParacoccus zeaxanthinifaciensが好ましく、特にParacoccus carotinifaciensが好ましい。Paracoccus属に属する細菌の具体的な菌株の例として、Paracoccus carotinifaciensE−396株(FERM BP−4283)およびParacoccus属細菌A−581−1株(FERM BP−4671)が挙げられ、これらの変異株も本発明に好ましく用いられる。
【0039】
動植物及び/又は微生物から溶媒にて抽出の際には、水などの極性溶媒や有機溶媒を用いることができる。有機溶媒としては、特に制限されないが、メタノール、エタノール、プロパノール、ブタノール等のアルコール類、エチレングリコール、プロピレングリコール、グリセリン等の多価アルコール類、アセトン、メチルエチルケトン等のケトン類、酢酸メチル、酢酸エチル等のエステル類、テトラヒドロフラン、ジエチルエーテル等のエーテル類、ジクロロメタン、ジクロロエタン、クロロホルム等のハロゲン化炭化水素類、ヘキサン、ペンタン等の脂肪族炭化水素類、トルエン等の芳香族炭化水素類、ポリエチレングリコール等のポリエーテル類、ピリジン類等が挙げられる。これらは単独で、もしくは2種以上を組み合わせて用いることができる。
【0040】
本発明の皮脂産生抑制剤を特に食品に含有する場合には、安全性の観点から、上記の有機溶媒の中でも、エタノール、ヘキサンを使用することが好ましい。また、抽出効率を上げるために、水、酵素、各種界面活性剤等を、本発明の効果を損なわない範囲で使用することも可能である。
【0041】
溶媒による抽出においては、抽出を複数回行うこともできる。また、近年注目を浴びている超臨界抽出法を使用することも可能である。
【0042】
このようにして得られた抽出液は、濃縮操作により濃縮物とすることが好ましい。濃縮操作としては、例えば、エバポレーターのような減圧濃縮装置を用いたり、加熱したりして、溶媒を除去することが挙げられる。次いで、濃縮物を公知の精製手段により精製することで、純度の高いカロテノイド及び/又はその誘導体を得ることができる。具体的には、例えば、該抽出物をシリカゲルカラムクロマトグラフィーで数回精製したり、アルカリ処理や溶媒分画等により不純物を除去した後に、シリカゲルカラムクロマトグラフィーにて精製したりすることにより、カロテノイドを得ることができる。
【0043】
以下、本発明を実施例により具体的に説明するが、本発明はこれらの実施例に限定されるものではない。
【0044】
<β−クリプトキサンチンによるトリアシルグリセロール(以下、「TG」と略す。)の
産生抑制効果>
実施例1
(実験項目と細胞の培養方法)
ハムスターの脂腺細胞に対するβ−クリプトキサンチンの皮脂産生抑制効果を評価するため、以下の(1)〜(4)の確認試験を実施した。
(1)インスリンにて脂質合成が誘導されていない(「インスリン未誘導」と略す場合がある。)ハムスター脂腺細胞に対し、β−クリプトキサンチンを1.1μM、3.3μM、10μM、若しくは13cisRAを0.01μM、0.1μM、1μM、それぞれ添加し、蓄積されるTG量を比較評価した。
(2)インスリン10nMにて脂質合成が誘導された(「インスリン誘導」と略す場合がある。)ハムスター脂腺細胞に対し、β−クリプトキサンチンを1.1μM、3.3μM、10μM、若しくは13cis RAを0.01μM、0.1μM、1μM、それぞれ添加し、蓄積されるTG量を比較評価した。
(3)インスリン未誘導(レーン1〜3)及びインスリン誘導(レーン4〜6)のハムスター脂腺細胞に対し、β−クリプトキサンチン(10μM レーン2,5)若しくは13cisRA(1μM レーン3,6)を添加した場合の培養日数3日、6日、8日目に蓄積されたTG量を比較評価した。
(4)インスリン未誘導(〔A〕)及びインスリン誘導(〔B〕)のハムスター脂腺細胞内に形成される脂肪滴に対するβ−クリプトキサンチン(10μM)と13cisRA(1μM)の影響を比較評価した。
【0045】
〔標準操作〕
上記評価における標準操作を以下に示す。
細胞を2.7×105細胞/ディッシュとなるように35mmディッシュ(Falcon社製)に播種し1日培養した後、インスリン(Sigma Chemical社製)10nM存在下および/又は非存在下にて、各種濃度のβ−クリプトキサンチン(商品名:β−Cryptoxanthin(試験研究用)、商品コード:SY−001、四国八洲社製、「β―cpx」と略す場合がある。)若しくは13cisRA(Sigma Chemical社製)を、Sebocyte-growth medium(「SG medium」と略す場合がある。)に添加した後、一定期間培養を行った。なお、β−クリプトキサンチン、13cisRAのいずれも添加しないものは、溶媒コントロール(「C」と略す場合がある。)とした。
SG mediumの組成を以下に示す。
SG medium:
6v/v% fetal bovine serum(Thermo Fisher Scientific社製)、2v/v% human serum(MP Biomedicals社製)、0.68mM L-glutamine(和光純薬工業社製)、 100 unit/ml penicillin G(MP Biomedicals社製)および100μg/ml硫 酸streptomycin(明治製菓社製)を含むDulbecco's modified Eagle's medium/Ham's F-12 medium(1:1)(Invitrogen社製)
【0046】
上記培養の後、細胞内部に蓄積するTG量を定量するために、以下の操作を行った。
〔TG量の測定〕
培養処理した細胞をリン酸緩衝液で2回洗浄し、0.25% trypsin (DIFCO Laboratries社製)および0.02wt/v% EDTA (Sigma Chemicals社製)を含むリン酸緩衝液(1 ml)を用い細胞を回収した。得られた細胞懸濁液を氷冷下、超音波粉砕装置(Bioruptor,コスモバイオ社製)を用い、200W、10秒間の粉砕処理計10回行い細胞を粉砕した。細胞内のTG量は、リキテックTGIIキット(Roche Diagnostics社製)を用い添付の操作方法に従い測定した。
すなわち、細胞破砕液に添付の処理液1[1.65 IU/ml glycerol kinase/6 IU/ml glycerol-3-phosphate oxidase/catalase/2.95mMdisodiumadenosine-5’-triphosphate/0.65mM sodiumN-(3,5-dimethoxyphenyl)-N’-succinylethylenediamine]を添加し、37℃で10分間反応させて遊離型グリセロールを除去した。直ちに添付の処理液2[0.55 IU/ml lipoprotein lipase/peroxidase/0.65 mM4-aminoantipyrin]を添加し、さらに37℃で10分間反応させた。反応終了後、590nmにおける吸光度をマイクロプレートリーダー(インフィニットF200、テカンジャパン製)により測定し、triolein標準液(60mg/ml)の吸光度を基準に得られたTG量を算出した。
【0047】
前述の(1)、(2)、(3)の確認試験の結果を、それぞれ図1、2、3に示す。
【0048】
また、細胞内の脂肪滴形成を以下に示すnile red染色法により解析した。
〔脂肪滴形成の検出方法〕
0.1v/v% nile red (Sigma Chemicals社製)を含むdimethyl sulfoxide (DMSO) (Sigma Chemicals社製)溶液と精製水を1:1000(容量比)で混合したものをnile red染色液として使用した。ハムスターの脂腺細胞を96-well multiplates (Falcon社製)に播種して24時間培養後、insulin非存在(〔A〕)又は存在下(〔B〕)(10nM)、b-cryptoxanthin(〔A〕レーン:2、〔B〕レーン:3 10μM)および13cisRA(〔A〕レーン3、〔B〕レーン4 1μM)を含むSG mediumにて8日間培養処理を行った。なお、〔A〕及び〔B〕のレーン1は溶媒コントロールとした。
培養処理終了後、細胞をリン酸緩衝液で洗浄後、4wt/v% paraformaldehyde (和光純薬工業社製)を含むリン酸緩衝液を加えて室温で15分間固定した。その後、細胞をリン酸緩衝液で洗浄し、nile red染色液を加えて遮光し室温で15分間染色した。染色後、細胞をPBS(-)にて洗浄し,脂肪滴に取り込まれたnile redの蛍光強度(励起波長:535 nm,蛍光波長:595 nm)をマイクロプレートリーダーにて測定した。
【0049】
前述の(4)の確認試験の結果を、それぞれ図4に示す。
【0050】
図1〜3からも明らかなように、インスリン未誘導時、誘導時のいずれにおいてもβ−クリプトキサンチンの添加により、容量依存的、時間依存的にTGの蓄積を抑制した。また、図4から、インスリンの誘導の有無に関わらず、β−クリプトキサンチンは脂肪滴の形成を抑制していることが分かる。以上より、β−クリプトキサンチンは脂線細胞内部に蓄積される脂肪滴形成の阻害を通じてTGの蓄積を抑制していることが明らかとなった。
【技術分野】
【0001】
本発明は、皮脂の産生を抑制する皮脂産生抑制剤、該剤を含有する化粧品、飲食品、医薬品、飼料、ペットフードに関する。
【背景技術】
【0002】
皮膚の付属器官である皮脂腺より分泌された皮脂は、表皮に脂肪膜を形成することで外界物質に対する緩衝機能、殺菌機能、内因性物質の排泄作用などの生理的に重要な機能を担っている(例えば、非特許文献1、2参照)。そのため、皮脂線の機能異常、すなわち皮脂の過剰分泌および分泌低下は、それぞれ尋常性ざ瘡、脂漏性皮疹、乾皮症(乾燥肌)といった皮膚疾患の発症に密接に関連している。なかでも、皮脂分泌亢進に起因したざ瘡は、主として顔面に発症することから思春期のみならず成人の男女においても精神的ストレスを伴う皮膚疾患であり、患者のQuality of lifeを低下させる(例えば、非特許文献1〜4参照)。
【0003】
皮脂の産生・分泌には、男性ホルモンである5α−ジヒドロテストステロンやインスリンなどが関与することが報告されている(例えば、非特許文献5〜8参照)。また、リン酸化タンパク質の一つであり、細胞内脂肪滴の形成のみならず脂質合成・分解調節にも関与するペリリピンが、ハムスター皮脂腺において発現していることが報告されている(例えば、非特許文献9、10参照)。
【0004】
ざ瘡は毛胞閉塞および皮脂貯留によって面皰が生じる非炎症性ざ瘡と、偏性嫌気性グラム陽性桿菌であるPropionibacteriumacne(P. acne)の増殖およびそれに対する免疫応答に起因した炎症反応を伴う炎症性ざ瘡に分類される(例えば、非特許文献11、12参照)。両者は病理的に異なることから、ざ瘡治の二面性を踏まえた医療戦略が必須であると考えられる(例えば、非特許文献13参照)。非炎症性ざ瘡には表皮角化異常の改善のためレチノイン酸製剤である13−cis Retinoic acid(イソトレチノイン、以下「13cisRA」と略す)が、炎症性ざ瘡にはP.acneを標的とした経口抗菌剤が処方されている(例えば、非特許文献14参照)。また13cisRAは、ざ瘡の根本的な原因である皮脂産生の異常な亢進も直接的に抑制できるが(例えば、非特許文献15〜17参照)、その催奇形性の問題から長期間の薬剤使用は制限されている(例えば、非特許文献14参照)。したがって、皮脂産生を直接的に抑制することができる、安全かつ有効な医薬品の開発が望まれているのが現状である。
【0005】
これら状況を鑑み、天然の生薬等からの抽出物を用いた抑制剤(例えば、特許文献1、2参照)など、複数の皮脂産生抑制剤が存在する。
【0006】
しかしながら、上記のような公知の皮脂産生抑制剤はその安全性などに問題があり、また満足のいく効果が得られるものがなかった。これらの現状から、少量で安全に長期間使用しても問題のない皮脂産生抑制効果のある商品が求められていた。
【0007】
カロテノイドは、中央部に共役二重結合とメチル基の側差を持つ化合物であり、炭化水素のみで構成されているカロテンと酸素原子を含むキサントフィルに分類される。カロテンは、分子鎖の両端に環状の炭化水素を有するα−カロテン、β−カロテンと、分子鎖の両端に環状の炭化水素を有しないリコペンにも分類される。これらカロテノイドは、共役二重結合鎖や環状の炭化水素に付加される側鎖などによって多くの種類が存在し、構造が決定したカロテノイドは750種以上存在する。動物はカロテノイドを合成する作用が無く、植物や一部の微生物がカロテノイドの合成を可能としている。
【0008】
カロテノイドのうち、α−カロテン、β−カロテン、ルテイン/ゼアキサンチン、リコペン、クリプトキサンチンは、特に血中への移行性が高いカロテノイドとして知られており、臓器などにも蓄積することが知られている。また疫学研究などから心臓血管疾患などの発生と負の相関を持ち(例えば、非特許文献18参照)、黄斑変性の予防(例えば、非特許文献19参照)などの効果があると報告されている。
【0009】
しかしながら、カロテノイド及び/又はその誘導体が、脂腺に作用し、皮脂の産生を抑制することは知られていなかった。
【先行技術文献】
【特許文献】
【0010】
【特許文献1】特開2003−212789号公報
【特許文献2】特開2005−206588号公報
【非特許文献】
【0011】
【非特許文献1】標準皮膚科学(瀧川雅浩,富田靖,橋本隆編) (2007) 医学書院, 25-27, 339-341.
【非特許文献2】Thiboutot, D. (2004) J. Invest. Dermatol. 123, 1-12
【非特許文献3】Farrar, M. D. and Ingham, E. (2004) Clin. Dermatol. 22, 380-384.
【非特許文献4】Zouboulis, C. C., Eady, A., Philpott, M., Goldsmith, L. A., Orfanos, C., Cunliffe, W. C., and Rossenfield, R. (2005) Exp. Dermatol. 14, 143-152.
【非特許文献5】Plewig, G. and Luderschmidt, C. (1977) J. Invest. Dermatol. 68, 171-176.
【非特許文献6】Akamatsu, H., Zouboulis, C. C., and Orfanos, C. E. (1992) J. Invest. Dermatol. 99, 509-511.
【非特許文献7】Deplewski, D. and Rosenfield, R. L. (1999) Endocrinology 140, 4089-4094.
【非特許文献8】Sato, T., Imai, N., Akimoto, N., Sakiguchi, T., Kitamura, K., and Ito, A. (2001) J. Invest. Dermatol. 117, 965-970.
【非特許文献9】Akimoto,N.,Sato,T.,Iwata,C.,Koshizuka,M.,Shibata,F.,Nagai,A., Sumida,M.,and Ito,A. (2005) J. Invest. Dermatol. 124, 1127-1133.
【非特許文献10】Kimmel, A. R., Brasaemle, D. L., McAndrews-Hill, M., Sztalryd, C., and Londos, C. (2010) J. Lipid Res. 51, 468-471.
【非特許文献11】Bojar, R. A. and Holland, K. T. (2004) Clin. Dermatol. 22, 357-379.
【非特許文献12】Pawin, H., Beylot, C., Chivot, M., Poli, F., Revuz, J., and Dreno, B. (2004) Eur. J. Dermatol. 14, 4-12.
【非特許文献13】皮膚科診療プラクティス18ニキビ治療の技法 (吉川福美,宮地良樹,瀧川雅浩編) (2005) 文光堂,48-52. 171-175.
【非特許文献14】Thiboutot, D., Gollnick, H., Bettoli, V., Dreno, B., Kang, S., Leyden, J. J., Shalita, A. R., Lozada, V. T., Berson, D., Finlay, A., Goh, C. L., Herane, M. I., Kaminsky, A., Kubba, R., Layton, A., Miyachi, Y., Perez, M., Martin, J. P., Ramos-E-Silva, M., See, J. A., Shear, N., Wolf, J. Jr. (2009) J. Am. Acad. Dermatol. 60, S1-S50.
【非特許文献15】Tsukada, M., Schroder, M., Roos, T. C., Chandraratna, R. A., Reichert, U., Merk, H. F., Orfanos, C. E., and Zouboulis, C. C. (2000) J. Invest. Dermatol. 115, 321-327.
【非特許文献16】Zouboulis, C. C. (2006) J. Invest. Dermatol. 126, 2154-2156.
【非特許文献17】Sato, T., Takahashi, A., Kojima, M., Akimoto, N., Yano, M., and Ito, A. (2007) J. Invest. Dermatol. 127, 2740-2748.
【非特許文献18】治療 Vol.84 果物と生活習慣病(杉浦 実)(2002)No.4 142−144
【非特許文献19】D Max Snodderly (1995) Am J Clin Nutr. 62,1448S−61S
【発明の概要】
【発明が解決しようとする課題】
【0012】
本発明の目的は、上記の問題を解決し、少量で効果を発揮し、長期間使用しても安全上問題のない皮脂産生抑制剤、該皮脂産生抑制剤を含有する化粧品、飲食品、医薬品、飼料、ペットフード等を提供することにある。
【課題を解決するための手段】
【0013】
本発明者らは、上記課題を解決するために鋭意検討した結果、意外にもカロテノイド及び/又はその誘導体、特にクリプトキサンチン及び/又はその誘導体に皮脂産生抑制効果を見出し、本発明に到達した。
【0014】
すなわち本発明は下記の通りである。
(1)カロテノイド及び/又はその誘導体を含有することを特徴とする皮脂産生抑制剤。
(2)カロテノイド及び/又はその誘導体が、クリプトキサンチン及び/又はその誘導体であることを特徴とする皮脂産生抑制剤。
(3)クリプトキサンチン及び/又はその誘導体が、かんきつ類由来であることを特徴とする(2)記載の皮脂産生抑制剤。
(4)かんきつ類が、温州みかんであることを特徴とする(3)記載の皮脂産生抑制剤。
【図面の簡単な説明】
【0015】
【図1】インスリン非誘導性のハムスター脂腺細胞のトリアシルグリセロール(TG)産生に対するβ-cryptoxanthin及び13cisRAによる抑制効果を比較したグラフである。
【図2】インスリン誘導性のハムスター脂腺細胞のトリアシルグリセロール(TG)産生に対するβ-cryptoxanthinおよび13cisRAによる抑制効果を比較したグラフである。
【図3】インスリン誘導性のハムスター脂腺細胞のトリアシルグリセロール(TG)産生に対するβ-cryptoxanthinおよび13cisRAによる経時的な抑制効果を比較したグラフである。
【図4】インスリン非誘導性(〔A〕)又はインスリン誘導性(〔B〕)のハムスター脂腺細胞のトリアシルグリセロール(TG)産生におけるβ-cryptoxanthinおよび13cisRAによる細胞内脂肪滴形成抑制効果を比較したグラフである。
【発明を実施するための形態】
【0016】
以下、本発明を詳細に説明する。
【0017】
本発明におけるカロテノイドは、特に限定されないが、αークリプトキサンチン、β−クリプトキサンチン、イソクリプトキサンチン、アクチノエリスロール、アスタキサンチン、アスタシン、アドニキサンチン、フェニコキサンチン、β−アポ−8´−カロテナール、β−アポ−8´−カロテノール、アロキサンチン、アンテラキサンチン、イソアゲラキサンチン、イソゼアサキンチン、イソレニエラテン、β−イソレニエラテン、イドキサンチン、エキネノン、3´−エピルテイン、エリスロキサンチン硫酸、オケノン、オシラキサンチン、カプサンチン、カブソルビン、カロキサンチン、α−カロテン、β−カロテン、β−カロテノン、δ−カロテン、ε−カロテン、ε,ε−カロテン−3.3´−ジオール、η−カロテン、ζ−カロテン、カンタキサンチン、ギロキサンチン、グアラキサンチン、クリスタキサンチン、クロコキサンチン、クロセチン、クロロキサンチン、クロロバクテン、ケトミクソコキサンチン、ケトミクソール・フコシド、ゲリオデスキサンチン、ザイノキサンチン、サーモゼアキサンチン、ジアジノキサンチン、ジアトキサンチン、ジアポニューロスポレン、ジアポフィトエン、4.4´−ジアポリコペンジアール、2,2´−ジケトスピリロキサンチン、3,4−デヒドロロドピン、デヒドロリコペン、シトラナキサンチン、シトラナキサンチン、シフォナキサンチン、スタフィロキサンチン、スピロキサンチン、スフェロイデノン、スフェノイデン、ゼアキサンチン、タラキサンチン、ツナキサンチン、デオキシフレキシキサンチン、デカプレノキサンチン、テチアテン、デメチルスフェロイデン、パピリオエリトリン、トリケントリオロジン、トルラロジン、トルレン、ニューロスポラキサンチン、ニューロスポレン、ネオキサンチン、ノストキサンチン、バクテリオルビキサンチン、バクテリオルベリン、バスタキサンチン、パピリオエリトリノン、パピリオエリトリン、パラシロキサンチン、ハラシンチアキサンチン、ビオラキサンチン、フィザリエン、フィトエン、フィトフルエン、フィリプシアキサンチン、フェニコキサンチン、フコキサンチン、プラシノキサンチン、フラブキサンチン、フリチュラキサンチン、プレクタニアキサンチン、ヘテロキサンチン、ペリジニン、ヘレニエン、ボーケリアキサンチン、ミクソキサンチン、ミチロキサンチン、ムタトキサンチン、ムタトクローム、メソ・ゼアキサンチン、モナドキサンチン、ラクツーカキサンチン、リコペン、ルテイン、ルビキサンチン、ロドキサンチン、ロドピナール、ロドピノール、ロドビブリン、ロドピン、ロロキサンチンなどが挙げられる。
【0018】
本発明におけるカロテノイドの誘導体としては、特に限定されないが、前記カロテノイドの脂肪酸エステル体、硫酸エステル体、水酸基付加体、脱水酸基体、配糖体などが挙げられる。
【0019】
脂肪酸エステル体としては、その脂肪酸がラウリン酸(C12)、ミリスチン酸(C14)、パルミチン酸(C16)、ステアリン酸(C18)などの脂肪酸エステルが挙げられる。
【0020】
上記カロテノイド及び/又はその誘導体のなかでも、皮脂産生抑制効果の観点から、経口摂取する場合は、β−クリプトキサンチン、α−カロテン、β−カロテン、リコペン、ルテイン/ゼアキサンチン、及び/又はそれら誘導体が好ましく、β−クリプトキサンチン及び/又はその誘導体が特に好ましい。
【0021】
経皮吸収する場合は、皮脂産生抑制効果の観点から、β−クリプトキサンチン及び/またはその誘導体、アスタキサンチン及び/又はその誘導体、フコキサンチン及び/又はその誘導体などが好ましく、β−クリプトキサンチン及び/又はその誘導体が特に好ましい。
【0022】
本発明の皮脂産生抑制剤は、皮脂産生抑制効果の観点から、総カロテノイドに対する8種のカロテノイド(β−クリプトキサンチン、α−カロテン、β−カロテン、リコペン、ルテイン/ゼアキサンチン、アスタキサンチン、フコキサンチン)及び/又はそれら誘導体のカロテノイドの合計割合が50質量%以上であることが好ましく、70質量%以上がより好ましく、90質量%以上がいっそう好ましい。
【0023】
本発明の皮脂産生抑制剤の剤型は、固形状、半固形状、液状等のいずれであってもよく、配合される製品の形態に応じて適宜設定される。本発明の皮脂産生抑制剤が配合される製品には、その形態等に応じて、本発明の効果を損なわない範囲内で、水、油脂類、ロウ類、炭化水素類、脂肪酸類、高級アルコール類、エステル類、植物抽出エキス類、水溶性高分子、界面活性剤、金属石鹸、アルコール、多価アルコール、pH調整剤、酸化防止剤、紫外線吸収剤、防腐剤、香料、粉体、増粘剤、色素、キレート剤等の添加剤を含有してもよい。また、本発明の皮脂産生抑制剤が配合される製品には、その形態や用途等に応じて、本発明の効果を損なわない範囲で、機能性成分を含有してもよい。機能性成分としては、例えば、ビタミンC、コラーゲン、スクワラン、ナイアシン、ナイアシンアミド、ヒアルロン酸、プラセンタエキス、ソルビトール、キチン、キトサン、各種植物抽出物等が挙げられる。これらの配合量については、本発明の効果を損なわない限り限定されない。
【0024】
本発明における皮脂産生抑制剤は、カロテノイドとして成人1日あたりの摂取量が0.01〜100gとなるように摂取することが好ましく、さらに0.1〜50gが好ましく、0.1〜30gが一層好ましい。なお、成人1日あたりの摂取量が0.01g未満であると、皮脂産生抑制効果が低くなる場合がある。一方、成人1日あたりの摂取量が100gを超えると、得られる皮脂産生抑制効果に対して原料コストが高くなり好ましくない。
【0025】
本発明における皮脂産生抑制剤は、経口、経腸、径粘膜、注射等の任意の投与形態で使用できるので、化粧品、飲食品、医薬品、ペットフード、飼料等の製品に配合して使用される。
【0026】
本発明の皮脂産生抑制剤を化粧品に使用する場合、本発明の皮脂産生抑制剤を香粧学的に許容される基材や添加成分と組み合わせて所望の形態に調製して、皮脂産生抑制用の化粧品として提供される。このような化粧品の形態としては、特に制限されないが、具体的には、乳液、クリーム、化粧水(ローション)、パック、美容液、洗浄剤、メーキャップ化粧料等が挙げられる。
【0027】
また、本発明の皮脂産生抑制剤を飲食品に使用する場合、本発明の皮脂産生抑制剤を単独で又は他の食品素材や添加成分と組み合わせて所望の形態に調製して、皮脂産生抑制用の飲食品として提供される。このような飲食品としては、一般の飲食品の他、特定保健用食品、栄養補助食品、機能性食品、病者用食品等が挙げられる。これらの飲食品の形態として、特に制限されないが、具体的には、パン類、麺類等の主菜;チーズ、ハム、ウィンナー、魚介加工品等の副菜;果汁飲料、炭酸飲料、乳飲料等の飲料;クッキー、ケーキ、ゼリー、プリン、キャンディー、ヨーグルト等の嗜好品;錠剤、顆粒、粉剤、カプセル、ソフトカプセル、栄養ドリンク等のサプリメント等が例示される。なお、病者用食品については、皮脂産生抑制により症状の改善が見込まれる疾患の患者用の食事として使用することができる。
【0028】
更に、本発明の皮脂産生抑制剤を飲食品に使用する場合、本発明の皮脂産生抑制剤を単独で又は他の成分と組み合わせて、皮脂産生抑制用の食品添加剤として提供することもできる。
【0029】
また、本発明の皮脂産生抑制剤を医薬品に使用する場合、本発明の皮脂産生抑制剤を単独で、又は他の薬理活性成分、薬学的に許容される基材や添加成分等と組み合わせて所望の形態に調製して、皮脂産生抑制用の医薬品として提供される。このような医薬品の形態としては、特に制限されないが、具体的には、錠剤、顆粒剤、粉剤、カプセル剤、ソフトカプセル剤、シロップ剤等の経口投与製剤;外用剤、吸入剤、坐剤等の経皮又は経粘膜投与製剤;注射剤等が挙げられる。
【0030】
また、本発明の皮脂産生抑制剤を飼料又はペットフードに使用する場合、本発明の皮脂産生抑制剤を単独で又は他の飼料成分と組み合わせて所望の形態に調製して、皮脂産生抑制用の飼料又はペットフードとして提供される。該飼料又はペットフードに使用される飼料成分としては、例えば、トウモロコシ、小麦、大麦、ライ麦等の穀類;ふすま、米ぬか等のぬか類;コーングルテンミール、コーンジャムミール等の粕類;脱脂粉乳、ホエー、魚粉、骨粉等の動物性飼料類;ビール酵母等の酵母類;リン酸カルシウム、炭酸カルシウム等のカルシウム類;ビタミン類;油脂類;アミノ酸類;糖類等が挙げられる。
【0031】
本発明の皮脂産生抑制剤を化粧品、飲食品、医薬品、飼料およびペットフードとして使用する場合の皮脂産生抑制剤の投与又は摂取量については、該剤の投与形態、投与対象者の年齢、期待される効果等に応じて、皮脂産生抑制に有効な量を適宜設定すればよい。例えば、カロテノイドとして成人1日あたりの投与又は摂取量を、通常0.01〜100g程度、好ましくは0.1〜50g程度、更に好ましくは0.1〜30g程度に設定すればよい。このような投与又は摂取量を充足することにより、生体内で皮脂産生抑制効果を有効に奏させることができる。
【0032】
本発明の皮脂産生抑制剤、それを配合した化粧品、飲食物、医薬品、飼料およびペットフードには、本発明の効果を損なわない範囲で、必要に応じて、種々の機能性成分を配合することが出来る。機能性成分としては、例えば、他の皮脂産生抑制剤でも良いし、ビタミンC、コラーゲン、スクワラン、ナイアシン、ナイアシンアミド、ヒアルロン酸、プラセンタエキス、ソルビトール、キチン、キトサンや、その他にも種々の植物抽出物等が挙げられる。これらの配合量については、本発明の効果を損なわない限り限定されない。
【0033】
本発明の皮脂産生抑制剤の製造方法について、以下に例を挙げて説明する。
【0034】
本発明のカロテノイド及び/又はその誘導体は、動植物又は細菌から、溶媒などを用いて抽出する方法により得ることができる。さらに、上記カロテノイド抽出物は、常法により濃縮乾固させて濃縮することが好ましい。
【0035】
動植物由来のカロテノイドを得る場合に、用いる動植物は特に限定されないが、玄米、とうもろこし等の穀類、さつまいも、さといも、やまいも等のいも類とその加工物、あずき、いんげんまめ、えんどうまめ、ささげ、そらまめ、だいず、ひよこまめ、べにばないんげん、らいまめ、りょくとう、レンズまめ等の豆類、アーモンド、あさ、えごま、カシューナッツ、かや、銀杏、栗、くるみ、ココナッツ、ゴマ、しい、すいか、とち、はす、ひし、ピスタチオ、ひまわり、ブラジルナッツ、ヘーゼルナッツ、マカダミアナッツ、まつ、落花生等の種実類、アーティチョーク、あさつき、明日葉、アスパラガス、うど、おおさかしろな、丘ひじき、おくら、カブ、かぼちゃ、からしな、カリフラワー、かんぴょう、菊、キャベツ、きゅうり、ぎょうじゃにんにく、京菜、キノコ類、キンサイ、クレソン、くわい、ケール、コールラビ、こごみ、ごぼう、小松菜、ザーサイ、さんとうさい、ししとうがらし、しそ、じゅうろくささげ、春菊、じゅんさい、しょうが、しろうり、ずいき、すぐきな、ズッキーニ、せり、セロリー、ぜんまい、タアサイ、だいこん類、たいさい、高菜、タケノコ、たまねぎ類、たらのめ、チコリー、チンゲンサイ、つうし、つるな、つるむらさき、つわぶき、唐辛子、冬瓜、トマト類、トレビス、とんぶり、ながさきはくさい、なす類、なずな、にがうり、にら、ニンジン、にんにく、ねぎ、野沢菜、のびる、白菜類、パクチョイ、バジル、パセリ、はつかだいこん、はやとうり、ビート、ピーマン類、ひのな、ひろしまな、ふき類、ふだんそう、ブロッコリー、ほうれん草、ホースラディッシュ、まこも、みずかけな、三つ葉、みょうが、むかご、めたで、もやし類、モロヘイヤ、やまごぼう、ゆりね、ようさい、よめな、よもぎ、落花生、らっきょう、リーキ、ルバーブ、レタス類、れんこん、わけぎ、わさび、わらび等の野菜類、アセロラ、アボカド、杏、イチゴ、イチジク、いよかん、梅、温州みかん、オリーブ、オレンジ、オロブランコ、柿、かぼす、かりん、キウイフルーツ、キワノ、キンカン、グァバ、グズベリー、ぐみ、グレープフルーツ、ごれんし、サクランボ、さんぼうかん、シイクワシャ―、すいか、すだち、すもも、だいだい、タンゴール、ダンゼロ、チェリモヤ、ドリアン、夏みかん、なつめ、なつめやし、パインアップル、ハスカップ、はっさく、パッションフルーツ、バナナ、パパイア、ひゅうがなつ、びわ、ぶどう、ブルーベリー、ぶんたん、ホワイトサポテ、ポンカン、まくわうり、マルメロ、マンゴー、メロン、もも、やまもも、ゆず、ラズベリー、りんご、レモン等の果実類、あおさ、あおのり、あまのり、あらめ、いわのり、えごのり、おごのり、かわのり、くびれつた、昆布類、すいぜんじのり、天草、とさかのり、ひじき、ひとえぐさ、ふのり、まつも、むかでのり、もずく類、わかめ類等の海藻類、いかなご、いわな、うなぎ、キャビア、こち、さけ・ます類、ししゃも、たら類、どじょう、はぜ、ぼら、まぐろ、わかさぎ等の魚類、あげまき、あさり、あわび、いあたやがい、牡蠣、さざえ、しじみ、たにし、つぶ、とこぶし、トップシェル、ばいがい、ばかがい、ハマグリ類、帆立貝、ほっきがい、もがい等の貝類、えび類やかに類のような甲殻類、いか類やたこ類のような頭足類、その他うに、おきあみ、くらげ、しゃこ、なまこ、ほや等、いのしし、いのぶた、うさぎ、牛、馬、鯨、鹿、豚、めんよう、ヤギ、あいがも、鳥肉類等の肉類、うこっけい卵、うずら卵、鶏卵、ピータン等の卵類、牛乳などの乳類や加工品などが挙げられる。
【0036】
上記動植物の中でも、かんきつ類由来のものが好ましい。本発明におけるかんきつ類とは、ミカン科などに属する植物を挙げることができる。より具体的には、温州みかん、イヨカン、夏みかん、オレンジ、カボス、カワバタ、キシュウミカン、清見、キンカン、グレープフルーツ、ゲッキツ、三宝柑、シイクワサー、ジャバラ、スウィーティー、スダチ、ダイダイ、タチバナ、デコポン、ナツダイダイ、ハッサク、ネーブルオレンジ、バレンシアオレンジ、晩白柚、ヒュウガナツ、ブンタン、ポンカン、マンダリンオレンジ、ヤツシロ、ユズ、ライム、レモン、カラタチ(これらと同等又は類似の品種のものも含む)などが挙げられる。その中でも温州みかんがクリプトキサンチン及び/又はその誘導体の含有率が高く望ましい。
【0037】
微生物由来のカロテノイドを得る場合に、用いる微生物は特に限定されないが、カロテノイド産生能力を有するデュナリエラ、ヘマトコッカス等の藻類、ファフィア属、ロドトルーラ属等の酵母等から選択される微生物が挙げられる。これらの中でも、カロテノイド産生能力の観点から、Paracoccus属、Sphingomonas属、Brevundimonas属またはErythrobacter属に属する細菌が好ましく、Paracoccus属に属する細菌がより好ましい。
【0038】
Paracoccus属に属する細菌の中では、Paracoccus carotinifaciens、Paracoccus marcusii、ParacoccushaeundaensisおよびParacoccus zeaxanthinifaciensが好ましく、特にParacoccus carotinifaciensが好ましい。Paracoccus属に属する細菌の具体的な菌株の例として、Paracoccus carotinifaciensE−396株(FERM BP−4283)およびParacoccus属細菌A−581−1株(FERM BP−4671)が挙げられ、これらの変異株も本発明に好ましく用いられる。
【0039】
動植物及び/又は微生物から溶媒にて抽出の際には、水などの極性溶媒や有機溶媒を用いることができる。有機溶媒としては、特に制限されないが、メタノール、エタノール、プロパノール、ブタノール等のアルコール類、エチレングリコール、プロピレングリコール、グリセリン等の多価アルコール類、アセトン、メチルエチルケトン等のケトン類、酢酸メチル、酢酸エチル等のエステル類、テトラヒドロフラン、ジエチルエーテル等のエーテル類、ジクロロメタン、ジクロロエタン、クロロホルム等のハロゲン化炭化水素類、ヘキサン、ペンタン等の脂肪族炭化水素類、トルエン等の芳香族炭化水素類、ポリエチレングリコール等のポリエーテル類、ピリジン類等が挙げられる。これらは単独で、もしくは2種以上を組み合わせて用いることができる。
【0040】
本発明の皮脂産生抑制剤を特に食品に含有する場合には、安全性の観点から、上記の有機溶媒の中でも、エタノール、ヘキサンを使用することが好ましい。また、抽出効率を上げるために、水、酵素、各種界面活性剤等を、本発明の効果を損なわない範囲で使用することも可能である。
【0041】
溶媒による抽出においては、抽出を複数回行うこともできる。また、近年注目を浴びている超臨界抽出法を使用することも可能である。
【0042】
このようにして得られた抽出液は、濃縮操作により濃縮物とすることが好ましい。濃縮操作としては、例えば、エバポレーターのような減圧濃縮装置を用いたり、加熱したりして、溶媒を除去することが挙げられる。次いで、濃縮物を公知の精製手段により精製することで、純度の高いカロテノイド及び/又はその誘導体を得ることができる。具体的には、例えば、該抽出物をシリカゲルカラムクロマトグラフィーで数回精製したり、アルカリ処理や溶媒分画等により不純物を除去した後に、シリカゲルカラムクロマトグラフィーにて精製したりすることにより、カロテノイドを得ることができる。
【0043】
以下、本発明を実施例により具体的に説明するが、本発明はこれらの実施例に限定されるものではない。
【0044】
<β−クリプトキサンチンによるトリアシルグリセロール(以下、「TG」と略す。)の
産生抑制効果>
実施例1
(実験項目と細胞の培養方法)
ハムスターの脂腺細胞に対するβ−クリプトキサンチンの皮脂産生抑制効果を評価するため、以下の(1)〜(4)の確認試験を実施した。
(1)インスリンにて脂質合成が誘導されていない(「インスリン未誘導」と略す場合がある。)ハムスター脂腺細胞に対し、β−クリプトキサンチンを1.1μM、3.3μM、10μM、若しくは13cisRAを0.01μM、0.1μM、1μM、それぞれ添加し、蓄積されるTG量を比較評価した。
(2)インスリン10nMにて脂質合成が誘導された(「インスリン誘導」と略す場合がある。)ハムスター脂腺細胞に対し、β−クリプトキサンチンを1.1μM、3.3μM、10μM、若しくは13cis RAを0.01μM、0.1μM、1μM、それぞれ添加し、蓄積されるTG量を比較評価した。
(3)インスリン未誘導(レーン1〜3)及びインスリン誘導(レーン4〜6)のハムスター脂腺細胞に対し、β−クリプトキサンチン(10μM レーン2,5)若しくは13cisRA(1μM レーン3,6)を添加した場合の培養日数3日、6日、8日目に蓄積されたTG量を比較評価した。
(4)インスリン未誘導(〔A〕)及びインスリン誘導(〔B〕)のハムスター脂腺細胞内に形成される脂肪滴に対するβ−クリプトキサンチン(10μM)と13cisRA(1μM)の影響を比較評価した。
【0045】
〔標準操作〕
上記評価における標準操作を以下に示す。
細胞を2.7×105細胞/ディッシュとなるように35mmディッシュ(Falcon社製)に播種し1日培養した後、インスリン(Sigma Chemical社製)10nM存在下および/又は非存在下にて、各種濃度のβ−クリプトキサンチン(商品名:β−Cryptoxanthin(試験研究用)、商品コード:SY−001、四国八洲社製、「β―cpx」と略す場合がある。)若しくは13cisRA(Sigma Chemical社製)を、Sebocyte-growth medium(「SG medium」と略す場合がある。)に添加した後、一定期間培養を行った。なお、β−クリプトキサンチン、13cisRAのいずれも添加しないものは、溶媒コントロール(「C」と略す場合がある。)とした。
SG mediumの組成を以下に示す。
SG medium:
6v/v% fetal bovine serum(Thermo Fisher Scientific社製)、2v/v% human serum(MP Biomedicals社製)、0.68mM L-glutamine(和光純薬工業社製)、 100 unit/ml penicillin G(MP Biomedicals社製)および100μg/ml硫 酸streptomycin(明治製菓社製)を含むDulbecco's modified Eagle's medium/Ham's F-12 medium(1:1)(Invitrogen社製)
【0046】
上記培養の後、細胞内部に蓄積するTG量を定量するために、以下の操作を行った。
〔TG量の測定〕
培養処理した細胞をリン酸緩衝液で2回洗浄し、0.25% trypsin (DIFCO Laboratries社製)および0.02wt/v% EDTA (Sigma Chemicals社製)を含むリン酸緩衝液(1 ml)を用い細胞を回収した。得られた細胞懸濁液を氷冷下、超音波粉砕装置(Bioruptor,コスモバイオ社製)を用い、200W、10秒間の粉砕処理計10回行い細胞を粉砕した。細胞内のTG量は、リキテックTGIIキット(Roche Diagnostics社製)を用い添付の操作方法に従い測定した。
すなわち、細胞破砕液に添付の処理液1[1.65 IU/ml glycerol kinase/6 IU/ml glycerol-3-phosphate oxidase/catalase/2.95mMdisodiumadenosine-5’-triphosphate/0.65mM sodiumN-(3,5-dimethoxyphenyl)-N’-succinylethylenediamine]を添加し、37℃で10分間反応させて遊離型グリセロールを除去した。直ちに添付の処理液2[0.55 IU/ml lipoprotein lipase/peroxidase/0.65 mM4-aminoantipyrin]を添加し、さらに37℃で10分間反応させた。反応終了後、590nmにおける吸光度をマイクロプレートリーダー(インフィニットF200、テカンジャパン製)により測定し、triolein標準液(60mg/ml)の吸光度を基準に得られたTG量を算出した。
【0047】
前述の(1)、(2)、(3)の確認試験の結果を、それぞれ図1、2、3に示す。
【0048】
また、細胞内の脂肪滴形成を以下に示すnile red染色法により解析した。
〔脂肪滴形成の検出方法〕
0.1v/v% nile red (Sigma Chemicals社製)を含むdimethyl sulfoxide (DMSO) (Sigma Chemicals社製)溶液と精製水を1:1000(容量比)で混合したものをnile red染色液として使用した。ハムスターの脂腺細胞を96-well multiplates (Falcon社製)に播種して24時間培養後、insulin非存在(〔A〕)又は存在下(〔B〕)(10nM)、b-cryptoxanthin(〔A〕レーン:2、〔B〕レーン:3 10μM)および13cisRA(〔A〕レーン3、〔B〕レーン4 1μM)を含むSG mediumにて8日間培養処理を行った。なお、〔A〕及び〔B〕のレーン1は溶媒コントロールとした。
培養処理終了後、細胞をリン酸緩衝液で洗浄後、4wt/v% paraformaldehyde (和光純薬工業社製)を含むリン酸緩衝液を加えて室温で15分間固定した。その後、細胞をリン酸緩衝液で洗浄し、nile red染色液を加えて遮光し室温で15分間染色した。染色後、細胞をPBS(-)にて洗浄し,脂肪滴に取り込まれたnile redの蛍光強度(励起波長:535 nm,蛍光波長:595 nm)をマイクロプレートリーダーにて測定した。
【0049】
前述の(4)の確認試験の結果を、それぞれ図4に示す。
【0050】
図1〜3からも明らかなように、インスリン未誘導時、誘導時のいずれにおいてもβ−クリプトキサンチンの添加により、容量依存的、時間依存的にTGの蓄積を抑制した。また、図4から、インスリンの誘導の有無に関わらず、β−クリプトキサンチンは脂肪滴の形成を抑制していることが分かる。以上より、β−クリプトキサンチンは脂線細胞内部に蓄積される脂肪滴形成の阻害を通じてTGの蓄積を抑制していることが明らかとなった。
【特許請求の範囲】
【請求項1】
カロテノイド及び/又はその誘導体を含有することを特徴とする皮脂産生抑制剤。
【請求項2】
カロテノイド及び/又はその誘導体が、クリプトキサンチン及び/又はその誘導体であることを特徴とする皮脂産生抑制剤。
【請求項3】
クリプトキサンチン及び/又はその誘導体が、かんきつ類由来であることを特徴とする請求項2記載の皮脂産生抑制剤。
【請求項4】
かんきつ類が、温州みかんであることを特徴とする請求項3記載の皮脂産生抑制剤。
【請求項1】
カロテノイド及び/又はその誘導体を含有することを特徴とする皮脂産生抑制剤。
【請求項2】
カロテノイド及び/又はその誘導体が、クリプトキサンチン及び/又はその誘導体であることを特徴とする皮脂産生抑制剤。
【請求項3】
クリプトキサンチン及び/又はその誘導体が、かんきつ類由来であることを特徴とする請求項2記載の皮脂産生抑制剤。
【請求項4】
かんきつ類が、温州みかんであることを特徴とする請求項3記載の皮脂産生抑制剤。
【図1】


【図2】


【図3】


【図4】




【図2】


【図3】


【図4】


【公開番号】特開2013−28572(P2013−28572A)
【公開日】平成25年2月7日(2013.2.7)
【国際特許分類】
【出願番号】特願2011−167034(P2011−167034)
【出願日】平成23年7月29日(2011.7.29)
【出願人】(000004503)ユニチカ株式会社 (1,214)
【出願人】(506189582)
【出願人】(506188611)
【Fターム(参考)】
【公開日】平成25年2月7日(2013.2.7)
【国際特許分類】
【出願日】平成23年7月29日(2011.7.29)
【出願人】(000004503)ユニチカ株式会社 (1,214)
【出願人】(506189582)

【出願人】(506188611)

【Fターム(参考)】
[ Back to top ]

