皮膚疾患または病変の治療に有用なTOFA類似体
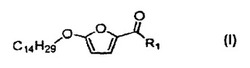
本発明は、5-(テトラデシルオキシ)-2-フランカルボン酸(TOFA)の類似体、並びに、皮脂腺機能亢進を特徴とする皮膚疾患または病変(例えば、座瘡および脂性肌、さらに他の皮膚疾患および病変)の治療におけるそれらの使用に関する。また本発明は、TOFA類似体と皮膚投与または経口投与用の製薬上許容可能な添加剤とを含む医薬組成物に関する。式(I)。


【発明の詳細な説明】
【技術分野】
【0001】
関連出願の相互参照
本願は、2009年7月8日に申請した米国仮特許出願第61/224,042号の35 U.S.C.119(e)に基づく利益を主張するものであり、その全ての内容は、ここに、参照により組み入れるものとする。
【0002】
発明の技術分野
本発明は、皮脂腺機能亢進を特徴とする皮膚疾患または病変(例えば座瘡および脂性肌)を治療するための5-(テトラデシルオキシ)-2-フランカルボン酸(TOFA)類似体の使用に関する。また本発明は、皮脂腺機能亢進を特徴とする皮膚疾患または病変(例えば座瘡および脂性肌)の治療で使用するためのTOFA類似体を含む医薬組成物および皮膚用組成物に関する。
【背景技術】
【0003】
機能亢進性皮脂腺疾患(例えば尋常性座瘡(座瘡)など)は、多くの人に障害を与える一般的な皮膚病変である。座瘡は、典型的には、思春期の始まりに現れ、14〜19歳の間にその発生のピークがある。座瘡の罹患率は、生涯のうち20代の中頃には大幅に低減する。座瘡病因は、多要因性の皮脂腺機能亢進(皮脂産生の増加)であり、脂漏、角化細胞の異常増殖/落屑および局所的炎症変化を促進する細菌コロニー形成を伴う。思春期にアンドロゲン産生が急増する結果、皮脂産生の増加が毛嚢上皮層の異常落屑と共に起こる。この皮脂と細胞残屑の混合物は面皰の基本成分であり、正常な皮膚フローラの一部であって炎症性座瘡への重要な一因である嫌気性グラム陽性菌プロピオニバクテリウム・アクネス(Propionibacterium acnes (P. acnes))の増殖に対して理想的な環境を提供する。その後、細菌誘導性白血球遊走因子および炎症誘発性メディエーターが局所的炎症反応を促進する。
【0004】
座瘡の臨床病変は、軽症座瘡の開放面皰(白色面皰)および閉鎖面皰(黒色面皰)から重症の炎症性座瘡の丘疹、膿疱、結節および嚢胞性病変または混合性病変に及ぶ。座瘡病変は、典型的には、顔、上背、胸部および上腕に生じる。座瘡の臨床経過は、それが大きくなって治まる傾向がある。病変の重症度は、季節的影響および心理的影響を含む多重要因の影響を受けるとともに、患者の病変を習慣的に処置する患者自身が誘発する外傷の影響を受ける。一般に、経過において一時的ではあるが、中等症〜重症の炎症性座瘡は、患者にとって長期的な影響を引き起こし得る実際的な病態、例えば、これらに限定されるものではないが、生活に支障を来たすほどの精神的ダメージおよび美観を損なう物理的傷跡を与える。
【0005】
中等症から重症の座瘡を治療するために様々な治療を利用することができる。これらの治療は特定の様相の病変に作用し得るか、場合によっては、いくつかの病因に作用し得る。しかし、現在利用可能な座瘡治療には重大な欠点がある。皮膚疾患の治療は、軽症から中等症の座瘡に対して十分な効果が得られないだけでなく、これらの治療で用いられる薬剤の多くは皮膚刺激性を生じる。皮膚用レチノイドおよびベンゾイルパーオキサイドを用いる治療は、面皰の除去、殺菌、および/または炎症の低減により、軽症から中等症の座瘡に対して有効である。皮膚科学的に、または経口的に投与される抗生物質を使用する治療は、抗生物質の静菌作用および抗炎症作用によって軽症から中等症の座瘡を治療するために使用することができる。しかし典型的には、経口抗生物質では満足な病変クリアランスは得られない。また一般的に、座瘡治療で使用される経口抗生物質の作用は遅効性であり、最善の結果を得るには3〜6か月の治療期間を要する。従って、特に弱年齢の患者においては、服薬遵守は難しい場合がある。さらに抗生物質の長期使用は、細菌の抗生物質耐性の恐れも伴う。また、光線による治療(例えば、420nmの青色光または1450nmの熱レーザー)は、皮脂腺に対するそれぞれの抗細菌性光力学的効果または熱的効果に基づき、軽症から中等症の座瘡の治療に使用することができる。
【0006】
現在のガイドラインで、中等症から重症の座瘡に罹患した患者に対して選択される治療投薬計画は、経口抗生物質とレチノイドなどの皮膚用剤との組み合わせである。治療抵抗性の結節性座瘡に罹患している患者に関しては、第1選択の治療は、経口レチノイド、例えば、アキュテイン(Accutane)(登録商標)(13-シス-レチノイン酸)からなっていてもよい。アキュテイン(登録商標)は皮脂腺に対して強力な抑制作用を有しているため、面皰を除去し、炎症を低減し、また皮脂腺内の増殖、分化および脂質生成を抑制するのに有用である。さらに、アキュテイン(登録商標)は、物理的な瘢痕形成または心理学的な傷形成のリスクのある患者の中等症または重症座瘡を治療するのにも用いられる。アキュテイン(登録商標)は、座瘡治療で効果が証明された長い歴史がある。アキュテイン(登録商標)で治療された多くの患者は、3〜6か月間、毎日投薬することで緩解を経験する。場合によっては、その治療は永続的な効果をもたらし、治癒の可能性がある。一方、アキュテイン(登録商標)は広く認められている催奇形性物質であり、さらに、高リスクのうつ病、血液脂質レベルの上昇、および健康に害のある粘膜皮膚変化をはじめとする、有意な全身性副作用をもたらすことが知られている。皮脂腺活性に対するアキュテイン(登録商標)の強力な抑制作用は、皮膚用レチノイドおよび皮膚用/経口用抗生物質の作用とは明確に異なる。しかし、座瘡の局所治療では、このアプローチがアキュテイン(登録商標)に伴う全身的有害作用のリスクを最小限にするので、依然として好まれている。経口で有効なアキュテイン(登録商標)様の薬剤が局所的に投与される場合には、皮膚および/または皮脂腺にそれらが限定的に浸透していく可能性があることから、実質的にはその活性は恐らく低いと考えられる。
【0007】
座瘡を治療する手段として、皮脂産生を低減することも既に記載されている。例えば、Zouboulis, C.C. et al., "Zileuton, an oral 5-lipoxygenase inhibitor, directly reduces sebum production", Dermatology (2005), Vol. 210, pp. 36-3 8;およびZouboulis, C.C. et al., "A new concept for acne therapy: a pilot study with zileuton, an oral 5-lipoxygenase inhibitor", Arch. Dermatol. (2003), Vol. 139, pp. 668-670を参照されたい。ジロートン(Zileuton)は、アラキドン酸からロイコトリエンB4(LTB4)の形成を触媒する酵素である5-リポキシゲナーゼの経口活性阻害剤であり、これが中等症から重症の座瘡患者に対して試験された。LTB4は、皮脂脂質の産生を促進する。この研究の結果、12週間で皮脂脂質が65%減少し、炎症性病変が71%減少したことが明らかになった。この研究によって、皮脂産生の阻害により作用する非レチノイドの使用で、座瘡が有意に改善され得ることが示唆された。
【先行技術文献】
【非特許文献】
【0008】
【非特許文献1】Zouboulis, C.C. ら, "Zileuton, an oral 5-lipoxygenase inhibitor, directly reduces sebum production", Dermatology, 2005年, 第210巻, pp. 36-38
【非特許文献2】Zouboulis, C.C.ら, "A new concept for acne therapy: a pilot study with zileuton, an oral 5-lipoxygenase inhibitor", Arch. Dermatol., 2003年, 第139巻, pp. 668-670
【発明の概要】
【発明が解決しようとする課題】
【0009】
したがって、座瘡および他の皮脂腺機能亢進を特徴とする皮膚疾患に対し、速効性で、効果があり、かつ安全性のある皮膚治療または経口治療が必要とされている。
【課題を解決するための手段】
【0010】
発明の概要
本明細書では、5-(テトラデシルオキシ)-2-フランカルボン酸(TOFA)の類似体、並びに、皮脂腺機能亢進を特徴とする皮膚疾患または病変(例えば、尋常性座瘡、集簇性座瘡、クロール座瘡(choracne)、酒さ、酒さ鼻、脂漏、脂漏性皮膚炎、皮脂腺肥厚、マイボーム腺機能不全の顔面酒さ、細胞分裂促進性脱毛、および脂性肌など)を治療するための前記類似体の使用方法を開示する。
【発明を実施するための形態】
【0011】
したがって、一態様では、本発明は、単一立体異性体またはそれらの混合物としての、式(I):
【化1】

【0012】
(式中、
R1は、-O-R2、-O-R3-OR2、-O-R3-OC(O)-N(R5)R6、-O-R3-N(R5)R6、-O-R3-N(R4)C(O)OR5、-O-R3-C(O)OR5、-O-R3-C(O)N(R5)R6または-N(R5)S(O)2-R4であり;
各R2は、独立して、アルキル、ハロアルキル、場合により置換されていてもよいアリール、場合により置換されていてもよいアラルキル、場合により置換されていてもよいヘテロシクリル、場合により置換されていてもよいヘテロシクリルアルキル、場合により置換されていてもよいヘテロアリール、または場合により置換されていてもよいヘテロアリールアルキルであり;
各R3は、独立して、場合により置換されていてもよいアルキレン鎖であり;
R4は、場合により置換されていてもよいアルキル、場合により置換されていてもよいアリール、場合により置換されていてもよいアラルキル、場合により置換されていてもよいヘテロアリール、または場合により置換されていてもよいヘテロアリールアルキルであり;
各R5は、独立して、水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリール、または場合により置換されていてもよいアラルキルであり;
各R6は、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアラルキル、または-R3-C(O)OR4であるか;
あるいは、任意のR5およびR6は、これらが両方とも結合されている窒素と一緒になって、場合により置換されていてもよいN-ヘテロシクリルまたは場合により置換されていてもよいN-ヘテロアリールを形成している)
で表される化合物、あるいはその製薬上許容可能な塩に関する。
【0013】
本発明の別の態様は、治療上有効な量の上記の式(I)で表される化合物、またはその製薬上許容可能な塩と、製薬上許容可能な添加剤とを含む医薬組成物に関する。
【0014】
別の態様では、本発明は、皮脂腺機能亢進を特徴とする皮膚疾患または病変のあるヒトの治療方法であって、治療上有効な量の上記の式(I)で表される化合物またはその製薬上許容可能な塩を、それを必要とするヒトに投与することを含む方法に関する。
【0015】
別の態様では、本発明は、皮脂腺機能亢進を特徴とする皮膚疾患または病変のあるヒトの治療方法であって、治療上有効な量の上記の式(I)で表される化合物またはその製薬上許容可能な塩と、製薬上許容可能な添加剤とを含む医薬組成物を、それを必要とするヒトに投与することを含む方法に関する。
【0016】
本発明の別の態様は、ヒトにおける皮脂腺活性の抑制方法であって、治療上有効な量の上記の式(I)で表される化合物またはその製薬上許容可能な塩を、それを必要とするヒトに投与することを含む方法に関する。
【0017】
本発明の別の態様は、ヒトにおける皮脂腺活性の抑制方法であって、治療上有効な量の上記の式(I)で表される化合物またはその製薬上許容可能な塩と、製薬上許容可能な添加剤とを含む医薬組成物を、それを必要とするヒトに投与することを含む方法に関する。
【0018】
本発明の別の態様は、炎症と特徴とする疾患または病変のあるヒトの治療方法であって、治療上有効な量の上記の式(I)で表される化合物またはその製薬上許容可能な塩と、製薬上許容可能な添加剤とを含む医薬組成物を、それを必要とするヒトに投与することを含む方法に関する。
【0019】
本発明の別の態様は、炎症を特徴とする疾患または病変のあるヒトのT細胞増殖およびサイトカイン分泌の低減方法であって、治療上有効な量の上記の式(I)で表される化合物またはその製薬上許容可能な塩と、製薬上許容可能な添加剤とを含む医薬組成物を、それを必要とするヒトに投与することを含む方法に関する。
【0020】
上記の本発明の様々な態様のうち、式(I)で表される化合物は、以下の米国特許(それらの全開示内容は、参照により本明細書に完全に組み入れられるものとする)で詳細に記載または請求されている化合物については包含されないものと理解されたい:米国特許第4,110,351号;米国特許第4,146,623号;米国特許第4,602,099号;および米国特許第4,980,371号。特定の実施形態において、式(I)で表される化合物は、5-ドデシロキシ-2-フロ酸、5-テトラデシルオキシ-2-フロ酸メチルエステル、5-テトラデシルオキシ-2-フロ酸ピペリジノエチルエステル、および5-テトラデシルオキシ-2-フロ酸3-ピロリジニルエステルは除く。
【0021】
本発明の上記の態様およびそれらの実施形態を下記により詳しく記載する。
【図面の簡単な説明】
【0022】
【図1】ハムスター耳皮脂腺に対するTOFA局所適応の効果と本発明の3種の化合物の同時適用の効果を評価するためのin vivoアッセイの結果を示す図である。未治療の耳および治療済みの耳について標準偏差を用いた平均皮脂腺計数(1群当たり動物5匹)を示す。* Students TestによりP<0.05。
【図2】化合物Aの適用21日間後と治療を停止した1週間後および2週間後のハムスター皮脂腺のサイズを評価するためのさらなるin vivoアッセイの結果を示す図である。未治療の耳および治療済みの耳について標準偏差を用いた平均皮脂腺計数(各時点で1群当たり動物7〜8匹)を示す。* P<0.05;** 溶媒で治療した動物と比較した場合P<0.005。
【図3】動物を、それぞれ対照ビヒクル(40%DMA/30%アセトン/30%エタノール)、TOFAおよび化合物Aで21日間連続して治療した試験で調製した耳切片の組織学的な所見を示す図である。
【0023】
発明の詳細な説明
定義
本明細書で指定した特定の化学基は、示した化学基で確認され得る炭素原子数の総数を表す簡略表記を前に付けることができる。例えば;C7-C12アルキルは、7〜12個の炭素原子総数を有する下記に定義したようなアルキル基を説明しており、また、C4-C12シクロアルキルアルキルは、4〜12個の炭素原子総数を有する下記に定義したようなシクロアルキルアルキル基を説明している。簡略表記の炭素総数は、記載した基の置換基に存在するであろう炭素を含むものではない。
【0024】
上記に加えて、本明細書および添付の特許請求の範囲で使用される場合においては、特に異なる記載のない限り、以下の用語は次に示す意味を有する:
「アミノ」は-NH2基を意味する。
【0025】
「シアノ」は-CN基を意味する。
【0026】
「ヒドロキシ」は-OH基を意味する。
【0027】
「イミノ」は=NH置換基を意味する。
【0028】
「ニトロ」は-NO2基を意味する。
【0029】
「オキソ」は=O置換基を意味する。
【0030】
「チオキソ」は=S置換基を意味する。
【0031】
「トリフルオロメチル」は-CF3基を意味する。
【0032】
「アルキル」は、炭素原子および水素原子のみからなり、不飽和は含有しておらず、1〜12個の炭素原子、好ましくは1〜8個の炭素原子、または1〜6個の炭素原子を有する直鎖状または分枝状の炭化水素鎖基を意味し、当該基は単結合により分子の残りの部分に結合される。例としては、メチル、エチル、n-プロピル、1-メチルエチル(イソプロピル)、n-ブチル、n-ペンチル、1,1-ジメチルエチル(t-ブチル)、3-メチルヘキシル、2-メチルヘキシルなどである。本明細書中で他に特段の記載のない限り、アルキル基は、場合により、以下の基のうちの1つの基で置換されていてもよい:アルキル、アルケニル、ハロ、ハロアルケニル、シアノ、ニトロ、アリール、シクロアルキル、ヘテロシクリル、ヘテロアリール、オキソ、トリメチルシラニル、-OR14、-OC(O)-R14、-N(R14)2、-C(O)R14、-C(O)OR14、-C(O)N(R14)2、-N(R14)C(O)OR16、-N(R14)C(O)R16、-N(R14)S(O)tR16(ここでtは1〜2である)、-S(O)tOR16(ここでtは1〜2である)、-S(O)pR16(ここでpは0〜2である)、および-S(O)tN(R14)2(ここでtは1〜2である)(この場合、各R14は、独立して、水素、アルキル、ハロアルキル、シクロアルキル、シクロアルキルアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアリールアルキルであり;各R16は、アルキル、ハロアルキル、シクロアルキル、シクロアルキルアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアリールアルキルである)。
【0033】
「アルキレン」または「アルキレン鎖」は、炭素および水素のみからなり、不飽和を含有しておらず、1〜12個の炭素原子を有するものであって、分子の残りの部分を置換基へと結合する直鎖状または分枝状の二価の炭化水素鎖を意味する。例えば、メチレン、エチレン、プロピレン、n-ブチレンなどである。アルキレン鎖は、単結合を介して分子の残りの部分に結合され、また単結合を介して置換基に結合される。分子の残りの部分に対する、または置換基に対するアルキレン鎖の結合点は、当該鎖内の1個の炭素または任意の2個の炭素を介しているものであってもよい。本明細書中で他に特段の記載のない限り、アルキレン鎖は、場合により、以下の基の1つの基で置換されていてもよい:アルキル、アルケニル、ハロ、ハロアルケニル、シアノ、ニトロ、アリール、シクロアルキル、ヘテロシクリル、ヘテロアリール、オキソ、トリメチルシラニル、-OR14、-OC(O)-R14、-N(R14)2、-C(O)R14、-C(O)OR14、-C(O)N(R14)2、-N(R14)C(O)OR16、-N(R14)C(O)R16、-N(R14)S(O)tR16(ここでtは1〜2である)、-S(O)tOR16(ここでtは1〜2である)、-S(O)pR16(ここでpは0〜2である)、および-S(O)tN(R14)2(ここでtは1〜2である)(この場合、各R14は、独立して、水素、アルキル、ハロアルキル、シクロアルキル、シクロアルキルアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアリールアルキルであり;各R16は、アルキル、ハロアルキル、シクロアルキル、シクロアルキルアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアリールアルキルである)。
【0034】
「アリール」は、水素、6〜18個の炭素原子および少なくとも1つの芳香族環を含む炭化水素環構造基を意味する。本発明の目的においては、アリール基は単環式、二環式、三環式または四環式構造であってもよく、これには縮合環構造または架橋環構造が包含されていてもよい。アリール基は、特に限定されるものではないが、アセアントリレン、アセナフチレン、アセフェナントリレン、アントラセン、アズレン、ベンゼン、クリセン、フルオランテン、フルオレン、as-インダセン、s-インダセン、インダン、インデン、ナフタレン、フェナレン、フェナントレン、プレイアデン(pleiadene)、ピレンおよびトリフェニレンから誘導されたアリール基を含む。本明細書中で他に特段の記載のない限り、用語「アリール」または接頭語「アラ-(ar-)」(例えば「アラルキル(aralkyl)」中のアラ(ar))は、場合により、次のものからなる群から独立して選択される1個または複数の置換基で置換されていてもよいアリール基を包含することを意味する:アルキル、アルケニル、ハロ、ハロアルキル、ハロアルケニル、シアノ、ニトロ、アリール、アラルキル、ヘテロアリール、ヘテロアリールアルキル、-R15-OR14、-R15-OC(O)-R14、-R15-N(R14)2、-R15-C(O)R14、-R15-C(O)OR14、-R15-C(O)N(R14)2、-R15-N(R14)C(O)OR16、-R15-N(R14)C(O)R16、-R15-N(R14)S(O)tR16(ここでtは1〜2である)、-R15-N=C(OR14)R14、-R15-S(O)tOR16(ここでtは1〜2である)、-R15-S(O)pR16(ここでpは0〜2である)、および-R15-S(O)tN(R14)2(ここでtは1〜2である)(この場合、各R14は、独立して、水素、アルキル、ハロアルキル、シクロアルキル、シクロアルキルアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアリールアルキルであり;各R15は、独立して、直接結合または直鎖状もしくは分枝状アルキレンまたはアルケニレン鎖であり;各R16は、アルキル、ハロアルキル、シクロアルキル、シクロアルキルアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアリールアルキルである)。
【0035】
「アラルキル」は、式-Rb-Rcの基(式中、Rbは上記で定義したアルキレン鎖であり、Rcは上記で定義した1個または複数のアリール基である)を意味し、例えばベンジル、ジフェニルメチルなどである。アラルキル基のアルキレン鎖部分は、場合により、アルキレン鎖について上述したように置換されていてもよい。アラルキル基のアリール部分は、場合により、アリール基に関して上述したように置換されていてもよい。
【0036】
「シクロアルキル」とは、炭素原子および水素原子のみからなる、安定性のある非芳香族の単環式または多環式炭化水素基を意味し、これは、3〜15個の炭素原子、好ましくは3〜10個の炭素原子を有する縮合環構造または架橋環構造を含んでいてもよく、また、これは飽和または不飽和であり、単結合を介して分子の残りの部分に結合する。単環式基としては、例えば、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチルおよびシクロオクチルが挙げられる。多環式基としては、例えば、アダマンチル、ノルボルニル、デカリニル(decalinyl)などが挙げられる。本明細書中で他に特段の記載のない限り、用語「シクロアルキル」は、場合により、次のものからなる群から独立して選択される1個または複数の置換基で置換されていてもよいシクロアルキル基を含むことを意味する:アルキル、アルケニル、ハロ、ハロアルキル、ハロアルケニル、シアノ、ニトロ、オキソ、アリール、アラルキル、シクロアルキル、シクロアルキルアルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリール、ヘテロアリールアルキル、-R15-OR14、-R15-OC(O)-R14、-R15-N(R14)2、-R15-C(O)R14、-R15-C(O)OR14、-R15-C(O)N(R14)2、-R15-N(R14)C(O)OR16、-R15-N(R14)C(O)R16、-R15-N(R14)S(O)tR16(ここでtは1〜2である)、-R15-N=C(OR14)R14、-R15-S(O)tOR16(ここでtは1〜2である)、-R15-S(O)pR16(ここでpは0〜2である)、および-R15-S(O)tN(R14)2(ここでtは1〜2である)(この場合、各R14は、独立して、水素、アルキル、ハロアルキル、シクロアルキル、シクロアルキルアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアリールアルキルであり;各R15は、独立して、直接結合または直鎖状もしくは分枝状アルキレンまたはアルケニレン鎖であり;各R16は、アルキル、ハロアルキル、シクロアルキル、シクロアルキルアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアリールアルキルである)。
【0037】
「ハロ」はブロモ、クロロ、フルオロまたはヨードを意味する。
【0038】
「ハロアルキル」は、上記で定義した1個または複数のハロ基で置換されている、上記で定義したアルキル基を意味し、例えば、トリフルオロメチル、ジフルオロメチル、トリクロロメチル、2,2,2-トリフルオロエチル、1-フルオロメチル-2-フルオロエチル、3-ブロモ-2-フルオロプロピル、1-ブロモメチル-2-ブロモエチルなどがある。ハロアルキル基のアルキル部分は、場合により、アルキル基に関して上記で定義したように置換されていてもよい。
【0039】
「ヘテロシクリル」は、2〜12個の炭素原子と、窒素、酸素および硫黄からなる群から選択される1〜6個のヘテロ原子とからなる、安定性のある3〜18員の非芳香族環基を意味する。本明細書中で他に特段の記載のない限り、ヘテロシクリル基は単環式、二環式、三環式または四環式環構造であってもよく、当該基は縮合環構造または架橋環構造を含んでいてもよい。また、ヘテロシクリル基中の窒素、炭素または硫黄原子は、場合により酸化されていてもよく;窒素原子は場合により四級化されていてもよく;またヘテロシクリル基は、部分的にまたは完全に飽和されていてもよい。こうしたヘテロシクリル基の例としては、特に限定されるものではないが、ジオキソラニル、チエニル[1,3]ジチアニル、デカヒドロイソキノリル、イミダゾリニル、イミダゾリジニル、イソチアゾリジニル、イソオキサゾリジニル、モルホリニル、オクタヒドロインドリル、オクタヒドロイソインドリル、2-オキソ-1,3-ジオキソール-4-イル、2-オキソピペラジニル、2-オキソピペリジニル、2-オキソピロリジニル、オキサゾリジニル、ピペリジニル、ピペラジニル、4-ピペリドニル、ピロリジニル、ピラゾリジニル、キヌクリジニル、チアゾリジニル、テトラヒドロフラニル、トリチアニル、テトラヒドロピラニル、チオモルホリニル、チアモルホリニル、1-オキソ-チオモルホリニル、および1,1-ジオキソ-チオモルホリニルが挙げられる。本明細書中で他に特段の記載のない限り、用語「ヘテロシクリル」は、場合により、次のものからなる群から選択される1個または複数の置換基で置換されていてもよい、上記で定義したヘテロシクリル基を含むことを意味する:アルキル、アルケニル、ハロ、ハロアルキル、ハロアルケニル、シアノ、オキソ、チオキソ、ニトロ、アリール、アラルキル、シクロアルキル、シクロアルキルアルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリール、ヘテロアリールアルキル、-R15-OR14、-R15-OC(O)-R14、-R15-N(R14)2、-R15-C(O)R14、-R15-C(O)OR14、-R15-C(O)N(R14)2、-R15-N(R14)C(O)OR16、-R15-N(R14)C(O)R16、-R15-N(R14)S(O)tR16(ここでtは1〜2である)、-R15-N=C(OR14)R14、-R15-S(O)tOR16(ここでtは1〜2である)、-R15-S(O)pR16(ここでpは0〜2である)、および-R15-S(O)tN(R14)2(ここでtは1〜2である)(この場合、各R14は、独立して、水素、アルキル、ハロアルキル、シクロアルキル、シクロアルキルアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアリールアルキルであり;各R15は、独立して、直接結合または直鎖状もしくは分枝状アルキレンもしくはアルケニレン鎖であり;各R16は、アルキル、ハロアルキル、シクロアルキル、シクロアルキルアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアリールアルキルである)。
【0040】
「N-ヘテロシクリル」は、少なくとも1個の窒素を含有する上記で定義したヘテロシクリル基を意味し、この場合、ヘテロシクリル基の分子の残りの部分への結合点は、ヘテロシクリル基中の窒素原子を介している。N-ヘテロシクリル基は、場合により、ヘテロシクリル基に関して上述したように置換されていてもよい。
【0041】
「ヘテロシクリルアルキル」は、式-RbRh(式中、Rbは上記で定義したアルキレン鎖であり、Rhは上記で定義したヘテロシクリル基であり、ヘテロシクリルが窒素含有ヘテロシクリルである場合、ヘテロシクリルは窒素原子でアルキレン鎖に結合されていてもよい)の基を意味する。ヘテロシクリルアルキル基のアルキレン鎖は、場合により、アルキレン鎖に関して上記で定義したように置換されていてもよい。ヘテロシクリルアルキル基のヘテロシクリル部分は、場合により、ヘテロシクリル基に関して上記で定義したように置換されていてもよい。
【0042】
「ヘテロアリール」は、水素原子、1〜13個の炭素原子、窒素、酸素および硫黄からなる群から選択される1〜6個のヘテロ原子、ならびに少なくとも1つの芳香族環を含む、5〜14員の環構造基を意味する。本発明の目的においては、ヘテロアリール基は単環式、二環式、三環式または四環式の環構造であってもよく、これには縮合環構造または架橋環構造が包含されていてもよい。また、ヘテロアリール基中の窒素、炭素または硫黄原子は、場合により酸化されていてもよく;窒素原子は、場合により四級化されていてもよい。例としては、特に限定されるものではないが、アゼピニル、アクリジニル、ベンズイミダゾリル、ベンズチアゾリル、ベンゾインドリル、ベンゾジオキソリル、ベンゾフラニル、ベンゾオキサゾリル、ベンゾチアゾリル、ベンゾチアジアゾリル、ベンゾ[b][1,4]ジオキセピニル、1,4-ベンゾジオキサニル、ベンゾナフトフラニル、ベンゾオキサゾリル、ベンゾジオキソリル、ベンゾジオキシニル、ベンゾピラニル、ベンゾピラノニル、ベンゾフラニル、ベンゾフラノニル、ベンゾチエニル(ベンゾチオフェニル)、ベンゾトリアゾリル、ベンゾ[4,6]イミダゾ[1,2-a]ピリジニル、カルバゾリル、シンノリニル、ジベンゾフラニル、ジベンゾチオフェニル、フラニル、フラノニル、イソチアゾリル、イミダゾリル、インダゾリル、インドリル、インダゾリル、イソインドリル、インドリジニル、イソインドリル、イソキノリル、インドリジニル、イソオキサゾリル、ナフチリジニル、オキサジアゾリル、2-オキソアゼピニル、オキサゾリル、オキシラニル、1-オキシドピリジニル、1-オキシドピリミジニル、1-オキシドピラジニル、1-オキシドピリダジニル、1-フェニル-1H-ピロリル、フェナジニル、フェノチアジニル、フェノキサジニル、フタラジニル、プテリジニル、プリニル、ピロリル、ピラゾリル、ピリジニル、ピラジニル、ピリミジニル、ピリダジニル、ピロリル、キナゾリニル、キノキサリニル、キノリニル、キヌクリジニル、イソキノリニル、テトラヒドロキノリニル、チアゾリル、チアジアゾリル、トリアゾリル、テトラゾリル、トリアジニル、およびチオフェニル(すなわちチエニル)が挙げられる。本明細書中で他に特段の記載のない限り、用語「ヘテロアリール」は、場合により、次のものからなる群から独立して選択される1個または複数の置換基で置換されていてもよい上記で定義したヘテロアリール基を含むことを意味する:アルキル、アルケニル、アルコキシ、ハロ、ハロアルキル、ハロアルケニル、シアノ、オキソ、チオキソ、ニトロ、アリール、アラルキル、シクロアルキル、シクロアルキルアルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリール、ヘテロアリールアルキル、-R15-OR14、-R15-OC(O)-R14、-R15-N(R14)2、-R15-C(O)R14、-R15-C(O)OR14、-R15-C(O)N(R14)2、-R15-N(R14)C(O)OR16、-R15-N(R14)C(O)R16、-R15-N(R14)S(O)tR16(ここでtは1〜2である)、-R15-N=C(OR14)R14、-R15-S(O)tOR16(ここでtは1〜2である)、-R15-S(O)pR16(ここでpは0〜2である)、および-R15-S(O)tN(R14)2(ここでtは1〜2である)(この場合、各R14は、独立して、水素、アルキル、アルケニル、ハロアルキル、シクロアルキル、シクロアルキルアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアリールアルキルであり;各R15は、独立して、直接結合または直鎖状もしくは分枝状アルキレンもしくはアルケニレン鎖であり;各R16は、アルキル、アルケニル、ハロアルキル、シクロアルキル、シクロアルキルアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアリールアルキルである)。
【0043】
「N-ヘテロアリール」は、少なくとも1個の窒素を含有する上記で定義したヘテロアリール基を意味し、この場合、ヘテロアリール基の分子の残りの部分への結合点は、ヘテロアリール基中の窒素原子を介してである。N-ヘテロアリール基は、場合により、ヘテロアリール基に関して上記で記載したように置換されていてもよい。
【0044】
「ヘテロアリールアルキル」は、式-RbRi(式中、Rbは上記で定義したアルキレン鎖であり、Riは上記で定義したヘテロアリール基である)の基を意味する。ヘテロアリールアルキル基のヘテロアリール部分は、場合により、ヘテロアリール基に関して上記で定義したように置換されていてもよい。ヘテロアリールアルキル基のアルキレン鎖部分は、場合により、アルキレン鎖に関して上記で定義したように置換されていてもよい。
【0045】
「皮膚疾患または病変」には、高活性皮脂腺活性に関連する疾患、例えば、尋常性座瘡、集簇性座瘡、クロール座瘡(choracne)、酒さ、酒さ鼻、脂漏、脂漏性皮膚炎、皮脂腺肥厚、マイボーム腺機能不全の顔面酒さ、細胞分裂促進性脱毛、および脂性肌などが含まれる。
【0046】
「皮膚科学的に許容可能な添加剤」としては、特に限定されるものではないが、任意のアジュバント、担体、ビヒクル、添加剤、滑沢剤、甘味料、希釈剤、防腐剤、色素/着色剤、調味料、界面活性剤、湿潤剤、分散剤、懸濁化剤、安定剤、等張剤、溶媒または乳化剤で、例えば、ヒトもしくは家畜動物に対する皮膚使用で許可され得るものとして米国食品医薬品局により承認されているもの、すなわち公知であるもの、あるいは、皮膚用組成物における使用に好適であるものが挙げられる。
【0047】
周知の通り、皮膚(特に角質層)は、外部環境の悪影響に対する身体的バリアを提供する。その際に、それは局所治療薬の吸収または経皮的送達の妨げともなる。このため、適切な皮膚科学的に許容可能な添加剤には、1種または複数の経皮吸収促進剤(または浸透促進剤)が含まれていてもよい。それらの薬剤は、皮膚バリアを通して治療薬(例えば、本明細書に記載のTOFA類似体)の拡散を促す物質である。これらの薬剤は、典型的には、皮膚の抵抗または耐性を低減するように作用し、治療薬の浸透を改善させる。特に、角質層の正常構造を不安定にする物質は細胞間の脂質組織を分断させることが可能で、それによりそのバリアとしての効果が低減する。これらの物質としては、角質層脂質へ分配されて直接効果をもたらす全ての脂質物質、またはタンパク質に作用して脂質構造の間接的な不安定性をもたらす全ての物質を挙げることができる。さらに、エタノールなどの溶媒は角質層から脂質を取り除き、その結果、その脂質組織が破壊され、そのバリア機能が機能しなくなる可能性がある。
【0048】
経皮吸収促進剤またはバリア機能崩壊物質の例としては、特に限定されるものではないが、次のものが挙げられる:アルコール系促進剤、例えば、1〜16個の炭素を含むアルカノール類、ベンジルアルコール、ブチレングリコール、ジエチレングリコール、グリコフロール、グリセリド、グリセリン、グリセロール、フェネチルアルコール、ポリプロピレングリコール、ポリビニルアルコールおよびフェノール;アミド系促進剤、例えば、N-ブチル-N-ドデシルアセトアミド、クロタミトン、N,N-ジメチルホルムアミド、N,N-ジメチルアセトアミド、N-メチルホルムアミドおよび尿素;アミノ酸、例えばL-α-アミノ酸、および水溶性タンパク質;アゾンおよびアゾン様化合物、例えばアザシクロアルカン;精油類、例えば、アーモンド油、酪酸アミル、杏仁油、アボカド油、カンファー、ヒマシ油、1-カルボン、ヤシ油、トウモロコシ油、綿実油、オイゲノール、メントール、アニス油、チョウジ油、オレンジ油、落花生油、ハッカ油、ローズ油、サフラワー油、ゴマ油、鮫肝油(スクアレン)、大豆油、ヒマワリ油およびクルミ油;ビタミン類およびハーブ類、例えば、アロエ、アラントイン、クログルミ抽出物、カミツレ抽出物、パンテノール、パパイン、トコフェロール、およびビタミンAパルミテート;ワックス類、例えばカンデリラワックス、カルナバワックス、セレシンワックス、蜜ろう、ラノリンワックス、ホホバオイル、ワセリン;混合物、例えば、分画植物油脂肪酸とグリセリンまたはプロピレングリコールとの第一級エステル、およびエステル交換中鎖トリグリセライド油;脂肪酸および脂肪酸エステル類、例えば、カプロン酸アミル、酢酸ブチル、カプリル酸、セチルエステル、セバシン酸ジエチル、リンゴ酸ジオクチル、エライジン酸カプリル酸エチル、パルミトステアリン酸エチルグリコール、ベヘン酸グリセリル、グルタミン酸グルコース、酢酸イソブチル、ラウレス-4、ラウリン酸、リンゴ酸、カプリン酸メチル、鉱油、ミリスチン酸、オレイン酸、パルミチン酸、PEG脂肪酸エステル、ポリオキシルエンソルビタンモノオレエート、ポリプロピレングリコール、プロピレングリコール、ジステアリン酸スクロース、サリチル酸、クエン酸ナトリウム、ステアリン酸、石鹸、およびカプロン酸トリグリセリド、カプリル酸トリグリセリド、カプリン酸トリグリセリドおよびラウリン酸トリグリセリド;大環状類、例えば、ブチル化ヒドロキシアニソール、シクロペンタデカノリド、シクロデキストリン;リン脂質およびホスフェート促進剤、例えば、ジアルキルホスフェート、ジテトラデシルホスフェート、レシチン、2-ピロリドン誘導体、例えば、アルキルピロリドン-5-カルボキシレートエステル、ピログルタミン酸エステル、N-メチルピロリドン、生物分解性ソフト経皮吸収促進剤、例えば、ジオキサン誘導体およびジオキソラン誘導体;スルホキシド促進剤、例えば、ジメチルスルホキシドおよびデシルメチルスルホキシド;酸促進剤、例えば、アルギン酸、ソルビン酸およびコハク酸;環状アミン類;イミダゾリノン類;イミダゾール類;ケトン類、例えば、アセトン、ジメチコーン、メチルエチルケトンおよびペンタンジオン;ラノリン誘導体、例えば、ラノリンアルコール、PEG 16ラノリンおよびアセチル化ラノリン;オキサゾリン類;オキサゾリンジノン類;プロリンエステル類;ピロール類、ウレタン類;並びに界面活性剤、例えば、ノンオキシノール、ポリソルベート、ポリオキシレンアルコール、ポリオキシレン脂肪酸エステル、ラウリル硫酸ナトリウムおよびモノステアリン酸ソルビタン。
【0049】
「皮膚科学的に有効な量」とは、ヒトに皮膚科学的に投与した場合(すなわち、皮脂腺への投与を提供する、全身投与または局部投与、例えば、局所投与、皮内投与、静脈内投与、経口投与、またはインプラント使用による投与)、ヒトにおける対象の疾患または病変の(下に定義したような)所望の治療を達成するのに十分である活性成分のその量を意味する。「皮膚科学的に有効な量」を構成する活性成分の量は、活性成分、疾患または病変およびその重症度、ならびに治療を受けるヒトの年齢によって変動するが、当業者によって、持ち得る知識および本明細書を考慮して慣例的に決定することができる。
【0050】
「安定性(のある)化合物」および「安定性(のある)構造」とは、反応混合物から有用な純度の程度に単離し、有効性のある治療薬へ製剤化するのに耐え得る十分に強固な化合物を示すものとする。
【0051】
「哺乳動物」には、ヒトと、家畜動物、例えば、実験動物および家庭用ペット(例えば、ネコ、イヌ、ブタ、ウシ、ヒツジ、ヤギ、ウマ、ウサギ)や野生動物などの非家畜の両方が含まれる。
【0052】
「任意の」または「場合により」とは、状況に関するその後に述べられる事象が生じてもよいし、生じなくてもよいことを意味し、また、その記載が、前記事象または状況が生じる場合の例示群およびそれらが起こらない場合の例示群を含んでいることを意味する。例えば、「場合により置換されていてもよいアリール」とは、アリール基が置換されていてもよいし、置換されていなくてもよいことを意味し、また、その記載には置換アリール基群と置換基を有しないアリール基群の両方が含まれることを意味する。官能基が「場合により置換されていてもよい」と記載され、そして、官能基の置換基もまた「場合により置換されていてもよい」と記載されている場合、本発明の目的においては、こうした繰り返しは5つまで限定され、好ましくはこうした繰り返しは2つまで限定される。
【0053】
「製薬上許容可能な担体、希釈剤または添加剤」としては、特に限定されるものではないが、ヒトまたは家畜における使用で認可され得るものとして米国食品医薬品局により既に承認されている全てのアジュバント、担体、添加剤、滑沢剤、甘味料、希釈剤、防腐剤、色素/着色剤、調味料、界面活性剤、湿潤剤、分散剤、懸濁化剤、安定剤、等張剤、溶媒または乳化剤が挙げられる。
【0054】
「製薬上許容可能な塩」としては、酸付加塩および塩基付加塩の両方が挙げられる。
【0055】
「製薬上許容可能な酸付加塩」とは、遊離塩基の生物学的効果および特性を保持しており、生物学的または非生物学的に有害ではなく、また、無機酸類および有機酸類と形成される塩を意味し、前記無機酸としては、例えば、特に限定されるものではないが、塩酸、臭化水素酸、硫酸、硝酸、リン酸などが挙げられ、有機酸類としては、例えば、特に限定されるものではないが、酢酸、2,2-ジクロロ酢酸、アジピン酸、アルギン酸、アスコルビン酸、アスパラギン酸、ベンゼンスルホン酸、安息香酸、4-アセトアミド安息香酸、樟脳酸、カンファー-10-スルホン酸、カプリン酸、カプロン酸、カプリル酸、炭酸、ケイ皮酸、クエン酸、シクラミン酸、ドデシル硫酸、エタン-1,2-ジスルホン酸、エタンスルホン酸、2-ヒドロキシエタンスルホン酸、ギ酸、フマル酸、ガラクタル酸、ゲンチシン酸、グルコヘプトン酸、グルコン酸、グルクロン酸、グルタミン酸、グルタル酸、2-オキソ-グルタル酸、グリセロリン酸、グリコール酸、馬尿酸、イソ酪酸、乳酸、ラクトビオン酸、ラウリン酸、マレイン酸、リンゴ酸、マロン酸、マンデル酸、メタンスルホン酸、ムチン酸、ナフタレン-1,5-ジスルホン酸、ナフタレン-2-スルホン酸、1-ヒドロキシ-2-ナフトエ酸、ニコチン酸、オレイン酸、オロト酸、シュウ酸、パルミチン酸、パモ酸、プロピオン酸、ピログルタミン酸、ピルビン酸、サリチル酸、4-アミノサルチル酸、セバシン酸、ステアリン酸、コハク酸、酒石酸、チオシアン酸、p-トルエンスルホン酸、トリフルオロ酢酸、ウンデシレン酸などが挙げられる。
【0056】
「製薬上許容可能な塩基付加塩」は、遊離酸の生物学的効果および特性を保持しており、また、生物学的または非生物学的に有害ではないそれらの塩を意味する。このような塩は、無機塩基または有機塩基を遊離酸へ添加することにより調製される。無機塩基から誘導される塩としては、特に限定されるものではないが、ナトリウム、カリウム、リチウム、アンモニウム、カルシウム、マグネシウム、鉄、亜鉛、銅、マンガン、アルミニウムの塩などが挙げられる。好ましい無機塩は、アンモニウム、ナトリウム、カリウム、カルシウムおよびマグネシウムの塩である。有機塩基から誘導される塩としては、特に限定されるものではないが、第一級、第二級および第三級アミンの塩、天然型置換アミンを含む置換アミン類、環状アミン類および塩基性イオン交換樹脂の塩、例えば、アンモニア、イソプロピルアミン、トリメチルアミン、ジエチルアミン、トリエチルアミン、トリプロピルアミン、ジエタノールアミン、エタノールアミン、デアノール、2-ジメチルアミノエタノール、2-ジエチルアミノエタノール、ジシクロヘキシルアミン、リジン、アルギニン、ヒスチジン、カフェイン、プロカイン、ヒドラバミン、コリン、ベタイン、ベネタミン、ベンザチン、エチレンジアミン、グルコサミン、メチルグルカミン、テオブロミン、トリエタノールアミン、トロメタミン、プリン、ピペラジン、ピペリジン、N-エチルピペリジン、ポリアミン樹脂などの塩が挙げられる。特に好ましい有機塩基は、イソプロピルアミン、ジエチルアミン、エタノールアミン、トリメチルアミン、ジシクロヘキシルアミン、コリンおよびカフェインである。
【0057】
「医薬組成物」とは、本発明の化合物と、生物学的に活性のある化合物を哺乳動物(例えばヒト)へ送達するために当技術分野で一般的に認可されている媒体との製剤を意味する。こうした媒体としては、そのために製薬上許容された担体、希釈剤または添加剤が挙げられる。
【0058】
「治療上有効な量」とは、哺乳動物(好ましくはヒト)に投与された場合に、疾患または病変のある哺乳動物(好ましくはヒト)における対象の疾患または病変の治療をするのに効果が十分である、本発明の化合物のその量を意味する。「治療上有効な量」を構成する本発明の化合物の量は、化合物、疾患または病変およびその重症度、投与方法、ならびに治療を受ける哺乳動物の年齢によって変動するが、当業者によって、持ち得る知識および本明細書を考慮して慣例的に決定することができる。好ましくは、本発明の目的においては、「治療上有効な量」は、皮脂腺活性を抑制するのに十分な本発明の化合物のその量である。
【0059】
本明細書で使用する場合の「治療する」または「治療」とは、哺乳動物(好ましくはヒト)における対象の疾患または病変の治療を網羅し、次のものを含む:
(i) 疾患または病変の哺乳動物における発症の予防;
(ii) 哺乳動物における疾患または病変を抑制、すなわち、その進行の阻止;
(iii) 哺乳動物における疾患または病変の緩和、すなわち、疾患または病変の回復をもたらすこと;あるいは、
(iv) 哺乳動物における疾患または病変の徴候を緩和、すなわち、基礎疾患または病変に対処することなく徴候を軽減すること。
【0060】
本明細書では、「疾患」および「病変」という用語は同義で使用されていてもよいし、異なる意味で使用されていてもよい。異なる場合とは、特定の疾病または病変の原因因子が未知であり(そのため、病因学がまだ機能していない)、その結果、未だ疾患とは認められておらず、好ましくない病変または症候としてのみ認識されている(この場合、多少の徴候の特定の組み合わせは臨床医により同定されている)ような場合である。
【0061】
本発明の化合物またはこれらの製薬上許容可能な塩は、1種または複数の不斉中心を含み得るが、それゆえ、絶対立体配置における用語で、(R)-もしくは(S)-として、またはアミノ酸に関しては(D)-もしくは(L)-として定義することができる、鏡像異性体、ジアステレオマー、および他の立体異性体が得られる。本発明は、可能性のあるこのような全ての異性体、並びに、これらのラセミ体および光学的な純粋形態を含むことを意味する。光学的に活性な(+)および(-)、(R)-および(S)-、または(D)-および(L)-異性体群は、キラルシントンまたはキラル試薬を用いて調製することができるか、あるいは、例えば、クロマトグラフィーや分画結晶化などの慣用の技術を用いて分割することができる。個々の鏡像異性体を調製/単離する慣用の技術は、適当な光学的に純粋な前駆体からのキラル合成、または、例えば、キラル高圧液体クロマトグラフィー(HPLC)を用いる、ラセミ化合物(またはラセミ化合物の塩もしくは誘導体)の分割を含む。本明細書に記載の化合物群がオレフィン二重結合または他の幾何学的不斉中心を含有する場合であって、他に特段の記載のない限り、本化合物群はEおよびZの両幾何異性体を含むものとする。同様に、全ての互変異性体形態もまた包含されるものとする。
【0062】
「立体異性体」は、同一結合によって同一原子群で構成されているが、相互変換できない、異なる三次元構造を有する化合物を意味する。本発明は、様々な立体異性体およびそれらの混合物を意図するものであり、また、2種の立体異性体であって、相互の分子を重ね合わせることのできない鏡像関係になっていることを意味する「鏡像異性体」を含む。
【0063】
本明細書で使用している化学命名プロトコルおよび構造式は、ChemDraw Version 10ソフトウェアネーミングプログラム(CambridgeSoft)を使用する、I.U.P.A.C.命名法体系の改良形態である。本明細書で使用している複合化学物質名については、置換基は、それが結合している基の前に命名されている。例えば、2-シクロプロピルエチルは、エチル骨格をシクロプロピル置換基とともに含む。化学構造式では、十分な水素原子に結合されており、その原子価が完全であると仮定される一部の炭素原子を除いて、全ての結合が同定されている。
【0064】
置換基中の括弧の使用は、本明細書においてスペースを節約するために用いている。したがって、置換基中の括弧の使用は、括弧内に書き入れた基が括弧より前の原子に直接結合されていることを示す。例えば、R1に関する選択の1つは-O-R3-OC(O)-N(R5)R6基である。この基の式は、以下のように図示することができる。
【化2】

【0065】
したがって、例えば、R1が3-モルホノプロポキシである式(I)で表される化合物;すなわち、次式の化合物:
【化3】

【0066】
は、本明細書では、3-モルホリノプロピル5-(テトラデシルオキシ)フラン-2-カルボキシレートと命名されている。
【0067】
発明の実施形態
発明の概要で上述した本発明の種々の態様のうち、特定の実施形態が好ましい。
【0068】
発明の概要で上述した式(I)で表される化合物のうち、一実施形態は、
R1が-O-R2であり;
R2が独立して、アルキルまたはヘテロシクリルアルキルである
式(I)で表される化合物である。
【0069】
この実施形態のうち、一実施形態は、次のものから選択される式(I)で表される化合物である:
イソプロピル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
4-メチルペンチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;および、
(5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチル5-(テトラデシルオキシ)フラン-2-カルボキシレート。
【0070】
発明の概要で上述した式(I)で表される化合物のうち、別の実施形態は、
R1が-O-R2であり;
R2がハロアルキルまたは置換アリールである
式(I)で表される化合物である。
【0071】
この実施形態のうち、一実施形態は、次のものから選択される式(I)で表される化合物である:
2,2,2-トリフルオロエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2,2,2-トリクロロエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-ブロモエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;および、
2-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)安息香酸。
【0072】
発明の概要で上述した式(I)で表される化合物のうち、別の実施形態は、
R1が-O-R3-OR2であり;
R2が場合により置換されていてもよいヘテロシクリルアルキルであり;
R3が場合により置換されていてもよいアルキレン鎖である
式(I)で表される化合物である。
【0073】
この実施形態のうち、一実施形態は、3-(テトラヒドロ-2H-ピラン-2-イルオキシ)プロピル5-(テトラデシルオキシ)フラン-2-カルボキシレートである式(I)で表される化合物である。
【0074】
発明の概要で上述した式(I)で表される化合物のうち、別の実施形態は、
R1は、-O-R3-OC(O)-N(R5)R6であり;
各R2は、独立して、アルキル、ハロアルキル、場合により置換されていてもよいアリール、場合により置換されていてもよいアラルキル、場合により置換されていてもよいヘテロシクリル、場合により置換されていてもよいヘテロシクリルアルキル、場合により置換されていてもよいヘテロアリールまたは場合により置換されていてもよい置換ヘテロアリールアルキルであり;
R3は、場合により置換されていてもよいアルキレン鎖であり;
R5は、水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリールまたは場合により置換されていてもよいアラルキルであり;および、
R6は、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアラルキルまたは-R3-C(O)OR3であり;また、
あるいは、任意のR5およびR6は、これらが両方とも結合されている窒素と一緒になって、場合により置換されていてもよいN-ヘテロシクリルまたは場合により置換されていてもよいN-ヘテロアリールを形成している、
式(I)で表される化合物である。
【0075】
この実施形態のうち、一実施形態は、次のものから選択される式(I)で表される化合物である:
1-(ベンジル(メチル)カルバモイルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
1-((2-エトキシ-2-オキソエチル)(メチル)カルバモイルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
4-(2S)-2-ベンジル1-(1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチル)ピロリジン-1,2-ジカルボキシレート;
1-(4-フェニルシクロヘキサンカルボニルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチル3-フェニルピロリジン-1-カルボキシレート;
1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチル3,4-ジヒドロイソキノリン-2(1H)-カルボキシレート;
1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチルピペリジン-1-カルボキシレート;
1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチルモルホリン-4-カルボキシレート;
1-tert-ブチル4-(1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチル)ピペラジン-1,4-ジカルボキシレート;および、
1-(ジシクロヘキシルカルバモイルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレート。
【0076】
発明の概要で上述した式(I)で表される化合物のうち、別の実施形態は、
R1が、-O-R3-N(R5)R6であり;
R3が、場合により置換されていてもよいアルキレン鎖であり;
R5が、水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリールまたは場合により置換されていてもよいアラルキルであり;
R6が、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアラルキルまたは-R3-C(O)OR4であり;また、
あるいは、任意のR5およびR6が、これらが両方とも結合されている窒素と一緒になって、場合により置換されていてもよいN-ヘテロシクリルまたは場合により置換されていてもよいN-ヘテロアリールを形成している
式(I)で表される化合物である。
【0077】
この実施形態のうち、一実施形態は、次のものから選択される式(I)で表される化合物である:
2-(ジメチルアミノ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-モルホリノエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;または、
3-モルホリノプロピル5-(テトラデシルオキシ)フラン-2-カルボキシレート。
【0078】
発明の概要で上述した式(I)で表される化合物のうち、別の実施形態は、
R1が-O-R3-N(R4)C(O)OR5であり;
R3が場合により置換されていてもよいアルキレン鎖であり;
R4が場合により置換されていてもよいアルキル、場合により置換されていてもよいアリール、場合により置換されていてもよいアラルキル、場合により置換されていてもよいヘテロアリールまたは場合により置換されていてもよいヘテロアリールアルキルであり;
R5が水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリールまたは場合により置換されていてもよいアラルキルである
式(I)で表される化合物である。
【0079】
発明の概要で上述した式(I)で表される化合物のうち、別の実施形態は、
R1が-O-R3-C(O)OR5であり;
R3が場合により置換されていてもよいアルキレン鎖であり;
R5が水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリールまたは場合により置換されていてもよいアラルキルである
式(I)で表される化合物である。
【0080】
発明の概要で上述した式(I)で表される化合物のうち、別の実施形態は、
R1が-O-R3-C(O)N(R5)R6であり;
R3が場合により置換されていてもよいアルキレン鎖であり;
R5が水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリールまたは場合により置換されていてもよいアラルキルであり;
R6がアルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアラルキルまたは-R3-C(O)OR4であるか;あるいは、
R5およびR6が、これらが両方とも結合されている窒素と一緒になって、場合により置換されていてもよいN-ヘテロシクリルまたは場合により置換されていてもよいN-ヘテロアリールを形成している
式(I)で表される化合物である。
【0081】
この実施形態のうち、一実施形態は、次のものから選択される式(I)で表される化合物である:
2-(ベンジル(メチル)アミノ)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
tert-ブチル4-(2-(5-テトラデシルオキシ)フラン-2-カルボニルオキシ)アセチル)ピペラジン-1-カルボキシレート;
2-(ジシクロヘキシルアミノ)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-(4-シクロヘキシルピペラジン-1-イル)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-オキソ-2-(4-フェニルピペラジン-1-イル)エチル-5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-((2-エトキシ-2-オキソエチル)(メチル)アミノ)-2-オキソエチル5-テトラデシルオキシ)フラン-2-カルボキシレート;
2-オキソ-2-(ピペリジン-1-イル)エチル-5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-モルホリノ-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-(3,4-ジヒドロイソキノリン-2(1H)-イル)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;および、
(S)-ベンジル1-(2-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)アセチル)ピロリジン-2-カルボキシレート。
【0082】
発明の概要で上述した式(I)で表される化合物のうち、別の実施形態は、
R1が-N(R5)S(O)2-R4であり;
R4が場合により置換されていてもよいアルキル、場合により置換されていてもよいアリール、場合により置換されていてもよいアラルキル、場合により置換されていてもよいヘテロアリールまたは場合により置換されていてもよいヘテロアリールアルキルであり;
R5が独立して、水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリールまたは場合により置換されていてもよいアラルキルである
式(I)で表される化合物である。
【0083】
この実施形態のうち、一実施形態は、5-(テトラデシルオキシ)-N-トシルフラン-2-カルボキサミドである、式(I)で表される化合物である。
【0084】
発明の概要で上述した医薬組成物のうち、一実施形態は、医薬組成物が、皮膚科学的に有効な量の式(I)で表される化合物またはその製薬上許容可能な塩と、皮膚科学的に許容可能な添加剤とを含む皮膚用組成物であるものである。
【0085】
別の実施形態は、皮膚用組成物がゲル製剤、アルコール性ゲル製剤、ヒドロアルコール性ゲル製剤またはクリーム剤であるものである。
【0086】
別の実施形態は、医薬組成物が、皮膚科学的に有効な量の式(I)で表される化合物またはその製薬上許容可能な塩と、皮膚科学的に許容可能な添加剤とを含む経口組成物であるものである。
【0087】
発明の概要で上述した皮脂腺機能亢進を特徴とする皮膚疾患または病変のあるヒトの治療方法のうち、この方法の一実施形態は、皮膚疾患または病変が、尋常性座瘡、集簇性座瘡、クロール座瘡(choracne)、酒さ、酒さ鼻、脂漏、脂漏性皮膚炎、皮脂腺肥厚、マイボーム腺機能不全の顔面酒さ、細胞分裂促進性脱毛、および脂性肌からなる群から選択されるものである。
【0088】
この方法の別の実施形態は、皮膚疾患が座瘡であるものである。
【0089】
この方法の別の実施形態は、皮膚疾患が脂性肌であるものである。
【0090】
この方法の別の実施形態は、治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩を局所投与するものである。
【0091】
この方法の別の実施形態は、治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩を全身投与するものである。
【0092】
この方法の別の実施形態は、治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩を経口投与するものである。
【0093】
発明の概要で上述した皮脂腺機能亢進を特徴とする皮膚疾患または病変のあるヒトの治療方法のうち、本方法の一実施形態は、皮膚疾患または病変が、尋常性座瘡、集簇性座瘡、クロール座瘡(choracne)、酒さ、酒さ鼻、脂漏、脂漏性皮膚炎、皮脂腺肥厚、マイボーム腺機能不全の顔面酒さ、細胞分裂促進性脱毛、および脂性肌からなる群から選択されるものである。
【0094】
この方法の別の実施形態は、皮膚疾患が座瘡であるものである。
【0095】
この方法の別の実施形態は、皮膚疾患が脂性肌であるものである。
【0096】
この方法の別の実施形態は、治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩を局所投与するものである。
【0097】
この方法の別の実施形態は、治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩を全身投与するものである。
【0098】
この方法の別の実施形態は、治療上有効な量の上述した式(I)で表される化合物またはその製薬上許容可能な塩を経口投与するものである。
【0099】
この方法の別の実施形態は、医薬組成物が皮膚用組成物であり、製薬上許容可能な添加剤が皮膚科学的に許容可能な添加剤であるものである。
【0100】
この方法の別の実施形態は、医薬組成物が全身用組成物であるものである。
【0101】
この方法の別の実施形態は、医薬組成物が経口用組成物であるものである。
【0102】
ヒトにおける皮脂腺活性の抑制方法であって、治療上有効な量の発明の概要で上述した式(I)で表される化合物またはその製薬上許容可能な塩を、それを必要とするヒトに投与することを含む方法のうち、この方法の一実施形態は、治療上有効な量を局所投与するものである。
【0103】
この方法の別の実施形態は、治療上有効な量を全身投与するものである。
【0104】
この方法の別の実施形態は、治療上有効な量を経口投与するものである。
【0105】
ヒトにおける皮脂腺活性の抑制方法であって、発明の概要で上述した、治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩と、製薬上許容可能な添加剤を含む医薬組成物を、それを必要とするヒトに投与することを含む方法のうち、この方法の一実施形態は、上述の治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩を局所投与するものである。
【0106】
この方法の別の実施形態は、医薬組成物を全身投与するものである。
【0107】
この方法の別の実施形態は、医薬組成物を経口投与するものである。
【0108】
この方法の別の実施形態は、医薬組成物が皮膚用組成物であり、製薬上許容可能な添加剤が皮膚科学的に許容可能な添加剤であるものである。
【0109】
この方法の別の実施形態は、医薬組成物が全身用組成物であるものである。
【0110】
この方法の別の実施形態は、医薬組成物が経口用組成物であるものである。
【0111】
発明の概要で上述した皮脂腺機能亢進を特徴とする皮膚疾患または病変のあるヒトの治療方法のうち、この方法の一実施形態は、疾患または病変が炎症性座瘡であるものである。
【0112】
この方法の別の実施形態は、治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩を局所投与するものである。
【0113】
この方法の別の実施形態は、治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩を全身投与するものである。
【0114】
この方法の別の実施形態は、治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩を経口投与するものである。
【0115】
この法の別の実施形態は、医薬組成物が皮膚用組成物であり、製薬上許容可能な添加剤が皮膚科学的に許容可能な添加剤であるものである。
【0116】
この方法の別の実施形態は、医薬組成物を全身投与するものである。
【0117】
この方法の別の実施形態は、医薬組成物を経口投与するものである。
【0118】
発明の概要で上述した、炎症を特徴とする疾患または病変をもつヒトのT細胞増殖およびサイトカイン分泌の低減方法のうち、この方法の一実施形態は、疾患または病変が炎症性座瘡であるものである。
【0119】
この方法の別の実施形態は、治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩を全身投与するものである。
【0120】
この方法の別の実施形態は、治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩を全身投与するものである。
【0121】
この方法の別の実施形態は、治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩を経口投与するものである。
【0122】
この方法の別の実施形態は、医薬組成物が皮膚用組成物であり、製薬上許容可能な添加剤が皮膚科学的に許容可能な添加剤であるものである。
【0123】
この方法の別の実施形態は、医薬組成物が全身用組成物であるものである。
【0124】
この方法の別の実施形態は、医薬組成物が経口用組成物であるものである。
【0125】
発明の有用性
皮脂腺機能亢進による皮脂産生の増加は、一般に、座瘡病因の引き金になっていると考えられているいくつかの要因の1つである。皮脂形成において、特異的上皮細胞型である脂腺細胞の段階的分化があり、それは基本始原細胞から発生し脂質形成細胞に至る。これらの細胞は腺排出口の方向へ向かう。大きくなったこれらの細胞は最終的に破裂し(ホロクリン分泌)、その脂質濃厚内容物(皮脂)が放出される。皮脂の全体的構成は、スクアレン(12%)、コレステロール(2%)、ワックスエステル(26%)およびジグリセリド/トリグリセリド/遊離脂肪酸(57%)からなる(Zouboulis et al., "An oral 5-lipoxygenase inhibitor, directly reduces sebum production". Dermatology. (2005) 210:36-38)を参照されたい)。遊離脂肪酸レベルは、皮脂内に存在するジグリセリドおよびトリグリセリドの細菌分解により増加し得る(Thiboutot D. "Regulation of human sebaceous glands" J. Invest Dermatol. (2004) 123:1-12を参照されたい)。
【0126】
また遊離脂肪酸は、局所免疫細胞の活性化により座瘡の炎症性様相を促し、それらの様々な炎症誘発因子の放出を促進し得る。
【0127】
脂肪酸合成は、アセチルCoAからマロニルCoAへのカルボキシル化で始まる。この不可逆反応は、脂肪酸合成での関与段階(committed step)である。マロニルCoAの合成は、アセチルCoAカルボキシラーゼ(ACC)により触媒される(Brownsey, R.W. et al., "Regulation of acetyl-CoA carboxylase", Biochem Soc. Trans. (2006) 34: 223-227を参照されたい)。ACCは2種の組織特異的アイソフォーム、すなわち、単鎖265kDaタンパク質(ACC1)および280kDaタンパク質(ACC2)として存在する(Waldrop, G.L. et al., "Targeting acetyl-CoA carboxylase for anti-obesity therap, " Curr. Med. Chem. - Immun., Endoc. & Metab. Agents (2002) 3: 229-234を参照されたい)。
【0128】
哺乳動物細胞において、ACC1は細胞質ゾル内に存在するが、ACC2はミトコンドリアに局在している。一般に、ACC1は長鎖脂肪酸合成の役割を担うが、ミトコンドリアACC2は脂肪酸酸化を抑制するよう作用する。ACCアイソフォームの発現は組織特異的であり、ホルモンおよび栄養状態に応答する。ACC1は、脂質合成組織において、特に脂肪、肝臓および乳腺においてハイレベルで発現される。ACC2は肝臓ACCの微量成分であり、また、心臓および骨格筋で比較的低レベルではあるが発現される重要なアイソフォームである。ACCアイソフォーム発現パターンはまだ報告されていないが、活性ACCがヒト皮脂腺中に存在していることが明らかになっている(Smythe, C.D. et al., "The activity of HMG-CoA reductase and acetyl-CoA carboxylase in human apocrine sweat glands, sebaceous glands, and hair follicles is regulated by phosphorylation and by exogenous cholesterol, " J. Invest. Dermatol. (1998) 111:139-148を参照されたい)。ACCおよび他の脂肪酸およびコレステロール合成制御酵素は、思春期における皮脂産生増大と座瘡の発現に関与する主要因のアンドロゲンによって確実に制御されることが判明している(Rosignoli, C. et al., "Involvement of the SREBP pathway in the mode of action of androgens in sebaceous glands in vivo", Exp. Dermatol. (2003) 12:480-489を参照されたい)。
【0129】
またACCは、細菌の脂肪酸合成における第1の関与・制御段階も触媒する。細菌増殖にとって膜脂質生合成は必須であるため、ACC活性の阻害は、面皰内に通常存在する細菌の増殖を減少させる可能性がある。
【0130】
長鎖(炭素16〜20個)脂肪酸アシル-CoAチオエステルは、哺乳類ACCの有効な生理学的最終産物阻害剤であることが明らかとなった。
【0131】
TOFA (5-(テトラデシルオキシ)-2-フランカルボン酸)は、以下の構造:
【化4】

【0132】
を有する公知の脂質低下化合物である。
【0133】
TOFAおよびその製薬上許容可能な塩は、米国特許第4,110,351号に開示および請求されている(その開示は参照により完全に本明細書に組み入れるものとする)。TOFAは、ラットおよびサルの双方で血漿トリグリセリドレベルを下げることが確認された(例えば、Parker, R.A. et al., J. Med. Chem. (1977), Vol. 20, pp. 781-791を参照)。また、肝臓脂肪酸合成を阻害することも確認されている(例えば、Ribereau-Gayon, G. , FEBS Lett. (1976), Vol. 62, No. 309-312; Panek, E. et al., Lipids (1977), Vol. 12, pp. 814-818; Kariya, T. et al., Biochem. Biophys. Res. Commun. (1978), Vol. 80, pp. 1022-1024; およびHarris, R.A. et al., Hormones and Energy Metabolism (Klachko, D.M. et al., eds.), Vol. III, pp. 17-42を参照されたい)。
【0134】
TOFAは、細胞内でそのアシルCoAチオエステルに変換された場合、ACCの生理学的最終産物阻害剤である長鎖脂肪酸アシル-CoAに似た機序によりACC活性を阻害する(McCune, S.A. et al., J. Biol. Chem. (1979), Vol. 254, No. 20., pp. 10095-10101を参照されたい)。TOFAは、脂肪酸ミメティックとして、皮脂産生を低減し、治療部位での病原細菌の増殖に作用し得ることにより、皮脂腺疾患に多重効果を及ぼすことができる。
【0135】
皮脂腺機能亢進を抑制するためにTOFAを使用する方法、並びに、座瘡および炎症の治療においてTOFAを使用する方法は公知である。例えば、PCT公表特許公報第WO 2008/058034を参照されたい。
【0136】
本発明の化合物のようなTOFA類似体は、本明細書で皮脂腺活性の有効な抑制剤として開示されており、したがって、座瘡などの皮脂腺機能亢進を特徴とする皮膚疾患または病変のある哺乳動物(好ましくはヒト)の治療に有用である。また本明細書に記載のTOFA類似体は、T細胞増殖およびサイトカイン分泌を低減させることにより、炎症を特徴とする疾患または病変のある哺乳動物の治療に有用であり得る。
【0137】
本発明の化合物の調製
以下の反応スキームは、立体異性体として、またはその混合物としての、本発明の化合物、すなわち、式(I)で表される化合物:
【化5】

【0138】
(式中、R1は、発明の概要において上で定義した通りである)
またはその製薬上許容可能な塩の調製方法を示す。
【0139】
以下の記載においては、記載した式の置換基および/または可変部分の組み合わせは、こうした提案により安定性のある化合物が得られる場合のみ認められ得るものと理解されたい。
【0140】
また、下に記載の方法において、中間体化合物の官能基が好適な保護基で保護される必要があり得ることも当業者には十分に理解されよう。こうした官能基としては、ヒドロキシ、アミノ、メルカプトおよびカルボン酸を挙げることができる。ヒドロキシに適する保護基としては、トリアルキルシリルまたはジアリールアルキルシリル(例えば、t-ブチルジメチルシリル、t-ブチルジフェニルシリルまたはトリメチルシリル)、テトラヒドロピラニル、ベンジルなどを挙げることができる。アミノ、アミジノおよびグアニジノに適する保護基としては、t-ブトキシカルボニル、ベンジルオキシカルボニルなどが挙げられる。メルカプトに適する保護基としては、-C(O)-R’’(式中、R’’はアルキル、アリールまたはアラルキルである)、p-メトキシベンジル、トリチルなどが挙げられる。カルボン酸に適する保護基としては、アルキル、アリールまたはアリールアルキルエステルが挙げられる。
【0141】
保護基は標準技術に従って付加し、または除去することができるが、それは当業者には周知であり、また本明細書に記載されている通りである。
【0142】
保護基の使用については、Greene, T.W. and P.G.M. Wuts, Protective Groups in Organic Synthesis (2006), 4th Ed., Wileyに詳細に記載されている。また保護基は、Wang樹脂または2-クロロトリチル-クロリド樹脂などの高分子樹脂であってもよい。
【0143】
当業者には、本発明の化合物を反応スキームの下に記載した1つと同様の方法により、または当業者に公知の方法により製造することができることは理解されよう。また当業者は、適切な出発成分を使用し、必要とされる合成パラメーターを変更することによって、下記に詳細に説明してはいない本発明の他の化合物を、以下に記載の方法と同様にして製造することができることも理解するであろう。一般的に、出発成分は、Sigma Aldrich, Lancaster Synthesis, Inc., Maybridge, Matrix Scientific, TCI, およびFluorochem USAなどの提供元から得ることが可能であるか、当業者に公知の情報により合成可能であるか(例えば、Smith, M.B. and J. March, Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 5th edition (Wiley, December 2000)を参照)、本明細書に記載のように調製することができる。TOFAは、例えば、Cedarlane Laboratories, Inc.から入手することができる。
【化6】

【0144】
本発明の化合物は、反応スキーム1(式中、R2、R4およびR5は、それぞれ、発明の概要において上で記載した通りである)に記載のようにして、5-(テトラデシルオキシ)フラン-2-カルボン酸(TOFA)のカルボン酸基を好適な試薬(例えば、特に限定されるものではないが、塩化オキサリル、塩化チオニル、無水酢酸、トリフルオロ酢酸無水物、トルエンスルホニルクロリド、ヒドロキシスクシンアミド、ヒドロキシベンゾトリアゾール、ジシクロヘキシルカルボジイミド、またはカルボニルジイミダゾールなど)で活性化することにより調製することができる。活性化された酸化合物は、一般に、0℃〜周囲温度で調製され、単離することができるか、あるいは、塩基(トリエチルアミン、ピリジンなど)の存在下で好適なアルコールまたはスルホンアミドを用いてin situで反応させることができる。生成物は、反応物から、標準技術(例えば、溶媒抽出法、クロマトグラフィー、結晶化、蒸留など)を用いて、単離し精製することができる。
【化7】

【0145】
また本発明の化合物は、反応スキーム2(式中、R2、R3、R5およびR6は、それぞれ、発明の概要において上述した通りである)に概説したように調製することもできる。TOFAは、好適な脱離基を有するアルキル化剤(ハロゲン化物、トリフレート、トシルレート、メシレートなど)(市販品を購入するか、当技術分野で公知の技術を使用し調製したもの)を、好適な塩基(例えば、特に限定されるものではないが、炭酸カリウム、炭酸セシウム、テトラブチルアンモニウム水酸化物、トリエチルアミンなど)の存在下で反応させることができる。この反応は、N,N-ジメチルホルムアミドなどの好適な溶媒中で行なうことが可能であり、通常、周囲温度〜70℃の温度で実施される。生成物は、反応物から、標準技術(例えば、溶媒抽出法、クロマトグラフィー、結晶化、蒸留など)を用いて、単離し精製することができる。
【化8】

【0146】
本発明の化合物は、反応スキーム3において上で示したようにして調製することもできる。TOFAは、2種の好適な脱離基を含有するリンカー(ハロゲン化物、トリフレート、トシレート、メシレートなど)と反応させることができる。第1の反応は、上記の反応スキーム2に示したように行なわれる。次いで、この反応の生成物を好適な求核試薬(例えば、特に限定されるものはないが、アミン類(上記に示したもの)、アルコール類またはフェノール類など)と、DMFまたはTHFなどの好適な溶媒中で反応させる。一般に、この反応は、好適な塩基(これは、テトラブチルアンモニウム水酸化物、過剰のアミン求核試薬、トリエチルアミンなどであってもよい)の存在下で、12時間、周囲温度で行なわれる。生成物は、反応物から、標準技術(例えば、溶媒抽出法、クロマトグラフィー、結晶化、蒸留など)を用いて、単離し精製することができる。
【0147】
場合によっては、上記に示した反応スキームの最終生産物は、例えば、置換操作によって、さらに変化させることができる。これらの操作としては、本発明の化合物の調製に必要とされる場合、特に限定されるものではないが、酸化、還元、アルキル化、アシル化および加水分解などが挙げられる。こうした操作は、有機化学分野の当業者にとっては周知である。またこれらの操作は、T. W. Greene and P. G. M. Wuts, "Protective Groups in Organic Synthesis", Second Edition, John Wiley and Sons, New York, 1991で概説されている方法により、保護基(例えば、Boc基、テトラヒドロピラン基など)の除去を含んでいてもよい。
【0148】
遊離塩基または酸の形態で存在する、上記および下記で調製した本発明の全ての化合物は、当業者に公知の方法に従い、適切な無機または有機の塩基または酸を用いた処理を行うことにより、それらの製薬上許容可能な塩に変換することができる。本明細書で調製した化合物の塩は、当業者に公知の標準技術によって、それらの遊離塩基または酸に変換させることができる。
【0149】
式(I)で表される化合物の調製に関する以下の合成実施例は、本発明の実施を補佐するための例示として記載されているが、本発明の範囲を限定することを意図するものではない。質量分析計試料は、シングルMSモードで操作するエレクトロスプレーイオン化MicroMass 質量分析計で分析した。試料は、クロマトグラフィーを使用し、質量分析計へ導入した。1H NMRスペクトルは、Bruker社製装置を使用して400MHzで記録するか、Varian社製装置を使用して300MHzで記録した。元素分析は、Canadian Microanalytical Ltd., Delta, BC, Canadaにより実施した。
【実施例】
【0150】
合成実施例1
2,2,2-トリフルオロエチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化9】

【0151】
5-(テトラデシルオキシ)フラン-2-カルボン酸(1.3g、4.0mmol)を含むCH2Cl2(40mL)の撹拌した室温懸濁液に、N,N'-ジシクロヘキシルカルボジイミド(0.990g、4.8mmol)、N,N-ジメチルアミノピリジン(0.488g、4.0mmol)および2,2,2-トリフルオロエタノール(0.875mL、12.0mmol)を加えた。フラスコにキャップし、撹拌を16時間継続した。その時間で、TLC(ヘキサン中10%EtOAc、Rf=0.05(SM)および0.25(Prod))は出発物質が完全に消費されたことを示した。得られた懸濁液をCH2Cl2(40mL)で希釈し、濾過し濃縮した。この粗製物質は、ヘキサン中5〜20%EtOAcで溶出するフラッシュクロマトグラフィーにより精製した。さらに、得られた固体は、加熱2-プロパノール30mL中で最小量の水を加えて再結晶化することにより精製し、白色針状物として1.13g(70%)の表題化合物を得た。MS (m/z, ES-): 406.0 (M-1, 100%); EA C23H36F3NO2に対する実測値: C: 62.20, H: 8.18; 計算値: C: 62.05, H: 8.18; 1H NMR (400 MHz, DMSO-d6) δ: 7.4 (d, 1H), 5.7 (d, 1H), 4.9 (q, 2H), 4.2 (t, 2H), 1.50-1.57 (m, 2H), 1.10-1.20 (m, 22H), 0.85 (t, 3H)。
【0152】
合成実施例2
2,2,2-トリクロロエチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化10】

【0153】
表題化合物は、実施例1で記載したようにして、0.228g(0.7mmol)の5-(テトラデシルオキシ)フラン-2-カルボン酸と0.196mL(2.04mmol)の2,2,2-トリクロロエタノールから出発し調製した。1H NMR (400 MHz, DMSO-d6) δ: 7.4 (d, 1H), 5.74 (d, 1H), 5.03 (s, 2H), 4.19 (t, 2H), 1.7 (p, 2H), 1.2-1.5 (m, 22H), 0.85 (t, 3H)。
【0154】
合成実施例3
イソプロピル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化11】

【0155】
表題化合物は、実施例1で記載したようにして、0.228g(0.7mmol)の5-(テトラデシルオキシ)フラン-2-カルボン酸および0.161mL(2.1mmol)の2-プロパノールから出発し調製した。MS (m/z, ES+): 366.30 (M+, 100%); 1H NMR (400 MHz, DMSO-d6) δ: 7.2 (d, 1H), 5.6 (d, 1H), 5.0 (p, 1H), 4.1 (t, 2H), 1.7 (p, 2H), 1.3-1.4 (m, 2H), 1.23 (d, 6H), 1.2 (s, 20H), 0.85 (t, 3H)。
【0156】
合成実施例4
メチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化12】

【0157】
表題化合物は、実施例1で記載したようにして、0.228g(0.7mmol)の5-(テトラデシルオキシ)フラン-2-カルボン酸および0.083mL(2.1mmol)のメタノールから出発し調製した。MS (m/z, ES+): 339.34 (M+1, 100%)。
【0158】
合成実施例5
2-ブロモエチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化13】

【0159】
表題化合物は、実施例1で記載したようにして、0.228g(0.7mmol)の5-(テトラデシルオキシ)フラン-2-カルボン酸および0.150mL(2.1mmol)の2-ブロモエタノールから出発し調製した。MS (m/z, ES+): 446.30 (79BrM+1, 100%), 448.30 (81BrM+1, 80%); 1H NMR (400 MHz, DMSO-d6) δ: 7.30 (d, 1H), 5.67 (d, 1H), 4.49 (t, 2H), 4.16 (t, 2H), 3.73 (t, 2H), 1.72 (p, 2H), 1.3-1.45 (m, 2H), 1.25 (s, 20H), 0.85 (t, 3H); EA C21H35BrO4に対する実測値: C: 58.93, H: 8.52;計算値: C: 58.47, H: 8.18。
【0160】
合成実施例6
5-(テトラデシルオキシ)-N-トシルフラン-2-カルボキサミドの合成
【化14】

【0161】
表題化合物は、実施例1で記載したようにして、0.228g(0.7mmol)の5-(テトラデシルオキシ)フラン-2-カルボン酸および0.361g(2.1mmol)の4-メチルベンゼンスルホンアミドから出発し調製した。MS (m/z, ES-): 476.63 (M-1, 100%)。
【0162】
合成実施例7
(5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化15】

【0163】
5-(テトラデシルオキシ)フラン-2-カルボン酸(0.228g、0.70mmol)を含むDMF(4mL)の撹拌した室温溶液に、炭酸カリウム(0.146g、1.05mmol)および4-(ブロモメチル)-5-メチル-1,3-ジオキソール-2-オン(0.160g、0.84mmol)を加えた。反応容器にキャップし、撹拌を14時間継続した。その時間に、TLC(ヘキサン中20%EtOAc、Rf=0.10(SM)および0.40(Prod))は出発物質が完全に消費されたことを示した。この反応は、水(5mL)、飽和食塩水(5mL)およびEtOAc(30mL)を添加することによりクエンチした。この2相混合物を分液漏斗に移し、有機相を飽和食塩水で3回抽出した(3×10mL)。有機相を乾燥させ、濃縮して無色の油状物を得た。得られた粗製物質を、ヘキサン中5〜20%EtOAcで溶出するフラッシュクロマトグラフィーにより精製し、無色のシロップが得られ、これは静置により固化した。1H NMR (400 MHz, DMSO-d6) δ: 7.2 (d, 1H), 5.6 (d, 1H), 5.1 (s, 2H), 4.1 (t, 2H), 2.18 (s, 3H), 1.6-1.8 (m, 2H), 1.3-1.4 (m, 2H), 1.23 (d, 6H), 1.2 (s, 20H), 0.85 (t, 3H)。
【0164】
合成実施例8
1-(ベンジル(メチル)カルバモイルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化16】

【0165】
A.1-クロロエチルベンジル(メチル)カーバメート
N-メチルベンジルアミン(0.260mL、2mmol)を含むEtOAc(3mL)および3mLの飽和NaHCO3溶液の激しく撹拌した懸濁液に、1-クロロエチルクロロホルメート(0.160mL、2mmol)を加えた。起泡が認められた。気体の生成の終了時に、反応混合物をヘキサン(10mL)で希釈した。水相を除去し、有機相を飽和食塩水(5mL)で洗浄し、乾燥、濃縮したところ、油状物としての粗生成物が得られた(〜0.250g)。この化合物は、それ以上精製を行うことなく後続の工程で使用した。
【0166】
B. 1-(ベンジル(メチル)カルバモイルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレート
上記で調製した1-クロロエチルベンジル(メチル)カーバメートをN,N-ジメチルホルムアミド(5mL)中に溶解させ、次いで、5-(テトラデシルオキシ)フラン-2-カルボン酸(0.180g、0.544mmol)、テトラブチルアンモニウムヒドロキシドペンタハイドレード(0.209g、0.60mmol)、およびヨウ化ナトリウム(〜15mg)をこの反応容器に加えた。得られた懸濁液は、14時間撹拌しながら60℃に加熱した。反応溶液のHPLC解析は、全出発物質が低級極性生成物に変換されたことを示した。次いで、反応物を飽和食塩水(5mL)、水(5mL)およびEtOAc(70mL)でクエンチした。有機相を水(30mL)および飽和食塩水(30mL)で連続的に洗浄し、次いで、乾燥、濃縮した。得られた粗製物質をヘキサン中5〜20%のEtOAcで溶出するフラッシュクロマトグラフィーにより精製したところ、わずかに茶色の油状物として0.120g(43%)の表題化合物が得られた。1H NMR (300 MHz, CDCl3) δ: 7.15-7.40 (m, 6H), 7.05 (p, 1H), 5.30 (d, 1H), 4.40-4.60 (m, 2H), 4.10 (t, 2H), 2.85 (d, 3H) 1.7-1.9 (m, 2H), 1.79 (p, 2H), 1.55-1.62 (m, 3H), 1.18-1.50 (m, 22H), 0.89 (t, 3H)。
【0167】
合成実施例9
1-((2-エトキシ-2-オキソエチル)(メチル)カルバモイルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化17】

【0168】
表題化合物は、実施例8の工程1および工程2に記載のようにして、0.20mL(1.8mmol)の1-クロロエチルクロロホルメート、0.267g(1.8mmol)のサルコシンエチルエステルヒドロクロリドおよび4mLの飽和NaHCO3溶液から出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.18 (t, 1H), 6.98 (dq, 1H), 5.3 (d, 1H), 4.03-4.23 (m, 5H), 3.8-3.9 (m, 1H), 2.98 (s, 3H), 1.75 (p, 2H), 1.52-1.6 (m, 3H), 1.2-1.5 (m, 27H), 0.85 (t, 3H)。
【0169】
合成実施例10
(2S)-2-ベンジル1-(1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチル)ピロリジン-1,2-ジカルボキシレートの合成
【化18】

【0170】
表題化合物は、実施例8の工程1および工程2に記載のようにして、0.20mL(1.8mmol)の1-クロロエチルクロロホルメート、0.435g(1.8mmol)のL-ベンジルプロリンハイドロクロリドおよび4mLの飽和NaHCO3溶液から出発し調製した。この化合物は、2種のジアステレオマーの混合物として単離された。1H NMR (300 MHz, CDCl3) δ: 7.25-7.4 (m, 5H), 6.9-7.2 (m, 2H), 5.0-5.3 (m, 2H), 4.35-4.45 (m, 1H), 4.0-4.18 (m, 2H), 3.4-3.65 (m, 2H), 2.1-2.3 (m, 1H), 1.8-2.0 (m, 2H), 1.65-1.8 (m, 2H), 1.45-1.6 (m, 3H), 1.2-1.5 (m, 24H), 0.9 (t, 3H)。
【0171】
合成実施例11
1-(4-フェニルシクロヘキサンカルボニルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化19】

【0172】
表題化合物は、実施例8の工程1および工程2に記載のようにして、0.20mL(1.8mmol)の1-クロロエチルクロロホルメート、0.303g(1.8mmol)の1-フェニルピペラジンおよび4mLの飽和NaHCO3溶液から出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.25-7.35 (m, 2H), 7.20 (d, 1H, J = 4 Hz), 7.04 (q, 1H, J = 5 Hz), 6.85-6.95 (m, 3H), 5.30 (d, 1H, J = 4 Hz), 4.15 (app t, 2H, J = 3.5 Hz), 3.63 (br t, 4H), 3.18 (br s, 4H), 1.8 (p, 2H, J = 8 Hz), 1.60 (d, 3H, J = 6 Hz), 1.20-1.5 (m, 22H), 0.87 (t, 3H, J = 7 Hz)。
【0173】
合成実施例12
1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチル3-フェニルピロリジン-1-カルボキシレートの合成
【化20】

【0174】
表題化合物は、実施例8の工程1および工程2に記載のようにして、0.20mL(1.8mmol)の1-クロロエチルクロロホルメート、0.167g(1.8mmol)の3-フェニルピロリジンおよび4mLの飽和NaHCO3溶液から出発し調製した。この化合物は、4種のジアステレオマーの混合物として単離された。1H NMR (300 MHz, CDCl3) δ: 7.18-7.3 (m, 5H), 7.2 (q, 1H), 6.93 (d, 1H), 5.3 (d, 1H), 4.12 (t, 2H), 3.1-4.0 (m, 5H), 2.2-2.35 (m, 1H), 1.95-2.05 (m, 1H), 1.75 (t, 2H), 1.5-1.65 (m, 3H), 1.2-1.5 (m, 22H), 0.9 (t, 3H)。
【0175】
合成実施例13
1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチル3,4-ジヒドロイソキノリン-2(1H)-カルボキシレートの合成
【化21】

【0176】
表題化合物は、実施例8の工程1および工程2に記載のようにして、0.20mL(1.8mmol)の1-クロロエチルクロロホルメート、0.305g(1.8mmol)の1,2,3,4-テトラヒドロイソキノリンヒドロクロリドおよび4mLの飽和NaHCO3溶液から出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.0-7.2 (m, 6H), 5.3 (d, 1H), 4.6 (d, 2H), 4.1 (t, 2H), 3.6-3.75 (m, 2H), 2.8-2.87 (m, 2H), 1.75 (p, 2H), 1.5-1.62 (m, 3H), 1.2-1.5 (m, 22H), 0.9 (t, 3H)。
【0177】
合成実施例14
1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチルピペリジン-1-カルボキシレートの合成
【化22】

【0178】
表題化合物は、実施例8の工程1および工程2に記載のようにして、0.20mL(1.8mmol)の1-クロロエチルクロロホルメート、0.178mL(1.8mmol)のピペリジン、および4mLの飽和NaHCO3溶液から出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.18 (d, 1H), 6.98 (q, 1H), 5.3 (d, 1H), 4.08-4.18 (m, 2H), 3.38-3.42 (m, 4H), 1.5-1.8 (m, 33H), 0.89 (t, 3H)。
【0179】
合成実施例15
1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチルモルホリン-4-カルボキシレートの合成
【化23】

【0180】
表題化合物は、実施例8の工程1および工程2に記載のようにして、0.20mL(1.8mmol)の1-クロロエチルクロロホルメート、0.157mL(1.8mmol)のモルホリンおよび4mLの飽和NaHCO3溶液から出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.18 (d, 1H), 7.05 (q, 1H), 5.32 (d, 1H), 4.1 (t, 2H), 3.6-3.6 (m, 4H), 3.45-3.55 (m, 4H), 1.75 (p, 2H), 1.5-1.65 (m, 3H), 1.2-1.5 (m, 22H), 0.85 (t, 3H)。
【0181】
合成実施例16
1-tert-ブチル4-(1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチル)ピペラジン-1,4-ジカルボキシレートの合成
【化24】

【0182】
表題化合物は、実施例8の工程1および工程2に記載のようにして、0.20mL(1.8mmol)の1-クロロエチルクロロホルメート、0.335mg(1.8mmol)のtert-ブチル1-ピペラジンカルボキシレートおよび4mLの飽和NaHCO3溶液から出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.2 (d, 1H), 6.97 (q, 1H), 5.3 (d, 1H), 4.1 (t, 2H), 3.4 (br s, 8H), 1.75 (p, 2H), 1.5-1.6 (m, 3H) 1.5 (s, 9H), 1.2-1.5 (m, 22H), 0.9 (t, 3H)。
【0183】
合成実施例17
1-(ジシクロヘキシルカルバモイルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化25】

【0184】
表題化合物は、実施例8の工程1および工程2に記載のようにして、0.20mL(1.8mmol)の1-クロロエチルクロロホルメート、0.220mg(1.8mmol)のジシクロヘキシルアミンおよび3mLの飽和NaHCO3溶液から出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.1 (d, 1H), 7.0 (q, 1H), 5.3 (d, 1H), 4.05-4.15 (m, 2H), 3.6 (br s, 1H), 3.2 (br s, 1H), 1.65-1.8 (m, 10H), 1.55-1.65 (m, 11H), 1.2-1.5 (m, 24H), 1.0-1.2 (m, 2H), 0.8 (t, 3H)。
【0185】
合成実施例18
2-(ジメチルアミノ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化26】

【0186】
0℃でTHF中に溶解した2-ブロモエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート(0.186g、0.43mmol)(実施例5で調製したもの)の溶液に、撹拌しながらジメチルアミン(THF中の2M溶液の1mL、2.15mmol)を加えた。この溶液を撹拌しながら室温まで温め、12時間継続した。この時間に、反応は濃縮乾固された。この粗製物質を、酢酸エチルを含むヘキサン(5〜35%)で溶出するフラッシュクロマトグラフィーにより精製し、ろう状の無色固体として0.121g(71%)の表題化合物を得た。MS (m/z, ES+): 396.29 (M+1, 100%); 1H NMR (400 MHz, DMSO-d6) δ: 7.2 (d, 1H), 5.6 (d, 1H), 4.23 (t, 2H), 4.13 (t, 2H), 2.53 (t, 2H), 2.18 (s, 6H), 1.7 (p, 2H), 1.2-1.5 (m, 22H), 0.85 (t, 3H)。
【0187】
合成実施例19
3-モルホリノプロピル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化27】

【0188】
A. 3-クロロプロピル5-(テトラデシルオキシ)フラン-2-カルボキシレート
5-(テトラデシルオキシ)フラン-2-カルボン酸(0.650g、2.0mmol)を含む10mLのN,N-ジメチルホルムアミドの激しく撹拌した懸濁液に、3-クロロブロモプロパン(0.618mL、6.0mmol)、テトラブチルアンモニウム水酸化物ペンタハイドレート(0.734g、4.2mmol)およびヨウ化ナトリウム(〜20mg)を加えた。この懸濁液は、短時間で溶液の状態になるように見えた。その後、非常に細かく分散した白色沈殿物が認められた。この反応物を12時間撹拌した。次いで、懸濁液をEtOAc(100mL)、飽和食塩水(50mL)および水(50mL)で希釈した。これらの相を分離させ、有機相を水(50mL)および飽和食塩水(50mL)で洗浄した。次いで、有機相を乾燥させ、濃縮したところ、0.554gの表題化合物が得られた。この物質は、それ以上精製することなく後続の工程で使用した。
【0189】
B. 3-(ピペリジン-1-イル)プロピル5-(テトラデシルオキシ)フラン-2-カルボキシレート
上記で調製した3-クロロプロピル5-(テトラデシルオキシ)フラン-2-カルボキシレート(0.272g、0.68mmol)を含む6mLのN,N-ジメチルホルムアミドの溶液に、モルホリン(0.535mL、6.1mmol)およびヨウ化ナトリウム(10mg)を加えた。得られた溶液を36時間、55℃で撹拌した。この時間で、反応混合物のHPLC解析は、出発物質がほぼ完全に消費されたことを示した。この溶液をEtOAc(30mL)、飽和食塩水(10mL)および水(10mL)で希釈し、両方の相が透明な溶液となった。これらの相を分離させ、有機相を水(20mL)および飽和食塩水(20mL)で洗浄し、次いで、乾燥、濃縮した。粗製物質をヘキサン中5〜40%EtOAcで溶出するフラッシュクロマトグラフィーにより精製したところ、0.217gの表題化合物が得られた。1H NMR (300 MHz, CDCl3) δ: 7.10 (d, 1H), 5.30 (d, 1H), 4.30 (t, 2H), 4.10 (t, 2H), 3.7 (t, 4H), 2.40-2.50 (m, 6H), 1.90 (p, 2H), 1.76 (p, 2H), 1.18-1.50 (m, 22H), 0.89 (t, 3H)。
【0190】
合成実施例20
2-(ベンジル(メチル)アミノ)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化28】

【0191】
A. N-ベンジル-2-クロロ-N-メチルアセトアミド
N-メチルベンジルアミン(0.260mL、2mmol)を含むEtOAc(3mL)および3mLの飽和NaHCO3溶液の激しく撹拌した懸濁液に、クロロアセチルクロリド(0.160mL、2mmol)を添加した。起泡が認められた。気体生成が終わったら、反応混合物をヘキサン(10mL)で希釈した。これらの相を分離させ、有機相を飽和食塩水(5mL)で洗浄し、乾燥、濃縮したところ、油状物として表題化合物〜0.250gが得られた。この粗製物質は、それ以上精製を行うことなく後続の工程で使用した。
【0192】
B. 2-(ベンジル(メチル)アミノ)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート
上記で調製したN-ベンジル-2-クロロ-N-メチルアセトアミド(0.250g)をN,N-ジメチルホルムアミド10mL中に溶解した。この溶液に、5-(テトラデシルオキシ)フラン-2-カルボン酸(0.180g、0.544mmol)、テトラブチルアンモニウム水酸化物ペンタハイドレード(0.209g、0.554mmol)、およびヨウ化ナトリウム(〜15mg)を添加した。この懸濁液は、14時間撹拌しながら60℃に加熱した。反応物を飽和食塩水(5mL)、水(5mL)およびEtOAc(40mL)でクエンチした。これらの相を分離させ、さらに有機相をEtOAc(30mL)で希釈し、水(30mL)および飽和食塩水(30mL)で連続的に洗浄し、次いで、乾燥、濃縮した。得られた粗製物質をヘキサン中5〜20%EtOAcで溶出するフラッシュクロマトグラフィーにより精製し、粘性の油状物として所望の化合物を得た。この物質はさらに2-プロパノールおよび水から再結晶化により精製し、0.130g(52%)の表題化合物を得た。1H NMR (300 MHz, CDCl3) δ: 7.20-7.40 (m, 6H), 5.30-5.35 (m, 1H), 4.92 (s, 2H), 4.50-4.61 (app d, 2H), 4.10 (m, 2H), 2.90-2.98 (app d, 3H), 1.79 (p, 2H), 1.18-1.50 (m, 22H), 0.89 (t, 3H)。
【0193】
合成実施例21
tert-ブチル4-(2-(5-テトラデシルオキシ)フラン-2-カルボニルオキシ)アセチル)ピペラジン-1-カルボキシレートの合成
【化29】

【0194】
表題化合物は、工程1の反応混合物をヘキサンではなくEtOAcで希釈することを除いては、実施例20の工程1および工程2に記載のようにして、0.373g(2.0 mmol)のtert-ブチル1-ピペラジンカルボキシレート(2.0mmol)および0.160mL(2mmol)のクロロアセチルクロリドから出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.22 (d, 1H), 5.3 (d, 1H), 4.85 (s, 2H), 4.15 (t, 2H), 3.55-3.65 (m, 2H), 3.4-3.52 (m, 6H), 1.75 (p, 2H), 1.45 (s, 9H), 1.2-1.5 (m, 22H), 0.8 (t, 3H)。
【0195】
合成実施例22
2-(ジシクロヘキシルアミノ)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化30】

【0196】
表題化合物は、工程1の反応混合物をヘキサンではなくEtOAcで希釈することを除いては、実施例20の工程1および工程2に記載のようにして、0.244mL(2.0mmol)のジシクロヘキシルアミンおよび0.160mL(2mmol)のクロロアセチルクロリドから出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.2 (d, 1H), 5.3 (d, 1H), 4.8 (s, 2H), 4.1-4.18 (m, 2H), 3.22 (t, 2H), 2.9-3.05 (m, 2H), 2.3-2.5 (m, 2H), 1.1-1.9 (m, 40H), 0.83 (t, 3H)。
【0197】
合成実施例23
2-(4-シクロヘキシルピペラジン-1-イル)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化31】

【0198】
表題化合物は、工程1の反応混合物をヘキサンではなくEtOAcで希釈することを除いては、実施例20の工程1および工程2に記載のようにして、0.337g(2.0mmol)の1-シクロヘキシルピペラジンおよび0.160mL(2mmol)のクロロアセチルクロリドから出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.22 (d, 1H), 5.3 (d, 1H), 4.9 (s, 2H), 4.1 (t, 2H), 3.6 (t, 2H), 3.4 (t, 2H), 2.57 (p, 4H), 2.2-2.35 (m, 1H), 1.5-1.8 (m, 6H), 1.2-1.5 (m, 28H), 0.83 (t, 3H)。
【0199】
合成実施例24
2-オキソ-2-(4-フェニルピペラジン(piperzin)-1-イル)エチル-5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化32】

【0200】
表題化合物は、工程1の反応混合物をヘキサンではなくEtOAcで希釈することを除いては、実施例20の工程1および工程2に記載のようにして、0.324g(2.0mmol)の1-フェニルピペラジンおよび0.160mL(2mmol)のクロロアセチルクロリドから出発し調製した。表題化合物は、さらにイソプロパノールおよび水からの再結晶化により精製した。1H NMR (300 MHz, CDCl3) δ: 7.23-7.35 (m, 4H), 6.9 (d, 2H), 5.34 (d, 1H), 4.95 (s, 2H), 4.13 (t, 2H), 3.78-3.82 (m, 2H), 3.69-3.63 (m, 2H), 3.15-3.25 (m, 4H), 1.75 (p, 2H), 1.2-1.5 (m, 22H), 0.86 (t, 3H)。
【0201】
合成実施例25
2-((2-エトキシ-2-オキソエチル)(メチル)アミノ)-2-オキソエチル5-テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化33】

【0202】
表題化合物は、工程1の反応混合物をヘキサンではなくEtOAcで希釈することを除いては、実施例20の工程1および工程2に記載のようにして、0.307g(2.0mmol)のサルコシンエチルエステルヒドロクロリドおよび0.160mL(2mmol)のクロロアセチルクロリドから出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.23 (d, 1H), 5.32 (d, 1H), 4.95 and 4.8 (2s (回転異性体), 2H), 4.05-4.25 (m, 6H), 3.1 and 3.0 (2s (回転異性体), 3H), 1.75 (p, 2H), 1.2-1.5 (m, 25H), 0.9 (t, 3H)。
【0203】
合成実施例26
2-オキソ-2-(ピペリジン-1-イル)エチル-5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化34】

【0204】
表題化合物は、工程1の反応混合物をヘキサンではなくEtOAcで希釈することを除いては、実施例20の工程1および工程2に記載のようにして、0.198mL(2.0mmol)のピペリジンおよび0.160mL(2mmol)のクロロアセチルクロリドから出発し調製した。工程2で単離した粗製物質は、イソプロパノールからの再結晶化により精製した。1H NMR (300 MHz, CDCl3) δ: 7.22 (d, 1H), 5.35 (d, 1H), 4.87 (s, 2H), 4.15 (t, 2H), 3.55-3.6 (m, 2H), 3.3-3.4 (m, 2H), 1.75 (p, 2H), 1.5-1.7 (m, 6H), 1.2-1.5 (m, 22H), 0.9 (t, 3H)。
【0205】
合成実施例27
2-モルホリノ-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化35】

【0206】
表題化合物は、工程1の反応混合物をヘキサンではなくEtOAcで希釈することを除いては、実施例20の工程1および工程2に記載のようにして、0.157mL(2.0mmol)のモルホリンおよび0.160mL(2mmol)のクロロアセチルクロリドから出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.23 (d, 1H), 5.35 (d, 1H), 4.86 (s, 2H), 4.15 (t, 2H), 3.68-3.75 (m, 4H), 3.6-3.65 (m, 2H), 3.4-3.45 (m, 2H), 1.75 (p, 2H), 1.2-1.5 (m, 22H), 0.9 (t, 3H)。
【0207】
合成実施例28
2-(3,4-ジヒドロイソキノリン-2(1H)-イル)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化36】

【0208】
表題化合物は、工程1の反応混合物がヘキサンではなくヘキサン:EtOAcの1:1混合物で希釈することを除いては、実施例20の工程1および工程2に記載のようにして、0.339g(2.0mmol)の1,2,3,4-テトラヒドロイソキノリンヒドロクロリドおよび0.160mL(2mmol)のクロロアセチルクロリドから出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.05-7.25 (m, 5H), 5.32 (d, 1H), 4.95 (2s (回転異性体), 2H), 4.65 および 4.7 (2s (回転異性体), 2H), 4.15 (t, 2H), 3.83 およびd 3.63 (2t (回転異性体), 2H), 2.92 および 2.85 (2t (回転異性体), 2H), 1.78 (p, 2H), 1.2-1.5 (m, 22H), 0.9 (t, 3H)。
【0209】
合成実施例29
(S)-ベンジル1-(2-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)アセチル)ピロリジン-2-カルボキシレートの合成
【化37】

【0210】
表題化合物は、工程1の反応混合物をヘキサンではなくEtOAcで希釈することを除いては、実施例20の工程1および工程2に記載のようにして、0.483g(2.0mmol)のL-プロリンベンジルエステルヒドロクロリドおよび0.160mL(2mmol)のクロロアセチルクロリドから出発し調製した。工程2で単離された粗製物質は、イソプロパノールから再結晶化により精製した。1H NMR (300 MHz, CDCl3) δ: 7.23-7.25 (m, 5H), 7.2 (d, 1H), 5.3 (d, 1H), 5.15 (d, 2H), 4.2-5.0 (m, 3H), 4.13 (t, 2H), 3.5-3.7 (m, 2H), 1.95-2.3 (m, 4H), 1.75 (p, 2H), 1.2-1.5 (m, 22H), 0.83 (t, 3H)。
【0211】
合成実施例30
4-メチルペンチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化38】

【0212】
5-(テトラデシルオキシ)フラン-2-カルボン酸(0.162g、0.5mmol)を含むN,N-ジメチルホルムアミド10mLの激しく撹拌した懸濁液に、1-ブロモ-4-メチルペンタン(0.247g、1.5mmol)、炭酸セシウム(0.243g、0.75mmol)およびヨウ化ナトリウム(〜20mg)を添加した。この懸濁液は、短時間で溶液になったように見え、その後、非常に細かく分散した白色沈殿物が認められた。反応物を12時間撹拌した。この時間で、反応溶液のHPLC解析は、TOFAがそれほど極性ではない生成物へ完全に転換したことを示した。この懸濁液をEtOAc(40mL)、飽和食塩水(20mL)および水(20mL)で希釈した。これらの相を分離させ、有機相を水(20mL)および飽和食塩水(20mL)で洗浄し、次いで、乾燥、濃縮した。得られた粗製物質をヘキサン中0〜20%EtOAcで溶出するフラッシュクロマトグラフィーにより精製したところ、0.127g(62%)の表題化合物が得られた。1H NMR (300 MHz, CDCl3) δ: 7.15 (d, 1H), 5.30 (d, 1H), 4.22 (t, 2H), 4.10 (t, 2H), 1.18-1.80 (m, 29H), 0.89 (t, 9H)。
【0213】
合成実施例31
3-(テトラヒドロ-2H-ピラン-2-イルオキシ)プロピル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化39】

【0214】
表題化合物は、実施例30に記載のようにして、0.335g(1.5mmol)の2-(3-ブロモプロポキシ)テトラヒドロ-2H-ピランおよび0.162g(0.5mmol)の5-(テトラデシルオキシ)フラン-2-カルボン酸から出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.15 (d, 1H), 5.30 (d, 1H), 4.59-4.62 (m, 1H), 4.40 (app t, 2H), 4.10 (t, 2H), 3.80-3.90 (m, 2H), 3.40-3.60 (m, 2H), 2.05 (p, 2H), 1.20-1.85 (m, 30H), 0.89 (t, 3H)。
【0215】
合成実施例32
2-モルホリノエチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化40】

【0216】
表題化合物は、合計0.730gの炭酸セシウムを添加してヒドロクロリドを中和することを除いては、実施例30に記載のようにして、0.224g(1.2mmol)の4-(2-クロロエチル)モルホリンヒドロクロリドおよび0.162g(0.5mmol)の5-(テトラデシルオキシ)フラン-2-カルボン酸から出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.15 (d, 1H), 5.30 (d, 1H), 4.40 (t, 2H), 4.10 (t, 2H), 3.70 (app t, 4H), 2.70 (t, 2H), 2.55 (app t, 4H), 1.80 (p, 2H), 1.18-1.55 (m, 22H), 0.89 (t, 3H)。
【0217】
合成実施例33
2-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)安息香酸の合成
【化41】

【0218】
5-(テトラデシルオキシ)フラン-2-カルボン酸(0.324g、1mmol)を含む10mLのCH2Cl2の冷却し(0℃)撹拌した懸濁液に、塩化オキサリル(0.135mL、1.5mmol)とN,N-ジメチルホルムアミド2滴を加えた。直ぐに起泡が認められた。この溶液は、気体発生が終了し、全ての懸濁固体が溶解するその時まで、撹拌を継続しながら室温まで温めた。次いで、この溶液をもう一度0℃まで冷却し、サリチル酸(0.180g、1.3mmol)およびEt3N(3mL)を素早く撹拌した反応物に加えた。2時間撹拌した後、反応物をEtOAc(100mL)で希釈し、有機相を1M HCl(2×100mL)および飽和食塩水(100mL)で洗浄し、次いで、乾燥、濃縮し、白色固体残渣を得た。粗製物質は、1%AcOHを含むヘキサン中の5〜40%EtOAcで溶出するフラッシュクロマトグラフィーにより精製した。得られた物質は、さらにCH2Cl2およびヘキサンからの再結晶化により精製し、白色結晶物質として0.225g(57%)の表題化合物を得た。1H NMR (300 MHz, CDCl3) δ: 8.08 (dd, 1H), 7.62 (dt, 1H), 7.32-7.38 (m, 2H), 7.24 (dd, 1H), 5.39 (d, 1H), 4.18 (t, 2H), 1.80 (p, 2H), 1.2-1.5 (m, 22H), 0.88 (t, 3H)。
【0219】
本発明の化合物の試験
ヒト脂腺細胞機能に関する研究は、好適な細胞系が不足していることから比較的制限を受けてきた。最近、SZ95脂腺細胞が、シミアンウィルス-40ラージT抗原に関するコード領域を含有のプラスミドでトランスフェクトされたヒトの顔皮脂腺細胞を用いて調製された(Zouboulis, C.C. et al., J. Invest. Dermatol. (1999), Vol. 113, pp. 1011-1020を参照されたい)。SZ95細胞は、ヒト脂腺細胞に典型的に関係する多数の分子を発現する。基礎研究により、皮脂分泌の脂質スクアレンおよびワックスエステル、並びにトリグリセリドおよび遊離脂肪酸の合成が明らかとなった(Zouboulis CC, Seltmann H, Neitzel H, Orfanos CE. Establishment and characterization of an immortalized human sebaceous gland cell line (SZ95). J. Invest Dermatol. (1999) 113:1011-1020を参照されたい)。
【0220】
したがって、SZ95細胞によって、脂腺細胞増殖および分化の多くの様相を説明することができる(Wrobel, A. et al., "Differentiation and apoptosis in human immortalized sebocytes", J. Invest Dermatol. (2003) 120:175-181を参照されたい)。
【0221】
アラキドン酸(AA)を用いる処理では、96ウェルマイクロタイタープレートフォーマットを使用し、SZ95脂腺細胞の脂質レベルが再現性良く約5倍に上昇した。SZ95細胞は、例えば、アキュテイン(登録商標)およびコレステロール合成阻害剤(スタチン)(これらは共に、かかる細胞による脂質産生を低減する能力を示す)などの皮脂抑制ポテンシャルのある化合物を同定するのに使用することができる(例えば、Tsukada, M. et al., "13-cis retinoic acid exerts its specific activity on human sebocytes through selective intracellular isomerization to all-trans retinoic acid and binding to retinoid acid receptors", J. Invest. Dermatol. (2000) 115:321-327を参照されたい)。
【0222】
また本発明の化合物の投与は、免疫/炎症制御サイトカインの増殖および分泌をはじめとする、T細胞活性化と関連のある様々なパラメーターを阻害することもできる。したがって、TOFA類似体は、例えば、炎症性座瘡の治療においてT細胞増殖およびサイトカイン分泌を低減させることにより、炎症を特徴とする皮膚疾患または病変を治療する際の有用な薬剤となり得る。
【0223】
有望な座瘡治療を評価するためのin vivo実験は、ハムスターの耳皮脂腺が構造、生化学および生理学の点からヒトのものと密接な類似点を有していることから、以下のハムスターアッセイを使用して実施することができる。
【0224】
in vivoでの抗皮脂腺活性試験
シリアンゴールデンハムスター(Oryctolagus cuniculus)の耳皮脂腺モデルを使用し、TOFAおよびTOFA類似体の繰り返し適用の効果を評価した。オスの動物は、雄性ホルモンの高い内因的レベルによりメスに比べて大きな皮脂腺を有している理由で用いた。化合物の効果を明らかにするため、ハムスターの耳から調製した断片を中性脂質特異的着色剤のオイルレッドOで処理した。着色結果を同一動物の未処理耳と比較し、動物の全体的な生理学的状態のあらゆる変化、並びに、局部薬剤適用から得られる有望な全身的効果を報告した。
【0225】
動物治療およびモニタリング
一般的に、化合物は、40%ジメチルアセトアミド(DMA)/30%アセトン/30%エタノール(ビヒクル)で調製し適用した。動物は、典型的には、実験開始時は10〜12週齢であり、体重は100〜150gであった。5〜8匹の動物から治療群を構成した。麻酔をかけていないハムスターに、耳当たり20μLの容量でピペットを使用して、右耳の腹側表面上に試験物質を投与した。手袋をはめた指で約15秒間、物質を治療部位へ優しくマッサージして施した。ハムスターは、治療を連続して15〜28日、毎日1回受けた。試験物質は、適用日毎に同じ4時間以内に適用した。左耳は未処理のままとし、内部対照部位として取り扱った。動物は、治療に関係する一般的な状況と可能性のある臨床的兆候、例えば、浮腫、紅斑、変色または耳の他の変化について毎日評価した。またハムスターは、一般的健康についても塗布外観、挙動および活動レベルにより評価した。
【0226】
組織学用の試料調製
動物は、最終(第21回)適用の約16〜20時間後に、CO2窒息により安楽死させた。続いて、皮脂腺分析用の組織試料を、組織学分野の担当により取得した。右耳(治療済)および左耳(未処理)を安楽死させたハムスターから慎重に取り出した。治療済みの耳の3.5mmパンチ生検を腹側表面上にマーキング色素でマーキングした。未処理耳のパンチ生検は、腹側表面上に別の組織マーキング色素でマーキングした。組織は、「Neg 50」凍結用包埋剤を満たしたラベル済みのモールドに入れ、液体窒素で凍結させた。これらのブロックは、必要とされるまで-70℃で保存するために、パラフィルム、次いでアルミニウムホイルで続けてラップした。
【0227】
皮脂腺分析
皮脂腺状態を評価するため、まず、耳断面をスライド・ガラス上に約8μm厚で切断し、直ちに10%緩衝ホルマリンで固定した。切片は標準法により脂質特異的なオイルレッドO色素で染色し、Faramount(Dakocytomation, Ca)アクリル封入剤でカバーし、カバーをスリップさせ、次いで、セットした。オイルレッドOで染色した組織切片部は、Olympus BX60顕微鏡上にマウントしたSpot RTデジタルカメラを用いて観察した。オイルレッドOで染色した組織切片図は、Olympus BX60顕微鏡上でマウントされたSpot RTディジタルカメラを用いて観察した。切片の画像は、4×顕微鏡対物レンズを使用して得た。画像は、特定の動物識別番号、スライド番号および倍率を使用して保存した。相対的な皮脂腺エリア(赤い染色エリア)は、Image-Proソフトウェア(Media Cybernetics Inc., Silver Spring, MD)を使用して測定した。画像分析のエリアは、表皮−皮膚接合部から中央軟骨ラインにより区別される組織中線までの領域を含む真皮であった。データは、分析した全エリアと比較し、代表的な脂質含有構造である赤い色調の組織断面のエリアをパーセンテージとして表した。
【0228】
以下の生物学的実施例は、皮脂腺機能亢進を特徴とする皮膚疾患または病変のあるヒトの治療、ヒトにおける皮脂腺活性の抑制、あるいはT細胞増殖およびサイトカイン分泌の低減における本発明化合物の有効性を判定するために当業者により用いることができる。
【0229】
生物学的実施例1
SZ95脂腺細胞における脂質合成の阻害
不死化ヒト脂腺細胞細胞系(SZ95)は、Zouboulis, C.C. et al., J. Invest. Dermatol. (1999), Vol. 113, pp. 1011-1020に記載のようにして培養物中で維持した。脂質合成は、アラキドン酸(AA)でSZ95細胞を処理することにより刺激した。脂質生成および脂質阻害試験の測定に関しては、試験化合物をジメチルスルホキシド(DMSO)中に溶解させ、96ウェルマイクロタイタープレートに所望濃度で加えた。次いで、細胞を72時間まで培養した後、プレートをPBSで3回洗浄し、最終容量の200μLPBS/ウェルを加えた。細胞中性脂質の染色については、5μLのNile Red溶液(DMSOに溶解、0.2mg/mL)を各ウェルに加え、最低60分間インキュベートした。次いで、蛍光測定プレートリーダーを使用して、プレート蛍光を定量した(励起波長:490nm;発光波長:590nm)。試験化合物による脂質レベルの抑制は、試験化合物の存在下でAAに刺激された細胞の未刺激対照細胞で得られた値に対する蛍光減少(%)として示した。細胞の生存率は、テトラゾリウム試薬(MTS)の生存細胞による着色ホルマザン生成物への変換を利用して測定した。これらのアッセイに関し、試験化合物はジメチルスルホキシド(DMSO)中に溶解させ、96ウェルプレートへ接種した細胞に所望濃度で加えた。細胞を試験化合物の存在下で48時間培養した後、プレートをPBSで3回洗浄した。1ウェル当たり最終容量100μLの培地を加えた。20μLのMTS溶液(滅菌PBS中0.2mg/mL)を各ウェルに加え、所望の吸光度に達するまで、最低60分間インキュベートした。ウェルの発色現像は、590nmの吸光度でプレートリーダーを使用して測定した。試験化合物による細胞生存率に対する効果は、未処理対照細胞で得られた値に対する試験化合物存在下でのAA刺激細胞の吸光度減少(%)として示した。
【0230】
本発明の化合物は、このアッセイで試験した場合、脂質合成の用量依存性抑制を示した。
【0231】
生物学的実施例2
LNCaP細胞による脂質蓄積に対する本発明化合物の効果
ヒト前立腺LNCaP腺癌細胞系は、American Type Culture Collectionから入手することができる。細胞は、10%ウシ胎仔血清(FCS)、4mM Glutamax、1mM ピルビン酸ナトリウム、1mM HEPES、ペニシリン(100U/mL)およびストレプトマイシン(100μg/mL)を含有するRPMI 1640培地で維持する。実験に関し、約10,000細胞/ウェルを、RPMI 1640 10%FBSを入れた6ウェル組織培養プレート中で72時間平板培養する。血清アンドロゲンの有効効果を最小限にするため、FCSを除いた5%活性炭/デキストランを含有する培地を72時間加える。次いで、脂質合成は、50nMのアンドロゲンジヒドロテストステロン(DHT)を添加することにより刺激する。本発明の化合物をDMSO中で可溶化し、処理した5%活性炭/デキストランを含有するRPMI 1640を各種濃度で加える。細胞は、37℃で96時間、これらの因子の存在下でインキュベートする。続いて、脂質蓄積をNile Red染色とフローサイトメトリー分析により定量する。試験化合物で処理したウェルの脂質レベルを、ビヒクル処理した細胞で得られた結果と比較する。
【0232】
生物学的実施例3
3T3-L1脂肪細胞分化および脂質蓄積に対する本発明化合物の効果
マウス3T3-L1前脂肪細胞(American Type Culture Collection)を継代培養し、10%ウシ胎仔血清(FCS)、1mM ピルビン酸ナトリウム、ペニシリン(100U/ml)/ストレプトマイシン(100μg/ml)および4mM Glutamax(Gibco/Life Technologies)を補充したダルベッコ変性イーグル培地(DMEM)で維持する。脂肪細胞分化の開始については、3T3-L1細胞を培養プレートまたは培養皿中へ密集度で平板培養し、密集後2日間補充DMEM中で増殖させる。開始培地は、0.5mM 3-イソブチル-1-メチルキサンチン、1μM デキサメタゾンおよび10μg/mlのヒトインスリンを含むDMEMから構成されている。発育培地はインシュリン(10μg/ml)を含有し、これを48〜72時間後に開始培地と交換する。細胞脂質は、オイルレッドO染色により発現される。
【0233】
生物学的実施例4
活性化されたヒト末梢血液単核細胞(PBMC)による増殖およびサイトカイン産生に対する本発明化合物の効果
PBMCは、密度勾配遠心分離により異なるドナーから単離する。異なる量の本発明化合物を、2組の異なる刺激の存在下においてPBMC培養液に加える。刺激を活性化する1つはフィトヘマグルチニン(PHA)で、Tリンパ球により増殖およびサイトカイン合成を刺激する植物由来マイトジェンである。またこれらの細胞製剤は、インターフェロン-γ(IFN-γ)およびリポ多糖類(LPS)の組み合わせを用いても活性化され、PBMC調製物内の単球画分によりサイトカイン産生が刺激される。48時間培養した後、フローサイトメトリー系の定量化方法を使用し、サイトカインレベルの同時定量のために細胞上清を取得する。サイトカインレベルは、並行して作製した標準曲線から補間する。細胞生存率は、3-(4,5-ジメチルチアゾール-2-イル)-5-(3-カルボキシメトキシフェニル)-2-(4-スルホフェニル)-2H-テトラゾリウム、分子内塩(MTS)の生細胞ミトコンドリア脱水素酵素による可溶性フォルマザン生成物への変換に基づき、比色測定法を使用して評価する。細胞増殖は、培養物に3H-チミジンを添加し、シンチレーション計数を使用し、DNAへのその取り込みレベルを測定することにより判定する。
【0234】
生物学的実施例5
合成皮脂中の溶解性の測定
本明細書に記載の化合物を試験し、脂質でのそれらの溶解性を評価することができる。溶解性の測定には、合成皮脂混合物を使用した。より詳しくは、約5mgの化合物を1.5mlのエッペンドルフチューブに加え、次いで、これを0.1mlの合成皮脂と混合し、その後、短時間ボルテックスした。混合物を32℃に予熱したシェーカー中の試料に入れ、次いで、一晩撹拌した。HPLC解析用のサンプリングを行う前に、チューブをエッペンドルフ遠心分離機に入れ、5分間13000rpmで回転させ、不溶性の薬剤部分を沈澱させた。遠心分離後、三連で、可溶性分画のトップ部分の20uLを分析用2ml HPLCバイアルへサンプリングし、その質量を記録した。次いで、1mlのTHFを各バイアルに加え、皮脂を可溶化した。それらの濃度を測定するため、全化合物のHPLC解析を同一流速条件下で実施した。
【0235】
以下の本発明化合物をこのアッセイで試験した:
2,2,2-トリフルオロエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート(化合物A);
イソプロピル5-(テトラデシルオキシ)フラン-2-カルボキシレート(化合物B)
(5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチル(5-(テトラデシルオキシ)フラン-2-カルボキシレート(化合物C)。
【0236】
表1は、化合物A、BおよびCが顕著に低い融点を示すこと、またTOFAに比べて液体合成皮脂における溶解性がはるかに高いことを示している。このことは、これらの特性が皮膚とそれらの結合性を促進し、脂質過多の皮脂腺環境へ送達することができるということである。
【表1】

【0237】
生物学的実施例6
in vivoアッセイ
一連のハムスター実験は、TOFAと比較した本発明化合物の有望な抗皮脂腺活性に関する試験を実施した。全ての実験において、TOFAおよび本発明化合物の反復局所適用は、十分な許容性が認められた。これらの動物の未治療耳および治療済み耳について、紅斑、浮腫、炎症または組織ネクローシスのどちらでもないことが確認された。ハムスターは、全実験期間を通じて、標準の挙動と体重増加を示した。
【0238】
これらの実験では、本発明化合物、TOFAおよびビヒクルをオスのハムスターの耳上に適用した。治療終了時に、ハムスターは殺処理され、治療部位の皮脂腺領域が測定された。この試験体系の未処理耳はアッセイ内部対照として、また有望な全身療法効果を検出する手段として役割を果たした。
【0239】
このハムスターアッセイは、ハムスター耳皮脂腺上における本発明の3種の化合物(化合物A、BおよびC)と同時に、TOFAの局所適用の効果を評価した。試験化合物は、40%DMA/30%アセトン/30%エタノール中に、21日間75mMで局所的に毎日適用した。
【0240】
図1に示したように、本発明化合物(特に化合物A)は、このアッセイで試験した場合、TOFAとの比較およびビヒクルとの比較で、皮脂腺領域を低減する能力を示した。
【0241】
生物学的実施例7
in vivoアッセイ − 抑制作用の維持
本実施例は、化合物Aを21日間適用した後、また治療停止の1週間後および2週間後のハムスター皮脂腺サイズを評価した。化合物Aは、40%DMA/30%アセトン/30%エタノールの混合物で適用した。治療後の皮脂腺回復特性を評価するため、1週間および2週間のフォローアップサンプリング時期も含んでいた。腺サイズの有意な低下は、化合物Aを21日間治療することで再び生じた(図2に示す)。ビヒクル処理した動物との比較では、平均腺エリアは、化合物Aで治療したハムスターに対し63.5%低下した。治療終了の2週間後に調製した試料については、化合物Aに暴露された耳の皮脂腺カウント数は、対照値よりも有意に低下した。この所見は、本明細書に記載のTOFA類似体は、治療後の腺活性に対し比較的抑制作用が維持されていることを示唆している。さらに、この所見は、過度のリバウンド効果は治療投薬計画の停止後に生じる可能性がないことを示唆している。
【0242】
生物学的実施例8
in vivo アッセイ − 皮脂腺の低減
図3は、動物が対照ビヒクル(40%DMA/30%アセトン/30%エタノール)、混合物中75mM濃度のTOFAおよび化合物Aで21日間連続して治療した試験で調製した耳切片の組織学的状態を示す。対照、TOFAおよび化合物Aで治療したハムスターの耳から調製した皮膚切片には、明らかに感知され得る炎症性細胞は存在しない。
【0243】
切片はオイルレッドOで処理し、中性脂質を検出するとともに、ヘマトキシリンで対比染色した。画像は、上方に位置した腹側耳表面方向である。皮脂腺領域の減少は、化合物Aを治療したハムスターから調製した切片で明らかである。ビヒクルで治療した対照と比較すると、表皮の厚さは、TOFAまたは化合物Aで治療したハムスターから得られた試料に対して厚い。
【0244】
本発明の医薬組成物および投与
本発明の化合物を含む医薬組成物またはその製薬上許容可能な塩、および製薬上許容可能な添加剤は本発明の一態様である。これらの医薬組成物は、活性成分(すなわち、式(I)で表される化合物)を治療上有効な量でヒトに投与することができる任意の形態であってもよい。例えば、医薬組成物は、半固体(ゲル)、固体、液体または気体(エアロゾル)の形態をしていてもよい。代表的な投与経路としては、特に限定されるものではないが、全身投与(経口投与および非経口投与を含む)、局所投与、口腔内投与、経皮投与、舌下投与、経鼻投与、直腸投与、膣内投与および経鼻投与が挙げられる。本明細書で用いられる非経口投与薬という用語は、皮下注射、無針注射、静脈注射、筋肉注射、硬膜外注射、胸骨内注射または静注技術を包含する。本発明の医薬組成物は、ヒトへ組成物を投与した際にその中に含有されている活性成分が体内に吸収されるように製剤化される。ヒトに投与される本発明の医薬組成物は、1種または複数の用量単位の形態をとっていてもよく、その場合、例えば、単回投与量単位であり得る錠剤、カプセル剤、カシェ剤またはパッチ剤であり、また、エアロゾル形態の本発明の医薬組成物の容器は、多数回の用量単位を保持し得る。
【0245】
皮脂腺機能亢進を特徴とする皮膚疾患の治療において、式(I)で表される化合物は、好ましくは、下記により詳細に記載したように、皮膚科学的に許容可能な組成物で、それが必要とされるヒトの皮膚(すなわち局所的)に投与される。こうした組成物が使用される場合(例えば、式(I)で表される化合物および皮膚科学的に許容可能な添加剤を含む皮膚用組成物が、それが必要とされるヒトの皮膚上に置かれる場合)、式(I)で表される化合物は、患者の皮膚との連続的接触にあり、それにより治療が行われる。
【0246】
式(I)の任意の好適な量の化合物は、こうした皮膚用組成物中で用いられ、有効に用いられる量は脂腺細胞からの皮脂の産生を有効的に抑制し、長期間にわたって組成物中で安定性を保つ使用量で提供される。好ましくは、安定性は、典型的には、皮膚科学的に許容可能な組成物の製造、パッケージ、出荷および/または保管にあたる、長期間(例えば、約3年以下、1年以下、または約6か月以下)にわたる。式(I)で表される化合物は、溶液中に、部分的に非溶解部分を含む溶液中に、または完全に溶解していない懸濁液中に存在していてもよい。式(I)で表される化合物は、本発明の皮膚用組成物中に、皮膚用組成物の約0.001重量%〜約80重量%、約0.001重量%〜約50重量%、約0.001重量%〜約25重量%、または約0.001重量%〜約6重量%の濃度範囲で存在していてもよい。一実施形態では、式(I)で表される化合物は、皮膚用組成物の約0.001重量%〜約10重量%、約0.1重量%〜約10重量%、または約1.0重量%〜約5.0重量%の濃度範囲で存在することができる。本発明の別の実施形態では、局所投与される式(I)で表される化合物の皮膚疾患用製剤は、重量%で、約40%ジメチルアセトアミド(DMA)/30%アセトン/30%エタノール中に約3%のTOFAを含有する。
【0247】
本発明の皮膚用組成物は、溶液剤、ローション剤、フォーム剤、ゲル剤、クリーム剤および/または軟膏剤の形態をとることができる。好ましくは、皮膚用組成物は、局所製剤(例えば、ゲル剤、フォーム剤、クリーム剤、軟膏剤)である。
【0248】
本発明の皮膚用組成物は、毛包脂腺(pilosebaceous unit)への担体として作用する、1種または複数の「親油性の溶媒(類)」を含有していてもよい。本発明に有用な親油性溶媒は、水および/または低級鎖アルコールと混和性であり、25℃で水よりも蒸気圧が小さいものであり得る(〜23.8mmHg)。本発明に有用な親油性溶媒は、グリコール(特にプロピレングリコール)であってもよい。特に、プロピレングリコールは、ポリエチレングリコール、特に分子量の範囲が200〜20000のポリエチレングリコールのクラスのものであり得る。好ましくは、溶媒はグリコールエーテルのクラスの一部であってもよい。より詳しくは、本発明の親油性溶媒は、ジエチレングリコールモノエチルエーテル(トランスクトール)であってもよい。本明細書では、「ジエチレングリコールモノエチルエーテル」(「DGME」)または「トランスクトール」は、2-(2-エトキシエトキシ)エタノール{CAS NO 001893}またはエチオキシジグリコール(ethyoxydiglycol)を意味する。
【0249】
また、本発明の皮膚用組成物は、25℃で23.8mmHg以上の蒸気圧を有する1種または複数の「賦形剤(類)」を含有していることも可能である。賦形剤は、濃縮物に関して、皮膚上で式(I)で表される化合物が濃縮されるように、親油性溶媒以上の蒸気圧を有していなければならない。1種の賦形剤または賦形剤類の組み合わせの合計の好ましい濃度範囲は、皮膚用組成物の約0.1重量%〜約10重量%、さらに好ましくは約10重量%〜約50重量%、より詳しくは約50重量%〜約95重量%であってもよい。本明細書で使用するための例(これに限定されない)としては、水および低級アルコール、例えばエタノール、2-プロパノールおよびn-プロパノールが挙げられる。さらに好ましくは、賦形剤は水、エタノールおよび/または2-プロパノールである。特に、賦形剤はエタノールおよび/または水であってもよい。
【0250】
また、本発明の皮膚用組成物は、湿潤効果を提供するために使用される1種または複数の「湿潤剤(類)」を含有していてもよい。好ましくは、湿潤剤は組成物中で安定性を維持する。任意の好適な濃度の単一湿潤剤または湿潤剤の組み合わせは、得られた濃度が所望の湿潤効果を提供するという条件で用いることができる。一般的に、湿潤剤の好適な量は、使用される特定の湿潤剤または湿潤剤類に依存する。単一湿潤剤または湿潤剤類の組み合わせの合計の好ましい濃度範囲は、皮膚用組成物の約0.1重量%〜約70重量%、さらに好ましくは約5.0重量%〜約30重量%、より詳しくは約10重量%〜約25重量%であり得る。本明細書で使用される例(これに限定されない)としては、グリセリン、多価アルコールおよびシリコンオイルが挙げられる。さらに好ましくは、湿潤剤はグリセリン、プロピレングリコールおよび/またはシクロメチコンである。とりわけ、賦形剤はグリセリンおよび/またはシクロメチコンであってもよい。
【0251】
また、本発明の皮膚用組成物は、最終溶液の粘性を高めるゲル化剤を含有していてもよい。ゲル化剤は、乳化剤としても作用することができる。本皮膚用組成物は、それを皮膚へ適用した場合にで崩壊され、変質する、透明なゲル剤およびソフトゲル剤を形成することが可能であり、それにより、皮膚上で乾燥しないゲル剤が得られる。一般的に、ゲル化剤の濃度および組み合わせは、最終製品の物理安定性に依存する。ゲル化剤の好ましい濃度範囲は、皮膚用組成物の約0.01重量%〜約20重量%、さらに好ましくは約0.1重量%〜約10重量%、より詳しくは約0.5重量%〜約5重量%であってもよい。本明細書で使用される例(これに限定されない)としては、セルロース、アクリルポリマーおよびアクリレートクロスポリマーのクラスが挙げられる。好ましくは、ヒドロキシプロピルセルロース、ヒドロキシメチルセルロース、プルロニックPF127ポリマー、カルボマー980、カルボマー1342およびカルボマー940、さらに好ましくはヒドロキシプロピルセルロース、プルロニックPF127カルボマー980およびカルボマー1342、より詳しくはヒドロキシプロピルセルロース(Klucel(登録商標) EF、GFおよび/またはHF)、プルロニックPF127、カルボマー980および/またはカルボマー1342(Pemulen(登録商標) TR-1、TR-2および/またはカルボポール(登録商標) ETD 2020)である。
【0252】
本発明の皮膚用組成物は、1種または複数の酸化防止剤、ラジカルスカベンジャーおよび/または安定化剤を含有していてもよく、好ましい濃度範囲は、皮膚用組成物の約0.001重量%〜約0.1重量%、さらに好ましくは約0.1重量%〜約5重量%である。本明細書で使用される例(これらに限定されない)としては、ブチルヒドロキシトルエン、ブチルヒドロキシアニソール、パルミチン酸アルコルビル、クエン酸、ビタミンE、ビタミンEアセテート、ビタミンE-TPGS、アスコルビン酸、トコフェルソラン(tocophersolan)および没食子酸プロピルが挙げられる。より詳しくは、酸化防止剤は、パルミチン酸アルコルビル、ビタミンEアセテート、ビタミンE-TPGS、ビタミンEまたはブチルヒドロキシトルエンであってもよい。
【0253】
また、本発明の皮膚用組成物は、抗細菌特性および/または抗真菌特性を示す防腐剤を含有していてもよい。防腐剤は本発明のゲル化した皮膚用組成物中に存在し、その品質保持に対する細菌および/または真菌の影響を最小限にすることができる。本発明の皮膚用組成物中の好ましい防腐剤の濃度範囲は、皮膚用組成物の約0.001重量%〜約0.01重量%さらに好ましくは約0.01重量%〜約0.5重量%である。本明細書で使用するための例(これに限定されない)としては、ジアゾリジニル尿素、メチルパラベン、プロピルパラベン、テトラナトリウムEDTAおよびエチルパラベンが挙げられる。より詳しくは、防腐剤はメチルパラベンおよびプロピルパラベンの組み合わせであってもよい。
【0254】
皮膚用組成物は、場合により、1種または複数のキレート剤を含むことができる。本明細書では、「キレート剤」または「キレート化剤」という用語は、複合体を形成し構造から金属イオンを除去し、金属イオンが化学反応へ容易に関与すること、または化学反応を触媒することができないようにすることが可能なそれらの皮膚効果薬剤を意味する。本明細書で使用するキレート剤は、皮膚用組成物の好ましくは、約0.001重量%〜約10重量%、さらに好ましくは約0.05重量%〜約5.0重量%の範囲の濃度で製剤化される。本明細書で使用するための例(これに限定されるものではない)としては、EDTA、エデト酸ジナトリウム、エデト酸ジカルシウム、シクロデキストリン、エデト酸トリナトリウム、クエン酸、クエン酸ナトリウム、グルコン酸およびグルコン酸カリウムが挙げられる。とりわけ、キレート剤は、EDTA、エデト酸ジナトリウム、エデト酸ジカリウム、エデト酸トリナトリウムまたはグルコン酸カリウムであってもよい。
【0255】
本発明の皮膚用組成物は、任意の化粧料で好適な形態で、好ましくはローションまたはクリームとして、また軟膏もしくはオイルベースで、並びにスプレー可能な液体形態(例えば、皮膚に適用した場合、ローション剤または軟膏が有するべとべと感のない化粧品的に許容可能な方法で乾燥している、基剤、ビヒクルまたは担体中にTOFAを含んでいるスプレー)で提供することができる。
【0256】
さらに、本発明の皮膚用組成物は、一般に使用されている1種または複数の適合する化粧品として許容可能なアジュバント、例えば、着色剤、香料、エモリエント剤、湿潤剤など、並びに植物、例えば、アロエ、カモミールなどを含むことができる。
【0257】
本発明の皮膚用組成物を局所投与する際、治療しようとするヒトの皮膚は、本発明の皮膚用組成物の投与前に、場合により前処理(例えば、石鹸および水による皮膚の洗浄、または、アルコール系洗浄剤による皮膚の消毒)することができる。
【0258】
皮脂腺機能亢進を特徴とする皮膚疾患または病変を治療する際、式(I)で表される化合物または式(I)で表される化合物を含む医薬組成物は、下記でより詳細に記載したようにして、製薬上許容可能な組成物で、それを必要とするヒトに全身投与(好ましくは経口投与)することもできる。
【0259】
経口投与する本発明の医薬組成物は、当業者に公知の標準的な方法によって、式(I)の化合物を適切な製薬上許容可能な担体、希釈剤または添加剤と組み合わせることにより製造することができる。本発明の医薬組成物は、ヒトへ組成物を投与した時にその中に含有されている式(I)の化合物が体内に吸収されるように製剤化される。
【0260】
経口投与する本発明の医薬組成物は、散剤、粒剤、圧縮錠剤、丸剤、カプセル剤、チューインガム、ウエハーなどの形態へ製剤化することができる。こうした固形組成物は、典型的には、1種または複数の不活性希釈剤または可食担体を含有する。さらに、下記の1種または複数が存在していてもよい:結合剤、例えば、カルボキシメチルセルロース、エチルセルロース、微結晶性セルロース、トラガカントゴムまたはゼラチン;添加剤、例えば、デンプン、ラクトースまたはデキストリン、崩壊剤、例えば、アルギン酸、アルギン酸ナトリウム、プリモゲル(Primogel)、コーンスターチなど;滑剤、例えば、ステアリン酸マグネシウムまたはステロテックス(Sterotex);滑沢剤、例えば、コロイド状二酸化ケイ素;甘味剤、例えば、スクロースまたはサッカリン;着香料、例えば、ペパーミント、サリチル酸メチルまたはオレンジフレーバー;および着色剤。
【0261】
本発明の医薬組成物がカプセル形態(例えばゼラチンカプセル)である場合、上記タイプの物質に加えて、ポリエチレングリコールまたはオイルなどの液体担体を含有していてもよい。
【0262】
また、経口投与される本発明の医薬組成物は、液体形態、例えばエリキシル、シロップ、溶液、エマルションまたは懸濁液であってもよい。さらに、本医薬組成物は、場合により、甘味料、防腐剤、色素/着色剤および調味料の1種または複数を含有していてもよい。
【0263】
また、本発明の液体医薬組成物は、以下のアジュバントの1種または複数を含んでいてもよい:滅菌水、食塩水(好ましくは生理食塩液)、リンゲル液、等張食塩水、溶媒または懸濁媒として有用であり得る合成モノグリセリドまたはジグリセリドなどの固定油、ポリエチレングリコール、グリセリン、プロピレングリコールまたは他の溶媒;抗菌剤、例えば、ベンジルアルコールまたはメチルパラベン;酸化防止剤、例えば、アスコルビン酸または亜硫酸水素ナトリウム;キレート剤、例えば、エチレンジアミン四酢酸;緩衝液、例えば、アセテート、シトラートまたはホスフェート、並びに、塩化ナトリウムまたはデキストロースなどの等張性調節剤。
【0264】
本発明の液体医薬組成物は、その必要性のあるヒトに投与する場合、治療上有効な量の式(I)で表される化合物を含有する。一般的に、この量は、組成物中、式(I)の化合物が少なくとも0.01%である。この量は、組成物の全重量の約0.1重量%〜約70%の間で変動し得る。好ましい経口医薬組成物は、経口組成物の約1.0重量%〜約50重量%の範囲の濃度で式(I)の化合物を含有する。
【0265】
本発明の医薬組成物は、固体または液体の用量単位の物理的形態を変化させる各種物質を含んでいてもよい。例えば、本組成物は、活性成分の周囲にコーティングシェルを形成する物質を含んでいてもよい。コーティングシェルを形成する物質は、典型的に不活性であり、例えば、糖、シェラックおよび他の腸溶コーティング剤から選択することができる。あるいは、活性成分はゼラチンカプセルでカプセル化されていてもよい。
【0266】
さらに、固体形態または液体形態の本発明の医薬組成物は、式(I)の化合物に結合し、それによって、式(I)の化合物の全身送達を促進する薬剤を含んでいてもよい。この能力で作用し得る好適な薬剤としては、モノクローナルまたはポリクローナル抗体、タンパク質またはリポソームが挙げられる。
【0267】
また、本発明の医薬組成物の全身投与は、注射による投与、例えば皮下注射、静脈注射、筋内注射、脊髄注射または腹膜腔内注射、並びに、経皮投与、口腔粘膜投与または経肺投与、および無針注射投与を包含する。
【0268】
有用な注射用医薬組成物は、活性化合物(群)の滅菌懸濁液、溶液またはエマルションを含む水性または油性ビヒクルを包含する。さらに、本組成物は製剤化薬剤、例えば、懸濁化剤、安定化剤および/または分散剤を含有していてもよい。注射用の医薬組成物は、単位剤形中、例えば、アンプル中または多回投与容器中に存在していてもよく、また追加の防腐剤を含有していてもよい。
【0269】
あるいは、注射用医薬組成物は、使用前に好適なビヒクル(例えば、これらに限定されるものではないが、発熱性物質除去蒸留水、緩衝液、デキストロース溶液など)で再構成するための粉末形態で提供することができる。そのためには、活性化合物(すなわち、式(I)の化合物)は、凍結乾燥などの任意の当該分野で公知の技術によって乾燥させ、使用前に再構成させることができる。
【0270】
口腔粘膜投与については、浸透しようとするバリアに対する適切な浸透剤が製剤で使用される。こうした浸透剤は、当技術分野で周知である。
【0271】
持続性送達については、式(I)で表される化合物またはその製薬上許容可能な塩は、埋め込みまたは筋肉注射によって、投与用の持効性製剤として製剤化することができる。式(I)で表される化合物またはその製薬上許容可能な塩は、(例えば、許容可能なオイル中のエマルションとしての)好適なポリマー物質または疎水性物質またはイオン交換樹脂と製剤化することができるか、あるいは難溶性誘導体として(例えば、難溶性塩として)製剤化することができる。あるいは、経皮吸収用の式(I)で表される化合物またはその製薬上許容可能な塩を時間をかけて放出する付着性ディスクまたはパッチとして製造された経皮送達システムも用いることができる。そのためには、浸透促進剤または経皮吸収促進剤を、活性化合物の経皮浸透の促進を目的として使用することができる。好適な経皮パッチは、例えば、米国特許第5,407,713号;米国特許第5,352,456号;米国特許第5,332,213号;米国特許第5,336,168号;米国特許第5,290,561号;米国特許第5,254,346号;米国特許第5,164,189号;米国特許第5,163,899号;米国特許第5,088,977号;米国特許第5,087,240号;米国特許第5,008,110号;および米国特許第4,921,475号に記載されている。
【0272】
無針注射による本発明の医薬組成物の投与は、米国特許第6,756,053号に開示されている技術を使用して用いることができる。
【0273】
あるいは、本発明の医薬組成物に他の医薬用送達システムを用いることができる。リポソームおよびエマルションは、活性化合物(群)またはプロドラッグ(群)の送達に使用可能な送達ビヒクルの公知の例である。ジメチルスルホキシド(DMSO)などの特定の有機溶媒も使用可能であるが、通常、毒性が高いという代償を払う。
【0274】
本発明の医薬組成物は、所望の場合、活性化合物(群)を含有する1種または複数の単位剤形を含有していてもよいパックまたはディスペンサーデバイス中に存在させることができる。パックは、例えば、金属箔またはプラスチック箔、例えばブリスターパックなどを含む。パックまたはディスペンサーデバイスには、投与に関する説明書を添付することができる。
【0275】
上記で述べた本発明の医薬組成物は、医薬分野で周知の方法によって、または本明細書に記載の方法によって製造することができる。例えば、Remington's Pharmaceutical Sciences, 18th Ed., (Mack Publishing Company, Easton, Pennsylvania, 1990)を参照されたい。
【0276】
本発明の医薬組成物は、治療上有効な量でヒトに投与されるが、それは様々な要因、例えば、式(I)で表される化合物の活性;式(I)で表される化合物の代謝の安定性および作用期間;ヒトの年齢、体重、一般的健康、性別および食事;投与の様式および時間;排出の速度;薬の組み合わせ;並びに、特定の疾患または病変の重症度に依存して変わる。一般に、式(I)で表される化合物の治療上有効な日用量は、(70kgの哺乳動物に対し)約0.001mg/kg(すなわち0.07mg)〜約100mg/kg(すなわち7.0gm)であり;好ましくは、治療上有効投与量は、(70kgの哺乳動物に対し)約0.01mg/kg(すなわち0.7mg)〜約50mg/kg(すなわち3.5gm)であり;さらに好ましくは、治療上有効投与量は、(70kgの哺乳動物に対し)約1mg/kg(すなわち70mg)〜25mg/kg(すなわち1.75gm)である。
【0277】
以下の製剤実施例1〜5は、式(I)の代表的な化合物および1種または複数の皮膚科学的に許容可能な添加剤を含む本発明の皮膚用組成物を提供する。
【0278】
製剤実施例1
皮膚疾患用アルコールゲル製剤
以下の製剤の製品は半固体の透明なゲルである。
【表2】

【0279】
上記の製剤は、以下のように調製することができる。アルコールおよびジエチレングリコールモノエチルエーテルを合わせる。トコフェルソラン、エデト酸ジナトリウムおよび式(I)の化合物を混合しながら溶解させる。ヒドロキシプロピルセルロースを添加し、高速混合して素早くかつ均一に分散させる。生成物は、均一分散後、混合から取り出される。
【0280】
製剤実施例2
皮膚疾患用水性ゲル製剤
以下の製剤の製品は半固体の透明なソフトゲル製剤である。
【表3】

【0281】
上記の製剤は、以下のように調製することができる。液体、ジエチレングリコールモノエチルエーテル、グリセリンおよび水を混合する。ポリソルベート80およびトコフェルソランを添加し、混合して溶解させる。式(I)の化合物を添加し、混合して溶解させる。エデト酸ジナトリウム、メチルパラベンおよびプロピルパラベンを添加し、混合して溶解させる。アクリレート/C10-C30アルキルアクリレートクロスポリマーは、高速混合しながら、均一な混合物が得られるまで素早く分散させる。トロルアミンを持続的に混合しながら添加し、pH約6.75で粘着性ゲルを得る(水で1:9に希釈される場合)。
【0282】
製剤実施例3
皮膚疾患用ヒドロアルコール性ゲル製剤
以下の製剤の製品は半固体の透明なソフトゲル製剤である。
【表4】

【0283】
上記の製剤は、以下のように調製することができる。液体、ジエチレングリコールモノエチルエーテル、グリセリンアルコールおよび水を混合する。ポリソルベート80およびトコフェルソランを添加し、混合して溶解させる。式(I)の化合物を添加し、混合して溶解させる。エデト酸ジナトリウム、メチルパラベンおよびプロピルパラベンを添加し、混合して溶解させる。アクリレート/C10-C30アルキルアクリレートクロスポリマーおよびヒドロキシプロピルセルロースを、均一な混合物が得るまで高速混合しながら素早く分散させる。トロルアミンを持続的に混合しながら添加し、pH約6.75で粘着性ゲルを得る(水で1:9に希釈される場合)。
【0284】
製剤実施例4
皮膚疾患用クリーム剤
式(I)で表される化合物はクリームとしても製剤化することができるが、その一例は以下の通りである:
【表5】

【0285】
上記の製剤は、以下のように調製することができる。
【0286】
A. 水相
水およびジエチレングリコールモノエチルエーテルを一緒に混合する。トコフェルソランを添加し、混合して溶解させる。式(I)の化合物を添加し、混合して溶解させる。トリラウレス-4ホスフェート、エデト酸ジナトリウム、メチルパラベンおよびプロピルパラベンを添加し、混合して溶解させる。アクリレート/C10-C30アルキルアクリレートクロスポリマーおよびカルボマー940を均一な混合物が得られるまで高速混合しながら素早く分散させる。得られた混合物を撹拌しながら約65℃〜約75℃の温度で加熱し、溶液を形成させる。
【0287】
B. 油相
白色ワセリン、シクロメチコン、ミリスチン酸イソプロピルおよびセトステアリルアルコールを別の容器中で合わせ、約65℃〜約75℃の温度で完全に溶解させ、撹拌した。
【0288】
C. 水相を撹拌しながら、油相を均一なエマルションが得られるまでゆっくりと加える。得られたエマルションにトロルアミンをゆっくりと加え、pH約6.75でクリームを得る。この生成物は、連続混合を行いながら25℃に冷却する。
【0289】
製剤実施例5
皮膚疾患用フォーム剤
式(I)で表される化合物はフォームとして製剤化することができるが、その一例は以下の通りである。
【表6】

【0290】
* 噴射剤は最終製剤の4.0重量%である。噴射剤は1種の気体または気体の混合物である。好適な気体としては、ブタン、イソブタン、プロパン、イソプロパンおよびイソペンタン(isopentate)が挙げられる。
【0291】
上記製剤は、以下のように調製することができる。
【0292】
A. 水相
水およびジエチレングリコールモノエチルエーテルを混合する。トコフェルソランを添加し、混合して溶解させる。TOFAを添加し、混合して溶解させる。エデト酸ジナトリウムおよびプロピルパラベンを添加し、混合して溶解させる。アクリレート/C10-C30アルキルアクリレートクロスポリマーを、均一な混合物が得るまで高速混合で速やかに分散させる。得られた混合物を撹拌しながら約60℃〜約70℃の温度の溶液まで加熱する。
【0293】
B. 油相
ステアリルアルコール、ラウレス-23およびPEG-100ステアレートを別の容器中で合わせ、撹拌しながら、約60℃〜約70℃の温度で完全に溶解させる。
【0294】
C. 水相を撹拌しながら、油相を均一なエマルションが得られるまでゆっくりと加える。トロルアミンを加え、所望のpHとする。この得られた製剤は、連続混合を行いながら25℃に冷却する。この製剤は、噴射剤の入った圧力仕様の適切な気密容器に包装する。
【0295】
組み合わせ療法
本発明の化合物は、皮脂腺機能亢進を特徴とする皮膚疾患または病変の治療において、1種または複数の他の治療薬と有用に組み合わせることができる。例えば、本発明の化合物は、同時に、連続的に、または別々に、以下に示す他の治療薬と組み合わせて投与することができる。例えば、特に限定されるものではないが、
・局所用/経口用抗生物質、例えば、クリンダマイシン、テトラサイクリン、ミノサイクリン(minoccline)、ドキシサイクリン(deoxycycline)、エリスロマイシン、トリメトプリムおよびアジスロマイシン;
・レチノイド類、例えば、アキュテイン(登録商標)、トレチノイン(tretinion)、タザロテンおよびアダパレン;
・ベンゾイルパーオキサイド;
・青色光/赤色光;
・光力学療法(PDT);
・抗アンドロゲン化合物、例えば、PSK 3841;
・5-αレダクターゼI型阻害剤;
・面皰改善剤(comedolytics)、例えば、サリチル酸、アゼライン酸、硫黄、レゾルシノール
などがある。
【0296】
本明細書では、「組み合わせ」とは、本発明の化合物と、皮膚疾患または病変の治療に有用な1種または複数の追加の治療薬との全ての混合物または順序使用(permutation)を意味する。本明細書で他に明示されていない限り、「組み合わせ」には、本発明の化合物と1種または複数の治療薬との同時送達または連続送達が包含され得る。また、本明細書で他に明示されていない限り、「組み合わせ」には、本発明の化合物と(例えば、本発明の化合物と皮膚疾患の許容可能な添加剤とを含む皮膚用組成物または医薬組成物)別の治療薬との剤形が包含され得る。また、本明細書で他に明示されていない限り、「組み合わせ」には、本発明の化合物の別の治療薬との投与経路を包含し得る。また、本明細書で他に明示されていない限り、「組み合わせ」とは、本発明の化合物と別の治療薬とを含む組成物を包含し得る。剤形、投与経路、並びに、皮膚用組成物および医薬組成物は、限定されるものではないが、本明細書に記載のものが包含される。
【0297】
本明細書で引用されている全ての米国特許、米国特許出願公報、米国特許出願、外国特許、外国特許出願および非特許公報は、参照によりそれら全文を本明細書に組み入れるものとする。
【0298】
前述の発明は理解を促すためにかなり詳細に記載されているが、特定の変更および変形が添付の特許請求の範囲内で実施され得ることは明白であろう。したがって、記載した実施形態は例示として考えるべきものであって、限定的ではなく、また、本発明は本明細書に記載した詳述に限定されるものではないが、添付の特許請求の範囲内および均等物内で変更することは可能である。
【技術分野】
【0001】
関連出願の相互参照
本願は、2009年7月8日に申請した米国仮特許出願第61/224,042号の35 U.S.C.119(e)に基づく利益を主張するものであり、その全ての内容は、ここに、参照により組み入れるものとする。
【0002】
発明の技術分野
本発明は、皮脂腺機能亢進を特徴とする皮膚疾患または病変(例えば座瘡および脂性肌)を治療するための5-(テトラデシルオキシ)-2-フランカルボン酸(TOFA)類似体の使用に関する。また本発明は、皮脂腺機能亢進を特徴とする皮膚疾患または病変(例えば座瘡および脂性肌)の治療で使用するためのTOFA類似体を含む医薬組成物および皮膚用組成物に関する。
【背景技術】
【0003】
機能亢進性皮脂腺疾患(例えば尋常性座瘡(座瘡)など)は、多くの人に障害を与える一般的な皮膚病変である。座瘡は、典型的には、思春期の始まりに現れ、14〜19歳の間にその発生のピークがある。座瘡の罹患率は、生涯のうち20代の中頃には大幅に低減する。座瘡病因は、多要因性の皮脂腺機能亢進(皮脂産生の増加)であり、脂漏、角化細胞の異常増殖/落屑および局所的炎症変化を促進する細菌コロニー形成を伴う。思春期にアンドロゲン産生が急増する結果、皮脂産生の増加が毛嚢上皮層の異常落屑と共に起こる。この皮脂と細胞残屑の混合物は面皰の基本成分であり、正常な皮膚フローラの一部であって炎症性座瘡への重要な一因である嫌気性グラム陽性菌プロピオニバクテリウム・アクネス(Propionibacterium acnes (P. acnes))の増殖に対して理想的な環境を提供する。その後、細菌誘導性白血球遊走因子および炎症誘発性メディエーターが局所的炎症反応を促進する。
【0004】
座瘡の臨床病変は、軽症座瘡の開放面皰(白色面皰)および閉鎖面皰(黒色面皰)から重症の炎症性座瘡の丘疹、膿疱、結節および嚢胞性病変または混合性病変に及ぶ。座瘡病変は、典型的には、顔、上背、胸部および上腕に生じる。座瘡の臨床経過は、それが大きくなって治まる傾向がある。病変の重症度は、季節的影響および心理的影響を含む多重要因の影響を受けるとともに、患者の病変を習慣的に処置する患者自身が誘発する外傷の影響を受ける。一般に、経過において一時的ではあるが、中等症〜重症の炎症性座瘡は、患者にとって長期的な影響を引き起こし得る実際的な病態、例えば、これらに限定されるものではないが、生活に支障を来たすほどの精神的ダメージおよび美観を損なう物理的傷跡を与える。
【0005】
中等症から重症の座瘡を治療するために様々な治療を利用することができる。これらの治療は特定の様相の病変に作用し得るか、場合によっては、いくつかの病因に作用し得る。しかし、現在利用可能な座瘡治療には重大な欠点がある。皮膚疾患の治療は、軽症から中等症の座瘡に対して十分な効果が得られないだけでなく、これらの治療で用いられる薬剤の多くは皮膚刺激性を生じる。皮膚用レチノイドおよびベンゾイルパーオキサイドを用いる治療は、面皰の除去、殺菌、および/または炎症の低減により、軽症から中等症の座瘡に対して有効である。皮膚科学的に、または経口的に投与される抗生物質を使用する治療は、抗生物質の静菌作用および抗炎症作用によって軽症から中等症の座瘡を治療するために使用することができる。しかし典型的には、経口抗生物質では満足な病変クリアランスは得られない。また一般的に、座瘡治療で使用される経口抗生物質の作用は遅効性であり、最善の結果を得るには3〜6か月の治療期間を要する。従って、特に弱年齢の患者においては、服薬遵守は難しい場合がある。さらに抗生物質の長期使用は、細菌の抗生物質耐性の恐れも伴う。また、光線による治療(例えば、420nmの青色光または1450nmの熱レーザー)は、皮脂腺に対するそれぞれの抗細菌性光力学的効果または熱的効果に基づき、軽症から中等症の座瘡の治療に使用することができる。
【0006】
現在のガイドラインで、中等症から重症の座瘡に罹患した患者に対して選択される治療投薬計画は、経口抗生物質とレチノイドなどの皮膚用剤との組み合わせである。治療抵抗性の結節性座瘡に罹患している患者に関しては、第1選択の治療は、経口レチノイド、例えば、アキュテイン(Accutane)(登録商標)(13-シス-レチノイン酸)からなっていてもよい。アキュテイン(登録商標)は皮脂腺に対して強力な抑制作用を有しているため、面皰を除去し、炎症を低減し、また皮脂腺内の増殖、分化および脂質生成を抑制するのに有用である。さらに、アキュテイン(登録商標)は、物理的な瘢痕形成または心理学的な傷形成のリスクのある患者の中等症または重症座瘡を治療するのにも用いられる。アキュテイン(登録商標)は、座瘡治療で効果が証明された長い歴史がある。アキュテイン(登録商標)で治療された多くの患者は、3〜6か月間、毎日投薬することで緩解を経験する。場合によっては、その治療は永続的な効果をもたらし、治癒の可能性がある。一方、アキュテイン(登録商標)は広く認められている催奇形性物質であり、さらに、高リスクのうつ病、血液脂質レベルの上昇、および健康に害のある粘膜皮膚変化をはじめとする、有意な全身性副作用をもたらすことが知られている。皮脂腺活性に対するアキュテイン(登録商標)の強力な抑制作用は、皮膚用レチノイドおよび皮膚用/経口用抗生物質の作用とは明確に異なる。しかし、座瘡の局所治療では、このアプローチがアキュテイン(登録商標)に伴う全身的有害作用のリスクを最小限にするので、依然として好まれている。経口で有効なアキュテイン(登録商標)様の薬剤が局所的に投与される場合には、皮膚および/または皮脂腺にそれらが限定的に浸透していく可能性があることから、実質的にはその活性は恐らく低いと考えられる。
【0007】
座瘡を治療する手段として、皮脂産生を低減することも既に記載されている。例えば、Zouboulis, C.C. et al., "Zileuton, an oral 5-lipoxygenase inhibitor, directly reduces sebum production", Dermatology (2005), Vol. 210, pp. 36-3 8;およびZouboulis, C.C. et al., "A new concept for acne therapy: a pilot study with zileuton, an oral 5-lipoxygenase inhibitor", Arch. Dermatol. (2003), Vol. 139, pp. 668-670を参照されたい。ジロートン(Zileuton)は、アラキドン酸からロイコトリエンB4(LTB4)の形成を触媒する酵素である5-リポキシゲナーゼの経口活性阻害剤であり、これが中等症から重症の座瘡患者に対して試験された。LTB4は、皮脂脂質の産生を促進する。この研究の結果、12週間で皮脂脂質が65%減少し、炎症性病変が71%減少したことが明らかになった。この研究によって、皮脂産生の阻害により作用する非レチノイドの使用で、座瘡が有意に改善され得ることが示唆された。
【先行技術文献】
【非特許文献】
【0008】
【非特許文献1】Zouboulis, C.C. ら, "Zileuton, an oral 5-lipoxygenase inhibitor, directly reduces sebum production", Dermatology, 2005年, 第210巻, pp. 36-38
【非特許文献2】Zouboulis, C.C.ら, "A new concept for acne therapy: a pilot study with zileuton, an oral 5-lipoxygenase inhibitor", Arch. Dermatol., 2003年, 第139巻, pp. 668-670
【発明の概要】
【発明が解決しようとする課題】
【0009】
したがって、座瘡および他の皮脂腺機能亢進を特徴とする皮膚疾患に対し、速効性で、効果があり、かつ安全性のある皮膚治療または経口治療が必要とされている。
【課題を解決するための手段】
【0010】
発明の概要
本明細書では、5-(テトラデシルオキシ)-2-フランカルボン酸(TOFA)の類似体、並びに、皮脂腺機能亢進を特徴とする皮膚疾患または病変(例えば、尋常性座瘡、集簇性座瘡、クロール座瘡(choracne)、酒さ、酒さ鼻、脂漏、脂漏性皮膚炎、皮脂腺肥厚、マイボーム腺機能不全の顔面酒さ、細胞分裂促進性脱毛、および脂性肌など)を治療するための前記類似体の使用方法を開示する。
【発明を実施するための形態】
【0011】
したがって、一態様では、本発明は、単一立体異性体またはそれらの混合物としての、式(I):
【化1】

【0012】
(式中、
R1は、-O-R2、-O-R3-OR2、-O-R3-OC(O)-N(R5)R6、-O-R3-N(R5)R6、-O-R3-N(R4)C(O)OR5、-O-R3-C(O)OR5、-O-R3-C(O)N(R5)R6または-N(R5)S(O)2-R4であり;
各R2は、独立して、アルキル、ハロアルキル、場合により置換されていてもよいアリール、場合により置換されていてもよいアラルキル、場合により置換されていてもよいヘテロシクリル、場合により置換されていてもよいヘテロシクリルアルキル、場合により置換されていてもよいヘテロアリール、または場合により置換されていてもよいヘテロアリールアルキルであり;
各R3は、独立して、場合により置換されていてもよいアルキレン鎖であり;
R4は、場合により置換されていてもよいアルキル、場合により置換されていてもよいアリール、場合により置換されていてもよいアラルキル、場合により置換されていてもよいヘテロアリール、または場合により置換されていてもよいヘテロアリールアルキルであり;
各R5は、独立して、水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリール、または場合により置換されていてもよいアラルキルであり;
各R6は、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアラルキル、または-R3-C(O)OR4であるか;
あるいは、任意のR5およびR6は、これらが両方とも結合されている窒素と一緒になって、場合により置換されていてもよいN-ヘテロシクリルまたは場合により置換されていてもよいN-ヘテロアリールを形成している)
で表される化合物、あるいはその製薬上許容可能な塩に関する。
【0013】
本発明の別の態様は、治療上有効な量の上記の式(I)で表される化合物、またはその製薬上許容可能な塩と、製薬上許容可能な添加剤とを含む医薬組成物に関する。
【0014】
別の態様では、本発明は、皮脂腺機能亢進を特徴とする皮膚疾患または病変のあるヒトの治療方法であって、治療上有効な量の上記の式(I)で表される化合物またはその製薬上許容可能な塩を、それを必要とするヒトに投与することを含む方法に関する。
【0015】
別の態様では、本発明は、皮脂腺機能亢進を特徴とする皮膚疾患または病変のあるヒトの治療方法であって、治療上有効な量の上記の式(I)で表される化合物またはその製薬上許容可能な塩と、製薬上許容可能な添加剤とを含む医薬組成物を、それを必要とするヒトに投与することを含む方法に関する。
【0016】
本発明の別の態様は、ヒトにおける皮脂腺活性の抑制方法であって、治療上有効な量の上記の式(I)で表される化合物またはその製薬上許容可能な塩を、それを必要とするヒトに投与することを含む方法に関する。
【0017】
本発明の別の態様は、ヒトにおける皮脂腺活性の抑制方法であって、治療上有効な量の上記の式(I)で表される化合物またはその製薬上許容可能な塩と、製薬上許容可能な添加剤とを含む医薬組成物を、それを必要とするヒトに投与することを含む方法に関する。
【0018】
本発明の別の態様は、炎症と特徴とする疾患または病変のあるヒトの治療方法であって、治療上有効な量の上記の式(I)で表される化合物またはその製薬上許容可能な塩と、製薬上許容可能な添加剤とを含む医薬組成物を、それを必要とするヒトに投与することを含む方法に関する。
【0019】
本発明の別の態様は、炎症を特徴とする疾患または病変のあるヒトのT細胞増殖およびサイトカイン分泌の低減方法であって、治療上有効な量の上記の式(I)で表される化合物またはその製薬上許容可能な塩と、製薬上許容可能な添加剤とを含む医薬組成物を、それを必要とするヒトに投与することを含む方法に関する。
【0020】
上記の本発明の様々な態様のうち、式(I)で表される化合物は、以下の米国特許(それらの全開示内容は、参照により本明細書に完全に組み入れられるものとする)で詳細に記載または請求されている化合物については包含されないものと理解されたい:米国特許第4,110,351号;米国特許第4,146,623号;米国特許第4,602,099号;および米国特許第4,980,371号。特定の実施形態において、式(I)で表される化合物は、5-ドデシロキシ-2-フロ酸、5-テトラデシルオキシ-2-フロ酸メチルエステル、5-テトラデシルオキシ-2-フロ酸ピペリジノエチルエステル、および5-テトラデシルオキシ-2-フロ酸3-ピロリジニルエステルは除く。
【0021】
本発明の上記の態様およびそれらの実施形態を下記により詳しく記載する。
【図面の簡単な説明】
【0022】
【図1】ハムスター耳皮脂腺に対するTOFA局所適応の効果と本発明の3種の化合物の同時適用の効果を評価するためのin vivoアッセイの結果を示す図である。未治療の耳および治療済みの耳について標準偏差を用いた平均皮脂腺計数(1群当たり動物5匹)を示す。* Students TestによりP<0.05。
【図2】化合物Aの適用21日間後と治療を停止した1週間後および2週間後のハムスター皮脂腺のサイズを評価するためのさらなるin vivoアッセイの結果を示す図である。未治療の耳および治療済みの耳について標準偏差を用いた平均皮脂腺計数(各時点で1群当たり動物7〜8匹)を示す。* P<0.05;** 溶媒で治療した動物と比較した場合P<0.005。
【図3】動物を、それぞれ対照ビヒクル(40%DMA/30%アセトン/30%エタノール)、TOFAおよび化合物Aで21日間連続して治療した試験で調製した耳切片の組織学的な所見を示す図である。
【0023】
発明の詳細な説明
定義
本明細書で指定した特定の化学基は、示した化学基で確認され得る炭素原子数の総数を表す簡略表記を前に付けることができる。例えば;C7-C12アルキルは、7〜12個の炭素原子総数を有する下記に定義したようなアルキル基を説明しており、また、C4-C12シクロアルキルアルキルは、4〜12個の炭素原子総数を有する下記に定義したようなシクロアルキルアルキル基を説明している。簡略表記の炭素総数は、記載した基の置換基に存在するであろう炭素を含むものではない。
【0024】
上記に加えて、本明細書および添付の特許請求の範囲で使用される場合においては、特に異なる記載のない限り、以下の用語は次に示す意味を有する:
「アミノ」は-NH2基を意味する。
【0025】
「シアノ」は-CN基を意味する。
【0026】
「ヒドロキシ」は-OH基を意味する。
【0027】
「イミノ」は=NH置換基を意味する。
【0028】
「ニトロ」は-NO2基を意味する。
【0029】
「オキソ」は=O置換基を意味する。
【0030】
「チオキソ」は=S置換基を意味する。
【0031】
「トリフルオロメチル」は-CF3基を意味する。
【0032】
「アルキル」は、炭素原子および水素原子のみからなり、不飽和は含有しておらず、1〜12個の炭素原子、好ましくは1〜8個の炭素原子、または1〜6個の炭素原子を有する直鎖状または分枝状の炭化水素鎖基を意味し、当該基は単結合により分子の残りの部分に結合される。例としては、メチル、エチル、n-プロピル、1-メチルエチル(イソプロピル)、n-ブチル、n-ペンチル、1,1-ジメチルエチル(t-ブチル)、3-メチルヘキシル、2-メチルヘキシルなどである。本明細書中で他に特段の記載のない限り、アルキル基は、場合により、以下の基のうちの1つの基で置換されていてもよい:アルキル、アルケニル、ハロ、ハロアルケニル、シアノ、ニトロ、アリール、シクロアルキル、ヘテロシクリル、ヘテロアリール、オキソ、トリメチルシラニル、-OR14、-OC(O)-R14、-N(R14)2、-C(O)R14、-C(O)OR14、-C(O)N(R14)2、-N(R14)C(O)OR16、-N(R14)C(O)R16、-N(R14)S(O)tR16(ここでtは1〜2である)、-S(O)tOR16(ここでtは1〜2である)、-S(O)pR16(ここでpは0〜2である)、および-S(O)tN(R14)2(ここでtは1〜2である)(この場合、各R14は、独立して、水素、アルキル、ハロアルキル、シクロアルキル、シクロアルキルアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアリールアルキルであり;各R16は、アルキル、ハロアルキル、シクロアルキル、シクロアルキルアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアリールアルキルである)。
【0033】
「アルキレン」または「アルキレン鎖」は、炭素および水素のみからなり、不飽和を含有しておらず、1〜12個の炭素原子を有するものであって、分子の残りの部分を置換基へと結合する直鎖状または分枝状の二価の炭化水素鎖を意味する。例えば、メチレン、エチレン、プロピレン、n-ブチレンなどである。アルキレン鎖は、単結合を介して分子の残りの部分に結合され、また単結合を介して置換基に結合される。分子の残りの部分に対する、または置換基に対するアルキレン鎖の結合点は、当該鎖内の1個の炭素または任意の2個の炭素を介しているものであってもよい。本明細書中で他に特段の記載のない限り、アルキレン鎖は、場合により、以下の基の1つの基で置換されていてもよい:アルキル、アルケニル、ハロ、ハロアルケニル、シアノ、ニトロ、アリール、シクロアルキル、ヘテロシクリル、ヘテロアリール、オキソ、トリメチルシラニル、-OR14、-OC(O)-R14、-N(R14)2、-C(O)R14、-C(O)OR14、-C(O)N(R14)2、-N(R14)C(O)OR16、-N(R14)C(O)R16、-N(R14)S(O)tR16(ここでtは1〜2である)、-S(O)tOR16(ここでtは1〜2である)、-S(O)pR16(ここでpは0〜2である)、および-S(O)tN(R14)2(ここでtは1〜2である)(この場合、各R14は、独立して、水素、アルキル、ハロアルキル、シクロアルキル、シクロアルキルアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアリールアルキルであり;各R16は、アルキル、ハロアルキル、シクロアルキル、シクロアルキルアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアリールアルキルである)。
【0034】
「アリール」は、水素、6〜18個の炭素原子および少なくとも1つの芳香族環を含む炭化水素環構造基を意味する。本発明の目的においては、アリール基は単環式、二環式、三環式または四環式構造であってもよく、これには縮合環構造または架橋環構造が包含されていてもよい。アリール基は、特に限定されるものではないが、アセアントリレン、アセナフチレン、アセフェナントリレン、アントラセン、アズレン、ベンゼン、クリセン、フルオランテン、フルオレン、as-インダセン、s-インダセン、インダン、インデン、ナフタレン、フェナレン、フェナントレン、プレイアデン(pleiadene)、ピレンおよびトリフェニレンから誘導されたアリール基を含む。本明細書中で他に特段の記載のない限り、用語「アリール」または接頭語「アラ-(ar-)」(例えば「アラルキル(aralkyl)」中のアラ(ar))は、場合により、次のものからなる群から独立して選択される1個または複数の置換基で置換されていてもよいアリール基を包含することを意味する:アルキル、アルケニル、ハロ、ハロアルキル、ハロアルケニル、シアノ、ニトロ、アリール、アラルキル、ヘテロアリール、ヘテロアリールアルキル、-R15-OR14、-R15-OC(O)-R14、-R15-N(R14)2、-R15-C(O)R14、-R15-C(O)OR14、-R15-C(O)N(R14)2、-R15-N(R14)C(O)OR16、-R15-N(R14)C(O)R16、-R15-N(R14)S(O)tR16(ここでtは1〜2である)、-R15-N=C(OR14)R14、-R15-S(O)tOR16(ここでtは1〜2である)、-R15-S(O)pR16(ここでpは0〜2である)、および-R15-S(O)tN(R14)2(ここでtは1〜2である)(この場合、各R14は、独立して、水素、アルキル、ハロアルキル、シクロアルキル、シクロアルキルアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアリールアルキルであり;各R15は、独立して、直接結合または直鎖状もしくは分枝状アルキレンまたはアルケニレン鎖であり;各R16は、アルキル、ハロアルキル、シクロアルキル、シクロアルキルアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアリールアルキルである)。
【0035】
「アラルキル」は、式-Rb-Rcの基(式中、Rbは上記で定義したアルキレン鎖であり、Rcは上記で定義した1個または複数のアリール基である)を意味し、例えばベンジル、ジフェニルメチルなどである。アラルキル基のアルキレン鎖部分は、場合により、アルキレン鎖について上述したように置換されていてもよい。アラルキル基のアリール部分は、場合により、アリール基に関して上述したように置換されていてもよい。
【0036】
「シクロアルキル」とは、炭素原子および水素原子のみからなる、安定性のある非芳香族の単環式または多環式炭化水素基を意味し、これは、3〜15個の炭素原子、好ましくは3〜10個の炭素原子を有する縮合環構造または架橋環構造を含んでいてもよく、また、これは飽和または不飽和であり、単結合を介して分子の残りの部分に結合する。単環式基としては、例えば、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、シクロヘプチルおよびシクロオクチルが挙げられる。多環式基としては、例えば、アダマンチル、ノルボルニル、デカリニル(decalinyl)などが挙げられる。本明細書中で他に特段の記載のない限り、用語「シクロアルキル」は、場合により、次のものからなる群から独立して選択される1個または複数の置換基で置換されていてもよいシクロアルキル基を含むことを意味する:アルキル、アルケニル、ハロ、ハロアルキル、ハロアルケニル、シアノ、ニトロ、オキソ、アリール、アラルキル、シクロアルキル、シクロアルキルアルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリール、ヘテロアリールアルキル、-R15-OR14、-R15-OC(O)-R14、-R15-N(R14)2、-R15-C(O)R14、-R15-C(O)OR14、-R15-C(O)N(R14)2、-R15-N(R14)C(O)OR16、-R15-N(R14)C(O)R16、-R15-N(R14)S(O)tR16(ここでtは1〜2である)、-R15-N=C(OR14)R14、-R15-S(O)tOR16(ここでtは1〜2である)、-R15-S(O)pR16(ここでpは0〜2である)、および-R15-S(O)tN(R14)2(ここでtは1〜2である)(この場合、各R14は、独立して、水素、アルキル、ハロアルキル、シクロアルキル、シクロアルキルアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアリールアルキルであり;各R15は、独立して、直接結合または直鎖状もしくは分枝状アルキレンまたはアルケニレン鎖であり;各R16は、アルキル、ハロアルキル、シクロアルキル、シクロアルキルアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアリールアルキルである)。
【0037】
「ハロ」はブロモ、クロロ、フルオロまたはヨードを意味する。
【0038】
「ハロアルキル」は、上記で定義した1個または複数のハロ基で置換されている、上記で定義したアルキル基を意味し、例えば、トリフルオロメチル、ジフルオロメチル、トリクロロメチル、2,2,2-トリフルオロエチル、1-フルオロメチル-2-フルオロエチル、3-ブロモ-2-フルオロプロピル、1-ブロモメチル-2-ブロモエチルなどがある。ハロアルキル基のアルキル部分は、場合により、アルキル基に関して上記で定義したように置換されていてもよい。
【0039】
「ヘテロシクリル」は、2〜12個の炭素原子と、窒素、酸素および硫黄からなる群から選択される1〜6個のヘテロ原子とからなる、安定性のある3〜18員の非芳香族環基を意味する。本明細書中で他に特段の記載のない限り、ヘテロシクリル基は単環式、二環式、三環式または四環式環構造であってもよく、当該基は縮合環構造または架橋環構造を含んでいてもよい。また、ヘテロシクリル基中の窒素、炭素または硫黄原子は、場合により酸化されていてもよく;窒素原子は場合により四級化されていてもよく;またヘテロシクリル基は、部分的にまたは完全に飽和されていてもよい。こうしたヘテロシクリル基の例としては、特に限定されるものではないが、ジオキソラニル、チエニル[1,3]ジチアニル、デカヒドロイソキノリル、イミダゾリニル、イミダゾリジニル、イソチアゾリジニル、イソオキサゾリジニル、モルホリニル、オクタヒドロインドリル、オクタヒドロイソインドリル、2-オキソ-1,3-ジオキソール-4-イル、2-オキソピペラジニル、2-オキソピペリジニル、2-オキソピロリジニル、オキサゾリジニル、ピペリジニル、ピペラジニル、4-ピペリドニル、ピロリジニル、ピラゾリジニル、キヌクリジニル、チアゾリジニル、テトラヒドロフラニル、トリチアニル、テトラヒドロピラニル、チオモルホリニル、チアモルホリニル、1-オキソ-チオモルホリニル、および1,1-ジオキソ-チオモルホリニルが挙げられる。本明細書中で他に特段の記載のない限り、用語「ヘテロシクリル」は、場合により、次のものからなる群から選択される1個または複数の置換基で置換されていてもよい、上記で定義したヘテロシクリル基を含むことを意味する:アルキル、アルケニル、ハロ、ハロアルキル、ハロアルケニル、シアノ、オキソ、チオキソ、ニトロ、アリール、アラルキル、シクロアルキル、シクロアルキルアルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリール、ヘテロアリールアルキル、-R15-OR14、-R15-OC(O)-R14、-R15-N(R14)2、-R15-C(O)R14、-R15-C(O)OR14、-R15-C(O)N(R14)2、-R15-N(R14)C(O)OR16、-R15-N(R14)C(O)R16、-R15-N(R14)S(O)tR16(ここでtは1〜2である)、-R15-N=C(OR14)R14、-R15-S(O)tOR16(ここでtは1〜2である)、-R15-S(O)pR16(ここでpは0〜2である)、および-R15-S(O)tN(R14)2(ここでtは1〜2である)(この場合、各R14は、独立して、水素、アルキル、ハロアルキル、シクロアルキル、シクロアルキルアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアリールアルキルであり;各R15は、独立して、直接結合または直鎖状もしくは分枝状アルキレンもしくはアルケニレン鎖であり;各R16は、アルキル、ハロアルキル、シクロアルキル、シクロアルキルアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアリールアルキルである)。
【0040】
「N-ヘテロシクリル」は、少なくとも1個の窒素を含有する上記で定義したヘテロシクリル基を意味し、この場合、ヘテロシクリル基の分子の残りの部分への結合点は、ヘテロシクリル基中の窒素原子を介している。N-ヘテロシクリル基は、場合により、ヘテロシクリル基に関して上述したように置換されていてもよい。
【0041】
「ヘテロシクリルアルキル」は、式-RbRh(式中、Rbは上記で定義したアルキレン鎖であり、Rhは上記で定義したヘテロシクリル基であり、ヘテロシクリルが窒素含有ヘテロシクリルである場合、ヘテロシクリルは窒素原子でアルキレン鎖に結合されていてもよい)の基を意味する。ヘテロシクリルアルキル基のアルキレン鎖は、場合により、アルキレン鎖に関して上記で定義したように置換されていてもよい。ヘテロシクリルアルキル基のヘテロシクリル部分は、場合により、ヘテロシクリル基に関して上記で定義したように置換されていてもよい。
【0042】
「ヘテロアリール」は、水素原子、1〜13個の炭素原子、窒素、酸素および硫黄からなる群から選択される1〜6個のヘテロ原子、ならびに少なくとも1つの芳香族環を含む、5〜14員の環構造基を意味する。本発明の目的においては、ヘテロアリール基は単環式、二環式、三環式または四環式の環構造であってもよく、これには縮合環構造または架橋環構造が包含されていてもよい。また、ヘテロアリール基中の窒素、炭素または硫黄原子は、場合により酸化されていてもよく;窒素原子は、場合により四級化されていてもよい。例としては、特に限定されるものではないが、アゼピニル、アクリジニル、ベンズイミダゾリル、ベンズチアゾリル、ベンゾインドリル、ベンゾジオキソリル、ベンゾフラニル、ベンゾオキサゾリル、ベンゾチアゾリル、ベンゾチアジアゾリル、ベンゾ[b][1,4]ジオキセピニル、1,4-ベンゾジオキサニル、ベンゾナフトフラニル、ベンゾオキサゾリル、ベンゾジオキソリル、ベンゾジオキシニル、ベンゾピラニル、ベンゾピラノニル、ベンゾフラニル、ベンゾフラノニル、ベンゾチエニル(ベンゾチオフェニル)、ベンゾトリアゾリル、ベンゾ[4,6]イミダゾ[1,2-a]ピリジニル、カルバゾリル、シンノリニル、ジベンゾフラニル、ジベンゾチオフェニル、フラニル、フラノニル、イソチアゾリル、イミダゾリル、インダゾリル、インドリル、インダゾリル、イソインドリル、インドリジニル、イソインドリル、イソキノリル、インドリジニル、イソオキサゾリル、ナフチリジニル、オキサジアゾリル、2-オキソアゼピニル、オキサゾリル、オキシラニル、1-オキシドピリジニル、1-オキシドピリミジニル、1-オキシドピラジニル、1-オキシドピリダジニル、1-フェニル-1H-ピロリル、フェナジニル、フェノチアジニル、フェノキサジニル、フタラジニル、プテリジニル、プリニル、ピロリル、ピラゾリル、ピリジニル、ピラジニル、ピリミジニル、ピリダジニル、ピロリル、キナゾリニル、キノキサリニル、キノリニル、キヌクリジニル、イソキノリニル、テトラヒドロキノリニル、チアゾリル、チアジアゾリル、トリアゾリル、テトラゾリル、トリアジニル、およびチオフェニル(すなわちチエニル)が挙げられる。本明細書中で他に特段の記載のない限り、用語「ヘテロアリール」は、場合により、次のものからなる群から独立して選択される1個または複数の置換基で置換されていてもよい上記で定義したヘテロアリール基を含むことを意味する:アルキル、アルケニル、アルコキシ、ハロ、ハロアルキル、ハロアルケニル、シアノ、オキソ、チオキソ、ニトロ、アリール、アラルキル、シクロアルキル、シクロアルキルアルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリール、ヘテロアリールアルキル、-R15-OR14、-R15-OC(O)-R14、-R15-N(R14)2、-R15-C(O)R14、-R15-C(O)OR14、-R15-C(O)N(R14)2、-R15-N(R14)C(O)OR16、-R15-N(R14)C(O)R16、-R15-N(R14)S(O)tR16(ここでtは1〜2である)、-R15-N=C(OR14)R14、-R15-S(O)tOR16(ここでtは1〜2である)、-R15-S(O)pR16(ここでpは0〜2である)、および-R15-S(O)tN(R14)2(ここでtは1〜2である)(この場合、各R14は、独立して、水素、アルキル、アルケニル、ハロアルキル、シクロアルキル、シクロアルキルアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアリールアルキルであり;各R15は、独立して、直接結合または直鎖状もしくは分枝状アルキレンもしくはアルケニレン鎖であり;各R16は、アルキル、アルケニル、ハロアルキル、シクロアルキル、シクロアルキルアルキル、アリール、アラルキル、ヘテロシクリル、ヘテロシクリルアルキル、ヘテロアリールまたはヘテロアリールアルキルである)。
【0043】
「N-ヘテロアリール」は、少なくとも1個の窒素を含有する上記で定義したヘテロアリール基を意味し、この場合、ヘテロアリール基の分子の残りの部分への結合点は、ヘテロアリール基中の窒素原子を介してである。N-ヘテロアリール基は、場合により、ヘテロアリール基に関して上記で記載したように置換されていてもよい。
【0044】
「ヘテロアリールアルキル」は、式-RbRi(式中、Rbは上記で定義したアルキレン鎖であり、Riは上記で定義したヘテロアリール基である)の基を意味する。ヘテロアリールアルキル基のヘテロアリール部分は、場合により、ヘテロアリール基に関して上記で定義したように置換されていてもよい。ヘテロアリールアルキル基のアルキレン鎖部分は、場合により、アルキレン鎖に関して上記で定義したように置換されていてもよい。
【0045】
「皮膚疾患または病変」には、高活性皮脂腺活性に関連する疾患、例えば、尋常性座瘡、集簇性座瘡、クロール座瘡(choracne)、酒さ、酒さ鼻、脂漏、脂漏性皮膚炎、皮脂腺肥厚、マイボーム腺機能不全の顔面酒さ、細胞分裂促進性脱毛、および脂性肌などが含まれる。
【0046】
「皮膚科学的に許容可能な添加剤」としては、特に限定されるものではないが、任意のアジュバント、担体、ビヒクル、添加剤、滑沢剤、甘味料、希釈剤、防腐剤、色素/着色剤、調味料、界面活性剤、湿潤剤、分散剤、懸濁化剤、安定剤、等張剤、溶媒または乳化剤で、例えば、ヒトもしくは家畜動物に対する皮膚使用で許可され得るものとして米国食品医薬品局により承認されているもの、すなわち公知であるもの、あるいは、皮膚用組成物における使用に好適であるものが挙げられる。
【0047】
周知の通り、皮膚(特に角質層)は、外部環境の悪影響に対する身体的バリアを提供する。その際に、それは局所治療薬の吸収または経皮的送達の妨げともなる。このため、適切な皮膚科学的に許容可能な添加剤には、1種または複数の経皮吸収促進剤(または浸透促進剤)が含まれていてもよい。それらの薬剤は、皮膚バリアを通して治療薬(例えば、本明細書に記載のTOFA類似体)の拡散を促す物質である。これらの薬剤は、典型的には、皮膚の抵抗または耐性を低減するように作用し、治療薬の浸透を改善させる。特に、角質層の正常構造を不安定にする物質は細胞間の脂質組織を分断させることが可能で、それによりそのバリアとしての効果が低減する。これらの物質としては、角質層脂質へ分配されて直接効果をもたらす全ての脂質物質、またはタンパク質に作用して脂質構造の間接的な不安定性をもたらす全ての物質を挙げることができる。さらに、エタノールなどの溶媒は角質層から脂質を取り除き、その結果、その脂質組織が破壊され、そのバリア機能が機能しなくなる可能性がある。
【0048】
経皮吸収促進剤またはバリア機能崩壊物質の例としては、特に限定されるものではないが、次のものが挙げられる:アルコール系促進剤、例えば、1〜16個の炭素を含むアルカノール類、ベンジルアルコール、ブチレングリコール、ジエチレングリコール、グリコフロール、グリセリド、グリセリン、グリセロール、フェネチルアルコール、ポリプロピレングリコール、ポリビニルアルコールおよびフェノール;アミド系促進剤、例えば、N-ブチル-N-ドデシルアセトアミド、クロタミトン、N,N-ジメチルホルムアミド、N,N-ジメチルアセトアミド、N-メチルホルムアミドおよび尿素;アミノ酸、例えばL-α-アミノ酸、および水溶性タンパク質;アゾンおよびアゾン様化合物、例えばアザシクロアルカン;精油類、例えば、アーモンド油、酪酸アミル、杏仁油、アボカド油、カンファー、ヒマシ油、1-カルボン、ヤシ油、トウモロコシ油、綿実油、オイゲノール、メントール、アニス油、チョウジ油、オレンジ油、落花生油、ハッカ油、ローズ油、サフラワー油、ゴマ油、鮫肝油(スクアレン)、大豆油、ヒマワリ油およびクルミ油;ビタミン類およびハーブ類、例えば、アロエ、アラントイン、クログルミ抽出物、カミツレ抽出物、パンテノール、パパイン、トコフェロール、およびビタミンAパルミテート;ワックス類、例えばカンデリラワックス、カルナバワックス、セレシンワックス、蜜ろう、ラノリンワックス、ホホバオイル、ワセリン;混合物、例えば、分画植物油脂肪酸とグリセリンまたはプロピレングリコールとの第一級エステル、およびエステル交換中鎖トリグリセライド油;脂肪酸および脂肪酸エステル類、例えば、カプロン酸アミル、酢酸ブチル、カプリル酸、セチルエステル、セバシン酸ジエチル、リンゴ酸ジオクチル、エライジン酸カプリル酸エチル、パルミトステアリン酸エチルグリコール、ベヘン酸グリセリル、グルタミン酸グルコース、酢酸イソブチル、ラウレス-4、ラウリン酸、リンゴ酸、カプリン酸メチル、鉱油、ミリスチン酸、オレイン酸、パルミチン酸、PEG脂肪酸エステル、ポリオキシルエンソルビタンモノオレエート、ポリプロピレングリコール、プロピレングリコール、ジステアリン酸スクロース、サリチル酸、クエン酸ナトリウム、ステアリン酸、石鹸、およびカプロン酸トリグリセリド、カプリル酸トリグリセリド、カプリン酸トリグリセリドおよびラウリン酸トリグリセリド;大環状類、例えば、ブチル化ヒドロキシアニソール、シクロペンタデカノリド、シクロデキストリン;リン脂質およびホスフェート促進剤、例えば、ジアルキルホスフェート、ジテトラデシルホスフェート、レシチン、2-ピロリドン誘導体、例えば、アルキルピロリドン-5-カルボキシレートエステル、ピログルタミン酸エステル、N-メチルピロリドン、生物分解性ソフト経皮吸収促進剤、例えば、ジオキサン誘導体およびジオキソラン誘導体;スルホキシド促進剤、例えば、ジメチルスルホキシドおよびデシルメチルスルホキシド;酸促進剤、例えば、アルギン酸、ソルビン酸およびコハク酸;環状アミン類;イミダゾリノン類;イミダゾール類;ケトン類、例えば、アセトン、ジメチコーン、メチルエチルケトンおよびペンタンジオン;ラノリン誘導体、例えば、ラノリンアルコール、PEG 16ラノリンおよびアセチル化ラノリン;オキサゾリン類;オキサゾリンジノン類;プロリンエステル類;ピロール類、ウレタン類;並びに界面活性剤、例えば、ノンオキシノール、ポリソルベート、ポリオキシレンアルコール、ポリオキシレン脂肪酸エステル、ラウリル硫酸ナトリウムおよびモノステアリン酸ソルビタン。
【0049】
「皮膚科学的に有効な量」とは、ヒトに皮膚科学的に投与した場合(すなわち、皮脂腺への投与を提供する、全身投与または局部投与、例えば、局所投与、皮内投与、静脈内投与、経口投与、またはインプラント使用による投与)、ヒトにおける対象の疾患または病変の(下に定義したような)所望の治療を達成するのに十分である活性成分のその量を意味する。「皮膚科学的に有効な量」を構成する活性成分の量は、活性成分、疾患または病変およびその重症度、ならびに治療を受けるヒトの年齢によって変動するが、当業者によって、持ち得る知識および本明細書を考慮して慣例的に決定することができる。
【0050】
「安定性(のある)化合物」および「安定性(のある)構造」とは、反応混合物から有用な純度の程度に単離し、有効性のある治療薬へ製剤化するのに耐え得る十分に強固な化合物を示すものとする。
【0051】
「哺乳動物」には、ヒトと、家畜動物、例えば、実験動物および家庭用ペット(例えば、ネコ、イヌ、ブタ、ウシ、ヒツジ、ヤギ、ウマ、ウサギ)や野生動物などの非家畜の両方が含まれる。
【0052】
「任意の」または「場合により」とは、状況に関するその後に述べられる事象が生じてもよいし、生じなくてもよいことを意味し、また、その記載が、前記事象または状況が生じる場合の例示群およびそれらが起こらない場合の例示群を含んでいることを意味する。例えば、「場合により置換されていてもよいアリール」とは、アリール基が置換されていてもよいし、置換されていなくてもよいことを意味し、また、その記載には置換アリール基群と置換基を有しないアリール基群の両方が含まれることを意味する。官能基が「場合により置換されていてもよい」と記載され、そして、官能基の置換基もまた「場合により置換されていてもよい」と記載されている場合、本発明の目的においては、こうした繰り返しは5つまで限定され、好ましくはこうした繰り返しは2つまで限定される。
【0053】
「製薬上許容可能な担体、希釈剤または添加剤」としては、特に限定されるものではないが、ヒトまたは家畜における使用で認可され得るものとして米国食品医薬品局により既に承認されている全てのアジュバント、担体、添加剤、滑沢剤、甘味料、希釈剤、防腐剤、色素/着色剤、調味料、界面活性剤、湿潤剤、分散剤、懸濁化剤、安定剤、等張剤、溶媒または乳化剤が挙げられる。
【0054】
「製薬上許容可能な塩」としては、酸付加塩および塩基付加塩の両方が挙げられる。
【0055】
「製薬上許容可能な酸付加塩」とは、遊離塩基の生物学的効果および特性を保持しており、生物学的または非生物学的に有害ではなく、また、無機酸類および有機酸類と形成される塩を意味し、前記無機酸としては、例えば、特に限定されるものではないが、塩酸、臭化水素酸、硫酸、硝酸、リン酸などが挙げられ、有機酸類としては、例えば、特に限定されるものではないが、酢酸、2,2-ジクロロ酢酸、アジピン酸、アルギン酸、アスコルビン酸、アスパラギン酸、ベンゼンスルホン酸、安息香酸、4-アセトアミド安息香酸、樟脳酸、カンファー-10-スルホン酸、カプリン酸、カプロン酸、カプリル酸、炭酸、ケイ皮酸、クエン酸、シクラミン酸、ドデシル硫酸、エタン-1,2-ジスルホン酸、エタンスルホン酸、2-ヒドロキシエタンスルホン酸、ギ酸、フマル酸、ガラクタル酸、ゲンチシン酸、グルコヘプトン酸、グルコン酸、グルクロン酸、グルタミン酸、グルタル酸、2-オキソ-グルタル酸、グリセロリン酸、グリコール酸、馬尿酸、イソ酪酸、乳酸、ラクトビオン酸、ラウリン酸、マレイン酸、リンゴ酸、マロン酸、マンデル酸、メタンスルホン酸、ムチン酸、ナフタレン-1,5-ジスルホン酸、ナフタレン-2-スルホン酸、1-ヒドロキシ-2-ナフトエ酸、ニコチン酸、オレイン酸、オロト酸、シュウ酸、パルミチン酸、パモ酸、プロピオン酸、ピログルタミン酸、ピルビン酸、サリチル酸、4-アミノサルチル酸、セバシン酸、ステアリン酸、コハク酸、酒石酸、チオシアン酸、p-トルエンスルホン酸、トリフルオロ酢酸、ウンデシレン酸などが挙げられる。
【0056】
「製薬上許容可能な塩基付加塩」は、遊離酸の生物学的効果および特性を保持しており、また、生物学的または非生物学的に有害ではないそれらの塩を意味する。このような塩は、無機塩基または有機塩基を遊離酸へ添加することにより調製される。無機塩基から誘導される塩としては、特に限定されるものではないが、ナトリウム、カリウム、リチウム、アンモニウム、カルシウム、マグネシウム、鉄、亜鉛、銅、マンガン、アルミニウムの塩などが挙げられる。好ましい無機塩は、アンモニウム、ナトリウム、カリウム、カルシウムおよびマグネシウムの塩である。有機塩基から誘導される塩としては、特に限定されるものではないが、第一級、第二級および第三級アミンの塩、天然型置換アミンを含む置換アミン類、環状アミン類および塩基性イオン交換樹脂の塩、例えば、アンモニア、イソプロピルアミン、トリメチルアミン、ジエチルアミン、トリエチルアミン、トリプロピルアミン、ジエタノールアミン、エタノールアミン、デアノール、2-ジメチルアミノエタノール、2-ジエチルアミノエタノール、ジシクロヘキシルアミン、リジン、アルギニン、ヒスチジン、カフェイン、プロカイン、ヒドラバミン、コリン、ベタイン、ベネタミン、ベンザチン、エチレンジアミン、グルコサミン、メチルグルカミン、テオブロミン、トリエタノールアミン、トロメタミン、プリン、ピペラジン、ピペリジン、N-エチルピペリジン、ポリアミン樹脂などの塩が挙げられる。特に好ましい有機塩基は、イソプロピルアミン、ジエチルアミン、エタノールアミン、トリメチルアミン、ジシクロヘキシルアミン、コリンおよびカフェインである。
【0057】
「医薬組成物」とは、本発明の化合物と、生物学的に活性のある化合物を哺乳動物(例えばヒト)へ送達するために当技術分野で一般的に認可されている媒体との製剤を意味する。こうした媒体としては、そのために製薬上許容された担体、希釈剤または添加剤が挙げられる。
【0058】
「治療上有効な量」とは、哺乳動物(好ましくはヒト)に投与された場合に、疾患または病変のある哺乳動物(好ましくはヒト)における対象の疾患または病変の治療をするのに効果が十分である、本発明の化合物のその量を意味する。「治療上有効な量」を構成する本発明の化合物の量は、化合物、疾患または病変およびその重症度、投与方法、ならびに治療を受ける哺乳動物の年齢によって変動するが、当業者によって、持ち得る知識および本明細書を考慮して慣例的に決定することができる。好ましくは、本発明の目的においては、「治療上有効な量」は、皮脂腺活性を抑制するのに十分な本発明の化合物のその量である。
【0059】
本明細書で使用する場合の「治療する」または「治療」とは、哺乳動物(好ましくはヒト)における対象の疾患または病変の治療を網羅し、次のものを含む:
(i) 疾患または病変の哺乳動物における発症の予防;
(ii) 哺乳動物における疾患または病変を抑制、すなわち、その進行の阻止;
(iii) 哺乳動物における疾患または病変の緩和、すなわち、疾患または病変の回復をもたらすこと;あるいは、
(iv) 哺乳動物における疾患または病変の徴候を緩和、すなわち、基礎疾患または病変に対処することなく徴候を軽減すること。
【0060】
本明細書では、「疾患」および「病変」という用語は同義で使用されていてもよいし、異なる意味で使用されていてもよい。異なる場合とは、特定の疾病または病変の原因因子が未知であり(そのため、病因学がまだ機能していない)、その結果、未だ疾患とは認められておらず、好ましくない病変または症候としてのみ認識されている(この場合、多少の徴候の特定の組み合わせは臨床医により同定されている)ような場合である。
【0061】
本発明の化合物またはこれらの製薬上許容可能な塩は、1種または複数の不斉中心を含み得るが、それゆえ、絶対立体配置における用語で、(R)-もしくは(S)-として、またはアミノ酸に関しては(D)-もしくは(L)-として定義することができる、鏡像異性体、ジアステレオマー、および他の立体異性体が得られる。本発明は、可能性のあるこのような全ての異性体、並びに、これらのラセミ体および光学的な純粋形態を含むことを意味する。光学的に活性な(+)および(-)、(R)-および(S)-、または(D)-および(L)-異性体群は、キラルシントンまたはキラル試薬を用いて調製することができるか、あるいは、例えば、クロマトグラフィーや分画結晶化などの慣用の技術を用いて分割することができる。個々の鏡像異性体を調製/単離する慣用の技術は、適当な光学的に純粋な前駆体からのキラル合成、または、例えば、キラル高圧液体クロマトグラフィー(HPLC)を用いる、ラセミ化合物(またはラセミ化合物の塩もしくは誘導体)の分割を含む。本明細書に記載の化合物群がオレフィン二重結合または他の幾何学的不斉中心を含有する場合であって、他に特段の記載のない限り、本化合物群はEおよびZの両幾何異性体を含むものとする。同様に、全ての互変異性体形態もまた包含されるものとする。
【0062】
「立体異性体」は、同一結合によって同一原子群で構成されているが、相互変換できない、異なる三次元構造を有する化合物を意味する。本発明は、様々な立体異性体およびそれらの混合物を意図するものであり、また、2種の立体異性体であって、相互の分子を重ね合わせることのできない鏡像関係になっていることを意味する「鏡像異性体」を含む。
【0063】
本明細書で使用している化学命名プロトコルおよび構造式は、ChemDraw Version 10ソフトウェアネーミングプログラム(CambridgeSoft)を使用する、I.U.P.A.C.命名法体系の改良形態である。本明細書で使用している複合化学物質名については、置換基は、それが結合している基の前に命名されている。例えば、2-シクロプロピルエチルは、エチル骨格をシクロプロピル置換基とともに含む。化学構造式では、十分な水素原子に結合されており、その原子価が完全であると仮定される一部の炭素原子を除いて、全ての結合が同定されている。
【0064】
置換基中の括弧の使用は、本明細書においてスペースを節約するために用いている。したがって、置換基中の括弧の使用は、括弧内に書き入れた基が括弧より前の原子に直接結合されていることを示す。例えば、R1に関する選択の1つは-O-R3-OC(O)-N(R5)R6基である。この基の式は、以下のように図示することができる。
【化2】

【0065】
したがって、例えば、R1が3-モルホノプロポキシである式(I)で表される化合物;すなわち、次式の化合物:
【化3】

【0066】
は、本明細書では、3-モルホリノプロピル5-(テトラデシルオキシ)フラン-2-カルボキシレートと命名されている。
【0067】
発明の実施形態
発明の概要で上述した本発明の種々の態様のうち、特定の実施形態が好ましい。
【0068】
発明の概要で上述した式(I)で表される化合物のうち、一実施形態は、
R1が-O-R2であり;
R2が独立して、アルキルまたはヘテロシクリルアルキルである
式(I)で表される化合物である。
【0069】
この実施形態のうち、一実施形態は、次のものから選択される式(I)で表される化合物である:
イソプロピル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
4-メチルペンチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;および、
(5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチル5-(テトラデシルオキシ)フラン-2-カルボキシレート。
【0070】
発明の概要で上述した式(I)で表される化合物のうち、別の実施形態は、
R1が-O-R2であり;
R2がハロアルキルまたは置換アリールである
式(I)で表される化合物である。
【0071】
この実施形態のうち、一実施形態は、次のものから選択される式(I)で表される化合物である:
2,2,2-トリフルオロエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2,2,2-トリクロロエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-ブロモエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;および、
2-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)安息香酸。
【0072】
発明の概要で上述した式(I)で表される化合物のうち、別の実施形態は、
R1が-O-R3-OR2であり;
R2が場合により置換されていてもよいヘテロシクリルアルキルであり;
R3が場合により置換されていてもよいアルキレン鎖である
式(I)で表される化合物である。
【0073】
この実施形態のうち、一実施形態は、3-(テトラヒドロ-2H-ピラン-2-イルオキシ)プロピル5-(テトラデシルオキシ)フラン-2-カルボキシレートである式(I)で表される化合物である。
【0074】
発明の概要で上述した式(I)で表される化合物のうち、別の実施形態は、
R1は、-O-R3-OC(O)-N(R5)R6であり;
各R2は、独立して、アルキル、ハロアルキル、場合により置換されていてもよいアリール、場合により置換されていてもよいアラルキル、場合により置換されていてもよいヘテロシクリル、場合により置換されていてもよいヘテロシクリルアルキル、場合により置換されていてもよいヘテロアリールまたは場合により置換されていてもよい置換ヘテロアリールアルキルであり;
R3は、場合により置換されていてもよいアルキレン鎖であり;
R5は、水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリールまたは場合により置換されていてもよいアラルキルであり;および、
R6は、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアラルキルまたは-R3-C(O)OR3であり;また、
あるいは、任意のR5およびR6は、これらが両方とも結合されている窒素と一緒になって、場合により置換されていてもよいN-ヘテロシクリルまたは場合により置換されていてもよいN-ヘテロアリールを形成している、
式(I)で表される化合物である。
【0075】
この実施形態のうち、一実施形態は、次のものから選択される式(I)で表される化合物である:
1-(ベンジル(メチル)カルバモイルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
1-((2-エトキシ-2-オキソエチル)(メチル)カルバモイルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
4-(2S)-2-ベンジル1-(1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチル)ピロリジン-1,2-ジカルボキシレート;
1-(4-フェニルシクロヘキサンカルボニルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチル3-フェニルピロリジン-1-カルボキシレート;
1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチル3,4-ジヒドロイソキノリン-2(1H)-カルボキシレート;
1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチルピペリジン-1-カルボキシレート;
1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチルモルホリン-4-カルボキシレート;
1-tert-ブチル4-(1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチル)ピペラジン-1,4-ジカルボキシレート;および、
1-(ジシクロヘキシルカルバモイルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレート。
【0076】
発明の概要で上述した式(I)で表される化合物のうち、別の実施形態は、
R1が、-O-R3-N(R5)R6であり;
R3が、場合により置換されていてもよいアルキレン鎖であり;
R5が、水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリールまたは場合により置換されていてもよいアラルキルであり;
R6が、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアラルキルまたは-R3-C(O)OR4であり;また、
あるいは、任意のR5およびR6が、これらが両方とも結合されている窒素と一緒になって、場合により置換されていてもよいN-ヘテロシクリルまたは場合により置換されていてもよいN-ヘテロアリールを形成している
式(I)で表される化合物である。
【0077】
この実施形態のうち、一実施形態は、次のものから選択される式(I)で表される化合物である:
2-(ジメチルアミノ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-モルホリノエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;または、
3-モルホリノプロピル5-(テトラデシルオキシ)フラン-2-カルボキシレート。
【0078】
発明の概要で上述した式(I)で表される化合物のうち、別の実施形態は、
R1が-O-R3-N(R4)C(O)OR5であり;
R3が場合により置換されていてもよいアルキレン鎖であり;
R4が場合により置換されていてもよいアルキル、場合により置換されていてもよいアリール、場合により置換されていてもよいアラルキル、場合により置換されていてもよいヘテロアリールまたは場合により置換されていてもよいヘテロアリールアルキルであり;
R5が水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリールまたは場合により置換されていてもよいアラルキルである
式(I)で表される化合物である。
【0079】
発明の概要で上述した式(I)で表される化合物のうち、別の実施形態は、
R1が-O-R3-C(O)OR5であり;
R3が場合により置換されていてもよいアルキレン鎖であり;
R5が水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリールまたは場合により置換されていてもよいアラルキルである
式(I)で表される化合物である。
【0080】
発明の概要で上述した式(I)で表される化合物のうち、別の実施形態は、
R1が-O-R3-C(O)N(R5)R6であり;
R3が場合により置換されていてもよいアルキレン鎖であり;
R5が水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリールまたは場合により置換されていてもよいアラルキルであり;
R6がアルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアラルキルまたは-R3-C(O)OR4であるか;あるいは、
R5およびR6が、これらが両方とも結合されている窒素と一緒になって、場合により置換されていてもよいN-ヘテロシクリルまたは場合により置換されていてもよいN-ヘテロアリールを形成している
式(I)で表される化合物である。
【0081】
この実施形態のうち、一実施形態は、次のものから選択される式(I)で表される化合物である:
2-(ベンジル(メチル)アミノ)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
tert-ブチル4-(2-(5-テトラデシルオキシ)フラン-2-カルボニルオキシ)アセチル)ピペラジン-1-カルボキシレート;
2-(ジシクロヘキシルアミノ)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-(4-シクロヘキシルピペラジン-1-イル)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-オキソ-2-(4-フェニルピペラジン-1-イル)エチル-5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-((2-エトキシ-2-オキソエチル)(メチル)アミノ)-2-オキソエチル5-テトラデシルオキシ)フラン-2-カルボキシレート;
2-オキソ-2-(ピペリジン-1-イル)エチル-5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-モルホリノ-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-(3,4-ジヒドロイソキノリン-2(1H)-イル)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;および、
(S)-ベンジル1-(2-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)アセチル)ピロリジン-2-カルボキシレート。
【0082】
発明の概要で上述した式(I)で表される化合物のうち、別の実施形態は、
R1が-N(R5)S(O)2-R4であり;
R4が場合により置換されていてもよいアルキル、場合により置換されていてもよいアリール、場合により置換されていてもよいアラルキル、場合により置換されていてもよいヘテロアリールまたは場合により置換されていてもよいヘテロアリールアルキルであり;
R5が独立して、水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリールまたは場合により置換されていてもよいアラルキルである
式(I)で表される化合物である。
【0083】
この実施形態のうち、一実施形態は、5-(テトラデシルオキシ)-N-トシルフラン-2-カルボキサミドである、式(I)で表される化合物である。
【0084】
発明の概要で上述した医薬組成物のうち、一実施形態は、医薬組成物が、皮膚科学的に有効な量の式(I)で表される化合物またはその製薬上許容可能な塩と、皮膚科学的に許容可能な添加剤とを含む皮膚用組成物であるものである。
【0085】
別の実施形態は、皮膚用組成物がゲル製剤、アルコール性ゲル製剤、ヒドロアルコール性ゲル製剤またはクリーム剤であるものである。
【0086】
別の実施形態は、医薬組成物が、皮膚科学的に有効な量の式(I)で表される化合物またはその製薬上許容可能な塩と、皮膚科学的に許容可能な添加剤とを含む経口組成物であるものである。
【0087】
発明の概要で上述した皮脂腺機能亢進を特徴とする皮膚疾患または病変のあるヒトの治療方法のうち、この方法の一実施形態は、皮膚疾患または病変が、尋常性座瘡、集簇性座瘡、クロール座瘡(choracne)、酒さ、酒さ鼻、脂漏、脂漏性皮膚炎、皮脂腺肥厚、マイボーム腺機能不全の顔面酒さ、細胞分裂促進性脱毛、および脂性肌からなる群から選択されるものである。
【0088】
この方法の別の実施形態は、皮膚疾患が座瘡であるものである。
【0089】
この方法の別の実施形態は、皮膚疾患が脂性肌であるものである。
【0090】
この方法の別の実施形態は、治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩を局所投与するものである。
【0091】
この方法の別の実施形態は、治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩を全身投与するものである。
【0092】
この方法の別の実施形態は、治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩を経口投与するものである。
【0093】
発明の概要で上述した皮脂腺機能亢進を特徴とする皮膚疾患または病変のあるヒトの治療方法のうち、本方法の一実施形態は、皮膚疾患または病変が、尋常性座瘡、集簇性座瘡、クロール座瘡(choracne)、酒さ、酒さ鼻、脂漏、脂漏性皮膚炎、皮脂腺肥厚、マイボーム腺機能不全の顔面酒さ、細胞分裂促進性脱毛、および脂性肌からなる群から選択されるものである。
【0094】
この方法の別の実施形態は、皮膚疾患が座瘡であるものである。
【0095】
この方法の別の実施形態は、皮膚疾患が脂性肌であるものである。
【0096】
この方法の別の実施形態は、治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩を局所投与するものである。
【0097】
この方法の別の実施形態は、治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩を全身投与するものである。
【0098】
この方法の別の実施形態は、治療上有効な量の上述した式(I)で表される化合物またはその製薬上許容可能な塩を経口投与するものである。
【0099】
この方法の別の実施形態は、医薬組成物が皮膚用組成物であり、製薬上許容可能な添加剤が皮膚科学的に許容可能な添加剤であるものである。
【0100】
この方法の別の実施形態は、医薬組成物が全身用組成物であるものである。
【0101】
この方法の別の実施形態は、医薬組成物が経口用組成物であるものである。
【0102】
ヒトにおける皮脂腺活性の抑制方法であって、治療上有効な量の発明の概要で上述した式(I)で表される化合物またはその製薬上許容可能な塩を、それを必要とするヒトに投与することを含む方法のうち、この方法の一実施形態は、治療上有効な量を局所投与するものである。
【0103】
この方法の別の実施形態は、治療上有効な量を全身投与するものである。
【0104】
この方法の別の実施形態は、治療上有効な量を経口投与するものである。
【0105】
ヒトにおける皮脂腺活性の抑制方法であって、発明の概要で上述した、治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩と、製薬上許容可能な添加剤を含む医薬組成物を、それを必要とするヒトに投与することを含む方法のうち、この方法の一実施形態は、上述の治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩を局所投与するものである。
【0106】
この方法の別の実施形態は、医薬組成物を全身投与するものである。
【0107】
この方法の別の実施形態は、医薬組成物を経口投与するものである。
【0108】
この方法の別の実施形態は、医薬組成物が皮膚用組成物であり、製薬上許容可能な添加剤が皮膚科学的に許容可能な添加剤であるものである。
【0109】
この方法の別の実施形態は、医薬組成物が全身用組成物であるものである。
【0110】
この方法の別の実施形態は、医薬組成物が経口用組成物であるものである。
【0111】
発明の概要で上述した皮脂腺機能亢進を特徴とする皮膚疾患または病変のあるヒトの治療方法のうち、この方法の一実施形態は、疾患または病変が炎症性座瘡であるものである。
【0112】
この方法の別の実施形態は、治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩を局所投与するものである。
【0113】
この方法の別の実施形態は、治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩を全身投与するものである。
【0114】
この方法の別の実施形態は、治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩を経口投与するものである。
【0115】
この法の別の実施形態は、医薬組成物が皮膚用組成物であり、製薬上許容可能な添加剤が皮膚科学的に許容可能な添加剤であるものである。
【0116】
この方法の別の実施形態は、医薬組成物を全身投与するものである。
【0117】
この方法の別の実施形態は、医薬組成物を経口投与するものである。
【0118】
発明の概要で上述した、炎症を特徴とする疾患または病変をもつヒトのT細胞増殖およびサイトカイン分泌の低減方法のうち、この方法の一実施形態は、疾患または病変が炎症性座瘡であるものである。
【0119】
この方法の別の実施形態は、治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩を全身投与するものである。
【0120】
この方法の別の実施形態は、治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩を全身投与するものである。
【0121】
この方法の別の実施形態は、治療上有効な量の式(I)で表される化合物またはその製薬上許容可能な塩を経口投与するものである。
【0122】
この方法の別の実施形態は、医薬組成物が皮膚用組成物であり、製薬上許容可能な添加剤が皮膚科学的に許容可能な添加剤であるものである。
【0123】
この方法の別の実施形態は、医薬組成物が全身用組成物であるものである。
【0124】
この方法の別の実施形態は、医薬組成物が経口用組成物であるものである。
【0125】
発明の有用性
皮脂腺機能亢進による皮脂産生の増加は、一般に、座瘡病因の引き金になっていると考えられているいくつかの要因の1つである。皮脂形成において、特異的上皮細胞型である脂腺細胞の段階的分化があり、それは基本始原細胞から発生し脂質形成細胞に至る。これらの細胞は腺排出口の方向へ向かう。大きくなったこれらの細胞は最終的に破裂し(ホロクリン分泌)、その脂質濃厚内容物(皮脂)が放出される。皮脂の全体的構成は、スクアレン(12%)、コレステロール(2%)、ワックスエステル(26%)およびジグリセリド/トリグリセリド/遊離脂肪酸(57%)からなる(Zouboulis et al., "An oral 5-lipoxygenase inhibitor, directly reduces sebum production". Dermatology. (2005) 210:36-38)を参照されたい)。遊離脂肪酸レベルは、皮脂内に存在するジグリセリドおよびトリグリセリドの細菌分解により増加し得る(Thiboutot D. "Regulation of human sebaceous glands" J. Invest Dermatol. (2004) 123:1-12を参照されたい)。
【0126】
また遊離脂肪酸は、局所免疫細胞の活性化により座瘡の炎症性様相を促し、それらの様々な炎症誘発因子の放出を促進し得る。
【0127】
脂肪酸合成は、アセチルCoAからマロニルCoAへのカルボキシル化で始まる。この不可逆反応は、脂肪酸合成での関与段階(committed step)である。マロニルCoAの合成は、アセチルCoAカルボキシラーゼ(ACC)により触媒される(Brownsey, R.W. et al., "Regulation of acetyl-CoA carboxylase", Biochem Soc. Trans. (2006) 34: 223-227を参照されたい)。ACCは2種の組織特異的アイソフォーム、すなわち、単鎖265kDaタンパク質(ACC1)および280kDaタンパク質(ACC2)として存在する(Waldrop, G.L. et al., "Targeting acetyl-CoA carboxylase for anti-obesity therap, " Curr. Med. Chem. - Immun., Endoc. & Metab. Agents (2002) 3: 229-234を参照されたい)。
【0128】
哺乳動物細胞において、ACC1は細胞質ゾル内に存在するが、ACC2はミトコンドリアに局在している。一般に、ACC1は長鎖脂肪酸合成の役割を担うが、ミトコンドリアACC2は脂肪酸酸化を抑制するよう作用する。ACCアイソフォームの発現は組織特異的であり、ホルモンおよび栄養状態に応答する。ACC1は、脂質合成組織において、特に脂肪、肝臓および乳腺においてハイレベルで発現される。ACC2は肝臓ACCの微量成分であり、また、心臓および骨格筋で比較的低レベルではあるが発現される重要なアイソフォームである。ACCアイソフォーム発現パターンはまだ報告されていないが、活性ACCがヒト皮脂腺中に存在していることが明らかになっている(Smythe, C.D. et al., "The activity of HMG-CoA reductase and acetyl-CoA carboxylase in human apocrine sweat glands, sebaceous glands, and hair follicles is regulated by phosphorylation and by exogenous cholesterol, " J. Invest. Dermatol. (1998) 111:139-148を参照されたい)。ACCおよび他の脂肪酸およびコレステロール合成制御酵素は、思春期における皮脂産生増大と座瘡の発現に関与する主要因のアンドロゲンによって確実に制御されることが判明している(Rosignoli, C. et al., "Involvement of the SREBP pathway in the mode of action of androgens in sebaceous glands in vivo", Exp. Dermatol. (2003) 12:480-489を参照されたい)。
【0129】
またACCは、細菌の脂肪酸合成における第1の関与・制御段階も触媒する。細菌増殖にとって膜脂質生合成は必須であるため、ACC活性の阻害は、面皰内に通常存在する細菌の増殖を減少させる可能性がある。
【0130】
長鎖(炭素16〜20個)脂肪酸アシル-CoAチオエステルは、哺乳類ACCの有効な生理学的最終産物阻害剤であることが明らかとなった。
【0131】
TOFA (5-(テトラデシルオキシ)-2-フランカルボン酸)は、以下の構造:
【化4】

【0132】
を有する公知の脂質低下化合物である。
【0133】
TOFAおよびその製薬上許容可能な塩は、米国特許第4,110,351号に開示および請求されている(その開示は参照により完全に本明細書に組み入れるものとする)。TOFAは、ラットおよびサルの双方で血漿トリグリセリドレベルを下げることが確認された(例えば、Parker, R.A. et al., J. Med. Chem. (1977), Vol. 20, pp. 781-791を参照)。また、肝臓脂肪酸合成を阻害することも確認されている(例えば、Ribereau-Gayon, G. , FEBS Lett. (1976), Vol. 62, No. 309-312; Panek, E. et al., Lipids (1977), Vol. 12, pp. 814-818; Kariya, T. et al., Biochem. Biophys. Res. Commun. (1978), Vol. 80, pp. 1022-1024; およびHarris, R.A. et al., Hormones and Energy Metabolism (Klachko, D.M. et al., eds.), Vol. III, pp. 17-42を参照されたい)。
【0134】
TOFAは、細胞内でそのアシルCoAチオエステルに変換された場合、ACCの生理学的最終産物阻害剤である長鎖脂肪酸アシル-CoAに似た機序によりACC活性を阻害する(McCune, S.A. et al., J. Biol. Chem. (1979), Vol. 254, No. 20., pp. 10095-10101を参照されたい)。TOFAは、脂肪酸ミメティックとして、皮脂産生を低減し、治療部位での病原細菌の増殖に作用し得ることにより、皮脂腺疾患に多重効果を及ぼすことができる。
【0135】
皮脂腺機能亢進を抑制するためにTOFAを使用する方法、並びに、座瘡および炎症の治療においてTOFAを使用する方法は公知である。例えば、PCT公表特許公報第WO 2008/058034を参照されたい。
【0136】
本発明の化合物のようなTOFA類似体は、本明細書で皮脂腺活性の有効な抑制剤として開示されており、したがって、座瘡などの皮脂腺機能亢進を特徴とする皮膚疾患または病変のある哺乳動物(好ましくはヒト)の治療に有用である。また本明細書に記載のTOFA類似体は、T細胞増殖およびサイトカイン分泌を低減させることにより、炎症を特徴とする疾患または病変のある哺乳動物の治療に有用であり得る。
【0137】
本発明の化合物の調製
以下の反応スキームは、立体異性体として、またはその混合物としての、本発明の化合物、すなわち、式(I)で表される化合物:
【化5】

【0138】
(式中、R1は、発明の概要において上で定義した通りである)
またはその製薬上許容可能な塩の調製方法を示す。
【0139】
以下の記載においては、記載した式の置換基および/または可変部分の組み合わせは、こうした提案により安定性のある化合物が得られる場合のみ認められ得るものと理解されたい。
【0140】
また、下に記載の方法において、中間体化合物の官能基が好適な保護基で保護される必要があり得ることも当業者には十分に理解されよう。こうした官能基としては、ヒドロキシ、アミノ、メルカプトおよびカルボン酸を挙げることができる。ヒドロキシに適する保護基としては、トリアルキルシリルまたはジアリールアルキルシリル(例えば、t-ブチルジメチルシリル、t-ブチルジフェニルシリルまたはトリメチルシリル)、テトラヒドロピラニル、ベンジルなどを挙げることができる。アミノ、アミジノおよびグアニジノに適する保護基としては、t-ブトキシカルボニル、ベンジルオキシカルボニルなどが挙げられる。メルカプトに適する保護基としては、-C(O)-R’’(式中、R’’はアルキル、アリールまたはアラルキルである)、p-メトキシベンジル、トリチルなどが挙げられる。カルボン酸に適する保護基としては、アルキル、アリールまたはアリールアルキルエステルが挙げられる。
【0141】
保護基は標準技術に従って付加し、または除去することができるが、それは当業者には周知であり、また本明細書に記載されている通りである。
【0142】
保護基の使用については、Greene, T.W. and P.G.M. Wuts, Protective Groups in Organic Synthesis (2006), 4th Ed., Wileyに詳細に記載されている。また保護基は、Wang樹脂または2-クロロトリチル-クロリド樹脂などの高分子樹脂であってもよい。
【0143】
当業者には、本発明の化合物を反応スキームの下に記載した1つと同様の方法により、または当業者に公知の方法により製造することができることは理解されよう。また当業者は、適切な出発成分を使用し、必要とされる合成パラメーターを変更することによって、下記に詳細に説明してはいない本発明の他の化合物を、以下に記載の方法と同様にして製造することができることも理解するであろう。一般的に、出発成分は、Sigma Aldrich, Lancaster Synthesis, Inc., Maybridge, Matrix Scientific, TCI, およびFluorochem USAなどの提供元から得ることが可能であるか、当業者に公知の情報により合成可能であるか(例えば、Smith, M.B. and J. March, Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 5th edition (Wiley, December 2000)を参照)、本明細書に記載のように調製することができる。TOFAは、例えば、Cedarlane Laboratories, Inc.から入手することができる。
【化6】

【0144】
本発明の化合物は、反応スキーム1(式中、R2、R4およびR5は、それぞれ、発明の概要において上で記載した通りである)に記載のようにして、5-(テトラデシルオキシ)フラン-2-カルボン酸(TOFA)のカルボン酸基を好適な試薬(例えば、特に限定されるものではないが、塩化オキサリル、塩化チオニル、無水酢酸、トリフルオロ酢酸無水物、トルエンスルホニルクロリド、ヒドロキシスクシンアミド、ヒドロキシベンゾトリアゾール、ジシクロヘキシルカルボジイミド、またはカルボニルジイミダゾールなど)で活性化することにより調製することができる。活性化された酸化合物は、一般に、0℃〜周囲温度で調製され、単離することができるか、あるいは、塩基(トリエチルアミン、ピリジンなど)の存在下で好適なアルコールまたはスルホンアミドを用いてin situで反応させることができる。生成物は、反応物から、標準技術(例えば、溶媒抽出法、クロマトグラフィー、結晶化、蒸留など)を用いて、単離し精製することができる。
【化7】

【0145】
また本発明の化合物は、反応スキーム2(式中、R2、R3、R5およびR6は、それぞれ、発明の概要において上述した通りである)に概説したように調製することもできる。TOFAは、好適な脱離基を有するアルキル化剤(ハロゲン化物、トリフレート、トシルレート、メシレートなど)(市販品を購入するか、当技術分野で公知の技術を使用し調製したもの)を、好適な塩基(例えば、特に限定されるものではないが、炭酸カリウム、炭酸セシウム、テトラブチルアンモニウム水酸化物、トリエチルアミンなど)の存在下で反応させることができる。この反応は、N,N-ジメチルホルムアミドなどの好適な溶媒中で行なうことが可能であり、通常、周囲温度〜70℃の温度で実施される。生成物は、反応物から、標準技術(例えば、溶媒抽出法、クロマトグラフィー、結晶化、蒸留など)を用いて、単離し精製することができる。
【化8】

【0146】
本発明の化合物は、反応スキーム3において上で示したようにして調製することもできる。TOFAは、2種の好適な脱離基を含有するリンカー(ハロゲン化物、トリフレート、トシレート、メシレートなど)と反応させることができる。第1の反応は、上記の反応スキーム2に示したように行なわれる。次いで、この反応の生成物を好適な求核試薬(例えば、特に限定されるものはないが、アミン類(上記に示したもの)、アルコール類またはフェノール類など)と、DMFまたはTHFなどの好適な溶媒中で反応させる。一般に、この反応は、好適な塩基(これは、テトラブチルアンモニウム水酸化物、過剰のアミン求核試薬、トリエチルアミンなどであってもよい)の存在下で、12時間、周囲温度で行なわれる。生成物は、反応物から、標準技術(例えば、溶媒抽出法、クロマトグラフィー、結晶化、蒸留など)を用いて、単離し精製することができる。
【0147】
場合によっては、上記に示した反応スキームの最終生産物は、例えば、置換操作によって、さらに変化させることができる。これらの操作としては、本発明の化合物の調製に必要とされる場合、特に限定されるものではないが、酸化、還元、アルキル化、アシル化および加水分解などが挙げられる。こうした操作は、有機化学分野の当業者にとっては周知である。またこれらの操作は、T. W. Greene and P. G. M. Wuts, "Protective Groups in Organic Synthesis", Second Edition, John Wiley and Sons, New York, 1991で概説されている方法により、保護基(例えば、Boc基、テトラヒドロピラン基など)の除去を含んでいてもよい。
【0148】
遊離塩基または酸の形態で存在する、上記および下記で調製した本発明の全ての化合物は、当業者に公知の方法に従い、適切な無機または有機の塩基または酸を用いた処理を行うことにより、それらの製薬上許容可能な塩に変換することができる。本明細書で調製した化合物の塩は、当業者に公知の標準技術によって、それらの遊離塩基または酸に変換させることができる。
【0149】
式(I)で表される化合物の調製に関する以下の合成実施例は、本発明の実施を補佐するための例示として記載されているが、本発明の範囲を限定することを意図するものではない。質量分析計試料は、シングルMSモードで操作するエレクトロスプレーイオン化MicroMass 質量分析計で分析した。試料は、クロマトグラフィーを使用し、質量分析計へ導入した。1H NMRスペクトルは、Bruker社製装置を使用して400MHzで記録するか、Varian社製装置を使用して300MHzで記録した。元素分析は、Canadian Microanalytical Ltd., Delta, BC, Canadaにより実施した。
【実施例】
【0150】
合成実施例1
2,2,2-トリフルオロエチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化9】

【0151】
5-(テトラデシルオキシ)フラン-2-カルボン酸(1.3g、4.0mmol)を含むCH2Cl2(40mL)の撹拌した室温懸濁液に、N,N'-ジシクロヘキシルカルボジイミド(0.990g、4.8mmol)、N,N-ジメチルアミノピリジン(0.488g、4.0mmol)および2,2,2-トリフルオロエタノール(0.875mL、12.0mmol)を加えた。フラスコにキャップし、撹拌を16時間継続した。その時間で、TLC(ヘキサン中10%EtOAc、Rf=0.05(SM)および0.25(Prod))は出発物質が完全に消費されたことを示した。得られた懸濁液をCH2Cl2(40mL)で希釈し、濾過し濃縮した。この粗製物質は、ヘキサン中5〜20%EtOAcで溶出するフラッシュクロマトグラフィーにより精製した。さらに、得られた固体は、加熱2-プロパノール30mL中で最小量の水を加えて再結晶化することにより精製し、白色針状物として1.13g(70%)の表題化合物を得た。MS (m/z, ES-): 406.0 (M-1, 100%); EA C23H36F3NO2に対する実測値: C: 62.20, H: 8.18; 計算値: C: 62.05, H: 8.18; 1H NMR (400 MHz, DMSO-d6) δ: 7.4 (d, 1H), 5.7 (d, 1H), 4.9 (q, 2H), 4.2 (t, 2H), 1.50-1.57 (m, 2H), 1.10-1.20 (m, 22H), 0.85 (t, 3H)。
【0152】
合成実施例2
2,2,2-トリクロロエチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化10】

【0153】
表題化合物は、実施例1で記載したようにして、0.228g(0.7mmol)の5-(テトラデシルオキシ)フラン-2-カルボン酸と0.196mL(2.04mmol)の2,2,2-トリクロロエタノールから出発し調製した。1H NMR (400 MHz, DMSO-d6) δ: 7.4 (d, 1H), 5.74 (d, 1H), 5.03 (s, 2H), 4.19 (t, 2H), 1.7 (p, 2H), 1.2-1.5 (m, 22H), 0.85 (t, 3H)。
【0154】
合成実施例3
イソプロピル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化11】

【0155】
表題化合物は、実施例1で記載したようにして、0.228g(0.7mmol)の5-(テトラデシルオキシ)フラン-2-カルボン酸および0.161mL(2.1mmol)の2-プロパノールから出発し調製した。MS (m/z, ES+): 366.30 (M+, 100%); 1H NMR (400 MHz, DMSO-d6) δ: 7.2 (d, 1H), 5.6 (d, 1H), 5.0 (p, 1H), 4.1 (t, 2H), 1.7 (p, 2H), 1.3-1.4 (m, 2H), 1.23 (d, 6H), 1.2 (s, 20H), 0.85 (t, 3H)。
【0156】
合成実施例4
メチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化12】

【0157】
表題化合物は、実施例1で記載したようにして、0.228g(0.7mmol)の5-(テトラデシルオキシ)フラン-2-カルボン酸および0.083mL(2.1mmol)のメタノールから出発し調製した。MS (m/z, ES+): 339.34 (M+1, 100%)。
【0158】
合成実施例5
2-ブロモエチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化13】

【0159】
表題化合物は、実施例1で記載したようにして、0.228g(0.7mmol)の5-(テトラデシルオキシ)フラン-2-カルボン酸および0.150mL(2.1mmol)の2-ブロモエタノールから出発し調製した。MS (m/z, ES+): 446.30 (79BrM+1, 100%), 448.30 (81BrM+1, 80%); 1H NMR (400 MHz, DMSO-d6) δ: 7.30 (d, 1H), 5.67 (d, 1H), 4.49 (t, 2H), 4.16 (t, 2H), 3.73 (t, 2H), 1.72 (p, 2H), 1.3-1.45 (m, 2H), 1.25 (s, 20H), 0.85 (t, 3H); EA C21H35BrO4に対する実測値: C: 58.93, H: 8.52;計算値: C: 58.47, H: 8.18。
【0160】
合成実施例6
5-(テトラデシルオキシ)-N-トシルフラン-2-カルボキサミドの合成
【化14】

【0161】
表題化合物は、実施例1で記載したようにして、0.228g(0.7mmol)の5-(テトラデシルオキシ)フラン-2-カルボン酸および0.361g(2.1mmol)の4-メチルベンゼンスルホンアミドから出発し調製した。MS (m/z, ES-): 476.63 (M-1, 100%)。
【0162】
合成実施例7
(5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化15】

【0163】
5-(テトラデシルオキシ)フラン-2-カルボン酸(0.228g、0.70mmol)を含むDMF(4mL)の撹拌した室温溶液に、炭酸カリウム(0.146g、1.05mmol)および4-(ブロモメチル)-5-メチル-1,3-ジオキソール-2-オン(0.160g、0.84mmol)を加えた。反応容器にキャップし、撹拌を14時間継続した。その時間に、TLC(ヘキサン中20%EtOAc、Rf=0.10(SM)および0.40(Prod))は出発物質が完全に消費されたことを示した。この反応は、水(5mL)、飽和食塩水(5mL)およびEtOAc(30mL)を添加することによりクエンチした。この2相混合物を分液漏斗に移し、有機相を飽和食塩水で3回抽出した(3×10mL)。有機相を乾燥させ、濃縮して無色の油状物を得た。得られた粗製物質を、ヘキサン中5〜20%EtOAcで溶出するフラッシュクロマトグラフィーにより精製し、無色のシロップが得られ、これは静置により固化した。1H NMR (400 MHz, DMSO-d6) δ: 7.2 (d, 1H), 5.6 (d, 1H), 5.1 (s, 2H), 4.1 (t, 2H), 2.18 (s, 3H), 1.6-1.8 (m, 2H), 1.3-1.4 (m, 2H), 1.23 (d, 6H), 1.2 (s, 20H), 0.85 (t, 3H)。
【0164】
合成実施例8
1-(ベンジル(メチル)カルバモイルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化16】

【0165】
A.1-クロロエチルベンジル(メチル)カーバメート
N-メチルベンジルアミン(0.260mL、2mmol)を含むEtOAc(3mL)および3mLの飽和NaHCO3溶液の激しく撹拌した懸濁液に、1-クロロエチルクロロホルメート(0.160mL、2mmol)を加えた。起泡が認められた。気体の生成の終了時に、反応混合物をヘキサン(10mL)で希釈した。水相を除去し、有機相を飽和食塩水(5mL)で洗浄し、乾燥、濃縮したところ、油状物としての粗生成物が得られた(〜0.250g)。この化合物は、それ以上精製を行うことなく後続の工程で使用した。
【0166】
B. 1-(ベンジル(メチル)カルバモイルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレート
上記で調製した1-クロロエチルベンジル(メチル)カーバメートをN,N-ジメチルホルムアミド(5mL)中に溶解させ、次いで、5-(テトラデシルオキシ)フラン-2-カルボン酸(0.180g、0.544mmol)、テトラブチルアンモニウムヒドロキシドペンタハイドレード(0.209g、0.60mmol)、およびヨウ化ナトリウム(〜15mg)をこの反応容器に加えた。得られた懸濁液は、14時間撹拌しながら60℃に加熱した。反応溶液のHPLC解析は、全出発物質が低級極性生成物に変換されたことを示した。次いで、反応物を飽和食塩水(5mL)、水(5mL)およびEtOAc(70mL)でクエンチした。有機相を水(30mL)および飽和食塩水(30mL)で連続的に洗浄し、次いで、乾燥、濃縮した。得られた粗製物質をヘキサン中5〜20%のEtOAcで溶出するフラッシュクロマトグラフィーにより精製したところ、わずかに茶色の油状物として0.120g(43%)の表題化合物が得られた。1H NMR (300 MHz, CDCl3) δ: 7.15-7.40 (m, 6H), 7.05 (p, 1H), 5.30 (d, 1H), 4.40-4.60 (m, 2H), 4.10 (t, 2H), 2.85 (d, 3H) 1.7-1.9 (m, 2H), 1.79 (p, 2H), 1.55-1.62 (m, 3H), 1.18-1.50 (m, 22H), 0.89 (t, 3H)。
【0167】
合成実施例9
1-((2-エトキシ-2-オキソエチル)(メチル)カルバモイルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化17】

【0168】
表題化合物は、実施例8の工程1および工程2に記載のようにして、0.20mL(1.8mmol)の1-クロロエチルクロロホルメート、0.267g(1.8mmol)のサルコシンエチルエステルヒドロクロリドおよび4mLの飽和NaHCO3溶液から出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.18 (t, 1H), 6.98 (dq, 1H), 5.3 (d, 1H), 4.03-4.23 (m, 5H), 3.8-3.9 (m, 1H), 2.98 (s, 3H), 1.75 (p, 2H), 1.52-1.6 (m, 3H), 1.2-1.5 (m, 27H), 0.85 (t, 3H)。
【0169】
合成実施例10
(2S)-2-ベンジル1-(1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチル)ピロリジン-1,2-ジカルボキシレートの合成
【化18】

【0170】
表題化合物は、実施例8の工程1および工程2に記載のようにして、0.20mL(1.8mmol)の1-クロロエチルクロロホルメート、0.435g(1.8mmol)のL-ベンジルプロリンハイドロクロリドおよび4mLの飽和NaHCO3溶液から出発し調製した。この化合物は、2種のジアステレオマーの混合物として単離された。1H NMR (300 MHz, CDCl3) δ: 7.25-7.4 (m, 5H), 6.9-7.2 (m, 2H), 5.0-5.3 (m, 2H), 4.35-4.45 (m, 1H), 4.0-4.18 (m, 2H), 3.4-3.65 (m, 2H), 2.1-2.3 (m, 1H), 1.8-2.0 (m, 2H), 1.65-1.8 (m, 2H), 1.45-1.6 (m, 3H), 1.2-1.5 (m, 24H), 0.9 (t, 3H)。
【0171】
合成実施例11
1-(4-フェニルシクロヘキサンカルボニルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化19】

【0172】
表題化合物は、実施例8の工程1および工程2に記載のようにして、0.20mL(1.8mmol)の1-クロロエチルクロロホルメート、0.303g(1.8mmol)の1-フェニルピペラジンおよび4mLの飽和NaHCO3溶液から出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.25-7.35 (m, 2H), 7.20 (d, 1H, J = 4 Hz), 7.04 (q, 1H, J = 5 Hz), 6.85-6.95 (m, 3H), 5.30 (d, 1H, J = 4 Hz), 4.15 (app t, 2H, J = 3.5 Hz), 3.63 (br t, 4H), 3.18 (br s, 4H), 1.8 (p, 2H, J = 8 Hz), 1.60 (d, 3H, J = 6 Hz), 1.20-1.5 (m, 22H), 0.87 (t, 3H, J = 7 Hz)。
【0173】
合成実施例12
1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチル3-フェニルピロリジン-1-カルボキシレートの合成
【化20】

【0174】
表題化合物は、実施例8の工程1および工程2に記載のようにして、0.20mL(1.8mmol)の1-クロロエチルクロロホルメート、0.167g(1.8mmol)の3-フェニルピロリジンおよび4mLの飽和NaHCO3溶液から出発し調製した。この化合物は、4種のジアステレオマーの混合物として単離された。1H NMR (300 MHz, CDCl3) δ: 7.18-7.3 (m, 5H), 7.2 (q, 1H), 6.93 (d, 1H), 5.3 (d, 1H), 4.12 (t, 2H), 3.1-4.0 (m, 5H), 2.2-2.35 (m, 1H), 1.95-2.05 (m, 1H), 1.75 (t, 2H), 1.5-1.65 (m, 3H), 1.2-1.5 (m, 22H), 0.9 (t, 3H)。
【0175】
合成実施例13
1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチル3,4-ジヒドロイソキノリン-2(1H)-カルボキシレートの合成
【化21】

【0176】
表題化合物は、実施例8の工程1および工程2に記載のようにして、0.20mL(1.8mmol)の1-クロロエチルクロロホルメート、0.305g(1.8mmol)の1,2,3,4-テトラヒドロイソキノリンヒドロクロリドおよび4mLの飽和NaHCO3溶液から出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.0-7.2 (m, 6H), 5.3 (d, 1H), 4.6 (d, 2H), 4.1 (t, 2H), 3.6-3.75 (m, 2H), 2.8-2.87 (m, 2H), 1.75 (p, 2H), 1.5-1.62 (m, 3H), 1.2-1.5 (m, 22H), 0.9 (t, 3H)。
【0177】
合成実施例14
1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチルピペリジン-1-カルボキシレートの合成
【化22】

【0178】
表題化合物は、実施例8の工程1および工程2に記載のようにして、0.20mL(1.8mmol)の1-クロロエチルクロロホルメート、0.178mL(1.8mmol)のピペリジン、および4mLの飽和NaHCO3溶液から出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.18 (d, 1H), 6.98 (q, 1H), 5.3 (d, 1H), 4.08-4.18 (m, 2H), 3.38-3.42 (m, 4H), 1.5-1.8 (m, 33H), 0.89 (t, 3H)。
【0179】
合成実施例15
1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチルモルホリン-4-カルボキシレートの合成
【化23】

【0180】
表題化合物は、実施例8の工程1および工程2に記載のようにして、0.20mL(1.8mmol)の1-クロロエチルクロロホルメート、0.157mL(1.8mmol)のモルホリンおよび4mLの飽和NaHCO3溶液から出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.18 (d, 1H), 7.05 (q, 1H), 5.32 (d, 1H), 4.1 (t, 2H), 3.6-3.6 (m, 4H), 3.45-3.55 (m, 4H), 1.75 (p, 2H), 1.5-1.65 (m, 3H), 1.2-1.5 (m, 22H), 0.85 (t, 3H)。
【0181】
合成実施例16
1-tert-ブチル4-(1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチル)ピペラジン-1,4-ジカルボキシレートの合成
【化24】

【0182】
表題化合物は、実施例8の工程1および工程2に記載のようにして、0.20mL(1.8mmol)の1-クロロエチルクロロホルメート、0.335mg(1.8mmol)のtert-ブチル1-ピペラジンカルボキシレートおよび4mLの飽和NaHCO3溶液から出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.2 (d, 1H), 6.97 (q, 1H), 5.3 (d, 1H), 4.1 (t, 2H), 3.4 (br s, 8H), 1.75 (p, 2H), 1.5-1.6 (m, 3H) 1.5 (s, 9H), 1.2-1.5 (m, 22H), 0.9 (t, 3H)。
【0183】
合成実施例17
1-(ジシクロヘキシルカルバモイルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化25】

【0184】
表題化合物は、実施例8の工程1および工程2に記載のようにして、0.20mL(1.8mmol)の1-クロロエチルクロロホルメート、0.220mg(1.8mmol)のジシクロヘキシルアミンおよび3mLの飽和NaHCO3溶液から出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.1 (d, 1H), 7.0 (q, 1H), 5.3 (d, 1H), 4.05-4.15 (m, 2H), 3.6 (br s, 1H), 3.2 (br s, 1H), 1.65-1.8 (m, 10H), 1.55-1.65 (m, 11H), 1.2-1.5 (m, 24H), 1.0-1.2 (m, 2H), 0.8 (t, 3H)。
【0185】
合成実施例18
2-(ジメチルアミノ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化26】

【0186】
0℃でTHF中に溶解した2-ブロモエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート(0.186g、0.43mmol)(実施例5で調製したもの)の溶液に、撹拌しながらジメチルアミン(THF中の2M溶液の1mL、2.15mmol)を加えた。この溶液を撹拌しながら室温まで温め、12時間継続した。この時間に、反応は濃縮乾固された。この粗製物質を、酢酸エチルを含むヘキサン(5〜35%)で溶出するフラッシュクロマトグラフィーにより精製し、ろう状の無色固体として0.121g(71%)の表題化合物を得た。MS (m/z, ES+): 396.29 (M+1, 100%); 1H NMR (400 MHz, DMSO-d6) δ: 7.2 (d, 1H), 5.6 (d, 1H), 4.23 (t, 2H), 4.13 (t, 2H), 2.53 (t, 2H), 2.18 (s, 6H), 1.7 (p, 2H), 1.2-1.5 (m, 22H), 0.85 (t, 3H)。
【0187】
合成実施例19
3-モルホリノプロピル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化27】

【0188】
A. 3-クロロプロピル5-(テトラデシルオキシ)フラン-2-カルボキシレート
5-(テトラデシルオキシ)フラン-2-カルボン酸(0.650g、2.0mmol)を含む10mLのN,N-ジメチルホルムアミドの激しく撹拌した懸濁液に、3-クロロブロモプロパン(0.618mL、6.0mmol)、テトラブチルアンモニウム水酸化物ペンタハイドレート(0.734g、4.2mmol)およびヨウ化ナトリウム(〜20mg)を加えた。この懸濁液は、短時間で溶液の状態になるように見えた。その後、非常に細かく分散した白色沈殿物が認められた。この反応物を12時間撹拌した。次いで、懸濁液をEtOAc(100mL)、飽和食塩水(50mL)および水(50mL)で希釈した。これらの相を分離させ、有機相を水(50mL)および飽和食塩水(50mL)で洗浄した。次いで、有機相を乾燥させ、濃縮したところ、0.554gの表題化合物が得られた。この物質は、それ以上精製することなく後続の工程で使用した。
【0189】
B. 3-(ピペリジン-1-イル)プロピル5-(テトラデシルオキシ)フラン-2-カルボキシレート
上記で調製した3-クロロプロピル5-(テトラデシルオキシ)フラン-2-カルボキシレート(0.272g、0.68mmol)を含む6mLのN,N-ジメチルホルムアミドの溶液に、モルホリン(0.535mL、6.1mmol)およびヨウ化ナトリウム(10mg)を加えた。得られた溶液を36時間、55℃で撹拌した。この時間で、反応混合物のHPLC解析は、出発物質がほぼ完全に消費されたことを示した。この溶液をEtOAc(30mL)、飽和食塩水(10mL)および水(10mL)で希釈し、両方の相が透明な溶液となった。これらの相を分離させ、有機相を水(20mL)および飽和食塩水(20mL)で洗浄し、次いで、乾燥、濃縮した。粗製物質をヘキサン中5〜40%EtOAcで溶出するフラッシュクロマトグラフィーにより精製したところ、0.217gの表題化合物が得られた。1H NMR (300 MHz, CDCl3) δ: 7.10 (d, 1H), 5.30 (d, 1H), 4.30 (t, 2H), 4.10 (t, 2H), 3.7 (t, 4H), 2.40-2.50 (m, 6H), 1.90 (p, 2H), 1.76 (p, 2H), 1.18-1.50 (m, 22H), 0.89 (t, 3H)。
【0190】
合成実施例20
2-(ベンジル(メチル)アミノ)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化28】

【0191】
A. N-ベンジル-2-クロロ-N-メチルアセトアミド
N-メチルベンジルアミン(0.260mL、2mmol)を含むEtOAc(3mL)および3mLの飽和NaHCO3溶液の激しく撹拌した懸濁液に、クロロアセチルクロリド(0.160mL、2mmol)を添加した。起泡が認められた。気体生成が終わったら、反応混合物をヘキサン(10mL)で希釈した。これらの相を分離させ、有機相を飽和食塩水(5mL)で洗浄し、乾燥、濃縮したところ、油状物として表題化合物〜0.250gが得られた。この粗製物質は、それ以上精製を行うことなく後続の工程で使用した。
【0192】
B. 2-(ベンジル(メチル)アミノ)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート
上記で調製したN-ベンジル-2-クロロ-N-メチルアセトアミド(0.250g)をN,N-ジメチルホルムアミド10mL中に溶解した。この溶液に、5-(テトラデシルオキシ)フラン-2-カルボン酸(0.180g、0.544mmol)、テトラブチルアンモニウム水酸化物ペンタハイドレード(0.209g、0.554mmol)、およびヨウ化ナトリウム(〜15mg)を添加した。この懸濁液は、14時間撹拌しながら60℃に加熱した。反応物を飽和食塩水(5mL)、水(5mL)およびEtOAc(40mL)でクエンチした。これらの相を分離させ、さらに有機相をEtOAc(30mL)で希釈し、水(30mL)および飽和食塩水(30mL)で連続的に洗浄し、次いで、乾燥、濃縮した。得られた粗製物質をヘキサン中5〜20%EtOAcで溶出するフラッシュクロマトグラフィーにより精製し、粘性の油状物として所望の化合物を得た。この物質はさらに2-プロパノールおよび水から再結晶化により精製し、0.130g(52%)の表題化合物を得た。1H NMR (300 MHz, CDCl3) δ: 7.20-7.40 (m, 6H), 5.30-5.35 (m, 1H), 4.92 (s, 2H), 4.50-4.61 (app d, 2H), 4.10 (m, 2H), 2.90-2.98 (app d, 3H), 1.79 (p, 2H), 1.18-1.50 (m, 22H), 0.89 (t, 3H)。
【0193】
合成実施例21
tert-ブチル4-(2-(5-テトラデシルオキシ)フラン-2-カルボニルオキシ)アセチル)ピペラジン-1-カルボキシレートの合成
【化29】

【0194】
表題化合物は、工程1の反応混合物をヘキサンではなくEtOAcで希釈することを除いては、実施例20の工程1および工程2に記載のようにして、0.373g(2.0 mmol)のtert-ブチル1-ピペラジンカルボキシレート(2.0mmol)および0.160mL(2mmol)のクロロアセチルクロリドから出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.22 (d, 1H), 5.3 (d, 1H), 4.85 (s, 2H), 4.15 (t, 2H), 3.55-3.65 (m, 2H), 3.4-3.52 (m, 6H), 1.75 (p, 2H), 1.45 (s, 9H), 1.2-1.5 (m, 22H), 0.8 (t, 3H)。
【0195】
合成実施例22
2-(ジシクロヘキシルアミノ)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化30】

【0196】
表題化合物は、工程1の反応混合物をヘキサンではなくEtOAcで希釈することを除いては、実施例20の工程1および工程2に記載のようにして、0.244mL(2.0mmol)のジシクロヘキシルアミンおよび0.160mL(2mmol)のクロロアセチルクロリドから出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.2 (d, 1H), 5.3 (d, 1H), 4.8 (s, 2H), 4.1-4.18 (m, 2H), 3.22 (t, 2H), 2.9-3.05 (m, 2H), 2.3-2.5 (m, 2H), 1.1-1.9 (m, 40H), 0.83 (t, 3H)。
【0197】
合成実施例23
2-(4-シクロヘキシルピペラジン-1-イル)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化31】

【0198】
表題化合物は、工程1の反応混合物をヘキサンではなくEtOAcで希釈することを除いては、実施例20の工程1および工程2に記載のようにして、0.337g(2.0mmol)の1-シクロヘキシルピペラジンおよび0.160mL(2mmol)のクロロアセチルクロリドから出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.22 (d, 1H), 5.3 (d, 1H), 4.9 (s, 2H), 4.1 (t, 2H), 3.6 (t, 2H), 3.4 (t, 2H), 2.57 (p, 4H), 2.2-2.35 (m, 1H), 1.5-1.8 (m, 6H), 1.2-1.5 (m, 28H), 0.83 (t, 3H)。
【0199】
合成実施例24
2-オキソ-2-(4-フェニルピペラジン(piperzin)-1-イル)エチル-5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化32】

【0200】
表題化合物は、工程1の反応混合物をヘキサンではなくEtOAcで希釈することを除いては、実施例20の工程1および工程2に記載のようにして、0.324g(2.0mmol)の1-フェニルピペラジンおよび0.160mL(2mmol)のクロロアセチルクロリドから出発し調製した。表題化合物は、さらにイソプロパノールおよび水からの再結晶化により精製した。1H NMR (300 MHz, CDCl3) δ: 7.23-7.35 (m, 4H), 6.9 (d, 2H), 5.34 (d, 1H), 4.95 (s, 2H), 4.13 (t, 2H), 3.78-3.82 (m, 2H), 3.69-3.63 (m, 2H), 3.15-3.25 (m, 4H), 1.75 (p, 2H), 1.2-1.5 (m, 22H), 0.86 (t, 3H)。
【0201】
合成実施例25
2-((2-エトキシ-2-オキソエチル)(メチル)アミノ)-2-オキソエチル5-テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化33】

【0202】
表題化合物は、工程1の反応混合物をヘキサンではなくEtOAcで希釈することを除いては、実施例20の工程1および工程2に記載のようにして、0.307g(2.0mmol)のサルコシンエチルエステルヒドロクロリドおよび0.160mL(2mmol)のクロロアセチルクロリドから出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.23 (d, 1H), 5.32 (d, 1H), 4.95 and 4.8 (2s (回転異性体), 2H), 4.05-4.25 (m, 6H), 3.1 and 3.0 (2s (回転異性体), 3H), 1.75 (p, 2H), 1.2-1.5 (m, 25H), 0.9 (t, 3H)。
【0203】
合成実施例26
2-オキソ-2-(ピペリジン-1-イル)エチル-5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化34】

【0204】
表題化合物は、工程1の反応混合物をヘキサンではなくEtOAcで希釈することを除いては、実施例20の工程1および工程2に記載のようにして、0.198mL(2.0mmol)のピペリジンおよび0.160mL(2mmol)のクロロアセチルクロリドから出発し調製した。工程2で単離した粗製物質は、イソプロパノールからの再結晶化により精製した。1H NMR (300 MHz, CDCl3) δ: 7.22 (d, 1H), 5.35 (d, 1H), 4.87 (s, 2H), 4.15 (t, 2H), 3.55-3.6 (m, 2H), 3.3-3.4 (m, 2H), 1.75 (p, 2H), 1.5-1.7 (m, 6H), 1.2-1.5 (m, 22H), 0.9 (t, 3H)。
【0205】
合成実施例27
2-モルホリノ-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化35】

【0206】
表題化合物は、工程1の反応混合物をヘキサンではなくEtOAcで希釈することを除いては、実施例20の工程1および工程2に記載のようにして、0.157mL(2.0mmol)のモルホリンおよび0.160mL(2mmol)のクロロアセチルクロリドから出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.23 (d, 1H), 5.35 (d, 1H), 4.86 (s, 2H), 4.15 (t, 2H), 3.68-3.75 (m, 4H), 3.6-3.65 (m, 2H), 3.4-3.45 (m, 2H), 1.75 (p, 2H), 1.2-1.5 (m, 22H), 0.9 (t, 3H)。
【0207】
合成実施例28
2-(3,4-ジヒドロイソキノリン-2(1H)-イル)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化36】

【0208】
表題化合物は、工程1の反応混合物がヘキサンではなくヘキサン:EtOAcの1:1混合物で希釈することを除いては、実施例20の工程1および工程2に記載のようにして、0.339g(2.0mmol)の1,2,3,4-テトラヒドロイソキノリンヒドロクロリドおよび0.160mL(2mmol)のクロロアセチルクロリドから出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.05-7.25 (m, 5H), 5.32 (d, 1H), 4.95 (2s (回転異性体), 2H), 4.65 および 4.7 (2s (回転異性体), 2H), 4.15 (t, 2H), 3.83 およびd 3.63 (2t (回転異性体), 2H), 2.92 および 2.85 (2t (回転異性体), 2H), 1.78 (p, 2H), 1.2-1.5 (m, 22H), 0.9 (t, 3H)。
【0209】
合成実施例29
(S)-ベンジル1-(2-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)アセチル)ピロリジン-2-カルボキシレートの合成
【化37】

【0210】
表題化合物は、工程1の反応混合物をヘキサンではなくEtOAcで希釈することを除いては、実施例20の工程1および工程2に記載のようにして、0.483g(2.0mmol)のL-プロリンベンジルエステルヒドロクロリドおよび0.160mL(2mmol)のクロロアセチルクロリドから出発し調製した。工程2で単離された粗製物質は、イソプロパノールから再結晶化により精製した。1H NMR (300 MHz, CDCl3) δ: 7.23-7.25 (m, 5H), 7.2 (d, 1H), 5.3 (d, 1H), 5.15 (d, 2H), 4.2-5.0 (m, 3H), 4.13 (t, 2H), 3.5-3.7 (m, 2H), 1.95-2.3 (m, 4H), 1.75 (p, 2H), 1.2-1.5 (m, 22H), 0.83 (t, 3H)。
【0211】
合成実施例30
4-メチルペンチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化38】

【0212】
5-(テトラデシルオキシ)フラン-2-カルボン酸(0.162g、0.5mmol)を含むN,N-ジメチルホルムアミド10mLの激しく撹拌した懸濁液に、1-ブロモ-4-メチルペンタン(0.247g、1.5mmol)、炭酸セシウム(0.243g、0.75mmol)およびヨウ化ナトリウム(〜20mg)を添加した。この懸濁液は、短時間で溶液になったように見え、その後、非常に細かく分散した白色沈殿物が認められた。反応物を12時間撹拌した。この時間で、反応溶液のHPLC解析は、TOFAがそれほど極性ではない生成物へ完全に転換したことを示した。この懸濁液をEtOAc(40mL)、飽和食塩水(20mL)および水(20mL)で希釈した。これらの相を分離させ、有機相を水(20mL)および飽和食塩水(20mL)で洗浄し、次いで、乾燥、濃縮した。得られた粗製物質をヘキサン中0〜20%EtOAcで溶出するフラッシュクロマトグラフィーにより精製したところ、0.127g(62%)の表題化合物が得られた。1H NMR (300 MHz, CDCl3) δ: 7.15 (d, 1H), 5.30 (d, 1H), 4.22 (t, 2H), 4.10 (t, 2H), 1.18-1.80 (m, 29H), 0.89 (t, 9H)。
【0213】
合成実施例31
3-(テトラヒドロ-2H-ピラン-2-イルオキシ)プロピル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化39】

【0214】
表題化合物は、実施例30に記載のようにして、0.335g(1.5mmol)の2-(3-ブロモプロポキシ)テトラヒドロ-2H-ピランおよび0.162g(0.5mmol)の5-(テトラデシルオキシ)フラン-2-カルボン酸から出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.15 (d, 1H), 5.30 (d, 1H), 4.59-4.62 (m, 1H), 4.40 (app t, 2H), 4.10 (t, 2H), 3.80-3.90 (m, 2H), 3.40-3.60 (m, 2H), 2.05 (p, 2H), 1.20-1.85 (m, 30H), 0.89 (t, 3H)。
【0215】
合成実施例32
2-モルホリノエチル5-(テトラデシルオキシ)フラン-2-カルボキシレートの合成
【化40】

【0216】
表題化合物は、合計0.730gの炭酸セシウムを添加してヒドロクロリドを中和することを除いては、実施例30に記載のようにして、0.224g(1.2mmol)の4-(2-クロロエチル)モルホリンヒドロクロリドおよび0.162g(0.5mmol)の5-(テトラデシルオキシ)フラン-2-カルボン酸から出発し調製した。1H NMR (300 MHz, CDCl3) δ: 7.15 (d, 1H), 5.30 (d, 1H), 4.40 (t, 2H), 4.10 (t, 2H), 3.70 (app t, 4H), 2.70 (t, 2H), 2.55 (app t, 4H), 1.80 (p, 2H), 1.18-1.55 (m, 22H), 0.89 (t, 3H)。
【0217】
合成実施例33
2-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)安息香酸の合成
【化41】

【0218】
5-(テトラデシルオキシ)フラン-2-カルボン酸(0.324g、1mmol)を含む10mLのCH2Cl2の冷却し(0℃)撹拌した懸濁液に、塩化オキサリル(0.135mL、1.5mmol)とN,N-ジメチルホルムアミド2滴を加えた。直ぐに起泡が認められた。この溶液は、気体発生が終了し、全ての懸濁固体が溶解するその時まで、撹拌を継続しながら室温まで温めた。次いで、この溶液をもう一度0℃まで冷却し、サリチル酸(0.180g、1.3mmol)およびEt3N(3mL)を素早く撹拌した反応物に加えた。2時間撹拌した後、反応物をEtOAc(100mL)で希釈し、有機相を1M HCl(2×100mL)および飽和食塩水(100mL)で洗浄し、次いで、乾燥、濃縮し、白色固体残渣を得た。粗製物質は、1%AcOHを含むヘキサン中の5〜40%EtOAcで溶出するフラッシュクロマトグラフィーにより精製した。得られた物質は、さらにCH2Cl2およびヘキサンからの再結晶化により精製し、白色結晶物質として0.225g(57%)の表題化合物を得た。1H NMR (300 MHz, CDCl3) δ: 8.08 (dd, 1H), 7.62 (dt, 1H), 7.32-7.38 (m, 2H), 7.24 (dd, 1H), 5.39 (d, 1H), 4.18 (t, 2H), 1.80 (p, 2H), 1.2-1.5 (m, 22H), 0.88 (t, 3H)。
【0219】
本発明の化合物の試験
ヒト脂腺細胞機能に関する研究は、好適な細胞系が不足していることから比較的制限を受けてきた。最近、SZ95脂腺細胞が、シミアンウィルス-40ラージT抗原に関するコード領域を含有のプラスミドでトランスフェクトされたヒトの顔皮脂腺細胞を用いて調製された(Zouboulis, C.C. et al., J. Invest. Dermatol. (1999), Vol. 113, pp. 1011-1020を参照されたい)。SZ95細胞は、ヒト脂腺細胞に典型的に関係する多数の分子を発現する。基礎研究により、皮脂分泌の脂質スクアレンおよびワックスエステル、並びにトリグリセリドおよび遊離脂肪酸の合成が明らかとなった(Zouboulis CC, Seltmann H, Neitzel H, Orfanos CE. Establishment and characterization of an immortalized human sebaceous gland cell line (SZ95). J. Invest Dermatol. (1999) 113:1011-1020を参照されたい)。
【0220】
したがって、SZ95細胞によって、脂腺細胞増殖および分化の多くの様相を説明することができる(Wrobel, A. et al., "Differentiation and apoptosis in human immortalized sebocytes", J. Invest Dermatol. (2003) 120:175-181を参照されたい)。
【0221】
アラキドン酸(AA)を用いる処理では、96ウェルマイクロタイタープレートフォーマットを使用し、SZ95脂腺細胞の脂質レベルが再現性良く約5倍に上昇した。SZ95細胞は、例えば、アキュテイン(登録商標)およびコレステロール合成阻害剤(スタチン)(これらは共に、かかる細胞による脂質産生を低減する能力を示す)などの皮脂抑制ポテンシャルのある化合物を同定するのに使用することができる(例えば、Tsukada, M. et al., "13-cis retinoic acid exerts its specific activity on human sebocytes through selective intracellular isomerization to all-trans retinoic acid and binding to retinoid acid receptors", J. Invest. Dermatol. (2000) 115:321-327を参照されたい)。
【0222】
また本発明の化合物の投与は、免疫/炎症制御サイトカインの増殖および分泌をはじめとする、T細胞活性化と関連のある様々なパラメーターを阻害することもできる。したがって、TOFA類似体は、例えば、炎症性座瘡の治療においてT細胞増殖およびサイトカイン分泌を低減させることにより、炎症を特徴とする皮膚疾患または病変を治療する際の有用な薬剤となり得る。
【0223】
有望な座瘡治療を評価するためのin vivo実験は、ハムスターの耳皮脂腺が構造、生化学および生理学の点からヒトのものと密接な類似点を有していることから、以下のハムスターアッセイを使用して実施することができる。
【0224】
in vivoでの抗皮脂腺活性試験
シリアンゴールデンハムスター(Oryctolagus cuniculus)の耳皮脂腺モデルを使用し、TOFAおよびTOFA類似体の繰り返し適用の効果を評価した。オスの動物は、雄性ホルモンの高い内因的レベルによりメスに比べて大きな皮脂腺を有している理由で用いた。化合物の効果を明らかにするため、ハムスターの耳から調製した断片を中性脂質特異的着色剤のオイルレッドOで処理した。着色結果を同一動物の未処理耳と比較し、動物の全体的な生理学的状態のあらゆる変化、並びに、局部薬剤適用から得られる有望な全身的効果を報告した。
【0225】
動物治療およびモニタリング
一般的に、化合物は、40%ジメチルアセトアミド(DMA)/30%アセトン/30%エタノール(ビヒクル)で調製し適用した。動物は、典型的には、実験開始時は10〜12週齢であり、体重は100〜150gであった。5〜8匹の動物から治療群を構成した。麻酔をかけていないハムスターに、耳当たり20μLの容量でピペットを使用して、右耳の腹側表面上に試験物質を投与した。手袋をはめた指で約15秒間、物質を治療部位へ優しくマッサージして施した。ハムスターは、治療を連続して15〜28日、毎日1回受けた。試験物質は、適用日毎に同じ4時間以内に適用した。左耳は未処理のままとし、内部対照部位として取り扱った。動物は、治療に関係する一般的な状況と可能性のある臨床的兆候、例えば、浮腫、紅斑、変色または耳の他の変化について毎日評価した。またハムスターは、一般的健康についても塗布外観、挙動および活動レベルにより評価した。
【0226】
組織学用の試料調製
動物は、最終(第21回)適用の約16〜20時間後に、CO2窒息により安楽死させた。続いて、皮脂腺分析用の組織試料を、組織学分野の担当により取得した。右耳(治療済)および左耳(未処理)を安楽死させたハムスターから慎重に取り出した。治療済みの耳の3.5mmパンチ生検を腹側表面上にマーキング色素でマーキングした。未処理耳のパンチ生検は、腹側表面上に別の組織マーキング色素でマーキングした。組織は、「Neg 50」凍結用包埋剤を満たしたラベル済みのモールドに入れ、液体窒素で凍結させた。これらのブロックは、必要とされるまで-70℃で保存するために、パラフィルム、次いでアルミニウムホイルで続けてラップした。
【0227】
皮脂腺分析
皮脂腺状態を評価するため、まず、耳断面をスライド・ガラス上に約8μm厚で切断し、直ちに10%緩衝ホルマリンで固定した。切片は標準法により脂質特異的なオイルレッドO色素で染色し、Faramount(Dakocytomation, Ca)アクリル封入剤でカバーし、カバーをスリップさせ、次いで、セットした。オイルレッドOで染色した組織切片部は、Olympus BX60顕微鏡上にマウントしたSpot RTデジタルカメラを用いて観察した。オイルレッドOで染色した組織切片図は、Olympus BX60顕微鏡上でマウントされたSpot RTディジタルカメラを用いて観察した。切片の画像は、4×顕微鏡対物レンズを使用して得た。画像は、特定の動物識別番号、スライド番号および倍率を使用して保存した。相対的な皮脂腺エリア(赤い染色エリア)は、Image-Proソフトウェア(Media Cybernetics Inc., Silver Spring, MD)を使用して測定した。画像分析のエリアは、表皮−皮膚接合部から中央軟骨ラインにより区別される組織中線までの領域を含む真皮であった。データは、分析した全エリアと比較し、代表的な脂質含有構造である赤い色調の組織断面のエリアをパーセンテージとして表した。
【0228】
以下の生物学的実施例は、皮脂腺機能亢進を特徴とする皮膚疾患または病変のあるヒトの治療、ヒトにおける皮脂腺活性の抑制、あるいはT細胞増殖およびサイトカイン分泌の低減における本発明化合物の有効性を判定するために当業者により用いることができる。
【0229】
生物学的実施例1
SZ95脂腺細胞における脂質合成の阻害
不死化ヒト脂腺細胞細胞系(SZ95)は、Zouboulis, C.C. et al., J. Invest. Dermatol. (1999), Vol. 113, pp. 1011-1020に記載のようにして培養物中で維持した。脂質合成は、アラキドン酸(AA)でSZ95細胞を処理することにより刺激した。脂質生成および脂質阻害試験の測定に関しては、試験化合物をジメチルスルホキシド(DMSO)中に溶解させ、96ウェルマイクロタイタープレートに所望濃度で加えた。次いで、細胞を72時間まで培養した後、プレートをPBSで3回洗浄し、最終容量の200μLPBS/ウェルを加えた。細胞中性脂質の染色については、5μLのNile Red溶液(DMSOに溶解、0.2mg/mL)を各ウェルに加え、最低60分間インキュベートした。次いで、蛍光測定プレートリーダーを使用して、プレート蛍光を定量した(励起波長:490nm;発光波長:590nm)。試験化合物による脂質レベルの抑制は、試験化合物の存在下でAAに刺激された細胞の未刺激対照細胞で得られた値に対する蛍光減少(%)として示した。細胞の生存率は、テトラゾリウム試薬(MTS)の生存細胞による着色ホルマザン生成物への変換を利用して測定した。これらのアッセイに関し、試験化合物はジメチルスルホキシド(DMSO)中に溶解させ、96ウェルプレートへ接種した細胞に所望濃度で加えた。細胞を試験化合物の存在下で48時間培養した後、プレートをPBSで3回洗浄した。1ウェル当たり最終容量100μLの培地を加えた。20μLのMTS溶液(滅菌PBS中0.2mg/mL)を各ウェルに加え、所望の吸光度に達するまで、最低60分間インキュベートした。ウェルの発色現像は、590nmの吸光度でプレートリーダーを使用して測定した。試験化合物による細胞生存率に対する効果は、未処理対照細胞で得られた値に対する試験化合物存在下でのAA刺激細胞の吸光度減少(%)として示した。
【0230】
本発明の化合物は、このアッセイで試験した場合、脂質合成の用量依存性抑制を示した。
【0231】
生物学的実施例2
LNCaP細胞による脂質蓄積に対する本発明化合物の効果
ヒト前立腺LNCaP腺癌細胞系は、American Type Culture Collectionから入手することができる。細胞は、10%ウシ胎仔血清(FCS)、4mM Glutamax、1mM ピルビン酸ナトリウム、1mM HEPES、ペニシリン(100U/mL)およびストレプトマイシン(100μg/mL)を含有するRPMI 1640培地で維持する。実験に関し、約10,000細胞/ウェルを、RPMI 1640 10%FBSを入れた6ウェル組織培養プレート中で72時間平板培養する。血清アンドロゲンの有効効果を最小限にするため、FCSを除いた5%活性炭/デキストランを含有する培地を72時間加える。次いで、脂質合成は、50nMのアンドロゲンジヒドロテストステロン(DHT)を添加することにより刺激する。本発明の化合物をDMSO中で可溶化し、処理した5%活性炭/デキストランを含有するRPMI 1640を各種濃度で加える。細胞は、37℃で96時間、これらの因子の存在下でインキュベートする。続いて、脂質蓄積をNile Red染色とフローサイトメトリー分析により定量する。試験化合物で処理したウェルの脂質レベルを、ビヒクル処理した細胞で得られた結果と比較する。
【0232】
生物学的実施例3
3T3-L1脂肪細胞分化および脂質蓄積に対する本発明化合物の効果
マウス3T3-L1前脂肪細胞(American Type Culture Collection)を継代培養し、10%ウシ胎仔血清(FCS)、1mM ピルビン酸ナトリウム、ペニシリン(100U/ml)/ストレプトマイシン(100μg/ml)および4mM Glutamax(Gibco/Life Technologies)を補充したダルベッコ変性イーグル培地(DMEM)で維持する。脂肪細胞分化の開始については、3T3-L1細胞を培養プレートまたは培養皿中へ密集度で平板培養し、密集後2日間補充DMEM中で増殖させる。開始培地は、0.5mM 3-イソブチル-1-メチルキサンチン、1μM デキサメタゾンおよび10μg/mlのヒトインスリンを含むDMEMから構成されている。発育培地はインシュリン(10μg/ml)を含有し、これを48〜72時間後に開始培地と交換する。細胞脂質は、オイルレッドO染色により発現される。
【0233】
生物学的実施例4
活性化されたヒト末梢血液単核細胞(PBMC)による増殖およびサイトカイン産生に対する本発明化合物の効果
PBMCは、密度勾配遠心分離により異なるドナーから単離する。異なる量の本発明化合物を、2組の異なる刺激の存在下においてPBMC培養液に加える。刺激を活性化する1つはフィトヘマグルチニン(PHA)で、Tリンパ球により増殖およびサイトカイン合成を刺激する植物由来マイトジェンである。またこれらの細胞製剤は、インターフェロン-γ(IFN-γ)およびリポ多糖類(LPS)の組み合わせを用いても活性化され、PBMC調製物内の単球画分によりサイトカイン産生が刺激される。48時間培養した後、フローサイトメトリー系の定量化方法を使用し、サイトカインレベルの同時定量のために細胞上清を取得する。サイトカインレベルは、並行して作製した標準曲線から補間する。細胞生存率は、3-(4,5-ジメチルチアゾール-2-イル)-5-(3-カルボキシメトキシフェニル)-2-(4-スルホフェニル)-2H-テトラゾリウム、分子内塩(MTS)の生細胞ミトコンドリア脱水素酵素による可溶性フォルマザン生成物への変換に基づき、比色測定法を使用して評価する。細胞増殖は、培養物に3H-チミジンを添加し、シンチレーション計数を使用し、DNAへのその取り込みレベルを測定することにより判定する。
【0234】
生物学的実施例5
合成皮脂中の溶解性の測定
本明細書に記載の化合物を試験し、脂質でのそれらの溶解性を評価することができる。溶解性の測定には、合成皮脂混合物を使用した。より詳しくは、約5mgの化合物を1.5mlのエッペンドルフチューブに加え、次いで、これを0.1mlの合成皮脂と混合し、その後、短時間ボルテックスした。混合物を32℃に予熱したシェーカー中の試料に入れ、次いで、一晩撹拌した。HPLC解析用のサンプリングを行う前に、チューブをエッペンドルフ遠心分離機に入れ、5分間13000rpmで回転させ、不溶性の薬剤部分を沈澱させた。遠心分離後、三連で、可溶性分画のトップ部分の20uLを分析用2ml HPLCバイアルへサンプリングし、その質量を記録した。次いで、1mlのTHFを各バイアルに加え、皮脂を可溶化した。それらの濃度を測定するため、全化合物のHPLC解析を同一流速条件下で実施した。
【0235】
以下の本発明化合物をこのアッセイで試験した:
2,2,2-トリフルオロエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート(化合物A);
イソプロピル5-(テトラデシルオキシ)フラン-2-カルボキシレート(化合物B)
(5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチル(5-(テトラデシルオキシ)フラン-2-カルボキシレート(化合物C)。
【0236】
表1は、化合物A、BおよびCが顕著に低い融点を示すこと、またTOFAに比べて液体合成皮脂における溶解性がはるかに高いことを示している。このことは、これらの特性が皮膚とそれらの結合性を促進し、脂質過多の皮脂腺環境へ送達することができるということである。
【表1】

【0237】
生物学的実施例6
in vivoアッセイ
一連のハムスター実験は、TOFAと比較した本発明化合物の有望な抗皮脂腺活性に関する試験を実施した。全ての実験において、TOFAおよび本発明化合物の反復局所適用は、十分な許容性が認められた。これらの動物の未治療耳および治療済み耳について、紅斑、浮腫、炎症または組織ネクローシスのどちらでもないことが確認された。ハムスターは、全実験期間を通じて、標準の挙動と体重増加を示した。
【0238】
これらの実験では、本発明化合物、TOFAおよびビヒクルをオスのハムスターの耳上に適用した。治療終了時に、ハムスターは殺処理され、治療部位の皮脂腺領域が測定された。この試験体系の未処理耳はアッセイ内部対照として、また有望な全身療法効果を検出する手段として役割を果たした。
【0239】
このハムスターアッセイは、ハムスター耳皮脂腺上における本発明の3種の化合物(化合物A、BおよびC)と同時に、TOFAの局所適用の効果を評価した。試験化合物は、40%DMA/30%アセトン/30%エタノール中に、21日間75mMで局所的に毎日適用した。
【0240】
図1に示したように、本発明化合物(特に化合物A)は、このアッセイで試験した場合、TOFAとの比較およびビヒクルとの比較で、皮脂腺領域を低減する能力を示した。
【0241】
生物学的実施例7
in vivoアッセイ − 抑制作用の維持
本実施例は、化合物Aを21日間適用した後、また治療停止の1週間後および2週間後のハムスター皮脂腺サイズを評価した。化合物Aは、40%DMA/30%アセトン/30%エタノールの混合物で適用した。治療後の皮脂腺回復特性を評価するため、1週間および2週間のフォローアップサンプリング時期も含んでいた。腺サイズの有意な低下は、化合物Aを21日間治療することで再び生じた(図2に示す)。ビヒクル処理した動物との比較では、平均腺エリアは、化合物Aで治療したハムスターに対し63.5%低下した。治療終了の2週間後に調製した試料については、化合物Aに暴露された耳の皮脂腺カウント数は、対照値よりも有意に低下した。この所見は、本明細書に記載のTOFA類似体は、治療後の腺活性に対し比較的抑制作用が維持されていることを示唆している。さらに、この所見は、過度のリバウンド効果は治療投薬計画の停止後に生じる可能性がないことを示唆している。
【0242】
生物学的実施例8
in vivo アッセイ − 皮脂腺の低減
図3は、動物が対照ビヒクル(40%DMA/30%アセトン/30%エタノール)、混合物中75mM濃度のTOFAおよび化合物Aで21日間連続して治療した試験で調製した耳切片の組織学的状態を示す。対照、TOFAおよび化合物Aで治療したハムスターの耳から調製した皮膚切片には、明らかに感知され得る炎症性細胞は存在しない。
【0243】
切片はオイルレッドOで処理し、中性脂質を検出するとともに、ヘマトキシリンで対比染色した。画像は、上方に位置した腹側耳表面方向である。皮脂腺領域の減少は、化合物Aを治療したハムスターから調製した切片で明らかである。ビヒクルで治療した対照と比較すると、表皮の厚さは、TOFAまたは化合物Aで治療したハムスターから得られた試料に対して厚い。
【0244】
本発明の医薬組成物および投与
本発明の化合物を含む医薬組成物またはその製薬上許容可能な塩、および製薬上許容可能な添加剤は本発明の一態様である。これらの医薬組成物は、活性成分(すなわち、式(I)で表される化合物)を治療上有効な量でヒトに投与することができる任意の形態であってもよい。例えば、医薬組成物は、半固体(ゲル)、固体、液体または気体(エアロゾル)の形態をしていてもよい。代表的な投与経路としては、特に限定されるものではないが、全身投与(経口投与および非経口投与を含む)、局所投与、口腔内投与、経皮投与、舌下投与、経鼻投与、直腸投与、膣内投与および経鼻投与が挙げられる。本明細書で用いられる非経口投与薬という用語は、皮下注射、無針注射、静脈注射、筋肉注射、硬膜外注射、胸骨内注射または静注技術を包含する。本発明の医薬組成物は、ヒトへ組成物を投与した際にその中に含有されている活性成分が体内に吸収されるように製剤化される。ヒトに投与される本発明の医薬組成物は、1種または複数の用量単位の形態をとっていてもよく、その場合、例えば、単回投与量単位であり得る錠剤、カプセル剤、カシェ剤またはパッチ剤であり、また、エアロゾル形態の本発明の医薬組成物の容器は、多数回の用量単位を保持し得る。
【0245】
皮脂腺機能亢進を特徴とする皮膚疾患の治療において、式(I)で表される化合物は、好ましくは、下記により詳細に記載したように、皮膚科学的に許容可能な組成物で、それが必要とされるヒトの皮膚(すなわち局所的)に投与される。こうした組成物が使用される場合(例えば、式(I)で表される化合物および皮膚科学的に許容可能な添加剤を含む皮膚用組成物が、それが必要とされるヒトの皮膚上に置かれる場合)、式(I)で表される化合物は、患者の皮膚との連続的接触にあり、それにより治療が行われる。
【0246】
式(I)の任意の好適な量の化合物は、こうした皮膚用組成物中で用いられ、有効に用いられる量は脂腺細胞からの皮脂の産生を有効的に抑制し、長期間にわたって組成物中で安定性を保つ使用量で提供される。好ましくは、安定性は、典型的には、皮膚科学的に許容可能な組成物の製造、パッケージ、出荷および/または保管にあたる、長期間(例えば、約3年以下、1年以下、または約6か月以下)にわたる。式(I)で表される化合物は、溶液中に、部分的に非溶解部分を含む溶液中に、または完全に溶解していない懸濁液中に存在していてもよい。式(I)で表される化合物は、本発明の皮膚用組成物中に、皮膚用組成物の約0.001重量%〜約80重量%、約0.001重量%〜約50重量%、約0.001重量%〜約25重量%、または約0.001重量%〜約6重量%の濃度範囲で存在していてもよい。一実施形態では、式(I)で表される化合物は、皮膚用組成物の約0.001重量%〜約10重量%、約0.1重量%〜約10重量%、または約1.0重量%〜約5.0重量%の濃度範囲で存在することができる。本発明の別の実施形態では、局所投与される式(I)で表される化合物の皮膚疾患用製剤は、重量%で、約40%ジメチルアセトアミド(DMA)/30%アセトン/30%エタノール中に約3%のTOFAを含有する。
【0247】
本発明の皮膚用組成物は、溶液剤、ローション剤、フォーム剤、ゲル剤、クリーム剤および/または軟膏剤の形態をとることができる。好ましくは、皮膚用組成物は、局所製剤(例えば、ゲル剤、フォーム剤、クリーム剤、軟膏剤)である。
【0248】
本発明の皮膚用組成物は、毛包脂腺(pilosebaceous unit)への担体として作用する、1種または複数の「親油性の溶媒(類)」を含有していてもよい。本発明に有用な親油性溶媒は、水および/または低級鎖アルコールと混和性であり、25℃で水よりも蒸気圧が小さいものであり得る(〜23.8mmHg)。本発明に有用な親油性溶媒は、グリコール(特にプロピレングリコール)であってもよい。特に、プロピレングリコールは、ポリエチレングリコール、特に分子量の範囲が200〜20000のポリエチレングリコールのクラスのものであり得る。好ましくは、溶媒はグリコールエーテルのクラスの一部であってもよい。より詳しくは、本発明の親油性溶媒は、ジエチレングリコールモノエチルエーテル(トランスクトール)であってもよい。本明細書では、「ジエチレングリコールモノエチルエーテル」(「DGME」)または「トランスクトール」は、2-(2-エトキシエトキシ)エタノール{CAS NO 001893}またはエチオキシジグリコール(ethyoxydiglycol)を意味する。
【0249】
また、本発明の皮膚用組成物は、25℃で23.8mmHg以上の蒸気圧を有する1種または複数の「賦形剤(類)」を含有していることも可能である。賦形剤は、濃縮物に関して、皮膚上で式(I)で表される化合物が濃縮されるように、親油性溶媒以上の蒸気圧を有していなければならない。1種の賦形剤または賦形剤類の組み合わせの合計の好ましい濃度範囲は、皮膚用組成物の約0.1重量%〜約10重量%、さらに好ましくは約10重量%〜約50重量%、より詳しくは約50重量%〜約95重量%であってもよい。本明細書で使用するための例(これに限定されない)としては、水および低級アルコール、例えばエタノール、2-プロパノールおよびn-プロパノールが挙げられる。さらに好ましくは、賦形剤は水、エタノールおよび/または2-プロパノールである。特に、賦形剤はエタノールおよび/または水であってもよい。
【0250】
また、本発明の皮膚用組成物は、湿潤効果を提供するために使用される1種または複数の「湿潤剤(類)」を含有していてもよい。好ましくは、湿潤剤は組成物中で安定性を維持する。任意の好適な濃度の単一湿潤剤または湿潤剤の組み合わせは、得られた濃度が所望の湿潤効果を提供するという条件で用いることができる。一般的に、湿潤剤の好適な量は、使用される特定の湿潤剤または湿潤剤類に依存する。単一湿潤剤または湿潤剤類の組み合わせの合計の好ましい濃度範囲は、皮膚用組成物の約0.1重量%〜約70重量%、さらに好ましくは約5.0重量%〜約30重量%、より詳しくは約10重量%〜約25重量%であり得る。本明細書で使用される例(これに限定されない)としては、グリセリン、多価アルコールおよびシリコンオイルが挙げられる。さらに好ましくは、湿潤剤はグリセリン、プロピレングリコールおよび/またはシクロメチコンである。とりわけ、賦形剤はグリセリンおよび/またはシクロメチコンであってもよい。
【0251】
また、本発明の皮膚用組成物は、最終溶液の粘性を高めるゲル化剤を含有していてもよい。ゲル化剤は、乳化剤としても作用することができる。本皮膚用組成物は、それを皮膚へ適用した場合にで崩壊され、変質する、透明なゲル剤およびソフトゲル剤を形成することが可能であり、それにより、皮膚上で乾燥しないゲル剤が得られる。一般的に、ゲル化剤の濃度および組み合わせは、最終製品の物理安定性に依存する。ゲル化剤の好ましい濃度範囲は、皮膚用組成物の約0.01重量%〜約20重量%、さらに好ましくは約0.1重量%〜約10重量%、より詳しくは約0.5重量%〜約5重量%であってもよい。本明細書で使用される例(これに限定されない)としては、セルロース、アクリルポリマーおよびアクリレートクロスポリマーのクラスが挙げられる。好ましくは、ヒドロキシプロピルセルロース、ヒドロキシメチルセルロース、プルロニックPF127ポリマー、カルボマー980、カルボマー1342およびカルボマー940、さらに好ましくはヒドロキシプロピルセルロース、プルロニックPF127カルボマー980およびカルボマー1342、より詳しくはヒドロキシプロピルセルロース(Klucel(登録商標) EF、GFおよび/またはHF)、プルロニックPF127、カルボマー980および/またはカルボマー1342(Pemulen(登録商標) TR-1、TR-2および/またはカルボポール(登録商標) ETD 2020)である。
【0252】
本発明の皮膚用組成物は、1種または複数の酸化防止剤、ラジカルスカベンジャーおよび/または安定化剤を含有していてもよく、好ましい濃度範囲は、皮膚用組成物の約0.001重量%〜約0.1重量%、さらに好ましくは約0.1重量%〜約5重量%である。本明細書で使用される例(これらに限定されない)としては、ブチルヒドロキシトルエン、ブチルヒドロキシアニソール、パルミチン酸アルコルビル、クエン酸、ビタミンE、ビタミンEアセテート、ビタミンE-TPGS、アスコルビン酸、トコフェルソラン(tocophersolan)および没食子酸プロピルが挙げられる。より詳しくは、酸化防止剤は、パルミチン酸アルコルビル、ビタミンEアセテート、ビタミンE-TPGS、ビタミンEまたはブチルヒドロキシトルエンであってもよい。
【0253】
また、本発明の皮膚用組成物は、抗細菌特性および/または抗真菌特性を示す防腐剤を含有していてもよい。防腐剤は本発明のゲル化した皮膚用組成物中に存在し、その品質保持に対する細菌および/または真菌の影響を最小限にすることができる。本発明の皮膚用組成物中の好ましい防腐剤の濃度範囲は、皮膚用組成物の約0.001重量%〜約0.01重量%さらに好ましくは約0.01重量%〜約0.5重量%である。本明細書で使用するための例(これに限定されない)としては、ジアゾリジニル尿素、メチルパラベン、プロピルパラベン、テトラナトリウムEDTAおよびエチルパラベンが挙げられる。より詳しくは、防腐剤はメチルパラベンおよびプロピルパラベンの組み合わせであってもよい。
【0254】
皮膚用組成物は、場合により、1種または複数のキレート剤を含むことができる。本明細書では、「キレート剤」または「キレート化剤」という用語は、複合体を形成し構造から金属イオンを除去し、金属イオンが化学反応へ容易に関与すること、または化学反応を触媒することができないようにすることが可能なそれらの皮膚効果薬剤を意味する。本明細書で使用するキレート剤は、皮膚用組成物の好ましくは、約0.001重量%〜約10重量%、さらに好ましくは約0.05重量%〜約5.0重量%の範囲の濃度で製剤化される。本明細書で使用するための例(これに限定されるものではない)としては、EDTA、エデト酸ジナトリウム、エデト酸ジカルシウム、シクロデキストリン、エデト酸トリナトリウム、クエン酸、クエン酸ナトリウム、グルコン酸およびグルコン酸カリウムが挙げられる。とりわけ、キレート剤は、EDTA、エデト酸ジナトリウム、エデト酸ジカリウム、エデト酸トリナトリウムまたはグルコン酸カリウムであってもよい。
【0255】
本発明の皮膚用組成物は、任意の化粧料で好適な形態で、好ましくはローションまたはクリームとして、また軟膏もしくはオイルベースで、並びにスプレー可能な液体形態(例えば、皮膚に適用した場合、ローション剤または軟膏が有するべとべと感のない化粧品的に許容可能な方法で乾燥している、基剤、ビヒクルまたは担体中にTOFAを含んでいるスプレー)で提供することができる。
【0256】
さらに、本発明の皮膚用組成物は、一般に使用されている1種または複数の適合する化粧品として許容可能なアジュバント、例えば、着色剤、香料、エモリエント剤、湿潤剤など、並びに植物、例えば、アロエ、カモミールなどを含むことができる。
【0257】
本発明の皮膚用組成物を局所投与する際、治療しようとするヒトの皮膚は、本発明の皮膚用組成物の投与前に、場合により前処理(例えば、石鹸および水による皮膚の洗浄、または、アルコール系洗浄剤による皮膚の消毒)することができる。
【0258】
皮脂腺機能亢進を特徴とする皮膚疾患または病変を治療する際、式(I)で表される化合物または式(I)で表される化合物を含む医薬組成物は、下記でより詳細に記載したようにして、製薬上許容可能な組成物で、それを必要とするヒトに全身投与(好ましくは経口投与)することもできる。
【0259】
経口投与する本発明の医薬組成物は、当業者に公知の標準的な方法によって、式(I)の化合物を適切な製薬上許容可能な担体、希釈剤または添加剤と組み合わせることにより製造することができる。本発明の医薬組成物は、ヒトへ組成物を投与した時にその中に含有されている式(I)の化合物が体内に吸収されるように製剤化される。
【0260】
経口投与する本発明の医薬組成物は、散剤、粒剤、圧縮錠剤、丸剤、カプセル剤、チューインガム、ウエハーなどの形態へ製剤化することができる。こうした固形組成物は、典型的には、1種または複数の不活性希釈剤または可食担体を含有する。さらに、下記の1種または複数が存在していてもよい:結合剤、例えば、カルボキシメチルセルロース、エチルセルロース、微結晶性セルロース、トラガカントゴムまたはゼラチン;添加剤、例えば、デンプン、ラクトースまたはデキストリン、崩壊剤、例えば、アルギン酸、アルギン酸ナトリウム、プリモゲル(Primogel)、コーンスターチなど;滑剤、例えば、ステアリン酸マグネシウムまたはステロテックス(Sterotex);滑沢剤、例えば、コロイド状二酸化ケイ素;甘味剤、例えば、スクロースまたはサッカリン;着香料、例えば、ペパーミント、サリチル酸メチルまたはオレンジフレーバー;および着色剤。
【0261】
本発明の医薬組成物がカプセル形態(例えばゼラチンカプセル)である場合、上記タイプの物質に加えて、ポリエチレングリコールまたはオイルなどの液体担体を含有していてもよい。
【0262】
また、経口投与される本発明の医薬組成物は、液体形態、例えばエリキシル、シロップ、溶液、エマルションまたは懸濁液であってもよい。さらに、本医薬組成物は、場合により、甘味料、防腐剤、色素/着色剤および調味料の1種または複数を含有していてもよい。
【0263】
また、本発明の液体医薬組成物は、以下のアジュバントの1種または複数を含んでいてもよい:滅菌水、食塩水(好ましくは生理食塩液)、リンゲル液、等張食塩水、溶媒または懸濁媒として有用であり得る合成モノグリセリドまたはジグリセリドなどの固定油、ポリエチレングリコール、グリセリン、プロピレングリコールまたは他の溶媒;抗菌剤、例えば、ベンジルアルコールまたはメチルパラベン;酸化防止剤、例えば、アスコルビン酸または亜硫酸水素ナトリウム;キレート剤、例えば、エチレンジアミン四酢酸;緩衝液、例えば、アセテート、シトラートまたはホスフェート、並びに、塩化ナトリウムまたはデキストロースなどの等張性調節剤。
【0264】
本発明の液体医薬組成物は、その必要性のあるヒトに投与する場合、治療上有効な量の式(I)で表される化合物を含有する。一般的に、この量は、組成物中、式(I)の化合物が少なくとも0.01%である。この量は、組成物の全重量の約0.1重量%〜約70%の間で変動し得る。好ましい経口医薬組成物は、経口組成物の約1.0重量%〜約50重量%の範囲の濃度で式(I)の化合物を含有する。
【0265】
本発明の医薬組成物は、固体または液体の用量単位の物理的形態を変化させる各種物質を含んでいてもよい。例えば、本組成物は、活性成分の周囲にコーティングシェルを形成する物質を含んでいてもよい。コーティングシェルを形成する物質は、典型的に不活性であり、例えば、糖、シェラックおよび他の腸溶コーティング剤から選択することができる。あるいは、活性成分はゼラチンカプセルでカプセル化されていてもよい。
【0266】
さらに、固体形態または液体形態の本発明の医薬組成物は、式(I)の化合物に結合し、それによって、式(I)の化合物の全身送達を促進する薬剤を含んでいてもよい。この能力で作用し得る好適な薬剤としては、モノクローナルまたはポリクローナル抗体、タンパク質またはリポソームが挙げられる。
【0267】
また、本発明の医薬組成物の全身投与は、注射による投与、例えば皮下注射、静脈注射、筋内注射、脊髄注射または腹膜腔内注射、並びに、経皮投与、口腔粘膜投与または経肺投与、および無針注射投与を包含する。
【0268】
有用な注射用医薬組成物は、活性化合物(群)の滅菌懸濁液、溶液またはエマルションを含む水性または油性ビヒクルを包含する。さらに、本組成物は製剤化薬剤、例えば、懸濁化剤、安定化剤および/または分散剤を含有していてもよい。注射用の医薬組成物は、単位剤形中、例えば、アンプル中または多回投与容器中に存在していてもよく、また追加の防腐剤を含有していてもよい。
【0269】
あるいは、注射用医薬組成物は、使用前に好適なビヒクル(例えば、これらに限定されるものではないが、発熱性物質除去蒸留水、緩衝液、デキストロース溶液など)で再構成するための粉末形態で提供することができる。そのためには、活性化合物(すなわち、式(I)の化合物)は、凍結乾燥などの任意の当該分野で公知の技術によって乾燥させ、使用前に再構成させることができる。
【0270】
口腔粘膜投与については、浸透しようとするバリアに対する適切な浸透剤が製剤で使用される。こうした浸透剤は、当技術分野で周知である。
【0271】
持続性送達については、式(I)で表される化合物またはその製薬上許容可能な塩は、埋め込みまたは筋肉注射によって、投与用の持効性製剤として製剤化することができる。式(I)で表される化合物またはその製薬上許容可能な塩は、(例えば、許容可能なオイル中のエマルションとしての)好適なポリマー物質または疎水性物質またはイオン交換樹脂と製剤化することができるか、あるいは難溶性誘導体として(例えば、難溶性塩として)製剤化することができる。あるいは、経皮吸収用の式(I)で表される化合物またはその製薬上許容可能な塩を時間をかけて放出する付着性ディスクまたはパッチとして製造された経皮送達システムも用いることができる。そのためには、浸透促進剤または経皮吸収促進剤を、活性化合物の経皮浸透の促進を目的として使用することができる。好適な経皮パッチは、例えば、米国特許第5,407,713号;米国特許第5,352,456号;米国特許第5,332,213号;米国特許第5,336,168号;米国特許第5,290,561号;米国特許第5,254,346号;米国特許第5,164,189号;米国特許第5,163,899号;米国特許第5,088,977号;米国特許第5,087,240号;米国特許第5,008,110号;および米国特許第4,921,475号に記載されている。
【0272】
無針注射による本発明の医薬組成物の投与は、米国特許第6,756,053号に開示されている技術を使用して用いることができる。
【0273】
あるいは、本発明の医薬組成物に他の医薬用送達システムを用いることができる。リポソームおよびエマルションは、活性化合物(群)またはプロドラッグ(群)の送達に使用可能な送達ビヒクルの公知の例である。ジメチルスルホキシド(DMSO)などの特定の有機溶媒も使用可能であるが、通常、毒性が高いという代償を払う。
【0274】
本発明の医薬組成物は、所望の場合、活性化合物(群)を含有する1種または複数の単位剤形を含有していてもよいパックまたはディスペンサーデバイス中に存在させることができる。パックは、例えば、金属箔またはプラスチック箔、例えばブリスターパックなどを含む。パックまたはディスペンサーデバイスには、投与に関する説明書を添付することができる。
【0275】
上記で述べた本発明の医薬組成物は、医薬分野で周知の方法によって、または本明細書に記載の方法によって製造することができる。例えば、Remington's Pharmaceutical Sciences, 18th Ed., (Mack Publishing Company, Easton, Pennsylvania, 1990)を参照されたい。
【0276】
本発明の医薬組成物は、治療上有効な量でヒトに投与されるが、それは様々な要因、例えば、式(I)で表される化合物の活性;式(I)で表される化合物の代謝の安定性および作用期間;ヒトの年齢、体重、一般的健康、性別および食事;投与の様式および時間;排出の速度;薬の組み合わせ;並びに、特定の疾患または病変の重症度に依存して変わる。一般に、式(I)で表される化合物の治療上有効な日用量は、(70kgの哺乳動物に対し)約0.001mg/kg(すなわち0.07mg)〜約100mg/kg(すなわち7.0gm)であり;好ましくは、治療上有効投与量は、(70kgの哺乳動物に対し)約0.01mg/kg(すなわち0.7mg)〜約50mg/kg(すなわち3.5gm)であり;さらに好ましくは、治療上有効投与量は、(70kgの哺乳動物に対し)約1mg/kg(すなわち70mg)〜25mg/kg(すなわち1.75gm)である。
【0277】
以下の製剤実施例1〜5は、式(I)の代表的な化合物および1種または複数の皮膚科学的に許容可能な添加剤を含む本発明の皮膚用組成物を提供する。
【0278】
製剤実施例1
皮膚疾患用アルコールゲル製剤
以下の製剤の製品は半固体の透明なゲルである。
【表2】

【0279】
上記の製剤は、以下のように調製することができる。アルコールおよびジエチレングリコールモノエチルエーテルを合わせる。トコフェルソラン、エデト酸ジナトリウムおよび式(I)の化合物を混合しながら溶解させる。ヒドロキシプロピルセルロースを添加し、高速混合して素早くかつ均一に分散させる。生成物は、均一分散後、混合から取り出される。
【0280】
製剤実施例2
皮膚疾患用水性ゲル製剤
以下の製剤の製品は半固体の透明なソフトゲル製剤である。
【表3】

【0281】
上記の製剤は、以下のように調製することができる。液体、ジエチレングリコールモノエチルエーテル、グリセリンおよび水を混合する。ポリソルベート80およびトコフェルソランを添加し、混合して溶解させる。式(I)の化合物を添加し、混合して溶解させる。エデト酸ジナトリウム、メチルパラベンおよびプロピルパラベンを添加し、混合して溶解させる。アクリレート/C10-C30アルキルアクリレートクロスポリマーは、高速混合しながら、均一な混合物が得られるまで素早く分散させる。トロルアミンを持続的に混合しながら添加し、pH約6.75で粘着性ゲルを得る(水で1:9に希釈される場合)。
【0282】
製剤実施例3
皮膚疾患用ヒドロアルコール性ゲル製剤
以下の製剤の製品は半固体の透明なソフトゲル製剤である。
【表4】

【0283】
上記の製剤は、以下のように調製することができる。液体、ジエチレングリコールモノエチルエーテル、グリセリンアルコールおよび水を混合する。ポリソルベート80およびトコフェルソランを添加し、混合して溶解させる。式(I)の化合物を添加し、混合して溶解させる。エデト酸ジナトリウム、メチルパラベンおよびプロピルパラベンを添加し、混合して溶解させる。アクリレート/C10-C30アルキルアクリレートクロスポリマーおよびヒドロキシプロピルセルロースを、均一な混合物が得るまで高速混合しながら素早く分散させる。トロルアミンを持続的に混合しながら添加し、pH約6.75で粘着性ゲルを得る(水で1:9に希釈される場合)。
【0284】
製剤実施例4
皮膚疾患用クリーム剤
式(I)で表される化合物はクリームとしても製剤化することができるが、その一例は以下の通りである:
【表5】

【0285】
上記の製剤は、以下のように調製することができる。
【0286】
A. 水相
水およびジエチレングリコールモノエチルエーテルを一緒に混合する。トコフェルソランを添加し、混合して溶解させる。式(I)の化合物を添加し、混合して溶解させる。トリラウレス-4ホスフェート、エデト酸ジナトリウム、メチルパラベンおよびプロピルパラベンを添加し、混合して溶解させる。アクリレート/C10-C30アルキルアクリレートクロスポリマーおよびカルボマー940を均一な混合物が得られるまで高速混合しながら素早く分散させる。得られた混合物を撹拌しながら約65℃〜約75℃の温度で加熱し、溶液を形成させる。
【0287】
B. 油相
白色ワセリン、シクロメチコン、ミリスチン酸イソプロピルおよびセトステアリルアルコールを別の容器中で合わせ、約65℃〜約75℃の温度で完全に溶解させ、撹拌した。
【0288】
C. 水相を撹拌しながら、油相を均一なエマルションが得られるまでゆっくりと加える。得られたエマルションにトロルアミンをゆっくりと加え、pH約6.75でクリームを得る。この生成物は、連続混合を行いながら25℃に冷却する。
【0289】
製剤実施例5
皮膚疾患用フォーム剤
式(I)で表される化合物はフォームとして製剤化することができるが、その一例は以下の通りである。
【表6】

【0290】
* 噴射剤は最終製剤の4.0重量%である。噴射剤は1種の気体または気体の混合物である。好適な気体としては、ブタン、イソブタン、プロパン、イソプロパンおよびイソペンタン(isopentate)が挙げられる。
【0291】
上記製剤は、以下のように調製することができる。
【0292】
A. 水相
水およびジエチレングリコールモノエチルエーテルを混合する。トコフェルソランを添加し、混合して溶解させる。TOFAを添加し、混合して溶解させる。エデト酸ジナトリウムおよびプロピルパラベンを添加し、混合して溶解させる。アクリレート/C10-C30アルキルアクリレートクロスポリマーを、均一な混合物が得るまで高速混合で速やかに分散させる。得られた混合物を撹拌しながら約60℃〜約70℃の温度の溶液まで加熱する。
【0293】
B. 油相
ステアリルアルコール、ラウレス-23およびPEG-100ステアレートを別の容器中で合わせ、撹拌しながら、約60℃〜約70℃の温度で完全に溶解させる。
【0294】
C. 水相を撹拌しながら、油相を均一なエマルションが得られるまでゆっくりと加える。トロルアミンを加え、所望のpHとする。この得られた製剤は、連続混合を行いながら25℃に冷却する。この製剤は、噴射剤の入った圧力仕様の適切な気密容器に包装する。
【0295】
組み合わせ療法
本発明の化合物は、皮脂腺機能亢進を特徴とする皮膚疾患または病変の治療において、1種または複数の他の治療薬と有用に組み合わせることができる。例えば、本発明の化合物は、同時に、連続的に、または別々に、以下に示す他の治療薬と組み合わせて投与することができる。例えば、特に限定されるものではないが、
・局所用/経口用抗生物質、例えば、クリンダマイシン、テトラサイクリン、ミノサイクリン(minoccline)、ドキシサイクリン(deoxycycline)、エリスロマイシン、トリメトプリムおよびアジスロマイシン;
・レチノイド類、例えば、アキュテイン(登録商標)、トレチノイン(tretinion)、タザロテンおよびアダパレン;
・ベンゾイルパーオキサイド;
・青色光/赤色光;
・光力学療法(PDT);
・抗アンドロゲン化合物、例えば、PSK 3841;
・5-αレダクターゼI型阻害剤;
・面皰改善剤(comedolytics)、例えば、サリチル酸、アゼライン酸、硫黄、レゾルシノール
などがある。
【0296】
本明細書では、「組み合わせ」とは、本発明の化合物と、皮膚疾患または病変の治療に有用な1種または複数の追加の治療薬との全ての混合物または順序使用(permutation)を意味する。本明細書で他に明示されていない限り、「組み合わせ」には、本発明の化合物と1種または複数の治療薬との同時送達または連続送達が包含され得る。また、本明細書で他に明示されていない限り、「組み合わせ」には、本発明の化合物と(例えば、本発明の化合物と皮膚疾患の許容可能な添加剤とを含む皮膚用組成物または医薬組成物)別の治療薬との剤形が包含され得る。また、本明細書で他に明示されていない限り、「組み合わせ」には、本発明の化合物の別の治療薬との投与経路を包含し得る。また、本明細書で他に明示されていない限り、「組み合わせ」とは、本発明の化合物と別の治療薬とを含む組成物を包含し得る。剤形、投与経路、並びに、皮膚用組成物および医薬組成物は、限定されるものではないが、本明細書に記載のものが包含される。
【0297】
本明細書で引用されている全ての米国特許、米国特許出願公報、米国特許出願、外国特許、外国特許出願および非特許公報は、参照によりそれら全文を本明細書に組み入れるものとする。
【0298】
前述の発明は理解を促すためにかなり詳細に記載されているが、特定の変更および変形が添付の特許請求の範囲内で実施され得ることは明白であろう。したがって、記載した実施形態は例示として考えるべきものであって、限定的ではなく、また、本発明は本明細書に記載した詳述に限定されるものではないが、添付の特許請求の範囲内および均等物内で変更することは可能である。
【特許請求の範囲】
【請求項1】
単一立体異性体またはそれらの混合物としての式(I)で表される化合物:
【化1】

(式中、
R1は、-O-R2、-O-R3-OR2、-O-R3-OC(O)-N(R5)R6、-O-R3-N(R5)R6、-O-R3-N(R4)C(O)OR5、-O-R3-C(O)OR5、-O-R3-C(O)N(R5)R6または-N(R5)S(O)2-R4であり;
各R2は、独立して、アルキル、ハロアルキル、場合により置換されていてもよいアリール、場合により置換されていてもよいアラルキル、場合により置換されていてもよいヘテロシクリル、場合により置換されていてもよいヘテロシクリルアルキル、場合により置換されていてもよいヘテロアリール、または場合により置換されていてもよいヘテロアリールアルキルであり;
各R3は、独立して、場合により置換されていてもよいアルキレン鎖であり;
R4は、場合により置換されていてもよいアルキル、場合により置換されていてもよいアリール、場合により置換されていてもよいアラルキル、場合により置換されていてもよいヘテロアリール、または場合により置換されていてもよいヘテロアリールアルキルであり;
各R5は、独立して、水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリール、または場合により置換されていてもよいアラルキルであり;
各R6は、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアラルキル、または-R3-C(O)OR4であるか;
あるいは、任意のR5およびR6は、これらが両方とも結合されている窒素と一緒になって、場合により置換されていてもよいN-ヘテロシクリルまたは場合により置換されていてもよいN-ヘテロアリールを形成している)
で表される化合物、あるいはその製薬上許容可能な塩。
【請求項2】
R1が-O-R2であり;
R2が独立して、アルキルまたはヘテロシクリルアルキルである、
請求項1に記載の化合物。
【請求項3】
イソプロピル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
4-メチルペンチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;および、
(5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチル5-(テトラデシルオキシ)フラン-2-カルボキシレート
から選択される、請求項2に記載の化合物。
【請求項4】
R1が-O-R2であり;
R2がハロアルキルまたは置換アリールである、
請求項1に記載の化合物。
【請求項5】
2,2,2-トリフルオロエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2,2,2-トリクロロエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-ブロモエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;および、
2-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)安息香酸
から選択される請求項4に記載の化合物。
【請求項6】
R1が-O-R3-OR2であり;
R2が場合により置換されていてもよいヘテロシクリルアルキルであり;
R3が場合により置換されていてもよいアルキレン鎖である、
請求項1に記載の化合物。
【請求項7】
3-(テトラヒドロ-2H-ピラン-2-イルオキシ)プロピル5-(テトラデシルオキシ)フラン-2-カルボキシレートである、請求項6に記載の化合物。
【請求項8】
R1が-O-R3-OC(O)-N(R5)R6であり;
各R2が独立してアルキル、ハロアルキル、場合により置換されていてもよいアリール、場合により置換されていてもよいアラルキル、場合により置換されていてもよいヘテロシクリル、場合により置換されていてもよいヘテロシクリルアルキル、場合により置換されていてもよいヘテロアリールまたは場合により置換されていてもよい置換ヘテロアリールアルキルであり;
R3が場合により置換されていてもよいアルキレン鎖であり;
R5が水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリールまたは場合により置換されていてもよいアラルキルであり;および、
R6がアルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアラルキルまたは-R3-C(O)OR3であり;また、
あるいは、任意のR5およびR6は、これらが両方とも結合されている窒素と一緒になって、場合により置換されていてもよいN-ヘテロシクリルまたは場合により置換されていてもよいN-ヘテロアリールを形成している、
請求項1に記載の化合物。
【請求項9】
1-(ベンジル(メチル)カルバモイルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
1-((2-エトキシ-2-オキソエチル)(メチル)カルバモイルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
4-(2S)-2-ベンジル1-(1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチル)ピロリジン-1,2-ジカルボキシレート;
1-(4-フェニルシクロヘキサンカルボニルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチル3-フェニルピロリジン-1-カルボキシレート;
1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチル3,4-ジヒドロイソキノリン-2(1H)-カルボキシレート;
1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチルピペリジン-1-カルボキシレート;
1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチルモルホリン-4-カルボキシレート;
1-tert-ブチル4-(1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチル)ピペラジン-1,4-ジカルボキシレート;および、
1-(ジシクロヘキシルカルバモイルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレート
から選択される、請求項8に記載の化合物。
【請求項10】
R1が-O-R3-N(R5)R6であり;
R3が場合により置換されていてもよいアルキレン鎖であり;
R5が水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリールまたは場合により置換されていてもよいアラルキルであり;
R6がアルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアラルキルまたは-R3-C(O)OR4であり;また、
あるいは、任意のR5およびR6が、これらが両方とも結合されている窒素と一緒になって、場合により置換されていてもよいN-ヘテロシクリルまたは場合により置換されていてもよいN-ヘテロアリールを形成している、
請求項1に記載の化合物。
【請求項11】
2-(ジメチルアミノ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-モルホリノエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;または、
3-モルホリノプロピル5-(テトラデシルオキシ)フラン-2-カルボキシレート
から選択される、請求項10に記載の化合物。
【請求項12】
R1が-O-R3-N(R4)C(O)OR5であり;
R3が場合により置換されていてもよいアルキレン鎖であり;
R4が場合により置換されていてもよいアルキル、場合により置換されていてもよいアリール、場合により置換されていてもよいアラルキル、場合により置換されていてもよいヘテロアリールまたは場合により置換されていてもよいヘテロアリールアルキルであり;
R5が水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリールまたは場合により置換されていてもよいアラルキルである、
請求項1に記載の化合物。
【請求項13】
R1が-O-R3-C(O)OR5であり;
R3が場合により置換されていてもよいアルキレン鎖であり;
R5が水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリールまたは場合により置換されていてもよいアラルキルである、
請求項1に記載の化合物。
【請求項14】
R1が-O-R3-C(O)N(R5)R6であり;
R3が場合により置換されていてもよいアルキレン鎖であり;
R5が水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリールまたは場合により置換されていてもよいアラルキルであり;
R6がアルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアラルキルまたは-R3-C(O)OR4であるか;あるいは、
R5およびR6が、これらが両方とも結合されている窒素と一緒になって、場合により置換されていてもよいN-ヘテロシクリルまたは場合により置換されていてもよいN-ヘテロアリールを形成している、
請求項1に記載の化合物。
【請求項15】
2-(ベンジル(メチル)アミノ)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
tert-ブチル4-(2-(5-テトラデシルオキシ)フラン-2-カルボニルオキシ)アセチル)ピペラジン-1-カルボキシレート;
2-(ジシクロヘキシルアミノ)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-(4-シクロヘキシルピペラジン-1-イル)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-オキソ-2-(4-フェニルピペラジン-1-イル)エチル-5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-((2-エトキシ-2-オキソエチル)(メチル)アミノ)-2-オキソエチル5-テトラデシルオキシ)フラン-2-カルボキシレート;
2-オキソ-2-(ピペリジン-1-イル)エチル-5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-モルホリノ-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-(3,4-ジヒドロイソキノリン-2(1H)-イル)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;および、
(S)-ベンジル1-(2-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)アセチル)ピロリジン-2-カルボキシレート
から選択される、請求項14に記載の化合物。
【請求項16】
R1が-N(R5)S(O)2-R4であり;
R4が場合により置換されていてもよいアルキル、場合により置換されていてもよいアリール、場合により置換されていてもよいアラルキル、場合により置換されていてもよいヘテロアリールまたは場合により置換されていてもよいヘテロアリールアルキルであり;
R5が独立して、水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリールまたは場合により置換されていてもよいアラルキルである、
請求項1に記載の化合物。
【請求項17】
5-(テトラデシルオキシ)-N-トシルフラン-2-カルボキサミドである、請求項16に記載の化合物。
【請求項18】
皮脂腺機能亢進を特徴とする皮膚疾患または病変のあるヒトの治療で使用するための、請求項1〜17のいずれか1項に記載の化合物またはその製薬上許容可能な塩。
【請求項19】
皮膚疾患または病変が尋常性座瘡、集簇性座瘡、クロール座瘡、酒さ、酒さ鼻、脂漏、脂漏性皮膚炎、皮脂腺肥厚、マイボーム腺機能不全の顔面酒さ、細胞分裂促進性脱毛、および脂性肌からなる群から選択される、請求項18に記載の化合物。
【請求項20】
皮膚疾患が座瘡である、請求項19に記載の化合物。
【請求項21】
皮膚疾患が脂性肌である、請求項19に記載の化合物。
【請求項22】
ヒトにおける皮脂腺活性の抑制で使用するための、請求項1〜17のいずれか1項に記載の化合物またはその製薬上許容可能な塩。
【請求項23】
炎症を特徴とする疾患または病変の治療で使用するための、請求項1〜17のいずれか1項に記載の化合物またはその製薬上許容可能な塩。
【請求項24】
疾患または病変が炎症性座瘡である、請求項23に記載の化合物。
【請求項25】
炎症を特徴とする疾患または病変のあるヒトのT細胞増殖およびサイトカイン分泌の低減で使用するための、請求項1〜17のいずれか1項に記載の化合物またはその製薬上許容可能な塩。
【請求項26】
治療上有効な量の請求項1〜25のいずれか1項に記載の化合物またはその製薬上許容可能な塩と、製薬上または皮膚科学上許容可能な添加剤とを含む医薬組成物。
【請求項27】
医薬組成物が皮脂腺機能亢進を特徴とする皮膚疾患または病変のあるヒトの治療で使用するための皮膚用組成物である、請求項26に記載の医薬組成物。
【請求項28】
皮膚疾患または病変が、尋常性座瘡、集簇性座瘡、クロール座瘡、酒さ、酒さ鼻、脂漏、脂漏性皮膚炎、皮脂腺肥厚、マイボーム腺機能不全の顔面酒さ、細胞分裂促進性脱毛、および脂性肌からなる群から選択される、請求項27に記載の医薬組成物。
【請求項29】
皮膚疾患が座瘡である、請求項28に記載の医薬組成物。
【請求項30】
皮膚疾患が脂性肌である、請求項28に記載の医薬組成物。
【請求項31】
ヒトの皮脂腺活性の抑制で使用するための、請求項26に記載の医薬組成物。
【請求項32】
炎症を特徴とする疾患または病変のあるヒトの治療で使用するための、請求項26に記載の医薬組成物。
【請求項33】
疾患または病変が炎症性座瘡である、請求項32に記載の医薬組成物。
【請求項34】
炎症を特徴とする疾患または病変のあるヒトのT細胞増殖およびサイトカイン分泌の低減で使用するための、請求項26に記載の医薬組成物。
【請求項1】
単一立体異性体またはそれらの混合物としての式(I)で表される化合物:
【化1】

(式中、
R1は、-O-R2、-O-R3-OR2、-O-R3-OC(O)-N(R5)R6、-O-R3-N(R5)R6、-O-R3-N(R4)C(O)OR5、-O-R3-C(O)OR5、-O-R3-C(O)N(R5)R6または-N(R5)S(O)2-R4であり;
各R2は、独立して、アルキル、ハロアルキル、場合により置換されていてもよいアリール、場合により置換されていてもよいアラルキル、場合により置換されていてもよいヘテロシクリル、場合により置換されていてもよいヘテロシクリルアルキル、場合により置換されていてもよいヘテロアリール、または場合により置換されていてもよいヘテロアリールアルキルであり;
各R3は、独立して、場合により置換されていてもよいアルキレン鎖であり;
R4は、場合により置換されていてもよいアルキル、場合により置換されていてもよいアリール、場合により置換されていてもよいアラルキル、場合により置換されていてもよいヘテロアリール、または場合により置換されていてもよいヘテロアリールアルキルであり;
各R5は、独立して、水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリール、または場合により置換されていてもよいアラルキルであり;
各R6は、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアラルキル、または-R3-C(O)OR4であるか;
あるいは、任意のR5およびR6は、これらが両方とも結合されている窒素と一緒になって、場合により置換されていてもよいN-ヘテロシクリルまたは場合により置換されていてもよいN-ヘテロアリールを形成している)
で表される化合物、あるいはその製薬上許容可能な塩。
【請求項2】
R1が-O-R2であり;
R2が独立して、アルキルまたはヘテロシクリルアルキルである、
請求項1に記載の化合物。
【請求項3】
イソプロピル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
4-メチルペンチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;および、
(5-メチル-2-オキソ-1,3-ジオキソール-4-イル)メチル5-(テトラデシルオキシ)フラン-2-カルボキシレート
から選択される、請求項2に記載の化合物。
【請求項4】
R1が-O-R2であり;
R2がハロアルキルまたは置換アリールである、
請求項1に記載の化合物。
【請求項5】
2,2,2-トリフルオロエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2,2,2-トリクロロエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-ブロモエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;および、
2-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)安息香酸
から選択される請求項4に記載の化合物。
【請求項6】
R1が-O-R3-OR2であり;
R2が場合により置換されていてもよいヘテロシクリルアルキルであり;
R3が場合により置換されていてもよいアルキレン鎖である、
請求項1に記載の化合物。
【請求項7】
3-(テトラヒドロ-2H-ピラン-2-イルオキシ)プロピル5-(テトラデシルオキシ)フラン-2-カルボキシレートである、請求項6に記載の化合物。
【請求項8】
R1が-O-R3-OC(O)-N(R5)R6であり;
各R2が独立してアルキル、ハロアルキル、場合により置換されていてもよいアリール、場合により置換されていてもよいアラルキル、場合により置換されていてもよいヘテロシクリル、場合により置換されていてもよいヘテロシクリルアルキル、場合により置換されていてもよいヘテロアリールまたは場合により置換されていてもよい置換ヘテロアリールアルキルであり;
R3が場合により置換されていてもよいアルキレン鎖であり;
R5が水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリールまたは場合により置換されていてもよいアラルキルであり;および、
R6がアルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアラルキルまたは-R3-C(O)OR3であり;また、
あるいは、任意のR5およびR6は、これらが両方とも結合されている窒素と一緒になって、場合により置換されていてもよいN-ヘテロシクリルまたは場合により置換されていてもよいN-ヘテロアリールを形成している、
請求項1に記載の化合物。
【請求項9】
1-(ベンジル(メチル)カルバモイルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
1-((2-エトキシ-2-オキソエチル)(メチル)カルバモイルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
4-(2S)-2-ベンジル1-(1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチル)ピロリジン-1,2-ジカルボキシレート;
1-(4-フェニルシクロヘキサンカルボニルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチル3-フェニルピロリジン-1-カルボキシレート;
1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチル3,4-ジヒドロイソキノリン-2(1H)-カルボキシレート;
1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチルピペリジン-1-カルボキシレート;
1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチルモルホリン-4-カルボキシレート;
1-tert-ブチル4-(1-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)エチル)ピペラジン-1,4-ジカルボキシレート;および、
1-(ジシクロヘキシルカルバモイルオキシ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレート
から選択される、請求項8に記載の化合物。
【請求項10】
R1が-O-R3-N(R5)R6であり;
R3が場合により置換されていてもよいアルキレン鎖であり;
R5が水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリールまたは場合により置換されていてもよいアラルキルであり;
R6がアルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアラルキルまたは-R3-C(O)OR4であり;また、
あるいは、任意のR5およびR6が、これらが両方とも結合されている窒素と一緒になって、場合により置換されていてもよいN-ヘテロシクリルまたは場合により置換されていてもよいN-ヘテロアリールを形成している、
請求項1に記載の化合物。
【請求項11】
2-(ジメチルアミノ)エチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-モルホリノエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;または、
3-モルホリノプロピル5-(テトラデシルオキシ)フラン-2-カルボキシレート
から選択される、請求項10に記載の化合物。
【請求項12】
R1が-O-R3-N(R4)C(O)OR5であり;
R3が場合により置換されていてもよいアルキレン鎖であり;
R4が場合により置換されていてもよいアルキル、場合により置換されていてもよいアリール、場合により置換されていてもよいアラルキル、場合により置換されていてもよいヘテロアリールまたは場合により置換されていてもよいヘテロアリールアルキルであり;
R5が水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリールまたは場合により置換されていてもよいアラルキルである、
請求項1に記載の化合物。
【請求項13】
R1が-O-R3-C(O)OR5であり;
R3が場合により置換されていてもよいアルキレン鎖であり;
R5が水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリールまたは場合により置換されていてもよいアラルキルである、
請求項1に記載の化合物。
【請求項14】
R1が-O-R3-C(O)N(R5)R6であり;
R3が場合により置換されていてもよいアルキレン鎖であり;
R5が水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリールまたは場合により置換されていてもよいアラルキルであり;
R6がアルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアラルキルまたは-R3-C(O)OR4であるか;あるいは、
R5およびR6が、これらが両方とも結合されている窒素と一緒になって、場合により置換されていてもよいN-ヘテロシクリルまたは場合により置換されていてもよいN-ヘテロアリールを形成している、
請求項1に記載の化合物。
【請求項15】
2-(ベンジル(メチル)アミノ)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
tert-ブチル4-(2-(5-テトラデシルオキシ)フラン-2-カルボニルオキシ)アセチル)ピペラジン-1-カルボキシレート;
2-(ジシクロヘキシルアミノ)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-(4-シクロヘキシルピペラジン-1-イル)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-オキソ-2-(4-フェニルピペラジン-1-イル)エチル-5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-((2-エトキシ-2-オキソエチル)(メチル)アミノ)-2-オキソエチル5-テトラデシルオキシ)フラン-2-カルボキシレート;
2-オキソ-2-(ピペリジン-1-イル)エチル-5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-モルホリノ-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;
2-(3,4-ジヒドロイソキノリン-2(1H)-イル)-2-オキソエチル5-(テトラデシルオキシ)フラン-2-カルボキシレート;および、
(S)-ベンジル1-(2-(5-(テトラデシルオキシ)フラン-2-カルボニルオキシ)アセチル)ピロリジン-2-カルボキシレート
から選択される、請求項14に記載の化合物。
【請求項16】
R1が-N(R5)S(O)2-R4であり;
R4が場合により置換されていてもよいアルキル、場合により置換されていてもよいアリール、場合により置換されていてもよいアラルキル、場合により置換されていてもよいヘテロアリールまたは場合により置換されていてもよいヘテロアリールアルキルであり;
R5が独立して、水素、アルキル、場合により置換されていてもよいシクロアルキル、場合により置換されていてもよいアリールまたは場合により置換されていてもよいアラルキルである、
請求項1に記載の化合物。
【請求項17】
5-(テトラデシルオキシ)-N-トシルフラン-2-カルボキサミドである、請求項16に記載の化合物。
【請求項18】
皮脂腺機能亢進を特徴とする皮膚疾患または病変のあるヒトの治療で使用するための、請求項1〜17のいずれか1項に記載の化合物またはその製薬上許容可能な塩。
【請求項19】
皮膚疾患または病変が尋常性座瘡、集簇性座瘡、クロール座瘡、酒さ、酒さ鼻、脂漏、脂漏性皮膚炎、皮脂腺肥厚、マイボーム腺機能不全の顔面酒さ、細胞分裂促進性脱毛、および脂性肌からなる群から選択される、請求項18に記載の化合物。
【請求項20】
皮膚疾患が座瘡である、請求項19に記載の化合物。
【請求項21】
皮膚疾患が脂性肌である、請求項19に記載の化合物。
【請求項22】
ヒトにおける皮脂腺活性の抑制で使用するための、請求項1〜17のいずれか1項に記載の化合物またはその製薬上許容可能な塩。
【請求項23】
炎症を特徴とする疾患または病変の治療で使用するための、請求項1〜17のいずれか1項に記載の化合物またはその製薬上許容可能な塩。
【請求項24】
疾患または病変が炎症性座瘡である、請求項23に記載の化合物。
【請求項25】
炎症を特徴とする疾患または病変のあるヒトのT細胞増殖およびサイトカイン分泌の低減で使用するための、請求項1〜17のいずれか1項に記載の化合物またはその製薬上許容可能な塩。
【請求項26】
治療上有効な量の請求項1〜25のいずれか1項に記載の化合物またはその製薬上許容可能な塩と、製薬上または皮膚科学上許容可能な添加剤とを含む医薬組成物。
【請求項27】
医薬組成物が皮脂腺機能亢進を特徴とする皮膚疾患または病変のあるヒトの治療で使用するための皮膚用組成物である、請求項26に記載の医薬組成物。
【請求項28】
皮膚疾患または病変が、尋常性座瘡、集簇性座瘡、クロール座瘡、酒さ、酒さ鼻、脂漏、脂漏性皮膚炎、皮脂腺肥厚、マイボーム腺機能不全の顔面酒さ、細胞分裂促進性脱毛、および脂性肌からなる群から選択される、請求項27に記載の医薬組成物。
【請求項29】
皮膚疾患が座瘡である、請求項28に記載の医薬組成物。
【請求項30】
皮膚疾患が脂性肌である、請求項28に記載の医薬組成物。
【請求項31】
ヒトの皮脂腺活性の抑制で使用するための、請求項26に記載の医薬組成物。
【請求項32】
炎症を特徴とする疾患または病変のあるヒトの治療で使用するための、請求項26に記載の医薬組成物。
【請求項33】
疾患または病変が炎症性座瘡である、請求項32に記載の医薬組成物。
【請求項34】
炎症を特徴とする疾患または病変のあるヒトのT細胞増殖およびサイトカイン分泌の低減で使用するための、請求項26に記載の医薬組成物。
【図1】


【図2】


【図3】




【図2】


【図3】


【公表番号】特表2012−532871(P2012−532871A)
【公表日】平成24年12月20日(2012.12.20)
【国際特許分類】
【出願番号】特願2012−519602(P2012−519602)
【出願日】平成22年7月1日(2010.7.1)
【国際出願番号】PCT/US2010/040795
【国際公開番号】WO2011/005660
【国際公開日】平成23年1月13日(2011.1.13)
【出願人】(512005645)ダーミラ(カナダ),インコーポレーテッド (1)
【Fターム(参考)】
【公表日】平成24年12月20日(2012.12.20)
【国際特許分類】
【出願日】平成22年7月1日(2010.7.1)
【国際出願番号】PCT/US2010/040795
【国際公開番号】WO2011/005660
【国際公開日】平成23年1月13日(2011.1.13)
【出願人】(512005645)ダーミラ(カナダ),インコーポレーテッド (1)
【Fターム(参考)】
[ Back to top ]

