皮膚角化促進剤
【課題】皮膚のバリア機能の改善、皮膚の老化防止に有用な皮膚角化促進剤を提供する。
【解決手段】アコヤ貝の貝殻もしくは真珠断片またはこれらの粉末が産出するナクレインタンパク質を含み、このナクレインタンパク質は、(I)アコヤ貝等をキレート剤で脱灰して得られる物質を抽出して得られるタンパク質であるか、(II)この抽出物質と大腸菌、酵母菌、または蚕のいずれか1つから選択される宿主細胞とを利用して遺伝子工学的に製造されるタンパク質である。
【解決手段】アコヤ貝の貝殻もしくは真珠断片またはこれらの粉末が産出するナクレインタンパク質を含み、このナクレインタンパク質は、(I)アコヤ貝等をキレート剤で脱灰して得られる物質を抽出して得られるタンパク質であるか、(II)この抽出物質と大腸菌、酵母菌、または蚕のいずれか1つから選択される宿主細胞とを利用して遺伝子工学的に製造されるタンパク質である。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は皮膚の角化促進剤に関し、特にナクレインタンパク質を含む角化促進剤に関する。
【背景技術】
【0002】
皮膚は体の最も外側に存在しており、細菌などの外界からの刺激に対するバリアとなっている。皮膚は、角質細胞が基底細胞から有棘細胞、顆粒細胞、さらには角層細胞へと約4週間かけて変化(角化)し、これらの細胞中で細胞間脂質やNMF、さらにはコーニファイドエンベローブを形成することによってバリア機能を成し遂げている。しかし老化等によってこの角化の速度が低下すると、皮膚のくすみや肌荒れなどを引き起こすことが知られている。そのため皮膚の角化を促進する角化促進剤が開発されてきた。
例えば、皮膚の角化とともにコーニファイドエンベローブの成分として生成されるタンパク質であるソラヤシンの発現量を指標として、このソラヤシン発現が増強される物質を研究した結果、酪酸またはその誘導体、およびカルシウムイオン供給化合物を含有する皮膚角化促進剤が知られている(特許文献1)。
【0003】
また、タイソウ抽出物を有効成分として含有することを特徴とする表皮角化細胞増殖促進剤(特許文献2)、ハス胚芽抽出物を含有することを特徴とする表皮角化細胞増殖促進剤(特許文献3)がそれぞれ知られている。
【0004】
一方、アコヤガイの貝殻は、炭酸カルシウムを主成分としており、貝殻外側の稜柱層は炭酸カルシウムとタンパク質が交互に重なった層状構造をなしている。この層状構造は、外套膜の表面で構築され、通常は血流に乗って運ばれてきたカルシウムイオンが外套膜より分泌されたタンパク質の触媒作用下に生成された炭酸イオンと結合し炭酸カルシウムの結晶としてタンパク質層の上に沈着して形成される。貝殻中に存在するタンパク質には、この結晶の大きさや真珠層の幅を制御している酸不溶性のタンパク質であるコンキオリンを始め、多数のタンパク質が知られている。その中で炭酸脱水素ドメインとGly−Xaa−Asn(ここで、Xaa=Asp、Asn、Glu)ドメインから構成されているナクレインがある(非特許文献1)。
また、遺伝子工学的に産生される真珠タンパク質(ナクレイン)の製造方法が開示されている(特許文献4)。
また、粒度50〜200μmに粉砕した真珠層をグアニジン塩酸塩で抽出したタンパク質成分を医薬目的の使用、およびそれらを含む組成物に利用する方法が知られている(特許文献5)。
【0005】
しかしながら、従来の角化促進成分の作用は十分ではなく、また、ナクレインタンパク質が皮膚角化促進剤として使用できることは、従来知られていなかった。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2009−155269公報
【特許文献2】特開2006−316028号公報
【特許文献3】特開2002−68993号公報
【特許文献4】国際公開WO96/35786号公報
【特許文献5】特表2000−504314号公報
【非特許文献】
【0007】
【非特許文献1】Miyamoto et al.Proc.Natl. Acad. Sci. USA, 93, 9657−9660(1996)
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、上記問題に対処するためになされたものであり、皮膚のバリア機能の改善、皮膚の老化防止に有用な皮膚角化促進剤の提供を目的とする。
【課題を解決するための手段】
【0009】
アコヤ貝貝殻中のナクレインタンパク質はカルシウムを結合・運搬し貝殻を形成する役割を担っている。一方、皮膚は角質細胞が基底細胞から有棘細胞、顆粒細胞、さらには角層細胞へと約4週間かけて分化し、この分化につれてカルシウム濃度が高くなる。ナクレインタンパク質が皮膚の分化にどのように作用するのか試験した結果、皮膚の分化に関連の深いS100A7遺伝子の発現が確認された。本発明は、このような知見に基づくものである。
すなわち、本発明の皮膚角化促進剤は、貝殻もしくは真珠断片またはこれらの粉末由来のナクレインタンパク質を含むことを特徴とする。特に貝殻がアコヤ貝の貝殻であることを特徴とする。
また、上記ナクレインタンパク質が貝殻もしくは真珠断片またはこれらの粉末をキレート剤で脱灰して得られる物質からの抽出物であることを特徴とする。
また、上記ナクレインタンパク質は、貝殻もしくは真珠断片またはこれらの粉末をキレート剤で脱灰して得られる物質からの抽出物と、大腸菌、酵母菌、または蚕のいずれか1つから選択される宿主細胞とを利用して遺伝子工学的に製造されるタンパク質であることを特徴とする。
【発明の効果】
【0010】
本発明は、ナクレインタンパク質を配合するため、皮膚のバリア機能の改善、皮膚の老化防止に有用な皮膚角化促進剤が得られる。
【図面の簡単な説明】
【0011】
【図1】イオン交換クロマトグラフィー溶出画分のSDS−PAGE結果を示す図である。
【図2】S100A7の遺伝子発現量の結果を示す図である。
【発明を実施するための形態】
【0012】
ナクレインタンパク質は、(I)貝殻、特にアコヤ貝の貝殻もしくは真珠断片またはこれらの粉末をキレート剤で脱灰して得られる物質を抽出する方法、(II)上記(I)の方法で得られるタンパク質を大腸菌、酵母菌、または蚕のいずれか1つから選択される宿主細胞とを利用する方法により製造される。
上記(I)の方法について説明する。
本発明で好ましく使用できる貝殻としては、特に限定はなくアコヤ貝(Pictada martensii)、イガイ(Mytilus coruscum)、イケチョウガイ(Hyriopsis schlegelii)、カラスガイ(Cristaria plicata)等ウグイスガイ科、イガイ科、イシガイ科の貝類等が例示される。特に好適なものは、真珠養殖などで多量に得られるアコヤ貝(真珠貝)である。
真珠断片とは、真珠を割り核を取り除いた破砕片である。真珠断片の製造方法は粉砕するのではなく真珠をそのまままたは複数個の断片に割ることにより得られる。真珠としては、アコヤ貝、イケチョウ貝などの真珠貝より得られる球体真珠、マベ貝より得られるマベ半円真珠殻などが挙げられる。
【0013】
本発明の皮膚角化促進剤に用いられるナクレインタンパク質は、貝殻もしくは真珠断片またはこれらの粉末を水に分散する工程と、上記分散された貝殻もしくは断片またはこれらの粉末に含まれるカルシウムイオンに対して等モル以上のキレート剤を加えて脱灰する工程を経て製造される物質を原料とする。
これより、酸に溶解する物質を抽出するか、イオン交換樹脂や、分子量分画、吸着樹脂等の1種または2種以上の方法を適用して、ナクレインタンパク質あるいはナクレインタンパク質を含む分画を製造できる。
【0014】
キレート剤で脱灰して得られる物質を抽出する方法は、貝殻等をキレート剤で脱灰して得られる物質を抽出する方法である。
脱灰処理に使用できるキレート剤としては、エチレンジアミン四酢酸塩、1−ヒドロキシエタン−1,1−ジフォスホン酸、1−ヒドロキシエタン−1,1−ジフォスホン酸四ナトリウム塩、クエン酸ナトリウム、ポリリン酸ナトリウム、メタリン酸ナトリウム、グルコン酸等のキレート剤であれば用いることができる。
これらの中でエチレンジアミン四酢酸塩が、他のキレート剤より効率的に脱灰処理を行なえるので好ましい。エチレンジアミン四酢酸塩としては、二ナトリウム塩、三ナトリウム塩、四ナトリウム塩等いずれも使用できる。
【0015】
アコヤ貝の貝殻を原料とする脱灰処理方法について以下説明する。
(1)必要により、アコヤ貝貝殻を破砕して貝殻断片とする。
アコヤ貝貝殻は破砕する前に回転バレル研磨機、振動バレル研磨機等を用いて稜柱層を取り除くことが好ましい。稜柱層を取り除くことにより脱灰時間を短くすることができる。
また、破砕する場合、その方法は、回転バレル研磨機、振動バレル研磨機等で稜柱層を取り除く工程でその研磨強度を調整することによって行なうか、別途、ハンマーミル等で行なう。
【0016】
(2)アコヤ貝貝殻断片または粉末を水に分散させて、この断片等に含まれるカルシウムイオンに対して等モル以上のエチレンジアミン四酢酸塩を加える。
アコヤ貝貝殻に含まれるタンパク質(約2重量%)を考慮して、また、貝殻断片が炭酸カルシウムとして、カルシウムイオン量を算出する。エチレンジアミン四酢酸塩は少なくとも1個のカルシウムイオンとキレートを形成するので、エチレンジアミン四酢酸塩はカルシウムイオンに対して等モル以上使用する。好ましくは等モル〜5倍等モル量である。
また、エチレンジアミン四酢酸塩は水に溶解し難いため、水に分散されているアコヤ貝貝殻の量が多い場合、あるいはエチレンジアミン四酢酸塩の濃度を高める場合には、アコヤ貝貝殻を分散させている水のpHを、水酸化ナトリウムなどのアルカリを添加することで、pH7.0〜9.0に調整することが好ましい。
分散液の条件として、分散されるアコヤ貝貝殻の濃度は、0.1〜10重量%、好ましくは0.5〜3重量%である。0.1重量%未満であるとナクレインタンパク質の生産性が劣り、10重量%をこえると脱灰処理に長い時間がかかる。
【0017】
(3)上記分散液を、好ましくは穏やかな条件で撹拌する。ここで穏やかな条件とは、アコヤ貝貝殻の脱灰処理により炭酸カルシウムが除去されてナクレインタンパク質を含む溶液を得られる条件をいう。
【0018】
得られた溶液から水、好ましくは酸により、それらに溶解する物質を抽出するか、イオン交換樹脂や、分子量分画、吸着樹脂等の1種または2種以上の方法を適用して、ナクレインあるいはナクレインを含む分画を得る。
【0019】
上記ナクレインタンパク質は、SDS−ポリアクリルアミドゲル電気泳動(SDS−PAGE)により分析した結果、分子量約55kDaのタンパク質である。本発明においては、この特定の分子量を有するタンパク質と同時に、イオン交換クロマトグラフィーを用いて精製されるナクレインを含む分画物も利用できる。
【0020】
上記(I)の方法で得られるナクレインタンパク質は、大腸菌、酵母菌、または蚕のいずれか1つから選択される宿主細胞とを利用して、公知の遺伝子工学的に多量に製造することができる(上記(II)の方法)。例えば、国際公開番号WO96/35786号公報記載の方法で製造できる。
【0021】
本発明の皮膚角化促進剤は、皮膚角化促進剤の形態で皮膚に適用される。また、皮膚角化促進剤は、皮膚化粧料、外用医薬部外品、医療用皮膚外用剤に配合できる。
【0022】
また、本発明の皮膚角化促進剤には、上記成分の他に医薬品や化粧品の各種製剤において使用されている界面活性剤、油性成分、保湿剤、高分子化合物、紫外線吸収剤、抗炎症剤、殺菌剤、酸化防止剤、金属イオン封鎖剤、防腐剤、ビタミン類、色素、香料、水等を配合することができる。
ナクレインタンパク質の配合割合としては、皮膚角化促進剤全体に対して、0.00001〜1.0重量%で、好ましくは0.001〜0.5重量%である。
【0023】
本発明の皮膚角化促進剤は、常法に従い、通常の皮膚角化促進剤として知られる種々の形態の基材に配合して調製することができる。その形態としては、特に限定されず、例えば、ローション類、乳液類、クリーム類、軟膏類、パック類等の任意の剤形を選択することができる。
【実施例】
【0024】
実施例1
ナクレインタンパク質を以下の方法で製造した。
アコヤ貝貝殻の稜柱層を、バレル研磨機を用いて取り除いた。稜柱層を取り除き真珠層が主成分となった貝殻粉末200gに、水酸化ナトリウムでpH8.0に調整した0.5MのEDTA水溶液を1000ml加えて、72時間、温度4℃で撹拌した。
撹拌により得られた溶液を8270Gの遠心力で30分間遠心分離した。上清を、30mMトリス−塩酸緩衝液(pH8.0)で、セロハンチューブ(三光純薬社製、商品名セルロースチューブC−150)を用いて透析した。透析外液は1回4000ml使用し、3回交換した。透析後、さらに8270Gの遠心力で30分間遠心分離した。上清を、目の粗さ0.45μmのフィルターでろ過した。以上の遠心分離および透析操作を4℃で行なった。
【0025】
上記抽出液をイオン交換クロマトグラフィーを用いて精製した。イオン交換クロマトグラフィーの分取条件を以下に示す。
カラム:TSKgel DEAE−5PW(東ソー社製 55.0mmΦ×20.0cmL)
移動層:30mMトリス−塩酸緩衝液(pH8.0)0.5〜1.0M塩化ナトリウムグラジエント、なお、塩化ナトリウムは0.5Mで60分間流した後、150分かけて1.0Mにした。
流速 :6.0ml/min.
検出器:紫外線吸光度検出器280nm
分画 :5分間隔
なお、分画は60分後のグラジエント開始より検出器で確認しながら、吸光し始めた時点より開始した。
【0026】
結果を図1に示す。図1はイオン交換クロマトグラフィー溶出画分のSDS−PAGE結果を示す。
フラクションNo.4を分取して、蒸留水を外液として透析を行なった。透析外液は1回2000ml使用し3回交換した。透析内液を凍結乾燥した。分取されたフラクションNo.4の成分は、分子量55kDaのタンパク質であり、このタンパク質はナクレインであることが、MALDI−TOF MSに供し、得られたアミノ酸配列をMascotで相同性検索した結果より明らかとなった。
【0027】
上記ナクレインタンパク質のヒト由来表皮細胞に対する影響を確認するため、表皮の分化に関わる代表的なタンパク質であるS100A7の遺伝子発現の変化を、リアルタイムPCRを用いて評価した。
S100A7は、乾癬の皮膚に過剰発現している分泌タンパク質として最初に同定されたタンパク質であり多くの炎症性疾患においても、過剰発現が確認されている。またS100A7は、体の表面でバクテリアを殺す働きがある。従って抗菌タンパク質であることが明らかとなっている。
【0028】
<細胞培養>
2継代目のヒト包皮由来表皮細胞(クラボウ、StrainNo.445529)を50−70%コンフルエントとなるようHuMedia−KG2培地(フェノールレッド不含)で培養後、カルシウム濃度が0.5mMおよび1.8mMの2種類のHuMedia−KG2培地に、10μMおよび100μΜ(終濃度)となるよう添加し、さらに2日間37℃、5%CO2インキュベータ中で8日間培養した。
【0029】
<RNAの抽出>
細胞からの Total RNAの抽出は、トリプシン/EDTAで剥離後、SV Total RNA Isolation System(プロメガ社)を用い、プロメガ社の添付マニュアル(日本語プロトコールNoTM048J2001年6月作成)に従い調製した。RNA濃度は、NanoDrop1000(Thermo SCIENTIFIC)を用い算出した。
【0030】
<RT反応およびリアルタイムPCR>
2.5μgのTotal RNAを使い、MMLV Reverse Transcriptase RNaseH−(東洋紡社)を用い、東洋紡社推奨プロトコール(TOYOBO BIOCHEMICALS FOR LIFE SCIENCE 2008/2009のページ1−42)に従いRT反応を行なった。
リアルタイムPCRはAppliedBiosystems 7500 リアルタイムPCR Systemを用い、以下のように実施した。SYBR Green法を用い(THUNDERBIRD SYBR qPCR Mix,東洋紡社)、7500 リアルタイムPCR Systemの操作マニュアル(AppliedBiosystems)を用いて、Comparative CT(△△CT)法(n=3)により遺伝子発現比較を実施した。内部標準としてGAPDHを使用した。
【0031】
<使用プライマー>
S100A7:フォワードプライマーがTGCTGACGATGATGAAGGAGの塩基配列と、リバースプライマーがATGTCTCCCAGCAAGGACAGの塩基配列とのセット
GAPDH:フォワードプライマーがGAGTCAACGGATTTGGTCGTの塩基配列と、リバースプライマーがTTGATTTTGGAGGGATCTCGの塩基配列とのセット
【0032】
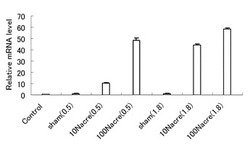
図2にリアルタイムPCRの結果を示す。図2は、増殖培地(カルシウム濃度を0.15mM)を1としたときの相対値で表したS100A7の遺伝子発現量である。
カルシウムは皮膚の分化に影響を及ぼす最もよく知られた成分で、表皮基底層から有棘層、顆粒層と分化が進むに従い、その濃度も高くなることが知られている。ナクレインタンパク質の皮膚の分化に対する作用を確認する目的で、中濃度(0.5mM)ならびに高濃度(1.8mM)のカルシウムの存在下で、10μΜおよび100μΜのナクレインタンパク質を作用し、表皮の分化と関連の深い、S100A7の遺伝子発現量の変化をリアルタイムPCRを用い確認した。その結果、図2に示すように、カルシウム濃度による差は多少認められるが、S100A7が非常に強く誘導されることが判明した。
【0033】
S100A7は、皮膚の角化とともにコーニファイドエンベローブの成分として生成されることが知られており、皮膚角化の指標として有用である。本発明の皮膚角化促進剤は、このS100A7の発現を顕著に増強させる。また、S100A7は、コーニファイドエンベローブの成分であるから、本発明の皮膚角化促進剤を用いれば、皮膚のバリア機能が改善される。また、S100A7は抗菌作用を有することが知られているため、本発明皮膚角化促進剤を用いれば、皮膚の抗菌作用が増強され、バリア機能が増大する。
【産業上の利用可能性】
【0034】
本発明は皮膚のバリア機能の改善、皮膚の老化防止に有用な皮膚角化促進剤が得られるため、滑らかな皮膚形成に役立つ基礎化粧品素材の開発が可能となる。
【技術分野】
【0001】
本発明は皮膚の角化促進剤に関し、特にナクレインタンパク質を含む角化促進剤に関する。
【背景技術】
【0002】
皮膚は体の最も外側に存在しており、細菌などの外界からの刺激に対するバリアとなっている。皮膚は、角質細胞が基底細胞から有棘細胞、顆粒細胞、さらには角層細胞へと約4週間かけて変化(角化)し、これらの細胞中で細胞間脂質やNMF、さらにはコーニファイドエンベローブを形成することによってバリア機能を成し遂げている。しかし老化等によってこの角化の速度が低下すると、皮膚のくすみや肌荒れなどを引き起こすことが知られている。そのため皮膚の角化を促進する角化促進剤が開発されてきた。
例えば、皮膚の角化とともにコーニファイドエンベローブの成分として生成されるタンパク質であるソラヤシンの発現量を指標として、このソラヤシン発現が増強される物質を研究した結果、酪酸またはその誘導体、およびカルシウムイオン供給化合物を含有する皮膚角化促進剤が知られている(特許文献1)。
【0003】
また、タイソウ抽出物を有効成分として含有することを特徴とする表皮角化細胞増殖促進剤(特許文献2)、ハス胚芽抽出物を含有することを特徴とする表皮角化細胞増殖促進剤(特許文献3)がそれぞれ知られている。
【0004】
一方、アコヤガイの貝殻は、炭酸カルシウムを主成分としており、貝殻外側の稜柱層は炭酸カルシウムとタンパク質が交互に重なった層状構造をなしている。この層状構造は、外套膜の表面で構築され、通常は血流に乗って運ばれてきたカルシウムイオンが外套膜より分泌されたタンパク質の触媒作用下に生成された炭酸イオンと結合し炭酸カルシウムの結晶としてタンパク質層の上に沈着して形成される。貝殻中に存在するタンパク質には、この結晶の大きさや真珠層の幅を制御している酸不溶性のタンパク質であるコンキオリンを始め、多数のタンパク質が知られている。その中で炭酸脱水素ドメインとGly−Xaa−Asn(ここで、Xaa=Asp、Asn、Glu)ドメインから構成されているナクレインがある(非特許文献1)。
また、遺伝子工学的に産生される真珠タンパク質(ナクレイン)の製造方法が開示されている(特許文献4)。
また、粒度50〜200μmに粉砕した真珠層をグアニジン塩酸塩で抽出したタンパク質成分を医薬目的の使用、およびそれらを含む組成物に利用する方法が知られている(特許文献5)。
【0005】
しかしながら、従来の角化促進成分の作用は十分ではなく、また、ナクレインタンパク質が皮膚角化促進剤として使用できることは、従来知られていなかった。
【先行技術文献】
【特許文献】
【0006】
【特許文献1】特開2009−155269公報
【特許文献2】特開2006−316028号公報
【特許文献3】特開2002−68993号公報
【特許文献4】国際公開WO96/35786号公報
【特許文献5】特表2000−504314号公報
【非特許文献】
【0007】
【非特許文献1】Miyamoto et al.Proc.Natl. Acad. Sci. USA, 93, 9657−9660(1996)
【発明の概要】
【発明が解決しようとする課題】
【0008】
本発明は、上記問題に対処するためになされたものであり、皮膚のバリア機能の改善、皮膚の老化防止に有用な皮膚角化促進剤の提供を目的とする。
【課題を解決するための手段】
【0009】
アコヤ貝貝殻中のナクレインタンパク質はカルシウムを結合・運搬し貝殻を形成する役割を担っている。一方、皮膚は角質細胞が基底細胞から有棘細胞、顆粒細胞、さらには角層細胞へと約4週間かけて分化し、この分化につれてカルシウム濃度が高くなる。ナクレインタンパク質が皮膚の分化にどのように作用するのか試験した結果、皮膚の分化に関連の深いS100A7遺伝子の発現が確認された。本発明は、このような知見に基づくものである。
すなわち、本発明の皮膚角化促進剤は、貝殻もしくは真珠断片またはこれらの粉末由来のナクレインタンパク質を含むことを特徴とする。特に貝殻がアコヤ貝の貝殻であることを特徴とする。
また、上記ナクレインタンパク質が貝殻もしくは真珠断片またはこれらの粉末をキレート剤で脱灰して得られる物質からの抽出物であることを特徴とする。
また、上記ナクレインタンパク質は、貝殻もしくは真珠断片またはこれらの粉末をキレート剤で脱灰して得られる物質からの抽出物と、大腸菌、酵母菌、または蚕のいずれか1つから選択される宿主細胞とを利用して遺伝子工学的に製造されるタンパク質であることを特徴とする。
【発明の効果】
【0010】
本発明は、ナクレインタンパク質を配合するため、皮膚のバリア機能の改善、皮膚の老化防止に有用な皮膚角化促進剤が得られる。
【図面の簡単な説明】
【0011】
【図1】イオン交換クロマトグラフィー溶出画分のSDS−PAGE結果を示す図である。
【図2】S100A7の遺伝子発現量の結果を示す図である。
【発明を実施するための形態】
【0012】
ナクレインタンパク質は、(I)貝殻、特にアコヤ貝の貝殻もしくは真珠断片またはこれらの粉末をキレート剤で脱灰して得られる物質を抽出する方法、(II)上記(I)の方法で得られるタンパク質を大腸菌、酵母菌、または蚕のいずれか1つから選択される宿主細胞とを利用する方法により製造される。
上記(I)の方法について説明する。
本発明で好ましく使用できる貝殻としては、特に限定はなくアコヤ貝(Pictada martensii)、イガイ(Mytilus coruscum)、イケチョウガイ(Hyriopsis schlegelii)、カラスガイ(Cristaria plicata)等ウグイスガイ科、イガイ科、イシガイ科の貝類等が例示される。特に好適なものは、真珠養殖などで多量に得られるアコヤ貝(真珠貝)である。
真珠断片とは、真珠を割り核を取り除いた破砕片である。真珠断片の製造方法は粉砕するのではなく真珠をそのまままたは複数個の断片に割ることにより得られる。真珠としては、アコヤ貝、イケチョウ貝などの真珠貝より得られる球体真珠、マベ貝より得られるマベ半円真珠殻などが挙げられる。
【0013】
本発明の皮膚角化促進剤に用いられるナクレインタンパク質は、貝殻もしくは真珠断片またはこれらの粉末を水に分散する工程と、上記分散された貝殻もしくは断片またはこれらの粉末に含まれるカルシウムイオンに対して等モル以上のキレート剤を加えて脱灰する工程を経て製造される物質を原料とする。
これより、酸に溶解する物質を抽出するか、イオン交換樹脂や、分子量分画、吸着樹脂等の1種または2種以上の方法を適用して、ナクレインタンパク質あるいはナクレインタンパク質を含む分画を製造できる。
【0014】
キレート剤で脱灰して得られる物質を抽出する方法は、貝殻等をキレート剤で脱灰して得られる物質を抽出する方法である。
脱灰処理に使用できるキレート剤としては、エチレンジアミン四酢酸塩、1−ヒドロキシエタン−1,1−ジフォスホン酸、1−ヒドロキシエタン−1,1−ジフォスホン酸四ナトリウム塩、クエン酸ナトリウム、ポリリン酸ナトリウム、メタリン酸ナトリウム、グルコン酸等のキレート剤であれば用いることができる。
これらの中でエチレンジアミン四酢酸塩が、他のキレート剤より効率的に脱灰処理を行なえるので好ましい。エチレンジアミン四酢酸塩としては、二ナトリウム塩、三ナトリウム塩、四ナトリウム塩等いずれも使用できる。
【0015】
アコヤ貝の貝殻を原料とする脱灰処理方法について以下説明する。
(1)必要により、アコヤ貝貝殻を破砕して貝殻断片とする。
アコヤ貝貝殻は破砕する前に回転バレル研磨機、振動バレル研磨機等を用いて稜柱層を取り除くことが好ましい。稜柱層を取り除くことにより脱灰時間を短くすることができる。
また、破砕する場合、その方法は、回転バレル研磨機、振動バレル研磨機等で稜柱層を取り除く工程でその研磨強度を調整することによって行なうか、別途、ハンマーミル等で行なう。
【0016】
(2)アコヤ貝貝殻断片または粉末を水に分散させて、この断片等に含まれるカルシウムイオンに対して等モル以上のエチレンジアミン四酢酸塩を加える。
アコヤ貝貝殻に含まれるタンパク質(約2重量%)を考慮して、また、貝殻断片が炭酸カルシウムとして、カルシウムイオン量を算出する。エチレンジアミン四酢酸塩は少なくとも1個のカルシウムイオンとキレートを形成するので、エチレンジアミン四酢酸塩はカルシウムイオンに対して等モル以上使用する。好ましくは等モル〜5倍等モル量である。
また、エチレンジアミン四酢酸塩は水に溶解し難いため、水に分散されているアコヤ貝貝殻の量が多い場合、あるいはエチレンジアミン四酢酸塩の濃度を高める場合には、アコヤ貝貝殻を分散させている水のpHを、水酸化ナトリウムなどのアルカリを添加することで、pH7.0〜9.0に調整することが好ましい。
分散液の条件として、分散されるアコヤ貝貝殻の濃度は、0.1〜10重量%、好ましくは0.5〜3重量%である。0.1重量%未満であるとナクレインタンパク質の生産性が劣り、10重量%をこえると脱灰処理に長い時間がかかる。
【0017】
(3)上記分散液を、好ましくは穏やかな条件で撹拌する。ここで穏やかな条件とは、アコヤ貝貝殻の脱灰処理により炭酸カルシウムが除去されてナクレインタンパク質を含む溶液を得られる条件をいう。
【0018】
得られた溶液から水、好ましくは酸により、それらに溶解する物質を抽出するか、イオン交換樹脂や、分子量分画、吸着樹脂等の1種または2種以上の方法を適用して、ナクレインあるいはナクレインを含む分画を得る。
【0019】
上記ナクレインタンパク質は、SDS−ポリアクリルアミドゲル電気泳動(SDS−PAGE)により分析した結果、分子量約55kDaのタンパク質である。本発明においては、この特定の分子量を有するタンパク質と同時に、イオン交換クロマトグラフィーを用いて精製されるナクレインを含む分画物も利用できる。
【0020】
上記(I)の方法で得られるナクレインタンパク質は、大腸菌、酵母菌、または蚕のいずれか1つから選択される宿主細胞とを利用して、公知の遺伝子工学的に多量に製造することができる(上記(II)の方法)。例えば、国際公開番号WO96/35786号公報記載の方法で製造できる。
【0021】
本発明の皮膚角化促進剤は、皮膚角化促進剤の形態で皮膚に適用される。また、皮膚角化促進剤は、皮膚化粧料、外用医薬部外品、医療用皮膚外用剤に配合できる。
【0022】
また、本発明の皮膚角化促進剤には、上記成分の他に医薬品や化粧品の各種製剤において使用されている界面活性剤、油性成分、保湿剤、高分子化合物、紫外線吸収剤、抗炎症剤、殺菌剤、酸化防止剤、金属イオン封鎖剤、防腐剤、ビタミン類、色素、香料、水等を配合することができる。
ナクレインタンパク質の配合割合としては、皮膚角化促進剤全体に対して、0.00001〜1.0重量%で、好ましくは0.001〜0.5重量%である。
【0023】
本発明の皮膚角化促進剤は、常法に従い、通常の皮膚角化促進剤として知られる種々の形態の基材に配合して調製することができる。その形態としては、特に限定されず、例えば、ローション類、乳液類、クリーム類、軟膏類、パック類等の任意の剤形を選択することができる。
【実施例】
【0024】
実施例1
ナクレインタンパク質を以下の方法で製造した。
アコヤ貝貝殻の稜柱層を、バレル研磨機を用いて取り除いた。稜柱層を取り除き真珠層が主成分となった貝殻粉末200gに、水酸化ナトリウムでpH8.0に調整した0.5MのEDTA水溶液を1000ml加えて、72時間、温度4℃で撹拌した。
撹拌により得られた溶液を8270Gの遠心力で30分間遠心分離した。上清を、30mMトリス−塩酸緩衝液(pH8.0)で、セロハンチューブ(三光純薬社製、商品名セルロースチューブC−150)を用いて透析した。透析外液は1回4000ml使用し、3回交換した。透析後、さらに8270Gの遠心力で30分間遠心分離した。上清を、目の粗さ0.45μmのフィルターでろ過した。以上の遠心分離および透析操作を4℃で行なった。
【0025】
上記抽出液をイオン交換クロマトグラフィーを用いて精製した。イオン交換クロマトグラフィーの分取条件を以下に示す。
カラム:TSKgel DEAE−5PW(東ソー社製 55.0mmΦ×20.0cmL)
移動層:30mMトリス−塩酸緩衝液(pH8.0)0.5〜1.0M塩化ナトリウムグラジエント、なお、塩化ナトリウムは0.5Mで60分間流した後、150分かけて1.0Mにした。
流速 :6.0ml/min.
検出器:紫外線吸光度検出器280nm
分画 :5分間隔
なお、分画は60分後のグラジエント開始より検出器で確認しながら、吸光し始めた時点より開始した。
【0026】
結果を図1に示す。図1はイオン交換クロマトグラフィー溶出画分のSDS−PAGE結果を示す。
フラクションNo.4を分取して、蒸留水を外液として透析を行なった。透析外液は1回2000ml使用し3回交換した。透析内液を凍結乾燥した。分取されたフラクションNo.4の成分は、分子量55kDaのタンパク質であり、このタンパク質はナクレインであることが、MALDI−TOF MSに供し、得られたアミノ酸配列をMascotで相同性検索した結果より明らかとなった。
【0027】
上記ナクレインタンパク質のヒト由来表皮細胞に対する影響を確認するため、表皮の分化に関わる代表的なタンパク質であるS100A7の遺伝子発現の変化を、リアルタイムPCRを用いて評価した。
S100A7は、乾癬の皮膚に過剰発現している分泌タンパク質として最初に同定されたタンパク質であり多くの炎症性疾患においても、過剰発現が確認されている。またS100A7は、体の表面でバクテリアを殺す働きがある。従って抗菌タンパク質であることが明らかとなっている。
【0028】
<細胞培養>
2継代目のヒト包皮由来表皮細胞(クラボウ、StrainNo.445529)を50−70%コンフルエントとなるようHuMedia−KG2培地(フェノールレッド不含)で培養後、カルシウム濃度が0.5mMおよび1.8mMの2種類のHuMedia−KG2培地に、10μMおよび100μΜ(終濃度)となるよう添加し、さらに2日間37℃、5%CO2インキュベータ中で8日間培養した。
【0029】
<RNAの抽出>
細胞からの Total RNAの抽出は、トリプシン/EDTAで剥離後、SV Total RNA Isolation System(プロメガ社)を用い、プロメガ社の添付マニュアル(日本語プロトコールNoTM048J2001年6月作成)に従い調製した。RNA濃度は、NanoDrop1000(Thermo SCIENTIFIC)を用い算出した。
【0030】
<RT反応およびリアルタイムPCR>
2.5μgのTotal RNAを使い、MMLV Reverse Transcriptase RNaseH−(東洋紡社)を用い、東洋紡社推奨プロトコール(TOYOBO BIOCHEMICALS FOR LIFE SCIENCE 2008/2009のページ1−42)に従いRT反応を行なった。
リアルタイムPCRはAppliedBiosystems 7500 リアルタイムPCR Systemを用い、以下のように実施した。SYBR Green法を用い(THUNDERBIRD SYBR qPCR Mix,東洋紡社)、7500 リアルタイムPCR Systemの操作マニュアル(AppliedBiosystems)を用いて、Comparative CT(△△CT)法(n=3)により遺伝子発現比較を実施した。内部標準としてGAPDHを使用した。
【0031】
<使用プライマー>
S100A7:フォワードプライマーがTGCTGACGATGATGAAGGAGの塩基配列と、リバースプライマーがATGTCTCCCAGCAAGGACAGの塩基配列とのセット
GAPDH:フォワードプライマーがGAGTCAACGGATTTGGTCGTの塩基配列と、リバースプライマーがTTGATTTTGGAGGGATCTCGの塩基配列とのセット
【0032】
図2にリアルタイムPCRの結果を示す。図2は、増殖培地(カルシウム濃度を0.15mM)を1としたときの相対値で表したS100A7の遺伝子発現量である。
カルシウムは皮膚の分化に影響を及ぼす最もよく知られた成分で、表皮基底層から有棘層、顆粒層と分化が進むに従い、その濃度も高くなることが知られている。ナクレインタンパク質の皮膚の分化に対する作用を確認する目的で、中濃度(0.5mM)ならびに高濃度(1.8mM)のカルシウムの存在下で、10μΜおよび100μΜのナクレインタンパク質を作用し、表皮の分化と関連の深い、S100A7の遺伝子発現量の変化をリアルタイムPCRを用い確認した。その結果、図2に示すように、カルシウム濃度による差は多少認められるが、S100A7が非常に強く誘導されることが判明した。
【0033】
S100A7は、皮膚の角化とともにコーニファイドエンベローブの成分として生成されることが知られており、皮膚角化の指標として有用である。本発明の皮膚角化促進剤は、このS100A7の発現を顕著に増強させる。また、S100A7は、コーニファイドエンベローブの成分であるから、本発明の皮膚角化促進剤を用いれば、皮膚のバリア機能が改善される。また、S100A7は抗菌作用を有することが知られているため、本発明皮膚角化促進剤を用いれば、皮膚の抗菌作用が増強され、バリア機能が増大する。
【産業上の利用可能性】
【0034】
本発明は皮膚のバリア機能の改善、皮膚の老化防止に有用な皮膚角化促進剤が得られるため、滑らかな皮膚形成に役立つ基礎化粧品素材の開発が可能となる。
【特許請求の範囲】
【請求項1】
貝殻もしくは真珠断片またはこれらの粉末由来のナクレインタンパク質を含むことを特徴とする皮膚角化促進剤。
【請求項2】
前記貝殻がアコヤ貝であることを特徴とする請求項1記載の皮膚角化促進剤。
【請求項3】
前記ナクレインタンパク質が前記貝殻もしくは真珠断片またはこれらの粉末をキレート剤で脱灰して得られる物質からの抽出物であることを特徴とする請求項1または請求項2記載の皮膚角化促進剤。
【請求項4】
前記ナクレインタンパク質が前記抽出物と大腸菌、酵母菌、または蚕のいずれか1つから選択される宿主細胞とを利用して遺伝子工学的に製造されることを特徴とする請求項3記載の皮膚角化促進剤。
【請求項1】
貝殻もしくは真珠断片またはこれらの粉末由来のナクレインタンパク質を含むことを特徴とする皮膚角化促進剤。
【請求項2】
前記貝殻がアコヤ貝であることを特徴とする請求項1記載の皮膚角化促進剤。
【請求項3】
前記ナクレインタンパク質が前記貝殻もしくは真珠断片またはこれらの粉末をキレート剤で脱灰して得られる物質からの抽出物であることを特徴とする請求項1または請求項2記載の皮膚角化促進剤。
【請求項4】
前記ナクレインタンパク質が前記抽出物と大腸菌、酵母菌、または蚕のいずれか1つから選択される宿主細胞とを利用して遺伝子工学的に製造されることを特徴とする請求項3記載の皮膚角化促進剤。
【図2】


【図1】




【図1】


【公開番号】特開2011−162469(P2011−162469A)
【公開日】平成23年8月25日(2011.8.25)
【国際特許分類】
【出願番号】特願2010−25326(P2010−25326)
【出願日】平成22年2月8日(2010.2.8)
【出願人】(000166959)御木本製薬株式会社 (66)
【出願人】(304026696)国立大学法人三重大学 (270)
【Fターム(参考)】
【公開日】平成23年8月25日(2011.8.25)
【国際特許分類】
【出願日】平成22年2月8日(2010.2.8)
【出願人】(000166959)御木本製薬株式会社 (66)
【出願人】(304026696)国立大学法人三重大学 (270)
【Fターム(参考)】
[ Back to top ]

