目標の癌組織を視覚化する励起/検出/投射システム
【課題】
【解決手段】病変組織と正常組織とに対して、異なる濃度の蛍光マーキング物質を与えて患者の治療を行った後、システムは、前記病変組織と前記正常組織とを視覚的に識別する。光源は、前記組織に励起光を照射する。検出器は、前記組織から戻ってくる光を検出し、制御部は、前記異なる濃度を表す測定された特性に基づいて前記戻ってきた光を評価する。光投射器は、前記戻ってきた光の前記評価に対応して、所定の特徴を有する光を投射する。
【解決手段】病変組織と正常組織とに対して、異なる濃度の蛍光マーキング物質を与えて患者の治療を行った後、システムは、前記病変組織と前記正常組織とを視覚的に識別する。光源は、前記組織に励起光を照射する。検出器は、前記組織から戻ってくる光を検出し、制御部は、前記異なる濃度を表す測定された特性に基づいて前記戻ってきた光を評価する。光投射器は、前記戻ってきた光の前記評価に対応して、所定の特徴を有する光を投射する。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、一般的には、蛍光マーカーを用いた癌組織の光学検出に関し、より詳細には、外科医が切除するためにマーキングされる組織を視覚的に強調するための光学システムに関する。
【背景技術】
【0002】
外科切除のような治療の際に病変{りかん}組織と正常組織とを識別するため、蛍光マーカーが用いられてきた。そこでは、以下のような光線力学的物質が用いられる。すなわち、腫瘍細胞に光線力学的物質を集積し、該物質の蛍光を利用することにより癌細胞を検出する。そのような物質の一例としては、5−アミノレブリン酸(5−ALA)が挙げられる。この物質は、細胞に取り込まれた場合、正常細胞においてはすぐに排除されるが、癌細胞においては蛍光物質プロトポルフィリンIXに変化する。腫瘍除去手術の際、組織に励起光を当てると、その結果発光する蛍光領域により除去すべき癌がマーキングされる。他の周知の光感受性物質として、アラバマ州バーミンガム アキシカンファーマ社(Axcan Pharma)によりフォトフリン(Photofrin、登録商標)として市販されているポルフィマーナトリウムがある。
【0003】
上記のような光感受性物質は病変組織における濃度が低いため、該組織で発生する蛍光量が低いことがある。このため、外科医がマーカー物質を含む全ての領域を視認することは難しい場合がある。特に脳のような器官の手術では、正常組織に対して影響を与えずに全ての癌組織を除去できるようにするため、癌組織と正常組織との境界を正確に確認できることが望まれている。このような確認作業の改善を目的として、蛍光発光する領域を感知するための、人間の眼よりも高感度な電子システムが開発されてきた。このようなシステムでは、蛍光領域の感知画像は、ディスプレイスクリーンやモニタ上に表示される。しかしながら、そのようなシステムにおいても、組織除去を行う際、外科医はモニタ上に表示された領域が実際は患者のどの部分に位置しているのかを判断する必要があるという不具合がある。
【発明の概要】
【0004】
本発明は、患者の癌領域を直接示すことができるという効果がある。本発明は、蛍光領域を電子的に検知した後、符号化された像を患者上に重ね合わせることにより、癌組織と正常組織との視覚的な識別を容易に行うことが可能となる。
【図面の簡単な説明】
【0005】
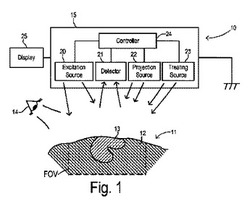
【図1】図1は、本発明に係るシステムの第1実施形態を示すブロック図である。
【図2】図2は、従来技術によって病変組織を視覚的にマーキングした場合の正常組織及び病変組織を有する対象組織を示す図である。
【図3】図3は、本発明によって病変組織を視覚的にマーキングした場合の正常組織及び病変組織を有する対象組織を示す図である。
【図4】図4は、本発明に係る励起モジュールの一実施形態を示すブロック図である。
【図5】図5は、本発明に係る検知モジュールの一実施形態を示すブロック図である。
【図6】図6は、本発明に係る検知モジュールの他の実施形態を示すブロック図である。
【図7】図7は、励起後に対象組織から得られる光のスペクトルを示すエネルギープロット図である。
【図8】図8は、蛍光発光する病変組織が存在するか否かを検出するために用いられる通過帯域幅を示す図である。
【図9】図9は、本発明に係る投射モジュールの一実施形態を示すブロック図である。
【図10】図10は、本発明に係る好ましい方法のフローチャートである。
【図11】図11は、発光及び受光機能を全て含む本発明に係る他のシステムを示すブロック図である。
【図12】図12は、図11のシステムによって行われることが可能な、本発明に係る他の方法のフローチャートである。
【発明を実施するための形態】
【0006】
本発明は、患者に光感受性物質を取り込ませて、蛍光物質を病変した癌細胞に集積させる光線力学療法(PDD)の一形態である。図1に示すように、PDDシステム10は、患者11を治療する際に用いられる。患者11の正常組織12及び病変組織13は、外科的処置の間、露出しており、外科医又はその他の専門医は、裸眼14によって、それら組織を視認している。その際、システム10は、該システム10の視野FOV内において病変組織13をより良好に視覚化することにより、外科医をアシストする。
【0007】
システム10は、相互に作用しあう、いくつかのモジュールを有する。それらモジュールは、単一のハウジング15に収納してもよいし、別々に構成してもよい。第1モジュール20は、病変組織13において蛍光物質を励起させる波長を有する光を発光するための励起源を備える。光感受性物質が5−ALAの場合、励起源モジュール20は、約420nmの波長を有する青色光を発光する。青色光は青色レーザや青色LEDによって発生させてもよい。青色光は、患者11に直接向けてもよいし、レンズや散光器のような光学部品を通して患者11に当ててもよい。
【0008】
第2モジュール21は、組織における位置検出を行う際に光感受性物質から発光する蛍光に応答する検出器を備える。以下で述べるように、位置検出は、スキャンミラーやCCD撮像装置又はその他の周知技術を用いて、組織において領域を識別するための測定を個別に行うことで実施することができる。検出器モジュール21は、赤色光(例えば、5−ALAの場合、波長640nm)の発光に応答するようになっている。
【0009】
第3モジュール22は、検出器モジュール21からの位置検出データに対応して、病変組織から発光される弱い蛍光よりも容易に視覚確認し易い光を用いて病変組織が検出された領域を照射するための投射源を備える。投射源の光は、異なる色、異なる強度又はその他の異なる光学特性、特徴(cue)又は符号化によって評価されることが好ましい。そうすることにより、外科医は、病変組織の境界を識別することができる。ある好ましい実施形態では、投射源モジュール22は、視覚確認し易い明るい緑色光を用いて病変組織13を照射する。他の視覚的特徴、画像符号化の例としては、投射光の時間変動強度、時間変動色属性、又は投射光の画像パターンが含まれる。
【0010】
オプションとして、病変組織13が検出された地点に治療放射光を当てるための治療用光源を有する第4モジュール23を設けてもよい。治療光源モジュール13は、当分野では周知である、病変細胞に死を引き起こすようにマーカー物質と相互作用する赤色レーザを備えてもよい。押しボタン又はその他の手動制御手段を設けることによって、外科医が必要と判断する場合のみ、治療用光源を動作させるようにしてもよい。
【0011】
制御部24は、モジュール20〜23と接続され、その動作を調整し、データを処理・共有させる。正常組織12及び病変組織13のライブ画像を生成するため、オプションとしてディスプレイ25を制御部24に接続することもできる。
【0012】
図2は、従来技術の方法によって蛍光発光させた場合の視認図を示す。患者は、正常組織12及び病変組織13、27を有している。病変組織13、27は全て、蛍光マーカー物質を含むが、外科医の裸眼で認識可能な赤色光を発生させるだけの濃度を有している領域は領域28のみである。本発明では、照射光を追加投射するため、外科医は、図3で示すように、全ての病変組織に直接対応する緑色光29を視認する。本発明のシステムでは、蛍光マーカーの濃度がある閾値を超える値を維持している限り、病変組織は検出され、投射源は、濃度を維持している病変組織の場所を示し続ける。
【0013】
図4は、励起源モジュール20を詳細に示す。青色LEDレーザアレイ30は、LED出力駆動部31によって動作する。アレイ30からの青色光は、散光器32を通り、目標物に一様に励起照射される。
【0014】
図5は、検出器モジュール21の第1実施形態を詳細に示す。目標物からの蛍光及び反射光は、(レンズのような)光学部品35によって集光され、ハーフミラー36を通って、微小電気機械システム(マイクロマシン、MEMS)スキャナ37に到達する。MEMSスキャナ37は、スキャン可能なミラー38を有する。該ミラー38を制御部24の制御によって偏向することにより、目標物のある特定の領域(すなわち、1画素)から受けた光を反射させて、ハーフミラー36に戻し、さらにビームスプリッタ40に進める。該画素からの光の一部は、フォトダイオード41に向かい、オプションで設けたディスプレイ上の画像生成をサポートする。該組織画素からの光の他の部分は、ビームスプリッタ40によって、レンズ42を通り、分光計43に向かう。分光計43は、高速フーリエ変換(FFT)又は他の技術を用いて、組織画素から受光した光を分析し、蛍光波長として受光した光エネルギが、病変組織の存在を示す所定の閾値を超えているか否かを決定する。その結果は、分光計43から制御部24へ送られる。
【0015】
図6は、検出器モジュール21の他の実施形態を示す。この実施形態では、画素スキャニングを用いる場合よりも、完全な画像が得られる。目標物からの光は、レンズ46を含む可能性のある光学系45によって集光される。光は、ビームスプリッタ47を通り、該光の第1部分は、電荷結合素子(CCD)48に向かう。電荷結合素子48では、(オプションの)ディスプレイモニタへ送る画像が形成される。該入射光の他の部分は、ビームスプリッタ47によってフィルタ51を通って、CCD50へ向かう。同様に、該光のさらに他の部分は、フィルタ53を通って、CCD52に向かい、またさらに他の部分は、フィルタ55を通って、CCD54に向かう。CCD50、52、54からの画像データは、制御部24に送られ、病変組織が存在するか否かを決定するための分析が行われる。以下の図7と図8との関連で説明されるように、放射蛍光が所定の閾値を超えているCCD画像内の画素を検出するため、フィルタ51、53、55は、放射蛍光の波長において又は該波長の近傍において異なる波長の光を通過させる。
【0016】
図7は、青色光を照射している際、組織から反射/放射される光のスペクトルを示す。該光スペクトル強度は、青色照射源の基本波長(例えば、約420nm)にピークをもつ。通常、正常組織において、反射光強度は、57で示されるように、赤領域に向かって又赤領域を通じて減衰している。これとは異なるスペクトル58は、蛍光マーカーを含む病変組織が存在する場合のものである。この場合、スペクトルは、波長640nmの周辺で第2ピーク60に向かって増大する。図7に示すスペクトルは、検出された画像内の個々の画素又は個々の組織領域に対応する。各画素は、それぞれマーカー物質の濃度に対応したスペクトルを有する。
【0017】
図8に示すように、受光した光のエネルギを測定するための通過帯域B1、B2、B3を用いて、各スペクトルにおけるピークの存在を検出することができる。エネルギ分布がピークを示す場合は、癌組織が検出される。フィルタ51、53、55は、帯域幅B1、B2、B3にそれぞれ対応しており、B2は、ピーク放射波長が中心となっている。CCD画像における各画素での強度(すなわち、大きさ)を比較することにより、該当するピークが存在するかどうかを検出できる。したがって、通過帯域B2に対する強度から通過帯域B1に対する強度を引いた値が0より大きく、且つ通過帯域B2に対する強度から通過帯域B3に対する強度を引いた値が0より大きい場合、ピークを検出し、対応する画素は、病変としてマーキングされる。そうでない場合は、対応する画素は、正常としてマーキングされる。
【0018】
図9は、投射源モジュール22の一実施形態の詳細を示す。緑色LEDやその他の緑色レーザ源のような緑色光源63は、出力駆動部64によって駆動する。緑色光は、ハーフミラー65に反射されて、揺動可能なミラー67を有するMEMSスキャナ66に達する。制御部24は、病変としてマークされた画素に従って、ミラー67を位置決めし、駆動部64を駆動して緑色光源63をONにし、緑色光ビームをミラー65及び光学系68を通じて、目標となる組織上の対応する画素に照射する。スキャンミラー67は、全ての画素にわたって広がる水平/垂直軌跡によって制御してもよい。その際、該当する画素を横切る場合のみ緑色光源63が動作するようにすればよい。
【0019】
以下では、図10に示すフローチャートを参照して、本発明に係る好ましい方法が説明される。ステップ70では、投射源と検出モジュールとの位置を合わせるための位置較正が行われる。較正ステップの一実施形態では、投射源からの緑色レーザ光の画素を目標領域にわたってスキャンし、同時に、検出器モジュールのCCDにおいて該緑色光で照射された画素による像の位置をモニタする。対応画素同士を正確に関連付けるため、制御部は、投射器と検出器の座標空間を相関させた較正マップを生成する。ステップ71では、目標領域が青色励起光によって照射される。ステップ72では、次にどの画素をスキャンすべきかが決定される。該励起光に応答して、マーカー物質を含む組織が蛍光を放射する。ステップ73では、スキャンした画素の蛍光波長とその近傍の波長の相対エネルギが決定される。ステップ74では、該相対エネルギレベルが癌組織を示しているか否かが決定される。癌組織でない場合は、ステップ71に戻り、励起光で目標領域を照射し、スキャンすべき次の画素を決定する。癌組織が検出された場合は、ステップ75において、該当する画素が投射光によって照射される(例えば、緑色マーカー光又は治療用レーザによる照射)。緑色レーザを用いて、赤色蛍光によって示される病変組織の領域に対応する組織上にパターンを描画してもよい。
【0020】
図11は、他の実施形態を示す。この実施形態に係るPDDシステム80では、全てのモジュールが1つのユニットに統合されている。青色レーザ82、赤色レーザ83、緑色レーザ84からのレーザ光は、ビーム分離/結合器81によって受光され、さらにピンホールシェード85又は他の光学系及びハーフミラー86を通ってMEMSスキャナ87へと向かう。それらレーザ光は、MEMSスキャナ87のスキャン可能なミラー88によって、アパーチャ90(他の光学系を含んでも、含まなくてもよい)を通って目標物91へと向けられる。光線力学療法(PDT)に用いられる赤色レーザは、マーカー物質の蛍光波長(例えば、640nm)に対応することが好ましいが、他の波長を用いてもよい。ビーム分離/結合器81は、必要に応じて二色性(ダイクロイック)スプリッタで構成してもよい。
【0021】
目標物91からの光(放射された蛍光も含む)は、ハーフミラー86を通り、MEMSスキャナ87におけるミラー88に向かう。スキャンした画素の光は、ミラー88からミラー86へと向かい、ピンホールシェード85を通ってビーム分離/結合器81に到達する。光の一部は、フィルタ94、95を通ってそれぞれ光検出器92、93へと向かう。フィルタ94、95のうちの1つは、放射される蛍光の波長を中心としており、他のフィルタは、その近傍に対応する通過帯域幅を有する。図11に示す装置を用いて、裸眼に対して均等照明となるようなスキャン速度で、励起、検出、投射マーキング及び治療が、画素毎に行われる。ピークの検出は、放射蛍光の波長を含む通過帯域幅でのエネルギとその近傍の通過帯域幅でのエネルギとを比較することによって行われる。近傍の通過帯域は、放射蛍光の波長を含む通過帯域幅より低波長側にあることが好ましい。病変組織に対応するピークの検出における、通過帯域B1のエネルギに対する通過帯域B2のエネルギの比としては、約1.3の所定閾値を用いることができる。或いは、入射光をさらに別のビームに分離して、放射蛍光の波長よりも高波長側の通過帯域及び低波長側の通過帯域の両方と比較してもよい。
【0022】
図12は、図11のシステムを用いた好ましい方法を示す。ステップ100において、スキャンを開始する(すなわち、第1画素から始まる)。ステップ101において、これからスキャンする画素にMEMSスキャナをセットして、青色光レーザをONにして励起を行う。ステップ102において、各通過帯域幅内に戻ってくる波長のエネルギを測定する。そして、ステップ103において、スキャンした画素に対してピークがあるかどうかを決定するためのチェックを行う。ピークがある場合、ステップ104において、緑色レーザ光を所定時間t1秒の間、ONにする。ピークがない場合、ステップ104をスキップする。
【0023】
ステップ105において、位置データが制御部のメモリに保存される。スキャン領域の各画素に対して、保存した位置データは、ピークが検出されたかどうかを表す。ステップ106において、スキャンMEMSミラーを、次の画素に対応する次の位置に移動する。ステップ107において、像全体のスキャンが終了したかどうかをチェックする。終了していない場合、ステップ101に戻り、青色レーザによる励起を続ける。スキャンが終了した場合、ステップ108において、緑色レーザの全体投射スキャンを、メモリに保存された最新の位置データに基づいて行う。投射スキャンは、前記所定時間t1秒よりも大きい時間t2秒の間、続けるようにしてもよい。このようにして、病変組織の位置を検出しながら、第1検出スキャンが行われる。第1検出スキャンではまた、病変組織に対する緑色レーザを用いた最初の照射が行われる。領域全体の検出スキャンが一旦行われれば、緑色レーザだけをスキャンして、検出プロセスによる中断なしで明瞭な画像を確実に見られるようしてもよい。組織が動いたり、診断システムが移動したりする可能性があるので、t2秒遅れで、周期的に再検出を行うことが好ましい。ここで、t2は、再検出を行う必要が生じるような、起こりうる最も速い移動速度に基づいて選ばれる。t2の値は、例えば、約250msに設定される。
【0024】
オプションとして、ステップ109を行ってもよい。ステップ109では、外科医にとって対象領域が自然な見え方になるように、t3秒の間、(別体の光源又は色光源の重ね合わせの効果により)白色光照射が行われる。白色光は、病変組織だけではなく、装置の視野全体に照射されることが好ましい。
【技術分野】
【0001】
本発明は、一般的には、蛍光マーカーを用いた癌組織の光学検出に関し、より詳細には、外科医が切除するためにマーキングされる組織を視覚的に強調するための光学システムに関する。
【背景技術】
【0002】
外科切除のような治療の際に病変{りかん}組織と正常組織とを識別するため、蛍光マーカーが用いられてきた。そこでは、以下のような光線力学的物質が用いられる。すなわち、腫瘍細胞に光線力学的物質を集積し、該物質の蛍光を利用することにより癌細胞を検出する。そのような物質の一例としては、5−アミノレブリン酸(5−ALA)が挙げられる。この物質は、細胞に取り込まれた場合、正常細胞においてはすぐに排除されるが、癌細胞においては蛍光物質プロトポルフィリンIXに変化する。腫瘍除去手術の際、組織に励起光を当てると、その結果発光する蛍光領域により除去すべき癌がマーキングされる。他の周知の光感受性物質として、アラバマ州バーミンガム アキシカンファーマ社(Axcan Pharma)によりフォトフリン(Photofrin、登録商標)として市販されているポルフィマーナトリウムがある。
【0003】
上記のような光感受性物質は病変組織における濃度が低いため、該組織で発生する蛍光量が低いことがある。このため、外科医がマーカー物質を含む全ての領域を視認することは難しい場合がある。特に脳のような器官の手術では、正常組織に対して影響を与えずに全ての癌組織を除去できるようにするため、癌組織と正常組織との境界を正確に確認できることが望まれている。このような確認作業の改善を目的として、蛍光発光する領域を感知するための、人間の眼よりも高感度な電子システムが開発されてきた。このようなシステムでは、蛍光領域の感知画像は、ディスプレイスクリーンやモニタ上に表示される。しかしながら、そのようなシステムにおいても、組織除去を行う際、外科医はモニタ上に表示された領域が実際は患者のどの部分に位置しているのかを判断する必要があるという不具合がある。
【発明の概要】
【0004】
本発明は、患者の癌領域を直接示すことができるという効果がある。本発明は、蛍光領域を電子的に検知した後、符号化された像を患者上に重ね合わせることにより、癌組織と正常組織との視覚的な識別を容易に行うことが可能となる。
【図面の簡単な説明】
【0005】
【図1】図1は、本発明に係るシステムの第1実施形態を示すブロック図である。
【図2】図2は、従来技術によって病変組織を視覚的にマーキングした場合の正常組織及び病変組織を有する対象組織を示す図である。
【図3】図3は、本発明によって病変組織を視覚的にマーキングした場合の正常組織及び病変組織を有する対象組織を示す図である。
【図4】図4は、本発明に係る励起モジュールの一実施形態を示すブロック図である。
【図5】図5は、本発明に係る検知モジュールの一実施形態を示すブロック図である。
【図6】図6は、本発明に係る検知モジュールの他の実施形態を示すブロック図である。
【図7】図7は、励起後に対象組織から得られる光のスペクトルを示すエネルギープロット図である。
【図8】図8は、蛍光発光する病変組織が存在するか否かを検出するために用いられる通過帯域幅を示す図である。
【図9】図9は、本発明に係る投射モジュールの一実施形態を示すブロック図である。
【図10】図10は、本発明に係る好ましい方法のフローチャートである。
【図11】図11は、発光及び受光機能を全て含む本発明に係る他のシステムを示すブロック図である。
【図12】図12は、図11のシステムによって行われることが可能な、本発明に係る他の方法のフローチャートである。
【発明を実施するための形態】
【0006】
本発明は、患者に光感受性物質を取り込ませて、蛍光物質を病変した癌細胞に集積させる光線力学療法(PDD)の一形態である。図1に示すように、PDDシステム10は、患者11を治療する際に用いられる。患者11の正常組織12及び病変組織13は、外科的処置の間、露出しており、外科医又はその他の専門医は、裸眼14によって、それら組織を視認している。その際、システム10は、該システム10の視野FOV内において病変組織13をより良好に視覚化することにより、外科医をアシストする。
【0007】
システム10は、相互に作用しあう、いくつかのモジュールを有する。それらモジュールは、単一のハウジング15に収納してもよいし、別々に構成してもよい。第1モジュール20は、病変組織13において蛍光物質を励起させる波長を有する光を発光するための励起源を備える。光感受性物質が5−ALAの場合、励起源モジュール20は、約420nmの波長を有する青色光を発光する。青色光は青色レーザや青色LEDによって発生させてもよい。青色光は、患者11に直接向けてもよいし、レンズや散光器のような光学部品を通して患者11に当ててもよい。
【0008】
第2モジュール21は、組織における位置検出を行う際に光感受性物質から発光する蛍光に応答する検出器を備える。以下で述べるように、位置検出は、スキャンミラーやCCD撮像装置又はその他の周知技術を用いて、組織において領域を識別するための測定を個別に行うことで実施することができる。検出器モジュール21は、赤色光(例えば、5−ALAの場合、波長640nm)の発光に応答するようになっている。
【0009】
第3モジュール22は、検出器モジュール21からの位置検出データに対応して、病変組織から発光される弱い蛍光よりも容易に視覚確認し易い光を用いて病変組織が検出された領域を照射するための投射源を備える。投射源の光は、異なる色、異なる強度又はその他の異なる光学特性、特徴(cue)又は符号化によって評価されることが好ましい。そうすることにより、外科医は、病変組織の境界を識別することができる。ある好ましい実施形態では、投射源モジュール22は、視覚確認し易い明るい緑色光を用いて病変組織13を照射する。他の視覚的特徴、画像符号化の例としては、投射光の時間変動強度、時間変動色属性、又は投射光の画像パターンが含まれる。
【0010】
オプションとして、病変組織13が検出された地点に治療放射光を当てるための治療用光源を有する第4モジュール23を設けてもよい。治療光源モジュール13は、当分野では周知である、病変細胞に死を引き起こすようにマーカー物質と相互作用する赤色レーザを備えてもよい。押しボタン又はその他の手動制御手段を設けることによって、外科医が必要と判断する場合のみ、治療用光源を動作させるようにしてもよい。
【0011】
制御部24は、モジュール20〜23と接続され、その動作を調整し、データを処理・共有させる。正常組織12及び病変組織13のライブ画像を生成するため、オプションとしてディスプレイ25を制御部24に接続することもできる。
【0012】
図2は、従来技術の方法によって蛍光発光させた場合の視認図を示す。患者は、正常組織12及び病変組織13、27を有している。病変組織13、27は全て、蛍光マーカー物質を含むが、外科医の裸眼で認識可能な赤色光を発生させるだけの濃度を有している領域は領域28のみである。本発明では、照射光を追加投射するため、外科医は、図3で示すように、全ての病変組織に直接対応する緑色光29を視認する。本発明のシステムでは、蛍光マーカーの濃度がある閾値を超える値を維持している限り、病変組織は検出され、投射源は、濃度を維持している病変組織の場所を示し続ける。
【0013】
図4は、励起源モジュール20を詳細に示す。青色LEDレーザアレイ30は、LED出力駆動部31によって動作する。アレイ30からの青色光は、散光器32を通り、目標物に一様に励起照射される。
【0014】
図5は、検出器モジュール21の第1実施形態を詳細に示す。目標物からの蛍光及び反射光は、(レンズのような)光学部品35によって集光され、ハーフミラー36を通って、微小電気機械システム(マイクロマシン、MEMS)スキャナ37に到達する。MEMSスキャナ37は、スキャン可能なミラー38を有する。該ミラー38を制御部24の制御によって偏向することにより、目標物のある特定の領域(すなわち、1画素)から受けた光を反射させて、ハーフミラー36に戻し、さらにビームスプリッタ40に進める。該画素からの光の一部は、フォトダイオード41に向かい、オプションで設けたディスプレイ上の画像生成をサポートする。該組織画素からの光の他の部分は、ビームスプリッタ40によって、レンズ42を通り、分光計43に向かう。分光計43は、高速フーリエ変換(FFT)又は他の技術を用いて、組織画素から受光した光を分析し、蛍光波長として受光した光エネルギが、病変組織の存在を示す所定の閾値を超えているか否かを決定する。その結果は、分光計43から制御部24へ送られる。
【0015】
図6は、検出器モジュール21の他の実施形態を示す。この実施形態では、画素スキャニングを用いる場合よりも、完全な画像が得られる。目標物からの光は、レンズ46を含む可能性のある光学系45によって集光される。光は、ビームスプリッタ47を通り、該光の第1部分は、電荷結合素子(CCD)48に向かう。電荷結合素子48では、(オプションの)ディスプレイモニタへ送る画像が形成される。該入射光の他の部分は、ビームスプリッタ47によってフィルタ51を通って、CCD50へ向かう。同様に、該光のさらに他の部分は、フィルタ53を通って、CCD52に向かい、またさらに他の部分は、フィルタ55を通って、CCD54に向かう。CCD50、52、54からの画像データは、制御部24に送られ、病変組織が存在するか否かを決定するための分析が行われる。以下の図7と図8との関連で説明されるように、放射蛍光が所定の閾値を超えているCCD画像内の画素を検出するため、フィルタ51、53、55は、放射蛍光の波長において又は該波長の近傍において異なる波長の光を通過させる。
【0016】
図7は、青色光を照射している際、組織から反射/放射される光のスペクトルを示す。該光スペクトル強度は、青色照射源の基本波長(例えば、約420nm)にピークをもつ。通常、正常組織において、反射光強度は、57で示されるように、赤領域に向かって又赤領域を通じて減衰している。これとは異なるスペクトル58は、蛍光マーカーを含む病変組織が存在する場合のものである。この場合、スペクトルは、波長640nmの周辺で第2ピーク60に向かって増大する。図7に示すスペクトルは、検出された画像内の個々の画素又は個々の組織領域に対応する。各画素は、それぞれマーカー物質の濃度に対応したスペクトルを有する。
【0017】
図8に示すように、受光した光のエネルギを測定するための通過帯域B1、B2、B3を用いて、各スペクトルにおけるピークの存在を検出することができる。エネルギ分布がピークを示す場合は、癌組織が検出される。フィルタ51、53、55は、帯域幅B1、B2、B3にそれぞれ対応しており、B2は、ピーク放射波長が中心となっている。CCD画像における各画素での強度(すなわち、大きさ)を比較することにより、該当するピークが存在するかどうかを検出できる。したがって、通過帯域B2に対する強度から通過帯域B1に対する強度を引いた値が0より大きく、且つ通過帯域B2に対する強度から通過帯域B3に対する強度を引いた値が0より大きい場合、ピークを検出し、対応する画素は、病変としてマーキングされる。そうでない場合は、対応する画素は、正常としてマーキングされる。
【0018】
図9は、投射源モジュール22の一実施形態の詳細を示す。緑色LEDやその他の緑色レーザ源のような緑色光源63は、出力駆動部64によって駆動する。緑色光は、ハーフミラー65に反射されて、揺動可能なミラー67を有するMEMSスキャナ66に達する。制御部24は、病変としてマークされた画素に従って、ミラー67を位置決めし、駆動部64を駆動して緑色光源63をONにし、緑色光ビームをミラー65及び光学系68を通じて、目標となる組織上の対応する画素に照射する。スキャンミラー67は、全ての画素にわたって広がる水平/垂直軌跡によって制御してもよい。その際、該当する画素を横切る場合のみ緑色光源63が動作するようにすればよい。
【0019】
以下では、図10に示すフローチャートを参照して、本発明に係る好ましい方法が説明される。ステップ70では、投射源と検出モジュールとの位置を合わせるための位置較正が行われる。較正ステップの一実施形態では、投射源からの緑色レーザ光の画素を目標領域にわたってスキャンし、同時に、検出器モジュールのCCDにおいて該緑色光で照射された画素による像の位置をモニタする。対応画素同士を正確に関連付けるため、制御部は、投射器と検出器の座標空間を相関させた較正マップを生成する。ステップ71では、目標領域が青色励起光によって照射される。ステップ72では、次にどの画素をスキャンすべきかが決定される。該励起光に応答して、マーカー物質を含む組織が蛍光を放射する。ステップ73では、スキャンした画素の蛍光波長とその近傍の波長の相対エネルギが決定される。ステップ74では、該相対エネルギレベルが癌組織を示しているか否かが決定される。癌組織でない場合は、ステップ71に戻り、励起光で目標領域を照射し、スキャンすべき次の画素を決定する。癌組織が検出された場合は、ステップ75において、該当する画素が投射光によって照射される(例えば、緑色マーカー光又は治療用レーザによる照射)。緑色レーザを用いて、赤色蛍光によって示される病変組織の領域に対応する組織上にパターンを描画してもよい。
【0020】
図11は、他の実施形態を示す。この実施形態に係るPDDシステム80では、全てのモジュールが1つのユニットに統合されている。青色レーザ82、赤色レーザ83、緑色レーザ84からのレーザ光は、ビーム分離/結合器81によって受光され、さらにピンホールシェード85又は他の光学系及びハーフミラー86を通ってMEMSスキャナ87へと向かう。それらレーザ光は、MEMSスキャナ87のスキャン可能なミラー88によって、アパーチャ90(他の光学系を含んでも、含まなくてもよい)を通って目標物91へと向けられる。光線力学療法(PDT)に用いられる赤色レーザは、マーカー物質の蛍光波長(例えば、640nm)に対応することが好ましいが、他の波長を用いてもよい。ビーム分離/結合器81は、必要に応じて二色性(ダイクロイック)スプリッタで構成してもよい。
【0021】
目標物91からの光(放射された蛍光も含む)は、ハーフミラー86を通り、MEMSスキャナ87におけるミラー88に向かう。スキャンした画素の光は、ミラー88からミラー86へと向かい、ピンホールシェード85を通ってビーム分離/結合器81に到達する。光の一部は、フィルタ94、95を通ってそれぞれ光検出器92、93へと向かう。フィルタ94、95のうちの1つは、放射される蛍光の波長を中心としており、他のフィルタは、その近傍に対応する通過帯域幅を有する。図11に示す装置を用いて、裸眼に対して均等照明となるようなスキャン速度で、励起、検出、投射マーキング及び治療が、画素毎に行われる。ピークの検出は、放射蛍光の波長を含む通過帯域幅でのエネルギとその近傍の通過帯域幅でのエネルギとを比較することによって行われる。近傍の通過帯域は、放射蛍光の波長を含む通過帯域幅より低波長側にあることが好ましい。病変組織に対応するピークの検出における、通過帯域B1のエネルギに対する通過帯域B2のエネルギの比としては、約1.3の所定閾値を用いることができる。或いは、入射光をさらに別のビームに分離して、放射蛍光の波長よりも高波長側の通過帯域及び低波長側の通過帯域の両方と比較してもよい。
【0022】
図12は、図11のシステムを用いた好ましい方法を示す。ステップ100において、スキャンを開始する(すなわち、第1画素から始まる)。ステップ101において、これからスキャンする画素にMEMSスキャナをセットして、青色光レーザをONにして励起を行う。ステップ102において、各通過帯域幅内に戻ってくる波長のエネルギを測定する。そして、ステップ103において、スキャンした画素に対してピークがあるかどうかを決定するためのチェックを行う。ピークがある場合、ステップ104において、緑色レーザ光を所定時間t1秒の間、ONにする。ピークがない場合、ステップ104をスキップする。
【0023】
ステップ105において、位置データが制御部のメモリに保存される。スキャン領域の各画素に対して、保存した位置データは、ピークが検出されたかどうかを表す。ステップ106において、スキャンMEMSミラーを、次の画素に対応する次の位置に移動する。ステップ107において、像全体のスキャンが終了したかどうかをチェックする。終了していない場合、ステップ101に戻り、青色レーザによる励起を続ける。スキャンが終了した場合、ステップ108において、緑色レーザの全体投射スキャンを、メモリに保存された最新の位置データに基づいて行う。投射スキャンは、前記所定時間t1秒よりも大きい時間t2秒の間、続けるようにしてもよい。このようにして、病変組織の位置を検出しながら、第1検出スキャンが行われる。第1検出スキャンではまた、病変組織に対する緑色レーザを用いた最初の照射が行われる。領域全体の検出スキャンが一旦行われれば、緑色レーザだけをスキャンして、検出プロセスによる中断なしで明瞭な画像を確実に見られるようしてもよい。組織が動いたり、診断システムが移動したりする可能性があるので、t2秒遅れで、周期的に再検出を行うことが好ましい。ここで、t2は、再検出を行う必要が生じるような、起こりうる最も速い移動速度に基づいて選ばれる。t2の値は、例えば、約250msに設定される。
【0024】
オプションとして、ステップ109を行ってもよい。ステップ109では、外科医にとって対象領域が自然な見え方になるように、t3秒の間、(別体の光源又は色光源の重ね合わせの効果により)白色光照射が行われる。白色光は、病変組織だけではなく、装置の視野全体に照射されることが好ましい。
【特許請求の範囲】
【請求項1】
病変組織と正常組織とに対して、異なる濃度の蛍光マーキング物質を与えて患者の治療を行い、前記病変組織と前記正常組織とを視覚的に識別するためのシステムであって、前記システムは、
前記組織に励起光を照射する光源と、
前記組織から戻ってくる光を検出する検出器と、
前記異なる濃度を表す測定された特性に基づいて前記戻ってきた光を評価する制御部と、
前記戻ってきた光の前記評価に対応して、所定の特徴を有する光を投射する光投射器と、
を備えることを特徴とする病変組織と正常組織とを視覚的に識別するためのシステム。
【請求項2】
請求項1記載のシステムにおいて、
前記検出器は、各画素域から戻ってくる光を検出し、前記光投射器は、前記蛍光マーキング物質の濃度が閾値を超えると前記制御部が特定する各画素域に、前記特徴を有する光を投射することを特徴とする病変組織と正常組織とを視覚的に識別するためのシステム。
【請求項3】
請求項1記載のシステムにおいて、
前記検出器は、光検出器と、前記組織から戻ってくる光を前記光検出器に向けるスキャンミラーと、で構成されることを特徴とする病変組織と正常組織とを視覚的に識別するためのシステム。
【請求項4】
請求項3記載のシステムにおいて、
前記光検出器は、電荷結合素子(CCD)で構成されることを特徴とする病変組織と正常組織とを視覚的に識別するためのシステム。
【請求項5】
請求項3記載のシステムにおいて、
前記光検出器は、分光計で構成されることを特徴とする病変組織と正常組織とを視覚的に識別するためのシステム。
【請求項6】
請求項3記載のシステムにおいて、
前記スキャンミラーは、微小電気機械システム(MEMS)で構成されることを特徴とする病変組織と正常組織とを視覚的に識別するためのシステム。
【請求項7】
請求項1記載のシステムにおいて、
前記光投射器は、所定の色の光を投射する光源と、前記蛍光マーキング物質の濃度が閾値を超えると前記制御部が特定する各画素域に、前記所定の色の光を向けるスキャンミラーと、で構成されることを特徴とする病変組織と正常組織とを視覚的に識別するためのシステム。
【請求項8】
請求項1記載のシステムにおいて、
前記制御部が評価した前記測定された特性は、前記組織の各画素域に対して戻ってくる光のエネルギに対応することを特徴とする病変組織と正常組織とを視覚的に識別するためのシステム。
【請求項9】
請求項1記載のシステムにおいて、
前記制御部は、高速フーリエ変換を用いて前記戻ってくる光を分析し、前記組織の各画素域に存在する前記マーキング物質の蛍光波長のエネルギが、所定の閾値を超えているか否かを決定する、
ことを特徴とする病変組織と正常組織とを視覚的に識別するためのシステム。
【請求項10】
請求項1記載のシステムにおいて、
前記検出器は、前記戻ってくる光を前記マーキング物質の蛍光波長を含む第1通過帯域と、前記蛍光波長近傍の波長を含む第2通過帯域とによってフィルタリングするフィルタで構成され、前記制御部は、前記戻ってくる光の前記第1及び第2通過帯域のエネルギを比較し、前記異なる濃度を決定することを特徴とする病変組織と正常組織とを視覚的に識別するためのシステム。
【請求項11】
請求項1記載のシステムにおいて、
前記所定の特徴を有する投射光を受光する同一の前記組織に対する光線力学療法(PDT)用の治療用レーザをさらに備えることを特徴とする病変組織と正常組織とを視覚的に識別するためのシステム。
【請求項12】
病変組織と正常組織とに対して、異なる濃度の蛍光マーキング物質を与えるステップと、
励起光を前記組織に照射するステップと、
前記組織から戻ってくる蛍光を検出するステップと、
前記異なる濃度を表す測定された特性に基づいて前記戻ってきた光を評価するステップと、
前記戻ってきた光の前記評価に対応して、所定の特徴を有する光を投射するステップと、
を備えることを特徴とする病変組織と正常組織とを視覚的に識別する方法。
【請求項13】
請求項12記載の方法において、
前記検出ステップでは、各画素域から戻ってくる光を検出し、前記投射ステップでは、前記蛍光マーキング物質の濃度が閾値を超えると特定する各画素域に、前記特徴を有する光を投射することを特徴とする正常組織と病変組織とを視覚的に識別する方法。
【請求項14】
請求項13記載の方法において、
前記検出ステップでは、前記各画素域に沿ってミラーをスキャンする
ことを特徴とする正常組織と病変組織とを視覚的に識別する方法。
【請求項15】
請求項13記載の方法において、
前記投射ステップでは、前記各画素域に沿ってミラーをスキャンすることを特徴とする正常組織と病変組織とを視覚的に識別する方法。
【請求項16】
請求項12記載の方法において、
前記所定の特徴は、所定の色を有する光で構成されることを特徴とする正常組織と病変組織とを視覚的に識別する方法。
【請求項17】
請求項12記載の方法において、
前記測定した特性は、前記組織の各画素域に対して戻ってくる蛍光のエネルギに対応することを特徴とする正常組織と病変組織とを視覚的に識別する方法。
【請求項18】
請求項17記載の方法において、
高速フーリエ変換を用いて前記戻ってくる光を分析し、前記組織の各画素域に存在する前記マーキング物質の蛍光波長のエネルギが、所定の閾値を超えているか否かを決定することを特徴とする正常組織と病変組織とを視覚的に識別する方法。
【請求項19】
請求項17記載の方法において、
前記検出ステップは、さらに、前記戻ってくる光を前記マーキング物質の蛍光波長を含む第1通過帯域と、前記蛍光波長近傍の波長を含む第2通過帯域とによってフィルタリングし、前記評価するステップは、さらに、前記戻ってくる光の前記第1及び第2通過帯域のエネルギを比較し、前記異なる濃度を決定することを特徴とする正常組織と病変組織とを視覚的に識別する方法。
【請求項20】
請求項12記載の方法において、
前記所定の特徴を有する投射光を受光する同一の前記組織に対する光線力学療法(PDT)用のレーザ光を投射するステップをさらに備えることを特徴とする正常組織と病変組織とを視覚的に識別する方法。
【請求項21】
蛍光マーキング物質で処理された対象物を照射する方法であって、前記対象物は複数の画素域を有する領域を網羅し、前記蛍光マーキング物質の濃度は、異なる各画素域で変化し、
(a)光学系を所定の画素域へスキャンするステップと、
(b)前記蛍光マーキング物質を励起させて蛍光発光させるために、前記所定の画素域を、前記光学系を介して励起光により照射するステップと、
(c)前記マーキング物質の蛍光波長を含む第1通過帯域と、近傍の波長を含む第2通過帯域と、を有する複数の通過帯域に対して前記所定の画素域から放射された光のエネルギを測定するステップと、
(d)前記第1通過帯域がピークエネルギを示すか否か決定するために前記エネルギを比較するステップと、
(e)前記第1通過帯域がピークエネルギを示す場合、前記光学系を介して、第1所定時間の間、所定の特徴を有する投射光で前記所定の画素域を照射するステップと、
(f)前記第1通過帯域がピークエネルギを示すか否かの決定をメモリに保存するステップと、
(g)前記光学系を次の画素域へスキャンし、前記領域が完了するまで各画素域でステップ(b)〜(f)を繰り返すステップと、
を備えることを特徴とする蛍光マーキング物質で処理された対象物を照射する方法。
【請求項22】
請求項21記載の方法において、
(h)前記保存された決定がピークエネルギを示す全ての画素域へ前記光学系を順にスキャンし、前記保存された決定がピークエネルギを示す画素域へスキャンした際に、前記所定の特徴を有する投射光を投射するステップと、
(i)第2所定時間の経過後、ステップ(h)を終了し、ステップ(a)〜(g)を繰り返すステップと、
をさらに備えることを特徴とする蛍光マーキング物質で処理された対象物を照射する方法。
【請求項23】
請求項22記載の方法において、
ステップ(a)〜(g)を繰り返すステップの前に、第3所定時間の間、前記領域を白色光で照射するステップをさらに備えることを特徴とする蛍光マーキング物質で処理された対象物を照射する方法。
【請求項1】
病変組織と正常組織とに対して、異なる濃度の蛍光マーキング物質を与えて患者の治療を行い、前記病変組織と前記正常組織とを視覚的に識別するためのシステムであって、前記システムは、
前記組織に励起光を照射する光源と、
前記組織から戻ってくる光を検出する検出器と、
前記異なる濃度を表す測定された特性に基づいて前記戻ってきた光を評価する制御部と、
前記戻ってきた光の前記評価に対応して、所定の特徴を有する光を投射する光投射器と、
を備えることを特徴とする病変組織と正常組織とを視覚的に識別するためのシステム。
【請求項2】
請求項1記載のシステムにおいて、
前記検出器は、各画素域から戻ってくる光を検出し、前記光投射器は、前記蛍光マーキング物質の濃度が閾値を超えると前記制御部が特定する各画素域に、前記特徴を有する光を投射することを特徴とする病変組織と正常組織とを視覚的に識別するためのシステム。
【請求項3】
請求項1記載のシステムにおいて、
前記検出器は、光検出器と、前記組織から戻ってくる光を前記光検出器に向けるスキャンミラーと、で構成されることを特徴とする病変組織と正常組織とを視覚的に識別するためのシステム。
【請求項4】
請求項3記載のシステムにおいて、
前記光検出器は、電荷結合素子(CCD)で構成されることを特徴とする病変組織と正常組織とを視覚的に識別するためのシステム。
【請求項5】
請求項3記載のシステムにおいて、
前記光検出器は、分光計で構成されることを特徴とする病変組織と正常組織とを視覚的に識別するためのシステム。
【請求項6】
請求項3記載のシステムにおいて、
前記スキャンミラーは、微小電気機械システム(MEMS)で構成されることを特徴とする病変組織と正常組織とを視覚的に識別するためのシステム。
【請求項7】
請求項1記載のシステムにおいて、
前記光投射器は、所定の色の光を投射する光源と、前記蛍光マーキング物質の濃度が閾値を超えると前記制御部が特定する各画素域に、前記所定の色の光を向けるスキャンミラーと、で構成されることを特徴とする病変組織と正常組織とを視覚的に識別するためのシステム。
【請求項8】
請求項1記載のシステムにおいて、
前記制御部が評価した前記測定された特性は、前記組織の各画素域に対して戻ってくる光のエネルギに対応することを特徴とする病変組織と正常組織とを視覚的に識別するためのシステム。
【請求項9】
請求項1記載のシステムにおいて、
前記制御部は、高速フーリエ変換を用いて前記戻ってくる光を分析し、前記組織の各画素域に存在する前記マーキング物質の蛍光波長のエネルギが、所定の閾値を超えているか否かを決定する、
ことを特徴とする病変組織と正常組織とを視覚的に識別するためのシステム。
【請求項10】
請求項1記載のシステムにおいて、
前記検出器は、前記戻ってくる光を前記マーキング物質の蛍光波長を含む第1通過帯域と、前記蛍光波長近傍の波長を含む第2通過帯域とによってフィルタリングするフィルタで構成され、前記制御部は、前記戻ってくる光の前記第1及び第2通過帯域のエネルギを比較し、前記異なる濃度を決定することを特徴とする病変組織と正常組織とを視覚的に識別するためのシステム。
【請求項11】
請求項1記載のシステムにおいて、
前記所定の特徴を有する投射光を受光する同一の前記組織に対する光線力学療法(PDT)用の治療用レーザをさらに備えることを特徴とする病変組織と正常組織とを視覚的に識別するためのシステム。
【請求項12】
病変組織と正常組織とに対して、異なる濃度の蛍光マーキング物質を与えるステップと、
励起光を前記組織に照射するステップと、
前記組織から戻ってくる蛍光を検出するステップと、
前記異なる濃度を表す測定された特性に基づいて前記戻ってきた光を評価するステップと、
前記戻ってきた光の前記評価に対応して、所定の特徴を有する光を投射するステップと、
を備えることを特徴とする病変組織と正常組織とを視覚的に識別する方法。
【請求項13】
請求項12記載の方法において、
前記検出ステップでは、各画素域から戻ってくる光を検出し、前記投射ステップでは、前記蛍光マーキング物質の濃度が閾値を超えると特定する各画素域に、前記特徴を有する光を投射することを特徴とする正常組織と病変組織とを視覚的に識別する方法。
【請求項14】
請求項13記載の方法において、
前記検出ステップでは、前記各画素域に沿ってミラーをスキャンする
ことを特徴とする正常組織と病変組織とを視覚的に識別する方法。
【請求項15】
請求項13記載の方法において、
前記投射ステップでは、前記各画素域に沿ってミラーをスキャンすることを特徴とする正常組織と病変組織とを視覚的に識別する方法。
【請求項16】
請求項12記載の方法において、
前記所定の特徴は、所定の色を有する光で構成されることを特徴とする正常組織と病変組織とを視覚的に識別する方法。
【請求項17】
請求項12記載の方法において、
前記測定した特性は、前記組織の各画素域に対して戻ってくる蛍光のエネルギに対応することを特徴とする正常組織と病変組織とを視覚的に識別する方法。
【請求項18】
請求項17記載の方法において、
高速フーリエ変換を用いて前記戻ってくる光を分析し、前記組織の各画素域に存在する前記マーキング物質の蛍光波長のエネルギが、所定の閾値を超えているか否かを決定することを特徴とする正常組織と病変組織とを視覚的に識別する方法。
【請求項19】
請求項17記載の方法において、
前記検出ステップは、さらに、前記戻ってくる光を前記マーキング物質の蛍光波長を含む第1通過帯域と、前記蛍光波長近傍の波長を含む第2通過帯域とによってフィルタリングし、前記評価するステップは、さらに、前記戻ってくる光の前記第1及び第2通過帯域のエネルギを比較し、前記異なる濃度を決定することを特徴とする正常組織と病変組織とを視覚的に識別する方法。
【請求項20】
請求項12記載の方法において、
前記所定の特徴を有する投射光を受光する同一の前記組織に対する光線力学療法(PDT)用のレーザ光を投射するステップをさらに備えることを特徴とする正常組織と病変組織とを視覚的に識別する方法。
【請求項21】
蛍光マーキング物質で処理された対象物を照射する方法であって、前記対象物は複数の画素域を有する領域を網羅し、前記蛍光マーキング物質の濃度は、異なる各画素域で変化し、
(a)光学系を所定の画素域へスキャンするステップと、
(b)前記蛍光マーキング物質を励起させて蛍光発光させるために、前記所定の画素域を、前記光学系を介して励起光により照射するステップと、
(c)前記マーキング物質の蛍光波長を含む第1通過帯域と、近傍の波長を含む第2通過帯域と、を有する複数の通過帯域に対して前記所定の画素域から放射された光のエネルギを測定するステップと、
(d)前記第1通過帯域がピークエネルギを示すか否か決定するために前記エネルギを比較するステップと、
(e)前記第1通過帯域がピークエネルギを示す場合、前記光学系を介して、第1所定時間の間、所定の特徴を有する投射光で前記所定の画素域を照射するステップと、
(f)前記第1通過帯域がピークエネルギを示すか否かの決定をメモリに保存するステップと、
(g)前記光学系を次の画素域へスキャンし、前記領域が完了するまで各画素域でステップ(b)〜(f)を繰り返すステップと、
を備えることを特徴とする蛍光マーキング物質で処理された対象物を照射する方法。
【請求項22】
請求項21記載の方法において、
(h)前記保存された決定がピークエネルギを示す全ての画素域へ前記光学系を順にスキャンし、前記保存された決定がピークエネルギを示す画素域へスキャンした際に、前記所定の特徴を有する投射光を投射するステップと、
(i)第2所定時間の経過後、ステップ(h)を終了し、ステップ(a)〜(g)を繰り返すステップと、
をさらに備えることを特徴とする蛍光マーキング物質で処理された対象物を照射する方法。
【請求項23】
請求項22記載の方法において、
ステップ(a)〜(g)を繰り返すステップの前に、第3所定時間の間、前記領域を白色光で照射するステップをさらに備えることを特徴とする蛍光マーキング物質で処理された対象物を照射する方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【図12】


【公表番号】特表2013−515266(P2013−515266A)
【公表日】平成25年5月2日(2013.5.2)
【国際特許分類】
【出願番号】特願2012−546097(P2012−546097)
【出願日】平成22年12月20日(2010.12.20)
【国際出願番号】PCT/US2010/061188
【国際公開番号】WO2011/084722
【国際公開日】平成23年7月14日(2011.7.14)
【出願人】(000109543)テルモ株式会社 (2,232)
【出願人】(508123858)SBIファーマ株式会社 (13)
【Fターム(参考)】
【公表日】平成25年5月2日(2013.5.2)
【国際特許分類】
【出願日】平成22年12月20日(2010.12.20)
【国際出願番号】PCT/US2010/061188
【国際公開番号】WO2011/084722
【国際公開日】平成23年7月14日(2011.7.14)
【出願人】(000109543)テルモ株式会社 (2,232)
【出願人】(508123858)SBIファーマ株式会社 (13)
【Fターム(参考)】
[ Back to top ]

