目的タンパク質または目的ペプチドにアミノ酸を導入する方法
【課題】本発明の課題は、簡便かつ低コストに、アミノ酸を目的タンパク質または目的ペプチドに導入する方法を提供することであり、目的タンパク質または目的ペプチドへのアミノ酸導入のスケールアップを可能にする方法を提供することである。
【解決手段】1)目的タンパク質または目的ペプチド、2)導入するアミノ酸、3)tRNA、4)アミノアシルtRNA合成酵素、5)アミノアシルtRNAタンパク質転移酵素を、同じ混合液中に、単一の容器内に存在させることによる。
【解決手段】1)目的タンパク質または目的ペプチド、2)導入するアミノ酸、3)tRNA、4)アミノアシルtRNA合成酵素、5)アミノアシルtRNAタンパク質転移酵素を、同じ混合液中に、単一の容器内に存在させることによる。
【発明の詳細な説明】
【技術分野】
【0001】
本発明は、目的タンパク質または目的ペプチドにアミノ酸を導入する方法に関する。さらには、目的タンパク質または目的ペプチドにアミノ酸を導入するためのキットおよび、前記アミノ酸を導入する方法もしくは導入キットを用いて非天然タンパク質または非天然ペプチドを製造する方法に関する。
【背景技術】
【0002】
タンパク質の機能解析などの目的のため、天然に存在するタンパク質のアミノ酸配列を任意に組換えて構造を改変することが、遺伝子工学的な手法により、比較的古くから行われている。また、天然のアミノ酸のみならず、非天然のアミノ酸をタンパク質へ導入することも行われている。非天然アミノ酸導入により、タンパク質の構造・機能の解析のみならず、何らかの機能を人工的に付加した人工的なタンパク質の作製も可能になる。
【0003】
機能性基をタンパク質表面に導入する場合、一般に用いられるのがタンパク質の特定残基への化学修飾である。また、近年タンパク質中のアミノ酸残基の置換が可能となったため、タンパク質合成系を拡張することで、アミノ骨格を有する所望の非天然型アミノ酸をタンパク質中に導入することが可能となった。
【0004】
タンパク質合成系を用いずに、酵素的に非天然アミノ酸をtRNAに結合させる方法が開示されている(非特許文献1および2)。目的タンパク質と非天然アミノ酸によりアミノアシル化されたtRNAとを、ロイシル/フェニルアラニルタンパク質転移酵素の存在下で混合すると、目的タンパク質のN末端だけに非天然アミノ酸が転移することが見出された。
【0005】
また、tRNAの3'末端に様々な非天然アミノ酸を結合させる酵素として、アミノアシルtRNA合成酵素変異体が作製されている(非特許文献3)。かかる酵素を用いて、翻訳系により非天然アミノ酸をタンパク質もしくはペプチドに導入する方法が開示されている(特許文献1)。
【特許文献1】国際公開WO03/073238号
【非特許文献1】Chembiochem, 2006, 7, 1676-1679
【非特許文献2】Biopolymers, 2007, 88, 263
【非特許文献3】Chembiochem, 2002, 02-03, 235-237
【発明の開示】
【発明が解決しようとする課題】
【0006】
従来のアミノ酸導入方法では、導入するアミノ酸をtRNAの3'末端に予めアミノアシル化した分子(アミノアシルtRNA)を作製し、それを単離する必要があった。アミノアシルtRNAの作製には、導入するアミノ酸の誘導体化(多段階の有機合成反応)が必要であり、操作が非常に煩雑かつ専門知識が必要であった。得られるアミノアシルtRNAの量は極めて限定され、原料が希少であるため、導入するアミノ酸を付与させた目的タンパク質を大スケールで作製することが不可能であった。また、酵素的にタンパク質へアミノ酸を導入する場合には、反応時にtRNA分子が徐々に蓄積し、酵素反応を徐々に阻害することにもなりかねないという問題点があった。
【0007】
本発明の課題は、高効率・簡便かつ低コストに、アミノ酸を目的タンパク質または目的ペプチドに導入する方法を提供することであり、目的タンパク質または目的ペプチドへのアミノ酸導入のスケールアップを可能にする方法を提供することである。
【課題を解決するための手段】
【0008】
本願発明者らは、上記課題を鑑み鋭意検討した結果、1)目的タンパク質または目的ペプチド、2)導入するアミノ酸、3)tRNA、4)アミノアシルtRNA合成酵素、5)アミノアシルtRNAタンパク質転移酵素を、同じ混合液中に、単一の容器内に存在させることにより、本発明の課題が解決されることを見出し、本発明を達成した。
【0009】
すなわち、本発明は以下よりなる。
1.少なくとも以下を含む混合溶液を用いて、目的タンパク質または目的ペプチドにアミノ酸を導入する方法:
1)目的タンパク質または目的ペプチド、
2)導入するアミノ酸、
3)tRNA、
4)アミノアシルtRNA合成酵素、
5)アミノアシルtRNAタンパク質転移酵素。
2.混合溶液中における目的タンパク質または目的ペプチドとtRNAのモル比が、30:1〜1:1である前項1に記載の方法。
3.混合溶液中における目的タンパク質または目的ペプチドとアミノアシルtRNA合成酵素のモル比が、100:1〜2:1である前項1または2に記載の方法。
4.アミノアシルtRNAタンパク質転移酵素が、ロイシル/フェニルアラニルtRNAタンパク質転移酵素またはその変異体である前項1〜3のいずれか1項に記載の方法。
5.目的タンパク質または目的ペプチドのN末端が塩基性アミノ酸であり、導入するアミノ酸が目的タンパク質または目的ペプチドのN末端に導入される、前項4に記載の方法。
6.アミノアシルtRNA合成酵素が、アミノアシルtRNA合成酵素の変異体である前項1〜5のいずれか1項に記載の方法。
7.導入するアミノ酸が、フッ素を含有するアミノ酸である、前項1〜6のいずれか1に記載の方法。
8.導入するアミノ酸が、以下から選択される少なくとも1以上のアミノ酸である前項1〜6のいずれか1項に記載の方法:
2-アミノ-3-(4-アミノ-フェニル)-プロピオン酸;
2-アミノ-3-ナフタレン-1-イル-プロピオン酸;
2-アミノ-3-ナフタレン-2-イル-プロピオン酸;
2-アミノ-3-アントラセン-2-イル-プロピオン酸;
2-アミノ-3-(4-ニトロ-フェニル)-プロピオン酸;
2-アミノ-3-(4-エチニル-フェニル)-プロピオン酸;
2-アミノ-3-(4-ハロ-フェニル)-プロピオン酸;
2-アミノ-3-(4-エトキシ-フェニル)-プロピオン酸;
2-アミノ-3-(4-メトキシ-フェニル)-プロピオン酸;
2-アミノ-3-キノリン-2-イル-プロピオン酸;
2-アミノ-3-(4-フルオロメトキシ-フェニル)-プロピオン酸;
2-アミノ-3-(4-アジド-フェニル)-プロピオン酸;
2-アミノ-3-[4-(2-フルオロ-エトキシ)-フェニル]-プロピオン酸;
2-アミノ-3-(6-メトキシ-ナフタレン-2-イル)-プロピオン酸;
2-アミノ-3-フェニル-プロピオン酸。
9.少なくとも以下を含む前項1〜8のいずれか1項に記載の方法に用いる、目的タンパク質または目的ペプチドへのアミノ酸導入用キット:
1)tRNA、
2)アミノアシルtRNA合成酵素、
3)アミノアシルtRNAタンパク質転移酵素。
10.前項1〜8のいずれか1項に記載の方法または前項9に記載のキットを用いる、非天然タンパク質または非天然ペプチドを製造する方法。
【発明の効果】
【0010】
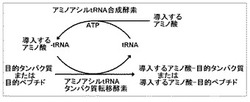
本発明の方法(以下、「Nexta系」とも称する)によれば、tRNAのアミノアシル化、アミノ酸の目的タンパク質への転移反応が引き続いて起こり(図1参照)、アミノアシルtRNAは系中で自発的に作製されるため、アミノアシルtRNAを単離する必要がなくなり、操作が非常に簡便となった。また、導入するアミノ酸の誘導体化等の煩雑な操作も不要となった。さらに、転移反応中にこれまでは副生成物として蓄積されていたtRNAが、本手法においては触媒として働き、再利用されるため、高価なtRNA分子は少量しか必要とされなくなった。したがって、タンパク質導入の大幅なスケールアップおよびコスト削減が可能となった。
【発明を実施するための最良の形態】
【0011】
本発明においてペプチドとは、2個以上のアミノ酸を含有するアミノ酸配列を有するものをいい、分子量5000以上のペプチドをタンパク質という。また、本明細書においてタンパク質とは、例えば生体内で産生された場合には、生体内で何らかの機能・活性を示し得るペプチドを指す。
本発明において用いられる「目的タンパク質」もしくは「目的ペプチド」は、アミノ酸を導入する対象となるタンパク質もしくはペプチドを指す。目的タンパク質もしくは目的ペプチドは、天然のものであっても、非天然のものであっても、どちらでも用いることができる。
天然のタンパク質もしくはペプチドは、例えば種々の生物の生体内から単離して得ることができる。また、遺伝子工学的手法や有機合成などの自体公知の手法を用いて、産生することも可能である。非天然のタンパク質もしくはペプチドも同様に、遺伝子工学的手法や、有機合成などの自体公知の手法を用いて、産生することが可能である。
さらに、用いるアミノアシルtRNAタンパク質転移酵素などの条件に応じて、目的タンパク質もしくは目的ペプチドには、特定の位置に、特定のアミノ酸が存在することが好ましい。例えば、アミノアシルtRNAタンパク質転移酵素として、ロイシル/フェニルアラニルtRNAタンパク質転移酵素(以下、「L/F転移酵素」とも称する)を使用する場合、目的タンパク質もしくは目的ペプチドのN末端に、塩基性のアミノ酸(例えばリジンもしくはアルギニン)が存在している必要がある。
【0012】
「導入するアミノ酸」は、天然のアミノ酸でも非天然のアミノ酸でもどちらも使用することができる。「天然アミノ酸」とは、天然に存在する20種類のアミノ酸を意味する。「非天然アミノ酸」とは、天然アミノ酸以外のアミノ酸を意味する。さらに詳細には、非天然アミノ酸とは、同一分子内にアミノ基とカルボン酸基を有する天然に存在しない人工のあらゆる化合物を指す。非天然アミノ酸は、種々の化合物をアミノ酸骨格(アミノ酸中のカルボン酸基、アミノ基、およびこれらを連結する部分を含むものをさす)に結合させることにより作製することができる。本発明の非天然アミノ酸には、既に、公知の非天然アミノ酸に加えて、将来得られるであろう非天然アミノ酸も含まれる。
【0013】
例えば、非天然アミノ酸として、蛍光物質等の種々の標識物をアミノ酸骨格に結合させたり、放射性同位元素等をアミノ酸に取り込ませたものを用いることもでき、これにより該標識物を取り込んだ標識化タンパク質もしくはペプチドが得られる。それぞれの標識物に応じた方法を用いて、該標識化タンパク質を直接的に、または標識物が酵素基質または抗原性物質である場合などは酵素化学的手法または酵素免疫化学的手法などの間接的手法により、検出および精製することができ、医学、薬学、高分子化学、生化学等に関連する様々な技術分野において様々な用途への利用が期待される。また、非天然アミノ酸として、バイオ直交性を有するアミノ酸を用いることができる。かかるバイオ直交性を有するアミノ酸を導入されたタンパク質やペプチドは、当該導入された位置特異的に、用途に応じてさらなる化学修飾が可能となる。
【0014】
また「導入するアミノ酸」として、フッ素を含有するアミノ酸を用いることができる。フッ素を含有するアミノ酸は、アミノ酸骨格を有する化合物においてフッ素が導入された化合物を意味するが、当該フッ素の核種は問わない。フッ素を含有するアミノ酸としては、図2に示す番号14(2,3,4,5,6-ペンタフルオロフェニルアラニン),19,27のアミノ酸が例示されるがこれらに限定されるものではない。フッ素を含有するアミノ酸として特に好ましいものは、19と27のアミノ酸である。
【0015】
本発明において導入するアミノ酸は、使用するアミノアシルtRNA合成酵素、アミノアシルtRNAタンパク質転移酵素によって適宜選択することができる。例えば、図2に示すアミノ酸番号1〜2および4〜28(番号3は番号28のアミノ酸においてXがI(ヨウ素)であるもの)から選択することができるが、特にこれらに限定されない。アミノアシルtRNA合成酵素として大腸菌由来フェニルアラニルtRNA合成酵素変異体(294番目のアラニンがグリシンに置換:Ala294→Gly)、アミノアシルtRNAタンパク質転移酵素としてロイシル/フェニルアラニルtRNAタンパク質転移酵素を用いる場合は、図2の番号1,4,6〜8,11,12,16,18,19,25,26,27,28のアミノ酸を使用することができ(各アミノ酸の名称については下記表1を参照)、さらに好ましくは図2の番号4,6,7,11,12,16,18,19,25,26,27,28のアミノ酸を使用することができる。また、アミノアシルtRNA合成酵素として大腸菌由来フェニルアラニルtRNA合成酵素変異体(Ala294→Gly)、アミノアシルtRNAタンパク質転移酵素としてロイシル/フェニルアラニルtRNAタンパク質転移酵素変異体(173番目のフェニルアラニンがアラニンに置換:Phe173→Ala)を用いる場合は、図2の番号23のアミノ酸を使用することができる。
【表1】

なお、番号4,12,18,19,26,27のアミノ酸は、分子イメージングなどに使用できるため有用である。
図2に記載のアミノ酸の入手方法は、実施例1を参照されたい。図2の番号27のアミノ酸は、CSPS Pharmaceuticals社(カタログ番号:51504)もしくはAmatek Chemical社(カタログ番号:A-0080)より購入することができ、Aurora Screening Library社、Ambinter Stock Screening Collection社、Enamine Screening Library社、Nanosyn Compound Library社などから購入することもできる。
【0016】
本明細書中における「tRNA」とは、アミノアシルtRNA合成酵素によりアミノアシル化されることが公知であるtRNA、ならびに公知tRNA以外には、本発明にて使用するアミノアシルtRNA合成酵素によるアミノアシル化される機能を有し、かつ本発明にて使用するアミノアシルtRNAタンパク質転移酵素により、当該非天然アミノアシルtRNAに結合しているアミノアシル基がタンパク質もしくはペプチドに転移される機能を有するtRNAを含む。かかる機能を有するtRNAは、公知のtRNAのクローバーリーフ二次構造と同様の二次構造であってもよいし、クローバーリーフ二次構造をとらなくてもよく、いかなる大きさ及び構造であってもよい。
公知のtRNAの例としては、tRNAPheまたはtRNALeuなどの天然tRNAが含まれる。また、本発明のtRNAには、非天然tRNAも含まれるが、本発明にて使用するアミノアシルtRNA合成酵素によるアミノアシル化される機能を有し、かつ本発明にて使用するアミノアシルtRNAタンパク質転移酵素により、当該非天然アミノアシルtRNAに結合しているアミノアシル基がタンパク質もしくはペプチドに転移される機能を有するものであれば、いかなるものでも用いることができる。例えば、本発明において、非特許文献3に記載のアミノアシルtRNA合成酵素を用いる場合は、tRNAPheを用いることが好ましい。
本発明におけるtRNAは、自体公知の方法により合成して、もしくは市販のものを購入して入手することができる(例えば、天然の大腸菌由来フェニルアラニンtRNA、および、天然の大腸菌由来フェニルアラニンtRNAを含むtRNA粗精製物は、SIGMA社より入手可能)。
【0017】
アミノアシルtRNA合成酵素(以下、「aaRS」と称することもある)とは、一般的にはリボソームでの遺伝暗号の翻訳における基質となるアミノアシルtRNAの合成を担う酵素である。aaRSはタンパク質を合成するのに使われる20種のアミノ酸に対応した20種類が存在し、例えば、リジン(Lys)に対応するaaRSはリジルtRNA合成酵素と呼ばれる。本発明において用いられるアミノアシルtRNA合成酵素としては、導入する天然アミノ酸もしくは非天然アミノ酸に対して基質特異性を有する野生型のアミノアシルtRNA合成酵素、ならびに、本来のアミノ酸に対する特異性に比べて非天然アミノ酸誘導体等に対して特異性が高められたアミノアシルtRNA合成酵素の変異体を用いることができる。好ましくは、大腸菌由来フェニルアラニルtRNA合成酵素変異体(Ala294→Gly)(非特許文献3)を用いることができる。
本発明におけるアミノアシルtRNA合成酵素は、自体公知の方法により合成して、もしくは市販のものを購入して入手することができる(例えば、天然のアミノアシルtRNA合成酵素はSIGMA社から入手可能)。
【0018】
アミノアシルtRNAタンパク質転移酵素とは、tRNAの3'末端に付加されたアミノ酸をタンパク質のアミノ末端(N末端)へ転移し、遺伝暗号を介することなくペプチド結合形成反応を触媒する酵素をさす。アミノアシルtRNAタンパク質転移酵素として、天然に存在する野生型酵素のほか、同様の機能を有する変異型転移酵素を用いることもできる。アミノアシルtRNAタンパク質転移酵素として、好ましくはロイシル/フェニルアラニルtRNAタンパク質転移酵素(L/F転移酵素)を用いることができる。L/F転移酵素は大腸菌由来であり、tRNAに結合しているフェニルアラニンや、ロイシン、メチオニンなどの疎水性アミノ酸を、N末端にリジンやアルギニンを有するタンパク質もしくはペプチドに転移させる反応を触媒する酵素である。また、L/F転移酵素変異体(173番目のフェニルアラニンがアラニンに置換(Phe173→Ala))を使用することもできる(K. Suto et al., EMBO J., 25, 5942-5950 (2006))。かかる転移酵素変異体は、野生型が認識しないアミノ酸を認識して、目的タンパク質または目的ペプチドのN末端に転移させることができる(M. Taki, et al., Chembiochem, 2008, 9, 719-722)。アミノアシルtRNAタンパク質転移酵素は、自体公知の方法(例えば遺伝子工学的手法)により合成して入手することができる。
【0019】
本発明の方法において用いられる混合溶液中には、反応に好適な緩衝液、塩類などを適宜存在させることができる。緩衝液としては、例えばHepes緩衝液、Tris-酢酸などが挙げられる。実施例では、反応緩衝液A、Bの2液を混合して用いた。A液の組成は、終濃度で、10mM MgCl2、1mM Spermidine、50mM Hepes緩衝液(pH 7.6)、B液の組成は、終濃度で2.5mM ATP、20mM KCl、2mM DTTである。
【0020】
混合溶液中における、目的タンパク質または目的ペプチド、導入するアミノ酸、tRNA、アミノアシルtRNA合成酵素、アミノアシルtRNAタンパク質転移酵素の各成分の濃度は、任意に設定可能である。好ましくは、混合溶液中における目的タンパク質または目的ペプチドとtRNAのモル比は、30:1〜1:1、さらに好ましくは10:1〜4:1である。また、好ましくは、混合溶液中における目的タンパク質または目的ペプチドとアミノアシルtRNA合成酵素のモル比は、100:1〜2:1、さらに好ましくは50:1〜20:1である。本発明によると、tRNAは系中で再利用されるため少量しか必要とされない。好ましくは、混合溶液中における目的タンパク質または目的ペプチドと導入するアミノ酸のモル比は、100:1〜1:1000、より好ましくは25:1〜1:400、さらに好ましくは1:1〜1:120である。導入するアミノ酸は、目的タンパク質または目的ペプチドに比べて少量でも導入可能であり、導入するアミノ酸量が目的タンパク質もしくは目的ペプチドに比べて過剰であっても、本方法の反応系を阻害することはないと考えられる。導入するアミノ酸が貴重な場合はアミノ酸量を少量にし、逆に目的タンパク質もしくは目的ペプチドが貴重な場合は、目的タンパク質もしくは目的ペプチドを少量にして、反応を行うことができる。
【0021】
温度およびpHなどの反応条件は、使用する酵素などに応じて任意の条件を選択できる。反応温度は、好ましくは約0℃〜50℃、さらに好ましくは約4℃〜37℃である。反応pHは、好ましくは約6〜9、さらに好ましくは約7〜8である。反応時間は、好ましくは約10分以上であり、さらに好ましくは約15分〜120分である。
【0022】
本発明の方法は、目的タンパク質または目的ペプチド、導入するアミノ酸、tRNA、アミノアシルtRNA合成酵素、およびアミノアシルtRNAタンパク質転移酵素を含む混合溶液をインキュベーションすることにより反応させる工程、そして、導入するアミノ酸が結合した目的タンパク質または目的ペプチドを回収する工程を含む。
詳細には、まず、導入するアミノ酸を準備する工程を含む。使用するアミノ酸は、1種類でもよいし複数種でもよい。目的タンパク質または目的ペプチド、導入するアミノ酸、tRNA、アミノアシルtRNA合成酵素、アミノアシルtRNAタンパク質転移酵素を含む混合溶液を調製する工程を含む。これらの構成成分は、一度に混合されても良いし、任意の順番で混合されてもよい。次に、混合溶液をインキュベーションすることにより反応させる工程を含む。例えば、37℃、60分間インキュベーションすることにより、反応を進行させる。次に、反応を停止させる工程を含む。例えば、TFA(トリフルオロ酢酸)水溶液を混合して反応を停止させる。その後、濃縮脱塩処理によりアミノ酸の導入されたタンパク質もしくはペプチド(「非天然タンパク質もしくは非天然ペプチド」と称する。)を回収する工程を含む。例えばZipTip処理により濃縮脱塩処理して非天然タンパク質もしくは非天然ペプチドを精製することができる。
【0023】
本発明はさらに、少なくともtRNA、アミノアシルtRNA合成酵素、アミノアシルtRNAタンパク質転移酵素を含む、目的タンパク質または目的ペプチドへのアミノ酸導入用キットを対象とする。かかるキットには好ましくは、1種もしくは複数種の導入するアミノ酸が含まれる。各構成成分は、1つの容器中に存在した状態で提供されてもよいし、別個の容器中に分離して存在した状態で提供されても良い。当該キットには、緩衝液、塩類などの必要な試薬が含まれていることも好ましい。
また、本発明は、前記のアミノ酸導入方法もしくは、アミノ酸導入用キットを用いる、非天然タンパク質または非天然ペプチドを製造する方法をも対象とする。
【実施例】
【0024】
以下、実施例により本発明を説明するが、本発明はこれらに限定されるものではない。
【0025】
(実施例1)導入するアミノ酸の準備
(1)図2の番号19 O-フルオロメチル-L-チロシン(O-fluoromethyl-L-tyrosine)(以下「fmTyr」と略す)を、下記化学式1に示したスキームに従って合成した(参照:Emmons WD, Ferries AF. J Am Chem Soc 1953; 75: 2257およびJOURNAL OF LABELLED COMPOUNDS AND RADIOPHARMACEUTICALS,J Label Compd Radiopharm 2003; 46: 555.566)。
【化1】

【0026】
(2)図2の番号1〜18、20〜22、24〜26のアミノ酸の入手方法は以下の通りである。番号23のアミノ酸については、後述する。
図2の番号1のアミノ酸はSIGMA社、番号2のアミノ酸はChemika社、番号3のアミノ酸(p-ヨードフェニルアラニン(2-アミノ-3-(4-ヨード-フェニル)-プロピオン酸)、番号28のアミノ酸においてXがIであるもの)は渡辺化学工業株式会社、番号4のアミノ酸はBACHEM社、番号5のアミノ酸はACROS社、番号6〜9のアミノ酸は渡辺化学工業株式会社、番号10および11のアミノ酸は国産化学株式会社、番号12〜14のアミノ酸は渡辺化学工業株式会社、番号15のアミノ酸はACROS社、番号16のアミノ酸は、渡辺化学工業株式会社より購入した。番号17のアミノ酸は、Chemistry & Biology, Volume 8, Issue 3, March 2001, Pages 243-252に記載の方法に基づいて合成した。番号18および20のアミノ酸は渡辺化学工業株式会社より購入した。番号21のアミノ酸は、RSP Amino Acids社から購入し、TFA処理をして脱保護(脱Boc)をした。番号22のアミノ酸は、SIGMA社より購入した。番号24のアミノ酸は、渡辺化学工業株式会社より購入した。番号25のアミノ酸は、特開2006-342299号に記載の方法により合成した。番号26のアミノ酸は渡辺化学工業株式会社より購入した。番号27のアミノ酸はJ Nucl Med 2002; 43:187-199およびJ Nucl Med 1999; 40:205-212に記載の方法に基づいて合成した。
【0027】
(3)図2の番号23のアミノ酸は、下記化学式2に示したスキームに従って合成した。
【化2】

6-メトキシ-2-ナフチルアルデヒド(4.00g)をメタノール約100 mLに、加熱しながら溶解した。溶液を室温まで冷却し、NaBH4 0.81 gを撹拌しながら少量ずつ加えた。室温で一晩撹拌し、冷水20mLを加え、還流管をつけて30分間加熱して余分のNaBH4を分解させた。エバポレーターを用いて、溶媒を減圧除去すると白い結晶が残った。水を140mL、酢酸エチルを加え、結晶を溶解した。溶液を分液ロートに入れた。オイル相を別のビーカーにとり、水相を酢酸エチルで3回洗い、酢酸エチル相を抽出した。抽出液(酢酸エチル相)を蒸留水で1回洗浄し、NaCl飽和溶液で1回洗浄した。約7gの無水MgSO4 を加え水分を除去した。MgSO4をろ過して除き、エバポレーターで溶媒を蒸発させ、残った結晶を真空ラインで3時間減圧し、溶媒を完全に除去した。白色結晶(2-ヒドロキシメチル-6-メトキシナフタレン)3.65 g(90 %)が得られた。
2-ヒドロキシメチル-6-メトキシナフタレンを精製して乾燥した後、フラスコで無水ベンゼン 37 mLに加熱・撹拌しながら溶解し、氷冷した。溶液に、PBr3 5.5 mLを氷冷下で撹拌しながら加えた。暗所室温(約25℃)で24時間静置した。溶液をジエチルエーテル約180 mL/冷蒸留水約120mLの混合物を入れたビーカー中に撹拌しながらゆっくり注ぎ込んだ。混合溶液を分液ロートに入れ、下層(水相)をビーカーに取り、ジエチルエーテルで1回洗った。分液ロート中のエーテル相を蒸留水で3回洗浄した。残ったエーテル相をフラスコにいれ、7gのMgSO4を加えて、水分を除去した。MgSO4をろ過し、ろ液をエバポレーターで減圧乾燥し、少し黄色がかった白色結晶を得た。結晶を真空ラインで約3時間乾燥させた。収量4.6 g (94%)、2-ブロモメチル-6-メトキシナフタレンを得た。
無水エタノール50.6 mLをフラスコに入れて、シリカゲル乾燥管を付けた。金属ナトリウムをろ紙上で、表面の酸化物などをそぎ落とし、エタノール中に投入した。投入した合計量は予定量(506 mg,1.2当量)を約10%超える程度であった。フラスコにシリカゲル乾燥管をつけ、ナトリウムを溶解した。溶液にアセトアミドマロン酸ジエチル(4.37g)を撹拌しながら溶解した。2-ブロモメチル-6-メトキシナフタレン (4.6g,18.32mmol)を別のフラスコ中でジオキサン 50.6 mLに溶解した。この溶液を前者の溶液に撹拌しながらゆっくり加え、室温で一晩撹拌した。溶媒(エタノールとジオキサン)をエバポレーターで減圧除去した。残渣に酢酸エチル100 mLと5% 硫酸水素カリウム水溶液40 mLを加えた。分液ロートに入れ、よく振り混ぜた後、水相を除去した。除去した水相を20 mLの酢酸エチルで2回抽出した。有機相を一つにまとめて、5% 硫酸水素カリウム水溶液、水、飽和食塩水の順で各2回づつ洗浄した。Na2SO4を入れて乾燥させ、ろ取した。エバポレーターで溶媒を減圧除去した。収量6.9 g(収率 97%)、ジエチル(6-メトキシ-2-ナフチル)アセトアミドマロン酸を得た。
ジエチル(6-メトキシ-2-ナフチル)アセトアミドマロン酸 6.9g (17.8 mmol) をエタノール/ジオキサン=1/1(v/v%)110ml に懸濁し、1N 水酸化ナトリウム水溶液 73ml (73 mmol) 加えた。60℃で3時間撹拌した。60℃で撹拌しながら1N 塩酸 76 ml を少量ずつ加えた。脱炭酸が始まるので、二酸化炭素の泡が出なくなるまで60℃に保った。ビーカーに蒸留水 約780 ml を入れ、撹拌しながら溶液を少しずつ加えて、室温まで放冷し、一晩冷蔵庫で冷やした。析出物を濾取し(吸引濾過)、水でよく洗浄し、減圧乾燥させ、番号23のアミノ酸を得た。
【0028】
(実施例2)導入するアミノ酸の量の検討
0.025 O.D./μl E. coli tRNAPhe 2.0μl(77 pmol)、10×アミノアシル化緩衝液A 1.0μl、10×アミノアシル化緩衝液B 1.0μl、350 pmol/μl Lys-Bradykinin 1.0μl(350 pmol)、33μM E. coli フェニルアラニルtRNA合成酵素(PheRS(Ala294→Gly)) 0.5μl(16.5 pmol)、26μM L/F転移酵素 0.5μl(13 pmol)と、100 mM fmTyrを、0μl、0.77μl(77 nmol)、0.77μl(7.7 nmol)、0.77μl(770 pmol)で変化させた混合溶液(超純水(mQ水)で全量10μlに調節)を作製した。これらの混合溶液を7℃で60分間インキュベートした。反応後、終濃度が3%になるようにTFAを加え、vortexにより混合し、卓上遠心機で1分間遠心した。目的ペプチドをZipTipC18処理(脱塩処理)し、マトリックス(CHCA)を含む溶出液で溶出し、MALDI-TOF-MASSで確認した。
なお、10×アミノアシル化緩衝液Aは、0.1 M MgCl2・0.01 M Spermidine/0.5 M HEPES緩衝液(pH 7.6)であり、10×アミノアシル化緩衝液Bは、0.025 M ATP・0.2 M KCl・0.02 M DTT/mQ水である。
【0029】
結果を図3に示す。AはfmTyr 0μl、Bは0.77μl(77 nmol)、Cは0.77μl(7.7 nmol)、Dは0.77μl(770 pmol)の結果である。いずれのアミノ酸濃度においても、本発明の方法によりLys-BradykininをfmTyrで標識することができた。fmTyrの量は、標識の対象となるLys-Bradykininに対して約2倍量で十分であると考えられた。
【0030】
(実施例3)反応時間の検討
0.025 O.D./μl E. coli tRNAPhe 4.0μl(154 pmol)、10×アミノアシル化緩衝液A 2.0μl、10×アミノアシル化緩衝液B 2.0μl、350 pmol/μl Lys-Bradykinin 2.0μl(700 pmol)、1 mM fmTyr 1.54μl(1540 pmol)、33μM E. coli PheRS(Ala294→Gly) 1.0μl(33 pmol)、26μM L/F転移酵素 1μl(26 pmol)を混合した混合溶液(mQ水で全量20μlに調節)を作製した。これらの混合溶液を、3μl×6本に分注した。37℃で0分間、10分間、20分間、30分間、50分間、80分間インキュベートした。反応後、終濃度が3%になるようにTFAを加え、vortexにより混合し、卓上遠心機で1分間遠心した。目的ペプチドをZipTipC18処理(脱塩処理)し、マトリックス(CHCA)を含む溶出液で溶出し、MALDI-TOF-MASSで確認した。
【0031】
結果を図4に示す。Aは0分間、Bは10分間、Cは20分間、Dは30分間、Eは50分間、Fは80分間の結果を示す。これらの結果より、本発明の方法では20分間で反応が完了すると考えられた。
【0032】
(実施例4)導入するアミノ酸の種類の検討
図2に示した番号1〜26の26種類のアミノ酸について、本発明の方法により、Lys-Bradykininに導入できるかどうかを検討した。
0.025 O.D./μl E. coli tRNAPhe 16.0μl(614 pmol)、10×アミノアシル化緩衝液A 8.0μl、10×アミノアシル化緩衝液B 8.0μl、350 pmol/μl Lys-Bradykinin 8.0μl(2800 pmol)、33μM E. coli PheRS(Ala294→Gly) 4.0μl(132 pmol)、26μM L/F転移酵素 4μl(104 pmol)を混合した混合溶液(mQ水で全量64μlに調節)を作製した。これらの混合溶液を、4μlに分注し、各混合溶液に各種アミノ酸溶液(20 mM) 1μl(終濃度4 mM)を添加し、37℃で90分間インキュベートした。反応後、終濃度が3%になるようにTFAを加え、vortexにより混合し、卓上遠心機で1分間遠心した。目的ペプチドをZipTipC18処理(脱塩処理)し、マトリックス(CHCA)を含む溶出液で溶出し、MALDI-TOF-MASSで確認した。なお、10×アミノアシル化緩衝液Aは、0.1 M MgCl2・0.01 M Spermidine/0.5 M HEPES緩衝液(pH 7.6)であり、10×アミノアシル化緩衝液Bは、0.025 M ATP・0.2 M KCl・0.02 M DTT/mQ水である。
【0033】
図2の番号1および8のアミノ酸を用いた場合は、Lys-Bradykininのピークとアミノ酸が付加したピークの両方が確認できた。番号3,4,6,7,11,12,16,18,19,25,26のアミノ酸を用いた場合は、Lys-Bradykininへアミノ酸が付加したピークのみが確認できた。上記以外のアミノ酸はまったく導入できなかった。
【0034】
(実施例5)tRNA量の検討
0.025 O.D./μl E. coli tRNAPheを、2.0μl(77 pmol)、1μl(38.5 pmol)、0.5μl(19.25 pmol)に変化させ、アミノ酸1 mM fmTyr 0.77μl(0.77 nmol)とした以外は、実施例2と同様に混合溶液を調製し、反応を行った。
【0035】
結果を図5に示す。AはtRNAPheを2.0μl(77 pmol)、Bは1μl(38.5 pmol)、Cは0.5μl(19.25 pmol)の場合の結果を示す。tRNAが2.0μlの場合、60分間で完全にアミノ酸を導入することができた。
【0036】
(実施例6)反応温度の検討
実施例3と同様に、全量20μlの混合溶液を作製した。これらの混合溶液を、5μl×4本に分注した。反応温度を、4℃、15℃、26℃、37℃に変化させ、60分間インキュベートした。反応後、終濃度が3%になるようにTFAを加え、vortexにより混合し、卓上遠心機で1分間遠心した。目的ペプチドをZipTipC18処理(脱塩処理)し、マトリックス(CHCA)を含む溶出液で溶出し、MALDI-TOF-MASSで確認した。
【0037】
結果を図6に示す。Aは4℃、Bは15℃、Cは26℃、Dは37℃の結果を示す。全ての温度で、原料のピークがほとんどみられなくなり、反応が完了したと考えられた。
【0038】
(比較例1)従来法(2工程)によるアミノ酸の導入
mQ水 37.84μl、0.025 O.D./μl E. coli tRNAPhe 16.0μl(616 pmol)、10×アミノアシル化緩衝液A 8.0μl、10×アミノアシル化緩衝液B 8.0μl、100mM fmTyr 6.16μl(616 pmol)、33μM E. coli PheRS(Ala294→Gly) 4.0μl(132 pmol)を混合した溶液を2本作製し、37℃で60分間インキュベートした。反応終了後、塩を加えた。そして、フェノール/クロロホルム/イソアミルアルコール処理し、さらに、クロロホルム/イソアミルアルコール処理して、EtOH沈殿させた。70% EtOHで除塩し、減圧乾燥した。
一方の溶液に、mQ水 0.875μl、反応緩衝液 0.625μl、350 pmol/μl Lys-Bradykinin 0.5μl(175 pmol)、26μM L/F転移酵素 0.5μl(13 pmol)を混合し、他方の溶液(ネガティブコントロール)には、26μM L/F転移酵素 0.5μl(13 pmol)の代わりにL/F転移酵素の透析時に用いた緩衝液 0.5μlを混合した。なお、反応緩衝液は、1M KCl/1M Tris-HCl(pH7.8)である、37℃で30分間インキュベートした。反応後、終濃度が3%になるようにTFAを加え、vortexして混合し、卓上遠心機で1分間遠心した。目的ペプチドをZipTipC18処理(脱塩処理)し、マトリックス(CHCA)を含む溶出液で溶出し、MALDI-TOF-MASSで確認した。
【0039】
結果を図7に示す。L/F転移酵素が存在しなかったもの(ネガティブコントロール)では転移反応が起こらなかった(A)。L/F転移酵素を添加したものは転移反応が起こり、Lys-BradykininをfmTyrで標識することができた(B)。Lys-Bradykininが残ったのは、fmTyr-tRNAPheがLys-Bradykininに対して少量であり、不足したためと考えられた。
【0040】
(実施例7)L/F転移酵素変異体(Phe173→Ala)によるアミノ酸の導入
0.025 O.D./μl E. coli tRNAPhe 16.0μl(614 pmol)、10×アミノアシル化緩衝液A 8.0μl、10×アミノアシル化緩衝液B 8.0μl、350 pmol/μl Lys-Bradykinin 8.0μl(2800 pmol)、33μM E. coli PheRS(Ala294→Gly) 4.0μl(132 pmol)、26μM L/F転移酵素(Phe173→Ala) 4μl(104 pmol)を混合した混合溶液(mQ水で全量64μlに調節)を作製した。これらの混合溶液を、4μl×16本に分注し、各混合溶液に20 mM 番号23のアミノ酸 1.0μl(20000 pmol)を添加した。37℃で90分間インキュベートした。反応後、終濃度が3%になるようにTFAを加え、vortexにより混合し、卓上遠心機で1分間遠心した。目的ペプチドをZipTipC18処理(脱塩処理)し、マトリックス(CHCA)を含む溶出液で溶出し、MALDI-TOF-MASSで確認した。
【0041】
結果を図8に示す。Aは1回目の溶出、Bは2回目の溶出、Cは3回目の溶出の結果を示す。変異型L/F転移酵素(Phe173→Ala)により、アミノ酸をLys-Bradykininに導入することができた。
【0042】
(実施例8)野生型L/F転移酵素によるアミノ酸の導入
0.025 O.D./μl E. coli tRNAPhe 4.0μl(153.5 pmol)、10×アミノアシル化緩衝液A 2.0μl、10×アミノアシル化緩衝液B 2.0μl、350 pmol/μl Lys-Bradykinin 2.0μl(700 pmol)、1 mM feTyr(番号27のアミノ酸) 1.54μl(1540 pmol)、33μM E. coli PheRS(Ala294→Gly) 1.0μl(33 pmol)、26μM L/F転移酵素(WT) 1μl(26 pmol)を混合した混合溶液(mQ水で全量20μlに調節)を作製した。これらの混合溶液を、3μl×6本に分注した。37℃で0分間、10分間、20分間、30分間、50分間、80分間インキュベートした。反応後、終濃度が3%になるようにTFAを加え、vortexにより混合し、卓上遠心機で1分間遠心した。目的ペプチドをZipTipC18処理(脱塩処理)し、マトリックス(CHCA)を含む溶出液で溶出し、MALDI-TOF-MASSで確認した。
【0043】
結果を図9に示す。Aは0分間、Bは10分間、Cは20分間、Dは30分間、Eは50分間、Fは80分間の結果を示す。これらの結果より、本発明の方法では30〜50分間でアミノ酸の導入がほぼ完了すると考えられた。
【0044】
(実施例9)tRNA量の検討
10×アミノアシル化緩衝液A 2.0μL、10×アミノアシル化緩衝液B 2.0μL、0.35 nmol/μL Lys-Bradykinin 2.0μL(0.70nmol)、33μM E. coli フェニルアラニルtRNA合成酵素(PheRS(Ala294→Gly)) 1.0μL(33pmol)、26μM L/F転移酵素(WT) 1.0μL(26pmol)、0.70mM O-メチルチロシン(O-metyltyrosine 図2の番号12のアミノ酸(以下「mTyr」と略することもある)) 4.0μL(2.8nmol)混合溶液(mQ水で全量16μLに調節)を作製した。これを4μLで4本に分注し、各種濃度のE. coli tRNAPhe(0.10 O.D./μL、0.025 O.D./μL、6.3×10-3O.D./μL、1.6×10-3O.D./μL)を1.0μL(0.15nmol、39pmol、9.6pmol、2.4pmol)ずつ加えた。 これら混合溶液を37℃で60分間インキュベートした。反応後、終濃度が3%になるようTFAを加え、vortexにより混合し、卓上遠心機で1分間遠心した。目的ペプチドをZipTipC18処理(脱塩処理)し、マトリックス(CHCA)を含む溶出液で溶出し、MALDI-TOF-MASSで確認した。
【0045】
結果を図10に示す。AはtRNAPheを0.15nmol、Bは39pmol、Cは9.6pmol、Dは2.4pmolの場合の結果を示す。tRNAが9.6pmolの場合、60分間で完全にアミノ酸を導入することができた。
【0046】
(実施例10)反応時間の検討
10×アミノアシル化緩衝液A 2.5μL、10×アミノアシル化緩衝液B 2.5μL、0.35 nmol/μL Lys-Bradykinin 2.5μL(0.88nmol)、33μM E. coli フェニルアラニルtRNA合成酵素(PheRS(Ala294→Gly)) 1.25μL(41pmol)、26μM L/F転移酵素 1.25μL(33pmol)、0.35mM mTyr 5.0μL(1.8nmol)、 0.025 O.D./μL E. coli tRNAPhe 5.0μL(0.19nmol)混合溶液(mQ水で全量20μLに調節)を作製した。これを5μLで5本に分注し、これら混合溶液を37℃で所定の時間(0分間、1分間、5分間、10分間、20分間)反応した。反応後、終濃度が3%になるようTFAを加え、vortexにより混合し、卓上遠心機で1分間遠心した。目的ペプチドをZipTipC18処理(脱塩処理)し、マトリックス(CHCA)を含む溶出液で溶出し、MALDI-TOF-MASSで確認した。
【0047】
結果を図11に示す。Aは0分間、Bは1分間、Cは5分間、Dは10分間、Eは20分間の結果を示す。これらの結果より、本発明の方法では20分間で反応が完了すると考えられた。
【0048】
(実施例11)導入するアミノ酸の量の検討
10×アミノアシル化緩衝液A 2.5μL、10×アミノアシル化緩衝液B 2.5μL、0.35 nmol/μL Lys-Bradykinin 2.5μL(0.88nmol)、33μM E. coli フェニルアラニルtRNA合成酵素(PheRS(Ala294→Gly)) 1.25μL(41pmol)、26μM L/F転移酵素 1.25μL(33pmol)、0.025O.D./μL E. coli tRNAPhe 5.0μL(0.19nmol)混合溶液(mQ水で全量20μLに調節)を作製した。これを4μLで5本に分注し、mQ水 1μL、またはmTyr(88μM、0.18mM、0.35mM、0.70mM)を1.0μL(88pmol、0.18nmol、0.35nmol、0.70nmol)ずつ加えた。 これら混合溶液を37℃で60分間インキュベートした。反応後、終濃度が3%になるようTFAを加え、vortexにより混合し、卓上遠心機で1分間遠心した。目的ペプチドをZipTipC18処理(脱塩処理)し、マトリックス(CHCA)を含む溶出液で溶出し、MALDI-TOF-MASSで確認した。
【0049】
結果を図12に示す。AはmTyr 0mol、Bは88pmol、Cは0.18nmol、Dは0.35nmol、Eは0.70nmolの結果である。いずれのアミノ酸濃度においても、本発明の方法によりLys-BradykininをmTyrで標識することができた。mTyrの量は、標識の対象となるLys-Bradykininに対して等量で十分であると考えられた。
【0050】
(実施例12)反応温度の検討
10×アミノアシル化緩衝液A 2.0μL、10×アミノアシル化緩衝液B 2.0μL、0.35 nmol/μL Lys-Bradykinin 2.0μL(0.70nmol)、33μM E. coli フェニルアラニルtRNA合成酵素(PheRS(Ala294→Gly)) 1.0μL(33pmol)、26μM L/F転移酵素 1.0μL(26pmol)、0.35mM mTyr 4.0μL(1.4nmol)、 0.025 O.D./μL E. coli tRNAPhe 4.0μL(0.15nmol)混合溶液(mQ水で全量20μLに調節)を作製した。これを5μLで4本に分注し、これら混合溶液を所定の温度(4℃、15℃、26℃、37℃)で20分間反応した。反応後、終濃度が3%になるようTFAを加え、vortexにより混合し、卓上遠心機で1分間遠心した。目的ペプチドをZipTipC18処理(脱塩処理)し、マトリックス(CHCA)を含む溶出液で溶出し、MALDI-TOF-MASSで確認した。
【0051】
結果を図13に示す。Aは4℃、Bは15℃、Cは26℃、Dは37℃の結果を示す。全ての温度で、本発明の方法によりLys-BradykininをmTyrで標識することができた。
【0052】
(比較例2)従来法(2工程)によるアミノ酸の導入
mQ水 13.2μL、0.025 O.D./μL E. coli tRNAPhe 16.0μL(0.62nmol)、10×アミノアシル化緩衝液A 8.0μL、10×アミノアシル化緩衝液B 8.0μL、20mM O-メチルチロシン(mTyr) 30.8μL(0.62μmol)、33μM E. coli PheRS(Ala294→Gly) 4.0μl(0.13nmol)を混合した溶液を2本作製し、37℃で60分間インキュベートした。反応終了後、塩を加えた。そして、フェノール/クロロホルム/イソアミルアルコール処理し、さらに、クロロホルム/イソアミルアルコール処理して、EtOH沈殿させた。70% EtOHで除塩し、減圧乾燥した。乾燥後、一方に、反応緩衝液 1.5μL、0.35nmol/μL Lys-Bradykinin 0.5μL(0.18nmol)、26μM L/F転移酵素 0.5μL(13pmol)を混合し、他方(ネガティブコントロール)には、26μM L/F転移酵素の代わりにL/F転移酵素の透析時に用いた緩衝液 0.5μLを混合し、37℃で30分間インキュベートした。なお、反応緩衝液は、0.33M KCl/83mM Tris-HCl(pH8.0)である。反応後、終濃度が3%になるようにTFAを加え、vortexして混合し、卓上遠心機で1分間遠心した。目的ペプチドをZipTipC18処理(脱塩処理)し、マトリックス(CHCA)を含む溶出液で溶出し、MALDI-TOF-MASSで確認した。
【0053】
結果を図14に示す。L/F転移酵素が存在しなかったもの(ネガティブコントロール)では転移反応が起こらなかった(A)。L/F転移酵素を添加したものは転移反応が起こり、Lys-BradykininをmTyrで標識することができた(B)。
【産業上の利用可能性】
【0054】
本発明によれば、高効率・簡便かつ低コストに、アミノ酸を目的タンパク質または目的ペプチドに導入することができる。得られた非天然タンパク質または非天然ペプチドは、それら本来の活性を保ったままであり、さらに、蛍光修飾したり、担体上に固定化したりすることができるため、タンパク質またはペプチドの機能解析や、これらを用いて医薬スクリーニングを行うことが可能になると考えられる。
【図面の簡単な説明】
【0055】
【図1】本発明の方法(Nexta法)における反応の模式図である。
【図2】実施例にて使用したアミノ酸の構造式を示す図である。
【図3】本発明の方法により導入するアミノ酸の量について検討した結果を示す図である(実施例2)。
【図4】本発明の方法の反応時間について検討した結果を示す図である(実施例3)。
【図5】本発明の方法において使用するtRNAの量について検討した結果を示す図である(実施例5)。
【図6】本発明の方法の反応温度について検討した結果を示す図である(実施例6)。
【図7】従来法(2工程)によるアミノ酸導入の結果を示す図である(比較例1)。
【図8】本発明の方法(Nexta法)の別の実施形態の結果を示す図である(実施例7)。
【図9】本発明の方法(Nexta法)の別の実施形態の結果を示す図である(実施例8)。
【図10】本発明の方法において使用するtRNAの量について検討した結果を示す図である(実施例9)。
【図11】本発明の方法の反応時間について検討した結果を示す図である(実施例10)。
【図12】本発明の方法により導入するアミノ酸の量について検討した結果を示す図である(実施例11)。
【図13】本発明の方法の反応温度について検討した結果を示す図である(実施例12)。
【図14】従来法(2工程)によるアミノ酸導入の結果を示す図である(比較例2)。
【技術分野】
【0001】
本発明は、目的タンパク質または目的ペプチドにアミノ酸を導入する方法に関する。さらには、目的タンパク質または目的ペプチドにアミノ酸を導入するためのキットおよび、前記アミノ酸を導入する方法もしくは導入キットを用いて非天然タンパク質または非天然ペプチドを製造する方法に関する。
【背景技術】
【0002】
タンパク質の機能解析などの目的のため、天然に存在するタンパク質のアミノ酸配列を任意に組換えて構造を改変することが、遺伝子工学的な手法により、比較的古くから行われている。また、天然のアミノ酸のみならず、非天然のアミノ酸をタンパク質へ導入することも行われている。非天然アミノ酸導入により、タンパク質の構造・機能の解析のみならず、何らかの機能を人工的に付加した人工的なタンパク質の作製も可能になる。
【0003】
機能性基をタンパク質表面に導入する場合、一般に用いられるのがタンパク質の特定残基への化学修飾である。また、近年タンパク質中のアミノ酸残基の置換が可能となったため、タンパク質合成系を拡張することで、アミノ骨格を有する所望の非天然型アミノ酸をタンパク質中に導入することが可能となった。
【0004】
タンパク質合成系を用いずに、酵素的に非天然アミノ酸をtRNAに結合させる方法が開示されている(非特許文献1および2)。目的タンパク質と非天然アミノ酸によりアミノアシル化されたtRNAとを、ロイシル/フェニルアラニルタンパク質転移酵素の存在下で混合すると、目的タンパク質のN末端だけに非天然アミノ酸が転移することが見出された。
【0005】
また、tRNAの3'末端に様々な非天然アミノ酸を結合させる酵素として、アミノアシルtRNA合成酵素変異体が作製されている(非特許文献3)。かかる酵素を用いて、翻訳系により非天然アミノ酸をタンパク質もしくはペプチドに導入する方法が開示されている(特許文献1)。
【特許文献1】国際公開WO03/073238号
【非特許文献1】Chembiochem, 2006, 7, 1676-1679
【非特許文献2】Biopolymers, 2007, 88, 263
【非特許文献3】Chembiochem, 2002, 02-03, 235-237
【発明の開示】
【発明が解決しようとする課題】
【0006】
従来のアミノ酸導入方法では、導入するアミノ酸をtRNAの3'末端に予めアミノアシル化した分子(アミノアシルtRNA)を作製し、それを単離する必要があった。アミノアシルtRNAの作製には、導入するアミノ酸の誘導体化(多段階の有機合成反応)が必要であり、操作が非常に煩雑かつ専門知識が必要であった。得られるアミノアシルtRNAの量は極めて限定され、原料が希少であるため、導入するアミノ酸を付与させた目的タンパク質を大スケールで作製することが不可能であった。また、酵素的にタンパク質へアミノ酸を導入する場合には、反応時にtRNA分子が徐々に蓄積し、酵素反応を徐々に阻害することにもなりかねないという問題点があった。
【0007】
本発明の課題は、高効率・簡便かつ低コストに、アミノ酸を目的タンパク質または目的ペプチドに導入する方法を提供することであり、目的タンパク質または目的ペプチドへのアミノ酸導入のスケールアップを可能にする方法を提供することである。
【課題を解決するための手段】
【0008】
本願発明者らは、上記課題を鑑み鋭意検討した結果、1)目的タンパク質または目的ペプチド、2)導入するアミノ酸、3)tRNA、4)アミノアシルtRNA合成酵素、5)アミノアシルtRNAタンパク質転移酵素を、同じ混合液中に、単一の容器内に存在させることにより、本発明の課題が解決されることを見出し、本発明を達成した。
【0009】
すなわち、本発明は以下よりなる。
1.少なくとも以下を含む混合溶液を用いて、目的タンパク質または目的ペプチドにアミノ酸を導入する方法:
1)目的タンパク質または目的ペプチド、
2)導入するアミノ酸、
3)tRNA、
4)アミノアシルtRNA合成酵素、
5)アミノアシルtRNAタンパク質転移酵素。
2.混合溶液中における目的タンパク質または目的ペプチドとtRNAのモル比が、30:1〜1:1である前項1に記載の方法。
3.混合溶液中における目的タンパク質または目的ペプチドとアミノアシルtRNA合成酵素のモル比が、100:1〜2:1である前項1または2に記載の方法。
4.アミノアシルtRNAタンパク質転移酵素が、ロイシル/フェニルアラニルtRNAタンパク質転移酵素またはその変異体である前項1〜3のいずれか1項に記載の方法。
5.目的タンパク質または目的ペプチドのN末端が塩基性アミノ酸であり、導入するアミノ酸が目的タンパク質または目的ペプチドのN末端に導入される、前項4に記載の方法。
6.アミノアシルtRNA合成酵素が、アミノアシルtRNA合成酵素の変異体である前項1〜5のいずれか1項に記載の方法。
7.導入するアミノ酸が、フッ素を含有するアミノ酸である、前項1〜6のいずれか1に記載の方法。
8.導入するアミノ酸が、以下から選択される少なくとも1以上のアミノ酸である前項1〜6のいずれか1項に記載の方法:
2-アミノ-3-(4-アミノ-フェニル)-プロピオン酸;
2-アミノ-3-ナフタレン-1-イル-プロピオン酸;
2-アミノ-3-ナフタレン-2-イル-プロピオン酸;
2-アミノ-3-アントラセン-2-イル-プロピオン酸;
2-アミノ-3-(4-ニトロ-フェニル)-プロピオン酸;
2-アミノ-3-(4-エチニル-フェニル)-プロピオン酸;
2-アミノ-3-(4-ハロ-フェニル)-プロピオン酸;
2-アミノ-3-(4-エトキシ-フェニル)-プロピオン酸;
2-アミノ-3-(4-メトキシ-フェニル)-プロピオン酸;
2-アミノ-3-キノリン-2-イル-プロピオン酸;
2-アミノ-3-(4-フルオロメトキシ-フェニル)-プロピオン酸;
2-アミノ-3-(4-アジド-フェニル)-プロピオン酸;
2-アミノ-3-[4-(2-フルオロ-エトキシ)-フェニル]-プロピオン酸;
2-アミノ-3-(6-メトキシ-ナフタレン-2-イル)-プロピオン酸;
2-アミノ-3-フェニル-プロピオン酸。
9.少なくとも以下を含む前項1〜8のいずれか1項に記載の方法に用いる、目的タンパク質または目的ペプチドへのアミノ酸導入用キット:
1)tRNA、
2)アミノアシルtRNA合成酵素、
3)アミノアシルtRNAタンパク質転移酵素。
10.前項1〜8のいずれか1項に記載の方法または前項9に記載のキットを用いる、非天然タンパク質または非天然ペプチドを製造する方法。
【発明の効果】
【0010】
本発明の方法(以下、「Nexta系」とも称する)によれば、tRNAのアミノアシル化、アミノ酸の目的タンパク質への転移反応が引き続いて起こり(図1参照)、アミノアシルtRNAは系中で自発的に作製されるため、アミノアシルtRNAを単離する必要がなくなり、操作が非常に簡便となった。また、導入するアミノ酸の誘導体化等の煩雑な操作も不要となった。さらに、転移反応中にこれまでは副生成物として蓄積されていたtRNAが、本手法においては触媒として働き、再利用されるため、高価なtRNA分子は少量しか必要とされなくなった。したがって、タンパク質導入の大幅なスケールアップおよびコスト削減が可能となった。
【発明を実施するための最良の形態】
【0011】
本発明においてペプチドとは、2個以上のアミノ酸を含有するアミノ酸配列を有するものをいい、分子量5000以上のペプチドをタンパク質という。また、本明細書においてタンパク質とは、例えば生体内で産生された場合には、生体内で何らかの機能・活性を示し得るペプチドを指す。
本発明において用いられる「目的タンパク質」もしくは「目的ペプチド」は、アミノ酸を導入する対象となるタンパク質もしくはペプチドを指す。目的タンパク質もしくは目的ペプチドは、天然のものであっても、非天然のものであっても、どちらでも用いることができる。
天然のタンパク質もしくはペプチドは、例えば種々の生物の生体内から単離して得ることができる。また、遺伝子工学的手法や有機合成などの自体公知の手法を用いて、産生することも可能である。非天然のタンパク質もしくはペプチドも同様に、遺伝子工学的手法や、有機合成などの自体公知の手法を用いて、産生することが可能である。
さらに、用いるアミノアシルtRNAタンパク質転移酵素などの条件に応じて、目的タンパク質もしくは目的ペプチドには、特定の位置に、特定のアミノ酸が存在することが好ましい。例えば、アミノアシルtRNAタンパク質転移酵素として、ロイシル/フェニルアラニルtRNAタンパク質転移酵素(以下、「L/F転移酵素」とも称する)を使用する場合、目的タンパク質もしくは目的ペプチドのN末端に、塩基性のアミノ酸(例えばリジンもしくはアルギニン)が存在している必要がある。
【0012】
「導入するアミノ酸」は、天然のアミノ酸でも非天然のアミノ酸でもどちらも使用することができる。「天然アミノ酸」とは、天然に存在する20種類のアミノ酸を意味する。「非天然アミノ酸」とは、天然アミノ酸以外のアミノ酸を意味する。さらに詳細には、非天然アミノ酸とは、同一分子内にアミノ基とカルボン酸基を有する天然に存在しない人工のあらゆる化合物を指す。非天然アミノ酸は、種々の化合物をアミノ酸骨格(アミノ酸中のカルボン酸基、アミノ基、およびこれらを連結する部分を含むものをさす)に結合させることにより作製することができる。本発明の非天然アミノ酸には、既に、公知の非天然アミノ酸に加えて、将来得られるであろう非天然アミノ酸も含まれる。
【0013】
例えば、非天然アミノ酸として、蛍光物質等の種々の標識物をアミノ酸骨格に結合させたり、放射性同位元素等をアミノ酸に取り込ませたものを用いることもでき、これにより該標識物を取り込んだ標識化タンパク質もしくはペプチドが得られる。それぞれの標識物に応じた方法を用いて、該標識化タンパク質を直接的に、または標識物が酵素基質または抗原性物質である場合などは酵素化学的手法または酵素免疫化学的手法などの間接的手法により、検出および精製することができ、医学、薬学、高分子化学、生化学等に関連する様々な技術分野において様々な用途への利用が期待される。また、非天然アミノ酸として、バイオ直交性を有するアミノ酸を用いることができる。かかるバイオ直交性を有するアミノ酸を導入されたタンパク質やペプチドは、当該導入された位置特異的に、用途に応じてさらなる化学修飾が可能となる。
【0014】
また「導入するアミノ酸」として、フッ素を含有するアミノ酸を用いることができる。フッ素を含有するアミノ酸は、アミノ酸骨格を有する化合物においてフッ素が導入された化合物を意味するが、当該フッ素の核種は問わない。フッ素を含有するアミノ酸としては、図2に示す番号14(2,3,4,5,6-ペンタフルオロフェニルアラニン),19,27のアミノ酸が例示されるがこれらに限定されるものではない。フッ素を含有するアミノ酸として特に好ましいものは、19と27のアミノ酸である。
【0015】
本発明において導入するアミノ酸は、使用するアミノアシルtRNA合成酵素、アミノアシルtRNAタンパク質転移酵素によって適宜選択することができる。例えば、図2に示すアミノ酸番号1〜2および4〜28(番号3は番号28のアミノ酸においてXがI(ヨウ素)であるもの)から選択することができるが、特にこれらに限定されない。アミノアシルtRNA合成酵素として大腸菌由来フェニルアラニルtRNA合成酵素変異体(294番目のアラニンがグリシンに置換:Ala294→Gly)、アミノアシルtRNAタンパク質転移酵素としてロイシル/フェニルアラニルtRNAタンパク質転移酵素を用いる場合は、図2の番号1,4,6〜8,11,12,16,18,19,25,26,27,28のアミノ酸を使用することができ(各アミノ酸の名称については下記表1を参照)、さらに好ましくは図2の番号4,6,7,11,12,16,18,19,25,26,27,28のアミノ酸を使用することができる。また、アミノアシルtRNA合成酵素として大腸菌由来フェニルアラニルtRNA合成酵素変異体(Ala294→Gly)、アミノアシルtRNAタンパク質転移酵素としてロイシル/フェニルアラニルtRNAタンパク質転移酵素変異体(173番目のフェニルアラニンがアラニンに置換:Phe173→Ala)を用いる場合は、図2の番号23のアミノ酸を使用することができる。
【表1】

なお、番号4,12,18,19,26,27のアミノ酸は、分子イメージングなどに使用できるため有用である。
図2に記載のアミノ酸の入手方法は、実施例1を参照されたい。図2の番号27のアミノ酸は、CSPS Pharmaceuticals社(カタログ番号:51504)もしくはAmatek Chemical社(カタログ番号:A-0080)より購入することができ、Aurora Screening Library社、Ambinter Stock Screening Collection社、Enamine Screening Library社、Nanosyn Compound Library社などから購入することもできる。
【0016】
本明細書中における「tRNA」とは、アミノアシルtRNA合成酵素によりアミノアシル化されることが公知であるtRNA、ならびに公知tRNA以外には、本発明にて使用するアミノアシルtRNA合成酵素によるアミノアシル化される機能を有し、かつ本発明にて使用するアミノアシルtRNAタンパク質転移酵素により、当該非天然アミノアシルtRNAに結合しているアミノアシル基がタンパク質もしくはペプチドに転移される機能を有するtRNAを含む。かかる機能を有するtRNAは、公知のtRNAのクローバーリーフ二次構造と同様の二次構造であってもよいし、クローバーリーフ二次構造をとらなくてもよく、いかなる大きさ及び構造であってもよい。
公知のtRNAの例としては、tRNAPheまたはtRNALeuなどの天然tRNAが含まれる。また、本発明のtRNAには、非天然tRNAも含まれるが、本発明にて使用するアミノアシルtRNA合成酵素によるアミノアシル化される機能を有し、かつ本発明にて使用するアミノアシルtRNAタンパク質転移酵素により、当該非天然アミノアシルtRNAに結合しているアミノアシル基がタンパク質もしくはペプチドに転移される機能を有するものであれば、いかなるものでも用いることができる。例えば、本発明において、非特許文献3に記載のアミノアシルtRNA合成酵素を用いる場合は、tRNAPheを用いることが好ましい。
本発明におけるtRNAは、自体公知の方法により合成して、もしくは市販のものを購入して入手することができる(例えば、天然の大腸菌由来フェニルアラニンtRNA、および、天然の大腸菌由来フェニルアラニンtRNAを含むtRNA粗精製物は、SIGMA社より入手可能)。
【0017】
アミノアシルtRNA合成酵素(以下、「aaRS」と称することもある)とは、一般的にはリボソームでの遺伝暗号の翻訳における基質となるアミノアシルtRNAの合成を担う酵素である。aaRSはタンパク質を合成するのに使われる20種のアミノ酸に対応した20種類が存在し、例えば、リジン(Lys)に対応するaaRSはリジルtRNA合成酵素と呼ばれる。本発明において用いられるアミノアシルtRNA合成酵素としては、導入する天然アミノ酸もしくは非天然アミノ酸に対して基質特異性を有する野生型のアミノアシルtRNA合成酵素、ならびに、本来のアミノ酸に対する特異性に比べて非天然アミノ酸誘導体等に対して特異性が高められたアミノアシルtRNA合成酵素の変異体を用いることができる。好ましくは、大腸菌由来フェニルアラニルtRNA合成酵素変異体(Ala294→Gly)(非特許文献3)を用いることができる。
本発明におけるアミノアシルtRNA合成酵素は、自体公知の方法により合成して、もしくは市販のものを購入して入手することができる(例えば、天然のアミノアシルtRNA合成酵素はSIGMA社から入手可能)。
【0018】
アミノアシルtRNAタンパク質転移酵素とは、tRNAの3'末端に付加されたアミノ酸をタンパク質のアミノ末端(N末端)へ転移し、遺伝暗号を介することなくペプチド結合形成反応を触媒する酵素をさす。アミノアシルtRNAタンパク質転移酵素として、天然に存在する野生型酵素のほか、同様の機能を有する変異型転移酵素を用いることもできる。アミノアシルtRNAタンパク質転移酵素として、好ましくはロイシル/フェニルアラニルtRNAタンパク質転移酵素(L/F転移酵素)を用いることができる。L/F転移酵素は大腸菌由来であり、tRNAに結合しているフェニルアラニンや、ロイシン、メチオニンなどの疎水性アミノ酸を、N末端にリジンやアルギニンを有するタンパク質もしくはペプチドに転移させる反応を触媒する酵素である。また、L/F転移酵素変異体(173番目のフェニルアラニンがアラニンに置換(Phe173→Ala))を使用することもできる(K. Suto et al., EMBO J., 25, 5942-5950 (2006))。かかる転移酵素変異体は、野生型が認識しないアミノ酸を認識して、目的タンパク質または目的ペプチドのN末端に転移させることができる(M. Taki, et al., Chembiochem, 2008, 9, 719-722)。アミノアシルtRNAタンパク質転移酵素は、自体公知の方法(例えば遺伝子工学的手法)により合成して入手することができる。
【0019】
本発明の方法において用いられる混合溶液中には、反応に好適な緩衝液、塩類などを適宜存在させることができる。緩衝液としては、例えばHepes緩衝液、Tris-酢酸などが挙げられる。実施例では、反応緩衝液A、Bの2液を混合して用いた。A液の組成は、終濃度で、10mM MgCl2、1mM Spermidine、50mM Hepes緩衝液(pH 7.6)、B液の組成は、終濃度で2.5mM ATP、20mM KCl、2mM DTTである。
【0020】
混合溶液中における、目的タンパク質または目的ペプチド、導入するアミノ酸、tRNA、アミノアシルtRNA合成酵素、アミノアシルtRNAタンパク質転移酵素の各成分の濃度は、任意に設定可能である。好ましくは、混合溶液中における目的タンパク質または目的ペプチドとtRNAのモル比は、30:1〜1:1、さらに好ましくは10:1〜4:1である。また、好ましくは、混合溶液中における目的タンパク質または目的ペプチドとアミノアシルtRNA合成酵素のモル比は、100:1〜2:1、さらに好ましくは50:1〜20:1である。本発明によると、tRNAは系中で再利用されるため少量しか必要とされない。好ましくは、混合溶液中における目的タンパク質または目的ペプチドと導入するアミノ酸のモル比は、100:1〜1:1000、より好ましくは25:1〜1:400、さらに好ましくは1:1〜1:120である。導入するアミノ酸は、目的タンパク質または目的ペプチドに比べて少量でも導入可能であり、導入するアミノ酸量が目的タンパク質もしくは目的ペプチドに比べて過剰であっても、本方法の反応系を阻害することはないと考えられる。導入するアミノ酸が貴重な場合はアミノ酸量を少量にし、逆に目的タンパク質もしくは目的ペプチドが貴重な場合は、目的タンパク質もしくは目的ペプチドを少量にして、反応を行うことができる。
【0021】
温度およびpHなどの反応条件は、使用する酵素などに応じて任意の条件を選択できる。反応温度は、好ましくは約0℃〜50℃、さらに好ましくは約4℃〜37℃である。反応pHは、好ましくは約6〜9、さらに好ましくは約7〜8である。反応時間は、好ましくは約10分以上であり、さらに好ましくは約15分〜120分である。
【0022】
本発明の方法は、目的タンパク質または目的ペプチド、導入するアミノ酸、tRNA、アミノアシルtRNA合成酵素、およびアミノアシルtRNAタンパク質転移酵素を含む混合溶液をインキュベーションすることにより反応させる工程、そして、導入するアミノ酸が結合した目的タンパク質または目的ペプチドを回収する工程を含む。
詳細には、まず、導入するアミノ酸を準備する工程を含む。使用するアミノ酸は、1種類でもよいし複数種でもよい。目的タンパク質または目的ペプチド、導入するアミノ酸、tRNA、アミノアシルtRNA合成酵素、アミノアシルtRNAタンパク質転移酵素を含む混合溶液を調製する工程を含む。これらの構成成分は、一度に混合されても良いし、任意の順番で混合されてもよい。次に、混合溶液をインキュベーションすることにより反応させる工程を含む。例えば、37℃、60分間インキュベーションすることにより、反応を進行させる。次に、反応を停止させる工程を含む。例えば、TFA(トリフルオロ酢酸)水溶液を混合して反応を停止させる。その後、濃縮脱塩処理によりアミノ酸の導入されたタンパク質もしくはペプチド(「非天然タンパク質もしくは非天然ペプチド」と称する。)を回収する工程を含む。例えばZipTip処理により濃縮脱塩処理して非天然タンパク質もしくは非天然ペプチドを精製することができる。
【0023】
本発明はさらに、少なくともtRNA、アミノアシルtRNA合成酵素、アミノアシルtRNAタンパク質転移酵素を含む、目的タンパク質または目的ペプチドへのアミノ酸導入用キットを対象とする。かかるキットには好ましくは、1種もしくは複数種の導入するアミノ酸が含まれる。各構成成分は、1つの容器中に存在した状態で提供されてもよいし、別個の容器中に分離して存在した状態で提供されても良い。当該キットには、緩衝液、塩類などの必要な試薬が含まれていることも好ましい。
また、本発明は、前記のアミノ酸導入方法もしくは、アミノ酸導入用キットを用いる、非天然タンパク質または非天然ペプチドを製造する方法をも対象とする。
【実施例】
【0024】
以下、実施例により本発明を説明するが、本発明はこれらに限定されるものではない。
【0025】
(実施例1)導入するアミノ酸の準備
(1)図2の番号19 O-フルオロメチル-L-チロシン(O-fluoromethyl-L-tyrosine)(以下「fmTyr」と略す)を、下記化学式1に示したスキームに従って合成した(参照:Emmons WD, Ferries AF. J Am Chem Soc 1953; 75: 2257およびJOURNAL OF LABELLED COMPOUNDS AND RADIOPHARMACEUTICALS,J Label Compd Radiopharm 2003; 46: 555.566)。
【化1】

【0026】
(2)図2の番号1〜18、20〜22、24〜26のアミノ酸の入手方法は以下の通りである。番号23のアミノ酸については、後述する。
図2の番号1のアミノ酸はSIGMA社、番号2のアミノ酸はChemika社、番号3のアミノ酸(p-ヨードフェニルアラニン(2-アミノ-3-(4-ヨード-フェニル)-プロピオン酸)、番号28のアミノ酸においてXがIであるもの)は渡辺化学工業株式会社、番号4のアミノ酸はBACHEM社、番号5のアミノ酸はACROS社、番号6〜9のアミノ酸は渡辺化学工業株式会社、番号10および11のアミノ酸は国産化学株式会社、番号12〜14のアミノ酸は渡辺化学工業株式会社、番号15のアミノ酸はACROS社、番号16のアミノ酸は、渡辺化学工業株式会社より購入した。番号17のアミノ酸は、Chemistry & Biology, Volume 8, Issue 3, March 2001, Pages 243-252に記載の方法に基づいて合成した。番号18および20のアミノ酸は渡辺化学工業株式会社より購入した。番号21のアミノ酸は、RSP Amino Acids社から購入し、TFA処理をして脱保護(脱Boc)をした。番号22のアミノ酸は、SIGMA社より購入した。番号24のアミノ酸は、渡辺化学工業株式会社より購入した。番号25のアミノ酸は、特開2006-342299号に記載の方法により合成した。番号26のアミノ酸は渡辺化学工業株式会社より購入した。番号27のアミノ酸はJ Nucl Med 2002; 43:187-199およびJ Nucl Med 1999; 40:205-212に記載の方法に基づいて合成した。
【0027】
(3)図2の番号23のアミノ酸は、下記化学式2に示したスキームに従って合成した。
【化2】

6-メトキシ-2-ナフチルアルデヒド(4.00g)をメタノール約100 mLに、加熱しながら溶解した。溶液を室温まで冷却し、NaBH4 0.81 gを撹拌しながら少量ずつ加えた。室温で一晩撹拌し、冷水20mLを加え、還流管をつけて30分間加熱して余分のNaBH4を分解させた。エバポレーターを用いて、溶媒を減圧除去すると白い結晶が残った。水を140mL、酢酸エチルを加え、結晶を溶解した。溶液を分液ロートに入れた。オイル相を別のビーカーにとり、水相を酢酸エチルで3回洗い、酢酸エチル相を抽出した。抽出液(酢酸エチル相)を蒸留水で1回洗浄し、NaCl飽和溶液で1回洗浄した。約7gの無水MgSO4 を加え水分を除去した。MgSO4をろ過して除き、エバポレーターで溶媒を蒸発させ、残った結晶を真空ラインで3時間減圧し、溶媒を完全に除去した。白色結晶(2-ヒドロキシメチル-6-メトキシナフタレン)3.65 g(90 %)が得られた。
2-ヒドロキシメチル-6-メトキシナフタレンを精製して乾燥した後、フラスコで無水ベンゼン 37 mLに加熱・撹拌しながら溶解し、氷冷した。溶液に、PBr3 5.5 mLを氷冷下で撹拌しながら加えた。暗所室温(約25℃)で24時間静置した。溶液をジエチルエーテル約180 mL/冷蒸留水約120mLの混合物を入れたビーカー中に撹拌しながらゆっくり注ぎ込んだ。混合溶液を分液ロートに入れ、下層(水相)をビーカーに取り、ジエチルエーテルで1回洗った。分液ロート中のエーテル相を蒸留水で3回洗浄した。残ったエーテル相をフラスコにいれ、7gのMgSO4を加えて、水分を除去した。MgSO4をろ過し、ろ液をエバポレーターで減圧乾燥し、少し黄色がかった白色結晶を得た。結晶を真空ラインで約3時間乾燥させた。収量4.6 g (94%)、2-ブロモメチル-6-メトキシナフタレンを得た。
無水エタノール50.6 mLをフラスコに入れて、シリカゲル乾燥管を付けた。金属ナトリウムをろ紙上で、表面の酸化物などをそぎ落とし、エタノール中に投入した。投入した合計量は予定量(506 mg,1.2当量)を約10%超える程度であった。フラスコにシリカゲル乾燥管をつけ、ナトリウムを溶解した。溶液にアセトアミドマロン酸ジエチル(4.37g)を撹拌しながら溶解した。2-ブロモメチル-6-メトキシナフタレン (4.6g,18.32mmol)を別のフラスコ中でジオキサン 50.6 mLに溶解した。この溶液を前者の溶液に撹拌しながらゆっくり加え、室温で一晩撹拌した。溶媒(エタノールとジオキサン)をエバポレーターで減圧除去した。残渣に酢酸エチル100 mLと5% 硫酸水素カリウム水溶液40 mLを加えた。分液ロートに入れ、よく振り混ぜた後、水相を除去した。除去した水相を20 mLの酢酸エチルで2回抽出した。有機相を一つにまとめて、5% 硫酸水素カリウム水溶液、水、飽和食塩水の順で各2回づつ洗浄した。Na2SO4を入れて乾燥させ、ろ取した。エバポレーターで溶媒を減圧除去した。収量6.9 g(収率 97%)、ジエチル(6-メトキシ-2-ナフチル)アセトアミドマロン酸を得た。
ジエチル(6-メトキシ-2-ナフチル)アセトアミドマロン酸 6.9g (17.8 mmol) をエタノール/ジオキサン=1/1(v/v%)110ml に懸濁し、1N 水酸化ナトリウム水溶液 73ml (73 mmol) 加えた。60℃で3時間撹拌した。60℃で撹拌しながら1N 塩酸 76 ml を少量ずつ加えた。脱炭酸が始まるので、二酸化炭素の泡が出なくなるまで60℃に保った。ビーカーに蒸留水 約780 ml を入れ、撹拌しながら溶液を少しずつ加えて、室温まで放冷し、一晩冷蔵庫で冷やした。析出物を濾取し(吸引濾過)、水でよく洗浄し、減圧乾燥させ、番号23のアミノ酸を得た。
【0028】
(実施例2)導入するアミノ酸の量の検討
0.025 O.D./μl E. coli tRNAPhe 2.0μl(77 pmol)、10×アミノアシル化緩衝液A 1.0μl、10×アミノアシル化緩衝液B 1.0μl、350 pmol/μl Lys-Bradykinin 1.0μl(350 pmol)、33μM E. coli フェニルアラニルtRNA合成酵素(PheRS(Ala294→Gly)) 0.5μl(16.5 pmol)、26μM L/F転移酵素 0.5μl(13 pmol)と、100 mM fmTyrを、0μl、0.77μl(77 nmol)、0.77μl(7.7 nmol)、0.77μl(770 pmol)で変化させた混合溶液(超純水(mQ水)で全量10μlに調節)を作製した。これらの混合溶液を7℃で60分間インキュベートした。反応後、終濃度が3%になるようにTFAを加え、vortexにより混合し、卓上遠心機で1分間遠心した。目的ペプチドをZipTipC18処理(脱塩処理)し、マトリックス(CHCA)を含む溶出液で溶出し、MALDI-TOF-MASSで確認した。
なお、10×アミノアシル化緩衝液Aは、0.1 M MgCl2・0.01 M Spermidine/0.5 M HEPES緩衝液(pH 7.6)であり、10×アミノアシル化緩衝液Bは、0.025 M ATP・0.2 M KCl・0.02 M DTT/mQ水である。
【0029】
結果を図3に示す。AはfmTyr 0μl、Bは0.77μl(77 nmol)、Cは0.77μl(7.7 nmol)、Dは0.77μl(770 pmol)の結果である。いずれのアミノ酸濃度においても、本発明の方法によりLys-BradykininをfmTyrで標識することができた。fmTyrの量は、標識の対象となるLys-Bradykininに対して約2倍量で十分であると考えられた。
【0030】
(実施例3)反応時間の検討
0.025 O.D./μl E. coli tRNAPhe 4.0μl(154 pmol)、10×アミノアシル化緩衝液A 2.0μl、10×アミノアシル化緩衝液B 2.0μl、350 pmol/μl Lys-Bradykinin 2.0μl(700 pmol)、1 mM fmTyr 1.54μl(1540 pmol)、33μM E. coli PheRS(Ala294→Gly) 1.0μl(33 pmol)、26μM L/F転移酵素 1μl(26 pmol)を混合した混合溶液(mQ水で全量20μlに調節)を作製した。これらの混合溶液を、3μl×6本に分注した。37℃で0分間、10分間、20分間、30分間、50分間、80分間インキュベートした。反応後、終濃度が3%になるようにTFAを加え、vortexにより混合し、卓上遠心機で1分間遠心した。目的ペプチドをZipTipC18処理(脱塩処理)し、マトリックス(CHCA)を含む溶出液で溶出し、MALDI-TOF-MASSで確認した。
【0031】
結果を図4に示す。Aは0分間、Bは10分間、Cは20分間、Dは30分間、Eは50分間、Fは80分間の結果を示す。これらの結果より、本発明の方法では20分間で反応が完了すると考えられた。
【0032】
(実施例4)導入するアミノ酸の種類の検討
図2に示した番号1〜26の26種類のアミノ酸について、本発明の方法により、Lys-Bradykininに導入できるかどうかを検討した。
0.025 O.D./μl E. coli tRNAPhe 16.0μl(614 pmol)、10×アミノアシル化緩衝液A 8.0μl、10×アミノアシル化緩衝液B 8.0μl、350 pmol/μl Lys-Bradykinin 8.0μl(2800 pmol)、33μM E. coli PheRS(Ala294→Gly) 4.0μl(132 pmol)、26μM L/F転移酵素 4μl(104 pmol)を混合した混合溶液(mQ水で全量64μlに調節)を作製した。これらの混合溶液を、4μlに分注し、各混合溶液に各種アミノ酸溶液(20 mM) 1μl(終濃度4 mM)を添加し、37℃で90分間インキュベートした。反応後、終濃度が3%になるようにTFAを加え、vortexにより混合し、卓上遠心機で1分間遠心した。目的ペプチドをZipTipC18処理(脱塩処理)し、マトリックス(CHCA)を含む溶出液で溶出し、MALDI-TOF-MASSで確認した。なお、10×アミノアシル化緩衝液Aは、0.1 M MgCl2・0.01 M Spermidine/0.5 M HEPES緩衝液(pH 7.6)であり、10×アミノアシル化緩衝液Bは、0.025 M ATP・0.2 M KCl・0.02 M DTT/mQ水である。
【0033】
図2の番号1および8のアミノ酸を用いた場合は、Lys-Bradykininのピークとアミノ酸が付加したピークの両方が確認できた。番号3,4,6,7,11,12,16,18,19,25,26のアミノ酸を用いた場合は、Lys-Bradykininへアミノ酸が付加したピークのみが確認できた。上記以外のアミノ酸はまったく導入できなかった。
【0034】
(実施例5)tRNA量の検討
0.025 O.D./μl E. coli tRNAPheを、2.0μl(77 pmol)、1μl(38.5 pmol)、0.5μl(19.25 pmol)に変化させ、アミノ酸1 mM fmTyr 0.77μl(0.77 nmol)とした以外は、実施例2と同様に混合溶液を調製し、反応を行った。
【0035】
結果を図5に示す。AはtRNAPheを2.0μl(77 pmol)、Bは1μl(38.5 pmol)、Cは0.5μl(19.25 pmol)の場合の結果を示す。tRNAが2.0μlの場合、60分間で完全にアミノ酸を導入することができた。
【0036】
(実施例6)反応温度の検討
実施例3と同様に、全量20μlの混合溶液を作製した。これらの混合溶液を、5μl×4本に分注した。反応温度を、4℃、15℃、26℃、37℃に変化させ、60分間インキュベートした。反応後、終濃度が3%になるようにTFAを加え、vortexにより混合し、卓上遠心機で1分間遠心した。目的ペプチドをZipTipC18処理(脱塩処理)し、マトリックス(CHCA)を含む溶出液で溶出し、MALDI-TOF-MASSで確認した。
【0037】
結果を図6に示す。Aは4℃、Bは15℃、Cは26℃、Dは37℃の結果を示す。全ての温度で、原料のピークがほとんどみられなくなり、反応が完了したと考えられた。
【0038】
(比較例1)従来法(2工程)によるアミノ酸の導入
mQ水 37.84μl、0.025 O.D./μl E. coli tRNAPhe 16.0μl(616 pmol)、10×アミノアシル化緩衝液A 8.0μl、10×アミノアシル化緩衝液B 8.0μl、100mM fmTyr 6.16μl(616 pmol)、33μM E. coli PheRS(Ala294→Gly) 4.0μl(132 pmol)を混合した溶液を2本作製し、37℃で60分間インキュベートした。反応終了後、塩を加えた。そして、フェノール/クロロホルム/イソアミルアルコール処理し、さらに、クロロホルム/イソアミルアルコール処理して、EtOH沈殿させた。70% EtOHで除塩し、減圧乾燥した。
一方の溶液に、mQ水 0.875μl、反応緩衝液 0.625μl、350 pmol/μl Lys-Bradykinin 0.5μl(175 pmol)、26μM L/F転移酵素 0.5μl(13 pmol)を混合し、他方の溶液(ネガティブコントロール)には、26μM L/F転移酵素 0.5μl(13 pmol)の代わりにL/F転移酵素の透析時に用いた緩衝液 0.5μlを混合した。なお、反応緩衝液は、1M KCl/1M Tris-HCl(pH7.8)である、37℃で30分間インキュベートした。反応後、終濃度が3%になるようにTFAを加え、vortexして混合し、卓上遠心機で1分間遠心した。目的ペプチドをZipTipC18処理(脱塩処理)し、マトリックス(CHCA)を含む溶出液で溶出し、MALDI-TOF-MASSで確認した。
【0039】
結果を図7に示す。L/F転移酵素が存在しなかったもの(ネガティブコントロール)では転移反応が起こらなかった(A)。L/F転移酵素を添加したものは転移反応が起こり、Lys-BradykininをfmTyrで標識することができた(B)。Lys-Bradykininが残ったのは、fmTyr-tRNAPheがLys-Bradykininに対して少量であり、不足したためと考えられた。
【0040】
(実施例7)L/F転移酵素変異体(Phe173→Ala)によるアミノ酸の導入
0.025 O.D./μl E. coli tRNAPhe 16.0μl(614 pmol)、10×アミノアシル化緩衝液A 8.0μl、10×アミノアシル化緩衝液B 8.0μl、350 pmol/μl Lys-Bradykinin 8.0μl(2800 pmol)、33μM E. coli PheRS(Ala294→Gly) 4.0μl(132 pmol)、26μM L/F転移酵素(Phe173→Ala) 4μl(104 pmol)を混合した混合溶液(mQ水で全量64μlに調節)を作製した。これらの混合溶液を、4μl×16本に分注し、各混合溶液に20 mM 番号23のアミノ酸 1.0μl(20000 pmol)を添加した。37℃で90分間インキュベートした。反応後、終濃度が3%になるようにTFAを加え、vortexにより混合し、卓上遠心機で1分間遠心した。目的ペプチドをZipTipC18処理(脱塩処理)し、マトリックス(CHCA)を含む溶出液で溶出し、MALDI-TOF-MASSで確認した。
【0041】
結果を図8に示す。Aは1回目の溶出、Bは2回目の溶出、Cは3回目の溶出の結果を示す。変異型L/F転移酵素(Phe173→Ala)により、アミノ酸をLys-Bradykininに導入することができた。
【0042】
(実施例8)野生型L/F転移酵素によるアミノ酸の導入
0.025 O.D./μl E. coli tRNAPhe 4.0μl(153.5 pmol)、10×アミノアシル化緩衝液A 2.0μl、10×アミノアシル化緩衝液B 2.0μl、350 pmol/μl Lys-Bradykinin 2.0μl(700 pmol)、1 mM feTyr(番号27のアミノ酸) 1.54μl(1540 pmol)、33μM E. coli PheRS(Ala294→Gly) 1.0μl(33 pmol)、26μM L/F転移酵素(WT) 1μl(26 pmol)を混合した混合溶液(mQ水で全量20μlに調節)を作製した。これらの混合溶液を、3μl×6本に分注した。37℃で0分間、10分間、20分間、30分間、50分間、80分間インキュベートした。反応後、終濃度が3%になるようにTFAを加え、vortexにより混合し、卓上遠心機で1分間遠心した。目的ペプチドをZipTipC18処理(脱塩処理)し、マトリックス(CHCA)を含む溶出液で溶出し、MALDI-TOF-MASSで確認した。
【0043】
結果を図9に示す。Aは0分間、Bは10分間、Cは20分間、Dは30分間、Eは50分間、Fは80分間の結果を示す。これらの結果より、本発明の方法では30〜50分間でアミノ酸の導入がほぼ完了すると考えられた。
【0044】
(実施例9)tRNA量の検討
10×アミノアシル化緩衝液A 2.0μL、10×アミノアシル化緩衝液B 2.0μL、0.35 nmol/μL Lys-Bradykinin 2.0μL(0.70nmol)、33μM E. coli フェニルアラニルtRNA合成酵素(PheRS(Ala294→Gly)) 1.0μL(33pmol)、26μM L/F転移酵素(WT) 1.0μL(26pmol)、0.70mM O-メチルチロシン(O-metyltyrosine 図2の番号12のアミノ酸(以下「mTyr」と略することもある)) 4.0μL(2.8nmol)混合溶液(mQ水で全量16μLに調節)を作製した。これを4μLで4本に分注し、各種濃度のE. coli tRNAPhe(0.10 O.D./μL、0.025 O.D./μL、6.3×10-3O.D./μL、1.6×10-3O.D./μL)を1.0μL(0.15nmol、39pmol、9.6pmol、2.4pmol)ずつ加えた。 これら混合溶液を37℃で60分間インキュベートした。反応後、終濃度が3%になるようTFAを加え、vortexにより混合し、卓上遠心機で1分間遠心した。目的ペプチドをZipTipC18処理(脱塩処理)し、マトリックス(CHCA)を含む溶出液で溶出し、MALDI-TOF-MASSで確認した。
【0045】
結果を図10に示す。AはtRNAPheを0.15nmol、Bは39pmol、Cは9.6pmol、Dは2.4pmolの場合の結果を示す。tRNAが9.6pmolの場合、60分間で完全にアミノ酸を導入することができた。
【0046】
(実施例10)反応時間の検討
10×アミノアシル化緩衝液A 2.5μL、10×アミノアシル化緩衝液B 2.5μL、0.35 nmol/μL Lys-Bradykinin 2.5μL(0.88nmol)、33μM E. coli フェニルアラニルtRNA合成酵素(PheRS(Ala294→Gly)) 1.25μL(41pmol)、26μM L/F転移酵素 1.25μL(33pmol)、0.35mM mTyr 5.0μL(1.8nmol)、 0.025 O.D./μL E. coli tRNAPhe 5.0μL(0.19nmol)混合溶液(mQ水で全量20μLに調節)を作製した。これを5μLで5本に分注し、これら混合溶液を37℃で所定の時間(0分間、1分間、5分間、10分間、20分間)反応した。反応後、終濃度が3%になるようTFAを加え、vortexにより混合し、卓上遠心機で1分間遠心した。目的ペプチドをZipTipC18処理(脱塩処理)し、マトリックス(CHCA)を含む溶出液で溶出し、MALDI-TOF-MASSで確認した。
【0047】
結果を図11に示す。Aは0分間、Bは1分間、Cは5分間、Dは10分間、Eは20分間の結果を示す。これらの結果より、本発明の方法では20分間で反応が完了すると考えられた。
【0048】
(実施例11)導入するアミノ酸の量の検討
10×アミノアシル化緩衝液A 2.5μL、10×アミノアシル化緩衝液B 2.5μL、0.35 nmol/μL Lys-Bradykinin 2.5μL(0.88nmol)、33μM E. coli フェニルアラニルtRNA合成酵素(PheRS(Ala294→Gly)) 1.25μL(41pmol)、26μM L/F転移酵素 1.25μL(33pmol)、0.025O.D./μL E. coli tRNAPhe 5.0μL(0.19nmol)混合溶液(mQ水で全量20μLに調節)を作製した。これを4μLで5本に分注し、mQ水 1μL、またはmTyr(88μM、0.18mM、0.35mM、0.70mM)を1.0μL(88pmol、0.18nmol、0.35nmol、0.70nmol)ずつ加えた。 これら混合溶液を37℃で60分間インキュベートした。反応後、終濃度が3%になるようTFAを加え、vortexにより混合し、卓上遠心機で1分間遠心した。目的ペプチドをZipTipC18処理(脱塩処理)し、マトリックス(CHCA)を含む溶出液で溶出し、MALDI-TOF-MASSで確認した。
【0049】
結果を図12に示す。AはmTyr 0mol、Bは88pmol、Cは0.18nmol、Dは0.35nmol、Eは0.70nmolの結果である。いずれのアミノ酸濃度においても、本発明の方法によりLys-BradykininをmTyrで標識することができた。mTyrの量は、標識の対象となるLys-Bradykininに対して等量で十分であると考えられた。
【0050】
(実施例12)反応温度の検討
10×アミノアシル化緩衝液A 2.0μL、10×アミノアシル化緩衝液B 2.0μL、0.35 nmol/μL Lys-Bradykinin 2.0μL(0.70nmol)、33μM E. coli フェニルアラニルtRNA合成酵素(PheRS(Ala294→Gly)) 1.0μL(33pmol)、26μM L/F転移酵素 1.0μL(26pmol)、0.35mM mTyr 4.0μL(1.4nmol)、 0.025 O.D./μL E. coli tRNAPhe 4.0μL(0.15nmol)混合溶液(mQ水で全量20μLに調節)を作製した。これを5μLで4本に分注し、これら混合溶液を所定の温度(4℃、15℃、26℃、37℃)で20分間反応した。反応後、終濃度が3%になるようTFAを加え、vortexにより混合し、卓上遠心機で1分間遠心した。目的ペプチドをZipTipC18処理(脱塩処理)し、マトリックス(CHCA)を含む溶出液で溶出し、MALDI-TOF-MASSで確認した。
【0051】
結果を図13に示す。Aは4℃、Bは15℃、Cは26℃、Dは37℃の結果を示す。全ての温度で、本発明の方法によりLys-BradykininをmTyrで標識することができた。
【0052】
(比較例2)従来法(2工程)によるアミノ酸の導入
mQ水 13.2μL、0.025 O.D./μL E. coli tRNAPhe 16.0μL(0.62nmol)、10×アミノアシル化緩衝液A 8.0μL、10×アミノアシル化緩衝液B 8.0μL、20mM O-メチルチロシン(mTyr) 30.8μL(0.62μmol)、33μM E. coli PheRS(Ala294→Gly) 4.0μl(0.13nmol)を混合した溶液を2本作製し、37℃で60分間インキュベートした。反応終了後、塩を加えた。そして、フェノール/クロロホルム/イソアミルアルコール処理し、さらに、クロロホルム/イソアミルアルコール処理して、EtOH沈殿させた。70% EtOHで除塩し、減圧乾燥した。乾燥後、一方に、反応緩衝液 1.5μL、0.35nmol/μL Lys-Bradykinin 0.5μL(0.18nmol)、26μM L/F転移酵素 0.5μL(13pmol)を混合し、他方(ネガティブコントロール)には、26μM L/F転移酵素の代わりにL/F転移酵素の透析時に用いた緩衝液 0.5μLを混合し、37℃で30分間インキュベートした。なお、反応緩衝液は、0.33M KCl/83mM Tris-HCl(pH8.0)である。反応後、終濃度が3%になるようにTFAを加え、vortexして混合し、卓上遠心機で1分間遠心した。目的ペプチドをZipTipC18処理(脱塩処理)し、マトリックス(CHCA)を含む溶出液で溶出し、MALDI-TOF-MASSで確認した。
【0053】
結果を図14に示す。L/F転移酵素が存在しなかったもの(ネガティブコントロール)では転移反応が起こらなかった(A)。L/F転移酵素を添加したものは転移反応が起こり、Lys-BradykininをmTyrで標識することができた(B)。
【産業上の利用可能性】
【0054】
本発明によれば、高効率・簡便かつ低コストに、アミノ酸を目的タンパク質または目的ペプチドに導入することができる。得られた非天然タンパク質または非天然ペプチドは、それら本来の活性を保ったままであり、さらに、蛍光修飾したり、担体上に固定化したりすることができるため、タンパク質またはペプチドの機能解析や、これらを用いて医薬スクリーニングを行うことが可能になると考えられる。
【図面の簡単な説明】
【0055】
【図1】本発明の方法(Nexta法)における反応の模式図である。
【図2】実施例にて使用したアミノ酸の構造式を示す図である。
【図3】本発明の方法により導入するアミノ酸の量について検討した結果を示す図である(実施例2)。
【図4】本発明の方法の反応時間について検討した結果を示す図である(実施例3)。
【図5】本発明の方法において使用するtRNAの量について検討した結果を示す図である(実施例5)。
【図6】本発明の方法の反応温度について検討した結果を示す図である(実施例6)。
【図7】従来法(2工程)によるアミノ酸導入の結果を示す図である(比較例1)。
【図8】本発明の方法(Nexta法)の別の実施形態の結果を示す図である(実施例7)。
【図9】本発明の方法(Nexta法)の別の実施形態の結果を示す図である(実施例8)。
【図10】本発明の方法において使用するtRNAの量について検討した結果を示す図である(実施例9)。
【図11】本発明の方法の反応時間について検討した結果を示す図である(実施例10)。
【図12】本発明の方法により導入するアミノ酸の量について検討した結果を示す図である(実施例11)。
【図13】本発明の方法の反応温度について検討した結果を示す図である(実施例12)。
【図14】従来法(2工程)によるアミノ酸導入の結果を示す図である(比較例2)。
【特許請求の範囲】
【請求項1】
少なくとも以下を含む混合溶液を用いて、目的タンパク質または目的ペプチドにアミノ酸を導入する方法:
1)目的タンパク質または目的ペプチド、
2)導入するアミノ酸、
3)tRNA、
4)アミノアシルtRNA合成酵素、
5)アミノアシルtRNAタンパク質転移酵素。
【請求項2】
混合溶液中における目的タンパク質または目的ペプチドとtRNAのモル比が、30:1〜1:1である請求項1に記載の方法。
【請求項3】
混合溶液中における目的タンパク質または目的ペプチドとアミノアシルtRNA合成酵素のモル比が、100:1〜2:1である請求項1または2に記載の方法。
【請求項4】
アミノアシルtRNAタンパク質転移酵素が、ロイシル/フェニルアラニルtRNAタンパク質転移酵素またはその変異体である請求項1〜3のいずれか1項に記載の方法。
【請求項5】
目的タンパク質または目的ペプチドのN末端が塩基性アミノ酸であり、導入するアミノ酸が目的タンパク質または目的ペプチドのN末端に導入される、請求項4に記載の方法。
【請求項6】
アミノアシルtRNA合成酵素が、アミノアシルtRNA合成酵素の変異体である請求項1〜5のいずれか1項に記載の方法。
【請求項7】
導入するアミノ酸が、フッ素を含有するアミノ酸である、請求項1〜6のいずれか1に記載の方法。
【請求項8】
導入するアミノ酸が、以下から選択される少なくとも1以上のアミノ酸である請求項1〜6のいずれか1項に記載の方法:
2-アミノ-3-(4-アミノ-フェニル)-プロピオン酸;
2-アミノ-3-ナフタレン-1-イル-プロピオン酸;
2-アミノ-3-ナフタレン-2-イル-プロピオン酸;
2-アミノ-3-アントラセン-2-イル-プロピオン酸;
2-アミノ-3-(4-ニトロ-フェニル)-プロピオン酸;
2-アミノ-3-(4-エチニル-フェニル)-プロピオン酸;
2-アミノ-3-(4-ハロ-フェニル)-プロピオン酸;
2-アミノ-3-(4-エトキシ-フェニル)-プロピオン酸;
2-アミノ-3-(4-メトキシ-フェニル)-プロピオン酸;
2-アミノ-3-キノリン-2-イル-プロピオン酸;
2-アミノ-3-(4-フルオロメトキシ-フェニル)-プロピオン酸;
2-アミノ-3-(4-アジド-フェニル)-プロピオン酸;
2-アミノ-3-[4-(2-フルオロ-エトキシ)-フェニル]-プロピオン酸;
2-アミノ-3-(6-メトキシ-ナフタレン-2-イル)-プロピオン酸;
2-アミノ-3-フェニル-プロピオン酸。
【請求項9】
少なくとも以下を含む請求項1〜8のいずれか1項に記載の方法に用いる、目的タンパク質または目的ペプチドへのアミノ酸導入用キット:
1)tRNA、
2)アミノアシルtRNA合成酵素、
3)アミノアシルtRNAタンパク質転移酵素。
【請求項10】
請求項1〜8のいずれか1項に記載の方法または請求項9に記載のキットを用いる、非天然タンパク質または非天然ペプチドを製造する方法。
【請求項1】
少なくとも以下を含む混合溶液を用いて、目的タンパク質または目的ペプチドにアミノ酸を導入する方法:
1)目的タンパク質または目的ペプチド、
2)導入するアミノ酸、
3)tRNA、
4)アミノアシルtRNA合成酵素、
5)アミノアシルtRNAタンパク質転移酵素。
【請求項2】
混合溶液中における目的タンパク質または目的ペプチドとtRNAのモル比が、30:1〜1:1である請求項1に記載の方法。
【請求項3】
混合溶液中における目的タンパク質または目的ペプチドとアミノアシルtRNA合成酵素のモル比が、100:1〜2:1である請求項1または2に記載の方法。
【請求項4】
アミノアシルtRNAタンパク質転移酵素が、ロイシル/フェニルアラニルtRNAタンパク質転移酵素またはその変異体である請求項1〜3のいずれか1項に記載の方法。
【請求項5】
目的タンパク質または目的ペプチドのN末端が塩基性アミノ酸であり、導入するアミノ酸が目的タンパク質または目的ペプチドのN末端に導入される、請求項4に記載の方法。
【請求項6】
アミノアシルtRNA合成酵素が、アミノアシルtRNA合成酵素の変異体である請求項1〜5のいずれか1項に記載の方法。
【請求項7】
導入するアミノ酸が、フッ素を含有するアミノ酸である、請求項1〜6のいずれか1に記載の方法。
【請求項8】
導入するアミノ酸が、以下から選択される少なくとも1以上のアミノ酸である請求項1〜6のいずれか1項に記載の方法:
2-アミノ-3-(4-アミノ-フェニル)-プロピオン酸;
2-アミノ-3-ナフタレン-1-イル-プロピオン酸;
2-アミノ-3-ナフタレン-2-イル-プロピオン酸;
2-アミノ-3-アントラセン-2-イル-プロピオン酸;
2-アミノ-3-(4-ニトロ-フェニル)-プロピオン酸;
2-アミノ-3-(4-エチニル-フェニル)-プロピオン酸;
2-アミノ-3-(4-ハロ-フェニル)-プロピオン酸;
2-アミノ-3-(4-エトキシ-フェニル)-プロピオン酸;
2-アミノ-3-(4-メトキシ-フェニル)-プロピオン酸;
2-アミノ-3-キノリン-2-イル-プロピオン酸;
2-アミノ-3-(4-フルオロメトキシ-フェニル)-プロピオン酸;
2-アミノ-3-(4-アジド-フェニル)-プロピオン酸;
2-アミノ-3-[4-(2-フルオロ-エトキシ)-フェニル]-プロピオン酸;
2-アミノ-3-(6-メトキシ-ナフタレン-2-イル)-プロピオン酸;
2-アミノ-3-フェニル-プロピオン酸。
【請求項9】
少なくとも以下を含む請求項1〜8のいずれか1項に記載の方法に用いる、目的タンパク質または目的ペプチドへのアミノ酸導入用キット:
1)tRNA、
2)アミノアシルtRNA合成酵素、
3)アミノアシルtRNAタンパク質転移酵素。
【請求項10】
請求項1〜8のいずれか1項に記載の方法または請求項9に記載のキットを用いる、非天然タンパク質または非天然ペプチドを製造する方法。
【図1】


【図2】


【図8】


【図3】


【図4】


【図5】


【図6】


【図7】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】




【図2】


【図8】


【図3】


【図4】


【図5】


【図6】


【図7】


【図9】


【図10】


【図11】


【図12】


【図13】


【図14】


【公開番号】特開2009−106267(P2009−106267A)
【公開日】平成21年5月21日(2009.5.21)
【国際特許分類】
【出願番号】特願2008−135410(P2008−135410)
【出願日】平成20年5月23日(2008.5.23)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成19年(2007年)11月25日、BMB2007(第30回日本分子生物学会年会・第80回日本生化学会大会 合同大会) 発行の、「BMB2007(第30回日本分子生物学会年会・第80回日本生化学会大会 合同大会)講演要旨集」に発表
【出願人】(504147243)国立大学法人 岡山大学 (444)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
【公開日】平成21年5月21日(2009.5.21)
【国際特許分類】
【出願日】平成20年5月23日(2008.5.23)
【新規性喪失の例外の表示】特許法第30条第1項適用申請有り 平成19年(2007年)11月25日、BMB2007(第30回日本分子生物学会年会・第80回日本生化学会大会 合同大会) 発行の、「BMB2007(第30回日本分子生物学会年会・第80回日本生化学会大会 合同大会)講演要旨集」に発表
【出願人】(504147243)国立大学法人 岡山大学 (444)
【出願人】(301021533)独立行政法人産業技術総合研究所 (6,529)
【Fターム(参考)】
[ Back to top ]

