直接可視化ロボットによる術中放射線療法アプリケータ装置
【解決手段】 本発明は、アパーチャからの放射線源を交互に閉鎖・曝露させる手段によって、カプセル(カセットとも呼ばれる)およびアパーチャを持つロボットアプリケータ装置を患者体内で展開させることを提案する。カプセルおよびアパーチャは手術用ロボットに統合され、以下で詳述するとおりロボットIORT(術中放射線療法)アプリケータ装置となる。カプセル、放射線源、およびIORTアプリケータのアームは、組織に治療上の放射線量を照射する十分な量で電離放射線に曝露させるために、医師、物理士または技師が体内の組織を見たり選択できるように統合されている。ロボット操作装置を使用して、医師や物理士は曝露対象の組織に放射線を遠隔照射するだけでなく、曝露時間も制御することになる。望ましい治療効果を得るべく、治療対象の組織の断端や深さおよび適切な放射線源または放射性同位体(ニュートロン、X線、α、βまたはγ放射体を含む任意の粒子放射体であり得る)を特定・計算するために、制御手段が追加されることになる。本発明によって、放射線感受性組織に隣接しての、定位手術や限局的な近接放射線療法が可能となる。
【発明の詳細な説明】
【技術分野】
【0001】
本出願は、2007年9月19日に届出された「直接可視化ロボットによる術中放射線療法アプリケータ装置」と題する米国仮出願第60/973,545号および2008年9月18日に届出された同名の米国仮出願第61/098,225号の利益を主張し、必要に応じて米国を含む国内段階でのその一部継続出願となる。
【0002】
本発明は、放射線放出がより高い精度で腫瘍(特に臓器腫瘍)を破壊し、下層の健常な基本的組織を破壊することなく質の高い断端を残すことができるように開閉式のアパーチャを有しロボット操作される、患者体内で展開される放射線源を内蔵した可動式の小型カプセルまたはカセットによるがんの放射線治療に関連する。本発明により、限局的な近接放射線療法が可能となる。本発明により、α線、β線およびニュートロン、X線、γ線またはそれらを組み合わせて術中照射を実際的に利用することが可能となる。
【背景技術】
【0003】
術中放射線療法は従来、大型で煩雑な線形加速器および放射性物質の注入により提供されてきたが、どちらも著しい二次的被害や結果的な死亡の原因となることがあり、転帰を大幅に改善するという実証はされてこなかった。卵巣がんなどの多くのがんで大きな長期的問題となっているのは、切除(手術)に際して、微視的がんを含むあらゆるがん手術による全摘出を意味する断端陰性(clear margin)もしくは最適な縮小(optimal debulking)を得るのが困難な点である。その結果、残存がん細胞が残存することが多く、原発性がんから離れて到達や破壊が難しいその他の場所に移動する場合がある(実際頻繁に発生する)。さらに、がん細胞が移動(転移)しうるその他の部位は、発見時点では臓器を侵食していない場合でも、繊細な臓器組織に隣接して、または該組織に存在することが多い。転移性がん細胞はその後、新しい病変部位の局所血液供給を用いて成長し始め、そのうちに臓器機能を弱化させ、最終的には臓器を破壊し、多くの場合は死亡に至らしめる。
【0004】
従来の体外放射線療法技術は多くの場合、罹患した臓器に照射される放射線の相対毒性を理由にこのような局所転移の治療に対しては効果が低い。がんの破壊に十分な放射線量は同様に、手術外の設定において特定の線量をがん性病変のみに照射できないことを理由に、問題の罹患した組織または臓器にとっても致死的である。体外放射線療法技術では小さな転移性病変に正確に的を絞ることができないことは十分文書化されており、以下に関連している。
a.)高精度のCT/MR/PETで小さな病変を可視化できないこと
b.)小さながん性病変に正確に的を絞る上で必要な期間に、臓器運動をリアルタイムで特定・追跡できないこと
c.)正常臓器への許容できない損傷を生じさせずに十分な線量を腫瘍に照射する上で十分な、従来的、原体照射的、IMRT、サイバーナイフまたは断層撮影法の技術を用いた体外放射線量をがん性病変に限定することができないこと。
【0005】
全摘出(すなわち最適な外科的切除)を裏付ける統計情報には非常に説得力がある。研究では、局所進行卵巣がんでは予後が不良であり、卵巣がん症例すべての51%を占めるIII期卵巣がんでは、例えば最適な縮小(optimal debulking)が行われたがんの五年間の生存率(肉眼での残存疾患が明らかでない)は21%〜5%であり、化学療法や手術技術の進化にもかかわらず過去25年間において死亡率にはほとんど変化がなかったことが実証されている。[Gunderson]
【0006】
残存疾患の量は、一次的手技および二次的手技の両方において、腫瘍縮小手術(すなわち肉眼で見えるがん細胞の全摘出)の価値を実証する多数の研究によって裏付けられた予後指標である。つまり、残存疾患の量が多いほど予後が不良となる。腫瘍縮小手術は、残存疾患が1 cm以下の患者では無進行生存日数や全生存を長期化することが示されてきた。これらの患者では化学治療薬による治療が有益だが、卵巣がんの進行や死亡率は依然として高いままである。残存疾患の低下に対する価値が高いことが示されている。残存疾患が皆無の場合の平均生存期間は39カ月間、残存疾患が0.5 cm未満の平均生存期間は29カ月間、残存疾患が0.5 cm〜1.5 cmでは18カ月間、残存疾患が1.5 cmを上回る場合は11カ月間以下に低下した。[Griffiths]
【0007】
放射線療法は、腫瘍性(がん性)疾患の治療法としてよく知られている。放射線療法は一般に、許容できない罹患率を生じさせずに特に残存疾患の部位に線量を照射できないことや、腹部の正常組織が極めて繊細なために生じる死亡率を理由に、腹部がんの治療は試みられたものの成功を収めてこなかった。術中放射線療法は、過去において正常組織への線量を最小限に抑えつつ腫瘍に正確に放射線を照射できなかったことを理由に、幅広く適応されてこなかった。
【0008】
放射性核種を照射するその他の試みにはカテーテルの配置が含まれるが、本発明で熟考されているロボットアーム装置や線量照射装置ならびに外科手術中のリアルタイムでの線量測定や線源の選択がない場合には柔軟性に欠け、本発明が提案する方法で正確に誘導することができず、治療の過程において素早く再配置することもできない。言い換えれば、いったんカテーテルが配置されると固定されて第二の手術がない限り不動となる。その一方、提案の発明では手術時点での即時かつ正確な位置付けが可能であり、カテーテル配置の従来の方法ではえることのできなかった柔軟性や精度が得られる。
【0009】
本発明は、術中ロボット手術装置の一形態でありDaVinci Robotic Surgery Deviceと呼ばれるIntuitive Surgical, Inc.社開発・所有の最近の技術、またより一般的にはカリフォルニア州シルバンのQPC Lasers社が製造するBright Lase Ultra Laser(TM)手術用レーザーを含む術中ロボット手術装置に統合されることを提案している。術中ロボット手術装置に関連する技術の例には、『Performing cardiac surgery without cardioplegia, Evans他(米国特許第6,468,265号、2002年10月22日)』、『Manipulator positioning linkage for robotic surgery, Blumenkranz他(米国特許第6,246,200号、2001年6月12日)』、『Master having redundant degrees of freedom, Salisbury, Jr.他(米国特許第6,684,129号、2004年1月27日)』、および『Minimally invasive surgical training using robotics and telecollaboration, Wang他(米国特許第7,413,565号、2008年8月19日)』などの自動制御を例証した装置が挙げられ、手術用ロボットによる術中手術装置や手術用ロボットによる統合型術中システムを例証するために、参照することにより採用される。放射線腫瘍学の分野は、体外放射線療法のための画像に基づく放射線療法の治療計画が1990年代に導入されたことで著しく変化した。一例に、線形加速度放射線システムを用いたPhilips社製のMobitron(TM)がある。上記を実現する技術によって、これまで不可能だった方法でがん治療用の正確な照射野の設計が実現するが、その大きさから体裁が悪いという面があり、治療上の最大利点(すなわち、罹患していない組織への照射を避けつつ高リスクの腫瘍部を狙う)を提供するように治療用ビームを最適に狙った位置に正確に操作することはできない。術中の設定においてがんやその他の腫瘍を正確に狙うことができる必要性もまた、長い間切望されてきた。DaVinciスタイルの術中手術装置や同様の装置(より一般的には「手術用ロボット」と呼ばれる)の開発によって、この目標を求めて探求すべき新しい手段が生まれたが、この手段こそが本発明の主題である。
【0010】
本発明の目的上、患者を安定化してから医師が少なくとも一つのロボット装置またはアームを操作する形でロボットを用いて手術や治療を行うことを提案する装置を、手術用ロボットと呼ぶ。本発明の目的上、放射線治療カプセルまたはカセットや関連する誘導システムをロボットマニピュレーターアームへのアタッチメントとして使用する手術用ロボットを、手術用ロボット術中放射線療法装置またはSRIORTと呼ぶ。
【0011】
本発明は、装置によって医師が手術時に直接見える状態で、リアルタイムで一つまたは複数の腫瘍部位に致死放射線量を特定・照射できる点で独特である。対照的に、当該技術ではアプリケータが配置され、後日かつ手術後にMammosite(R)バルーン/カテーテルタイプの装置またはそれを使用して放射線源を後日配置できる後充填カテーテルを含有する平角な材料などの装置を用いて放射線を照射する。
【0012】
上述のように、術中放射線術後療法および術中療法は大型で煩雑な線形加速器および放射性物質の注入を提供してきたが、どちらも著しい二次的被害や結果的な死亡の原因となることがあり、転帰を大幅に改善するという実証はされてこなかった。
【0013】
その他のアプローチは柔軟性に欠け、本発明が提案するような方法で正確に誘導することができず、治療の過程において素早く再配置することもできない。言い換えれば、いったんカテーテルが配置されると固定されて第二の手術がない限り不動となる。その一方、提案の発明では手術時点での即時かつ正確な位置付けが可能となり、カテーテル配置の従来の方法では得ることのできなかった柔軟性や精度が得られる。追加的な利点は、提案の発明では、線形加速器に基づく術中技術において現在必要とされる開腹手術ではなく、非開腹の腹腔鏡下手術中に術中放射線療法を導入することが認められる点である。
【0014】
本発明では、より明確に狙いを絞ったがん性組織の治療を可能にするIORTへの新たな追加機能を提案し、がん性病変に局所化した致死放射線量を照射しつつ重要臓器の損傷を最小限に抑えるために必要な、さまざまな角度からの放射線照射を指図することができる。
【0015】
SRIORT装置は、手術用ロボットを用いたロボット操作の正確な手術を提供する能力と、その後に同一の手術用ロボットを用いて手術室において、正常組織には放射線量をかけず既知または疑われる残存疾患の領域を治療するための極めて局所的な方法での放射線の照射を実現する可動式のアパーチャ、照準装置、線量やタイミングロジックを特定の活性やエネルギー特性を備えたラジオアイソトープを含有するSRIORT装置に取り付ける能力と組み合わせることで、当該技術における不利な点を克服して、著しい治療上の利点となる。本装置は、治療領域、望ましい治療の深さそして必要な放射線量を正確に特定するために、PET/CT/MR、およびビデオ画像、術中超音波映像、および触覚応答センサーを含む直接画像化法を組み合わせている。
【0016】
SRIORT装置によって、従来の術中放射線治療に見られる開腹術の必要性なく、腫瘍部位への直接かつリアルタイムでの照射野の術中配置が認められ、同時にロボット部分によって外科医および放射線腫瘍医は電離放射線へのスタッフの曝露がほぼ皆無または皆無な形で手術室においてリアルタイムで望ましい治療を行うことができることから、本発明は放射線療法の分野における大きな前進を示す。これは開腹手術の必要性をなくし、低侵襲手術を利用し、従来のカテーテルに基づく小線源治療に対する第二の手術の必要性を低下させる。
【0017】
本発明の出願はまた、決定組織への近接性から「手術不能」がんと見なされてきたがんへの放射線の照射も熟考している。本発明によって、致死的な結果または望ましくない結果を伴わない放射線療法には従来的に適さない放射線感受性組織に隣接して、正確な方法で放射線による定位的な治療介入を行うことが可能になる。
【発明の概要】
【発明が解決しようとする課題】
【0018】
本発明の第一の目的は、カプセルや被照射組織の近くにいる人物が安全に行うことのできない体内照射による手術を要しない断端の精度向上を可能にすることである。
【0019】
第二の目的は、手術で摘出した組織に隣接する組織の目視を可能にし、リアルタイムで排除する必要がある組織に照射するか、摘出組織の断端を大きく取るために組織に照射することである。
【0020】
第三の目的は、「手術不能」な組織(すなわち、放射線感受性の組織、または切除するのが危険な組織)を正確に摘出または回避することができるように、そのような組織の目視も含めて、患者体内での照射によって正確な深さで組織を摘出できるようにすることである。
【0021】
第四の目的は、高精度のCT/MR/PETで検出されたものなど、小さな病変の可視化と摘出を可能にすることである。
【0022】
第五の目的は、小さながん性病変を正確に狙う必要のある期間に臓器または組織運動をリアルタイムで特定・追跡し、臓器または組織運動に対応して照射を調整することである。
【0023】
第六の目的は、正常臓器への許容できない損傷を生じさせることなく腫瘍に十分な線量を照射するのに十分な良性、悪性またはがん性の病変に照射を制限し、従来的、原体照射的、IMRT、サイバーナイフまたは断層撮影法の技術を用いた体外放射線量を正確な病変や望ましい断端に限定することができないことから生じる不正確さや二次的被害を回避することである。
【0024】
第七の目的は、必要となる侵襲時間を最小限に抑え、同時に放射線への不要な曝露時間を低下させるために、手術用ロボットを動作させうるより高い速度と正確さを使用することである。
【課題を解決するための手段】
【0025】
本発明は、アパーチャからの放射線源を交互に閉鎖・曝露させる手段によって、カプセル(カセットとも呼ばれる)およびアパーチャを持つロボットアプリケータ装置を患者体内で展開させることを提案する。カプセルおよびアパーチャは手術用ロボットに統合され、以下で詳述するとおりロボットIORT(術中放射線療法)アプリケータ装置となる。カプセル、放射線源、およびIORTアプリケータのアームは、スタッフへの曝露を避けつつ、組織に治療放射線量を照射するために十分な量の電離放射線に曝露させるために、医師、物理士または技師が体内の組織を対話形式で見たり選択できるように統合されている。ロボット操作装置を使用して、医師や物理士は曝露対象の組織に放射線を遠隔照射するだけでなく、曝露時間も制御することになる。望ましい治療効果を得るべく、治療対象の組織の断端や深さおよび適切な放射線源または放射性同位体(ニュートロン、X線、α、βまたはγ放射体を含む任意の粒子放射体であり得る)を特定・計算するために、制御手段が追加されることになる。
【0026】
本明細書で説明する本発明は、手術用ロボットシステムの遠隔誘導下で、がん性腫瘍や良性腫瘍を致死線量に曝すために正確な照射野の導入、可視化および照準化を可能にする閉塞的な遮蔽機構を備えた、放射線生成同位体またはX線を搭載したカプセルまたは粒子発生器を取り付け・統合することで、がんまたは一つまたは複数の腫瘍を含むその他の腫瘍を持つ患者体内への放射線治療の新しい形態の実現を目的とする手術用ロボットマシンとの放射線照射装置の統合から構成される。本発明は、腫瘍細胞のさらなる成長を阻害し罹患した異常細胞のさらなる成長を制限するために腫瘍細胞を十分な時間照射野に曝露させることで、手術中にがん性組織を放射線量に曝すことを目的として、ロボット制御下で、カプセルの選択、手術用ロボットアームへの取り付けおよび直接かつ画像誘導で可視化される下での患者への放射線の導入を実現する。
【0027】
本発明は手術中の使用を意図しているため、がん手術に熟達した外科医は、放射線治療の使用や照射に熟達した放射線腫瘍医や医学物理士と協力して、腫瘍の外科的切除の時点で、また治効量の放射線量を腫瘍に照射するために計画された外科手術の一環として手術中に放射線治療を行う上で必要な場合はその後時間をおいて、本発明を使用することになる。本発明は、超音波、MRI、CT、PETまたはPET/CTまたは医用画像誘導の組み合わせなどの画像技術を用いて、放射線治療や照射に関連した合併症を可能な限り最小限に抑えるべく罹患していない組織には線量を照射することなく治効量の照射線量を発生させるために、事前または外科手術と同時に、患者内部の照射野の正しく正確な配置や組織曝露のタイミングについて放射線腫瘍医を誘導・指示する。本明細書で説明する本発明により操作者は、上述した医用画像、照射手術中に照射用カプセルを挿入する時点での重要な解剖的ランドマークの空間推論によるリアルタイムの誘導、手術用ロボットの位置報告技術を通したアプリケータの正確な位置の画像表示システムに対する三次元でのリアルタイム描写、および可視光技術を用いた直接可視化によって操作者にとって関心のある腫瘍性組織(良性またはがん性)を特定し、操作者が医師によるロボットの遠隔制御下で手術用ロボットマニピュレーターアームを使用して、人体内で、適切な放射線の種類と曝露で腫瘍に照射して疾患を治癒および/または管理する確率を高めるような方法で、術中放射線治療用カプセルの正確な位置付けを可能にする。
【図面の簡単な説明】
【0028】
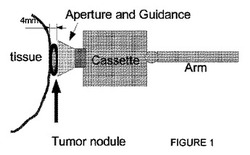
【図1】図1は、体内組織(1)と上記組織に配置され標的となっている腫瘍結節(2)(例は4 mm。深さは表示)との相対位置を示す。放射性物質を含むカセット(4)とロボットアーム(5)上のカセットの一般位置とともに、位置決め機構を含むシュラウド(3)の簡易図が組織上で示されている。
【発明を実施するための形態】
【0029】
発明の好適な方法は、下記に説明する通りシャッターを備えた交換式照射カプセルを第一に選択することを提案している。治療する組織の深さや大きさに基づいて、カプセルに配置する放射線源が選択され、SRIORTのロボットアームに取り付けられる。次に、別の画像法またはこれらの任意の組み合わせの有無に関係なく、直接見える状態で組織の照射のためにアームを適切な位置に移動する。
上記を詳述すると、発明の重要な構成要素は以下の通りである。
放射線源。
手術用ロボットに接続され腹腔鏡/手術用ロボット切開を通じて患者体内に挿入される、特定の制御電子機器や装置を備えた、空洞へのアパーチャがある放射線源を含むカプセル/アーム。
病変、腫瘍、組織、または臓器については、望ましくはビデオ画面またはコンピュータモニタまたはその他の表示手段で手術用ロボットの操作ステーションから見ることのできる、手術室においてリアルタイムでの、CT、MRI、超音波、機能MRI、PET、PET/CTおよび核医学スキャンを含む、手術前の医用画像や手術前の融合医用画像を表示する機構。
体内における放射線源カプセルの座標をリアルタイムで特定・追跡し、画像上に現在プログラミングされた照射野分布を投影させ、手術用ロボットに対する組織位置についてリアルタイムでの更新を行って望ましい組織への過剰照射を避ける汎用コンピュータなどの制御手段によって、手術前画像上でカプセルの三次元の位置を表示する機構。
望ましくはビデオ画面、コンピュータモニタ、またはカプセルの体内位置を表示し、可視光、赤外線や紫外線またはこれらの任意の組み合わせを用いて直接見える状態で前進と位置付けを行う手段上で、視覚的な追跡を行う機構。
(上記の組み合わせまたは超音波エコーを用いて)腫瘍、および腫瘍の深さを特定する機構。
アパーチャサイズを設定し、望ましい線量を受け入れ、選択された放射線源、物理的パラメータおよび特性に基づき曝露時間を計算する機構。
手術室スタッフへの曝露を防止しつつ望ましい放射線量、望ましい腫瘍容積に対する照射野サイズや形状を提供するために、空洞において適切に位置付けられた放射線源を起動させる機構。これは通常、電気機械アクチュエータがカプセル内で閉じたシャッターを開くことを意味する。ただし、手術用ロボットアーム内にあるピンなどのアクチュエータがシャッターを起動させて開くように、機械的結合を行うことも可能である。カメラに使用されるスタイルの渦巻き状に開閉する虹彩シャッターや単純なドア機構によって、調整可能なアパーチャを提供することができる。
体内における放射線源カプセルの座標をリアルタイムで特定・追跡し、例えばビデオ画面、コンピュータモニタまたは表示手段上で、手術前画像でカプセルの三次元の位置、画像上での照射野分布を示す放射線治療後報告、および被照射組織への推定損傷を表示する機構。
これらの構成要素と機構を以下で詳述する。
【0030】
本発明のがんに対する応用は以下の通りである。
【0031】
医師は、腫瘍およびがんの進行が疑われるその他の部位(時として「ホットスポット」と呼ばれる)を位置確認するために、標準の医療処置に従って患者体内の原像を撮る。これらは、PET、CT、MRIおよび核医学スキャンを含むさまざまな医用画像法で特定可能な部位である。医師は、外科的介入の過程においてがんが疑われるその他の部位を目視で特定する。
【0032】
医師は次に、腹部を切開しSRIORTを起動させる。SRIORTのロボットアームにはテレビカメラが取り付けられている。SRIORTには、ロボットアームに取り付けられ遠隔制御される付属品がある。次に手術用SRIORTは内膜を切開するために使用され、切断用器具は医師による切除の実施に使用される。外科医は、必要に応じて焼灼・清拭し、最終的にはSRIORTアーム上のカメラから残りの組織を閲覧することができ、上述の医用画像とともにどの部位にさらに放射線治療が必要かを判断する。
【0033】
卵巣がんの場合、手術により最大限の縮小が得られたとしても、多くの場合、肝臓表面、横隔膜および腸部位が関連した疾患の点在が残る。相当な罹患率や死亡率さえも引き起こさず、または予想外に高い放射線に手術室スタッフを曝さずには、がん転移を排除するための狙いを絞った十分な放射線量を十分正確に照射できないことを理由に、体外照射(全腹部放射線療法)、従来の小線源治療または広範アイソトープ療法もしくは加速器を用いた従来の術中放射線療法によって通常これらの部位を治療することは不可能である。
【0034】
浸透させたい組織の深さや照射すべき望ましい線量に基づき、適切な放射タイプ、エネルギーそして強度のラジオアイソトープまたは装置生成の照射(X線)でありうる特定の放射線源がSRIORTアーム上のカプセルに配置されるよう選択される。このカプセルは、SRIORTアームに恒久的に取り付けるか、または放射線源の異なる物理的特性に適応した交換式モジュールであることが望ましい。カプセルは、照射野の方向と大きさ、および漏洩放射線からのスタッフ防護の両方に必要な遮蔽体を備え、装置の大きさのバランスを取るように設計される必要がある。次にカプセルは、その保管位置からロボット制御により選択され、SRIORTのアームに取り付けられ、患者体内の照射に適切な位置に移動される。次に医師は、カプセルと提案されるビーム位置をその角度に移動し、望ましいビーム角度を病変に移動させる。SRIORTには、病変の直接可視化を可能にするカメラが備わっている。超音波変換器またはプローブなど、腫瘍に適した別の画像装置をカメラに使用することもできる。放射線ビーム応用のスポットを特定し光をあてるためにレーザーを取り付けることができる。
【0035】
体外の線形加速器を用いた従来のIORTは、10〜20 Gy(Gy = 灰色 = ジュール/kg 電離放射により物質に蓄積されたエネルギー)の線量を使用した。これらの線量は、多種多様な装置や同位体で、最も一般的にはIr−192またはCs−137などの高い比放射能を持つものと、またさらに最近のX線ダイオードおよび固体X線生成器を使用することもできる。さらに、Sr−90(エネルギー0.195 MeVのβ放射体)などのその他の放射体も使用できる。下記の表は、副産物と典型的なエネルギーや半減期の例を示している。
【0036】
【表1】

【0037】
同位体に対する以下の公式によって線量が計算される。
【0038】
【数1】

【0039】
これらの線源およびその他の線源の放射能範囲は通常、5〜10 Ci(10 Ci=370 GBq)である。例えば、10 Ci線源強度を仮定し、放射能を線量に変換する上で使用される特定の空気カーマ率定数
【数2】

【0040】
を持つIridium−192を用いて、図1に示す4 mmの腫瘍に対してアプリケータのカプセルから深さ5 mm(4 mm + 1 mm 断端)に20 Gyを照射するためには、以下の曝露が必要となる。
【0041】
【数3】

【0042】
上記パラメータを仮定した場合、曝露時間は、2000/11001 = 0.181分間、つまり10秒間となる。典型的な線源表面間距離として0.25 cmが選択された。それ故、SRIORTを使用した手術室でのリアルタイムの誘導において、曝露、照射野の位置確認と大きさを正確に制御しつつ、各病変を1分以内で治療することができる。
【0043】
単位時間あたりの照射線量に対するこの曝露範囲における距離の絶対的臨界を理由に、カプセルは光測距法を用いた独立した電子距離測定器を持つ。
【0044】
臓器運動が懸念される場合は、医師の裁量により、腫瘍から0.5 cmなど距離をより開いて装置を位置付けることができる。臓器運動または患者の相対運動に適応するように調整を行うこともできる。この距離について、上記計算では曝露時間0.67分間または40.2秒が得られる。
【0045】
曝露時間は二重タイマーバックアップシステムにより電子制御され、これによって一次タイマー設定時間が過ぎると、バックアップ用の二次タイマーが稼動し、アパーチャを閉じて放射線の曝露を止める。これらのタイマーは両方とも、操作者のコンソール上にはっきりと見えるディスプレイを備え、これにはカセットに放射線が存在する場合に可視・可聴なアラームが付いている。また、カセットの制御電子回路によってアパーチャを閉じることができない場合(放射線源の場合)または放射線生成装置の電源を停止できない場合(X線ダイオード装置の場合)に可視・可聴な第二のアラームも付いている。
【0046】
カセットの放射線「安全性」を確保したチャンバーとアパーチャは、放射線遮蔽体を念頭において構築されている。装置は線量率が高低両方の線源を使用できることから、遮蔽体は幾つかの理由により義務付けられているが、その中で最も重要な理由は、装置の迷放射線放出から患者組織を防護し、装置または放射線源の移動中に手術室スタッフを防護することである。
【0047】
遮蔽体の計算は、劣化ウラニウム、鉛またはタングステンのいずれかの使用を根拠としている。遮蔽特性に優れ、ウラニウム製遮蔽体はより薄く、腹腔鏡下の創傷(1〜3 cm)への挿入や体内に挿入された後のロボット制御での操作がより簡単なより軽量カセットが実現することから、好適な遮蔽体はウラニウムである。典型的な線源サイズ(現在使用されているNucletronおよびVarian線源に基づく)は、直径0.5 mmx長さ5 mmである。線源が患者内に存在する時間中に線量を許容レベルに低下させるために、提案されるこの計算例では、線源が患者内にある手術は最長1時間持続すると仮定される。この時間中に線源は放射線を放出し、治療中の医学治療的な放射線の使用においては低リスクで60 cGyを曝露させることができる。手術室スタッフへの曝露はこれよりも低く保つ必要があるため、さらなる外部遮蔽体を患者周りに配置してALARAの放射線安全の限界を満たすようにする。ロボットのワークステーションを患者から遠ざけて配置することができることで、外部遮蔽体の必要性が最小限に抑えられる。遮蔽体の計算式:
【数4】

【0048】
線源強度として10 Ciが選ばれた。変換係数はCiあたり37 GBqである。平均的な患者の「厚さ」はおよそ20 cmであるため、放射線遮蔽体の計算を目的とする患者身体表面への距離としては通常、10センチメートルが選択される。この線量率を許容レベルにまで低下させるために、線量は60 cGy/時未満または遮蔽のおよそ1または2の1/10価層まで低下される。Ir−192での劣化ウラニウムの1/10価層は6.5 mmであるため、劣化ウラニウム1.3 cmによって完全遮蔽が実現し、10 cmでの漏洩照射線量率は411 cGy/時から10 cmでは4.1 cGy/時に、5 cmでは16 cGy/時に低下する。タングステンが選択された場合、遮蔽体の厚さはおよそ22 mmである必要がある。
【0049】
線源サイズ、遮蔽要件、および必要な電子装置やアダプタを考えた場合、好適な方法でのカセットの最終寸法は直径4 cmx長さ5 cmまたは4 cmx3 cmx5 cmである。円錐部分については、円錐が望ましい場合には円錐の発散角は被照射組織の外径と一致すべきである。円錐の形状は、腫瘍の形状に応じて選択することができる。円錐(使用される場合)は、非常に短くてもよい(3〜4 mm)。不規則な腫瘍の形状に適合するよう、カセットに取り付けられる円錐はさまざまなものであってもよい。これによって線源、関連する可視化、計測・制御電子装置そして機械安全装置を囲む十分な空間が得られる。SIユニットでの遮蔽体の計算式:
【数5】

【0050】
シャッターの直径は、少なくとも望ましい最大照射野サイズである。最も要求される可能性の高いシャッターは、最大2 cm開くように設計されたものである。照射の視準は線源サイズによって決定される可能性がより高いが、特定の治療計画ではシャッターサイズが望ましい最大視準よりも大きくなければならない。
【0051】
発明の第二の方法では、位置決めシステムとしてのみカセット装置を使用し、放射線の照射用に装置は移送管コネクタを備え、これによってNucletron HDRまたはVarian HDR装置などの既存の高線量率遠隔操作式後充填装置を使用して放射線源を提供することが可能となる。これらの装置は上述のものと類似するIr−192線源を備え、これがケーブルに取り付けられ、HDRおよびSRIORTカセットに取り付けられた移送管により位置付けられる。このオプションは、組織内放射線治療で利用できる装置を有する機関で利用できるものである。この場合、線源照射機構以外には線源はカセットの一部ではなく、むしろ装置が適切に位置付けられた後に照射が行われる。この配置には多くのデメリットがあるため自己完結型システムよりも好適ではないが、その最も顕著な点は、線源が移送管を移動する中で線源が自由に放射されるためにスタッフ全員が手術室を離れる必要が生じ、手術の所要時間が大幅に長くなることである。
【0052】
この装置の利点は、装置が小型で、直接見える状態で、SRIORT制御システムによってリアルタイムで簡単に操作できることである。これによって、外科医や放射線腫瘍医は手術の過程で、残存疾患や切除不能疾患の部位を決定し、腫瘍を滅菌するために正確かつ相互作用的に放射線線量を照射することができる。カプセルの放射線源は従来の線形加速器アームよりも低いため、カプセルを保持した関節式ロボットの「手」を用いて高精度で体内にカプセルを設置し、ロボットによる切開を通じてカプセルを体内に挿入しつつ照射野を正確な腫瘍部位に方向付けることができる。
【0053】
使用する線源の放射能強度が高くなる可能性があるため、電子/機械のオーバーライド両方を搭載した緊急アパーチャ閉機構が装置で使用される。システムにはまた、シャッターを開くまたはアパーチャを曝露させる電気/機械信号がない場合には、アパーチャのデフォルトを閉位置にするフェイルセーフ機構を備えている。X線生成装置の場合は、正電流の直接命令がない限り、フェイルセーフによって装置に電流が流れないようになっている。
【0054】
さらに本装置は、関節式ロボットの「手首」または「手」装置とともに制御可能なアパーチャを備えた遮蔽カプセルを有することで、アパーチャを開く前に放射線源の正確な位置付けが可能となり、装置の位置付けと確認が行われるまで放射線から正常組織が防護される。これは、術中放射線療法の応用に対する現在の方法からの大きな前進である。
【0055】
遮蔽カプセルを使用する目的は、カプセルと内部の放射線源が望ましい位置に移動する間の組織への損傷を最小限に抑えることである。カプセルは鉛、タングステンまたはウラニウムなどの高密度遮蔽材で製造されており、カプセルはそこから放射粒子が放出されるアパーチャを覆うシャッターを備えている。シャッターはまた、タングステンなどの高密度遮蔽材で製造してもよいが、適切かつ必要な放射線防護を提供するのに十分な質量エネルギーの減衰係数に関するデータを含む、Berger & Seltzerハンドブックに記載した材料から選択することもできる。カプセルの設計は、レンズ交換式カメラと同じように、交換式シャッターの適応を認めるものである。
【0056】
交換式カプセルは遮蔽された保管装置で保管し、手術室環境で従来使用されるように蒸気滅菌またはガス滅菌できる。放射線源は保管用ピグから抽出されるが、これは放射線源材料の輸送・保管に使用されるより大型の高度に遮蔽された貯蔵室で、通常は鉛またはタングステンで製造され、手術室の患者のすぐ近くに位置し、カプセル移動時のスタッフや患者への曝露を最小限に抑える。γ線を放出する線源からすべてのγ放射線を遮蔽するのは非現実的だが、ロボット支援の術中放射線療法アプリケータによって実現される距離そして十分な量の遮蔽によって、スタッフへの曝露を最小限に抑えつつ、NCRPの放射線作業者への曝露限界に適合する形で装置を使用できるようになる。装置には、放射線防護のALARA(As Low As Reasonably Achievable=合理的に達成可能な限り低く抑えるべき)の哲学に従い、また計画される手術の許容される職業曝露限度を相当下回り、手術スタッフを防護するために手術室に設置された移動式の遮蔽部材という形態での十分な遮蔽を含む。室内曝露合計を計測・記録するために、測量器が装置やワークステーション内に構築される。ラジオアイソトープ次第であるが、患者を遮蔽するために可動式の患者遮蔽体を利用することができ、患者の曝露を最小限に抑えるように手術による侵入部位用アパーチャ付きのものが望ましい。その移動式の患者遮蔽体は、可動式キャスター上の鉛遮蔽体などの一つまたは一連のフード付き容器、または一つまたは一連の鉛エプロンという形態でもよい。
【0057】
カセットをロボットアーム上の制御接触に対応する内部配線に接続された接触を持つよう設計するか、カセットの内部配線をロボットアームへのワイヤーハーネスによって接続することができる。別の好適な方法はワイヤレス制御機構であるが、電離放射線のレベルが問題になる可能性がある。
【0058】
α放射体またはβ放射体については、軽量カプセルが可能である。現行技術では、粒子加速器を粒子、陽子、電子または軽イオンの効果的応用に使用することはできないが、これらは治療上効果のあるエネルギーレベルでは路程が極めて短いものの、その路程内ではがん細胞の繁殖能力(DNAや細胞が破砕したDNAを修復する能力)にとって壊滅的である。ラジオアイソトープから放射されたα粒子、またそれほどではないがβ粒子は、γ線と同様に多種多様の同位体から簡単に得ることができる。[Berger and Selzer, Attix]
【0059】
α粒子は高線エネルギー付与(LET)粒子と見なされ、二重鎖DNA切断という形でDNAに相当な損害を与え、細胞がこの損害を適切に修復するのは非常に困難である。対照的にγ線とx線は低LET粒子であり、DNA近くで水分を発生させるヒドロキシルフリーラジカルの放射線分解を発生させることで作動し、細胞生存と線量を比較した線形象限曲線に従い一重鎖と二重鎖の切断を引き起こし、ついにはがん細胞の繁殖恒常性が失われる。β粒子も同様に線エネルギー付与は低いが、二重鎖の切断を引き起こし、非低酸素環境における酸素によって恒久的になりうる一重鎖切断の一群を通じてDNAを破壊することができる。
【0060】
SRIORTアームに取り付けられたカプセルによって、α放射体またはβ放射体を健常組織から完全に遮蔽し、放射線源がその標的に位置付けされる際の過渡損傷を最小限に抑えることが可能となる。望ましいビームサイズにアパーチャを設定し、正確な位置かつ望ましい角度でアパーチャを位置付け、カプセルのシャッターを開く場合にのみ、放射線ビームが病変に照射する望ましい方向にカプセル内のシャッターから放出される。X線生成装置の場合、X線源は上記パラメータが満たされた場合にのみ起動する。
【0061】
組織内の粒子経路の長さは極めて予測可能であり、肝臓、腎臓や腸などの正常組織への損傷を最小限に抑えつつ、がん組織をより高い精度で破壊することができる。Sr−90は、適切な遮蔽体がなければ命にかかわる典型的なβ放射体であるが、提案されるカプセルで使用される場合は標的部位に安全に方向付けることができる。α粒子を放出する同位体と同様に、γ線またはX線を生じさせうる線源はカプセルに適切な遮蔽体を施して使用することができる。β放射体の大きな利点は、本発明の新技術による非常に効果が高く予測可能な放射同位体の実現と、遮蔽体の簡素化による容積減少を理由とするカプセルの小型化である。当業者が利用できる線源として表(例えばBerger & Seltzerの表)に規定した金属または適切な電子阻止能を持つルーサイトなどのプラスチックを遮蔽体に使用することができる。より小さく狭い空間にある相当に小さな腫瘍を治療することが可能になる。
【0062】
カプセルのシャッターは、単に放射線アパーチャを閉じるドアと同等のものでもよい。好適な方法は、クラムシェル型の外側カバーを備えた虹彩アパーチャである。アパーチャはさまざまな直径に開くことができ、医師は治療すべき病変の大きさや容積の表面積を選択することができる。患者体内で照射すべき腫瘍に光をあてるために、カセットの外部に光源を配置することができる。照射野光の役目を果たす別の光源は放射線の放出元であるアパーチャの後方にあり、虹彩の後方に存在することによって、医師は放射線源がクラムシェルによって開かれる前に、腫瘍を最大限に網羅するべく装置を位置付ける際に病変の目視を続けることができる。さらにこの方法は装置が配置されている間に一つまたは他方のアパーチャが故障した場合に冗長防護を提供し、装置を患者から取り除き、安全に修復を行えるまで遮蔽されたピグに安全に蓄積することができるようになる。好適な光源はLED、光ファイバーまたは固体発光体である。
【0063】
治療手術を完了した後、SRIORTアームおよび放射線源は、次回のための滅菌と準備を行うことのできるピグまたは適切な保管装置に遠隔保管することができる。便宜上、保管装置はその上に遮蔽容器またはピグを伴うテーブルが望ましい。保管装置は複数のピグを備えていることがよくある。遮蔽体ピグを含む保管装置は、クローゼットや保管用キャビネットが使用される場合であっても、遮蔽線源格納テーブルと呼ばれる。放射線安全性を確保するため、各ピグは線源がピグに存在するか存在しないかを保証するための放射線存在の検出手段を備えるものとする。規制により、これは通常、手術室内の検出器、および/または電離箱、電位計またはガイガー・ミューラー式の計数管などの、遮蔽線源格納テーブル内にあるセンサーである。
【0064】
放射線源に加え、レーザーまたは粒子放出装置を含む、組織破壊のために補助的に使用されるその他の装置をユニットに取り付けることもできる。本装置は放射線源の輸送に限定されず、X線ダイオードまたはその他の放射線源と併用することもできる。
【0065】
手術用ロボットは一つ以上のアームを備えることができるため、本発明によって、医師が照射中に別のカプセルを選択しようと決めた場合には、その時点で使用していたカプセルを素早く引っ込め、その抜き取り経路を記憶させ、好適な放射線源を持つ新しいカプセルを挿入できるように、一つ以上のカプセルを遮蔽線源格納テーブルに準備できるようになる。
【0066】
発明の好適な方法の応用例
以下の2つの例では、SRIORT装置およびシステムが実際の実施においてどのように使用されるかを説明している。医師によっては、専門分野で受けた訓練の違いを理由に、こうした手術に直接従事する必要があろう。いずれの場合でも、重要な役割を果たすのは外科医と放射線腫瘍医である。外科医は関連分野において特に訓練を受けることになり、放射線腫瘍医は腫瘍治療のための放射線の適切な使用、応用および線量について訓練を受けている。さらに、放射線腫瘍医と協力して放射線現の使用について特に訓練を受けた医学物理士が、SRIORT装置を用いた放射線照射の立案に対応できる必要がある。
【実施例1】
【0067】
腹部腫瘍(卵巣がんIIIb期)
最初に、がん治療において患者に行う手術の性質を患者に伝える。患者がこの情報を聞いて確認を行い同意した後に、患者は手術室に進み、仰臥位で手術台に配置される。その後、麻酔医は全身麻酔を用いて患者に麻酔をかける。
【0068】
十分な全身麻酔が注入された後、麻酔下の患者を検査して、可能であれば疾患の程度を判断する。その後、患者には通常の滅菌条件で準備を行い、ドレープをかけ、およそ1〜1.5 cmの長さの臍下横切開が行われる。その後、直接見える状態で、切開部分から腹膜腔に、穿孔にTVカメラを備えた腹腔鏡套管針を進める。腹部に侵入した後、腹部に二酸化炭素ガスを吹き入れ、腹腔内臓器外で腹壁を膨張させる。その後、これもまたTVカメラにより直接見える状態で、一連の類似の切開を行い、手術の過程においてロボットアームを配置できるように腹部に套管針を導入する。これらの套管針が設置されると、ロボット動作システムを手術台の位置に配置し、ロボットアームを準備位置に配置する。次に医師はSRIORT制御ステーションに進むが、これは術中照射装置が動作している期間中、合理的に達成可能な限り低い放射線防護を提供するために、十分な物理的特性を持つ放射線遮蔽体の後方にある手術室に位置している。ワークステーションには、患者に配置されたロボットカメラによる可視化システムが備わっており、表示方法を選択できる。制御ステーションはまた、コンピュータと関連する電子回路の制御下、医師が自然な方法でロボットアームを移動・操作できるようにする人間工学的なロボットのハンドマニピュレーターを備えている。
【0069】
次に外科医は、以前に配置した套管針から患者内に適切なロボットアームを配置し、その次に該ロボットアームを制御ステーションから操作して手術を行う。外科医は通常、腹水貯留部位に吸引を配置するためにロボットアームを使用し、この貯留は転移性がん細胞の微視的分析のため病理検査に送られる。その後、滅菌水で腹部を洗浄し、該滅菌水もまた分析のため病理検査に送られる。
【0070】
この段階で、外科医は子宮摘出術、両側卵管卵巣摘出術および骨盤リンパ節郭清や大動脈周囲リンパ節郭清を行う。この部分の手術が完了したら、外科医は腹部の残りの部分に注意を向ける。局所進行性の卵巣がんでは通常、網もまた摘出される。その後、外科医はロボット装置やカメラを用いてがんのさらなる形跡がないか、腸の残りの部分を検査する。外科医は、膀胱、直腸、腸、腹膜面、肝臓および横隔膜の下側を検査する。病変が発見されたら、外科医はロボット手術システムを用いて腹膜内の目に見える疾患をできる限り切除する。縮小プロセスにおいて、SRIORTシステムを用いる外科医はマーキング装置を作動させ、この装置が腹部内または手術野内で特定および/または切除された既知または疑わしいがんの部位すべての空間的座標を記録する。次に、手術後および将来の手術において、微視的疾患の治療のためにさらに放射線療法が検討される場合のある潜在的な位置を特定するために、これらの座標を利用することができる。
【0071】
マーキング装置は、外科医が将来のある時点で位置を選択したり、手術室の画像モニタ上に単独で、または手術前画像と重ねてウェイポイントを表示することを可能にする、保存された解剖学的「ウェイポイント」を作成するべく、ロボットアーム、表示システムおよび制御の現在の空間的位置や設定を記録するために制御コンピュータに信号を送る電子制御から構成されている。これにより、外科医や放射線腫瘍医はさらなる研究、照射または手術のために患者内の関心部位に戻ることが可能となる。さらに、装置によって外科医は、将来のある時点で、術後的に、疑わしい組織を放射線特定するために金核種マーカーを配置することができる。位置の変化に適応して手術中にウェイポイントを調整することもできる。
【0072】
外科医が作業を終えると、放射線腫瘍医が外科医と協力して、コンピュータ断層撮影法スキャン(CT/CAT)、放射断層撮影法スキャン(PETまたはPET/CT)、磁気共鳴映像法スキャン(MRI)、超音波映像および患者内での位置や放射線の局所化に有益なその他の画像技術を含むがこれらに限定はされない手術前医用画像を、手術室のモニタ上に配置する。外科医と放射線腫瘍医が照射すべき部位を決定すると、放射線腫瘍医が医学物理士との相談の上、病変の治療に使用される放射線源から手術に必要なスタッフを防護するために、遮蔽装置を移動して手術室に設置する。
【0073】
その後、放射線源を含むカセットを取り付ける能力を持つSRIORTロボットアプリケータアームを含むカートが、カセットや放射線源とともに、手術室に持ち込まれる。
【0074】
放射線腫瘍医が病変の治療に使用すべき適切な放射線源と線量を選んだら、医学物理士は、別々のコンピュータワークステーションを用いて、使用すべき線源、使用すべきビームサイズそして照射の深さと照射すべき放射線線量を特定するために、SRIORT装置を前もってプログラムする。これらのパラメータが装置にプログラムされると、放射線の照射に進むことが可能となる。
【0075】
典型的には、現在行われているように、例えば前立腺がん用の核種において、病変がマーキングされると、提案された手術のシミュレーションが行われる。現在利用できる放射線シミュレーションの技術は、システムと併用される汎用コンピュータのプログラミングに組み込まれる。
【0076】
放射線腫瘍医は使用すべき適切なアームを選択し、SRIORT装置を用いて、放射線源の保管カート(放射性核種線源の場合はピグ)から選択されたカセットを抜き取る位置にアームを移動する。カセットには電気接続があり、これによってカセットはSRIORTマニピュレーターそして制御ステーションにその存在を識別させることができる。SRIORTは、カセットの識別内容を物理士が以前に行ったプログラム済みの線源選択と放射線量の計画と比較し、適切なカセットが正しい線源に取り付けられたことを確認する。次に、遮蔽された貯蔵室(ピグ)にある線源は特定のサイズにアパーチャを設定させ、各々のサイズを計測して抜き取る前にアパーチャサイズ制御の正確さを検証する。次にシャッターが開き、放射線検出器を露出させて線源の放射能/強度がプログラム済みのコントローラで計算・参照された予測値に合致することを検証する。これによって、放射線腫瘍医や物理士は装置を患者内に実際に導入する前に不一致を解決することができる。
【0077】
計画と曝露のパラメータが検証されると、SRIORT制御システムによって医師はカセットを取り外し、適切な套管針からカセットを患者内の位置に運ぶロボットアームを操作することができる。カセットはまた、手術室内そして何よりも患者内での正確な空間的位置を特定する位置決め変換器を含む。この位置はまた、医用画像を含む画像ワークステーションに送信され、患者内での放射線源の位置は手術室のモニタに表示されるとともに、SRIORTビジョンシステム上で患者内でも直接可視化される。これは通常、光の可視スペクトルを用いて行われるが、通常の可視光では観察できない生理的活性を放射線腫瘍医が観察して、潜在的な残存がんの部位を特定・治療し再発を防ぐ医師の能力を高めるために、赤外線スペクトルなど非可視スペクトルを可視スペクトルに対してマッピングすることもまた可能である。
【0078】
これらの可視化スキーマで、SRIORT制御ステーションから医師は放射線カセットを適切な位置に進めて標的に放射線を照射する。次に放射線腫瘍医は、病変の治療に適切なアパーチャサイズを設定してから、アパーチャを通じて実際の放射線野を再現する自己完結型の照射野光という手段によってこのアパーチャを視覚識別する。この照射野光を関心領域と比較した上で、医師は被照射部位に正確に適合するように線源とアパーチャサイズの位置をリアルタイムで微調整する。照射野光は、カセットに、またはカセットを運ぶSRIORTアームに取り付けられた照準レーザー装置で補われる。
【0079】
これが終わると、SRIORTは放射線量率と時間の最終計算を行い、シャッターが開き、カセットの放射線源は適切な疾患制御にとって望ましい線量と深さで病変に照射することができる。放射線腫瘍医は、SRIORTを直接操作することで、関心領域について以前に保存した座標、画像研究および直接可視光/可視領域外でのスペクトルマッピング情報を検討・考察できる。
【0080】
このプロセスは、がん性病変の恒久的な根絶を最大の希望として、特定されるすべての病変を適切に治療するために必要な限り何回も反復される。いずれの場合でも、放射線腫瘍医と医学物理士は、多種多様なカセットの中から手術時に放射線治療すべき各病変に対する適切な術中照射アプリケータを選択し、がんや腫瘍性疾患を治癒する最大の機会として、線源をリアルタイムで操作・プログラムできる。
【0081】
頭や首、脳または胸部などのその他の部位の場合、疾患部位に適切な修正を加えた上で、上述の手技を同様に適用することができる。このSRIORT装置では、加速器を正確に位置付けることができないことを理由に過去においては術中に治療不能であった部位を治療するために、放射線の使用ができるようになる。Med−Tech社の小線源治療術中アプリケータなどのその他の装置には、放射線感受性臓器または該臓器に隣接する病変に許容できない罹患率を生じさせることなく、関心病変をピンポイント治療する上で必要な精度が備わっていない。
【0082】
本発明は切開手術や組織の切除に関する手技および十分な断端を達成するためのフォローアップ照射に焦点をあてているものの、本発明はいわゆる「手術不能がん」など切除が望ましいと考えられない手術にも適用できる。上記には例えば、切除するには死亡率のリスクが高すぎる大動脈隣接の病変などが挙げられる。本発明によって、組織を繰り返し破壊する際に、重要な血管や臓器から離して(潜在的には)段階的な方法で照射を使用できるため、放射線感受性組織との物理的接触が避けられ、および/または健常組織の再成長を可能にする。
【0083】
別の変形型は、運動臓器上でまたは運動臓器と併用してセンサーを使用し、当該センサーからの出力をシャッターおよびアパーチャの開閉とカプセルの位置付けに合わせることである。そのため、心臓組織上の病変について、組織に対するカプセルの相対運動において特定のポイントでのみ発生するよう放射線曝露の時間を設定させるために、EKGリードを接続したり汎用コンピュータに統合することができる。別の方法としては、放射線曝露が特定の距離範囲でのみ発生するように、カプセル上の視覚式、光学式、または超音波式のいずれかの距離計をアパーチャと連係させることができる。これによって、患者への危険は格段に低い形で、特定の心臓や肺大動脈の病変をスタンドオフの組織照射によって治療できるようになる。カプセルは、律動的な組織運動と連動して移動させることができる。
【0084】
本発明は、例えば、肝臓内の実質内病変と併用することができる。肝臓は放射線感受性組織であり、実質内病変は通常、必ず致死的な結果を伴うことから放射線療法には適していない。
【0085】
本発明によって、定位的放射線治療タイプの技術が可能になり、医師は照射効果の深さをリアルタイムで判断し、線量をリアルタイムで調整できる。願わくは、これにより患者身体の他の侵襲を避けることができる。
【0086】
本発明は、カプセルの確実な取り付けのための手段を熟考しており、ロボットアームはカプセルを確実に固定する締め具、指、バヨネット、留め金またはスライド機構を備え、さらに確実に固定された(すなわち、カプセルがロボットアームに安全に取り付けられた)時のみに作動する電気フィードバック機構を備えている。確実な取り付けの手段にはまた、上記で引用した米国特許第6,246,200号で定義した手術用エンドエフェクタを含む。
【0087】
本発明は、照射用カプセルの侵入を促すために手術用ロボットのその他のアームまたは組織の操作を手術に使用できることを熟考している。
【0088】
複数のコンソールが熟考される場合、先行技術では、相反する具体的な命令がない限り常に放射性物質を含むカプセルの取り扱いを優先させることが望ましい調停機構を説明しているが、本発明では同左を使用する。
【0089】
可能性としては、定義済みの軸方向を支援するために音声インターフェースを含むことができるが、放射線安全上の理由、閉じたマニュアル・オーバーライドおよび制御が必要な点を忘れないことが重要である。
【0090】
電気通信や制御の好適な方法は、ロボットアーム上の接触に対するカプセル上のピンによる物理的な電気接続や制御(またはその逆)であるが、発明のその他の方法として、手術用ロボット間または手術用ロボットへの電気通信、および/またはカプセルへの電気通信の使用が挙げられる。
【0091】
画像という用語は、CT(コンピュータ断層撮影法)、MRI(磁気共鳴映像法)、超音波または超音波映像、機能MRI、PET(放射断層撮影法)、PET/CTおよび核医学スキャンを含むことを意図する。
【0092】
直接可視化という用語は、直接可視化を可能にするための可視光、赤外線および紫外線、またはその任意の組み合わせの使用を含む。
【0093】
また、カプセル上の直接可視化のための一つ以上の取り付け手段を通じて真の体内の立体的視覚化を可能にする二つの直接可視化手段を意味する、立体的内視鏡または立体的腹腔鏡を配置するという概念が提案されている。
【0094】
直接可視化という用語は、直接可視化を可能にするための可視光、赤外線および紫外線、またはその任意の組み合わせの使用を含み、これには内視鏡および腹腔鏡が含れる。
【0095】
また、カプセル上の直接可視化のための一つ以上の取り付け手段を通じて真の体内の立体的視覚化を可能にする二つの直接可視化手段を意味する、立体的内視鏡または立体的腹腔鏡を配置するという概念が提案されている。
【0096】
「スタンドオフ遠隔検出」という用語には、距離を決定するためのレーダーおよび電気信号を含む。本発明において、スタンドオフ遠隔検出は主に、シュラウドが使用される場合は該シュラウド端部までの放射線源の長さを考慮した上で、放射線源から被照射組織までの距離を決定するための手段である。超音波距離計やレーザー光学式距離計など、その他のスタンドオフ遠隔検出の形態も取り上げられている。
【0097】
フェイルセーフの閉位置とは、電源、特にシャッターを作動させる電源が失われた場合に、シャッターが閉まり、放射線が患者へと放出されるアパーチャを塞ぐ機構を意味する。
【0098】
本明細書で示される実施形態は、当該技術分野の当業者が行ったり使用することのできる数ある実施形態および変更形態のほんの数例である。本発明はこれらの実施形態に限定されない。当業者は、特に前文の教示内容に鑑みて、本発明で熟考できる別の実施形態や変更形態を行うことができる。それ故、以下の請求項は、本発明が請求する精神および範囲内に含まれうる別の実施形態、変更形態または同等の内容を網羅することも意図している。
【0099】
参考文献
Attix, Frank H, Introduction to Radiologic Physics and Radiation Dosimetry, John Wiley & Sons, 1986
Berger & Seltzer, Tables of Energy Losses and Ranges of Electrons and Positrons, NASA, 1964
Gunderson & Tepper, Clinical Radiation Oncology, 2nd Edition, Chapter 15, Intraoperative Irradiation, pp 315−328
Haddock MG, Petersen IA Webb MJ: Intraoperative Radiotherapy for locally advanced gynecologic malignancies, Frontiers of Radiation Therapy Oncology, 31:356−259; 1997
Khan, Faiz: The Physics of Radiation Therapy, 1984, Williams & Wilkins, Baltimore, ISBN 0−683−04501−6
Petersen, IA, Haddock, MG, Donohue, JH: Use of intraoperative Electron Beam Radiotherapy in the Management of Retroperitoneal Soft Tissue Sarcoma, Int. J. Radiat Oncol Biol Phys 50:126−131, 2001
Ramsay J, Suit HD: Experimental Studies on the incidence of metastases after failure of radiation treatment and the effect of salvage surgery. Int. J. Radiat Oncol Biol Phys 14:1165−1168; 1988
Stump, KE, DeWerd, LA, Micka, JA, and Anderson, DR: Calibration of New HDR Ir−192 Sources. Med Physics, Vol 29(7):1483−1488
Suit HD: Local control in patient survival. Int. J. Radiat Oncol Biol Phys 23:653−660, 1992
Suit HD: Potential for improving survival rates for the cancer patient by increasing efficacy of treatment of the primary lesion. Cancer 50:1227−1234, 1982
Swiss Society for Radiobiology and Physics, Dosimetry and Quality Assurance in High Dose Rate Brachytherapy with Iridium−192, Recommendation #13, January, 2005, ISBN 3908−125−36−7
【技術分野】
【0001】
本出願は、2007年9月19日に届出された「直接可視化ロボットによる術中放射線療法アプリケータ装置」と題する米国仮出願第60/973,545号および2008年9月18日に届出された同名の米国仮出願第61/098,225号の利益を主張し、必要に応じて米国を含む国内段階でのその一部継続出願となる。
【0002】
本発明は、放射線放出がより高い精度で腫瘍(特に臓器腫瘍)を破壊し、下層の健常な基本的組織を破壊することなく質の高い断端を残すことができるように開閉式のアパーチャを有しロボット操作される、患者体内で展開される放射線源を内蔵した可動式の小型カプセルまたはカセットによるがんの放射線治療に関連する。本発明により、限局的な近接放射線療法が可能となる。本発明により、α線、β線およびニュートロン、X線、γ線またはそれらを組み合わせて術中照射を実際的に利用することが可能となる。
【背景技術】
【0003】
術中放射線療法は従来、大型で煩雑な線形加速器および放射性物質の注入により提供されてきたが、どちらも著しい二次的被害や結果的な死亡の原因となることがあり、転帰を大幅に改善するという実証はされてこなかった。卵巣がんなどの多くのがんで大きな長期的問題となっているのは、切除(手術)に際して、微視的がんを含むあらゆるがん手術による全摘出を意味する断端陰性(clear margin)もしくは最適な縮小(optimal debulking)を得るのが困難な点である。その結果、残存がん細胞が残存することが多く、原発性がんから離れて到達や破壊が難しいその他の場所に移動する場合がある(実際頻繁に発生する)。さらに、がん細胞が移動(転移)しうるその他の部位は、発見時点では臓器を侵食していない場合でも、繊細な臓器組織に隣接して、または該組織に存在することが多い。転移性がん細胞はその後、新しい病変部位の局所血液供給を用いて成長し始め、そのうちに臓器機能を弱化させ、最終的には臓器を破壊し、多くの場合は死亡に至らしめる。
【0004】
従来の体外放射線療法技術は多くの場合、罹患した臓器に照射される放射線の相対毒性を理由にこのような局所転移の治療に対しては効果が低い。がんの破壊に十分な放射線量は同様に、手術外の設定において特定の線量をがん性病変のみに照射できないことを理由に、問題の罹患した組織または臓器にとっても致死的である。体外放射線療法技術では小さな転移性病変に正確に的を絞ることができないことは十分文書化されており、以下に関連している。
a.)高精度のCT/MR/PETで小さな病変を可視化できないこと
b.)小さながん性病変に正確に的を絞る上で必要な期間に、臓器運動をリアルタイムで特定・追跡できないこと
c.)正常臓器への許容できない損傷を生じさせずに十分な線量を腫瘍に照射する上で十分な、従来的、原体照射的、IMRT、サイバーナイフまたは断層撮影法の技術を用いた体外放射線量をがん性病変に限定することができないこと。
【0005】
全摘出(すなわち最適な外科的切除)を裏付ける統計情報には非常に説得力がある。研究では、局所進行卵巣がんでは予後が不良であり、卵巣がん症例すべての51%を占めるIII期卵巣がんでは、例えば最適な縮小(optimal debulking)が行われたがんの五年間の生存率(肉眼での残存疾患が明らかでない)は21%〜5%であり、化学療法や手術技術の進化にもかかわらず過去25年間において死亡率にはほとんど変化がなかったことが実証されている。[Gunderson]
【0006】
残存疾患の量は、一次的手技および二次的手技の両方において、腫瘍縮小手術(すなわち肉眼で見えるがん細胞の全摘出)の価値を実証する多数の研究によって裏付けられた予後指標である。つまり、残存疾患の量が多いほど予後が不良となる。腫瘍縮小手術は、残存疾患が1 cm以下の患者では無進行生存日数や全生存を長期化することが示されてきた。これらの患者では化学治療薬による治療が有益だが、卵巣がんの進行や死亡率は依然として高いままである。残存疾患の低下に対する価値が高いことが示されている。残存疾患が皆無の場合の平均生存期間は39カ月間、残存疾患が0.5 cm未満の平均生存期間は29カ月間、残存疾患が0.5 cm〜1.5 cmでは18カ月間、残存疾患が1.5 cmを上回る場合は11カ月間以下に低下した。[Griffiths]
【0007】
放射線療法は、腫瘍性(がん性)疾患の治療法としてよく知られている。放射線療法は一般に、許容できない罹患率を生じさせずに特に残存疾患の部位に線量を照射できないことや、腹部の正常組織が極めて繊細なために生じる死亡率を理由に、腹部がんの治療は試みられたものの成功を収めてこなかった。術中放射線療法は、過去において正常組織への線量を最小限に抑えつつ腫瘍に正確に放射線を照射できなかったことを理由に、幅広く適応されてこなかった。
【0008】
放射性核種を照射するその他の試みにはカテーテルの配置が含まれるが、本発明で熟考されているロボットアーム装置や線量照射装置ならびに外科手術中のリアルタイムでの線量測定や線源の選択がない場合には柔軟性に欠け、本発明が提案する方法で正確に誘導することができず、治療の過程において素早く再配置することもできない。言い換えれば、いったんカテーテルが配置されると固定されて第二の手術がない限り不動となる。その一方、提案の発明では手術時点での即時かつ正確な位置付けが可能であり、カテーテル配置の従来の方法ではえることのできなかった柔軟性や精度が得られる。
【0009】
本発明は、術中ロボット手術装置の一形態でありDaVinci Robotic Surgery Deviceと呼ばれるIntuitive Surgical, Inc.社開発・所有の最近の技術、またより一般的にはカリフォルニア州シルバンのQPC Lasers社が製造するBright Lase Ultra Laser(TM)手術用レーザーを含む術中ロボット手術装置に統合されることを提案している。術中ロボット手術装置に関連する技術の例には、『Performing cardiac surgery without cardioplegia, Evans他(米国特許第6,468,265号、2002年10月22日)』、『Manipulator positioning linkage for robotic surgery, Blumenkranz他(米国特許第6,246,200号、2001年6月12日)』、『Master having redundant degrees of freedom, Salisbury, Jr.他(米国特許第6,684,129号、2004年1月27日)』、および『Minimally invasive surgical training using robotics and telecollaboration, Wang他(米国特許第7,413,565号、2008年8月19日)』などの自動制御を例証した装置が挙げられ、手術用ロボットによる術中手術装置や手術用ロボットによる統合型術中システムを例証するために、参照することにより採用される。放射線腫瘍学の分野は、体外放射線療法のための画像に基づく放射線療法の治療計画が1990年代に導入されたことで著しく変化した。一例に、線形加速度放射線システムを用いたPhilips社製のMobitron(TM)がある。上記を実現する技術によって、これまで不可能だった方法でがん治療用の正確な照射野の設計が実現するが、その大きさから体裁が悪いという面があり、治療上の最大利点(すなわち、罹患していない組織への照射を避けつつ高リスクの腫瘍部を狙う)を提供するように治療用ビームを最適に狙った位置に正確に操作することはできない。術中の設定においてがんやその他の腫瘍を正確に狙うことができる必要性もまた、長い間切望されてきた。DaVinciスタイルの術中手術装置や同様の装置(より一般的には「手術用ロボット」と呼ばれる)の開発によって、この目標を求めて探求すべき新しい手段が生まれたが、この手段こそが本発明の主題である。
【0010】
本発明の目的上、患者を安定化してから医師が少なくとも一つのロボット装置またはアームを操作する形でロボットを用いて手術や治療を行うことを提案する装置を、手術用ロボットと呼ぶ。本発明の目的上、放射線治療カプセルまたはカセットや関連する誘導システムをロボットマニピュレーターアームへのアタッチメントとして使用する手術用ロボットを、手術用ロボット術中放射線療法装置またはSRIORTと呼ぶ。
【0011】
本発明は、装置によって医師が手術時に直接見える状態で、リアルタイムで一つまたは複数の腫瘍部位に致死放射線量を特定・照射できる点で独特である。対照的に、当該技術ではアプリケータが配置され、後日かつ手術後にMammosite(R)バルーン/カテーテルタイプの装置またはそれを使用して放射線源を後日配置できる後充填カテーテルを含有する平角な材料などの装置を用いて放射線を照射する。
【0012】
上述のように、術中放射線術後療法および術中療法は大型で煩雑な線形加速器および放射性物質の注入を提供してきたが、どちらも著しい二次的被害や結果的な死亡の原因となることがあり、転帰を大幅に改善するという実証はされてこなかった。
【0013】
その他のアプローチは柔軟性に欠け、本発明が提案するような方法で正確に誘導することができず、治療の過程において素早く再配置することもできない。言い換えれば、いったんカテーテルが配置されると固定されて第二の手術がない限り不動となる。その一方、提案の発明では手術時点での即時かつ正確な位置付けが可能となり、カテーテル配置の従来の方法では得ることのできなかった柔軟性や精度が得られる。追加的な利点は、提案の発明では、線形加速器に基づく術中技術において現在必要とされる開腹手術ではなく、非開腹の腹腔鏡下手術中に術中放射線療法を導入することが認められる点である。
【0014】
本発明では、より明確に狙いを絞ったがん性組織の治療を可能にするIORTへの新たな追加機能を提案し、がん性病変に局所化した致死放射線量を照射しつつ重要臓器の損傷を最小限に抑えるために必要な、さまざまな角度からの放射線照射を指図することができる。
【0015】
SRIORT装置は、手術用ロボットを用いたロボット操作の正確な手術を提供する能力と、その後に同一の手術用ロボットを用いて手術室において、正常組織には放射線量をかけず既知または疑われる残存疾患の領域を治療するための極めて局所的な方法での放射線の照射を実現する可動式のアパーチャ、照準装置、線量やタイミングロジックを特定の活性やエネルギー特性を備えたラジオアイソトープを含有するSRIORT装置に取り付ける能力と組み合わせることで、当該技術における不利な点を克服して、著しい治療上の利点となる。本装置は、治療領域、望ましい治療の深さそして必要な放射線量を正確に特定するために、PET/CT/MR、およびビデオ画像、術中超音波映像、および触覚応答センサーを含む直接画像化法を組み合わせている。
【0016】
SRIORT装置によって、従来の術中放射線治療に見られる開腹術の必要性なく、腫瘍部位への直接かつリアルタイムでの照射野の術中配置が認められ、同時にロボット部分によって外科医および放射線腫瘍医は電離放射線へのスタッフの曝露がほぼ皆無または皆無な形で手術室においてリアルタイムで望ましい治療を行うことができることから、本発明は放射線療法の分野における大きな前進を示す。これは開腹手術の必要性をなくし、低侵襲手術を利用し、従来のカテーテルに基づく小線源治療に対する第二の手術の必要性を低下させる。
【0017】
本発明の出願はまた、決定組織への近接性から「手術不能」がんと見なされてきたがんへの放射線の照射も熟考している。本発明によって、致死的な結果または望ましくない結果を伴わない放射線療法には従来的に適さない放射線感受性組織に隣接して、正確な方法で放射線による定位的な治療介入を行うことが可能になる。
【発明の概要】
【発明が解決しようとする課題】
【0018】
本発明の第一の目的は、カプセルや被照射組織の近くにいる人物が安全に行うことのできない体内照射による手術を要しない断端の精度向上を可能にすることである。
【0019】
第二の目的は、手術で摘出した組織に隣接する組織の目視を可能にし、リアルタイムで排除する必要がある組織に照射するか、摘出組織の断端を大きく取るために組織に照射することである。
【0020】
第三の目的は、「手術不能」な組織(すなわち、放射線感受性の組織、または切除するのが危険な組織)を正確に摘出または回避することができるように、そのような組織の目視も含めて、患者体内での照射によって正確な深さで組織を摘出できるようにすることである。
【0021】
第四の目的は、高精度のCT/MR/PETで検出されたものなど、小さな病変の可視化と摘出を可能にすることである。
【0022】
第五の目的は、小さながん性病変を正確に狙う必要のある期間に臓器または組織運動をリアルタイムで特定・追跡し、臓器または組織運動に対応して照射を調整することである。
【0023】
第六の目的は、正常臓器への許容できない損傷を生じさせることなく腫瘍に十分な線量を照射するのに十分な良性、悪性またはがん性の病変に照射を制限し、従来的、原体照射的、IMRT、サイバーナイフまたは断層撮影法の技術を用いた体外放射線量を正確な病変や望ましい断端に限定することができないことから生じる不正確さや二次的被害を回避することである。
【0024】
第七の目的は、必要となる侵襲時間を最小限に抑え、同時に放射線への不要な曝露時間を低下させるために、手術用ロボットを動作させうるより高い速度と正確さを使用することである。
【課題を解決するための手段】
【0025】
本発明は、アパーチャからの放射線源を交互に閉鎖・曝露させる手段によって、カプセル(カセットとも呼ばれる)およびアパーチャを持つロボットアプリケータ装置を患者体内で展開させることを提案する。カプセルおよびアパーチャは手術用ロボットに統合され、以下で詳述するとおりロボットIORT(術中放射線療法)アプリケータ装置となる。カプセル、放射線源、およびIORTアプリケータのアームは、スタッフへの曝露を避けつつ、組織に治療放射線量を照射するために十分な量の電離放射線に曝露させるために、医師、物理士または技師が体内の組織を対話形式で見たり選択できるように統合されている。ロボット操作装置を使用して、医師や物理士は曝露対象の組織に放射線を遠隔照射するだけでなく、曝露時間も制御することになる。望ましい治療効果を得るべく、治療対象の組織の断端や深さおよび適切な放射線源または放射性同位体(ニュートロン、X線、α、βまたはγ放射体を含む任意の粒子放射体であり得る)を特定・計算するために、制御手段が追加されることになる。
【0026】
本明細書で説明する本発明は、手術用ロボットシステムの遠隔誘導下で、がん性腫瘍や良性腫瘍を致死線量に曝すために正確な照射野の導入、可視化および照準化を可能にする閉塞的な遮蔽機構を備えた、放射線生成同位体またはX線を搭載したカプセルまたは粒子発生器を取り付け・統合することで、がんまたは一つまたは複数の腫瘍を含むその他の腫瘍を持つ患者体内への放射線治療の新しい形態の実現を目的とする手術用ロボットマシンとの放射線照射装置の統合から構成される。本発明は、腫瘍細胞のさらなる成長を阻害し罹患した異常細胞のさらなる成長を制限するために腫瘍細胞を十分な時間照射野に曝露させることで、手術中にがん性組織を放射線量に曝すことを目的として、ロボット制御下で、カプセルの選択、手術用ロボットアームへの取り付けおよび直接かつ画像誘導で可視化される下での患者への放射線の導入を実現する。
【0027】
本発明は手術中の使用を意図しているため、がん手術に熟達した外科医は、放射線治療の使用や照射に熟達した放射線腫瘍医や医学物理士と協力して、腫瘍の外科的切除の時点で、また治効量の放射線量を腫瘍に照射するために計画された外科手術の一環として手術中に放射線治療を行う上で必要な場合はその後時間をおいて、本発明を使用することになる。本発明は、超音波、MRI、CT、PETまたはPET/CTまたは医用画像誘導の組み合わせなどの画像技術を用いて、放射線治療や照射に関連した合併症を可能な限り最小限に抑えるべく罹患していない組織には線量を照射することなく治効量の照射線量を発生させるために、事前または外科手術と同時に、患者内部の照射野の正しく正確な配置や組織曝露のタイミングについて放射線腫瘍医を誘導・指示する。本明細書で説明する本発明により操作者は、上述した医用画像、照射手術中に照射用カプセルを挿入する時点での重要な解剖的ランドマークの空間推論によるリアルタイムの誘導、手術用ロボットの位置報告技術を通したアプリケータの正確な位置の画像表示システムに対する三次元でのリアルタイム描写、および可視光技術を用いた直接可視化によって操作者にとって関心のある腫瘍性組織(良性またはがん性)を特定し、操作者が医師によるロボットの遠隔制御下で手術用ロボットマニピュレーターアームを使用して、人体内で、適切な放射線の種類と曝露で腫瘍に照射して疾患を治癒および/または管理する確率を高めるような方法で、術中放射線治療用カプセルの正確な位置付けを可能にする。
【図面の簡単な説明】
【0028】
【図1】図1は、体内組織(1)と上記組織に配置され標的となっている腫瘍結節(2)(例は4 mm。深さは表示)との相対位置を示す。放射性物質を含むカセット(4)とロボットアーム(5)上のカセットの一般位置とともに、位置決め機構を含むシュラウド(3)の簡易図が組織上で示されている。
【発明を実施するための形態】
【0029】
発明の好適な方法は、下記に説明する通りシャッターを備えた交換式照射カプセルを第一に選択することを提案している。治療する組織の深さや大きさに基づいて、カプセルに配置する放射線源が選択され、SRIORTのロボットアームに取り付けられる。次に、別の画像法またはこれらの任意の組み合わせの有無に関係なく、直接見える状態で組織の照射のためにアームを適切な位置に移動する。
上記を詳述すると、発明の重要な構成要素は以下の通りである。
放射線源。
手術用ロボットに接続され腹腔鏡/手術用ロボット切開を通じて患者体内に挿入される、特定の制御電子機器や装置を備えた、空洞へのアパーチャがある放射線源を含むカプセル/アーム。
病変、腫瘍、組織、または臓器については、望ましくはビデオ画面またはコンピュータモニタまたはその他の表示手段で手術用ロボットの操作ステーションから見ることのできる、手術室においてリアルタイムでの、CT、MRI、超音波、機能MRI、PET、PET/CTおよび核医学スキャンを含む、手術前の医用画像や手術前の融合医用画像を表示する機構。
体内における放射線源カプセルの座標をリアルタイムで特定・追跡し、画像上に現在プログラミングされた照射野分布を投影させ、手術用ロボットに対する組織位置についてリアルタイムでの更新を行って望ましい組織への過剰照射を避ける汎用コンピュータなどの制御手段によって、手術前画像上でカプセルの三次元の位置を表示する機構。
望ましくはビデオ画面、コンピュータモニタ、またはカプセルの体内位置を表示し、可視光、赤外線や紫外線またはこれらの任意の組み合わせを用いて直接見える状態で前進と位置付けを行う手段上で、視覚的な追跡を行う機構。
(上記の組み合わせまたは超音波エコーを用いて)腫瘍、および腫瘍の深さを特定する機構。
アパーチャサイズを設定し、望ましい線量を受け入れ、選択された放射線源、物理的パラメータおよび特性に基づき曝露時間を計算する機構。
手術室スタッフへの曝露を防止しつつ望ましい放射線量、望ましい腫瘍容積に対する照射野サイズや形状を提供するために、空洞において適切に位置付けられた放射線源を起動させる機構。これは通常、電気機械アクチュエータがカプセル内で閉じたシャッターを開くことを意味する。ただし、手術用ロボットアーム内にあるピンなどのアクチュエータがシャッターを起動させて開くように、機械的結合を行うことも可能である。カメラに使用されるスタイルの渦巻き状に開閉する虹彩シャッターや単純なドア機構によって、調整可能なアパーチャを提供することができる。
体内における放射線源カプセルの座標をリアルタイムで特定・追跡し、例えばビデオ画面、コンピュータモニタまたは表示手段上で、手術前画像でカプセルの三次元の位置、画像上での照射野分布を示す放射線治療後報告、および被照射組織への推定損傷を表示する機構。
これらの構成要素と機構を以下で詳述する。
【0030】
本発明のがんに対する応用は以下の通りである。
【0031】
医師は、腫瘍およびがんの進行が疑われるその他の部位(時として「ホットスポット」と呼ばれる)を位置確認するために、標準の医療処置に従って患者体内の原像を撮る。これらは、PET、CT、MRIおよび核医学スキャンを含むさまざまな医用画像法で特定可能な部位である。医師は、外科的介入の過程においてがんが疑われるその他の部位を目視で特定する。
【0032】
医師は次に、腹部を切開しSRIORTを起動させる。SRIORTのロボットアームにはテレビカメラが取り付けられている。SRIORTには、ロボットアームに取り付けられ遠隔制御される付属品がある。次に手術用SRIORTは内膜を切開するために使用され、切断用器具は医師による切除の実施に使用される。外科医は、必要に応じて焼灼・清拭し、最終的にはSRIORTアーム上のカメラから残りの組織を閲覧することができ、上述の医用画像とともにどの部位にさらに放射線治療が必要かを判断する。
【0033】
卵巣がんの場合、手術により最大限の縮小が得られたとしても、多くの場合、肝臓表面、横隔膜および腸部位が関連した疾患の点在が残る。相当な罹患率や死亡率さえも引き起こさず、または予想外に高い放射線に手術室スタッフを曝さずには、がん転移を排除するための狙いを絞った十分な放射線量を十分正確に照射できないことを理由に、体外照射(全腹部放射線療法)、従来の小線源治療または広範アイソトープ療法もしくは加速器を用いた従来の術中放射線療法によって通常これらの部位を治療することは不可能である。
【0034】
浸透させたい組織の深さや照射すべき望ましい線量に基づき、適切な放射タイプ、エネルギーそして強度のラジオアイソトープまたは装置生成の照射(X線)でありうる特定の放射線源がSRIORTアーム上のカプセルに配置されるよう選択される。このカプセルは、SRIORTアームに恒久的に取り付けるか、または放射線源の異なる物理的特性に適応した交換式モジュールであることが望ましい。カプセルは、照射野の方向と大きさ、および漏洩放射線からのスタッフ防護の両方に必要な遮蔽体を備え、装置の大きさのバランスを取るように設計される必要がある。次にカプセルは、その保管位置からロボット制御により選択され、SRIORTのアームに取り付けられ、患者体内の照射に適切な位置に移動される。次に医師は、カプセルと提案されるビーム位置をその角度に移動し、望ましいビーム角度を病変に移動させる。SRIORTには、病変の直接可視化を可能にするカメラが備わっている。超音波変換器またはプローブなど、腫瘍に適した別の画像装置をカメラに使用することもできる。放射線ビーム応用のスポットを特定し光をあてるためにレーザーを取り付けることができる。
【0035】
体外の線形加速器を用いた従来のIORTは、10〜20 Gy(Gy = 灰色 = ジュール/kg 電離放射により物質に蓄積されたエネルギー)の線量を使用した。これらの線量は、多種多様な装置や同位体で、最も一般的にはIr−192またはCs−137などの高い比放射能を持つものと、またさらに最近のX線ダイオードおよび固体X線生成器を使用することもできる。さらに、Sr−90(エネルギー0.195 MeVのβ放射体)などのその他の放射体も使用できる。下記の表は、副産物と典型的なエネルギーや半減期の例を示している。
【0036】
【表1】

【0037】
同位体に対する以下の公式によって線量が計算される。
【0038】
【数1】

【0039】
これらの線源およびその他の線源の放射能範囲は通常、5〜10 Ci(10 Ci=370 GBq)である。例えば、10 Ci線源強度を仮定し、放射能を線量に変換する上で使用される特定の空気カーマ率定数
【数2】

【0040】
を持つIridium−192を用いて、図1に示す4 mmの腫瘍に対してアプリケータのカプセルから深さ5 mm(4 mm + 1 mm 断端)に20 Gyを照射するためには、以下の曝露が必要となる。
【0041】
【数3】

【0042】
上記パラメータを仮定した場合、曝露時間は、2000/11001 = 0.181分間、つまり10秒間となる。典型的な線源表面間距離として0.25 cmが選択された。それ故、SRIORTを使用した手術室でのリアルタイムの誘導において、曝露、照射野の位置確認と大きさを正確に制御しつつ、各病変を1分以内で治療することができる。
【0043】
単位時間あたりの照射線量に対するこの曝露範囲における距離の絶対的臨界を理由に、カプセルは光測距法を用いた独立した電子距離測定器を持つ。
【0044】
臓器運動が懸念される場合は、医師の裁量により、腫瘍から0.5 cmなど距離をより開いて装置を位置付けることができる。臓器運動または患者の相対運動に適応するように調整を行うこともできる。この距離について、上記計算では曝露時間0.67分間または40.2秒が得られる。
【0045】
曝露時間は二重タイマーバックアップシステムにより電子制御され、これによって一次タイマー設定時間が過ぎると、バックアップ用の二次タイマーが稼動し、アパーチャを閉じて放射線の曝露を止める。これらのタイマーは両方とも、操作者のコンソール上にはっきりと見えるディスプレイを備え、これにはカセットに放射線が存在する場合に可視・可聴なアラームが付いている。また、カセットの制御電子回路によってアパーチャを閉じることができない場合(放射線源の場合)または放射線生成装置の電源を停止できない場合(X線ダイオード装置の場合)に可視・可聴な第二のアラームも付いている。
【0046】
カセットの放射線「安全性」を確保したチャンバーとアパーチャは、放射線遮蔽体を念頭において構築されている。装置は線量率が高低両方の線源を使用できることから、遮蔽体は幾つかの理由により義務付けられているが、その中で最も重要な理由は、装置の迷放射線放出から患者組織を防護し、装置または放射線源の移動中に手術室スタッフを防護することである。
【0047】
遮蔽体の計算は、劣化ウラニウム、鉛またはタングステンのいずれかの使用を根拠としている。遮蔽特性に優れ、ウラニウム製遮蔽体はより薄く、腹腔鏡下の創傷(1〜3 cm)への挿入や体内に挿入された後のロボット制御での操作がより簡単なより軽量カセットが実現することから、好適な遮蔽体はウラニウムである。典型的な線源サイズ(現在使用されているNucletronおよびVarian線源に基づく)は、直径0.5 mmx長さ5 mmである。線源が患者内に存在する時間中に線量を許容レベルに低下させるために、提案されるこの計算例では、線源が患者内にある手術は最長1時間持続すると仮定される。この時間中に線源は放射線を放出し、治療中の医学治療的な放射線の使用においては低リスクで60 cGyを曝露させることができる。手術室スタッフへの曝露はこれよりも低く保つ必要があるため、さらなる外部遮蔽体を患者周りに配置してALARAの放射線安全の限界を満たすようにする。ロボットのワークステーションを患者から遠ざけて配置することができることで、外部遮蔽体の必要性が最小限に抑えられる。遮蔽体の計算式:
【数4】

【0048】
線源強度として10 Ciが選ばれた。変換係数はCiあたり37 GBqである。平均的な患者の「厚さ」はおよそ20 cmであるため、放射線遮蔽体の計算を目的とする患者身体表面への距離としては通常、10センチメートルが選択される。この線量率を許容レベルにまで低下させるために、線量は60 cGy/時未満または遮蔽のおよそ1または2の1/10価層まで低下される。Ir−192での劣化ウラニウムの1/10価層は6.5 mmであるため、劣化ウラニウム1.3 cmによって完全遮蔽が実現し、10 cmでの漏洩照射線量率は411 cGy/時から10 cmでは4.1 cGy/時に、5 cmでは16 cGy/時に低下する。タングステンが選択された場合、遮蔽体の厚さはおよそ22 mmである必要がある。
【0049】
線源サイズ、遮蔽要件、および必要な電子装置やアダプタを考えた場合、好適な方法でのカセットの最終寸法は直径4 cmx長さ5 cmまたは4 cmx3 cmx5 cmである。円錐部分については、円錐が望ましい場合には円錐の発散角は被照射組織の外径と一致すべきである。円錐の形状は、腫瘍の形状に応じて選択することができる。円錐(使用される場合)は、非常に短くてもよい(3〜4 mm)。不規則な腫瘍の形状に適合するよう、カセットに取り付けられる円錐はさまざまなものであってもよい。これによって線源、関連する可視化、計測・制御電子装置そして機械安全装置を囲む十分な空間が得られる。SIユニットでの遮蔽体の計算式:
【数5】

【0050】
シャッターの直径は、少なくとも望ましい最大照射野サイズである。最も要求される可能性の高いシャッターは、最大2 cm開くように設計されたものである。照射の視準は線源サイズによって決定される可能性がより高いが、特定の治療計画ではシャッターサイズが望ましい最大視準よりも大きくなければならない。
【0051】
発明の第二の方法では、位置決めシステムとしてのみカセット装置を使用し、放射線の照射用に装置は移送管コネクタを備え、これによってNucletron HDRまたはVarian HDR装置などの既存の高線量率遠隔操作式後充填装置を使用して放射線源を提供することが可能となる。これらの装置は上述のものと類似するIr−192線源を備え、これがケーブルに取り付けられ、HDRおよびSRIORTカセットに取り付けられた移送管により位置付けられる。このオプションは、組織内放射線治療で利用できる装置を有する機関で利用できるものである。この場合、線源照射機構以外には線源はカセットの一部ではなく、むしろ装置が適切に位置付けられた後に照射が行われる。この配置には多くのデメリットがあるため自己完結型システムよりも好適ではないが、その最も顕著な点は、線源が移送管を移動する中で線源が自由に放射されるためにスタッフ全員が手術室を離れる必要が生じ、手術の所要時間が大幅に長くなることである。
【0052】
この装置の利点は、装置が小型で、直接見える状態で、SRIORT制御システムによってリアルタイムで簡単に操作できることである。これによって、外科医や放射線腫瘍医は手術の過程で、残存疾患や切除不能疾患の部位を決定し、腫瘍を滅菌するために正確かつ相互作用的に放射線線量を照射することができる。カプセルの放射線源は従来の線形加速器アームよりも低いため、カプセルを保持した関節式ロボットの「手」を用いて高精度で体内にカプセルを設置し、ロボットによる切開を通じてカプセルを体内に挿入しつつ照射野を正確な腫瘍部位に方向付けることができる。
【0053】
使用する線源の放射能強度が高くなる可能性があるため、電子/機械のオーバーライド両方を搭載した緊急アパーチャ閉機構が装置で使用される。システムにはまた、シャッターを開くまたはアパーチャを曝露させる電気/機械信号がない場合には、アパーチャのデフォルトを閉位置にするフェイルセーフ機構を備えている。X線生成装置の場合は、正電流の直接命令がない限り、フェイルセーフによって装置に電流が流れないようになっている。
【0054】
さらに本装置は、関節式ロボットの「手首」または「手」装置とともに制御可能なアパーチャを備えた遮蔽カプセルを有することで、アパーチャを開く前に放射線源の正確な位置付けが可能となり、装置の位置付けと確認が行われるまで放射線から正常組織が防護される。これは、術中放射線療法の応用に対する現在の方法からの大きな前進である。
【0055】
遮蔽カプセルを使用する目的は、カプセルと内部の放射線源が望ましい位置に移動する間の組織への損傷を最小限に抑えることである。カプセルは鉛、タングステンまたはウラニウムなどの高密度遮蔽材で製造されており、カプセルはそこから放射粒子が放出されるアパーチャを覆うシャッターを備えている。シャッターはまた、タングステンなどの高密度遮蔽材で製造してもよいが、適切かつ必要な放射線防護を提供するのに十分な質量エネルギーの減衰係数に関するデータを含む、Berger & Seltzerハンドブックに記載した材料から選択することもできる。カプセルの設計は、レンズ交換式カメラと同じように、交換式シャッターの適応を認めるものである。
【0056】
交換式カプセルは遮蔽された保管装置で保管し、手術室環境で従来使用されるように蒸気滅菌またはガス滅菌できる。放射線源は保管用ピグから抽出されるが、これは放射線源材料の輸送・保管に使用されるより大型の高度に遮蔽された貯蔵室で、通常は鉛またはタングステンで製造され、手術室の患者のすぐ近くに位置し、カプセル移動時のスタッフや患者への曝露を最小限に抑える。γ線を放出する線源からすべてのγ放射線を遮蔽するのは非現実的だが、ロボット支援の術中放射線療法アプリケータによって実現される距離そして十分な量の遮蔽によって、スタッフへの曝露を最小限に抑えつつ、NCRPの放射線作業者への曝露限界に適合する形で装置を使用できるようになる。装置には、放射線防護のALARA(As Low As Reasonably Achievable=合理的に達成可能な限り低く抑えるべき)の哲学に従い、また計画される手術の許容される職業曝露限度を相当下回り、手術スタッフを防護するために手術室に設置された移動式の遮蔽部材という形態での十分な遮蔽を含む。室内曝露合計を計測・記録するために、測量器が装置やワークステーション内に構築される。ラジオアイソトープ次第であるが、患者を遮蔽するために可動式の患者遮蔽体を利用することができ、患者の曝露を最小限に抑えるように手術による侵入部位用アパーチャ付きのものが望ましい。その移動式の患者遮蔽体は、可動式キャスター上の鉛遮蔽体などの一つまたは一連のフード付き容器、または一つまたは一連の鉛エプロンという形態でもよい。
【0057】
カセットをロボットアーム上の制御接触に対応する内部配線に接続された接触を持つよう設計するか、カセットの内部配線をロボットアームへのワイヤーハーネスによって接続することができる。別の好適な方法はワイヤレス制御機構であるが、電離放射線のレベルが問題になる可能性がある。
【0058】
α放射体またはβ放射体については、軽量カプセルが可能である。現行技術では、粒子加速器を粒子、陽子、電子または軽イオンの効果的応用に使用することはできないが、これらは治療上効果のあるエネルギーレベルでは路程が極めて短いものの、その路程内ではがん細胞の繁殖能力(DNAや細胞が破砕したDNAを修復する能力)にとって壊滅的である。ラジオアイソトープから放射されたα粒子、またそれほどではないがβ粒子は、γ線と同様に多種多様の同位体から簡単に得ることができる。[Berger and Selzer, Attix]
【0059】
α粒子は高線エネルギー付与(LET)粒子と見なされ、二重鎖DNA切断という形でDNAに相当な損害を与え、細胞がこの損害を適切に修復するのは非常に困難である。対照的にγ線とx線は低LET粒子であり、DNA近くで水分を発生させるヒドロキシルフリーラジカルの放射線分解を発生させることで作動し、細胞生存と線量を比較した線形象限曲線に従い一重鎖と二重鎖の切断を引き起こし、ついにはがん細胞の繁殖恒常性が失われる。β粒子も同様に線エネルギー付与は低いが、二重鎖の切断を引き起こし、非低酸素環境における酸素によって恒久的になりうる一重鎖切断の一群を通じてDNAを破壊することができる。
【0060】
SRIORTアームに取り付けられたカプセルによって、α放射体またはβ放射体を健常組織から完全に遮蔽し、放射線源がその標的に位置付けされる際の過渡損傷を最小限に抑えることが可能となる。望ましいビームサイズにアパーチャを設定し、正確な位置かつ望ましい角度でアパーチャを位置付け、カプセルのシャッターを開く場合にのみ、放射線ビームが病変に照射する望ましい方向にカプセル内のシャッターから放出される。X線生成装置の場合、X線源は上記パラメータが満たされた場合にのみ起動する。
【0061】
組織内の粒子経路の長さは極めて予測可能であり、肝臓、腎臓や腸などの正常組織への損傷を最小限に抑えつつ、がん組織をより高い精度で破壊することができる。Sr−90は、適切な遮蔽体がなければ命にかかわる典型的なβ放射体であるが、提案されるカプセルで使用される場合は標的部位に安全に方向付けることができる。α粒子を放出する同位体と同様に、γ線またはX線を生じさせうる線源はカプセルに適切な遮蔽体を施して使用することができる。β放射体の大きな利点は、本発明の新技術による非常に効果が高く予測可能な放射同位体の実現と、遮蔽体の簡素化による容積減少を理由とするカプセルの小型化である。当業者が利用できる線源として表(例えばBerger & Seltzerの表)に規定した金属または適切な電子阻止能を持つルーサイトなどのプラスチックを遮蔽体に使用することができる。より小さく狭い空間にある相当に小さな腫瘍を治療することが可能になる。
【0062】
カプセルのシャッターは、単に放射線アパーチャを閉じるドアと同等のものでもよい。好適な方法は、クラムシェル型の外側カバーを備えた虹彩アパーチャである。アパーチャはさまざまな直径に開くことができ、医師は治療すべき病変の大きさや容積の表面積を選択することができる。患者体内で照射すべき腫瘍に光をあてるために、カセットの外部に光源を配置することができる。照射野光の役目を果たす別の光源は放射線の放出元であるアパーチャの後方にあり、虹彩の後方に存在することによって、医師は放射線源がクラムシェルによって開かれる前に、腫瘍を最大限に網羅するべく装置を位置付ける際に病変の目視を続けることができる。さらにこの方法は装置が配置されている間に一つまたは他方のアパーチャが故障した場合に冗長防護を提供し、装置を患者から取り除き、安全に修復を行えるまで遮蔽されたピグに安全に蓄積することができるようになる。好適な光源はLED、光ファイバーまたは固体発光体である。
【0063】
治療手術を完了した後、SRIORTアームおよび放射線源は、次回のための滅菌と準備を行うことのできるピグまたは適切な保管装置に遠隔保管することができる。便宜上、保管装置はその上に遮蔽容器またはピグを伴うテーブルが望ましい。保管装置は複数のピグを備えていることがよくある。遮蔽体ピグを含む保管装置は、クローゼットや保管用キャビネットが使用される場合であっても、遮蔽線源格納テーブルと呼ばれる。放射線安全性を確保するため、各ピグは線源がピグに存在するか存在しないかを保証するための放射線存在の検出手段を備えるものとする。規制により、これは通常、手術室内の検出器、および/または電離箱、電位計またはガイガー・ミューラー式の計数管などの、遮蔽線源格納テーブル内にあるセンサーである。
【0064】
放射線源に加え、レーザーまたは粒子放出装置を含む、組織破壊のために補助的に使用されるその他の装置をユニットに取り付けることもできる。本装置は放射線源の輸送に限定されず、X線ダイオードまたはその他の放射線源と併用することもできる。
【0065】
手術用ロボットは一つ以上のアームを備えることができるため、本発明によって、医師が照射中に別のカプセルを選択しようと決めた場合には、その時点で使用していたカプセルを素早く引っ込め、その抜き取り経路を記憶させ、好適な放射線源を持つ新しいカプセルを挿入できるように、一つ以上のカプセルを遮蔽線源格納テーブルに準備できるようになる。
【0066】
発明の好適な方法の応用例
以下の2つの例では、SRIORT装置およびシステムが実際の実施においてどのように使用されるかを説明している。医師によっては、専門分野で受けた訓練の違いを理由に、こうした手術に直接従事する必要があろう。いずれの場合でも、重要な役割を果たすのは外科医と放射線腫瘍医である。外科医は関連分野において特に訓練を受けることになり、放射線腫瘍医は腫瘍治療のための放射線の適切な使用、応用および線量について訓練を受けている。さらに、放射線腫瘍医と協力して放射線現の使用について特に訓練を受けた医学物理士が、SRIORT装置を用いた放射線照射の立案に対応できる必要がある。
【実施例1】
【0067】
腹部腫瘍(卵巣がんIIIb期)
最初に、がん治療において患者に行う手術の性質を患者に伝える。患者がこの情報を聞いて確認を行い同意した後に、患者は手術室に進み、仰臥位で手術台に配置される。その後、麻酔医は全身麻酔を用いて患者に麻酔をかける。
【0068】
十分な全身麻酔が注入された後、麻酔下の患者を検査して、可能であれば疾患の程度を判断する。その後、患者には通常の滅菌条件で準備を行い、ドレープをかけ、およそ1〜1.5 cmの長さの臍下横切開が行われる。その後、直接見える状態で、切開部分から腹膜腔に、穿孔にTVカメラを備えた腹腔鏡套管針を進める。腹部に侵入した後、腹部に二酸化炭素ガスを吹き入れ、腹腔内臓器外で腹壁を膨張させる。その後、これもまたTVカメラにより直接見える状態で、一連の類似の切開を行い、手術の過程においてロボットアームを配置できるように腹部に套管針を導入する。これらの套管針が設置されると、ロボット動作システムを手術台の位置に配置し、ロボットアームを準備位置に配置する。次に医師はSRIORT制御ステーションに進むが、これは術中照射装置が動作している期間中、合理的に達成可能な限り低い放射線防護を提供するために、十分な物理的特性を持つ放射線遮蔽体の後方にある手術室に位置している。ワークステーションには、患者に配置されたロボットカメラによる可視化システムが備わっており、表示方法を選択できる。制御ステーションはまた、コンピュータと関連する電子回路の制御下、医師が自然な方法でロボットアームを移動・操作できるようにする人間工学的なロボットのハンドマニピュレーターを備えている。
【0069】
次に外科医は、以前に配置した套管針から患者内に適切なロボットアームを配置し、その次に該ロボットアームを制御ステーションから操作して手術を行う。外科医は通常、腹水貯留部位に吸引を配置するためにロボットアームを使用し、この貯留は転移性がん細胞の微視的分析のため病理検査に送られる。その後、滅菌水で腹部を洗浄し、該滅菌水もまた分析のため病理検査に送られる。
【0070】
この段階で、外科医は子宮摘出術、両側卵管卵巣摘出術および骨盤リンパ節郭清や大動脈周囲リンパ節郭清を行う。この部分の手術が完了したら、外科医は腹部の残りの部分に注意を向ける。局所進行性の卵巣がんでは通常、網もまた摘出される。その後、外科医はロボット装置やカメラを用いてがんのさらなる形跡がないか、腸の残りの部分を検査する。外科医は、膀胱、直腸、腸、腹膜面、肝臓および横隔膜の下側を検査する。病変が発見されたら、外科医はロボット手術システムを用いて腹膜内の目に見える疾患をできる限り切除する。縮小プロセスにおいて、SRIORTシステムを用いる外科医はマーキング装置を作動させ、この装置が腹部内または手術野内で特定および/または切除された既知または疑わしいがんの部位すべての空間的座標を記録する。次に、手術後および将来の手術において、微視的疾患の治療のためにさらに放射線療法が検討される場合のある潜在的な位置を特定するために、これらの座標を利用することができる。
【0071】
マーキング装置は、外科医が将来のある時点で位置を選択したり、手術室の画像モニタ上に単独で、または手術前画像と重ねてウェイポイントを表示することを可能にする、保存された解剖学的「ウェイポイント」を作成するべく、ロボットアーム、表示システムおよび制御の現在の空間的位置や設定を記録するために制御コンピュータに信号を送る電子制御から構成されている。これにより、外科医や放射線腫瘍医はさらなる研究、照射または手術のために患者内の関心部位に戻ることが可能となる。さらに、装置によって外科医は、将来のある時点で、術後的に、疑わしい組織を放射線特定するために金核種マーカーを配置することができる。位置の変化に適応して手術中にウェイポイントを調整することもできる。
【0072】
外科医が作業を終えると、放射線腫瘍医が外科医と協力して、コンピュータ断層撮影法スキャン(CT/CAT)、放射断層撮影法スキャン(PETまたはPET/CT)、磁気共鳴映像法スキャン(MRI)、超音波映像および患者内での位置や放射線の局所化に有益なその他の画像技術を含むがこれらに限定はされない手術前医用画像を、手術室のモニタ上に配置する。外科医と放射線腫瘍医が照射すべき部位を決定すると、放射線腫瘍医が医学物理士との相談の上、病変の治療に使用される放射線源から手術に必要なスタッフを防護するために、遮蔽装置を移動して手術室に設置する。
【0073】
その後、放射線源を含むカセットを取り付ける能力を持つSRIORTロボットアプリケータアームを含むカートが、カセットや放射線源とともに、手術室に持ち込まれる。
【0074】
放射線腫瘍医が病変の治療に使用すべき適切な放射線源と線量を選んだら、医学物理士は、別々のコンピュータワークステーションを用いて、使用すべき線源、使用すべきビームサイズそして照射の深さと照射すべき放射線線量を特定するために、SRIORT装置を前もってプログラムする。これらのパラメータが装置にプログラムされると、放射線の照射に進むことが可能となる。
【0075】
典型的には、現在行われているように、例えば前立腺がん用の核種において、病変がマーキングされると、提案された手術のシミュレーションが行われる。現在利用できる放射線シミュレーションの技術は、システムと併用される汎用コンピュータのプログラミングに組み込まれる。
【0076】
放射線腫瘍医は使用すべき適切なアームを選択し、SRIORT装置を用いて、放射線源の保管カート(放射性核種線源の場合はピグ)から選択されたカセットを抜き取る位置にアームを移動する。カセットには電気接続があり、これによってカセットはSRIORTマニピュレーターそして制御ステーションにその存在を識別させることができる。SRIORTは、カセットの識別内容を物理士が以前に行ったプログラム済みの線源選択と放射線量の計画と比較し、適切なカセットが正しい線源に取り付けられたことを確認する。次に、遮蔽された貯蔵室(ピグ)にある線源は特定のサイズにアパーチャを設定させ、各々のサイズを計測して抜き取る前にアパーチャサイズ制御の正確さを検証する。次にシャッターが開き、放射線検出器を露出させて線源の放射能/強度がプログラム済みのコントローラで計算・参照された予測値に合致することを検証する。これによって、放射線腫瘍医や物理士は装置を患者内に実際に導入する前に不一致を解決することができる。
【0077】
計画と曝露のパラメータが検証されると、SRIORT制御システムによって医師はカセットを取り外し、適切な套管針からカセットを患者内の位置に運ぶロボットアームを操作することができる。カセットはまた、手術室内そして何よりも患者内での正確な空間的位置を特定する位置決め変換器を含む。この位置はまた、医用画像を含む画像ワークステーションに送信され、患者内での放射線源の位置は手術室のモニタに表示されるとともに、SRIORTビジョンシステム上で患者内でも直接可視化される。これは通常、光の可視スペクトルを用いて行われるが、通常の可視光では観察できない生理的活性を放射線腫瘍医が観察して、潜在的な残存がんの部位を特定・治療し再発を防ぐ医師の能力を高めるために、赤外線スペクトルなど非可視スペクトルを可視スペクトルに対してマッピングすることもまた可能である。
【0078】
これらの可視化スキーマで、SRIORT制御ステーションから医師は放射線カセットを適切な位置に進めて標的に放射線を照射する。次に放射線腫瘍医は、病変の治療に適切なアパーチャサイズを設定してから、アパーチャを通じて実際の放射線野を再現する自己完結型の照射野光という手段によってこのアパーチャを視覚識別する。この照射野光を関心領域と比較した上で、医師は被照射部位に正確に適合するように線源とアパーチャサイズの位置をリアルタイムで微調整する。照射野光は、カセットに、またはカセットを運ぶSRIORTアームに取り付けられた照準レーザー装置で補われる。
【0079】
これが終わると、SRIORTは放射線量率と時間の最終計算を行い、シャッターが開き、カセットの放射線源は適切な疾患制御にとって望ましい線量と深さで病変に照射することができる。放射線腫瘍医は、SRIORTを直接操作することで、関心領域について以前に保存した座標、画像研究および直接可視光/可視領域外でのスペクトルマッピング情報を検討・考察できる。
【0080】
このプロセスは、がん性病変の恒久的な根絶を最大の希望として、特定されるすべての病変を適切に治療するために必要な限り何回も反復される。いずれの場合でも、放射線腫瘍医と医学物理士は、多種多様なカセットの中から手術時に放射線治療すべき各病変に対する適切な術中照射アプリケータを選択し、がんや腫瘍性疾患を治癒する最大の機会として、線源をリアルタイムで操作・プログラムできる。
【0081】
頭や首、脳または胸部などのその他の部位の場合、疾患部位に適切な修正を加えた上で、上述の手技を同様に適用することができる。このSRIORT装置では、加速器を正確に位置付けることができないことを理由に過去においては術中に治療不能であった部位を治療するために、放射線の使用ができるようになる。Med−Tech社の小線源治療術中アプリケータなどのその他の装置には、放射線感受性臓器または該臓器に隣接する病変に許容できない罹患率を生じさせることなく、関心病変をピンポイント治療する上で必要な精度が備わっていない。
【0082】
本発明は切開手術や組織の切除に関する手技および十分な断端を達成するためのフォローアップ照射に焦点をあてているものの、本発明はいわゆる「手術不能がん」など切除が望ましいと考えられない手術にも適用できる。上記には例えば、切除するには死亡率のリスクが高すぎる大動脈隣接の病変などが挙げられる。本発明によって、組織を繰り返し破壊する際に、重要な血管や臓器から離して(潜在的には)段階的な方法で照射を使用できるため、放射線感受性組織との物理的接触が避けられ、および/または健常組織の再成長を可能にする。
【0083】
別の変形型は、運動臓器上でまたは運動臓器と併用してセンサーを使用し、当該センサーからの出力をシャッターおよびアパーチャの開閉とカプセルの位置付けに合わせることである。そのため、心臓組織上の病変について、組織に対するカプセルの相対運動において特定のポイントでのみ発生するよう放射線曝露の時間を設定させるために、EKGリードを接続したり汎用コンピュータに統合することができる。別の方法としては、放射線曝露が特定の距離範囲でのみ発生するように、カプセル上の視覚式、光学式、または超音波式のいずれかの距離計をアパーチャと連係させることができる。これによって、患者への危険は格段に低い形で、特定の心臓や肺大動脈の病変をスタンドオフの組織照射によって治療できるようになる。カプセルは、律動的な組織運動と連動して移動させることができる。
【0084】
本発明は、例えば、肝臓内の実質内病変と併用することができる。肝臓は放射線感受性組織であり、実質内病変は通常、必ず致死的な結果を伴うことから放射線療法には適していない。
【0085】
本発明によって、定位的放射線治療タイプの技術が可能になり、医師は照射効果の深さをリアルタイムで判断し、線量をリアルタイムで調整できる。願わくは、これにより患者身体の他の侵襲を避けることができる。
【0086】
本発明は、カプセルの確実な取り付けのための手段を熟考しており、ロボットアームはカプセルを確実に固定する締め具、指、バヨネット、留め金またはスライド機構を備え、さらに確実に固定された(すなわち、カプセルがロボットアームに安全に取り付けられた)時のみに作動する電気フィードバック機構を備えている。確実な取り付けの手段にはまた、上記で引用した米国特許第6,246,200号で定義した手術用エンドエフェクタを含む。
【0087】
本発明は、照射用カプセルの侵入を促すために手術用ロボットのその他のアームまたは組織の操作を手術に使用できることを熟考している。
【0088】
複数のコンソールが熟考される場合、先行技術では、相反する具体的な命令がない限り常に放射性物質を含むカプセルの取り扱いを優先させることが望ましい調停機構を説明しているが、本発明では同左を使用する。
【0089】
可能性としては、定義済みの軸方向を支援するために音声インターフェースを含むことができるが、放射線安全上の理由、閉じたマニュアル・オーバーライドおよび制御が必要な点を忘れないことが重要である。
【0090】
電気通信や制御の好適な方法は、ロボットアーム上の接触に対するカプセル上のピンによる物理的な電気接続や制御(またはその逆)であるが、発明のその他の方法として、手術用ロボット間または手術用ロボットへの電気通信、および/またはカプセルへの電気通信の使用が挙げられる。
【0091】
画像という用語は、CT(コンピュータ断層撮影法)、MRI(磁気共鳴映像法)、超音波または超音波映像、機能MRI、PET(放射断層撮影法)、PET/CTおよび核医学スキャンを含むことを意図する。
【0092】
直接可視化という用語は、直接可視化を可能にするための可視光、赤外線および紫外線、またはその任意の組み合わせの使用を含む。
【0093】
また、カプセル上の直接可視化のための一つ以上の取り付け手段を通じて真の体内の立体的視覚化を可能にする二つの直接可視化手段を意味する、立体的内視鏡または立体的腹腔鏡を配置するという概念が提案されている。
【0094】
直接可視化という用語は、直接可視化を可能にするための可視光、赤外線および紫外線、またはその任意の組み合わせの使用を含み、これには内視鏡および腹腔鏡が含れる。
【0095】
また、カプセル上の直接可視化のための一つ以上の取り付け手段を通じて真の体内の立体的視覚化を可能にする二つの直接可視化手段を意味する、立体的内視鏡または立体的腹腔鏡を配置するという概念が提案されている。
【0096】
「スタンドオフ遠隔検出」という用語には、距離を決定するためのレーダーおよび電気信号を含む。本発明において、スタンドオフ遠隔検出は主に、シュラウドが使用される場合は該シュラウド端部までの放射線源の長さを考慮した上で、放射線源から被照射組織までの距離を決定するための手段である。超音波距離計やレーザー光学式距離計など、その他のスタンドオフ遠隔検出の形態も取り上げられている。
【0097】
フェイルセーフの閉位置とは、電源、特にシャッターを作動させる電源が失われた場合に、シャッターが閉まり、放射線が患者へと放出されるアパーチャを塞ぐ機構を意味する。
【0098】
本明細書で示される実施形態は、当該技術分野の当業者が行ったり使用することのできる数ある実施形態および変更形態のほんの数例である。本発明はこれらの実施形態に限定されない。当業者は、特に前文の教示内容に鑑みて、本発明で熟考できる別の実施形態や変更形態を行うことができる。それ故、以下の請求項は、本発明が請求する精神および範囲内に含まれうる別の実施形態、変更形態または同等の内容を網羅することも意図している。
【0099】
参考文献
Attix, Frank H, Introduction to Radiologic Physics and Radiation Dosimetry, John Wiley & Sons, 1986
Berger & Seltzer, Tables of Energy Losses and Ranges of Electrons and Positrons, NASA, 1964
Gunderson & Tepper, Clinical Radiation Oncology, 2nd Edition, Chapter 15, Intraoperative Irradiation, pp 315−328
Haddock MG, Petersen IA Webb MJ: Intraoperative Radiotherapy for locally advanced gynecologic malignancies, Frontiers of Radiation Therapy Oncology, 31:356−259; 1997
Khan, Faiz: The Physics of Radiation Therapy, 1984, Williams & Wilkins, Baltimore, ISBN 0−683−04501−6
Petersen, IA, Haddock, MG, Donohue, JH: Use of intraoperative Electron Beam Radiotherapy in the Management of Retroperitoneal Soft Tissue Sarcoma, Int. J. Radiat Oncol Biol Phys 50:126−131, 2001
Ramsay J, Suit HD: Experimental Studies on the incidence of metastases after failure of radiation treatment and the effect of salvage surgery. Int. J. Radiat Oncol Biol Phys 14:1165−1168; 1988
Stump, KE, DeWerd, LA, Micka, JA, and Anderson, DR: Calibration of New HDR Ir−192 Sources. Med Physics, Vol 29(7):1483−1488
Suit HD: Local control in patient survival. Int. J. Radiat Oncol Biol Phys 23:653−660, 1992
Suit HD: Potential for improving survival rates for the cancer patient by increasing efficacy of treatment of the primary lesion. Cancer 50:1227−1234, 1982
Swiss Society for Radiobiology and Physics, Dosimetry and Quality Assurance in High Dose Rate Brachytherapy with Iridium−192, Recommendation #13, January, 2005, ISBN 3908−125−36−7
【特許請求の範囲】
【請求項1】
遠隔操作が可能な少なくとも一つのロボットアームを備えた術中手術装置と、
外科切開を受ける患者について、カプセルは前記の少なくとも一つの組織に照射するためのもの、前記切開は前記の外科切開を通じて挿入可能な前記カプセルに合った大きさのものである、少なくとも一つの組織に照射するための交換式カプセルと、
前記カプセル内にある前記空洞に向かうアパーチャ開口部を有し、前記カプセル内にある前記空洞に向かうアパーチャ開口部を交互に開閉するシャッターを備え、上記ロボットアーム上に取り付け可能な前記カプセルと、
ロボットアームの電気通信と制御のための第一の手段を備えた前記ロボットアームと、
ロボットアームの電気通信と制御のための前記手段との互換能力を持つことを目的に互換性を持つ、電気通信と制御のための第二の手段を備えた前記カプセルと、
前記ロボットアームおよび電気通信と制御のための前記第一および第二の手段との互換能力を持つことを目的に互換性を持つ、前記ロボットアームと前記カプセル間の確実な取り付けのための手段と、
上記アパーチャ内で患者組織に照射する放射線源を含むような大きさの前記アパーチャ内にある前記空洞と、
前記カプセル外部では放射線を減衰させるために選択された遮蔽体を持つ前記カプセルと、
前記シャッター用の電子機械制御と、
少なくとも開閉位置を持つ電気機械的に制御可能な前記シャッターと、
フェイルセーフの閉位置を備える前記シャッターと、
前記の電子機械制御を作動させて前記シャッターを開き、前記患者組織を前記カプセル内に配置した放射線源に曝露させることができるように、患者の被照射組織に隣接する前記カプセルの前記アパーチャを移動させるために前記カプセルと連係する、前記の少なくとも一つの遠隔操作可能なロボットアームを備えた前記術中手術装置を含む、手術用ロボットによる術中放射線療法装置。
【請求項2】
ロジックを提供し、前記装置に対して運動、タイミング、可視化、照射および位置報告の諸機能を実施するようプログラムされた、前記カプセルを行き来するデータを送信するための汎用コンピュータをさらに含む、請求項1に記載の手術用ロボットによる術中放射線療法装置。
【請求項3】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項2に記載の手術用ロボットによる術中放射線療法装置。
【請求項4】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項2に記載の手術用ロボットによる術中放射線療法装置。
【請求項5】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項4に記載の手術用ロボットによる術中放射線療法装置。
【請求項6】
罹患したすべての組織が手術で摘出されたかどうか、またさらに照射が必要かどうかを確認するための、前記カプセルに隣接する組織を遠隔手段によって直接可視化するための少なくとも一つの手段をさらに含む、請求項2に記載の手術用ロボットによる統合型術中放射線療法システム。
【請求項7】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項6に記載の手術用ロボットによる術中放射線療法装置。
【請求項8】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項6に記載の手術用ロボットによる術中放射線療法装置。
【請求項9】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項7に記載の手術用ロボットによる術中放射線療法装置。
【請求項10】
適切な被照射断端を決定するための腫瘍の深さなど、組織の深さを決定するために超音波検出を利用する手段をさらに含む、請求項1〜9に記載の手術用ロボットによる術中放射線療法装置。
【請求項11】
前記カプセルに隣接する組織の遠隔表示による直接可視化の少なくとも一つの手段をさらに含む、請求項1〜9に記載の手術用ロボットによる術中放射線療法装置。
【請求項12】
前記組織への照射に適切な前記カプセルの前記空洞内の選択された放射線源と、
前記カプセルを前記患者内に置くように提案された期間、前記シャッターを前記の閉位置に置く一方で、前記の選択された放射線源に対する遮蔽特性に基づき、前記患者への過剰な放射線量に対して放射線を減衰するよう選択された前記カプセルをさらに含む、請求項1〜9に記載の手術用ロボットによる術中放射線療法装置。
【請求項13】
前記汎用コンピュータに統合され、定義済み軸上での前記カプセルの方向を支援するべく前記装置の操作者の音声認識を可能にするためにマニュアル・オーバーライドに従う音声インターフェースをさらに含む、請求項1〜9に記載の手術用ロボットによる術中放射線療法装置。
【請求項14】
前記の被照射組織から前記放射線源までの距離を確認するために光測距法を用いた電子距離測定器をさらに含む、請求項2〜9に記載の手術用ロボットによる術中放射線療法装置。
【請求項15】
放射線源から被照射組織までの距離を決定するためのスタンドオフ遠隔検出をさらに含む、請求項2〜9に記載の手術用ロボットによる術中放射線療法装置。
【請求項16】
前記システムの操作者にとって目に見える、患者の少なくとも一つの組織の医用画像を表示する手段と、
遠隔操作できる少なくとも一つのロボットアームと、
外科切開を受ける患者について、カプセルは前記の少なくとも一つの組織に照射するためのもの、前記切開は前記の外科切開を通じて挿入可能な前記カプセルに合った大きさのものである、少なくとも一つの組織に照射するための交換式カプセルと、
前記カプセル内にある前記空洞に向かうアパーチャ開口部を有し、前記カプセル内にある前記空洞に向かうアパーチャ開口部を交互に開閉するシャッターを備え、上記ロボットアーム上に取り付け可能な前記カプセルと、
ロボットアームの電気通信と制御のための第一の手段を備えた前記の少なくとも一つのロボットアームと、
ロボットアームの電気通信と制御のための前記手段との互換能力を持つことを目的に互換性を持つ、電気通信と制御のための第二の手段を備えた前記カプセルと、
前記ロボットアームおよび電気通信と制御のための前記第一および第二の手段との互換能力を持つことを目的に互換性を持つ、前記ロボットアームと前記カプセル間の確実な取り付けのための手段と、
上記アパーチャ内で患者組織に照射する放射線源を含むような大きさの前記アパーチャ内にある前記空洞と、
前記カプセル外部では放射線を減衰させるために選択された遮蔽体を持つ前記カプセルと、
前記シャッター用の電子機械制御と、
少なくとも開閉位置を持つ電気機械的に制御可能な前記シャッターと、
フェイルセーフの閉位置を備える前記シャッターと、
前記患者に隣接して配列された遮蔽線源格納テーブルと、
可動式の患者遮蔽体と、
前記の電子機械制御を作動させて前記シャッターを開き、前記患者組織を前記カプセル内に配置した放射線源に曝露させることができるように、前記カプセルを前記遮蔽線源格納テーブルから取り除き、その後、患者の被照射組織に隣接する前記カプセルの前記アパーチャを移動させるために前記カプセルと連係する、前記の手術用ロボットによる統合型術中放射線療法装置に統合される前記の少なくとも一つの遠隔操作可能なロボットアームをさらに含む、手術用ロボットによる統合型術中放射線療法システム。
【請求項17】
適切な被照射断端を決定するための腫瘍の深さなど、組織の深さを決定するために超音波検出を利用する手段をさらに含む、請求項16に記載の手術用ロボットによる統合型術中放射線療法装置。
【請求項18】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項17に記載の手術用ロボットによる術中放射線療法装置。
【請求項19】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項17に記載の手術用ロボットによる術中放射線療法装置。
【請求項20】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項19に記載の手術用ロボットによる術中放射線療法装置。
【請求項21】
ロジックを提供し、前記装置に対して運動、タイミング、可視化、照射および位置報告の諸機能を実施するようプログラムされた、前記カプセルを行き来するデータを送信するための汎用コンピュータをさらに含む、請求項16に記載の手術用ロボットによる統合型術中放射線療法装置。
【請求項22】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項21に記載の手術用ロボットによる術中放射線療法装置。
【請求項23】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項21に記載の手術用ロボットによる術中放射線療法装置。
【請求項24】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項23に記載の手術用ロボットによる術中放射線療法装置。
【請求項25】
適切な被照射断端を決定するための腫瘍の深さなど、組織の深さを決定するために超音波検出を利用する手段をさらに含む、請求項21に記載の手術用ロボットによる統合型術中放射線療法装置。
【請求項26】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項25に記載の手術用ロボットによる術中放射線療法装置。
【請求項27】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項25に記載の手術用ロボットによる術中放射線療法装置。
【請求項28】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項27に記載の手術用ロボットによる術中放射線療法装置。
【請求項29】
最初の従来の切除手術の終わりに再訪して、照射が適切かどうかを判断するべく特定の組織の迅速な再訪と診察を行うことができるようウェイポイントを位置確認・記録するための手段をさらに含む、請求項21に記載の手術用ロボットによる統合型術中放射線療法装置。
【請求項30】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項29に記載の手術用ロボットによる術中放射線療法装置。
【請求項31】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項29に記載の手術用ロボットによる術中放射線療法装置。
【請求項32】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項31に記載の手術用ロボットによる術中放射線療法装置。
【請求項33】
前記ロボットアームと比較して前記患者の医用画像の三次元座標を位置確認するための手段と、
体内における前記カプセルの三次元座標のリアルタイムでの特定・追跡、および前記患者において照射すべき前記の少なくとも一つの組織と比較した場合の体内における前記カプセルの位置を表示するための手段をさらに含む、請求項21に記載の手術用ロボットによる統合型術中放射線療法装置。
【請求項34】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項33に記載の手術用ロボットによる術中放射線療法装置。
【請求項35】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項33に記載の手術用ロボットによる術中放射線療法装置。
【請求項36】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項35に記載の手術用ロボットによる術中放射線療法装置。
【請求項37】
前記の選択された放射線源の放射特性に関するデータ入力の受理、被照射組織タイプの入力の受理、被照射組織からの前記線源の距離に関するデータ入力の受理、前記シャッターが開いた位置に存在する時間に関するデータ入力の受理、放射線情報に関する情報入力の受理、および前記表示手段でのリアルタイムの照射野分布の表示の出力が可能な前記汎用コンピュータと、
前記の被照射組織と比較した望ましい断端を判断し、前記カプセルを自動的に位置確認し、前記断端に基づき位置確認のための前記手段を出力するための前記汎用コンピュータと、前記組織を照射するために前記カプセルの三次元座標を特定・追跡し、前記シャッターを開き、前記シャッターの前記開口部の限度を設定するための手段をさらに含む、請求項33に記載の手術用ロボットによる統合型術中放射線療法装置。
【請求項38】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項37に記載の手術用ロボットによる術中放射線療法装置。
【請求項39】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項37に記載の手術用ロボットによる術中放射線療法装置。
【請求項40】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項39に記載の手術用ロボットによる術中放射線療法装置。
【請求項41】
前記カプセルに隣接する組織の遠隔表示による直接可視化の少なくとも一つの手段をさらに含む、請求項37に記載の手術用ロボットによる統合型術中放射線療法装置。
【請求項42】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項41に記載の手術用ロボットによる術中放射線療法装置。
【請求項43】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項41に記載の手術用ロボットによる術中放射線療法装置。
【請求項44】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項43に記載の手術用ロボットによる術中放射線療法装置。
【請求項45】
適切な被照射断端を決定するための腫瘍の深さなど、組織の深さを決定するために超音波検出を利用する手段をさらに含む、請求項37に記載の手術用ロボットによる統合型術中放射線療法装置。
【請求項46】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項45に記載の手術用ロボットによる術中放射線療法装置。
【請求項47】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項45に記載の手術用ロボットによる術中放射線療法装置。
【請求項48】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項47に記載の手術用ロボットによる術中放射線療法装置。
【請求項49】
前記の被照射組織から前記放射線源までの距離を確認するために光測距法を用いた電子距離測定器をさらに含む、請求項37に記載の手術用ロボットによる統合型術中放射線療法装置。
【請求項50】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項49に記載の手術用ロボットによる術中放射線療法装置。
【請求項51】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項49に記載の手術用ロボットによる術中放射線療法装置。
【請求項52】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項51に記載の手術用ロボットによる術中放射線療法装置。
【請求項53】
放射線源から被照射組織までの距離を決定するためのスタンドオフ遠隔検出をさらに含む、請求項37に記載の手術用ロボットによる統合型術中放射線療法装置。
【請求項54】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項53に記載の手術用ロボットによる術中放射線療法装置。
【請求項55】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項53に記載の手術用ロボットによる術中放射線療法装置。
【請求項56】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項55に記載の手術用ロボットによる術中放射線療法装置。
【請求項57】
最初の従来の切除手術の終わりに再訪して、照射が適切かどうかを判断するべく特定の組織の迅速な再訪と診察を行うことができるようウェイポイントを位置確認・記録するための手段をさらに含む、請求項37に記載の手術用ロボットによる統合型術中放射線療法装置。
【請求項58】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項57に記載の手術用ロボットによる術中放射線療法装置。
【請求項59】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項57に記載の手術用ロボットによる術中放射線療法装置。
【請求項60】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項59に記載の手術用ロボットによる術中放射線療法装置。
【請求項61】
被照射組織を持つ患者において、前記組織への照射にとって適切な前記カプセルの前記空洞内の選択された放射線源と、
前記カプセルを前記患者内に置くように提案された期間、前記シャッターを前記の閉位置に置く一方で、前記の選択された放射線源に対する遮蔽特性に基づき、前記患者への過剰な放射線量に対して放射線を減衰するよう選択された前記カプセルをさらに含む、請求項16〜60に記載の手術用ロボットによる術中放射線療法装置。
【請求項62】
前記汎用コンピュータに統合され、定義済み軸上での前記カプセルの方向を支援するべく前記装置の操作者の音声認識を可能にするためにマニュアル・オーバーライドに従う音声インターフェースをさらに含む、請求項21〜60に記載の手術用ロボットによる術中放射線療法装置。
【請求項1】
遠隔操作が可能な少なくとも一つのロボットアームを備えた術中手術装置と、
外科切開を受ける患者について、カプセルは前記の少なくとも一つの組織に照射するためのもの、前記切開は前記の外科切開を通じて挿入可能な前記カプセルに合った大きさのものである、少なくとも一つの組織に照射するための交換式カプセルと、
前記カプセル内にある前記空洞に向かうアパーチャ開口部を有し、前記カプセル内にある前記空洞に向かうアパーチャ開口部を交互に開閉するシャッターを備え、上記ロボットアーム上に取り付け可能な前記カプセルと、
ロボットアームの電気通信と制御のための第一の手段を備えた前記ロボットアームと、
ロボットアームの電気通信と制御のための前記手段との互換能力を持つことを目的に互換性を持つ、電気通信と制御のための第二の手段を備えた前記カプセルと、
前記ロボットアームおよび電気通信と制御のための前記第一および第二の手段との互換能力を持つことを目的に互換性を持つ、前記ロボットアームと前記カプセル間の確実な取り付けのための手段と、
上記アパーチャ内で患者組織に照射する放射線源を含むような大きさの前記アパーチャ内にある前記空洞と、
前記カプセル外部では放射線を減衰させるために選択された遮蔽体を持つ前記カプセルと、
前記シャッター用の電子機械制御と、
少なくとも開閉位置を持つ電気機械的に制御可能な前記シャッターと、
フェイルセーフの閉位置を備える前記シャッターと、
前記の電子機械制御を作動させて前記シャッターを開き、前記患者組織を前記カプセル内に配置した放射線源に曝露させることができるように、患者の被照射組織に隣接する前記カプセルの前記アパーチャを移動させるために前記カプセルと連係する、前記の少なくとも一つの遠隔操作可能なロボットアームを備えた前記術中手術装置を含む、手術用ロボットによる術中放射線療法装置。
【請求項2】
ロジックを提供し、前記装置に対して運動、タイミング、可視化、照射および位置報告の諸機能を実施するようプログラムされた、前記カプセルを行き来するデータを送信するための汎用コンピュータをさらに含む、請求項1に記載の手術用ロボットによる術中放射線療法装置。
【請求項3】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項2に記載の手術用ロボットによる術中放射線療法装置。
【請求項4】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項2に記載の手術用ロボットによる術中放射線療法装置。
【請求項5】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項4に記載の手術用ロボットによる術中放射線療法装置。
【請求項6】
罹患したすべての組織が手術で摘出されたかどうか、またさらに照射が必要かどうかを確認するための、前記カプセルに隣接する組織を遠隔手段によって直接可視化するための少なくとも一つの手段をさらに含む、請求項2に記載の手術用ロボットによる統合型術中放射線療法システム。
【請求項7】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項6に記載の手術用ロボットによる術中放射線療法装置。
【請求項8】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項6に記載の手術用ロボットによる術中放射線療法装置。
【請求項9】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項7に記載の手術用ロボットによる術中放射線療法装置。
【請求項10】
適切な被照射断端を決定するための腫瘍の深さなど、組織の深さを決定するために超音波検出を利用する手段をさらに含む、請求項1〜9に記載の手術用ロボットによる術中放射線療法装置。
【請求項11】
前記カプセルに隣接する組織の遠隔表示による直接可視化の少なくとも一つの手段をさらに含む、請求項1〜9に記載の手術用ロボットによる術中放射線療法装置。
【請求項12】
前記組織への照射に適切な前記カプセルの前記空洞内の選択された放射線源と、
前記カプセルを前記患者内に置くように提案された期間、前記シャッターを前記の閉位置に置く一方で、前記の選択された放射線源に対する遮蔽特性に基づき、前記患者への過剰な放射線量に対して放射線を減衰するよう選択された前記カプセルをさらに含む、請求項1〜9に記載の手術用ロボットによる術中放射線療法装置。
【請求項13】
前記汎用コンピュータに統合され、定義済み軸上での前記カプセルの方向を支援するべく前記装置の操作者の音声認識を可能にするためにマニュアル・オーバーライドに従う音声インターフェースをさらに含む、請求項1〜9に記載の手術用ロボットによる術中放射線療法装置。
【請求項14】
前記の被照射組織から前記放射線源までの距離を確認するために光測距法を用いた電子距離測定器をさらに含む、請求項2〜9に記載の手術用ロボットによる術中放射線療法装置。
【請求項15】
放射線源から被照射組織までの距離を決定するためのスタンドオフ遠隔検出をさらに含む、請求項2〜9に記載の手術用ロボットによる術中放射線療法装置。
【請求項16】
前記システムの操作者にとって目に見える、患者の少なくとも一つの組織の医用画像を表示する手段と、
遠隔操作できる少なくとも一つのロボットアームと、
外科切開を受ける患者について、カプセルは前記の少なくとも一つの組織に照射するためのもの、前記切開は前記の外科切開を通じて挿入可能な前記カプセルに合った大きさのものである、少なくとも一つの組織に照射するための交換式カプセルと、
前記カプセル内にある前記空洞に向かうアパーチャ開口部を有し、前記カプセル内にある前記空洞に向かうアパーチャ開口部を交互に開閉するシャッターを備え、上記ロボットアーム上に取り付け可能な前記カプセルと、
ロボットアームの電気通信と制御のための第一の手段を備えた前記の少なくとも一つのロボットアームと、
ロボットアームの電気通信と制御のための前記手段との互換能力を持つことを目的に互換性を持つ、電気通信と制御のための第二の手段を備えた前記カプセルと、
前記ロボットアームおよび電気通信と制御のための前記第一および第二の手段との互換能力を持つことを目的に互換性を持つ、前記ロボットアームと前記カプセル間の確実な取り付けのための手段と、
上記アパーチャ内で患者組織に照射する放射線源を含むような大きさの前記アパーチャ内にある前記空洞と、
前記カプセル外部では放射線を減衰させるために選択された遮蔽体を持つ前記カプセルと、
前記シャッター用の電子機械制御と、
少なくとも開閉位置を持つ電気機械的に制御可能な前記シャッターと、
フェイルセーフの閉位置を備える前記シャッターと、
前記患者に隣接して配列された遮蔽線源格納テーブルと、
可動式の患者遮蔽体と、
前記の電子機械制御を作動させて前記シャッターを開き、前記患者組織を前記カプセル内に配置した放射線源に曝露させることができるように、前記カプセルを前記遮蔽線源格納テーブルから取り除き、その後、患者の被照射組織に隣接する前記カプセルの前記アパーチャを移動させるために前記カプセルと連係する、前記の手術用ロボットによる統合型術中放射線療法装置に統合される前記の少なくとも一つの遠隔操作可能なロボットアームをさらに含む、手術用ロボットによる統合型術中放射線療法システム。
【請求項17】
適切な被照射断端を決定するための腫瘍の深さなど、組織の深さを決定するために超音波検出を利用する手段をさらに含む、請求項16に記載の手術用ロボットによる統合型術中放射線療法装置。
【請求項18】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項17に記載の手術用ロボットによる術中放射線療法装置。
【請求項19】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項17に記載の手術用ロボットによる術中放射線療法装置。
【請求項20】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項19に記載の手術用ロボットによる術中放射線療法装置。
【請求項21】
ロジックを提供し、前記装置に対して運動、タイミング、可視化、照射および位置報告の諸機能を実施するようプログラムされた、前記カプセルを行き来するデータを送信するための汎用コンピュータをさらに含む、請求項16に記載の手術用ロボットによる統合型術中放射線療法装置。
【請求項22】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項21に記載の手術用ロボットによる術中放射線療法装置。
【請求項23】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項21に記載の手術用ロボットによる術中放射線療法装置。
【請求項24】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項23に記載の手術用ロボットによる術中放射線療法装置。
【請求項25】
適切な被照射断端を決定するための腫瘍の深さなど、組織の深さを決定するために超音波検出を利用する手段をさらに含む、請求項21に記載の手術用ロボットによる統合型術中放射線療法装置。
【請求項26】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項25に記載の手術用ロボットによる術中放射線療法装置。
【請求項27】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項25に記載の手術用ロボットによる術中放射線療法装置。
【請求項28】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項27に記載の手術用ロボットによる術中放射線療法装置。
【請求項29】
最初の従来の切除手術の終わりに再訪して、照射が適切かどうかを判断するべく特定の組織の迅速な再訪と診察を行うことができるようウェイポイントを位置確認・記録するための手段をさらに含む、請求項21に記載の手術用ロボットによる統合型術中放射線療法装置。
【請求項30】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項29に記載の手術用ロボットによる術中放射線療法装置。
【請求項31】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項29に記載の手術用ロボットによる術中放射線療法装置。
【請求項32】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項31に記載の手術用ロボットによる術中放射線療法装置。
【請求項33】
前記ロボットアームと比較して前記患者の医用画像の三次元座標を位置確認するための手段と、
体内における前記カプセルの三次元座標のリアルタイムでの特定・追跡、および前記患者において照射すべき前記の少なくとも一つの組織と比較した場合の体内における前記カプセルの位置を表示するための手段をさらに含む、請求項21に記載の手術用ロボットによる統合型術中放射線療法装置。
【請求項34】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項33に記載の手術用ロボットによる術中放射線療法装置。
【請求項35】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項33に記載の手術用ロボットによる術中放射線療法装置。
【請求項36】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項35に記載の手術用ロボットによる術中放射線療法装置。
【請求項37】
前記の選択された放射線源の放射特性に関するデータ入力の受理、被照射組織タイプの入力の受理、被照射組織からの前記線源の距離に関するデータ入力の受理、前記シャッターが開いた位置に存在する時間に関するデータ入力の受理、放射線情報に関する情報入力の受理、および前記表示手段でのリアルタイムの照射野分布の表示の出力が可能な前記汎用コンピュータと、
前記の被照射組織と比較した望ましい断端を判断し、前記カプセルを自動的に位置確認し、前記断端に基づき位置確認のための前記手段を出力するための前記汎用コンピュータと、前記組織を照射するために前記カプセルの三次元座標を特定・追跡し、前記シャッターを開き、前記シャッターの前記開口部の限度を設定するための手段をさらに含む、請求項33に記載の手術用ロボットによる統合型術中放射線療法装置。
【請求項38】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項37に記載の手術用ロボットによる術中放射線療法装置。
【請求項39】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項37に記載の手術用ロボットによる術中放射線療法装置。
【請求項40】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項39に記載の手術用ロボットによる術中放射線療法装置。
【請求項41】
前記カプセルに隣接する組織の遠隔表示による直接可視化の少なくとも一つの手段をさらに含む、請求項37に記載の手術用ロボットによる統合型術中放射線療法装置。
【請求項42】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項41に記載の手術用ロボットによる術中放射線療法装置。
【請求項43】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項41に記載の手術用ロボットによる術中放射線療法装置。
【請求項44】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項43に記載の手術用ロボットによる術中放射線療法装置。
【請求項45】
適切な被照射断端を決定するための腫瘍の深さなど、組織の深さを決定するために超音波検出を利用する手段をさらに含む、請求項37に記載の手術用ロボットによる統合型術中放射線療法装置。
【請求項46】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項45に記載の手術用ロボットによる術中放射線療法装置。
【請求項47】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項45に記載の手術用ロボットによる術中放射線療法装置。
【請求項48】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項47に記載の手術用ロボットによる術中放射線療法装置。
【請求項49】
前記の被照射組織から前記放射線源までの距離を確認するために光測距法を用いた電子距離測定器をさらに含む、請求項37に記載の手術用ロボットによる統合型術中放射線療法装置。
【請求項50】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項49に記載の手術用ロボットによる術中放射線療法装置。
【請求項51】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項49に記載の手術用ロボットによる術中放射線療法装置。
【請求項52】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項51に記載の手術用ロボットによる術中放射線療法装置。
【請求項53】
放射線源から被照射組織までの距離を決定するためのスタンドオフ遠隔検出をさらに含む、請求項37に記載の手術用ロボットによる統合型術中放射線療法装置。
【請求項54】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項53に記載の手術用ロボットによる術中放射線療法装置。
【請求項55】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項53に記載の手術用ロボットによる術中放射線療法装置。
【請求項56】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項55に記載の手術用ロボットによる術中放射線療法装置。
【請求項57】
最初の従来の切除手術の終わりに再訪して、照射が適切かどうかを判断するべく特定の組織の迅速な再訪と診察を行うことができるようウェイポイントを位置確認・記録するための手段をさらに含む、請求項37に記載の手術用ロボットによる統合型術中放射線療法装置。
【請求項58】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項57に記載の手術用ロボットによる術中放射線療法装置。
【請求項59】
前記シャッターを通じて前記カプセルから放射される放射線ビームを狭めるシュラウドをさらに含む、請求項57に記載の手術用ロボットによる術中放射線療法装置。
【請求項60】
調整可能なアパーチャサイズを備えた前記カプセルをさらに含む、請求項59に記載の手術用ロボットによる術中放射線療法装置。
【請求項61】
被照射組織を持つ患者において、前記組織への照射にとって適切な前記カプセルの前記空洞内の選択された放射線源と、
前記カプセルを前記患者内に置くように提案された期間、前記シャッターを前記の閉位置に置く一方で、前記の選択された放射線源に対する遮蔽特性に基づき、前記患者への過剰な放射線量に対して放射線を減衰するよう選択された前記カプセルをさらに含む、請求項16〜60に記載の手術用ロボットによる術中放射線療法装置。
【請求項62】
前記汎用コンピュータに統合され、定義済み軸上での前記カプセルの方向を支援するべく前記装置の操作者の音声認識を可能にするためにマニュアル・オーバーライドに従う音声インターフェースをさらに含む、請求項21〜60に記載の手術用ロボットによる術中放射線療法装置。
【図1】




【公表番号】特表2010−538804(P2010−538804A)
【公表日】平成22年12月16日(2010.12.16)
【国際特許分類】
【出願番号】特願2010−526019(P2010−526019)
【出願日】平成20年9月19日(2008.9.19)
【国際出願番号】PCT/US2008/077100
【国際公開番号】WO2009/039428
【国際公開日】平成21年3月26日(2009.3.26)
【出願人】(510077772)
【出願人】(510077783)
【Fターム(参考)】
【公表日】平成22年12月16日(2010.12.16)
【国際特許分類】
【出願日】平成20年9月19日(2008.9.19)
【国際出願番号】PCT/US2008/077100
【国際公開番号】WO2009/039428
【国際公開日】平成21年3月26日(2009.3.26)
【出願人】(510077772)

【出願人】(510077783)

【Fターム(参考)】
[ Back to top ]

