相乗的な抗癌組成物
本発明は、癌を治療するのに有用な組成物を提供する。前記組成物には、抗新生物チオール結合性ミトコンドリアオキシダントと、抗新生物核酸結合性物質、抗新生物代謝拮抗物質塩基類似体、またはドセタキセルとの相乗的な組み合わせが含まれる。また、前記組み合わせの相乗的な効果を試験する方法、および前記相乗的な組み合わせを使用して癌を治療する方法が提供される。
【発明の詳細な説明】
【関連出願の相互参照】
【0001】
本出願は、2003年12月8日に出願された米国仮特許出願第60/528,181号に対する優先権を主張する。この出願の開示内容は、参照によってその全体が本明細書中に組み込まれる。
【連邦政府によって後援を受けた研究に関する記載】
【0002】
本出願は、国立癌研究所、国立衛生研究所によって与えられたCA 17094のもと米国政府の補助で行われた。米国政府が本発明の権利者である。
【発明の分野】
【0003】
[0003] 本発明は、抗新生物チオール結合性ミトコンドリアオキシダント(an antineoplastic thiol-binding mitochondrial oxidant)、ならびに抗新生物核酸結合性物質(an antineoplastic nucleic acid binding agent)、抗新生物代謝拮抗物質塩基類似体(an antineoplastic antimetabolite base analog)、およびドセタキセルから選択された第二の抗新生物物質の相乗的な組み合わせを使用して癌を治療する方法および組成物に関する。
【発明の背景】
【0004】
[0004] 多くの組み合わせ療法の効果を予想するのは難しい。例えば、ある複数の薬物は互いに相互作用を引き起こし、その治療学的効果を低減させたり、あるいは望まれない副作用をもたらす。これらの薬物は、典型的には拮抗作用を有するものとして分類される。他の薬物は、個々の薬物の総和としての治療学的効果を示す。これらの組み合わせは、付加的効果を有するものとして分類される。さらに、他の薬物の組み合わせは、個々の薬物の総和を上回る治療学的指数を達成する。これらは、相乗的効果を有するものとして分類される。
【0005】
[0005] 相乗的な効果を有する組み合わせ療法は、多くの理由から非常に望ましい。例えば、相乗的な組み合わせ療法における各成分は、単一療法(すなわち、一つの薬物投与)における個々の薬物の治療学的量よりも少ない量で使用することができる。さらに、副作用の危険性および/または重症度を、各薬物の量を減少させることによって著しく減らすことができる。さらに、組み合わせ療法は、治療の全体的効果を著しく増加させることができる。しかしながら、残念ながら、相乗的効果を有する薬物の組み合わせを発見することは、大部分が経験によるものである。
【0006】
[0006] 組み合わせ療法の相乗的作用は、副作用が極度または激しい場合および/または単一量の効果が望ましくない場合、治療において特に有用である。例えば、癌の治療は、しばしば悪心、嘔吐、骨髄抑制、および患者に対する他の激しい不快感を生じる。同様に、ウイルス感染の治療、例えばHIV感染の治療は、一以上のこれらのタイプの副作用を生じる。さらに、癌またはHIV感染治療の有効性の程度は理想よりも少ない。
【0007】
[0007] さらに、耐性の発達は、ウイルス感染、例えばHIVおよびHBV感染の治療、ならびに現存する化学療法において最近の主要な関心事になってきている。通常、耐性は、使用される薬物がウイルスの複製を完全に停止させるのに十分な効き目がないときに生じる。ウイルスが薬物の存在中において完全に複製できる場合、薬物があるにもかかわらずウイルスが複製できる状態が発見されるまでウイルスは変異の機会を得る。いったん変異が起こると増殖に抑制がきかず、直ちにそのウイルス個体の優性株になってしまう。薬物は新株に対して徐々に効かなくなる。また、交差耐性に関する問題が増加する。交差耐性は、一つの薬物に対する耐性をもたらす変異が他の薬物に対する耐性をもたらすときに起こる。幾つかの研究は、二つの薬物を組み合わせることが、一つまたは両方の薬物に対する耐性の発達を、どちらか一方の薬物を単独で使用したときと比較して遅らせることを示している。他の研究は、三つの薬物の組み合わせが、さらにこの利益を伸ばすことを示す。結果として、耐性を防ぐまたは少なくとも遅らせる最良の方法は、複数の薬物の組み合わせ療法を採用することであると考えられる。
【0008】
[0008] 幾つかの組み合わせ療法は、癌よびウイルス感染を治療するために現在有用であるけれども、依然として、癌およびウイルス感染についてのさらなる組み合わせ療法の必要性が存在する。本発明は、これらの問題および他の問題を解決する。
【本発明の概要】
【0009】
[0009] 驚くべきことに、抗新生物チオール結合性ミトコンドリアオキシダントと、抗新生物核酸結合性物質、抗新生物代謝拮抗物質塩基類似体、またはドセタキセルとの組み合わせが、癌患者を治療するのに使用されるとき、相乗的効果を有することを発見した。
【0010】
[0010] 第一の側面において、本発明は、このような治療を必要とするヒトの癌を治療するための方法を提供する。本発明の方法は、患者に対して薬学的に有効量の組成物を投与することを含む。前記組成物には、抗新生物チオール結合性ミトコンドリアオキシダントおよび抗新生物核酸結合性物質が含まれる。前記有効量は、相乗的な治療学的細胞毒性効果を提供する。
【0011】
[0011] 他の側面において、本発明は、このような治療を必要とするヒトの癌を治療するための方法を提供する。前記方法は、患者に対して薬学的に有効量の組成物を投与することを含む。前記組成物には、抗新生物チオール結合性ミトコンドリアオキシダントおよび抗新生物代謝拮抗物質塩基類似体が含まれる。前記有効量は、相乗的な治療学的細胞毒性効果を提供する。
【0012】
[0012] 他の側面において、本発明は、このような治療を必要とするヒトの癌を治療するための方法を提供する。前記方法は、患者に対して薬学的に有効量の組成物を投与することを含む。前記組成物には、抗新生物チオール結合性ミトコンドリアオキシダントおよびドセタキセルが含まれる。前記有効量は、相乗的な治療学的細胞毒性効果を提供する。
【本発明の詳細な説明】
【0013】
I.定義
[0024] 用語「癌」が本明細書中で使用されるとき、白血病、癌腫および肉腫を含む、哺乳類に見出される全ての種類の癌、新生物、または悪性腫瘍を表わす。
【0014】
典型的な癌には、脳、乳房、頚部、大腸、頭部&頚部、肝臓、腎臓、肺、非小肺細胞癌、黒色腫、中皮腫、卵巣癌、肉腫、胃癌、子宮癌および髄芽細胞腫が含まれる。さらなる例には、ホジキン病、非ホジキン性リンパ腫、多発性骨髄腫、神経芽細胞腫、卵巣癌、横紋筋肉腫、原発性血小板血症、原発性マクログロブリン血症、原発性脳腫瘍、癌、悪性膵臓インシュリン産生腫瘍、悪性カルチノイド、尿膀胱癌、前悪性の皮膚病変、精巣癌、リンパ腫、甲状腺癌、神経芽細胞腫、食道癌、尿生殖路癌、悪性高カルシウム血症、子宮体癌、副腎皮質癌、膵臓内分泌および外分泌腫瘍、および前立腺癌が含まれる。
【0015】
[0025] 用語「白血病」は、広く血液形成器官の進行性の悪性疾患をいい、一般的には血液および骨髄中の白血球およびその前駆体の異常増殖および発達によって特徴づけられる。白血病は、臨床的には (1) 急性疾患または慢性疾患といった疾患の期間および特徴; (2) 細胞の種類; 骨髄系(骨髄行性)、リンパ系(リンパ行性)、または単球; および(3)血中の異常細胞数の増加または非増加(一般的な白血病または無白血性白血病(亜白血性白血病))に基づいて分類されるのが一般的である。P388白血病モデルは、インビボでの抗白血病活性を予測するモデルとして広く認められている。P388アッセイは、一般的には治療対象の白血病の種類に関わらずインビボでの抗白血病活性のレベルをを示す。従って、本発明には、白血病の治療方法、好ましくは、急性無リンパ性白血病、慢性リンパ性白血病、急性顆粒球性白血病、慢性顆粒球性白血病、急性前骨髄球性白血病、成体T細胞白血病、非白血球増加性白血症、白血球血症性白血病、好塩基球性白血病、芽球白血病、ウシ白血病、慢性骨髄性白血病、皮膚白血病、幹細胞性白血病、好酸球性白血病、グロス白血病、線毛細胞白血病、血球母細胞性白血病、血球始原細胞性白血病、組織球性白血病、幹細胞性白血病、急性単球白血病、白血球減少症白血病、リンパ性白血病、リンパ芽球性白血病、リンパ球性白血病、リンパ行性白血病、リンパ球系白血病、リンパ肉腫細胞白血病、肥満細胞白血病、巨核球性白血病、小骨髄芽球性白血病、単球白血病、骨髄芽球性白血病、骨髄球性白血病、骨髄顆粒球性白血病、骨髄単球性白血病、ネーゲリ白血病、形質細胞白血病、多発性骨髄腫、プラズマ細胞性白血病、前骨髄球性白血病、リーダー細胞性白血病、シリング白血病、幹細胞性白血病、亜白血性白血病、および未分化細胞白血病の治療方法が含まれる。
【0016】
[0026] 用語「肉腫」は、一般的には胚性結合組織様の物質でできた腫瘍を意味し、一般的には原線維または均質な物質内に包埋された、密に詰め込まれた細胞で構成される。抗新生物チオール結合性ミトコンドリアオキシダントと抗癌剤との組み合わせで治療可能な肉腫には、軟骨肉腫、線維肉腫、リンパ肉腫、メラニン肉腫、粘液性肉腫、骨肉腫、アベメチー肉腫、脂肪肉腫、脂質肉腫、蜂窩性軟部肉腫、エナメル芽細胞肉腫、ブドウ状肉腫、緑色腫肉腫、絨毛膜癌、胚性肉腫、ウィルムス腫瘍肉腫、子宮内膜肉腫、間質性肉腫、ユーイング肉腫、筋膜肉腫、線維形成肉腫、巨細胞肉腫、顆粒球性肉腫、ホジキン肉腫、特発性多発色素出血性肉腫、B細胞の免疫芽球性肉腫、リンパ腫、T細胞の免疫芽細胞肉腫、イェンセン肉腫、カポジ肉腫、クップファー細胞肉腫、血管肉腫、白血肉腫、悪性間葉腫肉腫、傍骨性骨肉腫、細網肉腫、ラウス肉腫、漿液嚢胞性肉腫、滑膜肉腫、および末梢血管拡張性肉腫が含まれる。
【0017】
[0027] 用語「黒色腫」は、皮膚および他の器官のメラニン細胞系から生じる腫瘍を意味する。抗新生物チオール結合性ミトコンドリアオキシダントと抗癌剤との組み合わせで治療可能な黒色腫には、例えば、肢端黒子型黒色腫、メラニン欠乏性黒色腫、良性若年性黒色腫、クラウドマン黒色腫、S91黒色腫、ハーディング−パッセー黒色腫、若年性黒色腫、悪性黒子型黒色腫、悪性黒色腫、結節性メラノーマ、爪下黒色腫、および表在拡大型黒色腫が含まれる。
【0018】
[0028] 用語「癌腫」とは、周囲組織に浸潤および転移する傾向のある上皮細胞でできた悪性の新規増殖を意味する。抗新生物チオール結合性ミトコンドリアオキシダントと抗癌剤との組み合わせで治療可能な典型的な癌腫には、例えば、腺房癌、小葉癌、腺嚢癌腫、腺様嚢胞癌、腺癌、副腎皮質癌、肺胞腺癌、肺胞上皮細胞癌、基底細胞癌、基底細胞性癌、類基底細胞癌、基底有棘細胞癌、肺胞上皮癌、細気管支癌、気管支原性癌、大脳様癌、細胆管細胞性癌、絨毛癌、膠様癌、面ぽう癌、コーパス(corpus)癌、篩状癌、胸鎧癌、皮膚癌、円筒状癌、円柱細胞癌、腺管癌、デューラム癌、胎児性癌、髄様癌、エピアモイド(epiermoid)癌、上皮性アデノイド癌、外方発育癌、潰瘍性癌、線維癌、ゼラチン状癌、膠様癌、巨細胞癌、巨大細胞性癌、腺性癌、顆粒膜細胞癌、毛母癌、血様癌、肝細胞癌、ヒュルトレ細胞癌、硝子質癌、副腎様癌、小児胎児性癌、in situ癌、表皮内癌、上皮内癌腫、Krompecher癌、Kulchitzky細胞癌、大細胞型癌、レンズ状癌、lenticulare癌、脂肪腫様癌、脂肪上皮性癌、延髄性癌、髄様癌、黒色癌、モール(molle)癌、粘液癌、粘液分泌性癌、粘膜細胞癌、粘液性類表皮癌、粘液癌、粘液性癌、粘液腫性癌、上咽頭癌、燕麦細胞癌、骨化性癌、類骨癌、乳頭状癌、門脈周囲癌、上皮内癌、有棘細胞癌、軟性癌、腎臓の腎細胞癌、予備細胞癌、肉腫様癌、シュナイダー癌、スキルス癌、陰嚢癌、印環細胞癌、単純癌、小細胞型癌、ソレノイド癌、回転楕円面細胞癌、紡錘体細胞癌、海綿様癌、扁平上皮癌、有棘細胞癌、ストリング癌、血管拡張癌、血管拡張様癌、移行上皮癌、結節癌、結節状癌、疣状癌、および絨毛癌が含まれる。
【0019】
[0029] 用語「抗新生物性」とは、癌の増殖の阻害または防止を意味する。「癌の増殖の阻害または防止」には、所定の療法または治療を行わなかったときと比較した癌の増殖の減少が含まれる。化合物が抗新生物性を有しているか否かを決定するのに有用な細胞毒性アッセイは、以下の文献に記載されている(Assays for Testing the Anticancer Synergistic Activity of a Combination of an Antineoplastic Thiol-binding Mitochondrial Oxidant and a Second Antineoplastic Agent)。
【0020】
[0030] 「組み合わせ療法」または「補助的療法」は、本明細書で使用されるとき、薬剤を必要とする患者が、その疾患についての他の薬剤を抗新生物チオール結合性ミトコンドリアオキシダントとの組み合わせにおいて与えられることを意味する。この組み合わせ療法は、患者を最初に一つの薬剤で治療し、次に他の薬剤または二つの薬剤を同時に与える経時的療法とすることができる。
【0021】
[0031] 「イメキソン」は、未置換の4-イミノ-1,3-ジアザビシクロ[3.1.0]-ヘキサン-2-オン、またはその薬学的に許容可能な塩または溶媒化合物を意味する。
【0022】
[0032] 「患者」は、ヒトを含む哺乳動物を意味する。
【0023】
[0033] 「相乗的な治療学的細胞毒性効果」は、本明細書で使用されるとき、細胞毒性アッセイを行ったときに少なくとも2つの化合物の組み合わせが相乗効果を示すことを意味する(以下の、抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質の組み合わせの相乗的抗癌活性を試験するためのアッセイを参照)。相乗効果は、50パーセント有効原理を使用して評価される(Chou, etal., Adv Enzyme Regul 22 : 27-55 (1984) )。当該方法は、ミカエリスメンテンの速度式に基づいており、薬物の組み合わせの効果を数値的な指標、すなわち組み合わせ指数(C.I.)に変換する。組み合わせ指数が1未満である場合は、相乗効果ありと認められる。組み合わせ指数が1である場合は、単純な総和である。組み合わせ指数が1を超える場合は、拮抗作用が認められる。
【0024】
[0034] 単独でのまたは他の置換基の一部としての用語「アルキル」は、特に明記しない限り、完全飽和、単不飽和または多不飽であり、かつ二価および多価の基を含むことができる、指定された炭素原子の数を有する(すなわちCl-C10は1〜10の炭素数を意味する)、直鎖または枝分かれ鎖、または環式炭化水素基、またはこれらの組み合わせを意味する。飽和炭化水素基の例には、例えばメチル、エチル、n-プロピル、イソプロピル、n-ブチル、t-ブチル、イソブチル、sec-ブチル、シクロヘキシル、(シクロヘキシル)メチル、シクロプロピルメチル、これらの相同体および異性体、例えばn-ペンチル、n-ヘキシル、n-ヘプチル、n-オクチル、およびこれらに類する基が含まれるがこれらに限定されない。飽和アルキル基は、一以上の二重結合または三重結合を有するものである。不飽和アルキル基の例には、ビニル、2-プロペニル、クロチル、2-イソペンテニル、2-(ブタジエニル)、2,4-ペンタジエニル、3-(1,4-ペンタジエニル)、エチニル、1-および3-プロピニル、3-ブチニル、およびより高度な相同体および異性体が含まれるがこれらに限定されない。用語「アルキル」は、特に明記しない限り、以下により詳細に定義されたアルキルの誘導体(例えば「ヘテロアルキル」)を含むことを意味する。炭化水素基に限定したアルキル基は、「ホモアルキル」と称呼する。
【0025】
[0035] 単独でのまたは他の置換基の一部としての用語「アルキレン」は、-CH2CH2CH2CH2-によって例証されるアルカンから誘導された二価の基を意味するがこれらに限定されない。さらに、アルキレンには、「ヘテロアルキレン」として以下に記載されたグループが含まれる。典型的には、アルキル(またはアルキレン)基は1〜24の炭素原子を有し、10個または数個の炭素原子を有する基が本発明において好ましい。「より低級のアルキル」または「より低級のアルキレン」は、より短い鎖、一般的には8以下の炭素原子を有するより短い鎖状のアルキルまたはアルキレン基である。
【0026】
[0036] 用語「アルコキシ」、「アルキルアミノ」および「アルキルチオ」(またはチオアルコキシ)は、その通常の意味において使用され、それぞれ酸素原子、アミノ基、または硫黄原子を介して分子の残部に結合したアルキル基を意味する。
【0027】
[0037] 単独でのまたは他の用語と組み合わせての用語「ヘテロアルキル」は、特に明記しない限り、一定数の炭素原子と、O, N, SiおよびSからなる群から選択された少なくとも一つのヘテロ原子からなる、安定な直鎖または枝分かれ鎖、または環式炭化水素基、またはこれらの組み合わせを意味する。窒素および硫黄原子が任意的に酸化され得、窒素へテロ原子が任意的に四分子化される。ヘテロ原子O, NおよびSおよびSiは、ヘテロアルキル基の任意の内部の位置に配置されるかまたはアルキル基が分子の残部に結合する位置に配置され得る。例には、-CH2-CH2-O-CH3, -CH2-CH2-NH-CH3, -CH2-CH2-N(CH3)-CH3, -CH2-S-CH2-CH3, -CH2-CH2, -S(O)-CH3, -CH2-CH2-S(O)2-CH3, -CH=CH-O-CH3, -Si(CH3)3, -CH2-CH=N-OCH3, および-CH=CH-N(CH3)-CH3が含まれるがこれらに限定されない。二つまでのヘテロ原子は連続的であってもよく、例えば-CH2-NH-OCH3および-CH2-O-Si(CH3)3であってもよい。同様に、単独でのまたは他の置換基の一部としての用語「ヘテロアルキレン」は、ヘテロアルキルから誘導された二価の基を意味する(例証として、これに限定されないが、-CH2-CH2-S-CH2-CH2-および-CH2-S-CH2-CH2-NH-CH2-)。ヘテロアルキレン基について、ヘテロ原子はまた、鎖終端の片方または両方を占有することができる(例えば、アルキレンオキシ、アルキレンジオキシ、アルキレンアミノ、アルキレンジアミノ、およびこれらに類するもの)。さらにまた、アルキレンおよびヘテロアルキレン連結基について、連結基の配向性は、連結基の式が記載されているその方向性によって意味付けられない。例えば、式-C(O)2R'-は、-C(0)2R'-および-R'C(O)2-の両方を意味する。
【0028】
[0038] 単独でのまたは他の用語との組み合わせにおける用語「シクロアルキル」および「ヘテロシクロアルキル」は、特に明記しない限り、それぞれ「アルキル」および「ヘテロアルキル」の環式の態様を表わす。さらに、ヘテロシクロアルキルについて、ヘテロ原子は、ヘテロ環が残りの分子と結合する位置に存在できる。シクロアルキルの例には、シクロペンチル、シクロヘキシル、1-シクロヘキセニル、3-シクロヘキセニル、シクロヘプチル、およびこれらに類するものが含まれるがこれらに限定されない。ヘテロシクロアルキルの例には、1-(1,2,5,6-テトラヒドロピリジル)、1-ピペリジニル、2-ピペリジニル、3-ピペリジニル、4-モルフォリニル、3-モルフォリニル、3-チオモルフォリニル、テトラヒドロフラン-2-イル、テトラヒドロフラン-3-イル、テトラヒドロチエン-2-イル、テトラヒドロチエン-3-イル、1-ピペラジニル、2-ピペラジニル、およびこれらに類するものが含まれる。
【0029】
[0039] 単独でのまたは他の置換基の一部としての用語「ハロ」または「ハロゲン」は、特に明記しない限り、フッ素、塩素、臭素、またはヨウ素原子を意味する。さらに、用語「ハロアルキル」には、モノハロアルキルおよびポリハロアルキルが含まれることを意味する。例えば、用語「ハロ(Cl-C4)アルキル」には、トリフルオロメチル、2,2,2-トリフルオロエチル、4-クロロブチル、3-ブロモプロピル、およびこれらに類するものが含まれることを意味するがこれらに限定されない。
【0030】
[0040] 用語「アリール」は、特に明記しない限り、特定の多不飽和の芳香族炭化水素置換基を意味する。単環または複数の環(好ましくは1〜3つの環)が互いに融合または共有結合的に連結している。用語「ヘテロアリール」は、N, O, およびSから選択された1〜4のヘテロ原子を含むアリール基(または環)を意味する。ここで、窒素および硫黄原子は任意的に酸化され、かつ窒素原子は任意的に四分子化される。ヘテロアリール基は、ヘテロ原子を通して分子の残基と結合することができる。アリールおよびヘテロアリール基の制限のない例には、フェニル、1-ナフチル、2-ナフチル、4-ビフェニル、1-ピロリル、2-ピロリル、3-ピロリル、3-ピラゾリル、2-イミダゾリル、4-イミダゾリル、ピラジニル、2-オキサゾリル、4-オキサゾリル、2-フェニル-4-オキサゾリル、5-オキサゾリル、3-イソオキサゾリル、4-イソオキサゾリル、5-イソオキサゾリル、2-チアゾリル、4-チアゾリル、5-チアゾリル、2-フリル、3-フリル、2-チエニル、3-チエニル、2-ピリジル、3-ピリジル、4-ピリジル、2-ピリミジル、4-ピリミジル、5-ベンゾチアゾリル、プリニル、2-ベンゾイミダゾリル、5-インドリル、1-イソキノリル、5-イソキノリル、2-キノキサリニル、5-キノキサリニル、3-キノリル、および6-キノリルが含まれる。上記に示したアリールおよびヘテロアリール環系の各々の置換基は、以下に記載の許容可能な置換基の群から選択される。
【0031】
[0041] 簡潔に言えば、用語「アリール」には、他の用語(例えば、アリールオキシ、アリールチオキシ、アリールアルキル)と組み合わせて使用されるとき、上記に定義したようなアリールおよびヘテロアリール環の両方が含まれる。従って、用語「アリールアルキル」には、アリール基がアルキル基と結合している基(例えば、ベンジル、フェネチル、ピリジルメチルおよびこれらに類する基)が含まれることを意味する。ここでのアルキル基には、炭素原子(例えばメチレン基)が、例えば酸素原子(例えば、フェノキシメチル、2-ピリジルオキシメチル、3-(1-ナフチルオキシ)プロピル、およびこれらに類するもの)によって置換されているアルキル基が含まれる。
【0032】
[0042] 本明細書で使用される用語「オキソ」は、炭素原子と二重結合する酸素を意味する。
【0033】
[0043] 上記用語の各々(例えば「アルキル」、「ヘテロアルキル」、「アリール」および「ヘテロアリール」)は、その基の置換された形態および置換されていない形態の両方を含むことを意味する。各タイプの基についての好ましい置換基は、以下に提供される。
【0034】
[0044] アルキルおよびヘテロアルキル基についての置換基(アルキレン、アルケニル、ヘテロアルキレン、ヘテロアルケニル、アルキニル、シクロアルキル、ヘテロシクロアルキル、シクロアルケニル、およびヘテロシクロアルケニル基についての置換基を含む)は、0から(2m'+1)(m'は、置換基の炭素原子の数)までの範囲の数における、-OR', =O, =NR', =N-OR', -NR'R", -SR', -ハロゲン, -SiR'R''R''', -OC(O)R', -C(O)R', -CO2R', -CONR'R'', -OC(O)NR'R'', -NR''C(O)R', -NR'-C(O)NR''R''', -NR''C(O)2R', -NR-C(NR'R''R''')=NR'''', -NR-C(NR'R'')=NR''', -S(O)R', -S(O)2R', -S(O)2NR'R'', -NRSO2R', -CNおよび-NO2から選択された一以上の種々の基であり得るがこれらに限定されない。R', R'', R'''およびR''''は、好ましくはそれぞれ独立して、水素、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないアリール、例えば1〜3のハロゲンで置換されたアリール、置換されたまたは置換されていないアルキル、アルコキシまたはチオアルコキシ基、またはアリールアルキル基を意味する。本発明の化合物が一以上のR基を含むとき、例えば、一以上の基が存在するときのR', R'', R'''およびR''''基の各々がそうであるように、各々のR基はそれぞれ独立して選択される。R'およびR''が同じ窒素原子と結合するとき、これらは該窒素原子で互いに結合し、5-, 6-、または7-員環を形成することができる。例えば、-NR'R''には、1-ピロリジニルおよび4-モルフォリニルが含まれるこれらに限定されない。置換基の上記議論から、用語「アルキル」には、水素基以外の基、例えばハロアルキル基(例えば-CF3および-CH2CF3)およびアシル基(例えば-C(O)CH3, -C(O)CF3, -C(O)CH2OCH3, およびこれらに類する基)と結合した炭素原子を含むグループが含まれることを当業者は理解するであろう。
【0035】
[0045] アルキル基について記載された置換基と同様、アリール基およびヘテロアリール基についての置換基は様々であり、例えば、0から芳香族環系上の結合可能な原子価の総数までの範囲の数における、ハロゲン、 -OR', =O, =NR', =N-OR', -NR'R'', -SR', -ハロゲン、-SiR'R''R''', -OC(O)R', -C(O)R', -CO2R',- CONR'R'', -OC(O)NR'R'', -NR''C(O)R', -NR'-C(O)NR''R''', -NR''C(0)2R', -NR-C(NR'R''R''')=NR'''', -NR-C(NR'R'')=NR''', -S(O)R', -S(O)2R', -S(O)2NR'R'', -NRSO2R', -CNおよび-N02, -R', -N3, -CH(Ph)2, フルオロ(C1-C4)アルコキシ、およびフルオロ(C1-C4)アルキルから選択される。in a number ranging from zero to the total number of open valences on the aromatic ring system; R', R'', R'''およびR''''は、好ましくはそれぞれ独立して水素、アルキル、ヘテロアルキル、アリールおよびヘテロアリールから選択される。本発明の化合物が一以上のR基を含むとき、一以上の基が存在するときの各R', R'',R'''およびR''''基がそうであるように、各々のR基はそれぞれ独立して選択される。
【0036】
[0046] アリールまたはヘテロアリール環の隣接する原子上の二つの置換基は、式 -T-C(O)-(CRR')q-U-の置換基と任意的に置換されてもよい(式中、TおよびUは、それぞれ独立して-NR-, -O-, -CRR'-または単結合であり、かつqは0〜3の整数である)。代わりに、アリールまたはヘテロアリール環の隣接する原子上の二つの置換基は、式-A-(CH2)r-B-の置換基と任意的に置換されていてもよい(式中、AおよびBは、それぞれ独立して-CRR'-, -O-, -NR-, -S-, -S(O)-, -S(O)2-, -S(0)2NR'-または単結合であり、かつrは1〜4の整数である)。このように形成された新しい環の単結合の一つは、任意的には二重結合で置換されてもよい。代わりに、アリールまたはヘテロアリール環の隣接する原子上の二つの置換基は、式-(CRR')S-X-(CR''R''')d-の置換基と任意的に置換されていてもよい(式中、sおよびdは、それぞれ独立して0〜3の整数であり、かつXは、-O-, -NR'-, -S-, -S(O)-, -S(O)2-, または-S(O)2NR'-である)。置換基R, R', R'' およびR'''は、好ましくは独立して水素、または置換されたもしくは置換されていない(C1-C6)アルキルから選択される。
【0037】
[0047] 本明細書中で使用される用語「ヘテロ原子」には、酸素(O)、窒素(N)、硫黄(S)および珪素(Si)が含まれることを意味する。
【0038】
[0048] 「核酸」とは、DNA、RNA、一本鎖、二本鎖、またはより高度に凝集したハイブリダイゼーションモチーフ、およびこれらの任意の化学的修飾体のいずれかを意味する。修飾体には、付加的荷電、分極率、水素結合、静電相互作用、および核酸リガンド塩基に対する官能性または核酸リガンド全体に対する官能性を与える他の化学基を有するものが含まれるがこれらに限定されない。このような修飾体には、ペプチド核酸、リン酸ジエステル基修飾体(例えばホスホロチオネート、メチルホスホン酸塩)、2'-位の糖修飾体、5-位のピリミジン修飾体、8-位のプリン修飾体、環外アミンでの修飾体、4-チオウリジンの置換体、5-ブロモまたは5-ヨウ素-ウラシルの置換体; 主鎖修飾体、メチル化、異常塩基対の組み合わせ(例えば、イソ塩基 イソシチジンおよびイソグアニジンおよびこれに類似するもの)が含まれるがこれらに限定されない。修飾体にはまた、キャッピングのような3'および5'修飾体が含まれ得る。
【0039】
[0049] 用語「薬学的に許容可能な塩」には、本明細書中に記載された化合物上に存在する特定の置換基による、比較的毒性のない酸または塩基で調製された活性化合物の塩が含まれることを意味する。本発明の化合物が酸性の官能基をを含む場合、塩基付加の塩は、中性形態の本発明の化合物と十分な量の所望の塩基とを接触させることによって得られ得る。薬学的に許容可能な塩基付加の塩の例には、ナトリウム、カリウム、カルシウム、アンモニウム、有機アミノ、またはマグネシウム塩、または類似の塩が含まれる。本発明の化合物が塩基性の官能基を含む場合、酸付加の塩は、中性形態の本発明の化合物と十分な量の所望の酸とを、生であるいは適切な不活性溶媒中で接触させることによって得られ得る。薬学的に許容可能な酸付加の塩には、塩化水素酸、臭化水素酸、硝酸、炭酸、一水素炭酸、リン酸、一水素リン酸、二水素リン酸、硫酸、一水素硫酸、ヨウ化水素酸、亜リン酸、およびこれらに類する酸のような無機酸、ならびに酢酸、プロピオン酸、イソブチル酸、マレイン酸、マロン酸、安息香酸、コハク酸、スベリン酸、フマル酸、乳酸、マンデル酸、フタル酸、ベンゼンスルホン酸、p-トリルスルホン酸、クエン酸、酒石酸、メタンスルホン酸、およびこれらに類する酸のような比較的毒性のない有機酸から誘導された塩が含まれる。さらに、アミノ酸の塩(例えば、アルギネートおよびこれに類する塩)および有機酸の塩(例えば、グルクロン酸、ガラクツロン酸およびこれらに類する塩)が含まれる(例えば、Berge et al., "Pharmaceutical Salts", Journal of Pharmaceutical Science, 1977,66, 1-19)。本発明の特定の化合物には、本発明の化合物を塩基付加の塩または酸付加の塩に転換できる塩基性および酸性の官能基の両方が含まれる。
【0040】
[0050] 中性形態の本発明の化合物は、好ましくは従来の手法において、前記塩を塩基または酸と接触させ、かつ親化合物を単離することによって再生される。親形態の化合物は、特定の物理的性質、例えば極性溶媒中における溶解度において様々な塩の形態とは異なる。
[0051] 塩の形態に加えて、本発明は、プロドラッグ形態にある化合物を提供する。本明細書中に記載された化合物のプロドラッグは、生理学的条件下での化学的変化を直ちに受け、本発明の化合物を提供する化合物である。さらに、プロドラッグは、生体外環境下における化学的または生化学的方法によって本発明の化合物に転換することができる。例えば、プロドラッグは、適切な酵素または化学試薬をもつ経皮性パッチリザーバ内に含まれるとき、本発明の化合物にゆるやかに転換され得る。
【0041】
[0052] 本発明の特定の化合物には、非溶解性の形態と、水和された形態を含む溶解性の形態が存在し得る。一般的には、溶解性の形態は非溶解性の形態と同等であり、本発明の範囲内に包含される。本発明の特定の化合物は、多層結晶またはアモルファス形態で存在し得る。一般的には、全ての物理的形態は、本発明によって考えられる用途について同等であり、本発明の範囲内に含まれる。
【0042】
[0053] 本発明の特定の化合物は、非対称性の炭素原子(光学中心)または二重結合を有し; ラセミ化合物、ジアステレオマー、幾何異性体および単一異性体は、本発明の範囲内に包含される。
【0043】
[0054] 本発明の化合物はまた、前記化合物を構成する一以上の原子に、アイソトープを通常とは異なる割合で含み得る。例えば、化合物は、放射活性同位元素、例えばトリチウム(3H)、ヨウ素-125(125I)または炭素-14(14C)で放射標識され得る。本発明の化合物の全てのアイソトープ変異体は、放射活性があろうとなかろうと、本発明の範囲内に包含される。
【0044】
II.癌を治療するのに有用な相乗的化合物
[0055] 一つの側面において、本発明は、癌を治療するのに有用な新規組成物を提供する。本発明の組成物には、抗新生物チオール結合性ミトコンドリアオキシダントと、抗新生物核酸結合性物質、抗新生物代謝拮抗物質塩基類似体、およびドセタキセルから選択された第二の抗新生物物質とが含まれる。驚くべきことに、抗新生物チオール結合性ミトコンドリアオキシダントと第二の抗新生物物質との組み合わせが、相乗的な治療学的細胞毒性効果を示すことが発見された。
【0045】
[0056] 本発明の組成物は、癌腫、肉腫、および他の形態の癌を含む広範な範囲の癌を治療するのに有用である。典型的な癌には、多発性骨髄腫、B-リンパ球プラズマ細胞腫、卵巣癌(例えば、発展的段階の卵巣上皮性細胞癌)、黒色腫(例えば、転移性黒色腫)、白血病(例えば、リンパ系白血病および非リンパ系起源白血病)、大腸癌(例えば、転移性大腸癌)、乳癌、肺癌(例えば、転移性肺癌)、および膵臓癌(例えば、膵臓の内分泌腺および外分泌腺の新生物)が含まれる。典型的な内性腫瘍膵臓疾患には、非機能性内分泌腫瘍、ソマトスタチン産生腫瘍、グルカゴン産生腫瘍、ビポーマ、ガストリン産生腫瘍、およびインシュリン産生腫瘍が含まれる。
【0046】
A.抗新生物チオール結合性ミトコンドリアオキシダント
[0057] 本発明の抗新生物チオール結合性ミトコンドリアオキシダントは、癌の増殖を阻害または防止する化合物であって、チオール含有分子上のチオール基に結合することができ、酸化的ストレスを促進し、かつ細胞性ミトコンドリア膜電位を乱す。抗新生物チオール結合性ミトコンドリアオキシダントは、他の細胞性小器官に対する変化がほとんど誘導されない間に、典型的にはミトコンドリア超微細構造(例えば隆起)の著しい変化を誘導する。ミトコンドリア超微細構造の変化は、典型的にはミトコンドリア生体分子、例えばミトコンドリアDNAに対する酸化的ストレスの誘導によって引き起こされる。ミトコンドリアDNAに対する酸化的ダメージおよびミトコンドリア形態の変化に加えて、抗新生物チオール結合性ミトコンドリアオキシダントは、ミトコンドリア膜電位の撹乱、シトクロムc解離の誘導、カスパーゼ3,8,および9の活性化、ならびにアポトーシスの誘導とともに、典型的には反応性酸素種(ROS)の増強を引き起こす。
【0047】
[0058] 幾つかの実施態様において、抗新生物チオール結合性ミトコンドリアオキシダントは、リボヌクレオチドレダクターゼ阻害剤を阻害または減少させる(抗新生物チオール結合性ミトコンドリアオキシダント欠乏中における活性と比較して)。他の実施態様において、抗新生物チオール結合性ミトコンドリアオキシダントは、DNAをアルキル化しない。他の実施態様において、抗新生物チオール結合性ミトコンドリアオキシダントは、リシンのε-アミノ基とは反応しない。
【0048】
[0059] 抗新生物チオール結合性ミトコンドリアオキシダントの特性を測定する技術は、以下の文献に詳細に議論および開示されている。Dvorakova et al., Neoplasia 97: 3544-3551 (2001), Dvorakova et al., Biochemical Pharmacology 60: 749-758 (2000), Dvorakova et al., Anti-Cancer Drugs 13: 1031-1042 (2002), Dvorakova et al., Molecular Cancer Therapeutics 1: 185-195 (2002), およびIyengar et al., J. Med. Chem. 47, 218-223 (2004).
[0060] 模範的実施態様において、抗新生物チオール結合性ミトコンドリアオキシダントには、アジリジン環(例えば、式(I)、(II)、および(III)の化合物)が含まれる。アジリジン環は、抗新生物チオール結合性ミトコンドリアオキシダントを、細胞性チオール(例えばグルタチオンSトランスフェラーゼ(GSH))および細胞性タンパク質内部のシステイン残基と結合させることができる。細胞性チオール、例えばシステインおよびGSHが枯渇した結果として、腫瘍細胞が酸化に対して高度に感受性になる。
【0049】
[0061] 模範的実施態様において、アジリジン環を有する抗新生物チオール結合性ミトコンドリアオキシダントは、以下の式で表わされた置換されたまたは置換されていないアジリジン-1-カルボキシアミドである。
【化1】

【0050】
[0062] 式(I)において、R1, R2, R3, R4およびR5は、それぞれ独立して、水素、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。R4およびR5は、任意的には置換されたまたは置換されていない5〜7員環を形成するために互いに結合している。
【0051】
[0063] 関連した実施態様において、R4は、シアノ、CO2R4A、またはCONR4BR4Cである。R4Aは、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないシクロアルキル、および置換されたまたは置換されていないアリールから選択される。R4Bは、水素、または置換されたまたは置換されていないアルキルである。R4Cは、水素、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロシクロアルキル、または置換されたまたは置換されていないアリールである。さらに関連した実施態様において、R4はシアノである。
【0052】
[0064] 他の関連した実施態様において、R1, R2およびR3は、それぞれ独立して、水素、置換されたまたは置換されていない(C1-C6)アルキル、置換されたまたは置換されていない2〜6員のヘテロアルキル、置換されたまたは置換されていない(C1-C6)シクロアルキル、置換されたまたは置換されていない5〜7員環のヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。R4は、シアノ、置換されていないカルボキシアミドまたは置換されていないカルボキシ酸エステルである。R5は、水素、または置換されたまたは置換されていない(C1-C4)アルキルである。R6は、置換されたまたは置換されていない(C1-C8)アルキル、置換されたまたは置換されていない5〜7員環のヘテロシクロアルキル、または置換されたまたは置換されていないアリールである。
【0053】
[0065] 他の関連した実施態様において、R4およびR5は、置換された5員環を形成するために互いに連結している。さらに関連した実施態様において、式(I)の化合物は、イメキソンである。模範的実施態様において、イメキソンが抗新生物チオール結合性ミトコンドリアオキシダントである場合、組成物中のイメキソンの濃度は少なくとも0.5μg/mlである。他の模範的実施態様において、組成物中のイメキソンの濃度は少なくとも1.0μg/mlである。他の模範的実施態様において、組成物中のイメキソンの濃度は1.0μg/ml〜500μg/mlである。
【0054】
[0066] 他の模範的実施態様において、抗新生物チオール結合性ミトコンドリアオキシダントは、置換されたまたは置換されていないアジリジン-1-カルボキシアミドおよび置換されたまたは置換されていない4-イミン-1,3-ジアゾビシクロ[3.1.0]-ヘキサン-2-オンから選択される。本発明において有用なアジリジン-1-カルボキシアミドおよびこれらの環式誘導体は、本出願と同じ譲受人に譲渡された米国特許第6,297,230号および米国特許第6,476,236号において詳細に議論されている(参照によってその全体が本明細書中に組み込まれる)。
【0055】
[0067] 有用な置換されたまたは置換されていない4-イミン-1,3-ジアゾビシクロ[3.1.0]-ヘキサン-2-オンが以下の式を有する。
【化2】

【0056】
[0068] 式(II)において、R1, R2およびR3は、それぞれ独立して水素、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。模範的な実施態様において、R1, R2およびR3は、それぞれ独立して水素、置換されたまたは置換されていない(C1-C6)アルキル、置換されたまたは置換されていない2〜6員のヘテロアルキル、置換されたまたは置換されていない(C1-C6)シクロアルキル、置換されたまたは置換されていない5〜7員のヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。
【0057】
[0069] 関連した実施態様において、R1, R2およびR3はそれぞれ独立して水素、および置換されたまたは置換されていない(C1-C6)アルキルから選択される。
【0058】
[0070] 他の関連した実施態様において、R1, R2およびR3は水素である。R1, R2およびR3が水素である場合、式Iの化合物がイメキソンになることを当業者は認識するであろう。従って、関連した実施態様において、抗新生物チオール結合性ミトコンドリアオキシダントはイメキソンである。
【0059】
[0071] 模範的な実施態様において、置換されたまたは置換されていないアジリジン-1-カルボキシアミドは、以下の式を有する:
【化3】

【0060】
[0072] 式(III)において、R1, R2およびR3はそれぞれ独立して水素、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。R4は、シアノ、CO2R4A、またはCONR4BR4Cである。R4Aは、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないシクロアルキル、および置換されたまたは置換されていないアリールから選択される。R4Bは、水素、または置換されたもしくは置換されていないアルキルである。R4Cは、水素、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロシクロアルキル、または置換されたまたは置換されていないアリールである。R5は、水素、または置換されたまたは置換されていないアルキルである。R6は、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロシクロアルキル、または置換されたまたは置換されていないアリールである。
【0061】
[0073] 関連した実施態様において、R4はシアノである。R4がシアノである場合、当該分子は置換されたまたは置換されていないシアノアジリジンになり得る。
【0062】
[0074] 模範的な実施態様において、R1, R2およびR3は、それぞれ独立して水素、置換されたまたは置換されていない(C1-C6)シクロアルキル、置換されたまたは置換されていない5〜7員環のヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。R4は、シアノ、置換されていないカルボキシアミドまたは置換されていないカルボキシ酸エステルである。R5は、水素、または置換されたまたは置換されていない(C1-C4)アルキルである。R6は、置換されたまたは置換されていない(C1-C8)アルキル、置換されたまたは置換されていない5〜7員環のヘテロシクロアルキル、または置換されたまたは置換されていないアリールである。
【0063】
[0075] 関連した実施態様において、R1, R2およびR3は、それぞれ独立して水素および置換されたまたは置換されていない(C1-C8)アルキルから選択される。R4はシアノおよびR5は水素である。
【0064】
B.抗新生物核酸結合性物質
[0076] 他の側面において、本発明は、抗新生物チオール結合性ミトコンドリアオキシダントおよび抗新生物核酸結合物質を含む薬学的組成物を提供する。驚くべきことに、抗新生物チオール結合性ミトコンドリアオキシダントおよび抗新生物核酸結合物質の組み合わせは、相乗的な治療学的細胞毒性効果を示す。
【0065】
[0077] 抗新生物核酸結合物質は、癌の増殖を阻害または防止し、かつ置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、または置換されたまたは置換されていないヘテロアリール基を、細胞核酸上の求核性部位に共有結合させる。典型的には、抗新生物核酸結合物質は、核酸の鎖の架橋結合、異常塩基対形成、脱プリン反応、アルキル化された核酸の除去修復、および/または核酸鎖の切断を引き起こす求電子性化学種である。従って、抗新生物核酸結合物質は、単官能性(一つの反応基)、二官能性(二つの反応基)または多官能性(三つ以上の反応基)であり得る。抗新生物核酸結合性物質は作用の特定のメカニズムによって制限されないけれども、N7、O6、およびグアニンの2アミノ窒素は、抗新生物核酸結合性物質に対する感受性が特に高い。
【0066】
[0078] ある化合物が細胞性核酸上の求核性部位に共有結合するか否かを決定する試験法は当業者に周知である。このような試験法のより詳細な議論は、例えばPrice et al., “Chemistry of Alkylation” in Ahtineoplastic and Immunosuppressive Agents, Part II, Ed by Sartorelli et al., Berlin, Springer-Verlag, 1975, pp.1-5 ; Johnson et al., Molec Pharmacol 3: 195(1967); and Kohn, et al., Cancer Res 37: 1450(1977) に詳細に説明されている。
【0067】
[0079] 模範的な実施形態において、抗新生物核酸結合性物質は、置換されたまたは置換されていないアルキル基、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、または置換されたまたは置換されていないヘテロアリール基を、核酸上の求核性部位に共有結合させる。さらなる実施態様において、核酸上の求核性部位は、N7、O6、および2-アミノ窒素グアニン窒素性塩基である。
【0068】
[0080] 他の模範的実施態様において、抗新生物核酸結合性物質は、抗新生物DNA結合性物質である。抗新生物DNA結合性物質は、置換されたまたは置換されていないアルキル基、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、または置換されたまたは置換されていないヘテロアリール基を、細胞性DNA上の求核性部位に結合させる。
【0069】
[0081] 例えば、抗新生物窒素マスタード、抗新生物アルキルスルホン酸塩、抗新生物ニトロソ尿素、抗新生物白金複合体、抗新生物イミダゾールカルボキサミド、アルトレタミンおよびこれらの誘導体、マイトマイシンCおよびこれらの誘導体、ベンゾキノン含有結合性物質、およびチオテパおよびこれらの誘導体を含む様々な抗新生物核酸結合性物質が、本発明において有用である。模範的な実施態様において、抗新生物核酸結合性物質は、抗新生物窒素マスタード、抗新生物イミダゾールカルボキサミド、および抗新生物白金複合体から選択される。他の模範的実施態様において、抗新生物核酸結合性物質は、メルファラン、シクロホスファミド、カルムスチン、メクロレタミン、チオテパ、クロランブシル、ロムスチン、イホスファミド、マイトマイシンC、シスプラチン、カルボプラチン、オキサリプラチンおよびダカルバジンから選択される。他の模範的実施態様において、抗新生物核酸結合性物質は、メルファラン、カルムスチン、メクロレタミン、チオテパ、クロランブシル、ロムスチン、イホスファミド、マイトマイシンC、シスプラチン、カルボプラチン、オキサリプラチンおよびダカルバジンから選択される。従って、ある実施態様において、抗新生物核酸結合性物質はシクロホスファミドではない。
【0070】
[0082] 本発明において有用な抗新生物窒素マスタードには、DNA、RNAおよび/またはポリペプチド分子上の反応基と共有結合する塩素化された脱離基を有する化合物が含まれる。模範的な実施態様において、窒素マスタードは、式:
(Cl2CH2)2N-R1 (IV)
を有する。
【0071】
[0083] 式(IV)において、R1は、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。関連した実施態様において、R1は、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロシクロアルキルから選択される。さらなる関連した実施態様において、R1は、置換されたまたは置換されていない(C1-C5)アルキル、置換されたまたは置換されていないフェニル、および置換されたまたは置換されていないシクロホスファミドから選択される。他の関連した実施態様において、R1は置換されたフェニルである。
【0072】
[0084] 他の模範的実施態様において、窒素マスタードは、メクロレタミン、メルファラン、シクロホスファミド、およびクロランブシルおよびこれらの誘導体から選択される。関連した実施態様において、窒素マスタードは、メルファランおよびシクロホスファミドから選択される。他の関連した実施態様において、窒素マスタードは、クロランブシルおよびメルファランから選択される。
【0073】
[0085] 他の模範的実施態様において、窒素マスタードは、シクロホスファミドではない。
【0074】
[0086] 本発明において有用な抗新生物白金複合体には、ストランド間またはストランド内の付加物および/または架橋細胞性巨大分子、例えばDNAを形成する化合物が含まれる。典型的には、白金複合体には、白金II(Pt2+)または白金IV化学種(Pt4+)が含まれる。
【0075】
[0087] 他の実施態様において、抗新生物白金複合体は、式:
【化4】

【0076】
を有する。
【0077】
[0088] 式(V)において、R1, R2, R3, およびR4は、それぞれ独立して水素、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。R1およびR2は、任意的には一緒に結合し、これらが結合する白金と環を形成する。R5は、ハロゲンおよびOR7から選択される。R6は、それぞれ独立してハロゲンおよびOR8から選択される。R7およびR8は、それぞれ独立して置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。R7およびR8は、任意的には一緒に結合し、これらが結合する原子と環を形成する。
【0078】
[0089] 他の模範的実施態様において、抗新生物白金複合体は、シスプラチン、カルボプラチン、オキサリプラチン、およびこれらの誘導体から選択される。他の模範的実施態様において、抗新生物白金複合体は、シスプラチン、カルボプラチン、およびオキサリプラチンから選択される。他の模範的実施態様において、抗新生物白金複合体は、シスプラチン、カルボプラチンから選択される。
【0079】
[0090] 模範的実施態様において、抗新生物イミダゾールカルボキサミドは、式:
【化5】

【0080】
を有する。
【0081】
[0091] 式(VI)において、R1, R2,およびR3は、それぞれ独立して水素、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。R1およびR2は、任意的には一緒に結合して環を形成する。
【0082】
[0092] 関連した実施態様において、R2は-N=N-N-R4である。R4は、環を形成するためにR1と結合する置換されたまたは置換されていない(C1-C5)アルキル、または置換されたまたは置換されていない(C1-C5)アルキレンである。さらなる関連した実施態様において、R3は水素である。
【0083】
[0093] 他の模範的実施態様において、抗新生物イミダゾールカルボキサミドは、テモゾルオミド、ダカルバジン、およびこれらの誘導体から選択される。他の模範的実施態様において、抗新生物イミダゾールカルボキサミドはダカルバジンである。
【0084】
[0094] 他の模範的実施態様において、抗新生物核酸結合性物質は、メルファラン、シクロホスファミド、カルムスチン、メクロレタミン、チオテパ、クロランブシル、ロムスチン、イホスファミド、マイトマイシンC、シスプラチン、カルボプラチン、オキサリプラチン、ダカルバジン、およびこれらの誘導体から選択される。他の模範的実施態様において、抗新生物核酸結合性物質は、メルファラン、シスプラチンおよびダカルバジンおよびこれらの誘導体から選択される。他の模範的実施態様において、抗新生物核酸結合性物質は、シクロホスファミドではない。
【0085】
[0095] 本発明の抗新生物アルキルスルホン酸塩には、典型的には少なくとも一つの電子欠乏性スルホン酸塩の基が含まれる。カルボニウムイオンは、DNAのアルキル化を誘導する抗新生物アルキルスルホン酸塩の全身的吸収の後に直ちに形成される。
【0086】
[0096] 模範的実施態様において、アルキルスルホン酸塩は、以下の構造を有する:
【化6】

【0087】
[0097] 式(VII)において、R1およびR3は、それぞれ独立して置換されたまたは置換されていないアルキルおよび置換されたまたは置換されていないヘテロアルキルから選択される。R2は、置換されたまたは置換されていないアルキレンおよび置換されたまたは置換されていないヘテロアルキレンから選択される。関連した実施態様において、R1およびR3は、置換されていないアルキルであり、R2は、置換されていないアルキレンである。さらなる関連した実施態様において、R1およびR3は、置換されていない(C1-C5)アルキルであり、R2は、置換されていない(C1-C5)アルキレンである。
【0088】
[0098] 他の実施態様において、アルキルスルホン酸塩は、ブスルファンまたはその誘導体である。関連した実施態様において、アルキルスルホン酸塩は、ブスルファンである。
【0089】
[0099] 他の模範的実施態様において、本発明のマイトマイシン誘導体は、以下の式を有する。
【化7】

【0090】
[0100] 式(VIII)において、Xは、=NR1, NHR2およびOR3から選択される。R1は、置換されたまたは置換されていないアルキルおよび置換されたまたは置換されていないヘテロアルキルから選択される。R2およびR3は、それぞれ独立して水素、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、および置換されたまたは置換されていないアリールから選択される。YはOR3である(R3は、水素および置換されたまたは置換されていないアルキルから選択される)。Zは、水素および置換されたまたは置換されていないアルキルから選択される。
【0091】
[0101] 関連した実施態様において、R1は、置換されたまたは置換されていない2〜5員のヘテロアルキルである。他の関連した実施態様において、R2は、水素、置換されたまたは置換されていない2〜5員のヘテロアルキルおよび置換されたまたは置換されていないアリールである。他の関連した実施態様において、Yは、-OCH3および-OHから選択される。他の関連した実施態様において、Zは水素および-CH3から選択される。
【0092】
[0102] 他の模範的実施態様において、マイトマイシン誘導体には、マイトマイシンA、マイトマイシンB、マイトマイシンC、ポルフィロマイシン、BMY-25282、BMS-181174、KW2149、およびM83が含まれる。
【0093】
[0103] 他の模範的実施態様において、ベンゾキノン含有結合性物質は、式:
【化8】

【0094】
を有する。
【0095】
[0104] 式(IX)において、R1は、NHR3、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、および置換されたまたは置換されていないヘテロシクロアルキルから選択される。R2は、水素、NHR4、置換されたまたは置換されていないアルキル、および置換されたまたは置換されていないヘテロアルキルから選択される。R3およびR4は、それぞれ独立して置換されたまたは置換されていないアルキルおよび置換されたまたは置換されていないヘテロアルキルから選択される。
【0096】
[0105] 関連した実施態様において、R1は、メチル、アズリジニル(azridinyl)、およびNHR3から選択される(式中、R3は、置換されたまたは置換されていないC1-C5アルキルである)。さらなる関連した実施態様において、R3は、CO2CH2CH3またはCH2CH20Hである。
【0097】
[0106] 他の模範的実施態様において、本発明のニトロソ尿素には、ビス-クロロエチルニトロソ尿素(BCNU)、N-(2-クロロエチル)-N'-(4-シクロヘキシル)-N-ニトロソ尿素(CCNU)、N-(2-クロロエチル)-N'-(4-シクロヘキシル)-N-ニトロソ尿素(メチル-CCNU)、およびこれらの誘導体が含まれる。他の模範的実施態様において、ニトロソ尿素は、式:
【化9】

【0098】
を有する。
【0099】
[0107] 式(X)において、R1は、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。関連した実施態様において、R1は、置換されたまたは置換されていないアルキル、および置換されたまたは置換されていないシクロアルキルから選択される。
【0100】
C.抗新生物代謝拮抗物質塩基類似体
[0108] 他の側面において、本発明は、抗新生物チオール結合性ミトコンドリアオキシダントおよび抗新生物代謝拮抗物質塩基類似体を含む薬学的組成物を提供する。驚くべきことに、抗新生物チオール結合性ミトコンドリアオキシダントおよび抗新生物代謝拮抗物質塩基類似体の組み合わせが、相乗的な治療学的細胞毒性効果を示すことを発見した。
【0101】
[0109] 抗新生物代謝拮抗物質塩基類似体は、癌の増殖を阻害および抑制し、かつ細胞核酸合成酵素を阻害することによって細胞核酸合成を乱す。細胞核酸合成酵素の阻害は、典型的には天然のヌクレオシド、ヌクレオチドおよび/または窒素性塩基(すなわち、アデニン、グアニン、ウラシル、シトシン、またはチミン)の構造を模倣することによって達成される。従って、本発明の抗新生物代謝拮抗物質塩基類似体には、アデニン、グアニン、ウラシル、シトシン、またはチミンヌクレオチド、ヌクレオシドおよび/または窒素性塩基の類似体が含まれる。
【0102】
[0110]細胞核酸酵素を阻害するか否かを決定するためのアッセイは当業者にとって周知である。このようなアッセイのより詳細な議論は、例えばHitchings et al., ”Mechanisms of action of purine and pyrimidine analogs" in Cancer Chemotherapy, Basic and Clinical Applications, ed. by Brodsky, et al, New York, Grune and Stratton, 1967, pp: 26-36; Santi, et al., Biochemistry 13: 471 (1974); Waqar et al., Biochem. Journal, 121: 803 (1971); およびHuang et al., Cancer Res 51 : 6110-6117, (1991) に詳細に記載されている。
【0103】
[0111] 模範的実施態様において、抗新生物代謝拮抗物質塩基類似体は、以下の式を有する:
【化10】

【0104】
[0112] 式(XI)において、R1は、水素、置換されたリボースおよび置換されたデオキシリボースから選択される。R2は、水素、ハロゲン、-SH、-NH2、-OH、=O、および-SR4から選択される。R4は、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。R3は、水素、ハロゲン、-SH、-NH2、および-OHから選択される。破線aは、単結合または二重結合である。Xは、=N-または-NH-から選択される。aが二重結合およびmが0である場合、Xは=N-であり、mが1の場合、Xは-NH-である。記号mは0または1の整数である。R2が=Oまたはmが1の場合、破線aは単結合である。
【0105】
[0113] 関連した実施態様において、R2は、-NH2, -OH, -SHおよび-SR4から選択される。
【0106】
[0114] 他の関連した実施態様において、R4は、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。他の関連した実施態様において、R4は、置換されたまたは置換されていないヘテロシクロアルキルおよび置換されたまたは置換されていないヘテロアリールから選択される。
【0107】
[0115] 他の関連した実施態様において、R3は、水素、F、Cl、および-NH2から選択される。
【0108】
[0116] 他の関連した実施態様において、R1は、置換されたリボースおよび置換されたデオキシリボースから選択される。置換されたリボースおよび置換されたデオキシリボースは、細胞のDNAまたはRNAに見出されるリボースおよびデオキシリボース環と同一であってもよい。代わりに、置換されたリボースおよび置換されたデオキシリボースは、細胞のDNAまたはRNAに見出されるリボースおよびデオキシリボース環の類似体であってもよい。例えば、リボースの2’Cに結合したヒドロキシル基は、α-OHまたはβ-OHであってもよい。5’Cは、ヒドロキシル基、リン酸エステル基、リン酸ジエステル基、リン酸トリエステル基、またはこれらのリン酸エステル誘導体(例えば、リン酸チオエステル)と結合してもよい。
【0109】
[0117] 他の関連した実施態様において、mは0である。
【0110】
[0118] 従って、他の模範的実施態様において、抗新生物代謝拮抗物質塩基類似体は、以下の式を有する。
【化11】

【0111】
[0119] 式(XII)において、RおよびR3は、上述した式(XI)において定義した通りである。R6, R7, R8,およびR9は、それぞれ独立して水素、ハロゲン、-OH、およびOR10から選択される。R10は、置換されたまたは置換されていないアルキル、および置換されたまたは置換されていないヘテロアルキルから選択される。R5は、置換されたまたは置換されていないアルキルおよび-P(X1)O2-R11から選択される。R11は、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロシクロアルキル、-P(X1)O2および-P(X2)O-P(X1)O2から選択される。X1、X2、X3は、それぞれ独立してOおよびSから選択される。破線aは、単結合または二重結合である。R2が=Oである場合、破線aは単結合である。Xは=N-または-NH-から選択され、aが二重結合である場合、Xは=N-であり、aが単結合である場合、Xは-NH-である。
【0112】
[0120] 関連した実施態様において、R6, R7, R8,およびR9は、それぞれ独立して水素、F、-OH、およびOR10から選択される。
【0113】
[0121] 他の関連した実施態様において、抗新生物代謝拮抗物質塩基類似体は、以下の式を有する:
【化12】

【0114】
[0122] 式(XIII)において、R1は、水素、置換されたリボースおよび置換されたデオキシリボースから選択される。R2は、水素、ハロゲン、および置換されたまたは置換されていないアルキルから選択される。R3は、水素、=O, NH2, NH2・HCl、および置換されたまたは置換されていないアルキルから選択される。破線aは、単結合または二重結合である。R3が=Oである場合、破線aは単結合である。Xは=N-および-NH-から選択され、aが二重結合である場合、Xは=N-であり、aが単結合である場合、Xは-NH-である。
【0115】
[0123] 関連した実施態様において、R2は、水素、F、および置換されたまたは置換されていない(C1-C5)アルキルから選択される。他の関連した実施態様において、R2は、水素、F、および置換されていない(C1-C5)アルキルから選択される。
【0116】
[0124] 他の関連した実施態様において、R1は、置換されたリボースおよび置換されたデオキシリボースから選択される。置換されたリボースおよび置換されたデオキシリボースは、細胞のDNAまたはRNAに見出されるリボースおよびデオキシリボース環と同一であってもよい。代わりに、置換されたリボースおよび置換されたデオキシリボースは、細胞のDNAまたはRNAに見出されるリボースおよびデオキシリボース環の類似体であってもよい。例えば、リボースの2’Cに結合したヒドロキシル基は、α-OHまたはβ-OHであってもよい。5’Cは、ヒドロキシル基、リン酸エステル基、リン酸ジエステル基、リン酸トリエステル基、またはこれらのリン酸エステル誘導体(例えば、リン酸チオエステル)と結合してもよい。
【0117】
[0125] 従って、他の模範的な実施態様において、抗新生物代謝拮抗物質塩基類似体は、以下の式を有する:
【化13】

【0118】
[0126] 式(XIV)において、R2、R3、Xおよびaは、式(XIII)において上記に定義した通りである。R5, R6, R7, R8,およびR9は、式(XII)において上記に定義した通りである。
【0119】
[0127] 他の模範的な実施態様において、抗新生物代謝拮抗物質塩基類似体は、メルカプトプリン、チオグアニン、アザチオプリン、フルダラビン、クラドリビン、ペントスタチン、フルオロウラシル、シタラビン、カペシタビン、ゲムシタビン、フロクスウリジン、およびこれらの誘導体から選択される。他の模範的な実施態様において、抗新生物代謝拮抗物質塩基類似体は、メルカプトプリン、チオグアニン、アザチオプリン、フルダラビン、クラドリビン、ペントスタチン、フルオロウラシル、シタラビン、カペシタビン、ゲムシタビン、およびフロクスウリジンから選択される。他の模範的な実施態様において、抗新生物代謝拮抗物質塩基類似体は、5-フルオロウラシル、シタラビン、およびゲムシタビンから選択される。
【0120】
D.ドセタキセル
[0128] 他の側面において、本発明は、抗新生物チオール結合性ミトコンドリアオキシダントおよびドセタキセル(またはその商業的名称、Taxotere(登録商標)で言及)を含む薬学的組成物を提供する。驚くべきことに、抗新生物チオール結合性ミトコンドリアオキシダントおよびドセタキセルの組み合わせは、相乗的な治療学的細胞毒性効果を示す。
【0121】
III.抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質の組み合わせについての相乗的な抗癌活性を試験するアッセイ
[0129] 他の側面において、本発明は、抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質の組み合わせが、相乗的な治療学的細胞毒性効果を有するか否かについて決定するアッセイを提供する。上記に定義されたように、「相乗的な治療学的細胞毒性効果」とは、少なくとも2つの化合物の組み合わせが、細胞毒性試験において相乗効果を示すことを意味する。
【0122】
[0130] 模範的実施態様において、相乗効果は、50パーセント有効原理を使用して評価される(Chou, etal., Adv Enzyme Regul 22 : 27-55 (1984) )。当該方法は、ミカエリスメンテンの速度式に基づいており、薬物の組み合わせの効果を数値的な指標、すなわち組み合わせ指数(C.I.)に変換する。組み合わせ指数が1未満である場合は、相乗効果ありと認められる。組み合わせ指数が1である場合は、単純な総和である。組み合わせ指数が1を超える場合は、拮抗作用が認められる。当業者は、C.I.値の範囲を超える組み合わせ効果を観察することもあるであろう。従って、薬物濃度範囲の少なくとも過半数において一貫性のある組み合わせのみが、相乗的薬剤、付加的薬剤、または拮抗的薬剤として分類される。
【0123】
[0131] 模範的な実施態様において、抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質の組み合わせ指数は、1.0未満である。他の模範的実施態様において、抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質の組み合わせ指数は、少なくとも0.9未満である。他の模範的実施態様において、抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質の組み合わせ指数は、少なくとも0.8未満である。他の模範的実施態様において、抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質の組み合わせ指数は、少なくとも0.7未満である。他の模範的実施態様において、抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質の組み合わせ指数は、少なくとも0.6未満である。
【0124】
[0132] 多数の生物学的アッセイは、最適な抗腫瘍活性についての化合物の特定の組み合わせの選択を評価および最適化するために利用可能である。腫瘍細胞に対する薬剤のインビトロでの浸漬、およびげっ歯類モデル、時には大型動物モデルにおけるインビボ抗腫瘍アッセイを含むこれらのアッセイは、おおよそ二つのグループに分けることができる。腫瘍細胞を用いたインビトロアッセイおよび動物モデルにおけるインビボアッセイの両方は、以下に議論される。そしてこれらのアッセイは、チオール結合性ミトコンドリアオキシダント、核酸結合性物質、または代謝拮抗物質塩基類似体が、抗新生物特性を示すか否かを決定するために等しく適用可能である。
【0125】
[0133] 抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質の組み合わせについてのインビトロでの細胞毒性アッセイは、動物、特にヒト起源の確立された腫瘍細胞株を使用するのが一般的である。これらの細胞株は、商業的な供給源、例えば、メリーランド州ベテスダにあるアメリカン タイプ ティシュー カルチャー ラボラトリー、および複数の研究所の腫瘍バンクから入手可能である。本発明の組み合わせ薬剤に対する浸漬は、温度、酸素および実験室で利用可能な栄養素について生理学的条件をシミュレートしながら行われ得る。これらのインビトロアッセイでは、例えば、1)コロニーの形成; 2)経時的な細胞分裂の単純な定量化; 3)無傷の細胞膜をもつ細胞では排除されるいわゆる「生」色素の取り込み; 4)増殖性(生存可能な)細胞への放射標識された栄養素の取り込みによって判断を行う。コロニー形成アッセイでは、確立された細胞株と、癌患者から外科的に取り出された新鮮な腫瘍生検の両方が使用される。このタイプのアッセイにおいて、細胞は典型的にはぺトリ皿の軟質ゲル上で増殖し、および細胞(>60μの大きさ)のコロニー数またはグループ数は、視覚的または自動化された画像分析系のいずれかでカウントされる。比較は、同一の条件のもとでコロニーを発達させることができる未処理のコントロール細胞と行われる。なぜなら、コロニーの形成は癌表現型の特徴の一つであり、悪性腫瘍細胞のみが固体マトリックスに付着せずにコロニーを形成するからである。従って、これは本発明のスクリーニング手順の組み合わせとして使用され得る。コロニー形成アッセイで得られた結果が同じ薬物での臨床試験の結果と一致することを示す多数の刊行物が存在する。
【0126】
[0134] 細胞の総数を数え上げる手法は、細胞株または新鮮な腫瘍生検のインビトロ試験で最も単純な手法である。このアッセイでは、細胞の凝集塊を典型的には脱凝集して単一の単位にする。これは、細胞の数を、顕微鏡用格子で目視で数えるかまたは自動化されたフローシステム(例えばフローサイトメトリーまたはCoulter(登録商標)カウンター)を使用して数えるためである。そして、コントロール(未処理)の細胞増殖率を、処理された(抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質の組み合わせ)細胞増殖率と比較する。また、生色素染色は、抗腫瘍アッセイの古くからあるホールマークの一つである。このタイプの手法において、細胞(未処理または抗癌剤で処理された細胞)は、無傷の(生存している)細胞を除いて色素(例えばメチレンブルー)にさらされる。色素で染色された細胞(死細胞または瀕死の細胞)の数を「分子」に、色素で染色されなかった細胞の数を「分母」にとる。これらは骨の折れるアッセイであり、要する時間および終点の相対的に非特異的な性質が原因で、現在ではあまり使用されていない。
【0127】
[0135] 生色素染色に加えて、放射標識された栄養素および/またはヌクレオチドの組み込みを利用して生存度を調べることができる。これは、火星で生命を探索するためにバイキング着陸船において使用された試験方法であり、生命活動の証拠として放射活性物質がどのくらいサンプル内に取り込まれるかということを生命活動の証拠とする。腫瘍細胞アッセイにおいて、典型的な実験では、(3H)トリチウムまたは14Cでラベルされたヌクレオチド(例えばチミジン)の取り込みが行われる。コントロール(未処理)の細胞では、単位時間当たりDNA成分がある量だけ取り込まれる。この取り込み速度を、薬物で処理された細胞における取り込み速度と比較する。これは、迅速かつ簡易な定量可能なアッセイであり、大きな(カウント可能な)コロニーを形成しない細胞で大変大きな利点を有する。但し、取り扱いや処分に不安の残る放射性同位元素を使用するという欠点もある。
【0128】
[0136] これらのタイプの試験に利用可能なヒトおよびげっ歯類腫瘍細胞株の大きな細胞バンクが存在する。国立癌研究所が行った最新の試験系では、60を超える確立された感受性かつ多剤耐性の多様な細胞サブタイプをもつヒト細胞株の細胞バンクを使用している。ここには、新規薬剤を試験するための、典型的には5〜6の確立されたおよび十分に特徴付けられた特定のサブタイプのヒト腫瘍細胞(例えば、肺癌の非小細胞または小細胞)が含まれる。Compare(登録商標)と呼ばれるグラフィック分析系を使用して、色素(スルホロダミンBまたはMTTテトラゾリウム色素)の取り込みに関する全体的感受性を役立たせる。この手法の特異的な終着点は、ヒト癌の一つの組織学的サブタイプにおいて独自の活性をもつ組み合わせを同定することである。さらに、複数の物質に対する抵抗性を示し、かつ幾つかの場合において多剤耐性ポンプ、p-糖タンパク質を発現することが知られているヒト癌の少数の亜系統が存在する。これらの耐性細胞を使用するアッセイは、NCIラボラトリーおよび全ての許認可された大学の研究室または個人的研究所からの化合物のスクリーニングについて現在進行中である。NCIアッセイの終了点は、スルホローダミンBと呼ばれるタンパク質色素の取り込み(付着腫瘍細胞について)であり、活性ミトコンドリア酵素におけるテトラゾリウム(青色)色素の還元である(非付着性、自由に浮遊するタイプの細胞について)。この後者の方法は、骨髄腫、白血病およびリンパ腫を含む血液学的な癌について特に有用である。
【0129】
[0137] 一般的には、ある薬物の組み合わせが、インビトロで腫瘍細胞の増殖(例えば、コロニーの形成または色素の取り込み)を阻害するある程度の活性を発揮したとき、抗腫瘍効果の実験がインビボで行われる。げっ歯類は、腫瘍増殖率および生存限界点が明確であり、かつこれらの動物は一般的にはヒトと同じタイプの毒性および薬物代謝パターンを示すので、抗腫瘍活性の最初のアッセイにもっぱら使用される。ここで、同系(同じ遺伝子系)の腫瘍は、典型的には脱凝集したカウント可能なドナー動物の組織片から収集され、その後に同系(同株)の宿主マウスに注入して戻した。ある程度の時間が経過した後、抗癌剤の組み合わせを腹腔内または静脈内に注入するかまたは経口投与する。腫瘍の増殖率および/または生存率を決定し、未処理の対照群、または抗新生物チオール結合性ミトコンドリアオキシダントもしくは第二の抗新生物物質のみを有する対照群と比較した。これらのアッセイにおいて、増殖率は、典型的には動物の側腹部前方において増殖する注入された腫瘍について測定を行う。腫瘍の垂直方向の直径は、腫瘍全体の質量または体積の予測値に変換される。予め定めた質量に到達するまでの時間を、未処理の対照群の動物において腫瘍増殖に必要とした時間と比較する。ある実施態様において、処理動物において所定の質量に到達するまでの時間が対照群と比較して>25%も増加した。他の実施態様において、処理動物において所定の質量に到達するまでの時間が対照群と比較して>42%も増加した。この著しい効果は、腫瘍増殖抑制効果とみなすことができる。非局在性の腫瘍、例えば白血病にとって、生存率は終了点として使用され得、処理動物と未処理動物(または溶媒処理対照群)との間で比較を行う。一般的には、陽性の新規物質による寿命の著しい増加もやはり>20〜42%に達する。早期の死は、任意の未処理の対照群が新規化合物について毒性を示す前に起こる。
【0130】
[0138] 全てのこれらのアッセイについて、抗癌剤の組み合わせについての試験は、致死量に非常に近い投与量および10%(LD10)および/または所定の許容限界値の投与量(著しい毒性を示すが同じ系統の動物において致死量には至らない量)で、同じ投与経路および同じ投与スケジュールで行われる。同じような研究がまた、ラット腫瘍モデルにおいて行われ得る。但し、ラットはマウスと比べて大型の動物で取り扱いが困難なので、マウスモデルほど好ましいとはいえない。
【0131】
[0139] ごく最近、ヒトの腫瘍が、種々の免疫欠損マウスモデルに移植された。ここで、nu/nuまたは「ヌード」マウスと呼ばれるマウスを使用してヒト腫瘍の増殖についてインビボアッセイが行われた。体毛がなく機能的な胸腺を欠くヌードマウスにおいて、ヒトの腫瘍(何百万の細胞)は、典型的には側腹部に注入され、その後ゆっくりと腫瘍の増殖が起こる。腫瘍塊の視認可能な発達は、「生着」と呼ばれる。抗癌剤は、その後幾つかの経路(IV, IM, SQ, PO)で腫瘍移植部位の末端に注入され、増殖率は、腫瘍の最も幅広の部分の垂直方向の測定によって計算される。多数のヒト腫瘍は、ヌードマウスモデルにおいてうまく「生着」することが知られている。但し、これらの動物は免疫不全が原因で介入性の感染症にかかり易い。代わりのマウスモデルには、重症複合型免疫不全症(SCID)(リンパ球の成熟が妨げられる)のマウスが含まれる。このため、SCIDマウスは、機能的なBおよびTリンパ球を産生しない。しかしながら、これらの動物は正常な細胞障害性T細胞の活性を有する。それにも関わらず、SCIDマウスは多数のヒト腫瘍を「生着」させる。SCID表現型の動物を、SCID表現型が維持されているならば最小量から検出不可能な微小量になるはずの血清中の免疫グロブリンの産生量を測定することによって「漏れ」についてスクリーニングする。一般的には上述したような腫瘍の測定および薬物の投与を行う。SCIDマウスの使用は、多くの場合においてヌードマウスの置き換えである。SCIDマウスは、より多くのヒト腫瘍を生着させる能力を有すると考えられ、かつ介入性の感染症に対する感受性が欠損している点でより丈夫であると考えられるからである。
【0132】
[0140] 薬剤耐性についての試験には、任意のインビトロおよびインビボモードが含まれ得る(但し、インビトロモードの方がより特徴づけられる)。これらの試験において、細胞の亜系統は、一般的にはインビトロまたは稀にインビボで抗癌剤の組み合わせの濃度を増加させながら連続的にさらすことによって特定の薬剤に対する耐性が強まる。いったん特定の薬剤に対する高度の耐性を獲得したら(一般的には>4〜5倍)、その細胞株の耐性のメカニズム(例えば、p-糖タンパク質または他のもののような多剤耐性膜ポンプの発現)についての研究をさらに進める。その後、特定の細胞株の反応パターンを発達させる従来の抗癌剤との交差耐性について試験が行われ得る。この細胞株を使用して、その後、その耐性細胞において潜在的な活性を有する新規薬剤について調べる。薬剤耐性のメカニズムの実証と、現存する化学療法剤に対する耐性を示すヒトの癌において効用を示す可能性のある薬剤の同定が可能である。つい最近、耐性のあるヒト腫瘍細胞の使用は、インビボモデルの多剤耐性ヒト多発性骨髄腫の発達を伴うSCIDマウスモデルにまで及んでいる。
【0133】
[0141] これらの試験系の全ては、抗癌剤の組み合わせの抗腫瘍活性を特徴づけるために、一般的にはインビトロからインビボへと移行する連続的な順番において組み合わされる。一般的には、どの腫瘍タイプが特定の組み合わせ薬剤に対して特に感受性が強いのか、逆に、どの腫瘍タイプがインビトロにおいて特定の組み合わせ薬剤に対する本質的な耐性を有するのかを見出すことが望まれる。この情報を使用して、実験がげっ歯類モデルにおいて計画され、インビトロでの活性を示す組み合わせが許容されるか否か、および動物内で活性を示すか否かについて評価を行う。動物における最初の実験には、一般的には毒性試験が含まれ、許容可能な投与計画を決定し、その後にその投与計画を使用して上述した抗腫瘍効果を評価する。これらの二つのタイプのアッセイで活性を示す薬剤の組み合わせについて、SCIDまたはヌードマウス内で増殖するヒト腫瘍における試験を行う。ここで活性が確認される場合、これらの薬剤の組み合わせは、潜在的な臨床薬剤の開発の候補になる。
【0134】
IV.抗新生物チオール結合性ミトコンドリアオキシダントの特徴を測定するためのアッセイ
[0142] 上述したように、本発明の抗新生物チオール結合性ミトコンドリアオキシダントは、癌の増殖を阻害または防止する化合物であり、チオール基と結合することができ、酸化ストレスおよびミトコンドリアの細胞膜電位の乱れを促進する。ある実施形態において、抗新生物チオール結合性ミトコンドリアオキシダントは、リボヌクレオチドレダクターゼ阻害剤の活性を阻害または減少させる。ある化合物が抗腫瘍活性を示すか否かを決定するのに有用な細胞毒性試験については、上述したとおりである(抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質の組み合わせの抗癌剤の相乗的な活性について試験するためのアッセイを参照)。他の特徴を測定するためのアッセイについては以下に記載する。
【0135】
A.チオール結合アッセイ
[0143] チオール含有分子に結合する試験化合物の能力は、水溶液中の前記試験化合物をチオール含有分子(例えば、システインまたはグルタチオン)と混合することによって評価され得る。前記溶液をチオール基と試験化合物とが結合して反応産物を形成するのに十分な時間にわたってインキュベートする。十分な時間をかけて混合物をインキュベーションした後、任意の適切な分離方法 (例えば、 薄層クロマトグラフィー(TLC))を前記溶液上で行い反応産物を単離する。反応産物を単離した後、該反応産物を任意的にはさらに精製する(例えば、ろ過)。そして、任意の適切な技術、例えば核磁気共鳴法または質量分析法を使用して検出を行う。
【0136】
[0144] 適切な反応時間、反応溶媒、および溶出溶媒の選択は、化学および生化学分野の当業者にとって周知である。チオール結合性アッセイのさらなる詳細な議論は、Iyengar et al., J. Med. Chem. 47: 218-223 (2004)に与えられる。
【0137】
B.酸化ストレスおよびミトコンドリア膜電位のアッセイ
[0145] 酸化ストレスの存在は、酸化されたヌクレオチドと結合することができる抗体(例えば、十分に特徴づけられたモノクローナル抗体8-OHdG)を使用して評価され得る。適切な細胞株、例えばミエローマ細胞は、様々な時間地点において試験化合物で処理され得る。次に、細胞はホルムアルデヒドで固定され得、続いてメタノールで透過化処理される。次に、細胞を適切な抗酸化ヌクレオチド抗体で免疫処理し、任意の適切な検出技術、例えば第二抗体系(例えばビオチン化された第二抗体と、続くCy5-共役ストレプトアビジンの添加)を使用して視覚化する。核の局在性は、適切な核染色、例えばYOYO-1(登録商標)染色(Molecular Probes)を使用して達成され得る。共焦点レーザー顕微鏡を使用してミトコンドリア細胞区画内の酸化ダメージを視覚化する。
【0138】
[0146] ミトコンドリア膜電位(MMP)の喪失は、ダメージのないミトコンドリア内への陽イオン荷電色素の取り込みと保持に基づいたフローサイトメトリーによって測定され得る。有用な色素の例には、CMX-Ros として知られたMitoTracker Red(登録商標)、およびJC-1 (共にMolecular Probes, Eugene ORから利用可能)が含まれる。色素は、原形質膜を通して消極的に拡散し、負に帯電した内膜環境を保持する損傷のない膜をもつミトコンドリア内に取り込まれて優先的に染色を行う。MMPが低下するとき、色素のシグナル強度は、対照細胞群におけるダメージのないミトコンドリアと比較して減少する。JC-1試薬は、MMPが喪失してミトコンドリア内膜が消極したときに、赤色から緑色までの蛍光発光シフトを受ける。MMPアッセイのより詳細な議論については、Decaudin et al., Cytometry 25: 333-340 (1996);およびManzini et al., J Cell Biol 138: 449-469(1997)を参照されたい。
【0139】
[0147] 酸化ストレスおよびミトコンドリア膜電位を測定するアッセイのさらなる詳細は、Dvorakova et al., Neoplasia 97: 3544-3551 (2001), Dvorakova et al., Biochemical Pharmacology 60: 749-758 (2000), Dvorakova etal., Anti-Cancer Drugs 13: 1031-1042 (2002),およびDvorakova et al., Molecular Cancer Therapeutics 1: 185-195 (2002)に見出すことができる。
【0140】
C.リボヌクレオチドレダクターゼ活性アッセイ
[0148] リボヌクレオチドレダクターゼ(RNR)活性は、先ず最初に細胞培養物を適切な試験化合物と接触させることによって測定され得る。次に、細胞を収集し、細胞溶解物を適切な技術によって精製して、デオキシシチジン(RNR活性の特定の産物)およびリン酸化後のシチジンを分離する(例えば、Affigel 601カラムまたは高分離能のHPLC C-18カラム)。デオキシシチジン産物の量を測定し、試験化合物を添加していない細胞によって生成された産物の量と比較する。その結果、RNR活性を阻害または低下させる試験化合物の能力を決定する。
【0141】
[0149] 代わりにの方法において、デオキシリボヌクレトチド(RNR 活性の産物)が、DNAポリメラーゼ反応とのカップリングを介して検出される。内因性RNAを分解するRNAseを使用すると検出感度が高くなる。
【0142】
[0150] RNR活性アッセイのより詳細な議論については、Wright et al., Adv Enzyme Regul 19: 105-127 (1981); およびJong et al., J Biomed Sci 5: 62-68(1998)を参照されたい。
【0143】
V.投与
[0151] 本発明の薬学的組成物は、体内でより容易に分散および溶解されるように微細化または粉末化され得る。薬物を粉砕または微粉砕する方法は、当業者に周知の方法、例えばハンマー・ミルまたは類似の製粉装置を使用する。
【0144】
[0152] 内部投与に適した投与形態(組成物)には、単位当たり約1.0ミリグラム〜約5000ミリグラムの活性成分が含まれる。これらの薬学的組成物において、活性成分は、組成物の総重量に基づいて約0.5〜約95重量%の量で存在してもよい。投与形態を示す他の表記には、体表面積(BSA)の平方メートル当たりのmg(mg/m2)がある。典型的には、大人は約1.75m2のBSAを有する。患者の体重に基づいて、投与は、一日または一週間当たり一以上の投与が数回行われる。薬学的に効果的な量を達成するために、複数の投与単位が必要となり得る。例えば、投与形態が1000mgであり、かつ患者の体重が40kgである場合、一つの錠剤またはカプセル錠は患者の体重1kg当たり25mgの投与を与える。患者の体重が80kgである場合は12.5mg/kgの投与を与える。
【0145】
[0153] 一般的な手引きとして、ヒトについては、体重1キログラム(kg)当たり約1ミリグラム(mg)〜体重1 kg当たり約10000 mgが、薬学的に効果的な投与量として適切である。好ましくは、約5 mg/kg 〜約2500 mg/kg体重が使用される。他の好ましい投与量範囲は、25 mg/kg〜約1000 mg/kg体重である。しかしながら、体重1キログラム(kg)当たり約2ミリグラム(mg)〜体重1kg当たり約400 mgの投与量が、幾つかの癌を治療するのに適している。
【0146】
[0154] 静脈注入では、投与の最も好ましい速度は、定速注入中において約1〜約1000 mg/kg/分の範囲とすることができる。本発明の薬学的組成物は、一日一回で投与され得、あるいは一日の投与量の合計を二回、三回、または四回に分けて投与してもよい。抗新生物チオール結合性ミトコンドリアオキシダントは、一般的には一日一回以上の投与回数から一週間当たり1回〜3回の投与回数で与えられる。
【0147】
[0155] 本発明の薬学的組成物は、利用可能な全ての従来の方法によって投与される。特に、本発明の薬学的組成物は、個々の治療学的薬剤として、あるいは他の治療学的薬剤との組み合わせにおいて、医薬との組み合わせにおける使用についての利用可能な全ての従来の方法によって投与される。
【0148】
[0156] 癌治療における抗新生物チオール結合性ミトコンドリアオキシダントと第二の抗新生物物質の投与量および同定は、それぞれ患者の反応および生理機能、副作用の型および重症度、疾患の治療経過、好ましい投与計画、患者の予後または他の因子に基づいて変化し得る。
【0149】
[0157] 抗新生物チオール結合性ミトコンドリアオキシダントと第二の抗新生物物質の割合は、所望の治療学的効果、観察される副作用、または医療従事者に周知の考慮すべき事項に基づいて、必要に応じて変化させ得る。一般的には、抗新生物チオール結合性ミトコンドリアオキシダント対第二の抗新生物物質の割合は、重量ベースで約0.5% : 99.5%〜約99.5% : 0.5%の範囲とすることができる。模範的な実施態様において、その割合は、約20% : 80%〜約80% : 20%の範囲にある。他の模範的実施態様において、その割合は、約40% : 60%〜約60% : 40%の範囲にある。他の模範的実施態様において、その割合は、約45% : 55%〜約55% : 45%の範囲にある。他の模範的実施態様において、その割合は、約50% : 50%である。
[0158] 第二の抗新生物物質の前または後に抗新生物チオール結合性ミトコンドリアオキシダントが投与されるとき、抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質の各投与量および投与計画は変化し得る。補助的または組み合わせ療法は逐次的とすることができる。すなわち、抗新生物チオール結合性ミトコンドリアオキシダントで治療した後、第二の抗新生物物質で治療を行う(あるいはその逆)。また、抗新生物チオール結合性ミトコンドリアオキシダントと第二の抗新生物物質を実質的に同時に投与する同時治療が可能である。逐次的な療法は、抗新生物チオール結合性ミトコンドリアオキシダントを投与した後、抗新生物物質を投与する前の適切な時間内に行うことができる。一方、同時療法における同時的な両薬剤での治療は、同日投与または別投与とすることができる。
【0150】
[0159] 正確な投与計画は、治療対象の疾患、疾患の重症度および治療に対する反応に依存する。例えば、抗新生物チオール結合性ミトコンドリアオキシダントの完全な投与計画は、第二の抗新生物物質の完全な投与計画の前または後に投与され得る。あるいは、抗新生物チオール結合性ミトコンドリアオキシダントと第二の抗新生物物質との交互の投与が行われ得る。さらなる例として、抗新生物チオール結合性ミトコンドリアオキシダントは、第二の抗新生物物質と同時に投与され得る。
【0151】
[0160] 第二の抗新生物物質、薬学的キャリアの同定、および抗新生物チオール結合性ミトコンドリアオキシダントの投与量は、哺乳類の生物種およびその体重と、治療対象の癌またはウイルス感染の種類に基づいて幅広く変化し得る。投与量は、既知の因子、例えば特定の第二の抗新生物物質およびその投与の仕方および経路の薬力学的特性;年齢、性別、代謝速度、吸収効率、患者の健康および体重;症状の性質および程度;同時治療の種類;治療の回数;および所望の治療学的効果に依存して変化し得る。
【0152】
[0161] 抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質は、単一の投与形態で一緒に投与され得るか、または二以上の異なる投与形態で別々に投与され得る。これらは、使用される投与形態に依存して、それぞれ独立して同じ投与経路または二以上の異なる投与経路によって投与され得る。
【0153】
[0162] 適切な薬学的組成物および投与形態には、好ましくは抗新生物チオール結合性ミトコンドリアオキシダントと、任意的には抗癌剤または抗ウイルス化合物とが含まれる。抗新生物チオール結合性ミトコンドリアオキシダント対抗癌剤または抗ウイルス化合物の割合は、重量ベースで約1 : 0.01〜10 : 1、および好ましくは1 : 0.05〜1 : 1の範囲内とすることができる。
【0154】
[0163] 抗癌剤または抗ウイルス化合物の投与およびその範囲は、特定の薬剤または化合物、および癌の種類またはウイルス感染の種類に依存するであろう。当業者は、適切な投与を突き止めることができるであろう。
【0155】
VI.投与形態
[0164] 投与単位には、単一の化合物、または抗新生物チオール結合性ミトコンドリアオキシダントと一以上の第二の抗新生物物質との混合物が含まれ得る。抗新生物チオール結合性ミトコンドリアオキシダントは、経口投与形態、例えば錠剤、カプセル、錠剤、粉、顆粒、エリキシル、チンキ、懸濁液、シロップおよびエマルジョンのような経口投与形態で投与され得る。抗新生物チオール結合性ミトコンドリアオキシダントまたは第二の抗新生物物質はまた、静脈内(ボーラスまたは注入)、腹腔内、皮下内、筋肉内形態、または製薬分野において通常の知識を有する者に周知の全ての投与形態で投与され得る。
【0156】
[0165] 抗新生物チオール結合性ミトコンドリアオキシダントまたは第二の抗新生物物質は、典型的には、投与の意図された形態に関して適切に選択され、かつ従来の薬学的プラクティスと一致した適切な薬学的希釈剤、増量剤、賦形剤またはキャリア(薬学的に許容可能なキャリアまたはキャリア材料として本明細書で集合的に言及される)との混合形態で投与される。単位体は、経口投与、直腸投与、局所的投与、静脈内注入または非経口投与に適した投与形態になるであろう。
【0157】
[0166] 薬学的組成物は単独で投与され得るかまたは薬学的に許容可能なキャリアと混合し得る。このキャリアは、固体または液体とし得、キャリアのタイプは一般的には使用される投与のタイプに基づいて選択される。
【0158】
[0167] 本発明の経口投与形態を処方するのに使用され得る薬学的に許容可能なキャリアおよび賦形剤の特定の例は、当業者に周知である。例えば米国特許第3,903,297号を参照されたい(全ての目的についてのその全体における参照によって本明細書中に組み込まれる)。本発明に有用な投与形態を作るための技術および組成物もまた、当業者に周知である。例えば、7 Modern Pharmaceutics, 第9章および10章(Banker & Rhodes, Eds., 1979); Pharmaceutical Dosage Forms : Tablets (Lieberman et al.,1981) ; Ansel, Introduction to Pharmaceutical Dosage Forms 2nd Ed. (1976); Remington's Pharmaceutical Sciences, 17th ed. (Mack Publishing Company, Easton, Pa., 1985); Advances in Pharmaceutical Sciences (David Ganderton, Trevor Jones, Eds., 1992); Advances in Pharmaceutical Sciences Vol 7. (David Ganderton, Trevor Jones, James McGinity, Eds., 1995); Aqueous Polymeric Coatings for Pharmaceutical Dosage Forms (Drugs and the Pharmaceutical Sciences, Series 36 (James McGinity, Ed., 1989) ; Pharmaceutical Particulate Carriers : Theapeutic Applications : Drugs and the Pharmaceutical Sciences, Vol. 61 (Alain Rolland, Ed., 1993); Drug Delivery to the Gastrointestinal Tract (Ellis Horwood Books in the Biol
ogical Sciences. Pharmaceutical Technologyのシリーズ; J. G. Hardy, S. S. Davis, Clive G. Wilson, Eds. ); Modern Pharmaceutics Drugs and the Pharmaceutical Sciences, Vol 40 (Gilbert S. Banker, Christopher T. Rhodes, Eds.) を参照されたい。これらの全てが全ての目的についてのその全体における参照によって本明細書中に組み込まれる。
【0159】
[0168] 錠剤には、適切なバインダー、潤滑油、崩壊剤、着色剤、香味剤、流動性誘導剤、および溶融剤が含まれ得る。例えば、錠剤またはカプセル錠の投与単位形態における経口投与について、活性薬剤成分は、経口性で、非毒性、薬学的に許容可能な不活性キャリア、例えばラクトース、ゼラチン、寒天、デンプン、スクロース、グルコース、メチルセルロース、ステアリン酸マグネシウム、燐酸カルシウム、硫酸カルシウム、マンニトール、ソルビトール等と組み合わせることができる。適切なバインダーには、デンプン、ゼラチン、天然糖、例えばグルコースまたはβ乳糖、コーン甘味料、天然および合成ガム、例えばアカシア、トラガカントゴムまたはアルギン酸ナトリウム、カルボキシメチルセルロース、ポリエチレングリコール、ワックス等が含まれる。これらの投与形態において使用される潤滑剤には、オレイン酸ナトリウム、ステアリン酸ナトリウム、ステアリン酸マグネシウム、安息香酸ナトリウム、酢酸ソーダ、塩化ナトリウム等が含まれる。崩壊薬には、デンプン、メチルセルロース、寒天、ベントナイト、キサンガム等が含まれるがこれらに限定されない。
【0160】
[0169] 薬学的組成物はまた、リポソーム送達系、例えば小さな単層のベシクル、大きな単層のベシクルおよび多層のベシクルの形態で投与され得る。リポソームは、種々のリン脂質、例えばコレステロール、ステアリールアミン、またはホスファチジルコリンから形成され得る。
【0161】
[0170] 薬学的組成物はまた、標的薬剤キャリアまたはプロドラッグとして可溶性ポリマーと結合し得る。適切な可溶性ポリマーには、ポリビニルピロリドン、ピランコポリマー、ポリヒドロキシルプロピルメタクリルアミド-フェノール、ポリヒドロキシエチルアスパルタ-ミデフェノール、およびパルミトイル残基で置換されたポリエチルエンオキシド-ポリリシンが含まれる。さらに、抗新生物チオール結合性ミトコンドリアオキシダントは、薬剤の制御された放出を達成するのに有用な生分解性ポリマーの一群、例えば、ポリ乳酸、ポリグリコール酸、ポリ乳酸とポリグリコール酸のコポリマー、ポリイプシロンカプロラクトン、ポリヒドロキシ酪酸、ポリオルトエステル、ポリアセタ−ル、ポリジヒドロピラン、ポリシアノアシラート、およびヒドロゲルの架橋性または両親媒性のブロックコポリマーと結合し得る。
【0162】
[0171] 活性成分は、固体投与形態(例えばカプセル剤、錠剤および粉末)または液体投与形態(例えば、エリキシル、シロップおよび懸濁液)で経口投与され得る。また、無菌の液体投与形態で非経口的に投与され得る。
【0163】
[0172] ゼラチンカプセル剤には、活性成分および粉末キャリア、例えばラクトース、デンプン、セルロース誘導体、ステアリン酸マグネシウム、ステアリン酸等が含まれ得る。類似の希釈剤には、圧縮された錠剤を製造するために使用され得る。錠剤およびカプセル錠の両方は、即効性の製品または数時間にわたる薬剤の持続的放出を提供する徐放性の製品として製造され得る。圧縮された錠剤は、全ての不快な味を隠し、かつ空気から錠剤を保護するために糖質コートまたはフィルムコートがなされ得、あるいは胃腸管における選択的分解のために腸溶性コートがなされ得る。
【0164】
[0173] 液体投与形態における経口投与について、経口薬剤成分は、経口性で、非毒性、薬学的に許容可能な全ての不活性キャリア、例えばエタノール、グリセロール、水等と組み合わせられる。適切な液体投与形態の例には、溶液または水の懸濁液、薬学的に許容可能な油脂、アルコールまたはエステルを含む他の有機溶媒、エマルジョン、シロップまたはエリキシル、懸濁液、非沸騰性の顆粒から再構成された溶液および/または懸濁液、および沸騰性の顆粒から再構成された沸騰性の製剤が含まれる。このような液体投与形態には、例えば適切な溶剤、防腐剤、乳化剤、懸濁剤、希釈剤、甘味料、増粘剤および溶融剤が含まれる。
【0165】
[0174] 経口投与についての液体投与形態には、患者の許容性を高めるために着色剤および香味剤が含まれ得る。一般的には、水、適切な油、食塩、水溶性ブドウ糖(グルコース)、および関連した糖液およびグリコール(例えば、プロピレングリコールまたはポリエチレングリコール)が、非経口溶液のための適切なキャリアである。非経口投与のための溶液には、好ましくは活性成分の水溶性の塩、適切な安定化剤、および必要に応じてバッファー物質が含まれる。抗酸化剤、例えば亜硫酸水素ナトリウム、亜硫酸ナトリウムまたはアスコルビン酸(単独または組み合わされた)は、適切な安定化剤である。クエン酸およびその塩類およびナトリウムEDTAがまた使用される。さらに、非経口溶液には、防腐剤、例えばベンズアルコニウムクロリド、メチル-またはプロピル-パラベン、およびクロロブタノールが含まれ得る。適切な薬学的キャリアは、この分野における標準的な参照テキストであるRemington's Pharmaceutical Sciences, Mack Publishing Companyに記載されている。
【0166】
[0175] 薬学的組成物はまた、適切な鼻腔内ビヒクルの使用を介して鼻腔内形態で投与され得るか、または当業者に周知の経皮パッチの形態を使用して経皮性経路を介して投与され得る。経皮送達系の形態で投与されるために、投薬は、一般的には投与計画の間中、断続的ではなく連続的であろう。
【0167】
[0176] 非経口的形態および静脈内注入形態にはまた、選択された注入または送達系のタイプと適合するミネラルおよび他の物質が含まれ得る。
【0168】
[0177] 抗新生物チオール結合性ミトコンドリアオキシダントの投与のための有用な薬学的投与形態は、以下のように例証される。
【0169】
A.カプセル錠
[0178] 多数のカプセル錠の単位体は、標準的な二片性の硬質ゼラチンカプセルを、各々10〜500 ミリグラムの粉末状活性成分、5〜50ミリグラムのセルロース、および6ミリグラムのステアリン酸マグネシウムで充填させることによって調製される。
【0170】
B.軟質ゼラチンカプセル錠
[0179] 消化可能な油、例えばダイズ油、綿実油またはオリーブ油中の活性成分の混合物が調製され、ポジティブ置換ポンプによってゼラチンに注入され、100〜500ミリグラムの活性成分を含む軟質ゼラチンカプセル錠を形成する。カプセル錠は洗浄されて乾燥される。
【0171】
C.錠剤
[0180] 多数の錠剤は、投与単位体が100〜500ミリグラムの活性成分、0.2ミリグラムのコロイド状二酸化珪素、5ミリグラムのステアリン酸マグネシウム、50〜275ミリグラムの微結晶性セルロース、11ミリグラムのデンプンおよび98.8ミリグラムのラクトースとなるように、従来の手順によって調製される。適切なコーティングを施して、嗜好性を高めたり吸収性を遅らせたりすることができる。
【0172】
D.注入可能な溶液
[0181] 注入による投与のために適した非経口的組成物は、1.5重量%の活性成分を10重量%のプロピレングリコールおよび水中で攪拌することによって調製される。溶液は、塩化ナトリウムで等張液に調製され滅菌される。
【0173】
E.懸濁液
[0182] 水性懸濁液は、5ml当たり、100 mg の微細分割された活性成分、200mgのカルボキシルメチルセルロースナトリウム、5mgの安息香酸ナトリウム、1.0gのソルビトール液、U.S.P、および0.025mlのバニリンが含まれるように経口投与用に調製される。
【0174】
F.キット
[0183] 本発明にはまた、例えば癌の治療に有用な薬学的キットが含まれる。該キットには、薬学的有効量の抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質を含む薬学的組成物を含む一以上の容器が含まれる。該キットには、さらに望ましくは一以上の様々な従来の薬学的キット部品、例えば一以上の薬学的に許容可能なキャリアを含む容器、追加の容器等が含まれる。これらは当業者にとって自明であろう。投与される成分の量の指示、投与についてのガイドライン、および/または成分を混合するためのガイドラインとなる印刷された説明書(挿入紙またはラベル紙)がまた、キット内に含まれ得る。特異的な材料および条件が本発明を実施するためには重要であるが、非特異的な材料および条件もまた、それらが認知される発明の利益を妨げない限りにおいて排除されないことを理解すべきである。
【0175】
[0184] 薬学的なキャリアは、固体または液体であり得、そのタイプは一般的には使用される投与のタイプに基づいて選択される。活性化薬剤は、凝集化粉末として、錠剤またはカプセル錠、リポソームの形態において共投与され得るかまたは液体形態において共投与され得る。適切な固体キャリアの例には、ラクトース、スクロース、ゼラチンおよび寒天が含まれる。カプセル錠または錠剤は容易に処方され得、嚥下または咀嚼が容易なように調製され得る。他の固体形態には、顆粒および原末が含まれる。錠剤には、適切なバインダー、潤滑油、希釈剤、崩壊剤、着色剤、香味剤、流動性誘導剤、および溶融剤が含まれ得る。適切な液体投与形態の例には、溶液または水中の懸濁液、薬学的に許容可能な油脂、アルコールまたはエステルを含む他の有機溶媒、エマルジョン、シロップまたはエリキシル、懸濁液、非沸騰性の顆粒から再構成された溶液および/または懸濁液、および沸騰性の顆粒から再構成された沸騰性の製剤が含まれる。このような液体投与形態には、例えば適切な溶剤、防腐剤、乳化剤、懸濁剤、希釈剤、甘味料、増粘剤および溶融剤が含まれる。経口投与形態には、任意的には香味剤および着色剤が含まれる。非経口的および静脈内注入形態にはまた、選択された注入または送達系のタイプと適合するミネラルおよび他の物質が含まれ得る。
【0176】
VII.治療の方法
[0185] 治療の方法には、治療対象の特定の癌または腫瘍タイプの治療に効果的である任意の適切な方法にし得る。治療は、経口投与、直腸投与、局所的投与、非経口投与または静脈内注入投与され得、または腫瘍または癌への直接注入によって投与され得る。効果的な量を加える方法はまた、治療対象の疾患または疾病に基づいて変化する。適切なキャリア、追加の癌阻害化合物、投与を容易にする化合物または希釈剤とともに処方された、抗新生物チオール結合性ミトコンドリアオキシダントの静脈内、皮下内または筋肉内注入による非経口的治療方法は、温血動物に対して化合物を投与する好ましい方法であると考えられる。
【0177】
[0186] 当業者は、インビトロおよびインビボの両方で既知の癌細胞株を使用するルーチン的スクリーニングを通して突き止めることができる。細胞株は、American Tissue Type Cultureまたは他の研究室から入手可能である。
【0178】
[0187] 以下の例は例証であり、発明を制限することを意図するものではない。
【0179】
A.薬学的処方に対する反応の測定
[0188] 腫瘍の大きさは、腫瘍塊についてのx線写真、コンピュータ化された断層撮影(CATスキャン)、核磁気共鳴(NMR)スキャンまたは直接的な物理的触診を用いた腫瘍の客観的走査によって治療の前に評価される。代わりに、腫瘍は、マーカー物質、例えば大腸癌からのアルファフェトプロテイン、卵巣癌からのCA125抗原、または多発性骨髄腫からの血清ミエローマ"M"タンパク質を分泌する可能性がある。これらの分泌された生成物のレベルは、計算される腫瘍の大きさの推定を可能にする。腫瘍の大きさについてのこれらの直接的および間接的な測定は、治療前に行われ、その後、薬剤を投与した後に間隔を空けて繰り返される。これらは、客観的な反応が得られたか否かを判断するためである。癌治療の客観的な反応は、一般的には測定可能な腫瘍疾患の>50%への収縮(部分的な反応)を示すかまたは全ての測定可能な疾患の完全な消失(完全な反応)を示す。典型的には、真に部分的反応または完全な反応として分類されるこれらの反応は、一定の期間、典型的には一ヶ月にわたって維持されなければならない。さらに、腫瘍の急速な増殖の安定化が起こり得、または<50%への腫瘍の収縮が起こり得、小さな反応または安定な疾患と称される。一般的には、生存率の増加は、治療に対する完全な反応を得られたことに付随するが、あるケースでは、部分的な反応が長期間にわたって維持される場合、部分的な反応もまた患者の生存率の増加に貢献し得る。患者が受ける化学療法はまた、典型的にはこれらの疾患の程度に応じて「始動」される。その前および後に、化学療法がこの疾患の程度が変化したかどうかをみるために再始動される。幾つかの状況において、腫瘍は、十分に収縮し、かつ転移が起こらなければ、化学療法の後に外科的切除が可能である。広範な疾患のため外科的切除を前もって行うことはできない。このケースにおいて、新規な薬学的組成物での化学療法的治療は、潜在的に治療的手術に対する補助として使用される。さらに、患者は、症候性の問題、例えば痛みを発生させる、脊椎または他の場所に特有の病変を有している場合があり、これらの病変に対しては局所的な放射線療法を行う必要がある。これは、本発明の全身性薬学的組成物の連続的使用に付け加えて行われ得る。
【0180】
B.毒性の評価と投与計画の設定
[0189] 患者は、各コースの化学療法で毒性について評価される。典型的には、肝臓の機能的酵素および腎臓の機能的酵素についての効果、例えばクレアチニンの清掃率またはBUNを調べる。また、骨髄についての効果、典型的には感染症と戦うのに重要な顆粒球の抑制および/または止血または鬱血のために重要な血小板の抑制を調べる。骨髄抑制性薬剤を投与すると、正常な血球数の最下点に治療後1〜3週の間に達する。その後、1〜2週間を過ぎると回復する。正常な白血球数の回復に基づいて、治療が再開される。
【0181】
[0190] 一般的には、完全なおよび部分的な反応は、腫瘍細胞の数において少なくとも1〜2 logの減少で評価される(90〜99%の効果的な療法)。進行した癌をもつ患者を診断すると、典型的には>109の腫瘍を有する。腫瘍の大きさを非常に小さな状態まで減らし、可能であれば疾患の治癒を得るために、複合的な治療が必要になる。
【0182】
C.患者の臨床的管理
[0191] 数週間にわたる連続的な薬剤投与を含む新規な薬学的処方での治療サイクルの終わりに、患者は、治療に対する反応(完全な緩解および部分的な緩解)、血液作業によって測定される毒性、および通常の健康状態に分類されるパフォーマンス状態または生活の質について評価される。後者には、患者の通常の活性レベルと正常な日々の機能を担うその能力が含まれる。反応の強力な予測値となることが見出され、幾つかの抗癌剤は、実際には顕著な腫瘍の収縮を引き起こさずにパフォーマンス状態および通常の健康感を向上させ得る。代謝拮抗物質ゲムシタビンは、全体的な生存率を変化させずに生活の質を向上させるかまたは高い客観的な反応速度を生み出す膵臓癌で認められた薬剤の一例である。従って、治癒されない幾つかの癌では、薬学的処方は、疾患の完全な緩解または部分的な緩解に影響を与えずに、顕著な利益、健康なパフォーマンス状態等を同様に与えるであろう。
【0183】
[0192] 血液学的な疾患、例えば多発性骨髄腫、リンパ腫および白血病において、反応は、腫瘍直径の測定を介しては評価されない。これらの疾患は、体のリンパ性および血行性領域全体にわたって広く転移しているからである。従って、これらの拡散して広がった疾患に対する反応は、一般的には骨髄生検の結果によって評価される。異常な腫瘍細胞胚の数が定量され、完全な反応は、骨髄生検試料における全ての腫瘍細胞の検出の喪失(例えば、微視的検出)によって示される。B細胞腫瘍では、多発性骨髄腫の血清マーカー、Mタンパク質が電気泳動法によって測定され得、Mタンパク質が実質的に減少した場合、原発性腫瘍の反応の証拠になる。再び多発性骨髄腫において、骨髄生検は、試料中に存在する異常な腫瘍形質細胞の数を定量するのに使用され得る。これらの疾患について、一般的により高い投与療法が、骨髄および/またはリンパ区画における反応に影響を与えるために使用される。
【0184】
[0193] 新規な薬学的処方についての計画された臨床用途は、肺癌、乳癌、悪性黒色腫、エイズ関連のリンパ腫、多剤耐性の(MDR)腫瘍(骨髄腫、白血病、乳癌および大腸癌)、前立腺癌、多発性骨髄腫、Bリンパ球プラズマ細胞腫、進行段階の卵巣上皮細胞癌、転移性黒色腫、リンパ様および非リンパ系の起源の白血病、転移性の大腸癌、乳癌および転移性の肺癌、および内分泌および外分泌膵臓の腫瘍についての治療である。
【0185】
[0194] 本明細書中に使用された用語および表現は制限を課すものではなく、これらの用語および表現の使用は、記載された特徴の等価物またはその一部を排除することを意図するものではない。様々な修飾が本発明の範囲内で可能であることが認識される。さらに、本発明の任意の実施態様の一以上の特徴は、本発明の範囲を逸脱しない範囲において、本発明の他の実施態様の一以上の特徴と組み合わせ得る。例えば、本発明の相乗的な組み合わせの特徴は、疾患状態を治療する方法および/または本明細書中に記載された薬学的組成物に等しく適用可能である。本明細書中で引用された全ての刊行物、特許、および特許出願は、全ての目的についてその全体が参照によって本明細書中に組み込まれる。
【0186】
例
[0195] 以下、本発明を例証するが本発明はこれらの例に制限されない。
【0187】
材料
[0196] イメキソンを、国立癌研究所から寄付を受け、Seres Laboratories Incorporated (Santa Rosa, CA)によって製造した。シスプラチンを、Bayer Corp (Spokane, WA)から得た。シタラビンを、Bedford Laboratories (Bedford, OH)から購入した。デキサメタゾンを、Sigma(St. Louis, MO)から購入した。ドキソルビシンを、Fujisawa USA (Deerfield, IL)から得た。ダカルバジン(DTIC)を、Bayer Corp (West Haven, CT)から購入した。5-フルオロウラシルを、Allergan Inc.(Irvine, CA)から購入した。ゲムシタビンを、Eli Lilly and Co(Indiana, IN)から購入した。メルファランおよびビノレルビン(vinorelbine)を、Glaxo Wellcome, Inc.(Research Triangle Park, NC)から購入した。メトトレキセートを、Bristol(Syracuse, NY)から得た。パクリタキセルを、Bristol (Princeton, NJ)から購入した。タキソテールを、Aventis(Collegeville, PA)から得た。
【0188】
[0197] ヒト悪性黒色腫A375細胞およびヒト骨髄腫8226細胞は、American Type Culture Collection (Rockville, MD)から得られた。急性骨髄性白血病(KG-1)細胞は、Alan List博士(アリゾナ大学, Tucson, AZ)によって好意的に提供された。膵臓癌細胞系統、MiaPaCaは、Daniel Von Hoff 博士(アリゾナ大学, Tucson, AZ)によって好意的に提供された。37℃の5% C02を含む加湿されたインキュベーター内において、10%(v/v)熱不活性化ウシ血清(Hyclone Laboratories, Logan, UT)、2mM L-グルタミン、ペニシリン(100 U/ml)およびストレプトマイシン(100 μg/ml)で増強されたRPMI1640培地(Gibco-BRL Products, Grand Island, NY)中で全ての細胞株の培養を行った。
【0189】
[0198] メスのSCID(c.B-17/lcrACC SCID)マウス(5〜6)週齢を、アリゾナ大学の動物ケア施設および使用委員会によって承認されたプロトコルのもと、アリゾナ大学の動物ケア施設(Tucson, AZ)によって管理され、実験動物ケアの全米協会のガイドラインに基づいて飼育された育種コロニーから購入した。標準的な小さな隔離飼育器内の木片の床敷きの上でマウスを飼育した。そして、Isoblox (Harlan/Teklad, Madison, WI)を与えた。マウスには、標準的なげっ歯類の固形飼料 (Harlan/Teklad, Madison, WI)および無菌水を自由に与えた。その間、12時間/12時間の昼/夜のスケジュールで管理を行った。アリゾナ大学の動物ケア施設および使用委員会は、全てのプロトコルを承認した。実験の最後に、全米獣医協会によって概略を示された手順に従ってマウスを安楽死させた。
【0190】
例1
[0199] 例1は、抗新生物チオール結合性ミトコンドリアオキシダントと第二の抗新生物物質との組み合わせがインビトロで相乗的な細胞毒性効果を示すか否かを決定する方法を例証する。
【0191】
[0200] 96ウェルプレート(BD Biosciences, Lexington, KY)において、各プレートの最後の11のカラムにおいて1ウェル当たり160μlの増殖培地中に約2500個の細胞を播種した。各プレートの最初のカラムを、ブランクとして使用するために細胞を含まない160μlの増殖培地で満たした。24時間のインキュベーション期間の後、最後の10のカラム内における細胞を、40μlイメキソン(抗新生物チオール結合性ミトコンドリアオキシダント)、40μlの第二の抗新生物物質、または20μlのイメキソンと20μlの第二の抗新生物物質で処理した(一列目をブランクとして放置し、二列目を細胞増殖が阻害されていない対照群として放置した)。12の抗新生物薬剤について試験を行った:シスプラチン、シタラビン、デキサメタゾン、ドキソルビシン、ダカルバジン(DTIC)、5-フルオロウラシル、ゲムシタビン、イリノテカン、メルファラン、メトトレキセート、パクリタキセル、タキソテール、およびビノレルビン(vinorelbine)。組み合わせ研究において使用された薬剤の濃度と割合を、単一薬剤実験のIC50値から決定した。各組み合わせ研究について使用された薬剤の範囲を、各抗腫瘍薬剤についてのIC50値の上下に小さな濃度変化を与えることによって明らかにした。第二の抗新生物物質各々のIC50値を、イメキソンについてのIC50値と比較し、次の組み合わせ薬剤において使用される固定された一定の割合を確立した。細胞に薬剤を投与後5日目にして、8226/s細胞を含む96ウェルプレートをMTTアッセイを使用して分析した(Rubinstein, L.V. et al., J Natl Cancer Inst 82: 1113-111 (1990))。一方、A375細胞を含むプレートをSRBアッセイを使用して分析した(Skehan, P. et al. J Natl Cancer Inst 82: 1107-1112 (1990))。
【0192】
[0201] 相乗性は、Chou et al., Advances in Enzyme Regulation 22: 27-33 (1984)の方法に基づいて計算された組み合わせ指数から決定した。様々な組み合わせについての組み合わせ指数は、図1〜8のイメキソンの濃度の関数として表わされる。
【0193】
[0202] 表1は、イメキソンとの組み合わせにおける第二の抗新生物物質の相乗的効果についての実証を示す。
【表1】

【0194】
例2
[0203] 例2は、抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質が、インビボにおいて相乗的抗癌効果を示すか否かを決定する方法について例証する。
【0195】
例2.1:SCIDマウスの膵臓癌
[0204] ゲムシタビンとイメキソンを、SCIDマウスにおける膵臓癌を治療するために組み合わせて使用した。0日目に16匹のSCIDマウスに対して10×106の生きたMiaPaCa腫瘍細胞を右後方腹部に皮下注射によって接種した。4匹のマウスについては、対照群として使用し、治療を行わなかった。他の4匹のマウスについては、その後、一日目を始めとして9日間にわたって100 mg/kg/日のスケジュールのもとイメキソンで治療を行った。さらに他の4匹のマウスについては、1、5および9日目に180 mg/kg/日のスケジュールのもとゲムシタビンで治療を行った。さらに最後の4匹のマウスについては、9日間にわたって100 mg/kg/日のスケジュールのもとイメキソンで治療を行い、かつ1、5および9日目に180 mg/kg/日のスケジュールのもとゲムシタビンで治療を行った。
【0196】
[0205] 腫瘍の増殖について、キャリパーを使用して毎週ミリメートル単位で測定を行い、長さと幅を決定した。マウスの重量と生存率についても毎週モニターを行った。腫瘍の体積を、以下の式を使用して計算した。
【0197】
(長さ×幅2)/2
[0206] 図9に示したように、ゲムシタビンとイメキソンの組み合わせで治療されたSCIDマウスは、対照群のマウス、イメキソンで治療されたマウス、およびゲムシタビンで治療されたマウスと比較してより高い程度の腫瘍増殖阻害性を発揮した。
【0198】
例2.2:SCIDマウスの骨髄性白血病
[0207] シタラビンとイメキソンを、SCIDマウスにおけるヒトKG-1急性骨髄性白血病を治療するために組み合わせて使用した。0日目に20匹のSCIDマウスに対して10×106の生きたKG-1白血病細胞を右後方腹部に皮下注射によって接種した。4匹のマウスについては、対照群として使用し、治療を行わなかった。他の4匹のマウスについては、一日目を始めとして9日間にわたって100 mg/kg/日のスケジュールのもとイメキソンで治療を行った。さらに他の4匹のマウスについては、1日目を始めとして5日間にわたって150 mg/kg/日のスケジュールのもとイメキソンで治療を行った。さらに他の4匹のマウスについては、1、5、および9日目に800 mg/kg/日のスケジュールのもとシタラビンで治療を行った。さらに最後の4匹のマウスについては、9日間にわたって100 mg/kg/日のスケジュールのもとイメキソンで治療を行い、かつ1、5および9日目に800 mg/kg/日のスケジュールのもとシタラビンで治療を行った。
【0199】
[0208] 腫瘍の増殖について、キャリパーを使用して毎週ミリメートル単位で測定を行い、長さと幅を決定した。マウスの重量と生存率についても毎週モニターを行った。腫瘍の体積を、以下の式を使用して計算した。
【0200】
(長さ×幅2)/2
[0209] 図10に示したように、シタラビンとイメキソンの組み合わせは、イメキソンで治療されたマウス、シタラビンで治療されたマウス、または対照群のマウスと比較してより高い程度の腫瘍増殖阻害性を発揮した。
【0201】
例3
[0210] 例3は、イメキソンと第二の抗新生物物質をマウスに投与した実験からの毒性学的結果を示す。
【0202】
[0211] ゲムシタビン(180 mg/kg日 1, 5および9日目)またはシタラビン(800 mg/kg日 1, 4および7日目)とともにイメキソン(100 mg/kg/日×9日間)を与えた非腫瘍性(すなわち正常)マウスにおいて毒性学的研究を行った。試験は、ゲムシタビンまたはシタラビンと組み合わされたイメキソンについて、骨髄毒性の増加または腎臓および肝臓機能の低下が起きたか否かについて評価を行った。イメキソンと、シタラビンまたはゲムシタビンとを組み合わせて治療されたマウスの血小板数の結果を以下の表2に示す。
【表2】

【0203】
[0212] その結果は、組み合わせ薬剤について腎臓または肝臓機能への著しい影響はないことを示した。各組み合わせ薬剤について白血球数の減少が観察された。しかし、そのレベルはWBC値の正常範囲の下限値には至らなかった。ほとんど全ての減少は、リンパ球を含む。ヒトの正常な骨髄細胞における主要な標的と考えられる好中球についての影響はなかった。赤血球の数は、イメキソンでわずかに増加した。同様に、血小板数は各組み合わせ薬剤で低下したが、著しく低いレベルを示すものではない。全体としては、イメキソンとシタラビンまたはゲムシタビンとの総量の組み合わせ薬剤では、顕著な骨髄毒性は観察されなかった。
【図面の簡単な説明】
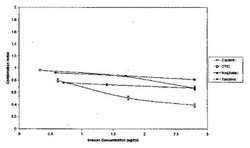
【0204】
【図1】図1は、A375細胞内における、シスプラチン、ダカルバジン(DTIC)、メルファランまたはタキソテールと組み合わせたイメキソンについての組み合わせ指数データを表わしたものである。
【図2】図2は、8226/s細胞における、シスプラチン、ダカルバジン(DTIC)、メルファランまたはタキソテールと組み合わせたイメキソンについての組み合わせ指数データを表わしたものである。
【図3】図3は、A375細胞における、シタラビン、5-フルオロウラシル、またはゲムシタビンと組み合わせたイメキソンについての組み合わせ指数データを表わしたものである。
【図4】図4は、8226/s細胞における、シタラビン、5-フルオロウラシル、またはゲムシタビンと組み合わせたイメキソンについての組み合わせ指数データを表わしたものである。
【図5】図5は、A375細胞における、メトトレキセートまたはドキソルビシンと組み合わせたイメキソンについての組み合わせ指数データを表わしたものである。
【図6】図6は、8226/s細胞における、デキサメタゾン、ドキソルビシン、メトトレキセート、またはパクリタキセルについての組み合わせ指数データを表わしたものである。
【図7】図7は、A375細胞における、デキサメタゾン、パクリタキセル、またはビノレルビン(vinorelbine)と組み合わせたイメキソンについての組み合わせ指数データを表わしたものである。
【図8】図8は、8226/s細胞における、ビノレルビンと組み合わせたイメキソンについての組み合わせ指数データを表わしたものである。
【図9】図9は、マウスにおける、ゲムシタビンと組み合わせたイメキソンの抗白血病効果を表わしたものである。
【図10】図10は、マウスにおける、シタラビンと組み合わせたイメキソンの抗白血病効果を表わしたものである。
【図11】図11は、インビトロでのヒト多発性骨髄腫細胞(8226/s)における、トポイソメラーゼ阻害剤イリノテカンと組み合わせたイメキソンの拮抗効果を表わしたものである。
【関連出願の相互参照】
【0001】
本出願は、2003年12月8日に出願された米国仮特許出願第60/528,181号に対する優先権を主張する。この出願の開示内容は、参照によってその全体が本明細書中に組み込まれる。
【連邦政府によって後援を受けた研究に関する記載】
【0002】
本出願は、国立癌研究所、国立衛生研究所によって与えられたCA 17094のもと米国政府の補助で行われた。米国政府が本発明の権利者である。
【発明の分野】
【0003】
[0003] 本発明は、抗新生物チオール結合性ミトコンドリアオキシダント(an antineoplastic thiol-binding mitochondrial oxidant)、ならびに抗新生物核酸結合性物質(an antineoplastic nucleic acid binding agent)、抗新生物代謝拮抗物質塩基類似体(an antineoplastic antimetabolite base analog)、およびドセタキセルから選択された第二の抗新生物物質の相乗的な組み合わせを使用して癌を治療する方法および組成物に関する。
【発明の背景】
【0004】
[0004] 多くの組み合わせ療法の効果を予想するのは難しい。例えば、ある複数の薬物は互いに相互作用を引き起こし、その治療学的効果を低減させたり、あるいは望まれない副作用をもたらす。これらの薬物は、典型的には拮抗作用を有するものとして分類される。他の薬物は、個々の薬物の総和としての治療学的効果を示す。これらの組み合わせは、付加的効果を有するものとして分類される。さらに、他の薬物の組み合わせは、個々の薬物の総和を上回る治療学的指数を達成する。これらは、相乗的効果を有するものとして分類される。
【0005】
[0005] 相乗的な効果を有する組み合わせ療法は、多くの理由から非常に望ましい。例えば、相乗的な組み合わせ療法における各成分は、単一療法(すなわち、一つの薬物投与)における個々の薬物の治療学的量よりも少ない量で使用することができる。さらに、副作用の危険性および/または重症度を、各薬物の量を減少させることによって著しく減らすことができる。さらに、組み合わせ療法は、治療の全体的効果を著しく増加させることができる。しかしながら、残念ながら、相乗的効果を有する薬物の組み合わせを発見することは、大部分が経験によるものである。
【0006】
[0006] 組み合わせ療法の相乗的作用は、副作用が極度または激しい場合および/または単一量の効果が望ましくない場合、治療において特に有用である。例えば、癌の治療は、しばしば悪心、嘔吐、骨髄抑制、および患者に対する他の激しい不快感を生じる。同様に、ウイルス感染の治療、例えばHIV感染の治療は、一以上のこれらのタイプの副作用を生じる。さらに、癌またはHIV感染治療の有効性の程度は理想よりも少ない。
【0007】
[0007] さらに、耐性の発達は、ウイルス感染、例えばHIVおよびHBV感染の治療、ならびに現存する化学療法において最近の主要な関心事になってきている。通常、耐性は、使用される薬物がウイルスの複製を完全に停止させるのに十分な効き目がないときに生じる。ウイルスが薬物の存在中において完全に複製できる場合、薬物があるにもかかわらずウイルスが複製できる状態が発見されるまでウイルスは変異の機会を得る。いったん変異が起こると増殖に抑制がきかず、直ちにそのウイルス個体の優性株になってしまう。薬物は新株に対して徐々に効かなくなる。また、交差耐性に関する問題が増加する。交差耐性は、一つの薬物に対する耐性をもたらす変異が他の薬物に対する耐性をもたらすときに起こる。幾つかの研究は、二つの薬物を組み合わせることが、一つまたは両方の薬物に対する耐性の発達を、どちらか一方の薬物を単独で使用したときと比較して遅らせることを示している。他の研究は、三つの薬物の組み合わせが、さらにこの利益を伸ばすことを示す。結果として、耐性を防ぐまたは少なくとも遅らせる最良の方法は、複数の薬物の組み合わせ療法を採用することであると考えられる。
【0008】
[0008] 幾つかの組み合わせ療法は、癌よびウイルス感染を治療するために現在有用であるけれども、依然として、癌およびウイルス感染についてのさらなる組み合わせ療法の必要性が存在する。本発明は、これらの問題および他の問題を解決する。
【本発明の概要】
【0009】
[0009] 驚くべきことに、抗新生物チオール結合性ミトコンドリアオキシダントと、抗新生物核酸結合性物質、抗新生物代謝拮抗物質塩基類似体、またはドセタキセルとの組み合わせが、癌患者を治療するのに使用されるとき、相乗的効果を有することを発見した。
【0010】
[0010] 第一の側面において、本発明は、このような治療を必要とするヒトの癌を治療するための方法を提供する。本発明の方法は、患者に対して薬学的に有効量の組成物を投与することを含む。前記組成物には、抗新生物チオール結合性ミトコンドリアオキシダントおよび抗新生物核酸結合性物質が含まれる。前記有効量は、相乗的な治療学的細胞毒性効果を提供する。
【0011】
[0011] 他の側面において、本発明は、このような治療を必要とするヒトの癌を治療するための方法を提供する。前記方法は、患者に対して薬学的に有効量の組成物を投与することを含む。前記組成物には、抗新生物チオール結合性ミトコンドリアオキシダントおよび抗新生物代謝拮抗物質塩基類似体が含まれる。前記有効量は、相乗的な治療学的細胞毒性効果を提供する。
【0012】
[0012] 他の側面において、本発明は、このような治療を必要とするヒトの癌を治療するための方法を提供する。前記方法は、患者に対して薬学的に有効量の組成物を投与することを含む。前記組成物には、抗新生物チオール結合性ミトコンドリアオキシダントおよびドセタキセルが含まれる。前記有効量は、相乗的な治療学的細胞毒性効果を提供する。
【本発明の詳細な説明】
【0013】
I.定義
[0024] 用語「癌」が本明細書中で使用されるとき、白血病、癌腫および肉腫を含む、哺乳類に見出される全ての種類の癌、新生物、または悪性腫瘍を表わす。
【0014】
典型的な癌には、脳、乳房、頚部、大腸、頭部&頚部、肝臓、腎臓、肺、非小肺細胞癌、黒色腫、中皮腫、卵巣癌、肉腫、胃癌、子宮癌および髄芽細胞腫が含まれる。さらなる例には、ホジキン病、非ホジキン性リンパ腫、多発性骨髄腫、神経芽細胞腫、卵巣癌、横紋筋肉腫、原発性血小板血症、原発性マクログロブリン血症、原発性脳腫瘍、癌、悪性膵臓インシュリン産生腫瘍、悪性カルチノイド、尿膀胱癌、前悪性の皮膚病変、精巣癌、リンパ腫、甲状腺癌、神経芽細胞腫、食道癌、尿生殖路癌、悪性高カルシウム血症、子宮体癌、副腎皮質癌、膵臓内分泌および外分泌腫瘍、および前立腺癌が含まれる。
【0015】
[0025] 用語「白血病」は、広く血液形成器官の進行性の悪性疾患をいい、一般的には血液および骨髄中の白血球およびその前駆体の異常増殖および発達によって特徴づけられる。白血病は、臨床的には (1) 急性疾患または慢性疾患といった疾患の期間および特徴; (2) 細胞の種類; 骨髄系(骨髄行性)、リンパ系(リンパ行性)、または単球; および(3)血中の異常細胞数の増加または非増加(一般的な白血病または無白血性白血病(亜白血性白血病))に基づいて分類されるのが一般的である。P388白血病モデルは、インビボでの抗白血病活性を予測するモデルとして広く認められている。P388アッセイは、一般的には治療対象の白血病の種類に関わらずインビボでの抗白血病活性のレベルをを示す。従って、本発明には、白血病の治療方法、好ましくは、急性無リンパ性白血病、慢性リンパ性白血病、急性顆粒球性白血病、慢性顆粒球性白血病、急性前骨髄球性白血病、成体T細胞白血病、非白血球増加性白血症、白血球血症性白血病、好塩基球性白血病、芽球白血病、ウシ白血病、慢性骨髄性白血病、皮膚白血病、幹細胞性白血病、好酸球性白血病、グロス白血病、線毛細胞白血病、血球母細胞性白血病、血球始原細胞性白血病、組織球性白血病、幹細胞性白血病、急性単球白血病、白血球減少症白血病、リンパ性白血病、リンパ芽球性白血病、リンパ球性白血病、リンパ行性白血病、リンパ球系白血病、リンパ肉腫細胞白血病、肥満細胞白血病、巨核球性白血病、小骨髄芽球性白血病、単球白血病、骨髄芽球性白血病、骨髄球性白血病、骨髄顆粒球性白血病、骨髄単球性白血病、ネーゲリ白血病、形質細胞白血病、多発性骨髄腫、プラズマ細胞性白血病、前骨髄球性白血病、リーダー細胞性白血病、シリング白血病、幹細胞性白血病、亜白血性白血病、および未分化細胞白血病の治療方法が含まれる。
【0016】
[0026] 用語「肉腫」は、一般的には胚性結合組織様の物質でできた腫瘍を意味し、一般的には原線維または均質な物質内に包埋された、密に詰め込まれた細胞で構成される。抗新生物チオール結合性ミトコンドリアオキシダントと抗癌剤との組み合わせで治療可能な肉腫には、軟骨肉腫、線維肉腫、リンパ肉腫、メラニン肉腫、粘液性肉腫、骨肉腫、アベメチー肉腫、脂肪肉腫、脂質肉腫、蜂窩性軟部肉腫、エナメル芽細胞肉腫、ブドウ状肉腫、緑色腫肉腫、絨毛膜癌、胚性肉腫、ウィルムス腫瘍肉腫、子宮内膜肉腫、間質性肉腫、ユーイング肉腫、筋膜肉腫、線維形成肉腫、巨細胞肉腫、顆粒球性肉腫、ホジキン肉腫、特発性多発色素出血性肉腫、B細胞の免疫芽球性肉腫、リンパ腫、T細胞の免疫芽細胞肉腫、イェンセン肉腫、カポジ肉腫、クップファー細胞肉腫、血管肉腫、白血肉腫、悪性間葉腫肉腫、傍骨性骨肉腫、細網肉腫、ラウス肉腫、漿液嚢胞性肉腫、滑膜肉腫、および末梢血管拡張性肉腫が含まれる。
【0017】
[0027] 用語「黒色腫」は、皮膚および他の器官のメラニン細胞系から生じる腫瘍を意味する。抗新生物チオール結合性ミトコンドリアオキシダントと抗癌剤との組み合わせで治療可能な黒色腫には、例えば、肢端黒子型黒色腫、メラニン欠乏性黒色腫、良性若年性黒色腫、クラウドマン黒色腫、S91黒色腫、ハーディング−パッセー黒色腫、若年性黒色腫、悪性黒子型黒色腫、悪性黒色腫、結節性メラノーマ、爪下黒色腫、および表在拡大型黒色腫が含まれる。
【0018】
[0028] 用語「癌腫」とは、周囲組織に浸潤および転移する傾向のある上皮細胞でできた悪性の新規増殖を意味する。抗新生物チオール結合性ミトコンドリアオキシダントと抗癌剤との組み合わせで治療可能な典型的な癌腫には、例えば、腺房癌、小葉癌、腺嚢癌腫、腺様嚢胞癌、腺癌、副腎皮質癌、肺胞腺癌、肺胞上皮細胞癌、基底細胞癌、基底細胞性癌、類基底細胞癌、基底有棘細胞癌、肺胞上皮癌、細気管支癌、気管支原性癌、大脳様癌、細胆管細胞性癌、絨毛癌、膠様癌、面ぽう癌、コーパス(corpus)癌、篩状癌、胸鎧癌、皮膚癌、円筒状癌、円柱細胞癌、腺管癌、デューラム癌、胎児性癌、髄様癌、エピアモイド(epiermoid)癌、上皮性アデノイド癌、外方発育癌、潰瘍性癌、線維癌、ゼラチン状癌、膠様癌、巨細胞癌、巨大細胞性癌、腺性癌、顆粒膜細胞癌、毛母癌、血様癌、肝細胞癌、ヒュルトレ細胞癌、硝子質癌、副腎様癌、小児胎児性癌、in situ癌、表皮内癌、上皮内癌腫、Krompecher癌、Kulchitzky細胞癌、大細胞型癌、レンズ状癌、lenticulare癌、脂肪腫様癌、脂肪上皮性癌、延髄性癌、髄様癌、黒色癌、モール(molle)癌、粘液癌、粘液分泌性癌、粘膜細胞癌、粘液性類表皮癌、粘液癌、粘液性癌、粘液腫性癌、上咽頭癌、燕麦細胞癌、骨化性癌、類骨癌、乳頭状癌、門脈周囲癌、上皮内癌、有棘細胞癌、軟性癌、腎臓の腎細胞癌、予備細胞癌、肉腫様癌、シュナイダー癌、スキルス癌、陰嚢癌、印環細胞癌、単純癌、小細胞型癌、ソレノイド癌、回転楕円面細胞癌、紡錘体細胞癌、海綿様癌、扁平上皮癌、有棘細胞癌、ストリング癌、血管拡張癌、血管拡張様癌、移行上皮癌、結節癌、結節状癌、疣状癌、および絨毛癌が含まれる。
【0019】
[0029] 用語「抗新生物性」とは、癌の増殖の阻害または防止を意味する。「癌の増殖の阻害または防止」には、所定の療法または治療を行わなかったときと比較した癌の増殖の減少が含まれる。化合物が抗新生物性を有しているか否かを決定するのに有用な細胞毒性アッセイは、以下の文献に記載されている(Assays for Testing the Anticancer Synergistic Activity of a Combination of an Antineoplastic Thiol-binding Mitochondrial Oxidant and a Second Antineoplastic Agent)。
【0020】
[0030] 「組み合わせ療法」または「補助的療法」は、本明細書で使用されるとき、薬剤を必要とする患者が、その疾患についての他の薬剤を抗新生物チオール結合性ミトコンドリアオキシダントとの組み合わせにおいて与えられることを意味する。この組み合わせ療法は、患者を最初に一つの薬剤で治療し、次に他の薬剤または二つの薬剤を同時に与える経時的療法とすることができる。
【0021】
[0031] 「イメキソン」は、未置換の4-イミノ-1,3-ジアザビシクロ[3.1.0]-ヘキサン-2-オン、またはその薬学的に許容可能な塩または溶媒化合物を意味する。
【0022】
[0032] 「患者」は、ヒトを含む哺乳動物を意味する。
【0023】
[0033] 「相乗的な治療学的細胞毒性効果」は、本明細書で使用されるとき、細胞毒性アッセイを行ったときに少なくとも2つの化合物の組み合わせが相乗効果を示すことを意味する(以下の、抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質の組み合わせの相乗的抗癌活性を試験するためのアッセイを参照)。相乗効果は、50パーセント有効原理を使用して評価される(Chou, etal., Adv Enzyme Regul 22 : 27-55 (1984) )。当該方法は、ミカエリスメンテンの速度式に基づいており、薬物の組み合わせの効果を数値的な指標、すなわち組み合わせ指数(C.I.)に変換する。組み合わせ指数が1未満である場合は、相乗効果ありと認められる。組み合わせ指数が1である場合は、単純な総和である。組み合わせ指数が1を超える場合は、拮抗作用が認められる。
【0024】
[0034] 単独でのまたは他の置換基の一部としての用語「アルキル」は、特に明記しない限り、完全飽和、単不飽和または多不飽であり、かつ二価および多価の基を含むことができる、指定された炭素原子の数を有する(すなわちCl-C10は1〜10の炭素数を意味する)、直鎖または枝分かれ鎖、または環式炭化水素基、またはこれらの組み合わせを意味する。飽和炭化水素基の例には、例えばメチル、エチル、n-プロピル、イソプロピル、n-ブチル、t-ブチル、イソブチル、sec-ブチル、シクロヘキシル、(シクロヘキシル)メチル、シクロプロピルメチル、これらの相同体および異性体、例えばn-ペンチル、n-ヘキシル、n-ヘプチル、n-オクチル、およびこれらに類する基が含まれるがこれらに限定されない。飽和アルキル基は、一以上の二重結合または三重結合を有するものである。不飽和アルキル基の例には、ビニル、2-プロペニル、クロチル、2-イソペンテニル、2-(ブタジエニル)、2,4-ペンタジエニル、3-(1,4-ペンタジエニル)、エチニル、1-および3-プロピニル、3-ブチニル、およびより高度な相同体および異性体が含まれるがこれらに限定されない。用語「アルキル」は、特に明記しない限り、以下により詳細に定義されたアルキルの誘導体(例えば「ヘテロアルキル」)を含むことを意味する。炭化水素基に限定したアルキル基は、「ホモアルキル」と称呼する。
【0025】
[0035] 単独でのまたは他の置換基の一部としての用語「アルキレン」は、-CH2CH2CH2CH2-によって例証されるアルカンから誘導された二価の基を意味するがこれらに限定されない。さらに、アルキレンには、「ヘテロアルキレン」として以下に記載されたグループが含まれる。典型的には、アルキル(またはアルキレン)基は1〜24の炭素原子を有し、10個または数個の炭素原子を有する基が本発明において好ましい。「より低級のアルキル」または「より低級のアルキレン」は、より短い鎖、一般的には8以下の炭素原子を有するより短い鎖状のアルキルまたはアルキレン基である。
【0026】
[0036] 用語「アルコキシ」、「アルキルアミノ」および「アルキルチオ」(またはチオアルコキシ)は、その通常の意味において使用され、それぞれ酸素原子、アミノ基、または硫黄原子を介して分子の残部に結合したアルキル基を意味する。
【0027】
[0037] 単独でのまたは他の用語と組み合わせての用語「ヘテロアルキル」は、特に明記しない限り、一定数の炭素原子と、O, N, SiおよびSからなる群から選択された少なくとも一つのヘテロ原子からなる、安定な直鎖または枝分かれ鎖、または環式炭化水素基、またはこれらの組み合わせを意味する。窒素および硫黄原子が任意的に酸化され得、窒素へテロ原子が任意的に四分子化される。ヘテロ原子O, NおよびSおよびSiは、ヘテロアルキル基の任意の内部の位置に配置されるかまたはアルキル基が分子の残部に結合する位置に配置され得る。例には、-CH2-CH2-O-CH3, -CH2-CH2-NH-CH3, -CH2-CH2-N(CH3)-CH3, -CH2-S-CH2-CH3, -CH2-CH2, -S(O)-CH3, -CH2-CH2-S(O)2-CH3, -CH=CH-O-CH3, -Si(CH3)3, -CH2-CH=N-OCH3, および-CH=CH-N(CH3)-CH3が含まれるがこれらに限定されない。二つまでのヘテロ原子は連続的であってもよく、例えば-CH2-NH-OCH3および-CH2-O-Si(CH3)3であってもよい。同様に、単独でのまたは他の置換基の一部としての用語「ヘテロアルキレン」は、ヘテロアルキルから誘導された二価の基を意味する(例証として、これに限定されないが、-CH2-CH2-S-CH2-CH2-および-CH2-S-CH2-CH2-NH-CH2-)。ヘテロアルキレン基について、ヘテロ原子はまた、鎖終端の片方または両方を占有することができる(例えば、アルキレンオキシ、アルキレンジオキシ、アルキレンアミノ、アルキレンジアミノ、およびこれらに類するもの)。さらにまた、アルキレンおよびヘテロアルキレン連結基について、連結基の配向性は、連結基の式が記載されているその方向性によって意味付けられない。例えば、式-C(O)2R'-は、-C(0)2R'-および-R'C(O)2-の両方を意味する。
【0028】
[0038] 単独でのまたは他の用語との組み合わせにおける用語「シクロアルキル」および「ヘテロシクロアルキル」は、特に明記しない限り、それぞれ「アルキル」および「ヘテロアルキル」の環式の態様を表わす。さらに、ヘテロシクロアルキルについて、ヘテロ原子は、ヘテロ環が残りの分子と結合する位置に存在できる。シクロアルキルの例には、シクロペンチル、シクロヘキシル、1-シクロヘキセニル、3-シクロヘキセニル、シクロヘプチル、およびこれらに類するものが含まれるがこれらに限定されない。ヘテロシクロアルキルの例には、1-(1,2,5,6-テトラヒドロピリジル)、1-ピペリジニル、2-ピペリジニル、3-ピペリジニル、4-モルフォリニル、3-モルフォリニル、3-チオモルフォリニル、テトラヒドロフラン-2-イル、テトラヒドロフラン-3-イル、テトラヒドロチエン-2-イル、テトラヒドロチエン-3-イル、1-ピペラジニル、2-ピペラジニル、およびこれらに類するものが含まれる。
【0029】
[0039] 単独でのまたは他の置換基の一部としての用語「ハロ」または「ハロゲン」は、特に明記しない限り、フッ素、塩素、臭素、またはヨウ素原子を意味する。さらに、用語「ハロアルキル」には、モノハロアルキルおよびポリハロアルキルが含まれることを意味する。例えば、用語「ハロ(Cl-C4)アルキル」には、トリフルオロメチル、2,2,2-トリフルオロエチル、4-クロロブチル、3-ブロモプロピル、およびこれらに類するものが含まれることを意味するがこれらに限定されない。
【0030】
[0040] 用語「アリール」は、特に明記しない限り、特定の多不飽和の芳香族炭化水素置換基を意味する。単環または複数の環(好ましくは1〜3つの環)が互いに融合または共有結合的に連結している。用語「ヘテロアリール」は、N, O, およびSから選択された1〜4のヘテロ原子を含むアリール基(または環)を意味する。ここで、窒素および硫黄原子は任意的に酸化され、かつ窒素原子は任意的に四分子化される。ヘテロアリール基は、ヘテロ原子を通して分子の残基と結合することができる。アリールおよびヘテロアリール基の制限のない例には、フェニル、1-ナフチル、2-ナフチル、4-ビフェニル、1-ピロリル、2-ピロリル、3-ピロリル、3-ピラゾリル、2-イミダゾリル、4-イミダゾリル、ピラジニル、2-オキサゾリル、4-オキサゾリル、2-フェニル-4-オキサゾリル、5-オキサゾリル、3-イソオキサゾリル、4-イソオキサゾリル、5-イソオキサゾリル、2-チアゾリル、4-チアゾリル、5-チアゾリル、2-フリル、3-フリル、2-チエニル、3-チエニル、2-ピリジル、3-ピリジル、4-ピリジル、2-ピリミジル、4-ピリミジル、5-ベンゾチアゾリル、プリニル、2-ベンゾイミダゾリル、5-インドリル、1-イソキノリル、5-イソキノリル、2-キノキサリニル、5-キノキサリニル、3-キノリル、および6-キノリルが含まれる。上記に示したアリールおよびヘテロアリール環系の各々の置換基は、以下に記載の許容可能な置換基の群から選択される。
【0031】
[0041] 簡潔に言えば、用語「アリール」には、他の用語(例えば、アリールオキシ、アリールチオキシ、アリールアルキル)と組み合わせて使用されるとき、上記に定義したようなアリールおよびヘテロアリール環の両方が含まれる。従って、用語「アリールアルキル」には、アリール基がアルキル基と結合している基(例えば、ベンジル、フェネチル、ピリジルメチルおよびこれらに類する基)が含まれることを意味する。ここでのアルキル基には、炭素原子(例えばメチレン基)が、例えば酸素原子(例えば、フェノキシメチル、2-ピリジルオキシメチル、3-(1-ナフチルオキシ)プロピル、およびこれらに類するもの)によって置換されているアルキル基が含まれる。
【0032】
[0042] 本明細書で使用される用語「オキソ」は、炭素原子と二重結合する酸素を意味する。
【0033】
[0043] 上記用語の各々(例えば「アルキル」、「ヘテロアルキル」、「アリール」および「ヘテロアリール」)は、その基の置換された形態および置換されていない形態の両方を含むことを意味する。各タイプの基についての好ましい置換基は、以下に提供される。
【0034】
[0044] アルキルおよびヘテロアルキル基についての置換基(アルキレン、アルケニル、ヘテロアルキレン、ヘテロアルケニル、アルキニル、シクロアルキル、ヘテロシクロアルキル、シクロアルケニル、およびヘテロシクロアルケニル基についての置換基を含む)は、0から(2m'+1)(m'は、置換基の炭素原子の数)までの範囲の数における、-OR', =O, =NR', =N-OR', -NR'R", -SR', -ハロゲン, -SiR'R''R''', -OC(O)R', -C(O)R', -CO2R', -CONR'R'', -OC(O)NR'R'', -NR''C(O)R', -NR'-C(O)NR''R''', -NR''C(O)2R', -NR-C(NR'R''R''')=NR'''', -NR-C(NR'R'')=NR''', -S(O)R', -S(O)2R', -S(O)2NR'R'', -NRSO2R', -CNおよび-NO2から選択された一以上の種々の基であり得るがこれらに限定されない。R', R'', R'''およびR''''は、好ましくはそれぞれ独立して、水素、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないアリール、例えば1〜3のハロゲンで置換されたアリール、置換されたまたは置換されていないアルキル、アルコキシまたはチオアルコキシ基、またはアリールアルキル基を意味する。本発明の化合物が一以上のR基を含むとき、例えば、一以上の基が存在するときのR', R'', R'''およびR''''基の各々がそうであるように、各々のR基はそれぞれ独立して選択される。R'およびR''が同じ窒素原子と結合するとき、これらは該窒素原子で互いに結合し、5-, 6-、または7-員環を形成することができる。例えば、-NR'R''には、1-ピロリジニルおよび4-モルフォリニルが含まれるこれらに限定されない。置換基の上記議論から、用語「アルキル」には、水素基以外の基、例えばハロアルキル基(例えば-CF3および-CH2CF3)およびアシル基(例えば-C(O)CH3, -C(O)CF3, -C(O)CH2OCH3, およびこれらに類する基)と結合した炭素原子を含むグループが含まれることを当業者は理解するであろう。
【0035】
[0045] アルキル基について記載された置換基と同様、アリール基およびヘテロアリール基についての置換基は様々であり、例えば、0から芳香族環系上の結合可能な原子価の総数までの範囲の数における、ハロゲン、 -OR', =O, =NR', =N-OR', -NR'R'', -SR', -ハロゲン、-SiR'R''R''', -OC(O)R', -C(O)R', -CO2R',- CONR'R'', -OC(O)NR'R'', -NR''C(O)R', -NR'-C(O)NR''R''', -NR''C(0)2R', -NR-C(NR'R''R''')=NR'''', -NR-C(NR'R'')=NR''', -S(O)R', -S(O)2R', -S(O)2NR'R'', -NRSO2R', -CNおよび-N02, -R', -N3, -CH(Ph)2, フルオロ(C1-C4)アルコキシ、およびフルオロ(C1-C4)アルキルから選択される。in a number ranging from zero to the total number of open valences on the aromatic ring system; R', R'', R'''およびR''''は、好ましくはそれぞれ独立して水素、アルキル、ヘテロアルキル、アリールおよびヘテロアリールから選択される。本発明の化合物が一以上のR基を含むとき、一以上の基が存在するときの各R', R'',R'''およびR''''基がそうであるように、各々のR基はそれぞれ独立して選択される。
【0036】
[0046] アリールまたはヘテロアリール環の隣接する原子上の二つの置換基は、式 -T-C(O)-(CRR')q-U-の置換基と任意的に置換されてもよい(式中、TおよびUは、それぞれ独立して-NR-, -O-, -CRR'-または単結合であり、かつqは0〜3の整数である)。代わりに、アリールまたはヘテロアリール環の隣接する原子上の二つの置換基は、式-A-(CH2)r-B-の置換基と任意的に置換されていてもよい(式中、AおよびBは、それぞれ独立して-CRR'-, -O-, -NR-, -S-, -S(O)-, -S(O)2-, -S(0)2NR'-または単結合であり、かつrは1〜4の整数である)。このように形成された新しい環の単結合の一つは、任意的には二重結合で置換されてもよい。代わりに、アリールまたはヘテロアリール環の隣接する原子上の二つの置換基は、式-(CRR')S-X-(CR''R''')d-の置換基と任意的に置換されていてもよい(式中、sおよびdは、それぞれ独立して0〜3の整数であり、かつXは、-O-, -NR'-, -S-, -S(O)-, -S(O)2-, または-S(O)2NR'-である)。置換基R, R', R'' およびR'''は、好ましくは独立して水素、または置換されたもしくは置換されていない(C1-C6)アルキルから選択される。
【0037】
[0047] 本明細書中で使用される用語「ヘテロ原子」には、酸素(O)、窒素(N)、硫黄(S)および珪素(Si)が含まれることを意味する。
【0038】
[0048] 「核酸」とは、DNA、RNA、一本鎖、二本鎖、またはより高度に凝集したハイブリダイゼーションモチーフ、およびこれらの任意の化学的修飾体のいずれかを意味する。修飾体には、付加的荷電、分極率、水素結合、静電相互作用、および核酸リガンド塩基に対する官能性または核酸リガンド全体に対する官能性を与える他の化学基を有するものが含まれるがこれらに限定されない。このような修飾体には、ペプチド核酸、リン酸ジエステル基修飾体(例えばホスホロチオネート、メチルホスホン酸塩)、2'-位の糖修飾体、5-位のピリミジン修飾体、8-位のプリン修飾体、環外アミンでの修飾体、4-チオウリジンの置換体、5-ブロモまたは5-ヨウ素-ウラシルの置換体; 主鎖修飾体、メチル化、異常塩基対の組み合わせ(例えば、イソ塩基 イソシチジンおよびイソグアニジンおよびこれに類似するもの)が含まれるがこれらに限定されない。修飾体にはまた、キャッピングのような3'および5'修飾体が含まれ得る。
【0039】
[0049] 用語「薬学的に許容可能な塩」には、本明細書中に記載された化合物上に存在する特定の置換基による、比較的毒性のない酸または塩基で調製された活性化合物の塩が含まれることを意味する。本発明の化合物が酸性の官能基をを含む場合、塩基付加の塩は、中性形態の本発明の化合物と十分な量の所望の塩基とを接触させることによって得られ得る。薬学的に許容可能な塩基付加の塩の例には、ナトリウム、カリウム、カルシウム、アンモニウム、有機アミノ、またはマグネシウム塩、または類似の塩が含まれる。本発明の化合物が塩基性の官能基を含む場合、酸付加の塩は、中性形態の本発明の化合物と十分な量の所望の酸とを、生であるいは適切な不活性溶媒中で接触させることによって得られ得る。薬学的に許容可能な酸付加の塩には、塩化水素酸、臭化水素酸、硝酸、炭酸、一水素炭酸、リン酸、一水素リン酸、二水素リン酸、硫酸、一水素硫酸、ヨウ化水素酸、亜リン酸、およびこれらに類する酸のような無機酸、ならびに酢酸、プロピオン酸、イソブチル酸、マレイン酸、マロン酸、安息香酸、コハク酸、スベリン酸、フマル酸、乳酸、マンデル酸、フタル酸、ベンゼンスルホン酸、p-トリルスルホン酸、クエン酸、酒石酸、メタンスルホン酸、およびこれらに類する酸のような比較的毒性のない有機酸から誘導された塩が含まれる。さらに、アミノ酸の塩(例えば、アルギネートおよびこれに類する塩)および有機酸の塩(例えば、グルクロン酸、ガラクツロン酸およびこれらに類する塩)が含まれる(例えば、Berge et al., "Pharmaceutical Salts", Journal of Pharmaceutical Science, 1977,66, 1-19)。本発明の特定の化合物には、本発明の化合物を塩基付加の塩または酸付加の塩に転換できる塩基性および酸性の官能基の両方が含まれる。
【0040】
[0050] 中性形態の本発明の化合物は、好ましくは従来の手法において、前記塩を塩基または酸と接触させ、かつ親化合物を単離することによって再生される。親形態の化合物は、特定の物理的性質、例えば極性溶媒中における溶解度において様々な塩の形態とは異なる。
[0051] 塩の形態に加えて、本発明は、プロドラッグ形態にある化合物を提供する。本明細書中に記載された化合物のプロドラッグは、生理学的条件下での化学的変化を直ちに受け、本発明の化合物を提供する化合物である。さらに、プロドラッグは、生体外環境下における化学的または生化学的方法によって本発明の化合物に転換することができる。例えば、プロドラッグは、適切な酵素または化学試薬をもつ経皮性パッチリザーバ内に含まれるとき、本発明の化合物にゆるやかに転換され得る。
【0041】
[0052] 本発明の特定の化合物には、非溶解性の形態と、水和された形態を含む溶解性の形態が存在し得る。一般的には、溶解性の形態は非溶解性の形態と同等であり、本発明の範囲内に包含される。本発明の特定の化合物は、多層結晶またはアモルファス形態で存在し得る。一般的には、全ての物理的形態は、本発明によって考えられる用途について同等であり、本発明の範囲内に含まれる。
【0042】
[0053] 本発明の特定の化合物は、非対称性の炭素原子(光学中心)または二重結合を有し; ラセミ化合物、ジアステレオマー、幾何異性体および単一異性体は、本発明の範囲内に包含される。
【0043】
[0054] 本発明の化合物はまた、前記化合物を構成する一以上の原子に、アイソトープを通常とは異なる割合で含み得る。例えば、化合物は、放射活性同位元素、例えばトリチウム(3H)、ヨウ素-125(125I)または炭素-14(14C)で放射標識され得る。本発明の化合物の全てのアイソトープ変異体は、放射活性があろうとなかろうと、本発明の範囲内に包含される。
【0044】
II.癌を治療するのに有用な相乗的化合物
[0055] 一つの側面において、本発明は、癌を治療するのに有用な新規組成物を提供する。本発明の組成物には、抗新生物チオール結合性ミトコンドリアオキシダントと、抗新生物核酸結合性物質、抗新生物代謝拮抗物質塩基類似体、およびドセタキセルから選択された第二の抗新生物物質とが含まれる。驚くべきことに、抗新生物チオール結合性ミトコンドリアオキシダントと第二の抗新生物物質との組み合わせが、相乗的な治療学的細胞毒性効果を示すことが発見された。
【0045】
[0056] 本発明の組成物は、癌腫、肉腫、および他の形態の癌を含む広範な範囲の癌を治療するのに有用である。典型的な癌には、多発性骨髄腫、B-リンパ球プラズマ細胞腫、卵巣癌(例えば、発展的段階の卵巣上皮性細胞癌)、黒色腫(例えば、転移性黒色腫)、白血病(例えば、リンパ系白血病および非リンパ系起源白血病)、大腸癌(例えば、転移性大腸癌)、乳癌、肺癌(例えば、転移性肺癌)、および膵臓癌(例えば、膵臓の内分泌腺および外分泌腺の新生物)が含まれる。典型的な内性腫瘍膵臓疾患には、非機能性内分泌腫瘍、ソマトスタチン産生腫瘍、グルカゴン産生腫瘍、ビポーマ、ガストリン産生腫瘍、およびインシュリン産生腫瘍が含まれる。
【0046】
A.抗新生物チオール結合性ミトコンドリアオキシダント
[0057] 本発明の抗新生物チオール結合性ミトコンドリアオキシダントは、癌の増殖を阻害または防止する化合物であって、チオール含有分子上のチオール基に結合することができ、酸化的ストレスを促進し、かつ細胞性ミトコンドリア膜電位を乱す。抗新生物チオール結合性ミトコンドリアオキシダントは、他の細胞性小器官に対する変化がほとんど誘導されない間に、典型的にはミトコンドリア超微細構造(例えば隆起)の著しい変化を誘導する。ミトコンドリア超微細構造の変化は、典型的にはミトコンドリア生体分子、例えばミトコンドリアDNAに対する酸化的ストレスの誘導によって引き起こされる。ミトコンドリアDNAに対する酸化的ダメージおよびミトコンドリア形態の変化に加えて、抗新生物チオール結合性ミトコンドリアオキシダントは、ミトコンドリア膜電位の撹乱、シトクロムc解離の誘導、カスパーゼ3,8,および9の活性化、ならびにアポトーシスの誘導とともに、典型的には反応性酸素種(ROS)の増強を引き起こす。
【0047】
[0058] 幾つかの実施態様において、抗新生物チオール結合性ミトコンドリアオキシダントは、リボヌクレオチドレダクターゼ阻害剤を阻害または減少させる(抗新生物チオール結合性ミトコンドリアオキシダント欠乏中における活性と比較して)。他の実施態様において、抗新生物チオール結合性ミトコンドリアオキシダントは、DNAをアルキル化しない。他の実施態様において、抗新生物チオール結合性ミトコンドリアオキシダントは、リシンのε-アミノ基とは反応しない。
【0048】
[0059] 抗新生物チオール結合性ミトコンドリアオキシダントの特性を測定する技術は、以下の文献に詳細に議論および開示されている。Dvorakova et al., Neoplasia 97: 3544-3551 (2001), Dvorakova et al., Biochemical Pharmacology 60: 749-758 (2000), Dvorakova et al., Anti-Cancer Drugs 13: 1031-1042 (2002), Dvorakova et al., Molecular Cancer Therapeutics 1: 185-195 (2002), およびIyengar et al., J. Med. Chem. 47, 218-223 (2004).
[0060] 模範的実施態様において、抗新生物チオール結合性ミトコンドリアオキシダントには、アジリジン環(例えば、式(I)、(II)、および(III)の化合物)が含まれる。アジリジン環は、抗新生物チオール結合性ミトコンドリアオキシダントを、細胞性チオール(例えばグルタチオンSトランスフェラーゼ(GSH))および細胞性タンパク質内部のシステイン残基と結合させることができる。細胞性チオール、例えばシステインおよびGSHが枯渇した結果として、腫瘍細胞が酸化に対して高度に感受性になる。
【0049】
[0061] 模範的実施態様において、アジリジン環を有する抗新生物チオール結合性ミトコンドリアオキシダントは、以下の式で表わされた置換されたまたは置換されていないアジリジン-1-カルボキシアミドである。
【化1】

【0050】
[0062] 式(I)において、R1, R2, R3, R4およびR5は、それぞれ独立して、水素、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。R4およびR5は、任意的には置換されたまたは置換されていない5〜7員環を形成するために互いに結合している。
【0051】
[0063] 関連した実施態様において、R4は、シアノ、CO2R4A、またはCONR4BR4Cである。R4Aは、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないシクロアルキル、および置換されたまたは置換されていないアリールから選択される。R4Bは、水素、または置換されたまたは置換されていないアルキルである。R4Cは、水素、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロシクロアルキル、または置換されたまたは置換されていないアリールである。さらに関連した実施態様において、R4はシアノである。
【0052】
[0064] 他の関連した実施態様において、R1, R2およびR3は、それぞれ独立して、水素、置換されたまたは置換されていない(C1-C6)アルキル、置換されたまたは置換されていない2〜6員のヘテロアルキル、置換されたまたは置換されていない(C1-C6)シクロアルキル、置換されたまたは置換されていない5〜7員環のヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。R4は、シアノ、置換されていないカルボキシアミドまたは置換されていないカルボキシ酸エステルである。R5は、水素、または置換されたまたは置換されていない(C1-C4)アルキルである。R6は、置換されたまたは置換されていない(C1-C8)アルキル、置換されたまたは置換されていない5〜7員環のヘテロシクロアルキル、または置換されたまたは置換されていないアリールである。
【0053】
[0065] 他の関連した実施態様において、R4およびR5は、置換された5員環を形成するために互いに連結している。さらに関連した実施態様において、式(I)の化合物は、イメキソンである。模範的実施態様において、イメキソンが抗新生物チオール結合性ミトコンドリアオキシダントである場合、組成物中のイメキソンの濃度は少なくとも0.5μg/mlである。他の模範的実施態様において、組成物中のイメキソンの濃度は少なくとも1.0μg/mlである。他の模範的実施態様において、組成物中のイメキソンの濃度は1.0μg/ml〜500μg/mlである。
【0054】
[0066] 他の模範的実施態様において、抗新生物チオール結合性ミトコンドリアオキシダントは、置換されたまたは置換されていないアジリジン-1-カルボキシアミドおよび置換されたまたは置換されていない4-イミン-1,3-ジアゾビシクロ[3.1.0]-ヘキサン-2-オンから選択される。本発明において有用なアジリジン-1-カルボキシアミドおよびこれらの環式誘導体は、本出願と同じ譲受人に譲渡された米国特許第6,297,230号および米国特許第6,476,236号において詳細に議論されている(参照によってその全体が本明細書中に組み込まれる)。
【0055】
[0067] 有用な置換されたまたは置換されていない4-イミン-1,3-ジアゾビシクロ[3.1.0]-ヘキサン-2-オンが以下の式を有する。
【化2】

【0056】
[0068] 式(II)において、R1, R2およびR3は、それぞれ独立して水素、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。模範的な実施態様において、R1, R2およびR3は、それぞれ独立して水素、置換されたまたは置換されていない(C1-C6)アルキル、置換されたまたは置換されていない2〜6員のヘテロアルキル、置換されたまたは置換されていない(C1-C6)シクロアルキル、置換されたまたは置換されていない5〜7員のヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。
【0057】
[0069] 関連した実施態様において、R1, R2およびR3はそれぞれ独立して水素、および置換されたまたは置換されていない(C1-C6)アルキルから選択される。
【0058】
[0070] 他の関連した実施態様において、R1, R2およびR3は水素である。R1, R2およびR3が水素である場合、式Iの化合物がイメキソンになることを当業者は認識するであろう。従って、関連した実施態様において、抗新生物チオール結合性ミトコンドリアオキシダントはイメキソンである。
【0059】
[0071] 模範的な実施態様において、置換されたまたは置換されていないアジリジン-1-カルボキシアミドは、以下の式を有する:
【化3】

【0060】
[0072] 式(III)において、R1, R2およびR3はそれぞれ独立して水素、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。R4は、シアノ、CO2R4A、またはCONR4BR4Cである。R4Aは、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないシクロアルキル、および置換されたまたは置換されていないアリールから選択される。R4Bは、水素、または置換されたもしくは置換されていないアルキルである。R4Cは、水素、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロシクロアルキル、または置換されたまたは置換されていないアリールである。R5は、水素、または置換されたまたは置換されていないアルキルである。R6は、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロシクロアルキル、または置換されたまたは置換されていないアリールである。
【0061】
[0073] 関連した実施態様において、R4はシアノである。R4がシアノである場合、当該分子は置換されたまたは置換されていないシアノアジリジンになり得る。
【0062】
[0074] 模範的な実施態様において、R1, R2およびR3は、それぞれ独立して水素、置換されたまたは置換されていない(C1-C6)シクロアルキル、置換されたまたは置換されていない5〜7員環のヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。R4は、シアノ、置換されていないカルボキシアミドまたは置換されていないカルボキシ酸エステルである。R5は、水素、または置換されたまたは置換されていない(C1-C4)アルキルである。R6は、置換されたまたは置換されていない(C1-C8)アルキル、置換されたまたは置換されていない5〜7員環のヘテロシクロアルキル、または置換されたまたは置換されていないアリールである。
【0063】
[0075] 関連した実施態様において、R1, R2およびR3は、それぞれ独立して水素および置換されたまたは置換されていない(C1-C8)アルキルから選択される。R4はシアノおよびR5は水素である。
【0064】
B.抗新生物核酸結合性物質
[0076] 他の側面において、本発明は、抗新生物チオール結合性ミトコンドリアオキシダントおよび抗新生物核酸結合物質を含む薬学的組成物を提供する。驚くべきことに、抗新生物チオール結合性ミトコンドリアオキシダントおよび抗新生物核酸結合物質の組み合わせは、相乗的な治療学的細胞毒性効果を示す。
【0065】
[0077] 抗新生物核酸結合物質は、癌の増殖を阻害または防止し、かつ置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、または置換されたまたは置換されていないヘテロアリール基を、細胞核酸上の求核性部位に共有結合させる。典型的には、抗新生物核酸結合物質は、核酸の鎖の架橋結合、異常塩基対形成、脱プリン反応、アルキル化された核酸の除去修復、および/または核酸鎖の切断を引き起こす求電子性化学種である。従って、抗新生物核酸結合物質は、単官能性(一つの反応基)、二官能性(二つの反応基)または多官能性(三つ以上の反応基)であり得る。抗新生物核酸結合性物質は作用の特定のメカニズムによって制限されないけれども、N7、O6、およびグアニンの2アミノ窒素は、抗新生物核酸結合性物質に対する感受性が特に高い。
【0066】
[0078] ある化合物が細胞性核酸上の求核性部位に共有結合するか否かを決定する試験法は当業者に周知である。このような試験法のより詳細な議論は、例えばPrice et al., “Chemistry of Alkylation” in Ahtineoplastic and Immunosuppressive Agents, Part II, Ed by Sartorelli et al., Berlin, Springer-Verlag, 1975, pp.1-5 ; Johnson et al., Molec Pharmacol 3: 195(1967); and Kohn, et al., Cancer Res 37: 1450(1977) に詳細に説明されている。
【0067】
[0079] 模範的な実施形態において、抗新生物核酸結合性物質は、置換されたまたは置換されていないアルキル基、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、または置換されたまたは置換されていないヘテロアリール基を、核酸上の求核性部位に共有結合させる。さらなる実施態様において、核酸上の求核性部位は、N7、O6、および2-アミノ窒素グアニン窒素性塩基である。
【0068】
[0080] 他の模範的実施態様において、抗新生物核酸結合性物質は、抗新生物DNA結合性物質である。抗新生物DNA結合性物質は、置換されたまたは置換されていないアルキル基、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、または置換されたまたは置換されていないヘテロアリール基を、細胞性DNA上の求核性部位に結合させる。
【0069】
[0081] 例えば、抗新生物窒素マスタード、抗新生物アルキルスルホン酸塩、抗新生物ニトロソ尿素、抗新生物白金複合体、抗新生物イミダゾールカルボキサミド、アルトレタミンおよびこれらの誘導体、マイトマイシンCおよびこれらの誘導体、ベンゾキノン含有結合性物質、およびチオテパおよびこれらの誘導体を含む様々な抗新生物核酸結合性物質が、本発明において有用である。模範的な実施態様において、抗新生物核酸結合性物質は、抗新生物窒素マスタード、抗新生物イミダゾールカルボキサミド、および抗新生物白金複合体から選択される。他の模範的実施態様において、抗新生物核酸結合性物質は、メルファラン、シクロホスファミド、カルムスチン、メクロレタミン、チオテパ、クロランブシル、ロムスチン、イホスファミド、マイトマイシンC、シスプラチン、カルボプラチン、オキサリプラチンおよびダカルバジンから選択される。他の模範的実施態様において、抗新生物核酸結合性物質は、メルファラン、カルムスチン、メクロレタミン、チオテパ、クロランブシル、ロムスチン、イホスファミド、マイトマイシンC、シスプラチン、カルボプラチン、オキサリプラチンおよびダカルバジンから選択される。従って、ある実施態様において、抗新生物核酸結合性物質はシクロホスファミドではない。
【0070】
[0082] 本発明において有用な抗新生物窒素マスタードには、DNA、RNAおよび/またはポリペプチド分子上の反応基と共有結合する塩素化された脱離基を有する化合物が含まれる。模範的な実施態様において、窒素マスタードは、式:
(Cl2CH2)2N-R1 (IV)
を有する。
【0071】
[0083] 式(IV)において、R1は、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。関連した実施態様において、R1は、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロシクロアルキルから選択される。さらなる関連した実施態様において、R1は、置換されたまたは置換されていない(C1-C5)アルキル、置換されたまたは置換されていないフェニル、および置換されたまたは置換されていないシクロホスファミドから選択される。他の関連した実施態様において、R1は置換されたフェニルである。
【0072】
[0084] 他の模範的実施態様において、窒素マスタードは、メクロレタミン、メルファラン、シクロホスファミド、およびクロランブシルおよびこれらの誘導体から選択される。関連した実施態様において、窒素マスタードは、メルファランおよびシクロホスファミドから選択される。他の関連した実施態様において、窒素マスタードは、クロランブシルおよびメルファランから選択される。
【0073】
[0085] 他の模範的実施態様において、窒素マスタードは、シクロホスファミドではない。
【0074】
[0086] 本発明において有用な抗新生物白金複合体には、ストランド間またはストランド内の付加物および/または架橋細胞性巨大分子、例えばDNAを形成する化合物が含まれる。典型的には、白金複合体には、白金II(Pt2+)または白金IV化学種(Pt4+)が含まれる。
【0075】
[0087] 他の実施態様において、抗新生物白金複合体は、式:
【化4】

【0076】
を有する。
【0077】
[0088] 式(V)において、R1, R2, R3, およびR4は、それぞれ独立して水素、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。R1およびR2は、任意的には一緒に結合し、これらが結合する白金と環を形成する。R5は、ハロゲンおよびOR7から選択される。R6は、それぞれ独立してハロゲンおよびOR8から選択される。R7およびR8は、それぞれ独立して置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。R7およびR8は、任意的には一緒に結合し、これらが結合する原子と環を形成する。
【0078】
[0089] 他の模範的実施態様において、抗新生物白金複合体は、シスプラチン、カルボプラチン、オキサリプラチン、およびこれらの誘導体から選択される。他の模範的実施態様において、抗新生物白金複合体は、シスプラチン、カルボプラチン、およびオキサリプラチンから選択される。他の模範的実施態様において、抗新生物白金複合体は、シスプラチン、カルボプラチンから選択される。
【0079】
[0090] 模範的実施態様において、抗新生物イミダゾールカルボキサミドは、式:
【化5】

【0080】
を有する。
【0081】
[0091] 式(VI)において、R1, R2,およびR3は、それぞれ独立して水素、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。R1およびR2は、任意的には一緒に結合して環を形成する。
【0082】
[0092] 関連した実施態様において、R2は-N=N-N-R4である。R4は、環を形成するためにR1と結合する置換されたまたは置換されていない(C1-C5)アルキル、または置換されたまたは置換されていない(C1-C5)アルキレンである。さらなる関連した実施態様において、R3は水素である。
【0083】
[0093] 他の模範的実施態様において、抗新生物イミダゾールカルボキサミドは、テモゾルオミド、ダカルバジン、およびこれらの誘導体から選択される。他の模範的実施態様において、抗新生物イミダゾールカルボキサミドはダカルバジンである。
【0084】
[0094] 他の模範的実施態様において、抗新生物核酸結合性物質は、メルファラン、シクロホスファミド、カルムスチン、メクロレタミン、チオテパ、クロランブシル、ロムスチン、イホスファミド、マイトマイシンC、シスプラチン、カルボプラチン、オキサリプラチン、ダカルバジン、およびこれらの誘導体から選択される。他の模範的実施態様において、抗新生物核酸結合性物質は、メルファラン、シスプラチンおよびダカルバジンおよびこれらの誘導体から選択される。他の模範的実施態様において、抗新生物核酸結合性物質は、シクロホスファミドではない。
【0085】
[0095] 本発明の抗新生物アルキルスルホン酸塩には、典型的には少なくとも一つの電子欠乏性スルホン酸塩の基が含まれる。カルボニウムイオンは、DNAのアルキル化を誘導する抗新生物アルキルスルホン酸塩の全身的吸収の後に直ちに形成される。
【0086】
[0096] 模範的実施態様において、アルキルスルホン酸塩は、以下の構造を有する:
【化6】

【0087】
[0097] 式(VII)において、R1およびR3は、それぞれ独立して置換されたまたは置換されていないアルキルおよび置換されたまたは置換されていないヘテロアルキルから選択される。R2は、置換されたまたは置換されていないアルキレンおよび置換されたまたは置換されていないヘテロアルキレンから選択される。関連した実施態様において、R1およびR3は、置換されていないアルキルであり、R2は、置換されていないアルキレンである。さらなる関連した実施態様において、R1およびR3は、置換されていない(C1-C5)アルキルであり、R2は、置換されていない(C1-C5)アルキレンである。
【0088】
[0098] 他の実施態様において、アルキルスルホン酸塩は、ブスルファンまたはその誘導体である。関連した実施態様において、アルキルスルホン酸塩は、ブスルファンである。
【0089】
[0099] 他の模範的実施態様において、本発明のマイトマイシン誘導体は、以下の式を有する。
【化7】

【0090】
[0100] 式(VIII)において、Xは、=NR1, NHR2およびOR3から選択される。R1は、置換されたまたは置換されていないアルキルおよび置換されたまたは置換されていないヘテロアルキルから選択される。R2およびR3は、それぞれ独立して水素、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、および置換されたまたは置換されていないアリールから選択される。YはOR3である(R3は、水素および置換されたまたは置換されていないアルキルから選択される)。Zは、水素および置換されたまたは置換されていないアルキルから選択される。
【0091】
[0101] 関連した実施態様において、R1は、置換されたまたは置換されていない2〜5員のヘテロアルキルである。他の関連した実施態様において、R2は、水素、置換されたまたは置換されていない2〜5員のヘテロアルキルおよび置換されたまたは置換されていないアリールである。他の関連した実施態様において、Yは、-OCH3および-OHから選択される。他の関連した実施態様において、Zは水素および-CH3から選択される。
【0092】
[0102] 他の模範的実施態様において、マイトマイシン誘導体には、マイトマイシンA、マイトマイシンB、マイトマイシンC、ポルフィロマイシン、BMY-25282、BMS-181174、KW2149、およびM83が含まれる。
【0093】
[0103] 他の模範的実施態様において、ベンゾキノン含有結合性物質は、式:
【化8】

【0094】
を有する。
【0095】
[0104] 式(IX)において、R1は、NHR3、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、および置換されたまたは置換されていないヘテロシクロアルキルから選択される。R2は、水素、NHR4、置換されたまたは置換されていないアルキル、および置換されたまたは置換されていないヘテロアルキルから選択される。R3およびR4は、それぞれ独立して置換されたまたは置換されていないアルキルおよび置換されたまたは置換されていないヘテロアルキルから選択される。
【0096】
[0105] 関連した実施態様において、R1は、メチル、アズリジニル(azridinyl)、およびNHR3から選択される(式中、R3は、置換されたまたは置換されていないC1-C5アルキルである)。さらなる関連した実施態様において、R3は、CO2CH2CH3またはCH2CH20Hである。
【0097】
[0106] 他の模範的実施態様において、本発明のニトロソ尿素には、ビス-クロロエチルニトロソ尿素(BCNU)、N-(2-クロロエチル)-N'-(4-シクロヘキシル)-N-ニトロソ尿素(CCNU)、N-(2-クロロエチル)-N'-(4-シクロヘキシル)-N-ニトロソ尿素(メチル-CCNU)、およびこれらの誘導体が含まれる。他の模範的実施態様において、ニトロソ尿素は、式:
【化9】

【0098】
を有する。
【0099】
[0107] 式(X)において、R1は、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。関連した実施態様において、R1は、置換されたまたは置換されていないアルキル、および置換されたまたは置換されていないシクロアルキルから選択される。
【0100】
C.抗新生物代謝拮抗物質塩基類似体
[0108] 他の側面において、本発明は、抗新生物チオール結合性ミトコンドリアオキシダントおよび抗新生物代謝拮抗物質塩基類似体を含む薬学的組成物を提供する。驚くべきことに、抗新生物チオール結合性ミトコンドリアオキシダントおよび抗新生物代謝拮抗物質塩基類似体の組み合わせが、相乗的な治療学的細胞毒性効果を示すことを発見した。
【0101】
[0109] 抗新生物代謝拮抗物質塩基類似体は、癌の増殖を阻害および抑制し、かつ細胞核酸合成酵素を阻害することによって細胞核酸合成を乱す。細胞核酸合成酵素の阻害は、典型的には天然のヌクレオシド、ヌクレオチドおよび/または窒素性塩基(すなわち、アデニン、グアニン、ウラシル、シトシン、またはチミン)の構造を模倣することによって達成される。従って、本発明の抗新生物代謝拮抗物質塩基類似体には、アデニン、グアニン、ウラシル、シトシン、またはチミンヌクレオチド、ヌクレオシドおよび/または窒素性塩基の類似体が含まれる。
【0102】
[0110]細胞核酸酵素を阻害するか否かを決定するためのアッセイは当業者にとって周知である。このようなアッセイのより詳細な議論は、例えばHitchings et al., ”Mechanisms of action of purine and pyrimidine analogs" in Cancer Chemotherapy, Basic and Clinical Applications, ed. by Brodsky, et al, New York, Grune and Stratton, 1967, pp: 26-36; Santi, et al., Biochemistry 13: 471 (1974); Waqar et al., Biochem. Journal, 121: 803 (1971); およびHuang et al., Cancer Res 51 : 6110-6117, (1991) に詳細に記載されている。
【0103】
[0111] 模範的実施態様において、抗新生物代謝拮抗物質塩基類似体は、以下の式を有する:
【化10】

【0104】
[0112] 式(XI)において、R1は、水素、置換されたリボースおよび置換されたデオキシリボースから選択される。R2は、水素、ハロゲン、-SH、-NH2、-OH、=O、および-SR4から選択される。R4は、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。R3は、水素、ハロゲン、-SH、-NH2、および-OHから選択される。破線aは、単結合または二重結合である。Xは、=N-または-NH-から選択される。aが二重結合およびmが0である場合、Xは=N-であり、mが1の場合、Xは-NH-である。記号mは0または1の整数である。R2が=Oまたはmが1の場合、破線aは単結合である。
【0105】
[0113] 関連した実施態様において、R2は、-NH2, -OH, -SHおよび-SR4から選択される。
【0106】
[0114] 他の関連した実施態様において、R4は、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールから選択される。他の関連した実施態様において、R4は、置換されたまたは置換されていないヘテロシクロアルキルおよび置換されたまたは置換されていないヘテロアリールから選択される。
【0107】
[0115] 他の関連した実施態様において、R3は、水素、F、Cl、および-NH2から選択される。
【0108】
[0116] 他の関連した実施態様において、R1は、置換されたリボースおよび置換されたデオキシリボースから選択される。置換されたリボースおよび置換されたデオキシリボースは、細胞のDNAまたはRNAに見出されるリボースおよびデオキシリボース環と同一であってもよい。代わりに、置換されたリボースおよび置換されたデオキシリボースは、細胞のDNAまたはRNAに見出されるリボースおよびデオキシリボース環の類似体であってもよい。例えば、リボースの2’Cに結合したヒドロキシル基は、α-OHまたはβ-OHであってもよい。5’Cは、ヒドロキシル基、リン酸エステル基、リン酸ジエステル基、リン酸トリエステル基、またはこれらのリン酸エステル誘導体(例えば、リン酸チオエステル)と結合してもよい。
【0109】
[0117] 他の関連した実施態様において、mは0である。
【0110】
[0118] 従って、他の模範的実施態様において、抗新生物代謝拮抗物質塩基類似体は、以下の式を有する。
【化11】

【0111】
[0119] 式(XII)において、RおよびR3は、上述した式(XI)において定義した通りである。R6, R7, R8,およびR9は、それぞれ独立して水素、ハロゲン、-OH、およびOR10から選択される。R10は、置換されたまたは置換されていないアルキル、および置換されたまたは置換されていないヘテロアルキルから選択される。R5は、置換されたまたは置換されていないアルキルおよび-P(X1)O2-R11から選択される。R11は、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロシクロアルキル、-P(X1)O2および-P(X2)O-P(X1)O2から選択される。X1、X2、X3は、それぞれ独立してOおよびSから選択される。破線aは、単結合または二重結合である。R2が=Oである場合、破線aは単結合である。Xは=N-または-NH-から選択され、aが二重結合である場合、Xは=N-であり、aが単結合である場合、Xは-NH-である。
【0112】
[0120] 関連した実施態様において、R6, R7, R8,およびR9は、それぞれ独立して水素、F、-OH、およびOR10から選択される。
【0113】
[0121] 他の関連した実施態様において、抗新生物代謝拮抗物質塩基類似体は、以下の式を有する:
【化12】

【0114】
[0122] 式(XIII)において、R1は、水素、置換されたリボースおよび置換されたデオキシリボースから選択される。R2は、水素、ハロゲン、および置換されたまたは置換されていないアルキルから選択される。R3は、水素、=O, NH2, NH2・HCl、および置換されたまたは置換されていないアルキルから選択される。破線aは、単結合または二重結合である。R3が=Oである場合、破線aは単結合である。Xは=N-および-NH-から選択され、aが二重結合である場合、Xは=N-であり、aが単結合である場合、Xは-NH-である。
【0115】
[0123] 関連した実施態様において、R2は、水素、F、および置換されたまたは置換されていない(C1-C5)アルキルから選択される。他の関連した実施態様において、R2は、水素、F、および置換されていない(C1-C5)アルキルから選択される。
【0116】
[0124] 他の関連した実施態様において、R1は、置換されたリボースおよび置換されたデオキシリボースから選択される。置換されたリボースおよび置換されたデオキシリボースは、細胞のDNAまたはRNAに見出されるリボースおよびデオキシリボース環と同一であってもよい。代わりに、置換されたリボースおよび置換されたデオキシリボースは、細胞のDNAまたはRNAに見出されるリボースおよびデオキシリボース環の類似体であってもよい。例えば、リボースの2’Cに結合したヒドロキシル基は、α-OHまたはβ-OHであってもよい。5’Cは、ヒドロキシル基、リン酸エステル基、リン酸ジエステル基、リン酸トリエステル基、またはこれらのリン酸エステル誘導体(例えば、リン酸チオエステル)と結合してもよい。
【0117】
[0125] 従って、他の模範的な実施態様において、抗新生物代謝拮抗物質塩基類似体は、以下の式を有する:
【化13】

【0118】
[0126] 式(XIV)において、R2、R3、Xおよびaは、式(XIII)において上記に定義した通りである。R5, R6, R7, R8,およびR9は、式(XII)において上記に定義した通りである。
【0119】
[0127] 他の模範的な実施態様において、抗新生物代謝拮抗物質塩基類似体は、メルカプトプリン、チオグアニン、アザチオプリン、フルダラビン、クラドリビン、ペントスタチン、フルオロウラシル、シタラビン、カペシタビン、ゲムシタビン、フロクスウリジン、およびこれらの誘導体から選択される。他の模範的な実施態様において、抗新生物代謝拮抗物質塩基類似体は、メルカプトプリン、チオグアニン、アザチオプリン、フルダラビン、クラドリビン、ペントスタチン、フルオロウラシル、シタラビン、カペシタビン、ゲムシタビン、およびフロクスウリジンから選択される。他の模範的な実施態様において、抗新生物代謝拮抗物質塩基類似体は、5-フルオロウラシル、シタラビン、およびゲムシタビンから選択される。
【0120】
D.ドセタキセル
[0128] 他の側面において、本発明は、抗新生物チオール結合性ミトコンドリアオキシダントおよびドセタキセル(またはその商業的名称、Taxotere(登録商標)で言及)を含む薬学的組成物を提供する。驚くべきことに、抗新生物チオール結合性ミトコンドリアオキシダントおよびドセタキセルの組み合わせは、相乗的な治療学的細胞毒性効果を示す。
【0121】
III.抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質の組み合わせについての相乗的な抗癌活性を試験するアッセイ
[0129] 他の側面において、本発明は、抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質の組み合わせが、相乗的な治療学的細胞毒性効果を有するか否かについて決定するアッセイを提供する。上記に定義されたように、「相乗的な治療学的細胞毒性効果」とは、少なくとも2つの化合物の組み合わせが、細胞毒性試験において相乗効果を示すことを意味する。
【0122】
[0130] 模範的実施態様において、相乗効果は、50パーセント有効原理を使用して評価される(Chou, etal., Adv Enzyme Regul 22 : 27-55 (1984) )。当該方法は、ミカエリスメンテンの速度式に基づいており、薬物の組み合わせの効果を数値的な指標、すなわち組み合わせ指数(C.I.)に変換する。組み合わせ指数が1未満である場合は、相乗効果ありと認められる。組み合わせ指数が1である場合は、単純な総和である。組み合わせ指数が1を超える場合は、拮抗作用が認められる。当業者は、C.I.値の範囲を超える組み合わせ効果を観察することもあるであろう。従って、薬物濃度範囲の少なくとも過半数において一貫性のある組み合わせのみが、相乗的薬剤、付加的薬剤、または拮抗的薬剤として分類される。
【0123】
[0131] 模範的な実施態様において、抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質の組み合わせ指数は、1.0未満である。他の模範的実施態様において、抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質の組み合わせ指数は、少なくとも0.9未満である。他の模範的実施態様において、抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質の組み合わせ指数は、少なくとも0.8未満である。他の模範的実施態様において、抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質の組み合わせ指数は、少なくとも0.7未満である。他の模範的実施態様において、抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質の組み合わせ指数は、少なくとも0.6未満である。
【0124】
[0132] 多数の生物学的アッセイは、最適な抗腫瘍活性についての化合物の特定の組み合わせの選択を評価および最適化するために利用可能である。腫瘍細胞に対する薬剤のインビトロでの浸漬、およびげっ歯類モデル、時には大型動物モデルにおけるインビボ抗腫瘍アッセイを含むこれらのアッセイは、おおよそ二つのグループに分けることができる。腫瘍細胞を用いたインビトロアッセイおよび動物モデルにおけるインビボアッセイの両方は、以下に議論される。そしてこれらのアッセイは、チオール結合性ミトコンドリアオキシダント、核酸結合性物質、または代謝拮抗物質塩基類似体が、抗新生物特性を示すか否かを決定するために等しく適用可能である。
【0125】
[0133] 抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質の組み合わせについてのインビトロでの細胞毒性アッセイは、動物、特にヒト起源の確立された腫瘍細胞株を使用するのが一般的である。これらの細胞株は、商業的な供給源、例えば、メリーランド州ベテスダにあるアメリカン タイプ ティシュー カルチャー ラボラトリー、および複数の研究所の腫瘍バンクから入手可能である。本発明の組み合わせ薬剤に対する浸漬は、温度、酸素および実験室で利用可能な栄養素について生理学的条件をシミュレートしながら行われ得る。これらのインビトロアッセイでは、例えば、1)コロニーの形成; 2)経時的な細胞分裂の単純な定量化; 3)無傷の細胞膜をもつ細胞では排除されるいわゆる「生」色素の取り込み; 4)増殖性(生存可能な)細胞への放射標識された栄養素の取り込みによって判断を行う。コロニー形成アッセイでは、確立された細胞株と、癌患者から外科的に取り出された新鮮な腫瘍生検の両方が使用される。このタイプのアッセイにおいて、細胞は典型的にはぺトリ皿の軟質ゲル上で増殖し、および細胞(>60μの大きさ)のコロニー数またはグループ数は、視覚的または自動化された画像分析系のいずれかでカウントされる。比較は、同一の条件のもとでコロニーを発達させることができる未処理のコントロール細胞と行われる。なぜなら、コロニーの形成は癌表現型の特徴の一つであり、悪性腫瘍細胞のみが固体マトリックスに付着せずにコロニーを形成するからである。従って、これは本発明のスクリーニング手順の組み合わせとして使用され得る。コロニー形成アッセイで得られた結果が同じ薬物での臨床試験の結果と一致することを示す多数の刊行物が存在する。
【0126】
[0134] 細胞の総数を数え上げる手法は、細胞株または新鮮な腫瘍生検のインビトロ試験で最も単純な手法である。このアッセイでは、細胞の凝集塊を典型的には脱凝集して単一の単位にする。これは、細胞の数を、顕微鏡用格子で目視で数えるかまたは自動化されたフローシステム(例えばフローサイトメトリーまたはCoulter(登録商標)カウンター)を使用して数えるためである。そして、コントロール(未処理)の細胞増殖率を、処理された(抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質の組み合わせ)細胞増殖率と比較する。また、生色素染色は、抗腫瘍アッセイの古くからあるホールマークの一つである。このタイプの手法において、細胞(未処理または抗癌剤で処理された細胞)は、無傷の(生存している)細胞を除いて色素(例えばメチレンブルー)にさらされる。色素で染色された細胞(死細胞または瀕死の細胞)の数を「分子」に、色素で染色されなかった細胞の数を「分母」にとる。これらは骨の折れるアッセイであり、要する時間および終点の相対的に非特異的な性質が原因で、現在ではあまり使用されていない。
【0127】
[0135] 生色素染色に加えて、放射標識された栄養素および/またはヌクレオチドの組み込みを利用して生存度を調べることができる。これは、火星で生命を探索するためにバイキング着陸船において使用された試験方法であり、生命活動の証拠として放射活性物質がどのくらいサンプル内に取り込まれるかということを生命活動の証拠とする。腫瘍細胞アッセイにおいて、典型的な実験では、(3H)トリチウムまたは14Cでラベルされたヌクレオチド(例えばチミジン)の取り込みが行われる。コントロール(未処理)の細胞では、単位時間当たりDNA成分がある量だけ取り込まれる。この取り込み速度を、薬物で処理された細胞における取り込み速度と比較する。これは、迅速かつ簡易な定量可能なアッセイであり、大きな(カウント可能な)コロニーを形成しない細胞で大変大きな利点を有する。但し、取り扱いや処分に不安の残る放射性同位元素を使用するという欠点もある。
【0128】
[0136] これらのタイプの試験に利用可能なヒトおよびげっ歯類腫瘍細胞株の大きな細胞バンクが存在する。国立癌研究所が行った最新の試験系では、60を超える確立された感受性かつ多剤耐性の多様な細胞サブタイプをもつヒト細胞株の細胞バンクを使用している。ここには、新規薬剤を試験するための、典型的には5〜6の確立されたおよび十分に特徴付けられた特定のサブタイプのヒト腫瘍細胞(例えば、肺癌の非小細胞または小細胞)が含まれる。Compare(登録商標)と呼ばれるグラフィック分析系を使用して、色素(スルホロダミンBまたはMTTテトラゾリウム色素)の取り込みに関する全体的感受性を役立たせる。この手法の特異的な終着点は、ヒト癌の一つの組織学的サブタイプにおいて独自の活性をもつ組み合わせを同定することである。さらに、複数の物質に対する抵抗性を示し、かつ幾つかの場合において多剤耐性ポンプ、p-糖タンパク質を発現することが知られているヒト癌の少数の亜系統が存在する。これらの耐性細胞を使用するアッセイは、NCIラボラトリーおよび全ての許認可された大学の研究室または個人的研究所からの化合物のスクリーニングについて現在進行中である。NCIアッセイの終了点は、スルホローダミンBと呼ばれるタンパク質色素の取り込み(付着腫瘍細胞について)であり、活性ミトコンドリア酵素におけるテトラゾリウム(青色)色素の還元である(非付着性、自由に浮遊するタイプの細胞について)。この後者の方法は、骨髄腫、白血病およびリンパ腫を含む血液学的な癌について特に有用である。
【0129】
[0137] 一般的には、ある薬物の組み合わせが、インビトロで腫瘍細胞の増殖(例えば、コロニーの形成または色素の取り込み)を阻害するある程度の活性を発揮したとき、抗腫瘍効果の実験がインビボで行われる。げっ歯類は、腫瘍増殖率および生存限界点が明確であり、かつこれらの動物は一般的にはヒトと同じタイプの毒性および薬物代謝パターンを示すので、抗腫瘍活性の最初のアッセイにもっぱら使用される。ここで、同系(同じ遺伝子系)の腫瘍は、典型的には脱凝集したカウント可能なドナー動物の組織片から収集され、その後に同系(同株)の宿主マウスに注入して戻した。ある程度の時間が経過した後、抗癌剤の組み合わせを腹腔内または静脈内に注入するかまたは経口投与する。腫瘍の増殖率および/または生存率を決定し、未処理の対照群、または抗新生物チオール結合性ミトコンドリアオキシダントもしくは第二の抗新生物物質のみを有する対照群と比較した。これらのアッセイにおいて、増殖率は、典型的には動物の側腹部前方において増殖する注入された腫瘍について測定を行う。腫瘍の垂直方向の直径は、腫瘍全体の質量または体積の予測値に変換される。予め定めた質量に到達するまでの時間を、未処理の対照群の動物において腫瘍増殖に必要とした時間と比較する。ある実施態様において、処理動物において所定の質量に到達するまでの時間が対照群と比較して>25%も増加した。他の実施態様において、処理動物において所定の質量に到達するまでの時間が対照群と比較して>42%も増加した。この著しい効果は、腫瘍増殖抑制効果とみなすことができる。非局在性の腫瘍、例えば白血病にとって、生存率は終了点として使用され得、処理動物と未処理動物(または溶媒処理対照群)との間で比較を行う。一般的には、陽性の新規物質による寿命の著しい増加もやはり>20〜42%に達する。早期の死は、任意の未処理の対照群が新規化合物について毒性を示す前に起こる。
【0130】
[0138] 全てのこれらのアッセイについて、抗癌剤の組み合わせについての試験は、致死量に非常に近い投与量および10%(LD10)および/または所定の許容限界値の投与量(著しい毒性を示すが同じ系統の動物において致死量には至らない量)で、同じ投与経路および同じ投与スケジュールで行われる。同じような研究がまた、ラット腫瘍モデルにおいて行われ得る。但し、ラットはマウスと比べて大型の動物で取り扱いが困難なので、マウスモデルほど好ましいとはいえない。
【0131】
[0139] ごく最近、ヒトの腫瘍が、種々の免疫欠損マウスモデルに移植された。ここで、nu/nuまたは「ヌード」マウスと呼ばれるマウスを使用してヒト腫瘍の増殖についてインビボアッセイが行われた。体毛がなく機能的な胸腺を欠くヌードマウスにおいて、ヒトの腫瘍(何百万の細胞)は、典型的には側腹部に注入され、その後ゆっくりと腫瘍の増殖が起こる。腫瘍塊の視認可能な発達は、「生着」と呼ばれる。抗癌剤は、その後幾つかの経路(IV, IM, SQ, PO)で腫瘍移植部位の末端に注入され、増殖率は、腫瘍の最も幅広の部分の垂直方向の測定によって計算される。多数のヒト腫瘍は、ヌードマウスモデルにおいてうまく「生着」することが知られている。但し、これらの動物は免疫不全が原因で介入性の感染症にかかり易い。代わりのマウスモデルには、重症複合型免疫不全症(SCID)(リンパ球の成熟が妨げられる)のマウスが含まれる。このため、SCIDマウスは、機能的なBおよびTリンパ球を産生しない。しかしながら、これらの動物は正常な細胞障害性T細胞の活性を有する。それにも関わらず、SCIDマウスは多数のヒト腫瘍を「生着」させる。SCID表現型の動物を、SCID表現型が維持されているならば最小量から検出不可能な微小量になるはずの血清中の免疫グロブリンの産生量を測定することによって「漏れ」についてスクリーニングする。一般的には上述したような腫瘍の測定および薬物の投与を行う。SCIDマウスの使用は、多くの場合においてヌードマウスの置き換えである。SCIDマウスは、より多くのヒト腫瘍を生着させる能力を有すると考えられ、かつ介入性の感染症に対する感受性が欠損している点でより丈夫であると考えられるからである。
【0132】
[0140] 薬剤耐性についての試験には、任意のインビトロおよびインビボモードが含まれ得る(但し、インビトロモードの方がより特徴づけられる)。これらの試験において、細胞の亜系統は、一般的にはインビトロまたは稀にインビボで抗癌剤の組み合わせの濃度を増加させながら連続的にさらすことによって特定の薬剤に対する耐性が強まる。いったん特定の薬剤に対する高度の耐性を獲得したら(一般的には>4〜5倍)、その細胞株の耐性のメカニズム(例えば、p-糖タンパク質または他のもののような多剤耐性膜ポンプの発現)についての研究をさらに進める。その後、特定の細胞株の反応パターンを発達させる従来の抗癌剤との交差耐性について試験が行われ得る。この細胞株を使用して、その後、その耐性細胞において潜在的な活性を有する新規薬剤について調べる。薬剤耐性のメカニズムの実証と、現存する化学療法剤に対する耐性を示すヒトの癌において効用を示す可能性のある薬剤の同定が可能である。つい最近、耐性のあるヒト腫瘍細胞の使用は、インビボモデルの多剤耐性ヒト多発性骨髄腫の発達を伴うSCIDマウスモデルにまで及んでいる。
【0133】
[0141] これらの試験系の全ては、抗癌剤の組み合わせの抗腫瘍活性を特徴づけるために、一般的にはインビトロからインビボへと移行する連続的な順番において組み合わされる。一般的には、どの腫瘍タイプが特定の組み合わせ薬剤に対して特に感受性が強いのか、逆に、どの腫瘍タイプがインビトロにおいて特定の組み合わせ薬剤に対する本質的な耐性を有するのかを見出すことが望まれる。この情報を使用して、実験がげっ歯類モデルにおいて計画され、インビトロでの活性を示す組み合わせが許容されるか否か、および動物内で活性を示すか否かについて評価を行う。動物における最初の実験には、一般的には毒性試験が含まれ、許容可能な投与計画を決定し、その後にその投与計画を使用して上述した抗腫瘍効果を評価する。これらの二つのタイプのアッセイで活性を示す薬剤の組み合わせについて、SCIDまたはヌードマウス内で増殖するヒト腫瘍における試験を行う。ここで活性が確認される場合、これらの薬剤の組み合わせは、潜在的な臨床薬剤の開発の候補になる。
【0134】
IV.抗新生物チオール結合性ミトコンドリアオキシダントの特徴を測定するためのアッセイ
[0142] 上述したように、本発明の抗新生物チオール結合性ミトコンドリアオキシダントは、癌の増殖を阻害または防止する化合物であり、チオール基と結合することができ、酸化ストレスおよびミトコンドリアの細胞膜電位の乱れを促進する。ある実施形態において、抗新生物チオール結合性ミトコンドリアオキシダントは、リボヌクレオチドレダクターゼ阻害剤の活性を阻害または減少させる。ある化合物が抗腫瘍活性を示すか否かを決定するのに有用な細胞毒性試験については、上述したとおりである(抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質の組み合わせの抗癌剤の相乗的な活性について試験するためのアッセイを参照)。他の特徴を測定するためのアッセイについては以下に記載する。
【0135】
A.チオール結合アッセイ
[0143] チオール含有分子に結合する試験化合物の能力は、水溶液中の前記試験化合物をチオール含有分子(例えば、システインまたはグルタチオン)と混合することによって評価され得る。前記溶液をチオール基と試験化合物とが結合して反応産物を形成するのに十分な時間にわたってインキュベートする。十分な時間をかけて混合物をインキュベーションした後、任意の適切な分離方法 (例えば、 薄層クロマトグラフィー(TLC))を前記溶液上で行い反応産物を単離する。反応産物を単離した後、該反応産物を任意的にはさらに精製する(例えば、ろ過)。そして、任意の適切な技術、例えば核磁気共鳴法または質量分析法を使用して検出を行う。
【0136】
[0144] 適切な反応時間、反応溶媒、および溶出溶媒の選択は、化学および生化学分野の当業者にとって周知である。チオール結合性アッセイのさらなる詳細な議論は、Iyengar et al., J. Med. Chem. 47: 218-223 (2004)に与えられる。
【0137】
B.酸化ストレスおよびミトコンドリア膜電位のアッセイ
[0145] 酸化ストレスの存在は、酸化されたヌクレオチドと結合することができる抗体(例えば、十分に特徴づけられたモノクローナル抗体8-OHdG)を使用して評価され得る。適切な細胞株、例えばミエローマ細胞は、様々な時間地点において試験化合物で処理され得る。次に、細胞はホルムアルデヒドで固定され得、続いてメタノールで透過化処理される。次に、細胞を適切な抗酸化ヌクレオチド抗体で免疫処理し、任意の適切な検出技術、例えば第二抗体系(例えばビオチン化された第二抗体と、続くCy5-共役ストレプトアビジンの添加)を使用して視覚化する。核の局在性は、適切な核染色、例えばYOYO-1(登録商標)染色(Molecular Probes)を使用して達成され得る。共焦点レーザー顕微鏡を使用してミトコンドリア細胞区画内の酸化ダメージを視覚化する。
【0138】
[0146] ミトコンドリア膜電位(MMP)の喪失は、ダメージのないミトコンドリア内への陽イオン荷電色素の取り込みと保持に基づいたフローサイトメトリーによって測定され得る。有用な色素の例には、CMX-Ros として知られたMitoTracker Red(登録商標)、およびJC-1 (共にMolecular Probes, Eugene ORから利用可能)が含まれる。色素は、原形質膜を通して消極的に拡散し、負に帯電した内膜環境を保持する損傷のない膜をもつミトコンドリア内に取り込まれて優先的に染色を行う。MMPが低下するとき、色素のシグナル強度は、対照細胞群におけるダメージのないミトコンドリアと比較して減少する。JC-1試薬は、MMPが喪失してミトコンドリア内膜が消極したときに、赤色から緑色までの蛍光発光シフトを受ける。MMPアッセイのより詳細な議論については、Decaudin et al., Cytometry 25: 333-340 (1996);およびManzini et al., J Cell Biol 138: 449-469(1997)を参照されたい。
【0139】
[0147] 酸化ストレスおよびミトコンドリア膜電位を測定するアッセイのさらなる詳細は、Dvorakova et al., Neoplasia 97: 3544-3551 (2001), Dvorakova et al., Biochemical Pharmacology 60: 749-758 (2000), Dvorakova etal., Anti-Cancer Drugs 13: 1031-1042 (2002),およびDvorakova et al., Molecular Cancer Therapeutics 1: 185-195 (2002)に見出すことができる。
【0140】
C.リボヌクレオチドレダクターゼ活性アッセイ
[0148] リボヌクレオチドレダクターゼ(RNR)活性は、先ず最初に細胞培養物を適切な試験化合物と接触させることによって測定され得る。次に、細胞を収集し、細胞溶解物を適切な技術によって精製して、デオキシシチジン(RNR活性の特定の産物)およびリン酸化後のシチジンを分離する(例えば、Affigel 601カラムまたは高分離能のHPLC C-18カラム)。デオキシシチジン産物の量を測定し、試験化合物を添加していない細胞によって生成された産物の量と比較する。その結果、RNR活性を阻害または低下させる試験化合物の能力を決定する。
【0141】
[0149] 代わりにの方法において、デオキシリボヌクレトチド(RNR 活性の産物)が、DNAポリメラーゼ反応とのカップリングを介して検出される。内因性RNAを分解するRNAseを使用すると検出感度が高くなる。
【0142】
[0150] RNR活性アッセイのより詳細な議論については、Wright et al., Adv Enzyme Regul 19: 105-127 (1981); およびJong et al., J Biomed Sci 5: 62-68(1998)を参照されたい。
【0143】
V.投与
[0151] 本発明の薬学的組成物は、体内でより容易に分散および溶解されるように微細化または粉末化され得る。薬物を粉砕または微粉砕する方法は、当業者に周知の方法、例えばハンマー・ミルまたは類似の製粉装置を使用する。
【0144】
[0152] 内部投与に適した投与形態(組成物)には、単位当たり約1.0ミリグラム〜約5000ミリグラムの活性成分が含まれる。これらの薬学的組成物において、活性成分は、組成物の総重量に基づいて約0.5〜約95重量%の量で存在してもよい。投与形態を示す他の表記には、体表面積(BSA)の平方メートル当たりのmg(mg/m2)がある。典型的には、大人は約1.75m2のBSAを有する。患者の体重に基づいて、投与は、一日または一週間当たり一以上の投与が数回行われる。薬学的に効果的な量を達成するために、複数の投与単位が必要となり得る。例えば、投与形態が1000mgであり、かつ患者の体重が40kgである場合、一つの錠剤またはカプセル錠は患者の体重1kg当たり25mgの投与を与える。患者の体重が80kgである場合は12.5mg/kgの投与を与える。
【0145】
[0153] 一般的な手引きとして、ヒトについては、体重1キログラム(kg)当たり約1ミリグラム(mg)〜体重1 kg当たり約10000 mgが、薬学的に効果的な投与量として適切である。好ましくは、約5 mg/kg 〜約2500 mg/kg体重が使用される。他の好ましい投与量範囲は、25 mg/kg〜約1000 mg/kg体重である。しかしながら、体重1キログラム(kg)当たり約2ミリグラム(mg)〜体重1kg当たり約400 mgの投与量が、幾つかの癌を治療するのに適している。
【0146】
[0154] 静脈注入では、投与の最も好ましい速度は、定速注入中において約1〜約1000 mg/kg/分の範囲とすることができる。本発明の薬学的組成物は、一日一回で投与され得、あるいは一日の投与量の合計を二回、三回、または四回に分けて投与してもよい。抗新生物チオール結合性ミトコンドリアオキシダントは、一般的には一日一回以上の投与回数から一週間当たり1回〜3回の投与回数で与えられる。
【0147】
[0155] 本発明の薬学的組成物は、利用可能な全ての従来の方法によって投与される。特に、本発明の薬学的組成物は、個々の治療学的薬剤として、あるいは他の治療学的薬剤との組み合わせにおいて、医薬との組み合わせにおける使用についての利用可能な全ての従来の方法によって投与される。
【0148】
[0156] 癌治療における抗新生物チオール結合性ミトコンドリアオキシダントと第二の抗新生物物質の投与量および同定は、それぞれ患者の反応および生理機能、副作用の型および重症度、疾患の治療経過、好ましい投与計画、患者の予後または他の因子に基づいて変化し得る。
【0149】
[0157] 抗新生物チオール結合性ミトコンドリアオキシダントと第二の抗新生物物質の割合は、所望の治療学的効果、観察される副作用、または医療従事者に周知の考慮すべき事項に基づいて、必要に応じて変化させ得る。一般的には、抗新生物チオール結合性ミトコンドリアオキシダント対第二の抗新生物物質の割合は、重量ベースで約0.5% : 99.5%〜約99.5% : 0.5%の範囲とすることができる。模範的な実施態様において、その割合は、約20% : 80%〜約80% : 20%の範囲にある。他の模範的実施態様において、その割合は、約40% : 60%〜約60% : 40%の範囲にある。他の模範的実施態様において、その割合は、約45% : 55%〜約55% : 45%の範囲にある。他の模範的実施態様において、その割合は、約50% : 50%である。
[0158] 第二の抗新生物物質の前または後に抗新生物チオール結合性ミトコンドリアオキシダントが投与されるとき、抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質の各投与量および投与計画は変化し得る。補助的または組み合わせ療法は逐次的とすることができる。すなわち、抗新生物チオール結合性ミトコンドリアオキシダントで治療した後、第二の抗新生物物質で治療を行う(あるいはその逆)。また、抗新生物チオール結合性ミトコンドリアオキシダントと第二の抗新生物物質を実質的に同時に投与する同時治療が可能である。逐次的な療法は、抗新生物チオール結合性ミトコンドリアオキシダントを投与した後、抗新生物物質を投与する前の適切な時間内に行うことができる。一方、同時療法における同時的な両薬剤での治療は、同日投与または別投与とすることができる。
【0150】
[0159] 正確な投与計画は、治療対象の疾患、疾患の重症度および治療に対する反応に依存する。例えば、抗新生物チオール結合性ミトコンドリアオキシダントの完全な投与計画は、第二の抗新生物物質の完全な投与計画の前または後に投与され得る。あるいは、抗新生物チオール結合性ミトコンドリアオキシダントと第二の抗新生物物質との交互の投与が行われ得る。さらなる例として、抗新生物チオール結合性ミトコンドリアオキシダントは、第二の抗新生物物質と同時に投与され得る。
【0151】
[0160] 第二の抗新生物物質、薬学的キャリアの同定、および抗新生物チオール結合性ミトコンドリアオキシダントの投与量は、哺乳類の生物種およびその体重と、治療対象の癌またはウイルス感染の種類に基づいて幅広く変化し得る。投与量は、既知の因子、例えば特定の第二の抗新生物物質およびその投与の仕方および経路の薬力学的特性;年齢、性別、代謝速度、吸収効率、患者の健康および体重;症状の性質および程度;同時治療の種類;治療の回数;および所望の治療学的効果に依存して変化し得る。
【0152】
[0161] 抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質は、単一の投与形態で一緒に投与され得るか、または二以上の異なる投与形態で別々に投与され得る。これらは、使用される投与形態に依存して、それぞれ独立して同じ投与経路または二以上の異なる投与経路によって投与され得る。
【0153】
[0162] 適切な薬学的組成物および投与形態には、好ましくは抗新生物チオール結合性ミトコンドリアオキシダントと、任意的には抗癌剤または抗ウイルス化合物とが含まれる。抗新生物チオール結合性ミトコンドリアオキシダント対抗癌剤または抗ウイルス化合物の割合は、重量ベースで約1 : 0.01〜10 : 1、および好ましくは1 : 0.05〜1 : 1の範囲内とすることができる。
【0154】
[0163] 抗癌剤または抗ウイルス化合物の投与およびその範囲は、特定の薬剤または化合物、および癌の種類またはウイルス感染の種類に依存するであろう。当業者は、適切な投与を突き止めることができるであろう。
【0155】
VI.投与形態
[0164] 投与単位には、単一の化合物、または抗新生物チオール結合性ミトコンドリアオキシダントと一以上の第二の抗新生物物質との混合物が含まれ得る。抗新生物チオール結合性ミトコンドリアオキシダントは、経口投与形態、例えば錠剤、カプセル、錠剤、粉、顆粒、エリキシル、チンキ、懸濁液、シロップおよびエマルジョンのような経口投与形態で投与され得る。抗新生物チオール結合性ミトコンドリアオキシダントまたは第二の抗新生物物質はまた、静脈内(ボーラスまたは注入)、腹腔内、皮下内、筋肉内形態、または製薬分野において通常の知識を有する者に周知の全ての投与形態で投与され得る。
【0156】
[0165] 抗新生物チオール結合性ミトコンドリアオキシダントまたは第二の抗新生物物質は、典型的には、投与の意図された形態に関して適切に選択され、かつ従来の薬学的プラクティスと一致した適切な薬学的希釈剤、増量剤、賦形剤またはキャリア(薬学的に許容可能なキャリアまたはキャリア材料として本明細書で集合的に言及される)との混合形態で投与される。単位体は、経口投与、直腸投与、局所的投与、静脈内注入または非経口投与に適した投与形態になるであろう。
【0157】
[0166] 薬学的組成物は単独で投与され得るかまたは薬学的に許容可能なキャリアと混合し得る。このキャリアは、固体または液体とし得、キャリアのタイプは一般的には使用される投与のタイプに基づいて選択される。
【0158】
[0167] 本発明の経口投与形態を処方するのに使用され得る薬学的に許容可能なキャリアおよび賦形剤の特定の例は、当業者に周知である。例えば米国特許第3,903,297号を参照されたい(全ての目的についてのその全体における参照によって本明細書中に組み込まれる)。本発明に有用な投与形態を作るための技術および組成物もまた、当業者に周知である。例えば、7 Modern Pharmaceutics, 第9章および10章(Banker & Rhodes, Eds., 1979); Pharmaceutical Dosage Forms : Tablets (Lieberman et al.,1981) ; Ansel, Introduction to Pharmaceutical Dosage Forms 2nd Ed. (1976); Remington's Pharmaceutical Sciences, 17th ed. (Mack Publishing Company, Easton, Pa., 1985); Advances in Pharmaceutical Sciences (David Ganderton, Trevor Jones, Eds., 1992); Advances in Pharmaceutical Sciences Vol 7. (David Ganderton, Trevor Jones, James McGinity, Eds., 1995); Aqueous Polymeric Coatings for Pharmaceutical Dosage Forms (Drugs and the Pharmaceutical Sciences, Series 36 (James McGinity, Ed., 1989) ; Pharmaceutical Particulate Carriers : Theapeutic Applications : Drugs and the Pharmaceutical Sciences, Vol. 61 (Alain Rolland, Ed., 1993); Drug Delivery to the Gastrointestinal Tract (Ellis Horwood Books in the Biol
ogical Sciences. Pharmaceutical Technologyのシリーズ; J. G. Hardy, S. S. Davis, Clive G. Wilson, Eds. ); Modern Pharmaceutics Drugs and the Pharmaceutical Sciences, Vol 40 (Gilbert S. Banker, Christopher T. Rhodes, Eds.) を参照されたい。これらの全てが全ての目的についてのその全体における参照によって本明細書中に組み込まれる。
【0159】
[0168] 錠剤には、適切なバインダー、潤滑油、崩壊剤、着色剤、香味剤、流動性誘導剤、および溶融剤が含まれ得る。例えば、錠剤またはカプセル錠の投与単位形態における経口投与について、活性薬剤成分は、経口性で、非毒性、薬学的に許容可能な不活性キャリア、例えばラクトース、ゼラチン、寒天、デンプン、スクロース、グルコース、メチルセルロース、ステアリン酸マグネシウム、燐酸カルシウム、硫酸カルシウム、マンニトール、ソルビトール等と組み合わせることができる。適切なバインダーには、デンプン、ゼラチン、天然糖、例えばグルコースまたはβ乳糖、コーン甘味料、天然および合成ガム、例えばアカシア、トラガカントゴムまたはアルギン酸ナトリウム、カルボキシメチルセルロース、ポリエチレングリコール、ワックス等が含まれる。これらの投与形態において使用される潤滑剤には、オレイン酸ナトリウム、ステアリン酸ナトリウム、ステアリン酸マグネシウム、安息香酸ナトリウム、酢酸ソーダ、塩化ナトリウム等が含まれる。崩壊薬には、デンプン、メチルセルロース、寒天、ベントナイト、キサンガム等が含まれるがこれらに限定されない。
【0160】
[0169] 薬学的組成物はまた、リポソーム送達系、例えば小さな単層のベシクル、大きな単層のベシクルおよび多層のベシクルの形態で投与され得る。リポソームは、種々のリン脂質、例えばコレステロール、ステアリールアミン、またはホスファチジルコリンから形成され得る。
【0161】
[0170] 薬学的組成物はまた、標的薬剤キャリアまたはプロドラッグとして可溶性ポリマーと結合し得る。適切な可溶性ポリマーには、ポリビニルピロリドン、ピランコポリマー、ポリヒドロキシルプロピルメタクリルアミド-フェノール、ポリヒドロキシエチルアスパルタ-ミデフェノール、およびパルミトイル残基で置換されたポリエチルエンオキシド-ポリリシンが含まれる。さらに、抗新生物チオール結合性ミトコンドリアオキシダントは、薬剤の制御された放出を達成するのに有用な生分解性ポリマーの一群、例えば、ポリ乳酸、ポリグリコール酸、ポリ乳酸とポリグリコール酸のコポリマー、ポリイプシロンカプロラクトン、ポリヒドロキシ酪酸、ポリオルトエステル、ポリアセタ−ル、ポリジヒドロピラン、ポリシアノアシラート、およびヒドロゲルの架橋性または両親媒性のブロックコポリマーと結合し得る。
【0162】
[0171] 活性成分は、固体投与形態(例えばカプセル剤、錠剤および粉末)または液体投与形態(例えば、エリキシル、シロップおよび懸濁液)で経口投与され得る。また、無菌の液体投与形態で非経口的に投与され得る。
【0163】
[0172] ゼラチンカプセル剤には、活性成分および粉末キャリア、例えばラクトース、デンプン、セルロース誘導体、ステアリン酸マグネシウム、ステアリン酸等が含まれ得る。類似の希釈剤には、圧縮された錠剤を製造するために使用され得る。錠剤およびカプセル錠の両方は、即効性の製品または数時間にわたる薬剤の持続的放出を提供する徐放性の製品として製造され得る。圧縮された錠剤は、全ての不快な味を隠し、かつ空気から錠剤を保護するために糖質コートまたはフィルムコートがなされ得、あるいは胃腸管における選択的分解のために腸溶性コートがなされ得る。
【0164】
[0173] 液体投与形態における経口投与について、経口薬剤成分は、経口性で、非毒性、薬学的に許容可能な全ての不活性キャリア、例えばエタノール、グリセロール、水等と組み合わせられる。適切な液体投与形態の例には、溶液または水の懸濁液、薬学的に許容可能な油脂、アルコールまたはエステルを含む他の有機溶媒、エマルジョン、シロップまたはエリキシル、懸濁液、非沸騰性の顆粒から再構成された溶液および/または懸濁液、および沸騰性の顆粒から再構成された沸騰性の製剤が含まれる。このような液体投与形態には、例えば適切な溶剤、防腐剤、乳化剤、懸濁剤、希釈剤、甘味料、増粘剤および溶融剤が含まれる。
【0165】
[0174] 経口投与についての液体投与形態には、患者の許容性を高めるために着色剤および香味剤が含まれ得る。一般的には、水、適切な油、食塩、水溶性ブドウ糖(グルコース)、および関連した糖液およびグリコール(例えば、プロピレングリコールまたはポリエチレングリコール)が、非経口溶液のための適切なキャリアである。非経口投与のための溶液には、好ましくは活性成分の水溶性の塩、適切な安定化剤、および必要に応じてバッファー物質が含まれる。抗酸化剤、例えば亜硫酸水素ナトリウム、亜硫酸ナトリウムまたはアスコルビン酸(単独または組み合わされた)は、適切な安定化剤である。クエン酸およびその塩類およびナトリウムEDTAがまた使用される。さらに、非経口溶液には、防腐剤、例えばベンズアルコニウムクロリド、メチル-またはプロピル-パラベン、およびクロロブタノールが含まれ得る。適切な薬学的キャリアは、この分野における標準的な参照テキストであるRemington's Pharmaceutical Sciences, Mack Publishing Companyに記載されている。
【0166】
[0175] 薬学的組成物はまた、適切な鼻腔内ビヒクルの使用を介して鼻腔内形態で投与され得るか、または当業者に周知の経皮パッチの形態を使用して経皮性経路を介して投与され得る。経皮送達系の形態で投与されるために、投薬は、一般的には投与計画の間中、断続的ではなく連続的であろう。
【0167】
[0176] 非経口的形態および静脈内注入形態にはまた、選択された注入または送達系のタイプと適合するミネラルおよび他の物質が含まれ得る。
【0168】
[0177] 抗新生物チオール結合性ミトコンドリアオキシダントの投与のための有用な薬学的投与形態は、以下のように例証される。
【0169】
A.カプセル錠
[0178] 多数のカプセル錠の単位体は、標準的な二片性の硬質ゼラチンカプセルを、各々10〜500 ミリグラムの粉末状活性成分、5〜50ミリグラムのセルロース、および6ミリグラムのステアリン酸マグネシウムで充填させることによって調製される。
【0170】
B.軟質ゼラチンカプセル錠
[0179] 消化可能な油、例えばダイズ油、綿実油またはオリーブ油中の活性成分の混合物が調製され、ポジティブ置換ポンプによってゼラチンに注入され、100〜500ミリグラムの活性成分を含む軟質ゼラチンカプセル錠を形成する。カプセル錠は洗浄されて乾燥される。
【0171】
C.錠剤
[0180] 多数の錠剤は、投与単位体が100〜500ミリグラムの活性成分、0.2ミリグラムのコロイド状二酸化珪素、5ミリグラムのステアリン酸マグネシウム、50〜275ミリグラムの微結晶性セルロース、11ミリグラムのデンプンおよび98.8ミリグラムのラクトースとなるように、従来の手順によって調製される。適切なコーティングを施して、嗜好性を高めたり吸収性を遅らせたりすることができる。
【0172】
D.注入可能な溶液
[0181] 注入による投与のために適した非経口的組成物は、1.5重量%の活性成分を10重量%のプロピレングリコールおよび水中で攪拌することによって調製される。溶液は、塩化ナトリウムで等張液に調製され滅菌される。
【0173】
E.懸濁液
[0182] 水性懸濁液は、5ml当たり、100 mg の微細分割された活性成分、200mgのカルボキシルメチルセルロースナトリウム、5mgの安息香酸ナトリウム、1.0gのソルビトール液、U.S.P、および0.025mlのバニリンが含まれるように経口投与用に調製される。
【0174】
F.キット
[0183] 本発明にはまた、例えば癌の治療に有用な薬学的キットが含まれる。該キットには、薬学的有効量の抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質を含む薬学的組成物を含む一以上の容器が含まれる。該キットには、さらに望ましくは一以上の様々な従来の薬学的キット部品、例えば一以上の薬学的に許容可能なキャリアを含む容器、追加の容器等が含まれる。これらは当業者にとって自明であろう。投与される成分の量の指示、投与についてのガイドライン、および/または成分を混合するためのガイドラインとなる印刷された説明書(挿入紙またはラベル紙)がまた、キット内に含まれ得る。特異的な材料および条件が本発明を実施するためには重要であるが、非特異的な材料および条件もまた、それらが認知される発明の利益を妨げない限りにおいて排除されないことを理解すべきである。
【0175】
[0184] 薬学的なキャリアは、固体または液体であり得、そのタイプは一般的には使用される投与のタイプに基づいて選択される。活性化薬剤は、凝集化粉末として、錠剤またはカプセル錠、リポソームの形態において共投与され得るかまたは液体形態において共投与され得る。適切な固体キャリアの例には、ラクトース、スクロース、ゼラチンおよび寒天が含まれる。カプセル錠または錠剤は容易に処方され得、嚥下または咀嚼が容易なように調製され得る。他の固体形態には、顆粒および原末が含まれる。錠剤には、適切なバインダー、潤滑油、希釈剤、崩壊剤、着色剤、香味剤、流動性誘導剤、および溶融剤が含まれ得る。適切な液体投与形態の例には、溶液または水中の懸濁液、薬学的に許容可能な油脂、アルコールまたはエステルを含む他の有機溶媒、エマルジョン、シロップまたはエリキシル、懸濁液、非沸騰性の顆粒から再構成された溶液および/または懸濁液、および沸騰性の顆粒から再構成された沸騰性の製剤が含まれる。このような液体投与形態には、例えば適切な溶剤、防腐剤、乳化剤、懸濁剤、希釈剤、甘味料、増粘剤および溶融剤が含まれる。経口投与形態には、任意的には香味剤および着色剤が含まれる。非経口的および静脈内注入形態にはまた、選択された注入または送達系のタイプと適合するミネラルおよび他の物質が含まれ得る。
【0176】
VII.治療の方法
[0185] 治療の方法には、治療対象の特定の癌または腫瘍タイプの治療に効果的である任意の適切な方法にし得る。治療は、経口投与、直腸投与、局所的投与、非経口投与または静脈内注入投与され得、または腫瘍または癌への直接注入によって投与され得る。効果的な量を加える方法はまた、治療対象の疾患または疾病に基づいて変化する。適切なキャリア、追加の癌阻害化合物、投与を容易にする化合物または希釈剤とともに処方された、抗新生物チオール結合性ミトコンドリアオキシダントの静脈内、皮下内または筋肉内注入による非経口的治療方法は、温血動物に対して化合物を投与する好ましい方法であると考えられる。
【0177】
[0186] 当業者は、インビトロおよびインビボの両方で既知の癌細胞株を使用するルーチン的スクリーニングを通して突き止めることができる。細胞株は、American Tissue Type Cultureまたは他の研究室から入手可能である。
【0178】
[0187] 以下の例は例証であり、発明を制限することを意図するものではない。
【0179】
A.薬学的処方に対する反応の測定
[0188] 腫瘍の大きさは、腫瘍塊についてのx線写真、コンピュータ化された断層撮影(CATスキャン)、核磁気共鳴(NMR)スキャンまたは直接的な物理的触診を用いた腫瘍の客観的走査によって治療の前に評価される。代わりに、腫瘍は、マーカー物質、例えば大腸癌からのアルファフェトプロテイン、卵巣癌からのCA125抗原、または多発性骨髄腫からの血清ミエローマ"M"タンパク質を分泌する可能性がある。これらの分泌された生成物のレベルは、計算される腫瘍の大きさの推定を可能にする。腫瘍の大きさについてのこれらの直接的および間接的な測定は、治療前に行われ、その後、薬剤を投与した後に間隔を空けて繰り返される。これらは、客観的な反応が得られたか否かを判断するためである。癌治療の客観的な反応は、一般的には測定可能な腫瘍疾患の>50%への収縮(部分的な反応)を示すかまたは全ての測定可能な疾患の完全な消失(完全な反応)を示す。典型的には、真に部分的反応または完全な反応として分類されるこれらの反応は、一定の期間、典型的には一ヶ月にわたって維持されなければならない。さらに、腫瘍の急速な増殖の安定化が起こり得、または<50%への腫瘍の収縮が起こり得、小さな反応または安定な疾患と称される。一般的には、生存率の増加は、治療に対する完全な反応を得られたことに付随するが、あるケースでは、部分的な反応が長期間にわたって維持される場合、部分的な反応もまた患者の生存率の増加に貢献し得る。患者が受ける化学療法はまた、典型的にはこれらの疾患の程度に応じて「始動」される。その前および後に、化学療法がこの疾患の程度が変化したかどうかをみるために再始動される。幾つかの状況において、腫瘍は、十分に収縮し、かつ転移が起こらなければ、化学療法の後に外科的切除が可能である。広範な疾患のため外科的切除を前もって行うことはできない。このケースにおいて、新規な薬学的組成物での化学療法的治療は、潜在的に治療的手術に対する補助として使用される。さらに、患者は、症候性の問題、例えば痛みを発生させる、脊椎または他の場所に特有の病変を有している場合があり、これらの病変に対しては局所的な放射線療法を行う必要がある。これは、本発明の全身性薬学的組成物の連続的使用に付け加えて行われ得る。
【0180】
B.毒性の評価と投与計画の設定
[0189] 患者は、各コースの化学療法で毒性について評価される。典型的には、肝臓の機能的酵素および腎臓の機能的酵素についての効果、例えばクレアチニンの清掃率またはBUNを調べる。また、骨髄についての効果、典型的には感染症と戦うのに重要な顆粒球の抑制および/または止血または鬱血のために重要な血小板の抑制を調べる。骨髄抑制性薬剤を投与すると、正常な血球数の最下点に治療後1〜3週の間に達する。その後、1〜2週間を過ぎると回復する。正常な白血球数の回復に基づいて、治療が再開される。
【0181】
[0190] 一般的には、完全なおよび部分的な反応は、腫瘍細胞の数において少なくとも1〜2 logの減少で評価される(90〜99%の効果的な療法)。進行した癌をもつ患者を診断すると、典型的には>109の腫瘍を有する。腫瘍の大きさを非常に小さな状態まで減らし、可能であれば疾患の治癒を得るために、複合的な治療が必要になる。
【0182】
C.患者の臨床的管理
[0191] 数週間にわたる連続的な薬剤投与を含む新規な薬学的処方での治療サイクルの終わりに、患者は、治療に対する反応(完全な緩解および部分的な緩解)、血液作業によって測定される毒性、および通常の健康状態に分類されるパフォーマンス状態または生活の質について評価される。後者には、患者の通常の活性レベルと正常な日々の機能を担うその能力が含まれる。反応の強力な予測値となることが見出され、幾つかの抗癌剤は、実際には顕著な腫瘍の収縮を引き起こさずにパフォーマンス状態および通常の健康感を向上させ得る。代謝拮抗物質ゲムシタビンは、全体的な生存率を変化させずに生活の質を向上させるかまたは高い客観的な反応速度を生み出す膵臓癌で認められた薬剤の一例である。従って、治癒されない幾つかの癌では、薬学的処方は、疾患の完全な緩解または部分的な緩解に影響を与えずに、顕著な利益、健康なパフォーマンス状態等を同様に与えるであろう。
【0183】
[0192] 血液学的な疾患、例えば多発性骨髄腫、リンパ腫および白血病において、反応は、腫瘍直径の測定を介しては評価されない。これらの疾患は、体のリンパ性および血行性領域全体にわたって広く転移しているからである。従って、これらの拡散して広がった疾患に対する反応は、一般的には骨髄生検の結果によって評価される。異常な腫瘍細胞胚の数が定量され、完全な反応は、骨髄生検試料における全ての腫瘍細胞の検出の喪失(例えば、微視的検出)によって示される。B細胞腫瘍では、多発性骨髄腫の血清マーカー、Mタンパク質が電気泳動法によって測定され得、Mタンパク質が実質的に減少した場合、原発性腫瘍の反応の証拠になる。再び多発性骨髄腫において、骨髄生検は、試料中に存在する異常な腫瘍形質細胞の数を定量するのに使用され得る。これらの疾患について、一般的により高い投与療法が、骨髄および/またはリンパ区画における反応に影響を与えるために使用される。
【0184】
[0193] 新規な薬学的処方についての計画された臨床用途は、肺癌、乳癌、悪性黒色腫、エイズ関連のリンパ腫、多剤耐性の(MDR)腫瘍(骨髄腫、白血病、乳癌および大腸癌)、前立腺癌、多発性骨髄腫、Bリンパ球プラズマ細胞腫、進行段階の卵巣上皮細胞癌、転移性黒色腫、リンパ様および非リンパ系の起源の白血病、転移性の大腸癌、乳癌および転移性の肺癌、および内分泌および外分泌膵臓の腫瘍についての治療である。
【0185】
[0194] 本明細書中に使用された用語および表現は制限を課すものではなく、これらの用語および表現の使用は、記載された特徴の等価物またはその一部を排除することを意図するものではない。様々な修飾が本発明の範囲内で可能であることが認識される。さらに、本発明の任意の実施態様の一以上の特徴は、本発明の範囲を逸脱しない範囲において、本発明の他の実施態様の一以上の特徴と組み合わせ得る。例えば、本発明の相乗的な組み合わせの特徴は、疾患状態を治療する方法および/または本明細書中に記載された薬学的組成物に等しく適用可能である。本明細書中で引用された全ての刊行物、特許、および特許出願は、全ての目的についてその全体が参照によって本明細書中に組み込まれる。
【0186】
例
[0195] 以下、本発明を例証するが本発明はこれらの例に制限されない。
【0187】
材料
[0196] イメキソンを、国立癌研究所から寄付を受け、Seres Laboratories Incorporated (Santa Rosa, CA)によって製造した。シスプラチンを、Bayer Corp (Spokane, WA)から得た。シタラビンを、Bedford Laboratories (Bedford, OH)から購入した。デキサメタゾンを、Sigma(St. Louis, MO)から購入した。ドキソルビシンを、Fujisawa USA (Deerfield, IL)から得た。ダカルバジン(DTIC)を、Bayer Corp (West Haven, CT)から購入した。5-フルオロウラシルを、Allergan Inc.(Irvine, CA)から購入した。ゲムシタビンを、Eli Lilly and Co(Indiana, IN)から購入した。メルファランおよびビノレルビン(vinorelbine)を、Glaxo Wellcome, Inc.(Research Triangle Park, NC)から購入した。メトトレキセートを、Bristol(Syracuse, NY)から得た。パクリタキセルを、Bristol (Princeton, NJ)から購入した。タキソテールを、Aventis(Collegeville, PA)から得た。
【0188】
[0197] ヒト悪性黒色腫A375細胞およびヒト骨髄腫8226細胞は、American Type Culture Collection (Rockville, MD)から得られた。急性骨髄性白血病(KG-1)細胞は、Alan List博士(アリゾナ大学, Tucson, AZ)によって好意的に提供された。膵臓癌細胞系統、MiaPaCaは、Daniel Von Hoff 博士(アリゾナ大学, Tucson, AZ)によって好意的に提供された。37℃の5% C02を含む加湿されたインキュベーター内において、10%(v/v)熱不活性化ウシ血清(Hyclone Laboratories, Logan, UT)、2mM L-グルタミン、ペニシリン(100 U/ml)およびストレプトマイシン(100 μg/ml)で増強されたRPMI1640培地(Gibco-BRL Products, Grand Island, NY)中で全ての細胞株の培養を行った。
【0189】
[0198] メスのSCID(c.B-17/lcrACC SCID)マウス(5〜6)週齢を、アリゾナ大学の動物ケア施設および使用委員会によって承認されたプロトコルのもと、アリゾナ大学の動物ケア施設(Tucson, AZ)によって管理され、実験動物ケアの全米協会のガイドラインに基づいて飼育された育種コロニーから購入した。標準的な小さな隔離飼育器内の木片の床敷きの上でマウスを飼育した。そして、Isoblox (Harlan/Teklad, Madison, WI)を与えた。マウスには、標準的なげっ歯類の固形飼料 (Harlan/Teklad, Madison, WI)および無菌水を自由に与えた。その間、12時間/12時間の昼/夜のスケジュールで管理を行った。アリゾナ大学の動物ケア施設および使用委員会は、全てのプロトコルを承認した。実験の最後に、全米獣医協会によって概略を示された手順に従ってマウスを安楽死させた。
【0190】
例1
[0199] 例1は、抗新生物チオール結合性ミトコンドリアオキシダントと第二の抗新生物物質との組み合わせがインビトロで相乗的な細胞毒性効果を示すか否かを決定する方法を例証する。
【0191】
[0200] 96ウェルプレート(BD Biosciences, Lexington, KY)において、各プレートの最後の11のカラムにおいて1ウェル当たり160μlの増殖培地中に約2500個の細胞を播種した。各プレートの最初のカラムを、ブランクとして使用するために細胞を含まない160μlの増殖培地で満たした。24時間のインキュベーション期間の後、最後の10のカラム内における細胞を、40μlイメキソン(抗新生物チオール結合性ミトコンドリアオキシダント)、40μlの第二の抗新生物物質、または20μlのイメキソンと20μlの第二の抗新生物物質で処理した(一列目をブランクとして放置し、二列目を細胞増殖が阻害されていない対照群として放置した)。12の抗新生物薬剤について試験を行った:シスプラチン、シタラビン、デキサメタゾン、ドキソルビシン、ダカルバジン(DTIC)、5-フルオロウラシル、ゲムシタビン、イリノテカン、メルファラン、メトトレキセート、パクリタキセル、タキソテール、およびビノレルビン(vinorelbine)。組み合わせ研究において使用された薬剤の濃度と割合を、単一薬剤実験のIC50値から決定した。各組み合わせ研究について使用された薬剤の範囲を、各抗腫瘍薬剤についてのIC50値の上下に小さな濃度変化を与えることによって明らかにした。第二の抗新生物物質各々のIC50値を、イメキソンについてのIC50値と比較し、次の組み合わせ薬剤において使用される固定された一定の割合を確立した。細胞に薬剤を投与後5日目にして、8226/s細胞を含む96ウェルプレートをMTTアッセイを使用して分析した(Rubinstein, L.V. et al., J Natl Cancer Inst 82: 1113-111 (1990))。一方、A375細胞を含むプレートをSRBアッセイを使用して分析した(Skehan, P. et al. J Natl Cancer Inst 82: 1107-1112 (1990))。
【0192】
[0201] 相乗性は、Chou et al., Advances in Enzyme Regulation 22: 27-33 (1984)の方法に基づいて計算された組み合わせ指数から決定した。様々な組み合わせについての組み合わせ指数は、図1〜8のイメキソンの濃度の関数として表わされる。
【0193】
[0202] 表1は、イメキソンとの組み合わせにおける第二の抗新生物物質の相乗的効果についての実証を示す。
【表1】

【0194】
例2
[0203] 例2は、抗新生物チオール結合性ミトコンドリアオキシダントおよび第二の抗新生物物質が、インビボにおいて相乗的抗癌効果を示すか否かを決定する方法について例証する。
【0195】
例2.1:SCIDマウスの膵臓癌
[0204] ゲムシタビンとイメキソンを、SCIDマウスにおける膵臓癌を治療するために組み合わせて使用した。0日目に16匹のSCIDマウスに対して10×106の生きたMiaPaCa腫瘍細胞を右後方腹部に皮下注射によって接種した。4匹のマウスについては、対照群として使用し、治療を行わなかった。他の4匹のマウスについては、その後、一日目を始めとして9日間にわたって100 mg/kg/日のスケジュールのもとイメキソンで治療を行った。さらに他の4匹のマウスについては、1、5および9日目に180 mg/kg/日のスケジュールのもとゲムシタビンで治療を行った。さらに最後の4匹のマウスについては、9日間にわたって100 mg/kg/日のスケジュールのもとイメキソンで治療を行い、かつ1、5および9日目に180 mg/kg/日のスケジュールのもとゲムシタビンで治療を行った。
【0196】
[0205] 腫瘍の増殖について、キャリパーを使用して毎週ミリメートル単位で測定を行い、長さと幅を決定した。マウスの重量と生存率についても毎週モニターを行った。腫瘍の体積を、以下の式を使用して計算した。
【0197】
(長さ×幅2)/2
[0206] 図9に示したように、ゲムシタビンとイメキソンの組み合わせで治療されたSCIDマウスは、対照群のマウス、イメキソンで治療されたマウス、およびゲムシタビンで治療されたマウスと比較してより高い程度の腫瘍増殖阻害性を発揮した。
【0198】
例2.2:SCIDマウスの骨髄性白血病
[0207] シタラビンとイメキソンを、SCIDマウスにおけるヒトKG-1急性骨髄性白血病を治療するために組み合わせて使用した。0日目に20匹のSCIDマウスに対して10×106の生きたKG-1白血病細胞を右後方腹部に皮下注射によって接種した。4匹のマウスについては、対照群として使用し、治療を行わなかった。他の4匹のマウスについては、一日目を始めとして9日間にわたって100 mg/kg/日のスケジュールのもとイメキソンで治療を行った。さらに他の4匹のマウスについては、1日目を始めとして5日間にわたって150 mg/kg/日のスケジュールのもとイメキソンで治療を行った。さらに他の4匹のマウスについては、1、5、および9日目に800 mg/kg/日のスケジュールのもとシタラビンで治療を行った。さらに最後の4匹のマウスについては、9日間にわたって100 mg/kg/日のスケジュールのもとイメキソンで治療を行い、かつ1、5および9日目に800 mg/kg/日のスケジュールのもとシタラビンで治療を行った。
【0199】
[0208] 腫瘍の増殖について、キャリパーを使用して毎週ミリメートル単位で測定を行い、長さと幅を決定した。マウスの重量と生存率についても毎週モニターを行った。腫瘍の体積を、以下の式を使用して計算した。
【0200】
(長さ×幅2)/2
[0209] 図10に示したように、シタラビンとイメキソンの組み合わせは、イメキソンで治療されたマウス、シタラビンで治療されたマウス、または対照群のマウスと比較してより高い程度の腫瘍増殖阻害性を発揮した。
【0201】
例3
[0210] 例3は、イメキソンと第二の抗新生物物質をマウスに投与した実験からの毒性学的結果を示す。
【0202】
[0211] ゲムシタビン(180 mg/kg日 1, 5および9日目)またはシタラビン(800 mg/kg日 1, 4および7日目)とともにイメキソン(100 mg/kg/日×9日間)を与えた非腫瘍性(すなわち正常)マウスにおいて毒性学的研究を行った。試験は、ゲムシタビンまたはシタラビンと組み合わされたイメキソンについて、骨髄毒性の増加または腎臓および肝臓機能の低下が起きたか否かについて評価を行った。イメキソンと、シタラビンまたはゲムシタビンとを組み合わせて治療されたマウスの血小板数の結果を以下の表2に示す。
【表2】

【0203】
[0212] その結果は、組み合わせ薬剤について腎臓または肝臓機能への著しい影響はないことを示した。各組み合わせ薬剤について白血球数の減少が観察された。しかし、そのレベルはWBC値の正常範囲の下限値には至らなかった。ほとんど全ての減少は、リンパ球を含む。ヒトの正常な骨髄細胞における主要な標的と考えられる好中球についての影響はなかった。赤血球の数は、イメキソンでわずかに増加した。同様に、血小板数は各組み合わせ薬剤で低下したが、著しく低いレベルを示すものではない。全体としては、イメキソンとシタラビンまたはゲムシタビンとの総量の組み合わせ薬剤では、顕著な骨髄毒性は観察されなかった。
【図面の簡単な説明】
【0204】
【図1】図1は、A375細胞内における、シスプラチン、ダカルバジン(DTIC)、メルファランまたはタキソテールと組み合わせたイメキソンについての組み合わせ指数データを表わしたものである。
【図2】図2は、8226/s細胞における、シスプラチン、ダカルバジン(DTIC)、メルファランまたはタキソテールと組み合わせたイメキソンについての組み合わせ指数データを表わしたものである。
【図3】図3は、A375細胞における、シタラビン、5-フルオロウラシル、またはゲムシタビンと組み合わせたイメキソンについての組み合わせ指数データを表わしたものである。
【図4】図4は、8226/s細胞における、シタラビン、5-フルオロウラシル、またはゲムシタビンと組み合わせたイメキソンについての組み合わせ指数データを表わしたものである。
【図5】図5は、A375細胞における、メトトレキセートまたはドキソルビシンと組み合わせたイメキソンについての組み合わせ指数データを表わしたものである。
【図6】図6は、8226/s細胞における、デキサメタゾン、ドキソルビシン、メトトレキセート、またはパクリタキセルについての組み合わせ指数データを表わしたものである。
【図7】図7は、A375細胞における、デキサメタゾン、パクリタキセル、またはビノレルビン(vinorelbine)と組み合わせたイメキソンについての組み合わせ指数データを表わしたものである。
【図8】図8は、8226/s細胞における、ビノレルビンと組み合わせたイメキソンについての組み合わせ指数データを表わしたものである。
【図9】図9は、マウスにおける、ゲムシタビンと組み合わせたイメキソンの抗白血病効果を表わしたものである。
【図10】図10は、マウスにおける、シタラビンと組み合わせたイメキソンの抗白血病効果を表わしたものである。
【図11】図11は、インビトロでのヒト多発性骨髄腫細胞(8226/s)における、トポイソメラーゼ阻害剤イリノテカンと組み合わせたイメキソンの拮抗効果を表わしたものである。
【特許請求の範囲】
【請求項1】
抗新生物チオール結合性ミトコンドリアオキシダントおよび抗新生物核酸結合性物質を含む組成物を、患者に対して相乗的な治療学的細胞毒性効果を与える治療学的有効量投与することを含む、ヒト患者の癌を治療するための方法。
【請求項2】
前記抗新生物チオール結合性ミトコンドリアオキシダントが、アジリジン環を含む請求項1に記載の方法。
【請求項3】
前記抗新生物チオール結合性ミトコンドリアオキシダントが、置換されたまたは置換されていないアジリジン-1-カルボキシアミドである請求項1に記載の方法。
【請求項4】
前記抗新生物チオール結合性ミトコンドリアオキシダントが、以下の式を有する請求項1に記載の方法。
【化1】

(式中、R1, R2, R3, R4およびR5は、それぞれ独立して水素、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールからなる群から選択され、R4およびR5は、任意的には互いに結合して置換されたまたは置換されていない5〜7員環を形成する)。
【請求項5】
前記抗新生物チオール結合性ミトコンドリアオキシダントが、イメキソンである請求項1に記載の方法。
【請求項6】
R4が、シアノである請求項4に記載の方法。
【請求項7】
前記抗新生物核酸結合性物質が、抗新生物DNA結合性物質である請求項1に記載の方法。
【請求項8】
前記抗新生物核酸結合性物質が、窒素マスタード、マイトマイシン誘導体、アルキルスルホン酸塩、ニトロソ尿素、白金複合体、アルトレタミン、およびイミダゾールカルボキサミドからなる群から選択される請求項1に記載の方法。
【請求項9】
前記抗新生物核酸結合性物質が、窒素マスタード、イミダゾールカルボキサミド、および白金複合体からなる群から選択される請求項1に記載の方法。
【請求項10】
前記抗新生物核酸結合性物質が、メルファラン、シクロホスファミド、カルムスチン、メクロレタミン、チオテパ、クロランブシル、ロムスチン、イホスファミド、マイトマイシンC、シスプラチン、カルボプラチン、オキサリプラチンおよびダカルバジンからなる群から選択される請求項1に記載の方法。
【請求項11】
前記癌が、多発性骨髄腫、B-リンパ球プラズマ細胞腫、卵巣癌、黒色腫、白血病、大腸癌、乳癌、肺癌、および膵臓癌から選択される請求項1に記載の方法。
【請求項12】
前記膵臓癌が、膵臓の腺癌である請求項11に記載の方法。
【請求項13】
前記抗新生物核酸結合性物質が、シクロホスファミドではない請求項5に記載の方法。
【請求項14】
抗新生物チオール結合性ミトコンドリアオキシダントおよび抗新生物代謝拮抗物質塩基類似体を含む組成物を、患者に対して相乗的な治療学的細胞毒性効果を与える治療学的有効量投与することを含む、患者の癌を治療するための方法。
【請求項15】
前記抗新生物チオール結合性ミトコンドリアオキシダントが、アジリジン環を含む請求項14に記載の方法。
【請求項16】
前記抗新生物チオール結合性ミトコンドリアオキシダントが、以下の式を有する請求項14に記載の方法。
【化2】

(式中、R1, R2, R3, R4およびR5は、それぞれ独立して水素、ハロゲン、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールからなる群から選択され、R4およびR5は、任意的には互いに結合して置換されたまたは置換されていない5〜7員環を形成する)。
【請求項17】
前記抗新生物チオール結合性ミトコンドリアオキシダントが、イメキソンである請求項14に記載の方法。
【請求項18】
R4が、シアノである請求項16に記載の方法。
【請求項19】
前記抗新生物代謝拮抗物質塩基類似体が、メルカプトプリン、チオグアニン、アザチオプリン、フルダラビン、クラドリビン、ペントスタチン、フルオロウラシル、シタラビン、カペシタビン、ゲムシタビン、およびフロクスウリジンからなる群から選択される請求項14に記載の方法。
【請求項20】
前記抗新生物代謝拮抗物質塩基類似体が、5-フルオロウラシル、シタラビン、およびゲムシタビンからなる群から選択される請求項14に記載の方法。
【請求項21】
前記抗新生物代謝拮抗物質塩基類似体が、ゲムシタビンである請求項14に記載の方法。
【請求項22】
前記癌が、多発性骨髄腫、B-リンパ球プラズマ細胞腫、卵巣癌、黒色腫、白血病、大腸癌、乳癌、肺癌および膵臓癌から選択される請求項14に記載の方法。
【請求項23】
前記膵臓癌が、膵臓の腺癌である請求項22に記載の方法。
【請求項24】
抗新生物チオール結合性ミトコンドリアオキシダントおよびドセタキセルを含む組成物を、患者に対して相乗的な治療学的細胞毒性効果を与える治療学的有効量投与することを含む、患者の癌を治療するための方法。
【請求項25】
前記抗新生物チオール結合性ミトコンドリアオキシダントが、アジリジン環を含む請求項24に記載の方法。
【請求項26】
前記抗新生物チオール結合性ミトコンドリアオキシダントが、以下の式を有する請求項24に記載の方法。
【化3】

(式中、R1, R2, R3, R4およびR5は、それぞれ独立して水素、ハロゲン、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールからなる群から選択され、R4およびR5は、任意的には互いに結合して置換されたまたは置換されていない5〜7員環を形成する)。
【請求項27】
R4が、シアノである請求項26に記載の方法。
【請求項28】
前記抗新生物チオール結合性ミトコンドリアオキシダントが、イメキソンである請求項24に記載の方法。
【請求項29】
前記癌が、多発性骨髄腫、B-リンパ球プラズマ細胞腫、卵巣癌、黒色腫、白血病、大腸癌、乳癌、肺癌および膵臓癌から選択される請求項24に記載の方法。
【請求項30】
前記膵臓癌が、膵臓の腺癌である請求項24に記載の方法。
【請求項1】
抗新生物チオール結合性ミトコンドリアオキシダントおよび抗新生物核酸結合性物質を含む組成物を、患者に対して相乗的な治療学的細胞毒性効果を与える治療学的有効量投与することを含む、ヒト患者の癌を治療するための方法。
【請求項2】
前記抗新生物チオール結合性ミトコンドリアオキシダントが、アジリジン環を含む請求項1に記載の方法。
【請求項3】
前記抗新生物チオール結合性ミトコンドリアオキシダントが、置換されたまたは置換されていないアジリジン-1-カルボキシアミドである請求項1に記載の方法。
【請求項4】
前記抗新生物チオール結合性ミトコンドリアオキシダントが、以下の式を有する請求項1に記載の方法。
【化1】

(式中、R1, R2, R3, R4およびR5は、それぞれ独立して水素、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールからなる群から選択され、R4およびR5は、任意的には互いに結合して置換されたまたは置換されていない5〜7員環を形成する)。
【請求項5】
前記抗新生物チオール結合性ミトコンドリアオキシダントが、イメキソンである請求項1に記載の方法。
【請求項6】
R4が、シアノである請求項4に記載の方法。
【請求項7】
前記抗新生物核酸結合性物質が、抗新生物DNA結合性物質である請求項1に記載の方法。
【請求項8】
前記抗新生物核酸結合性物質が、窒素マスタード、マイトマイシン誘導体、アルキルスルホン酸塩、ニトロソ尿素、白金複合体、アルトレタミン、およびイミダゾールカルボキサミドからなる群から選択される請求項1に記載の方法。
【請求項9】
前記抗新生物核酸結合性物質が、窒素マスタード、イミダゾールカルボキサミド、および白金複合体からなる群から選択される請求項1に記載の方法。
【請求項10】
前記抗新生物核酸結合性物質が、メルファラン、シクロホスファミド、カルムスチン、メクロレタミン、チオテパ、クロランブシル、ロムスチン、イホスファミド、マイトマイシンC、シスプラチン、カルボプラチン、オキサリプラチンおよびダカルバジンからなる群から選択される請求項1に記載の方法。
【請求項11】
前記癌が、多発性骨髄腫、B-リンパ球プラズマ細胞腫、卵巣癌、黒色腫、白血病、大腸癌、乳癌、肺癌、および膵臓癌から選択される請求項1に記載の方法。
【請求項12】
前記膵臓癌が、膵臓の腺癌である請求項11に記載の方法。
【請求項13】
前記抗新生物核酸結合性物質が、シクロホスファミドではない請求項5に記載の方法。
【請求項14】
抗新生物チオール結合性ミトコンドリアオキシダントおよび抗新生物代謝拮抗物質塩基類似体を含む組成物を、患者に対して相乗的な治療学的細胞毒性効果を与える治療学的有効量投与することを含む、患者の癌を治療するための方法。
【請求項15】
前記抗新生物チオール結合性ミトコンドリアオキシダントが、アジリジン環を含む請求項14に記載の方法。
【請求項16】
前記抗新生物チオール結合性ミトコンドリアオキシダントが、以下の式を有する請求項14に記載の方法。
【化2】

(式中、R1, R2, R3, R4およびR5は、それぞれ独立して水素、ハロゲン、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールからなる群から選択され、R4およびR5は、任意的には互いに結合して置換されたまたは置換されていない5〜7員環を形成する)。
【請求項17】
前記抗新生物チオール結合性ミトコンドリアオキシダントが、イメキソンである請求項14に記載の方法。
【請求項18】
R4が、シアノである請求項16に記載の方法。
【請求項19】
前記抗新生物代謝拮抗物質塩基類似体が、メルカプトプリン、チオグアニン、アザチオプリン、フルダラビン、クラドリビン、ペントスタチン、フルオロウラシル、シタラビン、カペシタビン、ゲムシタビン、およびフロクスウリジンからなる群から選択される請求項14に記載の方法。
【請求項20】
前記抗新生物代謝拮抗物質塩基類似体が、5-フルオロウラシル、シタラビン、およびゲムシタビンからなる群から選択される請求項14に記載の方法。
【請求項21】
前記抗新生物代謝拮抗物質塩基類似体が、ゲムシタビンである請求項14に記載の方法。
【請求項22】
前記癌が、多発性骨髄腫、B-リンパ球プラズマ細胞腫、卵巣癌、黒色腫、白血病、大腸癌、乳癌、肺癌および膵臓癌から選択される請求項14に記載の方法。
【請求項23】
前記膵臓癌が、膵臓の腺癌である請求項22に記載の方法。
【請求項24】
抗新生物チオール結合性ミトコンドリアオキシダントおよびドセタキセルを含む組成物を、患者に対して相乗的な治療学的細胞毒性効果を与える治療学的有効量投与することを含む、患者の癌を治療するための方法。
【請求項25】
前記抗新生物チオール結合性ミトコンドリアオキシダントが、アジリジン環を含む請求項24に記載の方法。
【請求項26】
前記抗新生物チオール結合性ミトコンドリアオキシダントが、以下の式を有する請求項24に記載の方法。
【化3】

(式中、R1, R2, R3, R4およびR5は、それぞれ独立して水素、ハロゲン、置換されたまたは置換されていないアルキル、置換されたまたは置換されていないヘテロアルキル、置換されたまたは置換されていないシクロアルキル、置換されたまたは置換されていないヘテロシクロアルキル、置換されたまたは置換されていないアリール、および置換されたまたは置換されていないヘテロアリールからなる群から選択され、R4およびR5は、任意的には互いに結合して置換されたまたは置換されていない5〜7員環を形成する)。
【請求項27】
R4が、シアノである請求項26に記載の方法。
【請求項28】
前記抗新生物チオール結合性ミトコンドリアオキシダントが、イメキソンである請求項24に記載の方法。
【請求項29】
前記癌が、多発性骨髄腫、B-リンパ球プラズマ細胞腫、卵巣癌、黒色腫、白血病、大腸癌、乳癌、肺癌および膵臓癌から選択される請求項24に記載の方法。
【請求項30】
前記膵臓癌が、膵臓の腺癌である請求項24に記載の方法。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【図8】


【図9】


【図10】


【図11】


【公表番号】特表2007−513202(P2007−513202A)
【公表日】平成19年5月24日(2007.5.24)
【国際特許分類】
【出願番号】特願2006−543951(P2006−543951)
【出願日】平成16年12月8日(2004.12.8)
【国際出願番号】PCT/US2004/041093
【国際公開番号】WO2005/055952
【国際公開日】平成17年6月23日(2005.6.23)
【出願人】(503356875)ジ・アリゾナ・ボード・オブ・リージェンツ・オン・ビハーフ・オブ・ザ・ユニバーシティー・オブ・アリゾナ (7)
【Fターム(参考)】
【公表日】平成19年5月24日(2007.5.24)
【国際特許分類】
【出願日】平成16年12月8日(2004.12.8)
【国際出願番号】PCT/US2004/041093
【国際公開番号】WO2005/055952
【国際公開日】平成17年6月23日(2005.6.23)
【出願人】(503356875)ジ・アリゾナ・ボード・オブ・リージェンツ・オン・ビハーフ・オブ・ザ・ユニバーシティー・オブ・アリゾナ (7)
【Fターム(参考)】
[ Back to top ]

