眼のラジオサージェリ
処置放射線量を患者の標的構造に伝達するように構成されるラジオサージェリシステムを説明する。幾つかの態様において、炎症性の眼の疾患、特に、黄斑変性が治療される。幾つかの態様において、眼構造は、眼のイメージングに基づきグローバル座標系に配置される。幾つかの態様において、グローバル座標系内の眼構造は、座標系内の眼構造に基づいて方向付けられる自動位置決めシステムの方向を導く。幾つかの態様において、眼構造の位置は、追跡され、及びラジオサージェリシステムの状態に関連する。幾つかの態様において、ビームエネルギー、方向、治療期間について用いられる。治療計画は、治療される特定疾患及び避けられる構造の少なくとも一方を決定する。幾つかの態様において、構造は、眼であり、そして、眼は、システムによって追跡される。幾つかの態様において、眼は所定場所に保持され、態様によっては、眼は患者が固定する。幾つかの態様において、基準は、位置決めを目的として眼上に配置される。幾つかの態様において、眼からの反射が位置決めのために用いられる。幾つかの態様において、放射線力学療法は、他の治療の前後に付随物を伝達することができ、他の治療と併用されるラジオサージェリについて説明される。
【発明の詳細な説明】
【技術分野】
【0001】
関連出願
本出願は、2007年6月4日に出願の米国仮出願第60/933,220号、2007年4月9日に出願の米国仮出願第60/922,741号、2006年12月13日に出願の米国仮出願第60/869,872号、2006年10月19日に出願の米国仮出願第60/862,210号、2006年10月18日に出願の米国仮出願第60/862,044号、及び、2006年10月16日に出願の米国仮出願第60/829,676号の優先権の利益を主張するものであり、これらの全部は参照により本明細書に組み込まれる。
【0002】
本開示は、標的(targeted)光子エネルギーを用いる眼疾患の治療に関する。特に、本開示は、眼(球)構造のイメージガイド低エネルギーX線療法(image-guided low energy x-ray therapy)のための装置、システム、及び方法に関する。
【背景技術】
【0003】
黄斑変性とは、ヒト眼球の網膜中央付近にある黄斑の光検知細胞が、機能不全及び徐々に機能低下を引き起こす状態である。黄斑変性は、50歳以上の人々において視界中心の損失の主な原因となっている。臨床的証拠及び組織学的証拠から、一部の黄斑変性が、最終的に網膜の破壊を引き起こす炎症過程によって又は炎症過程の結果として、生じることが示されている。炎症過程は、網膜の直接的な破壊、又は、網膜内に液体や血液を滲出して急速な瘢痕化を起こす新生血管膜の形成を経た破壊の結果として生じ得る。
【0004】
黄斑変性に対する処置の多くは、地図状萎縮型又「乾性」の加齢黄斑変性症(AMD)よりも、新生血管型(又は「湿性」)の黄斑変性の抑制を目的としている。全ての湿性AMDは、最初は乾性AMDとして現れる。実際に、最新の眼イメージング(ophthalmic imaging)では、現在の傾向として、湿性AMDは視力喪失前に識別されている。黄斑変性に対する処置としては、眼に直接的に投与する薬物(抗VEGF療法)及び標的処置薬(targeting drug)と組み合わせたレーザ療法(光線力学療法)の使用が含まれ、黄斑変性に対する他の処置としては、近接照射療法(即ち、β線を発生する物質の局所的照射)が含まれる。
【発明の概要】
【発明が解決しようとする課題】
【0005】
本開示は、眼の特定領域以外の部分を放射線に実質的に曝すことなく、その特定領域を照射することによる眼疾患の治療を提供するシステム、方法、及び装置である。本明細書に記載の幾つかの態様において、眼に関する多種多様な病状の治療に用いることができる複数の放射線療法システムが開示される。例えば、これらのシステムは、黄斑変性、糖尿病性網膜症、炎症性網膜症、感染性網膜症、眼又は眼の周りの腫瘍、緑内障、屈折障害、白内障、眼のあらゆる組織における手術後の炎症、翼状片(ptyrigium)、及び、ドライアイなどを治療するために、単独で又は他の療法と組み合わせて用いられてもよい。
【0006】
本明細書に記載の幾つかの態様では、放射線療法(又は外部から適用する放射線療法)が黄斑変性の治療に用いられ、黄斑変性に対する標準的治療法が開示される。黄斑変性の放射線療法は、幾つかの合併症を示す。例えば、眼は、水晶体や視神経など幾つもの重要な構造を含んでおり、このような構造は、過剰な放射線の曝露により損傷を受ける可能性がある。外部照射療法の適用は、装置と、療法を適用する方法とにより制限される。このような装置及び方法は、身体内のあらゆる場所に存在する腫瘍などの疾患の治療に用いられる従前の放射線技術であり、とりわけ眼の放射線療法用として開発されたものではない。加えて、ロジスティックス(logistics)は、そのような治療装置が腫瘍に対する療法を取り入れたものであり、腫瘍に対する療法を置換するものであるので、患者選別及び処置の実施に関する限り困難である。
【0007】
定位放射線療法とは、複数の方向から放射線ビームを照射して標的上に収束(焦点合わせ)させることを一般に指す。このような療法は、大型の直線加速器(ライナック)又は、例えば、コバルト60(ガンマナイフ)などの放射性線源を用いることで達成される。ロボット定位手術(例えば、Accuray Inc.に譲渡された2006年2月14日に出願の米国特許出願第11/354,411号、発明の名称「適応性X線制御(Adaptive X-ray Control)」を参照。この出願の全ては参照により本明細書に組み込まれる)は、大型のライナックが患者の周りを動き及び標的に向けて放射線ビームを連続して照射する定位放射の応用である。線量は正常組織を避けて標的周囲に制御され得るので、療法は少量の分割線量を伝達(送達)することができる。この手法は、放射線療法に対して「ラジオサージェリ」と呼ばれることがある。概括的に言えば、ラジオサージェリは放射線療法の一形態である。
【0008】
網膜の放射線療法の試みでは、いかなる重大な有害性も伴わずに、視力が安定化又は改善されることが示されてきた。また、放射線は、患者の新生血管膜を乾燥させ視覚を安定させることが示されてきた。しかしながら、放射線療法を用いた黄斑変性治療には、治療領域を限局すること及び治療領域に対して放射線を特定的に用いることを含む限界があるため、このような黄斑放射線療法では、多くの場合、網膜の全体を、不必要で有害となる虞がある放射線に曝すことになる。さらに、黄斑に特定的に与える放射線量は、多数の日又は週にまたがって複数に分割されるように制限されていない。より多くの線量を24時間未満の期間で黄斑に特定的に与えることにより、従前の試みで示された以上の影響を疾患に与えることになる。
【0009】
また、湿性AMDに対する近接照射療法は、湿性AMDを治療する上で効果的な治療法である(Neovista, Inc.、プレスリリース、2007年3月。この内容の全ては参照により本明細書に組み込まれる)。この療法の主な制約は、近接照射プローブを配置するために、後眼房の硝子体液を部分的に除去する侵襲性処置を必要とすることである。加えて、線量の分割は、治療効果を伝えるために必要とされる侵襲性のために制限される。さらに、その治療効果は、外科医による正確な配置及び外科医の手の安定性に依存する。
【0010】
その他の眼の疾患として、緑内障がある。この疾患において、手術は、多くの場合、薬物療法後の二次処置である。線維柱帯形成術、線維柱帯切開術、管形成術(canaloplasty)、レーザ虹彩切開術、短絡(shunt)の配置、及びその他の処置などの処置では、外科手術による外傷の結果としての瘢痕形成のため、全ての患者が一時的な影響を被る。抗炎症薬は、これらの処置の後で生じる慢性的な瘢痕化に対して一時的及び予防的の少なくとも一方の解決法を提供するようである。しかし、薬物を一日数回は投与しなければならず、また、例えば、眼の不必要な領域への浸潤など、その薬物自体の副作用プロフィールを伴う。いくつかの放射線量(例えば、幾つかの例では略5Gy〜略20Gy、及び幾つかの形態では略10Gyまでの放射線量)は、(2006年10月5日発行の英国医学会会報(British Medical Journal)、Kirwan他、南アフリカにおける緑内障排液手術の成功に関するβ線の効果:無作為化制御試験(Effect of Beta Radiation on Success of Glaucoma Drainage Surgery in South Africa: randomized controlled trial)を参照。この内容の全ては参照により本明細書に組み込まれる)緑内障手術後における瘢痕化の予防に有益となり得る。水晶体嚢の混濁化は、眼内レンズ(リファレンスを加える)の配置に関する白内障治療の後によく見受けられる。この瘢痕化は、手術による外傷、水晶体細胞の増殖、及び物質不和合性により生じる。
【0011】
本明細書に開示するシステム、方法及び装置により治療可能な眼のその他の疾患には、眼の翼状片がある。翼状片は、通常、角膜縁周囲結膜(perilimbal conjunctiva)をこえて形成され角膜の表面上に伸びる、隆起した表面的、外因的な眼の腫瘤である。翼状片は、小型で萎縮性静止状態の病変から、角膜トポグラフィーを歪めることがあり、症状が進行した場合に角膜の光心を不明瞭にすることがある大型で活動性を有し急速に成長する血管結合組織の病変状態に変化することがある。翼状片は、多くの場合、かなりの時間を屋外、特に、太陽が降り注ぐ気候の屋外で過ごしている人々に生じ、長期間、太陽光線、特に紫外線を浴びること、並びに、乾燥し、埃っぽく及び風の強い状態におかれて慢性的に眼に刺激を受けることとの関連が示されてきたが、翼状片の正確な原因は十分に解明されていない。翼状片は、炎症を起こすことがあり、その症状は、多くの場合、炎症の緩和を促進可能な局所的な点眼液又は軟膏により治療される。翼状片が、視力を脅かす程大型である場合、又は角膜に侵入した場合、一般に、病変は、視力に影響が及ぼされる前に外科的除去により治療される。しかしながら、どの外科技術を用いても、その再発率は、多くの場合、50〜60%程度と高い。本明細書に開示するシステム、方法、及び装置は、放射線量を投与して翼状片再発の可能性を低減するために手術後に用いることができ、幾つかの態様においては、放射線量を、手術前に翼状片の進行を緩め又は止めるために用いることもできる(放射及び腫瘍学(Radiation and Oncology)74 (2005) 25−29、「翼状片の非外科的、排他的ストロンチウム/Yイットリウム90のβ照射による長期結果(Long-term results of non-surgical, exclusive strontium/yytrium-90 beta irradiation of pterygia)」参照。この内容の全ては参照により本明細書に組み込まれる)。
【0012】
幾つかの態様において、放射線療法システムは、レーザ療法に付随して用いられる。即ち、レーザは、単にX線装置を眼の被選択標的に向けるために用いられるのではなく、指向及び治療の双方に用いられる。これらの態様において、レーザは、眼構造の治療に適した少なくとも1つの追加のエネルギー又は波長を含むとよい。X線は、レーザ療法に関して過剰な瘢痕化を制限又は低減するためにレーザと同一領域に適用されるとよい。例えば、システム及び方法の幾つかの態様は、線維柱帯切除術などの緑内障治療と共に用いられることができる。この態様では、X線又は放射線量が瘢痕化を制限又は低減するように適用される一方で、レーザは眼の小柱網に穿孔又は開口を形成するように用いられる。
【0013】
幾つかの態様において、システムは、標的組織を加熱するための加熱源を提供するように構成されることができ、X線は、標的組織の加熱に連動して照射される。前文における「連動して照射」の用語は、組織の加熱に備えてX線を照射できること、組織の加熱に続けてX線を照射できること、又は、組織の加熱と同時にX線を照射できること、を意味する。X線を、加熱処置の前に、略2日〜略10日の間で照射することができ、幾つかの態様によっては、X線を、加熱処置に続いて略2日〜略10日の間で照射することができる。幾つかの態様において、X線を、加熱処置の前に略2日未満の期間で照射し、幾つかの態様によっては、X線を、加熱処置に続いて略2日未満の期間で照射する。幾つかの態様において、X線を、加熱による組織の処置前に略10日超照射し、幾つかの態様によっては、X線を、加熱による組織の処置に続いて略10日超照射する。幾つかの態様において、これら処置方法を複数のバリエーションで用いてもよい。例えば、加熱による標的組織の複数の処置を、X線の照射前後に適用することができる。他の態様では、X線による標的組織の複数の処置を、加熱による標的組織の処置前後に適用することができる。幾つかの態様において、前述した実質的に同時の処置は、相互に略72時間、48時間、36時間、24時間、12時間、6時間、2時間、1時間、30分、10分、及び、1分以内の加熱及びX線による標的組織の処置を含むことができる。幾つかの態様において、前述した実質的に同時の処置は、相互に略1週間、2週間、3週間、及び1カ月以内の加熱及びX線による標的組織の処置を含むことができる。
【0014】
幾つかの態様において、レーザ療法は、眼組織を穿刺する針を通して適用される。例えば、針又はカニューレは、硝子体に薬物を投与するために、眼の強膜を貫通して配置されることができる。また、針又はカニューレは、レーザポインタなどの光ポインタビームを案内するために用いられることができる。光ポインタは網膜に向けられ、網膜上の照らされた領域を、水晶体を通して視覚化することができる。そして、放射線装置を、カニューレと、例えば同一線上などに位置合わせして、X線ビームを、レーザポインタに沿った軌道で照射し、レーザポインタと同位置で網膜と交差させることができる。このような態様において、網膜上の標的は、本明細書に開示するシステム、方法、及び装置により識別され、目標とされ、及び治療されることができる。
【0015】
この開示の幾つかの態様において、複数の電動の眼イメージングシステムが利用されるが、レーザ療法は、治療に用いられる唯一の放射線エネルギー源である。このような態様において、異なる角度から強膜を通じて該強膜の深部構造へと光子を通過させることにより放射線を収束させるシステムの機能は、X線発生システムをオフに保持しつつレーザ放射により前眼房又は後眼房の疾患治療に利用されることができる。幾つかの態様において、X線発生器は、システムに含まれない。このような態様において、眼モデル(eye model)、トラッキング(追跡)、制御、及び、X線療法用の収束システムは、レーザ療法のために利用される。
【0016】
特定の態様において、治療計画システムを用いる装置は、眼の特定領域を標的とする放射線療法を提供するために用いられる。治療計画システムは、眼の物理的変数又は医者からの疾患変数をまとめ、眼の構造に治療効果を送達するようX線システムを向けるものである。上記装置は、眼の標的領域に収束するように1以上の角度から複数の放射線狭ビームを照射する。特定の態様において、装置は、網膜などの後眼の構造に、放射線ビームを収束させてもよい。特定の態様において、装置は、強膜、角膜又は小柱網などの眼の前部構造に、放射線ビームを収束させしてもよい。治療計画システムは、強膜などの眼の表面に沿った複数の異なるポイントにおいて眼へのビームエントリ方向を計画することができる。各個人に固有の解剖学的構造は、正確な標的決めのために、並びに、幾つかの態様によっては装置のX線ビームの自動位置決め(ポジショニング)及び自動定位のために、治療計画システムに組み込まれる。
【0017】
本明細書に記載の幾つかの態様において、患者に放射線を伝達(送達)するために提供される治療システムは、患者の眼の解剖学的データから生成される眼モデルと、放射線ビームを照射するエミッタと、該エミッタに連結され、前記眼モデルに基づいて、前記放射線ビームが前記眼の外面又は前記眼の内部の標的に伝達されるように、前記眼の外面又は前記眼の内部の場所に対して前記エミッタを配置する位置決めガイドと、を含む。
【0018】
幾つかの態様において、前記場所は、前記標的を含んで構成される。前記エミッタは、略10keV〜略500keVの間の光子エネルギーを有する放射線ビームを伝達するように、又は、前記エミッタは、略25keV〜略100keVの間で調整可能な放射線ビームを伝達するように、構成されることができる。幾つかの態様において、前記放射線ビームは、X線ビームを含む。幾つかの態様において、前記システムは、さらに、前記眼モデルに基づいて、ビーム標的、ビーム強度、ビームエネルギー、ビーム軌道、治療領域サイズ、治療領域形状、前記エミッタから前記標的までの距離、照射時間、及び、線量、のうち少なくとも2つを決定する計画モジュールを含む。
【0019】
前記位置決めガイドは、幾つかの態様において、前記計画モジュールからの情報に基づいて、前記エミッタが第1位置において第1放射線ビームを前記眼の第1部分を通り前記眼の範囲内の治療領域に作用させる(向ける)ように、前記エミッタを配置する請求項7記載のシステム。前記位置決めガイドは、前記計画モジュールからの情報に基づいて、前記エミッタが第2位置において第2放射線ビームを前記眼の第2部分を通り前記眼の範囲内の治療領域に作用させる(向ける)ように、前記エミッタを配置する請求項7記載のシステム。前記計画モジュールは、該計画モジュールの出力に作用する使用者からの入力を受信するように適応される幾つかの態様において、前記システムは、前記眼の位置を感知し、及び、該眼の位置に関する情報を前記計画モジュールに中継する感知モジュールを含む。
【0020】
前記システムは、幾つかの態様において、前記眼の位置を感知し、及び、該眼の位置に関する情報を前記位置決めガイドに中継する感知モジュールをさらに含んで構成される。前記感知モジュールは、前記眼に物理的に接触する部分を含むことができ、前記眼の角膜上に又は前記眼の角膜を覆って配置可能なレンズを含むことができる。前記感知モジュールは、幾つかの態様において、例えば、レーザにより、前記眼の位置を光学的に感知することができる。
【0021】
また、幾つかの態様において、前記システムは、略0.5mm〜略6mm幅に前記放射線ビームをコリメートするコリメータを含む。また、前記コリメートビームは、前記コリメータから最大で略50cm離れた距離で、略10%未満の半影を有することができる。前記位置決めガイドは、幾つかの態様において、その使用時に、前記エミッタが前記標的から50cm以内の第1距離から前記標的に向けて放射線ビームを伝達するように、前記エミッタを前記第1距離に配置するように構成される。幾つかの態様において、コリメータは、前記放射線ビームが前記標的に伝達されるときに、該標的から略10cm以内に配置されて使用される。
【0022】
前記システムは、前記放射線ビームを前記標的に向けられない程に前記患者の眼が動いたこと検出する検出器をさらに含むことができる。幾つかの態様において、前記エミッタは、前記患者の眼が所定の位置又は所定の位置範囲から外れて動いた場合に、前記放射線ビームの照射を自動的に停止するように構成される。幾つかの態様は、コリメータを通過し、前記眼に向かうレーザビームを照射するレーザエミッタを含み、及び、幾つかの態様では、前記レーザビームは前記X線エミッタと同一軸に沿って適用される。
【0023】
本明細書に記載の幾つかの態様は、眼に放射線を伝達するシステムを開示する。該システムは、患者の眼の解剖学的データから生成される眼モデルと、略10keV〜略500keVのエネルギーを有するX線ビームを眼に伝達するエミッタと、前記エミッタと連結され、前記エミッタと連結され、前記眼モデルに基づいて、前記放射線ビームが前記眼の外面又は前記眼の内部の標的に伝達されるように、前記眼の外面又は前記眼の内部の場所に対して前記エミッタを配置する位置決めガイドと、前記眼モデルに基づいて治療用の少なくとも2つのパラメータを決定する計画モジュールと、を含む。幾つかの態様において、前記少なくとも2つのパラメータは、ビーム標的、ビーム強度、ビームエネルギー、ビーム軌道、治療領域サイズ、治療領域形状、前記エミッタから前記標的までの距離、照射時間、及び、線量、の2つを含む。
【0024】
前記位置決めガイドは、さらに、幾つかの態様において、前記眼の領域を標的として第1X線ビームを第1位置から前記眼の強膜における第1領域に向けるように構成され、前記眼の領域と実質的に同一の領域を標的として第2X線ビームを第2位置から前記強膜の第2領域に向けるように構成される。幾つかの態様において、前記眼の前記領域は、前記眼における黄斑、強膜、小柱網、及び水晶体包の少なくとも1つである。
【0025】
前記システムは、前記X線ビームをコリメートするコリメータをさらに含むことができる。幾つかの態様において、前記コリメータは、略0.5mm〜略6mmの幅に前記X線ビームをコリメートするように構成され、及び幾つかの態様において、前記システムは、前記コリメータから前記標的までの略50cm離れた距離で、略5%未満の半影を有するX線ビームを生成するように構成される。前記エミッタは、幾つかの態様において、略25keV〜略150keVの間の光子エネルギーを有するX線ビームを伝達するように構成される。幾つかの態様において、前記コリメータは、前記X線ビームが前記標的に伝達されるときに、該標的から略10cm以内に配置されて使用される。
【0026】
幾つかの態様において、ヒトに放射線を伝達する治療システムを提供する。該システムは、患者の眼の解剖学的データから生成される眼モデルと、前記眼にX線ビームを伝達するエミッタと、前記X線ビームが前記眼の外面又は前記眼の内部の標的に伝達されるように、前記眼の外面又は前記眼の内部の場所に対して前記エミッタを配置する手段と、を含んで構成され、前記手段は、前記エミッタと連結され、該エミッタを前記眼モデルに基づいて配置する。
【0027】
幾つかの態様は、患者に放射線を伝達する治療システムを提供する。該システムは、放射線ビームを発生するエミッタと、前記エミッタと連結され、前記放射線ビームを前記眼の外面又は前記眼の内部の標的に伝達するように、前記眼の外面又は前記眼の内部の位置に対して前記エミッタの位置を操作可能な位置決めガイドと、を含み、前記エミッタが前記標的から略50cm以内に配置される。幾つかの態様において、前記システムは、さらに、前記エミッタと連結され、前記エミッタが放射線ビームを放射するときに前記標的から略10cm以内に配置されて使用されるコリメータを含む。幾つかの態様において、前記システムは、さらに、前記エミッタと連結されるコリメートレーザエミッタを含む。
【0028】
本明細書に記載の幾つかの態様において、眼の黄斑変性を治療する方法が開示される。該方法は、イメージ装置により取得される解剖学的データを有する患者の眼モデルを提供すること、光子エネルギーが略40keV〜略100keV、幾つかの態様においては光子エネルギーが略40keV〜略250keV、を有し、略0.5mm〜略6mm幅のX線ビームを生成すること、ビームが眼の強膜を通過して網膜に至るように前記X線ビームを向けること、略1Gy〜略40GyのX線放射を網膜に照射すること、を含むとよい。
【0029】
幾つかの態様において、X線ビーム幅、光子エネルギー、及びX線ビームの方向の少なくとも1つが眼モデルに基づいて決定される方法を提供する。該方法は、幾つかの態様において、略15Gy〜略25GyのX線放射を網膜に照射すること、をさらに提供する。幾つかの態様において、X線放射による治療は、分割されることができ、及び、計画システムは、それまで(以前)の治療の量及び場所のトラック(track)を保持することができる。幾つかの態様において、前記方法は、放射線を網膜に照射することにより眼の新生血管を低減すること、を含む。前記方法は、さらに、放射線を網膜に照射する前又は後に、加熱、冷却、血管内皮増殖因子(VEGF)アンタゴニスト、VEGF−受容体アンタゴニスト、VEGF若しくはVEGF受容体に対する抗体、DNA鎖切断増加若しくはDNA修復減少のモダリティ、アポトーシスレベル増加のモダリティ、内皮細胞死増加のモダリティ、タキサン若しくはその他の微小管阻害剤、イリノテカンなどのトポイソメラーゼ阻害剤、シロリムスなどのリムスファミリー(limus family)の製剤、テモゾロミド(temozolomide)などDNAをメチル化する化合物、カペシタビン(capecitabine)などの5−フルオロウラシル類似体若しくはプロドラッグ、チラパザミン(tirapazamine)などの遊離基誘導エージェント、ゲフィチニブ若しくはエルロチニブ(erlotinib)などの小分子チロシンキナーゼ阻害剤、ボルテゾミブ(bortezomib)などのNFκB阻害剤若しくはダウンレギュレータ(downregulator)、マイクロ波エネルギー、レーザエネルギー、高圧酸素、過飽和状態の酸素、超音波エネルギー、高周波エネルギー、治療薬、の少なくとも1つを患者に施すこと、を含む。前記方法は、幾つかの態様において、さらに、眼の外部の第1位置から強膜を通過して網膜に至るように第1X線ビームを向けること、及び眼の外部の第2位置から強膜を通過して網膜に至るように第2X線ビームを向けること、を含む。幾つかの態様において、X線ビームは、眼の毛様体扁平部を通過するように向けられる。X線ビームは、幾つかの態様において、眼の黄斑に向けられる。
【0030】
本明細書の幾つかの態様は、患者の眼を治療する方法を開示する。該方法は、イメージ装置により取得される解剖学的データに基づいて眼モデルを提供すること、略0.5mm〜略6mmのビーム幅を夫々有する第1X線ビーム及び第2X線ビームを生成すること、前記第1ビームが前記眼の強膜における第1領域を通過して網膜の標的に至るように前記第1X線ビームを向けること、前記第2ビームが前記強膜における第2領域を通過して前記網膜における実質的に前記第1ビームと同一の標的に至るように前記第2X線ビームを向けること、を含み、前記第1ビーム及び第2ビームが通過する前記第1領域及び第2領域が前記眼モデルに基づいて選択される。
【0031】
幾つかの態様において、第1ビームの軌道が眼モデルに基づいて決定され、及び、幾つかの態様において、第1X線ビームを向けること及び第2X線ビームを向けることが連続して行われる。幾つかの態様において、前記第1X線ビーム及び前記第2X線ビームは、略25keV〜略100keVの光子エネルギーを有する。前記第1X線ビーム及び前記第2X線ビームの中心は、幾つかの態様において、眼の角膜輪部から略0.5mm〜略6mmの距離で強膜上のポイントに投射される。幾つかの態様において、前記方法は、さらに、前記第1X線ビームを向ける前に、並行して、又は連続して、加熱、冷却、VEGFアンタゴニスト、VEGF−受容体アンタゴニスト、VEGF若しくはVEGF受容体に対する抗体、マイクロ波エネルギー、高周波エネルギー、レーザエネルギー、治療薬、の少なくとも1つを患者に施すこと、を含む。前記X線ビームは、幾つかの態様において、網膜から略50cm未満に配置されるX線源により生成される。幾つかの態様において、前記X線ビームは、眼から略10cm以内に配置される線源の端部から照射される。幾つかの態様において、網膜は、前記治療の1セッションの間に、略15Gy、幾つかの態様においては略25Gy、また、幾つかの態様においては略35Gy、のX線放射が照射される。
【0032】
本明細書に開示される幾つかの態様は、患者の眼を治療する方法に関する。該方法は、イメージ装置により取得される解剖学的データに基づいて眼モデルを提供すること、略0.5mm〜略6mmのビーム幅を夫々有する第1X線ビーム及び第2X線ビームを生成すること、前記第1ビームが前記眼の第1領域を通過して前記眼内の標的に至るように前記第1X線ビームを向けること、並びに前記第2ビームが前記眼の第2領域を通過して前記眼内の実質的に同一の標的に至るように前記第2X線ビームを向けること、を含み、前記第1ビーム経路及び前記第2ビーム経路が通過する前記眼の前記第1領域及び第2領域が前記眼モデルに基づいて選択される。
【0033】
幾つかの態様において、前記標的は、前記眼の水晶体包を含む。幾つかの態様において、前記標的は、前記眼の小柱網又は腫瘍を含む。幾つかの態様において、前記第1領域は、前記眼の角膜を含んで構成される。幾つかの態様において、前記第1X線ビーム及び前記第2X線ビームは、略25keV〜略100keVの光子エネルギーを有する。幾つかの態様において、前記第1X線ビーム及び前記第2X線ビームは、前記眼から略10cm以内に配置されるコリメータによりコリメートされ、及び、幾つかの態様において、前記第1X線ビーム及び前記第2X線ビームは、前記眼から略10cm以内に配置されるX線源により生成される。また、前記X線源は、前記眼の50cm、40cm、及び、10cm、の少なくとも1つ以内に配置されることができる。
【0034】
幾つかの態様において、前記眼の前記第1領域は、強膜の第1領域を含んで構成され、前記眼の前記第2領域は、前記強膜の第2領域を含んで構成され、及び、前記強膜の第1領域から前記強膜の第2領域の端〜端の距離が略0.1mm〜略2mmである。幾つかの態様において、前記第1X線ビーム及び前記第2X線ビームは、前記眼の外部の鼻部から向けられる。幾つかの方法は、さらに、X線放射線療法システムを前記患者の眼の中心に位置合わせすること、を含む。また、幾つかの方法は、前記眼モデルを用いて前記黄斑領域を治療する計画を作成すること、を含み、前記第1X線ビーム及び前記第2X線ビームは前記黄斑領域で重ね合わされ、及び、前記第1X線ビーム及び前記第2X線ビームは略0.5mm〜略6mmにコリメートされる。
【0035】
本明細書に記載の幾つかの態様は、患者の眼の網膜に放射線を適用する方法を開示する。該方法は、イメージ装置により患者の黄斑の位置を取得(局在化)すること、前記黄斑をグローバル座標系にリンク(連結)すること、及び、前記座標系に基づいて前記黄斑に外部放射線ビームを適用すること、を含む。
【0036】
幾つかの態様は、さらに、前記グローバル座標系にリンクされ又は前記グローバル座標系でトラック可能な物質を前記眼の強膜に接触させること、を含む。特定の態様において、前記外部ビーム照射の動きは、前記座標系に基づいて自動化される。また、幾つかの態様において、前記方法は、眼の動きを検出すること、を含む。幾つかの態様は、さらに、眼の動きを検出した後に、黄斑と座標系との間の関係を再計算すること、を含む。幾つかの態様において、前記眼及び網膜を前記座標系に連結するように、前記眼の内部へ基準マーカーを差し込む(挿入する)こと、を含む。幾つかの態様において、前記外部ビーム照射は、収束外部ビーム照射である。
【0037】
本明細書では、患者の眼に対する放射線療法を計画する方法を開示し、その態様を記載する。幾つかの態様において、該方法は、前記患者の網膜のイメージデータを取得すること、前記データをグローバル座標系に連結すること、網膜に対して収束電離放射線ビームのアライメント及びターゲティングを可能にするようにレーザを用いること、前記グローバル座標系における前記網膜の位置に基づいて、自動化された収束外部ビーム療法を前記網膜に適用すること、を含む。
【0038】
幾つかの態様は、患者の眼の領域を治療する方法を提供する。該方法は、略40keV〜略250keVの光子エネルギーを有する略0.5mm〜略6mm幅のX線ビームを生成すること、前記X線ビームを前記眼の領域に向けること、略1Gy〜略40GyのX線放射線量で前記領域を照射し、前記眼の領域を治療すること、を含む。
【0039】
幾つかの態様において、前記方法は、さらに、イメージ装置により取得される解剖学的データを有する前記眼のモデルを提供すること、を含み、前記X線ビーム幅、前記X線ビームの光子エネルギー、及び前記X線ビームの方向、の少なくとも1つが、前記眼のモデルに基づいて決定される。幾つかの態様において、前記領域は、略15Gy〜略25GyのX線放射で照射され、及び、幾つかの態様において、前記領域は、前記眼の網膜を含む。前記治療は、前記網膜に放射線を照射することにより前記眼の新生血管を減少させること、及び、乾性加齢黄斑変性(AMD)から新生血管形成への進行を実質的に防止すること、の少なくとも一方を含むことができる。また、幾つかの態様において、前記方法は、加熱、冷却、VEGFアンタゴニスト、VEGF受容体アンタゴニスト、VEGF若しくはVEGF受容体に対する抗体、マイクロ波エネルギー、高周波エネルギー、レーザ、光線力学物質(エージェント)、及び、放射線力学物質(エージェント)並びに治療薬、の少なくとも1つを前記患者に施すこと、を含む。幾つかの態様は、さらに、前記眼の外部の第1位置から強膜を通り網膜に至るように第1X線ビームを向けること、及び、前記眼の外部の第2位置から強膜を通り網膜に至るように第2X線ビームを向けること、を含む。前記X線ビームは、幾つかの態様において、前記眼の毛様体扁平部を通るように向けられ、及び、幾つかの態様において、前記X線ビームは、前記眼の黄斑に向けられる。また、前記X線ビームは、前記眼の強膜を通り前記眼の黄斑に至るように向けることもできる。
【0040】
幾つかの態様では、線量を2以上のビームに分割することを提供し、及び、幾つかの態様では、前記線量を2以上の治療セッションに分割し、該治療セッションの夫々を少なくとも1日間隔で生じさせる。本明細書に記載の幾つかの方法は、さらに、前記領域に前記X線放射を照射する間に、前記X線ビームに対する前記眼の位置を決定すること、及び、前記眼の位置が移動閾値を超えると、前記X線ビームをシャットオフすること、を含む。
【0041】
本明細書に記載の患者の眼を治療する幾つかの方法は、イメージ装置により取得される解剖学的データに基づいて眼モデルを提供すること、第1ビームが前記眼の第1領域を通過して前記眼内の標的に至るように第1X線ビームを向けること、及び第2ビームが前記眼の第2領域を通過して前記眼内の実質的に同一の標的に至るように第2X線ビームを向けること、を含み、前記第1ビーム及び前記第2ビームが通過する前記第1領域及び第2領域は、前記眼モデルに基づいて選択され、前記方法はさらに、前記標的に対する前記第1X線ビームの照射、前記標的に対する前記第2X線ビームの照射、及び、前記標的に対する前記第1X線ビームの照射と前記標的に対する前記第2X線ビームの照射との間の期間、の少なくとも1つの間に、前記眼の位置を評価すること、を含む。
【0042】
前記標的に対する前記第1X線ビームの照射の間に評価を実行すること、を提供し、幾つかの方法は、さらに、前記眼が移動閾値を超えて移動したときに、前記第1X線ビームの照射を停止又は低減させること、を含む。幾つかの方法は、さらに、前記眼の位置を評価して得られる情報に基づいて前記第2X線ビームを向けること、を含む。
【0043】
幾つかの方法は、眼の放射線療法を計画する方法を提供する。該方法は、少なくとも1つの放射線ビームから眼の領域における標的に対して実放射線量を伝達する治療計画を作成すること、及び前記治療計画を示す情報を出力モジュールに出力すること、を含み、前記作成することは、前記眼の外部の放射線源から前記標的に伝達される第1推定放射線量を決定すること、及び前記放射線源から前記眼の視神経及び水晶体の少なくとも一方が受信する第2推定放射線量を決定すること、を含み、前記第2推定放射線量は、前記第1推定放射線量の略40%以下であり、前記治療計画は、前記少なくとも1つの放射線ビームの幅、前記放射線源から前記標的までの距離、前記ビームの軌道、最大ビームエネルギー、及び前記第1推定放射線量、の少なくとも1つを含んで構成され、前記少なくとも1つの放射線ビームの幅、前記放射線源から前記標的までの距離、及び前記ビームの軌道、の前記少なくとも1つは、前記標的に対する前記第1推定放射線量及び前記眼の前記視神経及び前記水晶体の少なくとも一方に対する前記第2推定放射線量の伝達を生じさせるように選択される。
【0044】
幾つかの態様において、前記視神経が受ける前記推定放射線量及び前記水晶体が受ける前記推定放射線量の少なくとも一方は、前記標的に伝達される前記推定放射線量の20%以下である。幾つかの態様において、前記視神経が受ける前記推定放射線量及び前記水晶体が受ける前記推定放射線量の少なくとも一方は、前記標的に伝達される前記推定放射線量の10%以下である。幾つかの態様において、前記視神経が受ける前記推定放射線量及び前記水晶体が受ける前記推定放射線量の少なくとも一方は、前記標的に伝達される前記推定放射線量の5%以下である。特定の態様において、前記視神経が受ける前記推定放射線量及び前記水晶体が受ける前記推定放射線量の少なくとも一方は、前記標的に伝達される前記推定放射線量の1%以下である。
【0045】
特定の態様において、前記出力モジュールは、コンピュータモニタ、LCD、LED、携帯装置、紙、コンピュータ可読媒体、コンピュータ実行可能命令、及び、放射線源に対する通信リンク、の少なくとも1つを含んで構成される。幾つかの態様は、前記標的組織に対して放射線の実線量を伝達する10日前から伝達後の3日の間の期間に、前記眼に対して熱エネルギーを伝達すること、をさらに含む。
【0046】
幾つかの態様において、前記方法は、前記標的に対して実放射線量を伝達すること、をさらに含む。幾つかの態様において、前記標的に伝達される前記推定放射線量、前記視神経が受ける前記推定放射線量、及び前記水晶体が受ける前記推定放射線量の少なくとも1つは、モンテカルロシミュレーションにより決定される。幾つかの態様において、前記少なくとも1つの放射線ビームの少なくとも1つは、幾何学的な断面形状を有する。幾つかの態様において、前記幾何学的な断面形状は、楕円状、円状、環状、同心円状の環状、多角形状、クレセント状、の少なくとも1つを含んで構成される。前記視神経が受信する前記推定放射線量及び前記水晶体が受信する前記推定放射線量の少なくとも一方は、外面対深部(surface-to-depth)のビームエネルギー表示に基づくものである。幾つかの態様において、前記視神経が受ける前記推定放射線量及び前記水晶体が受ける前記推定放射線量の少なくとも一方は、略250keV未満の最大ビームエネルギーを有するX線源からの分散光のトレーシングに基づくものである。
【0047】
幾つかの態様において、前記複数の放射線ビームが夫々の横断ゾーンで強膜を通り抜けるように、前記標的に伝達される前記複数の放射線ビームの軌道を決定すること、を含み、前記夫々の横断ゾーンは、あらゆる他の交差ゾーンと実質的に重ならない、方法を開示する。
【0048】
幾つかの態様において、前記複数のビームの少なくとも1つは、前記標的でその他の前記複数のビームと重なる。幾つかの態様は、前記少なくとも1つの放射線ビームを略6mm未満の横断面寸法(直径)を有するサイズにコリメートすること、をさらに含む。幾つかの態様は、前記眼の外面に対する放射線量が前記標的に対する放射線量の3倍未満となるように濾過(フィルトレーション)量を決定すること、をさらに含み、少なくとも1つの放射線ビームが略50keV〜略300keVを有する。
【0049】
幾つかの態様において、前記第1X線ビームは、少なくとも部分的に重金属を含んで構成されるフィルタによりろ過される。幾つかの態様は、前記標的に対する治療放射線量が略30分未満内で照射されるように、放射線療法システムに供給される略1mA〜略40mAの電流を決定すること、をさらに含む。幾つかの態様において、前記X線ビームはコリメートされ、及び、前記コリメータは前記標的から略20cm以内に配置される。幾つかの態様は、前記視神経に対する前記推定放射線量を最小化するように、少なくとも1つの放射線ビームの方向を決定すること、をさらに含み、前記第1X線ビームは、前記眼の外部から前記眼内部の標的への伝達に関して、鼻方向から側頭方向へ又は下方向から上方向へ伝達される。
【0050】
幾つかの態様は、眼の放射線療法を計画する方法に関する。該方法は、少なくとも1つの放射線ビームから眼の領域における標的に対して実放射線量を伝達する治療計画を作成すること、及び前記治療計画を示す情報を出力モジュールに出力すること、を含み、前記作成することは、前記眼の外部の放射線源から前記標的に伝達される第1推定放射線量を決定すること、及び前記標的の中心から略6mm未満の場所に位置する他の眼組織が前記放射線源から受ける第2推定放射線量を決定すること、を含み、前記第2推定放射線量は、前記第1推定放射線量の略40%以下であり、前記治療計画は、前記少なくとも1つの放射線ビームの幅、前記放射線源から前記標的までの距離、前記ビームの軌道、及び前記第1推定放射線量、の少なくとも1つを含んで構成され、前記少なくとも1つの放射線ビーム幅、前記放射線源から前記標的までの距離、前記ビームの軌道、の前記少なくとも1つは、前記標的に対する前記第1推定放射線量及び前記その他の眼組織に対する前記第2推定放射線量の伝達を生じさせるように選択される。
【0051】
幾つかの態様は、治療期間の間に眼を治療する方法に関する。該方法は、治療期間の間に眼の視神経及び水晶体の少なくとも一方に照射される放射線量が標的に伝達する放射線量の僅か略40%以下となるように、眼の外部にある線源から眼の網膜内又は網膜上にある前記標的に放射線を向けること、を含む。幾つかの態様において、前記放射線は、前記眼の毛様体扁平部を実質的に通するように向けられる。
【0052】
幾つかの態様において、治療期間の間に眼を治療する方法に関する。該方法は、
前記治療期間の間に標的の中心から略6mm未満の場所に位置する眼組織に照射される放射線量が前記標的に伝達される放射線量の略40%以下となるように、前記眼の外部にある線源から前記眼の内の前記標的に放射線を向けること、を含む。
【0053】
幾つかの態様は、患者の眼の炎症を治療する方法を開示。該方法は、眼内の炎症領域の場所を示すデータに基づいて、治療期間の間に前記炎症領域の中心から略6mmを越える場所に位置する眼組織に対して照射される放射線量が前記炎症領域に伝達する放射量の略40%以下となるように、前記眼の外部にある線源から、前記眼の前部領域を通り、前記炎症領域へ少なくとも1つのX線ビームを向けること、を含む。
【0054】
幾つかの態様において、前記領域は、ドルーゼを含んで構成される。幾つかの態様において、前記眼の前記前部領域は、角膜である。幾つかの態様において、前記眼の前記前部領域は、前記眼の角膜の外側の強膜である。幾つかの態様において、前記少なくとも1つのX線ビームは、略1mmより小さい横断面寸法(直径)を有する。幾つかの態様において、前記ビームは、略1mm〜略5mmの間の直径を有する。幾つかの態様において、前記少なくとも1つのX線ビームは、高強度と低強度の交互の領域を含んで構成される。幾つかの態様において、前記眼に接触する装置を用いて決定される治療軸に対する所定角度で前記眼に放射線療法システムを向けること、をさらに含む。幾つかの態様において、前記装置は、前記放射線療法システムと眼に関するデータを光学的に通信する。幾つかの態様は、眼−接触装置を用いて決定される治療軸に対する所定角度で前記眼に放射線療法システムを向けること、をさらに含む。幾つかの態様は、前記眼からの光の反射、眼底イメージ、前記眼の瞳孔イメージ、及び前記眼の角膜輪部イメージの1つを用いて決定される治療軸に対する所定角度で前記眼に放射線療法システムを向けること、をさらに含む。
【0055】
幾つかの態様において、眼に放射線を伝達する方法は、眼の前部−後部軸を提供すること、前記眼の前部−後部軸に対して治療軸を定義すること、前記眼に向けて照射されるX線ビームをコリメートし、該コリメートX線ビームが略6mm未満の横断面寸法(直径)を有するようにするコリメータを前記治療軸に対する所定角度に位置合わせすること、前記治療軸に対する所定角度で前記X線ビームを照射すること、を含む。
【0056】
幾つかの態様において、前記コリメートX線ビームは、前記コリメータから略10cmの場所で略20%未満の半影を有する。幾つかの態様において、前記治療軸は、前記眼の中心光軸である。幾つかの態様において、前記治療軸は、前記眼の視軸である。幾つかの態様において、前記治療軸は、前記角膜輪部又は角膜の中心に対して垂直である。幾つかの態様は、前記治療軸に対して前記コリメート放射線ビームを動かすこと、及び、第2コリメートX線ビームを照射すること、をさらに含む。幾つかの態様は、前記コリメート放射線ビームに対して前記眼を動かすこと、をさらに含む。幾つかの態様は、前記眼の強膜上の投射スポットに前記コリメートX線ビームを位置合わせすること、をさらに含む。幾つかの態様において、前記スポットは、前記治療軸に位置合わせされる。幾つかの態様において、前記スポットは、前記コリメートX線ビームに位置合わせされる。幾つかの態様において、前記コリメートX線ビームを照射することは、治療計画ソフトウェアプログラムに基づいて行われる。
【0057】
幾つかの態様において、放射線療法システムによる放射線ビームで眼の眼球構造を治療する方法は、第1部分を含んで構成され、前記眼球構造を通る軸がさらに該第1部分を通る眼接触部材を、前記眼の表面に接触させること、及び前記眼の外部に位置する放射線療法システムから前記眼球構造に向けて複数の放射線ビームを照射すること、を含んで構成され、該複数の放射線ビームの夫々は前記眼球構造の治療部位で前記軸と交差する軌道をとり、該治療部位は前記複数の放射線ビームの少なくとも1つにより事実上治療可能である。
【0058】
幾つかの態様は、前記眼接触部材で前記眼を第1位置に実質的に固定すること、をさらに含む。幾つかの態様において、前記眼接触部材は、前記眼の外部から内部へ電磁放射線の第1波長を伝達する伝達部を含んで構成される。幾つかの態様において、前記第1部分は、電磁放射線の第2波長を反射する。幾つかの態様において、前記第1部分は、前記眼接触部材内又は前記眼接触部材上の中心に配置される。幾つかの態様において、前記複数の放射線ビームの少なくとも1つは、レーザ光を含んで構成される。幾つかの態様において、前記複数の放射線ビームの少なくとも1つは、X線を含んで構成される。
【0059】
幾つかの態様において、放射線療法システムによる眼球構造の治療用の患者眼球インタフェースは、眼の外面に係合する眼接触表面を有し、前記眼を実質的に第1位置に保持する眼ホルダー、を含んで構成され、前記眼ホルダーは、前記眼の外部に配置される線源から前記眼に放射線ビームが伝達されている間に、前記眼が実質的に前記第1位置にあることの指示(indication)を感知器に提供するように構成される。
【0060】
幾つかの態様は、前記眼球インタフェースを通る前記放射線ビームを伝達可能な物質をさらに含んで構成される。幾つかの態様において、前記放射線ビームは、レーザ光を含んで構成される。幾つかの態様において、前記放射線ビームは、X線を含んで構成される。
【0061】
本明細書に記載の幾つかの態様において、放射線療法システムによる眼球構造の治療用の患者眼球インタフェースは、眼を実質的に安定可能な位置に保持するように適合されるホルダーと、眼を実質的に安定可能な位置に保持するように適合されるホルダーと、前記眼の位置を示し及び前記放射線療法システムから照射される放射線ビームの特性を決定する情報を、前記ホルダーと放射線療法システムとの間に伝える通信リンクと、を含んで構成される。
【0062】
幾つかの態様において、前記通信リンクは、光の波長の幾つかを反射する反射物質を含んで構成される。幾つかの態様において、前記情報により決定される前記放射線ビームの特性は、前記放射線ビームの軌道及び照射状態若しくは無照射状態の少なくとも1つを含んで構成される。幾つかの態様において、前記ホルダーは、前記眼に接触する。幾つかの態様において、前記ホルダーは、前記眼の外部の表面に取り付け可能である。幾つかの態様において、前記ホルダーは、前記放射線療法システムに機械的に連結される。幾つかの態様において、前記放射線療法システムに対する前記通信リンクは、光リンクである。幾つかの態様において、前記ホルダーは、前記眼の軸に前記放射線療法システムを位置合わせするように適合される。幾つかの態様において、前記ホルダーは、前記眼の視軸に前記放射線療法システムを位置合わせするように適合される。幾つかの態様は、前記ホルダーに対する前記眼の位置を視覚化するカメラを、さらに含む。幾つかの態様において、前記カメラは、前記眼の動きを検出し、該眼の動きに関するデータをイメージングソフトウェアに伝える。
【0063】
幾つかの態様において、前記ホルダーは、前記強膜に接触する。幾つかの態様において、前記ホルダーは、前記角膜に接触する。幾つかの態様において、前記ホルダーは、少なくとも部分的にX線エネルギーを通さない。幾つかの態様において、前記ホルダーは、少なくとも部分的にX線エネルギーを通す。幾つかの態様において、前記ホルダーは、前記眼に対して吸引を適用するように構成される。
【0064】
幾つかの態様において、患者の眼にX線ビームを伝達するシステムは、網膜から略15cm以内に配置されて使用される少なくとも1つのX線コリメータと、前記コリメータの長軸に実質的に位置合わせされ、前記眼の表面及び該眼の表面に接触する装置の少なくとも一方に、前記コリメータを通って照射されるX線ビームの方向を示す印を提供するレーザビームを照射するレーザと、を含んで構成される。
【0065】
幾つかの態様において、前記システムは、前記X線ビームを伝達するX線管の陽極に略10mA〜略800mAの電流を供給するように適合される電源装置をさらに含んで構成される。幾つかの態様において、前記陽極は、固定陽極又は回転陽極である。幾つかの態様は、前記眼に接触し、前記眼の位置を保持するように構成される眼接触部材をさらに含んで構成される。
【0066】
幾つかの態様において、眼の放射線療法の方法は、疾患の治療に治療上有用な関連放射線量を有する眼球疾患について、眼の外部に配置されてX線ビームを介して放射線量を伝達するX線源から、前記疾患を罹った前記眼組織の標的までの距離を提供すること、及び前記放射線源から前記標的までの前記距離に基づいて、前記距離により前記放射線源から隔てられている前記標的に対して前記放射線源から照射される前記X線ビームの前記放射線量を達成する上で要求されるエネルギーレベルを出力モジュールに出力すること、を含んで構成され、前記エネルギーレベルは、前記放射線源から前記標的への距離に依存する。
【0067】
幾つかの態様において、疾患組織を放射線で治療する方法は、治療される患者の第1疾患に基づいて、放射線療法システムから照射されて、推定放射線量を実質的に伝達する放射線ビームのエネルギーレベルを選択すること、及び前記選択エネルギーレベルの印を出力モジュールに出力すること、を含み、前記治療される第1疾患は、複数の疾患のうちの1つであり、前記複数の疾患の夫々は、該複数の疾患の夫々に対する治療放射線量を得る上で、前記複数の疾患のうちの別の疾患に対する治療放射線量を得るために要するエネルギーレベルとは異なるエネルギーレベルを要求する。
【0068】
幾つかの態様において、前記第1疾患は前記患者の眼に影響を与え、及び、前記放射線ビームは前記眼に向けて照射される。幾つかの態様において、前記第1疾患は、前記患者の眼の黄斑変性を含んで構成される。幾つかの態様において、前記第1疾患は、前記患者の眼の翼状片を含んで構成される。幾つかの態様において、前記第1疾患は、眼球の腫瘍、緑内障、及び前癌病変の少なくとも1つを含んで構成される。
【0069】
幾つかの態様において、疾患組織を放射線で治療するシステムは、治療される患者の疾患に基づく選択であって、放射線療法システムから照射されて実質的に推定放射線量を伝達する放射線ビームのエネルギーレベルの選択を含んで構成される入力を受信する処理モジュールを含んで構成され、前記治療される第1疾患は、複数の疾患のうちの1つであり、前記複数の疾患の夫々は、該複数の疾患の夫々に対する治療放射線量を得る上で、前記複数の疾患のうちの別の疾患に対する治療放射線量を得るために要するエネルギーレベルとは異なるエネルギーレベルを要求し、前記処理モジュールは、前記入力に基づいて、前記選択エネルギーレベルの指示を出力モジュールに出力する。
【0070】
幾つかの態様において、疾患組織を放射線で治療する方法は、治療される患者の第1疾患に基づいて、放射線療法システムから照射されて実質的に推定放射線量を伝達する放射線ビームのエネルギーレベルを選択すること、及び前記選択エネルギーレベルの指示を出力モジュールに出力すること、を含み、前記治療される第1疾患は、複数の疾患のうちの1つであり、前記複数の疾患の夫々は、該複数の疾患の夫々に対する治療放射線量を得る上で、前記複数の疾患のうちの別の疾患に対する治療放射線量を得る上で要するエネルギーレベルとは異なるエネルギーレベル、ビームサイズ、及び表面対深部の比(surface-to-depth ratio)の少なくとも1つを要求する。
【0071】
幾つかの態様において、疾患眼組織を治療する放射線療法システムは、放射線源から照射される僅か略6mmの横断面幅を有する放射線ビームをコリメートし、前記放射ビームが放射されるときに、前記放射ビームがたどる第1軸を定義するコリメータと、前記コリメータにより定義された前記第1軸に位置合わせされる第2軸に沿って、前記第1軸の指示を提供する光ビームを照射する光ガイドと、を含む。
【0072】
幾つかの態様において、前記光ビームは、レーザを含んで構成される。幾つかの態様において、前記コリメータの前記第1軸と前記光ガイドの前記第2軸とは、共線(同一線上)にある。幾つかの態様において、前記光ガイドは、放射線療法の標的を視覚化し、及び、前記放射線療法システムからの共線X線ビームの伝達をガイドするように、前記眼に差込可能である。幾つかの態様において、前記光ガイドを差込可能なカニューレをさらに含んで構成される。幾つかの態様において、前記カニューレは、眼の表面に固定されるように構成される。
【0073】
幾つかの態様において、眼を放射線で治療するシステムは、放射線を照射する放射線源及び照射された放射線をビームにコリメートするコリメータと、前記眼を横断する軸に前記ビームを位置合わせする位置合わせシステムと、前記ビームが前記軸に位置合わせされていないときに、前記放射線源からの放射線照射を減少させるゲートメカニズムと、を含む。
【0074】
幾つかの態様は、眼底、角膜輪部、角膜、及び眼の表面からの反射の少なくとも1つを検出するイメージ検出システムをさらに含む。幾つかの態様において、前記イメージ検出システムが閾値を超える前記眼の動きを検出したときに、前記ゲートメカニズムが前記放射線源からの放射線照射を減少させる。
【0075】
幾つかの態様において、眼を放射線で治療するシステムは、治療セッションの間に放射線を照射し、前記照射された放射線を略6mm未満の横断面寸法(直径)を有するコリメートビームにコリメートする放射線源と、前記治療セッションの間に座標系に前記眼構造の位置を繰り返しマッピングする眼マッピングモジュールと、を含む。
【0076】
幾つかの態様は、前記照射される放射線を眼構造に向けるように前記眼に対して前記放射線源を移動させる放射線源移動器をさらに含んで構成される。幾つかの態様において、前記放射線源は、前記治療セッションの間に前記眼の位置に対して静止するように構成される。幾つかの態様において、眼構造が前記コリメートビームの経路内にないときに、放射線の照射を減少又は停止させるシステムシャットオフをさらに含む。幾つかの態様は、眼構造が前記コリメートビームの経路内にあるように前記眼を実質的に保持するホルダーをさらに含む。
【0077】
幾つかの態様において、眼に放射線を伝達する計画システムは、前記眼の生体測定パラメータを含んで構成される入力を受信する処理モジュールと、を含んで構成され、前記処理モジュールは、前記生体測定パラメータに基づいて、前記眼の強膜上に照射されるX線ビームの方向を電動システムに出力する。幾つかの態様において、前記生体測定パラメータは、眼球軸長、前眼房深度、角膜厚、及び角膜直径の少なくとも1つを含んで構成される。
【0078】
本開示の要約を目的として、本開示の特定の態様、利点、及び新規な特徴を本明細書に記載している。全ての利点が、任意の特定の実施形態によって必ずしも達成される必要がないことが理解される。従って、本開示は、本明細書に記載又は示唆されているその他の利点を必ずしも達成することなく、本明細書に記載の1つの利点又は一群の利点を達成又は最適化する方法で実施又は実行されてもよい。
【図面の簡単な説明】
【0079】
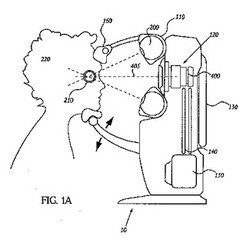
【図1A】放射線療法を用いて眼を治療するシステムの一実施形態に係る側面図
【図1B】放射線治療システムの一実施形態に係る回路構成を示す図
【図1C】眼の構造を示す図
【図1D】眼上のレンズと通信する放射線療法システムの一実施形態を示す図
【図1E】眼上のレンズと通信する放射線療法システムの一実施形態を示す図
【図1F】X線放射線スペクトルを示す図
【図1G】眼と放射線療法装置との間のインタフェースを示す図
【図1H】インタフェースを装着可能なホルダーを示す図
【図1I】レンズインタフェースを有する放射線療法装置を配置するために用いる方法の概略図
【図1J】レンズインタフェースを有する放射線療法装置を配置するために用いる方法の概略図
【図1K】レンズインタフェースを含み、配置システムを有する放射線治療システムを示す図
【図2A】図1A〜図1Bの幾つかのシステム構成要素を示す放射線療法システムの一実施形態に係る側面図
【図2B−1】様々なコリメータの一実施形態を示す図
【図2B−2】様々なコリメータの一実施形態を示す図
【図2B−3】様々なコリメータの一実施形態を示す図
【図2B−4】様々なコリメータの一実施形態を示す図
【図2C】治療のために眼の範囲内の所定位置を標的とする放射線治療システムの一実施形態を示す図
【図2D】治療のための眼範囲内の所定位置を標的とする放射線療法システムの幾つかの実施形態を示す図
【図2E】放射線療法システム及びシステムの臨床応用方法の概略図
【図2F】眼のバイオメトリ(biometry)を決定し、該バイオメトリを本明細書に開示のシステムが用いる手順のシナリオを示す図
【図2G】放射線療法システム及び配置システムの一実施形態に係る概略配置図
【図2H】眼の視軸に関して放射線療法システムを配置するために用いることができる一実施形態の概略配置図
【図3A】放射線療法制御モジュールにおけるサブシステムの一実施形態を示す図
【図3B】放射線療法制御モジュールにおけるサブシステムの一実施形態を示す図
【図4】本明細書に開示の方法に従って眼の位置を追跡する一例を示す眼の側面図
【図5】モデル化を目的として用いられる眼の代表的な幾何モデルを示す図
【図6】眼の前面及び眼軸に関する代表的なビーム角度を示す図
【図7A】眼の網膜に到達するために眼を通る放射線ビーム及び標的組織に対する線量プロフィールの代表的なシミュレーションを示す図
【図7B】眼の網膜に到達するために眼を通る放射線ビーム及び標的組織に対する線量プロフィールの代表的なシミュレーションを示す図
【図7C】眼の網膜に到達するために眼を通る放射線ビーム及び標的組織に対する線量プロフィールの代表的なシミュレーションを示す図
【図7D】眼の網膜に到達するために眼を通る放射線ビーム及び標的組織に対する線量プロフィールの代表的なシミュレーションを示す図
【図7E】眼の網膜に到達するために眼を通る放射線ビーム及び標的組織に対する線量プロフィールの代表的なシミュレーションを示す図
【図7F】眼の網膜に到達するために眼を通る放射線ビーム及び標的組織に対する線量プロフィールの代表的なシミュレーションを示す図
【図8】異なるエネルギー効果及び眼の構造上の線量を分析するために実行したモンテカルロシミュレーションの結果を示す図
【図9】眼の様々な構造上における様々な治療状況の効果を分析するために実行したモンテカルロシミュレーションの結果を示す図
【図10】モンテカルロシミュレーションモデルを検証するためにヒトの眼を通る細密X線ビームの実験結果を示す図
【図11A1】眼モデルを貫通する細密X線ビームの結果を示す図
【図11A2】眼モデルを貫通する細密X線ビームの結果を示す図
【図11B】眼モデルを貫通する細密X線ビームの結果を示す図
【図11C】理論的及び実験的なデータに基づく治療計画の一実施形態を示す図
【図11D】理論的及び実験的なデータに基づく治療計画の一実施形態を示す図
【図11E】理論的及び実験的なデータに基づく治療計画の一実施形態を示す図
【図11F】理論的及び実験的なデータに基づく治療計画の一実施形態を示す図
【図11G】理論的及び実験的なデータに基づく治療計画の一実施形態を示す図
【図11H】他の放射線ビームと比較した本明細書に記載の常用電圧放射線ビームのイメージを示す図
【図11I】他の放射線ビームと比較した本明細書に記載の常用電圧放射線ビームのイメージを示す図
【図11J】ロボットシステムを用いて眼の後部に焦点合わせされた3つのビームの実験結果を示す図
【図12A】本明細書に記載のロボットシステムの一実施形態を示す図
【図12B】本明細書に記載のロボットシステムの一実施形態を示す図
【図12C】本明細書に記載の一実施形態に従う治療プランニング過程の一実施形態を示す図
【図12D】強膜の一部を通って針を配置するために位置合わせされる放射線治療装置の一実施形態を示す図
【発明を実施するための形態】
【0080】
図面には、本開示の様々な特徴を実現する全体構成が記載されている。図面及びこれと関連する説明は、開示の範囲を限定するのではなく、開示の実施形態を説明するために提供されるものである。また、全図にわたり、符号は、要素間の対応を示すために、可能な限り同一のものが利用される。
【0081】
本明細書に記載の複数の実施形態には、ヒトの眼を放射線療法で治療するシステム及び方法が含まれる。後述する幾つかの実施形態は、放射線療法を用いて眼の黄斑変性を治療するシステム及び方法に関する。例えば、実施形態によっては、システム及び方法は、網膜の新生血管を遅らせ又は低減させるように網膜の選択部分に放射線療法を用いることについて説明する。また、本明細書に記載の幾つかの実施形態は、放射線療法を用いて、緑内障を治療する、又は創傷治癒をコントロールする、システム及び方法に関する。例えば、システム及び方法の幾つかの実施形態では、術後合併症の可能性を減らすために、線維柱帯形成術、線維柱帯切開術、管形成術(canaloplasty)、及び、レーザ虹彩切開術など、緑内障手術に続いて前眼房の組織上に放射線療法を用いることについて説明する。他の実施形態において、システム及び方法は、ドルーゼ(drusen)(黄斑変性において失明に至らせる網膜の炎症性沈着物)を治療するために放射線療法を用いることについて説明する。ドルーゼ及び周囲炎症の局部的な治療は、乾性AMD及び湿性AMDの少なくとも一方の進行を妨げることができる。
【0082】
幾つかの実施形態において、レーザは、レーザを網膜に入射する位置と実質的に同一位置における共局在(co-localized)X線照射と併用されて(アジュバント(adjuvant)療法)ドルーゼに適用される。レーザによって、放射線療法を促進可能な局部的な加熱効果を得ることができ、又は、放射線が部位周囲の瘢痕化を防止できると共に、レーザによって部位又はレーザスポットを切除することができる。このような併用療法は、夫々の処置の効力を個々別々に向上させることができる。同様に、アジュバント療法は、1以上の薬物療法と併用されるX線放射線療法、又は、薬物若しくは化学物質の働きを向上させるその他の放射線療法を含むことができる。幾つかの実施形態において、X線療法は、例えば、硝子体切除術、白内障除去、線維柱帯形成術、線維柱帯切除術、レーザ光凝固術及びその他の手術などの侵襲性手術と併用される。
【0083】
本明細書に用いる放射線は、広義の用語であって、次のものに限定しないが、少なくともガンマ放射線から電波までの範囲をカバーするあらゆるフォトニックベースの電磁放射線、X線、紫外線、可視光線、赤外線、マイクロ波、及び電波エネルギー、などを含む通常の意味を有することを意図している。従って、計画された放射線療法及び導かれた放射線療法は、眼に対してあらゆる波長範囲のエネルギーを適用することができる。
【0084】
この開示に用いる放射線療法は、広義の用語であって、次のものに限定しないが、少なくとも電磁放射線を通じたエネルギー伝達により疾患を治療するあらゆる臨床治療などを含む通常の意味を有することを意図している。X線放射は、広く、略10nm以下〜略0.01nmに至るまでの波長を有する光子に関する。ガンマ線は、略0.01nm以下の波長を有する電磁波に関する。紫外線放射は、略10nm〜略400nmの波長を有する光子に関する。可視光線は、略400nm〜略700nmの波長を有する光子に関する。略700nmの波長を有する光子は、一般に、赤外放射領域に存在する。電磁放射線のX線領域の範囲内で、低エネルギーX線は、常用電圧として見なすことができる。本明細書の開示において、常用電圧の定義を変化させる範囲内に含まれる正確な光子エネルギーと共に、常用電圧は、少なくとも略20keV〜略500keVのエネルギーを伴うX線光子に関する。
【0085】
本明細書で使用する用語「グローバル座標系」は、機械の実空間(physical world)又は空間(room)を示す。グローバル座標系は、一般に、例えば、コンピュータ又はその他の装置などの機械と、その機械により使用される実空間又は空間とを関連付ける系である。グローバル座標系は、例えば、機械、機械の構成要素、又はその他のものを第1位置から第2位置に移動させるために用いられることができる。また、グローバル座標系は、例えば、第2アイテムに対する第1アイテムの位置を特定(識別)するために用いられることができる。幾つかの実施形態において、グローバル座標系は、1次元環境に基づくものである。幾つかの実施形態において、グローバル座標系は、2次元環境に基づくものであり、及び、実施形態によっては、グローバル座標系は、3次元以上の多次元環境に基づく。
【0086】
本明細書で用いられるカーマは、X線ビームが空気に衝突したときに、空気中の単位体積当たりに放出(又は吸収)されるエネルギーに関する。カーマの測定単位は、Gy(グレイ)である。空気カーマ率は、単位時間当たりに空気に吸収されるカーマ(Gy)である。同様に、「組織カーマ」率は、単位時間あたりに組織に吸収される放射である。カーマは、全波長にジュール(joule)読み取りを組み込むため、放射波長を選ばない。
【0087】
本明細書で使用する用語「放射線量」は、広義の用語であって、次のものに限定しないが、一般に、組織の単位質量あたりの吸収エネルギーを含むことを意味する。測定放射線量の一例はグレイである。グレイは、1キログラムありの1ジュールに等しく、また、一般に、100ラド(rad)に等しい。例えば、本明細書の一実施形態で用いる放射線量は、放射線の総量であるか、又は、所定期間中に受信又は放射されるエネルギーであり、組織の単位質量あたりの吸収エネルギーであってもよい。例えば、放射線量は、治療の過程、セッション又は治療の間における組織の単位質量あたりの吸収エネルギー総量であってもよい。
【0088】
本明細書で使用する用語「軌道」は、広義の用語であって、次のものに限定しないが、一般に、経路(パス)、方位(orientation)、角度、又は進行方向を含むことを意味する。例えば、本明細書の一実施形態で用いる、光ビームの軌道は、光ビームの実際の経路又は計画された経路を含むことができる。幾つかの実施形態において、光ビームの軌道は、光ビームを照射する光源の方位により決定されることができ、及び、軌道は、実施形態によっては、例えば、角度などを測定されることができ、又は、例えば、軸若しくは面等に対して決定されることができる。
【0089】
本明細書で使用する用語「位置あわせする(align)」は、広義の用語であって、次のものに限定しないが、一般に、0°〜180°の間の一定の角度関係を有するものを含むことを意味する。例えば、本明細書で用いる2つの光ビーム又は2つのX線ビームは、夫々が共線(collinear)である場合、夫々が異なる固定角に向けられる場合、又は、異なる固定関係を有する場合に、位置合わせされ得る。幾つかの実施形態において、位置合わせされた複数の光ビーム又は複数のX線間の角度は、略0°〜略360°の範囲に及ぶことがあり得、及び、略90°、略180°若しくは略270°を含むことができる。
【0090】
本明細書で使用する用語「治療軸」は、広義の用語であって、次のものに限定しないが、一般に、放射線療法装置と関連した器官の軸を含むことを意味する。例えば、実施形態によっては、器官の軸は、角度などにより、放射線療法装置の軸と関連する。幾つかの実施形態において、器官の軸と放射線療法装置の軸との交点は、放射線療法ビームの標的を定義するために用いられる。
【0091】
本明細書で使用する用語「治療セッション」は、広義の用語であって、次のものに限定しないが、一般に、加熱療法、放射線療法又は標的組織を治療するその他の療法の少なくとも1つの実施を1つ又は複数含むことを意味する。例えば、実施形態によっては、治療セッションは、眼に対するX線ビームの照射を1つ含むことができる。また、幾つかの実施形態において、治療セッションは、患者の眼に対するX線ビームの照射又はレーザ放射線の照射を複数含むことができる。幾つかの実施形態において、治療セッションは、例えば、患者が治療のために診療所に一度だけ通院するなどの場合に限定されているが、実施形態によっては、患者が診療所に複数回通院する場合には、治療セッションを複数回に分けることもできる。幾つかの実施形態において、治療セッションは、放射線療法を施す単一治療を含むことができ、及び、実施形態によっては、治療セッションは、夫々の治療に対する異なるプロトコルに続く複数の治療を含むことができる。幾つかの実施形態において、治療セッションは、略1日に限定されてもよく、及び、実施形態によっては、治療セッションは、略2日、略3日、略5日、略1週間、略10日、略2週間、略3週間、略1ヶ月、略6週間、略2ヶ月、略3ヶ月、略6ヶ月、略1年、又はそれ以上であってもよい。本明細書で使用する用語「治療期間」は、広義の用語であって、次のものに限定しないが、一般に、1つ又は複数の放射線療法又はこれと関連する組織の治療上の処置を含み、また、1つ又は複数の治療セッションを含むことができることを意味する。
【0092】
本明細書で使用する用語「位数(orders of magnitude)」は、広義の用語であって、次のものに限定しないが、一般に、スケールのクラス又はあらゆる量の大きさを含むことを意味する。夫々のクラスは、先行するクラスに関する割合の値を含む。例えば、実施形態によっては、夫々のクラスに関する割合は、10であってもよい。実施形態において、1位数は、10の一乗に基づく大きさであり、2位数は、10の二乗又は100に基づく大きさであり、及び、3位数は、10の三乗又は1000に基づく大きさである。
【0093】
幾つかの実施形態において、放射線療法システムは、放射線療法のための放射線ビームを生じるように構成される。ビームは、異なるサイズ又は異なる断面形状のビームを生じるようにコリメートされることができる。ビーム形状は、一般に、X線経路の最後のコリメータ開口によって定義される。ここで、ビーム経路の2つのコリメータのうち、2次コリメータが、ビーム経路の最後のコリメータであり、「成形コリメータ」と呼ばれることがある。また、1次コリメータは、X線出力を最初に減衰させ及び複数のコリメータのうち最も大きく減衰させることができるので、最初のコリメータと呼ばれることがある。2次コリメータは、一般に、X線ビームの最終的な形状を設定することができる。例えば、最後のコリメータ開口が四角である場合、ビーム形状は同様に四角である。最後のコリメータ開口が円形であれば、ビームは円形である。最後のコリメータが複数の穴を有する場合、標的に到達するビームは、その複数の穴の夫々が備えるあらゆる形状(放射線が通過する面積(area)に対応する形状若しくは放射線を通過させない面積に対応する形状、又は放射線を制限する面積に対応する形状)を有する。幾つかの実施形態において、1次コリメータとして機能すると共にビーム成形コリメータとしても機能するコリメータを1つだけを用いてもよい。
【0094】
半影は、最後のコリメータ面積、ビーム形状及びビームサイズによる線量外縁の減衰に関するものであり、通常は最後のコリメータからの任意距離で測定される。本明細書で使用する半影とは、広義の用語であって、通常のものを意味するものであり、次のものに限定しないが、一般に、X線ビームが組織の第1表面又は眼球内部の標的組織に到達するとき(半影に関して参照される場合はどちらでもよい)の最後のコリメータ面積より外縁の照射パーセンテージを含むことを意味する。例えば、半影は、X線ビームが眼の表面に到達するとき又はX線ビームが眼の網膜に到達するときの最後のコリメータ面積より外縁の照射パーセンテージを含むことができる。半影は、ビームの広がりだけでなく、空気及び組織を通過した結果のビーム散乱をも包含することがあり得る。次のものに限定する意図ではないが、半影は、実施形態によっては、放射線レベルが散乱及びビーム広がりの双方を含む1次ビームサイズ放射線の20%未満になる場所で、1次ビームサイズからの直線距離に従って使用される。例えば、コリメータにより決定されるビーム直径がコリメータ出口で5mmであり、組織標的での直径が6mmである場合(ここで、放射照射量は、5mmビーム直径上の線量の20%である(組織での直径))、半影は、0.5/3.0mm(半径)又は16%である。
【0095】
理想的には、標的組織上のビーム入射サイズは、X線ビームに曝される最後のコリメータと同一サイズである。すなわち、半影は、理想的にはゼロである。実際には、ゼロ半影は、コリメータが標的から任意距離にあるとビーム広がりが生じるため、その達成は困難である。しかし、半影は、例えば、コリメータ物質、コリメータ物質の処理、X線管(チューブ)の陽極の位置、X線管の陽極並びに組織標的に対するコリメータの位置、及び、X線源に対するコリメータの相対的なサイジング(sizing)などによって、最適化することができる。本明細書で提供するシステム及び方法の幾つかの実施形態において、組織(例えば、眼)への侵入点における半影パーセンテージは、略10%未満である。幾つかの実施形態において、侵入点での半影パーセンテージは、略5%未満であり、及び、実施形態によっては、侵入点での半影パーセンテージは、略1%未満である。
【0096】
また、半影は、標的領域における成形コリメータゾーン外縁の照射パーセンテージに関連し得る。例えば、眼に対する適用において、半影は、前述の黄斑において成形コリメータゾーン外縁の照射パーセンテージに関連し得る。幾つかの実施形態において、黄斑での半影は、略40%未満であり、幾つかの実施形態において、黄斑での半影は、略20%未満であり、幾つかの実施形態において、黄斑での半影は、略10%未満であり、及び、幾つかの実施形態において、黄斑での半影は、略5%未満である。半影は、治療計画に組み込まれる要因又はパラメータになり得る。例えば、半影の予測情報は、治療を計画するために利用されることができる。一実施形態において、微細なコリメートビーム(例えば、最後のコリメータ出口で、4mm直径を有するコリメートビーム)は、強膜に適用される。網膜におけるビームは、5mm直径(半影は25%)又は6mm直径(半影は50%)であるとよい。これらビーム直径は、疾患の適用範囲に対して充分な大きさである。この方法は、眼の前部構造に照射される放射線を最小限に抑えると共に、網膜における疾患を完全にカバーする。本実施形態において、X線ビームの広がりは、網膜に対する治療量を犠牲にすることなく、眼の前面組織への照射サイズを最小にするために利用される。
【0097】
関連定義には、線量減衰に関する「等線量減衰」があり、これは、関心領域の線量地図(dose map)である。等線量減衰は、Gy/mmで測定されることができる。ここで、mmは、関心点からの直線距離を表す。
【0098】
広がり角は、線源のジオメトリが与える光子から十分に予測可能である。そして、広がり角は、散乱や、モンテカルロシミュレーションを含めた若しくは考慮したその他の物理的現象などを夫々計算することができる。大抵の場合、X線源は、理想的な点光源ではなく、有限体積を有する。この非理想的なケースは、コリメータのビーム経路の設計に入力される。この場合、コリメータは、理想的な点光源に対してではなく非理想的なX線源に対して異なって設計される。例えば、X線源は、正方形若しくは長方形又は楕円の線源であってもよい。線源の最大直径は、略0.5mm、略1.0mm、略2.0mm、略3.0mm、略4.0mm又は略5.0mmであってもよい。幾つかの実施形態において、線源の最大直径は、治療される構造に従ってさらに調節されることができる。
【0099】
より短波長の光子は、より高エネルギーの放射に対応する。X線の高エネルギー範囲は、通常、MeV範囲であり、及び、一般に、(放射を発生させる方法から独立した)ガンマX線に関連する。比較的に短波長のX線光子は、常用電圧X線と呼ばれる。短波長の高エネルギー放射は、標的組織への深侵入に相当する。このため、MeVエネルギーを利用する大部分の適用では、患者及び周囲環境に広範囲な遮蔽を必要とする。この開示の幾つかの実施形態において、診断目的又は低エネルギー常用電圧X線源に一般に用いられるX線は、眼の疾患及び患者の比較的に浅在部分にある障害(例えば、胸部、手術中の放射適用、皮膚癌、及び、末梢血管障害やインプラントなどのその他の障害)、の少なくとも一方の療法に用いられることができる。診断に一般に用いられるX線は、X線光子の細ビームにX線ビームを細密にコリメートすることで、及び、浅在領域にビームを向けることで、療法に用いられることができる。障害が身体内部に数センチ入った深部に存在する場合、高エネルギー源(例えば、MeV)は、障害に対するエネルギーの侵入性を高めるために好ましい。小半影を有する小直径のMeVX線ビームをコリメートするのは困難である。これは、非常に高速の光子が、二次X線及びその他の放射の生成を含む二次相互作用を組織に生じさせるためである。500keV未満のエネルギー、及び、200keVよりもさらに低エネルギーのX線は、非常に小さな直径でより適切にコリメートされることができる。
【0100】
また、「レーザ」エネルギーは、紫外線放射などの短波長から赤外放射などの長波長までの範囲におよぶ異なるエネルギーを有する光子で構成される。レーザは、放射の特定波長よりも、より伝達メカニズムに関連する。レーザ光は、光子が互に同相でほとんど拡散せずに移動するという点で、「コヒーレント」であると考えられる。また、レーザ光は、空間を進むときに比較的にほとんど拡散せずに移動するようにコリメートされる。光は、コヒーレント(同位相で)とならずに及びレーザとならずに、コリメートされることができる。例えば、レンズを、非X線光をコリメートするために用いることができる。X線光は、通常、非レンズコリメータを用いてコリメートされる。そして、半影は、良好なコリメーションの程度を定義する。レーザポインタは、通常、可視化用ツールである一方、より大きく、より高いフラックスレーザは、医療用途に利用される。本明細書に記載のシステム及び方法の幾つかの実施形態において、例えば、レンズや鏡などの光学装置(optics)を用いることができ、実施形態によっては、コリメータを用いてもよいが、介在光学要素は存在しない。
【0101】
2つの眼房は、前眼房及び後眼房である。前眼房は、特に、水晶体(レンズ)、結膜、角膜、強膜、小柱装置(trabecular apparatus)、毛様体、筋肉、プロセス(processes)、及び、虹彩を含む。後眼房は、特に、硝子体液、網膜及び視神経を含む。
【0102】
この開示で使用する「眼の疾患」は、広義の用語であって、通常のものを意味するほか、次のものに限定しないが、一般に、前眼部の疾患(例えば、緑内障、老視、白内障、ドライアイ、結膜炎)だけでなく、後眼部の疾患(例えば、網膜症、加齢黄斑変性症、糖尿病性黄斑変性症、及び脈絡膜メラノーマ)を少なくとも含む。
【0103】
ドルーゼは、網膜下のブルッフ膜における硝子質の沈着物である。この沈着物は、炎症過程で生じ、又は、少なくとも炎症過程の標識となる。これは、70歳以上の患者の間で大きな割合で存在する。因果関係は解明されていないが、ドルーゼは、炎症が生じる位置及び新生血管が将来的に生じる可能性が高い位置の標識に関連する。これらの位置は、いわゆる「脆弱な網膜」の領域である。従って、本明細書で記載するように、その領域に炎症を抑える放射線を照射することは、患者にとって有益な場合がある。
【0104】
放射線療法は、歴史的に眼の疾患の治療に僅かに成功している。例えば、近年公表されたコクランメタアナリシス(Cochrane meta-analysis)(シグナバネル等著、加齢黄斑変性の新生血管に対する放射線療法、コクランデータベース、2006年4月発行(Signanavanel et. al. Radiotherapy for neovascular age-related macular degeneration, The Cochrane Database, Issue 4, 2006)。この内容は参照により本明細書に組み込まれる)において、著者は、AMDに対する放射線療法のメリットを論じている。この全体的な結論は以下の通りである。眼科医は、放射線腫瘍医を患者に関わらせることに消極的であったこと、具体的な方法を臨床プロトコルに用いなかったため、放射線源から放射線を局所化することが困難であったこと、並びに、分割スキーム(fractionation scheme)及び照射(dosing)が、標準化されていなかったこと(標準化に関しては詳細に後述し、及び、図示している)。この開示に記載の実施形態により、放射線腫瘍診療所に委託することなく眼科医が実行可能であって、臨床治療に特有の装置及びプロトコル、並びに標準化された照射を提供する分割スキームによって、放射線源を局所化可能である、システム及び方法が提供されている。
【0105】
近接照射療法は、少なくともアジュバント療法としての薬物療法と併用される場合に非常に有益な作用を生じる。該近接照射療法は、治療領域に放射線量を提供し、及び高効率で線量を照射する。しかし、近接照射療法は、治療計画(例えば、外科医があらゆる患者の様々な位置に対してもプローブを保持できるなどの治療計画)に関する限り制御が困難であり、及び、近接照射療法は、通常、切ることができない(例えば、ストロンチウムの半減期が29年であるため)。
【0106】
放射線療法システム
【0107】
図1Aのポータブル常用電圧放射線療法治療システム(PORT)10は、治療期間の間に略1Gy〜略40Gy、又は治療期間の間に略10Gy〜略20Gyを、次のものに限定しないが、網膜、強膜、黄斑、視神経、水晶体又は人工水晶体のカプセル状嚢(capsular bag)、毛様体筋、レンズ、角膜、シュレム管、脈絡膜、及び結膜を含む眼の領域のあらゆる場所に伝達するように構成されることができる。幾つかの実施形態において、システムは、治療期間の間に略15Gy〜略25Gyを伝達するように構成されることができる。幾つかの実施形態において、システム10は、あらゆる分割スキーム(例えば、1日あたり略1Gy、1日あたり略5Gy、1ヵ月あたり略10Gy、又は、1年あたり略25Gy)でX線療法をもたらすことができ、治療計画システムは、患者に特有の解剖学的構造並びに疾患の特徴に基づいて治療された領域をメモリに保存し、及びメモリから呼び出すことができる。このような特長及び以前の治療歴は、後の参考のために治療データベースに保存される。
【0108】
また、システムは、疾患の程度又は治療される眼の領域に従って異なる光子エネルギーを伝達することができる。例えば、X線発生管は、略20keV〜略40keV、〜略60keV、〜略100keVの範囲の光子エネルギーを有する光子を伝達することができる。眼の前部構造に対しては、略20keV〜略50keVの範囲の光子エネルギーを有する光子を用いるとよい。これは、このような範囲の光子エネルギーを有する光子は、侵入の程度が浅いからである。眼の後部構造に対しては(網膜への深侵入のために)、略60keV〜略100keV又はそれ以上の範囲の光子エネルギーを有する光子を利用するとよい。幾つかの実施形態において、X線発生管は、略10keV〜略500keV、略25keV〜略100keV、略25keV〜略150keV、略40keV〜略100keV、又は、前述した範囲又はこれら範囲のあらゆる組み合わせの範囲の光子エネルギーを有する光子を放射することができる。幾つかの実施形態において、光子エネルギーの選択は、治療対象の実際の患者の眼から取得した解剖学的データにより生成される眼モデルを算入できる診断の計算に基づくことができる。医療治療の専門家は、疾患に基づくビームエネルギーを選択することができ、そして、機器に所望のエネルギーレベルを設定することができる。幾つかの実施形態において、システムは、医療専門家から、疾患のタイプに関する入力を受信することができ、エネルギーレベルを予め設定されることができ、そして、医療専門家による修正を受信することができる。
【0109】
PORTは、本明細書の幾つかの実施形態において眼の適用に関連して説明しているが、常用電圧X線の到達範囲にあるあらゆる表在性の身体構造、又は、外科手術の間にアクセス可能な構造体に対しても適用することができる。例えば、胸部などの領域で、関心構造に到達させるために、40keVを越えるが200keV未満のエネルギーを有するX線を用いるとよい。例えば、その他の関心構造としては、皮膚病変、顔面病変、頭並びに首の粘膜病変、爪、筋肉、軟組織、肛門直腸領域、前立腺、陰部、関節、腱、筋肉、及び、尿生殖路などを含む。
【0110】
PORTは、眼の範囲内の特定構造以外には適用させずに、その特定構造にだけ適用させることができる。これは、PORTのイメージングシステム、モデリングシステム、及び、微細調整可能なコリメートビームが、眼の内部にある特定構造を標的とすることができ、小半影(例えば、略1mm〜略5mmビームにつき、半影が略10〜20%未満)を有するX線ビームの正確な方向付けを提供することができるためである。また、PORT療法は、個々に区別され、全ての患者に対して生成されるカスタマイズ治療計画を可能にする生体測定表示に基づく。
【0111】
前述したように、常用電圧発生器、又はその他の低エネルギーX発生器は、分厚い防壁、特殊遮蔽装置、又は、略500keVを越える光子エネルギーを有するX線を発生する装置により要求される特殊制御を要求することなく、部屋に設置されるシステムを可能にする。また、常用電圧発生器又はその他の低エネルギーX線発生器は、ライナックよりもさらに小型であり、より小型の発生器の駆動を可能とし、及び、制御モータのエネルギーを低減できるだけでなく、内部遮蔽及び外部遮蔽をも低減することができる。さらに、低エネルギーX線発生器は、ビームコリメーション及びビームを向けるスキーム(scheme)を容易にするため、ビームが小半影を有し及びより隙間のないコリメーションを可能にする。さらに、X線源を移動するために要求されるスキームにおいて、エネルギーは、線源を異なる位置に移動させるために用いられるのではなく、及び、全システムは低エネルギーX線源を有してスケールダウンされる。
【0112】
幾つかの実施形態において、放射線療法システムは、眼に関する多種多様な病状を治療するために用いられる。例えば、システムは、黄斑変性、糖尿病性網膜症、炎症性網膜症、感染の網膜症、眼の内部、眼の周囲若しくは眼に接する腫瘍、緑内障、屈折障害、白内障、眼の構造に関する手術後(例えば、線維柱帯形成術、線維柱帯切除術、眼内レンズ、緑内障ドレナージ管、角膜移植、感染、原因不明の炎症性疾患の手術後など)のあらゆる炎症、プチリジウム(ptyrigium)、ドライアイ、及び、その他の眼疾患又は眼に関するその他の病状などを治療するために、単独で又はその他の治療と併用して用いられることができる。また、放射線療法システムは、最大ビームエネルギービーム角度、眼のジオメトリ(幾何学的形状)のための制御、及び、患者並びに眼、の少なくとも一方が所定位置から移動したときに装置を停止するための制御、を含む。
【0113】
放射線治療システムは、実施形態によって、放射線源と、該線源を三次元空間の座標に応じて制御及び移動するシステムと、イメージングシステムと、治療パラメータを入力するヘルスケアプロフェッショナル用のインタフェースと、を含む。具体的には、放射線療法システムの幾つかの実施形態は、放射線源並びに線源を作動するための電源装置と、電動制御モジュール又は線源に対する制御電力と共に線源の方向を操作するサブシステムと、関心構造(例えば、眼)に対して線源と制御とをリンク(連結)させる連結モジュールと、イメージングサブシステムを含む放射線療法発生モジュール又はサブシステムを含んで構成される。幾つかの実施形態において、これらモジュールは、ヘルスケアプロフェッショナル用のインタフェースにリンクされ、及び、治療計画システムの基礎を形成する。用語「モジュール」及び「サブシステム」は、本開示において交互に用いられることができる。
【0114】
図1Aは、放射線療法を用いて眼疾患を治療するシステム10の一実施形態に係る側面図を示す。図示した実施形態において、放射療法治療システム10は、放射線療法発生モジュール又はサブシステム110と、放射線療法制御モジュール又はサブシステム120と、インタフェースディスプレイ130と、処理モジュール140と、電源装置150と、ヘッドレスト160と、カメラであり得るイメージングモジュール400と、を含んで構成される。
【0115】
一実施形態において、放射線療法装置は、患者220の眼210に、X線を伝達する。電源装置150は、システム10内部に設けられるか、又は、システム10(例えば、床に)に隣接して設けられるとよい。しかし、実施形態によっては、電源装置150は、システム10から離れた異なる位置に設けられることもできる。電源装置150は、X線発生器110に(一体構成で)物理的に連結されることができ、又は、X線発生器(例えば、電源装置とは独立して移動し、及び、例えば、高電力ケーブルを通じて接続されるX線源)から外されることができる。実施形態によっては、電源装置は再充電可能なポータブル電源である。また、幾つかの実施形態において、X線管の冷却システムが提供される。冷却システムは、水、油又は空気対流であり得、及び、冷却システムは、放射線療法システム10に設置されることができ、又は、放射線療法システム10から離れて配置されることができる。
【0116】
電圧は、略110V又は略220Vの壁電圧(変圧器を経た壁電圧)であり得、装置、サブシステム又はシステムモジュールのために用いられることができる。X線を発生させるためにシステムに供給される電流は、略1A(アンペア)のオーダー、略50mAより低いオーダー、又は、略5mAから略10mAのオーダーであるとよい。幾つかの実施形態において、電源装置は、数百ミリアンペア(例えば、略600mA)に達する電流を伝えることができる。例えば、略100mAから1A、又は、略100mAから1A超の範囲の電流は、システムのプロトコル又は機能が、例えば、X線源が回転陽極源(rotating anode source)である場合など高電流に適応するように構成されるときに用いられることができる。
【0117】
幾つかの実施形態において、電源装置に要求されることは、X線管内の陰極からX線の陽極に電子を飛ばすために高電圧を発生可能であるということである。電子移動は、真空X線管内で起こる。高電圧(例えば、略30,000〜略300,000V(ボルト)、又はそれ以上の高電圧)は、真空内部で電子を加速するために要求されることができる。第2電流は、一般に、フィラメントから電子を発生させるためにX線電源装置で用いられ、電子は、その後、電位により加速される。従って、X線電源装置は、通常は、X線を発生させるために2つの電源装置を有する。一旦発生されると、電子は、高電位の影響を受けて陽極の方向へ速度が上がる。陽極は、X線を発生する代表的には静止した物質(例えば、タングステン、モリブデン)である。
【0118】
陽極は、放射線源とみなされ、及び、陽極のサイズ及び構造は、半影決定の役割を有する。例えば、点光源は、略1mm以下の最大直径を有する陽極により近似され、複数点光源は、高密な半影により最高品質ビームを伝えることができ、略1mm超の陽極を有する線源は、最適ではなく、また、例えば、2mm、3mm、4mm又は5mmの線源は、本明細書に記載の実施形態に関連して用いられることができる。しかし、半影は、略1mm以下である横断面寸法(直径)を有する線源よりも大型の寸法を有する線源より、一般に、大型である。また、陽極は、X線フラックスの主要な決定因子である。陽極で発生する熱は、X線源により達成される最大フラックスの主要な制限因子である。冷却できる陽極の範囲に応じて、X線フラックスを増加させることができる。これは、半影のトレードオフの要素部であり、大型の陽極は、多量の熱に起因する大型の電流を許容することができる。X線出力は、より大きなX線フラックスを可能にするより低温度に対する非常に高電流の電流に関連する。幾つかの実施形態において、回転陽極源は、時間と共に異なる点へ移動する陽極によって、陽極を「冷却する」ために用いられる。
【0119】
一旦、電子がX線を発生する物質に衝突すると、X線が発生する。システムのケーシング内の吸収金属(例えば、アルミニウム、鉛、又はタングステン)は、線源110から散乱する生成X線を多量に吸収する。エスケープが予め計画されたX線は、線源から放出され、及び、コリメータ(例えば、1次又は2次のコリメータ)に移動し若しくは選択的にフィルタ(例えば、アルミニウムフィルタ)を通じてコリメータに移動する。コリメータは、患者220にX線を向けるように計画される。特に、本明細書に記載のように、コリメータは、半影の形成並びに散乱を最小化、及び、X線ビームの形状並びに方向、の少なくとも一方を最適化するように、設計及び製造されることができる。電源装置は、電力漏洩を低減するために高絶縁された高電力ケーブルによりX線源に接続されるとよい。
【0120】
コリメータは、1以上のコリメータ(例えば、図2Aに示したように、1次コリメータ1030、2次コリメータ1040、さらに3次コリメータ1052)であり得る。実施形態によっては、2次(成形)コリメータが、患者の眼1300に近接して配置され(例えば、10cm以内)、及び、1次コリメータ1030が線源1070に近接して配置される。この種の構成は、眼1300の眼構造上の線源1070により発生させられる半影を低減することができる。線源は濾過(filtration)を含むことができ、また、コリメータが濾過を含むことができる。
【0121】
幾つかの実施形態において、コリメータは、特殊開口である。開口は、調節されることができ、例えば、開口は、略1.0cm〜略0.5mm、又は、略0.5cm未満〜0.01cmに調節されることができる。幾つかの実施形態において、開口は、略0.5mm〜略7.0mmの間で調節される(例えば、機器のオペレータによって自動又は手動で調整される)。幾つかの実施形態において、コリメータは、タングステン、鉛、アルミニウム又はその他の重金属から構成される。幾つかの実施形態において、コリメータは、通過する放射のために円柱形状を有し、実施形態によっては、コリメータは、通過する放射のために円錐形状を有する。幾つかの実施形態において、コリメータ開口は、円形状を有する。特定の実施形態において、コリメータは、通過するX線のために曲線形状を有する。コリメータは、標的で要求される放射分布に対応して成形されることができ、例えば、実施形態によっては、黄斑領域に放射を集中させると共に、視神経を避けることができる。これは、視神経を避けるために、黄斑の視神経側(鼻側)が黄斑の側頭部側よりも少量の線量を受信するように、クレセント(crescent)形状のコリメータ又はその他の重量配分(weighted distribution)により方向付けられる放射線であると好ましい。
【0122】
幾つかの実施形態において、コリメータは、ワイヤ放電加工を用いて切断され、その他の実施形態では、コリメータ経路は、レーザを用いて切断及び研磨される。幾つかの実施形態において、コリメータは、平滑な輪郭がつけられ、放射線がコリメーション装置を通過するときの散乱を低減するように切断及び研磨される端部を有する。幾つかの実施形態において、コリメータは、ビームを比較的修正するが、シャープな輪郭を有しないように、他の部分より薄い(thinner)金属部分を有する。他の実施形態においては、コリメータは、完全な開口でなくて、大量のX線エネルギーが要求される領域に対しては薄い物質である。例えば、フィルタ物質の厚さは、形状又はフィルタ物質の所望フィルタリング特性に従って変化させてもよい。幾つかの実施形態において、フィルタ物質の厚さを半分に低減すると、該フィルタ物質の厚さを低減した部分を放射線ビームが通過することを可能にするが、厚さを低減していないフィルタ部分を放射線ビームが通過しようとする場合には依然として実質的に遮断される。幾つかの実施形態において、フィルタ厚さは、全体的に一定であるが、異なるX線不透過性を備える物質が用いられる。例えば、高X線不透過性を備える物質は、X線放射にフィルタをかけるために用いられ、及び、低X線不透過性を備える物質は、例えば、X線の通過を可能にする開口の位置に用いられる。
【0123】
幾つかの実施形態(例えば、図2C)において、光ポインタ1410(例えば、光源1450から放射されるレーザビーム)は、X線ビーム1400と一致するように、コリメータ1405に連結され、又は、コリメータ1405の後方に連結され、光ポインタ1410は、放射線源がコリメータ及びX線ビームのトラッキング入射角1420、1430で入る眼1300の表面上の位置を示すことができる。コリメータ1405は、放射線が入る眼状のポイントを示すポインタとして機能し得る光源1450との共線にあるとよい。幾つかの実施形態において、光ポインタ位置は、眼構造(例えば、角膜輪部(limbus))に関して、ポインタの位置を識別するイメージ認識システムと共に、放射線療法線源を追跡するために用いられ、及び、放射線療法装置は、イメージに基づいて(例えば、眼の角膜輪部からさらに離れて又は近接する領域に)移動される。幾つかの実施形態において、治療者は、角膜輪部に関するレーザポインタの位置を視覚化して、その位置に手動でX線源を調整する。
【0124】
幾つかの実施形態において、レーザポインタ1210は、図2B−1に示すように最上部に位置するか、又は、1次若しくは2次のコリメータ1215を通るX線ビームと一致する。レーザポインタ(レーザ光)1210は、コリメータ開口を通過し、X線1200と実質的に同一の表面位置にあたるように、レーザポインタ1210とコリメータ開口1216を位置合わせする反射体1220により反射されることができる。幾つかの実施形態において、レーザポインタ1210は、コリメータ開口1216を通過するX線ビーム1200と実質的に同一軌道を有するように、コリメータ開口1216によって位置合わせされる。あらゆる場合において、レーザポインタ1210及びX線ビーム1200の方向は、相互に結びつけられ、何れかの既知の位置が、一方のビームの既知の位置と等しくなる。
【0125】
反射体1220は、ビームスプリッタであってもよい。このビームスプリッタは、エネルギー1200を透過させることができ、さらに、X線エネルギーの所望スペクトルを生成するフィルタとして機能する。レーザポインタ1210は、(図2Cに示す)システムカメラ1460が検出可能な波長を放射することができる。これによれば、ポインタ1210は、放射線ビームが眼に入る箇所を示すので、これをカメラ上で確認することができる。また、ポインタ1410は、X線源が電力供給され及び関心眼構造若しくは関心標的組織1480に対する正確な方位に向ける視覚確認として役立つ。システム内の第2カメラ、レーザポインタの入射角、及び、定義によって、X線ビームが決定されることができる。
【0126】
例えば、カメラなどの少なくとも1つのイメージングモジュール400、1460は、少なくとも実時間(リアルタイム)で眼を追うためにシステムに含まれる。実施形態によっては、イメージングモジュール400、1460、又はカメラは、前述したX線源トラッキング装置(例えば、レーザポインタ1210)の有無に関わらず、眼を撮像する。カメラは、眼の位置を検出することができ、及び、X線の方向並びにコリメータシステムを眼の位置に関連づけることができる。システム10上の放射線療法システムのオペレータに指示を与える選択的な表示130は、実施形態によっては、リアルタイムにX線装置の位置を表示することができる。
【0127】
一実施形態(図4)において、カメラ2055が眼の位置を検出し、及び、デジタル化ソフトウェアが眼の位置を追跡するために用いられる。眼は、予め設定された位置2060(又は治療領域)の範囲内に存在する。この位置は、角膜輪部の端部と一致しており、眼が移動閾値を越えて位置2054から外れると、シグナル2090が放射線源2000に送信される。本明細書で使用する用語「移動閾値」は、広義の用語であって、通常のものを意味するものであり、次のものに限定しないが、放射線源2000を停止させることなく、眼が治療パラメータの範囲内を移動し又は該範囲内に存在する程度(degree)又は測定値を含む。幾つかの実施形態において、移動閾値は、ラジアン、度、ミリメータ、インチなどで測定されることができる。眼が移動閾値を越えて位置2057へ外れると、放射線源2000はオフされ、一方、眼が位置2054又は移動閾値の範囲内であると、放射線源2057はオンされる。移動閾値をセットするいくつかの方法において、治療プロフェッショナルは、角膜輪部2060の端部境界を定め、及び、その角膜輪部2060の端部を治療計画ソフトウェアに登録する。眼の角膜輪部が、定めた端部境界から2030へ離れる場合、放射装置を停止するためにシグナル2090が放射装置に送信される。
【0128】
幾つかの実施形態において、接続部又は連結部162は、システムから延設され、及び眼210に接触する(図1D及び1E)。接続部は、機械的な接続に加えて、システムと眼との間の光学的通信又はその他の通信を含むことができる物理的な接続であり得る。物理的接続部162は、幾つかの機能を提供することができる。例えば、実施形態によっては、接続部162は、角膜又は強膜に直接に適用されるために、決定された眼の位置へと機械的に伸長されることができる。また、接続部162は、患者が治療の最初から最後まで所定位置に眼を保持することに応じるように、眼の制止のために提供される。加えて、眼は、例えば、患者の眼が治療を実行するために麻酔されている場合に、予め定めた所定位置に移動されることができる。最後に、眼に関する物理的接続は、角膜の領域を保護するために物理的接続装置底面に点眼潤滑剤を用いることができる。角膜の物理的接続部162は、システムに関する眼の位置決めを可能にする。
【0129】
放射線療法システム10から眼への物理的接続部162は、図1E(図1Cの308も参照)の眼に関する角膜輪部905に接触でき、又は、角膜915若しくは強膜925に接触できる。物理的接続は、多少の力により適切に眼を移動させ又は保持するために、眼に対して多少のフリクションを適用する吸引式装置912を含むことができる。特定の実施形態において、接続部162は、吸引が適用されたときに強膜に接触する。物理的接続部162は、眼に別途に挿入される強膜レンズ935又は角膜レンズとドッキングすることができる。物理的接続部のあらゆる物質は、X線を透過させることができ、又は、ある程度のX線を吸収することができる。
【0130】
物理的接続部162は、患者の眼の安定化を補助することができ、レンズ下の眼球運動を低減する。潤滑剤がレンズ内側に塗布される場合、該レンズは、治療の間、眼を保護するためにゲル又は潤滑剤を保持することができる。また、レンズは、角膜に酸素を提供できる貫通孔を含むことができる。
【0131】
物理的接続部162は、放射線療法システムと患者との間の剰余(スペース)を移動可能であることができ、物理的接続部162は、剛性、実質的に剛性であってもよく、又は、軸方向又はねじれ方向に可動性を与えるばね165を含むことができる。幾つかの実施形態において、接続部162は、全てが機械式ではなく、放射線療法システムと眼の上に位置するレンズ935との間を通信する光学式又はその他の非接触方式である。物理的接続部162は、放射線療法システムに対する座標基準フレーム(coordinate reference frame)を示すこと、及び、眼に対する装置の移動信号を出力すること、の少なくとも一方を実行できる。従って、接続部162は、患者の動きを抑制することにより眼の位置決めを保持することに加えて、眼の位置を保持することを支援できる。物理的接続部162は、無線送信機、レーザポインタ、又は三次元空間に眼を位置させることができるように、カメラに取り込むことができる機能を含み得る。
【0132】
幾つかの実施形態において、眼に対する物理的接続部162は、角膜輪部の中心及び該中心を通る治療軸を識別するように、治療者によって眼上の位置にドッキングされる。そして、眼の位置決めは、放射線療法システムにより識別及び追跡されることができる。眼モデルと組み合わせた角膜輪部の既知の中心に関して、放射線療法システムは、網膜に放射線を伝達するため、治療軸及び角膜輪部の中心に向けられることができる。
【0133】
幾つかの実施形態において、物理的接続部162は、放射線療法連結装置945を含むことができる(図1G)。連結装置945は、例えば、強膜レンズ及び放射線療法連結表面950を含むことができる眼表面960を有する。眼表面960は、角膜を覆うこと及び角膜に接触することができ、又は、強膜に接触することにより角膜を覆うことができる。幾つかの実施形態において、眼表面960は、角膜及び強膜の双方を覆うこと、接触すること、ができる。眼表面960は、実施形態によっては、レンズであり得、及び、実施形態によっては、表面960は、少量の屈折又は完全に屈折しない実質的な透明窓であることができる。眼表面960は、眼のゲルを保持するために用いられることができ、又は、中心の孔部を有するシェルであり得る。眼表面960は、例えば、IOLマスター、光コヒーレンストモグラフィー(断層映像法)(OCT)、角膜表面マッピング、MRI、CTスキャン、及び、超音波などの画像診断技術を用いて、個々の患者に合わせてカスタマイズされることができる。眼表面960は、柔軟性、剛性、又は、コンポジットであり得る。フランジ970は、開瞼を保持するように機能することができ、又は、放射線療法装置の基準(fiducial)として機能することができる。
【0134】
眼表面960の反対側は、放射線療法連結表面950、又は放射線療法連結表面部955である。これらの表面は、個別に又は集合的に、放射線療法システムを有する連結装置945と連結する。眼及び眼構造と連動する眼表面インタフェース960、放射線療法部950、955は、眼表面を放射線療法システムに連結する。放射線療法部950、955は、様々な方法で連結装置945を放射線療法システムに連結することができる。例えば、放射線療法部950、955は、レーザポインタを介して、赤外線連結を介して、マクロは連結を介して、機械的連結を介して、反射器を介して、又は、放射線療法送信機を介して、放射線療法装置を連結することができる。
【0135】
連結装置945の追加の構成要素は、装置のジオメトリ、又は、装置945と放射線療法システムとの間の幾何学的な関係を定義することができる基準マーカー970である。幾つかの実施形態における放射線療法連結装置945の追加の構成装置は、装置を横断する内腔985であって、実施形態によっては、該内腔985は、眼の表面まで伸長する。内腔985は、(例えば、A−scanなどで)眼軸長を測定するために用いられることができるプローブ962を通すために用いられることができる。幾つかの実施形態において、プローブ962は、患者の眼から離れて外部(outward)を指すことができるレーザポインタプローブ962を含むことができる。外部ポインティングレーザポインタは、放射線療法システムと関連して、装置と眼との配置(アライメント)を決定するために用いられることができる。幾つかの実施形態において、レーザポインタは、眼の軸に関して放射線療法装置を整列配置するために用いられ、及び、放射線療法のオン(所定位置にあるときにオン)又はオフ(所定位置から外れたときにオフ)を切り替えるために用いられることができる。これらの実施形態において、患者は、装置のオンとオフを切り替え、及び、眼を機械に位置合わせしたときには放射線療法システムを操作し、装置が放射線療法装置により整列配置されないときには放射線療法システムを停止する。
【0136】
幾つかの実施形態において、プローブ962は、鏡964を含む。鏡964は、放射線療法装置の整列又は誤整列を示すビーム反射体として機能することができる。鏡964は、例えば、レーザポインタ又はLEDなどの光であり得る。放射線療法装置から生じる光、及び、連結装置945上の鏡964による光の反射は、放射線療法装置に関する鏡の方向を表す。鏡は、角膜表面に対して並行にされることができる。この場合に、鏡に対して垂直なビームは、角膜に対して略垂直である。角膜に対する垂直なビームは、眼の光軸又は眼軸を通って移動し、及び、眼の後極の中心に到達する(図1I及び図1Jに示し及び記載)。
【0137】
幾つかの実施形態において、鏡は、一部の波長を反射し、それ以外を透過するいわゆる「ホットミラー」又は「コールドミラー」と呼ばれる。「ホットミラー」は、例えば、患者、治療専門医又はカメラがレンズを透過して見ることが可能であるように、赤外線レーザポインタを反射し、及び可視光を透過することができる。可視レーザポインタを反射すると共に赤外線を透過するように、「コールドミラー」は、赤外線を透過し、可視を反射し得る。コールドミラーは、例えば、治療の間に赤外線眼底カメラの利用が要求される場合に用いられることができる。
【0138】
幾つかの実施形態において、装置945の連結表面950、955は、眼を適所で保持するためのホルダー971(図1H)に取り付けられることができる。ホルダー971は、放射線療法装置に設置されることもできるが、好ましくは、例えば、放射装置を保持するテーブル又はプラットフォーム974に設置されるフレームなどによって、放射線療法装置から離れた位置に設置されるとよい。幾つかの実施形態において、フレーム972は、複数の関節を有し、及び、実施形態によっては、フレーム972は、片持ち梁のように可撓性又は弾力性がある。フレーム972は、連結装置945がホルダー971に取り付けられると、患者の眼に対して、連結装置945を介して伝達する多少の力を提供する。
【0139】
幾つかの実施形態において、連結装置945は、放射線透過性の物質、又は、少なくとも一部の放射線を通過させる物質を含むことができる。幾つかの実施形態において、連結装置945の放射線透過性物質は、治療の間、治療X線ビームの通過を可能にするように構成されることができる。例えば、連結装置945は、眼の位置を保持するために眼に係合することができ、及び、X線ビームは、連結装置945の少なくとも一部を通る軌道で眼組織を標的とするように向けられることができる。従って、治療計画システムは、連結装置945を係合する場所や連結装置945を眼上の何処に位置させるかなどを厳密に考慮することなく、X線ビーム軌道を計画することができる。
【0140】
幾つかの実施形態において、連結装置945は、放射性不透過性物質、又は、放射の伝達を減少若しくは制限する物質を含むことができる。幾つかの実施形態において、連結装置945の放射性不透過性物質は、例えば、X線ビームなどの放射物質の伝達を制限するように構成されることができる。例えば、連結装置945は、眼の位置を保持するために眼に係合することができ、及び、眼組織を標的とするように向けられたX線ビームを通過させず若しくは物質を通過するX線ビームを実質的に制限する。これら実施形態において、連結装置945は、(例えば、水晶体、視神経、角膜などの)眼構造に対する放射線照射を制限することにより、重要な眼構造の遮蔽として用いられることができる。
【0141】
治療計画システムは、放射性不透過性物質を識別又は認識するように構成されることができ、及び、連結装置945を横切ることができる軌道であって、標的組織方向への軌道を有するX線ビームの適用を制限することができる。例えば、連結装置945が眼に係合すると、連結装置945を通過して標的組織にX線ビームを適用する眼の外側の場所にゾーンが形成される。ゾーン空間は、連結装置945が実質的に円形であると、標的組織から連結装置945までを円錐形の形で映し出す形となる。ここにX線ビームの線源が配置されると、X線ビームの軌道は連結装置945から標的組織を通過することができるようになる。
【0142】
標的組織から伸長し、連結装置945を通過する軸は、標的組織を治療するために連結装置945を通過することが要求され得るビーム軌道を表す。連結装置945が放射性不透過性物質を含む場合、該物質がX線ビームを妨げ又はX線ビームに影響を及ぼすので、連結装置945を通過する軌道は、最適アプローチであってはならない。従って、実施形態によっては、線源は、標的組織を治療するために連結装置945を通過する軌道と一致する空間の外側に再配置され、及び、連結装置945を通過しない新規な軌道が設定され得る。この新規な軌道は、連結装置を通過する軸を横切り、又は該軸と並行ではなくなる。また、幾つかの実施形態において、新規な軌道は、連結装置を通過する軸に対して並行であってもよいが、軸と共線ではなく、及び、軸と同一側から標的に向けられない。そして、類似の新規な軌道は、軸と類似の関係を有して再現されることができる。
【0143】
幾つかの実施形態において、連結装置945は、放射性不透過性物質及び放射線透過性物質を含むことができる。幾つかの実施形態において、連結装置945の放射性不透過性物質は、例えば、X線ビームなどの放射性物質の伝達を制限するように構成されることができ、及び、放射線透過性物質は、物質を通過する放射線(例えば、X線ビーム)の伝達が可能なように構成されることができる。また、連結装置945は、X線ビームが標的組織を通過し得る軌道に沿う配列を提供するように構成されることができる。さらに、幾つかの実施形態において、連結装置945は、ビームサイズ又はビーム形状を制限することにより3次コリメータとして動作することができる。例えば、連結装置945の放射線透過性物質は、2次コリメータの開口と同程度のサイズ又は形状にされることができる。このような実施形態において、X線ビームが放射線透過性物質を通じて放射されると、連結装置945のあらゆる半影は、周囲放射性不透過性物質によって遮断され得る。幾つかの実施形態において、放射性不透過性物質の開口は、放射線透過性物質の代わりに提供されてもよい。従って、連結装置945は、遮蔽物又は標的機能をさらに提供することができる。
【0144】
連結装置945を提供する幾つかの実施形態は、該連結装置945の中心周囲に放射状に設けられた複数の開口又は放射線透過性物質部分を備える。開口は、円、四角、長方形、楕円、曲線、不規則に、環状に、同心円状などに形成されることができる。幾つかの実施形態において、連結装置945は、組織を標的とする放射線伝達を許容するように装置の中心部だけに、開口又は放射線透過性物質部分を含んで構成される。
【0145】
幾つかの実施形態において、連結装置945は、該連結装置945の実質的な中心部(例えば、眼表面960の部分)が放射性不透過性物質を含んで構成されることができ、及び、その中心部の周囲又は外縁のまわりの連結装置945の部分は、放射線透過性物質部で構成される。従って、放射線療法の間、中心部は眼構造を遮蔽するように作動することができ、及びX線ビームは放射線透過性物質を通過することができる。このように、連結装置945は、放射性不透過性物質に実質的に妨げられずに標的組織に到達するX線ビームを可能にしつつ、眼に係合するためのより大きな眼表面960を有することができる。
【0146】
図1I及び図1Jは、連結装置975が放射線療法システム990を整列配置するために用いることができるメカニズムを表す。レーザポインタビーム977(幾つかの実施形態において放射線ビームと共線であるレーザポインタビーム977)は、コリメータ開口979を通り放射線療法装置990から照射され、連結装置975の鏡976で反射する。図1Iに示すような機器の整列配置をしない場合において、レーザポインタビーム977は、コリメータ開口979の共線上には跳ね返らないが、軸外、すなち、図示した反射点980に跳ね返る。放射線療法システム990の方位は、反射点980の位置を直接可視化することによって、又は、反射点980の位置を検出して、所定配置にレーザポインタビーム977を導くように放射線療法システム990を調整するセンサーによって、手動又は自動的に調整されることができる。実際に、レーザポインタが整列配置されると(図1J)、レーザポインタ977は反射され、及び、その反射点980が実質的にコリメータ開口979とになる。
【0147】
図1Kは、適所に連結装置975を有する放射線療法システムを示す。治療軸214、即ち、使用される放射線ビームの適用について参照を提供する治療軸214は、放射療法システムのシステム軸211であって、矢印112で示す方向にX線源110を回転するシステム軸211に繋げられ又は配置される。X線源110は、イメージングサブシステム400及び(図1Dにも図示した)対応する軸405と共に又は独立して、システム軸211を中心軸として回転することができる。システム軸211と一致する治療軸214に関して、及び、眼210と係合する連結装置975に関して、放射線ビームの軌道は、患者220の眼210における標的組織に一致するように、放射線ビームを向けるために決定されることができる。治療軸214、システム軸211、連結装置975の位置、及びX線源110の位置の空間の定義は、例えば、放射線ビームの方位及び照射を指示するためなどに使用可能な限定座標フレームを提供する。
【0148】
幾つかの実施形態において、X線源110は、例えば、治療計画システム及び眼の仮想モデルによって定義された1つの移動性焦点の周りを移動することができる。移動性焦点は、プログラムされることができ、又は、眼のあらゆる場所に位置することができ、及び、例えば、黄斑などの固定焦点に対する治療の間に、異なる位置に移動することができる焦点である。幾つかの実施形態において、X線源110は、固定軸又は移動軸の周りを6自由度で動くことができる。幾つかの実施形態において、X線源110は、治療領域及び要求線量の所定程度に依存して、眼の前部又はさらには眼の後部における眼構造を治療するために1つのスポットに固定された状態になる。
【0149】
幾つかの実施形態において、X線源110は、眼21に関する異なる位置に移動することにより、及び、強膜上の実質的に異なる侵入点で強膜を通るX線を伝達することにより、X線を標的に集中させるが、各X線ビームは、実質的に眼の範囲内にある同一の標的に到達する。幾つかの実施形態において、X線源110は、6自由度、5自由度、4自由度、3自由度、又は2自由度によって動かされる。幾つかの実施形態において、X線源110は固定であり、及び、コリメータが動かされ、又は、眼の異なる領域にビームを照射するために、眼若しくは患者が動かされる。幾つかの実施形態において、網膜は、強膜に関する1つの位置にX線ビームを維持することによって治療される。X線源110は、ロボットアーム又は手動でシステムオペレータによって自動的に動かされることができる。X線源110の根本的な三次元位置は、眼モデルと、眼に関するX線ビームの位置を決定するロボットアームと、の間を通信する治療計画により命令されることができる。
【0150】
幾つかの実施形態において、例えば、黄斑変性及び糖尿病性黄斑浮腫の少なくとも一方の網膜疾患を治療するために、X線源110に、小移動だけが要求される。これらの実施形態において、6自由度がX線源110に適用されることができるが、各自由度の範囲は、移動システムが略1000cm3、500cm3、100cm3又は略50のcm3の空間内の移動だけで収まるように制限されるとよい。これら体積範囲内のロボットの速度は、ロボットが0.5cm/s、1cm/s、3cm/s、5cm/sで動けるように、定義されることができる。夫々の微小治療線量は比較的に短く及び小距離に適用されるので、ロボットは、速度及び移動距離をより小サイズのために犠牲にすることができる。
【0151】
幾つかの実施形態において、複数のX線源が用いられ、該複数のX線源は、眼の表面上又は眼内の1つの標的組織に複数のX線ビームを全て集中させて伝達できるように、空間内の異なるポイントに夫々配置される。例えば、放射線システムは、3〜6個のX線源を備えることができ、該複数のX線源の夫々は、異なる軌道を有して配置される。また、各軌道の全ては、眼内の治療領域(例えば、図1Cに示したように、中心窩240)で交差するように構成される。X線ビームの適用は、同時又は連続して実行されることができる。同時操作される複数のX線源による治療では、治療時間を短縮することができ、及び、これにより、治療期間の間に患者が動く可能性を低減する。
【0152】
幾つかの実施形態において、放射線療法を眼の毛様体扁平部領域(図1C参照)に実質的に伝達することが、治療システムの目的の1つである。毛様体扁平部215は、毛様体突起218と網膜280の末梢部(鋸状縁)との間に存在する眼の領域である。眼の毛様体扁平部215領域は、強膜260から網膜280の間にある最少の重要な構造を含む。これは、外科医が眼に薬を噴射できる領域、又は、硝子体切除術を実行するための領域である。このアプローチによって眼構造に対する損傷リスクが減少する。同様に、放射線療法は、放射線を、例えば、水晶体などの構造に損傷を与える可能性を最小にするために、毛様体扁平部領域215を通過して眼の後部に伝達することができ、及び、さらに、視神経275に到達する最小放射線と共に、例えば、中心窩240の後部に到達させることができる。本明細書に記載のイメージガイド(画像誘導)常用電圧療法は、このような特殊な治療を可能にする。
【0153】
幾つかの実施形態において、患者がX線放射の照射による影響を受けない人工水晶体(人工眼内レンズ)を有している場合、放射線療法では、角膜又は人工水晶体を通って、中心軸、眼の視軸を直接通って、又は、角膜を直接通って、網膜に伝達されることができる。幾つかの実施形態において、X線放射による治療は、人工水晶体を埋め込むための治療と同時に、提供されてもよい。
【0154】
続けて図1Cを参照する。眼軸300は、通常、眼軸300によって定義され、及び、角膜255の湾曲中央にある。また、この軸300は、光軸又は治療軸と呼ばれることがある。治療軸は、治療標的に一致するあらゆる軸を含むことができる。視軸306は、中心窩305の中心から瞳孔217の中心を通る線により表される。角度カッパー(κ)213は、視軸306と光軸300とがなす角度で表される。眼軸300は、角膜の中央から後方に網膜280まで一直線に伸びる垂直な直線又は軸によって定義されることができる。また、この記述において、この軸は、治療軸と呼ばれることができる。角膜輪部308は、一般に、角膜が強膜に接する遷移エリア、又は、視覚的に、眼の色素性領域が眼の白領域に接する場所である。毛様体扁平部角α212は、眼軸中心300から測定されることができ、及び、眼軸中心から略10°〜略50°の範囲であり得る。眼の毛様体扁平部215領域は、角度α212で眼の中心線300に関連することができる。幾つかの実施形態において、細密コリメーション(例えば、直径が略6〜8mm未満)及び小半影(例えば、強膜の略10%未満)のX線は、例えば、網膜280の治療対象構造に到達するように、眼の幾つかの重要な構造を避けつつ、軌道250に沿って眼の毛様体扁平部領域215に入る。本明細書に記載の実施形態によっては、X線が実質的に眼の毛様体扁平部領域215だけから入るように、治療の間、眼は、強制的で物理的若しくは機械的な補助を受けて、又は、所定点に患者を固定することによって、安定化させることができる。
【0155】
特定の実施形態において、患者は、眼の軸に対して固定(安定化)される。患者又は装置が動くと、イメージングサブシステム400又はカメラは、その移動を検出し、及び、装置を停止し、又は、装置若しくはコリメータのX線照射領域のシャッターを閉じる。幾つかの実施形態において、X線源110は、治療計画システムによって決定される1以上の位置に応じて、眼のまわりを移動させられ、網膜280に到達するように眼の毛様体扁平部部位215を通過する放射線を伝達する。眼の組織を通過する定義された治療軸及び軌道は、該治療軸と関連するシステムによってX線ビームの放射角度を決定づける。全線量は、強膜の異なる領域にわたって分割されるが、例えば、黄斑又は中心窩など網膜の所望領域に到達させるために、毛様体扁平部215領域を透過する。
【0156】
図1I〜図1Jに示し及び前述したように、鏡976は、後方の放射線療法システム990へレーザポインタビーム977を反射することができる。反射されたレーザポインタビーム977は、レーザポインタビーム977の位置に関するフィードバックを提供することができ、及び放射線療法システム990を抑制又は脱抑制することができるセンサー992を活性化することができる。放射線療法システム990の配置又は誤整列をセンサー992が検出したときが、放射線療法システムに対する抑制又は脱抑制のためのトリガーあってもよい。例えば、実施形態によっては、眼が許容可能な操作方向範囲内にあるときに、レーザポインタ光がセンサー992上へ反射されるように、レーザポインタビーム977が構成されることができる。従って、レーザポインタ光がセンサー992上へ反射されると、センサー992は、反射光を検出し、及び、放射線療法システム990、又は、センサー992若しくはシステム990の処理モジュールに対する入射光の指示を提供する。放射線療法システム990又は処理モジュールは、眼の適切な方向をプログラムされることができ、及び、システム990は、センサー992が反射レーザポインタ光の受信を示したときに、識別する。そして、システムは、放射線ビームを放射することができ、及び、放射線源は、放射線ビームを照射するために電力が供給され、又は、システム上のシャッターは、放射線ビームを眼に照射することを可能にするために開かれることができる。
【0157】
治療過程の間、眼が動くことで、反射レーザポインタ光がセンサー992に入射されなくなると、眼が動いたこと、及び、眼が許容可能な操作方向範囲内にないことの指示がセンサー992によってシステムに通知される。これにより、放射エミッタに対する電力供給が終了され、又は、眼に対する放射線の照射を停止するために、コリメータのシャッターが閉じられる。
【0158】
幾つかの実施形態において、反射光又はレーザポインタ977は、連結装置975、鏡976、及び、光源977を発する放射線療法装置990、との間の配置における角度を示すことができる。図1I及び図1Jは、強膜レンズ(scleral lens)950(図1I)を有する放射線療法装置990及び眼952(図1J)の眼軸又は視軸の実質的な同軸配列を示す。この形態では、反射ビーム977及び入射光978は、レーザポインタを発射する場所であるコリメータ979上に反射ビームとして後方反射980するので、夫々を区別できない。図1Iは、入射光978とその後方に反射する反射977とがコリメータ上で一致しない(979,980)誤整列を示す。配列の状態をモニタするカメラは、入射光978とその反射977が同軸配置されていないときに、システムを停止する信号を出力することができる。
【0159】
放射線療法システム10のヘッドレスト160の部分は、放射線治療システム10に関連して患者の眼210の位置を実質的に固定化するために、患者220の頭を抑えるために用いられる。治療を適用している医師は、X線源110を患者の眼の中心軸300に位置合わせすることができる。レスト160は、治療の間、患者の位置を維持するために構成されることができる。患者がレスト160から離れて動くか又はレストから眼を動かす場合、X線システムは、患者の位置を再調整するために、手動又は自動で(例えば、ゲート制御により)停止されることができる。
【0160】
一般に、患者頭部は、イメージングシステム400及び治療計画システムの少なくとも一方によって眼210が追跡されている間に、ヘッドレスト160により適所に保持され、及び、X線源110は、X線ビームが毛様体扁平部部位215を通過して眼に入るように、移動される。これにより、X線が網膜の標的領域にまで入り込み、該X線が網膜に向かって眼組織を通過するときに重大な損傷を与える可能性を低減する。
【0161】
治療計画システム800(図1B及び図2E)は、システム10に関する治療者インタフェースを提供する。治療方針は、例えば、生体測定モダリティ(biometric modality)、例えば、眼底撮影、又は、光コヒーレンストモグラフィー、CTスキャン、MRIスキャン、及び、超音波モダリティの少なくとも1つを含むことができるイメージングサブシステム400を含む生体測定モダリティの組み合わせを用いて所定事前処理計画に基づいて開発される。これらモダリティからの情報は、個人に特異的な疾患の負担と共に、患者各個人の解剖的パラメータ(生体測定)を含むコンピュータ処理の仮想眼モデルに集積される。あらゆる又は全てのこれらモダリティは、リアルタイムにシステムが利用でき、又は、治療前にシステムに集積されることができる。治療計画は、例えば、放射療法システム10のインタフェースディスプレイ130モジュールに出力される。そして、治療者は、放射線療法システム10を用いる疾患に対して、放射線療法を向けるために、治療計画の仮想モデルを用いることができる。
【0162】
本明細書で使用する「眼モデル」又は「眼のモデル」は、例えば、次のものに限定しないが、前後方向の寸法、横方向の寸法、トランス角膜縁(translimbal)の距離、角膜縁−角膜縁(limbal-limbal)の距離、角膜から水晶体の距離、角膜から網膜の距離、特定の眼構造の粘性、強膜の厚さ、角膜の厚さ、水晶体の厚さ、治療軸に関する視神経の位置、視軸、黄斑、中心窩、新生血管膜、角膜又は網膜の湾曲度、強膜の領域の湾曲、及び、視神経寸法、などの少なくとも1つを含むデータに基づく眼のあらゆる表現に関する。このようなデータは、例えば、超音波、走査レーザ検眼鏡検査、光コヒーレンストモグラフィー、その他の光学的画像、蛍光体(phosphor)画像、スケールのためにレーザポインタと組み合わせた画像、コントラスト有り若しくは無しのCTスキャン、及び、T2、などの少なくも1つ、T1、又は、コントラスト有り若しくは無しの機能的磁気共鳴画像法などのイメージング技術から得ることができる。また、このようなデータは、角膜曲率測定、屈折測定、網膜の神経線維層測定、角膜トポグラフィー、直接カリパス測定などで得ることができる。眼モデルを生成するために用いるデータは、コンピュータを用いて処理及び表示の少なくとも1つを実行されることができる。本明細書で使用する用語「モデリング」は、次のものに限定しないが、モデルを生成することが含まれる。
【0163】
眼モデルは、放射線療法装置の座標系と眼の解剖学的構造を連結する仮想のモデルである。眼モデルは、眼構造のジオメトリに基づくことができ、及び、モデルを発生するために、パラメータデータ並びに数式から導かれることができる。あるいは、眼のジオメトリは、例えば、CTスキャンやMRIなどによる断層画像から導かれる。定義される治療軸及び定義される眼の解剖学的構造と共に、連結装置は、眼表面に接触することができ、及び、眼モデルによって放射線療法装置にリンク(連結)されることができる。そして、放射線療法装置は、眼モデルに基づいて配置される。
【0164】
幾つかの実施形態において、眼のリアルタイム可視化は、放射線ビーム軌道に位置合わせされるレーザを照射することによって利用されることができる。レーザ位置の観測は、放射線ビーム軌道の正確な方位を視覚的に示すために用いられることができる。例えば、放射線ビームの縁が重要な構造を避けるように、角膜輪部から略1mm〜略約4mmで配置されることを要求してもよい。放射線療法装置からのレーザポインタが角膜輪部から1〜4mmのスポットに到達するように、放射線療法眼モデルは、眼の範囲内の構造に関する適切な角度に応じて放射線療法装置を向ける眼の軸性パラメータを用いる。
【0165】
幾つかの実施形態において、レーザポインタは、強膜を通過することが求められポイントに向かって、強膜上に指向される。一旦、レーザポインタが所望の位置に位置付けられると、レーザポインタが強膜の部分に固定されると共に、放射線源が強膜上の所望の位置に対して指向される。そして、放射線源が活性化されて放射線ビームが照射されると、放射線ビームは、所望の位置及び眼の範囲内の標的位置を実質的に通過する。放射線ビームが通過する眼の一部分は、本明細書において横断ゾーン(例えば、図2Dの符号515)、又は交差ゾーンとして呼ばれ得る。
【0166】
治療計画システム800の概要図を示す図1Bの参照を再開する。図1Bには、楕円形状のバックグランドが描かれており、及び、4つのサブシステム間のグローバル相互接続が示されている。治療計画システム800は、治療者により指示された領域及び疾患の少なくとも一方に4つのサブシステムを向ける。4つのサブシステムは、総括して、X線サブシステム700、連結サブシステム500、電動サブシステム600、及び、イメージングサブシステム400を含む。これらのサブシステム又はモジュールは、患者の眼に総合的な治療を提供するために相互に作用する。
【0167】
サブシステムは、治療計画システム800を調整するように機能する。また、治療計画システム(TPS)800は、眼の物質界、システムの物理的構成要素、及び、治療者と治療チームとに相互作用し並びに特定の患者と疾患情報とを含む仮想コンピュータ環境、との間にインタフェースを提供する。主に、連結システム500、及び、第2に、イメージングシステム400が、物質界と仮想世界とのリンク(連結)を補助する。
【0168】
仮想世界の範囲内で、治療計画システムは、医療関係者又はイメージングシステム400により取得された物理的測定値及び生体測定値に基づくコンピュータ処理の仮想患者眼モデル505を生成する。また、仮想世界のコンピュータモデル505(図2D)は、放射線システム524から、横断又は交差ゾーン515を含み得る眼の前部領域を通り、眼への異なる入力角度に基づいて治療される構造体514に向かうX線ビーム520の投射路510をシミュレーションする機能を有する。さらに、モデルは、治療計画の間の処理過程を考慮して、例えば、視神経512などの重要な眼の構造を識別及び含むことができる。さらにまた、仮想世界は、装置524を制御するための治療者インタフェース、物質界又は実際の物理的標的構造に対する装置のインタフェースを含む。治療者からの入力、及び、ビーム角度や療法を案内する所望方向のモデリングが集積された後、仮想世界は、3次元空間の適切な位置にX線装置を動かすため、電動サブシステムに情報を出力する。連結サブシステム500(物質界における連結サブシステム)は、前述したように、1以上のレーザ又は角度検出器を用いて眼表面に対するX線ビームの入射角を決定するメカニズムを含むことができる。
【0169】
幾つかの実施形態において、連結システム500は、眼上又は眼内のスポット(実質上のスポット、反射スポット、基準スポット、又は、放射基準スポット)516を撮像することができるカメラ518を含む。また、カメラは、例えば、瞳孔、角膜、強膜、角膜輪部、虹彩、眼底、視神経、黄斑、又は治療される病変などの構造を視覚化することができる。そして、カメラからの情報は、仮想の眼モデル522、モーションに応じて、及び放射線療法システム524に伝達されるとよい。特定の実施形態において、連結システム500は、眼との物理的接続である。幾つかの実施形態において、連結システム500は、物理的リンクではないが、眼の水晶体と検知システムとの間の通信リンクである。例えば、水晶体は、システム500に対する眼位置を中継(リレー)する通信ビーコンであり得る。幾つかの実施形態において、水晶体は、療法における次のステージを決定し得る標識であって、イメージングカメラ518により撮像される標識を含むことができる。幾つかの実施形態において、これら技術の組み合わせが用いられる。
【0170】
幾つかの実施形態において、眼の位置及びX線源の位置は、常に知られており、及び、これにより、X線の入射角を認識することができる。例えば、眼の中心軸は、治療軸として決定及び定義されることができる。X線源は、中心軸から既知の角度に補正(オフセット)される。前述したように、中心軸又は治療軸は、幾つかの実施形態において、角膜又は角膜輪部の中心に対する垂線であって、及び、該中心の垂線から網膜へ一直線に後方へ伸ばした軸としてみなすことができる。幾つかの実施形態において、連結サブシステムは、角膜から「輝き(glint)」又は反射を検出することができる。輝きと瞳孔の中心との間の関係は、患者又は患者の眼が動かない場合、一定である。患者が動く場合、瞳孔の中心に対する輝きは、同一位置ではない。これが生じたことを検出器は検出することができ、及び、X線装置を停止又はシステムを遮断するために、その信号を仮想世界からX線装置に送信することができる。あるいは、連結システムは、角膜の中心に対する強膜レンズの中心を比較することができる。レンズ及び角膜の双方は、それぞれ輝きを有し、及び、それらの配列は、それらの中心が相互に対して垂直であること確実にする。
【0171】
連結サブシステムから得られる情報は、好ましくは、コンピュータシステム及び仮想眼モデルに送信される。イメージングサブシステム400は、図2Cに示したカメラ1460によりリアルタイムに眼のイメージをキャプチャーして、そのデータを仮想の眼モデルを生成するソフトウェアプログラムに供給する。物質界連結システム500との併用において、眼を通過するX線ビームの予測経路を仮想画像上に生成することができる。治療部位に従って、電動システム及びX線システムの少なくとも一方は、再調整されることができる。例えば、ロボットアームは、TPSが生成し及びイメージングシステム400がキャプチャーした眼のモデルに基づいて、眼上若しくは眼内の所定箇所にX線ビームを照射又は送信するために、X線源110を所定位置に動かすことができる。
【0172】
特定の実施形態において、放射線療法発生システム100は、図1Aの装置の概略図を用いて前述した、X線サブシステム700としての常用電圧(又は低エネルギー)放射線療法発生器を含むことができる。放射線療法生成サブシステム110は、図1Aにおいて、患者220の眼210に向けられる放射線療法ビームを発生する。特定の実施形態において、放射線療法制御モジュール120は、放射線療法生成サブシステム110が発生する有向の(方向を持った)狭放射線療法ビームを放射するエミッタ200を含む。
【0173】
本明細書で使用する用語「エミッタ」は、普通又は通常の意味を有することを意図しており、及び、エミッタは、次のものに限定しないが、コリメータ及びフィルタの少なくとも一方を含み得る様々な構造を含むことができる。幾つかの実施形態において、制御モジュール120は、放射線療法発生サブシステム110から放射されるX線ビームをコリメートするために構成される。
【0174】
X線サブシステム700は、比エネルギー(specific energy)以上のX線だけがフィルタを通過するように、X線管が放射した放射線療法放射線を導くこと及びフィルタにかけることの少なくとも一方を実行することができる。特定の実施形態において、X線サブシステム700は、X線ビームのパターン又は形状を決定するコリメータを含むことができる。線源のフィルタリングは、好ましくは、前述したように、表面−深部(surface-depth)の線量と同様に、X線ビーム内部の低エネルギー量を決定するとよい。幾つかの実施形態において、眼表面における線量の蓄熱を制限するために、略4:1未満の表面対深部(surface-to-depth)の線量を有する常用電圧X線を伝達することが望ましい。幾つかの実施形態において、常用電圧X線を用いるときに、略3:1又は略1.5:1未満で略1:1を越える表面対深部の線量を有することが望ましい。また、表面−深部の線量は、X線管から放出される最大ビームエネルギーを変更することによって変化させることができる。例えば、翼状片などの眼表面上の疾患に対して又は以前の線維柱帯形成術による瘢痕化を治療するために、X線管から放出される最大ビームエネルギーは、例えば、略40keV、略50keV、又は略60keVなどの低エネルギーであるとよい。これらの疾患において、表面対深部の比率は、略30:1、略50:1、又は、略100:1であることが望ましい。従って、放射線療法制御システムは、X線の電力出力、X線のスペクトル、X線ビームのサイズ、及び、X線ビームの半影の1以上を制御することができる。
【0175】
特定の実施形態において、放射線療法システムの電動サブシステム600は、眼210のその他の部位への照射を避ける共に、眼210の標的部位上又は部位内に導いて患者の眼210の特定領域を照射するように、X線源から照射される狭放射線療法ビームを導くX線源及びコリメータを動かすことができる。例えば、網膜などの眼の後部領域の構造体、又は、例えば、小柱網、強膜、角膜、毛様体突起、水晶体、水晶体包、又はシュレム管などの眼の前部領域にある構造体、を標的としてもよい。システム10は、次のものに限定しないが、網膜、強膜、黄斑、視神経、毛様体、水晶体、角膜、シュレム管、脈絡膜、水晶体のカプセル状嚢、及び、結膜などを含む眼のあらゆる部位に放射線療法を伝えることができる。
【0176】
特定の実施形態において、X線サブシステム700は、特定の直径及び形状の狭ビームを生じさせるためにX線をコリメートすることができる。例えば、コリメータを用いる特定の実施形態において、コリメータ出口の直径は、コリメータから放射される放射線療法ビームの直径を調整するために増減されることができる。特定の実施形態において、X線サブシステム700は、略0.1mm〜略6mmの直径を有するビームを放射することができる。特定の実施形態において、X線サブシステム700は、略0.1mm未満の直径を有するビームを放射することができる。特定の実施形態において、X線サブシステム700は、略0.5mm〜略5mmの直径を有するビームを放射することができる。下記に詳述するように、狭ビーム及び仮想モデルは、エネルギーが眼の特定領域に適用され及び眼の他の領域には適用されないことを確実にするために有用である。
【0177】
幾つかの実施形態(図2B−1〜図2B−3)において、放射線制御モジュールは、円形1212又は非円形の1214の形状を有するX線ビームを照射することができる。実施形態によっては、放射線制御モジュールは、長方形(矩形)1214又は正方形の形状を有するX線ビームを放射することができる。幾つかの実施形態において、放射線制御モジュールは、不透明領域1218を中心に有する円形のコリメータ1215から、弧形、楕円形、又はドーナッツ状(環状)構成1217の形状を有するX線ビームを放射することができる。幾つかの実施形態において、コリメータ1215は、正確に整形されたビーム1200を提供するために、例えば、図2B−4に示した円錐形状の開口1232を含むことができる。幾つかの実施形態において、コリメータ1215は、X線が強膜及び網膜に到達するときに、そのX線が鏡面反射ドット構成を有するように、開口(例えば、図2B−4の開口)を複数有する。「マイクロ分割(micro-fractionation)」と呼ばれ得るX線の小斑点構成(speckled configuration)は、網膜及び脈絡膜の正常な血管に少量の放射線を適用するものであるので、改良安全性プロフィールを可能にし得る。
【0178】
特定の実施形態において、放射線療法システム10は、患者の眼の特定解剖学的構造によって方向付けられる狭く有向の治療ビームを用いることによって、眼の特定領域を選択的に照射し、眼のその他の領域には放射があたらないようにすることを可能にする。例えば、放射線療法制御モジュール120は、放射線療法生成モジュール110により発生した放射線療法ビームを患者の黄斑に案内することができると共に、実質的に、水晶体、小柱装置(trabecular apparatus)、及び視神経などの患者の眼のその他の領域に対しては放射線照射を避けることができる。
【0179】
既知の眼の解剖学的構造に基づく放射に関する眼の特定領域を選択的に標的化することによって、及び、放射線システムを治療目的のために解剖学的構造に選択的にリンクすることによって、治療領域のエリア以外は、放射線の潜在的な有害曝露を避けることができる。幾つかの実施形態において、X線ビームは、虹彩270と網膜280との間の強膜260のゾーンである毛様体扁平部領域215を通過して眼に入る軌道250をたどる。この領域にビームを向けることによって、及び、特殊化コリメータを用いてビームの半影又は散乱を抑制することによって、ビームは、眼の構造上に局所化されることができると共に、眼のその他の構造、例えば、角膜255、毛様体及び毛様体線維216及びその他の構造などには最小光子が照射される。
【0180】
特定の実施形態において、放射線治療システム10は、放射線療法ビームの放射を制御するためのシャッターを含むことができる。シャッターは、放射線発生モジュール110が発生する放射を通さない物質を含んで構成されることができる。特定の実施形態において、シャッターは、放射線療法発生モジュール110からのビーム照射を制御するために用いられることができる。特定の実施形態において、シャッターは、放射線療法制御モジュール120からのビーム照射を制御するために用いられることができる。特定の実施形態において、シャッターは、モジュール110、120の何れの内部にも設けられることができると共に、特定の実施形態において、シャッターは、モジュール110、120の何れの外部にも設けられることができる。幾つかの実施形態において、システム10は、X線放射を停止するためにターンオフされ、及び、特定の実施形態において、X線源110は、標的に対するX線放射を抑制若しくは停止するために、ターンオフされるか又はその強度を低減する。特定の実施形態において、シャッター又は開口は、形状又はサイズが変化する。
【0181】
特定の実施形態において、及び前述した図1Aに関して、放射線治療システム10は、1つの角度から放射線療法ビームを伝達することができる。特定の実施形態において、放射線治療システム10は、ビームを治療標的に集中させるために、複数の角度から放射線療法ビームを伝達することができる。複数の角度から放射線療法ビームを伝達することができるシステム10の特定の実施形態は、複数の固定放射線療法案内モジュールを含むことができる。固定放射線療法モジュールは、放射線療法ビームを適切な角度で眼に伝達するために、様々な位置に配置されることができる。例えば、放射線治療システム10の特定の実施形態は、仮想円の外周まわりに等間隔で置かれるという方法で、放射線療法治療システム10に接続される5つの放射線源モジュール−放射案内モジュール対(ペア)を含む。これら実施形態において、電源装置は、様々なX線発生器を切り替えるスイッチング電源装置であり得る。また、複数の角度から放射線療法ビームを伝達することができるシステム10の特定の実施形態は、放射線療法案内モジュールを動かすことを含むことができる。さらに、複数の角度から放射線療法ビームを伝達することができるシステム10の特定の実施形態は、例えば、ロボットなどの電動サブシステム700(図1B)を用いて放射線療法線源を動かすことを含むことができる。
【0182】
本開示の幾つかの実施形態において、常用電圧X線は、X線発生モジュール700から発生される。この常用電圧療法のX線光子は、総括すると、システム10に対して遮蔽又はその他の保護メカニズムを適用し得る必要がないほどの低エネルギー光子である。例えば、診断X線機器は、常用電圧エネルギーを有する光子を放射し、及び、最小の遮蔽を必要とし、通常は、唯一、鉛スクリーンだけが用いられる。重要なことは、常用電圧療法エネルギーが用いられるときに、専用の部屋又は「ボールト(vault)」が要求されないことである。また、診断X線機器は、携帯可能(ポータブル)であり、そして、臨床環境の異なる部屋又は位置に移動可能である。一方、ライナック又はMeVレンジのエネルギーを有するX線を一般的に伝達するLINACSは、高エネルギーX線光子が高透過能力を有するため、装置周囲の隔壁を厚くすることを要求する。高エネルギー光子、LINACSが有する付随物としては、非常な大きな電力、及び、これら高エネルギー光子を発生する機械装置であって、高電圧電源、熱伝達方法、及び、内部遮蔽法及び保護メカニズムを含む機械装置が要求される。この増加する複雑性は、高エネルギー光子を発生させることによる高コストを生じるだけでなく、移動を困難にする非常に重量のある装置となる。特に、前述及び実験的に基づいて説明し、後述するように、MeV光子は、身体内の表在性構造の治療には不要であり、実際には、該MeV光子は、例えば、表在性放射だけが要求されるときに、骨を通り抜け脳まで透過するので、表在性構造に対して多くの不都合を有する。
【0183】
X線サブシステム
【0184】
X線サブシステム700は、X線を発生し、及び、電源装置、コリメータ並びにX線管を含むことができる。特定の好ましい実施形態において、X線サブシステム700は、10keV〜500keVのエネルギー又は、最大800keVのエネルギーを有する常用電圧X線を生じる常用電圧X線発生システム1070を含む。このタイプのX線発生スキームは、タングステン又はその他の重金属標的に対して電子を加速する高圧電源を含む。この電子の衝突によりX線エネルギーを有する電磁エネルギーが発生する。
【0185】
常用電圧又は低エネルギーX線発生器は、通常は、略1keV〜略500keV又は最大略1MeVのレンジのX線を放射する。幾つかの実施形態において、本明細書に記載のシステムは、略25keV〜略100keVレンジの光子エネルギーを有するX線を放射する。低エネルギーX線システムの使用は、外来患者総合施設又はその他の総合施設におけるこれらX放射線治療システムの設置を可能にし、及び、導入のための諸経費及び高エネルギー(MeV又はガンマ)X線システムが要求する初期投資要求は不要である。例えば、AMDなどの眼の疾患の治療において、眼科医は多くの患者を治療することができるので、何百万もの患者を悩ます疾患を治療するときに、非常な重要な構成装置を、眼科医院又は眼科医院に近接して設置することが重要である。装置の作動が放射線腫瘍学センター(radiation oncology center)内に限られる場合、治療可能な患者数は、アクセス、コスト、他の患者との競争、その他の理由から、さらに制限されることになるであろう。
【0186】
幾つかの実施形態における放射線発生モジュールは、X線を発生させるために配置される構成要素から構成される。例えば、電源装置は、電子を発生し及び該電子を陽極(一般的に、タングステン、モリブデン、鉄、銅、ニッケル又は鉛などの重金属から製造される陽極)へ加速させるために適した電流を発生させる。電子がそのような金属に衝突したときに、X線が発生する。
【0187】
X線スペクトルの例示的な一群を図1Fに示す。用語「kVp」は、X線電源装置の最大(ピーク)電圧を指す。これは、一般に、X線源(keV)によって伝達される最大光子エネルギーに一致する。X線が高圧電気によって発生されたとき、様々なX線レベルのX線スペクトラムが得られる。図1Fには、典型的なスペクトルの一群が示されている。最高電圧は、通常は、最大X線光子エネルギーと一致する。例えば、図1Fの80kVpスペクトルは、最大80kVpを有し、図の左方向テールに低エネルギー放射を有する。同様に、60kVpスペクトラムは、最大60keVを有し、図の左方向テールは80kVpスペクトルと同様である。図の全てのスペクトルは、3mm厚のアルミニウムでフィルタにかけられている。フィルタは、スペクトル曲線を形づくる。低波長は、高波長よりもより大きなフィルタにかけられる。未加工スペクトルをフィルタにかけない場合、そのエネルギーを眼の表在性構造(例えば、強膜)が吸収してしまうので、未加工スペクトルにフィルタをかけることは、所定箇所に適用する表在性エネルギーとしてのX線エネルギーをカスタマイズするために重要である。網膜の構造に到達する所定のX線エネルギーと共に眼の前部構造が吸収する最小エネルギーの範囲内において、低エネルギー光子(主として低域フィルタ)よりも大きな高エネルギー光子を含み得る未加工スペクトルのフィルタリングは、システム、フィルタリングを有するシステムにとって重要である。前述したように、幾つかの疾患処理のために、低電圧が低keVピークに一致するように用いられると、眼の前部構造に到達する低エネルギーX線が優位を占めるので望ましい。電源装置の電力調整は、X線のピーク電圧を減少させ、高エネルギー光子の量を制限し得る。幾つかの実施形態において、不等分割フィルタ(non-uniform filter)が用いられると好ましい場合があり得る。例えば、フィルタは、1つの治療領域のX線スペクトルの相違を変化させることを収容するためにそれ全体の厚さを変化させることを有してもよい。例えば、フィルタは、1つの治療領域におけるX線スペクトルを複数の異なるX線スペクトルに変化させるために、X線が通過するフィルタ厚を変化することができる。
【0188】
図1Aに示す電源装置150は、放射モジュールに電力を供給する。電源装置150は、所定の電流を必要とするX線を発射するために定格化される。例えば、80KeVpのX線が10mAで線源から発射される場合、電力要求は、800W(80kV×0.01A)である。電源装置とX線源との接続には、高電圧から環境を保護及び遮蔽する高圧ケーブルが用いられる。ケーブルは可撓性であり、及び、幾つかの実施形態では、電源装置は移動(モバイル)機能を有する。幾つかの実施形態において、電源装置は、オイルジャケット又は水ジャケット、及び、フィンやファンによる対流冷却により冷却される。冷却流体は、装置を通って移動し、及び、システム10外部のリザーバーで冷却されることができる。
【0189】
電動サブシステム
【0190】
図2A及び図12Aは、図1Bに示した治療システム1000の電動サブシステム600の一実施形態を示す。このサブシステムは、眼の解剖学的構造及び治療される疾患に関するX線ビームの方向及びサイズを制御するので、治療システムの有用な構成要素である。概括的に言えば、電動サブシステムは、患者の生体測定データから生成される個人用の眼モデルによって、グローバル座標系1150の空間に向けられる。モデルからのデータは、眼上又は眼内の標的にX線ビームを向けるために治療計画システムを通じて電動サブシステム600に伝達される。
【0191】
特定の実施形態において、システムは、X線源及びコリメータの少なくとも一方を動かすために、コリメーションシステム3315、シャッターシステム及び電気機械作動システムを含むことができる。図2A及び12Aを参照すると、常用電圧X線源又は常用電圧X線管1070、3325が示されている。コリメータ1030、1040、1052、3315は、X線光子の小コリメートビーム1062を生じるために較正される。好ましい眼病用の実施形態において、細密コリメートビーム1062は、横断面積が略1mm2〜略20mm2の円形又は他の形状であり、直径が略0.5mm〜略6.0mmである。複数のコリメータは、半影率の改善、小半影、特定構造の非常に微細なX線の適用を可能にする。図2B−1〜図2B−3は、様々なコリメータ構成が示された種々のコリメータ設計の実施形態を示す。例えば、図2B−3は、ドーナッツ状又は環状のX線形状を発生するコリメータ構成を示す。図2B−4は、半影を制限又は実質的に均一な放射線ビームを形成するノズル形状又は円錐形状1232を有したコリメータ構成を示す。その他の断面形状としては、例えば、同心円状の輪、楕円、円、多角形、及びクレセントを含むことができる。フィルタ1010、1020と連動して作動するコリメータは、好ましくは、実質的に平行構成を有するビーム1062としてコリメータから放出されるX線を生じるとよい。
【0192】
特定の実施形態において、電動システム3300は、所定位置範囲3335の放射線量で眼を治療するためにカスタマイズされる。位置範囲3335は、眼及び治療容積が小さいことに対応して制限され、及び、線源は、治療領域に相対的に近接させて配置される。X線管3325は、眼のジオメトリ及びシステムの他の構成要素により決定されるが、治療プログラムの全体にわたって、略1cm3〜略5cm3の容積範囲内を動くことができる。また、X線管のサイズ及びエネルギーにより決まる、この体積内での移動時間は、数分の期間にわたって生じることができる。この数分は、電動システム及びテーブルトップ位置決めシステムを考慮した電動システム3300の駆動に要求されるモータサイズの制限を受ける。位置決めシステムの制限された移動は、相対的にチューブを拘束して及びその移動をさせずにシステムを単純化できるので、冷却チューブ3345と、電源装置3320に通じる電源装置チューブ3322と、の構成を可能にする。眼を治療するためにシステムがカスタマイズされるので、X線発生システムの多くの構成要素は、例えば、ライナックより小型である。眼に対するカスタム化は、より多くの場所における配置及び治療者の利便性に関する限り、システムにより多くの柔軟性をもたらす。
【0193】
電動サブシステム又は制御システム600は、図1Bにおいて、相互作用し、グローバル治療計画システム800の指示を受ける。電動サブシステム600は、治療計画システム800からコマンドを受信する。治療計画システム800は、X線装置をオンにしている時間長、眼モデル又は治療計画システムからのデータを利用する眼標的に対するX線ビームの方向、コリメータサイズ、及び、治療線量などのコマンドの1つを命令することができる。眼標的1300及び制御システム600は、連結システムの基礎であるグローバル座標空間1150において、リンクされることができる。治療計画システム800は、グローバル座標システム1150を用いて療法することを命令する。X線制御システム600は、眼標的に関するX線ビームの方向及び位置を命令し、及び、治療計画システム800からのコマンドの結果に基づいて、X線源を所望位置に移動させる。
【0194】
幾つかの実施形態において、コリメータ及びX線源の少なくとも一方は、手動又は自動的に1以上の自由度で眼の眼球まわりの多数の位置にビームを移動させ得る移動ホイール又はシャフト(1100,1110,1120)に設置されることができる。幾つかの実施形態において、X線源1070は、例えば、ロボット又は自動化位置決めシステム3300によって、1以上の自由度で移動可能である。ロボットは、例えば、デカルト座標系1150や極座標系などのグローバル座標系に対して、X線源を動かす。座標系の基点は、都合のよい物理的空間のあらゆる場所であり得る。幾つかの実施形態において、X線源は、4自由度、5自由度、又は6自由度で移動可能である。また、幾つかの実施形態において、ロボットは、例えば、コリメータなどのX線制御システムのあらゆる他の構成要素を移動させるために利用される。幾つかの実施形態において、コリメータは、コリメータが備える電気機械システムにより制御される。
【0195】
また、電動サブシステムは、例えば、患者が装置から離れた場合など必要に応じて、ビームのオンオフを瞬時に切り替える1以上のシャッターを含むことができる。X線源1070及びコリメータの少なくとも一方は、電気機械作動システム(1100、1110、1120)を通じて、空間におけるあらゆる軸を動くことができる。
【0196】
X線連結サブシステム500は、包括的な治療計画システム800の下でX線発生サブシステム700と一体化する。本明細書に記載の複数の目的を達成できる少なくとも1つのレーザポインタ又はその他の相対的なコリメート光源(例えば、発散が小角度である発光ダイオード)1060(図2Cの符号1410)を、図2A、及びより詳細には図2Cに示す。幾つかの実施形他において、レーザポインタ1060は、X線ビームが伝達される場所の視覚的マーカーとなるように、レーザビームの中心軌跡とX線ビーム1062の中心軌跡とがほぼ一致するように、コリメートX線ビーム1062の方向と結びつく。X線は可視光ではないので、レーザポインタは、放射線療法システムの他の構成要素と関連してX線ビームの方向を識別するために用いられる。X線ビームの中心が向けられる場合には、レーザビームの中心も、これに対応して図2Cに示すように同様に向けられている。
【0197】
放射線療法連結システム
【0198】
本開示の第3の主要なサブシステムは、連結サブシステム又はモジュール500である。概括的に言えば、連結モジュール500は、眼の位置に対してX線ビーム位置の方向を調整する。図2A〜図2Dを用いて前述したように、幾つかの実施形態は、X線ビームと共線であるレーザポインタ1060(必要があれば1以上のレーザポインタ)を含む。レーザポインタ(又は複数のレーザポインタ)は、X線が衝突する強膜又はその他の表面に対するレーザビーム1500(図3A)の入射角を検出することができる。入射角1510、1520は、強膜又は他の表面上の2つの直交照射角(θ,φ)によって定義されることができる。1以上のレーザポインタ1060の中心軌跡は、好ましくは、強膜又は他の表面に衝突するX線ビームの中心軌跡と一致するとよい。
【0199】
また、詳細に後述するように、レーザポインタは、眼がカメラ1550により画像化及びデジタル化され、又はイメージングサブシステムで追跡されたときに、眼1600の表面に視覚的マーク(図3A)1570を提供するイメージングサブシステムの重要な目的のために用いられる。デジタル化画像上の視覚的マーク1570及びレーザビーム1500の入射角1510,1520、コンピュータが生成したX線(又はレーザ)の投射1700,1730(図3B)は、コンピュータ生成(仮想)網膜1720上に形成されことができる。幾つかの実施形態において、投射1700、1730は同一であり、及び、実施形態によっては、投射は異なってもよい。例えば、幾つかの実施例において、眼外部の投射1700は、眼内の投射1730とは異なる特性(例えば、軌道、半影、その他の特性)を有することができる。
【0200】
コンピュータ生成仮想網膜1720(図3B)は、さらに詳細に後述するが、仮想の眼モデルの構成要素であり、及び、例えば、OCT、CTスキャン、MRI、Aスキャン(A-scan)若しくはBスキャン(B-scan)、超音波、これらの組み合わせ、又は、例えば、眼底検査及びスキャニングレーザ検眼鏡検査の少なくとも一方によるその他の眼の画像化などのイメージングシステムから出力される実データを通じて得られる。網膜1720に加えて、眼の範囲内のあらゆる構造にX線を伝達することを、仮想眼モデル1725で表示することができる。
【0201】
図3Aに示すように、レーザビーム1500は、スクリーン1590上のマーク1570として示される。スクリーン1590は、カメラが捉えたイメージ描写であり、そして、治療計画システム800でデジタル化された形態である。角度θ1520、角度φ1510、及び、眼1600のデジタル化画像上におけるレーザポインタのマーク1570の位置により、「仮想の眼」1725を通る経路1730が、コンピュータシステム1710(図3B)で決定されることができる。位置が正確でない場合、標的ポイント及びレーザ/X線の位置を再調整するために、信号が電動モジュールに返信されることができる。
【0202】
特定の実施形態において、第2のカメラは、レーザポインタ及びX線ビームの角度を検出するために用いられることができる。これらの角度は、X線ビームの方向を検出して、及び、再位置決めのために信号を電動システムに送信するために用いられることができる。このフィードバックシステムは、眼に対するX線照射の投射を補正するのと同様に、電動サブシステムの正確な位置決めを確実にすることができる。
【0203】
幾つかの実施形態において、眼の位置を検出するために、アナログシステムが用いられる。このような実施形態において、標的構造(眼)はその位置が推定され、及び、X線制御システムがX線源を眼の眼球周りに位置させ、そして、眼構造に対して所定量の放射線を適用する。
【0204】
特定の実施形態において、図1Eに示すように、眼に対する物理的接続は、眼と放射線療法システムとの間の直接連結に用いられる。このような実施形態において、眼とシステムとの間の接続は、例えば、強膜コンタクトレンズ935などのレンズを媒介にすることができる。そして、レンズ935とシステム10との間の物理的リンクは、放射線療法システム10と直接リンクする構造175により提供される。強膜レンズ935は、ソフトレンズ又はハードレンズであり得る。レンズ935は、治療の間に眼を安定化(固定化)させるために、強膜に適用可能な1以上の吸引接続をさらに含むことができる。
【0205】
強膜レンズ935及び強膜レンズ935と協働するアタッチメントは、空間における眼を所定箇所に局限するために用いられることができる。強膜の位置がレンズにより認識されると、同様に眼の位置も認識される。そして、眼は、放射線療法装置10に連結される。幾つかの実施形態において、コンタクトレンズと放射線療法装置10との間の接続は、非機械的接続である。該接続は、例えば、レーザポインタや、放射線療法に対する眼の現実の位置を検出する1以上のカメラなどの光学的な接続である。物理的空間における眼の位置は、仮想眼モデルにおけるビーム位置をシミュレートするために用いられ、そして、そのシミュレート結果が、所望のビーム方向、角度、位置、治療時間、その他を伝えるために、X線システムを配置する物質界に戻される。
【0206】
幾つかの実施形態、例えば、図2Gを参照すると、ラジオサージェリ装置2745に対するアライメント(心合わせ)システムの概略図が示されている。記載されている治療軸2735は、システムから、眼のインタフェース(例えば、強膜レンズ)を通り、眼2720の後極に至る垂直な直線により表されている。カメラ2740は、眼の前部における領域、又は、レーザポインタ2765の出口領域を画像化することができる。黄斑レンズ及びガイド2730は、ラジオサージェリシステム上にレーザポインタビームを反射できる鏡を含むことができる。該反射は、カメラ2740が検出可能である。ラジオサージェリシステムと鏡とが直角をなすと、全体のシステムが、(図1I及び図1Jを用いて上述したように)治療軸2735に沿って一直線に整列配置されたことになる。また、同様に、このようなアライメントシステムは、誤整列又は患者/眼の移動に対する放射線療法システムのゲートを開閉するために用いられることができる。例えば、鏡からの反射は、センサーと通信することができる。反射ビームとセンサーとの間の直通通信がない場合、放射線療法システムは、ゲートを閉じることができる。
【0207】
幾つかの実施形他において、眼内の治療構造に伝達されるX線ビームの散乱線量を知ることが望ましい。例えば、強膜を通過するビームにより網膜の新生血管が治療されるときに、レンズ又は神経系に対する散乱がモデル化されるとよい。幾つかの実施形態において、このモデル化は、網膜(治療される1次構造)上の新生血管膜に対する線量を知るためにも要求されることができる。
【0208】
イメージングサブシステム
【0209】
本開示に記載の各実施形態の有利なその他の特長はイメージングサブシステム400である。該イメージングサブシステム400は、眼のトラッキングシステム(図4)として機能することができ、及び、患者の動き又は眼の移動をその他の前述したサブシステムに連結する機能を提供することができる。このサブシステム400は、患者の眼2010が治療領域2060から大幅に動かないようにすることを有利にも確実にする。カメラ2055は、図3Aのカメラ1550と同一であることができる。カメラ2055は、スクリーン2050にイメージを伝える。また、撮像されたレーザスポット2052も、スクリーン2050上に示される。ビデオスクリーン2050は、図3Bのビデオスクリーン1710と同一であることができる。図4のフィールド2060は、眼が動くことができるゾーンである。眼2010がスクリーン上のゾーン2060外に動く場合、放射線源は、停止若しくはシャッターを閉じ、さもなければ、眼2010から離れる。幾つかの実施形態において、眼2030のイメージが領域2060外に移動した眼2010として反映されると、シャッターオフに切り替えるために、信号2090がX線制御システム(図2A)に送信される。眼を治療領域内で動かないようにすることを確実にする意外に、イメージングサブシステムは、コンピュータ生成仮想眼に戻るレーザポインタ/X線ビーム2052の投影を可能にすることによりその他のサブシステムと連結する。
【0210】
幾つかの実施形態において、イメージングサブシステムは、空間における眼の3Dレンダリングを生成するために用いられる2以上のカメラを含んで構成される。3Dレンダリングは、総合的な治療スキームと一体化される。
【0211】
治療計画システム
【0212】
治療計画システム800は、一部分において、仮想システムであり、及び、相互関係にある全モジュールを統合した図1Bに示されており、さらに、ヘルスケアプロバイダに対してインタフェースを提供する。計画システム800は、システム10の「脳」であり、及び、療法を処方する治療者と患者に療法を伝えることとの間にインタフェースを提供する。治療計画システムは、解剖学的に、生体測定で、及び、幾つかの場合においては、眼についての幾何学的な仮定から、患者及び疾患並びにシステムについての情報を有する「仮想眼モデル」を集積化する。情報は、好ましくは、眼の特定領域に対して特定の放射線量を適用するように放射線源を指示できる治療計画に組み込まれるとよく、線量は、治療計画システム800に入力され、及び、治療計画システム800から出力される。治療計画システム800の特定の実施形態において、放射治療は、異常組織又は別途に治療される組織以外の組織を修復するために、数日、数週間、数ヶ月の期間にわたって細分化されてもよい。治療計画システム800は、治療者が治療及び線量領域をマップすることができ、及び、各患者に対する治療を調整することができる。
【0213】
図2Eを参照する。治療計画システム800は、ラジオサージェリシステム10を用いる治療方法を中心に形成される。特定の実施形態において、システム10のイメージングモジュール400は、眼の登録及びイメージングシステム810を含む。特定の実施形態において、眼−トラッキングシステムは、治療計画システム800用に、例えば、眼球運動などの患者の動きを追跡するように構成される。眼−トラッキングシステム810は、治療者入力を経て患者の眼の3次元イメージを計算することができ、及び、患者の眼の移動をリアルタイムにトラッキングすることを含むことができる。眼−トラッキングシステムは、前述したように、眼に関する多くの病状に対して放射線治療計画を決定するための要因となるデータを取得する。例えば、眼−トラッキングシステムは、その取得データを用いて、患者の眼の後部領域イメージを生成することができる。特定の実施形態において、データは、放射線治療システム10の処理モジュール140のために、有線通信又はその他の手段(例えば、無線手段)を経て伝達されることができる。特定の実施形態において、処理モジュール140は、患者の眼上のデータを処理することができ、及び、インタフェースディスプレイ130上に患者の眼のイメージを表示することができる。特定の実施形態において、インタフェースディスプレイ130は、眼の動きを含む、患者の眼のリアルタイムイメージを表示することができる。
【0214】
特定の実施形態において、眼−トラッキングシステムは、患者の眼上のデータを取得すると共に、患者の顔は、イメージングモジュール400の方向において、患者の眼が実質的に前方に面するように、関節のあるヘッドレスト160により真っ直ぐに配置及び固定される。特定の実施形態において、眼−トラッキングシステムは、ジョイスティックの使用により調整可能なアライメントシステムを含むことができる。ジョイスティックは、イメージングモジュール400によってインタフェースディスプレイ130に表示されるイメージの位置及び形の少なくとも一方を調整するために、固定台上で、水平に、垂直に、又は、水平並びに垂直の両方に、傾けられることができる。
【0215】
本開示のその他の特長は、治療のための総合計画である。装置の大きさ及び特定の解剖学的構造を治療する装置の制限は、スケールメリットを可能にする治療計画システムの範囲を制限する。X線ビームは、眼の標的領域に対して選択的に放射線を適用し、及び、眼のその他の領域には有害な高X線量の放射線を適用しないように、集光されるとよい。しかし、実施形態によっては、眼は、治療を受ける解剖的部位だけである。特定の実施形態において、網膜は、眼の治療システムの標的である。1以上のビームは、強膜を通過して、網膜の所定部位を目指す。治療計画の目的のために、システムの出力ビームに関して眼及び網膜の3次元位置を認識することは好ましい。治療計画システムは、詳細画像及び眼のジオメトリの再現を組み入れた後、標的方向の出力ビームポイントへX線出力を操作するために、X線システムを向ける。幾つかの実施形態において、X線システムは、自動的に向けられ及び動かされる。
【0216】
治療計画システム800は、例えば、光コヒーレンストモグラフィー(OCT)、超音波イメージングシステム、CTスキャン、MRI、PET、細隙灯顕微鏡検査、直接可視化、アナログ又はデジタル写真などのイメージングシステム(これらをまとめてバイオメトリー測定部820と呼ぶ)を利用することができ、又は、該イメージングシステムと連結されることができる。幾つかの実施形態において、このようなシステムは、眼の位置及び生じ得る状態を更新する第2システムが2つあるように、放射線療法装置と共にリアルタイムフィードバックシステムに組み込まれる。比較的高度であるが、システム800は、眼の領域に限定されることができ、及び、これにより、眼に対して特定イメージング装置だけを利用する。
【0217】
幾つかの実施形態において、治療計画システムは、患者の頭部全体の軟組織及び骨構造を組み入れる。モデルは、妨害解剖学的構造を治療から除外し得るように、全解剖学的構造を組み入れる。例えば、治療計画は、眼に関する放射線療法ビームの方向性を指示するために、鼻、前頭部、及び、関連する皮膚並びに軟骨を組み入れる。幾つかの実施形態において、これらの構造は、グローバル座標系、トラッキングの補助、及び、眼の治療領域などに関連する。
【0218】
幾つかの実施形態において、治療計画システムは、リアルタイムX線線量が眼構造に伝達され得るように、モンテカルロ(MC)シミュレーションなどの物理的モデリング技術を治療計画に組み入れる。このような実施形態において、治療計画システム800に対する入力は、治療計画を設計するモンテカルロシミュレーションに集積され、計画の有効性や、治療上の有毒性及び潜在的な毒性の双方がリアルタイムにシミュレートされ得る。幾つかの実施形態において、幾何学的光線トラッキングモデルは、従来のモンテカルロシミュレーションに基づく推定値を利用する。従来のモンテカルロに関する光線トラッキングモデルは、線量測定の迅速化及びリアルタイムシミュレーションを支持する。
【0219】
図2Eに示す方法は、次の通りである。例えば、構造及び線量などのバイオメトリー測定値820及び使用者制御部875は、治療計画システム800に入力される。その他の入力としては、眼登録及びイメージングシステム810からの情報が含まれる。治療計画システム800の出力は、X線源830をオンタイム及びオフタイム(線量制御)で向けると共に、線源を動かし及び位置させるために、X線源及び電動サブシステムに送信するコマンドなどで構成される。幾つかの実施形態において、最大ビームエネルギーは、特定の疾患に対する線量及び計画を生成するために、治療計画システムにより設定される。線量840が伝達された後、治療計画システム800は、追加線量840を伝達するために、X線源移動部にシグナルを出力する。このサイクルは、治療が完了するまで数回繰り返すことができる。
【0220】
図2Fは、基準座標系940の範囲内で、眼モデルを生成し、その後に、眼に対して放射線療法装置を整列配置するために、バイオメトリー測定部910を用いる実施形態を示す。幾つかの実施形態において、Aスキャン超音波910は、例えば、眼軸長、前眼房深さ及び角膜厚さなどの生体測定データを取得するために使用される。これらのデータは、例えば、白−白距離(white-white distance)及び角膜厚さの少なくとも一方の測定パラメータと組み合わされることができ、及び、データをパラメータ化し、及び該パラメータ化データを基準座標系940に配置するコンピュータ化モデル920に入力されることができる。このステップの後に、ロボットが、眼と同一の基準座標系930の範囲内に配置される。
【0221】
図2Gは、ラジオサージェリ装置2745を整列配置するための配置2700を示す。整列配置の目標は、ラジオサージェリ装置2745の出力、及び、オプションとして、治療軸2735若しくはその他で定義された眼の軸を有するレーザポインタ2765、を整列配置することである。装置2745が治療軸に整列配置されると、装置2745は、眼の後極2720に略整列配置される。眼の後極は、略黄斑の位置である。幾つかの実施形態において、コリメータアセンブリは、集束放射が治療軸2735から伸長して後極2720及び黄斑へ入り後極2720の全体に適用されるように、作成される。カメラ2740は、ラジオサージェリ装置とレーザポインティング装置との併用位置の検査及び維持の少なくとも一方を実行するために用いられる。カメラは、その検証の基礎を、眼接触装置2730におくことができ、又は、単に眼上の可視構造イメージングに基づくことができる。
【0222】
幾つかの実施形態において、カメラ2740がレーザポインタ位置を検出し、及び、標的上のそのポインタ位置に基づいて、位置検査に用いられる新たなレーザポインタ位置に関する代替位置にラジオサージェリ装置が移動される。
【0223】
幾つかの実施形態において、患者固定(図2Hに示す患者固定)は、視軸2790にラジオサージェリ装置を整列配置するために利用される。オブジェクトと網膜との間に位置する線は、本明細書に記載の放射線療法システムが治療のために設定する領域である中心窩に向けられる(黄斑中心に配置される)。幾つかの実施形態において、視軸を識別することができ、及び、該軸2790に装置を整列配置できるように、患者はオブジェクトに固定されることが要求される。患者は視線固定点2770に眼を固定する。該視線固定点は、幾つかの実施形態において、円形の標的である。線は、オブジェクトと瞳孔2780中心との間に引かれ、眼の後極方向に投射されたときに、黄斑又は中心窩2760と交差する。一実施形態において、視線固定点2770は、瞳孔中心2780を経て網膜に対する円の中心を通る線が視軸と一致するような円の中心である。レンズ2772は、視線固定点2770から放射線が分岐しないように、視線固定点2770からの光をコリメート又は整列配置するために用いられ、及び、視線固定点2770の中央領域は、視軸の出発点として用いられることができる。そして、視軸2790は、当然に、他の実施形態における眼軸の代わりに、この実施形態での治療軸となる。一旦この線が空間において定義されると、放射線療法装置は、この仮想線を中心にして回転することができ、標的組織(中心窩として示す標的組織)に放射線ビーム2750を伝達する。放射線療法装置からのビーム2750は、黄斑2760に到達するが、角膜2785、水晶体2777及び視神経2775を避けるための正確な角度に設定されることができる。
【0224】
例えば、単一ビームを所望の放射量で伝達する場合、治療計画システムは、特定の解剖学的構造と関連してX線ビームの方向を決定し、X線源をターンオンする。標的に線量蓄積を生じさせるために2つのビームが要求される場合、治療計画システムは、ビームサイズ、標的に対するビーム角度、及び、特定患者の解剖学的構造を決定し、そして、第1角度で眼に対して第1ビームを適用し、及び、標的に関する第2角度で第2ビームを適用する。3つのビーム、4つのビーム、5つのビーム、及び、6つのビームの夫々に対して同一の方法が用いられる。
【0225】
モンテカルロシミュレーション及び実験検証
【0226】
モンテカルロ(MC)シミュレーションは、X線が影響を与える構造体に対して、X線の吸収、散乱、及び、照射をモデル化するために用いられる。モンテカルロ法は、様々な物理的及び数学的体系の挙動をシミュレーションし、及び、その他の計算のための計算アルゴリズムのクラスに広く用いられる。モンテカルロ法は、幾つかの方法において非決定論的であり、確率論的なその他のシミュレーション法(例えば有限要素モデリング)から区別される。モンテカルロシミュレーションは、全治療計画システムに不可欠な要素を形成し、及び、放射線に関する治療計画を補助するために用いられる。また、モンテカルロシミュレーションは、放射線療法システム10の実施可能性並びにその他の要素を予測及び命令するために用いられることができる(例えば、コリメータ及び治療計画スキームの最適化)。例えば、コリメーション設計、エネルギーレベル及びフィルタリング療法は、モンテカルロシミュレーションを用いて予測されることができる。モンテカルロシミュレーションにより予測される設計は、実験的に検証及び微調整されなければならない。MCシミュレーションは、初期使用を予測することができる。解剖学的構造、ビームエネルギー及び治療量が類似する放射線療法の幾つかの実施形態において、モンテカルロシミュレーションが、一度だけ実行され、経路変数(path variable)(例えば、光線トラッキング又はその他の幾何学的方法論による経路変数)を変更する。この場合、モンテカルロシミュレーションに戻る必要はない。
【0227】
幾つかの実施形態において、MCシミュレーションは、治療計画システムに組み込まれ、及び、その他の実施例において、MCシミュレーションは、治療計画システム800が用いるアルゴリズムに対して命令を出力する。MCシミュレーションは、治療の境界を生成するために、多くの場合、治療計画システムの最終過程において用いられる。例えば、MCシミュレーションは、X線ビームの半影を予測することができる。X線ビームの半影は、X線ビームを向け及び水晶体、視神経、その他についてのX線ビームに対する境界制限を設定するために、仮想世界で用いられる。
【0228】
幾つかの実施形態において、加齢黄斑変性症(AMD)は、X線発生システムにより治療される疾患である。幾つかの実施形態において、X線システム10は、例えば、レーザ光凝固術、及び、レーザ線維柱帯切開術若しくはレーザ線維柱帯切除術などの治療における手術後の瘢痕化を治療するために用いられる。幾つかの実施形態において、X線システムは、翼状片、眼の腫瘍又は前癌状態の病変(例えば、血管腫や母斑)を治療するために用いられる。重要なことは、X線治療システムが、幾つかの部位を選択的に照射できる一方、他の部位には照射をしないことが可能である点にある。幾つかの実施形態において、放射線は、異常組織又は別途に治療される組織以外の組織を修復するために、数日、数週間、数ヶ月の期間にわたって細分化される。
【0229】
1)図1の縮尺上の装置により臨床的関連時間周期でAMDを治療するために、低エネルギー放射が網膜に伝達されることができることの検証、2)臨床的関連距離からの検証、及び、3)X線管の初期設計仕様に対する治療システムの幾つかのパラメータを最適化すること、のために、MCシミュレーションが実行される。
【0230】
眼のジオメトリが得られ、及び、図5に示す2次元仮想モデル、次に、3次元仮想モデルが生成される。軟組織及び硬組織(例えば、骨2065)は、図5のモデルに組み込まれている。軸2082は、眼軸であり、また、眼の光軸と呼ばれる。図6は、仮想眼の光軸に対する異なるビーム角度(2100、2110、2120、2130、2140)を示している。仮想眼は、この実施形態においてAMDを治療するために黄斑領域に療法をシミュレートするこのシステムでモデル化される。このシミュレーションにおいて、ビームの夫々は、眼中心軸2082からの異なる角度で眼に入射される。この例では、眼軸は、眼の治療軸とみなされる。ビームの夫々は、異なる経路で眼を通り、及び、眼を通る異なる経路に従って、例えば、黄斑2094、視神経2085、水晶体2075、強膜2076、角膜2080及び中心窩2092などの様々な構造に影響を及ぼす。このモデリングは、放射線療法装置が伝達する放射角度を決定するために用いられ、及び、治療計画アルゴリズムに組み込まれる。例えば、図6において、ビーム2120は、眼の眼軸を一直線に通って眼に入り、及び、ビーム2100は、毛様体扁平部から入る。一連のX線エネルギーは、略40keV〜略80keVまでのエネルギー範囲を用いてモデル化される。提案されたコリメーションスキームは、一連の異なるフィルタ(略1mm〜略3mm厚のアルミニウム(Al)のフィルタ)であるときに、近接平行ビームを生成するために用いられる。ビームの入射角、ビームの光子エネルギー及びビームの濾過の組み合わせは、様々な構造に堆積するエネルギー相対量を全て考慮に入れる。
【0231】
図7A〜図7Eは、X線ビームが、例えば、水晶体2260や視神経2085などのその他構造体に対して最小の散乱で強膜2200を通り網膜2250を実際に透過することができることを示す略80keVエネルギーのMCシミュレーションによる幾つかの結果を示す。密なドット表示は、MCシミュレーションにおける実際のX線光子を示す。例えば、特定のビーム角度(図7A)における水晶体上の光子の相対的な少なさは、水晶体レベルでの光子吸収が乏しいことを示す。これらのシミュレーションは、0.8mm幅の低エネルギーX線ビームが、中心軸から離れた所定角度で、実質的に眼の前部の重要な構造を避け得ることを表している。このモデリングは、治療される各患者及び疾患に対する治療計画に組み込まれる。
【0232】
図7F(上図)は、毛様体扁平部の領域から眼に入る一連のビームのシミュレーション結果を示す。これらの角度は、眼を反時計回りするようなクロック角度(clock angle)(符号a〜h)であり、及び、眼を通るそれらの透過は、眼の前部構造に影響を及ぼすだけでなく、眼とは異なる後方の非対称構造(例えば、神経)にも影響を及ぼす場合がある。このシミュレーションは、標的領域に対する線量を最大にすると共に視神経に対する線量は最小にする方法を計画するためのものであり、及び、ジオメトリを変化させて各々の患者に対して実行することができる。幾つかの実施形態において、シミュレーションは、毛様体扁平部を通る眼の方向にビームを向けることにより、鼻側−側頭側、及び、尾側−頭側の様々な位置に対応する様々な時計文字盤上の入射角(図7Fの符号a〜h)から、実行される。幾つかの実施形態において、これらのビームは、横断面(例えば、横断面直径)が略2mm〜略5mmの間であり、及び、略60keV〜略150keVの間のエネルギーを有する(図11H参照)。図7Fに示すビームe,f,g,h,a、即ち、下方から上方へ向かうビーム及び鼻側から側頭側へ向かうビームの少なくとも一方は、視神経2085及び水晶体2260に関する最も最適なプロフィールを有する。
【0233】
幾つかの実施形態において、特定の角度又は方向は、治療の間に避けることが好ましい特定の構造に対応して識別される。従って、これらの構造に対応する角度は、治療の間、X線の軌道には用いられないので、視神経を避けることができるようになる。例えば、実施形態によっては、角度b(図7F)は、視神経2085を通過するX線軌道に対応し得る。これらの実施形態において、角度bは、視神経をX線にさらす可能性を低減するために用いられてはならない。角度は、治療計画を最適化し、及び、放射線に影響される構造が存在する場合には可能な限りリスクを低減するものが使用され得る。図7Fは、8個の軌道角を示す。幾つかの実施形態において、X線軌道は、8個未満又は8個を超える複数の軌道角を含むことができる。例えば、実施形態によっては、4個の軌道角、6個の軌道角、10個又は12個の軌道角が提示される。これらの実施形態において、最適ビーム方向は、鼻側方向から入るように考慮されるビーム(例えば、b,a,h,g,f)により提供される。強膜上のビーム入射角及び該ビームの網膜に対する伝達は、治療計画により選択され、及び、標的構造に対して放射線療法を最適化するために治療計画システムにより用いられる。
【0234】
図7Fの下図は、上図において、角度がつけられたビームのうち、その1つの網膜上の線量を示す。このようなビームに対する予測された等線量減衰(isodose fall-off)は、等線量領域を100%超えるが10%未満である略1mm〜略2mmビームで略0.05mm〜略0.1mmの範囲内において略90%を超える。高線量領域2290は、ビームがある角度で眼に入ることから生じる。線量の増加は、全体領域の平均よりも略10%〜20%程度である。さらに、複数のビームが眼に入るので、増加線量2290の面積は網膜の領域を超えて平均する。従って、高線量領域は、不均等分布を説明するために治療方針に組み込まれる。
【0235】
図8は、図7A〜図7Eにおけるデータの定量的なグラフ図である。図示されているのは、様々なX線管ポテンシャル及び様々なアルミニウムフィルタ厚さ2385に対する表面対網膜線量である。このグラフは、図6に示したビーム2100及び2140のデータである。表面対網膜線量の比が図8に示されている(すなわち、網膜における線量に対する強膜における入射線量である)。図8では、大部分のビームエネルギー(管ポテンシャル)において、強膜に対する線量が網膜に対する線量の3倍程度であることを確認できる。略40kVpを超えるエネルギーに対して、表面線量対網膜線量2375の比は、略3:1未満である。即ち、スポットが同一位置に維持される場合、網膜に略25Gyが伝達されたとき、強膜に対する最大線量は略75Gyであり得る。もちろん、ビームが眼周辺で移動されるときは、略75Gyは、面積上で平均化され、及び、黄斑には略25Gy未満の線量が与えられるようになる。これは、強膜に沿った異なるポイントに対するX線ビームの移動の結果を示す図6に表示されている。80keV2380において、表面対深部線量の比は、1mmのフィルタリングに関しては略2.2に近い。これらのデータは、システム10の治療計画及び設計に集積され、及び、部分的に、X線管の使用時間及びポテンシャルを決定する。また、ビームの表面−深部線量は、様々な疾患を治療するための治療エネルギーレベル及び対応する管ポテンシャルの決定において重要な要素であって、治療計画システムに組み込まれる。
【0236】
眼の毛様体扁平部領域に伝達される、略1mmを超える濾過で略40keVを超えるエネルギーレベルでの細密コリメートX線放射は、網膜に伝達する治療線量よりも強膜、水晶体又は視神経での蓄積(buildup)が比較的に低い線量を有して、網膜に放射線の治療線量を伝達するために用いられることができる。例えば、網膜に対する治療量が略25Gy以下である場合、ビームが透過する強膜のあらゆる領域に対する線量は略25Gy未満である。
【0237】
図9は、網膜以外の眼の領域に対する散乱線量及びこれらを網膜と比較した棒グラフである。この対数図から確認できるように、水晶体2400(ビーム2100、2140)及び視神経(ビーム2140単独)に対する線量(眼の構造において最も影響を受けやすい2つの構造)は、網膜の黄斑領域2450に伝達する線量よりも少なくとも1桁は少ない。その他のビーム角度は、これらの構造では明らかに線量が高くなる。従って、放射線の25Gy線量は、例えば、水晶体、強膜、脈絡膜などその他の眼構造に到達する少なくとも1桁は少ない放射線を有して、眼の毛様体扁平部領域を通じて網膜の領域に伝達することができる。このシミュレーションは、X線発生システム及びサブシステムに対する設計仕様を命令する。また、これらのシミュレーションは、治療標的に対する線量が重要な構造に対する線量よりも高くなるように、計画の構成要素として治療計画システム800に組み込まれることができる。例えば、各患者に特有の解剖学的構造を組み入れる計画システムは、強膜を通る照射の角度及び位置に依存して各構造に伝達される放射量をシミュレートすることができる。例えば、水晶体及び視神経などの構造に対するX線が非常に高い場合、角度、ビームサイズ及びビームエネルギーに従って、眼構造に対する放射線伝達は変化し、及び代替の方向が選択され得る。
【0238】
図10を参照する。MCシミュレーションの有効性を検証し及び眼が水の球体であると仮定され得ることを確認するために、ヒト死体眼2500を取得し及びX線源の表面対深部線量の比を実験に基づいて決定した。特に、放射X線ビーム2510のパラメータは、眼2500から出たビーム2520のパラメータと比較された。MCシミュレーションにおいて眼が水であると見なされるとき、図10の実験配置(experimental set-up)からの比は、それと一致することが証明された。例えば、表面対深部(2mm濾過で80keVの2cm深部)の比は、MCモデルが予測したように確かに3:1であった。追加の作業は、各深部での線量減衰が同様に一致するかを検証した。この実験作業は、MCを用いるモデリング予測が眼構造に対して正確であることを確認し、及び、X線高エネルギーに関するMCシミュレーション中で一般に要求される2次相互作用が低エネルギーX線を必要としないことを確認する。この観測は、MCシミュレーションを有意に単純化し、及び、幾何学的な関係及びビーム拡散予測を用いて治療計画をする場合に迅速なリアルタイムシミュレーションを可能にする。さらに、システム10設計に用いられる設計基準は、ヒト組織の取得に関する時間及び費用よりも、それら予測のために水を用いて正確にモデル化されることができる。
【0239】
さらに、分析及び実験は、臨床的に関連する時間周期(例えば、30分を超えない時間周期)において、黄斑に25Gyが伝達すること、図1のシステムがX線源に略1mA〜略40mAの電流を引くこと、を示す。正確なmA数は、X線管が眼に対してどれだけ近接するか、及び、所望の最大透過深さに依存して伝達される最大スペクトルエネルギー(例えば、略50keV)、に依存する。このパラメータは、システムパラメータをセットするシステムオペレータが用いる治療計画に集積される。管が眼に非常に近接し、低透過率が求められる場合、システムは、眼から離れたシステムが引く電流よりも少ない電流を引く。幾つかの実施形態において、10分より短時間内で網膜に伝達するには、略15Gy〜略25Gyを必要とする。このような実施形態では、管電流は少なくとも25mAが必要であり、及び、X線管が網膜から25cm以内に近接することが必要である。このパラメータは、略60〜略100keVのエネルギー、及び、アルミニウム、鉛、タングステン又はその他のX線吸収金属を有する1mm〜3mmの濾過、に対するものである。コリメータは、眼の眼表面から略5cm未満にあり、光子エネルギーは、鼻下側領域の眼から入る略1mm〜略6mmの間の直径を有する1〜5本の100keVのビームである。鼻領域は、視神経から最も距離が離れており、及び、下側領域は、鼻骨及び前頭骨を避けるために好ましい。これらの仮定は、前頭骨から外側を真っ直ぐ見るように配置された眼に対するものである。本実施形態において、治療時間は、5分未満である。この場合、電流は、略15mA〜略40mAの範囲である。1〜4本の各ビームの夫々は、略3秒〜略5分の間、ターンオンされることができる。幾つかの実施形態において、3本のビームが治療で用いられる。幾つかの実施形態において、コリメータは、眼の表面から略3cm以内に配置され、及び、実施形態によっては、コリメータは、眼の表面の約10cm以内に配置される。
【0240】
図11A1は、単一コリメートX線ビーム2600の結果を示し、及び、図11A2は、ビーム2600が水(眼)を略2cm透過した後のビーム2620を示す。成形コリメータは、水面から略5.0cmである。図11A2から確認できるように、眼を透過した後、図11A1に示す成形ビームの10%未満となったオリジナルビーム幅2620の周りには、小半影幅2610が存在する。これらのデータは、発散及び散乱からの等線量減衰の双方を組み入れ、及び、標的から略10cm以内のコリメータについて、半影が非常に小さくなり得ることを明らかにする。この実施形態におけるビームエネルギーは、略80keVである。図11Bは、X線検出フィルム範囲内の測定による半影のグラフ図を表す。デルタ2650は、X線感光フィルムによって記録されるように、表面と深部との間のエネルギー吸収を示す。2640対2630に見られるテールは、ビームが眼を通りエネルギーを損失するときの半影作用の程度が少ないことを示す。実際には、0.5mm〜6mmスポットサイズの半影は、略0.001%を切ることができ、及び、標的に対するコリメータの設置位置に依存して略10%まで上昇する。
【0241】
図11C〜図11Gは、前述したようなビーム総数のシミュレーションを表す。シミュレーションは、前述した装置パラメータに基づいてモンテカルロシミュレーションを用いて達成され、図11A1及び図11A2に示す実験的に検証した単一のビームプロフィールを生成する。あるいは、ビームは、モンテカルロシミュレーションによって検証されるビームの光線トラッキングジオメトリ又は幾何モデルを用いて生成されることができる。この場合、光線トラッキングとモンテカルロシミュレーションとの間の誤差が、ビーム幅、ビームエネルギー、及びビームが進む組織量に対して微小変化を有する類似の組織量を進むビームを考慮したときに、相対的に一定であるようにされる。図11C、図11Dに示すように、ラジオサージェリビームの伝達方法の幾つかの実施形態において、ラジオサージェリビームは、眼の前部に示されている。図11Cにおいて、眼の強膜3010上の横断ゾーン3000は、ラジオサージェリビームが横断する場所、又は、強膜3010と交差する場所を示している。このようなビームの散乱及び等線量減衰は、低いことが知られており(例えば、10%以内)、このようなビームは、相互に実質的に重なり合うことなく、所定ビーム直径の範囲内に配置されることができる。
【0242】
後極の中心及び黄斑領域の中心に対するビームの角度は、眼モデル及び治療計画により決定される。図11Dは、図11Cに示すビームであって、強膜を通過して進行し、黄斑領域3025に集束する複数のラジオサージェリビーム3020に関する図を示す。複数のラジオサージェリビーム3020は、僅か略100ミクロン間隔で、及び、治療される標的領域により略2mm又は略3mm離して、配置されることができる。ビーム3000は、眼の下側領域又は鼻領域から強膜に入る。
【0243】
さらに、複数のビーム3020は、標的領域で相互に略50ミクロン〜略500ミクロン間隔で配置可能であることが知られている。この場合、例えば、水晶体、強膜及び視神経などの構造体上での線量の蓄積は測定されない。また、所望の放射線量を伝達するために多くとも略5本及び略5本以上のビームを含む治療計画に関する、有用であり得るビームが1本以上の(例えば、20Gyを超える)線量を網膜の標的領域に伝達するためのモデル化及び実験が知られている。
【0244】
前述のように、標的に対するビームの表面対深部の比は、伝達線量の計画における要素である。100keVレンジのエネルギーを有するラジオサージェリビームの場合、表面対標的線量は、略2:1より低く、又は最大略5.1であり得る。エネルギー及び表面対標的の比におけるこのようなレンジ内で、強膜のあらゆる特定の領域は、許容できない放射線量を受信しない。例えば、網膜における4本のビームは24Gy(1本あたり6Gy)を有するが、強膜における個々の領域に対する線量は略15Gyである。該線量は、強膜で十分に許容されるように決定されている。実際は、多くとも40Gyの線量は、強膜で十分に許容され得る。パジック及びグレナーが示すように(放射及び腫瘍学74 (2005) 25−29、「翼状片の非外科的、排他的ストロンチウム/Yイットリウム90のβ照射による長期結果」)、強膜上の多くとも50Gyと等しい線量は、若い患者の10年後まで有害ではない。この場合、50Gyが強膜上の一点に伝達されると、黄斑の領域には18〜24Gyが伝えられる。このような治療療法は、ビームだけを必要とする可能性がある。
【0245】
図11Eは、この実施形態において、網膜、特に黄斑に重ね合わせたビーム3040を示す。半影3050の著しい減衰は非常に早く、略98%のビームの縁3060から数ミリメートルである。
【0246】
図11Fは、黄斑を囲う脈管弓(vascular arcade)の間の標的に、フレア型ラジオサージェリスポット3070を形成するためにカスタム形成コリメータが生成した楕円形の重ね合わせビームの一実施形態を示す。
【0247】
図11Gは、複数の独立した穴又は複数の独立したコリメート領域を有するコリメータを通過することで生成された線量(マイクロ分割)が標的領域でチェック模様3090として出現する実施形態を示す。このような「マイクロ分割」は、標的領域に対して副作用を低減し改善した療法を可能にできる。網膜下にある血管に対する放射線量の制限により該血管の作用によってもたらされる副作用の範囲に対して、及び、各マイクロ分割に関する付随的な局所性を考慮すれば、治療作用を犠牲にせずに網膜の脈管構造を避けることができる。幾つかの実施形態において、新生血管領域の発生は、識別され及び治療計画に組み込まれる。このような実施形態において、領域の血管新生を止めるために、この部位に放射線量を集中させることができる。幾つかの実施形態において、輪状又は環状の治療領域は、識別され、及び、輪状領域若しくは環状領域の中心部への血管新生を止め又は減少させるために治療される。
【0248】
図11Hは、微細コリメート常用電圧ラジオサージェリビーム3100と従来技術治療ビーム3105との間の脳CT3170上の比較を示す。従来技術治療ビーム3105は、以前に試みられている(マーカス等著、加齢黄斑変性を悪化させる再発性脈絡膜新生血管に対する放射療法、英国眼科学雑誌、2004年 88 pps.,114−119(Marcus, et.al., Radiotherapy for recurrent choroidal neovascularization complicating age-related macular degeneration; Br. J. Ophthalmology, 2004; 88 pps.,114-119))。従来技術治療ビーム3105において、大型のライナックは、眼に対する位置決め又はカスタム化を特に実行することなく用いられていた。従来の治療ビーム経路3105は、CTスキャン3170上の等線量計算を示す。図は、同側の全視神経及び網膜を取り囲む90〜100%等線量ボリュームを示す。さらに反対側の視神経3106は、63%の線量3107を受信している。その結果、マーカス等が実行した治療では、複数日にわたって線量を分割することが要求され、及び、正常組織に対する損傷を抑えるために線量は小さく分割された。このような分割、必要最低限度の線量、及び計画スキームは、おそらく、このような研究における有効性の欠如を導く。加えて、放射線を黄斑に適用するこの従来技術の試みは、眼球運動又は眼の位置を考慮していない。
【0249】
これとは対照的に、微細コリメート常用電圧ビームのビーム経路3100が示されている。この実験的及び理論的に検証されたマイクロコリメート100keVビームは、毛様体扁平部部位3110の強膜から入り、該強膜に18Gyを伝達し、視神経3106、水晶体3115及び角膜3120から完全に外れ、黄斑領域3125に8Gyの治療線量を伝達する。その後、脳において、放射は、眼の後の骨で1〜2Gy(符号3135)に拡散され、及び、脳組織及び頭蓋骨3180において急速に0.5Gy(符号3130)へと減衰する。眼の異なるクロック角度におけるこのようなビームの3本に関して、黄斑上の重ね合わせは24Gyであり、強膜上の3つの異なる入力ポイントでは強膜に対して僅か18Gyだけである。
【0250】
図11Iは、類似の従来技術治療ビーム(アダムズ、ジェー等著、医療用線量測定 24(4) 233−238(Adams, J. et. al; Medical Dosimetry 24(4) 233-238))を示す。この研究(陽子線研究)において、90%の等線量ライン3230は、視神経3210及び黄斑3200を取り囲む。加えて、眼の位置及び運動は、この研究において制御されていない。この研究の著者は、12Gyに分割した陽子線放射が網膜の非常に広範囲で20〜24Gyになる可能性があるとの重大な事態を報告した。このような事態は、療法のあらゆる利益を否定する可能性がある。本明細書に記載のX線伝達は、疾患が存在する黄斑に対してだけの伝達を可能にすると共に、疾患が存在しないその他の領域に対してはX線の伝達を制限又は避ける。
【0251】
図11Jは、標的部位3250に100keVオーバーラップ常用電圧X線をベンチトップ伝達(benchtop delivery)した後のラジオクロミックフィルム(radiochromic film)の概略図を示す。オーバーラップX線ビーム3275の領域は、そのオーバーラップ領域の線量が24Gyであることを示す。視神経3260は、オーバーラップの中心位置から縮尺距離でビームのオーバーラップ配置の側方に位置する。急速な等線量減衰3273,3277は、視神経3260から十分に離れたオーバーラップ領域3275の外側に生じる。特に、領域3265に示す等線量は、治療スポット3275における線量の実に略1%〜略10%である(0.24Gy〜2.4Gy)。このようなデータは、細密ビームコリメーション及びオーバーラップビームジオメトリの結果である。これは、治療領域を明確にする微細コリメートオーバーラップ常用電圧X線ビーム能力の物理的な証明である。視神経の線量に対する治療線量は10〜100倍は異なるため、分割は要求されず、及び、全線量は、例えば、視神経などの重要構造の損傷に対する考慮を最小にし、一度のセッションで治療領域に与えられることができる。このようなオーバーラップ領域は、治療計画システム、ビームエネルギー、コリメーション及びフィルタリングにより決定される眼のあらゆる場所で最適化され及び眼のあらゆる場所に配置されることができる。また、オーバーラップの範囲は、システムパラメータによる範囲内で決定される。例えば、網膜の黄斑変性に対する治療全領域は、腫瘍や血管腫瘍の治療領域とは異ならせることができる。
【0252】
このようなモデリング技術、パラメータ、及び前述のイメージングシステムによって、集積システムが考慮され及び開発されることができる。幾つかの実施形態では、図12Aに示すように、網膜にラジオサージェリを伝達する所望のビーム角度を生じるように、5自由度位置決めステージが用いられる。コリメータ3315は、前述の細密コリメート放射線ビームと共に許容可能な半影を可能にするために、患者3330の眼に近接して位置される。コリメータは、後部網膜におけるスポットサイズが略4mm〜7mmとなるように、典型的に略1mm〜略4mmである。レーザポインタ3225は、ビームスプリッタを進行し、その中心に放射線ビームを合わせるためにコリメータから出る。領域3335は、装置が移動できる空間である。この空間は、患者に実行するイメージングに基づいて計画されることができる。この空間は、X線源3325を移動させるモーションシステムの単純化を考慮に入れた小領域である。また、システム3300は、冷却液体をX線管3325に供給し及びX線管3325から排出するホースシステム3310、3345を含む。
【0253】
図12Bは、患者の眼3460を治療するシステム3300の横断面図を示す。レーザポインタ3225は、ビーム3415をビームスプリッタ3420に向け、及び、X線ビームの範囲内で中央に置かれるコリメータから出力される。X線陽極3400は、最大直径が略50ミクロン〜略5mmを有し、及び、網膜から略50mm〜200mm離れて配置されることができる。一実施形態において網膜からこの距離に陽極3400を維持することは、小半影を維持することを可能にする。放射線ビーム3410は、コリメータ3315を経て伝達され、及び、その発散経路は、例えば、水晶体や角膜などの前眼房にある重要構造を避けて、ほぼ毛様体扁平部領域から眼に入る。幾つかの実施形態において、レンズ3450は眼3460の強膜又は角膜に接触し、及び、放射線療法システムを向ける基準として用いられることができる。コリメータは、典型的に、強膜上のビームエントリポイントから略1cm〜略12cmの範囲内に位置する。
【0254】
図12Cは、放射線療法装置を含む臨床の流れを示す。画像診断法及び身体検査(3500)は、生成される3D座標マップを通じて眼モデルを構築するために用いられる(3510)。特定疾患に対する線量は、治療領域及び回避領域に基づく最大ビームエネルギーとして選択される。これらの変量は、疾患や疾患組織の深さに関する治療者入力とともに、治療ソフトウェアにより決定される。そして、患者が配置され、及び、オプションとして接触装置が患者の眼に対して又は近接して配置される(3520)。患者及びガイドは、ガイドに配置され(3530)、及び、放射線量治療が適用される(3540)。
【0255】
図12Dは、少なくとも部分的に強膜3620に設けられ及び更には眼の硝子体3630まで入る針3600に対して配置される放射線療法装置の治療上の配置を示す。光ガイド3700又はポインタは、コリメート光源を網膜に照射するために、針に配置され又は針に連結されることができる。針3600及び光ガイド3700は、コリメート光源が網膜上の所定ポイントを安定して照射するように、強膜3620に固定されることができる。そして、放射線療法装置は、針3600により位置合わせされ、放射線を針及び光ガイド経路に沿って網膜の所望領域へと直線に伝達する。この配置に関して、網膜の小領域が精密な標的とされることができる。
【0256】
組み合わせ療法
【0257】
放射線療法装置10は、眼のその他の治療と共に組み合わせて用いられることができる。放射線療法は、その他の治療による副作用を抑えるために用いられることができ、及び、その他の療法と相乗効果を生じることができる。例えば、放射線療法は、網膜上のレーザ熱傷、インプラント、又は、眼の前領域の手術のために、適用されることができる。放射線療法は、1以上の医薬、医療、及び、光線力学による治療(photodynamic treatment)若しくはエージェント(photodynamic agent)の少なくとも1つと併用されることができる。ここで用いる「光線力学物質(エージェント)」は、その平易及び通常の意味を意図するものであり、次のものに限定しないが、光に反応するエージェント、光の作用で組織を感光するエージェントなどを含む。例えば、放射線療法は、抗VEFG治療、VEGF受容体、ステロイド、抗炎症性化合物、DNA結合分子、酸素ラジカル形成療法、酸素運搬分子、ポルフィリン分子、ポルフィリン療法、ガドリニウム、微粒子ベースの剤形、腫瘍化学療法、熱治療、超音波治療、及び、レーザ治療などと関連させて用いることができる。
【0258】
幾つかの実施形態において、放射線増感剤及び放射能防御剤の少なくとも一方は、放射療法の作用を減少又は増加させる治療と併用されることができる。この治療は、トーマス等著、放射線調整剤:治療法の概要及び今後の調査、北アメリカ血液・腫瘍学会誌、20 (2006) 119−139(Thomas, et al., Radiation Modifiers: Treatment Overview and Future Investigations, Hematol. Oncol. Clin. N. Am. 20 (2006) 119-139)、セナン等著、抗脈管形成療法を併用する放射線臨床試験の設計、腫瘍学会誌 12 (2007) 465−477(Senan, et al., Design of Clinical Trials of Radiation Combined with Antiangiogenic Therapy, Oncologist 12 (2007) 465-477)で説明されており、これらの論文の全ては、参照により本明細書に組み込まれる。幾つかの実施形態は、5−フルオロウラシル、フッ素化ピリミジンアンチメタボライト(fluorinated pyrimidine antimetabolite)、抗S期細胞毒素(anti-S phase cytotoxin)、5−フルオロウリジントリフォスフェート(5-fluorouridine triphosphate)、2−デオキシフロオロウリジンモノホスファート(2-deoxyfluorouridme monophosphate)(Fd-UMP)並びに2−デオキシフロオロウリジントリフォスフェートカペシタビン(2-deoxyfluorouridine triphosphate capecitabine)、例えば、シスプラチン(cisplatin)やカルボプラチン(carboplatin)などのプラチナ同族体(platinum analogues)、フルオロピリミジン(fluoropyrimidine)、ゲムシタビン(gemcitabine)、アンチメタボライト、タキサン、ドセタキセル、トポイソメラーゼI阻害剤(topoisomerase I inhibitor)、イリノテカン、シクロオキシゲナーゼ2阻害剤(cyclo-oxygenase-2 inhibitor)、低酸素細胞放射線増感剤(hypoxic cell radiosensitizer)、抗脈管形成療法(antiangiogenic therapy)、ベバシズマブ(bevacizumab)、組み換えモノクローナル抗体(recombinant monoclonal antibody)、ラス癌遺伝子媒介(ras mediation)並びに上皮成長因子受容体(epidermal growth factor receptor)、腫瘍壊死因子ベクトル(tumor necrosis factor vector)、アデノウイルスベクトル(adenoviral vector)Egr−TNF(Ad5.Egr-TNF)、及び、ハイパーサーミア(異常高熱)などの放射線増感剤及び治療の少なくとも一方に関する放射線療法を含む。幾つかの実施形態は、アミホスチン(amifostine)、スクラルファート(sucralfate)、細胞保護チオール(cytoprotective thiol)、ビタミンC、ビタミン及び酸化防止剤(ビタミンC)は、トコフェロールモノグルコシド(tocopherol-monoglucoside)、ペントキシフィリン(pentoxifylline)、アルファトコフェロール(alpha-tocopherol)、βカロチン、及びピロカルピン(pilocarpine)などの放射能防御剤及び治療の少なくとも一方を含む。
【0259】
血管新生阻害剤(Antiangiogenic Agents)(AAs)は、新しい血管の成長を阻害することを目的とする。ベバシズマブは、血管の成長を制御する信号経路の中心的役割を果たすリガンドであるVEGFを結合及び中和することにより作用するヒト化モノクローナル抗体である。調査結果は、抗VEGF療法がヒト組織において直接の抗血管作用を有することを示唆する。対照的に、小分子チロシンキナーゼ阻害剤(TKIs)は、VEGFRsの活性化を妨げ、そして、直接のVEGFへの結合よりもダウンストリーム信号経路を抑制する。血管損傷剤(Vascular damaging agents)(VDA)は、確立した血管構造に迅速な停止を生じさせ、2次敵な組織死を導く。微小管不安定エージェント(microtubule-destabilizing agent)は、コンブレタスタチン(combretastatin)並びにZD6126、及び、VDAの2つの主族である5,6−ジメチルキサンテノン−4−酢酸(5,6−ジメチルキサンテノン−4−酢酸)に関する薬剤を含む。混合型阻害剤は、例えば、EGFR阻害剤又は中和剤を含み、及び、細胞毒性抗癌剤も用いることができる。
【0260】
放射線力学療法(Radiodyamic Therapy)
【0261】
放射線力学療法は、併用全身療法(concomitantly administered systemic therapy)によるコリメートX線の組み合わせに関する。本明細書で使用する用語「放射線力学物質(エージェント)(radiodynamic agent)」は、その通常及び平易な意味を意図するものであり、次のものに限定しないが、例えば、X線などの放射線に反応するエージェント、放射線の作用で組織を感光するエージェントなどを含む。光線力学療法と同様に、化合物が組織に又は硝子体に投与される。そして、治療される眼の領域は、前述した眼モデルを用いて放射線療法による直接の標的とされる。標的領域は、眼モデルを用いて正確に局所化されることができ、そして、放射線は、眼データに基づくPORTシステム及び仮想イメージングシステムを用いて正確に適用されることができる。例えば、標的がドルーゼである場合、眼疾患を治療するために、略1mm以下のビームサイズが放射線力学療法に用いられる。その他の実施形態において、ビームサイズは略6mm未満である。
【0262】
特定の態様及び実施形態を開示したが、これらは単なる例示に過ぎず、開示の範囲を制限することを意図するものではない。本明細書に開示する新規な方法及び新規なシステムは、実際には、本発明の趣旨を逸脱することなく、様々な他の形態で実施され得る。添付の特許請求の範囲及びその均等物は、開示の範囲及び趣旨に含まれる形態及び修正を包含することを意図するものである。
【技術分野】
【0001】
関連出願
本出願は、2007年6月4日に出願の米国仮出願第60/933,220号、2007年4月9日に出願の米国仮出願第60/922,741号、2006年12月13日に出願の米国仮出願第60/869,872号、2006年10月19日に出願の米国仮出願第60/862,210号、2006年10月18日に出願の米国仮出願第60/862,044号、及び、2006年10月16日に出願の米国仮出願第60/829,676号の優先権の利益を主張するものであり、これらの全部は参照により本明細書に組み込まれる。
【0002】
本開示は、標的(targeted)光子エネルギーを用いる眼疾患の治療に関する。特に、本開示は、眼(球)構造のイメージガイド低エネルギーX線療法(image-guided low energy x-ray therapy)のための装置、システム、及び方法に関する。
【背景技術】
【0003】
黄斑変性とは、ヒト眼球の網膜中央付近にある黄斑の光検知細胞が、機能不全及び徐々に機能低下を引き起こす状態である。黄斑変性は、50歳以上の人々において視界中心の損失の主な原因となっている。臨床的証拠及び組織学的証拠から、一部の黄斑変性が、最終的に網膜の破壊を引き起こす炎症過程によって又は炎症過程の結果として、生じることが示されている。炎症過程は、網膜の直接的な破壊、又は、網膜内に液体や血液を滲出して急速な瘢痕化を起こす新生血管膜の形成を経た破壊の結果として生じ得る。
【0004】
黄斑変性に対する処置の多くは、地図状萎縮型又「乾性」の加齢黄斑変性症(AMD)よりも、新生血管型(又は「湿性」)の黄斑変性の抑制を目的としている。全ての湿性AMDは、最初は乾性AMDとして現れる。実際に、最新の眼イメージング(ophthalmic imaging)では、現在の傾向として、湿性AMDは視力喪失前に識別されている。黄斑変性に対する処置としては、眼に直接的に投与する薬物(抗VEGF療法)及び標的処置薬(targeting drug)と組み合わせたレーザ療法(光線力学療法)の使用が含まれ、黄斑変性に対する他の処置としては、近接照射療法(即ち、β線を発生する物質の局所的照射)が含まれる。
【発明の概要】
【発明が解決しようとする課題】
【0005】
本開示は、眼の特定領域以外の部分を放射線に実質的に曝すことなく、その特定領域を照射することによる眼疾患の治療を提供するシステム、方法、及び装置である。本明細書に記載の幾つかの態様において、眼に関する多種多様な病状の治療に用いることができる複数の放射線療法システムが開示される。例えば、これらのシステムは、黄斑変性、糖尿病性網膜症、炎症性網膜症、感染性網膜症、眼又は眼の周りの腫瘍、緑内障、屈折障害、白内障、眼のあらゆる組織における手術後の炎症、翼状片(ptyrigium)、及び、ドライアイなどを治療するために、単独で又は他の療法と組み合わせて用いられてもよい。
【0006】
本明細書に記載の幾つかの態様では、放射線療法(又は外部から適用する放射線療法)が黄斑変性の治療に用いられ、黄斑変性に対する標準的治療法が開示される。黄斑変性の放射線療法は、幾つかの合併症を示す。例えば、眼は、水晶体や視神経など幾つもの重要な構造を含んでおり、このような構造は、過剰な放射線の曝露により損傷を受ける可能性がある。外部照射療法の適用は、装置と、療法を適用する方法とにより制限される。このような装置及び方法は、身体内のあらゆる場所に存在する腫瘍などの疾患の治療に用いられる従前の放射線技術であり、とりわけ眼の放射線療法用として開発されたものではない。加えて、ロジスティックス(logistics)は、そのような治療装置が腫瘍に対する療法を取り入れたものであり、腫瘍に対する療法を置換するものであるので、患者選別及び処置の実施に関する限り困難である。
【0007】
定位放射線療法とは、複数の方向から放射線ビームを照射して標的上に収束(焦点合わせ)させることを一般に指す。このような療法は、大型の直線加速器(ライナック)又は、例えば、コバルト60(ガンマナイフ)などの放射性線源を用いることで達成される。ロボット定位手術(例えば、Accuray Inc.に譲渡された2006年2月14日に出願の米国特許出願第11/354,411号、発明の名称「適応性X線制御(Adaptive X-ray Control)」を参照。この出願の全ては参照により本明細書に組み込まれる)は、大型のライナックが患者の周りを動き及び標的に向けて放射線ビームを連続して照射する定位放射の応用である。線量は正常組織を避けて標的周囲に制御され得るので、療法は少量の分割線量を伝達(送達)することができる。この手法は、放射線療法に対して「ラジオサージェリ」と呼ばれることがある。概括的に言えば、ラジオサージェリは放射線療法の一形態である。
【0008】
網膜の放射線療法の試みでは、いかなる重大な有害性も伴わずに、視力が安定化又は改善されることが示されてきた。また、放射線は、患者の新生血管膜を乾燥させ視覚を安定させることが示されてきた。しかしながら、放射線療法を用いた黄斑変性治療には、治療領域を限局すること及び治療領域に対して放射線を特定的に用いることを含む限界があるため、このような黄斑放射線療法では、多くの場合、網膜の全体を、不必要で有害となる虞がある放射線に曝すことになる。さらに、黄斑に特定的に与える放射線量は、多数の日又は週にまたがって複数に分割されるように制限されていない。より多くの線量を24時間未満の期間で黄斑に特定的に与えることにより、従前の試みで示された以上の影響を疾患に与えることになる。
【0009】
また、湿性AMDに対する近接照射療法は、湿性AMDを治療する上で効果的な治療法である(Neovista, Inc.、プレスリリース、2007年3月。この内容の全ては参照により本明細書に組み込まれる)。この療法の主な制約は、近接照射プローブを配置するために、後眼房の硝子体液を部分的に除去する侵襲性処置を必要とすることである。加えて、線量の分割は、治療効果を伝えるために必要とされる侵襲性のために制限される。さらに、その治療効果は、外科医による正確な配置及び外科医の手の安定性に依存する。
【0010】
その他の眼の疾患として、緑内障がある。この疾患において、手術は、多くの場合、薬物療法後の二次処置である。線維柱帯形成術、線維柱帯切開術、管形成術(canaloplasty)、レーザ虹彩切開術、短絡(shunt)の配置、及びその他の処置などの処置では、外科手術による外傷の結果としての瘢痕形成のため、全ての患者が一時的な影響を被る。抗炎症薬は、これらの処置の後で生じる慢性的な瘢痕化に対して一時的及び予防的の少なくとも一方の解決法を提供するようである。しかし、薬物を一日数回は投与しなければならず、また、例えば、眼の不必要な領域への浸潤など、その薬物自体の副作用プロフィールを伴う。いくつかの放射線量(例えば、幾つかの例では略5Gy〜略20Gy、及び幾つかの形態では略10Gyまでの放射線量)は、(2006年10月5日発行の英国医学会会報(British Medical Journal)、Kirwan他、南アフリカにおける緑内障排液手術の成功に関するβ線の効果:無作為化制御試験(Effect of Beta Radiation on Success of Glaucoma Drainage Surgery in South Africa: randomized controlled trial)を参照。この内容の全ては参照により本明細書に組み込まれる)緑内障手術後における瘢痕化の予防に有益となり得る。水晶体嚢の混濁化は、眼内レンズ(リファレンスを加える)の配置に関する白内障治療の後によく見受けられる。この瘢痕化は、手術による外傷、水晶体細胞の増殖、及び物質不和合性により生じる。
【0011】
本明細書に開示するシステム、方法及び装置により治療可能な眼のその他の疾患には、眼の翼状片がある。翼状片は、通常、角膜縁周囲結膜(perilimbal conjunctiva)をこえて形成され角膜の表面上に伸びる、隆起した表面的、外因的な眼の腫瘤である。翼状片は、小型で萎縮性静止状態の病変から、角膜トポグラフィーを歪めることがあり、症状が進行した場合に角膜の光心を不明瞭にすることがある大型で活動性を有し急速に成長する血管結合組織の病変状態に変化することがある。翼状片は、多くの場合、かなりの時間を屋外、特に、太陽が降り注ぐ気候の屋外で過ごしている人々に生じ、長期間、太陽光線、特に紫外線を浴びること、並びに、乾燥し、埃っぽく及び風の強い状態におかれて慢性的に眼に刺激を受けることとの関連が示されてきたが、翼状片の正確な原因は十分に解明されていない。翼状片は、炎症を起こすことがあり、その症状は、多くの場合、炎症の緩和を促進可能な局所的な点眼液又は軟膏により治療される。翼状片が、視力を脅かす程大型である場合、又は角膜に侵入した場合、一般に、病変は、視力に影響が及ぼされる前に外科的除去により治療される。しかしながら、どの外科技術を用いても、その再発率は、多くの場合、50〜60%程度と高い。本明細書に開示するシステム、方法、及び装置は、放射線量を投与して翼状片再発の可能性を低減するために手術後に用いることができ、幾つかの態様においては、放射線量を、手術前に翼状片の進行を緩め又は止めるために用いることもできる(放射及び腫瘍学(Radiation and Oncology)74 (2005) 25−29、「翼状片の非外科的、排他的ストロンチウム/Yイットリウム90のβ照射による長期結果(Long-term results of non-surgical, exclusive strontium/yytrium-90 beta irradiation of pterygia)」参照。この内容の全ては参照により本明細書に組み込まれる)。
【0012】
幾つかの態様において、放射線療法システムは、レーザ療法に付随して用いられる。即ち、レーザは、単にX線装置を眼の被選択標的に向けるために用いられるのではなく、指向及び治療の双方に用いられる。これらの態様において、レーザは、眼構造の治療に適した少なくとも1つの追加のエネルギー又は波長を含むとよい。X線は、レーザ療法に関して過剰な瘢痕化を制限又は低減するためにレーザと同一領域に適用されるとよい。例えば、システム及び方法の幾つかの態様は、線維柱帯切除術などの緑内障治療と共に用いられることができる。この態様では、X線又は放射線量が瘢痕化を制限又は低減するように適用される一方で、レーザは眼の小柱網に穿孔又は開口を形成するように用いられる。
【0013】
幾つかの態様において、システムは、標的組織を加熱するための加熱源を提供するように構成されることができ、X線は、標的組織の加熱に連動して照射される。前文における「連動して照射」の用語は、組織の加熱に備えてX線を照射できること、組織の加熱に続けてX線を照射できること、又は、組織の加熱と同時にX線を照射できること、を意味する。X線を、加熱処置の前に、略2日〜略10日の間で照射することができ、幾つかの態様によっては、X線を、加熱処置に続いて略2日〜略10日の間で照射することができる。幾つかの態様において、X線を、加熱処置の前に略2日未満の期間で照射し、幾つかの態様によっては、X線を、加熱処置に続いて略2日未満の期間で照射する。幾つかの態様において、X線を、加熱による組織の処置前に略10日超照射し、幾つかの態様によっては、X線を、加熱による組織の処置に続いて略10日超照射する。幾つかの態様において、これら処置方法を複数のバリエーションで用いてもよい。例えば、加熱による標的組織の複数の処置を、X線の照射前後に適用することができる。他の態様では、X線による標的組織の複数の処置を、加熱による標的組織の処置前後に適用することができる。幾つかの態様において、前述した実質的に同時の処置は、相互に略72時間、48時間、36時間、24時間、12時間、6時間、2時間、1時間、30分、10分、及び、1分以内の加熱及びX線による標的組織の処置を含むことができる。幾つかの態様において、前述した実質的に同時の処置は、相互に略1週間、2週間、3週間、及び1カ月以内の加熱及びX線による標的組織の処置を含むことができる。
【0014】
幾つかの態様において、レーザ療法は、眼組織を穿刺する針を通して適用される。例えば、針又はカニューレは、硝子体に薬物を投与するために、眼の強膜を貫通して配置されることができる。また、針又はカニューレは、レーザポインタなどの光ポインタビームを案内するために用いられることができる。光ポインタは網膜に向けられ、網膜上の照らされた領域を、水晶体を通して視覚化することができる。そして、放射線装置を、カニューレと、例えば同一線上などに位置合わせして、X線ビームを、レーザポインタに沿った軌道で照射し、レーザポインタと同位置で網膜と交差させることができる。このような態様において、網膜上の標的は、本明細書に開示するシステム、方法、及び装置により識別され、目標とされ、及び治療されることができる。
【0015】
この開示の幾つかの態様において、複数の電動の眼イメージングシステムが利用されるが、レーザ療法は、治療に用いられる唯一の放射線エネルギー源である。このような態様において、異なる角度から強膜を通じて該強膜の深部構造へと光子を通過させることにより放射線を収束させるシステムの機能は、X線発生システムをオフに保持しつつレーザ放射により前眼房又は後眼房の疾患治療に利用されることができる。幾つかの態様において、X線発生器は、システムに含まれない。このような態様において、眼モデル(eye model)、トラッキング(追跡)、制御、及び、X線療法用の収束システムは、レーザ療法のために利用される。
【0016】
特定の態様において、治療計画システムを用いる装置は、眼の特定領域を標的とする放射線療法を提供するために用いられる。治療計画システムは、眼の物理的変数又は医者からの疾患変数をまとめ、眼の構造に治療効果を送達するようX線システムを向けるものである。上記装置は、眼の標的領域に収束するように1以上の角度から複数の放射線狭ビームを照射する。特定の態様において、装置は、網膜などの後眼の構造に、放射線ビームを収束させてもよい。特定の態様において、装置は、強膜、角膜又は小柱網などの眼の前部構造に、放射線ビームを収束させしてもよい。治療計画システムは、強膜などの眼の表面に沿った複数の異なるポイントにおいて眼へのビームエントリ方向を計画することができる。各個人に固有の解剖学的構造は、正確な標的決めのために、並びに、幾つかの態様によっては装置のX線ビームの自動位置決め(ポジショニング)及び自動定位のために、治療計画システムに組み込まれる。
【0017】
本明細書に記載の幾つかの態様において、患者に放射線を伝達(送達)するために提供される治療システムは、患者の眼の解剖学的データから生成される眼モデルと、放射線ビームを照射するエミッタと、該エミッタに連結され、前記眼モデルに基づいて、前記放射線ビームが前記眼の外面又は前記眼の内部の標的に伝達されるように、前記眼の外面又は前記眼の内部の場所に対して前記エミッタを配置する位置決めガイドと、を含む。
【0018】
幾つかの態様において、前記場所は、前記標的を含んで構成される。前記エミッタは、略10keV〜略500keVの間の光子エネルギーを有する放射線ビームを伝達するように、又は、前記エミッタは、略25keV〜略100keVの間で調整可能な放射線ビームを伝達するように、構成されることができる。幾つかの態様において、前記放射線ビームは、X線ビームを含む。幾つかの態様において、前記システムは、さらに、前記眼モデルに基づいて、ビーム標的、ビーム強度、ビームエネルギー、ビーム軌道、治療領域サイズ、治療領域形状、前記エミッタから前記標的までの距離、照射時間、及び、線量、のうち少なくとも2つを決定する計画モジュールを含む。
【0019】
前記位置決めガイドは、幾つかの態様において、前記計画モジュールからの情報に基づいて、前記エミッタが第1位置において第1放射線ビームを前記眼の第1部分を通り前記眼の範囲内の治療領域に作用させる(向ける)ように、前記エミッタを配置する請求項7記載のシステム。前記位置決めガイドは、前記計画モジュールからの情報に基づいて、前記エミッタが第2位置において第2放射線ビームを前記眼の第2部分を通り前記眼の範囲内の治療領域に作用させる(向ける)ように、前記エミッタを配置する請求項7記載のシステム。前記計画モジュールは、該計画モジュールの出力に作用する使用者からの入力を受信するように適応される幾つかの態様において、前記システムは、前記眼の位置を感知し、及び、該眼の位置に関する情報を前記計画モジュールに中継する感知モジュールを含む。
【0020】
前記システムは、幾つかの態様において、前記眼の位置を感知し、及び、該眼の位置に関する情報を前記位置決めガイドに中継する感知モジュールをさらに含んで構成される。前記感知モジュールは、前記眼に物理的に接触する部分を含むことができ、前記眼の角膜上に又は前記眼の角膜を覆って配置可能なレンズを含むことができる。前記感知モジュールは、幾つかの態様において、例えば、レーザにより、前記眼の位置を光学的に感知することができる。
【0021】
また、幾つかの態様において、前記システムは、略0.5mm〜略6mm幅に前記放射線ビームをコリメートするコリメータを含む。また、前記コリメートビームは、前記コリメータから最大で略50cm離れた距離で、略10%未満の半影を有することができる。前記位置決めガイドは、幾つかの態様において、その使用時に、前記エミッタが前記標的から50cm以内の第1距離から前記標的に向けて放射線ビームを伝達するように、前記エミッタを前記第1距離に配置するように構成される。幾つかの態様において、コリメータは、前記放射線ビームが前記標的に伝達されるときに、該標的から略10cm以内に配置されて使用される。
【0022】
前記システムは、前記放射線ビームを前記標的に向けられない程に前記患者の眼が動いたこと検出する検出器をさらに含むことができる。幾つかの態様において、前記エミッタは、前記患者の眼が所定の位置又は所定の位置範囲から外れて動いた場合に、前記放射線ビームの照射を自動的に停止するように構成される。幾つかの態様は、コリメータを通過し、前記眼に向かうレーザビームを照射するレーザエミッタを含み、及び、幾つかの態様では、前記レーザビームは前記X線エミッタと同一軸に沿って適用される。
【0023】
本明細書に記載の幾つかの態様は、眼に放射線を伝達するシステムを開示する。該システムは、患者の眼の解剖学的データから生成される眼モデルと、略10keV〜略500keVのエネルギーを有するX線ビームを眼に伝達するエミッタと、前記エミッタと連結され、前記エミッタと連結され、前記眼モデルに基づいて、前記放射線ビームが前記眼の外面又は前記眼の内部の標的に伝達されるように、前記眼の外面又は前記眼の内部の場所に対して前記エミッタを配置する位置決めガイドと、前記眼モデルに基づいて治療用の少なくとも2つのパラメータを決定する計画モジュールと、を含む。幾つかの態様において、前記少なくとも2つのパラメータは、ビーム標的、ビーム強度、ビームエネルギー、ビーム軌道、治療領域サイズ、治療領域形状、前記エミッタから前記標的までの距離、照射時間、及び、線量、の2つを含む。
【0024】
前記位置決めガイドは、さらに、幾つかの態様において、前記眼の領域を標的として第1X線ビームを第1位置から前記眼の強膜における第1領域に向けるように構成され、前記眼の領域と実質的に同一の領域を標的として第2X線ビームを第2位置から前記強膜の第2領域に向けるように構成される。幾つかの態様において、前記眼の前記領域は、前記眼における黄斑、強膜、小柱網、及び水晶体包の少なくとも1つである。
【0025】
前記システムは、前記X線ビームをコリメートするコリメータをさらに含むことができる。幾つかの態様において、前記コリメータは、略0.5mm〜略6mmの幅に前記X線ビームをコリメートするように構成され、及び幾つかの態様において、前記システムは、前記コリメータから前記標的までの略50cm離れた距離で、略5%未満の半影を有するX線ビームを生成するように構成される。前記エミッタは、幾つかの態様において、略25keV〜略150keVの間の光子エネルギーを有するX線ビームを伝達するように構成される。幾つかの態様において、前記コリメータは、前記X線ビームが前記標的に伝達されるときに、該標的から略10cm以内に配置されて使用される。
【0026】
幾つかの態様において、ヒトに放射線を伝達する治療システムを提供する。該システムは、患者の眼の解剖学的データから生成される眼モデルと、前記眼にX線ビームを伝達するエミッタと、前記X線ビームが前記眼の外面又は前記眼の内部の標的に伝達されるように、前記眼の外面又は前記眼の内部の場所に対して前記エミッタを配置する手段と、を含んで構成され、前記手段は、前記エミッタと連結され、該エミッタを前記眼モデルに基づいて配置する。
【0027】
幾つかの態様は、患者に放射線を伝達する治療システムを提供する。該システムは、放射線ビームを発生するエミッタと、前記エミッタと連結され、前記放射線ビームを前記眼の外面又は前記眼の内部の標的に伝達するように、前記眼の外面又は前記眼の内部の位置に対して前記エミッタの位置を操作可能な位置決めガイドと、を含み、前記エミッタが前記標的から略50cm以内に配置される。幾つかの態様において、前記システムは、さらに、前記エミッタと連結され、前記エミッタが放射線ビームを放射するときに前記標的から略10cm以内に配置されて使用されるコリメータを含む。幾つかの態様において、前記システムは、さらに、前記エミッタと連結されるコリメートレーザエミッタを含む。
【0028】
本明細書に記載の幾つかの態様において、眼の黄斑変性を治療する方法が開示される。該方法は、イメージ装置により取得される解剖学的データを有する患者の眼モデルを提供すること、光子エネルギーが略40keV〜略100keV、幾つかの態様においては光子エネルギーが略40keV〜略250keV、を有し、略0.5mm〜略6mm幅のX線ビームを生成すること、ビームが眼の強膜を通過して網膜に至るように前記X線ビームを向けること、略1Gy〜略40GyのX線放射を網膜に照射すること、を含むとよい。
【0029】
幾つかの態様において、X線ビーム幅、光子エネルギー、及びX線ビームの方向の少なくとも1つが眼モデルに基づいて決定される方法を提供する。該方法は、幾つかの態様において、略15Gy〜略25GyのX線放射を網膜に照射すること、をさらに提供する。幾つかの態様において、X線放射による治療は、分割されることができ、及び、計画システムは、それまで(以前)の治療の量及び場所のトラック(track)を保持することができる。幾つかの態様において、前記方法は、放射線を網膜に照射することにより眼の新生血管を低減すること、を含む。前記方法は、さらに、放射線を網膜に照射する前又は後に、加熱、冷却、血管内皮増殖因子(VEGF)アンタゴニスト、VEGF−受容体アンタゴニスト、VEGF若しくはVEGF受容体に対する抗体、DNA鎖切断増加若しくはDNA修復減少のモダリティ、アポトーシスレベル増加のモダリティ、内皮細胞死増加のモダリティ、タキサン若しくはその他の微小管阻害剤、イリノテカンなどのトポイソメラーゼ阻害剤、シロリムスなどのリムスファミリー(limus family)の製剤、テモゾロミド(temozolomide)などDNAをメチル化する化合物、カペシタビン(capecitabine)などの5−フルオロウラシル類似体若しくはプロドラッグ、チラパザミン(tirapazamine)などの遊離基誘導エージェント、ゲフィチニブ若しくはエルロチニブ(erlotinib)などの小分子チロシンキナーゼ阻害剤、ボルテゾミブ(bortezomib)などのNFκB阻害剤若しくはダウンレギュレータ(downregulator)、マイクロ波エネルギー、レーザエネルギー、高圧酸素、過飽和状態の酸素、超音波エネルギー、高周波エネルギー、治療薬、の少なくとも1つを患者に施すこと、を含む。前記方法は、幾つかの態様において、さらに、眼の外部の第1位置から強膜を通過して網膜に至るように第1X線ビームを向けること、及び眼の外部の第2位置から強膜を通過して網膜に至るように第2X線ビームを向けること、を含む。幾つかの態様において、X線ビームは、眼の毛様体扁平部を通過するように向けられる。X線ビームは、幾つかの態様において、眼の黄斑に向けられる。
【0030】
本明細書の幾つかの態様は、患者の眼を治療する方法を開示する。該方法は、イメージ装置により取得される解剖学的データに基づいて眼モデルを提供すること、略0.5mm〜略6mmのビーム幅を夫々有する第1X線ビーム及び第2X線ビームを生成すること、前記第1ビームが前記眼の強膜における第1領域を通過して網膜の標的に至るように前記第1X線ビームを向けること、前記第2ビームが前記強膜における第2領域を通過して前記網膜における実質的に前記第1ビームと同一の標的に至るように前記第2X線ビームを向けること、を含み、前記第1ビーム及び第2ビームが通過する前記第1領域及び第2領域が前記眼モデルに基づいて選択される。
【0031】
幾つかの態様において、第1ビームの軌道が眼モデルに基づいて決定され、及び、幾つかの態様において、第1X線ビームを向けること及び第2X線ビームを向けることが連続して行われる。幾つかの態様において、前記第1X線ビーム及び前記第2X線ビームは、略25keV〜略100keVの光子エネルギーを有する。前記第1X線ビーム及び前記第2X線ビームの中心は、幾つかの態様において、眼の角膜輪部から略0.5mm〜略6mmの距離で強膜上のポイントに投射される。幾つかの態様において、前記方法は、さらに、前記第1X線ビームを向ける前に、並行して、又は連続して、加熱、冷却、VEGFアンタゴニスト、VEGF−受容体アンタゴニスト、VEGF若しくはVEGF受容体に対する抗体、マイクロ波エネルギー、高周波エネルギー、レーザエネルギー、治療薬、の少なくとも1つを患者に施すこと、を含む。前記X線ビームは、幾つかの態様において、網膜から略50cm未満に配置されるX線源により生成される。幾つかの態様において、前記X線ビームは、眼から略10cm以内に配置される線源の端部から照射される。幾つかの態様において、網膜は、前記治療の1セッションの間に、略15Gy、幾つかの態様においては略25Gy、また、幾つかの態様においては略35Gy、のX線放射が照射される。
【0032】
本明細書に開示される幾つかの態様は、患者の眼を治療する方法に関する。該方法は、イメージ装置により取得される解剖学的データに基づいて眼モデルを提供すること、略0.5mm〜略6mmのビーム幅を夫々有する第1X線ビーム及び第2X線ビームを生成すること、前記第1ビームが前記眼の第1領域を通過して前記眼内の標的に至るように前記第1X線ビームを向けること、並びに前記第2ビームが前記眼の第2領域を通過して前記眼内の実質的に同一の標的に至るように前記第2X線ビームを向けること、を含み、前記第1ビーム経路及び前記第2ビーム経路が通過する前記眼の前記第1領域及び第2領域が前記眼モデルに基づいて選択される。
【0033】
幾つかの態様において、前記標的は、前記眼の水晶体包を含む。幾つかの態様において、前記標的は、前記眼の小柱網又は腫瘍を含む。幾つかの態様において、前記第1領域は、前記眼の角膜を含んで構成される。幾つかの態様において、前記第1X線ビーム及び前記第2X線ビームは、略25keV〜略100keVの光子エネルギーを有する。幾つかの態様において、前記第1X線ビーム及び前記第2X線ビームは、前記眼から略10cm以内に配置されるコリメータによりコリメートされ、及び、幾つかの態様において、前記第1X線ビーム及び前記第2X線ビームは、前記眼から略10cm以内に配置されるX線源により生成される。また、前記X線源は、前記眼の50cm、40cm、及び、10cm、の少なくとも1つ以内に配置されることができる。
【0034】
幾つかの態様において、前記眼の前記第1領域は、強膜の第1領域を含んで構成され、前記眼の前記第2領域は、前記強膜の第2領域を含んで構成され、及び、前記強膜の第1領域から前記強膜の第2領域の端〜端の距離が略0.1mm〜略2mmである。幾つかの態様において、前記第1X線ビーム及び前記第2X線ビームは、前記眼の外部の鼻部から向けられる。幾つかの方法は、さらに、X線放射線療法システムを前記患者の眼の中心に位置合わせすること、を含む。また、幾つかの方法は、前記眼モデルを用いて前記黄斑領域を治療する計画を作成すること、を含み、前記第1X線ビーム及び前記第2X線ビームは前記黄斑領域で重ね合わされ、及び、前記第1X線ビーム及び前記第2X線ビームは略0.5mm〜略6mmにコリメートされる。
【0035】
本明細書に記載の幾つかの態様は、患者の眼の網膜に放射線を適用する方法を開示する。該方法は、イメージ装置により患者の黄斑の位置を取得(局在化)すること、前記黄斑をグローバル座標系にリンク(連結)すること、及び、前記座標系に基づいて前記黄斑に外部放射線ビームを適用すること、を含む。
【0036】
幾つかの態様は、さらに、前記グローバル座標系にリンクされ又は前記グローバル座標系でトラック可能な物質を前記眼の強膜に接触させること、を含む。特定の態様において、前記外部ビーム照射の動きは、前記座標系に基づいて自動化される。また、幾つかの態様において、前記方法は、眼の動きを検出すること、を含む。幾つかの態様は、さらに、眼の動きを検出した後に、黄斑と座標系との間の関係を再計算すること、を含む。幾つかの態様において、前記眼及び網膜を前記座標系に連結するように、前記眼の内部へ基準マーカーを差し込む(挿入する)こと、を含む。幾つかの態様において、前記外部ビーム照射は、収束外部ビーム照射である。
【0037】
本明細書では、患者の眼に対する放射線療法を計画する方法を開示し、その態様を記載する。幾つかの態様において、該方法は、前記患者の網膜のイメージデータを取得すること、前記データをグローバル座標系に連結すること、網膜に対して収束電離放射線ビームのアライメント及びターゲティングを可能にするようにレーザを用いること、前記グローバル座標系における前記網膜の位置に基づいて、自動化された収束外部ビーム療法を前記網膜に適用すること、を含む。
【0038】
幾つかの態様は、患者の眼の領域を治療する方法を提供する。該方法は、略40keV〜略250keVの光子エネルギーを有する略0.5mm〜略6mm幅のX線ビームを生成すること、前記X線ビームを前記眼の領域に向けること、略1Gy〜略40GyのX線放射線量で前記領域を照射し、前記眼の領域を治療すること、を含む。
【0039】
幾つかの態様において、前記方法は、さらに、イメージ装置により取得される解剖学的データを有する前記眼のモデルを提供すること、を含み、前記X線ビーム幅、前記X線ビームの光子エネルギー、及び前記X線ビームの方向、の少なくとも1つが、前記眼のモデルに基づいて決定される。幾つかの態様において、前記領域は、略15Gy〜略25GyのX線放射で照射され、及び、幾つかの態様において、前記領域は、前記眼の網膜を含む。前記治療は、前記網膜に放射線を照射することにより前記眼の新生血管を減少させること、及び、乾性加齢黄斑変性(AMD)から新生血管形成への進行を実質的に防止すること、の少なくとも一方を含むことができる。また、幾つかの態様において、前記方法は、加熱、冷却、VEGFアンタゴニスト、VEGF受容体アンタゴニスト、VEGF若しくはVEGF受容体に対する抗体、マイクロ波エネルギー、高周波エネルギー、レーザ、光線力学物質(エージェント)、及び、放射線力学物質(エージェント)並びに治療薬、の少なくとも1つを前記患者に施すこと、を含む。幾つかの態様は、さらに、前記眼の外部の第1位置から強膜を通り網膜に至るように第1X線ビームを向けること、及び、前記眼の外部の第2位置から強膜を通り網膜に至るように第2X線ビームを向けること、を含む。前記X線ビームは、幾つかの態様において、前記眼の毛様体扁平部を通るように向けられ、及び、幾つかの態様において、前記X線ビームは、前記眼の黄斑に向けられる。また、前記X線ビームは、前記眼の強膜を通り前記眼の黄斑に至るように向けることもできる。
【0040】
幾つかの態様では、線量を2以上のビームに分割することを提供し、及び、幾つかの態様では、前記線量を2以上の治療セッションに分割し、該治療セッションの夫々を少なくとも1日間隔で生じさせる。本明細書に記載の幾つかの方法は、さらに、前記領域に前記X線放射を照射する間に、前記X線ビームに対する前記眼の位置を決定すること、及び、前記眼の位置が移動閾値を超えると、前記X線ビームをシャットオフすること、を含む。
【0041】
本明細書に記載の患者の眼を治療する幾つかの方法は、イメージ装置により取得される解剖学的データに基づいて眼モデルを提供すること、第1ビームが前記眼の第1領域を通過して前記眼内の標的に至るように第1X線ビームを向けること、及び第2ビームが前記眼の第2領域を通過して前記眼内の実質的に同一の標的に至るように第2X線ビームを向けること、を含み、前記第1ビーム及び前記第2ビームが通過する前記第1領域及び第2領域は、前記眼モデルに基づいて選択され、前記方法はさらに、前記標的に対する前記第1X線ビームの照射、前記標的に対する前記第2X線ビームの照射、及び、前記標的に対する前記第1X線ビームの照射と前記標的に対する前記第2X線ビームの照射との間の期間、の少なくとも1つの間に、前記眼の位置を評価すること、を含む。
【0042】
前記標的に対する前記第1X線ビームの照射の間に評価を実行すること、を提供し、幾つかの方法は、さらに、前記眼が移動閾値を超えて移動したときに、前記第1X線ビームの照射を停止又は低減させること、を含む。幾つかの方法は、さらに、前記眼の位置を評価して得られる情報に基づいて前記第2X線ビームを向けること、を含む。
【0043】
幾つかの方法は、眼の放射線療法を計画する方法を提供する。該方法は、少なくとも1つの放射線ビームから眼の領域における標的に対して実放射線量を伝達する治療計画を作成すること、及び前記治療計画を示す情報を出力モジュールに出力すること、を含み、前記作成することは、前記眼の外部の放射線源から前記標的に伝達される第1推定放射線量を決定すること、及び前記放射線源から前記眼の視神経及び水晶体の少なくとも一方が受信する第2推定放射線量を決定すること、を含み、前記第2推定放射線量は、前記第1推定放射線量の略40%以下であり、前記治療計画は、前記少なくとも1つの放射線ビームの幅、前記放射線源から前記標的までの距離、前記ビームの軌道、最大ビームエネルギー、及び前記第1推定放射線量、の少なくとも1つを含んで構成され、前記少なくとも1つの放射線ビームの幅、前記放射線源から前記標的までの距離、及び前記ビームの軌道、の前記少なくとも1つは、前記標的に対する前記第1推定放射線量及び前記眼の前記視神経及び前記水晶体の少なくとも一方に対する前記第2推定放射線量の伝達を生じさせるように選択される。
【0044】
幾つかの態様において、前記視神経が受ける前記推定放射線量及び前記水晶体が受ける前記推定放射線量の少なくとも一方は、前記標的に伝達される前記推定放射線量の20%以下である。幾つかの態様において、前記視神経が受ける前記推定放射線量及び前記水晶体が受ける前記推定放射線量の少なくとも一方は、前記標的に伝達される前記推定放射線量の10%以下である。幾つかの態様において、前記視神経が受ける前記推定放射線量及び前記水晶体が受ける前記推定放射線量の少なくとも一方は、前記標的に伝達される前記推定放射線量の5%以下である。特定の態様において、前記視神経が受ける前記推定放射線量及び前記水晶体が受ける前記推定放射線量の少なくとも一方は、前記標的に伝達される前記推定放射線量の1%以下である。
【0045】
特定の態様において、前記出力モジュールは、コンピュータモニタ、LCD、LED、携帯装置、紙、コンピュータ可読媒体、コンピュータ実行可能命令、及び、放射線源に対する通信リンク、の少なくとも1つを含んで構成される。幾つかの態様は、前記標的組織に対して放射線の実線量を伝達する10日前から伝達後の3日の間の期間に、前記眼に対して熱エネルギーを伝達すること、をさらに含む。
【0046】
幾つかの態様において、前記方法は、前記標的に対して実放射線量を伝達すること、をさらに含む。幾つかの態様において、前記標的に伝達される前記推定放射線量、前記視神経が受ける前記推定放射線量、及び前記水晶体が受ける前記推定放射線量の少なくとも1つは、モンテカルロシミュレーションにより決定される。幾つかの態様において、前記少なくとも1つの放射線ビームの少なくとも1つは、幾何学的な断面形状を有する。幾つかの態様において、前記幾何学的な断面形状は、楕円状、円状、環状、同心円状の環状、多角形状、クレセント状、の少なくとも1つを含んで構成される。前記視神経が受信する前記推定放射線量及び前記水晶体が受信する前記推定放射線量の少なくとも一方は、外面対深部(surface-to-depth)のビームエネルギー表示に基づくものである。幾つかの態様において、前記視神経が受ける前記推定放射線量及び前記水晶体が受ける前記推定放射線量の少なくとも一方は、略250keV未満の最大ビームエネルギーを有するX線源からの分散光のトレーシングに基づくものである。
【0047】
幾つかの態様において、前記複数の放射線ビームが夫々の横断ゾーンで強膜を通り抜けるように、前記標的に伝達される前記複数の放射線ビームの軌道を決定すること、を含み、前記夫々の横断ゾーンは、あらゆる他の交差ゾーンと実質的に重ならない、方法を開示する。
【0048】
幾つかの態様において、前記複数のビームの少なくとも1つは、前記標的でその他の前記複数のビームと重なる。幾つかの態様は、前記少なくとも1つの放射線ビームを略6mm未満の横断面寸法(直径)を有するサイズにコリメートすること、をさらに含む。幾つかの態様は、前記眼の外面に対する放射線量が前記標的に対する放射線量の3倍未満となるように濾過(フィルトレーション)量を決定すること、をさらに含み、少なくとも1つの放射線ビームが略50keV〜略300keVを有する。
【0049】
幾つかの態様において、前記第1X線ビームは、少なくとも部分的に重金属を含んで構成されるフィルタによりろ過される。幾つかの態様は、前記標的に対する治療放射線量が略30分未満内で照射されるように、放射線療法システムに供給される略1mA〜略40mAの電流を決定すること、をさらに含む。幾つかの態様において、前記X線ビームはコリメートされ、及び、前記コリメータは前記標的から略20cm以内に配置される。幾つかの態様は、前記視神経に対する前記推定放射線量を最小化するように、少なくとも1つの放射線ビームの方向を決定すること、をさらに含み、前記第1X線ビームは、前記眼の外部から前記眼内部の標的への伝達に関して、鼻方向から側頭方向へ又は下方向から上方向へ伝達される。
【0050】
幾つかの態様は、眼の放射線療法を計画する方法に関する。該方法は、少なくとも1つの放射線ビームから眼の領域における標的に対して実放射線量を伝達する治療計画を作成すること、及び前記治療計画を示す情報を出力モジュールに出力すること、を含み、前記作成することは、前記眼の外部の放射線源から前記標的に伝達される第1推定放射線量を決定すること、及び前記標的の中心から略6mm未満の場所に位置する他の眼組織が前記放射線源から受ける第2推定放射線量を決定すること、を含み、前記第2推定放射線量は、前記第1推定放射線量の略40%以下であり、前記治療計画は、前記少なくとも1つの放射線ビームの幅、前記放射線源から前記標的までの距離、前記ビームの軌道、及び前記第1推定放射線量、の少なくとも1つを含んで構成され、前記少なくとも1つの放射線ビーム幅、前記放射線源から前記標的までの距離、前記ビームの軌道、の前記少なくとも1つは、前記標的に対する前記第1推定放射線量及び前記その他の眼組織に対する前記第2推定放射線量の伝達を生じさせるように選択される。
【0051】
幾つかの態様は、治療期間の間に眼を治療する方法に関する。該方法は、治療期間の間に眼の視神経及び水晶体の少なくとも一方に照射される放射線量が標的に伝達する放射線量の僅か略40%以下となるように、眼の外部にある線源から眼の網膜内又は網膜上にある前記標的に放射線を向けること、を含む。幾つかの態様において、前記放射線は、前記眼の毛様体扁平部を実質的に通するように向けられる。
【0052】
幾つかの態様において、治療期間の間に眼を治療する方法に関する。該方法は、
前記治療期間の間に標的の中心から略6mm未満の場所に位置する眼組織に照射される放射線量が前記標的に伝達される放射線量の略40%以下となるように、前記眼の外部にある線源から前記眼の内の前記標的に放射線を向けること、を含む。
【0053】
幾つかの態様は、患者の眼の炎症を治療する方法を開示。該方法は、眼内の炎症領域の場所を示すデータに基づいて、治療期間の間に前記炎症領域の中心から略6mmを越える場所に位置する眼組織に対して照射される放射線量が前記炎症領域に伝達する放射量の略40%以下となるように、前記眼の外部にある線源から、前記眼の前部領域を通り、前記炎症領域へ少なくとも1つのX線ビームを向けること、を含む。
【0054】
幾つかの態様において、前記領域は、ドルーゼを含んで構成される。幾つかの態様において、前記眼の前記前部領域は、角膜である。幾つかの態様において、前記眼の前記前部領域は、前記眼の角膜の外側の強膜である。幾つかの態様において、前記少なくとも1つのX線ビームは、略1mmより小さい横断面寸法(直径)を有する。幾つかの態様において、前記ビームは、略1mm〜略5mmの間の直径を有する。幾つかの態様において、前記少なくとも1つのX線ビームは、高強度と低強度の交互の領域を含んで構成される。幾つかの態様において、前記眼に接触する装置を用いて決定される治療軸に対する所定角度で前記眼に放射線療法システムを向けること、をさらに含む。幾つかの態様において、前記装置は、前記放射線療法システムと眼に関するデータを光学的に通信する。幾つかの態様は、眼−接触装置を用いて決定される治療軸に対する所定角度で前記眼に放射線療法システムを向けること、をさらに含む。幾つかの態様は、前記眼からの光の反射、眼底イメージ、前記眼の瞳孔イメージ、及び前記眼の角膜輪部イメージの1つを用いて決定される治療軸に対する所定角度で前記眼に放射線療法システムを向けること、をさらに含む。
【0055】
幾つかの態様において、眼に放射線を伝達する方法は、眼の前部−後部軸を提供すること、前記眼の前部−後部軸に対して治療軸を定義すること、前記眼に向けて照射されるX線ビームをコリメートし、該コリメートX線ビームが略6mm未満の横断面寸法(直径)を有するようにするコリメータを前記治療軸に対する所定角度に位置合わせすること、前記治療軸に対する所定角度で前記X線ビームを照射すること、を含む。
【0056】
幾つかの態様において、前記コリメートX線ビームは、前記コリメータから略10cmの場所で略20%未満の半影を有する。幾つかの態様において、前記治療軸は、前記眼の中心光軸である。幾つかの態様において、前記治療軸は、前記眼の視軸である。幾つかの態様において、前記治療軸は、前記角膜輪部又は角膜の中心に対して垂直である。幾つかの態様は、前記治療軸に対して前記コリメート放射線ビームを動かすこと、及び、第2コリメートX線ビームを照射すること、をさらに含む。幾つかの態様は、前記コリメート放射線ビームに対して前記眼を動かすこと、をさらに含む。幾つかの態様は、前記眼の強膜上の投射スポットに前記コリメートX線ビームを位置合わせすること、をさらに含む。幾つかの態様において、前記スポットは、前記治療軸に位置合わせされる。幾つかの態様において、前記スポットは、前記コリメートX線ビームに位置合わせされる。幾つかの態様において、前記コリメートX線ビームを照射することは、治療計画ソフトウェアプログラムに基づいて行われる。
【0057】
幾つかの態様において、放射線療法システムによる放射線ビームで眼の眼球構造を治療する方法は、第1部分を含んで構成され、前記眼球構造を通る軸がさらに該第1部分を通る眼接触部材を、前記眼の表面に接触させること、及び前記眼の外部に位置する放射線療法システムから前記眼球構造に向けて複数の放射線ビームを照射すること、を含んで構成され、該複数の放射線ビームの夫々は前記眼球構造の治療部位で前記軸と交差する軌道をとり、該治療部位は前記複数の放射線ビームの少なくとも1つにより事実上治療可能である。
【0058】
幾つかの態様は、前記眼接触部材で前記眼を第1位置に実質的に固定すること、をさらに含む。幾つかの態様において、前記眼接触部材は、前記眼の外部から内部へ電磁放射線の第1波長を伝達する伝達部を含んで構成される。幾つかの態様において、前記第1部分は、電磁放射線の第2波長を反射する。幾つかの態様において、前記第1部分は、前記眼接触部材内又は前記眼接触部材上の中心に配置される。幾つかの態様において、前記複数の放射線ビームの少なくとも1つは、レーザ光を含んで構成される。幾つかの態様において、前記複数の放射線ビームの少なくとも1つは、X線を含んで構成される。
【0059】
幾つかの態様において、放射線療法システムによる眼球構造の治療用の患者眼球インタフェースは、眼の外面に係合する眼接触表面を有し、前記眼を実質的に第1位置に保持する眼ホルダー、を含んで構成され、前記眼ホルダーは、前記眼の外部に配置される線源から前記眼に放射線ビームが伝達されている間に、前記眼が実質的に前記第1位置にあることの指示(indication)を感知器に提供するように構成される。
【0060】
幾つかの態様は、前記眼球インタフェースを通る前記放射線ビームを伝達可能な物質をさらに含んで構成される。幾つかの態様において、前記放射線ビームは、レーザ光を含んで構成される。幾つかの態様において、前記放射線ビームは、X線を含んで構成される。
【0061】
本明細書に記載の幾つかの態様において、放射線療法システムによる眼球構造の治療用の患者眼球インタフェースは、眼を実質的に安定可能な位置に保持するように適合されるホルダーと、眼を実質的に安定可能な位置に保持するように適合されるホルダーと、前記眼の位置を示し及び前記放射線療法システムから照射される放射線ビームの特性を決定する情報を、前記ホルダーと放射線療法システムとの間に伝える通信リンクと、を含んで構成される。
【0062】
幾つかの態様において、前記通信リンクは、光の波長の幾つかを反射する反射物質を含んで構成される。幾つかの態様において、前記情報により決定される前記放射線ビームの特性は、前記放射線ビームの軌道及び照射状態若しくは無照射状態の少なくとも1つを含んで構成される。幾つかの態様において、前記ホルダーは、前記眼に接触する。幾つかの態様において、前記ホルダーは、前記眼の外部の表面に取り付け可能である。幾つかの態様において、前記ホルダーは、前記放射線療法システムに機械的に連結される。幾つかの態様において、前記放射線療法システムに対する前記通信リンクは、光リンクである。幾つかの態様において、前記ホルダーは、前記眼の軸に前記放射線療法システムを位置合わせするように適合される。幾つかの態様において、前記ホルダーは、前記眼の視軸に前記放射線療法システムを位置合わせするように適合される。幾つかの態様は、前記ホルダーに対する前記眼の位置を視覚化するカメラを、さらに含む。幾つかの態様において、前記カメラは、前記眼の動きを検出し、該眼の動きに関するデータをイメージングソフトウェアに伝える。
【0063】
幾つかの態様において、前記ホルダーは、前記強膜に接触する。幾つかの態様において、前記ホルダーは、前記角膜に接触する。幾つかの態様において、前記ホルダーは、少なくとも部分的にX線エネルギーを通さない。幾つかの態様において、前記ホルダーは、少なくとも部分的にX線エネルギーを通す。幾つかの態様において、前記ホルダーは、前記眼に対して吸引を適用するように構成される。
【0064】
幾つかの態様において、患者の眼にX線ビームを伝達するシステムは、網膜から略15cm以内に配置されて使用される少なくとも1つのX線コリメータと、前記コリメータの長軸に実質的に位置合わせされ、前記眼の表面及び該眼の表面に接触する装置の少なくとも一方に、前記コリメータを通って照射されるX線ビームの方向を示す印を提供するレーザビームを照射するレーザと、を含んで構成される。
【0065】
幾つかの態様において、前記システムは、前記X線ビームを伝達するX線管の陽極に略10mA〜略800mAの電流を供給するように適合される電源装置をさらに含んで構成される。幾つかの態様において、前記陽極は、固定陽極又は回転陽極である。幾つかの態様は、前記眼に接触し、前記眼の位置を保持するように構成される眼接触部材をさらに含んで構成される。
【0066】
幾つかの態様において、眼の放射線療法の方法は、疾患の治療に治療上有用な関連放射線量を有する眼球疾患について、眼の外部に配置されてX線ビームを介して放射線量を伝達するX線源から、前記疾患を罹った前記眼組織の標的までの距離を提供すること、及び前記放射線源から前記標的までの前記距離に基づいて、前記距離により前記放射線源から隔てられている前記標的に対して前記放射線源から照射される前記X線ビームの前記放射線量を達成する上で要求されるエネルギーレベルを出力モジュールに出力すること、を含んで構成され、前記エネルギーレベルは、前記放射線源から前記標的への距離に依存する。
【0067】
幾つかの態様において、疾患組織を放射線で治療する方法は、治療される患者の第1疾患に基づいて、放射線療法システムから照射されて、推定放射線量を実質的に伝達する放射線ビームのエネルギーレベルを選択すること、及び前記選択エネルギーレベルの印を出力モジュールに出力すること、を含み、前記治療される第1疾患は、複数の疾患のうちの1つであり、前記複数の疾患の夫々は、該複数の疾患の夫々に対する治療放射線量を得る上で、前記複数の疾患のうちの別の疾患に対する治療放射線量を得るために要するエネルギーレベルとは異なるエネルギーレベルを要求する。
【0068】
幾つかの態様において、前記第1疾患は前記患者の眼に影響を与え、及び、前記放射線ビームは前記眼に向けて照射される。幾つかの態様において、前記第1疾患は、前記患者の眼の黄斑変性を含んで構成される。幾つかの態様において、前記第1疾患は、前記患者の眼の翼状片を含んで構成される。幾つかの態様において、前記第1疾患は、眼球の腫瘍、緑内障、及び前癌病変の少なくとも1つを含んで構成される。
【0069】
幾つかの態様において、疾患組織を放射線で治療するシステムは、治療される患者の疾患に基づく選択であって、放射線療法システムから照射されて実質的に推定放射線量を伝達する放射線ビームのエネルギーレベルの選択を含んで構成される入力を受信する処理モジュールを含んで構成され、前記治療される第1疾患は、複数の疾患のうちの1つであり、前記複数の疾患の夫々は、該複数の疾患の夫々に対する治療放射線量を得る上で、前記複数の疾患のうちの別の疾患に対する治療放射線量を得るために要するエネルギーレベルとは異なるエネルギーレベルを要求し、前記処理モジュールは、前記入力に基づいて、前記選択エネルギーレベルの指示を出力モジュールに出力する。
【0070】
幾つかの態様において、疾患組織を放射線で治療する方法は、治療される患者の第1疾患に基づいて、放射線療法システムから照射されて実質的に推定放射線量を伝達する放射線ビームのエネルギーレベルを選択すること、及び前記選択エネルギーレベルの指示を出力モジュールに出力すること、を含み、前記治療される第1疾患は、複数の疾患のうちの1つであり、前記複数の疾患の夫々は、該複数の疾患の夫々に対する治療放射線量を得る上で、前記複数の疾患のうちの別の疾患に対する治療放射線量を得る上で要するエネルギーレベルとは異なるエネルギーレベル、ビームサイズ、及び表面対深部の比(surface-to-depth ratio)の少なくとも1つを要求する。
【0071】
幾つかの態様において、疾患眼組織を治療する放射線療法システムは、放射線源から照射される僅か略6mmの横断面幅を有する放射線ビームをコリメートし、前記放射ビームが放射されるときに、前記放射ビームがたどる第1軸を定義するコリメータと、前記コリメータにより定義された前記第1軸に位置合わせされる第2軸に沿って、前記第1軸の指示を提供する光ビームを照射する光ガイドと、を含む。
【0072】
幾つかの態様において、前記光ビームは、レーザを含んで構成される。幾つかの態様において、前記コリメータの前記第1軸と前記光ガイドの前記第2軸とは、共線(同一線上)にある。幾つかの態様において、前記光ガイドは、放射線療法の標的を視覚化し、及び、前記放射線療法システムからの共線X線ビームの伝達をガイドするように、前記眼に差込可能である。幾つかの態様において、前記光ガイドを差込可能なカニューレをさらに含んで構成される。幾つかの態様において、前記カニューレは、眼の表面に固定されるように構成される。
【0073】
幾つかの態様において、眼を放射線で治療するシステムは、放射線を照射する放射線源及び照射された放射線をビームにコリメートするコリメータと、前記眼を横断する軸に前記ビームを位置合わせする位置合わせシステムと、前記ビームが前記軸に位置合わせされていないときに、前記放射線源からの放射線照射を減少させるゲートメカニズムと、を含む。
【0074】
幾つかの態様は、眼底、角膜輪部、角膜、及び眼の表面からの反射の少なくとも1つを検出するイメージ検出システムをさらに含む。幾つかの態様において、前記イメージ検出システムが閾値を超える前記眼の動きを検出したときに、前記ゲートメカニズムが前記放射線源からの放射線照射を減少させる。
【0075】
幾つかの態様において、眼を放射線で治療するシステムは、治療セッションの間に放射線を照射し、前記照射された放射線を略6mm未満の横断面寸法(直径)を有するコリメートビームにコリメートする放射線源と、前記治療セッションの間に座標系に前記眼構造の位置を繰り返しマッピングする眼マッピングモジュールと、を含む。
【0076】
幾つかの態様は、前記照射される放射線を眼構造に向けるように前記眼に対して前記放射線源を移動させる放射線源移動器をさらに含んで構成される。幾つかの態様において、前記放射線源は、前記治療セッションの間に前記眼の位置に対して静止するように構成される。幾つかの態様において、眼構造が前記コリメートビームの経路内にないときに、放射線の照射を減少又は停止させるシステムシャットオフをさらに含む。幾つかの態様は、眼構造が前記コリメートビームの経路内にあるように前記眼を実質的に保持するホルダーをさらに含む。
【0077】
幾つかの態様において、眼に放射線を伝達する計画システムは、前記眼の生体測定パラメータを含んで構成される入力を受信する処理モジュールと、を含んで構成され、前記処理モジュールは、前記生体測定パラメータに基づいて、前記眼の強膜上に照射されるX線ビームの方向を電動システムに出力する。幾つかの態様において、前記生体測定パラメータは、眼球軸長、前眼房深度、角膜厚、及び角膜直径の少なくとも1つを含んで構成される。
【0078】
本開示の要約を目的として、本開示の特定の態様、利点、及び新規な特徴を本明細書に記載している。全ての利点が、任意の特定の実施形態によって必ずしも達成される必要がないことが理解される。従って、本開示は、本明細書に記載又は示唆されているその他の利点を必ずしも達成することなく、本明細書に記載の1つの利点又は一群の利点を達成又は最適化する方法で実施又は実行されてもよい。
【図面の簡単な説明】
【0079】
【図1A】放射線療法を用いて眼を治療するシステムの一実施形態に係る側面図
【図1B】放射線治療システムの一実施形態に係る回路構成を示す図
【図1C】眼の構造を示す図
【図1D】眼上のレンズと通信する放射線療法システムの一実施形態を示す図
【図1E】眼上のレンズと通信する放射線療法システムの一実施形態を示す図
【図1F】X線放射線スペクトルを示す図
【図1G】眼と放射線療法装置との間のインタフェースを示す図
【図1H】インタフェースを装着可能なホルダーを示す図
【図1I】レンズインタフェースを有する放射線療法装置を配置するために用いる方法の概略図
【図1J】レンズインタフェースを有する放射線療法装置を配置するために用いる方法の概略図
【図1K】レンズインタフェースを含み、配置システムを有する放射線治療システムを示す図
【図2A】図1A〜図1Bの幾つかのシステム構成要素を示す放射線療法システムの一実施形態に係る側面図
【図2B−1】様々なコリメータの一実施形態を示す図
【図2B−2】様々なコリメータの一実施形態を示す図
【図2B−3】様々なコリメータの一実施形態を示す図
【図2B−4】様々なコリメータの一実施形態を示す図
【図2C】治療のために眼の範囲内の所定位置を標的とする放射線治療システムの一実施形態を示す図
【図2D】治療のための眼範囲内の所定位置を標的とする放射線療法システムの幾つかの実施形態を示す図
【図2E】放射線療法システム及びシステムの臨床応用方法の概略図
【図2F】眼のバイオメトリ(biometry)を決定し、該バイオメトリを本明細書に開示のシステムが用いる手順のシナリオを示す図
【図2G】放射線療法システム及び配置システムの一実施形態に係る概略配置図
【図2H】眼の視軸に関して放射線療法システムを配置するために用いることができる一実施形態の概略配置図
【図3A】放射線療法制御モジュールにおけるサブシステムの一実施形態を示す図
【図3B】放射線療法制御モジュールにおけるサブシステムの一実施形態を示す図
【図4】本明細書に開示の方法に従って眼の位置を追跡する一例を示す眼の側面図
【図5】モデル化を目的として用いられる眼の代表的な幾何モデルを示す図
【図6】眼の前面及び眼軸に関する代表的なビーム角度を示す図
【図7A】眼の網膜に到達するために眼を通る放射線ビーム及び標的組織に対する線量プロフィールの代表的なシミュレーションを示す図
【図7B】眼の網膜に到達するために眼を通る放射線ビーム及び標的組織に対する線量プロフィールの代表的なシミュレーションを示す図
【図7C】眼の網膜に到達するために眼を通る放射線ビーム及び標的組織に対する線量プロフィールの代表的なシミュレーションを示す図
【図7D】眼の網膜に到達するために眼を通る放射線ビーム及び標的組織に対する線量プロフィールの代表的なシミュレーションを示す図
【図7E】眼の網膜に到達するために眼を通る放射線ビーム及び標的組織に対する線量プロフィールの代表的なシミュレーションを示す図
【図7F】眼の網膜に到達するために眼を通る放射線ビーム及び標的組織に対する線量プロフィールの代表的なシミュレーションを示す図
【図8】異なるエネルギー効果及び眼の構造上の線量を分析するために実行したモンテカルロシミュレーションの結果を示す図
【図9】眼の様々な構造上における様々な治療状況の効果を分析するために実行したモンテカルロシミュレーションの結果を示す図
【図10】モンテカルロシミュレーションモデルを検証するためにヒトの眼を通る細密X線ビームの実験結果を示す図
【図11A1】眼モデルを貫通する細密X線ビームの結果を示す図
【図11A2】眼モデルを貫通する細密X線ビームの結果を示す図
【図11B】眼モデルを貫通する細密X線ビームの結果を示す図
【図11C】理論的及び実験的なデータに基づく治療計画の一実施形態を示す図
【図11D】理論的及び実験的なデータに基づく治療計画の一実施形態を示す図
【図11E】理論的及び実験的なデータに基づく治療計画の一実施形態を示す図
【図11F】理論的及び実験的なデータに基づく治療計画の一実施形態を示す図
【図11G】理論的及び実験的なデータに基づく治療計画の一実施形態を示す図
【図11H】他の放射線ビームと比較した本明細書に記載の常用電圧放射線ビームのイメージを示す図
【図11I】他の放射線ビームと比較した本明細書に記載の常用電圧放射線ビームのイメージを示す図
【図11J】ロボットシステムを用いて眼の後部に焦点合わせされた3つのビームの実験結果を示す図
【図12A】本明細書に記載のロボットシステムの一実施形態を示す図
【図12B】本明細書に記載のロボットシステムの一実施形態を示す図
【図12C】本明細書に記載の一実施形態に従う治療プランニング過程の一実施形態を示す図
【図12D】強膜の一部を通って針を配置するために位置合わせされる放射線治療装置の一実施形態を示す図
【発明を実施するための形態】
【0080】
図面には、本開示の様々な特徴を実現する全体構成が記載されている。図面及びこれと関連する説明は、開示の範囲を限定するのではなく、開示の実施形態を説明するために提供されるものである。また、全図にわたり、符号は、要素間の対応を示すために、可能な限り同一のものが利用される。
【0081】
本明細書に記載の複数の実施形態には、ヒトの眼を放射線療法で治療するシステム及び方法が含まれる。後述する幾つかの実施形態は、放射線療法を用いて眼の黄斑変性を治療するシステム及び方法に関する。例えば、実施形態によっては、システム及び方法は、網膜の新生血管を遅らせ又は低減させるように網膜の選択部分に放射線療法を用いることについて説明する。また、本明細書に記載の幾つかの実施形態は、放射線療法を用いて、緑内障を治療する、又は創傷治癒をコントロールする、システム及び方法に関する。例えば、システム及び方法の幾つかの実施形態では、術後合併症の可能性を減らすために、線維柱帯形成術、線維柱帯切開術、管形成術(canaloplasty)、及び、レーザ虹彩切開術など、緑内障手術に続いて前眼房の組織上に放射線療法を用いることについて説明する。他の実施形態において、システム及び方法は、ドルーゼ(drusen)(黄斑変性において失明に至らせる網膜の炎症性沈着物)を治療するために放射線療法を用いることについて説明する。ドルーゼ及び周囲炎症の局部的な治療は、乾性AMD及び湿性AMDの少なくとも一方の進行を妨げることができる。
【0082】
幾つかの実施形態において、レーザは、レーザを網膜に入射する位置と実質的に同一位置における共局在(co-localized)X線照射と併用されて(アジュバント(adjuvant)療法)ドルーゼに適用される。レーザによって、放射線療法を促進可能な局部的な加熱効果を得ることができ、又は、放射線が部位周囲の瘢痕化を防止できると共に、レーザによって部位又はレーザスポットを切除することができる。このような併用療法は、夫々の処置の効力を個々別々に向上させることができる。同様に、アジュバント療法は、1以上の薬物療法と併用されるX線放射線療法、又は、薬物若しくは化学物質の働きを向上させるその他の放射線療法を含むことができる。幾つかの実施形態において、X線療法は、例えば、硝子体切除術、白内障除去、線維柱帯形成術、線維柱帯切除術、レーザ光凝固術及びその他の手術などの侵襲性手術と併用される。
【0083】
本明細書に用いる放射線は、広義の用語であって、次のものに限定しないが、少なくともガンマ放射線から電波までの範囲をカバーするあらゆるフォトニックベースの電磁放射線、X線、紫外線、可視光線、赤外線、マイクロ波、及び電波エネルギー、などを含む通常の意味を有することを意図している。従って、計画された放射線療法及び導かれた放射線療法は、眼に対してあらゆる波長範囲のエネルギーを適用することができる。
【0084】
この開示に用いる放射線療法は、広義の用語であって、次のものに限定しないが、少なくとも電磁放射線を通じたエネルギー伝達により疾患を治療するあらゆる臨床治療などを含む通常の意味を有することを意図している。X線放射は、広く、略10nm以下〜略0.01nmに至るまでの波長を有する光子に関する。ガンマ線は、略0.01nm以下の波長を有する電磁波に関する。紫外線放射は、略10nm〜略400nmの波長を有する光子に関する。可視光線は、略400nm〜略700nmの波長を有する光子に関する。略700nmの波長を有する光子は、一般に、赤外放射領域に存在する。電磁放射線のX線領域の範囲内で、低エネルギーX線は、常用電圧として見なすことができる。本明細書の開示において、常用電圧の定義を変化させる範囲内に含まれる正確な光子エネルギーと共に、常用電圧は、少なくとも略20keV〜略500keVのエネルギーを伴うX線光子に関する。
【0085】
本明細書で使用する用語「グローバル座標系」は、機械の実空間(physical world)又は空間(room)を示す。グローバル座標系は、一般に、例えば、コンピュータ又はその他の装置などの機械と、その機械により使用される実空間又は空間とを関連付ける系である。グローバル座標系は、例えば、機械、機械の構成要素、又はその他のものを第1位置から第2位置に移動させるために用いられることができる。また、グローバル座標系は、例えば、第2アイテムに対する第1アイテムの位置を特定(識別)するために用いられることができる。幾つかの実施形態において、グローバル座標系は、1次元環境に基づくものである。幾つかの実施形態において、グローバル座標系は、2次元環境に基づくものであり、及び、実施形態によっては、グローバル座標系は、3次元以上の多次元環境に基づく。
【0086】
本明細書で用いられるカーマは、X線ビームが空気に衝突したときに、空気中の単位体積当たりに放出(又は吸収)されるエネルギーに関する。カーマの測定単位は、Gy(グレイ)である。空気カーマ率は、単位時間当たりに空気に吸収されるカーマ(Gy)である。同様に、「組織カーマ」率は、単位時間あたりに組織に吸収される放射である。カーマは、全波長にジュール(joule)読み取りを組み込むため、放射波長を選ばない。
【0087】
本明細書で使用する用語「放射線量」は、広義の用語であって、次のものに限定しないが、一般に、組織の単位質量あたりの吸収エネルギーを含むことを意味する。測定放射線量の一例はグレイである。グレイは、1キログラムありの1ジュールに等しく、また、一般に、100ラド(rad)に等しい。例えば、本明細書の一実施形態で用いる放射線量は、放射線の総量であるか、又は、所定期間中に受信又は放射されるエネルギーであり、組織の単位質量あたりの吸収エネルギーであってもよい。例えば、放射線量は、治療の過程、セッション又は治療の間における組織の単位質量あたりの吸収エネルギー総量であってもよい。
【0088】
本明細書で使用する用語「軌道」は、広義の用語であって、次のものに限定しないが、一般に、経路(パス)、方位(orientation)、角度、又は進行方向を含むことを意味する。例えば、本明細書の一実施形態で用いる、光ビームの軌道は、光ビームの実際の経路又は計画された経路を含むことができる。幾つかの実施形態において、光ビームの軌道は、光ビームを照射する光源の方位により決定されることができ、及び、軌道は、実施形態によっては、例えば、角度などを測定されることができ、又は、例えば、軸若しくは面等に対して決定されることができる。
【0089】
本明細書で使用する用語「位置あわせする(align)」は、広義の用語であって、次のものに限定しないが、一般に、0°〜180°の間の一定の角度関係を有するものを含むことを意味する。例えば、本明細書で用いる2つの光ビーム又は2つのX線ビームは、夫々が共線(collinear)である場合、夫々が異なる固定角に向けられる場合、又は、異なる固定関係を有する場合に、位置合わせされ得る。幾つかの実施形態において、位置合わせされた複数の光ビーム又は複数のX線間の角度は、略0°〜略360°の範囲に及ぶことがあり得、及び、略90°、略180°若しくは略270°を含むことができる。
【0090】
本明細書で使用する用語「治療軸」は、広義の用語であって、次のものに限定しないが、一般に、放射線療法装置と関連した器官の軸を含むことを意味する。例えば、実施形態によっては、器官の軸は、角度などにより、放射線療法装置の軸と関連する。幾つかの実施形態において、器官の軸と放射線療法装置の軸との交点は、放射線療法ビームの標的を定義するために用いられる。
【0091】
本明細書で使用する用語「治療セッション」は、広義の用語であって、次のものに限定しないが、一般に、加熱療法、放射線療法又は標的組織を治療するその他の療法の少なくとも1つの実施を1つ又は複数含むことを意味する。例えば、実施形態によっては、治療セッションは、眼に対するX線ビームの照射を1つ含むことができる。また、幾つかの実施形態において、治療セッションは、患者の眼に対するX線ビームの照射又はレーザ放射線の照射を複数含むことができる。幾つかの実施形態において、治療セッションは、例えば、患者が治療のために診療所に一度だけ通院するなどの場合に限定されているが、実施形態によっては、患者が診療所に複数回通院する場合には、治療セッションを複数回に分けることもできる。幾つかの実施形態において、治療セッションは、放射線療法を施す単一治療を含むことができ、及び、実施形態によっては、治療セッションは、夫々の治療に対する異なるプロトコルに続く複数の治療を含むことができる。幾つかの実施形態において、治療セッションは、略1日に限定されてもよく、及び、実施形態によっては、治療セッションは、略2日、略3日、略5日、略1週間、略10日、略2週間、略3週間、略1ヶ月、略6週間、略2ヶ月、略3ヶ月、略6ヶ月、略1年、又はそれ以上であってもよい。本明細書で使用する用語「治療期間」は、広義の用語であって、次のものに限定しないが、一般に、1つ又は複数の放射線療法又はこれと関連する組織の治療上の処置を含み、また、1つ又は複数の治療セッションを含むことができることを意味する。
【0092】
本明細書で使用する用語「位数(orders of magnitude)」は、広義の用語であって、次のものに限定しないが、一般に、スケールのクラス又はあらゆる量の大きさを含むことを意味する。夫々のクラスは、先行するクラスに関する割合の値を含む。例えば、実施形態によっては、夫々のクラスに関する割合は、10であってもよい。実施形態において、1位数は、10の一乗に基づく大きさであり、2位数は、10の二乗又は100に基づく大きさであり、及び、3位数は、10の三乗又は1000に基づく大きさである。
【0093】
幾つかの実施形態において、放射線療法システムは、放射線療法のための放射線ビームを生じるように構成される。ビームは、異なるサイズ又は異なる断面形状のビームを生じるようにコリメートされることができる。ビーム形状は、一般に、X線経路の最後のコリメータ開口によって定義される。ここで、ビーム経路の2つのコリメータのうち、2次コリメータが、ビーム経路の最後のコリメータであり、「成形コリメータ」と呼ばれることがある。また、1次コリメータは、X線出力を最初に減衰させ及び複数のコリメータのうち最も大きく減衰させることができるので、最初のコリメータと呼ばれることがある。2次コリメータは、一般に、X線ビームの最終的な形状を設定することができる。例えば、最後のコリメータ開口が四角である場合、ビーム形状は同様に四角である。最後のコリメータ開口が円形であれば、ビームは円形である。最後のコリメータが複数の穴を有する場合、標的に到達するビームは、その複数の穴の夫々が備えるあらゆる形状(放射線が通過する面積(area)に対応する形状若しくは放射線を通過させない面積に対応する形状、又は放射線を制限する面積に対応する形状)を有する。幾つかの実施形態において、1次コリメータとして機能すると共にビーム成形コリメータとしても機能するコリメータを1つだけを用いてもよい。
【0094】
半影は、最後のコリメータ面積、ビーム形状及びビームサイズによる線量外縁の減衰に関するものであり、通常は最後のコリメータからの任意距離で測定される。本明細書で使用する半影とは、広義の用語であって、通常のものを意味するものであり、次のものに限定しないが、一般に、X線ビームが組織の第1表面又は眼球内部の標的組織に到達するとき(半影に関して参照される場合はどちらでもよい)の最後のコリメータ面積より外縁の照射パーセンテージを含むことを意味する。例えば、半影は、X線ビームが眼の表面に到達するとき又はX線ビームが眼の網膜に到達するときの最後のコリメータ面積より外縁の照射パーセンテージを含むことができる。半影は、ビームの広がりだけでなく、空気及び組織を通過した結果のビーム散乱をも包含することがあり得る。次のものに限定する意図ではないが、半影は、実施形態によっては、放射線レベルが散乱及びビーム広がりの双方を含む1次ビームサイズ放射線の20%未満になる場所で、1次ビームサイズからの直線距離に従って使用される。例えば、コリメータにより決定されるビーム直径がコリメータ出口で5mmであり、組織標的での直径が6mmである場合(ここで、放射照射量は、5mmビーム直径上の線量の20%である(組織での直径))、半影は、0.5/3.0mm(半径)又は16%である。
【0095】
理想的には、標的組織上のビーム入射サイズは、X線ビームに曝される最後のコリメータと同一サイズである。すなわち、半影は、理想的にはゼロである。実際には、ゼロ半影は、コリメータが標的から任意距離にあるとビーム広がりが生じるため、その達成は困難である。しかし、半影は、例えば、コリメータ物質、コリメータ物質の処理、X線管(チューブ)の陽極の位置、X線管の陽極並びに組織標的に対するコリメータの位置、及び、X線源に対するコリメータの相対的なサイジング(sizing)などによって、最適化することができる。本明細書で提供するシステム及び方法の幾つかの実施形態において、組織(例えば、眼)への侵入点における半影パーセンテージは、略10%未満である。幾つかの実施形態において、侵入点での半影パーセンテージは、略5%未満であり、及び、実施形態によっては、侵入点での半影パーセンテージは、略1%未満である。
【0096】
また、半影は、標的領域における成形コリメータゾーン外縁の照射パーセンテージに関連し得る。例えば、眼に対する適用において、半影は、前述の黄斑において成形コリメータゾーン外縁の照射パーセンテージに関連し得る。幾つかの実施形態において、黄斑での半影は、略40%未満であり、幾つかの実施形態において、黄斑での半影は、略20%未満であり、幾つかの実施形態において、黄斑での半影は、略10%未満であり、及び、幾つかの実施形態において、黄斑での半影は、略5%未満である。半影は、治療計画に組み込まれる要因又はパラメータになり得る。例えば、半影の予測情報は、治療を計画するために利用されることができる。一実施形態において、微細なコリメートビーム(例えば、最後のコリメータ出口で、4mm直径を有するコリメートビーム)は、強膜に適用される。網膜におけるビームは、5mm直径(半影は25%)又は6mm直径(半影は50%)であるとよい。これらビーム直径は、疾患の適用範囲に対して充分な大きさである。この方法は、眼の前部構造に照射される放射線を最小限に抑えると共に、網膜における疾患を完全にカバーする。本実施形態において、X線ビームの広がりは、網膜に対する治療量を犠牲にすることなく、眼の前面組織への照射サイズを最小にするために利用される。
【0097】
関連定義には、線量減衰に関する「等線量減衰」があり、これは、関心領域の線量地図(dose map)である。等線量減衰は、Gy/mmで測定されることができる。ここで、mmは、関心点からの直線距離を表す。
【0098】
広がり角は、線源のジオメトリが与える光子から十分に予測可能である。そして、広がり角は、散乱や、モンテカルロシミュレーションを含めた若しくは考慮したその他の物理的現象などを夫々計算することができる。大抵の場合、X線源は、理想的な点光源ではなく、有限体積を有する。この非理想的なケースは、コリメータのビーム経路の設計に入力される。この場合、コリメータは、理想的な点光源に対してではなく非理想的なX線源に対して異なって設計される。例えば、X線源は、正方形若しくは長方形又は楕円の線源であってもよい。線源の最大直径は、略0.5mm、略1.0mm、略2.0mm、略3.0mm、略4.0mm又は略5.0mmであってもよい。幾つかの実施形態において、線源の最大直径は、治療される構造に従ってさらに調節されることができる。
【0099】
より短波長の光子は、より高エネルギーの放射に対応する。X線の高エネルギー範囲は、通常、MeV範囲であり、及び、一般に、(放射を発生させる方法から独立した)ガンマX線に関連する。比較的に短波長のX線光子は、常用電圧X線と呼ばれる。短波長の高エネルギー放射は、標的組織への深侵入に相当する。このため、MeVエネルギーを利用する大部分の適用では、患者及び周囲環境に広範囲な遮蔽を必要とする。この開示の幾つかの実施形態において、診断目的又は低エネルギー常用電圧X線源に一般に用いられるX線は、眼の疾患及び患者の比較的に浅在部分にある障害(例えば、胸部、手術中の放射適用、皮膚癌、及び、末梢血管障害やインプラントなどのその他の障害)、の少なくとも一方の療法に用いられることができる。診断に一般に用いられるX線は、X線光子の細ビームにX線ビームを細密にコリメートすることで、及び、浅在領域にビームを向けることで、療法に用いられることができる。障害が身体内部に数センチ入った深部に存在する場合、高エネルギー源(例えば、MeV)は、障害に対するエネルギーの侵入性を高めるために好ましい。小半影を有する小直径のMeVX線ビームをコリメートするのは困難である。これは、非常に高速の光子が、二次X線及びその他の放射の生成を含む二次相互作用を組織に生じさせるためである。500keV未満のエネルギー、及び、200keVよりもさらに低エネルギーのX線は、非常に小さな直径でより適切にコリメートされることができる。
【0100】
また、「レーザ」エネルギーは、紫外線放射などの短波長から赤外放射などの長波長までの範囲におよぶ異なるエネルギーを有する光子で構成される。レーザは、放射の特定波長よりも、より伝達メカニズムに関連する。レーザ光は、光子が互に同相でほとんど拡散せずに移動するという点で、「コヒーレント」であると考えられる。また、レーザ光は、空間を進むときに比較的にほとんど拡散せずに移動するようにコリメートされる。光は、コヒーレント(同位相で)とならずに及びレーザとならずに、コリメートされることができる。例えば、レンズを、非X線光をコリメートするために用いることができる。X線光は、通常、非レンズコリメータを用いてコリメートされる。そして、半影は、良好なコリメーションの程度を定義する。レーザポインタは、通常、可視化用ツールである一方、より大きく、より高いフラックスレーザは、医療用途に利用される。本明細書に記載のシステム及び方法の幾つかの実施形態において、例えば、レンズや鏡などの光学装置(optics)を用いることができ、実施形態によっては、コリメータを用いてもよいが、介在光学要素は存在しない。
【0101】
2つの眼房は、前眼房及び後眼房である。前眼房は、特に、水晶体(レンズ)、結膜、角膜、強膜、小柱装置(trabecular apparatus)、毛様体、筋肉、プロセス(processes)、及び、虹彩を含む。後眼房は、特に、硝子体液、網膜及び視神経を含む。
【0102】
この開示で使用する「眼の疾患」は、広義の用語であって、通常のものを意味するほか、次のものに限定しないが、一般に、前眼部の疾患(例えば、緑内障、老視、白内障、ドライアイ、結膜炎)だけでなく、後眼部の疾患(例えば、網膜症、加齢黄斑変性症、糖尿病性黄斑変性症、及び脈絡膜メラノーマ)を少なくとも含む。
【0103】
ドルーゼは、網膜下のブルッフ膜における硝子質の沈着物である。この沈着物は、炎症過程で生じ、又は、少なくとも炎症過程の標識となる。これは、70歳以上の患者の間で大きな割合で存在する。因果関係は解明されていないが、ドルーゼは、炎症が生じる位置及び新生血管が将来的に生じる可能性が高い位置の標識に関連する。これらの位置は、いわゆる「脆弱な網膜」の領域である。従って、本明細書で記載するように、その領域に炎症を抑える放射線を照射することは、患者にとって有益な場合がある。
【0104】
放射線療法は、歴史的に眼の疾患の治療に僅かに成功している。例えば、近年公表されたコクランメタアナリシス(Cochrane meta-analysis)(シグナバネル等著、加齢黄斑変性の新生血管に対する放射線療法、コクランデータベース、2006年4月発行(Signanavanel et. al. Radiotherapy for neovascular age-related macular degeneration, The Cochrane Database, Issue 4, 2006)。この内容は参照により本明細書に組み込まれる)において、著者は、AMDに対する放射線療法のメリットを論じている。この全体的な結論は以下の通りである。眼科医は、放射線腫瘍医を患者に関わらせることに消極的であったこと、具体的な方法を臨床プロトコルに用いなかったため、放射線源から放射線を局所化することが困難であったこと、並びに、分割スキーム(fractionation scheme)及び照射(dosing)が、標準化されていなかったこと(標準化に関しては詳細に後述し、及び、図示している)。この開示に記載の実施形態により、放射線腫瘍診療所に委託することなく眼科医が実行可能であって、臨床治療に特有の装置及びプロトコル、並びに標準化された照射を提供する分割スキームによって、放射線源を局所化可能である、システム及び方法が提供されている。
【0105】
近接照射療法は、少なくともアジュバント療法としての薬物療法と併用される場合に非常に有益な作用を生じる。該近接照射療法は、治療領域に放射線量を提供し、及び高効率で線量を照射する。しかし、近接照射療法は、治療計画(例えば、外科医があらゆる患者の様々な位置に対してもプローブを保持できるなどの治療計画)に関する限り制御が困難であり、及び、近接照射療法は、通常、切ることができない(例えば、ストロンチウムの半減期が29年であるため)。
【0106】
放射線療法システム
【0107】
図1Aのポータブル常用電圧放射線療法治療システム(PORT)10は、治療期間の間に略1Gy〜略40Gy、又は治療期間の間に略10Gy〜略20Gyを、次のものに限定しないが、網膜、強膜、黄斑、視神経、水晶体又は人工水晶体のカプセル状嚢(capsular bag)、毛様体筋、レンズ、角膜、シュレム管、脈絡膜、及び結膜を含む眼の領域のあらゆる場所に伝達するように構成されることができる。幾つかの実施形態において、システムは、治療期間の間に略15Gy〜略25Gyを伝達するように構成されることができる。幾つかの実施形態において、システム10は、あらゆる分割スキーム(例えば、1日あたり略1Gy、1日あたり略5Gy、1ヵ月あたり略10Gy、又は、1年あたり略25Gy)でX線療法をもたらすことができ、治療計画システムは、患者に特有の解剖学的構造並びに疾患の特徴に基づいて治療された領域をメモリに保存し、及びメモリから呼び出すことができる。このような特長及び以前の治療歴は、後の参考のために治療データベースに保存される。
【0108】
また、システムは、疾患の程度又は治療される眼の領域に従って異なる光子エネルギーを伝達することができる。例えば、X線発生管は、略20keV〜略40keV、〜略60keV、〜略100keVの範囲の光子エネルギーを有する光子を伝達することができる。眼の前部構造に対しては、略20keV〜略50keVの範囲の光子エネルギーを有する光子を用いるとよい。これは、このような範囲の光子エネルギーを有する光子は、侵入の程度が浅いからである。眼の後部構造に対しては(網膜への深侵入のために)、略60keV〜略100keV又はそれ以上の範囲の光子エネルギーを有する光子を利用するとよい。幾つかの実施形態において、X線発生管は、略10keV〜略500keV、略25keV〜略100keV、略25keV〜略150keV、略40keV〜略100keV、又は、前述した範囲又はこれら範囲のあらゆる組み合わせの範囲の光子エネルギーを有する光子を放射することができる。幾つかの実施形態において、光子エネルギーの選択は、治療対象の実際の患者の眼から取得した解剖学的データにより生成される眼モデルを算入できる診断の計算に基づくことができる。医療治療の専門家は、疾患に基づくビームエネルギーを選択することができ、そして、機器に所望のエネルギーレベルを設定することができる。幾つかの実施形態において、システムは、医療専門家から、疾患のタイプに関する入力を受信することができ、エネルギーレベルを予め設定されることができ、そして、医療専門家による修正を受信することができる。
【0109】
PORTは、本明細書の幾つかの実施形態において眼の適用に関連して説明しているが、常用電圧X線の到達範囲にあるあらゆる表在性の身体構造、又は、外科手術の間にアクセス可能な構造体に対しても適用することができる。例えば、胸部などの領域で、関心構造に到達させるために、40keVを越えるが200keV未満のエネルギーを有するX線を用いるとよい。例えば、その他の関心構造としては、皮膚病変、顔面病変、頭並びに首の粘膜病変、爪、筋肉、軟組織、肛門直腸領域、前立腺、陰部、関節、腱、筋肉、及び、尿生殖路などを含む。
【0110】
PORTは、眼の範囲内の特定構造以外には適用させずに、その特定構造にだけ適用させることができる。これは、PORTのイメージングシステム、モデリングシステム、及び、微細調整可能なコリメートビームが、眼の内部にある特定構造を標的とすることができ、小半影(例えば、略1mm〜略5mmビームにつき、半影が略10〜20%未満)を有するX線ビームの正確な方向付けを提供することができるためである。また、PORT療法は、個々に区別され、全ての患者に対して生成されるカスタマイズ治療計画を可能にする生体測定表示に基づく。
【0111】
前述したように、常用電圧発生器、又はその他の低エネルギーX発生器は、分厚い防壁、特殊遮蔽装置、又は、略500keVを越える光子エネルギーを有するX線を発生する装置により要求される特殊制御を要求することなく、部屋に設置されるシステムを可能にする。また、常用電圧発生器又はその他の低エネルギーX線発生器は、ライナックよりもさらに小型であり、より小型の発生器の駆動を可能とし、及び、制御モータのエネルギーを低減できるだけでなく、内部遮蔽及び外部遮蔽をも低減することができる。さらに、低エネルギーX線発生器は、ビームコリメーション及びビームを向けるスキーム(scheme)を容易にするため、ビームが小半影を有し及びより隙間のないコリメーションを可能にする。さらに、X線源を移動するために要求されるスキームにおいて、エネルギーは、線源を異なる位置に移動させるために用いられるのではなく、及び、全システムは低エネルギーX線源を有してスケールダウンされる。
【0112】
幾つかの実施形態において、放射線療法システムは、眼に関する多種多様な病状を治療するために用いられる。例えば、システムは、黄斑変性、糖尿病性網膜症、炎症性網膜症、感染の網膜症、眼の内部、眼の周囲若しくは眼に接する腫瘍、緑内障、屈折障害、白内障、眼の構造に関する手術後(例えば、線維柱帯形成術、線維柱帯切除術、眼内レンズ、緑内障ドレナージ管、角膜移植、感染、原因不明の炎症性疾患の手術後など)のあらゆる炎症、プチリジウム(ptyrigium)、ドライアイ、及び、その他の眼疾患又は眼に関するその他の病状などを治療するために、単独で又はその他の治療と併用して用いられることができる。また、放射線療法システムは、最大ビームエネルギービーム角度、眼のジオメトリ(幾何学的形状)のための制御、及び、患者並びに眼、の少なくとも一方が所定位置から移動したときに装置を停止するための制御、を含む。
【0113】
放射線治療システムは、実施形態によって、放射線源と、該線源を三次元空間の座標に応じて制御及び移動するシステムと、イメージングシステムと、治療パラメータを入力するヘルスケアプロフェッショナル用のインタフェースと、を含む。具体的には、放射線療法システムの幾つかの実施形態は、放射線源並びに線源を作動するための電源装置と、電動制御モジュール又は線源に対する制御電力と共に線源の方向を操作するサブシステムと、関心構造(例えば、眼)に対して線源と制御とをリンク(連結)させる連結モジュールと、イメージングサブシステムを含む放射線療法発生モジュール又はサブシステムを含んで構成される。幾つかの実施形態において、これらモジュールは、ヘルスケアプロフェッショナル用のインタフェースにリンクされ、及び、治療計画システムの基礎を形成する。用語「モジュール」及び「サブシステム」は、本開示において交互に用いられることができる。
【0114】
図1Aは、放射線療法を用いて眼疾患を治療するシステム10の一実施形態に係る側面図を示す。図示した実施形態において、放射療法治療システム10は、放射線療法発生モジュール又はサブシステム110と、放射線療法制御モジュール又はサブシステム120と、インタフェースディスプレイ130と、処理モジュール140と、電源装置150と、ヘッドレスト160と、カメラであり得るイメージングモジュール400と、を含んで構成される。
【0115】
一実施形態において、放射線療法装置は、患者220の眼210に、X線を伝達する。電源装置150は、システム10内部に設けられるか、又は、システム10(例えば、床に)に隣接して設けられるとよい。しかし、実施形態によっては、電源装置150は、システム10から離れた異なる位置に設けられることもできる。電源装置150は、X線発生器110に(一体構成で)物理的に連結されることができ、又は、X線発生器(例えば、電源装置とは独立して移動し、及び、例えば、高電力ケーブルを通じて接続されるX線源)から外されることができる。実施形態によっては、電源装置は再充電可能なポータブル電源である。また、幾つかの実施形態において、X線管の冷却システムが提供される。冷却システムは、水、油又は空気対流であり得、及び、冷却システムは、放射線療法システム10に設置されることができ、又は、放射線療法システム10から離れて配置されることができる。
【0116】
電圧は、略110V又は略220Vの壁電圧(変圧器を経た壁電圧)であり得、装置、サブシステム又はシステムモジュールのために用いられることができる。X線を発生させるためにシステムに供給される電流は、略1A(アンペア)のオーダー、略50mAより低いオーダー、又は、略5mAから略10mAのオーダーであるとよい。幾つかの実施形態において、電源装置は、数百ミリアンペア(例えば、略600mA)に達する電流を伝えることができる。例えば、略100mAから1A、又は、略100mAから1A超の範囲の電流は、システムのプロトコル又は機能が、例えば、X線源が回転陽極源(rotating anode source)である場合など高電流に適応するように構成されるときに用いられることができる。
【0117】
幾つかの実施形態において、電源装置に要求されることは、X線管内の陰極からX線の陽極に電子を飛ばすために高電圧を発生可能であるということである。電子移動は、真空X線管内で起こる。高電圧(例えば、略30,000〜略300,000V(ボルト)、又はそれ以上の高電圧)は、真空内部で電子を加速するために要求されることができる。第2電流は、一般に、フィラメントから電子を発生させるためにX線電源装置で用いられ、電子は、その後、電位により加速される。従って、X線電源装置は、通常は、X線を発生させるために2つの電源装置を有する。一旦発生されると、電子は、高電位の影響を受けて陽極の方向へ速度が上がる。陽極は、X線を発生する代表的には静止した物質(例えば、タングステン、モリブデン)である。
【0118】
陽極は、放射線源とみなされ、及び、陽極のサイズ及び構造は、半影決定の役割を有する。例えば、点光源は、略1mm以下の最大直径を有する陽極により近似され、複数点光源は、高密な半影により最高品質ビームを伝えることができ、略1mm超の陽極を有する線源は、最適ではなく、また、例えば、2mm、3mm、4mm又は5mmの線源は、本明細書に記載の実施形態に関連して用いられることができる。しかし、半影は、略1mm以下である横断面寸法(直径)を有する線源よりも大型の寸法を有する線源より、一般に、大型である。また、陽極は、X線フラックスの主要な決定因子である。陽極で発生する熱は、X線源により達成される最大フラックスの主要な制限因子である。冷却できる陽極の範囲に応じて、X線フラックスを増加させることができる。これは、半影のトレードオフの要素部であり、大型の陽極は、多量の熱に起因する大型の電流を許容することができる。X線出力は、より大きなX線フラックスを可能にするより低温度に対する非常に高電流の電流に関連する。幾つかの実施形態において、回転陽極源は、時間と共に異なる点へ移動する陽極によって、陽極を「冷却する」ために用いられる。
【0119】
一旦、電子がX線を発生する物質に衝突すると、X線が発生する。システムのケーシング内の吸収金属(例えば、アルミニウム、鉛、又はタングステン)は、線源110から散乱する生成X線を多量に吸収する。エスケープが予め計画されたX線は、線源から放出され、及び、コリメータ(例えば、1次又は2次のコリメータ)に移動し若しくは選択的にフィルタ(例えば、アルミニウムフィルタ)を通じてコリメータに移動する。コリメータは、患者220にX線を向けるように計画される。特に、本明細書に記載のように、コリメータは、半影の形成並びに散乱を最小化、及び、X線ビームの形状並びに方向、の少なくとも一方を最適化するように、設計及び製造されることができる。電源装置は、電力漏洩を低減するために高絶縁された高電力ケーブルによりX線源に接続されるとよい。
【0120】
コリメータは、1以上のコリメータ(例えば、図2Aに示したように、1次コリメータ1030、2次コリメータ1040、さらに3次コリメータ1052)であり得る。実施形態によっては、2次(成形)コリメータが、患者の眼1300に近接して配置され(例えば、10cm以内)、及び、1次コリメータ1030が線源1070に近接して配置される。この種の構成は、眼1300の眼構造上の線源1070により発生させられる半影を低減することができる。線源は濾過(filtration)を含むことができ、また、コリメータが濾過を含むことができる。
【0121】
幾つかの実施形態において、コリメータは、特殊開口である。開口は、調節されることができ、例えば、開口は、略1.0cm〜略0.5mm、又は、略0.5cm未満〜0.01cmに調節されることができる。幾つかの実施形態において、開口は、略0.5mm〜略7.0mmの間で調節される(例えば、機器のオペレータによって自動又は手動で調整される)。幾つかの実施形態において、コリメータは、タングステン、鉛、アルミニウム又はその他の重金属から構成される。幾つかの実施形態において、コリメータは、通過する放射のために円柱形状を有し、実施形態によっては、コリメータは、通過する放射のために円錐形状を有する。幾つかの実施形態において、コリメータ開口は、円形状を有する。特定の実施形態において、コリメータは、通過するX線のために曲線形状を有する。コリメータは、標的で要求される放射分布に対応して成形されることができ、例えば、実施形態によっては、黄斑領域に放射を集中させると共に、視神経を避けることができる。これは、視神経を避けるために、黄斑の視神経側(鼻側)が黄斑の側頭部側よりも少量の線量を受信するように、クレセント(crescent)形状のコリメータ又はその他の重量配分(weighted distribution)により方向付けられる放射線であると好ましい。
【0122】
幾つかの実施形態において、コリメータは、ワイヤ放電加工を用いて切断され、その他の実施形態では、コリメータ経路は、レーザを用いて切断及び研磨される。幾つかの実施形態において、コリメータは、平滑な輪郭がつけられ、放射線がコリメーション装置を通過するときの散乱を低減するように切断及び研磨される端部を有する。幾つかの実施形態において、コリメータは、ビームを比較的修正するが、シャープな輪郭を有しないように、他の部分より薄い(thinner)金属部分を有する。他の実施形態においては、コリメータは、完全な開口でなくて、大量のX線エネルギーが要求される領域に対しては薄い物質である。例えば、フィルタ物質の厚さは、形状又はフィルタ物質の所望フィルタリング特性に従って変化させてもよい。幾つかの実施形態において、フィルタ物質の厚さを半分に低減すると、該フィルタ物質の厚さを低減した部分を放射線ビームが通過することを可能にするが、厚さを低減していないフィルタ部分を放射線ビームが通過しようとする場合には依然として実質的に遮断される。幾つかの実施形態において、フィルタ厚さは、全体的に一定であるが、異なるX線不透過性を備える物質が用いられる。例えば、高X線不透過性を備える物質は、X線放射にフィルタをかけるために用いられ、及び、低X線不透過性を備える物質は、例えば、X線の通過を可能にする開口の位置に用いられる。
【0123】
幾つかの実施形態(例えば、図2C)において、光ポインタ1410(例えば、光源1450から放射されるレーザビーム)は、X線ビーム1400と一致するように、コリメータ1405に連結され、又は、コリメータ1405の後方に連結され、光ポインタ1410は、放射線源がコリメータ及びX線ビームのトラッキング入射角1420、1430で入る眼1300の表面上の位置を示すことができる。コリメータ1405は、放射線が入る眼状のポイントを示すポインタとして機能し得る光源1450との共線にあるとよい。幾つかの実施形態において、光ポインタ位置は、眼構造(例えば、角膜輪部(limbus))に関して、ポインタの位置を識別するイメージ認識システムと共に、放射線療法線源を追跡するために用いられ、及び、放射線療法装置は、イメージに基づいて(例えば、眼の角膜輪部からさらに離れて又は近接する領域に)移動される。幾つかの実施形態において、治療者は、角膜輪部に関するレーザポインタの位置を視覚化して、その位置に手動でX線源を調整する。
【0124】
幾つかの実施形態において、レーザポインタ1210は、図2B−1に示すように最上部に位置するか、又は、1次若しくは2次のコリメータ1215を通るX線ビームと一致する。レーザポインタ(レーザ光)1210は、コリメータ開口を通過し、X線1200と実質的に同一の表面位置にあたるように、レーザポインタ1210とコリメータ開口1216を位置合わせする反射体1220により反射されることができる。幾つかの実施形態において、レーザポインタ1210は、コリメータ開口1216を通過するX線ビーム1200と実質的に同一軌道を有するように、コリメータ開口1216によって位置合わせされる。あらゆる場合において、レーザポインタ1210及びX線ビーム1200の方向は、相互に結びつけられ、何れかの既知の位置が、一方のビームの既知の位置と等しくなる。
【0125】
反射体1220は、ビームスプリッタであってもよい。このビームスプリッタは、エネルギー1200を透過させることができ、さらに、X線エネルギーの所望スペクトルを生成するフィルタとして機能する。レーザポインタ1210は、(図2Cに示す)システムカメラ1460が検出可能な波長を放射することができる。これによれば、ポインタ1210は、放射線ビームが眼に入る箇所を示すので、これをカメラ上で確認することができる。また、ポインタ1410は、X線源が電力供給され及び関心眼構造若しくは関心標的組織1480に対する正確な方位に向ける視覚確認として役立つ。システム内の第2カメラ、レーザポインタの入射角、及び、定義によって、X線ビームが決定されることができる。
【0126】
例えば、カメラなどの少なくとも1つのイメージングモジュール400、1460は、少なくとも実時間(リアルタイム)で眼を追うためにシステムに含まれる。実施形態によっては、イメージングモジュール400、1460、又はカメラは、前述したX線源トラッキング装置(例えば、レーザポインタ1210)の有無に関わらず、眼を撮像する。カメラは、眼の位置を検出することができ、及び、X線の方向並びにコリメータシステムを眼の位置に関連づけることができる。システム10上の放射線療法システムのオペレータに指示を与える選択的な表示130は、実施形態によっては、リアルタイムにX線装置の位置を表示することができる。
【0127】
一実施形態(図4)において、カメラ2055が眼の位置を検出し、及び、デジタル化ソフトウェアが眼の位置を追跡するために用いられる。眼は、予め設定された位置2060(又は治療領域)の範囲内に存在する。この位置は、角膜輪部の端部と一致しており、眼が移動閾値を越えて位置2054から外れると、シグナル2090が放射線源2000に送信される。本明細書で使用する用語「移動閾値」は、広義の用語であって、通常のものを意味するものであり、次のものに限定しないが、放射線源2000を停止させることなく、眼が治療パラメータの範囲内を移動し又は該範囲内に存在する程度(degree)又は測定値を含む。幾つかの実施形態において、移動閾値は、ラジアン、度、ミリメータ、インチなどで測定されることができる。眼が移動閾値を越えて位置2057へ外れると、放射線源2000はオフされ、一方、眼が位置2054又は移動閾値の範囲内であると、放射線源2057はオンされる。移動閾値をセットするいくつかの方法において、治療プロフェッショナルは、角膜輪部2060の端部境界を定め、及び、その角膜輪部2060の端部を治療計画ソフトウェアに登録する。眼の角膜輪部が、定めた端部境界から2030へ離れる場合、放射装置を停止するためにシグナル2090が放射装置に送信される。
【0128】
幾つかの実施形態において、接続部又は連結部162は、システムから延設され、及び眼210に接触する(図1D及び1E)。接続部は、機械的な接続に加えて、システムと眼との間の光学的通信又はその他の通信を含むことができる物理的な接続であり得る。物理的接続部162は、幾つかの機能を提供することができる。例えば、実施形態によっては、接続部162は、角膜又は強膜に直接に適用されるために、決定された眼の位置へと機械的に伸長されることができる。また、接続部162は、患者が治療の最初から最後まで所定位置に眼を保持することに応じるように、眼の制止のために提供される。加えて、眼は、例えば、患者の眼が治療を実行するために麻酔されている場合に、予め定めた所定位置に移動されることができる。最後に、眼に関する物理的接続は、角膜の領域を保護するために物理的接続装置底面に点眼潤滑剤を用いることができる。角膜の物理的接続部162は、システムに関する眼の位置決めを可能にする。
【0129】
放射線療法システム10から眼への物理的接続部162は、図1E(図1Cの308も参照)の眼に関する角膜輪部905に接触でき、又は、角膜915若しくは強膜925に接触できる。物理的接続は、多少の力により適切に眼を移動させ又は保持するために、眼に対して多少のフリクションを適用する吸引式装置912を含むことができる。特定の実施形態において、接続部162は、吸引が適用されたときに強膜に接触する。物理的接続部162は、眼に別途に挿入される強膜レンズ935又は角膜レンズとドッキングすることができる。物理的接続部のあらゆる物質は、X線を透過させることができ、又は、ある程度のX線を吸収することができる。
【0130】
物理的接続部162は、患者の眼の安定化を補助することができ、レンズ下の眼球運動を低減する。潤滑剤がレンズ内側に塗布される場合、該レンズは、治療の間、眼を保護するためにゲル又は潤滑剤を保持することができる。また、レンズは、角膜に酸素を提供できる貫通孔を含むことができる。
【0131】
物理的接続部162は、放射線療法システムと患者との間の剰余(スペース)を移動可能であることができ、物理的接続部162は、剛性、実質的に剛性であってもよく、又は、軸方向又はねじれ方向に可動性を与えるばね165を含むことができる。幾つかの実施形態において、接続部162は、全てが機械式ではなく、放射線療法システムと眼の上に位置するレンズ935との間を通信する光学式又はその他の非接触方式である。物理的接続部162は、放射線療法システムに対する座標基準フレーム(coordinate reference frame)を示すこと、及び、眼に対する装置の移動信号を出力すること、の少なくとも一方を実行できる。従って、接続部162は、患者の動きを抑制することにより眼の位置決めを保持することに加えて、眼の位置を保持することを支援できる。物理的接続部162は、無線送信機、レーザポインタ、又は三次元空間に眼を位置させることができるように、カメラに取り込むことができる機能を含み得る。
【0132】
幾つかの実施形態において、眼に対する物理的接続部162は、角膜輪部の中心及び該中心を通る治療軸を識別するように、治療者によって眼上の位置にドッキングされる。そして、眼の位置決めは、放射線療法システムにより識別及び追跡されることができる。眼モデルと組み合わせた角膜輪部の既知の中心に関して、放射線療法システムは、網膜に放射線を伝達するため、治療軸及び角膜輪部の中心に向けられることができる。
【0133】
幾つかの実施形態において、物理的接続部162は、放射線療法連結装置945を含むことができる(図1G)。連結装置945は、例えば、強膜レンズ及び放射線療法連結表面950を含むことができる眼表面960を有する。眼表面960は、角膜を覆うこと及び角膜に接触することができ、又は、強膜に接触することにより角膜を覆うことができる。幾つかの実施形態において、眼表面960は、角膜及び強膜の双方を覆うこと、接触すること、ができる。眼表面960は、実施形態によっては、レンズであり得、及び、実施形態によっては、表面960は、少量の屈折又は完全に屈折しない実質的な透明窓であることができる。眼表面960は、眼のゲルを保持するために用いられることができ、又は、中心の孔部を有するシェルであり得る。眼表面960は、例えば、IOLマスター、光コヒーレンストモグラフィー(断層映像法)(OCT)、角膜表面マッピング、MRI、CTスキャン、及び、超音波などの画像診断技術を用いて、個々の患者に合わせてカスタマイズされることができる。眼表面960は、柔軟性、剛性、又は、コンポジットであり得る。フランジ970は、開瞼を保持するように機能することができ、又は、放射線療法装置の基準(fiducial)として機能することができる。
【0134】
眼表面960の反対側は、放射線療法連結表面950、又は放射線療法連結表面部955である。これらの表面は、個別に又は集合的に、放射線療法システムを有する連結装置945と連結する。眼及び眼構造と連動する眼表面インタフェース960、放射線療法部950、955は、眼表面を放射線療法システムに連結する。放射線療法部950、955は、様々な方法で連結装置945を放射線療法システムに連結することができる。例えば、放射線療法部950、955は、レーザポインタを介して、赤外線連結を介して、マクロは連結を介して、機械的連結を介して、反射器を介して、又は、放射線療法送信機を介して、放射線療法装置を連結することができる。
【0135】
連結装置945の追加の構成要素は、装置のジオメトリ、又は、装置945と放射線療法システムとの間の幾何学的な関係を定義することができる基準マーカー970である。幾つかの実施形態における放射線療法連結装置945の追加の構成装置は、装置を横断する内腔985であって、実施形態によっては、該内腔985は、眼の表面まで伸長する。内腔985は、(例えば、A−scanなどで)眼軸長を測定するために用いられることができるプローブ962を通すために用いられることができる。幾つかの実施形態において、プローブ962は、患者の眼から離れて外部(outward)を指すことができるレーザポインタプローブ962を含むことができる。外部ポインティングレーザポインタは、放射線療法システムと関連して、装置と眼との配置(アライメント)を決定するために用いられることができる。幾つかの実施形態において、レーザポインタは、眼の軸に関して放射線療法装置を整列配置するために用いられ、及び、放射線療法のオン(所定位置にあるときにオン)又はオフ(所定位置から外れたときにオフ)を切り替えるために用いられることができる。これらの実施形態において、患者は、装置のオンとオフを切り替え、及び、眼を機械に位置合わせしたときには放射線療法システムを操作し、装置が放射線療法装置により整列配置されないときには放射線療法システムを停止する。
【0136】
幾つかの実施形態において、プローブ962は、鏡964を含む。鏡964は、放射線療法装置の整列又は誤整列を示すビーム反射体として機能することができる。鏡964は、例えば、レーザポインタ又はLEDなどの光であり得る。放射線療法装置から生じる光、及び、連結装置945上の鏡964による光の反射は、放射線療法装置に関する鏡の方向を表す。鏡は、角膜表面に対して並行にされることができる。この場合に、鏡に対して垂直なビームは、角膜に対して略垂直である。角膜に対する垂直なビームは、眼の光軸又は眼軸を通って移動し、及び、眼の後極の中心に到達する(図1I及び図1Jに示し及び記載)。
【0137】
幾つかの実施形態において、鏡は、一部の波長を反射し、それ以外を透過するいわゆる「ホットミラー」又は「コールドミラー」と呼ばれる。「ホットミラー」は、例えば、患者、治療専門医又はカメラがレンズを透過して見ることが可能であるように、赤外線レーザポインタを反射し、及び可視光を透過することができる。可視レーザポインタを反射すると共に赤外線を透過するように、「コールドミラー」は、赤外線を透過し、可視を反射し得る。コールドミラーは、例えば、治療の間に赤外線眼底カメラの利用が要求される場合に用いられることができる。
【0138】
幾つかの実施形態において、装置945の連結表面950、955は、眼を適所で保持するためのホルダー971(図1H)に取り付けられることができる。ホルダー971は、放射線療法装置に設置されることもできるが、好ましくは、例えば、放射装置を保持するテーブル又はプラットフォーム974に設置されるフレームなどによって、放射線療法装置から離れた位置に設置されるとよい。幾つかの実施形態において、フレーム972は、複数の関節を有し、及び、実施形態によっては、フレーム972は、片持ち梁のように可撓性又は弾力性がある。フレーム972は、連結装置945がホルダー971に取り付けられると、患者の眼に対して、連結装置945を介して伝達する多少の力を提供する。
【0139】
幾つかの実施形態において、連結装置945は、放射線透過性の物質、又は、少なくとも一部の放射線を通過させる物質を含むことができる。幾つかの実施形態において、連結装置945の放射線透過性物質は、治療の間、治療X線ビームの通過を可能にするように構成されることができる。例えば、連結装置945は、眼の位置を保持するために眼に係合することができ、及び、X線ビームは、連結装置945の少なくとも一部を通る軌道で眼組織を標的とするように向けられることができる。従って、治療計画システムは、連結装置945を係合する場所や連結装置945を眼上の何処に位置させるかなどを厳密に考慮することなく、X線ビーム軌道を計画することができる。
【0140】
幾つかの実施形態において、連結装置945は、放射性不透過性物質、又は、放射の伝達を減少若しくは制限する物質を含むことができる。幾つかの実施形態において、連結装置945の放射性不透過性物質は、例えば、X線ビームなどの放射物質の伝達を制限するように構成されることができる。例えば、連結装置945は、眼の位置を保持するために眼に係合することができ、及び、眼組織を標的とするように向けられたX線ビームを通過させず若しくは物質を通過するX線ビームを実質的に制限する。これら実施形態において、連結装置945は、(例えば、水晶体、視神経、角膜などの)眼構造に対する放射線照射を制限することにより、重要な眼構造の遮蔽として用いられることができる。
【0141】
治療計画システムは、放射性不透過性物質を識別又は認識するように構成されることができ、及び、連結装置945を横切ることができる軌道であって、標的組織方向への軌道を有するX線ビームの適用を制限することができる。例えば、連結装置945が眼に係合すると、連結装置945を通過して標的組織にX線ビームを適用する眼の外側の場所にゾーンが形成される。ゾーン空間は、連結装置945が実質的に円形であると、標的組織から連結装置945までを円錐形の形で映し出す形となる。ここにX線ビームの線源が配置されると、X線ビームの軌道は連結装置945から標的組織を通過することができるようになる。
【0142】
標的組織から伸長し、連結装置945を通過する軸は、標的組織を治療するために連結装置945を通過することが要求され得るビーム軌道を表す。連結装置945が放射性不透過性物質を含む場合、該物質がX線ビームを妨げ又はX線ビームに影響を及ぼすので、連結装置945を通過する軌道は、最適アプローチであってはならない。従って、実施形態によっては、線源は、標的組織を治療するために連結装置945を通過する軌道と一致する空間の外側に再配置され、及び、連結装置945を通過しない新規な軌道が設定され得る。この新規な軌道は、連結装置を通過する軸を横切り、又は該軸と並行ではなくなる。また、幾つかの実施形態において、新規な軌道は、連結装置を通過する軸に対して並行であってもよいが、軸と共線ではなく、及び、軸と同一側から標的に向けられない。そして、類似の新規な軌道は、軸と類似の関係を有して再現されることができる。
【0143】
幾つかの実施形態において、連結装置945は、放射性不透過性物質及び放射線透過性物質を含むことができる。幾つかの実施形態において、連結装置945の放射性不透過性物質は、例えば、X線ビームなどの放射性物質の伝達を制限するように構成されることができ、及び、放射線透過性物質は、物質を通過する放射線(例えば、X線ビーム)の伝達が可能なように構成されることができる。また、連結装置945は、X線ビームが標的組織を通過し得る軌道に沿う配列を提供するように構成されることができる。さらに、幾つかの実施形態において、連結装置945は、ビームサイズ又はビーム形状を制限することにより3次コリメータとして動作することができる。例えば、連結装置945の放射線透過性物質は、2次コリメータの開口と同程度のサイズ又は形状にされることができる。このような実施形態において、X線ビームが放射線透過性物質を通じて放射されると、連結装置945のあらゆる半影は、周囲放射性不透過性物質によって遮断され得る。幾つかの実施形態において、放射性不透過性物質の開口は、放射線透過性物質の代わりに提供されてもよい。従って、連結装置945は、遮蔽物又は標的機能をさらに提供することができる。
【0144】
連結装置945を提供する幾つかの実施形態は、該連結装置945の中心周囲に放射状に設けられた複数の開口又は放射線透過性物質部分を備える。開口は、円、四角、長方形、楕円、曲線、不規則に、環状に、同心円状などに形成されることができる。幾つかの実施形態において、連結装置945は、組織を標的とする放射線伝達を許容するように装置の中心部だけに、開口又は放射線透過性物質部分を含んで構成される。
【0145】
幾つかの実施形態において、連結装置945は、該連結装置945の実質的な中心部(例えば、眼表面960の部分)が放射性不透過性物質を含んで構成されることができ、及び、その中心部の周囲又は外縁のまわりの連結装置945の部分は、放射線透過性物質部で構成される。従って、放射線療法の間、中心部は眼構造を遮蔽するように作動することができ、及びX線ビームは放射線透過性物質を通過することができる。このように、連結装置945は、放射性不透過性物質に実質的に妨げられずに標的組織に到達するX線ビームを可能にしつつ、眼に係合するためのより大きな眼表面960を有することができる。
【0146】
図1I及び図1Jは、連結装置975が放射線療法システム990を整列配置するために用いることができるメカニズムを表す。レーザポインタビーム977(幾つかの実施形態において放射線ビームと共線であるレーザポインタビーム977)は、コリメータ開口979を通り放射線療法装置990から照射され、連結装置975の鏡976で反射する。図1Iに示すような機器の整列配置をしない場合において、レーザポインタビーム977は、コリメータ開口979の共線上には跳ね返らないが、軸外、すなち、図示した反射点980に跳ね返る。放射線療法システム990の方位は、反射点980の位置を直接可視化することによって、又は、反射点980の位置を検出して、所定配置にレーザポインタビーム977を導くように放射線療法システム990を調整するセンサーによって、手動又は自動的に調整されることができる。実際に、レーザポインタが整列配置されると(図1J)、レーザポインタ977は反射され、及び、その反射点980が実質的にコリメータ開口979とになる。
【0147】
図1Kは、適所に連結装置975を有する放射線療法システムを示す。治療軸214、即ち、使用される放射線ビームの適用について参照を提供する治療軸214は、放射療法システムのシステム軸211であって、矢印112で示す方向にX線源110を回転するシステム軸211に繋げられ又は配置される。X線源110は、イメージングサブシステム400及び(図1Dにも図示した)対応する軸405と共に又は独立して、システム軸211を中心軸として回転することができる。システム軸211と一致する治療軸214に関して、及び、眼210と係合する連結装置975に関して、放射線ビームの軌道は、患者220の眼210における標的組織に一致するように、放射線ビームを向けるために決定されることができる。治療軸214、システム軸211、連結装置975の位置、及びX線源110の位置の空間の定義は、例えば、放射線ビームの方位及び照射を指示するためなどに使用可能な限定座標フレームを提供する。
【0148】
幾つかの実施形態において、X線源110は、例えば、治療計画システム及び眼の仮想モデルによって定義された1つの移動性焦点の周りを移動することができる。移動性焦点は、プログラムされることができ、又は、眼のあらゆる場所に位置することができ、及び、例えば、黄斑などの固定焦点に対する治療の間に、異なる位置に移動することができる焦点である。幾つかの実施形態において、X線源110は、固定軸又は移動軸の周りを6自由度で動くことができる。幾つかの実施形態において、X線源110は、治療領域及び要求線量の所定程度に依存して、眼の前部又はさらには眼の後部における眼構造を治療するために1つのスポットに固定された状態になる。
【0149】
幾つかの実施形態において、X線源110は、眼21に関する異なる位置に移動することにより、及び、強膜上の実質的に異なる侵入点で強膜を通るX線を伝達することにより、X線を標的に集中させるが、各X線ビームは、実質的に眼の範囲内にある同一の標的に到達する。幾つかの実施形態において、X線源110は、6自由度、5自由度、4自由度、3自由度、又は2自由度によって動かされる。幾つかの実施形態において、X線源110は固定であり、及び、コリメータが動かされ、又は、眼の異なる領域にビームを照射するために、眼若しくは患者が動かされる。幾つかの実施形態において、網膜は、強膜に関する1つの位置にX線ビームを維持することによって治療される。X線源110は、ロボットアーム又は手動でシステムオペレータによって自動的に動かされることができる。X線源110の根本的な三次元位置は、眼モデルと、眼に関するX線ビームの位置を決定するロボットアームと、の間を通信する治療計画により命令されることができる。
【0150】
幾つかの実施形態において、例えば、黄斑変性及び糖尿病性黄斑浮腫の少なくとも一方の網膜疾患を治療するために、X線源110に、小移動だけが要求される。これらの実施形態において、6自由度がX線源110に適用されることができるが、各自由度の範囲は、移動システムが略1000cm3、500cm3、100cm3又は略50のcm3の空間内の移動だけで収まるように制限されるとよい。これら体積範囲内のロボットの速度は、ロボットが0.5cm/s、1cm/s、3cm/s、5cm/sで動けるように、定義されることができる。夫々の微小治療線量は比較的に短く及び小距離に適用されるので、ロボットは、速度及び移動距離をより小サイズのために犠牲にすることができる。
【0151】
幾つかの実施形態において、複数のX線源が用いられ、該複数のX線源は、眼の表面上又は眼内の1つの標的組織に複数のX線ビームを全て集中させて伝達できるように、空間内の異なるポイントに夫々配置される。例えば、放射線システムは、3〜6個のX線源を備えることができ、該複数のX線源の夫々は、異なる軌道を有して配置される。また、各軌道の全ては、眼内の治療領域(例えば、図1Cに示したように、中心窩240)で交差するように構成される。X線ビームの適用は、同時又は連続して実行されることができる。同時操作される複数のX線源による治療では、治療時間を短縮することができ、及び、これにより、治療期間の間に患者が動く可能性を低減する。
【0152】
幾つかの実施形態において、放射線療法を眼の毛様体扁平部領域(図1C参照)に実質的に伝達することが、治療システムの目的の1つである。毛様体扁平部215は、毛様体突起218と網膜280の末梢部(鋸状縁)との間に存在する眼の領域である。眼の毛様体扁平部215領域は、強膜260から網膜280の間にある最少の重要な構造を含む。これは、外科医が眼に薬を噴射できる領域、又は、硝子体切除術を実行するための領域である。このアプローチによって眼構造に対する損傷リスクが減少する。同様に、放射線療法は、放射線を、例えば、水晶体などの構造に損傷を与える可能性を最小にするために、毛様体扁平部領域215を通過して眼の後部に伝達することができ、及び、さらに、視神経275に到達する最小放射線と共に、例えば、中心窩240の後部に到達させることができる。本明細書に記載のイメージガイド(画像誘導)常用電圧療法は、このような特殊な治療を可能にする。
【0153】
幾つかの実施形態において、患者がX線放射の照射による影響を受けない人工水晶体(人工眼内レンズ)を有している場合、放射線療法では、角膜又は人工水晶体を通って、中心軸、眼の視軸を直接通って、又は、角膜を直接通って、網膜に伝達されることができる。幾つかの実施形態において、X線放射による治療は、人工水晶体を埋め込むための治療と同時に、提供されてもよい。
【0154】
続けて図1Cを参照する。眼軸300は、通常、眼軸300によって定義され、及び、角膜255の湾曲中央にある。また、この軸300は、光軸又は治療軸と呼ばれることがある。治療軸は、治療標的に一致するあらゆる軸を含むことができる。視軸306は、中心窩305の中心から瞳孔217の中心を通る線により表される。角度カッパー(κ)213は、視軸306と光軸300とがなす角度で表される。眼軸300は、角膜の中央から後方に網膜280まで一直線に伸びる垂直な直線又は軸によって定義されることができる。また、この記述において、この軸は、治療軸と呼ばれることができる。角膜輪部308は、一般に、角膜が強膜に接する遷移エリア、又は、視覚的に、眼の色素性領域が眼の白領域に接する場所である。毛様体扁平部角α212は、眼軸中心300から測定されることができ、及び、眼軸中心から略10°〜略50°の範囲であり得る。眼の毛様体扁平部215領域は、角度α212で眼の中心線300に関連することができる。幾つかの実施形態において、細密コリメーション(例えば、直径が略6〜8mm未満)及び小半影(例えば、強膜の略10%未満)のX線は、例えば、網膜280の治療対象構造に到達するように、眼の幾つかの重要な構造を避けつつ、軌道250に沿って眼の毛様体扁平部領域215に入る。本明細書に記載の実施形態によっては、X線が実質的に眼の毛様体扁平部領域215だけから入るように、治療の間、眼は、強制的で物理的若しくは機械的な補助を受けて、又は、所定点に患者を固定することによって、安定化させることができる。
【0155】
特定の実施形態において、患者は、眼の軸に対して固定(安定化)される。患者又は装置が動くと、イメージングサブシステム400又はカメラは、その移動を検出し、及び、装置を停止し、又は、装置若しくはコリメータのX線照射領域のシャッターを閉じる。幾つかの実施形態において、X線源110は、治療計画システムによって決定される1以上の位置に応じて、眼のまわりを移動させられ、網膜280に到達するように眼の毛様体扁平部部位215を通過する放射線を伝達する。眼の組織を通過する定義された治療軸及び軌道は、該治療軸と関連するシステムによってX線ビームの放射角度を決定づける。全線量は、強膜の異なる領域にわたって分割されるが、例えば、黄斑又は中心窩など網膜の所望領域に到達させるために、毛様体扁平部215領域を透過する。
【0156】
図1I〜図1Jに示し及び前述したように、鏡976は、後方の放射線療法システム990へレーザポインタビーム977を反射することができる。反射されたレーザポインタビーム977は、レーザポインタビーム977の位置に関するフィードバックを提供することができ、及び放射線療法システム990を抑制又は脱抑制することができるセンサー992を活性化することができる。放射線療法システム990の配置又は誤整列をセンサー992が検出したときが、放射線療法システムに対する抑制又は脱抑制のためのトリガーあってもよい。例えば、実施形態によっては、眼が許容可能な操作方向範囲内にあるときに、レーザポインタ光がセンサー992上へ反射されるように、レーザポインタビーム977が構成されることができる。従って、レーザポインタ光がセンサー992上へ反射されると、センサー992は、反射光を検出し、及び、放射線療法システム990、又は、センサー992若しくはシステム990の処理モジュールに対する入射光の指示を提供する。放射線療法システム990又は処理モジュールは、眼の適切な方向をプログラムされることができ、及び、システム990は、センサー992が反射レーザポインタ光の受信を示したときに、識別する。そして、システムは、放射線ビームを放射することができ、及び、放射線源は、放射線ビームを照射するために電力が供給され、又は、システム上のシャッターは、放射線ビームを眼に照射することを可能にするために開かれることができる。
【0157】
治療過程の間、眼が動くことで、反射レーザポインタ光がセンサー992に入射されなくなると、眼が動いたこと、及び、眼が許容可能な操作方向範囲内にないことの指示がセンサー992によってシステムに通知される。これにより、放射エミッタに対する電力供給が終了され、又は、眼に対する放射線の照射を停止するために、コリメータのシャッターが閉じられる。
【0158】
幾つかの実施形態において、反射光又はレーザポインタ977は、連結装置975、鏡976、及び、光源977を発する放射線療法装置990、との間の配置における角度を示すことができる。図1I及び図1Jは、強膜レンズ(scleral lens)950(図1I)を有する放射線療法装置990及び眼952(図1J)の眼軸又は視軸の実質的な同軸配列を示す。この形態では、反射ビーム977及び入射光978は、レーザポインタを発射する場所であるコリメータ979上に反射ビームとして後方反射980するので、夫々を区別できない。図1Iは、入射光978とその後方に反射する反射977とがコリメータ上で一致しない(979,980)誤整列を示す。配列の状態をモニタするカメラは、入射光978とその反射977が同軸配置されていないときに、システムを停止する信号を出力することができる。
【0159】
放射線療法システム10のヘッドレスト160の部分は、放射線治療システム10に関連して患者の眼210の位置を実質的に固定化するために、患者220の頭を抑えるために用いられる。治療を適用している医師は、X線源110を患者の眼の中心軸300に位置合わせすることができる。レスト160は、治療の間、患者の位置を維持するために構成されることができる。患者がレスト160から離れて動くか又はレストから眼を動かす場合、X線システムは、患者の位置を再調整するために、手動又は自動で(例えば、ゲート制御により)停止されることができる。
【0160】
一般に、患者頭部は、イメージングシステム400及び治療計画システムの少なくとも一方によって眼210が追跡されている間に、ヘッドレスト160により適所に保持され、及び、X線源110は、X線ビームが毛様体扁平部部位215を通過して眼に入るように、移動される。これにより、X線が網膜の標的領域にまで入り込み、該X線が網膜に向かって眼組織を通過するときに重大な損傷を与える可能性を低減する。
【0161】
治療計画システム800(図1B及び図2E)は、システム10に関する治療者インタフェースを提供する。治療方針は、例えば、生体測定モダリティ(biometric modality)、例えば、眼底撮影、又は、光コヒーレンストモグラフィー、CTスキャン、MRIスキャン、及び、超音波モダリティの少なくとも1つを含むことができるイメージングサブシステム400を含む生体測定モダリティの組み合わせを用いて所定事前処理計画に基づいて開発される。これらモダリティからの情報は、個人に特異的な疾患の負担と共に、患者各個人の解剖的パラメータ(生体測定)を含むコンピュータ処理の仮想眼モデルに集積される。あらゆる又は全てのこれらモダリティは、リアルタイムにシステムが利用でき、又は、治療前にシステムに集積されることができる。治療計画は、例えば、放射療法システム10のインタフェースディスプレイ130モジュールに出力される。そして、治療者は、放射線療法システム10を用いる疾患に対して、放射線療法を向けるために、治療計画の仮想モデルを用いることができる。
【0162】
本明細書で使用する「眼モデル」又は「眼のモデル」は、例えば、次のものに限定しないが、前後方向の寸法、横方向の寸法、トランス角膜縁(translimbal)の距離、角膜縁−角膜縁(limbal-limbal)の距離、角膜から水晶体の距離、角膜から網膜の距離、特定の眼構造の粘性、強膜の厚さ、角膜の厚さ、水晶体の厚さ、治療軸に関する視神経の位置、視軸、黄斑、中心窩、新生血管膜、角膜又は網膜の湾曲度、強膜の領域の湾曲、及び、視神経寸法、などの少なくとも1つを含むデータに基づく眼のあらゆる表現に関する。このようなデータは、例えば、超音波、走査レーザ検眼鏡検査、光コヒーレンストモグラフィー、その他の光学的画像、蛍光体(phosphor)画像、スケールのためにレーザポインタと組み合わせた画像、コントラスト有り若しくは無しのCTスキャン、及び、T2、などの少なくも1つ、T1、又は、コントラスト有り若しくは無しの機能的磁気共鳴画像法などのイメージング技術から得ることができる。また、このようなデータは、角膜曲率測定、屈折測定、網膜の神経線維層測定、角膜トポグラフィー、直接カリパス測定などで得ることができる。眼モデルを生成するために用いるデータは、コンピュータを用いて処理及び表示の少なくとも1つを実行されることができる。本明細書で使用する用語「モデリング」は、次のものに限定しないが、モデルを生成することが含まれる。
【0163】
眼モデルは、放射線療法装置の座標系と眼の解剖学的構造を連結する仮想のモデルである。眼モデルは、眼構造のジオメトリに基づくことができ、及び、モデルを発生するために、パラメータデータ並びに数式から導かれることができる。あるいは、眼のジオメトリは、例えば、CTスキャンやMRIなどによる断層画像から導かれる。定義される治療軸及び定義される眼の解剖学的構造と共に、連結装置は、眼表面に接触することができ、及び、眼モデルによって放射線療法装置にリンク(連結)されることができる。そして、放射線療法装置は、眼モデルに基づいて配置される。
【0164】
幾つかの実施形態において、眼のリアルタイム可視化は、放射線ビーム軌道に位置合わせされるレーザを照射することによって利用されることができる。レーザ位置の観測は、放射線ビーム軌道の正確な方位を視覚的に示すために用いられることができる。例えば、放射線ビームの縁が重要な構造を避けるように、角膜輪部から略1mm〜略約4mmで配置されることを要求してもよい。放射線療法装置からのレーザポインタが角膜輪部から1〜4mmのスポットに到達するように、放射線療法眼モデルは、眼の範囲内の構造に関する適切な角度に応じて放射線療法装置を向ける眼の軸性パラメータを用いる。
【0165】
幾つかの実施形態において、レーザポインタは、強膜を通過することが求められポイントに向かって、強膜上に指向される。一旦、レーザポインタが所望の位置に位置付けられると、レーザポインタが強膜の部分に固定されると共に、放射線源が強膜上の所望の位置に対して指向される。そして、放射線源が活性化されて放射線ビームが照射されると、放射線ビームは、所望の位置及び眼の範囲内の標的位置を実質的に通過する。放射線ビームが通過する眼の一部分は、本明細書において横断ゾーン(例えば、図2Dの符号515)、又は交差ゾーンとして呼ばれ得る。
【0166】
治療計画システム800の概要図を示す図1Bの参照を再開する。図1Bには、楕円形状のバックグランドが描かれており、及び、4つのサブシステム間のグローバル相互接続が示されている。治療計画システム800は、治療者により指示された領域及び疾患の少なくとも一方に4つのサブシステムを向ける。4つのサブシステムは、総括して、X線サブシステム700、連結サブシステム500、電動サブシステム600、及び、イメージングサブシステム400を含む。これらのサブシステム又はモジュールは、患者の眼に総合的な治療を提供するために相互に作用する。
【0167】
サブシステムは、治療計画システム800を調整するように機能する。また、治療計画システム(TPS)800は、眼の物質界、システムの物理的構成要素、及び、治療者と治療チームとに相互作用し並びに特定の患者と疾患情報とを含む仮想コンピュータ環境、との間にインタフェースを提供する。主に、連結システム500、及び、第2に、イメージングシステム400が、物質界と仮想世界とのリンク(連結)を補助する。
【0168】
仮想世界の範囲内で、治療計画システムは、医療関係者又はイメージングシステム400により取得された物理的測定値及び生体測定値に基づくコンピュータ処理の仮想患者眼モデル505を生成する。また、仮想世界のコンピュータモデル505(図2D)は、放射線システム524から、横断又は交差ゾーン515を含み得る眼の前部領域を通り、眼への異なる入力角度に基づいて治療される構造体514に向かうX線ビーム520の投射路510をシミュレーションする機能を有する。さらに、モデルは、治療計画の間の処理過程を考慮して、例えば、視神経512などの重要な眼の構造を識別及び含むことができる。さらにまた、仮想世界は、装置524を制御するための治療者インタフェース、物質界又は実際の物理的標的構造に対する装置のインタフェースを含む。治療者からの入力、及び、ビーム角度や療法を案内する所望方向のモデリングが集積された後、仮想世界は、3次元空間の適切な位置にX線装置を動かすため、電動サブシステムに情報を出力する。連結サブシステム500(物質界における連結サブシステム)は、前述したように、1以上のレーザ又は角度検出器を用いて眼表面に対するX線ビームの入射角を決定するメカニズムを含むことができる。
【0169】
幾つかの実施形態において、連結システム500は、眼上又は眼内のスポット(実質上のスポット、反射スポット、基準スポット、又は、放射基準スポット)516を撮像することができるカメラ518を含む。また、カメラは、例えば、瞳孔、角膜、強膜、角膜輪部、虹彩、眼底、視神経、黄斑、又は治療される病変などの構造を視覚化することができる。そして、カメラからの情報は、仮想の眼モデル522、モーションに応じて、及び放射線療法システム524に伝達されるとよい。特定の実施形態において、連結システム500は、眼との物理的接続である。幾つかの実施形態において、連結システム500は、物理的リンクではないが、眼の水晶体と検知システムとの間の通信リンクである。例えば、水晶体は、システム500に対する眼位置を中継(リレー)する通信ビーコンであり得る。幾つかの実施形態において、水晶体は、療法における次のステージを決定し得る標識であって、イメージングカメラ518により撮像される標識を含むことができる。幾つかの実施形態において、これら技術の組み合わせが用いられる。
【0170】
幾つかの実施形態において、眼の位置及びX線源の位置は、常に知られており、及び、これにより、X線の入射角を認識することができる。例えば、眼の中心軸は、治療軸として決定及び定義されることができる。X線源は、中心軸から既知の角度に補正(オフセット)される。前述したように、中心軸又は治療軸は、幾つかの実施形態において、角膜又は角膜輪部の中心に対する垂線であって、及び、該中心の垂線から網膜へ一直線に後方へ伸ばした軸としてみなすことができる。幾つかの実施形態において、連結サブシステムは、角膜から「輝き(glint)」又は反射を検出することができる。輝きと瞳孔の中心との間の関係は、患者又は患者の眼が動かない場合、一定である。患者が動く場合、瞳孔の中心に対する輝きは、同一位置ではない。これが生じたことを検出器は検出することができ、及び、X線装置を停止又はシステムを遮断するために、その信号を仮想世界からX線装置に送信することができる。あるいは、連結システムは、角膜の中心に対する強膜レンズの中心を比較することができる。レンズ及び角膜の双方は、それぞれ輝きを有し、及び、それらの配列は、それらの中心が相互に対して垂直であること確実にする。
【0171】
連結サブシステムから得られる情報は、好ましくは、コンピュータシステム及び仮想眼モデルに送信される。イメージングサブシステム400は、図2Cに示したカメラ1460によりリアルタイムに眼のイメージをキャプチャーして、そのデータを仮想の眼モデルを生成するソフトウェアプログラムに供給する。物質界連結システム500との併用において、眼を通過するX線ビームの予測経路を仮想画像上に生成することができる。治療部位に従って、電動システム及びX線システムの少なくとも一方は、再調整されることができる。例えば、ロボットアームは、TPSが生成し及びイメージングシステム400がキャプチャーした眼のモデルに基づいて、眼上若しくは眼内の所定箇所にX線ビームを照射又は送信するために、X線源110を所定位置に動かすことができる。
【0172】
特定の実施形態において、放射線療法発生システム100は、図1Aの装置の概略図を用いて前述した、X線サブシステム700としての常用電圧(又は低エネルギー)放射線療法発生器を含むことができる。放射線療法生成サブシステム110は、図1Aにおいて、患者220の眼210に向けられる放射線療法ビームを発生する。特定の実施形態において、放射線療法制御モジュール120は、放射線療法生成サブシステム110が発生する有向の(方向を持った)狭放射線療法ビームを放射するエミッタ200を含む。
【0173】
本明細書で使用する用語「エミッタ」は、普通又は通常の意味を有することを意図しており、及び、エミッタは、次のものに限定しないが、コリメータ及びフィルタの少なくとも一方を含み得る様々な構造を含むことができる。幾つかの実施形態において、制御モジュール120は、放射線療法発生サブシステム110から放射されるX線ビームをコリメートするために構成される。
【0174】
X線サブシステム700は、比エネルギー(specific energy)以上のX線だけがフィルタを通過するように、X線管が放射した放射線療法放射線を導くこと及びフィルタにかけることの少なくとも一方を実行することができる。特定の実施形態において、X線サブシステム700は、X線ビームのパターン又は形状を決定するコリメータを含むことができる。線源のフィルタリングは、好ましくは、前述したように、表面−深部(surface-depth)の線量と同様に、X線ビーム内部の低エネルギー量を決定するとよい。幾つかの実施形態において、眼表面における線量の蓄熱を制限するために、略4:1未満の表面対深部(surface-to-depth)の線量を有する常用電圧X線を伝達することが望ましい。幾つかの実施形態において、常用電圧X線を用いるときに、略3:1又は略1.5:1未満で略1:1を越える表面対深部の線量を有することが望ましい。また、表面−深部の線量は、X線管から放出される最大ビームエネルギーを変更することによって変化させることができる。例えば、翼状片などの眼表面上の疾患に対して又は以前の線維柱帯形成術による瘢痕化を治療するために、X線管から放出される最大ビームエネルギーは、例えば、略40keV、略50keV、又は略60keVなどの低エネルギーであるとよい。これらの疾患において、表面対深部の比率は、略30:1、略50:1、又は、略100:1であることが望ましい。従って、放射線療法制御システムは、X線の電力出力、X線のスペクトル、X線ビームのサイズ、及び、X線ビームの半影の1以上を制御することができる。
【0175】
特定の実施形態において、放射線療法システムの電動サブシステム600は、眼210のその他の部位への照射を避ける共に、眼210の標的部位上又は部位内に導いて患者の眼210の特定領域を照射するように、X線源から照射される狭放射線療法ビームを導くX線源及びコリメータを動かすことができる。例えば、網膜などの眼の後部領域の構造体、又は、例えば、小柱網、強膜、角膜、毛様体突起、水晶体、水晶体包、又はシュレム管などの眼の前部領域にある構造体、を標的としてもよい。システム10は、次のものに限定しないが、網膜、強膜、黄斑、視神経、毛様体、水晶体、角膜、シュレム管、脈絡膜、水晶体のカプセル状嚢、及び、結膜などを含む眼のあらゆる部位に放射線療法を伝えることができる。
【0176】
特定の実施形態において、X線サブシステム700は、特定の直径及び形状の狭ビームを生じさせるためにX線をコリメートすることができる。例えば、コリメータを用いる特定の実施形態において、コリメータ出口の直径は、コリメータから放射される放射線療法ビームの直径を調整するために増減されることができる。特定の実施形態において、X線サブシステム700は、略0.1mm〜略6mmの直径を有するビームを放射することができる。特定の実施形態において、X線サブシステム700は、略0.1mm未満の直径を有するビームを放射することができる。特定の実施形態において、X線サブシステム700は、略0.5mm〜略5mmの直径を有するビームを放射することができる。下記に詳述するように、狭ビーム及び仮想モデルは、エネルギーが眼の特定領域に適用され及び眼の他の領域には適用されないことを確実にするために有用である。
【0177】
幾つかの実施形態(図2B−1〜図2B−3)において、放射線制御モジュールは、円形1212又は非円形の1214の形状を有するX線ビームを照射することができる。実施形態によっては、放射線制御モジュールは、長方形(矩形)1214又は正方形の形状を有するX線ビームを放射することができる。幾つかの実施形態において、放射線制御モジュールは、不透明領域1218を中心に有する円形のコリメータ1215から、弧形、楕円形、又はドーナッツ状(環状)構成1217の形状を有するX線ビームを放射することができる。幾つかの実施形態において、コリメータ1215は、正確に整形されたビーム1200を提供するために、例えば、図2B−4に示した円錐形状の開口1232を含むことができる。幾つかの実施形態において、コリメータ1215は、X線が強膜及び網膜に到達するときに、そのX線が鏡面反射ドット構成を有するように、開口(例えば、図2B−4の開口)を複数有する。「マイクロ分割(micro-fractionation)」と呼ばれ得るX線の小斑点構成(speckled configuration)は、網膜及び脈絡膜の正常な血管に少量の放射線を適用するものであるので、改良安全性プロフィールを可能にし得る。
【0178】
特定の実施形態において、放射線療法システム10は、患者の眼の特定解剖学的構造によって方向付けられる狭く有向の治療ビームを用いることによって、眼の特定領域を選択的に照射し、眼のその他の領域には放射があたらないようにすることを可能にする。例えば、放射線療法制御モジュール120は、放射線療法生成モジュール110により発生した放射線療法ビームを患者の黄斑に案内することができると共に、実質的に、水晶体、小柱装置(trabecular apparatus)、及び視神経などの患者の眼のその他の領域に対しては放射線照射を避けることができる。
【0179】
既知の眼の解剖学的構造に基づく放射に関する眼の特定領域を選択的に標的化することによって、及び、放射線システムを治療目的のために解剖学的構造に選択的にリンクすることによって、治療領域のエリア以外は、放射線の潜在的な有害曝露を避けることができる。幾つかの実施形態において、X線ビームは、虹彩270と網膜280との間の強膜260のゾーンである毛様体扁平部領域215を通過して眼に入る軌道250をたどる。この領域にビームを向けることによって、及び、特殊化コリメータを用いてビームの半影又は散乱を抑制することによって、ビームは、眼の構造上に局所化されることができると共に、眼のその他の構造、例えば、角膜255、毛様体及び毛様体線維216及びその他の構造などには最小光子が照射される。
【0180】
特定の実施形態において、放射線治療システム10は、放射線療法ビームの放射を制御するためのシャッターを含むことができる。シャッターは、放射線発生モジュール110が発生する放射を通さない物質を含んで構成されることができる。特定の実施形態において、シャッターは、放射線療法発生モジュール110からのビーム照射を制御するために用いられることができる。特定の実施形態において、シャッターは、放射線療法制御モジュール120からのビーム照射を制御するために用いられることができる。特定の実施形態において、シャッターは、モジュール110、120の何れの内部にも設けられることができると共に、特定の実施形態において、シャッターは、モジュール110、120の何れの外部にも設けられることができる。幾つかの実施形態において、システム10は、X線放射を停止するためにターンオフされ、及び、特定の実施形態において、X線源110は、標的に対するX線放射を抑制若しくは停止するために、ターンオフされるか又はその強度を低減する。特定の実施形態において、シャッター又は開口は、形状又はサイズが変化する。
【0181】
特定の実施形態において、及び前述した図1Aに関して、放射線治療システム10は、1つの角度から放射線療法ビームを伝達することができる。特定の実施形態において、放射線治療システム10は、ビームを治療標的に集中させるために、複数の角度から放射線療法ビームを伝達することができる。複数の角度から放射線療法ビームを伝達することができるシステム10の特定の実施形態は、複数の固定放射線療法案内モジュールを含むことができる。固定放射線療法モジュールは、放射線療法ビームを適切な角度で眼に伝達するために、様々な位置に配置されることができる。例えば、放射線治療システム10の特定の実施形態は、仮想円の外周まわりに等間隔で置かれるという方法で、放射線療法治療システム10に接続される5つの放射線源モジュール−放射案内モジュール対(ペア)を含む。これら実施形態において、電源装置は、様々なX線発生器を切り替えるスイッチング電源装置であり得る。また、複数の角度から放射線療法ビームを伝達することができるシステム10の特定の実施形態は、放射線療法案内モジュールを動かすことを含むことができる。さらに、複数の角度から放射線療法ビームを伝達することができるシステム10の特定の実施形態は、例えば、ロボットなどの電動サブシステム700(図1B)を用いて放射線療法線源を動かすことを含むことができる。
【0182】
本開示の幾つかの実施形態において、常用電圧X線は、X線発生モジュール700から発生される。この常用電圧療法のX線光子は、総括すると、システム10に対して遮蔽又はその他の保護メカニズムを適用し得る必要がないほどの低エネルギー光子である。例えば、診断X線機器は、常用電圧エネルギーを有する光子を放射し、及び、最小の遮蔽を必要とし、通常は、唯一、鉛スクリーンだけが用いられる。重要なことは、常用電圧療法エネルギーが用いられるときに、専用の部屋又は「ボールト(vault)」が要求されないことである。また、診断X線機器は、携帯可能(ポータブル)であり、そして、臨床環境の異なる部屋又は位置に移動可能である。一方、ライナック又はMeVレンジのエネルギーを有するX線を一般的に伝達するLINACSは、高エネルギーX線光子が高透過能力を有するため、装置周囲の隔壁を厚くすることを要求する。高エネルギー光子、LINACSが有する付随物としては、非常な大きな電力、及び、これら高エネルギー光子を発生する機械装置であって、高電圧電源、熱伝達方法、及び、内部遮蔽法及び保護メカニズムを含む機械装置が要求される。この増加する複雑性は、高エネルギー光子を発生させることによる高コストを生じるだけでなく、移動を困難にする非常に重量のある装置となる。特に、前述及び実験的に基づいて説明し、後述するように、MeV光子は、身体内の表在性構造の治療には不要であり、実際には、該MeV光子は、例えば、表在性放射だけが要求されるときに、骨を通り抜け脳まで透過するので、表在性構造に対して多くの不都合を有する。
【0183】
X線サブシステム
【0184】
X線サブシステム700は、X線を発生し、及び、電源装置、コリメータ並びにX線管を含むことができる。特定の好ましい実施形態において、X線サブシステム700は、10keV〜500keVのエネルギー又は、最大800keVのエネルギーを有する常用電圧X線を生じる常用電圧X線発生システム1070を含む。このタイプのX線発生スキームは、タングステン又はその他の重金属標的に対して電子を加速する高圧電源を含む。この電子の衝突によりX線エネルギーを有する電磁エネルギーが発生する。
【0185】
常用電圧又は低エネルギーX線発生器は、通常は、略1keV〜略500keV又は最大略1MeVのレンジのX線を放射する。幾つかの実施形態において、本明細書に記載のシステムは、略25keV〜略100keVレンジの光子エネルギーを有するX線を放射する。低エネルギーX線システムの使用は、外来患者総合施設又はその他の総合施設におけるこれらX放射線治療システムの設置を可能にし、及び、導入のための諸経費及び高エネルギー(MeV又はガンマ)X線システムが要求する初期投資要求は不要である。例えば、AMDなどの眼の疾患の治療において、眼科医は多くの患者を治療することができるので、何百万もの患者を悩ます疾患を治療するときに、非常な重要な構成装置を、眼科医院又は眼科医院に近接して設置することが重要である。装置の作動が放射線腫瘍学センター(radiation oncology center)内に限られる場合、治療可能な患者数は、アクセス、コスト、他の患者との競争、その他の理由から、さらに制限されることになるであろう。
【0186】
幾つかの実施形態における放射線発生モジュールは、X線を発生させるために配置される構成要素から構成される。例えば、電源装置は、電子を発生し及び該電子を陽極(一般的に、タングステン、モリブデン、鉄、銅、ニッケル又は鉛などの重金属から製造される陽極)へ加速させるために適した電流を発生させる。電子がそのような金属に衝突したときに、X線が発生する。
【0187】
X線スペクトルの例示的な一群を図1Fに示す。用語「kVp」は、X線電源装置の最大(ピーク)電圧を指す。これは、一般に、X線源(keV)によって伝達される最大光子エネルギーに一致する。X線が高圧電気によって発生されたとき、様々なX線レベルのX線スペクトラムが得られる。図1Fには、典型的なスペクトルの一群が示されている。最高電圧は、通常は、最大X線光子エネルギーと一致する。例えば、図1Fの80kVpスペクトルは、最大80kVpを有し、図の左方向テールに低エネルギー放射を有する。同様に、60kVpスペクトラムは、最大60keVを有し、図の左方向テールは80kVpスペクトルと同様である。図の全てのスペクトルは、3mm厚のアルミニウムでフィルタにかけられている。フィルタは、スペクトル曲線を形づくる。低波長は、高波長よりもより大きなフィルタにかけられる。未加工スペクトルをフィルタにかけない場合、そのエネルギーを眼の表在性構造(例えば、強膜)が吸収してしまうので、未加工スペクトルにフィルタをかけることは、所定箇所に適用する表在性エネルギーとしてのX線エネルギーをカスタマイズするために重要である。網膜の構造に到達する所定のX線エネルギーと共に眼の前部構造が吸収する最小エネルギーの範囲内において、低エネルギー光子(主として低域フィルタ)よりも大きな高エネルギー光子を含み得る未加工スペクトルのフィルタリングは、システム、フィルタリングを有するシステムにとって重要である。前述したように、幾つかの疾患処理のために、低電圧が低keVピークに一致するように用いられると、眼の前部構造に到達する低エネルギーX線が優位を占めるので望ましい。電源装置の電力調整は、X線のピーク電圧を減少させ、高エネルギー光子の量を制限し得る。幾つかの実施形態において、不等分割フィルタ(non-uniform filter)が用いられると好ましい場合があり得る。例えば、フィルタは、1つの治療領域のX線スペクトルの相違を変化させることを収容するためにそれ全体の厚さを変化させることを有してもよい。例えば、フィルタは、1つの治療領域におけるX線スペクトルを複数の異なるX線スペクトルに変化させるために、X線が通過するフィルタ厚を変化することができる。
【0188】
図1Aに示す電源装置150は、放射モジュールに電力を供給する。電源装置150は、所定の電流を必要とするX線を発射するために定格化される。例えば、80KeVpのX線が10mAで線源から発射される場合、電力要求は、800W(80kV×0.01A)である。電源装置とX線源との接続には、高電圧から環境を保護及び遮蔽する高圧ケーブルが用いられる。ケーブルは可撓性であり、及び、幾つかの実施形態では、電源装置は移動(モバイル)機能を有する。幾つかの実施形態において、電源装置は、オイルジャケット又は水ジャケット、及び、フィンやファンによる対流冷却により冷却される。冷却流体は、装置を通って移動し、及び、システム10外部のリザーバーで冷却されることができる。
【0189】
電動サブシステム
【0190】
図2A及び図12Aは、図1Bに示した治療システム1000の電動サブシステム600の一実施形態を示す。このサブシステムは、眼の解剖学的構造及び治療される疾患に関するX線ビームの方向及びサイズを制御するので、治療システムの有用な構成要素である。概括的に言えば、電動サブシステムは、患者の生体測定データから生成される個人用の眼モデルによって、グローバル座標系1150の空間に向けられる。モデルからのデータは、眼上又は眼内の標的にX線ビームを向けるために治療計画システムを通じて電動サブシステム600に伝達される。
【0191】
特定の実施形態において、システムは、X線源及びコリメータの少なくとも一方を動かすために、コリメーションシステム3315、シャッターシステム及び電気機械作動システムを含むことができる。図2A及び12Aを参照すると、常用電圧X線源又は常用電圧X線管1070、3325が示されている。コリメータ1030、1040、1052、3315は、X線光子の小コリメートビーム1062を生じるために較正される。好ましい眼病用の実施形態において、細密コリメートビーム1062は、横断面積が略1mm2〜略20mm2の円形又は他の形状であり、直径が略0.5mm〜略6.0mmである。複数のコリメータは、半影率の改善、小半影、特定構造の非常に微細なX線の適用を可能にする。図2B−1〜図2B−3は、様々なコリメータ構成が示された種々のコリメータ設計の実施形態を示す。例えば、図2B−3は、ドーナッツ状又は環状のX線形状を発生するコリメータ構成を示す。図2B−4は、半影を制限又は実質的に均一な放射線ビームを形成するノズル形状又は円錐形状1232を有したコリメータ構成を示す。その他の断面形状としては、例えば、同心円状の輪、楕円、円、多角形、及びクレセントを含むことができる。フィルタ1010、1020と連動して作動するコリメータは、好ましくは、実質的に平行構成を有するビーム1062としてコリメータから放出されるX線を生じるとよい。
【0192】
特定の実施形態において、電動システム3300は、所定位置範囲3335の放射線量で眼を治療するためにカスタマイズされる。位置範囲3335は、眼及び治療容積が小さいことに対応して制限され、及び、線源は、治療領域に相対的に近接させて配置される。X線管3325は、眼のジオメトリ及びシステムの他の構成要素により決定されるが、治療プログラムの全体にわたって、略1cm3〜略5cm3の容積範囲内を動くことができる。また、X線管のサイズ及びエネルギーにより決まる、この体積内での移動時間は、数分の期間にわたって生じることができる。この数分は、電動システム及びテーブルトップ位置決めシステムを考慮した電動システム3300の駆動に要求されるモータサイズの制限を受ける。位置決めシステムの制限された移動は、相対的にチューブを拘束して及びその移動をさせずにシステムを単純化できるので、冷却チューブ3345と、電源装置3320に通じる電源装置チューブ3322と、の構成を可能にする。眼を治療するためにシステムがカスタマイズされるので、X線発生システムの多くの構成要素は、例えば、ライナックより小型である。眼に対するカスタム化は、より多くの場所における配置及び治療者の利便性に関する限り、システムにより多くの柔軟性をもたらす。
【0193】
電動サブシステム又は制御システム600は、図1Bにおいて、相互作用し、グローバル治療計画システム800の指示を受ける。電動サブシステム600は、治療計画システム800からコマンドを受信する。治療計画システム800は、X線装置をオンにしている時間長、眼モデル又は治療計画システムからのデータを利用する眼標的に対するX線ビームの方向、コリメータサイズ、及び、治療線量などのコマンドの1つを命令することができる。眼標的1300及び制御システム600は、連結システムの基礎であるグローバル座標空間1150において、リンクされることができる。治療計画システム800は、グローバル座標システム1150を用いて療法することを命令する。X線制御システム600は、眼標的に関するX線ビームの方向及び位置を命令し、及び、治療計画システム800からのコマンドの結果に基づいて、X線源を所望位置に移動させる。
【0194】
幾つかの実施形態において、コリメータ及びX線源の少なくとも一方は、手動又は自動的に1以上の自由度で眼の眼球まわりの多数の位置にビームを移動させ得る移動ホイール又はシャフト(1100,1110,1120)に設置されることができる。幾つかの実施形態において、X線源1070は、例えば、ロボット又は自動化位置決めシステム3300によって、1以上の自由度で移動可能である。ロボットは、例えば、デカルト座標系1150や極座標系などのグローバル座標系に対して、X線源を動かす。座標系の基点は、都合のよい物理的空間のあらゆる場所であり得る。幾つかの実施形態において、X線源は、4自由度、5自由度、又は6自由度で移動可能である。また、幾つかの実施形態において、ロボットは、例えば、コリメータなどのX線制御システムのあらゆる他の構成要素を移動させるために利用される。幾つかの実施形態において、コリメータは、コリメータが備える電気機械システムにより制御される。
【0195】
また、電動サブシステムは、例えば、患者が装置から離れた場合など必要に応じて、ビームのオンオフを瞬時に切り替える1以上のシャッターを含むことができる。X線源1070及びコリメータの少なくとも一方は、電気機械作動システム(1100、1110、1120)を通じて、空間におけるあらゆる軸を動くことができる。
【0196】
X線連結サブシステム500は、包括的な治療計画システム800の下でX線発生サブシステム700と一体化する。本明細書に記載の複数の目的を達成できる少なくとも1つのレーザポインタ又はその他の相対的なコリメート光源(例えば、発散が小角度である発光ダイオード)1060(図2Cの符号1410)を、図2A、及びより詳細には図2Cに示す。幾つかの実施形他において、レーザポインタ1060は、X線ビームが伝達される場所の視覚的マーカーとなるように、レーザビームの中心軌跡とX線ビーム1062の中心軌跡とがほぼ一致するように、コリメートX線ビーム1062の方向と結びつく。X線は可視光ではないので、レーザポインタは、放射線療法システムの他の構成要素と関連してX線ビームの方向を識別するために用いられる。X線ビームの中心が向けられる場合には、レーザビームの中心も、これに対応して図2Cに示すように同様に向けられている。
【0197】
放射線療法連結システム
【0198】
本開示の第3の主要なサブシステムは、連結サブシステム又はモジュール500である。概括的に言えば、連結モジュール500は、眼の位置に対してX線ビーム位置の方向を調整する。図2A〜図2Dを用いて前述したように、幾つかの実施形態は、X線ビームと共線であるレーザポインタ1060(必要があれば1以上のレーザポインタ)を含む。レーザポインタ(又は複数のレーザポインタ)は、X線が衝突する強膜又はその他の表面に対するレーザビーム1500(図3A)の入射角を検出することができる。入射角1510、1520は、強膜又は他の表面上の2つの直交照射角(θ,φ)によって定義されることができる。1以上のレーザポインタ1060の中心軌跡は、好ましくは、強膜又は他の表面に衝突するX線ビームの中心軌跡と一致するとよい。
【0199】
また、詳細に後述するように、レーザポインタは、眼がカメラ1550により画像化及びデジタル化され、又はイメージングサブシステムで追跡されたときに、眼1600の表面に視覚的マーク(図3A)1570を提供するイメージングサブシステムの重要な目的のために用いられる。デジタル化画像上の視覚的マーク1570及びレーザビーム1500の入射角1510,1520、コンピュータが生成したX線(又はレーザ)の投射1700,1730(図3B)は、コンピュータ生成(仮想)網膜1720上に形成されことができる。幾つかの実施形態において、投射1700、1730は同一であり、及び、実施形態によっては、投射は異なってもよい。例えば、幾つかの実施例において、眼外部の投射1700は、眼内の投射1730とは異なる特性(例えば、軌道、半影、その他の特性)を有することができる。
【0200】
コンピュータ生成仮想網膜1720(図3B)は、さらに詳細に後述するが、仮想の眼モデルの構成要素であり、及び、例えば、OCT、CTスキャン、MRI、Aスキャン(A-scan)若しくはBスキャン(B-scan)、超音波、これらの組み合わせ、又は、例えば、眼底検査及びスキャニングレーザ検眼鏡検査の少なくとも一方によるその他の眼の画像化などのイメージングシステムから出力される実データを通じて得られる。網膜1720に加えて、眼の範囲内のあらゆる構造にX線を伝達することを、仮想眼モデル1725で表示することができる。
【0201】
図3Aに示すように、レーザビーム1500は、スクリーン1590上のマーク1570として示される。スクリーン1590は、カメラが捉えたイメージ描写であり、そして、治療計画システム800でデジタル化された形態である。角度θ1520、角度φ1510、及び、眼1600のデジタル化画像上におけるレーザポインタのマーク1570の位置により、「仮想の眼」1725を通る経路1730が、コンピュータシステム1710(図3B)で決定されることができる。位置が正確でない場合、標的ポイント及びレーザ/X線の位置を再調整するために、信号が電動モジュールに返信されることができる。
【0202】
特定の実施形態において、第2のカメラは、レーザポインタ及びX線ビームの角度を検出するために用いられることができる。これらの角度は、X線ビームの方向を検出して、及び、再位置決めのために信号を電動システムに送信するために用いられることができる。このフィードバックシステムは、眼に対するX線照射の投射を補正するのと同様に、電動サブシステムの正確な位置決めを確実にすることができる。
【0203】
幾つかの実施形態において、眼の位置を検出するために、アナログシステムが用いられる。このような実施形態において、標的構造(眼)はその位置が推定され、及び、X線制御システムがX線源を眼の眼球周りに位置させ、そして、眼構造に対して所定量の放射線を適用する。
【0204】
特定の実施形態において、図1Eに示すように、眼に対する物理的接続は、眼と放射線療法システムとの間の直接連結に用いられる。このような実施形態において、眼とシステムとの間の接続は、例えば、強膜コンタクトレンズ935などのレンズを媒介にすることができる。そして、レンズ935とシステム10との間の物理的リンクは、放射線療法システム10と直接リンクする構造175により提供される。強膜レンズ935は、ソフトレンズ又はハードレンズであり得る。レンズ935は、治療の間に眼を安定化(固定化)させるために、強膜に適用可能な1以上の吸引接続をさらに含むことができる。
【0205】
強膜レンズ935及び強膜レンズ935と協働するアタッチメントは、空間における眼を所定箇所に局限するために用いられることができる。強膜の位置がレンズにより認識されると、同様に眼の位置も認識される。そして、眼は、放射線療法装置10に連結される。幾つかの実施形態において、コンタクトレンズと放射線療法装置10との間の接続は、非機械的接続である。該接続は、例えば、レーザポインタや、放射線療法に対する眼の現実の位置を検出する1以上のカメラなどの光学的な接続である。物理的空間における眼の位置は、仮想眼モデルにおけるビーム位置をシミュレートするために用いられ、そして、そのシミュレート結果が、所望のビーム方向、角度、位置、治療時間、その他を伝えるために、X線システムを配置する物質界に戻される。
【0206】
幾つかの実施形態、例えば、図2Gを参照すると、ラジオサージェリ装置2745に対するアライメント(心合わせ)システムの概略図が示されている。記載されている治療軸2735は、システムから、眼のインタフェース(例えば、強膜レンズ)を通り、眼2720の後極に至る垂直な直線により表されている。カメラ2740は、眼の前部における領域、又は、レーザポインタ2765の出口領域を画像化することができる。黄斑レンズ及びガイド2730は、ラジオサージェリシステム上にレーザポインタビームを反射できる鏡を含むことができる。該反射は、カメラ2740が検出可能である。ラジオサージェリシステムと鏡とが直角をなすと、全体のシステムが、(図1I及び図1Jを用いて上述したように)治療軸2735に沿って一直線に整列配置されたことになる。また、同様に、このようなアライメントシステムは、誤整列又は患者/眼の移動に対する放射線療法システムのゲートを開閉するために用いられることができる。例えば、鏡からの反射は、センサーと通信することができる。反射ビームとセンサーとの間の直通通信がない場合、放射線療法システムは、ゲートを閉じることができる。
【0207】
幾つかの実施形他において、眼内の治療構造に伝達されるX線ビームの散乱線量を知ることが望ましい。例えば、強膜を通過するビームにより網膜の新生血管が治療されるときに、レンズ又は神経系に対する散乱がモデル化されるとよい。幾つかの実施形態において、このモデル化は、網膜(治療される1次構造)上の新生血管膜に対する線量を知るためにも要求されることができる。
【0208】
イメージングサブシステム
【0209】
本開示に記載の各実施形態の有利なその他の特長はイメージングサブシステム400である。該イメージングサブシステム400は、眼のトラッキングシステム(図4)として機能することができ、及び、患者の動き又は眼の移動をその他の前述したサブシステムに連結する機能を提供することができる。このサブシステム400は、患者の眼2010が治療領域2060から大幅に動かないようにすることを有利にも確実にする。カメラ2055は、図3Aのカメラ1550と同一であることができる。カメラ2055は、スクリーン2050にイメージを伝える。また、撮像されたレーザスポット2052も、スクリーン2050上に示される。ビデオスクリーン2050は、図3Bのビデオスクリーン1710と同一であることができる。図4のフィールド2060は、眼が動くことができるゾーンである。眼2010がスクリーン上のゾーン2060外に動く場合、放射線源は、停止若しくはシャッターを閉じ、さもなければ、眼2010から離れる。幾つかの実施形態において、眼2030のイメージが領域2060外に移動した眼2010として反映されると、シャッターオフに切り替えるために、信号2090がX線制御システム(図2A)に送信される。眼を治療領域内で動かないようにすることを確実にする意外に、イメージングサブシステムは、コンピュータ生成仮想眼に戻るレーザポインタ/X線ビーム2052の投影を可能にすることによりその他のサブシステムと連結する。
【0210】
幾つかの実施形態において、イメージングサブシステムは、空間における眼の3Dレンダリングを生成するために用いられる2以上のカメラを含んで構成される。3Dレンダリングは、総合的な治療スキームと一体化される。
【0211】
治療計画システム
【0212】
治療計画システム800は、一部分において、仮想システムであり、及び、相互関係にある全モジュールを統合した図1Bに示されており、さらに、ヘルスケアプロバイダに対してインタフェースを提供する。計画システム800は、システム10の「脳」であり、及び、療法を処方する治療者と患者に療法を伝えることとの間にインタフェースを提供する。治療計画システムは、解剖学的に、生体測定で、及び、幾つかの場合においては、眼についての幾何学的な仮定から、患者及び疾患並びにシステムについての情報を有する「仮想眼モデル」を集積化する。情報は、好ましくは、眼の特定領域に対して特定の放射線量を適用するように放射線源を指示できる治療計画に組み込まれるとよく、線量は、治療計画システム800に入力され、及び、治療計画システム800から出力される。治療計画システム800の特定の実施形態において、放射治療は、異常組織又は別途に治療される組織以外の組織を修復するために、数日、数週間、数ヶ月の期間にわたって細分化されてもよい。治療計画システム800は、治療者が治療及び線量領域をマップすることができ、及び、各患者に対する治療を調整することができる。
【0213】
図2Eを参照する。治療計画システム800は、ラジオサージェリシステム10を用いる治療方法を中心に形成される。特定の実施形態において、システム10のイメージングモジュール400は、眼の登録及びイメージングシステム810を含む。特定の実施形態において、眼−トラッキングシステムは、治療計画システム800用に、例えば、眼球運動などの患者の動きを追跡するように構成される。眼−トラッキングシステム810は、治療者入力を経て患者の眼の3次元イメージを計算することができ、及び、患者の眼の移動をリアルタイムにトラッキングすることを含むことができる。眼−トラッキングシステムは、前述したように、眼に関する多くの病状に対して放射線治療計画を決定するための要因となるデータを取得する。例えば、眼−トラッキングシステムは、その取得データを用いて、患者の眼の後部領域イメージを生成することができる。特定の実施形態において、データは、放射線治療システム10の処理モジュール140のために、有線通信又はその他の手段(例えば、無線手段)を経て伝達されることができる。特定の実施形態において、処理モジュール140は、患者の眼上のデータを処理することができ、及び、インタフェースディスプレイ130上に患者の眼のイメージを表示することができる。特定の実施形態において、インタフェースディスプレイ130は、眼の動きを含む、患者の眼のリアルタイムイメージを表示することができる。
【0214】
特定の実施形態において、眼−トラッキングシステムは、患者の眼上のデータを取得すると共に、患者の顔は、イメージングモジュール400の方向において、患者の眼が実質的に前方に面するように、関節のあるヘッドレスト160により真っ直ぐに配置及び固定される。特定の実施形態において、眼−トラッキングシステムは、ジョイスティックの使用により調整可能なアライメントシステムを含むことができる。ジョイスティックは、イメージングモジュール400によってインタフェースディスプレイ130に表示されるイメージの位置及び形の少なくとも一方を調整するために、固定台上で、水平に、垂直に、又は、水平並びに垂直の両方に、傾けられることができる。
【0215】
本開示のその他の特長は、治療のための総合計画である。装置の大きさ及び特定の解剖学的構造を治療する装置の制限は、スケールメリットを可能にする治療計画システムの範囲を制限する。X線ビームは、眼の標的領域に対して選択的に放射線を適用し、及び、眼のその他の領域には有害な高X線量の放射線を適用しないように、集光されるとよい。しかし、実施形態によっては、眼は、治療を受ける解剖的部位だけである。特定の実施形態において、網膜は、眼の治療システムの標的である。1以上のビームは、強膜を通過して、網膜の所定部位を目指す。治療計画の目的のために、システムの出力ビームに関して眼及び網膜の3次元位置を認識することは好ましい。治療計画システムは、詳細画像及び眼のジオメトリの再現を組み入れた後、標的方向の出力ビームポイントへX線出力を操作するために、X線システムを向ける。幾つかの実施形態において、X線システムは、自動的に向けられ及び動かされる。
【0216】
治療計画システム800は、例えば、光コヒーレンストモグラフィー(OCT)、超音波イメージングシステム、CTスキャン、MRI、PET、細隙灯顕微鏡検査、直接可視化、アナログ又はデジタル写真などのイメージングシステム(これらをまとめてバイオメトリー測定部820と呼ぶ)を利用することができ、又は、該イメージングシステムと連結されることができる。幾つかの実施形態において、このようなシステムは、眼の位置及び生じ得る状態を更新する第2システムが2つあるように、放射線療法装置と共にリアルタイムフィードバックシステムに組み込まれる。比較的高度であるが、システム800は、眼の領域に限定されることができ、及び、これにより、眼に対して特定イメージング装置だけを利用する。
【0217】
幾つかの実施形態において、治療計画システムは、患者の頭部全体の軟組織及び骨構造を組み入れる。モデルは、妨害解剖学的構造を治療から除外し得るように、全解剖学的構造を組み入れる。例えば、治療計画は、眼に関する放射線療法ビームの方向性を指示するために、鼻、前頭部、及び、関連する皮膚並びに軟骨を組み入れる。幾つかの実施形態において、これらの構造は、グローバル座標系、トラッキングの補助、及び、眼の治療領域などに関連する。
【0218】
幾つかの実施形態において、治療計画システムは、リアルタイムX線線量が眼構造に伝達され得るように、モンテカルロ(MC)シミュレーションなどの物理的モデリング技術を治療計画に組み入れる。このような実施形態において、治療計画システム800に対する入力は、治療計画を設計するモンテカルロシミュレーションに集積され、計画の有効性や、治療上の有毒性及び潜在的な毒性の双方がリアルタイムにシミュレートされ得る。幾つかの実施形態において、幾何学的光線トラッキングモデルは、従来のモンテカルロシミュレーションに基づく推定値を利用する。従来のモンテカルロに関する光線トラッキングモデルは、線量測定の迅速化及びリアルタイムシミュレーションを支持する。
【0219】
図2Eに示す方法は、次の通りである。例えば、構造及び線量などのバイオメトリー測定値820及び使用者制御部875は、治療計画システム800に入力される。その他の入力としては、眼登録及びイメージングシステム810からの情報が含まれる。治療計画システム800の出力は、X線源830をオンタイム及びオフタイム(線量制御)で向けると共に、線源を動かし及び位置させるために、X線源及び電動サブシステムに送信するコマンドなどで構成される。幾つかの実施形態において、最大ビームエネルギーは、特定の疾患に対する線量及び計画を生成するために、治療計画システムにより設定される。線量840が伝達された後、治療計画システム800は、追加線量840を伝達するために、X線源移動部にシグナルを出力する。このサイクルは、治療が完了するまで数回繰り返すことができる。
【0220】
図2Fは、基準座標系940の範囲内で、眼モデルを生成し、その後に、眼に対して放射線療法装置を整列配置するために、バイオメトリー測定部910を用いる実施形態を示す。幾つかの実施形態において、Aスキャン超音波910は、例えば、眼軸長、前眼房深さ及び角膜厚さなどの生体測定データを取得するために使用される。これらのデータは、例えば、白−白距離(white-white distance)及び角膜厚さの少なくとも一方の測定パラメータと組み合わされることができ、及び、データをパラメータ化し、及び該パラメータ化データを基準座標系940に配置するコンピュータ化モデル920に入力されることができる。このステップの後に、ロボットが、眼と同一の基準座標系930の範囲内に配置される。
【0221】
図2Gは、ラジオサージェリ装置2745を整列配置するための配置2700を示す。整列配置の目標は、ラジオサージェリ装置2745の出力、及び、オプションとして、治療軸2735若しくはその他で定義された眼の軸を有するレーザポインタ2765、を整列配置することである。装置2745が治療軸に整列配置されると、装置2745は、眼の後極2720に略整列配置される。眼の後極は、略黄斑の位置である。幾つかの実施形態において、コリメータアセンブリは、集束放射が治療軸2735から伸長して後極2720及び黄斑へ入り後極2720の全体に適用されるように、作成される。カメラ2740は、ラジオサージェリ装置とレーザポインティング装置との併用位置の検査及び維持の少なくとも一方を実行するために用いられる。カメラは、その検証の基礎を、眼接触装置2730におくことができ、又は、単に眼上の可視構造イメージングに基づくことができる。
【0222】
幾つかの実施形態において、カメラ2740がレーザポインタ位置を検出し、及び、標的上のそのポインタ位置に基づいて、位置検査に用いられる新たなレーザポインタ位置に関する代替位置にラジオサージェリ装置が移動される。
【0223】
幾つかの実施形態において、患者固定(図2Hに示す患者固定)は、視軸2790にラジオサージェリ装置を整列配置するために利用される。オブジェクトと網膜との間に位置する線は、本明細書に記載の放射線療法システムが治療のために設定する領域である中心窩に向けられる(黄斑中心に配置される)。幾つかの実施形態において、視軸を識別することができ、及び、該軸2790に装置を整列配置できるように、患者はオブジェクトに固定されることが要求される。患者は視線固定点2770に眼を固定する。該視線固定点は、幾つかの実施形態において、円形の標的である。線は、オブジェクトと瞳孔2780中心との間に引かれ、眼の後極方向に投射されたときに、黄斑又は中心窩2760と交差する。一実施形態において、視線固定点2770は、瞳孔中心2780を経て網膜に対する円の中心を通る線が視軸と一致するような円の中心である。レンズ2772は、視線固定点2770から放射線が分岐しないように、視線固定点2770からの光をコリメート又は整列配置するために用いられ、及び、視線固定点2770の中央領域は、視軸の出発点として用いられることができる。そして、視軸2790は、当然に、他の実施形態における眼軸の代わりに、この実施形態での治療軸となる。一旦この線が空間において定義されると、放射線療法装置は、この仮想線を中心にして回転することができ、標的組織(中心窩として示す標的組織)に放射線ビーム2750を伝達する。放射線療法装置からのビーム2750は、黄斑2760に到達するが、角膜2785、水晶体2777及び視神経2775を避けるための正確な角度に設定されることができる。
【0224】
例えば、単一ビームを所望の放射量で伝達する場合、治療計画システムは、特定の解剖学的構造と関連してX線ビームの方向を決定し、X線源をターンオンする。標的に線量蓄積を生じさせるために2つのビームが要求される場合、治療計画システムは、ビームサイズ、標的に対するビーム角度、及び、特定患者の解剖学的構造を決定し、そして、第1角度で眼に対して第1ビームを適用し、及び、標的に関する第2角度で第2ビームを適用する。3つのビーム、4つのビーム、5つのビーム、及び、6つのビームの夫々に対して同一の方法が用いられる。
【0225】
モンテカルロシミュレーション及び実験検証
【0226】
モンテカルロ(MC)シミュレーションは、X線が影響を与える構造体に対して、X線の吸収、散乱、及び、照射をモデル化するために用いられる。モンテカルロ法は、様々な物理的及び数学的体系の挙動をシミュレーションし、及び、その他の計算のための計算アルゴリズムのクラスに広く用いられる。モンテカルロ法は、幾つかの方法において非決定論的であり、確率論的なその他のシミュレーション法(例えば有限要素モデリング)から区別される。モンテカルロシミュレーションは、全治療計画システムに不可欠な要素を形成し、及び、放射線に関する治療計画を補助するために用いられる。また、モンテカルロシミュレーションは、放射線療法システム10の実施可能性並びにその他の要素を予測及び命令するために用いられることができる(例えば、コリメータ及び治療計画スキームの最適化)。例えば、コリメーション設計、エネルギーレベル及びフィルタリング療法は、モンテカルロシミュレーションを用いて予測されることができる。モンテカルロシミュレーションにより予測される設計は、実験的に検証及び微調整されなければならない。MCシミュレーションは、初期使用を予測することができる。解剖学的構造、ビームエネルギー及び治療量が類似する放射線療法の幾つかの実施形態において、モンテカルロシミュレーションが、一度だけ実行され、経路変数(path variable)(例えば、光線トラッキング又はその他の幾何学的方法論による経路変数)を変更する。この場合、モンテカルロシミュレーションに戻る必要はない。
【0227】
幾つかの実施形態において、MCシミュレーションは、治療計画システムに組み込まれ、及び、その他の実施例において、MCシミュレーションは、治療計画システム800が用いるアルゴリズムに対して命令を出力する。MCシミュレーションは、治療の境界を生成するために、多くの場合、治療計画システムの最終過程において用いられる。例えば、MCシミュレーションは、X線ビームの半影を予測することができる。X線ビームの半影は、X線ビームを向け及び水晶体、視神経、その他についてのX線ビームに対する境界制限を設定するために、仮想世界で用いられる。
【0228】
幾つかの実施形態において、加齢黄斑変性症(AMD)は、X線発生システムにより治療される疾患である。幾つかの実施形態において、X線システム10は、例えば、レーザ光凝固術、及び、レーザ線維柱帯切開術若しくはレーザ線維柱帯切除術などの治療における手術後の瘢痕化を治療するために用いられる。幾つかの実施形態において、X線システムは、翼状片、眼の腫瘍又は前癌状態の病変(例えば、血管腫や母斑)を治療するために用いられる。重要なことは、X線治療システムが、幾つかの部位を選択的に照射できる一方、他の部位には照射をしないことが可能である点にある。幾つかの実施形態において、放射線は、異常組織又は別途に治療される組織以外の組織を修復するために、数日、数週間、数ヶ月の期間にわたって細分化される。
【0229】
1)図1の縮尺上の装置により臨床的関連時間周期でAMDを治療するために、低エネルギー放射が網膜に伝達されることができることの検証、2)臨床的関連距離からの検証、及び、3)X線管の初期設計仕様に対する治療システムの幾つかのパラメータを最適化すること、のために、MCシミュレーションが実行される。
【0230】
眼のジオメトリが得られ、及び、図5に示す2次元仮想モデル、次に、3次元仮想モデルが生成される。軟組織及び硬組織(例えば、骨2065)は、図5のモデルに組み込まれている。軸2082は、眼軸であり、また、眼の光軸と呼ばれる。図6は、仮想眼の光軸に対する異なるビーム角度(2100、2110、2120、2130、2140)を示している。仮想眼は、この実施形態においてAMDを治療するために黄斑領域に療法をシミュレートするこのシステムでモデル化される。このシミュレーションにおいて、ビームの夫々は、眼中心軸2082からの異なる角度で眼に入射される。この例では、眼軸は、眼の治療軸とみなされる。ビームの夫々は、異なる経路で眼を通り、及び、眼を通る異なる経路に従って、例えば、黄斑2094、視神経2085、水晶体2075、強膜2076、角膜2080及び中心窩2092などの様々な構造に影響を及ぼす。このモデリングは、放射線療法装置が伝達する放射角度を決定するために用いられ、及び、治療計画アルゴリズムに組み込まれる。例えば、図6において、ビーム2120は、眼の眼軸を一直線に通って眼に入り、及び、ビーム2100は、毛様体扁平部から入る。一連のX線エネルギーは、略40keV〜略80keVまでのエネルギー範囲を用いてモデル化される。提案されたコリメーションスキームは、一連の異なるフィルタ(略1mm〜略3mm厚のアルミニウム(Al)のフィルタ)であるときに、近接平行ビームを生成するために用いられる。ビームの入射角、ビームの光子エネルギー及びビームの濾過の組み合わせは、様々な構造に堆積するエネルギー相対量を全て考慮に入れる。
【0231】
図7A〜図7Eは、X線ビームが、例えば、水晶体2260や視神経2085などのその他構造体に対して最小の散乱で強膜2200を通り網膜2250を実際に透過することができることを示す略80keVエネルギーのMCシミュレーションによる幾つかの結果を示す。密なドット表示は、MCシミュレーションにおける実際のX線光子を示す。例えば、特定のビーム角度(図7A)における水晶体上の光子の相対的な少なさは、水晶体レベルでの光子吸収が乏しいことを示す。これらのシミュレーションは、0.8mm幅の低エネルギーX線ビームが、中心軸から離れた所定角度で、実質的に眼の前部の重要な構造を避け得ることを表している。このモデリングは、治療される各患者及び疾患に対する治療計画に組み込まれる。
【0232】
図7F(上図)は、毛様体扁平部の領域から眼に入る一連のビームのシミュレーション結果を示す。これらの角度は、眼を反時計回りするようなクロック角度(clock angle)(符号a〜h)であり、及び、眼を通るそれらの透過は、眼の前部構造に影響を及ぼすだけでなく、眼とは異なる後方の非対称構造(例えば、神経)にも影響を及ぼす場合がある。このシミュレーションは、標的領域に対する線量を最大にすると共に視神経に対する線量は最小にする方法を計画するためのものであり、及び、ジオメトリを変化させて各々の患者に対して実行することができる。幾つかの実施形態において、シミュレーションは、毛様体扁平部を通る眼の方向にビームを向けることにより、鼻側−側頭側、及び、尾側−頭側の様々な位置に対応する様々な時計文字盤上の入射角(図7Fの符号a〜h)から、実行される。幾つかの実施形態において、これらのビームは、横断面(例えば、横断面直径)が略2mm〜略5mmの間であり、及び、略60keV〜略150keVの間のエネルギーを有する(図11H参照)。図7Fに示すビームe,f,g,h,a、即ち、下方から上方へ向かうビーム及び鼻側から側頭側へ向かうビームの少なくとも一方は、視神経2085及び水晶体2260に関する最も最適なプロフィールを有する。
【0233】
幾つかの実施形態において、特定の角度又は方向は、治療の間に避けることが好ましい特定の構造に対応して識別される。従って、これらの構造に対応する角度は、治療の間、X線の軌道には用いられないので、視神経を避けることができるようになる。例えば、実施形態によっては、角度b(図7F)は、視神経2085を通過するX線軌道に対応し得る。これらの実施形態において、角度bは、視神経をX線にさらす可能性を低減するために用いられてはならない。角度は、治療計画を最適化し、及び、放射線に影響される構造が存在する場合には可能な限りリスクを低減するものが使用され得る。図7Fは、8個の軌道角を示す。幾つかの実施形態において、X線軌道は、8個未満又は8個を超える複数の軌道角を含むことができる。例えば、実施形態によっては、4個の軌道角、6個の軌道角、10個又は12個の軌道角が提示される。これらの実施形態において、最適ビーム方向は、鼻側方向から入るように考慮されるビーム(例えば、b,a,h,g,f)により提供される。強膜上のビーム入射角及び該ビームの網膜に対する伝達は、治療計画により選択され、及び、標的構造に対して放射線療法を最適化するために治療計画システムにより用いられる。
【0234】
図7Fの下図は、上図において、角度がつけられたビームのうち、その1つの網膜上の線量を示す。このようなビームに対する予測された等線量減衰(isodose fall-off)は、等線量領域を100%超えるが10%未満である略1mm〜略2mmビームで略0.05mm〜略0.1mmの範囲内において略90%を超える。高線量領域2290は、ビームがある角度で眼に入ることから生じる。線量の増加は、全体領域の平均よりも略10%〜20%程度である。さらに、複数のビームが眼に入るので、増加線量2290の面積は網膜の領域を超えて平均する。従って、高線量領域は、不均等分布を説明するために治療方針に組み込まれる。
【0235】
図8は、図7A〜図7Eにおけるデータの定量的なグラフ図である。図示されているのは、様々なX線管ポテンシャル及び様々なアルミニウムフィルタ厚さ2385に対する表面対網膜線量である。このグラフは、図6に示したビーム2100及び2140のデータである。表面対網膜線量の比が図8に示されている(すなわち、網膜における線量に対する強膜における入射線量である)。図8では、大部分のビームエネルギー(管ポテンシャル)において、強膜に対する線量が網膜に対する線量の3倍程度であることを確認できる。略40kVpを超えるエネルギーに対して、表面線量対網膜線量2375の比は、略3:1未満である。即ち、スポットが同一位置に維持される場合、網膜に略25Gyが伝達されたとき、強膜に対する最大線量は略75Gyであり得る。もちろん、ビームが眼周辺で移動されるときは、略75Gyは、面積上で平均化され、及び、黄斑には略25Gy未満の線量が与えられるようになる。これは、強膜に沿った異なるポイントに対するX線ビームの移動の結果を示す図6に表示されている。80keV2380において、表面対深部線量の比は、1mmのフィルタリングに関しては略2.2に近い。これらのデータは、システム10の治療計画及び設計に集積され、及び、部分的に、X線管の使用時間及びポテンシャルを決定する。また、ビームの表面−深部線量は、様々な疾患を治療するための治療エネルギーレベル及び対応する管ポテンシャルの決定において重要な要素であって、治療計画システムに組み込まれる。
【0236】
眼の毛様体扁平部領域に伝達される、略1mmを超える濾過で略40keVを超えるエネルギーレベルでの細密コリメートX線放射は、網膜に伝達する治療線量よりも強膜、水晶体又は視神経での蓄積(buildup)が比較的に低い線量を有して、網膜に放射線の治療線量を伝達するために用いられることができる。例えば、網膜に対する治療量が略25Gy以下である場合、ビームが透過する強膜のあらゆる領域に対する線量は略25Gy未満である。
【0237】
図9は、網膜以外の眼の領域に対する散乱線量及びこれらを網膜と比較した棒グラフである。この対数図から確認できるように、水晶体2400(ビーム2100、2140)及び視神経(ビーム2140単独)に対する線量(眼の構造において最も影響を受けやすい2つの構造)は、網膜の黄斑領域2450に伝達する線量よりも少なくとも1桁は少ない。その他のビーム角度は、これらの構造では明らかに線量が高くなる。従って、放射線の25Gy線量は、例えば、水晶体、強膜、脈絡膜などその他の眼構造に到達する少なくとも1桁は少ない放射線を有して、眼の毛様体扁平部領域を通じて網膜の領域に伝達することができる。このシミュレーションは、X線発生システム及びサブシステムに対する設計仕様を命令する。また、これらのシミュレーションは、治療標的に対する線量が重要な構造に対する線量よりも高くなるように、計画の構成要素として治療計画システム800に組み込まれることができる。例えば、各患者に特有の解剖学的構造を組み入れる計画システムは、強膜を通る照射の角度及び位置に依存して各構造に伝達される放射量をシミュレートすることができる。例えば、水晶体及び視神経などの構造に対するX線が非常に高い場合、角度、ビームサイズ及びビームエネルギーに従って、眼構造に対する放射線伝達は変化し、及び代替の方向が選択され得る。
【0238】
図10を参照する。MCシミュレーションの有効性を検証し及び眼が水の球体であると仮定され得ることを確認するために、ヒト死体眼2500を取得し及びX線源の表面対深部線量の比を実験に基づいて決定した。特に、放射X線ビーム2510のパラメータは、眼2500から出たビーム2520のパラメータと比較された。MCシミュレーションにおいて眼が水であると見なされるとき、図10の実験配置(experimental set-up)からの比は、それと一致することが証明された。例えば、表面対深部(2mm濾過で80keVの2cm深部)の比は、MCモデルが予測したように確かに3:1であった。追加の作業は、各深部での線量減衰が同様に一致するかを検証した。この実験作業は、MCを用いるモデリング予測が眼構造に対して正確であることを確認し、及び、X線高エネルギーに関するMCシミュレーション中で一般に要求される2次相互作用が低エネルギーX線を必要としないことを確認する。この観測は、MCシミュレーションを有意に単純化し、及び、幾何学的な関係及びビーム拡散予測を用いて治療計画をする場合に迅速なリアルタイムシミュレーションを可能にする。さらに、システム10設計に用いられる設計基準は、ヒト組織の取得に関する時間及び費用よりも、それら予測のために水を用いて正確にモデル化されることができる。
【0239】
さらに、分析及び実験は、臨床的に関連する時間周期(例えば、30分を超えない時間周期)において、黄斑に25Gyが伝達すること、図1のシステムがX線源に略1mA〜略40mAの電流を引くこと、を示す。正確なmA数は、X線管が眼に対してどれだけ近接するか、及び、所望の最大透過深さに依存して伝達される最大スペクトルエネルギー(例えば、略50keV)、に依存する。このパラメータは、システムパラメータをセットするシステムオペレータが用いる治療計画に集積される。管が眼に非常に近接し、低透過率が求められる場合、システムは、眼から離れたシステムが引く電流よりも少ない電流を引く。幾つかの実施形態において、10分より短時間内で網膜に伝達するには、略15Gy〜略25Gyを必要とする。このような実施形態では、管電流は少なくとも25mAが必要であり、及び、X線管が網膜から25cm以内に近接することが必要である。このパラメータは、略60〜略100keVのエネルギー、及び、アルミニウム、鉛、タングステン又はその他のX線吸収金属を有する1mm〜3mmの濾過、に対するものである。コリメータは、眼の眼表面から略5cm未満にあり、光子エネルギーは、鼻下側領域の眼から入る略1mm〜略6mmの間の直径を有する1〜5本の100keVのビームである。鼻領域は、視神経から最も距離が離れており、及び、下側領域は、鼻骨及び前頭骨を避けるために好ましい。これらの仮定は、前頭骨から外側を真っ直ぐ見るように配置された眼に対するものである。本実施形態において、治療時間は、5分未満である。この場合、電流は、略15mA〜略40mAの範囲である。1〜4本の各ビームの夫々は、略3秒〜略5分の間、ターンオンされることができる。幾つかの実施形態において、3本のビームが治療で用いられる。幾つかの実施形態において、コリメータは、眼の表面から略3cm以内に配置され、及び、実施形態によっては、コリメータは、眼の表面の約10cm以内に配置される。
【0240】
図11A1は、単一コリメートX線ビーム2600の結果を示し、及び、図11A2は、ビーム2600が水(眼)を略2cm透過した後のビーム2620を示す。成形コリメータは、水面から略5.0cmである。図11A2から確認できるように、眼を透過した後、図11A1に示す成形ビームの10%未満となったオリジナルビーム幅2620の周りには、小半影幅2610が存在する。これらのデータは、発散及び散乱からの等線量減衰の双方を組み入れ、及び、標的から略10cm以内のコリメータについて、半影が非常に小さくなり得ることを明らかにする。この実施形態におけるビームエネルギーは、略80keVである。図11Bは、X線検出フィルム範囲内の測定による半影のグラフ図を表す。デルタ2650は、X線感光フィルムによって記録されるように、表面と深部との間のエネルギー吸収を示す。2640対2630に見られるテールは、ビームが眼を通りエネルギーを損失するときの半影作用の程度が少ないことを示す。実際には、0.5mm〜6mmスポットサイズの半影は、略0.001%を切ることができ、及び、標的に対するコリメータの設置位置に依存して略10%まで上昇する。
【0241】
図11C〜図11Gは、前述したようなビーム総数のシミュレーションを表す。シミュレーションは、前述した装置パラメータに基づいてモンテカルロシミュレーションを用いて達成され、図11A1及び図11A2に示す実験的に検証した単一のビームプロフィールを生成する。あるいは、ビームは、モンテカルロシミュレーションによって検証されるビームの光線トラッキングジオメトリ又は幾何モデルを用いて生成されることができる。この場合、光線トラッキングとモンテカルロシミュレーションとの間の誤差が、ビーム幅、ビームエネルギー、及びビームが進む組織量に対して微小変化を有する類似の組織量を進むビームを考慮したときに、相対的に一定であるようにされる。図11C、図11Dに示すように、ラジオサージェリビームの伝達方法の幾つかの実施形態において、ラジオサージェリビームは、眼の前部に示されている。図11Cにおいて、眼の強膜3010上の横断ゾーン3000は、ラジオサージェリビームが横断する場所、又は、強膜3010と交差する場所を示している。このようなビームの散乱及び等線量減衰は、低いことが知られており(例えば、10%以内)、このようなビームは、相互に実質的に重なり合うことなく、所定ビーム直径の範囲内に配置されることができる。
【0242】
後極の中心及び黄斑領域の中心に対するビームの角度は、眼モデル及び治療計画により決定される。図11Dは、図11Cに示すビームであって、強膜を通過して進行し、黄斑領域3025に集束する複数のラジオサージェリビーム3020に関する図を示す。複数のラジオサージェリビーム3020は、僅か略100ミクロン間隔で、及び、治療される標的領域により略2mm又は略3mm離して、配置されることができる。ビーム3000は、眼の下側領域又は鼻領域から強膜に入る。
【0243】
さらに、複数のビーム3020は、標的領域で相互に略50ミクロン〜略500ミクロン間隔で配置可能であることが知られている。この場合、例えば、水晶体、強膜及び視神経などの構造体上での線量の蓄積は測定されない。また、所望の放射線量を伝達するために多くとも略5本及び略5本以上のビームを含む治療計画に関する、有用であり得るビームが1本以上の(例えば、20Gyを超える)線量を網膜の標的領域に伝達するためのモデル化及び実験が知られている。
【0244】
前述のように、標的に対するビームの表面対深部の比は、伝達線量の計画における要素である。100keVレンジのエネルギーを有するラジオサージェリビームの場合、表面対標的線量は、略2:1より低く、又は最大略5.1であり得る。エネルギー及び表面対標的の比におけるこのようなレンジ内で、強膜のあらゆる特定の領域は、許容できない放射線量を受信しない。例えば、網膜における4本のビームは24Gy(1本あたり6Gy)を有するが、強膜における個々の領域に対する線量は略15Gyである。該線量は、強膜で十分に許容されるように決定されている。実際は、多くとも40Gyの線量は、強膜で十分に許容され得る。パジック及びグレナーが示すように(放射及び腫瘍学74 (2005) 25−29、「翼状片の非外科的、排他的ストロンチウム/Yイットリウム90のβ照射による長期結果」)、強膜上の多くとも50Gyと等しい線量は、若い患者の10年後まで有害ではない。この場合、50Gyが強膜上の一点に伝達されると、黄斑の領域には18〜24Gyが伝えられる。このような治療療法は、ビームだけを必要とする可能性がある。
【0245】
図11Eは、この実施形態において、網膜、特に黄斑に重ね合わせたビーム3040を示す。半影3050の著しい減衰は非常に早く、略98%のビームの縁3060から数ミリメートルである。
【0246】
図11Fは、黄斑を囲う脈管弓(vascular arcade)の間の標的に、フレア型ラジオサージェリスポット3070を形成するためにカスタム形成コリメータが生成した楕円形の重ね合わせビームの一実施形態を示す。
【0247】
図11Gは、複数の独立した穴又は複数の独立したコリメート領域を有するコリメータを通過することで生成された線量(マイクロ分割)が標的領域でチェック模様3090として出現する実施形態を示す。このような「マイクロ分割」は、標的領域に対して副作用を低減し改善した療法を可能にできる。網膜下にある血管に対する放射線量の制限により該血管の作用によってもたらされる副作用の範囲に対して、及び、各マイクロ分割に関する付随的な局所性を考慮すれば、治療作用を犠牲にせずに網膜の脈管構造を避けることができる。幾つかの実施形態において、新生血管領域の発生は、識別され及び治療計画に組み込まれる。このような実施形態において、領域の血管新生を止めるために、この部位に放射線量を集中させることができる。幾つかの実施形態において、輪状又は環状の治療領域は、識別され、及び、輪状領域若しくは環状領域の中心部への血管新生を止め又は減少させるために治療される。
【0248】
図11Hは、微細コリメート常用電圧ラジオサージェリビーム3100と従来技術治療ビーム3105との間の脳CT3170上の比較を示す。従来技術治療ビーム3105は、以前に試みられている(マーカス等著、加齢黄斑変性を悪化させる再発性脈絡膜新生血管に対する放射療法、英国眼科学雑誌、2004年 88 pps.,114−119(Marcus, et.al., Radiotherapy for recurrent choroidal neovascularization complicating age-related macular degeneration; Br. J. Ophthalmology, 2004; 88 pps.,114-119))。従来技術治療ビーム3105において、大型のライナックは、眼に対する位置決め又はカスタム化を特に実行することなく用いられていた。従来の治療ビーム経路3105は、CTスキャン3170上の等線量計算を示す。図は、同側の全視神経及び網膜を取り囲む90〜100%等線量ボリュームを示す。さらに反対側の視神経3106は、63%の線量3107を受信している。その結果、マーカス等が実行した治療では、複数日にわたって線量を分割することが要求され、及び、正常組織に対する損傷を抑えるために線量は小さく分割された。このような分割、必要最低限度の線量、及び計画スキームは、おそらく、このような研究における有効性の欠如を導く。加えて、放射線を黄斑に適用するこの従来技術の試みは、眼球運動又は眼の位置を考慮していない。
【0249】
これとは対照的に、微細コリメート常用電圧ビームのビーム経路3100が示されている。この実験的及び理論的に検証されたマイクロコリメート100keVビームは、毛様体扁平部部位3110の強膜から入り、該強膜に18Gyを伝達し、視神経3106、水晶体3115及び角膜3120から完全に外れ、黄斑領域3125に8Gyの治療線量を伝達する。その後、脳において、放射は、眼の後の骨で1〜2Gy(符号3135)に拡散され、及び、脳組織及び頭蓋骨3180において急速に0.5Gy(符号3130)へと減衰する。眼の異なるクロック角度におけるこのようなビームの3本に関して、黄斑上の重ね合わせは24Gyであり、強膜上の3つの異なる入力ポイントでは強膜に対して僅か18Gyだけである。
【0250】
図11Iは、類似の従来技術治療ビーム(アダムズ、ジェー等著、医療用線量測定 24(4) 233−238(Adams, J. et. al; Medical Dosimetry 24(4) 233-238))を示す。この研究(陽子線研究)において、90%の等線量ライン3230は、視神経3210及び黄斑3200を取り囲む。加えて、眼の位置及び運動は、この研究において制御されていない。この研究の著者は、12Gyに分割した陽子線放射が網膜の非常に広範囲で20〜24Gyになる可能性があるとの重大な事態を報告した。このような事態は、療法のあらゆる利益を否定する可能性がある。本明細書に記載のX線伝達は、疾患が存在する黄斑に対してだけの伝達を可能にすると共に、疾患が存在しないその他の領域に対してはX線の伝達を制限又は避ける。
【0251】
図11Jは、標的部位3250に100keVオーバーラップ常用電圧X線をベンチトップ伝達(benchtop delivery)した後のラジオクロミックフィルム(radiochromic film)の概略図を示す。オーバーラップX線ビーム3275の領域は、そのオーバーラップ領域の線量が24Gyであることを示す。視神経3260は、オーバーラップの中心位置から縮尺距離でビームのオーバーラップ配置の側方に位置する。急速な等線量減衰3273,3277は、視神経3260から十分に離れたオーバーラップ領域3275の外側に生じる。特に、領域3265に示す等線量は、治療スポット3275における線量の実に略1%〜略10%である(0.24Gy〜2.4Gy)。このようなデータは、細密ビームコリメーション及びオーバーラップビームジオメトリの結果である。これは、治療領域を明確にする微細コリメートオーバーラップ常用電圧X線ビーム能力の物理的な証明である。視神経の線量に対する治療線量は10〜100倍は異なるため、分割は要求されず、及び、全線量は、例えば、視神経などの重要構造の損傷に対する考慮を最小にし、一度のセッションで治療領域に与えられることができる。このようなオーバーラップ領域は、治療計画システム、ビームエネルギー、コリメーション及びフィルタリングにより決定される眼のあらゆる場所で最適化され及び眼のあらゆる場所に配置されることができる。また、オーバーラップの範囲は、システムパラメータによる範囲内で決定される。例えば、網膜の黄斑変性に対する治療全領域は、腫瘍や血管腫瘍の治療領域とは異ならせることができる。
【0252】
このようなモデリング技術、パラメータ、及び前述のイメージングシステムによって、集積システムが考慮され及び開発されることができる。幾つかの実施形態では、図12Aに示すように、網膜にラジオサージェリを伝達する所望のビーム角度を生じるように、5自由度位置決めステージが用いられる。コリメータ3315は、前述の細密コリメート放射線ビームと共に許容可能な半影を可能にするために、患者3330の眼に近接して位置される。コリメータは、後部網膜におけるスポットサイズが略4mm〜7mmとなるように、典型的に略1mm〜略4mmである。レーザポインタ3225は、ビームスプリッタを進行し、その中心に放射線ビームを合わせるためにコリメータから出る。領域3335は、装置が移動できる空間である。この空間は、患者に実行するイメージングに基づいて計画されることができる。この空間は、X線源3325を移動させるモーションシステムの単純化を考慮に入れた小領域である。また、システム3300は、冷却液体をX線管3325に供給し及びX線管3325から排出するホースシステム3310、3345を含む。
【0253】
図12Bは、患者の眼3460を治療するシステム3300の横断面図を示す。レーザポインタ3225は、ビーム3415をビームスプリッタ3420に向け、及び、X線ビームの範囲内で中央に置かれるコリメータから出力される。X線陽極3400は、最大直径が略50ミクロン〜略5mmを有し、及び、網膜から略50mm〜200mm離れて配置されることができる。一実施形態において網膜からこの距離に陽極3400を維持することは、小半影を維持することを可能にする。放射線ビーム3410は、コリメータ3315を経て伝達され、及び、その発散経路は、例えば、水晶体や角膜などの前眼房にある重要構造を避けて、ほぼ毛様体扁平部領域から眼に入る。幾つかの実施形態において、レンズ3450は眼3460の強膜又は角膜に接触し、及び、放射線療法システムを向ける基準として用いられることができる。コリメータは、典型的に、強膜上のビームエントリポイントから略1cm〜略12cmの範囲内に位置する。
【0254】
図12Cは、放射線療法装置を含む臨床の流れを示す。画像診断法及び身体検査(3500)は、生成される3D座標マップを通じて眼モデルを構築するために用いられる(3510)。特定疾患に対する線量は、治療領域及び回避領域に基づく最大ビームエネルギーとして選択される。これらの変量は、疾患や疾患組織の深さに関する治療者入力とともに、治療ソフトウェアにより決定される。そして、患者が配置され、及び、オプションとして接触装置が患者の眼に対して又は近接して配置される(3520)。患者及びガイドは、ガイドに配置され(3530)、及び、放射線量治療が適用される(3540)。
【0255】
図12Dは、少なくとも部分的に強膜3620に設けられ及び更には眼の硝子体3630まで入る針3600に対して配置される放射線療法装置の治療上の配置を示す。光ガイド3700又はポインタは、コリメート光源を網膜に照射するために、針に配置され又は針に連結されることができる。針3600及び光ガイド3700は、コリメート光源が網膜上の所定ポイントを安定して照射するように、強膜3620に固定されることができる。そして、放射線療法装置は、針3600により位置合わせされ、放射線を針及び光ガイド経路に沿って網膜の所望領域へと直線に伝達する。この配置に関して、網膜の小領域が精密な標的とされることができる。
【0256】
組み合わせ療法
【0257】
放射線療法装置10は、眼のその他の治療と共に組み合わせて用いられることができる。放射線療法は、その他の治療による副作用を抑えるために用いられることができ、及び、その他の療法と相乗効果を生じることができる。例えば、放射線療法は、網膜上のレーザ熱傷、インプラント、又は、眼の前領域の手術のために、適用されることができる。放射線療法は、1以上の医薬、医療、及び、光線力学による治療(photodynamic treatment)若しくはエージェント(photodynamic agent)の少なくとも1つと併用されることができる。ここで用いる「光線力学物質(エージェント)」は、その平易及び通常の意味を意図するものであり、次のものに限定しないが、光に反応するエージェント、光の作用で組織を感光するエージェントなどを含む。例えば、放射線療法は、抗VEFG治療、VEGF受容体、ステロイド、抗炎症性化合物、DNA結合分子、酸素ラジカル形成療法、酸素運搬分子、ポルフィリン分子、ポルフィリン療法、ガドリニウム、微粒子ベースの剤形、腫瘍化学療法、熱治療、超音波治療、及び、レーザ治療などと関連させて用いることができる。
【0258】
幾つかの実施形態において、放射線増感剤及び放射能防御剤の少なくとも一方は、放射療法の作用を減少又は増加させる治療と併用されることができる。この治療は、トーマス等著、放射線調整剤:治療法の概要及び今後の調査、北アメリカ血液・腫瘍学会誌、20 (2006) 119−139(Thomas, et al., Radiation Modifiers: Treatment Overview and Future Investigations, Hematol. Oncol. Clin. N. Am. 20 (2006) 119-139)、セナン等著、抗脈管形成療法を併用する放射線臨床試験の設計、腫瘍学会誌 12 (2007) 465−477(Senan, et al., Design of Clinical Trials of Radiation Combined with Antiangiogenic Therapy, Oncologist 12 (2007) 465-477)で説明されており、これらの論文の全ては、参照により本明細書に組み込まれる。幾つかの実施形態は、5−フルオロウラシル、フッ素化ピリミジンアンチメタボライト(fluorinated pyrimidine antimetabolite)、抗S期細胞毒素(anti-S phase cytotoxin)、5−フルオロウリジントリフォスフェート(5-fluorouridine triphosphate)、2−デオキシフロオロウリジンモノホスファート(2-deoxyfluorouridme monophosphate)(Fd-UMP)並びに2−デオキシフロオロウリジントリフォスフェートカペシタビン(2-deoxyfluorouridine triphosphate capecitabine)、例えば、シスプラチン(cisplatin)やカルボプラチン(carboplatin)などのプラチナ同族体(platinum analogues)、フルオロピリミジン(fluoropyrimidine)、ゲムシタビン(gemcitabine)、アンチメタボライト、タキサン、ドセタキセル、トポイソメラーゼI阻害剤(topoisomerase I inhibitor)、イリノテカン、シクロオキシゲナーゼ2阻害剤(cyclo-oxygenase-2 inhibitor)、低酸素細胞放射線増感剤(hypoxic cell radiosensitizer)、抗脈管形成療法(antiangiogenic therapy)、ベバシズマブ(bevacizumab)、組み換えモノクローナル抗体(recombinant monoclonal antibody)、ラス癌遺伝子媒介(ras mediation)並びに上皮成長因子受容体(epidermal growth factor receptor)、腫瘍壊死因子ベクトル(tumor necrosis factor vector)、アデノウイルスベクトル(adenoviral vector)Egr−TNF(Ad5.Egr-TNF)、及び、ハイパーサーミア(異常高熱)などの放射線増感剤及び治療の少なくとも一方に関する放射線療法を含む。幾つかの実施形態は、アミホスチン(amifostine)、スクラルファート(sucralfate)、細胞保護チオール(cytoprotective thiol)、ビタミンC、ビタミン及び酸化防止剤(ビタミンC)は、トコフェロールモノグルコシド(tocopherol-monoglucoside)、ペントキシフィリン(pentoxifylline)、アルファトコフェロール(alpha-tocopherol)、βカロチン、及びピロカルピン(pilocarpine)などの放射能防御剤及び治療の少なくとも一方を含む。
【0259】
血管新生阻害剤(Antiangiogenic Agents)(AAs)は、新しい血管の成長を阻害することを目的とする。ベバシズマブは、血管の成長を制御する信号経路の中心的役割を果たすリガンドであるVEGFを結合及び中和することにより作用するヒト化モノクローナル抗体である。調査結果は、抗VEGF療法がヒト組織において直接の抗血管作用を有することを示唆する。対照的に、小分子チロシンキナーゼ阻害剤(TKIs)は、VEGFRsの活性化を妨げ、そして、直接のVEGFへの結合よりもダウンストリーム信号経路を抑制する。血管損傷剤(Vascular damaging agents)(VDA)は、確立した血管構造に迅速な停止を生じさせ、2次敵な組織死を導く。微小管不安定エージェント(microtubule-destabilizing agent)は、コンブレタスタチン(combretastatin)並びにZD6126、及び、VDAの2つの主族である5,6−ジメチルキサンテノン−4−酢酸(5,6−ジメチルキサンテノン−4−酢酸)に関する薬剤を含む。混合型阻害剤は、例えば、EGFR阻害剤又は中和剤を含み、及び、細胞毒性抗癌剤も用いることができる。
【0260】
放射線力学療法(Radiodyamic Therapy)
【0261】
放射線力学療法は、併用全身療法(concomitantly administered systemic therapy)によるコリメートX線の組み合わせに関する。本明細書で使用する用語「放射線力学物質(エージェント)(radiodynamic agent)」は、その通常及び平易な意味を意図するものであり、次のものに限定しないが、例えば、X線などの放射線に反応するエージェント、放射線の作用で組織を感光するエージェントなどを含む。光線力学療法と同様に、化合物が組織に又は硝子体に投与される。そして、治療される眼の領域は、前述した眼モデルを用いて放射線療法による直接の標的とされる。標的領域は、眼モデルを用いて正確に局所化されることができ、そして、放射線は、眼データに基づくPORTシステム及び仮想イメージングシステムを用いて正確に適用されることができる。例えば、標的がドルーゼである場合、眼疾患を治療するために、略1mm以下のビームサイズが放射線力学療法に用いられる。その他の実施形態において、ビームサイズは略6mm未満である。
【0262】
特定の態様及び実施形態を開示したが、これらは単なる例示に過ぎず、開示の範囲を制限することを意図するものではない。本明細書に開示する新規な方法及び新規なシステムは、実際には、本発明の趣旨を逸脱することなく、様々な他の形態で実施され得る。添付の特許請求の範囲及びその均等物は、開示の範囲及び趣旨に含まれる形態及び修正を包含することを意図するものである。
【特許請求の範囲】
【請求項1】
患者の眼の解剖学的データから生成される眼モデルと、
放射線ビームを照射するエミッタと、
前記エミッタと連結され、前記眼モデルに基づいて、前記放射線ビームが前記眼の外面又は前記眼の内部の標的に伝達されるように、前記眼の外面又は前記眼の内部の場所に対して前記エミッタを配置する位置決めガイドと、
を含んで構成される患者に放射線を伝達する治療システム。
【請求項2】
前記場所は、前記標的を含んで構成される請求項1記載のシステム。
【請求項3】
前記エミッタは、略10keV〜略500keVの間の光子エネルギーを有する放射線ビームを照射するように構成される請求項1記載のシステム。
【請求項4】
前記放射線ビームは、X線ビームを含んで構成される請求項3記載のシステム。
【請求項5】
前記エミッタは、略25keV〜略150keVの間の放射線ビームを照射するように構成される請求項1記載のシステム。
【請求項6】
前記放射線ビームは、X線ビームを含んで構成される請求項5記載のシステム。
【請求項7】
前記眼モデルに基づいて、ビーム標的、ビーム強度、ビームエネルギー、ビーム軌道、治療領域サイズ、治療領域形状、前記エミッタから前記標的までの距離、照射時間、及び線量、の少なくとも2つを決定する計画モジュールをさらに含んで構成される請求項1記載のシステム。
【請求項8】
前記位置決めガイドは、前記計画モジュールからの情報に基づいて、前記エミッタが第1位置において第1放射線ビームを前記眼の第1部分を通り前記眼の範囲内の治療領域に向けるように、前記エミッタを配置する請求項7記載のシステム。
【請求項9】
前記位置決めガイドは、前記計画モジュールからの情報に基づいて、前記エミッタが第2位置において第2放射線ビームを前記眼の第2部分を通り前記眼の範囲内の治療領域に作用させるように、前記エミッタを配置する請求項7記載のシステム。
【請求項10】
前記計画モジュールは、該計画モジュールの出力に作用する使用者からの入力を受信するように適応される請求項7記載のシステム。
【請求項11】
前記眼の位置を感知し、及び、該眼の位置に関する情報を前記計画モジュールに中継する感知モジュールをさらに含んで構成される請求項7記載のシステム。
【請求項12】
前記眼の位置を感知し、及び、該眼の位置に関する情報を前記位置決めガイドに中継する感知モジュールをさらに含んで構成される請求項1記載のシステム。
【請求項13】
前記感知モジュールは、前記眼に物理的に接触する部分を含んで構成される請求項11記載のシステム。
【請求項14】
前記感知モジュールは、前記眼の角膜上に又は前記眼の角膜を覆って配置可能なレンズを含んで構成される請求項11記載のシステム。
【請求項15】
前記感知モジュールは、前記眼の位置を光学的に感知する請求項11記載のシステム。
【請求項16】
前記感知モジュールは、レーザをさらに含んで構成される請求項11記載のシステム。
【請求項17】
略0.5mm〜略6mm幅に前記放射線ビームをコリメートするコリメータをさらに含んで構成される請求項1記載のシステム。
【請求項18】
前記放射線ビームは、前記コリメータから最大で略50cm離れた距離で、略10%未満の半影を有する請求項17記載のシステム。
【請求項19】
前記放射線ビームが前記標的に伝達されるときに、該標的から略10cm以内に配置されて使用されるコリメータをさらに含んで構成される請求項1記載のシステム。
【請求項20】
前記位置決めガイドは、使用時に、前記エミッタが前記標的から50cm以内の第1距離から前記標的に向けて放射線ビームを伝達するように、前記エミッタを前記第1距離に配置する請求項1記載のシステム。
【請求項21】
前記放射線ビームを前記標的に向けられない程に前記患者の眼が動いたことを検出する検出器をさらに含んで構成される請求項1記載のシステム。
【請求項22】
前記エミッタは、前記患者の眼が所定の位置又はの位置範囲から外れて動いた場合に、前記放射線ビームの照射を自動的に停止するように構成される請求項21記載のシステム。
【請求項23】
コリメータを通り、前記眼に向かうレーザビームを照射するレーザエミッタをさらに含んで構成される請求項1記載のシステム。
【請求項24】
患者の眼の解剖学的データから生成される眼モデルと、
略10keV〜略500keVのエネルギーを有するX線ビームを眼に伝達するエミッタと、
前記エミッタと連結され、前記眼モデルに基づいて、前記放射線ビームが前記眼の外面又は前記眼の内部の標的に伝達されるように、前記眼の外面又は前記眼の内部の場所に対して前記エミッタを配置する位置決めガイドと、
を含んで構成される、眼に放射線を伝達するシステム。
【請求項25】
前記少なくとも2つのパラメータは、ビーム標的、ビーム強度、ビームエネルギー、ビーム軌道、治療領域サイズ、治療領域形状、前記エミッタから前記標的までの距離、照射時間、及び、線量、の2つを含んで構成される請求項24記載のシステム。
【請求項26】
前記位置決めガイドは、前記眼の領域を標的として第1X線ビームを第1位置から前記眼の強膜における第1領域に向けるように構成され、前記眼の領域と実質的に同一の領域を標的として第2X線ビームを第2位置から前記強膜の第2領域に向けるようにさらに構成される請求項24記載のシステム。
【請求項27】
前記領域は、前記眼の黄斑を含んで構成される請求項26記載のシステム。
【請求項28】
前記領域は、前記眼の強膜、前記眼の小柱網、及び前記眼の水晶体包の少なくとも1つを含んで構成される請求項26記載のシステム。
【請求項29】
前記X線ビームをコリメートするコリメータをさらに含んで構成される請求項24記載のシステム。
【請求項30】
前記コリメータは、略0.5mm〜略6mmの幅に前記X線ビームをコリメートする請求項29記載のシステム。
【請求項31】
前記コリメータから前記標的までの略50cm離れた距離で、略5%未満の半影を有するX線ビームを生成するようにさらに構成される請求項29記載のシステム。
【請求項32】
前記X線ビームが前記標的に伝達されるときに、該標的から略10cm以内に配置されて使用されるコリメータをさらに含んで構成される請求項24記載のシステム。
【請求項33】
前記エミッタは、略25keV〜略150keVの間の光子エネルギーを有するX線ビームを伝達するように構成される請求項24記載のシステム。
【請求項34】
患者の眼の解剖学的データから生成される眼モデルと、
前記眼にX線ビームを伝達するエミッタと、
前記X線ビームが前記眼の外面又は前記眼の内部の標的に伝達されるように、前記眼の外面又は前記眼の内部の場所に対して前記エミッタを配置する手段と、
を含んで構成され、
前記手段は、前記エミッタと連結され、該エミッタを前記眼モデルに基づいて配置する
ヒトに放射線を伝達する治療システム。
【請求項35】
眼の放射線療法を計画する方法であって、
少なくとも1つの放射線ビームから眼の領域における標的に対して実放射線量を伝達する治療計画を作成すること、及び
前記治療計画を示す情報を出力モジュールに出力すること、
を含んで構成され、
前記作成することは、
前記眼の外部の放射線源から前記標的に伝達される第1推定放射線量を決定すること、及び
前記放射線源から前記眼の視神経及び水晶体の少なくとも一方が受信する第2推定放射線量を決定すること、
を含んで構成され、
前記第2推定放射線量は、前記第1推定放射線量の略40%以下であり、
前記治療計画は、前記少なくとも1つの放射線ビームの幅、前記放射線源から前記標的までの距離、前記ビームの軌道、最大ビームエネルギー、及び前記第1推定放射線量、の少なくとも1つを含んで構成され、
前記少なくとも1つの放射線ビームの幅、前記放射線源から前記標的までの距離、前記ビームの軌道、の前記少なくとも1つは、前記標的に対する前記第1推定放射線量及び前記眼の前記視神経及び前記水晶体の少なくとも一方に対する前記第2推定放射線量の伝達を生じさせるように選択される、
方法。
【請求項36】
前記視神経が受ける前記推定放射線量及び前記水晶体が受ける前記推定放射線量の少なくとも一方は、前記標的に伝達される前記推定放射線量の20%以下である請求項35記載の方法。
【請求項37】
前記視神経が受ける前記推定放射線量及び前記水晶体が受ける前記推定放射線量の少なくとも一方は、前記標的に伝達される前記推定放射線量の10%以下である請求項35記載の方法。
【請求項38】
前記視神経が受ける前記推定放射線量及び前記水晶体が受ける前記推定放射線量の少なくとも一方は、前記標的に伝達される前記推定放射線量の5%以下である請求項35記載の方法。
【請求項39】
前記視神経が受ける前記推定放射線量及び前記水晶体が受ける前記推定放射線量の少なくとも一方は、前記標的に伝達される前記推定放射線量の1%以下である請求項35記載の方法。
【請求項40】
前記出力モジュールは、コンピュータモニタ、LCD、LED、携帯装置、紙、コンピュータ可読媒体、コンピュータ実行可能命令、及び、前記放射線源に対する通信リンク、の少なくとも1つを含んで構成される請求項35記載の方法。
【請求項41】
前記標的組織に対して前記実放射線量を伝達する10日前から伝達後の3日までの間の期間に、前記眼に対して熱エネルギーを伝達すること、をさらに含んで構成される請求項35記載の方法。
【請求項42】
前記標的に対して前記実放射線量を伝達すること、をさらに含んで構成される請求項35記載の方法。
【請求項43】
前記標的に伝達される前記推定放射線量、前記視神経が受ける前記推定放射線量、及び前記水晶体が受ける前記推定放射線量の少なくとも1つは、モンテカルロシミュレーションにより決定される請求項35記載の方法。
【請求項44】
前記少なくとも1つの放射線ビームの少なくとも1つは、幾何学的な断面形状を有する請求項35記載の方法。
【請求項45】
前記幾何学的な断面形状は、楕円状、円状、環状、同心円状の環状、多角形状、クレセント状、の少なくとも1つを含んで構成される請求項44記載の方法。
【請求項46】
前記視神経が受ける前記推定放射線量及び前記水晶体が受ける前記推定放射線量の少なくとも一方は、外面対深部のビームエネルギー表示に基づくものである請求項35記載の方法。
【請求項47】
前記視神経が受ける前記推定放射線量及び前記水晶体が受ける前記推定放射線量の少なくとも一方は、略250keV未満の最大ビームエネルギーを有するX線源からの分散光のトレーシングに基づくものである請求項35記載の方法。
【請求項48】
前記複数の各放射線ビームが夫々の横断ゾーンで強膜を通り抜けるように、前記標的に伝達される前記複数の放射線ビームの軌道を決定すること、
をさらに含んで構成され、
前記夫々の横断ゾーンは、あらゆる他の交差ゾーンと実質的に重ならない
請求項35記載の方法
【請求項49】
前記複数のビームの少なくとも1つは、前記標的でその他の前記複数のビームと重なる請求項48記載の方法。
【請求項50】
前記少なくとも1つの放射線ビームを略6mm未満の横断面寸法を有するサイズにコリメートすること、をさらに含んで構成される請求項49記載の方法。
【請求項51】
前記眼の外面に対する放射線量が前記標的に対する放射線量の3倍未満となるように濾過量を決定すること、をさらに含んで構成され、
前記少なくとも1つの放射線ビームは、略50keV〜略300keVを有する
請求項50記載の方法。
【請求項52】
前記第1X線ビームは、少なくとも部分的に重金属を含んで構成されるフィルタでろ過される請求項51記載の方法。
【請求項53】
前記標的に対する治療放射線量が略30分未満内で照射されるように、放射線療法システムに供給される略1mA〜略40mAの電流を決定すること、をさらに含んで構成される請求項35記載の方法。
【請求項54】
前記X線ビームはコリメートされ、及び、前記コリメータは前記標的から略20cm以内に配置される請求項35記載の方法。
【請求項55】
前記視神経に対する前記推定放射線量を最小化するように、前記少なくとも1つの放射線ビームの方向を決定すること、をさらに含んで構成され、
前記第1X線ビームは、前記眼の外部から前記眼の内部の標的への伝達に対して、鼻方向から側頭方向へ又は下方向から上方向へ伝達される
請求項35記載の方法。
【請求項56】
眼の放射線療法を計画する方法であって、
少なくとも1つの放射線ビームから眼の領域における標的に対して実放射線量を伝達する治療計画を作成すること、及び
前記治療計画を示す情報を出力モジュールに出力すること、
を含んで構成され、
前記作成することは、
前記眼の外部の放射線源から前記標的に伝達される第1推定放射線量を決定すること、及び
前記標的の中心から略6mm未満の場所に位置する他の眼組織が前記放射線源から受ける第2推定放射線量を決定すること、
を含んで構成され、
前記第2推定放射線量は、前記第1推定放射線量の略40%以下であり、
前記治療計画は、前記少なくとも1つの放射線ビームの幅、前記放射線源から前記標的までの距離、前記ビームの軌道、及び前記第1推定放射線量、の少なくとも1つを含んで構成され、
前記少なくとも1つの放射線ビーム幅、前記放射線源から前記標的までの距離、前記ビームの軌道、の前記少なくとも1つは、前記標的に対する前記第1推定放射線量及び前記その他の眼組織に対する前記第2推定放射線量の伝達を生じさせるように選択される、
方法。
【請求項57】
治療期間の間に眼を治療する方法であって、
前記治療期間の間に前記眼の視神経及び水晶体の少なくとも一方に照射される放射線量が標的に伝達される放射線量の略40%以下となるように、前記眼の外部にある線源から前記眼の網膜内又は網膜上にある前記標的に放射線を向けること、を含んで構成される方法。
【請求項58】
前記放射線は、前記眼の毛様体扁平部を実質的に通るように向けられる請求項57記載の方法。
【請求項59】
治療期間の間に眼を治療する方法であって、
前記治療期間の間に標的の中心から略6mm未満の場所に位置する眼組織に照射される放射線量が前記標的に伝達される放射線量の略40%以下となるように、前記眼の外部にある線源から前記眼の内の前記標的に放射線を向けること、を含んで構成される方法。
【請求項60】
眼内の炎症領域の場所を示すデータに基づいて、治療期間の間に前記炎症領域の中心から略6mmを越える場所に位置する眼組織に対して照射される放射線量が前記炎症領域に伝達する放射量の略40%以下となるように、前記眼の外部にある線源から、前記眼の前部領域を通り、前記炎症領域へ少なくとも1つのX線ビームを向けること、
を含んで構成される、患者の眼の炎症を治療する方法。
【請求項61】
前記領域は、ドルーゼを含んで構成される請求項60記載の方法。
【請求項62】
前記眼の前記前部領域は、角膜である請求項60記載の方法。
【請求項63】
前記眼の前記前部領域は、前記眼の角膜の外側の強膜である請求項60記載の方法。
【請求項64】
前記少なくとも1つのX線ビームは、略1mmより小さい横断面寸法を有する請求項60記載の方法。
【請求項65】
前記ビームは、略1mm〜略5mmの間の直径を有する請求項60記載の方法。
【請求項66】
前記少なくとも1つのX線ビームは、高強度と低強度の交互の領域を含んで構成される請求項60記載の方法。
【請求項67】
前記眼に接触する装置を用いて決定される治療軸に対する所定角度で前記眼に放射線療法システムを向けること、をさらに含んで構成される請求項60記載の方法。
【請求項68】
前記装置は、前記放射線療法システムと眼に関するデータを光学的に通信する請求項67記載の方法。
【請求項69】
眼−接触装置を用いて決定される治療軸に対する所定角度で前記眼に放射線療法システムを向けること、をさらに含んで構成される請求項60記載の方法。
【請求項70】
前記眼からの光の反射、眼底イメージ、前記眼の瞳孔イメージ、及び前記眼の角膜輪部イメージの1つを用いて決定される治療軸に対する所定角度で前記眼に放射線療法システムを向けること、をさらに含んで構成される請求項60記載の方法。
【請求項71】
眼の前部−後部軸を提供すること、
前記眼の前部−後部軸に対して治療軸を定義すること、
前記眼に向けて照射されるX線ビームをコリメートし、該コリメートX線ビームが略6mm未満の横断面寸法を有するようにするコリメータを前記治療軸に対する所定角度に位置合わせすること、
前記治療軸に対する所定角度で前記X線ビームを照射すること、
を含んで構成される、眼に放射線を伝達する方法。
【請求項72】
前記コリメートX線ビームは、前記コリメータから略10cmの場所で略20%未満の半影を有する請求項71記載の方法。
【請求項73】
前記治療軸は、前記眼の中心光軸である請求項71記載の方法。
【請求項74】
前記治療軸は、前記眼の視軸である請求項71記載の方法。
【請求項75】
前記治療軸は、前記角膜輪部又は角膜の中心に対して垂直である請求項71記載の方法。
【請求項76】
前記治療軸に対して前記コリメート放射線ビームを動かすこと、及び、第2コリメートX線ビームを照射すること、をさらに含んで構成される請求項71記載の方法。
【請求項77】
前記コリメート放射線ビームに対して前記眼を動かすこと、をさらに含んで構成される請求項71記載の方法。
【請求項78】
前記眼の強膜上の投射スポットに前記コリメートX線ビームを位置合わせすること、をさらに含んで構成される請求項71記載の方法。
【請求項79】
前記スポットは、前記治療軸に位置合わせされる請求項78記載の方法。
【請求項80】
前記スポットは、前記コリメートX線ビームに位置合わせされる請求項78記載の方法。
【請求項81】
前記コリメートX線ビームを照射することは、治療計画ソフトウェアプログラムに基づいて行われる請求項71記載の方法。
【請求項82】
放射線療法システムによる放射線ビームで眼の眼球構造を治療する方法であって、
第1部分を含んで構成され、前記眼球構造を通る軸がさらに該第1部分を通る眼接触部材を、前記眼の表面に接触させること、及び
前記眼の外部に位置する放射線療法システムから前記眼球構造に向けて複数の放射線ビームを照射すること、を含んで構成され、
該複数の放射線ビームの夫々は前記眼球構造の治療部位で前記軸と交差する軌道をとり、該治療部位は前記複数の放射線ビームの少なくとも1つにより事実上治療可能である
方法。
【請求項83】
前記眼接触部材で前記眼を第1位置に実質的に固定すること、をさらに含んで構成される請求項82記載の方法。
【請求項84】
前記眼接触部材は、前記眼の外部から内部へ電磁放射線の第1波長を伝達する伝達部を含んで構成される請求項82記載の方法。
【請求項85】
前記第1部分は、電磁放射線の第2波長を反射する請求項82記載の方法。
【請求項86】
前記第1部分は、前記眼接触部材内又は前記眼接触部材上の中心に配置される請求項82記載の方法。
【請求項87】
前記複数の放射線ビームの少なくとも1つは、レーザ光を含んで構成される請求項82記載の方法。
【請求項88】
前記複数の放射線ビームの少なくとも1つは、X線を含んで構成される請求項82記載の方法。
【請求項89】
眼の外面に係合する眼接触表面を有し、前記眼を実質的に第1位置に保持する眼ホルダー、
を含んで構成され、
前記眼ホルダーは、前記眼の外部に配置される線源から前記眼に放射線ビームが伝達されている間に、前記眼が実質的に前記第1位置にあることの指示を感知器に提供するように構成される
放射線療法システムによる眼球構造の治療用の患者眼球インタフェース。
【請求項90】
前記眼球インタフェースを通る前記放射線ビームを伝達する物質をさらに含んで構成される請求項89記載の患者眼球インタフェース。
【請求項91】
前記放射線ビームは、レーザ光を含んで構成される請求項90記載の患者眼球インタフェース。
【請求項92】
前記放射線ビームは、X線を含んで構成される請求項90記載の患者眼球インタフェース。
【請求項93】
眼を実質的に安定可能な位置に保持するように適合されるホルダーと、
前記眼の位置を示し及び前記放射線療法システムから照射される放射線ビームの特性を決定する情報を、前記ホルダーと放射線療法システムとの間で伝える通信リンクと、
を含んで構成される放射線療法システムによる眼球構造の治療用の患者眼球インタフェース。
【請求項94】
前記通信リンクは、光の波長の幾つかを反射する反射物質を含んで構成される請求項93記載の患者眼球インタフェース。
【請求項95】
前記情報により決定される前記放射線ビームの特性は、前記放射線ビームの軌道及び照射状態若しくは無照射状態の少なくとも1つを含んで構成される請求項93記載の患者眼球インタフェース。
【請求項96】
前記ホルダーは、前記眼に接触する請求項93記載の患者眼球インタフェース。
【請求項97】
前記ホルダーは、前記眼の外部の表面に取り付け可能である請求項93記載の患者眼球インタフェース。
【請求項98】
前記ホルダーは、前記放射線療法システムに機械的に連結される請求項93記載の患者眼球インタフェース。
【請求項99】
前記放射線療法システムに対する前記通信リンクは、光リンクである請求項93記載の患者眼球インタフェース。
【請求項100】
前記ホルダーは、前記眼の軸に前記放射線療法システムを位置合わせするように適合される請求項93記載の患者眼球インタフェース。
【請求項101】
前記ホルダーは、前記眼の視軸に前記放射線療法システムを位置合わせするように適合される請求項93記載の患者眼球インタフェース。
【請求項102】
前記ホルダーに対する前記眼の位置を視覚化するカメラを、さらに含んで構成される請求項93記載の患者眼球インタフェース。
【請求項103】
前記カメラは、前記眼の動きを検出し、該眼の動きに関するデータをイメージングソフトウェアに伝える請求項102記載の患者眼球インタフェース。
【請求項104】
前記ホルダーは、前記強膜に接触する請求項93記載の患者眼球インタフェース。
【請求項105】
前記ホルダーは、前記角膜に接触する請求項93記載の患者眼球インタフェース。
【請求項106】
前記ホルダーは、少なくとも部分的にX線エネルギーを通さない請求項93記載の患者眼球インタフェース。
【請求項107】
前記ホルダーは、少なくとも部分的にX線エネルギーを通す請求項93記載の患者眼球インタフェース。
【請求項108】
前記ホルダーは、前記眼に対して吸引を適用するように構成される請求項93記載の患者眼球インタフェース。
【請求項109】
網膜から略15cm以内に配置されて使用される少なくとも1つのX線コリメータと、
前記コリメータの長軸に実質的に位置合わせされ、前記眼の表面及び該眼の表面に接触する装置の少なくとも一方に、前記コリメータを通って照射されるX線ビームの方向を示す印を提供するレーザビームを照射するレーザと、
を含んで構成される、患者の眼にX線ビームを送達するシステム。
【請求項110】
前記X線ビームを伝達するX線管の陽極に略10mA〜略800mAの電流を供給するように構成される電源装置をさらに含んで構成される請求項109記載のシステム。
【請求項111】
前記陽極は、固定陽極又は回転陽極である請求項110記載のシステム。
【請求項112】
前記眼に接触し、前記眼の位置を保持するように構成される目接触部材をさらに含んで構成される請求項109記載のシステム。
【請求項113】
疾患の治療に治療上有用な関連放射線量を有する眼球疾患について、眼の外部に配置されてX線ビームを介して放射線量を伝達するX線源から、前記疾患を罹った前記眼組織の標的までの距離を提供すること、及び
前記放射線源から前記標的までの前記距離に基づいて、前記距離により前記放射線源から隔てられている前記標的に対して前記放射線源から照射される前記X線ビームの前記放射線量を達成する上で要求されるエネルギーレベルを出力モジュールに出力すること、
を含んで構成され、
前記エネルギーレベルは、前記放射線源から前記標的への距離に依存する
眼の放射線療法の方法。
【請求項114】
治療される患者の第1疾患に基づいて、放射線療法システムから照射されて推定放射線量を実質的に伝達する放射線ビームのエネルギーレベルを選択すること、及び
前記選択エネルギーレベルの指示を出力モジュールに出力すること、
を含んで構成され、
前記治療される第1疾患は、複数の疾患のうちの1つであり、
前記複数の疾患の夫々は、該複数の疾患の夫々に対する治療放射線量を得る上で、前記複数の疾患のうちの別の疾患に対する治療放射線量を得る上で要求されるエネルギーレベルとは異なるエネルギーレベルを要求する、
放射線で疾患組織を治療する方法。
【請求項115】
前記第1疾患は前記患者の眼に影響を与え、及び、前記放射線ビームは前記眼に向けて照射される請求項114記載の方法。
【請求項116】
前記第1疾患は、前記患者の眼の黄斑変性を含んで構成される請求項114記載の方法。
【請求項117】
前記第1疾患は、前記患者の眼の翼状片を含んで構成される請求項114記載の方法。
【請求項118】
前記第1疾患は、眼球の腫瘍、緑内障、及び前癌病変の少なくとも1つを含んで構成される請求項114記載の方法。
【請求項119】
治療される患者の疾患に基づく選択であって、放射線療法システムから照射されて推定放射線量を実質的に伝達する放射線ビームのエネルギーレベルの選択を含んで構成される入力を受信する処理モジュール
を含んで構成され、
前記治療される第1疾患は、複数の疾患のうちの1つであり、
前記複数の疾患の夫々は、該複数の疾患の夫々に対する治療放射線量を得る上で、前記複数の疾患のうちの別の疾患に対する治療放射線量を得る上で要求されるエネルギーレベルとは異なるエネルギーレベルを要求し、
前記処理モジュールは、前記入力に基づいて、前記選択エネルギーレベルの指示を出力モジュールに出力する
放射線で疾患組織を治療するシステム。
【請求項120】
治療される患者の第1疾患に基づいて、放射線療法システムから照射されて推定放射線量を実質的に伝達する放射線ビームのエネルギーレベルを選択すること、及び
前記選択エネルギーレベルの指示を出力モジュールに出力すること、
を含んで構成され、
前記治療される第1疾患は、複数の疾患のうちの1つであり、
前記複数の疾患の夫々は、該複数の疾患の夫々に対する治療放射線量を得る上で、前記複数の疾患のうちの別の疾患に対する治療放射線量を得る上で要求されるエネルギーレベルとは異なるエネルギーレベル、ビームサイズ、及び表面対深部の比の少なくとも1つを要求する、
放射線で疾患組織を治療する方法。
【請求項121】
放射線源から照射される僅か略6mmの横断面幅を有する放射線ビームをコリメートし、前記放射ビームが放射されるときに、前記放射ビームがたどる第1軸を定義するコリメータと、
前記コリメータにより定義された前記第1軸に位置合わせされる第2軸に沿って、前記第1軸の指示を提供する光ビームを照射する光ガイドと、
を含んで構成される、疾患眼組織を治療する放射線療法システム。
【請求項122】
前記光ビームは、レーザを含んで構成される請求項121記載の放射線療法システム。
【請求項123】
前記コリメータの前記第1軸と前記光ガイドの前記第2軸とは、共線にある請求項121記載の放射線療法システム。
【請求項124】
前記光ガイドは、放射線療法の標的を視覚化し、及び、前記放射線療法システムからの共線X線ビームの伝達をガイドするように、前記眼に差込可能である請求項121記載の放射線療法システム。
【請求項125】
前記光ガイドを差込可能なカニューレをさらに含んで構成される請求項121記載の放射線療法システム。
【請求項126】
前記カニューレは、眼の表面に固定されるように構成される請求項125記載の放射線療法システム。
【請求項127】
放射線を照射する放射線源及び照射された放射線をビームにコリメートするコリメータと、
眼を横断する軸に前記ビームを位置合わせする位置合わせシステムと、
前記ビームが前記軸に位置合わせされていないときに、前記放射線源からの放射線照射を減少させるゲートメカニズムと、
を含んで構成される、放射線で眼を治療するシステム。
【請求項128】
眼底、角膜輪部、角膜、及び眼の表面からの反射の少なくとも1つを検出するイメージ検出システムをさらに含んで構成される請求項127記載のシステム。
【請求項129】
前記イメージ検出システムが閾値を超える前記眼の動きを検出したときに、前記ゲートメカニズムが前記放射線源からの放射線照射を減少させる請求項128記載のシステム。
【請求項130】
治療セッションの間に放射線を照射し、及び、前記照射された放射線を略6mm未満の横断面寸法を有するコリメートビームにコリメートする放射線源と、
前記治療セッションの間に座標系に眼構造の位置を繰り返しマッピングする眼マッピングモジュールと、
を含んで構成される、放射線で眼を治療するシステム。
【請求項131】
前記照射される放射線を眼構造に向けるように前記眼に対して前記放射線源を移動させる放射線源移動器をさらに含んで構成される請求項130記載のシステム。
【請求項132】
前記放射線源は、前記治療セッションの間に、前記眼の位置に対して静止するように構成される請求項130記載のシステム。
【請求項133】
眼構造が前記コリメートビームの経路内にないときに、放射線の照射を減少又は停止させるシステムシャットオフをさらに含んで構成される請求項130記載のシステム。
【請求項134】
前記眼構造が前記コリメートビームの経路内にあるように前記眼を実質的に保持するホルダーをさらに含んで構成される請求項130記載のシステム。
【請求項135】
眼の生体測定パラメータを含んで構成される入力を受信する処理モジュール、を含んで構成され、
前記処理モジュールは、前記生体測定パラメータに基づいて、前記眼の強膜上に照射されるX線ビームの方向を電動システムに出力する
眼に放射線を伝達する計画システム。
【請求項136】
前記生体測定パラメータは、眼球軸長、前眼房深度、角膜厚、及び角膜直径の少なくとも1つを含んで構成される請求項135記載のシステム。
【請求項137】
少なくとも部分的に患者の眼のイメージデータを取得すること、
前記イメージデータに基づいて、前記患者の眼の黄斑位置を特定すること、
前記眼の内部又は表面に配置される基準マーカーの第1位置を特定すること、
前記基準マーカーの前記第1位置に対して、座標系に前記黄斑の位置をマッピングし、前記座標系における前記黄斑のマッピング位置を生成すること、
前記黄斑のマッピング位置に基づいて、前記黄斑に放射線を照射する放射線源を配置すること、
前記配置された放射線源から前記黄斑に放射線を照射すること、
を含んで構成される、患者の眼に放射線を適用する方法。
【請求項138】
前記患者の強膜に接触する接触レンズが前記基準マーカーを含んで構成される請求項137記載の方法。
【請求項139】
前記患者の角膜に接触する接触レンズが前記基準マーカーを含んで構成される請求項137記載の方法。
【請求項140】
前記座標系に基づいて、前記放射線源の配置が自動化される請求項137記載の方法。
【請求項141】
前記基準マーカーの第2位置への移動に基づいて前記放射線源を再配置すること、をさらに含んで構成される請求項137記載の方法。
【請求項142】
前記放射線源の再配置後に、前記放射線源から前記黄斑に追加の放射線ビームを照射すること、をさらに含んで構成される請求項141記載の方法。
【請求項143】
前記黄斑の位置をマッピングした後に、前記眼の動きを検出すること、をさらに含んで構成される請求項137記載の方法。
【請求項144】
前記眼の動きを検出した後に、前記黄斑の新たな位置と座標系との間の相対的な関係を決定すること、をさらに含んで構成される請求項143記載の方法。
【請求項145】
前記放射線源の位置を変更するポジショナに対して前記黄斑の新たな位置情報を中継すること、をさらに含んで構成される請求項144記載の方法。
【請求項146】
前記眼のドルーゼの領域に前記放射線を適用すること、をさらに含んで構成される請求項137記載の方法。
【請求項147】
前記放射線を照射することは、放射線ビームを照射すること、含んで構成される請求項137記載の方法。
【請求項148】
少なくとも1つの追加の放射線ビームを前記黄斑に適用すること、をさらに含んで構成される請求項147記載の方法。
【請求項149】
前記放射線ビーム及び前記少なくとも1つの追加の放射線ビームは、同時に照射される請求項148記載の方法。
【請求項150】
前記放射線ビーム及び前記少なくとも1つの追加の放射線ビームは、前記黄斑を含む組織のボリュームと交差するように向けられる請求項148記載の方法。
【請求項151】
網膜のイメージデータを取得することは、三角測量法、干渉分光法、及び位相シフト法の少なくとも1つを含んで構成される請求項137記載の方法。
【請求項152】
前記イメージデータは、コンピュータトモグラフィー、磁気共鳴映像法(MRI)、光コヒーレンストモグラフィー、及びポジトロンエミッショントモグラフィーの少なくとも1つにより取得される請求項137記載の方法。
【請求項153】
少なくとも部分的に患者の眼のイメージデータを取得すること、
前記イメージデータに基づいて、前記患者の眼の黄斑位置を特定すること、
前記眼の前部構造の第1位置を特定すること、
前記眼の前部構造の前記第1位置に対して、座標系に前記黄斑の位置をマッピングし、前記座標系における前記黄斑のマッピング位置を作成すること、
前記座標系における前記黄斑マッピング位置に基づいて、前記黄斑に放射線量を照射する放射線源を配置すること、及び
前記配置された放射線源から前記黄斑に放射線ビームを照射すること、
を含んで構成される、患者の眼に放射線を適用する方法。
【請求項154】
前記眼の前部構造は、強膜を含んで構成される請求項153記載の方法。
【請求項155】
前記眼の前部構造は、角膜、前眼房、虹彩、結膜、瞳孔、虹彩角膜角、小柱網、水晶体包、人工水晶体、毛様体、毛様体筋、角膜輪部、毛様体扁平部、強膜輪、及び眼の水晶体の少なくとも1つを含んで構成される請求項153記載の方法。
【請求項156】
前記前部構造の第2位置への移動に基づいて、前記放射線源を再配置すること、をさらに含んで構成される請求項153記載の方法。
【請求項157】
前記放射線源の再配置後に、前記放射線源から前記黄斑に追加の放射線ビームを照射すること、をさらに含んで構成される請求項156記載の方法。
【請求項158】
網膜のイメージデータを取得することは、三角測量法、干渉分光法、及び位相シフト法の少なくとも1つを含んで構成される請求項153記載の方法。
【請求項159】
略40keV〜略250keVの光子エネルギーを有する略0.5mm〜略6mm幅のX線ビームを生成すること、
前記X線ビームを前記眼の領域に向けること、及び
略1Gy〜略40GyのX線放射線量で前記領域を照射し、前記眼の領域を治療すること、
を含んで構成される、患者の眼の領域を治療する方法。
【請求項160】
イメージ装置により取得される解剖学的データを有する前記眼のモデルを提供すること、をさらに含んで構成され、
前記X線ビームの幅、前記X線ビームの光子エネルギー、及び前記X線ビームの方向の少なくとも1つが、前記眼のモデルに基づいて決定される
請求項159記載の方法。
【請求項161】
前記領域は、略15Gy〜略25GyのX線放射で照射される請求項159記載の方法。
【請求項162】
前記領域は、前記眼の網膜を含んで構成される請求項159記載の方法。
【請求項163】
前記治療することは、前記網膜に前記放射線を照射することにより前記眼の新生血管を減少させること、を含む請求項162記載の方法。
【請求項164】
前記眼の領域を治療することは、乾性加齢黄斑変性から新生血管形成への進行を実質的に防止すること、を含む請求項162記載の方法。
【請求項165】
加熱、冷却、VEGFアンタゴニスト、VEGF受容体アンタゴニスト、VEGF又はVEGF受容体に対する抗体、マイクロ波エネルギー、高周波エネルギー、レーザ、光力学的物質、放射線力学的物質及び治療薬の少なくとも1つを前記患者に施すこと、をさらに含んで構成される請求項159記載の方法。
【請求項166】
前記眼の外部の第1位置から強膜を通り網膜に至るように第1X線ビームを向けること、及び、前記眼の外部の第2位置から前記強膜を通り前記網膜に至るように第2X線ビームを向けること、をさらに含んで構成される請求項159記載の方法。
【請求項167】
前記X線ビームは、前記眼の毛様体扁平部を通るように向けられる請求項159記載の方法。
【請求項168】
前記X線ビームは、前記眼の黄斑に向けられる請求項159記載の方法。
【請求項169】
前記X線ビームは、前記眼の強膜を通り前記眼の黄斑に至るように向けられる請求項159記載の方法。
【請求項170】
前記線量は、2以上のビームに分割される請求項159記載の方法。
【請求項171】
前記線量は2以上の治療セッションに分割され、該治療セッションの夫々は少なくとも1日間隔で行われる請求項159記載の方法。
【請求項172】
前記領域に前記X線放射を照射する間に、前記X線ビームに対する前記眼の位置を決定すること、をさらに含んで構成される請求項159記載の方法。
【請求項173】
前記眼の位置が移動閾値を超えると、前記X線ビームをシャットオフすること、をさらに含んで構成される請求項172記載の方法。
【請求項174】
イメージ装置により取得される解剖学的データに基づいて眼モデルを提供すること、
略0.5mm〜略6mmのビーム幅を夫々有する第1X線ビーム及び第2X線ビームを生成すること、
前記第1ビームが前記眼の強膜における第1領域を通過して網膜の標的に至るように前記第1X線ビームを向けること、並びに
前記第2ビームが前記強膜における第2領域を通過して前記網膜における実質的に前記第1ビームと同一の標的に至るように前記第2X線ビームを向けること、
を含んで構成され、
前記第1ビーム及び第2ビームが通過する前記強膜における前記第1領域及び第2領域は、前記眼モデルに基づいて選択される
患者の眼を治療する方法。
【請求項175】
前記第1X線ビームの軌道は、前記眼モデルに基づいて決定される請求項174記載の方法。
【請求項176】
前記第1X線ビームを向けること及び前記第2X線ビームを向けることは、連続して行われる請求項174記載の方法。
【請求項177】
前記第1X線ビーム及び前記第2X線ビームは、略25keV〜略100keVの光子エネルギーを有する請求項174記載の方法。
【請求項178】
前記第1X線ビーム及び前記第2X線ビームの中心は、前記眼の角膜輪部から略0.5mm〜略6mmの距離で強膜上のポイントを通して投射される請求項174記載の方法。
【請求項179】
前記第1X線ビームを向ける前に、加熱、冷却、VEGFアンタゴニスト、VEGF−受容体アンタゴニスト、VEGF又はVEGF受容体に対する抗体、マイクロ波エネルギー、高周波エネルギー、レーザ、光力学物質、放射線力学物質及び治療薬の少なくとも1つを前記患者に施すこと、をさらに含んで構成される請求項174記載の方法。
【請求項180】
前記X線ビームは、前記網膜から略50cm未満に配置されるX線源により生成される請求項174記載の方法。
【請求項181】
前記X線ビームは、前記眼から略10cm以内に配置される線源の端部から照射される請求項174記載の方法。
【請求項182】
前記網膜は、前記治療の1セッションの間に、略15Gy〜略25GyのX線放射が照射される請求項174記載の方法。
【請求項183】
イメージ装置により取得される解剖学的データに基づいて眼モデルを提供すること、
略0.5mm〜略6mmのビーム幅を夫々有する第1X線ビーム及び第2X線ビームを生成すること、
前記第1ビームが前記眼の第1領域を通過して前記眼内の標的に至るように前記第1X線ビームを向けること、並びに
第2ビームが前記眼の第2領域を通過して前記眼内の実質的に同一の標的に至るように前記第2X線ビームを向けること、
を含んで構成され、
前記第1ビーム及び前記第2ビームが通過する前記眼の前記第1領域及び第2領域は、前記眼モデルに基づいて選択される
患者の眼を治療する方法。
【請求項184】
前記標的は、前記眼の後水晶体包を含んで構成される請求項183記載の方法。
【請求項185】
前記標的は、前記眼の小柱網を含んで構成される請求項183記載の方法。
【請求項186】
前記標的は、前記網膜の領域を含んで構成される請求項183記載の方法。
【請求項187】
前記標的は、腫瘍を含んで構成される請求項183記載の方法。
【請求項188】
前記第1領域は、前記眼の角膜を含んで構成される請求項183記載の方法。
【請求項189】
前記第1X線ビーム及び前記第2X線ビームは、略25keV〜略100keVの光子エネルギーを有する請求項183記載の方法。
【請求項190】
前記第1X線ビーム及び前記第2X線ビームは、前記眼から略10cm以内に配置されるコリメータによりコリメートされる請求項183記載の方法。
【請求項191】
前記第1X線ビーム及び前記第2X線ビームは、前記眼から略10cm以内に配置されるX線源により生成される請求項183記載の方法。
【請求項192】
前記X線源を前記眼の50cm以内に動かすこと、をさらに含んで構成される請求項183記載の方法。
【請求項193】
前記X線源を前記眼の40cm以内に動かすこと、をさらに含んで構成される請求項183記載の方法。
【請求項194】
前記X線源を前記眼の10cm以内に動かすこと、をさらに含んで構成される請求項183記載の方法。
【請求項195】
前記眼の前記第1領域は、強膜の第1領域を含んで構成され、前記眼の前記第2領域は、前記強膜の第2領域を含んで構成され、及び、前記強膜の第1領域から前記強膜の第2領域の端〜端の距離が略0.1mm〜略2mmである請求項183記載の方法。
【請求項196】
前記第1X線ビーム及び前記第2X線ビームは、前記眼の外部の鼻部から向けられる請求項183記載の方法。
【請求項197】
X線放射線療法システムを前記患者の眼の中心に位置合わせすること、をさらに含んで構成される請求項183記載の方法。
【請求項198】
前記眼モデルを用いて前記黄斑領域を治療する計画を作成すること、をさらに含んで構成され、
前記第1X線ビーム及び前記第2X線ビームは前記黄斑領域で重ねあわされ、及び、前記第1X線ビーム及び前記第2X線ビームは略0.5mm〜略6mmにコリメートされる
請求項183記載の方法。
【請求項199】
イメージ装置により取得される解剖学的データに基づいて眼モデルを提供すること、
第1ビームが前記眼の第1領域を通過して前記眼内の標的に至るように前記第1X線ビームを向けること、
第2ビームが前記眼の第2領域を通過して前記眼内の実質的に同一の標的に至るように前記第2X線ビームを向けること、
前記標的に対する前記第1X線ビームの照射、前記標的に対する前記第2X線ビームの照射、及び前記標的に対する前記第1X線ビームの照射と前記標的に対する前記第2X線ビームの照射との間の期間、の少なくとも1つの間に、前記眼の位置を評価すること、
を含んで構成され、
前記第1ビーム及び前記第2ビームが通過する前記第1領域及び第2領域は、前記眼モデルに基づいて選択される
患者の眼を治療する方法。
【請求項200】
前記評価することは、前記標的に対する前記第1X線ビームの照射の間に行われ、
前記眼が移動閾値を超えて動いたときに、前記第1X線ビームの照射を停止又は減少させること、をさらに含んで構成される請求項199記載の方法。
【請求項201】
前記眼の位置を評価することから得られる情報に基づいて、前記第2X線ビームを向けること、をさらに含んで構成される請求項199記載の方法。
【請求項1】
患者の眼の解剖学的データから生成される眼モデルと、
放射線ビームを照射するエミッタと、
前記エミッタと連結され、前記眼モデルに基づいて、前記放射線ビームが前記眼の外面又は前記眼の内部の標的に伝達されるように、前記眼の外面又は前記眼の内部の場所に対して前記エミッタを配置する位置決めガイドと、
を含んで構成される患者に放射線を伝達する治療システム。
【請求項2】
前記場所は、前記標的を含んで構成される請求項1記載のシステム。
【請求項3】
前記エミッタは、略10keV〜略500keVの間の光子エネルギーを有する放射線ビームを照射するように構成される請求項1記載のシステム。
【請求項4】
前記放射線ビームは、X線ビームを含んで構成される請求項3記載のシステム。
【請求項5】
前記エミッタは、略25keV〜略150keVの間の放射線ビームを照射するように構成される請求項1記載のシステム。
【請求項6】
前記放射線ビームは、X線ビームを含んで構成される請求項5記載のシステム。
【請求項7】
前記眼モデルに基づいて、ビーム標的、ビーム強度、ビームエネルギー、ビーム軌道、治療領域サイズ、治療領域形状、前記エミッタから前記標的までの距離、照射時間、及び線量、の少なくとも2つを決定する計画モジュールをさらに含んで構成される請求項1記載のシステム。
【請求項8】
前記位置決めガイドは、前記計画モジュールからの情報に基づいて、前記エミッタが第1位置において第1放射線ビームを前記眼の第1部分を通り前記眼の範囲内の治療領域に向けるように、前記エミッタを配置する請求項7記載のシステム。
【請求項9】
前記位置決めガイドは、前記計画モジュールからの情報に基づいて、前記エミッタが第2位置において第2放射線ビームを前記眼の第2部分を通り前記眼の範囲内の治療領域に作用させるように、前記エミッタを配置する請求項7記載のシステム。
【請求項10】
前記計画モジュールは、該計画モジュールの出力に作用する使用者からの入力を受信するように適応される請求項7記載のシステム。
【請求項11】
前記眼の位置を感知し、及び、該眼の位置に関する情報を前記計画モジュールに中継する感知モジュールをさらに含んで構成される請求項7記載のシステム。
【請求項12】
前記眼の位置を感知し、及び、該眼の位置に関する情報を前記位置決めガイドに中継する感知モジュールをさらに含んで構成される請求項1記載のシステム。
【請求項13】
前記感知モジュールは、前記眼に物理的に接触する部分を含んで構成される請求項11記載のシステム。
【請求項14】
前記感知モジュールは、前記眼の角膜上に又は前記眼の角膜を覆って配置可能なレンズを含んで構成される請求項11記載のシステム。
【請求項15】
前記感知モジュールは、前記眼の位置を光学的に感知する請求項11記載のシステム。
【請求項16】
前記感知モジュールは、レーザをさらに含んで構成される請求項11記載のシステム。
【請求項17】
略0.5mm〜略6mm幅に前記放射線ビームをコリメートするコリメータをさらに含んで構成される請求項1記載のシステム。
【請求項18】
前記放射線ビームは、前記コリメータから最大で略50cm離れた距離で、略10%未満の半影を有する請求項17記載のシステム。
【請求項19】
前記放射線ビームが前記標的に伝達されるときに、該標的から略10cm以内に配置されて使用されるコリメータをさらに含んで構成される請求項1記載のシステム。
【請求項20】
前記位置決めガイドは、使用時に、前記エミッタが前記標的から50cm以内の第1距離から前記標的に向けて放射線ビームを伝達するように、前記エミッタを前記第1距離に配置する請求項1記載のシステム。
【請求項21】
前記放射線ビームを前記標的に向けられない程に前記患者の眼が動いたことを検出する検出器をさらに含んで構成される請求項1記載のシステム。
【請求項22】
前記エミッタは、前記患者の眼が所定の位置又はの位置範囲から外れて動いた場合に、前記放射線ビームの照射を自動的に停止するように構成される請求項21記載のシステム。
【請求項23】
コリメータを通り、前記眼に向かうレーザビームを照射するレーザエミッタをさらに含んで構成される請求項1記載のシステム。
【請求項24】
患者の眼の解剖学的データから生成される眼モデルと、
略10keV〜略500keVのエネルギーを有するX線ビームを眼に伝達するエミッタと、
前記エミッタと連結され、前記眼モデルに基づいて、前記放射線ビームが前記眼の外面又は前記眼の内部の標的に伝達されるように、前記眼の外面又は前記眼の内部の場所に対して前記エミッタを配置する位置決めガイドと、
を含んで構成される、眼に放射線を伝達するシステム。
【請求項25】
前記少なくとも2つのパラメータは、ビーム標的、ビーム強度、ビームエネルギー、ビーム軌道、治療領域サイズ、治療領域形状、前記エミッタから前記標的までの距離、照射時間、及び、線量、の2つを含んで構成される請求項24記載のシステム。
【請求項26】
前記位置決めガイドは、前記眼の領域を標的として第1X線ビームを第1位置から前記眼の強膜における第1領域に向けるように構成され、前記眼の領域と実質的に同一の領域を標的として第2X線ビームを第2位置から前記強膜の第2領域に向けるようにさらに構成される請求項24記載のシステム。
【請求項27】
前記領域は、前記眼の黄斑を含んで構成される請求項26記載のシステム。
【請求項28】
前記領域は、前記眼の強膜、前記眼の小柱網、及び前記眼の水晶体包の少なくとも1つを含んで構成される請求項26記載のシステム。
【請求項29】
前記X線ビームをコリメートするコリメータをさらに含んで構成される請求項24記載のシステム。
【請求項30】
前記コリメータは、略0.5mm〜略6mmの幅に前記X線ビームをコリメートする請求項29記載のシステム。
【請求項31】
前記コリメータから前記標的までの略50cm離れた距離で、略5%未満の半影を有するX線ビームを生成するようにさらに構成される請求項29記載のシステム。
【請求項32】
前記X線ビームが前記標的に伝達されるときに、該標的から略10cm以内に配置されて使用されるコリメータをさらに含んで構成される請求項24記載のシステム。
【請求項33】
前記エミッタは、略25keV〜略150keVの間の光子エネルギーを有するX線ビームを伝達するように構成される請求項24記載のシステム。
【請求項34】
患者の眼の解剖学的データから生成される眼モデルと、
前記眼にX線ビームを伝達するエミッタと、
前記X線ビームが前記眼の外面又は前記眼の内部の標的に伝達されるように、前記眼の外面又は前記眼の内部の場所に対して前記エミッタを配置する手段と、
を含んで構成され、
前記手段は、前記エミッタと連結され、該エミッタを前記眼モデルに基づいて配置する
ヒトに放射線を伝達する治療システム。
【請求項35】
眼の放射線療法を計画する方法であって、
少なくとも1つの放射線ビームから眼の領域における標的に対して実放射線量を伝達する治療計画を作成すること、及び
前記治療計画を示す情報を出力モジュールに出力すること、
を含んで構成され、
前記作成することは、
前記眼の外部の放射線源から前記標的に伝達される第1推定放射線量を決定すること、及び
前記放射線源から前記眼の視神経及び水晶体の少なくとも一方が受信する第2推定放射線量を決定すること、
を含んで構成され、
前記第2推定放射線量は、前記第1推定放射線量の略40%以下であり、
前記治療計画は、前記少なくとも1つの放射線ビームの幅、前記放射線源から前記標的までの距離、前記ビームの軌道、最大ビームエネルギー、及び前記第1推定放射線量、の少なくとも1つを含んで構成され、
前記少なくとも1つの放射線ビームの幅、前記放射線源から前記標的までの距離、前記ビームの軌道、の前記少なくとも1つは、前記標的に対する前記第1推定放射線量及び前記眼の前記視神経及び前記水晶体の少なくとも一方に対する前記第2推定放射線量の伝達を生じさせるように選択される、
方法。
【請求項36】
前記視神経が受ける前記推定放射線量及び前記水晶体が受ける前記推定放射線量の少なくとも一方は、前記標的に伝達される前記推定放射線量の20%以下である請求項35記載の方法。
【請求項37】
前記視神経が受ける前記推定放射線量及び前記水晶体が受ける前記推定放射線量の少なくとも一方は、前記標的に伝達される前記推定放射線量の10%以下である請求項35記載の方法。
【請求項38】
前記視神経が受ける前記推定放射線量及び前記水晶体が受ける前記推定放射線量の少なくとも一方は、前記標的に伝達される前記推定放射線量の5%以下である請求項35記載の方法。
【請求項39】
前記視神経が受ける前記推定放射線量及び前記水晶体が受ける前記推定放射線量の少なくとも一方は、前記標的に伝達される前記推定放射線量の1%以下である請求項35記載の方法。
【請求項40】
前記出力モジュールは、コンピュータモニタ、LCD、LED、携帯装置、紙、コンピュータ可読媒体、コンピュータ実行可能命令、及び、前記放射線源に対する通信リンク、の少なくとも1つを含んで構成される請求項35記載の方法。
【請求項41】
前記標的組織に対して前記実放射線量を伝達する10日前から伝達後の3日までの間の期間に、前記眼に対して熱エネルギーを伝達すること、をさらに含んで構成される請求項35記載の方法。
【請求項42】
前記標的に対して前記実放射線量を伝達すること、をさらに含んで構成される請求項35記載の方法。
【請求項43】
前記標的に伝達される前記推定放射線量、前記視神経が受ける前記推定放射線量、及び前記水晶体が受ける前記推定放射線量の少なくとも1つは、モンテカルロシミュレーションにより決定される請求項35記載の方法。
【請求項44】
前記少なくとも1つの放射線ビームの少なくとも1つは、幾何学的な断面形状を有する請求項35記載の方法。
【請求項45】
前記幾何学的な断面形状は、楕円状、円状、環状、同心円状の環状、多角形状、クレセント状、の少なくとも1つを含んで構成される請求項44記載の方法。
【請求項46】
前記視神経が受ける前記推定放射線量及び前記水晶体が受ける前記推定放射線量の少なくとも一方は、外面対深部のビームエネルギー表示に基づくものである請求項35記載の方法。
【請求項47】
前記視神経が受ける前記推定放射線量及び前記水晶体が受ける前記推定放射線量の少なくとも一方は、略250keV未満の最大ビームエネルギーを有するX線源からの分散光のトレーシングに基づくものである請求項35記載の方法。
【請求項48】
前記複数の各放射線ビームが夫々の横断ゾーンで強膜を通り抜けるように、前記標的に伝達される前記複数の放射線ビームの軌道を決定すること、
をさらに含んで構成され、
前記夫々の横断ゾーンは、あらゆる他の交差ゾーンと実質的に重ならない
請求項35記載の方法
【請求項49】
前記複数のビームの少なくとも1つは、前記標的でその他の前記複数のビームと重なる請求項48記載の方法。
【請求項50】
前記少なくとも1つの放射線ビームを略6mm未満の横断面寸法を有するサイズにコリメートすること、をさらに含んで構成される請求項49記載の方法。
【請求項51】
前記眼の外面に対する放射線量が前記標的に対する放射線量の3倍未満となるように濾過量を決定すること、をさらに含んで構成され、
前記少なくとも1つの放射線ビームは、略50keV〜略300keVを有する
請求項50記載の方法。
【請求項52】
前記第1X線ビームは、少なくとも部分的に重金属を含んで構成されるフィルタでろ過される請求項51記載の方法。
【請求項53】
前記標的に対する治療放射線量が略30分未満内で照射されるように、放射線療法システムに供給される略1mA〜略40mAの電流を決定すること、をさらに含んで構成される請求項35記載の方法。
【請求項54】
前記X線ビームはコリメートされ、及び、前記コリメータは前記標的から略20cm以内に配置される請求項35記載の方法。
【請求項55】
前記視神経に対する前記推定放射線量を最小化するように、前記少なくとも1つの放射線ビームの方向を決定すること、をさらに含んで構成され、
前記第1X線ビームは、前記眼の外部から前記眼の内部の標的への伝達に対して、鼻方向から側頭方向へ又は下方向から上方向へ伝達される
請求項35記載の方法。
【請求項56】
眼の放射線療法を計画する方法であって、
少なくとも1つの放射線ビームから眼の領域における標的に対して実放射線量を伝達する治療計画を作成すること、及び
前記治療計画を示す情報を出力モジュールに出力すること、
を含んで構成され、
前記作成することは、
前記眼の外部の放射線源から前記標的に伝達される第1推定放射線量を決定すること、及び
前記標的の中心から略6mm未満の場所に位置する他の眼組織が前記放射線源から受ける第2推定放射線量を決定すること、
を含んで構成され、
前記第2推定放射線量は、前記第1推定放射線量の略40%以下であり、
前記治療計画は、前記少なくとも1つの放射線ビームの幅、前記放射線源から前記標的までの距離、前記ビームの軌道、及び前記第1推定放射線量、の少なくとも1つを含んで構成され、
前記少なくとも1つの放射線ビーム幅、前記放射線源から前記標的までの距離、前記ビームの軌道、の前記少なくとも1つは、前記標的に対する前記第1推定放射線量及び前記その他の眼組織に対する前記第2推定放射線量の伝達を生じさせるように選択される、
方法。
【請求項57】
治療期間の間に眼を治療する方法であって、
前記治療期間の間に前記眼の視神経及び水晶体の少なくとも一方に照射される放射線量が標的に伝達される放射線量の略40%以下となるように、前記眼の外部にある線源から前記眼の網膜内又は網膜上にある前記標的に放射線を向けること、を含んで構成される方法。
【請求項58】
前記放射線は、前記眼の毛様体扁平部を実質的に通るように向けられる請求項57記載の方法。
【請求項59】
治療期間の間に眼を治療する方法であって、
前記治療期間の間に標的の中心から略6mm未満の場所に位置する眼組織に照射される放射線量が前記標的に伝達される放射線量の略40%以下となるように、前記眼の外部にある線源から前記眼の内の前記標的に放射線を向けること、を含んで構成される方法。
【請求項60】
眼内の炎症領域の場所を示すデータに基づいて、治療期間の間に前記炎症領域の中心から略6mmを越える場所に位置する眼組織に対して照射される放射線量が前記炎症領域に伝達する放射量の略40%以下となるように、前記眼の外部にある線源から、前記眼の前部領域を通り、前記炎症領域へ少なくとも1つのX線ビームを向けること、
を含んで構成される、患者の眼の炎症を治療する方法。
【請求項61】
前記領域は、ドルーゼを含んで構成される請求項60記載の方法。
【請求項62】
前記眼の前記前部領域は、角膜である請求項60記載の方法。
【請求項63】
前記眼の前記前部領域は、前記眼の角膜の外側の強膜である請求項60記載の方法。
【請求項64】
前記少なくとも1つのX線ビームは、略1mmより小さい横断面寸法を有する請求項60記載の方法。
【請求項65】
前記ビームは、略1mm〜略5mmの間の直径を有する請求項60記載の方法。
【請求項66】
前記少なくとも1つのX線ビームは、高強度と低強度の交互の領域を含んで構成される請求項60記載の方法。
【請求項67】
前記眼に接触する装置を用いて決定される治療軸に対する所定角度で前記眼に放射線療法システムを向けること、をさらに含んで構成される請求項60記載の方法。
【請求項68】
前記装置は、前記放射線療法システムと眼に関するデータを光学的に通信する請求項67記載の方法。
【請求項69】
眼−接触装置を用いて決定される治療軸に対する所定角度で前記眼に放射線療法システムを向けること、をさらに含んで構成される請求項60記載の方法。
【請求項70】
前記眼からの光の反射、眼底イメージ、前記眼の瞳孔イメージ、及び前記眼の角膜輪部イメージの1つを用いて決定される治療軸に対する所定角度で前記眼に放射線療法システムを向けること、をさらに含んで構成される請求項60記載の方法。
【請求項71】
眼の前部−後部軸を提供すること、
前記眼の前部−後部軸に対して治療軸を定義すること、
前記眼に向けて照射されるX線ビームをコリメートし、該コリメートX線ビームが略6mm未満の横断面寸法を有するようにするコリメータを前記治療軸に対する所定角度に位置合わせすること、
前記治療軸に対する所定角度で前記X線ビームを照射すること、
を含んで構成される、眼に放射線を伝達する方法。
【請求項72】
前記コリメートX線ビームは、前記コリメータから略10cmの場所で略20%未満の半影を有する請求項71記載の方法。
【請求項73】
前記治療軸は、前記眼の中心光軸である請求項71記載の方法。
【請求項74】
前記治療軸は、前記眼の視軸である請求項71記載の方法。
【請求項75】
前記治療軸は、前記角膜輪部又は角膜の中心に対して垂直である請求項71記載の方法。
【請求項76】
前記治療軸に対して前記コリメート放射線ビームを動かすこと、及び、第2コリメートX線ビームを照射すること、をさらに含んで構成される請求項71記載の方法。
【請求項77】
前記コリメート放射線ビームに対して前記眼を動かすこと、をさらに含んで構成される請求項71記載の方法。
【請求項78】
前記眼の強膜上の投射スポットに前記コリメートX線ビームを位置合わせすること、をさらに含んで構成される請求項71記載の方法。
【請求項79】
前記スポットは、前記治療軸に位置合わせされる請求項78記載の方法。
【請求項80】
前記スポットは、前記コリメートX線ビームに位置合わせされる請求項78記載の方法。
【請求項81】
前記コリメートX線ビームを照射することは、治療計画ソフトウェアプログラムに基づいて行われる請求項71記載の方法。
【請求項82】
放射線療法システムによる放射線ビームで眼の眼球構造を治療する方法であって、
第1部分を含んで構成され、前記眼球構造を通る軸がさらに該第1部分を通る眼接触部材を、前記眼の表面に接触させること、及び
前記眼の外部に位置する放射線療法システムから前記眼球構造に向けて複数の放射線ビームを照射すること、を含んで構成され、
該複数の放射線ビームの夫々は前記眼球構造の治療部位で前記軸と交差する軌道をとり、該治療部位は前記複数の放射線ビームの少なくとも1つにより事実上治療可能である
方法。
【請求項83】
前記眼接触部材で前記眼を第1位置に実質的に固定すること、をさらに含んで構成される請求項82記載の方法。
【請求項84】
前記眼接触部材は、前記眼の外部から内部へ電磁放射線の第1波長を伝達する伝達部を含んで構成される請求項82記載の方法。
【請求項85】
前記第1部分は、電磁放射線の第2波長を反射する請求項82記載の方法。
【請求項86】
前記第1部分は、前記眼接触部材内又は前記眼接触部材上の中心に配置される請求項82記載の方法。
【請求項87】
前記複数の放射線ビームの少なくとも1つは、レーザ光を含んで構成される請求項82記載の方法。
【請求項88】
前記複数の放射線ビームの少なくとも1つは、X線を含んで構成される請求項82記載の方法。
【請求項89】
眼の外面に係合する眼接触表面を有し、前記眼を実質的に第1位置に保持する眼ホルダー、
を含んで構成され、
前記眼ホルダーは、前記眼の外部に配置される線源から前記眼に放射線ビームが伝達されている間に、前記眼が実質的に前記第1位置にあることの指示を感知器に提供するように構成される
放射線療法システムによる眼球構造の治療用の患者眼球インタフェース。
【請求項90】
前記眼球インタフェースを通る前記放射線ビームを伝達する物質をさらに含んで構成される請求項89記載の患者眼球インタフェース。
【請求項91】
前記放射線ビームは、レーザ光を含んで構成される請求項90記載の患者眼球インタフェース。
【請求項92】
前記放射線ビームは、X線を含んで構成される請求項90記載の患者眼球インタフェース。
【請求項93】
眼を実質的に安定可能な位置に保持するように適合されるホルダーと、
前記眼の位置を示し及び前記放射線療法システムから照射される放射線ビームの特性を決定する情報を、前記ホルダーと放射線療法システムとの間で伝える通信リンクと、
を含んで構成される放射線療法システムによる眼球構造の治療用の患者眼球インタフェース。
【請求項94】
前記通信リンクは、光の波長の幾つかを反射する反射物質を含んで構成される請求項93記載の患者眼球インタフェース。
【請求項95】
前記情報により決定される前記放射線ビームの特性は、前記放射線ビームの軌道及び照射状態若しくは無照射状態の少なくとも1つを含んで構成される請求項93記載の患者眼球インタフェース。
【請求項96】
前記ホルダーは、前記眼に接触する請求項93記載の患者眼球インタフェース。
【請求項97】
前記ホルダーは、前記眼の外部の表面に取り付け可能である請求項93記載の患者眼球インタフェース。
【請求項98】
前記ホルダーは、前記放射線療法システムに機械的に連結される請求項93記載の患者眼球インタフェース。
【請求項99】
前記放射線療法システムに対する前記通信リンクは、光リンクである請求項93記載の患者眼球インタフェース。
【請求項100】
前記ホルダーは、前記眼の軸に前記放射線療法システムを位置合わせするように適合される請求項93記載の患者眼球インタフェース。
【請求項101】
前記ホルダーは、前記眼の視軸に前記放射線療法システムを位置合わせするように適合される請求項93記載の患者眼球インタフェース。
【請求項102】
前記ホルダーに対する前記眼の位置を視覚化するカメラを、さらに含んで構成される請求項93記載の患者眼球インタフェース。
【請求項103】
前記カメラは、前記眼の動きを検出し、該眼の動きに関するデータをイメージングソフトウェアに伝える請求項102記載の患者眼球インタフェース。
【請求項104】
前記ホルダーは、前記強膜に接触する請求項93記載の患者眼球インタフェース。
【請求項105】
前記ホルダーは、前記角膜に接触する請求項93記載の患者眼球インタフェース。
【請求項106】
前記ホルダーは、少なくとも部分的にX線エネルギーを通さない請求項93記載の患者眼球インタフェース。
【請求項107】
前記ホルダーは、少なくとも部分的にX線エネルギーを通す請求項93記載の患者眼球インタフェース。
【請求項108】
前記ホルダーは、前記眼に対して吸引を適用するように構成される請求項93記載の患者眼球インタフェース。
【請求項109】
網膜から略15cm以内に配置されて使用される少なくとも1つのX線コリメータと、
前記コリメータの長軸に実質的に位置合わせされ、前記眼の表面及び該眼の表面に接触する装置の少なくとも一方に、前記コリメータを通って照射されるX線ビームの方向を示す印を提供するレーザビームを照射するレーザと、
を含んで構成される、患者の眼にX線ビームを送達するシステム。
【請求項110】
前記X線ビームを伝達するX線管の陽極に略10mA〜略800mAの電流を供給するように構成される電源装置をさらに含んで構成される請求項109記載のシステム。
【請求項111】
前記陽極は、固定陽極又は回転陽極である請求項110記載のシステム。
【請求項112】
前記眼に接触し、前記眼の位置を保持するように構成される目接触部材をさらに含んで構成される請求項109記載のシステム。
【請求項113】
疾患の治療に治療上有用な関連放射線量を有する眼球疾患について、眼の外部に配置されてX線ビームを介して放射線量を伝達するX線源から、前記疾患を罹った前記眼組織の標的までの距離を提供すること、及び
前記放射線源から前記標的までの前記距離に基づいて、前記距離により前記放射線源から隔てられている前記標的に対して前記放射線源から照射される前記X線ビームの前記放射線量を達成する上で要求されるエネルギーレベルを出力モジュールに出力すること、
を含んで構成され、
前記エネルギーレベルは、前記放射線源から前記標的への距離に依存する
眼の放射線療法の方法。
【請求項114】
治療される患者の第1疾患に基づいて、放射線療法システムから照射されて推定放射線量を実質的に伝達する放射線ビームのエネルギーレベルを選択すること、及び
前記選択エネルギーレベルの指示を出力モジュールに出力すること、
を含んで構成され、
前記治療される第1疾患は、複数の疾患のうちの1つであり、
前記複数の疾患の夫々は、該複数の疾患の夫々に対する治療放射線量を得る上で、前記複数の疾患のうちの別の疾患に対する治療放射線量を得る上で要求されるエネルギーレベルとは異なるエネルギーレベルを要求する、
放射線で疾患組織を治療する方法。
【請求項115】
前記第1疾患は前記患者の眼に影響を与え、及び、前記放射線ビームは前記眼に向けて照射される請求項114記載の方法。
【請求項116】
前記第1疾患は、前記患者の眼の黄斑変性を含んで構成される請求項114記載の方法。
【請求項117】
前記第1疾患は、前記患者の眼の翼状片を含んで構成される請求項114記載の方法。
【請求項118】
前記第1疾患は、眼球の腫瘍、緑内障、及び前癌病変の少なくとも1つを含んで構成される請求項114記載の方法。
【請求項119】
治療される患者の疾患に基づく選択であって、放射線療法システムから照射されて推定放射線量を実質的に伝達する放射線ビームのエネルギーレベルの選択を含んで構成される入力を受信する処理モジュール
を含んで構成され、
前記治療される第1疾患は、複数の疾患のうちの1つであり、
前記複数の疾患の夫々は、該複数の疾患の夫々に対する治療放射線量を得る上で、前記複数の疾患のうちの別の疾患に対する治療放射線量を得る上で要求されるエネルギーレベルとは異なるエネルギーレベルを要求し、
前記処理モジュールは、前記入力に基づいて、前記選択エネルギーレベルの指示を出力モジュールに出力する
放射線で疾患組織を治療するシステム。
【請求項120】
治療される患者の第1疾患に基づいて、放射線療法システムから照射されて推定放射線量を実質的に伝達する放射線ビームのエネルギーレベルを選択すること、及び
前記選択エネルギーレベルの指示を出力モジュールに出力すること、
を含んで構成され、
前記治療される第1疾患は、複数の疾患のうちの1つであり、
前記複数の疾患の夫々は、該複数の疾患の夫々に対する治療放射線量を得る上で、前記複数の疾患のうちの別の疾患に対する治療放射線量を得る上で要求されるエネルギーレベルとは異なるエネルギーレベル、ビームサイズ、及び表面対深部の比の少なくとも1つを要求する、
放射線で疾患組織を治療する方法。
【請求項121】
放射線源から照射される僅か略6mmの横断面幅を有する放射線ビームをコリメートし、前記放射ビームが放射されるときに、前記放射ビームがたどる第1軸を定義するコリメータと、
前記コリメータにより定義された前記第1軸に位置合わせされる第2軸に沿って、前記第1軸の指示を提供する光ビームを照射する光ガイドと、
を含んで構成される、疾患眼組織を治療する放射線療法システム。
【請求項122】
前記光ビームは、レーザを含んで構成される請求項121記載の放射線療法システム。
【請求項123】
前記コリメータの前記第1軸と前記光ガイドの前記第2軸とは、共線にある請求項121記載の放射線療法システム。
【請求項124】
前記光ガイドは、放射線療法の標的を視覚化し、及び、前記放射線療法システムからの共線X線ビームの伝達をガイドするように、前記眼に差込可能である請求項121記載の放射線療法システム。
【請求項125】
前記光ガイドを差込可能なカニューレをさらに含んで構成される請求項121記載の放射線療法システム。
【請求項126】
前記カニューレは、眼の表面に固定されるように構成される請求項125記載の放射線療法システム。
【請求項127】
放射線を照射する放射線源及び照射された放射線をビームにコリメートするコリメータと、
眼を横断する軸に前記ビームを位置合わせする位置合わせシステムと、
前記ビームが前記軸に位置合わせされていないときに、前記放射線源からの放射線照射を減少させるゲートメカニズムと、
を含んで構成される、放射線で眼を治療するシステム。
【請求項128】
眼底、角膜輪部、角膜、及び眼の表面からの反射の少なくとも1つを検出するイメージ検出システムをさらに含んで構成される請求項127記載のシステム。
【請求項129】
前記イメージ検出システムが閾値を超える前記眼の動きを検出したときに、前記ゲートメカニズムが前記放射線源からの放射線照射を減少させる請求項128記載のシステム。
【請求項130】
治療セッションの間に放射線を照射し、及び、前記照射された放射線を略6mm未満の横断面寸法を有するコリメートビームにコリメートする放射線源と、
前記治療セッションの間に座標系に眼構造の位置を繰り返しマッピングする眼マッピングモジュールと、
を含んで構成される、放射線で眼を治療するシステム。
【請求項131】
前記照射される放射線を眼構造に向けるように前記眼に対して前記放射線源を移動させる放射線源移動器をさらに含んで構成される請求項130記載のシステム。
【請求項132】
前記放射線源は、前記治療セッションの間に、前記眼の位置に対して静止するように構成される請求項130記載のシステム。
【請求項133】
眼構造が前記コリメートビームの経路内にないときに、放射線の照射を減少又は停止させるシステムシャットオフをさらに含んで構成される請求項130記載のシステム。
【請求項134】
前記眼構造が前記コリメートビームの経路内にあるように前記眼を実質的に保持するホルダーをさらに含んで構成される請求項130記載のシステム。
【請求項135】
眼の生体測定パラメータを含んで構成される入力を受信する処理モジュール、を含んで構成され、
前記処理モジュールは、前記生体測定パラメータに基づいて、前記眼の強膜上に照射されるX線ビームの方向を電動システムに出力する
眼に放射線を伝達する計画システム。
【請求項136】
前記生体測定パラメータは、眼球軸長、前眼房深度、角膜厚、及び角膜直径の少なくとも1つを含んで構成される請求項135記載のシステム。
【請求項137】
少なくとも部分的に患者の眼のイメージデータを取得すること、
前記イメージデータに基づいて、前記患者の眼の黄斑位置を特定すること、
前記眼の内部又は表面に配置される基準マーカーの第1位置を特定すること、
前記基準マーカーの前記第1位置に対して、座標系に前記黄斑の位置をマッピングし、前記座標系における前記黄斑のマッピング位置を生成すること、
前記黄斑のマッピング位置に基づいて、前記黄斑に放射線を照射する放射線源を配置すること、
前記配置された放射線源から前記黄斑に放射線を照射すること、
を含んで構成される、患者の眼に放射線を適用する方法。
【請求項138】
前記患者の強膜に接触する接触レンズが前記基準マーカーを含んで構成される請求項137記載の方法。
【請求項139】
前記患者の角膜に接触する接触レンズが前記基準マーカーを含んで構成される請求項137記載の方法。
【請求項140】
前記座標系に基づいて、前記放射線源の配置が自動化される請求項137記載の方法。
【請求項141】
前記基準マーカーの第2位置への移動に基づいて前記放射線源を再配置すること、をさらに含んで構成される請求項137記載の方法。
【請求項142】
前記放射線源の再配置後に、前記放射線源から前記黄斑に追加の放射線ビームを照射すること、をさらに含んで構成される請求項141記載の方法。
【請求項143】
前記黄斑の位置をマッピングした後に、前記眼の動きを検出すること、をさらに含んで構成される請求項137記載の方法。
【請求項144】
前記眼の動きを検出した後に、前記黄斑の新たな位置と座標系との間の相対的な関係を決定すること、をさらに含んで構成される請求項143記載の方法。
【請求項145】
前記放射線源の位置を変更するポジショナに対して前記黄斑の新たな位置情報を中継すること、をさらに含んで構成される請求項144記載の方法。
【請求項146】
前記眼のドルーゼの領域に前記放射線を適用すること、をさらに含んで構成される請求項137記載の方法。
【請求項147】
前記放射線を照射することは、放射線ビームを照射すること、含んで構成される請求項137記載の方法。
【請求項148】
少なくとも1つの追加の放射線ビームを前記黄斑に適用すること、をさらに含んで構成される請求項147記載の方法。
【請求項149】
前記放射線ビーム及び前記少なくとも1つの追加の放射線ビームは、同時に照射される請求項148記載の方法。
【請求項150】
前記放射線ビーム及び前記少なくとも1つの追加の放射線ビームは、前記黄斑を含む組織のボリュームと交差するように向けられる請求項148記載の方法。
【請求項151】
網膜のイメージデータを取得することは、三角測量法、干渉分光法、及び位相シフト法の少なくとも1つを含んで構成される請求項137記載の方法。
【請求項152】
前記イメージデータは、コンピュータトモグラフィー、磁気共鳴映像法(MRI)、光コヒーレンストモグラフィー、及びポジトロンエミッショントモグラフィーの少なくとも1つにより取得される請求項137記載の方法。
【請求項153】
少なくとも部分的に患者の眼のイメージデータを取得すること、
前記イメージデータに基づいて、前記患者の眼の黄斑位置を特定すること、
前記眼の前部構造の第1位置を特定すること、
前記眼の前部構造の前記第1位置に対して、座標系に前記黄斑の位置をマッピングし、前記座標系における前記黄斑のマッピング位置を作成すること、
前記座標系における前記黄斑マッピング位置に基づいて、前記黄斑に放射線量を照射する放射線源を配置すること、及び
前記配置された放射線源から前記黄斑に放射線ビームを照射すること、
を含んで構成される、患者の眼に放射線を適用する方法。
【請求項154】
前記眼の前部構造は、強膜を含んで構成される請求項153記載の方法。
【請求項155】
前記眼の前部構造は、角膜、前眼房、虹彩、結膜、瞳孔、虹彩角膜角、小柱網、水晶体包、人工水晶体、毛様体、毛様体筋、角膜輪部、毛様体扁平部、強膜輪、及び眼の水晶体の少なくとも1つを含んで構成される請求項153記載の方法。
【請求項156】
前記前部構造の第2位置への移動に基づいて、前記放射線源を再配置すること、をさらに含んで構成される請求項153記載の方法。
【請求項157】
前記放射線源の再配置後に、前記放射線源から前記黄斑に追加の放射線ビームを照射すること、をさらに含んで構成される請求項156記載の方法。
【請求項158】
網膜のイメージデータを取得することは、三角測量法、干渉分光法、及び位相シフト法の少なくとも1つを含んで構成される請求項153記載の方法。
【請求項159】
略40keV〜略250keVの光子エネルギーを有する略0.5mm〜略6mm幅のX線ビームを生成すること、
前記X線ビームを前記眼の領域に向けること、及び
略1Gy〜略40GyのX線放射線量で前記領域を照射し、前記眼の領域を治療すること、
を含んで構成される、患者の眼の領域を治療する方法。
【請求項160】
イメージ装置により取得される解剖学的データを有する前記眼のモデルを提供すること、をさらに含んで構成され、
前記X線ビームの幅、前記X線ビームの光子エネルギー、及び前記X線ビームの方向の少なくとも1つが、前記眼のモデルに基づいて決定される
請求項159記載の方法。
【請求項161】
前記領域は、略15Gy〜略25GyのX線放射で照射される請求項159記載の方法。
【請求項162】
前記領域は、前記眼の網膜を含んで構成される請求項159記載の方法。
【請求項163】
前記治療することは、前記網膜に前記放射線を照射することにより前記眼の新生血管を減少させること、を含む請求項162記載の方法。
【請求項164】
前記眼の領域を治療することは、乾性加齢黄斑変性から新生血管形成への進行を実質的に防止すること、を含む請求項162記載の方法。
【請求項165】
加熱、冷却、VEGFアンタゴニスト、VEGF受容体アンタゴニスト、VEGF又はVEGF受容体に対する抗体、マイクロ波エネルギー、高周波エネルギー、レーザ、光力学的物質、放射線力学的物質及び治療薬の少なくとも1つを前記患者に施すこと、をさらに含んで構成される請求項159記載の方法。
【請求項166】
前記眼の外部の第1位置から強膜を通り網膜に至るように第1X線ビームを向けること、及び、前記眼の外部の第2位置から前記強膜を通り前記網膜に至るように第2X線ビームを向けること、をさらに含んで構成される請求項159記載の方法。
【請求項167】
前記X線ビームは、前記眼の毛様体扁平部を通るように向けられる請求項159記載の方法。
【請求項168】
前記X線ビームは、前記眼の黄斑に向けられる請求項159記載の方法。
【請求項169】
前記X線ビームは、前記眼の強膜を通り前記眼の黄斑に至るように向けられる請求項159記載の方法。
【請求項170】
前記線量は、2以上のビームに分割される請求項159記載の方法。
【請求項171】
前記線量は2以上の治療セッションに分割され、該治療セッションの夫々は少なくとも1日間隔で行われる請求項159記載の方法。
【請求項172】
前記領域に前記X線放射を照射する間に、前記X線ビームに対する前記眼の位置を決定すること、をさらに含んで構成される請求項159記載の方法。
【請求項173】
前記眼の位置が移動閾値を超えると、前記X線ビームをシャットオフすること、をさらに含んで構成される請求項172記載の方法。
【請求項174】
イメージ装置により取得される解剖学的データに基づいて眼モデルを提供すること、
略0.5mm〜略6mmのビーム幅を夫々有する第1X線ビーム及び第2X線ビームを生成すること、
前記第1ビームが前記眼の強膜における第1領域を通過して網膜の標的に至るように前記第1X線ビームを向けること、並びに
前記第2ビームが前記強膜における第2領域を通過して前記網膜における実質的に前記第1ビームと同一の標的に至るように前記第2X線ビームを向けること、
を含んで構成され、
前記第1ビーム及び第2ビームが通過する前記強膜における前記第1領域及び第2領域は、前記眼モデルに基づいて選択される
患者の眼を治療する方法。
【請求項175】
前記第1X線ビームの軌道は、前記眼モデルに基づいて決定される請求項174記載の方法。
【請求項176】
前記第1X線ビームを向けること及び前記第2X線ビームを向けることは、連続して行われる請求項174記載の方法。
【請求項177】
前記第1X線ビーム及び前記第2X線ビームは、略25keV〜略100keVの光子エネルギーを有する請求項174記載の方法。
【請求項178】
前記第1X線ビーム及び前記第2X線ビームの中心は、前記眼の角膜輪部から略0.5mm〜略6mmの距離で強膜上のポイントを通して投射される請求項174記載の方法。
【請求項179】
前記第1X線ビームを向ける前に、加熱、冷却、VEGFアンタゴニスト、VEGF−受容体アンタゴニスト、VEGF又はVEGF受容体に対する抗体、マイクロ波エネルギー、高周波エネルギー、レーザ、光力学物質、放射線力学物質及び治療薬の少なくとも1つを前記患者に施すこと、をさらに含んで構成される請求項174記載の方法。
【請求項180】
前記X線ビームは、前記網膜から略50cm未満に配置されるX線源により生成される請求項174記載の方法。
【請求項181】
前記X線ビームは、前記眼から略10cm以内に配置される線源の端部から照射される請求項174記載の方法。
【請求項182】
前記網膜は、前記治療の1セッションの間に、略15Gy〜略25GyのX線放射が照射される請求項174記載の方法。
【請求項183】
イメージ装置により取得される解剖学的データに基づいて眼モデルを提供すること、
略0.5mm〜略6mmのビーム幅を夫々有する第1X線ビーム及び第2X線ビームを生成すること、
前記第1ビームが前記眼の第1領域を通過して前記眼内の標的に至るように前記第1X線ビームを向けること、並びに
第2ビームが前記眼の第2領域を通過して前記眼内の実質的に同一の標的に至るように前記第2X線ビームを向けること、
を含んで構成され、
前記第1ビーム及び前記第2ビームが通過する前記眼の前記第1領域及び第2領域は、前記眼モデルに基づいて選択される
患者の眼を治療する方法。
【請求項184】
前記標的は、前記眼の後水晶体包を含んで構成される請求項183記載の方法。
【請求項185】
前記標的は、前記眼の小柱網を含んで構成される請求項183記載の方法。
【請求項186】
前記標的は、前記網膜の領域を含んで構成される請求項183記載の方法。
【請求項187】
前記標的は、腫瘍を含んで構成される請求項183記載の方法。
【請求項188】
前記第1領域は、前記眼の角膜を含んで構成される請求項183記載の方法。
【請求項189】
前記第1X線ビーム及び前記第2X線ビームは、略25keV〜略100keVの光子エネルギーを有する請求項183記載の方法。
【請求項190】
前記第1X線ビーム及び前記第2X線ビームは、前記眼から略10cm以内に配置されるコリメータによりコリメートされる請求項183記載の方法。
【請求項191】
前記第1X線ビーム及び前記第2X線ビームは、前記眼から略10cm以内に配置されるX線源により生成される請求項183記載の方法。
【請求項192】
前記X線源を前記眼の50cm以内に動かすこと、をさらに含んで構成される請求項183記載の方法。
【請求項193】
前記X線源を前記眼の40cm以内に動かすこと、をさらに含んで構成される請求項183記載の方法。
【請求項194】
前記X線源を前記眼の10cm以内に動かすこと、をさらに含んで構成される請求項183記載の方法。
【請求項195】
前記眼の前記第1領域は、強膜の第1領域を含んで構成され、前記眼の前記第2領域は、前記強膜の第2領域を含んで構成され、及び、前記強膜の第1領域から前記強膜の第2領域の端〜端の距離が略0.1mm〜略2mmである請求項183記載の方法。
【請求項196】
前記第1X線ビーム及び前記第2X線ビームは、前記眼の外部の鼻部から向けられる請求項183記載の方法。
【請求項197】
X線放射線療法システムを前記患者の眼の中心に位置合わせすること、をさらに含んで構成される請求項183記載の方法。
【請求項198】
前記眼モデルを用いて前記黄斑領域を治療する計画を作成すること、をさらに含んで構成され、
前記第1X線ビーム及び前記第2X線ビームは前記黄斑領域で重ねあわされ、及び、前記第1X線ビーム及び前記第2X線ビームは略0.5mm〜略6mmにコリメートされる
請求項183記載の方法。
【請求項199】
イメージ装置により取得される解剖学的データに基づいて眼モデルを提供すること、
第1ビームが前記眼の第1領域を通過して前記眼内の標的に至るように前記第1X線ビームを向けること、
第2ビームが前記眼の第2領域を通過して前記眼内の実質的に同一の標的に至るように前記第2X線ビームを向けること、
前記標的に対する前記第1X線ビームの照射、前記標的に対する前記第2X線ビームの照射、及び前記標的に対する前記第1X線ビームの照射と前記標的に対する前記第2X線ビームの照射との間の期間、の少なくとも1つの間に、前記眼の位置を評価すること、
を含んで構成され、
前記第1ビーム及び前記第2ビームが通過する前記第1領域及び第2領域は、前記眼モデルに基づいて選択される
患者の眼を治療する方法。
【請求項200】
前記評価することは、前記標的に対する前記第1X線ビームの照射の間に行われ、
前記眼が移動閾値を超えて動いたときに、前記第1X線ビームの照射を停止又は減少させること、をさらに含んで構成される請求項199記載の方法。
【請求項201】
前記眼の位置を評価することから得られる情報に基づいて、前記第2X線ビームを向けること、をさらに含んで構成される請求項199記載の方法。
【図1A】


【図1B】


【図1C】


【図1D】


【図1E】


【図1F】


【図1G】


【図1H】


【図1I】


【図1J】


【図1K】


【図2A】


【図2B−1】


【図2B−2】


【図2B−3】


【図2B−4】


【図2C】


【図2D】


【図2E】


【図2F】


【図2G】


【図2H】


【図3A】


【図3B】


【図4】


【図5】


【図6】


【図7A】


【図7B】


【図7C】


【図7D】


【図7E】


【図7F】


【図8】


【図9】


【図10】


【図11A1】


【図11A2】


【図11B】


【図11C】


【図11D】


【図11E】


【図11F】


【図11G】


【図11H】


【図11I】


【図11J】


【図12A】


【図12B】


【図12C】


【図12D】




【図1B】


【図1C】


【図1D】


【図1E】


【図1F】


【図1G】


【図1H】


【図1I】


【図1J】


【図1K】


【図2A】


【図2B−1】


【図2B−2】


【図2B−3】


【図2B−4】


【図2C】


【図2D】


【図2E】


【図2F】


【図2G】


【図2H】


【図3A】


【図3B】


【図4】


【図5】


【図6】


【図7A】


【図7B】


【図7C】


【図7D】


【図7E】


【図7F】


【図8】


【図9】


【図10】


【図11A1】


【図11A2】


【図11B】


【図11C】


【図11D】


【図11E】


【図11F】


【図11G】


【図11H】


【図11I】


【図11J】


【図12A】


【図12B】


【図12C】


【図12D】


【公表番号】特表2010−506689(P2010−506689A)
【公表日】平成22年3月4日(2010.3.4)
【国際特許分類】
【出願番号】特願2009−533492(P2009−533492)
【出願日】平成19年10月16日(2007.10.16)
【国際出願番号】PCT/US2007/081569
【国際公開番号】WO2008/118198
【国際公開日】平成20年10月2日(2008.10.2)
【出願人】(509108995)オラヤ セラピューティクス,インコーポレーテッド (2)
【氏名又は名称原語表記】ORAYA THERAPEUTICS, INC.
【Fターム(参考)】
【公表日】平成22年3月4日(2010.3.4)
【国際特許分類】
【出願日】平成19年10月16日(2007.10.16)
【国際出願番号】PCT/US2007/081569
【国際公開番号】WO2008/118198
【国際公開日】平成20年10月2日(2008.10.2)
【出願人】(509108995)オラヤ セラピューティクス,インコーポレーテッド (2)
【氏名又は名称原語表記】ORAYA THERAPEUTICS, INC.
【Fターム(参考)】
[ Back to top ]

