眼の疾患及び障害の治療のための5−(1H−ピラゾール−5−イル)チアゾール系化合物
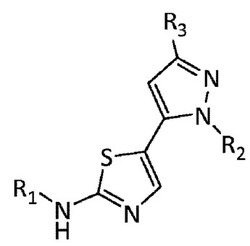
LIMキナーゼ2の阻害剤が、これらを含む医薬組成物及びその使用方法とともに開示される。特定の化合物は、式(I)の化合物である。
【化1】

【化1】

【発明の詳細な説明】
【技術分野】
【0001】
1. 発明の分野
本発明は、キナーゼ阻害剤、それらを含む組成物、並びに様々な疾患及び障害を治療するためのそれらの使用の方法に関する。
【背景技術】
【0002】
2. 背景
タンパク質キナーゼは、ATPから受容タンパク質へのγ−リン酸基の移動を触媒する酵素群である。ヒトゲノムは、500種類を超える様々なタンパク質キナーゼをコードすると推測されており、それらのキナーゼのうち多くががん及び炎症を含む広範な疾患及び障害に関与している。
【0003】
LIMキナーゼ(LIMK)は、p53経路と結び付いている。例えば、特許文献1を参照されたい。LIMKは、2つのN末端LIMモチーフと1つのC末端タンパク質キナーゼドメインとの特有の組合せを有する小さなサブファミリーのキナーゼに属する。これらのLIMモチーフ及びキナーゼドメインは、幾つかの推定カゼインキナーゼ認識部位及びmapキナーゼ認識部位を含有する高プロリン領域及び高セリン領域により連結されている。LIMキナーゼ及びそれらの経路タンパク質は、アクチン細胞骨格のRho誘導性の再組織化に寄与すると考えられている(同上)。LIMキナーゼファミリー成員には、LIMキナーゼ1(LIMK1)及びLIMキナーゼ2(LIMK2)が含まれる。その両方がコフィリンをリン酸化し、Rhoファミリー依存性のアクチン細胞骨格の再構成(rearrangement)を調節する(同上)。
【0004】
LIMキナーゼ阻害剤ががんの治療に提唱されている(同上、特許文献2、非特許文献1、非特許文献2)。LIMK阻害剤が、柱細胞(trabecular cells)におけるアクチン脱重合を促進すること及び眼圧を低下させることによって、緑内障を治療するのに有用であり得ることも示唆されている。特許文献3を参照されたい。特許文献4及び特許文献5も参照されたい。現在の緑内障療法は、様々なメカニズムにより効果を発揮する。プロスタグランジンF2a類似体(例えば、ラタノプロスト)は、眼からの流体流出の眼内圧(IOP)非依存性の増大をもたらす。炭酸脱水酵素(Carbonic anhydrous)阻害剤(例えば、アセタゾールアミド)、β−ブロッカー(例えば、チモロール)、交感神経模倣薬(例えば、ピロカルピン)、及びαアドレナリン受容体アゴニスト(例えば、ブリモニジン)は、房水産生を減少させる。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】国際公開第02/099048号
【特許文献2】国際公開第2003003016号
【特許文献3】国際公開第04/047868号
【特許文献4】米国特許出願公開第2009−0042893号
【特許文献5】米国特許出願公開第2009−0264450号
【非特許文献】
【0006】
【非特許文献1】Stanyon, Clement A. and Bernard, Ora., Int. J. Biochem. & Cell Biol. 31(3/4): 389-394 (1999)
【非特許文献2】Yoshioka, Kiyoko et al., Proc. National Acad. Sci. USA 100(12): 7247-7252 (2003)
【発明の概要】
【0007】
3. 発明の概要
本発明は一部には、式:
【0008】
【化1】

【0009】
の化合物、及びそれらの薬学的に許容される塩に関し、その置換基が本明細書で規定される。特定の化合物は、LIMK2の強力な阻害剤である。
【0010】
本発明の一つの実施の形態は、本明細書で開示の化合物を含む医薬製剤(formulations)を包含する。
【0011】
別の実施の形態は、緑内障、神経変性及び感染症等の視力に影響を及ぼす様々な疾患及び障害(例えば、眼の疾患及び障害)の治療、管理及び予防のために本明細書に開示の化合物を使用する方法を包含する。
【図面の簡単な説明】
【0012】
4. 図面の簡単な説明
【図1】以下の実施例に記載の眼圧亢進アッセイにおける本発明の化合物(S)−N−(5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)チアゾール−2−イル)−2−(ピロリジン−2−イル)アセトアミドの用量応答を示す図である。
【発明を実施するための形態】
【0013】
5. 詳細な説明
5.1. 定義
特に明示のない限り、「アルケニル」という用語は、2〜20(例えば、2〜10又は2〜6)個の炭素原子を有し、少なくとも1つの炭素−炭素二重結合を含む直鎖、分岐鎖及び/又は環式の炭化水素を意味する。代表的なアルケニル部分としては、ビニル、アリル、1−ブテニル、2−ブテニル、イソブチレニル、1−ペンテニル、2−ペンテニル、3−メチル−1−ブテニル、2−メチル−2−ブテニル、2,3−ジメチル−2−ブテニル、1−ヘキセニル、2−ヘキセニル、3−ヘキセニル、1−ヘプテニル、2−ヘプテニル、3−ヘプテニル、1−オクテニル、2−オクテニル、3−オクテニル、1−ノネニル、2−ノネニル、3−ノネニル、1−デセニル、2−デセニル及び3−デセニルが挙げられる。
【0014】
特に明示のない限り、「アルコキシ」という用語は、−O−アルキル基を意味する。アルコキシ基の例としては、−OCH3、−OCH2CH3、−O(CH2)2CH3、−O(CH2)3CH3、−O(CH2)4CH3及び−O(CH2)5CH3が挙げられるが、これらに限定されない。
【0015】
特に明示のない限り、「アルキル」という用語は、1〜20(例えば、1〜10又は1〜4)個の炭素原子を有する直鎖、分岐鎖及び/又は環式(「シクロアルキル」)の炭化水素を意味する。1個〜4個の炭素を有するアルキル部分は「低級アルキル」と称される。アルキル基の例としては、メチル、エチル、プロピル、イソプロピル、n−ブチル、t−ブチル、イソブチル、ペンチル、ヘキシル、イソヘキシル、ヘプチル、4,4−ジメチルペンチル、オクチル、2,2,4−トリメチルペンチル、ノニル、デシル、ウンデシル及びドデシルが挙げられるが、これらに限定されない。シクロアルキル部分は単環式又は多環式であってもよく、例としてはシクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル及びアダマンチルが挙げられる。アルキル部分の更なる例は直鎖部分、分岐鎖部分及び/又は環式部分(例えば、1−エチル−4−メチル−シクロヘキシル)を有する。「アルキル」という用語は飽和炭化水素、並びにアルケニル部分及びアルキニル部分を含む。
【0016】
特に明示のない限り、「アルキルアリール」又は「アルキル−アリール」という用語は、アリール部分と結合したアルキル部分を意味する。
【0017】
特に明示のない限り、「アルキルヘテロアリール」又は「アルキル−ヘテロアリール」という用語は、ヘテロアリール部分と結合したアルキル部分を意味する。
【0018】
特に明示のない限り、「アルキル複素環」又は「アルキル−複素環」という用語は、複素環部分と結合したアルキル部分を意味する。
【0019】
特に明示のない限り、「アルキニル」という用語は、2〜20(例えば、2〜20又は2〜6)個の炭素原子を有し、少なくとも1つの炭素−炭素三重結合を含む直鎖、分岐鎖又は環式の炭化水素を意味する。代表的なアルキニル部分としては、アセチレニル、プロピニル、1−ブチニル、2−ブチニル、1−ペンチニル、2−ペンチニル、3−メチル−1−ブチニル、4−ペンチニル、1−ヘキシニル、2−ヘキシニル、5−ヘキシニル、1−ヘプチニル、2−ヘプチニル、6−ヘプチニル、1−オクチニル、2−オクチニル、7−オクチニル、1−ノニニル、2−ノニニル、8−ノニニル、1−デシニル、2−デシニル及び9−デシニルが挙げられる。
【0020】
特に明示のない限り、「アリール」という用語は、炭素原子及びH原子で構成される芳香環、又は芳香族若しくは部分芳香族の環系を意味する。アリール部分はともに結合又は融合した複数の環を含んでいてもよい。アリール部分の例としては、アントラセニル、アズレニル、ビフェニル、フルオレニル、インダン、インデニル、ナフチル、フェナントレニル、フェニル、1,2,3,4−テトラヒドロ−ナフタレン及びトリルが挙げられるが、これらに限定されない。
【0021】
特に明示のない限り、「アリールアルキル」又は「アリール−アルキル」という用語は、アルキル部分と結合したアリール部分を意味する。
【0022】
特に明示のない限り、「ハロゲン」及び「ハロ」という用語は、フッ素、塩素、臭素及びヨウ素を包含する。
【0023】
特に明示のない限り、「ヘテロアルキル」という用語は、炭素原子の少なくとも1つがヘテロ原子(例えば、N、O又はS)で置き換えられたアルキル部分(例えば、直鎖、分岐鎖又は環式)を表す。
【0024】
特に明示のない限り、「ヘテロアルキルアリール」又は「ヘテロアルキル−アリール」という用語は、アルキル部分と結合したヘテロアルキル部分を表す。
【0025】
特に明示のない限り、「ヘテロアルキル複素環」又は「ヘテロアルキル−複素環」という用語は、複素環部分と結合したヘテロアルキル部分を表す。
【0026】
特に明示のない限り、「ヘテロアリール」という用語は、炭素原子の少なくとも1つがヘテロ原子(例えば、N、O又はS)で置き換えられたアリール部分を意味する。例としては、アクリジニル、ベンゾイミダゾリル、ベンゾフラニル、ベンゾイソチアゾリル、ベンゾイソオキサゾリル、ベンゾキナゾリニル、ベンゾチアゾリル、ベンゾオキサゾリル、フリル、イミダゾリル、インドリル、イソチアゾリル、イソオキサゾリル、オキサジアゾリル、オキサゾリル、フタラジニル、ピラジニル、ピラゾリル、ピリダジニル、ピリジル、ピリミジニル、ピリミジル、ピロリル、キナゾリニル、キノリニル、テトラゾリル、チアゾリル及びトリアジニルが挙げられるが、これらに限定されない。
【0027】
特に明示のない限り、「ヘテロアリールアルキル」又は「ヘテロアリール−アルキル」という用語は、アルキル部分と結合したヘテロアリール部分を意味する。
【0028】
特に明示のない限り、「複素環」という用語は、炭素、H及び少なくとも1つのヘテロ原子(例えば、N、O又はS)で構成される芳香族、部分芳香族、又は非芳香族の単環式又は多環式の環又は環系を表す。複素環は、ともに融合又は結合した複数(すなわち2つ以上)の環を含み得る。複素環はヘテロアリールを含む。例としては、ベンゾ[1,3]ジオキソリル、2,3−ジヒドロ−ベンゾ[1,4]ジオキシニル、シンノリニル、フラニル、ヒダントイニル、モルホリニル、オキセタニル、オキシラニル、ピペラジニル、ピペリジニル、ピロリジノニル、ピロリジニル、テトラヒドロフラニル、テトラヒドロピラニル、テトラヒドロピリジニル、テトラヒドロピリミジニル、テトラヒドロチオフェニル、テトラヒドロチオピラニル及びバレロラクタミルが挙げられるが、これらに限定されない。
【0029】
特に明示のない限り、「複素環アルキル」又は「複素環−アルキル」という用語は、アルキル部分と結合した複素環部分を表す。
【0030】
特に明示のない限り、「ヘテロシクロアルキル」という用語は、非芳香族の複素環を表す。
【0031】
特に明示のない限り、「ヘテロシクロアルキルアルキル」又は「ヘテロシクロアルキル−アルキル」という用語は、アルキル部分と結合したヘテロシクロアルキル部分を表す。
【0032】
特に明示のない限り、「LIMK2 IC50」という用語は、以下の実施例に記載のin vitroヒトLIMキナーゼ2阻害アッセイを使用して決定した化合物のIC50である。
【0033】
特に明示のない限り、「管理する(manage)」、「管理すること(managing)」及び「管理(management)」という用語は、特定の疾患若しくは障害に既に罹患した患者において疾患若しくは障害の再発を予防すること、及び/又は疾患若しくは障害に罹患している患者が寛解期にある時間を延長させることを包含する。この用語は、疾患若しくは障害の閾値、発症及び/若しくは継続期間を調節すること、又は患者の疾患若しくは障害に対する応答の仕方を変えることを包含する。
【0034】
特に明示のない限り、「薬学的に許容される塩」という用語は、薬学的に許容される非毒性の酸又は塩基(無機酸及び無機塩基並びに有機酸及び有機塩基を含む)から調製される塩を表す。好適な薬学的に許容される塩基付加塩としては、アルミニウム、カルシウム、リチウム、マグネシウム、カリウム、ナトリウム及び亜鉛から生成される金属塩、又はリジン、N,N’−ジベンジルエチレンジアミン、クロロプロカイン、コリン、ジエタノールアミン、エチレンジアミン、メグルミン(N−メチルグルカミン)及びプロカインから生成される有機塩が挙げられるが、これらに限定されない。好適な非毒性の酸としては、酢酸、アルギン酸、アントラニル酸、ベンゼンスルホン酸、安息香酸、カンファースルホン酸、クエン酸、エテンスルホン酸、ギ酸、フマル酸、フロ酸、ガラクツロン酸、グルコン酸、グルクロン酸、グルタミン酸、グリコール酸、臭化水素酸、塩酸、イセチオン酸、乳酸、マレイン酸、リンゴ酸、マンデル酸、メタンスルホン酸、ムチン酸、硝酸、パモン酸、パントテン酸、フェニル酢酸、リン酸、プロピオン酸、サリチル酸、ステアリン酸、コハク酸、スルファニル酸、硫酸、酒石酸及びp−トルエンスルホン酸等の無機酸及び有機酸が挙げられるが、これらに限定されない。具体的な非毒性酸としては、塩酸、臭化水素酸、リン酸、硫酸、及びメタンスルホン酸が挙げられる。したがって、具体的な塩の例としては、塩酸塩及びメシル酸塩が挙げられる。他のものも当該技術分野において既知である。例えば、Remington's Pharmaceutical Sciences(第18版、Mack Publishing, Easton PA: 1990)、及びRemington: The Science and Practice of Pharmacy(第19版、Mack Publishing, Easton PA: 1995)を参照されたい。
【0035】
特に明示のない限り、「強力なLIMK2阻害剤」は、LIMK2 IC50が約250nM未満である化合物である。
【0036】
特に明示のない限り、「予防する(prevent)」、「予防すること(preventing)」及び「予防(prevention)」という用語は、患者が特定の疾患又は障害に罹患し始める前に行う処置を意図するものであり、疾患又は障害の重症度を抑制又は低減する。換言すると、この用語は予防法を包含する。
【0037】
特に明示のない限り、化合物の「予防的に有効な量」は、疾患若しくは病態、若しくは疾患若しくは病態に関連する1つ若しくは複数の症状を予防するのに、又はその再発を予防するのに十分な量である。化合物の「予防的に有効な量」は、単独で又は他の薬剤と組み合わせて、疾患の予防において予防的利点をもたらす治療剤の量を意味する。「予防的に有効な量」という用語は、予防法を全体的に改善する、又は別の予防剤の予防的な有効性を高める量を包含し得る。
【0038】
特に明示のない限り、「置換された」という用語は、化学構造又は部分を説明するために使用する場合は、H原子の1つ又は複数が、アルコール、アルデヒド、アルコキシ、アルカノイルオキシ、アルコキシカルボニル、アルケニル、アルキル(例えば、メチル、エチル、プロピル、t−ブチル)、アルキニル、アルキルカルボニルオキシ(−OC(O)アルキル)、アミド(例えば、−C(O)NH−アルキル−、−アルキルNHC(O)アルキル)、アミジニル(例えば、−C(NH)NH−アルキル−、−C(NR)NH2)、アミン(アルキルアミノ、アリールアミノ、アリールアルキルアミノ等の第1級、第2級及び第3級のアミン)、アロイル、アリール、アリールオキシ、アゾ、カルバモイル(例えば、−NHC(O)O−アルキル−、−OC(O)NH−アルキル)、カルバミル(例えば、CONH2、CONH−アルキル、CONH−アリール、CONH−アリールアルキル)、カルボニル、カルボキシル、カルボン酸、カルボン酸無水物、カルボン酸塩化物、シアノ、エステル、エポキシド、エーテル(例えば、メトキシ、エトキシ)、グアニジノ、ハロ、ハロアルキル(例えば、−CCl3、−CF3、−C(CF3)3)、ヘテロアルキル、ヘミアセタール、イミン(第1級及び第2級)、イソシアネート、イソチオシアネート、ケトン、ニトリル、ニトロ、オキソ、ホスホジエステル、スルフィド、スルホンアミド(例えば、SO2NH2)、スルホン、スルホニル(アルキルスルホニル、アリールスルホニル及びアリールアルキルスルホニルを含む)、スルホキシド、チオール(例えば、スルフヒドリル、チオエーテル)並びに尿素(例えば、−NHCONH−アルキル−)等の(しかしこれらに限定されない)化学的部分又は官能基で置換された、その構造又は部分の誘導体を表す。
【0039】
特に明示のない限り、化合物の「治療的に有効な量」は、疾患若しくは病態の治療若しくは管理において治療的利点をもたらすのに、又は疾患若しくは病態に関連した1つ若しくは複数の症状を遅延させる若しくは最小限に抑えるのに十分な量である。化合物の「治療的に有効な量」は、疾患又は病態の治療又は管理に治療的利点をもたらす、単独の又は他の療法と組み合わせた治療剤の量を意味する。「治療的に有効な量」という用語は、療法を全体的に改善するか、疾患若しくは病態の症状若しくは原因を低減若しくは回避するか、又は別の治療剤の治療的な有効性を高める量を包含し得る。
【0040】
特に明示のない限り、「治療する(treat)」、「治療すること(treating)」及び「治療(treatment)」という用語は、患者が特定の疾患又は障害に罹患している間に行う処置を意図し、これによって疾患若しくは障害の重症度が低減するか、又は疾患若しくは障害の進行が遅延若しくは減速する。
【0041】
特に明示のない限り、「挙げられる(含む)(include)」という用語は、「挙げられる(含む)が、これらに限定されない」と同じ意味を有し、「挙げられる(含む)(includes)」という用語は、「挙げられる(含む)が、これらに限定されない」と同じ意味を有する。同様に、「等の(such as)」という用語は、「等の(しかしこれらに限定されない)」という用語と同じ意味を有する。
【0042】
特に明示のない限り、一連の名詞の直前にくる1つ又は複数の形容詞は、それぞれの名詞を修飾するものとして解釈される。例えば、「必要に応じて置換されたアルキル(alkyl)、アリール又はヘテロアリール」という語句は、「必要に応じて置換されたアルキル、必要に応じて置換されたアリール、又は必要に応じて置換されたヘテロアリール」と同じ意味を有する。
【0043】
より大きい化合物の一部分を形成する化学的部分は、単一分子として存在する場合に一般的に指す名称、又はその基を一般的に指す名称を使用して本明細書に記載されることがあることに留意すべきである。例えば、「ピリジン」及び「ピリジル」という用語は、他の化学的部分と結合した部分を記載するのに使用する場合に、同じ意味を表す。したがって、「XOH(式中、Xはピリジルである)」及び「XOH(式中、Xはピリジンである)」という2つの語句には同じ意味が与えられ、化合物ピリジン−2−オール、ピリジン−3−オール及びピリジン−4−オールを包含する。
【0044】
或る構造又は或る構造の一部分の立体化学が例えば太線又は破線で示されない場合、その構造又はその構造の一部分はその全ての立体異性体を包含すると解釈されることにも留意すべきである。さらに、満たされていない原子価を有することが図で示された任意の原子はこの原子価を満たすのに十分なH原子と結合していると推測される。さらに、一本の破線と平行した一本の実線で示された化学結合は、原子価が許容する場合、単結合及び二重結合の両方(例えば、芳香族結合)を包含する。
【0045】
5.2. 化合物
本発明は、式:
【0046】
【化2】

【0047】
(式中、R1がH、C(O)RA、S(O)nRA、C(O)NRARB、S(O)nNRARB、S(O)nORA、C(NH)NRARB、C(O)ORA、C(S)NRARB、C(SRB)NRA、P(O)(ORA)2、又は必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換された)アルキル、アリール若しくは複素環であり、R2がH、C(O)RA、S(O)nRA、C(O)NRARB、S(O)nNRARB、S(O)nORA、又は必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換された)アルキル、アリール若しくは複素環であり、R3がH、ハロゲン、OR、NRARB、必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、ヒドロキシル、シアノ、NRARB、SRA、CO2RA、C(O)NRARBで置換された)アルキルであり、各RAが独立して、H、若しくは必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換された)アルキル、アリール、アルキルアリール若しくはアルキル−複素環であり、各RBが、必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換された)アルキル若しくはアリールであり、又はRA及びRBが同じ窒素原子と結合する場合、RA及びRBは該窒素原子とともに、必要に応じて置換された複素環(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換されたピペリジニル、モルホリノ、チオモルホリノ、ピペラジニル、ピロリジノ及びアゼチジノ)を形成することができ、nが0〜2である)の化合物、及びその薬学的に許容される塩を包含する。
【0048】
特定の実施形態では、上記化合物は、以下のうちの1つ又は複数が当てはまるようなものである:R1がC(O)RAであり、R2がCHF2であり、R3が2,6−ジクロロフェニルである場合、RAはエトキシ、シクロプロピル若しくはイソプロピルではなく;R1がC(O)RAであり、R2がH若しくはCHF2であり、R3が3,5−ジメチルフェニルである場合、RAはメトキシではなく;R1がC(O)NRARBであり、R2がピラジルであり、R3が2,6−ジメチル−4−メトキシフェニルであり、RAがHである場合、RBはエチルではなく;又はR1がHであり、R2がメチルである場合、R3はクロロではない。
【0049】
一つの実施形態では、上記化合物は、式:
【0050】
【化3】

【0051】
(式中、各R2Aは独立して、シアノ、ハロ、ヒドロキシル、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又は必要に応じて置換された(例えば必要に応じてフッ素化された)アルキル、アルコキシル若しくはアリールであり、mは0〜5である)の化合物である。
【0052】
別の実施形態では、上記化合物は、式:
【0053】
【化4】

【0054】
の化合物である。
【0055】
本明細書に記載の式により包含される特定の化合物では、RAは、必要に応じてハロ、ヒドロキシル、アミノ、アルキルアミノ又はジアルキルアミノのうちの1つ又は複数で置換されたアルキルである。幾つかの実施形態では、RAはイソプロピルである。幾つかの実施形態では、RAはアミノで置換されたアルキルである。幾つかの実施形態では、少なくとも1つのR2Aはクロロである。
【0056】
一つの実施形態では、上記化合物は、式:
【0057】
【化5】

【0058】
の化合物である。
【0059】
本明細書に記載の式により包含される特定の化合物では、R2Aはブロモである。幾つかの実施形態では、mは2又は3である。幾つかの実施形態では、R3はH又は必要に応じて置換された低級アルキルである。幾つかの実施形態では、R3はジフルオロメチルである。
【0060】
本発明の特定の化合物は、強力なLIMK2阻害剤である。或る特定の化合物は、約100nM未満、75nM未満、50nM未満、25nM未満又は10nM未満のLIMK2 IC50を有する。
【0061】
5.3. 合成方法
本発明の化合物を、当該技術分野で既知の方法により調製することができる共通の中間体N−(2,4−ジメトキシベンジル)−4−アセチル−2−アミノチアゾール(a)から合成することができる。アプローチの1つが、Ross-MacDonald, et al., Mol. Cancer Ther. 7:3490 (2008)に記載されており、以下のスキーム1で示される:
【0062】
【化6】

【0063】
次に、得られるN−(2,4−ジメトキシ)−4−アセチル−2−アミノチアゾール(a)を、以下のスキーム2に示されるように本発明の化合物に変換する:
【0064】
【化7】

【0065】
スキーム2に示した方法では、N−(2,4−ジメトキシ)−4−アセチル−2−アミノチアゾール(a)を、適切な求電子剤(例えば置換マロネート又はジメチルホルムアミドジメチルアセタール)及び塩基(例えばナトリウムエトキシド)の存在下で加熱することによりカルボニル化して、化合物(b)を得る。エノン(b)と式R2−NHNH2の置換ヒドラジン(c)との縮合により、ピラゾール(d)が与えられる。高温で吸湿性のある(wet)酸(例えばトリフルオロ酢酸)を用いた化合物(d)の脱保護により、2−アミノチアゾール(e)が与えられる。それから2−アミノチアゾール(e)を、適切な求電子剤(例えば酸塩化物、スルホニルクロリド、イソシアネート又はヘテロアリールクロリド)の添加を介して、又は2−ブロモ−アミノチアゾールへの変換(Das, et al. J. Med. Chem. 2006, 49, 6819-6832を参照されたい)及び好適な求核剤(例えばアミン、アルコール又はアニリン)との置換を介して化合物(f)へと変換することができる。
【0066】
式R2−NHNH2のヒドラジン(c)を、当該技術分野で既知の方法に従ってそれらに対応するアミンから調製することができる。アプローチの1つが、Finkelstein, et al.の国際公開第2008124092号に記載されており、以下のスキーム3で示される:
【0067】
【化8】

【0068】
5.4. 使用方法
本発明は、LIMK2を阻害する方法であって、LIMK2を強力なLIMK2阻害剤と接触させることを含む、LIMK2を阻害する方法を包含する。好ましい強力なLIMK2阻害剤は本発明の化合物(すなわち本明細書で開示の化合物)である。
【0069】
特定の実施形態は、患者において炎症性の疾患又は障害を治療、管理又は予防する方法であって、それを必要とする患者に治療的に又は予防的に有効な量の本発明の化合物を投与することを含む、患者において炎症性の疾患又は障害を治療、管理又は予防する方法を包含する。
【0070】
別の実施形態は、患者においてがんを治療、管理又は予防する方法であって、それを必要とする患者に治療的に又は予防的に有効な量の本発明の化合物を投与することを含む、患者においてがんを治療、管理又は予防する方法を包含する。
【0071】
別の実施形態は、患者の眼内圧を低下させる方法であって、それを必要とする患者においてLIMK2の活性又は発現を阻害することを含む、患者の眼内圧を低下させる方法を包含する。一方法では、LIMK2の活性は、患者の眼を強力なLIMK2阻害剤と接触させることによって阻害される。特定の強力なLIMK2阻害剤が、本明細書で開示される。別の方法では、LIMK2の発現は、LIMK2の発現を阻害する化合物(例えば、siRNA)を患者の眼に投与することによって阻害される。
【0072】
別の実施形態は、患者において視力に影響を及ぼす疾患又は障害を治療、管理又は予防する方法であって、それを必要とする患者においてLIMK2の活性又は発現を阻害することを含む、患者において視力に影響を及ぼす疾患又は障害を治療、管理又は予防する方法を包含する。一方法では、LIMK2の活性は、患者の眼を強力なLIMK2阻害剤と接触させることによって阻害される。特定の強力なLIMK2阻害剤が、本明細書で開示される。視力に影響を及ぼす疾患及び障害としては、緑内障、神経変性疾患、及び感染性疾患が挙げられる。
【0073】
5.5. 医薬製剤
本発明は、1つ又は複数の本発明の化合物を含む医薬組成物を包含する。或る特定の医薬組成物は、患者への経口投与、粘膜(例えば、鼻腔、舌下、膣、口腔又は直腸)投与、非経口(例えば、皮下、静脈内、ボーラス注入、筋肉内又は動脈内)投与、経皮投与、局所投与及び眼(例えば、局所、硝子体内)投与に好適な単一の単位剤形である。
【0074】
剤形の例としては、限定されるものではないが、錠剤;カプレット;軟弾性ゼラチンカプセル等のカプセル;カシェ(cachets:カプセル);トローチ;ロゼンジ;分散液;坐剤;軟膏;パップ(湿布);ペースト;粉末;包帯剤;クリーム;硬膏;溶液;パッチ;エアロゾル(例えば、経鼻スプレー又は吸入器);ゲル;懸濁液(例えば、水性又は非水性の液体懸濁液、水中油型エマルション、又は油中水型液体エマルション)、溶液及びエリキシルを含む患者への経口投与又は粘膜投与に好適な液体剤形;患者への非経口投与に好適な液体剤形;並びに再構成して患者への非経口投与に好適な液体剤形をもたらすことができる無菌固体(例えば、結晶性又は非結晶性の固体)が挙げられる。
【0075】
製剤は、投与方式に合わせる必要がある。例えば、経口投与は、本発明の化合物を消化管内での分解から保護するために腸溶性コーティングを必要とする。同様に、製剤は作用部位への活性成分(複数の場合もあり)の送達を促進する成分を含有し得る。例えば、化合物は、分解酵素から該化合物を保護し、循環系における輸送を促進し、細胞膜を通って細胞内部位へ至る送達を行うために、リポソーム製剤で投与され得る。
【0076】
剤形の組成、形状及び種類は、その用途に応じて異なる。例えば、疾患の急性期治療に使用する剤形は、該剤形に含まれる1つ又は複数の活性成分を、同じ疾患の慢性期治療に使用する剤形よりも多量に含有していてもよい。同様に、非経口剤形は、該剤形に含まれる1つ又は複数の活性成分を、同じ疾患を治療するために使用する経口剤形よりも少量含有していてもよい。本発明により包含される特定の剤形が互いに異なるこれら及び他の方法は、当業者には容易に明らかである。例えばRemington's Pharmaceutical Sciences、第18版(Mack Publishing, Easton PA: 1990)を参照されたい。
【0077】
5.5.1. 経口剤形
経口投与に好適な本発明の医薬組成物は、錠剤(例えば、チュアブル錠)、カプレット、カプセル及び液体(例えば、香味付与したシロップ)等の(しかしこれらに限定されない)個別の剤形として提供することができる。このような剤形は所定量の活性成分を含有し、当業者に既知の製薬法によって調製することができる。例えば、Remington's Pharmaceutical Sciences、第18版、(Mack Publishing, Easton PA: 1990)を参照されたい。
【0078】
典型的な経口剤形は、従来の薬学的配合技法に従い、密接な混和物中で活性成分(複数の場合もあり)を少なくとも1つの賦形剤と組み合わせることによって調製する。賦形剤は、投与に望ましい調製物の形態に応じて広範な形態を取ることができる。
【0079】
その投与のしやすさのため、錠剤及びカプセルが最も有益な経口単位剤形である。所望に応じて、錠剤は、標準的な水性又は非水性の技法によってコーティングすることができる。このような剤形は、従来の製薬法により調製することができる。一般に、医薬組成物及び剤形は、活性成分を液体担体、微粉固体担体、又はその両方と均一かつ密接に混和し、次に生成物を必要に応じて所望の形状に成形することによって調製する。崩壊剤は、固体剤形に組み込み、迅速な溶解を容易にする(facilitate)ことができる。また、滑剤を組み込んで、剤形(例えば、錠剤)の製造を容易にすることができる。
【0080】
5.5.2. 非経口剤形
非経口剤形は、皮下経路、静脈内経路(ボーラス注入を含む)、筋肉内経路及び動脈内経路を含むがこれらに限定されない様々な経路によって患者に投与することができる。典型的には夾雑物に対する患者の自然防御を介さずに投与するため、非経口剤形は具体的には無菌であるか、又は患者に投与する前に滅菌可能である。非経口剤形の例としては、すぐに注入できる溶液、薬学的に許容される注入用の媒体にすぐに溶解又は懸濁できる乾燥製品、すぐに注入できる懸濁液、及びエマルションが挙げられるが、これらに限定されない。
【0081】
本発明の非経口剤形を提供するために使用することができる好適な媒体は、当業者に既知である。例としては、注射用水(USP);塩化ナトリウム注射液、リンゲル液、デキストロース注射液、デキストロース及び塩化ナトリウム注射液、並びに乳酸加リンゲル液等の(しかしこれらに限定されない)水性媒体;エチルアルコール、ポリエチレングリコール及びポリプロピレングリコール等の(しかしこれらに限定されない)水混和性媒体;並びにトウモロコシ油、綿実油、ラッカセイ油、ゴマ油、オレイン酸エチル、ミリスチン酸イソプロピル及び安息香酸ベンジル等の(しかしこれらに限定されない)非水性媒体が挙げられるが、これらに限定されない。
【0082】
5.5.3. 経皮剤形、局所剤形及び粘膜剤形
経皮剤形、局所剤形及び粘膜剤形としては、点眼溶液、スプレー、エアロゾル、クリーム、ローション、軟膏、ゲル、溶液、エマルション、懸濁液、又は当業者に既知の他の形態が挙げられるが、これらに限定されない。例えば、Remington's Pharmaceutical Sciences、第18版(Mack Publishing, Easton PA: 1990)、及びIntroduction to Pharmaceutical Dosage Forms、第4版(Lea & Febiger, Philadelphia: 1985)を参照されたい。経皮剤形としては、皮膚に貼付し一定時間装用することにより、所望量の活性成分の透過が可能となり得る、「リザーバ型」パッチ又は「マトリクス型」パッチが挙げられる。
【0083】
経皮剤形、局所剤形及び粘膜剤形を提供するために使用され得る好適な賦形剤(例えば、担体及び希釈剤)並びに他の材料は、薬学の当業者に既知であり、所定の医薬組成物又は剤形を適用する特定の組織に応じて異なる。
【0084】
治療対象の特定の組織に応じて、本発明の活性成分による治療前に、治療と同時に、又は治療後に、更なる構成成分を使用することができる。例えば、透過亢進剤を使用して、組織への活性成分の送達を補助し得る。
【0085】
また、医薬組成物若しくは剤形のpH、又は医薬組成物若しくは剤形が適用される組織のpHを調整して、1つ又は複数の活性成分の送達を改善することができる。同様に、溶媒担体の極性、そのイオン強度、又は張性(tonicity)を調整して、送達を改善することができる。また、送達が改善するように、ステアレート等の化合物を医薬組成物又は剤形に添加して、1つ又は複数の活性成分の親水性又は親油性を有利に変化させることができる。この点に関して、ステアレートは、製剤用の脂質媒体として、乳化剤又は界面活性剤として、及び送達亢進剤又は透過亢進剤として作用し得る。活性成分の種々の塩、水和物又は溶媒和物を使用して、得られる組成物の特性を更に調整することができる。
【0086】
5.5.4. 点眼剤形
本発明の化合物は、水溶液、水性懸濁液及び軟膏を使用して、眼に(例えば、局所的に)送達することができる。当業者が認識するように、点眼製品は、眼の微生物汚染を防ぐために最終容器中で無菌でなければならない。容器を開けた場合に、無菌性を維持するのに保存料を使用してもよい。点眼製剤は、製剤のpH、緩衝能、粘性及び張性を制御することも必要とする。好ましい製剤は、pHが約6.5〜8.5であり、緩衝能が約0.01〜0.1である。特定の製剤は等張である。特定の製剤は、粘性が約25cps〜50cpsである。
【0087】
活性医薬成分(API)をその作用部位に効果的に送達する安全な媒体を提供するのに使用され得る成分は、既知であるが、APIの物理的及び化学的な特徴に応じて変わる。
【0088】
適切に緩衝化した水溶液を水溶性の化合物の送達に使用してもよい。典型的には、溶液組成物において、組成物の粘性を増大させるのに高分子成分を使用する。好適なポリマーの例としては、セルロースポリマー(例えば、ヒドロキシプロピルメチルセルロース、ヒドロキシエチルセルロース、エチルヒドロキシエチルセルロース)、合成ポリマー(例えば、カルボキシビニルポリマー、ポリビニルアルコール)、多糖類(例えば、キサンタンガム、グアーガム及びデキストラン)及びそれらの混合物が挙げられる。例えば、米国特許第4,136,173号及び同第7,244,440号を参照されたい。化合物を送達するのに懸濁液を使用してもよい。高分子成分は典型的には、不溶性成分の懸濁又は容易な再分散性の維持に役立つ物理的安定性助剤として懸濁液組成物中で使用される(同上)。
【0089】
製剤の無菌性を確保するのに、保存料を使用してもよい。好適な保存料としては、塩化ベンザルコニウム、塩化ベンゼトニウム、クロロブタノール、酢酸フェニル水銀、硝酸フェニル水銀、チメロサール、メチルパラベン及びプロピル−パラベンが挙げられる。また、酸化を受けやすい製剤の安定性を確保するために、抗酸化剤を使用してもよい。好適な抗酸化剤としては、エチレンジアミン四酢酸、重亜硫酸ナトリウム、メタ重亜硫酸ナトリウム及びチオ尿素が挙げられる。
【実施例】
【0090】
6.実施例
本発明の態様は、以下の実施例から理解することができるが、該実施例は本発明の範囲を限定しない。
【0091】
6.1. N−(2,4−ジメトキシベンジル)−4−アセチル−2−アミノチアゾール(3)の合成
【0092】
【化9】

【0093】
1−(2,4−ジメトキシベンジル)チオ尿素(1)
2,4−ジメトキシベンジルアミン(15mL、99.8mmol)を300mLのジクロロメタン中の1,1’−チオカルボニルジイミダゾール(90%、21.8g、110mmol)の溶液に30分かけて添加漏斗によって添加した。反応混合物を室温で3時間撹拌した。反応時にメタノール性アンモニア溶液(2N、250mL、500mmol)を添加して、それを72時間撹拌した。揮発性物質を真空下で除去した。得られる固体を100mLのジクロロメタン中でスラリー状にし、ろ過した。沈殿物を過剰量のジクロロメタンで洗浄し、褐色の固体としてチオ尿素1を得た(17.5g、収率77%)。1H NMR(400MHz,DMSO−d6)δ:7.66(br.s.,1H)、7.12(d,J=7.9Hz,1H)、7.00(br.s.,2H)、6.55(d,J=2.2Hz,1H)、6.49(d,J=8.2Hz,1H)、4.46(d,J=4.2Hz,2H)、3.79(s,3H)、3.74(s,3H)。MS(ES+)[M+H]+:227.2。
N’−(2,4−ジメトキシベンジルカルバモチオイル)−N,N−ジメチルホルムイミドアミド(2)
ジメチルホルムアミドジメチルアセタール(5.8mL、41.0mmol)を、30mLのエタノール中の1−(2,4−ジメトキシベンジル)チオ尿素(1、6.2g、27.3mmol)の溶液に添加し、80℃(この温度で反応物が均質な溶液になる)で1時間加熱し、LCMS分析により反応が完了したとみなした。室温まで冷却しながら、反応物に窒素ガス流を通し、これにより白色の固体が析出した。この固体をろ過し、100mLのエタノールで2回洗浄して、白色の固体としてイミン異性体の1:1混合物を得た(6.55g、収率85%、イミドアミド異性体の2.5:1混合物)。1H NMR(400MHz,DMSO−d6)δ:(主異性体):8.79(t,J=6.0Hz,1H)、8.70(s,1H)、7.00(d,J=7.9Hz,1H)、6.53(d,J=1.8Hz,1H)、6.43〜6.46(m,1H)、4.61(d,J=6.0Hz,2H)、3.78(s,3H)、3.73(s,3H)、3.13(s,3H)、2.99(s,3H)。(副異性体):8.67(t,J=6.0Hz,1H)、8.65(s,1H)、7.02(d,J=7.7Hz,1H)、6.51(d,J=2.2Hz,1H)、6.44〜6.47(m,1H)、4.45(d,J=6.2Hz,2H)、3.77(s,3H)、3.73(s,3H)、3.13(s,3H)、2.97(s,3H)。MS(ES+)[M+H]+:282.2。
N−(2,4−ジメトキシベンジル)−4−アセチル−2−アミノチアゾール(3)
クロロアセトン(1.21mL、15.2mmol)を32mLのアセトニトリル中のホルムイミドアミド2(3.56g、12.7mmol)に添加した。この混合物を3時間かけて75℃まで加熱した。開始反応体積が半分に低減するまで、室温まで冷却しながら、反応物に窒素ガス流を通した。37.5mLの水及び12.5mLの飽和NaHCO3水溶液を添加し、スラリーを15分間撹拌した。沈殿物をろ過し、水及び20%ジエチルエーテル/ヘキサンをそれぞれ100mL用いて洗浄して、真空下で乾燥させた後、オフホワイト色の固体としてアセチルチアゾール3を得た(3.49g、収率95%)。1H NMR(DMSO−d6):8.85(br.s.,1H)、7.97(s,1H)、7.15(d,J=8.4Hz,1H)、6.57(d,J=2.2Hz,1H)、6.48(dd,J=8.4,2.2Hz,1H)、4.37(d,J=5.1Hz,2H)、3.79(s,3H)、3.74(s,3H)、2.34(s,3H)。MS(ES+)[M+H]+:371.1、[M+H+H2O]+:389.1。
【0094】
6.2. 5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)チアゾール−2−アミン(6)の合成
【0095】
【化10】

【0096】
1−(2−(2,4−ジメトキシベンジルアミノ)チアゾール−5−イル)−4,4−ジフルオロブタン−1,3−ジオン(4)
エタノール(およそ3N、5.4mL)中のナトリウムエトキシドの溶液におけるアミノチアゾール3(1.11g、3.80mmol)及びジエチル2,2−ジフルオロマロネート(2.98g、15.2mmol)の混合物を5時間かけて75℃まで加熱し、その後反応物は均質になった。室温まで冷却した後、反応混合物を過剰量の水とともにフラスコに移した。pHを氷酢酸を用いて5〜6に調整した。得られる固体をろ過し、水/メタノール(2:1(v:v))及びジエチルエーテル/ヘキサン(1:4(v:v))をそれぞれ100mL用いて洗浄した。固体を真空下で終夜乾燥させ、橙色の固体として表題の化合物を得た(1.05g、収率74%)。1H NMR(DMSO−d6)δ:9.26(br.s.,1H)、8.33(s,1H)、7.16(d,J=8.3Hz,1H)、6.57〜6.61(m,2H)、6.50(dd,J=8.3,2.5Hz,1H)、4.41(br.s.,2H)、3.80(s,3H)、3.75(s,3H)、3.35(br.s.,1H)。19F NMR(DMSO−d6)δ:−126.70(d,J=53.9Hz)。MS(ES+)[M+H]+:293.1。
5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)−N−(2,4−ジメトキシベンジル)チアゾール−2−アミン(5)
6mLのエタノール中のケトン4(296mg、0.800mmol)と2,6−ジクロロフェニルヒドラジン塩酸塩(205mg、0.960mmol)との混合物を2時間かけて75℃まで加熱した。反応物を冷却し、4mLの水及び1.5mLの飽和NaHCO3水溶液で処理し(treated)、それにより沈殿物の形成がもたらされた。沈殿物をろ過し(filtered)、水/メタノール(2:1(v:v))及びジエチルエーテル/ヘキサン(1:4(v:v))をそれぞれ10mL用いて洗浄した。固体を真空下で終夜乾燥させ、ベージュ色の固体としてピラゾール5を得た(358mg、収率88%)。1H NMR(DMSO−d6)δ:8.12(t,J=5.7Hz,1H)、7.77(d,J=8.8Hz,1H)、7.77(d,J=7.1Hz,1H)、7.70(dd,J=9.4,6.6Hz,1H)、7.21(s,1H)、7.07(d,J=3.8Hz,1H)、7.01(t,J=32.1Hz,1H)、6.53(d,J=2.5Hz,1H)、6.45(dd,J=8.3,2.5Hz,1H)、4.25(d,J=5.6Hz,2H)、3.76(s,3H)、3.73(s,3H)。19F NMR(DMSO−d6)δ:−112.52(d,J=53.9Hz)。MS(ES+)[M+H]+:511.0。
5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)チアゾール−2−アミン(6)
ピラゾール5(358mg、0.703mmol)の入ったバイアルに、0.5mLの水及び5mLのトリフルオロ酢酸を添加した。反応が進行するにつれて、反応物は明るいピンク色に変わる。4時間後、反応物を20mLの水で希釈し、飽和NaHCO3水溶液で中和した。固体をろ過し、水で洗浄して、シリカゲルクロマトグラフィ(50%から100%までの勾配の酢酸エチル/ヘキサン)により更に精製して、薄い橙色の無定形の固体として2−アミノチアゾール6を得た(237mg、収率94%)。1H NMR(メタノール−d4)δ:7.57〜7.68(m,3H)、6.93(s,1H)、6.86(s,1H)、6.80(t,J=54.6Hz,1H)。19F NMR(メタノール−d4)δ:−114.37(d,J=55.1Hz)。MS(ES+)[M+H]+:361.1。
【0097】
6.3. N−(5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)チアゾール−2−イル)ブチルアミドの合成
【0098】
【化11】

【0099】
N−(5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)チアゾール−2−イル)ブチルアミド(7)
THF(0.5mL)中のアミノチアゾール6(20mg、0.055mmol)の溶液に、N−メチルモルホリン(0.030mL、0.278mmol)、その後塩化ブチリル(0.030mL、0.278mmol)を添加した。反応物を5分間撹拌した。反応物をろ過し、真空下で濃縮して、分取HPLC(30×100mmのC18カラム、10%から100%までのメタノール:水(10mMの酢酸アンモニウム)、15分、45mL/分)により精製して、所望のアミド7を得た(9.5mg、収率40%、HPLC分析による純度98.9%)。1H NMR(メタノール−d4)δ:7.57〜7.69(m,3H)、7.37(s,1H)、7.00(s,1H)、6.83(t,J=54.8Hz,1H)、2.41(t,J=7.5Hz,2H)、1.63〜1.75(m,2H)、0.96(t,J=7.5Hz,3H)。19F NMR(メタノール−d4)δ:−114.40(d,J=55.1Hz)。MS(ES+)[M+H]+:431.0。
【0100】
6.4. N−(5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)チアゾール−2−イル)−4−(ジメチルアミノ)ブタンアミドの合成
【0101】
【化12】

【0102】
N−(5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)チアゾール−2−イル)−4−(ジメチルアミノ)ブタンアミド(8)
酢酸イソ−プロピル(2.0mL)中のアミノチアゾール6(80mg、0.22mmol)の溶液に、N,N−ジイソプロピルエチルアミン(0.19mL、1.1mmol)、4−(ジメチルアミノ)ブタン酸塩酸塩(93mg、0.55mmol)及びHATu(211mg、0.55mmol)を添加した。反応物を80℃で1時間加熱し、その後飽和NH4Cl水溶液/ブラインの1:1(v:v)混合物を用いてクエンチした。水層を酢酸エチルで抽出した。複合有機層をブラインで洗浄し、硫酸マグネシウムで乾燥させ、ろ過し、濃縮した。粗残渣を分取HPLC(30×100mmのC18カラム、10%から100%までのメタノール:水(10mMのギ酸アンモニウム)、15分、45mL/分)により精製して、所望のアミドを得た(8、65mg、収率62%)。1H NMR(メタノール−d4)δ:7.57〜7.69(m,3H)、7.39(s,1H)、7.01(s,1H)、6.84(t,J=54.8Hz,1H)、3.06〜3.15(m,2H)、2.84(s,6H)、2.59(t,J=6.9Hz,2H)、1.99〜2.10(m,2H)。19F NMR(メタノール−d4)δ:−114.37(d,J=54.9Hz)。MS(ES+)[M+H]+:474.0。
【0103】
6.5. (S)−N−(5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)チアゾール−2−イル)−2−(ピロリジン−2−イル)アセトアミドの合成
【0104】
【化13】

【0105】
(S)−N−(5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)チアゾール−2−イル)−2−(ピロリジン−2−イル)アセトアミド(9)
酢酸イソ−プロピル(0.5mL)中のアミノチアゾール6(25mg、0.069mmol)の溶液に、N,N−ジイソプロピルエチルアミン(0.060mL、0.35mmol)、(S)−2−(1−tert−ブトキシカルボニル)ピロリジン−2−イル)酢酸塩酸塩(39mg、0.17mmol)及びHATu(65mg、0.17mmol)を添加した。反応物を80℃で1時間加熱し、その後飽和NH4Cl水溶液/ブラインの1:1(v:v)混合物を用いてクエンチした。水層を酢酸エチルで抽出した。複合有機層をブラインで洗浄し、硫酸マグネシウムで乾燥させ、ろ過し、濃縮した。粗残渣を1mLのメタノールに入れ、4N HClのジオキサン溶液0.2mLを添加した。反応物を60℃で1時間加熱した。揮発性物質を真空下で除去し、粗残渣を分取HPLC(30×100mmのC18カラム、10%から100%までのメタノール:水(10mMのギ酸アンモニウム)、15分、45mL/分)により精製して、モノホルメート塩として所望のアミドを得た(9、13.0mg、収率36%)。1H NMR(メタノール−d4)δ:8.47(s,1H)、7.56〜7.69(m,3H)、7.45(s,1H)、7.02(s,1H)、6.84(t,J=54.6Hz,1H)、3.85〜3.96(m,1H)、3.06(dd,J=17.6,3.7Hz,1H)、2.81〜2.93(m,1H)、2.22〜2.34(m,1H)、2.04〜2.15(m,1H)、1.92〜2.04(m,1H)、1.65〜1.79(m,1H)。13C NMR(DMSO−d6)δ:168.7、158.7、148.2(t,J=29.3Hz)、138.4、138.3、134.4、133.8、133.5、129.5、116.6、111.0(t,J=232.7Hz)、103.2、54.8、44.6、36.8、29.8、23.0。19F NMR(メタノール−d4)δ:−114.38(d,J=55.1Hz)。MS(ES+)[M+H]+:472.1。
【0106】
6.6. 5−(1−(2,6−ジクロロフェニル)−1H−ピラゾール−5−イル)チアゾール−2−アミン(13)の合成
【0107】
【化14】

【0108】
1−(2−(2,4−ジメトキシベンジルアミノ)チアゾール−5−イル)−3−(ジメチルアミノ)プロパ−2−エン−1−オン(11)
22.5mLのジメチルホルムアミドジメチルアセタール中のケトン3(2.25g、7.70mmol)を105℃まで18時間かけて加熱した。溶液を周囲温度まで冷却した。2.5mLのエタノール、その後67mLのジエチルエーテルを添加した。この沈殿した混合物を30分間撹拌し、ろ過した。沈殿物を過剰量のジエチルエーテルで洗浄し、18時間真空下で乾燥させ、オフホワイト色の固体としてエノン11を得た(1.00g、収率37%)。1H NMR(DMSO−d6)δ:8.38(t,J=5.7Hz,1H)、7.77(s,1H)、7.47(d,J=12.3Hz,1H)、7.15(d,J=8.2Hz,1H)、6.56(d,J=2.2Hz,1H)、6.48(dd,J=8.3,2.3Hz,1H)、5.58(d,J=12.6Hz,1H)、4.32(d,J=5.5Hz,2H)、3.80(s,3H)、3.74(s,3H)、3.33(s,6H)。MS(ES−)[M−H]:346.1。
【0109】
5−(1−(2,6−ジクロロフェニル)−1H−ピラゾール−5−イル)−N−(2,4−ジメトキシベンジル)チアゾール−2−アミン(12)
7mLのエタノール中のケトン11(347mg、1.00mmol)と2,6−ジクロロフェニルヒドラジン塩酸塩(256mg、1.20mmol)との混合物を75℃まで2時間かけて加熱した。反応物を冷却し、5mLの水及び1.5mLの飽和NaHCO3水溶液で処理し、沈殿物の形成がもたらされた。沈殿物をろ過し、水/メタノール(2:1(v:v))及びジエチルエーテル/ヘキサン(1:4(v:v))をそれぞれ10mL用いて洗浄した。固体を真空下で乾燥させ、更に精製することなく次の工程に使用した。MS(ES+)[M+H]+:461.1。
5−(1−(2,6−ジクロロフェニル)−1H−ピラゾール−5−イル)チアゾール−2−アミン(13)
ピラゾール12(460mg、1.00mmol)の入ったバイアルに、1.5mLの水及び7mLのトリフルオロ酢酸を添加した。反応が進行するにつれて、反応物は明るいピンク色に変わる。4時間後、反応物を20mLの水で希釈し、飽和NaHCO3水溶液で中和した。固体をろ過し、水で洗浄して、シリカゲルクロマトグラフィ(40%から80%までの勾配の酢酸エチル/ヘキサン)により更に精製して、薄い黄色の固体として2−アミノチアゾール13を得た(216mg、2工程で収率70%)。1H NMR(メタノール−d4)δ:7.76(d,J=2.0Hz,1H)、7.55〜7.66(m,3H)、6.84(s,1H)、6.64(d,J=2.0Hz,1H)。MS(ES+)[M+H]+:311.1。
【0110】
6.7. N−(5−(1−(2,6−ジクロロフェニル)−1H−ピラゾール−5−イル)チアゾール−2−イル)ブチルアミド(14)の合成
【0111】
【化15】

【0112】
N−(5−(1−(2,6−ジクロロフェニル)−1H−ピラゾール−5−イル)チアゾール−2−イル)ブチルアミド(14)
THF(1.0mL)中のアミノチアゾール13(35mg、0.11mmol)の溶液に、N−メチルモルホリン(0.12mL、1.1mmol)、その後塩化ブチリル(0.12mL、1.1mmol)を添加した。反応物を5分間撹拌した。反応物をろ過し、真空下で濃縮して、分取HPLC((30×100mmのC18カラム、10%から100%までのメタノール:水(10mMの酢酸アンモニウム)、15分、45mL/分)により精製して、所望のアミド14を得た(7.4mg、収率18%、HPLC分析による純度97.6%)。1H NMR(メタノール−d4)δ:7.83(d,J=2.0Hz,1H)、7.55〜7.68(m,3H)、7.28(s,1H)、6.79(d,J=2.0Hz,1H)、2.41(t,J=7.4Hz,2H)、1.62〜1.76(m,2H)、0.96(t,J=7.4Hz,3H)。MS(ES+)[M+H]+:381.1。
【0113】
6.8. 4−アセトアミド−N−(5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)チアゾール−2−イル)ブタンアミド(15)の合成
【0114】
【化16】

【0115】
4−アセトアミド−N−(5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)チアゾール−2−イル)ブタンアミド(15)
酢酸イソ−プロピル(0.5mL)中のアミノチアゾール13(20mg、0.064mmol)の溶液に、N,N−ジイソプロピルエチルアミン(0.057mL、0.32mmol)、4−アセトアミドブタン酸(28mg、0.19mmol)及びHATu(94mg、0.21mmol)を添加した。反応物を80℃で1時間加熱し、その後飽和NH4Cl水溶液/ブラインの1:1(v:v)混合物を用いてクエンチした。水層を酢酸エチルで抽出した。複合有機層をブラインで洗浄し、硫酸マグネシウムで乾燥させ、ろ過し、濃縮した。粗残渣を分取HPLC(30×100mmのC18カラム、10%から100%までのメタノール:水(10mMの酢酸アンモニウム)、15分、45mL/分)により精製して、所望のアミドを得た(15、8.5mg、収率30%、HPLC分析による純度95%)。1H NMR(メタノール−d4)δ:7.82(d,J=2.0Hz,1H)、7.55〜7.68(m,3H)、7.27(s,1H)、6.78(d,J=2.0Hz,1H)、3.21(t,J=6.8Hz,2H)、2.47(t,J=7.3Hz,2H)、1.90(s,3H)、1.85(t,J=7.1Hz,2H)。MS(ES+)[M+H]+:438.0。
【0116】
6.9. (2,6−ジメチルフェニル)ヒドラジン塩酸塩の合成
【0117】
【化17】

【0118】
(2,6−ジメチルフェニル)ヒドラジン塩酸塩(18)
添加漏斗を備えた100mL容の丸底フラスコに、6.25mLの濃HCl及び5mLの水を入れた。溶液を−5℃に冷却した。2,6−ジメチルアニリン(3.5mL、28.2mmol)をシリンジによって滴下すると、白色の沈殿物が形成した。この混合物を更に15分間撹拌した。5mLの水中の亜硝酸ナトリウム(1.95g、28.2mmol)の溶液を−5℃でシリンジによって滴下し、白色の混合物が橙色に変わった。30分後、23mLの濃HCl/水の1:1(v:v)溶液中の塩化スズ(II)(13.4g、70.5mmol)の溶液を添加漏斗によって1時間かけて滴下した。反応物を周囲温度で終夜激しく撹拌した。得られる沈殿物をろ過し、ブライン及びジエチルエーテルで連続して洗浄した。それから沈殿物を、35mLのジエチルエーテル及び50mLの10N NaOH水溶液の入ったフラスコに0℃で添加した。固体が溶解するまで、混合物を周囲温度で撹拌した。層を分離し、水層を50mLのジエチルエーテルで2回抽出した。複合エーテル層を0℃に冷却し、ジオキサン(6.25mL)中の4N HClを滴下し、反応物を30分間撹拌した。得られる白色の固体をろ過し、冷ジエチルエーテルで洗浄して、真空下で乾燥させ、ヒドラジンの一塩酸塩18を得た(1.24g、収率25%)。
【0119】
6.10. (2,6−ジメチル−4−シアノフェニル)ヒドラジン塩酸塩の合成
【0120】
【化18】

【0121】
(2,6−ジクロロ−4−シアノフェニル)ヒドラジン塩酸塩(19)
81mLのTHF中の2,6−ジクロロ−4−シアノアニリン(5.00g、26.7mmol)の溶液の入ったフラスコを0℃に冷却した。三フッ化ホウ素ジエチルエーテレート(5.03mL、40.1mmol)をシリンジによって滴下し、その後亜硝酸tert−ブチル(3.80mL、32.0mmol)を滴下した。この反応物を更に60分間撹拌すると、その間に褐色の沈殿物が形成した。100mLのジエチルエーテルを添加し、混合物を30分間撹拌した。沈殿物をろ過し、過剰量のジエチルエーテルで洗浄した。ジアゾニウム塩を褐色の固体として単離し(5.57g、収率78%)、更に精製せずに続く還元に使用した。1H NMR(DMSO−d6)δ:8.31(s,2H)。生成物は質量分析計では電離しない。
【0122】
これまでの工程から得られたジアゾニウム塩(5.57g、20.8mmol)を52mLの濃HCl/水の1:1(v:v)溶液中で懸濁し、0℃に冷却した。塩化スズ(II)(9.85g、52.0mmol)を500mgずつ添加した。反応物を室温で45時間撹拌した。得られる沈殿物をろ過し、ブライン及びジエチルエーテルで連続して洗浄した。それから沈殿物を、100mLのジエチルエーテル及び100mLの6N NaOH水溶液の入ったフラスコに添加した。混合物を周囲温度で3時間撹拌した。層を分離し、水層を100mLのジエチルエーテル及び50mLの酢酸エチルで抽出した。複合有機層を濃縮した。粗残渣を150mLのジエチルエーテル及び20mLの酢酸エチルに0℃で入れた。4N HClのジオキサン溶液(8.0mL)を滴下し、反応物を0℃で30分間撹拌して、終夜0℃に置いた。褐色の固体をろ過により回収し、冷ジエチルエーテルで洗浄し、真空下で乾燥させ、主に一塩酸塩としてヒドラジン19を得た(928mg、収率19%、1H NMR分析による純度約70%)。1H NMR(DMSO−d6)δ:8.09(s,2H)。MS(ES−)[M−H]:200.1。
【0123】
6.11. LIMK2の発現及び精製
LIMK2を、BAC−to−BAC(商標)バキュロウイルス発現系(Invitrogen)を使用して発現させた。取扱説明書に記載の製造業者の指示に従って、組換えバキュロウイルスを作製した。簡潔に述べると、LIMK2インサートを保有するプラスミド(pFactBac1又はpFastBacHT)をMAX efficiency DH10Bacコンピテント大腸菌中に形質転換して、組換えバクミドを生成した。DH10Bac大腸菌宿主株は、ミニ−attTn7標的部位を有するバキュロウイルスシャトルベクター(バクミド)と、ヘルパープラスミドとを含有し、pFastBacベクター上のミニ−Tn7因子と、バクミド上のミニ−(mini-)attTn7標的部位との間の転位後に組換えバクミドの生成を可能にする。転位反応が、ヘルパープラスミドによって供給される転位タンパク質の存在下で起こる。細胞をプレート培養し、取扱説明書に記載のように、白色のコロニーを摘み出してバクミドを単離した。
【0124】
単離バクミドDNAをSF9細胞中にトランスフェクトし、組換えバキュロウイルスを生成し、トランスフェクションの5日後にウイルスを回収した。ウイルスを0.2の感染多重度(MOI)でT75フラスコ内で増幅させた。増幅ウイルスを使用して、タンパク質発現のために5のMOIでSF9細胞を感染させた。
【0125】
LIMK2構築物の小規模精製のために、組換えバキュロウイルスに感染させたSf9細胞の培養液50mlを使用した。細胞を500×gで5分間の遠心分離によって採取した。それから、細胞をリシスバッファー(細胞1g当たり5倍量)中で再懸濁した。典型的なリシスバッファーは以下のものを含有する:50mM HEPES(pH8.0)、300mM KCl、10% グリセロール、1% NP−40、15mM イミダゾール、1mM ベンズアミジン、及びRocheの完全プロテアーゼ阻害剤(細胞溶解液50ml当たり1錠)。14000psi〜20000psiの液体圧でMicrofluidicsのMicrofluidizer M−110Yに1回通し、その後4℃で15分間60000×gで溶解液を遠心分離することにより細胞懸濁液を溶解させた。
【0126】
それから、上清を、ニトリロ三酢酸(NTA)と共有結合したコバルトイオンを含有するクロマトグラフィマトリクス上に直接装荷した。クロマトグラフィマトリクスは、タンパク質ローディング(loading)溶液と同じバッファー中で平衡化した。イオン荷電樹脂は典型的には、充填(packed)樹脂1ml当たり5mg〜10mgのヒスチジンタグ付けタンパク質と同等の結合能を有する。カラム上に装荷することができる抽出物の量は、抽出物中の可溶性ヒスチジンタグ付けタンパク質の量に応じて変わる。それからこのカラムを、1回目に50mM HEPES(pH8.0)、300mM KCl、10% グリセロール、1% NP−40、15mM イミダゾール、1mM ベンズアミジンで;2回目に、20mM HEPES(pH8.0)、500mM KCl、10% グリセロール及び20mM イミダゾールで;3回目に、20mM HEPES(pH8.0)、100mM KCl、10% グリセロール及び20mM イミダゾールで段階的に洗浄し、その後同じバッファー中の250mM イミダゾールで溶出した。それから、LIMK2タンパク質溶液を、SDS−PAGE、及びタンパク質のカルボキシル末端と内部触媒ドメインとの両方に指向性を有する市販の抗体を使用するウェスタンブロットで解析した。保存の目的で、このタンパク質を、50mM Tris(pH7.5)、150mM NaCl、0.1% BME、0.03% Brij−35及び50% グリセロールに透析した。
【0127】
大規模なLIMK2の精製を、10Lの培養量でWave Bioreactor(Wave Biotech)において行った。1mL当たり2〜3×106個の生存細胞の細胞培養液10LをMOI=5pfu/細胞で感染させ、感染後48時間で採取した。
【0128】
6.12. in vitro LIMK2阻害アッセイ
LIMK2阻害剤を同定するのに使用するin vitroアッセイを開発した。解析の読み取り値は、ATP基質から固定化ミエリン塩基性タンパク質でコーティングしたフラッシュプレート(Perkin Elmer Biosciences)中への33Pの取り込みであり、これは、プレートリーダーを備えたシンチレーションカウンタ(TopCount, Packard Bioscience, Meriden, CT)で計測した。384ウェルの平底MBPフラッシュプレートを使用し、総アッセイ量は50μlとした。HTSプログラムは、希釈のためにBiomek FXを利用するものとした。
【0129】
各アッセイに関して、成分及び条件は以下のとおりであった:200ngの酵素をアッセイバッファー(1×アッセイバッファーは、30mM HEPES(pH8.0)、5mM DTT及び10mM MgCl2を含有する)、10μM ATP、0.2μCi[γ−33P]−ATP、及び10μMの候補阻害化合物においてインキュベートした。反応物を室温で60分間インキュベートし、75μlの停止/洗浄バッファー(1×停止/洗浄(wash)バッファーは、50mM EDTA及び20mM Tris(pH7.4)を含有する)で3回洗浄した後、プレートをシンチレーションカウンタで読み取った。種々の濃度のスタウロスポリン(400nM、200nM、100nM及び50nM;BIOMOL(Plymouth Meeting, PA)で購入した)を各プレートの対照として使用した。
【0130】
6.13. デキサメタゾン誘導性の眼圧亢進モデル
1日当たりおよそ0.1mgのデキサメタゾン(dex)を放出するように、28日齢のマウスのAlzet浸透圧ミニポンプ(DURECT Corp., Cupertino, CA)に、水溶性のdexのPBS溶液(Sigma, St. Louis, MO)を満たした。ポンプがdexで満たされると、ポンプを、37℃で60時間、PBSで平衡化した。平衡化したポンプは、重量25グラム〜35グラムの野生型C57:129 F2ハイブリッドマウスの背中の皮下に外科的に設置した。外科切開傷は、5−0編み絹(braided silk)(ROBOZ, Gaithersburg, MD)で縫合し、試験期間全体を通して、抗生物質軟膏で処理した。外科切開傷は、TissueMend II(Webster Veterinary, Houston, TX)で接着した。鎮痛剤(ブプレノルフィン)を、外科処置の日及び外科処置の24時間後に、IP注射により投与した。眼内圧(IOP)を、TonoLab(Colonial Medical Supply Co., Franconia, NH)眼圧計を使用してこれらのマウスについて測定した。マウスを、イソフルランで軽く鎮静化し、0.5%プロパラカイン(Akorn, Buffalo Grove, IL)で局所麻酔を行った後、IOP測定を行った。ベースラインのIOPを、ミニポンプ埋め込みの1日前に測定した。ミニポンプ埋め込み後、4週間にわたり1週間に2〜3回、IOP測定を行った。眼圧降下候補化合物による薬理学試験を、埋め込みの21日〜28日後に行った。
【0131】
図1は、このモデルでの(S)−N−(5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)チアゾール−2−イル)−2−(ピロリジン−2−イル)アセトアミドの用量依存的な効果を示している。投与時間からのIOP測定値の平均変化は表1に与えられる。
【0132】
【表1】

【0133】
上で引用した全ての刊行物(例えば、特許及び特許出願)はその全体が、参照により本明細書中に援用される。
【技術分野】
【0001】
1. 発明の分野
本発明は、キナーゼ阻害剤、それらを含む組成物、並びに様々な疾患及び障害を治療するためのそれらの使用の方法に関する。
【背景技術】
【0002】
2. 背景
タンパク質キナーゼは、ATPから受容タンパク質へのγ−リン酸基の移動を触媒する酵素群である。ヒトゲノムは、500種類を超える様々なタンパク質キナーゼをコードすると推測されており、それらのキナーゼのうち多くががん及び炎症を含む広範な疾患及び障害に関与している。
【0003】
LIMキナーゼ(LIMK)は、p53経路と結び付いている。例えば、特許文献1を参照されたい。LIMKは、2つのN末端LIMモチーフと1つのC末端タンパク質キナーゼドメインとの特有の組合せを有する小さなサブファミリーのキナーゼに属する。これらのLIMモチーフ及びキナーゼドメインは、幾つかの推定カゼインキナーゼ認識部位及びmapキナーゼ認識部位を含有する高プロリン領域及び高セリン領域により連結されている。LIMキナーゼ及びそれらの経路タンパク質は、アクチン細胞骨格のRho誘導性の再組織化に寄与すると考えられている(同上)。LIMキナーゼファミリー成員には、LIMキナーゼ1(LIMK1)及びLIMキナーゼ2(LIMK2)が含まれる。その両方がコフィリンをリン酸化し、Rhoファミリー依存性のアクチン細胞骨格の再構成(rearrangement)を調節する(同上)。
【0004】
LIMキナーゼ阻害剤ががんの治療に提唱されている(同上、特許文献2、非特許文献1、非特許文献2)。LIMK阻害剤が、柱細胞(trabecular cells)におけるアクチン脱重合を促進すること及び眼圧を低下させることによって、緑内障を治療するのに有用であり得ることも示唆されている。特許文献3を参照されたい。特許文献4及び特許文献5も参照されたい。現在の緑内障療法は、様々なメカニズムにより効果を発揮する。プロスタグランジンF2a類似体(例えば、ラタノプロスト)は、眼からの流体流出の眼内圧(IOP)非依存性の増大をもたらす。炭酸脱水酵素(Carbonic anhydrous)阻害剤(例えば、アセタゾールアミド)、β−ブロッカー(例えば、チモロール)、交感神経模倣薬(例えば、ピロカルピン)、及びαアドレナリン受容体アゴニスト(例えば、ブリモニジン)は、房水産生を減少させる。
【先行技術文献】
【特許文献】
【0005】
【特許文献1】国際公開第02/099048号
【特許文献2】国際公開第2003003016号
【特許文献3】国際公開第04/047868号
【特許文献4】米国特許出願公開第2009−0042893号
【特許文献5】米国特許出願公開第2009−0264450号
【非特許文献】
【0006】
【非特許文献1】Stanyon, Clement A. and Bernard, Ora., Int. J. Biochem. & Cell Biol. 31(3/4): 389-394 (1999)
【非特許文献2】Yoshioka, Kiyoko et al., Proc. National Acad. Sci. USA 100(12): 7247-7252 (2003)
【発明の概要】
【0007】
3. 発明の概要
本発明は一部には、式:
【0008】
【化1】

【0009】
の化合物、及びそれらの薬学的に許容される塩に関し、その置換基が本明細書で規定される。特定の化合物は、LIMK2の強力な阻害剤である。
【0010】
本発明の一つの実施の形態は、本明細書で開示の化合物を含む医薬製剤(formulations)を包含する。
【0011】
別の実施の形態は、緑内障、神経変性及び感染症等の視力に影響を及ぼす様々な疾患及び障害(例えば、眼の疾患及び障害)の治療、管理及び予防のために本明細書に開示の化合物を使用する方法を包含する。
【図面の簡単な説明】
【0012】
4. 図面の簡単な説明
【図1】以下の実施例に記載の眼圧亢進アッセイにおける本発明の化合物(S)−N−(5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)チアゾール−2−イル)−2−(ピロリジン−2−イル)アセトアミドの用量応答を示す図である。
【発明を実施するための形態】
【0013】
5. 詳細な説明
5.1. 定義
特に明示のない限り、「アルケニル」という用語は、2〜20(例えば、2〜10又は2〜6)個の炭素原子を有し、少なくとも1つの炭素−炭素二重結合を含む直鎖、分岐鎖及び/又は環式の炭化水素を意味する。代表的なアルケニル部分としては、ビニル、アリル、1−ブテニル、2−ブテニル、イソブチレニル、1−ペンテニル、2−ペンテニル、3−メチル−1−ブテニル、2−メチル−2−ブテニル、2,3−ジメチル−2−ブテニル、1−ヘキセニル、2−ヘキセニル、3−ヘキセニル、1−ヘプテニル、2−ヘプテニル、3−ヘプテニル、1−オクテニル、2−オクテニル、3−オクテニル、1−ノネニル、2−ノネニル、3−ノネニル、1−デセニル、2−デセニル及び3−デセニルが挙げられる。
【0014】
特に明示のない限り、「アルコキシ」という用語は、−O−アルキル基を意味する。アルコキシ基の例としては、−OCH3、−OCH2CH3、−O(CH2)2CH3、−O(CH2)3CH3、−O(CH2)4CH3及び−O(CH2)5CH3が挙げられるが、これらに限定されない。
【0015】
特に明示のない限り、「アルキル」という用語は、1〜20(例えば、1〜10又は1〜4)個の炭素原子を有する直鎖、分岐鎖及び/又は環式(「シクロアルキル」)の炭化水素を意味する。1個〜4個の炭素を有するアルキル部分は「低級アルキル」と称される。アルキル基の例としては、メチル、エチル、プロピル、イソプロピル、n−ブチル、t−ブチル、イソブチル、ペンチル、ヘキシル、イソヘキシル、ヘプチル、4,4−ジメチルペンチル、オクチル、2,2,4−トリメチルペンチル、ノニル、デシル、ウンデシル及びドデシルが挙げられるが、これらに限定されない。シクロアルキル部分は単環式又は多環式であってもよく、例としてはシクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル及びアダマンチルが挙げられる。アルキル部分の更なる例は直鎖部分、分岐鎖部分及び/又は環式部分(例えば、1−エチル−4−メチル−シクロヘキシル)を有する。「アルキル」という用語は飽和炭化水素、並びにアルケニル部分及びアルキニル部分を含む。
【0016】
特に明示のない限り、「アルキルアリール」又は「アルキル−アリール」という用語は、アリール部分と結合したアルキル部分を意味する。
【0017】
特に明示のない限り、「アルキルヘテロアリール」又は「アルキル−ヘテロアリール」という用語は、ヘテロアリール部分と結合したアルキル部分を意味する。
【0018】
特に明示のない限り、「アルキル複素環」又は「アルキル−複素環」という用語は、複素環部分と結合したアルキル部分を意味する。
【0019】
特に明示のない限り、「アルキニル」という用語は、2〜20(例えば、2〜20又は2〜6)個の炭素原子を有し、少なくとも1つの炭素−炭素三重結合を含む直鎖、分岐鎖又は環式の炭化水素を意味する。代表的なアルキニル部分としては、アセチレニル、プロピニル、1−ブチニル、2−ブチニル、1−ペンチニル、2−ペンチニル、3−メチル−1−ブチニル、4−ペンチニル、1−ヘキシニル、2−ヘキシニル、5−ヘキシニル、1−ヘプチニル、2−ヘプチニル、6−ヘプチニル、1−オクチニル、2−オクチニル、7−オクチニル、1−ノニニル、2−ノニニル、8−ノニニル、1−デシニル、2−デシニル及び9−デシニルが挙げられる。
【0020】
特に明示のない限り、「アリール」という用語は、炭素原子及びH原子で構成される芳香環、又は芳香族若しくは部分芳香族の環系を意味する。アリール部分はともに結合又は融合した複数の環を含んでいてもよい。アリール部分の例としては、アントラセニル、アズレニル、ビフェニル、フルオレニル、インダン、インデニル、ナフチル、フェナントレニル、フェニル、1,2,3,4−テトラヒドロ−ナフタレン及びトリルが挙げられるが、これらに限定されない。
【0021】
特に明示のない限り、「アリールアルキル」又は「アリール−アルキル」という用語は、アルキル部分と結合したアリール部分を意味する。
【0022】
特に明示のない限り、「ハロゲン」及び「ハロ」という用語は、フッ素、塩素、臭素及びヨウ素を包含する。
【0023】
特に明示のない限り、「ヘテロアルキル」という用語は、炭素原子の少なくとも1つがヘテロ原子(例えば、N、O又はS)で置き換えられたアルキル部分(例えば、直鎖、分岐鎖又は環式)を表す。
【0024】
特に明示のない限り、「ヘテロアルキルアリール」又は「ヘテロアルキル−アリール」という用語は、アルキル部分と結合したヘテロアルキル部分を表す。
【0025】
特に明示のない限り、「ヘテロアルキル複素環」又は「ヘテロアルキル−複素環」という用語は、複素環部分と結合したヘテロアルキル部分を表す。
【0026】
特に明示のない限り、「ヘテロアリール」という用語は、炭素原子の少なくとも1つがヘテロ原子(例えば、N、O又はS)で置き換えられたアリール部分を意味する。例としては、アクリジニル、ベンゾイミダゾリル、ベンゾフラニル、ベンゾイソチアゾリル、ベンゾイソオキサゾリル、ベンゾキナゾリニル、ベンゾチアゾリル、ベンゾオキサゾリル、フリル、イミダゾリル、インドリル、イソチアゾリル、イソオキサゾリル、オキサジアゾリル、オキサゾリル、フタラジニル、ピラジニル、ピラゾリル、ピリダジニル、ピリジル、ピリミジニル、ピリミジル、ピロリル、キナゾリニル、キノリニル、テトラゾリル、チアゾリル及びトリアジニルが挙げられるが、これらに限定されない。
【0027】
特に明示のない限り、「ヘテロアリールアルキル」又は「ヘテロアリール−アルキル」という用語は、アルキル部分と結合したヘテロアリール部分を意味する。
【0028】
特に明示のない限り、「複素環」という用語は、炭素、H及び少なくとも1つのヘテロ原子(例えば、N、O又はS)で構成される芳香族、部分芳香族、又は非芳香族の単環式又は多環式の環又は環系を表す。複素環は、ともに融合又は結合した複数(すなわち2つ以上)の環を含み得る。複素環はヘテロアリールを含む。例としては、ベンゾ[1,3]ジオキソリル、2,3−ジヒドロ−ベンゾ[1,4]ジオキシニル、シンノリニル、フラニル、ヒダントイニル、モルホリニル、オキセタニル、オキシラニル、ピペラジニル、ピペリジニル、ピロリジノニル、ピロリジニル、テトラヒドロフラニル、テトラヒドロピラニル、テトラヒドロピリジニル、テトラヒドロピリミジニル、テトラヒドロチオフェニル、テトラヒドロチオピラニル及びバレロラクタミルが挙げられるが、これらに限定されない。
【0029】
特に明示のない限り、「複素環アルキル」又は「複素環−アルキル」という用語は、アルキル部分と結合した複素環部分を表す。
【0030】
特に明示のない限り、「ヘテロシクロアルキル」という用語は、非芳香族の複素環を表す。
【0031】
特に明示のない限り、「ヘテロシクロアルキルアルキル」又は「ヘテロシクロアルキル−アルキル」という用語は、アルキル部分と結合したヘテロシクロアルキル部分を表す。
【0032】
特に明示のない限り、「LIMK2 IC50」という用語は、以下の実施例に記載のin vitroヒトLIMキナーゼ2阻害アッセイを使用して決定した化合物のIC50である。
【0033】
特に明示のない限り、「管理する(manage)」、「管理すること(managing)」及び「管理(management)」という用語は、特定の疾患若しくは障害に既に罹患した患者において疾患若しくは障害の再発を予防すること、及び/又は疾患若しくは障害に罹患している患者が寛解期にある時間を延長させることを包含する。この用語は、疾患若しくは障害の閾値、発症及び/若しくは継続期間を調節すること、又は患者の疾患若しくは障害に対する応答の仕方を変えることを包含する。
【0034】
特に明示のない限り、「薬学的に許容される塩」という用語は、薬学的に許容される非毒性の酸又は塩基(無機酸及び無機塩基並びに有機酸及び有機塩基を含む)から調製される塩を表す。好適な薬学的に許容される塩基付加塩としては、アルミニウム、カルシウム、リチウム、マグネシウム、カリウム、ナトリウム及び亜鉛から生成される金属塩、又はリジン、N,N’−ジベンジルエチレンジアミン、クロロプロカイン、コリン、ジエタノールアミン、エチレンジアミン、メグルミン(N−メチルグルカミン)及びプロカインから生成される有機塩が挙げられるが、これらに限定されない。好適な非毒性の酸としては、酢酸、アルギン酸、アントラニル酸、ベンゼンスルホン酸、安息香酸、カンファースルホン酸、クエン酸、エテンスルホン酸、ギ酸、フマル酸、フロ酸、ガラクツロン酸、グルコン酸、グルクロン酸、グルタミン酸、グリコール酸、臭化水素酸、塩酸、イセチオン酸、乳酸、マレイン酸、リンゴ酸、マンデル酸、メタンスルホン酸、ムチン酸、硝酸、パモン酸、パントテン酸、フェニル酢酸、リン酸、プロピオン酸、サリチル酸、ステアリン酸、コハク酸、スルファニル酸、硫酸、酒石酸及びp−トルエンスルホン酸等の無機酸及び有機酸が挙げられるが、これらに限定されない。具体的な非毒性酸としては、塩酸、臭化水素酸、リン酸、硫酸、及びメタンスルホン酸が挙げられる。したがって、具体的な塩の例としては、塩酸塩及びメシル酸塩が挙げられる。他のものも当該技術分野において既知である。例えば、Remington's Pharmaceutical Sciences(第18版、Mack Publishing, Easton PA: 1990)、及びRemington: The Science and Practice of Pharmacy(第19版、Mack Publishing, Easton PA: 1995)を参照されたい。
【0035】
特に明示のない限り、「強力なLIMK2阻害剤」は、LIMK2 IC50が約250nM未満である化合物である。
【0036】
特に明示のない限り、「予防する(prevent)」、「予防すること(preventing)」及び「予防(prevention)」という用語は、患者が特定の疾患又は障害に罹患し始める前に行う処置を意図するものであり、疾患又は障害の重症度を抑制又は低減する。換言すると、この用語は予防法を包含する。
【0037】
特に明示のない限り、化合物の「予防的に有効な量」は、疾患若しくは病態、若しくは疾患若しくは病態に関連する1つ若しくは複数の症状を予防するのに、又はその再発を予防するのに十分な量である。化合物の「予防的に有効な量」は、単独で又は他の薬剤と組み合わせて、疾患の予防において予防的利点をもたらす治療剤の量を意味する。「予防的に有効な量」という用語は、予防法を全体的に改善する、又は別の予防剤の予防的な有効性を高める量を包含し得る。
【0038】
特に明示のない限り、「置換された」という用語は、化学構造又は部分を説明するために使用する場合は、H原子の1つ又は複数が、アルコール、アルデヒド、アルコキシ、アルカノイルオキシ、アルコキシカルボニル、アルケニル、アルキル(例えば、メチル、エチル、プロピル、t−ブチル)、アルキニル、アルキルカルボニルオキシ(−OC(O)アルキル)、アミド(例えば、−C(O)NH−アルキル−、−アルキルNHC(O)アルキル)、アミジニル(例えば、−C(NH)NH−アルキル−、−C(NR)NH2)、アミン(アルキルアミノ、アリールアミノ、アリールアルキルアミノ等の第1級、第2級及び第3級のアミン)、アロイル、アリール、アリールオキシ、アゾ、カルバモイル(例えば、−NHC(O)O−アルキル−、−OC(O)NH−アルキル)、カルバミル(例えば、CONH2、CONH−アルキル、CONH−アリール、CONH−アリールアルキル)、カルボニル、カルボキシル、カルボン酸、カルボン酸無水物、カルボン酸塩化物、シアノ、エステル、エポキシド、エーテル(例えば、メトキシ、エトキシ)、グアニジノ、ハロ、ハロアルキル(例えば、−CCl3、−CF3、−C(CF3)3)、ヘテロアルキル、ヘミアセタール、イミン(第1級及び第2級)、イソシアネート、イソチオシアネート、ケトン、ニトリル、ニトロ、オキソ、ホスホジエステル、スルフィド、スルホンアミド(例えば、SO2NH2)、スルホン、スルホニル(アルキルスルホニル、アリールスルホニル及びアリールアルキルスルホニルを含む)、スルホキシド、チオール(例えば、スルフヒドリル、チオエーテル)並びに尿素(例えば、−NHCONH−アルキル−)等の(しかしこれらに限定されない)化学的部分又は官能基で置換された、その構造又は部分の誘導体を表す。
【0039】
特に明示のない限り、化合物の「治療的に有効な量」は、疾患若しくは病態の治療若しくは管理において治療的利点をもたらすのに、又は疾患若しくは病態に関連した1つ若しくは複数の症状を遅延させる若しくは最小限に抑えるのに十分な量である。化合物の「治療的に有効な量」は、疾患又は病態の治療又は管理に治療的利点をもたらす、単独の又は他の療法と組み合わせた治療剤の量を意味する。「治療的に有効な量」という用語は、療法を全体的に改善するか、疾患若しくは病態の症状若しくは原因を低減若しくは回避するか、又は別の治療剤の治療的な有効性を高める量を包含し得る。
【0040】
特に明示のない限り、「治療する(treat)」、「治療すること(treating)」及び「治療(treatment)」という用語は、患者が特定の疾患又は障害に罹患している間に行う処置を意図し、これによって疾患若しくは障害の重症度が低減するか、又は疾患若しくは障害の進行が遅延若しくは減速する。
【0041】
特に明示のない限り、「挙げられる(含む)(include)」という用語は、「挙げられる(含む)が、これらに限定されない」と同じ意味を有し、「挙げられる(含む)(includes)」という用語は、「挙げられる(含む)が、これらに限定されない」と同じ意味を有する。同様に、「等の(such as)」という用語は、「等の(しかしこれらに限定されない)」という用語と同じ意味を有する。
【0042】
特に明示のない限り、一連の名詞の直前にくる1つ又は複数の形容詞は、それぞれの名詞を修飾するものとして解釈される。例えば、「必要に応じて置換されたアルキル(alkyl)、アリール又はヘテロアリール」という語句は、「必要に応じて置換されたアルキル、必要に応じて置換されたアリール、又は必要に応じて置換されたヘテロアリール」と同じ意味を有する。
【0043】
より大きい化合物の一部分を形成する化学的部分は、単一分子として存在する場合に一般的に指す名称、又はその基を一般的に指す名称を使用して本明細書に記載されることがあることに留意すべきである。例えば、「ピリジン」及び「ピリジル」という用語は、他の化学的部分と結合した部分を記載するのに使用する場合に、同じ意味を表す。したがって、「XOH(式中、Xはピリジルである)」及び「XOH(式中、Xはピリジンである)」という2つの語句には同じ意味が与えられ、化合物ピリジン−2−オール、ピリジン−3−オール及びピリジン−4−オールを包含する。
【0044】
或る構造又は或る構造の一部分の立体化学が例えば太線又は破線で示されない場合、その構造又はその構造の一部分はその全ての立体異性体を包含すると解釈されることにも留意すべきである。さらに、満たされていない原子価を有することが図で示された任意の原子はこの原子価を満たすのに十分なH原子と結合していると推測される。さらに、一本の破線と平行した一本の実線で示された化学結合は、原子価が許容する場合、単結合及び二重結合の両方(例えば、芳香族結合)を包含する。
【0045】
5.2. 化合物
本発明は、式:
【0046】
【化2】

【0047】
(式中、R1がH、C(O)RA、S(O)nRA、C(O)NRARB、S(O)nNRARB、S(O)nORA、C(NH)NRARB、C(O)ORA、C(S)NRARB、C(SRB)NRA、P(O)(ORA)2、又は必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換された)アルキル、アリール若しくは複素環であり、R2がH、C(O)RA、S(O)nRA、C(O)NRARB、S(O)nNRARB、S(O)nORA、又は必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換された)アルキル、アリール若しくは複素環であり、R3がH、ハロゲン、OR、NRARB、必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、ヒドロキシル、シアノ、NRARB、SRA、CO2RA、C(O)NRARBで置換された)アルキルであり、各RAが独立して、H、若しくは必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換された)アルキル、アリール、アルキルアリール若しくはアルキル−複素環であり、各RBが、必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換された)アルキル若しくはアリールであり、又はRA及びRBが同じ窒素原子と結合する場合、RA及びRBは該窒素原子とともに、必要に応じて置換された複素環(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換されたピペリジニル、モルホリノ、チオモルホリノ、ピペラジニル、ピロリジノ及びアゼチジノ)を形成することができ、nが0〜2である)の化合物、及びその薬学的に許容される塩を包含する。
【0048】
特定の実施形態では、上記化合物は、以下のうちの1つ又は複数が当てはまるようなものである:R1がC(O)RAであり、R2がCHF2であり、R3が2,6−ジクロロフェニルである場合、RAはエトキシ、シクロプロピル若しくはイソプロピルではなく;R1がC(O)RAであり、R2がH若しくはCHF2であり、R3が3,5−ジメチルフェニルである場合、RAはメトキシではなく;R1がC(O)NRARBであり、R2がピラジルであり、R3が2,6−ジメチル−4−メトキシフェニルであり、RAがHである場合、RBはエチルではなく;又はR1がHであり、R2がメチルである場合、R3はクロロではない。
【0049】
一つの実施形態では、上記化合物は、式:
【0050】
【化3】

【0051】
(式中、各R2Aは独立して、シアノ、ハロ、ヒドロキシル、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又は必要に応じて置換された(例えば必要に応じてフッ素化された)アルキル、アルコキシル若しくはアリールであり、mは0〜5である)の化合物である。
【0052】
別の実施形態では、上記化合物は、式:
【0053】
【化4】

【0054】
の化合物である。
【0055】
本明細書に記載の式により包含される特定の化合物では、RAは、必要に応じてハロ、ヒドロキシル、アミノ、アルキルアミノ又はジアルキルアミノのうちの1つ又は複数で置換されたアルキルである。幾つかの実施形態では、RAはイソプロピルである。幾つかの実施形態では、RAはアミノで置換されたアルキルである。幾つかの実施形態では、少なくとも1つのR2Aはクロロである。
【0056】
一つの実施形態では、上記化合物は、式:
【0057】
【化5】

【0058】
の化合物である。
【0059】
本明細書に記載の式により包含される特定の化合物では、R2Aはブロモである。幾つかの実施形態では、mは2又は3である。幾つかの実施形態では、R3はH又は必要に応じて置換された低級アルキルである。幾つかの実施形態では、R3はジフルオロメチルである。
【0060】
本発明の特定の化合物は、強力なLIMK2阻害剤である。或る特定の化合物は、約100nM未満、75nM未満、50nM未満、25nM未満又は10nM未満のLIMK2 IC50を有する。
【0061】
5.3. 合成方法
本発明の化合物を、当該技術分野で既知の方法により調製することができる共通の中間体N−(2,4−ジメトキシベンジル)−4−アセチル−2−アミノチアゾール(a)から合成することができる。アプローチの1つが、Ross-MacDonald, et al., Mol. Cancer Ther. 7:3490 (2008)に記載されており、以下のスキーム1で示される:
【0062】
【化6】

【0063】
次に、得られるN−(2,4−ジメトキシ)−4−アセチル−2−アミノチアゾール(a)を、以下のスキーム2に示されるように本発明の化合物に変換する:
【0064】
【化7】

【0065】
スキーム2に示した方法では、N−(2,4−ジメトキシ)−4−アセチル−2−アミノチアゾール(a)を、適切な求電子剤(例えば置換マロネート又はジメチルホルムアミドジメチルアセタール)及び塩基(例えばナトリウムエトキシド)の存在下で加熱することによりカルボニル化して、化合物(b)を得る。エノン(b)と式R2−NHNH2の置換ヒドラジン(c)との縮合により、ピラゾール(d)が与えられる。高温で吸湿性のある(wet)酸(例えばトリフルオロ酢酸)を用いた化合物(d)の脱保護により、2−アミノチアゾール(e)が与えられる。それから2−アミノチアゾール(e)を、適切な求電子剤(例えば酸塩化物、スルホニルクロリド、イソシアネート又はヘテロアリールクロリド)の添加を介して、又は2−ブロモ−アミノチアゾールへの変換(Das, et al. J. Med. Chem. 2006, 49, 6819-6832を参照されたい)及び好適な求核剤(例えばアミン、アルコール又はアニリン)との置換を介して化合物(f)へと変換することができる。
【0066】
式R2−NHNH2のヒドラジン(c)を、当該技術分野で既知の方法に従ってそれらに対応するアミンから調製することができる。アプローチの1つが、Finkelstein, et al.の国際公開第2008124092号に記載されており、以下のスキーム3で示される:
【0067】
【化8】

【0068】
5.4. 使用方法
本発明は、LIMK2を阻害する方法であって、LIMK2を強力なLIMK2阻害剤と接触させることを含む、LIMK2を阻害する方法を包含する。好ましい強力なLIMK2阻害剤は本発明の化合物(すなわち本明細書で開示の化合物)である。
【0069】
特定の実施形態は、患者において炎症性の疾患又は障害を治療、管理又は予防する方法であって、それを必要とする患者に治療的に又は予防的に有効な量の本発明の化合物を投与することを含む、患者において炎症性の疾患又は障害を治療、管理又は予防する方法を包含する。
【0070】
別の実施形態は、患者においてがんを治療、管理又は予防する方法であって、それを必要とする患者に治療的に又は予防的に有効な量の本発明の化合物を投与することを含む、患者においてがんを治療、管理又は予防する方法を包含する。
【0071】
別の実施形態は、患者の眼内圧を低下させる方法であって、それを必要とする患者においてLIMK2の活性又は発現を阻害することを含む、患者の眼内圧を低下させる方法を包含する。一方法では、LIMK2の活性は、患者の眼を強力なLIMK2阻害剤と接触させることによって阻害される。特定の強力なLIMK2阻害剤が、本明細書で開示される。別の方法では、LIMK2の発現は、LIMK2の発現を阻害する化合物(例えば、siRNA)を患者の眼に投与することによって阻害される。
【0072】
別の実施形態は、患者において視力に影響を及ぼす疾患又は障害を治療、管理又は予防する方法であって、それを必要とする患者においてLIMK2の活性又は発現を阻害することを含む、患者において視力に影響を及ぼす疾患又は障害を治療、管理又は予防する方法を包含する。一方法では、LIMK2の活性は、患者の眼を強力なLIMK2阻害剤と接触させることによって阻害される。特定の強力なLIMK2阻害剤が、本明細書で開示される。視力に影響を及ぼす疾患及び障害としては、緑内障、神経変性疾患、及び感染性疾患が挙げられる。
【0073】
5.5. 医薬製剤
本発明は、1つ又は複数の本発明の化合物を含む医薬組成物を包含する。或る特定の医薬組成物は、患者への経口投与、粘膜(例えば、鼻腔、舌下、膣、口腔又は直腸)投与、非経口(例えば、皮下、静脈内、ボーラス注入、筋肉内又は動脈内)投与、経皮投与、局所投与及び眼(例えば、局所、硝子体内)投与に好適な単一の単位剤形である。
【0074】
剤形の例としては、限定されるものではないが、錠剤;カプレット;軟弾性ゼラチンカプセル等のカプセル;カシェ(cachets:カプセル);トローチ;ロゼンジ;分散液;坐剤;軟膏;パップ(湿布);ペースト;粉末;包帯剤;クリーム;硬膏;溶液;パッチ;エアロゾル(例えば、経鼻スプレー又は吸入器);ゲル;懸濁液(例えば、水性又は非水性の液体懸濁液、水中油型エマルション、又は油中水型液体エマルション)、溶液及びエリキシルを含む患者への経口投与又は粘膜投与に好適な液体剤形;患者への非経口投与に好適な液体剤形;並びに再構成して患者への非経口投与に好適な液体剤形をもたらすことができる無菌固体(例えば、結晶性又は非結晶性の固体)が挙げられる。
【0075】
製剤は、投与方式に合わせる必要がある。例えば、経口投与は、本発明の化合物を消化管内での分解から保護するために腸溶性コーティングを必要とする。同様に、製剤は作用部位への活性成分(複数の場合もあり)の送達を促進する成分を含有し得る。例えば、化合物は、分解酵素から該化合物を保護し、循環系における輸送を促進し、細胞膜を通って細胞内部位へ至る送達を行うために、リポソーム製剤で投与され得る。
【0076】
剤形の組成、形状及び種類は、その用途に応じて異なる。例えば、疾患の急性期治療に使用する剤形は、該剤形に含まれる1つ又は複数の活性成分を、同じ疾患の慢性期治療に使用する剤形よりも多量に含有していてもよい。同様に、非経口剤形は、該剤形に含まれる1つ又は複数の活性成分を、同じ疾患を治療するために使用する経口剤形よりも少量含有していてもよい。本発明により包含される特定の剤形が互いに異なるこれら及び他の方法は、当業者には容易に明らかである。例えばRemington's Pharmaceutical Sciences、第18版(Mack Publishing, Easton PA: 1990)を参照されたい。
【0077】
5.5.1. 経口剤形
経口投与に好適な本発明の医薬組成物は、錠剤(例えば、チュアブル錠)、カプレット、カプセル及び液体(例えば、香味付与したシロップ)等の(しかしこれらに限定されない)個別の剤形として提供することができる。このような剤形は所定量の活性成分を含有し、当業者に既知の製薬法によって調製することができる。例えば、Remington's Pharmaceutical Sciences、第18版、(Mack Publishing, Easton PA: 1990)を参照されたい。
【0078】
典型的な経口剤形は、従来の薬学的配合技法に従い、密接な混和物中で活性成分(複数の場合もあり)を少なくとも1つの賦形剤と組み合わせることによって調製する。賦形剤は、投与に望ましい調製物の形態に応じて広範な形態を取ることができる。
【0079】
その投与のしやすさのため、錠剤及びカプセルが最も有益な経口単位剤形である。所望に応じて、錠剤は、標準的な水性又は非水性の技法によってコーティングすることができる。このような剤形は、従来の製薬法により調製することができる。一般に、医薬組成物及び剤形は、活性成分を液体担体、微粉固体担体、又はその両方と均一かつ密接に混和し、次に生成物を必要に応じて所望の形状に成形することによって調製する。崩壊剤は、固体剤形に組み込み、迅速な溶解を容易にする(facilitate)ことができる。また、滑剤を組み込んで、剤形(例えば、錠剤)の製造を容易にすることができる。
【0080】
5.5.2. 非経口剤形
非経口剤形は、皮下経路、静脈内経路(ボーラス注入を含む)、筋肉内経路及び動脈内経路を含むがこれらに限定されない様々な経路によって患者に投与することができる。典型的には夾雑物に対する患者の自然防御を介さずに投与するため、非経口剤形は具体的には無菌であるか、又は患者に投与する前に滅菌可能である。非経口剤形の例としては、すぐに注入できる溶液、薬学的に許容される注入用の媒体にすぐに溶解又は懸濁できる乾燥製品、すぐに注入できる懸濁液、及びエマルションが挙げられるが、これらに限定されない。
【0081】
本発明の非経口剤形を提供するために使用することができる好適な媒体は、当業者に既知である。例としては、注射用水(USP);塩化ナトリウム注射液、リンゲル液、デキストロース注射液、デキストロース及び塩化ナトリウム注射液、並びに乳酸加リンゲル液等の(しかしこれらに限定されない)水性媒体;エチルアルコール、ポリエチレングリコール及びポリプロピレングリコール等の(しかしこれらに限定されない)水混和性媒体;並びにトウモロコシ油、綿実油、ラッカセイ油、ゴマ油、オレイン酸エチル、ミリスチン酸イソプロピル及び安息香酸ベンジル等の(しかしこれらに限定されない)非水性媒体が挙げられるが、これらに限定されない。
【0082】
5.5.3. 経皮剤形、局所剤形及び粘膜剤形
経皮剤形、局所剤形及び粘膜剤形としては、点眼溶液、スプレー、エアロゾル、クリーム、ローション、軟膏、ゲル、溶液、エマルション、懸濁液、又は当業者に既知の他の形態が挙げられるが、これらに限定されない。例えば、Remington's Pharmaceutical Sciences、第18版(Mack Publishing, Easton PA: 1990)、及びIntroduction to Pharmaceutical Dosage Forms、第4版(Lea & Febiger, Philadelphia: 1985)を参照されたい。経皮剤形としては、皮膚に貼付し一定時間装用することにより、所望量の活性成分の透過が可能となり得る、「リザーバ型」パッチ又は「マトリクス型」パッチが挙げられる。
【0083】
経皮剤形、局所剤形及び粘膜剤形を提供するために使用され得る好適な賦形剤(例えば、担体及び希釈剤)並びに他の材料は、薬学の当業者に既知であり、所定の医薬組成物又は剤形を適用する特定の組織に応じて異なる。
【0084】
治療対象の特定の組織に応じて、本発明の活性成分による治療前に、治療と同時に、又は治療後に、更なる構成成分を使用することができる。例えば、透過亢進剤を使用して、組織への活性成分の送達を補助し得る。
【0085】
また、医薬組成物若しくは剤形のpH、又は医薬組成物若しくは剤形が適用される組織のpHを調整して、1つ又は複数の活性成分の送達を改善することができる。同様に、溶媒担体の極性、そのイオン強度、又は張性(tonicity)を調整して、送達を改善することができる。また、送達が改善するように、ステアレート等の化合物を医薬組成物又は剤形に添加して、1つ又は複数の活性成分の親水性又は親油性を有利に変化させることができる。この点に関して、ステアレートは、製剤用の脂質媒体として、乳化剤又は界面活性剤として、及び送達亢進剤又は透過亢進剤として作用し得る。活性成分の種々の塩、水和物又は溶媒和物を使用して、得られる組成物の特性を更に調整することができる。
【0086】
5.5.4. 点眼剤形
本発明の化合物は、水溶液、水性懸濁液及び軟膏を使用して、眼に(例えば、局所的に)送達することができる。当業者が認識するように、点眼製品は、眼の微生物汚染を防ぐために最終容器中で無菌でなければならない。容器を開けた場合に、無菌性を維持するのに保存料を使用してもよい。点眼製剤は、製剤のpH、緩衝能、粘性及び張性を制御することも必要とする。好ましい製剤は、pHが約6.5〜8.5であり、緩衝能が約0.01〜0.1である。特定の製剤は等張である。特定の製剤は、粘性が約25cps〜50cpsである。
【0087】
活性医薬成分(API)をその作用部位に効果的に送達する安全な媒体を提供するのに使用され得る成分は、既知であるが、APIの物理的及び化学的な特徴に応じて変わる。
【0088】
適切に緩衝化した水溶液を水溶性の化合物の送達に使用してもよい。典型的には、溶液組成物において、組成物の粘性を増大させるのに高分子成分を使用する。好適なポリマーの例としては、セルロースポリマー(例えば、ヒドロキシプロピルメチルセルロース、ヒドロキシエチルセルロース、エチルヒドロキシエチルセルロース)、合成ポリマー(例えば、カルボキシビニルポリマー、ポリビニルアルコール)、多糖類(例えば、キサンタンガム、グアーガム及びデキストラン)及びそれらの混合物が挙げられる。例えば、米国特許第4,136,173号及び同第7,244,440号を参照されたい。化合物を送達するのに懸濁液を使用してもよい。高分子成分は典型的には、不溶性成分の懸濁又は容易な再分散性の維持に役立つ物理的安定性助剤として懸濁液組成物中で使用される(同上)。
【0089】
製剤の無菌性を確保するのに、保存料を使用してもよい。好適な保存料としては、塩化ベンザルコニウム、塩化ベンゼトニウム、クロロブタノール、酢酸フェニル水銀、硝酸フェニル水銀、チメロサール、メチルパラベン及びプロピル−パラベンが挙げられる。また、酸化を受けやすい製剤の安定性を確保するために、抗酸化剤を使用してもよい。好適な抗酸化剤としては、エチレンジアミン四酢酸、重亜硫酸ナトリウム、メタ重亜硫酸ナトリウム及びチオ尿素が挙げられる。
【実施例】
【0090】
6.実施例
本発明の態様は、以下の実施例から理解することができるが、該実施例は本発明の範囲を限定しない。
【0091】
6.1. N−(2,4−ジメトキシベンジル)−4−アセチル−2−アミノチアゾール(3)の合成
【0092】
【化9】

【0093】
1−(2,4−ジメトキシベンジル)チオ尿素(1)
2,4−ジメトキシベンジルアミン(15mL、99.8mmol)を300mLのジクロロメタン中の1,1’−チオカルボニルジイミダゾール(90%、21.8g、110mmol)の溶液に30分かけて添加漏斗によって添加した。反応混合物を室温で3時間撹拌した。反応時にメタノール性アンモニア溶液(2N、250mL、500mmol)を添加して、それを72時間撹拌した。揮発性物質を真空下で除去した。得られる固体を100mLのジクロロメタン中でスラリー状にし、ろ過した。沈殿物を過剰量のジクロロメタンで洗浄し、褐色の固体としてチオ尿素1を得た(17.5g、収率77%)。1H NMR(400MHz,DMSO−d6)δ:7.66(br.s.,1H)、7.12(d,J=7.9Hz,1H)、7.00(br.s.,2H)、6.55(d,J=2.2Hz,1H)、6.49(d,J=8.2Hz,1H)、4.46(d,J=4.2Hz,2H)、3.79(s,3H)、3.74(s,3H)。MS(ES+)[M+H]+:227.2。
N’−(2,4−ジメトキシベンジルカルバモチオイル)−N,N−ジメチルホルムイミドアミド(2)
ジメチルホルムアミドジメチルアセタール(5.8mL、41.0mmol)を、30mLのエタノール中の1−(2,4−ジメトキシベンジル)チオ尿素(1、6.2g、27.3mmol)の溶液に添加し、80℃(この温度で反応物が均質な溶液になる)で1時間加熱し、LCMS分析により反応が完了したとみなした。室温まで冷却しながら、反応物に窒素ガス流を通し、これにより白色の固体が析出した。この固体をろ過し、100mLのエタノールで2回洗浄して、白色の固体としてイミン異性体の1:1混合物を得た(6.55g、収率85%、イミドアミド異性体の2.5:1混合物)。1H NMR(400MHz,DMSO−d6)δ:(主異性体):8.79(t,J=6.0Hz,1H)、8.70(s,1H)、7.00(d,J=7.9Hz,1H)、6.53(d,J=1.8Hz,1H)、6.43〜6.46(m,1H)、4.61(d,J=6.0Hz,2H)、3.78(s,3H)、3.73(s,3H)、3.13(s,3H)、2.99(s,3H)。(副異性体):8.67(t,J=6.0Hz,1H)、8.65(s,1H)、7.02(d,J=7.7Hz,1H)、6.51(d,J=2.2Hz,1H)、6.44〜6.47(m,1H)、4.45(d,J=6.2Hz,2H)、3.77(s,3H)、3.73(s,3H)、3.13(s,3H)、2.97(s,3H)。MS(ES+)[M+H]+:282.2。
N−(2,4−ジメトキシベンジル)−4−アセチル−2−アミノチアゾール(3)
クロロアセトン(1.21mL、15.2mmol)を32mLのアセトニトリル中のホルムイミドアミド2(3.56g、12.7mmol)に添加した。この混合物を3時間かけて75℃まで加熱した。開始反応体積が半分に低減するまで、室温まで冷却しながら、反応物に窒素ガス流を通した。37.5mLの水及び12.5mLの飽和NaHCO3水溶液を添加し、スラリーを15分間撹拌した。沈殿物をろ過し、水及び20%ジエチルエーテル/ヘキサンをそれぞれ100mL用いて洗浄して、真空下で乾燥させた後、オフホワイト色の固体としてアセチルチアゾール3を得た(3.49g、収率95%)。1H NMR(DMSO−d6):8.85(br.s.,1H)、7.97(s,1H)、7.15(d,J=8.4Hz,1H)、6.57(d,J=2.2Hz,1H)、6.48(dd,J=8.4,2.2Hz,1H)、4.37(d,J=5.1Hz,2H)、3.79(s,3H)、3.74(s,3H)、2.34(s,3H)。MS(ES+)[M+H]+:371.1、[M+H+H2O]+:389.1。
【0094】
6.2. 5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)チアゾール−2−アミン(6)の合成
【0095】
【化10】

【0096】
1−(2−(2,4−ジメトキシベンジルアミノ)チアゾール−5−イル)−4,4−ジフルオロブタン−1,3−ジオン(4)
エタノール(およそ3N、5.4mL)中のナトリウムエトキシドの溶液におけるアミノチアゾール3(1.11g、3.80mmol)及びジエチル2,2−ジフルオロマロネート(2.98g、15.2mmol)の混合物を5時間かけて75℃まで加熱し、その後反応物は均質になった。室温まで冷却した後、反応混合物を過剰量の水とともにフラスコに移した。pHを氷酢酸を用いて5〜6に調整した。得られる固体をろ過し、水/メタノール(2:1(v:v))及びジエチルエーテル/ヘキサン(1:4(v:v))をそれぞれ100mL用いて洗浄した。固体を真空下で終夜乾燥させ、橙色の固体として表題の化合物を得た(1.05g、収率74%)。1H NMR(DMSO−d6)δ:9.26(br.s.,1H)、8.33(s,1H)、7.16(d,J=8.3Hz,1H)、6.57〜6.61(m,2H)、6.50(dd,J=8.3,2.5Hz,1H)、4.41(br.s.,2H)、3.80(s,3H)、3.75(s,3H)、3.35(br.s.,1H)。19F NMR(DMSO−d6)δ:−126.70(d,J=53.9Hz)。MS(ES+)[M+H]+:293.1。
5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)−N−(2,4−ジメトキシベンジル)チアゾール−2−アミン(5)
6mLのエタノール中のケトン4(296mg、0.800mmol)と2,6−ジクロロフェニルヒドラジン塩酸塩(205mg、0.960mmol)との混合物を2時間かけて75℃まで加熱した。反応物を冷却し、4mLの水及び1.5mLの飽和NaHCO3水溶液で処理し(treated)、それにより沈殿物の形成がもたらされた。沈殿物をろ過し(filtered)、水/メタノール(2:1(v:v))及びジエチルエーテル/ヘキサン(1:4(v:v))をそれぞれ10mL用いて洗浄した。固体を真空下で終夜乾燥させ、ベージュ色の固体としてピラゾール5を得た(358mg、収率88%)。1H NMR(DMSO−d6)δ:8.12(t,J=5.7Hz,1H)、7.77(d,J=8.8Hz,1H)、7.77(d,J=7.1Hz,1H)、7.70(dd,J=9.4,6.6Hz,1H)、7.21(s,1H)、7.07(d,J=3.8Hz,1H)、7.01(t,J=32.1Hz,1H)、6.53(d,J=2.5Hz,1H)、6.45(dd,J=8.3,2.5Hz,1H)、4.25(d,J=5.6Hz,2H)、3.76(s,3H)、3.73(s,3H)。19F NMR(DMSO−d6)δ:−112.52(d,J=53.9Hz)。MS(ES+)[M+H]+:511.0。
5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)チアゾール−2−アミン(6)
ピラゾール5(358mg、0.703mmol)の入ったバイアルに、0.5mLの水及び5mLのトリフルオロ酢酸を添加した。反応が進行するにつれて、反応物は明るいピンク色に変わる。4時間後、反応物を20mLの水で希釈し、飽和NaHCO3水溶液で中和した。固体をろ過し、水で洗浄して、シリカゲルクロマトグラフィ(50%から100%までの勾配の酢酸エチル/ヘキサン)により更に精製して、薄い橙色の無定形の固体として2−アミノチアゾール6を得た(237mg、収率94%)。1H NMR(メタノール−d4)δ:7.57〜7.68(m,3H)、6.93(s,1H)、6.86(s,1H)、6.80(t,J=54.6Hz,1H)。19F NMR(メタノール−d4)δ:−114.37(d,J=55.1Hz)。MS(ES+)[M+H]+:361.1。
【0097】
6.3. N−(5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)チアゾール−2−イル)ブチルアミドの合成
【0098】
【化11】

【0099】
N−(5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)チアゾール−2−イル)ブチルアミド(7)
THF(0.5mL)中のアミノチアゾール6(20mg、0.055mmol)の溶液に、N−メチルモルホリン(0.030mL、0.278mmol)、その後塩化ブチリル(0.030mL、0.278mmol)を添加した。反応物を5分間撹拌した。反応物をろ過し、真空下で濃縮して、分取HPLC(30×100mmのC18カラム、10%から100%までのメタノール:水(10mMの酢酸アンモニウム)、15分、45mL/分)により精製して、所望のアミド7を得た(9.5mg、収率40%、HPLC分析による純度98.9%)。1H NMR(メタノール−d4)δ:7.57〜7.69(m,3H)、7.37(s,1H)、7.00(s,1H)、6.83(t,J=54.8Hz,1H)、2.41(t,J=7.5Hz,2H)、1.63〜1.75(m,2H)、0.96(t,J=7.5Hz,3H)。19F NMR(メタノール−d4)δ:−114.40(d,J=55.1Hz)。MS(ES+)[M+H]+:431.0。
【0100】
6.4. N−(5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)チアゾール−2−イル)−4−(ジメチルアミノ)ブタンアミドの合成
【0101】
【化12】

【0102】
N−(5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)チアゾール−2−イル)−4−(ジメチルアミノ)ブタンアミド(8)
酢酸イソ−プロピル(2.0mL)中のアミノチアゾール6(80mg、0.22mmol)の溶液に、N,N−ジイソプロピルエチルアミン(0.19mL、1.1mmol)、4−(ジメチルアミノ)ブタン酸塩酸塩(93mg、0.55mmol)及びHATu(211mg、0.55mmol)を添加した。反応物を80℃で1時間加熱し、その後飽和NH4Cl水溶液/ブラインの1:1(v:v)混合物を用いてクエンチした。水層を酢酸エチルで抽出した。複合有機層をブラインで洗浄し、硫酸マグネシウムで乾燥させ、ろ過し、濃縮した。粗残渣を分取HPLC(30×100mmのC18カラム、10%から100%までのメタノール:水(10mMのギ酸アンモニウム)、15分、45mL/分)により精製して、所望のアミドを得た(8、65mg、収率62%)。1H NMR(メタノール−d4)δ:7.57〜7.69(m,3H)、7.39(s,1H)、7.01(s,1H)、6.84(t,J=54.8Hz,1H)、3.06〜3.15(m,2H)、2.84(s,6H)、2.59(t,J=6.9Hz,2H)、1.99〜2.10(m,2H)。19F NMR(メタノール−d4)δ:−114.37(d,J=54.9Hz)。MS(ES+)[M+H]+:474.0。
【0103】
6.5. (S)−N−(5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)チアゾール−2−イル)−2−(ピロリジン−2−イル)アセトアミドの合成
【0104】
【化13】

【0105】
(S)−N−(5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)チアゾール−2−イル)−2−(ピロリジン−2−イル)アセトアミド(9)
酢酸イソ−プロピル(0.5mL)中のアミノチアゾール6(25mg、0.069mmol)の溶液に、N,N−ジイソプロピルエチルアミン(0.060mL、0.35mmol)、(S)−2−(1−tert−ブトキシカルボニル)ピロリジン−2−イル)酢酸塩酸塩(39mg、0.17mmol)及びHATu(65mg、0.17mmol)を添加した。反応物を80℃で1時間加熱し、その後飽和NH4Cl水溶液/ブラインの1:1(v:v)混合物を用いてクエンチした。水層を酢酸エチルで抽出した。複合有機層をブラインで洗浄し、硫酸マグネシウムで乾燥させ、ろ過し、濃縮した。粗残渣を1mLのメタノールに入れ、4N HClのジオキサン溶液0.2mLを添加した。反応物を60℃で1時間加熱した。揮発性物質を真空下で除去し、粗残渣を分取HPLC(30×100mmのC18カラム、10%から100%までのメタノール:水(10mMのギ酸アンモニウム)、15分、45mL/分)により精製して、モノホルメート塩として所望のアミドを得た(9、13.0mg、収率36%)。1H NMR(メタノール−d4)δ:8.47(s,1H)、7.56〜7.69(m,3H)、7.45(s,1H)、7.02(s,1H)、6.84(t,J=54.6Hz,1H)、3.85〜3.96(m,1H)、3.06(dd,J=17.6,3.7Hz,1H)、2.81〜2.93(m,1H)、2.22〜2.34(m,1H)、2.04〜2.15(m,1H)、1.92〜2.04(m,1H)、1.65〜1.79(m,1H)。13C NMR(DMSO−d6)δ:168.7、158.7、148.2(t,J=29.3Hz)、138.4、138.3、134.4、133.8、133.5、129.5、116.6、111.0(t,J=232.7Hz)、103.2、54.8、44.6、36.8、29.8、23.0。19F NMR(メタノール−d4)δ:−114.38(d,J=55.1Hz)。MS(ES+)[M+H]+:472.1。
【0106】
6.6. 5−(1−(2,6−ジクロロフェニル)−1H−ピラゾール−5−イル)チアゾール−2−アミン(13)の合成
【0107】
【化14】

【0108】
1−(2−(2,4−ジメトキシベンジルアミノ)チアゾール−5−イル)−3−(ジメチルアミノ)プロパ−2−エン−1−オン(11)
22.5mLのジメチルホルムアミドジメチルアセタール中のケトン3(2.25g、7.70mmol)を105℃まで18時間かけて加熱した。溶液を周囲温度まで冷却した。2.5mLのエタノール、その後67mLのジエチルエーテルを添加した。この沈殿した混合物を30分間撹拌し、ろ過した。沈殿物を過剰量のジエチルエーテルで洗浄し、18時間真空下で乾燥させ、オフホワイト色の固体としてエノン11を得た(1.00g、収率37%)。1H NMR(DMSO−d6)δ:8.38(t,J=5.7Hz,1H)、7.77(s,1H)、7.47(d,J=12.3Hz,1H)、7.15(d,J=8.2Hz,1H)、6.56(d,J=2.2Hz,1H)、6.48(dd,J=8.3,2.3Hz,1H)、5.58(d,J=12.6Hz,1H)、4.32(d,J=5.5Hz,2H)、3.80(s,3H)、3.74(s,3H)、3.33(s,6H)。MS(ES−)[M−H]:346.1。
【0109】
5−(1−(2,6−ジクロロフェニル)−1H−ピラゾール−5−イル)−N−(2,4−ジメトキシベンジル)チアゾール−2−アミン(12)
7mLのエタノール中のケトン11(347mg、1.00mmol)と2,6−ジクロロフェニルヒドラジン塩酸塩(256mg、1.20mmol)との混合物を75℃まで2時間かけて加熱した。反応物を冷却し、5mLの水及び1.5mLの飽和NaHCO3水溶液で処理し、沈殿物の形成がもたらされた。沈殿物をろ過し、水/メタノール(2:1(v:v))及びジエチルエーテル/ヘキサン(1:4(v:v))をそれぞれ10mL用いて洗浄した。固体を真空下で乾燥させ、更に精製することなく次の工程に使用した。MS(ES+)[M+H]+:461.1。
5−(1−(2,6−ジクロロフェニル)−1H−ピラゾール−5−イル)チアゾール−2−アミン(13)
ピラゾール12(460mg、1.00mmol)の入ったバイアルに、1.5mLの水及び7mLのトリフルオロ酢酸を添加した。反応が進行するにつれて、反応物は明るいピンク色に変わる。4時間後、反応物を20mLの水で希釈し、飽和NaHCO3水溶液で中和した。固体をろ過し、水で洗浄して、シリカゲルクロマトグラフィ(40%から80%までの勾配の酢酸エチル/ヘキサン)により更に精製して、薄い黄色の固体として2−アミノチアゾール13を得た(216mg、2工程で収率70%)。1H NMR(メタノール−d4)δ:7.76(d,J=2.0Hz,1H)、7.55〜7.66(m,3H)、6.84(s,1H)、6.64(d,J=2.0Hz,1H)。MS(ES+)[M+H]+:311.1。
【0110】
6.7. N−(5−(1−(2,6−ジクロロフェニル)−1H−ピラゾール−5−イル)チアゾール−2−イル)ブチルアミド(14)の合成
【0111】
【化15】

【0112】
N−(5−(1−(2,6−ジクロロフェニル)−1H−ピラゾール−5−イル)チアゾール−2−イル)ブチルアミド(14)
THF(1.0mL)中のアミノチアゾール13(35mg、0.11mmol)の溶液に、N−メチルモルホリン(0.12mL、1.1mmol)、その後塩化ブチリル(0.12mL、1.1mmol)を添加した。反応物を5分間撹拌した。反応物をろ過し、真空下で濃縮して、分取HPLC((30×100mmのC18カラム、10%から100%までのメタノール:水(10mMの酢酸アンモニウム)、15分、45mL/分)により精製して、所望のアミド14を得た(7.4mg、収率18%、HPLC分析による純度97.6%)。1H NMR(メタノール−d4)δ:7.83(d,J=2.0Hz,1H)、7.55〜7.68(m,3H)、7.28(s,1H)、6.79(d,J=2.0Hz,1H)、2.41(t,J=7.4Hz,2H)、1.62〜1.76(m,2H)、0.96(t,J=7.4Hz,3H)。MS(ES+)[M+H]+:381.1。
【0113】
6.8. 4−アセトアミド−N−(5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)チアゾール−2−イル)ブタンアミド(15)の合成
【0114】
【化16】

【0115】
4−アセトアミド−N−(5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)チアゾール−2−イル)ブタンアミド(15)
酢酸イソ−プロピル(0.5mL)中のアミノチアゾール13(20mg、0.064mmol)の溶液に、N,N−ジイソプロピルエチルアミン(0.057mL、0.32mmol)、4−アセトアミドブタン酸(28mg、0.19mmol)及びHATu(94mg、0.21mmol)を添加した。反応物を80℃で1時間加熱し、その後飽和NH4Cl水溶液/ブラインの1:1(v:v)混合物を用いてクエンチした。水層を酢酸エチルで抽出した。複合有機層をブラインで洗浄し、硫酸マグネシウムで乾燥させ、ろ過し、濃縮した。粗残渣を分取HPLC(30×100mmのC18カラム、10%から100%までのメタノール:水(10mMの酢酸アンモニウム)、15分、45mL/分)により精製して、所望のアミドを得た(15、8.5mg、収率30%、HPLC分析による純度95%)。1H NMR(メタノール−d4)δ:7.82(d,J=2.0Hz,1H)、7.55〜7.68(m,3H)、7.27(s,1H)、6.78(d,J=2.0Hz,1H)、3.21(t,J=6.8Hz,2H)、2.47(t,J=7.3Hz,2H)、1.90(s,3H)、1.85(t,J=7.1Hz,2H)。MS(ES+)[M+H]+:438.0。
【0116】
6.9. (2,6−ジメチルフェニル)ヒドラジン塩酸塩の合成
【0117】
【化17】

【0118】
(2,6−ジメチルフェニル)ヒドラジン塩酸塩(18)
添加漏斗を備えた100mL容の丸底フラスコに、6.25mLの濃HCl及び5mLの水を入れた。溶液を−5℃に冷却した。2,6−ジメチルアニリン(3.5mL、28.2mmol)をシリンジによって滴下すると、白色の沈殿物が形成した。この混合物を更に15分間撹拌した。5mLの水中の亜硝酸ナトリウム(1.95g、28.2mmol)の溶液を−5℃でシリンジによって滴下し、白色の混合物が橙色に変わった。30分後、23mLの濃HCl/水の1:1(v:v)溶液中の塩化スズ(II)(13.4g、70.5mmol)の溶液を添加漏斗によって1時間かけて滴下した。反応物を周囲温度で終夜激しく撹拌した。得られる沈殿物をろ過し、ブライン及びジエチルエーテルで連続して洗浄した。それから沈殿物を、35mLのジエチルエーテル及び50mLの10N NaOH水溶液の入ったフラスコに0℃で添加した。固体が溶解するまで、混合物を周囲温度で撹拌した。層を分離し、水層を50mLのジエチルエーテルで2回抽出した。複合エーテル層を0℃に冷却し、ジオキサン(6.25mL)中の4N HClを滴下し、反応物を30分間撹拌した。得られる白色の固体をろ過し、冷ジエチルエーテルで洗浄して、真空下で乾燥させ、ヒドラジンの一塩酸塩18を得た(1.24g、収率25%)。
【0119】
6.10. (2,6−ジメチル−4−シアノフェニル)ヒドラジン塩酸塩の合成
【0120】
【化18】

【0121】
(2,6−ジクロロ−4−シアノフェニル)ヒドラジン塩酸塩(19)
81mLのTHF中の2,6−ジクロロ−4−シアノアニリン(5.00g、26.7mmol)の溶液の入ったフラスコを0℃に冷却した。三フッ化ホウ素ジエチルエーテレート(5.03mL、40.1mmol)をシリンジによって滴下し、その後亜硝酸tert−ブチル(3.80mL、32.0mmol)を滴下した。この反応物を更に60分間撹拌すると、その間に褐色の沈殿物が形成した。100mLのジエチルエーテルを添加し、混合物を30分間撹拌した。沈殿物をろ過し、過剰量のジエチルエーテルで洗浄した。ジアゾニウム塩を褐色の固体として単離し(5.57g、収率78%)、更に精製せずに続く還元に使用した。1H NMR(DMSO−d6)δ:8.31(s,2H)。生成物は質量分析計では電離しない。
【0122】
これまでの工程から得られたジアゾニウム塩(5.57g、20.8mmol)を52mLの濃HCl/水の1:1(v:v)溶液中で懸濁し、0℃に冷却した。塩化スズ(II)(9.85g、52.0mmol)を500mgずつ添加した。反応物を室温で45時間撹拌した。得られる沈殿物をろ過し、ブライン及びジエチルエーテルで連続して洗浄した。それから沈殿物を、100mLのジエチルエーテル及び100mLの6N NaOH水溶液の入ったフラスコに添加した。混合物を周囲温度で3時間撹拌した。層を分離し、水層を100mLのジエチルエーテル及び50mLの酢酸エチルで抽出した。複合有機層を濃縮した。粗残渣を150mLのジエチルエーテル及び20mLの酢酸エチルに0℃で入れた。4N HClのジオキサン溶液(8.0mL)を滴下し、反応物を0℃で30分間撹拌して、終夜0℃に置いた。褐色の固体をろ過により回収し、冷ジエチルエーテルで洗浄し、真空下で乾燥させ、主に一塩酸塩としてヒドラジン19を得た(928mg、収率19%、1H NMR分析による純度約70%)。1H NMR(DMSO−d6)δ:8.09(s,2H)。MS(ES−)[M−H]:200.1。
【0123】
6.11. LIMK2の発現及び精製
LIMK2を、BAC−to−BAC(商標)バキュロウイルス発現系(Invitrogen)を使用して発現させた。取扱説明書に記載の製造業者の指示に従って、組換えバキュロウイルスを作製した。簡潔に述べると、LIMK2インサートを保有するプラスミド(pFactBac1又はpFastBacHT)をMAX efficiency DH10Bacコンピテント大腸菌中に形質転換して、組換えバクミドを生成した。DH10Bac大腸菌宿主株は、ミニ−attTn7標的部位を有するバキュロウイルスシャトルベクター(バクミド)と、ヘルパープラスミドとを含有し、pFastBacベクター上のミニ−Tn7因子と、バクミド上のミニ−(mini-)attTn7標的部位との間の転位後に組換えバクミドの生成を可能にする。転位反応が、ヘルパープラスミドによって供給される転位タンパク質の存在下で起こる。細胞をプレート培養し、取扱説明書に記載のように、白色のコロニーを摘み出してバクミドを単離した。
【0124】
単離バクミドDNAをSF9細胞中にトランスフェクトし、組換えバキュロウイルスを生成し、トランスフェクションの5日後にウイルスを回収した。ウイルスを0.2の感染多重度(MOI)でT75フラスコ内で増幅させた。増幅ウイルスを使用して、タンパク質発現のために5のMOIでSF9細胞を感染させた。
【0125】
LIMK2構築物の小規模精製のために、組換えバキュロウイルスに感染させたSf9細胞の培養液50mlを使用した。細胞を500×gで5分間の遠心分離によって採取した。それから、細胞をリシスバッファー(細胞1g当たり5倍量)中で再懸濁した。典型的なリシスバッファーは以下のものを含有する:50mM HEPES(pH8.0)、300mM KCl、10% グリセロール、1% NP−40、15mM イミダゾール、1mM ベンズアミジン、及びRocheの完全プロテアーゼ阻害剤(細胞溶解液50ml当たり1錠)。14000psi〜20000psiの液体圧でMicrofluidicsのMicrofluidizer M−110Yに1回通し、その後4℃で15分間60000×gで溶解液を遠心分離することにより細胞懸濁液を溶解させた。
【0126】
それから、上清を、ニトリロ三酢酸(NTA)と共有結合したコバルトイオンを含有するクロマトグラフィマトリクス上に直接装荷した。クロマトグラフィマトリクスは、タンパク質ローディング(loading)溶液と同じバッファー中で平衡化した。イオン荷電樹脂は典型的には、充填(packed)樹脂1ml当たり5mg〜10mgのヒスチジンタグ付けタンパク質と同等の結合能を有する。カラム上に装荷することができる抽出物の量は、抽出物中の可溶性ヒスチジンタグ付けタンパク質の量に応じて変わる。それからこのカラムを、1回目に50mM HEPES(pH8.0)、300mM KCl、10% グリセロール、1% NP−40、15mM イミダゾール、1mM ベンズアミジンで;2回目に、20mM HEPES(pH8.0)、500mM KCl、10% グリセロール及び20mM イミダゾールで;3回目に、20mM HEPES(pH8.0)、100mM KCl、10% グリセロール及び20mM イミダゾールで段階的に洗浄し、その後同じバッファー中の250mM イミダゾールで溶出した。それから、LIMK2タンパク質溶液を、SDS−PAGE、及びタンパク質のカルボキシル末端と内部触媒ドメインとの両方に指向性を有する市販の抗体を使用するウェスタンブロットで解析した。保存の目的で、このタンパク質を、50mM Tris(pH7.5)、150mM NaCl、0.1% BME、0.03% Brij−35及び50% グリセロールに透析した。
【0127】
大規模なLIMK2の精製を、10Lの培養量でWave Bioreactor(Wave Biotech)において行った。1mL当たり2〜3×106個の生存細胞の細胞培養液10LをMOI=5pfu/細胞で感染させ、感染後48時間で採取した。
【0128】
6.12. in vitro LIMK2阻害アッセイ
LIMK2阻害剤を同定するのに使用するin vitroアッセイを開発した。解析の読み取り値は、ATP基質から固定化ミエリン塩基性タンパク質でコーティングしたフラッシュプレート(Perkin Elmer Biosciences)中への33Pの取り込みであり、これは、プレートリーダーを備えたシンチレーションカウンタ(TopCount, Packard Bioscience, Meriden, CT)で計測した。384ウェルの平底MBPフラッシュプレートを使用し、総アッセイ量は50μlとした。HTSプログラムは、希釈のためにBiomek FXを利用するものとした。
【0129】
各アッセイに関して、成分及び条件は以下のとおりであった:200ngの酵素をアッセイバッファー(1×アッセイバッファーは、30mM HEPES(pH8.0)、5mM DTT及び10mM MgCl2を含有する)、10μM ATP、0.2μCi[γ−33P]−ATP、及び10μMの候補阻害化合物においてインキュベートした。反応物を室温で60分間インキュベートし、75μlの停止/洗浄バッファー(1×停止/洗浄(wash)バッファーは、50mM EDTA及び20mM Tris(pH7.4)を含有する)で3回洗浄した後、プレートをシンチレーションカウンタで読み取った。種々の濃度のスタウロスポリン(400nM、200nM、100nM及び50nM;BIOMOL(Plymouth Meeting, PA)で購入した)を各プレートの対照として使用した。
【0130】
6.13. デキサメタゾン誘導性の眼圧亢進モデル
1日当たりおよそ0.1mgのデキサメタゾン(dex)を放出するように、28日齢のマウスのAlzet浸透圧ミニポンプ(DURECT Corp., Cupertino, CA)に、水溶性のdexのPBS溶液(Sigma, St. Louis, MO)を満たした。ポンプがdexで満たされると、ポンプを、37℃で60時間、PBSで平衡化した。平衡化したポンプは、重量25グラム〜35グラムの野生型C57:129 F2ハイブリッドマウスの背中の皮下に外科的に設置した。外科切開傷は、5−0編み絹(braided silk)(ROBOZ, Gaithersburg, MD)で縫合し、試験期間全体を通して、抗生物質軟膏で処理した。外科切開傷は、TissueMend II(Webster Veterinary, Houston, TX)で接着した。鎮痛剤(ブプレノルフィン)を、外科処置の日及び外科処置の24時間後に、IP注射により投与した。眼内圧(IOP)を、TonoLab(Colonial Medical Supply Co., Franconia, NH)眼圧計を使用してこれらのマウスについて測定した。マウスを、イソフルランで軽く鎮静化し、0.5%プロパラカイン(Akorn, Buffalo Grove, IL)で局所麻酔を行った後、IOP測定を行った。ベースラインのIOPを、ミニポンプ埋め込みの1日前に測定した。ミニポンプ埋め込み後、4週間にわたり1週間に2〜3回、IOP測定を行った。眼圧降下候補化合物による薬理学試験を、埋め込みの21日〜28日後に行った。
【0131】
図1は、このモデルでの(S)−N−(5−(1−(2,6−ジクロロフェニル)−3−(ジフルオロメチル)−1H−ピラゾール−5−イル)チアゾール−2−イル)−2−(ピロリジン−2−イル)アセトアミドの用量依存的な効果を示している。投与時間からのIOP測定値の平均変化は表1に与えられる。
【0132】
【表1】

【0133】
上で引用した全ての刊行物(例えば、特許及び特許出願)はその全体が、参照により本明細書中に援用される。
【特許請求の範囲】
【請求項1】
眼投与に適した製剤であって、液体媒体と、式:
【化1】

(式中、
R1がH、C(O)RA、S(O)nRA、C(O)NRARB、S(O)nNRARB、S(O)nORA、C(NH)NRARB、C(O)ORA、C(S)NRARB、C(SRB)NRA、P(O)(ORA)2、又は必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換された)アルキル、アリール若しくは複素環であり、
R2がH、C(O)RA、S(O)nRA、C(O)NRARB、S(O)nNRARB、S(O)nORA、又は必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換された)アルキル、アリール若しくは複素環であり、
R3がH、ハロゲン、OR、NRARB、必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、ヒドロキシル、シアノ、NRARB、SRA、CO2RA、C(O)NRARBで置換された)アルキルであり、
各RAが独立して、H、若しくは必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換された)アルキル、アリール、アルキルアリール若しくはアルキル−複素環であり、
各RBが、必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換された)アルキル若しくはアリールであり、又は
RA及びRBが同じ窒素原子と結合する場合、RA及びRBは該窒素原子とともに、必要に応じて置換された複素環(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換されたピペリジニル、モルホリノ、チオモルホリノ、ピペラジニル、ピロリジノ及びアゼチジノ)を形成することができ、
nが0〜2である)の化合物又はその薬学的に許容される塩とを含む、眼投与に適した製剤。
【請求項2】
前記化合物が、
R1がC(O)RAであり、R2がCHF2であり、R3が2,6−ジクロロフェニルである場合、RAはエトキシ、シクロプロピル若しくはイソプロピルではなく、
R1がC(O)RAであり、R2がH若しくはCHF2であり、R3が3,5−ジメチルフェニルである場合、RAはメトキシではなく、又は
R1がC(O)NRARBであり、R2がピラジルであり、R3が2,6−ジメチル−4−メトキシフェニルであり、RAがHである場合、RBはエチルではない
ようなものである、請求項1に記載の製剤。
【請求項3】
前記化合物が、
R1がHであり、R2がメチルである場合、R3はクロロではないようなものである、請求項1に記載の製剤。
【請求項4】
前記化合物が、式:
【化2】

(式中、各R2Aは独立して、シアノ、ハロ、ヒドロキシル、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又は必要に応じて置換された(例えば必要に応じてフッ素化された)アルキル、アルコキシル若しくはアリールであり、mは0〜5である)の化合物である、請求項2に記載の製剤。
【請求項5】
前記化合物が、式:
【化3】

の化合物である、請求項4に記載の製剤。
【請求項6】
RAが、必要に応じてハロ、ヒドロキシル、アミノ、アルキルアミノ又はジアルキルアミノのうちの1つ又は複数で置換されたアルキルである、請求項5に記載の製剤。
【請求項7】
RAがイソプロピルである、請求項6に記載の製剤。
【請求項8】
RAがアミノで置換されたアルキルである、請求項6に記載の製剤。
【請求項9】
少なくとも1つのR2Aがクロロである、請求項6に記載の製剤。
【請求項10】
前記化合物が、式:
【化4】

の化合物である、請求項9に記載の製剤。
【請求項11】
R2Aがブロモである、請求項10に記載の製剤。
【請求項12】
mが2又は3である、請求項6に記載の製剤。
【請求項13】
R3がH又は必要に応じて置換された低級アルキルである、請求項6に記載の製剤。
【請求項14】
R3がジフルオロメチルである、請求項13に記載の製剤。
【請求項15】
式:
【化5】

(式中、
R1がH、C(O)RA、S(O)nRA、C(O)NRARB、S(O)nNRARB、S(O)nORA、C(NH)NRARB、C(O)ORA、C(S)NRARB、C(SRB)NRA、P(O)(ORA)2、又は必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換された)アルキル、アリール若しくは複素環であり、
R2がH、C(O)RA、S(O)nRA、C(O)NRARB、S(O)nNRARB、S(O)nORA、又は必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換された)アルキル、アリール若しくは複素環であり、
R3がH、ハロゲン、OR、NRARB、必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、ヒドロキシル、シアノ、NRARB、SRA、CO2RA、C(O)NRARBで置換された)アルキルであり、
各RAが独立して、H、若しくは必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換された)アルキル、アリール、アルキルアリール若しくはアルキル−複素環であり、
各RBが、必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換された)アルキル若しくはアリールであり、又は
RA及びRBが同じ窒素原子と結合する場合、RA及びRBは該窒素原子とともに、必要に応じて置換された複素環(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換されたピペリジニル、モルホリノ、チオモルホリノ、ピペラジニル、ピロリジノ及びアゼチジノ)を形成することができ、
nが0〜2であるが、但し
R1がC(O)RAであり、R2がCHF2であり、R3が2,6−ジクロロフェニルである場合、RAはエトキシ、シクロプロピル若しくはイソプロピルではなく、
R1がC(O)RAであり、R2がH若しくはCHF2であり、R3が3,5−ジメチルフェニルである場合、RAはメトキシではなく、
R1がC(O)NRARBであり、R2がピラジルであり、R3が2,6−ジメチル−4−メトキシフェニルであり、RAがHである場合、RBはエチルではなく、
R1がHであり、R2がメチルである場合、R3はクロロではない)の化合物又はその薬学的に許容される塩。
【請求項16】
式:
【化6】

(式中、各R2Aは独立して、シアノ、ハロ、ヒドロキシル、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又は必要に応じて置換された(例えば必要に応じてフッ素化された)アルキル、アルコキシル若しくはアリールであり、mは0〜5である)の化合物である、請求項15に記載の化合物。
【請求項17】
式:
【化7】

の化合物である、請求項16に記載の化合物。
【請求項18】
式:
【化8】

の化合物である、請求項17に記載の化合物。
【請求項19】
患者の眼内圧を低下させる方法であって、それを必要とする患者に、治療的に又は予防的に有効な量の請求項1又は15に記載の化合物を投与することを含む、患者の眼内圧を低下させる方法。
【請求項20】
患者において視力に影響を及ぼす疾患又は障害を治療、管理又は予防する方法であって、それを必要とする患者に、治療的に又は予防的に有効な量の請求項1又は15に記載の化合物を投与することを含む、患者において視力に影響を及ぼす疾患又は障害を治療、管理又は予防する方法。
【請求項21】
前記視力に影響を及ぼす疾患又は障害が緑内障、神経変性又は感染症である、請求項20に記載の方法。
【請求項1】
眼投与に適した製剤であって、液体媒体と、式:
【化1】

(式中、
R1がH、C(O)RA、S(O)nRA、C(O)NRARB、S(O)nNRARB、S(O)nORA、C(NH)NRARB、C(O)ORA、C(S)NRARB、C(SRB)NRA、P(O)(ORA)2、又は必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換された)アルキル、アリール若しくは複素環であり、
R2がH、C(O)RA、S(O)nRA、C(O)NRARB、S(O)nNRARB、S(O)nORA、又は必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換された)アルキル、アリール若しくは複素環であり、
R3がH、ハロゲン、OR、NRARB、必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、ヒドロキシル、シアノ、NRARB、SRA、CO2RA、C(O)NRARBで置換された)アルキルであり、
各RAが独立して、H、若しくは必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換された)アルキル、アリール、アルキルアリール若しくはアルキル−複素環であり、
各RBが、必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換された)アルキル若しくはアリールであり、又は
RA及びRBが同じ窒素原子と結合する場合、RA及びRBは該窒素原子とともに、必要に応じて置換された複素環(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換されたピペリジニル、モルホリノ、チオモルホリノ、ピペラジニル、ピロリジノ及びアゼチジノ)を形成することができ、
nが0〜2である)の化合物又はその薬学的に許容される塩とを含む、眼投与に適した製剤。
【請求項2】
前記化合物が、
R1がC(O)RAであり、R2がCHF2であり、R3が2,6−ジクロロフェニルである場合、RAはエトキシ、シクロプロピル若しくはイソプロピルではなく、
R1がC(O)RAであり、R2がH若しくはCHF2であり、R3が3,5−ジメチルフェニルである場合、RAはメトキシではなく、又は
R1がC(O)NRARBであり、R2がピラジルであり、R3が2,6−ジメチル−4−メトキシフェニルであり、RAがHである場合、RBはエチルではない
ようなものである、請求項1に記載の製剤。
【請求項3】
前記化合物が、
R1がHであり、R2がメチルである場合、R3はクロロではないようなものである、請求項1に記載の製剤。
【請求項4】
前記化合物が、式:
【化2】

(式中、各R2Aは独立して、シアノ、ハロ、ヒドロキシル、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又は必要に応じて置換された(例えば必要に応じてフッ素化された)アルキル、アルコキシル若しくはアリールであり、mは0〜5である)の化合物である、請求項2に記載の製剤。
【請求項5】
前記化合物が、式:
【化3】

の化合物である、請求項4に記載の製剤。
【請求項6】
RAが、必要に応じてハロ、ヒドロキシル、アミノ、アルキルアミノ又はジアルキルアミノのうちの1つ又は複数で置換されたアルキルである、請求項5に記載の製剤。
【請求項7】
RAがイソプロピルである、請求項6に記載の製剤。
【請求項8】
RAがアミノで置換されたアルキルである、請求項6に記載の製剤。
【請求項9】
少なくとも1つのR2Aがクロロである、請求項6に記載の製剤。
【請求項10】
前記化合物が、式:
【化4】

の化合物である、請求項9に記載の製剤。
【請求項11】
R2Aがブロモである、請求項10に記載の製剤。
【請求項12】
mが2又は3である、請求項6に記載の製剤。
【請求項13】
R3がH又は必要に応じて置換された低級アルキルである、請求項6に記載の製剤。
【請求項14】
R3がジフルオロメチルである、請求項13に記載の製剤。
【請求項15】
式:
【化5】

(式中、
R1がH、C(O)RA、S(O)nRA、C(O)NRARB、S(O)nNRARB、S(O)nORA、C(NH)NRARB、C(O)ORA、C(S)NRARB、C(SRB)NRA、P(O)(ORA)2、又は必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換された)アルキル、アリール若しくは複素環であり、
R2がH、C(O)RA、S(O)nRA、C(O)NRARB、S(O)nNRARB、S(O)nORA、又は必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換された)アルキル、アリール若しくは複素環であり、
R3がH、ハロゲン、OR、NRARB、必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、ヒドロキシル、シアノ、NRARB、SRA、CO2RA、C(O)NRARBで置換された)アルキルであり、
各RAが独立して、H、若しくは必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換された)アルキル、アリール、アルキルアリール若しくはアルキル−複素環であり、
各RBが、必要に応じて置換された(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換された)アルキル若しくはアリールであり、又は
RA及びRBが同じ窒素原子と結合する場合、RA及びRBは該窒素原子とともに、必要に応じて置換された複素環(例えば必要に応じてハロ、アルキル、アルコキシル、アリール、ヘテロアリール、ヒドロキシル、シアノ、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又はハロゲン化(例えばフッ素化)アルキル、アリール若しくはヘテロアリールで置換されたピペリジニル、モルホリノ、チオモルホリノ、ピペラジニル、ピロリジノ及びアゼチジノ)を形成することができ、
nが0〜2であるが、但し
R1がC(O)RAであり、R2がCHF2であり、R3が2,6−ジクロロフェニルである場合、RAはエトキシ、シクロプロピル若しくはイソプロピルではなく、
R1がC(O)RAであり、R2がH若しくはCHF2であり、R3が3,5−ジメチルフェニルである場合、RAはメトキシではなく、
R1がC(O)NRARBであり、R2がピラジルであり、R3が2,6−ジメチル−4−メトキシフェニルであり、RAがHである場合、RBはエチルではなく、
R1がHであり、R2がメチルである場合、R3はクロロではない)の化合物又はその薬学的に許容される塩。
【請求項16】
式:
【化6】

(式中、各R2Aは独立して、シアノ、ハロ、ヒドロキシル、NRARB、SRA、P(O)(ORA)2、CO2RA、C(O)NRARB、S(O)nRA、S(O)NRARB、又は必要に応じて置換された(例えば必要に応じてフッ素化された)アルキル、アルコキシル若しくはアリールであり、mは0〜5である)の化合物である、請求項15に記載の化合物。
【請求項17】
式:
【化7】

の化合物である、請求項16に記載の化合物。
【請求項18】
式:
【化8】

の化合物である、請求項17に記載の化合物。
【請求項19】
患者の眼内圧を低下させる方法であって、それを必要とする患者に、治療的に又は予防的に有効な量の請求項1又は15に記載の化合物を投与することを含む、患者の眼内圧を低下させる方法。
【請求項20】
患者において視力に影響を及ぼす疾患又は障害を治療、管理又は予防する方法であって、それを必要とする患者に、治療的に又は予防的に有効な量の請求項1又は15に記載の化合物を投与することを含む、患者において視力に影響を及ぼす疾患又は障害を治療、管理又は予防する方法。
【請求項21】
前記視力に影響を及ぼす疾患又は障害が緑内障、神経変性又は感染症である、請求項20に記載の方法。
【図1】




【公表番号】特表2013−518048(P2013−518048A)
【公表日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願番号】特願2012−550134(P2012−550134)
【出願日】平成23年1月21日(2011.1.21)
【国際出願番号】PCT/US2011/021970
【国際公開番号】WO2011/091204
【国際公開日】平成23年7月28日(2011.7.28)
【出願人】(508192566)レクシコン ファーマシューティカルズ インコーポレイテッド (38)
【Fターム(参考)】
【公表日】平成25年5月20日(2013.5.20)
【国際特許分類】
【出願日】平成23年1月21日(2011.1.21)
【国際出願番号】PCT/US2011/021970
【国際公開番号】WO2011/091204
【国際公開日】平成23年7月28日(2011.7.28)
【出願人】(508192566)レクシコン ファーマシューティカルズ インコーポレイテッド (38)
【Fターム(参考)】
[ Back to top ]

