眼への投与のためのFLAPインヒビタの局所製剤
本明細書には、眼への投与のための局所製剤が記載され、製剤は、眼の疾患、障害又は疾病を処置するために投与される。本明細書に開示される眼への投与のための局所製剤は、眼への局所投与のために製剤された治療上有効な量のFLAPインヒビタ化合物を含む。
【発明の詳細な説明】
【技術分野】
【0001】
本出願は、2008年12月23日に出願の米国仮特許出願第61/140,574号(発明の名称「眼への投与のためのFLAPインヒビタの局所製剤(TOPICAL FORMULATIONS OF FLAP INHIBITORS FOR ADMINISTRATION TO AN EYE)」)、および2009年5月7日に出願の米国仮特許出願第61/176,451号(発明の名称「眼への投与のためのFLAPインヒビタの局所製剤(TOPICAL FORMULATIONS OF FLAP INHIBITORS FOR ADMINISTRATION TO AN EYE)」)の利益を主張するものであり、これら両方は、引用することにより本明細書に組み込まれる。
【0002】
本明細書には、5−リポキシゲナーゼ−活性化タンパク質(FLAP)インヒビタ化合物を含む、哺乳動物の眼への投与のための局所製剤、および眼の疾患、障害又は疾病の処置又は予防におけるその使用方法が記載される。
【背景技術】
【0003】
眼の疾患、障害又は疾病は、眼及び/又は関連する組織の任意の異常な状態を含む。非制限的な例として、眼の障害は、加齢黄斑変性、アレルギー性結膜炎、前上葉区瘢痕化、眼瞼炎、眼瞼結膜炎、水疱性障害、瘢痕性類天疱瘡、結膜黒色腫、結膜炎、コンタクトレンズに関連する(contact lens-associated)巨大乳頭結膜炎、糖尿病性網膜症、眼乾燥、上強膜炎、緑内障、グリオーシス、環状肉芽腫、グレーブス眼症、眼球内黒色腫、角膜炎、角結膜炎、疼痛、瞼裂斑、術後疼痛、増殖性硝子体網膜症、翼状片、瘢痕化、強膜炎、シェーグレン症候群、ブドウ膜炎、春季角結膜炎又はそれらの組み合わせを含む。
【発明の概要】
【課題を解決するための手段】
【0004】
本明細書には、特定の実施形態において、眼への投与のための製剤が記載され、製剤は、眼の疾患、障害又は疾病(即ち、眼及び/又は関連する組織の異常な状態)を処置するために投与される。本明細書には、特定の実施形態における、眼への投与のための局所製剤が記載される。局所製剤は眼に許容可能な賦形剤で製剤される。
【0005】
特定の実施形態において、製剤は免疫障害(例えば自己免疫障害);増殖性障害(例えば眼球内黒色腫);アレルゲン、及び/又は、刺激物質との接触;線維芽細胞性障害(例えば瘢痕化);又はそれらの組み合わせを処置するために投与される。本明細書には、特定の実施形態において、眼への投与のための局所製剤が記載され、製剤は、加齢黄斑変性、アレルギー性結膜炎、前上葉区瘢痕化、眼瞼炎、眼瞼結膜炎、水疱性障害、瘢痕性類天疱瘡、結膜黒色腫、結膜炎、コンタクトレンズに関連する巨大乳頭結膜炎、糖尿病性網膜症、眼乾燥、上強膜炎、緑内障、グリオーシス、環状肉芽腫、グレーブス眼症、眼球内黒色腫、角膜炎、角結膜炎、疼痛、瞼裂斑、術後疼痛、増殖性硝子体網膜症、翼状片、瘢痕化、強膜炎、シェーグレン症候群、ブドウ膜炎、春季角結膜炎又はそれらの組み合わせを処置するために投与される。幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、治療上有効な量のFLAPインヒビタを含む。幾つかの実施形態において、本明細書に記載される眼への投与のための局所製剤は、アレルゲン及び/又は刺激物質及び/又は感染因子(例えば、ウイルス)との接触の前又は後に投与される。幾つかの実施形態において、本明細書に記載される眼への投与のための局所製剤は、身体外傷(例えば、手術)の前又後に投与される。幾つかの実施形態において、本明細書に記載される局所製剤は、眼の外側表面に関連する疾病のために投与される。他の実施形態において、局所製剤は眼の外側表面に投与されるが、眼の内部に関連する疾患を処置するために、続いて、眼内に浸透する。他の実施形態において、局所製剤は、眼に接触する組織又は眼の近くの組織を処置するために、眼内に又は眼の外側表面上に投与される:限定されない例は、涙管、眼瞼、睫毛、及び眼窩を含む。
【0006】
1つの態様において、本明細書には、眼の疾患、障害又は疾病の処置に有効な量におけるFLAPインヒビタ化合物、及び溶液、懸濁液、軟膏、クリーム、ローション、ニオソーム、ファーマコソーム、軟膏、又はゲルを提供するための、少なくとも1つの適切な薬学的に許容可能な賦形剤を含む、眼製剤が記載される。
【0007】
本明細書には、ロイコトリエン合成を阻害するための有効な量におけるFLAPインヒビタ化合物、及び溶液、懸濁液、軟膏、クリーム、ローション、ニオソーム、ファーマコソーム、軟膏、又はゲルを提供するための、少なくとも1つの適切な薬学的に許容可能な賦形剤を含む眼製剤が記載される。幾つかの実施形態において、阻害されたロイコトリエン合成により、結果的に、システイニルロイコトリエンのレベルが減少する。幾つかの実施形態において、阻害されたロイコトリエン合成により、結果的にLTB4のレベルが減少する。
【0008】
本明細書には、ロイコトリエン受容体をアンタゴナイズするための有効な量におけるFLAPインヒビタ、及び溶液、懸濁液、軟膏、クリーム、ローション、ニオソーム、ファーマコソーム、軟膏又はゲルを提供するための、適切な薬学的に許容可能な賦形剤を含む眼製剤が記載される。
【0009】
本明細書には、個体の眼内でインターロイキン−4(IL−4)合成を阻害するための有効な量におけるFLAPインヒビタを含む、眼製剤が記載される。
【0010】
本明細書には、個体の眼内で粘液の合成を低減又は阻害するための有効な量におけるFLAPインヒビタを含む、眼製剤が記載される。
【0011】
幾つかの実施形態において、本明細書に記載される任意の眼製剤は、抗生物質;抗真菌剤;ステロイド抗炎症剤;非ステロイド抗炎症剤;抗ヒスタミン剤;抗ウイルス剤;アルファアゴニスト;ベータ遮断剤;炭酸脱水酵素インヒビタ;縮瞳薬;プロスタグランジン;抗血管新生薬;ロテプレドノールエタボネート、肥満細胞安定化薬、シクロスポリン、及びDP2アンタゴニストから選択された治療上有効な量の化合物を更に含む。
【0012】
幾つかの実施形態において、上述の任意の眼製剤は、治療上有効な量のDP2受容体アンタゴニスト化合物を含む。
【0013】
1つの態様において、眼の疾患、障害又は疾病は、免疫障害;増殖性障害;アレルゲン及び/又は刺激物質との接触;線維芽細胞性障害;感染病(例えば、ウイルス感染)又はそれらの組み合わせである。
【0014】
別の態様において、眼の疾患、障害又は疾病は、加齢黄斑変性、アレルギー性結膜炎、前上葉区瘢痕化、眼瞼炎、眼瞼結膜炎、水疱性障害、瘢痕性類天疱瘡、結膜黒色腫、結膜炎、コンタクトレンズに関連する巨大乳頭結膜炎、糖尿病性網膜症、眼乾燥、上強膜炎、緑内障、グリオーシス、環状肉芽腫、グレーブス眼症、眼球内黒色腫、角膜炎、角結膜炎、疼痛、瞼裂斑、術後疼痛、増殖性硝子体網膜症、翼状片、瘢痕化、強膜炎、シェーグレン症候群、ブドウ膜炎、春季角結膜炎又はそれらの組み合わせである。
【0015】
本明細書には、治療上有効な量のFLAPインヒビタ化合物を含む眼製剤を、その必要のある個体の眼に投与する工程を含む、眼の疾患、障害又は疾病を処置する方法が提供される。
【0016】
本明細書には、FLAPインヒビタ化合物を含む眼製剤を、その必要のある個体の眼に投与する工程を含む、個体の眼内のロイコトリエン合成を阻害する方法が提供される。幾つかの実施形態において、ロイコトリエン合成の阻害により、結果的にシステイニルロイコトリエンのレベルが減少する。幾つかの実施形態において、ロイコトリエン合成の阻害により、結果的にLTB4のレベルが減少する。
【0017】
本明細書には、FLAPインヒビタ化合物を含む眼製剤を、その必要のある個体の眼に投与する工程を含む、個体の眼内のロイコトリエン受容体をアンタゴナイズする方法が提供される。
【0018】
本明細書には、FLAPインヒビタ化合物を含む眼製剤を、個体の眼に投与する工程を含む、その必要のある個体の眼内のインターロイキン−4(IL−4)合成を阻害する方法が提供される。
【0019】
本明細書には、FLAPインヒビタ化合物を含む眼製剤を、個体の眼に投与する工程を含む、その必要のある個体の眼内の粘液の合成を低減又は阻害する方法が提供される。
【0020】
1つの態様において、本明細書に記載される任意の方法は、抗生物質;抗真菌剤;ステロイド抗炎症剤;非ステロイド抗炎症剤;抗ヒスタミン剤;抗ウイルス剤;アルファアゴニスト;ベータ遮断剤;炭酸脱水酵素インヒビタ;縮瞳薬;プロスタグランジン;抗血管新生薬;ロテプレドノールエタボネート、肥満細胞安定化薬、シクロスポリン、及びDP2アンタゴニスト、及びそれらの組み合わせから選択される治療上有効な量の化合物を含む眼製剤を、その必要のある個体の眼に投与する工程を更に含む。
【0021】
1つの態様において、本明細書に記載される任意の方法は、治療上有効な量のDP2受容体アンタゴニスト化合物を含む眼製剤を、その必要のある個体の眼に投与する工程を更に含む。
【0022】
1つの態様において、眼製剤は、溶液、懸濁液、軟膏、ゲル、クリーム、リポソーム、ニオソーム、ファーマコソーム、ナノ粒子、又はそれらの組み合わせの形態である。
【0023】
他の態様において、眼製剤は、移植、挿入、注入、噴霧、洗浄、又はそれらの組み合わせを介して投与される。
【0024】
幾つかの実施形態において、眼の疾患、障害又は疾病は、免疫障害;増殖性障害;アレルゲン及び/又は刺激物質との接触;線維芽細胞性障害;又はそれらの組み合わせである。
【0025】
幾つかの実施形態において、眼の疾患、障害又は疾病は、加齢黄斑変性、アレルギー性結膜炎、前上葉区瘢痕化、眼瞼炎、眼瞼結膜炎、水疱性障害、瘢痕性類天疱瘡、結膜黒色腫、結膜炎、コンタクトレンズに関連する巨大乳頭結膜炎、糖尿病性網膜症、眼乾燥、上強膜炎、緑内障、グリオーシス、環状肉芽腫、グレーブス眼症、眼球内黒色腫、角膜炎、角結膜炎、疼痛、瞼裂斑、術後疼痛、増殖性硝子体網膜症、翼状片、瘢痕化、強膜炎、シェーグレン症候群、ブドウ膜炎、春季角結膜炎又はそれらの組み合わせである。
【0026】
1つの態様において、FLAPインヒビタ化合物は眼製剤の製造に使用される。1つの態様において、FLAPインヒビタ化合物及びDP2受容体アンタゴニスト化合物の組み合わせは、眼製剤の製造に使用される。
【0027】
1つの態様において、FLAPインヒビタ化合物は眼の疾患、障害又は疾病の処置のための眼製剤の製造に使用される。1つの態様において、FLAPインヒビタ化合物及び抗生物質;抗真菌剤;ステロイド抗炎症剤;非ステロイド抗炎症剤;抗ヒスタミン剤;抗ウイルス剤;アルファアゴニスト;ベータ遮断剤;炭酸脱水酵素インヒビタ;縮瞳薬;プロスタグランジン;抗血管新生薬;ロテプレドノールエタボネート、肥満細胞安定化薬、シクロスポリン、及びDP2アンタゴニスト;から選択される化合物の組み合わせは、眼の障害の処置のための眼製剤の製造に使用される。
【図面の簡単な説明】
【0028】
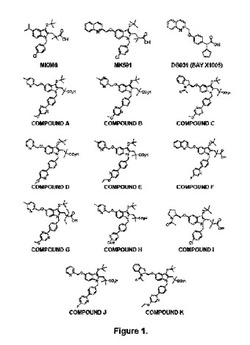
【図1】図1は、本明細書に記載されるFLAPインヒビタ化合物の用例を示す。
【図2】図2は、FLAPインヒビタ化合物CのRSVの眼病理への影響を示す。
【図3】図3は、化合物Cでの局所療法の、RSVに感染したマウスの眼内でのCysLTのレベルへの影響を示す。
【図4】図4は、化合物Cでの局所療法の、RSVに感染したマウスの眼内でのIL−4のレベルへの影響を示す。
【図5】図5は、眼内及び肺内でのRSVのプラーク形成単位(pfu)を示す。
【図6】図6は、FLAP阻害及びDP2受容体アンタゴニズムの、気管支肺胞洗浄液(BALF)における、細胞、好中球及びリンパ球の総数への影響を示す。
【図7】図7は、FLAPインヒビタ及びDP2受容体アンタゴニストの組み合わせの、BALFにおけるムチンの存在への影響を示す。
【発明を実施するための形態】
【0029】
ロイコトリエンは、多くの生物学的過程において重要な役割を果たすことを示されてきたアラキドン酸に由来する、炎症促進性の脂質メディエーターの種類に属する。アラキドン酸は、酵素5−リポキシゲナーゼ(5-LO)によって媒介された二段階過程において、ロイコトリエンA4(LTA4)に変換される。LTA4は、LTA4ヒドロラーゼを介してLTB4に変換されるか、LTC4シンターゼによって媒介されたグルタチオンとの接合を通してLTC4に変換されるかのいずれかである。アミド結合切断は、LTC4をLTD4に変換し、その後、続いてLTE4に変換する。最初の酸化段階とは、5−LO及び膜結合型の5−リポキシゲナーゼ−活性化タンパク質(FLAP)両方の本質的な介入を必要とする過程である。FLAPの阻害により、結果的にすべてのロイコトリエン生成が阻害される。LTB4は、Gタンパク質共役型受容体(GPCR)のBLT1及びBLT2のためのリガンドであり、両方の受容体は、炎症反応における走化性及び細胞刺激に関係する。
【0030】
ロイコトリエンは、眼の疾患、障害又は疾病の病因に関係する、炎症の脂質メディエーターである。ロイコトリエンは、アレルギー又は炎症性刺激に反応して、主に肥満細胞、好酸球、単球/大食細胞、及び好中球によって産生される。1つの態様において、眼の疾患、障害又は疾病によって影響される部分の生物学的組織は、高レベルのロイコトリエンを有する。5−リポキシゲナーゼに呼応するFLAPが、ロイコトリエン合成経路において第一段階を実行するために、ロイコトリエン合成経路におけるFLAPの役割は重要である。FLAPの阻害は、例として、加齢黄斑変性、アレルギー性結膜炎、前上葉区瘢痕化、眼瞼炎、眼瞼結膜炎、水疱性障害、瘢痕性類天疱瘡、結膜黒色腫、結膜炎、コンタクトレンズに関連する巨大乳頭結膜炎、糖尿病性網膜症、眼乾燥、上強膜炎、緑内障、グリオーシス、環状肉芽腫、グレーブス眼症、 眼球内黒色腫、角膜炎、角結膜炎、疼痛、瞼裂斑、術後疼痛、増殖性硝子体網膜症、翼状片、瘢痕化、強膜炎、シェーグレン症候群、ブドウ膜炎、春季角結膜炎又はそれらの組み合わせを含む、ロイコトリエン依存又はロイコトリエン媒介の眼の疾患、障害又は疾病の処置のための標的を与える。
【0031】
1つの態様において、ロイコトリエンは、眼の疾患、障害又は疾病の病因に関係する。眼の疾患、障害又は疾病は、FLAPインヒビタ化合物を含む医薬組成物の点眼投与によって処置又は予防される。
【0032】
本明細書には、ロイコトリエン依存又はロイコトリエン媒介の眼の疾患、障害又は疾病の処置又は予防のための、哺乳動物の眼内への局所投与に適している薬物の製造における、FLAPインヒビタの使用が開示される。
【0033】
本明細書には、FLAPインヒビタを使用する、眼への局所投与に適している医薬製剤、処置方法、眼への投与のための局所製剤を製剤する方法、産生する方法、製造する方法、治療法が記載される。
【0034】
本明細書には、特定の実施形態において、FLAPインヒビタ化合物を含む眼への投与のための局所製剤が記載され、製剤は眼の疾患、障害又は疾病を処置するために投与される。1つの態様において、哺乳動物の眼へのFLAPインヒビタ化合物の局所投与により、FLAPインヒビタ化合物の体内吸収が最小限になる。1つの態様において、眼へのFLAPインヒビタ化合物の局所投与により、眼の疾患、障害又は疾病の局所療法が提供される。1つの態様において、FLAPインヒビタ化合物での眼の疾患、障害又は疾病の局所療法により、FLAPインヒビタ化合物の全身投与に関連する、起こり得る副作用が低減する。
【0035】
幾つかの実施形態において、本明細書に記載される局所製剤は、眼の疾患、障害又は疾病を処置又は予防するために、抗生物質;抗真菌剤;ステロイド抗炎症剤;非ステロイド抗炎症剤;抗ヒスタミン剤;抗ウイルス剤;アルファアゴニスト;ベータ遮断剤;炭酸脱水酵素インヒビタ;縮瞳薬;プロスタグランジン;抗血管新生薬;ロテプレドノールエタボネート、肥満細胞安定化薬、シクロスポリン、及び/又はDP2アンタゴニストと組み合わせたFLAPインヒビタ化合物を含む。
【0036】
1つの態様において、眼の疾患、障害又は疾病は、ロイコトリエン及び/又はサイトカインの過剰産生の結果である。1つの態様において、眼の疾患、障害又は疾病は、限定されないが、眼の免疫障害、眼の増殖性障害、アレルゲン及び/又は刺激物質との接触から結果として生じる眼の障害、眼の線維芽細胞性障害、感染病又はそれらの組み合わせを含む。
【0037】
眼の免疫障害は、限定されないが、加齢黄斑変性、アレルギー性結膜炎、前上葉区瘢痕化、眼瞼炎、眼瞼結膜炎、水疱性障害、瘢痕性類天疱瘡、結膜黒色腫、結膜炎、コンタクトレンズに関連する巨大乳頭結膜炎、糖尿病性網膜症、眼乾燥、上強膜炎、緑内障、グリオーシス、環状肉芽腫、グレーブス眼症、眼球内黒色腫、角膜炎、角結膜炎、疼痛、瞼裂斑、術後疼痛、増殖性硝子体網膜症、翼状片、瘢痕化、強膜炎、シェーグレン症候群、ブドウ膜炎、春季角結膜炎又はそれらの組み合わせを含む。
【0038】
眼の増殖性障害は、限定されないが、眼球内黒色腫及び結膜黒色腫を含む。眼の感染病は、バクテリア(例えば、黄色ブドウ球菌)、ウイルス(例えば、呼吸器合胞体ウイルス(RSV)、クラミジア)などによって引き起こされた感染病を含む。
【0039】
本明細書には、特定の実施形態において、FLAPインヒビタ化合物を含む眼への投与のための局所製剤が記載され、製剤は眼の疾患、障害又は疾病を処置するために投与される。幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、治療上有効な量のFLAPインヒビタを含む。幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、アレルゲン及び/又は刺激物質との接触の前又は後に投与される。幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、身体外傷(例えば、手術)の前又は後に投与される。1つの態様において、FLAPインヒビタ化合物を含む本明細書に開示される眼への投与のための局所製剤は、手術後の瘢痕形成を処置又は予防するために眼及び/又はそれに関連する組織に投与される。本明細書に開示される眼への投与のための局所製剤は損傷部位に適用されることを理解されたい。幾つかの実施形態において、本明細書に記載される局所製剤は、追加の治療薬(例えばエヌセイド、DP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物を含み、手術後の瘢痕形成を処置及び予防するために、眼及び/又はそれに関連する組織に投与される。
【0040】
特定の例において、ロイコトリエンは、瘢痕化及び/又は線維芽細胞の移動に関係する。1つの態様において、FLAPの活性を阻害することは、線維芽細胞の活性及び/又は移動を阻害することであり、且つ/又は瘢痕化を処置することである。幾つかの実施形態において、本明細書に記載される局所製剤は、眼及び/又は関連する組織に投与されるFLAPインヒビタ化合物を含み、線維芽細胞の活性及び/又は移動を阻害し、且つ/又は瘢痕化を処置する。幾つかの実施形態において、本明細書に記載される局所製剤は、追加の治療薬(例えばDP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物を含み、眼及び/又は関連する組織に投与され、線維芽細胞の活性及び/又は移動を阻害し、且つ/又は瘢痕化を処置する。
【0041】
1つの態様において、ロイコトリエンは、本明細書に記載される眼の疾患、障害又は疾病の病因に関係する。FLAPの阻害により、結果的にロイコトリエンの産生が減少する。ロイコトリエンの量の減少により、結果的に眼の疾患、障害又は疾病などに関連する症状が減少する。1つの態様において、低減された量のロイコトリエンは、低減された量のシステイニルロイコトリエンである。1つの態様において、低減された量のロイコトリエンは、低減された量のLTB4である。幾つかの実施形態において、本明細書に記載される局所製剤は、追加の治療薬(例えばDP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物を含み、眼及び/又は関連する組織に投与され、ロイコトリエンの産生を阻害する。幾つかの実施形態において、本明細書に記載される局所製剤は、眼及び/又は関連する組織に投与されるFLAPインヒビタ化合物を含み、ロイコトリエンの産生を阻害する。
【0042】
1つの態様において、サイトカインは、本明細書に記載される眼の疾患、障害又は疾病の病因に関係する。幾つかの例において、FLAPの阻害により、結果的に少なくとも1つのサイトカインの産生が減少する。1つの態様において、サイトカインはインターロイキン4(IL-4)である。IL-4の減少により、結果的に眼の障害などに関連する症状が減少する。幾つかの実施形態において、本明細書に記載される局所製剤は、眼及び/又は関連する組織に投与されるFLAPインヒビタ化合物を含み、サイトカインの産生を阻害する。幾つかの実施形態において、本明細書に記載される局所製剤は、追加の治療薬(例えばDP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物を含み、眼及び/又は関連する組織に投与され、サイトカインの産生を阻害する。
【0043】
1つの態様において、涙液分泌(例えば、粘液、ムチン、膿など)の産生は、本明細書に記載される眼の疾患、障害又は疾病の病因に関係する。FLAPの阻害により、結果的に涙液分泌の産生が減少する。涙液分泌(例えば粘液産生)の減少により、結果的に眼の疾患、障害又は疾病などに関連する症状が減少する。幾つかの実施形態において、本明細書に記載される局所製剤は、眼及び/又は関連する組織に投与されるFLAPインヒビタ化合物を含み、哺乳動物の眼内で粘液及び/又はムチンの産生を阻害する。幾つかの実施形態において、本明細書に記載される局所製剤は、追加の治療薬(例えばDP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物を含み、眼及び/又は関連する組織に投与され、哺乳動物の眼内で粘液及び/又はムチンの産生を阻害する。
【0044】
1つの態様において、ムチンとして知られる特定のグリコシル化されたタンパク質の産生は、本明細書に記載される眼の疾患、障害又は疾病の病因に関係する。FLAPの阻害により、結果的にムチンの産生が減少する。ムチン産生の減少により、結果的に眼の疾患、障害又は疾病などに関連する症状が減少する。1つの態様において、低減された量のムチンは、低減された量の分泌型ムチンである。1つの態様において、分泌型ムチンはMUC4及びMUC7のタンパク質を含む。別の態様において、低減された量のムチンは、低減された量のゲル形成ムチンである。1つの態様において、ゲル形成ムチンはMUC5-ACタンパク質を含む。更に別の態様において、低減された量のムチンは、低減された量の膜結合性ムチンである。1つの態様において、膜結合性ムチンはMUC1とMUC16のタンパク質を含む。幾つかの実施形態において、本明細書に記載される局所製剤は、眼及び/又は関連する組織に投与されるFLAPインヒビタ化合物を含み、哺乳動物の眼内でムチンのタンパク質合成を阻害する。他の実施形態において、本明細書に記載される局所製剤は、眼及び/又は関係する組織に投与されるFLAPインヒビタ化合物を含み、哺乳動物の眼内で、ムチンの翻訳後修飾、例えばグリコシル化を阻害する。幾つかの実施形態において、本明細書に記載される局所製剤は、眼及び/又は関連する組織に投与されるFLAPインヒビタ化合物を含み、哺乳動物の眼内で、ムチンのタンパク質分解を増加させる。
【0045】
FLAPインヒビタ
1つの態様において、FLAPインヒビタ化合物は、本明細書又は当該技術分野に開示されるFLAPインヒビタ化合物から選択される。
【0046】
1つの態様において、FLAPインヒビタ化合物は、式(I)の化合物、その薬学的に許容可能な塩、薬学的に許容可能な溶媒和物、又はN-オキシドである:
【0047】
【化1】

【0048】
式中、
Aは、CH又はNであり;
R1は、−F、−Cl、−Br、−CN、C1−C4アルキル、C1−C4フルオロアルキル、−O−C1−C4アルキル、又は−O−C1−C4フルオロアルキルであり;
R2は、C1−C4アルキル又はC1−C4フルオロアルキルである。
【0049】
1つの態様において、Aは、CHである。別の態様において、Aは、Nである。1つの態様において、R1は、−F、−Cl、−Br、−CN、C1−C4アルキル、C1−C4フルオロアルキル、−O−C1−C4アルキル、又は−O−C1−C4フルオロアルキルである。1つの態様において、R1は、−F、−Cl、−Br、−CN、−CH3、−CH2CH3、シクロプロピル、−CF3、−OCH3、−OCH2CH3、又は−OCF3である。
【0050】
1つの態様において、R1は、H、−F、−Cl、−Br、−CN、−CH3、−CH2CH3、シクロプロピル、−CF3、−OCH3、−OCH2CH3、又は−OCF3である。別の態様において、R1は、−F、−Cl、−Br、−CN、−CH3、−CF3、−OCH3、又は−OCF3である。別の態様において、R1は、−CH3である。
【0051】
1つの態様において、R2は、C1−C4アルキルである。別の態様において、R2は、−CH3、又は−CH2CH3である。別の態様において、R2は、−CH3である。
【0052】
1つの態様において、R1は、−CH3であり、R2は−CH3である。1つの態様において、Aは、CHであり、R1は−CH3であり、R2は−CH3である。
【0053】
1つの態様において、FLAPインヒビタ化合物は、3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物A);又は3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピラジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物B);それらの薬学的に許容可能な塩、薬学的に許容可能な溶媒和物、又はN−オキシドである。1つの態様において、FLAPインヒビタ化合物は、化合物A;その薬学的に許容可能な塩、薬学的に許容可能な溶媒和物、又はN−オキシドである。
【0054】
別の態様において、FLAPインヒビタ化合物は、式(II)の化合物、その薬学的に許容可能な塩、薬学的に許容可能な溶媒和物、又はN−オキシドである:
【0055】
【化2】

【0056】
式中、
R2は、C1−C4アルキル又はC1−C4フルオロアルキルであり;
R3は、置換又は非置換の単環式又は二環式のへテロシクロアルキルである。
【0057】
1つの態様において、R2は、C1−C4アルキルである。別の態様において、R2は、−CH3、又は−CH2CH3である。別の態様において、R2は、−CH3である。別の態様において、R2は、−CH2CH3である。
【0058】
1つの態様において、R3は、環に少なくとも1つのN原子を含む、置換又は非置換の単環式又は二環式のへテロシクロアルキルである。1つの態様において、R3は、環に少なくとも1つのN原子を含む、置換又は非置換の単環式又は二環式のC3−C10ヘテロシクロアルキルである。
【0059】
1つの態様において、R3は、キノリジニル、ジオキシニル、ピペリジニル、モルフォリニル、チアジニル、テトラヒドロピリジニル、ピペラジニル、オキサジナノニル、ジヒドロピロリル、ジヒドロイミダゾリル、テトラヒドロフラニル、ジヒドロオキサゾリル、オキシラニル、ピロリジニル、ピラゾリジニル、イミダゾリジノニル、ピロリジノニル、ジヒドロフラノニル、ジオキソラノニル、チアゾリジニル、ピペリジノニル、テトラヒドロナフィリジニル、テトラヒドロキノリニル、テトラヒドロチエニル、インドリニル、及びチアゼパニルから選択される、置換又は非置換の単環式又は二環式のヘテロシクロアルキルである。
【0060】
1つの態様において、R3は、ピペリジニル、モルフォリニル、チアジニル、テトラヒドロピリジニル、ピペラジニル、ジヒドロピロリル、ジヒドロイミダゾリル、ピロリジニル、ピラゾリジニル、イミダゾリジノニル、ピロリジノニル、チアゾリジニル、ピペリジノニル、テトラヒドロナフィリジニル、テトラヒドロキノリニル、及びインドリニルから選択される、置換又は非置換の単環式又は二環式のヘテロシクロアルキルである。
【0061】
1つの態様において、R3は、ピペリジニル、モルフォリニル、ピペラジニル、ピロリジニル、ピロリジノニル、ピペリジノニル、テトラヒドロキノリニル、及びインドリニルから選択される、置換又は非置換の単環式又は二環式のヘテロシクロアルキルである。
【0062】
1つの態様において、R3は、ピペリジニル、モルフォリニル、ピペラジニル、ピロリジニル、テトラヒドロキノリニル、及びインドリニルから選択される、置換又は非置換の単環式又は二環式のヘテロシクロアルキルである。1つの態様において、R3は、置換又は非置換のピロリジニル、及びインドリニルである。1つの態様において、R3は、置換又は非置換のインドリニルである。
【0063】
更なる又は代替の実施形態において、R3は、以下から成る群から選択され:
【0064】
【化3】

【0065】
R4は、H、−C(=O)R5又は−SO2−C1−C4アルキルであり;R5はC1−C4アルキル、C1−C4フルオロアルキル、置換又は非置換のフェニル、置換又は非置換のヘテロアリール、又は−O−C1−C4アルキルである。
【0066】
更なる又は代替の実施形態において、R3は、以下から成る群から選択される:
【0067】
【化4】

【0068】
1つの態様において、R3は以下の通りである:
【0069】
【化5】

【0070】
1つの態様において、R4は、−C(=O)R5である。
【0071】
更なる又は代替の実施形態において、R3は、以下から成る群から選択される:
【0072】
【化6】

【0073】
更なる又は代替の実施形態において、R3は、以下から成る群から選択される:
【0074】
【化7】

【0075】
1つの態様において、R3は以下の通りである:
【0076】
【化8】

【0077】
1つの態様において、R5は、C1−C4アルキル、C1−C4フルオロアルキル、置換又は非置換のフェニル、又は−O−C1−C4アルキルである。別の態様において、R5は、−CH3、CH2CH3、−CH2CH2CH3、−CH2CH2CH2CH3、−CH(CH3)2、−C(CH3)3、−CF3、−OCH3、−OCH2CH3、又は−OC(CH3)3である。別の態様において、R5は、−CH3、−CH2CH3、−CH2CH2CH3、−CF3、−OCH3、−OCH2CH3、又は−OC(CH3)3である。更に別の態様において、R5は、−CH3である。
【0078】
1つの態様において、式(II)の化合物は以下の構造を有する:
【0079】
【化9】

【0080】
1つの態様において、FLAPインヒビタ化合物は、3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物C)又は3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−エトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物K);それらの薬学的に許容可能な塩、薬学的に許容可能な溶媒和物、又はN-オキシドである。1つの態様において、FLAPインヒビタ化合物は、化合物C;その薬学的に許容可能な塩、薬学的に許容可能な溶媒和物、又はN-オキシドである。1つの態様において、FLAPインヒビタ化合物は、化合物K;その薬学的に許容可能な塩、薬学的に許容可能な溶媒和物、又はN-オキシドである。
【0081】
1つの態様において、FLAPインヒビタは、(US 7,405,302として発行された)米国特許出願第11/538,762号;米国特許出願第12/131,828号;(2007/0105866として公開された)米国特許出願第11/553,946号;米国特許出願第11/925,841号;米国特許出願第12/089,706号;米国特許出願第12/089,707号;米国特許出願第12/092,570号;(2007/0219206として公開された)米国特許出願第11/744,555号;(2007/0225285として公開された)米国特許出願第11/746,010号;(2007/0244128として公開された)米国特許出願第11/745,387号;米国特許出願第12/257,876号;米国特許出願第61/055,887号;米国特許出願第61/055,899号;国際特許出願番号PCT/US07/86188;WO07/047207;WO07/056021;WO07/056220;WO07/056228;国際特許出願番号PCT/US08/62310;国際特許出願番号PCT/US08/062793;国際特許出願番号PCT/US08/62580;国際特許出願番号PCT/US2008/052960;国際特許出願番号PCT/US08/81190;国際特許出願番号PCT/US08/76225に記載される化合物から選択され;それぞれ、全体の引用により、本明細書に組み込まれる。
【0082】
1つの態様において、FLAPインヒビタは以下から選択される:(3−[3−tert−ブチルスルファニル−1−(4−クロロ−ベンジル)−5−イソプロピル−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸としても知られる)MK886;(3−[3−tert−ブチルスルファニル−1−(4−クロロ−ベンジル)−5−(キノリン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸としても知られる)MK591;(BAYX1005;シクロペンチル−[4−(キノリン−2−イルメトキシ)−フェニル]−酢酸としても知られる)DG031;化合物A(米国特許出願第11/553,946号に概説されるように調製される;3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸);化合物B(米国特許出願第11/553,946号に概説されるように調製される;3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピラジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸);化合物C(WO07/056220に概説されるように調製される;3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸);化合物D(3−[3−tert−ブチルスルファニル−1−[4−(6−メトキシ−ピリジン−3−イル)−ベンジル]−5−(ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸;米国特許出願第11/553,946号の化合物2乃至19を参照);化合物E(3−[3−tert−ブチルスルファニル−1−[4−(6−エトキシ−ピリジン−3−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸;米国特許出願第11/553,946号の化合物2乃至107を参照);化合物F(3−[3−tert−ブチルスルファニル−1−[4−(5−フルオロ−ピリジン−2−イル)−ベンジル]−5−(キノリン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸;米国特許出願第11/553,946号の化合物2乃至197を参照);化合物G(2−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イルメチル]−2−エチル−酪酸;米国特許出願第11/744,555号の化合物4乃至38を参照);化合物H(3−[3−tert−ブチルスルファニル−1−[4−(6−メトキシ−ピリジン−3−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸;米国特許出願第11/553,946号の化合物2乃至73を参照);化合物I(3−[5−((S)−1−アセチル−ピロリジン−2−イルメトキシ)−3−tert−ブチルスルファニル−1−(4−クロロ−ベンジル)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸;WO07/056220の化合物1乃至2を参照);化合物J(3−[3−tert−ブチルスルファニル−1−[4−(5−フルオロ−ピリジン−2−イル)−ベンジル]−5−(ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸;米国特許出願第11/553,946号の化合物2乃至201を参照);3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−エトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物K);それらの薬学的に許容可能な塩、薬学的に許容可能な溶媒和物、又はN-オキシド。
【0083】
別の態様において、FLAPインヒビタは、米国特許番号4,929,626;4970215;5,081,138;5,095,031;5,204,344;5,126,354;5,221,678;5,229,516;5,272,145;5,283,252;5,288,743;5,292,769;5,304,563;5,399,699;5,459,150;5,512,581;5,597,833;5,668,146;5,668,150;5,691,351;5,714,488;5,783,586;5,795,900;及び5,843,968に記載される化合物から選択され;それぞれ、FLAPインヒビタ化合物などの開示のための引用により、本明細書に組み込まれる。
【0084】
FLAPインヒビタ化合物のさらなる形態
幾つかの実施形態において、治療薬(例えばFLAPインヒビタ化合物及び/又は第2の治療薬)は、薬学的に許容可能な塩として、医薬組成物中に存在する。幾つかの実施形態において、薬学的に許容可能な塩は、FLAPインヒビタ化合物を酸と反応させることにより得られる。幾つかの他の実施形態において、薬学的に許容可能な塩は、FLAPインヒビタ化合物を塩基と反応させることにより得られる。他の実施形態において、治療薬は、本明細書に記載される医薬組成物の製造において、遊離酸又は遊離塩基として使用される。薬学的に許容可能な塩のタイプは、限定されないが、以下のものを含む:(1)化合物の遊離塩基の形態を、薬学的に許容可能な:例えば、塩酸、臭化水素酸、硫酸、リン酸、メタリン酸などのような無機酸と;又は、例えば、酢酸、プロピオン酸、ヘキサン酸、シクロペンチルプロピオン酸、グリコール酸、ピルビン酸、乳酸、マロン酸、コハク酸、リンゴ酸、マレイン酸、フマル酸、トリフルオロ酢酸、酒石酸、クエン酸、安息香酸、3−(4−ヒドロキシベンゾイル)安息香酸、桂皮酸、マンデル酸、メタンスルホン酸、エタンスルホン酸、1,2−エタンジスルホン酸、2−ヒドロキシエタンスルホン酸、ベンゼンスルホン酸、トルエンスルホン酸、2−ナフタリンスルホン酸、4−メチルビシクロ−[2.2.2.]oct−2−エン−1−カルボン酸、グルコペプトン酸、4,4’−メチレンビス−(3−ヒドロキシ−2−エン−1−カルボン酸)、3−フェニルプルピオン酸、トリメチル酢酸、第三ブチル酢酸、ラウリル硫酸、グルコン酸、グルタミン酸、ヒドロキシナフトエ酸、サリチル酸、ステアリン酸、ムコン酸、酪酸、フェニル酢酸、フェニル酪酸、バルプロ酸などのような有機酸と反応させることにより形成される酸付加塩;(2)親化合物中に存在する酸性プロトンが、金属イオン、例えば、アルカリ金属イオン(例えばリチウム、ナトリウム、カリウム)、アルカリ土類イオン(例えばマグネシウム、又はカルシウム)、又はアルミニウムイオンにより置換される時に形成される塩。幾つかの場合において、本明細書に記載されるFLAPインヒビタ化合物は、限定されないが、エタノールアミン、ジエタノールアミン、トリエタノールアミン、トロメタミン、N−メチルグルカミン、ジシクロヘキシルアミン、トリス(ヒドロキシメチル)メチルアミンなどの有機塩基と反応する。他の場合において、本明細書に記載されるFLAPインヒビタ化合物は、限定されないが、アルギニン、リジンなどのアミノ酸で塩を形成する。酸性プロトンを含む化合物で塩を形成するために使用される、許容可能な無機塩基は、限定されないが、水酸化アルミニウム、水酸化カルシウム、水酸化カリウム、炭酸ナトリウム、水酸化ナトリウムなどを含む。他の場合において、本明細書に記載されるFLAPインヒビタ化合物は、ナトリウム塩を形成し、ナトリウム塩として使用される。
【0085】
幾つかの実施形態において、本明細書に記載されるFLAPインヒビタ化合物は、溶媒付加の形態又はその結晶形、特に溶媒和物又は多形体を含む。溶媒和物は、定比又は不定比量いずれかの溶媒を含み、結晶化の過程において、水、エタノールなどの薬学的に許容可能な溶媒で形成され得る。水和物は、溶媒が水である時に形成され、アルコラートは、溶媒がアルコールである時に形成される。
【0086】
幾つかの実施形態において、本明細書に記載されるFLAPインヒビタ化合物は、1以上の立体中心を有し、各々の中心は、R又はSのいずれかの配置に独立して存在する。本明細書に示される化合物は、全てのジアステレオマー、エナンチオマー、及びエピマーの形態を、それらの適切な混合物と同様に含む。
【0087】
幾つかの実施形態において、本明細書に開示されるFLAPインヒビタ化合物上の部位は、様々な代謝反応に弱いため、代謝反応の場所への適切な置換基の取り込みは、代謝経路を低減するか、最小限にするか、除去する。具体的な実施形態において、代謝反応に対する芳香環の感受性を低減又は除去するための適切な置換基は、ほんの一例ではあるが、ハロゲン、重水素又はアルキル基である。
【0088】
幾つかの実施形態において、本明細書に記載されるFLAPインヒビタ化合物は、同位体的に(例えば放射性同位体を用いて)又は、限定されないが、発色団又は蛍光部分、生物発光ラベル、又は化学発光ラベルの使用を含む、別の他の手段により標識化される。幾つかの実施形態において、本明細書に記載されるFLAPインヒビタ化合物は、同位体的に標識化され、1以上の原子が、大抵は自然に見出される原子質量又は質量数とは異なる原子質量又は質量数を有する原子により置換されるという事実にも関わらず、本明細書に示される様々な式及び構造において列挙されるものと同一である。幾つかの実施形態において、1以上の水素原子は、重水素で置換される。幾つかの実施形態において、本明細書に記載される化合物上の代謝部位は、重水素化される。幾つかの実施形態において、重水素での置換は、例えば、インビボでの半減期の増加又は必要用量の減少などの、より大きな代謝安定性から生じる治療上の利点を与える。
【0089】
本明細書を通じて、群及びそれらの置換基は、安定した部分及び化合物を提供するために、当業者により選択される。
【0090】
眼の疾患、障害又は疾病
本明細書には、特定の実施形態において、眼への投与のための局所製剤が記載され、製剤は、眼の疾患、障害又は疾病を処置するために投与される。本明細書で使用されるように、眼の疾患、障害又は疾病は、眼又はそれに関連する組織の任意の異常な状態を含む。特定の例において、眼の疾患、障害又は疾病は、免疫不全(例えば自己免疫障害);、増殖性障害;アレルゲン、及び/又は刺激物質との接触;線維芽細胞性障害(例えば、外傷(例えば、手術)の後の瘢痕化);又はそれらの組み合わせによって引き起こされる。眼の疾患、障害又は疾病は、限定されないが、加齢性黄斑変性、アレルギー性結膜炎、前上葉区瘢痕化、眼瞼炎、眼瞼結膜炎、水疱性障害、瘢痕性類天疱瘡、結膜黒色腫、結膜炎、コンタクトレンズに関連する巨大乳頭結膜炎、糖尿病性網膜症、眼乾燥、上強膜炎、緑内障、グリオーシス、環状肉芽腫、グレーブス眼症、眼球内黒色腫、角膜炎、角結膜炎、疼痛、結膜脂肪斑、術後疼痛、増殖性硝子体網膜症、翼状片、瘢痕化、強膜炎、シェーグレン症候群、ブドウ膜炎、春季角結膜炎又はそれらの組み合わせを含む。
【0091】
幾つかの実施形態において、本明細書に開示される、眼への投与のための局所製剤は、アレルゲン及び/又は刺激物質及び/又は感染因子との接触の前又は後に投与される。幾つかの実施形態において、本明細書に開示される眼への投与のためのFLAPインヒビタの局所製剤は、アレルゲン及び/又は刺激物質及び/又は感染因子との接触の前又は後に、抗ヒスタミン剤及び/又は肥満細胞安定化薬と組み合わせて投与される。幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、身体的な外傷(例えば、手術)の前又は後に投与される。
【0092】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、結膜炎である。特定の例において、結膜炎はアレルゲンへの曝露から生じる。特定の例において、結膜炎は細菌、ウイルス又はクラミジア感染から生じる。特定の例において、ロイコトリエン及び/又はサイトカインは、結膜炎に関連する症状の幾つか又は全てを媒介する。1つの態様において、サイトカインはIL−4である。1つの態様において、結膜炎に関連する症状は,限定されないが、血管拡張、浮腫、充血を含む。特定の例において、FLAP活性を阻害することにより、ロイコトリエン及び/又は結膜炎に関連するIL−4の濃度が減少し、更に、結膜炎が処置される。幾つかの実施形態において、追加の治療薬(例えば、抗ヒスタミン剤、肥満細胞安定化薬、DP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、結膜炎が処置される。
【0093】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、角膜炎である。本明細書で使用されるように、角膜炎は、角膜の炎症により特徴付けられる障害である。特定の例において、ロイコトリエン及び/又はサイトカインは、角膜炎(例えば、血管拡張、浮腫、充血)に関連する症状の幾つか又は全てを媒介する。特定の例において、FLAP活性を阻害することにより、角膜炎に関連するロイコトリエン及び/又はサイトカインの濃度が減少する。幾つかの実施形態において、FLAP活性を阻害することにより、角膜炎が処置される。幾つかの実施形態において、FLAP活性を阻害することにより、血管拡張、浮腫、充血、又はそれらの組み合わせが処置される。幾つかの実施形態において、追加の治療薬(例えば、DP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、角膜炎が処置される。
【0094】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、角結膜炎(即ち、結膜炎および角膜炎(即ち、角膜の炎症)の組み合わせ)である。特定の例において、ロイコトリエン及び/又はサイトカインは、角膜炎および結膜炎(例えば、血管拡張、浮腫、充血)に関連する症状の幾つか又は全てを媒介する。特定の例において、FLAP活性を阻害することにより、角膜炎及び結膜炎に関連するロイコトリエンの濃度が減少する。幾つかの実施形態において、FLAP活性を阻害することにより、角結膜炎が処置される。幾つかの実施形態において、FLAP活性を阻害することにより、血管拡張、浮腫、充血、又はそれらの組み合わせが処置される。幾つかの実施形態において、追加の治療薬(例えばDP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、角膜炎及び結膜炎が処置される。
【0095】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、眼瞼炎である。本明細書で使用されるように、眼瞼炎は、眼瞼縁の炎症により特徴付けられる、眼の疾患、障害又は疾病である。特定の例において、ロイコトリエン及び/又はサイトカインは、眼瞼炎(例えば、血管拡張、浮腫、充血)に関連する症状の幾つか又は全てを媒介する。特定の例において、FLAP活性を阻害することにより、眼瞼炎に関連するロイコトリエンの濃度が減少する。幾つかの実施形態において、FLAP活性を阻害することにより、眼瞼炎が処置される。幾つかの実施形態において、FLAP活性を阻害することにより、血管拡張、浮腫、充血、又はそれらの組み合わせが処置される。幾つかの実施形態において、追加の治療薬(例えばDP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、眼瞼炎が処置される。
【0096】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの疾患、障害又は疾病とは、眼瞼結膜炎(即ち、結膜炎及び眼瞼炎(即ち、眼瞼の炎症)の組み合わせ)である。特定の例において、ロイコトリエンは、眼瞼炎及び結膜炎(例えば、血管拡張、浮腫、充血)に関連する症状の幾つか又は全てを媒介する。特定の例において、FLAP活性を阻害することにより、眼瞼炎及び結膜炎に関連するロイコトリエン及び/又はサイトカインの濃度が減少する。幾つかの実施形態において、FLAP活性を阻害することにより、眼瞼結膜炎が処置される。幾つかの実施形態において、FLAP活性を阻害することにより、血管拡張、浮腫、充血、又はそれらの組み合わせが処置される。幾つかの実施形態において、追加の治療薬(例えばDP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、眼瞼結膜炎が処置される。
【0097】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、強膜炎である。本明細書で使用されるように、強膜炎は、強膜の炎症により特徴付けられる障害である。特定の例において、ロイコトリエンは、強膜炎(例えば、血管拡張、浮腫、充血)に関連する症状の幾つか又は全てを媒介する。特定の例において、FLAP活性を阻害することにより、強膜炎に関連するロイコトリエン及び/又はサイトカインの濃度が減少する。幾つかの実施形態において、FLAP活性を阻害することにより、強膜炎が処置される。幾つかの実施形態において、FLAP活性を阻害することにより、血管拡張、浮腫、充血、又はそれらの組み合わせが処置される。幾つかの実施形態において、追加の治療薬(例えばDP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、強膜炎が処置される。
【0098】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、上強膜炎である。本明細書で使用されるように、上強膜炎は、充血、及び結膜浮腫の炎症により特徴付けられる上強膜の炎症性障害である。特定の例において、ロイコトリエンは、上強膜炎(例えば、血管拡張、浮腫、充血)に関連する症状の幾つか又は全てを媒介する。特定の例において、FLAP活性を阻害することにより、上強膜炎に関連するロイコトリエン及び/又はサイトカインの濃度が減少する。幾つかの実施形態において、FLAP活性を阻害することにより、上強膜炎が処置される。幾つかの実施形態において、FLAP活性を阻害することにより、血管拡張、浮腫、充血、又はそれらの組み合わせが処置される。幾つかの実施形態において、追加の治療薬(例えばDP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、上強膜炎が処置される。
【0099】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、ブドウ膜炎である。本明細書で使用されるように、ブドウ膜炎は、ブドウ膜の炎症性障害である。特定の例において、ロイコトリエンは、ブドウ膜炎(例えば、血管拡張、浮腫、充血)に関連する症状の幾つか又は全てを媒介する。特定の例において、FLAP活性を阻害することにより、ブドウ膜炎に関連するロイコトリエン及び/又はサイトカインの濃度が減少する。幾つかの実施形態において、FLAP活性を阻害することにより、ブドウ膜炎が処置される。幾つかの実施形態において、FLAP活性を阻害することにより、血管拡張、浮腫、充血、又はそれらの組み合わせが処置される。幾つかの実施形態において、追加の治療薬(例えばステロイド抗炎症剤;非ステロイド抗炎症剤、DP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、ブドウ膜炎が処置される。
【0100】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、シェーグレン症候群である。特定の例において、シェーグレン症候群は自己免疫障害であり、その中で、免疫細胞は涙を分泌する外分泌腺を攻撃及び破壊する。特定の例において、ロイコトリエンは、シェーグレン症候群(例えば、涙管への白血球の走化性)の進行に起因する因子の幾つか又は全てを媒介する。特定の例において、ロイコトリエンは、グレーブス眼症(例えば、血管拡張、浮腫、充血)に関連する症状の幾つか又は全てを媒介する。特定の例において、FLAP活性を阻害することにより、シェーグレン症候群に関連するロイコトリエン及び/又はサイトカインの濃度が減少する。幾つかの実施形態において、FLAP活性を阻害することにより、シェーグレン症候群が処置される。幾つかの実施形態において、FLAP活性を阻害することにより、涙管への白血球の走化性が阻害される。幾つかの実施形態において、FLAP活性を阻害することにより、血管拡張、浮腫、充血、又はそれらの組み合わせが処置される。幾つかの実施形態において、追加の治療薬(例えば、DP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、シェーグレン症候群が処置される。
【0101】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、(グレーブスの甲状腺関連又は甲状腺異常の眼窩疾患又は眼球突出としても知られる)グレーブス眼症である。グレーブス眼症は、眼窩に影響を与える自己免疫の炎症性障害である。特定の例において、免疫系は、甲状腺刺激ホルモン受容体(TSH−R)を抗原として認識し、攻撃する。特定の例において、ロイコトリエンは、グレーブス眼症(例えば、眼窩への白血球の走化性)の進行に起因する因子の幾つか又は全てを媒介する。特定の例において、ロイコトリエンは、グレーブス眼症(例えば、血管拡張、浮腫、充血)に関連する症状の幾つか又は全てを媒介する。特定の例において、FLAP活性を阻害することにより、グレーブス眼症に関連するロイコトリエン及び/又はサイトカインの濃度が減少する。幾つかの実施形態において、FLAP活性を阻害することにより、グレーブス眼症が処置される。幾つかの実施形態において、FLAP活性を阻害することにより、涙管への白血球の走化性が阻害される。幾つかの実施形態において、FLAP活性を阻害することにより、血管拡張、浮腫、充血、又はそれらの組み合わせが処置される。幾つかの実施形態において、追加の治療薬(例えば、ステロイド抗炎症剤、DP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、グレーブス眼症が処置される。
【0102】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、水疱性障害である。特定の例において、水疱性障害は、疱疹の形成(即ち、組織中の細胞間の液体貯留)により特徴付けられる。特定の例において、水疱性障害は自己免疫障害である。特定の例において、ロイコトリエンは、疱疹の形成を媒介する(例えば、毛細血管から組織への血漿の滲出を誘発する)。特定の例において、FLAP活性を阻害することにより、水疱性障害に関連するロイコトリエン及び/又はサイトカインの濃度が減少する。幾つかの実施形態において、FLAP活性を阻害することにより、水疱性障害が処置される。幾つかの実施形態において、FLAP活性を阻害することにより、毛細血管から組織への血漿の滲出が阻害される。幾つかの実施形態において、追加の治療薬(例えば、DP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、水疱性障害が処置される。
【0103】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、瘢痕化である。特定の例において、瘢痕は、コラーゲンの過剰産生から生じる線維組織の部分である。特定の例において、創傷治癒は、損傷部位への線維芽細胞の移動を含む。特定の例において、線維芽細胞はコラーゲンを沈着させる。特定の例において、線維芽細胞は、創傷部位で過剰なコラーゲンを沈着させ、結果的に瘢痕となる。特定の例において、ロイコトリエンは、線維芽細胞の活性を調節する。特定の例において、ロイコトリエンは、線維芽細胞のための走化性物質として作用する。特定の例において、ロイコトリエンの活性を阻害することにより、瘢痕化に関連する白血球の活性及び/又は移動が阻害される。特定の例において、FLAP活性を阻害することにより、瘢痕化に関連するロイコトリエン及び/又はサイトカインの濃度が減少する。特定の例において、FLAP活性を阻害することにより、瘢痕化に関連する線維芽細胞の活性及び/又は移動が阻害される。特定の例において、FLAPを阻害することにより、瘢痕化が処置される。1つの態様において、瘢痕化は前上葉区瘢痕化である。1つの態様において、瘢痕化は、別の眼の疾患、障害又は疾病の結果である。1つの態様において、瘢痕化は、限定されないが、結膜炎、角膜炎などの別の眼の疾患、障害又は疾病の結果である。1つの態様において、眼球表面は瘢痕化される。1つの態様において、FLAPインヒビタ化合物を含む、本明細書に開示される眼製剤は、哺乳動物の眼球表面の瘢痕化を処置又は予防する。1つの態様において、FLAPインヒビタ化合物を含む、本明細書に開示される眼製剤は、哺乳動物の眼球表面の術後瘢痕を処置又は予防する。1つの態様において、FLAPインヒビタ化合物を含む、本明細書に開示される眼製剤での非ステロイド抗炎症剤(NSAID)の組み合わせは、眼科手術に関連する疼痛及び炎症を処置するために使用される。幾つかの実施形態において、追加の治療薬(例えば、DP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、哺乳動物の眼内における瘢痕化が処置される。
【0104】
幾つかの実施形態において、本明細書に開示される局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、黒色腫(例えば、眼球内黒色腫、及び/又は結膜黒色腫)である。特定の例において、黒色腫は、黒色素細胞の増殖性障害である。特定の例において、ロイコトリエンは、黒色素細胞の成長を刺激する。更に、特定の例において、炎症は、黒色腫の成長を促進する。特定の例において、ロイコトリエンは、黒色腫に関連する炎症を媒介する。特定の例において、FLAP活性を阻害することにより、黒色腫に関連するロイコトリエン及び/又はサイトカインの濃度が減少し、眼球内黒色腫に関連する黒色素細胞の成長を遅らせる及び/又は阻害する。特定の例において、FLAP活性を阻害することにより、黒色腫に関連する炎症が減少する。特定の例において、FLAPを阻害することにより、眼球内黒色腫及び/又は結膜黒色腫が処置される。幾つかの実施形態において、追加の治療薬(例えば、DP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、黒色腫が処置される。
【0105】
幾つかの実施形態において、本明細書に開示される局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、眼感染(例えば、細菌、ウイルス又はクラミジア感染)である。特定の例において、感染は、涙液分泌(例えば、粘液、ムチン、膿など)の産生を引き起こす。特定の例において、ロイコトリエンは、感染した眼内で粘液の産生を媒介する。特定の例において、FLAP活性を阻害することにより、涙液分泌に関連するロイコトリエン及び/又はサイトカインの濃度が減少し、眼感染に関連する粘液の産生が遅れる且つ/又は阻害される。特定の例において、FLAP活性を阻害することにより、眼感染に関連する粘液産生が減少する。特定の例において、FLAPを阻害することにより、眼感染が処置される。幾つかの実施形態において、追加の治療薬(例えば、抗菌性、抗感染性、DP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、眼感染が処置される。
【0106】
特定の専門用語
用語「個体(individual)」、「患者(patient)」、又は「被験体(subject)」は、互換的に使用される。本明細書で使用されるように、それらは任意の哺乳動物を意味する。1つの態様において、哺乳動物はヒトである。
【0107】
用語「処置する(treat)」、「処置している(treating)」又は「処置(treatment)」、及び他の文法上の同義語は、本明細書で使用されるように、障害及び/又は障害の症状の発症を緩和し、軽減し、阻害し、減らし、寛解し、遅らせ、進行を阻止し、且つ/又は退行を誘発することを含む。用語は、障害の予防処置も含む。用語は更に、任意の治療効果を挙げることも含む。治療効果は、処置されている根本的な障害の根絶又は寛解、及び/又は改善が個体において観察されるような、根本的な障害に関連する1以上の生理学的な症状の根絶又は寛解を意味する。
【0108】
用語「予防する(prevent)」、「予防している(preventing)」又は「予防(prevention)」、及び他の文法上の同義語は、本明細書で使用されるように、障害の発達を阻害すること(阻止する又は止めること)、及び/又は障害の更なる進行を阻害すること(阻止する又は止めること)を含む。用語は、予防法を含むように意図されている。予防効果のために、本明細書に開示される製剤は、特定の障害を発達させる危険性のある個体、又は疾患の1以上の生理学的な症状を報告する個体、又は疾患の再発の危険性のある個体に投与される。
【0109】
用語「有効な量(effective amount)」又は「治療上有効な量(therapeutically effective amount)」は、本明細書で使用されるように、所望の結果、例えば、処置されている疾患、障害又は疾病の1以上の症状をある程度和らげることを達成する、投与されている薬剤(例えば、FLAPインヒビタ化合物)の量を示す。特定の例において、結果は、疾患の少なくとも1つの徴候、症状、又は原因の減少及び/又は緩和、又は生物系の任意の他の所望の変化である。
【0110】
用語「投与する(administer)」、「投与している(administering)」、「投与(administration)」などは、本明細書に使用されるように、生物学的作用の所望部位(例えば、眼の障害の部位)へのFLAPインヒビタの送達を可能にするために使用される方法を示す。これらの方法は、眼へのFLAPインヒビタの局所投与のための任意の適切な方法を含む。
【0111】
本明細書に使用されるような用語「眼(eye)」は、限定されないが、眼の外側表面及び内部、眼に接する血管、眼窩及び眼のソケット、眼、眼瞼、睫毛を囲む表皮の表面及び組織、及び眼を囲む脂肪性沈着物を含む。
【0112】
眼への投与のための局所製剤
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、局所効果(即ち、眼又はそれに関連する組織に限定される効果)のために、眼又はそれに関連する組織へのFLAPインヒビタ化合物の送達を促進する。特定の例において、FLAPインヒビタ化合物の局所投与は、FLAPインヒビタの全身投与に関連する副作用を減らす又は除去する。
【0113】
幾つかの実施形態において、眼への投与のためのFLAPインヒビタは、溶液、懸濁液(例えば、水性懸濁液)、軟膏、ゲル、クリーム、リポソーム、ニオソーム、ファーマコソーム、ナノ粒子、又はそれらの組み合わせとして製剤される。幾つかの実施形態において、眼への局所投与のためのFLAPインヒビタは、移植、挿入(例えば、不溶性挿入又は可溶性挿入を介する)、注入、噴霧、洗浄、又はそれらの組み合わせを介して投与される。
【0114】
幾つかの実施形態において、眼への局所投与のためのFLAPインヒビタは、溶液、懸濁液、クリーム、ローション、軟膏、及び/又はゲルとして製剤される。1つの実施形態において、FLAPインヒビタは、ヒトを含む哺乳動物の眼(又はそれに関連する組織)に適用され得る点眼薬として投与される。1つの実施形態において、FLAPインヒビタは、ヒトを含む哺乳動物の眼(又はそれに関連する組織)に適用され得る洗眼剤として投与される。
【0115】
溶液及び懸濁液
本明細書には、特定の実施形態において、眼への投与のための局所製剤が開示され、ここでの眼への投与のための局所製剤とは、溶液の形態である。本明細書には、特定の実施形態において、眼への投与のための局所製剤が開示され、ここでの眼への投与のための局所製剤とは、懸濁液の形態である。特定の例において、溶液又は懸濁液は組織を再水和し、そのため、水和の損失又は減少によって特徴付けられる眼の疾患、障害又は疾病に有用である。特定の例において、溶液は、眼への投与(注入)のための注射剤である。
【0116】
クリーム及びローション
本明細書には、特定の実施形態において、眼への投与のための局所製剤が開示され、ここでの眼への投与のための局所製剤とは、クリームの形態である。特定の例において、クリームは、水中油型乳剤又は油中水型乳剤において分散する、FLAPインヒビタ化合物を含む半固体(例えば、軟らかい固体又は濃い液体)の製剤である。本明細書には、特定の実施形態において、眼への投与のための局所製剤が開示され、ここでの眼への投与のための局所製剤とは、ローションの形態である。特定の例において、ローションは、流体乳濁液(例えば、水中油型乳剤又は油中水型乳剤)である。幾つかの実施形態において、ローション及び/又はクリームの疎水性成分は、動物(例えば、ラノリン、肝油、及び竜涎香)、植物(例えば、サフラワー油、ヒマシ油、ヤシ油、綿実油、メンヘーデン油、パーム核油、パーム油、ラッカセイ油、ダイズ油、ナタネ油、亜麻仁油、米ぬか油、パイン油、ゴマ油、又はヒマワリ種子油)、又は石油(例えば、鉱油、又はワセリン)から得られる。
【0117】
特定の例において、ローション及びクリームは、眼の疾患、障害又は疾病への「乾燥」効果(例えば、眼及び/又はそれに関連する組織から滲出される、幾つか又は全ての流体は、軟膏に混和できる)を有し、そのため、流体の滲出により特徴付けられる眼の疾患、障害又は疾病に有用である。
【0118】
軟膏
本明細書には、特定の実施形態において、眼への投与のための局所製剤が開示され、ここでの眼への投与のための局所製剤とは、軟膏の形態である。特定の例において、軟膏は、体温(眼及び/又はそれに関連する組織の温度を含む)で軟化又は溶解する半固形製剤である。特定の例において、軟膏は組織を再水和し、そのため、水分の損失により特徴付けられる眼の疾患、障害又は疾病に有用である。
【0119】
ゲル
本明細書には、特定の実施形態において、眼への投与のための局所製剤が開示され、ここでの眼への投与のための局所製剤とは、ゲルの形態である。特定の例において、ゲルは、液体中に分散される大型有機分子の分散から成る、半固定(又は半硬質)式である。特定の例において、ゲルは水溶性で、温水又は食塩水を使用して取り除かれる。特定の例において、ゲルは組織を再水和し、そのため、水分の損失により特徴付けられる眼の疾患、障害又は疾病に有用である。
【0120】
眼に許容可能な送達装置
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼と眼瞼の間に、又はFLAPインヒビタが放出される結膜嚢に挿入され得る装置を介して投与又は送達される。幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、角膜の表面を浸す涙液に、又は直接、角膜自体に放出され、一般的に固形物と密接に接触する。任意の適切な装置は、本明細書に開示される眼への投与のための局所製剤及び本明細書に開示される方法(例えば、アイゲートアプリケーター)とともに使用される。
【0121】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、点眼器を介して投与又は送達される。点眼器は、円柱状のバレルが圧力下で変形される時に、眼への投与量を測定及び送達する円柱状のバレルを含む、従来の点眼器など当該分野に周知の任意のものを含む。他のタイプの点眼器は、米国特許番号5,514,118;5,584,823;5,059,188;4,834,727;4,629,456;及び4,515,295に記載される点眼器のタイプを含み、その全ては、点眼器装置の開示のための引用により組み込まれる。
【0122】
眼に許容可能な注射可能なデポ製剤
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、注射可能なデポ製剤を介して投与又は送達される。本明細書で使用されるように、デポ製剤は、眼又はそれに関連する組織(例えば強膜)に(例えば皮下に、筋肉内に、硝子体内に、又は結膜下内に)注入される、制御放出製剤である。制御放出マトリックスへのFLAPインヒビタの比率及び使用されるマトリックスの性質は、薬物放出の速度を制御する。
【0123】
幾つかの実施形態において、デポ製剤は、生分解性高分子中でFLAPインヒビタの(マイクロカプセルマトリックスとしても知られる)マイクロカプセル化したマトリックスを形成することにより製剤される。幾つかの実施形態において、デポ製剤は、リポソーム又はマイクロエマルション中でFLAPインヒビタを捕捉することにより製剤される。
【0124】
眼に許容可能な賦形剤
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、担体、代用涙液、張性エンハンサー、pH調整剤、防腐剤、清澄剤、粘性エンハンサー、及び可溶化剤を含む、1以上の賦形剤を含む。
【0125】
幾つかの実施形態において、溶液、懸濁液、軟膏、ゲル、クリーム、リポソーム、ニオソーム、ファーマコソーム、ナノ粒子、又はそれらの組み合わせとして製剤された、眼への投与のためのFLAPインヒビタは、1以上の担体を含む。眼に許容可能な担体の例は、限定されないが、水、水の混合物及び以下のような水混和性の溶剤を含む;C1−アルカノールからC7−アルカノール;0.5〜5%の無毒な水溶性高分子を含む植物油又は鉱油;ゼラチン、アルギナート、ペクチン、トラガント、カラヤゴム、キサンタンガム、カラゲーニン、寒天及びアカシアを含む天然物;酢酸及びヒドロキシプロピルの澱粉を含む澱粉誘導体;及び中性のカーボポールなどの、ポリビニルアルコール、ポリビニルピロリドン、ポリビニルメチルエーテル、ポリエチレンオキシド、ポリアクリル酸、又はこれらのポリマーの混合物を含む、他の合成製品。
【0126】
幾つかの実施形態において、眼への投与のための局所製剤は、1以上の代用涙液を含む。代用涙液は、眼組織上の優れた湿潤性、潤滑、及び製剤の広がりを促進する。代用涙液はまた、使用者に不快感を与えない。特定の例において、代用涙液は、本明細書に開示される1以上の担体を備える。他の例において、代用涙液は、担体に加え、他の賦形剤である。典型的な代用涙液は、限定されないが、グリセロール、プロピレングリコール、及びエチレングリコールを含む、モノマープリオール;ポリエチレングリコールを含む、ポリマーポリオール;ヒドロキシプロピルメチルセルロース、カルボキシメチルセルロースナトリウム及びヒドロキシプロピルセルロースを含む、セルロースエステル;デキストラン70を含む、デキストラン;ゼラチンを含む、水溶性タンパク質;ポリビニルアルコール、 ポリビニルピロリドン、及びポビドンを含むビニルポリマー;及びカルボマー934P、カルボマー941、カルボマー940及びカルボマー974Pを含む、カルボマー;及び当該分野に知られている他の代用涙液を含む。他の市販の代用涙液は、限定されないが、Bion Tears(登録商標)、Celluvisc(登録商標)、Genteal(登録商標)、OccuCoat(登録商標)、Refresh(登録商標)、Teargen II(登録商標)、Tears Naturale(登録商標)、Tears Natural II(登録商標)、Tears Naturale Free(登録商標)、及びTheraTears(登録商標)などのセルロースエステル;及びAkwa Tears(登録商標)、HypoTears(登録商標)、Moisture Eyes(登録商標)、Murine Lubricating(登録商標)、及びVisine Tears(登録商標)などのポリビニルアルコールを含む。パラフィン代用涙液は、Lacri−Lube(登録商標)の軟膏を含む。代用涙液として使用される他の市販の軟膏は、Lubrifresh PM(登録商標)、Moisture Eyes PM(登録商標)及びRefresh PM(登録商標)を含む。
【0127】
眼への投与のための局所製剤は、眼に許容可能な張度を有する。特定の例において、涙液は、0.9%の塩化ナトリウム溶液又は2.5%のグリセロールの溶液に等価な等張性値を有している。特定の例において、約0.6%〜約1.8%の塩化ナトリウム等量の等張性値は、眼への局所投与に適している。特定の例において、本明細書に開示される眼への投与のための局所製剤は、約200〜約600 mOsm/Lのモル浸透圧濃度を有している。幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、低張であり、そのため、適切な張性レンジを獲得するのに適した、任意の薬剤を追加する必要がある。張度を調節する眼に許容可能な物質は、イオン及び非イオンの等張化剤を含む。イオンの等張化剤の限定されない例は、例えば、CaCl2、KBr、KCl、LiCl、Nal、NaBr又はNaCl、Na2S2O3、NaHSO4、Na2SO4又はホウ酸などの、アルカリ金属又は土類金属ハロゲン化合物である。別のイオンの等張化剤は、硫酸アンモニウムである。非イオンの張力促進剤は、例えば尿素、グリセロール、ソルビトール、マンニトール、プロピレングリコール、又はデキストロースである。
【0128】
幾つかの実施形態において、眼への投与のための局所製剤は、1以上のpH調整剤を含む。特定の例において、本明細書に開示される眼への投与のための局所製剤は、約4.0〜約8.0の範囲内でpHを有している。特定の例において、眼への投与のための製剤は、涙液に等価なpHを有している。pH調整剤は、限定されないが、ホウ酸、ホウ酸ナトリウム、クエン酸カリウム、クエン酸、重炭酸ナトリウム、トリス、及び(Na2HPO4、NaH2PO4及びKH2PO4の組み合わせを含む)様々な混合したリン酸緩衝液及びそれらの混合物を含む。
【0129】
眼への投与のための局所製剤は、眼に許容可能な清澄性を有している。特定の例において、適切な清澄性を欠く製剤は、眼の適切な機能を妨げる。眼に許容可能な清澄剤の例は、限定されないが、ポリソルベート20、ポリソルベート80、又はそれらの組み合わせを含む。
【0130】
幾つかの実施形態において、眼への投与のための局所製剤は、眼に許容可能な粘性エンハンサーを含む。特定の例において、粘性エンハンサーは、本明細書に開示される製剤が眼内にとどまる時間を増加させる。特定の例において、本明細書に開示される製剤が眼内にとどまる時間を増加させることは、より大きな薬物吸収及び効果を可能にする。粘膜付着性ポリマーの限定されない例は、カルボキシメチルセルロース、カルボマー(アクリル酸ポリマー)、ポリ(メタクリル酸メチル)、ポリアクリルアミド、ポリカルボフィル、アクリル酸/アクリル酸ブチルコポリマー、アルギン酸ナトリウム、デキストラン、ヒアルロン酸及びその塩、及びコンドロイチン硫酸及びその塩を含む。
【0131】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の後上葉区に(例えば、網膜、脈絡膜、硝子及び視神経に)投与又は送達される。幾つかの実施形態において、眼の後部に送達するための、本明細書に開示される眼への投与のための局所製剤は、可溶化剤、例えば、グルカン硫酸塩及び/又はシクロデキストリンを含む。使用され得るグルカン硫酸塩は、限定されないが、デキストラン硫酸塩、シクロデキストリン硫酸塩及びβ−1,3−グルカン硫酸塩、それらの自然体及び誘導体の両方、又は線維芽細胞成長因子(FGF)を含む組織に一時的に結合でき、その組織で保持されることが可能で、薬物の安定性及び/又は可溶性を改善し、及び/又は本明細書に開示される眼への投与のための局所製剤の浸透及び眼吸収を改善する、任意の化合物を含む。可溶化剤として使用され得るシクロデキストリン誘導体は、限定されないが、α−シクロデキストリン、β−シクロデキストリン、γ−シクロデキストリン、ヒドロキシエチルβ−シクロデキストリン、ヒドロキシプロピルγ−シクロデキストリン、ヒドロキシプロピルβ−シクロデキストリン、硫酸化β−シクロデキストリン、硫酸化α−シクロデキストリン、スルホブチルエーテルβ−シクロデキストリンを含む。
【0132】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、防腐剤を含む。防腐剤は、菌類又は細菌などの微生物の成長を防ぐ、又は破壊するために製剤に加えられる。眼への投与のための局所製剤に適している防腐剤の例は、限定されないが、塩化ベンザルコニウム(N−ベンジル−N −(C8−C18アルキル)−N,N−塩化ジメチルアンモニウム)、塩化ベンゾキソニウムなど;チオマーサル、硝酸フェニル水銀、酢酸フェニル水銀及びホウ酸フェニル水銀を含む、チオサリチル酸のアルキル水銀塩;過ホウ酸ナトリウム、亜鉛素酸ナトリウム;例えば、メチルパラベン又はプロピルパラベンを含む、パラベン;例えば、クロロブタノール、ベンジルアルコール又はフェニルエタノールを含む、アルコール;例えば、クロロヘキシジン、ポリヘキサメチレンビグアニド、過ホウ酸ナトリウム、Germal(登録商標)II又はソルビン酸を含む、グアニジン誘導体を含む。
【0133】
本明細書に開示される眼への投与のための局所製剤は、任意の適切な方法で製剤される。任意の適切な技術、担体、及び/又は賦形剤は、本明細書に開示されるFLAPインヒビタとの使用のため熟慮される。本明細書に記載される眼への投与のための局所製剤の要約のために、Kaur,I.P.,Kanwar,M.,Drug Dev Industrial Pharmacy,2002,28,473−493;Lang,J.C.,Adv Drug Delivery Rev.,1995,16,39−43;Remington:The Science and Practice of Pharmacy,Nineteenth Ed.(Easton,Pa.:Mack Publishing Company,1995); Hoover,John E.,Remington’s Sciences,Mack Publishing Co.,Easton,Pennsylvania 1975;Liberman,H.A.and Lachman,L.,Eds.,Pharmaceutical Dosage Forms,Marcel Decker,New York,N.Y.,1980;and Pharmaceutical Dosage Forms 及び Drug Delivery Systems,Seventh Ed.(Lippincott Williams & Wilkins1999)が参照され、そのような開示のための引用により、本明細書に組み込まれる。
【0134】
投薬
本明細書には、特定の実施形態において、眼への投与のための局所製剤が開示され、ここでの眼への投与のための局所製剤は、予防的な及び/又は治療上の処置のために投与される。特定の例において、この使用のための有効量は、疾患、障害又は疾病の重症度及び経過、以前の処置、個体の健康状態及び薬物に対する反応、及び処置する医師の判断による。幾つかの実施形態において、投与量は、約0.001重量%〜約10重量%である。
【0135】
本明細書に記載される化合物は、眼の任意の部分に随意に投与され、一般的に「点眼投与」と呼ばれる。眼への点眼投与は、限定されないが、眼内注射、網膜下注射、硝子体内注射、眼窩投与、結膜下注射、球後注射、(前眼房又は硝子体眼房への注射を含む)前房内注射、テノン嚢下の注射又はインプラント、点眼液、眼科用懸濁液剤、眼軟膏、眼球インプラント、眼球インサート、眼内の溶液、イオン泳動の使用、手術用の灌流液中での取り込み、及びパック(ほんの一例として、円蓋に挿入された飽和した綿球)を包含する。
【0136】
本明細書に開示される眼への投与のための局所製剤により、一般的に、FLAPインヒビタの少なくとも一部が通り抜ける角膜とFLAPインヒビタが直接接触するという結果になる。特定の例において、本明細書に開示される眼への投与のための局所製剤は、約2〜約24時間、より典型的には約4〜約24時間、及び最も典型的には約6〜24時間の眼内の有効な滞留時間を有している。
【0137】
眼への投与のための有用な局所製剤は、水溶液、懸濁液又は溶液/懸濁液になり、点眼薬の形態で提示され得る。所望の投薬は、規定数の滴剤を介して眼内へ投与され得る。例えば、25μlの滴量のために、1〜6滴の投与は、本明細書に開示される眼への投与のための局所製剤25〜150μlを送達する。水性製剤は,典型的には約0.01%〜約50%、より典型的には約0.1%〜約20%、更に典型的には約0.2%〜約10%、及び最も典型的には約0.5%〜約5%のFLAPインヒビタの重量/容量を含む。
【0138】
幾つかの実施形態において、眼への投与のための局所製剤は、コンタクトレンズに、溶液、懸濁液、ゲル、軟膏、クリーム又はローションの投薬を1回以上加え、一定期間、例えば、15分〜4時間レンズを挿入することにより投与され、これは1日当たり1回〜4回繰り返し可能である。コンタクトレンズの投薬は、角膜内の優先吸収などの利点をもたらし、投与量を最大限活用し、体内吸収のわずかな危険性同様、発症してしまうかもしれない軽度の発赤を最小限にする。有用なコンタクトレンズは、当該分野に周知の任意のものを含み、限定されないが、ポリメタクリル酸メチル(PMMA)レンズを含む、疎水性のハードレンズ;ヒドロキシエチルメタクリル酸メチルレンズを含む、親水性のソフトレンズ;シリコーンビニルプロリドンを含む、疎水性のフレキシブルレンズ;及び酢酸酪酸セルロースレンズを含む、親水性のハードレンズ(rigid hydrophilic lens)を含む。
【0139】
幾つかの実施形態において、眼の障害が改善されない場合、本明細書に開示される眼への投与のための局所製剤は、慢性的に(即ち、個体の一生の期間を含む、長期間の間)投与される。幾つかの実施形態において、眼の障害が改善されない場合、本明細書に開示される眼への投与のための局所製剤は、継続的に与えられ;或いは、投与されているFLAPインヒビタの投与量は、特定の期間、一時的に減らされる又は一時的に投与が中止される(即ち、「休薬期間」)。幾つかの実施形態において、休薬期間は、2日間から1年間続き、期間内のすべての整数を含む。幾つかの実施形態において、休薬期間中の減量は、約10%から約100%であり、期間内のすべての整数を含む。
【0140】
幾つかの実施形態において、眼の障害が改善される場合、本明細書に開示される眼への投与のための局所製剤は、維持量として投与される。幾つかの実施形態において、眼の障害が改善される場合、本明細書に記載される眼への投与のための局所製剤は、低頻度で又は減少した投与量で投与される。
【0141】
1つの実施形態において、本明細書に開示される眼への投与のための局所製剤は、FLAPインヒビタの即時放出のために製剤される。幾つかの実施形態において、FLAPインヒビタは、即時に、又は1分以内、又は5分以内、又は10分以内、又は15分以内、又は30分以内、又は60分以内又は90分以内に放出される。
【0142】
1つの実施形態において、本明細書に開示される眼への投与のための局所製剤は、FLAPインヒビタの遅延(又は制御)放出のために製剤される。幾つかの実施形態において、FLAPインヒビタ化合物は、15分、又は30分、又は1時間、又は4時間、又は6時間、又は12時間、又は18時間、又は1日、又は2日、又は3日、又は4日、又は5日、又は6日、又は7日、又は10日、又は12日、又は14日、又は18日、又は21日、又は25日、又は30日、又は45日、又は2ヶ月又は3ヶ月又は4ヶ月又は5ヶ月又は6ヶ月又は9ヶ月又は1年を超える期間にわたって放出される。
【0143】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、FLAPインヒビタの即時及び遅延(又は制御)放出のために製剤される。
【0144】
併用療法
1つの態様において、本明細書に開示される医薬組成物及び方法は、追加の治療薬を含む。1つの態様において、追加の治療薬は、FLAPインヒビタ化合物以外の治療薬である。
【0145】
1つの態様において、FLAPインヒビタ化合物を含む、本明細書に開示される局所製剤は、(別々に又は同じ製剤において)以下から選択される治療薬と共に同時投与される:抗生物質(例えば、硫酸ポリミキシンB/亜鉛バシトラシン、ポリミキシンB/ネオマイシン/グラミシジン、ポリミキシンB/トリメトプリム、ポリミキシンB/バシトラシン、フルオロキノロン(例えば、シプロフロキサシン、モキシフロキサシン、オフロキサシン、ガチフロキサシン、レボフロキサシン)、アミノグリコシド(例えば、トブラマイシン、アジスロマイシン、ゲンタマイシン、エリスロマイシン、バシトラシン);抗真菌剤(例えば、アムホテリシンB、イトラコナゾール、フルコナゾール、ボリコナゾール);ステロイド抗炎症剤(例えば、フルオロメトロン酢酸塩、酢酸プレドニソロン、ロテプレドノールエタボネート、リン酸プレドニソロンナトリウム、プレドニソロンナトリウム、リメキソロン、フルオロメトロン酢酸塩);非ステロイド抗炎症剤(例えば、ネパフェナク、ケトロラクトロメタミン、ブロムフェナク、ジクロフェナクナトリウム、ケトロラクトロメタミン、フマル酸ケトチフェン);抗ヒスタミン剤(例えば、フマル酸エメダスチン、塩酸オロパタジン、エピナスチンHCl、塩酸アゼラスチン、フマル酸ケトチフェン);抗ウイルス剤(例えば、アシクロビル、ビダラビン、トリフルリジン);アルファアゴニスト(例えば、アプラクロニジン、ブリモニジン、ビマトプロスト);ベータ遮断剤(例えば、塩酸ベタキソロール、塩酸レボブノロール、塩酸カルテオロール、メチプラノロール、マレイン酸チモロール、チモロール半水和物);炭酸脱水酵素インヒビタ(例えば、ブリンゾラミド、ドルゾラミド、アセタゾラミド);縮瞳薬(例えば、塩化アセチルコリン、エコチオフェート);プロスタグランジン(例えば、トラボプロスト、ビマトプロスト、ラタノプロスト);抗血管新生薬(例えば、ペガプタニブナトリウム、ラニビズマブ、ベルテポルフィン);ロテプレドノールエタボネート、肥満細胞安定化薬(例えば、ロドキサミドトロメタミン、ネドクロミルナトリウム、クロモリンナトリウム、ペミロラストカリウム)、シクロスポリン、及びDP2アンタゴニスト。
【0146】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)抗生物質と共に同時投与される。抗生物質は、限定されないが、硫酸ポリミキシンB/亜鉛バシトラシン、ポリミキシンB/ネオマイシン/グラミシジン、ポリミキシンB/トリメトプリム、ポリミキシンB/バシトラシン、フルオロキノロン(例えば、シプロフロキサシン、モキシフロキサシン、オフロキサシン、ガチフロキサシン、レボフロキサシン)、アミノグリコシド(例えばトブラマイシン、アジスロマイシン、ゲンタマイシン、エリスロマイシン、バシトラシン)を含む。
【0147】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)抗真菌剤と共に同時投与される。抗真菌剤は、限定されないが、アンホテリシンB、イトラコナゾール、フルコナゾール、及びボリコナゾールを含む。
【0148】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)ステロイド抗炎症剤と共に同時投与される。ステロイド抗炎症剤は、限定されないが、ベタメタゾン、プレドニゾン、アルクロメタゾン、アルドステロン、アムシノニド、ベクロメタゾン、ベタメタゾン、ブデソニド、シクレソニド、クロベタゾール、クロベタゾン、クロコルトロン、クロプレドノール、コルチゾン、コルチバゾール、デフラザコルト、デオキシコルチコステロン、デソニド、デスオキシメタゾン、デスオキシコルトン、デキサメタゾン、ジフロラゾン、ジフルコルトロン、ジフルプレドナート、フルクロロロン、フルドロコルチゾン、フルドロキシコルチド、フルメタゾン、フルニソリド、フルオシノロンアセトニド、フルオシノニド、フルオコルチン、フルオコルトロン、フルオロメトロン、フルペロロン、フルプレドニデン、フルチカゾン、ホルモコータル、ハルシノニド、ハロメタゾン、ヒドロコルチゾン/コルチゾール、アセポン酸ヒドロコルチゾン、ヒドロコルチゾンブテプレート、酪酸ヒドロコルチゾン、ロレプレドノール、メドリゾン、メプレドニゾン、メチルプレドニソロン、アセポン酸メチルプレドニソロン、モメタゾンフロ酸エステル、パラメタゾン、プレドニカルベート、プレドニゾン/プレドニソロン、リメキソロン、チキソコルトール、トリアムシノロン、及びウロベタゾールを含む。
【0149】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)非ステロイド抗炎症剤(NSAID)と共に同時投与される。NSAIDは、限定されないが、ネパフェナク、ケトロラク、ブロムフェナク、ジクロフェナク、ケトロラク、ケトチフェンを含む。
【0150】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)抗ヒスタミン剤と共に同時投与される。幾つかの実施形態において、抗ヒスタミン剤は、限定されないが、アンレキサノクス、アステミゾール、アザタジン、アゼラスチン、アクリバスチン、ブロムフェニラミン、セチリジン、レボセチリジン、エフレチリジン、クロルフェニラミン、クレマスチン、シクリジン、カレバスチン、シプロヘプタジン、カルビノキサミン、デスカルボエトキシロラタジン、ドキシラミン、ジメチンデン、エバスチン、エピナスチン、エフレチリジン、フェキソフェナジン、ヒドロキシジン、ケトチフェン、ロラタジン、レボカバスチン、ミゾラスチン、メキタジン、ミアンセリン、ノベラスチン、メクリジン、ノルアステミゾール、オロパタジン、ピクマスト、ピリラミン、プロメタジン、テルフェナジン、トリペレナミン、テメラスチン、トリメプラジン、及びトリプロリジンを含む。幾つかの実施形態において、抗ヒスタミン剤は、限定されないが、エメダスチン、オロパタジン、エピナスチン、アゼラスチン、ケトチフェンを含む。
【0151】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)抗ウイルス剤と共に同時投与される。抗ウイルス剤は、限定されないが、アシクロビル、ビダラビン、トリフルリジンを含む。
【0152】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)アルファアゴニストと共に同時投与される。アルファアゴニストは、限定されないが、アプラクロリジン、ブリモニジン、ビマトプロストを含む。
【0153】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)ベータ遮断剤と共に同時投与される。ベータ遮断剤は、限定されないが、ベタキソロール、レボブノロール、カルテオロール、メチプラノロール、チモロールを含む。
【0154】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)炭酸脱水酵素インヒビタと共に同時投与される。炭酸脱水酵素インヒビタは、限定されないが、ブリンゾラミド、ドルゾラミド、アセタゾラミドを含む。
【0155】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)縮瞳薬と共に同時投与される。縮瞳薬は、限定されないが、塩化アセチルコリン、エコチオパートを含む。
【0156】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)プロスタグランジンと共に同時投与される。プロスタグランジンは、限定されないが、トラボプロスト、ビマトプロスト、ラタノプロストを含む。
【0157】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)抗血管新生薬と共に同時投与される。抗血管新生薬は、限定されないが、ペガプタニブナトリウム、ラニビズマブ、ベルテポルフィンを含む。
【0158】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)エタボン酸ロテプレドノールと共に同時投与される。
【0159】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)肥満細胞安定化薬と共に同時投与される。肥満細胞安定化薬は、限定されないが、ロドキサミドトロメタミン、ネドクロミルナトリウム、クロモリンナトリウム、ペミロラストカリウムを含む。
【0160】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)シクロスポリンと共に同時投与される。
【0161】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)DP2受容体アンタゴニストと共に同時投与される。1つの態様において、追加の治療薬は、小分子DP2受容体アンタゴニスト化合物である。幾つかの実施形態において、DP2受容体アンタゴニストは、国際特許出願番号PCT/US09/35174(発明の名称「プロスタグランジンD2受容体のアンタゴニスト(Antagonists of Prostaglandin D2 receptors)」);国際特許出願番号PCT/US08/82056(発明の名称「PGD2受容体のアンタゴニスト(Antagonists of PGD2 receptors)」);国際特許出願番号PCT/US08/82082(発明の名称「PGD2受容体のアンタゴニスト(Antagonists of PGD2 receptors)」);国際特許出願番号PCT/US09/32495(発明の名称「プロスタグランジンD2受容体のN,N−二置換アミノアルキルビフェニルアンタゴニスト(N,N−disubstituted aminoalkylbiphenyl antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/32499(発明の名称「プロスタグランジンD2受容体のN,N−二置換アミノアルキルビフェニルアンタゴニスト(N,N−disubstituted aminoalkylbiphenyl antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/33961(発明の名称「プロスタグランジンD2受容体のアンタゴニストとしてのサイクリックジアリールエーテル化合物(Cyclic diaryl ether compounds as antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/38291(発明の名称「プロスタグランジンD2受容体のアミノアルキルフェニルアンタゴニスト(Aminoalkylphenyl antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/49621(発明の名称「プロスタグランジンD2受容体のアンタゴニスト(Antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/49631(発明の名称「プロスタグランジンD2受容体のアンタゴニスト(Antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/58655(発明の名称「プロスタグランジンD2受容体のヘテロアリールアンタゴニスト(Heteroaryl antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/58663(発明の名称「プロスタグランジンD2受容体のヘテロアリールアンタゴニスト(Heteroaryl antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/44219(発明の名称「プロスタグランジンD2受容体のトリサイクリックアンタゴニスト(Tricyclic antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/48327(発明の名称「プロスタグランジンD2受容体のシクロアルカン[B]インドールアンタゴニスト(Cycloaklane[B]indole antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/59256(発明の名称「プロスタグランジンD2受容体のヘテロアリールアンタゴニスト(Heteroaryl antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/59891(発明の名称「プロスタグランジンD2受容体のヘテロアルキルビフェニルアンタゴニスト(Heteroalkyl biphenyl antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/64630(発明の名称「プロスタグランジンD2受容体のヘテロサイクリックアンタゴニスト(Heterocyclic antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/63439(発明の名称「プロスタグランジンD2受容体のシクロアルカン[B]アザインドールアンタゴニスト(Cycloaklane[B]azaindole antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/63438(発明の名称「プロスタグランジンD2受容体のシクロアルカン[B]アザインドールアンタゴニスト(Cycloaklane[B]azaindole antagonists of prostaglandin D2 receptors)」);米国仮特許出願第61/147437(発明の名称「プロスタグランジンD2受容体アンタゴニストとしてのインドリジン化合物(Indolozine compounds as prostaglandin D2 receptor antagonists)」;又はそれらの薬学的に許容可能な塩又はN-オキシドに開示される化合物から選択される。
【0162】
幾つかの実施形態において、DP2受容体アンタゴニストは、AMG 009、AMG 853、WO 09/085177の化合物14、AZD1981、ODC9101(OC459)、OC499、OC1768、OC2125、OC2184、QAV680、MLN6095、ACT−129968、ADC3680、SAR398171、S555739、AP768、[2’−(3−ベンジル−1−エチル−ウレイドメチル)−6−メトキシ−4’−トリフルオロメチル−ビフェニル−3−イル]−酢酸、{3−[2−tert−ブチルスルファニルメチル−4−(2,2−ジメチル−プロピオニルアミノ)−フェノキシ]−4−メトキシ−フェニル}−酢酸、TM30642、TM30643、TM30089、TM27632、及びTM3170、{2’−[(N−シクロプロパンカルボニル−N−エチル−アミノ)−メチル]−6−メトキシ−4’−トリフルオロメチル−ビフェニル−3−イル}−酢酸、[2’−[(N−シクロプロパンカルボニル−N−エチル−アミノ)−メチル]−4’−(6−エトキシ−ピリジン−3−イル)−6−メトキシ−ビフェニル−3−イル]−酢酸、(5−{2−[(N−ベンジルオキシカルボニル−N−エチル−アミノ)−メチル]−4−トリフルオロメチル−フェニル}−ピリジン−3−イル)−酢酸、及び{8−[(4−フルオロ−ベンゼンスルホニル)−メチル−アミノ]−6,7,8,9−テトラヒドロ−ピリド[3,2−b]インドール−5−イル}−酢酸から選択される。
【0163】
幾つかの例において、本明細書に記載される任意の眼製剤又は方法におけるDP2受容体アンタゴニスト化合物へのFLAPインヒビタ化合物の量の比率は、約10:1から約1:10である:幾つかの例において、本明細書に記載される任意の眼製剤又は方法におけるDP2受容体アンタゴニストへのFLAPインヒビタ化合物の量の比率は、約10:1、約8:1、約6:1、約5:1、約4:1、約2:1、約1:1、約1:2、約1:4、約1:5、約1:6、約1:8、又は約1:10である。
【0164】
幾つかの実施形態において、FLAPインヒビタ及び追加の治療薬は、同じ医薬組成物中にある。幾つかの実施形態において、FLAPインヒビタ及び追加の治療薬は、別々の医薬組成物中にある。幾つかの実施形態において、FLAPインヒビタ及び追加の治療薬は、同時に投与される。幾つかの実施形態において、FLAPインヒビタ及び追加の治療薬は、異なる時間に投与される。
【0165】
実施例
実施例1:FLAPインヒビタの製剤
1つの態様において、FLAPインヒビタ化合物を含む水性点眼液を、水に10%のベータ−ヒドロキシプロピルシクロデキストリン(BHPC)中のFLAPインヒビタ化合物を溶かすことにより調製した。この製剤を使用して、以下の化合物は、1mg/mLで可溶性となった:化合物A(ナトリウム塩)、化合物B(ナトリウム塩)、化合物C(ナトリウム塩)、化合物I(ナトリウム塩)、化合物J(ナトリウム塩)、化合物G(ナトリウム塩)。化合物F(ナトリウム塩)は、1mg/mLで混濁液を形成した。
【0166】
実施例2:化合物Aの溶液
眼への投与に適している化合物Aの溶液を、下記の成分で製剤する:
【0167】
【表1】

【0168】
実施例3:化合物Bの溶液
眼への投与に適している化合物Bの溶液を、下記の成分で製剤する:
【0169】
【表2】

【0170】
実施例4:化合物Cの溶液
眼への投与に適している化合物Cの溶液を、下記の成分で製剤する:
【0171】
【表3】

【0172】
実施例5:アレルギー性結膜炎の徴候及び症状を低減する際に眼へのFLAPインヒビタ化合物の局所投与の効果を評価する臨床試験
単一施設、二重盲検、無作為、2つの方法のクロスオーバー、プラセボ対照の研究は、結膜アレルゲン負荷(conjunctival allergen challenge(CAC))の後の、アレルギー性結膜炎(AC)の個体の眼へのFLAPインヒビタ化合物の局所投与の安全性及び有効性を評価するためにある。各被験体は、動的治療(例えば、眼に投与されるFLAPインヒビタ化合物の局所製剤)又はプラセボを受ける。
【0173】
18〜65歳のどちらかの性別の10人の被験体を、研究に参加させる。全ての被験体は、眼アレルギー(アレルギー性結膜炎又は鼻炎結膜炎)の病歴を有するべきである。被験体のアレルギー状態を、(1)季節性又は通年性のアレルゲンへの陽性皮膚プリックテスト、(2)同じアレルゲンへの眼のアレルゲン負荷によって確認するべきである。
【0174】
被験体は、緑内障、前部又は後部ブドウ膜炎、臨床的に重大な眼瞼炎、濾胞性結膜炎、虹彩炎又は眼乾燥;糖尿病性網膜症、又は進行性の網膜疾患;活動性の眼感染の存在;眼のヘルペス性感染の陽性の病歴を有するべきではない。(無作為化の2週間前までに)任意の全身投与又は点眼投与されたコルチコステロイド;又は任意の全身投与又は点眼投与された肥満細胞安定化薬での前処置を有していた被験体;無作為化の4週間前に上気道感染症を有していた被験体、又は6ヶ月以内に眼科手術を受けた又は網膜剥離の病歴を有していた被験体もまた、除外される。妊娠の可能性がある女性の被験体は、陰性の尿妊娠テストの結果を文書で有するべきであり、研究の期間中に、医学的に証明された避妊の形態を実行しているべきである。同意書を、各被験体から得る。
【0175】
結膜アレルゲン負荷(CAC)のプロトコル
人口統計学的な病歴及び薬歴を患者から得る。適格患者は、患者が皮膚試験に従って以前に陽性反応を示したアレルゲンとともに双方でCACを実行する。アレルゲンを、陽性反応が認められるまで、増加する濃度で10分間隔に注入する。患者と医師は、その後、CACの3、7、及び20分後及び12時間後の各徴候への5段階評価(0=無しから4=無力化(incapacitating)まで)を使用して、眼炎症:眼のそう痒感、テアリング、及び発赤/ヒリヒリとした感覚の徴候及び症状を評価する。患者の症状スコアは、患者によって評価されるような個人得点の合計である。患者の症状スコア(PD 30)における30%の変化を誘発するアレルゲンの濃度を、AUC症状スコア0〜20分により測定されるように、確立する。各患者は、その後、クロスオ−バーの第1期の1日目及びクロスオ−バーの第2期の1日目にも再び、PD 30の濃度でアレルゲン負荷を受ける。各患者は、アレルゲン負荷の直後、(動的又はプラセボ)治療を受ける。クロスオーバーの2つの期間を、7日間の休薬期間によって分離する。
【0176】
研究の主要評価項目は、プラセボに対して処置される患者の症状スコア(AUC症状スコア0〜20分)の変動である。副次的評価項目は、患者及び医師によって評価されるような個体の眼の兆候及び病状、患者の総合評価、医師の総合評価、安全性及び忍容性、鼻の症状、及び涙液分泌中のバイオマーカーを含む。
【0177】
実施例6:アレルギー性結膜炎のラットモデル
アレルギー性結膜炎のラットモデルを、アレルギー性結膜炎の進行への眼へのFLAPインヒビタ化合物の局所投与の効果を試験するために使用する。雄のウィスターラット(250〜350g)を、1日目に、全ての四肢の足蹠への、オバルブミン(OVA、1mg)、ミョウバン(2mg)及び1010個の死滅した百日咳菌細胞を含む、0.6mLの食塩水の注入によって感作する。5日後、ラットを、背中の10の部位へのOVA(0.5mg)を含む1mlの食塩水の皮下注射によって追加免疫する。局所感作を、マイクロピペットを使用して、両眼に食塩水(10mg/ml、5μl)中のOVAを注入することにより、14日目から42日目まで毎日行なう。ラットを、(必要に応じて)14日目から42日目に全身性又は眼のFLAPインヒビタで処置する。眼を引っ掻く行動を、選択日にOVA後20分間数える。14、21、28、35及び42日目のOVA負荷に続く24時間、ラットに麻酔をかけ、結膜を取り除き、10%の中性緩衝ホルマリンで治療する。4−μmの厚い前頭切断を染色し、好酸球を数える。眼へのFLAPインヒビタ化合物での局所療法に続く、眼を引っ掻く行動及び結膜好酸球の阻害を、グラフパッドプリズムを使用して、記録し、プロットする。
【0178】
実施例7:RSV感染した眼のマウスモデル
呼吸器合胞体ウイルス(RSV)の眼感染のマウスモデルを、RSV誘発性の眼の免疫病理へのFLAPインヒビタ化合物の眼の適用効果を試験するために使用する(Bitko V,et al.,J.Virol.2007;81(2):783−90;Bitko V,et al.,Nat.Med.2005;11(1):50−5)。各マウスの眼を、60ngのFLAPインヒビタ化合物又は2μlの量におけるビヒクル(無菌食塩水)で局所的に処置する。FLAPインヒビタ化合物を、ウイルス接種の40分後注入し、その後、プロトコルの全期間中(14日間)、毎日1回注入する。
【0179】
眼内でのウイルス及びインヒビタの注入。6〜8歳の雌のBALB/cマウスを、Charles River Laboratoriesから購入した。RSV(Long株、血清型A)を、HEp−2細胞で成長させ、1011PFUの濃度にまで蔗糖層上で精製した(Bitko et al.,Nat.Med.11:50−55,2005 )。希釈を、必要に応じて、104PFU/2μLの終濃度への使用の直前に、リン酸緩衝食塩水(PBS)中で行った。同様に希釈した蔗糖溶液を、偽感染したコントロールマウス中で使用した。マウスに、ペントバルビタール(50mg/kg)の腹腔内注射により麻酔をかけ、2μLのPBS内のウイルスを、角膜表面に落とし、眼瞼閉鎖でマッサージした。接種の日を、0日目と考えた。FLAPインヒビタ化合物Cを、0日目のRSV接種の40分後、2μLの適用の直前にPBS中で60ng/μまで希釈し、その後、毎日希釈した。
【0180】
実験の持続時間:眼を毎日視覚的に検査し、RSV接種後の各日:2、4、6、8、9、10、12、14日目=合計8つの時点に収集する。3匹の動物を、各データ点のために使用する、即ち24匹のマウスをFLAPインヒビタ化合物Cで処置し、24匹のマウスをビヒクル制御で処置する(研究中に48匹のマウスを使用)。
【0181】
眼病理。眼疾患を、事前に記載されるように、細隙灯生体顕微鏡により評価した(Bitko V,et al.,J.Virol.2007;81(2):783−90)15;15;Girgis et al.,Invest.Ophthal.Vis.Sci.44:1591−1597,2003)。病理を、以下のような、0〜5の規模で採点した:0=澄んだ眼;1=隅での軽度の発赤;2=中等度の発赤及び注射;3=毛様体充血を有する結膜下及び角膜下注射;4=いくつかの粘液に関連する広範囲な注射;5=いくつかの粘液に関連する最も広範囲な注射。眼を、与えられた処置に気づかないリーダーと共にコード化された方法で検査した。図2は、RSVの眼病理へのFLAPインヒビタ化合物Cの影響を示す。FLAPインヒビタ化合物Cの眼の適用により、すべての観察日、すなわち、RSV誘発後の2〜14日間を通して病理スコアが減少する。眼を処置するRSVは、ゴム状残渣及びムチンが4日目に始まってから蓄積し、重い粘液が8日目まで蓄積することを示した。FLAPインヒビタ化合物Cで処置される感染した眼には、8日目にゴム状残渣及びムチンが蓄積することはなかった。
【0182】
CysLT測定。眼組織を、ポリトロンホモジナイザーを使用して、1〜3mlの溶解緩衝液(0.5%のトリトン−X−100、15 mMのトリスCl pH 7.4)中で均質化した。ロイコトリエン抽出のプロセスを進める前に、ホモジネートを、摂氏4℃で10分間10,000xgで遠心分離し、上清を、摂氏−80℃で凍結した。上清サンプルを、最終の容量、10%の冷エタノールで溶かし、沈殿させ、30分間氷の上に固定し、その後、15分間10,000xgで遠心分離した。廃棄された変性タンパク質ペレット及び脂質を含む上清を、感度30pg CysLT/mLまでのAssey Designsに記載される手順を使用し、標準曲線の線形部上に存在するように適切な希釈で、CysLT(EIA方法)のためにアッセイした。図3は、マウスにおけるRSVの眼の適用に続く、眼のホモジネートにおけるCysLTの増加及びマウスにおけるRSVの眼の適用に続く、CysLTのレベルへの化合物Cの効果を示す。化合物Cでの局所療法は、眼のホモジネートにおいてCysLTのレベルを減らした。
【0183】
インターロイキン−4(IL−4)測定。上述されるような眼の抽出を、抽出液におけるIL−4のレベルを測定するために使用する。図4は、マウスにおけるRSVの眼の適用に続く、眼のホモジネートにおけるIL−4の増加及びマウスにおけるRSVの眼の適用に続く、IL−4のレベルへのFLAPインヒビタの効果を示す。化合物Cでの局所療法は、眼のホモジネートにおいてIL−4のレベルを減らした。
【0184】
RSV RNA及びタンパク質:RSVを、以前記載されたように、ウェスタンブロット及び生存可能なウイルスアッセイ(プラーク形成単位;pfu)を使用して、様々な日に眼組織においてアッセイする。IL−5をRT−PCRによって定量化する。RSV RNA及びタンパク質を、眼及び肺において測定した(Urnowey et al.,BMC Microbiol.6:26,2006)。
【0185】
FLAPインヒビタ化合物Cの投与は、上述されるように、Th2細胞のサイトカインIL−4の産生の減少につながったが、眼又は肺におけるウイルス負荷の増加にはつながらなかった。FLAPインヒビタ化合物Cの投与は、眼又は肺におけるRSV mRNA又はタンパク質の増加にはつながらなかった(図5)。化合物Cは、肺におけるRSVを低減した。
【0186】
眼感染は、最終的に肺へ伝染し、標準的な呼吸器感染症を引き起こす。幾つかの例において、眼は、RSVが肺へ侵入するための門戸としての機能を果たす。そのため、FLAPインヒビタ化合物の眼の適用が、肺においてウイルス複製及びウイルスの量に任意の効果があるのかを測定するために、肺感染症をモニターすることは興味深い。
マウスの肺組織を収集し、ホモジネートをウイルス価及びウェスタンブロットのために作り出し、アッセイする(Matsuse H,et al.Allergology International 2007;56:165−169;Bitko V,et al.,J.Virol.2007;81(2):783−90)。
【0187】
統計分析。病理スコア、及び眼のCysLT及び/又はIL−4の濃度は、グラフパッドプリズムのソフトウェア(GraphPad Software,San Diego,CA)を使用して、二元配置分散分析に続き、ボンフェローニ事後解析に影響された。
【0188】
本明細書に記載される実施例及び実施形態は、例示目的のみのためであり、当該分野の当業者に提示される様々な修正又は変更は、本出願の精神および範囲内および添付の特許請求の範囲内に含まれるべきである。本明細書に使用される節の表題は、構成目的のみのものであって、記載される主題を限定するためのものではない。
【0189】
実施例8:マウスの亜慢性のスモークモデル(Subchronic Smoke Model)における併用療法
BALB/cマウスを群に分け、24時間、かごの中で気候順応させる(0日目)。対照群を空気に曝し、試験群を、8日間、1日につき7本のフィルター無しのタバコからの煙に曝した(1日目から8日目)。FLAPインヒビタ化合物(3−(3−(tert−ブチルチオ)−1−(4−(6−メトキシピリジン−3−イル)ベンジル)−5−((5−メチルピリジン−2−イル)メトキシ)−1H−インドール−2−イル)−2,2−ジメチルプロパン酸)(30mg/kg、1日2回)、DP2受容体アンタゴニスト5−{2−[(N−ベンジルオキシカルボニル−N−エチル−アミノ)−メチル]−4−トリフルオロメチル−フェニル}−ピリジン−3−イル)−酢酸(10mg/kg 1日4回)、又はFLAPインヒビタ化合物(3−(3−(tert−ブチルチオ)−1−(4−(6−メトキシピリジン−3−イル)ベンジル)−5−((5−メチルピリジン−2−イル)メトキシ)−1H−インドール−2−イル)−2,2−ジメチルプロパン酸)(30mg/kg、1日2回)及びDP2受容体アンタゴニスト5−{2−[(N−ベンジルオキシカルボニル−N−エチル−アミノ)−メチル]−4−トリフルオロメチル−フェニル}−ピリジン−3−イル)−酢酸(10mg/kg 1日4回)の組み合わせを1日目に始まり、13日目まで投与する。14日目に、気管支肺胞洗浄液(BALF)を、細胞、サイトカイン、ケモカイン(例えば、KC、IL−17、MIP−2、IL−6)、ムチン、及び/又はタンパク質の流入のために試験する。肺組織学も調べる。
トラフ血漿濃度を、以下の表に示す:
【0190】
【表4】

【0191】
図6は、BALFに存在する、細胞(図6A)、好中球(図6B)及びリンパ球(図6C)の総数への、FLAP阻害、DP2受容体アンタゴニズム、及びFLAPの阻害及びDP2受容体アンタゴニズムの組み合わせの効果を示す。図6Aにおいて、*は、P<0.05対空気、一元配置分散分析を表し;図6Bにおいて、*は、P<0.05対煙、テューキー法(Tukey's)での一元配置分散分析であり、***は、P<0.001対空気、テューキー法(Tukey's)での一元配置分散分析であり、「ns」は、P=0.055、片側t検定(one−tailed t−test)であり;及び図6Cにおいて、*は、P<0.05対煙、片側t検定である。
【0192】
図7は、BALF中のムチンの存在へのFLAP阻害、DP2受容体アンタゴニズム、及びFLAP阻害及びDP2受容体アンタゴニズムの組み合わせの効果を示す。図7Aにおいて、*は、P<0.05対煙、片側t検定を表す。亜慢性のスモーキングマウスモデルにおいて、BALF中のムチン分泌へのFLAPインヒビタ化合物及びDP2受容体アンタゴニスト化合物の組み合わせの効果は、付加的なものであり、即ち、FLAPインヒビタ化合物及びDP2受容体アンタゴニストの組み合わせは、各々の化合物のみよりも多い、BALF中のムチンの量を減らすことにつながった。1つの態様において、FLAPインヒビタ化合物単独の、又はFLAPインヒビタ化合物とDP2受容体アンタゴニストとの組み合わせの眼への局所投与の効果は、BALFにおいて観察されるように、同じ効果(例えば、機構的に予想される効果)を有する。
【0193】
本明細書に記載される実施例及び実施形態は、例示目的のみのためであり、当該分野の当業者に提示される様々な修正又は変更は、本出願の精神および範囲内および添付の特許請求の範囲内に含まれるべきである。本明細書に使用される節の表題は、構成目的のみのものであって、記載される主題を限定するためのものではない。
【技術分野】
【0001】
本出願は、2008年12月23日に出願の米国仮特許出願第61/140,574号(発明の名称「眼への投与のためのFLAPインヒビタの局所製剤(TOPICAL FORMULATIONS OF FLAP INHIBITORS FOR ADMINISTRATION TO AN EYE)」)、および2009年5月7日に出願の米国仮特許出願第61/176,451号(発明の名称「眼への投与のためのFLAPインヒビタの局所製剤(TOPICAL FORMULATIONS OF FLAP INHIBITORS FOR ADMINISTRATION TO AN EYE)」)の利益を主張するものであり、これら両方は、引用することにより本明細書に組み込まれる。
【0002】
本明細書には、5−リポキシゲナーゼ−活性化タンパク質(FLAP)インヒビタ化合物を含む、哺乳動物の眼への投与のための局所製剤、および眼の疾患、障害又は疾病の処置又は予防におけるその使用方法が記載される。
【背景技術】
【0003】
眼の疾患、障害又は疾病は、眼及び/又は関連する組織の任意の異常な状態を含む。非制限的な例として、眼の障害は、加齢黄斑変性、アレルギー性結膜炎、前上葉区瘢痕化、眼瞼炎、眼瞼結膜炎、水疱性障害、瘢痕性類天疱瘡、結膜黒色腫、結膜炎、コンタクトレンズに関連する(contact lens-associated)巨大乳頭結膜炎、糖尿病性網膜症、眼乾燥、上強膜炎、緑内障、グリオーシス、環状肉芽腫、グレーブス眼症、眼球内黒色腫、角膜炎、角結膜炎、疼痛、瞼裂斑、術後疼痛、増殖性硝子体網膜症、翼状片、瘢痕化、強膜炎、シェーグレン症候群、ブドウ膜炎、春季角結膜炎又はそれらの組み合わせを含む。
【発明の概要】
【課題を解決するための手段】
【0004】
本明細書には、特定の実施形態において、眼への投与のための製剤が記載され、製剤は、眼の疾患、障害又は疾病(即ち、眼及び/又は関連する組織の異常な状態)を処置するために投与される。本明細書には、特定の実施形態における、眼への投与のための局所製剤が記載される。局所製剤は眼に許容可能な賦形剤で製剤される。
【0005】
特定の実施形態において、製剤は免疫障害(例えば自己免疫障害);増殖性障害(例えば眼球内黒色腫);アレルゲン、及び/又は、刺激物質との接触;線維芽細胞性障害(例えば瘢痕化);又はそれらの組み合わせを処置するために投与される。本明細書には、特定の実施形態において、眼への投与のための局所製剤が記載され、製剤は、加齢黄斑変性、アレルギー性結膜炎、前上葉区瘢痕化、眼瞼炎、眼瞼結膜炎、水疱性障害、瘢痕性類天疱瘡、結膜黒色腫、結膜炎、コンタクトレンズに関連する巨大乳頭結膜炎、糖尿病性網膜症、眼乾燥、上強膜炎、緑内障、グリオーシス、環状肉芽腫、グレーブス眼症、眼球内黒色腫、角膜炎、角結膜炎、疼痛、瞼裂斑、術後疼痛、増殖性硝子体網膜症、翼状片、瘢痕化、強膜炎、シェーグレン症候群、ブドウ膜炎、春季角結膜炎又はそれらの組み合わせを処置するために投与される。幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、治療上有効な量のFLAPインヒビタを含む。幾つかの実施形態において、本明細書に記載される眼への投与のための局所製剤は、アレルゲン及び/又は刺激物質及び/又は感染因子(例えば、ウイルス)との接触の前又は後に投与される。幾つかの実施形態において、本明細書に記載される眼への投与のための局所製剤は、身体外傷(例えば、手術)の前又後に投与される。幾つかの実施形態において、本明細書に記載される局所製剤は、眼の外側表面に関連する疾病のために投与される。他の実施形態において、局所製剤は眼の外側表面に投与されるが、眼の内部に関連する疾患を処置するために、続いて、眼内に浸透する。他の実施形態において、局所製剤は、眼に接触する組織又は眼の近くの組織を処置するために、眼内に又は眼の外側表面上に投与される:限定されない例は、涙管、眼瞼、睫毛、及び眼窩を含む。
【0006】
1つの態様において、本明細書には、眼の疾患、障害又は疾病の処置に有効な量におけるFLAPインヒビタ化合物、及び溶液、懸濁液、軟膏、クリーム、ローション、ニオソーム、ファーマコソーム、軟膏、又はゲルを提供するための、少なくとも1つの適切な薬学的に許容可能な賦形剤を含む、眼製剤が記載される。
【0007】
本明細書には、ロイコトリエン合成を阻害するための有効な量におけるFLAPインヒビタ化合物、及び溶液、懸濁液、軟膏、クリーム、ローション、ニオソーム、ファーマコソーム、軟膏、又はゲルを提供するための、少なくとも1つの適切な薬学的に許容可能な賦形剤を含む眼製剤が記載される。幾つかの実施形態において、阻害されたロイコトリエン合成により、結果的に、システイニルロイコトリエンのレベルが減少する。幾つかの実施形態において、阻害されたロイコトリエン合成により、結果的にLTB4のレベルが減少する。
【0008】
本明細書には、ロイコトリエン受容体をアンタゴナイズするための有効な量におけるFLAPインヒビタ、及び溶液、懸濁液、軟膏、クリーム、ローション、ニオソーム、ファーマコソーム、軟膏又はゲルを提供するための、適切な薬学的に許容可能な賦形剤を含む眼製剤が記載される。
【0009】
本明細書には、個体の眼内でインターロイキン−4(IL−4)合成を阻害するための有効な量におけるFLAPインヒビタを含む、眼製剤が記載される。
【0010】
本明細書には、個体の眼内で粘液の合成を低減又は阻害するための有効な量におけるFLAPインヒビタを含む、眼製剤が記載される。
【0011】
幾つかの実施形態において、本明細書に記載される任意の眼製剤は、抗生物質;抗真菌剤;ステロイド抗炎症剤;非ステロイド抗炎症剤;抗ヒスタミン剤;抗ウイルス剤;アルファアゴニスト;ベータ遮断剤;炭酸脱水酵素インヒビタ;縮瞳薬;プロスタグランジン;抗血管新生薬;ロテプレドノールエタボネート、肥満細胞安定化薬、シクロスポリン、及びDP2アンタゴニストから選択された治療上有効な量の化合物を更に含む。
【0012】
幾つかの実施形態において、上述の任意の眼製剤は、治療上有効な量のDP2受容体アンタゴニスト化合物を含む。
【0013】
1つの態様において、眼の疾患、障害又は疾病は、免疫障害;増殖性障害;アレルゲン及び/又は刺激物質との接触;線維芽細胞性障害;感染病(例えば、ウイルス感染)又はそれらの組み合わせである。
【0014】
別の態様において、眼の疾患、障害又は疾病は、加齢黄斑変性、アレルギー性結膜炎、前上葉区瘢痕化、眼瞼炎、眼瞼結膜炎、水疱性障害、瘢痕性類天疱瘡、結膜黒色腫、結膜炎、コンタクトレンズに関連する巨大乳頭結膜炎、糖尿病性網膜症、眼乾燥、上強膜炎、緑内障、グリオーシス、環状肉芽腫、グレーブス眼症、眼球内黒色腫、角膜炎、角結膜炎、疼痛、瞼裂斑、術後疼痛、増殖性硝子体網膜症、翼状片、瘢痕化、強膜炎、シェーグレン症候群、ブドウ膜炎、春季角結膜炎又はそれらの組み合わせである。
【0015】
本明細書には、治療上有効な量のFLAPインヒビタ化合物を含む眼製剤を、その必要のある個体の眼に投与する工程を含む、眼の疾患、障害又は疾病を処置する方法が提供される。
【0016】
本明細書には、FLAPインヒビタ化合物を含む眼製剤を、その必要のある個体の眼に投与する工程を含む、個体の眼内のロイコトリエン合成を阻害する方法が提供される。幾つかの実施形態において、ロイコトリエン合成の阻害により、結果的にシステイニルロイコトリエンのレベルが減少する。幾つかの実施形態において、ロイコトリエン合成の阻害により、結果的にLTB4のレベルが減少する。
【0017】
本明細書には、FLAPインヒビタ化合物を含む眼製剤を、その必要のある個体の眼に投与する工程を含む、個体の眼内のロイコトリエン受容体をアンタゴナイズする方法が提供される。
【0018】
本明細書には、FLAPインヒビタ化合物を含む眼製剤を、個体の眼に投与する工程を含む、その必要のある個体の眼内のインターロイキン−4(IL−4)合成を阻害する方法が提供される。
【0019】
本明細書には、FLAPインヒビタ化合物を含む眼製剤を、個体の眼に投与する工程を含む、その必要のある個体の眼内の粘液の合成を低減又は阻害する方法が提供される。
【0020】
1つの態様において、本明細書に記載される任意の方法は、抗生物質;抗真菌剤;ステロイド抗炎症剤;非ステロイド抗炎症剤;抗ヒスタミン剤;抗ウイルス剤;アルファアゴニスト;ベータ遮断剤;炭酸脱水酵素インヒビタ;縮瞳薬;プロスタグランジン;抗血管新生薬;ロテプレドノールエタボネート、肥満細胞安定化薬、シクロスポリン、及びDP2アンタゴニスト、及びそれらの組み合わせから選択される治療上有効な量の化合物を含む眼製剤を、その必要のある個体の眼に投与する工程を更に含む。
【0021】
1つの態様において、本明細書に記載される任意の方法は、治療上有効な量のDP2受容体アンタゴニスト化合物を含む眼製剤を、その必要のある個体の眼に投与する工程を更に含む。
【0022】
1つの態様において、眼製剤は、溶液、懸濁液、軟膏、ゲル、クリーム、リポソーム、ニオソーム、ファーマコソーム、ナノ粒子、又はそれらの組み合わせの形態である。
【0023】
他の態様において、眼製剤は、移植、挿入、注入、噴霧、洗浄、又はそれらの組み合わせを介して投与される。
【0024】
幾つかの実施形態において、眼の疾患、障害又は疾病は、免疫障害;増殖性障害;アレルゲン及び/又は刺激物質との接触;線維芽細胞性障害;又はそれらの組み合わせである。
【0025】
幾つかの実施形態において、眼の疾患、障害又は疾病は、加齢黄斑変性、アレルギー性結膜炎、前上葉区瘢痕化、眼瞼炎、眼瞼結膜炎、水疱性障害、瘢痕性類天疱瘡、結膜黒色腫、結膜炎、コンタクトレンズに関連する巨大乳頭結膜炎、糖尿病性網膜症、眼乾燥、上強膜炎、緑内障、グリオーシス、環状肉芽腫、グレーブス眼症、眼球内黒色腫、角膜炎、角結膜炎、疼痛、瞼裂斑、術後疼痛、増殖性硝子体網膜症、翼状片、瘢痕化、強膜炎、シェーグレン症候群、ブドウ膜炎、春季角結膜炎又はそれらの組み合わせである。
【0026】
1つの態様において、FLAPインヒビタ化合物は眼製剤の製造に使用される。1つの態様において、FLAPインヒビタ化合物及びDP2受容体アンタゴニスト化合物の組み合わせは、眼製剤の製造に使用される。
【0027】
1つの態様において、FLAPインヒビタ化合物は眼の疾患、障害又は疾病の処置のための眼製剤の製造に使用される。1つの態様において、FLAPインヒビタ化合物及び抗生物質;抗真菌剤;ステロイド抗炎症剤;非ステロイド抗炎症剤;抗ヒスタミン剤;抗ウイルス剤;アルファアゴニスト;ベータ遮断剤;炭酸脱水酵素インヒビタ;縮瞳薬;プロスタグランジン;抗血管新生薬;ロテプレドノールエタボネート、肥満細胞安定化薬、シクロスポリン、及びDP2アンタゴニスト;から選択される化合物の組み合わせは、眼の障害の処置のための眼製剤の製造に使用される。
【図面の簡単な説明】
【0028】
【図1】図1は、本明細書に記載されるFLAPインヒビタ化合物の用例を示す。
【図2】図2は、FLAPインヒビタ化合物CのRSVの眼病理への影響を示す。
【図3】図3は、化合物Cでの局所療法の、RSVに感染したマウスの眼内でのCysLTのレベルへの影響を示す。
【図4】図4は、化合物Cでの局所療法の、RSVに感染したマウスの眼内でのIL−4のレベルへの影響を示す。
【図5】図5は、眼内及び肺内でのRSVのプラーク形成単位(pfu)を示す。
【図6】図6は、FLAP阻害及びDP2受容体アンタゴニズムの、気管支肺胞洗浄液(BALF)における、細胞、好中球及びリンパ球の総数への影響を示す。
【図7】図7は、FLAPインヒビタ及びDP2受容体アンタゴニストの組み合わせの、BALFにおけるムチンの存在への影響を示す。
【発明を実施するための形態】
【0029】
ロイコトリエンは、多くの生物学的過程において重要な役割を果たすことを示されてきたアラキドン酸に由来する、炎症促進性の脂質メディエーターの種類に属する。アラキドン酸は、酵素5−リポキシゲナーゼ(5-LO)によって媒介された二段階過程において、ロイコトリエンA4(LTA4)に変換される。LTA4は、LTA4ヒドロラーゼを介してLTB4に変換されるか、LTC4シンターゼによって媒介されたグルタチオンとの接合を通してLTC4に変換されるかのいずれかである。アミド結合切断は、LTC4をLTD4に変換し、その後、続いてLTE4に変換する。最初の酸化段階とは、5−LO及び膜結合型の5−リポキシゲナーゼ−活性化タンパク質(FLAP)両方の本質的な介入を必要とする過程である。FLAPの阻害により、結果的にすべてのロイコトリエン生成が阻害される。LTB4は、Gタンパク質共役型受容体(GPCR)のBLT1及びBLT2のためのリガンドであり、両方の受容体は、炎症反応における走化性及び細胞刺激に関係する。
【0030】
ロイコトリエンは、眼の疾患、障害又は疾病の病因に関係する、炎症の脂質メディエーターである。ロイコトリエンは、アレルギー又は炎症性刺激に反応して、主に肥満細胞、好酸球、単球/大食細胞、及び好中球によって産生される。1つの態様において、眼の疾患、障害又は疾病によって影響される部分の生物学的組織は、高レベルのロイコトリエンを有する。5−リポキシゲナーゼに呼応するFLAPが、ロイコトリエン合成経路において第一段階を実行するために、ロイコトリエン合成経路におけるFLAPの役割は重要である。FLAPの阻害は、例として、加齢黄斑変性、アレルギー性結膜炎、前上葉区瘢痕化、眼瞼炎、眼瞼結膜炎、水疱性障害、瘢痕性類天疱瘡、結膜黒色腫、結膜炎、コンタクトレンズに関連する巨大乳頭結膜炎、糖尿病性網膜症、眼乾燥、上強膜炎、緑内障、グリオーシス、環状肉芽腫、グレーブス眼症、 眼球内黒色腫、角膜炎、角結膜炎、疼痛、瞼裂斑、術後疼痛、増殖性硝子体網膜症、翼状片、瘢痕化、強膜炎、シェーグレン症候群、ブドウ膜炎、春季角結膜炎又はそれらの組み合わせを含む、ロイコトリエン依存又はロイコトリエン媒介の眼の疾患、障害又は疾病の処置のための標的を与える。
【0031】
1つの態様において、ロイコトリエンは、眼の疾患、障害又は疾病の病因に関係する。眼の疾患、障害又は疾病は、FLAPインヒビタ化合物を含む医薬組成物の点眼投与によって処置又は予防される。
【0032】
本明細書には、ロイコトリエン依存又はロイコトリエン媒介の眼の疾患、障害又は疾病の処置又は予防のための、哺乳動物の眼内への局所投与に適している薬物の製造における、FLAPインヒビタの使用が開示される。
【0033】
本明細書には、FLAPインヒビタを使用する、眼への局所投与に適している医薬製剤、処置方法、眼への投与のための局所製剤を製剤する方法、産生する方法、製造する方法、治療法が記載される。
【0034】
本明細書には、特定の実施形態において、FLAPインヒビタ化合物を含む眼への投与のための局所製剤が記載され、製剤は眼の疾患、障害又は疾病を処置するために投与される。1つの態様において、哺乳動物の眼へのFLAPインヒビタ化合物の局所投与により、FLAPインヒビタ化合物の体内吸収が最小限になる。1つの態様において、眼へのFLAPインヒビタ化合物の局所投与により、眼の疾患、障害又は疾病の局所療法が提供される。1つの態様において、FLAPインヒビタ化合物での眼の疾患、障害又は疾病の局所療法により、FLAPインヒビタ化合物の全身投与に関連する、起こり得る副作用が低減する。
【0035】
幾つかの実施形態において、本明細書に記載される局所製剤は、眼の疾患、障害又は疾病を処置又は予防するために、抗生物質;抗真菌剤;ステロイド抗炎症剤;非ステロイド抗炎症剤;抗ヒスタミン剤;抗ウイルス剤;アルファアゴニスト;ベータ遮断剤;炭酸脱水酵素インヒビタ;縮瞳薬;プロスタグランジン;抗血管新生薬;ロテプレドノールエタボネート、肥満細胞安定化薬、シクロスポリン、及び/又はDP2アンタゴニストと組み合わせたFLAPインヒビタ化合物を含む。
【0036】
1つの態様において、眼の疾患、障害又は疾病は、ロイコトリエン及び/又はサイトカインの過剰産生の結果である。1つの態様において、眼の疾患、障害又は疾病は、限定されないが、眼の免疫障害、眼の増殖性障害、アレルゲン及び/又は刺激物質との接触から結果として生じる眼の障害、眼の線維芽細胞性障害、感染病又はそれらの組み合わせを含む。
【0037】
眼の免疫障害は、限定されないが、加齢黄斑変性、アレルギー性結膜炎、前上葉区瘢痕化、眼瞼炎、眼瞼結膜炎、水疱性障害、瘢痕性類天疱瘡、結膜黒色腫、結膜炎、コンタクトレンズに関連する巨大乳頭結膜炎、糖尿病性網膜症、眼乾燥、上強膜炎、緑内障、グリオーシス、環状肉芽腫、グレーブス眼症、眼球内黒色腫、角膜炎、角結膜炎、疼痛、瞼裂斑、術後疼痛、増殖性硝子体網膜症、翼状片、瘢痕化、強膜炎、シェーグレン症候群、ブドウ膜炎、春季角結膜炎又はそれらの組み合わせを含む。
【0038】
眼の増殖性障害は、限定されないが、眼球内黒色腫及び結膜黒色腫を含む。眼の感染病は、バクテリア(例えば、黄色ブドウ球菌)、ウイルス(例えば、呼吸器合胞体ウイルス(RSV)、クラミジア)などによって引き起こされた感染病を含む。
【0039】
本明細書には、特定の実施形態において、FLAPインヒビタ化合物を含む眼への投与のための局所製剤が記載され、製剤は眼の疾患、障害又は疾病を処置するために投与される。幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、治療上有効な量のFLAPインヒビタを含む。幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、アレルゲン及び/又は刺激物質との接触の前又は後に投与される。幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、身体外傷(例えば、手術)の前又は後に投与される。1つの態様において、FLAPインヒビタ化合物を含む本明細書に開示される眼への投与のための局所製剤は、手術後の瘢痕形成を処置又は予防するために眼及び/又はそれに関連する組織に投与される。本明細書に開示される眼への投与のための局所製剤は損傷部位に適用されることを理解されたい。幾つかの実施形態において、本明細書に記載される局所製剤は、追加の治療薬(例えばエヌセイド、DP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物を含み、手術後の瘢痕形成を処置及び予防するために、眼及び/又はそれに関連する組織に投与される。
【0040】
特定の例において、ロイコトリエンは、瘢痕化及び/又は線維芽細胞の移動に関係する。1つの態様において、FLAPの活性を阻害することは、線維芽細胞の活性及び/又は移動を阻害することであり、且つ/又は瘢痕化を処置することである。幾つかの実施形態において、本明細書に記載される局所製剤は、眼及び/又は関連する組織に投与されるFLAPインヒビタ化合物を含み、線維芽細胞の活性及び/又は移動を阻害し、且つ/又は瘢痕化を処置する。幾つかの実施形態において、本明細書に記載される局所製剤は、追加の治療薬(例えばDP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物を含み、眼及び/又は関連する組織に投与され、線維芽細胞の活性及び/又は移動を阻害し、且つ/又は瘢痕化を処置する。
【0041】
1つの態様において、ロイコトリエンは、本明細書に記載される眼の疾患、障害又は疾病の病因に関係する。FLAPの阻害により、結果的にロイコトリエンの産生が減少する。ロイコトリエンの量の減少により、結果的に眼の疾患、障害又は疾病などに関連する症状が減少する。1つの態様において、低減された量のロイコトリエンは、低減された量のシステイニルロイコトリエンである。1つの態様において、低減された量のロイコトリエンは、低減された量のLTB4である。幾つかの実施形態において、本明細書に記載される局所製剤は、追加の治療薬(例えばDP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物を含み、眼及び/又は関連する組織に投与され、ロイコトリエンの産生を阻害する。幾つかの実施形態において、本明細書に記載される局所製剤は、眼及び/又は関連する組織に投与されるFLAPインヒビタ化合物を含み、ロイコトリエンの産生を阻害する。
【0042】
1つの態様において、サイトカインは、本明細書に記載される眼の疾患、障害又は疾病の病因に関係する。幾つかの例において、FLAPの阻害により、結果的に少なくとも1つのサイトカインの産生が減少する。1つの態様において、サイトカインはインターロイキン4(IL-4)である。IL-4の減少により、結果的に眼の障害などに関連する症状が減少する。幾つかの実施形態において、本明細書に記載される局所製剤は、眼及び/又は関連する組織に投与されるFLAPインヒビタ化合物を含み、サイトカインの産生を阻害する。幾つかの実施形態において、本明細書に記載される局所製剤は、追加の治療薬(例えばDP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物を含み、眼及び/又は関連する組織に投与され、サイトカインの産生を阻害する。
【0043】
1つの態様において、涙液分泌(例えば、粘液、ムチン、膿など)の産生は、本明細書に記載される眼の疾患、障害又は疾病の病因に関係する。FLAPの阻害により、結果的に涙液分泌の産生が減少する。涙液分泌(例えば粘液産生)の減少により、結果的に眼の疾患、障害又は疾病などに関連する症状が減少する。幾つかの実施形態において、本明細書に記載される局所製剤は、眼及び/又は関連する組織に投与されるFLAPインヒビタ化合物を含み、哺乳動物の眼内で粘液及び/又はムチンの産生を阻害する。幾つかの実施形態において、本明細書に記載される局所製剤は、追加の治療薬(例えばDP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物を含み、眼及び/又は関連する組織に投与され、哺乳動物の眼内で粘液及び/又はムチンの産生を阻害する。
【0044】
1つの態様において、ムチンとして知られる特定のグリコシル化されたタンパク質の産生は、本明細書に記載される眼の疾患、障害又は疾病の病因に関係する。FLAPの阻害により、結果的にムチンの産生が減少する。ムチン産生の減少により、結果的に眼の疾患、障害又は疾病などに関連する症状が減少する。1つの態様において、低減された量のムチンは、低減された量の分泌型ムチンである。1つの態様において、分泌型ムチンはMUC4及びMUC7のタンパク質を含む。別の態様において、低減された量のムチンは、低減された量のゲル形成ムチンである。1つの態様において、ゲル形成ムチンはMUC5-ACタンパク質を含む。更に別の態様において、低減された量のムチンは、低減された量の膜結合性ムチンである。1つの態様において、膜結合性ムチンはMUC1とMUC16のタンパク質を含む。幾つかの実施形態において、本明細書に記載される局所製剤は、眼及び/又は関連する組織に投与されるFLAPインヒビタ化合物を含み、哺乳動物の眼内でムチンのタンパク質合成を阻害する。他の実施形態において、本明細書に記載される局所製剤は、眼及び/又は関係する組織に投与されるFLAPインヒビタ化合物を含み、哺乳動物の眼内で、ムチンの翻訳後修飾、例えばグリコシル化を阻害する。幾つかの実施形態において、本明細書に記載される局所製剤は、眼及び/又は関連する組織に投与されるFLAPインヒビタ化合物を含み、哺乳動物の眼内で、ムチンのタンパク質分解を増加させる。
【0045】
FLAPインヒビタ
1つの態様において、FLAPインヒビタ化合物は、本明細書又は当該技術分野に開示されるFLAPインヒビタ化合物から選択される。
【0046】
1つの態様において、FLAPインヒビタ化合物は、式(I)の化合物、その薬学的に許容可能な塩、薬学的に許容可能な溶媒和物、又はN-オキシドである:
【0047】
【化1】

【0048】
式中、
Aは、CH又はNであり;
R1は、−F、−Cl、−Br、−CN、C1−C4アルキル、C1−C4フルオロアルキル、−O−C1−C4アルキル、又は−O−C1−C4フルオロアルキルであり;
R2は、C1−C4アルキル又はC1−C4フルオロアルキルである。
【0049】
1つの態様において、Aは、CHである。別の態様において、Aは、Nである。1つの態様において、R1は、−F、−Cl、−Br、−CN、C1−C4アルキル、C1−C4フルオロアルキル、−O−C1−C4アルキル、又は−O−C1−C4フルオロアルキルである。1つの態様において、R1は、−F、−Cl、−Br、−CN、−CH3、−CH2CH3、シクロプロピル、−CF3、−OCH3、−OCH2CH3、又は−OCF3である。
【0050】
1つの態様において、R1は、H、−F、−Cl、−Br、−CN、−CH3、−CH2CH3、シクロプロピル、−CF3、−OCH3、−OCH2CH3、又は−OCF3である。別の態様において、R1は、−F、−Cl、−Br、−CN、−CH3、−CF3、−OCH3、又は−OCF3である。別の態様において、R1は、−CH3である。
【0051】
1つの態様において、R2は、C1−C4アルキルである。別の態様において、R2は、−CH3、又は−CH2CH3である。別の態様において、R2は、−CH3である。
【0052】
1つの態様において、R1は、−CH3であり、R2は−CH3である。1つの態様において、Aは、CHであり、R1は−CH3であり、R2は−CH3である。
【0053】
1つの態様において、FLAPインヒビタ化合物は、3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物A);又は3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピラジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物B);それらの薬学的に許容可能な塩、薬学的に許容可能な溶媒和物、又はN−オキシドである。1つの態様において、FLAPインヒビタ化合物は、化合物A;その薬学的に許容可能な塩、薬学的に許容可能な溶媒和物、又はN−オキシドである。
【0054】
別の態様において、FLAPインヒビタ化合物は、式(II)の化合物、その薬学的に許容可能な塩、薬学的に許容可能な溶媒和物、又はN−オキシドである:
【0055】
【化2】

【0056】
式中、
R2は、C1−C4アルキル又はC1−C4フルオロアルキルであり;
R3は、置換又は非置換の単環式又は二環式のへテロシクロアルキルである。
【0057】
1つの態様において、R2は、C1−C4アルキルである。別の態様において、R2は、−CH3、又は−CH2CH3である。別の態様において、R2は、−CH3である。別の態様において、R2は、−CH2CH3である。
【0058】
1つの態様において、R3は、環に少なくとも1つのN原子を含む、置換又は非置換の単環式又は二環式のへテロシクロアルキルである。1つの態様において、R3は、環に少なくとも1つのN原子を含む、置換又は非置換の単環式又は二環式のC3−C10ヘテロシクロアルキルである。
【0059】
1つの態様において、R3は、キノリジニル、ジオキシニル、ピペリジニル、モルフォリニル、チアジニル、テトラヒドロピリジニル、ピペラジニル、オキサジナノニル、ジヒドロピロリル、ジヒドロイミダゾリル、テトラヒドロフラニル、ジヒドロオキサゾリル、オキシラニル、ピロリジニル、ピラゾリジニル、イミダゾリジノニル、ピロリジノニル、ジヒドロフラノニル、ジオキソラノニル、チアゾリジニル、ピペリジノニル、テトラヒドロナフィリジニル、テトラヒドロキノリニル、テトラヒドロチエニル、インドリニル、及びチアゼパニルから選択される、置換又は非置換の単環式又は二環式のヘテロシクロアルキルである。
【0060】
1つの態様において、R3は、ピペリジニル、モルフォリニル、チアジニル、テトラヒドロピリジニル、ピペラジニル、ジヒドロピロリル、ジヒドロイミダゾリル、ピロリジニル、ピラゾリジニル、イミダゾリジノニル、ピロリジノニル、チアゾリジニル、ピペリジノニル、テトラヒドロナフィリジニル、テトラヒドロキノリニル、及びインドリニルから選択される、置換又は非置換の単環式又は二環式のヘテロシクロアルキルである。
【0061】
1つの態様において、R3は、ピペリジニル、モルフォリニル、ピペラジニル、ピロリジニル、ピロリジノニル、ピペリジノニル、テトラヒドロキノリニル、及びインドリニルから選択される、置換又は非置換の単環式又は二環式のヘテロシクロアルキルである。
【0062】
1つの態様において、R3は、ピペリジニル、モルフォリニル、ピペラジニル、ピロリジニル、テトラヒドロキノリニル、及びインドリニルから選択される、置換又は非置換の単環式又は二環式のヘテロシクロアルキルである。1つの態様において、R3は、置換又は非置換のピロリジニル、及びインドリニルである。1つの態様において、R3は、置換又は非置換のインドリニルである。
【0063】
更なる又は代替の実施形態において、R3は、以下から成る群から選択され:
【0064】
【化3】

【0065】
R4は、H、−C(=O)R5又は−SO2−C1−C4アルキルであり;R5はC1−C4アルキル、C1−C4フルオロアルキル、置換又は非置換のフェニル、置換又は非置換のヘテロアリール、又は−O−C1−C4アルキルである。
【0066】
更なる又は代替の実施形態において、R3は、以下から成る群から選択される:
【0067】
【化4】

【0068】
1つの態様において、R3は以下の通りである:
【0069】
【化5】

【0070】
1つの態様において、R4は、−C(=O)R5である。
【0071】
更なる又は代替の実施形態において、R3は、以下から成る群から選択される:
【0072】
【化6】

【0073】
更なる又は代替の実施形態において、R3は、以下から成る群から選択される:
【0074】
【化7】

【0075】
1つの態様において、R3は以下の通りである:
【0076】
【化8】

【0077】
1つの態様において、R5は、C1−C4アルキル、C1−C4フルオロアルキル、置換又は非置換のフェニル、又は−O−C1−C4アルキルである。別の態様において、R5は、−CH3、CH2CH3、−CH2CH2CH3、−CH2CH2CH2CH3、−CH(CH3)2、−C(CH3)3、−CF3、−OCH3、−OCH2CH3、又は−OC(CH3)3である。別の態様において、R5は、−CH3、−CH2CH3、−CH2CH2CH3、−CF3、−OCH3、−OCH2CH3、又は−OC(CH3)3である。更に別の態様において、R5は、−CH3である。
【0078】
1つの態様において、式(II)の化合物は以下の構造を有する:
【0079】
【化9】

【0080】
1つの態様において、FLAPインヒビタ化合物は、3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物C)又は3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−エトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物K);それらの薬学的に許容可能な塩、薬学的に許容可能な溶媒和物、又はN-オキシドである。1つの態様において、FLAPインヒビタ化合物は、化合物C;その薬学的に許容可能な塩、薬学的に許容可能な溶媒和物、又はN-オキシドである。1つの態様において、FLAPインヒビタ化合物は、化合物K;その薬学的に許容可能な塩、薬学的に許容可能な溶媒和物、又はN-オキシドである。
【0081】
1つの態様において、FLAPインヒビタは、(US 7,405,302として発行された)米国特許出願第11/538,762号;米国特許出願第12/131,828号;(2007/0105866として公開された)米国特許出願第11/553,946号;米国特許出願第11/925,841号;米国特許出願第12/089,706号;米国特許出願第12/089,707号;米国特許出願第12/092,570号;(2007/0219206として公開された)米国特許出願第11/744,555号;(2007/0225285として公開された)米国特許出願第11/746,010号;(2007/0244128として公開された)米国特許出願第11/745,387号;米国特許出願第12/257,876号;米国特許出願第61/055,887号;米国特許出願第61/055,899号;国際特許出願番号PCT/US07/86188;WO07/047207;WO07/056021;WO07/056220;WO07/056228;国際特許出願番号PCT/US08/62310;国際特許出願番号PCT/US08/062793;国際特許出願番号PCT/US08/62580;国際特許出願番号PCT/US2008/052960;国際特許出願番号PCT/US08/81190;国際特許出願番号PCT/US08/76225に記載される化合物から選択され;それぞれ、全体の引用により、本明細書に組み込まれる。
【0082】
1つの態様において、FLAPインヒビタは以下から選択される:(3−[3−tert−ブチルスルファニル−1−(4−クロロ−ベンジル)−5−イソプロピル−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸としても知られる)MK886;(3−[3−tert−ブチルスルファニル−1−(4−クロロ−ベンジル)−5−(キノリン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸としても知られる)MK591;(BAYX1005;シクロペンチル−[4−(キノリン−2−イルメトキシ)−フェニル]−酢酸としても知られる)DG031;化合物A(米国特許出願第11/553,946号に概説されるように調製される;3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸);化合物B(米国特許出願第11/553,946号に概説されるように調製される;3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピラジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸);化合物C(WO07/056220に概説されるように調製される;3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸);化合物D(3−[3−tert−ブチルスルファニル−1−[4−(6−メトキシ−ピリジン−3−イル)−ベンジル]−5−(ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸;米国特許出願第11/553,946号の化合物2乃至19を参照);化合物E(3−[3−tert−ブチルスルファニル−1−[4−(6−エトキシ−ピリジン−3−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸;米国特許出願第11/553,946号の化合物2乃至107を参照);化合物F(3−[3−tert−ブチルスルファニル−1−[4−(5−フルオロ−ピリジン−2−イル)−ベンジル]−5−(キノリン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸;米国特許出願第11/553,946号の化合物2乃至197を参照);化合物G(2−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イルメチル]−2−エチル−酪酸;米国特許出願第11/744,555号の化合物4乃至38を参照);化合物H(3−[3−tert−ブチルスルファニル−1−[4−(6−メトキシ−ピリジン−3−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸;米国特許出願第11/553,946号の化合物2乃至73を参照);化合物I(3−[5−((S)−1−アセチル−ピロリジン−2−イルメトキシ)−3−tert−ブチルスルファニル−1−(4−クロロ−ベンジル)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸;WO07/056220の化合物1乃至2を参照);化合物J(3−[3−tert−ブチルスルファニル−1−[4−(5−フルオロ−ピリジン−2−イル)−ベンジル]−5−(ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸;米国特許出願第11/553,946号の化合物2乃至201を参照);3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−エトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物K);それらの薬学的に許容可能な塩、薬学的に許容可能な溶媒和物、又はN-オキシド。
【0083】
別の態様において、FLAPインヒビタは、米国特許番号4,929,626;4970215;5,081,138;5,095,031;5,204,344;5,126,354;5,221,678;5,229,516;5,272,145;5,283,252;5,288,743;5,292,769;5,304,563;5,399,699;5,459,150;5,512,581;5,597,833;5,668,146;5,668,150;5,691,351;5,714,488;5,783,586;5,795,900;及び5,843,968に記載される化合物から選択され;それぞれ、FLAPインヒビタ化合物などの開示のための引用により、本明細書に組み込まれる。
【0084】
FLAPインヒビタ化合物のさらなる形態
幾つかの実施形態において、治療薬(例えばFLAPインヒビタ化合物及び/又は第2の治療薬)は、薬学的に許容可能な塩として、医薬組成物中に存在する。幾つかの実施形態において、薬学的に許容可能な塩は、FLAPインヒビタ化合物を酸と反応させることにより得られる。幾つかの他の実施形態において、薬学的に許容可能な塩は、FLAPインヒビタ化合物を塩基と反応させることにより得られる。他の実施形態において、治療薬は、本明細書に記載される医薬組成物の製造において、遊離酸又は遊離塩基として使用される。薬学的に許容可能な塩のタイプは、限定されないが、以下のものを含む:(1)化合物の遊離塩基の形態を、薬学的に許容可能な:例えば、塩酸、臭化水素酸、硫酸、リン酸、メタリン酸などのような無機酸と;又は、例えば、酢酸、プロピオン酸、ヘキサン酸、シクロペンチルプロピオン酸、グリコール酸、ピルビン酸、乳酸、マロン酸、コハク酸、リンゴ酸、マレイン酸、フマル酸、トリフルオロ酢酸、酒石酸、クエン酸、安息香酸、3−(4−ヒドロキシベンゾイル)安息香酸、桂皮酸、マンデル酸、メタンスルホン酸、エタンスルホン酸、1,2−エタンジスルホン酸、2−ヒドロキシエタンスルホン酸、ベンゼンスルホン酸、トルエンスルホン酸、2−ナフタリンスルホン酸、4−メチルビシクロ−[2.2.2.]oct−2−エン−1−カルボン酸、グルコペプトン酸、4,4’−メチレンビス−(3−ヒドロキシ−2−エン−1−カルボン酸)、3−フェニルプルピオン酸、トリメチル酢酸、第三ブチル酢酸、ラウリル硫酸、グルコン酸、グルタミン酸、ヒドロキシナフトエ酸、サリチル酸、ステアリン酸、ムコン酸、酪酸、フェニル酢酸、フェニル酪酸、バルプロ酸などのような有機酸と反応させることにより形成される酸付加塩;(2)親化合物中に存在する酸性プロトンが、金属イオン、例えば、アルカリ金属イオン(例えばリチウム、ナトリウム、カリウム)、アルカリ土類イオン(例えばマグネシウム、又はカルシウム)、又はアルミニウムイオンにより置換される時に形成される塩。幾つかの場合において、本明細書に記載されるFLAPインヒビタ化合物は、限定されないが、エタノールアミン、ジエタノールアミン、トリエタノールアミン、トロメタミン、N−メチルグルカミン、ジシクロヘキシルアミン、トリス(ヒドロキシメチル)メチルアミンなどの有機塩基と反応する。他の場合において、本明細書に記載されるFLAPインヒビタ化合物は、限定されないが、アルギニン、リジンなどのアミノ酸で塩を形成する。酸性プロトンを含む化合物で塩を形成するために使用される、許容可能な無機塩基は、限定されないが、水酸化アルミニウム、水酸化カルシウム、水酸化カリウム、炭酸ナトリウム、水酸化ナトリウムなどを含む。他の場合において、本明細書に記載されるFLAPインヒビタ化合物は、ナトリウム塩を形成し、ナトリウム塩として使用される。
【0085】
幾つかの実施形態において、本明細書に記載されるFLAPインヒビタ化合物は、溶媒付加の形態又はその結晶形、特に溶媒和物又は多形体を含む。溶媒和物は、定比又は不定比量いずれかの溶媒を含み、結晶化の過程において、水、エタノールなどの薬学的に許容可能な溶媒で形成され得る。水和物は、溶媒が水である時に形成され、アルコラートは、溶媒がアルコールである時に形成される。
【0086】
幾つかの実施形態において、本明細書に記載されるFLAPインヒビタ化合物は、1以上の立体中心を有し、各々の中心は、R又はSのいずれかの配置に独立して存在する。本明細書に示される化合物は、全てのジアステレオマー、エナンチオマー、及びエピマーの形態を、それらの適切な混合物と同様に含む。
【0087】
幾つかの実施形態において、本明細書に開示されるFLAPインヒビタ化合物上の部位は、様々な代謝反応に弱いため、代謝反応の場所への適切な置換基の取り込みは、代謝経路を低減するか、最小限にするか、除去する。具体的な実施形態において、代謝反応に対する芳香環の感受性を低減又は除去するための適切な置換基は、ほんの一例ではあるが、ハロゲン、重水素又はアルキル基である。
【0088】
幾つかの実施形態において、本明細書に記載されるFLAPインヒビタ化合物は、同位体的に(例えば放射性同位体を用いて)又は、限定されないが、発色団又は蛍光部分、生物発光ラベル、又は化学発光ラベルの使用を含む、別の他の手段により標識化される。幾つかの実施形態において、本明細書に記載されるFLAPインヒビタ化合物は、同位体的に標識化され、1以上の原子が、大抵は自然に見出される原子質量又は質量数とは異なる原子質量又は質量数を有する原子により置換されるという事実にも関わらず、本明細書に示される様々な式及び構造において列挙されるものと同一である。幾つかの実施形態において、1以上の水素原子は、重水素で置換される。幾つかの実施形態において、本明細書に記載される化合物上の代謝部位は、重水素化される。幾つかの実施形態において、重水素での置換は、例えば、インビボでの半減期の増加又は必要用量の減少などの、より大きな代謝安定性から生じる治療上の利点を与える。
【0089】
本明細書を通じて、群及びそれらの置換基は、安定した部分及び化合物を提供するために、当業者により選択される。
【0090】
眼の疾患、障害又は疾病
本明細書には、特定の実施形態において、眼への投与のための局所製剤が記載され、製剤は、眼の疾患、障害又は疾病を処置するために投与される。本明細書で使用されるように、眼の疾患、障害又は疾病は、眼又はそれに関連する組織の任意の異常な状態を含む。特定の例において、眼の疾患、障害又は疾病は、免疫不全(例えば自己免疫障害);、増殖性障害;アレルゲン、及び/又は刺激物質との接触;線維芽細胞性障害(例えば、外傷(例えば、手術)の後の瘢痕化);又はそれらの組み合わせによって引き起こされる。眼の疾患、障害又は疾病は、限定されないが、加齢性黄斑変性、アレルギー性結膜炎、前上葉区瘢痕化、眼瞼炎、眼瞼結膜炎、水疱性障害、瘢痕性類天疱瘡、結膜黒色腫、結膜炎、コンタクトレンズに関連する巨大乳頭結膜炎、糖尿病性網膜症、眼乾燥、上強膜炎、緑内障、グリオーシス、環状肉芽腫、グレーブス眼症、眼球内黒色腫、角膜炎、角結膜炎、疼痛、結膜脂肪斑、術後疼痛、増殖性硝子体網膜症、翼状片、瘢痕化、強膜炎、シェーグレン症候群、ブドウ膜炎、春季角結膜炎又はそれらの組み合わせを含む。
【0091】
幾つかの実施形態において、本明細書に開示される、眼への投与のための局所製剤は、アレルゲン及び/又は刺激物質及び/又は感染因子との接触の前又は後に投与される。幾つかの実施形態において、本明細書に開示される眼への投与のためのFLAPインヒビタの局所製剤は、アレルゲン及び/又は刺激物質及び/又は感染因子との接触の前又は後に、抗ヒスタミン剤及び/又は肥満細胞安定化薬と組み合わせて投与される。幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、身体的な外傷(例えば、手術)の前又は後に投与される。
【0092】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、結膜炎である。特定の例において、結膜炎はアレルゲンへの曝露から生じる。特定の例において、結膜炎は細菌、ウイルス又はクラミジア感染から生じる。特定の例において、ロイコトリエン及び/又はサイトカインは、結膜炎に関連する症状の幾つか又は全てを媒介する。1つの態様において、サイトカインはIL−4である。1つの態様において、結膜炎に関連する症状は,限定されないが、血管拡張、浮腫、充血を含む。特定の例において、FLAP活性を阻害することにより、ロイコトリエン及び/又は結膜炎に関連するIL−4の濃度が減少し、更に、結膜炎が処置される。幾つかの実施形態において、追加の治療薬(例えば、抗ヒスタミン剤、肥満細胞安定化薬、DP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、結膜炎が処置される。
【0093】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、角膜炎である。本明細書で使用されるように、角膜炎は、角膜の炎症により特徴付けられる障害である。特定の例において、ロイコトリエン及び/又はサイトカインは、角膜炎(例えば、血管拡張、浮腫、充血)に関連する症状の幾つか又は全てを媒介する。特定の例において、FLAP活性を阻害することにより、角膜炎に関連するロイコトリエン及び/又はサイトカインの濃度が減少する。幾つかの実施形態において、FLAP活性を阻害することにより、角膜炎が処置される。幾つかの実施形態において、FLAP活性を阻害することにより、血管拡張、浮腫、充血、又はそれらの組み合わせが処置される。幾つかの実施形態において、追加の治療薬(例えば、DP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、角膜炎が処置される。
【0094】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、角結膜炎(即ち、結膜炎および角膜炎(即ち、角膜の炎症)の組み合わせ)である。特定の例において、ロイコトリエン及び/又はサイトカインは、角膜炎および結膜炎(例えば、血管拡張、浮腫、充血)に関連する症状の幾つか又は全てを媒介する。特定の例において、FLAP活性を阻害することにより、角膜炎及び結膜炎に関連するロイコトリエンの濃度が減少する。幾つかの実施形態において、FLAP活性を阻害することにより、角結膜炎が処置される。幾つかの実施形態において、FLAP活性を阻害することにより、血管拡張、浮腫、充血、又はそれらの組み合わせが処置される。幾つかの実施形態において、追加の治療薬(例えばDP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、角膜炎及び結膜炎が処置される。
【0095】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、眼瞼炎である。本明細書で使用されるように、眼瞼炎は、眼瞼縁の炎症により特徴付けられる、眼の疾患、障害又は疾病である。特定の例において、ロイコトリエン及び/又はサイトカインは、眼瞼炎(例えば、血管拡張、浮腫、充血)に関連する症状の幾つか又は全てを媒介する。特定の例において、FLAP活性を阻害することにより、眼瞼炎に関連するロイコトリエンの濃度が減少する。幾つかの実施形態において、FLAP活性を阻害することにより、眼瞼炎が処置される。幾つかの実施形態において、FLAP活性を阻害することにより、血管拡張、浮腫、充血、又はそれらの組み合わせが処置される。幾つかの実施形態において、追加の治療薬(例えばDP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、眼瞼炎が処置される。
【0096】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの疾患、障害又は疾病とは、眼瞼結膜炎(即ち、結膜炎及び眼瞼炎(即ち、眼瞼の炎症)の組み合わせ)である。特定の例において、ロイコトリエンは、眼瞼炎及び結膜炎(例えば、血管拡張、浮腫、充血)に関連する症状の幾つか又は全てを媒介する。特定の例において、FLAP活性を阻害することにより、眼瞼炎及び結膜炎に関連するロイコトリエン及び/又はサイトカインの濃度が減少する。幾つかの実施形態において、FLAP活性を阻害することにより、眼瞼結膜炎が処置される。幾つかの実施形態において、FLAP活性を阻害することにより、血管拡張、浮腫、充血、又はそれらの組み合わせが処置される。幾つかの実施形態において、追加の治療薬(例えばDP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、眼瞼結膜炎が処置される。
【0097】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、強膜炎である。本明細書で使用されるように、強膜炎は、強膜の炎症により特徴付けられる障害である。特定の例において、ロイコトリエンは、強膜炎(例えば、血管拡張、浮腫、充血)に関連する症状の幾つか又は全てを媒介する。特定の例において、FLAP活性を阻害することにより、強膜炎に関連するロイコトリエン及び/又はサイトカインの濃度が減少する。幾つかの実施形態において、FLAP活性を阻害することにより、強膜炎が処置される。幾つかの実施形態において、FLAP活性を阻害することにより、血管拡張、浮腫、充血、又はそれらの組み合わせが処置される。幾つかの実施形態において、追加の治療薬(例えばDP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、強膜炎が処置される。
【0098】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、上強膜炎である。本明細書で使用されるように、上強膜炎は、充血、及び結膜浮腫の炎症により特徴付けられる上強膜の炎症性障害である。特定の例において、ロイコトリエンは、上強膜炎(例えば、血管拡張、浮腫、充血)に関連する症状の幾つか又は全てを媒介する。特定の例において、FLAP活性を阻害することにより、上強膜炎に関連するロイコトリエン及び/又はサイトカインの濃度が減少する。幾つかの実施形態において、FLAP活性を阻害することにより、上強膜炎が処置される。幾つかの実施形態において、FLAP活性を阻害することにより、血管拡張、浮腫、充血、又はそれらの組み合わせが処置される。幾つかの実施形態において、追加の治療薬(例えばDP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、上強膜炎が処置される。
【0099】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、ブドウ膜炎である。本明細書で使用されるように、ブドウ膜炎は、ブドウ膜の炎症性障害である。特定の例において、ロイコトリエンは、ブドウ膜炎(例えば、血管拡張、浮腫、充血)に関連する症状の幾つか又は全てを媒介する。特定の例において、FLAP活性を阻害することにより、ブドウ膜炎に関連するロイコトリエン及び/又はサイトカインの濃度が減少する。幾つかの実施形態において、FLAP活性を阻害することにより、ブドウ膜炎が処置される。幾つかの実施形態において、FLAP活性を阻害することにより、血管拡張、浮腫、充血、又はそれらの組み合わせが処置される。幾つかの実施形態において、追加の治療薬(例えばステロイド抗炎症剤;非ステロイド抗炎症剤、DP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、ブドウ膜炎が処置される。
【0100】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、シェーグレン症候群である。特定の例において、シェーグレン症候群は自己免疫障害であり、その中で、免疫細胞は涙を分泌する外分泌腺を攻撃及び破壊する。特定の例において、ロイコトリエンは、シェーグレン症候群(例えば、涙管への白血球の走化性)の進行に起因する因子の幾つか又は全てを媒介する。特定の例において、ロイコトリエンは、グレーブス眼症(例えば、血管拡張、浮腫、充血)に関連する症状の幾つか又は全てを媒介する。特定の例において、FLAP活性を阻害することにより、シェーグレン症候群に関連するロイコトリエン及び/又はサイトカインの濃度が減少する。幾つかの実施形態において、FLAP活性を阻害することにより、シェーグレン症候群が処置される。幾つかの実施形態において、FLAP活性を阻害することにより、涙管への白血球の走化性が阻害される。幾つかの実施形態において、FLAP活性を阻害することにより、血管拡張、浮腫、充血、又はそれらの組み合わせが処置される。幾つかの実施形態において、追加の治療薬(例えば、DP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、シェーグレン症候群が処置される。
【0101】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、(グレーブスの甲状腺関連又は甲状腺異常の眼窩疾患又は眼球突出としても知られる)グレーブス眼症である。グレーブス眼症は、眼窩に影響を与える自己免疫の炎症性障害である。特定の例において、免疫系は、甲状腺刺激ホルモン受容体(TSH−R)を抗原として認識し、攻撃する。特定の例において、ロイコトリエンは、グレーブス眼症(例えば、眼窩への白血球の走化性)の進行に起因する因子の幾つか又は全てを媒介する。特定の例において、ロイコトリエンは、グレーブス眼症(例えば、血管拡張、浮腫、充血)に関連する症状の幾つか又は全てを媒介する。特定の例において、FLAP活性を阻害することにより、グレーブス眼症に関連するロイコトリエン及び/又はサイトカインの濃度が減少する。幾つかの実施形態において、FLAP活性を阻害することにより、グレーブス眼症が処置される。幾つかの実施形態において、FLAP活性を阻害することにより、涙管への白血球の走化性が阻害される。幾つかの実施形態において、FLAP活性を阻害することにより、血管拡張、浮腫、充血、又はそれらの組み合わせが処置される。幾つかの実施形態において、追加の治療薬(例えば、ステロイド抗炎症剤、DP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、グレーブス眼症が処置される。
【0102】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、水疱性障害である。特定の例において、水疱性障害は、疱疹の形成(即ち、組織中の細胞間の液体貯留)により特徴付けられる。特定の例において、水疱性障害は自己免疫障害である。特定の例において、ロイコトリエンは、疱疹の形成を媒介する(例えば、毛細血管から組織への血漿の滲出を誘発する)。特定の例において、FLAP活性を阻害することにより、水疱性障害に関連するロイコトリエン及び/又はサイトカインの濃度が減少する。幾つかの実施形態において、FLAP活性を阻害することにより、水疱性障害が処置される。幾つかの実施形態において、FLAP活性を阻害することにより、毛細血管から組織への血漿の滲出が阻害される。幾つかの実施形態において、追加の治療薬(例えば、DP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、水疱性障害が処置される。
【0103】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、瘢痕化である。特定の例において、瘢痕は、コラーゲンの過剰産生から生じる線維組織の部分である。特定の例において、創傷治癒は、損傷部位への線維芽細胞の移動を含む。特定の例において、線維芽細胞はコラーゲンを沈着させる。特定の例において、線維芽細胞は、創傷部位で過剰なコラーゲンを沈着させ、結果的に瘢痕となる。特定の例において、ロイコトリエンは、線維芽細胞の活性を調節する。特定の例において、ロイコトリエンは、線維芽細胞のための走化性物質として作用する。特定の例において、ロイコトリエンの活性を阻害することにより、瘢痕化に関連する白血球の活性及び/又は移動が阻害される。特定の例において、FLAP活性を阻害することにより、瘢痕化に関連するロイコトリエン及び/又はサイトカインの濃度が減少する。特定の例において、FLAP活性を阻害することにより、瘢痕化に関連する線維芽細胞の活性及び/又は移動が阻害される。特定の例において、FLAPを阻害することにより、瘢痕化が処置される。1つの態様において、瘢痕化は前上葉区瘢痕化である。1つの態様において、瘢痕化は、別の眼の疾患、障害又は疾病の結果である。1つの態様において、瘢痕化は、限定されないが、結膜炎、角膜炎などの別の眼の疾患、障害又は疾病の結果である。1つの態様において、眼球表面は瘢痕化される。1つの態様において、FLAPインヒビタ化合物を含む、本明細書に開示される眼製剤は、哺乳動物の眼球表面の瘢痕化を処置又は予防する。1つの態様において、FLAPインヒビタ化合物を含む、本明細書に開示される眼製剤は、哺乳動物の眼球表面の術後瘢痕を処置又は予防する。1つの態様において、FLAPインヒビタ化合物を含む、本明細書に開示される眼製剤での非ステロイド抗炎症剤(NSAID)の組み合わせは、眼科手術に関連する疼痛及び炎症を処置するために使用される。幾つかの実施形態において、追加の治療薬(例えば、DP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、哺乳動物の眼内における瘢痕化が処置される。
【0104】
幾つかの実施形態において、本明細書に開示される局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、黒色腫(例えば、眼球内黒色腫、及び/又は結膜黒色腫)である。特定の例において、黒色腫は、黒色素細胞の増殖性障害である。特定の例において、ロイコトリエンは、黒色素細胞の成長を刺激する。更に、特定の例において、炎症は、黒色腫の成長を促進する。特定の例において、ロイコトリエンは、黒色腫に関連する炎症を媒介する。特定の例において、FLAP活性を阻害することにより、黒色腫に関連するロイコトリエン及び/又はサイトカインの濃度が減少し、眼球内黒色腫に関連する黒色素細胞の成長を遅らせる及び/又は阻害する。特定の例において、FLAP活性を阻害することにより、黒色腫に関連する炎症が減少する。特定の例において、FLAPを阻害することにより、眼球内黒色腫及び/又は結膜黒色腫が処置される。幾つかの実施形態において、追加の治療薬(例えば、DP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、黒色腫が処置される。
【0105】
幾つかの実施形態において、本明細書に開示される局所製剤は、眼の疾患、障害又は疾病を処置するために投与され、ここでの眼の疾患、障害又は疾病とは、眼感染(例えば、細菌、ウイルス又はクラミジア感染)である。特定の例において、感染は、涙液分泌(例えば、粘液、ムチン、膿など)の産生を引き起こす。特定の例において、ロイコトリエンは、感染した眼内で粘液の産生を媒介する。特定の例において、FLAP活性を阻害することにより、涙液分泌に関連するロイコトリエン及び/又はサイトカインの濃度が減少し、眼感染に関連する粘液の産生が遅れる且つ/又は阻害される。特定の例において、FLAP活性を阻害することにより、眼感染に関連する粘液産生が減少する。特定の例において、FLAPを阻害することにより、眼感染が処置される。幾つかの実施形態において、追加の治療薬(例えば、抗菌性、抗感染性、DP2受容体アンタゴニスト)と組み合わせたFLAPインヒビタ化合物の投与により、眼感染が処置される。
【0106】
特定の専門用語
用語「個体(individual)」、「患者(patient)」、又は「被験体(subject)」は、互換的に使用される。本明細書で使用されるように、それらは任意の哺乳動物を意味する。1つの態様において、哺乳動物はヒトである。
【0107】
用語「処置する(treat)」、「処置している(treating)」又は「処置(treatment)」、及び他の文法上の同義語は、本明細書で使用されるように、障害及び/又は障害の症状の発症を緩和し、軽減し、阻害し、減らし、寛解し、遅らせ、進行を阻止し、且つ/又は退行を誘発することを含む。用語は、障害の予防処置も含む。用語は更に、任意の治療効果を挙げることも含む。治療効果は、処置されている根本的な障害の根絶又は寛解、及び/又は改善が個体において観察されるような、根本的な障害に関連する1以上の生理学的な症状の根絶又は寛解を意味する。
【0108】
用語「予防する(prevent)」、「予防している(preventing)」又は「予防(prevention)」、及び他の文法上の同義語は、本明細書で使用されるように、障害の発達を阻害すること(阻止する又は止めること)、及び/又は障害の更なる進行を阻害すること(阻止する又は止めること)を含む。用語は、予防法を含むように意図されている。予防効果のために、本明細書に開示される製剤は、特定の障害を発達させる危険性のある個体、又は疾患の1以上の生理学的な症状を報告する個体、又は疾患の再発の危険性のある個体に投与される。
【0109】
用語「有効な量(effective amount)」又は「治療上有効な量(therapeutically effective amount)」は、本明細書で使用されるように、所望の結果、例えば、処置されている疾患、障害又は疾病の1以上の症状をある程度和らげることを達成する、投与されている薬剤(例えば、FLAPインヒビタ化合物)の量を示す。特定の例において、結果は、疾患の少なくとも1つの徴候、症状、又は原因の減少及び/又は緩和、又は生物系の任意の他の所望の変化である。
【0110】
用語「投与する(administer)」、「投与している(administering)」、「投与(administration)」などは、本明細書に使用されるように、生物学的作用の所望部位(例えば、眼の障害の部位)へのFLAPインヒビタの送達を可能にするために使用される方法を示す。これらの方法は、眼へのFLAPインヒビタの局所投与のための任意の適切な方法を含む。
【0111】
本明細書に使用されるような用語「眼(eye)」は、限定されないが、眼の外側表面及び内部、眼に接する血管、眼窩及び眼のソケット、眼、眼瞼、睫毛を囲む表皮の表面及び組織、及び眼を囲む脂肪性沈着物を含む。
【0112】
眼への投与のための局所製剤
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、局所効果(即ち、眼又はそれに関連する組織に限定される効果)のために、眼又はそれに関連する組織へのFLAPインヒビタ化合物の送達を促進する。特定の例において、FLAPインヒビタ化合物の局所投与は、FLAPインヒビタの全身投与に関連する副作用を減らす又は除去する。
【0113】
幾つかの実施形態において、眼への投与のためのFLAPインヒビタは、溶液、懸濁液(例えば、水性懸濁液)、軟膏、ゲル、クリーム、リポソーム、ニオソーム、ファーマコソーム、ナノ粒子、又はそれらの組み合わせとして製剤される。幾つかの実施形態において、眼への局所投与のためのFLAPインヒビタは、移植、挿入(例えば、不溶性挿入又は可溶性挿入を介する)、注入、噴霧、洗浄、又はそれらの組み合わせを介して投与される。
【0114】
幾つかの実施形態において、眼への局所投与のためのFLAPインヒビタは、溶液、懸濁液、クリーム、ローション、軟膏、及び/又はゲルとして製剤される。1つの実施形態において、FLAPインヒビタは、ヒトを含む哺乳動物の眼(又はそれに関連する組織)に適用され得る点眼薬として投与される。1つの実施形態において、FLAPインヒビタは、ヒトを含む哺乳動物の眼(又はそれに関連する組織)に適用され得る洗眼剤として投与される。
【0115】
溶液及び懸濁液
本明細書には、特定の実施形態において、眼への投与のための局所製剤が開示され、ここでの眼への投与のための局所製剤とは、溶液の形態である。本明細書には、特定の実施形態において、眼への投与のための局所製剤が開示され、ここでの眼への投与のための局所製剤とは、懸濁液の形態である。特定の例において、溶液又は懸濁液は組織を再水和し、そのため、水和の損失又は減少によって特徴付けられる眼の疾患、障害又は疾病に有用である。特定の例において、溶液は、眼への投与(注入)のための注射剤である。
【0116】
クリーム及びローション
本明細書には、特定の実施形態において、眼への投与のための局所製剤が開示され、ここでの眼への投与のための局所製剤とは、クリームの形態である。特定の例において、クリームは、水中油型乳剤又は油中水型乳剤において分散する、FLAPインヒビタ化合物を含む半固体(例えば、軟らかい固体又は濃い液体)の製剤である。本明細書には、特定の実施形態において、眼への投与のための局所製剤が開示され、ここでの眼への投与のための局所製剤とは、ローションの形態である。特定の例において、ローションは、流体乳濁液(例えば、水中油型乳剤又は油中水型乳剤)である。幾つかの実施形態において、ローション及び/又はクリームの疎水性成分は、動物(例えば、ラノリン、肝油、及び竜涎香)、植物(例えば、サフラワー油、ヒマシ油、ヤシ油、綿実油、メンヘーデン油、パーム核油、パーム油、ラッカセイ油、ダイズ油、ナタネ油、亜麻仁油、米ぬか油、パイン油、ゴマ油、又はヒマワリ種子油)、又は石油(例えば、鉱油、又はワセリン)から得られる。
【0117】
特定の例において、ローション及びクリームは、眼の疾患、障害又は疾病への「乾燥」効果(例えば、眼及び/又はそれに関連する組織から滲出される、幾つか又は全ての流体は、軟膏に混和できる)を有し、そのため、流体の滲出により特徴付けられる眼の疾患、障害又は疾病に有用である。
【0118】
軟膏
本明細書には、特定の実施形態において、眼への投与のための局所製剤が開示され、ここでの眼への投与のための局所製剤とは、軟膏の形態である。特定の例において、軟膏は、体温(眼及び/又はそれに関連する組織の温度を含む)で軟化又は溶解する半固形製剤である。特定の例において、軟膏は組織を再水和し、そのため、水分の損失により特徴付けられる眼の疾患、障害又は疾病に有用である。
【0119】
ゲル
本明細書には、特定の実施形態において、眼への投与のための局所製剤が開示され、ここでの眼への投与のための局所製剤とは、ゲルの形態である。特定の例において、ゲルは、液体中に分散される大型有機分子の分散から成る、半固定(又は半硬質)式である。特定の例において、ゲルは水溶性で、温水又は食塩水を使用して取り除かれる。特定の例において、ゲルは組織を再水和し、そのため、水分の損失により特徴付けられる眼の疾患、障害又は疾病に有用である。
【0120】
眼に許容可能な送達装置
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼と眼瞼の間に、又はFLAPインヒビタが放出される結膜嚢に挿入され得る装置を介して投与又は送達される。幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、角膜の表面を浸す涙液に、又は直接、角膜自体に放出され、一般的に固形物と密接に接触する。任意の適切な装置は、本明細書に開示される眼への投与のための局所製剤及び本明細書に開示される方法(例えば、アイゲートアプリケーター)とともに使用される。
【0121】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、点眼器を介して投与又は送達される。点眼器は、円柱状のバレルが圧力下で変形される時に、眼への投与量を測定及び送達する円柱状のバレルを含む、従来の点眼器など当該分野に周知の任意のものを含む。他のタイプの点眼器は、米国特許番号5,514,118;5,584,823;5,059,188;4,834,727;4,629,456;及び4,515,295に記載される点眼器のタイプを含み、その全ては、点眼器装置の開示のための引用により組み込まれる。
【0122】
眼に許容可能な注射可能なデポ製剤
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、注射可能なデポ製剤を介して投与又は送達される。本明細書で使用されるように、デポ製剤は、眼又はそれに関連する組織(例えば強膜)に(例えば皮下に、筋肉内に、硝子体内に、又は結膜下内に)注入される、制御放出製剤である。制御放出マトリックスへのFLAPインヒビタの比率及び使用されるマトリックスの性質は、薬物放出の速度を制御する。
【0123】
幾つかの実施形態において、デポ製剤は、生分解性高分子中でFLAPインヒビタの(マイクロカプセルマトリックスとしても知られる)マイクロカプセル化したマトリックスを形成することにより製剤される。幾つかの実施形態において、デポ製剤は、リポソーム又はマイクロエマルション中でFLAPインヒビタを捕捉することにより製剤される。
【0124】
眼に許容可能な賦形剤
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、担体、代用涙液、張性エンハンサー、pH調整剤、防腐剤、清澄剤、粘性エンハンサー、及び可溶化剤を含む、1以上の賦形剤を含む。
【0125】
幾つかの実施形態において、溶液、懸濁液、軟膏、ゲル、クリーム、リポソーム、ニオソーム、ファーマコソーム、ナノ粒子、又はそれらの組み合わせとして製剤された、眼への投与のためのFLAPインヒビタは、1以上の担体を含む。眼に許容可能な担体の例は、限定されないが、水、水の混合物及び以下のような水混和性の溶剤を含む;C1−アルカノールからC7−アルカノール;0.5〜5%の無毒な水溶性高分子を含む植物油又は鉱油;ゼラチン、アルギナート、ペクチン、トラガント、カラヤゴム、キサンタンガム、カラゲーニン、寒天及びアカシアを含む天然物;酢酸及びヒドロキシプロピルの澱粉を含む澱粉誘導体;及び中性のカーボポールなどの、ポリビニルアルコール、ポリビニルピロリドン、ポリビニルメチルエーテル、ポリエチレンオキシド、ポリアクリル酸、又はこれらのポリマーの混合物を含む、他の合成製品。
【0126】
幾つかの実施形態において、眼への投与のための局所製剤は、1以上の代用涙液を含む。代用涙液は、眼組織上の優れた湿潤性、潤滑、及び製剤の広がりを促進する。代用涙液はまた、使用者に不快感を与えない。特定の例において、代用涙液は、本明細書に開示される1以上の担体を備える。他の例において、代用涙液は、担体に加え、他の賦形剤である。典型的な代用涙液は、限定されないが、グリセロール、プロピレングリコール、及びエチレングリコールを含む、モノマープリオール;ポリエチレングリコールを含む、ポリマーポリオール;ヒドロキシプロピルメチルセルロース、カルボキシメチルセルロースナトリウム及びヒドロキシプロピルセルロースを含む、セルロースエステル;デキストラン70を含む、デキストラン;ゼラチンを含む、水溶性タンパク質;ポリビニルアルコール、 ポリビニルピロリドン、及びポビドンを含むビニルポリマー;及びカルボマー934P、カルボマー941、カルボマー940及びカルボマー974Pを含む、カルボマー;及び当該分野に知られている他の代用涙液を含む。他の市販の代用涙液は、限定されないが、Bion Tears(登録商標)、Celluvisc(登録商標)、Genteal(登録商標)、OccuCoat(登録商標)、Refresh(登録商標)、Teargen II(登録商標)、Tears Naturale(登録商標)、Tears Natural II(登録商標)、Tears Naturale Free(登録商標)、及びTheraTears(登録商標)などのセルロースエステル;及びAkwa Tears(登録商標)、HypoTears(登録商標)、Moisture Eyes(登録商標)、Murine Lubricating(登録商標)、及びVisine Tears(登録商標)などのポリビニルアルコールを含む。パラフィン代用涙液は、Lacri−Lube(登録商標)の軟膏を含む。代用涙液として使用される他の市販の軟膏は、Lubrifresh PM(登録商標)、Moisture Eyes PM(登録商標)及びRefresh PM(登録商標)を含む。
【0127】
眼への投与のための局所製剤は、眼に許容可能な張度を有する。特定の例において、涙液は、0.9%の塩化ナトリウム溶液又は2.5%のグリセロールの溶液に等価な等張性値を有している。特定の例において、約0.6%〜約1.8%の塩化ナトリウム等量の等張性値は、眼への局所投与に適している。特定の例において、本明細書に開示される眼への投与のための局所製剤は、約200〜約600 mOsm/Lのモル浸透圧濃度を有している。幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、低張であり、そのため、適切な張性レンジを獲得するのに適した、任意の薬剤を追加する必要がある。張度を調節する眼に許容可能な物質は、イオン及び非イオンの等張化剤を含む。イオンの等張化剤の限定されない例は、例えば、CaCl2、KBr、KCl、LiCl、Nal、NaBr又はNaCl、Na2S2O3、NaHSO4、Na2SO4又はホウ酸などの、アルカリ金属又は土類金属ハロゲン化合物である。別のイオンの等張化剤は、硫酸アンモニウムである。非イオンの張力促進剤は、例えば尿素、グリセロール、ソルビトール、マンニトール、プロピレングリコール、又はデキストロースである。
【0128】
幾つかの実施形態において、眼への投与のための局所製剤は、1以上のpH調整剤を含む。特定の例において、本明細書に開示される眼への投与のための局所製剤は、約4.0〜約8.0の範囲内でpHを有している。特定の例において、眼への投与のための製剤は、涙液に等価なpHを有している。pH調整剤は、限定されないが、ホウ酸、ホウ酸ナトリウム、クエン酸カリウム、クエン酸、重炭酸ナトリウム、トリス、及び(Na2HPO4、NaH2PO4及びKH2PO4の組み合わせを含む)様々な混合したリン酸緩衝液及びそれらの混合物を含む。
【0129】
眼への投与のための局所製剤は、眼に許容可能な清澄性を有している。特定の例において、適切な清澄性を欠く製剤は、眼の適切な機能を妨げる。眼に許容可能な清澄剤の例は、限定されないが、ポリソルベート20、ポリソルベート80、又はそれらの組み合わせを含む。
【0130】
幾つかの実施形態において、眼への投与のための局所製剤は、眼に許容可能な粘性エンハンサーを含む。特定の例において、粘性エンハンサーは、本明細書に開示される製剤が眼内にとどまる時間を増加させる。特定の例において、本明細書に開示される製剤が眼内にとどまる時間を増加させることは、より大きな薬物吸収及び効果を可能にする。粘膜付着性ポリマーの限定されない例は、カルボキシメチルセルロース、カルボマー(アクリル酸ポリマー)、ポリ(メタクリル酸メチル)、ポリアクリルアミド、ポリカルボフィル、アクリル酸/アクリル酸ブチルコポリマー、アルギン酸ナトリウム、デキストラン、ヒアルロン酸及びその塩、及びコンドロイチン硫酸及びその塩を含む。
【0131】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、眼の後上葉区に(例えば、網膜、脈絡膜、硝子及び視神経に)投与又は送達される。幾つかの実施形態において、眼の後部に送達するための、本明細書に開示される眼への投与のための局所製剤は、可溶化剤、例えば、グルカン硫酸塩及び/又はシクロデキストリンを含む。使用され得るグルカン硫酸塩は、限定されないが、デキストラン硫酸塩、シクロデキストリン硫酸塩及びβ−1,3−グルカン硫酸塩、それらの自然体及び誘導体の両方、又は線維芽細胞成長因子(FGF)を含む組織に一時的に結合でき、その組織で保持されることが可能で、薬物の安定性及び/又は可溶性を改善し、及び/又は本明細書に開示される眼への投与のための局所製剤の浸透及び眼吸収を改善する、任意の化合物を含む。可溶化剤として使用され得るシクロデキストリン誘導体は、限定されないが、α−シクロデキストリン、β−シクロデキストリン、γ−シクロデキストリン、ヒドロキシエチルβ−シクロデキストリン、ヒドロキシプロピルγ−シクロデキストリン、ヒドロキシプロピルβ−シクロデキストリン、硫酸化β−シクロデキストリン、硫酸化α−シクロデキストリン、スルホブチルエーテルβ−シクロデキストリンを含む。
【0132】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、防腐剤を含む。防腐剤は、菌類又は細菌などの微生物の成長を防ぐ、又は破壊するために製剤に加えられる。眼への投与のための局所製剤に適している防腐剤の例は、限定されないが、塩化ベンザルコニウム(N−ベンジル−N −(C8−C18アルキル)−N,N−塩化ジメチルアンモニウム)、塩化ベンゾキソニウムなど;チオマーサル、硝酸フェニル水銀、酢酸フェニル水銀及びホウ酸フェニル水銀を含む、チオサリチル酸のアルキル水銀塩;過ホウ酸ナトリウム、亜鉛素酸ナトリウム;例えば、メチルパラベン又はプロピルパラベンを含む、パラベン;例えば、クロロブタノール、ベンジルアルコール又はフェニルエタノールを含む、アルコール;例えば、クロロヘキシジン、ポリヘキサメチレンビグアニド、過ホウ酸ナトリウム、Germal(登録商標)II又はソルビン酸を含む、グアニジン誘導体を含む。
【0133】
本明細書に開示される眼への投与のための局所製剤は、任意の適切な方法で製剤される。任意の適切な技術、担体、及び/又は賦形剤は、本明細書に開示されるFLAPインヒビタとの使用のため熟慮される。本明細書に記載される眼への投与のための局所製剤の要約のために、Kaur,I.P.,Kanwar,M.,Drug Dev Industrial Pharmacy,2002,28,473−493;Lang,J.C.,Adv Drug Delivery Rev.,1995,16,39−43;Remington:The Science and Practice of Pharmacy,Nineteenth Ed.(Easton,Pa.:Mack Publishing Company,1995); Hoover,John E.,Remington’s Sciences,Mack Publishing Co.,Easton,Pennsylvania 1975;Liberman,H.A.and Lachman,L.,Eds.,Pharmaceutical Dosage Forms,Marcel Decker,New York,N.Y.,1980;and Pharmaceutical Dosage Forms 及び Drug Delivery Systems,Seventh Ed.(Lippincott Williams & Wilkins1999)が参照され、そのような開示のための引用により、本明細書に組み込まれる。
【0134】
投薬
本明細書には、特定の実施形態において、眼への投与のための局所製剤が開示され、ここでの眼への投与のための局所製剤は、予防的な及び/又は治療上の処置のために投与される。特定の例において、この使用のための有効量は、疾患、障害又は疾病の重症度及び経過、以前の処置、個体の健康状態及び薬物に対する反応、及び処置する医師の判断による。幾つかの実施形態において、投与量は、約0.001重量%〜約10重量%である。
【0135】
本明細書に記載される化合物は、眼の任意の部分に随意に投与され、一般的に「点眼投与」と呼ばれる。眼への点眼投与は、限定されないが、眼内注射、網膜下注射、硝子体内注射、眼窩投与、結膜下注射、球後注射、(前眼房又は硝子体眼房への注射を含む)前房内注射、テノン嚢下の注射又はインプラント、点眼液、眼科用懸濁液剤、眼軟膏、眼球インプラント、眼球インサート、眼内の溶液、イオン泳動の使用、手術用の灌流液中での取り込み、及びパック(ほんの一例として、円蓋に挿入された飽和した綿球)を包含する。
【0136】
本明細書に開示される眼への投与のための局所製剤により、一般的に、FLAPインヒビタの少なくとも一部が通り抜ける角膜とFLAPインヒビタが直接接触するという結果になる。特定の例において、本明細書に開示される眼への投与のための局所製剤は、約2〜約24時間、より典型的には約4〜約24時間、及び最も典型的には約6〜24時間の眼内の有効な滞留時間を有している。
【0137】
眼への投与のための有用な局所製剤は、水溶液、懸濁液又は溶液/懸濁液になり、点眼薬の形態で提示され得る。所望の投薬は、規定数の滴剤を介して眼内へ投与され得る。例えば、25μlの滴量のために、1〜6滴の投与は、本明細書に開示される眼への投与のための局所製剤25〜150μlを送達する。水性製剤は,典型的には約0.01%〜約50%、より典型的には約0.1%〜約20%、更に典型的には約0.2%〜約10%、及び最も典型的には約0.5%〜約5%のFLAPインヒビタの重量/容量を含む。
【0138】
幾つかの実施形態において、眼への投与のための局所製剤は、コンタクトレンズに、溶液、懸濁液、ゲル、軟膏、クリーム又はローションの投薬を1回以上加え、一定期間、例えば、15分〜4時間レンズを挿入することにより投与され、これは1日当たり1回〜4回繰り返し可能である。コンタクトレンズの投薬は、角膜内の優先吸収などの利点をもたらし、投与量を最大限活用し、体内吸収のわずかな危険性同様、発症してしまうかもしれない軽度の発赤を最小限にする。有用なコンタクトレンズは、当該分野に周知の任意のものを含み、限定されないが、ポリメタクリル酸メチル(PMMA)レンズを含む、疎水性のハードレンズ;ヒドロキシエチルメタクリル酸メチルレンズを含む、親水性のソフトレンズ;シリコーンビニルプロリドンを含む、疎水性のフレキシブルレンズ;及び酢酸酪酸セルロースレンズを含む、親水性のハードレンズ(rigid hydrophilic lens)を含む。
【0139】
幾つかの実施形態において、眼の障害が改善されない場合、本明細書に開示される眼への投与のための局所製剤は、慢性的に(即ち、個体の一生の期間を含む、長期間の間)投与される。幾つかの実施形態において、眼の障害が改善されない場合、本明細書に開示される眼への投与のための局所製剤は、継続的に与えられ;或いは、投与されているFLAPインヒビタの投与量は、特定の期間、一時的に減らされる又は一時的に投与が中止される(即ち、「休薬期間」)。幾つかの実施形態において、休薬期間は、2日間から1年間続き、期間内のすべての整数を含む。幾つかの実施形態において、休薬期間中の減量は、約10%から約100%であり、期間内のすべての整数を含む。
【0140】
幾つかの実施形態において、眼の障害が改善される場合、本明細書に開示される眼への投与のための局所製剤は、維持量として投与される。幾つかの実施形態において、眼の障害が改善される場合、本明細書に記載される眼への投与のための局所製剤は、低頻度で又は減少した投与量で投与される。
【0141】
1つの実施形態において、本明細書に開示される眼への投与のための局所製剤は、FLAPインヒビタの即時放出のために製剤される。幾つかの実施形態において、FLAPインヒビタは、即時に、又は1分以内、又は5分以内、又は10分以内、又は15分以内、又は30分以内、又は60分以内又は90分以内に放出される。
【0142】
1つの実施形態において、本明細書に開示される眼への投与のための局所製剤は、FLAPインヒビタの遅延(又は制御)放出のために製剤される。幾つかの実施形態において、FLAPインヒビタ化合物は、15分、又は30分、又は1時間、又は4時間、又は6時間、又は12時間、又は18時間、又は1日、又は2日、又は3日、又は4日、又は5日、又は6日、又は7日、又は10日、又は12日、又は14日、又は18日、又は21日、又は25日、又は30日、又は45日、又は2ヶ月又は3ヶ月又は4ヶ月又は5ヶ月又は6ヶ月又は9ヶ月又は1年を超える期間にわたって放出される。
【0143】
幾つかの実施形態において、本明細書に開示される眼への投与のための局所製剤は、FLAPインヒビタの即時及び遅延(又は制御)放出のために製剤される。
【0144】
併用療法
1つの態様において、本明細書に開示される医薬組成物及び方法は、追加の治療薬を含む。1つの態様において、追加の治療薬は、FLAPインヒビタ化合物以外の治療薬である。
【0145】
1つの態様において、FLAPインヒビタ化合物を含む、本明細書に開示される局所製剤は、(別々に又は同じ製剤において)以下から選択される治療薬と共に同時投与される:抗生物質(例えば、硫酸ポリミキシンB/亜鉛バシトラシン、ポリミキシンB/ネオマイシン/グラミシジン、ポリミキシンB/トリメトプリム、ポリミキシンB/バシトラシン、フルオロキノロン(例えば、シプロフロキサシン、モキシフロキサシン、オフロキサシン、ガチフロキサシン、レボフロキサシン)、アミノグリコシド(例えば、トブラマイシン、アジスロマイシン、ゲンタマイシン、エリスロマイシン、バシトラシン);抗真菌剤(例えば、アムホテリシンB、イトラコナゾール、フルコナゾール、ボリコナゾール);ステロイド抗炎症剤(例えば、フルオロメトロン酢酸塩、酢酸プレドニソロン、ロテプレドノールエタボネート、リン酸プレドニソロンナトリウム、プレドニソロンナトリウム、リメキソロン、フルオロメトロン酢酸塩);非ステロイド抗炎症剤(例えば、ネパフェナク、ケトロラクトロメタミン、ブロムフェナク、ジクロフェナクナトリウム、ケトロラクトロメタミン、フマル酸ケトチフェン);抗ヒスタミン剤(例えば、フマル酸エメダスチン、塩酸オロパタジン、エピナスチンHCl、塩酸アゼラスチン、フマル酸ケトチフェン);抗ウイルス剤(例えば、アシクロビル、ビダラビン、トリフルリジン);アルファアゴニスト(例えば、アプラクロニジン、ブリモニジン、ビマトプロスト);ベータ遮断剤(例えば、塩酸ベタキソロール、塩酸レボブノロール、塩酸カルテオロール、メチプラノロール、マレイン酸チモロール、チモロール半水和物);炭酸脱水酵素インヒビタ(例えば、ブリンゾラミド、ドルゾラミド、アセタゾラミド);縮瞳薬(例えば、塩化アセチルコリン、エコチオフェート);プロスタグランジン(例えば、トラボプロスト、ビマトプロスト、ラタノプロスト);抗血管新生薬(例えば、ペガプタニブナトリウム、ラニビズマブ、ベルテポルフィン);ロテプレドノールエタボネート、肥満細胞安定化薬(例えば、ロドキサミドトロメタミン、ネドクロミルナトリウム、クロモリンナトリウム、ペミロラストカリウム)、シクロスポリン、及びDP2アンタゴニスト。
【0146】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)抗生物質と共に同時投与される。抗生物質は、限定されないが、硫酸ポリミキシンB/亜鉛バシトラシン、ポリミキシンB/ネオマイシン/グラミシジン、ポリミキシンB/トリメトプリム、ポリミキシンB/バシトラシン、フルオロキノロン(例えば、シプロフロキサシン、モキシフロキサシン、オフロキサシン、ガチフロキサシン、レボフロキサシン)、アミノグリコシド(例えばトブラマイシン、アジスロマイシン、ゲンタマイシン、エリスロマイシン、バシトラシン)を含む。
【0147】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)抗真菌剤と共に同時投与される。抗真菌剤は、限定されないが、アンホテリシンB、イトラコナゾール、フルコナゾール、及びボリコナゾールを含む。
【0148】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)ステロイド抗炎症剤と共に同時投与される。ステロイド抗炎症剤は、限定されないが、ベタメタゾン、プレドニゾン、アルクロメタゾン、アルドステロン、アムシノニド、ベクロメタゾン、ベタメタゾン、ブデソニド、シクレソニド、クロベタゾール、クロベタゾン、クロコルトロン、クロプレドノール、コルチゾン、コルチバゾール、デフラザコルト、デオキシコルチコステロン、デソニド、デスオキシメタゾン、デスオキシコルトン、デキサメタゾン、ジフロラゾン、ジフルコルトロン、ジフルプレドナート、フルクロロロン、フルドロコルチゾン、フルドロキシコルチド、フルメタゾン、フルニソリド、フルオシノロンアセトニド、フルオシノニド、フルオコルチン、フルオコルトロン、フルオロメトロン、フルペロロン、フルプレドニデン、フルチカゾン、ホルモコータル、ハルシノニド、ハロメタゾン、ヒドロコルチゾン/コルチゾール、アセポン酸ヒドロコルチゾン、ヒドロコルチゾンブテプレート、酪酸ヒドロコルチゾン、ロレプレドノール、メドリゾン、メプレドニゾン、メチルプレドニソロン、アセポン酸メチルプレドニソロン、モメタゾンフロ酸エステル、パラメタゾン、プレドニカルベート、プレドニゾン/プレドニソロン、リメキソロン、チキソコルトール、トリアムシノロン、及びウロベタゾールを含む。
【0149】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)非ステロイド抗炎症剤(NSAID)と共に同時投与される。NSAIDは、限定されないが、ネパフェナク、ケトロラク、ブロムフェナク、ジクロフェナク、ケトロラク、ケトチフェンを含む。
【0150】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)抗ヒスタミン剤と共に同時投与される。幾つかの実施形態において、抗ヒスタミン剤は、限定されないが、アンレキサノクス、アステミゾール、アザタジン、アゼラスチン、アクリバスチン、ブロムフェニラミン、セチリジン、レボセチリジン、エフレチリジン、クロルフェニラミン、クレマスチン、シクリジン、カレバスチン、シプロヘプタジン、カルビノキサミン、デスカルボエトキシロラタジン、ドキシラミン、ジメチンデン、エバスチン、エピナスチン、エフレチリジン、フェキソフェナジン、ヒドロキシジン、ケトチフェン、ロラタジン、レボカバスチン、ミゾラスチン、メキタジン、ミアンセリン、ノベラスチン、メクリジン、ノルアステミゾール、オロパタジン、ピクマスト、ピリラミン、プロメタジン、テルフェナジン、トリペレナミン、テメラスチン、トリメプラジン、及びトリプロリジンを含む。幾つかの実施形態において、抗ヒスタミン剤は、限定されないが、エメダスチン、オロパタジン、エピナスチン、アゼラスチン、ケトチフェンを含む。
【0151】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)抗ウイルス剤と共に同時投与される。抗ウイルス剤は、限定されないが、アシクロビル、ビダラビン、トリフルリジンを含む。
【0152】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)アルファアゴニストと共に同時投与される。アルファアゴニストは、限定されないが、アプラクロリジン、ブリモニジン、ビマトプロストを含む。
【0153】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)ベータ遮断剤と共に同時投与される。ベータ遮断剤は、限定されないが、ベタキソロール、レボブノロール、カルテオロール、メチプラノロール、チモロールを含む。
【0154】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)炭酸脱水酵素インヒビタと共に同時投与される。炭酸脱水酵素インヒビタは、限定されないが、ブリンゾラミド、ドルゾラミド、アセタゾラミドを含む。
【0155】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)縮瞳薬と共に同時投与される。縮瞳薬は、限定されないが、塩化アセチルコリン、エコチオパートを含む。
【0156】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)プロスタグランジンと共に同時投与される。プロスタグランジンは、限定されないが、トラボプロスト、ビマトプロスト、ラタノプロストを含む。
【0157】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)抗血管新生薬と共に同時投与される。抗血管新生薬は、限定されないが、ペガプタニブナトリウム、ラニビズマブ、ベルテポルフィンを含む。
【0158】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)エタボン酸ロテプレドノールと共に同時投与される。
【0159】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)肥満細胞安定化薬と共に同時投与される。肥満細胞安定化薬は、限定されないが、ロドキサミドトロメタミン、ネドクロミルナトリウム、クロモリンナトリウム、ペミロラストカリウムを含む。
【0160】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)シクロスポリンと共に同時投与される。
【0161】
幾つかの実施形態において、FLAPインヒビタ化合物を含む、本明細書に開示される眼の医薬組成物は、(別々に又は同じ製剤において)DP2受容体アンタゴニストと共に同時投与される。1つの態様において、追加の治療薬は、小分子DP2受容体アンタゴニスト化合物である。幾つかの実施形態において、DP2受容体アンタゴニストは、国際特許出願番号PCT/US09/35174(発明の名称「プロスタグランジンD2受容体のアンタゴニスト(Antagonists of Prostaglandin D2 receptors)」);国際特許出願番号PCT/US08/82056(発明の名称「PGD2受容体のアンタゴニスト(Antagonists of PGD2 receptors)」);国際特許出願番号PCT/US08/82082(発明の名称「PGD2受容体のアンタゴニスト(Antagonists of PGD2 receptors)」);国際特許出願番号PCT/US09/32495(発明の名称「プロスタグランジンD2受容体のN,N−二置換アミノアルキルビフェニルアンタゴニスト(N,N−disubstituted aminoalkylbiphenyl antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/32499(発明の名称「プロスタグランジンD2受容体のN,N−二置換アミノアルキルビフェニルアンタゴニスト(N,N−disubstituted aminoalkylbiphenyl antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/33961(発明の名称「プロスタグランジンD2受容体のアンタゴニストとしてのサイクリックジアリールエーテル化合物(Cyclic diaryl ether compounds as antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/38291(発明の名称「プロスタグランジンD2受容体のアミノアルキルフェニルアンタゴニスト(Aminoalkylphenyl antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/49621(発明の名称「プロスタグランジンD2受容体のアンタゴニスト(Antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/49631(発明の名称「プロスタグランジンD2受容体のアンタゴニスト(Antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/58655(発明の名称「プロスタグランジンD2受容体のヘテロアリールアンタゴニスト(Heteroaryl antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/58663(発明の名称「プロスタグランジンD2受容体のヘテロアリールアンタゴニスト(Heteroaryl antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/44219(発明の名称「プロスタグランジンD2受容体のトリサイクリックアンタゴニスト(Tricyclic antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/48327(発明の名称「プロスタグランジンD2受容体のシクロアルカン[B]インドールアンタゴニスト(Cycloaklane[B]indole antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/59256(発明の名称「プロスタグランジンD2受容体のヘテロアリールアンタゴニスト(Heteroaryl antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/59891(発明の名称「プロスタグランジンD2受容体のヘテロアルキルビフェニルアンタゴニスト(Heteroalkyl biphenyl antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/64630(発明の名称「プロスタグランジンD2受容体のヘテロサイクリックアンタゴニスト(Heterocyclic antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/63439(発明の名称「プロスタグランジンD2受容体のシクロアルカン[B]アザインドールアンタゴニスト(Cycloaklane[B]azaindole antagonists of prostaglandin D2 receptors)」);国際特許出願番号PCT/US09/63438(発明の名称「プロスタグランジンD2受容体のシクロアルカン[B]アザインドールアンタゴニスト(Cycloaklane[B]azaindole antagonists of prostaglandin D2 receptors)」);米国仮特許出願第61/147437(発明の名称「プロスタグランジンD2受容体アンタゴニストとしてのインドリジン化合物(Indolozine compounds as prostaglandin D2 receptor antagonists)」;又はそれらの薬学的に許容可能な塩又はN-オキシドに開示される化合物から選択される。
【0162】
幾つかの実施形態において、DP2受容体アンタゴニストは、AMG 009、AMG 853、WO 09/085177の化合物14、AZD1981、ODC9101(OC459)、OC499、OC1768、OC2125、OC2184、QAV680、MLN6095、ACT−129968、ADC3680、SAR398171、S555739、AP768、[2’−(3−ベンジル−1−エチル−ウレイドメチル)−6−メトキシ−4’−トリフルオロメチル−ビフェニル−3−イル]−酢酸、{3−[2−tert−ブチルスルファニルメチル−4−(2,2−ジメチル−プロピオニルアミノ)−フェノキシ]−4−メトキシ−フェニル}−酢酸、TM30642、TM30643、TM30089、TM27632、及びTM3170、{2’−[(N−シクロプロパンカルボニル−N−エチル−アミノ)−メチル]−6−メトキシ−4’−トリフルオロメチル−ビフェニル−3−イル}−酢酸、[2’−[(N−シクロプロパンカルボニル−N−エチル−アミノ)−メチル]−4’−(6−エトキシ−ピリジン−3−イル)−6−メトキシ−ビフェニル−3−イル]−酢酸、(5−{2−[(N−ベンジルオキシカルボニル−N−エチル−アミノ)−メチル]−4−トリフルオロメチル−フェニル}−ピリジン−3−イル)−酢酸、及び{8−[(4−フルオロ−ベンゼンスルホニル)−メチル−アミノ]−6,7,8,9−テトラヒドロ−ピリド[3,2−b]インドール−5−イル}−酢酸から選択される。
【0163】
幾つかの例において、本明細書に記載される任意の眼製剤又は方法におけるDP2受容体アンタゴニスト化合物へのFLAPインヒビタ化合物の量の比率は、約10:1から約1:10である:幾つかの例において、本明細書に記載される任意の眼製剤又は方法におけるDP2受容体アンタゴニストへのFLAPインヒビタ化合物の量の比率は、約10:1、約8:1、約6:1、約5:1、約4:1、約2:1、約1:1、約1:2、約1:4、約1:5、約1:6、約1:8、又は約1:10である。
【0164】
幾つかの実施形態において、FLAPインヒビタ及び追加の治療薬は、同じ医薬組成物中にある。幾つかの実施形態において、FLAPインヒビタ及び追加の治療薬は、別々の医薬組成物中にある。幾つかの実施形態において、FLAPインヒビタ及び追加の治療薬は、同時に投与される。幾つかの実施形態において、FLAPインヒビタ及び追加の治療薬は、異なる時間に投与される。
【0165】
実施例
実施例1:FLAPインヒビタの製剤
1つの態様において、FLAPインヒビタ化合物を含む水性点眼液を、水に10%のベータ−ヒドロキシプロピルシクロデキストリン(BHPC)中のFLAPインヒビタ化合物を溶かすことにより調製した。この製剤を使用して、以下の化合物は、1mg/mLで可溶性となった:化合物A(ナトリウム塩)、化合物B(ナトリウム塩)、化合物C(ナトリウム塩)、化合物I(ナトリウム塩)、化合物J(ナトリウム塩)、化合物G(ナトリウム塩)。化合物F(ナトリウム塩)は、1mg/mLで混濁液を形成した。
【0166】
実施例2:化合物Aの溶液
眼への投与に適している化合物Aの溶液を、下記の成分で製剤する:
【0167】
【表1】

【0168】
実施例3:化合物Bの溶液
眼への投与に適している化合物Bの溶液を、下記の成分で製剤する:
【0169】
【表2】

【0170】
実施例4:化合物Cの溶液
眼への投与に適している化合物Cの溶液を、下記の成分で製剤する:
【0171】
【表3】

【0172】
実施例5:アレルギー性結膜炎の徴候及び症状を低減する際に眼へのFLAPインヒビタ化合物の局所投与の効果を評価する臨床試験
単一施設、二重盲検、無作為、2つの方法のクロスオーバー、プラセボ対照の研究は、結膜アレルゲン負荷(conjunctival allergen challenge(CAC))の後の、アレルギー性結膜炎(AC)の個体の眼へのFLAPインヒビタ化合物の局所投与の安全性及び有効性を評価するためにある。各被験体は、動的治療(例えば、眼に投与されるFLAPインヒビタ化合物の局所製剤)又はプラセボを受ける。
【0173】
18〜65歳のどちらかの性別の10人の被験体を、研究に参加させる。全ての被験体は、眼アレルギー(アレルギー性結膜炎又は鼻炎結膜炎)の病歴を有するべきである。被験体のアレルギー状態を、(1)季節性又は通年性のアレルゲンへの陽性皮膚プリックテスト、(2)同じアレルゲンへの眼のアレルゲン負荷によって確認するべきである。
【0174】
被験体は、緑内障、前部又は後部ブドウ膜炎、臨床的に重大な眼瞼炎、濾胞性結膜炎、虹彩炎又は眼乾燥;糖尿病性網膜症、又は進行性の網膜疾患;活動性の眼感染の存在;眼のヘルペス性感染の陽性の病歴を有するべきではない。(無作為化の2週間前までに)任意の全身投与又は点眼投与されたコルチコステロイド;又は任意の全身投与又は点眼投与された肥満細胞安定化薬での前処置を有していた被験体;無作為化の4週間前に上気道感染症を有していた被験体、又は6ヶ月以内に眼科手術を受けた又は網膜剥離の病歴を有していた被験体もまた、除外される。妊娠の可能性がある女性の被験体は、陰性の尿妊娠テストの結果を文書で有するべきであり、研究の期間中に、医学的に証明された避妊の形態を実行しているべきである。同意書を、各被験体から得る。
【0175】
結膜アレルゲン負荷(CAC)のプロトコル
人口統計学的な病歴及び薬歴を患者から得る。適格患者は、患者が皮膚試験に従って以前に陽性反応を示したアレルゲンとともに双方でCACを実行する。アレルゲンを、陽性反応が認められるまで、増加する濃度で10分間隔に注入する。患者と医師は、その後、CACの3、7、及び20分後及び12時間後の各徴候への5段階評価(0=無しから4=無力化(incapacitating)まで)を使用して、眼炎症:眼のそう痒感、テアリング、及び発赤/ヒリヒリとした感覚の徴候及び症状を評価する。患者の症状スコアは、患者によって評価されるような個人得点の合計である。患者の症状スコア(PD 30)における30%の変化を誘発するアレルゲンの濃度を、AUC症状スコア0〜20分により測定されるように、確立する。各患者は、その後、クロスオ−バーの第1期の1日目及びクロスオ−バーの第2期の1日目にも再び、PD 30の濃度でアレルゲン負荷を受ける。各患者は、アレルゲン負荷の直後、(動的又はプラセボ)治療を受ける。クロスオーバーの2つの期間を、7日間の休薬期間によって分離する。
【0176】
研究の主要評価項目は、プラセボに対して処置される患者の症状スコア(AUC症状スコア0〜20分)の変動である。副次的評価項目は、患者及び医師によって評価されるような個体の眼の兆候及び病状、患者の総合評価、医師の総合評価、安全性及び忍容性、鼻の症状、及び涙液分泌中のバイオマーカーを含む。
【0177】
実施例6:アレルギー性結膜炎のラットモデル
アレルギー性結膜炎のラットモデルを、アレルギー性結膜炎の進行への眼へのFLAPインヒビタ化合物の局所投与の効果を試験するために使用する。雄のウィスターラット(250〜350g)を、1日目に、全ての四肢の足蹠への、オバルブミン(OVA、1mg)、ミョウバン(2mg)及び1010個の死滅した百日咳菌細胞を含む、0.6mLの食塩水の注入によって感作する。5日後、ラットを、背中の10の部位へのOVA(0.5mg)を含む1mlの食塩水の皮下注射によって追加免疫する。局所感作を、マイクロピペットを使用して、両眼に食塩水(10mg/ml、5μl)中のOVAを注入することにより、14日目から42日目まで毎日行なう。ラットを、(必要に応じて)14日目から42日目に全身性又は眼のFLAPインヒビタで処置する。眼を引っ掻く行動を、選択日にOVA後20分間数える。14、21、28、35及び42日目のOVA負荷に続く24時間、ラットに麻酔をかけ、結膜を取り除き、10%の中性緩衝ホルマリンで治療する。4−μmの厚い前頭切断を染色し、好酸球を数える。眼へのFLAPインヒビタ化合物での局所療法に続く、眼を引っ掻く行動及び結膜好酸球の阻害を、グラフパッドプリズムを使用して、記録し、プロットする。
【0178】
実施例7:RSV感染した眼のマウスモデル
呼吸器合胞体ウイルス(RSV)の眼感染のマウスモデルを、RSV誘発性の眼の免疫病理へのFLAPインヒビタ化合物の眼の適用効果を試験するために使用する(Bitko V,et al.,J.Virol.2007;81(2):783−90;Bitko V,et al.,Nat.Med.2005;11(1):50−5)。各マウスの眼を、60ngのFLAPインヒビタ化合物又は2μlの量におけるビヒクル(無菌食塩水)で局所的に処置する。FLAPインヒビタ化合物を、ウイルス接種の40分後注入し、その後、プロトコルの全期間中(14日間)、毎日1回注入する。
【0179】
眼内でのウイルス及びインヒビタの注入。6〜8歳の雌のBALB/cマウスを、Charles River Laboratoriesから購入した。RSV(Long株、血清型A)を、HEp−2細胞で成長させ、1011PFUの濃度にまで蔗糖層上で精製した(Bitko et al.,Nat.Med.11:50−55,2005 )。希釈を、必要に応じて、104PFU/2μLの終濃度への使用の直前に、リン酸緩衝食塩水(PBS)中で行った。同様に希釈した蔗糖溶液を、偽感染したコントロールマウス中で使用した。マウスに、ペントバルビタール(50mg/kg)の腹腔内注射により麻酔をかけ、2μLのPBS内のウイルスを、角膜表面に落とし、眼瞼閉鎖でマッサージした。接種の日を、0日目と考えた。FLAPインヒビタ化合物Cを、0日目のRSV接種の40分後、2μLの適用の直前にPBS中で60ng/μまで希釈し、その後、毎日希釈した。
【0180】
実験の持続時間:眼を毎日視覚的に検査し、RSV接種後の各日:2、4、6、8、9、10、12、14日目=合計8つの時点に収集する。3匹の動物を、各データ点のために使用する、即ち24匹のマウスをFLAPインヒビタ化合物Cで処置し、24匹のマウスをビヒクル制御で処置する(研究中に48匹のマウスを使用)。
【0181】
眼病理。眼疾患を、事前に記載されるように、細隙灯生体顕微鏡により評価した(Bitko V,et al.,J.Virol.2007;81(2):783−90)15;15;Girgis et al.,Invest.Ophthal.Vis.Sci.44:1591−1597,2003)。病理を、以下のような、0〜5の規模で採点した:0=澄んだ眼;1=隅での軽度の発赤;2=中等度の発赤及び注射;3=毛様体充血を有する結膜下及び角膜下注射;4=いくつかの粘液に関連する広範囲な注射;5=いくつかの粘液に関連する最も広範囲な注射。眼を、与えられた処置に気づかないリーダーと共にコード化された方法で検査した。図2は、RSVの眼病理へのFLAPインヒビタ化合物Cの影響を示す。FLAPインヒビタ化合物Cの眼の適用により、すべての観察日、すなわち、RSV誘発後の2〜14日間を通して病理スコアが減少する。眼を処置するRSVは、ゴム状残渣及びムチンが4日目に始まってから蓄積し、重い粘液が8日目まで蓄積することを示した。FLAPインヒビタ化合物Cで処置される感染した眼には、8日目にゴム状残渣及びムチンが蓄積することはなかった。
【0182】
CysLT測定。眼組織を、ポリトロンホモジナイザーを使用して、1〜3mlの溶解緩衝液(0.5%のトリトン−X−100、15 mMのトリスCl pH 7.4)中で均質化した。ロイコトリエン抽出のプロセスを進める前に、ホモジネートを、摂氏4℃で10分間10,000xgで遠心分離し、上清を、摂氏−80℃で凍結した。上清サンプルを、最終の容量、10%の冷エタノールで溶かし、沈殿させ、30分間氷の上に固定し、その後、15分間10,000xgで遠心分離した。廃棄された変性タンパク質ペレット及び脂質を含む上清を、感度30pg CysLT/mLまでのAssey Designsに記載される手順を使用し、標準曲線の線形部上に存在するように適切な希釈で、CysLT(EIA方法)のためにアッセイした。図3は、マウスにおけるRSVの眼の適用に続く、眼のホモジネートにおけるCysLTの増加及びマウスにおけるRSVの眼の適用に続く、CysLTのレベルへの化合物Cの効果を示す。化合物Cでの局所療法は、眼のホモジネートにおいてCysLTのレベルを減らした。
【0183】
インターロイキン−4(IL−4)測定。上述されるような眼の抽出を、抽出液におけるIL−4のレベルを測定するために使用する。図4は、マウスにおけるRSVの眼の適用に続く、眼のホモジネートにおけるIL−4の増加及びマウスにおけるRSVの眼の適用に続く、IL−4のレベルへのFLAPインヒビタの効果を示す。化合物Cでの局所療法は、眼のホモジネートにおいてIL−4のレベルを減らした。
【0184】
RSV RNA及びタンパク質:RSVを、以前記載されたように、ウェスタンブロット及び生存可能なウイルスアッセイ(プラーク形成単位;pfu)を使用して、様々な日に眼組織においてアッセイする。IL−5をRT−PCRによって定量化する。RSV RNA及びタンパク質を、眼及び肺において測定した(Urnowey et al.,BMC Microbiol.6:26,2006)。
【0185】
FLAPインヒビタ化合物Cの投与は、上述されるように、Th2細胞のサイトカインIL−4の産生の減少につながったが、眼又は肺におけるウイルス負荷の増加にはつながらなかった。FLAPインヒビタ化合物Cの投与は、眼又は肺におけるRSV mRNA又はタンパク質の増加にはつながらなかった(図5)。化合物Cは、肺におけるRSVを低減した。
【0186】
眼感染は、最終的に肺へ伝染し、標準的な呼吸器感染症を引き起こす。幾つかの例において、眼は、RSVが肺へ侵入するための門戸としての機能を果たす。そのため、FLAPインヒビタ化合物の眼の適用が、肺においてウイルス複製及びウイルスの量に任意の効果があるのかを測定するために、肺感染症をモニターすることは興味深い。
マウスの肺組織を収集し、ホモジネートをウイルス価及びウェスタンブロットのために作り出し、アッセイする(Matsuse H,et al.Allergology International 2007;56:165−169;Bitko V,et al.,J.Virol.2007;81(2):783−90)。
【0187】
統計分析。病理スコア、及び眼のCysLT及び/又はIL−4の濃度は、グラフパッドプリズムのソフトウェア(GraphPad Software,San Diego,CA)を使用して、二元配置分散分析に続き、ボンフェローニ事後解析に影響された。
【0188】
本明細書に記載される実施例及び実施形態は、例示目的のみのためであり、当該分野の当業者に提示される様々な修正又は変更は、本出願の精神および範囲内および添付の特許請求の範囲内に含まれるべきである。本明細書に使用される節の表題は、構成目的のみのものであって、記載される主題を限定するためのものではない。
【0189】
実施例8:マウスの亜慢性のスモークモデル(Subchronic Smoke Model)における併用療法
BALB/cマウスを群に分け、24時間、かごの中で気候順応させる(0日目)。対照群を空気に曝し、試験群を、8日間、1日につき7本のフィルター無しのタバコからの煙に曝した(1日目から8日目)。FLAPインヒビタ化合物(3−(3−(tert−ブチルチオ)−1−(4−(6−メトキシピリジン−3−イル)ベンジル)−5−((5−メチルピリジン−2−イル)メトキシ)−1H−インドール−2−イル)−2,2−ジメチルプロパン酸)(30mg/kg、1日2回)、DP2受容体アンタゴニスト5−{2−[(N−ベンジルオキシカルボニル−N−エチル−アミノ)−メチル]−4−トリフルオロメチル−フェニル}−ピリジン−3−イル)−酢酸(10mg/kg 1日4回)、又はFLAPインヒビタ化合物(3−(3−(tert−ブチルチオ)−1−(4−(6−メトキシピリジン−3−イル)ベンジル)−5−((5−メチルピリジン−2−イル)メトキシ)−1H−インドール−2−イル)−2,2−ジメチルプロパン酸)(30mg/kg、1日2回)及びDP2受容体アンタゴニスト5−{2−[(N−ベンジルオキシカルボニル−N−エチル−アミノ)−メチル]−4−トリフルオロメチル−フェニル}−ピリジン−3−イル)−酢酸(10mg/kg 1日4回)の組み合わせを1日目に始まり、13日目まで投与する。14日目に、気管支肺胞洗浄液(BALF)を、細胞、サイトカイン、ケモカイン(例えば、KC、IL−17、MIP−2、IL−6)、ムチン、及び/又はタンパク質の流入のために試験する。肺組織学も調べる。
トラフ血漿濃度を、以下の表に示す:
【0190】
【表4】

【0191】
図6は、BALFに存在する、細胞(図6A)、好中球(図6B)及びリンパ球(図6C)の総数への、FLAP阻害、DP2受容体アンタゴニズム、及びFLAPの阻害及びDP2受容体アンタゴニズムの組み合わせの効果を示す。図6Aにおいて、*は、P<0.05対空気、一元配置分散分析を表し;図6Bにおいて、*は、P<0.05対煙、テューキー法(Tukey's)での一元配置分散分析であり、***は、P<0.001対空気、テューキー法(Tukey's)での一元配置分散分析であり、「ns」は、P=0.055、片側t検定(one−tailed t−test)であり;及び図6Cにおいて、*は、P<0.05対煙、片側t検定である。
【0192】
図7は、BALF中のムチンの存在へのFLAP阻害、DP2受容体アンタゴニズム、及びFLAP阻害及びDP2受容体アンタゴニズムの組み合わせの効果を示す。図7Aにおいて、*は、P<0.05対煙、片側t検定を表す。亜慢性のスモーキングマウスモデルにおいて、BALF中のムチン分泌へのFLAPインヒビタ化合物及びDP2受容体アンタゴニスト化合物の組み合わせの効果は、付加的なものであり、即ち、FLAPインヒビタ化合物及びDP2受容体アンタゴニストの組み合わせは、各々の化合物のみよりも多い、BALF中のムチンの量を減らすことにつながった。1つの態様において、FLAPインヒビタ化合物単独の、又はFLAPインヒビタ化合物とDP2受容体アンタゴニストとの組み合わせの眼への局所投与の効果は、BALFにおいて観察されるように、同じ効果(例えば、機構的に予想される効果)を有する。
【0193】
本明細書に記載される実施例及び実施形態は、例示目的のみのためであり、当該分野の当業者に提示される様々な修正又は変更は、本出願の精神および範囲内および添付の特許請求の範囲内に含まれるべきである。本明細書に使用される節の表題は、構成目的のみのものであって、記載される主題を限定するためのものではない。
【特許請求の範囲】
【請求項1】
哺乳動物の眼の疾患、障害又は疾病の処置のための有効量におけるFLAPインヒビタ化合物と、
及び溶液、懸濁液、軟膏、クリーム、ローション、ニオソーム、ファーマコソーム、軟膏、又はゲルを提供するための少なくとも1つの薬学的に適切な賦形剤を含むことを特徴とする眼製剤。
【請求項2】
前記FLAPインヒビタ化合物は、ロイコトリエン合成を阻害し、ロイコトリエン受容体をアンタゴナイズし、インターロイキン-4(IL−4)合成を阻害し、又はムチン合成を阻害することを特徴とする請求項1記載の眼製剤。
【請求項3】
前記眼の疾患、障害又は疾病は、加齢性黄斑変性、アレルギー性結膜炎、前上葉区瘢痕化、眼瞼炎、眼瞼結膜炎、水疱性障害、瘢痕性類天疱瘡、結膜黒色腫、結膜炎、コンタクトレンズに関連する巨大乳頭結膜炎、糖尿病性網膜症、眼乾燥、上強膜炎、緑内障、グリオーシス、環状肉芽腫、グレーブス眼症、眼球内黒色腫、角膜炎、角結膜炎、疼痛、結膜脂肪斑、術後疼痛、増殖性硝子体網膜症、翼状片、瘢痕化、強膜炎、ウイルス感染、シェーグレン症候群、ブドウ膜炎、春季角結膜炎又はそれらの組み合わせであることを特徴とする請求項1記載の眼製剤
【請求項4】
FLAPインヒビタ化合物は、式(I)の化合物、その薬学的に許容可能な塩、又はN−オキシドであり:
【化1】

式中、
Aは、CH又はNであり、
R1は、H、−F、−Cl、−Br、−CN、C1−C4アルキル、C1−C4フルオロアルキル、-O-C1-C4アルキル、又は-O-C1-C4フルオロアルキルであり;
R2は、C1-C4アルキル又はC1-C4フルオロアルキルであることを特徴とする請求項1乃至3のいずれか1つ記載の眼製剤。
【請求項5】
FLAPインヒビタ化合物は、3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物A)であり;又は3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピラジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物B)、又は、それらの薬学的に許容可能な塩、又はN−オキシドであることを特徴とする請求項4記載の眼製剤。
【請求項6】
FLAPインヒビタ化合物は、式(II)の化合物、その薬学的に許容可能な塩、又はN−オキシドであり:
【化2】

式中、
R2は、C1−C4アルキル又はC1−C4フルオロアルキルであり;
R3は、置換又は非置換の単環式又は二環式のヘテロシクロアルキルであることを特徴とする請求項1乃至3のいずれか1つ記載の眼製剤。
【請求項7】
R3は、以下から成る群から選択され;
【化3】

R4は、H、−C(=O)R5又は−SO2−C1−C4アルキルであり;R5は、C1−C4アルキル、C1−C4フルオロアルキル、置換又は非置換のフェニル、置換又は非置換のヘテロアリール、又は−O−C1−C4アルキルであることを特徴とする請求項6記載の眼製剤。
【請求項8】
式(II)の化合物は、以下の構造を有することを特徴とする請求項7記載の眼製剤:
【化4】

【請求項9】
FLAPインヒビタ化合物は、3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物C)、3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−エトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物K)、又はそれらの薬学的に許容可能な塩、又はN−オキシドであることを特徴とする請求項8記載の眼製剤。
【請求項10】
FLAPインヒビタ化合物は、3−[3−tert−ブチルスルファニル−1−(4−クロロ−ベンジル)−5−イソプロピル−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(MK886);3−[3−tert−ブチルスルファニル−1−(4−クロロ−ベンジル)−5−(キノリン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(MK591);シクロペンチル−[4−(キノリン−2−イルメトキシ)−フェニル]−酢酸(DG031; BAY X1005);3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物A);3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピラジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物B);3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物C);3−[3−tert−ブチルスルファニル−1−[4−(6−メトキシ−ピリジン−3−イル)−ベンジル]−5−(ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物D);
3−[3−tert−ブチルスルファニル−1−[4−(6−エトキシ−ピリジン−3−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物E);3−[3−tert−ブチルスルファニル−1−[4−(5−フルオロ−ピリジン−2−イル)−ベンジル]−5−(キノリン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物F);2−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イルメチル]−2−エチル−酪酸(化合物G);3−[3−tert−ブチルスルファニル−1−[4−(6−メトキシ−ピリジン−3−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物H);3−[5−((S)−1−アセチル−ピロリジン−2−イルメトキシ)−3−tert−ブチルスルファニル−1−(4−クロロ−ベンジル)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物I);3−[3−tert−ブチルスルファニル−1−[4−(5−フルオロ−ピリジン−2−イル)−ベンジル]−5−(ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物J);3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−エトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物K);又は、それらの薬学的に許容可能な塩、又はN−オキシドであることを特徴とする請求項1乃至3のいずれか1つ記載の局所製剤。
【請求項11】
治療上有効な量の第2の化合物を更に含み、前記第2の化合物は、抗生物質;抗真菌剤;ステロイド抗炎症剤;非ステロイド抗炎症剤;抗ヒスタミン剤;抗ウイルス剤;アルファアゴニスト;ベータ遮断剤;炭酸脱水酵素インヒビタ;縮瞳薬;プロスタグランジン;抗血管新生薬;ロテプレドノールエタボネート、肥満細胞安定化薬、シクロスポリン又はDP2アンタゴニストであることを特徴とする請求項1乃至3のいずれか1つ記載の眼製剤。
【請求項12】
眼の障害を有する哺乳動物の少なくとも1つの眼に、治療上有効な量のFLAPインヒビタ化合物を含む眼製剤を投与する工程を含むことを特徴とする、哺乳動物における眼の疾患、障害又は疾病の処置方法。
【請求項13】
前記FLAPインヒビタ化合物は、ロイコトリエン合成を阻害し、ロイコトリエン受容体をアンタゴナイズし、インターロイキン−4(IL−4)合成を阻害し、又はムチン合成を阻害することを特徴とする請求項12記載の方法。
【請求項14】
前記眼製剤は、溶液、懸濁液、軟膏、ゲル、クリーム、リポソーム、ニオソーム、ファーマコソーム、ナノ粒子、又はそれらの組み合わせの形態であることを特徴とする請求項12記載の方法。
【請求項15】
前記眼製剤は、移植、挿入、注入、噴霧、洗浄又はそれらの組み合わせを介して投与されることを特徴とする請求項12記載の方法。
【請求項16】
眼の疾患、障害又は疾病は、加齢性黄斑変性、アレルギー性結膜炎、前上葉区瘢痕化、眼瞼炎、眼瞼結膜炎、水疱性障害、瘢痕性類天疱瘡、結膜黒色腫、結膜炎、コンタクトレンズに関連する巨大乳頭結膜炎、糖尿病性網膜症、眼乾燥、上強膜炎、緑内障、グリオーシス、環状肉芽腫、グレーブス眼症、眼球内黒色腫、角膜炎、角結膜炎、疼痛、結膜脂肪斑、術後疼痛、増殖性硝子体網膜症、翼状片、瘢痕化、強膜炎、シェーグレン症候群、ブドウ膜炎、春季角結膜炎、術後炎症、術後瘢痕又はそれらの組み合わせであることを特徴とする請求項12記載の方法。
【請求項17】
前記FLAPインヒビタ化合物は、式(I)の化合物、その薬学的に許容可能な塩、又はN−オキシドであり:
【化5】

式中、
Aは、CH又はNであり;
R1は、H、-F、-Cl、-Br、-CN、C1-C4アルキル、C1-C4フルオロアルキル、-O-C1-C4アルキル、又はO-C1-C4フルオロアルキルであり;
R2は、C1-C4アルキル又はC1-C4フルオロアルキルであることを特徴とする請求項12乃至16のいずれか1つ記載の方法。
【請求項18】
前記FLAPインヒビタ化合物は、3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物A);又は3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピラジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物B)、又はそれらの薬学的に許容可能な塩、又はN−オキシド、であることを特徴とする請求項17記載の方法。
【請求項19】
前記FLAPインヒビタ化合物は、式(II)の化合物、その薬学的に許容可能な塩、又はN−オキシドであり:
【化6】

式中、
R2は、C1-C4アルキル又はC1-C4フルオロアルキルであり;
R3は、置換又は非置換の単環式又は二環式のヘテロシクロアルキルであることを特徴とする請求項12乃至16のいずれか1つ記載の方法。
【請求項20】
R3は、以下から成る群から選択され;
【化7】

R4は、H、-C(=O)R5又は-SO2-C1-C4アルキルであり;R5は、C1-C4アルキル、C1-C4フルオロアルキル、置換又は非置換のフェニル、置換又は非置換のヘテロアリール、又は-O-C1-C4アルキルであることを特徴とする請求項19記載の方法。
【請求項21】
式(II)の化合物は、以下の構造を有することを特徴とする請求項20記載の方法:
【化8】

【請求項22】
前記FLAPインヒビタ化合物は、3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物C)、3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−エトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物K)、又はそれらの薬学的に許容可能な塩、又はN−オキシドであることを特徴とする請求項21記載の方法。
【請求項23】
前記FLAPインヒビタ化合物は、3−[3−tert−ブチルスルファニル−1−(4−クロロ−ベンジル)−5−イソプロピル−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(MK886);3−[3−tert−ブチルスルファニル−1−(4−クロロ−ベンジル)−5−(キノリン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(MK591);シクロペンチル−[4−(キノリン−2−イルメトキシ)−フェニル]−酢酸(DG031;BAY X1005);3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物A);3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピラジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物B);3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物C);3−[3−tert−ブチルスルファニル−1−[4−(6−メトキシ−ピリジン−3−イル)−ベンジル]−5−(ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物D);3−[3−tert−ブチルスルファニル−1−[4−(6−エトキシ−ピリジン−3−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物E);3−[3−tert−ブチルスルファニル−1−[4−(5−フルオロ−ピリジン−2−イル)−ベンジル]−5−(キノリン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物F);2−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イルメチル]−2−エチル−酪酸(化合物G);3−[3−tert−ブチルスルファニル−1−[4−(6−メトキシ−ピリジン−3−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物H);3−[5−((S)−1−アセチル−ピロリジン−2−イルメトキシ)−3−tert−ブチルスルファニル−1−(4−クロロ−ベンジル)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物I);3−[3−tert−ブチルスルファニル−1−[4−(5−フルオロ−ピリジン−2−イル)−ベンジル]−5−(ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物J);3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−エトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物K);又は、それらの薬学的に許容可能な塩、又はN−オキシドから選択されることを特徴とする請求項12乃至16のいずれか1つ記載の方法。
【請求項24】
抗生物質;抗真菌剤;ステロイド抗炎症剤;非ステロイド抗炎症剤;抗ヒスタミン剤;抗ウイルス剤;アルファアゴニスト;ベータ遮断剤;炭酸脱水酵素インヒビタ;縮瞳薬;プロスタグランジン;抗血管新生薬;ロテプレドノールエタボネート、肥満細胞安定化薬、シクロスポリン、及びDP2アンタゴニストから選択される治療上有効な量の化合物を、哺乳動物に投与する工程を更に含む、請求項12乃至16のいずれか1つ記載の方法。
【請求項25】
式(I)の化合物、その薬学的に許容可能な塩、又はN−オキシドであって;
【化9】

式中、
Aは、CH又はNであり;
R1は、-F、-Cl、-Br、-CN、C1-C4アルキル、C1-C4フルオロアルキル、-O-C1-C4アルキル、又はO-C1-C4フルオロアルキルであり;
R2は、C1-C4アルキル又はC1-C4フルオロアルキルであることを特徴とする式(I)の化合物、その薬学的に許容可能な塩、又はN−オキシド。
【請求項26】
式(I)の前記化合物は、3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物A);又は3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピラジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物B)、又はそれらの薬学的に許容可能な塩、又はN−オキシドであることを特徴とする請求項25記載の化合物。
【請求項27】
式(II)の化合物、その薬学的に許容可能な塩、又はN−オキシドであって;
【化10】

式中、
R2は、C1-C4アルキル又はC1-C4フルオロアルキルであり;
R3は、置換又は非置換の単環式又は二環式のヘテロシクロアルキルであることを特徴とする式(II)の化合物、その薬学的に許容可能な塩、又はN−オキシド。
【請求項28】
R3は、以下から成る群から選択され;
【化11】

R4は、H、−C(=O)R5又は−SO2−C1−C4アルキルであり;
R5は、C1-C4アルキル、C1-C4フルオロアルキル、置換又は非置換のフェニル、置換又は非置換のヘテロアリール、又は-O-C1-C4アルキルであることを特徴とする請求項31記載の化合物
【請求項29】
式(II)の前記化合物は、以下の構造を有することを特徴とする請求項28記載の化合物:
【化12】

【請求項30】
化合物は、3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物C)、又は3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−エトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物K)、又はそれらの薬学的に許容可能な塩、又はN−オキシドであることを特徴とする請求項29記載の化合物。
【請求項1】
哺乳動物の眼の疾患、障害又は疾病の処置のための有効量におけるFLAPインヒビタ化合物と、
及び溶液、懸濁液、軟膏、クリーム、ローション、ニオソーム、ファーマコソーム、軟膏、又はゲルを提供するための少なくとも1つの薬学的に適切な賦形剤を含むことを特徴とする眼製剤。
【請求項2】
前記FLAPインヒビタ化合物は、ロイコトリエン合成を阻害し、ロイコトリエン受容体をアンタゴナイズし、インターロイキン-4(IL−4)合成を阻害し、又はムチン合成を阻害することを特徴とする請求項1記載の眼製剤。
【請求項3】
前記眼の疾患、障害又は疾病は、加齢性黄斑変性、アレルギー性結膜炎、前上葉区瘢痕化、眼瞼炎、眼瞼結膜炎、水疱性障害、瘢痕性類天疱瘡、結膜黒色腫、結膜炎、コンタクトレンズに関連する巨大乳頭結膜炎、糖尿病性網膜症、眼乾燥、上強膜炎、緑内障、グリオーシス、環状肉芽腫、グレーブス眼症、眼球内黒色腫、角膜炎、角結膜炎、疼痛、結膜脂肪斑、術後疼痛、増殖性硝子体網膜症、翼状片、瘢痕化、強膜炎、ウイルス感染、シェーグレン症候群、ブドウ膜炎、春季角結膜炎又はそれらの組み合わせであることを特徴とする請求項1記載の眼製剤
【請求項4】
FLAPインヒビタ化合物は、式(I)の化合物、その薬学的に許容可能な塩、又はN−オキシドであり:
【化1】

式中、
Aは、CH又はNであり、
R1は、H、−F、−Cl、−Br、−CN、C1−C4アルキル、C1−C4フルオロアルキル、-O-C1-C4アルキル、又は-O-C1-C4フルオロアルキルであり;
R2は、C1-C4アルキル又はC1-C4フルオロアルキルであることを特徴とする請求項1乃至3のいずれか1つ記載の眼製剤。
【請求項5】
FLAPインヒビタ化合物は、3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物A)であり;又は3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピラジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物B)、又は、それらの薬学的に許容可能な塩、又はN−オキシドであることを特徴とする請求項4記載の眼製剤。
【請求項6】
FLAPインヒビタ化合物は、式(II)の化合物、その薬学的に許容可能な塩、又はN−オキシドであり:
【化2】

式中、
R2は、C1−C4アルキル又はC1−C4フルオロアルキルであり;
R3は、置換又は非置換の単環式又は二環式のヘテロシクロアルキルであることを特徴とする請求項1乃至3のいずれか1つ記載の眼製剤。
【請求項7】
R3は、以下から成る群から選択され;
【化3】

R4は、H、−C(=O)R5又は−SO2−C1−C4アルキルであり;R5は、C1−C4アルキル、C1−C4フルオロアルキル、置換又は非置換のフェニル、置換又は非置換のヘテロアリール、又は−O−C1−C4アルキルであることを特徴とする請求項6記載の眼製剤。
【請求項8】
式(II)の化合物は、以下の構造を有することを特徴とする請求項7記載の眼製剤:
【化4】

【請求項9】
FLAPインヒビタ化合物は、3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物C)、3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−エトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物K)、又はそれらの薬学的に許容可能な塩、又はN−オキシドであることを特徴とする請求項8記載の眼製剤。
【請求項10】
FLAPインヒビタ化合物は、3−[3−tert−ブチルスルファニル−1−(4−クロロ−ベンジル)−5−イソプロピル−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(MK886);3−[3−tert−ブチルスルファニル−1−(4−クロロ−ベンジル)−5−(キノリン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(MK591);シクロペンチル−[4−(キノリン−2−イルメトキシ)−フェニル]−酢酸(DG031; BAY X1005);3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物A);3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピラジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物B);3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物C);3−[3−tert−ブチルスルファニル−1−[4−(6−メトキシ−ピリジン−3−イル)−ベンジル]−5−(ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物D);
3−[3−tert−ブチルスルファニル−1−[4−(6−エトキシ−ピリジン−3−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物E);3−[3−tert−ブチルスルファニル−1−[4−(5−フルオロ−ピリジン−2−イル)−ベンジル]−5−(キノリン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物F);2−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イルメチル]−2−エチル−酪酸(化合物G);3−[3−tert−ブチルスルファニル−1−[4−(6−メトキシ−ピリジン−3−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物H);3−[5−((S)−1−アセチル−ピロリジン−2−イルメトキシ)−3−tert−ブチルスルファニル−1−(4−クロロ−ベンジル)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物I);3−[3−tert−ブチルスルファニル−1−[4−(5−フルオロ−ピリジン−2−イル)−ベンジル]−5−(ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物J);3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−エトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物K);又は、それらの薬学的に許容可能な塩、又はN−オキシドであることを特徴とする請求項1乃至3のいずれか1つ記載の局所製剤。
【請求項11】
治療上有効な量の第2の化合物を更に含み、前記第2の化合物は、抗生物質;抗真菌剤;ステロイド抗炎症剤;非ステロイド抗炎症剤;抗ヒスタミン剤;抗ウイルス剤;アルファアゴニスト;ベータ遮断剤;炭酸脱水酵素インヒビタ;縮瞳薬;プロスタグランジン;抗血管新生薬;ロテプレドノールエタボネート、肥満細胞安定化薬、シクロスポリン又はDP2アンタゴニストであることを特徴とする請求項1乃至3のいずれか1つ記載の眼製剤。
【請求項12】
眼の障害を有する哺乳動物の少なくとも1つの眼に、治療上有効な量のFLAPインヒビタ化合物を含む眼製剤を投与する工程を含むことを特徴とする、哺乳動物における眼の疾患、障害又は疾病の処置方法。
【請求項13】
前記FLAPインヒビタ化合物は、ロイコトリエン合成を阻害し、ロイコトリエン受容体をアンタゴナイズし、インターロイキン−4(IL−4)合成を阻害し、又はムチン合成を阻害することを特徴とする請求項12記載の方法。
【請求項14】
前記眼製剤は、溶液、懸濁液、軟膏、ゲル、クリーム、リポソーム、ニオソーム、ファーマコソーム、ナノ粒子、又はそれらの組み合わせの形態であることを特徴とする請求項12記載の方法。
【請求項15】
前記眼製剤は、移植、挿入、注入、噴霧、洗浄又はそれらの組み合わせを介して投与されることを特徴とする請求項12記載の方法。
【請求項16】
眼の疾患、障害又は疾病は、加齢性黄斑変性、アレルギー性結膜炎、前上葉区瘢痕化、眼瞼炎、眼瞼結膜炎、水疱性障害、瘢痕性類天疱瘡、結膜黒色腫、結膜炎、コンタクトレンズに関連する巨大乳頭結膜炎、糖尿病性網膜症、眼乾燥、上強膜炎、緑内障、グリオーシス、環状肉芽腫、グレーブス眼症、眼球内黒色腫、角膜炎、角結膜炎、疼痛、結膜脂肪斑、術後疼痛、増殖性硝子体網膜症、翼状片、瘢痕化、強膜炎、シェーグレン症候群、ブドウ膜炎、春季角結膜炎、術後炎症、術後瘢痕又はそれらの組み合わせであることを特徴とする請求項12記載の方法。
【請求項17】
前記FLAPインヒビタ化合物は、式(I)の化合物、その薬学的に許容可能な塩、又はN−オキシドであり:
【化5】

式中、
Aは、CH又はNであり;
R1は、H、-F、-Cl、-Br、-CN、C1-C4アルキル、C1-C4フルオロアルキル、-O-C1-C4アルキル、又はO-C1-C4フルオロアルキルであり;
R2は、C1-C4アルキル又はC1-C4フルオロアルキルであることを特徴とする請求項12乃至16のいずれか1つ記載の方法。
【請求項18】
前記FLAPインヒビタ化合物は、3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物A);又は3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピラジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物B)、又はそれらの薬学的に許容可能な塩、又はN−オキシド、であることを特徴とする請求項17記載の方法。
【請求項19】
前記FLAPインヒビタ化合物は、式(II)の化合物、その薬学的に許容可能な塩、又はN−オキシドであり:
【化6】

式中、
R2は、C1-C4アルキル又はC1-C4フルオロアルキルであり;
R3は、置換又は非置換の単環式又は二環式のヘテロシクロアルキルであることを特徴とする請求項12乃至16のいずれか1つ記載の方法。
【請求項20】
R3は、以下から成る群から選択され;
【化7】

R4は、H、-C(=O)R5又は-SO2-C1-C4アルキルであり;R5は、C1-C4アルキル、C1-C4フルオロアルキル、置換又は非置換のフェニル、置換又は非置換のヘテロアリール、又は-O-C1-C4アルキルであることを特徴とする請求項19記載の方法。
【請求項21】
式(II)の化合物は、以下の構造を有することを特徴とする請求項20記載の方法:
【化8】

【請求項22】
前記FLAPインヒビタ化合物は、3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物C)、3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−エトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物K)、又はそれらの薬学的に許容可能な塩、又はN−オキシドであることを特徴とする請求項21記載の方法。
【請求項23】
前記FLAPインヒビタ化合物は、3−[3−tert−ブチルスルファニル−1−(4−クロロ−ベンジル)−5−イソプロピル−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(MK886);3−[3−tert−ブチルスルファニル−1−(4−クロロ−ベンジル)−5−(キノリン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(MK591);シクロペンチル−[4−(キノリン−2−イルメトキシ)−フェニル]−酢酸(DG031;BAY X1005);3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物A);3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピラジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物B);3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物C);3−[3−tert−ブチルスルファニル−1−[4−(6−メトキシ−ピリジン−3−イル)−ベンジル]−5−(ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物D);3−[3−tert−ブチルスルファニル−1−[4−(6−エトキシ−ピリジン−3−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物E);3−[3−tert−ブチルスルファニル−1−[4−(5−フルオロ−ピリジン−2−イル)−ベンジル]−5−(キノリン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物F);2−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イルメチル]−2−エチル−酪酸(化合物G);3−[3−tert−ブチルスルファニル−1−[4−(6−メトキシ−ピリジン−3−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物H);3−[5−((S)−1−アセチル−ピロリジン−2−イルメトキシ)−3−tert−ブチルスルファニル−1−(4−クロロ−ベンジル)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物I);3−[3−tert−ブチルスルファニル−1−[4−(5−フルオロ−ピリジン−2−イル)−ベンジル]−5−(ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物J);3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−エトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物K);又は、それらの薬学的に許容可能な塩、又はN−オキシドから選択されることを特徴とする請求項12乃至16のいずれか1つ記載の方法。
【請求項24】
抗生物質;抗真菌剤;ステロイド抗炎症剤;非ステロイド抗炎症剤;抗ヒスタミン剤;抗ウイルス剤;アルファアゴニスト;ベータ遮断剤;炭酸脱水酵素インヒビタ;縮瞳薬;プロスタグランジン;抗血管新生薬;ロテプレドノールエタボネート、肥満細胞安定化薬、シクロスポリン、及びDP2アンタゴニストから選択される治療上有効な量の化合物を、哺乳動物に投与する工程を更に含む、請求項12乃至16のいずれか1つ記載の方法。
【請求項25】
式(I)の化合物、その薬学的に許容可能な塩、又はN−オキシドであって;
【化9】

式中、
Aは、CH又はNであり;
R1は、-F、-Cl、-Br、-CN、C1-C4アルキル、C1-C4フルオロアルキル、-O-C1-C4アルキル、又はO-C1-C4フルオロアルキルであり;
R2は、C1-C4アルキル又はC1-C4フルオロアルキルであることを特徴とする式(I)の化合物、その薬学的に許容可能な塩、又はN−オキシド。
【請求項26】
式(I)の前記化合物は、3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピリジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物A);又は3−[3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−5−(5−メチル−ピラジン−2−イルメトキシ)−1H−インドール−2−イル]−2,2−ジメチル−プロピオン酸(化合物B)、又はそれらの薬学的に許容可能な塩、又はN−オキシドであることを特徴とする請求項25記載の化合物。
【請求項27】
式(II)の化合物、その薬学的に許容可能な塩、又はN−オキシドであって;
【化10】

式中、
R2は、C1-C4アルキル又はC1-C4フルオロアルキルであり;
R3は、置換又は非置換の単環式又は二環式のヘテロシクロアルキルであることを特徴とする式(II)の化合物、その薬学的に許容可能な塩、又はN−オキシド。
【請求項28】
R3は、以下から成る群から選択され;
【化11】

R4は、H、−C(=O)R5又は−SO2−C1−C4アルキルであり;
R5は、C1-C4アルキル、C1-C4フルオロアルキル、置換又は非置換のフェニル、置換又は非置換のヘテロアリール、又は-O-C1-C4アルキルであることを特徴とする請求項31記載の化合物
【請求項29】
式(II)の前記化合物は、以下の構造を有することを特徴とする請求項28記載の化合物:
【化12】

【請求項30】
化合物は、3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−メトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物C)、又は3−{5−((S)−1−アセチル−2,3−ジヒドロ−1H−インドール−2−イルメトキシ)−3−tert−ブチルスルファニル−1−[4−(5−エトキシ−ピリミジン−2−イル)−ベンジル]−1H−インドール−2−イル}−2,2−ジメチル−プロピオン酸(化合物K)、又はそれらの薬学的に許容可能な塩、又はN−オキシドであることを特徴とする請求項29記載の化合物。
【図1】


【図2】


【図3】


【図4】


【図5】


【図6】


【図7】




【図2】


【図3】


【図4】


【図5】


【図6】


【図7】


【公表番号】特表2012−513407(P2012−513407A)
【公表日】平成24年6月14日(2012.6.14)
【国際特許分類】
【出願番号】特願2011−542552(P2011−542552)
【出願日】平成21年12月21日(2009.12.21)
【国際出願番号】PCT/US2009/069066
【国際公開番号】WO2010/075315
【国際公開日】平成22年7月1日(2010.7.1)
【出願人】(510209672)パンミラ ファーマシューティカルズ,エルエルシー. (17)
【Fターム(参考)】
【公表日】平成24年6月14日(2012.6.14)
【国際特許分類】
【出願日】平成21年12月21日(2009.12.21)
【国際出願番号】PCT/US2009/069066
【国際公開番号】WO2010/075315
【国際公開日】平成22年7月1日(2010.7.1)
【出願人】(510209672)パンミラ ファーマシューティカルズ,エルエルシー. (17)
【Fターム(参考)】
[ Back to top ]

